Настоящее изобретение относится к новым производным хиназолина, которые могут использоваться в качестве лигандов рецепторов нейропептида Y, в особенности в качестве антагонистов нейропептида Y (NPY).
Изобретение относится к соединениям формулы I
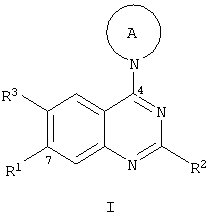
а также их фармацевтически приемлемым солям и эфирам, где
R1 представляет собой -O-R4 или -N(R5)(R6);
R2 представляет собой алкил или амино;
R3 представляет собой водород, алкил или галоген;
R4 представляет собой водород, алкил, алкоксиалкил, гидроксиалкил, аралкил, гетероциклилалкил, циклоалкилалкил, NH2-SO2-, амино-SO2- или алкил-SO2-;
R5 и R6 независимо выбраны из водорода, алкила, циклоалкила,
циклоалкилалкила, алкилкарбонила, циклоалкилкарбонила, арила, аралкила, арилкарбонила, алкоксиалкила, гидроксиалкила, гетероциклила, гетороциклилалкила, гетероциклилкарбонила, алкил-SO2-, арил-SO2-, гетероциклил-SO2- или амино-SO2-, или R5 и R6 вместе с атомом N, к которому они присоединены, образуют 5-10-членное гетероциклическое кольцо, которое необязательно включает второй гетероатом, выбранный из азота или кислорода, и где гетероциклическое кольцо необязательно замещено одним или несколькими заместителями, независимо выбранными из алкила или алкоксигруппы и
А представляет собой 5-7-членное насыщенное гетероциклическое кольцо, включающее атом азота, присоединенный к хиназолиновому кольцу, и необязательно второй гетероатом, который выбран из кислорода, серы или азота, и где кольцо А необязательно замещено одним или несколькими заместителями, независимо выбранными из галогена, алкила, алкокси, галоалкокси, циклоалкилалкокси, гидрокси, амино, ацетиламино, циано, гидроксиалкила, алкоксиалкила, галоалкоксиалкила и циклоалкилалкоксиалкила.
Соединения формулы I и их фармацевтически приемлемые соли являются новыми и обладают ценными фармацевтическими свойствами. Они являются лигандами нейропептидов, например антагонистами рецепторов нейропептидов, и, в частности, эти соединения являются селективными антагонистами рецепторов Y5 нейропептидов Y.
Нейропептид Y, состоящий из 36 аминокислотных остатков, широко распространен в центральной и периферической нервной системе. Этот пептид, в зависимости от типа рецептора, с которым он связывается, является медиатором различных физиологических эффектов. Эксперименты на животных показали, что нейропептид Y является мощным стимулятором потребления пищи, было также продемонстрировано, что активация рецепторов Y5 к нейропептиду Y приводит к гиперфагии и пониженному термогенезу. Таким образом, соединения, являющиеся антагонистами рецепторов к нейропептиду Y подтипа Y5, могут быть использованы для лечения пищевых расстройств, таких как ожирение и гиперфагия.
Современный подход к лечению этих заболеваний заключается в приеме медицинских препаратов, вызывающих снижение веса или предотвращающих его набор. Это достигается контролем над аппетитом, который управляется гипотоламусом, участком мозга, контролирующим прием пищи. Было показано, что у некоторых видов животных нейропептид Y (NPY) является одним из сильнейших центральных медиаторов, управляющих приемом пищи. Повышение уровня NPY приводило к повышенному потреблению пищи. Были идентифицированы различные рецепторы нейропептида Y (NPY), играющие важную роль в контроле над аппетитом и наборе веса. Взаимодействие с этими рецепторами может привести к снижению аппетита и последующему снижению веса. Снижение и долговременная стабилизация веса может играть решающую роль в снижении сопутствующих излишнему весу факторов риска, таких как артрит, заболевания сердечно-сосудистой системы, диабет и почечная недостаточность.
Следовательно, соединения формулы I могут использоваться для профилактики и лечения артрита, заболеваний сердечно-сосудистой системы, почечной недостаточности и, в особенности, для лечения и профилактики пищевых расстройств и ожирения.
Объектами настоящего изобретения являются соединения формулы I, и их вышеупомянутые соли и эфиры сами по себе, и их применение в качестве терапевтически активных веществ, способ получения упомянутых соединений, промежуточные соединения, фармацевтические композиции, лекарственные средства, содержащие указанные соединения, их фармацевтически активные соли и эфиры, применение упомянутых соединений, их солей и эфиров для профилактики и/или лечения артритов, заболеваний сердечно-сосудистой системы, диабетов, почечной недостаточности, в особенности пищевых расстройств, таких как гиперфагия и особенно ожирение, а также применение указанных соединений, их солей и эфиров для производства лекарственных средств для лечения или профилактики артритов, заболеваний сердечно-сосудистой системы, диабетов, почечной недостаточности, в особенности пищевых расстройств, таких как гиперфагия и ожирение.
В настоящем описании термин "алкил", отдельно или в комбинации, обозначает алкильную группу с прямой цепью или разветвленной цепью с 1-8 атомами углерода, предпочтительно алкильную группу с прямой или разветвленной цепью с 1-6 атомами углерода и особенно предпочтительно алкильную группу с прямой или разветвленной цепью с 1-4 атомами углерода. Примерами C1-C8 алкильных групп с прямой и разветвленной цепью являются метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, изомерные пентилы, изомерные гексилы, изомерные гептилы и изомерные октилы, предпочтительно метил и этил и наиболее предпочтительно метил.
Термин "циклоалкил", отдельно или в комбинации, обозначает циклоалкильное кольцо с 3-8 атомами углерода и предпочтительно циклоалкильное кольцо с 3-6 атомами углерода. Примерами С3-C8 циклоалкила являются циклопропил, метилциклопропил, диметилциклопропил, циклобутил, метилциклобутил, циклопентил, метилциклопентил, циклогексил, метилциклогексил, диметилциклогексил, циклогептил и циклооктил, предпочтительно циклопропил.
Термин "алкокси", отдельно или в комбинации, обозначает группу формулы алкил-O-, где термин "алкил" имеет указанное ранее значение, такое как метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси и трет-бутокси, 2-гидроксиэтокси, 2-метоксиэтокси, предпочтительно метокси и этокси и наиболее предпочтительно метокси.
Термин "арилокси", отдельно или в комбинации, обозначает группу формулы арил-O-, где термин "арил" имеет указанное ранее значение, такое как фенилокси.
Термин "арил", отдельно или в комбинации, обозначает фенильную или нафтильную группу, предпочтительно фенильную группу, которая необязательно имеет один или несколько заместителей, каждый независимо выбранный из галогена, трифторметила, амино, алкила, алкокси, алкилкарбонила, циано, карбамоила, алкоксикарбамоила, метилендиокси, карбокси, алкоксикарбонила, аминокарбонила, алкиламинокарбонила, диалкиламинокарбонила, гидрокси, нитро и т.п., такую как фенил, хлорфенил, трифторметилфенил, хлорфторфенил, аминофенил, метилкарбонилфенил, метоксифенил, метилендиоксифенил, 1-нафтил и 2-нафтил. Предпочтительным является фенил, 3-хлорфенил, 3-трифторметилфенил, 3-аминофенил, 4-метилкарбонилфенил, 4-метоксифенил и особенно фенил.
Термин "аралкил", отдельно или в комбинации, обозначает определенную выше алкильную или циклоалкильную группу, в которой один или несколько, предпочтительно один атом водорода замещен арильной группой, определенной выше. Предпочтительными являются бензил, бензил, замещенный гидрокси, алкокси или галогеном, предпочтительно фтором. Особенно предпочтительным является бензил.
Термин "гетероциклил", отдельно или в комбинации, обозначает насыщенный, частично ненасыщенный или ароматический 4-10-членный гетероцикл, содержащий один или несколько, предпочтительно один или два, гетероатома, выбранные из азота, кислорода или серы, где кислород и особенно азот являются предпочтительными. При желании гетероцикл может быть замещен по одному или нескольким углеродным атомам галогеном, алкилом, алкокси, оксо, циано, галоалкилом, предпочтительно трифторметилом и гетероциклилом, предпочтительно морфолинилом и пиррилидинилом, и/или по вторичному атому азота (т.е. -NH-) алкилом, циклоалкилом, аралкоксикарбонилом, алканоилом, фенилом или фенилалкилом, или по третичному атому азота (т.e. =N-) оксидогруппой, где галоген, алкил, циклоалкил и алкокси являются предпочтительными. Термин "гетероциклил" включает также гетероарил. Примерами гетероциклических групп являются пиридинил, пирролидинил, пиперидинил, морфолинил, пиперазинил, 3,4-дигидро-1Н-изохинолинил, азепанил, тетрагидрофуранил и тиофенил, причем каждое из этих колец может содержать один или несколько, предпочтительно один или два, заместителя, независимо выбранных из алкила, алкокси, галогена, трифторметила, циано, морфолинила и пирролидинила. Предпочтительными примерами гетероцикла являются пиридинил, пирролидинил, пиперидинил, морфолинил, тиофенил, тетрагидрофуранил и фурил, причем каждое из этих колец может содержать один или несколько, предпочтительно один или два, заместителя, выбранных из алкила, алкокси, галогена, трифтрометила и циано. Особенно предпочтительными примерами гетероцикла являются пирролидинил, пиридинил или фурил, причем каждое из этих колец может быть необязательно замещено галогеном или циано, предпочтительно фтором, хлором или циано.
Термин "гетороарил", отдельно или в комбинации, обозначает ароматический 5-10-членный гетероцикл, который содержит один или несколько, предпочтительно один или два гетероатома, выбранных из азота, кислорода или серы, где азот или кислород являются предпочтительными. При желании гетероцикл может быть замещен по одному или нескольким атомам углерода галогеном, алкилом, алкокси, циано, галоалкилом, гетероциклилом, предпочтительно трифторметилом. Предпочтительно гетероарильными циклами являются пиридинил или тиофенил, необязательно замещенные одним или несколькими, предпочтительно одним или двумя, заместителями, независимо выбранными из галогена, алкила, алкокси, циано и галоалкила, предпочтительно трифторметилом.
Термин "амино", отдельно или в комбинации, обозначает первичную, вторичную или третичную аминогруппу, связанную через атом азота, со вторичной аминогруппой, несущей алкильный или циклоалкильный заместитель, и третичной аминогруппой, несущей два одинаковых или различных алкильных или циклоалкильных заместителя, или два азотных заместителя вместе образуют кольцо, такие как, например, -NH2, метиламино, этиламино, диметиламино, диэтиламино, метилэтиламино, пирролидинил-1-ил или пиперидино и т.д., предпочтительно амино, диметиламино и диэтиламино и особенно первичная аминогруппа.
Термин "галоген" обозначает фтор, хлор, бром или йод и предпочтительно фтор, хлор или бром.
Термин "карбонил", отдельно или в комбинации, обозначает группу -С(O)-.
Термин "гидроксиалкил", отдельно или в комбинации, обозначает аклильную группу, подходящую под определение, данное выше, в которой один или несколько, предпочтительно один атом водорода замещен гидроксигруппой.
Термин "циано", отдельно или в комбинации, обозначает группу -CN.
Термин "гетероциклилокси", отдельно или в комбинации, обозначает группу гетероциклил-O-, где термин гетероциклил подходит под определение, данное выше.
Термин "ацетиламино", отдельно или в комбинации, обозначает группу -NH-CO-СН3.
Термин "фармацевтически приемлемые соли" обозначает соли, которые сохраняют биологическую эффективность и свойства свободных оснований или свободных кислот, которые не являются биологически или иным образом нежелательными. Такие соли получают с неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и др., предпочтительно соляная кислота, и органическими кислотами, такими как уксусная кислота, пропионовая кислота, гликолевая кислота, пирувиновая кислота, щавелевая кислота, малеиновая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота, N-ацетилцистеин и т.д. Кроме того, эти соли могут быть получены добавлением неорганического основания или органического основания со свободной кислотой. Соли, полученные из неорганического основания, включают, но не ограничиваются ими, соли натрия, калия, лития, аммония, кальция, магния и т.д. Соли, полученные из органических оснований, включают, но не ограничиваются ими, соли первичных, вторичных и третичных аминов, замещенных аминов, включая природные замещенные амины, циклические амины и основные ионообменные смолы, такие как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин, этаноламин, лизин, аргинин, N-этилпиперидин, пиперидин, полиминовые смолы и т.д. Соединение формулы I может также присутствовать в форме цвиттерионов. Особенно предпочтительными фармацевтически приемлемыми солями соединений формулы I являются гидрохлориды.
Соединения формулы I могут быть также сольватированы, например гидратированы. Сольват может быть получен в процессе производства или может быть получен, например, в результате гигроскопических свойств первоначально безводного соединения формулы I (гидратация). Термин фармацевтически приемлемые соли также включает физиологически приемлемые сольваты.
"Фармацевтически приемлемые эфиры" обозначает, что соединения общей формулы (I) могут быть дериватизированы по функциональным группам с получением производных, которые способны превращаться обратно в исходные соединения in vivo. Примеры таких соединений включают физиологически приемлемые и метаболически лабильные эфирные производные, такие как метоксиметиловые эфиры, метилтиометиловые эфиры и пивалоилоксиметиловые эфиры. Кроме того, любые физиологически приемлемые эквиваленты соединений общей формулы (I), подобные метаболически лабильным эфирам, которые способны преобразовываться в исходные соединения общей формулы (I) in vivo, входят в объем настоящего изобретения.
Термин "ингибитор липазы" относится к соединениям, которые способны ингибировать действия липаз, например желудочных и панкреатических липаз. Например, орлистат и липстатин, как описано в US 4598089, являются сильными ингибиторами липаз. Липстатин является природным продуктом микробного происхождения, а орлистат является результатом гидрирования липстатина. Другой ингибитор липаз включает класс соединений, обычно упоминаемый как панклицины. Панклицины являются аналогами орлистата (Mutoh и др., 1994). Термин "ингибитор липазы" относится также к полимерным связывающим липазы ингибиторам, например, описанным в WO 99/34786 (Geltex Pharmaceuticals Inc). Эти полимеры характеризуются тем, что они были замещены одной или несколькими группами, которые ингибируют липазы. Термин "ингибитор липазы" также включает фармацевтически приемлемые соли этих соединений. Термин "ингибитор липазы" предпочтительно относится к орлистату.
Орлистат является известным соединением, полезным для контроля или профилактики ожирения и гиперлипидемии. См. US 4598089 от 01.07.1986, который также раскрывает способы получения орлистата, и US 6004996, который раскрывает соответствующие фармацевтические композиции. Далее подходящие фармацевтические композиции описаны, например, в WO 00/09122 и WO 00/09123. Дополнительные способы получения орлистата раскрыты в европейских патентных заявках ЕР 185359, 189577, 443449 и 524495.
Предпочтительно орлистат вводится орально в дозе от 60 до 720 мг в день в раздельных дозах два-три раза в день. Предпочтительно субъекту вводится доза от 180 до 360 мг, наиболее предпочтительно 360 мг в день ингибитора липазы, предпочтительно в раздельных дозах два или, особенно, три раза в день. Субъект - предпочтительно полный или толстый человек, то есть человек с показателем массы тела 25 или выше. Вообще предпочтительно, чтобы ингибитор липазы вводился приблизительно через один или два часа после приема пищи, содержащей жир. Вообще, для введения определенного выше ингибитора липазы предпочтительно, чтобы лечение проводилось для человека с наследственным ожирением и индексом массы тела 25 или выше.
Орлистат может вводиться людям в обычных оральных композициях, таких как таблетки, покрытые таблетки, твердые и мягкие желатиновые капсулы, эмульсии или суспензии. Примерами носителей, которые могут использоваться для таблеток, покрытых таблеток, драже и твердых желатиновых капсул, являются лактоза, другие сахара и сахарные спирты, подобно сорбиту, манниту, мальтодекстрину или другие наполнители; поверхностно-приемлемые вещества, подобно лаурилсульфату натрия, Brij 96 или Tween 80; дезинтегрирующие вещества, подобно натрийгликолированному крахмалу, кукурузному крахмалу или его производным; полимеры, подобно повидону, кросповидону; тальк; стеариновая кислота или ее соли и т.п. Подходящими носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и т.п. Кроме того, фармацевтические составы могут содержать консервирующие агенты, солюбилизаторы, стабилизирующие агенты, увлажняющие агенты, эмульсифицирующие агенты, подслащивающие агенты, красители, отдушки, соли для изменения осмотического давления, буферы, покрывающие агенты и антиоксиданты. Они могут также содержать другие терапевтически полезные вещества. Составы могут быть удобно представлены в единичных дозированных формах и могут быть получены любыми методами, известными в фармацевтической области. Предпочтительно, орлистат вводится в соответствии с формулировкой, показанной в примерах и в US 6004996, соответственно.
Соединения формулы I могут содержать несколько асимметричных центров и могут присутствовать в форме оптически чистых энантиомеров, смесей энантиомеров, таких как, например, рацематы, оптически чистых диастереоизомеров, смесей диастереоизомеров, диастереоизомерных рацематов или смесей диастереоизомерных рацематов.
В номенклатуре, используемой в настоящем описании, атомы хиназолинового кольца пронумерованы следующим образом:

Предпочтительными являются соединения формулы I и их фармацевтически активные соли, особенно соединения формулы I.
Другими предпочтительными являются соединения формулы I, где R2 представляет собой алкил, в особенности метил.
Другими предпочтительными являются соединения формулы I, где R3 представляет собой водород.
Другими предпочтительными являются соединения формулы I, где R1 представляет собой -O-R4.
Другими предпочтительными являются соединения формулы I, где R1 представляет собой -N(R5)(R6).
Также предпочтительными являются соединения формулы I, где R4 представляет собой водород, аралкил, гетероциклилалкил или циклоалкилалкил. Особенно предпочтительными являются соединения формулы I, где R4 представляет собой бензил или пиридинилметил, замещенные циано, фтором или хлором.
Предпочтительными являются соединения формулы I, в которых R1 представляет собой -N(R5)(R6) и один из R5 или R6 является водородом, а второй может быть выбран из алкила, циклоалкила, циклоалкилалкила, алкилкарбонила, циклоалкилкарбонила, арила, аралкила, арилкарбонила, алкоксиалкила, гидроксиалкила, гетероциклила, гетероциклилалкила, гетероциклилкарбонила, алкил-SO2-, арил-SO2-, гетероциклил-SO2- или амино-SO2-.
Другими предпочтительными вариантами осуществления настоящего изобретения являются соединения формулы I, в которых R5 и R6 независимо выбраны из водорода, алкила, циклоалкила, арила, аралкила, гетороциклила или гетероциклилкарбонила. Особенно предпочтительными являются соединения формулы I, в которых R5 или R6 представляет собой водород, а второй представляет собой алкил, пиридинил или фуранилкарбонил.
Также предпочтительными являются соединения формулы I, где А является 5-7-членным насыщенным гетероциклическим кольцом, содержащим атом азота, присоединенный к хиназолиновому кольцу, где кольцо А может быть необязательно замещено одним или несколькими заместителями, предпочтительно одним заместителем, независимо выбранным из галогена, алкила, алкокси, галоалкокси, циклоалкилалкокси, гидрокси, амино, ацетиламино, циано, гидроксиалкила, алкоксиалкила, галоалкоксиалкила и циклоалкилалкоксиалкила. Также предпочтительными являются соединения формулы I, где А является 5-6-членным насыщенным гетероциклическим кольцом, предпочтительно 5-членным насыщенным гетероциклическим кольцом, содержащим атом азота, присоединенный к хиназолиновому кольцу, где кольцо А может быть необязательно замещено одним или несколькими заместителями, предпочтительно одним заместителем, независимо выбранным из галогена, алкила, алкокси, галоалкокси, циклоалкилалкокси, гидрокси, амино, ацетиламино, циано, гидроксиалкила, алкоксиалкила, галоалкоксиалкила и циклоалкилалкоксиалкила.
Другим предпочтительным вариантом осуществления настоящего изобретения являются соединения формулы I, где кольцо А является 5-членным насыщенным гетероциклическим кольцом, содержащим атом азота, присоединенный к хиназолиновому кольцу, и где кольцо А необязательно замещено одним или несколькими заместителями, предпочтительно одним заместителем, выбранным из алкокси, гидрокси или гидроксиалкила. Особенно предпочтительными являются соединения формулы I, в которых кольцо А представляет собой пирролидинил или пирролидинил, замещенный алкокси, гидрокси или гидроксиалкилом.
Наиболее предпочтительными являются соединения формулы I, где кольцо А представляет собой пирролидинил или пирролидинил, замещенный гидроксиметилом, метокси или этокси.
Примерами соединений формулы (I) являются
1. 7-бензилокси-2-метил-4-пирролидин-1-илхиназолин;
2. 2-метил-4-пирролидин-1-илхиназолин-7-ол;
3. 4-(2-метил-4-пирролидин-1-илхиназолин-7-илоксиметил)бензонитрил;
4. 7-(2-хлоропиридин-3-илметокси)-2-метил-4-пирролидин-1-илхиназолин;
5. 2-(2-метил-4-пирролидин-1-илхиназолин-7-илоксиметил)бензонитрил;
6. 7-(2-фторопиридин-3-илметокси)-2-метил-4-пирролидин-1-илхиназолин;
7. 5-(2-метил-4-пирролидин-1-илхиназолин-7-илоксиметил)пиридин-2-карбонитрил;
8. 7-циклопропилметокси-2-метил-4-пирролидин-1-илхиназолина гидрохлорид;
9. 4-(2-метил-4-пирролидин-1-илхиназолин-7-илокси)бензонитрила гидрохлорид;
10. (S)-[1-(7-бензилокси-2-метилхиназолин-4-ил)пирролидин-2-ил]метанол;
11. (S)-4-(2-гидроксиметилпирролидин-1-ил)-2-метилхиназолин-7-ол;
12. (S)-4-[4-(2-гидроксиметилпирролидин-1-ил)-2-метилхиназолин-7-илоксиметил]бензонитрил;
13. (S)-{1-[7-(2-хлоропиридин-3-илметокси)-2-метилхиназолин-4-ил]пирролидин-2-ил}метанол;
14. (S)-{1-[7-(2-фторопиридин-3-илметокси)-2-метилхиназолин-4-ил]пирролидин-2-ил}метанол;
15. (S)-5-[4-(2-гидроксиметилпирролидин-1-ил)-2-метилхиназолин-7-илоксиметил]пиридин-2-карбонитрил;
16. (S)-[1-(7-циклопропилметокси-2-метилхиназолин-4-ил)пирролидин-2-ил]метанол;
17. (S)-7-бензилокси-4-(3-этоксипирролидин-1-ил)-2-метилхиназолин;
18. (S)-4-(3-этоксипирролидин-1-ил)-2-метилхиназолин-7-ол;
19. (S)-4-[4-(3-этоксипирролидин-1-ил)-2-метилхиназолин-7-илоксиметил]бензонитрил;
20. (S)-1-(7-бензилокси-2-метилхиназолин-4-ил)пирролидин-3-ол;
21. (S)-4-(3-гидроксипирролидин-1-ил)-2-метилхиназолин-7-ол;
22. (S)-4-[4-(3-гидроксипирролидин-1-ил)-2-метилхиназолин-7-илоксиметил]бензонитрила гидрохлорид;
23. циклопропилметил-(2-метил-4-пирролидин-1-илхиназолин-7-ил)амин;
24. изобутил-(2-метил-4-пирролидин-1-илхиназолин-7-ил)амин;
25. (2,2-диметилпропил)-(2-метил-4-пирролидин-1-илхиназолин-7-ил)амин;
26. (2-хлоробензил)-(2-метил-4-пирролидин-1-илхиназолин-7-ил)амин;
27. (2-метилбензил)-(2-метил-4-пирролидин-1-илхиназолин-7-ил)амин;
28. 4-(2-метил-4-пирролидин-1-илхиназолин-7-иламино)бензонитрил;
29. (4-фторофенил)-(2-метил-4-пирролидин-1-илхиназолин-7-ил)амин;
30. (2-метил-4-пирролидин-1-илхиназолин-7-ил)пиридин-3-иламин;
31. (2-метил-4-пирролидин-1-илхиназолин-7-ил)амид фуран-2-карбоновой кислоты;
32. (S)-[4-(3-этоксипирролидин-1-ил)-2-метилхиназолин-7-ил]пиридин-3-иламин;
33. (S)-[4-(3-этоксипирролидин-1-ил)-2-метилхиназолин-7-ил]-(4-фторофенил)амин и
34. (S)-[4-(3-метоксипирролидин-1-ил)-2-метилхиназолин-7-ил]пиридин-3-иламин.
Примерами наиболее предпочтительных соединений формулы (I) являются
4-(2-метил-4-пирролидин-1-илхиназолин-7-илоксиметил)бензонитрил;
7-(2-хлоропиридин-3-илметокси)-2-метил-4-пирролидин-1-илхиназолин;
7-(2-фторопиридин-3-илметокси)-2-метил-4-пирролидин-1-илхиназолин;
(S)-{1-[7-(2-хлоропиридин-3-илметокси)-2-метилхиназолин-4-ил]пирролидин-2-ил}метанол;
(S)-4-[4-(3-этоксипирролидин-1-ил)-2-метилхиназолин-7-илоксиметил]бензонитрил;
изобутил-(2-метил-4-пирролидин-1-илхиназолин-7-ил)амин;
(2-метил-4-пирролидин-1-илхиназолин-7-ил)пиридин-3-иламин;
(2-метил-4-пирролидин-1-илхиназолин-7-ил)амид фуран-2-карбоновой кислоты;
(S)-[4-(3-этоксипирролидин-1-ил)-2-метилхиназолин-7-ил]пиридин-3-иламин и
(S)-[4-(3-метоксипирролидин-1-ил)-2-метилхиназолин-7-ил]пиридин-3-иламин.
Объектом изобретения является способ получения соединений формулы I.
Заместители и обозначения, используемые в нижеследующем описании способов, имеют значения, указанные выше, кроме особо оговоренных случаев.
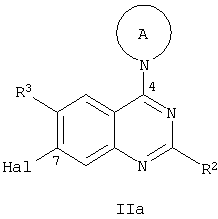
Соединения общей формулы Ia, где R1 представляет собой N(R5)(R6), могут быть получены по схеме 1 из соединений общей формулы IIa (Hal обозначает Cl, Br или I), содержащих заместители R2 и R3 и А, отвечающие приведенным выше обозначениям, по реакции, подобной конденсации по Бухвальду, катализируемой Pd из соответствующих аминов, амидов или сульфонамидов, например, с применением в качестве катализатора Pd(OAc)2, BINAP (2,2 бис(дифенилфосфино)-1,1-бинафтил) или Xanthphos в качестве хелатирующего фосфинового лиганда, NaOtBu или карбоната цезия в качестве основания, в растворителе, таком как толуол или диоксан, при умеренной температуре (S.L.Buchwald in: J. Am. Chem. Soc., 1996, с.10333; Асе. Chem. Res., 1998, с.805; Org Lett., 2000, 2, с.1104).
Альтернативным способом получения этих соединений является реакция Ульмана, в диоксане или ДМФА в присутствии хлорида или йодида Cu(I), аналогично методике, описанной S.L.Buchwald (J. Am. Chem. Soc., 2001, с.7727).

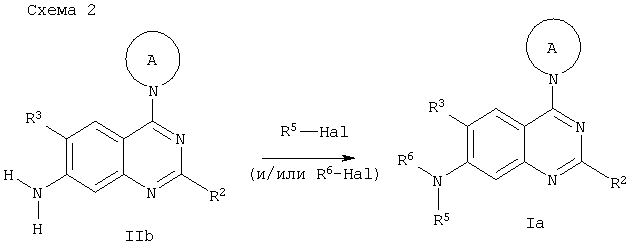
Альтернативно, соединения общей формулы Ia могут быть получены из соединений общей формулы IIb по схеме 2, с применением подходящей последовательности реакций алкилирования соответствующими галогеналкилами в присутствии основания, такого как гидрид натрия, в ТГФ или ДМСО. Для производных, в которых R5, R6 представляет собой арил или гетероарил, возможно применение реакций образования C/N связи по типу конденсации Бухвальда, катализируемой Pd, или конденсации по Ульману, с арил- и гетероарилгалогенидами, как это описано выше. Соединения, в которых R5, R6 представляет собой алкилкарбонил, арилкарбонил, гетероциклилкарбонил, арил-, гетероарил-, алкил- или амино- сульфонил, могут быть получены из соединений общей формулы IIb реакцией ацилирования (или сульфирования) с применением соответствующих ацилгалидов или сульфонилхлоридов в присутствии основания, например, ДМАП или триэтиламина в таких растворителях, как ТГФ или ДМФА, или хлористый метилен. Hal на схеме 2 обозначает хлор, бром или йод. Для соединений, в которых R2 представляет собой амин, введение защитных групп на аминогруппы до проведения описанных выше реакций является предпочтительным. Это может быть достигнуто, например, ацилированием аминогруппы (например, ацетилхлоридом) подходящего промежуточного соединения в реакционной схеме, указанной ниже, с применением стандартных условий, известных из уровня техники. Ацильная группа впоследствии может быть удалена гидролизом.
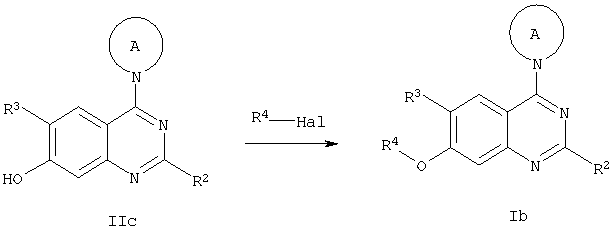
Соединения общей формулы Ib, в которых R1 представляет собой O-R4, могут быть получены по схеме 3 из соединений общей формулы IIc, содержащих заместители R2 и R3, подходящие под данные выше определения, реакцией алкилирования или сульфирования с применением соответствующих галидов или сульфонилхлоридов, в присутствии основания, например, К2СО3, в подходящем растворителе, например, ДМФА. При изменении последовательности реакций возможно введение радикала R4 в подходящие промежуточные соединения в реакционной последовательности, указанной ниже, до введения заместителей по 4-му положению хинолина.

Соединения общей формулы Ib также могут быть получены по схеме 3 из соединений общей формулы IIa с применением соответствующих спиртов R4ОН реакцией образования С/О связи, катализируемой Pd, с применением, например, Pd(OAc)2 в качестве катализатора, 2-(ди-трет-бутилфосфино)-1,1'-бинафтила в качестве лиганда, Cs2СО3 в качестве основания, толуола в качестве растворителя (аналогично методике: S.L.Buchwald, J. Am. Chem. Soc., 2001, 123, с.10770). Альтернативным способом получения является конденсация Ульмана с применением, например, йодида Cu(I) в качестве катализатора, Cs2СО3 в качестве основания, толуола в качестве растворителя, в присутствии каталитических количеств 1,10-фенантролина, аналогично ранее описанной методике S.L.Buchwald (Org. Letters, 2002, с.973).
Способ получения соединений общей формулы IIa-с представлен на схемах 4 и 5.
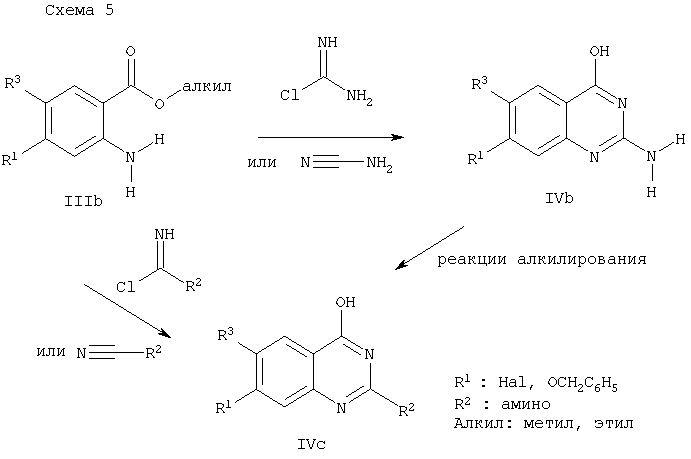
В случае соединений, в которых R2 представляет собой алкил, согласно схеме 4, исходными соединениями являются соответствующие производные 2-аминобензойной кислоты IIIa, которые либо ранее описаны в уровне техники, либо могут быть получены по стандартным методикам. Следующие стадии реакции проводятся по известным стандартным методикам. Так, реакция соединений общей формулы IIIa с хлоридами алкилкарбоновой кислоты в присутствии третичных аминов, например триэтиламина, каталитических количеств 4-диметиламинопиридина (ДМАП) и карбоната аммония, в ДМФА приводит к получению соответствующих хиназолинов общей формулы IVa. Альтернативным способом получения соединений IVa является реакция соединений IIIa с соответствующими алкилиминоэфирами в растворителе, например в метаноле, в присутствии основания, например триэтиламина, при температуре кипения реакционной смеси. Превращение в соответствующие хлорхиназолиновые производные общей формулы Va осуществляется с применением POCl3 при температуре кипения реакционной смеси, необязательно в присутствии N,N-диметиланилина, по стандартной методике, описанной в уровне техники. Последующая реакция с соответствующими аминами, обозначенными выше, либо с применением большого избытка амина без растворителя, либо с применением 2-кратного избытка амина в подходящем растворителе, таком как N-метилпирролидон, ксилол, этанол или ТГФ, необязательно в присутствии каталитических количеств NaI, с применением пиридина в качестве основания, приводит к образованию соединений общей формулы IIa и IIc (после отщепления бензилового эфира гидрированием). Соединения общей формулы IIb могут быть получены из соединений общей формулы IIa реакцией конденсации с бензофенонимином, катализируемой палладием, с последующим гидролизом по методу, описанному S.L.Buchwald (Tetrahedron Lett., 1997, с.6367).

Соединения общей формулы IIa-с, в которых R2 представляет собой NH2 или амино, могут быть получены по схеме 5. Так, эфиры 2-аминобензойной кислоты общей формулы IIIb (или аналогичные производные) могут быть превращены в хиназолины общей формулы IVb обработкой гидрохлоридом хлороформамидина в ДМСО в качестве растворителя (аналогичная реакция см.: J. Med. Chem., 1990, с.2045) или реакцией с цианамидом в присутствии HCl с последующей обработкой основанием, например NaOH (аналогичная реакция см.: J. Med. Chem., 2000, с.4288). NH2 группа в соединениях IVb может быть затем селективно проалкилирована реакцией с соответствующими алкилгадидами по известным методикам, приводя к соединениям общей формулы IVc. Другой способ получения соединений IVc реакцией соединений IIIb с замещенными цианамидами или хлороамидинами представлен на схеме 5. Последовательность превращений соединений общей формулы IVb и IVc в соединения общей формулы IIa-с, в которых R2 представляет собой амино, представлена на схеме 4.
Превращение соединений общей формулы I в фармацевтически приемлемые соли может быть осуществлено обработкой такого соединения неорганической кислотой, например, галогенводородной кислотой, такой как, например, соляная кислота, бромистоводородная кислота, серной кислотой, азотной кислотой, фосфорной кислотой и др. или обработкой органической кислотой, например, уксусной кислотой, лимонной кислотой, малеиновой кислотой, фумаровой кислотой, винной кислотой, метансульфокислотой, n-толуолсульфокислотой. При обработке соединений общей формулы I физиологически совместимыми основаниями возможно также получение соответствующих солей карбоновых кислот.
Превращение соединений общей формулы I в соответствующие фармацевтически приемлемые эфиры или амиды может быть осуществлено, например, обработкой подходящих амино- или гидроксильных групп, присутствующих в молекулах, карбоновой кислотой, например, уксусной кислотой, с применением конденсирующего реагента, например, гексафторофосфата бензотриазол-1-илокситрис(диметиламино)фосфония (ВОР) или N,N-дициклогексилкарбодиимида (DCCI) с получением эфира карбоновой кислоты или амида карбоновой кислоты.
Предпочтительный способ получения соединений формулы I включает одну из следующих реакций:
а) реакцию соединения общей формулы IIa с R6(R5)NH с получением соединения общей формулы Ia

где радикалы R2, R3, R5, R6 и А имеют значения, указанные выше, a Hal обозначает хлор, бром или йод;
б) реакцию соединения общей формулы IIb с R5-Hal и/или R6-Hal с получением соединения общей формулы Ia

где радикалы R2, R3, R5, R6 и А имеют значения, указанные выше, a Hal обозначает хлор, бром или йод;
в) реакцию соединения общей формулы IIc с R4-Hal с получением соединения общей формулы Ib

где радикалы R2, R3, R4 и А имеют значения, указанные выше, a Hal обозначает хлор, бром или йод;
г) реакцию соединения общей формулы IIa с R4-ОН с получением соединения общей формулы Ib
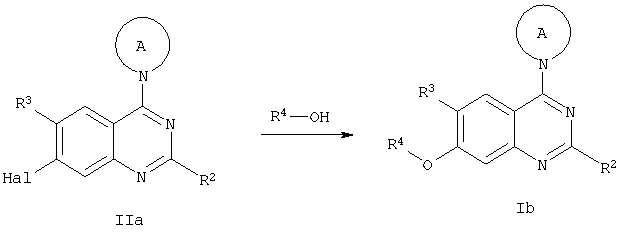
где радикалы R2, R3, R4 и А имеют значения, указанные выше, a Hal обозначает хлор, бром или йод.
Предпочтительными промежуточными соединениями являются:
7-бензилокси-4-хлор-2-метилхиназолин;
7-бром-2-метил-4-пирролидин-1-илхиназолин;
(S)-7-бром-4-(3-этоксипирролидин-1-ил)-2-метилхиназолин и
(S)-7-бром-4-(3-метоксипирролидин-1-ил)-2-метилхиназолин.
Другим объектом изобретения являются также соединения формулы I, описанные выше, для применения в качестве фармацевтически активных веществ.
Также объектом изобретения являются описанные выше соединения для получения лекарственных средств для профилактики и лечения заболеваний, вызываемых нарушениями, связанными с рецептором NPY, особенно для получения лекарственных средств для профилактики и лечения артритов, заболеваний сердечно-сосудистой системы, диабетов, почечной недостаточности и, особенно, пищевых расстройств и ожирения.
Также объектом изобретения являются фармацевтические композиции, содержащие соединение формулы I, описанное выше, и терапевтически инертный носитель.
Объектом изобретения является также применение описанных выше соединений для получения лекарственных средств, особенно для лечения и профилактики артритов, заболеваний сердечно-сосудистой системы, диабетов, почечной недостаточности и, особенно, пищевых расстройств и ожирения.
Другим объектом изобретения являются соединения, полученные в соответствии с одним из указанных выше способов.
Другим объектом изобретения является способ лечения и профилактики артритов, заболеваний сердечно-сосудистой системы, диабетов, почечной недостаточности и, особенно, пищевых расстройств и ожирения, заключающийся во введении эффективного количества описанного выше соединения.
Следующим аспектом изобретения является способ лечения ожирения у людей, нуждающихся в таком лечении, который включает введение человеку терапевтически эффективного количества соединения формулы I и терапевтически эффективного количества ингибитора липазы, особенно предпочтительно, где ингибитором липазы является орлистат. Также объектом настоящего изобретения является упомянутый способ, в котором введение может проводиться одновременно, раздельно или последовательно.
Другим предпочтительным вариантом осуществления настоящего изобретения является применение соединения формулы I для производства лекарственного средства для лечения и профилактики ожирения у пациента, также проходящего лечение ингибитором липазы, особенно предпочтительно орлистатом.
Другим объектом изобретения являются также описанные выше соединения для производства лекарственных средств для лечения и профилактики алкоголизма.
Другим объектом изобретения является способ лечения и профилактики алкоголизма.
Методы анализа
Клонирование кДНК рецепторов NPY5 мышей:
Цельную кДНК, кодирующую рецепторы NPY5 мыши (mNPY5) амплифицировали из кДНК мозга мыши с применением специфических праймеров, сконструированных на основе опубликованной в литературе последовательности, и Pfu ДНК-полимеразы. Продукт амплификации субклонировали в вектор экспрессии млекопитающего pcDNA3, используя сайты рестрикции Eco RI и XhoI. Положительные клоны секвенировали и один клон, кодирующий известную опубликованную последовательность, выбирали для дальнейшего производства стабильных клеточных клонов.
Стабильная трансфекция:
Клетки почки человеческого эмбриона 293 (НЕК293) подвергали трансфекции с 10 мкг mNPY5 ДНК с применением липофектамина. Через два дня после трансфекции инициировали селекцию генетицином (1 мг/мл) и отбирали несколько стабильных клонов. Один из клонов в дальнейшем использовали для фармацевтических характеристик.
Конкурентное связывание с радиоактивно меченными лигандами:
Клетки почки человеческого эмбриона 293 (НЕК293), экспрессирующие рекомбинантный рецептор NPY5 мыши (mNPY5), разрушали трехкратным циклом замораживания/оттаивания в гипотоническом Трис буфере (5 мМ, рН 7,4, 1 мМ MgCl2), затем гомогенизировали и центрифугировали при 72,000 об/мин в течение 15 минут. Осадок дважды промывали 75 мМ Трис буфером, рН 7,4, содержащим 25 мМ MgCl2, 250 мМ сахаразы, 0,1 мМ фенилметилсульфонилфторида и 0,1 мМ 1,10-фенантролина, суспендировали в том же самом буфере, и аликвоты хранили при -80°С. Белок определяли по методу Лори, с применением в качестве стандарта бычьего сывороточного альбумина (БСА).
Исследование конкурентного связывания с радиоактивно меченными лигандами проводили в 250 мкл 25 мМ Hepes буфере (рН 7,4, 2,5 мМ CaCl2, I мМ MgCl2, 1% бычьего сывороточного альбумина и 0,01% NaN3), содержащем 5 мкг белка, 100 пМ [125I] меченного пептида YY (PYY) и 10 мкл ДМСО, содержащего значительное количество немеченых тестируемых соединений. После инкубирования в течение 1 часа при 22°С связанные и свободные лиганды отделяли фильтрацией через фильтры из стекловолокна. Неспецифическое связывание оценивали в присутствии 1 мкМ немеченого PYY. Специфическое связывание определяли по разнице между общим связыванием и неспецифическим связыванием. Значения IC50 определялись как концентрация антагониста, который замещает 50% связывания [125I] меченного нейропептида Y. Эти значения определяли линейным регрессионным анализом после перевода полученных данных о связывании в logit/log значения.
Результаты, полученные в описанном тесте с применением некоторых из соединений по изобретению в качестве тестируемых соединений, представлены в таблице:
Предпочтительные соединения, описанные выше, обладали значениями IC50 менее 1000 нМ; более предпочтительные соединения обладали значениями IC50 менее 100 нМ, в особых случаях менее 10 нМ. Самые предпочтительные соединения обладали значениями IC50 менее 2 нМ. Эти результаты были получены с применением вышеописанного теста.
Соединения общей формулы I и их фармацевтически приемлемые соли и эфиры могут быть использованы в качестве лекарственных средств (например, в форме фармацевтических препаратов). Фармацевтические препараты могут вводиться внутренне, например, орально (например, в форме таблеток, покрытых таблеток, драже, твердых и мягких желатиновых капсул, сиропов, эмульсий или суспензий), назально (например, в форме назальных спреев) или ректально (например, в форме свечей). Однако введение также может осуществляться парентерально, например, внутримышечно или внутривенно (например, в форме растворов для инъекций).
Соединения общей формулы I и их фармацевтически приемлемые соли и эфиры могут быть обработаны фармацевтически инертными неорганическими или органическими адъювантами для получения таблеток, покрытых таблеток, драже и твердых желатиновых капсул. В качестве таких адъювантов для получения таблеток, драже и твердых желатиновых капсул могут быть использованы, например, лактоза, кукурузный крахмал и его производные, тальк, стеариновая кислота или ее соли и т.д.
Подходящими адъювантами для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые субстанции, жидкие полиолы и т.д.
Подходящими адъювантами для производства растворов и сиропов являются, например, вода, полиолы, сахароза, инвертированный сахар, глюкоза и т.д.
Подходящими адъювантами для получения растворов для инъекций являются, например, вода, спирты, полиолы, глицерин, растительные масла и т.д.
Подходящими адъювантами для получения свечей являются, например, натуральные или отвержденные масла, воски, жиры, полутвердые или жидкие полиолы и т.д.
Кроме того, фармацевтические препараты могут содержать консерванты, солюбилизаторы, вещества, повышающие вязкость, стабилизаторы, увлажняющие агенты, эмульгаторы, подсластители, красители, отдушки, соли, влияющие на осмотическое давление, буферы, маскирующие агенты или антиоксиданты. Они также могут содержать другие терапевтически ценные вещества.
В соответствии с настоящим изобретением соединения общей формулы I и их фармацевтически приемлемые соли могут быть использованы для профилактики и лечения артритов, заболеваний сердечно-сосудистой системы, диабетов, почечной недостаточности и, в особенности, пищевых расстройств и ожирения. Дозы могут варьироваться в широком диапазоне и, конечно, должны быть установлены в соответствии с индивидуальными требованиями в каждом отдельном случае. В целом, в случае орального введения дневная доза, составляющая от 0,1 мг до 20 мг на кг веса тела, предпочтительно от 0,5 мг до 4 мг на кг (то есть около 300 мг для человека), предпочтительно делится на 1-3 раздельные дозы, которые могут состоять, при необходимости, из того же количества. Нужно, однако, понимать, что указанный выше верхний предел может быть в случае необходимости превышен.
Изобретение поясняется примерами, не имеющими ограничительного характера.
Примеры
Пример 1
а) Раствор 0,44 г (1,55 ммоль) 7-бензилокси-4-хлор-2-метилхиназолина в 1,9 мл (23,2 ммоль) пирролидина кипятили с обратным холодильником в течение 17 часов в атмосфере аргона. Реакционную смесь концентрировали в вакууме, остаток наносили на колонку с силикагелем, элюировали CH2Cl2/MeOH (от 98:2 до 95:5). Полученные фракции объединяли и концентрировали в вакууме, получая 0,31 г (58,7%) целевого 7-бензилокси-2-метил-4-пирролидин-1-илхиназолина в виде вязкого желтого масла. ISP масс-спектроскопия, m/e: 320,4 (М+1 рассчитано для С20Н21N3О: 320).
Получение исходного соединения:
б) Суспензию 1,1 г (5,64 ммоль) 2-ацетиламино-4-гидроксибензойной кислоты (получение: Recl. Trav. Chim. Pays-Bas, 1953, 72, с.195), 1,6 мл (13,53 ммоль) бензилхлорида, 3,9 г (28,18 ммоль) карбоната калия в ДМФА (15 мл) перемешивали в течение 17 часов при 80°С в атмосфере аргона. Реакционную смесь концентрировали в вакууме и остаток переносили в смесь СН2Cl2 и воды. После разделения слоев водный слой однократно экстрагировали CH2Cl2, органические слои объединяли, промывали насыщенным раствором NaCl, высушивали над MgSO4 и концентрировали в вакууме, получая 1,89 г (85,75%) целевого бензилового эфира 2-ацетиламино-4-бензилоксибензойной кислоты в виде бесцветного порошка. ISP масс-спектроскопия, m/e: 376,5 (М+1 рассчитано для C23H21NO4: 375,42).
в) Суспензию 1,87 г (4,98 ммоль) бензилового эфира 2-ацетиламино-4-бензилоксибензойной кислоты в EtOH (20 мл) обрабатывали 1N NaOH (20-30 мл) и перемешивали при 95°С-130°С (масляная баня) до полного протекания реакции по данным ТСХ и ЯМР (время реакции около 34 часов). Реакционную смесь охлаждали до комнатной температуры, значение рН доводили до рН 6 добавлением 1N водной HCl, образовавшийся осадок отфильтровывали и высушивали в высоком вакууме, получая 1,19 г (91,7%) целевой 2-амино-4-бензилоксибензойной кислоты в виде бесцветного порошка. ISP масс-спектроскопия, m/e: 242,2 (М+1 рассчитано для C14H13NO3: 242).
г) К раствору 0,695 г (5,62 ммоль) гидрохлорида этилацетоамидата в МеОН (16 мл) при перемешивании при комнатной температуре добавляли 0,82 мл (5,86 ммоль) триэтиламина, через 5 минут добавляли 1,14 г (4,69 ммоль) 2-амино-4-бензилоксибензойную кислоты. Реакционную смесь кипятили с обратным холодильником в течение 5 часов, затем охлаждали до комнатной температуры, образовавшийся осадок отфильтровывали и высушивали в высоком вакууме, получая 0,9 г (69,4%) целевого 7-бензилокси-2-метил-1H-хиназолин-4-она в виде белого порошка. ISP масс-спектроскопия, m/e: 267,3 (М+1 рассчитано для C16H14N2O2: 267).
д) Суспензию 0,9 г (3,38 ммоль) 7-бензилокси-2-метил-1Н-хиназолин-4-она в POCl3 (4,6 мл, 50 ммоль) кипятили с обратным холодильником в течение 1,5 часов. Реакционную смесь концентрировали в вакууме, остаток переносили в смесь CH2Cl2 и холодного разбавленного раствора NaHCO3 (pH 7-8). После разделения слоев водный слой дважды экстрагировали CH2Cl2. Объединенные органические фракции промывали насыщенным раствором NaHCO3, насыщенным раствором NaCl, высушивали над Mg2SO4. Растворитель отгоняли в вакууме, получая 0,45 г (47,2%) сырого 7-бензилокси-4-хлор-2-метилхиназолина в виде темно-красного воскоподобного твердого вещества, которое без дополнительной очистки использовали в следующей стадии. Rf: 0,9 (СН2Cl2/МеОН: 9/1; исходное соединение Rf: 0,7).
Пример 2
К суспензии 0,255 г (0,8 ммоль) 7-бензилокси-2-метил-4-пирролидин-1-илхиназолина, полученного как описано в примере 1, в МеОН (5 мл) прибавляли 75 мг палладия на угле (10%) и гидрировали при комнатной температуре в течение 2 часов, до полного завершения реакции по данным ВЭЖХ. Катализатор отфильтровывали, фильтрат концентрировали в вакууме. Выпавший осадок отфильтровывали и высушивали в высоком вакууме, получая 0,19 г (98%) 2-метил-4-пирролидин-1-илхиназолин-7-ола в виде желтого порошка. ISP масс-спектроскопия, m/e: 230,2 (М+1 рассчитано для С13Н15N3О: 230).
Пример 3
Смесь 90 мг (0,4 ммоль) 2-метил-4-пирролидин-1-илхиназолин-7-ола, описанного в примере 2, 130 мг (0,94 ммоль) карбоната калия и 92 мг (0,47 ммоль) 4-(бромметил)бензонитрила в ДМФА (4 мл) нагревали при 100°С в течение 2,5 часов в атмосфере аргона. Реакционную смесь охлаждали до комнатной температуры, выливали в эфир (40 мл) и перемешивали в течение 5 минут. Выпавший осадок отфильтровывали, промывали водой, эфиром и высушивали в высоком вакууме, получая 108 мг (75,2%) 4-(2-метил-4-пирролидин-1-илхиназолин-7-илоксиметил)бензонитрила в виде светло-желтого порошка. ISP масс-спектроскопия, m/e: 345,4 (М+1 рассчитано для C21H20N4O: 345).
Пример 4
Аналогично методике, описанной в примере 3, реакцией 2-метил-4-пирролидин-1-илхиназолин-7-ола с 2-хлор-3-хлорметилпиридином получали 7-(2-хлорпиридин-3-илметокси)-2-метил-4-пирролидин-1-илхиназолин в виде светло-коричневого порошка. ISP масс-спектроскопия, m/e: 355,3 (М+1 рассчитано для C19H19ClN4O: 355).
Пример 5
Аналогично методике, описанной в примере 3, реакцией 2-метил-4-пирролидин-1-илхиназолин-7-ола с 2-бромметилбензонитрилом получали 2-(2-метил-4-пирролидин-1-илхиназолин-7-илоксиметил)бензонитрил в виде бесцветного порошка. ISP масс-спектроскопия, m/e: 345,4 (М+1 рассчитано для C21H20N4O: 345).
Пример 6
Аналогично методике, описанной в примере 3, реакцией 2-метил-4-пирролидин-1-илхиназолин-7-ола с 3-хлорметил-2-фторпиридином получали 7-(2-фторпиринин-3-илметокси)-2-метил-4-пирролидин-1-илхиназолин в виде светло-коричневого порошка. ISP масс-спектроскопия, m/e: 339,3 (М+1 рассчитано для C19H19FN4O: 339).
Пример 7
Аналогично методике, описанной в примере 3, реакцией 2-метил-4-пирролидин-1-илхиназолин-7-ола с 5-хлорметилпиридин-2-карбонитрилом получали 5-(2-метил-4-пирролидин-1-илхиназолин-7-илоксиметил)пиридин-2-карбонитрил в виде светло-коричневого порошка. ISP масс-спектроскопия, m/e: 346,4 (М+1 рассчитано для C20H19N5O: 346).
Пример 8
Аналогично методике, описанной в примере 3 (с выделением целевого продукта в виде гидрохлорида), реакцией 2-метил-4-пирролидин-1-илхиназолин-7-ола с циклопропилметилбромидом получали гидрохлорид 7-циклопропилметокси-2-метил-4-пирролидин-1-илхиназолина в виде белого порошка. ISP масс-спектроскопия, m/e: 284,2 (М+1 рассчитано для С17Н21N3О: 284).
Пример 9
Аналогично методике, описанной в примере 3 (с выделением целевого продукта в виде гидрохлорида), реакцией 2-метил-4-пирролидин-1-илхиназолин-7-ола с 4-бромбензонитрилом получали гидрохлорид 4-(2-метил-4-пирролидин-1-илхиназолин-7-илокси)бензонитрила в виде белого порошка. ISP масс-спектроскопия, m/e: 331,3 (М+1 рассчитано для C20H18N4O: 331).
Пример 10
Аналогично методике, описанной в примере 1, реакцией 7-бензилокси-4-хлор-2-метилхиназолина с избытком (S)-2-(гидроксиметил)пирролидина (2,5 мольных эквивалента) в 1-метил-2-пирролидоне в качестве растворителя при 100°С получали (S)-[1-(7-бензилокси-2-метилхиназолин-4-ил)пирролидин-2-ил]метанол в виде светло-коричневого масла. ISP масс-спектроскопия, m/e: 350,5 (М+1 рассчитано для C21H23N3O2: 350).
Пример 11
Аналогично методике, описанной в примере 2, гидрированием (S)-[1-(7-бензилокси-2-метилхиназолин-4-ил)пирролидин-2-ил]метанола, описанного в примере 10, в присутствии Pd на угле (10%) в МеОН, получали (S)-4-(2-гидроксиметилпирролидин-1-ил)-2-метилхинозалин-7-ол в виде вязкого светло-желтого масла. ISP масс-спектроскопия, m/e: 260,3 (М+1 рассчитано для С14Н17N3O2: 260).
Пример 12
Аналогично методике, описанной в примере 3, реакцией (S)-4-(2-гидроксиметилпирролидин-1-ил)-2-метилхиназолин-7-ола, описанного в примере 11, с 4-бромметилбензонитрилом получали (S)-4-[4-(2-гидроксиметилпирролидин-1-ил)-2-метилхиназолин-7-илоксиметил]бензонитрил в виде светло-желтой пены. ISP масс-спектроскопия, m/e: 375,4 (М+1 рассчитано для C22H22N4O2: 375).
Пример 13
Аналогично методике, описанной в примере 3, реакцией (S)-4-(2-гидроксиметилпирролидин-1-ил)-2-метилхиназолин-7-ола, описанного в примере 11, с гидрохлоридом 2-хлор-3-хлорметилпиридина получали (S)-{1-[7-(2-хлорпиридин-3-илметокси)-2-метилхиназолин-4-ил]пирролидин-2-ил}метанол в виде бесцветного порошка. ISP масс-спектроскопия, m/e: 385,3 М+1 рассчитано для C20H21ClN4O2: 385).
Пример 14
Аналогично методике, описанной в примере 3, реакцией (S)-4-(2-гидроксиметилпирролидин-1-ил)-2-метилхиназолин-7-ола, описанного в примере 11, с гидрохлоридом 2-фтор-3-хлорметилпиридина получали (S)-{1-[7-(2-фторпиридин-3-илметокси)-2-метилхиназолин-4-ил]пирролидин-2-ил}метанол в виде белого порошка. ISP масс-спектроскопия, m/e: 369,4 (М+1 рассчитано для C20H21FN4O2: 369).
Пример 15
Аналогично методике, описанной в примере 3, реакцией (S)-4-(2-гидроксиметилпирролидин-1-ил)-2-метилхиназолин-7-ола, описанного в примере 11, с 5-хлорметилпиридин-2-карбонитрилом получали (S)-5-[4-(2-гидроксиметилпирролидин-1-ил)-2-метилхиназолин-7-илоксиметил]пиридин-2-карбонитрил в виде белого порошка. ISP масс-спектроскопия, m/e: 376,4 (М+1 рассчитано для C21H21N5O2: 376).
Пример 16
Аналогично методике, описанной в примере 3, реакцией (S)-4-(2-гидроксиметилпирролидин-1-ил)-2-метилхиназолин-7-ола, описанного в примере 11, с циклопропилметилбромидом получали (S)-[1-(7-циклопропилметокси-2-метилхиназолин-4-ил)пирролидин-2-ил]метанол в виде белого порошка. ISP масс-спектроскопия, m/e: 314,4 (М+1 рассчитано для C18H23FN3O2: 314).
Пример 17
Аналогично методике, описанной в примере 1, реакцией 7-бензилокси-4-хлор-2-метилхиназолина с избытком (S)-3-этоксипирролидина (2,5 мольных эквивалента) в 1-метил-2-пирролидоне в качестве растворителя при 100°С получали (S)-7-бензилокси-4-(3-этоксипирролидин-1-ил)-2-метилхиназолин в виде желтого порошка. ISP масс-спектроскопия, m/e: 364,3 (М+1 рассчитано для C22H25N3O2: 364).
Пример 18
Аналогично методике, описанной в примере 2, гидрированием (S)-7-бензилокси-4-(3-этоксипирролидин-1-ил)-2-метилхиназолина, описанного в примере 17, в присутствии катализатора Pd на угле (10%) в МеОН получали (S)-4-(3-этоксипирролидин-1-ил)-2-метилхиназолин-7-ол в виде вязкого светло-желтого порошка. ISP масс-спектроскопия, m/e: 274,3 (М+1 рассчитано для C15H19N3O2: 274).
Пример 19
Аналогично методике, описанной в примере 3, реакцией (S)-4-(3-этоксипирролидин-1-ил)-2-метилхиназолин-7-ола, описанного в примере 18, с 4-бромметилбензонитрилом получали (S)-4-[4-(3-этоксипирролидин-1-ил)-2-метилхиназолин-7-илоксиметил]бензонитрил в виде бесцветного порошка. ISP масс-спектроскопия, m/e: 389,3 (М+1 рассчитано для C23H24N4O2: 389).
Пример 20
Аналогично методике, описанной в примере 1, реакцией 7-бензилокси-4-хлор-2-метилхиназолина с избытком (S)-3-гидроксипирролидина (2,5 мольных эквивалента) в 1-метил-2-пирролидоне в качестве растворителя при 100°С получали (S)-1-(7-бензилокси-2-метилхиназолин-4-ил)пирролидин-3-ол в виде желтого порошка. ISP масс-спектроскопия, m/e: 336,3 (М+1 рассчитано для С20Н21N3O2: 336).
Пример 21
Аналогично методике, описанной в примере 2, гидрированием (S)-1-(7-бензилокси-2-метилхиназолин-4-ил)пирролидин-3-ола, описанного в примере 20, в присутствии Pd на угле (10%) в МеОН получали (S)-4-(3-гидроксипирролидин-1-ил)-2-метилхиназолин-7-ол в виде светло-коричневого порошка. ISP масс-спектроскопия, m/e: 246,2 (М+1 рассчитано для С13Н15N3O2: 246).
Пример 22
Аналогично методике, описанной в примере 3 (с выделением целевого продукта в виде гидрохлорида) реакцией (S)-1-(7-бензилокси-2-метилхиназолин-4-ил)пирролидин-3-ола, описанного в примере 21, с 4-бромметилбензонитрилом получали гидрохлорид (S)-4-[4-(3-гидроксипирролидин-1-ил)-2-метилхинолин-7-илоксиметил]бензонитрила в виде бесцветного порошка. ISP масс-спектроскопия, m/e: 361,3 (М+1 рассчитано для C21H20N4O2: 361).
Пример 23
а) К суспензии 0,15 г (0,513 ммоль) 7-бром-2-метил-4-пирролидин-1-илхиназолина, 21,3 мг (0,034 ммоль) рацемического BINAP, 3,8 мг (0,017 ммоль) ацетата палладия(II) и 65,8 мг (0,685 ммоль) трет-бутилата натрия в толуоле (8 мл) при комнатной температуре прибавляли 0,365 г (5,13 ммоль) аминометилциклопропана, смесь кипятили с обратным холодильником в атмосфере аргона в течение 20 часов. Реакционную смесь отфильтровывали через стекловолокнистую фильтровальную бумагу и фильтрат переносили в смесь EtOAc и воды. После разделения слоев органический слой высушивали над сульфатом натрия и концентрировали в вакууме. Остаток переносили на колонку с силикагелем, элюировали смесью СН2Cl2/МеОН/NH4ОН (10:1:0,2). Объединенные фракции концентрировали в вакууме, получая 68 мг (46,9%) целевого циклопропилметил-(2-метил-4-пирролидин-1-илхиназолин-7-ил)амина в виде вязкого коричневого масла. ISP масс-спектроскопия, m/e: 283,2 (М+1 рассчитано для C17H22N4: 283).
Получение исходного соединения:
б) К раствору 1 г (4,63 ммоль) 4-бромантраниловой кислоты (J. Org. Chem. 1997, 62, c.1240-1256), 50 мг (0,417 ммоль) 4-(диметиламино)пиридина и 2,58 мл (18,5 ммоль) триэтиламина в сухом ДМФА (5 мл) при 3°С на водно-ледяной бане в атмосфере аргона прибавляли по каплям 0,79 мл (11,1 ммоль) ацетилхлорида в течение 20 минут. Реакционную смесь нагревали до 90°С в течение 3 часов, затем порциями в течение 10 минут прибавляли 1,32 г (13,89 ммоль) карбоната аммония и смесь перемешивали при той же температуре в течение 1 часа. После охлаждения реакционную смесь выливали в воду, выпавший осадок отфильтровывали, промывали водой и высушивали в вакууме, получая 1,1 г (99,4%) 7-бром-2-метил-3Н-хиназолин-4-она в виде светло-коричневого порошка. Т.пл.>191°С (разл.). EI масс-спектроскопия, m/e: 240 (М рассчитано для C9H7BrN2O: 240).
в) К суспензии 0,45 г (1,87 ммоль) 7-бром-2-метил-3Н-хиназолин-4-она в 0,48 мл N,N-диметиланилина прибавляли 1,41 мл (15,4 ммоль) оксихлорида фосфора, реакционную смесь нагревали при 60°С в течение 2 часов. Реакционную смесь упаривали в вакууме, остаток переносили в 20 мл воды, нейтрализовали 10 мл насыщенного раствора бикарбоната натрия и дважды экстрагировали 25 мл дихлорметана. Органический слой промывали 25 мл воды, 25 мл насыщенного раствора хлорида натрия, высушивали над сульфатом магния и упаривали в вакууме. Остаток очищали колоночной хроматографией на силикагеле, используя в качестве элюента смесь гептан/этилацетат (2:1), получая 0,29 г (59%) 7-бром-4-хлор-2-метилхиназолина в виде оранжевого порошка. Т пл.>82°С. EI масс-спектроскопия, m/e: 258 (М рассчитано для C9H6BrClN2: 258).
г) Раствор 0,8 г (3,1 ммоль) 7-бром-4-хлор-2-метилхиназолина в 2 мл пирролидина кипятили с обратным холодильником в течение 12 часов. Реакционную смесь концентрировали в вакууме, остаток переносили на колонку с силикагелем, элюировали смесью СН2Cl2/МеОН (95:5). Объединенные очищенные фракции концентрировали в вакууме, получая 1 г (100%) целевого 7-бром-2-метил-4-пирролидин-1-илхиназолина в виде твердого порошка. Т.пл. 120-122°С. ISP масс-спектроскопия, m/e: 292,2 (М+1 рассчитано для С13Н14BrN3: 292).
Пример 24
Аналогично методике, описанной в примере 23, реакцией 7-бром-2-метил-4-пирролидин-1-илхиназолина с изобутиламином получали изобутил-(2-метил-4-пирролидин-1-илхиназолин-7-ил)амин в виде светло-коричневого аморфного порошка. ISP масс-спектроскопия, m/e: 285,3 (М+1 рассчитано для C17H24N4: 284,4).
Пример 25
Аналогично методике, описанной в примере 23, реакцией 7-бром-2-метил-4-пирролидин-1-илхиназолина с 2,2-диметилпропиламином получали (2,2-диметилпропил)-(2-метил-4-пирролидин-1-илхиназолин-7-ил)амин в виде коричневой пены. ISP масс-спектроскопия, m/e: 299,5 (М+1 рассчитано для C18H26N4: 298,43).
Пример 26
Аналогично методике, описанной в примере 23, реакцией 7-бром-2-метил-4-пирролидин-1-илхиназолина с 2-хлорбензиламином получали (2-хлорбензил)-(2-метил-4-пирролидин-1-илхиназолин-7-ил)амин в виде желтого порошка. ISP масс-спектроскопия, m/e: 353,3 (М+1 рассчитано для C20H21ClN4: 353).
Пример 27
Аналогично методике, описанной в примере 23, реакцией 7-бром-2-метил-4-пирролидин-1-илхиназолина с 2-метилбензиламином получали (2-метилбензил)-(2-метил-4-пирролидин-1-илхиназолин-7-ил)амин в виде желтого порошка. ISP масс-спектроскопия, m/e: 333,3 (М+1 рассчитано для C21H24N4: 333).
Пример 28
Аналогично методике, описанной в примере 23, реакцией 7-бром-2-метил-4-пирролидин-1-илхиназолина с 4-аминобензонитрилом получали 4-(2-метил-4-пирролидин-1-илхиназолин-7-иламино)бензонитрил в виде светло-желтого порошка. ISP масс-спектроскопия, m/e: 330,4 (М+1 рассчитано для C20H19N5: 330).
Пример 29
Аналогично методике, описанной в примере 23, реакцией 7-бром-2-метил-4-пирролидин-1-илхиназолина с 4-фторанилином получали (4-фторфенил)-(2-метил-4-пирролидин-1-илхиназолин-7-ил)амин в виде темно-коричневого порошка. ISP масс-спектроскопия, m/e: 323,4 (М+1 рассчитано для C19H19FN4: 323).
Пример 30
Аналогично методике, описанной в примере 23, реакцией 7-бром-2-метил-4-пирролидин-1-илхиназолина с 3-аминопиридином получали (2-метил-4-пирролидин-1-илхиназолин-7-ил)пиридин-3-иламин в виде светло-коричневого порошка. ISP масс-спектроскопия, m/e: 306,4 (М+1 рассчитано для C18H19N5: 306).
Пример 31
К суспензии 0,12 г (0,41 ммоль) 7-бром-2-метил-4-пирролидин-1-илхиназолина, 3,9 мг (0,021 ммоль) йодида меди (I) и 0,267 г (0,82 ммоль) карбоната цезия в диоксане (5 мл) при комнатной температуре в атмосфере аргона добавляли 4,7 мг (0,041 ммоль) транс-1,2-диаминоциклогексана и 0,18 г (1,6 ммоль) 2-фурамида, реакционную смесь кипятили с обратным холодильником в течение 20 часов. Реакционную смесь выливали в смесь EtOAc и воды, после разделения слоев органическую фракцию дважды промывали водой, высушивали над сульфатом натрия и концентрировали в вакууме. Остаток наносили на колонку с силикагелем, элюировали смесью CH2Cl2/MeOH/NH4OH (9:1:0,5). Полученные очищенные фракции концентрировали в вакууме, получая 29 мг (22%) (2-метил-4-пирролидин-1-илхиназолин-7-ил)амида фуран-2-карбоновой кислоты в виде бесцветного порошка. ISP масс-спектроскопия, m/e: 323,4 (М+1 рассчитано для C18H18N4O2: 323).
Пример 32
а) Аналогично методике, описанной в примере 23, реакцией гидрохлорида (S)-7-бром-4-(3-этоксипирролидин-1-ил)-2-метилхиназолина с 3-аминопиридином получали (S)-[4-(3-этоксипирролидин-1-ил)-2-метилхиназолин-7-ил]пиридин-3-иламин в виде серого порошка. ISP масс-спектроскопия, m/e: 350,5 (М+1 рассчитано для C20H23N5O: 350).
Получение исходного соединения:
б) Аналогично методике, описанной в примере 23d), реакцией 7-бром-4-хлор-2-метилхиназолина с избытком (S)-3-этоксипирролидина (2,5 мольных эквивалента) в 1-метил-2-пирролидоне в качестве растворителя при 140°С получали гидрохлорид (S)-7-бром-4-(3-этоксипирролидин-1-ил)-2-метилхиназолина в виде светло-желтого порошка. ISP масс-спектроскопия, m/e: 336,2 (М+1 рассчитано для C15H18BrN3O: 336).
Пример 33
Аналогично методике, описанной в примере 23, реакцией гидрохлорида (S)-7-бром-4-(3-этоксипирролидин-1-ил)-2-метилхиназолина, описанного в примере 32b), с 4-фтороанилином получали (S)-[4-(3-этоксипирролидин-1-ил)-2-метилхиназолин-7-ил]-(4-фторфенил)амин в виде желтой пены. ISP масс-спектроскопия, m/e: 367,3 (М+1 рассчитано для C21H23FN4O: 367).
Пример 34
а) Аналогично методике, описанной в примере 23, реакцией (S)-7-бром-4-(3-метоксипирролидин-1-ил)-2-метилхиназолина с 3-аминопиридином получали (S)-[4-(3-метоксипирролидин-1-ил)-2-метилхиназолин-7-ил]пиридин-3-иламин в виде бесцветного порошка. ISP масс-спектроскопия, m/e: 336,3 (М+1 рассчитано для C19H21N5O: 336).
Получение исходного соединения:
б) Аналогично методике, описанной в примере 23d), реакцией 7-бром-4-хлор-2-метилхиназолина с избытком (S)-3-метоксипирролидина (2,5 мольных эквивалента) в 1-метил-2-пирролидоне в качестве растворителя при 140°С получали гидрохлорид (S)-7-бром-4-(3-метоксипирролидин-1-ил)-2-метилхиназолина в виде светло-оранжевого порошка. ISP масс-спектроскопия, m/e: 322,3 (М+1 рассчитано для C14H16BrN3O: 322).
Пример А
Соединение общей формулы I может использоваться в качестве активного ингредиента для получения известным способом таблеток следующего состава, мг:
Пример Б
Соединение общей формулы I может использоваться в качестве активного ингредиента для производства известным способом капсул следующего состава, мг:
| название | год | авторы | номер документа |
|---|---|---|---|
| ХИНОЛИНОВЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ АНТАГОНИСТОВ НЕЙРОПЕПТИДА Y | 2002 |
|
RU2300531C2 |
| ПРОИЗВОДНЫЕ ХИНОЛИНА В КАЧЕСТВЕ АНТАГОНИСТОВ NPY | 2003 |
|
RU2298002C2 |
| ПРОИЗВОДНЫЕ ДИГИДРОБЕНЗО[b][1,4]ДИАЗЕПИН-2-ОНА В КАЧЕСТВЕ АНТАГОНИСТОВ MGLUR2 II | 2002 |
|
RU2263112C2 |
| АРИЛХИНАЗОЛИНЫ | 2014 |
|
RU2701193C2 |
| БИАРИЛОКСИМЕТИЛАРЕНОВЫЕ КАРБОНОВЫЕ КИСЛОТЫ | 2004 |
|
RU2373187C2 |
| ПРОИЗВОДНЫЕ ТИАЗОЛА В КАЧЕСТВЕ АНТАГОНИСТОВ NPY | 2004 |
|
RU2321586C2 |
| ЗАМЕЩЕННЫЕ БЕНЗАМИДНЫЕ ПРОИЗВОДНЫЕ | 2010 |
|
RU2595902C2 |
| ИНГИБИТОРЫ ТИРОЗИНКИНАЗ | 2008 |
|
RU2445309C2 |
| ПРОИЗВОДНЫЕ ДИГИДРОБЕНЗО[b][1,4]ДИАЗЕПИН-2-ОНА В КАЧЕСТВЕ АНТАГОНИСТОВ I mGluR2 | 2002 |
|
RU2270197C2 |
| НОВЫЕ ПИРИМИДИНАМИДНЫЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ | 2003 |
|
RU2378267C2 |
Изобретение относится к новым производным хиназолина общей формулой I:

где R1 представляет собой -O-R4 или -N(R5)(R6); R2 представляет собой алкил; R3 представляет собой водород; R4 представляет собой водород, алкил, алкоксиалкил, гидроксиалкил, аралкил, пиридинилалкил, замещенный цианогруппой или галогеном, циклоалкилалкил; R5 и R6 независимо выбраны из водорода, алкила, циклоалкила, циклоалкилалкила, арила, аралкила, арилкарбонила, алкоксиалкила, гидроксиалкила, пиридинила, фуранилкарбонила, или R5 и R6 вместе с атомом N, к которому они присоединены, образуют 5-10-членное гетероциклическое кольцо, которое необязательно включает второй гетероатом, выбранный из азота или кислорода, и где гетероциклическое кольцо необязательно замещено одним или несколькими заместителями, независимо выбранными из алкила или алкоксигруппы; А представляет собой 5-7-членное насыщенное гетероциклическое кольцо, включающее атом азота, присоединенный к хиназолиновому кольцу, и необязательно второй гетероатом, который выбран из кислорода, серы или азота, и где кольцо А необязательно замещено одним или несколькими заместителями, независимо выбранными из алкокси, гидрокси, гидроксиалкила, алкоксиалкила, и их фармацевтически приемлемые соли и эфиры. Изобретение также относится к способу получения соединений формулы I и к фармацевтической композиции, обладающей антагонистической активностью в отношении нейропептида Y. Технический результат - получение новых биологически активных соединений и фармацевтических композиций на их основе, обладающих антагонистической активностью в отношении нейропептида Y. 4 н. и 13 з.п. формулы, 1 табл.

где R1 представляет собой -O-R4 или -N(R5)(R6);
R2 представляет собой алкил;
R3 представляет собой водород;
R4 представляет собой водород, алкил, алкоксиалкил, гидроксиалкил, аралкил, пиридинилалкил, замещенный цианогруппой или галогеном, циклоалкилалкил;
R5 и R6 независимо выбраны из водорода, алкила, циклоалкила, циклоалкилалкила, арила, аралкила, арилкарбонила, алкоксиалкила, гидроксиалкила, пиридинила, фуранилкарбонила или R5 и R6 вместе с атомом N, к которому они присоединены, образуют 5-10-членное гетероциклическое кольцо, которое необязательно включает второй гетероатом, выбранный из азота или кислорода, и где гетероциклическое кольцо необязательно замещено одним или несколькими заместителями, независимо выбранными из алкила или алкоксигруппы;
А представляет собой 5-7-членное насыщенное гетероциклическое кольцо, включающее атом азота, присоединенный к хиназолиновому кольцу, и необязательно второй гетероатом, который выбран из кислорода, серы или азота, и где кольцо А необязательно замещено одним или несколькими заместителями, независимо выбранными из алкокси, гидрокси, гидроксиалкила, алкоксиалкила,
и их фармацевтически приемлемые соли и эфиры.
4-(2-метил-4-пирролидин-1-илхиназолин-7-илоксиметил)бензонитрил;
7-(2-хлорпиридин-3-илметокси)-2-метил-4-пирролидин-1-илхиназолин;
7-(2-фторпиридин-3-илметокси)-2-метил-4-пирролидин-1-илхиназолин;
(S)-{1-[7-(2-хлорпиридин-3-илметокси)-2-метилхиназолин-4-ил]пирролидин-2-ил}метанол и
(S)-4-[4-(3-этоксипирролидин-1-ил)-2-метилхиназолин-7-илоксиметил]бензонитрил.
где R2, R3, R4 и А определены в п.1, a Hal обозначает хлор, бром или йод.
где R2, R3 и А определены в п.1, a Hal обозначает хлор, бром или йод,
с соединением формулы R6(R5)NH или с соединением формулы R4-OH, где R4, R5 и R6 определены в п.1, в присутствии Pd или соли Cu(I) в качестве катализатора с получением соединения общей формулы I

где R1, R2, R3 и А определены в п.1.
| Способ матирования поверхности фотоформы | 1977 |
|
SU669324A1 |
| WO 9909986 А, 04.03.1999 | |||
| WO 9207844 A, 14.05.1992 | |||
| УСКОРИТЕЛЬ ПЛАЗМЫ | 1996 |
|
RU2100916C1 |
| RU 99108663 А, 20.03.2001 | |||
| Способ получения производных хиназолина | 1975 |
|
SU555850A3 |
Авторы
Даты
2007-04-10—Публикация
2003-06-27—Подача