[0001] Настоящее изобретение относится к способу прямого определения биологической активности полипептида нейротоксина в клетках, включающему этапы: a) инкубации клеток, чувствительных к интоксикации нейротоксином, с полипептидом нейротоксина в течение периода времени и при условиях, обеспечивающих проявление биологической активности указанного полипептида нейротоксина; b) фиксации клеток и, необязательно, пермеабилизации клеток с помощью детергента; c) приведения клеток в контакт по меньшей мере с первым связывающим антителом, специфически связывающимся с нерасщепленным и расщепленным нейротоксином субстратом, и по меньшей мере со вторым связывающим антителом, специфически связывающимся с сайтом расщепления субстрата, расщепленного нейротоксином, при условиях, обеспечивающих связывание указанных связывающих антител с указанными субстратами; d) приведения клеток в контакт по меньшей мере с первым детектирующим антителом, специфически связывающимся с первым связывающим антителом, при условиях, обеспечивающих связывание указанного первого детектирующего антитела с указанным первым связывающим антителом, с образованием, таким образом, первых детектируемых комплексов, и по меньшей мере со вторым детектирующим антителом, специфически связывающимся со вторым связывающим антителом, при условиях, обеспечивающих связывание указанного второго детектирующего антитела с указанным вторым связывающим антителом, с образованием, таким образом, вторых детектируемых комплексов; e) определения количества первых и вторых детектируемых комплексов из этапа d); и f) расчета количества субстрата, расщепленного указанным полипептидом нейротоксина в указанных клетках, с помощью вторых детектируемых комплексов с определением, таким образом, биологической активности указанного полипептида нейротоксина в указанных клетках. Согласно настоящему изобретению также предложен набор для осуществления способа согласно настоящему изобретению.
[0002] Clostridium botulinum и Clostridium tetani продуцируют высокоактивные нейротоксины, например, ботулинические токсины (BoNT) и столбнячный токсин (TeNT), соответственно. Данные клостридиальные нейротоксины (CNT) специфически связываются с нейрональными клетками и нарушают высвобождение нейромедиатора. Каждый токсин синтезируется в виде неактивного непроцессированного одноцепочечного белка с молекулярной массой приблизительно 150 кДа. Посттрансляционный процессинг включает образование дисульфидных мостиков и ограниченный протеолиз (никирование) бактериальной(ыми) протеазой(ами). Активный нейротоксин состоит из двух цепей: N-концевой легкой цепи с молекулярной массой приблизительно 50 кДа и тяжелой цепи с молекулярной массой приблизительно 100 кДа, соединенных дисульфидной связью. Структурно и функционально CNT состоят из трех доменов, т.е. каталитической легкой цепи, тяжелой цепи, содержащей транслокационный домен (N-концевая половина), и рецептор-связывающий домен (С-концевая половина); см., например, Krieglstein 1990, Eur. J. Biochem. 188, 39; Krieglstein 1991, Eur. J. Biochem. 202, 41; Krieglstein 1994, J. Protein Chem. 13, 49. Ботулинические нейротоксины синтезируются в виде молекулярных комплексов, содержащих белок нейротоксина с молекулярной массой 150 кДа и ассоциированные нетоксичные белки. Размеры комплексов варьируют в пределах 300 кДа, более 500 кДа и 900 кДа в зависимости от клостридиального штамма и отдельных серотипов нейротоксина. Нетоксичные белки в данных комплексах стабилизируют нейротоксин и защищают его от деградации; см. Silberstein 2004, Pain Practice 4, S19-S26.
[0003] Clostridium botulinum секретирует семь различающихся по антигенным свойствам серотипов ботулинического нейротоксина (BoNT), обозначенных A-G. Все серотипы совместно с родственным столбнячным токсином (TeNT), секретируемым Clostridium tetani, представляют собой Zn2+-эндопротеазы, которые блокируют синаптический экзоцитоз посредством расщепления белков SNARE; см. Couesnon, 2006, Microbiology, 152, 759. CNT вызывают вялый паралич мышц, наблюдаемый при ботулизме и столбняке; см. Fischer 2007, PNAS 104, 10447.
[0004] Несмотря на токсические эффекты, комплекс ботулинического токсина применяют в качестве терапевтического агента при большом числе заболеваний. Ботулинический токсин серотипа А был одобрен для применения у людей в Соединенный Штатах в 1989 году для лечения страбизма, блефароспазма и других расстройств. Он коммерчески доступен в виде препарата белка ботулинического токсина A (BoNT/A), например, под торговым наименованием BOTOX (Allergan, Inc.) или под торговым наименованием DYSPORT/RELOXIN (Ipsen, Ltd). Улучшенный, некомплексный препарат ботулинического токсина А коммерчески доступен под торговым наименованием XEOMIN (Merz Pharmaceuticals, LLC). Для терапевтических применений препарат вводят путем инъекции непосредственно в мышцу, нуждающуюся в лечении. При физиологическом значении pH токсин высвобождается из белкового комплекса, и достигается желаемый фармакологический эффект. Эффект ботулинического токсина является лишь временным, что обуславливает возможную необходимость повторного введения ботулинического токсина для поддержания терапевтического эффекта.
[0005] Клостридиальные нейротоксины уменьшают силу произвольного сокращения мышц и эффективны для терапии страбизма, фокальной дистонии, включая цервикальную дистонию, и доброкачественного идиопатического блефароспазма. Также было показано, что они облегчают гемифациальный спазм и фокальную мышечную спастичность и, кроме того, эффективны при широком спектре других показаний, таких как нарушение работы желудочно-кишечного тракта, гипергидроз и косметическая коррекция морщин; см. Jost 2007, Drugs 67, 669.
[0006] В процессе производства клостридиальных нейротоксинов качественное и количественное определение указанных нейротоксинов, а также контроль качества биологически активных полипептидов нейротоксина имеют особое значение. При этом правительственные органы принимают только простые, надежные и валидированные анализы активности ботулинического токсина. В настоящее время биоанализ LD50 на мышах, анализ на летальность, остается «золотым стандартом», применяемым фармацевтическими производителями для анализа эффективности их препаратов; см. Arnon et al. (2001), JAMA 285, 1059-1070. Однако в последние годы были предприняты значительные усилия по поиску альтернативных подходов для уменьшения потребности в тестах на животных и всех недостатков, затрат и этических проблем, связанных с такого рода тестами на животных. Кроме того, органы государственного регулирования привлекают фармацевтические компании к применению принципа трех «R» для проверки эффективности ботулинических нейротоксинов: «Reduce, Refine, Replace» («Уменьшать, Улучшать, Заменять»); см. Straughan, Altera. Lab. Anim. (2006), 34, 305-313. Как следствие, были разработаны клеточные тест-системы с целью обеспечения приемлемых альтернатив способам с применением живых животных. В настоящий момент пока доступны только три клеточные тест-системы для определения биологической активности нейротоксина, которые, как было показано, являются достаточно чувствительными к полипептидам нейротоксина. Данные клеточные тест-системы включают применение первых нейронов, выделенных из эмбрионов грызунов, которые подвергают дифференцировке in vitro (Pellett et al. (2011), Biochem. Biophys. Res. Commun. 404, 388-392), дифференцированных нейронов из индуцированных плюрипотентных стволовых клеток (Whitemarsh et al. (2012), Toxicol. Sci. 126, 426-35) и субклона клеточной линии SiMa (WO 2010/105234 A1).
[0007] Однако выделение первых нейронов требует умерщвления животных и является трудоемким и времязатратным. К тому же, тест-системы с применением различных первых нейронов демонстрируют большой разброс данных. Аналогичным образом, получение дифференцированных нейронов из индуцированных плюрипотентных стволовых клеток является затруднительным и требует больших затрат времени. При этом хранение таких клеток очень проблематично. Анализы с применением линий опухолевых клеток часто недостаточно чувствительны к BoNT. Кроме того, для указанных линий опухолевых клеток требуются сложные протоколы дифференцировки, что приводит к большому разбросу данных и/или к высоким показателям неэффективности анализов с применением указанных клеточных линий.
[0008] Анализы для определения биологической активности клостридиальных нейротоксинов, описанные в данной области техники, включают анализ посредством вестерн-блоттинга, в котором активность нейротоксина определяют количественно на основании количества расщепленного субстрата нейротоксина в клеточных продуктах лизиса. В других анализах активность клостридиальных нейротоксинов измеряют посредством электрохемолюминесцентного (ECL) иммуноферментного анализа (ИФА) типа «сэндвич»; см. WO 2009/114748 А1. Также в этом случае биологическую активность клостридиального нейротоксина определяют посредством детекции расщепленного субстрата клостридиального нейротоксина после выделения из клеточного лизата. При этом в обоих способах анализа субстрат нейротоксина должен быть концентрирован.
[0009] С учетом вышесказанного, дополнительные тест-системы для определения активности полипептида нейротоксина, соответствующие требованиям правительственных органов и/или обеспечивающие альтернативу тест-системам с применением животных, высоко востребованы.
[0010] Таким образом, техническую проблему, лежащую в основе настоящего изобретения, можно рассматривать, как проблему обеспечения средств и способов, удовлетворяющих вышеупомянутым нуждам. Решение технической проблемы обеспечивается с помощью вариантов реализации, охарактеризованных в формуле изобретения и приведенных ниже.
[0011] В первом аспекте настоящее изобретение относится к способу прямого определения биологической активности полипептида нейротоксина в клетках, включающему этапы:
a) инкубации клеток, чувствительных к интоксикации нейротоксином, с полипептидом нейротоксина, в течение периода времени и при условиях, обеспечивающих проявление биологической активности указанного полипептида нейротоксина;
b) фиксации клеток и, необязательно, пермеабилизации клеток с помощью детергента;
c) приведения клеток в контакт по меньшей мере с первым связывающим антителом, специфически связывающимся с нерасщепленным и расщепленным нейротоксином субстратом, и по меньшей мере со вторым связывающим антителом, специфически связывающимся с сайтом расщепления субстрата, расщепленного нейротоксином, при условиях, обеспечивающих связывание указанных связывающих антител с указанными субстратами;
d) приведения клеток в контакт по меньшей мере с первым детектирующим антителом, специфически связывающимся с первым связывающим антителом, при условиях, обеспечивающих связывание указанного первого детектирующего антитела с указанным первым связывающим антителом, с образованием, таким образом, первых детектируемых комплексов, и по меньшей мере со вторым детектирующим антителом, специфически связывающимся со вторым связывающим антителом, при условиях, обеспечивающих связывание указанного второго детектирующего антитела с указанным вторым связывающим антителом, с образованием, таким образом, вторых детектируемых комплексов.
e) определения количества первых и вторых детектируемых комплексов из этапа d); и
f) расчета количества субстрата, расщепленного указанным полипептидом нейротоксина в указанных клетках, с помощью вторых детектируемых комплексов с определением, таким образом, биологической активности указанного полипептида нейротоксина в указанных клетках.
[0012] Способ согласно настоящему изобретению обеспечивает прямое определение биологической активности полипептида нейротоксина в клетках. Это означает отсутствие дальнейшей необходимости в лизисе клеток и выделении или концентрировании расщепленного субстрата нейротоксина из клеточных лизатов, как в способах, описанных в данной области техники. Например, в анализе посредством вестерн-блоттинга, описанном в данной области техники, субстрат нейротоксина концентрируют путем разделения и концентрирования компонентов соответствующего образца в полиакриламидном геле, содержащем додецилсульфат натрия (ДСН). В вышеупомянутом ECL-ИФА типа «сэндвич», описанном в данной области техники, концентрирование субстрата нейротоксина осуществляют с применением антител, которые специфически связываются с расщепленным субстратом нейротоксина в титрационном микропланшете, в который добавляют клеточный лизат. Расщепленный субстрат нейротоксина выделяют из лизата благодаря связыванию упомянутого антитела, что приводит к концентрированию указанного расщепленного субстрата клостридиального нейротоксина. В отличие от этого способа, в способе согласно настоящему изобретению расщепленный субстрат нейротоксина, как показано на примере SNAP-25, может быть детектирован непосредственно в клетке. С этой целью клетки, чувствительные к интоксикации нейротоксином, как определено более подробно в другом месте настоящего описания, инкубируют с полипептидом нейротоксина в течение периода времени и при условиях, обеспечивающих проявление биологической активности указанного полипептида нейротоксина. На следующем этапе клетки фиксируют, например, путем добавления фиксирующего агента, такого как метанол, этанол, ацетон, формальдегид или смеси упомянутых фиксирующих агентов. Необязательно, клетки могут быть пермеабилизованы посредством применения по меньшей мере одного детергента, как определено в другом месте настоящего описания, такого как Тритон Х-100, Твин 20, сапонин, дигитонин или н-октил-β-глюкопиранозид. Детергент может содержаться в подходящем буфере, таком как фосфатно-солевой буфер (ФСБ). Далее клетки приводят в контакт по меньшей мере с первым связывающим антителом, специфически связывающимся с нерасщепленным и расщепленным нейротоксином субстратом, и по меньшей мере со вторым связывающим антителом, специфически связывающимся с сайтом расщепления субстрата, расщепленного нейротоксином, при условиях, обеспечивающих связывание указанных связывающих антител с указанными субстратами. При этом первое связывающее антитело способно обеспечить определение общего содержания или количества субстрата нейротоксина в клетках посредством специфического связывания с соответствующим эпитопом, присутствующем как в нерасщепленном, так и в расщепленном нейротоксином субстрате нейротоксина. Второе связывающее антитело распознает и специфически связывается с эпитопом, присутствующем только в расщепленном субстрате нейротоксина, например, за счет специфического связывания с расщепленным нейротоксином сайтом в субстрате нейротоксина. В качестве альтернативы, клетки могут быть приведены в контакт со смесью указанных первого и второго связывающих антител, т.е. клетки приводят в контакт по меньшей мере с первым связывающим антителом и по меньшей мере со вторым связывающим антителом одновременно при упомянутых условиях. На следующем этапе клетки приводят в контакт по меньшей мере с первым детектирующим антителом, специфически связывающимся с первым связывающим антителом, при условиях, обеспечивающих связывание указанного первого детектирующего антитела с указанным первым связывающим антителом, с образованием, таким образом, первых детектируемых комплексов. На последующем этапе клетки приводят в контакт по меньшей мере со вторым детектирующим антителом, специфически связывающимся со вторым связывающим антителом, при условиях, обеспечивающих связывание указанного второго детектирующего антитела с указанным вторым связывающим антителом, с образованием, таким образом, вторых детектируемых комплексов. В качестве альтернативы, клетки могут быть приведены в контакт со смесью указанных первого и второго детектирующих антител, т.е. клетки приводят в контакт по меньшей мере с первым детектирующим антителом и по меньшей мере со вторым детектирующим антителом одновременно при упомянутых условиях. В качестве альтернативы, после пермеабилизации клетки могут быть приведены в контакт со смесью указанных первого и второго связывающих антител и указанных первого и второго детектирующих антител одновременно при упомянутых условиях. На следующем этапе определяют количество первых и вторых детектируемых комплексов. Наконец, количество субстрата, расщепленного указанным полипептидом нейротоксина в указанных клетках, рассчитывают с помощью вторых детектируемых комплексов. Таким образом, биологическую активность указанного полипептида нейротоксина определяют непосредственно в клетках.
[0013] Способ согласно настоящему изобретению описан более подробно ниже. Для получения клеточных культур клетки, чувствительные к интоксикации нейротоксином, как определено в настоящем описании, такие как нейрональные клетки, клетки SiMa или нейроны, полученные из индуцированных плюрипотентных стволовых клеток (iPS), сначала засевают в 96-луночные титрационные микропланшеты. Клетки SiMa подвергают дифференцировке в нейрональный фенотип, например, в соответствии со способами, предложенными в WO 2010/105234, а нейроны, полученные из iPS, подвергают дифференцировке в нейрональный фенотип, например, в соответствии со способами анализа, описанными в WO 2012/135621. Затем клетки подвергают интоксикации полипептидом нейротоксина, таким как BoNT/А, в течение примерно 72 часов. На следующем этапе клетки фиксируют на титрационном микропланшете перед проведением ИФА-анализа. Для фиксации клеток к ним может быть добавлен, например, охлажденный метанол (-20°С) на 20 минут при температуре -20°С.
[0014] Для проведения ИФА-анализа клетки сначала отмывают. В качестве промывочного буфера может быть использован, например, 0,1% Тритон Х-100 в 10 мМ буфере ФСБ (pH 7,4). Далее эндогенные протеазы гасят с помощью гасящего буфера, такого как 0,6% Н2О2 в 10 мМ ФСБ (pH 7,4), с последующим повторным этапом отмывки. На следующем этапе свободные связывающие участки титрационного микропланшета блокируют с помощью подходящего блокирующего буфера, такого как, например, 2% БСА в 10 мМ буфере ФСБ (pH 7,4) и 0,05% Тритон Х-100. Затем клетки пермеабилизуют с применением подходящего детергента. В качестве пермеабилизирующего буфера может быть использован, например, 0,5% Тритон Х-100 в 10 мМ буфере ФСБ. Пермеабилизация обеспечивает диффузию антител через поры, образующиеся в клетках. Далее клетки промывают промывочным буфером, как описано выше.
[0015] На следующем этапе пермеабилизованные клетки инкубируют, например, со смесью двух различных антител. Смесь содержит первое связывающее антитело, специфически связывающееся с нерасщепленным и расщепленным нейротоксином субстратом, и второе связывающее антитело, специфически связывающееся с сайтом расщепления субстрата, расщепленного нейротоксином. Указанные первое и второе связывающие антитела также могут применяться последовательно. Например, первое связывающее антитело может специфически связываться как с нерасщепленным, так и с расщепленным нейротоксином SNAP-25, что позволяет количественно определить общее количество или содержание SNAP-25 в клетках. Кроме того, при проведении оценки это первое связывающее антитело может применяться для нормализации количества расщепленного SNAP-25 в клетках, как описано в настоящем документе. Второе связывающее антитело специфически связывается с сайтом расщепления субстрата, расщепленного нейротоксином, и таким образом обеспечивает определение и детектирование субстрата, расщепленного нейротоксином, такого как BoNT/A-расщепленный SNAP-25.
[0016] Последующее детектирование общего субстрата нейротоксина и расщепленного нейротоксином субстрата нейротоксина в способе согласно настоящему изобретению может быть осуществлено непосредственно в титрационном микропланшете или чашке для культивирования, т.е. внутри клеток. Таким образом, предпочтительно, отсутствует необходимость в получении клеточных экстрактов и выделении и/или концентрировании субстрата нейротоксина из клеточного лизата в способе согласно настоящему изобретению, как в способах, описанных в данной области техники. Затем клетки промывают с целью удаления избытка антител, не связавшихся с соответствующим антигеном. На следующем этапе пермеабилизованные клетки приводят в контакт по меньшей мере с первым детектирующим антителом и по меньшей мере со вторым детектирующим антителом. Указанные антитела могут применяться в виде смеси, т.е. одновременно или последовательно. Первое детектирующее антитело специфически связывается с первым связывающим антителом. Таким образом, образуются первые детектируемые комплексы. Первое детектирующее антитело может быть направлено против видов, из которых получено первое связывающее антитело. Например, в случае применения кроличьего поликлонального антитела анти-SNAP-25 S9684 (Sigma) в качестве первого связывающего антитела, специфически связывающегося с нерасщепленным и BoNT/A-расщепленным субстратом SNAP-25, антитело против антител кролика, конъюгированное со щелочной фосфатазой, может быть использовано в качестве первого детектирующего антитела. Второе детектирующее антитело специфически связывается со вторым связывающим антителом. Таким образом, образуются вторые детектируемые комплексы. Второе детектирующее антитело может быть направлено против видов, из которых получено второе связывающее антитело. Например, в случае применения мышиного моноклонального антитела (mAb) 20-2-5 согласно настоящему изобретению, описанного в другом месте настоящего документа, в качестве второго связывающего антитела, специфически связывающегося с BoNT/A-расщепленным SNAP-25, антитело против антител мыши, конъюгированное с пероксидазой хрена (HRP), может быть использовано в качестве второго детектирующего антитела. Специалистам в данной области техники очевидно, что первое детектирующее антитело и второе детектирующее антитело конъюгированы с различными ферментами с целью обеспечения специфического детектирования соответствующих первого и второго связывающих антител, применяемых в способе согласно настоящему изобретению. Например, детектирование, основанное на использовании HRP, как описано в другом месте настоящего документа, может применяться для BoNT/A-расщепленного SNAP-25, а детектирование, основанное на использовании щелочной фосфатазы, - для общего (BoNT/A-расщепленного и нерасщепленного) SNAP-25. Далее клетки снова промывают. На следующем этапе к клеткам добавляют флуорогенный субстрат HRP. В качестве субстрата HRP может быть использован, например, Amplex UltraRed (Invitrogen), который характеризуется возбуждением при 540 нм и эмиссией при 600 нм. Инкубацию с субстратом HRP осуществляют в течение периода времени, достаточного для надлежащего превращения субстрата пероксидазой хрена. По окончании инкубации с субстратом HRP, например, субстрат щелочной фосфатазы (АР) DiFMUP (6,8-дифтор-4-метилумбеллиферилфосфат; возбуждение 360 нм; эмиссия 450 нм) может быть добавлен к субстрату HRP, и клетки инкубируют со смесью двух указанных субстратов. Инкубирование с указанным субстратом АР проводят в течение периода времени, обеспечивающего надлежащее превращение субстрата щелочной фосфатазой. Как известно в данной области техники, согласно определению предела детектирования субстрат должен быть превращен в количестве, достаточном для того, чтобы измеряемый сигнал составлял такое высокое значение как по меньшей мере среднее значение для контроля плюс три среднеквадратических отклонения. Предел детектирования может быть определен, как описано в литературе; см., например, Armbruster and Pry, Clinical Biochem. Rev. 2008, 29 (Supplement 1): S49-S52. В связи с тем, что оптимум pH щелочной фосфатазы находится в щелочной области, соответствующий субстратный буфер является сильнощелочным. При добавлении субстрата щелочной фосфатазы к субстрату HPR реакция, катализируемая пероксидазой хрена, останавливается под действием щелочного pH, и щелочная фосфатаза осуществляет превращение DiFMUP. Щелочной pH не влияет на превращенный субстрат HRP. Наконец, измеряют флуоресценцию двух субстратов, как указано далее:
Amplex UltraRed: Возбуждение 540 нм; эмиссия 600 нм
DiFMUP: Возбуждение 360 нм; эмиссия 450 нм
Как понятно специалистам в данной области техники, подходящими для детектирования первого и второго связывающего антитела в способе согласно настоящему изобретению являются только те флуорогенные субстраты, которые демонстрируют различные длины волн возбуждения/эмиссии для используемых субстратов. Только в этом случае они позволяют специфически детектировать каждый антиген, т.е. общий субстрат нейротоксина (такой как нерасщепленный и расщепленный нейротоксином SNAP-25) и расщепленный субстрат нейротоксина (такой как расщепленный нейротоксином SNAP-25). Таким образом, возможно количественное определение общего содержания субстрата нейротоксина и содержание расщепленного субстрата нейротоксина в каждой лунке или чашке для культивирования клеток одновременно. С учетом этого, возможна успешная автоматизация способа согласно настоящему изобретению. Как указано в другом месте настоящего описания, предполагается, что флуорогенные субстраты, выбранные для способа согласно настоящему изобретению, демонстрируют достаточный сдвиг между спектрами возбуждения/эмиссии с целью обеспечения специфического детектирования соответствующего субстрата. Данное требование выполняется, например, для субстрата HRP Amplex и его производных и для субстрата АР DiFMUP. Несмотря на то, что в оптимальном случае отсутствует перекрытие спектров возбуждения/эмиссии используемых флуорогенных субстратов, опытным путем было установлено, что перекрывание площадей пиков в спектрах возбуждения используемых флуорогенных субстратов на величину до 30% является допустимым.
[0017] Как дополнительно подтверждено специалистами в данной области техники, способ согласно настоящему изобретению обеспечивает прямое детектирование и количественное определение субстрата нейротоксина, расщепленного полипептидом нейротоксина, в клетках, что позволяет таким образом определять биологическую активность указанного полипептида нейротоксина в указанных клетках. Предпочтительно, способ согласно настоящему изобретению не требует получения клеточных лизатов или экстрактов и выделения или концентрирования расщепленного субстрата нейротоксина из клеточных лизатов/экстрактов, что необходимо в способах, известных в данной области техники. Как следствие, материал образца может быть сохранен. Также, с помощью способа согласно настоящему изобретению можно сократить подготовку образца и количество образцов, так как количество общего субстрата нейротоксина и количество расщепленного субстрата нейротоксина в образце могут быть определены одновременно. В анализах, описанных в данной области техники, образцы должны быть разделены с целью детектирования обоих антигенов, т.е. общего субстрата нейротоксина и расщепленного субстрата нейротоксина, отдельно друг от друга. Способ согласно настоящему изобретению делает разделение образца необязательным. Таким образом, можно избежать неоднородностей, возникающих вследствие разделения образцов, и материал образца может быть сохранен. Кроме того, антигены могут разрушаться в анализах, описанных в данной области техники, что может искажать результаты детектирования расщепленного субстрата нейротоксина. Это связано с тем, что в анализах, описанных в данной области техники, клетки инкубируют с содержащими детергенты лизирующими буферами, которые, однако, не способны инактивировать полипептид нейротоксина или другие эндогенные протеазы, что приводит к деградации субстрата нейротоксина при длительном хранении образцов. Более сильные лизирующие буферы не могут быть использованы для ECL-ИФА типа «сэндвич», описанного в известном уровне техники, из-за обязательного применения клеточного лизата в указанном анализе. Это связано с тем, что агрегация вышеупомянутых антигенов может приводить к неспецифической адсорбции антигенов на пластиковую поверхность чашек для культивирования клеток или титрационных микропланшетов, что, в свою очередь, нарушает детектирование антигенов с помощью соответствующих антител. В связи с тем, что антитела для детектирования антигенов также вступают в контакт с лизатом, они также могут агрегировать. В этом случае надежное и точное детектирование антигена уже невозможно. Авторы настоящего изобретения исследовали опытным путем такие реакции деградации с применением анализов посредством вестерн-блоттинга для детектирования биологической активности нейротоксина, описанных в данной области техники. Было обнаружено, что при длительном хранении лизатов при -20°С детектируемый сигнал для общего SNAP-25 по сравнению со свежими образцами лизатов сильно снижался, а отношение расщепленного нейротоксином субстрата SNAP-25 к нерасщепленному нейротоксином субстрату SNAP-25 сдвигалось вследствие процессов деградации во время замораживания. Авторами настоящего изобретения было обнаружено, что можно избежать деградации субстрата нейротоксина и/или нестабильности образцов путем фиксации клеток на чашке для культивирования, поскольку как субстрат нейротоксина, так и нейротоксин или другие эндогенные протеазы немедленно инактивируются за счет агрегации на чашке для культивирования клеток. Это может быть достигнуто, например, посредством фиксации клеток метанолом или другими фиксаторами или фиксирующими агентами, известными в данной области техники, такими как этанол, ацетон, формальдегид или их смеси, или другими фиксирующими агентами, описанными в настоящем документе. Анализ стабильности, например, родительских клеток SiMa (клетки нейробластомы человека; номер в Коллекции микроорганизмов и клеточных культур Германии (DSMZ, нем.: Deutsche Sammlung von Mikroorganismen und Zellkulturen): ACC 164) и нейронов, полученных из iPS (Whitemarsh et al. (2012), Toxicol. Sci. 126, 426-35), с применением данного способа фиксации не выявил различий между свежими клетками и клетками в чашках для культивирования, хранившихся в течение семи суток в холодильнике.
[0018] В настоящем описании неопределенная и определенная формы единственного числа включают ссылку как на единственное, так и на множественное число, если контекст явно не предписывает иное. В качестве примера, «клетка» относится к одной или более чем одной клетке.
[0019] В настоящем описании термин «примерно» при определении значения заявленной величины, числа, процента или термина относится к диапазону плюс или минус 10 процентов, 9 процентов, 8 процентов, 7 процентов, 6 процентов, 5 процентов, 4 процента, 3 процента, 2 процента или 1 процент от значения заявленного пункта, числа, процента или термина. Диапазон плюс или минус 10 процентов является предпочтительным.
[0020] Термины «содержащий», «содержит» и «состоящий из» в настоящем описании являются синонимами «включающий», «включает» или «заключающий», «заключает» и являются всеохватывающими или неограничивающими и не исключают дополнительных, неперечисленных членов, элементов или этапов способа. Очевидно, что термин «содержащий» включает термин «состоящий из». В частности, термин «содержать» в настоящем описании означает, что заявленное включает все перечисленные элементы или этапы способа, но также может включать дополнительные, неназванные элементы или этапы способа. Например, способ, включающий этапы a), b) и c), в узком смысле включает способ, которые состоит из этапов a), b) и c). Словосочетание «состоящий из» означает, что композиция (или устройство, или способ) включает перечисленные элементы (или этапы) и ничего более. В отличие от этого, термин «содержит» может также включать способ, включающий дополнительные этапы, например, этапы d) и e), в дополнение к этапам a), b) и c).
[0021] В случае использования в настоящем описании числовых диапазонов, таких как «в концентрации от 1 до 5 мкМ», указанный диапазон включает не только 1 и 5 мкМ, но также любые другие числовые значения между 1 и 5 мкМ, например, 2, 3 и 4 мкМ.
[0022] В настоящем описании термин «in vitro» обозначает наружное или внешнее по отношению к организму животного или человека. Термин «in vitro» в настоящем описании следует понимать как включающий «ех vivo». Термин «ех vivo» относится, как правило, к тканям или клеткам, удаленным из организма животного или человека, которые поддерживают и репродуцируют вне организма, например, в емкости для культивирования. Термин «in vivo» в настоящем описании обозначает внутреннее или действующее изнутри по отношению к организму животного или человека.
[0023] Термин «полипептид нейротоксина» в настоящем описании обозначает нейротоксины Clostridium botulinum и Clostridium tetani, т.е. ботулинические токсины (BoNT) и столбнячный токсин (TeNT). Конкретнее, указанный термин включает BoNT/A, BoNT/B, BoNT/C1, BoNT/D, BoNT/E, BoNT/F, BoNT/G и столбнячный нейротоксин (TeNT). Полипептид нейротоксина и, в частности, его легкую цепь и тяжелую цепь получают из одного из различающихся по антигенным свойствам серотипов ботулинических нейротоксинов, указанных выше. В одном аспекте указанные легкая и тяжелая цепи полипептида нейротоксина представляют собой легкую и тяжелую цепи нейротоксина, выбранного из группы, состоящей из: BoNT/A, BoNT/B, BoNT/C1, BoNT/D, BoNT/E, BoNT/F, BoNT/G или TeNT. В другом аспекте полинуклеотид, кодирующий указанные полипептиды нейротоксина, содержит нуклеотидную последовательность, указанную в SEQ ID NO: 1 (BoNT/A), SEQ ID NO: 3 (BoNT/B), SEQ ID NO: 5 (BoNT/C1), SEQ ID NO: 7 (BoNT/D), SEQ ID NO: 9 (BoNT/E), SEQ ID NO: 11 (BoNT/F), SEQ ID NO: 13 (BoNT/G) или SEQ ID NO: 15 (TeNT). Кроме того, один аспект включает полинуклеотид, содержащий нуклеотидную последовательность, кодирующую последовательность аминокислот, указанную в любой из SEQ ID NO: 2 (BoNT/A), SEQ ID NO: 4 (BoNT/B), SEQ ID NO: 6 (BoNT/C1), SEQ ID NO: 8 (BoNT/D), SEQ ID NO: 10 (BoNT/E), SEQ ID NO: 12 (BoNT/F), SEQ ID NO: 14 (BoNT/G) или SEQ ID NO: 16 (TeNT). Аспект, относящийся к средствам и способам согласно настоящему изобретению, также включает полипептид нейротоксина, содержащий или состоящий из последовательности аминокислот, выбранной из группы, состоящей из: SEQ ID NO: 2 (BoNT/A), SEQ ID NO: 4 (BoNT/B), SEQ ID NO: 6 (BoNT/C1), SEQ ID NO: 8 (BoNT/D), SEQ ID NO: 10 (BoNT/E), SEQ ID NO: 12 (BoNT/F), SEQ ID NO: 14 (BoNT/G) и SEQ ID NO: 16 (TeNT).
[0024] В другом аспекте указанный полинуклеотид представляет собой вариант вышеуказанных полинуклеотидов, содержащий одну или более нуклеотидных замен, делеций и/или вставок, которые в еще одном аспекте могут приводить к получению полипептида, содержащего одну или более аминокислотных замен, делеций и/или вставок. Кроме того, в другом аспекте вариант полинуклеотида согласно настоящему изобретению содержит вариант нуклеотидной последовательности, являющийся по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичным нуклеотидной последовательности, указанной в любой из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13 или 15, или вариант нуклеотидной последовательности, который кодирует последовательность аминокислот, являющуюся по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80 %, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентичной последовательности аминокислот, указанной в любой из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14 или 16. Термин «идентичный» в настоящем описании относится к идентичности последовательностей, характеризуемой путем определения числа идентичных аминокислот между двумя нуклеотидными последовательностями или двумя последовательностями аминокислот, где указанные последовательности выравнивают таким образом, чтобы получить наивысший порядок совпадения. Идентичность последовательностей может быть рассчитана с применением опубликованных методик или способов, закодированных в компьютерных программах, таких как, например, BLASTP, BLASTN или FASTA (Altschul 1990, J Mol Biol 215, 403). В одном аспекте значения процента идентичности рассчитывают по всей последовательности аминокислот. Квалифицированному специалисту доступен ряд программ, основанных на различных алгоритмах, для сравнения различных последовательностей. В данном случае алгоритмы Нидлмана-Вунша или Смита-Ватермана дают особенно надежные результаты. Для осуществления выравнивания последовательностей могут быть использованы программа PileUp (Higgins 1989, CABIOS 5, 151) или программы Gap и BestFit (Needleman 1970, J Mol Biol 48; 443; Smith 1981, Adv Appl Math 2, 482), которые представляют собой часть программного пакета GCG (Genetics Computer Group 1991, 575 Science Drive, Madison, Wisconsin, USA 53711). В другом аспекте настоящего изобретения значения идентичности последовательностей, перечисленные выше в процентах (%), определяют с помощью программы GAP по всей области последовательности со следующими настройками: штраф за открытие пропуска (Gap Weight): 50, штраф за продолжение пропуска (Length Weight): 3, среднее совпадение (Average Match): 10000 и среднее несовпадение (Average Mismatch): 0,000, которые, если не указано иное, должны всегда применяться в качестве стандартных настроек для выравнивания последовательностей. В одном аспекте каждый из вышеуказанных вариантов полинуклеотидов кодирует полипептид, сохраняющий одно или более и, в другом аспекте, все биологические свойства соответствующего полипептида нейротоксина, т.е. BoNT/A, BoNT/B, BoNT/C1, BoNT/D, BoNT/E, BoNT/F, BoNT/G или столбнячного нейротоксина (TeNT). Специалистам в данной области техники будет понятно, что полная биологическая активность сохраняется только после протеолитической активации, хотя и возможно, что не подвергшийся процессингу предшественник может проявлять некоторые биологические функции или быть частично активным. «Биологические свойства» в настоящем описании относятся к (a) связыванию с рецепторами, (b) интернализации, (c) транслокации через эндосомальную мембрану в цитозоль и/или (d) эндопротеолитическому расщеплению белков, принимающих участие в слиянии синаптических пузырьков с мембраной. Анализы для оценки биологической активности in vivo включают определение LD50 на мышах и мышиный диафрагмальный тест ex vivo, как описано Pearce et al. (Pearce 1994, Toxicol. Appl. Pharmacol. 128: 69-77) и Dressier et al. (Dressier 2005, Mov. Disord. 20:1617-1619, Keller 2006, Neuroscience 139: 629-637). Биологическую активность обычно выражают в мышиных единицах действия (MU). В настоящем описании 1 MU представляет собой количество нейротоксичного компонента, которое вызывает гибель 50% от данной мышиной популяции после внутрибрюшинной инъекции, т.е. в.б. LD50 для мышей. В другом аспекте варианты полинуклеотидов могут кодировать нейротоксины с улучшенными или измененными биологическими свойствами, например, они могут содержать сайты расщепления, которые улучшены для распознавания ферментами, или могут быть улучшены для связывания рецепторов или любого другого свойства, указанного выше.
[0025] Соответственно, термин «биологическая активность полипептида нейротоксина» в настоящем описании означает биологические свойства, характерные для полипептида нейротоксина, а именно (a) связывание с рецепторами, (b) интернализацию, (c) транслокацию через эндосомальную мембрану в цитозоль и/или (d) эндопротеолитическое расщепление белков, принимающих участие в слиянии синаптических пузырьков с мембраной. Предусматривается, что полипептид нейротоксина в соответствии с настоящим описанием проявляет по меньшей мере одно из свойств a)-d), указанных выше, предпочтительно эндопротеолитическое расщепление белков, принимающих участие в слиянии синаптических пузырьков с мембраной, или два или три или все четыре биологических свойства, перечисленные в пп. a)-d).
[0026] Аспекты настоящего изобретения в некоторой степени содержат клетку стабильной клеточной линии. В настоящем описании термин «клетка» относится к любой эукариотической клетке, чувствительной к интоксикации нейротоксином, таким как, например, BoNT/A, или любой эукариотической клетке, которая может захватывать нейротоксин. Термин «клетка» включает клетки из различных организмов, такие как, например, клетки мыши, крысы, свиньи, быка, лошади, примата и человека; из различных типов клеток, таких как, например, нейрональные и отличные от нейрональных; и могут быть изолированы из гетерогенной популяции клеток или ее части, ткани или организма. В настоящем описании термин «стабильная клеточная линия» является синонимом «иммортализованной клеточной линии» или «трансформированной клеточной линии» и относится к культуре клеток, выбранных для неограниченного деления из популяции клеток, полученной из организма, ткани или органа. По определению стабильная клеточная линия исключает первичные клеточные культуры. В настоящем описании термин «первичные клетки» представляет собой клетки, полученные непосредственно из свежих тканей или органов и не обладающие способностью к неограниченному делению. Например, в способе согласно настоящему изобретению могут применяться первичные нейрональные клетки. Стабильная клеточная линия может содержать гетерогенную популяцию клеток или однородную популяцию клеток. Стабильная клеточная линия, полученная из единственной клетки, называется клональной клеточной линией. Стабильная клеточная линия может представлять собой линию, клетки которой эндогенно экспрессируют все компоненты, необходимые для того, чтобы клетки проходили полный клеточный цикл, при этом нейротоксин, такой как BoNT/А, протеолитически расщепляет субстрат, такой как SNAP-25, и включает связывание нейротоксина с рецептором нейротоксина, такого как BoNT/A с рецептором BoNT/A, интернализацию комплекса нейротоксин/рецептор, транслокацию легкой цепи нейротоксина из внутриклеточной везикулы в цитоплазму и протеолитическое расщепление субстрата нейротоксина. В качестве альтернативы, стабильная клеточная линия может представлять собой линию, в клетки которой из экзогенного источника был введен по меньшей мере один компонент, необходимый для того, чтобы клетки проходили полный клеточный цикл, при этом нейротоксин, такой как BoNT/А, протеолитически расщепляет субстрат, такой как SNAP-25, и включает связывание нейротоксина с рецептором, такого как BoNT/A с рецептором BoNT/А, интернализацию комплекса нейротоксин/рецептор, транслокацию легкой цепи нейротоксина из внутриклеточной везикулы в цитоплазму и протеолитическое расщепление субстрата нейротоксина. Также рассматривается генно-инженерная клеточная линия, клетки такой стабильной клеточной линии могут экспрессировать, например, экзогенный FGFR2, экзогенный FGFR3, экзогенный SV2, экзогенный субстрат нейротоксина, такой как SNAP-25, или их комбинацию.
[0027] Термин «клетка(и), чувствительная(ые) к интоксикации нейротоксином», в настоящем описании означает клетку, которая может проходить полный клеточный цикл, при этом полипептид нейротоксина (например, BoNT/A) расщепляет субстрат нейротоксина (например, субстрат BoNT/A SNAP-25) и включает связывание нейротоксина с его соответствующим рецептором (например, связывание BoNT/A с рецептором BoNT/A), интернализацию комплекса нейротоксин/рецептор, транслокацию легкой цепи нейротоксина из внутриклеточной везикулы в цитоплазму и протеолитическое расщепление субстрата нейротоксина. Анализы для определения биологической активности полипептидов нейротоксина хорошо известны в данной области техники и также описаны в другом месте настоящего описания; см., например, Pellett et al. (2011), Biochem. Biophys. Res. Commun. 404, 388-392; Whitemarsh et al. (2012), Toxicol. Sci. 126, 426-35. Соответственно, термин «клетка, чувствительная к интоксикации нейротоксином», в настоящем описании означает клетку, чувствительную к нейротоксину. Указанный термин включает клетку или клеточную линию, например, изолированную, первичную клетку или ее клеточную линию, или клетку стабильной клеточной линии, или стабильную клеточную линию, например, опухолевые клетки или линии опухолевых клеток, которые способны к дифференцировке в нейрональные клетки, такие как клетки нейробластомы или линии клеток нейробластомы, как определено в другом месте настоящего описания. Например, указанная линия клеток нейробластомы может представлять собой линию клеток SiMa, которая коммерчески доступна в DSMZ (АСС 164). Конкретные клоны линии клеток SiMa также раскрыты в WO 2010/105234. Другие линии клеток нейробластомы, которые могут применяться в способе согласно настоящему изобретению, могут быть получены в Американской коллекции типовых культур (АТСС) или DSMZ под следующими номерами АТСС или DSMZ: линия клеток N1E-115 под № CRL-2263, линия клеток Neuro2a под № CCL-131, линия клеток SH-SY5Y под № CRL-2266, линия клеток PC12 под № CRL-1721, линия клеток MHH-NB-11 под № АСС 157 (DSMZ) и линия клеток SK-N-BE(2) под № CRL-2271. Другие опухолевые клетки, которые чувствительны к интоксикации нейротоксином, представляют собой клетки Р-19 (линии клеток эмбриональной карциномы мыши) (№ АСС 316 в DSMZ). Клетки, чувствительные к интоксикации нейротоксином, дополнительно включают нейроны, полученные из индуцированных плюрипотентных стволовых клеток (iPS), предпочтительно нейроны, полученные из индуцированных плюрипотентных стволовых клеток (iPS) человека; см., например, Whitemarsh et al. (2012), loc. cit. Данные нейроны, полученные из iPS человека, коммерчески доступны, например, в компании Cellular Dynamics. Способы получения клеток iPS описаны, например, Yu et al. (Science 2009 May 8; 324(5928): 797-801. Epub 2009), в WO 2011/056971 и WO 2011/025852. В некоторых аспектах iPS подвергают дифференцировке в нейроны с применением подходящих способов, например, описанных в WO 2012/135621 и заявках на патент США US 2010/0279403 и US 2010/0216181.
[0028] Термин «фиксация клеток» означает фиксацию клеток с применением способов, описанных в данной области техники. В общем, фиксация представляет собой химический процесс, с помощью которого биологические ткани защищают от разложения, таким образом предотвращая аутолиз. Фиксация останавливает любые протекающие биологические реакции, а также может увеличить механическую прочность или стабильность обработанных тканей. Фиксация позволяет сохранить образец биологического материала, такой как ткань или клетки, настолько близко к его естественному состоянию, насколько это возможно, в процессе подготовки указанных тканей или клеток для изучения или анализа. С этой целью фиксатор обычно блокирует собственные биомолекулы - в частности, протеолитические ферменты - которые в противном случае расщепляют или повреждают образец. Более того, фиксатор обычно защищает образец от повреждения извне. Фиксаторы токсичны для большинства распространенных микроорганизмов, включая бактерии, которые могут присутствовать в ткани или культуре клеток или которые могут иным образом заселять фиксированную ткань или культуру клеток. При этом многие фиксаторы химически изменяют фиксированный материал, делая его менее привлекательным, либо неусваиваемым или токсичным для условно-патогенных микроорганизмов. Наконец, фиксаторы часто изменяют клетки или ткани на молекулярном уровне, увеличивая их механическую прочность или стабильность. Увеличенная прочность и жесткость может помочь сохранить морфологию, а именно форму и структуру образца, по мере его обработки для дальнейшего анализа. Для специалистов в данной области техники очевидно, что выбор фиксатора и протокола фиксации может зависеть от запланированных дополнительных этапов обработки и конечных анализов. Например, в иммуногистохимическом исследовании применяют антитела, специфически связывающиеся с конкретным белком-мишенью, антигеном. Длительная фиксация может химически маскировать данные мишени и препятствовать связыванию антитела. В данных случаях может быть использован, например, быстрый способ фиксации с применением холодного формалина. В качестве альтернативы, клетки можно фиксировать добавлением охлажденного метанола (-20°С). Помимо альдегидов, таких как формальдегид или глутаральдегид, и спиртов, таких как этанол или метанол, в протоколах фиксации могут применяться окисляющие агенты, фиксация за счет защитного эффекта органического растворителя, опосредованного применением буфера Hepes-глутаминовая кислота (НОРЕ, англ.: Hepes-glutamic acid buffer-mediated organic solvent protection effect), ацетон или их смеси, такие как смесь метанола и ацетона, метанола и этанола, параформальдегида и Тритона Х-100 или параформальдегида и метанола. В одном аспекте способа согласно настоящему изобретению фиксацию клеток осуществляют добавлением фиксирующего агента, выбранного из группы, состоящей из: метанола, этанола, ацетона, формальдегида или их смесей. Для обеспечения и/или поддержания свободного доступа антитела к его антигену клетки необязательно могут быть пермеабилизованы с применением подходящего пермеабилизирующего буфера, содержащего по меньшей мере один детергент, такой как Тритон Х-100. Пермеабилизирующий буфер, который может применяться в способе согласно настоящему изобретению, представляет собой, например, 0,5% Тритон Х-100 в 10 мМ буфере ФСБ. В других аспектах способов согласно настоящему изобретению клетки могут быть пермеабилизованы с применением пермеабилизирующего буфера, такого как ФСБ, содержащий по меньшей мере один детергент, выбранный из Твина 20, сапонина, дигитонина или н-октил-β-глюкопиранозида. В других аспектах смеси двух или более детергентов, указанных в настоящем описании, могут применяться в указанном пермеабилизирующем буфере. В общем, величины силы и времени фиксации значительно меньше для клеток по сравнению с более толстыми, структурно сложными срезами ткани. Подготовка образца для иммуноцитохимического исследования по существу включает фиксацию клеток-мишеней на стекле, чашке для культивирования клеток или титрационном микропланшете. Полная фиксация иммобилизует антигены с сохранением первоначальной клеточной и субклеточной архитектуры и обеспечивает беспрепятственный доступ антител ко всем клеткам и субклеточным компартментам. Обычно используют различные фиксаторы, приведенные в качестве примера выше, и правильный выбор способа будет зависеть от природы исследуемого антигена и от свойств используемого антитела. В общем случае, способы фиксации подразделяют на два класса: органические растворители и сшивающие реагенты. Органические растворители, такие как спирты и ацетон, удаляют липиды и дегидратируют клетки, при этом осаждают белки на компонентах клеточной архитектуры. Сшивающие реагенты, такие как параформальдегид, образуют межмолекулярные мостики, обычно через свободные аминогруппы, с образованием, таким образом, сети связанных антигенов. Кросслинкеры сохраняют структуру клетки лучше, чем органические растворители, однако могут снижать антигенность некоторых клеточных компонентов и часто требуют добавления этапа пермеабилизации, как указано выше, для обеспечения доступа антитела к образцу. Фиксация обоими способами может привести к денатурации белковых антигенов, и по этой причине антитела, полученные против денатурированных белков, могут быть более подходящими для окрашивания клеток. Подходящий способ фиксации должен быть выбран согласно соответствующему применению. Способы фиксации клеток хорошо описаны в данной области техники (см., например, Methods in cell biology, Volume 37: Antibodies in cell biology; Edited by David J. Asai; 1993, Academic Press Inc.).
[0029] Термин «приведение в контакт», используемый в соответствии со способом согласно настоящему изобретению, означает приведение клеток и соответствующих антител в физическую близость с обеспечением физического и/или химического взаимодействия. Подходящие условия, обеспечивающие специфическое взаимодействие, хорошо известны специалистам в данной области техники. Очевидно, указанные условия будут зависеть от антител и клеток, применяемых в способе согласно настоящему изобретению, и могут быть модифицированы обычным способом специалистом в данной области техники. Более того, время, достаточное для обеспечения взаимодействия, также может быть сразу определено квалифицированным специалистом. Следует понимать, что между отдельными этапами приведения клеток в контакт с соответствующими антителами, указанными в способе согласно настоящему изобретению, могут быть проведены этапы промывки с целью достижения подходящих условий для приведения в контакт. Например, после приведения клеток в контакт по меньшей мере с первым связывающим антителом, специфичным к нерасщепленному и расщепленному нейротоксином субстрату, и по меньшей мере со вторым связывающим антителом, специфически связывающимся с сайтом расщепления субстрата, расщепленного нейротоксином на этапе c) способа согласно настоящему изобретению, перед применением первого детектирующего антитела и/или второго детектирующего антитела может быть включен этап промывки для удаления оставшегося раствора и/или избытка первого и второго связывающего антитела. Аналогично, в способе согласно настоящему изобретению этап промывки может быть включен после приведения клеток в контакт с первым и/или вторым детектирующим антителом. Подходящий промывочный буфер представляет собой, например, 0,1% Тритон Х-100 в 10 мМ ФСБ буфере (pH 7,4). В частности, термин «приведение в контакт» в настоящем описании относится к приведению клеток в контакт по меньшей мере с первым связывающим антителом, специфически связывающимся с нерасщепленным и расщепленным нейротоксином субстратом, и по меньшей мере со вторым связывающим антителом, специфически связывающимся с сайтом расщепления расщепленного нейротоксином субстрата, при условиях, обеспечивающих связывание указанных связывающих антител с указанными субстратами на этапе c) способа согласно настоящему изобретению. Первое и второе связывающие антитела могут быть применены к клеткам одновременно, например, в виде смеси, или последовательно. «Приведение в контакт» дополнительно относится к приведению клеток в контакт по меньшей мере с первым детектирующим антителом, специфически связывающимся с первым связывающим антителом, при условиях, обеспечивающих связывание указанного первого детектирующего антитела с указанным первым связывающим антителом, и по меньшей мере второго детектирующего антитела, специфически связывающегося со вторым связывающим антителом, в условиях, обеспечивающих связывание указанного второго детектирующего антитела с указанным вторым связывающим антителом на этапе d) способа согласно настоящему изобретению. При этом происходит образование первого и второго детектируемых комплексов. В качестве альтернативы, первое и второе детектирующие антитела также могут применяться последовательно.
[0030] В настоящем описании термин «антитело» относится к молекуле, вырабатываемой иммунной системой в ответ на конкретный антиген, которая специфически связывается с данным антигеном, и включает как природные антитела, так и антитела неприродного происхождения. Термин «антитело» в настоящем описании включает моноклональное антитело, поликлональное антитело, одноцепочечное антитело, димер или мультимер, химерное антитело, биспецифическое антитело, биспецифическое одноцепочечное антитело, мультиспецифическое антитело, синтетическое антитело, гуманизированное антитело, гетеровалентное антитело, ассоциированное с клеткой антитело, подобное рецептору IgG, линейное антитело, диатело, миниантитело или фрагмент любого из указанных антител. Фрагменты указанных антител включают, например, фрагменты Fab, Fv или scFv или химически модифицированные производные любого из данных фрагментов. Антитела могут быть получены способами, которые описаны в данной области техники; см., например, Harlow and Lane "Antibodies, A Laboratory Manual", CSH Press, Cold Spring Harbor, 1988. Моноклональные антитела могут быть получены с помощью методик, впервые описанных в  1975, Nature 256, 495, и
1975, Nature 256, 495, и  1981, Meth. Enzymol. 73, 3. Указанные методики включают слияние клеток миеломы мыши с клетками селезенки, полученными от иммунизированных млекопитающих. Антитела могут быть дополнительно улучшены посредством способов, хорошо известных в данной области техники. Например, для увеличения эффективности фаговых антител, которые связываются с эпитопами, может быть применен поверхностный плазменный резонанс, используемый в системе Biacore; см., например, Schier 1996, Human Antibodies Hybridomas 7, 97; Malmborg 1995, J. Immunol. Methods 183, 7. Антитела в соответствии с настоящим описанием также включают функциональные эквиваленты антител, т.е. агенты, способные к специфическому связыванию с целевыми эпитопами или частями субстратов нейротоксина. В одном аспекте такие функциональные эквиваленты включают связывающие белки, специфически связывающиеся с субстратами нейротоксина или их доменами, способные опосредовать указанное специфическое связывание. Антитело в соответствии с настоящим описанием может представлять собой полноразмерную молекулу иммуноглобулина, содержащую домены VH и VL, а также константный домен легкой цепи (CL) и константные домены тяжелой цепи CH1, СН2 и СН3, или иммунологически активный фрагмент полноразмерной молекулы иммуноглобулина, такой как, например, фрагмент Fab, фрагмент F(ab')2, фрагмент Fc, фрагмент Fd или фрагмент Fv. Антитело может быть получено из любого вида позвоночных (например, человека, козы, лошади, осла, мыши, крысы, кролика или курицы) и может быть любого типа (например, IgG, IgE, IgM, IgD или IgA), класса (например, IgA, IgD, IgE, IgG или IgM) или подкласса (IgG1, IgG2, IgG3, IgG4, IgA1 или IgA2). Для получения полной информации о структуре природных антител, антител неприродного происхождения и их фрагментов, связывающих соединения-антигены, см., например, Plueckthun в The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994); Borrabeck, Antibody Engineering 2nd ed. (Oxford University Press). Природные антитела обычно представляют собой гетеротетрамерные гликопротеины с молекулярной массой примерно 150000 Дальтон, состоящие из двух идентичных легких (L) цепей и двух идентичных тяжелых (Н) цепей. Каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, при этом число дисульфидных связей варьирует в тяжелых цепях иммуноглобулинов различных изотипов. Каждая тяжелая и легкая цепь также содержит регулярно расположенные внутрицепочечные дисульфидные связи. Каждая тяжелая цепь содержит на одном конце вариабельный домен (VH), за которым следует ряд константных доменов. Каждая легкая цепь содержит на одном конце вариабельный домен (VL) и константный домен на другом своем конце. Константный домен легкой цепи выравнен с первым константным доменом тяжелой цепи, и вариабельный домен легкой цепи выравнен с вариабельным доменом тяжелой цепи. Считается, что конкретные остатки аминокислот формируют поверхность раздела между вариабельными доменами легкой цепи и тяжелой цепи.
1981, Meth. Enzymol. 73, 3. Указанные методики включают слияние клеток миеломы мыши с клетками селезенки, полученными от иммунизированных млекопитающих. Антитела могут быть дополнительно улучшены посредством способов, хорошо известных в данной области техники. Например, для увеличения эффективности фаговых антител, которые связываются с эпитопами, может быть применен поверхностный плазменный резонанс, используемый в системе Biacore; см., например, Schier 1996, Human Antibodies Hybridomas 7, 97; Malmborg 1995, J. Immunol. Methods 183, 7. Антитела в соответствии с настоящим описанием также включают функциональные эквиваленты антител, т.е. агенты, способные к специфическому связыванию с целевыми эпитопами или частями субстратов нейротоксина. В одном аспекте такие функциональные эквиваленты включают связывающие белки, специфически связывающиеся с субстратами нейротоксина или их доменами, способные опосредовать указанное специфическое связывание. Антитело в соответствии с настоящим описанием может представлять собой полноразмерную молекулу иммуноглобулина, содержащую домены VH и VL, а также константный домен легкой цепи (CL) и константные домены тяжелой цепи CH1, СН2 и СН3, или иммунологически активный фрагмент полноразмерной молекулы иммуноглобулина, такой как, например, фрагмент Fab, фрагмент F(ab')2, фрагмент Fc, фрагмент Fd или фрагмент Fv. Антитело может быть получено из любого вида позвоночных (например, человека, козы, лошади, осла, мыши, крысы, кролика или курицы) и может быть любого типа (например, IgG, IgE, IgM, IgD или IgA), класса (например, IgA, IgD, IgE, IgG или IgM) или подкласса (IgG1, IgG2, IgG3, IgG4, IgA1 или IgA2). Для получения полной информации о структуре природных антител, антител неприродного происхождения и их фрагментов, связывающих соединения-антигены, см., например, Plueckthun в The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994); Borrabeck, Antibody Engineering 2nd ed. (Oxford University Press). Природные антитела обычно представляют собой гетеротетрамерные гликопротеины с молекулярной массой примерно 150000 Дальтон, состоящие из двух идентичных легких (L) цепей и двух идентичных тяжелых (Н) цепей. Каждая легкая цепь связана с тяжелой цепью одной ковалентной дисульфидной связью, при этом число дисульфидных связей варьирует в тяжелых цепях иммуноглобулинов различных изотипов. Каждая тяжелая и легкая цепь также содержит регулярно расположенные внутрицепочечные дисульфидные связи. Каждая тяжелая цепь содержит на одном конце вариабельный домен (VH), за которым следует ряд константных доменов. Каждая легкая цепь содержит на одном конце вариабельный домен (VL) и константный домен на другом своем конце. Константный домен легкой цепи выравнен с первым константным доменом тяжелой цепи, и вариабельный домен легкой цепи выравнен с вариабельным доменом тяжелой цепи. Считается, что конкретные остатки аминокислот формируют поверхность раздела между вариабельными доменами легкой цепи и тяжелой цепи.
[0031] Вариабельные домены антитела содержат полный антигенраспознающий и антигенсвязывающий участок, т.е. фрагмент Fv. Данный фрагмент содержит димер одного вариабельного домена тяжелой цепи (VH) и одного вариабельного домена легкой цепи (VL), находящихся в прочной, нековалентной ассоциации. Каждый домен содержит четыре каркасных участка (FR), которые большей частью принимают бета-складчатую конфигурацию, связанных с тремя гипервариабельными участками, которые образуют соединение в виде петель и в некоторых случаях частично формируют бета-складчатую структуру. Каждый гипервариабельных участок содержит последовательность аминокислот, которая соответствует участку, определяющему комплементарность (CDR). В совокупности, именно трехмерная конфигурация из шести участков CDR определяет антигенсвязывающий сайт на поверхности димера VH-VL, который обеспечивает специфичность связывания антигена. См., например, Cyrus Chothia, et al., Conformations of Immunoglobulin Hypervariable Regions, Nature 342(6252): 877-883 (1989); Elvin A. Kabat, et al. Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991). Константные домены антитела не участвуют непосредственно в связывании антитела с антигеном, однако проявляют различные эффекторные функции, такие как участие антитела в антителозависимой клеточной цитотоксичности.
[0032] «Селективное связывание» или «специфическое связывание» в настоящем описании включает свойства связывания, такие как, например, аффинность связывания, специфичность связывания и авидность связывания; см., например, David J. King, Applications и Engineering of Monoclonal Antibodies, pp. 240 (1998). Аффинность связывания относится к периоду времени пребывания антитела в сайте связывания его эпитопа и может рассматриваться как сила, с которой антитело связывается со своим эпитопом. Аффинность связывания может быть описана равновесной константой диссоциации антитела (KD), которую определяют как соотношение Kd/Ka в состоянии равновесия. Ka представляет собой константу скорости ассоциации антитела, и Kd представляет собой константу скорости диссоциации антитела. Аффинность связывания определяется как ассоциацией, так и диссоциацией, и отдельно ни высокая ассоциация, ни низкая диссоциация не обеспечивают высокой аффинности. Константа скорости ассоциации (Ka), или константа скорости образования комплекса (Kon), определяет число событий связывания в единицу времени, или склонность антитела и антигена обратимо ассоциировать с образованием комплекса антитело-антиген. Константу скорости ассоциации выражают в M-1⋅с-1 и символически изображают следующим образом: [Ab]×[Ag]×Kon. Чем больше константа скорости ассоциации, тем быстрее антитело связывается со своим антигеном, или тем выше аффинность связывания между антителом и антигеном. Константа скорости диссоциации (Kd), или константа скорости распада комплекса (Koff), определяет число событий диссоциаций в единицу времени, или склонность комплекса антитело-антиген обратимо распадаться (диссоциировать) на составляющие его молекулы, а именно антитело и антиген. Константу скорости диссоциации выражают в с-1 и символически изображают следующим образом: [Ab+Ag]×Koff. Чем меньше константа скорости диссоциации, тем прочнее антитело связано со своим антигеном, или тем выше аффинность связывания между антителом и антигеном. Равновесная константа диссоциации (KD) определяет скорость образования новых комплексов антитело-антиген и эквивалентна скорости диссоциации комплексов антитело-антиген в состоянии равновесия. Равновесную константу диссоциации выражают в М и определяют как Koff/Kon=[Ab]×[Ag]/[Ab+Ag], где [Ab] представляет собой молярную концентрацию антитела, [Ag] представляет собой молярную концентрацию антигена, и [Ab+Ag] представляет собой молярную концентрацию комплекса антитело-антиген, где все концентрации в таком соотношении, при котором система находится в состоянии равновесия. Чем меньше равновесная константа диссоциации, тем прочнее антитело связано со своим антигеном, или тем выше аффинность связывания между антителом и антигеном. Таким образом, в одном аспекте способа согласно настоящему изобретению первое связывающее антитело, специфически связывающееся с нерасщепленным и расщепленным нейротоксином субстратом, может иметь константу скорости ассоциации, составляющую, например, менее 1×105 М-1⋅с-1, менее 1×106 М-1⋅с-1, меньше чем 1×107 М-1⋅с-1 или менее 1×108 М-1⋅с-1. В другом аспекте первое связывающее антитело, специфически связывающееся с нерасщепленным и расщепленным нейротоксином субстратом, может иметь константу скорости ассоциации, составляющую, например, более 1×105 M-1⋅с-1, более 1×106 M-1⋅с-1, более 1×107 М-1⋅с-1 или более 1×108 М-1⋅с-1. В другом аспекте первое связывающее антитело, специфически связывающееся с нерасщепленным и расщепленным нейротоксином субстратом, может иметь константу скорости диссоциации, составляющую, например, менее 1×10-3 M-1⋅с-1, менее 1×10-4 М-1⋅c-1, менее 1×10-5 M-1⋅с-1 или менее 1×10-6 М-1⋅с-1. В еще одном аспекте первое связывающее антитело, специфически связывающееся с нерасщепленным и расщепленным нейротоксином субстратом, может иметь константу скорости диссоциации, составляющую, например, более 1×10-3 М-1⋅с-1, более 1×10-4 M-1⋅с-1, более 1×10-5 M-1⋅с-1 или более чем 1×10-6 M-1⋅c-1. В другом аспекте второе связывающее антитело, специфически связывающееся с сайтом расщепления субстрата, расщепленного нейротоксином, может иметь константу скорости ассоциации, составляющую, например, менее 1×105 М-1⋅с-1, менее 1×106 М-1⋅с-1, менее 1×107 М-1⋅с-1 или менее 1×108 М-1⋅с-1. В другом аспекте второе связывающее антитело, специфически связывающееся с сайтом расщепления субстрата, расщепленного нейротоксином, может иметь константу скорости ассоциации, составляющую, например, более 1×105 М-1⋅с-1, более 1×106 М-1⋅с-1, более 1×107 М-1⋅с-1 или более 1×108 М-1⋅с-1. В другом аспекте второе связывающее антитело, специфически связывающееся с сайтом расщепления субстрата, расщепленного нейротоксином, может иметь константу скорости диссоциации, составляющую, например, менее 1×10-3 M-1⋅с-1, менее 1×10-4 M-1⋅с-1, менее 1×10-5 М-1⋅с-1 или менее 1×10-6 M-1⋅с-1. В еще одном аспекте второе связывающее антитело, специфически связывающееся с сайтом расщепления субстрата, расщепленного нейротоксином, может иметь константу скорости диссоциации, составляющую например, более 1×10-3 M-1⋅с-1, более 1×10-4 M-1⋅с-1, более 1×10-5 M-1⋅с-1 или более 1×10-6 М-1⋅с-1.
[0033] Антигены-мишени, такие как расщепленные нейротоксином или нерасщепленные нейротоксином субстраты SNAP-25, VAMP/синаптобревин или синтаксин, в общем случае содержат один или более сайтов связывания, также называемых эпитопами, которые распознаются образованным CDR антигенсвязывающим сайтом антитела. В настоящем описании термин «эпитоп» является синонимом «антигенной детерминанты» и относится к участку антигена-мишени, такого как, например, пептид, полипептид, полисахарид или липидсодержащая молекула, способному к специфическому связыванию с иммуноглобулином или рецептором Т-клетки или иному взаимодействию с молекулой. Каждое антитело, специфически связывающееся с различными эпитопами, имеет различную структуру. Таким образом, для одного антигена может существовать более одного соответствующего антитела. «Специфическое связывание», в соответствии с настоящим описанием, может быть исследовано различными, хорошо известными способами, включая, например, эксперименты по конкурентному связыванию и вестерн-блоттинг. В соответствии с настоящим изобретением, эпитоп относится к антигенной детерминанте в субстратах нейротоксина, например, SNAP-25, VAMP/синаптобревине или синтаксине, которая распознается антителом. В настоящем описании термин «специфически» означает селективно и относится к обладанию уникальным эффектом, или воздействием, или реакции только по одному пути или только с одним веществом. В настоящем описании термин «специфически связывает» или «селективно связывает» по отношению к антителу или связывающему белку или связывающему домену относится к избирательному связыванию антитела или связывающего белка/домена с указанным эпитопом-мишенью таким образом, что антитело или связывающий белок/домен по существу не вступают в перекрестную реакцию с эпитопами, не являющимися мишенями. Минимальный размер пептида эпитопа, как определено в настоящем описании, составляет примерно пять аминокислотных остатков, и пептид эпитопа, как правило, содержит по меньшей мере 5, по меньшей мере 6, по меньшей мере 7, по меньшей мере 8, по меньшей мере 9, по меньшей мере 10, по меньшей мере 11, по меньшей мере 12, по меньшей мере 13, по меньшей мере 14, по меньшей мере 15, по меньшей мере 16, по меньшей мере 17, по меньшей мере 18, по меньшей мере 19, по меньшей мере 20, по меньшей мере 21, по меньшей мере 22, по меньшей мере 23, по меньшей мере 24, по меньшей мере 25 или по меньшей мере 30 аминокислотных остатков. Пептид эпитопа может представлять собой линейный или прерывистый эпитоп. Прерывистый эпитоп содержит аминокислотные остатки, которые не являются соседними в первичной структуре полипептида, но сближены в эпитопе за счет вторичной, третичной или четвертичной структуры пептида. Кроме того, также отмечено, что эпитоп может содержать фрагмент молекулы, отличный от аминокислотной последовательности, такой как, например, углеводный фрагмент, липидный фрагмент, такой как гликолипиды или липопротеины, или химически модифицированный аминокислотный фрагмент, такой как фосфолированная аминокислота.
[0034] В соответствии со способом согласно настоящему изобретению «первое связывающее антитело» специфически связывается с эпитопом, содержащимся в нерасщепленном и расщепленном нейротоксином субстрате. Указанные субстраты нейротоксина могут представлять собой, например, SNAP-25, VAMP/синаптобревин или синтаксин. Например, SNAP-25 является известным субстратом BoNT/A, BoNT/C1 и BoNT/E. VAMP/синаптобревин является субстратом BoNT/B, BoNT/D, BoNT/F, BoNT/G и TeNT, при этом синтаксин является субстратом BoNT/C1. Указанное первое связывающее антитело обеспечивает определение общего количества, т.е. общего содержания, соответствующего субстрата нейротоксина в клетках. Например, в SNAP-25, имеющем общую длину 205 аминокислотных остатков, сайт расщепления для BoNT/A расположен между аминокислотными остатками Gln 197 и Arg 198. Соответственно, антитело, специфически связывающееся с эпитопом, расположенным со стороны N-конца от сайта расщепления BoNT/А, т.е. эпитопом, расположенным между остатками аминокислот 1 и 198 SNAP-25, может применяться в качестве первого связывающего антитела. Например, указанное антитело может специфически связываться с N-концевым эпитопом или эпитопом, расположенным в средней части SNAP-25. В случае BoNT/C1 эпитоп, расположенный со стороны N-конца от сайта расщепления BoNT/C1 (Arg 198 - Ala 199), т.е. между остатками аминокислот 1 и 199 SNAP-25, может применяться в качестве первого связывающего антитела. В случае BoNT/E, эпитоп, расположенный со стороны N-конца от сайта расщепления BoNT/E (Arg 180 - Ile 181), т.е. между остатками аминокислот 1 и 181 SNAP-25, может применяться в качестве первого связывающего антитела. Если в качестве субстрата нейротоксина используют VAMP, эпитоп, расположенный со стороны N-конца от сайта расщепления BoNT/B (Gln 76 - Phe 77), т.е. между остатками аминокислот 1 и 77 VAMP, может применяться в качестве первого связывающего антитела. Эпитоп, расположенный со стороны N-конца от сайта расщепления BoNT/D (Lys 59 - Leu 60), т.е. между остатками аминокислот 1 и 60 VAMP2, может применяться в качестве первого связывающего антитела. Эпитоп, расположенный со стороны N-конца от сайта расщепления BoNT/F (Gln 58 - Lys 59), т.е. между остатками аминокислот 1 и 59 VAMP2, может применяться в качестве первого связывающего антитела. Эпитоп, расположенный со стороны N-конца от сайта расщепления BoN/G (Ala 81 - Ala 82), т.е. между остатками аминокислот 1 и 82 VAMP2, может применяться в качестве первого связывающего антитела. Если в качестве субстрата используют синтаксин, эпитоп, расположенный со стороны N-конца от сайта расщепления BoN/C1 (Lys 253 - Ala 254), т.е. между остатками аминокислот 1 и 254 синтаксина 1а, может быть применяться в качестве первого связывающего антитела.
[0035] В одном аспекте настоящего изобретения сайт расщепления нейротоксином, распознаваемый и расщепляемый протеазой BoNT/A, получен из белка, чувствительного к расщеплению BoNT/A. В одном аспекте такой белок представляет собой SNAP-25A или SNAP-25B человека, или их гомолог, паралог, или ортолог из крысы, мыши, быка, данио, карася, шпорцевой лягушки, гнюса, стронгилоцентротуса, лолиго, прудовика или аплизии. Подходящие сайты расщепления, полученные из указанных белков, предложены, например, в ЕР 1926744 В1.
[0036] В одном аспекте настоящего изобретения сайт расщепления нейротоксином, распознаваемый и расщепляемый протеазой BoNT/B, получен из белка, чувствительного к расщеплению BoNT/B. В одном аспекте такой белок представляет собой VAMP-1, VAMP-2 и VAMP- 3/целлубревин человека или мыши, VAMP-2 быка, VAMP-2 или VAMP-3 крысы, VAMP-1, VAMP-2 или VAMP-3 курицы, VAMP-1 гнюса, VAMP стронгилоцентротуса, sybA, synB, synC, synD или syn дрозофилы, VAMP пиявки, VAMP-2 или VAMP-3 шпорцевой пиявки, VAMP-1 или VAMP-2 данио, VAMP лолиго, VAMP прудовика, VAMP аплизии или SNB1-подобный свободноживущей нематоды или любой их ортолог, паралог или гомолог. Подходящие сайты расщепления, полученные из указанных белков, раскрыты в ЕР 1926744 В1.
[0037] В одном аспекте настоящего изобретения сайт расщепления нейротоксином, распознаваемый и расщепляемый протеазой BoNT/C1, получен из белка, чувствительного к расщеплению BoNT/C1. В одном аспекте такой белок представляет собой синтаксин 1А, синтаксин 1В1, синтаксин 2-1, синтаксин 2-2, синтаксин 2-3, синтаксин 3А или синтаксин 1В2 человека и мыши, синтаксин 1А, синтаксин 1В1 или синтаксин 1В2 быка или крысы, синтаксин 2 крысы или синтаксин 3 крысы, синтаксин 1А, синтаксин 1В1, синтаксин 1В2, синтаксин 2, синтаксин 3А, синтаксин 3В или синтаксин 3С мыши, синтаксин 1А или синтаксин 2 курицы; синтаксин 1А или синтаксин 1В шпорцевой лягушки, синтаксин 1А, синтаксин 1В или синтаксин 3 данио, синтаксин 1А или синтаксин 1В гнюса, синтаксин 1А или синтаксин 1В стронгилоцентротуса, синтаксин 1А или синтаксин 1В дрозофилы, синтаксин 1А или синтаксин 1В пиявки, синтаксин 1А или синтаксин 1В лолиго, синтаксин 1А или синтаксин 1В прудовки или любой их ортолог, паралог или гомолог. Подходящие сайты расщепления, полученные из указанных белков, раскрыты в ЕР 1926744 В1.
[0038] В одном аспекте настоящего изобретения сайт расщепления нейротоксином, распознаваемый и расщепляемый протеазой BoNT/D, получен из белка, чувствительного к расщеплению BoNT/D. В одном аспекте такой белок представляет собой VAMP-1, VAMP-2 и VAMP-3/целлубревин человека или мыши, VAMP-2 быка, VAMP-2 или VAMP-3 крысы, VAMP-1, VAMP-2 или VAMP-3 курицы, VAMP-1 гнюса, VAMP стронгилоцентротуса, sybA, synB, synC, synD или syn дрозофилы, VAMP пиявки, VAMP-2 или VAMP-3 шпорцевой лягушки, VAMP-1 или VAMP-2 данио, VAMP лолиго, VAMP прудовки, VAMP аплизии или SNB1-подобный свободноживущей нематоды или любой их ортолог, паралог или гомолог. Подходящие сайты расщепления, полученные из указанных белков, раскрыты в ЕР 1926744 В1.
[0039] В одном аспекте настоящего изобретения сайт расщепления нейротоксином, распознаваемый и расщепляемый протеазой BoNT/E, получен из белка, чувствительного к расщеплению BoNT/E. В одном аспекте такой белок представляет собой SNAP-25A или В человека или их гомолог, паралог, или ортолог из крысы, мыши, быка, данио, карася, шпорцевой лягушки, гнюса, стронгилоцентротуса, лолиго, прудовика или аплизии. Подходящие сайты расщепления, полученные из указанных белков, раскрыты в ЕР 1926744 В1.
[0040] В одном аспекте настоящего изобретения сайт расщепления нейротоксином, распознаваемый и расщепляемый протеазой BoNT/F, получен из белка, чувствительного к расщеплению BoNT/F. В одном аспекте такой белок представляет собой VAMP-1, VAMP-2 и VAMP-3/целлубревин человека или мыши, VAMP-2 быка, VAMP-2 или VAMP-3 крысы, VAMP-1, VAMP-2 или VAMP-3 курицы, VAMP-1 гнюса, VAMP стронгилоцентротуса, sybA, synB, synC, synD или syn дрозофилы, VAMP пиявки, VAMP-2 или VAMP-3 шпорцевой лягушки, VAMP-1 или VAMP-2 данио, VAMP лолиго, VAMP прудовки, VAMP аплизии или SNB1-подобный свободноживущей нематоды или любой их ортолог, паралог или гомолог. Подходящие сайты расщепления, полученные из указанных белков, раскрыты в ЕР 1926744 В1.
[0041] В одном аспекте настоящего изобретения сайт расщепления нейротоксином, распознаваемый и расщепляемый протеазой BoNT/G, получен из белка, чувствительного к расщеплению BoNT/G. В одном аспекте такой белок представляет собой VAMP-1, VAMP-2 и VAMP-3/целлубревин человека или мыши, VAMP-2 быка, VAMP-2 или VAMP-3 крысы, VAMP-1, VAMP-2 или VAMP-3 курицы, VAMP-1 гнюса, VAMP стронгилоцентротуса, sybA, synB, synC, synD или syn дрозофилы, VAMP пиявки, VAMP-2 или VAMP-3 шпорцевой лягушки, VAMP-1 или VAMP-2 данио, VAMP лолиго, VAMP прудовки, VAMP аплизии или SNB1-подобный свободноживущей нематоды или любой их ортолог, паралог или гомолог. Подходящие сайты расщепления, полученные из указанных белков, раскрыты в ЕР 1926744 В1.
[0042] В одном аспекте настоящего изобретения сайт расщепления нейротоксином, распознаваемый и расщепляемый протеазой TeNT, получен из белка, чувствительного к расщеплению TeNT. В одном аспекте такой белок представляет собой VAMP-1, VAMP-2 и VAMP-3/целлубревин человека или мыши, VAMP-2 быка, VAMP-2 или VAMP-3 крысы, VAMP-1, VAMP-2 или VAMP-3 курицы, VAMP-1 гнюса, VAMP стронгилоцентротуса, sybA, synB, synC, synD или syn дрозофилы, VAMP пиявки, VAMP-2 или VAMP-3 шпорцевой лягушки, VAMP-1 или VAMP-2 данио, VAMP лолиго, VAMP прудовки, VAMP аплизии или SNB1-подобный свободноживущей нематоды или любой их ортолог, паралог или гомолог. Подходящие сайты расщепления, полученные из указанных белков, раскрыты в ЕР 1926744 В1.
[0043] Примеры подходящих антител, которые могут применяться в качестве первых связывающих антител в способе согласно настоящему изобретению, включают, например, кроличье поликлональное антитело анти-SNAP-25 S9684 (Sigma) ( Е, Wang J, Molina Y, Nelson JB, Jacky BPS, et al. (2012) Botulinum Neurotoxin Serotype a Specific Cell-Based Potency Assay to Replace the Mouse Bioassay. PLoS ONE 7(11): e49516. doi:10.1371/journal.pone.0049516), кроличье поликлональное антитело анти-SNAP-25 PA5-19708 (Pierce Antibodies), кроличье поликлональное антитело анти-SNAP-25 PA5-19701 (Pierce Antibodies), антитело к VAMP/синаптобревину sc-13992 (Santa Cruz Biotechnology) или # 104 203 (Synaptic Systems) или антитело к синтаксину ADI-VAM-SV013 (Enzo Life Sciences).
Е, Wang J, Molina Y, Nelson JB, Jacky BPS, et al. (2012) Botulinum Neurotoxin Serotype a Specific Cell-Based Potency Assay to Replace the Mouse Bioassay. PLoS ONE 7(11): e49516. doi:10.1371/journal.pone.0049516), кроличье поликлональное антитело анти-SNAP-25 PA5-19708 (Pierce Antibodies), кроличье поликлональное антитело анти-SNAP-25 PA5-19701 (Pierce Antibodies), антитело к VAMP/синаптобревину sc-13992 (Santa Cruz Biotechnology) или # 104 203 (Synaptic Systems) или антитело к синтаксину ADI-VAM-SV013 (Enzo Life Sciences).
[0044] В одном аспекте первое связывающее антитело, которое распознает нерасщепленный и расщепленный нейротоксином субстрат, применяют для нормализации с целью определения общего количества субстрата нейротоксина в клетке, как показано в следующих примерах.
[0045] «Второе связывающее антитело» в соответствии с настоящим описанием специфически связывает сайт расщепления субстрата, расщепленного нейротоксином. Соответственно, указанное второе связывающее антитело селективно распознает субстрат нейротоксина, расщепленный нейротоксином, например, продукт расщепления SNAP-25 под действием BoNT/A. Напротив, указанное второе связывающее антитело не способно связывать нерасщепленный субстрат нейротоксина, такой как, например, нерасщепленный SNAP-25. Примеры подходящих антител, которые могут применяться в качестве вторых связывающих антител в способе согласно настоящему изобретению, включают, например, мышиные моноклональные антитела согласно настоящему изобретению, как указано ниже, мышиное моноклональное антитело МС-6053 (R&D Systems), которое распознает BoNT/A-расщепленный SNAP-25 (Baldwin and Barbieri 2007, Biochemistry 46, 3200-3210), а также мышиное моноклональное антитело DMAB4345 (Creative Diagnostics).
[0046] В другом аспекте настоящего изобретения предложены новые моноклональные антитела, специфически связывающиеся с сайтом расщепления SNAP-25, расщепленного нейротоксином, т.е. только со SNAP-25, расщепленным нейротоксином, при этом они не связывают нерасщепленный SNAP-25. Указанные моноклональные антитела были получены и охарактеризованы, как описано в следующих примерах, и благодаря своей высокой аффинности и специфичности к SNAP-25, расщепленному нейротоксином, были признаны особенно подходящими в качестве вторых связывающих антител для способа согласно настоящему изобретению. Предпочтительно, моноклональные антитела согласно настоящему изобретению распознают и специфически связывают эпитоп SNAP-25190-197 «TRIDEANQ», представленный в SEQ ID NO: 74, и/или SNAP-25197, т.е. расщепленный нейротоксином (например, BoNT/A) SNAP-25. Более предпочтительно, моноклональные антитела согласно настоящему изобретению распознают и специфически связывают эпитоп SNAP-25191-197 «RIDEANQ», представленный в SEQ ID NO: 75, и/или SNAP-25197, эпитоп SNAP-25192-197 «IDEANQ» с последовательностью, представленной в SEQ ID NO: 76, и/или SNAP-25197, или эпитоп SNAP-25193-197 «DEANQ», представленный в SEQ ID NO: 77, и/или SNAP-25197.
[0047] В одном аспекте настоящее изобретение относится к антителу или его фрагменту, которое специфически связывается с сайтом расщепления BoNT/А-расщепленного SNAP-25 и которое содержит вариабельный участок тяжелой цепи (VH), содержащий последовательность аминокислот, указанную в SEQ ID NO. 18, и/или вариабельный участок легкой цепи (VL), содержащий последовательность аминокислот, указанную в SEQ ID NO. 19. Настоящее изобретение дополнительно включает антитела или их фрагменты, содержащие один, два или три участка, определяющих комплементарность (CDR) указанного(ых) вариабельного(ых) участка(ов) тяжелой цепи и/или легкой цепи. Соответствующие последовательности CDRH1, CDRH2 и CDRH3 представлены в SEQ ID NO. 20-22, соответственно, при этом соответствующие последовательности CDRL1, CDRL2 и CDRL3 представлены в SEQ ID NO. 23-25, соответственно. Указанные последовательности соответствуют мышиному моноклональному антителу 20-2-5, как показано в следующих примерах. Кроме того, настоящее изобретение относится к антителу или его фрагменту, которое специфически связывается с сайтом расщепления BoNT/A-расщепленного SNAP-25 и которое содержит вариабельный участок тяжелой цепи (VH), содержащий последовательность аминокислот, представленную в SEQ ID NO. 26, и/или вариабельный участок легкой цепи (VL), содержащий последовательность аминокислот, представленную в SEQ ID NO. 27. Настоящее изобретение дополнительно включает антитела или их фрагменты, содержащие один, два или три участка, определяющих комплементарность (CDR) указанного(ых) вариабельного(ых) участка(ов) тяжелой цепи и/или легкой цепи. Соответствующие последовательности CDRH1, CDRH2 и CDRH3 представлены в SEQ ID NO. 28-30, соответственно, при этом соответствующие последовательности CDRL1, CDRL2 и CDRL3 представлены в SEQ ID NO. 31-33, соответственно. Указанные последовательности соответствуют мышиному моноклональному антителу 5-10-5, как показано в следующих примерах. Дополнительно, настоящее изобретение относится к антителу или его фрагменту, которое специфически связывается с сайтом расщепления BoNT/A-расщепленного SNAP-25 и которое содержит вариабельный участок тяжелой цепи (VH), содержащий последовательность аминокислот, представленную в SEQ ID NO. 34, и/или вариабельный участок легкой цепи (VL), содержащий последовательность аминокислот, представленную в SEQ ID NO. 35. Настоящее изобретение дополнительно включает антитела или их фрагменты, содержащие один, два или три участка, определяющих комплементарность (CDR) указанного(ых) вариабельного(ых) участка(ов) тяжелой цепи и/или легкой цепи. Соответствующие последовательности CDRH1, CDRH2 и CDRH3 представлены в SEQ ID NO. 36-38, соответственно, при этом соответствующие последовательности CDRL1, CDRL2 и CDRL3 представлены в SEQ ID NO. 39-41, соответственно. Указанные последовательности соответствуют мышиному моноклональному антителу 1-10-4, как показано в следующих примерах. Настоящее изобретение также относится к антителу или его фрагменту, которое специфически связывается с сайтом расщепления BoNT/A-расщепленного SNAP-25 и которое содержит вариабельный участок тяжелой цепи (VH), содержащий последовательность аминокислот, представленную в SEQ ID NO. 42, и/или вариабельный домен легкой цепи (VL), содержащий последовательность аминокислот, представленную в SEQ ID NO. 43. Настоящее изобретение дополнительно включает антитела или их фрагменты, содержащие один, два или три участка, определяющих комплементарность (CDR) указанного(ых) вариабельного(ых) участка(ов) тяжелой цепи и/или легкой цепи. Соответствующие последовательности CDRH1, CDRH2 и CDRH3 представлены в SEQ ID NO. 44-46, соответственно, при этом соответствующие последовательности CDRL1, CDRL2 и CDRL3 представлены в SEQ ID NO. 47-49, соответственно. Указанные последовательности соответствуют мышиному моноклональному антителу 16-5-4, как показано в следующих примерах. Дополнительно, настоящее изобретение относится к антителу или его фрагменту, которые специфически связывается с сайтом расщепления BoNT/A-расщепленного SNAP-25 и которое содержит вариабельный участок тяжелой цепи (VH), содержащий последовательность аминокислот, представленную в SEQ ID NO. 50, и/или вариабельный участок легкой цепи (VL), содержащий последовательность аминокислот, представленную в SEQ ID NO. 51. Настоящее изобретение дополнительно включает антитела или их фрагменты, содержащие один, два или три участка, определяющих комплементарность (CDR) указанного(ых) вариабельного(ых) участка(ов) тяжелой цепи и/или легкой цепи. Соответствующие последовательности CDRH1, CDRH2 и CDRH3 представлены в SEQ ID NO. 52-54, соответственно, при этом соответствующие последовательности CDRL1, CDRL2 и CDRL3 представлены в SEQ ID NO. 55-57, соответственно. Указанные последовательности соответствуют мышиному моноклональному антителу 6-3-8, как показано в следующих примерах. Настоящее изобретение дополнительно относится к антителу или его фрагменту, которое специфически связывается с сайтом расщепления BoNT/A-расщепленного SNAP-25 и которое содержит вариабельный участок тяжелой цепи (VH), содержащий последовательность аминокислот, представленную в SEQ ID NO. 58, и/или вариабельный участок легкой цепи (VL), содержащий последовательность аминокислот, представленную в SEQ ID NO. 59. Настоящее изобретение дополнительно включает антитела или их фрагменты, содержащие один, два или три участка, определяющих комплементарность (CDR) указанного(ых) вариабельного(ых) участка(ов) тяжелой цепи и/или легкой цепи. Соответствующие последовательности CDRH1, CDRH2 и CDRH3 представлены в SEQ ID NO. 60-62, соответственно, при этом соответствующие последовательности CDRL1, CDRL2 и CDRL3 представлены в SEQ ID NO. 63-65, соответственно. Указанные последовательности соответствуют мышиному моноклональному антителу 18-3-3, как показано в следующих примерах. Кроме того, настоящее изобретение относится к антителу или его фрагменту, которое специфически связывается с сайтом расщепления BoNT/A-расщепленного SNAP-25 и которое содержит вариабельный участок тяжелой цепи (VH), содержащий последовательность аминокислот, представленную в SEQ ID NO. 66, и/или вариабельный участок легкой цепи (VL), содержащий последовательность аминокислот, представленную в SEQ ID NO. 67. Настоящее изобретение дополнительно включает антитела или их фрагменты, содержащие один, два или три участка, определяющих комплементарность (CDR) указанного(ых) вариабельного(ых) участка(ов) тяжелой цепи и/или легкой цепи. Соответствующие последовательности CDRH1, CDRH2 и CDRH3 представлены в SEQ ID NO. 68-70, соответственно, при этом соответствующие последовательности CDRL1, CDRL2 и CDRL3 представлены в SEQ ID NO. 71-73, соответственно. Указанные последовательности соответствуют мышиному моноклональному антителу 14-12-1, как показано в следующих примерах.
[0048] Термин «первое детектирующее антитело» в настоящем описании представляет собой антитело, специфически связывающееся с первым связывающим антителом. Указанное первое детектирующее антитело обеспечивает специфическое детектирование первого связывающего антитела. Посредством измерения количества связанного первого детектирующего антитела можно определять количество первых детектируемых комплексов, так как количество связанного первого детектирующего антитела в первом детектируемом комплексе коррелирует с количеством первого связывающего антитела (и, соответственно, с количеством общего, т.е. расщепленного и нерасщепленного субстрата нейротоксина), содержащегося в первом детектируемом комплексе. Например, подходящее видоспецифичное антитело может быть использовано в качестве первого детектирующего антитела: если мышиное антитело применяют в качестве первого связывающего антитела, указанное первое детектирующее антитело может быть антителом против антител мыши, специфически связывающимся с мышиным антителом. Первое детектирующее антитело может представлять собой, например, антитело, конъюгированное со щелочной фосфатазой (АР), антитело, конъюгированное с пероксидазой хрена (HRP), или антитело, конъюгированное с флуоресцентным красителем. Конъюгация ферментов с антителами, например, с применением глутаральдегида, хорошо известна в данной области техники.
[0049] Иммуноферментный анализ (ИФА) применяется в течение почти 40 лет для количественного определения широкого ряда соединений и патогенов. Первоначально для проведения количественных анализов использовали радиоактивность, однако радиоиммунные анализы (РИА) были заменены анализами с применением ферментов для получения колориметрических результатов. Недавно были разработаны новые субстраты для получения флуоресцентных и люминесцентных продуктов. Основополагающий принцип новых методов анализа остается таким же, как и в колориметрических анализах. Субстрат превращают в подлежащее измерению соединение за счет ферментативной активности белков, конъюгированных с антителом, которое обеспечивает специфичность.
[0050] Широко применяемыми в ИФА конъюгатами ферментов являются конъюгаты, образованные со щелочной фосфатазой или пероксидазой хрена. Соответственно, в одном аспекте первое детектирующее антитело может быть конъюгировано, например, со щелочной фосфатазой или пероксидазой хрена. Дополнительные примеры конъюгатов ферментов, которые могут применяться в качестве первого детектирующего антитела в способе согласно настоящему изобретению, включают глюкозооксидазу, использующую глюкозу в качестве субстрата, тирозиназу, превращающую субстрат 1-(4-метилкумарин-7-ил)-3-(4-гидроксифенил)мочевину) (РАР-АМС) (Stratis Avrameas, Immunochemistry, Volume 6, Issue 1, January 1969, Pages 43-48, IN9-IN11, 49-52) или β-галактозидазу, превращающую субстрат 6,8-дифтор-4-метилумбеллиферил-β-D-галактопиранозид (DiFMUG) (Gee et al., Analytical Biochemistry, Volume 273, Issue 1, August 1999, pages 41-48). При добавлении субстрата, указанный субстрат превращается при участии фермента в детектируемую форму. Например, щелочная фосфатаза катализирует расщепление сложных эфиров фосфорной кислоты. Если антитело, конъюгированное со щелочной фосфатазой (АР), применяют в качестве первого детектирующего антитела, подходящий субстрат, такой как производное 4-метилумбеллиферил-фосфата, например, 6,8-дифтор-4-метилумбеллиферилфосфат (DiFMUP), или флуоресцеина дифосфат (FDP). 6,8-дифтор-4-метилумбеллиферилфосфат (DiFMUP) превращается при участии АР в детектируемую форму, т.е. флуорогенный продукт 6,8-дифтор-4-метилумбеллиферон. Указанный субстрат поставляется, например, компанией Molecular Probes. Значения интенсивности флуоресценции продукта реакции DiFMUP могут быть измерены с применением максимумов возбуждения/эмиссии, составляющих примерно 358/450 нм. Дополнительные субстраты, которые могут применяться для этой цели, представляют собой 9Н-(1,3-дихлор-9,9-диметилакридин-2-он-7-ил)фосфат (DDAO-фосфат; Invitrogen), флуоресцеина дифосфат (FDP; Sigma Aldrich) или 4-метилумбеллиферилфосфат (MUP; Invitrogen). DDAO-фосфат превращается при участии АР во флуорогенный продукт диметилакридинон (DDAO), имеющий максимумы возбуждения/эмиссии примерно 646/659 нм. Если в качестве субстрата для АР используют FDP, продукт реакции представляет собой флуоресцеин, имеющий максимумы возбуждения/эмиссии примерно 490/514 нм. Для MUP соответствующий продукт реакции представляет собой 4-метилумбеллиферон (7-гидрокси-4-метилкумарин), имеющий максимумы возбуждения/эмиссии примерно 360/449 нм. Эти субстраты также являются коммерчески доступными, например, в компании Molecular Probes. В качестве альтернативы, пероксидаза хрена может применяться в качестве конъюгата фермента для первого детектирующего антитела в способе согласно настоящему изобретению. Пероксидаза хрена (HRP) катализирует восстановление перекиси водорода (Н2О2) до воды (Н2О). В присутствии специфических субстратов, которые выступают в качестве доноров водорода, воздействие HRP превращает бесцветные или нефлуоресцирующие молекулы в цветные и/или флуоресцирующие фрагменты, соответственно. Например, Amplex® Red (Life Technologies) представляет собой субстрат для применения в пробах, содержащих HRP. В присутствие фермента пероксидазы Amplex Red реагирует с Н2О2 в стехиометрическом соотношении 1:1 с образованием резоруфина, красного флуоресцентного соединения, которое имеет максимумы поглощения и эмиссии флуоресценции, составляющие 563 нм и 587 нм, соответственно. Другой пример субстрата HRP представляет собой Amplex® UltraRed (Life Technologies). Как сообщается, реагент Amplex® UltraRed (возбуждение/эмиссия ~570/585 нм) имеет улучшенные характеристики реагента Amplex® Red, обеспечивая более яркую флуоресценцию и повышенную чувствительность при расчете на каждый моль пероксидазы хрена или в сопряженных ферментных анализах с применением пероксидазы хрена. Флуоресценция окисленного реагента Amplex® UltraRed (реагент Amplex® UltroxRed) также менее чувствительна к pH, а субстрат и продукт его окисления демонстрируют большую стабильность, чем реагент Amplex® Red, в присутствии перекиси водорода (Н2О2) или тиолов, таких как дитиотреитол (DTT). Подходящие субстраты HRP, которые дополнительно могут применяться в способе согласно настоящему изобретению, включают, например, 10-ацетил-3,7-дигидроксифеноксазин (ADHP; AnaSpec) или 3-(4-гидроксифенил)пропионовую кислоту (НРРА; AnaSpec) (Tuuminen et al. 1991, J. Immunoassay 12, 29-46).
[0051] В качестве альтернативы, первое детектирующее антитело может нести подходящую, детектируемую метку, которая обеспечивает детектирование первого связывающего антитела. Введение метки может быть проведено прямыми и непрямыми способами. Прямое введение метки включает связывание метки непосредственно (ковалентно или нековалентно) с первым детектирующим антителом. Непрямое введение метки включает связывание (ковалентно или нековалентно) агента, который специфически связывается с первым детектирующим антителом и который несет детектируемую метку. Такой агент может представлять собой, например, второе (высшего порядка) антитело, которое специфически связывается с первым детектирующим антителом. В таком случае второе антитело будет связано с детектируемой меткой. Следует понимать, что другие антитела высшего порядка могут быть дополнительно использованы для детектирования первого детектируемого комплекса. Антитела высшего порядка часто применяют для увеличения сигнала. Подходящие антитела высшего порядка могут также включать хорошо известную систему стрептавидин-биотин (Vector Laboratories, Inc.) и хорошо известные Dako LSAB™2 и LSAB™+ (меченый стрептавидин-биотин) или Dako PAP (пероксидаза-антипероксидаза). В другом аспекте указанная метка первого детектирующего антитела представляет собой флуоресцентный краситель, т.е. первое антитело конъюгировано с флуоресцентным красителем. В данном случае флуоресценцию можно измерять непосредственно с помощью устройства для регистрации флуоресценции. Типичные флуоресцентные метки включают флуоресцентные белки, такие как GFP и его производные, красители Cy, такие как Cy3 или Cy5, Texas Red, Fluorescein и красители Alexa, например, Alexa 568.
[0052] «Второе детектирующее антитело» в соответствии с настоящим описанием представляет собой антитело, специфически связывающееся со вторым связывающим антителом. Второе детектирующее антитело может быть, например, конъюгировано с ферментом, таким как щелочная фосфатаза, пероксидаза хрена, глюкозооксидаза или тирозиназа. Соответственно, в одном аспекте второе детектирующее антитело представляет собой антитело, конъюгированное со щелочной фосфатазой (АР), антитело, конъюгированное с пероксидазой хрена (HRP), антитело, конъюгированное с глюкозооксидазой, или антитело, конъюгированное с тирозиназой. Указанное второе детектирующее антитело обеспечивает специфическое детектирование второго связывающего антитела. Посредством измерения количества связанного второго детектирующего антитела можно определить количество вторых детектируемых комплексов, так как количество связанного второго детектирующего антитела во втором детектируемом комплексе коррелирует с количеством второго связывающего антитела (и, соответственно, с количеством расщепленного нейротоксином субстрата), содержащегося в первом детектируемом комплексе. Например, если кроличье антитело применяют в качестве второго связывающего антитела, антитело против антител кролика может быть использовано в качестве второго детектирующего антитела. Второе детектирующее антитело может нести фермент, как указано выше, или метку, такую как флуоресцентный краситель (т.е. второе детектирующее антитело конъюгировано с флуоресцентным красителем), как указано в другом месте настоящего описания применительно к первому детектирующему антителу. В одном аспекте способа согласно настоящему изобретению фермент, конъюгированный с первым детектирующим антителом, отличается от фермента, конъюгированного со вторым детектирующим антителом, для обеспечения специфического детектирования соответствующих первого и второго связывающих антител в способе согласно настоящему изобретению. Например, если первое детектирующее антитело представляет собой антитело, конъюгированное с АР, второе детектирующее антитело может представлять собой антитело, конъюгированное с пероксидазой хрена (HRP), или наоборот. При этом спектры возбуждения/эмиссии флуорогенных субстратов АР и HRP по существу не перекрываются, но отличны друг от друга, т.е. они демонстрируют явный сдвиг таким образом, чтобы обеспечить различие интенсивностей флуоресценции, генерируемой соответствующим продуктом. Например, DiFMUP демонстрирует возбуждение/эмиссию при ~358/450 нм, тогда как Amplex UltraRed демонстрирует возбуждение/эмиссию при ~570/585 нм, что обеспечивает точные измерения значений интенсивности флуоресценции, генерируемой путем превращения указанных флуорогенных субстратов с помощью соответствующих ферментов. В другом аспекте антитело, конъюгированное со щелочной фосфатазой (АР), применяют в качестве первого детектирующего антитела для антигена, который в избытке присутствует в клетке, т.е. для измерения количества общего (нерасщепленного и расщепленного) субстрата нейротоксина, такого как общий SNAP-25, в клетке. Антитело, конъюгированное с пероксидазой хрена (HRP), применяют в качестве второго детектирующего антитела для антигена, который представлен в клетке в меньшем количестве, т.е. для измерения количества расщепленного субстрата нейротоксина, такого как BoNT/A-расщепленный SNAP-25, в клетке. Как известно в данной области техники, субстраты HRP более чувствительны по сравнению с субстратами АР, что означает возможность детектирования меньшего количества. Если конъюгированное с HRP антитело применяют в качестве второго антитела для детектирования расщепленного SNAP-25, то меньшие количества расщепленного SNAP-25 являются детектируемыми. В свою очередь, можно определять меньшие количества BoNT/A, что увеличивает чувствительность анализа. В связи с тем, что конъюгированное с АР антитело применяют для измерения общего количества SNAP-25 в клетке, благодаря избытку аналита не требуется высокой чувствительности к субстрату.
[0053] Термин по «меньшей мере» в настоящем описании, такой как, например, «по меньшей мере первое связывающее антитело» означает, что в добавление к антителу, специфически связывающемуся с нерасщепленным и расщепленным нейротоксином субстратом, одно или более других антител с указанной специфичностью могут применяться в способе согласно настоящему изобретению. Аналогичным образом, «по меньшей мере второе связывающее антитело» означает, что в добавление к антителу, специфически связывающемуся с сайтом расщепления субстрата, расщепленного нейротоксином, одно или более других антител с указанной специфичностью могут применяться в способе согласно настоящему изобретению. При этом одно или более первых детектирующих антител, специфически связывающихся с первым детектирующим антителом (или первыми детектирующими антителами) могут применяться в способе согласно настоящему изобретению. Аналогичным образом, одно или более вторых детектирующих антител, специфически связывающихся со вторым детектирующим антителом (или вторыми детектирующими антителами), могут применяться в способе согласно настоящему изобретению.
[0054] Термин «первый детектируемый комплекс» относится к комплексу, содержащему первое связывающее антитело и первое детектирующее антитело, который специфически связывается с нерасщепленным и расщепленным нейротоксином субстратом, что позволяет определить общее содержание субстрата нейротоксина в клетке. Количество первого детектируемого комплекса может быть измерено посредством определения количества специфически связанного первого детектирующего антитела. Этого можно достичь в зависимости от природы фермента или метки первого детектирующего антитела, например, посредством измерения интенсивности флуоресценции.
[0055] Термин «второй детектируемый комплекс» относится к комплексу, содержащему второе связывающее антитело и второе детектирующее антитело, который специфически связывается с сайтом расщепления субстрата, расщепленного нейротоксином, что позволяет определить содержание расщепленного субстрата нейротоксина в клетке. Количество второго детектируемого комплекса может быть измерено посредством определения количества специфически связанного второго детектирующего антитела. Этого можно достичь в зависимости от природы фермента или метки второго детектирующего антитела, например, посредством измерения интенсивности флуоресценции.
[0056] Предполагается, что вместо иммуноферментного анализа (ИФА) может быть использована любая система детектирования для осуществления аспектов способа согласно настоящему изобретению при условии, что отношение сигнала к шуму может обеспечить статистически значимое отличие сигнала, обусловленного образованием комплексов антитело-антиген, от фонового сигнала. Неограничивающие примеры систем детектирования, основанных на иммунной реакции, включают анализ посредством иммуноблоттинга, такой как вестерн-блоттинг и дот-блоттинг, анализ посредством иммунопреципитации и ИФА типа «сэндвич». Детектирование сигнала может быть осуществлено с применением радиоавтографии с визуализацией или фосфовизуализацией (AU), биолюминесценции (BL), флуоресценции, резонансного переноса энергии, плоской поляризации, колориметрии или проточной цитометрии (FC). Описания систем детектирования, основанных на иммунной реакции, приведены, например, в Commonly Used Techniques in Molecular Cloning, pp. A8.1-A8-55 (Sambrook & Russell, eds., Molecular Cloning A Laboratory Manual, Vol. 3, 3.sup.rd ed. 2001); Detection Systems, pp. A9.1-A9-49 (Sambrook & Russell, eds., Molecular Cloning A Laboratory Manual, Vol. 3, 3.sup.rd ed. 2001).
[0057] В другом аспекте клетки, антитела, полипептиды нейротоксина и субстраты нейротоксина или любые другие продукты, указанные в настоящем описании, представляют собой изолированные клетки, антитела, полипептиды нейротоксина, субстраты нейротоксина или продукты, соответственно. В настоящем описании термин «изолированный», такой как изолированное антитело, относится к молекуле, отделенной от ее естественного окружения посредством вмешательства человека.
[0058] В одном аспекте способа согласно настоящему изобретению указанный способ представляет собой флуоресцентный метод.
[0059] В другом аспекте способа согласно настоящему изобретению полипептид нейротоксина представляет собой полипептид BoNT/A, BoNT/B, BoNT/C1, BoNT/D, BoNT/E, BoNT/F или BoNT/G или полипептид столбнячного нейротоксина (TeNT), как определено более подробно в другом месте настоящего описания.
[0060] В другом аспекте способа согласно настоящему изобретению субстрат нейротоксина представляет собой VAMP/синаптобревин, SNAP-25 или синтаксин.
[0061] Ниже по тексту указаны соответствующие номера доступа для соответствующих субстратов нейротоксина, которые могут применяться в способе согласно настоящему изобретению: SNAP-25 человека Р60880, синтаксин-1А Q16623, синтаксин-1В Р61266, синтаксин-2 Р32856, синтаксин-3 Q13277, синтаксин-4 Q12846, синтаксин-5 Q13190, синтаксин-6 O43752, синтаксин-7 O15400, синтаксин-8 Q9UNK0, синтаксин-10 O60499, синтаксин-11 O75558, синтаксин-12 Q86Y82, синтаксин-16 O14662, синтаксин-17 Р56962, синтаксин-18 Q9P2W9, синтаксин-19 Q8N4C7 человека; синаптобревин-1 Р23763, синаптобревин-2 Р63027, синаптобревин-3 Q15836 человека; синаптотагмин человека: синаптотагмин-1 Р21579, синаптотагмин-2 Q8N9I0, синаптотагмин-3 Q9BQG1, синаптотагмин-4 Q9H2B2, синаптотагмин-5 O00445, синаптотагмин-6 Q5T7P8, синаптотагмин-8 Q8NBV8, синаптотагмин-9 Q86SS6, синаптотагмин-10 Q6XYQ8, синаптотагмин-11 Q9BT88, синаптотагмин-12 Q8IV01, синаптотагмин-13 Q7L8C5, синаптотагмин-14 Q8NB59, синаптотагмин-15 Q9BQS2, синаптотагмин-16 Q17RD7, синаптотагмин-17 Q9BSW7, везикуло-ассоциированные мембранные белки человека (VAMP): везикуло-ассоциированный мембранный белок 1 Р23763, везикуло-ассоциированный мембранный белок 2 Р63027, везикуло-ассоциированный мембранный белок 3 Q15836, везикуло-ассоциированный мембранный белок 4 O75379, везикуло-ассоциированный мембранный белок 5 O95183, везикуло-ассоциированный мембранный белок 7 Р51809, везикуло-ассоциированный мембранный белок 8 Q9BV40; из синаптических везикулярных гликопротеинов (SV2): синаптический везикулярный гликопротеин 2A Q7L0J3, синаптический везикулярный гликопротеин 2В Q7L1I2, синаптический везикулярный гликопротеин 2С.
[0062] В другом аспекте настоящего изобретения клетки представляют собой нейрональные клетки или дифференцированные нейрональные клетки, выбранные из группы, состоящей из: первичных нейрональных клеток, опухолевых клеток, способных дифференцироваться в нейрональные клетки, такие как клетки нейробластомы или клеточные линии, определенные в другом месте настоящего описания, клетки Р19 или нейроны, полученные из индуцированных плюрипотентных стволовых клеток (iPS), предпочтительно нейроны, полученные из индуцированных плюрипотентных стволовых клеток (iPS) человека.
[0063] В другом аспекте способа согласно настоящему изобретению фиксацию клеток осуществляют посредством добавления фиксирующего агента, выбранного из группы, состоящей из: метанола, этанола, ацетона, формальдегида или их смесей. Предпочтительно, фиксацию клеток осуществляют посредством добавления охлажденного метанола (-20°С) и инкубации в течение 20 минут при температуре -20°С.
[0064] В одном аспекте способа согласно настоящему изобретению первое связывающее антитело, специфически связывающееся с нерасщепленным и расщепленным нейротоксином субстратом, обеспечивает определение общего количества субстрата нейротоксина в клетках. Подходящие участки связывания и эпитопы первого связывающего антитела в соответствующем(их) субстрате(ах) нейротоксина определены в другом месте настоящего описания.
[0065] В конкретных аспектах способа согласно настоящему изобретению первое связывающее антитело, специфически связывающееся с нерасщепленным и расщепленным нейротоксином субстратом, представляет собой кроличье поликлональное антитело анти-SNAP-25 S9684, кроличье поликлональное антитело анти-SNAP25 РА5-19708 (антитела Pierce) или кроличье поликлональное антитело анти-SNAP25 РА5-19701 (антитела Pierce).
[0066] В дополнительных аспектах способа согласно настоящему изобретению второе связывающее антитело представляет собой мышиное моноклональное антитело 20-2-5, 5-10-5, 1-10-4, 16-5-4, 6-3-8, 18-3-3 или 14-12-1 согласно изобретению или клон мышиного моноклонального антитела МС-6053 (R&D Systems). Предпочтительно, второе связывающее антитело представляет собой мышиное моноклональное антитело 20-2-5. Соответствующие последовательности вариабельных участков и CDR мышиных моноклональных антител согласно настоящему изобретению описаны в другом месте настоящего описания.
[0067] В конкретных аспектах способа согласно настоящему изобретению первое и/или второе связывающее антитело являет(ют)ся иммобилизованным(ыми). Например, указанное первое и/или второе связывающее антитело связано(ы) с твердофазной основой. В настоящем описании термин «твердофазная основа» является синонимом «твердой фазы» и относится к любой матрице, которая может быть использована для иммобилизации первого и/или второго связывающего антитела, предложенного в настоящем описании. Неограничивающие примеры твердофазных основ включают, например, тубу; чашку; колонку; стержни или тестовые полоски («dipsticks»); магнитные частицы, шарики или другие сферические или волокнистые хроматографические среды, такие как, например, агароза, сефароза, силикагель и пластик; и листы или мембраны, такие как, например, нитроцеллюлоза и поливинилиденфторид (PVDF). Твердофазная основа может быть сконструирована с применением широкого спектра материалов, таких как, например, стекло, углерод, полистирол, поливинилхлорид, полипропилен, полиэтилен, декстран, нейлон, диазоцеллюлоза или крахмал. Выбранная твердофазная основа может обладать физическим свойством, обеспечивающим ее легкое отделение от растворимого или несвязанного материала и, как правило, позволяющим отделять или иным образом удалять (например, посредством промывки, фильтрования, центрифугирования и т.д.) несвязанные материалы, такие как, например, избыток реагентов, побочные продукты реакции или растворители, из компонента анализа, связанного с твердофазной основой. Неограничивающие примеры получения и применения твердофазных основ, описаны, например, в публикациях Molecular Cloning, A Laboratory Manual, supra, (2001); и Current Protocols in Molecular Biology, supra, (2004), полное содержание каждой из которых включено в настоящее описание посредством ссылки. В одном аспекте первое и/или второе связывающее антитело конъюгировано с шариками. Предполагается, что конъюгаты антитела-шарики достаточно малы для того, чтобы быть способными проникнуть в клетки через поры, полученные путем пермеабилизации указанных клеток.
[0068] В конкретных аспектах способа согласно настоящему изобретению первое детектирующее антитело представляет собой антитело, конъюгированное со щелочной фосфатазой (АР), антитело, конъюгированное с пероксидазой хрена (HRP), или антитело, конъюгированное с флуоресцентным красителем.
[0069] В дополнительных конкретных аспектах способа согласно настоящему изобретению второе детектирующее антитело представляет собой антитело, конъюгированное со щелочной фосфатазой (АР), антитело, конъюгированное с пероксидазой хрена (HRP), антитело, конъюгированное с глюкозооксидазой, антитело, конъюгированное с тирозиназой или антитело, конъюгированное с β-галактозидазой.
[0070] Предпочтительно, антитело, конъюгированное со щелочной фосфатазой (АР), применяют в качестве первого детектирующего антитела для измерения количества общего (нерасщепленного и расщепленного) субстрата нейротоксина, такого как общий SNAP-25, в клетке; и антитело, конъюгированное с пероксидазой хрена (HRP), применяют в качестве второго детектирующего антитела для измерения количества расщепленного субстрата нейротоксина, такого как BoNT/A-расщепленного SNAP-25, в клетке.
[0071] В конкретных аспектах способа согласно настоящему изобретению субстрат АР представляет собой производное 4-метилумбеллиферилфосфата, такое как 6,8-дифтор-4-метилумбеллиферилфосфат (DiFMUP), или флуоресцеина дифосфат (FDP).
[0072] В конкретных аспектах способа согласно настоящему изобретению субстрат HRP представляет собой Amplex UltraRed, 10-ацетил-3,7-дигидроксифеноксазин (ADHP) или 3-(4-гидроксифенил)пропионовую кислоту (НРРА).
[0073] В более конкретном аспекте способа согласно настоящему изобретению способ осуществляют, как показано на фигуре 1.
[0074] Другой аспект настоящего изобретения относится к набору для осуществления способа согласно настоящему изобретению, содержащему:
a) совокупность первого связывающего антитела, второго связывающего антитела, первого детектирующего антитела и второго детектирующего антитела, при этом указанная совокупность обеспечивает осуществление способа согласно настоящему изобретению;
b) средства для расчета количества субстрата, расщепленного указанным нейротоксином, на основании количеств первого и второго детектируемых комплексов, определяемых с помощью совокупности согласно п. a); и
c) инструкции для осуществления указанного способа.
[0075] Термин «набор» в настоящем описании относится к совокупности вышеупомянутых средств или реагентов согласно настоящему изобретению, которые могут быть или могут не быть упакованы вместе. Компоненты набора могут быть составлены из отдельных ампул (т.е. в виде набора из отдельных частей) или обеспечены в одной ампуле. Кроме того, необходимо понимать, что набор согласно настоящему изобретению предназначен для осуществления на практике способов, упомянутых выше в настоящем описании. В одном аспекте предполагается, что все компоненты обеспечены в готовой к употреблению форме для осуществления на практике способа, упомянутого выше в настоящем описании. В другом аспекте набор содержит инструкции для осуществления указанного способа. Указанные инструкции могут быть обеспечены с помощью руководства пользователя в бумажной или электронной форме. Например, указанное руководство может содержать инструкции для интерпретации результатов, полученных при осуществлении вышеуказанных способов с применением набора согласно настоящему изобретению.
[0076] Наконец, другой аспект настоящего изобретения относится к способу получения готового продукта нейротоксина для применения в фармацевтических или косметических целях, включающему (i) определение биологической активности продукта нейротоксина способом согласно настоящему изобретению и (ii) получение продукта нейротоксина для применения в фармацевтических или косметических целях. Продукт нейротоксина может быть приготовлен различными способами в зависимости от целей предполагаемого применения, известных в данной области техники. Например, (биологически активный) продукт нейротоксина может применяться в комбинации с одним или более фармацевтически приемлемыми носителями в виде фармацевтической композиции. Фармацевтически приемлемый носитель (носители) должен быть приемлемым в смысле совместимости с другими ингредиентами состава и отсутствия вредного воздействия на его реципиента. Используемый фармацевтический носитель может включать твердое вещество, гель или жидкость. Примерами твердых носителей являются лактоза, гипс, сахароза, тальк, желатин, агар, пектин, камедь, стеарат магния, стеариновая кислота и т.п.. Примерами жидких носителей являются глицерин, фосфатно-солевой буферный раствор, вода, эмульсии, различные типы увлажняющих агентов и т.п.. Подходящие носители включают указанные выше и другие, хорошо известные в данной области техники, см., например, Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, Pennsylvania. В одном аспекте фармацевтическая композиция может быть растворена в разбавителе перед введением. Растворитель также выбирают таким образом, чтобы он не влиял на биологическую активность продукта нейротоксина. Примерами таких разбавителей являются дистиллированная вода или физиологический раствор. В дополнение, фармацевтическая композиция или состав также могут содержать другие носители или нетоксичные, нелекарственные, неиммуногенные стабилизаторы и т.п. Таким образом, в одном аспекте приготовленный продукт нейротоксина может находиться в жидкой или лиофилизированной форме. В одном аспекте он может быть представлен вместе с глицерином, белковыми стабилизаторами (ЧСА, человеческим сывороточным альбумином) или небелковыми стабилизаторами, такими как поливинилпирролидон (ПВП), гиалуроновая кислота или свободные аминокислоты. В одном аспекте подходящие небелковые стабилизаторы раскрыты в WO 2005/007185 или WO 2006/020208. В одном аспекте биологическая активность, определенная в соответствии с этапом (i) способа согласно настоящему изобретению, соответствует активности ботулинического токсина, составляющей 25, 50, 75, 100, 125, 150 или 200 Ед (единицы LD50 для мышей). Приготовленный продукт нейротоксина может применяться для лечения различных заболеваний или расстройств у человека или животных в терапевтической эффективной дозе или для косметических целей.
[0077] Заболевание или расстройство, указанное в настоящем описании, выбрано из группы, состоящей из произвольного мышечного тонуса, фокальной дистонии, включая цервикальную, краниальную дистонию, и доброкачественного идиопатического блефароспазма, гемифациального спазма и локального мышечного спазма, нарушений работы желудочно-кишечного тракта, гипергидроза и косметической коррекции морщин, блефароспазма, оромандибулярной дистонии, открыточелюстного типа, закрыточелюстного типа, бруксизма, синдрома Мейжа, дистонии языка, апраксии поднятия век, различных видов спастической кривошеи, антероколлиса, ретроколлиса, латероколлиса, тортиколлиса, фарингеальной дистонии, ларингеальной дистонии, спастической дистонии по аддукторному типу, спастической дистонии по абдукторному типу, спастических расстройств дыхания, дистонии конечностей, дистонии верхних конечностей, профессиональных дискинезий, писчего спазма, спазма музыканта, спазма игрока в гольф, дистонии нижних конечностей, аддукции бедра, абдукции бедра со сгибанием колена, разгибания колена, сгибания голеностопа, разгибания голеностопа, эквиноваруса, дистонии, приводящей к деформации стопы, стриарного пальца ноги, сгибания пальца ноги, разгибания пальца ноги, аксиальной дистонии, синдрома Пизанской башни, дистонии по типу «танец живота», сегментарной дистонии, гемидистонии, генерализованной дистонии, дистонии-паркинсонизма, сцепленной с Х-хромосомой (Lubag), тардивной дистонии, дистонии при спинально-церебеллярной атаксии, дистонии при болезни Паркинсона, дистонии при болезни Хантингтона, дистонии при болезни Халлервордена-Шпатца, допа-индуцированной дискинезии/дистонии, тардивной дискинезии/дистонии, пароксизмальной дискинезии/дистонии, кинезиогенного некинезиогенного нистагма мягкого неба, миоклонической миокимии, ригидности, доброкачественных мышечных судорог, наследственного тремора подбородка, парадоксальной дискинезий височно-нижнечелюстных мышц, односторонних спазмов жевательных мышц, гипертрофической бранхиальной миопатии, гипертрофии жевательных мышц, гипертрофии передней большеберцовой мышцы, нистагма, осциллопсического надъядерного паралича взора, эпилепсии, кожевниковской эпилепсии, подготовки оперативного лечения спастической кривошеи, абдукторного паралича голосовых связок, упорной мутационной дисфонии, дисфункции верхнего пищеводного сфинктера, гранулемы голосовых связок, синдрома Жилля де ла Туретта, миоклонуса мышц среднего уха, защитного спазма голосовой щели, расстройства речи после ларингэктомии, защитного птоза, заворота век, дисфункции сфинктера Одди, псевдоахалазии, нонахалазии, расстройств моторики пищевода, вагинизма, послеоперационного иммобилизационного тремора, дисфункции мочевого пузыря, детрузорно-сфинктерной диссинергии, спазма сфинктера мочевого пузыря, гемифасциального спазма, реиннервационной дискинезий, западения подбородка, синдрома мышечной скованности, тетануса простатического отдела уретры при гиперплазии простаты, ожирения, лечения стробизма при ДЦП, смешанного и сочетанного паралича, состояния после оперативного вмешательства по поводу отслойки сетчатки, состояния после оперативного вмешательства по поводу катаракты, при страбизме, связанном с афакией и миозитом, миопатического страбизма, диссоционной вертикальной девиации как дополнения при оперативных вмешательствах по поводу страбизма, сходящегося косоглазия, ахалазии, анальных трещин, гиперактивности желез внешней секреции, синдрома Фрея, синдрома «крокодиловых слез», подмышечного, ладонного, подошвенного гипергидроза, ринореи, ложной гиперсаливации при ОНМК, при болезни Паркинсона, при боковом амиотрофическом склерозе, спастических состояний, при энцефалитах и миелитах аутоиммунного генеза, рассеянного склероза, поперечного миелита, синдрома Девика, вирусных инфекций, бактериальных инфекций, паразитарных инфекций, грибковых инфекций, при наследственном спастическом парапарезе, при постинсультном синдроме, после полушарного инфаркта, инфаркта ствола мозга, инфаркта спинного мозга, травмы центральной нервной системы, поражений полушарий головного мозга, поражений ствола мозга, поражений спинного мозга, кровоизлияния в ЦНС, кровоизлияния в головной мозг, субарахноидального кровоизлияния, субдурального кровоизлияния, кровоизлияния в спинной мозг, при неоплазиях, опухолей полушарий головного мозга, опухолей ствола мозга, опухоли спинного мозга и вагинизма. Косметическое применение выбрано из лечения или уменьшения морщин по типу гусиных лапок или глабеллярных морщин, нахмуривания, асимметрии лица.
[0078] Все библиографические ссылки, упомянутые в настоящем описании, включены в настоящее описание посредством ссылки в отношении их полного содержания и содержания, специально упомянутого в настоящем описании.
[0079] На фигурах представлено:
[0080] Фигура 1: Диаграмма, на которой представлен принцип действия клеточного анализа согласно настоящему изобретению. Клетки, чувствительные к интоксикации нейротоксином, высаживают в многолуночные планшеты. Затем клетки подвергают интоксикации полипептидом нейротоксина и после заданного периода интоксикации фиксируют. Специфическое антитело к расщепленному нейротоксином SNAP-25 и специфическое антитело к нерасщепленному SNAP-25 связываются со специфическими сайтами связывания на SNAP-25. С помощью меченных ферментами вторых антител, специфичных к организмам-источникам первых, эти события связывания можно использовать для получения измеряемых сигналов, величина которых коррелирует с концентрацией расщепленного нейротоксином SNAP-25 и с общим количеством SNAP-25 в лунке. С увеличением концентрации BoNT/A увеличивается количество измеряемого расщепленного SNAP-25, что приводит к росту сигнала.
[0081] Фигура 2: На двух графиках представлены итоговые калибровочные кривые для определения BoNT/A с помощью нейронов, полученных из индуцированных плюрипотентных стволовых клеток (iPS), и клеток SiMa в соответствии с примером 2. Они показывают зависимость между, соответственно, концентрацией и активностью BoNT/A и измеренным сигналом флуоресценции (в относительных единицах флуоресценции, ОЕФ) для субстрата HRP и содержанием BoNT/A-расщепленного SNAP-25, нормализованным к общему количеству SNAP-25 в лунке. С увеличением концентрации и, соответственно, активности BoNT/A большее количество SNAP-25 превращается под действием нейротоксина, что приводит к увеличению содержания расщепленного SNAP-25.
[0082] Фигура 3: На графике представлена итоговая калибровочная кривая для определения BoNT/A с помощью нейронов, полученных из iPS, в соответствии с примером 4. Она показывает зависимость между, соответственно, концентрацией и активностью BoNT/А и измеренным сигналом флуоресценции (ОЕФ) для субстрата HRP и содержанием BoNT/A-расщепленного SNAP-25 и содержанием BoNT/A-расщепленного SNAP-25, нормализованным к общему количеству SNAP-25 в лунке. С увеличением, соответственно, концентрации и активности BoNT/A большее количество SNAP-25 превращается под действием нейротоксина, что приводит к увеличению содержания расщепленного SNAP-25.
[0083] Настоящее изобретение далее будет проиллюстрировано с помощью следующих примеров, которые, однако, не следует толковать как ограничивающие объем настоящего изобретения.
[0084] Пример 1: Создание моноклональных антител, специфически связывающихся с сайтом расщепления субстрата SNAP-25, расщепленного нейротоксином
Мышиные моноклональные антитела, специфически связывающиеся с сайтом расщепления субстрата SNAP-25, расщепленного нейротоксином, были созданы с применением стандартной гибридомной технологии. С этой целью мышей линии Balb/c (самки, 8 недель) иммунизировали пептидом SNAP-25190-197 с остатком цистеина на N-конце, «C-TRIDEANQ» (SEQ ID №: 17). Указанный N-концевой остаток цистеина не взят из аминокислотной последовательности SNAP-25, а был введен для сшивания пептида SNAP-25190-197 (SEQ ID №: 74) с гемоцианином фиссуреллы (ГФ). Гибридомные клетки были получены путем слияния клеток селезенки мыши с клетками миеломы линии SP2/0-Ag14 (SP2/0), приобретенными в Коллекции микроорганизмов и клеточных культур Германии (DSMZ GmbH, Braunschweig, АСС 146); см. также Hemmerlein et al., Molecular Cancer 2006, 5, 41. Скрининг на антитела, специфически связывающиеся с сайтом расщепления субстрата SNAP-25, расщепленного нейротоксином, проводили посредством ИФА. Полученные клоны подвергали селекции по их специфичности и аффинности к BoNT/A-расщепленному SNAP-25. В качестве отрицательного контроля клоны проверяли на отсутствие связывания с нерасщепленным SNAP-25206. В результате было установлено, что мышиные моноклональные антитела 20-2-5, 5-10-5, 1-10-4, 16-5-4, 6-3-8, 18-3-3 и 14-12-1 являлись высокоспецифичными к BoNT/A-расщепленному SNAP-25197 при отсутствии детектируемой кросс-реактивности в отношении SNAP25206 в ИФА и методах вестерн-блоттинга. Было проведено изотипирование указанных моноклональных антител с помощью набора для изотипирования мышиных моноклональных антител (Serotec). В результате было установлено, что мАт 20-2-5, 14-12-1, 6-3-8 и 5-10-5 представляют собой антитела класса IgG1, тогда как мАт 18-3-3, 16-5-4 и 1-10-4 представляют собой антитела класса IgG2a.
Соответствующие аминокислотные последовательности цепей VH и VL и соответствующие последовательности CDR (участков, определяющих комплементарность) вышеупомянутых мышиных моноклональных антител приведены в перечне последовательностей.
[0085] Пример 2: Двойной флуоресцентный клеточный ИФА для определения активности BoNT/A
Фиксация клеток
1. Удаляют среду/раствор токсина. Добавляют холодный метанол (-20°С)по 100 мкл в лунку и выдерживают в течение 20 мин при -20°С.
Примечание: Все последующие этапы проводят при комнатной температуре.
После фиксации клеток:
1. Удаляют раствор метанола и добавляют фосфатно-солевой буфер (ФСБ) по 100 мкл в лунку. В случае длительного хранения (>1 сут) следует добавить по 300 мкл буфера ФСБ в лунку и запечатать планшеты парафилмом. Планшеты следует хранить в холодильнике.
2. Удаляют буфер ФСБ и трижды промывают клетки промывочным буфером по 200 мкл в лунку. Каждую промывку проводят в течение 1 минуты при легком встряхивании.
3. Удаляют промывочный буфер, добавляют гасящий буфер по 100 мкл в лунку и инкубируют в течение 20 минут при легком встряхивании.
4. Удаляют гасящий буфер и однократно промывают клетки промывочным буфером по 300 мкл в лунку в течение 5 минут при легком встряхивании.
5. Удаляют промывочный буфер, добавляют блокирующий буфер по 200 мкл в лунку и выдерживают в течение 1 часа при легком встряхивании.
6. Удаляют блокирующий буфер, добавляют пермеабилизирующий буфер по 100 мкл в лунку и выдерживают в течение 15 минут при легком встряхивании.
7. Удаляют пермеабилизирующий буфер и однократно промывают клетки буфером ФСБ по 300 мкл в лунку. Данный этап проводят в течение 1 минуты при легком встряхивании.
8. Удаляют буфер ФСБ и добавляют в каждую лунку по 100 мкл смеси первых антител (разведение антител в блокирующем буфере). Инкубируют в течение ночи (16-18 ч) при легком встряхивании. Клетки одновременно инкубируют с двумя первыми антителами: мышиным антителом, специфичным к BoNT/A-расщепленному SNAP-25, и поликлональным кроличьим антителом, распознающим SNAP-25 (антитело для определения общего количества SNAP-25 для нормализации).
9. Удаляют смесь первых антител и промывают клетки 4 раза по 200 мкл промывочного буфера. Каждую промывку проводят в течение 5 минут при легком встряхивании.
10. Удаляют промывочный буфер, добавляют в каждую лунку по 100 мкл смеси вторых антител: конъюгированных с HRP антимышиных и конъюгированных с АР антикроличьих вторых антител (разведение антител в блокирующем буфере) и инкубируют в течение 2,5-3 часов при легком встряхивании.
11. Удаляют смесь вторых антител и промывают клетки 5 раз промывочным буфером по 200 мкл на лунку, затем однократно HEPES-буфером по 300 мкл в лунку. Каждый этап промывки проводят в течение 5 минут при легком встряхивании.
12. Удаляют из планшета буфер ФСБ и добавляют в каждую лунку по 75 мкл флуорогенного субстрата пероксидазы хрена (субстрат HRP). Инкубируют в течение 50 минут при легком перемешивании. Планшеты защищают от прямого попадания света.
13. Добавляют в каждую лунку по 75 мкл флуорогенного субстрата щелочной фосфатазы (субстрат АР) и дополнительно инкубируют в течение 50 минут при легком перемешивании. Планшеты защищают от прямого попадания света.
14. Прочитывают планшеты с помощью флуоресцентного устройства для прочтения планшетов:
возбуждение при 540 нм; эмиссия при 600 нм.
возбуждение при 360 нм; эмиссия при 450 нм.
15. Расчет
Для нормализации величину ОЕФ для расщепленного SNAP-25 (флуоресценция при 600 нм) нормализуют к величине ОЕФ для общего SNAP-25 (450 нм) в каждой лунке. Для лучшего отображения ОЕФ на диаграмме все значения умножают на коэффициент 1000 согласно следующему уравнению:
Затем полученные значения ОЕФ усредняют для каждого стандарта или образца.
Приготовление реагентов
Промывочный буфер:
0,1% Triton Х-100 в 10 мМ буфере ФСБ (pH 7,4)
Буфер ФСБ (10 мМ):
Фосфатно-солевой буфер (Sigma, №Р5368) (pH 7,4)
Гасящий буфер:
0,6% H2O2 в 10 мМ буфере ФСБ (pH 7,4)
Блокирующий буфер:
2% БСА в 10 мМ буфере ФСБ (pH 7,4) + 0,05% Triton Х-100
Пермеабилизирующий буфер:
0,5% Triton Х-100 в 10 мМ буфере ФСБ
Буфер HEPES:
50 мМ HEPES (4-(2-гидроксиэтил)-1-пиперазинэтансульфонат) (pH 7,4)
Субстрат HRP:
50 мМ HEPES (pH 7,4)
0,007% H2O2
150 пМ Amplex UltraRed
Субстрат АР:
25 мМ диэтаноламин (pH 9,8)
2 мМ MgCl2
100 мкл М DiFMUP
[0086] Пример 3: Описание калибровочных кривых для BoNT/А в клеточном ИФА согласно примеру 2 настоящего изобретения
Культивирование родительской линии клеток SiMA и их интоксикацию с помощью BoNT/A проводили согласно инструкции поставщика. Аналогично, культивирование и интоксикацию с помощью BoNT/A нейронов, полученных из индуцированных плюрипотентных стволовых клеток (iPS) человека (Cellular Dynamics), проводили согласно протоколу производителя.
ИФА проводили в соответствии с примером 2. В качестве первого связывающего антитела, специфически связывающегося с нерасщепленным и BoNT/A-расщепленным SNAP-25, применяли кроличье поликлональное антитело анти-SNAP-25 S9684 (Sigma). Данное антитело позволяет детектировать общее количество SNAP-25 в клетках. В качестве второго связывающего антитела, специфически связывающегося с сайтом расщепления BoNT/A-расщепленного SNAP-25, применяли клон 20-2-5 моноклонального антитела согласно настоящему изобретению (см. пример 1).
Два графика на фигуре 2 представляют собой калибровочные кривые, полученные для BoNT/A. Они показывают зависимость между, соответственно, концентрацией и активностью BoNT/A и измеренным сигналом флуоресценции (ОЕФ) для субстрата HRP и содержанием BoNT/A-расщепленного SNAP-25 (величины ОЕФ не корректировали по пустой пробе с целью демонстрации ошибок для индивидуальных стандартов BoNT/А). С увеличением концентрации и, соответственно, активности BoNT/A большее количество SNAP-25 превращается под действием нейротоксина, что вызывает увеличение содержания расщепленного SNAP-25. Зависимость сигнала от концентрации/активности BoNT/A можно описать, используя 4-параметрическое уравнение.
[0087] Пример 4: Двойной флуоресцентный клеточный ИФА для определения активности BoNT/A
Фиксация клеток
1. Удаляют среду/раствор токсина. Добавляют холодный метанол (-20°С) по 100 мкл в лунку и выдерживают в течение 20 мин при -20°С.
Примечание: Все последующие этапы проводят при комнатной температуре.
После фиксации клеток:
1. Удаляют раствор метанола и добавляют фосфатно-солевой буфер (ФСБ) по 100 мкл в лунку. В случае длительного хранения (>1 сут) следует добавить по 300 мкл буфера ФСБ в лунку и запечатать планшеты парафилмом. Планшеты следует хранить в холодильнике.
2. Удаляют буфер ФСБ и трижды промывают клетки буфером ФСБ по 200 мкл в лунку. Каждый этап проводят в течение 1 минуты при легком встряхивании.
3. Удаляют буфер ФСБ, добавляют гасящий буфер по 100 мкл в лунку и инкубируют в течение 20 минут при легком встряхивании.
4. Удаляют гасящий буфер и однократно промывают клетки буфером ФСБ по 300 мкл в лунку в течение 3 минут при легком встряхивании.
5. Удаляют буфер ФСБ, добавляют блокирующий буфер по 200 мкл в лунку и инкубируют в течение 1 часа при легком встряхивании.
6. Удаляют блокирующий буфер и добавляют в каждую лунку по 100 мкл смеси первых антител (разведение антител в блокирующем буфере). Инкубируют в течение ночи (16-18 ч) при легком встряхивании. Клетки одновременно инкубируют с двумя первыми антителами: мышиным антителом, специфичным к BoNT/A-расщепленному SNAP-25, и поликлональным кроличьим антителом, распознающим SNAP-25 (антитело для определения общего количества SNAP-25 для нормализации).
7. Удаляют смесь первых антител и четырежды промывают клетки 200 мкл буфера ФСБ. Каждый этап проводят в течение 3 минут при легком встряхивании.
8. Удаляют буфер ФСБ, добавляют в каждую лунку по 100 мкл смеси вторых антител: конъюгированных с HRP антимышиных и конъюгированных с АР антикроличьих вторых антител (разведение антител в блокирующем буфере) и инкубируют в течение 2,5-3 часов при легком встряхивании.
9. Удаляют смесь вторых антител и промывают клетки 5 раз буфером ФСБ по 200 мкл на лунку, затем однократно буфером HEPES по 300 мкл в лунку. Каждый этап промывки проводят в течение 3 минут при легком встряхивании.
10. Удаляют буфер HEPES из планшета и добавляют в каждую лунку по 75 мкл флуорогенного субстрата пероксидазы хрена (субстрат HRP). Инкубируют в течение 50 минут при легком встряхивании. Планшеты защищают от прямого попадания света.
11. Добавляют в каждую лунку по 75 мкл флуорогенного субстрата щелочной фосфатазы (субстрат АР) и дополнительно инкубируют в течение 50 минут при легком встряхивании. Планшеты защищают от прямого попадания света.
12. Прочитывают планшеты с помощью флуоресцентного устройства для прочтения планшетов:
возбуждение при 540 нм; эмиссия при 600 нм.
возбуждение при 360 нм; эмиссия при 450 нм.
13. Расчет
Для нормализации величину ОЕФ для расщепленного SNAP-25 (флуоресценция при 600 нм) нормализуют к величине ОЕФ для общего SNAP-25 (450 нм) в каждой лунке. Для лучшего отображения ОЕФ на диаграмме все значения умножают на коэффициент 1000 согласно следующему уравнению:
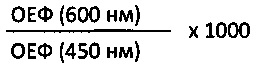
Затем полученные значения ОЕФ усредняют для каждого стандарта или образца.
Подготовка реагентов
Буфер ФСБ (10 мМ):
Фосфатно-солевой буфер (Sigma, №Р5368) (pH 7,4)
Гасящий буфер:
0,6% H2O2 в 10 мМ буфере ФСБ (pH 7,4)
Блокирующий буфер:
2% БСА в 10 мМ буфере ФСБ (pH 7,4) + 0,05% Triton Х-100
Буфер HEPES:
50 мМ HEPES (pH 7,4)
Субстрат HRP:
50 мМ HEPES (pH 7,4)
0,007% H2O2
150 пМ Amplex UltraRed
Субстрат АР:
25 мМ диэтаноламин (pH 9,8)
2 мМ MgCl2
100 мкл М DiFMUP
[0088] Пример 5: Описание калибровочных кривых для BoNT/А в клеточном ИФА согласно примеру 4 настоящего изобретения
Культивирование клеток нейронов, полученных из индуцированных плюрипотентных стволовых клеток (iPS) человека (Cellular Dynamics) и их интоксикацию с помощью BoNT/A проводили согласно протоколу производителя.
ИФА проводили в соответствии с примером 4. В качестве первого связывающего антитела, специфически связывающегося с нерасщепленным и BoNT/A-расщепленным SNAP-25, применяли кроличье поликлональное антитело анти-SNAP-25 S9684 (Sigma). Данное антитело позволяет детектировать общее количество SNAP-25 в клетках. В качестве второго связывающего антитела, специфически связывающегося с сайтом расщепления BoNT/A-расщепленного SNAP-25, применяли клон 20-2-5 моноклонального антитела согласно настоящему изобретению (см. пример 1).
График, приведенный на фигуре 3, представляет собой полученную калибровочную кривую для BoNT/A. Он показывает зависимость между, соответственно, концентрацией и активностью BoNT/A и измеренным сигналом флуоресценции (ОЕФ) для субстрата HRP и содержанием BoNT/A-расщепленного SNAP-25. С увеличением концентрации и, соответственно, активности BoNT/A большее количество SNAP-25 превращается под действием нейротоксина, что вызывает увеличение содержания расщепленного SNAP-25. Зависимость сигнала от концентрации/активности BoNT/A можно описать, используя 4-параметрическое уравнение.












































































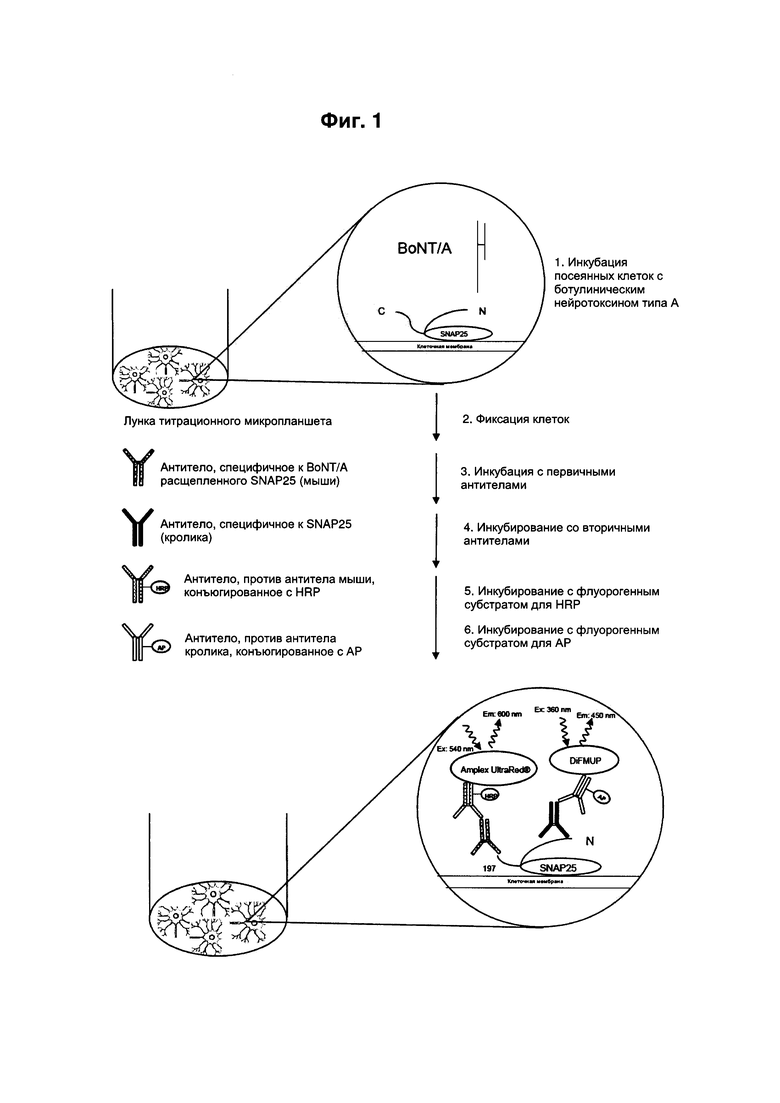
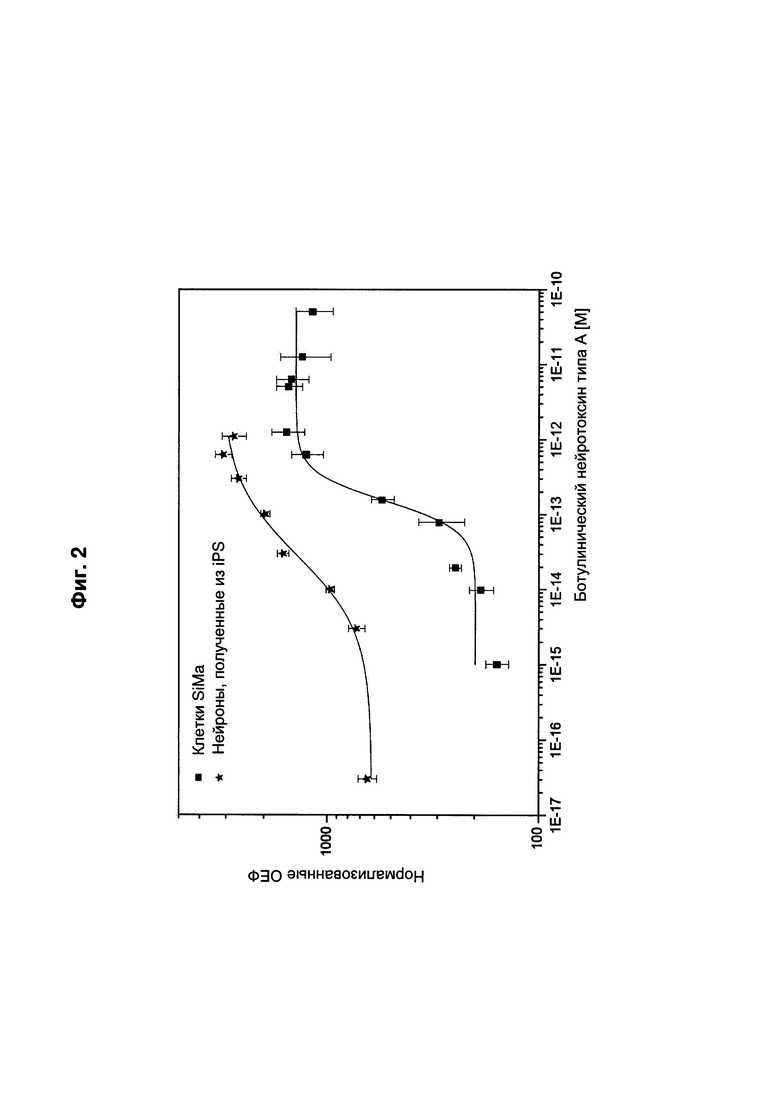
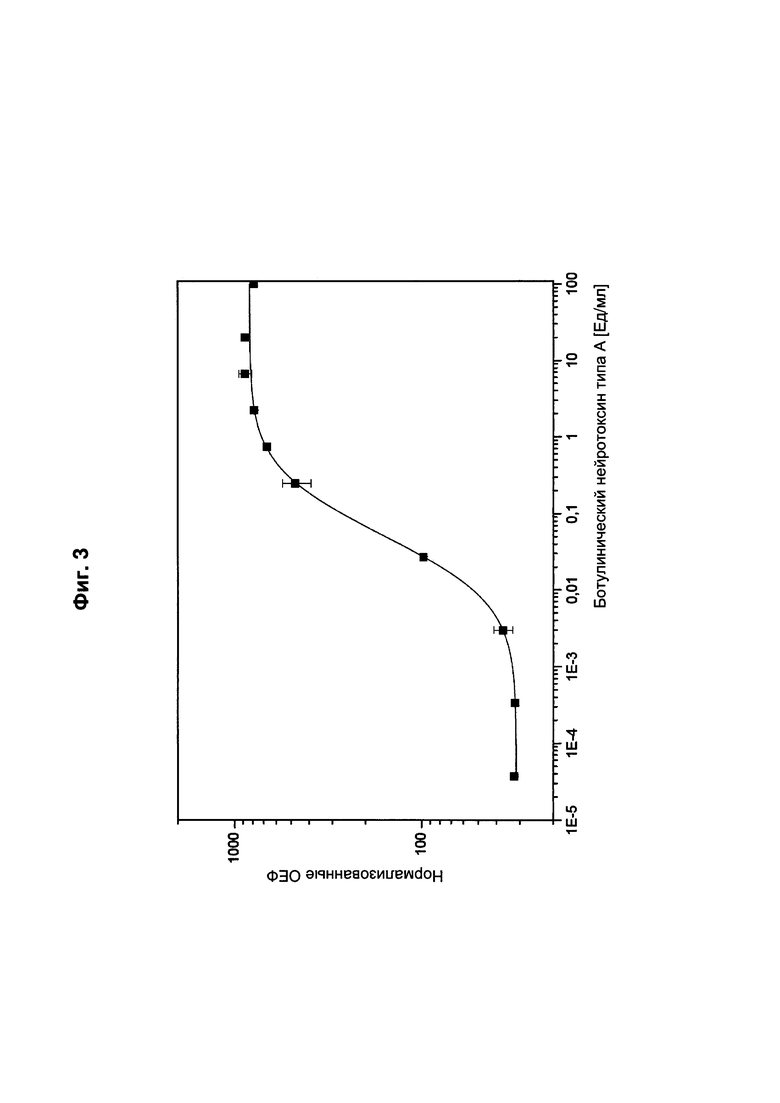
Группа изобретений относится к способам и наборам для определения биологической активности нейротоксинов. Раскрыт способ прямого определения биологической активности полипептида нейротоксина в клетках, включающий инкубацию клеток, чувствительных к интоксикации нейротоксином, с полипептидом нейротоксина; фиксацию клеток; приведение клеток в контакт по меньшей мере с первым связывающим антителом, специфически связывающимся с нерасщепленным и расщепленным нейротоксином субстратом, и по меньшей мере со вторым связывающим антителом, специфически связывающимся с сайтом расщепления субстрата, расщепленного нейротоксином; приведение клеток в контакт по меньшей мере с первым детектирующим антителом, специфически связывающимся с первым связывающим антителом, с образованием, таким образом, первых детектируемых комплексов, и по меньшей мере со вторым детектирующим антителом, специфически связывающимся со вторым связывающим антителом, с образованием, таким образом, вторых детектируемых комплексов, где первое детектирующее антитело и второе детектирующее антитело конъюгированы с различными ферментами; определение количества первых и вторых детектируемых комплексов и определение биологической активности указанного полипептида нейротоксина в указанных клетках. Также раскрыт набор для осуществления указанного способа. Группа изобретений обеспечивает прямое определение биологической активности полипептида нейротоксина в клетках без дополнительных стадий лизиса и выделения или концентрирования расщепленного субстрата нейротоксина из клеточных лизатов. 2 н. и 14 з.п. ф-лы, 3 ил., 5 пр.
1. Способ прямого определения биологической активности полипептида нейротоксина в клетках, включающий этапы:
a) инкубации клеток, чувствительных к интоксикации нейротоксином, с полипептидом нейротоксина в течение периода времени и при условиях, обеспечивающих проявление биологической активности указанного полипептида нейротоксина;
b) фиксации клеток;
c) приведения клеток в контакт по меньшей мере с первым связывающим антителом, специфически связывающимся с нерасщепленным и расщепленным нейротоксином субстратом, и по меньшей мере со вторым связывающим антителом, специфически связывающимся с сайтом расщепления субстрата, расщепленного нейротоксином, при условиях, обеспечивающих связывание указанных связывающих антител с указанными субстратами;
d) приведения клеток в контакт по меньшей мере с первым детектирующим антителом, специфически связывающимся с первым связывающим антителом, при условиях, обеспечивающих связывание указанного первого детектирующего антитела с указанным первым связывающим антителом с образованием, таким образом, первых детектируемых комплексов, и по меньшей мере со вторым детектирующим антителом, специфически связывающимся со вторым связывающим антителом, при условиях, обеспечивающих связывание указанного второго детектирующего антитела с указанным вторым связывающим антителом с образованием, таким образом, вторых детектируемых комплексов;
при этом первое детектирующее антитело и второе детектирующее антитело конъюгированы с различными ферментами;
e) определения количества первых и вторых детектируемых комплексов из этапа d); и
f) расчета количества субстрата, расщепленного указанным полипептидом нейротоксина в указанных клетках, с помощью вторых детектируемых комплексов с определением, таким образом, биологической активности указанного полипептида нейротоксина в указанных клетках.
2. Способ по п. 1, где указанный способ представляет собой флуоресцентный способ.
3. Способ по п. 1 или 2, в котором указанный полипептид нейротоксина представляет собой BoNT/A, BoNT/B, BoNT/C1, BoNT/D, BoNT/E, BoNT/F, BoNT/G или TeNT.
4. Способ по любому из пп. 1-3, в котором указанный субстрат представляет собой VAMP/синаптобревин, SNAP-25 или синтаксин.
5. Способ по любому из пп. 1-4, в котором указанные клетки представляют собой нейрональные клетки или дифференцированные нейрональные клетки, выбранные из группы, состоящей из: первичных нейрональных клеток, опухолевых клеток, способных дифференцироваться в нейрональные клетки, таких как клетки нейробластомы, клетки P19 или нейроны, полученные из индуцированных плюрипотентных стволовых клеток.
6. Способ по любому из пп. 1-5, в котором фиксацию клеток осуществляют путем добавления фиксирующего агента, выбранного из группы, состоящей из: метанола, этанола, ацетона, формальдегида или их смесей.
7. Способ по любому из пп. 1-6, в котором указанное первое связывающее антитело, специфически связывающееся с нерасщепленным и расщепленным нейротоксином субстратом, обеспечивает определение общего количества субстрата нейротоксина в клетках.
8. Способ по п. 7, в котором указанное первое связывающее антитело, специфически связывающееся с нерасщепленным и расщепленным нейротоксином субстратом, представляет собой кроличье поликлональное антитело анти-SNAP-25 S9684, кроличье поликлональное антитело анти-SNAP-25 PA5-19708 от Pierce Antibodies или кроличье поликлональное антитело анти-SNAP-25 PA5-19701 от Pierce Antibodies.
9. Способ по любому из пп. 1-8, в котором указанное второе связывающее антитело представляет собой антитело, содержащее CDRH1, CDRH2 и CDRH3, представленные в SEQ ID NO: 20 – 22, и CDRL1, CDRL2 и CDRL3, представленные в SEQ ID NO: 23 – 25, или мышиное моноклональное антитело MC-6053 от R&D Systems.
10. Способ по любому из пп. 1-9, в котором указанное первое и/или второе связывающее антитело является иммобилизованным.
11. Способ по любому из пп. 1-10, в котором указанное первое детектирующее антитело представляет собой антитело, конъюгированное со щелочной фосфатазой (AP), или антитело, конъюгированное с пероксидазой хрена (HRP).
12. Способ по любому из пп. 1-11, в котором указанное второе детектирующее антитело представляет собой антитело, конъюгированное со щелочной фосфатазой (AP), антитело, конъюгированное с пероксидазой хрена (HRP), антитело, конъюгированное с глюкозооксидазой, антитело, конъюгированное с тирозиназой, или антитело, конъюгированное с β-галактозидазой.
13. Способ по любому из пп. 11-12, в котором субстрат HRP представляет собой Amplex UltraRed, 10-ацетил-3,7-дигидроксифеноксазин (ADHP) или 3-(4-гидроксифенил)пропионовую кислоту (HPPA).
14. Способ по любому из пп. 11-13, в котором субстрат AP представляет собой производное 4-метилумбеллиферилфосфата, такое как 6,8-дифтор-4-метилумбеллиферилфосфат (DiFMUP) или флуоресцеина дифосфат (FDP).
15. Способ по п. 1, в котором этап b) включает фиксацию клеток и дополнительно пермеабилизацию клеток детергентом.
16. Набор для осуществления способа по любому из пп. 1-15, содержащий:
a. совокупность первого связывающего антитела, второго связывающего антитела, первого детектирующего антитела и второго детектирующего антитела, причем указанное второе связывающее антитело представляет собой антитело, содержащее CDRH1, CDRH2 и CDRH3, представленные в SEQ ID NО: 20–22, и CDRL1, CDRL2 и CDRL3, представленные в SEQ ID NО: 23–25, и при этом указанная совокупность обеспечивает осуществление способов по любому из пп. 1-15;
b. средства для расчета количества субстрата, расщепленного указанным нейротоксином, на основании количеств первого и второго детектируемых комплексов, определяемых с помощью совокупности согласно a); и
c. инструкции для осуществления указанного способа.
| WO 2009114748 A1, 17.09.2009 | |||
| СПОСОБ ИНДИКАЦИИ БИОЦИДНОЙ АКТИВНОСТИ ПЕРЕКИСНЫХ ДЕЗИНФИЦИРУЮЩИХ РАСТВОРОВ К БОТУЛИНИЧЕСКОМУ НЕЙРОТОКСИНУ | 2003 |
|
RU2265057C2 |
| WO 2011047265 A1, 21.04.2011 | |||
| NUSS J.E | |||
| et al | |||
| Development of Cell-Based Assays to Measure Botulinum Neurotoxin Serotype A Activity Using Cleavage-Sensitive Antibodies // J | |||
| Biomol | |||
| Screen., 2010, V.15, pp.42-51 | |||
| MAIRAL T | |||
| et al | |||
| Microfluorimeter with disposable polymer chip for detection of celiac disease toxic gliadin // Lab | |||
| Chip, 2009, V.9, pp.3535-3542 | |||
| KAWAGUCHI M | |||
| et al | |||
| Development of a highly selective fluorescence probe for alkaline phosphatase // Bioorganic and Medicinal Chemistry, 2011, V.21, pp.5088-5091. | |||
Авторы
Даты
2019-10-31—Публикация
2014-06-26—Подача