Данное изобретение относится к новому антителу, в частности, к моноклональному антителу, способному связываться с IGF-1R, а также к последовательностям аминокислот и нуклеиновых кислот, кодирующим указанное антитело.
Рецептор инсулиноподобного фактора роста 1, называемый IGF-1R (или иногда IGF1R), представляет собой рецептор с тирозинкиназной активностью, имеющий 70% гомологии с инсулиновым рецептором IR. IGF-1R представляет собой гликопротеин с молекулярной массой примерно 350000. Это гетеротетрамерный рецептор, в котором каждая из половин, связанных дисульфидными мостиками, состоит из внеклеточной α-субъединицы и трансмембранной β-субъединицы. IGF-1R связывает IGF1 и IGF2 с очень высокой аффинностью (Kd 1 нМ), но в равной степени способен связываться с инсулином с аффинностью в 100-1000 раз ниже. И наоборот, IR связывает инсулин с очень высокой аффинностью, хотя IGF связываются только с инсулиновым рецептором с аффинностью в 100 раз ниже. Тирозинкиназные домены IGF-1R и IR имеют очень высокую гомологию последовательностей, тогда как зоны с более слабой гомологией соответственно относятся к богатой цистеином области, расположенной на α-субъединице и на C-концевой части β-субъединицы. Различия в последовательностях, наблюдаемые в α-субъединице, расположены в области связывания лигандов и поэтому лежат в основе относительной аффинности IGF-1R и IR к IGF и инсулину, соответственно. Различия в C-концевой части β-субъединицы приводят к расхождению в сигнальных путях двух рецепторов; митогенные, дифференцировочные и антиапоптозные эффекты опосредуются IGF-1R, тогда как активация IR, прежде всего, включает эффекты на уровне метаболических путей.
Роль системы IGF в канцерогенезе стала предметом интенсивных исследований в последние 20 лет. Этот интерес возник в связи с обнаружением того факта, что IGF-1R, в дополнение к его митогенным и антиапоптозным свойствам, по-видимому, необходим для становления и поддержания трансформированного фенотипа. Фактически было точно установлено, что в огромном многообразии клеток сверхэкспрессия или конститутивная активация IGF-1R приводит к росту клеток независимо от носителя в средах, не содержащих фетальной бычьей сыворотки, и к образованию опухолей у бестимусных мышей. Само по себе это свойство не является уникальным, поскольку целый ряд продуктов сверхэкспрессированных генов может трансформировать клетки, включая значительное число рецепторов факторов роста. Однако решающим открытием, наглядно продемонстрировавшим основную роль, выполняемую IGF-1R в трансформации, было обнаружение того, что IGF-1R- клетки, в которых ген, кодирующий IGF-1R, был инактивирован, являются полностью невосприимчивыми к трансформации различными агентами, обычно способными трансформировать клетки, такими как белок Е5 вируса папилломы крупного рогатого скота, сверхэкспрессия EGFR или PDGFR, Т-антиген SV 40, активированный Ras или комбинация этих двух последних факторов.
В таком контексте IGF-1R долгое время рассматривался как интересная мишень в онкологии. Было инициировано большое число проектов, направленных на IGF-1R (с применением гуманизированных или человеческих антител или низкомолекулярных соединений), для разработки антагонистов IGF-1R для лечения раковых заболеваний, и было выполнено более 70 клинических испытаний по различным показаниям. Тем не менее, до сегодняшнего дня ни один из этих проектов не был успешным, и на рынке нет антител к IGF-1R.
Целью настоящего изобретения является получение по меньшей мере одного реагента, который может быть использован в качестве диагностического или прогностического биомаркера для обнаружения и/или мониторинга онкогенных расстройств, особенно тех, что характеризуются экспрессией IGF-1R, или тех, что опосредованы аберрантной экспрессией IGF-1R.
Ранее сообщалось о предшествовавших попытках получить представляющее ценность антитело, которое можно использовать в качестве соответствующего диагностического или прогностического инструмента, но ни одна из них не была удовлетворительной.
Как будет видно из последующих примеров, авторы изобретения неожиданно показали, что коммерчески доступные антитела, обычно используемые по сей день для количественной оценки опухолей, экспрессирующих IGF-1R, по-видимому, являются неактуальными, поскольку они дают ложно положительный и/или ложно отрицательный результат. Эта проблема привела, в частности, к неудаче в клинических испытаниях с антителами к IGF-1R из-за выбора пациентов, а не реальной активности антител к IGF-1R.
Более того, первые исследования, выполненные с использованием коммерчески доступных антител, показали несоответствие между количественной оценкой IGF-1R и противоопухолевой активностью целевых ADC (англ. antibody drug conjugate - конъюгат антитело-лекарственное средство), используемых в терапии.
Настоящее изобретение предназначено для устранения этой проблемы с помощью нового антитела, которое, в отличие от уже существующих, способно к деформации, что коррелирует с фармакологией терапии, нацеленной на IGF-1R.
Согласно первому аспекту, объектом данного изобретения является выделенное антитело или его антигенсвязывающий фрагмент, который с высокой аффинностью связывается с IGF-1R, предпочтительно с человеческим IGF-1R, и поэтому может быть использован в способах диагностики патологических гиперпролиферативных онкогенных расстройств, опосредованных экспрессией IGF-1R.
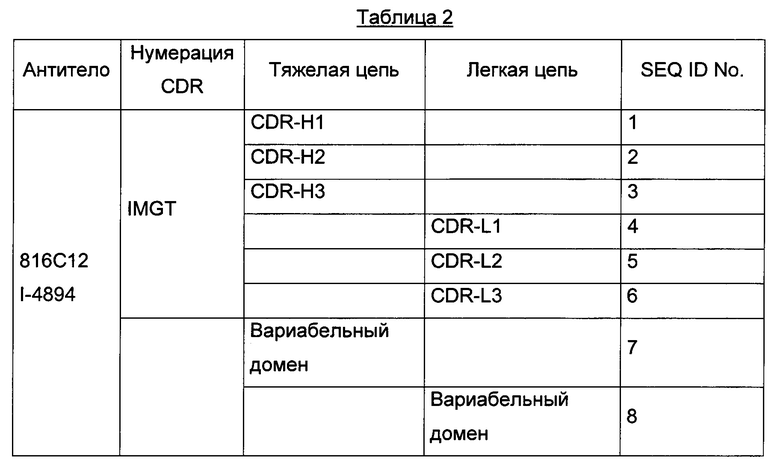
Один из вариантов осуществления изобретения относится к антителу или его антигенсвязывающему фрагменту, содержащему шесть участков, определяющих комплементарность (CDR), последовательностей SEQ ID No. 1, 2, 3, 4, 5 и 6.
Согласно одному варианту осуществления, изобретение относится к антителу к IGF-1R или его антигенсвязывающему фрагменту, характеризующемуся тем, что оно содержит:
i) тяжелую цепь, содержащую CDR-H1 последовательности SEQ ID No. 1, CDR-H2 последовательности SEQ ID No. 2 и CDR-H3 последовательности SEQ ID No. 3; и
ii) легкую цепь, содержащую CDR-L1 последовательности SEQ ID No. 4, CDR-L2 последовательности SEQ ID No. 5 и CDR-L3 последовательности SEQ ID No. 6.
Термины "антитело", "антитела", "ат" или "иммуноглобулин" используются взаимозаменяемо в самом широком смысле и включают моноклональные антитела, выделенные, сконструированные, полученные путем химического синтеза или рекомбинантные антитела (например, полноразмерные или интактные моноклональные антитела), поликлональные антитела, поливалентные антитела или мультиспецифические антитела (например, биспецифические антитела), а также фрагмент антитела, при условии, что все они проявляют требуемую биологическую активность. Согласно одному из вариантов осуществления, изобретение относится к рекомбинантному антителу.
Используемое в данном описании выражение "антитело к IGF-1R" считается аналогичным выражению "анти-IGF-1R антитело" и означает антитело, способное связываться с IGF-1R.
Под "IGF-1R-связывающим фрагментом" или "антигенсвязывающим фрагментом" антитела подразумевается любой пептид, полипептид или белок, сохраняющий способность связываться с мишенью IGF-1R (также обычно называемой антигеном) антитела. В одном из вариантов осуществления изобретения такие "антигенсвязывающие фрагменты" выбирают из группы, состоящей из Fv, scFv (sc означает одноцепочечный), Fab, F(ab')2, Fab', scFv-Fc фрагментов или диател, или любого фрагмента, время полужизни которого было увеличено с помощью химической модификации, такой как добавление полиалкиленгликоля, такого как полиэтиленгликоль ("ПЕГилирование") (пегилированные фрагменты называют Fv-PEG, scFv-PEG, Fab-PEG, F(ab')2-PEG или Fab'-PEG) ("PEG" означает полиэтиленгликоль), или путем включения в липосому, при этом указанные фрагменты имеют по меньшей мере один из характерных CDR антитела согласно изобретению. Предпочтительно, указанные "антигенсвязывающие фрагменты" будут состоять из или будут содержать частичную последовательность вариабельной области тяжелой или легкой цепи антитела, из которого они получены, при этом указанная частичная последовательность является достаточной для сохранения такой же специфичности связывания, как у антитела, из которого она получена, и достаточной аффинности, предпочтительно, по меньшей мере равной 1/100, более предпочтительно, по меньшей мере 1/10 аффинности антитела, из которого она получена, в отношении мишени.
Предпочтительно, указанный "фрагмент, связывающий IGF-1R" или "антигенсвязывающий фрагмент" содержит по меньшей мере:
i) CDR-H1 последовательности SEQ ID No. 1, CDR-H2 последовательности SEQ ID No. 2 и CDR-H3 последовательности SEQ ID No. 3; а также
ii) CDR-L1 последовательности SEQ ID No. 4, CDR-L2 последовательности SEQ ID No. 5 и CDR-L3 последовательности SEQ ID No. 6.
Под терминами "связывание", "связывает" и т.п. подразумевается, что антитело или любой его антигенсвязывающий фрагмент формирует с антигеном комплекс, который относительно стабилен в физиологических условиях. Специфическое связывание можно охарактеризовать равновесной константой диссоциации, которая составляет по меньшей мере примерно 1×10-6 М или менее. Способы определения того, будут ли две молекулы связываться, хорошо известны в данной области техники и включают, например, равновесный диализ, поверхностный плазмонный резонанс и тому подобное. Во избежание неопределенности следует пояснить, что это не означает, что указанное антитело не может связываться с другим антигеном или оказывать ему противодействие на низком уровне. Тем не менее, в качестве варианта осуществления, указанное антитело связывается только с указанным антигеном.
Под участками CDR подразумеваются гипервариабельные участки тяжелых и легких цепей иммуноглобулинов в соответствии с определением Международной информационной системы иммуногенетики (IMGT).
Уникальная нумерация IMGT была создана для сравнения вариабельных доменов независимо от антигенного рецептора, типа цепи или вида [Lefranc М.-Р., Immunology Today 18, 509 (1997) / Lefranc М.-Р., The Immunologist, 7, 132-136 (1999) / Lefranc, M.-P.,  , C., Ruiz, M., Giudicelli, V., Foulquier, E., Truong, F., Thouvenin-Contet, V. and Lefranc, Dev. Comp. Immunol., 27, 55-77 (2003)]. В уникальной нумерации IMGT консервативные аминокислоты всегда имеют одну и ту же позицию, например, цистеин 23 (1st-CYS), триптофан 41 (CONSERVED-TRP), гидрофобная аминокислота 89, цистеин 104 (2nd-CYS), фенилаланин или триптофан 118 (J-PHE или J-TRP). Уникальная нумерация IMGT предлагает стандартизированное разграничение каркасных областей (FR1-IMGT: позиции с 1 по 26, FR2-IMGT: с 39 по 55, FR3-IMGT: с 66 по 104, и FR4-IMGT: с 118 по 128) и областей, определяющих комплементарность: CDR1-IMGT: с 27 по 38, CDR2-IMGT: с 56 по 65, и CDR3-IMGT: со 105 по 117. Поскольку промежутки представляют незанятые позиции, то длины CDR-IMGT (показаны в скобках и разделены точками, например, [8.8.13]) становятся важной информацией. Уникальная нумерация IMGT используется в 2D графических представлениях, обозначенных как IMGT Colliers de Perles [Ruiz, M. and Lefranc, M.-P., Immunogenetics, 53, 857-883 (2002)/ Kaas, Q. and Lefranc, M.-P., Current Bioinformatics, 2, 21-30 (2007)], и в 3D структурах в IMGT/3Dstructure-DB [Kaas, Q., Ruiz, M. and Lefranc, M.-P., T cell receptor and MHC structural data. Nucl. Acids. Res., 32, D208-D210 (2004)].
, C., Ruiz, M., Giudicelli, V., Foulquier, E., Truong, F., Thouvenin-Contet, V. and Lefranc, Dev. Comp. Immunol., 27, 55-77 (2003)]. В уникальной нумерации IMGT консервативные аминокислоты всегда имеют одну и ту же позицию, например, цистеин 23 (1st-CYS), триптофан 41 (CONSERVED-TRP), гидрофобная аминокислота 89, цистеин 104 (2nd-CYS), фенилаланин или триптофан 118 (J-PHE или J-TRP). Уникальная нумерация IMGT предлагает стандартизированное разграничение каркасных областей (FR1-IMGT: позиции с 1 по 26, FR2-IMGT: с 39 по 55, FR3-IMGT: с 66 по 104, и FR4-IMGT: с 118 по 128) и областей, определяющих комплементарность: CDR1-IMGT: с 27 по 38, CDR2-IMGT: с 56 по 65, и CDR3-IMGT: со 105 по 117. Поскольку промежутки представляют незанятые позиции, то длины CDR-IMGT (показаны в скобках и разделены точками, например, [8.8.13]) становятся важной информацией. Уникальная нумерация IMGT используется в 2D графических представлениях, обозначенных как IMGT Colliers de Perles [Ruiz, M. and Lefranc, M.-P., Immunogenetics, 53, 857-883 (2002)/ Kaas, Q. and Lefranc, M.-P., Current Bioinformatics, 2, 21-30 (2007)], и в 3D структурах в IMGT/3Dstructure-DB [Kaas, Q., Ruiz, M. and Lefranc, M.-P., T cell receptor and MHC structural data. Nucl. Acids. Res., 32, D208-D210 (2004)].
Следует понимать, что, не противореча описанию настоящего изобретения, участки, определяющие комплементарность, или CDR, означают гипервариабельные участки тяжелых и легких цепей иммуноглобулинов, как определено в соответствии с системой нумерации IMGT.
Тем не менее, CDR также могут быть определены в соответствии с системой нумерации Kabat (Kabat et al., Sequences of proteins of immunological interest, 5th Ed., U.S. Department of Health and Human Services, NIH, 1991, и более поздние редакции). Существуют три CDR тяжелой цепи и три CDR легкой цепи. В данном контексте термин "CDR" в единственном и множественном числе применяется для обозначения, в зависимости от случая, одного или более или даже всех участков, содержащих большинство аминокислотных остатков, ответственных за аффинность связывания антитела с антигеном или эпитопом, который оно распознает. Чтобы упростить чтение настоящей заявки, CDR в соответствии с Kabat не определяют. Тем не менее, для специалиста в данной области было бы несложно, используя определения CDR в соответствии с IMGT, определить CDR в соответствии с Kabat.
Согласно частному варианту осуществления, антитело к IGF-1R по изобретению характеризуется тем, что оно содержит вариабельный домен тяжелой цепи последовательности SEQ ID No. 7 или любой последовательности, по меньшей мере на 90% гомологичной с последовательностью SEQ ID No. 7.
Согласно частному варианту осуществления, антитело к IGF-1R согласно изобретению характеризуется тем, что оно содержит вариабельный домен легкой цепи последовательности SEQ ID No. 8 или любой последовательности, по меньшей мере на 90% гомологичной с последовательностью SEQ ID No. 8.
Согласно еще одному варианту осуществления, антитело, обозначаемое как 816С12, характеризуется тем, что оно содержит последовательность вариабельного домена тяжелой цепи, содержащую аминокислотную последовательность SEQ ID No. 7 или последовательность, имеющую по меньшей мере 80%, предпочтительно 85%, 90%, 95% и 98% гомологию после оптимального выравнивания с последовательностью SEQ ID No. 7; и/или тем, что оно содержит последовательность вариабельной области легкой цепи, содержащую аминокислотную последовательность SEQ ID No. 8 или последовательность, имеющую по меньшей мере 80%, предпочтительно 85%, 90%, 95% и 98% гомологию после оптимального выравнивания с последовательностью SEQ ID No. 8.
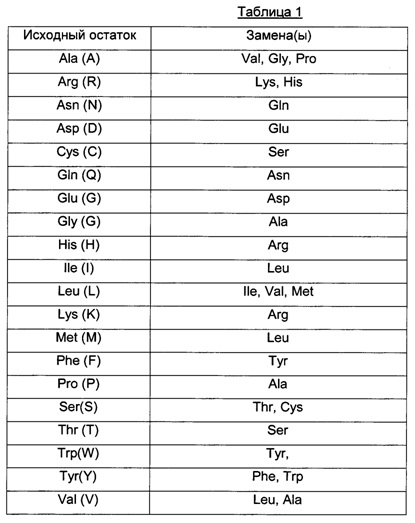
В контексте настоящего изобретения "процент гомологии" между двумя последовательностями нуклеиновых кислот или аминокислот означает процент идентичных нуклеотидов или аминокислотных остатков между двумя сравниваемыми последовательностями, полученный после оптимального выравнивания, при этом данный процент является чисто статистическим, и различия между этими двумя последовательностями распределены случайным образом по их длине. Сравнение двух последовательностей нуклеиновых кислот или аминокислот традиционно выполняется путем сравнения последовательностей после их оптимального выравнивания, при этом указанное сравнение можно проводить по сегментам или с помощью "окна выравнивания". Оптимальное выравнивание последовательностей для сравнения может быть осуществлено, помимо сравнения вручную, с помощью алгоритма поиска локальных гомологий Смита и Уотермана (Smith and Waterman) (1981) [Ad. App. Math. 2:482], с помощью алгоритма поиска локальной гомологии Нидлмана и Вунша (Neddleman and Wunsch) (1970) [J. Mol. Biol. 48:443], с помощью способа поиска подобия Пирсона и Липмана (Pearson and Lipman) (1988) [Proc. Natl. Acad. Sci. USA 85:2444] или при помощи компьютерного программного обеспечения, использующего эти алгоритмы (GAP, BESTFIT, FASTA и TFASTA в пакете программного обеспечения Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Мэдисон, Висконсин, США, или с помощью программного обеспечения для сравнения BLAST NR или BLAST Р). Для аминокислотной последовательности, имеющей по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90%, 95% и 98% гомологию с эталонной аминокислотной последовательностью, предпочтительные примеры включают последовательности, содержащие эталонную последовательность, определенные модификации, в частности, делецию, добавление или замену по меньшей мере одной аминокислоты, усечение или удлинение. В случае замены одной или более последовательных или непоследовательных аминокислот предпочтительными являются такие замены, в которых заменяемые аминокислоты заменяются "эквивалентными" аминокислотами. В данном контексте выражение "эквивалентные аминокислоты" используется для обозначения любых аминокислот, которые могут быть заменены одной из структурных аминокислот без изменения при этом биологических активностей соответствующих антител, и конкретные примеры таких замен представлены ниже.
Эквивалентные аминокислоты могут быть определены либо на основании их структурной гомологии с аминокислотами, которые они заменяют, либо по результатам сравнительных анализов биологической активности различных антигенсвязывающих белков, которые могут быть образованы.
В качестве неограничивающего примера в Таблице 1 ниже представлены возможные замены, которые могут быть осуществлены без существенного изменения биологической активности соответствующего модифицированного антигенсвязывающего белка; обратные замены, разумеется, также возможны в тех же условиях.
Частным аспектом изобретения является то, что антитело или любой его антигенсвязывающий фрагмент не связывается с инсулиновым рецептором (IR).
Согласно другому варианту осуществления антитело по изобретению состоит из моноклонального антитела.
Термин "моноклональное антитело" или "Mab" при использовании в данном описании относится к антителу, полученному из популяции по существу гомогенных антител, то есть индивидуальные антитела популяции идентичны, за исключением возможных природных мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела высокоспецифичны, будучи направленными против одного эпитопа. Такое моноклональное антитело может быть получено при выращивании одного клона В клеток или гибридомы. Моноклональные антитела также могут быть рекомбинантными, то есть полученными методами белковой инженерии. Моноклональные антитела также могут быть выделены из фаговой библиотеки антител. Кроме того, в отличие от препаратов поликлональных антител, которые обычно включают различные антитела, направленные против различных детерминант или эпитопов, каждое моноклональное антитело направлено против одного эпитопа антигена. Изобретение относится к антителу, выделенному или полученному путем очистки из природных источников или полученному путем генетической рекомбинации или химического синтеза.
В другом варианте осуществления антитело по изобретению состоит из рекомбинантного антитела. Термин "рекомбинантное антитело" относится к антителу, которое является результатом экспрессии рекомбинантной ДНК в живых клетках. Рекомбинантное антитело согласно данному изобретению получают с использованием лабораторных способов генетической рекомбинации, хорошо известных специалистам в данной области, создающих последовательности ДНК, которые не могут быть обнаружены в биологических организмах.
В другом варианте осуществления антитело по изобретению состоит из химически синтезированного антитела.
"Антитело к IGF-1R" включает (без противоречия описанию) мышиную, а также химерную и гуманизированную формы указанного антитела к IGF-1R.
Для большей ясности следующая таблица 2 иллюстрирует последовательности антитела 816С12, определенные согласно IMGT.
В одном варианте осуществления моноклональное антитело включает мышиное, химерное и гуманизированное антитела. Антитело может быть получено из гибридомы мышиного происхождения, депонированной во Французской коллекции культур микроорганизмов (CNCM, Институт Пастера, Париж, Франция), причем указанную гибридому получают путем слияния спленоцитов/лимфоцитов иммунизированных мышей Balb/C и клеток клеточной линии Sp 2/O-Ag 14 миеломы.
Согласно другому аспекту данное изобретение относится к мышиной гибридоме, способной секретировать моноклональное антитело по изобретению, в частности, к гибридоме мышиного происхождения, депонированной в CNCM, Институт Пастера, Париж, Франция, 17 сентября 2014 г. под номером I-4894.
Моноклональное антитело, обозначенное здесь как 816С12, или любой его антигенсвязывающий фрагмент, секретируемый указанной гибридомой I-4894, безусловно, является частью настоящего изобретения.
Настоящее изобретение относится к антителу к IGF-1R или его антигенсвязывающему фрагменту, характеризующемуся тем, что оно секретировано гибридомой, депонированной в CNCM, Институт Пастера, Париж, 17 сентября 2014 г. под номером I-4894.
В данном изобретении также описана мышиная гибридома, зарегистрированная в CNCM, Институт Пастера, Париж, 17 сентября 2014 г. под номером I-4894.
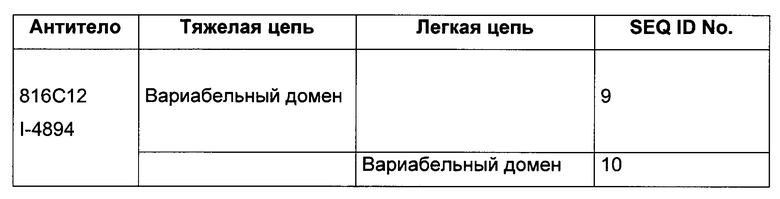
Новый аспект настоящего изобретения относится к выделенной нуклеиновой кислоте, характеризующейся тем, что она выбрана среди следующих нуклеиновых кислот:
a) нуклеиновая кислота, кодирующая антитело по данному изобретению;
b) нуклеиновая кислота, содержащая последовательность, выбранную из последовательностей SEQ ID No. 9 или 10, или последовательность, имеющую после оптимального выравнивания по меньшей мере 80%, предпочтительно 85%, 90%, 95% и 98% гомологию с последовательностями SEQ ID No. 9 или 10; и
c) нуклеиновые кислоты, комплементарные нуклеиновым кислотам, определенным в а) или b).
В таблице 3 ниже приведены различные нуклеотидные последовательности, касающиеся антитела 816С12 по данному изобретению.

Термины "нуклеиновая кислота", "нуклеиновая последовательность", "нуклеиновокислотная последовательность", "полинуклеотид", "олигонуклеотид", "полинуклеотидная последовательность" и "нуклеотидная последовательность", взаимозаменяемо используемые в данном описании, означают точную последовательность нуклеотидов, модифицированных или немодифицированных, определяющую фрагмент или область нуклеиновой кислоты, содержащей или не содержащей неприродные нуклеотиды и являющейся либо двухцепочечной ДНК, одноцепочечной ДНК, либо транскрипционными продуктами указанных ДНК.
Здесь также следует упомянуть, что данное изобретение не относится к нуклеотидным последовательностям в их природной хромосомной среде, т.е. в природном состоянии. Последовательности данного изобретения были выделены и/или очищены, т.е. были взяты прямо или косвенно, например, путем копирования, при этом их среда была по меньшей мере частично модифицирована. Также здесь следует упомянуть выделенные нуклеиновые кислоты, полученные путем рекомбинантной генетики посредством, например, клеток-хозяев, или полученные путем химического синтеза.
Данное изобретение также относится к вектору, содержащему нуклеиновую кислоту, описанную в данном изобретении.
В частности, данное изобретение направлено на клонирующие и/или экспрессионные векторы, которые содержат такую нуклеотидную последовательность.
Векторы по данному изобретению предпочтительно содержат элементы, которые позволяют экспрессировать и/или секретировать нуклеотидные последовательности в данной клетке-хозяине. Вектор, таким образом, может содержать промотор, сигналы инициации и окончания трансляции, а также подходящие области регуляции транскрипции. Он должен иметь способность стабильно сохраняться в клетке-хозяине и может дополнительно иметь специфические сигналы, которые определяют секрецию транслированного белка. Эти различные элементы отбираются и оптимизируются специалистами в данной области в соответствии с используемой клеткой-хозяином. С этой целью нуклеотидные последовательности могут быть вставлены в самореплицирующиеся векторы в выбранном хозяине или могут быть интегративными векторами выбранного хозяина.
Такие векторы получают способами, обычно используемыми специалистами в данной области, и полученные в результате клоны могут быть введены в подходящего хозяина стандартными способами, такими как липофекция, электропорация, тепловой шок или химические способы.
Векторы являются, например, векторами плазмидного или вирусного происхождения. Они используются для трансформации клеток-хозяев для клонирования или экспрессии нуклеотидных последовательностей по изобретению.
Данное изобретение также содержит клетки-хозяева, трансформированные вектором, описанным в данном изобретении, или содержащие его.
Клетка-хозяин может быть выбрана среди прокариотических или эукариотических систем, таких как бактериальные клетки, например, а также дрожжевые клетки или клетки животных, в частности, клетки млекопитающих. Также могут быть использованы клетки насекомых или растений.
Данное изобретение также касается животных, за исключением человека, которые содержат трансформированную клетку по данному изобретению.
Другой аспект данного изобретения касается способа получения антитела в соответствии с данным изобретением или одного из его функциональных фрагментов, который характеризуется тем, что включает следующие этапы:
а) культивирование в среде и в культуральных условиях, подходящих для клетки-хозяина по данному изобретению; и
б) извлечение указанного антитела или одного из его функциональных фрагментов, полученных таким образом, из культуральной среды или из указанных культивируемых клеток.
Трансформированные клетки согласно данному изобретению могут быть использованы в способах получения рекомбинантных полипептидов согласно данному изобретению. Способы получения полипептида согласно данному изобретению в рекомбинантной форме, характеризующиеся использованием вектора и/или клетки, трансформированной вектором согласно данному изобретению, также входят в настоящее изобретение. Предпочтительно клетку, трансформированную вектором согласно данному изобретению, культивируют в условиях, которые позволяют экспрессировать указанный полипептид и извлекать указанный рекомбинантный пептид.
Как уже упоминалось, клетка-хозяин может быть выбрана из прокариотических или эукариотических систем. В частности, можно идентифицировать нуклеотидные последовательности по изобретению, содействующие секреции в такой прокариотической или эукариотической системе. Вектор согласно данному изобретению, несущий такую последовательность, может быть таким образом выгодно использован для продукции рекомбинантных белков, предназначенных для секреции. Действительно, очистке этих рекомбинантных белков, представляющих интерес, будет способствовать тот факт, что они находятся в супернатанте клеточной культуры, а не внутри клеток-хозяев.
Также раскрыто применение антитела по изобретению в качестве биомаркера. Данные способы могут быть использованы для обнаружения или диагностики различных гиперпролиферативных онкогенных расстройств, связанных с экспрессией IGF-1R, например, но не ограничиваясь ими, рака предстательной железы, остеосарком, рака легкого, рака молочной железы, рака эндометрия, глиобластомы, рака толстой кишки, рака желудка, рака почки, рака поджелудочной железы, рака головы и шеи или какого-либо другого рака, связанного с экспрессией IGF-1R. Как будет понятно специалисту в данной области, уровень экспрессии антитела, связанный с определенным расстройством, будет варьировать в зависимости от характера и/или тяжести уже существующего состояния.
Введение антител по настоящему изобретению любым из стандартных способов, известных специалистам в данной области (например, местно, парентерально, внутримышечно и т.д.), дает чрезвычайно полезный способ обнаружения диспластических клеток в образце, а также позволяет врачу-клиницисту контролировать терапевтический режим пациента, проходящего лечение от гиперпролиферативного расстройства, связанного или опосредованного экспрессией IGF-1R.
Антитело согласно данному изобретению или его антигенсвязывающий фрагмент найдут применение в различных медицинских или исследовательских целях, включая обнаружение, диагностику, прогнозирование и установление стадии различных патологий, связанных с экспрессией IGF-1R.
Один из вариантов осуществления данного изобретения относится к антителу к IGF-1R или его антигенсвязывающему фрагменту, как описано выше, для применения в качестве агента для обнаружения опухолевых клеток, экспрессирующих IGF-1R.
Другим вариантом осуществления данного изобретения является антитело к IGF-1R или его антигенсвязывающий фрагмент, как описано выше, для применения в in vitro или ex vivo диагностике или прогнозировании онкогенного расстройства, связанного с экспрессией IGF-1R.
Понятие "диагностика" заболевания, используемое в данном документе, относится к процессу выявления или обнаружения наличия патологического гиперпролиферативного онкогенного расстройства, связанного с экспрессией IGF-1R или опосредованного ею, мониторинга прогрессирования заболевания, а также выявления или обнаружения клеток или образцов, которые указывают на расстройство, связанное с экспрессией IGF-1R.
"Прогнозирование" при использовании в данном описании означает оценку вероятности излечения от заболевания или предсказание возможного развития или исхода заболевания. Например, если образец от субъекта является отрицательным при окрашивании антителом к IGF-1R, "прогноз" для такого субъекта будет лучше чем, если бы образец был положительным при IGF-1R окрашивании. Образцы можно оценить по уровням экспрессии IGF-1R с помощью соответствующей шкалы, как будет более подробно описано далее.
Антитело к IGF-1R может находиться в форме иммуноконъюгата или меченого антитела для получения сигнала, который можно обнаружить и/или количественно оценить. При использовании с соответствующими метками или другими соответствующими обнаруживаемыми биомолекулами или химическими веществами, антитело к IGF-1R, в частности, может быть использовано для диагностического и прогностического применения in vitro и in vivo.
Метки для применения в иммунологических анализах, как правило, известны специалистам в данной области и включают ферменты, радиоизотопы и флуоресцентные, люминесцентные и хромогенные вещества, в том числе окрашенные частицы, такие как коллоидное золото или латексные шарики. Подходящие иммунологические анализы включают фермент-связанное иммуносорбентное исследование (ELISA). Специалистам в данной области хорошо известны различные типы меток и способы конъюгации меток с антителами к IGF-1R, такие как те, что изложены ниже.
При использовании в данном описании термин "онкогенное расстройство, связанное с экспрессией IGF-1R" включает в себя заболевания и другие расстройства, при которых было показано или предполагалось, что наличие высоких уровней IGF-1R (аберрантных) у субъекта, страдающего расстройством, либо обуславливает патофизиологию расстройства, либо является фактором, способствующим ухудшению расстройства. Альтернативно, такие расстройства могут подтверждаться, например, повышением уровней IGF-1R на поверхности клетки в пораженных клетках или тканях субъекта, страдающего расстройством. Повышение уровней IGF-1R может быть обнаружено при использовании антитела к IGF-1R.
В некоторых вариантах осуществления, термин "повышенная экспрессия", когда он используется по отношению к IGF-1R, относится к уровням экспрессии белка или гена, которые демонстрируют статистически значимое повышение экспрессии (измеренной с помощью экспрессии РНК или экспрессии белка) по сравнению с контролем.
Одним из вариантов осуществления является антитело к IGF-1R или его антигенсвязывающий фрагмент, описанные выше, для применения в определении того, будет ли для пациента с онкогенным расстройством полезным лечение ингибитором, нацеленным на путь IGF-1R, предпочтительно антителом к IGF-1R как таковым, в составе комбинированной терапии или в виде конъюгата.
Используемое в данном описании выражение "ингибитор, нацеленный на путь IGF-1R" означает любое соединение, способное уменьшать или ингибировать тирозинкиназную активность IGF-1R путем связывания либо с лигандом (лигандами) IGF-1R, либо с самим IGFR. Примерами таких ингибиторов являются белки, пептиды, антитела или конъюгаты "антитело - лекарственное средство" или любое химическое соединение, действующие как антагонисты IGF-1R, антисмысловые олигонуклеотиды или миРНК (англ. siRNA, small interfering RNA - малые интерферирующие РНК), ингибирующие экспрессию гена IGF-1R или гена, кодирующего один из лигандов IGFR, или любое другое лекарственное средство или соединение, известное специалистам в данной области.
Более конкретно, в контексте настоящего описания ингибитор, нацеленный на путь IGF-1R, охватывает любое соединение или молекулу, способную связываться с IGF-1R и ингибировать связывание его лиганда(ов).
Еще более конкретно, в контексте настоящего описания ингибитор, нацеленный на путь IGF-1R, охватывает любое моноклональное антитело, которое связывается с IGF-1R.
В еще одном предпочтительном варианте осуществления изобретения ингибитор, нацеленный на путь IGF-1R, состоит из конъюгата антитело-лекарственное средство (ADC), где фрагмент "антитело" нацелен на IGF-1R, а фрагмент "лекарственное средство" может быть выбран из любых лекарственных средств, таких как цитотоксическое средство, цитостатическое средство, токсины и т.п. В приведенном в качестве примера варианте осуществления фрагмент "лекарственное средство" может состоять из ауристатина, аналога или производного.
Объектом данного изобретения также является способ обнаружения in vitro или ex vivo наличия и/или локализации опухолевых клеток, экспрессирующих IGF-1R, у субъекта, при этом указанный способ включает этапы:
(a) контактирования биологического образца от указанного субъекта с антителом к IGF-1R или его антигенсвязывающим фрагментом в соответствии с настоящим изобретением, как описано выше; и
(b) обнаружения связывания указанного антитела к IGF-1R или его антигенсвязывающего фрагмента с указанным биологическим образцом.
Настоящее изобретение также относится к in vitro или ex vivo способу обнаружения и/или количественного измерения и/или определения уровня экспрессии IGF-1R, предпочтительно на поверхности клеток, у субъекта, при этом указанный способ включает этапы:
(a) контактирования биологического образца от указанного субъекта с антителом к IGF-1R или его антигенсвязывающим фрагментом согласно данному изобретению, как описано выше; и
(b) обнаружения и/или количественного измерения и/или определения уровня связывания указанного антитела к IGF-1R или его антигенсвязывающего фрагмента с указанным биологическим образцом.
Связывание антитела к IGF-1R можно обнаружить и/или количественно измерить и/или определить с помощью различных способов анализа, доступных специалисту в данной области. Хотя в данное изобретение включены любые подходящие средства для проведения анализа, в частности, можно упомянуть сортировку клеток с активированной флуоресценцией (Fluorescence Activated Cell Sorting, FACS), ELISA, вестерн-блоттинг и иммуногистохимию (IHC). Предпочтительные способы включают IHC и FACS.
Изобретение также описывает способ определения in vitro или ex vivo процента опухолевых клеток, экспрессирующих IGF-1R, у субъекта, при этом указанный способ включает этапы:
(a) контактирования биологического образца от указанного субъекта с антителом к IGF-1R или его антигенсвязывающим фрагментом, как описано выше; и
(b) количественного измерения процента клеток, экспрессирующих IGF-1R, в биологическом образце.
В другом варианте осуществления изобретения предложен способ определения in vitro или ex vivo уровня экспрессии IGF-1R в опухолевых клетках или в опухоли у субъекта, при этом указанный способ включает стадии:
(a) контактирования биологического образца от указанного субъекта с антителом к IGF-1R или его антигенсвязывающим фрагментом, как описано выше; и
(b) количественного измерения уровня связывания указанного антитела к IGF-1R или его антигенсвязывающего фрагмента с IGF-1R в указанном биологическом образце.
Как будет понятно специалисту в данной области, уровень связывания антитела к IGF-1R с IGF-1R можно количественно измерить любым способом, известным специалисту в данной области. Предпочтительные способы включают использование иммуноферментных процессов, таких как анализ ELISA, иммунофлуоресценция, IHC, радиоиммунный анализ (RIA) или FACS.
Согласно способу по данному изобретению, уровень связывания указанного антитела к IGF-1R или его антигенсвязывающего фрагмента с IGF-1R количественно измеряют путем сортировки клеток с активированной флуоресценцией (FACS) или иммуногистохимии (IHC).
"Биологическим образцом" может быть любой образец, который может быть взят у субъекта. Такой образец должен позволять определять уровни экспрессии биомаркера согласно изобретению. Таким образом, природа образца будет зависеть от природы опухоли.
Предпочтительные биологические образцы включают такие образцы, как образец крови, образец плазмы или образец лимфы, если рак представляет собой жидкую (не солидную) опухоль.
Предпочтительные биологические образцы включают такие образцы, как образец, взятый при биопсии, или образец, взятый в ходе хирургического резекционного лечения, если рак представляет собой твердую (солидную) опухоль.
Предпочтительно, биологический образец представляет собой биологическую жидкость, такую как сыворотка, клетки цельной крови, образец ткани или биоптат человеческого происхождения. Образец может включать, например, биоптат ткани, который можно удобно проанализировать на наличие патологического онкогенного расстройства, связанного с экспрессией IGF-1R.
После определения уровня экспрессии IGF-1R в исследуемых биологических образцах результаты могут быть сопоставлены с результатами для контрольных образцов, которые получены аналогично исследуемым биологическим образцам, но от людей, не имеющих онкогенного расстройства, связанного с экспрессией IGF-1R. Если уровень IGF-1R в исследуемом биологическом образце значительно повышен, можно сделать вывод, что существует высокая вероятность того, что у субъекта, от которого был получен образец, имеется или будет развиваться указанное расстройство.
Изобретение относится к способу in vitro или ex vivo диагностики или прогнозирования опухоли, экспрессирующей IGF-1R, где указанный способ включает стадии (i) определения уровня экспрессии IGF-1R с помощью способа определения in vitro или ex vivo уровня экспрессии IGF-1R в опухолевых клетках или в опухоли у субъекта в соответствии с настоящим изобретением и как описано выше, и (ii) сравнения уровня экспрессии, определенного на стадии (i), с эталонным уровнем экспрессии IGF-1R из нормальной ткани или ткани, не экспрессирующей IGF-1R.
Что касается разработки направленной противоопухолевой терапии, диагностика с помощью иммуногистологических методов дает in situ информацию об уровне экспрессии рецептора и, таким образом, позволяет выбрать пациентов, восприимчивых к лечению, на основании уровня экспрессии рецепторов, необходимого для такого лечения.
Определение стадии имеет потенциальную прогностическую ценность и обеспечивает критерии для разработки оптимальной терапии (Simpson et al., J. Clin. Oncology 18:2059 (2000)). Например, выбор стратегии лечения солидных опухолей основан на оценке стадии распространения опухоли, которую обычно осуществляют с использованием системы классификации злокачественных опухолей, основанной на определении трех факторов: Т - размера первичной опухоли, N - состояния лимфатических узлов, М - наличия или отсутствия отдаленных метастазов (TNM, Tumor/Node/Metastasis), Американского объединенного комитета по раку (AJCC). Общепризнанно, что хотя этот тест и система стадирования предоставляют некоторую ценную информацию относительно стадии диагностированного у пациента солидного рака, она является неточной и недостаточной. В частности, она не позволяет идентифицировать ранние стадии развития опухоли.
Другой вариант осуществления состоит из способа определения in vitro или ex vivo количественной оценки IGF-1R опухолевых клеток или опухоли у субъекта, при этом указанный способ включает стадии:
(а) контактирования биологического образца от указанного субъекта с антителом к IGF-1R или его антигенсвязывающим фрагментом, как описано выше;
(b) количественного измерения с помощью сортировки клеток с активированной флуоресценцией (FACS) или иммуногистохимии (IHC) уровня связывания указанного антитела к IGF-1R или его антигенсвязывающего фрагмента с IGF-1R в указанном биологическом образце; и
(c) количественной оценки опухолевых клеток или опухоли путем сравнения количественного уровня, измеренного на стадии (b), с соответствующей шкалой, основанной на двух параметрах, которыми являются интенсивность окрашивания и процент положительных клеток.
В одном варианте осуществления антитело к IGF-1R способно связывать IGF-1R, когда образцы ткани фиксированы в формалине, фиксированы в заменителе формалина, фиксированы в Glyco-fixx, залиты парафином и/или заморожены.
Для оценки прогностического значения IGF-1R может использоваться любой традиционный способ анализа рисков. Типичные способы анализа включают регрессионный анализ Кокса (Сох regression analysis), представляющий собой полупараметрический метод моделирования выживания или времени до наступления определенного события в цензурированных случаях (Hosmer and Lemeshow, 1999; Сох, 1972). В отличие от других анализов выживания, например, таблиц выживания Life Tables или метода Каплана-Мейера (Kaplan-Meyer), анализ Кокса позволяет включать в модели прогностические переменные (ковариаты). Используя традиционный способ анализа, например, анализ Кокса, можно проверить гипотезы относительно корреляции статуса экспрессии IGF-1R в первичной опухоли с временем до начала рецидива заболевания (время ремиссии или время до метастазирования) или с временем до наступления смерти по причине заболевания (время общей выживаемости). Регрессионный анализ Кокса также известен как модель пропорциональных рисков Кокса. Этот способ является стандартным способом проверки прогностической ценности опухолевого маркера для продолжительности жизни пациента. При использовании в многофакторном режиме параллельно исследуют влияние нескольких ковариат, что позволяет идентифицировать индивидуальные ковариаты, имеющие независимую прогностическую ценность, то есть самые полезные маркеры. Термин отрицательный или положительный "статус IGF-1R" также может обозначаться как [IGF-1R (-)] или [IGF-1R (+)].
Во время диагностики или мониторинга рака образец может быть "оценен количественно". В своей простейшей форме количественная оценка может быть категорически отрицательной или категорически положительной, исходя из визуального осмотра образцов при иммуногистохимии. Более сложная количественная оценка включает оценивание по двум параметрам - интенсивность окрашивания и доля окрашенных ("положительных") клеток среди анализируемых.
"Статус IGF-1R" по определению изобретения относится к классификации опухоли на принадлежность ее к IGF-1R-положительному [IGF-1R (+)] или IGF-1R-отрицательному [IGF-1R (-)] классу на основании определения уровня экспрессии IGF-1R, измеренного любыми способами, такими как иммуногистохимия (IHC), сортировка клеток с активированной флуоресценцией FACS, или другими способами, известными специалисту в данной области.
В одном из вариантов осуществления изобретения для обеспечения стандартизации образцы можно оценивать по уровням экспрессии GF-1R по разным шкалам, большая часть которых основана на оценке интенсивности реакционного продукта и проценте положительных клеток (Payne et al., Predictive markers in breast cancer - the present (Прогностические маркеры при раке молочной железы - сегодняшний день), Histopathology 2008, 52, 82-90).
Согласно другому варианту осуществления, указанная количественная оценка, в частности, на стадии (с) способа по настоящему изобретению, предполагает использование соответствующей шкалы, основанной на интенсивности окрашивания и проценте положительных клеток.
В качестве первого примера, по аналогии с быстрой количественной оценкой по шкале Allred для IHC оценки рецептора эстрогена и рецептора прогестерона, образцы можно оценивать по уровням экспрессии GF-1R на общей шкале от 0 до 8, объединяющей оценку интенсивности реактивности и доли окрашенных клеток (Harvey JM, Clarck GM, Osborne CK, Allred DC; J. Clin. Oncol. 1999; 17; 1474-1481). В частности, первый критерий интенсивности реактивности количественно оценивают по шкале от 0 до 3, при этом 0 соответствует "отсутствию реактивности", а 3 соответствует "сильной реактивности". Второй критерий доли реактивности подсчитывают по шкале от 0 до 5, где 0 соответствует "отсутствию реактивности", а 5 - "от 67 до 100% доле реактивности". Показатель интенсивности реактивности и оценку доли реактивности затем суммируют и получают общую оценку по шкале от 0 до 8. Общая оценка от 0 до 2 считается отрицательной, тогда как общая оценка от 3 до 8 считается положительной.
В соответствии с этой шкалой термины отрицательный или положительный "статус IGF-1R" опухолей или опухолевых клеток, используемые в настоящем описании, относятся к уровням экспрессии IGF-1R, соответствующим значениям от 0 до 2 или от 3 до 8 по шкале Allred, соответственно.
Приведенная далее Таблица 4 иллюстрирует критерии оценки результатов IHC в соответствии с методом Allred.
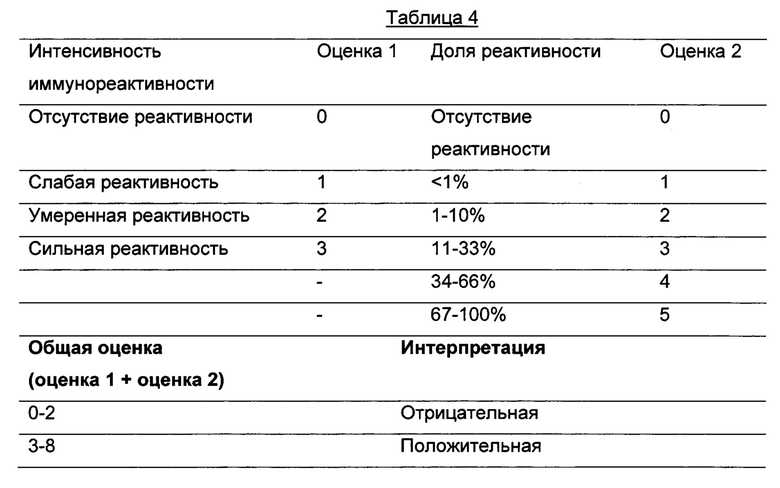
Согласно изобретению, способ характеризуется тем, что указанная приемлемая шкала является шкалой от 0 до 8, где отсутствие реактивности оценивают как 0, а сильную реактивность, составляющую от 67 до 100% доли реактивности, оценивают как 8.
Таким образом, согласно предпочтительному варианту осуществления, способ определения in vitro или ex vivo количественной оценки IGF-1R опухолевых клеток или опухоли у субъекта в соответствии с настоящим изобретением характеризуется тем, что на стадии (с) указанная приемлемая шкала является шкалой от 0 до 8, где отсутствие реактивности оценивают как 0, а сильную реактивность, составляющую от 67 до 100% доли реактивности, оценивают как 8.
Другими словами, описывается и заявляется способ определения in vitro или ex vivo статуса опухоли или опухолевых клеток у субъекта, где указанный способ включает стадии:
(a) количественной оценки опухоли или опухолевых клеток от субъекта в соответствии со шкалой Allred; и
(b) - i) определения того, что статус опухоли или опухолевых клеток соответствует [IGF-1R(+)] с оценкой по шкале Allred от 3 до 8; или
- ii) определения того, что статус опухоли или опухолевых клеток соответствует [IGF-1R(-)] с оценкой по шкале Allred от 0 до 2.
Согласно частному аспекту изобретения, статус опухоли или опухолевых клеток соответствует [IGF-1R (+)] с оценкой 3 по шкале Allred.
Согласно частному аспекту изобретения, статус опухоли или опухолевых клеток соответствует [IGF-1R (+)] с оценкой 4 по шкале Allred.
Согласно частному аспекту изобретения, статус опухоли или опухолевых клеток соответствует [IGF-1R (+)] с оценкой 5 по шкале Allred.
Согласно частному аспекту изобретения, статус опухоли или опухолевых клеток соответствует [IGF-1R (+)] с оценкой 6 по шкале Allred.
Согласно частному аспекту изобретения, статус опухоли или опухолевых клеток соответствует [IGF-1R (+)] с оценкой 7 по шкале Allred.
Согласно частному аспекту изобретения, статус опухоли или опухолевых клеток соответствует [IGF-1R (+)] с оценкой 8 по шкале Allred.
Согласно еще одному частному аспекту изобретения, статус опухоли или опухолевых клеток соответствует [IGF-1R (+)] с оценкой по шкале Allred от 3 до 8.
Другой описанный в данной работе способ определения in vitro или ex vivo статуса IGF-1R опухолевых клеток или опухоли у субъекта характеризуется тем, что способ включает стадии:
(a) количественной оценки IGF-1R опухолевых клеток или опухоли у указанного субъекта в соответствии со способом по п. 18; и
(b) определения того, что статус IGF-1R опухолевых клеток или опухоли соответствует [IGF-1R(+)] с оценкой от 3 до 8; или
(c) определения того, что статус IGF-1R опухолевых клеток или опухоли соответствует [IGF-1R(-)] с оценкой от 0 до 2.
В качестве второго примера, по аналогии со стандартным подсчетом для оценки рецептора HER-2 с помощью IHC, образцы, например, можно количественно оценивать по уровням экспрессии IGF-1R при помощи несколько более простого способа количественной оценки, соединяющего интенсивность окрашивания (предпочтительно, мембранного окрашивания) и долю клеток, которые проявляют окрашивание, в объединенной шкале от 0 до 3+.
По этой шкале, называемой упрощенной шкалой, 0 и 1+ соответствуют отрицательному окрашиванию, тогда как 2+ и 3+ соответствуют положительному окрашиванию. Тем не менее, оценки от 1+ до 3+ могут быть перекодированы на положительные, поскольку каждая положительная оценка может быть связана со значительно более высоким риском рецидива и смертельного исхода заболевания по сравнению с оценкой 0 (отрицательный статус), но увеличение интенсивности в ряду положительных оценок может обеспечить дополнительное снижение риска.
Вообще говоря, термины отрицательный или положительный "статус IGF-1R" опухолей или опухолевых клеток, используемые в настоящем описании, относятся к уровням экспрессии IGF-1R, соответствующим оценкам 0-1+ или 2+-3+ по упрощенной шкале, соответственно. Следует рассматривать только полную реактивность периферической мембранной части инвазивной опухоли, которая часто внешним видом напоминает "проволочную сетку". В соответствии с действующими правилами, образцы, оцененные как пограничные (т.е. имеющие оценку 2+ или 3+) в отношении IGF-1R, должны быть подвергнуты дополнительной оценке. Результаты IHC анализа следует исключить, и либо повторить их, либо проверить с помощью FISH или любого другого способа, если, в качестве неограничивающего примера, контроль не соответствует ожидаемому, артефакты затрагивают большую часть образца, и образец имеет сильную мембранную положительность нормальных протоков молочной железы (внутренний контроль), что позволяет говорить о повышенной демаскировке антигена.
Для большей ясности эти параметры представлены в приведенной далее Таблице 5.

Способ по изобретению характеризуется тем, что указанная приемлемая шкала является шкалой от 0 до 3+, где отсутствие мембранной реактивности опухолевых клеток оценивается как 0, а сильная полная реактивность в более чем 10% опухолевых клеток оценивается как 3+.
Более подробно, как описано выше, указанная приемлемая шкала является шкалой от 0 до 3, где отсутствие мембранной реактивности опухолевых клеток оценивается как 0; слабо заметная мембранная реактивность в более чем 10% опухолевых клеток оценивается как 1+; полная мембранная реактивность от слабой до умеренной в более чем 10% опухолевых клеток оценивается как 2+; и сильная полная реактивность в более чем 10% опухолевых клеток оценивается как 3+.
Другими словами, описывается и заявляется способ определения in vitro или ex vivo статуса опухоли по опухолевым клеткам от субъекта, где указанный способ включает стадии (а) количественной оценки опухоли или опухолевых клеток от субъекта в соответствии с упрощенной шкалой, как описано выше; и (b) определения того, что статус опухоли или опухолевых клеток соответствует [IGF-1R(+)] с оценкой 2+ или 3+; или (с) определения того, что статус опухоли или опухолевых клеток соответствует [IGF-1R(-)] с оценкой от 0 или 1+.
Согласно частному аспекту изобретения, опухоль или опухолевые клетки соответствуют [IGF-1R (+)] с оценкой 2+.
Согласно частному аспекту изобретения, опухоль соответствует или опухолевые клетки соответствуют [IGF-1R (+)] с оценкой 3+.
Согласно еще одному частному аспекту изобретения, опухоль соответствует или опухолевые клетки соответствуют [IGF-1R (+)] с оценкой 2+ или 3+.
Согласно другому варианту осуществления, изобретение относится к способу определения in vitro или ex vivo статуса IGF-1R опухолевых клеток или опухоли у субъекта, при этом указанный способ включает стадии:
(a) количественной оценки указанных IGF-1R опухолевых клеток или указанной опухоли у указанного субъекта в соответствии со способом настоящего изобретения, описанным выше; и
(b) - i) определения того, что статус IGF-1R опухолевых клеток или опухоли соответствует [IGF-1R(+)] с оценкой 2+ или 3+; или
- ii) определения того, что статус IGF-1R опухолевых клеток соответствует [IGF-1R(-)] с оценкой 0 или 1+.
Как правило, результаты испытания или анализа могут быть представлены в любом из множества форматов. Результаты могут быть представлены в качественном формате. Например, протокол испытаний может указывать лишь, был или не был обнаружен конкретный полипептид, возможно, также с указанием пределов обнаружения. Результаты могут отображаться в полуколичественном формате. Например, могут быть определены различные диапазоны, и диапазонам может быть присвоено количественное значение (например, от 0 до 3+ или от 0 до 8, в зависимости от используемой шкалы), обеспечивая тем самым определенную степень количественной информации. Такая оценка может отражать различные факторы, например, количество клеток, в которых обнаружен IGF-1R, интенсивность сигнала (которая может указывать на уровень экспрессии IGF-1R или клеток, несущих IGF-1R) и так далее. Результаты могут отображаться в количественном формате, например, в виде процента клеток, в которых обнаружен IGF-1R, в виде концентрации белка и так далее.
Среднему специалисту в данной области следует учитывать, что тип результата, обеспечиваемого испытанием, будет варьироваться в зависимости от технических ограничений испытания и биологической значимости, связанной с обнаружением полипептида. К примеру, в случае некоторых полипептидов важную информацию обеспечивает чисто качественный результат (например, обнаруживается или нет полипептид при определенном уровне обнаружения). В других случаях необходим более количественный результат (например, соотношение уровня экспрессии полипептида в тестируемом образце и нормального уровня).
Согласно другому аспекту, описан способ диагностики патологического гиперпролиферативного онкогенного расстройства или восприимчивости к патологическому состоянию, связанному с экспрессией IGF-1R, у субъекта, при этом указанный способ включает стадии:
(a) определения наличия или отсутствия клеток, несущих IGF-1R, в образце с помощью способа обнаружения клеток, экспрессирующих IGF-1R, и/или способа определения уровня экспрессии IGF-1R в соответствии с настоящим изобретением, и
(b) диагностики патологического состояния или восприимчивости к патологическому состоянию на основании наличия или отсутствия указанных клеток, несущих IGF-1R.
В описанных в данной работе способах обнаружение клеток, экспрессирующих IGF-1R, или увеличение уровней IGF-1R обычно указывает на наличие у пациента расстройства, опосредованного IGF-1R, или о подозрении на него.
Настоящее изобретение также предлагает способ прогнозирования риска развития рака у индивидуума, при этом указанный способ включает определение уровня экспрессии IGF-1R в образце ткани с помощью способа определения клеток, экспрессирующих IGF-1R, и/или способа определения уровня экспрессии IGF-1R в соответствии с настоящим изобретением, где высокий уровень экспрессии IGF-1R свидетельствует о высоком риске развития рака.
Изобретение также относится к способу оценки агрессивности опухоли.
"Агрессивность опухоли" при использовании в данном документе относится быстрому росту опухоли и тенденции к быстрому ее распространению.
Согласно одному из вариантов осуществления, указанный способ оценки агрессивности опухоли включает стадии:
(a) определения уровня IGF-1R, экспрессируемого клетками в образце опухоли, с помощью способа определения клеток, экспрессирующих IGF-1R, и/или способа определения уровня экспрессии IGF-1R в соответствии с настоящим изобретением,
(b) определения уровня IGF-1R, экспрессируемого в эквивалентном образце ткани, взятом от того же индивидуума в более позднее время, с помощью способа определения клеток, экспрессирующих IGF-1R, и/или способа определения уровня экспрессии IGF-1R в соответствии с настоящим изобретением, и
(c) определения соотношения между уровнем экспрессии, определенным на стадии (а), и уровнем, определенным на стадии (b),
где изменение соотношения экспрессии IGF-1R в образце опухоли с течением времени дает информацию о риске прогрессирования рака.
В предпочтительном варианте осуществления отношение уровня, определенного на стадии (а), к уровню, определенному на стадии (b), большее 1, указывает на агрессивность. Согласно другому варианту осуществления, соотношение, меньшее или равное 1, указывает на неагрессивность.
Другим аспектом данного изобретения является мониторинг экспрессии IGF-1R в ответ на проведение терапии, нацеленной на путь IGF-1R, с помощью способа обнаружения и/или количественного определения IGF-1R и/или определения уровня экспрессии в соответствии с настоящим изобретением. Такой мониторинг может быть очень полезным в случае, когда указанная терапия вызывает понижающую регуляцию и/или деградацию IGF-1R.
Кроме того, объектом изобретения является способ определения того, является ли онкогенное расстройство восприимчивым к лечению лекарственным средством, содержащим антитело, нацеленным на путь IGF-1R, при этом указанный способ включает стадии:
(а) определения in vitro или ex vivo статуса IGF-1R опухолевых клеток в опухоли субъекта в соответствии со способом количественной оценки по настоящему изобретению, как описано выше, и
(b) в случае, если статус IGF-1R опухолевых клеток или опухоли соответствует IGF-1R(+), определения того, что онкогенное расстройство является восприимчивым к лечению лекарственным средством, содержащим антитело, нацеленным на путь IGF-1R.
В частности, мониторинг экспрессии IGF-1R на поверхности клетки может быть важным инструментом для оценки эффективности лечения во время клинических исследований и во время "индивидуальной" терапии.
Таким образом, данная заявка предлагает способы определения для субъекта подходящей схемы лечения.
Увеличение или уменьшение уровня IGF-1R, которое может быть определено с помощью способа обнаружения и/или определения уровня экспрессии в соответствии с настоящим изобретением, является показателем развития рака, связанного с IGF-1R. Таким образом, измеряя увеличение числа клеток, экспрессирующих IGF-1R, или изменение концентрации IGF-1R, присутствующего в различных тканях или клетках, можно определить, является ли эффективной та или иная схема лечения, направленная на уменьшение интенсивности злокачественной опухоли, связанной с IGF-1R.
Еще одним объектом изобретения также является способ определения in vitro или ex vivo эффективности схемы лечения, предназначенной для облегчения онкогенного расстройства, связанного с IGF-1R, у субъекта, страдающего указанным расстройством, при этом указанный способ включает стадии:
(a) определения первого уровня экспрессии IGF-1R с помощью способа обнаружения и/или определения уровня экспрессии в соответствии с настоящим изобретением, как описано выше, в первом биологическом образце, при этом указанный первый биологический образец соответствует первому моменту времени лечения;
(b) определения второго уровня экспрессии IGF-1R с помощью способа обнаружения и/или определения уровня экспрессии в соответствии с настоящим изобретением, как описано выше, во втором биологическом образце, при этом указанный второй биологический образец соответствует второму, более позднему, моменту времени лечения;
(c) вычисления соотношения первого уровня экспрессии, определенного на стадии (а), и второго уровня экспрессии, определенного на стадии (b); и
(d) определения того, что эффективность указанной схемы лечения является высокой, если соотношение, вычисленное на стадии (с), больше 1; или же определения того, что эффективность указанной схемы лечения является низкой, если соотношение, вычисленное на стадии (с), меньше или равно 1.
Согласно предпочтительному варианту осуществления, указанная схема лечения, предназначенная для облегчения онкогенного расстройства, связанного с IGF-1R, у субъекта, страдающего указанным расстройством, включает проведение для субъекта терапии, нацеленной на путь IGF-1R.
В качестве еще одного объекта изобретения предложен способ визуализации in vivo онкогенного расстройства, связанного с экспрессией IGF-1R, с помощью способа обнаружения и/или определения уровня экспрессии в соответствии с настоящим изобретением. Такой способ полезен для локализации in vivo опухолевых клеток и для мониторинга их инвазивности. Равным образом, способ является полезным для мониторинга прогрессирования и/или реакции на лечение у пациентов с ранее диагностированным раком, опосредованным IGF-1R.
Вариантом осуществления изобретения является способ определения локализации опухолевых клеток, экспрессирующих IGF-1R, у субъекта, при этом указанный способ включает стадии:
a) введения субъекту антитела к IGF-1R или его антигенсвязывающего фрагмента в соответствии с настоящим изобретением; и
b) обнаружения связывания указанного антитела к IGF-1R, где связывание указывает на присутствие опухолевых клеток.
Для определения присутствия экспрессирующей опухоли можно использовать различные способы, известные специалистам в данной области. Тем не менее, предпочтительными средствами являются IHC и FACS.
Согласно другому аспекту, изобретение предлагает реагент для визуализации in vivo, где указанный реагент включает антитело к IGF-1R или его антигенсвязывающий фрагмент в соответствии с настоящим изобретением, при этом указанное антитело к GF-1R предпочтительно является меченым, более предпочтительно, меченным радиоактивным изотопом.
Настоящее изобретение также предполагает применение указанного реагента для медицинской визуализации у пациента, страдающего раком, опосредованным IGF-1R.
Способ согласно данному изобретению включает стадии:
(a) введения указанному пациенту эффективного для визуализации количества реагента для визуализации по изобретению,
(b) обнаружения указанного реагента.
Согласно предпочтительному варианту осуществления изобретения, агент для визуализации включает антитело к IGF-1R или его антигенсвязывающий фрагмент в соответствии с настоящим изобретением и активную часть.
"Активная часть" при использовании в данном документе представляет собой агент, позволяющий обнаруживать in vivo указанный реагент для визуализации. Активная часть согласно изобретению включает, в частности, радиоактивные элементы, такие как технеций-99m (99mTc), медь-67 (Cu-67), скандий-47 (Sc-47), лютеций-77 (Lu-177) медь-64 (Cu-64), иттрий-86 (Y-86) или йод-124 (I-124).
Агент для визуализации вводят в количестве, эффективном для диагностического применения у млекопитающего, такого как человек, и затем определяют локализацию и накопление агента для визуализации. Локализацию и накопление агента для визуализации можно обнаружить путем радионуклидной визуализации, радиосцинтиграфии, ядерной магнитно-резонансной визуализации, компьютерной томографии, позитронно-эмиссионной томографии, компьютерной аксиальной томографии, рентгенографии или магнитно-резонансной визуализации, флуоресцентного обнаружения и хемилюминесцентного обнаружения.
Что касается разработки направленной противоопухолевой терапии, диагностирование с помощью иммуногистологических методик дает in situ информацию об уровне экспрессии рецептора, например, относительно размера и/или локализации опухоли. Таким образом, диагностика позволяет выбирать пациентов, восприимчивых к лечению, на основании уровня экспрессии рецепторов, необходимого для такого лечения.
Особенно интересным аспектом изобретения является способ выбора пациента, больного раком, для которого определяют, будет ли полезным введение терапевтического количества лекарственного средства, содержащего антитело, нацеленного на путь IGF-1R, при этом указанный способ включает стадии:
(a) определения уровня экспрессии IGF-1R в соответствии со способом по изобретению, описанным выше;
(b) сравнения уровня экспрессии, определенного на предыдущей стадии (а), с эталонным уровнем экспрессии; и
(c) выбор пациента, для которого лечение лекарственным средством, содержащим антитело, нацеленным на путь IGF-1R, предположительно будет полезным, если соотношение уровня экспрессии, полученного на стадии (а), и эталонного уровня экспрессии больше 1; или
(d) выбор пациента, для которого лечение лекарственным средством, содержащим антитело, нацеленным на путь IGF-1R, предположительно не будет полезным, если соотношение уровня экспрессии, полученного на стадии (а), и эталонного уровня экспрессии меньше или равно 1.
Уровень экспрессии IGF-1R предпочтительно сравнивают или измеряют в сравнении с уровнями в контрольной клетке или образце, также называемыми "эталонным уровнем" или "эталонным уровнем экспрессии". Понятия "эталонный уровень", "эталонный уровень экспрессии", "контрольный уровень" и "контроль" в данном описании используют взаимозаменяемо. "Контрольный уровень" означает отдельный исходный уровень, измеряемый в сопоставимой контрольной клетке, которая, как правило, не имеет признаков рака или другого заболевания. Указанная контрольная клетка может быть получена от того же индивидуума, поскольку даже у пациента с раковым заболеванием ткань, являющаяся местом опухоли, вместе с тем включает и неопухолевую здоровую ткань. Она также может быть получена от другого индивидуума, который является здоровым, или у которого не обнаружено того заболевания, которым болен индивидуум, от которого получен пораженный или испытываемый образец. В контексте данного изобретения, термин "эталонный уровень" относится к "контрольному уровню" экспрессии IGF-1R, используемому для оценки измеряемого уровня экспрессии IGF-1R в содержащем раковую клетку образце пациента. Например, в случае если уровень IGF-1R в биологическом образце пациента выше, чем эталонный уровень IGF-1R, будет считаться, что клетки имеют высокий уровень экспрессии, или сверхэкспрессию, IGF-1R. Эталонный уровень может быть определен с помощью целого ряда способов. Таким образом, уровни экспрессии могут определять клетки, несущие IGF-1R, или, в качестве альтернативы, уровень экспрессии IGF-1R не зависит от количества клеток, экспрессирующих IGF-1R. Вследствие этого, эталонный уровень для каждого пациента может быть задан с помощью эталонного соотношения IGF-1R, где эталонное соотношение может быть определено любым из способов определения эталонных уровней, описанных в данном контексте.
Например, контроль может быть заданной величиной, которая может принимать различные формы. Это может быть одно пороговое значение, такое как медианное или среднее значение. "Эталонный уровень" может быть одним предельным значением, в равной степени применимым к каждому из пациентов индивидуально, или же эталонный уровень может варьироваться в зависимости от конкретных субпопуляций пациентов. Так, например, пожилые люди могут иметь эталонный уровень, отличный от такового у более молодых людей с той же формой рака, а эталонный уровень у женщин может отличаться от эталонного уровня у мужчин с такой же формой рака. В качестве альтернативы, "эталонный уровень" может быть определен путем измерения уровня экспрессии IGF-1R в неонкогенных раковых клетках из той же ткани, что и ткань исследуемых неопластических клеток. Равным образом, "эталонный уровень" может быть некоторым соотношением уровней IGF-1R в неопластических клетках пациента и уровней IGF-1R в неопухолевых клетках того же пациента. "Эталонный уровень" также может быть уровнем IGF-1R культивируемых in vitro клеток, которые можно использовать для имитации опухолевых клеток, или которые можно использовать каким-либо другим образом, позволяющим получать уровни экспрессии, точно определяющие эталонный уровень. С другой стороны, "эталонный уровень" может быть установлен на основании сравнительных групп, например, таких как группы, не имеющие повышенных уровней IGF-1R, и группы, имеющие повышенные уровни IGF-1R. Другим примером сравнительных групп могут быть группы пациентов, имеющих конкретное заболевание, состояние или симптомы, и группы без этого заболевания. Заданное значение может быть установлено, например, когда испытываемую популяцию делят поровну (или неравно) на группы, такие как группа низкого риска, группа среднего риска и группа высокого риска.
Эталонный уровень также можно определить путем сравнения уровня IGF-1R в популяциях пациентов с одинаковым видом рака. Это может быть осуществлено, например, путем анализа гистограммы, в которой графически представлена вся когорта пациентов, где первая ось представляет собой уровень IGF-1R, а вторая - число пациентов в когорте, чьи опухолевые клетки экспрессируют IGF-1R на заданном уровне. С помощью идентификации подмножеств популяций когорты, имеющих одинаковые или сходные уровни IGF-1R, могут быть определены две или более отдельные группы пациентов. Затем на основе уровня, который наиболее различает эти отдельные группы, можно определить эталонный уровень. Эталонный уровень также может представлять уровни двух или более маркеров, одним из которых является IGF-1R. Два или более маркера могут быть описаны, например, соотношением величин уровней каждого маркера.
Аналогично, практически здоровая популяция будет иметь "нормальный" диапазон, отличный от такового у популяции, о которой известно, что она имеет заболевание, связанное с экспрессией IGF-1R. Соответственно, выбранное заданное значение может учитывать категорию, в которую попадает человек.
Соответствующие диапазоны и категории могут быть выбраны специалистом в данной области с помощью всего лишь обычных экспериментов. Под «повышенным», «увеличенным» значением подразумевается показатель, высокий относительно выбранного контроля. Как правило, контроль будет основан на практически здоровых нормальных пациентах соответствующей возрастной группы.
Следует также понимать, что в качестве контроля в соответствии с изобретением, помимо заданных значений, могут использоваться образцы материалов, испытываемые параллельно с экспериментальными материалами. Примеры включают ткань или клетки, полученные одновременно от того же субъекта, например, части одной биопсии или части одного образца клеток субъекта.
Согласно другому варианту осуществления, изобретение относится к фармацевтической композиции для визуализации in vivo онкогенного заболевания, связанного с экспрессией IGF-1R, включающей антитело к IGF-1R или его антигенсвязывающий фрагмент в соответствии с настоящим изобретением, описанные выше, или его меченый антигенсвязывающий фрагмент и фармацевтически приемлемый носитель.
Согласно другому аспекту, также описан набор для обнаружения опухолевых клеток, экспрессирующих IGF-1R, у пациента, характеризующийся тем, что указанный набор содержит по меньшей мере антитело к IGF-1R или его антигенсвязывающий фрагмент, как описано выше, и предпочтительно, антитело 816С12.
В объем изобретения также входят упакованные материалы, включающие комбинацию реагентов в заданных количествах с инструкциями для проведения диагностического анализа, например, наборы. Набор содержит антитела к IGF-1R для обнаружения и количественного определения IGF-1R in vitro, например, с помощью ELISA. Если антитело к IGF-1R мечено ферментом, в набор будут включены субстраты и кофакторы, требуемые для фермента (например, предшественник субстрата, обеспечивающий поддающийся обнаружению хромофор или флуорофор). Помимо этого могут быть включены и другие добавки, такие как стабилизаторы, буферы (например, блокирующий буфер или лизирующий буфер) и т.п. Такой набор может включать коробку, разделенную на отсеки, куда помещается один или более контейнер, такой как флаконы, пробирки и т.п., где контейнеры содержат отдельные элементы изобретения. Например, один контейнер может содержать первое антитело, связанное с нерастворимым или частично растворимым носителем. Второй контейнер может содержать растворимое меченное для обнаружения второе антитело в лиофилизированной форме или в растворе. Коробка может также включать третий контейнер, содержащий меченное для обнаружения третье антитело в лиофилизированной форме или в растворе. Набор такого типа может быть использован в сэндвич-анализе по изобретению. Этикетка или листок-вкладыш могут содержать описание композиции и инструкции для предполагаемого использования in vitro или диагностики.
Относительные количества различных реагентов могут широко варьироваться для обеспечения в растворе концентраций реагентов, которые существенно оптимизируют чувствительность анализа. В частности, реагенты могут быть предоставлены в виде сухих порошков, обычно лиофилизированных, включающих вспомогательные вещества (эксципиенты), которые при растворении будут обеспечивать раствор реагента соответствующей концентрации.
Согласно еще одному аспекту, антитела к IGF-1R или их антигенсвязывающие фрагменты, такие как подробно описаны в данном контексте в соответствии с настоящим изобретением, мечены обнаруживаемым веществом, так что они могут быть упакованы и использоваться, например, в наборах, для диагностики или идентификации клеток, имеющих упомянутый выше антиген. Неограничивающие примеры таких меток включают флуорофоры, такие как флуоресцеинизотиоцианат; хромофоры, радионуклиды, биотин или ферменты. Такие меченые антитела к IGF-1R могут быть использованы, например, для гистологической локализации антигена, ELISA, сортировки клеток, а также в других иммунологических способах обнаружения или количественной оценки IGF-1R и клеток, несущих этот антиген.
Настоящее изобретение также направлено на набор, где указанный набор характеризуется тем, что он включает антитело к IGF-1R или его антигенсвязывающие фрагменты в соответствии с настоящим изобретением.
Настоящее изобретение также относится к набору, где указанный набор характеризуется тем, что он включает химерное или гуманизированное антитело к IGF-1R или его антигенсвязывающие фрагменты, которые могут быть получены из 6 CDR, имеющих последовательности SEQ ID No. 1-6, антитела к IGF-1R или его антигенсвязывающих фрагментов в соответствии с настоящим изобретением.
Также предложены наборы, которые могут быть использованы в качестве положительного контроля для очистки или иммунопреципитации IGF-1R из клеток. Набор для выделения и очистки IGF-1R может содержать антитело к IGF-1R или его антигенсвязывающие фрагменты, как подробно описано в данном контексте в соответствии с настоящим изобретением, соединенные с гранулами (например, с гранулами сефарозы). Могут быть предложены наборы, содержащие антитела для обнаружения и количественного определения IGF-1R in vitro, например, в ELISA. Набор включает контейнер и этикетку или листок-вкладыш, вложенный или связанный с контейнером. Могут быть включены дополнительные контейнеры, содержащие, например, разбавители и буферы, контрольные антитела. Этикетка или вкладыш могут содержать описание композиции и инструкции для предполагаемого использования in vitro или диагностики.
В частности, изобретение относится к набору для определения in vitro или ex vivo статуса IGF-1R опухолевых клеток опухоли у субъекта с помощью описанных здесь способов. Согласно предпочтительному варианту осуществления, как будет описано в примере, изобретение относится к набору для определения статуса IGF-1R опухоли или опухолевых клеток методами IHC и/или FACS.
Согласно частному варианту осуществления, изобретение состоит из набора, включающего по меньшей мере антитело к IGF-1R или его антигенсвязывающий фрагмент по настоящему изобретению, как описано выше, при этом указанное антитело является меченым.
Согласно предпочтительному варианту осуществления, набор согласно изобретению также включает реагент, используемый для определения степени связывания между указанным антителом к IGF-1R и IGF-1R.
В другом предпочтительном варианте осуществления набор по изобретению, используемый для определения in vitro или ex vivo уровня экспрессии IGF-1R в опухоли, экспрессирующей IGF-1R, также включает реагент для количественного измерения уровня связывания между указанным меченым антителом к IGF-1R и IGF-1R.
В еще одном варианте осуществления набор по изобретению также содержит: i) реагент для обнаружения степени связывания между указанным меченым антителом к IGF-1R и IGF-1R; и ii) положительный и отрицательный контрольные образцы для количественного измерения уровня экспрессии IGF-1R.
Указанный набор может дополнительно содержать поликлональное антитело, специфичное к мышиным антителам или к человеческим/гуманизированным антителам, предпочтительно, указанное поликлональное антитело, специфичное к мышиным, гуманизированным или человеческим антителам, является меченым.
В соответствии с частным вариантом осуществления изобретения, набор для выбора in vitro пациента, больного раком, для которого определено, будет ли полезным терапевтическое введение ингибитора, нацеленного на IGF-1R путь, может включать: i) реагент для обнаружения степени связывания между указанным антителом к IGF-1R и IGF-1R; ii) контрольный уровень, который скоррелирован с чувствительностью к ингибитору IGF-1R и/или iii) контрольный уровень, который скоррелирован с резистентностью к ингибитору IGF-1R.
Изобретение также относится к набору для определения того, будет ли для пациента с онкогенным расстройством полезным лечение лекарственным средством, содержащим антитело, нацеленным на путь IGF-1R, характеризующемуся тем, что указанный набор содержит по меньшей мере антитело к IGF-1R или его антигенсвязывающий фрагмент по настоящему изобретению, как описаны выше.
В другом варианте осуществления, указанный набор характеризуется тем, что он также включает:
i) реагент для обнаружения степени связывания между указанным антителом к IGF-1R и IGF-1R на поверхности опухолевых клеток; и/или
ii) реагент для количественного измерения уровня связывания между указанным антителом к IGF-1R и IGF-1R на поверхности опухолевых клеток.
Другие характеристики и преимущества изобретения приведены в продолжении описания с примерами и графическими материалами, пояснения к которым представлены ниже.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ.
Фиг. 1: Графическое изображение величин оптической плотности (OD), полученное при использовании антитела 816С12 в rhIGF1R ELISA. Согласование данных и ЕС50 определяют с помощью приложения Prism.
Фиг. 2А-2С: Иммуногистохимические (IHC) картины распознавания залитой в парафин опухоли MCF-7 с использованием антитела 816С12 (фиг. 2А), G11 анти-IGF-1R антитела (Roche Ventana) (фиг. 2В) или AF-305 анти-IGF-1R антитела (R&D system) (фиг. 2С).
Фиг. 3: In vivo активность анти-IGF-1R ADC на ксенотрансплантатной модели MCF-7.
Фиг. 4А-4С: Иммуногистохимические (IHC) картины распознавания залитой в парафин опухоли SBC-5 с использованием антитела 816С12, G11 анти-IGF-1R антитела (Roche Ventana) (фиг. 4В) или AF-305 анти-IGF-1R антитела (R&D system) (фиг. 4С).
Фиг. 5: In vivo активность анти-IGF-1R ADC на ксенотрансплантатной модели SBC-5.
ОПИСАНИЕ ПРИМЕРОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Пример 1: Создание и отбор 816С12
Моноклональные антитела (Mab) против rhIGF-1R получали и отбирали как описано ниже.
Самок мышей Balb/C иммунизировали путем подкожного введения 10 мкг рекомбинантного человеческого белка IGF-1R (R&D Systems, 391-GR) с адъювантом Фрейнда. Иммунизацию повторяли три раза с интервалами в 2 недели. Четвертую инъекцию проводили путем внутрибрюшинного введения в присутствии адъюванта.
Спустя три дня проводили слияние клеток селезенки с клетками миеломы SP2OAg14 с 50% ПЭГ. После 14 дней метаболической селекции на среде HAT (англ. hypoxanthine, aminopterine, thymidine - гипоксантин, аминоптерин, тимидин) гибридомные супернатанты (надосадочные жидкости) исследовали с помощью FACS, используя человеческие клетки рака молочной железы MCF7. Сохраняли только MCF7-связывающие антитела.
Затем антитела, представляющие интерес, клонировали путем предельного разведения. Через восемь дней после клонирования супернатанты снова отбирали путем FACS с использованием клеток MCF7. Было сохранено три положительных клона. Изотипирование секретируемых антител проводили с использованием набора SBA clonotyping system-HRP от Southern Biotechnologies (Cat: 5300-05). Наконец, один из клонов размножали и замораживали.
Для дальнейшего определения характеристик антитела 816С12 выполняли исследование ELISA гибридомных супернатантов, таких как rhIGF-1R, или rmIGF-1R, или rhIR. При проведении всех прямых ELISA исследуемые белки иммобилизовали (1 мкг/мл) на дне каждой лунки. После насыщения в лунки добавляли гибридомные супернатанты. После инкубационного периода в течение 1 часа и стадии промывки для обнаружения использовали раствор поликлонального антитела, помеченный козьими антителами к иммуноглобулину (IgG) мыши, конъюгированными с пероксидазой хрена (HRP), перед добавлением субстрата ТМВ. Реакцию останавливали добавлением 1М раствора H2SO4 перед определением оптической плотности (OD) с помощью спектрофотометра на длине волны 450 нм. Данные представлены ниже в Таблице 6.
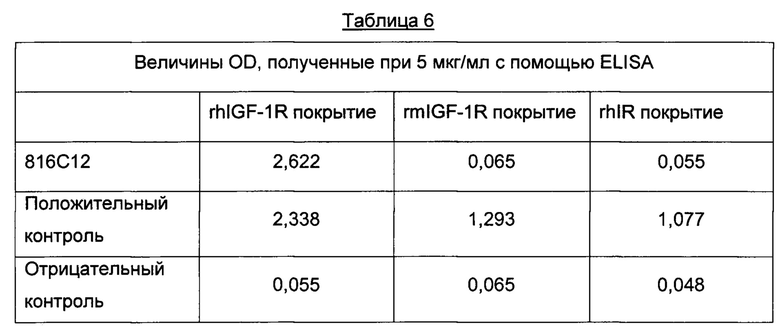
Кривая зависимости "доза-эффект" для антитела 816С12 на rhIGF-1R покрытии представлена на Фиг. 1. Величины ЕС50 определены с использованием приложения Prism.
Данные показали, что антитело 816С12 распознает только rhIGF-1R с ЕС50 0,41 нМ. Оно не связывается ни с мышиной формой IGF-1R, ни с человеческим IR.
Пример 2: Оценка корреляции стадирования с помощью антитела по изобретению и активности конъюгата антитело-лекарственное средство (ADC), нацеленного на IGF-1R, на ксенотрансплантатной модели MCF-7
Для корреляции степени злокачественности опухолей с фармакологией опухоли оценивали (раздел 2.1) и затем выполняли in vivo эксперименты на ксенотрансплантатной модели MCF-7 с использованием ADC, содержащего нацеленный на IGF-1R фрагмент антитела, заведомо интернализированного, и лекарственный фрагмент, состоящий из ауристатина (раздел 2.2).
2.1: Иммуногистохимическое обнаружение экспрессии IGF-1R на ксенотрансплантатной модели MCF-7
Срезы ткани из ксенотрансплантата MCF-7 депарафинизировали, регидратировали и помещали в буфер для демаскировки Target Retrieval Buffer 1Х (Dako S1699) на кипящей бане, предварительно нагретой до температуры 98°С, для высокотемпературной демаскировки антигена при температуре 98°С в течение 40 минут и затем в течение еще 20 минут в буфере Target Retrieval Buffer. После трех промываний в солевом трис-буфере с 0,05% Твин-20 (англ. Tris Buffer Saline - 0,05% tween 20 (TBS-T)) (Dako S3006) эндогенную пероксидазную активность блокировали с помощью блокирующего реагента для пероксидазы Peroxidase Blocking Reagent (Dako K4007) в течение пяти минут. Срезы промывали TBS-T и инкубировали с блокирующим реагентом (UltraV block-TA-125UB - LabVision) в течение 5 минут перед инкубацией либо с моноклональным антителом 810D12 (5 мкг/мл), либо с мышиным IgG1/каппа (5 мкг/мл, Х0931, Dako) в качестве отрицательного контроля в течение 1 часа при комнатной температуре. Срезы промывали TBS-T и инкубировали с Envision (Dako) в течение 30 минут. Для образования реакционного продукта коричневого цвета использовали диаминобензидин (Dako K3468). Препараты погружали на 2 минуты в гематоксилин для контр-окрашивания (Dako S3309).
Анти-IGF-1R моноклональное антитело 816С12 по настоящему изобретению избирательно окрашивает клеточную мембрану MCF-7. При такой IHC процедуре коричневый реакционный продукт коррелирует с позитивным окрашиванием клеточной мембраны, а недостаточность коричневого реакционного продукта коррелирует с негативным окрашиванием и отсутствием визуализации клеточной мембраны. При использовании мембранного алгоритма оценка окрашивания опухолевых клеток MCF-7 соответствовала 3+ (Фиг. 2А). При использовании антитела G11 (Roche Ventana) или анти-IGF-1R антител AF-305 (R&D система) срезы той же опухоли были оценены на 2+ (Фиг. 2В и 2С, соответственно).
2.2: In vivo активность анти-IGF-1R ADC на ксенотрансплантатной модели MCF-7
Анти-IGF-1R ADC оценивали in vivo на ксенотрансплантатной модели MCF-7.
Все процедуры с животными выполняли в соответствии с правилами 2010/63/UE Директивы по защите животных, используемых для научных целей. Протокол был одобрен Комитетом по этике работы с животными Института Пьера Фабра. Пять миллионов клеток MCF-7 вводили подкожно 7-недельным швейцарским/бестимусным мышам. Перед инъекцией клеток в левый бок мышей имплантировали гранулы эстрогена (Innovative Research of America), чтобы высвободить эстрогены, необходимые для роста опухолей MCF-7 in vivo.
Через двадцать дней после имплантации клеток MCF-7, когда опухоли достигли среднего размера 120-150 мм3, животных разделили на группы по 6 мышей в зависимости от размера и аспекта опухоли. Анти-IGF-1R ADC инокулировали внутрибрюшинно циклом по 6 инъекций каждые четыре дня (Q4d4). Состояние здоровья животных контролировали ежедневно. Объем опухоли измеряли с помощью электронного циркуля дважды в неделю до окончания исследования. Объем опухоли вычисляли по следующей формуле: π/6 × длина × ширина × высота. Токсичность оценивали по весу животных три раза в неделю. Статистический анализ проводили на каждом этапе с использованием теста Манна-Уитни.
Введение анти-IGF-1R ADC значительно ингибировало рост опухоли и даже вызывало полную регрессию роста опухоли (Фиг. 3), как и ожидалось, для опухоли, классифицированной как 3+, но не для опухоли, классифицированной как 2+.
Пример 3: Оценка корреляции стадирования с помощью антитела по изобретению и активности ADC, нацеленного на IGF-1R, на ксенотрансплантатной модели SBC-5
Для корреляции степени злокачественности опухолей с фармакологией опухоли оценивали (раздел 3.1) и затем выполняли in vivo эксперименты на ксенотрансплантатной модели SBC-5 с использованием ADC, содержащего нацеленный на IGF-1R фрагмент антитела и лекарственный фрагмент, состоящий из ауристатина (раздел 3.2).
3.1: Иммуногистохимическое обнаружение экспрессии IGF-1R на ксенотрансплантатной модели SBC-5
Уровень IGF-1R анализировали, используя протокол, аналогичный описанному в разделе 2.1 Примера 2 выше.
При обнаружении IGF-1R с помощью 816С12 были обнаружены низкие уровни (1+) (Фиг. 4А). При обнаружении IGF-1R с помощью G11 антитела (Roche Ventana) или AF-305 анти-IGF-1R антител (R&D System) срезы той же опухоли были оценены как 3+ (Фиг. 4В и 4С, соответственно).
3.2: In vivo активность анти-IGF-1R-ADC на ксенотрансплантатной модели SBC-5
Анти-IGF-1R ADC оценивали in vivo на ксенотрансплантатной модели SBC-5.
Все процедуры с животными выполняли в соответствии с правилами 2010/63/UE Директивы по защите животных, используемых для научных целей. Протокол был одобрен Комитетом по этике работы с животными Института Пьера Фабра. Пять миллионов клеток SBC-5 вводили подкожно 7-недельным бестимусным мышам. Через двенадцать дней после имплантации клеток, когда опухоли достигли среднего размера 150 мм3, животных разделили на группы по 6 мышей в зависимости от размера и аспекта опухоли. Анти-IGF-1R ADC инокулировали внутрибрюшинно циклом по 6 инъекций каждые четыре дня (Q4d6). Состояние здоровья животных контролировали ежедневно. Объем опухоли измеряли с помощью электронного циркуля дважды в неделю до окончания исследования. Объем опухоли вычисляли по следующей формуле: π/6 × длина × ширина × высота. Токсичность оценивали по весу животных три раза в неделю. Статистический анализ проводили на каждом этапе с использованием теста Манна-Уитни.
Инъекция анти-IGF-1R ADC не оказывала воздействия на прогрессирование опухолевых клеток SBC-5 (Фиг. 5), как и ожидалось, для опухоли, классифицированной как 1+, но не для опухоли, классифицированной как 3+.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛО К IGF-1R И ЕГО ПРИМЕНЕНИЕ ДЛЯ ДИАГНОСТИКИ РАКА | 2016 |
|
RU2706959C2 |
| ПРИМЕНЕНИЕ АНТИТЕЛА I-3859 ДЛЯ ВЫЯВЛЕНИЯ И ДИАГНОСТИКИ РАКА | 2012 |
|
RU2636032C2 |
| НОВОЕ АНТИТЕЛО К CXCR4 И ЕГО ПРИМЕНЕНИЕ ДЛЯ ВЫЯВЛЕНИЯ И ДИАГНОСТИКИ РАКА | 2012 |
|
RU2636345C2 |
| АНТИТЕЛО ПРОТИВ cMet И ЕГО ПРИМЕНЕНИЕ ДЛЯ ОПРЕДЕЛЕНИЯ И ДИАГНОСТИКИ РАКА | 2010 |
|
RU2582265C2 |
| НОВЫЕ МОДУЛЯТОРЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2627176C2 |
| НОВОЕ АНТИТЕЛО ДЛЯ ДИАГНОСТИКИ И (ИЛИ) ПРОГНОЗИРОВАНИЯ РАКА | 2011 |
|
RU2651513C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К CXCR4 ДЛЯ ЛЕЧЕНИЯ РАКА | 2011 |
|
RU2595394C2 |
| КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ РАКА, ЭКСПРЕССИРУЮЩЕГО IGF-1R | 2016 |
|
RU2728568C2 |
| НОВЫЕ МОДУЛЯТОРЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2592672C9 |
| АНТИТЕЛО ПРОТИВ IGF-1R И ЕГО ПРИМЕНЕНИЕ В КАЧЕСТВЕ АДРЕСУЮЩЕГО ПЕРЕНОСЧИКА ДЛЯ ЛЕЧЕНИЯ РАКА | 2015 |
|
RU2698977C2 |




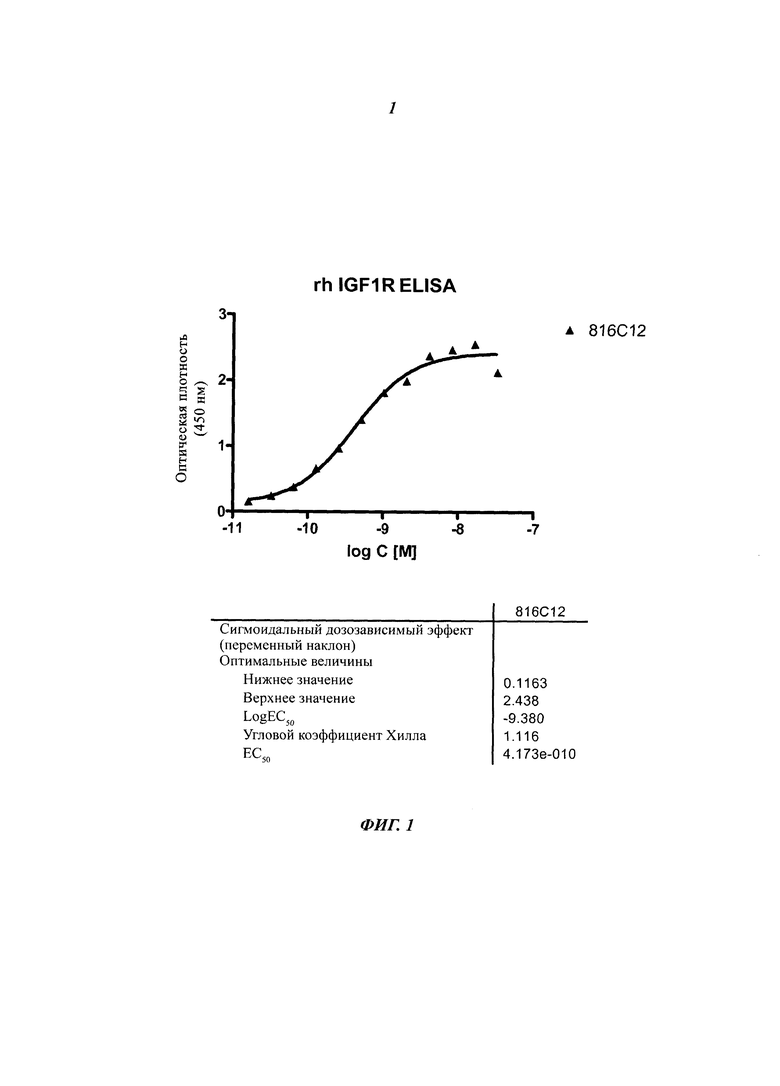

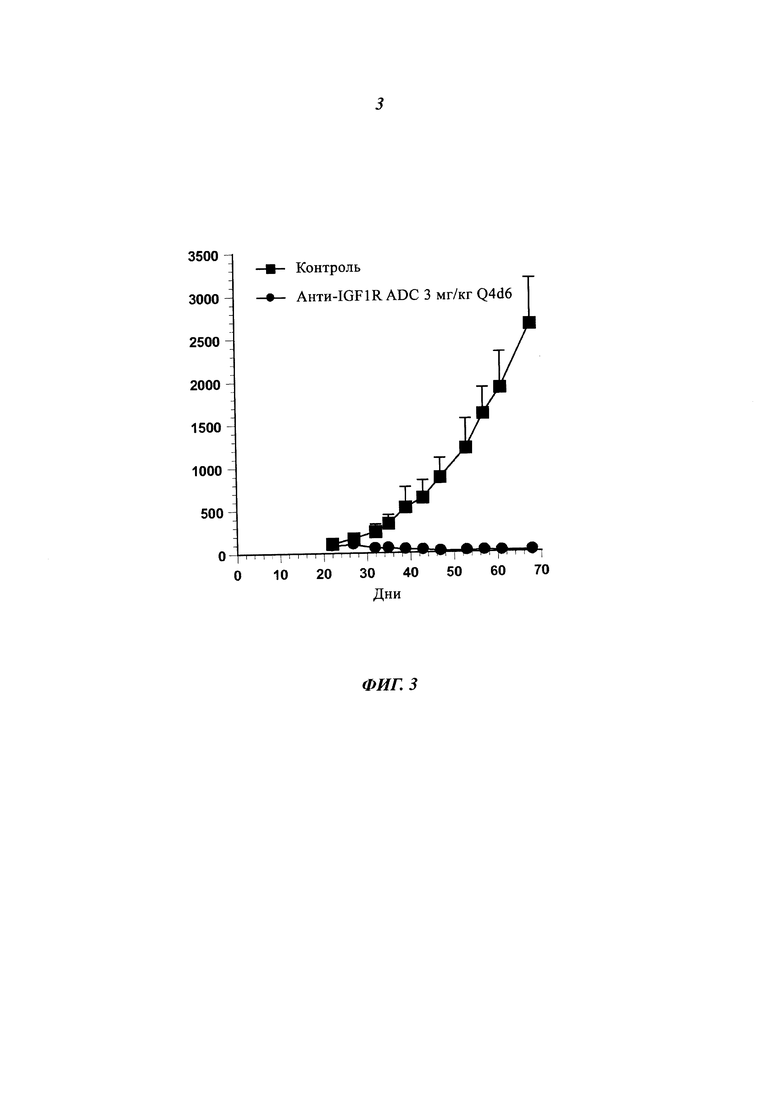

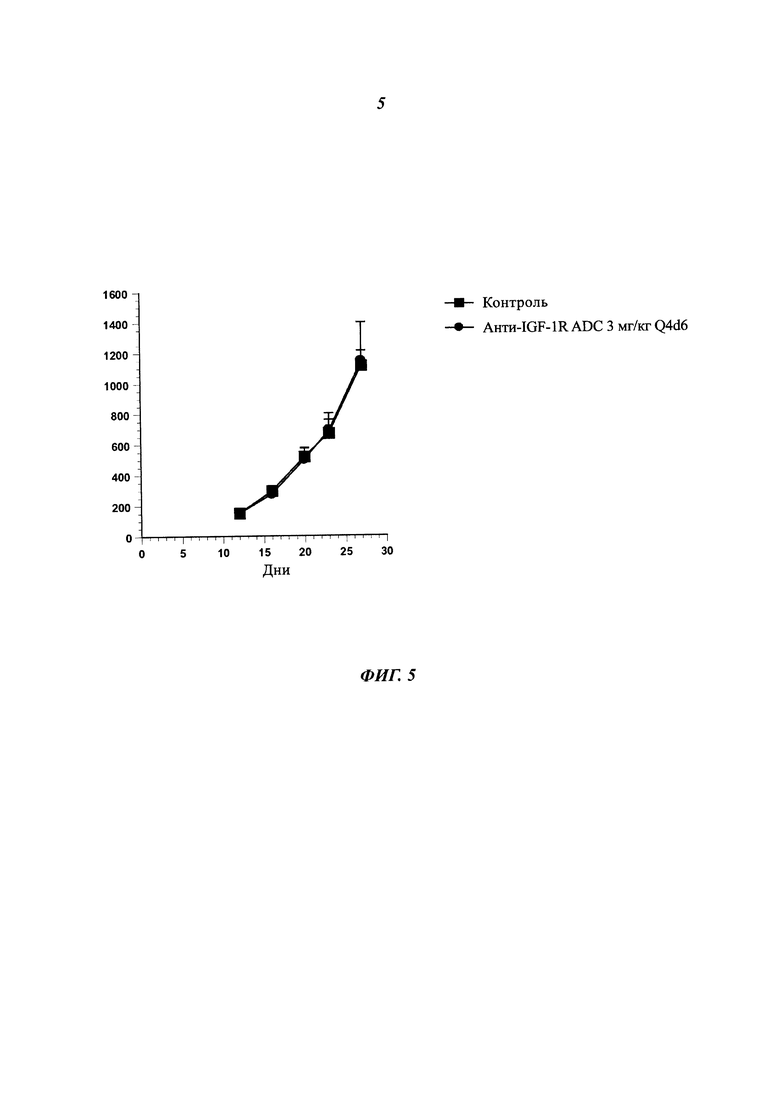
Настоящее изобретение относится к области иммунологии. Предложены антитела к рецептору инсулиноподобного фактора роста 1 (IGF-1R) и их антигенсвязывающие фрагменты. Также рассмотрен способ обнаружения наличия и/или локализации опухолевых клеток, способ определения процента опухолевых клеток, способ определения уровня экспрессии IGF-1R в опухолевых клетках, способ определения количественной оценки IGF-1R опухолевых клеток или опухоли. Кроме того, описан способ определения того, является ли онкогенное заболевание восприимчивым к лечению, способ определения эффективности схемы лечения, способ выбора пациента, а также набор для обнаружения опухолевых клеток и набор для определения того, будет ли для пациента с онкогенным расстройством положительно полезным лечение лекарственным средством. Данное изобретение может найти дальнейшее применение в терапии онкогенных заболеваний, в частности рака. 11 н. и 4 з.п. ф-лы, 9 ил., 6 табл., 3 пр.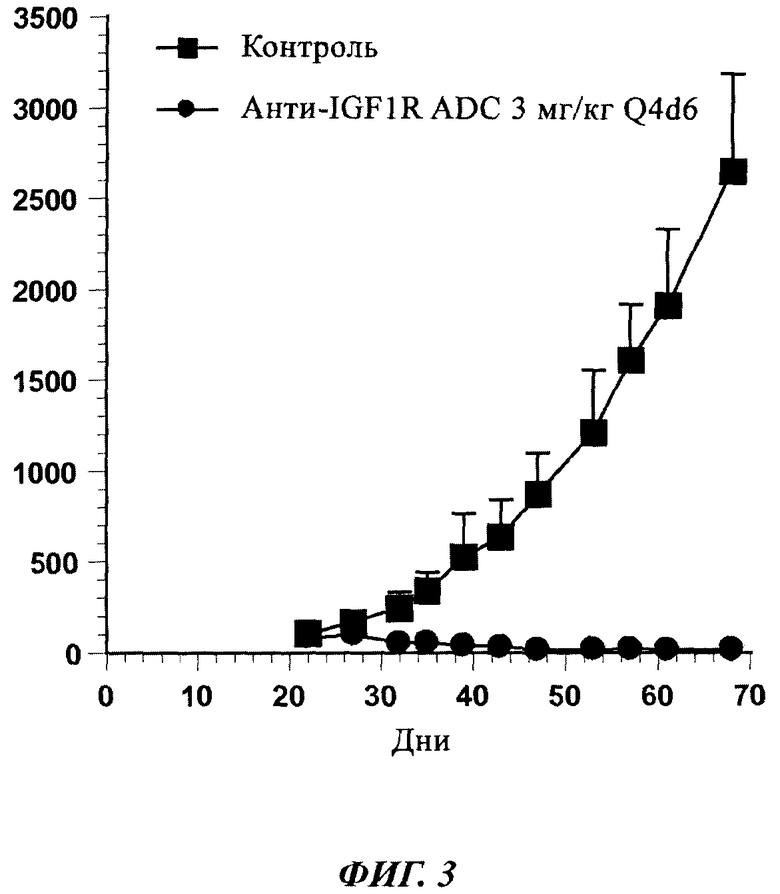
1. Антитело к рецептору инсулиноподобного фактора роста 1 (IGF-1R) или его антигенсвязывающий фрагмент, где антитело содержит: i) тяжелую цепь, содержащую CDR-H1 последовательности SEQ ID No. 1, CDR-H2 последовательности SEQ ID No. 2 и CDR-H3 последовательности SEQ ID No. 3; и ii) легкую цепь, содержащую CDR-L1 последовательности SEQ ID No. 4, CDR-L2 последовательности SEQ ID No. 5 и CDR-L3 последовательности SEQ ID No. 6, где CDR-H1, CDR-H2, CDR-H3, CDR-L1, CDR-L2 и CDR-L3 определены в соответствии с системой нумерации Международной информационной системы иммуногенетики (IMGT).
2. Антитело к IGF-1R по п. 1, где антитело содержит вариабельный домен тяжелой цепи последовательности SEQ ID No. 7 и/или вариабельный домен легкой цепи последовательности SEQ ID No. 8.
3. Антитело к IGF-1R или его антигенсвязывающий фрагмент, где антитело секретировано гибридомой, депонированной в CNCM, Институт Пастера, Париж, 17 сентября 2014 г. под номером I-4894.
4. Антитело к IGF-1R или его антигенсвязывающий фрагмент по любому из пп. 1-3 для применения в качестве агента для обнаружения опухолевых клеток, экспрессирующих IGF-1R, или для определения уровня экспрессии опухолевых клеток, экспрессирующих IGF-1R.
5. Антитело к IGF-1R или его антигенсвязывающий фрагмент по любому из пп. 1-3 для применения в in vitro или ex vivo диагностике или прогнозировании онкогенного расстройства, связанного с экспрессией IGF-1R.
6. Антитело к IGF-1R или его антигенсвязывающий фрагмент по любому из пп. 1-3 для применения в определении того, будет ли для пациента с онкогенным расстройством предположительно полезным лечение ингибитором, нацеленным на путь IGF-1R, предпочтительно антителом к IGF-1R как таковым, в составе комбинированной терапии или в виде конъюгата.
7. Способ обнаружения in vitro или ex vivo наличия и/или локализации опухолевых клеток, экспрессирующих IGF-1R, у субъекта, при этом указанный способ включает стадии:
(а) контактирования биологического образца от указанного субъекта с антителом к IGF-1R или его антигенсвязывающим фрагментом по любому из пп. 1-3;
и
(b) обнаружения связывания указанного антитела к IGF-1R или его антигенсвязывающего фрагмента с указанным биологическим образцом.
8. Способ определения in vitro или ex vivo процента опухолевых клеток, экспрессирующих IGF-1R, у субъекта, при этом указанный способ включает стадии:
(а) контактирования биологического образца от указанного субъекта с антителом к IGF-1R или его антигенсвязывающим фрагментом по любому из пп. 1-3;
и
(b) количественного измерения процента клеток, экспрессирующих IGF-1R, в биологическом образце.
9. Способ определения in vitro или ex vivo уровня экспрессии IGF-1R в опухолевых клетках у субъекта, при этом указанный способ включает стадии:
(а) контактирования биологического образца от указанного субъекта с антителом к IGF-1R или его антигенсвязывающим фрагментом по любому из пп. 1-3;
и
(b) количественного измерения уровня связывания указанного антитела к IGF-1R или его антигенсвязывающего фрагмента с IGF-1R в указанном биологическом образце.
10. Способ определения in vitro или ex vivo количественной оценки IGF-1R опухолевых клеток или опухоли у субъекта, при этом указанный способ включает стадии:
(а) контактирования биологического образца от указанного субъекта с антителом к IGF-1R или его антигенсвязывающим фрагментом по любому из пп. 1-3;
(b) количественного измерения с помощью сортировки клеток с активированной флуоресценцией (FACS) или иммуногистохимии (IHC) уровня связывания указанного антитела к IGF-1R или его антигенсвязывающего фрагмента с IGF-1R в указанном биологическом образце; и
(c) количественной оценки опухолевых клеток или опухоли путем сравнения количественного уровня, измеренного на стадии (b), с соответствующей шкалой, основанной на двух параметрах, которыми являются интенсивность окрашивания и процент положительных клеток.
11. Способ определения того, является ли онкогенное расстройство восприимчивым к лечению лекарственным средством, содержащим антитело, нацеленным на путь IGF-1R, при этом указанный способ включает стадии:
(а) определения in vitro или ex vivo статуса IGF-1R опухолевых клеток или опухоли субъекта в соответствии со способом по п. 10, и
(b) определения того, что, если статус IGF-1R опухолевых клеток или опухоли является IGF-1R(+), онкогенное расстройство будет восприимчивым к лечению лекарственным средством, содержащим антитело, нацеленным на путь IGF-1R.
12. Способ определения in vitro или ex vivo эффективности схемы лечения, предназначенной для облегчения онкогенного расстройства, связанного с IGF-1R, у субъекта, страдающего указанным расстройством, при этом способ включает стадии:
(a) определения первого уровня экспрессии IGF-1R по п. 9 в первом биологическом образце, при этом указанный первый биологический образец соответствует первому моменту времени указанного лечения;
(b) определения второго уровня экспрессии IGF-1R по п. 9 во втором биологическом образце, при этом указанный второй биологический образец соответствует второму, более позднему, моменту времени указанного лечения;
(c) вычисления соотношения первого уровня экспрессии, определенного на стадии (a), и второго уровня экспрессии, определенного на стадии (b); и
(d) определения того, что эффективность данной схемы лечения является высокой, если соотношение, вычисленное на стадии (c), больше 1; или определения того, что эффективность данной схемы лечения является низкой, если соотношение, вычисленное на стадии (c), меньше или равно 1.
13. Способ выбора пациента, больного раком, для которого определяют, будет ли полезным введение терапевтического количества лекарственного средства, содержащего антитело, нацеленного на путь IGF-1R, при этом способ включает стадии:
(а) определения уровня экспрессии IGF-1R в соответствии со способом по п. 9;
(b) сравнения уровня экспрессии, определенного на предыдущей стадии (а), с эталонным уровнем экспрессии; и
(c) выбора пациента, для которого лечение лекарственным средством, содержащим антитело, нацеленным на путь IGF-1R, предположительно будет полезным, если соотношение уровня экспрессии, определенного на стадии (a), и эталонного уровня экспрессии больше 1; или
(d) выбора пациента, для которого лечение лекарственным средством, содержащим антитело, нацеленным на путь IGF-1R, предположительно не будет полезным, если соотношение уровня экспрессии, определенного на стадии (a), и эталонного уровня экспрессии меньше или равно 1.
14. Набор для обнаружения опухолевых клеток, экспрессирующих IGF-1R, у пациента, где указанный набор содержит антитело к IGF-1R или его антигенсвязывающий фрагмент по любому из пп. 1-3 и инструкции для использования.
15. Набор для определения того, будет ли для пациента с онкогенным расстройством предположительно полезным лечение лекарственным средством, содержащим антитело, нацеленным на путь IGF-1R, где набор содержит антитело к IGF-1R или его антигенсвязывающий фрагмент по любому из пп. 1-3 и инструкции для использования.
| СПОСОБ ГЕНЕРИРОВАНИЯ АКТИВНЫХ АНТИТЕЛ К АНТИГЕНУ УСТОЙЧИВОСТИ, АНТИТЕЛА, ПОЛУЧЕННЫЕ ЭТИМ СПОСОБОМ, И ИХ ПРИМЕНЕНИЯ | 2007 |
|
RU2515904C2 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
Авторы
Даты
2019-11-21—Публикация
2016-04-27—Подача