Данное изобретение относится к области прогнозирования и/или диагностики, и/или контроля лечения пролиферативного заболевания у пациента. Более конкретно, данное изобретение относится к антителу, способному специфически связываться с CXCR4 (от англ. chemokine receptor 4-хемокиновый рецептор 4), а также применению указанного антитела и соответствующим способам выявления и диагностики патологических гиперпролиферативных онкогенных расстройств, связанных с экспрессией CXCR4. В некоторых воплощениях изобретения расстройствами являются онкогенные расстройства, связанные с повышенной экспрессией CXCR4 по отношению к норме, или любые другие патологии, связанные с избыточной экспрессией CXCR4. В заключение изобретение включает продукты и/или композиции или наборы, включающие по крайней мере такое антитело для прогноза и/или диагностики и/или контроля лечения некоторых видов рака.
Хемокины являются маленькими, секретируемыми пептидами, контролирующими миграцию лейкоцитов вдоль химического градиента лиганда, известного как хемокиновый градиент, особенно в иммунных реакциях (ZIotnick A. et al., 2000). Они делятся на два основных подсемейства, СС (β-хемокины) и СХС (α-хемокины), в зависимости от положения их NH2-концевых остатков цистеина, и связываются с G-белками рецепторов, чьи два крупных подсемейства обозначаются как CCR и CXCR. До настоящего времени у человека было обнаружено более 50 хемокинов и 18 рецепторов хемокинов.
Многие виды рака имеют сложную сеть хемокинов, влияющую на инфильтрацию опухоли иммунными клетками, а также рост опухолевых клеток, выживание, миграцию и ангиогенез. Иммунные клетки, эндотелиальные клетки и сами опухолевые клетки экспрессируют рецепторы хемокинов и могут отвечать на градиент хемокинов. Исследования образцов биопсии рака человека и моделей рака мыши показывают, что экспрессия рецепторов хемокинов раковыми клетками связана с увеличением их метастатической способности. Злокачественные клетки из разных типов рака имеют различные профили экспрессии хемокиновых рецепторов, но CXCR4 является наиболее часто встречающимся. Клетки из по крайней мере 23 различных типов рака человека эпителиального, мезенхимального и гемопоэтического происхождения экспрессируют CXCR4 рецептор (Balkwill F. et al., 2004).
Хемокиновый рецептор 4 (также известный как fusin, CD184, LESTR или HUMSTR) существует в виде двух изоформ, содержащих 352 или 360 аминокислот. Изоформа а имеет аминокислотную последовательность, представленную в базе данных Genbank под номером NP_001008540, в то время как изоформа b имеет аминокислотную последовательность, представленную в базе данных Genbank под номером NP_003458. Остаток Asn11 гликозилирован, остаток Туг21 модифицирован добавлением сульфатной группы, a Cys 109 и 186 связаны дисульфидным мостиком во внеклеточной части рецептора (Juarez J. et al., 2004).
Этот рецептор экспрессируется различного рода нормальными тканями, необученными Т-клетками без памяти, регуляторными Т-клетками, В-клетками, нейтрофилами, эндотелиальными клетками, первичными моноцитами, дендритными клетками, естественными киллерами, CD34+гемопоэтическими стволовыми клетками и на низком уровне в сердце, толстой кишке, печени, почках и мозге. CXCR4 играет ключевую роль в движении лейкоцитов, лимфопоэзе В-клеток и миелопоэзе.
Рецептор CXCR4 сверхэкспрессируется в большом количестве разновидностей рака, включая лимфому, лейкемию, множественную миелому, рак толстой кишки (Ottaiano А. и др., 2004), рак молочной железы (Като М. и соавт., 2003), рак предстательной железы (Sun Y.X. et al., 2003), рак легких [мелкокпеточная и немелкоклеточная карцинома (Phillips R.J. et al., 2003)], рак яичников (Scotton C.J. et al., 2002), рак поджелудочной железы (Koshiba Т. et al., 2000), рак почки, рак головного мозга (Barbero S. et al., 2002), глиобластому, но не ограничиваясь ими.
Уникальным лигандом рецептора CXCR4, описанным до настоящего времени, является SDF-1 (от англ. stromal cell-derived factor 1 - полученный из стромальных клеток фактор 1) или CXCL12 (от англ. chemokine (C-X-C motif) ligand 12 - хемокиновый (C-X-C мотив) лиганд 12). SDF-1 в большом количестве секретируется в лимфатических узлах, костном мозге, печени, легких и в меньшей степени почками, головным мозгом и кожей. CXCR4 также узнается хемокином-антагонистом, vMIP-ll (от англ. viral macrophage inflammatory protein II-вирусный макрофагальный воспалительный белок II), кодируемым человеческим вирусом герпеса III типа.
Комплекс CXCR4/SDF-1 играет ключевую роль в развитии рака и вовлечен непосредственно в миграцию и инвазию, приводящую к образованию метастаз. Действительно, раковые клетки экспрессируют рецептор CXCR4, они мигрируют и проникают в кровеносную систему. Затем раковые клетки задерживаются в сосудистых ложах в органах, производящих высокие уровни SDF-1 в местах пролиферации, индуцируют ангиогенез и образуют метастатические опухоли (Murphy P.M., 2001). Данный комплекс также участвует в пролиферации клеток через активацию пути экстраклеточной сигнал-регулируемой киназы (ЭРК) (Barbero S. et al., 2003) и ангиогенез (Romagnani P., 2004). Действительно, CXCR4 рецептор и его лиганд SDF-1 четко способствуют ангиогенезу, стимулируя экспрессию ФРЭС-А (фактор роста эндотелия сосудов А), которая в свою очередь увеличивает экспрессию CXCR4/SDF-1 (Bachelder R.E. et al., 2002). Также известно, что с ОАМ (опухоль-ассоциированные макрофаги), аккумулированные в гипоксических областях опухолей и стимулированные к взаимодействию с опухолевыми клетками и способствуют ангиогенезу. Было отмечено, что гипоксия активирует селективную экспрессию CXCR4 в различных типах клеток, включая ОАМ (Mantovani A et al., 2004). Недавно было показано, что комплекс CXCR4/SDF-1 регулирует движение/хоминг CXCR4+HSC/клеток-предшественников (от англ. hematopoietic stem cells - гемопоэтические стволовые клетки) и может играть роль в неоваскуляризации. Практика показывает, что кроме HSC, функциональный CXCR4 также экспрессируется стволовыми клетками из других тканей (TCSCs (от англ. tissue-committed stem cells - тканеспецифичные стволовые клетки)), поэтому SDF-1 могут играть ключевую роль в хемоаттрактации CXCR4+TCSCs клетками, необходимыми для регенерации органов/тканей, но данные TCSC также могут служить клеточным источником развития рака (теория РСК (раковых стволовых клеток)). Происхождение рака из стволовых клеток было продемонстрировано для лейкемии человека и недавно для нескольких солидных опухолей, таких как рак мозга и рак груди. Есть несколько примеров CXCR4+опухолей, возможно произошедших от нормальных CXCR4+ткане-Уорганоспецифических стволовых клеток, например, лейкозы, опухоли головного мозга, мелкокпеточный рак легких, рак молочной железы, гепатобластома, рак яичников и рак шейки матки (Kucia М. et al., 2005).
Ориентация метастазы рака, препятствующая CXCR4 рецептору, была продемонстрирована in vivo с использованием моноклональных антител, направленных против CXCR4 рецептора (Muller A. et al., 2001). Вкратце, было показано, что моноклональные антитела, направленные против рецептора CXCR4 (Mab 173 R&D Systems) значительно уменьшают количество метастазов в лимфатических узлах в ортотопической модели рака молочной железы (MDA-МВ231) у SCID (от англ. severe combined immunodeficiency-тяжелый комбинированный иммунодефицит) мышей. Другое исследование (Phillips R.J. et al., 2003) также показало решающую роль комплекса CXCR4/SDF-1 в образовании метастазов в ортотопической модели карциномы легких (А549) с использованием поликлональных антител против SDF-1, но в этом исследовании не было никакого эффекта ни на рост опухоли, ни на ангиогенез. В нескольких других исследованиях также описано ингибирование либо метастазов in vivo с помощью миРНК дуплексов из CXCR4 (Liang Z. et al., 2005) биоустойчивого антагониста CXCR4 пептида (Tamamura H. et al., 2003), либо роста опухоли in vivo с использованием малой молекулы антагониста CXCR4, например AMD 3100 (Rubin J.B. et al., 2003; De Faico V. et al., 2007) или Mab (патент WO 2004/059285 A2). Таким образом, CXCR4 является проверенной терапевтической мишенью для раковых заболеваний.
CXCR2 (от англ. chemokine receptor 2 - хемокиновый рецептор 2), другой хемокиновый рецептор, также описывается как интересная мишень в онкологии. Действительно, CXCR2 передает аутокринный сигнал клеточного роста в нескольких типах опухолевых клеток, а также косвенно может повлиять на рост опухоли путем стимуляции ангиогенеза (Tanaka Т. et al., 2005).
CXCR2 хемокиновый рецептор включает 360 аминокислот.Он экспрессируется в основном в эндотелиальных клетках и особенно во время неоваскуляризации. Несколько хемокинов связывают рецептор CXCR2: CXCL5, -6, -7, IL-8, GRO-α, -β и γ, которые принадлежат к ERL+проангиогенным хемокинам. Последовательность рецептора CXCR2 гомологична последовательности рецептора CXCR4: 37% последовательности идентичны и 48% последовательности гомологичны. Комплекс СХСР2/лиганды участвует в нескольких механизмах роста опухоли, таких как метастазирование (Singh P.K. et al., 1994), клеточная пролиферация (Owen J.D. et al., 1997) и ERL+хемокин-опосредованный ангиогенез (Stricter R.M. et al., 2004). Наконец, ОАМ и нейтрофилы являются ключевыми элементами индуцированного воспалением роста опухоли, а хемокины, такие как CXCL5, IL-8 и GRO-a, инициируют привлечение нейтрофилов.
Димеризация возникла как единый механизм для регуляции функции спаренных G-белком рецепторов, среди которых хемокиновые рецепторы (Wang J. and Norcross M., 2008). Показали, что гомо- и гетеродимеризация в ответ на связывание хемокина необходима для инициирования и изменения сигналинга с помощью ряда хемокиновых рецепторов. Все больше фактов поддерживает концепцию, что димеры рецепторов или олигомеры, вероятно, являются основной функциональной единицей хемокиновых рецепторов. Димеры хемокиновых рецепторов были найдены в отсутствие лигандов и хемокинов, вызывающих конфирмационные изменения рецепторных димеров. CXCR4, как известно, образует не только гомодимеры, но и гетеродимеры, в случае ДОР (дельта-опиоидный рецептор) (Hereld D., 2008) или CCR2 (Percherancier Y. et al., 2005). В последнем случае пептиды, полученные из трансмембранного домена CXCR4 ингибируют активацию путем блокирования лиганд-индуцируемых конформационных переходов димера (Percherancier Y. et al., 2005). Другое исследование показало, что CXCR4-TM4 пептид, синтетический пептид из трансмембранного региона CXCR4, уменьшает передачу энергии между протомерами CXCR4 в гомодимерах и ингибирует SDF-1-индуцированную миграцию и полимеризацию актина в злокачественных клетках (Wang J. et al., 2006). Совсем недавно было также описано, что CXCR7 образует функциональные гетеродимеры с CXCR4, что повышает SDF-1-индуцированный сигналинг (Sierra F. et al., 2007). Другие примеры основных гетеродимеров включают исследования, показывающие взаимодействовие CXCR1 и CXCR2, а также формирование соответствующих гомодимеров. Ни для одного из них не было отмечено взаимодействия с другим GPCR (альфа (1А)-адренорецептор), что указывает на специфику CXCR1 и CXCR2 взаимодействия (Wilson S. et al., 2005).
Как упоминалось ранее, CXCR4 и CXCR2 рецепторы являются интересными опухолевыми мишенями. Взаимодействие с данными рецепторами должно ингибировать рост опухоли и метастазов очень эффективным способом, путем уменьшения пролиферации опухолевых клеток, ангиогенеза, миграции опухолевых клеток и инвазии, привлечения нейтрофилов и макрофагов к опухолям и путем ингибирования CXCR4 PCK.
Два моноклональные антитела, упомянутые как 515Н7 и 414Н5, связывающиеся и индуцирующие конформационные изменения как в гомодимерах CXCR4, так и в гетеродимерах CXCR4/CXCR2, и обладающие сильной противоопухолевой активностью, были охарактеризованы ранее (см. WO 2010/037831). Кроме того, заявитель продемонстрировал существование гетеродимера CXCR4/CXCR2.
Данное изобретение направлено на обеспечение по меньшей мере одного реагента, лишенного какой-либо in vivo активности в моделях рака, который может быть использован в качестве диагностического или прогностического инструмента для онкогенных расстройств, в особенности характеризующихся экспрессией CXCR4 или опосредованных аберрантной экспрессией CXCR4.
Опубликованная патентная заявка WO 2010/125162 раскрывает два анти-CXCR4 моноклональных антитела, упомянутых как 515Н7 и 301 аЕ5, и их применение в области лечения ВИЧ.
Авторы данного изобретения неожиданно продемонстрировали, что указанное антитело 301 аЕ5 (также называемое в настоящем описании как 301 Е5 или более предпочтительно, со ссылкой на депонированную гибридому, I-3859: для целей данной заявки, эти термины схожи) не имеет никакой in vivo активности в области лечения рака, в отличие от другого антитела 515Н7, демонстрирующего сильные противоопухолевые свойства (как описано в WO 2010/ 037831). В частности, I-3859 не предотвращает связывание CXCR4 лиганда с рецептором.
Кроме того, заявители обнаружили, что антитела I-3859 способны к:
1) узнаванию CXCR4 в виде мономеров;
2) узнаванию CXCR4 в виде CXCR4/CXCR4 гомодимера;
3) узнаванию CXCR4 в виде CXCR4/CXCR2 гетеродимера;
4) иммунопреципитации CXCR4 из клеточного лизата;
5) узнаванию CXCR4 на поверхности CXCR4-экспрессирующих клеток посредством FACS (от англ. fluorescence-activated cell sorting - сортировка клеток с активированной флуоресценцией); и
6) узнаванию CXCR4 методом иммуногистохимии.
Из-за этих новых свойств, прежде неизвестных для антитела I-3859, авторы изобретения обнаружили, что указанное антитело может быть применено для идентификации CXCR4-экспрессирующих клеток и, в частности, экспрессирующих CXCR4 опухолевых клеток.
Таким образом, данное изобретение состоит в применении указанного антитела для обнаружения присутствия и/или местоположения CXCR4-зкспрессирующего заболевания. Изобретение может быть использовано в диагностике и/или прогнозировани, предпочтительно in vitro, CXCR4-экспрессирующих заболеваний. Предпочтительно указанным CXCR4-экспрессирующим заболеванием является рак.
Другим предпочтительным свойством антитела I-3859 в данном изобретении является распознавание эпитопа, близкого к эпитопу терапевтического моноклонального антитела 515Н7. Более конкретно, как было показано в экспериментальных примерах, I-3859 способно конкурировать с терапевтическим антителом 515Н7 за связывание с его эпитопом. Таким образом, указанное антитело I-3859 может использоваться, например, для выбора пациентов для лечения с помощью 515Н7 Mab. В частности, антитело I-3859 может быть использовано, для того чтобы проверить, что конформация CXCR4, присутствующего на поверхности клеток пациента, аналогична конформации, распознаваемой антителом 515Н7, показывая, что указанный пациент поддается терапии на основе антител 515Н7.
Первый аспект изобретения представляет собой выделенное антитело или его антигенсвязывающий фрагмент или его производное, специфически связывающееся с CXCR4 с высоким сродством и лишенное какой-либо активности in vivo. Указанное выделенное антитело или его антигенсвязывающий фрагмент или его производное, может быть применено в методах диагностики или прогнозирования патологических гиперпролиферативных онкогенных нарушений, опосредованных экспрессией CXCR4. В частности, указанные выделенные антитела могут быть использованы для in vivo визуализации. Предпочтительно, выделенное антитело в данном изобретении связывается с человеческим CXCR4.
В предпочтительном варианте изобретения, выделенное антитело или его антигенсвязывающий фрагмент или его производное предоставляется для применения в обнаружении присутствия CXCR4-экспрессирующих опухолей, где указанное антитело содержит по меньшей мере одну дополнительную CDR (complementary determining region - определяющая комплементарность антитела антигену область), выбранную из CDRs, включающих аминокислотную последовательность SEQ ID Nos: от 1 до 6 или по меньшей мере одну CDR, чья последовательность по крайней мере на 80%, предпочтительно 85%, 90%, 95% и 98% идентична после оптимального выравнивания последовательностям от 1 до 6.
Более предпочтительно, изобретение включает антитела, их антигенсвязывающие фрагменты или их производные, в соответствии с данным изобретением, полученные путем генетической рекомбинации или химического синтеза.
В соответствии с предпочтительным вариантом данного изобретения антитело, или его производное, или его антигенсвязывающий фрагмент, характеризуется тем, что состоит из моноклонального антитела.
Термин "моноклональное антитело", употребляемый в данном описании, означает антитело, полученное из почти гомогенной популяции антител. Более конкретно, отдельные антитела из популяции идентичны за исключением редких произошедших естественным путем мутаций, присутствующих в минимальных пропорциях. Другими словами, моноклональное антитело состоит из гомогенного антитела, полученного путем роста одного клеточного клона (например, гибридомы, эукариотическая клетка-хозяин, трансфецированная молекулой ДНК, кодирующей гомогенное антитело, прокариотическая клетка-хозяин, трансфецированная молекулой ДНК, кодирующей гомогенное антитело, и т.д.) и, как правило, характеризуется тяжелыми цепями одного и только одного класса и подкласса и легкими цепями только одного типа. Моноклональные антитела являются высокоспецифичными и направлены против одного антигена. Кроме того, в отличие от препаратов поликлональных антител, обычно включающих разные антитела, направленные против различных детерминант, или эпитопов, каждое моноклональное антитело направлено против одного эпитопа конкретного антигена.
Типичные антитела IgG состоит из двух идентичных тяжелых цепей и двух идентичных легких цепей, соединенных дисульфидными связями. Каждая тяжелая и легкая цепь содержит константную область и вариабельную область Каждая вариабельная область содержит три сегмента, называемых определяющими комплементарность областями ("CDRs") или "гипервариабельными участками", ответственные в первую очередь за связывание с эпитопом антигена. Они обычно называются CDR1, CDR2 и CDR3 и нумеруются последовательно с N-конца. Более высоко консервативные части вариабельных областей называются "каркасные области".
Существуют три CDRs тяжелых цепей и 3 CDRs легких цепей. Термин CDR или CDRs, используется в данном описании для того, чтобы указать, в зависимости от случая, одна из этих областей или несколько, или даже все из этих областей, содержащих большинство аминокислотных остатков, ответственны за связывание с помощью аффинности антитела к распознаваемому антигену или эпитопу.
В соответствии с изобретением, CDRs антитела будут определены в соответствии с системой нумерации IMGT. Для специалиста в данной области будет очевидно вывести CDRs, в соответствии с Kabat из CDRs, в соответствии с IMGT. CDRs, в соответствии с Kabat должны рассматриваться как часть изобретения.
Уникальная нумерация IMGT была определена для сравнения вариабельных доменов вне зависимости от рецептора антигена, типа цепи или вида [Lefranc M.-P., Immunology Today 18, 509 (1997) / Lefranc M.-P., The Immunologist, 7, 132-136 (1999) / Lefranc, M.-P., Pommie, С., Ruiz, M., Giudicelli,. V., Foulquier, E., Truong, L, Thouvenin-Contet, V. and Lefranc, Dev. Сотр. Immunol., 27, 55-77 (2003)]. В уникальной нумерации IMGT, консервативные аминокислоты всегда имеют ту же самую позицию, например цистеин 23 (первый - CYS), триптофан 41 (сохраненный - TRP), гидрофобная аминокислота 89, цистеин 104 (2-й CYS), фенилаланин или триптофан 118 (J-PHE или J-TRP). Уникальная нумерация IMGT обеспечивает стандартизированное разграничение каркасных областей (FR1 - IMGT: позиции с 1 до 26, FR2 - IMGT: с 39 до 55, FR3 - IMGT: с 66 до 104 и FR4 - IMGT: с 118 до 128) и гипервариабельных участков: CDR1 - IMGT: с 27 до 38, CDR2 - IMGT: с 56 до 65 и CDR3 - IMGT: с 105 до 117. Поскольку разрывы представляют собой оставшиеся позиции, длины CDR-IMGT (показаны в скобках и разделяются точками, например, [8.8.13]) становится важной информацией. Уникальная нумерация IMGT применяется в графических 2D представлениях, обозначенных как IMGT Colliers de Perles [Ruiz, M. and Lefranc, M.-P., Immunogenetics, 53, 857-883 (2002) / Kaas, Q. and Lefranc, M.-P.,' Current Bioinformatics, 2, 21-30 (2007)], и в 3D структурах в IMGT/3Dstructure-DB [Kaas, Q., Ruiz, M. and Lefranc, M.-P., T cell receptor and MHC structural data. Nucl. Acids. Res., 32, D208-D210 (2004)].
В частности, согласно первому аспекту изобретение включает антитело, или антигенсвязывающий фрагмент, или его производное, способные специфически связываться с CXCR4, включающим: I) тяжелую цепь, содержащую, по меньшей мере, одну из следующих CDR-H1, CDR-H2 и CDR-H3, как определено в соответствии с системой нумерации IMGT, где CDR-H1 содержит последовательность SEQ ID No.1, CDR-H2 содержит последовательность SEQ ID No.2 и CDR-H3 содержит последовательность SEQ ID No.3; и/или II) легкую цепь, содержащую, по меньшей мере, одну из следующих CDR-L1, CDR-L2 и CDR-L3, как определено в соответствии с системой нумерации IMGT, где CDR-L1 содержит последовательность SEQ ID No.4, CDR-L2 содержит последовательность SEQ ID No.5 и CDR-L3 содержит последовательность SEQ ID No.6.
В еще одном варианте данное изобретение также может являться антителом или антигенсвязывающим фрагментом, или его производным, содержащим:
- тяжелую цепь, содержащую следующие три CDRs, как определено в соответствии с IMGT, соответственно CDR-H1, имеющую последовательность SEQ ID No.1, CDR-H2, имеющую последовательность SEQ ID No.2 и CDR-H3, имеющую последовательность SEQ ID No.3, или последовательность, имеющую по меньшей мере 80%, предпочтительно 85%, 90%, 95% и 98% идентичность после оптимального выравнивания последовательностей с SEQ ID No.1, 2 или 3 соответственно; и
- легкую цепь, содержащую следующие три CDRs, как определено в соответствии с IMGT, соответственно CDR-L1, имеющую последовательность SEQ ID No.4, CDR-L2, имеющую последовательность SEQ ID No.5 и CDR-L3, имеющую последовательность SEQ ID No.6, или последовательность, имеющую по меньшей мере 80%, предпочтительно 85%, 90%, 95% и 98% идентичность после оптимального выравнивания последовательностей с SEQ ID No.4, 5 или 6, соответственно.
В контексте настоящего изобретения "процент идентичности" между двумя последовательностями нуклеиновых кислот или аминокислот означает процент одинаковых нуклеотидов или аминокислотных остатков между двумя сравниваемыми последовательностями, полученными после оптимального выравнивания. Данный процент является чисто статистическим и различия между двумя последовательностями распределены случайным образом по их длине. Сравнение последовательностей двух нуклеиновых кислот или аминокислот традиционно проводится путем сравнения последовательностей после их оптимального выравнивания, указанное сравнение возможно проводить по сегментам или с помощью "окна выравнивания". Оптимальное выравнивание сравнениваемых последовательностей может быть осуществлено, в дополнение к сравнению вручную, с помощью алгоритма локальной гомологии Смита- Ватермана (1981) [Ad. App. Math. 2:482], с помощью алгоритма локальной гомологии Нидлмана-Вунша (1970) [J. Mol. Bioi. 48:443], с помощью алгоритма локальной гомологии Пирсона-Липмана (1988) [Proc. Natl. Acad. Sci. USA 85:2444] или с помощью компьютерного программного обеспечения использующего перечисленные алгоритмы (GAP, BESTFIT, FASTA и TFASTA в программном комплексе Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, WI, или с помощью программного обеспечения BLAST NR или BLAST P).
Процент идентичности между двумя последовательностями нуклеиновых кислот или аминокислот определяется путем сравнения двух оптимально выровненных последовательностей, в ходе которого сравниваемые последовательности нуклеиновых кислот или аминокислот, способные содержать вставки или делеции, сравниваются с контрольной последовательностью для их оптимального выравнивания. Процент идентичности рассчитывают путем определения числа положений, в которых аминокислота или нуклеотидный остаток идентичен в обеих последовательностях, деления количества идентичных положений на общее число положений в окне выравнивания и умножения результата на 100 для получения процента идентичности между двумя последовательностями.
Например, программа BLAST, "BLAST 2 последовательности " (Tatusova et al., "Blast 2 sequences - a new tool for comparing protein and nucleotide sequences", FEMS Microbial., 1999, Lett. 174:247-250) доступная на сайте http://www.ncbi.nhn.nih.gov/gorf/bl2.html, может быть использована с параметрами по умолчанию (в частности, для параметров "open gap penalty": 5, и "extension gap penalty": 2; выбранной матрицей является, например, "BLOSUM 62" матрица, предлагаемая программой); процент идентичности между двумя сравниваемыми последовательностями вычисляется непосредственно программой.
Для аминокислотной последовательности, проявляющей по меньшей мере 80%, предпочтительно 85%, 90%, 95% и 98% идентичности с эталонной аминокислотной последовательностью, предпочтительные примеры включают те, которые содержат эталонную последовательность, некоторые модификации, в особенности делеция, вставка или замена по крайней мере одной аминокислоты, укорочение или удлинение. В случае замены одной или более последовательных или непоследовательно идущих аминокислот, предпочтение отдается таким заменам, в которых замещенные аминокислоты заменены на "эквивалентные" аминокислоты. В данном описании выражение "эквивалентная аминокислота" используется для обозначения любой аминокислоты, замена которой на одну из структурных аминокислот, не приведет к изменению биологической активности соответствующих антител и в тех конкретных примерах, приведенных ниже.
Эквивалентные аминокислоты могут быть определены или по их структурной гомологии с аминокислотами, которые они замещают или по результатам сравнительных испытаний биологической активности между различными антителами, которые могут быть получены.
В качестве неисчерпывающего примера ниже в таблице 1 приведены возможные замены, которые вероятно не будут приводить к значительному изменению биологической активности соответствующего модифицированного антитела; обратные замены, естественно, возможны при тех же условиях.
Согласно еще одному варианту изобретение представляет собой антитело I-3859, или один из его антигенсвязывающих фрагментов или производных, указанное антитело, содержащее последовательность вариабельного домена тяжелой цепи, содержащего аминокислотную последовательность SEQ ID No.7 или последовательность с, по крайней мере, 80%, предпочтительно 85%, 90%, 95% и 98% идентичности после оптимального выравнивания с последовательностью SEQ ID No.7; и/или содержащее последовательность вариабельного домена легкой цепи, содержащего аминокислотную последовательность SEQ ID No.8, или последовательность с, по крайней мере, 80%, предпочтительно 85%, 90%, 95% и 98% идентичности после оптимального выравнивания с последовательностью SEQ ID No.8.
В частности, указанное антигенсвязывающее производное состоит из связывающего белка, содержащего каркасный пептид, на который привита по крайней мере одна CDR, причем указанная CDR привита таким образом, чтобы сохранить все или часть свойств распознавания паратопа исходного антитела. В предпочтительном варианте осуществления указанный антигенсвязывающий белок представляет собой слитый белок, состоящий из каркасного пептида и по меньшей мере одной указанной CDR.
Одна или несколько последовательностей среди шести CDR последовательностей, описанных в данном изобретении, также могут присутствовать на различных иммуноглобулиновых каркасных белках. В этом случае последовательность белка делает возможным воссоздание пептидного скелета, подходящего для правильной укладки привитых CDRs, позволяя им сохранить свои свойства распознавания паратопа антигена.
Специалист в данной области будет осведомлен о способах выбора типа каркасного белка для прививки CDR. В частности, известно, что выбранные каркасные белки должны соответствовать как можно большему количеству критериев (Skerra A., J. Mol. Recogn., 2000, 13:167-187):
- достаточная филогенетическая консервативность;
- известная трехмерная структура (определенная, например, путем кристаллографии, ЯМР (ядерный магнитный резонанс) спектроскопии или любым другим способом, известным специалисту в данной области);
- небольшой размер;
- пост-транскрипционных модификаций мало или совсем нет; и/или
- легко производить,экспрессировать и очищать.
Источником этих белковых каркасов могут быть структуры, отобранные среди фибронектина и предпочтительно 10 домен фибронектина III типа, липокалин, антикалин (Skerra A., J. Biotechnol., 2001, 74(4):257-75), белок Z, полученный из домена В белка А золотистого стафилококка, тиоредоксин А или белки с повторяющимися мотивами наподобие "анкириновых повторов" (Kohl et al., PNAS, 2003, vol.100, No.4, 1700-1705), "армадилловых повторов", "лейцин-богатых повторов" и "тетратрикопептидных повторов", но ими выбор не ограничивается. Все подобные белковые мотивы были широко охарактеризованы в данной области, и, таким образом, хорошо известны специалистам в данной области.
Как описано выше, такие пептидные каркасы составляют от 1 до 6 CDRs, полученных из исходного антитела. Предпочтительно, но не является обязательным требованием, чтобы специалист в данной области техники выбирал хотя бы одну CDR из тяжелой цепи, поскольку последняя, как известно, в первую очередь отвечает за специфичность антитела. Выбор одного или нескольких соответствующих CDRs, очевиден специалисту в данной области, который будет затем выбирать подходящий известный способ (Beset al., FEBS letters 508, 2001, 67-74).
По антигенсвязывающим фрагментам антитела в соответствии с изобретением, должны быть пониматься, например, фрагменты Fv, scFv (sc=single chain - одноцепочечный), Fab, F(ab')2, Fab', scFv-Fc или диатела или любой фрагмент, чей период полураспада был увеличен путем химической модификации, такой как добавление полиалкиленгликоля, такого как полиэтиленгликоль (ПЭГилирование) (ПЭГилированные фрагменты называют Fv-ПЭГ, scFv-ПЭГ, Fab-ПЭГ, F(ab’)2-ПЭГ и Fab'-ПЭГ), либо включение в липосому, микросферы или PLGA, указанные фрагменты, обладающие по крайней мере одним из характерных CDRs по изобретению, которые в особенности способны проявлять основную активность, даже частичную, антитела, из которого они получены.
Предпочтительно, указанный антигенсвязывающие фрагменты будут содержать или включать в себя часть последовательности вариабельной области тяжелой или легкой цепи антитела, из которого они получены, упомянутая часть последовательности достаточна, чтобы сохранить ту же специфичность связывания, что и антитело, из которого она получена и достаточную аффинность, предпочтительно, по меньшей мере, равную 1/100, более предпочтительно, по крайней мере, 1/10 от таковой у антитела, из которого она получена.
Такой антигенсвязывающий фрагмент будет содержать, по крайней мере, пять аминокислот, предпочтительно 6, 7, 8, 10, 15, 25, 50 или 100 идущих друг за другом аминокислот из последовательности антитела, из которого он получен.
Предпочтительно, чтобы эти антигенсвязывающие фрагменты представляли собой Fv, scFv, Fab, F(ab')2, Fab', scFv-Fc или диатела, обычно обладающие такой же специфичностью связывания, что и антитело, из которого они получены. В соответствии с данным изобретением, антигенсвязывающие фрагменты антитела могут быть получены из антител, описанных выше такими методами, как ферментативное расщепление, в том числе пепсином или папаином, и/или путем расщепления дисульфидных мостиков посредством химического восстановления. Фрагменты антител могут быть также получены с помощью методов рекомбинантной генетики, также известных специалисту в данной области, или с помощью пептидного синтеза с помощью, например, автоматических синтезаторов пептидов, наподобие тех, которые продаются фирмой Applied Biosystems, и т.д.
Мышиная гибридома, способная секретировать моноклональное антитело согласно изобретению, депонирована в CNCM, Институт Пастера, Париж, Франция, 22 октября 2007 года под номером I-3859. Указанная гибридома получена путем слияния Balb/C иммунизированных спленоцитов мышей и клеток миеломы Sp 2/O-линии Ag 14.
Моноклональное антитело, называемое в данном описании 301аЕ5 или I-3859, или его антигенсвязывающий фрагмент или производное, арактеризуется тем, что выделяется указанной гибридомой.
Антитело I-3859 также может быть описано через его нуклеотидные последовательности, т.е. как содержащий тяжелую цепь, содержащую CDR-H1, кодируемый последовательностью SEQ ID No.9, CDR-H2, кодируемый последовательностью SEQ ID No.10 и CDR-НЗ, кодируемый последовательностью SEQ ID No.11; и/или легкую цепь, содержащую CDR-L1, кодируемый последовательностью SEQ ID No.12, CDR-L2, кодируемый последовательностью SEQ ID No.13 и CDR-L3, кодируемый последовательностью SEQ ID No.14.
Антитело I-3859 содержит тяжелую цепь, кодируемую нуклеотидной последовательностью SEQ ID No.15, или нуклеотидной последовательностью демонстрирующей процент идентичности по меньшей мере 80%, предпочтительно 85%, 90%, 95% и 98%, после оптимального выравнивания с SEQ ID No.15; и/или легкую цепь, кодируемую нуклеотидной последовательностью SEQ ID No.16, или нуклеотидной последовательностью демонстрирующей процент идентичности, по меньшей мере, 80%, предпочтительно 85%, 90%, 95% и 98%, после оптимального выравнивания с SEQ ID No.16.
Термины "нуклеиновая кислота", "нуклеиновая последовательность", "последовательность нуклеиновой кислоты", "полинуклеотид", "олигонуклеотид", "полинуклеотидная последовательность" и "нуклеотидная последовательность", используются взаимозаменяемо в данном описании, означают точную последовательность нуклеотидов, модифицированных или нет, определяя фрагмент или область нуклеиновой кислоты, содержащие или не содержащие неприродные нуклеотиды, и представляющую собой или двухцепочечную ДНК, одноцепочечную ДНК или транскрипционный продукт указанных ДНК.
"Нуклеиновые последовательности, демонстрирующей процент идентичности по меньшей мере 80%, предпочтительно 85%, 90%, 95% и 98%, после оптимального выравнивания с предпочтительной последовательностью" означает нуклеиновые последовательности, проявляющие, по отношению к эталонной нуклеиновой последовательности, некоторые модификации, такие как, в частности, делеция, укорочение, удлинение, химерное слияние и/или замена, особенно точечные. Предпочтительно, чтобы данные последовательности кодировали те же аминокислотные последовательности, что и эталонная последовательность, что связано с вырожденностью генетического кода, или были комплементарными последовательностями, способными специфически гибридизоваться с эталонными последовательностями, предпочтительно в крайне жестких условиях, в частности определенных ниже.
Гибридизация в крайне жестких условиях означает, что условия, связаны с температурой и ионной силой выбранными таким образом, что они обеспечивают поддержание гибридизации между двумя комплементарными фрагментами ДНК. На чисто иллюстративной основе, крайне жесткие условия на стадии гибридизации с целью определения нуклеотидных фрагментов, описанных выше, являются предпочтительными следующим образом.
ДНК-ДНК или ДНК-РНК гибридизации осуществляют в два этапа: (1) предгибридизация при 42°С в течение трех часов в фосфатном буфере (20 мМ, рН 7,5), содержащего 5Х SSC (1X SSC соответствует раствору 0,15 М NaCl+0,015 М цитрат натрия), 50% формамида, 7% SDS (sodium dodecyi sulfate - додецилсульфат натрия), 10Х раствор Денхардта, 5% сульфат декстрана и 1% ДНК спермы лосося; (2) основная гибридизация в течение 20 часов при температуре в зависимости от длины зонда (то есть: 42°С для зонда >100 нуклеотидов в длину) с последующими двумя 20-минутными промывками при 20°С в 2Х SSC+2% SDS, одна 20-минутная промывка при 20°С в 0,1Х SSC+0,1% SDS. Последнюю промывку проводят в 0,1Х SSC+0,1% SDS в течение 30 минут при 60°С для зонда >100 нуклеотидов в длину. Крайне жесткие условия гибридизации, описанные выше для полинуклеотида определенного размера могут быть адаптированы специалистом в данной области для более или менее длинных олигонуклеотидов, в соответствии с процедурами, описанными в Sambrook и др. (Molecular cloning: a laboratory manual, Cold Spring Harbor Laboratory; 3rd edition, 2001).
В другом аспекте, данное изобретение представляет собой антитело или его антигенсвязывающий фрагмент или его производное для in vitro или ex vivo диагностики или прогнозирования онкогенного расстройства, связанного с экспрессией CXCR4.
Таким образом, изобретение представляет собой способ in vitro или ex vivo диагностики или прогнозирования онкогенного расстройства, связанного с экспрессией CXCR4, включающий стадию тестирования связывания антитела или его антигенсвязывающего фрагмента или его производного с CXCR4.
В частности, изобретение представляет собой применение антитела I-3859, или его антигенсвязывающего фрагмента или его производного для in vitro диагностики или прогнозирования онкогенного расстройства связанного с экспрессией CXCR4.
Важно отметить, что указанное антитело или его антигенсвязывающий фрагмент или его производное не обладает в естественных условиях противоопухолевой активностью. Данное свойство имеет очевидные преимущества для диагностического применения, поскольку позволяет осуществлять скрининг пациента, или контроль над ходом лечения с антителом, не имеющим никакого воздействия или влияния на указанного пациента. Указанное свойство делает данное антитело предпочтительным инструментом для скрининга пациентов, поскольку оно не будет оказывать на пациента никакого вредного воздействия. Данному антителу или его антигенсвязывающему фрагменту или его производному будет найдено применение в различных медицинских или исследовательских целях, в том числе в обнаружении, диагностике и определении стадии различных патологий, ассоциированных с экспрессией CXCR4.
Термин "диагностика" заболевания, используемый в данном описании, относится к способу выявления или обнаружения присутствия патологического гиперпролиферативного онкогенного расстройства, связанного с или опосредованного экспрессией CXCR4, контроля прогрессирования заболевания и идентификации или обнаружения клеток или образцов, которые свидетельствуют о расстройстве, связанном с экспрессией CXCR4.
Термин "прогнозирование", используемый в данном описании, означает вероятность восстановления после заболевания или предсказание вероятного развития или исхода данного заболевания. Например, если образец из субъекта является отрицательным по окрашиванию с антителом, то "прогнозирование" по этому субъекту лучше, чем, если образец является положительным по окрашиванию с CXCR4. Образцы могут быть причиной для оценки экспрессии CXCR4 по соответствующей шкале, что будет более подробно описано далее.
Антитело может присутствовать в виде иммуноконъюгата или меченого антитела для получения детектируемого/количественного сигнала. При использовании подходящих меток или других соответствующих детектируемых биомолекул или химических веществ, антитело особенно полезно для in vitro и in vivo применения в диагностике и прогнозировании.
Метки для использования в иммунологических анализах, как правило, известны специалистам в данной области и включают ферменты, радиоизотопы, а также флуоресцентные, люминесцентные и хромогенные вещества, в том числе цветные частицы наподобие коллоидного золота или латексных шариков. Подходящие иммунологические анализы включают ИФА (иммуноферментный анализ). Различные типы меток и способов конъюгации метки с антителами, наподобие тех, что изложены ниже, хорошо известны специалистам в данной области.
Термин "онкогенное расстройство, связанное с экспрессией CXCR4", используемый в данном описании, предназначен для обозначения заболеваний и других расстройств, при которых наблюдается присутствие высоких уровней CXCR4 (аберрантных) у субъекта, страдающего от расстройства, как было показано, что они являются или подозреваются в том, что ответственны за патофизиологические расстройства или факторы, способствующие ухудшению расстройства. С другой стороны, такие расстройства могут быть подтверждены, например, путем увеличения количества CXCR4 на поверхности клеток, в пораженных клетках или тканях субъекта, страдающего от расстройства. Увеличение уровня CXCR4 может быть обнаружено с использованием антитела I-3859.
В некоторых вариантах термин "повышенная экспрессия" по отношению к CXCR4 относится к белку или уровню экспрессии гена, который демонстрирует статистически значимое увеличение в экспрессии (как измеряется экспрессия РНК или экспрессия белка) по отношению к контролю.
Предпочтительный аспект данного изобретения представляет собой способ для обнаружения in vitro или ex vivo присутствие CXCR4-экспрессирующей опухоли у субъекта, причем указанный способ включает следующие стадии:
(а) контактирование биологического образца субъекта с антителом, или его антигенсвязывающим фрагментом или его производным, и
(б) обнаружение связывания указанного антитела с указанным биологическим образцом.
Связывание антитела может быть обнаружено посредством различных анализов, доступных специалисту в данной области. Хотя любые подходящие средства для проведения анализов включены в данное изобретение, FACS, ИФА, вестерн-блоттинг и иммуногистохимия могут быть упомянуты по отдельности.
В другом варианте данное изобретение представляет собой способ обнаружения in vitro или ex vivo местоположения экспрессирующей CXCR4 опухоли у субъекта, причем указанный способ включает следующие стадии:
(а) контактирование биологического образца субъекта с антителом, или его антигенсвязывающим фрагментом или его производным, и
(б) обнаружение связывания указанного антитела, или его антигенсвязывающего фрагмента, или его производного с образцом.
В отношении обнаружения присутствия экспрессирующей опухоли, многие методы, известные специалисту в данной области, могут быть использованы. Предпочтительными способами являются иммуногистохимия и FACS.
Изобретение также представляет собой способ обнаружения in vitro или ex vivo клеток, экспрессирующих CXCR4 у субъекта, причем указанный способ включает следующие стадии:
(а) контактирование биологического образца субъекта с антителом, или его антигенсвязывающим фрагментом или его производным, и
(б) количественное определение процента клеток, экспрессирующих CXCR4 в указанном биологическом образце.
Еще один аспект настоящего изобретения представляет собой способ определения in vitro или ex vivo уровня экспрессии CXCR4 в CXCR4-экспрессирующей опухоли субъекта, причем указанный способ включает следующие стадии:
(а) контактирование биологического образца субъекта с антителом, или его антигенсвязывающим фрагментом или его производным, и
(б) количественное определение уровня связывания антитела с CXCR4 в указанном биологическом образце.
Как будет очевидно специалисту в данной области, уровень связывания антитела с CXCR4 может быть определен с помощью любых средств, известных специалисту в данной области. Предпочтительные способы включают использование иммуноферментных процессов, таких как ИФА, иммунофлюоресценция, иммуногистохимия, РИА (радиоиммунный анализ) или FACS.
Предпочтительно, биологический образец представляет собой биологическую жидкость, наподобие сыворотки, цельные клетки крови, образец ткани или биопсии человеческого происхождения. Образец может включать в себя, например, биопсию ткани, которая легко может быть проанализирована на наличие патологического гиперпролиферативного онкогенного расстройства, связанного с экспрессией CXCR4.
Еще один аспект данного изобретения представляет собой способ определения in vitro или ex vivo уровеня экспрессии CXCR4 в опухоли, полученной из субъекта, причем указанный способ включает следующие стадии:
(а) контактирование биологического образца субъекта с антителом, или его антигенсвязывающим фрагментом или его производным, и
(б) количественное определение уровня связывания указанного антитела, или его антигенсвязывающего фрагмента, или его производного с CXCR4 в образце.
После выполнения определения количества CXCR4, присутствующего в исследуемом образце, результаты можно сравнить с результатами контрольных образцов, полученных способом, подобным таковому для исследуемых образцов, но от физических лиц, не имеющих гиперпролиферативного онкогенного расстройства, связанного с экспрессией CXCR4. Если уровень CXCR4 значительно возрастает в исследуемом образце, то можно сделать вывод, что существует повышенная вероятность развития указанного расстройства у субъекта, от которого он был получен.
Изобретение представляет собой, в частности, способ in vitro или ex vivo диагностики или прогнозирования экспрессирующей CXCR4 опухоли, где указанный способ включает следующие стадии: (I) определение уровня экспрессии CXCR4, как описано выше, и (II) сравнение уровня экспрессии на стадии (I) с уровнем эталонной экспрессии CXCR4 от нормального ткани или не экспрессирующей CXCR4 ткани.
По отношению к развитию целевой противоопухолевой терапии, диагностика с использованием иммуногистологических методов на месте дает информацию об уровне экспрессии рецептора и, таким образом, дает возможность отбора (выбора) пациентов, восприимчивых к лечению последующим уровнем экспрессии рецепторов, необходимых для такого лечения.
Определение стадии обладает потенциальной прогностической ценностью и устанавливает критерии для проектирования оптимальной терапии. Simpson et al., J. Clin. Oncology 18:2059 (2000). Например, выбор для лечения солидных опухолей основан на стадировании опухоли, которое обычно выполняется с использованием теста TNM (Tumor/Node/Metastasis-международная классификация стадий злокачественных новообразований) американского объединенного комитета по раку. Широко известно, что, несмотря на то, что данный тест и стадийная система обеспечивают некоторую ценную информацию о стадии, на которой солидный рак был диагностирован у пациента, он неточный и недостаточный. В частности, он не может определить самые ранние этапы развития опухоли.
Изобретение представляет собой способ in vitro или ex vivo оценки опухоли у субъекта, причем указанный способ включает следующие стадии:
(а) контактирование биологического образца субъекта с антителом, или его антигенсвязывающим фрагментом или его производным, способным специфически связываться с CXCR4;
(б) количественное определение уровня связывания указанного антитела, или его антигенсвязывающего фрагмента, или его производного с CXCR4 в образце; и
(в) оценку опухоли при сравнении количественного уровня связывания указанного антитела, или его антигенсвязывающего фрагмента, или его производного, от субъекта по соответствующей шкале,
отличающийся тем, что указанное антитело или его антигенсвязывающий фрагмент, или его производное, включает в себя 1) тяжелую цепь, содержащую следующие три CDRs, соответственно CDR-H1, имеющий последовательность SEQ ID No.1, CDR-H2, имеющий последовательность SEQ ID No.2 и CDR-H3, имеющий последовательность SEQ ID No.3,; и 2) легкую цепь, содержащую следующие три CDRs, соответственно CDR-L1, имеющий последовательность SEQ ID No.4, CDR-L2, имеющий последовательность SEQ ID No.5 и CDR-L3, имеющий последовательность SEQ ID No.6.
В предпочтительном варианте антитело для диагностики способно связываться с целевым рецептором, когда образцы тканей зафиксированы в формалине, заместителе формалина, GLYCO-Fixx, парафине и/или заморожены.
Любой обычный способ анализа рисков может быть использован для оценки прогностического значения использования CXCR4. Репрезентативными методами анализа являются регрессионный анализ Кокса, являющийся полу параметрическим методом для моделирования выживания или время до наступления события в присутствии цензурированных случаев (Hosmer and Lemeshow, 1999; Сох, 1972). В отличие от других анализов выживаемости, например Таблицы Жизни или метода Каплана-Мейера, Кокс позволяет включать прогнозирующие переменные (ковариаты) в модели. Используя методы конвенционного анализа, например, Кокс может быть в состоянии для проверки гипотез относительно корреляции статуса экспрессии CXCR4 в первичной опухоли к времени до наступления или рецидива заболевания (время выживаемости без болезни, или время метастатической болезни), или время до смерти от заболевания (время общей выживаемости). Регрессионный анализ Кокса также известен как пропорциональный анализ опасности Кокса. Данный метод является стандартным для тестирования прогностической ценности опухолевого маркера по отношению ко времени выживания пациента. При использовании в многомерном режиме, эффект нескольких ковариат тестируется параллельно, так что отдельные независимые переменные, имеющие независимое прогностическое значение, могут быть идентифицированы, что делает их наиболее полезными маркерами. Термины отрицательный или положительный "статус CXCR4" также могут быть изображены как [CXCR4 (-)] или [CXCR4 (+)].
Образец может быть "оценен" во время диагностики или мониторинга рака. В своей простейшей форме, оценка может быть категорически отрицательной или положительной, если судить по визуальному осмотру образцов иммуногистохимии. Более количественная оценка включает суждение о двух параметрах: интенсивности окрашивания и доле окрашенных ("положительное") клеток образца.
Термин "статус CXCR4 " в контексте данного изобретения представляет собой отнесение опухоли к CXCR4 положительному [CXCR4 (+)] или CXCR4 отрицательному [CXCR4 (-)] классу на основе определения уровня экспрессии CXCR4, измеренной с помощью любых методов наподобие иммуногистохимии, FACS, или другими методами, известными специалистам в данной области.
В одном из вариантов изобретения для обеспечения стандартизации, образцы могут быть оценены по уровням экспрессии CXCR4 в различных шкалах, большинство из которых основаны на оценке интенсивности продукта реакции и проценте положительных клеток (Payne et al., Predictive markers in breast cancer-the present, Histopathology 2008, 52, 82-90).
В более предпочтительном варианте способа, указанная оценка включает в себя использование соответствующей шкалы, основанной на двух параметрах: интенсивности окрашивания и проценте положительных клеток.
В качестве первого примера, по аналогии с оценкой Квика-Оллреда для иммуногистохимии рецепторов эстрогена и прогестерона, образцы могут быть оценены по уровню экспрессии CXCR4 по глобальной шкале от 0 до 8, складывая баллы за интенсивность реакции и за долю окрашенных клеток (Harvey J.M, Clarck G.M, Osborne C.K., Allred D.C., J. Clin. Oncol. 1999; 17; 1474-1481). Более конкретно, первый критерий, интенсивность реакции, оценивали по шкале от 0 до 3, где 0 соответствовал значению "нет ответа", а 3 соответствовал значению "сильная реакция". Второй критерий, доля реагирующих клеток, оценивали по шкале от 0 до 5, где 0 соответствовал значению "нет реакции", а 5 соответствовал значению "67-100% доля реагирующих клеток". Оценки интенсивности реакции и доли реагирующих клеток затем суммировались для получения общего балла от 0 до 8.
Общий балл 0-2 рассматривался как отрицательный, в то время как общий балл 3-8 рассматривался как положительный результат.
Согласно этой шкале, термины отрицательный или положительный "статус CXCR4" опухолей, используемые в данном описании относятся к уровню экспрессии CXCR4, которому соответствуют 0-2 балла или 3-8 балов по шкале Оллреда, соответственно.
Таблица 2 далее иллюстрирует принципы для интерпретации результатов иммуногистохимии в соответствии с методом Оллреда.
В предпочтительном варианте данный способ относится к шкале от 0 до 8, где отсутствие реакции обозначается 0, а сильная реакция с долей 67-100% реагирующих клеток обозначается 8.
В другом варианте данного изобретения описан способ определения in vitro или ex vivo статуса опухоли, полученной от субъекта, где указанный способ включает стадии: (а) оценка опухоли субъекта в соответствии со шкалой Оллреда; и (б) определение того, что статус опухоли представляет собой [CXCR4 (+)] при оценке Оллреда от 3 до 8; или (с) определение того, что статус опухоли является [CXCR4 (-)] при оценке Оллреда от 0 до 2.
В конкретном аспекте изобретения, опухоль представляет собой [CXCR4 (+)] при оценке Оллреда равной 3.
В конкретном аспекте изобретения, опухоль представляет собой [CXCR4 (+)] при оценке Оллреда равной 4.
В конкретном аспекте изобретения, опухоль представляет собой [CXCR4 (+)] при оценке Оллреда равной 5.
В конкретном аспекте изобретения, опухоль представляет собой [CXCR4 (+)] при оценке Оллреда равной 6.
В конкретном аспекте изобретения, опухоль представляет собой [CXCR4 (+)] при оценке Оллреда равной 7.
В конкретном аспекте изобретения, опухоль представляет собой [CXCR4 (+)] при оценке Оллреда равной 8.
В другом конкретном аспекте изобретения, опухоль представляет собой [CXCR4 (+)]при оценке Оллреда от 3 до 8.
В качестве второго примера, по аналогии с обычной оценкой иммуногистохимии HER-2-рецептор образцы можно оценить, например, на уровень экспрессии CXCR4 каким-нибудь простым методом оценки, интегрирующим интенсивность окрашивания (предпочтительно мембранного окрашивания) и доли клеток, которые отображают окрашивание в соответствии со шкалой от 0 до 3+.
В этой шкале, называемой упрощенной шкалой, 0 и 1+являются отрицательным, тогда как 2+ и 3+ представляют положительное окрашивание. Между тем, значения от 1+ до 3+ могут записываться как положительные, потому что каждый положительный балл может быть связан со значительно более высоким риском рецидива и смертельного заболевания по сравнению с оценкой 0 (отрицательный), но увеличение интенсивности среди положительных оценок может обеспечить дополнительное снижение риска.
В целом, термины отрицательный или положительный "статус CXCR4" опухолей, применяемые в данном описании относятся к уровням экспрессии CXCR4, соответствующим баллам 0 - 1+ или 2+ - 3+ по упрощенной шкале, соответственно. Только полная переферическая мембранная реакция инвазивной опухоли должна быть рассмотрена, по внешнему виду она часто напоминает "проволочную сетку". Согласно ныне действующим руководствам, образцы оцененные как пограничные (оценка 2+ или 3+) для CXCR4, обязаны пройти дополнительную оценку. Анализ иммуногистохимии должен быть отклонен, и или пройти повторную проверку, или пройти проверку методом FISH, или любым другим методом, если; как не лимитирующий пример, контроль получился не таким как ожидалось, артефакты включились в большую часть образца и образец имеет сильно положительную мембрану в нормальных протоках молочной железы (внутренний контроль), указывая на чрезмерное извлечение антигена.
Для большей ясности, таблица 3 далее суммирует эти параметры.
В предпочтительном варианте способ по изобретению относится к шкале от 0 до 3+, на которой отсутствие мембранной реакции опухолевых клеток оценивается 0, а сильная полная реакция в более чем 10% опухолевых клеток оценивается 3+.
Более подробно, как описано выше, указанная соответствующая шкала представляет собой шкалу от 0 до 3+, на которой отсутствие мембранной реакции опухолевых клеток оценивается 0; слабо заметная мембранной реакции в более 10% опухолевых клеток оценивается 1+; от слабой до средней полной мембранной реакции в более 10% опухолевых клеток оценивается 2+; а сильная полная реакция в более чем 10% опухолевых клеток оценивается 3+.
В другом варианте данного изобретения описан способ определения in vitro или ex vivo статуса опухоли субъекта, где указанный способ включает стадии: (а) оценка опухоли субъекта в соответствии с упрощенной шкалой, описанной выше; и (б) определение того, что статус опухоли представляет собой [CXCR4 (+)] при оценке 2+ или 3+; или (с) определение того, что статус опухоли представляет собой [CXCR4 (-)]при оценке 0 или 1+.
В конкретном аспекте изобретения, опухоль представляет собой [CXCR4 (+)] при оценке равной 2+.
В конкретном аспекте изобретения, опухоль представляет собой [CXCR4 (+)] при оценке равной 3+.
В другом конкретном аспекте изобретения, опухоль представляет собой [CXCR4 (+)] при оценке равной 2+ или 3+.
Как правило, результаты теста или анализа согласно изобретению могут быть представлены в любом из различных форматов. Результаты могут быть представлены качественно. Например, протокол испытаний может указывать лишь на наличие или отсутствие обнаружения конкретного полипептида, возможно вместе с индикация пределов обнаружения. Результаты могут быть представлены полуколичественно. Например, могут быть определены различные диапазоны, и диапазоны обозначают оценку (например, от 0 до 3+ или от 0 до 8 в зависимости от используемой шкалы), которая обеспечивает определенную степень количественной информации. Такая оценка может отражать различные факторы, например, количество клеток, в которых CXCR4 обнаружен, интенсивность сигнала (который может указывать на уровень экспрессии CXCR4 или на CXCR4-несущие клетки) и другие. Результаты могут быть представлены в количественном виде, например, как процент от клеток, в которых обнаруживается полипептид (CXCR4), как концентрации белка и т.д.
Как будет понятно специалисту в данной области, тип выходной информации обеспечиваемой тестом, будет варьировать в зависимости от технических ограничений теста и биологической значимости, связанной с обнаружением полипептида. Например, в случае некоторых полипептидов чисто качественный выход (например, наличие или отсутствие обнаружения полипептида при определенном уровне обнаружения) снабжает существенной информацией. В других случаях необходим количественный выход (например, соотношение между уровнем экспрессии полипептида в исследуемом образце по сравнению с нормальным уровнем).
Данное изобретение также обеспечивает способ определения, является ли онкогенное расстройство восприимчивым к лечению анти-СХСР4 антителом, или его фрагментом или его производным, где указанный способ включает следующие стадии:
(а) определение in vitro или ex vivo CXCR4 статуса опухоли субъекта в соответствии со способами по изобретению, и
(б) определение, в случае CXCR4(+) статуса, является ли онкогенное расстройство восприимчивым к лечению с анти-СХСР4 антителом, или его фрагментом или его производным.
В другом аспекте данное изобретение представляет собой способ диагностики патологического гиперпролиферативного онкогенного расстройства или восприимчивости к патологическому состоянию, ассоциированному с экспрессией CXCR4 у субъекта, причем указанный способ включает следующие стадии:
(а) определение наличия или отсутствия CXCR4 несущих клеток в образце, и
(б) диагностика патологического состояния или восприимчивости к патологическому состоянию, основанному на наличии или отсутствии указанных CXCR4 несущих клеток.
В способах по изобретению, обнаружение CXCR4-экспрессирующих клеток или увеличения уровней CXCR4, как правило, указывает на пациента с или подозреваемого в наличии CXCR4-опосредованного расстройства.
Таким образом, данное изобретение представляет собой способ прогнозирования риска развития рака у индивида, причем указанный способ включает определение уровня экспрессии CXCR4 в образце ткани, в котором высокий уровень экспрессии CXCR4 свидетельствует о высоком риске развития рака.
Обнаружили, что экспрессия CXCR4 в большой степени связана с прогрессивными опухолевыми этапами в некоторых типах рака (Schimanski et al., J. C'lin Oncol, ASCO Annual Meeting Proceedings Part 1., 24(18S): 14018, 2006; Lee et al., Int. J Oncol., 34(2):473-480, 2009; Pagano, Tesi di dottorato, Universita degli Studi di Napoli Federico II, 2008). Таким образом, изобретение также представляет собой способ для оценки агрессивности опухоли. Термин "агрессивность опухоли", используемый в данном описании, обозначает быстро растущую опухоль с тенденцией к быстрому распространению.
В одном из вариантов указанный способ включает следующие стадии:
(а) определения уровня CXCR4, экспрессируемого клетками в образце опухоли, и
(б) определение уровня CXCR4, экспрессируемого эквивалентным образцом ткани, взятым позднее у того же индивида,
(в) определение отношения между уровнем экспрессии, полученным на стадии (а) и уровнем экспрессии, полученным на стадии (б),
где соотношение экспрессии CXCR4 в образце опухоли с течением времени снабжает информацией о рисках, связанных с прогрессированием рака.
В предпочтительном варианте изобретения отношение уровня, полученного на стадии (а) к уровню, полученному на стадии (б) выше, чем 1 указывает на агрессивность. В другом варианте изобретения отношение ниже или равно 1 указывает на отсутствие агрессивности.
Другим аспектом изобретения является контроль экспрессии CXCR4 в ответ на применение CXCR4-таргетной терапии. Такой контроль может быть очень полезен, когда указанная терапия вызывает снижение экспрессии и/или деградацию CXCR4.
В частности, контроль экспрессии CXCR4 на поверхности клетки может быть важным инструментом для оценки эффективности лечения в ходе клинических испытаний и " персонализированной " терапии.
Применение, таким образом, предоставляет методы для определения подходящего лечения для субъекта.
Увеличение или уменьшение уровня CXCR4 свидетельствует о развитии рака, связанного с CXCR4. Таким образом, измеряя увеличение количества клеток, экспрессирующих CXCR4 или изменений в концентрации CXCR4, присутствующего в различных тканях или клетках, можно определить, является ли эффективным конкретное лечение, направленное на смягчение злокачественности, связанной с CXCR4.
Поэтому, данное изобретение также представляет собой способ определения эффективности схемы лечения, предназначенной для облегчения онкогенного расстройства, связанного с CXCR4 у субъекта, страдающего от указанного заболевания, причем указанный способ включает следующие стадии:
(а) определение первого уровня экспрессии CXCR4 в первом биологическом образце, причем указанный биологический образец, соответствует первому моменту времени указанного лечения;
(б) определение второго уровня экспрессии CXCR4 во втором биологическом образце, причем указанный биологический образец соответствует второму, более позднему моменту времени указанного лечения;
(в) расчет соотношения указанного первого уровня экспрессии, полученного на стадии (а), к указанному второму уровню экспрессии, полученному на стадии (б); и
(г) определение того, что эффективность указанной схемы лечения высока, когда соотношение со стадии (в) больше 1; или
(д) определения того, что эффективность указанной схемы лечения низка, когда соотношение со стадии (в) меньше или равно 1.
В предпочтительном варианте изобретения указанная схема лечения, предназначенная для облегчения онкогенного расстройства, связанного с CXCR4 у субъекта, страдающего от указанного заболевания, включает применение CXCR4 ингибитора к указанному субъекту.
Другой предпочтительный вариант данного изобретения представляет собой способ выбора онкологического больного, которому введения терапевтического количества ингибитора CXCR4 пойдет на пользу, или нет, причем указанный способ включает следующие стадии:
(а) определение уровня экспрессии CXCR4 в соответствии со способами по изобретению;
(б) сравнение уровня экспрессии, полученного на стадии (а) с уровнем экспрессии эталона; и
(в) отбор пациентов, которым введение терапевтического количества ингибитора CXCR4 пойдет на пользу, если отношение уровня экспрессии, полученное в (а) к уровню экспрессии эталона больше 1; или
(г) отбор пациентов, которым введение терапевтического количества ингибитора CXCR4 не пойдет на пользу, если отношение уровня экспрессии, полученное в (а) к уровню экспрессии эталона равна или меньше 1.
В контексте данного описания термин "ингибитор CXCR4" охватывает любое соединение или молекулу, способную к связыванию с CXCR4 и ингибированию связывания лиганда. В качестве неисчерпывающего примера, ингибиторы CXCR4 включают AMD3100 и AMD3465. Другие ингибиторы CXCR4, пригодные к использованию, включают СТСЕ-0214; СТСЕ-9908; СР-1221 (линейные пептиды, циклические пептиды, природные аминокислоты, искуственные аминокислоты, и пептидомиметические соединения); TL40 и его аналоги; 4Р-бензоил-ТМ24003; KRH-1120; KRH-1636; KRH-2731; аналог полифемизина; ALX40-4C, но не ограничиваются ими. Тем не менее, другие ингибиторы CXCR4 описаны в WO 01/85196; WO 99/50461; WO 01/94420; и WO 03/090512, каждый из которых включен в данное описание путем ссылки.
В предпочтительном варианте изобретения ингибитор CXCR4 состоит из моноклонального антитела 515Н7.
В наиболее предпочтительном варианте изобретения указанный ингибитор CXCR4 является моноклональным антителом 515Н7 (WO 2010/037831).
Кроме того, задачей данного изобретения является создание in vivo способа визуализации онкогенного расстройства, связанного с экспрессией CXCR4 в качестве мономера и/или гомодимера. Подобный способ полезен для локализации опухоли in vivo, а также для контроля за ее инвазивностью. Кроме того, данный способ полезен для контроля прогрессирования и/или ответа на лечение пациентов, у которых ранее был диагностирован рак, опосредованный мономерным/гомодимерным CXCR.
В одном варианте данное изобретение представляет собой способ определения местоположения СХСК4-экспрессирующей опухоли у субъекта, причем указанный способ включает следующие стадии:
а) введение антитела I-3859, или его антигенсвязывающего фрагмента, или его производного субъекту; и
б) определение связывания указанного антитела,
где указанное связывание указывает на наличие опухоли.
В другом варианте данное изобретение представляет собой способ определения местоположения CXCR4-экспрессирующей опухоли у субъекта, причем указанный способ включает следующие стадии:
(а) введение антитела I-3859, или его антигенсвязывающего фрагмента, или его производного субъекту; и
б) определение связывания указанного антитела,
где указанное связывание отмечает местоположение опухоли.
В отношении обнаружения присутствия экспрессирующей опухоли, многие методы, известные специалисту в данной области, могут быть использованы. Тем не менее, предпочтительными способами являются иммуногистохимия и FACS.
В другом аспекте данное изобретение обеспечивает изображение реагента in vivo, указанный реагент, содержащий антитело в соответствии с изобретением, или его антигенсвязывающий фрагмент, или его производное, причем указанное антитело или его фрагмент или его производное предпочтительно должно быть помечено, более предпочтительно радиоактивно. Причем указанный реагент можно вводить пациенту, страдающему от CXCR4-опосредованного рака, в сочетании с фармацевтически эффективным средством доставки.
Данное изобретение также представляет собой применение указанного реагента в медицинской визуализации пациента, страдающего от CXCR4-опосредованного рака.
Способ согласно изобретению содержит следующие стадии:
(а) введение указанному пациенту эффективного для визуализации количества визуализирующего реагента, и
(б) обнаружения указанного реагента.
В одном варианте способ по изобретению позволяет обнаруживать присутствие CXCR4-экспрессирующей опухоли у указанного пациента. В другом варианте способ по изобретению позволяет обнаруживать местоположение CXCR4-экспрессирующей опухоли у указанного пациента.
В предпочтительном варианте изобретения визуализирующий агент включает в себя целевой фрагмент и активный фрагмент.
Термин "целевой фрагмент"", используемый в данном описании, представляет собой агент, специфически распознающий и связывающий CXCR4 на поверхности клетки. В конкретном варианте изобретения, целевой фрагмент представляет собой антитело, или его фрагмент, или его производное, которое специфически связывается с CXCR4. В частности, целевой фрагмент представляет собой антитело, или его фрагмент, или его производное, как описано выше. Предпочтительно целевым фрагментом является антителом I-3859.
Термин "активный компонент", используемый в данном описании, представляет собой агент, позволяющий осуществлять in vivo обнаружение указанного визуализирующего реагента. Активный компонент согласно данному изобретению включает в себя, в частности, радиоактивные элементы, такие как технеций-99 т (99mTc), медь-67 (Cu-67), скандий-47 (Sc-47), лютеций-77 (Lu-177), медь-64 (Cu-64), иттрий-86 (Y-86) или йод-124 (I-124).
Визуализирующий агент вводят в количестве, эффективном для диагностики у млекопитающих, таких как человек, и локализации и накопления визуализирующего агента, детектируемого позднее. Локализация и накопление визуализирующего агента могут быть обнаружены с помощью радионуклидной визуализации, радиосцинтиграфии, ЯМР томографии, КГ (компьютерная томография), ПЭТ (позитронно-эмиссионная томография), компьютеризованная аксиальная томография, рентгенологический или магнитно-резонансный метод визуализации, флуоресцентное обнаружение и хемилюминесцентное обнаружение.
Касаемо развития таргетной противоопухолевой терапии, диагностика с использованием иммуногистологических методов дает информацию об уровне экспрессии рецептора in situ, например, в отношении размера и/или местоположения опухоли Таким образом диагностика позволяет выбрать пациентов, восприимчивых к лечению, сопровождающемуся уровнем экспрессии рецепторов, необходимых для такого лечения.
В частности, уровень экспрессии CXCR4 измеряется предпочтительно с помощью или иммуногистохимии.
FACS анализ широко используется в иммунологии и гематологии для оценки наличия различных клеточных популяций в гетерогенной клеточной суспензии. Количество моноклональных антител, доступных для анализа FACS, довольно велико, и они соединены с различными флуорохромами, что позволяет одновременное окрашивание нескольких антигенов. Иммунофенотип является существенным параметром в диагностике онкогематологических больных. FACS анализ используется при анализе костного мозга, периферической крови и биопсии тканей с подозрением на гемобластоз (Martinez A. Cytometry Part В (Clinical Cytometry) 2003 56 В 8-15). Например, Фидлер с коллегами (Fiedler W. Blood 2003 102 2763-2767) сообщили об использовании FACS анализа для скрининга AML пациентов на экспрессию c-kit перед обработкой SU5416, малой молекулой, ингибирующей фосфорилирование VEGF рецепторов 1 и 2, c-kit, SCF рецептора и FMS- подобной тирозинкиназы-3 (FLT3).
Термин "биологический образец" означает любой образец, который можно получить от субъекта. Подобный образец должен позволять определение уровней экспрессии биомаркера по изобретению. Природа образца, таким образом, будет зависеть от природы опухоли. Предпочтительные биологические образцы для определения указанного уровня экспрессии биомаркеров при обнаружении активированного Akt и/или Erk белков включают образцы, такие как образец крови, образец плазмы или образец лимфы, если рак представляет собой жидкую опухоль. Под термином "жидкая опухоль", в данном описании подразумеваются опухоли крови или костного мозга, т.е. гематологические злокачественные опухоли, такие как лейкемия и множественная миелома. Предпочтительно, биологический образец представляет собой образец крови. Действительно, такой образец крови может быть получен посредством совершенно безвредного забора крови от пациента и, таким образом, позволяет использовать неинвазивную диагностику отвечающего или не отвечающего на CXCR4-ингибитор фенотипа.
Термин "биологический образец", используемый в данном описании, также включает в себя образцы солидного рака от исследуемых пациентов, когда рак является солидным раком. Подобный образец солидного рака позволяет специалисту выполнять любые измерения уровня биомаркера по изобретению. В некоторых случаях, способы в соответствии с изобретением могут дополнительно включать предварительную стадию получения солидного образца рака от пациента. Под термином "солидный образец рака" подразумевают образец опухолевой ткани. Даже у ракового больного, ткань, являющаяся местом опухоли, все еще включает неопухолевые здоровые ткани. Термин "образец рака" должен быть ограничен опухолевой тканью, полученной от пациента. Указанный "образец рака" может быть биопсией или образцом, взятым во время хирургической резекционной терапии.
Согласно одному аспекту, образец от пациента представляет собой раковую клетку или раковую ткань.
Данный образец может быть получен и, при необходимости, подготовлен в соответствии со способами, известными специалисту в данной области.
Раковая клетка или раковая ткань в данном изобретении особенно не ограничена.
Термин "рак", используемый в данном описании, представляет собой или описывает физиологическое состояние у млекопитающих, обычно характеризующееся нерегулируемой пролиферацией клеток. Термины "рак" и "раковый", используемые в данном описании, предназначены, чтобы охватить все этапы заболевания. Таким образом, термин "рак", используемый в данном описании, может включать как доброкачественные и злокачественные опухоли. Примеры рака включают, карциному, лимфому, бластому, саркому и лейкоз или лимфоидные злокачественные новообразования, но не ограничиваются ими. Более конкретно, рак согласно настоящему изобретению выбирают из группы, включающей плоскоклеточный рак (например, эпителиальный плоскоклеточный рак), рак легких, включая мелкоклеточный рак и немелкоклеточный рак, аденокарциному легких и плоскоклеточный рак легких, рак брюшины, гепатоцеллюлярный рак, гастральный или рак желудка, в том числе желудочно-кишечный рак и стромальный желудочно-кишечный рак, рак поджелудочной железы, глиобластому, рак шейки матки, рак яичников, рак печени, рак мочевого пузыря, рак мочевых путей, гепатому, рак молочной железы, рак толстой кишки, рак прямой кишки, колоректальный рак, рак эндометрия или карциному матки, карциному слюнных желез, рак почек или ренальный рак, рак предстательной железы, рак вульвы, рак щитовидной железы, карциному печени, анальную карциному, рак полового члена, меланому, поверхностно распространяющуюся меланому, пигментную злокачественную меланому, акральную пигментную меланому, узловую меланому, множественную миелому и В-клеточную лимфому (в том числе низкоуровневая/фолликулярная НХЛ (неходжкинская лимфома); мелколимфоцитарная (SL) НХЛ; среднеуровневая/фолликулярная НХЛ; среднеуровневая диффузная НХЛ; высокоуровневая иммунобластная НХЛ; высокоуровневая лимфобластная НХЛ; высокоуровневая мелкоклеточная НХЛ с нерасщепленным ядром; массивная НХЛ; лимфома из клеток мантии; СПИД-ассоциированная лимфома; и макроглобулинемию Вальденстрема); ХЛЛ (хронический лимфоцитарный лейкоз); ОЛЛ (острый лимфобластный лейкоз); волосатоклеточный лейкоз; ХМЛ (хронический миелобластный лейкоз); ОМЛ (острый миелобластный лейкоз); и ПТЛР (посттрансплантационные лимфопролиферативные расстройства), а также ненормальную пролиферацию сосудов, связанную с факоматозами, отек (наподобие тех, что связаны с опухолями головного мозга), синдром Мейгса, рак головного мозга, а также рак головы и шеи, и связанные с ними метастазы.
В предпочтительном варианте изобретения указанный рак выбирают из рака простаты, остеосаркомы, рака легких, рака молочной железы, рака эндометрия, лейкемии, лимфомы, множественной миеломы, рака яичников, рака поджелудочной железы и рака толстой кишки. В более предпочтительном варианте указанный рак включает клетки лимфомы, клетки лейкемии или клетки множественной миеломы.
Уровень экспрессии CXCR4 преимущественно сравнивается или измеряется по отношению к уровню в контрольной клетке или образце, также называемому как "эталонный уровень" или " эталонный уровень экспрессии". Термины "эталонный уровень", " эталонный уровень экспрессии", "контрольный уровень" и "контроль" взаимозаменяемы в спецификации. Термин "контрольный уровень" означает отдельный базовый уровень, измеренный в сопоставимой контрольной клетке, как правило, не связанной с болезнью или раком. Указанная контрольная клетка может быть из того же индивидуума, так как, даже у ракового больного, ткань, являющаяся местом опухоли все еще включает в себя неопухолевые здоровые ткани. Она также может быть получена от другого человека, являющегося нормальным или не страдающего той же болезнью, от которой получают больной или тестовый образец. В контексте данного изобретения, термин "эталонный уровень" представляет собой "контрольный уровень" экспрессии CXCR4 применяемый для оценки тестового уровня экспрессии CXCR4 в раковом содержащем клетки образце пациента. Например, когда уровень CXCR4 в биологическом образце пациента выше, чем у эталонного уровня CXCR4, клетки будут рассмотриваться, как имеющие высокий уровень экспрессии, или сверхэкспрессию, CXCR4. Эталонный уровень может быть определен с помощью множества методов. Уровни экспрессии может, таким образом определить CXCR4-несущие клетки или, альтернативно, уровень экспрессии CXCR4 зависит от числа клеток, экспрессирующих CXCR4. Таким образом, эталонный уровень для каждого пациента может быть установлен с помощью эталонного соотношения CXCR4, в котором эталонный коэффициент может быть определен с помощью любого из методов определения эталонных уровней, описанных в данном описании.
Например, контроль может быть заранее заданным значением, принимающим различные формы. Он может быть точкой разделения, наподобие медианы или среднего. "Эталонный уровень" может быть одним числом, в равной степени применимым к каждому пациенту индивидуально, или эталонный уровень может варьировать, в зависимости от конкретных субпопуляций пациентов. Так, например, пожилые люди могут иметь другой эталонный уровень нежели молодые люди с тем же раком, а женщины могут иметь эталонный уровень отличный от такового у мужчин с тем же раком. С другой стороны, "эталонный уровень" может определяться путем измерения уровня экспрессии CXCR4 в не онкогенных раковых клетках из той же ткани, что и ткани опухолевых клеток для тестирования. Кроме того, "эталонный уровень" может быть определенным соотношением CXCR4 в опухолевых клетках пациента по отношению к уровням CXCR4 в не опухолевых клетках того же пациента. "Эталонный уровень" также может быть уровнем CXCR4 культивируемых в пробирке клеток, которыми можно манипулировать, чтобы имитировать опухолевые клетки, или можно манипулировать любым другим способом, дающим уровни экспрессии, позволяющие точно определить эталонный уровень. С другой стороны, "эталонный уровень" может быть установлен на основании сравнительных групп, таких как группы, не обладающие повышенными уровнями CXCR4 и группы, обладающие повышенными уровнями CXCR4. Другой пример сравнительных групп представляют собой группы, имеющие конкретное заболевание, состояние или симптомы и группы без заболевания. Предопределенное значение может быть обговорено, например, где испытуемая популяция поделена поровну (или не поровну) на группы, например, группу низкого риска, группу среднего риска и группу высокого риска.
Эталонный уровень может быть также определен путем сравнения уровня CXCR4 в популяции пациентов, имеющих один и тот же рак. Такой результат может быть достигнут, например, путем анализа гистограммы, в которой вся когорта пациентов представлена графически, где первая ось представляет уровень CXCR4, а вторая ось представляет число пациентов в когорте, в которой опухолевые клетки экспрессируют CXCR4 на заданном уровне. Две или более отдельные группы пациентов могут быть определены путем идентификации подмножества популяций когорты, имеющих такие же или аналогичные уровни CXCR4. Затем может быть проведено определение эталонного уровня на основе уровня, лучше всего отличающего эти отдельные группы. Эталонный уровень может также представлять уровни двух или более маркеров, одним из которых является CXCR4. Два или более маркера могут быть представлены, например, в соотношении значений для уровней каждого маркера.
Кроме того, по-видимому, здоровая популяция будет иметь другой "нормальный" диапазон, чем будет иметь популяция, которая, как известно, имеет состояния, связанные с экспрессией CXCR4. Соответственно, предопределенное выбранное значение может учитывать категорию, в которую попадает индивид. Соответствующие диапазоны и категории могут быть выбраны в не более чем рутинных экспериментах специалистам в данной области. Под словами "повышенный" и "увеличенный" подразумевается высокий уровень относительно выбранного контроля. В норме контроль будет основываться на предположительно здоровых нормальных индивидах в соответствующей возрастной группе.
Кроме того, должно быть понятно, что контроль в соответствии с изобретением может быть, в дополнение к предопределенным значениям, образцам материалов, испытываемых параллельно с экспериментальными материалами. Примеры включают ткани или клетки, полученные в то же время от того же субъекта, например, части одной биопсии, или части образца, представленного одной клеткой от субъекта.
В другом варианте данное изобретение представляет собой фармацевтическую композицию для in vivo визуализации онкогенного расстройства, связанного с экспрессией CXCR4, включающей вышеописанное моноклональное антитело или его фрагмент, помеченный и связывающий CXCR4 in vivo, и фармацевтически приемлемый носитель.
В другом аспекте изобретения предложен набор, применимый для диагностики или прогнозирования процесса, причем указанный набор включает антитело по изобретению или его фрагмент или его производное.
Набор, применимый для обнаружения присутствия и/или местоположения CXCR4-экспрессирующей опухоли, может включать по меньшей мере одно из следующего:
а) антитело или его антигенсвязывающий фрагмент или его производное, включающий: 1) тяжелую цепь, включающую следующие три CDRs, соответственно CDR-H1, имеющую последовательность SEQ ID No.1, CDR-H2, имеющую последовательность SEQ ID No.2 и CDR-H3, имеющую последовательность SEQ ID No.З и 2) легкую цепь, включающую следующие три CDRs, соответственно CDR-L1, имеющую последовательность SEQ ID No.4, CDR-L2, имеющую последовательность SEQ ID No.5 и CDR-L3, имеющую последовательность SEQ ID No.6.
б) антитело с тяжелой цепью, включающей следующие три CDRs, соответственно CDR-H1, имеющую последовательность SEQ ID No.1, CDR-H2, имеющую последовательность SEQ ID No.2 и CDR-H3, имеющую последовательность SEQ ID No.3; и вариабельным доменом легкой цепи, включающей последовательность SEQ ID No.8;
в) антитела с вариабельным доменом тяжелой цепи, содержащей последовательность SEQ ID No.7; и легкую цепь, включающую следующие три CDRs, соответственно CDR-L1, имеющую последовательность SEQ ID No.4, CDR-L2, имеющую последовательность SEQ ID No.5 и CDR-L.3, имеющую последовательность SEQ ID No.6.
г) антитела с вариабельным доменом тяжелой цепи, содержащей последовательность SEQ ID No.7; и вариабельный домен легкой цепи, включающий последовательность SEQ ID No.8.
Упакованные материалы, содержащие комбинацию реагентов в заданных количествах с инструкциями для выполнения диагностического анализа, например наборы, также в рамках данного изобретение. Набор содержит антитела для обнаружения и количественного определения CXCR4 in vitro, например, с помощью ИФА. Антитело по данному изобретению может быть предоставлено в наборе для обнаружения и количественного определения CXCR4 in vitro, например, в ИФА. Там где антитело метят ферментом, в набор будут включены субстраты и кофакторы, необходимые для фермента (например, предшественник субстрата, обеспечивающий обнаружение хромофора или флуорофора). Кроме того, другие добавки могут быть включены, такие как стабилизаторы, буферы (например, блокирующий буфер или лизирующий буфер) и т.д. Подобный набор может включать коробку, разделенную на отсеки для хранения одной или более емкостей, таких как флаконы, пробирки и тому подобное, такие емкости содержат отдельные элементы изобретения. Например, одна емкость может содержать первое антитело, связанное с нерастворимым или частично растворимым носителем. Вторая емкость может содержать растворимое, меченое второе антитело, в лиофилизированной форме или в растворе. Коробка может также содержать третью емкость, содержащую меченое третье антитело в лиофилизированной форме или в растворе. Набор такого рода может быть использован в сэндвич-анализе по данному изобретению. На этикетке или вкладыш в упаковку может быть предоставлено описание состава, а также инструкции для предполагаемого in vitro или диагностического применения.
Относительные количества различных реагентов могут широко варьировать, чтобы обеспечить в растворе реагентов концентрации, существенно оптимизирующие чувствительность анализа. В частности, реагенты могут быть предоставлены в виде сухих порошков, обычно лиофилизированных, включая наполнители, которые при растворении будут обеспечивать раствор реагента, имеющий соответствующую концентрацию.
В еще одном дополнительном аспекте данного изобретения, моноклональные антитела или их связывающие фрагменты, подробно изложенные в данном описании, метят детектируемой частью молекулы, такой, что они могут быть упакованы и используются, например, в наборах, для диагностики или определения клеток, имеющих вышеупомянутый антиген. Неограничивающие примеры таких меток, включают флуорофоры, такие как изотиоцианат флуоресцеина; хромофоры, радионуклиды, биотин или ферменты. Подобные меченые антитела или их связывающие фрагменты могут быть использованы, например для гистологической локализации антигена, ИФА, сортировки клеток, а также других иммунологических методов обнаружения или количественного определения CXCR4, и клеток, несущих этот антиген.
Данные наборы также являются применимыми в качестве положительного контроля для очистки или иммунопреципитации CXCR4 из клеток. Для выделения и очистки CXCR4, набор может содержать антитела, описанные в данном описании, или их антигенсвязывающие фрагменты, соединенные с бусами (например, сефарозными бусами). Данные наборы могут быть содержать антитела для обнаружения и количественного определения CXCR4 в пробирке, например, в случае ИФА. Набор включает в себя коробку и этикетку или вкладыш, помещенный на или в коробку. Емкость содержит композицию, включающую по меньшей мере антитело I-3859, или его антигенсвязывающий фрагмент или его производное по изобретению. Дополнительные емкости, которые могут быть включены в набор, способны содержать, например разбавители, буферы и контрольные антитела. На этикетке или вкладыше в упаковку можно предоставить описание состава, а также инструкции для предполагаемого in vitro или диагностического применения.
Более конкретно, изобретение представляет собой набор для определения CXCR4 статуса опухоли способами по изобретению. В предпочтительном варианте, как будет описано далее в примерах, изобретение относится к набору для определения CXCR4 статуса опухоли с помощью иммуногистохимии и/или FACS методов.
В конкретном варианте изобретения оно состоит из набора, включающего, по крайней мере, антитело I-3859, или его антигенсвязывающий фрагмент или его производное, как описано выше, указанное антитело помечено.
В предпочтительном варианте изобретения набор дополнительно содержит реагент, применимый для определения степени связывания между указанным антителом I-3859 и CXCR4.
В другом предпочтительном варианте изобретения набор, применяемый для определения in vitro или ex vivo уровня экспрессии CXCR4 в экспрессирующих CXCR4 опухолях, дополнительно содержит реагент, используемый для количественного определения уровня связывания между указанным меченым антителом и CXCR4.
В еще одном варианте изобретения набор дополнительно включает: 1) реагент, используемый для определения степени связывания между указанным меченым антителом и CXCR4; и 2) положительные и отрицательные контрольные образцы, полезные для оценки уровня экспрессии CXCR4.
Указанный набор может дополнительно содержать поликлональное антитело, специфичное к мышиным антителам, предпочтительно указанное поликлональное антитело, специфичное для мышиных антител помечено.
В соответствии с конкретным вариантом настоящего изобретения набор для in vitro выбора больного раком, способного или нет согласно прогнозам, извлечь пользу от терапевтического введения ингибитора CXCR4, может включать: 1) реагент, применяемый для определения степени связывания между указанным антителом и CXCR4; 2) контрольный образец, коррелирующий с чувствительностью к ингибитору CXCR4 и/или 3) контрольный образец, коррелирующий с резистентностью к CXCR4 ингибитору.
Изобретение также представляет собой in vitro или ex vivo диагностический реагент, состоящий из антитела в соответствии с изобретением, или его антигенсвязывающий фрагмент или его производное, предпочтительно меченый, в частности с радиоактивной меткой, и его использование в медицинской визуализации, в частности, для обнаружения рака, связанного с клеточной экспрессии или сверхэкспрессией CXCR4.
Другие характеристики и преимущества данного изобретения станут ясны из нижеследующего описания с примерами и фигурами, чьи легенды представлены ниже.
Фиг.1 показывает, что I-3859 Mab иммунопреципитирует как CXCR4 мономеры, так и димеры.
Фиг.2А и 2В показывают, что I-3859 Mab регулирует как CXCR4 гомодимеры (А), так и CXCR4/CXCR2 гетеродимеры (В).
Фиг.3 показывает, что I-3859 Mab распознает CXCR4 на клеточной мембране с помощью FACS анализа.
Фиг.4А и 4В показывают, что I-3859 Mab входит в конкуренцию с анти-CXCR4 515Н7 терапевтическим моноклональным антителом для связывания с CXCR4 на клеточной мембране, с помощью FACS анализа.
Фиг.5 показывает, что I-3859 Mab не оказывает никакого эффекта на MDA-МВ-231 ксенотрансплантатную модель роста опухоли у бестимусных голых мышей.
Фиг.6 иллюстрирует иммуногистохимическое окрашивание с применением а) I-3859 и b) mIgG1 на RAMOS ксенотрансплантатной опухоли.
Фиг.7 иллюстрирует иммуногистохимическое окрашивание с применением а) I-3859 и b) mIgG1 на KARPAS299 ксенотрансплантатной опухоли.
Пример 1: Генерация анти-СХСК4 I-3859 МАБ (моноклональное антитело).
Для генерации МАБ к CXCR4, мышей линии BALB/C иммунизировали рекомбинантными NIH3T3-CXCR4 клетками и/или пептидами, соответствующими внеклеточной части CXCR4: N-концу и петле. Мышей 6-16 недельного возраста при первой иммунизации, иммунизировали один раз антигеном с полным адъювантом Фрейнда, подкожно, а затем от 2 до 6 иммунизации антигеном в неполном адъюванте Фрейнда, подкожно. Иммунный ответ контролировали с помощью ретроорбитального кровотечения. Сыворотку анализировали с помощью ИФА (как описано ниже) и мышей с более высокими титрами анти-CXCR4 антитела были использованы для слияния. Мышам внутривенно вводили антиген за два дня до смерти и удаления селезенки.
- ИФА
Чтобы выбрать мышей с образованием анти-CXCR4 антитела, сыворотки из иммунизированных мышей тестировали с помощью ИФА. Вкратце, планшеты для микротитрования покрывают очищенным [1-41]-N-концевым пептидом, конъюгированным с бычьим сывороточным альбумином (БСА) при 5 мкг эквивалентного пептида/мл, 100 мкл/лунку инкубировали при 4°С в течение ночи, затем блокировали 250 мкл/лунку 0,5% желатином в PBS. Растворы плазмы от CXCR4-иммунизированных мышей добавляли в каждую лунку и инкубировали 2 часа при 37°С. Планшеты промывали PBS и затем инкубировали с козьими антимышиными IgG антителами, конъюгированными с пероксидазой хрена (от англ. horse radish peroxidase, HRP) (Jackson Laboratories) в течение 1 часа при 37°С. После промывания планшеты проявляли субстратом ТМВ, реакцию останавливали через 5 минут добавлением 100 мкл/лунку 1М H2SO4. Мыши, способные вырабатывать самые высокие титры анти-CXCR4 антител были использованы для генерации антител.
- Генерация гибридом, производящих моноклональные антитела к CXCR4
Спленоциты мыши, выделенные из линии BALB/C мышей, развивающих самые высокие титры анти-СХСР4 антител сливали с ПЭГ к мышиной миеломе линии клеток SP2/O. Клетки высевали при приблизительно 1×105/лунку в микротитровальных планшетах с последующими двумя неделями инкубации на селективной среде, содержащей ультра культуральную среду + 2 мМ L-глутамина + 1 мМ пирувата натрия + 1х HAT. Затем лунки просматривали с помощью ИФА для анти-СХСР4 моноклональных IgG антител. Затем в секретирующих антитела гибридомах субклонировали, по крайней мере, путем двукратного лимитирующего разведения, культивировали in vitro, чтобы генерировать антитела для дальнейшего анализа.
Пример 2: I-3859 МАБ иммунопреципитирует как CXCR4 мономеры, так и димеры.
Клеточные осадки NIH3T3-CXCR4 промывали 20 мМ ТрисHCl, рН 8,5, содержащим 100 мМ (NH4)2SO4 и затем суспендировали в буфере для лизиса (20 мМ TrisHCl, рН 8,5, содержащий 100 мМ (NH4)2SO4, 10% глицерина, 1% CHAPSO и 10 мкл/мл коктейль ингибиторов протеаз). Клетки разрушали с помощью Potter Elvehjem гомогенизатора. Солюбилизированные мембраны собирали центрифугированием при 105000д при 4°С в течение 1 ч, затем инкубировали в течение ночи при 4°С с МАБ-13859 на гранулах сефарозы 4 В и выливали смесь в стеклянную колонку и промывали буфером для лизиса. Белки, захваченные 13859 МАБ, элюировали и анализировали с помощью вестерн-блоттинга с использованием анти-СХСК4 МАБ в качестве первичного антитела. Интересующие фракции объединяли, концентрировали и использовали как для анализа методом вестерн-блоттинга, так и для препаративного ДДС-ПААГ (электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия) анализа (4-12% Bis-Tris гель).
После окрашивания серебром, полосы, представляющие интерес, вырезали из геля и подвергали гель расщеплению с использованием автоматизированной системы расщепления белков, станции MassPREP (Waters, Milford, МА, США). Кусочки геля дважды промывали 50 мкл 25 мМ NH4HCO3 (Sigma, Steinheim, Германия) и 50 мкл ацетонитрила (Carlo Erba Reactifs-SDS, Val de Reuil, Франция). Количество цистеиновых остатков снизилось на 60°С в течение 1 часа с помощью 50 мкл 10 мМ DTT, приготовленного в 25 мМ NH4HCO3 и алкилированного при комнатной температуре в течение 20 минут с помощью 50 мкл 55 мМ иодацетамида (Sigma), полученного в 25 мМ NH4HCO3. После дегидратации кусочков геля с ацетонитрилом, белки расщепляли в течение ночи в геле путем добавления 10 мкл 12,5 нг/мкл модифицированного свиного трипсина (Promega, Madison, WI, США) в 25 мМ NH4HCO3 при комнатной температуре. Сформированные пептиды экстрагировали с помощью 35 мкл 60% ацетонитрила, содержащего 5% муравьиной кислоты (Riedel-de Haen, Seeize, Дания) с последующим удалением избытка ацетонитрил и подвергали воздействию nano-LC-MS/MS. Массовые данные, собранные во время анализа nanoLC-MS/MS были обработаны и преобразованы в *.mgf файлы, которые будут представлены в MASCOT™ поисковой системе. Поиск проводили с погрешностью в измерениях 0,25 Да в режимах MS и MS/MS.
Фиг.1 показывает вестерн-блот анализ элюированных концентрированных фракций после иммунопреципитации с помощью I-3859 МАБ в сочетании с бусинами сефарозы. Две полосы с очевидной молекулярной массой в 43 и 75 kDa окрашивали анти-CXCR4 МАБ, используемым в качестве первичного антитела.
Элюированная концентрированная фракция после иммунопреципитации с помощью I-3859 МАБ в сочетании с бусинами сефарозы были растворены в ДДС-ПААГ и визуализировали путем окрашивания серебром. Полосы с молекулярной массой в 43 и 75 кДа вырезали из геля, переваривали трипсином и анализировали с помощью LC-MS/MS как описано выше. Полученные списки пиков были переданы в Mascot для поиск пептидной последовательности по базе. CXCR4 был выявлен в обоих диапазонах:
Пять CXCR4 пептидов были определены в полосе 75-кДа через MASCOT™ поисковую систему: 31-38 пептид EENANFNK, содержащийся на N-конце CXCR4; 71-77 пептид SMTDKYR, содержащийся на внутриклеточной петле 1; 311-322 пептид TSAQHALTSVSR, 312-322 пептид SAQHALTSVSR, 313-322 пептид AQHALTSVSR, содержащийся на С-конце.
Девять CXCR4 пептидов были определены в полосе 43-кДа через MASCOT™ поисковую систему: 27-30 пептид PCFR, 31-38 пептид EENANFNK, содержащийся на N-конце; 71-77 пептид SMTDKYR, содержащийся на внутриклеточной петле 1; 135-143 пептид YLAIVHATN и 135-146 пептид YLAIVHATNSQR, содержащийся на внутриклеточной петле 2; 311-319 пептид TSAQHALTS, 311-322 пептид TSAQHALTSVSR, 312-322 пептид SAQHALTSVSR, 313 - 322 пептид AQHALTSVSR, содержащийся на С-конце.
Результаты, полученные в этом исследовании ясно показывают, что I-3859 МАБ способно к иммунопреципитации CXCR4. I-3859 МАБ узнает как мономеры CXCR4, так и димеры.
Пример 3: I-3859 МАБ регулирует как CXCR4 гомодимеры, так и CXCR4/CXCR2 гетеродимеры по анализу BRET (биолюминесцентный резонансный перенос энергии)
Этот функциональный анализ позволяет оценить конформационные изменения, индуцированные путем SDF-1 и/или I-3859 МАБ связывания с рецептором CXCR4 на уровне CXCR4 гомодимера и формирования CXCR2/CXCR4 гетеродимера.
Экспрессирующие векторы для каждого из исследуемых взаимодействующих партнеров были построены в виде слитых белков с соответствующим красителем (Rluc (Renilla reniformis luciferase - люцифераза Renilla reniformis) и YFP (Yellow fluorescent protein - желтый флуоресцирующий белок) с применением обычных способов молекулярной биологии. За два дня до проведения экспериментов BRET, клетки НЕК293 временно трансфицировали векторами экспрессии, кодирующими соответствующие партнеров BRET: [CXCR4/Rluc+CXCR4/YFP] для изучения CXCR4 гомодимеризации и [CXCR4-Rluc+CXCR2-YFP] для изучения CXCR4 и CXCR2 гетеродимеризации. На следующий день клетки были распределены в предварительно покрытых полилизином белых 96 МВт пластинах в полной культуральной среде [среда Игла, модифицированная Дульбекко (DMEM) с добавлением 10% эмбриональной телячьей сыворотки (FBS)]. Клетки сначала культивировали при 37°С с 5% CO2 для того, чтобы позволить клеткам прикрепиться к пластине. Затем клетки голодали в 200 мкл DMEM/лунку в течение ночи. Непосредственно перед началом эксперимента BRET, DMEM удаляли и клетки быстро промывали PBS. Затем клетки инкубировали в PBS в присутствии или в отсутствие антитела, 15 мин при 37°С перед добавлением коэлентеразина Н 5 мкМ с или без SDF-1 в конечном объеме 50 мкл. После инкубации в течение 5 минут при 37°С и дальнейшей инкубации в течение 20 минут при комнатной температуре, было инициировано световое излучение при 485 нм и 530 нм с помощью Mithras LB940 multilabel reader (Berthold) (1 сек/длина волны/лунку повторяли 15 раз при комнатной температуре).
Расчет соотношения BRET проводили, как описано ранее (Angers et al., 2000); [(излучение530 нм) - (излучение485 нм) Х Cf] / (излучение485 нм), где Cf=[(излучение530 нм) / (излучение485 нм) для клеток, экспрессирующих только слитый белок Rluc в тех же экспериментальных условиях. Упрощение днного уравнения показывает, что соотношение BRET соответствует соотношению 530/485 нм, получаеому, когда два BRET партнера присутствуют с поправкой на соотношение 530/485 нм, полученного в тех же экспериментальных условиях, когда только партнер, слитый с Rluc присутствует в анализе. Ради удобства чтения результаты выражены в процентах от базального сигнала.
Добавление SDF-1 (300 нм) вызвало увеличение сигнала BRET, в результате пространственной близости адаптера и акцепторных белков, слитых с рецептором CXCR4, примерно на 20%. Такое увеличение, вероятно, указывает или на образование CXCR4/CXCR4 гомодимеров, или на конформационные изменения уже существующих димеров (рис.2А). I-3859 МАБ был способен регулировать SDF-1-индуцированные конформационные изменения для CXCR4 гомодимеров (69% ингибирование SDF-1-индуцированное увеличение BRET). I-3859 МАБ также способно регулировать само по себе CXCR4/CXCR4 пространственную близость, что указывает на влияние I-3859 МАБ на конформацию CXCR4/CXCR4 гомодимера (рис.2А).
Сигнал BRET в результате пространственной близости CXCR4 и CXCR2 рецепторов в ответ на SDF-1 (300 нм) был снижен примерно на 20%. Такой результат позволяет предположить формирование CXCR4/CXCR2 гетеродимеров или конформационные изменения уже существующих димеров (рис.2В). I-3859 МАБ был способен регулировать SDF-1-индуцированные конформационные изменения для CXCR2/CXCR4 гетеродимеров с процентным отношением ингибирования SDF-1-индуцированного BRET снижения примерно на 100% и также способен регулировать само по себе CXCR4/CXCR2 пространственную близость, что указывает на влияние I-3859 МАБ на конформацию CXCR4/CXCR2 гетеродимера (рис.2 В).
Пример 4: I-3859 МАБ распознает CXCR4 на клеточной мембране с помощью FACS анализа.
В этом эксперименте, специфическое связывание I-3859 МАБ к человеческому CXCR4 исследовали с помощью FACS анализом.
NIH3T3, NIH3T3-hCXCR4 трансфицированные клетки, MDA-MB-231, Hela, и U937 линий раковых клеток инкубировали с моноклональным антителом I-3859. Затем клетки промывали 1% BSA/PBS/0,01% NaN3. Далее, меченые Alexa вторичные антитела были добавлены к клеткам и инкубировались при 4°С в течение 20 мин. Затем клетки снова промывали два раза. После второй отмывки проводили FACS анализ. Результаты этих исследований связывания предоставлены на рис.3; они показывают, что анти-СХСК4 I-3859 МАБ связывается с человеческим CXCR4-NIH3T3 трансфицированной клеточной линии [MFI (Mean Fluorescence Intensity - средняя интенсивность флуоресценции)], тогда как не было никакого связывания с родительскими клетками NIH3T3 (не показаны). Данное МАБ также способно распознавать рак клеточных линий человека, например MDA-MB-231 клетки рака молочной железы (МФО в концентрации LO! LG/мл=59), U937 промиелоцитарного раковые клетки (MFI в концентрации 10 мкг/мл=246) и клетки рака шейки матки HeLa (MFI в концентрации 10 мкг/мл=633), указывающие, что эти клеточные линии естественно сверхэкспрессируют CXCR4.
Пример 5: I-3859 МАБ входит в конкуренцию с анти-СХСК4 515Н7 терапевтическим моноклональным антителом для связывания с CXCR4 на клеточной мембране, с помощью FACS анализа.
В этом эксперименте, конкуренция между I-3859 и 515Н7 моноклональными антителами за связывание с человеческим CXCR4 исследовали с помощью FACS анализа.
NIH3T3-hCXCR4 трансфицированные клетки инкубировали с биотинилированным 515Н7 МАБ (5 мкг/мл) [узнающим NIH3T3-CXCR4 клетки (рис.4А)] и или I-3859 МАБ или 515Н7 МАБ (0-1 мг/мл) в течение 1 часа при 4°С. Затем клетки промывали 1% BSA/PBS/0,01% NaN3. Далее, меченный стрептавидин добавляли к клеткам и инкубировали их при температуре 4°С в течение 20 мин. Затем клетки снова промывали два раза. После второй отмывки проводили FACS анализ. Результаты этих обязательных исследований предоставлены на рис.4 В. Они показывают [MFI], что анти-CXCR4 I-3859 МАБ конкурирует с анти-CXCR4 515Н7 терапевтическим МАБ за связывание с человеческим CXCR4-NIH3T3 трансфицированных клеток. Как и ожидалось, не меченый 515Н7 МАБ также ингибирует связывание биотинилированного 515Н7 МАБ с CXCR4.
Пример 6: Оценка активности I-3859 МАБ в MDA-MB-231 ксенотрансплантатной модели опухолевого роста у бестимусных голых мышей.
Целью данного эксперимента являлась оценка способности анти-СХСР4 I-3859 МАБ к подавлению роста ксенотрансплантата MDB-MB-231 у бестимусных голых мышей.
Клетки MDA-MB-231 ЕСАСС регулярно культивировались в DMEM среде (Invitrogen Corporation, Шотландия, Великобритания), 10% FCS (Sigma, StLouis MD, США). Клетки были разделены за 48 часов до приживления так, чтобы они находились в экспоненциальной фазе роста. Десять миллионов MDA-MB-231 клеток в растворе PBS были привиты 7 недельным бестимусным голым мышам (Harlan, Франция). Через пять дней после имплантации опухоли были измеримы (34 мм3<V3<40 мм3) и животные были разделены на группы по 12 мышей с сопоставимым размером опухоли. Мышей обрабатывали внутрибрюшинно с нагрузочной дозой I-3859 МАБ 2 мг/мышь. Затем мышам вводили два раза в неделю по 1 мг/доза/мышь I-3859 МАБ. Группа, которой вводили PBS, была в этом эксперименте в качестве контрольной группы. Объем опухоли измеряли два раза в неделю и рассчитывали по формуле: π/6×длина×ширина×высота. Статистический анализ проводили в каждой измерении с использованием теста Манна-Уитни.
В этом эксперименте во время лечения смертность не наблюдалась. По сравнению с группой PBS, не было значительное ингибирование роста при of tumor D31 для I-3859 МАБ (1 mg/dose). Средний объем опухоли после 4 недель лечения не был меньше при I-3859 МАБ, чем при PBS (рис.5).
Пример 7: Иммуногистохимические исследования.
Срезы депарафинизировали, регидратации и помещали при 37°С в течение 10 минут в предварительно теплой протеазы 1 буфере (Ventana Medical System) для термически вызванного поиска эпитопа. После 3 отмывок в TBS-T (Tris Buffer Saline-0.05% tween 20 - Трис-буферном физиологическом растворе 0,05% Твин 20) (Dako S3006) активность эндогенной пероксидазы блокировали с использованием Peroxidase Blocking Reagent (Dako K4007) в течение пяти минут. Срезы промывали TBS-T и инкубировали в блокирующем реагента (UltraV block-TA-125UB-l_abVision) за 5 минут до инкубации с I-3859 (15 мкг/мл, клон I-3859, Pierre Fabre) или мышиным IgG1/каппа (15 мкг/мл, Х0931, Dako) в качестве контрольного изотипа в течение ночи при 4°С. Срезы промывали TBS-T и инкубировали с SignalStain Boost IHC detection Reagent (HRP, M) в течение 30 минут при комнатной температуре. Диаминобензидин был использован для развития коричневого продукта реакции (Dako K3468). Срезы погружали в гематоксилин на 4 минуты для контрастирования (Dako S3309) и промывали в PBS, до заключения в среду Paramount под покровное стекло. В этой иммуногистохимической процедуре, коричневый продукт реакции коррелирует с положительным окрашиванием клеточной мембраны, а отсутствие коричневого продукта реакции коррелирует с отрицательной окраской и отсутствием визуализации клеточной мембраны.
I-3859 МАБ дифференциально окрашивает клеточную мембрану различных типов опухолей. Фигуры 6 и 7 иллюстрируют окрашивание с применением двух моделей ксенотрансплантата, у которых была описана противоопухолевая активность с терапевтическим анти-СХСР-4 hz515H7 антителом: RAMOS и KARPAS299. Как показано на рис.6 и 7, обнаруженная экспрессия ниже в KARPAS299 (Рис.7) ксенотрансплантате, чем в RAMOS (рис.6). Полученные данные хорошо коррелируют с изучением экспрессии CXCR-4 методом проточной цитометрии. Действительно, RAMOS клетки экспрессируют CXCR-4 примерно на 5 уровней больше, чем KARPAS299 клетки (связывающая способность антитела: 200000 для RAMOS и 40000 для KARPAS299). Мембранозное окрашивание в KARPAS299 слабее (рис.7), в то время, как мембранозное окрашивание в RAMOS значительно выше (рис.6).
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВОЕ АНТИТЕЛО К CXCR4 И ЕГО ПРИМЕНЕНИЕ ДЛЯ ВЫЯВЛЕНИЯ И ДИАГНОСТИКИ РАКА | 2012 |
|
RU2636345C2 |
| ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К CXCR4 ДЛЯ ЛЕЧЕНИЯ РАКА | 2011 |
|
RU2595394C2 |
| АНТИТЕЛА К CXCR4 И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ РАКА | 2009 |
|
RU2573897C2 |
| АНТИТЕЛА ПРОТИВ CXCR4 ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИИ ВИЧ | 2010 |
|
RU2573902C2 |
| АНТИТЕЛО К IGF-1R И ЕГО ПРИМЕНЕНИЕ ДЛЯ ДИАГНОСТИКИ РАКА | 2016 |
|
RU2706959C2 |
| АНТИТЕЛО К IGF-1R И ЕГО ПРИМЕНЕНИЕ ДЛЯ ДИАГНОСТИКИ РАКА | 2016 |
|
RU2706967C2 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ АНТИ-СЕАСАМ 1 И АНТИ-PD АНТИТЕЛА ДЛЯ ТЕРАПИИ РАКА | 2014 |
|
RU2697522C1 |
| АНТИТЕЛО К CLDN18.2 И ЕГО ПРИМЕНЕНИЯ | 2018 |
|
RU2797709C2 |
| ANTI-CXCR4 АНТИТЕЛА И КОНЪЮГАТЫ АНТИТЕЛО-ЛЕКАРСТВО | 2014 |
|
RU2675516C2 |
| АНТИТЕЛО ПРОТИВ КЛАУДИНА 18А2 И ЕГО ПРИМЕНЕНИЕ | 2017 |
|
RU2793445C2 |






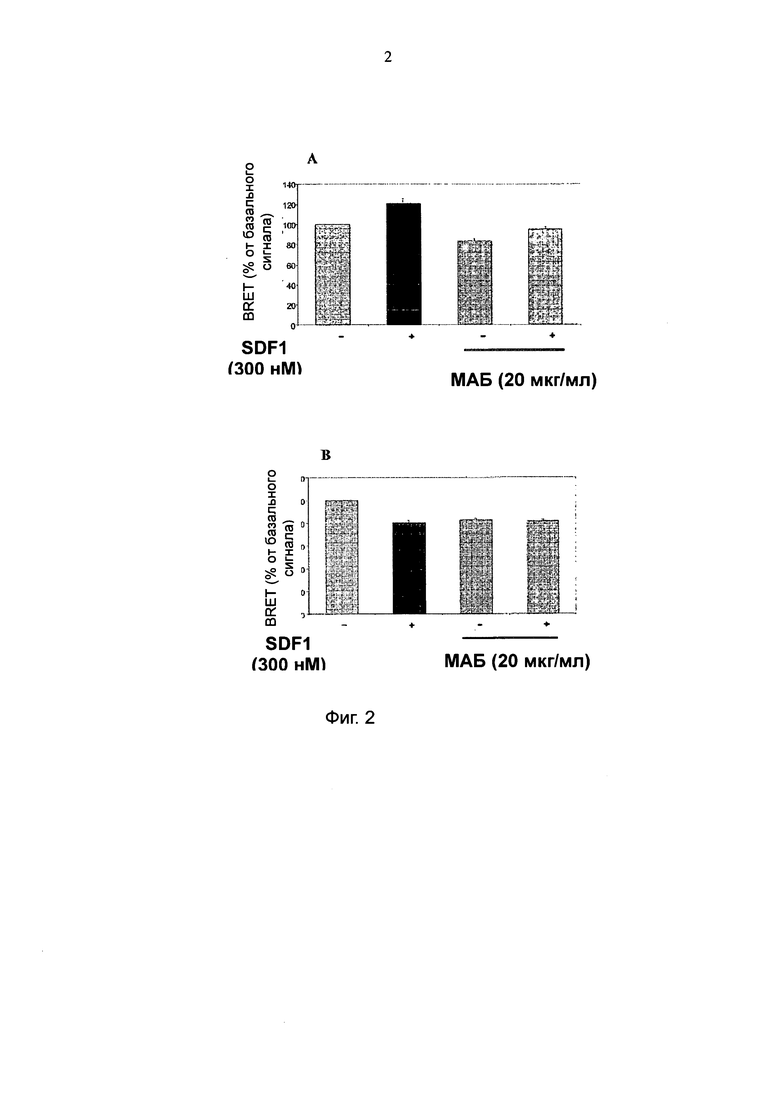
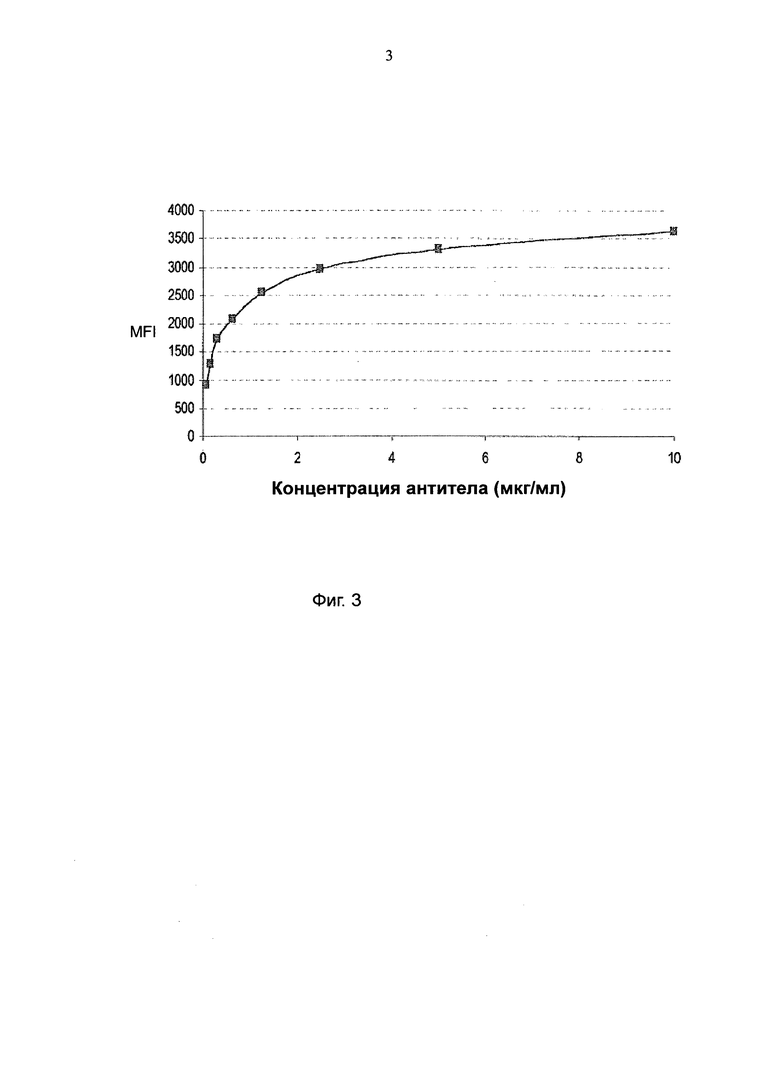
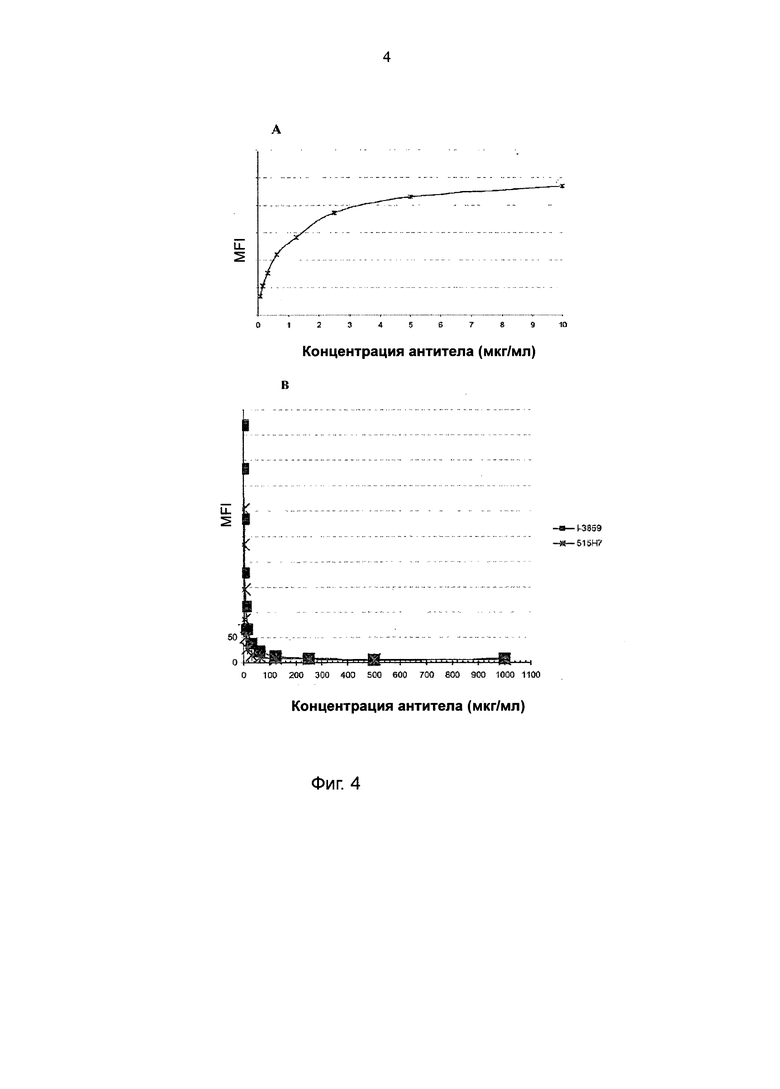
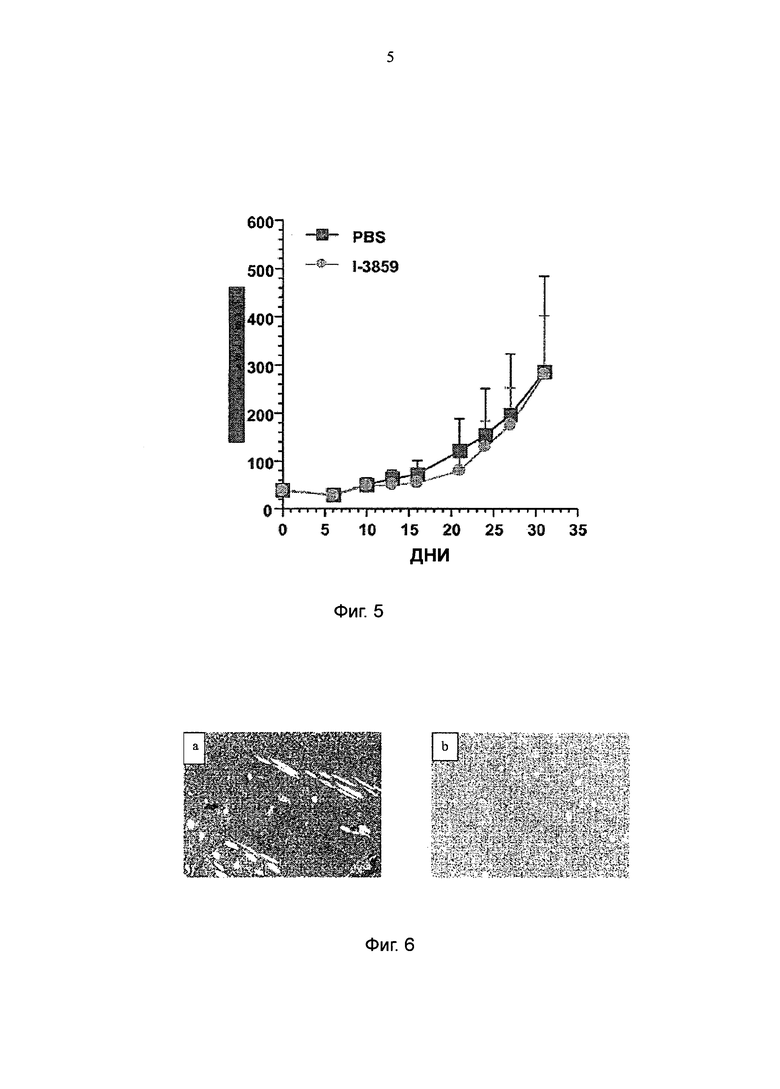

Изобретение относится к области биотехнологии, конкретно к применению выделенного антитела к CXCR4 в диагностике рака, что может быть использовано в медицине. В частности, раскрыты способы диагностики и/или прогнозирования онкогенного расстройства, связанного с экспрессией CXCR4, определения, является ли указанное расстройство или пациент, страдающий им восприимчивым к лечению анти-CXCR4 антителом, способы определения эффективной схемы лечения и наборы для лечения указанных заболеваний. Изобретение позволяет проводить эффективную диагностику и терапию онкогенных расстройств, характеризующихся экспрессией CXCR4. 5 н. и 13 з.п. ф-лы, 7 ил., 3 табл., 7 пр.
1. Способ обнаружения in vitro или ex vivo присутствия экспрессирующей CXCR4 опухоли у субъекта, причем указанный способ включает следующие стадии:
(а) контактирование биологического образца субъекта с антителом или его антигенсвязывающим фрагментом, способным специфически связываться с CXCR4; и
(б) обнаружение связывания указанного антитела или его антигенсвязывающего фрагмента с указанным биологическим образцом,
где указанное антитело или его антигенсвязывающий фрагмент включает: 1) тяжелую цепь, включающую следующие три CDR области, соответственно CDR-H1, имеющую последовательность SEQ ID No. 1, CDR-H2, имеющую последовательность SEQ ID No. 2, и CDR-H3, имеющую последовательность SEQ ID No. 3 и 2) легкую цепь, включающую следующие три CDR области, соответственно CDR-L1, имеющую последовательность SEQ ID No. 4, CDR-L2, имеющую последовательность SEQ ID No. 5, и CDR-L3, имеющую последовательность SEQ ID No. 6.
2. Способ по п. 1, где указанное антитело выбирают из:
а) антитела с тяжелой цепью, включающей следующие три CDR области, соответственно CDR-H1, имеющую последовательность SEQ ID No. 1, CDR-H2, имеющую последовательность SEQ ID No. 2, и CDR-H3, имеющую последовательность SEQ ID No. 3; и вариабельным доменом легкой цепи, включающим последовательность SEQ ID No. 8;
б) антитела с вариабельным доменом тяжелой цепи, содержащей последовательность SEQ ID No. 7; и легкой цепью, включающей следующие три CDR области, соответственно CDR-L1, имеющую последовательность SEQ ID No. 4, CDR-L2, имеющую последовательность SEQ ID No. 5, и CDR-L3, имеющую последовательность SEQ ID No. 6; или
в) антитела с вариабельным доменом тяжелой цепи, содержащей последовательность SEQ ID No. 7; и вариабельным доменом легкой цепи, включающей последовательность SEQ ID No. 8.
3. Способ по п. 1 или 2, где указанное антитело не обладает противоопухолевой активностью in vivo.
4. Способ по п. 1, в котором связывание указанного антитела или его антигенсвязывающего фрагмента с CXCR4 преимущественно выявляют методом сортировки флуоресцентно-активированных клеток (FACS) или иммуногистохимией (IHC).
5. Способ по п. 1, дополнительно включающий стадию:
(в) количественное определение уровня связывания указанного антитела или его антигенсвязывающего фрагмента с CXCR4 в указанном биологическом образце, тем самым определяя уровень экспрессии CXCR4 в указанном биологическом образце.
6. Способ по п. 5, дополнительно включающий стадии:
(г) количественное определение уровня связывания указанного антитела или его антигенсвязывающего фрагмента с CXCR4 в биологическом образце из нормальной ткани или неэкспрессирующей CXCR4 ткани, тем самым определяя эталонный уровень экспрессии CXCR4 в указанном биологическом образце;
(д) сравнение уровня экспрессии на стадии (в) с эталонным уровнем экспрессии CXCR4 на стадии (г).
7. Способ по п. 5 или 6, дополнительно включающий стадии:
(е) оценку опухоли при сравнении количественного уровня связывания указанного антитела или его антигенсвязывающего фрагмента от субъекта по соответствующей шкале.
8. Способ по п. 7, отличающийся тем, что соответствующая шкала основана на двух параметрах, являющихся интенсивностью окрашивания и процентом положительных клеток.
9. Способ по п. 7, отличающийся тем, что соответствующая шкала представляет собой шкалу от 0 до 8, где отсутствие реакции обозначается как 0, а сильная реакция с долей 67-100% реагирующих клеток обозначается как 8.
10. Способ по п. 9, дополнительно включающий стадии:
(ж) определение того, что статус опухоли является [CXCR4 (+)] при оценке от 3 до 8; или
(з) определение того, что статус опухоли является [CXCR4 (-)] при оценке от 0 до 2.
11. Способ по п. 7, отличающийся тем, что соответствующая шкала представляет собой шкалу от 0 до 3+, на которой отсутствие мембранной реакции опухолевых клеток оценивается как 0, а сильная полная реакция в более чем 10% опухолевых клеток оценивается как 3+.
12. Способ по п. 11, дополнительно включающий стадии:
(ж) определение того, что статус опухоли представляет собой [CXCR4 (+)] при оценке 2+ или 3+; или
(з) определение того, что статус опухоли является [CXCR4 (-)] при оценке 0 или 1+.
13. Способ определения, является ли онкогенное расстройство восприимчивым к лечению анти-CXCR4 антителом или его фрагментом, причем указанный способ включает следующие стадии:
(а) определение in vitro или ex vivo CXCR4 статуса опухоли у субъекта по п. 10 или 12, и
(б) определение того, восприимчиво ли онкогенное расстройство лечению антителом анти-CXCR4 или его фрагментом, если его статус является CXCR4(+).
14. Способ выбора пациента, страдающего раком, для которого согласно прогнозам благоприятно введение терапевтического количества ингибитора CXCR4, причем указанный способ включает следующие стадии:
(а) определение уровня экспрессии CXCR4 в биологическом образце от пациента в соответствии со способом по п. 5;
(б) определение эталонного уровня экспрессии в соответствии со способом по п. 6; и
(в) выбор пациента, для которого согласно прогнозам благоприятно введение терапевтического количества ингибитора CXCR4, если отношение уровня экспрессии, полученное на стадии (а), к эталонному уровню экспрессии, полученному на стадии (б), составляет больше 1.
15. Способ определения in vitro или ex vivo эффективности схемы лечения, предназначенной для облегчения экспрессирующей CXCR4 опухоли у субъекта, страдающего от указанного расстройства, причем указанный способ включает следующие стадии:
а) определение первого уровня экспрессии CXCR4 по п. 5 в первом биологическом образце, причем указанный биологический образец соответствует первому моменту времени указанного лечения;
(б) определение второго уровня экспрессии CXCR4 по п. 5 во втором биологическом образце, причем указанный биологический образец соответствует второму, более позднему, моменту времени указанного лечения;
(в) вычисление соотношения указанного первого уровня экспрессии, полученного на стадии (а), к указанному второму уровню экспрессии, полученному на стадии (б); и
(г) определение того, что эффективность указанной схемы лечения является высокой, когда соотношение, вычисляемое на стадии (в), составляет больше 1; или
(д) определения того, что эффективность указанной схемы лечения является низкой, когда соотношение, вычисляемое на стадии (в), меньше или равно второму уровню экспрессии или статистически близко.
16. Способ по п. 15, отличающийся тем, что указанная схема лечения, предназначенная для облегчения экспрессирующей CXCR4 опухоли у субъекта, страдающего от указанного расстройства, включает введение ингибитора CXCR4 указанному субъекту.
17. Набор для обнаружения присутствия и/или местоположения CXCR4-экспрессирующей опухоли, включающий инструкции для выполнения анализа и по меньшей мере одно из следующего:
а) антитело или его антигенсвязывающий фрагмент, содержащее: 1) тяжелую цепь, включающую следующие три CDR области, соответственно CDR-Н1, имеющую последовательность SEQ ID No. 1, CDR-H2, имеющую последовательность SEQ ID No. 2, и CDR-H3, имеющую последовательность SEQ ID No. 3, и 2) легкую цепь, включающую следующие три CDR области, соответственно CDR-L1, имеющую последовательность SEQ ID No. 4, CDR-L2, имеющую последовательность SEQ ID No. 5, и CDR-L3, имеющую последовательность SEQ ID No. 6;
б) антитело с тяжелой цепью, включающей следующие три CDR области, соответственно CDR-H1, имеющую последовательность SEQ ID No. 1, CDR-H2, имеющую последовательность SEQ ID No. 2, и CDR-H3, имеющую последовательность SEQ ID No. 3; и вариабельным доменом легкой цепи, включающей последовательность SEQ ID No. 8;
в) антитело с вариабельным доменом тяжелой цепи, содержащей последовательность SEQ ID No. 7; и легкой цепью, включающей следующие три CDR области, соответственно CDR-L1, имеющую последовательность SEQ ID No. 4, CDR-L2, имеющую последовательность SEQ ID No. 5, и CDR-L3, имеющую последовательность SEQ ID No. 6;
г) антитело с вариабельным доменом тяжелой цепи, содержащей последовательность SEQ ID No. 7; и вариабельным доменом легкой цепи, включающим последовательность SEQ ID No. 8.
18. Набор по п. 17, где указанное антитело меченое.
| СПОСОБ ПОДГОТОВКИ ВАЛКОВ ПИЛИГРИМОВЫХ СТАНОВ К ПРОКАТКЕ ГОРЯЧЕКАТАНЫХ ТРУБ | 2003 |
|
RU2246364C2 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Барабан для почвообрабатывающих фрезерных машин | 1928 |
|
SU10163A1 |
Авторы
Даты
2017-11-17—Публикация
2012-07-30—Подача