Изобретение относится к медицине, а именно к торакальной онкологии, и может быть использовано для скрининга злокачественных опухолей органов грудной полости: бронхов и/или трахеи.
Скрининг рака должен быть приемлемым для массового использования, недорогим, обладать высокой чувствительностью и специфичностью, высокой положительной и отрицательной предсказательной ценностью, а также быть безболезненным и безопасным для пациента. Важнейшими требованиями, определяющими эффективность любого метода скрининга рака легких (РЛ), являются высокие уровни специфичности и прогностичности положительного результата, которые должны быть порядка 90-99%. Требования к чувствительности и прогностичности отрицательного результата менее жесткие - не менее 90% и 85%, соответственно.
К нелучевым способам ранней диагностике РЛ традиционно относится стандартное цитологическое исследование мокроты (ЦИМ), а в последнее время осуществляются попытки анализа газового состава выдыхаемого воздуха.
Известен способ скрининга злокачественных опухолей органов грудной полости путем стандартного цитологического исследования мокроты, включающего забор материала, фиксацию, обработку, оценку.
Способ основан на поиске при микроскопии опухолевых клеток, метаплазии и дисплазии в образцах мокроты, нанесенных на предметное стекло и позволяет нередко установить не только злокачественную природу процесса, но и конкретную морфологическую разновидность РЛ. ЦИМ считается легко воспроизводимым, неинвазивным и недорогим методом ранней диагностики РЛ, имеет высокую специфичность, достигающую 98% (Wu G., Wang Е. Li J., et al. Clinical value of liquid-based cytologic test in sputum examination of patients with lung cancer // Zhongguo Fei Ai Za Zhi. - 2006. - 9(2). - P. 192-195; Wu G.X., Raz D.J. Lung Cancer Screening // Cancer Treat. Res. - 2016. - 170. - P. 1-23).
Недостатком способа является весьма низкая чувствительность, не превышающая 5-15%, причем значительно чаще выявляются опухоли центральной локализации. Возможности данного теста в распознавании раннего РЛ ограничены в связи как с возможным отсутствием у больных опухолевых клеток в образце мокроты, так и по причине субъективности интерпретации результатов исследования. Даже среди опытных цитопатологов до настоящего времени нет единого мнения о критериях определения «атипичные клетки».
Известен способ скрининга злокачественных опухолей органов грудной полости (Nakhleh М.K., Amal Н., Jeries R. etal. Diagnosis and Classification of 17 Diseases from 1404 Subjects via Pattern Analysis of Exhaled Molecules // ACSNano. - 2017. - 11(1). - P. 112-125), основанный на использовании электронного носа «NaNose» с массивом сенсоров на основе наночастиц золота (Au) с различными поверхностными модификаторами и сенсоров на основе сетей углеродных нанотрубок. Неорганические наноматериалы на основе этих датчиков обеспечивают электропроводность, тогда как органический слой функционирует как чувствительный элемент для распознавания адсорбированных низкомолекулярных летучих органических соединений (ЛОС). Сорбция ЛОС органической пленкой влияет на туннелирование электронов путем обратимого набухания или агрегации слоев, что увеличивает или уменьшает расстояние между частицами и приводит, соответственно, к увеличению или уменьшению электрического сопротивления пленки. Диэлектрическая проницаемость органической матрицы, окружающей металлические сердечники, увеличивается из-за более высокой диэлектрической проницаемости сорбированного газа. Химическое разнообразие как проводящих неорганических наноматериалов, так и органических слоев приводит к тому, что датчики реагируют по-разному на ЛОС выдыхаемого воздуха, что создает уникальные «отпечатки дыхания».
Способ основан на обследовании 1404 участников: 813 пациентов с 17 различными заболеваниями и 591 здоровых добровольцев в 4 странах: Израиле, Франции, США, Латвии и Китае. Для стратификации заболеваний использовалась серия бинарных классификаторов, полученных методом дискриминантного факторного анализа. Этот способ является ближайшим аналогом.
Недостатком способа является недостаточная чувствительность: 57-86%, при специфичности 43-84% для каждого классификатора. Показано, что «NaNose», в ряде случаев, способен различать морфологические типы РЛ: мелкоклеточный рак легких, аденокарцинома и плоскоклеточный рак и статус мутации EGFR, а также может быть использован как прогностический и предиктивный метод.
Техническим результатом изобретения является повышение точности неинвазивного раннего выявления злокачественных опухолей органов грудной полости.
Указанный технический результат изобретения достигается в способе скрининга злокачественных опухолей органов грудной полости, включающем определение состава выдыхаемого воздуха неселективным методом анализа летучих органических соединений с использованием металлооксидных сенсоров с перекрестной чувствительностью, в котором анализ летучих органических соединений осуществляют с одновременным использованием 7 металлооксидных хеморезисторных газовых сенсоров при последовательно устанавливаемых температурах 350, 400 и 450°С и дополнительно проводят цитологический анализ мокроты с изготовлением и микроскопическим исследованием 2 микропрепаратов, которые окрашивают гематоксилином и эозином, и при выявлении в отклике сенсоров на состав выдыхаемого воздуха статистически значимых отличий от контрольных значений, определенных заранее для используемых сенсоров, и одновременном обнаружении в микропрепаратах дисплазии и клеток рака диагностируют злокачественную опухоль. Способ иллюстрируется фиг. 1-5, где:
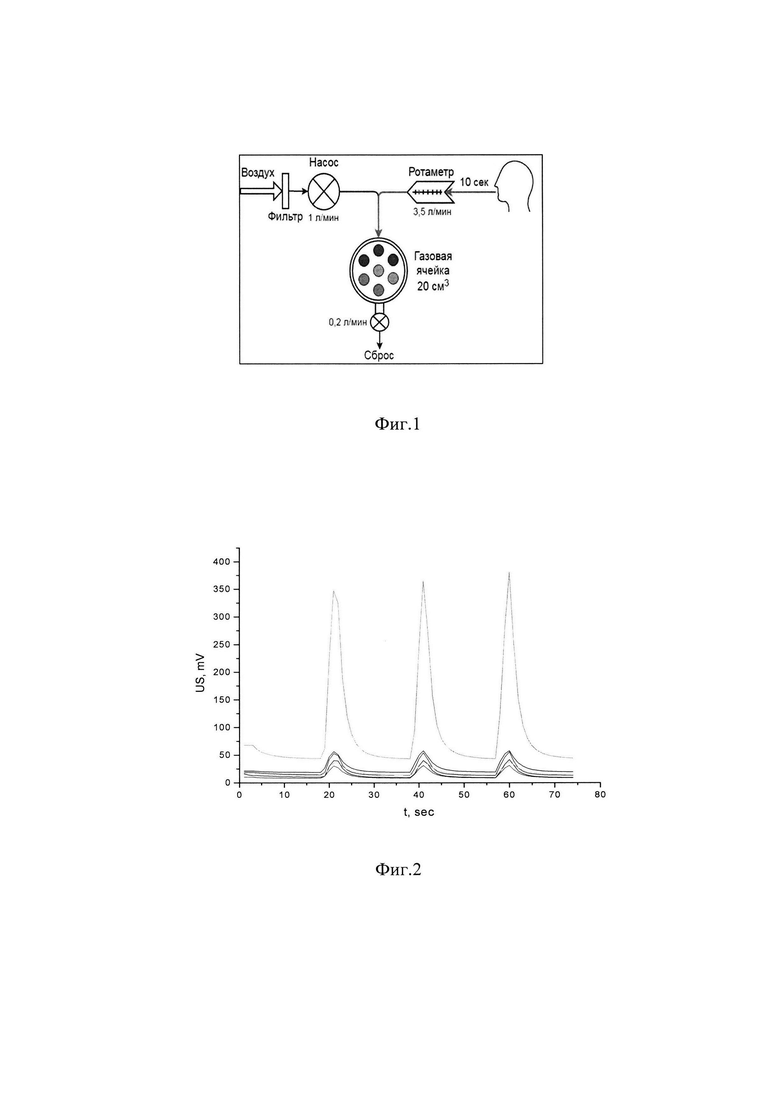
на фиг. 1 представлены схема и изображение непосредственных единовременных одномоментных «online» измерений.
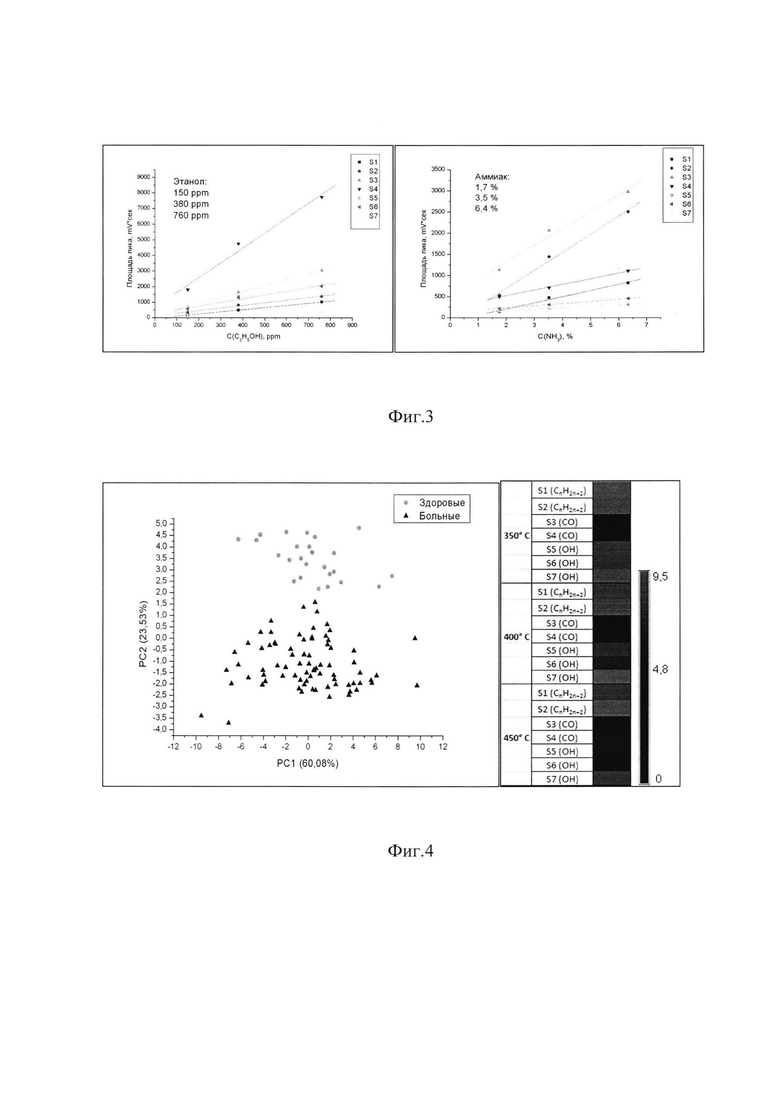
на фиг. 2 представлены отклики на выдыхаемый воздух 7 сенсоров при температуре 350°С (3 выдоха).
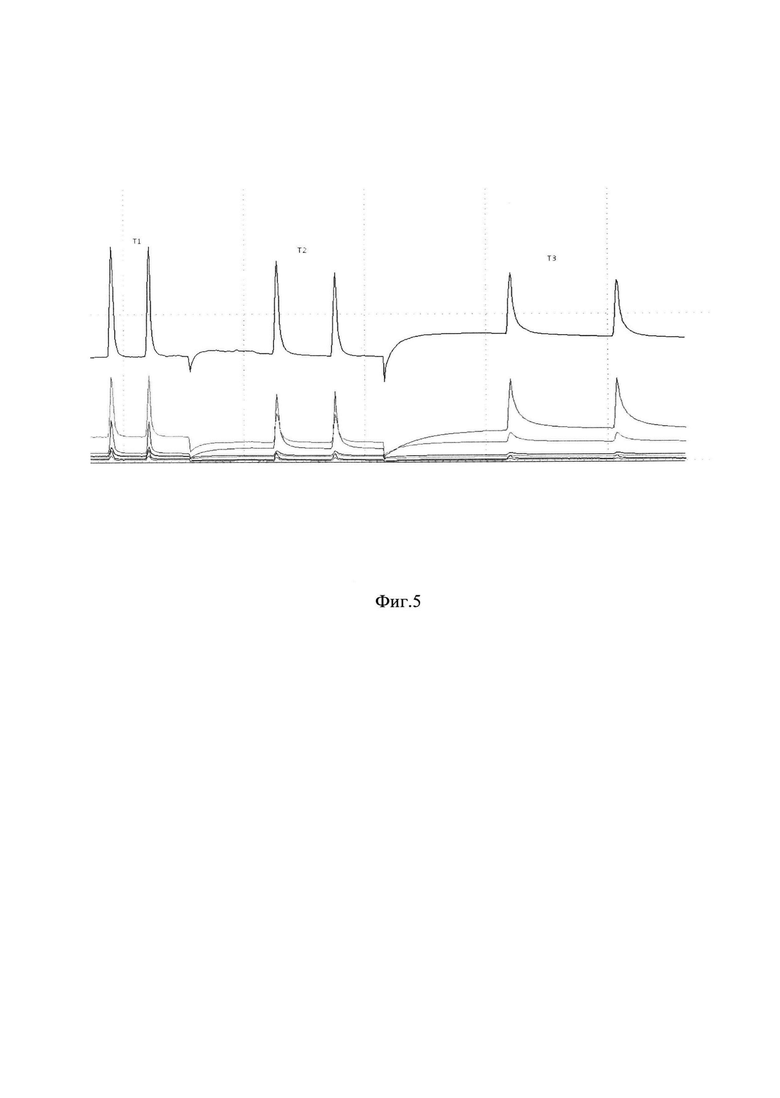
на фиг. 3 представлены показания сенсоров в парах этанола (150 ррт; 380 ррт; 760 ррт) и аммиака (1,7%; 3,5%; 6,4%).
на фиг. 4 представлены график счетов первых двух главных компонент РС1 и РС2 (в скобках приведена доля объясненной дисперсии для данной компоненты) и тепловая карта вклада переменных в значение РС2 на основе корреляций в процентах.
на фиг. 5 представлены примеры откликов сенсоров при 3-х температурных режимах (ось Y: напряжение на сенсоре, ось X: время).
Отклик сенсоров представляет собой графический пик (фиг. 2, 5). Площадь пика используется при математических расчетах для анализа состава выдыхаемого воздуха. Разброс амплитуды откликов (пиков) при каждой температуре составил от 2 до 15% в зависимости от типа сенсора.
При попадании ЛОС выдыхаемого воздуха на поверхность чувствительного слоя сенсора происходят процессы окисления/восстановления, в результате чего изменяется проводимость сенсора и возникает импульс, что отображается как пик на графике.
Изначально для каждого пациента анализировалось 6 выдохов в течение 10 секунд при скорости выходного потока из ячейки 2 л/мин (по 2 параллельных измерения на 3 температурных режима). Однако, статистически не значимый разброс значений откликов параллельных измерений в последующем позволил сократить число измерений при каждой температуре до 1 раза. В качестве аналитического сигнала берется интеграл пика и усредняется среди двух измерений для каждого из 7 сенсоров, в итоге для каждого пациента получается 21 значение, формирующее «отпечаток выдоха».
Для анализа выдыхаемого воздуха использовалась неселективная мультисенсорная система «электронный нос (E-nose)» на основе массива из 7 металлооксидных сенсоров. Металлооксидные сенсоры относятся к хеморезисторным газовым сенсорам, принцип действия которых основан на детектировании изменения сопротивления слоя оксида металла (SnO2 WO3, ZnO) в результате окисления или восстановления на его поверхности различных газов. Рабочая температура сенсоров такого типа находится в диапазоне 200-500°С. При различных температурах один и тот же сенсор обладает различной относительной чувствительностью к анализируемым соединениям, что позволяет виртуально увеличить количество используемых сенсоров. В мультисенсорной системе использовались полупроводниковые резистивные газовые сенсоры, изготовленные по толстопленочной технологии в лаборатории прикладной химической физики НИЦ "Курчатовский институт". Каждый сенсор представляет собой многослойную структуру, состоящую из полупроводникового газочувствительного слоя (собственно сенсора), диэлектрической подложки из оксида алюминия и слоя нагревателя. Полупроводниковый слой и слой нагревателя наносятся на разные стороны диэлектрической подложки методом трафаретной печати. Полупроводниковый газочувствительный слой состоит из нано-частиц диоксида олова с различными каталитическими добавками платины и/или палладия. Во время измерений температуры всех сенсоров ступенчато изменяли до 350°, 400° и 450°С. На каждой из 3 температурных площадок дожидались установления показаний сенсоров.
Именно те факты, что: 1) при трех различных температурах один и тот же сенсор меняет чувствительность, позволяя виртуально втрое увеличивать количество детекторов (с 7 до 21); 2) анализ выдыхаемого воздуха осуществляется путем непосредственных одновременных одномоментных «online» измерений, предотвращая появление неконтролируемых систематических погрешностей и существенно увеличивая производительность метода, определяет основные преимущества ранее неизвестной неселективной мультисенсорной системы «Е-nose».
Для оценки параметров измерения и характеристик мультисенсорной системы были проведены градуировки сенсоров по 3 веществам: этанол, 1-пропанол, аммиак. Процедура градуировки проводилась путем отбора в шприц (объемом 20 мл) насыщенных паров соединения и последующего их разбавления окружающим воздухом. Использовались: 96% этанол (ООО «Росбио») и 1-пропанол (Реахим, Харьковский завод реактивов), а также 10% водный раствор аммиака (ЗАО «Ярославская фармацевтическая фабрика»). Для расчета концентраций использовались табличные данные парциальных давлений над раствором: этанол (5.95 кПа, при 20°С), 1-пропанол (1,99 кПа, при 20°С), аммиак 10% (11,59 кПа, при 20°С). Отклик сенсоров линеен для выбранного диапазона концентраций. Математический анализ отношения сигнал/шум показал ожидаемый нижний порог обнаружения (с учетом показаний всех сенсоров).
Критериями включения пациента в исследование являлись: 1) возраст участника от 30 лет и старше; 2) возможность перенести при необходимости дополнительное обследование в полном объеме, в рамках гарантий ОМС, для постановки окончательного диагноза (компьютерной томографии органов грудной полости, фибробронхоскопия, трансторакальной трепан-биопсии.; 3) курящие в настоящий момент или бросивших курить менее 10 лет назад; 4) параллельное проведение цитологического исследования образцов мокроты; 5) подписанное информированное согласие на участие в исследовании.
В качестве критериев исключения пациентов использовались: 1) наличие опухолевого заболевания в анамнезе, выявленного менее 5 лет назад, за исключение рака кожи, рака шейки матки insitu; 2) тяжелые сопутствующие заболевания (наличие декомпенсированной патологии сердечно-сосудистой, дыхательной или эндокринной системы, декомпенсированная и субкомпенсированная полиорганная недостаточность, некорригируемая коагулопатия, нарушения мозгового кровообращения, нестабильная стенокардия; 3) ожидаемый срок жизни менее 1 года; 4) рак легкого и операции на легких в анамнезе.
Способ применен у 103 участников - 68 (66,0%) мужчин и 35 (34%) женщин. В первой группе было 78 добровольцев с морфологически верифицированным РЛ на различных стадиях распространения процесса. Средний возраст этой группы испытуемых составил 56±10 лет; мужчин в нее вошло - 56 (72%), женщин - 22 (28%). Вторая группа составила 25 добровольцев, не имеющих симптомов и патологии легких по результатам последней флюорографии, среди которых было 12 мужчин (48%) и 13 женщин (52%). Средний возраст во второй группе добровольцев составил 51±12 лет. В целом группы были репрезентативны. Образцы проб выдыхаемого воздуха были собраны согласно хельсинкскому этическому протоколу, выданному в ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, после подписания согласия каждого из участников. Изначально (n=38) среднее время диагностики при использовании предлагаемого способа составляло 14,5 минут (от 8 до 27 мин.), в связи с тем, что анализировалось 6 выдохов в течение 10 секунд при скорости выходного потока из ячейки 2 л/мин (по 2 параллельных измерения на 3 температурных режима). Однако, статистически не значимый разброс значений откликов параллельных измерений (2-15%; р>0,5) в последующем позволил сократить число измерений при каждой температуре до 1 раза (n=65), тем самым уменьшив время анализа до 6,3 мин (5-7 мин).
Усредненные показания 7 сенсоров при 3 разных температурах анализировали как 21 информативный признак. Поскольку распределение разброса среди каждой группы имело логнормальный характер, измеренные значения показаний сенсоров перед анализом по методу главных компонент (МГК) предварительно логарифмировались.
График счетов первых двух главных компонент (РС1 и РС2), описывающих более 83% объясненной дисперсии продемонстрировал статистически значимое разделение группы больных и участников контрольной группы по второй главной компоненте (РС2). Наибольшим вкладом в вариацию значений РС2 обладали сенсоры на предельные углеводороды (S1, S2) и сенсоры на -ОН группы (S5, S6, S7) при всех трех температурах. В пространстве первых трех главных компонент, объясняющих 90,8% дисперсии, была построена модель-классификатор с помощью метода линейного дискриминантного анализа (ЛДА), массив полученных данных был разбит на два набора: обучающий набор (nконтр.=12; nбольных.=34), и тестовый набор использовавшийся для проверки (nконтр.=13; nбольных=45).
Далее была проведена процедура перекрестной проверки для тестового набора, таким образом, каждый из образцов тестового набора был классифицирован, чтобы определить, является ли результат истинным положительным (ИП), ложно положительным (ЛП), истинно отрицательным (ИО) или ложно отрицательным (ЛО). Качество полученного классификатора проверялось путем расчета чувствительности (ИП/(ИП+ЛО)*100%), специфичности ((ИО/ИО+ЛП)*100%) и точности ((ИП+ИО) / размер выборки*100%).
Показатели чувствительности, специфичности и точности при анализе проб выдыхаемого воздуха составили 91,2%, 100% и 93,4% соответственно.
В качестве цитологических критериев РЛ использовались клеточные, структурные и функциональные признаки. Так, для плоскоклеточного ороговевающего РЛ были свойственны следующие клеточные признаки: 1) резкий полиморфизм; 2) гиперхромия центрально расположенных ядер; 3) низкое ядерно-цитоплазматическое соотношение. Для плоскоклеточного неороговевающего рака: 1) клетки с крупными гиперхромными ядрами и крупными нуклеолами; 2) атипические митозы; 3) высокое ядерно-цитоплазматическое соотношение. Для аденокарцином - ядерно-цитоплазматическая полярность, а для мелкоклеточного рака 1) полигональные гиперхромные клетки и 2) нечеткие ядрышки, скудная цитоплазма.
Структурными признаками плоскоклеточного неороговевающего рака легкого были 1) однослойные структуры; 2) межклеточные мостики, а ороговевающего еще и раковые жемчужины. Для аденокарцином были свойственны железистоподобные структуры, а для мелкоклеточного рака -конгруэнтные поверхности клеток.
Функциональными признаками плоскоклеточного ороговевающего РЛ были: 1) уплотненная цитоплазма с двойным контуром; 2) кератогиалинизированные структуры. Для плоскоклеточного неороговевающего рака свойственно отсутствие двойного контура цитоплазмы и чешуек. При аденокарциномах наблюдалась слизь в цитоплазме и в просвете структур. При мелкоклеточном раке наблюдалось отсутствие плоскоклеточной и железистой дифференцировки.
При цитологическом исследовании образцов мокроты результаты сведены в 5 групп: 1) без патологии - 12 (11,7%) участников; 2) гиперплазия (базально-клеточная и бокаловидных клеток) - 14 (13,6%) участников; 3) метаплазия (плоскоклеточная метаплазия без атипии клеток и атипическая плоскоклеточная метаплазия бронхиального эпителия) - 11 (10,7%) участников; 4) дисплазия подозрительная в отношении перехода в рак - 35 (34%) участников; 5) обнаружены клетки рака - 31 (30,1%) участник. Таким образом, обоснованные подозрения на рак легкого, по сумме 4 и 5 групп, при цитологическом исследовании высказаны у 66 участников (64,1%). После сопоставления результатов метода цитологического исследования мокроты с окончательными данными диагностики и морфологической верификации чувствительность его составила 38,2%, при высокой специфичности - 97,2%.
В итоге было показано, что совместное использование определения состава выдыхаемого воздуха неселективным методом анализа летучих органических соединений с использованием металлооксидных сенсоров с перекрестной чувствительностью и цитологического исследования мокроты по сравнению с изолированным использованием анализа выдыхаемого воздуха, позволяет статистически значимо (р=0,03) повысить чувствительность до 96,8% (95%CI:80,9%-99%) против 91,2% (95%CI:84%-96%), с некоторым допустимым снижением специфичности - 93,4% (95%CI:88%-96%) против 100% (95%CI:98%-100%).
Способ осуществляют, например, следующим образом.
Пациентам рекомендуется не принимать пищу и не курить как минимум за час до обследования. Непосредственно перед обследованием пациент должен прополоскать ротовую полость теплой водой.
Первым этапом производят отбор проб выдыхаемого воздуха следующим образом. Для анализа выдыхаемого воздуха используют неселективную мультисенсорную систему «электронный нос (E-nose)» на основе массива из 7 металлооксидных сенсоров, разработанную в лаборатории ФГАОУВО «Санкт-Петербургский национальный исследовательский университет информационных технологий, механики и оптики».
Последовательно устанавливают температуру сенсоров до 350°, 400° и 450°С. На каждой из 3 температурных площадок дожидаются установления показаний сенсоров. Пациент осуществляет каждый выдох в течение 10 секунд через стерильный загубник. Последовательно проводят измерения при температурах сенсоров 350°С, 400°С и 450°С.
Для анализа выдыхаемого воздуха реализуют схему непосредственных единовременных одномоментных «online» измерений, поскольку это позволяет устранить появление неконтролируемых систематических погрешностей, связанных с дополнительными процедурами отбора проб и существенно увеличивает производительность анализа. Для устранения эффекта памяти, связанного с десорбцией летучих органических соединений (ЛОС) со стенок ячейки и воздушных трактов установлен насос, который продувает воздушные тракты и ячейку с постоянной скоростью (1 л/мин), обеспечивая отсутствие дрейфа базовой линии сигнала сенсоров. Стоит подчеркнуть, что в онлайн режиме все измерения проводят относительно того уровня экзогенных ЛОС, который присутствует в атмосфере помещения. Это достигается за счет продувки ячейки нефильтрованным воздухом, поэтому можно отказаться от использования предварительной процедуры «очистки» легких - когда испытуемому перед измерением дают подышать фильтрованным воздухом в течение 3-5 минут. Такой способ существенно упрощает анализ и нивелирует нежелательный вклад экзогенных ЛОС.
В неравновесных условиях измерения для минимизации ошибки анализа, связанной с влиянием на регистрируемый сигнал скорости выдоха, в схему включают ротаметр, позволяющий контролировать скорость выдоха. Пациент в течение 10 секунд непрерывно выдыхает через стерильный загубник со средней скоростью 3,5 литра/мин. Таким образом, объем пробы для одного измерения составляет примерно 600 мл.
Вторым этапом осуществляют сбор мокроты без индукции для цитологического исследования в контейнеры объемом 50 мл, содержащие 25 мл фиксатора. Затем образцы помещают в холодильник (температурный режим от +2° до +8°С) на срок не более 5 дней перед дальнейшей обработкой. Из полученных образцов готовят 2 стекла для традиционного цитологического исследования, которые окрашивают гематоксилином и эозином. Окраска включает использование основного красителя гематоксилина, окрашивающего базофильные клеточные структуры ярко-синим цветом, и спиртового кислого красителя эозина, окрашивающего эозинофильные структуры клетки красно-розовым цветом. Базофильные структуры, как правило, содержат нуклеиновые кислоты (ДНК и РНК): клеточное ядро, рибосомы и РНК-богатые участки цитоплазмы. Эозинофильные структуры содержат внутри- и внеклеточные белки, например, тельца Леви. Цитоплазма является эозинофильной средой. Приготовленные препараты сушат при комнатной температуре в течение 15 минут. Непосредственно перед окрашиванием высушенные мазки фиксируют в 96° спирте 7 минут, промывают водой и высушивают. Окраску проводят гематоксилином Майера 20 минут, с ополаскиванием и последующим погружением (отсиниванием) на 15-20 минут в водопроводную воду. Мазки вновь окрашивают 0,25% раствором эозина, приготовленным из 1% основного раствора эозина, в течение 15 секунд. Промывают в воде и высушивают. Работа цитолога в основном ведется в светлом поле на объективах 40х, 60х и 100х. В стандартный набор объективов включены объективы планахромат 4х, 10х, 40х, 60х, 100xOil. Удобной опцией является промежуточный объектив планахромат 60х, который дает большее поле зрения и детализацию, чем традиционный объектив 100х, но при этом не требует иммерсионного масла для работы.
Способ подтверждается следующими клиническими примерами.
Пример 1. Больной М., 58 лет. Жалобы при поступлении на тяжесть в грудной клетке справа. Клинический диагноз: периферический рак левого верхнедолевого бронха T2bN0M0; IIA стадия. Диагноз подтвержден рентгенологически (при МСКТ органов грудной полости) и морфологически (трансторакальная трепан-биопсия; высокодифференцированная аденокарцинома).
При использовании заявляемого способа получены следующие данные: цитологически - выраженная дисплазия бронхиального эпителия, с подозрением на рак; при анализе выдыхаемого воздуха - статистически значимое (р=0,007) отличие площади пиков на отпечатке дыхания от контрольной группы, продолжительность исследования - 12 минут.
Пример 2. Больной К., 67 лет. Жалоб не было. При профилактической флюорографии выявлены изменения в правом легком. Диагноз: периферический рак правого нижнедолевого бронха cT1N0M0; Iв стадия. Диагноз подтвержден мультимодально - рентгенологически (при МСКТ органов грудной полости) и эмиссионно (ОФЭКТ-КТ). При морфологическом исследовании (бронхобиопсия) - умеренно дифференцированный плоскоклеточный рак.
При использовании заявляемого способа получены следующие данные: цитологически - метаплазия бронхиального эпителия. При анализе выдыхаемого воздуха - статистически значимое (р=0,003) отличие площади пиков на отпечатке дыхания от контрольной группы. Продолжительность исследования - 8,5 минут.
Пример 3. Больной Д., 56 лет. Жалобы при поступлении на сухой кашель. Диагноз: центральный рак левого верхнедолевого бронха; pT2bN1M0; IIв стадия. Диагноз подтвержден рентгенологически (при МСКТ органов грудной полости) и морфологически (бронхобиопсия) - плоскоклеточный рак.
При использовании заявляемого способа получены следующие данные: цитологически - клетки плоскоклеточного рака на фоне дисплазии бронхиального эпителия. При анализе выдыхаемого воздуха - статистически значимое (р=0,005) отличие площади пиков на отпечатке дыхания от контрольной группы, продолжительность исследования - 5,8 минут.
Таким образом, заявляемый способ, включающий определение состава выдыхаемого воздуха неселективным методом анализа летучих органических соединений с использованием металлооксидных сенсоров с перекрестной чувствительностью и цитологическое исследование мокроты, может быть использован для ранней диагностики рака легкого. Доказаны статистически значимые различия показателей чувствительности и специфичности между больными раком легкого и здоровыми участниками при использовании онлайн режима анализа. Небольшое время, необходимое для реализации способа (среднее время 6,3 мин.) и возможность измерений в реальном времени (онлайн) являются ключевыми моментами при дальнейшем перспективном его использовании в скрининговых программах диагностики рака легких.
Способ позволяет повысить точность неинвазивного раннего выявления злокачественных опухолей органов грудной полости.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ СКРИНИНГА НА РАК ЛЕГКИХ | 2023 |
|
RU2817246C1 |
| СПОСОБ НЕИНВАЗИВНОЙ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ЗАБОЛЕВАНИЙ ОРГАНОВ ДЫХАТЕЛЬНОЙ СИСТЕМЫ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2021 |
|
RU2760396C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ЗАБОЛЕВАНИЙ БРОНХОЛЕГОЧНОЙ СИСТЕМЫ | 1995 |
|
RU2117290C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ИНДИВИДУАЛЬНОГО РИСКА ФОРМИРОВАНИЯ ПЛОСКОКЛЕТОЧНОГО РАКА ЛЕГКОГО НА ОСНОВЕ АНАЛИЗА МИКРОБИОМА МОКРОТЫ | 2020 |
|
RU2771855C2 |
| ГАЗОВАЯ СЕНСОРНАЯ ЯЧЕЙКА ДЛЯ НЕИНВАЗИВНОГО АНАЛИЗА ВЫДЫХАЕМОГО ЧЕЛОВЕКОМ ВОЗДУХА | 2022 |
|
RU2787244C1 |
| СПОСОБ КОМБИНИРОВАННОГО ЭНДОСКОПИЧЕСКОГО КОНТРОЛЯ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ ТРАХЕИ И/ИЛИ БРОНХОВ | 2008 |
|
RU2365339C1 |
| СПОСОБ ДИАГНОСТИКИ РАКА ЛЕГКОГО | 1993 |
|
RU2088926C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ЦЕРВИКАЛЬНЫХ ДИСПЛАЗИЙ И РАКА ШЕЙКИ МАТКИ | 2012 |
|
RU2538618C2 |
| Способ диагностики рака легкого по анализу выдыхаемого пациентом воздуха на основе анализа биоэлектрических потенциалов обонятельного анализатора крысы | 2017 |
|
RU2666873C1 |
| БЛОК ДЕТЕКТИРОВАНИЯ ЛЕТУЧИХ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ В СОСТАВЕ ВЫДЫХАЕМОГО ЧЕЛОВЕКОМ ВОЗДУХА | 2024 |
|
RU2831639C1 |
Настоящее изобретение относится к медицине, а именно к способу скрининга злокачественных опухолей органов грудной полости, включающему определение состава выдыхаемого воздуха неселективным методом анализа летучих органических соединений с использованием металлооксидных сенсоров с перекрестной чувствительностью, отличающемуся тем, что анализ летучих органических соединений осуществляют с одновременным использованием 7 металлооксидных хеморезисторных газовых сенсоров при последовательно устанавливаемых температурах 350, 400 и 450°С и дополнительно проводят цитологический анализ мокроты с изготовлением и микроскопическим исследованием 2 микропрепаратов, которые окрашивают гематоксилином и эозином, и при выявлении в отклике сенсоров на состав выдыхаемого воздуха статистически значимых отличий от контрольных значений, определенных заранее для используемых сенсоров, и одновременном обнаружении в микропрепаратах дисплазии и клеток рака диагностируют злокачественную опухоль. Настоящее изобретение обеспечивает повышение точности неинвазивного раннего выявления злокачественных опухолей органов грудной полости. 5 ил.
Способ скрининга злокачественных опухолей органов грудной полости, включающий определение состава выдыхаемого воздуха неселективным методом анализа летучих органических соединений с использованием металлооксидных сенсоров с перекрестной чувствительностью, отличающийся тем, что анализ летучих органических соединений осуществляют с одновременным использованием 7 металлооксидных хеморезисторных газовых сенсоров при последовательно устанавливаемых температурах 350, 400 и 450°С и дополнительно проводят цитологический анализ мокроты с изготовлением и микроскопическим исследованием 2 микропрепаратов, которые окрашивают гематоксилином и эозином, и при выявлении в отклике сенсоров на состав выдыхаемого воздуха статистически значимых отличий от контрольных значений, определенных заранее для используемых сенсоров, и одновременном обнаружении в микропрепаратах дисплазии и клеток рака диагностируют злокачественную опухоль.
| Wu G | |||
| et al | |||
| Clinical value of liquid-based cytologic test in sputum examination of patients with lung cancer / Zhongguo Fei Ai Za Zhi, 2006, Vol.9, N.2, pp.192-195 | |||
| Behera B | |||
| et al | |||
| Electronic nose: a non-invasive technology for breath analysis of diabetes and lung cancer patients / J Breath Res, 6.03.2019 Mar Vol.13, N.2, pp.1-41 | |||
| СПОСОБ ОБНАРУЖЕНИЯ НЕОПЛАСТИЧЕСКИХ ЗАБОЛЕВАНИЙ ИСХОДЯ ИЗ СОЛЮБИЛИЗИРОВАННОГО ФИЗИОЛОГИЧЕСКОГО ОБРАЗЦА | 2004 |
|
RU2405158C2 |
Авторы
Даты
2019-11-22—Публикация
2019-04-24—Подача