Изобретение относится к биохимии и медицине и представляет собой фармацевтическую композицию, которая обеспечивает эффективную доставку тетрапептида [Acetyl]-His-Ala-Glu-Glu-[Amide] (HAEE), используемого в качестве лекарственной субстанции, через гематоэнцефалический барьер (ГЭБ) для лечения нейродегенеративных заболеваний, включая деменцию Альцгеймеровского типа (болезнь Альцгеймера). Авторами настоящего изобретения показано, что указанная композиция позволяет резко улучшить фармакокинетические характеристики и увеличить биодоступность лекарственной субстанции HAEE, что может значительно усилить терапевтический эффект от ее применения за счет предупреждения образования амилоидных бляшек путем полимеризации или агрегации в-амилоидных пептидов.
Болезнь Альцгеймера (далее БА) является самой распространенной нейродегенеративной патологией в мире и клинически сопровождается неуклонным снижением когнитивных функций (Гаврилова С.И. (2007). Фармакотерапия болезни Альцгеймера. Москва: Пульс.). Наследственные варианты болезни Альцгеймера составляют менее 1% всех случаев этой патологии и ассоциированы с мутациями в генах (Rogaev E.I., Sherrington R., Rogaeva E.A., Levesque G., Ikeda M., Liang Y., Chi H., Lin C., Holman K., Tsuda T., and Et Al. (1995) Familial Alzheimer's disease in kindreds with missense mutations in a gene on chromosome 1 related to the Alzheimer's disease type 3 gene. Nature. 376, 775-778), приводящими к конституциональному превышению физиологически нормального уровня бета-амилоида (Aβ), – короткого гетерогенного по С-концу полипептида длиной 39-43 аминокислотных остатков (Querfurth H.W., and Laferla F.M. (2010) Alzheimer's Disease. New England Journal of Medicine. 362, 329-344). Причины возникновения спорадических вариантов БА, которые охватывают более 95% пациентов, остаются неизвестными, но тесно связаны с аномальной агрегацией эндогенного Aβ. Существует три главных нейроморфологических признака, которые однозначно подтверждают (посмертно) диагноз для всех вариантов БА: - наличие в специфических отделах головного мозга характерных внеклеточных агрегатов, т.н. амилоидных бляшек, основными компонентами которых являются различные изоформы Aβ и ионы биометаллов цинка, а также меди и железа,
- внутриклеточные нейрофибриллярные клубки, где главный компонент – гиперфосфорилированный белок тау,
- дегенерация нейронов (Cummings J.L. (2004) Alzheimer's Disease. New England Journal of Medicine. 351, 56-67.). В настоящее время доступно лишь симптоматическое лечение БА, направленное на преодоление нейротрансмиттерного дефицита и замедляющее в среднем на 1-3 года переход пациента из относительно самостоятельного в абсолютно беспомощное состояние (Cummings J., Morstorf T., and Zhong K. (2014) Alzheimer's disease drug-development pipeline: few candidates, frequent failures. Alzheimer's Research & Therapy. 6, 37).
В патенте РФ № 2414925, публ.27.03.2011 представлено применение терапевтического человеческого альбумина для изготовления лекарственного средства для лечения пациентов, страдающих когнитивными расстройствами путем терапевтической плазмафильтрации. При этом, альбумин присутствует в среде замены при концентрации от 4% вплоть до 25 мас.%/об. При некоторых применениях альбумин присутствует при концентрации примерно от 4,5% до 5,5 мас.%/об. Причем независимо от концентрации бета-амилоида в крови, при применении терапевтической плазмафильтрации и замены объема нормоволемии альбумина с определенной частотой терапии происходит увеличение объема гиппокампа, которому сопутствует улучшение клинических симптомов болезни Альцгеймера. Это может быть следствием факторов, которые являются растворимыми и проницаемыми через гематоэнцефалический барьер. Однако способ плазмафильтрации часто вызывает осложнения и применим не для всех категорий пациентов.
Согласно широко принятой «амилоидной гипотезе», превращение физиологически нормального Aβ из мономерного состояния в растворимые нейротоксичные олигомеры, а затем в нерастворимые полимерные агрегаты, которые в конце концов накапливаются в виде амилоидных бляшек, является пусковым процессом патогенеза БА (Karran E., Mercken M., and De Strooper B. (2011) The amyloid cascade hypothesis for Alzheimer's disease: an appraisal for the development of therapeutics. Nat Rev Drug Discov. 10, 698-712.). Поэтому предотвращение церебрального амилоидогенеза путем ингибирования патологической олигомеризации Aβ, т.н. анти-амилоидная терапия, считается наиболее перспективной стратегией лечения БА (Schenk D., Basi G.S., and Pangalos M.N. (2012) Treatment Strategies Targeting Amyloid β-Protein. Cold Spring Harbor Perspectives in Medicine.). Было найдено, что синтетический пептид HAEE специфически связывается с металл-связывающим доменом 1-16 Aβ по участку 11-14, блокирует цинк-индуцированную димеризацию домена и замедляет агрегацию полноразмерного Aβ in vitro (Tsvetkov P.O., Cheglakov I.B., Ovsepyan A.A., Mediannikov O.Y., Morozov A.O., Telegin G.B., and Kozin S.A. (2015) Peripherally Applied Synthetic Tetrapeptides HAEE and RADD Slow Down the Development of Cerebral beta-Amyloidosis in AbetaPP/PS1 Transgenic Mice. J Alzheimers Dis. 46, 849-853). Внутривенные инъекции пептида HAEE замедляли развитие церебрального амилоидогенеза у мышей линии B6C3-Tg(APPswe, PSEN1-dE9)85Dbo/j, которые используются в качестве животной модели БА: среднее число амилоидных бляшек на срезе мозга уменьшалось с 14.2 ± 3.1 (для контрольных животных) до 5.8 ± 2.1 (для животных, подвергнутых терапевтическому воздействию) (Tsvetkov P.O., Cheglakov I.B., Ovsepyan A.A., Mediannikov O.Y., Morozov A.O., Telegin G.B., and Kozin S.A. (2015) Peripherally Applied Synthetic Tetrapeptides HAEE and RADD Slow Down the Development of Cerebral beta-Amyloidosis in AbetaPP/PS1 Transgenic Mice. J Alzheimers Dis. 46, 849-853.). По этому показателю эффективность препарата HAEE значительно превосходит анти-амилоидное действие Alzhemed (Tramiprosate) - одного из самых известных анти-агрегационных лекарственных кандидатов для лечения болезни Альцгеймера (Aisen P.S., Gauthier S., Ferris S.H., Saumier D., Haine D., Garceau D., Duong A., Suhy J., Oh J., Lau W.C., and Sampalis J. (2011) Tramiprosate in mild-to-moderate Alzheimer's disease - a randomized, double-blind, placebo-controlled, multi-centre study (the Alphase Study). Arch Med Sci. 7, 102-111.). При использовании Alzhemed в трансгенных мышах линии TgCRND8 происходило уменьшение числа амилоидных бляшек на 30% по сравнению с контрольными животными (Gervais F., Paquette J., Morissette C., Krzywkowski P., Yu M., Azzi M., Lacombe D., Kong X., Aman A., Laurin J., Szarek W.A., and Tremblay P. (2007) Targeting soluble Aβ peptide with Tramiprosate for the treatment of brain amyloidosis. Neurobiology of Aging. 28, 537-547.). Таким образом, в настоящее время пептид HAEE является одним из самых эффективных антиамилодных препаратов в мире (Goyal D., Shuaib S., Mann S., and Goyal B. (2017) Rationally Designed Peptides and Peptidomimetics as Inhibitors of Amyloid-β (Aβ) Aggregation: Potential Therapeutics of Alzheimer’s Disease. ACS Combinatorial Science. 19, 55-80.). Молекулярный механизм антиамилоидного действия тетрапептида HAEE хорошо установлен (Козин С.А., Барыкин Е.П., Митькевич В.А., Макаров А.А. (2018) Антиамилоидная терапия болезни Альцгеймера: современное состояние и перспективы. Биохимия. 83, 1331-1342.), и для оказания своего терапевтического воздействия эта субстанция должна проникать сквозь гематоэнцефалический барьер (ГЭБ).
Из уровня техники известно изобретение с целью лечения нейродегенеративных заболеваний, в частности болезни Альцгеймера, имеющее отношение к новому пептидному соединению Ra-R1-R2-R3-R4-Rb (I) или Ra-R4-R3-R2-R1-Rb (II), где Ra представляет собой N-концевую первичную аминную группу аминокислоты R1 или R4, либо свободную, либо замещенную аминозащитной группой, Rb представляет собой гидроксильную группу С-концевой карбоксильной группы аминокислоты R1 или R4, либо свободную, либо замещенную гидроксизащитной группой, и R1-R2-R3-R4 или R4-R3-R2-R1 представляют собой HADD, KADD, DDAK, RADD, DDAR, KAED, DEAK, RAED, DEAR, HADE, EDAH, KADE, EDAK, RADE, EDAR, HAEE, EEAH, KAEE, EEAK, RAEE и EEAR, главным образом используемому для связывания с в-амилоидными пептидами и/или предотвращения или уменьшения образования амилоидных бляшек, главным образом за счет ингибирования полимеризации вышеупомянутого амилоидного пептида в виде амилоидных бляшек. Причем, предпочтительно пептидное соединение, соответственно данному изобретению, выбрано из соединений с формулой (I) или (II), где R1-R2-R3-R4 или R4-R3-R2-R1, представлено одним из двух тетрапептидов HAEE и RADD. Наиболее предпочтительные пептидные соединения соответствуют формулам Ac-HAEE-NH2 и Ac-RADD-NH2. Также описана композиция для снижения или предотвращения связывания ионов Zn (II) с в-амилоидным пептидом, содержащая в качестве активного вещества указанное пептидное соединение, степень чистоты которого составляет по меньшей мере 98%, и фармацевтически приемлемый носитель для парентерального, чрескожного или чресслизистого введения. (патент РФ № 2588143 от 24.10.2011года, правообладатель КИМОНЕЛЛА ВЕНЧЕРС ЛТД (CY)).
Однако известно, что короткие заряженные пептиды типа HAEE имеют очень короткое время жизни в плазме крови (от нескольких секунд до нескольких минут) и с трудом проходят через ГЭБ, что существенно ослабляет эффективность их терапевтического воздействия (Fosgerau K., and Hoffmann T. (2015) Peptide therapeutics: current status and future directions. Drug Discovery Today. 20, 122-128; Wade J., and Otvos L. (2014) Current Challenges in Peptide-based Drug Discovery. Frontiers in Chemistry. 2.).
Задачей изобретения является создание фармацевтической композиции для лечения нейродегенеративных заболеваний с улучшенными фармакокинетическими характеристиками на основе субстанции HAEE.
Технический результат - увеличение биодоступности активной субстанции - пептида HAEE в мозге в пять раз за счет повышенной способности проходить ГЭБ; увеличение времени полувыведения субстанции HAEE из организма в два раза; улучшение когнитивных функций экспериментальных животных на 20%.
Поставленная задача достигается тем, что фармацевтическая композиция, предназначенная для лечения нейродегенеративных деменций, в том числе болезни Альцгеймера, содержит эффективное количество субстанции HAEE в эквимолярном комплексе с цинком и человеческим сывороточным альбумином (HAEE-Zn-HSA) в форме раствора для внутривенного введения с фармацевтически приемлемым носителем, выбранным из круга нейтральных носителей и разбавителей.
Известно, что альбумин обеспечивает транспорт ряда пептидов, включая бета-амилоид, через ГЭБ (Boada M., Anaya F., Ortiz P., Olazaran J. (2017) Efficacy and Safety of Plasma Exchange with 5% Albumin to Modify Cerebrospinal Fluid and Plasma Amyloid-в Concentrations and Cognition Outcomes in Alzheimer's Disease Patients: A Multicenter, Randomized, Controlled Clinical Trial. Journal of Alzheimer's disease : JAD. 56, 129-143.) и образует стабильный комплекс с одним ионом цинка (Blindauer C.A., Harvey I., Bunyan K.E., Stewart A.J., Sleep D., Harrison D.J., Berezenko S., and Sadler P.J. (2009) Structure, Properties, and Engineering of the Major Zinc Binding Site on Human Albumin. Journal of Biological Chemistry. 284, 23116-23124.).
Неожиданно было обнаружено, что HAEE образует специфический эквимолярный комплекс с цинк-связанным альбумином - HAEE-Zn-HSA.
Авторами настоящего изобретения экспериментально доказано, что заявленная композиция HAEE-Zn-HSA в форме раствора для внутривенного введения, где фармацевтически приемлемым носителем является, например, физиологический раствор, по сравнению с чистым тетрапептидом HAEE позволяет при внутривенном введении экспериментальным животным:
˗ в два раза увеличить время полувыведения HAEE из организма;
˗ в пять раз увеличить биодоступность этой субстанции в мозге;
˗ на 20% улучшить когнитивные функции экспериментальных животных.
Следовательно, заявленное изобретение соответствует условию новизны и изобретательского уровня.
Изобретение иллюстрируется следующими фигурами.
Фиг. 1 - Фармакокинетические кривые «концентрация - время» в крови крыс, однократное внутривенное введение в дозах 50, 300 и 900 мкг/кг, где:
А - зависимость концентрация-время в прямых координатах;
Б - представление данных в полулогарифмических координатах. Сплошные линии - аппроксимация экспериментальных данных уравнениями убывающей биэкспоненциальной зависимости в диапазоне 4-30 мин (двухкомпартментная модель). Пунктирные линии – результаты линеаризации экспоненциальных участков кривой (10-30 мин; моноэкспоненциальная зависимость) для расчета ряда фармакокинетических параметров.
Фиг.2 - Зависимость значений максимальной концентрации препарата HAEE в крови (Сmax) и кажущейся максимальной концентрации пептида на экспоненциальном участке кривой концентрация-время (В), площади под фармакокинетической кривой от 0 до 30 минут (AUC(0-30)) и от 0 до бесконечности (AUC(0-∞)) в зависимости от дозы препарата при однократном внутривенном введении препарата HAEE крысам (средняя масса –350 г), где А – AUC(0-30); Б – AUC(0-∞); В– Сmax; Г – В (кажущаяся максимальная концентрация пептида на экспоненциальном участке кривой концентрация-время).
Фиг. 3 – Фармакокинетические кривые «концентрация HАЕЕ - время» в крови кролика, внутривенное введение в дозе 0,12 мг/кг, где А - Зависимость концентрация-время в прямых координатах; Б - Представление данных в полулогарифмических координатах.
Фигура 4 - Концентрация препарата HAEE в крови в зависимости от времени.
Фигура 5 – Результаты теста «Водный лабиринт Морриса». (* - p<0.05 в сравнении с 1-м днем тестирования для группы HAEE в сравнении с контрольными группами (интактные трансгенные мыши и мыши дикого типа; U-testMann–Whitney, n=10 для каждой группы).
Приведенные ниже примеры являются подтверждением соответствия заявленного изобретения условию промышленной применимости.
ПРИМЕР 1. Экспериментальное свидетельство способности HAEE образовывать стабильные цинк-опосредованные межмолекулярные комплексы с человеческим альбумином.
При экспериментальных процедурах для приготовления водных растворов (если не указано другое) использовался коммерчески доступный лиофилизированный препарат тетрапептида синтетического HAEE (чистота более 98%).
Образование межмолекулярных комплексов между HAEE (аналитом) и иммобилизованным на поверхности биосенсорного чипа человеческим альбумином (лигандом) в отсутствии и в присутствии ионов цинка в количестве 100 микромолей/Литр в буферной системе, было исследовано с помощью биосенсора на эффекте поверхностного плазмонного резонанса (БППР) «BIAcore 3000» (GE Healthcare, США) в водных буферных системах при физиологических значениях pH. По результатам таких экспериментов рассчитывается значение константы диссоциации (Кд) взаимодействия растворимого аналита и иммобилизованного лиганда. Если значение Кд равно или меньше 10-4 М, то такое взаимодействие рассматривается в качестве биологически значимого.
Сенсорный чип CM5 с гидрофильной карбоксиметилированной декстрановой матрицей, подходящий буфер HBS (10 мМ HEPES, pH 7.4, 150 мМ NaCl, 3 мМ EDTA, 0.005% ПВА P20), 1-ethyl-3-(3-dimethylaminopropyl)-25 carbodiimide (EDC), N-hydroxysuccinimide (NHS), 2-(2-pyridinyldithio)-ethaneamine (PDEA), используемые в анализах, были закуплены у компании-производителя (BIAcore, GE, USA). Иммобилизация лиганда проводилась в соответствие с протоколами компании-производителя и с использованием соответствующих рабочих растворов. БППР эксперименты были проведены на инструменте «BIAcore 3000» (GE Healthcare, США). Человеческий альбумин (ЧА) был использован в качестве лиганда, который иммобилизировали через свободные аминогруппы по стандартному протоколу производителя. Для получения сенсограмм в отсутствии и в присутствии ионов цинка в количестве 100 микромолей/Литр концентрации образцов растворов HAEE (аналита) были 0, 2, 5, 10, 15 и 20 микромолей/Литр. После математической обработки полученного набора сенсограмм была установлена константа диссоциации образующихся комплексов между аналитом и лигандом.
На основании полученных данных было найдено, что константа диссоциации цинк-опосредованных взаимодействий между HAEE и иммобилизованным ЧА составляет 8.3 ± 0.7Ч10-7 M. При этом в отсутствии ионов цинка взаимодействия между HAEE и ЧА не наблюдалось. Таким образом, доказано образование стабильных межмолекулярных комплексов между человеческим альбумином и тестируемым пептидом в присутствии ионов цинка. Следовательно, тетрапептид HAEE согласно изобретению представляет собой субстанцию, способную образовывать стабильный межмолекулярный комплекс с цинк-связанным человеческим альбумином.
ПРИМЕР 2. Приготовление фармацевтической композиции HAEE-Zn-HSA.
В соответствии с настоящим изобретением фармацевтическая композиция HAEE-Zn-HSA в подходящей водной буферной системе, в диапазоне значений pH от 4 до 8, в присутствии или в отсутствии различных солей включает в себя эквимолярные количества субстанции HAEE, человеческого альбумина и ионов цинка, например, в форме хлорида цинка ZnCl2. При этом по каждому компоненту допускается отклонения в 20% (по массе). Например, для приготовления фармацевтической композиции HAEE-Zn-HSA, пригодной для проведения доклинических исследований 5 мг HAEE, 600 мг человеческого альбумина и 0,5 мг хлорида цинка (ZnCl2) растворяли в 20 миллилитрах физиологического раствора.
ПРИМЕР 3. Сравнительный анализ фармакокинетики препарата HAEE и субстанции HAEE из состава фармацевтической композиции HAEE-Zn-HSA.
Исследования фармакокинетики препарата HAEE, меченного тритием (радиохимическая чистота более 98%), выполнены на мышах линии C57Bl/6, крысах Wistar и кроликах породы Шиншилла. Определяли значения основных фармакокинетических показателей при однократном и многократном внутривенном введении данных препаратов, проверяли гипотезу линейности, т.е. зависимость значений фармакокинетических показателей от введенной дозы препарата, и изучали распределение субстанции HAEE между кровью и периферическими тканями.
Меченный пептид [3H] HAEE был получен в реакции высокотемпературного твердофазного каталитического изотопного обмена как было описано ранее (Yu.A. Zolotarev, A.K. Dadayan, Yu.A. Borisov, V.S. Kozik, // Solid State Isotope Exchange with Spillover Hydrogen in Organic Compounds. / Chemical Reviews, 2010, 110, 5425–5446).
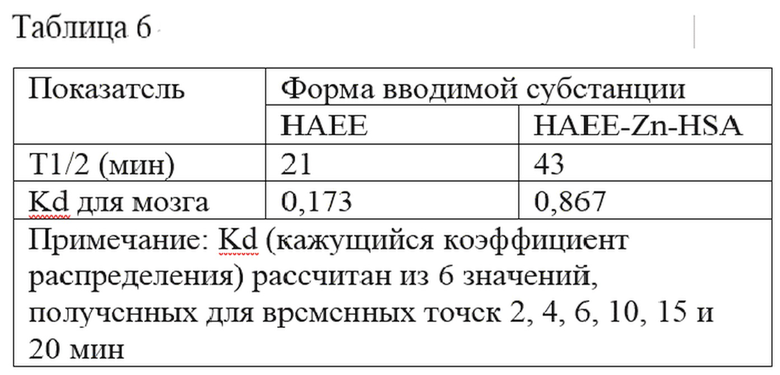
Пример 3.1. Группе крыс (N=6) был однократно внутривенно введен препарат HAEE в дозах 50, 300 и 900 мкг/кг. Отобранные и взвешенные пробы крови и тканей после специальной пробоподготовки подвергали радиохроматографическому анализу с помощью ВЭЖХ. Фармакокинетический профиль субстанции HAEE после однократного внутривенного введения препарата HAEE крысам (N=6) в дозах 50, 300 и 900 мкг/кг приведен на фигуре 1.
Усредненные значения основных фармакокинетических показателей субстанции HAEE после однократного внутривенного введения крысам препарата HAEE в дозах 50, 300 и 900 мкг/кг сведены в таблице 1.
Таблица 1
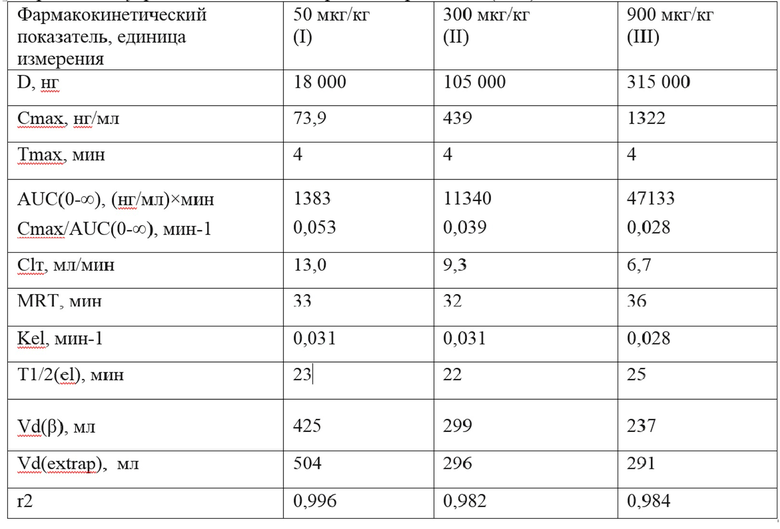
где
AUC0-∞ - площадь под фармакокинетической кривой концентрация-время от нуля до бесконечности;
AUC0-30 - площадь под фармакокинетической кривой «концентрация-время» от нуля до 30 минут;
Clт – общий клиренс (объем плазмы, который очищается от препарата в единицу времени);
Cmax - максимальное измеренное значение концентрации вещества в плазме крови;
Cmax/AUC(0-∞) - относительная скорость всасывания;
D – введенная доза вещества;
fт – тканевая доступность фармакологического средства, fт = AUC(0-20)ткань/AUC(0-20)кровь;
Kd – кажущийся коэффициент распределения фармакологического средства;
Kel - константа скорости выведения вещества из крови;
MRT – среднее время удержания (среднее время пребывания соединения в крови);
N – количество измерений (или количество животных в экспериментальной группе);
r2 – коэффициент детерминации;
T1/2(el) - время полувыведения вещества из крови;
Tmax – время достижения максимальной концентрации вещества в плазме крови;
Th1 - T-лимфоциты хелперы 1 (эффекторы гиперчувствительности замедленного типа);
Vd - кажущийся объем распределения вещества в центральном компартменте.
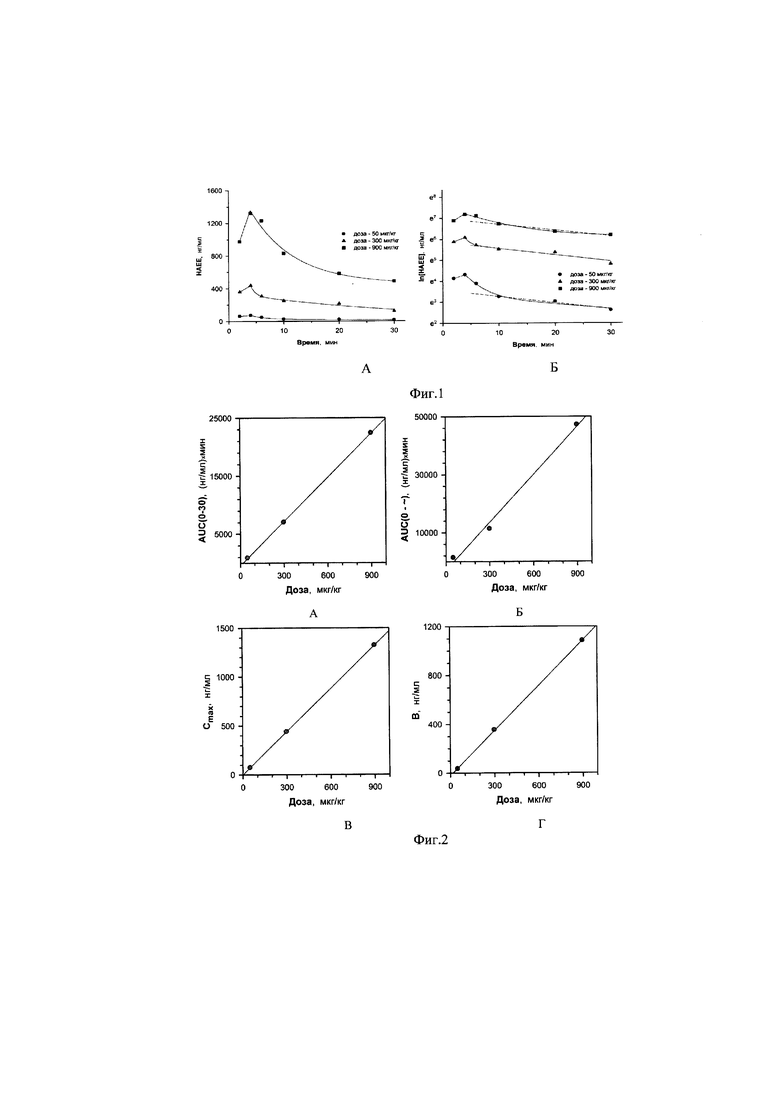
Зависимость параметров, приведенных в таблице 1 от введенной дозы представлена на фигуре 2.
В диапазоне исследованных доз от 50 до 900 мкг/кг фармакокинетика препарата HAEE у крыс имеет дозозависимый линейный характер: значения показателей Cmax и AUC0→∞ возрастают линейно с увеличением дозы изучаемого препарата. При этом, значения фармакокинетических показателей Kel, и T1/2el, полученных в однокомпартментной модели и характеризующих выведение субстанции HAEE из крови крыс, имеют близкие значения для всех исследованных доз препарата HAEE. На основании выявленных линейных зависимостей значений фармакокинетических показателей AUC0-∞ и Cmax от величины введенной дозы сделан вывод о линейности фармакокинетики препарата HAEE у крыс при однократном внутривенном введении.
Пример 3.2.
Многократное внутривенное введение препарата HAEE в дозе 0,3 мг/кг крысам (N=36) через день на протяжении 28 дней.
Результаты усредненных значений фармакокинетических показателей субстанции HAEE после однократного и многократного внутривенного введения крысам препарата HAEE в дозе 0,3 мг/кг и его потенциальной аккумуляции приведены в таблице 2.
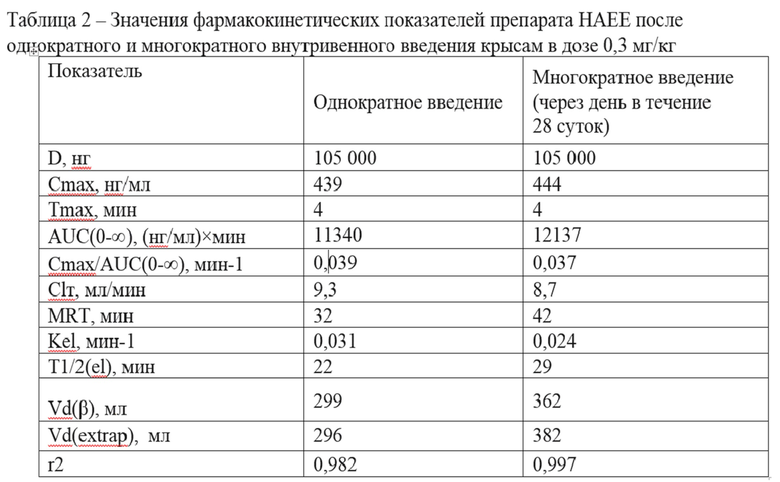
При сравнении значений фармакокинетических показателей субстанции HAEE после однократного и многократного внутривенного введения крысам препарата HAEE в дозе, близкой к терапевтической, не выявлено статистически значимых различий в значениях всех изученных показателей, следовательно, многократное внутривенное введение препарата HAEE не приводит к его аккумуляции и не вызывает изменения профиля фармакокинетики изучаемого препарата относительно его однократного введения.
У крыс при оценке результатов фармакокинетики после однократного внутривенного введения в нескольких дозах продемонстрирована линейность фармакокинетики субстанции HAEE на основании найденных линейных зависимостей фармакокинетических параметров AUC0-∞ и Cmax от величины введенной дозы. Значения периода полувыведения HAEE у крыс составили 22-25 минут в изученных дозах. При оценке результатов фармакокинетики пептида HAEE при многократном введении не выявлено его кумуляции в организме крыс, а также изменения характера фармакокинетики HAEE относительно его однократного введения.
Пример 3.3.
Однократное внутривенное введение препарата HAEE кроликам (N=3) в дозе 0,12 мг/кг.
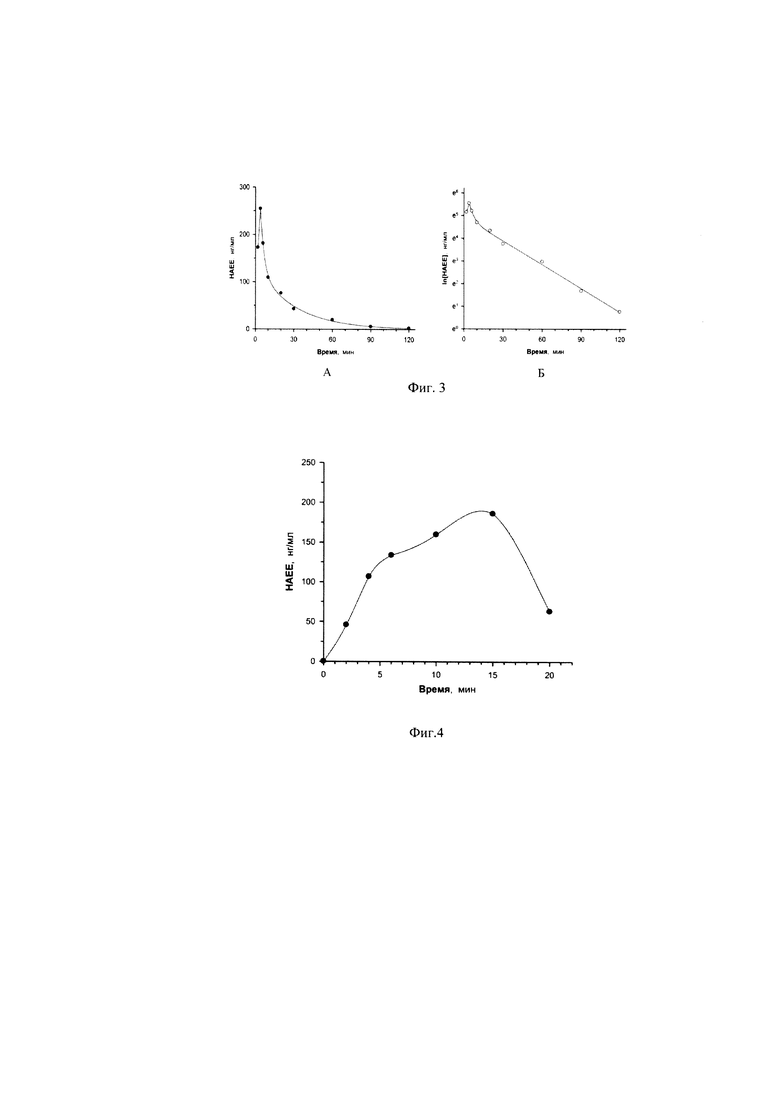
Фармакокинетический профиль пептида HAEE в крови кроликов приведен на фигуре 3.
Усредненные значения основных фармакокинетических показателей субстанции HAEE после однократного внутривенного введения препарата HAEE кроликам в дозе 0,12 мг/кг приведены в таблице 3.
Таблица 3
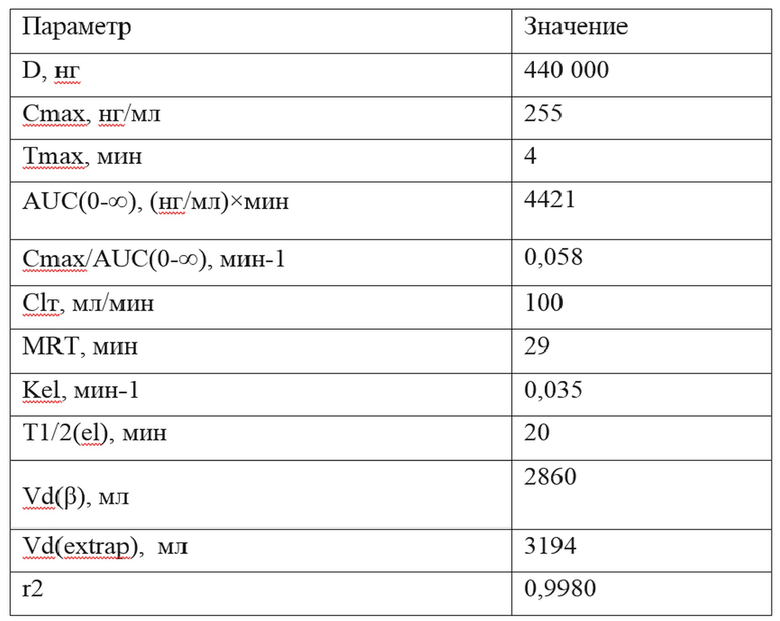
У кроликов максимальная концентрация HAEE (255 нг/мл) в крови отмечается уже через 4 мин после внутривенного введения. Время полувыведения пептида HAEE из крови кролика составляет 20 минут. Субстанция HAEE характеризуется быстрым выведением из крови, которое обусловлено его быстрым распределением по тканям организма с последующим протеолитическим гидролизом.
Пример 3.4.
Однократное внутрибрюшинное введение мышам (N=36) препарата HAEE в дозе 0,3 мг/кг.
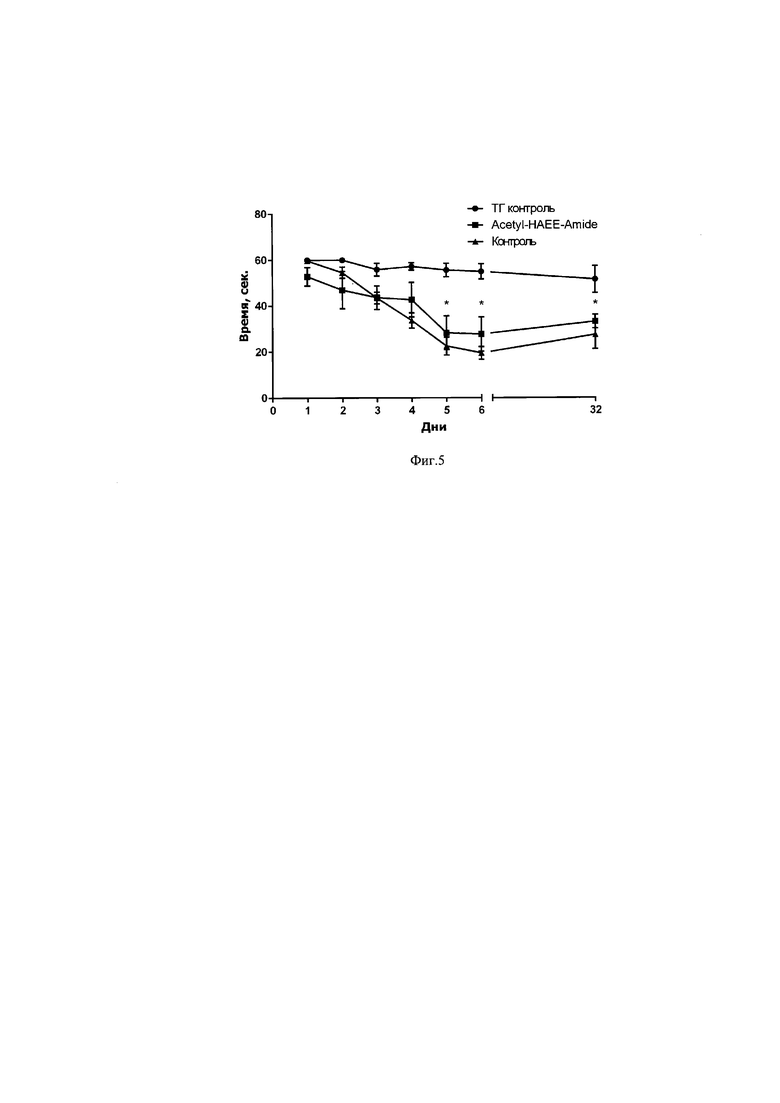
Результаты изучения распределения субстанции HAEE после однократного внутрибрюшинного введения препарата HAEE в дозе 0,3 мг/кг в крови мышей в зависимости от времени приведены на фигуре 4.
Значения концентрации субстанции HAEE в крови и тканях мышей после однократного внутрибрюшинного введения препарата HAEE в дозе 0,3 мг/кг в различных временных точках приведены в таблице 4.
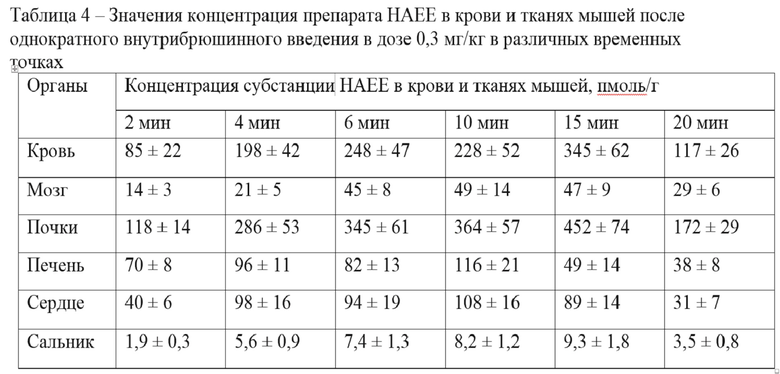
Значения фармакокинетических показателей субстанции HAEE в крови и внутренних органах мышей после однократного внутрибрюшинного введения препарата HAEE в дозе 0,3 мг/кг приведены в таблице 5.

В исследовании распределения субстанции HAEE между кровью и периферическими тканями показано, что его максимальная концентрация зафиксирована в тканях почек мышей. Наименьшая концентрация субстанции HAEE отмечена в жировой ткани сальника. Для всех исследуемых органов изменение концентрации препарата HAEE во времени было пропорционально изменению его уровня в системном кровотоке. Также установлено, что исследуемый препарат способен преодолевать гематоэнцефалический барьер – для ткани мозга кажущийся коэффициент распределения пептида HAEE имел значение Kd = 0,173, где Kd = Сткань / Скровь.
Таким образом, по результатам изучения фармакокинетики препарата HAEE после однократного внутривенного введения крысам в нескольких дозах продемонстрирована линейность его фармакокинетики. При многократном введении препарата HAEE не выявлено его аккумуляции в организме крыс, а также изменения характера фармакокинетики субстанции HAEE относительно его однократного введения. Пептид HAEE характеризуется быстрым выведением из крови, которое обусловлено его быстрым распределением по тканям организма с последующим протеолитическим гидролизом. При оценке распределения между кровью и периферическими тканями мышей показано, что максимальная концентрация субстанции HAEE наблюдалась в тканях почек. Подтверждена способность субстанции HAEE преодолевать гематоэнцефалический барьер.
Пример 3.5.
Исследования фармакокинетики субстанции HAEE из фармацевтической композиции HAEE-Zn-HSA было проведено на мышах при однократном внутрибрюшинном введении данной композиции. В таблице 6 приведено сравнение биодоступности с использованием кажущегося коэффициента распределения для мозга Kd и времени полувыведения T1/2 субстанции HAEE в зависимости от формы инъецированного препарата (препарат HAEE или фармацевтическая композиция HAEE-Zn-HSA) при однократном внутрибрюшинном введении мышам линии C57Bl/6 (N= 36) в дозе 0,05 мг/кг в пересчете на субстанцию HAEE.
Таким образом, использование фармацевтической композиции HAEE-Zn-HSA по сравнению с препаратом HAEE примерно в два раза увеличивает период полувыведения активной субстанции HAEE из организма и примерно в пять раз увеличивает биодоступность этой субстанции в мозге.
ПРИМЕР 4. Сравнительный анализ влияния внутривенных инъекций препарата HAEE и композиции HAEE-Zn-HSA на когнитивные функции экспериментальных животных.
Для сравнительной оценки влияния HAEE и фармацевтической композиции HAEE-Zn-HSA на характеристики памяти и обучения экспериментальных животных была использована стандартная методика оценки пространственной памяти в водном лабиринте Морриса. Водный лабиринт Морриса является классическим инструментом для оценки пространственной памяти, зависящей от функции гиппокампа. Важно отметить, что именно в гиппокампе у пациентов при болезни Альцгеймера и у трасгенных мышей линии «AвPP/PS1» агрессивно развивается церебральный амилоидоз. Были использованы четыре группы семимесячных мышей:
- интактные животные линии «AвPP/PS1» (N «intact» = 10 голов),
- инъектированные препаратом HAEE мыши линии «AвPP/PS1» (N «HAEE» = 10 голов; препарат вводился внутривенно в дозе 0,05 мг/кг три раза - в возрасте 4, 5 и 6 месяцев),
- инъектированные препаратом HAEE-Zn-HSA мыши линии «AвPP/PS1» (N «HAEE-Zn-HSA» = 10 голов; препарат вводился внутривенно в дозе 0,05 мг/кг три раза - в возрасте 4, 5 и 6 месяцев),
- контрольные мыши дикого типа (N «wt» = 10 голов).
Результаты анализа пространственной памяти животных, полученные в этом тесте и представленные на Фиг. 5, продемонстрировали значительную разницу между интактными и инъектированными мышами линии «AвPP/PS1». Начиная с 3-го дня обучения время, которое требовалось контрольным животным (дикого типа) и инъектированным препаратом HAEE трансгенным мышам для нахождения платформы, достоверно сокращалось. В то же время в группе интактных мышей линии «AвPP/PS1» это время оставалось таким же, как и на 1-й день обучения. Таким образом, было показано, что систематические внутривенные инъекции HAEE в дозах по 0,05 мг/кг приводили к улучшению способности животных к обучению и поддержанию долговременной памяти по сравнению с интактной контрольной группой трансгенных мышей, что свидетельствует о существенном когнитивно-стимулирующем эффекте этой субстанции.
При использовании для инъекций препарата на основе композиции HAEE-Zn-HSA эффект улучшения когнитивных функций, продемонстрированный инъекциями препарата HAEE, был существенно усилен, а именно, время нахождения платформы животными, которым вводился препарат на основе композиции HAEE-Zn-HSA, уменьшилось на 20% по сравнению с мышами, которым вводился препарат HAEE. Таким образом, фармацевтическая композиция HAEE-Zn-HSA повышает эффективность терапевтического действия пептида HAEE.
Изобретение относится к области биохимии и медицины и представляет собой фармацевтическую композицию для лечения нейродегенеративных заболеваний, содержащую эффективное количество пептида HAEE в эквимолярном комплексе HAEE-Zn-HSA с цинком и человеческим сывороточным альбумином в форме раствора для внутривенного введения с фармацевтически приемлемым носителем, выбранным из круга нейтральных носителей и разбавителей. Технический результат заключается в повышении стабильности и биодоступности активной субстанции - пептида HAEE, а также в улучшении когнитивных функций. 5 ил., 6 табл., 4 пр.
Фармацевтическая композиция для лечения нейродегенеративных заболеваний, содержащая эффективное количество пептида HAEE в эквимолярном комплексе HAEE-Zn-HSA с цинком и человеческим сывороточным альбумином в форме раствора для внутривенного введения с фармацевтически приемлемым носителем, выбранным из круга нейтральных носителей и разбавителей.
| US 2005037992 A1, 17.02.2005 | |||
| US 5763576 A, 09.06.1998 | |||
| LU J | |||
| et al | |||
| Albumin as a zinc carrier: properties of its high-affinity zinc-binding site // Biochem | |||
| Soc | |||
| Trans | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| - V | |||
| Коридорная многокамерная вагонеточная углевыжигательная печь | 1921 |
|
SU36A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| - P | |||
| Жатвенная машина | 1923 |
|
SU1317A1 |
| ПЕПТИДНОЕ СОЕДИНЕНИЕ, ПОЛЕЗНОЕ ДЛЯ ИНГИБИРОВАНИЯ ОБРАЗОВАНИЯ АМИЛОИДНЫХ БЛЯШЕК | 2011 |
|
RU2588143C2 |
| TSVETKOV P | |||
| O | |||
| et al | |||
| Peripherally Applied Synthetic Tetrapeptides HAEE and RADD Slow Down the Development | |||
Авторы
Даты
2019-12-18—Публикация
2019-08-15—Подача