Настоящее изобретение имеет отношение к новому пептидному соединению, главным образом используемому для связывания с β-амилоидными пептидами и/или предотвращения или уменьшения образования амилоидных бляшек, главным образом за счет ингибирования полимеризации вышеупомянутого амилоидного пептида в виде амилоидных бляшек.
Настоящее изобретение также имеет отношение к использованию в качестве лекарственного средства или для подготовки или определения препаратов с целью лечения нейродегенеративных заболеваний, в частности болезни Альцгеймера.
Болезнь Альцгеймера является нейродегенеративным заболеванием, главным образом у лиц пожилого возраста, характеризующимся длительным, в течение от 5 до 15 лет от начала заболевания, и необратимым снижением умственных способностей и, на более поздних стадиях болезни, потерей психомоторных функций.
Болезнь Альцгеймера является одной из наиболее частых причин деменции у пожилых людей, старше 55 лет, независимо от пола и образа жизни [1].
У некоторых пациентов заболевание может быть связано с наследственными нарушениями, но у большинства пациентов заболевание встречается спорадически, без какой-либо определенной причины [2].
По сей день не существует терапевтического метода лечения спорадических или наследственных форм данного заболевания. В настоящее время хорошо известно, что болезнь Альцгеймера не является неизбежным следствием процесса старения, а индуцирована ненормальным явлением агрегации β-амилоидных пептидов (далее «Aβ») [3, 4].
Аβ представляет собой пептид от 39 до 43 аминокислот (SwissProt ID Р05067), который образуется после последовательного расщепления белка-предшественника амилоида (обозначенного далее как «APP»). Aβ пептид представляет собой соединение, которое обычно обнаруживается в биологических жидкостях, таких как кровь или цереброспинальная жидкость, в которых он присутствует в низких концентрациях от 0,5 до 5 нМ, и это одинаково как у здоровых людей, так и у пациентов, страдающих болезнью Альцгеймера [5, 6].
С другой стороны, прогрессирование болезни Альцгеймера характеризуется внеклеточным накоплением или отложением в головном мозге пациента так называемых амилоидных бляшек. Эти бляшки являются результатом конформации пептидного мономера Aβ в форму димеров, затем растворимых олигомеров больших размеров, а затем их агрегации в форму нерастворимых фибриллярных β слоистых агрегатов, которые, в конечном итоге, дают начало амилоидным бляшкам [7].
Тем не менее, точный молекулярный механизм явления формирования амилоидных бляшек и запуска болезни Альцгеймера остается частично необъясненным и по сей день.
Некоторые исследования по сути приписывают высокий амилоидогенный потенциал фрагментам, состоящим из аминокислот 17-42 из COOH-конца Aβ пептида [9]. Другие исследования не исключают, что фрагменты, состоящие из аминокислот 1-16 Aβ пептида из области NH2-конца Aβ пептида, участвуют в патогенезе болезни Альцгеймера [10].
На настоящий момент, по всем этим имеющимся данным, можно сделать вывод, что 1-16 N-концевая область пептида Aβ является областью, которая несомненно участвует в наиболее убедительном и определяющем пути феномена формирования амилоидных бляшек, по следующим причинам.
Прежде всего, эта область у крыс содержит три мутации, отличающие Aβ пептид крысы от него же у других млекопитающих, даже если крысы не страдают болезнью Альцгеймера.
Был определено, что 1-16 N-концевая область является связывающим доменом, где цинк (Zn) и медь (Cu) присоединяются к Aβ пептиду [11-14]. В настоящее время было выявлено, что амилоидные бляшки характеризуются аномально высокой концентрацией двухвалентных металлов и, в частности, цинка [15]. Некоторое количество исследований и экспериментов, как in vivo так и in vitro, показали, что высокие концентрации цинка вызывают преципитацию Aβ пептида, приводящую к образованию амилоидных бляшек. Кроме того, было показано, что амилоидные бляшки более значимо образуются в окружении нейронов, имеющих высокие концентрации цинка [16-20].
Именно поэтому в настоящее время считается, что блокирование взаимодействия Aβ пептида с цинком должно привести к уменьшению агрегации Aβ пептида в виде амилоидных бляшек и тем самым предотвратить патологии, связанные с этим. Таким образом, в US 6001852, в качестве лекарственного средства для лечения болезни Альцгеймера предлагается Клиохинол, который является цинк-хелатирующим агентом. Тем не менее, использование цинк-хелатирующего агента требует специальных мишеней в области связывающего домена, где цинк присоединяется к Aβ пептиду, с целью избегания вмешательств в нормальный гомеостаз цинка в организме.
Другие исследования [21-30] показывают, что никотиновые рецепторы ацетилхолина играют роль главной цели нейротоксичности в связи с нарушениями в холинергической и когнитивной системе, вызванными образованием амилоидных бляшек. Именно поэтому в US 7018797 метод ингибирования связывания β-амилоидных пептидов с α-7 никотиновым рецептором ацетилхолина был предложен для лечения нейродегенеративных заболеваний. В US 7018797, соединения, полученные из нафталина, в частности, 5,8-дигидрокси-транс-2-ди (N-пропиламино)-3-метил-1,2,3,4-тетрагидронафталин более конкретно были предложены в качестве соединений, которые могут подавлять связывание Aβ пептида с α-7 никотиновым рецептором ацетилхолина.
Другие исследования показали, что взаимодействие области 13-1 бой аминокислоты Aβ пептида (HHQK, SEQ.ID.NO.27) с клетками микроглии мозга осуществляется за счет связывания с гепарансульфатом, который является связывающей молекулой для указанных клеток, входя в категорию гликозаминогликанов. Связывание пептида Aβ с поверхностными молекулами гликозаминогликанов клеток микроглии индуцирует образование олигомеров Aβ пептидов. Молекула Трамипросата (Tramiprosate) имитирует гликозаминогликаны и ингибирует процесс олигомеризации Aβ пептидов [31-36].
В US 7314724 в качестве лекарства против болезни Альцгеймера было предложено использование растворимых форм ламининов и их фрагментов (>10 кДа), которые способны связываться с Aβ и держать его в мономерном состоянии.
Более конкретные механизмы взаимодействия между Aβ пептидами и никотиновыми рецепторами ацетилхолина, также как и с ламининами, еще не были раскрыты.
Публикация WO 93/13789 от SmithKline Beecham описывает соединения со сложной формулой, включающей олигопептиды, защищенные по обоим сторонам, общая формула которых охватывает два гекса- или гептапептида, соединенных вместе с помощью химической связи. Применение соединений, описанных в данном документе, относится к стимуляции кроветворения для защиты организма от инфекций, в частности к стимуляции миелопоэтической системы, и не объясняет механизма действия этих соединений.
US 2004/214165 описывает белковую систему экспорта у микобактерий. Последовательность 646 из 4-HAED аминокислот является просто последовательностью концевой части одного из белков микобактерий, которая участвует в процессе экспорта белка. Но эта HAED последовательность не описана в US 2004/214165 в виде формулы индивидуального изолированного олигопептида и даже меньше, так сказать тем более, в качестве терапевтически активного пептида.
EP 2130550 описывает HAED последовательность (SEQ.ID.NO.39) как паттерн белка геликазы РНК, которая активна в производстве цитокинов мононуклеарными клетками крови. Но EP 2130550 не описывает тетрапептид HAED как изолированное соединение, и, тем более, в качестве защищенного соединения и, более того, так сказать тем более, в качестве активного соединения самого по себе.
В статье Gomez-Ruiz et al. In J. Dairy Sci. 90:4966-4973 от 2007 года описывается пептид EDAK и продукт, который обнаруживается в сыре, вытекающий из деградации белков молока, вызванной брожением за счет ферментов молочнокислых бактерий или ферментов, которые были искусственно добавлены в сыры. Эта статья ни описывает, ни предполагает, что этот изолированный, очищенный тетрапептид и, тем более, защищенный защитными группами, т.е. вне его смеси с сыром, может быть соединением интереса, взятым отдельно или, тем более, может быть активным соединением сам по себе.
В статье Chu et al. in J. Am. Chem. Sco. 1995, 117, 5419-54205 описывается способ для определения тетрапептидов спектрометрически. Эти тетрапептиды определены, как связывающиеся с рецепторами, т.е. ванкомицин, только N-конец тетрапептида защищен. Тетрапептид DDAH является лишь одним из пептидов, используемых в эксперименте, выбранных для демонстрации результатов манипуляций. В статье не описываются особенности активности этого тетрапептида DDAH.
Задачей настоящего изобретения является получение нового соединения, которое может быть использовано в определении или изготовлении препарата для лечения или профилактики заболеваний, связанных с нейродегенеративными расстройствами и/или с образованием амилоидных бляшек путем полимеризации или агрегации β-амилоидных пептидов.
В частности, целью настоящего изобретения является получение нового соединения, способного ингибировать взаимодействие β-амилоидных пептидов с ионами Zn (II). Действительно, известно, что формирование амилоидных бляшек за счет агрегации или полимеризации β-амилоидного пептида индуцировано образованием комплексов цинка с β-амилоидным пептидом, цинк до не которой степени действует в качестве кофактора этой агрегации или полимеризации.
В частности, целью настоящего изобретения является получение нового соединения, способного ингибировать образование β-амилоидных бляшек и делающего возможным лечение или профилактику болезни Альцгеймера или любых других дегенеративных заболеваний, связанных с образованием амилоидных бляшек.
Для этого настоящее изобретение предусматривает пептидное соединение со следующей общей формулой (I) или (II): 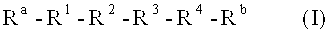
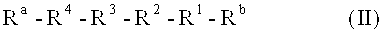
- R1 представляет собой аминокислотный остаток H, R и K;
- R2 представляет собой аминокислотный остаток A;
- R3 представляет собой аминокислотный остаток E или D;
- R4 представляет собой аминокислотный остаток E или D;
- Ra представляет собой N-концевую основную аминную функцию аминокислоты R1 и R4, либо свободную, либо замещенную защищенной группой, предпочтительно ацетил-группой (AC),
- Rb представляет собой гидроксильную функцию C-концевой карбоксильной группы аминокислоты R1 и R4, либо свободную, либо замещенную защищенной группой, предпочтительно группой NH2, NHR или NRR с R, представляющей собой C1-C4 алкильную цепь, т.е. соответствующую группе амидного типа, предпочтительно амидной группе (NH2).
Понятно, что пептидные соединения, в соответствии с настоящим изобретением, предназначены для того, чтобы быть индивидуально выделенными и очищенными соединениями, со степенью чистоты предпочтительно более 98%, предпочтительно по меньшей мере 99%, остатки могут быть сформированы с другими пептидами между прочим.
Известным способом и предпочтительно, аминокислоты R1, R2, R3, R4 должны иметь конфигурацию в форме их естественных изомеров L. Но аминокислоты R1, R2, R3 и R4, также могут быть аналогами с D конфигурацией.
Тем не менее, предпочтительно, чтобы пептидное соединение, соответственно настоящему изобретению, имело степень чистоты L-изомера более чем 98%, предпочтительно по меньшей мере 99% L-изомеров.
Изобретатели определили эти тетрапептиды путем характеристики различных аминокислот по связыванию тетрапептида с сайтом EVHH (SEQ.ID.NO.28) области 11-14 β-амилоида, в то время как охарактеризованные аминокислоты R1, R3 и R4, ионно противоположного знака, т.е. в состоянии сформировать сильные ионные связи с аминокислотой E (глутаматом) в позиции 11 для R1 и, соответственно, с Н (гистидином) в позициях 13 и 14 для R3 и, соответственно, R4, т.е. с 3мя из потенциально участвующих сайтов связывания ионов Zn (II) с β-амилоидом, и гидрофобная аминокислота A (аланин) способны формировать сильный гидрофобный эффект с V.
Тем самым охарактеризованные тетрапептиды формируют параллельные (формула I) и антипараллельные (формула II) нековалентные взаимодействия с EVHH мишенью области 11-14 β-амилоида. Учитывая тот факт, что три из четырех аминокислот в EBHH регионе-мишени имеют сильно заряженные группы, предпочтительнее аминокислоты, имеющие ионную комплементарность с этими тремя аминокислотами, в то время как выбор аминокислоты R2 был сделан в зависимости от рассмотрения стерической комплементарности между боковыми цепями аланина и валина, даже дальнейшей стабилизации за счет гидрофобных контактов между V и A, ионными связями с E и H.
Изобретатели экспериментально показали, что тетрапептиды, как указано выше, связываются с 3-мя хелатирующими агентами иона Zn (II), а именно с аминокислотами в позициях 11, 13 и 14, которые представляют собой оптимальный компромисс, по сравнению с другими соответствующими мишенями различных размеров, содержащими 1-4 хелатирующих агентов Zn (II), выбранных из позиций 6, 11, 13 и 14, особенно из областей, 9-11, 10-12, 11-13, 12-14, 13-15, 14-16, 11-16, 5-14 и 9-14, и по другим критериям определения, в частности, по размеру пептида, а именно оптимальным компромиссом является возможность использования указанного соединения в естественных условиях для ингибирования связывания ионов Zn (II) с β-амилоидным пептидом (Aβ) и для торможения олигомеризации β-амилоидного пептида, путем связывания тетрапептида с доменом для связывания ионов Zn (II) β-амилоидного пептида (Aβ).
Похоже, что сила взаимодействия может быть подорвана связью в положении 6. Наоборот, мишень, которая перекрывает только два сайта в позициях 6 и 11 или 13 и 14, недостаточна для ингибирования связывания ионов Zn (II).
Еще одно преимуществом тетрапептидов, соответственно данному изобретению, является то, что они сильно электрически заряжены, что способствует возможности их прохождения через гематоэнцефалический барьер.
Пептидные соединения включают в себя, в частности, последовательности R1-R2-R3-R4 и R4-R3-R2-R1, определенные формулами I и II в Таблице 1, приведенной ниже, и повторяются в последовательностях SEQ.ID.NO. с 1 по 24 из списка последовательностей, приложенных к описанию.
Аффинность этих тетрапептидов с лигандами, соответствующими фрагменту 1-16 области β-амилоидного пептида, была проверена путем вычисления константы диссоциации, Kd, в Примерах с 1 до 3. Их константы диссоциации меньше, чем у других исследованных пептидов: тетрапептидов, трипептидов, гексапептидов или декапептидов, не входящих в это определение по фактору 104.
Известным способом, указанные защитные группы являются группами совместимыми с фармацевтическим использованием в естественных условиях. Функцией защитных групп является нейтрализация электрического заряда амино- и карбоксильных концов пептида. В частности, N-конец может быть защищен формил группой (HCO-) или ацетил группой (CH3CO-), и C-конец может быть защищен группами -NH2, -NHR, -NRR, где R является C1-C4 алкилом или в дальнейшем -O-R, где R является C1-C4 алкилом или алкиламином, таким как -OCH3, -OCH2CH3 или -OCH2CH2NH2.
Следует напомнить, что:
- гидрофобными аминокислотами с неполярной группой являются аланин (A), валин (V), лейцин (L), изолейцин (I), метионин (M), фенилаланин (F), пролин (P) и триптофан (W),
- гидрофобными аминокислотами с полярной группой являются глицин (G), серии (S), треонин (T), цистеин (C), тирозин (Y), аспарагин (N) и глутамин (Q),
- аминокислотами с отрицательно заряженной группой в нейтральной (кислой) pH являются аспарагиновая кислота (D) и глутаминовая кислота (E), и
- аминокислотами с положительно заряженной группой в нейтральной (основной) pH являются лизин (K), аргинин (R) и гистидин (H).
Все природные а аминокислоты являются хиральными, поэтому оптически активными, за исключением глицина, и все находятся в L конфигурации, в соответствии с FISHER конфигурацией, или в S конфигурации, в соответствии с системой обозначений Кана-Ингольда-Прелога.
Встречаются три важных типа взаимодействия в связях между пептидами или во вторичных структурах пептидов, таких как α спирали или тип β складчатые слои, получающиеся в результате образования водородных связей между CO и NH группами основного скелета пептида, а именно:
- гидрофобный эффект: аминокислоты, для которых радикалы являются гидрофобными, имеют большее сродство друг к другу, чем для молекул воды, окружающих белок. И наоборот, гидрофильные аминокислоты, как правило, располагаются таким образом, чтобы быть в контакте с водой,
- ионные связи: радикалы, которые положительно заряжены, образуют ионные связи с теми, которые заряжены отрицательно, и
- водородные связи, которые имеются во взаимодействиях, которые менее сильные, чем те, что образовались в результате ионной связи и гидрофобного эффекта.
Предпочтительно пептидное соединение, соответственно данному изобретению, выбранное из соединений с формулой (I) или (II), где R1-R2-R3-R4 или, соответственно, R4-R3-R2-R1 представлено HAEE, EDAR, EEAH, EEAK, EEAR, HADE, KADD, KAEE, RADD, RADE, RAEE, HADD, DDAK, KAED, DEAR или KADE. Эти пептиды соответствуют в различном порядке последовательности SEQ.ID.NO.1, 3, 4, 5, 9, 12, 13, 15, 17, 18, 19, 20, 21, 22, 23 и 24.
Тетрапептиды, указанные выше, имеют константы диссоциации их взаимодействия с фрагментом 1-16 области β-амилоида, Kd, как рассчитано в Примерах 1-3 ниже, которые ниже, чем для других исследованных пептидов.
Более предпочтительно, пептидное соединение, соответственно данному изобретению, из числа соединений с формулой (I) или (II), где R1-R2-R3-R4 или R4-R3-R2-R1 представлено одним из тетрапептидов: HADD, DDAK, RADD, KAED, DEAR, KADE, HAEE и RAFE. Эти пептиды соответствуют последовательностям SEQ.ID.NO.1, 4, 5, 9, 12, 15, 19 и 23, соответственно. Они имеют еще более низкие константы диссоциации, Kd, чем у других исследованных пептидов, как рассчитано в Примерах от 1 до 3.
Более предпочтительно, пептидное соединение, соответственно данному изобретению, выбранное из соединений с формулой (I) или (II), где R1-R2-R3-R4 или R4-R3-R2-R1, представлено одним из двух тетрапептидов HAEE и RADD.
- R1 представляет собой аминокислотный остаток H,
- R2 представляет собой аминокислотный остаток A,
- R3 представляет собой аминокислотный остаток E,
- R4 представляет собой аминокислотный остаток E.
Наиболее предпочтительные пептидные соединения соответствуют формулам Ac-HAEE-NH2 и Ac-RADD-NH2.
Константы диссоциации взаимодействия, Kd, обоих этих пептидов с лигандом соответствующим фрагменту 1-16 области β-амилоида, в Примере 1, были самыми низкими из всех протестированных пептидов.
Оба эти пептидные соединения, также выступают как наиболее представительные в условиях ингибирования связывания ионов Zn (II) с β-амилоидным пептидом и ингибирования полимеризации или агрегации β-амилоидного пептида в виде бляшки, в присутствии физиологических концентраций ионов Zn (II), в особенности от 100 до 400 мкМ, путем связывания указанного β-амилоидного пептида, но, прежде всего, оба этих пептидных соединения обладают свойствами ингибирования образования амилоидных бляшек в естественных условиях на мышиных моделях, наиболее представительные из них описаны в Примерах ниже.
Объектом настоящего изобретения является также применение пептидного соединения, соответственно данному изобретению, для уменьшения или предотвращения связывания ионов Zn (II) с β-амилоидным пептидом путем связывания указанного пептидного соединения с указанным β-амилоидным пептидом.
Еще более конкретно, объектом настоящего изобретения является использование пептидного соединения, соответственно данному изобретению, для уменьшения или предотвращения полимеризации и/или агрегации β-амилоидного пептида, в присутствии ионов Zn (II), более конкретно в физиологических концентрациях ионов Zn (II), в особенности от 100 до 400 мкМ, путем связывания указанного пептидного соединения с указанным β-амилоидным пептидом.
Следовательно, настоящее изобретение относится к применению пептидного соединения, соответственно данному изобретению, для лечения заболеваний, связанных с образованием амилоидных бляшек.
Объектом настоящего изобретения является также применение пептидного соединения, соответственно данному изобретению, в качестве лекарственного средства, в особенности, для лечения нейродегенеративных заболеваний и, предпочтительно, для лечения болезни Альцгеймера.
Объектом настоящего изобретения является также применимая композиции для использования, соответственно данному изобретению, в которой активное вещество содержит, по меньшей мере, один остаток R1-R2-R3-R4 или R4-R3-R2-R1 пептидного соединения, соответственно данному изобретению.
Активное вещество может быть мультимером, состоящим из нескольких мономеров с последовательностью R1-R2-R3-R4 или R4-R3-R2-R1, связанных через связи, способные продолжительно во времени разлагаться в организме и тем самым освобождать тетрапептид, активный мономер.
Известным способом, пептидное соединение, соответственно данному изобретению, может быть сформулировано в виде эфира или их физиологически приемлемых производных солях.
Более конкретно, объектом настоящего изобретения является фармацевтическая композиция, содержащая соединение, соответственно данному изобретению, или активная субстанция, содержащая, по меньшей мере, один R1-R2-R3-R4 или R4-R3-R2-R1 остаток пептидного соединения, соответственно данному изобретению, с фармацевтически приемлемым носителем, предпочтительно проходящим через парентеральный, чрескожный или чресслизистый путь.
Более конкретно, фармацевтическая композиция, соответственно данному изобретению, будет сформулирована так, чтобы быть инъекционной, особенно для внутрисосудистого, внутримышечного, подкожного, внутриспинного или цереброспинального пути.
Другие способы введения, такие как оральный, букальный, назальный, ректальный или местный путь, могут быть предусмотрены при условии, что пептидное соединение, соответственно данному изобретению, составлено в такой форме, чтобы выдерживать деградацию до достижения клеток-мишеней головного мозга.
Более предпочтительно, указанная композиция представлена в лиофилизированной форме.
Более конкретно, в композиции, соответственно настоящему изобретению, концентрация указанного пептидного соединения составляет от 20 до 2000 мкМ. Следующие примеры описывают и демонстрируют эффективность пептидного соединения, соответственно данному изобретению, и даны только в качестве иллюстрации и не должны быть истолкованы, как ограничение изобретения.
В свете примеров, приведенных ниже, другие признаки и преимущества настоящего изобретения станут очевидными.
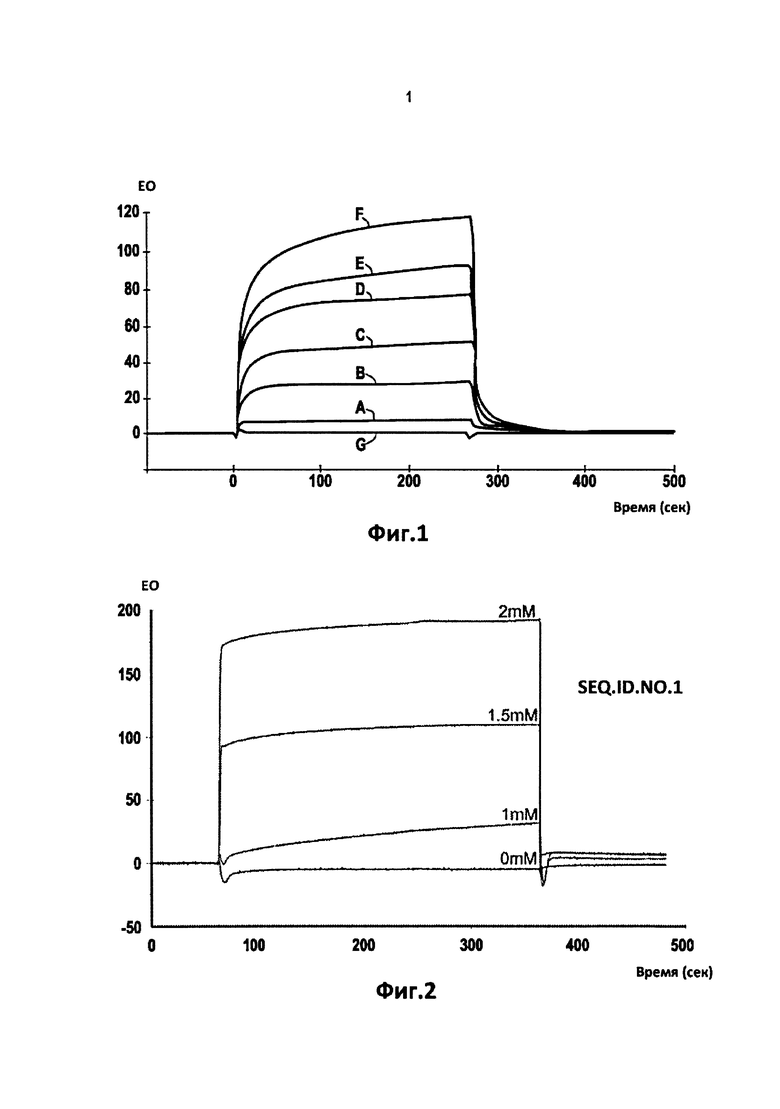
Фиг.1 Показаны кинетические кривые для связывания пептида Ac-HAEE-NH2 с лигандом, соответствующим 1-16 области β-амилоида, в различных концентрациях, т.е. кривая A = 2 мкМ, кривая B = 5 мкМ, кривая C = 10 мкМ, кривая D = 15 мкМ, кривая E = 20 мкМ, кривая F = 25 мкМ и кривой G = 0 мкМ, с оборудованием и в соответствии с процедурой Примера 1.
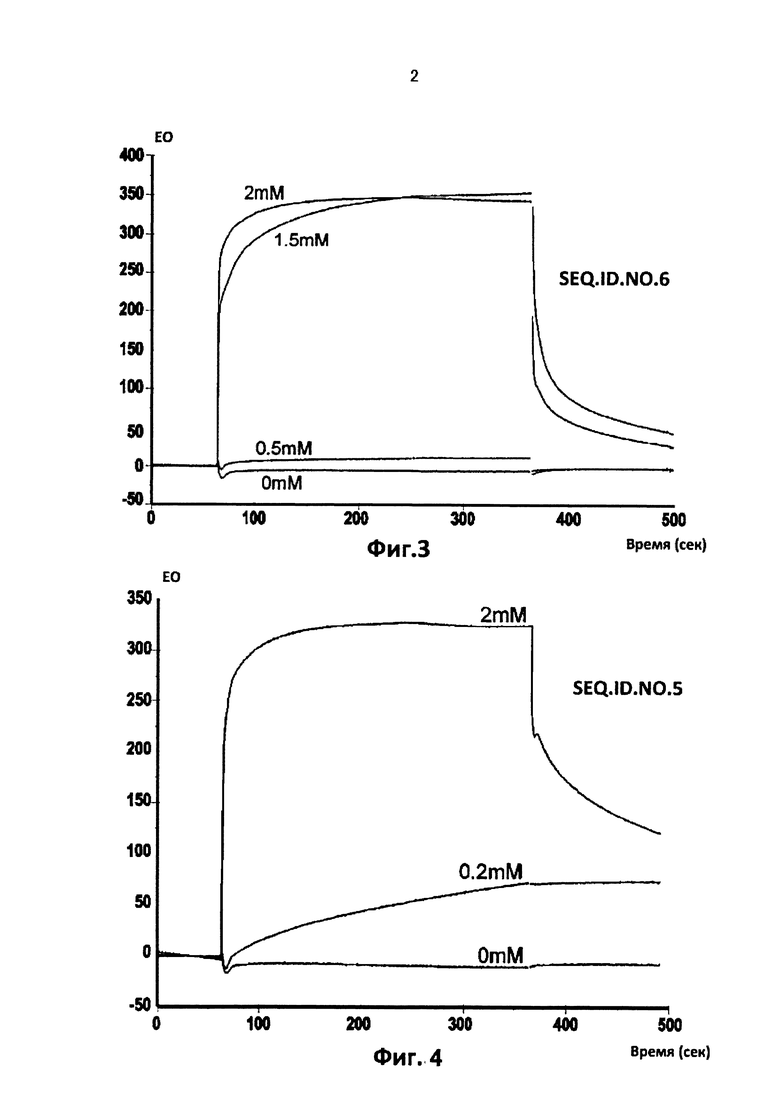
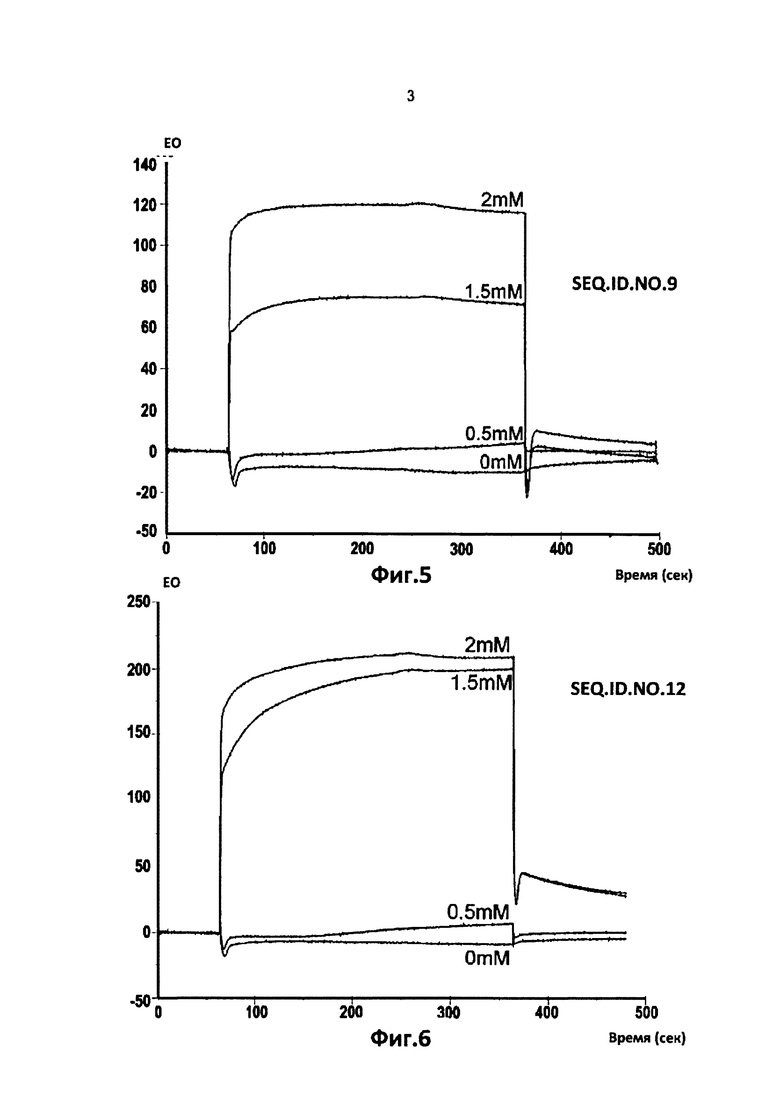
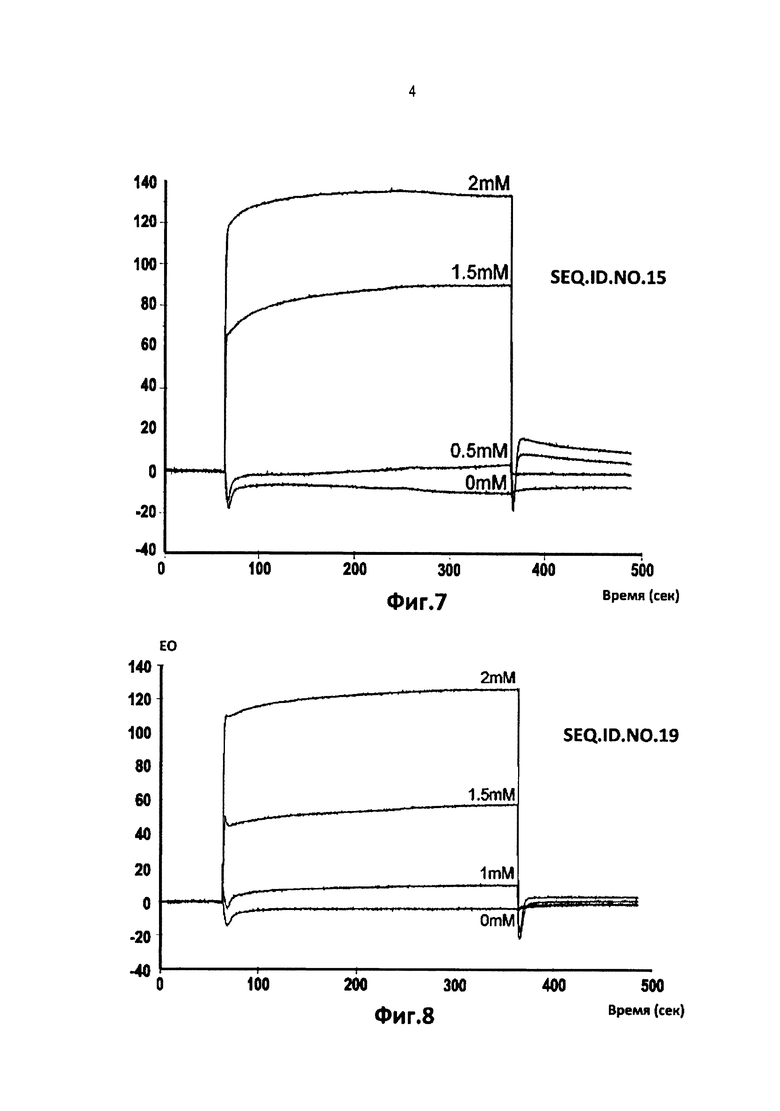
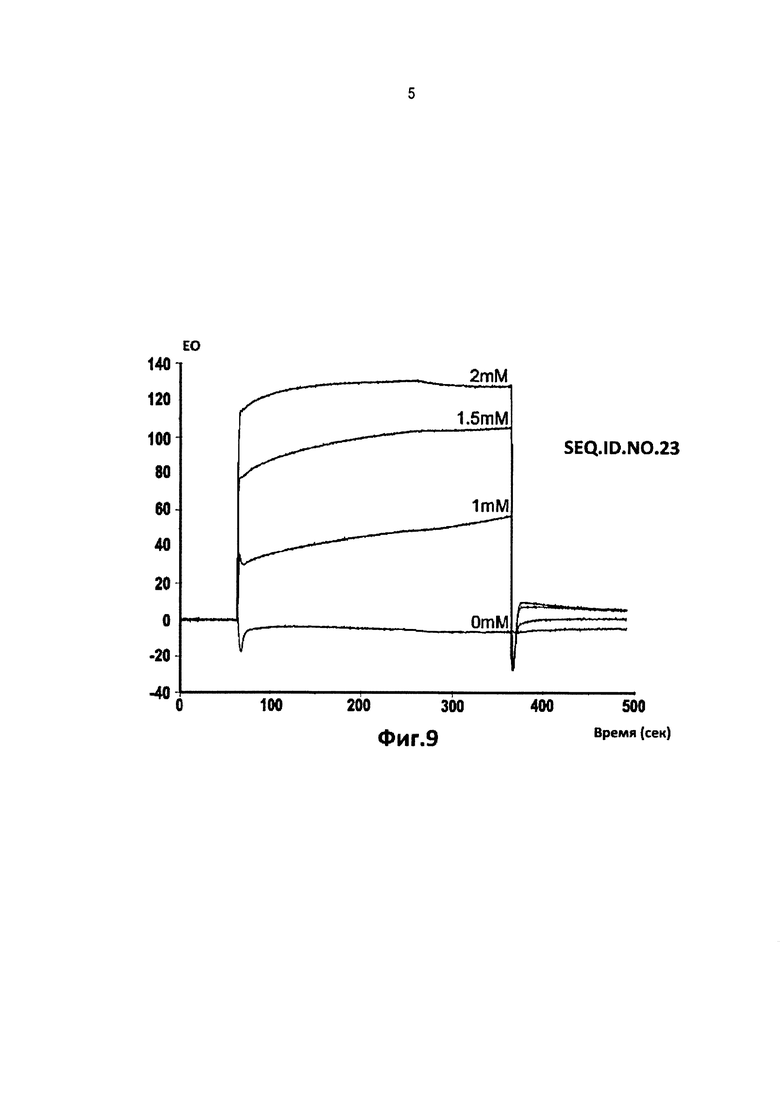
Фиг. от 2 до 9. Представлены кинетические кривые для связывания пептидов последовательности SEQ.ID.NO.1, 4, 5, 9, 12, 15, 19 и 23, соответственно с оборудованием и по методике Примера 3, указанный тетрапептид должен быть более очищенным, чем в Примере 1.
Вариации единиц ответа спектрометра на оси ординат (EO = единица ответа) в течение времени дают возможность вычисления константы диссоциации, Kd, связей тетрапептида с фрагментом области 1-16 β-амилоида пептида, как описано в Примерах 1 и 3.
Пример 1: связывание тетрапептида Ac-HAEE-NH2 (SEQ.ID.NO.19.) с иммобилизованным пептидным фрагментом, соответствующим 1-16 области β-амилоидного пептида.
Анализ был проведен при помощи поверхностно-плазмонно-резонансной спектроскопии (SPR) связей тетрапептида Ac-HAEE-NH2 с иммобилизованным пептидным фрагментом, соответствующим области 1-16 β-амилоидного пептида.
С помощью этого анализа возможно вычислить константу диссоциации, Kd, взаимодействия пептида с иммобилизованным лигандом, было понятно, что значение Kd тем меньше, чем выше взаимодействие с лигандом и, следовательно, устойчивость образовавшегося комплекса взаимодействия высокая. В этих способах, считается, что значимое специфическое взаимодействие присутствует, если Kd меньше или равна 10-4 М. С другой стороны, если Kd больше или равна 10-3 М, считается, что нет значимого связывания или взаимодействия.
Поверхностным плазмонным резонансом является физическое явление, в основном известное за счет его использования в качестве метода измерения связи лиганда с рецептором, адсорбированным на поверхности металлического слоя. Система детекции SPR измеряет вариацию показателя преломления в непосредственной близости от границы, когда лиганд связывается с рецептором.
Принципы поверхностно-плазмонно-резонансной спектроскопии описаны в Nagata, K. и Handa, H. (eds), Springer-Verlag, Tokyo, 2000.
Более конкретно, в системе SPR-спектроскопии, например, применяя биосенсоры от BIACORE, после иммобилизации лигандов на поверхности датчика типа чипа, в данном случае на указанном β-амилоидном фрагменте, аналитический реагент вводится на указанную поверхность с постоянной скоростью потока через систему микрофлюидных каналов. Поляризованный свет, излучаемый источником света, отражается от покрытой золотом поверхности чипа, а затем детектируется диодным ридером. Соответственно связыванию лиганда и аналитической молекулы отличается интенсивность отраженного света. Изменение ответа спектрометра (EO = единица ответа) позволяет рассчитать константу диссоциации взаимодействия.
Чипы биосенсора получены из GE Healthcare (США). SPR-спектроскопические эксперименты были проведены на аппарате BIACORE 3000. Реагенты для иммобилизации фрагмента β-амилоидного пептида (EDC, NHS, PDEA и цистеин) были куплены у GE Healthcare (США). Буфером, используемым для иммобилизации пептидного лиганда за счет образования тиоловых связей, являлся 10 мМ ацетат натрия при pH 4,5. Регенерирующим буфером являлся HBS буфер, содержащей среду с 10 мМ HEPES и 3 мМ EDTA, 0,005% сурфактантом P20 и 150 мМ NaCl при pH 7,4. Иммобилизационным буфером являлся HBS буфер при pH 7,4 и HEPES буфер при pH 6,8, 50 мМ, со 100 мкМ ионов Zn (II) для реактивного тетрапептида Ac-HAEE-NH2. Все буферы были профильтрованы перед использованием.
Пептидным фрагментом лиганда был: Ac-DAEFRHDSGYEVHHQKGGGGC-NH2, соответствующий последовательности SEQ.ID.NO.26. Этот пептид с 21 аминокислотами содержит 16 аминокислот N-концевого связывающего домена β-амилоида, т.е. DAEFRHDSGYEVHHQK (SEQ.ID.NO.25), за которым следует 4 аминокислоты глицин и цистеин С-конца. Цистеин является необходимым для иммобилизации лиганда на поверхности чипа с помощью тиоловых связей, в соответствии с процедурой поставщика. 4 аминокислоты глицина вследствие этого образуют связывающий тетрапептид ("линкер") между чипом и лигандом. Кроме того, таким образом иммобилизованный лиганд обладает достаточной гибкостью по отношению к поверхности, так законно имитируя условия взаимодействия между тетрапептидным реагентом и лигандом. Этот лиганд был привязан на CM5 чип биосенсора, следуя стандартной процедуре через тиоловые связи в условиях, описанных в руководстве датчика, предоставляемом поставщиком GE Healthcare (США).
Скорость потока, применявшаяся на всех этапах, составляла 5 мкл/мин. Карбоксиметил декстрановая матрица была активирована путем добавления смеси в соотношении 1:1 из 1-этил-3 (3-диметиламинопропил)-карбодиимида (EDC) и N-гидроксисукцинимида (NHS), т.е. 30 мкл EDC на 400 мМ и NHS на 100 мМ, с последующим введением 80 мМ PDEA (2(2 пиридинилдитио)-этан амин) в растворе 0,1 М бората натрия при pH 8,5. Затем был добавлен пептидный лиганд в буферном растворе ацетата натрия в количестве 0,05 мг/мл. Тиоловые группы, не вступившие в реакцию на поверхности CM5 чипов, были удалены с помощью 50 мМ раствора цистеина в 0,1 М буферном растворе ацетата натрия при pH 4, с тем, чтобы обеспечить поверхность, которая дала бы вариацию единиц ответа (EO) около 700 условных единиц с контрольным образцом жидкости. Контрольная жидкость взаимодействует с поверхностью чипа в соответствии с той же процедурой.
Реагент Ac-HAEE-NH2 был подготовлен путем разбавления 7 концентраций, т.е. 0, 2, 5, 10, 15, 20 и 25 мкМ, и введен в многоканальном режиме (20 мкл QUICKINJECT, 5 мкл/мин). Поверхность чипа был открыта на 330 секунд для буферного раствора реагента для того, чтобы отследить его связывание. Поверхность чипа затем регенерировалась путем введения регенерирующего буфера (20 мкл). Данные контрольной полоски были вычтены из сырых данных для полос, соответствующих иммобилизованным пептидам реагента. Далее, была рассчитана константа диссоциации, Kd, известным способом, от кривых, установленных для равновесного ответа (REQ) от концентрации (M) в оценке программой BIA 4,1. Затем были введены 7 образцов реагента в различных концентрациях в каналы с иммобилизованными лигандами на поверхности чипа.
Кривые кинетического связывания Ac-HAEE-NH2 с иммобилизованными пептидами, после вычитания ответов контроля, описаны на Фиг.1.
Кривые на Фиг.1 дают возможность вычисления константы диссоциации, Kd, взаимодействий, которые были оценены в 2,2×10-8 М.
В присутствии физиологических концентраций ионов Zn (II) (100-400 мкМ), константа диссоциации была практически неизменной. Тем не менее, высокие концентрации ионов Zn (II) (10 мМ) подавляли взаимодействие лиганда с реагентом. Если считать, что связывание ионов Zn (II) с Aβ пептидом характеризуются микромолярными (мкМ) значениями Kd, может быть предположено, что реагент Ac-HAEE-NH2 конкурирует с ионами Zn (II) за связывание с Aβ пептидом. Однако, аффинность реагента с Aβ пептидом значительно выше, чем у ионов Zn (II), так что пептид Ac-HAEE-NH2 предотвращает связывание ионов Zn (II) с пептидом Aβ при физиологических концентрациях.
Более конкретно, аффинность Ac-HAEE-NH2 реагента и Aβ амилоида больше, чем у ионов Zn (II).
Эксперименты показали, что в присутствии физиологических концентраций ионов Zn (II) на микромолярном уровне (менее 500 мкМ), связывание HAEE с 1-16 областью β-амилоида практически не изменяется в присутствии или в отсутствие ионов Zn (II). С другой стороны, более высокие концентрации ионов Zn (II), порядка 1 ммоль (мМ), подавляют взаимодействие между НАЕЕ и 1-16 областью Aβ. Эти данные показывают, что HAEE имеет большее сродство к области-мишени, чем ионы Zn (II), и способен блокировать взаимодействие между ионами Zn (II) и Aβ, когда ионы Zn (II) находятся в физиологических концентрациях.
Пример 2: Сравнительный пример
Ниже описаны эксперименты для связывания пептидного лиганда-мишени с соответствующей 1-16 областью β-амилоида, проводимые с другими пептидами в соответствии с процедурой, описанной в Примере 1.
1 - Все 23 других тетрапептида, перечисленных в таблице 1, соответствующие SEQ последовательности SEQ.ID.NO. от 1 до 18 и от 20 до 24 с теми же защитными группами Ra=Ac и Rb=NH2, были протестированы, и их константы диссоциации, Kd, были от 10-5 до 10-6 М. Эти константы диссоциации практически не менялись в присутствии цинка в физиологических концентрациях от 100 до 400 мкМ. Тетрапептидами, соответственно данному изобретению, имеющими низкую константу диссоциации, Kd, (за исключением HAEE), были: EDAR, EEAH, EEAK, EEAR, HADE, KADD, KAEE, RADD, RADE, RAEE, HADD, DDAK, KAED, DEAR и KADE.
Эти значения соответствуют прочным связям с целевым лигандом 1-16 области β-амилоидного пептида.
2 - Другие сравнительные примеры с 10 различными тетрапептидами, аналогичные тетрапептидам из Таблицы 1, но где одна аминокислота была заменена на аланин (A), т.е. указаны следующие тетрапептиды: AAEE, HAEA, HAAE, AADD, HAAD, HADA, AADE, RADA, RAAE, KAAE. соответствующие этим последовательности SEQ.ID.NO. от 29 до 38, соответственно, имели значительно большую константу диссоциации, т.е. Kd от 10-3 до 10-4 М, что соответствует неспецифическому или незначимому взаимодействию с целевым лигандом.
SEQ.ID.NO.29 взята из SEQ.ID.NO.23, в которой первая аминокислота R была заменена на A.
SEQ.ID.NO.30 взята из SEQ.ID.NO.19, где последняя аминокислота E была заменена на A.
SEQ.ID.NO.31 взята из SEQ.ID.NO.19, где третья аминокислота E была заменена на A.
SEQ.ID.NO.32 взята из SEQ.ID.NO.5, в которой первая аминокислота R была заменена на A.
SEQ.ID.NO.33 взята из SEQ.ID.NO.7, в которой третья аминокислота E была заменена на A.
SEQ.ID.NO.34 взята из SEQ.ID.NO.1, в которой последняя аминокислота D была заменена на A.
SEQ.ID.NO.35 взята из SEQ.ID.NO.13, в которой первая аминокислота H была заменена на A.
SEQ.ID.NO.36 взята из SEQ.ID.NO.5, в которой последняя аминокислота D была заменена на A.
SEQ.ID.NO.37 взята из SEQ.ID.NO.23, где третья аминокислота E была заменена на A.
SEQ.ID.NO.38 взята из SEQ.ID.NO.21, в которой третья аминокислота E была заменена на A.
Были протестированы 3-10 различных трипептида, соответствующих тетрапептиду SEQ.ID.NO.19 (HAEE), где были удалены 1, 2 или 3 аминокислоты в соответствии со следующими последовательностями SEQ.ID.NO. от 59 до 68: AEE, HAO, SHA, GHA, EEQ, AHA, IAH, FSH, ESD, ISH. Следует отметить, что ранее был описан трипептид AEE, соответствующий комплементарному трипептиду из 12-14 области в соответствии с критериями комплементарности. Эти трипептиды комплементарны областям Aβ пептидов, 9-11, 10-12, 11-13, 12-14, 13-15 и 14-16.
Эти 10 различных трипептидов имеют константу диссоциации от 10-3 до 10-4 М, что отражает отсутствие значимого или специфического взаимодействия с мишенью.
4 - Кроме того, были протестированы 10 различных гексапептидов, включая тетрапептид SEQ.ID.NO.19 (HAEE), предпочтительно соответственно данному изобретению, с добавлением 2ух аминокислот на их N-конце или на C-конце, а именно следующие гексапептиды: HAEESD, HAEEAD, HAEESE, HAEEGE, HAEEQE, LAHAEE, IAHAEE, FSHAEE, LGHAEE, ISHAEE. Эти гексапептиды комплементарны областям Aβ пептида 11-16 и 9-14.
Эти 10 гексапептидов, которые повторяются в списке последовательностей в SEQ.ID.NO. от 39 до 48, также имеют относительно высокие константы диссоциации, Kd, от 10-3 до 10-4 М, которые отражают отсутствие значимого или специфического взаимодействия с лигандом 1-16 области β-амилоида.
Все эти 10 гексапептиды соответствуют последовательностям, для которых 2 дополнительные аминокислоты могут взаимодействовать с аминокислотами 15-16 (QK) β-амилоида N-концевого удлинения и с аминокислотами GY области 9-10 (GY) в β-амилоида, в соответствии с ионными или гидрофобными взаимодействиями, как описано ранее.
5 - Наконец, были протестированы 10 декапептидов, взятых из списка последовательностей в следующей последовательности SEQ.ID.NO. от 49 до 58: HSLAHAEESD, KNIAHAEEAD, RNFSHAEESE, KQLGHAEEGE, RQISHAEEQE, DDHSLAHAEE, EEKNIAHAEE, EERNFSHAEE, DEKQLGHAEE, DERQISHAEE, и они имеют константы диссоциации, Kd, от 10-3 до 10-4 М, которые отражают отсутствие значимого или специфического взаимодействия с мишенью.
Эти декапептиды снова взяли предпочтительным тетрапептид, соответственно данному изобретению, SEQ.ID.NO.19 (HAEE), с 2 дополнительными аминокислотами на N-конце и 4 дополнительными аминокислотами на С-конце для SEQ.ID.NOS. от 49 по 53, и 6 дополнительными аминокислотами для декапептидов SEQ.ID.NO. от 54 до 58. Все декапептиды SEQ.ID.NO. от 49 до 58, содержащие дополнительные аминокислоты, определены как способные взаимодействовать с аминокислотами областей 7-10 и 15-16 β-амилоида в SEQ.ID.NO. от 49 до 53, и областей 5-10 β-амилоида в SEQ.ID.NO. от 54 до 58, которые делают мишенью область 5-14 Aβ пептида.
Все пептиды, испытанные выше в разделах 1- и 5-, включали в себя защитную группу для функции N-концевого амина, Ra=Ac и защитную группу гидроксильной функции C-концевой карбоксильной группы, Rb=NH2.
Пример 3: Связывание тетрапептидов, соответственно данному изобретению, с иммобилизованным пептидным фрагментом, соответствующим области 1-16 6-амилоидного пептида.
Тесты связывания, описанные в Примере 1, были воспроизведены с теми же материалами, реактивами и процедурами, за исключением следующих значимых отличий:
- примененным аппаратом BIACORE был аппарат BIACORE T100. Этот аппарат BIACORE Т100 дает более точные результаты, чем BIACORE 3000, потому что он включает в себя систему дегазации во время инъекции аналита на датчик и потому, что метод обнаружения межмолекулярных комплексов иммобилизованного лиганда/аналита на CM5 чипе является более точным.
- использованные тетрапептиды, соответственно данному изобретению, очищали до по крайней мере 99% L-изомеров, в соответствии с данным ВЭЖХ, предотвращали образование D-изомеров и/или удаляли их в процессе синтеза. В Примере 1 тетрапептиды включали только 98% изомеров L.
- примененными концентрациями тетрапептидов, соответственно данному изобретению, были 50, 100, 200, 500, 1000, 1500 и 2000 мкМ.
- эти эксперименты проводились в отсутствие цинка.
- поверхность CM5 чипов предусматривала поверхность, которая давала вариации единиц ответа (EO) около 1023 условных единиц с исследуемой контрольной жидкостью.
Кривые кинетики на фиг. от 2 до 9, позволяют вычислить константы диссоциации, Kd, в соответствии с методом, описанным в предыдущих публикациях (в частности, см. ссылку [39]), т.е. кривые позволяют вычислить kon и koff константы по формуле:
dR/dt=kon C (Rmax-R)-koff R, где:
- R представляет ответ на оси ординат
- С представляет собой концентрацию аналита
- Rmax теоретически максимальное значение R,
константы диссоциации Kd была дана по формуле Kd=koff/kon.
В таблице 2 указаны значения диссоциации, Kd, рассчитаные для тетрапептидов из последовательностей SEQ.ID.NO 1, 4, 5, 9, 12, 15, 19 и 23, которые имеют самые низкие значения.
В этом случае два аналита, содержащие последовательности SEQ.ID.NO.5 и 19, имели самые низкие константы диссоциации, Kd, составляющие примерно между 10-4 и 10-5 М.
Остальные шесть тетрапептидов из последовательностей SEQ.ID.NO.4, 9, 12, 15 и 23 дали значения Kd, составляющие между 10-3 и 10-2 М.
Другие тетрапептиды, соответственно этой модели, показали константы диссоциации, Kd, составляющие более чем 10-2 М.
Пример 4: Подавление образования β-амилоидных бляшек путем полимеризации или агрегации.
Феномен агрегации Aβ пептидов в виде амилоидных бляшек был продемонстрирован в пробирке с помощью набора "SYNTHALOID SCREENING PLATE ®" от QUALITY CONYTROLLED BIOCHEMICALS Inc. USA, включающим применение бляшек, покрытых центрами кристаллизации Aβ пептидов, и пептиды, меченные флуоресцентным маркером с целью выявления агрегатов (37, 38).
Был использован полный β пептид 1-40, меченные флуоресцентным маркером, в буфере, содержащем среды 50 мМ HEPES, pH 7,4, 0,1% BSA и 10% FCS, этот буфер содержал физиологические концентрации ионов Zn (II), и ингибиторы протеаз. Указанные бляшки были в форме плат, в том числе 96-луночных плат, в которые разливали по 100 мкл меченных Aβ пептидов (1-40) в концентрации 100 нМ. Их оставляли инкубироваться в течение 3 часов при комнатной температуре в лунках.
В некоторых лунках тетрапептиды AC-GAEE-NH2 и Ac-RADD-NH2, соответственно данному изобретению, были введены в различных концентрациях в зависимости от лунок (0, 5, 10, 20, 40, 80, 100 и 150 мкМ), для проверки влияния тетрапептидов, соответственно данному изобретению, на феномен агрегации Aβ пептидов.
Чтобы сделать это, в конце инкубации, из лунок были удалены несвязанные белки при помощи трех отмывок, с помощью буферного раствора, указанного выше. Количество связанного белка в виде агрегатов, связанных с лунками, измеряли путем измерения интенсивности флуоресценции.
Тетрапептиды HAEE и RADD, соответственно данному изобретению, фактически тормозят агрегацию Aβ пептида, с ингибирующими концентрациями IC50 20 мкМ. Следует напомнить, что концентрация IC50 представляет собой концентрацию, при которой агрегация 50% от Aβ пептида, введенного в лунки, может быть предотвращена.
По данным испытаний, описанных в руководстве пользователя к набору плат "SYNTHALOID SCREENING PLATE ®", считается, что соединение ингибирует связывание белка на твердом носителе, если его концентрация IC50 менее 100 мкМ.
Исследования в течение времени показывают, что пролонгированная инкубация в течение минимум 1 час амилоидных агрегатов с HAEE и RADD тетрапептидами в концентрации 20, 40, 80, 100 и 150 мкМ в дальнейшем приводит к необратимой дезагрегации амилоидных агрегатов.
Библиографические ссылки
[1] Cummings, J.L. (2004). Alzheimer's disease. N Engl J Med 351, 56-67.
[2] Selkoe, D.J. (2001). Alzheimer's disease: genes, proteins, and therapy. Physiol Rev 81, 741-66.
[3] Glenner, G.G. and Wong, C.W. (1984). Alzheimer's disease and Down's syndrome: sharing of a unique cerebrovascular amyloid fibril protein. Biochem Biophys Res Commun 122, 1131-5.
[4] Masters, C.L., Simms, G., Weinman, N.A., Multhaup, G., McDonald, B.L. and Beyreuther, K. (1985). Amyloid plaque core protein in Alzheimer disease and Down syndrome. Proc Natl Acad Sci USA 82, 4245-9.
[5] Mayeux, R. et al. (1999). Plasma amyloid beta-peptide 1-42 and incipient Alzheimer's disease. Ann Neurol 46, 412-6.
[6] Seubert, P. et al. (1992). Isolation and quantification of soluble Alzheimer's beta-peptide from biological fluids. Nature 359, 325-7.
[7] Hardy, J. and Selkoe, D.J. (2002). The amyloid hypothesis of Alzheimer's disease: progress and problems on the road to therapeutics. Science 297, 353-6.
[8] Luhrs, Т., Ritter, C., Adrian, M., Riek-Loher, D., Bohrmann, В., Dobeli, H., Schubert, D. and Riek, R. (2005). 3D structure of Alzheimer's amyloid-beta(1-42) fibrils. Proc Natl Acad Sci USA 102, 17342-7.
[9] Gowing, E., Roher, A.E., Woods, A.S., Cotter, R.J., Chaney, M., Little, S.P. and Ball, M.J. (1994). Chemical characterization of A beta 17-42 peptide, a component of diffuse amyloid deposits of Alzheimer disease. J Biol Chem 269, 10987-90.
[10] Mattson, M.P. (1995). Untangling the pathophysiochemistry of beta-amyloid. Nat Struct Biol 2, 926-8.
[11] Guilloreau, L., Damian, L., Coppel, Y., Mazarguil, H., Winterhalter, M. and Faller, P. (2006). Structural and thermo dynamical properties of Cull amyloid-beta16/28 complexes associated with Alzheimer's disease. J Biol Inorg Chem 11, 1024-38.
[12] Kozin, S.A., Zirah, S., Rebuffat, S., Hoa, G.H. and Debey, P. (2001). Zinc binding to Alzheimer's Abeta(1-16) peptide results in stable soluble complex. Biochem Biophys Res Commun 285, 959-64.
[13] Mekmouche, Y., Coppel, Y., Hochgrafe, K., Guilloreau, L., Talmard, C., Mazarguil, H. and Faller, P. (2005). Characterization of the Znll binding to the peptide amyloid-beta1-16 linked to Alzheimer's disease. Chembiochem 6, 1663-71.
[14] Zirah, S. et al. (2004). Zinc binding agonist effect on the recognition of the beta-amyloid (4-10) epitope by anti-beta-amyloid antibodies. Biochem Biophys Res Commun 321, 324-8.
[15] Lovell, M.A., Robertson, J.D., Teesdale, W.J., Campbell, J.L. and Markesbery, W.R. (1998). Copper, iron and Zinc in Alzheimer's disease senile plaques. J Neurol Sci 158, 47-52.
[16] Frederickson, C.J. and Bush, A.I. (2001). Synaptically released zinc: physiological functions and pathological effects. Biometals 14, 353-66.
[17] Frederickson, C.J., Suh, S.W., Silva, D. and Thompson, R.B. (2000). Importance of zinc in the central nervous system: the zinc-containing neuron. J Nutr 130, 1471S-83S.
[18] Friedlich, A.L. et al. (2004). Neuronal zinc exchange with the blood vessel wall promotes cerebral amyloid angiopathy in an animal model of Alzheimer's disease. J Neurosci 24, 3453-9.
[19] Bush, A.I. (2003). Copper, zinc, and the metallobiology of Alzheimer disease. Alzheimer Dis Assoc Disord 17, 147-50.
[20] Maynard, C.J., Bush, A.I., Masters, C.L., Cappai, R. and Li, Q.X. (2005). Metals and amyloid-beta in Alzheimer's disease. Int J Exp Pathol 86,147-59.
[21] Auld, D.S., Kar, S. and Quirion, R. (1998). Beta-amyloid peptides as direct cholinergic neuromodulators: a missing link? Trends Neurosci 21, 43-9.
[22] Kelly, J.F., Furukawa, K., Barger, S.W., Rengen, M.R., Mark, R.J., Blanc, E.M., Roth, G.S. and Mattson, M.P. (1996). Amyloid beta-peptide disrupts carbachol-induced muscarinic cholinergic signal transduction in cortical neurons. Proc Natl Acad Sci USA 93, 6753-8.
[23] Mijailovic, В., Mladenovic, Т., Karadaglic, D., Ninkovic, M., Jovic, P. and Pavlovic, M. (1996). [Clinical and laboratory studies of cholinergic urticaria]. Vojnosanit Pregl53, 497-501.
[24] Pedersen, W.A., Kloczewiak, M.A. and Blusztajn, J.K. (1996). Amyloid beta-protein reduces acetylcholine synthesis in a cell line derived from cholinergic neurons of the basal forebrain. Proc Natl Acad Sci USA 93, 8068-71.
[25] Wu, J., Kuo, Y.P., George, A.A., Xu, L, Hu, J. and Lukas, R.J. (2004). beta-Amyloid directly inhibits human alpha4beta2-nicotinic acetylcholine receptors heterologously expressed in human SH-EP1 cells. J Biol Chem 279, 37842-51.
[26] Coyle, J. and Kershaw, P. (2001). Galantamine, a cholinesterase inhibitor that ailosterically modulates nicotinic receptors: effects on the course of Alzheimer's disease. Biol Psychiatry 49, 289-99.
[27] Maelicke, A., Samochocki, M., Jostock, R., Fehrenbacher, A., Ludwig, J., Albuquerque, E.X. and Zerlin, M. (2001). Allosteric sensitization of nicotinic receptors by galantamine, a new treatment strategy for Alzheimer's disease. Biol Psychiatry 49, 279-88.
[28] Newhouse, P.A., Potter, A., Kelton, M. and Corwin, J. (2001). Nicotinic treatment of Alzheimer's disease. Biol Psychiatry 49, 268-78.
[29] Wang, H.Y., Li, W., Benedetti, N.J. and Lee, D.H. (2003). Alpha 7 nicotinic acetylcholine receptors mediate beta-amyloid peptide-induced tau protein phosphorylation. J Biol Chem 278, 31547-53.
[30] Christensen, D.D. (2007). Changing the Course of Alzheimer's Disease: Anti-Amyloid Disease-Modifying Treatments on the Horizon. J Clin Psychiatry 9, 32-41.
[31] Gervais, F. et al. (2007). Targeting soluble Abeta peptide with Tramiprosate for the treatment of brain amyloidosis. Neurobiol Aging 28, 537-47.
[32] Velazquez, P., Cribbs, D.H., Poulos, T.L and Tenner, A.J. (1997). Aspartate residue 7 in amyloid beta-protein is critical for classical complement pathway activation: implications for Alzheimer's disease pathogenesis. Nat Med 3, 77-9.
[33] Giulian, D. et al. (1998). The HHQK domain of beta-amyloid provides a structural basis for the immunopathology of Alzheimer's disease. J Biol Chem 273, 29719-26.
[34] Bronfman, F.C., Garrido, J., Alvarez, A., Morgan, C. and Inestrosa, N.C. (1996). Laminin inhibits amyloid-beta-peptide fibrillation. Neurosci Lett 218, 201-3.
[35] Castillo, G.M., Lukito, W., Peskind, E., Raskind, M., Kirschner, D.A., Yee, A.G. and Snow, A.D. (2000). Laminin inhibition of beta-amyloid protein (Abeta) fibrillogenesis and identification of an Abeta binding site localized to the globular domain repeats on the laminin a chain. J Neurosci Res 62, 451-62.
[36] Murtomaki, S., Risteli, J., Risteli, L., Koivisto, U.M., Johansson, S. and Liesi, P. (1992). Laminin and its neurite outgrowth-promoting domain in the brain in Alzheimer's disease and Down's syndrome patients. J Neurosci Res 32, 261-73.
[37] Caplan, M.R., Schwartzfarb, E.M., Zhang, S., Kamm, R.D. and Lauffenburger, D.A. (2002). Control of self-assembling oligopeptide matrix formation through systematic variation of amino acid sequence. Biomaterials 23, 219-27.
[38] Zhang, S. (2002). Emerging biological materials through molecular self-assembly. Biotechnol Adv 20, 321-39.
[39] Buneeva, O. Proteomics 2010, 10, 23-37.
| название | год | авторы | номер документа |
|---|---|---|---|
| Фармацевтическая композиция на основе пептида HAEE для лечения нейродегенеративных заболеваний | 2019 |
|
RU2709539C1 |
| Способ лечения нейродегенеративных заболеваний | 2021 |
|
RU2777871C1 |
| ПЕПТИД И СПОСОБ ЛЕЧЕНИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА | 2018 |
|
RU2679059C1 |
| ПЕПТИД И СПОСОБ ЛЕЧЕНИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА | 2018 |
|
RU2679080C1 |
| Способ получения пептида Ac-His-Ala-Glu-Glu-NH | 2021 |
|
RU2767030C1 |
| МАГНИЕВЫЙ КОМПЛЕКС ПЕПТИДА HAEE ДЛЯ ЛЕЧЕНИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2022 |
|
RU2784746C1 |
| ЦИНКОВЫЙ КОМПЛЕКС ПЕПТИДА HAEE ДЛЯ ЛЕЧЕНИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2022 |
|
RU2784319C1 |
| МЕДНЫЙ КОМПЛЕКС ПЕПТИДА HAEE ДЛЯ ЛЕЧЕНИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2022 |
|
RU2784732C1 |
| КАЛЬЦИЕВЫЙ КОМПЛЕКС ПЕПТИДА ДЛЯ ЛЕЧЕНИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2022 |
|
RU2785354C1 |
| СИНТЕТИЧЕСКИЙ ТЕТРАПЕПТИД HAEE И ЕГО ПРОИЗВОДНЫЕ, ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ВОССТАНОВЛЕНИЯ ФУНКЦИИ НЕЙРОНОВ ЧЕЛОВЕКА | 2023 |
|
RU2822603C1 |

















Изобретение относится к пептидному соединению Ra-R1-R2-R3-R4-Rb (I) или Ra-R4-R3-R2-R1-Rb (II), где Ra представляет собой N-концевую первичную аминную группу аминокислоты R1 или R4, либо свободную, либо замещенную аминозащитной группой, Rb представляет собой гидроксильную группу С-концевой карбоксильной группы аминокислоты R1 или R4, либо свободную, либо замещенную гидроксизащитной группой, и R1-R2-R3-R4 или R4-R3-R2-R1 представляют собой HADD, KADD, DDAK, RADD, DDAR, KAED, DEAK, RAED, DEAR, HADE, EDAH, KADE, EDAK, RADE, EDAR, HAEE, EEAH, KAEE, EEAK, RAEE и EEAR. Настоящее изобретение также относится к применению указанных полезных пептидных соединений, в частности, для связывания с β-амилоидными пептидами и ингибирования полимеризации их в виде амилоидных бляшек. Соединения могут быть использованы в качестве лекарственного средства или для подготовки или определения препаратов с целью лечения нейродегенеративных заболеваний, в частности болезни Альцгеймера. 7 н. и 14 з.п. ф-лы, 9 ил., 2 табл., 4 пр.
1. Пептидное соединение общей формулы (I) или (II)
Ra-R1-R2-R3-R4-Rb (I) или Ra-R4-R3-R2-R1-Rb (II),
где
- Ra представляет собой N-концевую первичную аминную группу аминокислоты R1 или R4, либо свободную, либо замещенную аминозащитной группой,
- Rb представляет собой гидроксильную группу С-концевой карбоксильной группы аминокислоты R1 или R4, либо свободную, либо замещенную гидроксизащитной группой, и
- R1-R2-R3-R4 или R4-R3-R2-R1 представляют собой HADD, KADD, DDAK, RADD, DDAR, KAED, DEAK, RAED, DEAR, HADE, EDAH, KADE, EDAK, RADE, EDAR, HAEE, EEAH, KAEE, EEAK, RAEE и EEAR,
при этом Ra пептида EDAK содержит указанную аминозащитную группу и Rb пептида EDAK содержит указанную гидроксизащитную группу.
2. Пептидное соединение по п. 1, где гидроксигруппа С-концевой карбоксильной группы пептида замещена защитной группой, выбранной из: -NH2, -NHR, -NRR, где R представляет собой C1-C4 алкил, и -O-R, где R представляет собой C1-C4 алкил или алкиламин.
3. Пептидное соединение по п. 1, где N-концевая аминогруппа пептида замещена защитной группой, выбранной из формильной группы (НСО-) и ацетильной группы (СН3СО-).
4. Пептидное соединение по п. 1, где защитные группы являются совместимыми с фармацевтическим применением in vivo.
5. Пептидное соединение по п. 1, выбранное из соединений формулы (I) или (II), где R1-R2-R3-R4 или R4-R3-R2-R1 представляют собой HAEE, EDAR, ЕЕАН, EEAK, EEAR, HADD, HADE, KADD, KAEE, RADD, RADE, RAEE, DDAK, KAED, DEAR или KADE.
6. Пептидное соединение по п. 5, выбранное из соединений формулы (I) или (II), где R1-R2-R3-R4 или R4-R3-R2-R1 представляют собой один из тетрапептидов HADD, DDAK, RADD, KAED, DEAR, KADE, HAEE и RAEE.
7. Пептидное соединение по п. 5, выбранное из соединений формулы (I) или (II), где R1-R2-R3-R4 или R4-R3-R2-R1 представляют собой один из двух тетрапептидов НАЕЕ и RADD.
8. Пептидное соединение по п. 5, где аминокислоты R1, R2, R3 и R4 находятся в виде природных изомеров L и Ra и Rb содержат защитные группы для всех тетрапептидов Ra-R1-R2-R3-R4-Rb (I) или Ra-R4-R3-R2-R1-Rb (II).
9. Пептидное соединение по п. 1, соответствующее формуле Ac-HAEE-NH2 или Ac-RADD-NH2.
10. Лекарственное средство для снижения или предотвращения связывания ионов Zn (II) с β-амилоидным пептидом, содержащее пептидное соединение по п. 1 в качестве активного вещества.
11. Композиция для снижения или предотвращения связывания ионов Zn (II) с β-амилоидным пептидом, содержащая активное вещество, содержащее по меньшей мере пептидное соединение по п. 1, степень чистоты которого составляет по меньшей мере 98%.
12. Фармацевтическая композиция для снижения или предотвращения связывания ионов Zn (II) с β-амилоидным пептидом, содержащая эффективное количество лекарственного средства по п. 10, с фармацевтически приемлемым носителем.
13. Фармацевтическая композиция по п. 12, содержащая фармацевтически приемлемый носитель для парентерального, чрескожного или чресслизистого введения.
14. Композиция по п. 13, где носитель подходит для внутрисосудистого, внутримышечного, подкожного, внутриспинного или цереброспинального введения.
15. Способ снижения или предотвращения связывания ионов Zn (II) с β-амилоидным пептидом, включающий связывание пептидного соединения по п. 1 с указанным β-амилоидным пептидом.
16. Способ снижения или предотвращения полимеризации и(или) агрегации β-амилоидного пептида в присутствии ионов Zn (II), включающий связывание пептидного соединения по п. 1 с указанным β-амилоидным пептидом.
17. Способ терапевтического лечения заболеваний, при которых установлено образование амилоидных бляшек, включающий введение пациенту фармацевтической композиции по п. 12.
18. Способ по п. 17 для лечения нейродегенеративных заболеваний.
19. Способ по п. 18 для лечения болезни Альцгеймера.
20. Способ по п. 17, где указанное пептидное соединение содержит НАЕЕ или RADD.
21. Способ по п. 20, где пептидное соединение представляет собой Ас-HAEE-NH2 или Ac-RADD-NH2.
| US 2004214165 A1, 28.10.2004 | |||
| УСТРОЙСТВО ДЛЯ ФОРМОВАНИЯ ТОРФА | 1998 |
|
RU2130550C1 |
| 0 |
|
SU196364A1 | |
| Накаливаемый катод | 1929 |
|
SU16040A1 |
| Gomez-Ruiz et al | |||
| J | |||
| Dairy Sci., 2007, 90:4966-4973 | |||
| CHU Y -H ET AL: "Free solution identification of candidate peptides from combinatorial libraries by affinity capillary electrophoresis/mass spectrometry", JOURNAL OF THE AMERICAN CHEMICAL SOCIETY, 1995, vol | |||
| Аппарат для испытания прессованных хлебопекарных дрожжей | 1921 |
|
SU117A1 |
| Способ изготовления электрических сопротивлений посредством осаждения слоя проводника на поверхности изолятора | 1921 |
|
SU19A1 |
Авторы
Даты
2016-06-27—Публикация
2011-10-24—Подача