Изобретение относится к медицине, а именно, к молекулярной биологии, онкологии, и может найти применение для оперативного определения степени злокачественности глиальной опухоли головного мозга.
Глиомы - инвазивные опухоли мозга, характеризующиеся высокими уровнями рецидивирования и смертности. Морфологически глиомы подразделяют на астроцитомы, олигодендроглиомы и смешанные олиго-астроцитомы. Приблизительно 70% всех глиом относятся к злокачественным; на этом фоне лишь 20% пациентов с данным заболеванием преодолевают 5-летний рубеж выживаемости (Wen P.Y., Kesari S. Malignant gliomas in adults. N. Engl. J. Med. 2008; 359: 492-507). Согласно классификации ВОЗ, по степени злокачественности (I-IV) глиомы дифференцируют на следующие группы: I (пилоцитарные астроцитомы), II (глиомы низкой степени злокачественности), III (глиомы высокой степени степени злокачественности), IV (глиобластомы).
Классификация глиом базируется на данных цитологического и гистологического исследования биоптата опухоли, полученного после хирургического удаления или стереотаксической биопсии. В целом диагностика достаточно трудоемкая, требующая высокого профессионализма врача-патогистолога и занимает продолжительное время (6-7 суток). Во многих случаях в силу труднодоступной локализации и разнородности структуры глиом затруднительно точно установить степень злокачественности опухоли. В последние десятилетия достижения молекулярной генетики широко внедряются в онкологическую практику, в том числе для диагностических и прогностических целей. Вводимая в широкую клиническую практику молекулярная классификация глиом, также как разрабатываемые панели биомаркеров повышают прогностическую и предиктивную способность традиционной гистопатологической шкалы. Учитывая быстро меняющийся ландшафт омиксных технологий, следует ожидать транслирование полногеномных данных в улучшенные виды терапии и прогностических средств для пациентов со злокачественными опухолями мозга (см. Кит ОИ., Водолажский Д.И., Расторгуев Э.Е., Франциянц Е.М., Поркшеян Д.Х., Панина С.Б. Мультиформная глиобластома: патогенез и молекулярные маркеры // Вопросы онкологии. 2017. Т. 63. №5. С. 694-701).
Одним из значимых сигнальных путей в развитии глиобластом является путь EGFR - рецептора эпидермального фактора роста из семейства рецепторных тирозинкиназ. Аберрантная экспрессия гена EGFR приводит к конститутивной активации одноименного каскада, что, в последствии, инициирует процессы злокачественнной трансформации в большинстве опухолей (Afif S.H., Pandith А.А., Bhat A.R. et al. EGFR and PTEN gene mutation status in glioblastoma patients and their prognostic impact on patient's survival // J. Carcinog. Mutagen. - 2015. - Vol. 6. - P. 218.). Это позволяет использовать показатель изменения экспрессии гена EGFR как молекулярный маркер степени злокачественности опухоли. MSI1 - это маркер нейрональных стволовых клеток, регулирующий баланс между самообновлением и терминальной дифференцировкой клеток. Изменение экспрессии этого гена ассоциируется с развитием опухолей головного мозга (Glazer RI, Vo DT, Penalva LO (2012). Musashil: an RBP with versatile functions in normal and cancer stem cells. Frontiers in Bioscience. 17: 54-64.). Hsa-miR-92a-1-5p - микроРНК, регулирующая экспрессию гена MSI1 на посттранскрипционном этапе (targetscan.com).
Анализ патентных источников показал наличие следующих изобретений близких по тематике к заявленному:
1) «Способ диагностики, прогнозирования и лечения глиомы» (см. заявка на изобретение 2008129028/14, опубл. 27.01.2010). Авторами предложено проводить иммуно-гистологическое исследование на послеоперационном опухолевом материале, в результате которого оценивается степень злокачественности глиомы. Согласно классификации глиом 2016 года (см. Louis D.N. et al. WHO Classification of Tumors of the Central Nervous System. 2016 //IARC: Lyon.) иммуно-гистологическое исследование злокачественных новообразований мозга должно войти в рутинную практику гистологической верификации окончательного диагноза ЗНО мозга. Тем не менее, возможность оперативного, менее дорогого способа G-дифференциации глиом с помощью маркеров экспрессии генов может стать эффективным скрининговым методом, в т.ч. на стадии стереотаксической биопсии. Однако на фоне менее затратного подхода продолжительность заявленного способа занимает 5-7 дней, что не дает преимуществ в оперативности получаемых результатов.
2) «Способ дифференциальной диагностики глиом головного мозга человека» (см. заявка на изобретение 2015108718/10, опубл. 10.05.2016). Авторами предложено проводить молекулярно-генетическое исследование относительной экспрессии 10-ти микроРНК на послеоперационном опухолевом материале, в результате которого оценивается степень злокачественности глиомы. Отметим, что предложенный авторами показатель относительной экспрессии рассчитывался с использованием Только одного референсного гена, подобранного по литературным данным, без валидации для конкретных условий. Референсные гены - маркеры внутреннего контроля, необходимые для нормализации данных исследуемых локусов с целью нивелирования влияния биологических различий. Во многих исследованиях было продемонстрировано, что не существует единого гена внутреннего контроля, поэтому для нормализации результатов RT-PCR рекомендуется использовать более одного эталонного гена, а обеспечение точных и надежных результатов требует предварительной проверки выбранных референсных генов (см. Hellemans J., Vandesompele J. Selection of Reliable Reference Genes for RT-qPCR Analysis. In: Biassoni R., Raso A. (eds) Quantitative Real-Time PCR. Methods in Molecular Biology (Methods and Protocols), vol 1160. 2014; см. Humana Press, New York, NY; Wang X., Fu Y., Ban L., Wang Z., Feng G., Li J., Gao H. Selection of reliable reference genes for quantitative real-time RT-PCR in alfalfa // Genes Genet. Syst., 2015, 90, p. 175-180).
Определяющими отличиями заявляемого способа, по сравнению с прототипом, являются:
- метод основан на сравнении относительной экспрессии экспериментально подобранной комбинации двух генов EGFR, MSI1 и одной микроРНК hsa-miR-92a-1-5p, которая таргетирует уровень мРНК гена MSI1 в клетке, что позволяет удешевить, упростить и значительно ускорить процедуру тестирования, а также провести анализ на небольшом количестве биопсийного материала;
- определение уровня экспрессии в образцах ткани проводят методом RT-PCR в реальном времени с использованием двух референсных микроРНК (hsa-miR-126-5p и hsa-miR-7-5p) и трех референсных генов (PSMC, ТВР, RPLO), подобранных с использованием программного обеспечения «GENorm», genorm.cmgg.be), с последующим геометрическим усреднением, что повышает точность и чувствительность тестирования;
- заключение о типе глиальной опухоли делают на основании тестирования образцов условно нормальной контрольной ткани (перифокальная зона) и опухолевой ткани головного мозга, что позволяет учитывать индивидуальные различия и гетерогенность глиом.
В предварительных исследованиях был выявлен широкий диапазон варьирования уровня экспрессии как онко-ассоциированных генов, так и таргетирующих их микроРНК. Данные относительной экспрессии двух генов и одной микроРНК оптимально дифференцировали глиомы II, III и IV степени злокачественности.
Техническим результатом заявляемого изобретения является создание нового, эффективного, специфичного способа дифференциальной диагностики глиом низкой степени злокачественности II и глиом высокой степени злокачественности III, IV согласно гистологическим критериям.
Технический результат достигается тем, что на основании анализа экспрессии генов и микро-РНК, включающий выделение тотальной РНК из тканевых проб глиом и перифокальной зоны, обратную транскрипцию с последующей амплификацией в режиме реального времени RT-PCR, отличающийся тем, что используют высокоспецифичные праймеры для генетических локусов EGFR, MSI1, PSMC4, ТВР, RPLO и микроРНК hsa-miR-92-1-5p, hsa-miR-126-5p, -hsa-miR-7-5p, анализируют полученные данные и вычисляют коэффициент относительной экспрессии Е для генов EGFR, MSI1 и микроРНК hsa-miR-92-1-5p с использованием трех высокоспецифичных референсных генов PSMC4, ТВР, RPLO и двух референсных высокоспецифичных микроРНК hsa-miR-126-5p, hsa-miR-7-5p и при значениях EEGFR<0.5 или EEGFR>1.5, EMSI1<0.5 или EMSI1>1.5, Ehsa.miR-92a-1-5p<0.5 или Ehsa.miR-92a-1-5p>1.5 хотя бы по одному локусу у пациента диагностируется глиома высокой степени злокачественности III, IV; отсутствие изменений экспрессии указанных локусов относительно контроля свидетельствует о соответствии опухоли II степени злокачественности; коэффициент Е рассчитывают по формуле:  где ΔCt (опухоль) - относительная экспрессия генов и микро-РНК в ткани глиом, где ΔCt(контроль) - относительная экспрессия генов и микро-РНК в ткани перифокальной зоны; при этом относительную экспрессию генетических локусов рассчитывают по формуле ΔCt = 2-(Ct целевого гена-Ct референсных генов), где Сtцелевого гена - среднее по трем повторам для целевых локусов EGFR или MSI1 и где Сtреференсных генов - среднее геометрическое значение референсных генов PSMC4, ТВР, RPLO; относительную экспрессию микро-РНК рассчитывают по формуле ΔCt = 2-(Ct целевой микроРНК-Ct референсных микроРНК), где Ct целевой микроРНК - среднее по трем повторам для микроРНК hsa-miR-92-1-5р и где Сtреференсных микроРНК - среднее геометрическое значение референсных микроРНК hsa-miR-126-5p, hsa-miR-7-5p.
где ΔCt (опухоль) - относительная экспрессия генов и микро-РНК в ткани глиом, где ΔCt(контроль) - относительная экспрессия генов и микро-РНК в ткани перифокальной зоны; при этом относительную экспрессию генетических локусов рассчитывают по формуле ΔCt = 2-(Ct целевого гена-Ct референсных генов), где Сtцелевого гена - среднее по трем повторам для целевых локусов EGFR или MSI1 и где Сtреференсных генов - среднее геометрическое значение референсных генов PSMC4, ТВР, RPLO; относительную экспрессию микро-РНК рассчитывают по формуле ΔCt = 2-(Ct целевой микроРНК-Ct референсных микроРНК), где Ct целевой микроРНК - среднее по трем повторам для микроРНК hsa-miR-92-1-5р и где Сtреференсных микроРНК - среднее геометрическое значение референсных микроРНК hsa-miR-126-5p, hsa-miR-7-5p.
Способ основан на патогенетическом факторе канцерогенеза - аберрантной экспрессии генов, ассоциированных с инициацией и развитием злокачественного процесса, что приводит к прогрессированию опухоли.
Заявленный способ включает следующие этапы: отбор биоматериала интраоперационно, выделение тотальной РНК из тканевых проб; проведение обратной транскрипции для наработки кДНК, RT-PCR полученной кДНК в присутствии специфичных праймеров; обработку данных для оценки изменения относительной экспрессии в опухолевых образцах, относительно контрольных.
Заявляемый способ осуществляется следующим образом.
У пациента производят отбор биоматериала интраоперационно. Образцы опухолевой ткани и перифокальной зоны замораживают в жидком азоте или фиксируют в РНК-среде для транспортировки в лабораторию и дальнейшего хранения.
Выделение тотальной РНК из ткани проводят подходящим методом экстракции. Выделенную РНК подвергают обратной транскрипции. Обратная транскрипция микроРНК проводится одновременно с полиаденилированием РНК, с использованием специфичных RT-праймеров. Последовательности RT-праймеров микроРНК, подобранные по литературным источникам (Balcells I., Cirera S., Busk P.K. Specific and sensitive quantitative RT-PCR of miRNAs with DNA primers //BMC biotechnology. - 2011. - Т. 11. - №.1. - C. 70; MirBase (http://www.mirbase.org/)), указаны в таблице 1.

Анализируемые последовательности генетических локусов амплифицируют в 20 мкл PCR-смеси, содержащей 1х PCR-буфер, 0,25 mM dNTPs, 2 мМ MgCl2, 1 ед.акт. Taq-DNA-полимеразы, по 0,5 мкМ прямого и обратного праймеров. Оптимизированные условия амплификации и последовательности PCR-праймеров собственного дизайна, подобранные с использованием баз данных MirBase, NCBI GenBank и программы Primer-BLAST (https://www.ncbi.nlm.nih.gov/tools/primer-blast/, приведены в таблице
2. Постановку RT-PCR каждого образца проводят в трех повторах.

Для оценки изменения относительной экспрессии в опухолевой ткани по сравнению с условно нормальной контрольной тканью для каждого локуса рассчитывают коэффициент Е по формуле  где ΔCt(опухоль) - относительная экспрессия генов и микро-РНК в ткани глиом, где ΔCt(контроль) - относительная экспрессия генов и микро-РНК в ткани перифокальной зоны; при этом относительную экспрессию генетических локусов рассчитывают по формуле ΔCt=2-(Сtцелевого гена-Ct референсных генов) - где Сtцелевого гена - среднее по трем повторам для целевых локусов EGFR или MSI1 и где Сtреференсных генов - среднее геометрическое значение референсных генов PSMC4, ТВР, RPLO; относительную экспрессию микро-РНК рассчитывают по формуле ΔCt = 2-(Сtцелевой микроРНК-Сtреференсных микроРНК), где Сtцелевой микроРНК - среднее по трем повторам для микроРНК hsa-miR-92-1-5р и где Сtреференсных микроРНК - среднее геометрическое значение референсных микроРНК hsa-miR-126-5p, hsa-miR-7-5p.
где ΔCt(опухоль) - относительная экспрессия генов и микро-РНК в ткани глиом, где ΔCt(контроль) - относительная экспрессия генов и микро-РНК в ткани перифокальной зоны; при этом относительную экспрессию генетических локусов рассчитывают по формуле ΔCt=2-(Сtцелевого гена-Ct референсных генов) - где Сtцелевого гена - среднее по трем повторам для целевых локусов EGFR или MSI1 и где Сtреференсных генов - среднее геометрическое значение референсных генов PSMC4, ТВР, RPLO; относительную экспрессию микро-РНК рассчитывают по формуле ΔCt = 2-(Сtцелевой микроРНК-Сtреференсных микроРНК), где Сtцелевой микроРНК - среднее по трем повторам для микроРНК hsa-miR-92-1-5р и где Сtреференсных микроРНК - среднее геометрическое значение референсных микроРНК hsa-miR-126-5p, hsa-miR-7-5p.
При значениях EEGFR<0.5 или EEGFR>1.5, EMSI1<0.5 или EMSI1>1.5, Ehsa-miR-92a-1-5p<0.5 или Ehsa-miR-92a-1-5p>1.5 хотя бы по одному локусу у пациента диагностируется глиома высокой степени злокачественности III, IV; отсутствие изменений экспрессии указанных локусов относительно контроля свидетельствует о соответствии опухоли II степени злокачественности.
В целях оценки потенциальной значимости выбранных маркеров была рассчитана их чувствительность и специфичность. Показано, что для дифференциации случаев глиом низкой и высокой степени злокачественности, маркер EGFR имеет чувствительность 85% и специфичность 50%, MSI1 чувствительность 100% и специфичность 45%, микроРНК hsa-miR-92a-1-5p чувствительность 100% и специфичность 40%. В то же время система из трех маркеров обладает чувствительностью 84% и специфичностью 99%. Предложенная система маркеров открыта и возможно увеличить ее чувствительность и/или дифференцирующую специфичность при расширении паттерна генетических локусов для оценки изменения относительной экспрессии в опухолевой ткани.
Для доказательства прогностической ценности предложенного способа приводится 3 выписки из историй болезни.
Пример №1.
Больная Г. обратилась в ФГБУ «РНИОИ» Минздрава России с жалобами на дезориентацию в пространстве.
Считает себя больной с мая 2018 г, когда появились вышеуказанные симптомы. Обратилась за медицинской помощью по месту жительства, где Выполнила МРТ с последующим выявлением объемного образования, направлена в ФГБУ «РНИОИ» Минздрава России. По решению врачебной комиссии по отбору пациентов для оказания высокотехнологичной Медицинской помощи больная госпитализирована в отделение нейроонкологии ФГБУ «РНИОИ» Минздрава России на хирургическое лечение.
Дата и вид операции: краниоэктомия от 28.06.2018: циторедуктивное удаление глиальной опухоли мозолистого тела с вовлечением лобных долей, поясных извилин с применением интраоперационной навигации.
Выполнение молекулярно-генетического исследования опухолевой и контрольной ткани от 29.06.2018: исследование экспрессии генов EGFR, MSI1 и микроРНК hsa-92a-1-5p не выявило значимых изменений экспрессии исследуемых локусов, что соответствует степени злокачественности G2.
Гистологическое исследование биоптата от 04.07.2018 - G2 олигодендроглиома.
Пример №2
Пациент Г. обратился в ФГБУ «РНИОИ» Минздрава России 24.04.2018 с жалобами на онемения в левой руке, слабость в левой ноге.
Начало заболевания отмечает около двух месяцев назад с онемением в левой руке, слабость в левой ноге. Консультирован неврологом по месту жительства, назначена консервативная терапия, без положительного эффекта. Далее рекомендовано выполнение МРТ головного мозга, где выявлено образование левой теменной доли головного мозга. Направлен в ФГБУ «РНИОИ» Минздрава России. По решению врачебной комиссии по отбору пациентов для оказания высокотехнологичной медицинской помощи больной госпитализирован в отделение нейроонкологии РНИОИ на хирургическое лечение.
Дата и вид операции: костно-пластическая краниотомия 25.04.2018, циторедуктивное удаление глйальной опухоли правой лобной и теменной долей головного мозга с применением интраоперационной навигации.
Выполнение молекулярно-генетического исследования опухолевой и контрольной ткани от 26.04.2018: исследование экспрессии генов EGFR, MSI1 и микроРНК hsa-92a-1-5p выявило значимое изменение экспрессии всех исследуемых локусов более чем в 1,5 раза, что соответствует степени злокачественности G3-G4.
Гистологическое исследование биоптата от 04.05.2018 - G4 глиобластома с обширными очагами некроза и кровоизлияний.
Пример №3
Пациентка С., 52 года, обратилась в ФГБУ «РНИОИ» Минздрава России 03.04.2018 с жалобами на легкие нарушения речи, головокружение, головные боли.
Начало заболевания отмечает 25.03.2018, когда впервые возник генерализованный эпилептический приступ, вызвана бригада СМП, доставлена в БМСП №5 г. Таганрога, где после стабилизации состояния, отправлена домой. Далее самостоятельно записалась на МРТ головного мозга с контрастированием, где выявлена опухоль левой лобной доли головного мозга. После этого обратилась в ФГБУ «РНИОИ» Минздрава России. Консилиум от 02.04.2018: показано удаление опухоли. Госпитализирована в отделение нейроонкологии ФГБУ «РНИОИ» Минздрава России для хирургического лечения.
Дата и вид операции: 06.04.2018 - костно-пластическая краниотомия, циторедуктивное удаление глиальной опухоли левой лобной доли головного мозга с применением интраоперационной навигации.
Участок удаленной опухоли и контрольной ткани был направлен на исследование экспрессии генов EGFR, MSI1 и микроРНК hsa-92a-1-5p. Результат исследования от 09.04.2018 выявил значимое изменение экспрессии MSI1 и микроРНК hsa-92a-1-5p более чем в 2,5 раза, что соответствует степени злокачественности G3-G4.
Гистологическое исследование от 10.04.18 г: низкодифференцированная опухоль солидного строения. Рекомендовано ИГХ.
Иммуногистохимическое исследование от 28.04.18 г. - гистологическая картина и иммунофенатип опухоли характерны для анапластической астроцитомы WHO grade III: p53-позитивная ядерная реакция в единичных опухолевых клетках; ki67 маркер пролиферативной активности - положительная экспрессия в 10% ядер опухолевых клеток.
Анализ представленных клинических случаев свидетельствует о возможности проведения дифференциальной диагностики глиомы с использованием исследования экспрессии генов EGFR, MSI1 и микроРНК hsa-miR-92a-1-5р.
Предлагаемым способом было осуществлено определение степени злокачественности глиом у 25 больных, результаты молекулярно-генетических исследований в дальнейшем подтверждены данными гистологического анализа.
«Способ дифференциальной диагностики глиом на основании анализа экспрессии генов и микро-РНК» позволяет диагностировать степень злокачественности глиом, что способствует уточнению диагноза и определению правильной тактики лечения, а также будет способствовать улучшению результатов лечения больных с глиальными опухолями. Заявляемый способ является экономически оправданным для уточнения диагноза и дает возможность скорректировать тактику лечения в послеоперационном периоде; обладает высокой чувствительностью (84%) и специфичностью (99%), его осуществление возможно на интраоперационном материале, способ занимает менее 8 часов.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ дифференциальной диагностики глиальных опухолей III и IV грейдов злокачественности | 2024 |
|
RU2837999C1 |
| Способ оценки степени анаплазии клеток в культуре глиомы | 2021 |
|
RU2780236C1 |
| Способ дифференциальной диагностики глиом высоких грейдов | 2022 |
|
RU2786003C1 |
| Способ оценки злокачественности клеток в культурах глиомы | 2022 |
|
RU2786007C1 |
| Способ диагностики глиальных опухолей головного мозга высокой степени злокачественности | 2020 |
|
RU2742413C1 |
| Способ малоинвазивной диагностики глиобластом | 2022 |
|
RU2788815C1 |
| Способ малоинвазивной диагностики менингиом и опухолей глиального ряда с уточнением степени злокачественности | 2022 |
|
RU2788814C1 |
| Способ определения радиочувствительности злокачественных опухолей прямой кишки | 2020 |
|
RU2754154C1 |
| Способ дифференциальной диагностики рака яичников, кистозных образований яичника и рака тела матки | 2024 |
|
RU2836527C1 |
| Тест-система "miR-M-SCREEN" для прогнозирования развития метастазов у больных колоректальным раком на основании уровня микро-РНК miR-26a и miR-143 в плазме крови | 2022 |
|
RU2786386C1 |
Изобретение относится к области биотехнологии и медицины. Предложен способ дифференциальной диагностики глиом на основании анализа экспрессии генов и микро-РНК, включающий выделение тотальной РНК из тканевых проб глиом и перифокальной зоны, обратную транскрипцию, с последующей амплификацией в режиме реального времени RT-PCR, отличающийся тем, что используют высокоспецифичные праймеры для генетических локусов EGFR, MSI1, PSMC4, ТВР, RPLO, и микро-РНК hsa-miR-92-1-5р, hsa-miR-126-5p, hsa-miR-7-5p, анализируют полученные данные и вычисляют коэффициент относительной экспрессии Е с использованием трех высокоспецифичных референсных генов: PSMC4, ТВР, RPLO и двух референсных высокоспецифичных микро-РНК: hsa-miR-126-5р, hsa-miR-7-5p, сравнивают полученные значения Е в опухолевой ткани с контрольными и при значениях EEGFR<0,5 или EEGFR>1,5, EMSI1<0,5 или EMSI1>1,5, Ehsa-miR-92a-1-5p<0,5 или Ehsa-miR-92a-1-5p>1,5 хотя бы по одному локусу у пациента диагностируется глиома высокой степени злокачественности III, IV; отсутствие изменений экспрессии указанных локусов относительно контроля свидетельствует о соответствии опухоли II степени злокачественности. Изобретение позволяет эффективно дифференцировать глиомы в медицине. 2 табл., 3 пр.
Способ дифференциальной диагностики глиом на основании анализа экспрессии генов и микро-РНК, включающий выделение тотальной РНК из тканевых проб глиом и перифокальной зоны, обратную транскрипцию, с последующей амплификацией в режиме реального времени RT-PCR, отличающийся тем, что используют высокоспецифичные праймеры для генетических локусов EGFR - F: AGGACGGGGACCAGACAA, R: CTGCGTACTTCCAGACCAGG, MSI1 - F: GGCTGTGGTTCGAGGGAC, R: CTGGGAGTCGAACCTGGAG, PSMC4 - F: CGCTCACGCATTTCGAGC, R: CAGGTGGGCCATACATGAGG, ТВР - F: GTGCCCGAAACGCCGAA, R: GTGGTTCGTGGCTCTCTTATCC, RPLO - F: GAGGAAACTCTGCATTCTCGC, R: CTGCAGACAGACACTGGCA и микро-РНК hsa-miR-92-1-5р - F: GAGGTTGGGATCGGTTGGAA, R: AGGTCCAGT(15)AGCA, hsa-miR-126-5p - F: CGCAGCATTATTACTTTTGGTAC, R: GTCCAG15(T)GCGTA, hsa-miR-7-5p - F: CGCAGTGGAAGACTAGTGA, R: GTCCAGT(15)CAAC, анализируют полученные данные и вычисляют коэффициент относительной экспрессии Е с использованием трех высокоспецифичных референсных генов: PSMC4, ТВР, RPLO и двух референсных высокоспецифичных микро-РНК: hsa-miR-126-5р, hsa-miR-7-5p, сравнивают полученные значения Е в опухолевой ткани с контрольными и при значениях EEGFR<0,5 или EEGFR>1,5, EMSI1<0,5 или EMSI1>1,5, Ehsa-miR-92a-1-5p<0,5 или Ehsa-miR-92a-1-5p>1,5 хотя бы по одному локусу у пациента диагностируется глиома высокой степени злокачественности III, IV; отсутствие изменений экспрессии указанных локусов относительно контроля свидетельствует о соответствии опухоли II степени злокачественности; коэффициент Е рассчитывают по формуле: 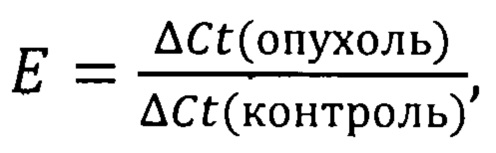 где ΔCt(опухоль) - относительная экспрессия генов и микро-РНК в ткани глиом, где ΔCt(контроль) - относительная экспрессия генов и микро-РНК в ткани перифокальной зоны; при этом относительную экспрессию генетических локусов рассчитывают по формуле ΔCt=2-(Сtцелевого гена-Ctреференсных генов), где Ctцелевого гена - по трем повторам для целевых локусов EGFR или MSI1 и где Сtреференсных генов - среднее геометрическое значение референсных генов PSMC4, ТВР, RPLO; относительную экспрессию микро-РНК рассчитывают по формуле ΔCt=2-(Сtцелевой микроРНК-Ctреференсных микроРНК), где Ctцелевой микроРНК - среднее по трем повторам для микро-РНК hsa-miR-92-1-5р и где Сtреференсных микроРНК - среднее геометрическое значение референсных микро-РНК hsa-miR-126-5р, hsa-miR-7-5p.
где ΔCt(опухоль) - относительная экспрессия генов и микро-РНК в ткани глиом, где ΔCt(контроль) - относительная экспрессия генов и микро-РНК в ткани перифокальной зоны; при этом относительную экспрессию генетических локусов рассчитывают по формуле ΔCt=2-(Сtцелевого гена-Ctреференсных генов), где Ctцелевого гена - по трем повторам для целевых локусов EGFR или MSI1 и где Сtреференсных генов - среднее геометрическое значение референсных генов PSMC4, ТВР, RPLO; относительную экспрессию микро-РНК рассчитывают по формуле ΔCt=2-(Сtцелевой микроРНК-Ctреференсных микроРНК), где Ctцелевой микроРНК - среднее по трем повторам для микро-РНК hsa-miR-92-1-5р и где Сtреференсных микроРНК - среднее геометрическое значение референсных микро-РНК hsa-miR-126-5р, hsa-miR-7-5p.
| AU 2017272272 A1, 04.01.2018 | |||
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ГЛИОМ ГОЛОВНОГО МОЗГА ЧЕЛОВЕКА | 2015 |
|
RU2583871C1 |
| AU 2009212543 D2, 09.07.2015 | |||
| Г.В | |||
| ПАВЛОВА | |||
| СОВРЕМЕННЫЕ МОЛЕКУЛЯРНЫЕ ПОДХОДЫ К ДИАГНОСТИКЕ И ЛЕЧЕНИЮ НИЗКОДИФФЕРЕНЦИРОВАННЫХ ГЛИОМ | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| КИТ О.И | |||
| ПРЕДИКТИВНАЯ ДИАГНОСТИКА МЕТАСТАТИЧЕСКОГО ПОРАЖЕНИЯ ЛИМФОУЗЛОВ У БОЛЬНЫХ АДЕНОКАРЦИНОМОЙ ЖЕЛУДКА | |||
| МЕДИЦИНСКИЙ ВЕСТНИК | |||
Авторы
Даты
2019-12-19—Публикация
2018-11-29—Подача