Изобретение относится к области медицины, в частности, фтизиатрии, и может быть использовано для оценки сбалансированности иммунной, воспалительной и противовоспалительной реакций макрофагов в резецированных участках легких у пациентов, больных туберкулезом легких, после проведения курса противотуберкулезной терапии с целью выбора или разработки тактики дальнейшего лечения.
Туберкулез - социально-значимое инфекционное заболевание, вызываемое бактерией Mycobacterium tuberculosis. Туберкулез характеризуется, с одной стороны, активацией врожденного и адаптивного звеньев иммунного ответа для элиминации патогена, с другой, образованием в пораженных органах патологического воспалительного процесса и зависимой от его тяжести общей реакции организма человека на инфекцию с различной выраженностью клинических проявлений заболевания. Заражение происходит аэрогенным путем в результате вдыхания с воздухом мельчайших частиц аэрозоля, в которых содержатся микобактерии (1-3). Проникая в альвеолярный макрофаг в результате фагоцитоза, М. tuberculosis может быть или уничтожен в клетке-хозяине в результате активации различных микробицидных механизмов или, наоборот, может создать благоприятную нишу для своего выживания и размножения в легких человека (1-6). Формирование множественной лекарственной устойчивости микобактерий туберкулеза делает неэффективным применение ряда противотуберкулезных средств и побуждает вести поиск дополнительных подходов к лечению туберкулеза, основанных, в частности, на иммунокоррекции. Известно, что повышение защитной функции организма человека в ответ на проникновение микобактерий осуществляется путем активации макрофагов в легких как одного из основных составляющих звеньев специфического иммунного ответа (6-9). От выраженности и полноценности фагоцитарной функции альвеолярных макрофагов зависит дальнейшее развитие заболевания (1-9).
Исход взаимодействия между клеткой-хозяином и инфекционным агентом зависит не только от активации макрофагов, выражающейся в увеличении количества альвеолярных макрофагов в легких, но и от их функционального состояния, определяемого синтезом и секрецией этими клетками биологически активных веществ провоспалительного, микробицидного и противовоспалительного действия (6-11). При активном туберкулезе в легких макрофаги продуцируют медиаторы воспаления, при этом воспаление является защитной реакцией организма на внедрение микобактерий туберкулеза. Важную роль в инициации и регуляции воспалительных процессов играют такие медиаторы воспалительного процесса, как цитокины и микробицидные факторы (11-14). Экспериментальные исследования показывают, что в физиологических условиях цитокиновый спектр в тканях легких довольно узок, продукция их мала, а регуляторное действие ограничено специфическими ингибиторами. При патологических состояниях (микробная инвазия, воспаление, повреждение тканей) расширяется качественный состав цитокинов и увеличивается их количество. Цитокины, участвуя в развитии иммунного ответа и воспалительных реакций при ответе на инфекцию, регулируют их продолжительность и амплитуду (9-14). Обычно цитокины продуцируются клетками кратковременно и локально, почти не поступая в кровоток (12-14). Именно поэтому попытки диагностики интенсивности воспаления в легких при активном туберкулезе путем определения цитокинов в плазме крови больного не дает точного результата (1).
В экспериментальных исследованиях, преимущественно на мышах показано, что провоспалительная функция альвеолярных макрофагов определяется синтезом ими высоко активных так называемых «провоспалительных», т.е. стимулирующих воспаление, цитокинов: интерферона гамма (IFNγ), фактора некроза опухолей альфа (TNFα), интерлейкина-1 бета (IL-1β), интерлейкина-12 (IL-12) и других. Эти цитокины активируют не только клетки врожденного и адаптивного звеньев иммунного ответа, но и сами макрофаги, их синтезирующие (13-15). Под действием IFNγ развивается окислительный стресс с накоплением активных форм кислорода (АФК) в макрофагах легких. Долгоживущие радикалы азота высвобождаются при окислении аргинина, катализируемого ферментом индуцибельной оксид азота-синтазы (iNOS), экспрессия гена которого активируется под действием провоспалительных цитокинов, прежде всего, IFNγ. Образующиеся высокотоксические соединения кислорода и азота осуществляют бактерицидные функции в легких пациентов, больных туберкулезом (4-6, 13-15). Однако их переизбыток приводит к усилению воспалительных, токсических и деструктивных процессов не только в легких, но и в других органах пациентов (7, 9, 15). После цитокинов наиболее важными медиаторами воспаления являются простаноиды, образуемые ферментом циклооксигеназой-2 (СОХ-2), экспрессия гена которого индуцируется в макрофагах под действием провоспалительных цитокинов (11, 15).
Известен способ определения интенсивности воспалительного процесса при инфильтративном туберкулезе у пациентов, включающий определение в сыворотке крови белков острой фазы - церулоплазмина (ЦП), гаптоглобина (ГП), С-реактивного белка (СРБ) орозомукоида (АГП), альфа 1-протеазного ингибитора (α1-ПИ) и альфа 2-макроглобулина (α2-МГ). Тяжесть и активность процесса оценивают по уровню неоптерина (Неоп) и активности аденозиндезаминазы (АДА). Распространенность процесса оценивают рентгенологически по числу пораженных сегментов: при поражении 1-2 сегментов процесс расценивают как ограниченный, 3-5 сегментов - как распространенный (16).
Известно использование в качестве маркеров воспаления при активном туберкулезе IL-6 и IL-9 в плазме крови и плевральной жидкости (17), определение содержания IFNγ, IL-4, МСР-3, MIP-1 бета и IP-10 в плазме крови (19), определение содержание в крови цитокинов/хемокинов/факторов роста CXCL9, CXCL10, PDGF-BB, IFNγ и IL-18 (19).
Существенным недостатком известных способов является то, что содержание в сыворотке крови указанных маркеров воспаления отражает интегральные показатели всего организма, не позволяя вычленить точный вклад в полученные значения про- и противовоспалительной активации альвеолярных макрофагов легких. Поскольку данные о взаимосвязи состояния цитокиновой системы в тканях легких и сыворотке крови оказались в значительной мере противоречивы (20-22), определение уровня цитокиновых и других маркеров в сыворотке крови пациентов, больных туберкулезом, в целом, малоинформативно для диагностики туберкулезного заболевания и оценки иммуновоспалительных процессов в легких пациентов (1). Другим недостатком известных способов является отсутствие связи интенсивности воспалительной реакции со степенью зараженности альвеолярных макрофагов микобактериями туберкулеза, что не позволяет определить адекватность реакции макрофагов на возбудителя, ее чрезмерность или недостаточность.
Однако, оценки интенсивности воспалительного процесса при активном туберкулезе недостаточно для выбора тактики лечения. Чрезмерно интенсивная воспалительная реакция становится серьезной угрозой для легких, приводит к прогрессирующей утрате дыхательной функции, обширным поражениям, захватывающим большие объемы легочной паренхимы и, соответственно, ее сосудистого русла. «Избыточная» реактивность иммунной системы на антигены микобактерий не менее опасна, чем недостаточный ответ. Соответственно, оценка интенсивности реакции иммунной системы на туберкулезный воспалительный процесс является важным фактором прогноза течения и исхода заболевания, также как индикатором необходимости регуляции иммунной реактивности.
Установлено, что в разрешении воспаления участвуют, так называемые, «противовоспалительные» цитокины, включая интерлейкин-4 (IL-4) и интерлейкин-10 (IL-10), - запускающие реакции, ингибирующие воспалительные процессы и стимулирующие восстановление функции органа (4-6, 12-15). Продукция альвеолярными макрофагами под действием противовоспалительных цитокинов основного фибробластного фактора роста (FGFb) привлекает фибробласты в зоны воспаления для их заживления. Значительный фиброз тканей может быть, с одной стороны, успешным завершением воспаления, с другой, массивные отложения коллагена также могут нарушать функцию легких (7, 8).
В связи с этим для правильного выбора тактики лечения пациента необходимо определение соотношения степени выраженности воспалительных реакций, состоящих из провоспалительного и микробицидного звеньев, и активности противовоспалительных реакций макрофагального звена иммунной системы при туберкулезной инфекции у человека. Баланс синтезируемых макрофагами про- и противовоспалительных факторов, микробицидных веществ позволяет, с одной стороны, элиминировать инфекционный агент в ходе развития иммуновоспалительных реакций в легких пациентов, а с другой, - предупредить не только прогрессирование и утяжеление воспаления, но и его переход в хроническую форму. Диагностика отклонения от этого баланса приобретает важное значение.
Несмотря на многочисленные экспериментальные исследования механизмов иммунной защиты организма при туберкулезной инфекции легких, отсутствуют способы решения этой задачи.
Задачей, на решение которой направлено изобретение, является оценка сбалансированности иммунной, воспалительной и противовоспалительной реакций альвеолярных макрофагов из резецированных участков легких пациентов, больных туберкулезом легких, в зависимости от степени зараженности альвеолярных макрофагов Mycobacterium tuberculosis.
Техническим результатом является выявление избыточности или недостаточности реакций альвеолярных макрофагов в ответ на инфекцию микобактериями туберкулеза после проведения курсов химиотерапии.
Решение поставленной задачи достигается тем, что из операционного материала резецированных участков легких пациентов, больных туберкулезом легких, получают ex vivo культуру альвеолярных макрофагов, культивируют ее в лунках на покровных стеклах одинакового размера в течение 16-18 часов; фиксируют клетки на покровных стеклах; выполняют окраску их по методу Циля-Нильсена для выявления в альвеолярных макрофагах микобактерий туберкулеза, окраску клеток на покровных стеклах флуоресцентными красителями, позволяющими различать в альвеолярных макрофагах факторы провоспалительной реакции - интерферон гамма, фактор некроза опухоли альфа, интерлейкин 1 бета, интерлейкин 12, циклооксигеназа-2 и/или факторы микробицидной реакции - активные формы кислорода и индуцибельная синтаза оксида азота и/или факторы противовоспалительной реакции - интерлейкин 4, интерлейкин 10, основной фактор роста фибробластов. Затем проводят цитологический анализ с оценкой количества альвеолярных макрофагов в ex vivo культуре суммарно по всем покровным стеклам; при наличии в ex vivo культуре клеток более, чем 100 тысяч альвеолярных макрофагов, от 10 тысяч до 100 тысяч или менее 10 тысяч альвеолярных макрофагов делают вывод о высокой, средней или низкой интенсивности иммунной реакции макрофагов соответственно; на покровных стеклах, окрашенных по методу Циля-Нильсена, определяют долю альвеолярных макрофагов, содержащих микобактерий туберкулеза, от общего числа альвеолярных макрофагов на этих покровных стеклах; при доле альвеолярных макрофагов, содержащих микобактерий, равной или большей 0.5%, делают заключение о высокой зараженности альвеолярных макрофагов микобактериями туберкулеза; при доле альвеолярных макрофагов, содержащих микобактерий туберкулеза, менее 0.5%, делают заключение о низкой зараженности альвеолярных макрофагов; для оценки интенсивности провоспалительной или микробицидной или противовоспалительной реакций альвеолярных макрофагов определяют долю альвеолярных макрофагов, окрашенных на анализируемый фактор, соответствующий одной из указанных реакций, от общего числа альвеолярных макрофагов на покровном стекле, окрашенном на анализируемый фактор; при выявлении более 50% альвеолярных макрофагов, окрасившихся на анализируемый фактор, делают заключение о высокой интенсивности реакции альвеолярных макрофагов, соответствующей данному фактору; при выявлении от 10% до 50% альвеолярных макрофагов, окрасившихся на анализируемый фактор, включительно, делают заключение о средней интенсивности реакции альвеолярных макрофагов, соответствующей данному фактору; при выявлении от 1% до менее 10% альвеолярных макрофагов, окрасившихся на анализируемый фактор, делают заключение о низкой интенсивности реакции альвеолярных макрофагов, соответствующей данному фактору; при выявлении менее 1% альвеолярных макрофагов, окрасившихся на анализируемый фактор, или их отсутствии, делают заключение об отсутствии реакции альвеолярных макрофагов, соответствующей данному фактору; при выявлении высокой и/или средней степени интенсивности реакции альвеолярных макрофагов, соответствующей двум и более факторам провоспалительной реакции и низкой интенсивности реакции, соответствующей остальным факторам данной реакции, делают заключение о высокой интенсивности провоспалительной реакции альвеолярных макрофагов; при выявлении высокой или средней интенсивности реакции альвеолярных макрофагов, соответствующей одному фактору провоспалительной реакции и низкой интенсивности реакции, соответствующей остальным факторам данной реакции или низкой интенсивности реакций, соответствующих всем факторам провоспалительной реакции, делают заключение о низкой интенсивности провоспалительной реакции альвеолярных макрофагов; при выявлении высокой интенсивности реакции, соответствующей одному из микробицидных факторов или средней интенсивности реакции, соответствующей обоим микробицидным факторам, делают заключение о высокой интенсивности микробицидной реакции альвеолярных макрофагов. При выявлении средней интенсивности реакции, соответствующей одному из микробицидных факторов и низкой интенсивности реакции, соответствующей другому микробицидному фактору, или низкой интенсивности реакции, соответствующей обоим микробицидным факторам, делают заключение о низкой интенсивности микробицидной реакции альвеолярных макрофагов; при выявлении высокой и/или средней интенсивности реакции, соответствующей двум и более факторам противовоспалительной реакции, делают заключение о высокой интенсивности противовоспалительной реакции альвеолярных макрофагов; при выявлении высокой или средней степени интенсивности реакции одного фактора противовоспалительной реакции и низкой интенсивности реакции остальных факторов данной реакции или низкой интенсивности реакции всех факторов противовоспалительной реакции, делают заключение о низкой интенсивности противовоспалительной реакции в альвеолярных макрофагах; сравнивают зараженность альвеолярных макрофагов микобактериями туберкулеза с интенсивностью иммунной реакции макрофагов, их провоспалительной, микробицидной и противовоспалительной реакций; при выявлении высокой или средней интенсивности иммунной реакции макрофагов и высокой интенсивности их провоспалительной, микробицидной и противовоспалительной реакций при низкой зараженности микобактериями делают заключение об избыточной активности макрофагальной иммунной, провоспалительной и микробицидной реакций; при выявлении средней интенсивности иммунной реакции макрофагов и низкой интенсивности их провоспалительной, микробицидной и противовоспалительной реакций при низкой зараженности микобактериями альвеолярных макрофагов делают заключение о недостаточной активности противовоспалительной реакции; при выявлении низкой интенсивности иммунной, провоспалительной и противовоспалительной реакций и высокой интенсивности микробицидной реакции макрофагов при их низкой зараженности микобактериями делают заключение об избыточной активности микробицидной реакции и недостаточной активности противовоспалительной реакции; при выявлении средней или низкой интенсивности иммунной реакции, низкой интенсивности микробицидной и противовоспалительной реакций и высокой интенсивности провоспалительной реакции макрофагов при их высокой зараженности микобактериями делают заключение о недостаточной активности иммунной и микробицидной реакций макрофагов для уничтожения микобактерий в легких пациента.
Раскрытие изобретения
Способ оценки сбалансированности иммунной, воспалительной и противовоспалительной реакций альвеолярных макрофагов из резецированных участков легких пациентов, больных туберкулезом легких, в зависимости от степени зараженности макрофагов Mycobacterium tuberculosis, включает забор операционного материала резецированных участков легких пациентов, больных туберкулезом легких, получение ex vivo культуры альвеолярных макрофагов, культивирование ее в лунках на покровных стеклах одинакового размера в течение 16-18 часов. Затем клетки фиксируют на покровных стеклах, выполняют окраску их по методу Циля-Нильсена для выявления в альвеолярных макрофагах микобактерий туберкулеза. На других покровных стеклах выполняют окраску клеток флуоресцентными красителями, позволяющими различать в альвеолярных макрофагах факторы провоспалительной реакции - интерферон гамма, фактор некроза опухоли альфа, интерлейкин 1 бета, интерлейкин 12, циклооксигеназа-2 и/или факторы микробицидной реакции - активные формы кислорода и индуцибельная синтаза оксида азота и/или факторы противовоспалительной реакции - интерлейкин 4, интерлейкин 10, основной фактор роста фибробластов. Затем проводят цитологический анализ с оценкой количества альвеолярных макрофагов в ex vivo культуре суммарно по всем покровным стеклам. При наличии в ex vivo культуре клеток более, чем 100 тысяч альвеолярных макрофагов, от 10 тысяч до 100 тысяч или менее 10 тысяч альвеолярных макрофагов делают вывод о высокой, средней или низкой интенсивности иммунной реакции макрофагов соответственно. На покровных стеклах, окрашенных по методу Циля-Нильсена, определяют долю альвеолярных макрофагов, содержащих микобактерий туберкулеза, от общего числа альвеолярных макрофагов на этих покровных стеклах. При доле альвеолярных макрофагов, содержащих микобактерий, равной или большей 0.5%, делают заключение о высокой зараженности альвеолярных макрофагов микобактериями туберкулеза; при доле альвеолярных макрофагов, содержащих микобактерий туберкулеза, менее 0.5%, делают заключение о низкой зараженности альвеолярных макрофагов.
Для оценки интенсивности провоспалительной или микробицидной или противовоспалительной реакций альвеолярных макрофагов определяют долю альвеолярных макрофагов, окрасившихся на анализируемый фактор, соответствующий одной из указанных реакций, от общего числа альвеолярных макрофагов на покровном стекле, окрашенном на анализируемый фактор. При выявлении более 50% альвеолярных макрофагов, окрасившихся на анализируемый фактор, делают заключение о высокой интенсивности реакции альвеолярных макрофагов, соответствующей данному фактору. При выявлении от 10% до 50% включительно альвеолярных макрофагов, окрасившихся на анализируемый фактор,, делают заключение о средней интенсивности реакции альвеолярных макрофагов, соответствующей данному фактору. При выявлении от 1% до менее 10% альвеолярных макрофагов, окрасившихся на анализируемый фактор, делают заключение о низкой интенсивности реакции альвеолярных макрофагов, соответствующей данному фактору. При выявлении менее 1% альвеолярных макрофагов, окрасившихся на анализируемый фактор, или их отсутствии делают заключение об отсутствии реакции альвеолярных макрофагов, соответствующей данному фактору.
При выявлении высокой и/или средней степени интенсивности реакции альвеолярных макрофагов, соответствующей двум и более факторам провоспалительной реакции и низкой интенсивности реакции, соответствующей остальным факторам данной реакции, делают заключение о высокой интенсивности провоспалительной реакции альвеолярных макрофагов. При выявлении высокой или средней интенсивности реакции альвеолярных макрофагов, соответствующей одному фактору провоспалительной реакции и низкой интенсивности реакции, соответствующей остальным факторам данной реакции или низкой интенсивности реакций, соответствующих всем факторам провоспалительной реакции, делают заключение о низкой интенсивности провоспалительной реакции альвеолярных макрофагов.
При выявлении высокой интенсивности реакции, соответствующей одному из микробицидных факторов или средней интенсивности реакции, соответствующей обоим микробицидным факторам, делают заключение о высокой интенсивности микробицидной реакции альвеолярных макрофагов. При выявлении средней интенсивности реакции, соответствующей одному из микробицидных факторов и низкой интенсивности реакции, соответствующей другому микробицидному фактору, или низкой интенсивности реакции, соответствующей обоим микробицидным факторам, делают заключение о низкой интенсивности микробицидной реакции альвеолярных макрофагов.
При выявлении высокой и/или средней интенсивности реакции, соответствующей двум и более факторам противовоспалительной реакции, делают заключение о высокой интенсивности противовоспалительной реакции альвеолярных макрофагов. При выявлении высокой или средней степени интенсивности реакции одного фактора противовоспалительной реакции и слабой интенсивности реакции остальных факторов данной реакции или слабой интенсивности реакции всех факторов противовоспалительной реакции, делают заключение о низкой интенсивности противовоспалительной реакции в альвеолярных макрофагах.
Затем сравнивают зараженность альвеолярных макрофагов микобактериями туберкулеза с интенсивностью иммунной, провоспалительной, микробицидной и противовоспалительной реакций альвеолярных макрофагов.
При выявлении высокой или средней интенсивности иммунной реакции и высокой интенсивности провоспалительной, микробицидной и противовоспалительной реакций альвеолярных макрофагов при их низкой зараженности микобактериями делают заключение об избыточной активности иммунной, провоспалительной и микробицидной реакций макрофагов.
При выявлении средней интенсивности иммунной реакции и низкой интенсивности провоспалительной, микробицидной и противовоспалительной реакций макрофагов при их низкой зараженности микобактериями делают заключение о недостаточной активности противовоспалительной реакции макрофагов.
При выявлении низкой интенсивности иммунной, провоспалительной и противовоспалительной реакций и высокой интенсивности микробицидной реакции макрофагов при их низкой зараженности микобактериями делают заключение об избыточной активности микробицидной реакции и недостаточной активности противовоспалительной реакции макрофагов.
При выявлении средней или низкой интенсивности иммунной микробицидной и противовоспалительной реакций и высокой интенсивности провоспалительной реакции макрофагов при их высокой зараженности микобактериями делают заключение о недостаточной активности иммунной и микробицидной реакций альвеолярных макрофагов для уничтожения микобактерий в легких пациента.
Для получения ex vivo культур клеток альвеолярных макрофагов из операционного материала больных туберкулезом легких может быть использован способ по патенту РФ на изобретение №2593725 (23). Способ включает получение из операционного материала легкого одинаковых по массе (20 г) образцов ткани (Фиг. 1, 3, 5, 7, 8), удаленных от макроскопических туберкулезных образований (каверн, туберкулем, крупных фиброзно-казеозных очагов), измельчение образца ткани легкого, проведение последующей гомогенизации измельченной ткани легкого с получением клеточной взвеси в физиологически приемлемом растворе. После осаждения клеток из клеточной взвеси путем центрифугирования при скорости 800-1200 об/мин в течение 4-5 мин. при комнатной температуре их высаживают в полной ростовой среде, например, DMEM/F12 с 10% сыворотки крови плодов коров, 2 мМ глутамина и 50 мкг/мл гентамицина в равном количестве на покровные стекла в лунки 24-луночных планшетов. Культивирование клеток осуществляют в течение 16-18 часов стандартно при температуре +37°С в атмосфере 5% СО2. Клеточные культуры, полученные ex vivo из операционного материала легких пациентов, больных туберкулезом, на 90-95% состоят из альвеолярных макрофагов, остальные клетки - нейтрофилы, дендритные клетки, многоядерные клетки Пирогова-Лангханса и лимфоциты (24). Жизнеспособность альвеолярных макрофагов и клеток других типов в течение указанного периода культивирования составляет 97-100% (Фиг. 1-9).
Все процедуры по получению ex vivo культур клеток выполняют с соблюдением правил асептики в соответствии с санитарными правилами работы с патогенными биологическими объектами (25, 26).
Перед фиксированием клеток через 16-18 часов после начала ex vivo культивирования в одну из лунок с клетками вносят флуоресцентный реагент, детектирующий образование АФК в цитоплазме клеток по появлению красного флуоресцентного сигнала, например, 5 мкМ CellROX Deep Red Reagent (Molecular Probes, USA, С10422) в полной ростовой среде, и оставляют на 30 минут при +37°С в атмосфере 5% СО2. После отмывания фосфатно-солевым буфером (рН 7.4) от реагента осуществляют фиксацию клеток на покровных стеклах в этой лунке. В остальных лунках после фиксации клеток на покровных стеклах проводят окрашивание клеток по методу Циля-Нильсена на кислотоустойчивые бактерии либо флуоресцентными красителями, позволяющими различать в альвеолярных макрофагах факторы провоспалительной, микробицидной и противовоспалительной реакций. Для фиксации клеток используют 4%-й раствор формалина, приготовленного на фосфатно-солевом буфере (рН 7.4).
Перед окраской клеток покровные стекла отмывают от фиксатора в фосфатно-солевом буферном растворе (рН 7.4) при комнатной температуре в течение 20 минут.
Одно покровное стекло с интактными клетками окрашивают по методу Циля-Нильсена (27) для идентификации кислотоустойчивых и, соответственно, жизнеспособных М. tuberculosis. Используют набор реагентов для окраски по методу Циля-Нильсена, например, производства ООО «Первая Лабораторная Компания» (Санкт-Петербург, Россия). В результате, М. tuberculosis с неповрежденной клеточной стенкой в альвеолярных макрофагах человека с туберкулезной инфекцией окрашиваются в красный цвет, ядра клеток-носителей возбудителя - в синий цвет, а их цитоплазма - в светло-голубой цвет (черно-белый вариант изображения с соответствующими обозначениями представлен на Фиг. 1, 3, 5, 7, 8). Подсчет общего числа макрофагов в препарате и количества макрофагов, содержащих микобактерий, производят под световым микроскопом.
Другие покровные стекла с клетками, за исключением стекла, инкубированного ранее с реагентом для выявления АФК, инкубируют в растворе 0.3% Тритон Х-100, приготовленного на фосфатно-солевом буфере (рН 7.4), в течение 2 минут при комнатной температуре с целью облегчения последующего проникновения антител в цитоплазму клеток. После трехкратной отмывки в фосфатно-солевом буфере (рН 7.4) от предыдущего раствора клетки инкубируют в растворах первичных антител, выявляющих про- и противовоспалительные цитокины, факторы микробицидной реакции альвеолярных макрофагов. Например, используют кроличьи поликлональные антитела к человеческим iNOS (Spring Bioscience, USA, E374), COX-2 (Santa Cruz, USA, sc-1747-R), TNFα (Thermo Fisher Scientific, USA, P300A) и IL-4 (Thermo Fisher Scientific, USA, PA5-25165), мышиные моноклональные антитела к человеческим IFNγ (Thermo Fisher Scientific, USA, 25718), IL-1β (Thermo Fisher Scientific, USA, 2805), IL-10 (Invitrogen, USA, AHC9102), IL-12 (Thermo Fisher Scientific, USA, MA-23715) и FGFb (BD Transduction Laboratory, USA, 610072).
Затем, после трехкратной отмывки в фосфатно-солевом буфере (рН 7.4) от растворов первичных антител, клетки инкубируют в растворах вторичных антител, меченых флуорохромами, выявляющими кроличьи или мышиные иммуноглобулины. Например, используют козьи поликлональные антитела к мышиным иммуноглобулинам класса G, конъюгированные с флуорохромом Alexa 488 (Thermo Fisher Scientific, USA, A-11001), дающие зеленый флуоресцентный сигнал, и к кроличьим иммуноглобулинам класса G, конъюгированные с флуорохромом Alexa 594 (Thermo Fisher Scientific, USA, 35561), дающие красный флуоресцентный сигнал. При использовании первичных антител разной видовой принадлежности можно одновременно окрашивать несколько маркеров. Например, на каждом препарате клеток окрашивают одновременно первичными антителами к IFNγ и TNFα, или IL-10 и iNOS, или IL-β и IL-4, или IL-12 и СОХ-2, затем используют оба типа вторичных антител, конъюгированных с флурохромами. Препарат с клетками, окрашенными на АФК, инкубируют с первичными антителами к FGFb, затем используют вторичные антитела, конъюгированные с флуорохромом Alexa 488.
В растворах первичных и вторичных антител, приготовленных на фосфатно-солевом буфере (рН 7.4) с 5% бычьего сывороточного альбумина в концентрациях, рекомендованных фирмой-производителем антител, клетки инкубируют в течение 60 минут при комнатной температуре на каждом этапе окраски. При использовании вторичных антител, конъюгированных с флуорохромами, препараты клеток инкубируют в темноте. Препарат с клетками, окрашенными на АФК, на всех этапах окраски инкубируют в темноте.
После трехкратной отмывки в фосфатно-солевом буфере (рН 7.4) от раствора вторичных антител каждый препарат клеток выкладывают в раствор, сохраняющий флуоресцентный сигнал от быстрого выгорания в процессе детекции. Например, используют Prolong Gold antifade mountant with DAPI (Molecular Probes, USA, P36935). Ядра клеток, окрашенные DAPI (4',6-diamidino-2-phenylindole), дают синий флуоресцентный сигнал. Готовые препараты клеток хранят в холодильнике при +4°С до следующего дня для окончательного застывания заключающего раствора. На следующий день (3-й сутки от получения операционного материала и начала ex vivo культивирования клеток) изучение макрофагов, продуцирующих анализируемые факторы, производят под флуоресцентным микроскопом с набором фильтров, выявляющих синий, зеленый и красный сигналы флуоресценции. Макрофаги считаются продуцирующими анализируемый фактор при окраске цитоплазмы клетки в соответствующий цвет (при одновременной детекции выявляли IFNγ (зеленый сигнал) и TNFα (красный сигнал), или IL-10 (зеленый сигнал) и iNOS (красный сигнал), или IL-1β (зеленый сигнал) и IL-4 (красный сигнал), или IL-12 (зеленый сигнал) и СОХ-2 (красный сигнал), или FGFb (зеленый сигнал) и АФК (красный сигнал) - черно-белый вариант изображения с соответствующими обозначениями представлен на Фиг. 2,4, 6, 9).
Сравнение полученных показателей согласно заявленному способу позволяет сделать заключение о том, какая или какие из реакций альвеолярных макрофагов на возбудитель туберкулеза легких являются избыточными или недостаточными с учетом зараженности альвеолярных макрофагов микобактериями туберкулеза у пациентов, прошедших курсы противотуберкулезной терапии, включая оперативное лечение (Таблицы 2, 3 и 4). Для осуществления способа достаточно 3 дней.
Заключения, полученные по заявленному способу, имеют большое значение для персонализации тактики ведения пациентов, особенно для больных туберкулезом с множественной и широкой лекарственной устойчивостью возбудителя, с выбором химиотерапии и иммунокоррекции в послеоперационный период лечения.
Перечень фигур, чертежей и иных материалов
Фиг. 1. Удаленная в ходе операции часть правого легкого пациента №1 (левая панель) и полученные из нее ex vivo культура альвеолярных макрофагов (центральная панель) и гистологический срез легочной ткани (правая панель), окрашенные по методу Циля-Нильсена. Масштабная черта 10 мкм. На альвеолярные макрофаги с М. tuberculosis указывают черные стрелки. Остальные клетки - альвеолярные макрофаги, не содержащие микобактерий.
Фиг. 2. Конфокальные флуоресцентные 3D изображения альвеолярных макрофагов из легкого пациента №1, содержащих IFNγ (левая панель), IL-1β и IL-4 одновременно (центральная панель), АФК (правая панель). Факторы и АФК визуализированы соответствующими антителами и красителем (в черно-белом варианте их цвет - темно-серый).
Фиг. 3. Кусочки ткани (центральная панель, диаметр дна контейнера 4.5 см) из удаленной в ходе операции части правого легкого пациента №3 (левая панель) и полученная из них ex vivo культура альвеолярных макрофагов (правая панель), окрашенная по методу Циля-Нильсена. Масштабная черта 10 мкм. На альвеолярный макрофаг с М. tuberculosis указывает черная стрелка. Остальные клетки - альвеолярные макрофаги, не содержащие микобактерий.
Фиг. 4. Конфокальные флуоресцентные 3D изображения альвеолярных макрофагов, содержащих TNFα (левая панель), IL-10 (центральная панель), и конфокальное флуоресцентное изображение гистологического среза ткани с альвеолярными макрофагами, содержащими IL-10 (правая панель), из легкого пациента №3. Факторы визуализированы соответствующими антителами (в черно-белом варианте их цвет -темно-серый на центральной панели и светло-серый на левой и правой панелях). На гистологическом срезе на альвеолярные макрофаги, содержащие IL-10, указывают белые стрелки.
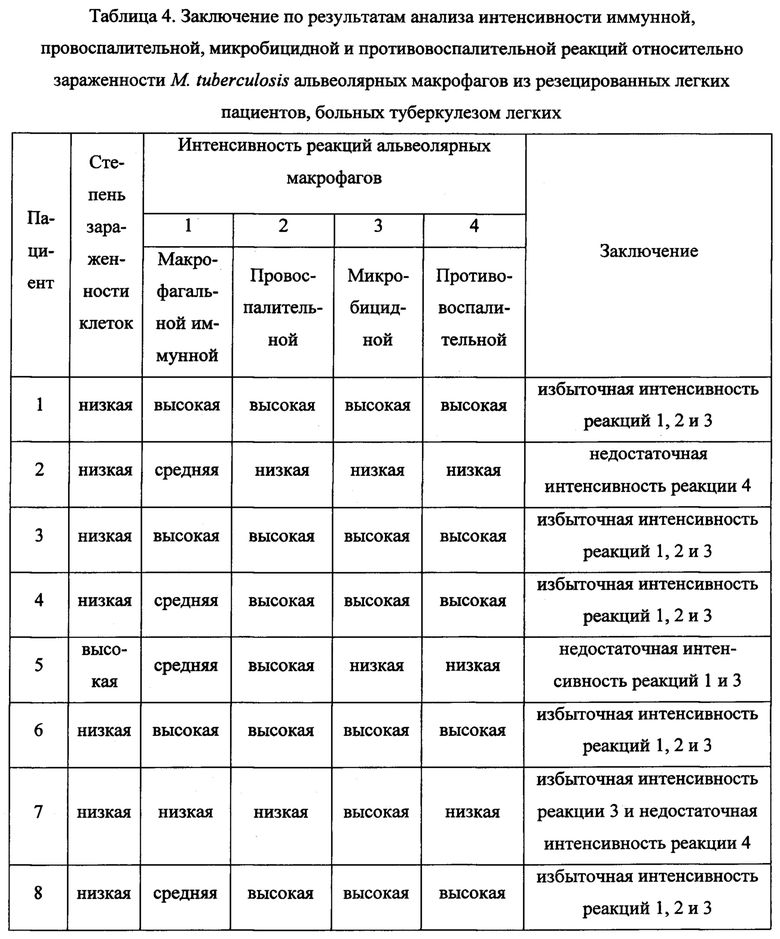
Фиг. 5. Удаленная в ходе операции часть левого легкого пациента №2 (левая панель) и полученные из нее ex vivo культура альвеолярных макрофагов (центральная панель) и гистологический срез легочной ткани (правая панель), окрашенные по методу Циля-Нильсена и не содержащие микобактерий. Масштабная черта 10 мкм (центральная панель) и 20 мкм (правая панель).
Фиг. 6. Конфокальные флуоресцентные 3D изображения альвеолярных макрофагов, не содержащих IFNγ и TNFα (левая панель), IL-10 (центральная панель), и конфокальное флуоресцентное изображение гистологического среза ткани с единичными альвеолярными макрофагами, содержащими iNOS (правая панель), из легкого пациента №2. Для визуализации факторов использованы соответствующие антитела (в черно-белом варианте их цвет - темно-серый на левой и центральной панелях и светло-серый на правой панели). На гистологическом срезе на альвеолярные макрофаги с iNOS указывают белые стрелки.
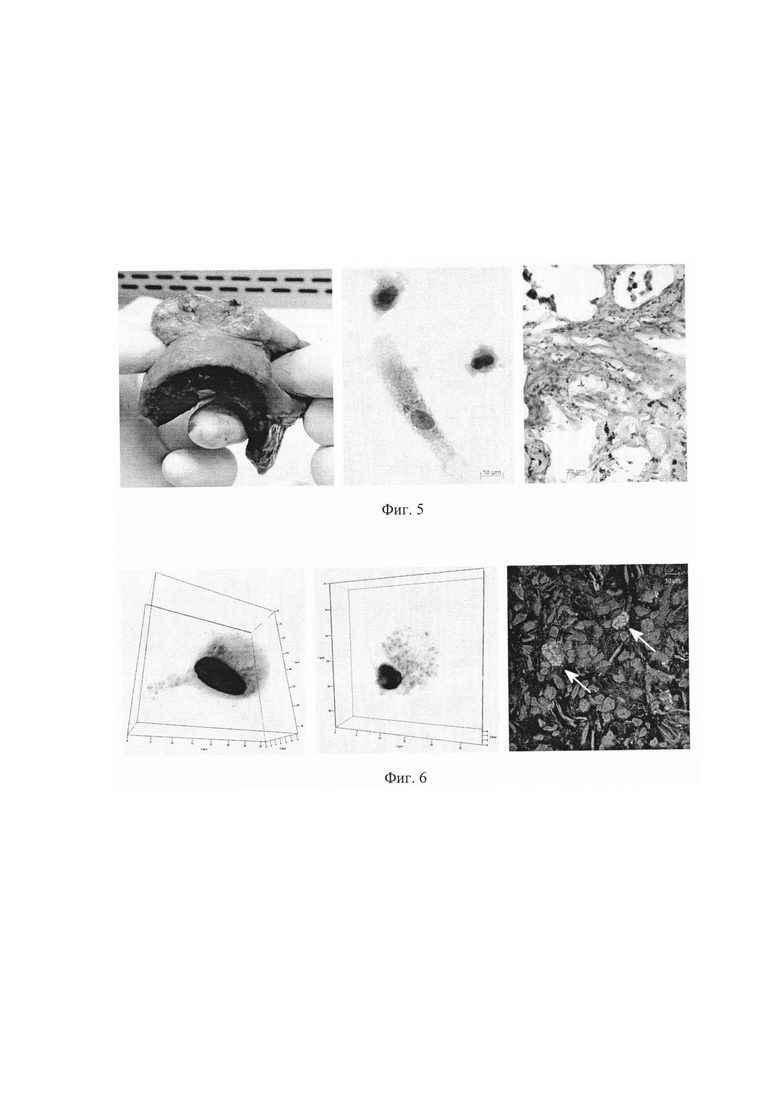
Фиг. 7. Удаленная в ходе операции часть правого легкого пациента №7 (левая панель) и полученные ex vivo культура альвеолярных макрофагов (центральная панель) и гистологический срез легочной ткани (правая панель), окрашенные по методу Циля-Нильсена и не содержащие микобактерий. Масштабная черта 10 мкм.
Фиг. 8. Удаленная в ходе операции часть правого легкого пациента №5 (левая панель) и полученные из нее ex vivo культура альвеолярных макрофагов (центральная панель) и гистологический срез легочной ткани (правая панель), окрашенные по методу Циля-Нильсена. Масштабная черта 10 мкм. На альвеолярные макрофаги с М. tuberculosis указывают черные стрелки. Остальные клетки - альвеолярные макрофаги, не содержащие микобактерий. На гистологическом срезе альвеолярный макрофаг с микобактериями выделен в рамке.
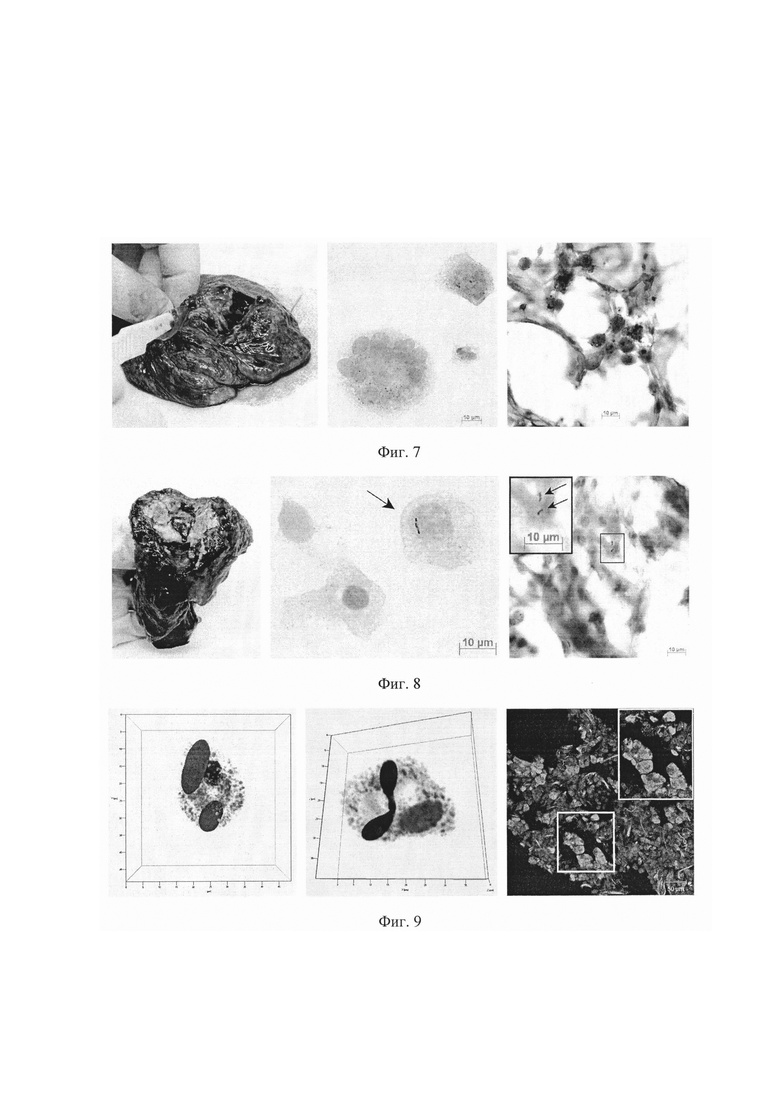
Фиг. 9. Конфокальные флуоресцентные 3D изображения альвеолярных макрофагов, содержащих IL-1β и IL-4 одновременно (левая панель), iNOS (центральная панель), и конфокальное флуоресцентное изображение гистологического среза ткани с альвеолярными макрофагами, содержащими iNOS (правая панель), из легкого пациента №5. Для визуализации факторов использованы соответствующие антитела (в черно-белом варианте их цвет - темно-серый на левой и центральной панелях и светло-серый на правой панели). На гистологическом срезе альвеолярные макрофаги с iNOS выделены в рамке.
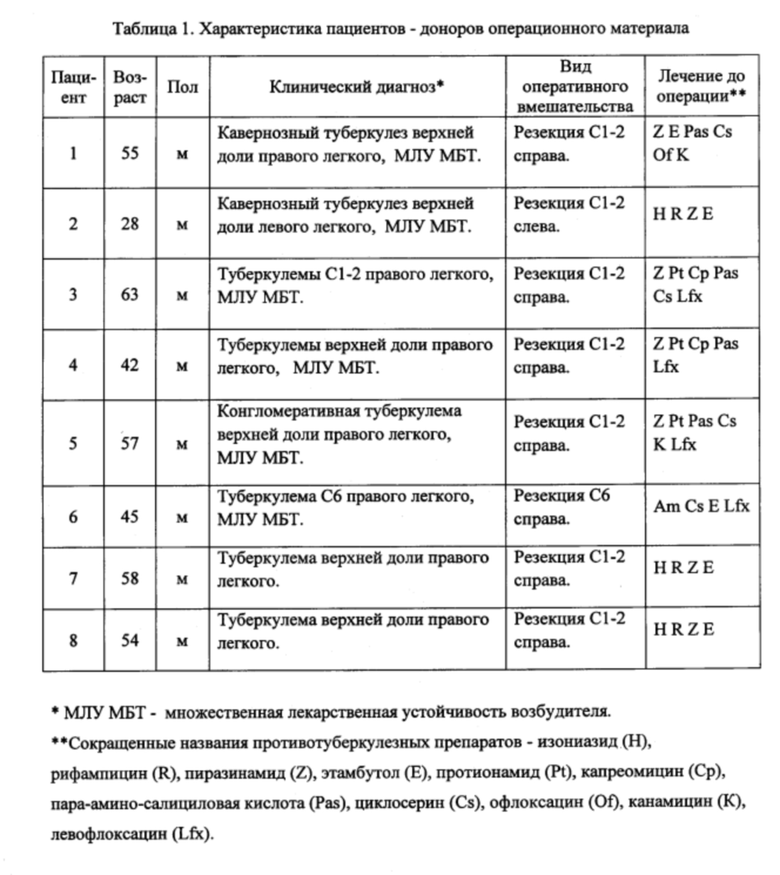
Таблица 1. Характеристика пациентов - доноров операционного материала.
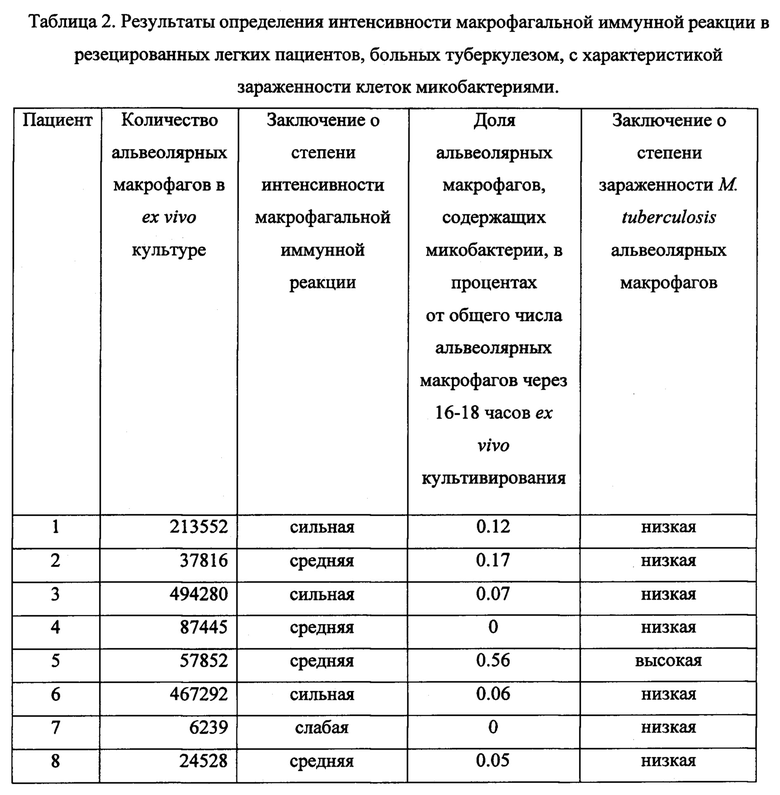
Таблица 2. Результаты определения интенсивности иммунной реакции макрофагов в резецированных участках легких пациентов, больных туберкулезом, с характеристикой зараженности клеток микобактериями.
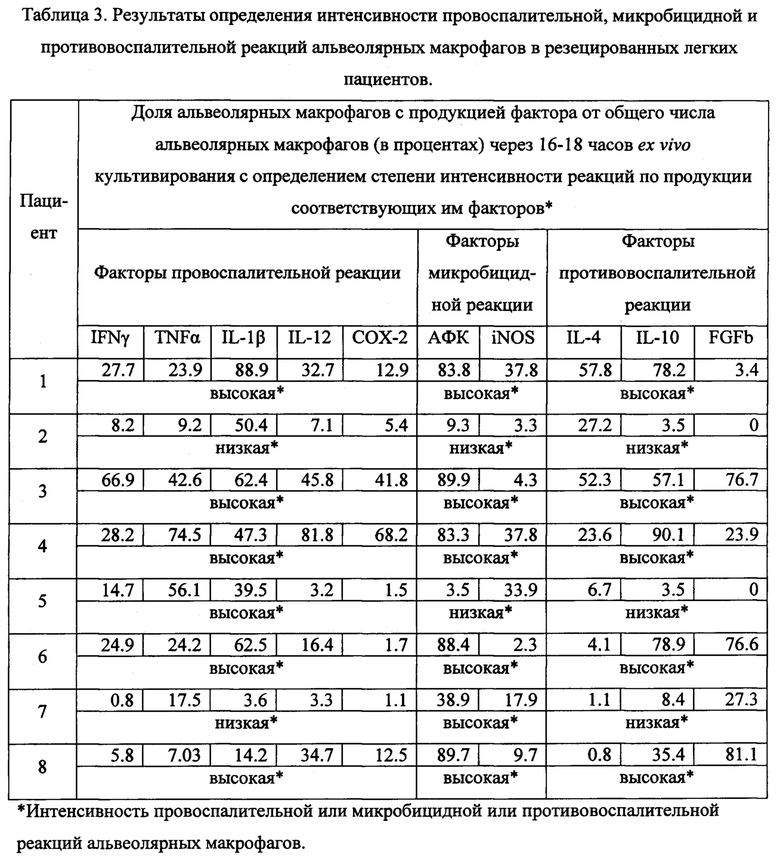
Таблица 3. Результаты определения интенсивности провоспалительной, микробицидной и противовоспалительной реакций альвеолярных макрофагов в резецированных участках легких пациентов.
Таблица 4. Заключение по результатам анализа интенсивности иммунной, провоспалительной, микробицидной и противовоспалительной реакций альвеолярных макрофагов из резецированных участков легких пациентов, больных туберкулезом легких в зависимости от их зараженности М. tuberculosis.
Осуществление изобретения
Результаты осуществления заявленного способа на 8 пациентах представлены в таблицах 1-4.
В таблице 1 представлены данные о возрасте и поле 8 пациентов, их клиническом диагнозе, виде оперативного вмешательства и перечне противотуберкулезных препаратов, применявшихся в дооперационный период лечения, чей операционный материал легких был использован для получения ex vivo культур альвеолярных макрофагов и их анализа через 16-18 ч после начала культивирования.
В таблице 2 представлены результаты оценки количества альвеолярных макрофагов в ex vivo культуре, полученной от каждого из пациентов, заключение о степени интенсивности иммунной реакции макрофагов в ответ на инфекцию микобактериями туберкулеза, о доли альвеолярных макрофагов, содержащих микобактерий, от общего числа альвеолярных макрофагов, с заключением о степени их зараженности у конкретного пациента.
В таблице 3 представлены данные по определению доли альвеолярных макрофагов, продуцирующих факторы провоспалительной, микробицидной и противовоспалительной реакции с заключением о степени интенсивности указанных реакций, отражающих процессы в пораженных инфекцией легких у конкретного пациента.
В таблице 4 представлены результаты заключения по заявленному способу на основе сопоставления результатов всех проведенных анализов.
Пример 1. Пациент №1 (55 лет) с кавернозным туберкулезом верхней доли правого легкого, с множественной лекарственной устойчивостью возбудителя (таблица 1). До операции пациент прошел курс противотуберкулезной терапии, включающей прием по утвержденной схеме пиразинамида, этамбутола, пара-амино-салициловой кислоты, циклосерина, офлоксацина и канамицина. В ходе оперативного вмешательства были удалены сегменты С1 и С2 правого легкого (Фиг. 1). Оценку всех показателей для альвеолярных макрофагов пациента №1 с использованием полученных ex vivo культур альвеолярных макрофагов осуществляли согласно заявленному способу через 18 часов после начала культивирования альвеолярных макрофагов. Одно из покровных стекол с ex vivo культурой альвеолярных макрофагов, полученной из операционного материала пациента №1, окрашивали флуоресцентным реагентом CellROX Deep Red Reagent для детекции образования АФК в цитоплазме клеток, затем макрофаги фиксировали на этом покровном стекле в 4% растворе формалина, приготовленного на фосфатно-солевом буфере (рН 7.4). Остальные покровные стекла с ex vivo культурой альвеолярных макрофагов пациента №1 фиксировали сразу после окончания культивирования. После фиксации альвеолярные макрофаги окрашивали по методу Циля-Нильсена (Фиг. 1) и флуоресцентно с использованием растворов соответствующих антител (Фиг. 2).
По результатам анализа согласно заявленному способу установлена низкая степень зараженности альвеолярных макрофагов (доля инфицированных микобактериями клеток составила 0.12%) при высокой интенсивности макрофагальной иммунной (в ex vivo культуре получено больше 200 тысяч альвеолярных макрофагов) и высокой интенсивности провоспалительной (88.9% альвеолярных макрофагов продуцировали IL-1β, почти треть альвеолярных макрофагов продуцировали IL-12 и IFNγ, почти четверть альвеолярных макрофагов продуцировали TNFα), высокой интенсивности микробицидной (83.8% альвеолярных макрофагов продуцировали АФК и больше трети альвеолярных макрофагов продуцировали активные формы азота при активации iNOS) и высокой интенсивности противовоспалительной (больше половины альвеолярных макрофагов продуцировали IL-4 и три четверти альвеолярных макрофагов продуцировали IL-10) реакций альвеолярных макрофагов из пораженных инфекцией легких пациента №1. Сделано заключение об избыточной интенсивности иммунной, провоспалительной и микробицидной реакций альвеолярных макрофагов пациента №1. Это позволяет лечащему врачу выбрать тактику послеоперационной терапии пациента №1, больного туберкулезом с множественной лекарственной устойчивостью возбудителя, в направлении снижения интенсивности этих реакций с одновременным усилением регенеративных процессов в легком, поскольку была выявлена слабая активация продукции FGFb альвеолярными макрофагами пациента №1.
Заключение по заявленному способу подтверждается данными патоморфологического и иммуногистохимического исследований тканей удаленных в ходе операции сегментов легкого пациента №1, окрашенных по методу Циля-Нильсена или антителами, в которых, соответственно, подтверждена низкая зараженность альвеолярных макрофагов микобактериями (Фиг. 1) и высокая интенсивность провоспалительной, микробицидной и противовоспалительной реакций макрофагов в резецированных участках легких пациента №1. Однако для осуществления гистологических анализов потребовалось несколько недель после проведенной операции, тогда как заключение по заявленному способу сделано уже через 3 дня после операции.
Пример 2. Пациент №3 (63 года) с туберкулезом верхней доли правого легкого (множественные туберкулемы C1, С2), с множественной лекарственной устойчивостью возбудителя (таблица 1). До операции пациент прошел курс противотуберкулезной терапии, включающей в соответствии с принятыми в Российской Федерации клиническими рекомендациями прием пиразинамида, протионамида, капреомицина, пара-амино-салициловой кислоты, циклосерина и левофлоксацина. В ходе оперативного вмешательства были удалены сегменты С1 и С2 правого легкого (Фиг. 3). Оценку всех показателей для альвеолярных макрофагов пациента №3 с использованием полученных ex vivo культур альвеолярных макрофагов (Фиг. 3) осуществляли согласно заявленному способу через 16 часов после начала культивирования альвеолярных макрофагов.
По результатам анализа согласно заявленному способу установлена низкая степень зараженности альвеолярных макрофагов (доля инфицированных микобактериями клеток составила 0.07%) при высокой интенсивности макрофагальной иммунной реакции (в ex vivo культуре получено почти 500 тысяч альвеолярных макрофагов) и высокой интенсивности провоспалительной (больше половины альвеолярных макрофагов продуцировали IFNγ и IL-1β, чуть меньше половины альвеолярных макрофагов продуцировали TNFα, IL-12 и СОХ-2), высокой интенсивности микробицидной (89.9% альвеолярных макрофагов продуцировали АФК) и высокой интенсивности противовоспалительной (больше половины альвеолярных макрофагов продуцировали IL-4, IL-10 и FGFb) реакций в пораженных инфекцией легких пациента №3 (Фиг. 4). Сделано заключение об избыточной интенсивности иммунной, провоспалительной и микробицидной реакций альвеолярных макрофагов пациента №3. Для заключения по заявленному способу потребовалось 3 дня после операции. По результатам проведенного анализа лечащему врачу рекомендована коррекция послеоперационной терапии пациента №3, больного туберкулезом с множественной лекарственной устойчивостью возбудителя, в направлении снижения интенсивности макрофагальной, провоспалительной и микробицидной реакций в легких этого пациента.
Заключение по заявленному способу подтверждается данными патоморфологического и иммуногистохимического исследований в течение нескольких недель тканей удаленных в ходе операции сегментов легкого пациента №3, окрашенных по методу Циля-Нильсена или антителами соответственно, которые подтвердили низкую зараженность альвеолярных макрофагов микобактериями и высокую интенсивность провоспалительной, микробицидной и противовоспалительной реакций в резецированных легких пациента №3 (Фиг. 4).
Пример 3. Пациент №2 (28 лет) с кавернозным туберкулезом верхней доли левого легкого, с множественной лекарственной устойчивостью возбудителя, диагностированной по результатам обследования в период данной госпитализации (таблица 1). До операции пациент прошел курс противотуберкулезной терапии, включающей прием по утвержденной схеме изониазида, рифампицина, пиразинамида и этамбутола. В ходе оперативного вмешательства были удалены сегменты С1 и С2 левого легкого (Фиг. 5). Оценку всех показателей для альвеолярных макрофагов пациента №2 с использованием полученных ex vivo культур альвеолярных макрофагов (Фиг. 5) осуществляли согласно заявленному способу через 18 часов после начала культивирования альвеолярных макрофагов.
По результатам анализа согласно заявленному способу установлена низкая степень зараженности альвеолярных макрофагов (доля инфицированных микобактериями клеток составила 0.17%) при средней интенсивности макрофагальной иммунной реакции (в ex vivo культуре получено меньше 40 тысяч альвеолярных макрофагов) и низкой интенсивности провоспалительной (половина альвеолярных макрофагов продуцировала только IL-1β, тогда как IFNγ, TNFα, IL-12 и СОХ-2 продуцировали меньше 10% альвеолярных макрофагов), низкой интенсивности микробицидной (меньше 10% альвеолярных макрофагов продуцировали АФК и iNOS) и низкой интенсивности противовоспалительной (меньше 30% альвеолярных макрофагов продуцировали IL-4 и почти не синтезировали IL-10 и FGFb) реакций в альвеолярных макрофагах пораженных инфекцией легких пациента №2 (Фиг. 6). Сделано заключение о недостаточной интенсивности противоспалительной реакции альвеолярных макрофагов пациента №2. Для заключения по заявленному способу потребовалось 3 дня после операции. Результаты проведенного анализа позволяют лечащему врачу выбрать тактику послеоперационной терапии пациента №2, больного туберкулезом с множественной лекарственной устойчивостью возбудителя, в направлении усиления интенсивности противоспалительной реакции с одновременным усилением регенеративных процессов в легком, поскольку продукция FGFb отсутствовала в альвеолярных макрофагах этого пациента.
При патоморфологическом и иммуногистохимическом исследовании в течение нескольких недель тканей удаленных в ходе операции сегментов легкого пациента №2, окрашенных по методу Циля-Нильсена или антителами соответственно, подтверждена низкая зараженность альвеолярных макрофагов микобактериями (Фиг. 5) и низкая интенсивность провоспалительной, микробицидной и противовоспалительной реакций (Фиг. 6) макрофагов в резецированных тканях легкого пациента №2.
Пример №4. Пациент №7 (58 лет) с туберкулезом верхней доли правого легкого (туберкулема С1 и С2) (таблица 1). До операции пациент прошел курс противотуберкулезной терапии, включающей прием по общепринятой схеме изониазида, рифампицина, пиразинамида и этамбутола вследстие отсутствия бактериовыделения и невозможности определить лекарственную чувствительность возбудителя. В ходе оперативного вмешательства были удалены сегменты С1 и С2 правого легкого (Фиг. 7). Оценку всех показателей для альвеолярных макрофагов пациента №7 с использованием полученных ex vivo культур альвеолярных макрофагов (Фиг. 7) осуществляли согласно заявленному способу через 18 часов после начала культивирования альвеолярных макрофагов.
По результатам анализа согласно заявленному способу установлена низкая степень зараженности альвеолярных макрофагов (инфицированных М. tuberculosis альвеолярных макрофагов в ex vivo культуре не выявили) при низкой интенсивности макрофагальной иммунной реакции (в ex vivo культуре получено меньше 7 тысяч альвеолярных макрофагов) и низкой интенсивности провоспалительной (меньше 20% альвеолярных макрофагов продуцировали только TNFα и почти не синтезировали IFNγ, IL-1β, IL-12 и СОХ-2), высокой интенсивности микробицидной (почти 40% альвеолярных макрофагов продуцировали АФК) и низкой интенсивности противовоспалительной (почти треть альвеолярных макрофагов продуцировала FGFb, меньше 9% альвеолярных макрофагов продуцировали IL-10 и только 1.1% альвеолярных макрофагов синтезировали IL-4) реакций макрофагов в пораженных инфекцией легких пациента №7. Сделано заключение об избыточной интенсивности микробицидной реакции и недостаточной интенсивности противоспалительной реакции альвеолярных макрофагов пациента №7. Результаты проведенного анализа позволяют лечащему врачу выбрать тактику послеоперационной терапии пациента №7 в направлении снижения интенсивности микробицидной реакции с одновременным усилением интенсивности противоспалительной реакции альвеолярных макрофагов этого пациента.
При патоморфологическом и иммуногистохимическом исследовании тканей удаленных в ходе операции сегментов легкого пациента №7, окрашенных по методу Циля-Нильсена, инфицированные микобактериями альвеолярные макрофаги также не найдены (Фиг. 7). При иммунопатологическом исследовании легочной ткани подтверждена низкая интенсивность провоспалительной и противовоспалительной реакций макрофагов в резецированных легких пациента №7. Однако для осуществления гистологических анализов потребовалось несколько недель после проведенной операции, тогда как заключение по заявленному способу сделано уже через 3 дня после операции.
Пример 5. Пациент №5 (63 года) с туберкулезом верхней доли правого легкого (конгломеративная туберкулема, бактериовыделение с множественной лекарственной устойчивостью возбудителя) (таблица 1). До операции пациент прошел курс противотуберкулезной терапии, включающей прием по утвержденной схеме пиразинамида, протионамида, пара-амино-салициловой кислоты, циклосерина, канамицина и левофлоксацина. В ходе оперативного вмешательства были удалены сегменты С1 и С2 правого легкого (Фиг. 8). Оценку всех показателей для альвеолярных макрофагов пациента №5 с использованием полученных ex vivo культур альвеолярных макрофагов (Фиг. 8) осуществляли согласно заявленному способу через 18 часов после начала культивирования альвеолярных макрофагов.
По результатам анализа согласно заявленному способу установлена высокая степень зараженности альвеолярных макрофагов (доля инфицированных микобактериями клеток составила 0.56%) при средней интенсивности макрофагальной иммунной реакции (в ex vivo культуре получено чуть больше 50 тысяч альвеолярных макрофагов), высокой интенсивности провоспалительной реакции (больше половины альвеолярных макрофагов продуцировала TNFα, почти четверть альвеолярных макрофагов синтезировала IFNγ и IL-1β) и низких интенсивностях микробицидной (только треть альвеолярных макрофагов продуцировала iNOS, почти не синтезируя АФК) и противовоспалительной (меньше 7% альвеолярных макрофагов продуцировали IL-4 и меньше 4% - IL-10) реакций макрофагов в пораженных инфекцией легких пациента №5 (Фиг. 9). Сделано заключение о недостаточной интенсивности иммунной и микробицидной реакций альвеолярных макрофагов пациента №5. Для заключения по заявленному способу потребовалось 3 дня после операции. Результаты проведенного анализа позволяют лечащему врачу выбрать тактику послеоперационной терапии пациента №5, больного туберкулезом с множественной лекарственной устойчивостью возбудителя, в направлении усиления интенсивности макрофагальной иммунной и микробицидной реакций в легких этого пациента с последующей активацией регенеративных процессов в легком, поскольку не была выявлена продукция FGFb в альвеолярных макрофагах пациента №5.
При патоморфологическом и иммуногистохимическом исследовании в течение нескольких недель тканей удаленных в ходе операции сегментов легкого пациента №5, окрашенных по методу Циля-Нильсена или антителами соответственно, подтверждена высокая зараженность альвеолярных макрофагов микобактериями (Фиг. 8), высокая интенсивность провоспалительной реакции и низкая интенсивность микробицидной (Фиг. 9) и противовоспалительной реакций макрофагов в резецированных легких пациента №5.
Список литературы
1. Фтизиатрия. Национальное руководство. Под ред. М.И. Перельмана. М.: ГЭОТАР-Медиа, 2007, 512 с.;
2. А.С. Апт, Т.К. Кондратьева. Туберкулез: патогенез, иммунный ответ и генетика хозяина. Молекулярная биология, 2008, Т. 42, №5, 880-890;
3. S.D. Lawn, A. Zumla. Tuberculosis. Lancet, 2011, vol. 378, no. 1, 57-72;
4. G. Weiss, U.S. Schaible. Macrophage defense mechanisms against intracellular bacteria. Immunological Reviews, 2015, vol. 264, no. 1,182-203;
5. C.N. Cheallaigh, C.P. de Castro, M.M. Coleman, J.C. Hope, J. Harris. Macrophages and tuberculosis. In: Handbook of macrophages. Ed.: R. Takahashi, H. Kai, Nova Science Publishers, 2012, 1-41;
6. G. Xu, J. Wang, G.F. Gao, C.H. Liu. Insights into battles between Mycobacterium tuberculosis and macrophages. Protein & Cell, 2014, vol. 5, no. 10, 728-736;
7. Клеточная биология легких в норме и при патологии: Руководство для врачей. Под ред. В.В. Ерохина, Л.К. Романовой. М.: Медицина, 2000, 496 с.;
8. Туберкулез. Патогенез, защита, контроль. Под ред. Б.Р. Блума. М.: Медицина, 2002, 696 с.;
9. Z. Hmama,  S. Josehp, Y. Av-Gay. Immunoevasion and immunosuppression of the macrophage by Mycobacterium tuberculosis. Immunological Reviews, 2015, vol. 264, no. 1, 220-232;
S. Josehp, Y. Av-Gay. Immunoevasion and immunosuppression of the macrophage by Mycobacterium tuberculosis. Immunological Reviews, 2015, vol. 264, no. 1, 220-232;
10. Б.В. Пинегин, M.И. Карсонова. Макрофаги: свойства и функции. Иммунология, 2009, Т. 30, №4, 241-249;
11. В.И. Кулинский. Биохимические аспекты воспаления. Биохимия, 2007, Т. 72, вып. 6, 733-746;
12. Г.И. Васильева, И.А.Иванова, С.Ю. Тюкавкина. Цитокины - общая система гомеостатической регуляции клеточных функций. Цитология, 2001, Т. 43, №12, 1101-1111;
13. K.D. Mayer-Barber, A. Sher. Cytokine and lipid mediator networks in tuberculosis. Immunology Rev., 2015, vol. 264, no. 1, 264-275;
14. T.R. Lerner, S. Borel, M.G. Gutierrez. The innate immune response in human tuberculosis. Cellular Microbiology, 2015, vol. 17, no. 9, 1277-1285;
15. S.J. Sasindran, J.B. Torrelles, Mycobacterium tuberculosis infection and inflammation: what is beneficial for the host and for the bacterium? Frontiers in Microbiology, 2011, vol. 2:2.
16. О.Т. Титаренко, М.Е. Дьякова, О.А. Маничева, Д.С. Эсмедляева, М.З. Догонадзе, Н.П. Алексеева, Т.Л. Перова, Н.Н. Мельникова. Биологические свойства Mycobacterium tuberculosis и характеристика воспалительного ответа при инфильтративном туберкулезе легких. Инфекция и иммунитет, 2014, Т. 4, №3, 221-228;
17. Y. Yu, Y. Zhang, S. Hu, D. Jin, X. Chen, Q. Jin, H. Liu. Different patterns of cytokines and chemokines combined with IFN-gamma production reflect Mycobacterium tuberculosis infection and disease. PLoS One, 2012, vol. 7: e44944;
18. A. Mihret, Y. Bekele, K. Bobosha, M. Kidd, A. Aseffa, R. Howe, G. Walzl. Plasma cytokines and chemokines differentiate between active disease and non-active tuberculosis infection. The Journal of Infection, 2013, vol. 66, 357-365;
19. K. Chavez, R. Ravindran, A. Dehnad, I.H. Khan. Gender biased immune-biomarkers in active tuberculosis and correlation of their profiles to efficacy of therapy. Tuberculosis, 2016, vol. 99, no. 1, 17-24;
20. H.P. Gideon, J. Phuah, A.J. Myers, B.D. Bryson, M.A. Rodgers, M.T. Coleman, et al. Variability in tuberculosis granuloma T cell responses exists, but a balance of pro- and anti-inflammatory cytokines is associated with sterilization. PLoS Pathogens, 2015, 11(1): e1004603;
21. M.A. Владимирский. Иммунологические методы диагностики туберкулезной инфекции у детей и подростков. Проблемы и перспективы. Иммунология, 2018, Т. 39, №1, 61-66;
22. С. Herzmann, М. Ernst, С. Lange, S. Stenger, S.H.E. Kaufmann, N. Reiling, et al. Pulmonary immune responses to Mycobacterium tuberculosis in exposed individuals. PLoS ONE, 2017, vol. 12(11): e0187882;
23. Патент на изобретение РФ №2593725 Способ получения ex vivo культур альвеолярных макрофагов из операционного материала больных туберкулезом легких и способ оценки вирулентности Mycobacterium tuberculosis с использованием полученных ex vivo культур альвеолярных макрофагов. Дата публикации 10.08.2016, Бюлл. №22. МПК C12N 5/0786. C12Q 1/02. C12R 1/32:
24. Е. Ufimtseva, N. Eremeeva, Е. Petrunina, Т. Umpeleva, S. Karskanova, S. Baiborodin, et al. Ex vivo expansion of alveolar macrophages with Mycobacterium tuberculosis from the resected lungs of patients with pulmonary tuberculosis. PLoS ONE, 2018, vol. 13, no. 2: e0191918;
25. СП 1.3.2322-08 «Безопасность работы с микроорганизмами III-IV групп патогенности (опасности) и возбудителями паразитных болезней». Утверждены постановлением Главного государственного санитарного врача от 28 января 2008 года №4, Бюллетень нормативных актов федеральных органов исполнительной власти, №19, 12.05.08. www.niiot.ru/doc/bank00/doc253/doc.htm
26. СП 2.1. 7.2790-10 «Санитарно-эпидемиологические требования к обращению с медицинскими отходами». Утверждены постановлением Главного государственного санитарного врача от 09 декабря 2010 года №163, Бюллетень нормативных актов федеральных органов исполнительной власти, №13, 28.03.11. www.medothod.ru/medicinskie-othody-SANPIN
27. Е.Д. Гольдберг, A.M. Дыгай, В.П. Шахов. Методы культуры ткани в гематологии. Томск, Изд-во Томского университета, 1992, стр. 77.


Изобретение относится к области медицины, в частности фтизиатрии, а именно к оценке сбалансированности иммунной, воспалительной и противовоспалительной реакций альвеолярных макрофагов из резецированных участков легких пациентов, больных туберкулезом легких, в зависимости от степени зараженности макрофагов Mycobacterium tuberculosis. Для этого выделяют альвеолярные макрофаги из операционного материала легких, проводят их культивирование в течение 16-18 ч в лунках на покровных стеклах, в ходе которого осуществляют дифференциальную окраску, позволяющую выявлять продукцию альвеолярными макрофагами факторов провоспалительной (IFNγ, TNFα, IL-1β, IL-12, COX-2), микробицидной (АФК, iNOS), противовоспалительной (IL-4, IL-10, FGFb) реакций, определяют интенсивность макрофагальной иммунной реакции по количеству альвеолярных макрофагов в ex vivo культуре, их зараженность микобактериями, затем по доле альвеолярных макрофагов, продуцирующих факторы провоспалительной, микробицидной, противовоспалительной реакций, оценивают интенсивность этих реакций, при сопоставлении которой со степенью зараженности альвеолярных макрофагов микобактериями делают заключение об отклонении от состояния сбалансированности указанных реакций альвеолярных макрофагов. Изобретение обеспечивает определение избыточности или недостаточности реакций альвеолярных макрофагов в ответ на инфекцию микобактериями туберкулеза после проведения курсов химиотерапии и операционного лечения больных туберкулезом легких. 9 ил., 4 табл., 5 пр.
Способ оценки сбалансированности иммунной, воспалительной и противовоспалительной реакций альвеолярных макрофагов из резецированных участков легких пациентов, больных туберкулезом легких, в зависимости от степени зараженности макрофагов Mycobacterium tuberculosis, включающий получение из операционного материала резецированной ткани легкого ex vivo культуры альвеолярных макрофагов, культивирование ее в лунках на покровных стеклах одинакового размера в течение 16-18 часов; фиксацию клеток на покровных стеклах; окраску их по методу Циля-Нильсена для выявления в альвеолярных макрофагах микобактерий туберкулеза, окраску клеток на покровных стеклах флуоресцентными красителями, позволяющими различать в альвеолярных макрофагах факторы провоспалительной реакции - интерферон гамма, фактор некроза опухоли альфа, интерлейкин 1 бета, интерлейкин 12, циклооксигеназа-2 и/или факторы микробицидной реакции - активные формы кислорода и индуцибельная синтаза оксида азота и/или факторы противовоспалительной реакции - интерлейкин 4, интерлейкин 10, основной фактор роста фибробластов; затем проводят цитологический анализ с оценкой количества альвеолярных макрофагов в ex vivo культуре суммарно по всем покровным стеклам; при наличии в ex vivo культуре клеток более чем 100 тысяч альвеолярных макрофагов, от 10 тысяч до 100 тысяч или менее 10 тысяч альвеолярных макрофагов делают вывод о высокой, средней или низкой интенсивности иммунной реакции макрофагов соответственно; на покровных стеклах, окрашенных по методу Циля-Нильсена, определяют долю альвеолярных макрофагов, содержащих микобактерии туберкулеза, от общего числа альвеолярных макрофагов на этих покровных стеклах; при доле альвеолярных макрофагов, содержащих микобактерии, равной или большей 0.5%, делают заключение о высокой зараженности альвеолярных макрофагов микобактериями туберкулеза; при доле альвеолярных макрофагов, содержащих микобактерии туберкулеза, менее 0.5%, делают заключение о низкой зараженности альвеолярных макрофагов; для оценки интенсивности провоспалительной или микробицидной или противовоспалительной реакций альвеолярных макрофагов определяют долю альвеолярных макрофагов, окрасившихся на анализирумый фактор, соответствующий одной из указанных реакций, от общего числа альвеолярных макрофагов на покровном стекле, окрашенном на анализируемый фактор; при выявлении более 50% альвеолярных макрофагов, окрасившихся на анализируемый фактор, делают заключение о высокой интенсивности реакции альвеолярных макрофагов, соответствующей данному фактору; при выявлении от 10% до 50%, включительно альвеолярных макрофагов, окрасившихся на анализируемый фактор, делают заключение о средней интенсивности реакции альвеолярных макрофагов, соответствующей данному фактору; при выявлении от 1% до менее 10% альвеолярных макрофагов, окрасившихся на анализируемый фактор, делают заключение о низкой интенсивности реакции альвеолярных макрофагов, соответствующей данному фактору; при выявлении менее 1% альвеолярных макрофагов, окрасившихся на анализируемый фактор, или их отсутствии, делают заключение об отсутствии реакции альвеолярных макрофагов, соответствующей данному фактору; при выявлении высокой и/или средней степени интенсивности реакции альвеолярных макрофагов, соответствующей двум и более факторам провоспалительной реакции и низкой интенсивности реакции, соответствующей остальным факторам данной реакции, делают заключение о высокой интенсивности провоспалительной реакции альвеолярных макрофагов; при выявлении высокой или средней интенсивности реакции альвеолярных макрофагов, соответствующей одному фактору провоспалительной реакции и низкой интенсивности реакции, соответствующей остальным факторам данной реакции или низкой интенсивности реакций, соответствующих всем факторам провоспалительной реакции, делают заключение о низкой интенсивности провоспалительной реакции альвеолярных макрофагов; при выявлении высокой интенсивности реакции, соответствующей одному из микробицидных факторов или средней интенсивности реакции, соответствующей обоим микробицидным факторам, делают заключение о высокой интенсивности микробицидной реакции альвеолярных макрофагов; при выявлении средней интенсивности реакции, соответствующей одному из микробицидных факторов и низкой интенсивности реакции, соответствующей другому микробицидному фактору, или низкой интенсивности реакции, соответствующей обоим микробицидным факторам, делают заключение о низкой интенсивности микробицидной реакции альвеолярных макрофагов; при выявлении высокой и/или средней интенсивности реакции, соответствующей двум и более факторам противовоспалительной реакции, делают заключение о высокой интенсивности противовоспалительной реакции альвеолярных макрофагов; при выявлении высокой или средней степени интенсивности реакции одного фактора противовоспалительной реакции и низкой интенсивности реакции остальных факторов данной реакции или низкой интенсивности реакции всех факторов противовоспалительной реакции, делают заключение о низкой интенсивности противовоспалительной реакции в альвеолярных макрофагах; сравнивают зараженность альвеолярных макрофагов микобактериями туберкулеза с интенсивностью макрофагальной иммунной реакции, провоспалительной, микробицидной и противовоспалительной реакций альвеолярных макрофагов; при выявлении высокой или средней интенсивности иммунной реакции и высокой интенсивности провоспалительной, микробицидной и противовоспалительной реакций макрофагов при их низкой зараженности микобактериями делают заключение об избыточной активности иммунной провоспалительной и микробицидной реакций макрофагов; при выявлении средней интенсивности иммунной реакции макрофагов и низкой интенсивности их провоспалительной, микробицидной и противовоспалительной реакций при низкой зараженности микобактериями альвеолярных макрофагов делают заключение о недостаточной активности противовоспалительной реакции макрофагов; при выявлении низкой интенсивности иммунной, провоспалительной и противовоспалительной реакций макрофагов и высокой интенсивности их микробицидной реакции при низкой зараженности микобактериями делают заключение об избыточной активности микробицидной реакции и недостаточной активности противовоспалительной реакции макрофагов; при выявлении средней или низкой интенсивности макрофагальной иммунной реакции, низкой интенсивности микробицидной и противовоспалительной реакций и высокой интенсивности провоспалительной реакции при высокой зараженности микобактериями альвеолярных макрофагов делают заключение о недостаточной активности иммунной и микробицидной реакций макрофагов для уничтожения микобактерий в легких пациента.
| СПОСОБ ПОЛУЧЕНИЯ ex vivo КУЛЬТУР АЛЬВЕОЛЯРНЫХ МАКРОФАГОВ ИЗ ОПЕРАЦИОННОГО МАТЕРИАЛА БОЛЬНЫХ ТУБЕРКУЛЕЗОМ ЛЕГКИХ И СПОСОБ ОЦЕНКИ ВИРУЛЕНТНОСТИ Mycobacterium tuberculosis С ИСПОЛЬЗОВАНИЕМ ПОЛУЧЕННЫХ ex vivo КУЛЬТУР АЛЬВЕОЛЯРНЫХ МАКРОФАГОВ | 2015 |
|
RU2593725C1 |
| ТИТАРЕНКО О | |||
| Т | |||
| и др | |||
| Биологические свойства Mycobacterium tuberculosis и характеристика воспалительного ответа при инфильтративном туберкулезе легких //Инфекция и иммунитет | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| - Т | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| - No | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| YU Y | |||
| et al | |||
| Different patterns of cytokines and chemokines combined with IFN-γ production reflect Mycobacterium | |||
Авторы
Даты
2020-02-03—Публикация
2019-05-30—Подача