Изобретение относится к биотехнологии и может быть использовано в пищевой и фармацевтической промышленности.
В последние годы усиливается интерес к лекарственным растениям с целью создания лечебных средств и биологически активных добавок нового поколения. Они направлены не только на поддержание общего состояния здоровья, но для целевого использования в лечении самых тяжелых заболеваний: сердечно-сосудистой системы, онкологии, сахарного диабета и т.д.
Перспективным сырьем для фармацевтической промышленности является такое лекарственное растение, как лапчатка белая (Potentilla alba L., семейство Розоцветные - Rosaceae). Из литературных источников известно, что подземная часть растения (корневище с корнями) содержит углеводы (крахмал), иридоиды, сапонины, фенолкарбоновые кислоты, флавоноиды (кверцетин), дубильные вещества (до 17%). Надземная часть растения содержит иридоиды, сапонины, фенолкарбоновые кислоты, флавоноиды (рутин), дубильные вещества (до 6%). В листьях обнаружены фенолкарбоновые кислоты и их производные, флавоноиды (Лавренов, В.К. Полная энциклопедия лекарственных растений / В.К. Лавренов, Г.В. Лавренова. - СПб.; М., 1991. - Т. 1. - 736 с.). В традиционной медицине лапчатку белую используют для лечения различных заболеваний, в частности, связанных с дисфункцией щитовидной железы.
Природная сырьевая база лапчатки белой крайне незначительна. Велика опасность уничтожения всех имеющихся запасов лапчатки белой в природе, если не позаботиться заранее об их восстановлении (Накопление биологически активных веществ в подземных частях лапчатки белой (Potentilla alba L.) в зависимости от срока культивирования / В.М. Косман и др. // Химия растительного сырья. - 2013. - №2. - С. 139-146.).
Крупных плантаций лапчатки белой пока не существует. Целесообразно размножать лапчатку вегетативным путем. В условиях культуры растения пригодны для заготовки на второй-третий год. Объемы биомассы культивируемой лапчатки белой превышает таковой в природных условиях за это же время в 4-5 раз уже на втором году жизни растения после посадки.
Новым решением является использование в качестве альтернативного источника возобновляемого экологически чистого сырья культур клеток и органов (бородатых корней, hairy roots) высших растений, относящихся к классу Dicotyledones.
Из уровня техники известен способ генетической трансформации растений селекционно-ценных образцов клевера лугового (патент РФ №2420060, опубл. 10.06.2011), согласно которому образцы морфогенной ткани с побегами клевера лугового разрезают на части размером 3-5 мм, которые помещают на среду Гамборга В5 с 2 мг/л 6-бензиламинопурина. Верхнюю поверхность среза эксплантов инокулируют агробактерией. Кокультивирование (совместное культивирование клеток in vitro) осуществляют в течение 48 часов, после чего экспланты отмывают от остатка агробактерий на среде Гамборга В5 того же состава с добавлением 50 мг/л канамицина и 500 мг/л цефотаксима. Регенерацию растений с корнями производят на среде того же состава, но без цефотаксима при отсутствии проявления агробактериальной инфекции.
В качестве недостатков известного изобретения следует признать необходимость использования дорогостоящих регуляторов роста для стабильного роста культуры in vitro.
Известна культура корня Hed.th. (Hedysarum theinum Krasnob.) - продуцент изофлавонов (патент РФ №2360964, опубл. 10.07.2009), обладающая всеми признаками pRi Т-ДНК трансформированных корней, а именно интенсивным ростом на питательных средах простого состава, не содержащих фитогормоны, плагиотропным ветвлением корней, а также генетической и биохимической стабильностью, способностью к синтезу видоспецифичных изофлавонов. Химический анализ вторичных метаболитов подтверждает, что он сохраняет способность к синтезу изофлавонов - ононина, гликозида тексазина, малонилононина, формононетина, характерных для корней целого растения.
Недостатком известного способа является низкий уровень содержания целевого продукта (изофлавонов).
Описан процесс агробактериальной трансформации корневой системы Rhaponticum carthamoides при инокулировании стерильных проростков штаммами Agrobacterium rhizogenes. У Rhaponticum carthamoides через месяц после заражения наблюдается образование корней или опухолей, из которых начинается спонтанная регенерация модифицированных растений. За 4 недели масса бородчатых корней увеличивается в 4-6 раз. Состав экдистероидов, в сумме составляющая 0,02-0,03%, различен в сравнении с корневищами природных растений (Получение культуры трансформированных корней Rhaponticum carthamoides / И.В. Орлова и др. Физиология растений. - 1998. - Т. 45. - №3. - С. 397-400).
Наиболее близким к заявляемому способу является способ получения культуры изолированных корней из растения, относящегося к классу Dicotyledones - Silene linicola K 1601 - продуцента экдистероидов (патент РФ №2605912, опубл. 27.12.2016), предусматривающий бактериальную трансформацию экспланта корня ювенильного растения Silene linicola агробактериальным штаммом R-1601 A. rhizogenes. Трансформированные корни от экспланта отделяют и культивируют. Изолированные корни культивируют первые два пассажа на среде Гамборга с добавлением 250 мг/л цефотаксима, последующие пассажи выращивают на среде Гамборга с добавлением 500 мг/л гидролизата казеина.
Недостатком данного способа является медленный прирост биомассы, незначительный уровень содержания целевого продукта (в данном случае - экдистероидов) в конечном продукте.
Техническая задача, решаемая использованием разработанного способа, состоит в получении биохимически стабильной культуры изолированных корней Potentilla alba L. (класс Dicotyledones).
Технический результат, достигаемый при реализации разработанного способа, состоит в обеспечении постоянного высокого темпа роста изолированных корней Potentilla alba L. на безгормональных питательных средах при высоком уровне биосинтеза флавоноидов.
В предлагаемом способе технический результат достигается тем, что осуществляют стерилизацию и проращивание семян Potentilla alba L. на питательной среде AS (Стрита), культивирование агробактериального штамма A. rhizogenes (А 4) на питательной среде YEV, инкубацию эксплантов растения в суспензии агробактерии, отделение трансформированных корней от экспланта и их последующее выращивание на безгормональной питательной среде Гамборга В-5.
Способ осуществляют следующим образом.
На первом этапе семена Potentilla alba L. обезжиривают, погружая их на несколько минут в 96%-й этиловый спирт, и просушивают на фильтровальной бумаге либо в токе воздуха в ламинарном боксе. Стерилизацию семян проводят в стерильном ламинарном боксе. В качестве стерилизатора используют диоцид.
По окончании стерилизации семена тщательно промывают стерильной дистиллированной водой (4-5 промываний), помещают в чашки Петри на среду AS (Стрита) и проращивают в темноте при температуре +26°С. Проклюнувшиеся семена переносят в отдельные пробирки или специальные стеклянные банки со средой того же состава и помещают на свет до образования молодых листьев (эксплантов растений).
Второй этап включает подготовку питательных сред для культивирования агробактерий и растительного материала.
Для инокуляции эксплантов растений используют дикий (не модифицированный) штамм Agrobacterium rhizogenes (А 4), который наращивают на питательной среде YEV течение 48 часов в темноте при температуре 26°С (либо при температуре 32°С в течение 24 часов) на качалке с круговым движением (амплитуда 5-10 см, скорость вращения 90 об./мин.).
Затем готовят питательную среду Мурасиге и Скуга MS 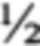 N, которую разливают в 2 колбы по 500 мл. Одну колбу оставляют без введения агара, во вторую вводят агар. Обе колбы автоклавируют 20 минут при 2 атм. Слегка остужают до температуры 60°С и разливают питательную среду с агаром по чашкам Петри.
N, которую разливают в 2 колбы по 500 мл. Одну колбу оставляют без введения агара, во вторую вводят агар. Обе колбы автоклавируют 20 минут при 2 атм. Слегка остужают до температуры 60°С и разливают питательную среду с агаром по чашкам Петри.
На третьем этапе помещают часть выросших микроорганизмов (А. Rhizogenes (А 4)) в стерильную воду (объем 100 мл). Подготавливают биоматериал: после появления пары настоящих листьев отделяют от корней надземную часть проростков; разрезают листья, подсемядольное колено и гипокотиль на сегменты размером 1,0-1,5 см. После этого осторожно накалывают иглой инсулинового шприца воль жилки по листу, вдоль эпикотиля и гипокотиля, стараясь достать иглой до центра, где проходит сосудистая система растений.
Затем переносят экспланты в среду для бактерий YEV и выдерживают в магнитной ванночке 10-100 секунд для более эффективной трансформации. Инкубируют экспланты в течение 48 часов, либо 24 часов, либо 12 часов. После 48-часовой (либо 24-часовой, либо 12 часовой) инкубации эксплантов с агробактерией растительный материал продолжительно отмывают стерильной питательной средой MS 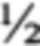 N (продолжительность инкубации эксплантов выбирают в зависимости от требуемого количества биологически активных веществ (вторичных метаболитов) фенольной природы в корневых культурах). Переносят отмытые экспланты на агаризованную среду того же состава, содержащую (250 мг/0,5 л) клафорана для элиминирования А. rhizogenes. Чашки Петри с эксплантами выставляют в «световую» комнату», в которой они находятся до образования трансформированных корней.
N (продолжительность инкубации эксплантов выбирают в зависимости от требуемого количества биологически активных веществ (вторичных метаболитов) фенольной природы в корневых культурах). Переносят отмытые экспланты на агаризованную среду того же состава, содержащую (250 мг/0,5 л) клафорана для элиминирования А. rhizogenes. Чашки Петри с эксплантами выставляют в «световую» комнату», в которой они находятся до образования трансформированных корней.
После достижения определенных размеров образовавшиеся корни пересаживают на свежую питательную среду Гамборга В-5 без гормонов для полного элиминирования бактерии A. Rhizogenes (А 4). Корни доращивают в «темновой» комнате (температура 26°С, влажность 60-70%).
При первой пересадке образовавшихся корней лучше сохранять часть ювенильного растения, из которой был инициирован их рост. Это обеспечит сохранение хорошей ростовой активности корневого инокулята. После 3-5 последующих пересадок непосредственно корневых эксплантов на агаризованную среду и достижения полной асептичности культуры корни переносят в жидкую питательную среду того же состава.
Полученные pRi Т-ДНК трансформированные корни, так называемые hairy roots, выращивают в условиях качания (90 об./мин) в темноте при температуре 26°С.
Пересадку полученных корней проводят через каждые 6-8 недель, используя для этого корневую культуру массой 500-750 мг, которую надо помещать в колбы с 50 мл жидкой питательной среды Гамборга В-5 (без гормонов).
Изобретение иллюстрируется следующими примерами.
Пример 1
Семена Potentilla alba L. обезжиривают, погружая их на несколько минут в 96%-й этиловый спирт, и просушивают на фильтровальной бумаге либо в токе воздуха в ламинарном боксе. Стерилизацию семян проводят в стерильном ламинарном боксе. В качестве стерилизатора используют диоцид: обезжиренные семена помещают в стерильную колбу с раствором диоцида на 15-20 минут. Для лучшего соприкосновения семян со стерилизующим веществом колбу периодически встряхивают.
По окончании стерилизации семена тщательно промывают стерильной дистиллированной водой (4-5 промываний), помещают в чашки Петри на среду AS (Стрита) и проращивают в темноте при температуре +26°С. Проклюнувшиеся семена переносят в отдельные пробирки или специальные стеклянные банки со средой того же состава и помещают на свет до образования молодых листьев (эксплантов растений).
Для инокуляции эксплантов проростков используют дикий (не модифицированный) штамм Agrobacterium rhizogenes (А 4), который наращивают на питательной среде YEV течение 48 часов в темноте при температуре 26°С (либо при температуре 32°С в течение 24 часов) на качалке с круговым движением (амплитуда 5-10 см, скорость вращения 90 об./мин.). Состав питательной среды для культивирования A. Rhizogenes (А 4) (1000 мл): мясной бульон + пептон - 5 г; дрожжевой экстракт - 1 г; сахароза - 6,6 г; MgSO4⋅7H2O - 3 г.
Затем готовят питательную среду Мурасиге и Скуга MS 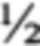 N. Состав среды MS
N. Состав среды MS 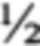 N (1000 мл): сахароза - 20 г; макросоли по MS
N (1000 мл): сахароза - 20 г; макросоли по MS 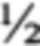 N - 50 мл; витамины по MS - 1 мл; микроэлементы по MS - 1 мл; Fe-хелат - 5 мл; мезоинозит - 5 мл; агар-агар - 7 г, рН 5,6-5,8. Состав солей (1000 мл): NH4NO3 - 16,5 г; KNO3 - 19,0 г; CaCl2 - 13,2 г; MgSO4⋅7H2O - 7,4 г; KH2PO4 - 3,4 г. Состав микроэлементов (1000 мл): MnSO4⋅4H2O - 22,3 г; Н3ВО3 - 6,2 г; ZnSO4⋅7H2O - 11,5 г; Na2MoO4⋅2H2O - 0,25 г; CuSO4⋅5H2O - 0,025 г; CoCl2⋅6H2O - 0,025 г; KI - 0,825 г. Состав витаминов (1000 мл): тиамин - 0,1 г; пиридоксин - 0,1 г; никотиновая кислота - 0,5 г. Питательную среду MS
N - 50 мл; витамины по MS - 1 мл; микроэлементы по MS - 1 мл; Fe-хелат - 5 мл; мезоинозит - 5 мл; агар-агар - 7 г, рН 5,6-5,8. Состав солей (1000 мл): NH4NO3 - 16,5 г; KNO3 - 19,0 г; CaCl2 - 13,2 г; MgSO4⋅7H2O - 7,4 г; KH2PO4 - 3,4 г. Состав микроэлементов (1000 мл): MnSO4⋅4H2O - 22,3 г; Н3ВО3 - 6,2 г; ZnSO4⋅7H2O - 11,5 г; Na2MoO4⋅2H2O - 0,25 г; CuSO4⋅5H2O - 0,025 г; CoCl2⋅6H2O - 0,025 г; KI - 0,825 г. Состав витаминов (1000 мл): тиамин - 0,1 г; пиридоксин - 0,1 г; никотиновая кислота - 0,5 г. Питательную среду MS 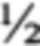 N разливают в 2 колбы по 500 мл. Одну колбу оставляют без введения агара, во вторую вводят агар. Обе колбы автоклавируют 20 минут при 2 атм. Слегка остужают и разливают питательную среду с агаром по чашкам Петри.
N разливают в 2 колбы по 500 мл. Одну колбу оставляют без введения агара, во вторую вводят агар. Обе колбы автоклавируют 20 минут при 2 атм. Слегка остужают и разливают питательную среду с агаром по чашкам Петри.
На следующем этапе помещают часть выросших микроорганизмов (А. Rhizogenes (А 4)) в стерильную воду (объем 100 мл). Подготавливают биоматериал: после появления пары настоящих листьев отделяют от корней надземную часть проростков; разрезают листья, подсемядольное колено и гипокотиль на сегменты размером 1,0-1,5 см. После этого осторожно накалывают иглой инсулинового шприца воль жилки по листу, вдоль эпикотиля и гипокотиля, стараясь достать иглой до центра, где проходит сосудистая система растений.
Затем переносят экспланты в среду для бактерий YEV и выдерживают в магнитной ванночке 10-100 секунд для более эффективной трансформации. Инкубируют экспланты в течение 48 часов. После инкубации эксплантов с агробактерией растительный материал продолжительно отмывают стерильной питательной средой MS 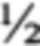 N. Переносят отмытые экспланты на агаризованную среду того же состава, содержащую (250 мг/0,5 л) клафорана для элиминирования A. Rhizogenes (А 4). Чашки Петри с эксплантами выставляют в «световую» комнату», в которой они находятся до образования трансформированных корней.
N. Переносят отмытые экспланты на агаризованную среду того же состава, содержащую (250 мг/0,5 л) клафорана для элиминирования A. Rhizogenes (А 4). Чашки Петри с эксплантами выставляют в «световую» комнату», в которой они находятся до образования трансформированных корней.
После достижения определенных размеров образовавшиеся корни пересаживают на свежую питательную среду Гамборга В-5 без гормонов для полного элиминирования бактерии A. Rhizogenes (А 4). Состав питательной среды Гамборга В-5 (1000 мл): сахароза - 20 г; макросоли по Гамборгу В-5 - 100 мл; витамины по Гамборгу В-5 - 10 мл; микроэлементы по Гамборгу В-5 - 1 мл; Fe-хелат - 5 мл. Состав макросолей (1000 мл): NaH2PO4⋅2H2O - 1,69 г; KNO3 - 25 г; (NH4)2SO4 - 1,34 г; MgSO4⋅7H2O - 2,5 г; CaCl2 - 1,5 г. Состав микросолей (1000 мл): H3BO3 - 3 г; ZnSO4⋅7H2O - 2 г; Na2MoO4⋅2H2O - 0,25 г; CoCl2⋅6H2O - 0,25 г; CuSO4⋅5H2O - 0,025 г; KI - 0,75 г. Состав витаминов (100 мл): тиамин - 1 г; пиридоксин - 0,1 г; никотиновая кислота - 0,1 г; мезоинозит - 10 г. Корни доращивают в «темновой» комнате (температура 26°С, влажность 60-70%).
При первой пересадке образовавшихся корней лучше сохранять часть ювенильного растения, из которой был инициирован их рост. Это обеспечит сохранение хорошей ростовой активности корневого инокулята. После 3-5 последующих пересадок непосредственно корневых эксплантов на агаризованную среду и достижения полной асептичности культуры корни переносят в жидкую питательную среду того же состава.
Полученные pRi Т-ДНК трансформированные корни, так называемые hairy roots, выращивают в условиях качания (90 об/мин) в темноте при температуре 26°С.
Пересадку полученных корней проводят через каждые 6-8 недель, используя для этого корневую культуру массой 500-750 мг, которую надо помещать в колбы с 50 мл жидкой питательной среды Гамборга В-5 (без гормонов).
Пример 2
Аналогичен примеру 1, но совместное инкубирование эксплантов с агробактерией осуществляют в течение 24 часов.
Пример 3
Аналогичен примеру 1, но совместное инкубирование эксплантов с агробактерией осуществляют в течение 12 часов.
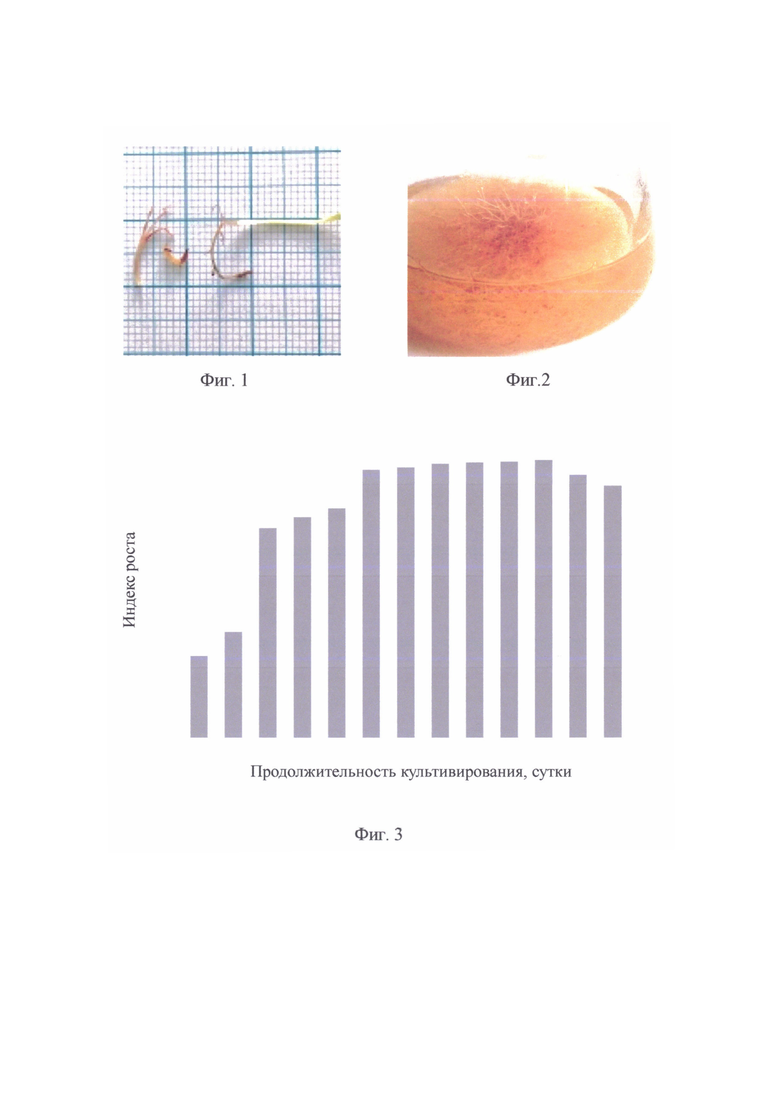
Показано, что трансформированные корни имеют большие размеры и имеют другой оттенок, что может быть вызвано системой питания в регулируемом режиме питательных сред и формированием вторичных метаболитов в другом составе и количестве, нежели в природной среде (фиг. 1).
Показано, что в результате реализации способа культура изолированных корней Potentilla alba L. растет стабильно, образует массу переплетенных корней (фиг. 2).
Из фиг. 3 следует, что индекс роста при продолжительности культивирования 12 ч составляет 28,7; при продолжительности культивирования 24 ч - 36,7; при продолжительности культивирования 48 ч - 36,0.
В полученных корневых культурах определяли содержание биологически активных веществ (вторичных метаболитов) фенольной природы. Результаты определения содержания флавоноидов и дубильных веществ в корневых культурах Potentilla alba L. представлены в таблице 1.
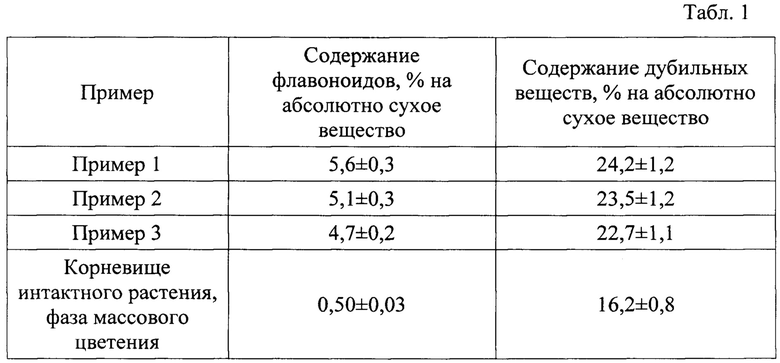
Данные таблицы 1 свидетельствуют о том, что содержание флавоноидов в полученных согласно настоящему изобретению корневых культурах превышает данное значение для корневища интактного растения в 10,0 раз, а содержание дубильных веществ - в 1,5 раза.
Таким образом, заявленный способ получения биохимически стабильной культуры изолированных корней растений класса двудольные позволяет обеспечить постоянный высокий темп роста изолированных корней на безгормональных питательных средах и высокий уровень биосинтеза флавоноидов.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ КУЛЬТУРЫ ИЗОЛИРОВАННЫХ КОРНЕЙ Silene linicola К1601 - ПРОДУЦЕНТА ЭКДИСТЕРОИДОВ | 2016 |
|
RU2605912C1 |
| СПОСОБ ВЫДЕЛЕНИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ АНТИМИКРОБНОГО ДЕЙСТВИЯ ИЗ КЛЕТОЧНЫХ КУЛЬТУР ЭЛЕУТЕРОКОККА КОЛЮЧЕГО ELEUTHEROCOCCUS SENTICOSUS RUPR. MAXIM. | 2021 |
|
RU2762431C1 |
| КУЛЬТУРА КОРНЯ Hed.th. (Hedysarum theinum Krasnob.) - ПРОДУЦЕНТ ИЗОФЛАВОНОВ | 2008 |
|
RU2360964C1 |
| СПОСОБ ГЕНЕТИЧЕСКОЙ ТРАНСФОРМАЦИИ РАСТЕНИЙ СЕЛЕКЦИОННО-ЦЕННЫХ ОБРАЗЦОВ КЛЕВЕРА ЛУГОВОГО | 2009 |
|
RU2420060C1 |
| Способ получения каллусной культуры Hedysarum alpinum L. | 2022 |
|
RU2787746C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛАПЧАТКИ БЕЛОЙ (Potentilla alba) | 2012 |
|
RU2525676C2 |
| СПОСОБ РЕГЕНЕРАЦИИ ХЛОПЧАТНИКА ИЗ СОМАТИЧЕСКИХ КЛЕТОК (ВАРИАНТЫ) | 1988 |
|
RU2128428C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОГО РАСТИТЕЛЬНОГО СЫРЬЯ ЛАПЧАТКИ БЕЛОЙ (Potentilla alba L.) В УСЛОВИЯХ ГИДРОПОНИКИ | 2014 |
|
RU2570623C1 |
| Способ получения @ -карболиновых алкалоидов из гармалы обыкновенной | 1988 |
|
SU1594180A1 |
| Способ получения культуры корня растения одуванчик кок-сагыз (Taraxacum kok-saghyz Rodin) | 2018 |
|
RU2691604C1 |
Изобретение относится к области биотехнологии. Изобретение представляет собой способ получения корневой культуры in vitro Potentilla alba L. - продуцента флавоноидов, характеризующийся тем, что семена Potentilla alba L. обезжиривают, просушивают, стерилизуют, тщательно промывают стерильной дистиллированной водой, помещают на среду AS (Стрита), проращивают в темноте, переносят в отдельные емкости со средой того же состава и помещают на свет до образования молодых листьев (эксплантов растений), отделяют от корней надземную часть проростков, разрезают листья, подсемядольное колено и гипокотиль на сегменты размером 1,0-1,5 см, накалывают иглой инсулинового шприца вдоль жилки по листу, вдоль эпикотиля и гипокотиля, до сосудистой системы растений, дикий (не модифицированный) штамм Agrobacterium rhizogenes (А 4) наращивают на питательной среде YEV в течение 48 часов в темноте при температуре 26°С, либо при температуре 32°С в течение 24 часов на качалке с круговым движением, подготовленные экспланты растений переносят на среду YEV с нарощенными агробактириями, выдерживают в магнитной ванночке 10-100 секунд и инкубируют 12-24 ч, отмывают стерильной питательной средой MS 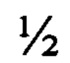 N, переносят на питательную агаризованную среду Мурасиге и Скуга MS
N, переносят на питательную агаризованную среду Мурасиге и Скуга MS 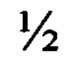 N с добавлением клафорана (250 мг/0,5 л) для элиминирования А. Rhizogenes (А 4), выставляют в «световую» комнату до образования трансформированных корней, корни пересаживают на свежую питательную среду Гамборга В-5 без гормонов для полного элиминирования бактерий А. Rhizogenes (А 4) и доращивают в «темновой» комнате в условиях качания. Изобретение позволяет обеспечить постоянный высокий темп роста изолированных корней Potentilla alba L. на безгормональных питательных средах при высоком уровне биосинтеза флавоноидов. 4 з.п. ф-лы, 3 ил., 1 табл., 3 пр.
N с добавлением клафорана (250 мг/0,5 л) для элиминирования А. Rhizogenes (А 4), выставляют в «световую» комнату до образования трансформированных корней, корни пересаживают на свежую питательную среду Гамборга В-5 без гормонов для полного элиминирования бактерий А. Rhizogenes (А 4) и доращивают в «темновой» комнате в условиях качания. Изобретение позволяет обеспечить постоянный высокий темп роста изолированных корней Potentilla alba L. на безгормональных питательных средах при высоком уровне биосинтеза флавоноидов. 4 з.п. ф-лы, 3 ил., 1 табл., 3 пр.
1. Способ получения корневой культуры in vitro Potentilla alba L. - продуцента флавоноидов, характеризующийся тем, что семена Potentilla alba L. обезжиривают, просушивают, стерилизуют, тщательно промывают стерильной дистиллированной водой, помещают на среду AS (Стрита), проращивают в темноте, переносят в отдельные емкости со средой того же состава и помещают на свет до образования молодых листьев (эксплантов растений), отделяют от корней надземную часть проростков, разрезают листья, подсемядольное колено и гипокотиль на сегменты размером 1,0-1,5 см, накалывают иглой инсулинового шприца вдоль жилки по листу, вдоль эпикотиля и гипокотиля, до сосудистой системы растений, дикий (не модифицированный) штамм Agrobacterium rhizogenes (А 4) наращивают на питательной среде YEV в течение 48 часов в темноте при температуре 26°С, либо при температуре 32°С в течение 24 часов на качалке с круговым движением, подготовленные экспланты растений переносят на среду YEV с нарощенными агробактериями, выдерживают в магнитной ванночке 10-100 секунд и инкубируют 12-24 ч, отмывают стерильной питательной средой MS  N, переносят на питательную агаризованную среду Мурасиге и Скуга MS
N, переносят на питательную агаризованную среду Мурасиге и Скуга MS 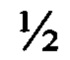 N с добавлением клафорана (250 мг/0,5 л) для элиминирования А. Rhizogenes (А 4), выставляют в «световую» комнату до образования трансформированных корней, корни пересаживают на свежую питательную среду Гамборга В-5 без гормонов для полного элиминирования бактерий А. Rhizogenes (А 4) и доращивают в «темновой» комнате в условиях качания.
N с добавлением клафорана (250 мг/0,5 л) для элиминирования А. Rhizogenes (А 4), выставляют в «световую» комнату до образования трансформированных корней, корни пересаживают на свежую питательную среду Гамборга В-5 без гормонов для полного элиминирования бактерий А. Rhizogenes (А 4) и доращивают в «темновой» комнате в условиях качания.
2. Способ получения корневой культуры in vitro Potentilla alba L. - продуцента флавоноидов по п. 1, отличающийся тем, что стерилизацию семян проводят в стерильном ламинарном боксе с использованием диоцида.
3. Способ получения корневой культуры in vitro Potentilla alba L. - продуцента флавоноидов по п. 1, отличающийся тем, что питательную агаризованную среду Мурасиге и Скуга MS 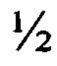 N перед переносом на нее эксплантов растений автоклавируют 20 мин при 2 атм и остужают до 60°С.
N перед переносом на нее эксплантов растений автоклавируют 20 мин при 2 атм и остужают до 60°С.
4. Способ получения корневой культуры in vitro Potentilla alba L. - продуцента флавоноидов по п. 1, отличающийся тем, что при первой пересадке образовавшихся корней сохраняют часть ювенильного растения, из которой был инициирован их рост, после 3-5 последующих пересадок непосредственно корневых эксплантов на агаризованную среду Мурасиге и Скуга MS 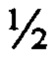 N и достижения полной асептичности культуры корни переносят в жидкую питательную среду того же состава.
N и достижения полной асептичности культуры корни переносят в жидкую питательную среду того же состава.
5. Способ получения корневой культуры in vitro Potentilla alba L. - продуцента флавоноидов по п. 1, отличающийся тем, что пересадку полученных корней проводят через каждые 6-8 недель, используя для этого корневую культуру массой 500-750 мг, которую помещают в колбы с 50 мл жидкой питательной среды Гамборга В-5 (без гормонов).
| СПОСОБ ПОЛУЧЕНИЯ КУЛЬТУРЫ ИЗОЛИРОВАННЫХ КОРНЕЙ Silene linicola К1601 - ПРОДУЦЕНТА ЭКДИСТЕРОИДОВ | 2016 |
|
RU2605912C1 |
| TENEA G.N., Manipulation of root biomass and biosynthetic potential of Glycyrrhiza glabra L | |||
| plants by Agrobacterium rhizogenes mediated transformation, Roumanian Biotechnological Letteres, vol.13, N5, 2008, p.3922-3932 | |||
| КУЛЬТУРА КОРНЯ Hed.th. (Hedysarum theinum Krasnob.) - ПРОДУЦЕНТ ИЗОФЛАВОНОВ | 2008 |
|
RU2360964C1 |
Авторы
Даты
2020-02-14—Публикация
2019-03-22—Подача