Изобретение относится к регенерации и трансформации хлопчатника, в частности хлопчатника вида Gossypium hirsutum Z. /Хлопчатник обыкновенный/.
В последнее время было получено много культур тканей in vitro, происходящих от различных растений, принадлежащих различным таксономическим группам. Для некоторых культур были также определены факторы, регулирующие рост и дифференциацию. Установление скрытых взаимодействий между различными группами растительных гормонов и регуляторов роста растений, действующих непосредственно или косвенным образом, отдельно или в синергичных комбинациях, продвинуло до некоторой степени понимание определенных взаимосвязей, существующих между клетками, тканями и органами. Однако имеющаяся в настоящее время информация относительно таких взаимосвязей далеко не полная.
Уже продолжительное количество времени был известен тот факт, что культуры клеток растений могут поддерживаться в недифференцирующем пролиферативном состоянии неопределенно длительное время. Однако только недавно было обнаружено, что можно экспериментально индуцировать повторную дифференциацию тканей, органов или целых растительных организмов. В работе Skoog et al "Chemical regulation of growth and organ formation in plant tissues cultured in vitro" Symp. Soc. Exp. Biol, 11: 18 - 130, 1958 /эта работа вводится в настоящее описание в виде ссылки/ было показано, что соответствующее отношение цитокинина к ауксину определяет природу органогенеза в ткани табачной сердцевины. Реорганизация или регенерация из каллюсных культур заключает в себе образование примордия побега или эмбрионов, которые приводят в результате к развитию ростков растений in vitro.
Преимущественная тенденция к органогенезу по сравнению с эмбриогенезом зависит от участвующих видов и от наличия определенных запускающих факторов, которые по своему характеру являются химическими и/или физическими.
В 1902 г., Haberlandt в своей работе "Kulturversuche mit isolierten planzenzellen", Mat. KI. Kais. Akad.; Wiss. 111:62 /вводимой в качестве ссылки/ предположил, что клетки растений обладают способностью продуцировать растение целиком и предсказал возможность получения такой регенерации опытным путем. В 1965 г. Reinert "Untersuchungen ubermorphogenese an Gewebekulturen", Ber. dt. Bot. Ces. 71:15, и St. eward et al, "Growth and organized development of cultured cells/11. Organiztion in cultures grown from freely suspended Cells, Am. J. Bot. 45: 705 - 708, независимо друг от друга подтвердили возможность соматического эмбриогенеза in vitro. Обе работы вводятся в настоящую заявку в виде ссылки. В экспериментальном проведении соматического эмбриогенеза стало очевидно, что решающую роль в этом процессе играют два компонента культуральной среды, ауксин и источник азота.
Было также показано, что процесс соматического эмибриогенеза протекает в две стадии: первая - индукция клеток с эмбриогенной компетенцией при высокой концентрации ауксина; вторая - развитие эмбрионной клеточной массы в эмбрионы при отсутствии или при низкой концентрации ауксина.
Индукция органогенеза или эмбриогенеза приводит к образованию в каллюсах различных структур. Тщательное изучение различных видов растений дает возможность сделать некоторые обобщения по поводу эволюционного пути развития, приводящего к образованию побегов, почек или эмбрионов.
Применение тканевой культуры для регенерации растений посредством органогенеза или эмбриогенеза является наиболее значительным вкладом в изучение морфогенеза в целях его дальнейшего практического применения.
В 1971 г. в своей работе "In vitro culture of fertilized cotton ovules", Bioseience 21: 906 - 907, 1971, вводимой в настоящее описание в виде ссылки, Beasley сообщил о получении каллюса в культуре семяпочки хлопчатника. Позже, Hsu et al в работе "Callus induction by (2-chlorethyl) phosphonic (CPA) acidmcultured cotton ovules", Physiol. Plant 36: 150 - 153, вводимой в настоящее описание в виде ссылки, наблюдал стимуляцию роста каллюсов, полученных из семяпочек, вызванную добавлением в среду CPA и гибберелловой кислоты. Кроме того, для Gossypium nirsutum и G. arboreum были получены каллюсные культуры посредством других эксплантатов, таких как (a) лист, Davis et al., "In vitro culture of callus tissues and cell suspensions from okra (Hibiscus esculentus) and cotton (Gossypium nirsutum)", In vitro 9: 395 - 398, 1974 (обе работы вводятся в настоящее описание в виде ссылки; (b) гипокотиль, Schenk et al. "Medium and techinque for induction and growth of monocotyledonous and dicotyledonous plant cell cultures", Can. J. Bot. 50: 199 - 204, 1972 (вводится в настоящее описание в виде ссылки); и (c) семядоля, Rani et al. "Establishment of tissue Cultures of Cotton", Plant Sci. Lett. 7: 163 - 169, 1976 (вводится в настоящее описание в виде ссылки).
Katterman et al. "The influence of a stron g reducing agent upon initiation of callus from the germinating seedling of Gossypium barbadense" Physiol. Plant 40: 98 - 101, 1977 (вводится в настоящее описание в виде ссылки) удалось получить плотный каллюс из семядолей G. Barbadense, а в одном случае, помимо этого, также растение целиком. Smith et al. "Defined condition the initiation and growth of Cotton callus in vitro, Gossypium arboreum", In vitro 13: 329 - 334, 1977 (вводится в настоящее описание в виде ссылки) определили условия для инициации и получения субкультуры каллюса, происходящего от гипокотиля G. arboreum. Вслед за этим Price et al. "Callus cultures of sixspecies of Cotton Gossypium L. on defined media", PI. Sci. Lett. 8: 115 - 119, 1977, и "Tissue culture of Gossypium Species and its potential in cotton genetics and crop inprovement", Beltwide Cotton production Research Conference Proc. pp. 51 - 55, 1977, of the National Cotton Council, Memphis, /вводятся в настоящее описание в виде ссылки/ определили условия для инициации и получения субкультуры каллюса от пяти видов Gossypium. Одной из основных проблем в получении культур многих видов растений является "потемнение" экспланта в культурной среде. Для хлопчатника такое высолаживание полифенолов можно избежать путем замен сахарозы глюкозой и путем переноса культуры в свежую среду каждые 10 дней. После 3 или 4 переносов на дополнительную глюкозную среду потемнение полностью прекращается и культуры могут быть перенесены обратно на дополнительную сахарозную среду. И хотя трудности, возникающие в связи с индукцией, потемнением и поддержания каллюсов в течение процесса субкультивирования были преодолены использованием определенных видов Gossypium, все же попытки регенерировать растения из каллюсных культур были либо безуспешными, либо слишком трудоемкими, т.е. содержали несколько стадий. В своей работе "Plant Regeneration from Callus Tissue of Gossypium hirsutum", L. Plant Sci. tett. 32: 89 - 93, 1983, вводимой в настоящее описание в виде ссылки, Davidonis и Hamilton сообщали о получении, в конечном счете, эмбрионов лишь через два года после начала культивирования. И хотя в целях осуществления регенерации растения in vitro было использовано большое количество различных субстанций роста, таких, как естественные фитогормоны и синтетические регуляторы роста, никаких выводов относительно специфичности и влияния различных факторов на регенерацию растений сделано не было. В самом деле, те же самые вещества, применяемые для различных видов растений, обладали способностью либо ингибировать рост растений, либо стимулировать его, либо вообще не оказывать никакого влияния на последний. Следовательно, за исключением некоторых стандартных процедур, остается проблема получения рабочего протокола для регенерации растений любого нового вида, а также остается нерешенной более трудная задача осуществления трансформации растений.
Настоящее изобретение относится к способу быстрой регенерации растений хлопчатника из сегментов, взятых от саженцев. Предложенный способ обеспечивает высокую степень повторяемости и надежности, а также дает возможность осуществлять генетическую трансформацию растений хлопчатника.
Краткое изложение сущности изобретения
Настоящее изобретение относится к способам регенерации необязательно с трансформацией хлопчатника из соматических клеток.
Зерно стерилизуют и выращивают в темноте до прорастания. Проросток является одним из источников экспланта, обычно, гипокотиля и семядоли. Другим источником экспланта является незрелый зиготический эмбрион развивающегося плода. Эксплант разделяют и культивируют в среде роста для образования первичного каллюса /содержащей глюкозу/ в течение периода времени, необходимого для развития каллюса на культуральной среде, которая препятствует выделению фенола и стимулирует клетки экспланта к делению и пролиферации. Затем каллюс, прошедший стадию фенольной секреции, переносят на севжую среду роста /содержащую сахарозу/, которая способствует развитию каллюса до эмбриогенного каллюса. Полученный эмбрион может быть затем подвергнут субкультивации для получения далее эмбриогенного каллюса, либо перенесен на другую среду роста /среду для прорастания растения/, где его культивируют в течение периода времени, необходимого для образования всходов, которые после определенного периода роста переносят в теплицу, а затем на поле, где они растут до стадии зрелого растения, от которого можно собирать урожай семян.
Эмбрионы можно также культивировать в суспензии. В этом случае после периода роста эмбрион, содержащий эмбриогенные агрегаты размером более 600 микрон, а предпочтительно, более 800 микрон, изолируют и используют для продуцирования растения. Каллюсы меньшего размера помещают в среду роста для повторного цикла в целях культивирования образующего растение каллюса или сохранения его в качестве эмбрионного источника.
Трансформация может происходить в стадии экспланта, каллюса или суспензии. Трансформация заключается в воздействии на эксплант, каллюс и/или эмбриогенный каллюс вектором Агробактерии, содержащим чужеродную к хлопчатнику последовательность экспрессируемого гена, в течение периода времени, достаточном для перехода этого гена в клетки. Остаток Агробактерии уничтожается токсичным к ней антибиотиком. После чего трансформированные клетки и/или эмбриогенный каллюс выделяют для формирования из них трансформированных проростков. В случае суспензионной культуры трансформацию и/или селекцию можно проводить до или после отделения эмбриогенного каллюса от клеток и каллюса, который является слишком незрелым для того, чтобы быть эмбриогенным.
Описанная выше процедура дает возможность получить растения с уникальными фенотипическими признаками и новые растения хлопчатника, которые обладают устойчивостью к антибиотикам, обычно ингибирующим рост клеток растений, повышенной устойчивостью и толерантностью к гербицидам и грибковым патогенам, а также растения хлопчатника, которые дают более высокие урожаи и улучшенное качество волокна.
Краткое описание фигур.
Фиг. 1 представляет собой фотографию, иллюстрирующую эмбриогенный каллюс /10/ хлопчатника с соматическим эмбрионом /11/ в различных стадиях развития, включая лист /14/ и корень /16/.
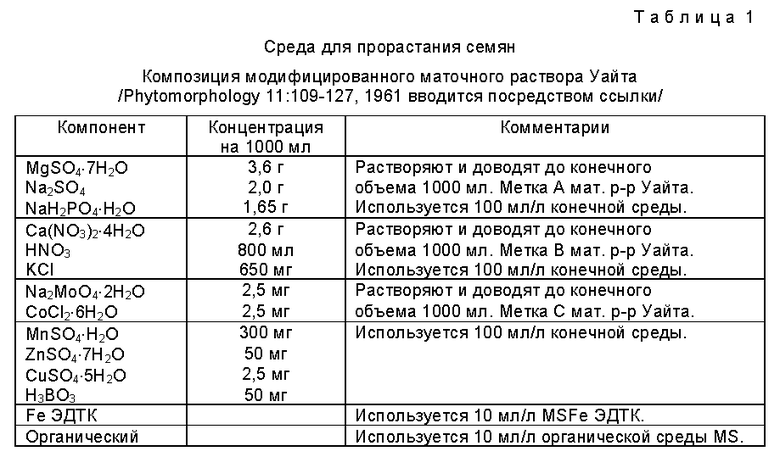
Фиг. 2 представляет собой фотографию соматического эмбриона хлопчатника на поздней глобулярной стадии, выделенной для образования культуры эмбриогенного каллюса, как показано на фиг. 1.
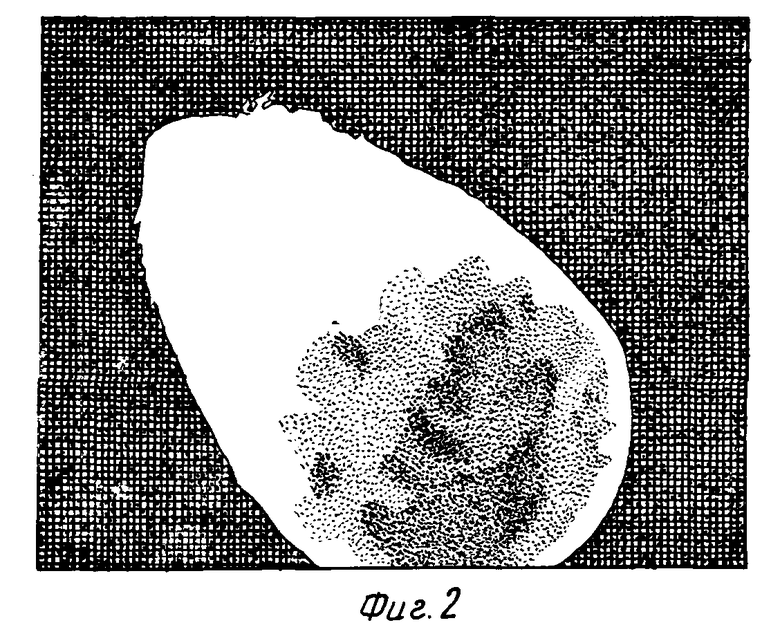
Фиг. 3, как и в случае фиг. 1, представляет собой фотографию, иллюстрирующую эмбрион и молодой проросток /18/ хлопчатника, культивируемого на среде для прорастания эмбриона.
Фиг. 4 представляет собой фотографию небольшой колонии эмбриогенных клеток из суспензионной культуры хлопчатника.
Фиг. 5 представляет собой фотографию глобулярной стадии эмбриона из суспензионной культуры.
Фиг. 6 иллюстрирует проросшие эмбрионы, полученные из суспензионных культур, и показывает появление листьев /14/ и корней /16/.
Фиг. 7 иллюстрирует развитие проростков хлопчатника, выращиваемого на среде прорастания эмбриона.
Подробное описание
Настоящее изобретение относится к регенерации посредством культуры ткани растений хлопчатника, в частности растений вида Gossypium hirsutum из соматических клеток в целях разделения их на полях. Клетки необязательно могут быть трансформированы в целях сообщения им чужеродной генетической информации.
В соответствии с настоящим изобретением, используются среды роста, приведенные в табл. 1 - 3.
С использованием любого из приведенных выше растворов приготавливают 1 литр среды способом, описанным ниже. За основу берут 200 мл деионизированной воды и затем добавляют туда различные маточные растворы в количествах, установленных для 1 литра конечной среды. Например, если необходимо 10 мл маточного раствора в конечной среде, то к 200 мл дистиллированной воды добавляют 10 мл маточного раствора. Для обеспечения гарантии того, что если останутся в растворе, обычно маточный раствор добавляют в том порядке, как это указано в приведенных выше композициях. После тщательного перемешивания в смесь добавляют дополнительное количество деионизированной воды с тем, чтобы довести раствор до требуемого объема 500 мл, и регулируют значение pH смеси в пределах от 5,8 до 6,0. Конечный объем доводят до 1000 мл, куда затем добавляют агар с культурой ткани, или ее эквивалента в количестве 0,8% масс. Затем смесь обрабатывают в автоклаве в течение 15 - 21 мин под давлением 15 - 21 фунт/дюйм2 (1,05 - 1,47 кг/см2) в целях устранения возможной инфекции, соответствующим образом помечают и оставляют на хранение в качестве стерильной среды.
Короче говоря, семена хлопчатника стерилизуются и высеваются на соответствующую среду для прорастания семян, такую как основная агаровая среда, помещенную в темное место на период времени, достаточный для прорастания семян. Нормальный период роста составляет около 4 недель, обычно от 7 до 14 дней.
Сегменты экспланта вырезаются от проростков. Предпочтительно, чтобы эксплант происходил от гипокотиля или семядоли. По желанию в качестве эксплантов можно также использовать незрелые эмбрионы от плодов, выращивающихся в теплицах, или растений хлопчатника, растущего на полях. Сегменты экспланта культивируются на среде роста для первичного каллюса, предпочтительно, полной питательной среде Мурагиге и Скуга /MS/, содержащей глюкозу. Культивирование происходит при температуре 25 - 35oC с циклом свет/темнота с периодом времени около 16 часов на свету и 8 часов в темноте. При культивировании в систему периодически подается свежая питательная среда в течение приблизительно около 3 - 4 недель до тех пор, пока не образуется недифференцированный каллюс. Затем это каллюс переносят в среду роста для вторичного каллюса, предпочтительно, в MS-среду, дополненную нафталинуксусной кислотой /NAA/ и сахарозой, в качестве углеродного источника, и культивируют в течение трех или четырех месяцев для получения эмбрионов.
Эмбрионы могут быть затем оставлены в среде роста для вторичного каллюса поддержания стадии эмбриона либо перенесены на среду для прорастания растений, такую как среда Бизли и Тинга, содержащую, предпочтительно, гидролизат казеина и источник аммония, после чего эти эмбрионы культивируют в течение 2 - 3 недель до получения проростков.
Эти проростки затем переносят в почву при условиях повышенной влажности, потом пересаживают в большие горшки, помещенные в теплице, и, наконец, высаживают на поля, где они выращиваются до полной зрелости.
Описанные выше способы были успешно использованы для образования соматических эмбрионов у хлопчатника вида Gossypium hirsutum при помощи культуры ткани и суспензионной культуры, чтобы в конечном счете получить зрелые растения из каллюсных культур, полученных от гипокотиля и семядоли для Acala-сортов Gossypium hirsutum, включая SJ2, SJ4, SJ5, B1644, B1810, B2724, CC510 и C1 и включая Acala "пиккер" Sioka и "стриппер" сорт FC 2017. Культуры могут быть трансформированы в нормальные растения с новыми признаками и свойствами.
В частности, данный способ включает стерилизацию семян хлопчатника. Соответствующая стерилизация может быть проведена сначала погружением семян в 95% этанол на 2 - 3 минуты, промываем их в стерильной воде один или несколько раз, потом пропитыванием эти семена 15% раствором гидрохлорита натрия в течение 15 - 20 минут, и, наконец, неоднократным промыванием в стерильной воде.
Стерилизованные семена затем переносятся в первую среду, называемую средой для прорастания семян. Указанная среда для прорастания является средой с нормальным содержанием соли. Подходящей средой для прорастания является среда Уайта или полуконцентрированная MS-среда (концентрация ингредиентов = 1/2). Прорастание происходит в темноте обычно в течение 12 - 14 дней.
Из проросшего семени вырезается, предпочтительно, гипокотиль и/или семядоли, которые разделяются или разрезаются на сегменты и культивируются на среде роста для первичного каллюса, такой как MS-среда, пополненная субстанциями, стимулирующими рост. Предпочтительной для этих целей средой является MS-среда, пополненная около 0,4 мл/л тиаминогидрохлорида, около 30 г/л глюкозы, около 2 мл/л нафталинуксусной кислоты, около 1 мг/л кинетина, регулятором роста и около 100 мг/л инозитола и агара. Тиамингидрохлорид может быть взят в концентрации от 0,1 до 0,5 мг/л, глюкоза - в концентрации от 20 до 30 г/л, нафталинуксусная кислота - от 1 до 10 мг/л, кинетин - около 1 - 2 мг/л и инозитол - около 50 - 100 мг/л.
Эти культуры поддерживаются при температуре около 25 - 35oC, предпочтительно при 30oC с циклом свет/темнота: около 16 ч на свету и около 8 ч - в темноте. Предпочтительно, чтобы интенсивность света составляла около 2000 - 4000 люкс, а более предпочтительно около 3000 - 4000 люкс.
Полученные каллюсы периодически подвергаются субкультивированию с интервалами в 3 - 4 недели, а затем переносятся в свежую среду роста для первичного каллюса. При культивировании эксплантов может иметь место выделение фенольных соединений из эксплантов, что выражается потемнением культуральной среды. В этом случае среду меняют более регулярно. Потемнения можно избежать путем замены культуральной среды через каждые 10 дней. Обычно, после трех- или пятиразовой замены среды фенольные выделения прекращаются. Если это все же происходит, то среду роста для первичного каллюса можно свежей средой роста каллюса, содержащей сахарозу или дополненной сахарозой в качестве источника углеродного питания.
После 3 - 4 недель культивирования на поверхностях вырезанных эксплантов активно развиваются каллюсы. Затем эти каллюсы переносят на свежую поддерживающую питательную среду для вторичного каллюса, которая, предпочтительно, является MS-средой, комбинированной с около 1 - 10 мг/л, а предпочтительно, около 1 - 5 мг/л среды NAA. Цитокинин используется в концентрации от 0 до 1 г/л. Среда для выращивания каллюса является средой с высоким содержанием соли, примерно в 10 раз превышающим содержание соли в среде для прорастания семян. Основное отличие питательных сред для первичного и вторичного каллюсов заключается в источнике углеродного питания. Глюкоза используется для стимуляции фенольной секреции. Тогда как сахароза используется для прекращения этой секреции. Равновесие питательной каллюсной среды может поддерживаться постоянным или меняться.
Полученные каллюсы переносятся с регулярными интервалами времени в свежую среду для выращивания каллюса, и обычно, после 5 - 7 переносов или до тех пор, пока на части каллюсов не будет видна антоцианиновая пигментация, начинает развиваться желтовато-белый эмбриогенный каллюс.
Затем эмбриогенный каллюс выборочно субкультивируют и поддерживают при помощи регулярного субкультивирования. Эмбриогенный каллюс содержит соматические эмбрионы в различных стадиях развития. Некоторые из них могут достигать той стадии развития, при которой они способны вырасти в небольшие проростки. Однако по большей части необходимо дальнейшее выращивание. Некоторые из этих эмбрионов можно продвинуть до стадии прорастания. Другие можно поддерживать в качестве источника эмбрионов для использования их в будущем.
На фиг. 2 показана эта стадия развития каллюсов хлопчатника Acala 10 с соматическими эмбрионами различных размеров 12, некоторые из которых имеют уже появившиеся листья 14 и корни 16. На фиг. 3 изображен соматический эмбрион в более поздней глобулярной стадии.
В соответствии с фиг. 4, дальнейшее развитие может быть достигнуто путем переноса соматических эмбрионов в третью питательную среду, определяемую в настоящем описании как среда для прорастания эмбрионов, среду, богатую азотом, обычно, в виде аммиака или его эквивалента. Подходящей для этих целей средой является среда Бизли и Тинга, предпочтительно, дополненная около 500 мг/л гидролизата казеина.
При прорастании соматических эмбрионов за 2 - 3 недели обычно образуются хорошо развитые проростки /18/ с 6 листьями и хорошо выраженной корневой системой.
На этой стадии развития проростки пересаживают в почву небольшими группами и выращивают в стандартном инкубаторе в условиях повышенной влажности. При этом поддерживается температура порядка 25 - 30oC /см. фиг. 7/.
После некоторого периода роста небольшие растения переносятся в более просторные горшки, помещенные в теплице, а после этого их пересаживают на поле, где выращивают до полной зрелости. Предпочтительно, чтобы все регенерированные растения были самоопыляемыми как во время роста в теплице, так и в полевых условиях, полученные при этом семена собираются. Затем семена проращиваются, и на поле в целях испытания потомственной линии высаживаются 4 - 5-недельные проростки и другие стандартные растения, полученные способом обычного разведения. Описанный выше способ позволяет получить жизнеспособные растения хлопчатника примерно от 35% эксплантов за период от 6 до 8 месяцев.
Пролиферация эмбриогенных клеток хлопчатника в суспензионных культурах
По желанию каллюс может быть разрезан на мелкие кусочки и затем выращиваться в суспензионной культуре.
В этой процедуре нормальная концентрация суспензии составляет около 750 - 1000 мг частей каллюса к 8 мл каллюсной среды роста, например, среды роста для вторичного каллюса (MS-среда, дополненная средой NAA). В предпочтительном осуществлении этого способа суспензия каллюса вводится в Т-пробирки, которые помещаются на барабаны роллера, вращающегося со скоростью 1,5 об/мин при световом режиме 16 часов на свету и 8 часов в темноте. Период роста составляет около 3 - 4 недель.
Через каждые 3 - 4 недели суспензию фильтруют для удаления крупных кусков ткани эмбриогенного каллюса, изображенного на фиг. 5, и для выделения каллюса в поздней глобулярной стадии, изображенного на фиг. 6. Полученный фильтрат снова возвращают в питательную среду для роста на 3 - 4 недели. Эта процедура неоднократно повторяется, в результате чего в период времени 3 - 4 недели собирают крупные агрегаты каллюса, а питательная среда для выращивания каллюса полностью или частично обновляется. Предпочтительно, чтобы на один объем оставшейся суспензии приходилось около или более 4 объемов добавленной свежей среды. Предпочтительно также, чтобы используемый фильтр имел сито с размером отверстия более 600 микрон, а более предпочтительно, более 800 микрон, так как из наблюдений было замечено, что клеточные массы с размерами частиц менее 600 микрон не развиваются в зрелые растения, тогда как клеточные массы с частицами более 600 мк, а предпочтительно, более 800 мк подвергаются достаточной дифференциации для того, чтобы стать эмбриогенным и развиваться в жизнеспособное растение.
Для инициации суспензионной культуры эмбриогенную каллюсную ткань помещают в колбу, такую как колба Дэлонга или колба Эрленмейера, содержащую жидкую питательную среду MS в количестве около 20 мл и NAA в концентрации 2,0 мг/л. Эту колбу помещают на круговую качалку и ее содержимое перемешивают со скоростью 100 - 110 об/мин. Через 3 - 4 недели суспензию фильтруют так, как это было описано выше для выделения крупных агрегатов для дальнейшего выращивания растения.
Обычно после третьей или четвертой субкультивации клеточную суспензию из "Т"-пробирки или колбы Дэлонга или Эрленмейера помещают в агаризованную MS-среду, содержащую NAA (2,0 мг/л) или среду Бизли и Тинга, содержащую гидролизат казеина (500 мг/л) и источник азота. За период 3 - 4 недели эмбриогенные каллюсы развиваются в видимые эмбрионы. Затем более крупные агрегаты помещают в вышеуказанную среду для получения эмбриогенных колоний с последующим развитием эмбрионов.
В обеих способах выращивания суспензионной культуры MS-среда используется для поддержания и/или стимулирования эмбрионов, в то время как среда для прорастания используется для ускоренного развития растения.
Регенерация хлопчатника
Пример 1
Регенерация растений из эксплантов, происходящих от семядоли
Семена хлопчатника Acala вида Gossypium hirsutum /сорт SJ2/ стерилизовали в 95% спирте в течение 3 минут, после чего дважды промывали стерильной водой, погружали на 15 минут в 15% раствор гипохлорита натрия, а затем снова промывали в стерильной воде. Стерилизованные семена проращивали в течение 14 дней на базальной агаровой среде, содержащейся в темноте, для получения проростков. Семядоли этих проростков разрезали на сегменты, размером 2 - 4 мм, которые затем в стерильных условиях переносили на каллюс-продуцирующую среду, содержащую среду Мурасиге и Скуга /MS/ с добавленными в нее основными и второстепенными солями. 0,4 мг/л тиамин-HCl, 30 г/л глюкозы, 2,0 мг/л нафталинуксусной кислоты /NAA/, 1 мг/л кинетина, 100 мг/л m-инозитола и агар /0,8%/. Эти культуры инкубировали при 30oC в инкубаторе Персиваля с флуоресцентным источником света /холодный дневной свет/ с интенсивностью 2000 - 4000 люкс в режиме: 16 часов на свету и 8 часов в темноте.
Через 3 - 4 недели на культивируемых сегментах ткани образуются каллюсы от белого до серо-зеленого цвета. Эти каллюсы субкультивировали каждые три-четыре недели на среде для выращивания каллюсов, содержащей MS-среду, в которую входят 100 мг/л m-инозитола, 20 г/л сахарозы, 2 мг/л нафталинуксусной кислоты /NAA/ и агар. Через 4 - 6 месяцев после первоначального помещения тканевых эксплантов на каллюс-продуцирующую среду образуются соматические эмбрионы. Каллюс и эмбрионы поддерживались на среде для выращивания каллюса путем субкультивирования в свежей среде для выращивания каллюса, которая заменялась каждые 3 - 4 недели.
Соматические эмбрионы, образованные на кусочках ткани, эксплантировали либо на свежую среду для выращивания каллюса, либо на среду Бизли и Тинга /среду для проращивания эмбрионов/.
Образованные от соматических эмбрионов соматические проростки затем переносили в среду Бизли и Тинга, содержащую 1200 мг/л нитрата и 500 мг/л гидролизата казеина в качестве органического источника азота. Среду сгущали при помощи загущающего агента /Гельтрита/ и проростки помещали в камеру Магента.
Соматические эмбрионы развиваются в проростки в течение около трех месяцев. Образовавшиеся проростки примерно 3 - 4 дюймов /около 7,5 - 10,2 см/ высотой, имеющие корни и 6 - 8 листьев, были пересажены в почву и поддерживались в инкубаторе в условиях повышенной влажности в течение трех-четырех недель, а затем перенесены в теплицу. После закаливания растения высаживают в открытый вспаханный грунт.
Пример 2
Процедура, описанная в примере 1, повторялась, но с использованием полуконцентрированной среды MS, в которой концентрация всех компонентов, входящих в эту среду, была снижена наполовину. Полученные результаты были в основном аналогичны предыдущим.
Пример 3
Повторялась процедура, описанная в примерах 1 и 2, за исключением того, что эксплантом были сегменты гипокотиля. Полученные результаты были в основном аналогичны предыдущим.
Пример 4
Повторялась процедура, описанная в примерах 1 и 2, за исключением того, что эксплантом были незрелые зиготические эмбрионы. Полученные результаты были в основном аналогичны предыдущим.
Пример 5
Процедуру, описанную в примерах 1 и 2, повторяли в сортами хлопчатника Acala SJ4, AJ5, AJ2C-1, GC510, B1644, B2724, B1810, пиккер-сорт Siokra и стриппер-сорт FC2017. Все эти растения были успешно регенерированы.
Пример 6
Процедуру, описанную в примере 1, повторяли до получения каллюса, способного образовывать соматические эмбрионы. Затем кусочки весом около 750 - 1000 мг активно развивающегося эмбриогенного каллюса суспендировали в 8 мл жидкой суспензионной среды, содержащей основные и второстепенные соли среды MS, дополненной 0,4 мг/л тиамина-HCl, 20 г/л сахарозы, 100 мг/л инозитола и нафталинуксусной кислоты 2 мг/л в Т-пробирках и помещали на вращающийся со скоростью 1,5 об/мин барабан роллера при режиме свет : темнота = 16 : 8. Источником света служила флуоресцентная лампа /холодный дневной свет/ с интенсивностью света около 2000 - 4500 люкс.
Через 4 недели в целях выделения крупных клеточных агрегатов суспензию фильтровали при помощи нейлонового сита с величиной отверстия 840 микрон. Фракцию менее 840 мкм осаждали и один раз промывали свежей суспензионной культуральной средой. Затем эту суспензию переносили в Т-пробирки /2 мл на пробирку/ и каждую пробирку разбавляли 6 мл свежей суспензионной культуральной средой. Эти культуры поддерживали путем повторения описанной выше процедуры с интервалом 10 - 12 дней. А именно суспензию фильтровали и только фракцию, содержащую клеточные агрегаты менее 840 микрон переносили на свежую суспензионную культуральную среду. Во всех случаях фракции, содержащие клеточные агрегаты, превышающие 840 микрон, помещали на среду для выращивания каллюса для получения зрелых соматических эмбрионов.
Соматические эмбрионы, образовавшиеся на среде для роста каллюса, выделяли и переносили в среду для проращивания эмбрионов, где они прорастали, развивались в проростки и выращивались на поле до зрелых растений по методу, описанному в примере 1.
Пример 7
Процедуру, описанную примере 6, повторяли за исключением того, что суспензионные культуры выращивали путем переноса 750 - 1000 мг эмбриогенных каллюсов в колбу Дэлонга, содержащую 15 - 20 мл жидкой MS-среды, дополненной 2 мг/л NAA. Колбу, содержащую культуру, помещали на круговую качалку, имеющую скорость перемешивания 100 - 110 об/мин. Через три недели суспензию фильтровали при помощи сита с размером отверстий 840 мкм в целях выделения крупных клеточных агрегатов для культивирования растений, как описано в примере 4. Суспензию с частичками меньше 840 микрон осаждали, промывали один раз в жидкой MS-среде и ресуспендировали в 2 - 5 мл жидкой MS-среде. Культуры поддерживали путем повторения этой процедуры с интервалом 7 - 10 дней. При каждом субкультивировании повторному культивированию подвергались только суспензии менее 840 мкм, а крупные агрегаты /840 микрон или более/ использовались для выращивания растений.
Пример 8
После трех или четырех культивирований в соответствии с описанной в примерах 6 и 7 процедурой 1,5 - 2,0 мл клеточной суспензии из Т-пробирок и колбы Дэлонга в каждом случае помещали в агаризованную MS-среду, содержащую 2 мл/л NAA и среду Бизли и Тинга, содержащую 500 мг/л гидролизата казеина. За три-четыре недели эмбриогенные каллюсы с развивающимися эмбрионами становятся видимым. И снова клеточные агрегаты размером 840 мкм и более платировали на среду для выращивания каллюса с целью получения эмбриогенных колоний с развивающимися эмбриогенами, которые в конечном счете образуют растения.





Изобретение относится к биотехнологии, может быть использовано в сельском хозяйстве для регенерации хлопчатника из соматических культур. Эксплант хлопчатника выделяют из пророщенных семян, культивируют его на твердой питательной среде, содержащей глюкозу для каллусообразования. При появлении первичного каллуса его переносят в твердую питательную среду, содержащую сахарозу. Культивируют на ней до развития вторичного каллуса. Варианты способа в средах используют сахарозу в качестве источника углерода в момент, когда фенольные секреции подходят к концу. В качестве экспланта используют эксплант, выделенный из гипокотиля и/или семядоли, происходящих от проростков и незрелых эмбрионов хлопчатника. Предлагаемые способы позволяют получить жизнеспособные растения хлопчатника примерно от 35% эксплантов за период от 6 до 8 мес. 3 с. и 21 з.п. ф-лы, 7 ил.
| US 4672035, 06.09.87. |
Авторы
Даты
1999-04-10—Публикация
1988-11-16—Подача