Изобретение относится к области биотехнологии и может быть использовано в фармацевтической промышленности для получения биологически активных веществ антимикробного действия из клеточных культур элеутерококка колючего (Eleutherococcus senticosus (Rupr.) Maxim.).
Данные ВОЗ свидетельствуют о том, что состояние среды обитания, качество продуктов питания и лекарственных препаратов во многом не удовлетворяют потребности современного человека [1-3]. В России неуклонно растет число лиц, страдающих или склонных к различным неинфекционным заболеваниям (болезни сердца и сосудов, рак, бронхиальная астма, сахарный диабет и др.), которые, как правило, имеют длительную продолжительность и являются результатом сочетания генетических, физиологических, экологических и поведенческих факторов [4].
Несбалансированное питание, стрессовое воздействие, экологическое неблагополучие и другие негативные факторы перегружают и истощают регуляторные системы организма человека. Одной из актуальных проблем медицины и здравоохранения является поиск и создание новых лекарственных препаратов на основе растительного сырья, а также использование растительных объектов в качестве промышленных продуцентов целевых метаболитов [5].
Элеутерококк колючий (Eleutherococcus senticosus (Rupr.) Maxim.) - один из представителей группы растений-адаптогенов [6, 7]. Растение широко используется в медицинской практике благодаря высокому спектру фармакологических свойств: повышение тонуса нервной системы, антистрессовой активности и адаптационной резистентности. Свойства элеутерококка колючего характеризуются наличием определенных биологически активных веществ (БАВ), а именно элеутерозидов А, В, B1, Е, E1, I, K, L и М, которые являются гликозидами кумаринов (элеутерозид В1), лигнанов (элеутерозид В, Е, Е1), стеринов (элеутерозид А) и тритерпеновых кислот (элеутерозид I, K, L, М). К другим БАВ элеутерококка колючего относят: фенолы, флавоноиды, фенольные кислоты и др. [8-10]. Для получения экологически чистого сырья с повышенным содержанием БАВ перспективно внедрять современные методы биотехнологии растений - культивирование клеток и органов растений (каллусные, суспензионные, корневые культуры) в условиях in vitro [11]. Для максимального выделения вторичных метаболитов из клеточных культур необходимо подбирать оптимальные условия экстракции.
Из существующего уровня техники известен способ производства пищевого лекарственного порошка на основе астрагала и элеутерококка (Патент KR №1020080016053, опубл. 21.02.2008). Способ производства экстракта элеутерококка колючего заключается в следующем. Корневище элеутерококка колючего тщательно высушивают, чтобы содержание влаги было не больше 5%. Далее смешивают высушенные корневища и дистиллированную воду (соотношение 1: 18-22) при нагревании в течение 2-3 ч., используя обратный холодильник. После смесь фильтруют через фильтровальную бумагу, полученный фильтрат концентрируют путем выпаривания растворителя с использованием роторного испарителя при пониженном давлении. Затем концентрат сушат в сублимационной сушилке для получения концентрированного порошка элеутерококка колючего.
В данном способе неполно описываются параметры экстракции: отсутствует информация о размере частиц и температуре экстракции.
Известен метод извлечения функциональных компонентов из элеутерококка колючего (Патент KR №1020170049984, опубл. 11.05.2017). Способ заключается в следующем. Высушенную кору веток растения измельчают до размера частиц от 3 до 5 мм. Очищенную воду добавляют в пылевидный продукт элеутерококка колючего, после суспендируют. Гидромодуль составляет 1:14-17. Стерилизацию суспензии проводят при 121°С в течение 10-20 мин. Далее суспензию охлаждают до 50°С и добавляют фермент (вискозим, либо пектиназа, либо лактозим, либо пектинекс, либо целлюлакс) для проведения ферментации в течение 0,5-3,0 ч. Для инактивации фермента суспензию нагревают до 121°С в течение 15 мин.
Данный способ характеризуется недостаточной выборкой параметров экстрагирования БАВ (варьируются только используемые ферменты), вследствие чего относительно сложно использовать эти параметры в качестве оптимальных для извлечения БАВ из клеточных культур элеутерококка колючего.
Наиболее близким к заявляемому способу (ближайшим аналогом) является способ приготовления адаптогенной композиции на основе экстракта элеутерококка колючего (Патент WO № 2020065428, опубл. 02.04.2020). Экстракт получают следующим образом. 10 г измельченных корней элеутерококка колючего трижды подвергают ультразвуковой экстракции с хлороформом (по 50 мл). После каждого цикла экстракции (15 мин) экстракт декантируют и фильтруют. Сырье снова погружают в хлороформ и проводят экстракцию. После третьего цикла сырье сушат в потоке жидкого азота для удаления хлороформа, а затем трижды экстрагируют 75% метанолом (по 50 мл). После каждого цикла экстракции (15 мин) экстракт декантируют и фильтруют. Сырье снова погружают в 75% метанол и проводят экстракцию. Получают 150 мл хлороформного экстракта и 150 мл 75% метанольного экстракта. Экстракты концентрируют с использованием вакуумного испарителя и затем лиофилизируют.
Существенным недостатком предложенного способа является сложность технологического процесса. Кроме того, в данном патенте рассмотрены только оптимальные параметры для извлечения БАВ из корней, следовательно, представленные параметры не могут быть рабочими для извлечения БАВ из других клеточных культур элеутерококка колючего.
Техническая задача, решаемая использованием разработанного изобретения, состоит в разработке нового способа выделения БАВ антимикробного действия из клеточных культур элеутерококка колючего (Eleutherococcus senticosus (Rupr.) Maxim.).
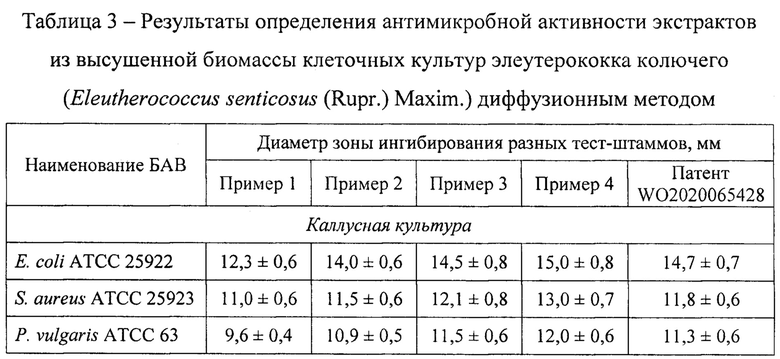
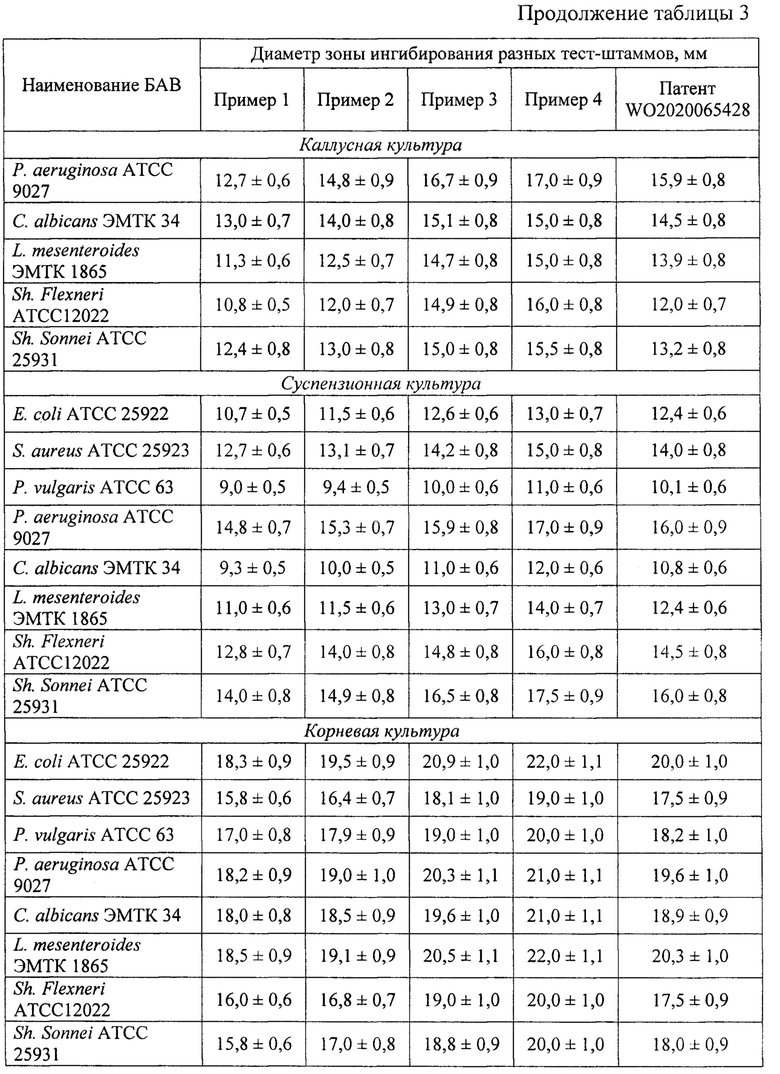
Техническим результатом, полученным при реализации заявленного способа, является получение экстракта биологически активных веществ каллусной, суспензионной, корневой культуры элеутерококка колючего, обладающего антимикробной активностью по отношению к патогенным и условно-патогенным микроорганизмам.
Для достижения указанного технического результата предложено использовать способ выделения биологически активных веществ антимикробного действия из клеточных культур элеутерококка колючего (Eleutherococcus senticosus (Rupr.) Maxim.), включающий культивирование каллусной, суспензионной, корневой культуры на питательных средах в условиях in vitro. Экстракция БАВ клеточных культур осуществляется при следующих условиях: гидромодуль 1:10, температура 60°С, продолжительность 60 мин. В качестве экстрагента для каллусной культуры используется метанол, для суспензионной и корневой - диэтиловый эфир.
Изобретение иллюстрируется следующими примерами.
Пример 1. На первом этапе осуществляют культивирование каллусных, суспензионных и корневых культур элеутерококка колючего (Eleutherococcus senticosus (Rupr.) Maxim.). Для получения каллусной культуры образцы (листовые пластины элеутерококка колючего) стерилизуют в 0,1% растворе сулемы в течение 1 мин, далее промывают трехкратно в течение 20 мин в бидистиллированной воде. Листовую пластину разрезают на сегменты размером 5×5 мм и помещают на агаризованную питательную среду. Цикл субкультивирования составляет 28 суток. Культивирование проводят в стерильных условиях, в темноте, при температуре 26°С и влажности 60-70%.
Для получения суспензионной культуры подготовку образца осуществляют аналогично предыдущей методике для каллуса. Суспензионные культуры клеток выращивают в жидких питательных средах в колбах объемом 250 мл (30-40 мл суспензии в колбе), на качалке (100 об./мин.). При пересеве на 1 объем инокулюма вносят от 3 до 10 частей свежей среды. Цикл выращивания суспензионных культур составляет 14-21 суток. Культивирование проводят в стерильных условиях, в темноте, при 26°С и влажности 60-70%. Для культивирования каллусной и суспензионной культуры используется среда Мурасиге и Скуга (MS). Состав среды MS (1000 мл): сахароза - 30 г; макросоли по MS - 50 мл; витамины по MS - 1 мл; микроэлементы по MS - 1 мл; Fe-хелат - 5 мл; мезоинозит - 5 мл; агар-агар (для каллусной культуры) - 7 г, гидролизат казеина - 0,5 г; хитозан, жасмоновая кислота, Tween 80, рН 5,6-5,8. Состав солей (1000 мл): NH4NO3 - 33,0 г; KNO3 - 38,0 г; CaCl2 - 24,4 г; MgSO4⋅7H2O - 14,8 г; KH2PO4 - 13,6 г. Состав микроэлементов (1000 мл): MnSO4⋅4H2O - 22,3 г; H3BO3 - 6,2 г; ZnSO4⋅7H2O - 11,5 г; Na2MoO4⋅2H2O - 0,25 г; CuSO4⋅5H2O - 0,025 г; CoCl2⋅6H2O - 0,025 г; KI - 0,825 г. Состав витаминов (1000 мл): тиамин - 0,1 г; пиридоксин - 0,1 г; никотиновая кислота - 0,5 г.
Культивирование корневых культур осуществляют по следующей методике. Предварительно получают трансформированные генами агробактерий корни. Для этого семена обезжиривают, погружая их на несколько минут в 96%-й этиловый спирт, и просушивают на фильтровальной бумаге либо в токе воздуха в ламинарном боксе. Стерилизацию семян проводят в стерильном ламинарном боксе. В качестве стерилизатора используют диоцид: обезжиренные семена помещают в стерильную колбу с раствором диоцида на 15-20 минут. Для лучшего соприкосновения семян со стерилизующим веществом колбу периодически встряхивают. По окончании стерилизации семена тщательно промывают стерильной дистиллированной водой (4-5 промываний), помещают в чашки Петри на среду Стрита и проращивают в темноте при температуре 26°С. Проклюнувшиеся семена переносят в отдельные пробирки или специальные стеклянные банки со средой того же состава и помещают на свет.
Для инокуляции эксплантов проростков используют дикий (не модифицированный) штамм Agrobacterium rhizogenes А4, который наращивают на питательной среде YEV в течение 48 часов в темноте при температуре 26°С на качалке с круговым движением (амплитуда 5-10 см, скорость вращения 90 об/мин). Состав питательной среды для культивирования A. rhizogenes (1000 мл): мясной бульон + пептон - 5 г; дрожжевой экстракт - 1 г; сахароза - 6,6 г; MgSO4⋅7H2O - 3 г. Затем готовят питательную среду Мурасиге и Скуга MS 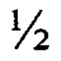 N. Состав среды MS
N. Состав среды MS 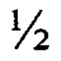 N (1000 мл): сахароза - 20 г; макросоли по MS
N (1000 мл): сахароза - 20 г; макросоли по MS 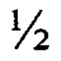 N - 50 мл; витамины по MS - 1 мл; микроэлементы по MS - 1 мл; Fe-хелат - 5 мл; мезоинозит - 5 мл; агар-агар -7 г, рН 5,6-5,8. Состав солей (1000 мл): NH4NO3 - 16,5 г; KNO3 - 19,0 г; CaCl2 - 13,2 г; MgSO4⋅7H2O - 7,4 г; KH2PO4 - 3,4 г. Состав микроэлементов (1000 мл): MnSO4⋅4H2O - 22,3 г; H3BO3 - 6,2 г; ZnSO4⋅7H2O - 11,5 г; Na2MoO4⋅2H2O - 0,25 г; CuSO4⋅5H2O - 0,025 г; CoCl2⋅6H2O - 0,025 г; KI - 0,825 г. Состав витаминов (1000 мл): тиамин - 0,1 г; пиридоксин - 0,1 г; никотиновая кислота - 0,5 г. Питательную среду MS
N - 50 мл; витамины по MS - 1 мл; микроэлементы по MS - 1 мл; Fe-хелат - 5 мл; мезоинозит - 5 мл; агар-агар -7 г, рН 5,6-5,8. Состав солей (1000 мл): NH4NO3 - 16,5 г; KNO3 - 19,0 г; CaCl2 - 13,2 г; MgSO4⋅7H2O - 7,4 г; KH2PO4 - 3,4 г. Состав микроэлементов (1000 мл): MnSO4⋅4H2O - 22,3 г; H3BO3 - 6,2 г; ZnSO4⋅7H2O - 11,5 г; Na2MoO4⋅2H2O - 0,25 г; CuSO4⋅5H2O - 0,025 г; CoCl2⋅6H2O - 0,025 г; KI - 0,825 г. Состав витаминов (1000 мл): тиамин - 0,1 г; пиридоксин - 0,1 г; никотиновая кислота - 0,5 г. Питательную среду MS 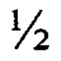 N разливают в 2 колбы по 500 мл. Одну колбу оставляют без введения агара, во вторую вводят агар. Обе колбы автоклавируют 20 минут при 2 атм. Слегка остужают и разливают питательную среду с агаром по чашкам Петри. На следующем этапе помещают часть выросших микроорганизмов (A. rhizogenes) в стерильную воду (объем 100 мл). Подготавливают биоматериал: после появления пары настоящих листьев отделяют от корней надземную часть проростков; разрезают листья, подсемядольное колено и гипокотиль на сегменты размером 1,0-1,5 см. После этого осторожно накалывают иглой инсулинового шприца вдоль жилки по листу, вдоль эпикотиля и гипокотиля, стараясь достать иглой до центра, где проходит сосудистая система растений. Затем переносят экспланты в среду для бактерий YEB и выдерживают в магнитной ванночке 10-100 секунд для более эффективной трансформации. Инкубируют экспланты в течение 48 часов. После инкубации эксплантов с агробактерией растительный материал продолжительно отмывают стерильной питательной средой MS
N разливают в 2 колбы по 500 мл. Одну колбу оставляют без введения агара, во вторую вводят агар. Обе колбы автоклавируют 20 минут при 2 атм. Слегка остужают и разливают питательную среду с агаром по чашкам Петри. На следующем этапе помещают часть выросших микроорганизмов (A. rhizogenes) в стерильную воду (объем 100 мл). Подготавливают биоматериал: после появления пары настоящих листьев отделяют от корней надземную часть проростков; разрезают листья, подсемядольное колено и гипокотиль на сегменты размером 1,0-1,5 см. После этого осторожно накалывают иглой инсулинового шприца вдоль жилки по листу, вдоль эпикотиля и гипокотиля, стараясь достать иглой до центра, где проходит сосудистая система растений. Затем переносят экспланты в среду для бактерий YEB и выдерживают в магнитной ванночке 10-100 секунд для более эффективной трансформации. Инкубируют экспланты в течение 48 часов. После инкубации эксплантов с агробактерией растительный материал продолжительно отмывают стерильной питательной средой MS  N. Переносят отмытые экспланты на агаризованную среду того же состава, содержащую (250 мг/0,5 л) клафорана для элиминирования A. rhizogenes. Чашки Петри с эксплантами выставляют в «световую» комнату», в которой они находятся до образования трансформированных корней. После достижения определенных размеров образовавшиеся корни пересаживают на свежую питательную среду. Корни доращивают в «темновой» комнате (температура 26°С, влажность 60-70%). После 3-5 последующих пересадок непосредственно корневых эксплантов на агаризованную среду и достижения полной асептичности культуры корни переносят в жидкую питательную среду того же состава. Полученные трансформированные корни выращивают в условиях качания (90 об/мин) в темноте при температуре 26°С. Пересадку полученных корней проводят через каждые 6-8 недель, используя для этого корневую культуру массой 500-750 мг, которую надо помещать в колбы с 50 мл жидкой питательной среды.
N. Переносят отмытые экспланты на агаризованную среду того же состава, содержащую (250 мг/0,5 л) клафорана для элиминирования A. rhizogenes. Чашки Петри с эксплантами выставляют в «световую» комнату», в которой они находятся до образования трансформированных корней. После достижения определенных размеров образовавшиеся корни пересаживают на свежую питательную среду. Корни доращивают в «темновой» комнате (температура 26°С, влажность 60-70%). После 3-5 последующих пересадок непосредственно корневых эксплантов на агаризованную среду и достижения полной асептичности культуры корни переносят в жидкую питательную среду того же состава. Полученные трансформированные корни выращивают в условиях качания (90 об/мин) в темноте при температуре 26°С. Пересадку полученных корней проводят через каждые 6-8 недель, используя для этого корневую культуру массой 500-750 мг, которую надо помещать в колбы с 50 мл жидкой питательной среды.
Сушку клеточных культур осуществляют при температуре 59±2°С до остаточной влажности 10-15%.
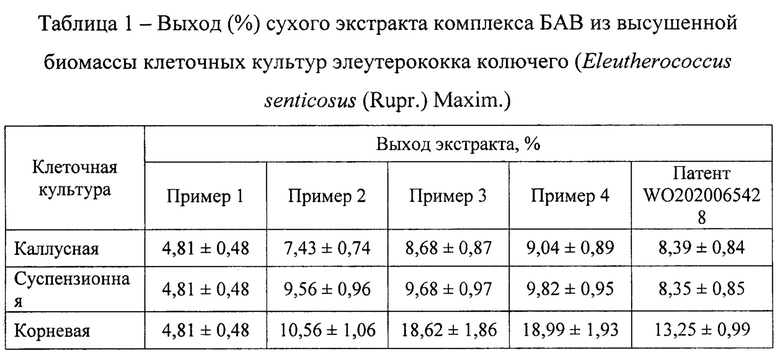
На втором этапе осуществляют экстрагирование БАВ из клеточных культур следующим образом. Навеску 3,0 г сухого растительного сырья (каллусная, суспензионная, корневая культура), взвешенную с точностью до 0,001 г, помещают в пластиковую пробирку объемом 50 мл, добавляют 40 мл 70% этилового спирта, помещают в шейкер и перемешивают в течение 60 мин при комнатной температуре. Сухую массу отделяют от раствора фильтрованием, фильтрат дополнительно центрифугируют при 3900 об/мин для удаления взвешенных частиц. Растворитель из экстракта упаривают при пониженном давлении из предварительно взвешенной колбы объемом 100 мл. Колбу взвешивают и определяют выход экстракта (таблица 1).
Пример 2. Аналогичен примеру 1, но в качестве экстрагента для каллусной культуры используется метанол, для суспензионной и корневой культуры - диэтиловый эфир.
Пример 3. Аналогичен примеру 2, но экстракция БАВ из каллусной, суспензионной, корневой культуры осуществляется при температуре 60°С.
Пример 4. Аналогичен примеру 3, но гидромодуль для каждого образца (каллусная, суспензионная, корневая культура) составляет 1:10.
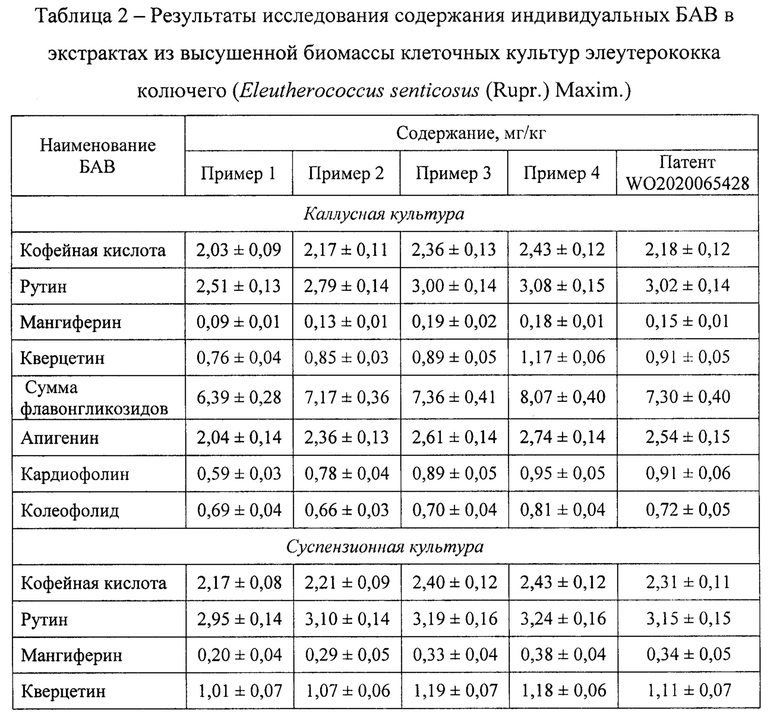
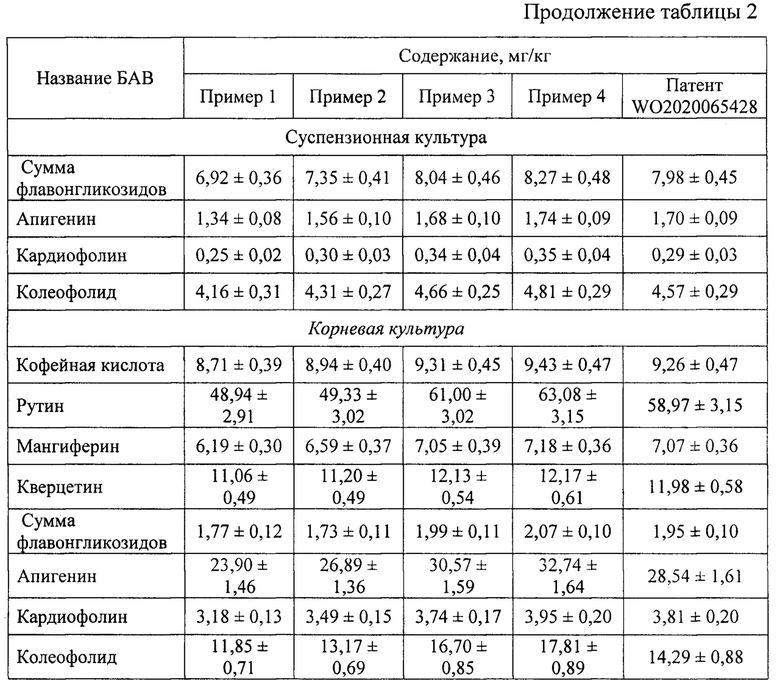
Экстракты клеточных культур элеутерококка колючего (Eleutherococcus senticosus (Rupr.) Maxim.), полученные методами, указанными в примерах 1-5, анализировали по следующим параметрам: выход сухого экстракта (таблица 1), содержание отдельных БАВ (таблица 2), антимикробная активность по отношению к патогенным и условно-патогенным микроорганизмам (таблица 3). Показано, что максимальные параметры экстрактов клеточных культур достигались при использовании способа экстракции по примеру 4. Также клеточные культуры экстрагировали по методу, представленному в ближайшем аналоге. Суммарный выход сухого экстракта клеточных культур по примеру 4 на 20,77% больше по сравнению с ближайшим аналогом, суммарное содержание отдельных БАВ - на 7,99%, суммарная антимикробная активность - на 3,84%.
Таким образом, заявляемый способ обеспечивает высокий выход биологически активных веществ из экстрактов клеточных культур элеутерококка колючего (Eleutherococcus senticosus (Rupr.) Maxim.), характеризующихся высокой антиоксидантной и антимикробной активностью.
Список литературы
1. Chapter 25 - Traffic-related environmental risk factors and their impact on oxidative stress and cardiovascular health / A. Daiber, J. Lelieveld, S. Steven et al. // Eustress and Distress. - 2020. - P. 489-510.
2. The impact of oxidative stress damage induced by the environmental stressors on COVID-19 / B.M. Bakadia, B.O.O. Boni, A.Ahmed et al. // Life Sciences. - 2021. - V. 264. - P. 118653.
3. Inflammation response, oxidative stress and DNA damage caused by urban air pollution exposure increase in the lack of DNA repair XPC protein / N. de Oliveira Alves, G.M. Pereira, M. Di Domenico et al. // Environment International. - 2020. - V. 145. - P. 106150.
4. Здравоохранение в России. 2019: Стат. сб. / Росстат. - М. - 2019. - 170 с.
5. Any war, G. Chapter 2 - Factors affecting the choice for plant-based products in drug discoveries / G. Anywar, J. Namukobe // Phytochemicals as Lead Compounds for New Drug Discovery. - 2020. - P. 15-24.
6. Davydova, M. Eleutherococcus senticosus (Rupr. & Maxim.) Maxim. (Araliaceae) as an adaptogen: a closer look / M. Davydova, A.D/ Krikorian // Journal of Ethnopharmacology. - 2000. - V. 72,1. 3. - P. 345-393.
7. Medicinal Plants from the 14th edition of the Russian Pharmacopoeia, recent updates / A.N. Shikov, I.A. Narkevich, E.V. Flisyuk, V.G. Luzhanin, O.N. Pozharitskaya // Journal of Ethnopharmacology. - 2020. - 113685. - 112 p.
8. Eleutherococcus species cultivated in Europe: A New Source of Compounds with Antiacetylcholinesterase, Antihyaluronidase, anti-DPPH, and cytotoxic activities / K. Adamczyk, M. Olech, J. Abramek et al. // Oxid. Med. Cell Longev. - 2019. - 8673521.
9. Zaluski, D. HPTLC-profiling of eleutherosides, mechanism of antioxidative action of eleutheroside E1, the PAMPA test with LC/MS detection and the structure-activity relationship / D. Zaluski, R. Kuzniewski, Z. Janeczkoa // Saudi J. Biol. Sci. - 2016. - 25 (3). - P. 520-528.
10. Кароматов, И.Д. Адаптоген - элеутерококк, свободоягодник колючий (обзор литературы) / И.Д. Кароматов, З.Т. Набиева // Биология и интегративная медицина. - 2017. - №11. - С. 147-160.
11. Srivastava, P. Chapter 30 - Herbal medicine and biotechnology for the benefit of human health / P. Srivastava, M. Singh, R. Chaturvedi // Models in Discovery and Translation. - 2020. - P. 613-629.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ КУЛЬТИВИРОВАНИЯ КАЛЛУСНОЙ КУЛЬТУРЫ ЛИМОННИКА КИТАЙСКОГО (SCISANDRA CHINENSIS (TURCZ.) BAILL.) В УСЛОВИЯХ IN VITRO | 2021 |
|
RU2757463C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ СУММЫ ФЕНИЛПРОПАНОИДОВ В КОРНЕВИЩАХ И КОРНЯХ ЭЛЕУТЕРОКОККА КОЛЮЧЕГО | 2022 |
|
RU2797411C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ЭЛЕУТЕРОЗИДА В В КОРНЕВИЩАХ И КОРНЯХ ЭЛЕУТЕРОКОККА КОЛЮЧЕГО | 2022 |
|
RU2796764C1 |
| Способ получения биологически активных веществ элеутерококка колючего ЕLеUтнеRососсUS SеNтIсоSUS RUpR. ет МахIм. | 1991 |
|
SU1792356A3 |
| Способ получения биологически активной добавки на основе молочной сыворотки и растительного экстракта | 2022 |
|
RU2792775C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕЗВЕРАТРОЛА | 2006 |
|
RU2326165C1 |
| Способ получения каллусной культуры цикория (Cichorium intybus L.) | 2023 |
|
RU2804841C1 |
| Композиция для приготовления специализированного продукта в форме леденцов | 2022 |
|
RU2796946C1 |
| ГЕПАТОПРОТЕКТОРНОЕ СРЕДСТВО | 2003 |
|
RU2244553C1 |
| БИОЛОГИЧЕСКИ АКТИВНАЯ ДОБАВКА К ПИЩЕ | 2013 |
|
RU2576817C2 |
Изобретение относится к биотехнологии. Предложен способ выделения биологически активных веществ антимикробного действия из клеточных культур элеутерококка колючего Eleutherococcus senticosus Rupr. Maxim., включающий культивирование клеточных каллусных, суспензионных или корневых культур элеутерококка колючего в условиях in vitro, экстрагирование биологически активных веществ из каллусной культуры этиловым спиртом или метанолом, диэтиловым эфиром - из суспензионной или корневой культур, перемешивание в шейкере в течение 60 мин при комнатной температуре или при температуре 60°С, отделение сухой массы фильтрованием, центрифугированием и упариванием при пониженном давлении. Изобретение обеспечивает получение экстракта биологически активных веществ каллусной, суспензионной или корневой культуры элеутерококка колючего, обладающего антимикробной активностью по отношению к патогенным и условно-патогенным микроорганизмам. 3 табл., 4 пр.
Способ выделения биологически активных веществ антимикробного действия из клеточных культур элеутерококка колючего Eleutherococcus senticosus Rupr. Maxim., включающий культивирование клеточных каллусных, суспензионных или корневых культур элеутерококка колючего в условиях in vitro, экстрагирование биологически активных веществ из клеточных культур, отличающийся тем, что при экстрагировании биологически активных веществ из клеточных культур навеску 3,0 г сухого растительного сырья каллусной, суспензионной или корневой культуры помещают в пластиковую пробирку объемом 50 мл, добавляют 40 мл 70% этилового спирта или метанола для каллусной культуры или диэтиловый эфир для суспензионной и корневой культуры, помещают в шейкер и перемешивают в течение 60 мин при комнатной температуре или при температуре 60°С, сухую массу отделяют от раствора фильтрованием, фильтрат дополнительно центрифугируют при 3900 об/мин для удаления взвешенных частиц, растворитель из экстракта упаривают при пониженном давлении из предварительно взвешенной колбы объемом 100 мл.
| Способ восстановления спиралей из вольфрамовой проволоки для электрических ламп накаливания, наполненных газом | 1924 |
|
SU2020A1 |
| Способ получения биологически активных веществ элеутерококка колючего ЕLеUтнеRососсUS SеNтIсоSUS RUpR. ет МахIм. | 1991 |
|
SU1792356A3 |
| СПОСОБ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНОЙ ДОБАВКИ ИЗ ЭЛЕУТЕРОКОККА КОЛЮЧЕГО ELEUTHEROCOCCUS SENTICOCUS MAX. ДЛЯ КОСМЕТИЧЕСКИХ ИЗДЕЛИЙ | 1991 |
|
RU2005482C1 |
| ПОПОВА Н.В., ПОТОРОКО И.Ю | |||
| "Повышение эффективности экстракции биологически активных веществ из растительного сырья методом ультразвукового воздействия" // Вестник ЮУрГУ, Серия "Пищевые и биотехнологии", 2018, т.6, N 1, с.14-22. | |||
Авторы
Даты
2021-12-21—Публикация
2021-01-29—Подача