Изобретение относится к области физиологии растений, биотехнологии и генной инженерии и может быть использовано в фармацевтической промышленности.
Копеечник чайный (Hedysarum theinum Krasnob.) - многолетнее травянистое растение, называемое также красным корнем, относится к семейству бобовых (Fabaceae) и к роду Hedysarum (Черепанов С.К. Сосудистые растения России и сопредельных государств (в пределах бывшего СССР). - Санкт-Петербург: изд. «Мир и семья». 1995).
Корни копеечника чайного находят широкое применение в народной медицине Сибири и используются как болеутоляющее, кроветворное, противовоспалительное и диуретическое средство (Володарская С.Б., Винокурова Е.Ю., Шульц Э.Э. К химическому изучению копеечника чайного. Физиолого-биохимические аспекты изучения лекарственных растений. Материалы международного совещания, посвященного памяти В.Г.Минаевой. 15-18 апреля 1998 года. 1998. Новосибирск. С.18-19).
Ценные целебные свойства растения, ограниченность его произрастания, а также отсутствие четких морфологических признаков, позволяющих безошибочно выявлять копеечник чайный из природной популяции растений рода Hedysarum, являются предпосылками для разработки биотехнологических приемов культивирования клеток растения в условиях in vitro, причем наиболее перспективным может быть введение в культуру именно корней этого растения.
Известны методы культивирования тканей in vitro других видов копеечника - копеечника забытого и копеечника альпийского (Ляпкова Н.С., Хадеева Н.В., Шаин С.С., Майсурян А.Н. Разработка методов культивирования тканей копеечника in vitro. Биотехнология, 1999, №1, с.55-61). Авторам удалось получить каллусные ткани листового, стеблевого и корневого происхождения, а также изолированные корни этих растений.
Однако культивирование недифференцированно растущих клеток растений не всегда гарантирует сохранение биосинтеза видоспецифичных соединений в условиях in vitro. Кроме того, выращивание клеточных культур, а также культивирование изолированных корней на питательной среде, содержащей фитогормоны, существенно ограничивает вероятность дальнейшего использования получаемой растительной массы и тем самым снижает ценность метода.
Учитывая редкость этого растения и сложность его видовой идентификации в биоценозах, полученную культуру корня Hedysarum theinum Krasnob. можно рассматривать как потенциальный источник экологически чистого сырья и как возможный способ размножения и сохранения этого растения.
Задачей изобретения является получение культуры корня Hed.th., интенсивно растущей в условиях in vitro на безгормональных питательных средах, сохраняющей способность к синтезу изофлавонов, характерных для корней целого растения, и обладающей генетической и биохимической стабильностью, для контролируемого выращивания лекарственного сырья в любое время года.
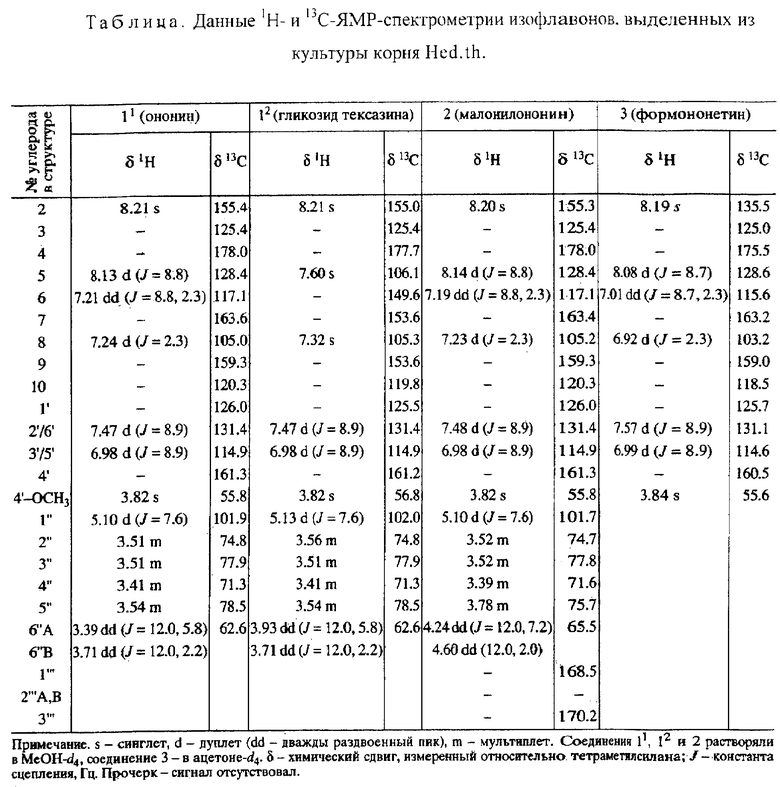
Поставленная задача решается созданием новой культуры корня Hedysarum theinum Krasnob., депонированной в Коллекции генетически трансформированных корней растений при Институте физиологии растений РАН - под обозначением Hed.th. - продуцента изофлавонов: ононина, гликозида тексазина, малонилононина, формононетина.
Видовая принадлежность культуры корня Hed.th. - Hedysarum theinum Krasnob.; происхождение культуры корня Hed.th. - семядоли ювенильных растений, трансформация pRi Agrobacterium rhizogenes, штамм А 4; культурально-морфологическая характеристика культуры корня Hed.th. - плагиотропно растущие и интенсивно ветвящиеся корни; условия выращивания культуры корня Hed.th. - на среде Гамборга (без фитогормонов) при температуре +22-25°С в условиях качания (90 об/мин), погруженная культура; процедура пересева - отделение кончиков корней через 7 недель (эксплант ~250 мг на 70 мл питательной среды); консервация - на агаризованной питательной среде Гамборга при комнатной температуре; при контроле контаминации в культуре корня Hed.th. бактерии и грибы не обнаружены; контроль видовой идентичности культуры корня Hed.th. - синтез видоспецифичных изофлавонов: ононина, гликозида тексазина, малонилононина, формононетина.
Изобретение иллюстрируется следующим примером.
Пример
При получении культуры корня Hed.th. путем pRi Т-ДНК трансформации используют стерильные проростки этого растения, выращенные из стерильных семян, с первыми двумя настоящими листочками. Стерилизацию обезжиренных этиловым спиртом семян проводят концентрированной серной кислотой в течение 3 мин, после чего их тщательно отмывают стерильной дистиллированной водой. Простерилизованные семена помещают в чашки Петри на агаризованную питательную среду Стрита (Смирнов А.М. Рост и метаболизм изолированных корней в стерильной культуре. - М.: Наука, 1970. С.92). Выдерживают семена в течение 4-5 дней при 26°С в темноте для их прорастания, после чего неконтаминированные проростки переносят в биологические пробирки на питательную среду того же состава. Выращивание ювенильных растений проводят при температуре 26°С на свету (12-часовое освещение люминесцентными лампами). После появления пары настоящих листьев надземную часть проростков отделяют, разрезают на сегменты, которые после осторожного накалывания иглой инсулинового шприца помещают в жидкую питательную среду Мурасиге и Скуга (МС), содержащую суспензию 48-часовой почвенной бактерии. Для инокуляции эксплантов проростков используют дикий (не модифицированный) штамм Agrobacterium rhizogenes (A 4). После инкубации обработанные сегменты промывают стерильной средой и переносят на агаризованную питательную среду МС, не содержащую гормонов с добавлением антибиотика (клафоран - 500 мг/мл) для элиминирования бактерии. Через 3-4 недели на семядолях в зонах поранения появляются плагиотропно растущие корни, что является морфологическим признаком успешной генетической трансформации (фиг.1а). Эти трансформированные участки отделяют и пересаживают на агаризованную питательную среду Гамборга (В5), содержащую уменьшенную дозу антибиотика (250 мг/мл) (фиг.1б). После 3-5 пассажей (период между пассажами составляет 5-7 недель) корневых эксплантов на агаризованной среде и достижения полной аксеничности культуры корня Hed.th. часть экспланта переносят в жидкую питательную среду того же состава, не содержащую антибиотик (фиг.2а), и выращивают в условиях качания (90 об/мин) в темноте при температуре 26°С. Исключение антибиотика после элиминирования бактерии приводит к стимуляции роста корней.
К настоящему времени культура корня Hed.th. растет стабильно, образуя массу рыхло переплетенных корней (фиг.2а, б). Для поддержания непрерывного роста культуры корня в период 6-8-недельного интервала между пересадками в культуральные колбы регулярно добавляют свежую питательную среду, что позволяет выращивать лекарственное сырье в контролируемых условиях в любое время года. Культура корня Hed.th. обладает всеми признаками pRi Т-ДНК трансформированных корней, а именно интенсивным ростом на питательных средах простого состава, не содержащих фитогормоны, плагиотропным ветвлением корней, а также генетической и биохимической стабильностью. По своей анатомии, морфологии и биохимии такие корни сопоставимы с корнями ювенильных растений, так как они не имеют вторичного роста, способствующего утолщению корней. Химический анализ вторичных метаболитов культуры корня Hed.th. подтверждает, что полученная культура корня сохраняет способность к синтезу вторичных метаболитов, характерных для корней целого растения. Основными вторичными метаболитами культуры корня Hed.th. являются изофлавоны. Профиль высокоэффективной жидкостной хроматографии (ВЭЖХ) метанольного экстракта культуры корня Hed.th. имеет большое сходство с профилем соответствующего экстракта корней проростков копеечника по времени удерживания (Rt) детектируемых веществ (фиг.3) и по УФ-спектрам их поглощения (фиг.4). В результате многократно проведенного препаративного разделения метанольного экстракта культуры корня Hed.th. выделены и очищены 4 вещества, которые на основании данных 1Н- и 13С-ЯМР-спектрометрии идентифицированы как изофлавоны группы формононетина: ононин, гликозид тексазина, малонилононин, формононетин (таблица), причем первые два вещества входят в состав смеси, представленной компонентом 1 на ВЭЖХ (фиг.3б). Структуры выделенных и идентифицированных вторичных метаболитов культуры корня Hed.th. представлены на фиг.5.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения каллусной культуры Hedysarum alpinum L. | 2022 |
|
RU2787746C1 |
| СПОСОБ РАЗМНОЖЕНИЯ КОПЕЕЧНИКА ЧАЙНОГО (HEDYSARUM THEINUM KRASNOB.) | 2013 |
|
RU2547593C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОРНЕВОЙ КУЛЬТУРЫ IN VITRO POTENTILLA ALBA L. - ПРОДУЦЕНТА ФЛАВОНОИДОВ | 2019 |
|
RU2714403C1 |
| Противовирусное средство на основе экстракта культуры "бородатых корней" ("hairy roots") селитрянки Шобера (Nitraria schoberi L.) | 2016 |
|
RU2615376C1 |
| Способ повышения флавоноид-образующей способности тканевой культуры in vitro гречихи посевной | 2023 |
|
RU2811024C1 |
| Способ клонального микроразмножения копеечника дагестанского | 2024 |
|
RU2840242C1 |
| СПОСОБ ПОЛУЧЕНИЯ КУЛЬТУРЫ ИЗОЛИРОВАННЫХ КОРНЕЙ Silene linicola К1601 - ПРОДУЦЕНТА ЭКДИСТЕРОИДОВ | 2016 |
|
RU2605912C1 |
| СПОСОБ ВЫРАЩИВАНИЯ EX SITU ВЫСОКОГОРНОГО РАСТЕНИЯ Hedysarum theinum krasnob. | 2010 |
|
RU2446670C1 |
| СПОСОБ РАЗМНОЖЕНИЯ ТРАНСГЕННЫХ РАСТЕНИЙ КЛЕВЕРА ЛУГОВОГО МЕТОДОМ КУЛЬТУРЫ ПОЧЕК IN VITRO | 2015 |
|
RU2617944C1 |
| СПОСОБ ОТБОРА IN VITRO КИСЛОТОВЫНОСЛИВЫХ ФОРМ КЛЕВЕРА ЛУГОВОГО (TRIFOLIUM PRATENSE L.) | 2019 |
|
RU2711781C1 |
Изобретение относится к области физиологии растений, биотехнологии и генной инженерии и может быть использовано в фармацевтической промышленности. Культура корня Hed.th. (Hedysarum theinum Krasnob.) обладает всеми признаками pRi Т-ДНК трансформированных корней, а именно интенсивным ростом на питательных средах простого состава, не содержащих фитогормоны, плагиотропным ветвлением корней, а также генетической и биохимической стабильностью, способностью к синтезу видоспецифичных изофлавонов. Химический анализ вторичных метаболитов подтверждает, что он сохраняет способность к синтезу изофлавонов - ононина, гликозида тексазина, малонилононина, формононетина, характерных для корней целого растения. 7 ил., 1 табл.
Культура корня Hedysarum theinum Krasnob., депонированная в Коллекции генетически трансформированных корней растений при Институте физиологии растений РАН - под обозначением Hed.th. - продуцент изофлавонов: ононина, гликозида тексазина, малонилононина, формононетина.
| ЛЯПКОВА Н.С | |||
| и др | |||
| Разработка методов культивирования тканей копеечника in vitro | |||
| Биотехнология, 1999, №1, с.55-61 | |||
| СМИРНОВ A.M | |||
| Рост и метаболизм изолированных корней в стерильной культуре | |||
| - М.: Наука, 1970 | |||
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| КРАСНОБОРОДОВ И.М., АЗОВЦЕВ Г.Р., ОРЛОВ В.П | |||
| Новый вид рода Hedysarum (Fabaceae) из Южной Сибири | |||
| Ботанический журнал, 1985, т.70, с.968-973. | |||
Авторы
Даты
2009-07-10—Публикация
2008-02-07—Подача