ОБЛАСТЬ ТЕХНИКИ
Настоящая заявка относится к области стабилизации нуклеиновых кислот в биологических образцах. Более конкретно, настоящее изобретение относится к способам и композициям для стабилизации дезоксирибонуклеиновой кислоты (ДНК) человека и микроорганизмов, присутствующей в сложных биологических образцах, таких как фекалии.
УРОВЕНЬ ТЕХНИКИ
Фекалии долгое время считали потенциально инфекционным продуктом жизнедеятельности пищеварительного тракта животного, который собирают для проведения исследования с целью определения наличия паразитов, таких как острицы и/или их яйца, или с целью обнаружения патогенных бактерий и грибов у симптоматичных животных и людей. Однако в последнее время с развитием персонализированной медицины и широкомасштабного промышленного производства пре- и пробиотиков диагностическое и, в особенности, прогностическое значение данного продукта, который относят к «отходам», возросло. Было показано, что простое изменение привычной диеты влияет на микробиоту или состав микробного сообщества в фекалиях (Walker et al., 2011; Wu et al., 2011), что, в свою очередь, может повлиять на здоровье и уменьшить частоту возникновения определенных заболеваний.
Колонизация желудочно-кишечного (ЖК) тракта начинается с рождения, и на формирование микробного сообщества, которое развивается с течением времени, воздействует множество факторов, включая набор генов индивидуума, возраст, пол, питание, употребление антибиотиков и других фармацевтических средств, состояние заболевания, образ жизни, географическое расположение/окружение, воздействие химических веществ, хирургические вмешательства и не только. Кишки колонизирует разнообразное микробное сообщество, состоящее приблизительно из 100 биллионов бактерий, которые играют значительную роль в здоровье человека, в частности, в переваривании пищи, энергетическом метаболизме хозяина, синтезе незаменимых витаминов, созревании эпителия, разрушении солей желчных кислот, метаболизме лекарственных препаратов и пищевых канцерогенов, а также в защите кишечника от колонизации патогенами.
Термин «кишечный микробном» предназначен для описания данной обширной совокупности симбиотических микроорганизмов в ЖК системе человека и совокупных взаимодействующих геномов данных организмов. Однако понимание данных функциональных взаимодействий между кишечной микробиотой и физиологическими процессами хозяина находится на начальном этапе. Проект «Микробном человека» позволил выяснить, что кишечный микробном приблизительно в 150 раз превышает геном человека и состоит приблизительно из 300-1000 видов и более 7000 штаммов бактерий. В кишечном микробиоме большинства млекопитающих преобладают бактерии четырех типов: Firmicutes, Bacteroidetes, Actinobacteria и Proteobacteria (Ley et al., 2007). Новое направление работы относится к анализу взаимодействия кишечного микробиома с паразитами кишечника, вирусами, дрожжами и многочисленными грибами, такими как Candida, Saccharomyces, Aspergillus и Penicillium. Некоторые эксперты высказали предположение, что суммарной информации, кодируемой геномом человека самим по себе, недостаточно для осуществления всех биологических функций организма (Lee and Mazmanian, 2010), что указывает на симбиоз между бактериями и людьми в качестве объяснения данного факта. Всего лишь приблизительно 10 процентов клеток человека фактически являются человеческими, а оставшиеся 90 процентов приходится на микробы, в связи с чем людей можно рассматривать как хозяев для своих микробных гостей или как суперорганизмов.
В течение многих десятилетий кишечные микробы были вовлечены в возникновение рака толстой кишки (Aries et al., 1969; Moore and Moore, 1995). Совсем недавно было обнаружено, что инфекция Helicobacter pylori является основной причиной рака желудка (гастрического рака), лимфомы желудка и пептической язвенной болезни (Parsonnet et al., 1991). Однако было выяснено, что кишечные микробы оказывают большее влияние на самочувствие и поведение людей, чем считалось ранее. В связи с увеличивающимися свидетельствами того, что между кишечником и головным мозгом существует коммуникация, кишечник назвали «вторым мозгом». Есть основания полагать, что многочисленные заболевания, такие как сердечно-сосудистое заболевание, диабет, стресс/нервозность, аутизм, болезнь Крона, болезнь раздраженного кишечника (БРК), аллергические нарушения, метаболический синдром и неврологическое воспаление, могут являться следствием нарушения регуляции кишечного микробиома. Однако исследователи только начинают расшифровывать то, что сейчас называют «осью микробном - кишечник - головной мозг», т.е. то, как микроорганизмы, колонизирующие ЖК тракт, могут влиять на биологические функции за пределами кишечника, в частности, молекулярные механизмы или перекрестное действие, посредством которого кишечный микробном влияет на иммунологические, эндокринные и нейрологические заболевания хозяина (Grenham et al., 2011; Kinross et al., 2011). Например, многие микробы образуют нейрометаболиты, которые представляют собой нейротрансмиттеры или модуляторы нейротрансмиссии, включая ГАМК (гамма-аминомасляную кислоту), норадреналин, серотонин, дофамин и ацетилхолин, которые воздействуют непосредственно на нервные окончания в кишечнике или посредством энтерохромаффинных клеток, присутствующих по всему ЖК тракту. Углеводы из пищевых волокон также расщепляются микробами, что приводит к образованию нейроактивных химических веществ, таких как н-бутират, ацетат, сероводород и пропионат. Кроме того, микробы образуют метаболиты, такие как белки, углеводы и другие молекулы, которые могут покидать кишечник и играть роль в увеличении передачи сигналов по всему организму.
Как у здоровых, так и у больных индивидуумов, а также при обнаружении сотен различных видов, образующих микробное сообщество кишечника, важно добиться понимания функциональной консорции бактерий в целом. Например, состав микробиоты определяет конкуренцию за пищевые компоненты в качестве субстратов для роста, преобразование сахара в ингибирующие продукты ферментации, образование субстратов для роста, высвобождение бактериоцинов (молекул, токсичных в отношении других видов бактерий), стимуляцию врожденной иммунной системы, конкуренцию по отношению к микробам, колонизирующим стенку кишечника, а также функцию кишечного барьера и многое другое. К сожалению, попытки определить отличительные черты и функцию членов кишечного микробиома с применением традиционных методик микробиологического культивирования оказались в значительной степени неудачными в связи с серьезными ограничениями, вытекающими из зависимости культивирования от соответствующих питательных веществ для роста, а также сложных условий процветания кишечной микрофлоры в целом in vitro. Оценки свидетельствуют, что всего 20-40% (Apajalahti et al., 2003) от суммарной микрофлоры кишечника можно культивировать с применением методик стандартного культивирования, так что подавляющее большинство микробного биоразнообразия утрачивается при применении способов на основе культивирования. Данный фактор дополнительно усугубляется потребностью подтвердить жизнеспособность микрофлоры кишечника, многие представители которой являются анаэробными, in vitro (О'Sullivan, 2000).
Множество культуральных сред по своей природе являются селективными в отношении определенных бактерий, в частности, тех бактерий, которым в физиологическом состоянии необходимы дополнительные или селективные средства или бактерии, что не позволяет проводить культивирование непосредственно из фекалий или материала кишечника. Также традиционное морфологическое исследование и биохимические тесты для обнаружения и характеризации кишечной микрофлоры являются невероятно трудоемкими, требующими значительных затрат времени и недостаточно точными, что ограничивает эффективность данных методов при проведении анализа образцов, полученных от большого количества индивидуумов, и при сравнении родства между видами бактерий, полученными от различных индивидуумов. Вследствие этого необходимы быстрые способы определения и стабилизации или «мгновенной фиксации» микробиома в точке сбора в сочетании с независимыми от культивирования молекулярными инструментами, такими как подходы на основе гена рибосомальной 16S РНК, зондов TaqMan, цифровой и «LATE» ПНР (Linear After The Exponential, с линейностью после экспоненциальной фазы) и метагеномного секвенирования, для преодоления данных ограничений и ошибок, а также для выявления истинной и подробной картины данной богатой экосистемы.
На сегодняшний день приблизительно 1 из каждых 20 госпитализированных пациентов заражается внутрибольничной инфекцией (ВБИ). В то время как заражаемость большинством типов ВБИ снижается, вспышки, вызванные Clostridium difficile, известным патобионтом, представляют собой все более увеличивающуюся проблему, от которой страдают пациенты в больницах и стационарах длительного пребывания. Инфекция С.difficile (С.difficile infection, CDI), как считают, является следствием желудочно-кишечного дисбиоза, т.е. нарушения резидентной микробиоты. Лечение антибиотиками уничтожает большинство бактерий в ЖК тракте, которые обычно контролируют С.difficile. В данном измененном окружении С.difficile размножается и образует токсины, которые повреждают выстилку кишки, вызывая симптомы, варьирующие от диареи до жизнеугрожающего воспаления и кровотечения выстилки толстой кишки. Согласно данным Центров по контролю и профилактике заболеваний (Centers for Disease Control and Prevention, CDC), в США одна только С.difficile связана со смертями 14000 человек в год. В больницах споры С.difficile, попавшие в фекалии, переносятся к пациентам и поверхностям главным образом через руки медицинских работников, которые дотрагивались до контаминированной поверхности или продукта. Эффективное лечение рецидивирующей инфекции С.difficile не является широко доступным. Парадоксально, но первичное лечение в случае инфекции С.difficile заключается во введении большого количества антибиотиков, при этом приблизительно у 20% пациентов наблюдаются рецидивы в течение месяца, и у многих из них фиксируются повторяющиеся обострения.
Нестандартная альтернативная процедура, трансплантация фекальной микробиоты (ТФМ), при которой фекалии от одного «донора» вводят в кишечник пациента, оказалась намного более эффективной, чем применение антибиотиков, при лечении рецидивирующих инфекций ЖК. Восстанавливая нарушения и приводя к микробному равновесию, инфузия фекалий от здоровых доноров, как представляется, позволяет держать под контролем пагубные бактерии, такие как С.difficile, и уничтожает заболевание даже у пациентов, которые страдали от повторяющихся изнурительных вспышек. В небольшом голландском исследовании Университета Амстердама 15 из 16 пациентов с рецидивирующей инфекцией С.difficile были вылечены посредством дуоденальной инфузии фекалий донора по сравнению со всего лишь 27% выздоровевших пациентов, которым вводили антибиотик ванкомицин в течение 2 недель (van Nood, Els et al. (2013)). Было показано, что инфузия фекалий донора приводила к улучшению микробного разнообразия в ЖК тракте пациента; данное разнообразие сохранялось в течение времени. Недавно Song et al. (2013) подтвердили предыдущие сообщения о том, что снижение разнообразия и богатства микробиоты в образцах фекалий от пациентов, страдающих от рецидивирующей инфекции С.difficile (RCDI, recurrent С.difficile infection), было восстановлено после ТФМ, и показатель разнообразия и богатства микробиоты стал соответствовать уровню, наблюдаемому у здорового донора. В данном динамическом исследовании ТФМ преимущественно влияла на Firmicutes и Proteobacteria, и после ТФМ фекальная микробиота пациентов продолжала меняться в течение по меньшей мере 16 недель.
Важно отметить, что точный механизм действия, который отвечает за успех ТФМ при лечении RCDI, остается неизвестным, и подтвержденный клиническим способом набор параметров для определения подходящего или идеального донора микробиоты отсутствует.Легкий и эффективный способ сбора образцов фекалий на месте и мгновенной фиксации собранного микробиома от большого количества индивидуумов -как здоровых доноров, так и пациентов с RCDI, в композиции при температуре окружающей среды во множестве временных точек необходим для картирования «базового» микробиома, обнаруженного в ЖК тракте здоровых индивидуумов в популяции, на основании чего можно оценивать изменения микробиома пациентов с RCDI. В конечном итоге, в будущем пациенты с RCDI будут получать лечение не антибиотиками, но персонализированными пробиотиками (препаратом/добавкой, содержащим живые бактерии, который принимают перорально для восстановления полезных бактерий в организме) и пребиотиками (неперевариваемыми компонентами пищи, такими как олигосахариды, которые стимулируют активность целевых избранных групп ЖК микрофлоры) или синбиотиками (синергическими комбинациями пробиотиков и пребиотиков) для возвращения микробиома данных пациентов в здоровое состояние.
Во избежание риска введения неидентифицированных, потенциально вредных микробов некоторые больницы начинают создавать системы собственного хранения. Фекалии пациента можно сохранить для использования в будущем в качестве антидота против возможной инфекции госпитальных «супербактерий». Использование собственных фекалий пациента для трансплантации значительно уменьшает риск введения вредных микробов и позволяет избежать длительного и дорогостоящего скрининга фекалий неродственных доноров для обнаружения инфекционных заболеваний. Однако, к сожалению, «экосистема» определенных людей, по-видимому, делает данных людей более восприимчивыми к заболеваниям, чем других. Следовательно, возможный недостаток, связанный с повторным введением собственных фекалий пациента, заключается в том, что данный подход может обеспечить только временные преимущества и не излечить пациентов от вредных микробов, таких как С.difficile. Со временем исследование микробиома может привести к идентификации «базовых» или «краеугольных» видов бактерий, которые способствуют определению здоровья человека, а затем к разработке персонализированной «бактериотерапии», состоящей из полностью охарактеризованных полезных бактериальных «коктейлей», на смену данному грубому способу трансплантации «неочищенных» фекалий. Фактически, на сегодняшний день были предложены варианты терапии на основе пробиотиков для широкого множества нарушений, связанных с кишечником, таких как БРК и синдром раздраженного кишечника. С принципиальной точки зрения исследователи и клиницисты в попытке охарактеризовать все виды микробиоты донора, обнаружить диагностические маркеры для прогнозирования предрасположенности к заболеванию и, в конечном итоге, обеспечить «персонализированную» медицинскую помощь, должны быть уверенными, что образцы фекалий, исследование которых проводят, обеспечивают истинное представление или «мгновенную фиксацию» микробиома донора in vivo, а не «уменьшенное» или искусственное представление о микробном сообществе. Следовательно, является необходимым эффективное средство для немедленного определения и стабилизации или мгновенной фиксации микробиома фекалий в момент сбора.
Рак толстой и прямой кишки (РТПК) в Европе и США характеризуется наивысшей степенью смертности среди других вариантов рака. Известно, что РТПК хорошо поддается лечению (>90%) при обнаружении на ранних стадиях, что делает ранний скрининг рака ценным подходом. На протяжении многих лет было разработано множество чувствительных способов исследования для обнаружения рака, таких как ирригоскопия с двойным контрастированием, колоноскопия и гибкая сигмоидоскопия. Однако финансовые затраты, потребность в инфраструктуре и в персонале, сопряженные с данными процедурами, создают громадные препятствия, не говоря уже о неудобствах и инвазивности для пациента. Помимо затрат, низкая пропускная способность затрудняет применение данных способов исследования для проведения общенационального первичного скрининга.
На сегодняшний день другим способом скрининга рака толстой и прямой кишки является анализ кала на скрытую кровь (АКСК). Данный тест позволяет обнаружить присутствие гемоглобина в образцах фекалий для определения наличия или отсутствия кровотечения в ЖК тракте в качестве косвенного прогностического фактора РТПК. Хотя данный тест является недорогим, его чувствительность и прогностическая ценность положительного результата является очень низкой, а частота ложноположительных результатов - весьма высокой. Вследствие этого ощущается огромная потребность в чувствительном, надежном, экономически эффективном, масштабируемом способе диагностики заболевания у подверженных риску и/или симптомных индивидуумов, а также в способе проведения повседневного диагностического скрининга бессимптомной популяции. В идеале индивидуум будет в обычном порядке собирать и стабилизировать часть своих фекалий в конфиденциальной обстановке собственного дома, а затем направит данный образец в исследовательскую лабораторию для проведения скрининга с целью обнаружения РТПК и других заболеваний.
Было признано, что непосредственное обнаружение и исследование опухолевых клеток, обнаруженных в просвете толстой кишки и выделенных из фекалий, является в большей степени положительным прогностическим фактором рака толстой и прямой кишки, чем скрытая кровь. Однако «целевая» или мутантная ДНК человека, свидетельствующая о раке или других заболеваниях, обычно встречается в биологическом образце с низкой частотой (например, 1% от суммарной ДНК человека в случае РТПК), часто при наличии высокого фона ДНК дикого типа (например, бактериальной ДНК и ДНК человека от нормальных клеток толстой кишки), и подвергается воздействию эндогенных ДНКаз человека (например, дезоксирибонуклеазы I) и/или бактериальных нуклеаз (например, микрококковой нуклеазы). В данном сложном образце то незначительное количество «целевой» ДНК человека, которая присутствует в образце фекалий, может быстро разложиться под действием нуклеазы и условий окружающей среды еще до того, как образец достигнет лаборатории, что отрицательно сказывается на клинической чувствительности диагностических тестов. Помимо обилия нуклеаз, анаэробные бактерии, составляющие более 99% бактерий в кишечнике, контактируют с воздухом сразу после того, как фекалии выделяются из пищеварительного тракта. Воздух, в особенности кислород, является токсичной окружающей средой для анаэробных бактерий, которая вызывает гибель 50% анаэробов в течение 4-5 минут и 95-97% - всего через 20 минут (Brusa et al., 1989). И вновь получение репрезентативного изображения или «мгновенная фиксация» всего микробиома и ДНК человека в фекалиях представляет собой проблему, с учетом того, что большинство образцов фекалий собирают дома, а не в лаборатории или учреждении здравоохранения.
Необходимо стабилизировать суммарную нуклеиновую кислоту в биологических образцах так, чтобы нуклеиновая кислота не деградировала в процессе манипуляций с образцом, транспортирования и хранения. Стандартная практика для минимизации деградации нуклеиновой кислоты в биологических образцах заключается в транспортировании целых образцов или их частей на сухом льду (-78°С) в централизованные исследовательские лаборатории, в которых образцы оттаивают и немедленно обрабатывают либо хранят в замороженном состоянии (при температуре от -80°С до -20°С). Затраты, логистика и инфраструктура, необходимые для обеспечения немедленной заморозки собранных образцов, хранения образцов в замороженном состоянии в процессе транспортирования в исследовательскую лабораторию и хранения образцов в оптимальных условиях перед анализом, вызывают значительные проблемы и риски, в особенности при применении для крупномасштабного и популяционного скрининга. Еще более проблематичным может оказаться обеспечение «репрезентативных» образцов для децентрализованного анализа образца с сохранением максимальной целостности последнего. Крайне желательно разработать более надежный и стандартизованный способ манипуляции с образцом, а также композицию, которая позволяет получить и сохранить истинное представление о профиле нуклеиновой кислоты каждого образца.
Исследование взаимосвязи между микробиомом и его хозяином-человеком в норме и при патологии основано на обнаружении и мониторинге микробных сообществ в течение периода времени. Недавние открытия продемонстрировали возможность применения таких микробных профилей в качестве биомаркеров, обладающих прогностической и диагностической ценностью. В публикуемой литературе становится очевидным, что из-за динамичного характера кишечного микробиома повторяющийся отбор проб в больших популяциях в течение времени является важным для разработки таких биомаркеров. Данные исследования, известные как Полномикробиомный поиск ассоциаций (Microbiome-Wide Association Studies, MWAS), осложняются низкой степенью соблюдения донором предписанных процедур, ненадежностью самосбора биологических образцов, высокой стоимостью и сложными процедурами доставки и манипуляций.
Используемые на сегодняшний день способы сбора образцов фекалий и анализа микробиоты включают транспортирование образцов в условиях, в которых образцы потенциально могут подвергаться воздействию температур, несовместимых со стабилизацией микробиома. Неспособность надлежащим образом стабилизировать микробном в процессе сбора, транспортирования, обработки и анализа образца вызывает риск затруднения понимания биологического и клинического значения профиля микробиома. Следовательно, необходимы надлежащие преданалитические процедуры для обеспечения наилучшего представления профиля микробиома in vivo.
Существует потребность в композициях и способах для стабилизации нуклеиновых кислот, в частности, ДНК человека и микроорганизмов, в сложных биологических образцах, таких как фекалии, в процессе транспортирования и хранения при температурах окружающей среды.
Приведенная дополнительная информация предоставлена с целью обнародования данных, которые, по мнению заявителя, возможно, имеют отношение к настоящему изобретению. Никакое признание не предполагает обязательно, что любые из предшествующих данных представляют собой предшествующий уровень техники по отношению к настоящему изобретению, и не должно быть истолковано таким образом.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является обеспечение композиции, способа и набора для стабилизации нуклеиновой кислоты, содержащейся в биологическом образце, при температуре окружающей среды.
Согласно одному аспекту настоящего изобретения предложен способ стабилизации нуклеиновой кислоты, содержащейся в биологическом образце, при температуре окружающей среды, причем указанный способ включает следующие этапы: а) получение биологического образца; b) приведение биологического образца в контакт с водной композицией, содержащей хелатирующее средство, причем указанное хелатирующее средство присутствует в концентрации по меньшей мере приблизительно 150 мМ и причем указанная композиция характеризуется значением рН по меньшей мере приблизительно 9,5, для образования смеси; с) гомогенизацию смеси согласно (b) с образованием гомогенной смеси; и d) хранение гомогенной смеси при температуре окружающей среды.
Согласно другому аспекту настоящего изобретения предложена водная композиция для стабилизации нуклеиновой кислоты, содержащейся в биологическом образце, при температуре окружающей среды, причем указанная композиция содержит хелатирующее средство, причем указанное хелатирующее средство присутствует в концентрации по меньшей мере приблизительно 150 мМ и причем указанная композиция характеризуется значением рН по меньшей мере приблизительно 9,5.
Согласно еще одному аспекту настоящего изобретения предложен набор для стабилизации нуклеиновой кислоты, содержащейся в биологическом образце, при температуре окружающей среды, причем указанный набор содержит: а) контейнер для образца, содержащий перепломбируемое средство укупорки; b) водную композицию, содержащую хелатирующее средство, причем указанное хелатирующее средство присутствует в концентрации по меньшей мере приблизительно 150 мМ, причем указанная композиция характеризуется значением рН по меньшей мере приблизительно 9,5 и причем указанная композиция необязательно содержится в контейнере для образца;
c) средство гомогенизации, которое необязательно содержится в контейнере для образца;
d) средство для переноса биологического образца или части указанного образца в контейнер для образца; и d) инструкции по применению.
Согласно одному варианту реализации настоящего изобретения нуклеиновая кислота представляет собой дезоксирибонуклеиновую кислоту (ДНК).
Согласно другому варианту реализации настоящего изобретения биологический образец выбирают из образца фекалий, образца почвы, образца канализационных вод, образца сточных вод или образца воды. Согласно другому варианту реализации настоящего изобретения биологический образец представляет собой образец фекалий. Согласно другому варианту реализации настоящего изобретения образец фекалий получают от млекопитающего. Согласно еще одному варианту реализации настоящего изобретения млекопитающее представляет собой человека.
Согласно другому варианту реализации настоящего изобретения хелатирующее средство выбирают из 1,2-циклогександиаминтетрауксусной кислоты (CDTA), диэтилентриаминпентауксусной кислоты (DTPА), тетраазациклододекантетрауксусной кислоты (DOTA), тетраазациклотетрадекантетрауксусной кислоты (ТЕТА), дезферриоксамина или хелатирующих аналогов указанных соединений. Согласно другому варианту реализации настоящего изобретения хелатирующее средство представляет собой CDTA.
Согласно другому варианту реализации настоящего изобретения концентрация хелатирующего средства составляет от приблизительно 150 мМ до приблизительно 500 мМ или от приблизительно 250 мМ до приблизительно 350 мМ. Согласно еще одному варианту реализации настоящего изобретения концентрация хелатирующего средства составляет приблизительно 300 мМ.
Согласно еще одному варианту реализации настоящего изобретения композиция характеризуется значением рН от приблизительно 9,5 до приблизительно 11,5 или от приблизительно 10,5 до приблизительно 11,5. Согласно другому варианту реализации настоящего изобретения композиция характеризуется значением рН приблизительно 11.
Согласно еще одному варианту реализации настоящего изобретения композиция дополнительно содержит по меньшей мере одно буферное средство, способное поддерживать буферные свойства в диапазоне рН от 9,5 до 11,5. Согласно другому варианту реализации настоящего изобретения буферное средство представляет собой бета-аланин.
Согласно еще одному варианту реализации настоящего изобретения композиция дополнительно содержит водорастворимый органический растворитель, такой как C1-С6 алканол. Согласно другому варианту реализации настоящего изобретения водорастворимый органический растворитель представляет собой этанол. Согласно еще одному варианту реализации настоящего изобретения этанол присутствует в композиции в концентрации менее приблизительно 30% по объему. Согласно еще одному варианту реализации настоящего изобретения этанол присутствует в композиции в концентрации менее приблизительно 24% по объему.
Согласно другому варианту реализации настоящего изобретения композиция дополнительно содержит детергент, такой как додецилсульфат натрия. Согласно еще одному варианту реализации настоящего изобретения композиция дополнительно содержит противовспенивающее средство, такое как Antifoam А. Согласно еще одному варианту реализации настоящего изобретения композиция дополнительно содержит противомикробное средство, такое как Триклозан или Проклин.
Согласно еще одному варианту реализации настоящего изобретения нуклеиновая кислота представляет собой микробную ДНК.
Согласно еще одному варианту реализации настоящего изобретения нуклеиновая кислота представляет собой микробную ДНК, и указанный способ стабилизирует профиль микробиома биологического образца. Согласно еще одному варианту реализации настоящего изобретения способ делает профиль микробиома биологического образца стабильным в течение по меньшей мере 7 дней, по меньшей мере 14 дней, по меньшей мере 30 дней или по меньшей мере 60 дней при комнатной температуре; по меньшей мере 7 дней или по меньшей мере 14 дней при температуре от приблизительно 37°С до приблизительно 50°С; и/или по меньшей мере 30 дней при температуре -20°С.
Согласно еще одному варианту реализации настоящего изобретения нуклеиновая кислота представляет собой микробную ДНК, и композиция/набор предназначены для стабилизации профиля микробиома биологического образца.
Согласно еще одному варианту реализации настоящего изобретения нуклеиновая кислота представляет собой ДНК человека. Согласно еще одному варианту реализации настоящего изобретения способ делает ДНК человека стабильной в течение: по меньшей мере 7 дней, по меньшей мере 14 дней, по меньшей мере 30 дней или по меньшей мере 60 дней при комнатной температуре; по меньшей мере 7 дней или по меньшей мере 14 дней при температуре от приблизительно 37°С до приблизительно 50°С; и/или по меньшей мере 30 дней при температуре -20°С.
Согласно еще одному варианту реализации настоящего изобретения способ включает гомогенизацию смеси биологического образца и водной композиции с применением средства гомогенизации.
Согласно другому варианту реализации настоящего изобретения средство гомогенизации согласно вышеописанному способу и набору представляет собой по меньшей мере один шарик для перемешивания. Согласно еще одному варианту реализации настоящего изобретения по меньшей мере один шарик для перемешивания представляет собой шарик для перемешивания из нержавеющей стали или шарик для перемешивания из карбида вольфрама. Согласно еще одному варианту реализации настоящего изобретения по меньшей мере один шарик для перемешивания представляет собой шарик для перемешивания из нержавеющей стали, диаметр которого составляет приблизительно 5,6-11,1 мм и плотность которого составляет по меньшей мере приблизительно 7,6 г/см3. Согласно еще одному варианту реализации настоящего изобретения диаметр шарика для перемешивания из нержавеющей стали составляет приблизительно 7,1-8,7 мм, и контейнер для образца представляет собой круглодонную пробирку, внутренний диаметр которой составляет приблизительно 12,9 мм.
Согласно другому варианту реализации настоящего изобретения способ включает образование смеси биологического образца и водной композиции в контейнере для образца, содержащем по меньшей мере один шарик для перемешивания, запечатывание контейнера для образца и гомогенизацию смеси посредством встряхивания смеси в присутствии по меньшей мере одного шарика для перемешивания. Согласно еще одному варианту реализации настоящего изобретения встряхивание осуществляют рукой.
Согласно другим вариантам реализации настоящего изобретения стабилизация нуклеиновой кислоты включает сохранение относительного изобилия нуклеиновой кислоты, содержащейся в биологическом образце, в процессе хранения при температуре окружающей среды.
Согласно еще одному варианту реализации настоящего изобретения предложен способ стабилизации ДНК, содержащейся в образце фекалий, при температуре окружающей среды, причем указанный способ включает следующие этапы: а) получение образца фекалий от млекопитающего; b) приведение образца фекалий в контакт с водной композицией, которая характеризуется значением рН от приблизительно 10,5 до приблизительно 11,5, причем указанная композиция содержит, по существу состоит или состоит из: CDTA в количестве от приблизительно 250 мМ до приблизительно 350 мМ; β-аланина в количестве от приблизительно 30 мМ до приблизительно 70 мМ; этанола в количестве от приблизительно 21,5% до приблизительно 23,5% по объему; додецилсульфата натрия в количестве от приблизительно 0 до приблизительно 1% (масс./об.); и Antifoam А в количестве от приблизительно 0 до приблизительно 0,2% (об./об.); с) гомогенизацию смеси согласно (b) с образованием гомогенной смеси; и d) хранение гомогенной смеси при температуре окружающей среды. Согласно еще одному варианту реализации настоящего изобретения водная композиция характеризуется значением рН приблизительно 11 и содержит, по существу состоит или состоит из: CDTA в количестве приблизительно 300 мМ; β-аланина в количестве приблизительно 50 мМ; этанола в количестве приблизительно 23,5% по объему; додецилсульфата натрия в количестве приблизительно 0,5% (масс./об.); и Antifoam А в количестве приблизительно 0,1% (об./об.). Согласно еще одному варианту реализации настоящего изобретения способ включает образование смеси образца фекалий и водной композиции в круглодонной пробирке, внутренний диаметр которой составляет приблизительно 12,9 мм и которая содержит по меньшей мере один шарик для перемешивания из нержавеющей стали, диаметр которого составляет приблизительно 5,6 - 11,1 мм и плотность которого составляет по меньшей мере приблизительно 7,6 г/см3, запечатывание круглодонной пробирки и гомогенизацию смеси посредством встряхивания смеси рукой в присутствии по меньшей мере одного шарика для перемешивания из нержавеющей стали. Согласно другому варианту реализации настоящего изобретения ДНК представляет собой микробную ДНК, и указанный способ стабилизирует профиль микробиома образца фекалий.
Согласно еще одному варианту реализации настоящего изобретения предложена водная композиция для стабилизации ДНК, содержащейся в образце фекалий, при температуре окружающей среды, причем указанный образец фекалий получают от млекопитающего, причем указанная композиция характеризуется значением рН от приблизительно 10,5 до приблизительно 11,5 и содержит, по существу состоит или состоит из: CDTA в количестве от приблизительно 250 мМ до приблизительно 350 мМ; β-аланина в количестве от приблизительно 30 мМ до приблизительно 70 мМ; этанола в количестве от приблизительно 21,5% до приблизительно 23,5% по объему; додецилсульфата натрия в количестве от приблизительно 0 до приблизительно 1% (масс./об.); и Antifoam А в количестве от приблизительно 0 до приблизительно 0,2% (об./об.). Согласно еще одному варианту реализации настоящего изобретения водная композиция характеризуется значением рН приблизительно 11 и содержит, по существу состоит или состоит из: CDTA в количестве приблизительно 300 мМ; β-аланина в количестве приблизительно 50 мМ; этанола в количестве приблизительно 23,5% по объему; додецилсульфата натрия в количестве приблизительно 0,5% (масс./об.); и Antifoam А в количестве приблизительно 0,1% (об./об.). Согласно другому варианту реализации настоящего изобретения ДНК представляет собой микробную ДНК, и указанная композиция предназначена для стабилизации профиля микробиома образца фекалий.
Согласно еще одному варианту реализации настоящего изобретения предложен набор для стабилизации нуклеиновой кислоты, содержащейся в биологическом образце, при температуре окружающей среды, причем указанный набор содержит: а) контейнер для образца, содержащий перепломбируемое средство укупорки; b) водную композицию, значение рН которой составляет от приблизительно 10,5 до приблизительно 11,5, и которая содержит, по существу состоит или состоит из: CDTA в количестве от приблизительно 250 мМ до приблизительно 350 мМ; β-аланина в количестве от приблизительно 30 мМ до приблизительно 70 мМ; этанола в количестве от приблизительно 21,5% до приблизительно 23,5% по объему; додецилсульфата натрия в количестве от приблизительно 0 до приблизительно 1% (масс./об.); и Antifoam А в количестве от приблизительно 0 до приблизительно 0,2% (об./об.), причем указанная композиция необязательно содержится в контейнере для образца; с) средство гомогенизации, которое необязательно содержится в контейнере для образца; d) средство для переноса биологического образца или части указанного образца в контейнер для образца; и d) инструкции по применению. Согласно другому варианту реализации настоящего изобретения водная композиция характеризуется значением рН приблизительно 11 и содержит, по существу состоит или состоит из: CDTA в количестве приблизительно 300 мМ; β-аланина в количестве приблизительно 50 мМ; этанола в количестве приблизительно 23,5% по объему; додецилсульфата натрия в количестве приблизительно 0,5% (масс./об.); и Antifoam А в количестве приблизительно 0,1% (об./об.). Согласно еще одному варианту реализации настоящего изобретения нуклеиновая кислота представляет собой микробную ДНК, и набор предназначен для стабилизации профиля микробиома биологического образца. Согласно еще одному варианту реализации настоящего изобретения средство гомогенизации представляет собой по меньшей мере один шарик для перемешивания из нержавеющей стали, диаметр которого составляет приблизительно 5,6 - 11,1 мм и плотность которого составляет по меньшей мере приблизительно 7,6 г/см3, и контейнер для образца представляет собой круглодонную пробирку, внутренний диаметр которой составляет приблизительно 12,9 мм.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Для лучшего понимания настоящего изобретения, а также других аспектов и дополнительных свойств указанного изобретения, приводится ссылка на следующее описание, которое следует использовать в сочетании с прилагаемыми чертежами, где:
На фигуре 1 графически представлены различия профиля микробиома образцов фекалий от 2 доноров (анализ методом ПЦР-ДГГЭ, полимеразной цепной реакции - денатурирующего градиентного гель-электрофореза);
На фигуре 2 представлен агарозный гель, демонстрирующий качество высокомолекулярной ДНК в образцах фекалий в момент времени Т=0 и через 14 дней при комнатной температуре в 1) композициях, содержащих различные концентрации CDTA (150-500 мМ), 2) композициях, содержащих различные концентрации EDTA (150-500 мМ), и 3) фекалиях, которые хранили без стабилизирующего раствора (нестабилизированные);
На фигуре 3 графически представлена зависимость стабильности профиля микробиома от гомогенизации образца и рН композиции согласно настоящему изобретению;
На фигуре 4 представлены результаты анализа методом ДГГЭ образцов фекалий, которые хранили в различных композициях в течение 14 дней при комнатной температуре;
На фигуре 5 представлены результаты анализа методом ДГГЭ образцов фекалий, которые хранили в различных композициях в течение 4 дней при комнатной температуре;
На фигуре 6 представлен агарозный гель, демонстрирующий качество высокомолекулярной ДНК в образцах фекалий, которые хранили в композиции при различных значениях рН в течение 9 дней при комнатной температуре;
На фигуре 7 представлен агарозный гель, демонстрирующий результаты, полученные при перемешивании образцов фекалий с композицией согласно настоящему изобретению с применением (А) нескольких стеклянных бусин и (В) шарика из нержавеющей стали;
На фигуре 8 представлены агарозные гели, демонстрирующие качество ДНК при хранении в композиции согласно настоящему изобретению при комнатной температуре в (А) день 0, (В) день 6, (С) день 7, (D) день 14, (Е) через одни месяц и (F) через 2 месяца;
На фигуре 9 представлены гели с результатами анализа методом ДГГЭ аликвот образца фекалий в трех повторах, полученных от одного и того же донора, которые хранили в композиции согласно настоящему изобретению;
На фигуре 10 представлен репрезентативный гель с результатами анализа методом ДГГЭ и % подобия (внизу геля) профиля микробиома образцов фекалий, которые хранили в композиции согласно настоящему изобретению в течение (А) 14 дней при комнатной температуре и (В) 7 дней и 2 месяцев при комнатной температуре;
На фигурах ПА и 11 В представлены агарозные гели с результатами анализа образцов фекалий от 2 доноров, которые хранили при температуре 37°С в композициях согласно настоящему изобретению;
На фигурах 12А и 12В представлен результат анализа методом ДГГЭ образцов фекалий от 2 доноров, которые хранили при температуре 37°С в композициях согласно настоящему изобретению;
На фигурах 13А-Е представлены агарозные гели с результатами анализа образцов фекалий от 3 доноров, которые хранили в композиции согласно настоящему изобретению при температуре -20°С, при комнатной температуре и при температуре 50°С;
На фигурах 14А-D представлены результаты анализа методом электрофореза в агарозном геле образцов фекалий от 3 доноров, которые хранили в композициях согласно настоящему изобретению при температуре 50°С и -20°С;
На фигурах 15А-В представлены результаты анализа методом ДГГЭ образцов фекалий от 2 доноров, которые хранили в композициях согласно настоящему изобретению при температуре 50°С в течение 14 дней;
На фигурах 16А-В представлены результаты анализа методом ДГГЭ образцов фекалий от 2 доноров, которые хранили в композиции согласно настоящему изобретению при температуре -20°С в течение 11 дней;
На фигуре 17 представлены результаты анализа в агарозном геле образцов фекалий в композиции согласно настоящему изобретению и образцов фекалий, которые подвергали воздействию 5 циклов замораживания/оттаивания;
На фигуре 18 представлены результаты анализа методом ДГГЭ образцов фекалий в композиции согласно настоящему изобретению и образцов, которые подвергали воздействию 5 циклов замораживания/оттаивания;
На фигуре 19 представлены результаты анализа главных координат (PCoA, principal coordinate analysis), которые демонстрируют, что в образцах, которые хранили в стабилизирующем растворе при различных температурах и в течение различных периодов времени (3 и 14 дней), наблюдается высокий уровень подобия изобилия OTU (operational taxonomic units, операционных таксономических единиц); и
На фигуре 20 представлено пропорциональное изобилие на уровне семейств в образцах, которые хранили со стабилизирующим раствором и без него при различных температурах и в течение различных периодов времени (3 и 14 дней).
На фигуре 21 представлена несхожесть расстояния Брея-Кертиса среди свежих образцов, среди образцов, стабилизированных в 104В рН 11, а также между свежими и стабилизированными в 104В рН 11 образцами. Применение критерия Манна-Уитни продемонстрировало сравнимую несхожесть во всех условиях, статистически значимых различий не наблюдалось.
На фигуре 22 проиллюстрировано, что в стабилизированных в 104В рН 11 образцах сохраняется богатство. Богатство оценивали посредством определения наличия/отсутствия отдельных OTU и проведения сравнения с применением индекса Шеннона. Применение критерия Манна-Уитни не продемонстрировало значительных различий между свежими образцами и образцами в 104В рН 11.
На фигуре 23 проиллюстрировано, что в образцах в 104В рН 11 наблюдалась высокая степень воспроизводимости профилей микробиома. Применение критерия Манна-Уитни в отношении расстояния Брея-Кертиса продемонстрировало сравнимую несхожесть образцов в трех повторах.
На фигуре 24 представлена несхожесть расстояния Брея-Кертиса между нестабилизированными и стабилизированными в 104В рН 11 (14 дней при температуре 23°С) и замороженными (14 дней при температуре -80°С) образцами фекалий по сравнению со свежими образцами. Значимость несхожести оценивали с применением критерия Манна-Уитни (*Р≤0,05).
На фигуре 25 представлена дендрограмма взвешенного Unifrac для % подобия микробиома репрезентативного донора. Для каждого условия проводили экстракции из трех биологических повторностей. Низкий % подобия свежим образцам свидетельствует об изменениях профиля микробиома в течение времени.
На фигуре 26 проиллюстрирована целостность ДНК образцов в 104В рН 11, которые подвергали имитированным условиям транспортирования. Репрезентативные образцы доноров хранили при температуре 23°С в течение 14 дней, 50°С в течение 1 дня, 37°С в течение 3 дней или подвергали воздействию нескольких циклов замораживания-оттаивания. Свежие образцы также хранили при температуре -80°С в течение 14 дней в качестве контроля.
На фигуре 27 проиллюстрирована несхожесть расстояния Брея-Кертиса образцов в 104В рН 11, которые подвергали имитированным условиям транспортирования. Применение критерия Манна-Уитни продемонстрировало отсутствие различия между образцами в 104В рН 11, которые хранили при различных температурах, и образцами, которые хранили при температуре -80°С. Значимая несхожесть наблюдалась в нестабилизированных образцах, которые хранили при температуре 37°С или которые подвергали воздействию условий замораживания-оттаивания (З/О), по сравнению с парными образцами при температуре -80°С (Р≤0,05 и Р≤0,01, соответственно).
На фигуре 28 представлены результаты анализа методом ДГГЭ профиля бактериального сообщества образцов фекалий от 2 доноров, обработанных композицией согласно настоящему изобретению, содержащей различные концентрации CDTA, и композицией, не содержащей CDTA, в течение 5 дней при температуре 40°С.
На фигуре 29 представлены результаты анализа методом ДГТЭ профилей бактериального сообщества образцов фекалий от 2 доноров, обработанных композицией согласно настоящему изобретению «104В рН И» или буфером TEN в течение 21 дня при температуре окружающей среды.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Следует отметить, что роль композиций для стабилизации нуклеиновой кислоты, описанных в настоящей заявке, заключается в стабилизации нуклеиновой кислоты и в «мгновенной фиксации» профилей суммарной ДНК в биологических образцах, таких как образцы фекалий, при температуре окружающей среды в течение длительных периодов времени. Экстракцию и выделение нуклеиновой кислоты, такой как ДНК, проводят на последовательных этапах с помощью коммерчески доступных наборов для экстракции после стабилизации нуклеиновых кислот, содержащихся в образцах фекалий, с применением композиций, описанных в настоящей заявке. Предпочтительно, композиции для стабилизации нуклеиновой кислоты, описанные в настоящей заявке, не содержат хаотропных солей (например, солей гуанидия, таких как тиоцианат гуанидия (GuSCN) или гидрохлорид гуанидия (GuHCl)), мочевины, фиксативов (например, формалина, параформальдегида и т.д.), восстанавливающих средств, поликатионов (таких как полилизин или полиакриламид), фенола или хлороформа. Ферменты, такие как протеазы (например, протеиназа K), лизоцим и т.д., не являются необходимыми для осуществления стабилизации нуклеиновых кислот, содержащихся в образцах фекалий, с применением композиций, описанных в настоящей заявке, и вследствие этого предпочтительно не включены в композиции, описанные в настоящей заявке. Таким образом, композиции и способы стабилизации нуклеиновой кислоты согласно настоящему изобретению позволяют избежать применения дорогостоящих и/или токсичных соединений, для которых часто требуются специальные условия хранения и транспортирования.
Если не указано обратное, все технические и научные термины, используемые в настоящей заявке, имеют те же значения, которые обычно понимаются средним специалистом в области техники, к которой относится настоящее изобретение.
В спецификации и в формуле изобретения формы единственного числа включают упоминания объектов во множественном числе, если из контекста однозначно не следует обратное.
Термин «включая» в настоящей заявке следует понимать как означающий то, что следующий за ним перечень не является исчерпывающим и может включать или может не включать любые другие дополнительные элементы, например, одно или несколько дополнительных свойств, компонентов и/или ингредиентов, при необходимости.
Термин «образец» в настоящей заявке означает любой образец, который потенциально содержит вещество, представляющее интерес, в частности, нуклеиновую кислоту, и необязательно белок или другие биомолекулы, представляющие интерес. Термин «образец» может включать раствор, такой как водный раствор, клетку, ткань, биопсию, порошок или популяцию одного или нескольких из указанных объектов. Образец может представлять собой биологический образец, такой как слюна, мокрота, образец ротового мазка, сыворотка, плазма, кровь, лейкотромбоцитарный слой, глоточные, назальные/назальные-глоточные или синусные мазки или секреты, мазки или соскобы горла, моча, слизь, фекалии/кал/экскременты, ректальные мазки, мазки из ран, химус, рвотная масса, желудочный сок, сок поджелудочной железы, жидкости или твердые вещества желудочно-кишечного (ЖК) тракта, семенная жидкость/сперма, мазки и секреты мочеполового тракта, спинномозговая жидкость, продукты кормления грудью или менструации, яичный желток, амниотическая жидкость, водянистая влага, жидкость стекловидного тела, секрет или мазок шейки матки, вагинальная жидкость/секрет/мазки или соскобы, образцы и аспираты костного мозга, плевральная жидкость и экссудаты, пот, гной, слезы, лимфа, бронхиальный или легочный лаваж или аспираты, перитонеальные экссудаты, культуры клеток и суспензии клеток, соединительная ткань, эпителий, мазки эпителия, слизистая мембрана, мышечная ткань, ткань плаценты, биопсии, экссудаты, ткань органов, нервная ткань, волосы, кожа или ногти, причем образцы вышеуказанного материала могут быть получены, например, от позвоночного, включая млекопитающее. Млекопитающее может представлять собой, например, человека, примата, отличного от человека, крупный рогатый скот (такой как корова, коза или овца), а также собаку, кошку, лошадь и т.д.
Согласно одному варианту реализации настоящего изобретения биологический образец представляет собой образец фекалий, и субъект представляет собой млекопитающее. Согласно другому варианту реализации настоящего изобретения биологический образец представляет собой образец фекалий, и субъект представляет собой человека.
Другие типы биологических образцов включают растения, экстракты растений, водоросли, образцы почвы, канализационные воды, сточные воды, воду, образцы окружающей среды, продукты питания, корм для крупного рогатого скота, корм для рыб, корм для животных, мазки с загрязненных или потенциально инфицированных поверхностей или оборудования (например, поверхностей при переработке мяса), мазки с поверхностей «касания» в больницах, домах сестринского ухода, центрах обслуживания амбулаторных больных, медицинских учреждениях или т.п. Согласно другим вариантам реализации настоящего изобретения биологический образец выбирают из образца почвы, образца канализационных вод, образца сточных вод или образца воды, причем любой из указанных образцов может быть загрязнен фекалиями.
Термин «микроорганизм» или «микроб» в настоящей заявке означает любые микроскопические организмы и споры, включая всех прокариот, а именно, эубактерии и архебактерии, и различные формы эукариот, в том числе простейшие, грибы (например, дрожжи), водоросли и животные, такие как коловратки и планарии. Например, группы бактерий, которые наиболее часто обнаруживают в фекалиях человека с применением секвенирования гена 16S рРНК, включают Firmicutes, Bacteroidetes, Spirochaetes, Fusobacteria, Deltaproteobacteria, Epsilonproteobacteria, Alphaproteobacteria, Betaproteobacteria, Gammaproteobacteria, Euryarchaeota, Eukarya, Desulfothiovibrio, Tm7, Cyanobacteria, Actinobacteria, Verrucomicrobia и Lentisphaerae.
Термин «вирус» или «вирионы» в настоящей заявке означает любой малый инфекционный агент, который реплицируется только внутри живых клеток других организмов. Вирусы могут инфицировать все типы форм жизни, от животных и растений до бактерий и архебактерий, и живут практически в любой экосистеме. На сегодняшний день известно 21 семейство вирусов, вызывающих заболевания людей: Adenoviridae, Herpesviridae, Papillomaviridae, Polyomaviridae, Poxviridae, Hepadnaviridae, Parvoviridae, Astroviridae, Caliciviridae, Picomaviridae, Coronaviridae, Flaviviridae, Togaviridae, Hepeviridae, Retroviridae, Orthomyxoviridae, Arenaviridae, Bunyaviridae, Filoviridae, Paramyxoviridae, Rhabdoviridae, Reoviridae (и гепатит D, в настоящее время не определенный). Генетический материал в вирусе может представлять собой дезоксирибонуклеиновую кислоту (ДНК) или рибонуклеиновую кислоту (РНК).
Нуклеиновая кислота, которую стабилизируют с применением композиций, описанных в настоящей заявке, может представлять собой ДНК или РНК, включая мРНК или вирусную РНК. Согласно одному варианту реализации настоящего изобретения нуклеиновая кислота представляет собой ДНК. Согласно другому варианту реализации настоящего изобретения ДНК получена от человека, вируса и микроорганизма. Согласно еще одному варианту реализации настоящего изобретения нуклеиновая кислота, которую стабилизируют с применением композиций, описанных в настоящей заявке, содержит ДНК человека и микробную ДНК.
Термин «температура окружающей среды» в настоящей заявке означает диапазон температур, с которым может столкнуться смесь биологического образца (например, образца фекалий) и композиций, стабилизирующих нуклеиновую кислоту, описанных в настоящей заявке, с момента сбора, в процессе транспортирования (которое может включать относительно экстремальные температуры, хотя обычно в течение более коротких периодов времени (например, <5 дней)), а также в процессе длительного хранения перед проведением анализа. Согласно одному варианту реализации настоящего изобретения температура представляет собой температуру окружающей среды, варьирующую от приблизительно -20°С до приблизительно 60°С. Согласно другому варианту реализации настоящего изобретения температура окружающей среды представляет собой комнатную температуру и варьирует от приблизительно 15°С до приблизительно 30°С.
Этап приведения образца фекалий в контакт с водными композициями, описанными в настоящей заявке, для образования смеси следует реализовать как можно скорее после выделения фекалий, и гомогенизацию смеси с образованием гомогенной смеси следует осуществить как можно скорее, предпочтительно, немедленно, для стабилизации нуклеиновых кислот, содержащихся в образце фекалий.
Как правило, химической стабилизации ДНК и РНК в биологическом образце, таком как слюна, кровь, мокрота, фекалии/кал и моча, достигают посредством применения буферов, поддерживающих соответствующее значение рН, а также посредством применения хелатирующих средств для предотвращения феномена окислительно-восстановительного цикла металла или связывания ионов металла с фосфатным скелетом нуклеиновых кислот. Термин «хелатор» или «хелатирующее средство» в настоящей заявке означает химическое соединение, которое образует растворимый стабильный комплекс с ионами определенного металла (например, Са2+ и Mg2+) и вызывает секвестрацию ионов так, что ионы становятся неспособными обычным путем реагировать с другими компонентами, такими как дезоксирибонуклеазы (ДНКазы) или эндонуклеазы (например, рестрикционные эндонуклеазы типа I, II и III) и экзонуклеазы (например, 3'-5' экзонуклеазы), - ферменты, присутствующие в избытке в ЖК тракте. Основным источником ДНКаз в ЖК тракте является секрет поджелудочной железы, а также резидентные микроорганизмы. В композиции согласно настоящему изобретению хелатирующее средство (средства) участвуют в ингибировании ДНКазы и роста микроорганизмов в биологических образцах. Хелатор может представлять собой, например, этиленгликоль тетрауксусной кислоты (EGTA), (2-гидроксиэтил)этилендиаминтриуксусную кислоту (HEDTA), диэтилентриаминпентауксусную кислоту (DTPА), нитрилотриуксусную кислоту (NTA), этилендиаминтриуксусную кислоту (EDTA), 1,2-циклогександиаминтетрауксусную кислоту (CDTA), N,N-бис(карбоксиметил)глицин, триэтилентетраамин (ТЕТА), тетраазациклододекантетрауксусную кислоту (DOTA), дезферриоксамин, безводный цитрат, цитрат натрия, цитрат кальция, цитрат аммония, бицитрат аммония, лимонную кислоту, цитрат диаммония, цитрат аммония железа и цитрат лития. Данные хелатирующие средства можно использовать по отдельности или в комбинации из двух или более средств. Согласно предпочтительному варианту реализации настоящего изобретения желаемыми являются более сильные хелаторы, чем EDTA (т.е. хелаторы с большей константой диссоциации, чем у EDTA, при связывании с металлом), которые используют в отдельности или в комбинации, которая содержит, не ограничиваясь указанными, CDTA, DTP A, DOTA, ТЕТА и дезферриоксамин или хелатирующие аналоги указанных соединений, в количестве от приблизительно 150 мМ до приблизительно 600 мМ, предпочтительно, в количестве от приблизительно 150 мМ до приблизительно 500 мМ, еще более предпочтительно, в количестве от приблизительно 250 мМ до приблизительно 350 мМ, и наиболее предпочтительно, в количестве приблизительно 300 мМ. Наиболее предпочтительно, хелатирующее средство в композиции согласно настоящему изобретению представляет собой CDTA.
EDTA представляет собой химическое вещество, широко используемое в промышленности, лабораториях, косметических средствах, медицине и в некоторых продуктах питания. Применение данного вещества основано на его способности «хелатировать» ионы металлов, в частности, бивалентных металлов и металлов с большей валентностью. CDTA менее часто используется в данных областях, но обладает такой же способностью, как EDTA, хелатировать ионы металлов. Важно отметить, что аффинность обоих хелаторов в отношении различных ионов металлов значительно варьирует. К1, показатель аффинности, выраженный в логарифмической шкале, представлен в таблице 1 (ниже). Первые 5 перечисленных хелаторов содержат различное количество и различные конфигурации карбоксилатных (R-COO-) групп, присоединенных к группам азота. ОРТ добавлен в таблицу 1 для сравнения в качестве хелатора на основе исключительно групп азота.
Сравнение CDTA и EDTA в таблице 1 демонстрирует, что данные средства существенно отличаются. Разницы в значениях Ki составляют 2,3 (Mg2+); 2,6 (Са2+); 2,4 (Мn2+); приблизительно 3 (Fe3+); 3,6 (Со2+); 0,8 (Сu2+); 2,9 (Zn2+). Это означает, что CDTA связывается с большинством металлов в 200-4000 раз сильнее, чем EDTA.


Следствием данной более сильной способности CDTA образовывать комплексы с металлами является то, что концентрация любого свободного иона металла будет ниже в присутствии эквивалентных концентраций CDTA или EDTA. Более важно, однако, что количество иона металла, который может образовать комплексы с биомолекулами, такими как нуклеиновые кислоты или белки, будет значительно ниже. Нуклеиновые кислоты в растворе, как известно, связывают ионы металлов, и удаление таких металлов, вероятно, улучшит химическую стабильность нуклеиновых кислот. Данный процесс может быть в особенности важным для переходных металлов, таких как Mn, Fe, Со и Сn, которые могут существовать в различных окислительных состояниях в результате присоединения или передачи электронов соединениям, таким как бимолекулярный кислород, супероксиданион и перекись водорода. Наконец, более сильная способность CDTA образовывать комплексы с металлами является весьма полезной в композициях, разработанных для подавления деградации нуклеиновой кислоты в биологических образцах, таких как фекалии, которые, как известно, в норме содержат большие количества ДНКазы, для стабилизации активной конформации которых требуются Са2+ и Mg2+.

Существуют и другие отличия между CDTA и EDTA, практические последствия которых наблюдаются в лаборатории или исследовательских учреждениях. Возможно, в связи с более низкими k1 и k2 значениями рKa EDTA (см. таблицу 2 выше) значительно сложнее получить динатриевую форму при рН 7,0 (из кислотной формы). Можно приготовить более концентрированные растворы CDTA, чем EDTA. Наконец, динатриевая форма CDTA является хорошо растворимой в этаноле по сравнению с ограниченной растворимостью динатриевой формы EDTA. Данные отличия делают CDTA наилучшим хелатором с точки зрения производства.
Как правило, рН композиции согласно настоящему изобретению можно поддерживать в желаемом щелочном диапазоне с применением одного или нескольких подходящих буферов; причем композицию забуферивают для поддержания рН биологического образца на подходящем значении, и указанная композиция стабилизирует указанную нуклеиновую кислоту при температуре окружающей среды. Согласно одному варианту реализации настоящего изобретения композиция содержит одно, два или более буферных средств (приведены неограничивающие примеры, см. таблицу 3) со значениями рKа, логарифмическими константами диссоциации кислоты, которые при температуре 25°С варьируют от 8,0 до 12,5, для поддержания рН в пределах предпочтительного диапазона от приблизительно 9,5 до приблизительно 11,5. Константа диссоциации кислоты, Kа, представляет собой количественный показатель силы кислоты в растворе. Чем больше значение Kа, тем больше диссоциация молекулы в растворе и, следовательно, тем сильнее кислота. В связи со многими порядками величины, которые охватывают значения Kа, на практике более широко используют логарифмический показатель константы диссоциации кислоты, рKа. Чем больше значение рKа, тем меньше степень диссоциации при любом данном рН, т.е. тем слабее кислота.
В живых организмах кислотно-основный гомеостаз и ферментативная кинетика зависят от значения рKа многих кислот и оснований, присутствующих в клетке и в организме. В химии знание значений рKа необходимо для приготовления буферных растворов, а также является предпосылкой для количественного понимания взаимодействия кислот или оснований и ионов металлов для образования комплексов. Специалист в данной области техники понимает, что данное соединение/буфер может забуферивать рН раствора, только если его концентрация является достаточной и если значение рН раствора близко (в пределах приблизительно одной единицы рН) к рKа раствора. Согласно одному варианту реализации настоящего изобретения рН композиции согласно настоящему изобретению находится в диапазоне от приблизительно 9,5 до приблизительно 11,5. Согласно предпочтительному варианту реализации настоящего изобретения рН композиции находится в диапазоне от приблизительно 10,5 до приблизительно 11,5, и предпочтительно рН составляет приблизительно 11. Количество буферного средства или средств может составлять, например, от приблизительно 1 мМ до приблизительно 1 М.
Согласно определенным вариантам реализации настоящего изобретения композиция содержит бета-аланин в качестве доминирующего буферного средства для поддержания рН в пределах желаемого диапазона от приблизительно 9,5 до приблизительно 11,5. Для поддержания рН приблизительно 11 можно выбрать буфер из таблицы 3 с рKа в диапазоне 10-12. Следует отметить, что карбоксилатные хелатирующие средства, такие как CDTA и EDTA, могут также способствовать буферной способности в данном диапазоне. Однако значения рKа (k4) CDTA и EDTA (таблица 2) значительно отличаются. Меньшее значение рKа (k4) EDTA (таблица 2) делает данное соединение потенциально пригодным для способствования поддержанию рН композиции согласно настоящему изобретению на нижней границе желаемого диапазона рН. Однако большее значение рKа (k4) CDTA делает данное соединение более подходящим для усиления буферной способности бета-аланина (или других буферов, перечисленных в таблице 3) на верхней границе желаемого диапазона (т.е. рН 11).


β-аланин представляет собой в особенности подходящий буфер для композиций согласно настоящему изобретению. Согласно одному варианту реализации настоящего изобретения рН композиции составляет от приблизительно 10,5 до приблизительно 11,5, и β-аланин присутствует в количестве от приблизительно 10 мМ до приблизительно 100 мМ или от приблизительно 30 мМ до приблизительно 70 мМ и, наиболее предпочтительно, в количестве приблизительно 50 мМ.
Термин «водорастворимый» или «смешиваемый с водой органический растворитель» в настоящей заявке означает любое вещество или соединение, содержащее углерод, обычно жидкость, которая растворяет растворенное вещество, химически отличную жидкость, твердое вещество или газ. Водорастворимый органический растворитель может представлять собой, например, один или несколько короткоцепочечных (например, C1-С6) алканолов, которые могут являться неразветвленными или разветвленными, таких как метанол, этанол, пропанол, изопропанол, бутанол, н-бутанол, пентанол, гексанол, или любую комбинацию указанных веществ. Согласно одному варианту реализации композиции согласно настоящему изобретению предпочтительный спирт представляет собой этанол. Согласно другому варианту реализации настоящего изобретения водорастворимый органический растворитель (например, этанол) присутствует в композиции в концентрации менее приблизительно 30% по объему, предпочтительно, менее приблизительно 24% по объему, например, от приблизительно 21,5% до приблизительно 23,5% по объему, наиболее предпочтительно, приблизительно 23,5% по объему. Согласно другим вариантам реализации настоящего изобретения смешиваемый с водой органический растворитель может отсутствовать.
Как правило, в данной области техники известно, что более 30% этанола необходимо для денатурации большинства белков. Свыше 60% этанола или 50% изопропанола необходимо для преципитации ДНК из раствора. Абсолютный этанол или метанол обычно используют в качестве закрепителя в гистологии, патологической анатомии и клеточной биологии для завершения биохимических реакций. Некоторые белки можно преципитировать добавлением смешиваемых с водой органических растворителей, таких как этанол и ацетон, в диапазоне 20 - 50% (об./об.). Этанол вызывает дегидрацию белков или уменьшение активности воды, следствием чего является электростатическое притяжение между белками, агрегация и инсолюбилизация. Не опираясь на какую-либо теорию, авторы настоящего изобретения считают, что относительно небольшой процент смешиваемых с водой органических растворителей в композиции согласно настоящему изобретению практически не обладает свойствами закрепителя, но предпочтительно облегчает перемешивание и диспергирование биологического образца (например, фекалий) и улучшает растворимость других химических соединений, которые могут быть добавлены в композицию согласно настоящему изобретению. Кроме того, для перевозки/транспортирования легковоспламеняющихся жидкостей желательно, чтобы содержание органических растворителей, таких как этанол, в растворе составляло менее 24% по объему для освобождения от выполнения нормативных требований к перевозке опасных грузов (Transport of Dangerous Goods, TDG) (номер Организации Объединенных Наций (ООН) 1170); в противном случае раствор, содержащий >24% этанола, относят к классу 3 (легковоспламеняющиеся жидкости), и для данного раствора обязательной является специальная упаковка, при этом сложность и стоимость транспортирования увеличивается.
Термин «детергент» или «поверхностно-активное вещество» в настоящей заявке означает любое органическое соединение, которое является амфифильным, может нарушить нековалентные связи в белках, денатурируя последние и вызывая утрату молекулами нативной вторичной, третичной и/или четвертичной структуры. Подходящий детергент может представлять собой, например, анионный детергент (такой как, например, додецилсульфат натрия (SDS), додецилсульфат лития, лаурилсульфат натрия (SLS), лаурилсульфат аммония), катионный детергент (четвертичные соли аммония, такие как, например, бромид цетримония/бромид цетилтриметиламмония/бромид гексадецил-триметил-аммония или СТАВ, хлорид цетилтриметиламмония (СТАС), хлорид цетилпиридина (СРС), хлорид бензалкония (ВАС)), цвиттерионное поверхностно-активное вещество (например, бетаины, 3-[(3-холамидопропил)диметиламмонио]-1-пропансульфонат (CHAPS), лецитин) или неионный детергент (такой как, например, Tween, Triton X или Brij). СТАВ, однако, менее идеален при работе с ДНК. Детергенты могут ингибировать действие ДНКаз, разрушая сложную структуру данных ферментов, облегчать диспергирование биологического образца в композиции согласно настоящему изобретению и способствовать солюбилизации множества химических веществ. Согласно определенным вариантам реализации композиции согласно настоящему изобретению детергент представляет собой SDS. Согласно другим вариантам реализации настоящего изобретения детергент (например, SDS) может присутствовать в водной композиции в количестве от приблизительно 0-4% (масс./об.), предпочтительно, приблизительно 0-1% (масс./об.), наиболее предпочтительно, приблизительно 0,5% (масс./об.).
Термин «противовспенивающее средство» или «антивспениватель» в настоящей заявке означает химическую добавку, которая уменьшает или препятствует образованию пены. Авторы настоящего изобретения наблюдали образование пены при энергичном встряхивании, необходимом для быстрого и полного диспергирования некоторых биологических образцов, в частности, фекалий, в пробирке, содержащей определенные варианты реализации композиции согласно настоящему изобретению, содержащей детергент. Указанная пена препятствовала и в некоторых образцах предотвращала полное перемешивание со средством гомогенизации и без такового. Противовспенивающие средства, такие как Antifoam A Concentrate (Sigma-Aldrich; кат. №А-5633), активный силиконовый полимер, значительно уменьшали образование пены в ходе указанного перемешивания биологического образца и композиции согласно настоящему изобретению. Таким образом, противовспенивающее средство следует предпочтительно включать в композиции, содержащие детергент, с целью минимизации образования пены. Другие примеры подходящих противовспенивающих средств, которые можно использовать по отдельности или в комбинации из двух или более средств, включают нерастворимые масла, полидиметилсилоксаны и другие силиконы, определенные спирты, стеараты и гликоли. Согласно другим вариантам реализации настоящего изобретения противовспенивающее средство (например, Antifoam А) может присутствовать в водной композиции в количестве от приблизительно 0-1% (об./об.), предпочтительно, приблизительно 0-0,2% (об./об.).
Термин «противомикробное средство» в настоящей заявке означает вещество или группу веществ, которые уменьшают скорость роста организма по сравнению со скоростью роста организма при отсутствии указанных веществ. Уменьшение скорости роста организма может составлять по меньшей мере 5%, более желательно, по меньшей мере 10%, еще более желательно, по меньшей мере 20%, 50% или 75% и, наиболее желательно, 90% или более. Данное определение также включает вещества, которые влияют на жизнеспособность, вирулентность или патогенность организма. Противомикробное средство может являться природным (например, полученным из бактерий), синтетическим или рекомбинантным. Противомикробное средство может являться бактериостатическим, бактерицидным или как бактериостатическим, так и бактерицидным. Противомикробное средство является бактериостатическим, если данное средство ингибирует деление клетки, не оказывая влияния на жизнеспособность ингибированной клетки. Противомикробное средство является бактерицидным, если данное средство вызывает гибель клеток. Гибель клеток обычно обнаруживают по отсутствию роста клеток в жидкой среде роста (например, по отсутствию мутности) или на твердой поверхности (например, по отсутствию образования колоний на агаре). Специалистам в данной области техники известно, что вещество или группа веществ, которые являются бактериостатическими при данной концентрации, могут являться бактерицидными при более высокой концентрации. Общепринятые противомикробные средства, известные в данной области техники, включают определенные спирты, Триклозан или Иргазан и Проклин 950. Композиция согласно настоящему изобретению может необязательно содержать противомикробное средство, такое как Триклозан. Согласно другим вариантам реализации настоящего изобретения противомикробное средство (например, Триклозан) может присутствовать в водной композиции в количестве от приблизительно 0-2% (масс./об.), предпочтительно, приблизительно 0-0,5% (масс./об.).
Композиции, описанные в настоящей заявке, при смешивании с биологическим образцом, в частности, образцом фекалий, стабилизируют нуклеиновые кислоты, содержащиеся в указанном образце, при температуре окружающей среды так, что нуклеиновые кислоты стабилизируются при хранении гомогенизированной смеси в течение длительных периодов времени.
Согласно одному варианту реализации настоящего изобретения биологический образец представляет собой образец фекалий, полученный от субъекта-человека, и нуклеиновая кислота представляет собой ДНК.
Специалисты в данной области техники понимают, что наличие высокомолекулярной ДНК в образце может обеспечить общий критерий стабилизации ДНК в образце в условиях хранения. Данный параметр можно оценить с применением метода электрофореза в агарозном геле, который может обеспечить критерий качества высокомолекулярной ДНК (например, четкая полоса по сравнению с размытой), а также количественный показатель количества высокомолекулярной ДНК (анализ методом денситометрии).
Помимо стабилизации высокомолекулярной ДНК, композиции, описанные в настоящей заявке, при смешивании с биологическим образцом, в частности, с образцом фекалий, стабилизируют нуклеиновые кислоты, содержащиеся в указанном образце, при температуре окружающей среды так, что при хранении гомогенизированной смеси в течение длительных периодов времени поддерживается относительное изобилие нуклеиновых кислот микроорганизмов и/или человека. Для определения того, поддерживается ли относительное изобилие нуклеиновых кислот микроорганизмов и/или человека, можно использовать множество методик, известных специалистам в данной области техники, например, методики, в которых применяют амплификацию или гибридизацию нуклеиновых кислот. Другая методика, которую можно использовать для оценки того, поддерживается ли относительное изобилие нуклеиновых кислот микроорганизмов и/или человека при хранении гомогенизированной смеси в течение длительных периодов времени, представляет собой анализ методом РЦР-ДГГЭ, более подробно описанный ниже. Также можно использовать желаемые профили 16S (для определения относительного изобилия операционных таксономических единиц (OTU, operational taxonomic units)), а также полнометагеномное секвенирование геномной ДНК методом «выстрела из дробового ружья» (WMS, whole-metagenomic shotgun; для определения относительного изобилия микробных генов/нуклеиновых кислот).
Согласно иллюстративному варианту реализации настоящего изобретения стабилизацию ДНК человека, в частности, можно оценить посредством определения того, сохраняет ли ДНК, полученная из биологических образцов, таких как образцы фекалий, которые инкубировали с композициями и согласно способам, описанным в настоящей заявке в течение периода времени (tхранения), способность поддерживать ПЦР-амплификацию целевого гена человека в обнаруживаемый продукт и, более конкретно, является ли уровень амплификации продукта ПНР подобным таковому для ДНК, экстрагированной и очищенной из той же гомогенной смеси или другой контрольной смеси в момент времени ноль. Как далее описано в примерах ниже, ДНК человека, очищенную из образцов фекалий, которые инкубировали с композициями и согласно способам, описанным в настоящей заявке, в Т=0 и T=txpaнения, можно амплифицировать методом количественной ПЦР в режиме реального времени (кПЦР) с применением праймеров, нацеленных на ген человека, и изменение значения Ct (ΔCt), полученное для аликвот ДНК, очищенных в Т=0 и Т=tхранения, может обеспечить количественный показатель стабильности ДНК человека. Значение ΔCt менее приблизительно 2 свидетельствует, что ДНК человека оказалась стабильной в течение времени хранения. Значение ΔCt менее приблизительно 1 свидетельствует о превосходной стабилизации.
Согласно одному варианту реализации настоящего изобретения ДНК человека, содержащаяся в образце фекалий, который инкубировали с композициями и согласно способам, описанным в настоящей заявке, оказывается стабильной при комнатной температуре в течение по меньшей мере 7 дней, по меньшей мере 14 дней, по меньшей мере 21 дня, по меньшей мере 30 дней или по меньшей мере 60 дней. Согласно другому варианту реализации настоящего изобретения ДНК человека, содержащаяся в образце фекалий, который инкубировали с композициями и согласно способам, описанным в настоящей заявке, оказывается стабильной при повышенных температурах, таких как 37°С или 50°С, в течение по меньшей мере 7 дней или по меньшей мере 14 дней. Согласно еще одному варианту реализации настоящего изобретения ДНК человека, содержащаяся в образце фекалий, который инкубировали с композициями и согласно способам, описанным в настоящей заявке, оказывается стабильной при температуре -20°С в течение по меньшей мере одного месяца (т.е. 30 дней).
Согласно другому варианту реализации настоящего изобретения нуклеиновая кислота представляет собой микробную ДНК, и указанный способ стабилизирует профиль микробиома биологического образца (например, образца фекалий). В настоящей заявке термин «профиль микробиома», как правило, означает суммарное микробное сообщество и биомолекулы в пределах определенного окружения, а также относительные количества указанных микробных сообществ и биомолекул.
Как более подробно описано ниже, стабильность профиля микробиома можно определить, например, посредством проведения ПЦР с ДНК, которую экстрагировали и очистили из гомогенных смесей биологического образца и композиций, описанных в настоящей заявке, после хранения гомогенных смесей при температуре окружающей среды в течение конкретного периода времени (tхранения) с применением пар праймеров, нацеленных на гены бактериальной 16S рРНК, и анализа методом денатурирующего градиентного гель-электрофореза (ДГГЭ). Специалисты в данной области техники понимают, что можно нацеливаться на другие бактериальные гены с вариабельными и невариабельными областями, при условии, что существует различие между видами, представляющими интерес. Затем полученный в результате профиль ПЦР-ДГГЭ сравнивают с таковым, полученным посредством проведения анализа методом ПЦР-ДГГЭ аналогичным образом с ДНК, которую экстрагировали и очистили из той же гомогенной смеси или другой контрольной смеси биологического образца и композиций в момент времени ноль. Согласно одному варианту реализации настоящего изобретения профиль микробиома биологического образца, такого как образец фекалий, можно считать стабилизированным при температуре окружающей среды в течение определенного периода времени (гранения), если профиль ПЦР-ДГГЭ после tхранения при температуре окружающей среды демонстрирует по меньшей мере 75% подобия профилю ПЦР-ДГГЭ в Т=0 и, наиболее предпочтительно, по меньшей мере 82% подобия профилю ПЦР-ДГГЭ в Т=0.
Согласно другому варианту реализации настоящего изобретения стабильность профиля микробиома можно определить, например, посредством амплификации и секвенирования вариабельной области гена бактериальной 16S рРНК (такой как гипервариабельная область V4) из ДНК, которую экстрагировали и очистили из гомогенных смесей биологического образца и композиций, описанных в настоящей заявке, после хранения гомогенных смесей при температуре окружающей среды в течение конкретного периода времени. Полученную в результате информацию секвенирования затем сравнивают с информацией, полученной посредством проведения амплификации и секвенирования вариабельной области гена бактериальной 16S рРНК аналогичным образом с ДНК, которую экстрагировали и очистили из той же гомогенной смеси в момент времени ноль, или с другим контролем. Для оценки стабильности микробиома в условиях хранения можно использовать различные формы биоинформатического анализа полученных данных секвенирования, известные специалистам в данной области техники, как более подробно описано в примерах ниже.
Согласно одному варианту реализации настоящего изобретения профиль микробиома образца фекалий, который инкубировали с композициями и согласно способам, описанным в настоящей заявке, оказывается стабильным при комнатной температуре в течение по меньшей мере 7 дней, по меньшей мере 14 дней, по меньшей мере 21 дня, по меньшей мере 30 дней или по меньшей мере 60 дней. Согласно другому варианту реализации настоящего изобретения профиль микробиома образца фекалий, который инкубировали с композициями и согласно способам, описанным в настоящей заявке, оказывается стабильным при повышенных температурах, таких как 37°С или 50°С, в течение по меньшей мере 7 дней или по меньшей мере 14 дней. Согласно еще одному варианту реализации настоящего изобретения профиль микробиома образца фекалий, который инкубировали с композициями и согласно способам, описанным в настоящей заявке, оказывается стабильным при температуре -20°С в течение по меньшей мере одного месяца (т.е. 30 дней).
Авторы настоящего изобретения неожиданно обнаружили, что чрезвычайно высокие концентрации менее часто используемого хелатирующего средства, CDTA, забуференного до щелочного рН (рН≥9,5, предпочтительно, рН 11), можно использовать для быстрого и эффективного захвата и стабилизации нуклеиновой кислоты и «мгновенной фиксации» профилей суммарной ДНК в биологических образцах при температуре окружающей среды в течение длительных периодов времени.
В частности, авторы настоящего изобретения неожиданно обнаружили, что композиции, забуференные до более высокого щелочного рН (приблизительно рН 10,5-11,5, предпочтительно, приблизительно рН 11), демонстрируют улучшенную стабильность микробиома ДНК по сравнению со стабилизирующими композициями, забуференными до меньшего значения рН. Данный результат, который невозможно было предсказать, фактически, стал неожиданным по следующей причине. Известно, что при более высоком рН, как правило, дезаминирование цитозина ускоряется. Также известно, что ДНК легче денатурирует при более высоком значении рН. Апуриновые сайты в ДНК (которые встречаются с низкой частотой) также будут легче расщепляться. Таким образом, авторы настоящего изобретения на основании результатов анализа методом электрофореза в агарозном геле, секвенирования гена бактериальной 16S рРНК и ДГГЭ неожиданно обнаружили, что при более высоком значении рН ДНК/профили микробиома оказались более стабильными.
Не опираясь на какую-либо теорию, считают, что причина видимого улучшения стабильности не является исключительно «химической». Это означает, что улучшенная стабильность микробиома ДНК наблюдается при более высоком щелочном рН, предположительно, в результате комбинации причин, некоторые из которых предложены ниже.
Было установлено, что CDTA функционирует намного эффективнее, чем EDTA, в композициях, описанных в настоящей заявке, для стабилизации ДНК/микробиома. 4 рKа для EDTA и CDTA представлены в таблице 2 выше. Данные показатели означают, что при щелочном рН CDTA содержит 3 отрицательных заряда, тогда как EDTA содержит 4 отрицательных заряда по мере того, как рН приближается к 11. Снова не опираясь на какую-либо теорию, считают, что причина лучших характеристик CDTA по сравнению с EDTA, предположительно, обусловлена меньшим отрицательным зарядом.
Цель исследования микробиома заключается в стабилизации и, в конечном итоге, в высвобождении ДНК из всех клеток в равном соотношении, предпочтительно, 100% ДНК из 100% клеток. Стабильность «профиля» высвободившейся ДНК может являться лучшей при более высоком значении рН, поскольку высокий рН может позволить приблизиться к достижению данной цели. Другими словами, при рН 11 можно стабилизировать и, в конечном итоге, высвободить большее количество бактериальной ДНК по сравнению с рН 9,5.
После высвобождения ДНК необходимо защитить от деградации ДНКазами в образцах фекалий. Некоторым ДНКазам в качестве кофакторов необходимы ионов металлов, а некоторым - нет. Снова не опираясь на какую-либо теорию, считают, что возможно, большее значение рН может являться более эффективным при ингибировании ДНКаз второго класса.
Неизвестные факторы (например, ингибиторы) в фекалиях могут связывать и секвестрировать ДНК или блокировать ПЦР-амплификацию. Возможно, более высокое значение рН может уменьшить вероятность одного или обоих из данных событий.
Наконец, после сбора образцов фекалий в стабилизирующие композиции необходимо предотвратить рост бактерий. В противном случае, «профиль» ДНК/микробиома изменится. Более высокое значение рН может являться более эффективным при ингибировании роста некоторых видов бактерий, чем меньшее значение рН (9,5).
Для сложных, в высшей степени вариабельных твердых и полутвердых типов образцов, таких как фекалии, также необходимо обеспечить механические или физические средства немедленного перемешивания образцов с композицией в момент сбора. Быстрая гомогенизация и полное разрушение свежесобранного биологического образца в композиции согласно настоящему изобретению обеспечивает стабилизацию репрезентативной «мгновенной фиксации» профилей суммарной ДНК в образце в течение длительных периодов времени при температуре окружающей среды. Как проиллюстрировано в примерах ниже, если композицию согласно настоящему изобретению добавляют к собранному образцу твердых фекалий, но не перемешивают надлежащим образом, качество ДНК ухудшается по сравнению с теми образцами, которые были перемешаны до гомогенности. Вследствие этого надлежащее перемешивание образцов является критичным для стабилизации ДНК с целью представления состояния ДНК in vivo (Т=0). Например, в ДНК, экстрагированной из таких образцов, после проведения анализа методом электрофореза в агарозном геле может наблюдаться деградация высокомолекулярной ДНК в образцах от некоторых доноров. Также, как видно из примеров, приведенных ниже, ненадлежащее перемешивание образцов фекалий от некоторых доноров приводит к негативным изменениям профиля микробиома, который измеряют в ходе анализа ПЦР и ДГТЭ 16S рРНК.
Во многих случаях сбор биологического образца, в частности, сбор фекалий, наилучшим образом проводится донорами в конфиденциальной обстановке собственного дома. В такой обстановке донор чувствует себя более комфортно, и ему предоставлены инструкции и соответствующее устройство для сбора биологического образца или набор, содержащий стабилизирующее химическое вещество или раствор, и донор может немедленно собрать и стабилизировать свежий биологический образец. Сбор образцов таким способом позволяет обеспечить наилучшее качество нуклеиновой кислоты для последующей экстракции и анализа и позволяет получить профили ДНК, наиболее соответствующие состоянию in vivo. Однако с целью сбора и стабилизации биологического образца дома или в удаленном месте сбора донору необходимо предоставить простые, безопасные и интуитивно понятные, но высокоэффективные средства для самостоятельного ручного перемешивания или перемешивания физическим способом собранного образца со стабилизирующим раствором. Предпочтительно, данное средство перемешивания является недорогим и не требует применения электричества, оборудования или специального обучения.
ДНК может быстро деградировать в биологических образцах (например, фекалиях) после контакта с воздухом, если ДНК не перемешали со стабилизирующим раствором или не заморозили немедленно на сухом льду в момент сбора. В случае гомогенных жидких биологических образцов, таких как кровь и моча, перемешивание не является большой проблемой; однако разрушение твердых и полутвердых негомогенных биологических образцов, таких как фекалии, в ограниченном количестве раствора и в течение ограниченного периода времени может являться чрезвычайно проблематичным. В результате долгого экспериментирования с различными средствами перемешивания (например, частицами из стекла/оксида кремния (≤1 мм; 2,65 г/см3), бусинами из стекла/оксида кремния (2-4 мм; 2,65 г/см3), стеклянными шариками (12,7 мм), шариками из оксида алюминия (7,9 мм; 3,95 г/см3) и шариками из нитрида кремния (7,1-7,9 мм; 3,21 г/см3), авторы настоящего изобретения обнаружили, что полного разрушения и гомогенизации образцов фекалий всех типов (типы 1-7 согласно Бристольской шкале стула), собранных в стандартные, коммерчески доступные лабораторные пробирки или пробирки для транспортирования (например, кругло донные пробирки объемом 10 мл (92×15,3 мм), кат. №60.610; Sarstedt), содержащие композицию согласно настоящему изобретению, можно достичь посредством простого ручного перемешивания с добавлением в пробирку по меньшей мере одного крупного (диаметром 5,6-11,1 мм, предпочтительно, 7,9 мм) плотного (плотностью 7,6-15,63 г/см3) металлического шарика, размер которого меньше внутреннего диаметра пробирки (например, 12,9 мм).
Авторы настоящего изобретения определили оптимальный выбор средства гомогенизации для стандартной, коммерчески доступной лабораторной пробирки, который включает: 1) соответствие формы пробирки (например, дна или основания внутри пробирки) форме средства гомогенизации (например, круглодонные пробирки для средства гомогенизации, которое представляет собой по меньшей мере один шарик для перемешивания, такой как шарик для перемешивания из нержавеющей стали) для предотвращения компактизации и/или захвата твердого материала в труднодоступных областях пробирки или контейнера; 2) выбор для средства гомогенизации наиболее плотного из возможных материалов (например, карбида вольфрама (15,63 г/см3), нержавеющей стали (7,6-8,0 г/см3); 3) выбор средства гомогенизации с внешним диаметром, незначительно меньшим, чем внутренний диаметр пробирки или контейнера (например, если средство гомогенизации представляет собой шарик для перемешивания, шарик для перемешивания будет характеризоваться диаметром приблизительно на 4-6 мм, предпочтительно, приблизительно на 4-5 мм и, наиболее предпочтительно, приблизительно на 5 мм меньшим, чем внутренний диаметр пробирки для перемешивания); и 4) выбор пробирки или контейнера со «свободным пространством» над образцом и стабилизирующим раствором, что позволяет средству гомогенизации набирать инерцию движения во время перемешивания рукой. Следует отметить, что шарик для перемешивания может иметь правильную или неправильную форму (например, может содержать выступы, шипы и т.д. и не обязательно должен являться идеально сферическим), и, как отмечено выше, предпочтительно, характеризуется плотностью по меньшей мере 5,0 г/см3, наиболее предпочтительно, по меньшей мере 7,6 г/см.
В случае если средство гомогенизации/шарик будет слишком маленьким по сравнению с пробиркой, образец будет перемещаться вокруг средства гомогенизации/шарика без диспергирования в стабилизирующем растворе. Напротив, в случае, если средство гомогенизации/шарик будет слишком большим (например, >11,1 мм) по сравнению с пробиркой (с внутренним диаметром 12,9 мм), образец не диспергируется или «раздавится» между средством гомогенизации/шариком и стенками пробирки, средство гомогенизации/шарик не наберет достаточной инерции движения, и образец будет компактизован на одном или обоих концах пробирки. В идеале, если внешний диаметр средства гомогенизации (например, шарика из карбида вольфрама или нержавеющей стали диаметром 7,9 мм) помещается между внутренними вертикальными стенками пробирки (например, пробирки Sarstedt объемом 10 мл, внутренний диаметр которой составляет 12,9 мм, см. выше) с зазором приблизительно 5 мм (по 2,5 мм с каждой стороны шарика), средство гомогенизации эффективно функционирует в качестве гомогенизатора, быстро разбивает или разрушает твердый или полутвердый образец фекалий (например, 400 мг; типы 1-7), собранный в композицию согласно настоящему изобретению (например, 2 мл), с образованием гомогенного жидкого образца, который затем можно легко пипетировать или подвергать манипуляциям либо обработке в лаборатории. Данное средство гомогенизации обеспечивает, что собранный биологический образец, даже твердые фекалии, быстро и полностью разрушается, и при этом быстро подвергается воздействию композиции согласно настоящему изобретению. Важно отметить, что, как определили авторы настоящего изобретения, для достижения полного своевременного разрушения образца (в течение 20-30 секунд) в ходе простого встряхивания пробирки рукой важным является плотность средства гомогенизации, а не только его диаметр по сравнению с пробиркой/контейнером. В связи с зачастую вязкой, тягучей природой фекалий (например, типа 4), сложно достичь полной гомогенизации данного образца в пробирках с плоским или коническим дном при применении сферического средства гомогенизации. Следовательно, для сферического средства гомогенизации наилучшим образом подходит пробирка со скругленным дном.
В настоящем изобретении предложен новый универсальный способ и композиция для стабилизации суммарной ДНК в особенно сложных, негомогенных биологических образцах при температуре окружающей среды для последующего применения в медицинской диагностике и клинических исследованиях у человека и животных (например, в диагностике заболевания и инфекции, при определении роли микробов в здоровье человека, в популяционной генетике для исследования эволюции микроорганизмов, вирулентности, устойчивости к лекарственным препаратам и эпидемиологии), при определении безопасности пищевых продуктов (на перерабатывающих производствах продуктов питания/мяса), при отборе проб почвы и сточных вод (в исследованиях окружающей среды), в области биобезопасности или биозащиты (биологическое оружие), исследовании корма животных, в науке/промышленности растений и животных и т.д.). Новый и быстро увеличивающийся интерес исследователей и клиницистов направлен на кишечную микробиоту или кишечный микробном. Насколько профиль микробов в фекалиях от здоровых доноров отличается от такового индивидуумов, страдающих от заболевания? Могут ли манипуляции с кишечным микробиомом человека улучшить здоровье? С точки зрения окружающей среды и с экономической и исследовательской точек зрения также существует огромный интерес к проведению анализа тысяч различных микроорганизмов в рубце многих представителей домашнего скота, в особенности тех животных, которых разводят для получения мяса и молочных продуктов.
Настоящее изобретение упрощает и ускоряет сбор и получение биологического образца, обеспечивая получение качественных образцов для последующего обнаружения ДНК человека, животного и микроорганизмов без необходимости поддержания холодовой цепи в процессе транспортирования или хранения. Настоящее изобретение можно использовать в а) центральных лабораториях или испытательных центрах с высокопроизводительными или автоматизированными системами, b) сельских или мобильных клиниках с минимальной лабораторной инфраструктурой и оборудованием, и с) отдаленных районах без электричества. Кроме того, больным и потенциально инфекционным индивидуумам нет необходимости ехать в клиники или больницы для сдачи биологического образца, что минимизирует распространение инфекционного заболевания, облегчает борьбу и надзор над эпидемическими заболеваниями и делает возможной быструю оценку и контроль ответа пациента на лечение.
Закрытая система/набор для сбора и гомогенизации, описанная в настоящей заявке, является недорогой в производстве и не требует приобретения дополнительного лабораторного оборудования (например, вортекса). Более важно, что с помощью ручного перемешивания закрытой пробирки, содержащей композицию согласно настоящему изобретению, с одним или несколькими шариками для гомогенизации даже в случае образца тяжелых фекалий (типы 1-2 согласно Бристольской шкале стула) можно достичь полного разрушения образца за секунды с получением гомогенной смеси. Самосбор донором уменьшает распространение инфекции и потенциальное перекрестное загрязнение образцами другого донора. Примечательно, что данный процесс сбора и гомогенизации образца может осуществляться неспециалистом, не обладающим лабораторным или клиническим опытом, в конфиденциальной обстановке собственного дома, что значительно улучшает участие и соблюдение донором предписанных процедур. Настоящее изобретение позволяет проводить безопасный сбор и стабилизацию «свежих» биологических образцов, значительно уменьшая деградацию, которая наблюдается во время перевозки неочищенных или необработанных биологических образцов в исследовательскую лабораторию и/или при варьирующих условиях хранения, что является важным для качества результатов последующих исследований.
Важно отметить, что в настоящем изобретении исследователям и клиницистам предложены крайне необходимые стабилизированные, репрезентативные биологические образцы, из которых можно выделить неискаженную ДНК. Получение неискаженной ДНК, т.е. репрезентативная мгновенная фиксация кишечного микробиома в момент сбора образца, увеличит качество и точность последующих анализов, сделает более точным сравнительную оценку внутри- и межсубъектных различий, а также различий внутри исследования, для изучения вариаций кишечных микробных сообществ человека в норме и при патологии. Интактная, неискаженная, богатая высокомолекулярная ДНК необходима для создания метагеномной библиотеки и характеризации интактных генетических путей с помощью подходов на основе последовательности или функционального скрининга. Кроме того, чрезмерная деградация ДНК в биологических образцах уменьшает эффективность секвенирования методом «выстрела из дробового ружья».
В последние несколько лет значительное внимание уделялось филогенетической композиции ДНК, экстрагированной из фекалий, относительно бактериального сообщества в свежих фекалиях. Распространенной практикой, главным образом, из-за практических соображений, является замораживание образцов фекалий после сбора и экстрагирование ДНК через значительно варьирующий период времени для проведения последующего анализа, такого как секвенирование или количественная ПЦР (кПЦР). Однако немаловажно, что как между опубликованными исследованиями, так и в рамках каждого исследования, как представляется, существуют значительные различия в: 1) периоде времени между дефекацией и замораживанием «свежих» фекалий; 2) условиях и длительности транспортирования; 3) продолжительности времени, в течение которого фекалии находились в замороженном состоянии перед проведением анализа; 4) продолжительности времени и температуре, которую применяли для оттаивания фекалий; и 5) периоде времени от момента сбора до выделения и обработки первой аликвоты для получения ДНК. В данных исследованиях Т=0 представляет собой момент, когда данные собранные, замороженные и часто хранившиеся образцы оттаивали для проведения обработки, а не время дефекации.
Однако при метагеномных исследованиях микробиоты человека анализы однозначно продемонстрировали, что условия хранения образцов фекалий могут отрицательно влиять на предполагаемый состав сообщества. Например, Bahl et al. (2012) с применением кПЦР и 6 различных пар праймеров, нацеленных на гены 16S рРНК значительных бактериальных групп, продемонстрировали, что замораживание образцов фекалий при температуре -20°С в течение 53±5 дней перед экстракцией влияло на соотношение между двумя наиболее преобладающими типами, а именно Firmicutes и Bacteroidetes, которых часто используют в качестве биомаркера при исследовании микробиологии кишечника. В частности, соотношение гена 16S рРНК Firmicutes к Bacteroidetes было значительно более высоким в образцах фекалий, которые были заморожены, по сравнению с идентичными образцами, которые не были заморожены. Крайне необходимым является средство для определения или мгновенной фиксации по меньшей мере трех ключевых аспектов исходного микробного сообщества или микробного сообщества in vivo при сборе образцов фекалий, которое стабилизировало бы i) изобилие каждого микроба, ii) богатство всего сообщества и iii) профили суммарной микробной ДНК.
Эффективная и объективная стабилизация (и экстракция) суммарной геномной бактериальной ДНК из сложных образцов фекалий является критическим первым этапом молекулярного исследования бактериального сообщества в кишечнике, например, получения профилей микробиома, которые представляют состояние донора in vivo. В частности, исследование микробных сообществ требует обеспечения «мгновенной фиксации» профиля микробиоты немедленно после сбора. Очевидно, что применяемый на сегодняшний день сбор образцов фекалий «на месте» является непрактичным, дорогим и не масштабируемым (Mclnnes & Cutting, 2010). Также на практике хорошо известно, что сложности, связанные со сбором образца, приводят к противоречивым результатам и низкой воспроизводимости. Более того, манипуляции с твердыми образцами представляют сложную задачу для автоматизации, вызывают увеличение стоимости и ограничение размера динамического исследования.
Для устранения значительных межлабораторных несоответствий между исследованиями и в рамках одного исследования существует потребность в разработке и реализации стандартизованного или универсального способа сбора и стабилизации биологических образцов в момент сбора до того, как на образцы начнут воздействовать неблагоприятные, часто экстремальные температуры в процессе транспортирования и длительного хранения. Настоящий способ гомогенизации биологических образцов, в частности, негомогенных образцов, сильно различающихся по типу и сложности, которые варьируют от жидких до твердых веществ, в эффективных композициях, стабилизирующих ДНК, в момент сбора образца обеспечивает максимальную целостность ДНК во всем образце, представляющую максимально близко состояние in vivo.
На сегодняшний день во многие исследования включают доноров для сбора образцов фекалий и либо не предоставляют донорам средств стабилизации, либо требуют применения хладоэлемента в ходе транспортирования. Проект «Микробном человека» (Human Microbiome Project, НМР), программа, запущенная в рамках дорожной карты Национального института здоровья (National Institutes of Health, NIH), спонсирует исследования, направленные на характеристику микробиома человека и анализ роли микробиома в здоровье и заболеваниях человека. Все члены, принимающие участие в исследовании по сбору образцов базового микробиома (Core Microbiome Sampling study) НМР, должны следовать Руководству по процедурам (Manual of Procedures, Mclnnes & Cutting, 2010), в котором описан, среди прочего, сбор образцов из ЖК тракта (см. раздел 7.3.3). Субъектам предоставляют набор для сбора фекалий и просят собирать образцы фекалий в течение 24 ч до сдачи образцов в клинику. Набор НМР включает два контейнера для сбора фекалий (один резервный), напоминающие большие коробки для маргарина, контейнер для перевозки Thermosafe (большая коробка из пенополистирола внутри картонной коробки), 8-10 гелевых пакетов для транспортирования образца (при температуре приблизительно 4°С), инструкции, этикетки и другие упаковочные материалы. Перед сбором образца субъектам следует поместить гелевые пакеты в морозильную камеру по меньшей мере на 12 часов. Фекалии помещают непосредственно в контейнер для сбора, закрывают крышкой, и весь контейнер запечатывают в пакет с молнией, после чего упаковывают в коробку из пенополистирола, полностью окруженную 8-10 замороженными гелевыми пакетами. Коробку из пенополистирола закрывают, помещают в картонную коробку, которую также закрывают, и субъект транспортирует данную громоздкую упаковку в клиническую лабораторию.
Существующие требования холодовой цепи перевозить свежие образцы, упакованные на льду или сухом льду, запечатанными в громоздкие контейнеры/холодильные камеры Styrofoam и картон, являются очень дорогими, даже непомерно дорогими для исследователей, проводящих исследования, для которых требуется среднее или большое количество доноров. Буквально, каждая перевозка фекалий в коммерчески доступном контейнере для сбора, окруженном замороженными хладоэлементами, в контейнере Styrofoam, в картонной коробке для перевозки или в наружной упаковке (16×13×14 дюймов) обходится приблизительно в 175 $ с использованием службы доставки UPS Next Day в пределах США. В данном подсчете не учитывается стоимость контейнера для сбора фекалий и каких-либо материалов для перевозки. Также во многих испытательных центрах требуется, чтобы биологические образцы перевозились на сухом льду, что добавляет значительные затраты в данный подсчет доставки. После того как лаборатория получила данные большие контейнеры для доставки, персонал должен немедленно распаковать и быстро обработать биологические образцы или поместить контейнеры для сбора в большие морозильные камеры для хранения до того момента, когда можно будет провести обработку партии. Напротив, настоящее изобретение позволяет снизить значительную часть текущей стоимости и неудобств доставки, и, что более важно, обеспечивает стабилизацию ДНК в собранных биологических образцах в момент сбора при температуре окружающей среды. С точки зрения донора, биологический образец собирают в конфиденциальной обстановке собственного дома, малую часть образца переносят в обычную пробирку или контейнер, который уже содержит стабилизирующий раствор, пробирку закрывают крышкой и для перемешивания встряхивают рукой, пробирку запечатывают в биологически безопасный пакет и отправляют в исследовательскую лабораторию в пупырчатом конверте или в небольшой коробке по минимальной текущей цене.
ПРИМЕРЫ
МАТЕРИАЛЫ И МЕТОДЫ
Следующие общие материалы и методы были использованы в приведенных ниже примерах, за исключением случаев, для которых указаны другие условия.
Сбор образцов фекалий
Каждому из здоровых доноров предоставляли следующие средства для сбора: а) контейнер для сбора фекалий (сиденье на унитаз); b) шприц для объемного сбора фекалий массой приблизительно 400 мг (т.е. шприц объемом 3 мл с отрезанным кончиком, с поршнем, откорректированным на объем сбора 400 мг); с) кругл о донную пробирку Sarstedt (круглодонная пробирка объемом 10 мл (92×15,3 мм), кат. №60.610; Sarstedt), содержащую композицию согласно настоящему изобретению (2 мл) и различные средства гомогенизации (например, шариковый подшипник из нержавеющей стали диаметром 7,9 мм, 420/440 SS Grade 25, Aimark Travers LTD или другие, как указано ниже); и d) инструкции по сбору фекалий. Пробирки взвешивали до и после сбора для определения фактического количества собранного образца фекалий. Каждого донора просили наполнить кончик шприца фекалиями до отмеченного объема (400 мг) и перенести образец фекалий в пробирку. Для полной гомогенизации образцов пробирки встряхивали рукой в течение 20-30 секунд.
Экстракция ДНК из образцов фекалий в композиции согласно настоящему изобретению
Если не указано обратное, 400 мг фекалий переносили в пробирку Sarstedt (круглодонная пробирка объемом 10 мл (92×15,3 мм), кат. №60.610; Sarstedt), содержащую 2 мл композиции согласно настоящему изобретению (как указано в примерах ниже) и шариковый подшипник из нержавеющей стали диаметром 7,9 мм. ДНК быстро экстрагировали из аликвот собранных образцов фекалий объемом 250 мкл, которые хранили в композиции согласно настоящему изобретению, с применением нескольких коммерчески доступных наборов для выделения ДНК. Было обнаружено, что образцы фекалий в композициях согласно настоящему изобретению являются совместимыми с набором для выделения ДНК PowerSoil® (МО BIO Laboratories, Inc., кат. №12888-100), набором для выделения ДНК PowerFecal™ (МО BIO Laboratories, Inc., кат. №12830-50), набором Zymo Research Fecal DNA MiniPrep с применением взбивания с бусинами (Zymo Research, кат. №D6010), мини-набором QIAamp DNA Feces (Qiagen, кат. №51504) и с набором PSP Spin Feces DNA Plus (Invitek, кат. №1038110200).
В соответствии с инструкциями к набору для выделения ДНК PowerFecal® проводили следующую процедуру [Примечание: этап нагрева до температуры 65°С пропускали]:
1. В предоставленную пробирку PowerBead добавляли 750 мкл раствора бусин и 250 мкл образца фекалий в композиции согласно настоящему изобретению. Пробирку аккуратно встряхивали на вортексе для перемешивания.
2. Добавляли 60 мкл Раствора С1, и пробирку переворачивали несколько раз или быстро встряхивали на вортексе.
3. Пробирку PowerBead закрепляли на адаптере вортекса и встряхивали на вортексе в течение 10 минут на максимальной скорости.
4. Пробирку PowerBead центрифугировали при 10000 g в течение 30 секунд.
5. Супернатант переносили в чистую пробирку для сбора объемом 2 мл (предоставлена).
6. Добавляли 250 мкл Раствора С2, и пробирку встряхивали на вортексе в течение 5 секунд, а затем инкубировали при температуре 4°С в течение 5 минут.
7. Пробирку для сбора центрифугировали при комнатной температуре в течение 1 минуты при 13000 g.
8. Исключая осадок, не более 600 мкл супернатанта переносили в чистую пробирку объемом 2 мл.
9. Добавляли 200 мкл Раствора С3, и пробирку быстро встряхивали на вортексе, затем инкубировали при температуре 4°С в течение 5 минут.
10. Пробирку центрифугировали при комнатной температуре в течение 1 минуты при 13000 g.
11. Исключая осадок, не более 750 мкл супернатанта переносили в чистую пробирку объемом 2 мл.
12. Раствор С4 перемешивали перед использованием. К супернатанту добавляли 1200 мкл Раствора С4, и пробирку встряхивали на вортексе в течение 5 секунд.
13. 675 мкл наносили на центробежный фильтр и центрифугировали при 13000 g в течение 1 минуты. Фильтрат отбрасывали, и дополнительные 675 мкл супернатанта наносили на центробежный фильтр и центрифугировали при 13000 g в течение 1 минуты. Оставшийся супернатант наносили на центробежный фильтр и центрифугировали при 13000 g в течение 1 минуты.
14. На центробежный фильтр наносили 500 мкл Раствора С5 и центрифугировали при комнатной температуре в течение 30 секунд при 13000 g. Фильтрат отбрасывали.
15. Снова проводили центрифугирование при комнатной температуре в течение 1 минуты при 13000 g.
16. Центробежный фильтр аккуратно помещали в чистую пробирку для сбора объемом 2 мл (предоставлена).
17.100 мкл Раствора С6 наносили в центр белой фильтровальной бумаги.
18. Пробирку центрифугировали при комнатной температуре в течение 30 секунд при 13000 g.
19. ДНК хранили замороженной (при температуре от -20 до -80°С).
Определение концентрации ДНК в очищенных образцах
A. Определение концентрации ДНК по поглощающей способности
Измерение поглощения при 260 нм (А260нм) широко используют для количественного определения ДНК. Для чистой двухцепочечной ДНК поглощение 1,0 при 260 нм соответствует концентрации 50 нг/мкл. Выходы ДНК из очищенных образцов фекалий, обработанных композициями согласно настоящему изобретению или не обработанных данными композициями, в различных условиях определяли с применением спектрофотометра NanoDrop 2000 с (Thermo Fisher Scientific Inc.). По 2 мкл каждого образца ДНК помещали на подставку и проводили анализ в диапазоне от 220 нм до 350 нм с измерением поглощения при 230 нм, 260 нм и 280 нм. Концентрацию ДНК в образце (нг/мкл), соотношение А260/А280 и соотношение А260/А230 рассчитывали с помощью программного обеспечения NanoDrop 2000 с. Суммарный выход ДНК на образец рассчитывали посредством умножения концентрации образца на соответствующий объем элюирования ДНК.
B. Флуориметрическое определение концентрации ДНК
Недостатки применения Агвонм включают (i) нечувствительность анализа и (ii) влияние компонентов, отличных от ДНК, таких как РНК, в частности, в образцах, которые не были тщательно очищены.
Выход ДНК из очищенных образцов также количественно определяли с применением флуоресцентного красителя PicoGreen® (200х; Invitrogen, кат. №Р7581); ДНК лямбда (Invitrogen, кат. №25250-010) использовали для получения стандартной кривой [в трех повторах; 0-50 нг/мкл]. PicoGreen представляет собой флуоресцентный краситель, который связывается с двухцепочечной ДНК (возбуждение 485 нм/испускание 535 нм) и который позволяет проводить чувствительное количественное определение субнанограммовых количеств двухцепочечной ДНК (дцДНК). Аликвоты каждого очищенного образца в трех повторах и стандарты ДНК лямбда обрабатывали в черном 96-луночном микропланшете с плоским дном (Greiner Bio-One, кат. №655209), и флуоресценцию измеряли с применением считывающего устройства для микропланшетов Infinite М200 (TECAN).
Целостность ДНК в образцах, хранившихся в стабилизирующих композициях
Аликвоту каждого очищенного образца разводили до концентрации 10 нг/мкл, исходя из концентрации, определенной с применением PicoGreen (см. выше). Для оценки целостности ДНК приблизительно 80 нг от каждого разведенного очищенного образца фекалий разделяли на 1% агарозном геле методом электрофореза в течение 30 минут при напряжении 100 вольт. Гель окрашивали в бромистом этидии (EtBr) с концентрацией 1 мкг/мл в дистиллированной воде в течение 15 минут при комнатной температуре, промывали и фотографировали на приборе для УФ-просвечивания с применением системы визуализации DigiDoc-IT™ (UVP LLC). ДНК считали стабилизированной и интактной, если окрашенная полоса на геле была четкой и составляла >23 Kb (тысяч пар оснований) по сравнению с лесенкой маркеров ДНК. В качестве эталонов размера использовали «лесенку» маркеров ДНК 1Kb+ (Life Technologies, кат. №10787-018) или фрагменты ДНК лямбда/Hind III (Life Technologies, кат. №15612-013).
a. готовили 1% агарозный гель (80 мл 1×TAC+0,8 г агарозы).
b. к 8 мкл очищенного образца в концентрации 10 нг/мкл добавляли 2 мкл 5х буфера для нанесения.
c. В лунки приготовленного 1% агарозного геля наносили по 10 мкл приготовленного образца (этап b); 5 мкл ДНК лямбда/фрагментов Hind III и/или 5 мкл лесенки маркеров ДНК 1Kb.
d. Проводили электрофоретическое разделение в геле при напряжении 100 В в течение 30 минут.
e. Гель окрашивали в EtBr (500 мкл 1 мг/мл EtBr +500 мл воды) в течение 15 минут.
f. Гель обесцвечивали в воде в течение 5 минут, г. Изображения получали в УФ.
Денатурирующий градиентный гель-электрофорез (ДГГЭ)
Для точной и воспроизводимой оценки стабильности различных микробиомов (фекалии, слюна, мокрота, кожа и т.д.) в композиции согласно настоящему изобретению использовали новый метод, называемый денатурирующим градиентным гель-электрофорезом (ДГГЭ). В основе данного метода лежит идея о том, что, если вариабельную область гена бактериальной 16S рРНК (в данном случае область V3) амплифицровать с применением ПЦР и праймеров на фланкирующей консервативной области, данные ампликоны будут характеризоваться температурой плавления, уникальной для данного вида бактерий (даже различия нуклеотидов будут влиять на плавление и, вследствие этого, приведут к отличному профилю).
Когда данный способ применяют для анализа образца, содержащего множество видов бактерий, амплификация с использованием консервативных праймеров приведет к получению матрицы ампликонов, все из которых обладают примерно одинаковой длиной, но характеризуются различным составом нуклеотидов в неконсервативной области. Затем данные ампликоны разделяют на геле, который содержит градиент денатурирующего раствора (мочевину и формамид). Ампликоны будут денатурировать на геле на различных стадиях, в зависимости от состава нуклеотидов, тем самым обеспечивая разрешение всех видов, которые присутствовали в образце.
Для того чтобы ампликоны ДНК не денатурировали в одноцепочечную форму, к прямому праймеру добавляли СG-«зажим» длиной ~30 нуклеотидов, который тормозит миграцию ампликонов на геле после денатурации вариабельного участка. Как правило, денатурирующий градиент на геле, составляющий 40%-60%, обеспечивает хорошее разрешение полос и при этом позволяет определить большинство видов, присутствующих в кишечнике. Электрофоретическое разделение на геле проводят при постоянной температуре 60°С для облегчения денатурации ампликонов, а также выдерживают гель при данной температуре в течение всего анализа.
Изображения гелей после проведения разделения методом ДГГЭ анализировали с применением программного обеспечения Syngene GeneTools (версия 4.03.00, Syngene). Фон изображения вычитали с применением метода катящегося диска (rolling disc) с радиусом 30 пикселей. Дорожки определяли и задавали вручную. Расположение начала и конца Rf и угол устанавливали вручную для корректировки «улыбающегося» геля. Полосы для анализа автоматически определяли для каждой дорожки; детектирование пика устанавливали по умолчанию (минимальная ширина 7 пикселей, минимальная высота пика 3 и минимальный объем пика 1%). Профили сравнивали с применением типа «профиля» в меню параметров совпадения с установкой допустимого отклонения 1%. Сравнение профиля приводило к автоматическому получению матрицы подобия со значениями подобия, которые варьировали от 0 до 100. Вообще говоря, для % подобия данный параметр означает любые изменения между 2 профилями, обычно различия в интенсивности полос. Таким образом, % подобия обеспечивает показатель различия изобилия видов. Если полоса среди профилей отсутствует, влияние на % подобия является более высоким, чем если интенсивность данной полосы просто уменьшается.
Гель ДГГЭ, представленный на фигуре 1, иллюстрирует, насколько различным может быть профиль микробиома образцов фекалий от двух различных доноров; между первым образцом фекалий (Донор А) и вторым образцом (Донор В) наблюдается всего лишь 22% подобия.
Анализ методом ПЦР-ДГГЭ проводили согласно процедуре, описанной ниже.
ПЦР-амплификация для ДГГЭ (с применением праймеров 16S с 5'-«зажимом» на прямом праймере)
a. 2 мкл ДНК в концентрации 10 нг/мкл добавляли в стрипы из 12 пробирок для ПЦР.
b. Готовили мастер-микс (98 мкг/реакцию): 76,7 мкл воды, 10 мкл 10× Буфера для ПЦР, 4 мкл 50 мМ MgCl2, 2,5 мкл дНТФ (дезоксирибонуклеотидтрифосфатов) в концентрации 10 мМ, 2 мкл обратного праймера в количестве 10 пмоль (PPUN518R, 5'-ATTACCGCGGCTGCTGG-3'), 2 мкл прямого праймера в количестве 10 пмоль (PRBA338F, 5'-CGCCCGCGCGCGGCGGGCGGGGCGGGGGCACGGGGGGACTCCTACGGGAGGCAGCAG-3') и 0,8 мкл Taq в концентрации 5 Е/мкл.
c. В каждую пробирку добавляли по 98 мкл мастер-микс.
d. ПЦР проводили на обычном аппарате для ПЦР: 1 цикл при температуре 92°С в течение 2 минут; 28 циклов при температуре 92°С в течение 60 секунд, 55°С в течение 30 секунд, 72°С в течение 60 секунд; с последующим 1 циклом при температуре 72°С в течение 6 минут.
Анализ ампликонов ПЦР методом ДГГЭ
а. Исходные растворы готовили для 8% акриламидного/бисакриламидного геля в 40% и 60% денатурирующих растворах:

b. Стеклянные планшеты и разделители собирали согласно инструкции к системе DCode (Bio-Rad).
c. Для получения и заливки 8% акриламидного/бисакриламидного геля с параллельным градиентом с применением 40% и 60% денатурирующих растворов использовали следующую процедуру:
- По 20 мл 40% и 60% денатурирующих растворов отмеряли в 2 отдельных лабораторных стаканах, подписанных «с низкой плотностью» и «с высокой плотностью», соответственно;
- В каждый раствор добавляли по 200 мкл 10% персульфата аммония (ПСА);
- В каждый раствор добавляли по 20 мкл TEMED;
- Растворы тщательно перемешивали посредством взбалтывания;
- Каждый раствор отбирали в отдельный шприц объемом 20 мл;
- Шприцы подсоединяли к аппарату для нанесения на гель, где было указано «с низкой плотностью» или «с высокой плотностью», для наполнения сверху;
- Примечание: Условия корректировки объема для геля размером 16×16 см с разделителями 1,0 мм составляли 18,5 мл;
- К каждому из шприцов подсоединяли Y-образную трубку, содержащую иголку на другом конце трубки;
- Иголку помещали между стеклянными планшетами;
- Медленно и равномерно выливали гель, поворачивая колесико так, чтобы обеспечить время для стабилизации градиента;
- Гелю позволяли полимеризоваться в течение нескольких часов;
- Y-образную трубку промывали струей воды.
d. Систему для электрофоретического разделения в геле предварительно нагревали в 1× буфере ТАЕ до температуры 55°С.
e. К 42 мкл продукта ПЦР добавляли 8 мкл красителя для нанесения Fermentas 6×.
f. К гелю подавали напряжение 200 В в течение 5 минут перед включением рециркуляционного насоса с целью перенести образцы из лунок в гель.
g. Электрофоретическое разделение в геле проводили в течение 14 часов при напряжении 70 В с включенным рециркуляционным насосом.
h. Гель окрашивали в 1× Sybr Gold в течение 30 минут (250 мл 1×TAE+25 мкл 10000×SybrGold).
i. Гель обесцвечивали в 1×TAE в течение 5 минут.
j. Изображения получали в УФ.
ПЦР 16S рРНК проводили с применением универсальных праймеров (область V3) с последующим анализом методом ДГГЭ с применением универсальной системы обнаружения мутаций DCode (Bio-Rad).
Секвенирование 16S рРНК
Проводили получение библиотеки секвенирования 16S рРНК, секвенирование и биоинформатическую обработку. Секвенирование ампликона гипервариабельной области V4 со спаренными концами проводили с применением системы Illumina® MiSeq® (250 циклов). С применением ресурса QIIME и скриптов пользователя последовательности фильтровали по качеству. Считываемые фрагменты со спаренными концами собирали и проводили поиск в эталонной базе данных Greengenes, кластеризованной на 97% согласно алгоритму UCLUST. После нормирования данных расстояние между образцами измеряли с применением взвешенного расстояния Unifrac в отношении данных об изобилии OTU (операционных таксономических единиц) (использует различия изобилия таксонов между образцами с применением попарного нормирования посредством разделения суммы различий на сумму всех изобилий) и данных о частоте невзвешенного расстояния Unifrac (учитывает только наличие/отсутствие таксонов).
Амплификация ДНК человека из очищенных образцов фекалий, хранившихся в композиции согласно настоящему изобретению
Стабильность ДНК человека в образцах фекалий, собранных в композицию согласно настоящему изобретению (подробно описано ниже) и хранившихся при комнатной температуре в течение 2 недель перед экстракцией суммарной ДНК (с помощью набора для выделения ДНК MoBio PowerSoil или PowerFecal), оценивали методом ПЦР в режиме реального времени или методом количественной ПЦР (кПЦР) с применением праймеров, нацеленных на уникальную копию гена тимидилатсинтазы человека (локус TYMS; NM001071.2). Для каждой реакции 50 нг очищенной ДНК амплифицировали в объеме 25 мкл, содержащем: 1× Буфер для ПЦР (20 мМ Tris, 50 мМ КС1), 2 мМ MgCb, 200 мкМ дНТФ (Invitrogen), 50 мкг/мл БСА (Sigma Aldrich), 1 мкМ красителя SYT09 (Invitrogen), 0,4 мкМ каждого из праймеров hTSml43F (5'-GCCCTCTGCCAGTTCTA-3') и hTSml43R (5'-TTCAGGCCCGTGATGT-3'; Invitrogen), 1 Е Taq-полимеразы (Invitrogen). Условия амплификации для мишени TS143 составляли: 1 цикл при температуре 95°С в течение 5 минут; 35 циклов при температуре 95°С в течение 20 секунд, 55°С в течение 20 секунд, 72°С в течение 30 секунд; с последующим 1 циклом при температуре 72°С в течение 10 минут. Программа кривой плавления была добавлена и состояла из: 1 цикла при температуре 95°С в течение 30°секунд со скоростью изменения 4,4°С/секунду (без детекции), 72°С в течение 10 минут со скоростью изменения 2,2°С/секунду (без детекции), 95°С со скоростью изменения 0,11°С/секунду (непрерывная детекция). Образцы ДНК анализировали в трех повторах на приборе Corbett Rotorgene RG-6000, и значения Ct для каждого образца рассчитывали с применением программного обеспечения Rotorgene 6000 серии 1.7. Значение Ct означает номер дробного цикла в момент, когда кривая амплификации пересекла порог обнаружения. Посредством установления пороговой линии и расчета пересечения с каждой кривой образца устанавливают значения Ct для каждого образца. Пороговую линию устанавливают в экспоненциальной фазе анализа значительно выше фонового уровня во избежание шума и ниже появления сигнала плато в поздних циклах. Как правило, значение Ct обратно пропорционально количеству ДНК в образце. ΔCt представляет собой различие в значениях Ct, полученных от двух аликвот, отобранных от одного образца в разное время, например, в моменты времени Т=0 и Т=14 дней после сбора образца.
ПРИМЕР 1 - Сравнение различных хелатирующих средств в композициях для стабилизации ДНК в образцах фекалий
В связи с большим количеством нуклеаз в фекалиях, которые преимущественно имеют бактериальное происхождение, авторы настоящего изобретения в процессе разработки композиции согласно настоящему изобретению проводили эксперименты с различными хелатирующими средствами и их концентрациями.
Композиции, описанные в данном примере, содержали 23,5% этанола, 0,5% SDS и 0,1% Antifoam А вместе с EDTA или CDTA в различных количествах, и были забуферены до рН 11 с применением 50 мМ β-аланина. В данном и последующих примерах содержание этанола и Antifoam А выражено в (% об./об.), и содержание других компонентов (SDS, триклозана) выражено в (% масс./об.).
В отношении фигуры 2, фекалии были собраны здоровым донором, и образцы массой 400 мг гомогенизировали в различных стабилизирующих растворах или хранили без стабилизирующего буфера (нестабилизированные) в течение 14 дней при комнатной температуре (к.т., 19-23°С) перед экстракцией ДНК с применением коммерчески доступного набора (набор для выделения ДНК PowerSoil или PowerFecal, MoBio). При сравнении качества или целостности очищенной ДНК в момент времени Т=0 и Т=14 дней агарозный гель однозначно демонстрирует, что высокомолекулярная ДНК в необработанных фекалиях в значительной степени деградирует в процессе хранения при к.т.(контроль, последние 2 дорожки на агарозном геле), образуя размытость на геле. Образцы фекалий (400 мг) от того же донора также гомогенизировали в: 1) композиции согласно настоящему изобретению, содержащей возрастающие количества CDTA (150, 300, 500 мМ); и 2) композиции согласно настоящему изобретению, в которой CDTA заменяли на EDTA (150,300, 500 мМ).
Неожиданно, во всех концентрациях (150, 300, 500 мМ), исследованных с образцами фекалий, CDTA превосходила по характеристикам EDTA при стабилизации высокомолекулярной ДНК как в свежесобранных образцах (Т=0), так и после выдерживания образцов при к.т. в течение 14 дней (фигура 2). Фактически, EDTA, но не CDTA, оказалась неожиданно пагубной для стабилизации (и экстракции) высокомолекулярной ДНК в концентрациях, превышающих 150 мМ.
Кроме того, сравнение более высоких концентраций (150, 300 и 500 мМ) EDTA и CDTA (таблица 4) поддерживает неожиданное открытие, что CDTA превосходит EDTA при стабилизации профилей микробиома, что подтверждается результатами ПЦР гена бактериальной 16S рРНК и анализа методом ДГГЭ ампликонов, как описано в разделе «Материалы и методы» выше. Через 14 и 30 дней при к.т. ДНК из образцов фекалий, которые хранили в композиции согласно настоящему изобретению с CDTA, сохраняла высокие проценты подобия с контрольными образцами, обработанными в момент времени Т=0. Напротив, профиль микробиома ДНК из тех же фекалий, которые хранили в композиции согласно настоящему изобретению, содержащей EDTA, продемонстрировал возрастающее различие с течением времени при к.т. по сравнению с контрольными образцами (обработанными в момент времени Т=0; таблица 4).

Следовательно, CDTA неожиданно превзошла по рабочим характеристикам EDTA с точки зрения способности стабилизировать интактную высокомолекулярную ДНК высокого качества и мгновенно фиксировать профиль микробиома в сложных негомогенных фекалиях. Таким образом, хелаторы, такие как CDTA, с константой диссоциации более высокой, чем у EDTA, обеспечивают наилучшую стабилизацию ДНК в биологических образцах, таких как образцы фекалий, и являются в особенности предпочтительными для применения в композициях, описанных в настоящей заявке. Данная способность стабилизировать образцы в момент сбора образца позволит устранить значительные межлабораторные несоответствия, наблюдаемые на сегодняшний день между исследованиями и в рамках каждого исследования.
ПРИМЕР 2 - Роль рН и хелатирующих средств в стабилизации образца фекалий в композиции согласно настоящему изобретению
Сложные взаимосвязи между перемешиванием образца фекалий, рН и концентрацией хелатирующего средства исследовали для определения эффекта данных параметров на стабильность профиля микробиома, которую подтверждали результатами ПЦР гена бактериальной 16S рРНК и анализа ампликонов методом ДГГЭ.
В первом из четырех экспериментов здоровый донор собирал фекалии и переносил по 400 мг фекалий в четыре пробирки, каждая из которых содержала один шарик из нержавеющей стали диаметром 7,9 мм и 2 мл композиции «104В рН 9,5» (300 мМ CDTA, 23,5% этанола, 0,5% SDS, 0,1% Antifoam А, рН 9,5) или «104В рН 11» (300 мМ CDTA, 50 мМ β-аланина, 23,5% этанола, 0,5% SDS, 0,1% Antifoam А, рН 11). Образцы в пробирках оставляли без воздействия (без перемешивания) или гомогенизировали посредством встряхивания рукой (с перемешиванием), а затем направляли в лабораторию при температуре окружающей среды. В течение 3-4 часов после сбора образца из каждой пробирки отбирали аликвоту 250 мкл для экстракции ДНК (Т=0), а затем образцы подвергали воздействию стресс-условий посредством хранения при температуре 30°С в течение 24 часов с последующим хранением при температуре -20°С в течение 11 дней (Т=11) перед экстракцией ДНК из второй аликвоты. Очищенную ДНК количественно определяли, а затем принимали решение относительно профилей бактериального сообщества или фингерпринтов с применением ДГГЭ для отделения ампликонов ПЦР гена 16S рРНК. Проценты подобия между образцами (дорожками на геле ДГГЭ) по сравнению с контрольным образцом при Т=0 рассчитывали для каждой композиции отдельно с применением программного обеспечения Syngene GeneTools (см. «Материалы и методы»).
Фигура 3 иллюстрирует улучшенные проценты подобия или стабильности профиля микробиома между образцами «день 11 без перемешивания» и образцами «день 0 с перемешиванием», когда рН композиции согласно настоящему изобретению увеличивали с 9,5 до 11; данный результат свидетельствует, что рН 11 обеспечивает дополнительную стабильность ДНК по сравнению с рН 9,5. Также в образцах «день 11 с перемешиванием» в пробирках с применением средства гомогенизации согласно настоящему изобретению, плотного стального шарика, последовательно наблюдалось улучшение стабильности профиля микробиома по сравнению с образцами «день 11 без перемешивания» при обоих исследованных значениях рН и, в частности, при рН 11.
Во втором эксперименте исследовали взаимосвязь между рН и концентрацией CDTA. Аликвоты фекалий здорового донора (400 мг) переносили в пробирки, содержащие металлический шарик из нержавеющей стали диаметром 7,9 мм и 2 мл одной из трех композиций: 1) 104В рН 9,5 (как описано выше); 2) 50 мМ CDTA, 50 мМ β-аланина, 23,5% этанола, 0,5% SDS, 0,2% Триклозана, 0,1% Antifoam А, рН 11,5; и 3) 50 мМ CDTA, 23,5% этанола, 0,5% SDS, 0,2% Триклозана, 0,1% Antifoam А, рН 9,5. Образцы гомогенизировали ручным перемешиванием и направляли в лабораторию при температуре окружающей среды, где отбирали аликвоту Т=0 (250 мкл) и экстрагировали ДНК. Оставшиеся образцы хранили при комнатной температуре в течение 4 и 14 дней, и проводили отбор аликвот и экстракцию ДНК в каждой временной точке.
Анализ методом электрофореза в агарозном геле позволил выяснить, что композиция 300 мМ CDTA при рН 9,5 (104В рН 9,5) стабилизировала высокомолекулярную ДНК в течение по меньшей мере 14 дней и демонстрировала превосходящую стабилизацию высокомолекулярной ДНК, чем две другие композиции, содержащие композицию 50 мМ CDTA при рН 9,5 или 11,5 (данные не показаны). Однако наличие интактной высокомолекулярной ДНК не указывает достоверно на то, что была достигнута мгновенная фиксация микробиома. Без эффективного стабилизирующего раствора виды бактерий могут реплицироваться или гибнуть без изменения суммарного количества, а также качества ДНК. Вследствие этого профили микробиома образцов изучали методом ПЦР гена бактериальной 16S рРНК и анализа ампликонов методом ДГГЭ, как описано в разделе «Материалы и методы» выше.
В отношении фигуры 4 и таблицы 5, анализ методом ДГГЭ позволил выяснить, что композиция 300 мМ CDTA при рН 9,5 демонстрировала превосходную стабилизацию профиля микробиома (94-96% подобия по сравнению с контролем t=0) в течение по меньшей мере 14 дней при комнатной температуре. Эффективность композиции 300 мМ CDTA при рН 9,5 по стабилизации профиля микробиома неожиданно превосходила таковую композиции 50 мМ CDTA при рН 9,5, которая демонстрирует только 15% подобия по сравнению с контролем t=0 через 14 дней при комнатной температуре. Композиция 50 мМ CDTA с рН 11,5, как представляется, «спасла» ДНК от довольно значительной деградации по сравнению с профилем микробиома, наблюдаемым для композиции 50 мМ CDTA с рН 9,5.
Следовательно, комбинация высокой концентрации CDTA и значительного щелочного рН необходима для стабилизации профиля микробиома образцов фекалий.
Таблица 5: Анализ профиля микробиома образцов фекалий, которые хранили в различных композициях в течение 14 дней при комнатной температуре.
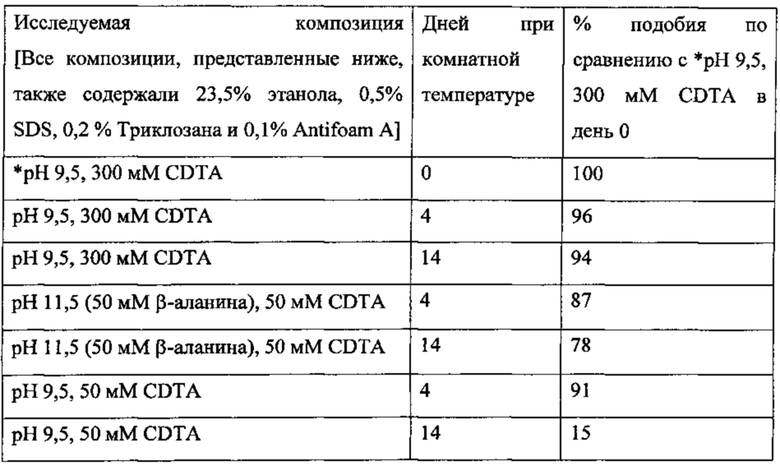
В третьем эксперименте также исследовали взаимосвязь между рН и концентрацией CDTA в композиции согласно настоящему изобретению. Аликвоты фекалий здорового донора (400 мг) переносили в пробирки, содержащие металлический шарик из нержавеющей стали диаметром 7,9 мм и 2 мл одной из двух композиций: 1) 300 мМ CDTA, 23,5% этанола, 0,5% SDS, 0,2% Триклозана, 0,1% Antifoam А, рН 9,5; и 2) 50 мМ CDTA, 23,5% этанола, 0,5% SDS, 0,2% Триклозана, 0,1% Antifoam А, рН 7,4. Образцы гомогенизировали ручным перемешиванием и направляли в лабораторию в условиях окружающей среды, где отбирали аликвоту Т=0 (250 мкл) и экстрагировали ДНК. Оставшиеся образцы хранили при комнатной температуре в течение 4 дней перед тем, как отбирали и обрабатывали вторую аликвоту.
Анализ методом электрофореза в агарозном геле позволил выяснить, что композиция 300 мМ CDTA при рН 9,5 стабилизировала интактную высокомолекулярную ДНК в фекалиях в большей степени, чем композиция 50 мМ CDTA при рН 7,4, в течение более 4 дней при к.т., и анализ методом ДГГЭ свидетельствует, что данная композиция также демонстрировала превосходящую стабилизацию профиля микробиома фекалий (97% подобия с Т=0 по сравнению с 10% подобия с Т=0, соответственно - см. фигуру 5 и таблицу 6). Стабильность профиля микробиома фекалий, гомогенизированных с композицией с рН 7,4 (10% подобия с Т=0 через 4 дня при к.т.), также была значительно более низкой, чем стабильность профиля микробиома фекалий, гомогенизированных с композицией 50 мМ CDTA при рН 9,5 (91% подобия с Т=0 через 4 дней при к.т., как отмечено выше).

В четвертом эксперименте исследовали взаимосвязь между рН при фиксированной высокой концентрации CDTA в композиции согласно настоящему изобретению. Аликвоты фекалий здорового донора (400 мг) переносили в пробирки, содержащие металлический шарик из нержавеющей стали диаметром 7,9 мм и 2 мл одной из двух композиций: 1) 300 мМ CDTA, 23,5% этанола, 0,5% SDS, 0,2% Триклозана, 0,1% Antifoam А, рН 7,4; и 2) 300 мМ CDTA, 23,5% этанола, 0,5% SDS, 0,2% Триклозана, 0,1% Antifoam А, рН 9,5. Образцы гомогенизировали ручным перемешиванием и направляли в лабораторию в условиях окружающей среды, где отбирали аликвоту в моменты времени Т=0,24 часа и 9 дней (250 мкл) и экстрагировали ДНК.
Анализ методом электрофореза в агарозном геле продемонстрировал, что образцы фекалий, перемешанные с композицией при рН 9,5, демонстрировали превосходящую стабилизацию высокомолекулярной ДНК по сравнению с образцами фекалий, перемешанными с композициями при рН, близком к нейтральному (рН 7,4), даже при наличии высоких (300 мМ) концентраций CDTA (см. фигуру 6).
Взятые вместе с результатами, представленными в примере 1, данные эксперименты свидетельствуют, что оптимальные условия для сохранения интактной высокомолекулярной ДНК и стабильных профилей микробиома при хранении при комнатной температуре наблюдаются, когда значение рН композиции превышает или равно 9,5, предпочтительно, приблизительно рН 10,5-11,5 или приблизительно рН 11, и концентрация CDTA превышает 50 мМ, предпочтительно, по меньшей мере приблизительно 150 мМ, наиболее предпочтительно, приблизительно 300 мМ.
Пример 3 - Стабилизация фекалий после перемешивания со стеклянными бусинами и бусинами из нержавеющей стали
Фекалии от здорового донора переносили в аликвотах массой по 400 мг в четыре пробирки, содержащие: 1) 2 мл стабилизирующего раствора 104В рН 9,5 (как определено выше) и четыре стеклянные бусины диаметром 4 мм плюс десять стеклянных бусин диаметром 2 мм; 2) 2 мл стабилизирующего раствора 104В рН 11 (как определено выше) и четыре стеклянные бусины диаметром 4 мм плюс десять стеклянных бусин диаметром 2 мм; 3) 2 мл стабилизирующего раствора 104В рН 9,5 и один шарик из нержавеющей стали диаметром 6 мм; 4) 2 мл стабилизирующего раствора 104В рН 11 и один шарик из нержавеющей стали диаметром 6 мм. Все четыре пробирки донор встряхивал рукой до перемешивания и направлял в лабораторию в условиях окружающей среды. В течение 3-4 часов после сбора образца ДНК экстрагировали, количественно определяли, и по 80 нг каждого очищенного образца анализировали на агарозном геле (см. «Материалы и методы» и фигуру 7). Перед отбором аликвоты образцы, содержащие стеклянные бусины, встряхивали на вортексе, и образцы, содержащие шарик из стали, встряхивали.
Данный пример демонстрирует преимущество применения шарика для перемешивания из нержавеющей стали для стабилизации интактной высокомолекулярной ДНК (>23 Kb) в свежесобранных фекалиях при комнатной температуре. Перемешивание образцов фекалий в лабораторных пробирках, содержащих композиции согласно настоящему изобретению при рН 9,5 и 11 и один плотный шарик из нержавеющей стали (фигура 7В), оказалось более эффективным, чем перемешивание с множеством стеклянных бусин двух размеров (фигура 7А), при сравнении качества высокомолекулярной ДНК на агарозных гелях. Ручное перемешивание фекалий с множеством стеклянных бусин и настоящей композицией (104В рН 9,5) заняло значительно больше времени, чем перемешивание с шариком из нержавеющей стали, и последний вариант продемонстрировал превосходящий результат с точки зрения сохранения интактной высокомолекулярной ДНК. Улучшение целостности ДНК в образцах, перемешанных со стеклянными бусинами, неожиданно наблюдалось даже в более щелочной (рН 11) композиции; данный результат свидетельствует, что важными являются как средство перемешивания/гомогенизации, так и рН стабилизирующего раствора.
Пример 4 - Допустимое отклонение объема композиции согласно настоящему изобретению
Фекалии представляют собой негомогенный биологический образец, внешний вид или плотность которого может значительно варьировать в зависимости от состояния пищеварительной системы, рациона и общего состояния здоровья. В норме стул является полутвердым, со слизистым покрытием. Бристольская шкала или классификация стула представляет собой медицинское вспомогательное средство, разработанное для подразделения формы фекалий человека на семь категорий, которые варьируют от типа 1 (отдельные твердые комки, похожие на орехи) до типа 7 (полностью жидкий стул, без твердых кусков, содержащий более 90% воды). Как правило, фекалии состоят приблизительно из 70-80% воды, 20-30% твердого вещества, но данный процент варьирует в зависимости от типа образца (1-7) или времени пребывания фекалий в кишечнике. Различия между фекалиями по твердости и содержанию воды являются существенной проблемой для сбора фекалий и однородного полного перемешивания со стабилизирующим раствором. Образцы 1-3 типов в особенности сложно полностью деспергировать в стабилизирующем растворе для получения гомогенной жидкости без разбавления образца (и, следовательно, ДНК), слишком большого для проведения последующего анализа. Также, образцы 1-3 типов характеризуются большей тенденцией по сравнению с другими типами образцов медленно впитывать жидкость, например, стабилизирующий раствор, что приводит к образованию густой полутвердой суспензии, которую сложно пипетировать в лаборатории. Более высокое содержание воды в образцах 4-7 типов и более мягкая консистенция делают данные образцы легче поддающимися перемешиванию в стабилизирующем растворе и пипетированию. Различия в процессе обработки могут также возникнуть в зависимости от способа (или коммерческого набора), который используют для экстракции ДНК из образцов фекалий.
Учитывая негомогенную природу фекалий, надежность композиции согласно настоящему изобретению при стабилизации суммарной интактной высокомолекулярной ДНК сравнивали в следующих экспериментах по определению соотношения. В двух отдельных экспериментах три здоровых донора собирали образцы фекалий (400 мг) в пробирки, содержащие шарик из нержавеющей стали диаметром 7,9 мм и различные объемы стабилизирующего раствора 104В рН 11 (как определено выше), для достижения следующих соотношений фекалии: стабилизирующий раствор - 1:3, 1:4, 1:5, 1:6, 1:8 и 1:10. Примечание: на гелях указано как «Фактическое соотношение», так и целевое «Соотношение», поскольку очень сложно многократно отобрать строго по 400 мг фекалий с помощью неприспособленного инструмента. Пробирки взвешивали до и после сбора образца для определения точного количества собранных фекалий на единицу композиции. Пробирки встряхивали рукой, и аликвоты объемом 250 мкл отбирали в момент времени Т=0 (фигура 8А) и через 6 дней (фигура 8В), 7 дней (фигура 8С), 14 дней (фигура 8D), 1 месяц (фигура 8Е) и 2 месяца (фигура 8F) при комнатной температуре. В некоторых случаях экстрагировали две аликвоты, чтобы продемонстрировать воспроизводимость повторностей (фигура 8А, С-F). ДНК экстрагировали, и по 80 нг ДНК анализировали на 1% агарозных гелях (фигуры 8А-F). На дорожки, отмеченные звездочками (*), было нанесено менее 80 нг ДНК в связи с тем, что в некоторых образцах концентрация ДНК после очистки составляла менее 10 нг/мкл. В данных экспериментах также проводили анализ на гелях ДГГЭ (фигура 10А и 10 В), и проценты подобия анализировали для определения стабильности профиля микробиома в данных образцах.
Данный пример демонстрирует, что широкий диапазон соотношений фекалии: стабилизирующий раствор приводил к получению интактной высокомолекулярной ДНК в образцах от момента времени Т=0 до по меньшей мере 2 месяцев хранения при комнатной температуре (фигуры 8А-F). Всего от 0,8 мл до 5,4 мл композиции согласно настоящему изобретению успешно стабилизировали ДНК и профили микробиома, которые содержатся в 400 мг фекалий, в течение по меньшей мере 2 месяцев в данных условиях (фигуры 8А-F и 10А-В). Данный широкий «рабочий» диапазон дает исследователю уверенность, что доноры смогут поместить значительно варьирующие количества образца фекалий в пробирки, содержащие фиксированный объем стабилизирующего раствора, и образец будет стабильным в течение по меньшей мере 2 месяцев при комнатной температуре. Анализ аликвот образцов в трех повторах с применением ДГГЭ (фигура 9) продемонстрировал, что профиль микробиома в аликвотах, отобранных от одного образца фекалий, был весьма согласованным (≥97%). Кроме того, анализ гелей ДГГЭ, полученных при анализе образцов в экспериментах по определению соотношения, продемонстрировал, что профили микробиома были в высшей степени стабилизированными (≥88% в момент времени 7 дней; ≥91% в момент времени 14 дней; ≥79% в момент времени 2 месяца) в широком диапазоне соотношений фекалии: стабилизирующий раствор композиции согласно настоящему изобретению (от 1:1,8 до 1:10,6) в течение длительных периодов времени при комнатной температуре (фигура 10А и 10В).
Вследствие этого предпочтительные соотношения фекалии: стабилизирующий раствор могут варьировать от приблизительно 1:1 до 1:20, предпочтительно, от 1:1 до 1:10, более предпочтительно, от 1:3 до 1:8 и, наиболее предпочтительно, соотношение фекалии: стабилизирующий раствор составляет приблизительно 1:5.
Композиции, описанные в настоящей заявке, позволяют исследователям коренным образом изменить процесс сбора больших количеств образцов фекалий. Исследователям больше не нужно ограничивать исследования в связи со стоимостью и логистикой доставки образцов на сухом льду или хранением сотен тысяч образцов фекалий в морозильных камерах в течение месяцев. Образцы, собранные в пробирки, содержащие композицию согласно настоящему изобретению, можно перевозить при температуре окружающей среды в пупырчатом конверте и хранить при комнатной температуре в лаборатории для обработки партии по усмотрению исследователя.
Пример 5 - Стабилизация образцов в композиции согласно настоящему изобретению и экстремальные температуры
Различные композиции, описанные в настоящей заявке, эффективно и быстро стабилизируют высокомолекулярную ДНК и профили микробиома в фекалиях здоровых доноров-людей при температуре «окружающей среды». Как отмечено выше, температура «окружающей среды» означает типичное воздействие температур, которые наблюдаются в ходе сбора, транспортирования, хранения и обработки биологических образцов. В зависимости от того, в какой точке мира собирали/транспортировали/хранили биологический образец, температуры могут легко варьировать от -20°С до 50°С, иногда в течение короткого периода времени. В данной области техники известно, что необработанные биологические образцы деградируют при данных температурах, в частности, при повышенных температурах. Существует потребность в надежном универсальном стабилизирующем растворе для биологического образца с целью поддержания ДНК в собранных образцах в состоянии, максимально близком к состоянию in vivo, т.е. для предотвращения деградации существующей интактной высокомолекулярной ДНК и/или предотвращения последующей деградации частично деградированной нуклеиновой кислоты, такой как ДНК человека, в образцах фекалий, и стабилизации профиля микробиома образцов фекалий.


Характеристики 6 композиций, стабилизирующих ДНК (таблица 7), разработанных авторами настоящего изобретения, исследовали и сравнивали в широком диапазоне температур окружающей среды, например, при температуре -20°С, при комнатной температуре (как правило, 19-23°С), 37°С и 50°С, со сложными, негомогенными, различающимися образцами фекалий. В первом эксперименте каждый из 2 здоровых доноров переносил по 400 мг фекалий в 6 пробирок, содержащих по 2 мл различных композиций (таблица 7) и один шарик из нержавеющей стали диаметром 7,9 мм. Пробирки встряхивали рукой для гомогенизации образцов фекалий, немедленно отбирали аликвоту (250 мкл) для экстракции ДНК (Т=0), а затем пробирки хранили при температуре 37°С в течение 7 и 21 дня.
Фигуры 11А и 11В демонстрируют, что все исследованные композиции стабилизировали интактную высокомолекулярную ДНК в течение по меньшей мере 3 недель, когда образцы фекалий хранили при температуре 37°С. Через 21 день при температуре 37°С концентрация ДНК, выделенной из образцов стула, которые хранили в композициях CBS, CBSA1 и CBSA2, была ниже, чем в образцах в других композициях, что приводило к появлению бледных полос на агарозных гелях в случае доноров А и В (фигура 11А и 11В). Неожиданно анализ методом ДГГЭ (фигура 12А и 12В) продемонстрировал, что профиль микробиома в данных образцах был также стабильным в течение первой недели при температуре 37°С, оптимальной температуре для роста бактерий фекалий, и начал изменяться до временной точки 21 день. Помимо 300 мМ CDTA, забуференной до рН 11, этанол представляется благоприятным для стабилизации или восстановления как высокомолекулярной ДНК, так и профиля микробиома.
Во втором эксперименте каждый из 3 здоровых доноров переносил по 400 мг фекалий в 3 пробирки, содержащие по 2 мл 104В и один шарик из нержавеющей стали диаметром 7,9 мм. Пробирки встряхивали рукой для гомогенизации образцов фекалий, немедленно отбирали аликвоту (250 мкл) для экстракции ДНК (Т=0), а затем пробирки хранили при температуре 50°С в течение 3 и 5 дней, при комнатной температуре в течение 1 месяца и при температуре -20°С в течение 1 месяца (фигуры 13А-Е). Фигуры 13А-Е демонстрируют, что 104В стабилизировала высокомолекулярную ДНК в течение по меньшей мере 5 дней при температуре 50°С (фигура 13В-С), 1 месяца при комнатной температуре (фигура 13D) и 1 месяца при температуре -20°С (фигура 13Е). Все образцы фекалий в трех повторах, собранные каждым донором, содержали интактную высокомолекулярную ДНК, вне зависимости от исследуемой температуры или периода времени.
В третьем эксперименте каждый из 3 здоровых доноров переносил по 400 мг фекалий в 3 пробирки, 2 из которых содержали по 2 мл 104В и СВЕ (таблица 7) и по одному шарику из нержавеющей стали диаметром 7,9 мм каждая, а третья пробирка была пустой («нет»). Пробирки со стабилизирующим раствором встряхивали рукой для гомогенизации образцов фекалий, из каждой пробирки немедленно отбирали аликвоту (250 мкл или 250 мг) для экстракции ДНК (Т=0), а затем пробирки хранили при температуре 50°С в течение 5 и 14 дней или при температуре -20°С в течение 11 дней (фигура 14А-D). Фигуры 14А-С демонстрируют, что как 104В, так и СВЕ сохраняли интактную высокомолекулярную ДНК в течение по меньшей мере 2 недель при температуре 50°С, тогда как в контрольных («нет») образцах с течением времени наблюдались признаки деградации. Неожиданно анализ методом ДГГЭ (фигура 15А и 15В) продемонстрировал, что профиль микробиома в данных образцах был также стабильным в течение 2 недель при температуре 50°С, экстремальной температуре для биомолекул, подобных ДНК. Интересно отметить, что проценты подобия были более высокими в образцах, которые хранили при температуре 50°С в течение 5 дней, а не 14 дней; данный результат свидетельствует, что длительное воздействие такой экстремальной температуры может привести к некоторой химической нестабильности ДНК самой по себе.
Фигура 14D демонстрирует, что как 104В, так и СВЕ сохраняла высокомолекулярную ДНК в образцах, хранившихся при температуре -20°С в морозильной камере (и впоследствии оттаянных) в течение по меньшей мере 11 дней. Однако при отсутствии стабилизирующего раствора при температуре -20°С в фекалиях наблюдались характерные признаки деградации ДНК. В образце донора А («нет») большинство высокомолекулярной ДНК деградировало и было представлено в виде размытости на агарозном геле. Напротив, в образцах донора В и С все еще можно было обнаружить небольшое количество высокомолекулярной ДНК; данный результат свидетельствует о различиях между донорами. Анализ образцов без стабилизирующего раствора методом ДГГЭ подтвердил, что профиль микробиома не был стабильным при температуре -20°С; % подобия контролю Т=0 для доноров А и С составил 52 и 69%, соответственно. Напротив, в 104В и СВЕ профиль микробиома был стабильным в течение 11 дней при температуре -20°С, о чем свидетельствуют высокие проценты подобия контрольным («нет») образцам (фигура 16А и 16В).
Взятые вместе данные примеры демонстрируют, что как 104В, так и СВЕ стабилизирует ДНК в образцах фекалий, которые хранили при экстремальных температурах в течение длительных периодов времени.
Пример 6 - Стабильность образцов фекалий, которые инкубировали в композиции согласно настоящему изобретению, под воздействием циклов замораживания/оттаивания
Как обсуждалось выше, в данной области техники известно, что профиль микробиома меняется, когда фекалии подвергаются воздействию всего лишь одного цикла замораживания и оттаивания с целью хранения или накопления. Данная деградация добавляет ненужную ошибку при анализе всех собранных образцов, которые транспортировали и/или хранили при температурах ниже нуля. В настоящем примере собирали фекалии от 3 здоровых доноров, и образцы по 400 мг переносили в пустые пробирки и пробирки, содержащие по 2 мл композиции согласно настоящему изобретению («104В рН 9,5»; как определено выше) со стеклянными бусинами (четыре бусины диаметром 4 мм и десять бусин диаметром 2 мм). Пробирки, содержащие стабилизирующий раствор и стеклянные бусины, интенсивно встряхивали на вортексе до полного перемешивания. После отбора аликвот по 250 мг или 250 мкл для экстракции ДНК в день 0 пробирки с образцами хранили в морозильной камере при температуре -20°С, и в течение десяти дней пять раз циклически меняли условия хранения от морозильной камеры до комнатной температуры с пребыванием образцов при каждой температуре в течение 24 часов. Пробирки с образцами оттаивали при температуре 50°С в течение 3 часов промышленным стандартным способом.
Анализ аликвот, отобранных в день 0, на агарозном геле демонстрирует, что при сборе в композицию согласно настоящему изобретению фекалии от каждого донора содержали высокомолекулярную ДНК (фигура 17). Неожиданно было обнаружено, что после воздействия 5 циклов замораживания/оттаивания (З/О) ДНК оставалась интактной (фигура 17). Анализ методом ДГГЭ подтвердил, что после 5 циклов З/О профиль микробиома образцов в композиции согласно настоящему изобретению оставался стабильным на 94% (фигура 18). В отличие от данных результатов, в незащищенных образцах наблюдалась значительная деградация профиля микробиома. После всего лишь одного цикла З/О профиль был всего лишь на 52% подобен профилю «свежесобранного образца» в день 0 до воздействия температуры -20°С. Следовательно, композиция согласно настоящему изобретению не только сохраняет интактную высокомолекулярную ДНК в течение множества циклов замораживания и оттаивания, но также стабилизирует профиль микробиома, кардинально уменьшая ошибку, вызванную данными условиями хранения.
Пример 7 - Гомогенизация образцов фекалий, собранных в композицию согласно настоящему изобретению
Как было описано выше, авторы настоящего изобретения проводили эксперименты с множеством различных материалов, которые можно использовать в стандартной коммерчески доступной лабораторной пробирке и/или пробирке для транспортирования объемом 10 мл (92 мм × 15,3 мм, внутренний диаметр приблизительно 12,9 мм) для полной и гарантированной гомогенизации образцов фекалий всех типов (типы 1-7 согласно Бристольской шкале стула). Было определено, что перемешивание следует проводить рукой и в течение относительно короткого периода времени (в пределах 180 секунд), чтобы обеспечить соблюдение донорами предписанных процедур и регулярное предоставление стабилизированных биологических образцов. Специалист в данной области техники понимает, как выбрать соответствующее средство гомогенизации для контейнеров больших или меньших, чем контейнер, который использовали в настоящих примерах (см. «Подробное описание»).
Стандартный одноразовый шприц объемом 3 мл модифицировали для сбора и переноса небольшого объемного количества фекалий в пробирку для сбора, описанную выше, содержащую композицию согласно настоящему изобретению («104В рН 11»; как определено выше) и средство гомогенизации. Коническую насадку или крепление для иголки шприца срезали для получения цилиндра постоянного диаметра. Поршень устанавливали в положение, которое облегчало сбор фиксированного количества фекалий, например, 400 мг, при помещении шприца в контейнер, содержащий фекалии. В цилиндре шприца было просверлено небольшое вентиляционное отверстие для выхода воздуха в ходе сбора образца фекалий. Шприц, наполненный образцом, переносили в открытые пробирки и надавливали на плунжер, внося 400 мг образца в пробирку, содержащую 2 мл стабилизирующего раствора и средство гомогенизации (например, шарик для гомогенизации, указанный ниже). Пробирку закрывали и встряхивали рукой в течение приблизительно 20 - 40 секунд или дольше (1-3 минут) для твердых образцов типа 1 (см. ниже). После интенсивного встряхивания образца возвратно-поступательным движением в присутствии средства гомогенизации образец фекалий распределяли в стабилизирующем растворе.
Если выбранный контейнер представляет собой лабораторную пробирку/флакон или пробирку/флакон для транспортирования, «шарик» или «сфера» для гомогенизации соответствующего размера, формы и плотности является необходимым для полного диспергирования негомогенных сложных образцов в композиции согласно настоящему изобретению. Тщательная гомогенизация собранного образца во время сбора также является важной для оптимальной стабилизации ДНК человека и микроорганизмов, которую подтверждают по наличию интактной высокомолекулярной ДНК, а также для стабилизации профиля микробиома, которую подтверждают результатами ПЦР гена бактериальной 16S рРНК и анализа ампликонов методом ДГГЭ. Как описано выше, для сферического средства гомогенизации дно лабораторной пробирки/флакона или пробирки/флакона для транспортирования также должно быть круглым, отражая форму средства гомогенизации, для предотвращения компактизации твердых частиц в мертвых пространствах внутри пробирки. Например, оптимальной гомогенизации образцов фекалий (в частности, типа 1-3) с помощью сферического средства гомогенизации очень сложно достичь с применением пробирок с коническим или с плоским дном. Сферическое средство гомогенизации не может образовать прямого контакта с конической поверхностью или с поверхностью в месте пересечения вертикальных стенок с основанием пробирки под углом 90 градусов, что вызывает компактизацию фекальных масс в данных мертвых пространствах/площадях.
В следующих таблицах 8-10 проиллюстрированы некоторые из различных коммерчески доступных материалов, исследованных авторами настоящего изобретения с целью поиска оптимального средства гомогенизации для стандартной лабораторной пробирки/пробирки для транспортирования (например, кат. №60.610, Sarstedt).

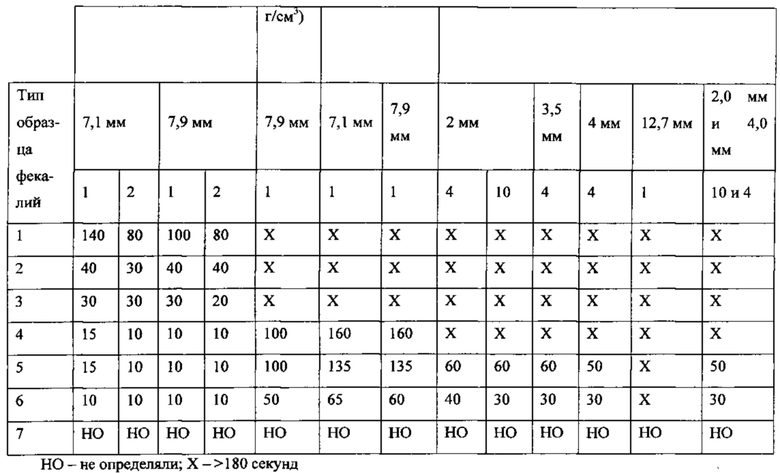
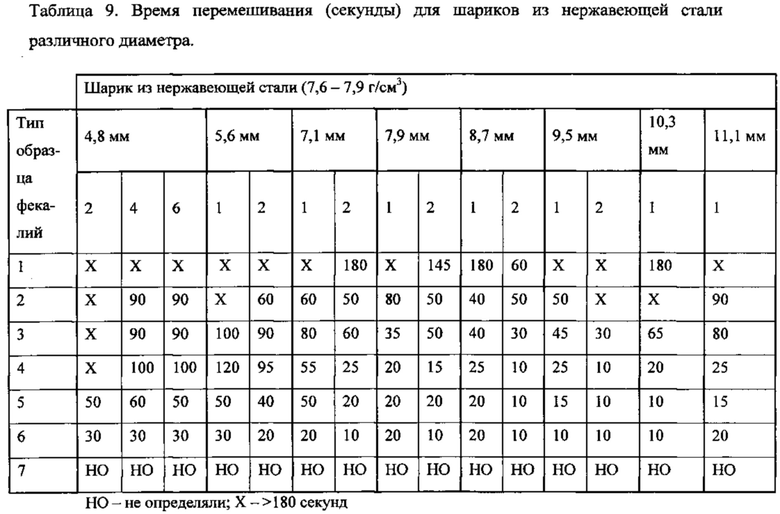

Образцы фекалий типов 1 и 2 являются очень плотными и содержат мало воды, что делает их непригодными для диспергирования рукой в композиции согласно настоящему изобретению в течение целесообразного периода времени (<3 минут) без применения средства гомогенизации. Для более мягких фекалий (типов 3-6) также требовалось средство гомогенизации, и длительность перемешивания пробирки рукой значительно уменьшалась с увеличением типа образца (таблицы 8-10). Средство гомогенизации не было необходимым для диспергирования образца типа 7 или диареи с композицией согласно настоящему изобретению. В данном случае роль «гомогенизатора» заключалась в полном разрушении и диспергировании негомогенного твердого или полутвердого образца по всему стабилизирующему раствору без применения электричества или батареек.
Важные свойства средства гомогенизации включают 1) плотность материала, 2) размер по отношению к внутреннему диаметру контейнера для биологического образца и 3) форму по отношению к контейнеру. Частицы (<1,2 мм) и небольшие бусины (≤4 мм) из стекла (приблизительно 2,0-4,5 г/см3)/поли(метил метакрилата, или ПММА (приблизительно 1,2 г/см3)/диоксида кремния (приблизительно 1,6-2,0 г/см3)/двуокиси циркония (приблизительно 6,02 г/см3)/ацетата целлюлозы (приблизительно 1,3 г/см3)/полиэтилена (приблизительно 0,9-1,3 г/см3) не соответствовали по размеру и не были достаточно плотными, чтобы выступать в качестве гомогенизатора для фекалий типа 1-4 в стандартной лабораторной пробирке, внутренний диаметр которой составляет 12,9 мм (таблица 8). Важно отметить, что даже большие шарики диаметром 7,9 мм, изготовленные из оксида алюминия (3,95 г/см3), или диаметром 7,1-7,9 мм, изготовленные из нитрида кремния (3,21 г/см3), а также стеклянные шарики диаметром 12,7 мм не были способны диспергировать образцы фекалий типа 1-3 (400 мг) в 2 мл композиции согласно настоящему изобретению менее чем за 180 секунд (таблица 8). Неожиданно было установлено, что даже через 180 секунд встряхивания пробирки тяжелое твердое вещество оставалось интактным в композиции согласно настоящему изобретению. Данные экспериментальные результаты привели к исследованию более плотных материалов, т.е. материалов с плотностями >3,95 г/см3. К сожалению, шарики с плотностями от 3,95 г/см3 до 7,6 г/см3 не были коммерчески доступными, и вследствие этого такие шарики невозможно было исследовать с образцами фекалий.
Затем шарики из нержавеющей стали (7,6-7,9 г/см3, таблицы 9 и 10) и карбида вольфрама (15,63 г/см3, таблица 8) исследовали с образцами фекалий массой 400 мг в 2 мл композиции согласно настоящему изобретению в круглодонной пробирке. Неожиданно было обнаружено, что даже тяжелые подобные орехам образцы фекалий типа 1 гомогенизировались с применением шариков из карбида вольфрама диаметром 7,1-7,9 мм и шариков из нержавеющей стали диаметром 7,1-8,7 мм за ≤140 и ≤180 секунд, соответственно. Образцы типа 2 гомогенизировались с применением шариков из карбида вольфрама диаметром 7,1-7,9 мм и шариков из нержавеющей стали диаметром 7,1-8,7 мм за ≤40 секунд и ≤80 секунд, соответственно. Образцы типа 3 гомогенизировались с применением шариков из карбида вольфрама диаметром (7,1-7,9 мм) и шариков из нержавеющей стали диаметром (7,1-8,7 мм) за ≤30 и ≤80 секунд, образцы типа 4 - за ≤15 и ≤55 секунд, образцы типа 5 - за ≤15 и 50 секунд, и образец типа 6 - за ≤10 и ≤22 секунд, соответственно.
Аналогично, шарики с плотностями от 7,9 г/см3 до 15,63 г/см3 невозможно было получить или исследовать; однако специалист в данной области техники может ожидать, что такое средство гомогенизации в диапазоне размеров 7,1-8,7 мм, безусловно, разрушит образцы фекалий менее чем за 180 секунд. Исключительно благодаря стоимости и простоте получения шарики из нержавеющей стали были предпочтительнее шариков из карбида вольфрама, и их оптимальный диаметр составлял 7,1-8,7 мм. Добавление второго шарика того же размера в большинстве случаев оказывалось полезным для уменьшения времени перемешивания (таблицы 8 и 9). В некоторых случаях комбинация шариков более одного размера оказывалась полезной для уменьшения времени, необходимого для гомогенизации образцов фекалий (таблица 10).
Учитывая то, что шарики диаметром 7,1-8,7 мм демонстрировали наилучшие характеристики в пробирках с внутренним диаметром 12,9 мм, промежуток приблизительно 2,1-2,9 мм с каждой стороны шарика обеспечивал оптимальное соответствие пробирке для гомогенизации образца за короткий период времени. Когда диаметр шариков из нержавеющей стали составлял ≤5,6 мм или ≥9,5 мм, время перемешивания образцов фекалий тяжелого типа (1-4) возрастало. Следовательно, с учетом данных результатов для образцов фекалий, консистенция которых варьировала от твердой до жидкой, в примерах, описанных в настоящей заявке, в качестве средства гомогенизации предпочтительно применяли шарики из нержавеющей стали диаметром 7,9 мм, если не указано обратное.
Пример 8 - Стабилизация профиля микробиоты кишечника с применением композиции согласно настоящему изобретению
Анализ микробиоты кишечника представляет значительный интерес для исследователей, изучающих полезные и вредные влияния микроорганизмов на здоровье человека. При проведении любого анализа микробиоты кишечника важно точно получить «мгновенную фиксацию» профиля микробиоты (т.е. гарантировать, что относительное изобилие операционных таксономических единиц [OTU] остается неизменным с момента сбора до момента обработки образца и анализа), который отражает состояние in vivo; таким образом, в таких исследованиях первостепенное значение имеет стабилизация образца в момент сбора. Применяемые на сегодняшний день способы сбора образцов стула и анализа микробиоты включают транспортирование образцов при температуре окружающей среды, 4°С или в замороженном состоянии. Однако данные способы потенциально могут подвергнуть образцы воздействию температур, несовместимых со стабилизацией микробиома; также ранее было показано, что замораживание образцов стула изменяет соотношение Firmicutes к Bacteroides (Bahl et al., (2012) FEMS Microbiol Letters 329:193-197).
В данном примере стабильность микробиома оценивали с применением чувствительного коммерчески доступного способа секвенирования гипервариабельной области V4 16S рРНК. Для данного исследования каждый из четырех доноров собирал один образец стула и помещал равные количества образца (по 400 мг) в три пробирки без стабилизирующего раствора и шесть пробирок со стабилизирующим раствором (300 мМ CDTA, 0,5% SDS, 23,5% этанола, 0,1% Antifoam А, 0,2% Триклозана, рН 9,5) и с шариком для перемешивания из нержавеющей стали диаметром 7,9 мм. Доноры транспортировали образцы в лабораторию при температуре окружающей среды, где отбирали аликвоту Т=0 (250 мкл или 250 мг) и экстрагировали ДНК с применением набора для выделения ДНК PowerFecal™ (MoBio Laboratories). Один образец от донора для каждого условия стабилизации хранили при каждой из исследуемых температур (-20°С, 4°С, 23°С, 37°С -только в стабилизирующем растворе) в течение 3 и 14 дней после экстракции ДНК. Один образец в стабилизирующем растворе подвергали воздействию пяти циклов замораживания-оттаивания.
В указанные временные точки ДНК из аликвот экстрагировали и направляли для получения библиотеки секвенирования 16S рРНК, секвенирования и биоинформатической обработки. Секвенирование ампликона гипервариабельной области V4 со спаренными концами проводили с применением системы Illumina® MiSeq® (250 циклов).
На фигурах 19 и 20 представлены данные, свидетельствующие, что образцы, которые полностью хранились в стабилизирующем растворе, характеризовались высокой степенью подобия изобилия OTU.
На фигуре 19 анализ главных координат (РСоА) на основании значений несхожести взвешенного расстояния Unifrac у двух доноров (В и D) продемонстрировал, что в образцах, которые хранили в стабилизирующем растворе при различных температурах (-20°С, 4°С, температура окружающей среды, 37°С) и в течение различных периодов времени (3 и 14 дней), наблюдался высокий уровень подобия изобилия OTU, что подтверждалось строгой кластеризацией на графике РСоА (образцы, хранившиеся в стабилизирующем буфере, имеют условные номера, которые начинаются с 4-9, например, D4 и В4, и сгруппированы в круги «Со стабилизатором» для каждого донора). Напротив, в случае образцов, которые хранили без стабилизирующего раствора (образцы, условные номера которых начинаются с 0 - 3, например, D3-1 и В3-1, и которые сгруппированы в круги «Без стабилизатора» для каждого донора), наблюдалась утрата подобия изобилия OTU, что подтверждалось большими расстояниями между образцами. Важно отметить, что при оценке наличия или отсутствия OTU наблюдалась статистически значимая разница между стабилизированными образцами и образцами без стабилизирующего раствора у всех четырех доноров (р=0,002, 0,002, 0,002 и 0,009, соответственно, измерение Unifrac). Наибольшие изменения профиля наблюдались в образцах, которые хранили при температуре -20°С без стабилизирующего раствора (образцы В2-1, В2-2, D2-1 и D2-2 на графиках РСоА), которые значительно отличались от образцов, которые хранили при температуре -20°С в стабилизирующем растворе (р=0,028, измерение взвешенного Unifrac); данный результат демонстрирует, что хранение образцов в новом стабилизирующем растворе может предотвратить изменения микробного профиля, которые наблюдались в нестабилизированных замороженных образцах (фигура 19).
На фигуре 20 пропорциональное изобилие на уровне семейств демонстрирует изменение в композиции образцов, которые хранили без стабилизирующего раствора при различных температурах в течение различного времени (3 и 14 дней). В частности, в образцах донора D без стабилизирующего раствора наблюдались увеличение количества Lachnospiraceae, Ruminococcaceae и Prevotellaceae и утрата Bacteroidaceae по сравнению с исходным уровнем. Напротив, образцы, которые хранили со стабилизирующим раствором при различных температурах и в течение различных периодов времени, сохраняли микробную композицию образца по сравнению с образцом исходного уровня.
Полученные данные свидетельствуют, что для надежного соотнесения изменений микробиоты кишечника с фенотипом, представляющим интерес, важно располагать воспроизводимым способом стабилизации профиля в момент сбора, поскольку применяемые на сегодняшний день способы стабилизации на основе температуры не способны обеспечить эффективность. Стабилизация химическим способом, продемонстрированная в настоящей заявке, обладает способностью поддерживать профиль микробиоты кишечника in vivo (т.е. строгую кластеризацию OTU) при различных температурах транспортирования, что позволяет исследователям улучшить достоверность данных и сравнение в рамках одного исследования. Данная стабилизация химическим способом также увеличивает удобство неконтролируемого самосбора и однозначно делает возможными исследования большой популяции, которые на сегодняшний день являются сложными с логистической точки зрения.
Пример 9 - Стабилизация ДНК человека в композиции согласно настоящему изобретению
Дополнительные данные относительно сбора образца фекалий, экстракции и количественного определения ДНК и амплификации ДНК человека см. в разделе «Материалы и методы».
Три здоровых донора получали инструкции и материалы для сбора образца фекалий на дому. После дефекации в большой контейнер, присоединенный к унитазу, приблизительно 400 мг фекалий немедленно переносили в круглодонную пробирку объемом 10 мл, содержащую 2 мл композиции согласно настоящему изобретению («104В рН 11»; как определено выше) и один шарик из нержавеющей стали диаметром 7,9 мм. После закрытия пробирки доноры встряхивали запечатанную пробирку в течение приблизительно 20 секунд для гомогенизации образца в композиции. Доноры, как правило, направляли гомогенизированные образцы в лабораторию при температуре окружающей среды в течение 3-4 часов после сбора. В лаборатории из каждой пробирки отбирали аликвоту Т=0 (250 мкл), а оставшийся образец хранили при комнатной температуре (к.т.) в течение 14 дней, и в данный момент времени отбирали вторую аликвоту (250 мкл).
ДНК очищали из каждой аликвоты с применением набора PowerFecal® для выделения ДНК; выход ДНК количественно определяли с применением флуоресцентного красителя PicoGreen® и флуориметрического метода (см. «Материалы и методы»). ДНК человека, очищенную из образцов фекалий в момент времени Т=0 и Т=14 дней, амплифицировали методом ПЦР в режиме реального времени или количественной ПЦР (кПЦР) с применением праймеров, нацеленных на уникальную копию гена тимидилатсинтазы человека. Изменение значений Ct (ΔCt), т.е. различие в трех повторах значения Ct, полученного для аликвот, очищенных в дни Т=0 и Т=14, отобранных от одного образца, представлено в таблице 11 ниже. Для каждого донора количество ДНК человека, обнаруженной в очищенных образцах в момент времени Т=0 и Т=14 дней, является эквивалентным. Данный пример, в результате которого были определены отличия, составляющие менее одного цикла, в ДНК из образцов фекалий, обработанных немедленно или хранившихся в течение 2 недель при к.т., демонстрирует, что ДНК человека является стабильной в композиции согласно настоящему изобретению для всех трех доноров.

Пример 10 - Композиция согласно настоящему изобретению стабилизирует профиль микробиома при комнатной температуре в течение 14 дней и в имитированных условиях транспортирования
Композиция согласно настоящему изобретению позволяет проводить простой самосбор и стабилизацию микробной ДНК из фекалий для определения профиля кишечного микробиома. Указанная композиция обладает уникальной способностью обеспечивать «мгновенную фиксацию» микробного профиля в момент сбора и поддерживать его в течение 14 дней при комнатной температуре.
В данном примере шесть здоровых доноров получали инструкции и материалы для сбора образца фекалий на дому. После дефекации в большой контейнер, присоединенный к унитазу, приблизительно 400 мг фекалий немедленно переносили в круглодонную пробирку объемом 10 мл, содержащую 2 мл композиции согласно настоящему изобретению («104В рН 11»; как определено выше) и один шарик из нержавеющей стали диаметром 7,9 мм. После закрытия пробирки доноры встряхивали запечатанную пробирку в течение приблизительно 20 секунд для гомогенизации образца в композиции. Каждый из 6 доноров отбирал по 3 образца от одного исходного образца фекалий (в сумме n=18) в композицию согласно настоящему изобретению. Дополнительно каждый донор отбирал аликвоты по 400 мг свежих фекалий от одного исходного образца фекалий и транспортировал в пустой пробирке объемом 10 мл в коробке из стиропенопласта с замороженными хладоэлементами согласно стандартной процедуре проекта «Микробном человека» (Руководство по процедурам - проект «Микробном человека», 2010).
Экстракцию ДНК на исходном уровне проводили в течение 3 часов после сбора. Для проведения анализа на исходном уровне из образцов 104В рН 11 отбирали аликвоту 0,25 мл и экстрагировали с применением набора для выделения ДНК PowerFecal® (МО ВIO Laboratories, Inc.). Каждый образец объемом 0,25 мл содержал приблизительно 50 мг фекалий и 200 мкл стабилизирующей жидкости, 104В рН 11. Эквивалентные количества фекалий (приблизительно 50 мг) экстрагировали из свежих нестабилизированных образцов. Оставшиеся образцы в 104В рН 11 и свежие нестабилизированные образцы разделяли на аликвоты и хранили при комнатной температуре (23±3°С) в течение 14 дней или подвергали воздействию имитированных условий транспортирования (50°С в течение 1 дня, 37°С в течение 3 дней или 3 цикла замораживания-оттаивания, причем один цикл состоял минимум из 3 часов при температуре -20°С и минимум 3 часов при температуре 30°С). Дополнительно аликвоту свежего стула от каждого донора хранили при температуре -80°С в качестве контроля. Через 14 дней хранения при комнатной температуре, в имитированных условиях транспортирования или при температуре -80°С из всех образцов экстрагировали вторую аликвоту с применением набора для выделения ДНК PowerFecal.
Концентрацию и выход ДНК определяли с применением реактива Quant-iT™ PicoGreen® (Life Technologies). Целостность и стабильность ДНК в течение времени оценивали посредством анализа приблизительно 50 нг очищенной ДНК на 0,8% агарозном геле и окрашивания бромистым этидием. «Лесенку» маркеров лямбда/Hind III использовали для определения размера очищенной ДНК.
Получение библиотеки секвенирования 16S рРНК, секвенирование и биоинформатическую обработку проводили с применением ресурса Metanome, Microbiome Discovery Service. Секвенирование ампликона гипервариабельной области V4 со спаренными концами проводили с применением системы Illumina® MiSeq®. С применением ресурса QIIME и скриптов пользователя последовательности фильтровали по качеству. Считываемые фрагменты со спаренными концами собирали и сравнивали с базой данных Greengenes, кластеризованной на 97% согласно алгоритму UCLUST. После нормирования данных расстояние между образцами измеряли с применением взвешенного расстояния Unifrac в отношении данных об изобилии операционных таксономических единиц OTU (использует различия изобилия таксонов между образцами с применением попарного нормирования посредством разделения суммы различий на сумму всех изобилий). Расстояния Брея-Кертиса измеряли с применением попарного нормирования посредством разделения суммы различий на сумму всех обнаруженных изобилий OTU. Во всех измерениях Брея-Кертиса свежий образец соответствующего донора, который экстрагировали сразу после сбора, использовали в качестве одного элемента для попарного сравнения. Анализ индекса Шеннона (ИШ) для каждого способа стабилизации проводили посредством измерения доли каждой OTU по сравнению с общим количеством OTU с последующим умножением на натуральный логарифм данной доли. Суммирование конечного продукта среди всех OTU позволило получить ИШ для каждого образца. Способы сбора образцов сравнивали с применением критерия Манна-Уитни.
Результаты
Композиция согласно настоящему изобретению поддерживает объективность профиля микробиома на момент сбора
Для исследования микробиома необходимо, чтобы полученный профиль представлял микробные сообщества in vivo, присутствующие у донора; таким образом, способ сбора и стабилизации не должен вносить изменения в микробном. Применение буферов для химической стабилизации может потенциально изменить микробную композицию образца в результате ускорения роста некоторых микробов и гибели других. В идеальных условиях стабилизирующая жидкость должна быть нейтральной (т.е. не должна вносить какой-либо ошибки в микробном). Сравнение профиля микробиома 16S рРНК из свежих и стабилизированных в 104В рН 11 образцов в момент времени Т=0 продемонстрировало, что композиция согласно настоящему изобретению сохраняет объективный профиль и не вносит ошибки (фигура 21).
Исследование относительного изобилия OTU различными статистическими способами (например, с применением взвешенного UniFrac) обеспечивает ценное описание микробного сообщества; однако данное исследование может затруднять понимание микробного сообщества в результате минимизации вклада микробов меньшего изобилия. Для надлежащего исследования профиля микробиома требуется сохранение «богатства» микробных сообществ. Богатство, которое определяют как количество видов микроорганизмов (OTU), присутствующих в образце, является весьма восприимчивым к условиям окружающей среды, включая изменения температуры, рН, концентрации кислорода и химического состава. Данные и другие факторы могут включать рост или гибель бактерий, которые изменяют OTU, обнаруженные в образце.
Свежие и стабилизированные в 104В рН 11 образцы от 6 доноров экстрагировали сразу после сбора. Микробные OTU, обнаруженные в образцах в 104В рН 11, сравнивали с OTU, присутствующими в соответствующих свежих образцах. Индекс Шеннона (ИШ) для разнообразия рассчитывали посредством преобразования данных об изобилии OTU в наличие/отсутствие сигналов. Применение критерия Манна-Уитни в отношении значения ИШ не продемонстрировало значительных различий между образцами в 104В рН 11 и свежими образцами; данный результат свидетельствует, что 104В рН 11 не влияет на богатство образцов (фигура 22).
Источники вариабельности при сборе образца фекалий
Анализ Брея-Кертиса продемонстрировал системную несхожесть в пределах повторов свежих образцов и образцов в 104В рН 11 в момент времени Т=0. Для понимания источников такой несхожести оценивали вариабельность, вводимую в процессе сбора и обработки образцов фекалий. Биологическую вариабельность оценивали посредством получения профилей микробиома от трех свежих образцов и трех образцов в 104В рН 11, отобранных от различных участков одного и того же исходного образца. Техническую вариабельность исследовали с применением образцов, собранных в 104В рН 11, поскольку данная система сбора обеспечивает получение гомогенизированных жидких образцов, что уменьшает экспериментальные ошибки в процессе обработки. Сравнивали профили повторностей экстракции ДНК из одной и той же пробирки (вариабельность экстракции) и повторов ГЩР/секвенирования той же ДНК (вариабельность секвенирования). Расстояния несхожести Брея-Кертиса, которые рассчитывали в пределах групп повторности, представлены на фигуре 23.
Схожая вариабельность наблюдалась в биологических повторностях свежих образцов и образцов, собранных в 104В рН 11 (расстояния Брея-Кертиса 0,14±0,01 и 0,11±0,01, соответственно). Анализ продемонстрировал, что техническая и биологическая вариабельность вносит некоторую несхожесть в профиль микробиома 16S рРНК (расстояния Брея-Кертиса для биологический вариабельности - 0,11; для вариабельности экстракции - 0,09 и вариабельности секвенирования - 0,08). В заключении подытожим, что источник наблюдавшейся несхожести можно объяснить технической или биологической вариабельностью и что 104В рН 11 не вносит каких-либо ошибок.
104В рН 11 эффективно сохраняет профили микробиома в течение по меньшей мере 14 дней при комнатной температуре
Помимо поддержания объективности профиля, для исследования микробиома необходимо точное сохранение структуры микробного сообщества в течение времени. Авторы настоящего изобретения оценивали способность 104В рН 11 стабилизировать образцы в процессе хранения при температуре 23°С в течение 14 дней.
Парные образцы, стабилизированные в 104В рН 11, и свежие образцы экстрагировали в момент времени ноль (ТО) и повторно экстрагировали после хранения при комнатной температуре (23°С) в течение 14 дней. Свежие образцы также хранили при температуре -80°С в течение 14 дней в качестве контроля. Подобие образцов оценивали с применением расстояний Брея-Кертиса. Анализ Манна-Уитни не продемонстрировал значительных различий между образцами в 104В рН 11 при температуре 23°С в течение 14 дней и образцами при температуре -80°С по сравнению с соответствующими свежими образцами (фигура 24). Напротив, нестабилизированные образцы продемонстрировали значительную несхожесть по сравнению с контролем -80°С или образцами, хранившимися в 104В рН 11 при комнатной температуре.
Для понимания воспроизводимости среди повторов проводили кластерный анализ взвешенного Unifrac с применением свежих, собранных в 104В рН 11 образцов (Т0 и Т14 дней) и нестабилизированных образцов (Т14 дней). Полученная в результате дендрограмма (фигура 25) демонстрирует строгую кластеризацию между свежими и стабилизированными в 104В рН 11 образцами даже через 14 дней (96% подобия). Нестабилизированные образцы кластеризовались в группу и были значительно отделены от профиля свежих образцов (~63% подобия). Вследствие этого надлежащая стабилизация оказывает значительный эффект на кластеризацию профиля в течение времени.
104В рН 11 эффективно сохраняет профиль микробиома в имитированных условиях транспортирования
В процессе транспортирования от места сбора до лаборатории, где проводится анализ и обработка, образцы обычно подвергаются воздействию неблагоприятных условий. Для имитации стандартных условий транспортирования нестабилизированные и стабилизированные в 104В рН 11 образцы подвергали воздействию температуры 50°С в течение 1 дня, 37°С в течение 3 дней или воздействию нескольких циклов замораживания-оттаивания (З/О). 104В рН 11 сохраняла полосы высокомолекулярной ДНК, тогда как для нестабилизированных образцов наблюдалась различная степень деградации, в частности, под воздействием температуры 50°С или циклов замораживания-оттаивания (фигура 26).
Наконец, анализ 16S рРНК подтвердил, что 104В рН 11 сохраняет структуру микробного сообщества даже при экстремальных температурах. Критерий Манна-Уитни при сравнении расстояния Брея-Кертиса образцов в 104В рН 11, которые подвергали воздействию обычных температур транспортирования, и парных образцов, которые хранили при температуре -80°С, не продемонстрировал значительных различий. Напротив, нестабилизированные образцы, которые хранили при температуре 37°С или которые подвергали воздействию циклов замораживания-оттаивания, продемонстрировали значительные отличия по сравнению с образцами, которые хранили при температуре -80°С (фигура 27).
Заключения
Стабилизация с точки зрения метагеномики представляет собой многоаспектное понятие, которое охватывает: а) объективность (способность получить неискаженные профили), b) воспроизводимость (гомогенный материал образца, от которого могут быть отобраны в высшей степени согласующиеся аликвоты), и с) целостность (молекулярную массу), которую измеряют в течение времени. Согласно результатам строго контролируемых экспериментов и тщательного анализа, 104В рН 11 эффективно стабилизировала микробиоту кишечника в фекалиях человека в процессе реальных условий транспортирования и манипуляций. Данный результат обладает первостепенным значением для экономически эффективного масштабирования, а также для оптимизации качества данных при исследовании и разработке биомаркеров.
Пример 11 - Дополнительные исследования роли хелатирующих средств для стабилизации образца при повышенных температурах
Стабильность микробного профиля в образце также чувствительна к повышенным температурам. В данных условиях не только потенциально могут активироваться вредные нуклеазы, но также некоторые виды микроорганизмов могут начать пролиферировать. В данном случае наличие хелатирующего средства (CDTA) является в особенности полезным для блокировки активности ДНКаз, а также для ингибирования роста бактерий.
В данном эксперименте здоровые доноры собирали фекалии и переносили по 400 мг фекалий в пробирку, содержащую один шарик из нержавеющей стали диаметром 7,9 мм и 2 мл композиции согласно настоящему изобретению с различной итоговой концентрацией хелатирующего средства CDTA: а) 300 мМ CDTA, 50 мМ β-аланина, 23,5% этанола, 0,5% SDS, 0,1% Antifoam А, рН 11 («104В pH11»); b) 150 мМ CDTA, 50 мМ β-аланина, 23,5% этанола, 0,5% SDS, 0,1% Antifoam А, рН 11, или с) 50 мМ β-аланина, 23,5% этанола, 0,5% SDS, 0,1% Antifoam А, рН 11 (без хелатирующего средства). Образцы гомогенизировали посредством встряхивания рукой (перемешивания), а затем направляли в лабораторию при комнатной температуре. В течение 24 часов после сбора образца из каждой пробирки отбирали аликвоту объемом 250 мкл для экстракции ДНК (Т=0). Затем собранные образцы хранили при температуре 40°С в течение 5 дней (Т=5), после чего проводили экстракцию ДНК из второй аликвоты. Очищенную ДНК количественно определяли, а затем принимали решение относительно профилей бактериального сообщества или фингерпринтов с применением ДГГЭ для отделения ампликонов ПЦР гена 16S рРНК. Проценты подобия между образцами (дорожками на геле ДГГЭ) по сравнению с контрольным образцом в момент времени Т=0 рассчитывали для каждой композиции отдельно с применением программного обеспечения Syngene GeneTools (см. «Материалы и методы»).
Фигура 28 демонстрирует превосходные проценты подобия или стабильность профиля микробиома при повышенных температурах между образцами «дня 5» и «дня 0» для композиции согласно настоящему изобретению, в которой CDTA присутствует в концентрации 150 мМ или 300 мМ, по сравнению с композицией без CDTA. Данный результат свидетельствует, что хелатирующее средство необходимо в композиции согласно настоящему изобретению для поддержания стабильности микробного профиля при повышенных температурах. Для композиции, содержащей 300 мМ и 150 мМ CDTA, микробные профили в «день 5» являлись на 96% и 95% подобными, соответственно, по сравнению с «днем 0», когда образцы фекалий хранили при температуре 40°С. Для сравнения, микробный профиль в «день 5» в композиции без CDTA составлял 71% по сравнению с «днем 0», когда образцы фекалий хранили при температуре 40°С.
Пример 12 - Превосходная стабилизация образцов в композиции согласно настоящему изобретению по сравнению с композициями предшествующего уровня техники
Нуклеиновые кислоты в образцах пациента имеют тенденцию деградировать после того, как образцы отбирают от пациента. Данная деградация может уменьшить эффективность анализа целостности нуклеиновой кислоты, в ходе которого образец оценивают как характеризующийся заболеванием (например, раком) на основании наличия интактных нуклеиновых кислот. АР Shuber и DH Whitney (патент США №2008/0124714) описывают способ стабилизации нуклеиновых кислот в образцах тканей и жидкостей организма с применением стабилизирующего раствора, который содержит буфер, соль и хелатирующее средство (например, «буфер TEN»).
В данном эксперименте здоровые доноры собирали фекалии и переносили по 400 мг фекалий в пробирку, содержащую один шарик из нержавеющей стали диаметром 7,9 мм и 2 мл композиции согласно настоящему изобретению (Композиция 1; 300 мМ CDTA, 50 мМ β-аланина, 23,5% этанола, 0,5% SDS, 0,1% Antifoam А, рН 11 («104В рН 11»)) или ii) приблизительно 400 мг фекалий в пробирку, содержащую 2 мл «Буфера TEN» (Композиция 2; 10 мМ Tris-HCl, 1 мМ EDTA, 150 мМ NaCl, рН 8, патент США №2008/0124714). Образцы в обеих пробирках гомогенизировали посредством встряхивания рукой (перемешивания), а затем направляли в лабораторию при комнатной температуре. В течение 24 часов после сбора образца из каждой пробирки отбирали аликвоту 250 мкл для экстракции ДНК (Т=0), а затем хранили при комнатной температуре в течение 21 дня (Т=21), после чего проводили экстракцию ДНК из второй аликвоты. Очищенную ДНК количественно определяли, а затем принимали решение относительно профилей бактериального сообщества или фингерпринтов с применением ДГГЭ для отделения ампликонов ПЦР гена 16S рРНК. Проценты подобия между образцами (дорожками на геле ДГГЭ) по сравнению с контрольным образцом в Т=0 рассчитывали для каждой композиции отдельно с применением программного обеспечения Syngene GeneTools (см. «Материалы и методы»).
Фигура 29 иллюстрирует превосходные проценты подобия или стабильности профиля микробиома между образцами «дня 21» и «дня 0» для композиции согласно настоящему изобретению по сравнению с композицией буфера TEN; данный результат свидетельствует, что композиция согласно настоящему изобретению обеспечивает улучшенную стабильность ДНК по сравнению с композициями, известными в данной области техники. Микробные профили донора А и В в «день 21» были на 82% и 94% подобными, соответственно, по сравнению с «днем 0», когда образцы фекалий хранили в присутствии композиции «104В рН 11». Для сравнения, микробные профили донора А и В в «день 21» были на 70% и 50% подобными, соответственно, по сравнению с «днем 0», когда образцы фекалий хранили в композиции согласно патенту США №2008/0124714.
В патенте США №2008/0124714 также упоминается «стабилизирующий буфер», состоящий из 0,5 М Tris, 0,15 М EDTA и 10 мМ NaCl (рН 9,0), в абзаце [0059] раздела «Материалы и методы». Однако отмечается, что единственным стабилизирующим буфером/раствором, который конкретно упоминается в последующих примерах, является «буфер TEN», указанный выше, и формула изобретения, а также принципы описания стабилизирующего раствора также охватывают варианты реализации, включающие «буфер TEN». В связи с этим не очевидно, что был исследован «стабилизирующий буфер» либо что такой буфер будет функционировать в способах, изложенных в патенте США 2008/0124714. Тем не менее, было проведено сравнительное исследование, в ходе которого анализировали рабочие характеристики вышеуказанного «стабилизирующего буфера» согласно патенту США 2008/0124714 по сравнению с композицией согласно настоящему изобретению, содержащей 150 мМ CDTA, 50 мМ β-аланина, 23,5% этанола, 0,5% SDS, 0,1% Antifoam А, рН 11, в тех же условиях, как описано в примере 1.
В ходе оценки стабильности микробиома в зависимости от композиции и времени результаты амплификации с применением ПЦР гена бактериальной 16S рРНК и анализа ампликонов методом ДГГЭ продемонстрировали, что композиция согласно настоящему изобретению, содержащая 150 мМ CDTA при рН 11, сохраняла больший процент подобия (86%) контролю (Т=0) после инкубации в течение 30 дней, чем «стабилизирующий буфер» согласно патенту США 2008/0124714, содержащий 150 мМ EDTA при рН 9,0 (79%).
Вследствие этого композиции согласно настоящему изобретению обеспечивают превосходящую стабилизацию профилей микробиома в образцах фекалий по сравнению с композициями, раскрытыми в патенте США 2008/0124714.
Список литературы
1. Lee YK and Mazmanian SK (2010) Has the microbiota played a critical role in the evolution of the adaptive immune system? Science 24:1768-1773.
2. Aries V, Crowther JS, Drasar BS, Hill MJ, Williams REO (1969) Bacteria and the aetiology of cancer of the large bowel. Gut 10:334-335.
3. Moore WEC and Moore LH (1995) Intestinal floras of populations that have a high risk of colon cancer. Applied Envir Microbiol 61 (9):3202-3207.
4. Parsonnet J, Friedman GD, Vandersteen DP, Chang Y, Vogelman JH, Orentreich N, Sibley RK (1991) Helicobacter pylori infection and the risk of gastric carcinoma. N Engl J Med 325:1127-1131.
5. Grenham S, Clarke G, Cryan JF, Dinan TG (2011) Brain-gut-microbe communication in health and disease. Front Physio 2:94.
6. Kinross JM, Darzi AW, Nicholson JK (2011) Gut microbiome-host interactions in health and disease. Genome Medicine 3:14.
7. Van Nood Els et al. (2013) Duodenal infusion of donor feces for recurrent Clostridium difficile. N Engl J Med 368(5):407-415.
8. Apajalahti JHA, Kettunen A, Nurminen PH, Jatila H, Holben WE (2003) Selective plating underestimates abundance and shows differential recovery of Bifidobacteria! species from human feces. Appl Environ Microbiol 69(9):5731-5735.
9. О'Sullivan D (2000) Methods for analysis of the intestinal microflora. Current Issues in Intestinal Microbiology 1(2):39-50.
10. Walker AW, Ince J, Duncan SH, Webster LM, Holtrop G, Ze X, Brown D, Stares MD, Scott P, Bergerat A, Louis P, Mcintosh F, Johnstone AM, Lobley GE, Parkhill J, Flint HJ (2011) International Society for Microbial Ecology Journal 5:220-230.
11. Wu GD, Chen J, Hoffmann C, Bittinger K, Chen Y-Y, Keilbaugh SA, Bewtra M, Knights D, Walters WA, Knight R, Sinha R, Gilroy E, Gupta K, Baldassano R, Nessel L, Li H, Bushman FD, Lewis JD (2011) Linking long-term dietary patterns with gut microbial enterotypes. Science 334:105-108.
12. Ley RE, Knight R, Gordon JI (2007) The human microbiome: eliminating the biomedical/environmental dichotomy in microbial ecology. Environ Microbiol 9:3-4.
13. Bahl MI, Bergstrom A, Licht TR (2012) Freezing fecal samples prior to DNA extraction affects the Firmicutes to Bacteroidetes ratio determined by downstream quantitative PCR analysis. FEBS Microbiol Lett 329: 193-197.
14. Olson J, Whitney DH, Durkee K, Shuber AP (2005) DNA stabilization is critical for maximizing performance of fecal DNA-based colorectal cancer tests. Diagn Mol Pathol 14(3):183-191.
15. Song Y, Garg S, Girotra M, Maddox C, von Rosenvinge EC, Dutta A, Dutta S, Fricke WF (2013) Microbiota dynamics in patients treated with fecal microbiota transplantation for recurrent Clostridium difficile infection. PLOS ONE 8(11):1-11.
16. Van der Giessen JWB, Eger A, Haagsma J, Haring RM, Gaastra W, van der Zeijst BAM (1992) Amplification of 16S rRNA sequences to detect Mycobacterium paratuberculosis. J Med Microbiol 36: 255-263.
17. Hurley SS, Splitter GA, Welch RA. Test for Johne's Disease. US 4,918,178
18. Kojima K. Process of extracting nucleic acid and process of simultaneously carrying out extraction and purification of nucleic acid. US 6,852,495
19. Ariefdjohan MW, Savaiano DA, Nakatsu CH (2010) Comparison of DNA extraction kits for PCR-DGGE analysis of human intestinal microbial communities from fecal specimens. Nutr J 9:23.
20. Smith B, Li N, Andersen AS, Slotved HC, Kxogfelt KA (2011) Optimising bacterial DNA extraction from faecal samples: comparison of three methods. Open Microbiol J 5:14-17.
21. Mclnnes P, Cutting M (2010) Manual of procedures for human microbiome project. Core Microbiome Sampling Protocol A; Protocol #07-001 (version 12.0)
22. Brusa T, Canzi E, Pacini N, Zancho R, Farrari A (1989) Oxygen tolerance of anaerobic bacteria isolated from human feces. Curr Microbiol 19:39-43.
23. US 2008/0124714 (A.P. Shuber and D.H. Whitney).
Все публикации, патенты и заявки на патент, упоминаемые в настоящей спецификации, характеризуют уровень компетентности специалистов в области техники, к которой относится настоящее изобретение, и включены в настоящую заявку посредством ссылки в той же степени, как если бы каждая отдельная публикация, патент или заявка на патент была конкретно и отдельно указана как включенная посредством ссылки.
Очевидно, что изобретение, которое было описано данным образом, может варьировать различными способами. Такие вариации не следует рассматривать как отклонение от сущности и объема изобретения, и все такие модификации, как очевидно специалисту в данной области техники, включены в объем следующей формулы изобретения. Объем формулы изобретения не следует ограничивать предпочтительными вариантами реализации, изложенными в описании, но ему следует дать наиболее широкое толкование, согласующееся с описанием в целом.
| название | год | авторы | номер документа |
|---|---|---|---|
| Устройство для сбора, транспортировки и хранения биомолекул из биологического образца | 2015 |
|
RU2696484C2 |
| АНАЛИТИЧЕСКИЙ СПОСОБ ДЛЯ КОЛИЧЕСТВЕННОЙ ОЦЕНКИ ЖИЗНЕСПОСОБНЫХ БАКТЕРИЙ, СОДЕРЖАЩИХСЯ В КОМПОЗИЦИЯХ ДЛЯ ТЕРАПИИ ДЛЯ ВОССТАНОВЛЕНИЯ МИКРОБИОТЫ (MRT) | 2017 |
|
RU2714841C1 |
| КОМПОЗИЦИИ И СПОСОБЫ | 2014 |
|
RU2664479C2 |
| Среда и устройство для сбора, хранения и транспортировки биологических образцов, а также их применение для стабилизации внеклеточных нуклеиновых кислот | 2022 |
|
RU2798013C1 |
| ИСПОЛЬЗОВАНИЕ МИКРОБНЫХ СООБЩЕСТВ ДЛЯ ЛЕЧЕНИЯ ЧЕЛОВЕКА И ЖИВОТНЫХ | 2017 |
|
RU2758387C2 |
| ИСПОЛЬЗОВАНИЕ МИКРОБНЫХ СООБЩЕСТВ ДЛЯ ЛЕЧЕНИЯ ЧЕЛОВЕКА И ЖИВОТНЫХ | 2017 |
|
RU2823233C2 |
| ПРИМЕНЕНИЕ ТВЕРДОЙ МИНЕРАЛЬНОЙ КОМПОЗИЦИИ ДЛЯ ПОВЫШЕНИЯ ПЛОДОРОДИЯ ВОЗДЕЛЫВАЕМЫХ ПОЧВ ИЛИ ПОЧВ ПАСТБИЩ | 2009 |
|
RU2520000C2 |
| КОМПОЗИЦИИ СРЕДСТВ ЛИЧНОЙ ГИГИЕНЫ И СПОСОБЫ СТАБИЛИЗАЦИИ МИКРОБИОМА | 2016 |
|
RU2727810C1 |
| КОМПОЗИЦИИ СРЕДСТВ ЛИЧНОЙ ГИГИЕНЫ И СПОСОБЫ СТАБИЛИЗАЦИИ МИКРОБИОМА | 2016 |
|
RU2765461C2 |
| ДОБАВКА ДЛЯ ВОДЫ И КОМПОЗИЦИЯ | 2018 |
|
RU2804432C2 |
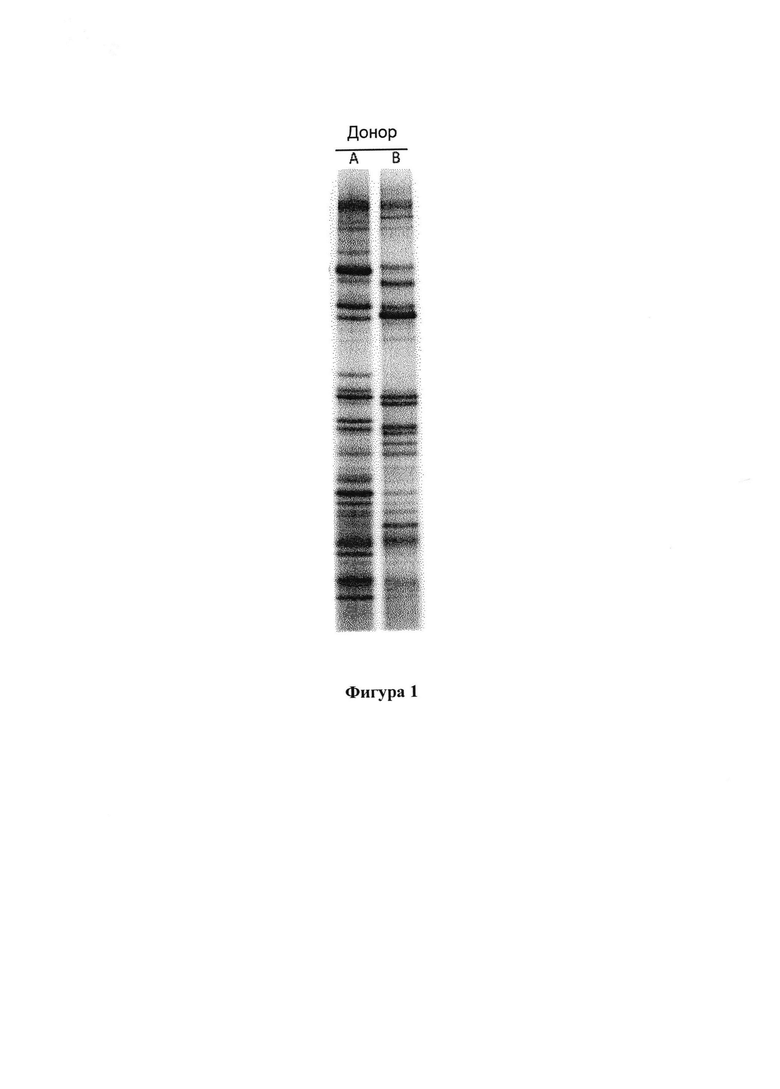



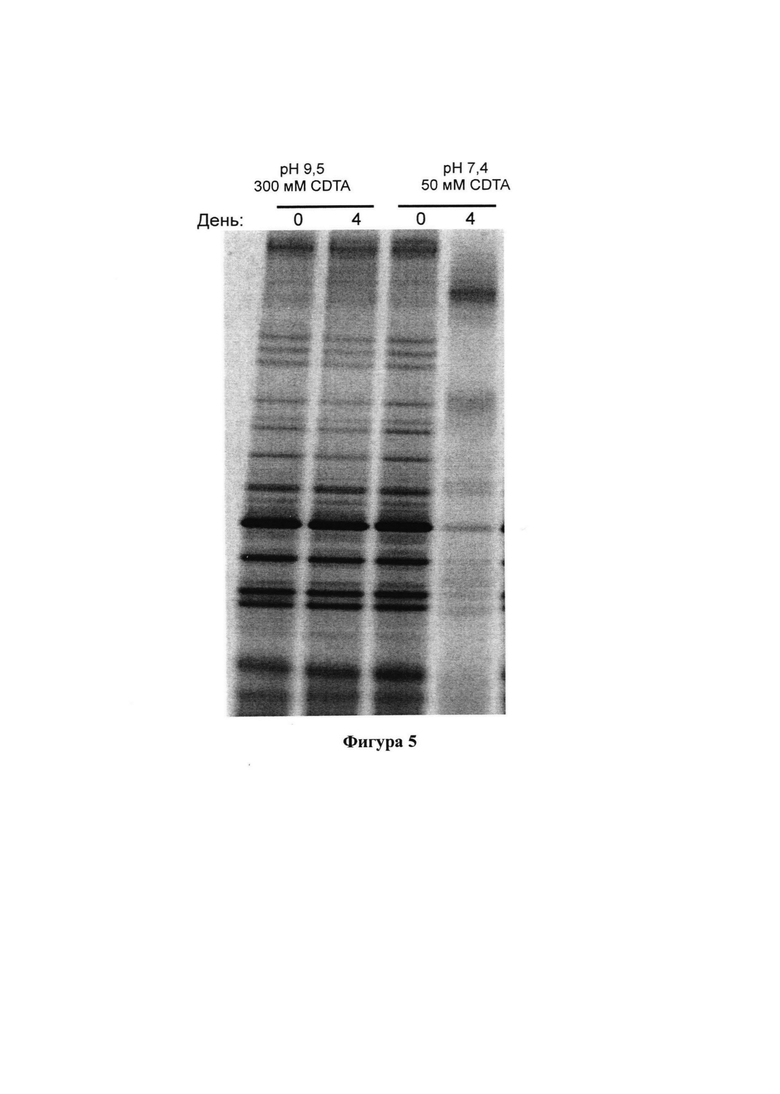
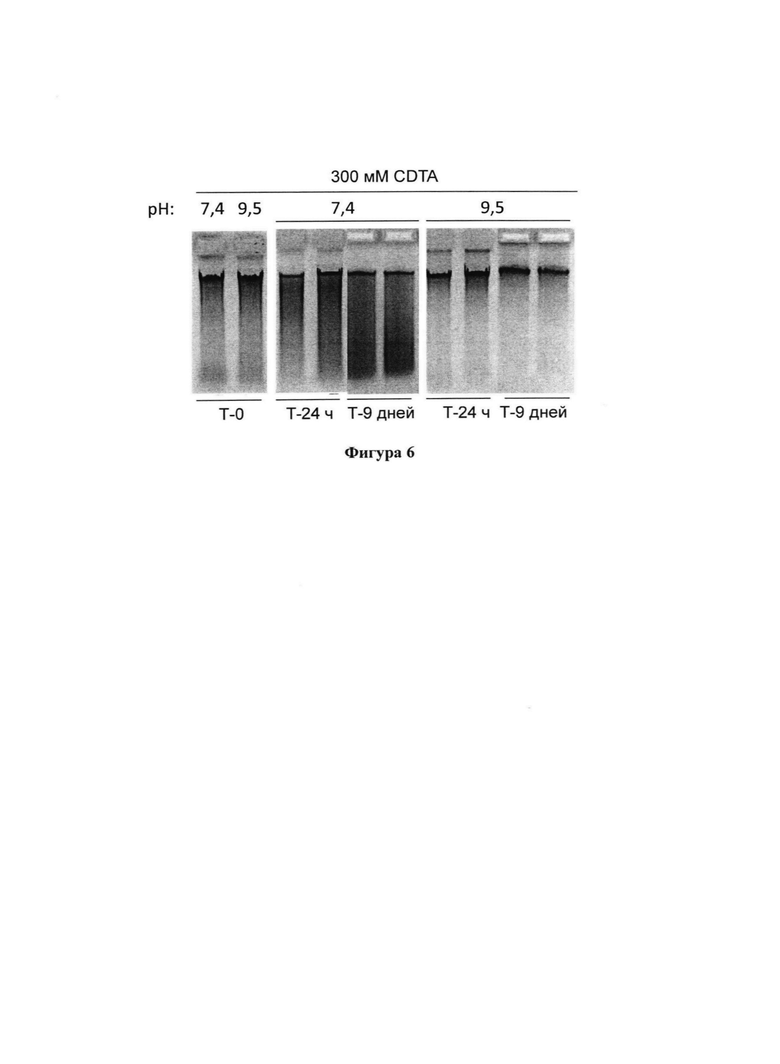
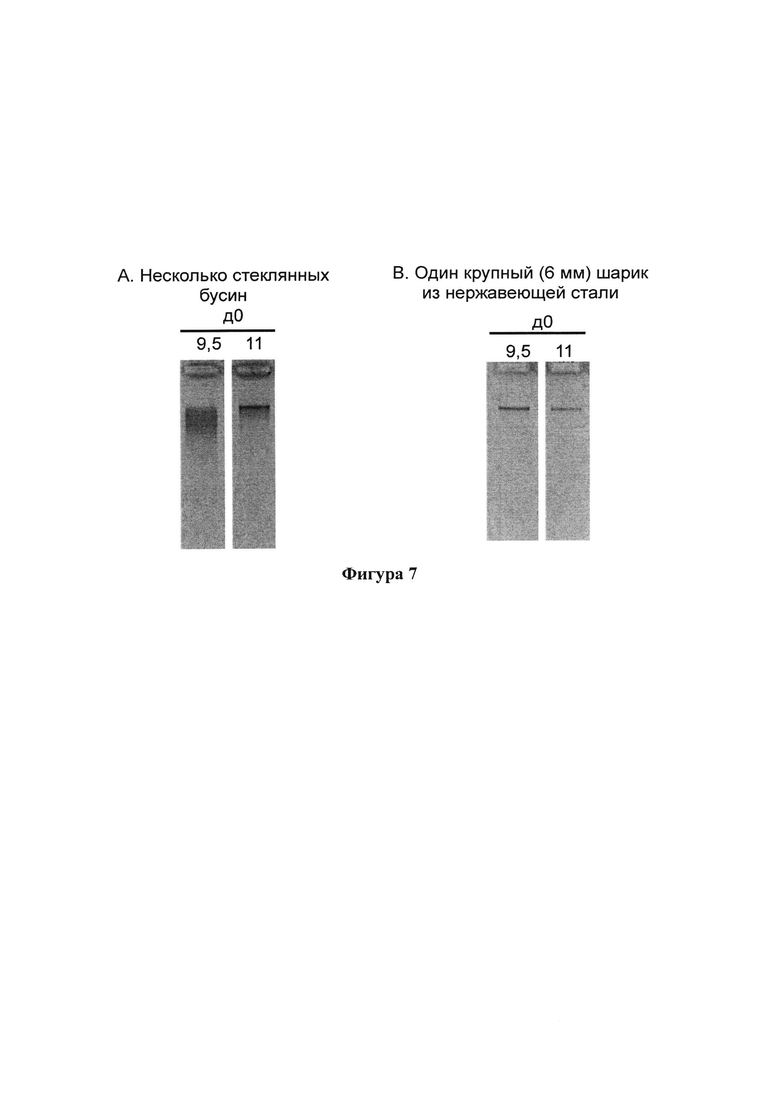
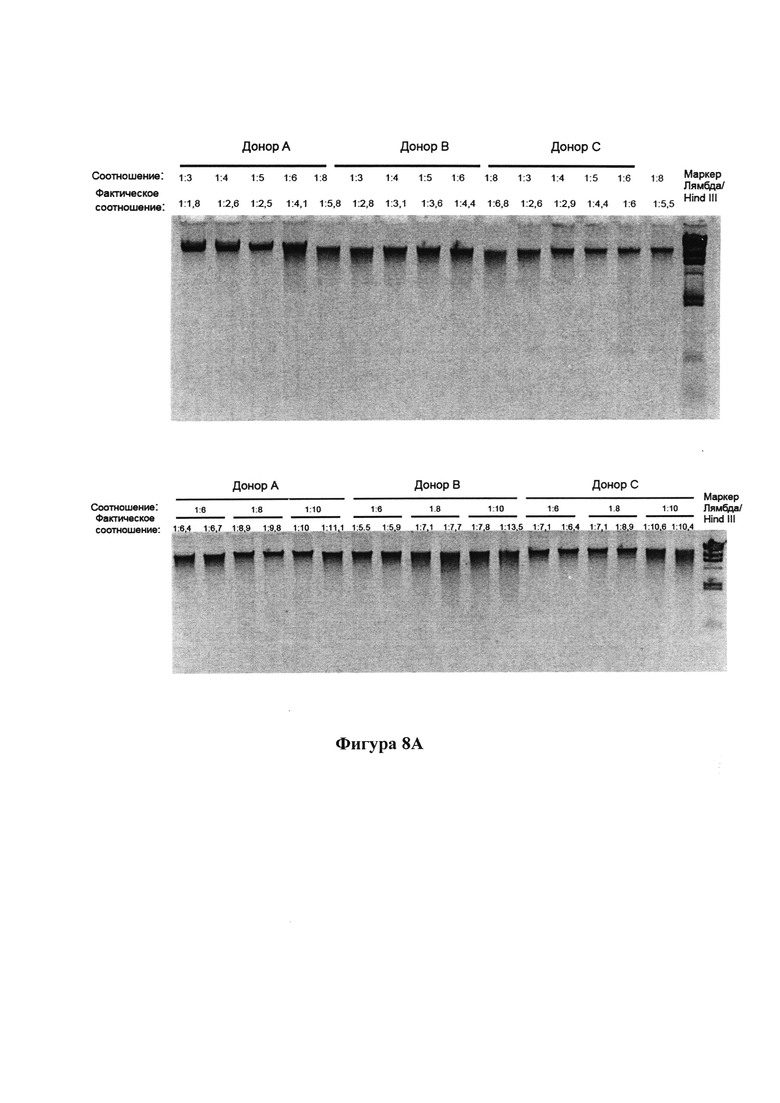




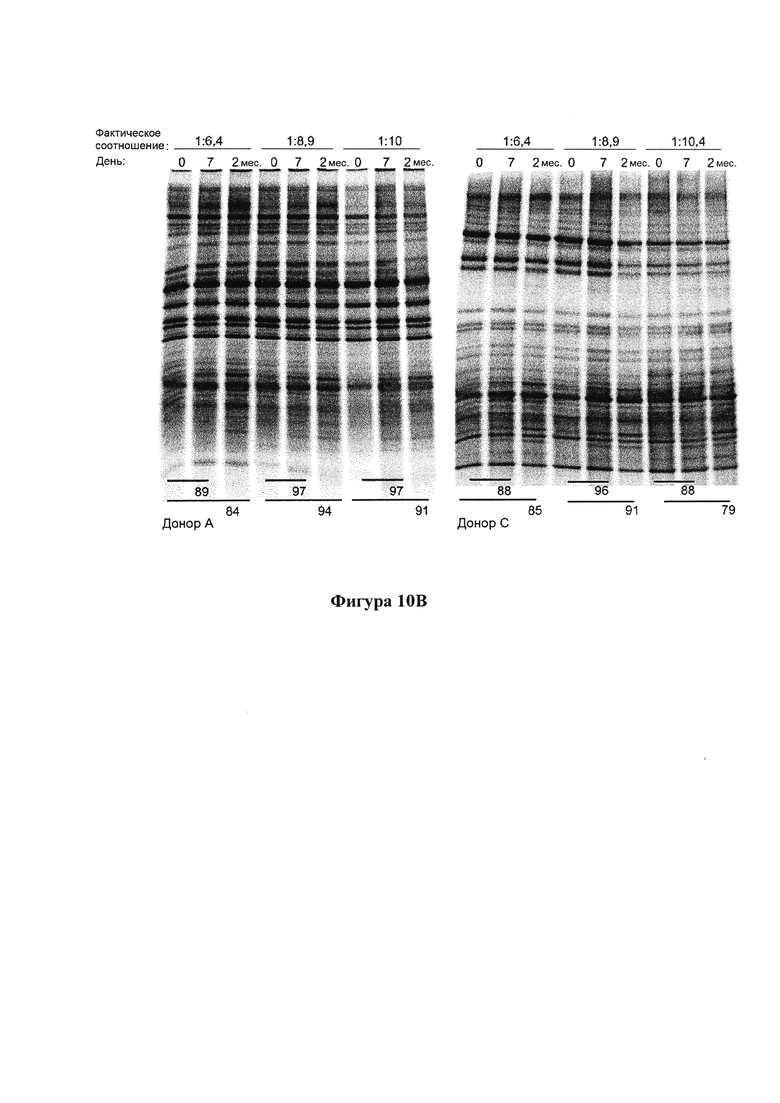

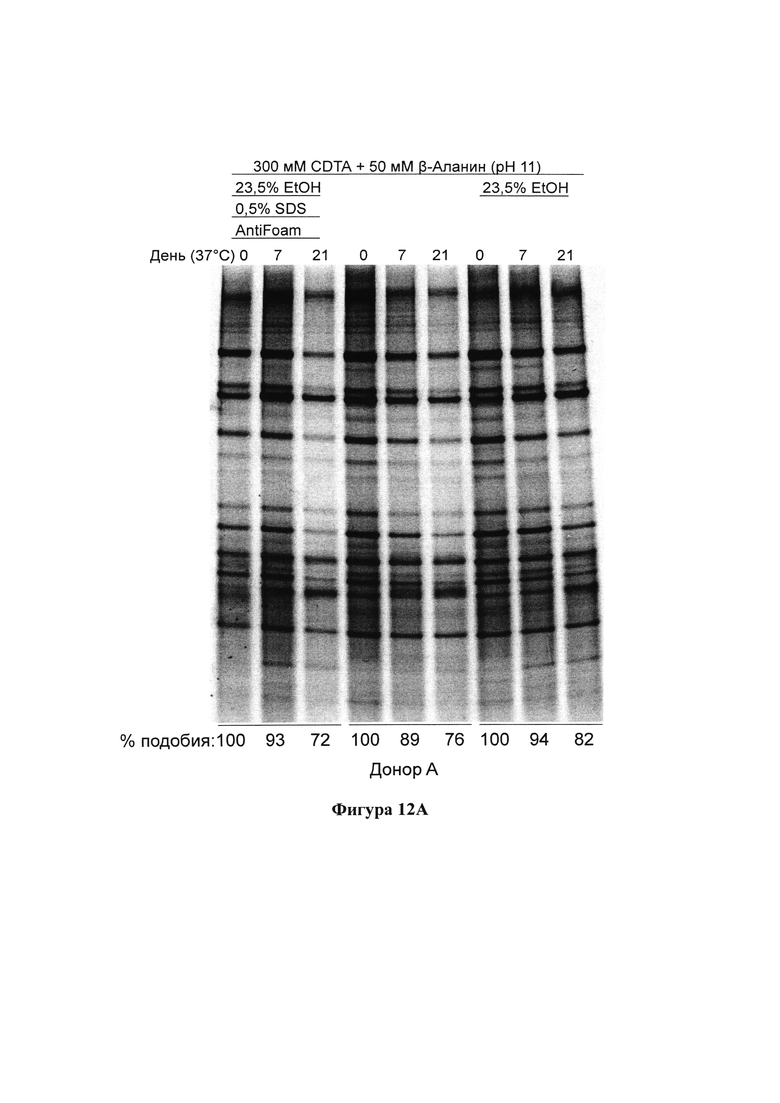

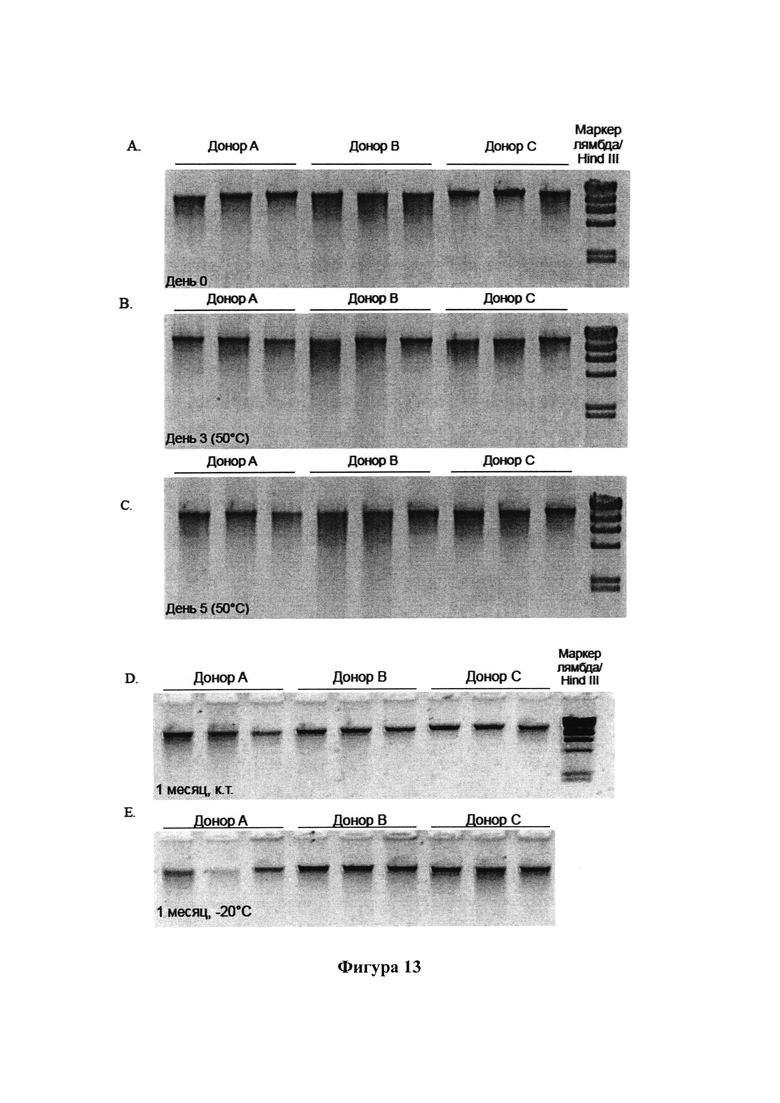
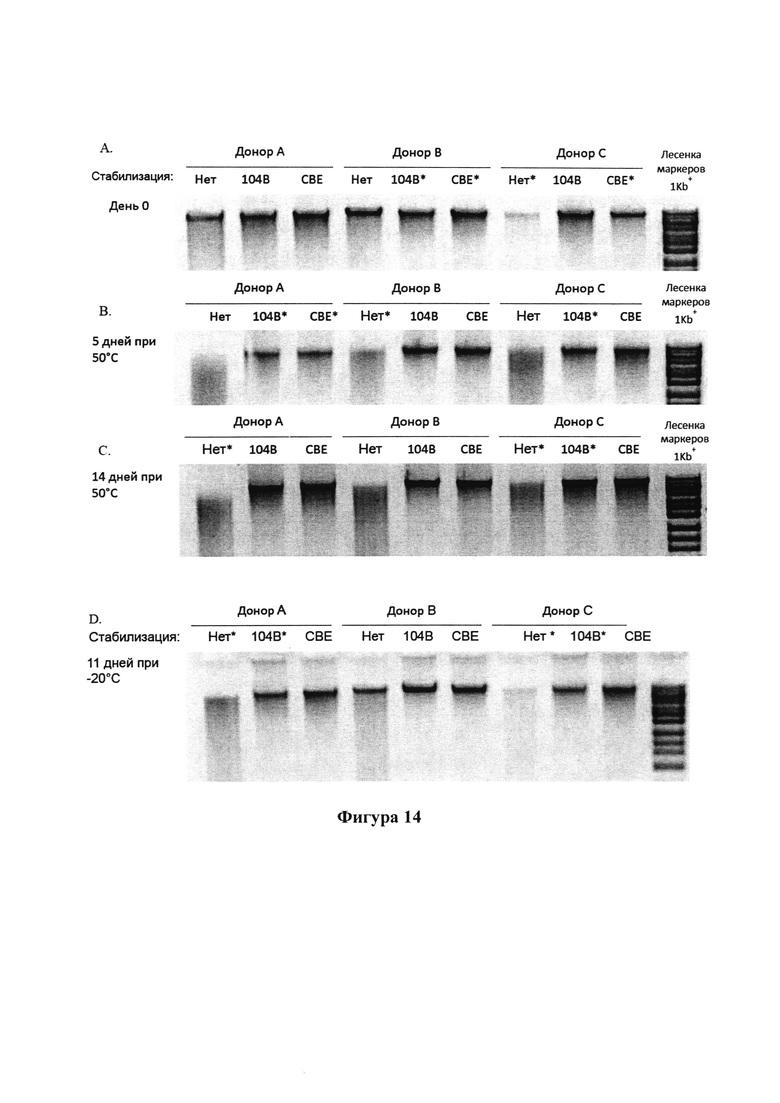

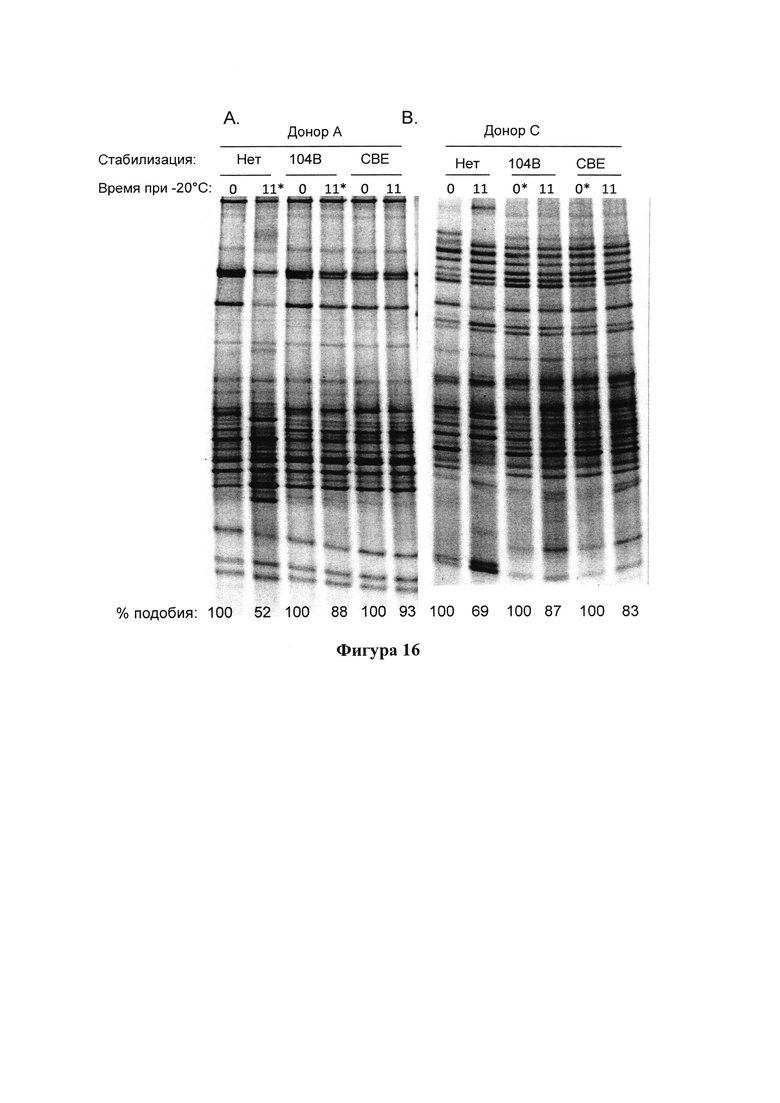


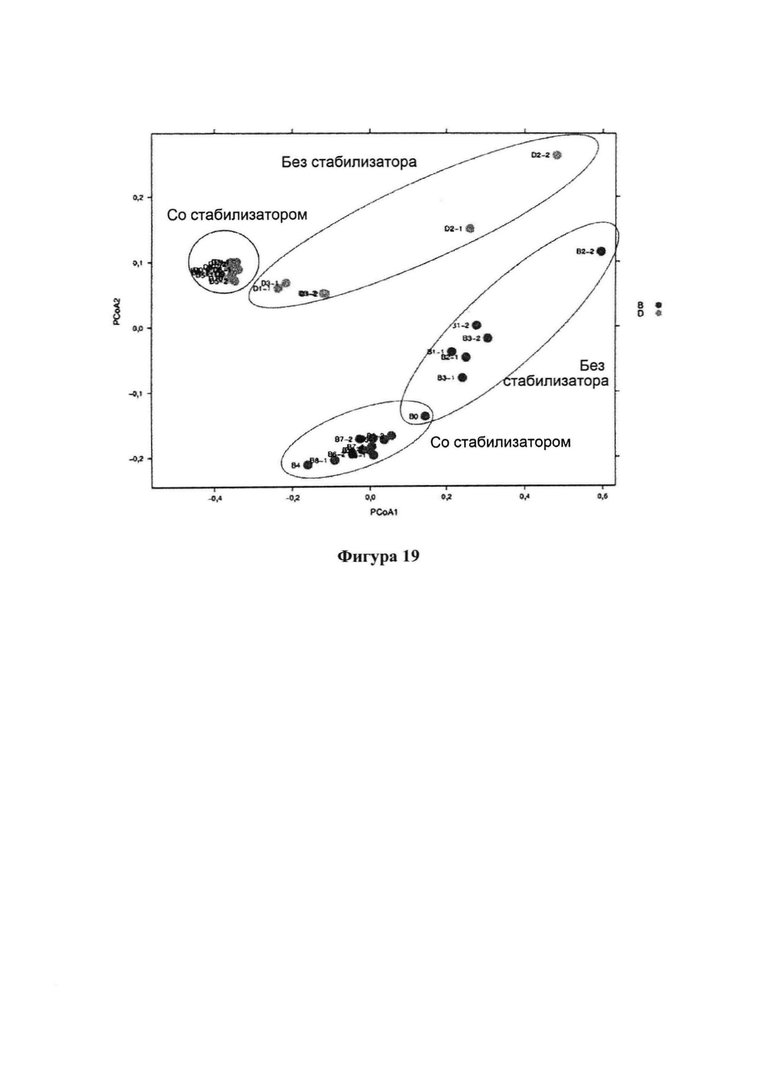






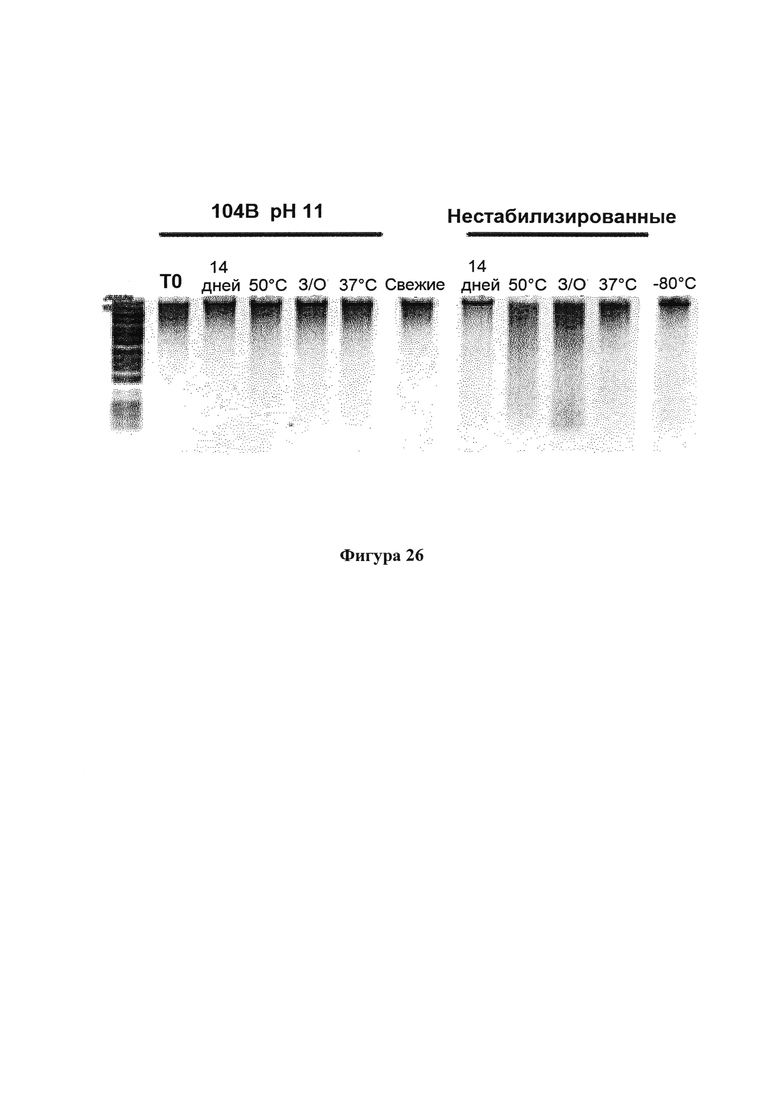

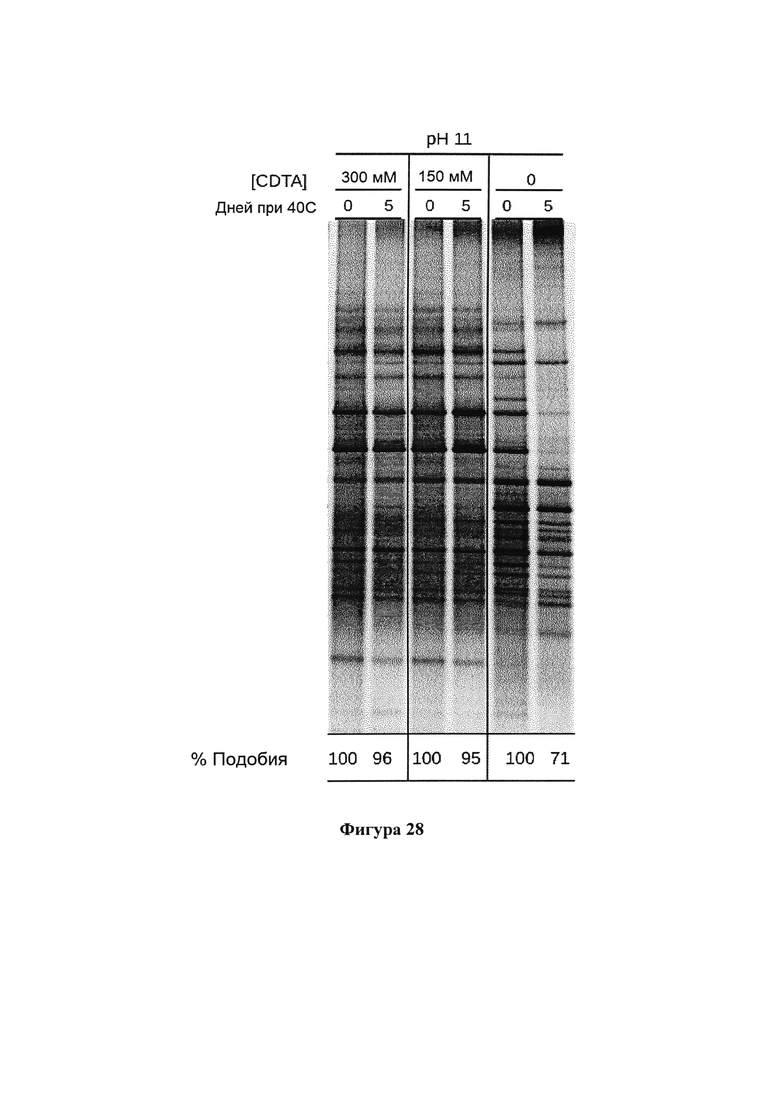

Группа изобретений относится к биотехнологии, в частности к области стабилизации дезоксирибонуклеиновой кислоты (ДНК) человека и микроорганизмов, присутствующей в сложных биологических образцах, таких как фекалии. Предложены способ, водная композиция и набор для стабилизации ДНК, содержащейся в фекалиях или образце, загрязненном фекалиями, при температуре окружающей среды. Указанный биологический образец приводят в контакт с водной композицией, содержащей хелатирующее средство, выбранное из этилендиаминтетрауксусной кислоты (EDTA) или 1,2-циклогександиаминтетрауксусной кислоты (CDTA), в концентрации от приблизительно 150 мМ до приблизительно 600 мМ и имеющей рН от 9,5 до 11,5. Полученную смесь гомогенизируют и хранят при температуре окружающей среды. Группа изобретений обеспечивает быстрый и эффективный захват и стабилизацию ДНК и «мгновенную фиксацию» профилей суммарной ДНК в биологических образцах при температуре окружающей среды в течение длительных периодов времени. 3 н. и 47 з.п. ф-лы, 29 ил., 11 табл., 12 пр.
1. Способ стабилизации дезоксирибонуклеиновой кислоты (ДНК), содержащейся в биологическом образце, при температуре окружающей среды, причем указанный способ включает следующие этапы:
a) получение биологического образца, где биологический образец представляет собой образец фекалий или образец, загрязненный фекалиями;
b) приведение указанного биологического образца в контакт с водной композицией, содержащей хелатирующее средство, причем указанное хелатирующее средство выбрано из этилендиаминтетрауксусной кислоты (EDTA) или 1,2-циклогександиаминтетрауксусной кислоты (CDTA) и присутствует в концентрации от приблизительно 150 мМ до приблизительно 600 мМ и причем указанная композиция характеризуется значением рН от 9,5 до 11,5, для образования смеси;
c) гомогенизацию смеси согласно (b) с образованием гомогенной смеси; и
d) хранение гомогенной смеси при температуре окружающей среды.
2. Способ по п. 1, отличающийся тем, что биологический образец представляет собой образец фекалий, полученный от млекопитающего, такого как человек.
3. Способ по п. 1 или 2, отличающийся тем, что указанное хелатирующее средство представляет собой CDTA.
4. Способ по п. 1, отличающийся тем, что концентрация указанного хелатирующего средства составляет от приблизительно 150 мМ до приблизительно 500 мМ или от приблизительно 250 мМ до приблизительно 350 мМ, предпочтительно приблизительно 300 мМ.
5. Способ по п. 1, отличающийся тем, что указанная композиция характеризуется значением рН от 10,5 до 11,5, предпочтительно 11.
6. Способ по п. 1, отличающийся тем, что указанная композиция характеризуется значением рН 11.
7. Способ по п. 1, отличающийся тем, что указанная композиция дополнительно содержит:
по меньшей мере одно буферное средство, способное поддерживать буферные свойства в диапазоне от рН 9,5 до 11,5, такое как бета-аланин; и/или
водорастворимый органический растворитель, такой как C1-C6 алканол.
8. Способ по п. 7, отличающийся тем, что указанный водорастворимый органический растворитель представляет собой этанол, который возможно присутствует в композиции в концентрации менее чем приблизительно 30% по объему, предпочтительно менее чем приблизительно 24% по объему.
9. Способ по п. 1, отличающийся тем, что указанная композиция дополнительно содержит:
детергент, такой как додецилсульфат натрия; и/или
противовспенивающее средство, такое как Antifoam A.
10. Способ по п. 1, отличающийся тем, что указанную смесь гомогенизируют с применением средства гомогенизации; возможно указанное средство гомогенизации представляет собой по меньшей мере один шарик для перемешивания, такой как шарик для перемешивания из нержавеющей стали или шарик для перемешивания из карбида вольфрама.
11. Способ по п. 10, отличающийся тем, что указанный способ включает образование смеси биологического образца и композиции в контейнере для образца, содержащем по меньшей мере один шарик для перемешивания, запечатывание контейнера для образца и гомогенизацию смеси посредством встряхивания смеси в присутствии по меньшей мере одного шарика для перемешивания; возможно указанное встряхивание осуществляют рукой.
12. Способ по п. 11, отличающийся тем, что указанный по меньшей мере один шарик для перемешивания представляет собой шарик для перемешивания из нержавеющей стали, диаметр которого составляет приблизительно 5,6 – 11,1 мм и плотность которого составляет по меньшей мере приблизительно 7,6 г/см3.
13. Способ по п. 12, отличающийся тем, что диаметр указанного шарика для перемешивания из нержавеющей стали составляет приблизительно 7,1 – 8,7 мм, и указанный контейнер для образца представляет собой круглодонную пробирку, внутренний диаметр которой составляет приблизительно 12,9 мм.
14. Способ по п. 1, отличающийся тем, что указанная ДНК представляет собой ДНК человека.
15. Способ по п. 14, отличающийся тем, что указанный способ делает ДНК человека стабильной в течение:
по меньшей мере 7 дней, по меньшей мере 14 дней, по меньшей мере 30 дней или по меньшей мере 60 дней при комнатной температуре;
по меньшей мере 7 дней или по меньшей мере 14 дней при температуре от приблизительно 37°C до приблизительно 50°C; и/или
по меньшей мере 30 дней при температуре -20°C.
16. Способ по п. 1, отличающийся тем, что указанная ДНК представляет собой микробную ДНК, и указанный способ стабилизирует профиль микробиома биологического образца.
17. Способ по п. 16, отличающийся тем, что указанный способ делает профиль микробиома биологического образца стабильным в течение:
по меньшей мере 7 дней, по меньшей мере 14 дней, по меньшей мере 30 дней или по меньшей мере 60 дней при комнатной температуре;
по меньшей мере 7 дней или по меньшей мере 14 дней при температуре от приблизительно 37°C до приблизительно 50°C; и/или
по меньшей мере 30 дней при температуре -20°C.
18. Способ по п. 1, отличающийся тем, что биологический образец представляет собой образец фекалий, полученный от млекопитающего, композиция характеризуется значением рН от 9,5 до 11,5 или от 10,5 до 11,5, предпочтительно 11, и указанная композиция содержит, по существу состоит или состоит из:
CDTA в количестве от приблизительно 250 мМ до приблизительно 350 мМ, предпочтительно приблизительно 300 мМ;
β-аланина в количестве от приблизительно 30 мМ до приблизительно 70 мМ, предпочтительно приблизительно 50 мМ;
этанола в количестве от приблизительно 21,5% до приблизительно 23,5% по объему, предпочтительно приблизительно 23,5% по объему;
додецилсульфата натрия в количестве от приблизительно 0 до приблизительно 1% (масс./об.), предпочтительно приблизительно 0,5% (масс./об.); и
Antifoam A в количестве от приблизительно 0 до приблизительно 0,2% (об./об.), предпочтительно приблизительно 0,1% (об./об.);
возможно, при этом указанный способ включает образование смеси образца фекалий и композиции в круглодонной пробирке, внутренний диаметр которой составляет приблизительно 12,9 мм и которая содержит по меньшей мере один шарик для перемешивания из нержавеющей стали, диаметр которого составляет приблизительно 5,6 – 11,1 мм и плотность которого составляет по меньшей мере приблизительно 7,6 г/см3, запечатывание круглодонной пробирки и гомогенизацию смеси посредством встряхивания смеси рукой в присутствии по меньшей мере одного шарика для перемешивания из нержавеющей стали.
19. Способ по п. 18, отличающийся тем, что указанная ДНК представляет собой микробную ДНК, и указанный способ стабилизирует профиль микробиома образца фекалий, причем указанный профиль микробиома образца фекалий остается стабильным в течение:
по меньшей мере 7 дней, по меньшей мере 14 дней, по меньшей мере 30 дней или по меньшей мере 60 дней при комнатной температуре;
по меньшей мере 7 дней или по меньшей мере 14 дней при температуре от приблизительно 37°C до приблизительно 50°C; и/или
по меньшей мере 30 дней при температуре -20°C.
20. Водная композиция для стабилизации дезоксирибонуклеиновой кислоты (ДНК), содержащейся в биологическом образце, при температуре окружающей среды, причем указанный биологический образец представляет собой образец фекалий или образец, загрязненный фекалиями, указанная композиция содержит хелатирующее средство, причем указанное хелатирующее средство выбрано из EDTA или CDTA и присутствует в концентрации от приблизительно 150 мМ до приблизительно 600 мМ, и причем указанная композиция характеризуется значением рН от 9,5 до 11,5.
21. Композиция по п. 20, отличающаяся тем, что указанный биологический образец представляет собой образец фекалий, полученный от млекопитающего, такого как человек.
22. Композиция по п. 20 или 21, отличающаяся тем, что указанное хелатирующее средство представляет собой CDTA.
23. Композиция по п. 20, отличающаяся тем, что концентрация указанного хелатирующего средства составляет от приблизительно 150 мМ до приблизительно 500 мМ или от приблизительно 250 мМ до приблизительно 350 мМ, предпочтительно приблизительно 300 мМ.
24. Композиция по п. 20, отличающаяся тем, что указанная композиция характеризуется значением рН от 10,5 до 11,5, предпочтительно 11.
25. Композиция по п. 20, отличающаяся тем, что указанная композиция характеризуется значением рН 11.
26. Композиция по п. 20, отличающаяся тем, что указанная композиция дополнительно содержит: по меньшей мере одно буферное средство, способное поддерживать буферные свойства в диапазоне рН от 9,5 до 11,5, такое как бета-аланин; и/или
водорастворимый органический растворитель, такой как C1-C6 алканол.
27. Композиция по п. 26, отличающаяся тем, что указанный водорастворимый органический растворитель представляет собой этанол, который возможно присутствует в композиции в концентрации менее чем приблизительно 30% по объему, предпочтительно менее чем приблизительно 24% по объему.
28. Композиция по п. 20, отличающаяся тем, что указанная композиция дополнительно содержит:
детергент, такой как додецилсульфат натрия; и/или
противовспенивающее средство, такое как Antifoam A.
29. Композиция по п. 20, отличающаяся тем, что указанная ДНК представляет собой ДНК человека.
30. Композиция по п. 20, отличающаяся тем, что указанная ДНК представляет собой микробную ДНК, и указанная композиция предназначена для стабилизации профиля микробиома биологического образца.
31. Композиция по п. 20, отличающаяся тем, что указанный биологический образец представляет собой образец фекалий, полученный от млекопитающего, указанная композиция характеризуется значением рН от 10,5 до 11,5, предпочтительно 11, и указанная композиция содержит, по существу состоит или состоит из:
CDTA в количестве от приблизительно 250 мМ до приблизительно 350 мМ, предпочтительно приблизительно 300 мМ;
β-аланина в количестве от приблизительно 30 мМ до приблизительно 70 мМ, предпочтительно приблизительно 50 мМ;
этанола в количестве от приблизительно 21,5% до приблизительно 23,5% по объему, предпочтительно приблизительно 23,5% по объему;
додецилсульфата натрия в количестве от приблизительно 0 до приблизительно 1% (масс./об.), предпочтительно приблизительно 0,5% (масс./об.); и
Antifoam A в количестве от приблизительно 0 до приблизительно 0,2% (об./об.), предпочтительно приблизительно 0,1% (об./об.).
32. Композиция по п. 31, отличающаяся тем, что указанная композиция предназначена для стабилизации профиля микробиома образца фекалий.
33. Набор для стабилизации дезоксирибонуклеиновой кислоты (ДНК), содержащейся в биологическом образце, при температуре окружающей среды, причем указанный биологический образец представляет собой образец фекалий или образец, загрязненный фекалиями, где указанный набор содержит:
a) контейнер для образца, содержащий перепломбируемое средство укупорки;
b) водную композицию, содержащую хелатирующее средство, причем указанное хелатирующее средство выбрано из EDTA или CDTA и присутствует в концентрации от приблизительно 150 мМ до приблизительно 600 мМ, причем указанная композиция характеризуется значением рН от 9,5 до 11,5;
c) средство гомогенизации;
d) средство для переноса биологического образца или части указанного образца в контейнер для образца; и
е) инструкции по применению.
34. Набор по п. 33, отличающийся тем, что указанная композиция содержится в контейнере для образца и/или средство гомогенизации содержится в контейнере для образца.
35. Набор по п. 33 или 34, отличающийся тем, что указанный биологический образец представляет собой образец фекалий, полученный от млекопитающего, такого как человек.
36. Набор по п. 33, отличающийся тем, что указанное хелатирующее средство представляет собой CDTA.
37. Набор по п. 33, отличающийся тем, что концентрация указанного хелатирующего средства составляет от приблизительно 150 мМ до приблизительно 500 мМ или от приблизительно 250 мМ до приблизительно 350 мМ, предпочтительно приблизительно 300 мМ.
38. Набор по п. 33, отличающийся тем, что указанная композиция характеризуется значением рН от 10,5 до 11,5, предпочтительно 11.
39. Набор по п. 33, отличающийся тем, что указанная композиция характеризуется значением рН, равным 11.
40. Набор по п. 33, отличающийся тем, что указанная композиция дополнительно содержит:
по меньшей мере одно буферное средство, способное поддерживать буферные свойства в диапазоне рН от 9,5 до 11,5, такое как бета-аланин; и/или
водорастворимый органический растворитель, такой как C1-C6 алканол.
41. Набор по п. 40, отличающийся тем, что указанный водорастворимый органический растворитель представляет собой этанол; который возможно присутствует в композиции в концентрации менее чем приблизительно 30% по объему, менее чем приблизительно 24% по объему.
42. Набор по п. 33, отличающийся тем, что указанная композиция дополнительно содержит:
детергент, такой как додецилсульфат натрия; и/или
противовспенивающее средство, такое как Antifoam A.
43. Набор по п. 33, отличающийся тем, что указанная ДНК представляет собой ДНК человека.
44. Набор по п. 33, отличающийся тем, что указанная ДНК представляет собой микробную ДНК, и указанный набор предназначен для стабилизации профиля микробиома биологического образца.
45. Набор по п. 33, отличающийся тем, что указанное средство гомогенизации представляет собой по меньшей мере один шарик для перемешивания, такой как шарик для перемешивания из нержавеющей стали или шарик для перемешивания из карбида вольфрама.
46. Набор по п. 45, отличающийся тем, что указанный по меньшей мере один шарик для перемешивания представляет собой шарик для перемешивания из нержавеющей стали, диаметр которого составляет приблизительно 5,6 – 11,1 мм и плотность которого составляет по меньшей мере приблизительно 7,6 г/см3.
47. Набор по п. 46, отличающийся тем, что диаметр указанного шарика для перемешивания из нержавеющей стали составляет приблизительно 7,1 – 8,7 мм, и указанный контейнер для образца представляет собой круглодонную пробирку, внутренний диаметр которой составляет приблизительно 12,9 мм.
48. Набор по п. 33, отличающийся тем, что указанный биологический образец представляет собой образец фекалий, полученный от млекопитающего, указанная композиция характеризуется значением рН от 10,5 до 11,5, предпочтительно 11, и указанная композиция содержит, по существу состоит или состоит из:
CDTA в количестве от приблизительно 250 мМ до приблизительно 350 мМ, предпочтительно 300 мМ;
β-аланина в количестве от приблизительно 30 мМ до приблизительно 70 мМ, предпочтительно 50 мМ;
этанола в количестве от приблизительно 21,5% до приблизительно 23,5% по объему, предпочтительно 23,5% по объему;
додецилсульфата натрия в количестве от приблизительно 0 до приблизительно 1% (масс./об.), предпочтительно приблизительно 0,5% (масс./об.) ; и
Antifoam A в количестве от приблизительно 0 до приблизительно 0,2% (об./об.), предпочтительно приблизительно 0,1% (об./об.).
49. Набор по п. 48, отличающийся тем, что указанная нуклеиновая кислота представляет собой микробную ДНК, и указанный набор предназначен для стабилизации профиля микробиома биологического образца.
50. Набор по п. 49, отличающийся тем, что указанное средство гомогенизации представляет собой по меньшей мере один шарик для перемешивания из нержавеющей стали, диаметр которого составляет приблизительно 5,6 – 11,1 мм и плотность которого составляет по меньшей мере приблизительно 7,6 г/см3, и указанный контейнер для образца представляет собой круглодонную пробирку, внутренний диаметр которой составляет приблизительно 12,9 мм.
| US 7482116 B2, 27.01.2009 | |||
| US 7482116 B2, 27.01.2009 | |||
| US 2012288956, 15.11.2012 | |||
| US 8293467, 23.10.2012 | |||
| US 8158357, 17.04.2012 | |||
| WO 2010123908 A1, 28.10.2010 | |||
| КОМПОЗИЦИЯ И СПОСОБ ДЛЯ ВЫДЕЛЕНИЯ НУКЛЕИНОВЫХ КИСЛОТ ИЗ КОМПЛЕКСНЫХ МАТЕРИАЛОВ С ПРИМЕНЕНИЕМ АНТИХАОТРОПНОЙ СОЛИ | 1999 |
|
RU2241004C2 |
| SMITH B | |||
| et al | |||
| "Optimising bacterial DNA extraction from faecal samples: comparison of three methods" | |||
| The Open Microbiology Journal | |||
| Машина для добывания торфа и т.п. | 1922 |
|
SU22A1 |
Авторы
Даты
2020-03-24—Публикация
2015-03-06—Подача