Изобретение относится к медицинской химии, конкретно к новым биологически активным соединениям - амидным производным простагландина F2α.
Простагландины представляют собой семейство полифункциональных биологически активных веществ синтезируемых в организме из арахидоновой кислоты с помощью циклооксигеназы (СОХ). Эти окисленные жирные кислоты являются аутокринными и паракринными липидными медиаторами, и для них характерно проявление широкого спектра физиологической активности, например, сочетание дилататорной (на гладких мышцах бронхов), констрикторной (на гладких мышцах желудочно-кишечного тракта), антиагрегационной (на тромбоцитах), гипо- или гипертензивной активностей [Nicolau A. In: Bioactive Lipids (Eds. Nicolau A., Kokotos J.) // Bridgewater: Oily Press, 2004. - 197 р]. Простагландин F2α образуется в организме в результате окислительного метаболизма арахидоновой кислоты под действием циклоксигеназы на первой стадии и редуктазы - на второй стадии биосинтеза [Smith W.L., Marnett L.J., DeWitt D.L. Prostaglandin and thromboxane biosynthesis // Pharmacology & Therapeutics. 1991, V. 49(3), P. 153-179]. Он является эндогенным лигандом G-белок сопряженного рецептора FP, активация которого приводит к мобилизации внутриклеточного кальция [Toh Н, Ichikawa A, Narumiya S. Molecular evolution of receptors for eicosanoids. // FEBS Lett. 1995, V. 361, P. 17-21].
Простагландины используются при лечении гипертензии, тромбозов, астмы, желудочных и кишечных язв, профилактики атеросклероза, а также в акушерстве. Агонисты FP-рецептора используются в клинике как агенты, снижающие внутриглазное давление [Woodward D.F., Lawrence R.A., Fairbairn С.Е., Shan Т., Williams L.S. Intraocular pressure effects of selective prostanoid receptor agonists involve different receptor subtypes according to radioligand binding studies. // J Lipid Mediat. 1993, V. 6(1-3), P. 545-553.]
Простамиды (амиды простагландинов и этаноламида) образуются в организме путем окисления этаноламида арахидоновой кислоты (анандамида) циклооксигеназой-2 [Kozak K.R., Crews B.C., Ray J.L., Tai H.H., Morrow J.D., Marnett L.J. Metabolism of prostaglandin glycerol esters and prostaglandin ethanolamides in vitro and in vivo. // J. Biol. Chem. 2001, V. 276(40), P. 36993-36998]. Оказалось, что эти производные также обладают способностью снижать внутриглазное давление. Наиболее известным препаратом этого класса является синтетический аналог простамида F2 - биматопрост, в котором остаток этаноламина заменен на остаток этиламина, а алкильная боковая цепь простамида модифицирована введением фенильного радикала [Woodward D.F., Krauss А.Н., Chen J., Lai R.K., Spada C.S., Burk R.M., Andrews S.W., Shi L., Liang Y., Kedzie K.M., Chen R., Gil D.W., Kharlamb A., Archeampong A., Ling J., Madhu C., Ni J., Rix P., Usansky J., Usansky H., Weber A., Welty D., Yang W., Tang-Liu D.D., Garst M.E., Brar В., Wheeler L.A., Kaplan L.J. The pharmacology of bimatoprost (Lumigan) // Surv. Ophthalmol. 2001, V. 45, Suppl 4, P. S337-S345].
Известны многочисленные аналоги простамидов, в которых модифицированы как простаноидная часть молекулы, так и этаноламидная. Наиболее близкими к заявляемым соединениям являются простамиды, обладающие нейрозащитным действием [Безуглов В.В., Бобров М.Ю., Грецкая Н.М., Серков И.В., Зинченко Г.Н., Акимов М.Г. Простамиды и их аналоги, обладающие нейрозащитным действием. / Патент РФ №2474426, приоритет от 26.12.2011, публикация 10.02.2013, Бюл. №4]. В данном патенте описаны аналоги простамида Е, содержащие остатки нитроксиэтиламина, глицина, гамма-аминомасляной кислоты, гидроксиэтиламина, тирамина и дофамина. Однако в данном патенте нет описания аналогов простамида F, содержащего такие же модифицированные остатки этаноламина.
Известны также аналоги простагландина F2α, например, патент [US Pat. No 7,910,767], в котором описаны эфиры, тиоэфиры и амиды простагландина F2α с измененной алкильной боковой цепью, обладающие измененной биологической активностью по сравнению с известными аналогами простагландина F2α, применяемыми в медицине (биматопростом, травопростом и др.).
Известны также аналоги простагландина F2α, содержащие нитроксигруппы.
US. Pat. No. 5,625,083 описывает динитроглицериновые эфиры простагландинов, в том числе и простагландина F2α, которые могут быть использованы как вазодилататоры, антигипертензивные агенты или бронходилататоры.
US. Pat. No. 8,101,658 описывает простамиды, генерирующие оксид азота, которые могут быть использованы для лечения глаукомы и повышенного внутриглазного давления.
Однако данные изобретения не содержат структур, раскрываемых в настоящем изобретении.
Задача данного изобретения - расширение номенклатуры биологически активных производных простагландина F2α, обладающих способностью понижать внутриглазное давление. Поставленная задача решается путем синтеза амидных производных простагландина F2α, в которых амидная часть представлена аминокислотами, их нитропроизводными, циклическими аминами и замещенными этаноламинами.
Таким образом, объектом данного изобретения являются амидные производные простагландина F2α общей формулы (1):
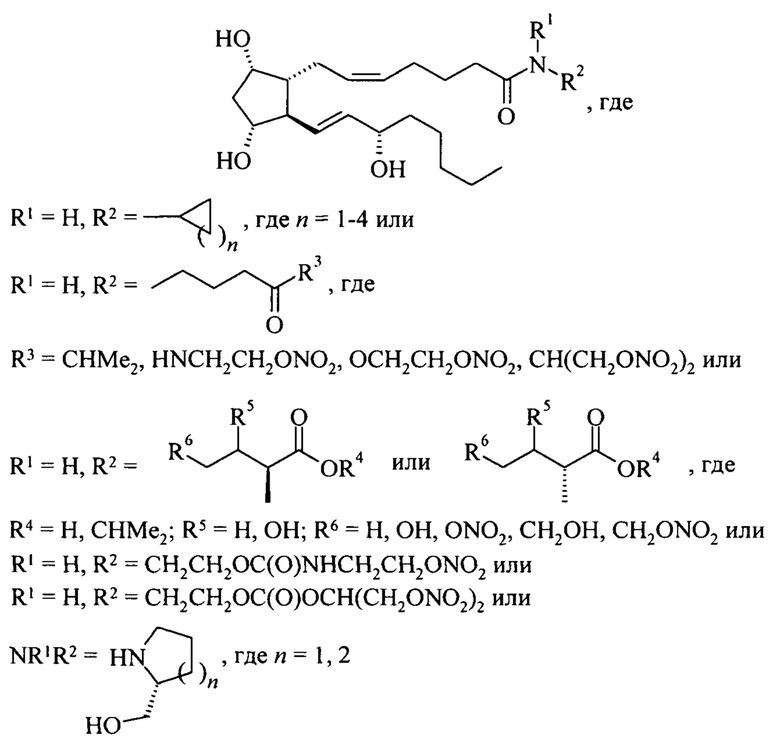
где R1 и R2 независимо означают водород, алкил, циклоалкил, гидроксиалкил, аминокислоты, эфиры и амиды аминокислот, а также R1+R2 могут означать гетероцикл (например, замещенный или незамещенный пиперидин, пирролидин и др.); а также фармацевтически приемлемые соли для соединений общей формулы (1) со свободной карбоксильной группой; а также смеси двух или более соединений общей формулы (1) в различных соотношениях.
Данные вещества обладают низкой цитотоксичностью и способны стимулировать образование эндогенного оксида азота в клетках млекопитающих.
Если не указано иное, все технические и научные термины, используемые в данном документе, имеют тот же смысл, который общепринят в области, к которой принадлежит изобретение, и может быть понят специалистом, имеющим соответствующие навыки.
«Замещенный» означает, что специфическая группа или остаток включают один или более заместителей, отличных от атома водорода.
«Незамещенный» означает, что специфическая группа или остаток не содержат заместителей, отличных от атома водорода.
«Алкил» означает незамещенную алкильную группу с прямой или разветвленной цепью, содержащую от 1 до 6 атомов углерода.
«Циклоалкил» означает циклическую насыщенную углеводородную группу с 3-6 кольцевыми атомами углерода (например, циклопропил, циклобутил и аналогичные).
«Смесь» - совместное включение двух и более веществ без образования химических связей, а физические свойства каждого из компонентов сохраняются без изменений.
«Фармацевтически приемлемая соль» означает, что компонент, образующий соль с карбоксильной группой заявляемых веществ не будет наносить вред организму человека.
«Фармацевтически приемлемый катион» означает, что данный катион при образовании соли не будет наносить вред организму человека.
В общем виде вещества настоящего изобретения могут быть синтезированы методами, известными из области химии. Некоторые процессы производства конкретных веществ настоящего изобретения иллюстрируют схемы, приведенные в примерах.
Биологические активности веществ настоящего изобретения включают: отсутствие цитотоксичности вплоть до концентрации 100 мкМ; способность снижать внутриглазное давление; способность повышать концентрацию внутриклеточного кальция, способность увеличивать продукцию оксида азота.
Заявляемые вещества, являясь аналогами природного простагландина F2α, способны взаимодействовать со специфическим простаноидным рецептором FP, что выражается в стимулировании мобилизации внутриклеточного кальция.
Неожиданным результатом данного изобретения является способность заявляемых веществ индуцировать эндогенный синтез оксида азота в клетках млекопитающих. Такие свойства не отмечены ранее ни для одного производного простагландина F2α. Более того, этим свойством обладали соединения, не содержащие NO-донорных групп, например амид простагландина F2α и изопропилового эфира серина (соединение 3).
Таким образом, задача данного изобретения решается путем синтеза новых амидных производных простагландина F2α общей формулы (1), обладающих способностью индуцировать эндогенный синтез оксида азота, что значительно расширяет возможности медицинского применения заявляемых веществ за счет вовлечения в механизм фармакологического эффекта эндогенного регулятора - оксида азота.
Нижеследующие примеры приведены в целях иллюстрирования настоящего изобретению и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения.
Пример 1. Амиды простагландина F2α с серином и его производными, циклопропиламином и L-пролинолом.
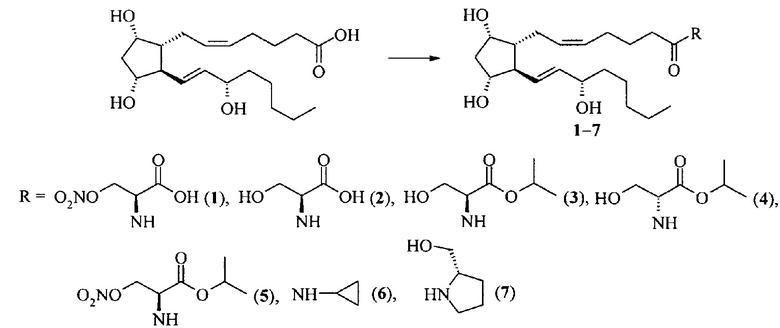
Амид простагландина F2α с L-нитросерином (1).
К раствору 150 мг (0.42 ммоль) простагландина F2α в 2 мл ацетонитрила в атмосфере аргона прибавляют 76 мкл (0.55 ммоль) Et3N, перемешивают 5 мин и прибавляют раствор 71 мкл (0.55 ммоль) изобутилхлорформиата в 500 мкл ацетонитрила. Реакционную смесь перемешивают 30 мин при 4°С, упаривают до половины объема, разбавляют 50 мл этилацетата и промывают водой (2×20 мл) и насыщенным водным раствором NaCl (20 мл) и сушат над безводным Na2SO4. Сушитель отфильтровывают, фильтрат упаривают на роторном испарителе в вакууме водоструйного насоса. Остаток высушивают в вакууме масляного насоса. Получают 171 мг смешанного ангидрида, желтое масло.
К раствору 104 мг (0.49 ммоль) азотнокислой соли L-нитросерина в 0.500 мл ДМФА при 4°С в атмосфере аргона прибавляют раствор полученного смешанного ангидрида в 1 мл ДМФА и 52 мкл N-метилморфолина и перемешивают полученную смесь 90 мин. Растворитель упаривают, остаток разбавляют 50 мл этил ацетата и промывают 2М водным раствором NaHSO4 (20 мл) и насыщенным водным раствором NaCl (20 мл) и сушат над безводным Na2SO4. Сушитель отфильтровывают, фильтрат упаривают на роторном испарителе в вакууме водоструйного насоса. Получают 162 мг амида простагландина F2α и L-нитросерина, желтоватое масло, выход 70%.
ПМР: 0.90 (3Н), 1.29 (6Н), 1.53 (3Н), 1.75 (2Н), 2.18 (7Н), 2.41 (2Н), 2.71 (1Н), 3.95 (1Н), 4.14 (2Н), 4.33 (1Н), 4.88 (2Н), 5.52 (4Н). Масс-спектр: 509.2832 [M+Na]+, 441.3282 [M-NO2+Na+H]+, 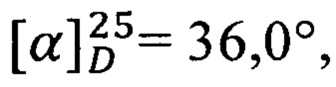 с=1, EtOH.
с=1, EtOH.
Амид простагландина F2α с L-серином (2).
Получен аналогично из простагландина F2α и L-серина. Выход 51%. ПМР: 0.84 (3Н), 1.3 (6Н), 1.52 (3Н), 1.95 (3Н), 2.16 (6Н), 2.33 (2Н), 2.68 (1Н), 3.89 (2Н), 3.92 (1Н), 4.19 (1Н), 4.32 (2Н), 5.34 (4Н), 7.8 (1H). 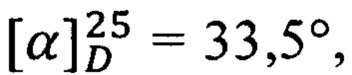 с=1, EtOH:H2O, 1:2.
с=1, EtOH:H2O, 1:2.
Амид простагландина F2α с изопропиловым эфиром L-серина (3).
Получен аналогично из простагландина F2α и гидрохлорида изопропилового эфира L-серина. Выход 57%. ПМР: 0.89 (3Н), 1.22 (6Н), 1.3 (9Н), 1.76 (3Н), 2.04 (6Н), 2.39 (2Н), 3.9 (2Н), 4.03 (2Н), 4.13 (1Н), 4.63 (1Н), 5.08 (1Н), 5.45 (4Н), 6.83 (1Н). 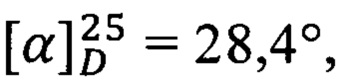 с=1, EtOH.
с=1, EtOH.
Амид простагландина F2α с изопропиловым эфиром D-серина (4).
Получен аналогично из простагландина F2α и гидрохлорида изопропилового эфира D-серина. Выход 35%. ПМР: 0.89 (3Н), 1.21 (6Н), 1.3 (9Н), 1.74 (3Н), 2.01 (6Н), 2.4 (2Н), 3.9 (2Н), 4.0 (2Н), 4.1 (1Н), 4.6 (1Н), 5.1 (1Н), 5.43 (4Н), 6.9 (1Н). - 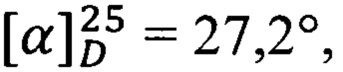 с=1, EtOH.
с=1, EtOH.
Амид простагландина F2α с изопропиловым эфиром L-нитросерина (5).
Получен аналогично из простагландина F2α и изопропилового эфира L-нитросерина. Выход 64%. ПМР: 0.84 (3Н), 1.16 (6Н), 1.23 (8Н), 1.51 (4Н), 1.96 (4Н), 2.12 (4Н), 3.88 (3Н), 4.52 (1Н), 4.9 (2Н), 5.34 (5Н), 7.9 (1H).
Амид простагландина F2α с циклопропиламином (6).
Получен аналогично из простагландина F2α и циклопропиламина. Выход 73%. ПМР: 0.50 (2Н), 0.78 (2Н), 0.90 (3Н), 1.31 (6Н), 1.61 (4Н), 1.86 (4Н), 2.06 (4Н), 2.36 (2Н), 2.70 (1H), 4.00 (1H), 4.09 (1H), 4.20 (1Н), 5.41 (1Н), 5.57 (2Н), 5.78 (2Н). 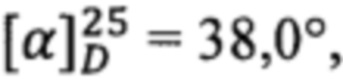 с=1, EtOH.
с=1, EtOH.
Амид простагландина F2α с L-пролинолом (7).
Получен аналогично из простагландина F2α и L-пролинола. Выход 61%. ПМР: 0.91 (3Н), 1.36 (6Н), 1.60 (6Н), 1.89 (6Н), 2.08 (4Н), 2.39 (1Н), 2.65 (1H), 3.2 (1Н), 3.45 (1Н), 3.57 (1H), 3.73 (1H), 3.90 (1Н), 4.06 (1Н), 4.21 (2Н), 5.48 (2Н), 5.69 (2Н). 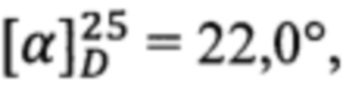 с=1, EtOH.
с=1, EtOH.
Пример 2. Амиды простагландина F2α и производных γ-аминомасляной кислоты.
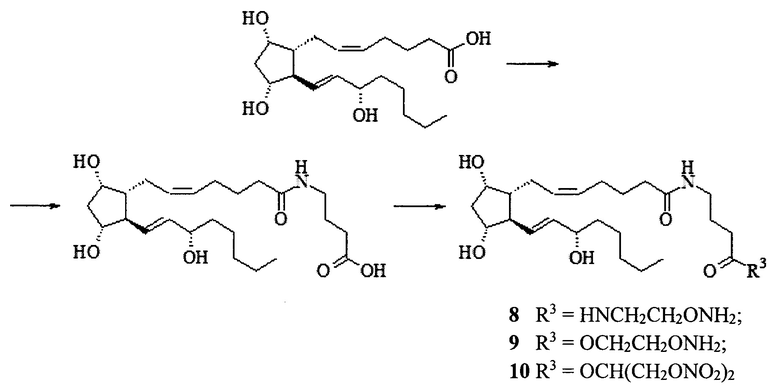
Амид простагландина F2α и γ-аминомасляной кислоты.
К раствору 103 мг (1.00 ммоль) γ-аминомасляной кислоты в 1 мл ацетонитрила прибавляют 600 мкл N,O-бис(триметилсилил) трифторацетамида и перемешивают 18 ч при 23°С.
К раствору 284 мг (0.8 ммоль) простагландина F2α в 3 мл ацетонитрила прибавляют 145 мкл (1.05 ммоль) триэтиламина и 125 мкл (0.96 ммоль) изобутилхлорформиата и перемешивают 30 мин при 23°С. Полученный смешанный ангидрид прибавляют к раствору силилированной γ-аминомасляной кислоты и перемешивают 4 ч при 23°С. К реакционной смеси прибавляют метанол (5 мл), перемешивают 20 мин и упаривают на роторном испарителе в вакууме водоструйного насоса. Остаток растворяют в этилацетате (20 мл) и промывают 2М водным раствором NaHSO4 (20 мл) и насыщенным водным раствором NaCl (20 мл) и сушат над безводным Na2SO4. Сушитель отфильтровывают, фильтрат упаривают на роторном испарителе в вакууме водоструйного насоса. Остаток очищают колоночной хроматографией на силикагеле. Получают 132 мг амида простагландина F2α и γ-аминомасляной, прозрачное масло, выход 60%. Масс-спектр: 462.2888 [M+Na]+.
Амид простагландина F2α с нитроэтаноламидом γ-аминомасляной кислоты (8).
К раствору 80 мг (0.18 ммоль) амида простагландина F2α с γ-аминомасляной кислотой в 3 мл ацетонитрила в атмосфере аргона прибавляют 30 мкл (0.23 ммоль) Et3N, перемешивают 5 мин и прибавляют 30 мкл (0.22 ммоль) изобутилхлорформата. Реакционную смесь перемешивают 30 мин при 4°С, прибавляют раствор 38 мг (0.37 ммоль) азотнокислой соли нитроэтаноламина и 50 мкл Et3N в 2 мл хлористого метилена и перемешивают 12 ч при 23°С. Растворитель упаривают, остаток разбавляют 20 мл этилацетата и промывают 2М водным раствором NaHSO4 (20 мл) и насыщенным водным раствором NaCl (20 мл) и сушат над безводным Na2SO4. Сушитель отфильтровывают, фильтрат упаривают на роторном испарителе в вакууме водоструйного насоса. Остаток очищают колоночной хроматографией на силикагеле. Получают 35 мг амида простагландина F2α и нитроэтаноламида γ-аминомасляной кислоты (8), выход 36%. ПМР: 0.88 (3Н), 1.21 (6Н), 1.65 (3Н), 1.77 (4Н), 2.11 (7Н), 2.38 (1Н), 2.62 (1Н), 3.33 (2Н), 3.55 (2Н), 3.97 (1H), 4.18 (2Н), 4.53 (2Н), 4.68 (2Н), 5.47 (4Н). 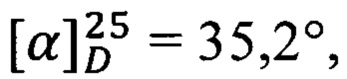 с=1, EtOH.
с=1, EtOH.
Амид простагландина F2α с нитроэтиленгликолевым эфиром γ-аминомасляной кислоты (9).
К раствору 14 мкл (0.12 ммоль) нитроэтиленгликоля в 1 мл хлористого метилена прибавляют 24 мг (0.12 ммоль) гидрохлорида N-(3-диметиламинопропил)-N'-этилкарбоната, 3 мг (0.02 ммоль) диметиламинопиридина и 45 мг (0.1 ммоль) амида простагландина F2α с γ-аминомасляной кислотой и перемешивают 90 мин при 23°С. Реакционную смесь разбавляют хлороформом (20 мл) и промывают 2М водным раствором NaHSO4 (20 мл), водой (2×20 мл) и насыщенным водным раствором NaCl (20 мл) и сушат над безводным Na2SO4. Сушитель отфильтровывают, фильтрат упаривают на роторном испарителе в вакууме водоструйного насоса. Остаток очищают колоночной хроматографией на силикагеле. Получают 20 мг амида (9), бесцветное масло, выход 37%.
ПМР: 0.89 (3Н), 1.38 (11Н), 1.88 (9Н), 2.27 (2Н), 2.87 (2Н), 3.22 (2Н), 3.81 (1Н), 3.99 (1H), 4.07 (1Н), 4.37 (2Н), 4.67 (2Н), 5.36 (4Н), 7.57 (1Н). 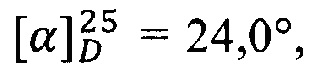 с=1, EtOH.
с=1, EtOH.
Амид простагландина F2α с динитроглицериновым эфиром γ-аминомасляной кислоты (10).
К раствору 84 мг (0.2 ммоль) амида простагландина F2α с γ-аминомасляной кислотой в 1 мл хлористого метилена в атмосфере аргона прибавляют раствор 44 мг (0.43 ммоль) гидрохлорида N-(3-диметиламинопропил)-N'-этилкарбодиимида в 0.5 мл хлористого метилена, 5 мг (0.04 ммоль) N-диметиламинопиридина и 42 мг (0.22 ммоль) динитрата глицерина и перемещивают 2 ч при 23°С. Растворитель упаривают, остаток разбавляют этилацетатом (20 мл) и промывают 2М водным раствором NaHSO4 (20 мл), водой (2×20 мл) и насыщенным водным раствором NaCl (20 мл) и сушат над безводным Na2SO4. Сушитель отфильтровывают, фильтрат упаривают на роторном испарителе в вакууме водоструйного насоса. Остаток очищают колоночной хроматографией на силикагеле. Получают 38 мг амида простагландина F2α с динитроглицериновым эфиром γ-аминомасляной кислоты (10), выход 33%. ПМР: 0.84 (3Н), 1.43 (14 Н), 1.98 (8Н), 2.34 (2Н), 3.04 (2Н), 3.88 (2Н), 4.31 (1Н), 4.46 (2Н), 4.77 (2Н), 5.36 (5Н), 7.75 (1Н). Масс-спектр: 626.2968 [M+Na]+, 586.3943 [М+Н-H2O]+. 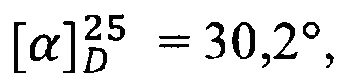 с=1, EtOH.
с=1, EtOH.
Пример 3. Амид простагландина F2α с 2-аминоэтил-[2-(нитрокси)этил]карбаматом (11).
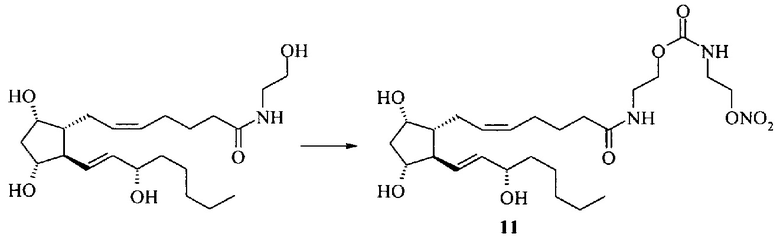
К раствору 150 мг (0.37 ммоль) амида простагландина F2α с этаноламином в 3 мл ацетонитрила прибавляют 93 мг (0.37 ммоль) дисукцинимидилкарбоната и 52 мкл (0.37 ммоль) Et3N и перемешивают при 23°С 1.5 ч. Затем прибавляют 62 мг (0.37 ммоль) азотнокислой соли нитроэтаноламина и 37 мг (0.37 ммоль) Et3N и перемешивают 18 ч при 4°С. Растворитель упаривают, остаток разбавляют 20 мл этилацетата и промывают 2М водным раствором NaHSO4 (20 мл) и насыщенным водным раствором NaCl (20 мл) и сушат над безводным Na2SO4. Сушитель отфильтровывают, фильтрат упаривают на роторном испарителе в вакууме водоструйного насоса. Остаток очищают колоночной хроматографией на силикагеле. Получают получают 38 мг амида (11), бесцветное масло, выход 19%. ПМР: 0.90 (3Н), 1.31 (6Н), 1.55 (4Н), 1.76 (3Н), 2.15 (5Н), 2.53 (2Н), 3.34 (2Н), 3.53 (2Н), 4.01 (1Н), 4.18 (4Н), 4.56 (2Н), 5.40 (2Н), 5.57 (2Н), 5.71 (1H), 6.25 (1Н). Масс-спектр: 552.2983 [M+Na]+. 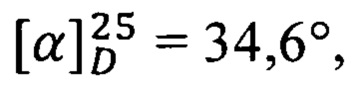 с=1, EtOH
с=1, EtOH
Амид простагландина F2α с 2-аминоэтил-2-(нитрокси)-1-[(нитрокси)метил]этил)карбонатом (12).
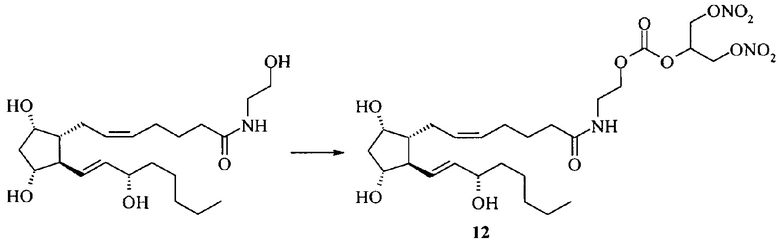
К раствору 55 мг (0.14 ммоль) амида простагландина F2α с этаноламином в 1.5 мл хлористого метилена прибавляют 32 мг (0.12 ммоль) дисукцинимидилкарбоната и 20 мкл (0.14 ммоль) Et3N и перемешивают при 23°С 40 мин. Затем прибавляют 25 мг (0.14 ммоль) динитрата глицерина и 16 мг (0.14 ммоль) N-диметиламинопиридина и перемешивают 18 ч при 4°С. Растворитель упаривают, остаток разбавляют 20 мл этилацетата и промывают 2М водным раствором NaHSO4 (20 мл) и насыщенным водным раствором NaCl (20 мл) и сушат над безводным Na2SO4. Сушитель отфильтровывают, фильтрат упаривают на роторном испарителе в вакууме водоструйного насоса. Остаток очищают колоночной хроматографией на силикагеле. Получают 20 мг амида (12), бесцветное масло, выход 19%. ПМР: 0.84 (3Н), 1.24-1.53 (12Н), 2.01 (8Н), 2.39 (1Н), 2.51 (1Н), 2.64 (2Н), 3.64 (2Н), 4.00 (2Н), 4.18 (1Н), 4.46 (2Н), 4.81 (2Н), 5.31 (5Н), 7.95 (1Н). Масс-спектр: 628.2770 [M+Na]+, 588.2843 [М+Н-H2O]+.
Пример 4. Цитотоксическая активность производных простагландина F2α.
Клетки 3T3-L1 инкубировали при 95% влажности, в атмосфере 5% СО2, при температуре 37°С. Культивирование проводили в среде DMEM, содержащей 7% FCS, 2 мМ глутамина, 100 ед/мл пенициллина, 100 мкг/мл стрептомицина и 0.25 мкг/мл амфотерицина В. Клетки пересевали каждые 48-72 ч. Для суспендирования клетки инкубировали в растворе Версена в течение 1 минуты и в растворе Трипсин-ЭДТА в течение 1 минуты (0.25%).
Оценка действия веществ на клетки
Клетки рассеивали по 30 тыс. в лунки 96-луночного планшета (монослой) в 100 мкл среды для МТТ-теста. Через 24 часа культивирования к клеткам добавляли 100 мкл исследуемых веществ в среде, использующейся для культивирования клеток, с заменой культуральной среды на новую. Клетки инкубировали с исследуемыми веществами 24 часа. В качестве положительного контроля использовали клетки, к которым добавляли 100 мкл среды, использующейся для культивирования клеток.
Оценка выживаемости клеток в культуре с помощью МТТ-теста
После окончания инкубации из каждой лунки убирали среду и в каждую лунку добавляли по 100 мкл реактива МТТ (0.5 мг/мл МТТ, 3.5 мг/мл D-глюкозы в растворе Хэнкса). Планшет помещали в СО2-инкубатор (Ependorf, Германия) на 1.5 часа. После этого убирали МТТ и в каждую лунку добавляли по 100 мкл DMSO и перемешивали 2 минуты на шейкере со скоростью 550 об/мин. После этого определяли оптическую плотность раствора при длинах волн 576 нм и 620 нм на планшетном иммуноферментном фотометре (ЭФОС 9305, ОАО «МЗ Сапфир»).
Все исследованные вещества не обладали заметной цитотоксичностью вплоть до концентрации 100 мкМ (таблица 1).
Таблица 1. Цитотоксичностъ производных простагландина F2α по отношению к культивируемым клеткам 3Т3-L1 мыши


Пример 5. Снижение внутриглазного давления под действием производных простагландина F2α.
Исследование проведено на кроликах породы Шиншилла массой 2,5-3 кг. ВГД измеряли при помощи автоматического ручного тонометра для ветеринарии Tonovet (Icare, Финляндия).
Для исследования каждого образца использовали 2 группы кроликов:
5 животных, получавших однократную инсталляцию образца в оба глаза;
5 животных, получавших однократную инсталляцию физраствора в оба глаза.
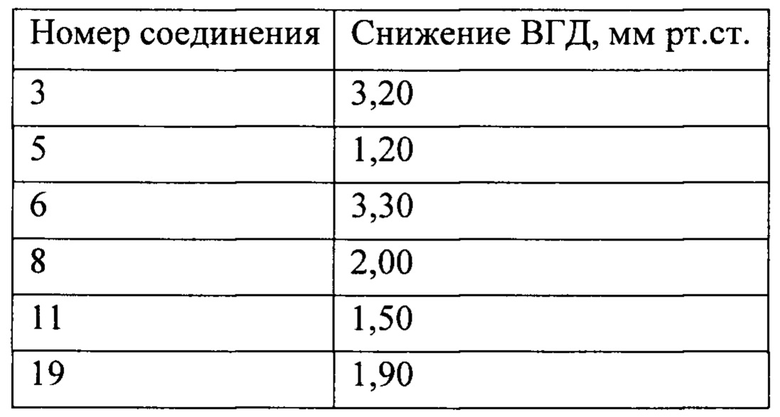
Все исследованные образцы закапывали по 2 капли одноразовой пипеткой. Измерение ВГД проводили до закапывания и далее через каждый час в течение 6 часов. Результаты представлены в таблице 2. Все исследованные вещества обладали способностью снижать внутриглазное давление у нормотензивных кроликов. Наиболее выражен этот эффект для соединений 3 и 6.
Таблица 2. Снижение внутриглазного давления у нормотензивных кроликов после инстилляции растворов производных простагландинов (максимальное значение усредненных данных по 5 животным)
Пример 6. Увеличение концентрации внутриклеточного кальция под действием производных простагландина F2α.
Клетки 3T3-L1 культивировали в среде DMEM с добавлением 10% сыворотки новорожденных телят (FCS), 4 мМ L-глутамина, 100 ед./мл пенициллина, 100 мкг/мл стрептомицина, 2.5 мкг/мл амфотерицина В. Клетки культивировали в атмосфере 5% CO2, 95% влажности при температуре 37°С.
Плотность клеток на момент эксперимента 7000 в лунке 96-луночного планшета, краситель Calcium Green (1.5 мМ, загрузка в 0.4% Pluronic F-62 в среде инкубации без БСА 1 час при 37С, троекратная промывка 200 мкл среды инкубации после загрузки), среда инкубации: раствор Хэнкса, 1 г/л D-глюкоза, 1 мг/мл обезжиренный БСА, внесение веществ в этаноле (<0.5% финальная концентрация), инкубация при 25°С, детектирование при длине волны возб. 485 нм, детектирования 535 нм.
Результаты
При добавлении испытуемых веществ к клеткам 3T3-L1 происходит увеличение концентрации внутриклеточного кальция. Так при добавлении веществ сравнения: 67 мкМ простагландина F2α и простамида F2 (этаноламида простагландина F2α) флуоресценция кальциевого сенсора возрастает на 195 и 185 у.е. относительно контроля соответственно за 10 мин; тогда как в присутствии вещества 3, такое увеличение составило 405 у.е.
Пример 7. Генерация оксида азота под действием производных простагландина F2α.
Клетки 3T3-L1 инкубировали при 95% влажности, в атмосфере 5% СО2, при температуре 37°С. Культивирование проводили в среде DMEM, содержащей 7% FBS, 2 мМ глутамина, 100 ед/мл пенициллина, 100 мкг/мл стрептомицина и 0.25 мкг/мл амфотерицина В. Клетки пересевали каждые 48-72 ч. Для суспендирования клетки инкубировали в растворе Версена в течение 2-3 мин и в растворе Трипсин-ЭДТА (0.25%).
Определение уровня генерации NO
Клетки рассеивали по 30 тыс. в лунки (монослой) 96-луночного планшета в 100 мкл среды. Инкубация с веществами продолжалась 20 часов. После этого из каждой лунки отбирали аликвоту среды и определяли концентрацию NO по модифицированному методу Гриса. К 75 мкл анализируемой смеси в лунках 96-луночного планшета для ИФА добавляли 12.5 мкл водного раствора 0.04% сульфаниламида, выдерживали при комнатной температуре 10 мин с защитой от света, после чего добавляли 12.5 мкл 2% раствора нафтилэтилендиамина в 3М HCl, выдерживали еще 10 минут при комнатной температуре с защитой от света, после чего определяли оптическое поглощение при длине волны 540 нм.
Для большинства исследованных соединений максимальную активность по индукции генерации оксида азота наблюдали при концентрации испытуемого вещества 100 мкМ. Результаты отображены в Таблице 3.
Таблица 3. Генерация оксида азота (NO) клетками 3Т3-L1 мыши под действием производных простагландина F2α при концентрации 100 мкМ
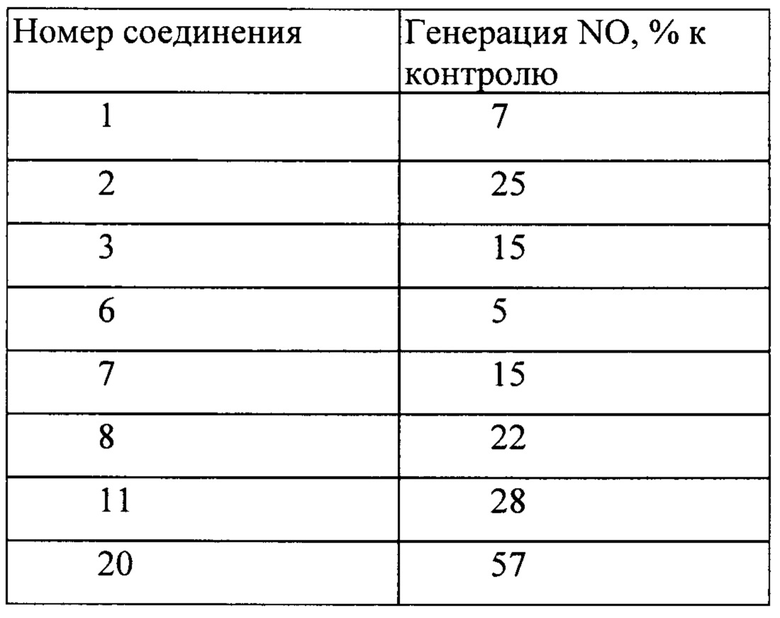
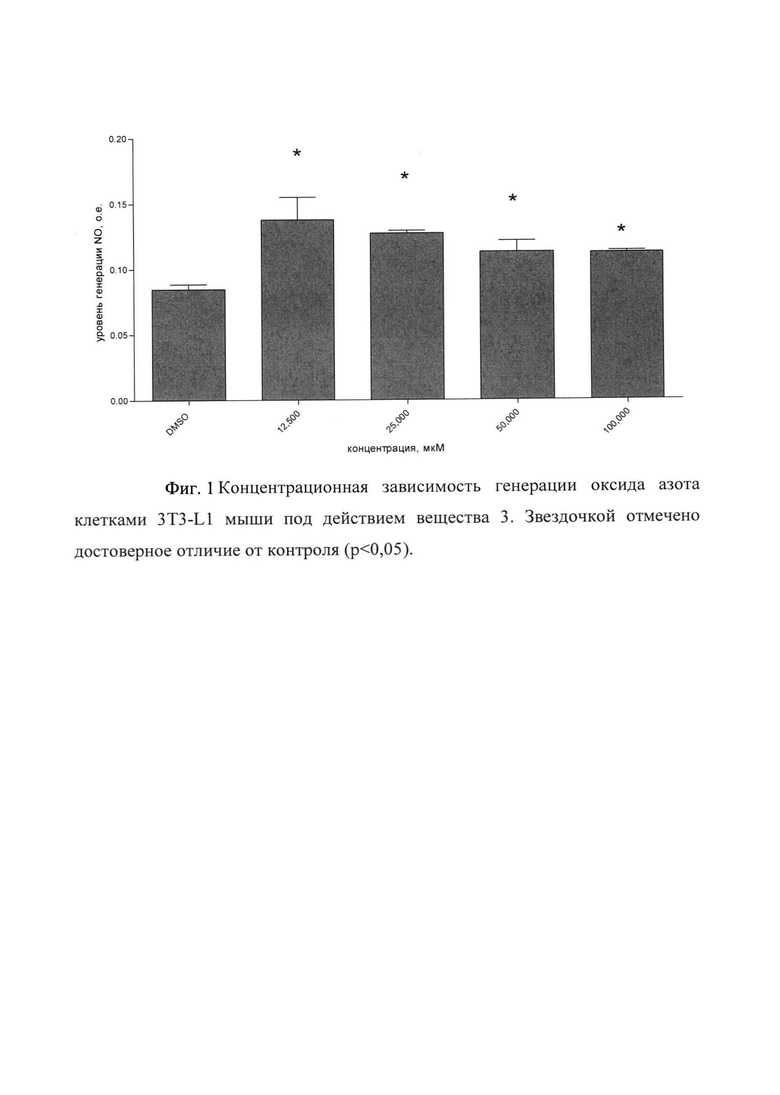
Однако для амида простагландина F2α (3) наиболее эффективной была концентрация 25 мкМ. При этой концентрации уровень оксида азота в клетках 3T3-L1 повышался на 60% по отношению к контролю, указанному на Фигуре 1.
| название | год | авторы | номер документа |
|---|---|---|---|
| 1,3-ДИНИТРОГЛИЦЕРИНОВЫЕ ЭФИРЫ ПОЛИНЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ, ГИДРОКСИПРОИЗВОДНЫХ ПОЛИНЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ И ПРОСТАГЛАНДИНОВ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 1993 |
|
RU2067094C1 |
| Производные нестероидных противовоспалительных средств | 2018 |
|
RU2732297C2 |
| ПРОСТАМИДЫ И ИХ АНАЛОГИ, ОБЛАДАЮЩИЕ НЕЙРОЗАЩИТНЫМ ДЕЙСТВИЕМ | 2011 |
|
RU2474426C1 |
| 5-АМИНО-3-(2-НИТРОКСИПРОПИЛ)-1,2,4-ТИАДИАЗОЛЫ | 2010 |
|
RU2434856C1 |
| N, N', N'-ТРИЗАМЕЩЕННЫЕ ИЗОСЕЛЕНОМОЧЕВИНЫ | 2010 |
|
RU2434852C1 |
| ИНГИБИТОРЫ КАСПАЗ | 1999 |
|
RU2274642C2 |
| СПИРО[2.3]ГЕКСАНОВЫЕ АМИНОКИСЛОТЫ - КОНФОРМАЦИОННО-ЖЕСТКИЕ АНАЛОГИ γ-АМИНОМАСЛЯНОЙ КИСЛОТЫ - И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2016 |
|
RU2629357C1 |
| ЗАМЕЩЕННЫЕ ЦИКЛОПЕНТАНЫ, ОБЛАДАЮЩИЕ ПРОСТАГЛАНДИНОВОЙ АКТИВНОСТЬЮ | 2009 |
|
RU2505530C2 |
| ПРОИЗВОДНЫЕ АЛЬФА-(N-СУЛЬФОНАМИДО)АЦЕТАМИДА КАК ИНГИБИТОРЫ БЕТА-АМИЛОИДА | 2002 |
|
RU2300518C2 |
| ЛИШЕННЫЕ ПОБОЧНЫХ ЭФФЕКТОВ ПРОИЗВОДНЫЕ ПРОСТАГЛАНДИНОВ ДЛЯ ЛЕЧЕНИЯ ГЛАУКОМЫ | 1998 |
|
RU2207858C2 |
Изобретение относится к медицинской химии, конкретно к соединению указанной ниже общей формулы или его фармацевтически приемлемым солям, которые обладают способностью снижать внутриглазное давление, при этом имеют низкую цитотоксичность и способны стимулировать образование эндогенного оксида азота в клетках. В указанной общей формуле R1=Н, 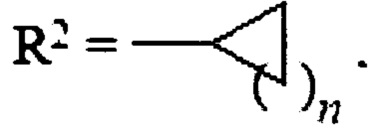 , где n=1-4, или R1=Н,
, где n=1-4, или R1=Н, 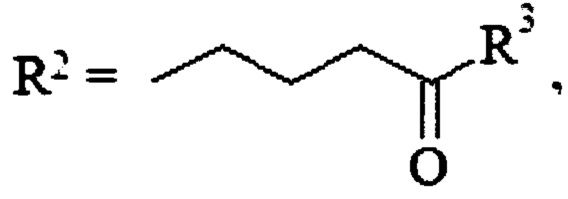 , где R3=СНМе2, HNCH2CH2ONO2, OCH2CH2ONO2, OCH(CH2ONO2)2, или R1=H,
, где R3=СНМе2, HNCH2CH2ONO2, OCH2CH2ONO2, OCH(CH2ONO2)2, или R1=H, 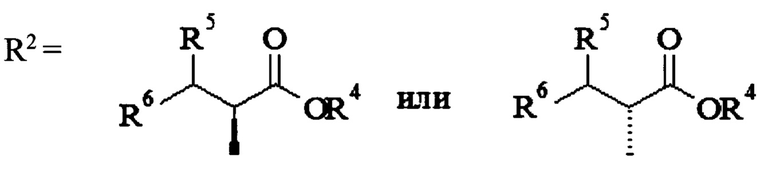 , где R4=Н, СНМе2; R5=Н, ОН; R6=Н, ОН, ONO2, СН2ОН, CH2ONO2, или R1=Н, R2=CH2CH2OC(O)NHCH2CH2ONO2, или R1=Н, R2=CH2CH2OC(O)OCH(CH2ONO2)2, или
, где R4=Н, СНМе2; R5=Н, ОН; R6=Н, ОН, ONO2, СН2ОН, CH2ONO2, или R1=Н, R2=CH2CH2OC(O)NHCH2CH2ONO2, или R1=Н, R2=CH2CH2OC(O)OCH(CH2ONO2)2, или 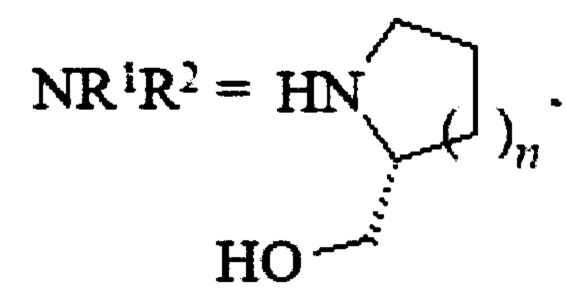 , где n=1, 2. 2 з.п. ф-лы, 3 табл., 1 ил., 7 пр.
, где n=1, 2. 2 з.п. ф-лы, 3 табл., 1 ил., 7 пр.
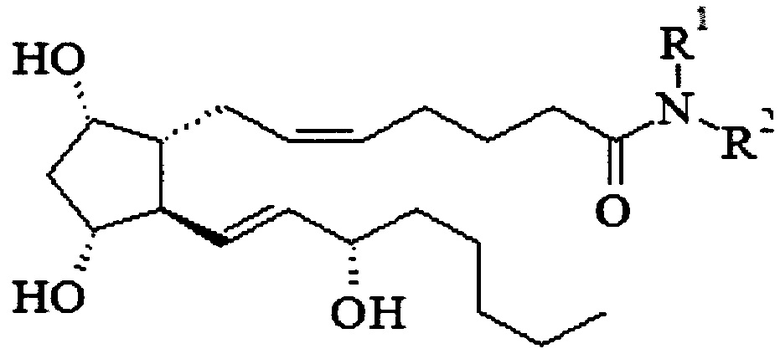
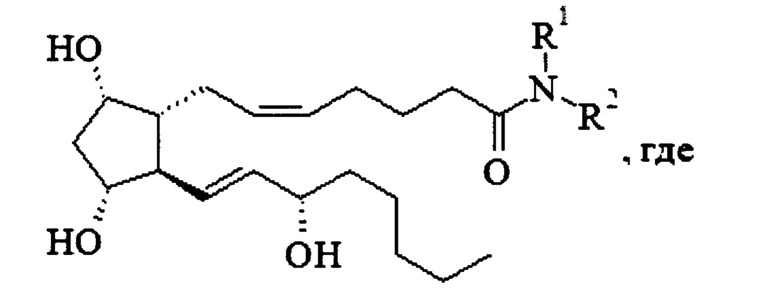
1. Соединение общей формулы
R1=Н, 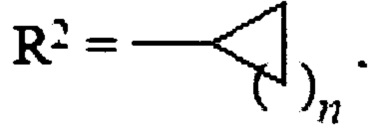 , где n=1-4, или
, где n=1-4, или
R1=Н, 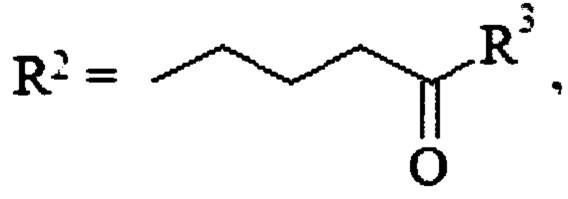 , где
, где
R3=СНМе2, HNCH2CH2ONO2, OCH2CH2ONO2, OCH(CH2ONO2)2, или
R1=H, 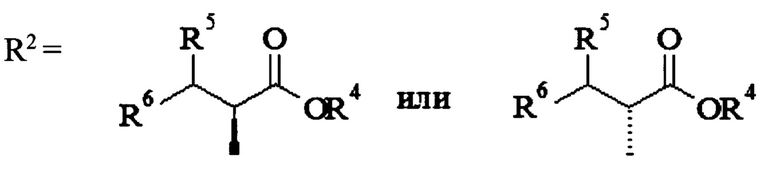 ,
,
где R4=Н, СНМе2; R5=Н, ОН; R6=Н, ОН, ONO2, СН2ОН, CH2ONO2, или
R1=Н, R2=CH2CH2OC(O)NHCH2CH2ONO2, или
R1=Н, R2=CH2CH2OC(O)OCH(CH2ONO2)2, или
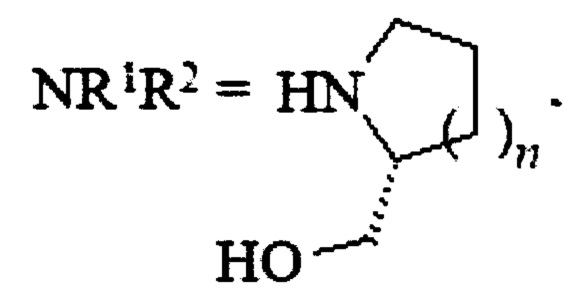 , где n=1, 2,
, где n=1, 2,
или его фармацевтически приемлемая соль.
2. Соединение по п.1, выбранное из
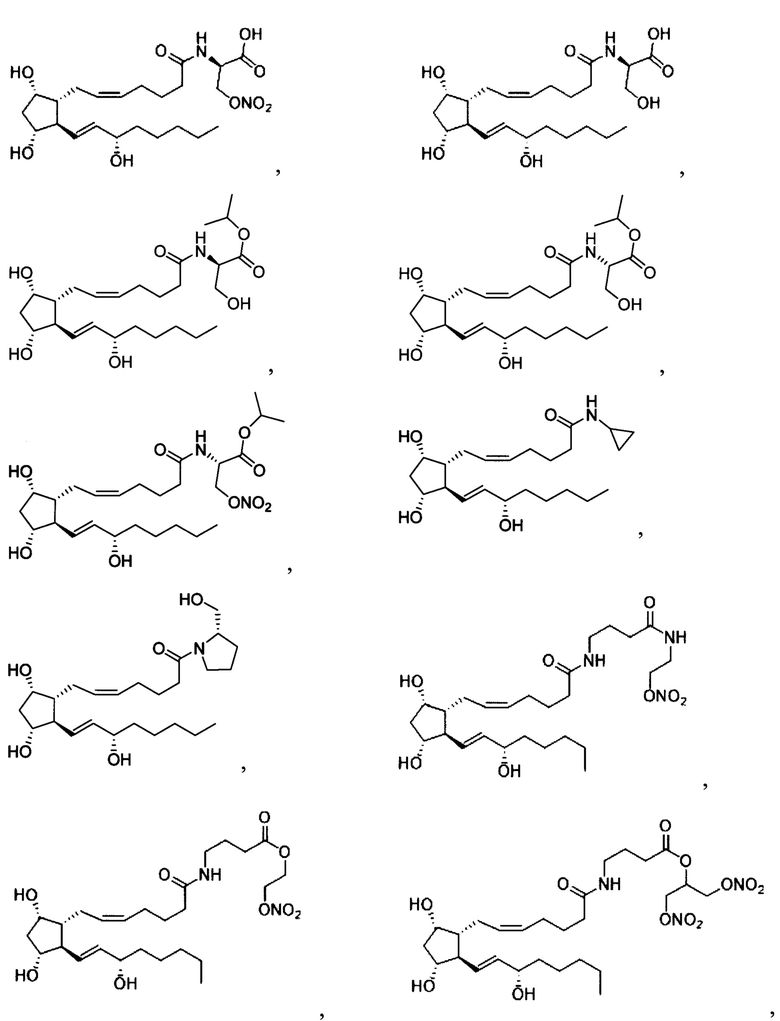
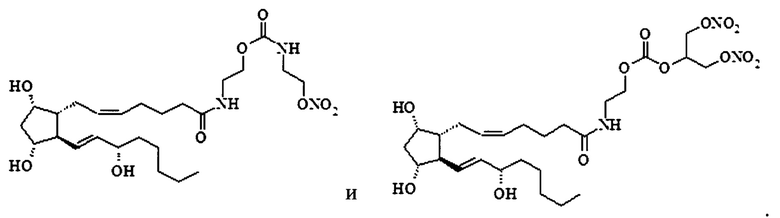
3. Соединение по любому из пп. 1, 2, обладающее способностью снижать внутриглазное давление.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Способ смешанной растительной и животной проклейки бумаги | 1922 |
|
SU49A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| ПРОСТАМИДЫ И ИХ АНАЛОГИ, ОБЛАДАЮЩИЕ НЕЙРОЗАЩИТНЫМ ДЕЙСТВИЕМ | 2011 |
|
RU2474426C1 |
Авторы
Даты
2020-04-14—Публикация
2018-05-17—Подача