Изобретение относится к способу лечения глаукомы и внутриглазной гипертензии с применением аналогов простагландинов или их производных, которые не обладают или обладают уменьшенным меланогенным эффектом на глаз. Настоящее изобретение также относится к офтальмологическим композициям, содержащим простагландиновые соединения, не обладающим или обладающим уменьшенным меланогенным эффектом на глаз.
Глаукома представляет собой заболевание глаза, которое характеризуется увеличением внутриглазного давления, экскавацией диска зрительного нерва и постепенной потерей поля зрения. Аномально высокое внутриглазное давление, как известно, является вредным для глаза, и имеются ясные признаки того, что внутриглазное давление при глаукоме является наиболее важным фактором, вызывающим дегенеративные изменения в сетчатке и диске зрительного нерва. Однако точный патофизиологический механизм открытоугольной глаукомы до сих пор остается неизвестным. Если не проводить лечение, то глаукома может привести к слепоте, причем, как правило, заболевание течет медленно с прогрессирующей потерей зрения.
Внутриглазное давление (ВГД) может быть определено согласно формуле (1):
(1) ВГД=Ре+(Ft-Fu)•R,
где Ре - эписклеральное венозное давление, Ft представляет собой образование внутриглазной жидкости, Fu представляет собой часть внутриглазной жидкости, которая покидает глаз через увеосклеральный отводящий путь, и R представляет собой сопротивление в трабекулярном отводящем пути. Внутриглазная жидкость образуется в передней и задней глазных камерах ресничными отростками позади радужной оболочки. Затем жидкость течет через зрачок в переднюю камеру и в норме выходит из глаза через трабекулярную сеть (фонтановы пространства) и шлеммов канал в эписклеральные вены, расположенные вне глазного яблока. Однако часть внутриглазной жидкости может покидать глаз по увеосклеральному отводящему пути. Считается, что поток в данном пути испытывает минимальное влияние внутриглазного давления (Bill, 1975). Нормальное внутриглазное давление у человека находится в интервале 12-22 мм рт. ст. При более высоком давлении, т.е. выше 22 мм рт. ст., существует повышенный риск того, что может быть поврежден глаз. Однако при одной особой форме глаукомы, глаукоме нормального напряжения, могут иметь место повреждения и при значении внутриглазного давления в пределах физиологической нормы. Также известны противоположные ситуации, т.е. у некоторых индивидуумов может наблюдаться аномально высокое внутриглазное давление без проявления каких бы то ни было дефектов в поле зрения или диске зрительного нерва. Такие условия обычно обозначаются как внутриглазная гипертензия.
Лечение глаукомы может быть проведено с помощью лекарств, лазера или хирургического вмешательства. При лекарственном лечении целью является либо снижение образования внутриглазной жидкости (Ft), или снижение сопротивления оттоку внутриглазной жидкости (R), которые согласно вышеуказанной формуле 1 приведут к уменьшению внутриглазного давления, альтернативно увеличение оттока внутриглазной жидкости по увеосклеральному пути, что согласно формуле 1 также приводит к уменьшению внутриглазного давления.
Простагландины и, как правило, PGF2α, их эфиры и аналоги уменьшают внутриглазное давление, главным образом, увеличивая увеосклеральный отток внутриглазной жидкости (Crawford and Kaufman, 1987; Nilsson et al., 1989; Toris et al. , 1993; Stjernschantz et al., 1995). Применение простагландинов и их производных описано в нескольких заявках на выдачу патента и патентах, например в US 4599353 (Bito), US 4952581 (Bito), WO89/03384 (Resul and Stjernschantz), EP 170258 (Cooper), EP 253094 (Goh) и в EP 308135 (Ueno).
Простагландины - это жирные кислоты, как правило образованные из таких предшественников, как эйкозатриеновая, эйкозатетраеновая и эйкозапентаеновая кислота, в ходе ряда метаболических стадий, включая оксигенацию. Природные простагландины, как правило, имеют общую структуру:
Соответственно простагландины несут циклопентановое кольцо, к которому присоединены две углеродные цепи, причем верхнюю цепь обычно называют альфа-цепью, а нижнюю обычно называют омега-цепью. Простагландины подразделяют на подгруппы А, В, С, D, Е, F, G, Н, I и J в зависимости от структуры и заместителей циклопентанового кольца:
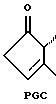
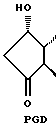



Альфа-цепь является 7-углеродной алифатической цепью с карбоксильной группой на конце, в то время как омега-цепь является 8-углеродной алифатической цепью с метильной группой на конце. В зависимости от числа двойных связей в этих цепях им присваиваются нижние индексы от 1 до 3. В простагландинах с нижним индексом 1, например PGF1α, двойная связь расположена между 13 и 14 углеродами омега-цепи, и в простагландинах природного происхождения имеет трансконфигурацию. В простагландинах с нижним индексом 2, например PGF2α, дополнительная двойная связь в цис-конфигурации расположена между 5 и 6 атомом алифатической цепи и, наконец, в простагландинах с нижним индексом 3, третья двойная связь расположена между 17 и 18 углеродами в омега-цепи. В природных простагландинах эта двойная связь находится также в цис-конфигурации. Все природные простагландины имеют гидроксильную группу при 15 атоме углерода, которая является важной для биологической активности.
Рецепторная система природных простагландинов была выявлена лишь недавно. Таким образом, большинство простагландиновых рецепторов фармакологически охарактеризованы, и их молекулярная структура идентифицирована с применением молекулярно-биологических методик (Coleman et al., 1994). Для природных простагландинов существуют специфические рецепторы. Рецепторам PGD, PGE, PGF, PGI2 (простациклина) и TxA2 (тромбоксана) соответствует аббревиатура DP, EP, FP, IP и ТР соответственно. В дальнейшем было показано, что EP рецепторы могут быть подразделены на четыре рецептора, а именно рецепторы EP1, ЕР2, ЕР3 и ЕР4. Отдельные ткани или клетки могут экспрессировать мало или много таких рецепторов в зависимости от эволюционного развития системы данных физиологически активных веществ у различных видов. Так, например, было показано, что сфинктерная мышца радужки кошки экспрессирует в основном FP-рецепторы, которые функционально сопряжены и опосредуют сужение зрачка, в то время как соответствующая гладкая мышца глаза быка экспрессирует EP1- и ТР-рецепторы, активация которых приводит к сокращению мышцы. Соединение, которое связывается со специфическим рецептором и активирует его, называется агонистом, в то время как вещество, которое связывается с рецептором без его активации, называется антагонистом.
Относительно практической применимости многих простагландинов и их производных в качестве подходящих лекарств для лечения глаукомы или внутриглазной гипертензии лимитирующим фактором может быть их свойство увеличивать пигментацию радужной оболочки глаза (Stjernschantz and Aim, 1996). Так, во время хронического лечения обезьян или человека цвет радужной оболочки имеет тенденцию становиться темнее, превращаясь в коричневый. И если это не имеет никаких медицинских последствий, то при рассмотрении с косметической точки зрения, это является понятным недостатком особенно у пациентов, проходящих лечение только на одном глазе. Таким образом, было бы желательно идентифицировать простагландины, которые эффективно уменьшают внутриглазное давление и не вызывают побочного эффекта увеличенной пигментации радужной оболочки.
Авторы настоящего изобретения неожиданно обнаружили, что производные и аналоги простагландинов, которые являются селективными агонистами для EP1-подгруппы простагландиновых рецепторов, отвечают критериям простагландинового аналога, который эффективно снижает внутриглазное давление, не вызывая увеличенного образования пигмента (меланогенеза) в радужной оболочке глаза. Предпосылкой данной находки явилось то, что при изучении с целью выявления подтипов простаноидных рецепторов в меланоцитах радужной оболочки человека, авторы настоящего изобретения обнаружили, что данные клетки экспрессируют FP, EP2 и ЕР3 рецепторы, но не EP1 и ТР рецепторы. Кроме того, авторы настоящего изобретения исследовали эффект снижения внутриглазного давления нескольких относительно селективных агонистов EP1 и обнаружили, что данные аналоги простагландинов эффективно и сильно снижают внутриглазное давление как у кошек, так и у обезьян.
Таким образом, теперь очевидно, что применяя селективные агонисты EP1 рецепторов, внутриглазное давление у приматов и, таким образом, также и у человека может быть снижено, причем без увеличения или со значительным уменьшением меланогенеза как побочного эффекта, так как меланин-продуцирующие клетки, меланоциты, не имеют специфического рецептора, необходимого для трансмембранной передачи сигнала в клетку. Хотя в настоящее время авторы настоящего изобретения не располагают клиническим доказательством того, что такие селективные агонисты EP1 не приводят к увеличению пигментации радужки, так как время возникновения данного явления зачастую составляет 6-12 месяцев, и, таким образом, требуются чрезвычайно долгие и дорогостоящие эксперименты на приматах, однако авторы настоящего изобретения могут сделать заключение из соответствующих исследований in vitro, что такая увеличенная пигментация не встречается в присутствии специфических передающих сигналы рецепторов в клеточной мембране меланоцитов.
Соответственно высокая селективность или специфичность к EP1 рецептору по сравнению с другими простагландиновыми рецепторами глаза характеризует соединения, применимые в способе или композициях по данному изобретению. Нет необходимости говорить, что чем более селективно соединение по отношению к EP1-рецептору, тем более хорошие получали результаты, но некоторое преимущество также было достигнуто в случаях некоторых взаимодействий с другими рецепторами. Высокая селективность в данной связи означает, что эффект на EP1 рецептор по крайней мере более чем в 5 раз, особенно более чем в 10 раз и, в частности, более чем в 100 или в 1000 раз превышает эффект на другие простагландиновые рецепторы.
В соответствии с первым осуществлением настоящее изобретение относится к офтальмологической композиции для лечения глаукомы и внутриглазной гипертензии без усиления или с ослаблением побочного эффекта, выражающегося в меланогенезе, включающей в себя терапевтически активное и физиологически приемлемое количество соединения общей формулы: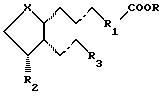
где волнистые связи изображают α- или β-конфигурацию, а пунктирные связи представляют собой простую связь, тройную связь или двойную связь в цис- или транс-конфигурации;
R представляет собой водород, насыщенный или ненасыщенный алкил, предпочтительно C1-10 алкил, циклоалкил, предпочтительно С3-8 циклоалкил, арил, арилалкил, предпочтительно арил-С2-5 алкил, или гетероарил;
R1 представляет собой насыщенную или ненасыщенную алкильную группу, содержащую 2-5 атомов углерода, необязательно прерванную гетероатомами, выбранными из кислорода, серы и азота, циклоалкил, предпочтительно С3-7 циклоалкил, циклоалкенил, предпочтительно С3-7 циклоалкенил, арил или гетероарил;
Х представляет собой С-ОН или С=O;
R2 представляет собой водород, гидрокси, метил, этил, метокси или OCOR4, где R4 представляет собой неразветвленную или разветвленную цепь насыщенной или ненасыщенной алкильной группы, предпочтительно C1-10 алкил, особенно C1-6 алкил, или циклоалкил, предпочтительно С3-8 циклоалкил, или арильную группу;
R3 представляет собой неразветвленную или разветвленную цепь насыщенной или ненасыщенной алкильной группы, предпочтительно содержащую 3-8 атомов углерода, особенно 3-5 атомов углерода, необязательно прерванную одним или более гетероатомами, выбранными из кислорода, серы и азота, причем каждый атом углерода необязательно замещен заместителем, выбранным из C1-5 алкильной, гидроксильной и карбонильной групп, причем гидрокси и карбонил предпочтительно присоединены к 15 атому углерода простагландиновой структуры, и указанная алкильная группа необязательно содержит циклоалкильную, предпочтительно С3-8 циклоалкильную, арильную или гетероарильную группу, которая может быть замещена одним из или независимо C1-3 алкилом, C1-3 алкокси, гидрокси, нитро, трифторметилом или галогеном; или его фармацевтически приемлемой солью или сложным эфиром, которое представляет собой селективный агонист EP1-простаноидных рецепторов, и офтальмологически совместимый носитель.
В соответствии с первым осуществлением настоящее изобретение относится к применению простагландинового аналога, который является селективным агонистом EP1-простаноидных рецепторов, как определено выше, для приготовления лекарственного препарата для лечения глаукомы или внутриглазной гипертензии без усиления или с ослаблением побочного эффекта, выражающегося в меланогенезе.
Специфическими простагландиновыми аналогами, которые авторы настоящего изобретения применяли для иллюстрации и доказательства данного изобретения, были PGF2β (1), изопропиловый эфир PGF2β (2), 17-фенил-18,19,20-тринор-РGЕ2 (3), изопропиловый эфир 17-фенил-18,19,20-тринор-РGЕ2 (4), 15(R,S)-16,16-триметилен-РGЕ2 (5), метиловый эфир 15(R, S)-16,16-триметилен-РGЕ2 (6) и изопропиловый эфир 13,14-дигидро-17-(3-фторфенил)-18,19,20-тринор-РGЕ2 (7). Все эти аналоги являются относительно селективными агонистами EP1 рецептора. Рецепторные профили тестируемых соединений представлены в таблице I.
С одной стороны, изобретение относится к применению агонистов, селективных простагландиновых EP1 рецепторов, лишенных меланогенного эффекта, для лечения глаукомы или внутриглазной гипертензии. Способ лечения глаукомы или внутриглазной гипертензии включает в себя контакт с поверхностью глаза с эффективно снижающим внутриглазное давление количеством композиции, которая содержит указанный EP1 простагландин, для того чтобы уменьшить внутриглазное давление и поддерживать указанное давление на низком уровне. Композиция обычно содержит приблизительно 0,1-100 мкг, главным образом 1-30 мкг на однократное применение активного начала. Композиция местно наносится на глаз 1-3 раза в сутки.
Простагландиновое производное смешивают с офтальмологически совместимым носителем, известным в данной области. Носитель, который может быть использован для приготовления композиций по данному изобретению, включает в себя водные растворы, например физиологические растворы солей, растворы масел или мази. Более того, носитель может содержать офтальмологически совместимые консерванты, такие как, например, хлорид бензалкония, поверхностно-активные вещества, такие как полисорбат 80, липосомы или полимеры, например метилцеллюлоза, поливиниловый спирт, поливинилпирролидон и гиалуроновая кислота; они могут применяться для увеличения вязкости. Более того, возможно использование растворимых или нерастворимых лекарственных добавок.
С другой стороны, настоящее изобретение относится к офтальмологическому составу для медикаментозного лечения глаукомы или внутриглазной гипертензии, который включает эффективно снижающие внутриглазное давление количества простагландинового аналога, который, как определено выше, является селективным агонистом EP1 рецепторов, и офтальмологически совместимый носитель. Эффективные количества обычно включают в себя дозу приблизительно 0,1-100 мкг в приблизительно 10-50 мкл композиции. Композиции по настоящему изобретению имеют понятные преимущества над существующими простагландиновыми композициями вследствие селективности активного соединения к EP1 рецепторам по сравнению с другими простагландиновыми рецепторами с исключенным или по крайней мере значительно уменьшенным риском пигментации.
И в еще одном аспекте настоящее изобретение относится к использованию простагландиновых аналогов для приготовления лекарств для лечения глаукомы и внутриглазной гипертензии.
Предпочтительно простагландиновый аналог получают из простагландинов PGF или PGE типов. В частности, аналог простагландина является соединением, обычно имеющим следующую формулу: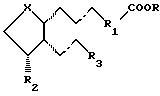
где волнистые связи изображают α- или β-конфигурацию, а пунктирные связи представляют собой простую связь, тройную связь или двойную связь в цис- или транс-конфигурации;
R представляет собой водород, насыщенный или ненасыщенный алкил, предпочтительно C1-10 алкил, циклоалкил, предпочтительно С3-8 циклоалкил, арил, арилалкил, предпочтительно арил-С2-5 алкил, или гетероарил;
R1 представляет собой насыщенную или ненасыщенную алкильную группу, содержащую 2-5 атомов углерода, необязательно прерванную гетероатомами, выбранными из кислорода, серы и азота, циклоалкила, предпочтительно С3-7 циклоалкила, циклоалкенила, предпочтительно С3-7 циклоалкенила, арила или гетероарила;
Х представляет собой С-ОН или С=O;
R2 представляет собой водород, гидрокси, метил, этил, метокси или OCOR4, где R4 представляет собой неразветвленную или разветвленную цепь насыщенной или ненасыщенной алкильной группы, предпочтительно C1-10 алкил, особенно C1-6 алкил, или циклоалкил, предпочтительно С3-8 циклоалкил, или арильную группу;
R3 представляет собой неразветвленную или разветвленную цепь насыщенной или ненасыщенной алкильной группы, предпочтительно содержащую 3-8 атомов углерода, особенно 3-5 атомов углерода, необязательно прерванную одним или более гетероатомами, выбранными из кислорода, серы и азота, причем каждый атом углерода необязательно замещен заместителем, выбранным из C1-5 алкильной, гидроксильной и карбонильной групп, причем гидрокси и карбонил предпочтительно присоединены к 15 атому углерода простагландиновой структуры, и указанная алкильная группа необязательно содержит циклоалкильную, предпочтительно С3-8 циклоалкильную, арильную или гетероарильную группу, которая может быть замещена одним из или независимо C1-3 алкилом, C1-3 алкокси, гидрокси, нитро, трифторметилом или галогеном, или его фармацевтически приемлемой солью, или сложным эфиром.
Арил является предпочтительно замещенным или незамещенным фенилом.
Типичными гетероарильными группами являются тиофен, фуран, тиазол, изотиазол, оксазол, изоксазол, пиридин, пиразин, пиримидин, пиридазин.
Арил, гетероарил и циклоалкил могут быть моно-, независимо ди-, или мультизамещенными C1-3 алкилом, C1-3 алкокси, гидрокси, нитро, трифторметилом или галогеном.
Ненасыщенный алкил может содержать одну и более двойных и/или тройных связей.
Галогеном является фтор, хлор, бром или иод, особенно фтор, хлор или бром.
Простагландины могут быть в виде эпимерных смесей так же, как и в форме отдельных эпимеров.
Изобретение поясняется посредством нижеследующих неограничивающих примеров.
Идентификация простагландиновых рецепторов.
Простагландиновые рецепторы идентифицировали, применяя методику обратно-транскриптазной полимеразной цепной реакции (RT-PCR). Специфические праймеры были сконструированы для рецепторов FP, EP1, EP2, EP3 и ТР. Праймеры, использованные в исследованиях, представлены в таблице II. RT-PCR выполняли на мРНК, выделенной из меланоцитов радужки человека в культуре. Культивированные клетки использовали для приготовления мРНК. RT-PCR смесь анализировали на агарозном геле и полосы ожидаемого размера клонировали и секвенировали. Указанные последовательности анализировали на сходство с последовательностью каждого простагландинового рецептора.
Способы. Меланоциты радужки человека выделяли и культивировали согласно Ни et al. (1993) и использовали в ранних пассажах. Клетки выращивали до образования сливной культуры и собирали для обогащения мРНК.
мРНК выделяли, применяя Dynals мРНК Direct System (Dynal A/S, Norway), согласно инструкциям производителя. Для обогащения применяли 100000-200000 клеток меланоцитов человека. мРНК ковалентно связывается с меченым олиго-dT Dynabead. Применяя обратную транскриптазу, первую цепь кДНК синтезируют непосредственно Dynabead с олиго-dT в качестве праймера обратной транскриптазы. Вторую цепь кДНК синтезируют с применением 3'-праймера последовательности соответствующего простагландинового рецептора с получением двухцепочечной ДНК. Такой же набор Dynabead использовали для каждой рецепторной RT-PCR. Рецепторспецифичные праймеры использовали для PCR-амплифицирования ДНК из кДНК, связанной с Dynabead, согласно инструкциям производителя. Для FP и EP3 рецепторной реакции PCR выполняли в конечном объеме 50 мкл, содержащем 5% ДМСО, 200 мкМ dNTP и 20 пмоль каждого праймера. Для других рецепторов применяли горячий старт, используя AmpliWax pellets (Perkin Elmer, USA) в конечном объеме 75 мкл, содержащем 5% ДМСО, 200 мкМ dNTP и 20 пмоль каждого праймера (см. табл.II).
PCR смесь данных реакций анализировали на 1% LMP агарозном геле (BioRad Laboratories, USA). Ожидаемого размера фрагменты ДНК были ТА-клонированы с применением ТА-клонирующего набора согласно инструкциям изготовителя (Invitrogen Inc. , USA) и секвенированы на Applied Biosystem Model 373A ДНК секвенирующей системе (Applied Biosystems Inc., USA) согласно Applied Biosystems' протоколу для их Taq Dye Диокси терминирующего цикла набора для секвенирования. Полученные первичные данные обрабатывали на компьютере VAX с использованием программ анализа последовательностей из Genetics Computer Group Inc. , Madison, USA (Devereux, J., et al., Nucleic Acids Research 12 (1): 387-395 (1984). Результаты: Основываясь на данных RT-PCR, авторы смогли показать экспрессию FP, EP2 и EP3 рецепторов в меланоцитах радужки человека. Однако авторы не смогли показать присутствие EP1 и ТР рецепторов (таблица III). В качестве позитивных контролей амплифицировали ожидаемые EP1 и ТР фрагменты с теми же праймерами из типовой библиотеки кДНК человека. Обогащали поли-А мРНК из выделенных меланоцитов радужки человека два раза и выполняли PCR реакции несколько раз с одинаковым результатом.
СИНТЕЗ ПРОИЗВОДНЫХ ПРОСТАГЛАНДИНОВ
Структуры конечных соединений, полученных в примерах, показаны на схеме 1, представленной в конце описания.
Пример 1. PGF2β (соединение 1)
Указанное в заголовке соединение куплено у Cayman Chemicals Company, Ann Arbor Michigan, USA.
Пример 2. Изопропиловый эфир PGF2β (соединение 2)
DBU (163,5 мг, 1,01 ммоль) добавляли к перемешиваемому раствору PGF2β (Cayman Chemicals) (60 мг, 0,169 ммоль) в ацетоне (20 мл) при 0oС. Смеси позволяли нагреться до комнатной температуры, добавляли по каплям изопропилиодид (222,6 мг, 1,34 ммоль). Через 48 часов (мониторинг с помощью ТСХ) смесь разбавляли этилацетатом (40 мл), промывали солевым раствором (30 мл), 3% лимонной кислотой (2•40 мл) и 5% гидрокарбонатом натрия (2•30 мл) и сушили над безводным сульфатом натрия. Растворитель удаляли в вакууме и остаток хроматографировали на силикагеле, применяя этилацетат:ацетон 3:1 в качестве элюента. Это давало бесцветное масло с выходом 46 мг (68%).
1H ЯМР (CDCl3) d 1,3 (д, 6Н), 1,6-1,7 (дм, 4Н), 2,0-2,2 (дм, 6Н), 2,3 (т, 2Н), 4,0-4,1 (м, 3Н), 5,0 (септ, 1Н), 5,5 (м, 2Н), 5,6 (м, 2Н). 13С ЯМР (CDCl3) d 135,9, 132,2, 130,5, 128,0, 75,3, 74,8, 72,85, 67,6, 56,23, 52,25, 51,59, 42,32, 37,35, 33,44, 31,74, 29,14, 26,66, 24,79, 22,6, 21,8, 14,03.
Пример 3. 17-Фенил-18,19,20-тринор-PGE2 (соединение 3)
Указанное в заголовке соединение куплено у Cayman Chemicals Company, Ann Arbor Michigan, USA.
Пример 4. Изопропиловый эфир 17-фенил-18,19,20-тринор-PGE2 (соединение 4)
DBU (43,5 мг, 0,29 ммоль) в ацетонитриле (1 мл) по каплям добавляли к перемешиваемому раствору соединения 3 (22,1 мг, 0,057 ммоль) в ацетонитриле (3 мл) при 0oС. Смеси позволяли нагреться до комнатной температуры, после чего добавляли по каплям изопропилиодид (78,0 мг, 0,46 ммоль) в ацетонитриле (2 мл). После перемешивания в течение 12 часов (мониторинг с помощью ТСХ) реакционную смесь гасили водой (8 мл), смесь экстрагировали этилацетатом (2•50 мл) и экстракт промывали солевым раствором (10 мл), 3% лимонной кислотой (10 мл) и, наконец, 5% гидрокарбонатом натрия (10 мл). После сушки над безводным сульфатом натрия растворитель удаляли в вакууме и остаточное масло хроматографировали на силикагеле, применяя этилацетат в качестве элюента. Это позволяло получить 230 мг продукта (69%) указанного в заголовке соединения в виде бесцветного масла: Rf=0,516 (этилацетат: ацетон:НОАс 1:1:0,02).
1H ЯМР (СDСl3) d 0,89 (м, 3Н), 1,3 (д, 6Н), 2,6-2,8 (м, 2Н), 4,1 (м, 2Н), 5,0 (м, 1Н), 5,3-5,7 (дм, 4Н), 7,2 (м, 5Н). 13C ЯМР (СDСl3) d 10,9, 13,9, 21,8, 22,9, 23,8, 24,49, 24,8, 25,17, 25,6, 26,68, 28,93, 30,45, 31,77, 33,90, 34,01, 34,07, 38,8, 46,22, 53,3, 54,48, 66,83, 67,62, 68,18, 71,77, 72,21, 76,35, 77,00, 77,2, 77,64, 125,93, 126,46, 128,39, 128,44, 128,79, 130,63, 130,81, 131,04, 137,79, 213,88.
Пример 5. 15RS-16,16-триметилен-РGЕ2 (соединение 5)
К перемешиваемому раствору метилового эфира 15RS-16,16-триметилен-РGЕ2 (52 мг, 0,13 ммоль) в ацетоне (0,4 мл) и фосфатного буфера рН 7 (4 мл) добавляли липазу VII (40 мг). Смесь перемешивали при комнатной температуре в течение 24 часов (мониторинг с помощью ТСХ). Смесь гасили этанолом (3 мл) и экстрагировали этилацетатом (2•10 мл). Органический слой промывали солевым раствором, сушили (сульфат натрия) и концентрировали в вакууме, получая 46 мг продукта в виде масла.
Пример 6. Метиловый эфир 15RS-16,16-триметилен-РGЕ2 (соединение 6)
Синтез 15RS-16,16-триметиленпростагландин E2 (Skotnicki, S. et al., 1977) схематически показан на схеме 2. Выделенные жирным нижеследующие фигуры относятся к соответствующим структурам в схеме 2.
Этил 2,2-триметиленгексаноат (9)
К перемешиваемому раствору N-изопропилциклогексиламина (56,2 г, 398 ммоль) в ТГФ (400 мл) при -78oС быстро добавляли н-BuLi (159 мл, 398 ммоль, 2,5 М в гексане). К полученному раствору по каплям добавляли этил циклобутанкарбоксилат (8) (50 г, 390 ммоль) и перемешивали в течение 30 мин, затем нагревали до 0oС и капали в раствор н-бутилиодида (159 мл, 398 ммоль, 2,5 моль в гексане) в ДМСО (200 мл). Реакционную смесь перемешивали в течение 1 ч при комнатной температуре (мониторинг с помощью ТСХ). Соль удаляли фильтрацией и фильтрат концентрировали в вакууме. Остаток растворяли в гексане и промывали 2% НСl, солевым раствором и водой, затем сушили над сульфатом натрия и выпаривали в вакууме. Остаточное масло перегоняли (49-56oС, 1 мм рт. ст.) с получением 26,5 г (37%) продукта.
1H ЯМР (СDСl3) d 0,9 (т, 3Н), 1,2 (т, 3Н), 1,8-2,0 (дм, 5Н), 2,2-2,5 (м, 3Н), 4,2 (м, 2Н).
2,2-Триметиленгексан-1-ол (10)
К перемешиваемому раствору этил 2,2-триметиленгексаноата (9) (26,5 г, 144 ммоль) в сухом толуоле (100 мл) по каплям добавляли DIBAL-H (206 мл, 289 ммоль, 1,4 моль в толуоле) при 0oС. Полученный раствор перемешивали при комнатной температуре в течение 3 ч (мониторинг с помощью ТСХ) и затем выливали в 5% ледяную НСl. Органический слой отделяли и промывали 5% НСl, солевым раствором, сушили, фильтровали и концентрировали с получением 30 г продукта в виде масла. 1H ЯМР (СDСl3) d 0,9 (т, 3Н), 1,8-2,0 (дм, 5Н), 2,5 (м, 1Н), 3,0 (м, 1Н), 3,6 (м, 2Н).
2,2-Триметиленгексальдегид (11)
К раствору 2,2-триметиленгексан-1-ола (10) (30 г, 210 ммоль) в DME (400 мл) добавляли дициклогексанкарбодиимид (DCC) (130 г, 630 ммоль), ДМСО (120 мл) и ортофосфорную кислоту (10,3 г). Смесь перемешивали при комнатной температуре в течение 3 ч (мониторинг с помощью ТСХ) и фильтровали. Фильтрат разбавляли дихлорметаном (300 мл) и промывали водой. Отделяли органический слой. Остаток удаляли фильтрацией. Фильтрат промывали солевым раствором (100 мл), сушили и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле, применяя гексан в качестве элюента, с получением указанного в заголовке продукта (17,3 г) в виде масла.
1H ЯМР (СDСl3) d 0,9 (т, 3Н), 1,2 (т, 3Н), 1,8-2,0 (дм, 5Н), 8,8 (с, 1Н).
4,4-Триметилен-1-октин-3-ол (12)
К раствору литий ацетилид-этилендиаминового комплекса (12,2 г, 132 ммоль) в ДМСО (10 мл) добавляли раствор 2,2-триметиленгексальдегида (11) (17 г, 120 ммоль) в ДМСО (20 мл) при 0oС в атмосфере N2. Смесь перемешивали при комнатной температуре в течение 24 ч (мониторинг с помощью ТСХ) и затем выливали в охлажденную на льду 2% НСl (50 мл) и эфир (50 мл). Органический слой отделяли и водный слой экстрагировали эфиром (50 мл), объединенные органические фазы промывали солевым раствором, сушили, фильтровали и концентрировали в вакууме. Остаток хроматографировали на силикагеле, применяя гексан: этилацетат 5:1 в качестве элюента с получением 12 (7,6 г, 38%) в виде масла.
Е-Трибутилолово-4,4-триметилен-1-октен-3-ол (13)
Смесь 4,4-триметилен-1-октин-3-ола (12) (5,0 г, 30 ммоль), гидрида трибутилолова (14,6 мл, 54,2 ммоль) и AIBN (30 мг) перемешивали при 130oС в течение 24 ч (мониторинг с помощью ТСХ). Остаток хроматографировали на силикагеле, применяя гексан и гексан:эфир 9:1 соответственно в качестве элюента с получением указанного в заголовке соединения (13) (12,54 г, 91,4%) в виде масла.
Е-Трибутилолово-4,4-триметилен-3-триметилсилилокси-1-октен (14)
К смеси Е-трибутилолово-4,4-триметилен-1-октен-3-ола (13) (7 г, 15,3 ммоль) в ДМФ (100 мл) добавляли имидазол (2,1 г, 30,6 ммоль) и триметилсилилхлорид (2,5 г, 23,0 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч (мониторинг с помощью ТСХ). Смесь распределяли между водой (200 мл) и эфиром (200 мл). Органическую фазу сушили и выпаривали в вакууме. Остаток хроматографировали на силикагеле, применяя гексан в качестве элюента, с получением 14 (5,53 г).
Метиловый эфир 11,15-бис триметилсилилокси-16,16-триметилен-5,6-дидегидро-РGЕ2 (17)
В сухую 100 мл трехгорлую колбу загружали цианид меди (I) (928 мг, 10,4 ммоль) и магнитную мешалку. Колбу закрывали резиновой пробкой и нагревали под вакуумом, чтобы удалить следы воды, и охлаждали до 0oС в атмосфере N2. Сухой ТГФ затем добавляли к метиллитию (14 мл, 22,4 ммоль, 1,6 моль в диэтиловом эфире) с помощью шприца. Смесь перемешивали при 0oС 15 мин, в течение которых суспензия становилась прозрачной и гомогенной. Раствор Е-трибутилолово-4,4-триметилен-3-триметилсилилокси-1-октен (14) (5,9 г, 11,2 ммоль) в ТГФ (10 мл) добавляли с помощью шприца при 0oС и перемешивали при комнатной температуре в течение 30 мин. К полученному раствору добавляли раствор 4-(трет-бутил-диметилсилилокси)циклопентенона (15) (1,7 г, 8 ммоль) в ТГФ (6 мл), триметилсилилхлорида (4,35 г, 40 ммоль) и триэтиламина (8,1 г, 80 ммоль) при -70oС последовательно и перемешивали при -70oС в течение еще 15 мин, затем в течение 15 мин при 0oС. Смесь распределяли между гексаном (600 мл) и водой (300 мл). Органический слой отделяли, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме с получением неочищенного эфира силиленола в виде прозрачного масла. К перемешиваемому раствору эфира силиленола в ТГФ (50 мл) в атмосфере N2 при -30oС добавляли раствор метиллития (7,7 мл, 12,3 ммоль, 1,6 моль в диэтиловом эфире) и перемешивали в течение 30 мин с последующим добавлением свежеприготовленного метил-1-трифлат-2-гексиноата (16) (Erhardt, P.W., et al., 1987; Caldwell A.G., et al., 1979) и перемешивали при -40oС в течение 5 мин. Полученный раствор гасили насыщенным водным раствором хлорида аммония (30 мл) и экстрагировали эфиром (3•100 мл), сушили на сульфате натрия, фильтровали и концентрировали в вакууме. Остаток хроматографировали на силикагеле, применяя гексан:этилацетат (1:1) в качестве элюента, с получением прозрачного масла из смеси 15RS изомеров (2,71 г, 57,3%) Rf=0,36 (SiO2, эфир:гексан 1:1).
1H ЯМР (СDСl3) d 0,2 (дм, 12Н), 0,8-0,9 (мс, 18Н), 1,8 (м, 2Н), 2,3 (м, 4Н), 3,7 (с, 3Н), 3,9-4,1 (дм, 2Н), 5,5-5,6 (2Н).
1H ЯМР также выполняли на десилилированном аналоге, метиловом эфире 16,16-триметилен-5,6-дидегидро-РGЕ2.
1H ЯМР (СDСl3) d 0,9 (т, 3Н), 1,2-1,3 (м, 3Н), 1,9-2,1 (м, 4Н), 3,7 (с, 3Н), 4,1 (м, 2Н), 5,6-5,9 (дм, 2Н).
Метиловый эфир 11,15-бис триметилсилилокси-16,16-триметилен-PGE2
К перемешиваемому раствору метилового эфира 11,15-бис триметилсилилокси-16,16-триметилен-5,6-дидегидро-PGE2 (17) (500 мг, 0,8 ммоль) в смеси бензол:циклогексан 1:1 (50 мл) добавляли Pd-BaSO4 (250 мг) и хинолин (250 мг) и перемешивали при -40oС в атмосфере Н2 в течение 5 ч (мониторинг с помощью ТСХ). Реакционную смесь разбавляли эфиром и фильтровали через целит и концентрировали в вакууме. Остаток хроматографировали на силикагеле, применяя гексан:этилацетат 9:1, с получением 442 мг соответствующего продукта.
Метиловый эфир 16,16-триметилен-РGЕ2 (6)
К раствору метилового эфира 11,15-бис триметилсилилокси-16, 16-триметилен-РGЕ2 (374 мг, 0,589 ммоль) в ТГФ (18 мл) добавляли 40% HF (3,5 мл) в ТГФ (1 мл) при 0oС. Реакционную смесь перемешивали в течение 5 ч (мониторинг с помощью ТСХ) и затем выливали в смесь 5% гидрокарбоната натрия (30 мл) и этилацетата (50 мл). Органический слой отделяли и водный слой промывали этилацетатом (2•30 мл). Органические слои объединяли и сушили на сульфате натрия и концентрировали в вакууме. Остаток хроматографировали на силикагеле, применяя последовательно гексан:этилацетат 1:1 и этилацетат, с получением 6 (75 мг, 31%) в виде масла.
1H ЯМР (СDСl3) d 0,9 (т, 3Н), 1,3 (т, 6Н), 2,0-2,6 (мм, 9Н), (дм, 5Н), 3,6 (с, 3Н), 4,1 (м, 2Н), 5,4 (м, 2Н), 5,6-5,8 (дм, 2Н); 13C ЯМР (СDСl3) d 14,222, 14,9, 23,7, 24,7, 25,2, 26,2, 26,5, 26,6, 26,8, 29,7, 33,4, 36,5, 44,9, 46,0, 51,6, 54,0, 54,6, 71,9, 76,7, 77,06, 77,1, 77,38, 126,5, 126,9, 127,7, 130,9, 132,5, 132,9, 133,36, 133,46, 174,15, 214,32.
Пример 7. Синтез изопропилового эфира 13,14-дигидро-17-(3-фторфенил)-18,19,20-тринор PGE2 (соединение 7)
Синтез указанного в заголовке соединения схематически показан на схеме 3. Выделенные жирным фигуры относятся к соответствующим структурам схемы 3.
Диметил-(2-оксо-4-(3-фторфенилбутил)фосфонат
К перемешиваемой суспензии гидрида натрия (4,17 г, 138 ммоль), предварительно промытого н-пентаном, в сухом ТГФ (250 мл) при комнатной температуре по каплям добавляли раствор диметил-2-оксопропилфосфоната (23,12 г, 132,3 ммоль) в ТГФ (110 мл). Реакционную смесь перемешивали в течение 2 ч, затем охлаждали на ледяной бане и обрабатывали раствором н-BuLi (10,2 г, 158,7 ммоль) в гексане, что приводило к образованию темно-коричневого раствора. Перемешивание продолжали в течение 2 ч при 0oС с последующим добавлением по каплям 3-фторбензилбромида (25 г, 132,3 ммоль) в ТГФ (50 мл). Реакционную смесь постепенно нагревали до комнатной температуры и через 3 ч (мониторинг с помощью ТСХ) ее гасили 10% НСl (20 мл). Смесь выливали в ледяную воду (200 мл), экстрагировали СHСl3 (2•150 мл), органические слои собирали, промывали солевым раствором (150 мл), хроматографировали на силикагеле, применяя последовательно CH2Cl2 и EtOAc в качестве элюента, получая 19,5 г желтоватого масла. Rf=0,37 (силикагель, EtOAc:ацетон 1:1).
(1S, 5R, 6R,7R)-6-Формил-7-(4-фенилбензоилокси)-2- оксабицикло[3.3.0]октан-3-он (19)
К раствору спирта 18 (19,0 г, 53,9 ммоль) в DME (100 мл), охлажденного до 18oС, добавляли дициклогексилкарбодиимид (DCC) (33,3, 161,8 ммоль), ДМСО (38,2 мл) и фосфорную кислоту (1,43 мл, 21,28 ммоль). Температуру реакционной смеси поддерживали ниже 25oС в течение 30 мин. Реакционную смесь перемешивали при комнатной температуре в течение дополнительных 2 часов (мониторинг с помощью ТСХ) и осадок удаляли фильтрацией и промывали эфиром (2•50 мл). Объединенный органический слой промывали водой (50 мл) и солевым раствором (2•50 мл), водный раствор экстрагировали эфиром (100 мл), органические слои собирали и сушили над сульфатом натрия, отфильтровывали и использовали непосредственно для следующего этапа. ТСХ Rf=0,37 (силикагель, EtOAc:толуол 2:1).
(1S, 5R, 6R,7R)-6-{3-Оксо-5-(3-фторфенил)-1-Е-пентенил}-7-(4-фенилбензоилокси)-2-оксабицикло[3.3.0]октан-3-он (20)
К перемешиваемой суспензии NaH (1,9 г, 65,1 ммоль), предварительно промытого н-пентаном, в DME (130 мл) в атмосфере азота по каплям добавляли диметил-2-оксо-4-(3-фторфенил)бутилфосфонат (Wadsworth, Jr. , W.S., et al. 1961) (19,3 г, 70,5 ммоль) в DME (100 мл) и энергично перемешивали в течение 1 ч при комнатной температуре. Затем смесь охлаждали до -10oС и добавляли по каплям раствор неочищенного альдегида 19. Через 30 мин при 0oС и 2 ч, при комнатной температуре (мониторинг с помощью ТСХ) реакционную смесь нейтрализовали уксусной кислотой, растворитель удаляли в вакууме и остаток растворяли в EtOAc (200 мл) и промывали водой (50 мл) и солевым раствором (50 мл). Органический слой сушили над безводным сульфатом натрия, фильтровали и упаривали в вакууме. Остаток перемешивали с эфиром (100 мл), полученный белый осадок фильтровали и промывали холодным эфиром, получая белое кристаллическое вещество (17 г, 58,5%). Rf=0,56 (силикагель, этилацетат:толуол 2:1).
(1S, 5R, 6R,7R)-6-(3S-3-Гидрокси-5-(3-фторфенил)-1-пентенил)-7-(4-фенилбензоилокси)-2-оксабицикло[3.3.0]октан-3-он (21)
К перемешиваемому раствору енона 20 (17,1 г, 34,3 ммоль) в ТГФ (20 мл) и хлорида церия (СеСl3•7Н2О) (3,8 г, 10,3 ммоль) в смеси ТГФ:эфир 1:2 (60 мл), охлажденного до -20 oС, в атмосфере азота добавляли боргидрид натрия (0,8 г, 20,57 ммоль) маленькими порциями. Реакционную смесь перемешивали в течение 2 ч (мониторинг с помощью ТСХ). Температуру поднимали до ±0oС, затем гасили добавлением воды (20 мл) и водным раствором 10% НСl до рН 4 и экстрагировали EtOAc (50 мл). Органический слой отделяли и промывали солевым раствором, сушили на безводном сульфате натрия, концентрировали в вакууме и дважды хроматографировали на силикагеле, применяя последовательно толуол:ЕtOАс 2:1 и 1: 1 в качестве элюента, получая 4 (5 г) в виде белого кристаллического продукта Rf=0,32 (силикагель, EtOAc:толуол 2:1).
(1S, 5R, 6R, 7R)-6-{ 3R-3-Гидрокси-5-(3-фторфенил)-1-пентил}-7-(4-фенилбензоилокси)-2-оксабицикло[3.3.0]октан-3-он (22)
К суспензии 10% Pd/C (0,1 г) в нитрите натрия (3,6 мл, 1,8 ммоль) и этаноле (15 мл) добавляли раствор 21 (3 г, 6,0 ммоль) в этаноле (6,0 мл). Смесь перемешивали в атмосфере водорода в течение 6 ч (мониторинг с помощью ТСХ) и гасили 1М раствором НСl. Катализатор удаляли фильтрацией через прокладку из целита, промывали абсолютным этанолом (15 мл). Растворитель удаляли в вакууме. Полученное масло растворяли EtOAc (100 мл) и промывали 15% солевым раствором (30 мл). Водную фазу промывали EtOAc (40 мл). Объединенные органические экстракты сушили над сульфатом натрия и фильтровали. Растворитель удаляли в вакууме. Остаток хроматографировали на силикагеле, применяя EtOAc в качестве элюента, что давало 5 (2,94 г), Rf=0,25 (силикагель, EtOAc).
(1S, 5R,6R,7R)-6-{3R-3-Гидрокси-5-(3-фторфенил)-1-пентил}-7-R-гидрокси-2-оксабицикло[3.3.0]октан-3-он (23)
К раствору лактона 22 (2,8 г, 5,65 ммоль) в метаноле (15 мл) добавляли карбонат калия (0,47 г, 3,3 ммоль) и смесь перемешивали при температуре окружающей среды в течение 6 ч (мониторинг с помощью ТСХ). Смесь нейтрализовали 10% водным раствором НСl и экстрагировали EtOAc (2•30 мл). Органическую фазу сушили на безводном сульфате натрия и выпаривали до сухого состояния. Неочищенный продукт хроматографировали на силикагеле, применяя EtOAc: ацетон 1:1 в качестве элюента. Указанное в заголовке соединение 23 получали в виде белого кристаллического продукта; выход 1,6 г, Rf=0,17 (силикагель, EtOAc).
1H ЯМР (СDСl3) d 1,2-1,4 (м, 1Н), 1,54 (м, 3Н), 1,8 (м, 3Н), 2,1 (м, 1Н), 2,2 (м, 1Н), 2,3 (м, 1Н), 2,6 (м, 2Н), 2,67 (м, 1Н), 2,8 (м, 2Н), 3,60 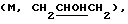 4,0
4,0 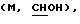 4,92
4,92  6,8-7,0 (м, 3Н), 7,28 (м, 1Н).
6,8-7,0 (м, 3Н), 7,28 (м, 1Н).
(1S, 5R, 6R, 7R)-6-{ 3R-3-трет-бутилдиметилсилилокси-5-(3-фторфенил)-1-пентил}- 7-R-трет-бутилдиметилсилилокси-2 -оксабицикло[3.3.0]октан-3-он (24)
трет-Бутилдиметилсилилхлорид (2,3 г, 14,9 ммоль) добавляли одной порцией к раствору диола 23, триэтиламина (2,1 мл, 14,8 ммоль) и 4-диметиламинопиридина (0,06 г, 0,1 ммоль) в дихлорметане (20 мл) с энергичным перемешиванием при комнатной температуре в течение 24 ч и реакционную смесь концентрировали в вакууме. Неочищенный продукт растворяли в этилацетате (50 мл), промывали водой (20 мл) и 5% водным раствором гидрокарбоната натрия (20 мл). Органическую фазу сушили на сульфате натрия, фильтровали и концентрировали в вакууме. Остаток хроматографировали на силикагеле, применяя дихлорметан в качестве элюента, с получением 3 г продукта в виде масла. Rf=0,68 (силикагель, эфир).
(1S, 5R, 6R, 7R)-6-{ 3R-3-трет-бутилдиметилсилилокси-5-(3-фторфенил)-1-пентил}-7-R-трет-бутилдиметилсилилокси- 2-оксабицикло[3.3.0]октан-3-ол (25)
Раствор гидрида диизобутилалюминия (DIBAL) (1,1 г, 7,43 ммоль) в сухом толуоле (5,3 мл) по каплям добавляли к перемешиваемому раствору лактона 24 (2,7 г, 4,95 ммоль) в сухом ТГФ (30 мл) при -72/-80oС. Через 1 ч (мониторинг с помощью ТСХ) реакционную смесь гасили метанолом (5 мл), и нагревали до комнатной температуры, и добавляли воду (50 мл), 10% водный раствор НС1 (50 мл), экстрагировали EtOAc (2•50 мл). Органический слой сушили сульфатом натрия, фильтровали, растворитель удаляли в вакууме и остаток хроматографировали на силикагеле, применяя EtOAc и EtOAc:ацетон 1:1 соответственно в качестве элюента с получением желтого маслянистого продукта (2,7 г), Rf=0,85 (силикагель, этилацетат 1:1).
13,14-Дигидро-11,15-ди-трет-бутилдиметилсилилокси-17-(3-фторфенил)-18,19,20-тринор-PGF2α (26)
К перемешиваемой суспензии бромида 4-карбоксибутилтрифенилфосфония (8,78 г, 19,82 ммоль) в ТГФ (50 мл) в атмосфере азота при 0-5oС добавляли трет-бутоксид калия (3,89 г, 34,6 ммоль) и смесь перемешивали в течение 30 мин при комнатной температуре. К полученному красно-оранжевому раствору илида при -15/-10oС добавляли лактол 25 (2,7 г, 4,95 ммоль) в ТГФ (10 мл) и смесь перемешивали в течение 3-4 ч (мониторинг с помощью ТСХ). Реакционную смесь разбавляли водой (30 мл) и промывали эфиром (4•40 мл). Водный слой подкисляли 5% водным раствором лимонной кислоты до рН 4 и экстрагировали EtOAc (2•50 мл). Органическую фазу промывали солевым раствором (30 мл), сушили на сульфате натрия и фильтровали. Растворитель удаляли в вакууме и жидкое глиноподобное 26 использовали непосредственно без выделения на следующей стадии.
Изопропиловый эфир 13,14-дигидро-11,15 -ди-трет-бутилдиметилсилилокси-17- (3-фторфенил) -18, 19, 20-тринор-PGF2α (27)
DBU (5,28 г, 34,7 ммоль) по каплям добавляли к перемешиваемому раствору неочищенного продукта 26 (3,16 г, 4,96 ммоль) в ацетоне (20 мл) при 0oС. Смеси позволяли нагреться до комнатной температуры и добавляли по каплям изопропилиодид (5,05 г, 29,7 ммоль). Через 4 ч (мониторинг с помощью ТСХ) смесь разбавляли EtOAc (100 мл), промывали солевым раствором (30 мл), 3% лимонной кислотой (2•25 мл) и 5% гидрокарбонатом натрия (2•25 мл) и сушили над безводным сульфатом натрия. Растворитель удаляли в вакууме и остаток хроматографировали на силикагеле, применяя эфир:петролейный эфир 1:2 в качестве элюента. Это позволяло получить бесцветное масло, выход 1,7 г, Rf= 0,43 (силикагель, эфир:петролейный эфир 1:2).
1H ЯМР (СDСl3) d 0,1 (м, 9Н), 0,9 (м, 16Н), 1,2 (м, 9Н), 1,6-1,8 (мм, 10Н), 2,12 (м, 2Н), 2,22-2,33 (м, 2Н), 2,6-2,9 (дм, 2Н), 3,65  3,94
3,94 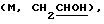 4,16
4,16 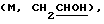 5,0 (септ, 1Н), 5,38 (м, шир.д), 5,47 (м, шир.д), 6,8-7,0 (дм, Аr, 3Н), 7,2 (м, Аr, 1Н).
5,0 (септ, 1Н), 5,38 (м, шир.д), 5,47 (м, шир.д), 6,8-7,0 (дм, Аr, 3Н), 7,2 (м, Аr, 1Н).
Изопропиловый эфир 13,14-дигидро-11,15-ди-трет-бутилдиметилсилилокси-17-(3-фторфенил)-18,19,20-тринор-РGЕ2 (28)
Дихлорхромат пиридиния (2,43 г, 11,25 ммоль) на оксиде алюминия (20 г) добавляли малыми порциями к раствору 27 (1,7 г, 2,5 ммоль) в дихлорметане (30 мл) и смесь перемешивали при комнатной температуре (мониторинг с помощью ТСХ), фильтровали и осадок промывали смесью эфир:этилацетат 2:1. Растворитель удаляли в вакууме. Остаток разбавляли эфиром (100 мл) и промывали водой (30 мл), 5% водным раствором NaHCO3 (3•20 мл), органическую фазу отделяли и сушили над сульфатом натрия и выпаривали в вакууме с получением 28 (1,3 г) в виде масла. Rf=0,72 (силикагель, этилацетат).
Изопропиловый эфир 13,14-дигидро-17-(3-фторфенил)-18,19,20-тринор-РGЕ2 (7)
Фторид водорода 15% (12 мл) добавляли к раствору 28 (314 мг) в ацетонитриле. Смесь перемешивали при комнатной температуре в течение 4 ч (мониторинг с помощью ТСХ). Реакционную смесь разбавляли этилацетатом (100 мл) и промывали водой (3•20 мл), сушили и выпаривали в вакууме. Остаток хроматографировали на силикагеле, применяя этилацетат в качестве элюента, что давало 7 (64 мг) в виде масла, Rf=0,43 (силикагель, этилацетат).
1H ЯМР (СDСl3) d. 1,2 (д, 6Н), 1,6-1,8 (м, 6Н), 1,8 (м, 2Н), 2,12 (м, 2Н), 2,2-2,3 (м, 2Н), 2,6-2,8 (дм, 2Н), 3,6  4,16
4,16 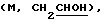 5,0 (септ, 1Н), 5,38 (м, шир.д), 5,47 (м, шир.д), 6,8-7,0 (дм, Аr, 3Н), 7,2 (м, Аr, 1Н).
5,0 (септ, 1Н), 5,38 (м, шир.д), 5,47 (м, шир.д), 6,8-7,0 (дм, Аr, 3Н), 7,2 (м, Аr, 1Н).
Фармакология
Эффект снижения внутриглазного давления от тестируемых соединений у кошек и обезьян
Соединения тестировали на эффект снижения внутриглазного давления в моделях на животных. Внутриглазное давление измеряли калиброванным пневмотонометром. В качестве экспериментальных животных применяли европейских домашних кошек и cynomolgus обезьян. Перед измерением роговую оболочку глаза анестезировали оксибупрокаином. Снижение внутриглазного давления после местного лечения PGF2β-изопропиловым эфиром (2), 17-фенил-18,19,20-тринор-РGЕ2-изопропиловым эфиром (4), 15RS-16,16-триметилен-метиловым эфиром (6) и 13,14-дигидро-17- (3-фторфенил) -18,19, 20-тринор-РGЕ2-изопропиловым эфиром (7) показано в таблицах IV и V.
Как можно видеть, как у кошек, так и у обезьян все простагландиновые аналоги с предпочтением для EP1 рецептора значительно снижали внутриглазное давление.
Таким образом, настоящее изобретение показывает, что соединения с селективным стимуляторным эффектом на EP1 рецепторы снижают внутриглазное давление и что такие соединения не могут обладать меланогенным эффектом или по крайней мере обладают значительно сниженным эффектом в глазе, так как продуцирующие пигмент клетки, меланоциты человека, не имеют EP1 рецептора. Таким образом, можно избежать общего побочного эффекта повышенной пигментации радужки во время хронической терапии простагландинами, селективными для EP1 рецепторов.
Для целей настоящего описания и следующей формулы изобретения в подходящем контексте слово "включает" и его вариации следует понимать как подразумевающие включение указанного целого числа, или стадии, или группы целых чисел или стадий, а не исключение любых других целого числа, или стадии, или группы целых чисел или стадий.
Ссылка на любой источник из уровня техники в настоящем описании не подразумевает и не должна быть истолкована как признание или любая форма предположения, что указанный источник из уровня техники составляет часть общедоступных сведений в Новой Зеландии.
Литература
Bill, A. (1975). Blood circulation and fluid dynamics in the eye. Physiol. Rev. 55; 383-417.
Coleman, R.A., Smith, W.L. and Narumiya, S. (1994). VIII. International Union of Pharmacology classification of prostanoid receptors: Properties, distribution and structure of the receptors and their subtypes. Pharmacol. Rev. 46; 205-229.
Crawford, К. and Kaufman, P. (1987). Pilocarpine antagonizes PGF2α-induced ocular hypotension in monkeys. Arch. Ophthalmol. 105; 1112-1116.
Ernhardt, P. W, Owens, A.H. (1987). Facile Formation of Quaternary azetidinium compounds During Triflation of Dialkylaminopropanols. Synth. Commun. 17, 469-475.
Caldwell, A.G., Harris, C.J., Stepny, R., Whittaker, N. (1979). Hydantoin Prostaglandin analogues, Potent and Selective Inhibitors of Platelet Aggregation. J.C.S. Chem. Commun. 561.
Skotnicki, S., Schaub, E., Weiss, J. (1977). Prostaglandins and congeners. 14. Synthesis and Bronchodialator Activity of dl-16,16-trimethylene-prostaglandins. J. Med. Chem. 20, 1042.
Hu, D-N, et al. (1993). Investigative Ophthalmology and Visual Science 34; 2210-2219.
Nilsson, S. F. E., Samuelsson, M., Bill, A. and Stjernhantz, J. (1989). Increased uveoscleral outflow as a possible mechanism of ocular hypotension caused by prostaglandin F2α-isopropyi ester in the cynomolgus monkey. Exp. Eye Res. 48; 707-716.
Stjernshantz, J. ,  , G.,
, G.,  , В. and Resul, B. (1995). Preclinical pharmacology of latanoprost. Advances in Prostaglandin, Thromboxane and Leukotriene Research 23; 513-518.
, В. and Resul, B. (1995). Preclinical pharmacology of latanoprost. Advances in Prostaglandin, Thromboxane and Leukotriene Research 23; 513-518.
Stjernhantz, J. and Aim, A. (1996). Latanoprost as a new horizon in the medical management of glaucoma. Current Opinion in Ophthalmology 7; 2; 11-17.
Toris, С., Camras, С.В. and Yablonski, M.E. (1993). Effects of PhXA41, a new prostaglandin F2α analogue, on aqueous humor dynamics in human eyes. Ophthalmology 10; 1297-1304.
Wodswarth, Jr. , W. S., Emmon, W.D. (1961). The Utility of Phosphonate Carbanions in Olefin Synthesis. J. Am. Chem. Soc.83, 1733.







Описана композиция для лечения глаукомы и внутриглазной гипертензии и применение агонистов ЕР1 простаноидных рецепторов, которые эффективно снижают внутриглазное давление, но не обладают или уменьшают эффект пигментации радужной оболочки, при этом простагландиновый аналог, который является ЕР1 селективным агонистом, наносится местно на глаз. Изобретение обеспечивает ослабление побочного эффекта, выражающегося в меланогенезе. 2 с. и 2 з.п. ф-лы, 5 табл.
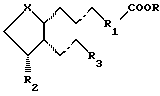
где волнистые связи изображают α- или β-конфигурацию, а пунктирные связи представляют собой простую связь, тройную связь или двойную связь в цис- или транс-конфигурации;
R представляет собой водород, насыщенный или ненасыщенный алкил, предпочтительно, С1-10алкил, циклоалкил, предпочтительно, С3-8циклоалкил, арил, арилалкил, предпочтительно, арил-С2-5алкил, или гетероарил;
R1 представляет собой насыщенную или ненасыщенную алкильную группу, содержащую 2-5 атомов углерода, необязательно прерванную гетероатомами, выбранными из кислорода, серы и азота, циклоалкил, предпочтительно, С3-7циклоалкил, циклоалкенил, предпочтительно, С3-7циклоалкенил, арил или гетероарил;
Х представляет собой С-ОН или С=О;
R2 представляет собой водород, гидрокси, метил, этил, метокси или OCOR4, где R4 представляет собой неразветвленную или разветвленную цепь насыщенной или ненасыщенной алкильной группы, предпочтительно С1-10алкил, особенно С1-6алкил, или циклоалкил, предпочтительно С3-8циклоалкил, или арильную группу;
R3 представляет собой неразветвленную или разветвленную цепь насыщенной или ненасыщенной алкильной группы, предпочтительно содержащую 3-8 атомов углерода, особенно 3-5 атомов углерода, необязательно прерванную одним или более гетероатомами, выбранными из кислорода, серы и азота, причем каждый атом углерода необязательно замещен заместителем, выбранным из С1-5алкильной, гидроксильной и карбонильной групп, причем гидрокси и карбонил предпочтительно присоединены к 15 атому углерода простагландиновой структуры, и указанная алкильная группа необязательно содержит циклоалкильную, предпочтительно С3-8циклоалкильную, арильную или гетероарильную группу, которая может быть замещена одним из или независимо С1-3алкилом, С1-3алкокси, гидрокси, нитро, трифторметилом или галогеном,
или его фармацевтически приемлемой соли или сложного эфира, которое представляет собой селективный агонист ЕР1-простаноидных рецепторов, и офтальмологически совместимый носитель.
| БИБЛИОТЕКА I | 0 |
|
SU308135A1 |
| US 4132738, 02.01.1979 | |||
| WO 9408585 А, 28.04.1994 | |||
| J | |||
| Biol | |||
| Chem., 1993, v.268, р.20175-8 | |||
| RU 94019981 А1, 10.06.1996. | |||
Авторы
Даты
2003-07-10—Публикация
1998-07-10—Подача