Область техники
Настоящее изобретение относится к новым классам соединений, которые представляют собой ингибиторы каспаз, в частности ингибиторы интерлейкин-1β-превращающего фермента (ICE). Данное изобретение относится также к фармацевтическим композициям, включающим эти соединения. Соединения и фармацевтические композиции настоящего изобретения особенно хорошо подходят для ингибирования активности каспазы и, следовательно, могут быть успешно применены в качестве агентов, направленных против заболеваний, опосредованных интерлейкином-1 (IL-1), апоптозом, фактором, индуцирующим интерферон-γ (IGIF), или интерфероном-γ (IFN-γ), включая воспалительные заболевания, аутоиммунные заболевания, деструктивные заболевания костей, нарушения пролиферации, инфекционные заболевания и дегенеративные заболевания. Данное изобретение также относится к способам ингибирования активности каспаз и снижению продукции IGIF и продукции IFN-γ, а также к способам лечения заболеваний, опосредованных интерлейкином-1, апоптозом и интерфероном-γ, с применением соединений и композиций настоящего изобретения. Это изобретение также относится к способам получения соединений настоящего изобретения.
Известный уровень техники
Интерлейкин-1 (IL-1) представляет собой основной провоспалительный и иммунорегуляторный белок, который стимулирует дифференцировку и пролиферацию фибробластов, продукцию простагландинов, коллагеназы и фосфолипазы синовиальными клетками и хондроцитами, дегрануляцию базофилов и эозинофилов и активацию нейтрофилов. Oppenheim, J.H. et al., Immunology Today, 7, pp.45-56 (1986). Таким образом, он вовлечен в патогенез хронических и острых воспалительных и аутоиммунных заболеваний. Например, при ревматоидном артрите IL-1 является медиатором как симптомов воспаления, так и разрушения протеогликанов хряща в пораженных суставах. Wood, D.D. et al., Arthritis Rheum. 26, 975 (1983); Pettipher, E.J. et al., Proc. Natl. Acad. Sci. USA 71, 295 (1986); Arend, W.P. and Dayer, J.M., Arthritis Rheum. 38, 151 (1995). IL-1 является также высокоэффективным агентом, вызывающим резорбцию кости. Jandiski, J.J., J. Oral Path 17, 145 (1988); Dewhirst, F.E. et al., J.Immunol. 8, 2562 (1985). При деструктивных заболеваниях костей, таких как остеоартрит и множественная миелома, его называют по-другому, как "фактор, активирующий остеокласты". Betaille, R. et al., Int. J.Clin. Lab. Res. 21(4), 283 (1992). При определенных нарушениях пролиферации, таких как острый миелолейкоз и множественная миелома, IL-1 может стимулировать рост опухолевых клеток и их адгезию. Bani, M.R., J.Natl. Cancer Inst. 83, 123, (1991); Vidal-Vanaciocha, F., Cancer Res. 54, 2667 (1994). При этих нарушениях IL-1 также стимулирует продукцию других цитокинов, таких как IL-6, который может модулировать развитие опухоли (Tartour et al., Cancer Res. 54, p.6243 (1994). IL-1 продуцируется преимущественно моноцитами периферической крови в виде составляющей воспалительного ответа и существует в двух отдельных формах с агонистическим действием, IL-1α и IL-1β. Mosely, B.S. et al., Proc. Nat. Acad. Sci., 84, pp.4572-4576 (1987); Lonnemann, G. et al., Eur. J. Immunol., 19, pp.1531-1536 (1989).
IL-1β синтезируется в виде биологически неактивного предшественника, pIL-1β. У pIL-1β отсутствует обычная лидирующая последовательность и он не подвергается действию пептидаз, отщепляющих сигнальную последовательность. March, C.J., Nature, 315, pp.641-647 (1985). Вместо этого pIL-1β расщепляется между Asp-116 и Ala-117 интерлейкин-1β-превращающим ферментом (ICE) с получением биологически активного С-концевого фрагмента, обнаруживаемого в сыворотке человека и синовиальной жидкости. Sleath, P.R. et al., J. Biol. Chem., 265, pp.14526-14528 (1992); A.D.Howard et al., J. Immunol., 147, pp.2964-2969 (1991). ICE представляет собой цистеиновую протеазу, локализованную, в первую очередь, в моноцитах. Она превращает предшественник IL-1β в зрелую форму. Black, R.A. et al., FEEBS Lert., 247, pp.386-390 (1989); Kostura, M.J. et al., Proc. Natl. Acad. Sci. U.S.A., 86, pp.5227-5231 (1989). Процессинг с помощью ICE необходим также для транспорта зрелого IL-1β через клеточную мембрану.
ICE (или каспаза-1) представляет собой член семейства гомологичных ферментов, называемых каспазами. Эти гомологи имеют сходные последовательности в районах активных сайтов ферментов. Такие гомологи (каспазы) включают ТХ (или ICErel-II или ICH-2) (каспаза-4) (Faucheu et al., EMBO J., 14, p.1914 (1955); Kamens J. et al., J. Biol. Chem., 270, p.15250 (1995); Nicholson et al., J. Biol. Chem., 270 15870 (1995)), TY (или ICErel-III) (каспаза-5) (Nicholson et al., J. Biol. Chem., 270, p.15870 (1995); ICH-1 (или Nedd-2) (каспаза-2) (Wang, L. et al., Cell, 78, p.739 (1994), MCH-2 (каспаза-6), (Fernandes-Alnemri, Т. et al., Cancer Res., 55, p.2737 (1995), CPP32 (или YAMA или апопаин) (каспаза-3) (Fernandes-Alnemri, Т. et al., J. Biol. Chem., 269, р.33761 (1994); Nicholson, D.W. et al., Nature, 376, p.37 (1995)), CMH-1 (или МСН-3) (каспаза-7) (Lippke et al., J. Biol. Chem., 271(4), р.1825-1828 (1996)); Fernandes-Alnemri, T. et al., Cancer Res. (1995)), Mch5 (каспаза-8) (Muzio, M. et al., Cell 85(6), 817-827, (1996)), МСН-6 (каспаза-9) (Duan, Н. et al., J. Biol. Chem., 271(34), р.16720-16724 (1996)), Mch4 (каспаза-10) (Vincenz, С. et al., J. Biol. Chem., 272, p.6578-6583 (1997); Fernandes-Ainemri, T. et al., Proc. Natl. Acad. Sci. 93, p.7464-7469 (1996)), Ich-3 (каспаза-11) (Wang, S. et al., J. Biol. Chem., 271, p.20530-20587 (1996)), mCASP-12 (каспаза-12), (Van de Craen, M. et al., FEBS Lett. 403, p.61-69 (1997); Yuan, Y. and Miura, M. PCT Publication WO 95/00160 (1995)), ERICE (каспаза-13), (Humke E.W. et al., J. Biol. Chem., 273(25) p.15702-15707 (1998)), и MICE (каспаза-14) (Hu, S. et al., J. Biol. Chem., 273(45) p.29648-29653 (1998)).
Каждый из этих гомологов ICE, также как сам ICE, способен индуцировать апоптоз при гиперэкспрессии в трансфицированных клеточных линиях. Ингибирование одного или более из этих гомологов пептидильным ингибитором ICE Tyr-Val-Ala-Asp-хлорметилкетоном ведет к ингибированию апоптоза в исходных клетках или клеточных линиях. Lazebnik et al., Nature, 371, р.346 (1994).
Каспазы, очевидно, вовлечены также в регуляцию программируемой клеточной гибели, или апоптоза. Yuan, J. et al., Cell, 75, pp.641-652 (1993); Miura, M. et al., Cell, 75, pp.653-660 1993; Nett-Fiordalisi, M.A. et al., J. Cell Biochem., 17B, p.117 (1993). В частности, ICE или гомологи ICE, как полагают, связаны с регуляцией апоптоза при нейродегенеративных заболеваниях, таких как болезни Альцгеймера и Паркинсона. Marx, J. and M.Baringa, Science. 259, pp.760-762 (1993); Gagliardini, V. et al., Science, 263, pp.826-828 (1994). Терапевтическое применение ингибирования апоптоза может включать лечение болезни Альцгеймера, болезни Паркинсона, паралич, инфаркт миокарда, атрофию спинного мозга и старение.
Показано, что ICE опосредует апоптоз (программируемую гибель клетки в определенных типах тканей. Steller, Н., Science, 267, р.1445 (1995); Whyte, M. and Evan, G., Nature, 376, p.17 (1995); Martin, S.J. and Green, D.R., Cell, 82, p.349 (1995); Ainemri, E.S. et al., J. Biol. Chem., 270, p.4312 (1995); Yuan, J.Curr. Opin. Cell Biol., 7, p.211 (1995). Трансгенная мышь с разрушенным геном ICE характеризуется дефицитом апоптоза, опосредованного Fas (Kuida, К. et al., Science 267, 2000 (1995)). Эта активность ICE отлична от его роли в качестве фермента процессинга про-IL-1β. Возможно, что в определенных тканевых типах ингибирование ICE может не влиять на секрецию зрелого IL-1β, но может ингибировать апоптоз.
Ферментативно-активный ICE был описан ранее как гетеродимер, состоящий из двух субъединиц, р20 и р10 (с молекулярной массой 20 кДа и 10 кДа соответственно). Эти субъединицы происходят из профермента 45 кДа (р45) через 30 кДа форму с помощью процесса активации, который является автокаталитическим. Thornberry, N.A. et al., Nature, 356, pp.768-774 (1992). Профермент ICE разделен на несколько функциональных доменов: продомен (р14), субъединицу р22/20, полипептидный линкер и субъединицу р10. Thornberry et al., выше; Casano et al., Genomics, 20, pp.474-481 (1994).
Полная длина р45 охарактеризована по его кДНК и аминокислотной последовательности. Патентные заявки РСТ WO 91/15577 и WO 94/00154. кДНК и аминокислотные последовательности р20 и р10 также известны. Thornberry et al., выше. ICE мыши и крысы также клонированы и секвенированы. Они имеют высокую гомологию аминокислотной и нуклеотидной последовательности с ICE человека. Miller, D.K. et al., Ann. N.Y. Acad. Sci., 696, pp.133-148 (1993); Molineaux, S.M. et al., Proc. Nat. Acad. Sci., 90, pp.1809-1813 (1993). Трехмерная структура ICE определена при рентгеновской кристаллографии с атомным разрешением. Wilson, К.Р. et al., Nature, 370, pp.270-275 (1994). Активный фермент существует в виде тетрамера из двух р20 и двух р10 субъединиц.
Недавно была выявлена связь ICE и других членов семейства ICE/CED-3 с превращением про-IGIF в IGIF или с продукцией IFN-γ in vivo (заявка РСТ PCT/US96/20843, публикация №WO 97/22619, которая включена здесь в качестве ссылки). IGIF синтезируется in vivo в виде белка-предшественника "про-IGIF".
Фактор, индуцирующий интерферон-гамма (IGIF) представляет собой полипептид размера примерно 18 кДа, который стимулирует продукцию Т-клетками интерферона-гамма (IFN-γ). IGIF продуцируется активированными клетками Купфера и макрофагами in vivo и экспортируется из этих клеток при стимуляции эндотоксином. Таким образом, соединение, которое снижает продукцию IGIF, должно быть полезно в качестве ингибитора такой стимуляции Т-клеток, что, в свою очередь, должно снижать уровни продукции IFN-γ этими клетками.
IFN-γ представляет собой цитокин с иммуномодуляторным влиянием на различные иммунные клетки. В частности, IFN-γ вовлечен в активацию макрофагов и отбор Th1 клеток (F.Belardelli, APMIS, 103, р.161 (1995)). IFN-γ проявляет свои эффекты частично за счет модуляции экспрессии генов по STAT и IRF путям (С.Schindler and J.E.Darnell, Ann. Rev. Biochem., 64, p.621 (1995); Т.Taniguchi, J.Cancer Res. Clin. Oncol., 121, p.516 (1995)).
Мыши, у которых отсутствует IFN-γ или его рецептор, характеризуются множественными дефектами функций иммунных клеток и устойчивы к эндотоксическому шоку (S.Huang et al., Science, 259, р.1742 (1993); D.Dalton et al., Science, 259, p.1739 (1993); B.D.Car et al., J. Exp. Med., 179, p.1437 (1994)). Вместе с IL-12, IGIF, очевидно, является сильным индуктором продукции IFN-γ Т клетками (Н.Okamura et al., Infection and Immunity, 63, p.3966 (1995); H. Okamura et al., Nature, 378, p.88 (1995); S.Ushio et al., J.Immunol., 156, p.4274 (1996)).
Показано, что IFN-γ участвует в развитии патологии, связанной с различными воспалительными, инфекционными и аутоиммунными нарушениями и заболеваниями. Таким образом, соединения, способные снижать продукцию IFN-γ, должны быть полезны для облегчения патологических состояний, связанных с эффектами IFN-γ.
Соответственно, композиции и способы, способные регулировать превращение про-IGIF в IGIF, должны быть полезны для снижения продукции IGIF и IFN-γ in vitro и, таким образом, для смягчения вредных эффектов этих белков, которые вносят вклад в нарушения и заболевания человека.
Ингибиторы каспаз представляют собой класс соединений, полезных для контролирования воспаления и апоптоза или обоих. Описаны пептидные и пептидильные ингибиторы ICE (РСТ патентные заявки WO 91/15577, WO 93/05071, WO 93/09135, WO 93/12076, WO 93/14777, WO 93/16710, WO 95/35308, WO 96/30395, WO 96/33209 и WO 98/01133; европейские патентные заявки 503561, 547699, 618223, 623592 и 623606 и патенты США №№5434248, 5710153, 5716929 и 5744451). Такие пептидильные ингибиторы ICE, как было показано, блокируют продукцию зрелого IL-1β в мышиной модели воспаления (смотри ниже) и подавляют рост лейкозных клеток in vitro (Estrov et al., Blood, 84, 380a (1994)). Однако из-за их пептидной природы такие ингибиторы обычно характеризуются нежелательными фармакологическими свойствами, такими как слабое проникновение в клетку и клеточная активность, плохая всасываемость при пероральном приеме, нестабильность и быстрый метаболизм. Plattner, J.J. and D.W.Norbeck, in Drug Discovery Technologies, C.R. Clark and W.H.Moos, Eds. (Ellis Horwood, Chichester, England, 1990), pp.92-126. Эти свойства препятствуют их продвижению в качестве эффективных лекарств.
Были также сообщения о том, что непептидильные соединения тормозят ICE in vitro. РСТ патентная заявка WO 55/26958; патент US 5552400; Dolle et al., J.Med. Chem., 39, pp.2438-2440 (1996).
Неясно, однако, имеют ли эти соединения подходящие фармакологические профили для того, чтобы быть терапевтически пригодными.
Соответственно, существует потребность в соединениях, которые могут эффективно тормозить активность каспаз и которые имеют благоприятную активность in vivo, для использования их в качестве агентов для профилактики и лечения хронических и острых форм болезней, опосредованных IL-1, апоптозом, IGIF или IFN-γ, а также воспалительных, аутоиммунных заболеваний, заболеваний с деструкцией кости, пролиферативных, инфекционных или дегенеративных заболеваний.
Сущность изобретения
В настоящем изобретении предлагаются новые классы соединений и фармацевтически приемлемые их производные, которые полезны в качестве ингибиторов каспаз, в частности, в качестве ингибиторов ICE. Эти соединения могут быть использованы сами по себе или в сочетании с другими лекарственными или профилактическими средствами, такими как антибиотики, иммуномодуляторы или другие противовоспалительные агенты, для лечения или профилактики заболеваний, опосредованных IL-1, апоптозом, IGIF или IFN-γ. В соответствии с предпочтительным осуществлением соединения настоящего изобретения способны взаимодействовать с активным сайтом каспазы и тормозить активность этого фермента.
Главной целью настоящего изобретения является представление новых классов соединений, представленных формулой I, которые имеют благоприятные профили in vivo
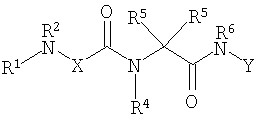
где разные заместители описаны здесь.
Дополнительной целью настоящего изобретения является представление фармацевтических композиций, включая мультикомпонентные композиции. В этом изобретении также предлагаются способы применения и получения соединений настоящего изобретения и родственных им соединений.
Подробное описание изобретения
Для того чтобы описанное здесь изобретение могло быть понято более полно, излагается следующее подробное описание.
В заявке использованы следующие сокращения и определения.
Сокращения
Термин "каспаза" относится к ферменту, который является членом семейства ферментов, которое включает ICE (смотри Н.Hara, Natl. Acad. Sci., 94, pp.2007-2012 (1997)).
Термины "HBV", "HCV" и "HGV" относятся к вирусу гепатита-В, вирусу гепатита-С и вирусу гепатита-G соответственно.
Термин "Ki" относится к числовому измерению эффективности соединения в плане ингибирования активности фермента-мишени, такого как ICE. Более низкие величины Кi отражают более высокую эффективность. Величину Ki получают путем подгонки экспериментально определенных величин скорости к стандартным равенствам ферментативной кинетики (смотри I.H.Segel, Enzyme Kinetics, Wiley-Interscience, 1975).
Термин "фактор, индуцирующий интерферон гамма" или "IGIF" относится к фактору, который способен стимулировать эндогенную продукцию IFN-γ.
Термин "ингибитор каспазы" относится к соединению, которое способно проявлять детектируемое ингибирование одной или более каспаз. Термин "ингибитор ICE" относится к соединению, которое способно проявлять детектируемое ингибирование ICE и необязательно одной или более дополнительных каспаз. Ингибирование этих ферментов может быть определено с применением способов, описанных и включенных здесь в качестве ссылки.
Специалист в данной области понимает, что ингибитор фермента in vivo необязательно является ингибитором фермента in vitro. Например, пролекарственная форма соединения обычно не проявляет или проявляет низкую активность при анализе in vitro. Такие пролекарственные формы могут изменять метаболические или другие биохимические процессы у пациента, обеспечивая действие ингибитора ICE in vivo.
Термин "цитокин" относится к молекуле, которая опосредует взаимодействие между клетками.
Термин "состояние" относится к любому заболеванию, нарушению или эффекту, который вызывает вредные биологические последствия у субъекта.
Термин "субъект" относится к животному или одной или более клетке, происходящей от животного организма. Предпочтительно животным является млекопитающее, наиболее предпочтительно человек. Клетки могут быть в любой форме, включая, но не ограничиваясь клетками, остающимися в ткани, клеточными кластерами, иммортализованными клетками, трансфицированными или трансформированными клетками и клетками, происходящими от животного, которое было физически или фенотипически изменено.
Термин "пациент", используемый в этой заявке, относится к любому животному, предпочтительно человеку.
Термин "алкил" относится к линейному или разветвленному, насыщенному алифатическому углеводороду, содержащему от 1 до 6 атомов.
Термин "алкенил" относится к линейному или разветвленному, ненасыщенному углеводороду, содержащему от 2 до 6 атомов и, по меньшей мере, одну двойную связь.
Термин "алкинил" относится к линейному или разветвленному, ненасыщенному углеводороду, содержащему от 2 до 6 атомов и, по меньшей мере, одну тройную связь.
Термин "циклоалкил" относится к моно- или полициклической, неароматической углеводородной кольцевой системе, которая необязательно может содержать ненасыщенные связи в системе кольца. Примеры включают циклогексил, адамантил, норборнил и спироциклопентил.
Термин "арил" относится к моно- или полициклической кольцевой системе, которая содержит 6, 10, 12 или 14 углеродов, где, по меньшей мере, одно кольцо кольцевой системы является ароматическим. Арильные группы данного изобретения являются необязательно одно- или многозамещенными R11. Примеры арильных кольцевых систем включают фенил, нафтил и тетрагидронафтил.
Термин "гетероарил" относится к моно- или полициклической кольцевой системе, которая содержит от 1 до 15 углеродных атомов и от 1 до 4 гетероатомов и в которой, по меньшей мере, одно кольцо кольцевой системы является ароматическим. Гетероатомы представляют собой серу, азот или кислород. Гетероарильные группы данного изобретения являются необязательно одно- или многозамещенными R11.
Термин "гетероциклическая" относится к моно- или полициклической кольцевой системе, которая содержит от 1 до 15 атомов углерода и от 1 до 4 гетероатомов, где моно- или полициклическая кольцевая система может необязательно содержать ненасыщенные связи, но не является ароматической. Гетероатомы независимо представляют собой серу, азот или кислород.
Термин "алкиларил" относится к алкильной группе, в которой атом водорода алкильной группы замещен арильным радикалом.
Термин "алкилгетероарил" относится к алкильной группе, в которой атом водорода алкильной группы замещен гетероарильным радикалом.
Термин "аминокислотная боковая цепь" относится к любой группе, присоединенной к а углероду природной или синтетической аминокислоты.
Термин "заместитель" относится к замещению атома водорода в соединении группой-заместителем.
Термин "линейная цепь" относится к цепи смежных, неразветвленных ковалентно связанных атомов. Линейная цепь может быть замещенной, но эти заместители не являются частью линейной цепи.
В химических формулах скобки применяют для того, чтобы отметить связь в молекулах или группах. В частности, скобки применяют, чтобы показать: 1) что более чем один атом или группа соединены с конкретным атомом или 2) точку разветвления (т.е. атом непосредственно перед открытием скобки связан как с атомом или группой в скобках, так и с атомом или группой непосредственно после скобки). Примером первого употребления является "-N(алкил)2", указывая на то, что две алкильные группы связаны с атомом N. Примером второго употребления является "-C(O)NH2", указывая на то, что карбонильная группа и амино (NH2) группа, обе связаны с указанным атомом атомом углерода. -C(O)NH2 группа может быть представлена другими способами, включая следующую структуру:
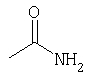
Заместители могут быть представлены в разных формах. Эти различные формы известны специалистам в данной области и могут применяться как взаимозаменяемые. Например, метильный заместитель фенильного кольца может быть представлен в любой из последующих форм:
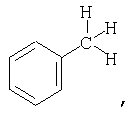
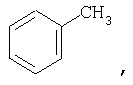
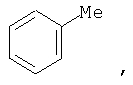
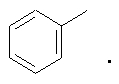
Различные формы заместителей, такие как метил, применяются здесь как взаимозаменяемые.
Другие определения, где это необходимо, представлены в описании.
Соединения изобретения
Соединениями одного осуществления А настоящего изобретения являются соединения, представленные формулой I
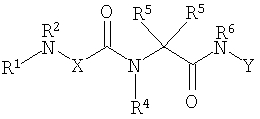
где Y представляет собой
(а)
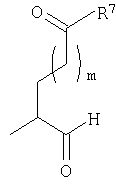
предлагаемый так, что когда R7 представляет собой -ОН, то Y может также быть
(b)
Х представляет собой -C(R3)2- или -N(R3)-;
m равно 0 или 1;
R1 представляет собой Н, -C(O)R8, -C(O)C(O)R8, -S(O2)R8, S(O)R8, -С(O)OR8, -C(O)N(H)R8, S(O)2N(Н)-R8, S(O)N(H)-R8, -C(O)C(O)N(H)R8, -C(O)CH=CHR8, -C(O)CH2OR8, -C(O)CH2N(H)R8, -C(O)N(R8)2, -S(O)2N(R8)2, -S(O)N(R8)2, -С(О)С(O)N(R8)2, -C(O)CH2N(R8)2, -CH2R8, -СН2-алкенил-R8 или -СН2-алкинил-R8;
R2 представляет собой -Н и каждый R3 независимо является -Н, аминокислотной боковой цепью, -R8, алкенил-R9 или алкинил-R9, или R2 и один R3 вместе с атомами, к которым они присоединены, образуют от 3 до 7-членную циклическую или гетероциклическую кольцевую систему, в которой атом водорода, связанный с любым алкильным или циклоалкильным атомом углерода, необязательно замещен -R10, атом водорода, связанный с любым арильным или гетероарильным атомом углерода, необязательно замещен -R11, атом водорода, связанный с любым атомом азота кольцевой системы необязательно замещен -R1;
R4 представляет собой -Н и каждый R5 независимо является -Н, аминокислотной боковой цепью, -R8, алкенил-R9 или алкинил-R9, или R4 и один R5 вместе с атомами, к которым они присоединены, образуют от 3 до 7-членную циклическую или гетероциклическую кольцевую систему, в которой атом водорода, связанный с любым алкильным или циклоалкильным атомом углерода, необязательно замещен R10, атом водорода, связанный с любым арильным или гетероарильным атомом углерода, необязательно замещен R11 и атом водорода, связанный с любым атомом азота кольцевой системы необязательно замещен -R1;
R6 представляет собой -Н;
R7 представляет собой -ОН, -OR8 или -N(Н)ОН;
каждый R8 независимо представляет собой -алкил, -циклоалкил, -арил, -гетероарил, -гетероциклил, -алкилциклоалкил, -алкиларил, -алкилгетероарил или алкилгетероциклил, где атом водорода, связанный с любым алкильным или циклоалкильным атомом углерода, необязательно замещен R10, атом водорода, сзязанный с любым арильным или гетероарильным атомом углерода, необязательно замещен R11 и атом водорода, связанный с любым атомом азота необязательно замещен -R1;
каждый R9 независимо представляет собой -арил, -гетероарил, циклоалкил или гетероциклил, где атом водорода, связанный с любым алкильным или циклоалкильным атомом углерода, необязательно замещен R10, атом водорода, связанный с любым арильным или гетероарильным атомом углерода, необязательно замещен R11 и атом водорода, связанный с любым атомом азота необязательно замещен -R1;
каждый R10 независимо представляет собой -ОН, -SH, -F, -Cl, -Br, -I, -NO2, -CN, -NH2, -CO2Н, -C(O)NH2, -N(H)C(O)H, -N(Н)С(О)NH2, -перфторалкил, -O-алкил, -O-арил, -O-алкил-арил, -N(Н)алкил, -N(Н)арил, -N(Н)алкиларил, N(алкил)2, -C(O)N(Н)алкил, -С(О)N(алкил)2, -N(Н)С(О)алкил, -N(Н)С(О)N(Н)-алкил, -N(Н)С(О)N(алкил)2, -S-алкил, -S-арил, -S-алкиларил, -S(О)2алкил, -S(О)алкил, -С(О)алкил, -CH2NH2, -CH2N(Н)алкил или CH2N(алкил)2, -алкил, -циклоалкил, -арил, -гетероарил, -гетероциклил, -алкилциклоалкил, -алкиларил, -алкилгетероарил или -алкилгетероциклил, где атом водорода, связанный с любым арильным или гетероарильным атомом углерода, необязательно замещен R11 и атом водорода, связанный с любым атомом азота необязательно замещен -R1, и
каждый R11 независимо представляет собой -ОН, -SH, -F, -Cl, -Br, -I, -NO2, -CN, -NH2, -CO2Н, -С(O)NH2, -N(H)C(O)Н, -N(Н)С(О)NH2, -алкил, -циклоалкил, -перфторалкил, -O-алкил, -O-арил, -O-алкиларил, -N(H)алкил, -N(Н)арил, -N(H)-алкиларил, N(алкил)2, -С(О)N(Н)алкил, С(О)N(алкил)2, -N(Н)С(O)алкил, -N(Н)С(O)N(Н)алкил, -N(Н)С(О)N(алкил)2, -S-алкил, -S-арил, -S-алкиларил, -S(О)2алкил, -S(О)алкил, -С(О)алкил, CH2NH2, CH2N(H)алкил или CH2N(алкил)2.
В противоположном варианте осуществления А:
R1 представляет собой Н, R8, -C(O)R8, -C(O)C(O)R8, -S(O)2R8, S(O)R8, -C(O)OR8, -C(O)N(H)R8, S(O)2N(Н)-R8, -S(O)N(H)-R8, -C(O)C(O)N(H)R8, -C(O)CH=CHR8, -C(O)CH2OR8, -C(O)CH2N(H)R8, -C(O)N(R8)2, -S(O)2N(R8)2, -S(O)N(R8)2, -C(O)C(O)N(R8)2, -C(O)CH2N(R8)2, -CH2R8, -CH2-алкенил-R8 или -СН2-алкинил-R8;
R2 представляет собой -Н и каждый R3 независимо является -Н, аминокислотной боковой цепью, -R8, алкенил-R9 или алкинил-R9, или каждый R3 вместе с атомом, к которому они присоединены, образует от 3 до 7-членную циклическую или гетероциклическую кольцевую систему, или R2 и один R3 вместе с атомами, к которым они присоединены, образуют от 3 до 7-членную циклическую или гетероциклическую кольцевую систему, в которой атом водорода, связанный с любым алкильным или циклоалкильным атомом углерода, необязательно замещен -R10, атом водорода, связанный с любым арильным или гетероарильным атомом углерода, необязательно замещен -R11, атом водорода, связанный с любым атомом азота кольцевой системы необязательно замещен -R1;
каждый R10 независимо представляет собой -ОН, -SH, -F, -Cl, -Br, -I, -NO2, -CN, -NH2, -СО2Н, -C(O)NH2, -N(H)C(O)H, -N(Н)С(О)NH2, -перфторалкил, -O-алкил, -O-арил, -О-алкил-арил, -N(Н)алкил, -N(Н)арил, -N(Н)-алкиларил, N(алкил)2, -C(O)N(H)алкил, -С(О)N(алкил)2, -N(Н)С(О)алкил, -N(H)C(O)O-алкил, -N(Н)С(О)Оарил, -N(Н)С(О)Оалкиларил, -N(Н)С(O)Огетероарил, -N(Н)С(О)Оалкилгетероарил, -N(Н)С(О)Оциклоалкил, -N(H)C(O)N(Н)алкил, -N(Н)С(О)N(алкил)2, -N(Н)С(О)N(Н)арил, -N(Н)С(О)N(Н)алкиларил, -N(Н)С(О)N(Н)гетероарил, -N(Н)С(O)N(Н)алкилгетероарил, -N(Н)С(О)N(Н)циклоалкил, -S-алкил, -S-арил, -S-алкиларил, -S(O)2алкил, -S(O)алкил, -С(О)алкил, CH2NH2, CH2N(H)алкил или CH2N(алкил)2, -алкил, -циклоалкил, -арил, -гетероарил, -гетероциклил, -алкилциклоалкил, -алкиларил, -алкилгетероарил или алкилгетероциклил, где атом водорода, связанный с любым арильным или гетероарильным атомом углерода, необязательно замещен R11 и атом водорода, связанный с любым атомом азота, необязательно замещен R1, и
другие заместители, как указано выше.
В любых указанных выше осуществлениях предпочтительно, чтобы
m равнялся 0;
R2 представлял собой -Н;
один из R3 представлял собой -Н и другие R3 представляли собой -R8, алкенил-R9 или алкинил-R9 или
R4 и один R5 вместе с атомами, к которым они присоединены, образовывали от 3 до 7-членную циклическую или гетероциклическую кольцевую систему, в которой атом водорода, связанный с любым алкильным или циклоалкильным атомом углерода, необязательно замещен R10, атом водорода, связанный с любым арильным или гетероарильным атомом углерода, необязательно замещен R11 и атом водорода, связанный с любым атомом азота кольцевой системы, необязательно замещен R1, где кольцевая система представляет собой
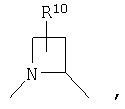
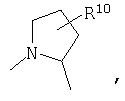
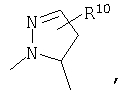
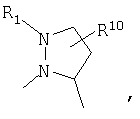
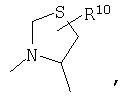
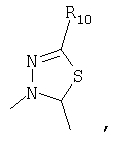
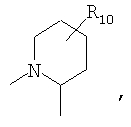
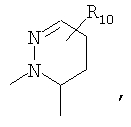
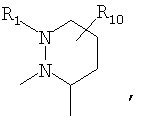
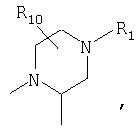
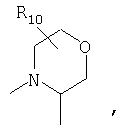
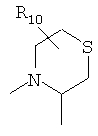 или
или 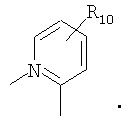
В другом предпочтительном осуществлении Х представляет собой C(R3)2 или R3 представляет собой аминокислотную боковую цепь, -R8, алкенил-R9 или алкинил-R9.
Более предпочтительно, чтобы один R3 представлял собой -Н и другой R3 являлся алкилом, или
R4 и один R5 вместе с атомами, к которым они присоединены, образовывали от 3 до 7-членную циклическую или гетероциклическую кольцевую систему, в которой любой атом водорода, связанный с атомом углерода кольцевой системы, необязательно замещен R10 и любой атом водорода, связанный с атомом азота кольцевой системы, необязательно замещен R1, выбирали из
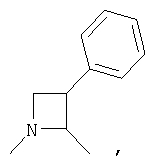
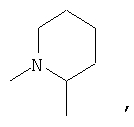
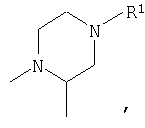
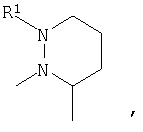
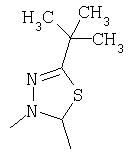 или
или 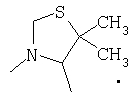
Наиболее предпочтительно, чтобы один R3 представлял собой -Н и другой R3 являлся -С(Н)(СН3)2 или -С(СН3)3 и
R4 и один R5 вместе с атомами, к которым они присоединены, образовывали от 3 до 7-членную циклическую или гетероциклическую кольцевую систему, в которой любой атом водорода, связанный с атомом углерода кольцевой системы, необязательно замещен R10 и любой атом водорода, связанный с атомом азота кольцевой системы, необязательно замещен R1 выбирали из



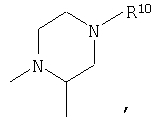

 или
или 
В другом наиболее предпочтительном осуществлении один R3 представляет собой -Н и другие R3 представляют собой -СН3, -С(Н)(СН3)2 или -С(СН3)3, а R4 и R5 представляют собой указанное непосредственно выше.
В соответствии с другим осуществлением В в настоящем изобретении предлагается соединение формулы I, а котором Y представляет собой
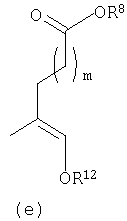 или
или 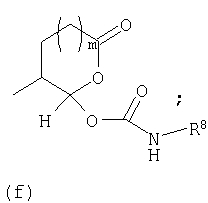
предлагаемое так, чтобы когда R6 не является водородом, R6 и Y вместе с азотом, к которому они присоединены, образуют кольцо (g):
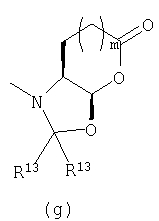
R12 представляет собой -С(O)алкил, -С(О)циклоалкил, -С(О)алкиенил, -С(О)алкиларил, -С(О)алкилгетероарил, -С(O)-гетероциклил или -С(О)алкилгетероциклил;
R13 представляет собой -Н, -алкил, -арил, -алкиларил или -алкилгетероарил и
другие заместители представляют собой описанное выше.
Предпочтительно в (с), (d), (е) или (f), чтобы R8 представлял собой метил, этил, н-пропил, изопропил, циклопентил, фенэтил или бензил.
Предпочтительные определения для других индивидуальных компонентов воплощения В являются теми же, что и указанные выше для воплощения А.
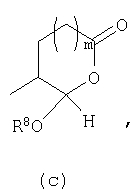
В предпочтительном осуществлении С настоящего изобретения предлагаются соединения формулы I

где Y представляет собой
(а)
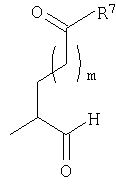 или
или
(b)
m равно 0 или 1;
X представляет собой -C(R3)2-;
R1 представляет собой Н, R8, -C(O)R8, -C(O)C(O)R8, -S(O)2R8, S(O)R8, -C(O)OR8, -C(O)N(H)R8, -S(O)2N(H)-R8, -S(O)N(H)-R8, -C(O)C(O)N(H)R8, -C(O)CH=CHR8, -С(O)СН2OR8, -C(O)CH2N(H)R8, -C(O)N(R8)2, -S(O)2N(R8)2, -S(O)N(R8)2, -C(O)C(O)N(R8)2, -C(O)CH2N(R8)2, -CH2R8, -СН2-алкенил-R8 или -СН2-алкинил-R8;
R2 представляет собой -Н и каждый R3 независимо является -Н, аминокислотной боковой цепью, -R8, алкенил-R9 или алкинил-R9, или каждый R3 вместе с атомом, к которому они присоединены, образует от 3 до 7-членную циклическую или гетероциклическую кольцевую систему, в которой атом водорода, связанный с любым алкильным или циклоалкильным атомом углерода, необязательно замещен -R10, атом водорода, связанный с любым арильным или гетероарильным атомом углерода, необязательно замещен -R11, атом водорода, связанный с любым атомом азота кольцевой системы, необязательно замещен -R1;
R4 представляет собой -Н и каждый R5 независимо является -Н, аминокислотной боковой цепью, -R8, алкенил-R9 или алкинил-R9, или R4 и один R5 вместе с атомами, к которым они присоединены, образуют от 3 до 7-членную циклическую или гетероциклическую кольцевую систему, в которой атом водорода, связанный с любым алкильным или циклоалкильным атомом углерода, необязательно замещен R10, атом водорода, сзязанный с любым арильным или гетероарильным атомом углерода, необязательно замещен R11 и атом водорода, связанный с любым атомом азота кольцевой системы необязательно замещен -R1;
R6 представляет собой -Н;
R7 представляет собой -ОН, -OR8, -N(H)OH или -N(H)S(O)2R8;
каждый R8 независимо представляет собой -алкил, -циклоалкил, -арил, -гетероарил, -гетероциклил, -алкилциклоалкил, -алкиларил, -алкилгетероарил или -алкилгетероциклил, где атом водорода, связанный с любым алкильным или циклоалкильным атомом углерода, необязательно замещен R10, атом водорода, связанный с любым арильным или гетероарильным атомом углерода, необязательно замещен R11 и атом водорода, связанный с любым атомом азота, необязательно замещен R1;
каждый R9 независимо представляет собой -арил, -гетероарил, циклоалкил или -гетероциклил, где атом водорода, связанный с любым алкильным или циклоалкильным атомом углерода, необязательно замещен R10, атом водорода, связанный с любым арильным или гетероарильным атомом углерода, необязательно замещен R11 и атом водорода, связанный с любым атомом азота необязательно замещен R1;
каждый R10 независимо представляет собой -ОН, -SH, -F, -Cl, -Br, -I, -NO2, -CN, -NH2, -CO2H, -C(O)NH2, -N(H)C(O)H, -N(Н)С(О)NH2, -перфторалкил, -O-алкил, -O-арил, -О-алкиларил, -N(Н)алкил, -N(Н)арил, -N(Н)-алкиларил, -N(алкил)2, -C(O)N(Н)алкил, -C(O)N(алкил)2, -N(Н)С(О)алкил, -N(H)C(O)O-алкил, -N(H)С(О)Оарил, -N(Н)С(О)Оалкиларил, -N(Н)С(О)Огетероарил, -N(Н)С(О)Оалкилгетероарил, -N(Н)С(О)Оциклоалкил, -N(Н)С(O)N(Н)алкил, -N(H)C(O)N(алкил)2, -N(Н)С(О)N(Н)арил, -N(Н)С(О)N(Н)алкиларил, -N(Н)С(О)N(Н)гетероарил, -N(Н)С(O)N(Н)алкилгетероарил, -N(Н)С(О)N(Н)циклоалкил, -S-алкил, -S-арил, -S-алкиларил, -S(O)2алкил, -S(O)алкил, -С(О)алкил, CH2NH2, CH2N(H)алкил или CH2N(алкил)2, -алкил, -циклоалкил, -арил, -гетероарил, -гетероциклил, -алкилцик-лоалкил, -алкиларил, -алкилгетероарил или алкилгетероциклил, где атом водорода, связанный с любым арильным или гетероарильным атомом углерода, необязательно замещен R11 и атом водорода, связанный с любым атомом азота, необязательно замещен R1, и
каждый R11 независимо представляет собой -ОН, -SH, -F, -Cl, -Br, -I, -NO2, -CN, -NH2, -CO2Н, -C(O)NH2, -N(H)C(O)H, -N(Н)С(О)NH2, -алкил, -циклоалкил, -перфторалкил, -O-алкил, -O-арил, -O-алкиларил, -N(H)алкил, -N(H)арил, -N(H)-алкиларил, -N(алкил)2, -С(О)N(Н)алкил, С(О)N(алкил)2, -N(H)C(O)-алкил, -N(H)C(O)N(Н)алкил, -N(Н)С(О)N(алкил)2, -S-алкил, -S-арил, -S-алкиларил, -S(O)2алкил, -S(O)алкил, -С(О)алкил, -CH2NH2, -CH2N(Н)алкил или -CH2N(алкил)2;
предлагаемые так, что, если R3 представляет собой -Н, то другие R3 не являются -Н.
В другом предпочтительном осуществлении D настоящего изобретения предлагается соединение формулы I, в котором Y представляет собой
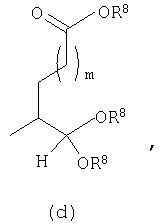
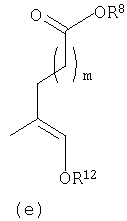 или
или 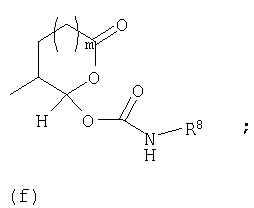
R12 представляет собой -С(O)алкил, -С(О)циклоалкил, -С(О)алкиенил, -С(О)алкиларил, -С(О)алкилгетероарил, С(О)гетероциклил или -С(О)алкилгетероциклил и
другие заместители представляют собой описанное выше, за исключением того, что обе R3 группы могут быть -Н.
В любых других осуществлениях A-D предпочтительными соединениями являются те, в которых
R1 представляет собой -C(O)R8 или -С(О)(O)R8;
R2 и один R3 оба являются -Н и другой R3 представляет собой аминокислотную боковую цепь, -R8, алкенил-R9 или алкинил-R9 или
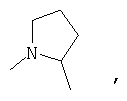
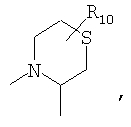
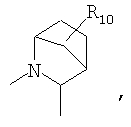
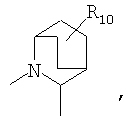
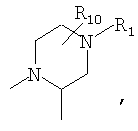
R4 и один R5 вместе с атомами, к которым они присоединены, образуют кольцевую систему, выбираемую из



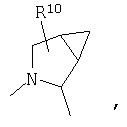



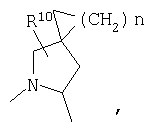
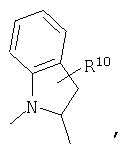
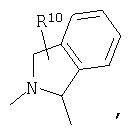
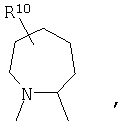

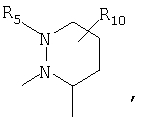
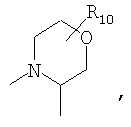

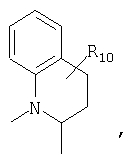
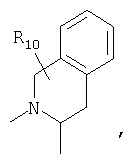
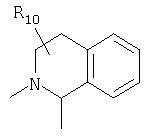 или
или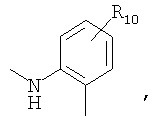
предлагаемых так, что каждая из кольцевых систем может необязательно замещаться одной или более группами R11.
В противоположном варианте предпочтительными соединениями осуществлений A-D являются те, в которых R3 представляет собой -Н и другой R3 является метилом, изопропилом, трет-бутилом, -CH2SR8, -CH2SO2R8, -CH2SO2R8, -CH2CH2SR8, CH2CH2SO2R8.
Более предпочтительными соединениями осуществлений A-D являются те, в которых R4 и один R5 вместе с атомами, к которым они присоединены, образуют кольцевую систему
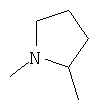
и другой R5 является Н или
один R3 представляет собой -Н и другой R3 является метилом.
В противоположном варианте более предпочтительными соединениями осуществлений A-D являются те, в которых R4 и один R5 вместе с атомами, к которым они присоединены, образуют кольцевую систему
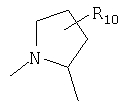
и другой R5 является Н.
В указанном выше альтернативном осуществлении R10 является предпочтительно 4-фтором или 4,4-дифтором.
Более предпочтительными соединениями настоящего изобретения являются те, в которых R3 является метилом, и
R4 и один R5 вместе с атомами, к которым они присоединены, образуют кольцевую систему

и другой R5 является Н.
В противоположном варианте наиболее предпочтительными соединениями осуществлений A-D являются те, в которых R3 является метилом и R4 и один R5 вместе с атомами, к которым они присоединены, образуют кольцевую систему

и другой R5 является Н;
R10 является 4-фтором или 4,4-дифтором.
Предпочтительными соединениями осуществлений (В) или (D) являются те, в которых Y представляет собой
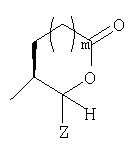
где Z представляет собой -OR8 и Z является СН3О,
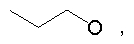
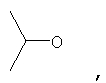
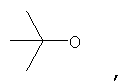

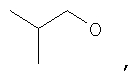
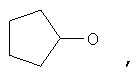
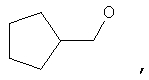
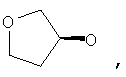
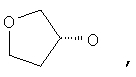
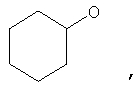
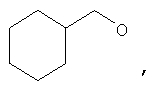
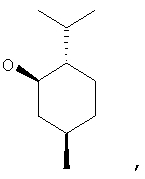
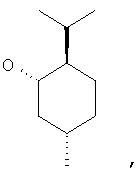
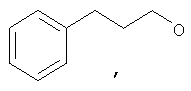
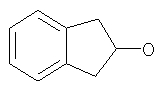
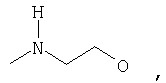
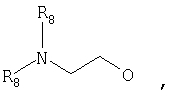
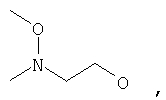
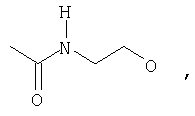
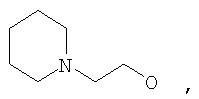
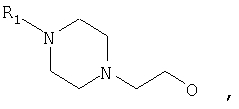
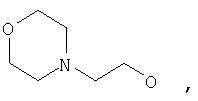
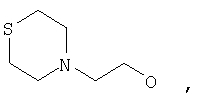
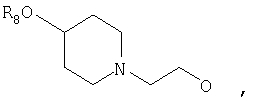
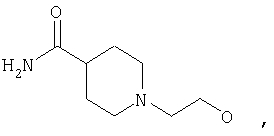
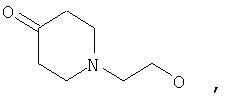
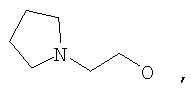
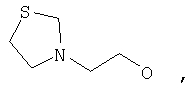
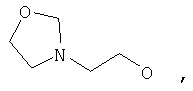
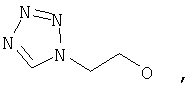
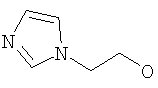 или
или 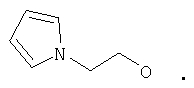
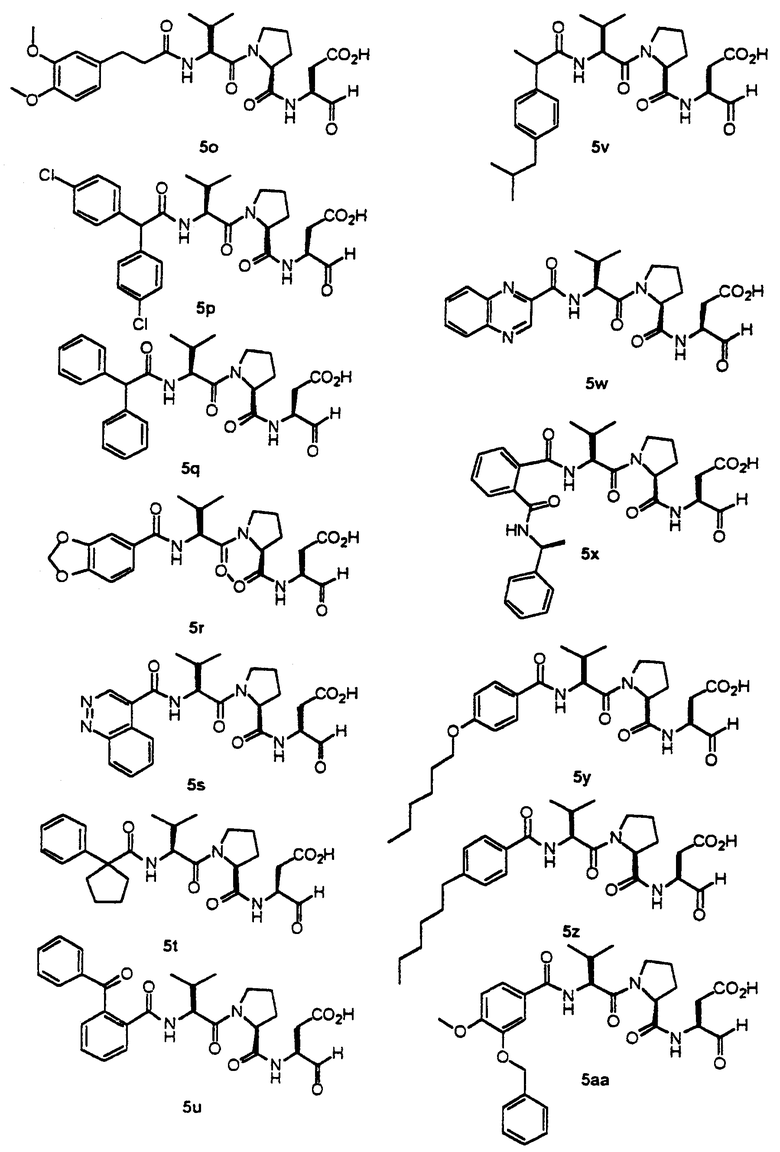
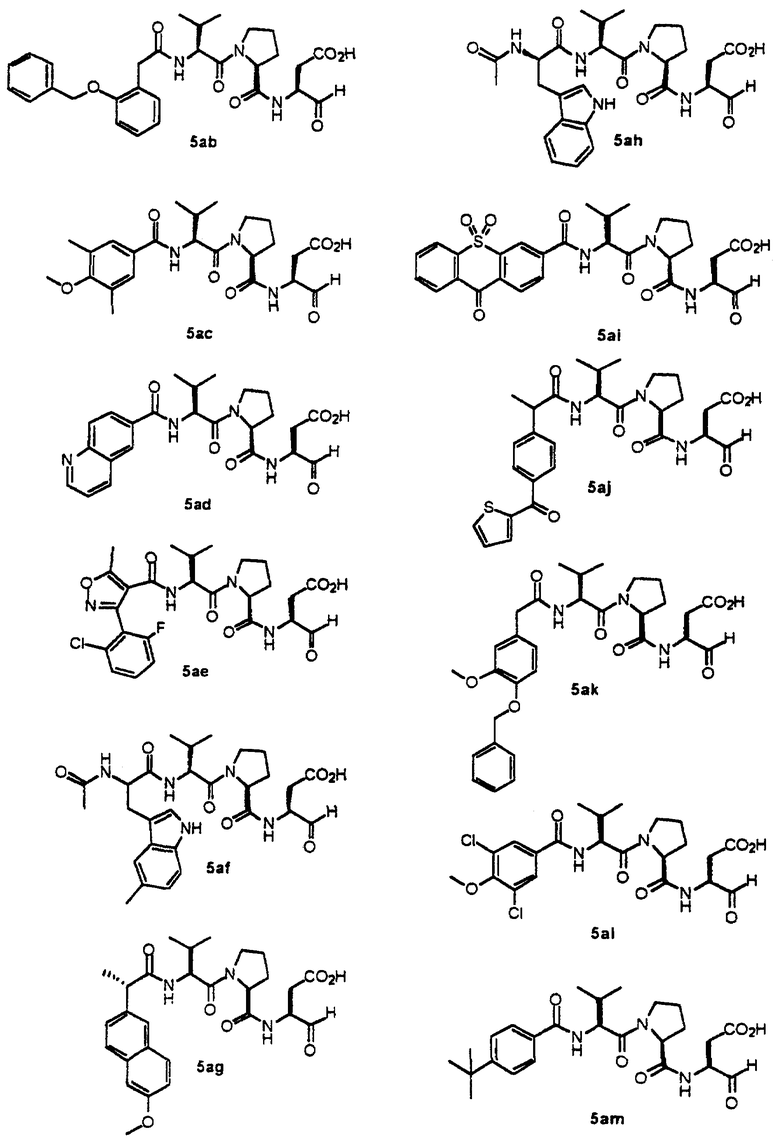
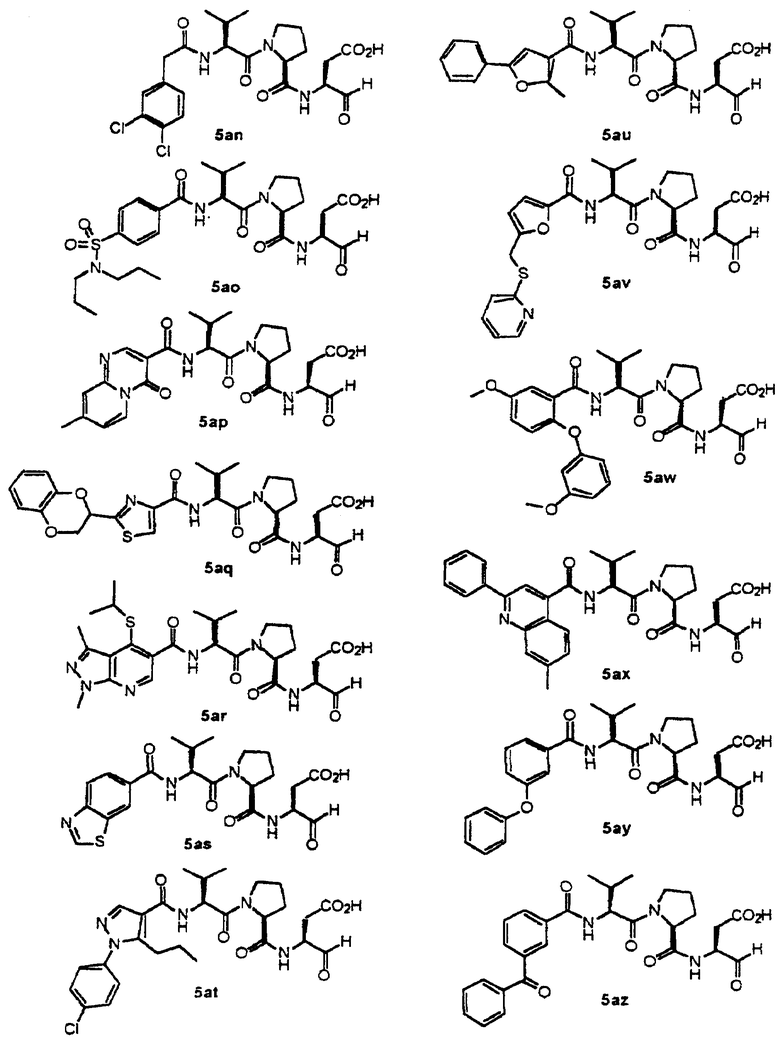
Конкретные соединения настоящего изобретения включают, не ограничиваясь этим, примеры 5a-5bd, 7a-7at, 9a-9g, 15a-15f, 16a-16b, 17a-17e, 18a-18f, 20a-20t, 23a-23i, 24a-24e, 25a-25e, 26a-26h, 27a-27n, 28a-28c, 29a-29s, 32a-32e, 34, G1, G2, 41, 42, 45, 46, 51, 52, 56, 57, 60, 61, 64, 65, 68, 69, 72, 73, 76-93, 98a-z, aa-az и ba-bb, 101, 102a, 102b, 108a-d, 110, 111, 116a-h, 120a и b, 121, 122 a-v и 123 а-с.
Соединения настоящего изобретения могут содержать один или более "асимметричных" атома углерода и, таким образом, могут существовать как рацематы и рацемические смеси, одиночные энантиомеры, смеси диастереомеров и индивидуальные диастереомеры. Каждый стереогенный углерод может иметь конфигурацию R или S. Хотя конкретные соединения и скелеты в этой заявке могут быть изображены в конкретной стереохимической конфигурации, представлены также соединения и скелеты, имеющие либо противоположную стереохимию при любом данном хиральном центре или их смеси.
Все такие изомерные формы данных соединений специально включены в настоящее изобретение, также как их фармацевтически приемлемые производные.
Термин "фармацевтически приемлемые производные" обозначает любую фармацевтически приемлемую соль, эфир или соль такого эфира соединения настоящего изобретения или любого другого соединения, которые при введении реципиенту способны давать (прямо или непрямо) соединение настоящего изобретения или его активный метаболит или остаток.
Фармацевтически приемлемые соли соединений настоящего изобретения включают, например, соли фармацевтически приемлемых неорганических и органических кислот и оснований. Примеры подходящих кислот включают соляную, бромистоводородную, серную, азотную, хлорную, фумаровую, малеиновую, фосфорную, гликолевую, молочную, салициловую, сукцинатную, толуол-пара-сульфоновую, винную, уксусную, лимонную, метансульфоновую, муравьиную, бензойную, малоновую, нафталин-2-сульфоновую и бензолсульфонсзую кислоты. Другие кислоты, такие как щавелевая, не являясь сами по себе фармацевтически приемлемыми, можно применять для получения солей, пригодных в качестве промежуточных продуктов при получении соединений данного изобретения и их фармацевтически пригодных кислых аддитивных солей. Соли, которые получают из подходящих оснований, включают соли щелочных металлов (например, натрия), щелочноземельных металлов (например, магния), аммония и N-(C1-4алкил)4 +.
В настоящем изобретении включает также "образование четвертичных оснований" любых основных азотсодержащих групп раскрытых здесь соединений. Азот основания может образовывать четвертичное основание с любыми агентами, известными специалистам в данной области, включая, например, низшие галогеналкилы, такие как хлористый, бромистый и иодистый метил, этил, пропил и бутил; серные диалкилы, включая серный диметил, диэтил, дибутил и диамил; галогеналкилы с длинной цепью, такие как хлористый, бромистый и иодистый децил, лаурил, миристил и стеарил; галогенаралкилы, включая бромистый бензил и фенэтил. С помощью такого образования четвертичных оснований могут быть получены растворимые в воде или в масле продукты.
При наличии многих заместителей каждый заместитель может быть включен независимо от любого другого заместителя до тех пор, пока в результате сочетания заместителей образуется стабильное соединение.
Сочетания заместителей и переменных, предлагаемые в настоящем изобретении, являются только теми, которые ведут к образованию стабильных соединений. Используемый здесь термин "стабильное" относится к соединениям, которые обладают стабильностью, достаточной для их производства и введения млекопитающему с помощью способов, известных науке. Обычно такие соединения стабильны при температуре 40°С или менее в течение по меньшей мере недели при отсутствии влажности или других химически активных условий.
Предпочтительные соединения настоящего изобретения могут легко поступать в кровоток пациентов при пероральном введении. Такая доступность при пероральном введении делает эти соединения прекрасными агентами для схем перорального профилактического и терапевтического лечения заболеваний, опосредуемых IL-1, апоптозом, IGIF или IFN-γ.
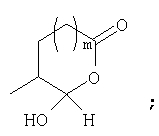
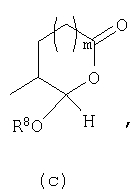
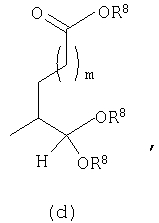
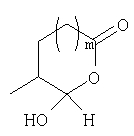
Должно быть понятно, что соединения настоящего изобретения могут существовать в виде равновесия различных форм, зависящего от условий, включая выбор растворителя, рН и других условий, известных специалистам в данной области. Все такие формы данных соединений специально включены в настоящее изобретение. В частности, многие из этих соединений, особенно те из них, которые содержат в Y альдегидные или кетонные группы и карбоксильные группы, могут иметь полуацетальные или гидратные формы. Например, соединения осуществления А имеют полуацетальную форму, когда Y представляет собой
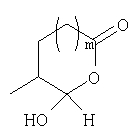
В зависимости от выбора растворителя и других условий, известных специалистам в данной области, соединения настоящего изобретения могут также иметь гидратную, ацилоксиацетальную, ацетальную или енольную формы. Например, соединения настоящего изобретения имеют гидратные формы, когда Y представляет собой
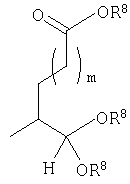
и R8 представляет собой Н;
ацилокси-ацетальные формы, когда Y представляет собой
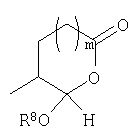
ацетальные формы, когда Y представляет собой и R8 отличен от Н;
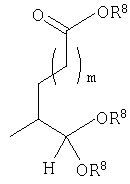
енольные формы, когда Y представляет собой
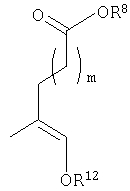
Кроме того, должно быть понятно, что равновесные формы соединений настоящего изобретения могут включать таутомерные формы. Все такие формы данных соединений специально включены в настоящее изобретение.
Соединения формулы I могут быть синтезированы с применением традиционной техники. Эти соединения удобно синтезировать из доступных готовых исходных материалов.
Соединения настоящего изобретения могут быть получены с применением описанных здесь способов. Специалисты в данной области могут учитывать, что эти способы не являются единственными для синтеза соединений, описанных в этой заявке и заявленных в формуле изобретения. Для специалистов в данной области должны быть очевидны и другие способы. Кроме того, описанные здесь различные стадии синтеза могут быть выполнены в противоположной последовательности или порядке для получения описываемых соединений.
Должно быть понятно, что соединения настоящего изобретения можно модифицировать с помощью подходящих функциональных групп для увеличения избирательности биологических свойств. Такие модификации известны науке и включают те из них, которые увеличивают биологическую проницаемость в данную биологическую систему (например, кровь, лимфатическую систему, центральную нервную систему), увеличивают доступность при пероральном приеме, увеличивают растворимость, создавая возможность введения с помощью инъекции, изменяют метаболизм и модифицируют скорость экскреции. Кроме того, соединения могут быть изменены до формы пролекарства таким образом, что желаемое соединение образуется в организме пациента в результате действия на пролекарство метаболических и других биохимических процессов. Такие пролекарственные формы обычно не проявляют или проявляют слабую активность при тестировании in vitro. Некоторые примеры пролекарственных форм включают кетальные, ацетальные, оксимные, иминные и гидразонные формы соединений, которые содержат кетонные или альдегидные группы, особенно если они содержатся в группе Y соединений настоящего изобретения. Другие примеры пролекарственных форм включают геми-кетальные, полуацетальные, ацилокси-кетальные, ацилокси-ацетальные, кетальные, ацетальные и енольные формы, которые здесь описаны.
Композиции и способы
Соединения настоящего изобретения представляют собой ингибиторы каспаз, в частности ингибиторы ICE. Соответственно эти. соединения способны направлять и сдерживать события при заболеваниях, опосредуемых IL-1, апоптозом, IGIF или IFN-γ, и таким образом предельно снижать активность этого белка при воспалительных заболеваниях, аутоиммунных заболеваниях, деструктивных заболеваниях костей, нарушениях пролиферации, инфекционных заболеваниях и дегенеративных заболеваниях. Например, соединения настоящего изобретения тормозят превращение предшественника IL-1β в зрелую форму IL-1β с помощью ингибирования ICE. Поскольку ICE существенен для продукции IL-1, ингибирование этого фермента эффективно блокирует инициацию IL-1-опосредуемых физиологических эффектов и симптомов, таких как воспаление, путем ингибирования продукции зрелого IL-1. Таким образом, с помощью ингибирования активности предшественника IL-1β соединения настоящего изобретения эффективно действуют в качестве ингибиторов IL-1.
Соединения настоящего изобретения тормозят также превращение про-IGIF в активный IGIF путем ингибирования ICE. Поскольку ICE существенен для продукции зрелого IGIF, ингибирование ICE эффективно блокирует инициацию IGIF-опосредуемых физиологических эффектов и симптомов путем ингибирования продукции зрелого IGIF. IGIF, в свою очередь, существенен для продукции IFN-γ. ICE, следовательно, эффективно блокирует инициацию IFN-γ-опосредуемых физиологических эффектов и симптомов путем ингибирования продукции зрелого IGIF и, таким образом, продукции IFN-γ.
Соединения настоящего изобретения неожиданно оказались биологически доступными при сравнении с пептидильными ингибиторами, такими как описанные, например, в ЕР 618223, ЕР 623592, WO 93/09135, WO 93/16710, патент США №5434248, WO 95/35308 или WO 96/33209. Таким образом, фармацевтические композиции и способы настоящего изобретения должны быть полезны для контролирования активности каспаз in vivo. Фармацевтические композиции и способы настоящего изобретения, таким образом, должны быть полезны для контроля уровней IL-1, IGIF или IFN-γ in vivo и для лечения или снижения развития или эффектов состояний, опосредованных IL-1, апоптозом, IGIF или IFN-γ, включая заболевания, нарушения или эффекты.
Фармацевтические композиции настоящего изобретения включают соединение формулы I или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Такие композиции могут необязательно включать дополнительный терапевтический агент. Такие агенты включают, но не ограничиваются этим, противовоспалительный агент, ингибитор металлопротеиназы матрикса, ингибитор липоксигеназы, антагонист цитокинов, иммунодепрессант, противораковый агент, противовирусный агент, цитокин, ростовой фактор, иммуномодулятор, простагландин или соединение, сдерживающее усиленную пролиферацию сосудов.
Термин "фармацевтически приемлемый носитель" относится к нетоксичному носителю, который можно вводить пациенту вместе с соединением настоящего изобретения и который не нарушает его фармакологической активности.
Фармацевтически приемлемые носители, которые можно применять в фармацевтических композициях настоящего изобретения, включают, не ограничиваясь этим, ионообменники, окись алюминия, стеарат алюминия, лецитин, белки сыворотки, такие как альбумин сыворотки человека, забуферивающие вещества, такие как фосфат, глицин, сорбиновая кислота, сорбат калия, частичные глицеридные смеси насыщенных растительных жирных кислот, вода, соли или электролиты, такие как протаминсульфат, вторичный кислый фосфат натрия, кислый фосфат калия, хористый натрий, соли цинка, коллоидная двуокись кремния, трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, натриевая соль карбоксиметилцеллюлозы, полиакрилаты, парафины, полиэтилен-полиоксипропилена сополимеры, ланолин и самоэмульгирующие системы для доставки лекарств (SEDDS), такие как α-токоферол, сукцинат полиэтиленгликоля 1000 или другие сходные полимерные матрицы для доставки.
В фармацевтических композициях, включающих в качестве активного компонента только соединение осуществлений A-D, способы введения таких композиций могут дополнительно включать стадию введения субъекту дополнительного агента. Такие агенты включают, но не ограничиваются этим, противовоспалительный агент, ингибитор металлопротеиназы матрикса, ингибитор липоксигеназы, антагонист цитокинов, иммунодепрессант, противораковый агент, противовирусный агент, цитокин, ростовой фактор, иммуномодулятор, простагландин или соединение, содерживающее усиленную пролиферацию сосудов.
Теркин "фармацевтически приемлемое количество" относится к количеству, эффективному для лечения или улучшения течения заболеваний пациента, опосредованных IL-1, апоптозом, IGIF или IFN-γ. Термин "эффективное количество для профилактики" относится к количеству, эффективному для профилактики или по существу уменьшению у пациента заболеваний, опосредованных IL-1, апоптозом, IGIF или IFN-γ.
Соединения настоящего изобретения можно применять традиционным способом для контролирования уровней IGIF и IFN-γ in vivo и для лечения заболеваний или снижения развития или тяжести эффектов, которые опосредуются IL-1, апоптозом, IGIF или IFN-γ. Такие способы лечения, уровень их дозировок и требования могут быть выбраны специалистами в данной области из доступных способов и методик.
Например, соединение настоящего изобретения можно сочетать с фармацевтически приемлемым адъювантом для введения пациенту, страдающему от заболевания, опосредованного IL-1, апоптозом, IGIF или IFN-γ, с помощью фармацевтически приемлемого способа и в количестве, эффективном для снижения тяжести этого заболевания.
В противоположном варианте соединения настоящего изобретения можно применять в композициях и способах для лечения или профилактики индивидуумов от заболеваний, опосредованных IL-1, апоптозом, IGIF или IFN-γ, в течение продолжительного периода времени, соединения могут быть применены в таких композициях либо сами по себе, либо совместно с другими соединениями настоящего изобретения способом, состоящим из обычно используемого для ингибиторов ферментов в фармацевтических композициях. Например, соединение настоящего изобретения можно сочетать с фармацевтически приемлемыми адъювантами, традиционно применяемыми в вакцинах, и вводить в профилактически эффективных количествах для защиты индивидуумов в течение продолжительного периода времени от заболеваний, опосредованных IL-1, апоптозом, IGIF или IFN-γ.
Соединения формулы I можно также вводить совместно с другими ингибиторами каспаз или ICE для увеличения терапевтического или профилактического эффекта в отношении различных заболеваний, опосредованных IL-1, апоптозом, IGIF или IFN-γ.
Кроме того, соединения настоящего изобретения можно применять в сочетании либо с обычными противовоспалительными агентами, либо с ингибиторами металлопротеиназ матрикса, ингибиторами липоксигеназы и антагонистами цитокинов, отличных от IL-1β.
Соединения настоящего изобретения можно также вводить в сочетании с иммуномодуляторами (например, бропиримином, антителами против альфа-интерферона человека, IL-2, GM-CSF, метионин-энкефалином, альфа-интерфероном, диэтилдитиокарбаматом, фактором некроза опухолей, налтрексоном и ЕРО (эритропоэтином), с простагландинами или с противовирусными агентами (например, 3ТС, полисульфатированными полисахаридами, ганкловиром, рибавирином, ацикловиром, альфа-интерфероном, триметотрексатом и фанцикловиром) или пролекарствами этих или родственных им соединений для предотвращения или борьбы с симптомами заболевания, опосредованного IL-1, такими как воспаление.
Когда соединения настоящего изобретения вводят в сочетании с другими агентами, они могут вводиться пациенту последовательно или совместно. В противоположном варианте фармацевтические или профилактические композиции в соответствии с настоящим изобретением включают сочетание соединения формулы I и другого терапевтического или профилактического агента.
Фармацевтические композиции настоящего изобретения можно вводить перорально, парентерально, с помощью ингаляции спрея, местно, ректально, интраназально, защечно, вагинально или через имплантируемый резервуар. Заявители считают предпочтительным пероральное введение. Фармацевтические композиции настоящего изобретения могут содержать любые традиционные, нетоксичные, фармацевтически приемлемые носители, адъюванты или наполнители. В некоторых случаях рН состава может быть доведен фармацевтически приемлемыми кислотами, основаниями или буферами для увеличения стабильности соединения в составе или его формы для доставки. Применяемый здесь термин парентеральный способ включает подкожный, внутрикожный, внутривенный, внутримышечный, внутрисуставный, внутрисиновиальный, внутригрудинный, внутритекальный, внутриочаговый и внутричерепной способ введения или инфузии.
Фармацевтические композиции могут быть в форме стерильного препарата для инъекций, например в виде стерильной водной или масляной суспензии. Эта суспензия может быть составлена в соответствии со способами, известными в науке с применением подходящих диспергирующих или увлажняющих агентов (таких как, например, твин 80) и суспендирующих агентов. Стерильный препарат для инъекций может также быть стерильным раствором или суспензией для инъекций в нетоксичном подходящем для парэнтерального введения разбавителя или растворителя, например в виде раствора в 1,3-бутандиоле. Среди подходящих носителей и растворителей, которые можно применять, находятся маннитол, вода, раствор Рингера и изотонический раствор хлористого натрия. Кроме того, в качестве среды для растворения или суспендирования обычно применяют стерильные нелетучие масла. Для этих целей может быть применено любое слабо летучее масло, включая синтетические моно- или диглицериды. Для препаратов для инъекций пригодны жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, также как фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, особенно в их полиоксиэтилированных вариантах. Эти масляные растворы или суспензии могут также содержать растворитель или диспергирующий агент в виде спирта с длинной цепью, такой как описанный в Pharmacopeia Helvetica, или сходный спирт.
Фармацевтические композиции настоящего изобретения можно вводить в любой приемлемой для перорального введения форме дозировки, включая, но не ограничиваясь этим, капсулы, таблетки, а также водные суспензии и растворы. В случае таблеток для перорального употребления обычно применяемые носители включают лактозу и кукурузный крахмал. Обычно также добавляют смазывающие агенты, такие как стеарат магния. Для перорального введения в форме капсул удобные разбавители включают лактозу и высушенный кукурузный крахмал. Когда перорально вводят водные суспензии и растворы, а также пропиленгликоль, активный ингредиент сочетают с эмульгирующими и суспендирующими агентами. Если это желательно, могут быть добавлены определенные подсластители и/или отдушка, и/или подкрашивающие агенты.
Фармацевтические композиции настоящего изобретения можно также вводить в форме суппозиториев для ректального введения. Эти композиции могут быть получены путем смешивания соединения настоящего изобретения с подходящим, нераздражающим наполнителем, который является твердым при комнатной температуре, но жидким при ректальной температуре и, следовательно, будет плавиться в прямой кишке с высвобождением активных компонентов. Такие материалы включают, но не ограничиваются этим, масло какао, воск и полиэтиленгликоли.
Местное введение фармацевтических композиций настоящего изобретения особенно полезно, когда желаемое лечение охватывает зоны или органы, полностью готовые для местного нанесения. Для местного нанесения на кожу фармацевтическая композиция должна быть составлена в виде подходящей мази, содержащей активные компоненты, суспендированные или растворенные в носителе. Носители для местного введения соединений настоящего изобретения включают, но не ограничиваются этим, неорганическое масло, жидкий вазелин, белый вазелин, пропиленгликоль, соединение полиоксиэтилен-полиоксипропилена, эмульгирующий воск и воду. В противоположном варианте фармацевтическая композиция может быть составлена в виде подходящего лосьона или крема, содержащего активное соединение, суспендированное или растворенное в носителе. Подходящие носители включают, но не ограничиваются этим, неорганическое масло, моностеарат сорбитана, полисорбат 60, воск цетиловых эфиров, цетеариловый спирт, 2-октилдодеканол, бензиновый спирт и воду. Фармацевтические композиции настоящего изобретения могут также наноситься местно в нижние отделы кишечного тракта с помощью состава для ректального суппозитория или в подходящем составе для клизмы. В настоящее изобретение включены также действующие местно трансдермальные пластыри.
Фармацевтические композиции настоящего изобретения можно вводить с помощью интраназального аэрозоля или ингаляции. Такие композиции получают в соответствии с методами, хорошо известными при приготовлении фармацевтических составов, и они могут быть приготовлены в виде солевых растворов с применением бензилового спирта или других подходящих консервантов, ускорителей абсорбции для увеличения биологической доступности фторуглеродов и/или других солюбилизирующих или диспергирующих агентов, известных науке.
При монотерапии применимы уровни доз между приблизительно 0,01 и приблизительно 100 мг/кг веса тела в день, предпочтительно между приблизительно 0,5 и приблизительно 75 мг/кг веса тела в день и наиболее предпочтительно между приблизительно 1 и приблизительно 50 мг/кг веса тела в день активного ингредиента соединения для профилактики и лечения заболеваний, опосредованных IL-1, апоптозом, IGIF или IFN-γ, включая воспалительные заболевания, аутоиммунные заболевания, деструктивные заболевания костей, нарушения пролиферации, инфекционные заболевания, дегенеративные заболевания, некротические заболевания, воспалительный перитонит, остеоартрит, острый панкреатит, хронический панкреатит, бронхиальную астму, респираторный дистресс-синдром взрослых, гломерулонефит, ревматоидный артрит, системную красную волчанку, склеродерму, хронический тиреоидит, болезнь Грейвса, аутоиммунный гастрит, инсулин-зависимый сахарный диабет (тип I), аутоиммунную гемолитическую анемию, аутоиммунную нейтропению, тромбоцитопению, хронический активный гепатит, псевдопаралитическую миастению, воспалительную болезнь кишечника, болезнь Крона, псориаз, атрофический дерматит, реакцию "трансплантант против хозяина", остеопороз, множественные нарушения костей, связанные с миеломой, лейкозы и родственные им заболевания, миелодиспластический синдром, острый миелолейкоз, хронический миелолейкоз, метастазирующую меланому, саркому Капоши, множественную миелому, сепсис, септический шок, шигеллез, болезнь Альцгеймера, болезнь Паркинсона, ишемию головного мозга, ишемию миокарда, атрофию мышц спинального происхождения, рассеянный склероз, ВИЧ-ассоциированный энцефалит, СПИД-ассоциированный энцефалит, старение, облысение, неврологические нарушения, связанные с кровоизлиянием в мозг, язвенный колит, инфекционный гепатит, ювенильный сахарный диабет, плоский лишай, острый дерматомиозит, экзему, первичный цирроз, увеит, болезнь Бехчета, атопическое заболевания кожи, истинную эритроцитарную аплазию, апластическую анемию, амиотрофический латеральный склероз, нефротический синдром и системные заболевания с эффектами, локализованными в печени или других органах, имеющие воспалительный или атрофический компонент, вызываемые избыточным употреблением алкоголя или вирусами, такими как HBV, HCV, HGV, вирус желтой лихорадки, вирус лихорадки денге и вирус японского энцефалита.
Обычно фармацевтические композиции настоящего изобретения должны вводиться от приблизительно 1 до 5 раз в день или наоборот в виде постоянной инфузии. Такое введение может применяться в качестве хронической или острой терапии. Количество активного ингредиента, которое должно сочетаться с материалами носителя, для получения единицы лекарственной формы должно варьироваться в зависимости от субъекта, подвергаемого лечению, и от конкретного способа введения. Обычный препарат должен содержать от приблизительно 5% до приблизительно 95% активного соединения (вес/вес). Предпочтительно, чтобы такие препараты содержали от приблизительно 20% до приблизительно 80% активного соединения.
Когда композиции настоящего изобретения включают сочетание соединения формулы I и одного или более дополнительных терапевтических или профилактических агентов, как соединение, так и дополнительный агент должны быть представлены на уровне доз между приблизительно 10 и 80% дозы, обычно вводимой в режиме монотерапии.
Для улучшения состояния пациента, если необходимо, может быть введена поддерживающая доза соединения, композиции или комбинации настоящего изобретения. Следовательно, дозировка или частота введения, или оба параметра могут быть снижены в зависимости от тяжести симптомов до уровня, при котором сохраняется улучшенное состояние, при облегчении симптомов до желаемого уровня лечение должно быть прекращено. Пациенты могут, однако, требовать прерывистого лечения в течение длительного времени в отношении любых рецидивов или симптомов заболевания.
Как могут оценить специалисты в данной области, могут требоваться меньшие или большие дозы, чем указанные выше. Конкретная дозировка и схемы введения для любого конкретного пациента должны зависеть от различных факторов, включая активность конкретного применяемого соединения, возраст, вес тела, общее состояние здоровья, пол, диету, время введения, скорость экскреции, сочетание лекарств, тяжесть и течение заболевания, предрасположенность пациента к заболеванию и мнение лечащего врача.
Заболевания, опосредуемые IL-1 или апоптозом, которые можно лечить или предотвращать с помощью соединений настоящего изобретения, включают, но не ограничиваются этим, воспалительные заболевания, аутоиммунные заболевания, нарушения пролиферации, инфекционные заболевания и дегенеративные заболевания. Заболевания, опосредуемые апоптозом, которые можно лечить или предотвращать с помощью соединений настоящего изобретения включают дегенеративные заболевания.
Воспалительные заболевания, опосредуемые IL-1 или апоптозом, которые можно лечить или предотвращать, включают, но не ограничиваются этим, остеоартрит, острый панкреатит, хронический панкреатит, астму и синдром респираторного дистресса взрослых. Предпочтительными воспалительными заболеваниями являются остеоартрит или острый панкреатит.
Аутоиммунные заболевания, опосредуемые IL-1 или апоптозом, которые можно лечить или предотвращать, включают, но не ограничиваются этим, гломерулонефрит, ревматоидный артрит, системную красную волчанку, склеродерму, хронический тиреоидит, болезнь Грейвса, аутоиммунный гастрит, инсулин-зависимый сахарный диабет (тип I), аутоиммунную гемолитическую анемию, аутоиммунную нейтропению, тромбоцитопению, хронический активный гепатит, псевдопаралитическую миастению, множественный склероз, воспалительное заболевание кишечника, болезнь Крона, псориаз, атрофический дерматит и реакцию трансплантанта против хозяина. Предпочтительным аутоиммунным заболеванием является ревматоидный артрит, воспалительное заболевание кишечника, болезнь Крона, псориаз или атрофический дерматит.
Деструктивные нарушения костей, опосредуемые IL-1 или апоптозом, которые можно лечить или предотвращать, включают, но не ограничиваются этим, остеопороз и множественные нарушения костей, связанные с миеломой.
Нарушения пролиферации, опосредуемые IL-1 или апоптозом, которые можно лечить или предотвращать, включают, но не ограничиваются этим, лейкоз и родственные им заболевания, такие как миелодиспластический синдром, острый миелолейкоз, хронический миелолейкоз, метастазирующая меланома, саркома Капоша и множественная миелома.
Инфекционные заболевания, опосредуемые IL-1 или апоптозом, которые можно лечить или предотвращать, включают, но не ограничиваются этим, сепсис, септический шок и шигеллез.
Дегенеративные или некротические заболевания, опосредуемые IL-1 или апоптозом, которые можно лечить или предотвращать с помощью соединений настоящего изобретения, включают, но не ограничиваются этим, болезнь Альцгеймера, болезнь Паркинсона, ишемию головного мозга и ишемию миокарда. Предпочтительно дегенеративным заболеванием является болезнь Альцгеймера.
Дегенеративные заболевания, опосредуемые IL-1 или апоптозом, которые можно лечить или предотвращать с помощью соединений настоящего изобретения, включают, но не ограничиваются этим, болезнь Альцгеймера, болезнь Паркинсона, ишемию головного мозга, ишемию миокарда, атрофию спинальных мышц, множественный склероз, энцефалит, связанный со СПИДом, энцефалит, связанный с ВИЧ, старение, облысение и нейрологические нарушения, связанные с кровоизлиянием в мозг.
С помощью соединений настоящего изобретения можно лечить или предотвращать другие заболевания, имеющие воспалительный или апоптотический компонент. Такие заболевания могут быть системными болезнями или заболеваниями, сосредоточенными в печени или других органах, и они могут быть вызваны, например, избыточным поступлением спирта с пищей или вирусами, такими как HBV, HCV, HGV, вирус желтой лихорадки, вирус лихорадки денге и вирус японского энцефалита.
Заболевания, опосредуемые IGIF или INF-γ, которые можно лечить или предотвращать с помощью соединений настоящего изобретения, включают, но не ограничиваются этим, воспалительные, инфекционные, аутоиммунные, пролиферативные, нейродегенеративные и некротические состояния.
Воспалительные заболевания, опосредуемые IGIF или INF-γ, которые можно лечить или предотвращать, включают, но не ограничиваются этим, остеоартрит, острый панкреатит, хронический панкреатит, астму, ревматоидный артрит, воспалительное заболевание кишечника, болезнь Крона, язвенный колит, ишемию головного мозга, ишемию миокарда и синдром респираторного дистресса взрослых. Предпочтительно воспалительным заболеванием является ревматоидный артрит, язвенный колит, болезнь Крона, гепатит или синдром респираторного дистресса взрослых.
Инфекционные заболевания, опосредуемые IGIF или INF-γ, которые можно лечить или предотвращать включают, но не ограничиваются этим, инфекционный гепатит, сепсис, септический шок и шигеллез.
Аутоиммунные заболевания, опосредуемые IGIF или INF-γ, которые можно лечить или предотвращать включают, но не ограничиваются этим, гломерулонефрит, системную красную волчанку, склеродерму, хронический тиреоидит, болезнь Грейвса, аутоиммунный гастрит, инсулин-зависимый сахарный диабет (тип I), диабет молодых, аутоиммунную гемолитическую анемию, аутоиммунную нейтропению, тромбоцитопению, псевдопаралитическую миастению, множественный склероз, псориаз, плоский лишай, реакцию трансплантанта против хозяина, острый дерматомиозит, экзему, первичный цирроз, гепатит, увеит, болезнь Бехчета, атрофическое заболевание кожи, аплазию беспримесных красных клеток, апластическую анемию, амиотрофический латеральный склероз и нефротический синдром. Предпочтительно аутоиммунным заболеванием является гломерулонефрит, инсулин-зависимый сахарный диабет (тип I), диабет молодых, псориаз, реакция трансплантанта против хозяина или гепатит.
Более предпочтительные заболевания, которые можно лечить или предотвращать, включают ревматоидный артрит, воспалительное заболевание кишечника, включая болезнь Крона и язвенный колит, воспалительный перитонит, септический шок, панкреатит, травматическое повреждение мозга, отторжение трансплантируемых органов, остеоартрит, астму, псориаз, болезнь Альцгеймера, атрофический дерматит или лейкоз и родственные им заболевания, такие как миелодиспластический синдром или множественная миелома.
Соответственно, в одном осуществлении настоящего изобретения предлагается способ лечения или профилактики заболеваний, опосредованных IL-1 или апоптозом, у субъекта, включающий стадию введения этому субъекту любого соединения, фармацевтической композиции или комбинации, описанных здесь, и фармацевтически приемлемый носитель.
В другом осуществлении настоящего изобретения предлагается способ снижения продукции IGIF у субъекта, включающий стадию введения этому субъекту любого соединения, фармацевтической композиции или комбинации, описанных здесь, и фармацевтически приемлемый носитель.
В еще одном осуществлении настоящего изобретения предлагается способ снижения продукции IFN-γ у субъекта, включающий стадию введения этому субъекту любого соединения, фармацевтической композиции или комбинации, описанных здесь, и фармацевтически приемлемый носитель.
Хотя данное изобретение сфокусировано на применении раскрытых здесь соединений для профилактики и лечения заболеваний, опосредованных IL-1, апоптозом, IGIF или IFN-γ, соединения настоящего изобретения могут также служить в качестве агентов ингибирования активности других цистеиновых протеаз.
Соединения настоящего изобретения полезны также в качестве коммерческих реагентов, которые эффективно связываются с каспазами или другими цистеиновыми протеазами, включая, но не ограничиваясь этим, ICE. В качестве коммерческих реагентов соединения настоящего изобретения и их производные могут быть полезны для ингибирования протеолиза пептидов-мишеней в биологических или клеточных тестах для ICE или гомологов ICE, или можно создать их производное для связывания со стабильной смолой в качестве привязанного субстрата для применения при аффинной хроматографии. Это и другие применения, которые характеризуют коммерческие ингибиторы цистеиновых протеаз, должны быть очевидны специалистам в данной области.
Последующие примеры представлены для того, чтобы это изобретение было более полно понято. Данные примеры представлены только в качестве иллюстрации и не истолковываются как каким-либо образом ограничивающие объем изобретения.
Общие методы
Условия аналитической ВЭЖХ:
Колонка: С-18, размер частиц: 5 мкм, размер пор: 100 Å
Размер колонки: 4,6×150 мм
Растворитель А: 0,1% TFA/1% MeCN/98,9% вода
Растворитель В: 0,1% TFA/99,9% MeCN
Градиент: от А к В в течение 20 мин при скорости тока 1 мл/мин
Колонка: Cyano, размер частиц: 5 мкм, размер пор: 100 Å
Размер колонки: 4,6×150 мм
Растворитель А: 0,1% TFA/1% MeCN / 98,9% вода
Растворитель В: 0,1% TFA/99,9% MeCN
Градиент: А/В=99%/от 1% до 50%/50% в течение 20 мин при скорости тока 1 мл/мин
Масс-спектрометрический анализ, сопряженный с ВЭЖХ
Масс-спектрометрический анализ: все данные масс-спектрометрии получали, используя тройной квадрупольный масс-спектрометр Micromass Quattro II (Beverly, MA), снабженный источником ионизации в виде электроспрея с перекрестными пучками. Масс-спектрометр соединяли с системой ВЭЖХ производства Hewlett-Packard (HP1100). Автоматический пробоотборник для системы представлял собой манипулятор для жидкости Gilson 215 (Middleton, WI). Работа всего оборудования контролировалась пакетом программ MassLynx, полученным от Micromass.
Масс-спектрометрический анализ проводили с помощью жидкостной хроматографии-МС для определения чистоты и одновременного подтверждения молекулярной массой. В тех примерах, когда чистота образца была определена другим способом, вместо полного хроматографического анализа применяли анализ впрыскивания струи (FIA). Во всех случаях получали спектры как положительных, так и отрицательных ионов.
Условия получения масс-спектра: для всех экспериментов конфигурация масс-спектрометра включала электроспрей с противоэлектродом перекрестных пучков. Для снижения потока с ВЭЖХ до 40% от исходного применяли разбавитель потока. На входе устанавливали температуру 140°С и поток высуживающего газа устанавливали для доведения сигнала до максимума. Разрешение масс-спектрометра доводили до 0,65 amu FWHM и данные получали способом простого суммирования. В способе для положительных ионов устанавливали конусное напряжение 25 В, капиллярное напряжение было 3,8 кВ. В способе для отрицательных ионов устанавливали конусное напряжение 25 В и капиллярное напряжение было 3,5 кВ. В способах как для положительных, так и для отрицательных ионов время для получения полного спектра составляло 1 сек с временем переключения между сканированиями 0,25 сек. Диапазон массы, сканированной для молекул с предполагаемым молекулярной массой менее чем 350 amu, составлял 70-500 m/z, в то время как для молекул с предполагаемым молекулярной массой более чем 350 amu сканированное отношение массы к заряду составляло 200-1000 m/z.
Условия хроматографирования: жидкостную хроматографию проводили с применением колонки YMC AQ C18 (150 мм×3 мм с частицами 5 мкм и размером пор 120 Å). Для всех анализов для образования градиента элюции MeCN с 0,2% муравьиной кислотой смешивали с водой с 0,2% муравьиной кислотой. Градиентный профиль состоял исходно из 15% MeCN-воды и количество MeCN увеличивали линейно в течение 10 минут до 90%. Эту концентрацию поддерживали постоянной в течение 2 минут перед возвращением к исходным условиям. В течение всего анализа скорость потока составляла 0,9 мл/мин.
Условия впрыскивания струи: для получения данных FIA применяли смесь 1:1 воды к MeCN (обе с добавлением 3,2% муравьиной кислоты). Скорость потока составляла 0,3 мл/мин.
1H-ЯМР
Все 1H-ЯМР-спектры получали применяя ЯМР-спектрометра Bruker Instruments AMX-500 в данных растворителях.
Способы синтеза
Общая процедура получения соединений формулы I, осуществление С (схемы I-VI)
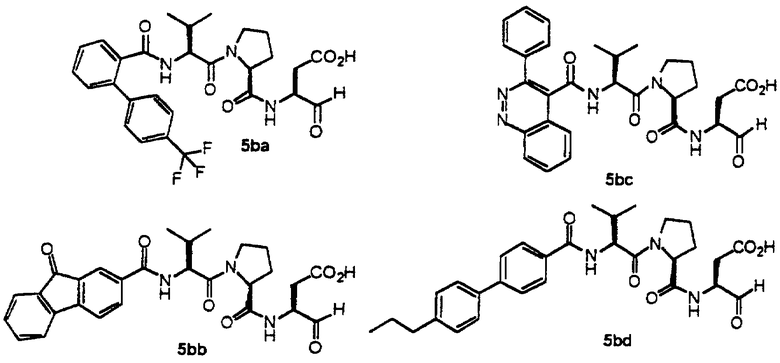
Процедура для получения аналогов 5a-5bd.
Схема I
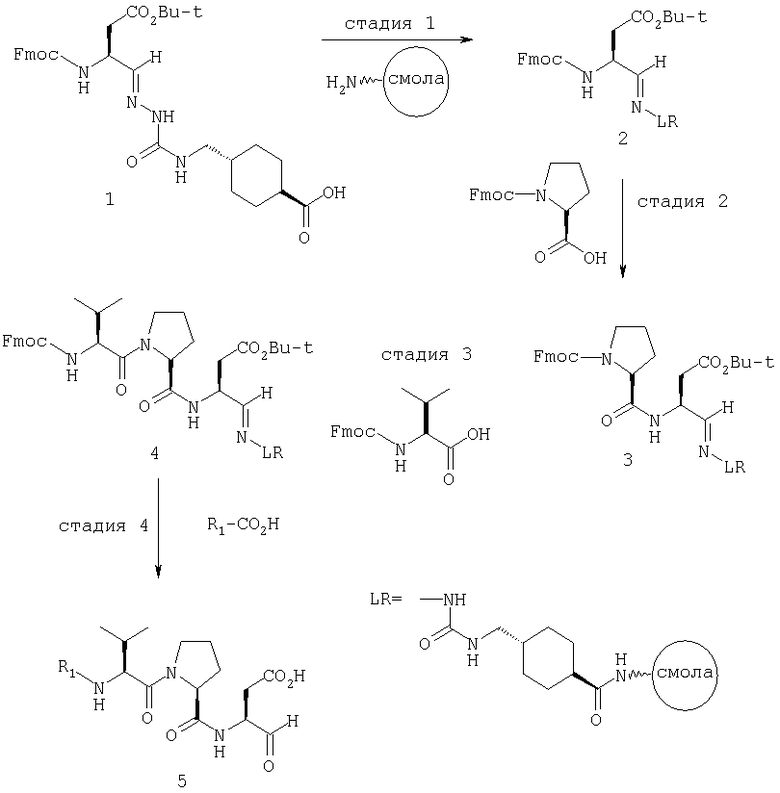
В схемах I-VIII вариабельный LR относится к линкеру смолы и определен, как показано выше в схеме I.
Стадия 1: порцию 6,7 г (нагрузка 0,8 ммоль/г, 5,36 ммоль) смолы солянокислой соли 4-метилбензгидриламина (схема I) промывали DMF (3×50 мл), 10% DIEA/DMF (3×50 мл) и N-метилпирролидинона (NMP) (3×50 мл). К суспензии отмытой смолы в 25 мл NMP добавляли последовательно соединение 1 (1,1 экв., 3,5 г, 5,90 ммоль) DIEA (3,33 экв., 3,1 мл, 17,70 ммоль), 1-гидроксибензотриазола гидрат (HOBt) (1,1 экв., 797 мг, 5,90 ммоль) и О-бензотриазол-N,N,N,N'-тетраметилурония гексафторфосфат (HBTU) (1,1 экв., 2,24 г, 5,90 ммоль). Соединение 1 получали в соответствии с литературной процедурой А.M.Murphy et al., J.Am. Chem. Soc., 114, pp.5156-3157 (1992). Смесь перемешивали при комнатной температуре в течение ночи, применяя шарнирный шейкер.
Результирующую смесь фильтровали и смолу промывали DMF, затем обрабатывали 12 мл 20% раствора уксусного ангидрида в DMF в течение 30 минут при комнатной температуре. Смесь фильтровали и смолу промывали последовательно DMF (2×50 мл), СН3ОН (50 мл), 1:1 DMF/CH2Cl2 (2×50 мл), СН3ОН (50 мл) и СН2Cl2 (3×50 мл). После высушивания под вакуумом получали 9,0 г смолы 2 (нагрузка 0,48 ммоль/г).
Стадия 2: к 4,5 г смолы 2 (0,48 ммоль/г, 2,16 ммоль) добавляли 25 мл 20% раствора пиперидина в DMF. Суспензию перемешивали вращением при комнатной температуре в течение 5 минут и сушили. Процедуру повторяли в течение 20 минут. Смолу затем промывали последовательно DMF (2×40 мл), CH3ОН (40 мл), СН2Cl2 (2×40 мл), СН3ОН (40 мл) и NMP (40 мл). К супензии смолы в 40 мл NMP добавляли последовательно 2,92 г N-Fmoc-пролина (4 экв., 8,64 ммоль), 3,0 мл DIEA (8 экв., 17,28 ммоль), 1,17 г HOBt (4 экв., 8,64 ммоль) и 3,27 г HBTU (4 экв., 8,64 ммоль). Смесь перемешивали вращением при комнатной температуре в течение ночи и сушили. Эту процедуру присединения повторяли в течение 3 часов. Смолу затем промывали последовательно DMF (2×40 мл), СН3ОН (40 мл), 1:1 DMF/CH2Cl2 (2×40 мл), СН3ОН (40 мл) и CH2Cl2 (3×40 мл) и быстро сушили под вакуумом для получения смолы 3.
Стадия 3: суспензию смолы 3 в 25 мл 20% раствора пиперидина в DMF перемешивали вращением при комнатной температуре в течение 5 мин. Суспензию сушили. Процедуру повторяли в течение 20 минут. Смолу промывали последовательно DMF (2×40 мл), СН3ОН (40 мл), СН2Cl2 (2×40 мл), СН3ОН (40 мл) и NMP (2×40 мл). К суспензии смолы в 40 мл NMP добавляли последовательно 2,93 г N-Fmoc-валина (4 экв., 8,64 ммоль), 3,0 мл DIEA (8 экв., 17,28 ммоль), 1,17 г HOBt (4 экз., 3,64 ммоль) и 3,27 г HBTU (4 экв., 8,64 ммоль). Смесь перемешивали вращением при комнатной температуре в течение ночи и сушили. Эту процедуру присоединения повторяли в течение 3 часов. Смолу затем промывали последовательно DMF (2×40 мл), СН3ОН (40 мл), 1:1 DMF/CH2Cl2 (2×40 мл), СН3ОН (40 мл) и CH2Cl2 (3×40 мл) и сушили под вакуумом для получения смолы 4 (0,45 ммоль/г).
Стадия 4: к 0,05 ммоль порции смолы 4 добавляли 2 мл 20% раствора пиперидина в DMF. Суспензию перемешивали вращением при комнатной температуре в течение 5 минут и сушили. Процедуру повторяли в течение 20 минут. Полученную смолу промывали последовательно DMF (3×5 мл), СН3ОН (5 мл) и NMP (3×5 мл). Затем добавляли желаемую карбоновую кислоту (4 экв., 02 ммоль), с последующим добавлением 0,8 мл 0,25 М раствора HOBt в NMP, 0,14 мл DIEA (8 экв., 0,4 ммоль) и 0,8 мл 0,25 М раствора HBTU в NMP. Смесь перемешивали вращением при комнатной температуре в течение ночи и сушили. Смолу промывали последовательно DMF (2×5 мл), СН3ОН (5 мл), 1:1 DMF/ CH2Cl2 (2×5 мл), СН3ОН (5 мл) и CH2Cl2 (3×5 мл) и сушили под вакуумом. Затем к смоле добавляли 2 мл порцию 95% раствора TFA в воде. Смесь перемешивали при комнатной температуре в течение одного часа и фильтровали. Фильтрат выпаривали и остаток переносили в ацетонитрил-воду и очищали препаративной ВЭЖХ для получения соединений 5a-5bd.
Выход продукта, условия аналитической ВЭЖХ, время удерживания ВЭЖХ, чистота продуктов и данные масс-спектрометрии, полученные для примеров 5a-5bd, 7a-7at, 9а-9g, 15а-15f, 16a-16b, 17a-17e, 18a-18f, 20a-20t, 23a-23i, 24a-24e, 25a-25e, 26a-26h, 27a-27n, 28a-28c, 29a-29s, 32a-32e представлены в таблице 1, если не отмечено иначе.
Градиент/ время (мин)
(М+Н или M+Na)
60%-90%/2'
60%-90%/2'
60%-90%/2'
60%-90%/2'
60%-90%/2'
60%-90%/2'
60%-90%/2'
60%-90%/2'
60%-90%/2'
60%-90%/2'
60%-90%/2'
60%-90%/2'
60%-90%/2'
60%-90%/2'
60%-90%/2'
Процедура получения аналогов 7a-7at.
Схема II
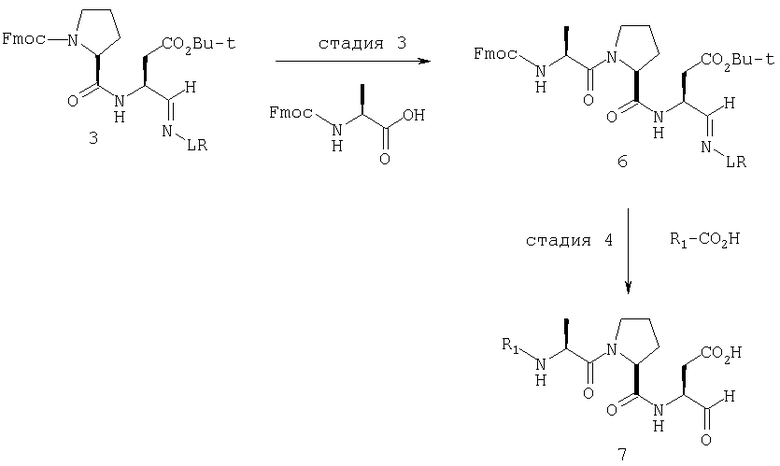
Аналоги 7a-7at получали, как описано выше в схеме I, замещая только Fmoc-валин на Fmoc-аланин на стадии 3 (схема II).
Стадия 3: суспензию смолы 3 (3,5 г, 1,75 ммоль) в 20 мл 20% раствора пиперидина в DMF перемешивали вращением при комнатной температуре в течение 5 мин. Суспензию сушили. Процедуру повторяли в течение 20 минут. Смолу промывали последовательно DMF (2×30 мл), СН3ОН (30 мл), СН2Cl2 (2×30 мл), СН3ОН (30 мл) и NMP (2×30 мл). К суспензии смолы в 30 мл NMP добавляли последовательно 1,44 г N-Fmoc-аланина (4 экв., 7,0 ммоль), 2,4 мл DIEA (8 экв., 14,0 ммоль), 0,95 г HOBt (4 экв., 7,0 ммоль) и 2,66 г HBTU (4 экв., 7,0 ммоль). Смесь перемешивали вращением при комнатной температуре в течение ночи и сушили. Эту процедуру присоединения повторяли в течение 3 часов. Смолу затем промывали последовательно DMF (2×30 мл), СН3ОН (30 мл), 1:1 DMF/CH2Cl2 (2×30 мл), СН3ОН (30 мл) и CH2Cl2 (3×30 мл) и сушили под вакуумом для получения смолы 6 (0,50 ммоль/г).
Стадия 4: к 0,125 ммоль порции смолы 6 добавляли 5 мл 20% раствора пиперидина в DMF. Суспензию перемешивали вращением при комнатной температуре в течение 5 минут и сушили. Процедуру повторяли в течение 20 минут. Полученную смолу промывали последовательно DMF (3×5 мл), СН3ОН (5 мл) и NMP (3×5 мл). Затем добавляли желаемую карбоновую кислоту (4 экв., 0,6 ммоль) с последующим добавлением 2,0 мл 0,25 М раствора HOBt в NMP, 0,35 мл DIEA (8 экв., 1,0 ммоль) и 2,0 мл 0,25 М раствора HBTU в NMP. Смесь перемешивали вращением при комнатной температуре в течение ночи и сушили. Смолу промывали последовательно DMF (3×5 мл), СН3ОН (5 мл), 1:1 DMF/CH2Cl2 (2×5 мл), СН3ОН (5 мл) и CH2Cl2 (3×5 мл) и сушили под вакуумом. Затем к смоле добавляли 5 мл порцию 95% раствора TFA в воде. Смесь перемешивали при комнатной температуре в течение одного часа и фильтровали. Фильтрат выпаривали и остаток растворяли в ацетонитрил-воде и очищали препаративной ВЭЖХ для получения соединений 7a-7at.
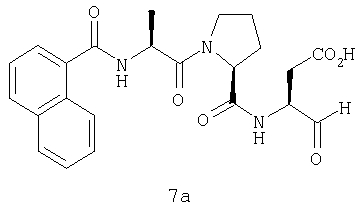
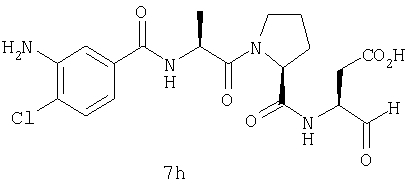
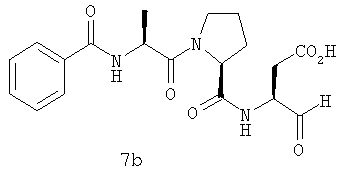
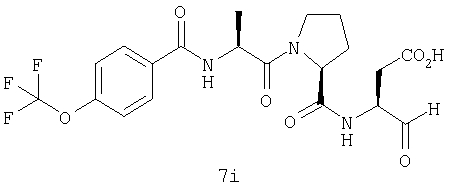
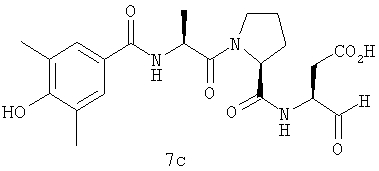
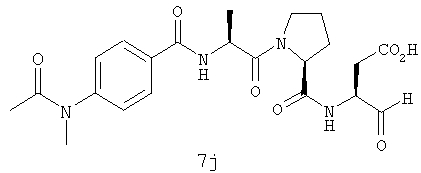
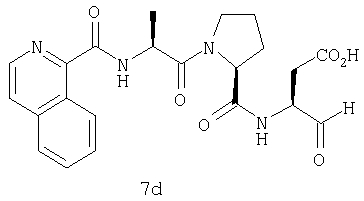
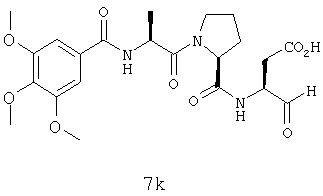
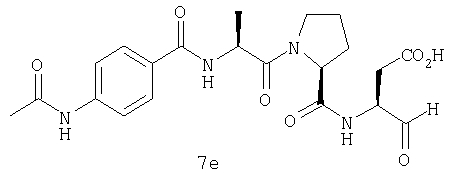
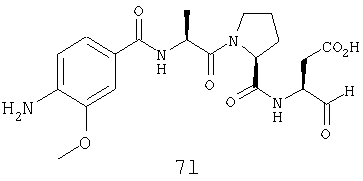
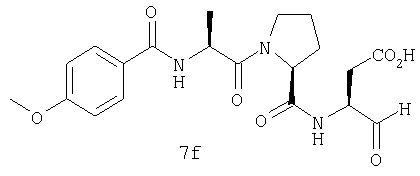
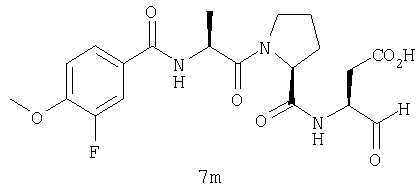
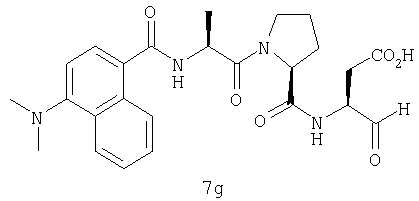
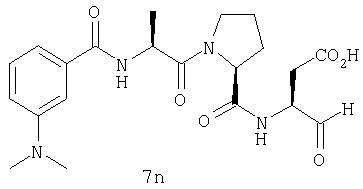
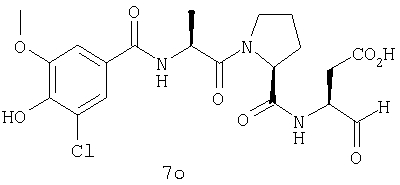
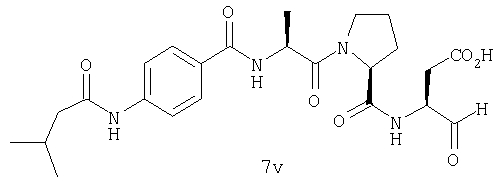
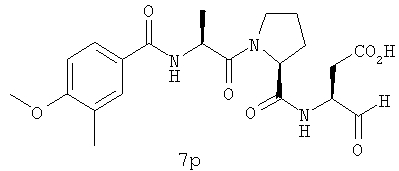
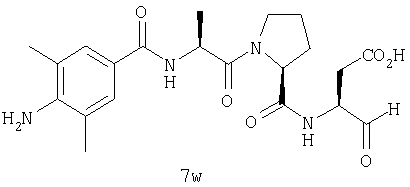
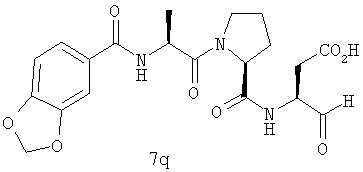
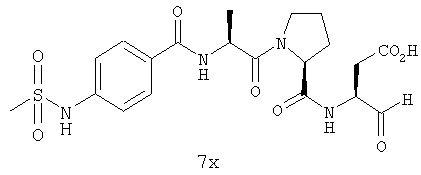
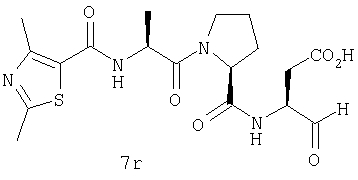
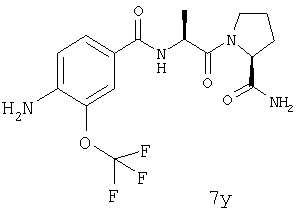
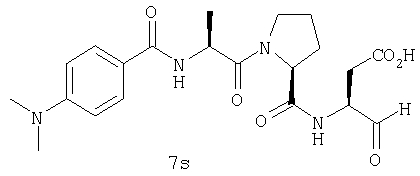
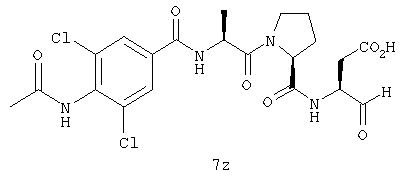
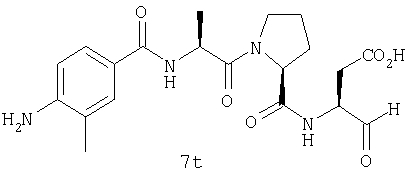
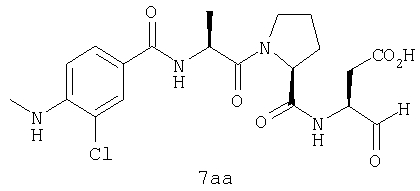
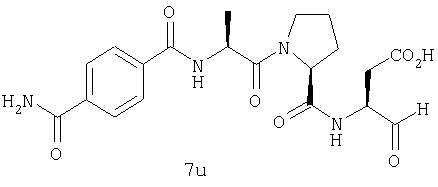
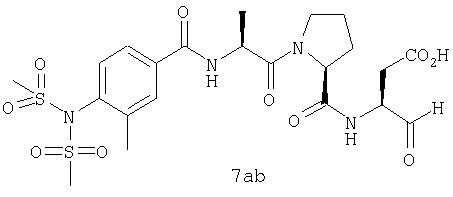
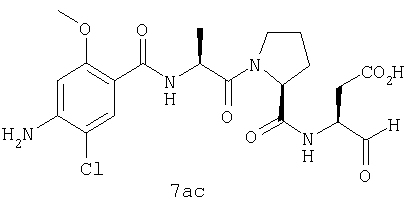
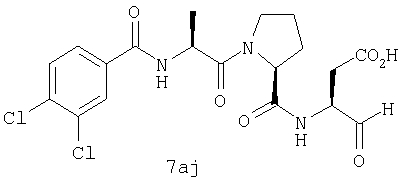
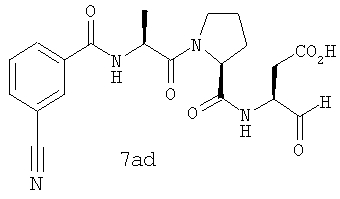
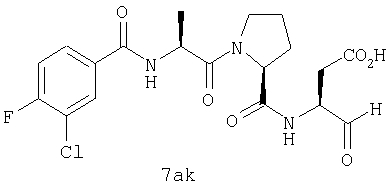
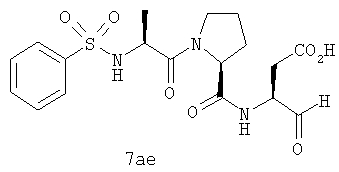
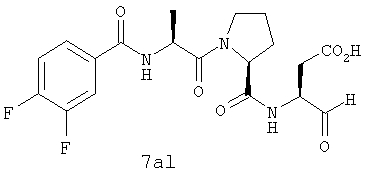
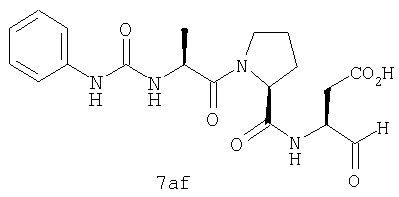
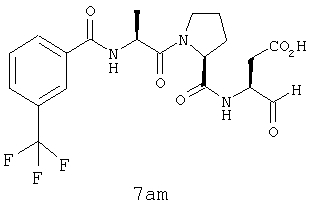
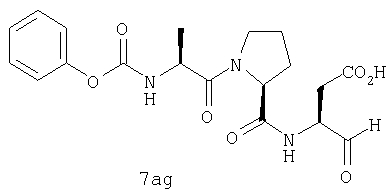
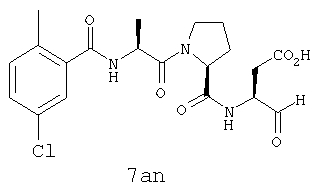
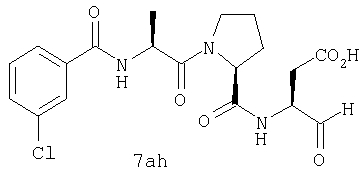
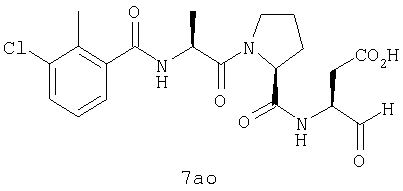
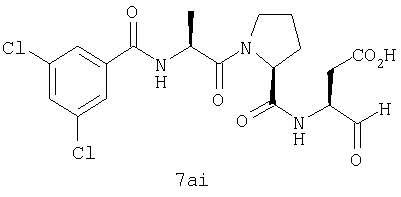
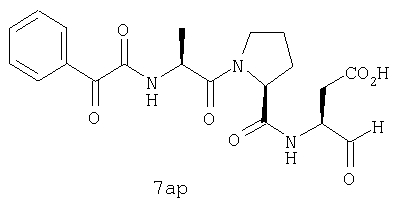
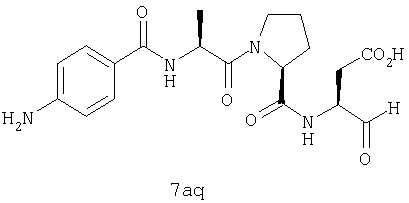
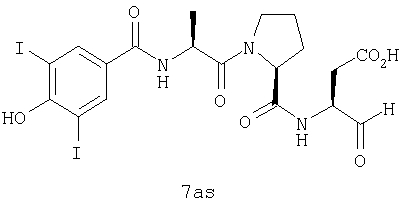
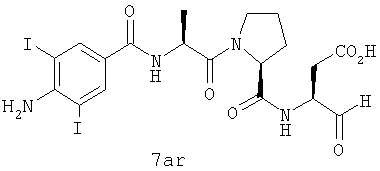
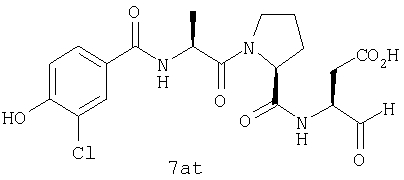
Процедура получения аналогов 9а-9g.
Схема III
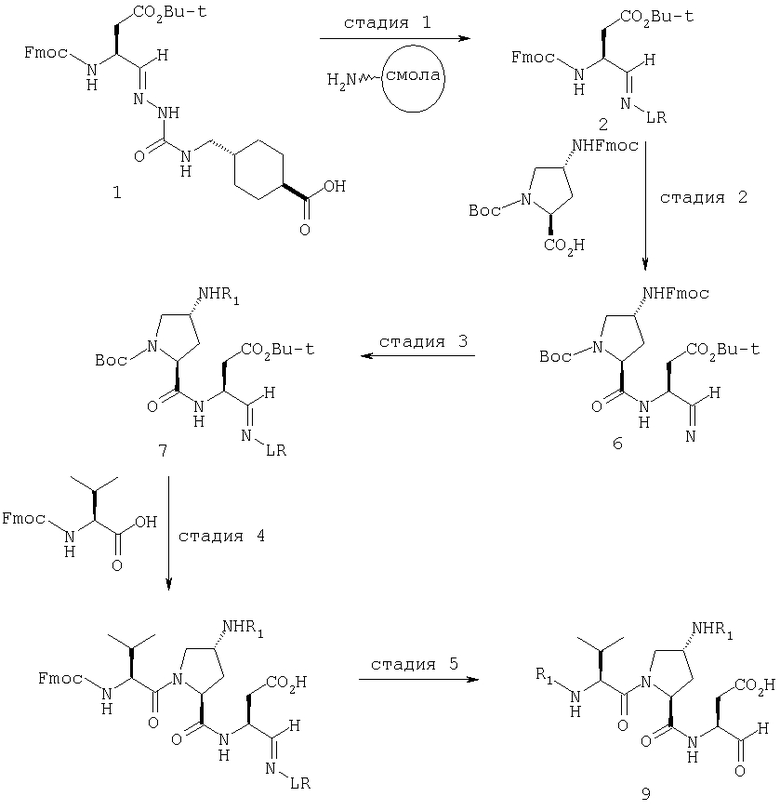
Стадия 1: порцию 10,0 г (нагрузка 0,75 ммоль/г, 7,5 ммоль) смолы AgroPore-аминометил (каталожный номер 800047) промывали DMF (3×40 мл), 10% DIEA/DMF (3×40 мл), DMF NMP и (3×40 мл). К указанной выше смоле добавляли последовательно соединение 1 (0,87 экв., 3,88 г, 6,55 ммоль), HBTU (1,14 экв., 3,13 г, 8,25 ммоль), HOBt (1,14 экв., 1,26 г, 8,25 ммоль) и NMP (40 мл). Реагенты затем смешивали с помощью пробулькивания азота через дно колбы в течение двух минут при комнатной температуре. Добавляли N,N-диизопропилэтиламин (3,33 экв., 4,35 мл, 25 ммоль) и полученную суспензию перемешивали при комнатной температуре в течение ночи, фильтровали, затем промывали последовательно NMP (3×40 мл) и DMF (3×40 мл). Смолу затем обрабатывали 50 мл 20% раствора уксусного ангидрида в DMF в течение 38 минут при комнатной температуре. Смесь фильтровали и последовательно промывали NMP (3×40 мл), СН2Cl2 (3×40 мл), 1:1 СН3ОН/CH2Cl2 (3×40 мл) и СН3ОН (3×40 мл). После высушивания под вакуумом получали 13,76 г смолы 2 (нагрузка 0,35 ммоль/г).
Стадия 2: семь реакционных сосудов, каждый нагружали 181 мг смолы 2 (0,48 ммоль/г, 0,063 ммоль), затем промывали CH2Cl2 (3×1 мл) и NMP (3×1 мл). Затем каждый сосуд обрабатывали 1 мл 25% раствора пиперидина в DMF и перемешивали (вортекс) при комнатной температуре в течение 15 минут. Эту процедуру повторяли трижды. Каждый сосуд затем промывали три раза NMP (3×1 мл). Сосуды затем обрабатывали 500 мкл раствора 0,4 М (2S,4R)-Fmoc-4-амино-1-Вос-пирролидин-2-карбоновой кислоты /0,4 М HOBt/ NMP, 500 мкл раствора 0,4 М HBTU/NMP и 250 мкл раствора 1,6 DIEA/ NMP и перемешивали в течение 3 часов при комнатной температуре. После перемешивания сосуды сушили и процедуру повторяли.
Стадия 3: полученную смолу промывали NMP (3×1 мл) и затем обрабатывали 1 мл 25% раствора пиперидина в DMF и перемешивали (вортекс) при комнатной температуре в течение 15 минут. Полученную смолу промывали NMP (3×1 мл), затем обрабатывали либо уксусным ангидридом, либо изопропилизоцианатом, либо хлористым метансульфонилом, либо метилхлорформатом. В случае уксусного ангидрида добавляли 300 мкл раствора 1,6 М DIEA/ NMP и 1 мл раствора 0,5 М уксусного ангидрида/0,125 М DIEA/ 0,015 М HOBt в NMP. В случае изопропилизоцианата добавляли 300 мкл раствора 1,6 М DIEA/ NMP и 1 мл раствора 1 М изопропилизоцианата в NMP. В случае хлористого метансульфонила добавляли 600 мкл раствора 1 М пиридина в CH2Cl2 и 600 мкл 1 М раствора хлористого метансульфонила в СН2Cl2. В случае метилхлорформата добавляли 500 мкл раствора 1,6 М DIEA/ NMP и 1 мл раствора 0,7 М метилхлорформата в CH2Cl2. Полученные суспензии перемешивали в течение 6 часов при комнатной температуре, растворитель выпаривали и процедуру присоединения повторяли.
Стадия 4: полученную смолу промывали NMP (3×1 мл), затем обрабатывали смесью 1:1 TFA/CH2Cl2 при комнатной температуре в течение 30 минут. Полученную смолу затем промывали СН2Cl2 (3×1 мл) и NMP (3×1 мл). Смолу затем обрабатывали 500 мкл раствора 0,4 М Fmoc-валин-карбоновой кислоты/ 0,4 М HOBt/ NMP, 500 мкл раствора 0,4 М HBTU/ NMP и 250 мкл раствора 1,6 М DIEA/ NMP и перемешивали в течение 3 часов при комнатной температуре. После перемешивания сосуды высушивали и процедуру присоединения повторяли.
Стадия 5: полученную смолу промывали NMP (3×1 мл), затем обрабатывали 1 мл 25% раствора пиперидина в DMF и перемешивали (вортекс) при комнатной температуре в течение 15 минут. Эту процедуру повторяли трижды. Полученную смолу промывали NMP (3×1 мл), затем обрабатывали 500 мкл раствора 0,4 М 1-изохинолинкарбоновой кислоты/ 0,4 М HOBt/ NMP или 500 мкл раствора 0,4 М пара-анисовой кислоты/ 0,4 М HOBt/ NMP. Полученные смеси обрабатывали 500 мкл раствора 0,4 М HBTU/ NMP и 250 мкл раствора 1,6 М DIEA/ NMP, затем перемешивали в течение 3 часов при комнатной температуре, растворитель упаривали и процедуру повторяли. Полученную смолу обрабатывали 1,5 мл 95% раствора TFA в воде и перемешивали при комнатной температуре в течение одного часа, затем фильтровали. Фильтрат упаривали и остаток переносили в смесь 2:1:2 DMF/ ацетонитрил/ вода и очищали препаративной ВЭЖХ для получения соединений 9а-9g.
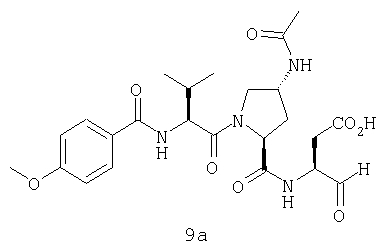
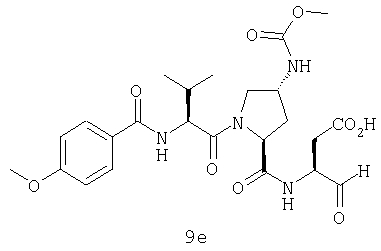
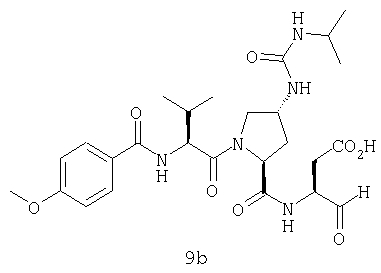
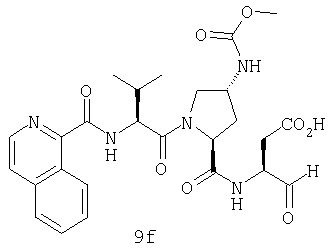
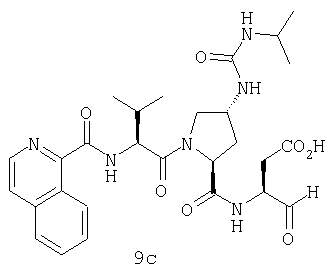
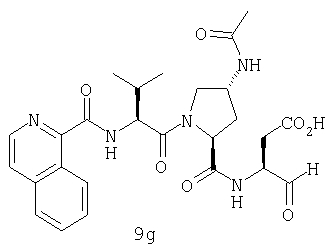
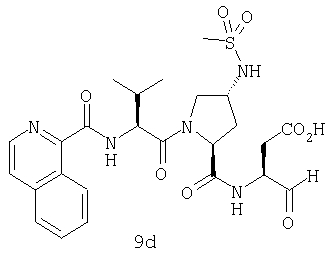
Процедура синтеза аналогов 15-18
Схема IV
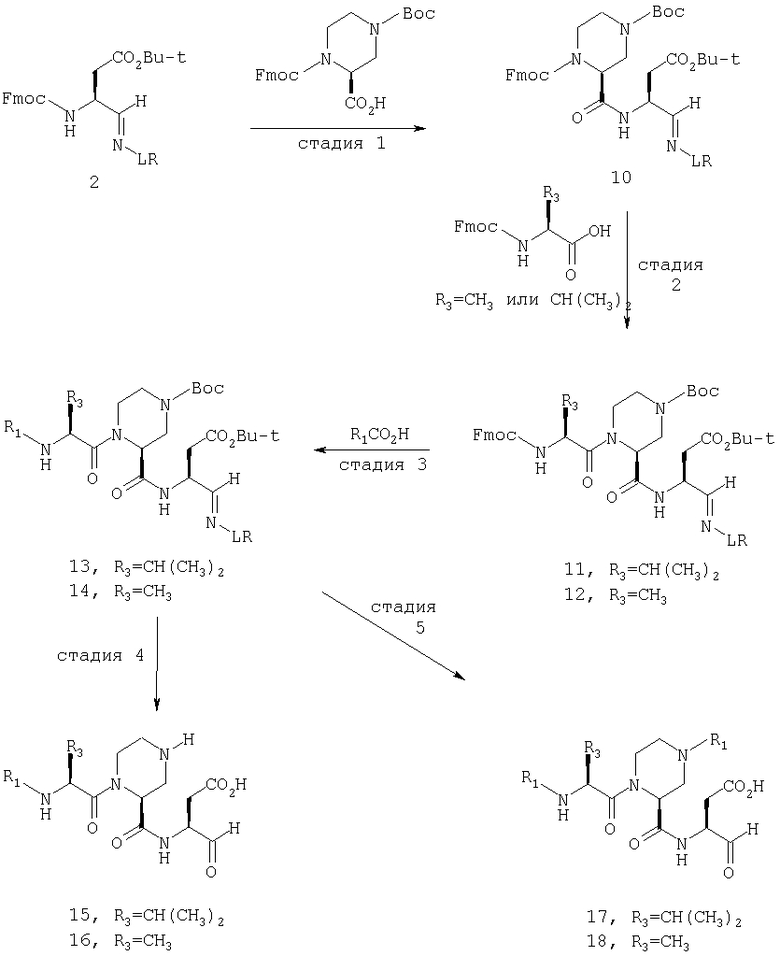
Получение аналогов 15 и 16 (схема IV)
Синтез 1-(9Н-фтор-9-илметил) эфира 4-трет-бутилового эфира 2-(S)-пиперазин-1,2,4-трикарбоновой кислоты.
К раствору 2-(S)-пиперазинкарбоновой кислоты (Lonza) (3 г, 15 моль) в 1:1 H2O: диоксан (30 мл) добавляли раствор (Вос)2О в диоксане (3,3 г, 15 ммоль, в 5 мл диоксана), при поддержании рН 11 с помощью 1 н. NaOH. pH поддерживали в течение 3 часов при комнатной температуре. Раствор доводили до рН 9,5 1 н. HCl, охлаждали до 0°С и обрабатывали Fmoc-Cl (3,87 г, 15 ммоль). рН поддерживали в районе 9,5 в течение 1 часа и смесь перемешивали при комнатной температуре в течение ночи. Полученную суспензию фильтровали и фильтрат обрабатывали 1 н. KHSO4 до рН 2, затем экстрагировали этилацетатом (2×75 мл). Органический слой сушили насыщенным солевым раствором и MgSO4, фильтровали и концентрировали для получения бесцветного масла. Масло растворяли в этилацетате и добавляли к гексану для получения 3,5 г (выход 51%) белого твердого вещества после выделения. 1H-ЯМР (500 МГц, ДМСО-d6) δ 1,55 (с, 9Н), 2,80-3,5 (м, 3Н), 3,8-4,9 (м, 5Н), 5,7 (уш., 1Н), 7,3 (м, 2Н), 7,3-7,9 м.д. (м, 8Н). ЖХ/МС (ES-): m/e 451,3 (М-Н).
Стадия 1: к 5 г смолы 2 (0,375 ммоль/г, 1,82 ммоль) добавляли 25 мл 20% раствора пиперидина в DMF. Суспензию перемешивали вращением при комнатной температуре в течение 5 минут и сушили. Процедуру повторяли в течение 20 минут. Смолу затем промывали последовательно DMF (2×50 мл), СН3ОН (50 мл), СН2Cl2 (2×50 мл), СН3ОН (50 мл) и NMP (50 мл). К суспензии смолы в 25 мл NMP добавляли последовательно 3,5 г N-Fmoc-Boc-пиперазинкарбоновой кислоты (4 экв., 7,48 ммоль), 1,0 мл DIEA (8 экв., 14,96 ммоль), 1,01 г HOBt (4 экв., 7,48 ммоль) и 2,83 г HBTU (4 экв., 7,48 ммоль). Смесь перемешивали вращением при комнатной температуре в течение ночи и сушили. Эту процедуру присоединения повторяли в течение 3 часов. Смолу затем промывали последовательно DMF (2×50 мл), СН3ОН (50 мл), 1:1 DMF/СН2Cl2 (2×50 мл), СН3ОН (1×50 мл) и СН2Cl2 (3×50 мл) и быстро сушили под вакуумом для получения смолы 10.
Стадия 2: к 5 г смолы 10 (загрузка 0,335 ммоль/г, 1,675 ммоль) добавляли 25 мл 20% раствора пиперидина в DMF. Суспензию перемешивали вращением при комнатной температуре в течение 5 минут и сушили. Процедуру повторяли в течение 20 минут. Смолу затем промывали последовательно DMF (2×50 мл), СН3ОН (50 мл), СН2Cl2 (2×50 мл), СН3ОН (50 мл) и NMP (2×50 мл). К суспензии смолы в 25 мл NMP добавляли последовательно 2,08 г N-Fmoc-валина или N-Fmoc-аланина (4 экв., 6,7 ммоль), 1,17 мл DIEA (4 экв., 6,7 ммоль), 0,905 г HOBt (4 экв., 6,7 ммоль) и 1,38 г HBTU (4 экв., 3,66 ммоль). Смесь перемешивали вращением при комнатной температуре в течение ночи и сушили. Эту процедуру присоединения повторяли в течение 3 часов. Смолу затем промывали последовательно DMF (2×50 мл), СН3ОН (50 мл), 1:1 DMF/CH2Cl2 (2×50 мл), СН3ОН (50 мл) и СН2Cl2 (3×50 мл) и сушили под вакуумом для получения смолы 11 или 12, соответственно (0,35 ммоль/г, 5 г).
Стадия 3: к порции 1,5 г (0,165 ммоль) смолы 11 или 12 добавляли 2 мл 20% раствора пиперидина в DMF. Суспензию перемешивали вращением при комнатной температуре в течение 5 минут и сушили. Процедуру повторяли в течение 20 минут. Полученную смолу промывали последовательно DMF (3×15 мл), СН3ОН (15 мл) и NMP (3×15 мл). Затем добавляли желаемую карбоновую кислоту (4 экв., 0,66 ммоль), затем 0,25 г HOBt (0,66 ммоль), 0,12 мл DIEA (4 экв., 0,66 ммоль) и 0,89 г (0,66 ммоль) HBTU в NMP. Смесь перемешивали вращением при комнатной температуре в течение ночи и сушили. Смолу промывали последовательно DMF (2×15 мл), СН3ОН (15 мл), 1:1 DMF/CH2Cl2 (2×15 мл), СН3ОН (15 мл) и CH2Cl2 (3×15 мл) и сушили под вакуумом для получения смолы 13 или 14.
Стадия 4: к смоле затем добавляли 2 мл порцию 95% раствора TFA в воде. Смесь перемешивали при комнатной температуре в течение одного часа и фильтровали. Фильтрат упаривали и остаток переносили ацетонитрил-воду и очищали препаративной ВЭЖХ для получения соединений 15 и 16.
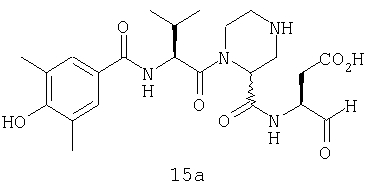
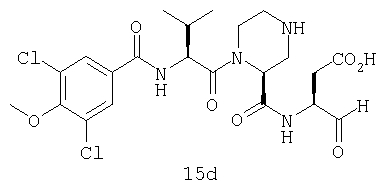
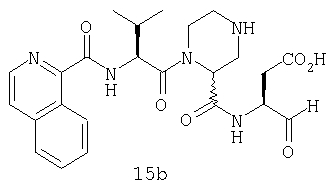
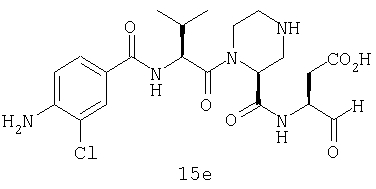
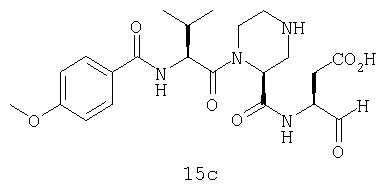
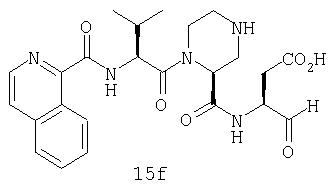
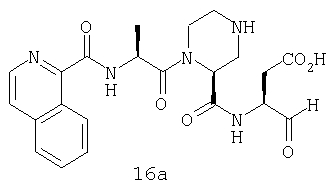
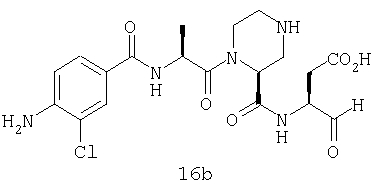
Процедура синтеза аналогов 17 и 18 (смотри схему IV)
Стадия 5: смолу 13 и 14 обрабатывали 2 мл 25% TFA/CH2Cl2 в течение 30 минут и промывали DMF (2×5 мл), 10% DIEA/CH2Cl2 (2×5 мл), DMF/CH2l2 (2×5 мл), СН3ОН (5 мл) и CH2Cl2 (3×5 мл) и сушили в течение 5 минут. Полученную смолу промывали NMP (3×1 мл), затем обрабатывали уксусным ангидридом или метоксиуксусной кислотой, или 2-пропансульфонилхлоридом, или изопропилизоцианатом, или хлористым метансульфонилом, или метилхлорформатом в соответствии с процедурой, применяемой для получения аналогов 9 (схема III). Соединения 17 и 18 получали, как описано на стадии 4 для соединений 15 и 16.
Соединения 17а и 17b получали восстановительным аминированием, применяя Na(ОАс)3ВН и НСНО (38% в воде, 0,2 мл) и СН3СООН (0,02 мл) перед стадией 4, и соединение 18е получали обработкой фосгеном, затем аммиаком перед стадией 4.
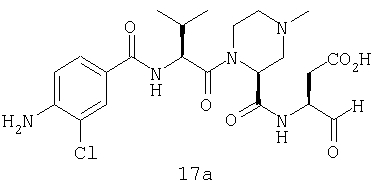
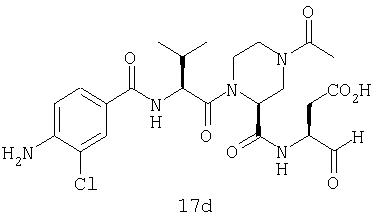
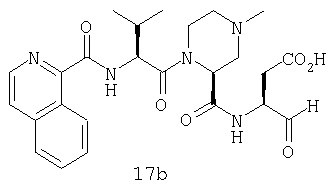
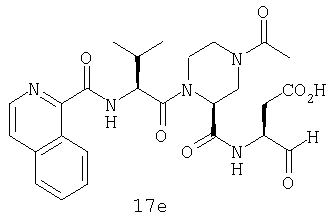
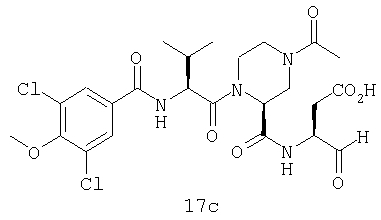
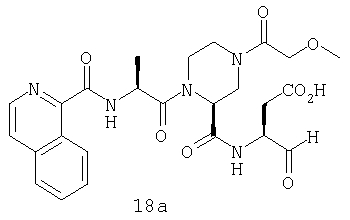
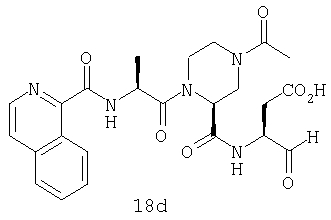
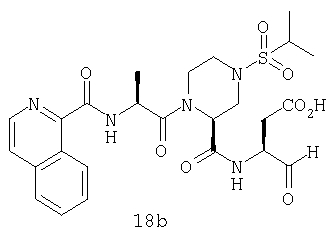
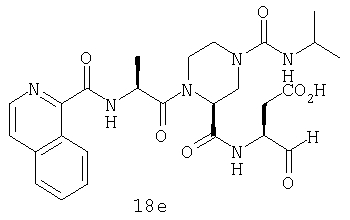
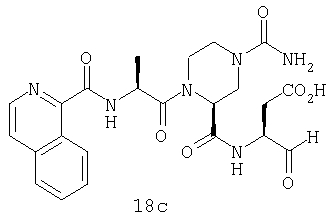
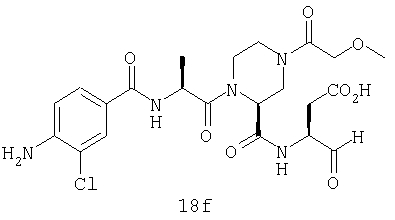
Процедура получения аналогов 20.
Соединения 20a-20t получали в соответствии с процедурой, описанной для соединений 5 (схема I), заменяя только Fmoc-валин на подходящую Fmoc-аминокислоту на стадии 3 (схема IV).
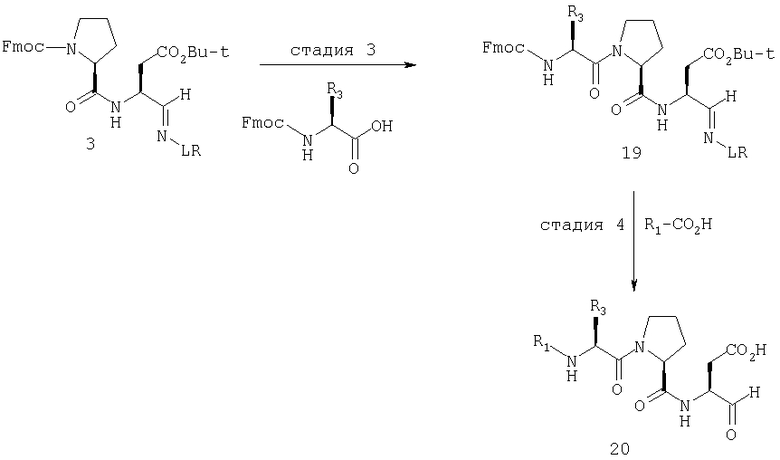
Получение 3-({1-[2-(4-амино-3-хлорбензоиламино)-3-метилсульфонилпропионил]-пирролидин-2-карбонил}амино-)-4-оксомасляной кислоты (20i).
Суспензию 0,132 ммоль смолы 3 в 4 мл 20% раствора пиперидина в DMF перемешивали вращением при комнатной температуре в течение 5 минут и смесь сушили. Процедуру повторяли в течение 20 минут. Смолу промывали последовательно DMF (дважды), СН3ОН (один раз), СН2Cl2 (дважды), СН3ОН (один раз) и NMP (дважды). К суспензии смолы в 4 мл NMP добавляли последовательно 189 мг N-Fmoc-метилцистеина (4 экв., 0,528 ммоль), 0,185 мл DIEA (8 экв., 1,056 ммоль), 71 мг HOBt (4 экв., 0,528 ммоль) и 200 мг HBTU (4 экв., 0,528 ммоль). Смесь перемешивали вращением при комнатной температуре в течение ночи и сушили. Эту процедуру присоединения повторяли в течение 3 часов. Смолу затем промывали последовательно DMF (дважды), СН3ОН (один раз) и 1:1 DMF/СН2Cl2 (дважды), СН3ОН (один раз) и СН2Cl2 (три раза) и сушили под вакуумом.
Суспензию 100 мг этой смолы в 2 мл 20% раствора пиперидина в DMF перемешивали вращением при комнатной температуре в течение 5 минут и сушили. Процедуру повторяли в течение 20 минут. Смолу промывали последовательно DMF (дважды), СН3ОН (один раз), СН2Cl2 (дважды), СН3ОН (один раз) и NMP (дважды). К суспензии смолы в 2 мл NMP добавляли последовательно 38 мг 4-амино-3-хлорбензойную кислоты (4 экв., 0,2 ммоль), 0,140 мл DIEA (8 экв., 0,4 ммоль), 27 мг HOBt (4 экв., 0,2 ммоль) и 76 мг HBTU (4 экв., 0,4 ммоль). Смесь перемешивали вращением при комнатной температуре в течение ночи и сушили. Смолу затем промывали последовательно DMF (дважды), СН3ОН (один раз) и 1:1 DMF/CH2Cl2 (дважды), СН3ОН (один раз) и CH2Cl2 (три раза) и сушили под вакуумом. Смолу затем обрабатывали 2 мл 95% TFA в воде в течение 1 часа. Суспензию фильтровали, фильтрат концентрировали под вакуумом и очищали препаративной ВЭЖХ для получения поименованного в заголовке соединения (20i).
Получение 3-({1-[2-(3,5-дихлор-4-гидроксибензоиламино)-4-метансульфонилбутирил]-пирролидин-2-карбонил}амино)-4-оксомасляной кислоты (20р).
Соединение 20р получали в соответствии с процедурой, применяемой для получения 20i, применяя Fmoc-метионин в качестве первого компонента, присоединенного к смоле 3, и 3,5-дихлор-4-гидроксибензойную кислоту в качестве второго компонента.
Получение 3-[(1-{2-[(изохинолин-1-карбонил)амино]-3-метансульфонилпропионил}-пирролидин-2-карбонил}амино]-4-оксомасляной кислоты (2r).
N-Fmoc-метилцистеин окисляли до соответствующего сульфона, применяя метод В.М.Trost and D.P.Curran, Tetrahedron Lett. 22, pp.1287-190 (1981). К раствору 0,714 г (2 ммоль) N-Fmoc-метилцистеина в 24 мл 1:1 раствора СН3ОН - вода, перемешиваемому при 0°С добавляли 3,68 г (3 экв., 6 ммоль) Oxone™. Смесь перемешивали при комнатной температуре в течение 48 часов, разводили водой, подкисляли до рН 2, применяя 6 н. HCl, и экстрагировали тремя 100 мл порциями этилацетата. Объединенные органические экстракты сушили (MgSO4) и концентрировали под вакуумом для получения 0,700 г (выход 89%) сульфона. 1H-ЯМР (ДМСО-d6, 500 МГц) δ 2,97 (с, 3Н), 3,49-3,59 (м, 2Н), 4,25 (м, 1Н), 4,30-4,38 (м, 2Н), 4,46 (м, 1Н), 7,33 (т, 2Н), 7,42 (т, 2Н), 7,70-8,00 (м, 4Н). Точная масса, рассчитанная для C19H19NO6S, m/e 389,09, найдено m/e 390,2.
Суспензию 0,250 ммоль смолы 3 в 10 мл 20% раствора пиперидина в DMF перемешивали вращением при комнатной температуре в течение 5 минут и смесь сушили. Процедуру повторяли в течение 20 минут. Смолу промывали последовательно DMF (дважды), СН3ОН (один раз), СН2Cl2 (дважды), СН3ОН (один раз) и NMP (дважды). К суспензии смолы в 6 мл NMP добавляли последовательно 200 мг сульфона N-Fmoc-метилцистеина (4 экв., 0,50 ммоль), 0,175 мл DIEA (8 экв., 1,00 ммоль), 70 мг HOBt (4 экв., 0,50 ммоль) и 188 мг HBTU (4 экв., 0,50 ммоль). Смесь перемешивали вращением при комнатной температуре в течение ночи и сушили. Эту процедуру присоединения повторяли в течение 3 часов. Смолу промывали последовательно DMF (дважды), СН3ОН (один раз), 1:1 DMF/CH2Cl2 (дважды), СН3ОН (один раз) и CH2Cl2 (три раза) и сушили под вакуумом.
Суспензию 150 мг этой смолы в 4 мл 20% раствора пиперидина в DMF перемешивали вращением при комнатной температуре в течение 5 минут и смесь сушили. Процедуру повторяли в течение 20 минут. Смолу промывали последовательно DMF (дважды), СН3ОН (один раз), CH2Cl2 (дважды), СН3ОН (один раз) и NMP (дважды). К суспензии смолы в 3 мл NMP добавляли последовательно 52 мг 1-изохинолинкарбоновой кислоты (4 экв., 0,3 ммоль), 0,104 мл DIEA (8 экв., 0,6 ммоль), 37 мг HOBt (4 экв., 0,3 ммоль) и 104 мг HBTU (4 экв., 0,3 ммоль). Смесь перемешивали вращением при комнатной температуре в течение ночи и сушили. Смолу промывали последовательно DMF (дважды), СН3ОН (один раз) и 1:1 DMF/CH2Cl2 (дважды), СН3ОН (один раз) и CH2Cl2 (три раза) и сушили под вакуумом. Смолу затем обрабатывали 2 мл 95% TFA в воде в течение 1 часа. Суспензию фильтровали, фильтрат концентрировали под вакуумом и очищали препаративной ВЭЖХ для получения указанного в заголовке соединения (20r).
Получение 3-({1-[2-(3,5-дихлор-4-гидроксибензоиламино)-3-метансульфонилпропионил]пирролидин-2-карбонил}амино)-4-оксомасляной кислоты (2s).
Соединение 20s получали в соответствии с процедурой, применяемой для получения 20i, применяя 3,5-дихлор-4-гидроксибензойную кислоту вместо 1-изохинолинкарбоновой кислоты.
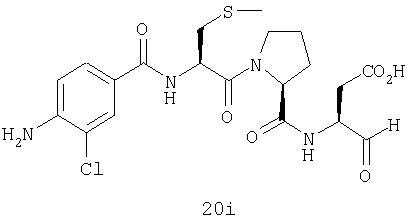
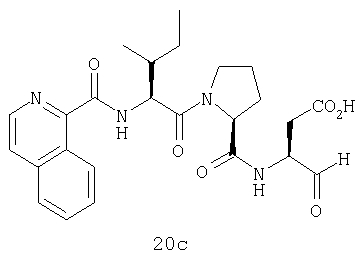
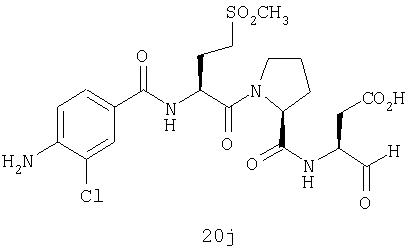
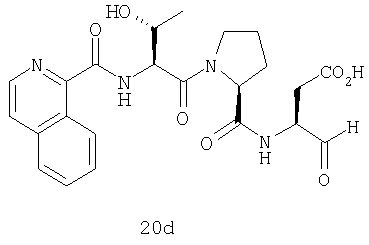
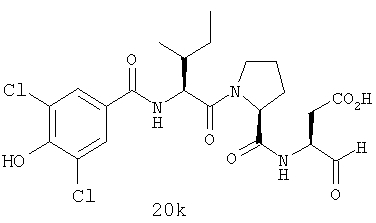
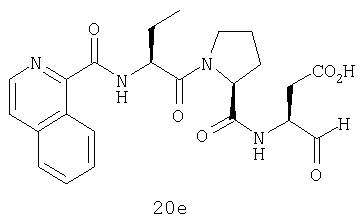
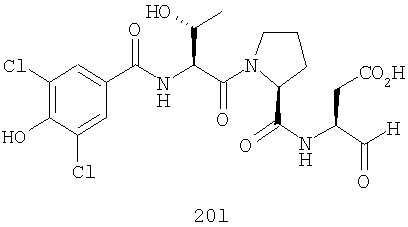
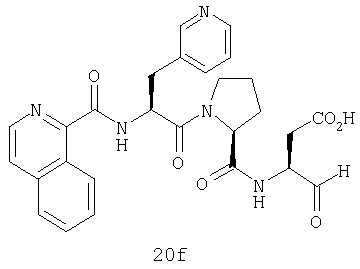
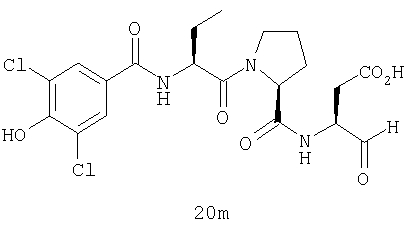
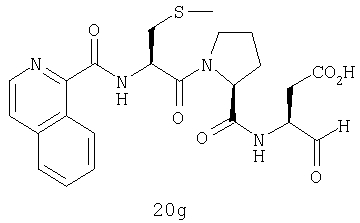
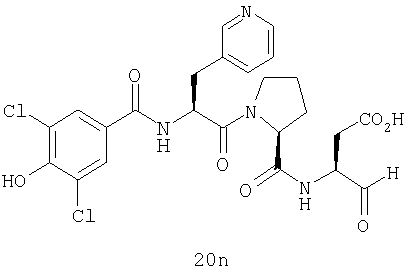
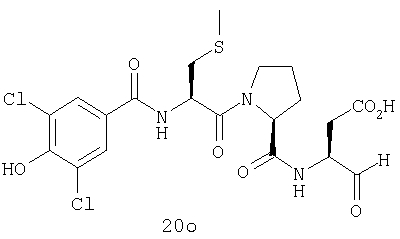
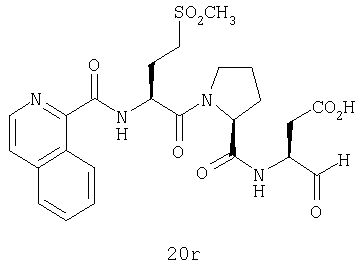
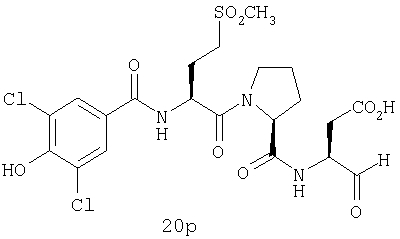
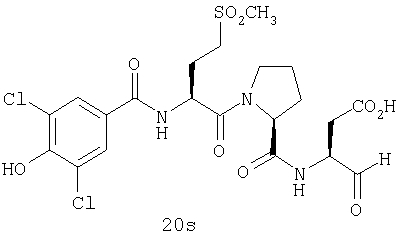
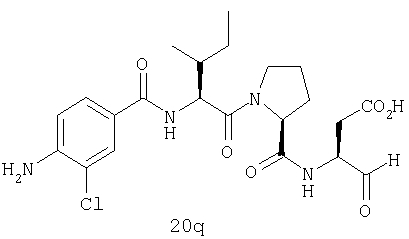
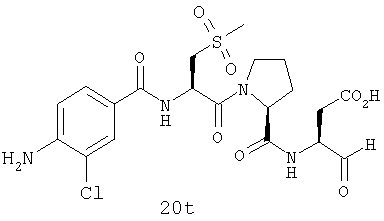
Процедура получения аналогов 23.
Соединения 23a-23i получали в соответствии с процедурой, описанной для соединений 7 (схема II), заменяя только Fmoc-пролин на подходящую Fmoc-аминокислоту на стадии 2 (схема VI).
Схема VI
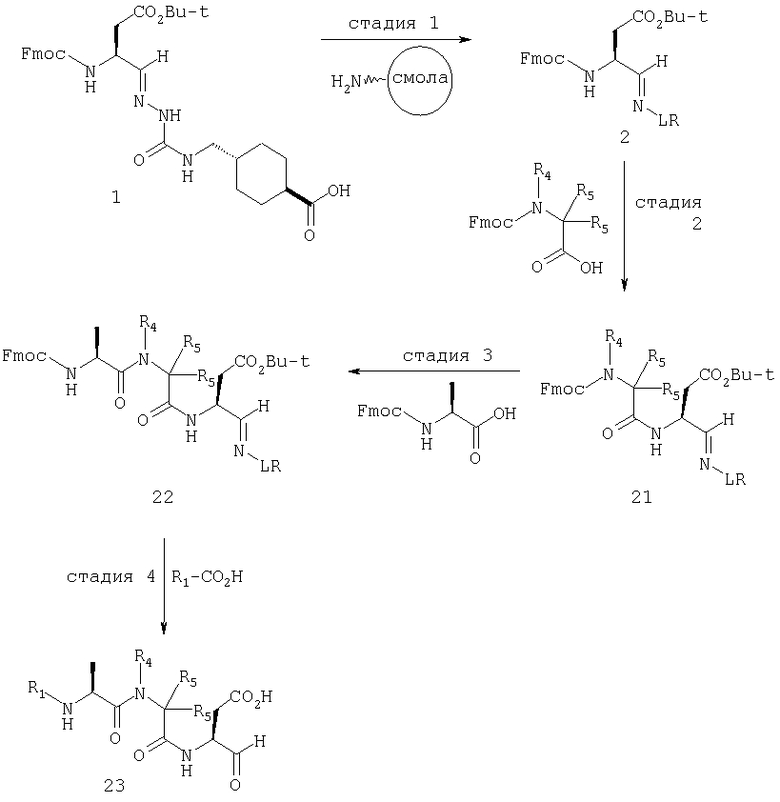
Получение 3-({2-[2-(4-амино-3-хлорбензоиламино)пропионил]-4-метил-3,4-дигидро-2Н-пиразол-3-карбонил}амино)-4-оксомасляной кислоты (23g).
Соединение 23g получали в соответствии с процедурой, описанной для соединений 7, заменяя только Fmoc-пролин на 1-(9Н-фтор-9-илметил)овый эфир 4-метил-4,5-дигидропиразол-1,5-дикарбоновой кислоты (схема II) на стадии 2.
Получение 1-(9Н-фтор-9-илметил)ового эфира 4-метил-4,5-дигидропиразол-1,5-дикарбоновой кислоты.
К раствору 650 мг (2 ммоль) (10,10-диметил-3,3-диоксо-λ6-тиа-4-аза-трицикло [5.2.1.00,0]дек-4-ил)-(4-метил-3,4-дигидро-2Н-пиразол-3-ил)метанона (J.Am. Chem. Soc., 119, pp.8379-8380 (1997)) в 6 мл воды и 14 мл THF, перемешиваемому при 0°С, добавляли 420 мг (10 ммоль, 5 экв.) гидроокиси лития. Смесь перемешивали при 0°С в течение 30 минут, разводили 20 мл воды и отмывали эфиром (20 мл). рН раствора затем доводили до 9 и добавляли раствор 519 мг (2 ммоль, 1 экв.) Fmoc-Cl в 3 мл диоксана. Смесь перемешивали при комнатной температуре в течение ночи, промывали эфиром, подкисляли до рН 2-3 и экстрагировали 3 порциями по 40 мл этилацетата. Объединенные органические экстракты промывали насыщенным солевым раствором, сушили (MgSO4) и концентрировали под вакуумом для получения 690 мг (выход 98%) бесцветной пены, которая была идентифицирована как соединение, указанное в заголовке. 1H-ЯМР (ДМСО-d6, 500 МГц) δ 1,2 (д, 3Н), 3,2 (м, 1Н), 4,2-4,6 (м, 3Н), 7,1 (с, 1Н), 7,2-7,5 (м, 5Н), 7,7-8,0 (м, 4Н). Точная масса, рассчитанная для C20H18N2O4, m/e 350,13, найдено m/e 351,3.
Получение 3-({1-[2-(4-амино-3-хлорбензоиламино)пропионил]-4-метоксипирролидин-2-карбонил}амино)-4-оксомасляной кислоты (23i).
Соединение 23i получали в соответствии с процедурой, описанной для соединений 7, заменяя только Fmoc-пролин на N-Fmoc-4-метоксипролин (схема II) на стадии 2.
Получение N-Fmoc-4-метоксипролина.
К раствору 735 мг (3 ммоль)метилового эфира N-Boc-4-гидроксипролина в 20 мл THF, перемешиваемому при 0°С, добавляли 79 мг (1,1 экв., 3,3 ммоль) 60% гидрида натрия в неорганическом масле. Смесь перемешивали при 0°С в течение 1 часа и добавляли иодистый метил (0,56 мл, 3 экв., 9 ммоль). Смесь перемешивали при комнатной температуре в течение ночи, гасили добавлением насыщенного водного хлористого аммония, разводили водой и экстрагировали тремя порциями по 80 мл этилацетата. Объединенные органические экстракты промывали насыщенным солевым раствором, сушили (MgSO4) и концентрировали под вакуумом для получения бледно-желтого масла. Масло вносили в 9 мл СН3ОН и 3 мл воды и добавляли 378 мг (3 экв., 9 ммоль) гидроокиси лития. Смесь перемешивали при комнатной температуре в течение ночи, разводили водой, подкисляли до рН 3 и экстрагировали тремя порциями по 80 мл этилацетата. Объединенные органические экстракты промывали насыщенным солевым раствором, сушили (MgSO4) и концентрировали под вакуумом. Масло остатка переносили в 10 мл TFA и раствор перемешивали при комнатной температуре в течение 2 часов и концентрировали под вакуумом. Масло остатка разводили 6 мл 10% водного карбоната калия и 3 мл диоксана и добавляли раствор 9-фторенилметилхлорформата (779 мг, 1 экв., 3 ммоль) в 5 мл диоксана. Смесь перемешивали при комнатной температуре в течение ночи, разводили водой, подкисляли до рН 3 и экстрагировали тремя порциями по 80 мл этилацетата. Объединенные органические экстракты промывали насыщенным солевым раствором, сушили (MgSO4) и концентрировали под вакуумом для получения масла, которое очищали колоночной хроматографией на силикагеле, элюируя СН2Cl2/СН3ОН 20:1 для получения 600 мг (55%) N-Fmoc-4-метоксипролина. Точная масса, рассчитанная для C21H21NO5, m/e 367,14, найдено m/e 368,4.
К порции 0,125 г смолы 2 добавляли 4 мл 20% раствора пиперидина в DMF. Смесь перемешивали вращением при комнатной температуре в течение 5 минут и сушили. Процедуру повторяли в течение 20 минут. Смолу промывали последовательно DMF (дважды), СН3ОН (один раз), CH2Cl2 (дважды), СН3ОН (один раз) и NMP (дважды). К суспензии смолы в 4 мл NMP добавляли последовательно 184 мг N-Fmoc-4-метоксипролина (4 экв., 0,50 ммоль), 0,175 мл DIEA (8 экв., 1,00 ммоль), 70 мг HOBt (4 экв., 0,50 ммоль) и 188 мг HBTU (4 экв., 0,50 ммоль). Смесь перемешивали вращением при комнатной температуре в течение ночи и сушили. Эту процедуру присоединения повторяли в течение 3 часов. Смолу промывали последовательно DMF (дважды), СН3ОН (один раз), 1:1 DMF/CH2Cl2 (дважды), СН3ОН (один раз) и CH2Cl2 (три раза) и сушили под вакуумом.
К смоле добавляли 4 мл 20% раствора пиперидина в DMF. Смесь перемешивали вращением при комнатной температуре в течение 5 минут и сушили. Процедуру повторяли в течение 20 минут. Смолу промывали последовательно DMF (дважды), СН3ОН (один раз), CH2Cl2 (дважды), СН3ОН (один раз) и NMP (дважды). К суспензии смолы в 4 мл NMP добавляли последовательно 156 мг N-Fmoc-4-аланина (4 экв., 0,50 ммоль), 0,175 мл DIEA (8 экв., 1,00 ммоль), 70 мг HOBt (4 экв., 0,50 ммоль) и 188 мг HBTU (4 экв., 0,50 ммоль). Смесь перемешивали вращением при комнатной температуре в течение ночи и сушили. Эту процедуру присоединения повторяли в течение 3 часов. Смолу промывали последовательно DMF (дважды), СН3ОН (один раз), 1:1 DMF/СН2Cl2 (дважды), СН3ОН (один раз) и CH2Cl2 (три раза) и сушили под вакуумом.
К смоле добавляли 4 мл 20% раствора пиперидина в DMF. Смесь перемешивали вращением при комнатной температуре в течение 5 минут и сушили. Процедуру повторяли в течение 20 минут. Смолу промывали последовательно DMF (дважды), СН3ОН (один раз), СН2Cl2 (дважды), СН3ОН (один раз) и NMP (дважды). К суспензии смолы в 4 мл NMP добавляли последовательно 80 мг 4-амино-3-хлорбензойной кислоты (4 экв., 0,50 ммоль), 0,175 мл DIEA (8 экв., 1,00 ммоль), 70 мг HOBt (4 экв., 0,50 ммоль) и 188 мг HBTU (4 экв., 0,50 ммоль). Смесь перемешивали вращением при комнатной температуре в течение ночи и сушили. Смолу промывали последовательно DMF (дважды), СН3ОН (один раз), 1:1 DMF/СН2Cl2 (дважды), СН3ОН (один раз) и CH2Cl2 (три раза) и сушили под вакуумом.
Смолу обрабатывали 4 мл 95% TFA в воде в течение 1 часа. Смесь фильтровали. Фильтрат концентрировали под вакуумом для получения масла, которое очищали ВЭЖХ для получения указанного в заголовке соединения (23i).
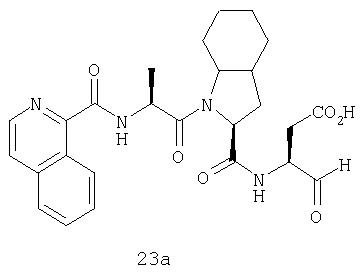
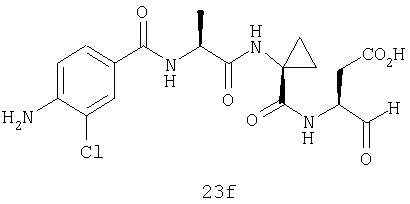
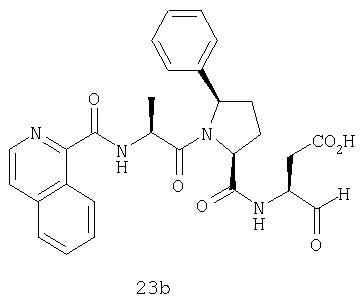
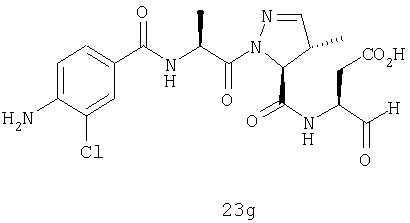
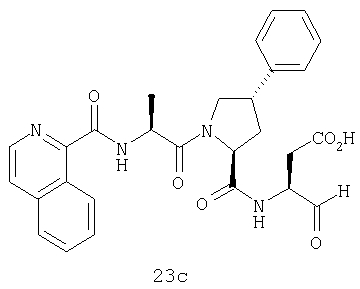
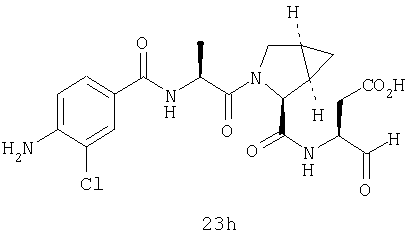
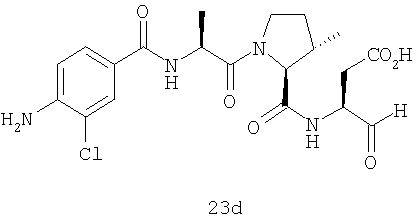
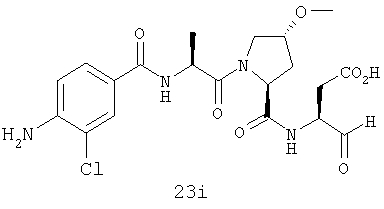
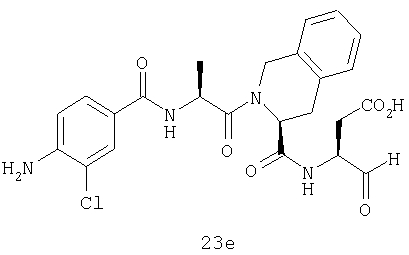
Процедура получения аналогов 24а-е
Соединения 24а-24е получали в соответствии с процедурой, описанной для соединений 5 (схема I), заменяя только Fmoc-пролин либо на Fmoc-азетидинкарбоновую кислоту, либо на транс-2-фенил-Fmoc-азетидинкарбоновую кислоту на стадии 2.
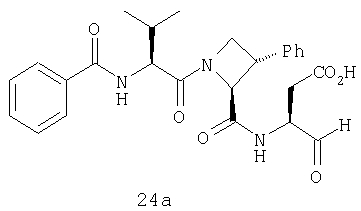
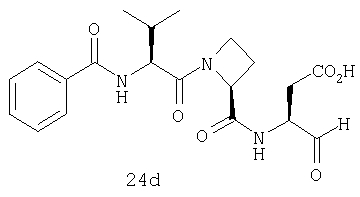
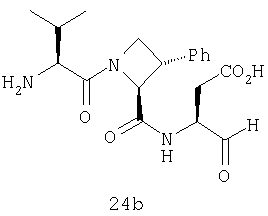
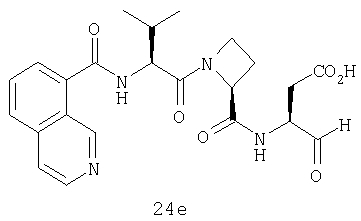
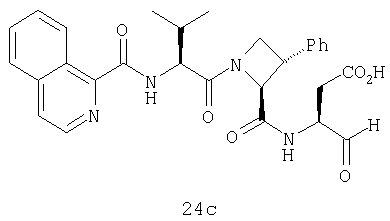
Процедура получения аналогов 25
Соединения 25а-25е получали в соответствии с процедурами, описанными для соединений 5 и 7 (схема I и схема II), заменяя только Fmoc-пролин на Fmoc-2(S)-пипеколиновую кислоту на стадии 2 и присоединяя либо Fmoc-валин, либо Fmoc-аланин, либо Fmoc-трет-лейцин на стадии 3.
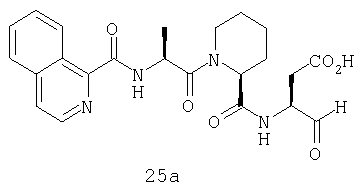
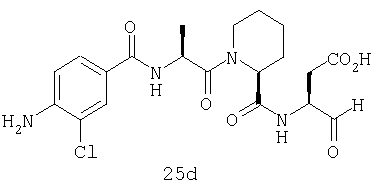
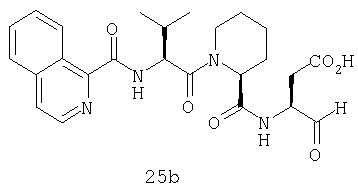
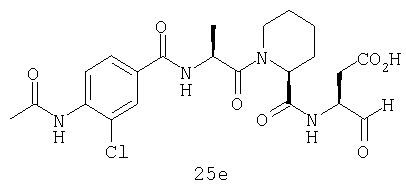
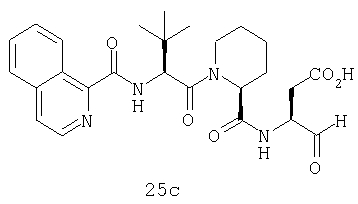
Процедура получения аналогов 26a-h
Соединения 26a-26h получали в соответствии с процедурой, описанной для соединений 23 (схема VI), заменяя только Fmoc-аланин на Fmoc-валин на стадии 3.
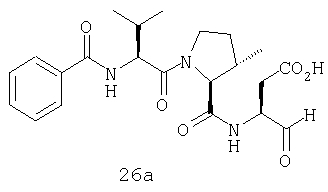
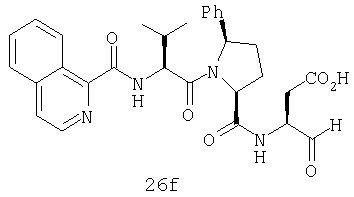
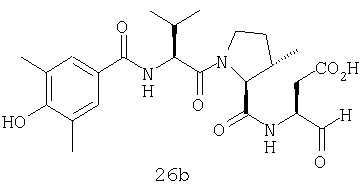
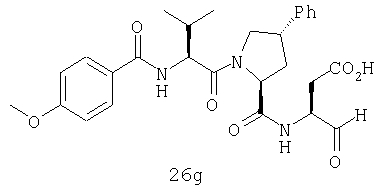
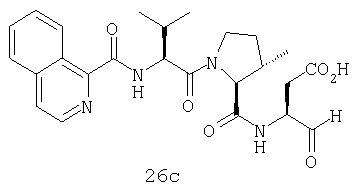
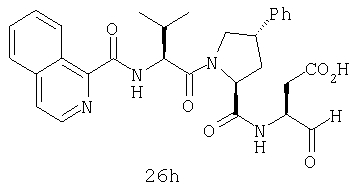
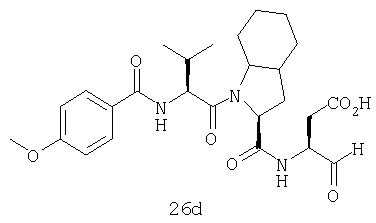
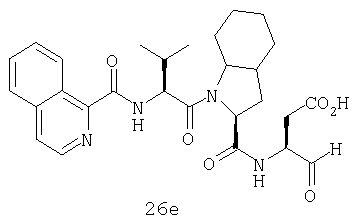
Процедура получения аналогов 27
Соединения 27а-27n получали в соответствии с процедурами, описанными для соединений 7 (схема II), заменяя только Fmoc-пролин на Fmoc-4,4-дифторпролин на стадии 2.
Получение метилового эфира N-Boc-4,4-дифторпролина: к раствору 9,63 мл (7,2 ммоль) оксалилхлорида в 10,6 мл СН2Cl2, перемешиваемому при -78°С, добавляли раствор 0,94 мл (13,2 ммоль) метилсульфоксида в 15 мл CH2Cl2. Раствор перемешивали при -78°С в течение 30 минут. Затем по каплям добавляли раствор 1,47 г (6 ммоль) метилового эфира N-Boc-4-гидроксипролина в 19 мл СН2Cl2. Смесь перемешивали при -78°С в течение 1,5 часов и добавляли 3,34 мл (24 ммоль) триэтиламина. Раствору давали нагреться до комнатной температуры и перемешивали в течение ночи. Затем его разводили 100 мл СН2Cl2, промывали последовательно 100 мл воды, 100 мл 1 н. HCl и 100 мл насыщенного солевого раствора, сушили (MgSO4) и концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (элюируя этилацетатом/гексанами, 1:3) для получения 1,294 г (выход 89%) метилового эфира N-Boc-4-оксопролина. 1H-ЯМР (500 МГц, CDCl3) δ 1,45 (м, 9Н), 2,60 (м, 1Н), 2,95 (м, 1Н), 3,75 (м, 3Н), 3,90 (м, 2Н), 4,80 (м, 1Н).
К раствору 808 мг (3,33 ммоль) метилового эфира N-Boc-4-оксопролина в 13 мл СН2Cl2, перемешиваемому при 0°С, добавляли 0,88 мл (7,19 ммоль, 2,2 экв.) DAST. Смесь перемешивали при 0°С в течение 2 часов, при комнатной температуре в течение 16 часов и вливали в ледяную воду. Смесь перемешивали при комнатной температуре в течение 2 часов. Органическую фазу отделяли, промывали водой, сушили (MgSO4) и концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (элюируя этилацетатом-гексанами, 1:8) для получения 754 мг (выход 79%) дифторированного производного в виде светло-желтого масла. 1H-ЯМР (500 МГц, CDCl3) δ 1,50 (м, 9Н), 2,45 (м, 1Н), 2,70 (м, 1Н), 3,75 (м, 3Н), 3,80 (м, 2Н), 4,50 (м, 1Н).
Получение N-Fmoc-4,4-дифторпролина.
К раствору 754 мг (2,85 ммоль) метилового эфира N-Boc-4,4-дифторпролина в 5 мл THF, перемешиваемому при 0°С, добавляли раствор 179 мг (4,27 ммоль) гидроокиси лития в 5 мл воды. Раствор перемешивали при 0°С в течение 3 часов, при комнатной температуре в течение 1 часа, разводили водой, экстрагировали эфиром, подкисляли до рН 2-3 и экстрагировали двумя порциями по 30 мл этилацетата. Объединенные органические экстракты промывали насыщенным солевым раствором, сушили (MgSO4) и концентрировали под вакуумом для получения 652 мг (91%) кислоты в виде бледно-желтого твердого вещества.
Раствор 652 мг (2 ммоль) N-Boc-4,4-дифторпролина в 10 мл 1:1 TFA: СН2Cl2 перемешивали при 0°С в течение 45 минут и концентрировали под вакуумом. Остаток переносили в 3 мл диоксана и добавляли 5 мл 10% водного карбоната натрия, затем раствор 675 мг (1 экв.) Fmoc-Cl в 5 мл диоксана. Смесь перемешивали при комнатной температуре в течение 16 часов, разводили 20 мл воды, экстрагировали 2 порциями по 20 мл диэтилового эфира, подкисляли до рН 2 и экстрагировали тремя порциями по 30 мл этилацетата. Объединенные органические экстракты промывали 50 мл насыщенного солевого раствора, сушили (MgSO4) и концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (элюируя СН2Cl2/СН3ОН, 10:1) для получения 850 мг (88%) N-Fmoc-4,4-дифторпролина в виде коричневатого твердого вещества. 1H-ЯМР (500 МГц, CDCl3) δ 2,55 (м, 1Н), 2,95 (м, 1Н), 3,80 (м, 2Н), 4,20 (м, 1Н), 4,30 (м, 2Н), 4,55 (м, 1Н), 7,32 (м, 2Н), 7,45 (м, 2Н), 7,70 (м, 2Н), 7,90 (м, 2Н). Точная масса, рассчитанная для C20H17F2NO4, m/e 373,11, найдено m/e 374,4.
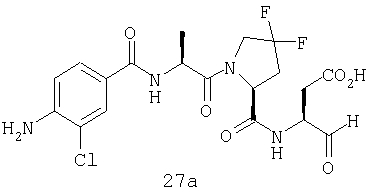
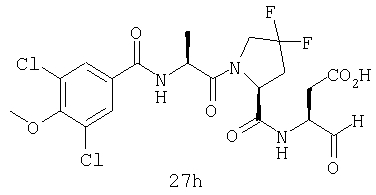
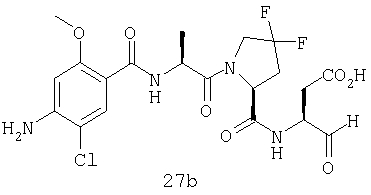
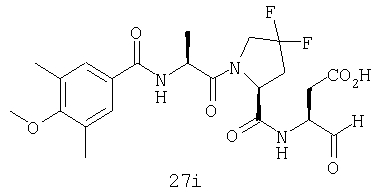
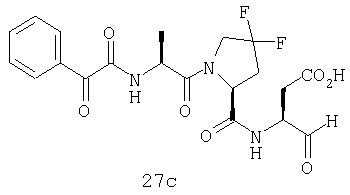
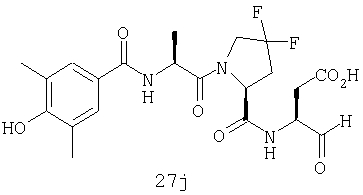
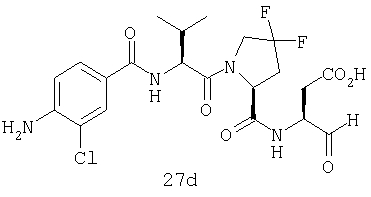
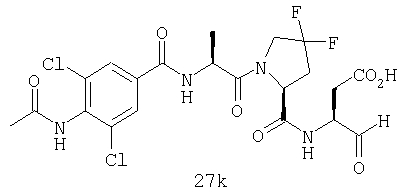
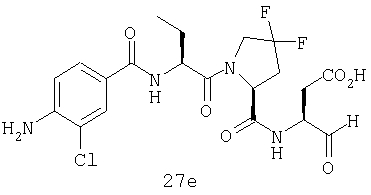 C
C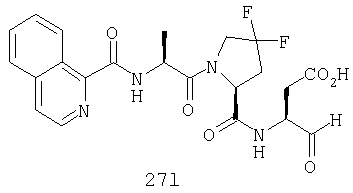
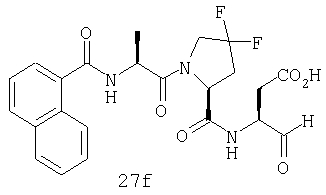
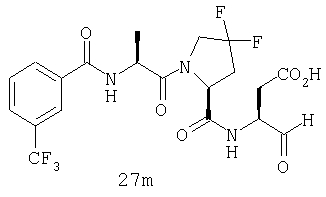
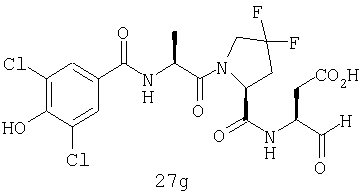
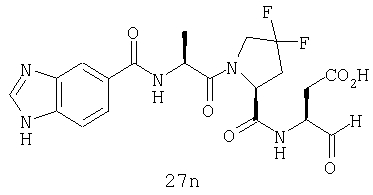
Соединения 28а-28с получали в соответствии с процедурами, описанными для соединений 5 и 7 (схема I и схема II), заменяя только Fmoc-пролин на Fmoc-диметилтиопролин на стадии 2.
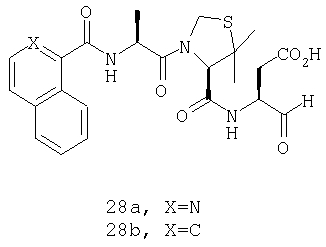
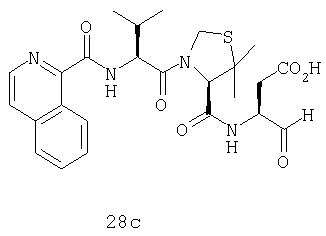
Общие процедуры получения соединений осуществления А формулы I (схемы VII-VIII)
Процедура получения аналогов 29.
Соединения 29a-29s получали в соответствии с процедурой, описанной для соединений 5 (схема I), заменяя только Fmoc-пролин на Fmoc-аланин на стадии 2 и применяя либо Fmoc-валин, либо Fmoc-аланин, либо Fmoc-трет-лейцин на стадии 3.
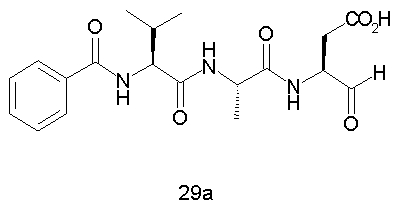
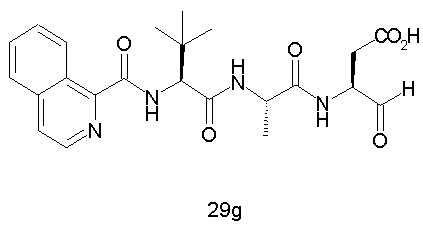
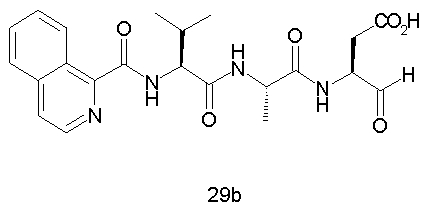
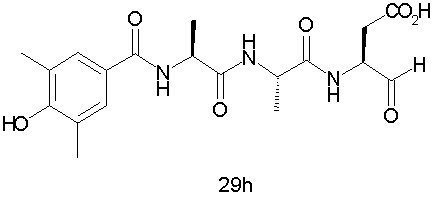
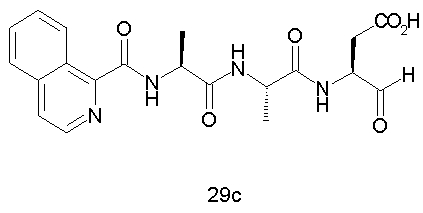
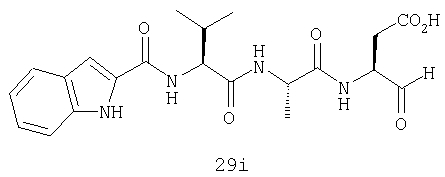
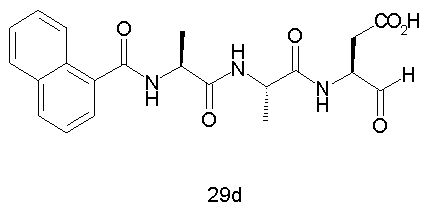
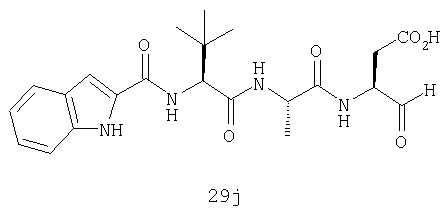
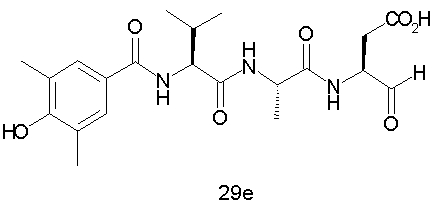
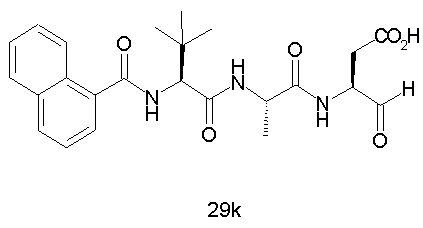
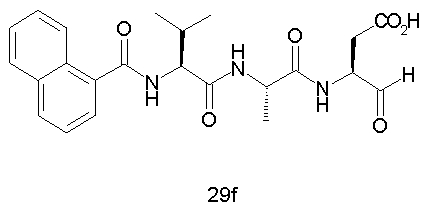
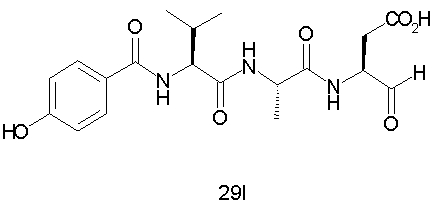
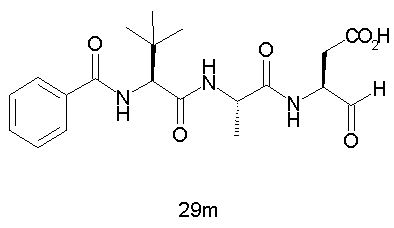
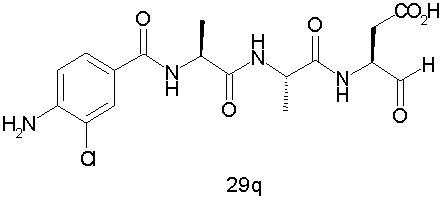
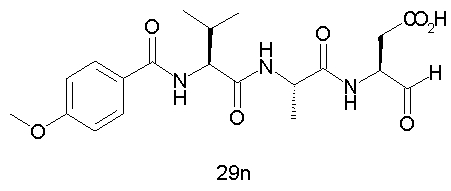
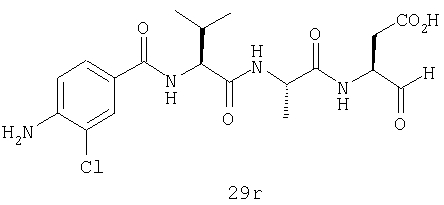
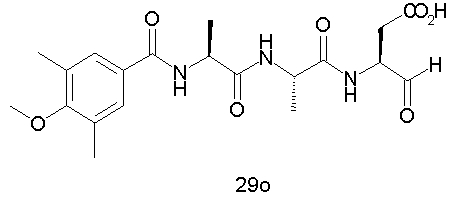
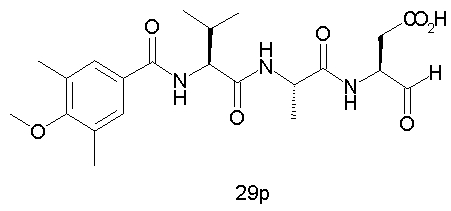
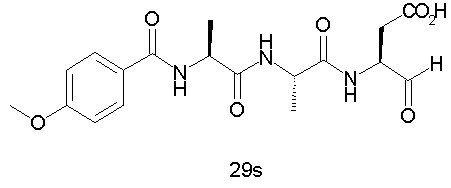
Процедура получения аналогов 32.
Соединения 32а-32е получали в соответствии с процедурой, описанной для соединений 5 (схема I), заменяя только Fmoc-пролин на 2-(3-трет-бутоксикарбониламино-2-оксопирролидин-1-ил)-4-метилпентаноевую кислоту (30) (Neosystem catalog number BB02101) на стадии 2, за которой следует стадия 4 (схема VII).
Соединения осуществления А формулы I, где R2 и R3, совместно с атомами, к которым они присоединены, образуют 5-членное кольцо.
Схема VII
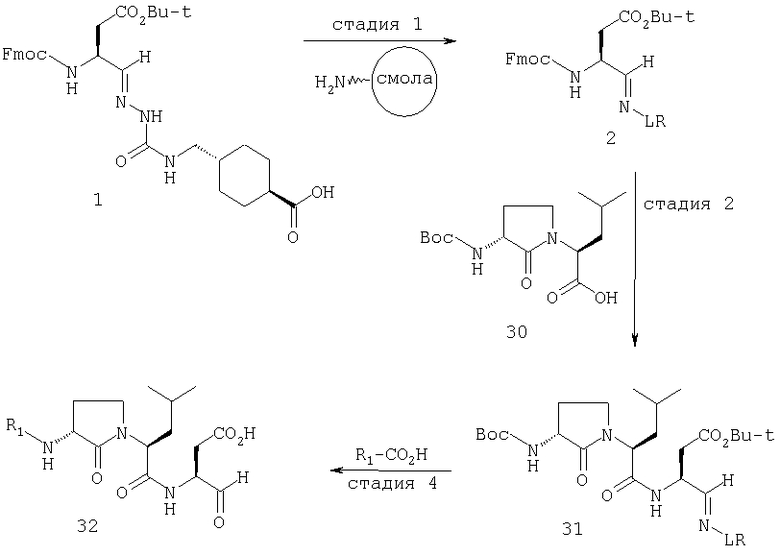
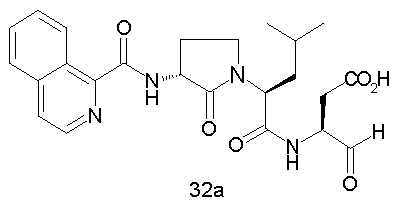
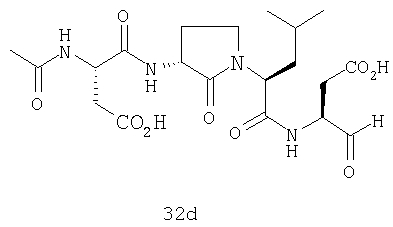
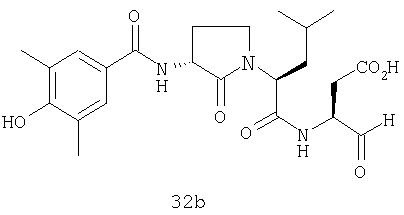
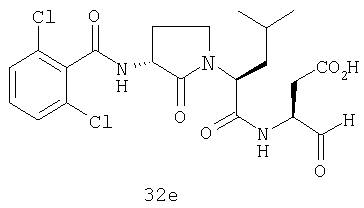
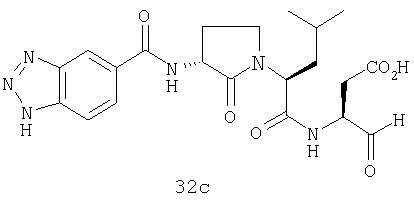
Соединение осуществления А формулы I, где Х=N-СН3.
Схема VIII
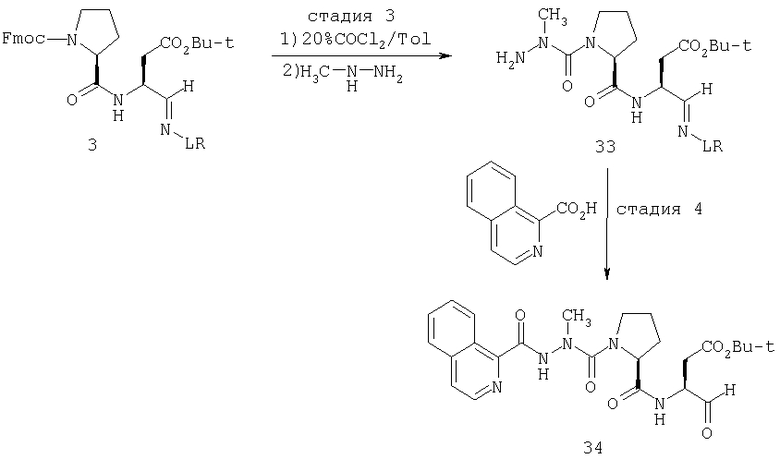
Получение 3-({1-[N-(изохинолин-1-карбонил)-N-метилгидразинкарбонил]пирролидин-2-карбонил}амино)-4-оксомасляной кислоты (34).
Суспензию 0,250 ммоль смолы 3 (схема VIII) в 10 мл 20% пиперидина в DMF перемешивали вращением при комнатной температуре в течение 5 минут и сушили. Процедуру повторяли в течение 20 минут. Смолу промывали последовательно DMF (дважды), СН3ОН (один раз), 1:1 DMF/CH2Cl2 (дважды), СН3ОН (один раз) и СН2Cl2 (три раза) и быстро сушили. К смоле добавляли 5 мл безводного CH2Cl2, 0,128 мл DIEA (3 экв., 0,75 ммоль) и 0,400 мл 20% раствора фосгена в толуоле (3 экв., 0,75 ммоль). Суспензию перемешивали вращением при комнатной температуре в течение 1,5 часов. Смесь сушили и смолу промывали CH2Cl2 несколько раз. К суспензии смолы в 5 мл CH2Cl2 добавляли 0,133 мл метилгидразина (10 экв., 2,5 ммоль). Смесь перемешивали вращением при комнатной температуре в течение ночи и сушили. Смолу промывали последовательно DMF (дважды), СН3ОН (один раз), 1:1 DMF/CH2Cl2 (дважды), СН3ОН (один раз) и СН2Cl2 (три раза) и сушили под вакуумом.
К порции 0,075 ммоль смолы в 3 мл NMP добавляли последовательно 52 мг 1-изохинолинкарбоновой кислоты (4 экв., 0,3 ммоль), 0,19 мл DIEA (8 экв., 0,6 ммоль), 37 мг HOBt (4 экв., 0,3 ммоль) и 104 мг HBTU (4 экв., 0,3 ммоль). Смесь перемешивали вращением при комнатной температуре в течение ночи и сушили. Смолу промывали последовательно DMF (дважды), СН3ОН (один раз), 1:1 DMF/CH2Cl2 (дважды), СН3ОН (один раз) и CH2Cl2 (три раза) и сушили под вакуумом.
Смолу обрабатывали 4 мл 95% раствора TFA в воде в течение 1 часа. Смесь фильтровали. Фильтрат концентрировали под вакуумом для получения масла, которое очищали ВЭЖХ для получения указанного в заголовке соединения (34).
Соединения осуществления А формулы I, где R3=R3=Н.
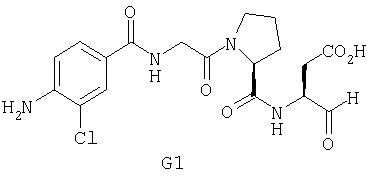
Получение 3-({1-[(4-амино-3-хлорбензоиламино)ацетил]пирролидин-2-карбонил}амино)-4-оксомасляной кислоты (G1).
Получали, как описано для соединений 7, заменяя только Fmoc-аланин на Fmoc-глицин на стадии 3 (схема II) для получения 4,3 мг соединения, указанного в заголовке. ЖХ-МС (ES+): m/e=425,2 (M+H).
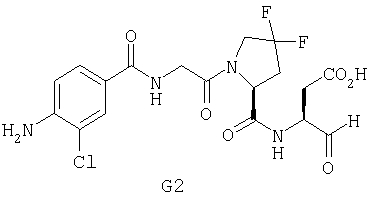
3-({1-[(4-Амино-3-хлорбензоиламино)ацетил]-4,4-дифторпирролидин-2-карбонил}амино)-4-оксомасляная кислота (G2).
Получали, как описано для соединений 7 и 27, заменяя только Fmoc-аланин на Fmoc-глицин на стадии 3 (схема II) для получения 10,0 мг соединения, указанного в заголовке. ЖХ-МС (ES+): m/e=461,2 (M+H).
Общие процедуры получения соединений осуществления С формулы I и осуществления D формулы 1(схемы IX-XXII).
Схема IX
Способ A
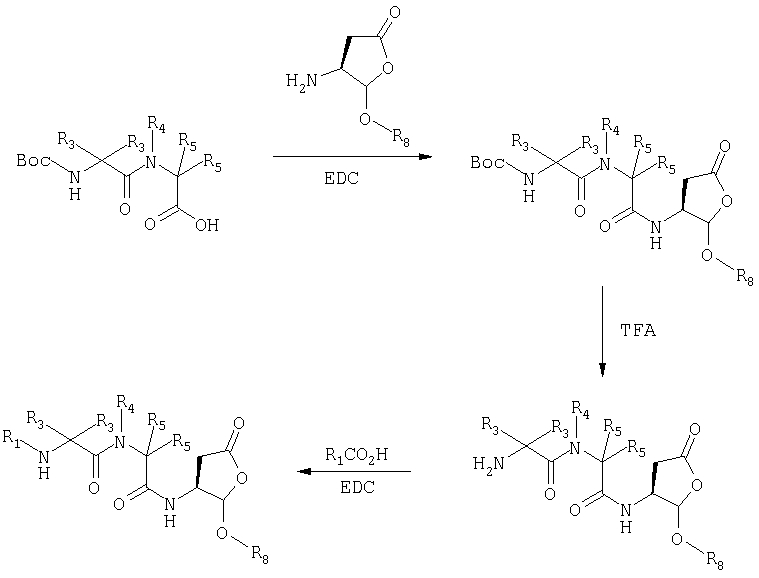
Способ В
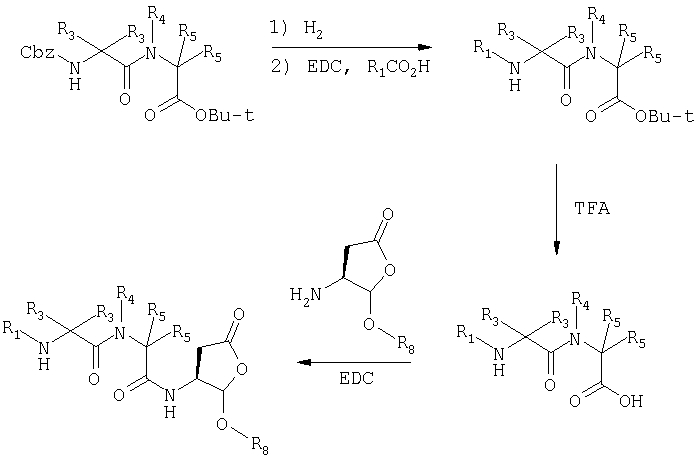
Источники выбранных кольцевых систем
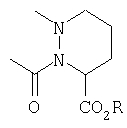
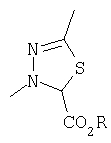
Jensen, К.A. et al., Acta Chemica Scand, 13, pp.1097-1103 (1961).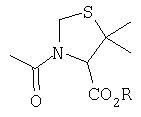
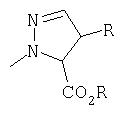
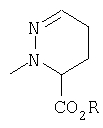
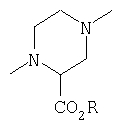
Rossen, К., Tetrahedron Lett., 36. pp.6419-6422 (1995).
Схема X
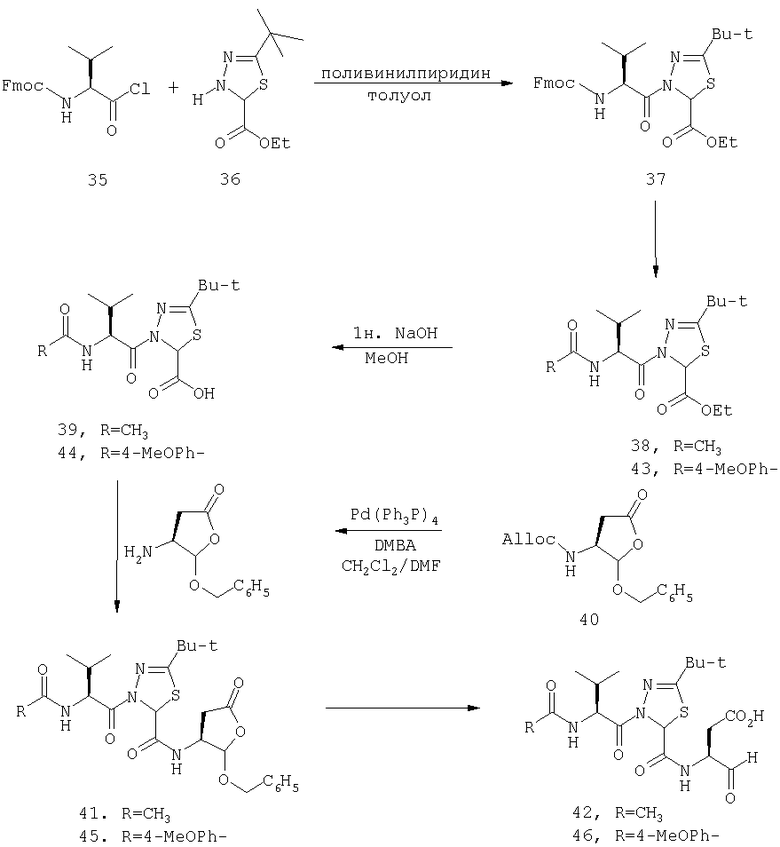
Этиловый эфир 5-трет-бутил-3-[2-(9Н-фтор-9-илметоксикарбониламино)-3-метилбутирил]-2,3-дигидро[1,3,4]тиадиазол-2-карбоновой кислоты (37).
Перемешиваемую суспензию поливинилпиридина (2,63 г, 25 ммоль) в растворе этилового эфира 5-трет-бутил-2,3-дигидро[1,3,4]тиадиазол-2-карбоновой кислоты (36) (J. Med. Chem., 34, p.439 (1991)), (2,16 г, 10 ммоль) в безводном толуоле обрабатывали добавлением по каплям 9Н-фтор-9-илметилового эфира (1-хлоркарбонил-2-метилпропил)карбаминовой кислоты (4,76 г, 12,1 ммоль) в 20 мл безводного толуола. После перемешивания в течение 16 часов суспензию фильтровали и фильтрат промывали насыщенным раствором бикарбоната натрия. Органический слой отделяли, промывали водой, сушили над безводным сульфатом натрия и упаривали для получения желтого масла. Очистка с помощью мгновенной хроматографии с элюцией 9/1 гексан/этилацетат дала 2,66 г (выход 49%) соединения, названного в заголовке (37), в виде прозрачного вязкого масла. 1H ЯМР (500 МГц, CD3OD) δ 0,89 (д, 1,5Н), 0,93 (д, 1,5Н), 1,00 (д, 1,5Н), 1,06 (д, 1,5Н), 1,22 (т, 3Н), 1,28 (с, 9Н), 2,12-2,22 (м, 0,5Н), 2,32-2,42 (м, 0,5Н), 4,18-4,28 (м, 2Н), 4,31-4,45 (м, 2Н), 4,96-5,01 (м, 0,5Н), 5,02-5,10 (м, 0,5Н), 5,52 (д, 0,5H), 5,61 (д, 0,5Н), 6,10 (с, 0,5Н), 6,13 (с, 0,5Н), 7,27-7,34 (м, 2Н), 7,35-7,42 (м, 2Н), 7,56-7,64 (м, 2Н), 7,73-7,78 (м, 2Н)
Этиловый эфир 3-(2-ацетиламино-3-метилбутирил)-5-трет-бутил-2,3-дигидро[1,2,4]тиадиазол-2-карбоновой кислоты (38).
К раствору (37) (схема IX) (0,508 г, 0,94 ммоль) в СН3CN (10 мл) добавляли диэтиламин (1 мл). Раствор перемешивали при комнатной температуре в течение 2 часов, удаляли под вакуумом и полученное масло азеотропировали с помощью CH2Cl2 (4x). Сырое масло растворяли в CH2Cl2 (5 мл) и добавляли триэтиламин (0,26 мл, 1,86 ммоль) и ацетилхлорид (80 мкл, 1,1 ммоль). Раствор перемешивали при комнатной температуре в атмосфере N2 в течение 2 часов. Растворитель упаривали, сырой материал растворяли в EtOAc, промывали 0,5 н. NaHSO4 (2х), насыщенным NaHCO3 (2x) и насыщенным солевым раствором, сушили над безводным Na2SO4, фильтровали и упаривали для получения желтого масла. Очистка с помощью мгновенной хроматографии на силикагеле с использованием гексанов/EtOAc (95/5 до 90/10%) дала продукт в виде желтого масла (0,301 г, выход 89%). 1H-ЯМР (500 МГц, CDCl3) δ 0,88 (дд, 3Н), 0,99 (дд, 3Н), 1,16-1,45 (м, 12Н), 2,02 (с, 3Н), 2,09-2,19 (м, 0,5Н), 2,30-2,40 (м, 0,5Н), 4,12-4,29 (м, 2Н), 5,20-5,27 (м, 0,5Н), 5,30-5,36 (м, 0,5Н), 6,60 (с, 0,5Н), 6,90 (с, 0,5Н), 6,20-6,31 (м, 1Н). Аналитическая ВЭЖХ (колонка С18), (смесь диастереомеров) 7,77, 7,98 мин. ЖХ-МС(ES+): m/e=358,3 (M+H).
3-(2-Ацетиламино-3-метилбутирил)-5-трет-бутил-2,3-дигидро[1,2,4]тиадиазол-2-карбоновая кислота (39).
К раствору 38 (0,301 г, 0,84 ммоль) в МеОН (10 мл) добавляли 1 н. раствор NaOH (1,7 мл, 1,7 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов и растворитель упаривали. Остаток растворяли в EtOAc, промывали 0,5 н. NaHSO4 (2x) и насыщенным солевым раствором, сушили над безводным Na2SO4, фильтровали и упаривали для получения соединения, указанного в заголовке, в виде желтого твердого вещества (0,277 г, количественно).
Получение аллилового эфира 2-(бензилокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты (40).
Соединение 40 получали из трет-бутилового эфира 3-аллилоксикарбониламино-4-гидроксимасляной кислоты с помощью модифицированной процедуры, описанной в Bioorg. Med. Chem. Lett. Vol. 2, No.6, pp.613-618 (1992).
К раствору ДМСО (27,52 г, 352 ммоль) в СН2Cl2 (240 мл) при -78°С добавляли оксалилхлорид (24,4 г, 192 ммоль). Через 15 мин медленно добавляли раствор трет-бутилового эфира 3-аллилоксикарбониламино-4-гидроксимасляной кислоты (41,44 г, 160 ммоль) в CH2Cl2 (100 мл) и перемешивали при -78°С еще в течение 1,5 часов. Добавляли DIEA (62,0 г, 480 ммоль) и смеси давали нагреться до комнатной температуры в течение 15 мин. Полученный раствор разводили CH2Cl2 (300 мл), промывали 0,5 н. NaHSO4 (500 мл×2), водой (300 мл×2) и насыщенным солевым раствором (400 мл×2). Органический слой сушили над безводным Na2SO4, фильтровали и концентрировали под вакуумом до объема 200 мл. К этому раствору добавляли бензиловый спирт (48 г, 444 ммоль), после чего добавляли  молекулярные сита (30 г) и п-толуолсульфоновую кислоту (0,8 г). Реакционную смесь перемешивали в течение 4 дней и добавляли TFA (96 мл). Полученную суспензию перемешивали в течение одного часа и затем выпаривали под вакуумом. Добавляли этилацетат (500 мл) и смесь фильтровали через целит. Фильтрат промывали насыщенным NaHCO3 (500 мл×2), водой (400 мл×2) и насыщенным солевым раствором (300 мл×2). Органический раствор сушили над безводным Na2SO4, фильтровали и упаривали под вакуумом для получения бледно-желтого масла, которое перемешивали с гексаном (400 мл×2) для получения 31 г сырого продукта из нижнего слоя остатка. Хроматография с использованием этилацетата/гексана (от 4/96 до 22/78) дала 6,97 г аллилового эфира анти-2-(бензилокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты (с большей отн. подв.), 4,53 г син-диастереомера и 12,97 г смеси диастереомеров (общий выход 53%). 1H-ЯМР (500 МГц, CDCl3) для анти-диастереомера: δ 2,41-2,45 (м, Н), 3,02-3,07 (м, Н), 4,28 (уш., Н), 4,50-4,80 (м, 3Н), 4,80-5,15 (м, 2Н), 5,24-5,32 (м, 2Н), 5,48 (с, Н), 5,88-6,00 (м, Н), 7,31-7,56 (м, 5Н); для син-диастереомера: δ 2,49-2,53 (м, Н), 2,83-2,89 (м, Н), 4,57-4,65 (м, 4Н), 4,87-4,90 (м, Н), 5,12-5,30 (м, 3Н), 5,52-5,53 (д, Н), 5,88-6,00 (м, Н), 7,31-7,39 (м, 5Н). Время задержки при аналитической ВЭЖХ: 10,49 мин для анти-диастереомера и 10,37 мин для син-диастереомера. ЖХ-МС: m/z=292 (M+H+).
молекулярные сита (30 г) и п-толуолсульфоновую кислоту (0,8 г). Реакционную смесь перемешивали в течение 4 дней и добавляли TFA (96 мл). Полученную суспензию перемешивали в течение одного часа и затем выпаривали под вакуумом. Добавляли этилацетат (500 мл) и смесь фильтровали через целит. Фильтрат промывали насыщенным NaHCO3 (500 мл×2), водой (400 мл×2) и насыщенным солевым раствором (300 мл×2). Органический раствор сушили над безводным Na2SO4, фильтровали и упаривали под вакуумом для получения бледно-желтого масла, которое перемешивали с гексаном (400 мл×2) для получения 31 г сырого продукта из нижнего слоя остатка. Хроматография с использованием этилацетата/гексана (от 4/96 до 22/78) дала 6,97 г аллилового эфира анти-2-(бензилокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты (с большей отн. подв.), 4,53 г син-диастереомера и 12,97 г смеси диастереомеров (общий выход 53%). 1H-ЯМР (500 МГц, CDCl3) для анти-диастереомера: δ 2,41-2,45 (м, Н), 3,02-3,07 (м, Н), 4,28 (уш., Н), 4,50-4,80 (м, 3Н), 4,80-5,15 (м, 2Н), 5,24-5,32 (м, 2Н), 5,48 (с, Н), 5,88-6,00 (м, Н), 7,31-7,56 (м, 5Н); для син-диастереомера: δ 2,49-2,53 (м, Н), 2,83-2,89 (м, Н), 4,57-4,65 (м, 4Н), 4,87-4,90 (м, Н), 5,12-5,30 (м, 3Н), 5,52-5,53 (д, Н), 5,88-6,00 (м, Н), 7,31-7,39 (м, 5Н). Время задержки при аналитической ВЭЖХ: 10,49 мин для анти-диастереомера и 10,37 мин для син-диастереомера. ЖХ-МС: m/z=292 (M+H+).
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 3-(2-ацетиламино-3-метилбутирил)-5-трет-бутил-2,3-дигидро[1,2,4]тиадиазол-2-карбоновой кислоты (41).
К раствору аллилового эфира (2-бензилокси-5-оксо-тетрагидрофуран-3-ил)карбаминовой кислоты (40) (0,385 г, 1,32 ммоль) в DMF (2 мл) и СН2Cl2 (2 мл) добавляли DMBA (0,456 г, 2,92 ммоль) и Pd(PPh3)4 (0,136 г, 0,12 ммоль) и раствор перемешивали при комнатной температуре в течение 15 мин. Добавляли раствор (39) в CH2Cl2 (4,5 мл) и DMF (0,5 мл), затем НОВТ (0,168 г, 1,24 ммоль) и EDC (0,256 г, 1,33 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов под N2. Растворитель упаривали. Сырой материал растворяли в EtOAc, промывали 0,5 н. NaHSO4 (2x), насыщенным NaHCO3 (2x) и насыщенным солевым раствором, сушили над безводным Na2SO4, фильтровали и упаривали для получения желтого твердого вещества. Очистка с помощью мгновенной колоночной хроматографии дала соединение, указанное в заголовке, (41) в виде смеси диастереомеров (374 мг, выход 88%). 1H-ЯМР (500 МГц, CDCl3) δ 0,75-1,05 (м, 6Н), 1,19-1,34 (м, 9Н), 1,93-2,08 (м, 3Н), 2,19-2,50 (м, 2Н), 2,80-3,03 (м, 1Н), 4,56-4,93 (м, 3Н), 5,02-5,20 (м, 1Н), 5,46-5,56 (м, 1Н), 5,95-6,16 (м, 2Н), 6,86-6,95 (м, 1Н), 7,20-7,43 (м, 5Н). Аналитическая ВЭЖХ (колонка С18), (смесь диастереомеров): 8,58 мин. ЖХ-МС (ES+) m/e=519,2 (М+Н).
Получение 3-{[3-(2-ацетиламино-3-метилбутирил)-5-трет-бутил-2,3-дигидро[1,3,4]тиадиазол-2-карбонил]амино}-4-оксомасляной кислоты (42).
Образец 45 мг (0,087 ммоль) 41 гидролизовали по способу А (смотри схему XXIII) для получения 17 мг (выход 45%) соединения, поименованного в заголовке. Аналитическая ВЭЖХ (колонка С18): 5,15 мин. ЖХ-МС (ES+): m/е=429,3 (М+Н).
Этиловый эфир 5-трет-бутил-3-[2-(4-метоксибензоиламино)-3-метилбутирил]-2,3-дигидро[1,3,4]тиадиазол-2-карбоновой кислоты (43).
Применяли способ, описанный выше для соединения 38, с использованием анизоилхлорида для получения 216 мг (50%) соединения, указанного в заголовке, в виде аморфного твердого вещества. 1H ЯМР (500 МГц, CDCl3) δ 0,92 (д, 1,5Н), 0,98 (д, 1,5Н), 1,03 (д, 1,5Н), 1,07 (д, 1,5Н), 1,21 (т, 3Н), 1,28 (с, (Н), 2,21-2,28 (м, 0,5Н), 2,41-2,48 (м, 0,5Н), 3,83 (с, 3Н), 4,15-4,28 (м, 2Н), 5,41-5,46 (м, 0,5Н), 5,48-5,53 (м, 0,5Н), 6,08 (с, 0,5Н), 6,13 (с, 0,5Н), 6,75 (д, 0,5Н), 6,85 (д, 0,5Н), 6,91 (д, 2Н), 7,59 (д, 2Н).
5-трет-Бутил-3-[2-(4-метоксибензоиламино)-3-метилбутирил]-2,3-дигидро[1,3,4]тиадиазол-2-карбоновая кислота (44).
С помощью процедуры, описанной для 39, получено 180 мг (количественно) соединения, указанного в заголовке, в виде белого твердого вещества. 1H ЯМР (500 МГц, CDCl3) 50,92 (д, 1,5Н), 0,96 (д, 1,5Н), 1,03 (д, 1,5Н), 1,07 (д, 1,5Н), 2,22-2,30 (м, 0,5Н), 2,37-2,45 (м, 0,5Н), 3,83 (с, 1,5Н) 3,84 (с, 1,5Н), 5,41-5,48 (м, 1Н), 6,14 (с, 0,5Н), 6,15 (с, 0,5Н), 6,87-6,95 (м, 2Н), 7,75-7,83 (м, 3Н).
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 5-трет-бутил-3-[2-(4-метоксибензоиламино)-3-метилбутирил]-2,3-дигидро[1,3,4]тиадиазол-2-карбоновой кислоты (45а и 45b).
С помощью процедуры, описанной для 41, получали сырое соединение, указанное в заголовке, в виде 4 диастереомеров. Сырой материал очищали с помощью мгновенной хроматографии, элюируя градиентом от CH2Cl2 до СН2Cl2/этилацетат (6/4) для получения 31 мг компонента с наибольшей отн. подв. в виде отдельного диастереомера (45а). Аналитическая ВЭЖХ (колонка Microsorb C18) 19,87 мин. 1H ЯМР (500 МГц, CDCl3) (отдельный диастереомер) δ 1,04 (д, 3Н), 1,14 (д, 3Н), 1,28 (с, 9Н), 2,77 (д, 0,5Н), 2,81 (д, 0,5Н), 2,90 (д, 0,5Н), 2,95 (д, 0,5Н), 3,84 (с, 3Н), 4,44-4,49 (м, 1Н), 4,53 (д, 1Н), 4,85 (д, 1Н), 5,02-5,08 (м, 1Н), 6,37 (с, 1Н), 6,41 (д, 1Н), 6,93 (д, 2Н), 7,26-7,40 (м, 5Н), 7,75 (д, 2Н), 7,92-7,96 (м, 1Н).
Фракция с меньшей отн. подв. содержала 185 мг твердого вещества в виде смеси 3:1:2 диастереомеров (45b). Аналитическая ВЭЖХ: колонка Microsorb C18, 19,00, 19,26, 20,02 мин. 1H ЯМР (500 МГц, CDCl3) (смесь 3:1:2 трех диастереомеров) δ 0,89 (д, 2,25Н), 0,98 (д, 0,75Н), 1,02 (д, 0,5Н), 1,03 (д, 1,5Н), 1,08 (д, 0,25Н), 1,10 (д, 0,75Н), 1,16 (с, 0,75Н), 1,17 (с, 2,25Н), 1,23 (с, 0,375Н), 1,24 (с, 1,125Н), 1,28 (с, 1,125 Н), 1,29 (с, 3,375Н), 2,12-2,18 (м, 0,33Н), 2,32-2,42 (м, 0,67Н), 2,43-2,51 (м, 0,5Н), 2,61-2,67 (м, 0,5Н), 2,84-2,92 (м, 0,5Н), 2,96-3,07 (м, 0,5Н), 3,85 (с, 3Н), 4,58-4,71 (м, 2Н), 4,81 (д, 0,16Н), 4,86 (д, 0,32Н), 4,91 (д, 0,52Н), 5,09-5,13 (м, 0,33Н), 5,14-5,18 (м, 0,67Н), 5,35 (дд, 1Н), 5,46 (с, 0,16Н), 5,53 (д, 0,32Н), 5,58-5,62 (д, 0,52Н), 6,17 (с, 0,52Н), 6,20 (с, 0,16Н), 6,34 (с, 0,32Н), 6,50 (д, 0,32Н), 6,62 (д, 0,16Н), 6,67 (д, 0,52Н), 6,86 (д, 0,33Н), 6,91 (д, 0,67Н), 6,94 (д, 1,0Н), 7,24-7,43 (м, 5Н), 7,61 (д, 1Н), 7,70 (д, 0,33Н), 7,71 (д, 0,67Н), 7,76 (д, 1Н).
Получение 3-({5-трет-бутил-3-[2-(4-метоксибензоиламино)-3-метилбутирил]-2,3-дигидро[1,3,4]тиадиазол-2-карбонил}амино)-4-оксомасляной кислоты (46а).
Образец 45а в количестве 30 мг гидролизовали по способу В (смотри схему XXIII) для получения 8 мг (выход 30%) желаемого продукта. Аналитическая ВЭЖХ (колонка Microsorb С18, ацетонитрил/вода с буфером TFA) 12,85 мин. 1H ЯМР (500 МГц, CD3OD) δ 0,98-1,1 (м, 6Н), 1,28 (с, 9Н), 2,20-2,31 (м, 1Н), 2,40-2,48 (м, 1Н), 2,6-2,72 (м, 1Н), 3,84 (с, 3Н), 4,18-4,26 (м, 1Н), 4,56-4,62 (м, 1Н), 5,25-5,32 (м, 1Н), 6,24-6,28 (м, 1Н), 6,98 (д, 2Н), 7,85 (д, 2Н).
Получение 3-({5-трет-бутил-3-[2-(4-метоксибензоиламино)-3-метилбутирил]-2,3-дигидро[1,3,4]тиадиазол-2-карбонил}амино)-4-оксомасляной кислоты (46b).
Образец 45b в количестве 30 мг (смесь 3 диастереомеров) гидролизовали по способу В (смотри схему XXIII) для получения 22 мг (выход 84%) желаемого продукта в виде смеси 3:2 диастереомеров. Аналитическая ВЭЖХ (колонка Microsorb циано): 7,08, 7,78 мин. 1H ЯМР (500 МГц, CD3OD) δ 0,98-1,08 (м, 4Н), 1,09-1,12 (м, 2Н), 1,29 и 1,31 (2 синглета, 9Н), 2,23-2,30 (м, 0,5Н), 2,36-2,55 (м, 1,5Н), 2,62-2,72 (м, 1Н), 3,85 (с, 3Н), 4,18-4,27 (м, 1Н), 4,58-4,65 (м, 1Н), 5,27-5,33 (м, 1Н), 6,23-6,27 (м, 1Н), 7,00 (д, 2Н), 7,70-7,88 (м, 2Н).
Схема XI
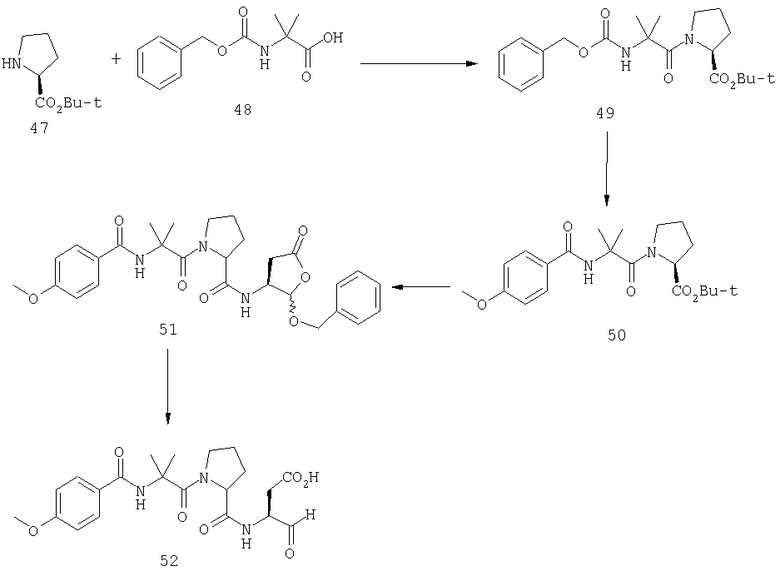
трет-Бутиловый эфир 1-(2-бензилоксикарбониламино-2-метилпропионил)пирролидин-2-карбоновой кислоты (49).
К раствору трет-бутилового эфира пролина (47) (2,00 г, 12 ммоль), в CH2Cl2 (15 мл) добавляли N-карбобензилокси-2-метилаланин (3,05 г, 13 ммоль), НОВТ (2,36 г, 17 ммоль) и EDC (3,43 г, 18 ммоль) и раствор перемешивали при комнатной температуре в атмосфере N2 в течение 48 часов. Растворитель упаривали, сырой материал растворяли в EtOAc, промывали 0,5 н. NaHSO4 (2x), насыщенным NaHCO3 (2х) и насыщенным солевым раствором, сушили над безводным Na2SO4, фильтровали и упаривали для получения белого твердого вещества (4,68 г, 100%). 1Н-ЯМР (500 МГц, CDCl3) δ 1,20-2,15 (м, 4Н), 1,43 (с, 9Н), 1,59 (д, 6Н), 3,21-3,79 (м, 2Н), 4,35 (уш. с, 1Н), 4,82-5,19 (м, 3Н), 5,74 (уш. с, 1Н), 7,17-7,49 (м, 5Н). Аналитическая ВЭЖХ (колонка С18): 10,66 мин. ЖХ-МС (ES+): m/e=391,3 (М+Н).
трет-Бутиловый эфир 1-[2-(4-метоксибензоиламино)-2-метилпропионил]пирролидин-2-карбоновой кислоты (50).
К раствору 49 (1,00 г, 2,56 ммоль) в МеОН (20 мл) добавляли 10% Pd/C (200 мг) и смесь перемешивали в атмосфере Н2 в течение 2 часов. Смесь фильтровали через 0,45 мкм PTFE фильтр и растворитель удаляли под вакуумом для получения бесцветного масла. Это масло растворяли в CH2Cl2 (25 мл) и добавляли DIEA (660 мкл, 3,79 ммоль) и пара-анизоилхлорид (480 мг, 2,8 ммоль). Раствор перемешивали при комнатной температуре в атмосфере N2 в течение 18 часов. Растворитель удаляли под вакуумом и масло растворяли в EtOAc. Органическую фазу промывали 0,5 н. NaHSO4 (2x), водой, насыщенным NaHCO3 (2x) и насыщенным солевым раствором. Органическую фазу сушили над Na2SO4, фильтровали и упаривали для получения белого твердого вещества, которое очищали мгновенной колоночной хроматографией с элюцией CH2Cl2/MeOH (от 99/1 до 98/2%) для получения соединения, указанного в заголовке, в виде белого твердого вещества (655 мг, выход 65%). 1H-ЯМР (500 МГц, CDCl3) δ 1,47 (с, 9Н), 1,68-2,24 (м, 5Н), 1,80 (д, 6Н), 3,55-3,68 (м, 1Н), 3,72-3,93 (м, 1Н), 3,84 (с, 3Н), 4,43-4,55 (м, 1Н), 6,90 (д, 2Н), 7,60 (уш. с, 1Н), 7,77 (д, 2Н). Аналитическая ВЭЖХ (колонка С18) 8,98 мин.
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-метоксибензоиламино)-2-метилпропионил]пирролидин-2-карбоновой кислоты (51).
К раствору 50 (325 мг, 0,83 ммоль) в диоксане (5 мл) добавляли триэтиламин (463 мкл, 3,32 ммоль) и TMS-трифлат (642 мкл, 3,32 ммоль), раствор перемешивали при 100°С в течение 5 часов и затем при комнатной температуре в течение 18 часов. Реакционную смесь разводили водой, рН доводили до 8 насыщенным NaHCO3, экстрагировали Et2O, сушили над Na2SO4, фильтровали и упаривали для получения белого твердого вещества (230 мг, выход 83%), которое использовали непосредственно на следующей стадии.
К раствору аллилового эфира (2-бензилокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты (40) (1,027 г, 3,5 ммоль) в СН2Cl2 (20 мл) добавляли DMBA (543 мг, 3,48 ммоль) и Pd(PPh3)4 (280 мг, 0,24 ммоль) и раствор перемешивали при комнатной температуре в атмосфере N2 в течение 20 минут. Добавляли раствор 1-[2-(4-метоксибензоиламино)-2-метилпропионил]пирролидин-2-карбоновой кислоты (818 мг, 2,45 ммоль) в СН2Cl2 (5 мл) и затем НОВТ (0,534 г, 3,95 ммоль) и EDC (738 мг, 3,84 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов в атмосфере N2. Растворитель упаривали, сырой материал растворяли в EtOAc, промывали 0,5 н. NaHSO4 (2x), насыщенным NaHCO3 (2x) и насыщенным солевым раствором, сушили над безводным Na2SO4, фильтровали и упаривали для получения желтого твердого вещества. Очистка мгновенной колоночной хроматографией с элюцией этилацетатом /гексанами (от 20/80 до 50/50%) дала продукт в виде бледно-желтого твердого вещества (760 мг, выход 61%). 1H-ЯМР (500 МГц, CD3OD) δ 1,53 (д, 6Н), 1,65-1,93 (м, 3Н), 1,96-2,14 (м, 1Н), 2,60 (дд, 0,1Н), 2,77 (дд, 0,85Н), 2,94 (дд, 0,85Н), 3,04-3,11 (м, 0,2Н), 3,42-3,52 (м, 1Н), 3,57-3,67 (м, 1Н), 3,84 (с, 3Н), 4,38-4,76 (м, 3Н), 4,84 (д, 1Н), 5,64-5,70 (м, 1Н), 6,96-7,03 (м, 2Н), 7,23-7,43 (м, 5Н), 7,78-7,97 (м, 2Н). Аналитическая ВЭЖХ (колонка С18): 13,32, 14,37 мин. ЖХ-МС (ES+): m/е=524,3 (М+Н).
Получение 3-({1-[2-(4-метоксибензоиламино)-2-метилпропионил]пирролидин-2-карбонил}амино)-4-оксомасляной кислоты (52).
Образец 51 в количестве 61 мг (0,14 ммоль) гидролизовали по способу С (смотри схему XXIII) для получения 30 мг (выход 60%) соединения, указанного в заголовке. Аналитическая ВЭЖХ (колонка С18): 6,79 мин. ЖХ-МС (ES+): m/e=434,3 (М+Н).
Схема XII
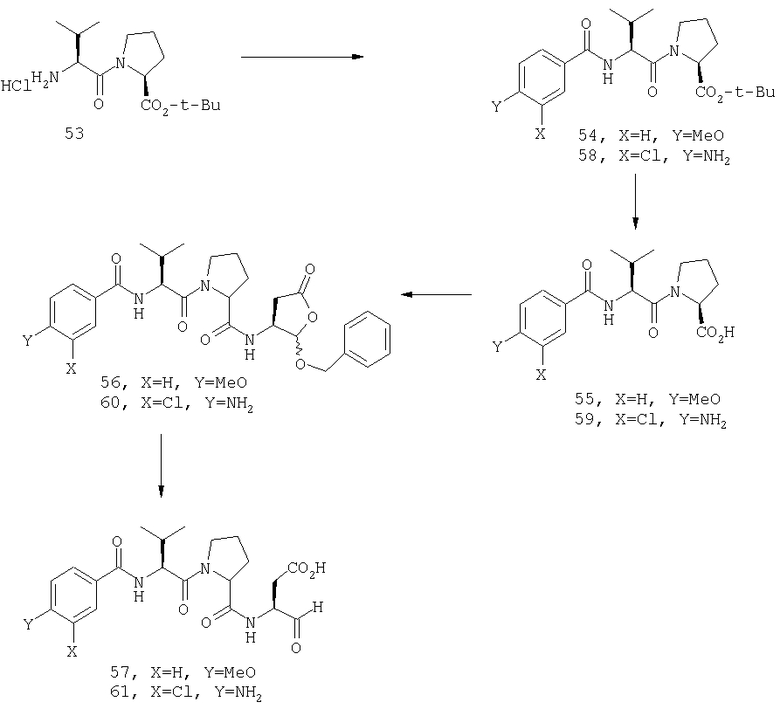
трет-Бутиловый эфир 1-[2-(4-метоксибензоиламино)-3-метилбутирил]пирролидин-2-карбоновой кислоты (54).
К суспензии H-val-pro-OtBu-HCl (53) (2,011 г, 7,44 ммоль) в CH2Cl2 (20 мл) добавляли DIEA (3,2 мл, 18,4 ммоль) и затем раствор 4-метоксибензоилхлорида (1,26 г, 7,4 ммоль) в СН2Cl2 (5 мл). Раствор перемешивали при комнатной температуре в атмосфере азота в течение 1 часа и затем концентрировали. Полученное масло растворяли в EtOAc, промывали 0,5 н. KHSO4 (2х), насыщенным NaHCO3 (2x) и насыщенным солевым раствором, затем концентрировали под вакуумом для получения соединения, указанного в заголовке, в виде белого твердого вещества (2,814 г, выход 94%). 1H-ЯМР (500 МГц, CDCl3) δ 1,05 (дд, 6Н), 1,46 (с, 9Н), 1,88-2,29 (м, 5Н), 3,65-3,74 (м, 1Н), 3,81-3,92 (м, 1Н), 3,85 (с, 3Н), 4,32-4,42 (м, 1Н), 4,81-4,91 (м, 1Н), 6,79-6,86 (м, 1Н), 6,91 (д, 2Н), 7,78 (д, 2Н). Аналитическая ВЭЖХ (колонка циано): 10,18 мин.
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-метоксибензоиламино)-3-метилбутирил]пирролидин-2-карбоновой кислоты (56).
Образец 54 в количестве 1,079 г (2,67 ммоль) растворяли в 15% TFA в CH2Cl2 (40 мл) и перемешивали при комнатной температуре в течение 4 часов. Растворитель концентрировали под вакуумом для получения 55 в виде белого твердого вещества (0,93 г, 100%), которое использовали на следующей стадии.
К раствору 40 (1,796 г, 6,17 ммоль) в СН2Cl2 (20 мл) добавляли DMBA (1,119 г, 7,17 ммоль) и Pd(PPh3)4 (0,683 г, 0,59 ммоль) и раствор перемешивали при комнатной температуре в течение 20 минут. Добавляли раствор 55 (0,928 г, 2,67 ммоль) в CH2Cl2 (17 мл) и DMF (2 мл), после чего добавляли НОВТ (0,811 г, 6,01 ммоль) и EDC (1,16 г, 6,04 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 часов в атмосфере N2. Растворитель упаривали, сырой материал растворяли в EtOAc, промывали 0,5 н. NaHSO4 (2x), насыщенным NaHCO3 (2x) и насыщенным солевым раствором, сушили над безводным Na2SO4, фильтровали и упаривали для получения желтого твердого вещества. Очистка мгновенной колоночной хроматографией с элюцией этилацетатом/СН2Cl2 (от 10/90 до 40/60%) дала соединение, указанное в заголовке, в виде бледно-желтого твердого вещества (910 мг, выход 63%). 1H-ЯМР (500 МГц, CDCl3) δ 0,96 (дд, 6Н), 1,84-2,19 (м, 4Н), 2,25-2,38 (м, 1H), 2,45 (дд, 1Н), 2,80-2,98 (м, 1Н), 3,60-3,72 (м, 1Н), 3,82-3,95 (м, 1H), 3,86 (с, 3Н), 4,26-4,95 (м, 6Н), 5,41 (с, 0,2Н), 5,53 (д, 0,8Н), 6,67-6,77 (м, 1H), 6,88-6,99 (д, 2Н), 7,22-7,57 (м, 5Н), 7,71-7,82 (д, 2Н). Аналитическая ВЭЖХ (колонка циано) (смесь 2 диастереомеров): 9,21 мин. ЖХ-МС (ES+): m/e=538,3 (М+Н).
3-({1-[2-(4-Метоксибензоиламино)-3-метилбутирил]пирролидин-2-карбонил}амино)-4-оксомасляная кислота (57).
Образец 56 в количестве 125 мг (0,23 ммоль) гидролизовали по способу А (смотри схему XXIII) для получения 60 мг (выход 58%) соединения, указанного в заголовке. Аналитическая ВЭЖХ: 5,71 мин. ЖХ-МС (ES+): m/е=448,2 (М+Н).
Получение 4-амино-3-хлорбензойной кислоты.
Суспензию 4-амино-3-хлорбензонитрила (4,82 г, 31,58 ммоль) нагревали до кипения с обратным холодильником в 6 н. HCl (140 мл). Осадок растворяли при нагревании для получения бесцветного раствора. При дальнейшем нагревании раствор мутнел. Через 9 часов реакционную смесь охлаждали до комнатной температуры. Образовавшийся осадок отфильтровывали, растворяли в ТГФ и растворитель упаривали. Остаток повторно концентрировали из толуола для получения белого твердого вещества (3,18 г, выход 59%). 1H-ЯМР (500 МГц, CD3OD:CDCl3, 1:4) δ 6,80 (д, 1H), 7,75 (дд, 1H), 7,94 (д, 1H). Аналитическая ВЭЖХ (колонка циано): 8,73 мин.
трет-Бутиловый эфир 1-[2-(4-амино-3-хлорбензоиламино)-3-метилбутирил]пирролидин-2-карбоновой кислоты (58).
К суспензии 53 (1,707 г, 6,31 ммоль) в CH2Cl2 (25 мл) при 0°С добавляли DIEA (3,2 мл, 18,4 ммоль) и затем раствор 4-амино-3-хлорбензойной кислоты (1,298 г, 7,56 ммоль), НОВТ (1,005 г, 7,44 ммоль) и EDC (1,456 г, 7,58 ммоль). Полученную смесь перемешивали при 0°С в течение 15 минут, затем давали нагреться до комнатной температуры и перемешивали в течение 18 часов. Растворитель упаривали, полученное масло растворяли в EtOAc, промывали 0,5 н. NaHSO4 (2x), насыщенным NaHCO3 (2x) и насыщенным солевым раствором для получения белого твердого вещества (2,68 г). Моментальная хроматография с использованием MeOH/CH2Cl2 (от 1/99 до 2/98%) дала 2,04 г (выход 76%) 58 в виде белого твердого вещества. 1H-ЯМР (500 МГц, CDCl3) δ 1,05 (дд, 6Н), 1,47 (с, 9Н), 1,86-2,29 (м, 5Н), 3,62-3,78 (м, 1Н), 3,78-3,94 (м, 1Н), 4,39 (дд, 1Н), 4,79-4,89 (дд, 1Н), 6,73 (д, 1Н), 6,78 (д, 1Н), 7,52 (дд, 1Н), 7,75 (д, 1Н). Аналитическая ВЭЖХ (колонка циано): 16,18 мин. ЖХ-МС (ES+): m/е=424,3 (М+Н).
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-амино-3-хлорбензоиламино)-3-метилбутирил]пирролидин-2-карбоновой кислоты (60).
Образец 58 в количестве 0,632 г (1,49 ммоль) растворяли в 50% TFA в CH2Cl2 (20 мл) и раствор перемешивали при комнатной температуре в течение 2 часов. Оставшуюся TFA удаляли повторным концентрированием из CH2Cl2 (3х) для получения продукта в виде белого твердого вещества.
Образец в количестве 385 мг (1,04 ммоль) вводили в реакцию с 40 по способу, использованному для соединения 56. Соединение, указанное в заголовке, (60) выделяли в виде желтого твердого вещества (265 мг, выход 45%). 1H-ЯМР (500 МГц, CD3OD) δ 0,89-1,12 (м, 6Н), 1,72-2,26 (м, 5Н), 2,49 (дд, 0,25Н), 2,60 (дд, 0,7Н), 2,80 (дд, 0,75Н), 2,96-3,09 (м, 0,3Н), 3,64-3,77 (м, 1Н), 3,94-4,10 (м, 1Н), 4,20-4,74 (м, 4Н), 4,76-4,95 (м, 1Н), 5,51 (с, 0,5Н), 5,61-5,70 (м, 1,5Н), 6,79 (дд, 1Н), 7,23-7,43 (м, 5Н), 7,48-7,61 (м, 1,4Н), 7,68-7,81 (м, 1Н), 7,99-8,12 (м, 0,6Н).
Аналитическая ВЭЖХ (колонка циано) (смесь 2 диастереомеров): 14,90, 15,20 мин. ЖХ-МС (ES+): m/е=557,2 (М+Н).
3-({1-[2-(4-Амино-3-хлорбензоиламино)-3-метилбутирил]пирролидин-2-карбонил}амино)-4-оксомасляная кислота (61).
Образец 60 в количестве 45 мг (0,08 ммоль) гидролизовали по способу А (смотри схему XXIII) для получения 30 мг (выход 80%) соединения, указанного в заголовке. 1H ЯМР (500 МГц, CD3OD) δ 1,06 (дд, 6Н), 1,78-2,38 (м, 5Н), 2,38-2,86 (м, 2Н), 3,62-3,83 (м, 1Н), 4,12-4,76 (м, 4Н), 7,04-7,21 (м, 1Н), 7,58-8,01 (м, 2Н). Аналитическая ВЭЖХ: 8,16 мин. ЖХ-МС (ES+): m/e=467,3 (M+H).
Схема XIII
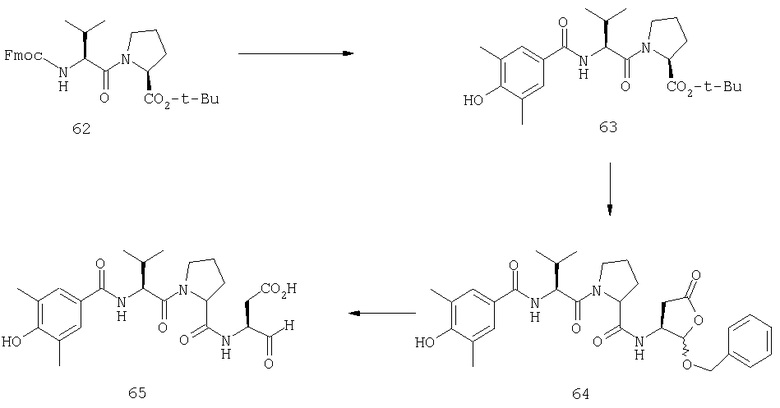
трет-Бутиловый эфир 1-[2-(4-гидрокси-3,5-диметилбензоиламино)-3-метилбутирил]пирролидин-2-карбоновой кислоты (63).
К раствору 62 (полученному из 53 и Fmoc-Cl) (600 мг, 1,22 ммоль) в безводном DMF (10 мл) добавляли диэтиламин (3 мл). Раствор перемешивали при комнатной температуре в атмосфере N2 в течение 3 часов и растворитель упаривали. Полученное масло растворяли в CH2Cl2 (8 мл), к раствору добавляли 3,5-диметил-4-гидроксибензойную кислоту (0,302 г, 1,82 ммоль), НОВТ (338 мг, 2,5 ммоль) и EDC (0,456 г, 2,43 ммоль) и раствор перемешивали при комнатной температуре в атмосфере N2 в течение 18 часов. Растворитель концентрировали под вакуумом и полученное масло растворяли в EtOAc, промывали 0,5 н. NaHSO4 (2x), насыщенным NaHCO3 (2х) и насыщенным солевым раствором для получения сырого продукта в виде белого твердого вещества (0,80 г). Моментальная хроматография с элюцией MeOH/CH2Cl2 (от 1/99 до 2/98%) дала 380 мг (выход 75%) белого твердого вещества. 1H-ЯМР (500 МГц, CDCl3) δ 1,06 (дд, 6Н), 1,47 (с, 9Н), 1,90-2,32 (м, 5Н), 2,24 (с, 6Н), 3,65-3,75 (м, 1Н), 3,84-3,92 (м, 1Н), 4,36-4,42 (м, 1Н), 4,82-4,88 (м, 1Н), 5,53-5,61 (м, 1Н), 6,77-6,85 (м, 1Н), 7,42 (с, 2Н). Аналитическая ВЭЖХ (колонка циано): 17,53 мин. ЖХ-МС (ES+): m/е=419,3 (М+Н).
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-гидрокси-3,5-диметилбензоиламино)-3-метилбутирил]пирролидин-2-карбоновой кислоты (64).
Соединение, указанное в заголовке, (64) в виде бледно-желтого твердого вещества (352 мг, выход 72%), получали из 63 и 40 по способу, использованному для получения 56. 1H-ЯМР (500 МГц, CD3OD) δ 0,83-1,28 (м, 6Н), 1,66-2,37 (м, 3Н), 2,23 (с, 6Н), 2,48-2,54 (м, 0,2Н), 2,61 (ддд, 0,8Н), 2,72 (ддд, 0,9Н), 3,01-3,09 (м, 1Н), 3,66-3,76 (м, 1Н), 3,95-4,07 (м, 1Н), 4,48-4,73 (м, 3Н), 4,75-4,92 (м, 1Н), 5,45-5,48 (м, 0,1Н), 5,61-5,64 (м, 0,1Н), 5,64-5,70 (м, 0,8Н), 7,21-7,62 (м, 6Н), 7,88-8,04 (м, 1Н). Аналитическая ВЭЖХ (колонка циано) (смесь 2 диастереомеров) 17,73 мин. ЖХ-МС (ES+) m/е=552,3(М+Н).
3-({1-[2-(4-Гидрокси-3,5-диметилбензоиламино)-3-метилбутирил]пирролидин-2-карбонил}амино)-4-оксомасляная кислота (65).
Образец 64 в количестве 160 мг (0,29 ммоль) гидролизовали по способу А (смотри схему XXIII) для получения 13,1 мг (выход 10%) соединения, указанного в заголовке. Аналитическая ВЭЖХ (колонка циано) 10,28 мин. ЖХ-МС (ES+) m/e=462,2 (М+Н).
Схема XIV
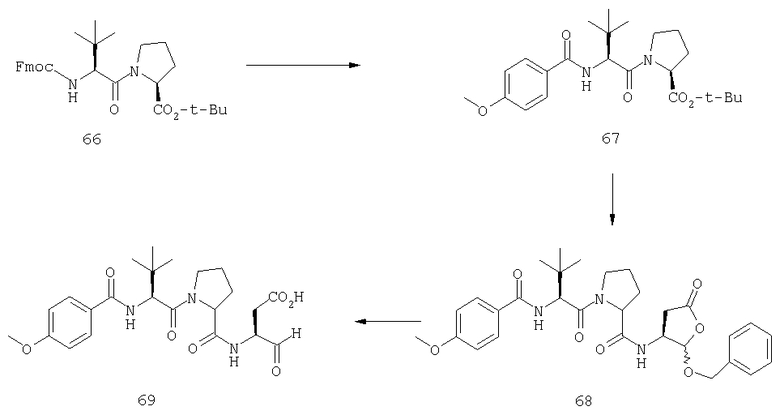
трет-Бутиловый эфир 1-[2-(2-9Н-флуорен-9-илацетиламино)-3,3-диметилбутирил]пирролидин-2-карбоновой кислоты (63).
К раствору H-pro-OtBu (53) (1,033 г, 6,0 ммоль, II, схема 5) в СН2Cl2 (20 мл) и DMF (5 мл) добавляли Fmoc-tLeu-OH (2,337 г, 6,60 ммоль, I, схема 5), НОВТ (1,63 г, 12,1 ммоль) и EDC (2,30 г, 12,0 ммоль) и раствор перемешивали при комнатной температуре в атмосфере N2 в течение 18 часов. Растворитель удаляли под вакуумом, остаток растворяли в EtOAc, промывали 0,5 н. NaHSO4 (2x), насыщенным NaHCO3 (2x) и насыщенным солевым раствором. Органический слой сушили над безводным Na2SO4 и упаривали для получения бледно-желтого твердого вещества (3,65 г). Моментальная хроматография с использованием EtOAc/гексанов (от 10/90 до 20/80%) дала соединение, указанное в заголовке, (66) (2,25 г, выход 74%). 1H-ЯМР (500 МГц, CDCl3) δ 1,09 (с, 9Н), 1,47 (с, 9Н), 1,79-2,28 (м, 3Н), 3,62-3,72 (м, 1Н), 3,76-3,83 (м, 1Н), 4,18-4,43 (м, 4Н), 5,48-5,67 (м, 1Н), 7,28-7,44 (м, 4Н), 7,55-7,64 (м, 2Н), 7,72-7,82 (м, 2Н). Аналитическая ВЭЖХ (колонка циано): 11,95 мин. ЖХ-МС (ES+): m/e=507,3 (M+H).
трет-Бутиловый эфир 1-[2-(4-метоксибензоиламино)-3,3-диметилбутирил]пирролидин-2-карбоновой кислоты (67).
К раствору 66 (0,503 г, 0,99 ммоль) в DMF (8 мл) добавляли диэтиламин (2,5 мл), раствор перемешивали при комнатной температуре в течение 1 часа и растворитель упаривали. Полученный остаток повторно концентрировали из CH2Cl2 (3х). Полученное масло растворяли в CH2Cl2 (9 мл) и DIEA (260 мкл, 1,49 ммоль) и добавляли 4-метоксибензоилхлорид (190 мг, 1,05 ммоль). Раствор перемешивали в атмосфере N2 в течение 18 часов и растворитель концентрировали под вакуумом. Остаток растворяли в EtOAc, промывали 0,5 н. NaHSO4 (2x), насыщенным НаНСО3 (2x) и насыщенным солевым раствором, затем сушили над безводным Na2SO4 и упаривали для получения белого твердого вещества (0,529 г). Моментальная хроматография на силикагеле с использованием МеОН/CH2Cl2 (от 1/99 до 2/98%) дала соединение, указанное в заголовке (2,25 г, выход 74%). 1H-ЯМР (500 МГц, CD3OD) δ 1,01 (с, 1,4Н), 1,11 (с, 7,6Н), 1,73-2,25 (м, 4Н), 2,47-2,77 (м, 1Н), 2,81 (дд, 0,7Н), 2,91-3,11 (м, 0,3Н), 3,61-4,03 (м, 3Н), 3,84 (с, 3Н), 4,29-4,49 (м, 1Н), 4,49-5,00 (м, 5Н), 5,46 (с, 0,15Н), 5,58-5,73 (м, 0,85Н), 6,94-7,04 (м, 2Н), 7,27-7,41 (м, 4Н), 7,61-7,73 (м, 1Н), 7,74-7,84 (м, 2Н). Аналитическая ВЭЖХ (колонка циано): 13,10 мин.
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-метоксибензоиламино)-3,3-диметилбутирил]пирролидин-2-карбоновой кислоты (68).
К раствору 67 (0,90 г, 1,74 ммоль) в CH2Cl2 (25 мл) добавляли 2,6-лутидин (2,1 мл, 18,0 ммоль) и TMS-трифлат (2,3 мл, 11,9 ммоль) и реакционную смесь перемешивали при комнатной температуре в атмосфере N2 в течение 1,5 часов. Полученную смесь разводили СН2Cl2, промывали 10% NaHCO3 (2x) и насыщенным солевым раствором, затем сушили над Na2SO4, фильтровали и упаривали. Остаток растворяли в CH2Cl2, затем обрабатывали DIEA (0,6 мл, 3,5 ммоль) и 4-метоксибензоилхлоридом (0,355 г, 2,09 ммоль) и перемешивали в атмосфере N2 при комнатной температуре в течение 18 часов. Сырой продукт очищали мгновенной хроматографией с элюцией CH2Cl2/MeOH (99/1) для получения соединения, указанного в заголовке (274 мг, выход 28%). 1H-ЯМР (500 МГц, CD3OD) δ 1,01 (с, 1,4Н), 1,11 (с, 7,6Н), 1,73-2,25 (м, 4Н), 2,47-2,77 (м, 1Н), 2,81 (дд, 0,7Н), 2,91-3,11 (м, 0,3Н), 3,61-4,03 (м, 3Н), 3,84 (с, 3Н), 4,29-4,49 (м, 1Н), 4,49-5,00 (м, 5Н), 5,46 (с, 0,15Н), 5,58-5,73 (м, 0,85Н), 6,94-7,04 (м, 2Н), 7,27-7,41 (м, 4Н), 7,61-7,73 (м, 1Н), 7,74-7,84 (м, 2Н). Аналитическая ВЭЖХ (колонка циано) (смесь 2 диастереомеров): 17,03, 17,39 мин. ЖХ-МС (ES+): m/е=552,3 (М+Н).
3-({1-[2-(4-Метоксибензоиламино)-3,3-диметилбутирил]пирролидин-2-карбонил}амино)-4-оксомасляная кислота (69).
Образец 68 в количестве 117 мг (0,21 ммоль) гидролизовали по способу С (смотри схему XXIII) для получения 40 мг (выход 41%) соединения, указанного в заголовке. Аналитическая ВЭЖХ: 7,16 мин. ЖХ-МС (ES+): m/е=462,3 (М+Н).
Схема XV
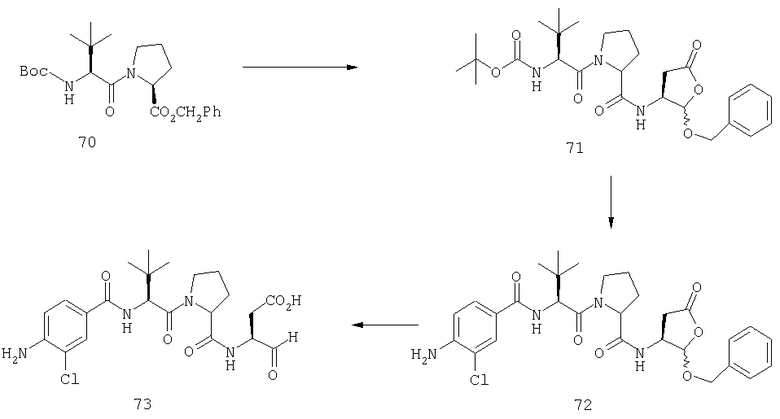
Бензиловый эфир 1-(2-трет-бутоксикарбониламино-3,3-диметилбутирил)пирролидин-2-карбоновой кислоты (70).
К суспензии H-pro-OBzl·HCl (2,00 г, 8,66 ммоль) в СН2Cl2 (20 мл) добавляли DIEA (2,25 мл, 12,92 ммоль) для получения бесцветного раствора. Добавляли Boc-tLeu-OH (1,95 г, 9,52 ммоль), НОВТ (1,76 г, 13,03 ммоль) и EDC (2,49 г, 12,95 ммоль) и раствор перемешивали в атмосфере N2 при комнатной температуре в течение 18 часов. Растворитель удаляли под вакуумом, растворяли в EtOAc и промывали Н2О, 0,5 н. NaHSO4 (2х), насыщенным NaHCO3 (2х) и насыщенным солевым раствором. Сушили над безводным Na2SO4 и упаривали для получения соединения, поименованного в заголовке (3,57 г, выход 99%). 1H-ЯМР (500 МГц, CDCl3) δ 0,99 (с, 9Н), 1,40 (с, 9Н), 1,88-2,33 (м, 4Н), 3,58-3,90 (м, 2Н), 4,21-4,35 (д, 1Н), 4,53-4,66 (м, 1Н), 5,04-5,38 (м, 3Н), 7,14-7,42 (м, 5Н). ЖХ-МС (ES+): m/e=419,4 (M+H).
трет-Бутиловый эфир (1-[2-(2-бензилокси-5-оксотетрагидрофуран-3-илкарбамоил)пирролидин-1-карбонил]-2,2-диметилпролил}карбаминовой кислоты (71).
Образец 70 в количестве 871 мг (2,08 ммоль) растворяли в МеОН (15 мл) и добавляли 10% Pd/C (200 мг). Суспензию перемешивали в атмосфере Н2 в течение 1 часа, затем фильтровали через целит и растворитель упаривали. Полученный остаток вводили в реакцию с 40 в соответствии с процедурой, использованной для получения 56, для получения 889 мг (выход 71%) соединения, указанного в заголовке, (71). 1H-ЯМР (500 МГц, CDCl3) δ 0,93 (с, 9Н), 1,44 (с, 9Н), 1,78-2,18 (м, 4Н), 2,29-2,49 (м, 2Н), 2,76-3,04 (м, 1Н), 3,50-3,70 (м, 1Н), 3,70-3,85 (м, 1Н), 4,20-4,37 (м, 1Н), 4,49-4,78 (м, 3Н), 4,78-4,98 (м, 1Н), 5,12-5,26 (м, 1Н), 5,40-5,59 (м, 1Н), 7,10-7,78 (м, 5Н). Аналитическая ВЭЖХ (колонка циано): 11,17 мин. ЖХ-МС (ES+): m/е=518,3 (М+Н).
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-амино-3-хлорбензоиламино)-3,3-диметилбутирил]пирролидин-2-карбоновой кислоты (72).
Раствор 456 мг (0,088 ммоль) 71 в СН2Cl2 (20 мл) обрабатывали безводной TFA (5 мл), затем премешивали при комнатной температуре в атмосфере N2 в течение 1 часа и упаривали досуха. Остаток повторно концентрировали из CH2Cl2 (3х) и сушили затем под вакуумом. Полученный остаток растворяли в СН2Cl2 (20 мл), охлаждали до 0°С, после чего обрабатывали DIEA (1,3 мл, 8 экв., 2,46 ммоль) и затем 4-амино-3-хлорбензойной кислотой (202 мг, 1,17 ммоль), НОВТ (183 мг, 1,35 ммоль) и EDC (279 мг, 1,45 ммоль). Полученной смеси давали нагреться до комнатной температуры и перемешивали в течение 18 часов. Растворитель удаляли под вакуумом, остаток растворяли в EtOAc, затем промывали дистиллированной водой (3х), 0,5 н. NaHSO4 (2х), насыщенным NaHCO3 (2х) и насыщенным солевым раствором. Органический слой сушили над Na2SO4, фильтровали и упаривали для получения остатка, который очищали мгновенной хроматографией при элюции СН2Cl2/МеОН (от 99/1 до 97/3%), что дало 265 мг (выход 57%) соединения, указанного в заголовке, (72) в виде желтого твердого вещества.
1H-ЯМР (500 МГц, CD3OD) δ 0,91-1,24 (м, 9Н), 1,70-2,27 (м, 4Н), 2,47-2,85 (м, 1,5Н), 2,99-3,13 (м, 0,5Н), 3,39-3,53 (м, 0,5Н), 3,60-3,78 (м, 1,5Н), 3,85-4,04 (м, 1Н), 4,24-4,47 (м, 2Н), 4,53-4,97 (м, 4Н), 5,46 (с, 0,3Н), 3,88-4,02 (м, 0,1Н), 5,60-5,69 (м, 0,6Н), 6,80 (д, 1Н), 7,22-7,77 (м, 7Н). Аналитическая ВЭЖХ (колонка циано)(смесь 2 диастереомеров): 15,90, 16,23 мин. ЖХ-МС (ES+): m/е=571,2 (М+Н).
3-({1-[2-(4-Амино-3-хлорбензоиламино)-3,3-диметилбутирил]пирролидин-2-карбонил}амино)-4-оксомасляная кислота (73).
Образец 72 в количестве 40 мг (0,07 ммоль) гидролизовали по способу А (смотри схему XXIII) для получения 25 мг (выход 74%) соединения, указанного в заголовке. Аналитическая ВЭЖХ (колонка циано): 10,66 мин. ЖХ-МС (ES+): m/е=481,3 (М+Н).
Схема XVI
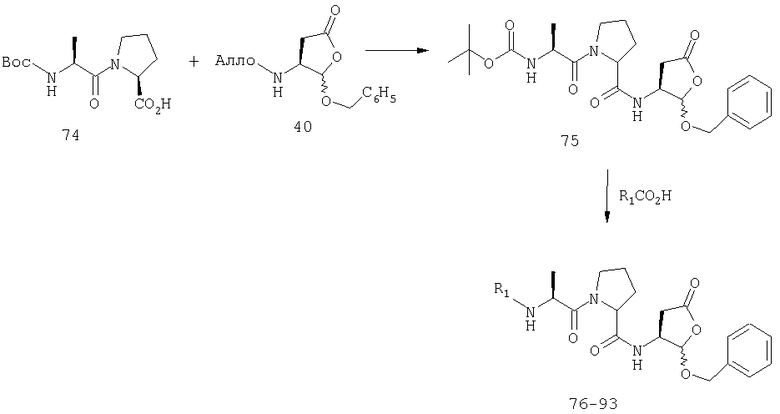
трет-Бутиловый эфир {2-[2-(2-бензоилокси-5-оксотетрагидрофуран-3-илкарбамоил)пирролидин-1-ил]-1-метил-2-оксоэтил}карбаминовой кислоты (75).
К раствору 40 (6,69 г, 23,0 ммоль) в безводном CH2Cl2 добавляли 1,3-диметилбарбитуровую кислоту (DMBA) (3,97 г, 25,4 ммоль) и Pd(PPh3)4 (1,12 г, 0,97 ммоль). Раствор перемешивали в атмосфере N2 при комнатной температуре в течение 15 мин, охлаждали до 0°С, затем добавляли Boc-ala-pro-OH (BaChem) (5,087 г, 17,8 ммоль), НОВТ (3,60 г, 26,7 ммоль) и EDC (5,12 г, 26,7 ммоль). Полученному раствору давали нагреться до комнатной температуры и перемешивали его в атмосфере N2 в течение 18 часов. Растворитель концентрировали под. вакуумом, остаток растворяли в EtOAc, затем промывали 0,5 н. NaHSO4 (2x), насыщенным NaHCO3 (2x) и насыщенным солевым раствором. Органический слой сушили над безводным Na2SO4 и упаривали для получения оранжевого масла (12,23 г). Мгновенная колоночная хроматография на силикагеле с использованием CH2Cl2/EtOAc (от 80/20 до 60/40) дала соединение, указанное в заголовке, 75 в виде желтого твердого вещества (7,28 г, выход 86%). 1H-ЯМР (500 МГц, CD3OD) δ 1,19-1,31 (м, 3Н), 1,42 (с, 9Н), 1,69-2,29 (м, 4Н), 2,45-2,67 (м, 0,9Н), 2,71-2,86 (м, 0,5Н), 2,99-3,10 (м, 0,6Н), 3,49-3,84 (м, 2H), 4,24-4,45 (м, 2,5Н), 4,57-4,73 (м, 1,5Н), 4,76-4,92 (м, 1H), 5,45 (с, 0,45Н), 5,63-5,68 (м, 0,55Н), 7,25-7,40 (м, 5Н). Аналитическая ВЭЖХ (колонка циано) (смесь 2 диастереомеров): 15,99, 16,33 мин. ЖХ-МС (ES+): m/е=476,3 (М+Н).
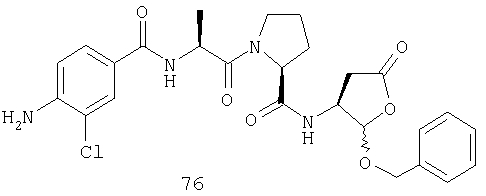
(2-Бензоилокси-5-оксотетрагидрофуран-3-ил)амид] [1-[2-(4-амино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (76).
Образец 75 в количестве 1,899 г (3,99 ммоль) в CH2Cl2 (20 мл) обрабатывали безводной TFA (5 мл), затем перемешивали при комнатной температуре в атмосфере N2 в течение 1 часа и упаривали досуха. Остаток повторно концентрировали из CH2Cl2 (3х) и сушили затем под вакуумом. Полученный остаток растворяли в СН2Cl2 (20 мл), охлаждали до 0°С, после чего обрабатывали DIEA (5,6 мл, 8 экв., 32,1 ммоль), 4-амино-3-хлорбензойной кислотой (0,910 г, 5,3 ммоль), НОВТ (0,824 г, 6,1 ммоль) и EDC (1,197 г, 6,23 ммоль). Полученную смесь нагревали до комнатной температуры и перемешивали в течение 18 часов. Растворитель удаляли под вакуумом, остаток растворяли в EtOAc, затем промывали дистиллированной водой (3х), 0,5 н. NaHSO4 (2х), насыщенным NaHCO3 (2x) и насыщенным солевым раствором. Органический слой сушили над Na2SO4, фильтровали и упаривали для получения остатка, который очищали мгновенной хроматографией при использовании СН2Cl2/МеОН (от 99/1 до 97/3%). Соединение, указанное в заголовке, было получено в виде белого твердого вещества (1,221 г, выход 58%). 1H-ЯМР (500 МГц, CD3OD) δ 1,15 (д, 0,25Н), 1,29-1,60 (м, 2,75Н), 2,41-2,54 (м, 0,5Н), 2,55-2,70 (м, 0,5H), 2,77 (дд, 0,5Н), 3,03 (ддд, 0,5Н), 3,59-3,75 (м, 1Н), 3,75-3,98 (м, 1Н), 4,26-5,01 (м, 5Н), 5,41-5,57 (м, 1Н), 5,60-5,76 (м, 0,5Н), 6,70-6,92 (м, 0,5Н), 7,15-7,48 (м, 5Н), 7,48-7,68 (м, 1Н), 7,68-7,88 (м, 1Н), 8,15-8,34 (м, 1Н). Аналитическая ВЭЖХ (колонка циано) (смесь 2 диастереомеров): 14,44, 14,89 мин. ЖХ-МС (ES+): m/е=529,3 (М+Н).
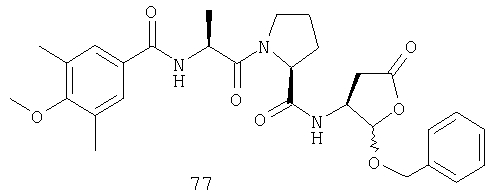
(2-Бензоилокси-5-оксотетрагидрофуран-3-ил)амид] [1-[2-(4-метокси-3,5-диметилбензоиламино)пропионил]пирролидин-2-карбоновую кислоту (77) синтезировали из 75 и 3,5-диметил-4-метоксибензойной кислоты в соответствии с процедурой, использованной для получения 76, и получили соединение, указанное в заголовке (1,18 г, выход 44%). 1H-ЯМР (500 МГц, CD3OD) δ 1,40 (м, 3Н), 1,67-2,41 (м, 4Н), 2,28 (с, 6Н), 2,48 (ддд, 0,5Н), 2,62 (дд, 0,5Н), 2,78 (ддд, 0,5Н), 3,04 (ддд, 0,5Н), 3,62-3,94 (м, 3Н), 3,71 (с, 3Н), 4,21-4,51 (м, 2Н), 4,59-4,85 (м, 4Н), 5,46 (с, 0,25Н), 5,52 (с, 0,25Н), 5,63 (д, 0,4Н), 5,67 (д, 0,1Н), 7,17-7,45 (м, 5Н), 7,45-7,65 (м, 2Н). Аналитическая ВЭЖХ (колонка циано) (смесь 2 диастереомеров): 15,06, 15,39 мин. ЖХ-МС (ES+): m/е=538 (М+Н).
Получение 4-ацетиламино-3-хлорбензойной кислоты
К раствору 4-амино-3-хлорбензойной кислоты (10,0 г, 58,3 ммоль) в безводном THF (100 мл) добавляли хлорангидрид уксусной кислоты (20,7 мл, 291,1 ммоль) и раствор перемешивали при комнатной температуре в течение 48 часов. Растворитель упаривали, продукт осаждали из гексанов, затем фильтровали и сушили для получения белого твердого вещества (11,73 г, выход 94%). 1H-ЯМР (500 МГц, CD3OD) δ 2,28 (с, 3Н), 7,92 (дд, 1Н), 7,99-8,16 (м, 2Н). Аналитическая ВЭЖХ (колонка циано): 7,84 мин.
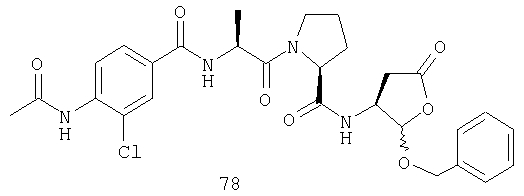
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-ацетиламино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (78).
Получали из 75 и 4-ацетиламино-3-хлорбензойной кислоты в соответствии с процедурой, использованной для получения 76, для получения соединения, указанного в заголовке (146 мг, выход 19%). 1H-ЯМР (500 МГц, CD3OD) δ 1,28-1,52 (м, 3Н), 1,68-2,38 (м, 4Н), 2,20 (с, 3Н), 2,41-2,88 (м, 1,5Н), 2,96-3,10 (м, 0,5Н), 2,96-3,10 (м, 0,5Н), 3,43-3,75 (м, 1Н), 3,80-3,96 (м, 1Н), 4,25-5,00 (м, %Н), 5,42-5,54 (м, 0,5Н), 5,63-5,78 (м, 0,5Н), 7,13-7,48 (м, 05Н), 7,79-8,14 (м, 2,5Н), 8,56-8,70 (м, 0,5Н). Аналитическая ВЭЖХ (колонка циано) (смесь 2 диастереомеров): 8,64 мин. ЖХ-МС (ES+): m/e=571,2 (М+Н).
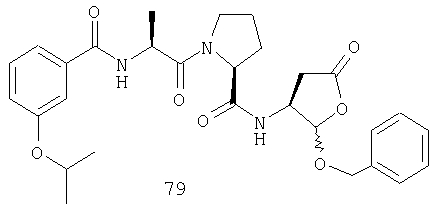
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(3-изопропоксибензоиламино)пропионил]пирролидин-2-карбоновой кислоты (79).
Получали из 75 и 3-изопропоксибензойной кислоты в соответствии с процедурой, использованной для получения 76, для получения соединения, указанного в заголовке (120 мг, выход 58%). 1H-ЯМР (500 МГц, CD3OD) δ 1,27 (д, 6Н), 1,33-1,52 (м, 3Н), 1,69-2,31 (м, 4Н), 2,49 (дд, 0,3Н), 2,63 (дд, 0,7Н), 2,78 (дд, 0,7Н), 3,03 (дд, 0,3Н), 3,43-3,73 (м, 1Н), 3,78-3,94 (м, 1Н), 4,27-4,47 (м, 2Н), 4,47-4,87 (м, 4Н), 5,47 (с, 0,7Н), 5,53 (д, 0,3Н), 5,64 (д, 0,8Н), 5,72 (д, 0,2Н), 6,98-7,12 (м, 1Н), 7,19-7,47 (м, 9Н). Аналитическая ВЭЖХ (колонка циано) (смесь 2 диастереомеров): 14,54, 14,85 мин. ЖХ-МС (ES+): m/е=538 (М+Н).
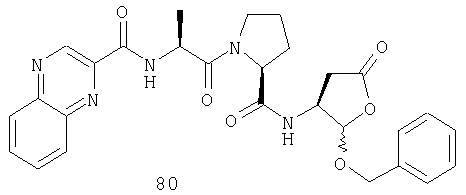
{2-[2-(2-Бензилокси-5-оксотетрагидрофуран-3-илкарбамоил)пирролидин-1-ил]-1-метил-2-оксоэтил}амид хиноксалин-2-карбоновой кислоты (80).
Получали из 75 и 2-хиноксалинкарбоновой кислоты в соответствии с процедурой, использованной для получения 76, для получения соединения, указанного в заголовке (122 мг, выход 60%). 1H-ЯМР (500 МГц, CD3OD) δ 1,12-1,67 (м, 3Н), 1,68-2,34 (м, 4Н), 2,35-2,70 (м, 0,85Н), 2,70-2,95 (м, 0,75Н), 3,06 (дд, 0,4Н), 3,41-3,49 (м, 2Н), 4,18-5,03 (м, 6Н), 5,47 (д, 0,5Н), 5,55 (д, 2Н), 5,67 (дд, 1Н), 5,71 (дд, 0,3Н), 7,03-7,53 (м, 5Н), 7,80-8,06 (м, 2Н), 8,06-8,34 (м, 2Н), 9,43-9,48 (м, 1Н). Аналитическая ВЭЖХ (колонка циано) (смесь 2 диастереомеров): 9,06 мин. ЖХ-МС (ES+): m/е=532,3 (М+Н).
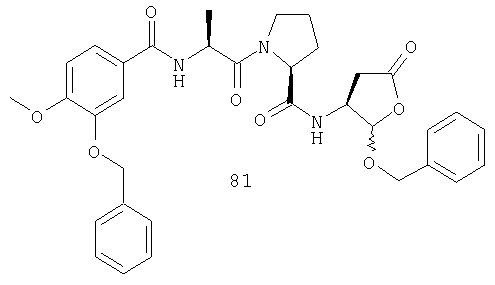
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-{3-бензилокси-4-метоксибензоиламино)пропионил]пирролидин-2-карбоновой кислоты (81).
Получали из 75 и 3-бензилокси-4-метоксибензойной кислоты в соответствии с процедурой, использованной для получения 76, для получения соединения, указанного в заголовке (142 мг, выход 58%). 1H-ЯМР (500 МГц, CD3OD) δ 1,14 (д, 0,3Н), 1,27-1,52 (м, 2,7Н), 1,66-2,30 (м, 4Н), 2,47 (дд, 0,4Н), 2,59 (дд, 0,6Н), 2,77 (дд, 0,6Н), 3,02 (дд, 0,4Н), 3,41-3,72 (м, 1Н), 3,72-3,99 (м, 2Н), 3,86 (с, 3Н), 4,19-4,86 (м, 5Н), 4,99-5,15 (м, 2Н), 5,45 (м, 0,8Н), 5,65 (м, 1,2Н), 6,98 (дд, 1Н), 7,11-7,63 (м, 12Н). Аналитическая ВЭЖХ (колонка циано) (смесь 2 диастереомеров): 12,28, 12,44 мин. ЖХ-МС (ES+): m/е=616,3 (М+Н).
4-Аллилокси-3,5-диметилбензойная кислота.
А смесь 4-гидрокси-3,5-диметилбензойной кислоты (3,32 г, 20 ммоль), бромистого аллила (7,26 г, 60 ммоль), хлористого бензилтриэтиламмония (455 мг, 2 ммоль) и К2СО3 (6,9 г, 50 ммоль) в DMF (50 мл) перемешивали при комнатной температуре в течение 16 часов. Смесь разводили этилацетатом (200 мл), промывали водой, насыщенным солевым раствором. Органический слой сушили над Na2SO4, фильтровали и упаривали под вакуумом для получения 5,3 г эфира в виде масла. Эфир кипятили с обратным холодильником с NaOH (5 г, 125 ммоль) в воде/метаноле (50 мл/50 мл) в течение 6 часов. Смесь упаривали под вакуумом для удаления метанола и полученный раствор разводили водой (200 мл), промывали этилацетатом/гексаном (30 мл/70 мл). Водный слой подкисляли при 0°С концентрированным раствором HCl до рН 2. Образовавшийся осадок собирали фильтрацией и промывали водой, сушили под глубоким вакуумом для получения 3,86 г (выход 94%) соединения, указанного в заголовке. 1H-ЯМР (500 МГц, CDCl3): δ 2,33 (с, 6Н), 4,35-4,37 (м, 2Н), 5,28-5,30 (м, Н), 5,42-5,46 (м, Н), 6,07-6,15 (м, Н), 7,79 (с, 2Н). Время задержки при аналитической ВЭЖХ: 11,28 мин. ЖХ-МС: m/z=205 (М-Н+).
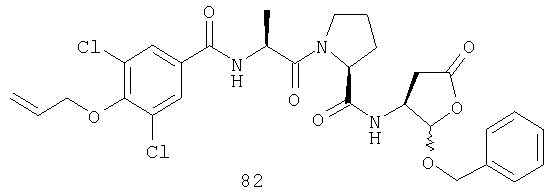
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-аллилокси-3,5-дихлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (82).
Получали из 75 и 4-аллилокси-3,5-дихлорбензойной кислоты в соответствии с процедурой, использованной для получения 76, для получения соединения, указанного в заголовке (208 мг, выход 47%). 1H-ЯМР (500 МГц, CDCl3) δ 1,05-1,58 (м, 3Н), 1,68-3,21 (м, 7Н), 3,39-3,90 (м, 3Н), 4,05-5,01 (м, 6Н), 5,22-5,62 (м, 3Н), 6,04-6,25 (м, 1Н), 6,94-7,63 (м, 8Н). Аналитическая ВЭЖХ (колонка циано) (смесь 2 диастереомеров): 9,69, 9,89 мин. ЖХ-МС(ES+): m/е=604,2 (М+Н).
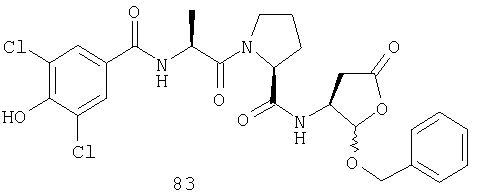
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(3,5-дихлор-4-гидроксибензоиламино)пропионил]пирролидин-2-карбоновой кислоты (83).
Образец 82 в количестве 140 мг (0,23 ммоль) растворяли в CH2Cl2 (4 мл) и обрабатывали DMBA (35,4 мг, 0,26 ммоль) и Pd(PPh3)4 (32 мг, 0,028 ммоль). Раствор перемешивали при 0°С в течение 15 мин, нагревали до комнатной температуры в течение 2 часов, затем разводили CH2Cl2 и промывали водой (2х) и насыщенным солевым раствором. Растворитель концентрировали под вакуумом и остаток очищали мгновенной хроматографией на силикагеле с использованием МеОН/СН2Cl2 (от 1/99 до 3/97) для получения соединения, указанного в заголовке (93,2 мг, выход 71%). 1H-ЯМР (500 МГц, CD3OD) δ 1,16 (д, 0,25Н), 1,28-1,49 (м, 2,75Н), 1,63-2,33 (м, 4Н), 2,48 (дд, 0,4Н), 3,39-3,59 (м, 0,2Н), 3,60-3,73 (м, 0,8Н), 3,73-3,96 (м, 1Н), 4,24-4,46 (м, 2Н), 4,57-4,92 (м, 7Н), 5,44 (с, 0,4Н), 5,50 (д, 0,4Н), 5,64 (д, 0,8Н), 5,75 (д, 0,5Н), 7,16-7,43 (м, 5Н), 7,78-7,89 (м, 1,6Н), 8,40-8,63 (м, 0,4Н). Аналитическая ВЭЖХ (колонка циано) (смесь 2 диастереомеров): 11,57, 11,82 мин. ЖХ-МС (ES+): m/e=564,1 (M+H).
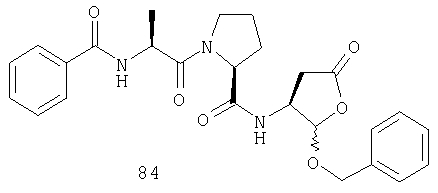
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-(2-бензоиламинопропионил)пирролидин-2-карбоновой кислоты (84).
Получали из 75 и бензоилхлорида в соответствии с процедурой, использованной для получения 76, для получения соединения, указанного в заголовке, в виде бесцветного масла (8 мг, 38% выход). 1H-ЯМР (500 МГц, CD3OD) δ 1,35-1,54 (м, 3Н), 1,72-2,30 (м, 4Н), 2,42-2,70 (м, 1,3Н), 2,74-2,84 (м, 0,5Н), 3,03 (дд, 0,2Н), 3,41-3,75 (м, 2Н), 3,81-3,96 (м, 1Н), 4,22-4,86 (м, 4Н), 5,46 (с, 0,3Н), 5,51-5,54 (м, 0,1Н), 5,66 (д, 0,5Н), 5,72 (д, 0,1Н), 7,20-7,57 (м, 7Н), 7,77-7,89 (м, 2Н), 8,42-8,67 (м, 1Н). Аналитическая ВЭЖХ (колонка циано) (смесь 2 диастереомеров): 15,23, 15,67 мин. ЖХ-МС (ES+): m/е=481,2 (M+H).
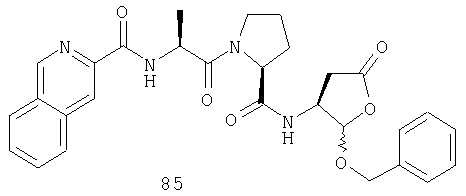
{2-(2-Бензилокси-5-оксотетрагидрофуран-3-илкарбамоил)пирролидин-1-ил]-1-метил-2-оксоэтил}амид изохинолин-1-карбоновой кислоты (85).
Получали из 75 и 1-изохинолинкарбоновой кислоты в соответствии с процедурой, использованной для получения 76, для получения соединения, указанного в заголовке (732 мг, выход 53%). 1H-ЯМР (500 МГц, CD3OD) δ 1,22-1,56 (м, 3Н), 1,70-2,34 (м, 4Н), 2,43-2,71 (м, 0,9Н), 2,73-2,89 (м, 0,5Н), 3,06 (ддд, 0,6Н), 3,42-3,81 (м, 2Н), 3,84-4,01 (м, 1Н), 4,29-5,00 (м, 5Н), 5,47 (д, 0,65Н), 5,55 (с, 0,3Н), 5,67 (д, 0,8Н), 5,72 (д, 0,25Н), 7,21-7,43 (м, 5Н), 7,49-7,83 (м, 2,8Н), 7,88-8,04 (м, 1,8Н), 8,45-8,54 (м, 0,8Н), 8,97-9,06 (м, 0,6Н). Аналитическая ВЭЖХ (смесь 2 диастереомеров): 15,71, 16,04 мин. ЖХ-МС (ES+): m/е=531,2 (М+Н).
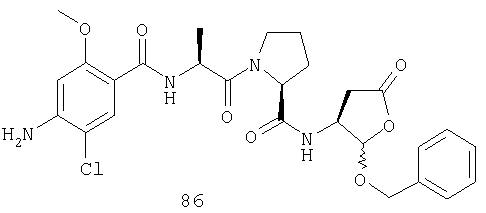
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-амино-5-хлор-2-метоксибензоиламино)пропионил]пирролидин-2-карбоновой кислоты (86).
Получали из 75 и 4-амино-5-хлор-2-метоксибензойной кислоты в соответствии с процедурой, использованной для получения 76, для получения соединения, указанного в заголовке (330 мг, выход 61%). 1H-ЯМР (500 МГц, CD3OD) δ 1,22 (д, 0,25Н), 1,29-1,50 (м, 0,75Н), 1,68-2,36 (м, 4Н), 2,38-2,89 (м, 1,5Н), 2,94-3,14 (м, 0,5Н), 3,37-3,98 (м, 6Н), 4,27-4,98 (м, 6Н), 5,44-5,50 (м, 0,4Н), 5,53-5,56 (с, 0,1Н), 5,60-5,75 (м, 0,5Н), 6,50 (с, 1Н), 7,17-7,45 (м, 4Н), 7,73-7,90 (м, 1Н), 8,49-8,70 (м, 1Н). Аналитическая ВЭЖХ (колонка циано) (смесь 2 диастереомеров): 16,39, 16,82 мин. ЖХ-МС (ES+): m/e=559,2 (M+H).
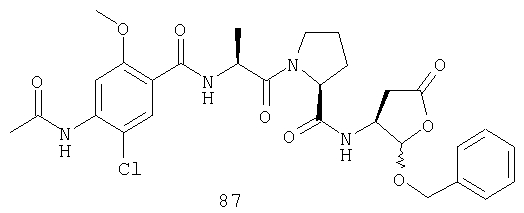
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-ацетиламино-5-хлор-2-метоксибензоиламино)пропионил]пирролидин-2-карбоновой кислоты (87).
Получали из 75 и 4-ацетиламино-5-хлор-2-метоксибензойной кислоты в соответствии с процедурой, использованной для получения 76, для получения соединения, указанного в заголовке (364 мг, выход 64%). 1H-ЯМР (500 МГц, CD3OD) δ 1,20-1,27 (м, 0,25), 1,35-1,49 (м, 0,75Н), 1,72-2,30 (м, 4Н), 2,23 (с, 3Н), 2,42-2,58 (м, 0,6Н), 2,59-2,68 (м, 0,5Н), 2,73-2,86 (м, 0,7Н), 2,99-3,11 (м, 0,7Н), 3,41-4,07 (м, 5Н), 4,29-4,97 (м, 5Н), 4,79-5,56 (м, 0,5Н), 5,65-5,73 (м, 0,5Н), 7,18-7,44 (м, 4,3Н), 7,90-8,09 (м, 2Н), 8,71-8,85 (м, 0,7Н). Аналитическая ВЭЖХ (колонка циано) (смесь 2 диастереомеров): 15,61, 16,01 мин. ЖХ-МС (ES+): m/е=601,1 (M+H).
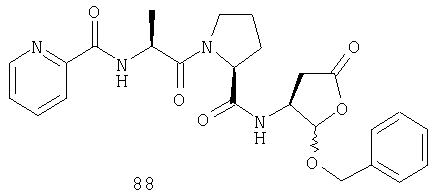
{2-[2-(2-Бензилокси-5-оксотетрагидрофуран-3-илкарбамоил)пирролидин-1-ил]-1-метил-2-оксоэтил}амид пиридин-2-карбоновой кислоты (88).
Получали из 75 и пиридин-2-карбоновой кислоты в соответствии с процедурой, использованной для получения 76, для получения соединения, указанного в заголовке (233 мг, выход 42%). 1H-ЯМР (500 МГц, CD3OD) δ 1,30-1,59 (м, 3Н), 1,68-2,36 (м, 4Н), 2,39-2,57 (м, 0,6Н), 2,57-2,69 (м, 0,35Н), 2,71-2,87 (м, 0,4Н), 3,05 (дд, 0,65Н), 3,39-3,93 (м, 3Н), 4,24-4,99 (м, 5Н), 5,49-5,55 (м, 0,8Н), 5,63-5,77 (м, 1,2Н), 7,17-7,46 (м, 5Н), 7,49-7,60 (м, 1Н), 7,89-7,99 (м, 1Н), 8,03-8,12 (м, 1Н), 8,58-8,67 (м, 1Н). Аналитическая ВЭЖХ (колонка циано) (смесь 2 диастереомеров): 8,63 мин. ЖХ-МС (ES+): m/e=481,3 (М+Н).
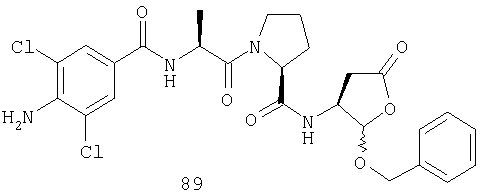
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид [1-[2-(4-амино-3,5-дихлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (89).
Получали из 75 и 3,5-дихлор-4-аминобензойной кислоты в соответствии с процедурой, использованной для получения 76, для получения соединения, указанного в заголовке (162 мг, выход 70%). 1H-ЯМР (500 МГц, CD3OD) δ 1,21-1,58 (м, 3Н), 1,58-2,37 (м, 4Н), 2,37-3,13 (м, 2Н), 3,43-3,74 (м, 1,5Н), 3,77-3,94 (м, 1Н), 4,28-4,51 (м, 1,5Н), 4,50-5,01 (м, 3Н), 5,41-5,77 (м, 1Н), 7,15-7,49 (м, 5Н), 7,66-7,88 (м, 2Н). Аналитическая ВЭЖХ (колонка циано) (смесь 2 диастереомеров): 8,36 мин. ЖХ-МС (ES+): m/е=563,2 (М+Н).
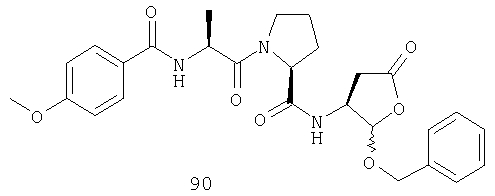
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-метоксибензоиламино)пропионил]пирролидин-2-карбоновой кислоты (90).
Получали из 75 и 4-метоксибензоилхлорида в соответствии с процедурой, использованной для получения 76, для получения соединения, указанного в заголовке (404 мг, 50%). 1Н-ЯМР (500 МГц, CD3OD) δ 1,19 (д, 0,3Н), 1,29-1,58 (м, 2,7Н), 1,58-2,38 (м, 4Н), 2,43-2,69 (м, 1Н), 2,74-2,86 (м, 0,6Н), 2,99-3,11 (м, 0,4Н), 3,39-3,75 (м, 1,5Н), 3,77-3,94 (м, 1Н), 3,84 (с, 3Н), 4,29-4,94 (м, 4,5Н), 5,45-5,55 (м, 4,5Н), 5,63-5,71 (м, 0,5Н), 5,73 (д, 0,1Н), 6,85-7,09 (м, 2Н), 7,19-7,44 (м, 4Н), 7,73-7,92 (м, 2Н), 8,26-8,44 (м, 1Н). Аналитическая ВЭЖХ (колонка циано) (смесь 2 диастереомеров): 15,18, 15,65 мин. ЖХ-МС (ES+): m/e=510,2 (M+H).
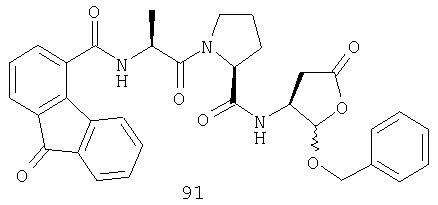
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-{2-[(9-оксо-9Н-флуорен-4-карбонил)амино]пропионил}пирролидин-2-карбоновой кислоты (91).
Получали из 75 и 9-оксо-9Н-флуоренкарбоновой кислоты в соответствии с процедурой, использованной для получения 76, для получения соединения, указанного в заголовке (403 мг, выход 44%). 1Н-ЯМР (500 МГц, CDCl3) δ 1,38-1,59 (м, 3Н), 1,75-2,37 (м, 4Н), 2,43-2,59 (м, 0,65Н), 2,59-2,72 (м, 0,35Н), 2,79-2,89 (м, 0,35Н), 3,01-3,11 (м, 0,65Н), 3,68-3,86 (м, 1Н), 3,92-4,09 (м, 1Н), 4,35-5,03 (м, 7Н), 5,42-5,90 (м, 1Н), 7,06-8,00 (м, 12Н). Аналитическая ВЭЖХ (колонка циано) (смесь 2 диастереомеров): 12,30 мин. ЖХ-МС (ES+): m/е=582,1 (М+Н).
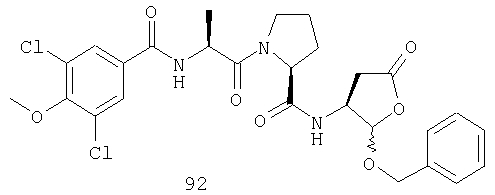
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(3,5-дихлор-4-метоксибензоиламино)пропионил]пирролидин-2-карбоновой кислоты (92).
Получали из 75 и 3,5-дихлор-4-метоксибензойной кислоты в соответствии с процедурой, использованной для получения 76, для получения соединения, указанного в заголовке (364 мг, выход 46%). 1H-ЯМР (500 МГц, CD3OD) δ 1,17 (д, 0,25Н), 1,28-1,53 (м, 2,75Н), 1,64-2,33 (м, 4Н), 2,39-2,94 (м, 1,5Н), 2,94-3,12 (м, 0,5Н), 3,41-3,74 (м, 2Н), 3,74-4,00 (м, 1Н), 3,91 (с, 3Н), 4,26-5,02 (м, 5Н), 5,42-5,81 (м, 1Н), 7,08 (д, 0,4Н), 7,21-7,43 (м, 4,6Н), 7,53-7,69 (м, 0,8Н), 7,85-7,97 (м, 1,2Н). Аналитическая ВЭЖХ (колонка циано) (смесь 2 диастереомеров): 10,79 мин. ЖХ-МС (ES+): m/е=578,2 (М+Н).
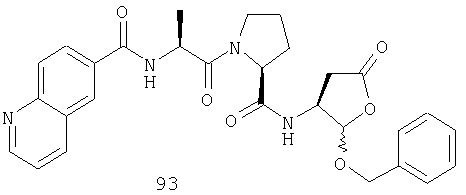
{2-(2-Бензилокси-5-оксотетрагидрофуран-3-илкарбамоил)пирролидин-1-ил]-1-метил-2-оксоэтил}амид хинолин-6-карбоновой кислоты (93).
Получали из 75 и 6-хинолинкарбоновой кислоты в соответствии с процедурой, использованной для получения 76, для получения соединения, указанного в заголовке (344 мг, выход 71%). 1H-ЯМР (500 МГц, CD3OD) δ 1,11-1,58 (м, 3Н), 1,69-2,40 (м, 4Н), 2,42-3,15 (м, 2Н), 3,80-4,01 (м, 1Н), 4,29-4,99 (м, 5Н), 5,44-5,54 (м, 0,5Н), 5,63-5,73 (д, 0,4Н), 5,73-5,79 (д, 0,1Н), 7,18-7,43 (м, 5Н), 7,56-7,67 (м, 1Н), 8,08 (д, 1Н), 8,13-8,25 (м, 1Н), 8,40-8,56 (м, 2Н), 8,88-8,99 (м, 1Н). Аналитическая ВЭЖХ (колонка циано) (смесь 2 диастереомеров): 10,27, 10,50 мин. ЖХ-МС (ES+): m/e=531,2 (M+H).
Схема XVII
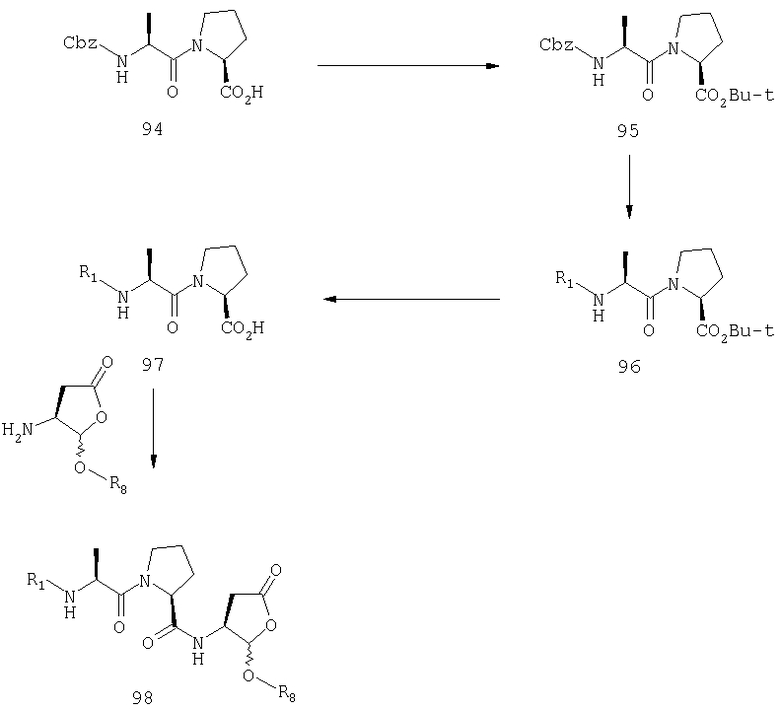
трет-Бутиловый эфир 1-(2-бензилоксикарбониламинопропионил)пирролидин-2-карбоновой кислоты (95).
Получали по способу, описанному Pierre Chevallet, Patrick Garrouste, Barbara Malawaska и Jean Martinez в Tetrahedron Letters, vol. 34, pp.7409-7412 (1993). Смесь Cbz-ala-pro-OH (10,0 г, 31,2 ммоль), бромистого трет-бутила (180 г, 1,31 моль), хлористого бензилтриэтиламмония (7,11 г, 31,2 ммоль) и К2СО3 (180 г, 1,30 моль) в N,N-диметилацетамиде (DMA) (225 мл) перемешивали при 55°С в течение 24 часов. Реакционную смесь охлаждали до комнатной температуры, разводили одним литром смеси льда и воды, экстрагировали этилацетатом (200 мл×3). Органический слой сушили над безводным Na2SO4, фильтровали и упаривали под вакуумом для получения 14 г масла, которое очищали мгновенной хроматографией с использованием гексана/этилацетата (от 95/5 до 50/50) для получения 11,73 г (выход 99,7%) соединения, указанного в заголовке, в виде прозрачного масла. 1H-ЯМР (500 МГц, CDCl3): δ 1,25-1,50 (м, 12 Н), 1,85-2,25 (м, 4Н), 3,42-3,70 (м, 2Н), 4,25-4,57 (м, 2Н), 5,07-5,11 (м, 2Н), 5,69 (д, Н), 7,28-7,38 (м, 5Н). Время задержки при аналитической ВЭЖХ: 11,07 мин. LC-MS: m/z=377 (М+Н+).
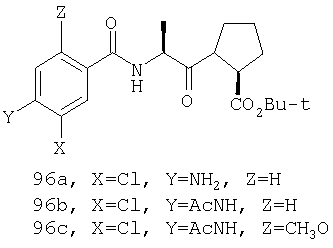
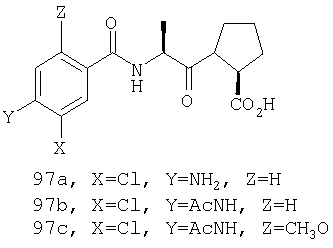
трет-Бутиловый эфир 1-[2-(4-амино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (96а).
К раствору 95 (10,50 г, 27,9 ммоль) в МеОН (100 мл) добавляли суспензию 10% Pd/C (5,00 г) в EtOAc (50 мл). Смесь перемешивали в атмосфере H2 в течение 48 часов, фильтровали через целит и растворитель упаривали для получения выхода воскообразного твердого вещества. Его растворяли в СН2Cl2 (100 мл) и DMF (50 мл) и раствор охлаждали до 0°С. Добавляли 4-амино-3-хлорбензойную кислоту (5,82 г, 27,2 ммоль), DIEA (14,58 мл, 83,7 ммоль), НОВТ (3,77 г, 27,9 ммоль) и EDC (6,68 г, 34,8 ммоль) и раствор перемешивали при 0°С в течение 15 мин, затем при комнатной температуре в течение 24 часов. Реакционную смесь разводили EtOAc, промывали NaHSO4 (2х), 10% NaHCO3 (2x) и насыщенным солевым раствором, затем сушили над MgSO4, фильтровали и упаривали. Сырой продукт очищали мгновенной колоночной хроматографией, используя CH2Cl2/MeOH (от 99/1 до 97/3%) для получения соединения, указанного в заголовке, в виде белого твердого вещества (7,75 г, выход 70%). 1Н-ЯМР (500 МГц, CD3CD) δ 1,27-1,67 (м, 12Н), 1,82-2,14 (м, 4Н), 3,48-3,85 (м, 2Н), 4,26-4,53 (м, 3Н), 4,81-4,98 (м, 1Н), 6,71 (д, 1Н), 7,15 (м, 1Н), 7,50 (дд, 1Н), 7,75 (д, 1Н). Аналитическая ВЭЖХ: 10,83 мин. ЖХ-МС (ES+): m/е=396,3 (МН-).
1-[2-(4-Амино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновая кислота (97а).
Получали из 96а обработкой TFA/CH2Cl2. После завершения реакции растворитель удаляли под вакуумом и остаток повторно концентрировали из толуола. Полученный остаток сушили под вакуумом до постоянного веса.
трет-Бутиловый эфир 1-[2-(4-ацетиламино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (96b).
Получали из 95 и 4-ацетиламино-3-хлорбензойной кислоты в соответствии со способом, использованным для получения 96а, для получения соединения, указанного в заголовке, в виде белого твердого вещества (9,18 г, выход 77%). 1H-ЯМР (500 МГц, CD3CD) δ 1,30-1,62 (м, 12Н), 1,85-2,16 (м, 3Н), 2,16-2,44 (м, 1Н), 2,27 (с, 3Н), 3,47-3,83 (м, 2Н), 4,34-4,54 (м, 1Н), 4,89 (м, 1Н), 7,27-7,39 (м, 1Н), 7,59-7,71 (м, 2Н), 7,83-7,97 (м, 1Н), 8,47 (д, 1Н). Аналитическая ВЭЖХ 9,43 мин.
1-[2-(4-Ацетилмино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновая кислота (97b).
Получали из 96b обработкой TFA/CH2Cl2. После завершения реакции растворитель удаляли под вакуумом и остаток повторно концентрировали из толуола. Полученный остаток сушили под вакуумом до постоянного веса.
4-Ацетиламино-5-хлор-2-метоксибензойная кислота.
Метиловый эфир 4-ацетиламино-5-хлор-2-метоксибензойной кислоты (2,09 г, 8,11 ммоль) растворяли в МеОН (110 мл), добавляли раствор LiOH (25,48 ммоль в 30 мл, 1:1 MeOH:H2O) и раствор перемешивали при комнатной температуре в течение 6 часов. Растворитель концентрировали под вакуумом, добавляли EtOAc, органическую фазу промывали 0,5 н. HCl и затем экстрагировали насыщенным NaHCO3 (2х). Водную фазу подкисляли 12 н. HCl до рН 1 и полученный преципитат экстрагировали CH2Cl2. Объединенные экстракты сушили над безводным Na2SO4, фильтровали и упаривали для получения соединения, указанного в заголовке, в виде белого твердого вещества (0,933 г, выход 50%). 1H-ЯМР (500 МГц, CDCl3) δ 2,31 (с, 3Н), 4,10 (с, 3Н), 7,78-7,92 (уш. с, 1Н), 8,17 (с, 1Н), 8,45 (с, 1Н). Аналитическая ВЭЖХ 5,62 мин.
трет-Бутиловый эфир 1-[2-(4-ацетиламино-5-хлор-2-метоксибензоиламино)пропионил]пирролидин-2-карбоновой кислоты (96с).
К раствору 95 (1,534 г, 4,07 ммоль) в МеОН (40 мл) добавляли 10%Pd/C (650 мг) и смесь перемешивали в атмосфере Н2 в течение 2 часов. Суспензию фильтровали через целит и упаривали для получения желтого масла. Это масло вводили в реакцию с 4-ацетил-5-хлор-2-метоксибензойной кислотой и проводили процедуру, использованную для получения 96а, для получения соединения, указанного в заголовке (497 мг, выход 52%). 1H-ЯМР (500 МГц, CD3CD) δ 1,46 (д, 3Н), 1,49 (с, 9Н), 1,80-2,01 (м, 3Н), 2,19-2,40 (м, 1Н), 2,22 (с, 3Н), 3,58-3,72 (м, 1Н), 3,78-3,89 (м, 1Н), 3,98-4,09 (с, 3Н), 4,31-4,45 (с, 1Н), 4,78-4,95 (м, 1Н), 7,89-8,10 (м, 2Н). Аналитическая ВЭЖХ 11,31 мин.
1-[2-(4-Ацетиламино-5-хлор-2-метоксибензоиламино)пропионил]пирролидин-2-карбоновая кислота (97с).
Получали из 96с обработкой TFA/CH2Cl2. После завершения реакции растворитель удаляли под вакуумом и остаток повторно концентрировали из толуола. Полученный остаток сушили под вакуумом до постоянного веса.
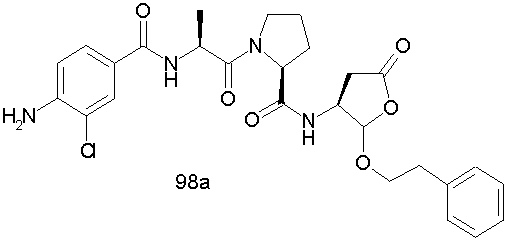
(5-Оксо-2-фенэтилокситетрагидрофуран-3-ил)амид 1-[2-(4-амино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (97с).
К раствору аллилового эфира (5-оксо-2-фенэтилокситетрагидрофуран-3-ил)карбаминовой кислоты (194 мг, 0,54 ммоль) (полученного, как описано для (40), с использованием фенилэтилового спирта) в безводном CH2Cl2 (5 мл) при 0°С добавляли DMBA (196 мг, 1,26 ммоль) и Pd(PPh3)4 (32 мг, 0,03 ммоль). Раствор перемешивали в течение 15 мин и добавляли раствор 97а (полученного из 96а обработкой TFA в CH2Cl2) (166 мг, 0,49 ммоль), DIEA (680 мкл, 3,90 ммоль) в СН2Cl2 (2 мл) и затем НОВТ (98 мг, 0,73 ммоль) и EDC (122 мг, 0,63 ммоль). Раствор перемешивали при 0°С в течение 15 мин и затем при комнатной температуре в течение 18 часов. Растворитель удаляли под вакуумом, остаток растворяли в EtOAc, затем промывали 0,5 н. NaHSO4 (2х), насыщенным NaHCO3 (2х) и насыщенным солевым раствором. Сушили над безводным Na2SO4 и упаривали для получения оранжевого твердого вещества, которое очищали мгновенной колоночной хроматографией с использованием СН2Cl2/MeOH (от 99/1 до 97/3%) для получения соединения, указанного в заголовке, в виде белого твердого вещества (190 мг, выход 73%). 1H-ЯМР (500 МГц, CD3OD) δ 1,29 (д, 0,6Н), 1,41 (д, 2,4Н), 1,78 (м, 1Н), 2,08 (м, 3Н), 2,56 (м, 1Н), 2,77 (дд, 1Н), 2,94 (т, 2Н), 3,53 (м, 0,3Н), 3,67 (м, 0,8Н), 3,85 (м, 2Н), 3,96-4,08 (м, 1Н), 4,40 (м, 2Н), 4,62 (м, 1Н), 4,67-4,79 (м, 1Н), 5,57 (д, 0,7Н), 5,60 (д, 0,3Н), 6,78 (дд, 1Н), 7,21 (м, 5Н), 7,58 (м, 1Н), 7,79 (м, 1Н), 8,26 (д, 1Н). Аналитическая ВЭЖХ: 14,52 мин. ЖХ-МС (ES+): m/е=543,2 (МН+).
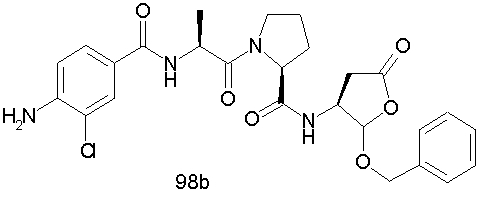
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-амино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98b).
Получали из син-диастереомера аллилового эфира (2-бензилокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты (40) и 97а, следуя способу, использованному для 98а.
Соединение, указанное в заголовке, выделяли в виде бледно-желтого твердого вещества (720 мг, выход 51%). 1H-ЯМР (500 МГц, CD3OD) δ 1,16 (д, 0,5Н), 1,40 (д, 2,5Н), 1,64-2,25 (м, 4Н), 2,61 (дд, 1Н), 2,79 (дд, 1Н), 3,37-3,59 (м, 1H, 3,59-3,74 (м, 1Н), 3,77-3,92 (м, 1H), 4,29-4,47 (м, 1Н, 4,47-5,02 (м, 4Н), 5,48 (с, 0,5Н), 5,66 (д, 1H), 5,63 (д, 0,5Н), 6,79 (д, 1H), 7,17-7,52 (м, 5Н), 7,48-7,62 (м, 1H), 7,68-7,83 (м, 1H). Аналитическая ВЭЖХ 15,98 мин. ЖХ-МС (ES+) m/e=529,2 (MH-).
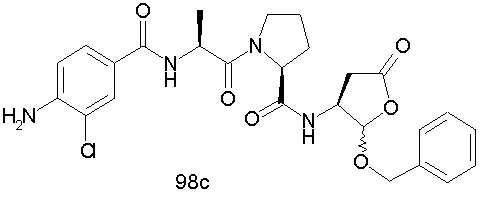
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-амино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98с).
Получали из анти-аллилового эфира (2-бензоилокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты (40) и 97а, для анти-диастереомера (186,6 мг, выход 46%). 1H-ЯМР (500 МГц, CD3OD) δ 1,30-1,52 (м, 3Н), 1,76-2,33 (м, 4Н), 2,41-2,59 (м, 1H), 2,90 (дд, 0,15Н), 3,04 (дд, 0,85Н), 3,44-3,75 (м, 1,5Н), 3,82-3,95 (м, 1H), 4,27-4,42 (м, 2Н), 4,42-4,56 (м, 0,5Н), 4,56-4,86 (м, 4Н), 5,42-5,55 (м, 1H), 6,79 (д, 1H), 7,21-7,42 (м, 4,6Н), 7,54-7,63 (м, 1,4Н), 7,76-7,83 (м, 0,65Н), 8,60-8,68 (м, 0,35Н). Аналитическая ВЭЖХ: 15,19 мин. ЖХ-МС (ES-): m/e=529,3 (MH+).
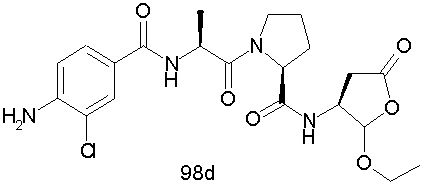
Аллиловый эфир 2-(этокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты.
Получали из трет-бутилового эфира 3-аллилоксикарбониламино-4-гидроксимасляной кислоты, как описано для (40) с использованием этанола. Хроматография с использованием гексана/этилацетата (от 95/5 до 80/20) дала 0,94 г анти-аллилового эфира 2-(этокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты (с более высокой отн. подв.), 1,96 г син-диастереомера (с меньшей отн. подв.) и 8,08 г смеси диастереомеров (суммарный выход 60%). 1H-ЯМР (500 МГц, CDCl3) для анти-диастереомера: δ 1,13-1,31 (м, 3Н), 2,31-2,45 (м, 1Н), 2,92-3,08 (м, 1Н), 3,52-3,72 (м, 1Н), 3,78-3,92 (м, 1Н), 4,10-4,25 (м, 1Н), 4,45-4,70 (м, 2Н), 5,00 (уш. с, 1Н), 5,12-5,45 (м, 3Н), 5,80-5,95 (м, 1Н); для син-диастереомера: δ 1,13-1,35 (м, 3Н), 2,38-2,50 (м, 1Н), 2,75-2,92 (м, 1Н), 3,60-3,73 (м, 1Н), 3,82-3,95 (м, 1Н), 4,40-4,70 (м, 3Н), 5,10-5,52 (м, 4Н), 5,80-5,94 (м, 1Н). LC-MS: m/z=230 (М+Н+) для обоих диастереомеров.
(2-Этокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-амино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98d).
Получали из аллилового эфира (2-этокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты и 97а, следуя способу, использованному для 98а. Соединение, указанное с заголовке, выделяли в виде белого твердого вещества (175 мг, 77% выход). 1Н-ЯМР (500 МГц, CD3OD) δ 1,13 (т, 0,5Н), 1,23 (т, 2,5Н), 1,36 (д, 0,5Н), 1,44 (д, 2,5Н), 1,75-2,38 (м, 4Н), 2,56 (дд, 1Н), 2,76 (дд, 1Н), 3,45-3,97 (м, 5Н), 4,47 (дд, 1Н), 4,59-4,67 (м, 1Н), 4,74 (кв, 1Н), 5,55 (д, 0,2Н), 5,56 (д, 0,8Н), 6,75-6,82 (м, 1Н), 7,56 (дд, 1Н), 7,77 (д, 1Н), 8,39 (д, 1Н). Аналитическая ВЭЖХ: 8,17 мин. ЖХ-МС (ES+): m/e=467,4 (MH+).
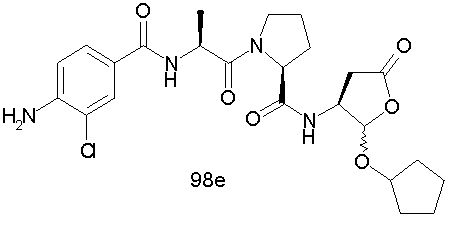
Аллиловый эфир (2-циклопентилокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты.
Получали из трет-бутилового эфира 3-аллилоксикарбониламино-4-гидроксимасляной кислоты, как описано для 40, с использованием циклопентанола для получения соединения, указанного в заголовке, в виде смеси диастереомеров. Мгновенная колоночная хроматография с использованием гексанов/EtOAc (от 90/10 до 80/20) дала син-диастереомер соединения, указанного в заголовке: син-диастереомер 1H-ЯМР (500 МГц, CDCl3) δ 1,5-2,0 (м, 8Н), 2,45 (дд, 1Н), 2,81 (дд, 0,9Н), 3,0 (дд, 0,1Н), 4,31 (м, 1Н), 4,59 (м, 4Н), 5,23 (м, 1Н), 5,32 (м, 1Н), 5,45 (с, 0,1Н), 5,51 (с, 0,9Н), 5,92, (м, 1Н) м.д.; анти-диастереомер 1Н-ЯМР (500 МГц, CDCl3) δ 1,50 (м, 2Н), 1,67 (м, 6Н), 2,36 (д, 1Н), 2,8 (дд, 0,08Н), 2,96 (дд, 0,92Н), 4,13 (м, 1Н), 4,25 (м, 1Н), 4,55 (уш., 2Н), 5,20 (д, 1H), 5,30 (м, 2Н), 5,43 (с, 0,92Н), 5,5 (д, 0,08Н), 5,89 (с, 1Н) м.д.
(2-Циклопентилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-амино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98е).
Получали из аллилового эфира (2-циклопентилокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты и 97а, следуя способу, использованному для 98а, для получения соединения, указанного в заголовке (280 мг, выход 51%). 1H-ЯМР (500 МГц, CD3OD) δ 1,38 (д, 0,5Н), 1,44 (д, 2,5Н), 1,49-2,35 (м, 12Н), 2,47 (дд, 0,7Н), 2,56 (дд, 0,3Н), 2,75 (дд, 0,3Н), 2,81-2,88 (м, 0,1Н), 2,97 (дд, 0,6Н), 3,47-3,76 (м, 0,2Н), 3,82-3,96 (м, 1Н), 4,10-4,40 (м, 2Н), 4,40-4,46 (м, 1Н), 5,44 (д, 0,5Н), 5,50 (д, 0,2Н), 5,65 (д, 0,3Н), 6,79 (д, 1Н), 7,54-7,64 (м, 1Н), 7,78 (д, 1Н), 8,21-8,31 (м, 1Н). Аналитическая ВЭЖХ: 15,02, 15,34 мин. ЖХ-МС (ES+): m/e=507,3 (МН+).
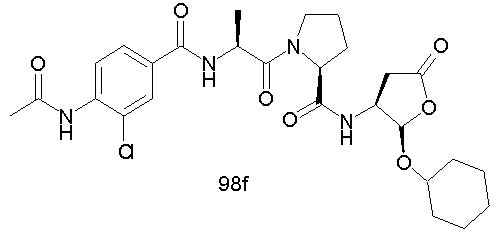
Аллиловый эфир (2-циклогексилокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты.
Получали из трет-бутилового эфира 3-аллилоксикарбониламино-4-гидроксимасляной кислоты, как описано для 40, с использованием циклогексанола для получения соединения, указанного в заголовке, в виде смеси диастереомеров (бледно-желтое масло) (4,62 г, выход 85%). Мгновенная колоночная хроматография с использованием циклогексанов/EtOAc (от 90/10 до 80/20) дала 394 мг (выход 7%) син-диастереомера соединения, указанного в заголовке. 1H-ЯМР (500 МГц, CDCl3) δ 1,11-2,09 (м, 10Н), 2,35-2,61 (дд, 1Н), 2,72-2,98 (дд, 1H), 3,60-3,83 (м, 1Н), 4,32-4,72 (м, 3Н), 5,06-5,43 (м, 2Н), 5,60 (д, 1Н), 5,82-6,03 (м, 1Н).
(2-Циклогексилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-ацетиламино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98f).
Получали из син-аллилового эфира (2-циклогексилокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты и 97b, следуя способу, использованному для 98а, для получения соединения, указанного в заголовке (121 мг, выход 33%). 1H-ЯМР (500 МГц, CD3OD) δ 1,06-1,61 (м, 9Н), 1,61-2,37 (м, 7Н), 2,22 (с, 3Н), 2,52-2,81 (м, 2Н), 3,49-3,78 (м, 2Н), 3,84-3,97 (м, 1Н), 4,42-4,57 (м, 1Н), 4,57-4,69 (м, 1Н), 5,67-5,81 (м, 1Н), 7,72-7,89 (м, 1Н), 7,89-8,12 (м, 2Н). Аналитическая ВЭЖХ: 9,84 мин. ЖХ-МС (ES+): m/e=563,3 (MH+).
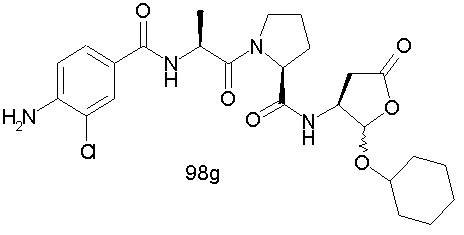
(2-Циклогексилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-амино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98g).
Получали из аллилового эфира син-(2-циклогексилокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты и 97a, следуя способу, использованному для 98а, для получения соединения, указанного в заголовке (153 мг, выход 47%). 1Н-ЯМР (500 МГц, CD3OD) δ 1,06-2,38 (м, 14Н), 1,42 (д, 3Н), 2,50-2,66 (м, 1Н), 2,69-2,82 (дд, 1Н), 3,06-3,75 (м, 2H), 3,80-3,94 (м, 1Н), 4,40-4,52 (м, 1Н), 4,57-4,65 (м, 1Н), 4,70-4,80 (м, 1Н), 5,72 (д, 1H), 6,71 (м, 1Н), 7,50-7,63 (м, 1Н), 7,78 (д, 0,6Н), 8,42 (д, 0,4Н). Аналитическая ВЭЖХ: 10,30 мин. ЖХ-МС (ES+): m/e=521,2 (МН+).
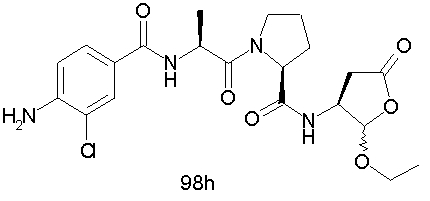
(2-Этокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-амино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98h).
Получали из аллилового эфира (2-этокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты и 97а, следуя способу, использованному для 98а. Соединение, указанное в заголовке, выделяли в виде белого твердого вещества (195 мг, выход 82%). 1H-ЯМР (500 МГц, CD3OD) δ 1,32-1,55 (м, 3Н), 1,58-1,77 (м, 3Н), 1,98-2,54 (м, 4Н), 2,68-2,76 (д, 0,3Н), 2,79-2,89 (м, 0,7Н), 2,96-3,10 (м, 0,7Н), 3,18-3,27 (дд, 0,3Н), 3,72-4,18 (м, 4Н), 4,46-5,12 (м, 3Н), 5,60 (с, 0,4Н), 5,74-5,84 (м, 0,6Н), 7,03 (д, 0,8Н), 7,75-7,86 (м, 1H), 8,01(д, 0,7Н), 8,35 (д, 0,3Н), 8,74 (д, 0,2Н). Аналитическая ВЭЖХ: 8,31 мин. ЖХ-МС (ES+): m/e=467,3 (MH+).
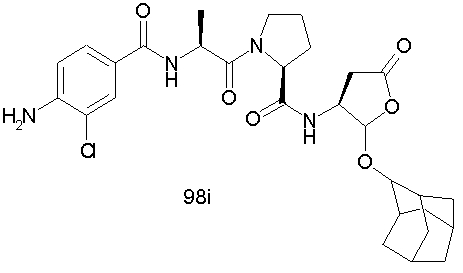
Аллиловый эфир [5-оксо-2-(трицикло[3,3,1,10,0]дец-2-илокси)тетрагидрофуран-3-ил]карбаминовой кислоты.
Получали из трет-бутилового эфира 3-аллилоксикарбониламино-4-гидроксимасляной кислоты, как описано для 40, с использованием 2-адамантола (6,21 г, 5 эквивалентов) для получения соединения, указанного в заголовке, в виде бледно-желтого масла (1,52 г, выход 61%). 1H-ЯМР (500 МГц, CDCl3) δ 1,38-2,22 (м, 14Н), 2,40 (д, 0,2Н), 2,53 (дд, 0,7Н), 2,87 (дд, 0,7Н), 2,87 (дд, 0,8Н), 3,00-3,12 (м, 0,3Н), 3,84-3,97 (м, 1Н), 4,40-4,71 (м, 3Н), 5,18-5,44 (м, 2Н), 5,53-5,69 (м, 1Н), 5,82-6,02 (м, 1Н).
[5-Оксо-2-(трицикло[3,3,1,10,0]дец-2-илокси)тетрагидрофуран-3-ил]амид 1-[2-(4-амино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98i).
Получали из аллилового эфира [5-оксо-2-(трицикло [3,3,1,10,0]дец-2-илокси)тетрагидрофуран-3-ил]карбаминовой кислоты и 97а, следуя способу, использованному для 98а. Соединение, указанное в заголовке, выделяли в виде белого твердого вещества (76 мг, выход 13%). 1Н-ЯМР (500 МГц, CD3OD) δ 1,38-2,22 (м, 14Н), 2,40 (д, 0,2Н), 2,53 (дд, 0,7Н), 2,87 (дд, 0,8Н), 3,00-3,12 (м, 0,3Н), 3,84-3,97 (м, 1Н), 4,40-4,71 (м, 3Н), 5,18-5,44 (м, 2Н), 5,53-5,69 (м, 1H), 5,82-6,02 (м, 1Н). Аналитическая ВЭЖХ: 11,89 мин. ЖХ-МС (ES+): m/e=573,2 (MH+).
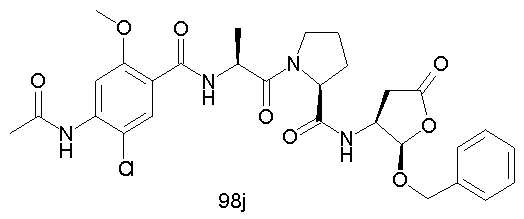
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-ацетиламино-5-хлор-2-метоксибензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98j).
Получали из трет-бутилового эфира син-{2-[2-(2-бензилокси-5-оксотетрагидрофуран-3-илкарбамоил)пирролидин-1-ил]-1-метил-2-оксоэтил}карбаминовой кислоты и 97с, следуя процедуре, использованной для 98а, для получения соединения, указанного в заголовке (222 мг, выход 82%). 1Н-ЯМР (500 МГц, CD3OD) δ 1,23 (д, 0,6Н), 1,42 (д, 2,4Н), 1,72-2,27 (м, 4Н), 2,23 (с, 3Н), 2,63 (дд, 1H), 2,77-2,88 (м, 1H), 3,43-3,52 (м, 0,5Н), 3,56-3,71 (м, 1,5Н), 3,74-3,85 (м, 1H), 3,98 (с, 3Н), 4,38-4,50 (м, 1,5Н), 4,51-4,92 (м, 4,5Н), 5,63-5,76 (м, 1H), 7,23-7,40 (м, 5Н), 7,97 (с, 1H), 8,45 (д, 1H), 8,69-8,80 (м, 1H). Аналитическая ВЭЖХ: 11,63 мин. ЖХ-МС (ES+): m/е=601,2 (МН+).
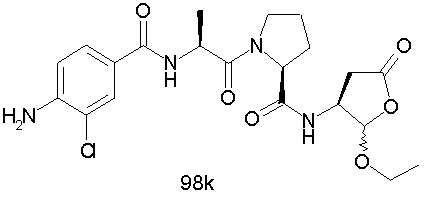
Синтез (2-этокси-5-оксотетрагидрофуран-3-ил)амида 1-[2-(4-амино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98k).
Получали из аллилового эфира (2-этокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты и 97а, следуя способу, использованному для 98а, для получения 175 мг соединения, указанного в заголовке (59%). 1H-ЯМР (500 МГц, 1:1 CDCl3:CD3OD) δ 1,10-1,28 (м, 3Н), 1,42 (д, 0,6Н), 1,46 (д, 2,4Н), 1,75-2,45 (м, 4Н), 2,45-2,70 (м, 1Н), 2,80-3,05 (м, 1Н), 3,50-3,95 (м, 4Н), 4,20-4,75 (м, 3Н), 4,75-4,90 (м, 1Н), 5,32 (с, 0,8Н), 5,38 (с, 0,2Н), 6,80 (д, 1Н), 7,55-7,84 (м, 2Н). Аналитическая ВЭЖХ: 10,47 мин. ЖХ-МС (ES+): m/е=467,3 (М+Н+).
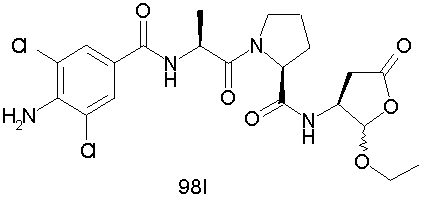
Синтез (2-этокси-5-оксотетрагидрофуран-3-ил)амида 1-[2-(4-амино-3,5-дихлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98l).
Получали из аллилового эфира (2-этокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты и трет-бутилового эфира 1-[2-(4-амино-3,5-дихлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты в соответствии со способом, использованным для 98а, для получения 158 мг соединения, указанного в заголовке (выход 54%). 1Н-ЯМР (500 МГц, 1:1 CDCl3:CD3OD) δ 1,08-1,30 (м, 3Н), 1,32-1,52 (м, 3Н), 1,72-2,44 (м, 4Н), 2,40-3,05 (м, 2Н), 3,50-3,97 (м, 4Н), 4,25-4,70 (м, 3Н), 4,70-4,86 (м, 1Н), 5,33 (с, 0,4Н), 5,47 (с, 0,1Н), 5,56 (д, 0,4Н), 5,62 (д, 0,1Н), 7,50 (с, 1Н), 7,80 (с, 1Н). Аналитическая ВЭЖХ: 10,84 мин. ЖХ-МС (ES-): m/e=501,2 (М+Н+).
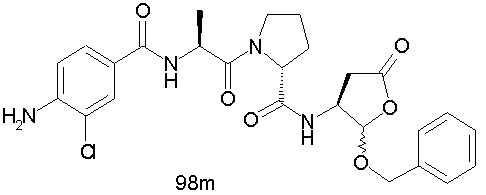
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-амино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98m).
Получали в соответствии с процедурой, использованной для получения 98а, используя Cbz-Ala-D-pro-OH для получения 230 мг соединения, указанного в заголовке (выход 69%). 1H-ЯМР (500 МГц, 1:1 CDCl3:CD3OD) δ 1,30 (д, 1,2Н), 1,45 (д, 1,8Н), 1,62-2,40 (м, 4Н), 2,40-3,10 (м, 2Н), 3,30-3,97 (м, 2Н), 4,33-4,95 (м, 5Н), 5,30 (с, 0,5Н), 5,68 (д, 0,5Н), 6,80 (д, 1Н), 7,25-7,95 (м, 7Н). Аналитическая ВЭЖХ: 11,56, 11,91 мин. ЖХ-МС (ES+): m/e=529,2 (М+Н+).
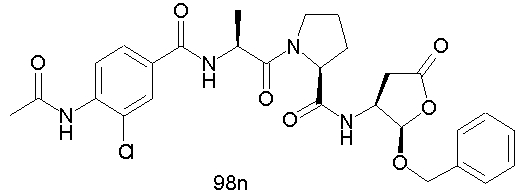
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-ацетиламино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98n).
Получали из 97b и аллила син-(2-бензилокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты в соответствии с процедурой, использованной для получения 98а, для получения 210 мг соединения, указанного в заголовке (выход 64%). 1H-ЯМР (500 МГц, 1:1 CDCl3:CD3OD) δ 1,33 (д, 0,6Н), 1,44 (д, 2,4Н), 1,68-2,40 (м, 4Н), 2,26 (с, 3Н), 2,55-3,05 (м, 2Н), 3,40-3,90 (м, 2Н), 4,20-4,95 (м, 5Н), 5,68 (д, 0,8Н), 5,84 (д, 0,2Н), 7,15-8,30 (м, 8Н). Аналитическая ВЭЖХ: 15,67 мин. ЖХ-МС (ES+): m/е=571,1 (М+Н+).
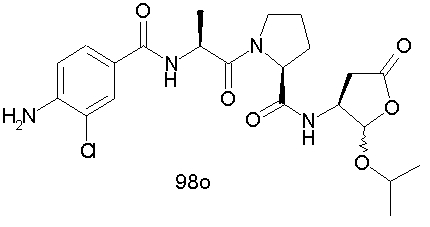
Аллиловый эфир (2-изопропокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты
Получали, как описано, для соединения 40, используя изопропанол, для получения 3,80 граммов (выход 81%) соединения, указанного в заголовке, в виде бесцветного масла. 1H-ЯМР (500 МГц, CDCl3) δ 1,10-1,35 (м, 6Н), 2,32-2,60 (м, 1Н), 2,82 (дд, 0,5Н), 3,02 (дд, 0,5Н), 3,82-4,11 (м, 1Н), 4,48-4,66 (м, 3Н), 5,20-5,36 (м, 2Н), 5,54 (дд, 1Н), 5,82-6,05 (м, 1Н). ЖХ-МС (ES+): m/e=244,2 (М+Н+).
(2-Изопропокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-амино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98о).
Получали из 97а и аллилового эфира (2-изопропокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты в соответствии с процедурой, использованной для получения 98а, для получения 200 мг соединения, указанного в заголовке (выход 66%). 1H-ЯМР (500 МГц, 1:1 CDCl3:CD3OD) δ 1,05-1,35 (м, 6Н), 1,35-1,50 (м, 3Н), 1,70-2,45 (м, 4Н), 2,45-3,05 (м, 2Н), 3,55-4,10 (м, 3Н), 4,15-4,88 (м, 4Н), 5,48 (с, 0,4Н), 5,58 (с, 0,1H), 5,64 (д, 0,4Н), 5,70 (д, 0,1Н), 6,78 (д, 1Н), 7,58 (д, 1Н), 7,80 (с, 1Н). Аналитическая ВЭЖХ: 12,19, 12,40 мин. ЖХ-МС (ES+): m/e=581,2 (М+Н+).
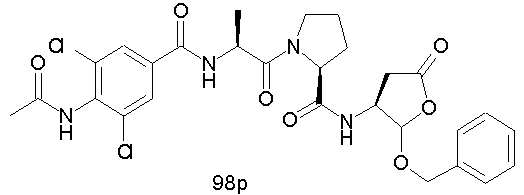
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-ацетиламино-3,5-дихлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98р).
Получали из трет-бутилового эфира 1-[2-(4-ацетиламино-3,5-дихлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты и аллилового эфира син-(2-бензилокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты в соответствии с процедурой, использованной для получения 98а, для получения 230 мг соединения, указанного в заголовке (выход 72%). 1H-ЯМР (500 МГц, 1:1 CDCl3:CD3OD) δ 1,36 (д, 0,6Н), 1,47 (д, 2,4Н), 1,68-2,47 (м, 4Н), 2,23 (с, 3Н), 2,60-3,15 (м, 2Н), 3,40-3,90 (м, 2Н), 4,15-4,95 (м, 5Н), 5,68 (д, 0,8Н), 5,84 (д, 0,2Н), 7,20-7,98 (м, 7Н). Аналитическая ВЭЖХ: 13,07 мин. ЖХ-МС (ES+): m/е=605,1 (М+Н+).
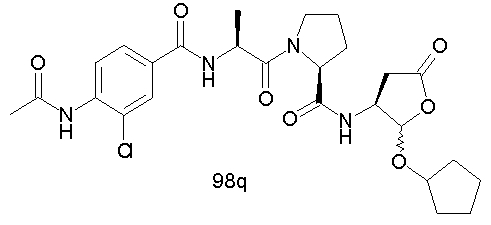
(2-Циклопентилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-ацетиламино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98q).
Получали из 97b и аллилового эфира (2-циклопентилокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты в соответствии с процедурой, использованной для получения 98а, для получения 215 мг соединения, указанного в заголовке (выход 69%). 1H-ЯМР (500 МГц, 1:1 CDCl3:CD3OD) δ 1,35-1,90 (м, 11Н), 1,90-2,35 (м, 4Н), 2,24 (с, 3Н), 2,40-3, 10 (м, 2Н), 3,50-3,95 (м, 3Н), 4,15-4,90 (м, 3Н), 5,44 (с, 0,55Н), 5,56 (с, 0,15Н), 5,64 (д, 0,22Н), 5,71 (д, 0,08Н), 7,70-8,25 (м, 3Н). Аналитическая ВЭЖХ: 12,13 мин. ЖХ-МС (ES+): m/e=549,2 (М+Н+).
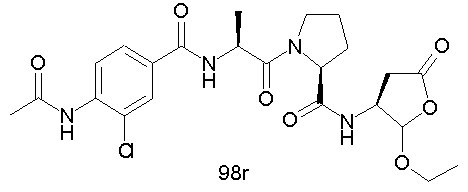
Синтез (2-этокси-5-оксотетрагидрофуран-3-ил)амида 1-[2-(4-ацетиламино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98r).
Получали из 97b и аллилового эфира син-(2-этокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты в соответствии с процедурой, использованной для получения 98а, для получения 68 мг соединения, указанного в заголовке (24%). 1H-ЯМР (500 МГц, 1:1 CDCl3:CD3OD) δ 1,13 (т, 0,6Н), 1,28 (т, 2,4Н), 1,38 (д, 0,6Н), 1,48 (д, 2,4Н), 1,75-2,40 (м, 4Н), 2,22 (с, 3Н), 2,55-2,88 (м, 2Н), 3,50-3,92 (м, 4Н), 4,40-4,90 (м, 3Н), 5,57 (д, 0,8Н), 5,61 (д, 0,2Н), 7,60-8,20 (м, 3Н). Аналитическая ВЭЖХ: 8,64 мин. ЖХ-МС (ES+): m/e=509,2 (М+H+).
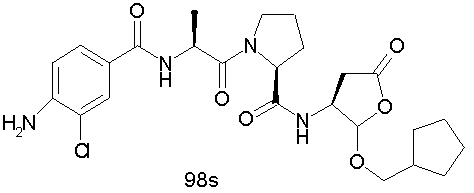
Получение аллилового эфира (2-циклопентил-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты.
Получали из трет-бутилового эфира 3-аллилоксикарбониламино-4-глдроксимасляной кислоты, как описано для соединения 40, с использованием циклопентилметанола (6,5 мл, 60 ммоль) для получения 2,98 граммов (общий выход 52%) соединения, указанного в заголовке, в виде смеси эпимеров. Очистка дала 0,97 граммов (выход 17%) 4(S),5(R) в виде бесцветного масла. 1H-ЯМР (500 МГц, CDCl3) δ 1,19 (м, 2Н), 1,54 (м, 4Н), 1,71 (м, 2Н), 2,16 (м, 1Н), 2,44 (дд, J=17,2, 10,4 Гц, 1Н), 2,82 (дд, J=17,2, 8,4 Гц, 1Н), 3,44 (дд, J=9,3, 7,2 Гц, 1Н), 3,71 (дд, J=9,3, 7,2 Гц, 1Н), 4,57 (м, 3Н), 5,32 (м, 3Н), 5,41 (д, J=5,2 Гц, 1Н), 5,91 (ддт, J=17,1, 10,4, 5 Гц, 1Н) м.д. ЖХ-МС (ES+): m/e=284.
Так же выделяли смесь эпимеров (0,66 граммов, выход 11%) и 4(S),5(S) эпимер (1,35 граммов, выход 24%) в виде воскообразного твердого вещества. 1H-ЯМР (500 МГц, CDCl3) δ 1,20 (м, 2Н), 1,54 (м, 4Н), 1,69 (м, 2Н), 2,10 (м, 1Н), 2,37 (д, J=8,1 Гц, 1Н), 2,97 (дд, J=18,0, 7,6 Гц, 1Н), 3,42 (дд, J=7,3, 1,7 Гц, 1Н), 3,49 (м, 2Н), 3,64 (дд, J=9,0, 7,3 Гц, 1Н), 4,19 (уш., 1Н), 4,55 (м, 2Н), 5,25 (м, 2Н), 5,36 (с, 1Н), 5,87 (м, 1Н) м.д. ЖХ-МС (ES+): m/е=284 (М+Н).
(2-Циклопентилметокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-амино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98s).
Получали из 97а и аллилового эфира син-(2-циклопентилметокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты в соответствии с процедурой, использованной для получения 98а, для получения 195 мг соединения, указанного в заголовке (выход 51%). 1H-ЯМР (500 МГц, 1:1 CDCl3:CD3OD) δ 1,15-1,90 (м, 11H), 1,90-2,40 (м, 5Н), 2,55-2,78 (м, 2Н), 3,50-3,90 (м, 4Н), 4,38-4,92 (м, 3Н), 5,53 (д, 0,8Н), 5,57 (д, 0,2Н), 6,78 (д, 1Н), 7,50-8,15 (м, 2Н). Аналитическая ВЭЖХ: 10,48 мин. ЖХ-МС (ES+): m/е=521,2 (М+Н+).
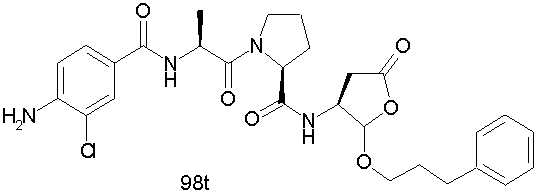
Аллиловый эфир (5-оксо-2-(3-фенилпропокси)тетрагидрофуран-3-ил)карбаминовой кислоты.
Получали из трет-бутилового эфира 3-аллилоксикарбониламино-4-гидроксимасляной кислоты, как описано для соединения 40, с использованием 3-фенилпропанола для получения 1,15 граммов (выход 32%) соединения, указанного в заголовке, в виде бесцветного масла. 1H-ЯМР (500 МГц, CDCl3) δ 1,82-2,05 (м, 2Н), 2,38 (дд, 1Н), 2,68 (м, 2Н), 2,82 (дд, 1Н), 3,55-3,65 (м, 1Н), 3,82-3,92 (м, 1Н), 4,48-4,72 (м, 3Н), 5,12-5,59 (м, 3Н), 5,82-6,03 (м, 1Н), 7,11-7,45 (м, 5Н). Аналитическая ВЭЖХ: 9,08 мин. ЖХ-МС (ES+): m/e=320,2 (М+Н+).
(5-Оксо-2-(3-фенилпропоксил)тетрагидрофуран-3-ил)амид 1-[2-(4-амино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98t).
Получали из 97b и аллилового эфира син-(5-оксо-2-(3-фенилпропоксил)тетрагидрофуран-3-ил)карбаминовой кислоты в соответствии с процедурой, использованной для получения 98а, для получения 200 мг соединения, указанного в заголовке (выход 57%). 1H-ЯМР (500 МГц, 1:1 CDCl3:CD3OD) δ 1,34 (д, 0,6Н), 1,44 (д, 2,4Н), 1,75-2,40 (м, 6Н), 2,50-2,95 (м, 4Н), 3,47-3,95 (м, 4Н), 4,38-4,82 (м, 3Н), 5,52 (д, 0,8Н), 5,56 (д, 0,2Н), 6,75-8,25 (м, 8Н). Аналитическая ВЭЖХ: 10,79 мин. ЖХ-МС (ES+): m/e=557,2 (М+Н+).
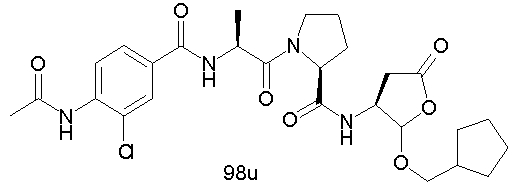
Синтез (2-циклопентилметокси-5-оксотетрагидрофуран-3-ил)амида 1-[2-(4-ацетиламино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98u).
Получали из 97b и аллилового эфира син-(2-циклопентилметокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты в соответствии с процедурой, использованной для получения 98а, для получения 215 мг соединения, указанного в заголовке (выход 67%). 1H-ЯМР (500 МГц, 1:1 CDCl3:CD3OD) δ 1,38 (д, 0,6Н), 1,47 (д, 2,4Н), 1,11-1,88 (м, 8Н), 1,92-2,40 (м, 5Н), 2,24 (с, 3Н), 2,53-2,86 (м, 2Н), 3,30-3,90 (м, 4Н), 4,38-4,89 (м, 3Н), 5,53 (д, 0,8Н), 5,60 (д, 0,2Н), 7,68-8,22 (м, 3Н). Аналитическая ВЭЖХ: 9,90 мин. ЖХ-МС (ES+): m/е=563,3 (М+Н+).
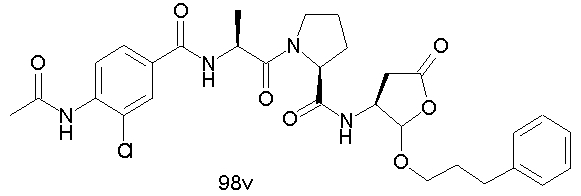
(5-Оксо-2-(3-фенилпропоксил)тетрагидрофуран-3-ил)амид 1-[2-(4-ацетиламино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98v).
Получали из трет-бутилового эфира 1-[2-(4-ацетиламино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты и аллилового эфира син-(5-оксо-2-(3-фенилпропоксил)тетрагидрофуран-3-ил)карбаминовой кислоты в соответствии с процедурой, использованной для получения 98а, для получения 238 мг соединения, указанного в заголовке (выход 75%). 1H-ЯМР (500 МГц, 1:1 CDCl3:CD3OD) δ 1,33 (д, 0,6Н), 1,56 (д, 2,4Н), 1,78-2,45 (м, 6Н), 2,27 (с, 3Н), 2,53-2,97 (м, 4Н), 3,53-3,94 (м, 4Н), 4,47-4,86 (м, 3Н), 5,53 (д, 0,8Н), 5,62 (д, 0,2Н), 7,11-8,26 (м, 8Н). Аналитическая ВЭЖХ: 10,27 мин. ЖХ-МС (ES-): m/е=599,2 (М+Н+).
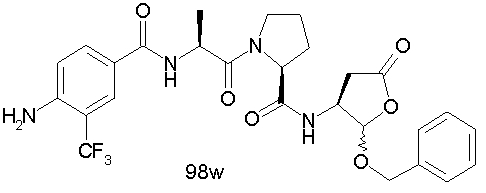
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-амино-3-трифторметилбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98w).
Получали из трет-бутилового эфира {2-[2-(2-бензилокси-5-оксотетрагидрофуран-3-илкарбамоил)пирролидин-1-ил]-1-метил-2-оксоэтил}карбаминовой кислоты и 4-амино-3-трифторметилбенэойной кислоты в соответствии с процедурой, использованной для получения 98а, для получения 56 мг соединения, указанного в заголовке (выход 48%). 1Н-ЯМР (500 МГц, 1:1 CDCl3:CD3OD) δ 1,20-1,55 (м, 3Н), 1,75-2,50 (м, 4Н), 2,50-3,10 (м, 2Н), 3,50-4,00 (м, 2Н), 4,30-5,00 (м, 5Н), 5,42 (с, 0,4Н), 5,51 (с, 0,2Н), 5,62 (д, 0,3Н), 5,78 (д, 0,1Н), 6,84 (д, 1Н), 7,20-8,15 (м, 7Н). Аналитическая ВЭЖХ: 14,90, 15,20 мин. ЖХ-МС (ES+): m/e=563,2 (М+Н+).
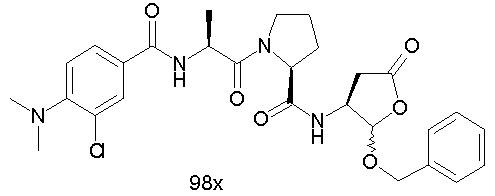
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(3-хлор-4-диметиламинобензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98х).
Получали из трет-бутилового эфира {2-[2-(2-бензилокси-5-оксотетрагидрофуран-3-илкарбамоил)пирролидин-1-ил]-1-метил-2-оксоэтил}карбаминовой кислоты и 3-хлор-4-диметиламинобензойной кислоты в соответствии с процедурой, использованной для получения 98а, для получения 82 мг соединения, указанного в заголовке (выход 44%). 1H-ЯМР (500 МГц, 1:1 CDCl3:CD3OD) δ 1,18-1,53 (м, 3Н), 1,70-2,40 (м, 4Н), 2,55-3,10 (м, 2Н), 2,84 (с, 6Н), 3,45-3,94 (м, 2Н), 4,25-4,95 (м, 5Н), 5,46 (с, 0,3Н), 5,51 (с, 0,2Н), 5,63 (д, 0,4Н), 5,73 (д, 0,1Н), 7,05 (д, 1Н), 7,15-7,95 (м, 7Н). Аналитическая ВЭЖХ: 11,85, 12,19 мин. ЖХ-МС (ES+): m/e=557,3 (М+Н+).
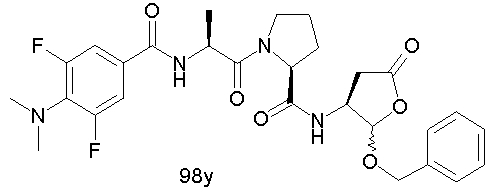
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-диметиламино-3,5-дифторбензоиламино)пропионил]-пирролидин-2-карбоновой кислоты (98y).
Получали из трет-бутилового эфира {2-[2-(2-бензилокси-5-оксотетрагидрофуран-3-илкарбамоил)пирролидин-1-ил]-1-метил-2-оксоэтил}карбаминовой кислоты и 4-диметиламино-3,5-дихлорбензойной кислоты в соответствии с процедурой, использованной для получения 98а, для получения 106 мг соединения, указанного в заголовке (выход 65%). 1Н-ЯМР (500 МГц, 1:1 CDCl3:CD3OD) δ 1,10-1,55 (м, 3Н), 1,75-2,30 (м, 4Н), 2,45-3,15 (м, 2Н), 2,84 (с, 6Н), 3,40-3,95 (м, 2Н), 4,15-4,95 (м, 5Н), 5,47 (с, 0,35Н), 5,54 (с, 0,15Н), 5,67 (д, 0,4Н), 5,77 (д, 0,1Н), 7,20-7,70 (м, 7Н). Аналитическая ВЭЖХ: 12,21, 12,51 мин. ЖХ-МС (ES+): m/е=559,2 (М+H+).
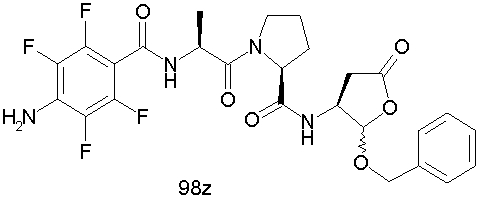
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-амино-2,3,5,6-тетрафторбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98z).
Получали из трет-бутилового эфира {2-[2-(2-бензилокси-5-оксотетрагидрофуран-3-илкарбамоил)пирролидин-1-ил]-1-метил-2-оксоэтил}карбаминовой кислоты и 4-амино-2,3,5,6-тетрафторбензойной кислоты в соответствии с процедурой, использованной для получения 98а, для получения 58 мг соединения, указанного в заголовке (выход 73%). 1H-ЯМР (500 МГц, 1:1 CDCl3:CD3OD) δ 1,30-1,50 (м, 3Н), 1,62-2,35 (м, 4Н), 2,45-3,12 (м, 2Н), 3,50-3,90 (м, 2Н), 4,20-4,95 (м, 5Н), 5,42 (с, 0,4Н), 5,52 (с, 0,1Н), 5,64 (д, 0,4Н), 5,82 (д, 0,1Н), 7,25-7,65 (м, 5H). Аналитическая ВЭЖХ: 16,56, 16,90 мин. ЖХ-МС (ES+): m/е=567,2 (М+Н+).
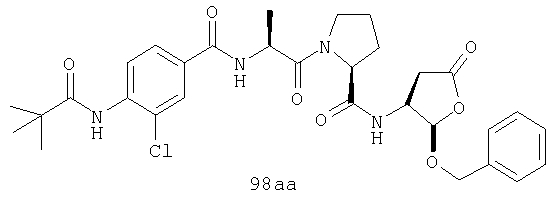
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-{2-[3-хлор-4-(2,2-диметилпропиониламино)бензоиламино]пропионил}пирролидин-2-карбоновой кислоты (98аа).
К суспензии 98b (100 мг, 0,19 ммоль) и поли(4-винилпиридина) (200 мг) добавляли хлорангидрид триметилуксусной кислоты (70 мкл, 0,57 ммоль). Полученную суспензию перемешивали в течение ночи при комнатной температуре, затем фильтровали и разводили EtOAc (25 мл). Органический слой промывали 10% NaHCO3 (2×25 мл), насыщенным NaCl (1×25 мл), сушили (MgSO4) и упаривали досуха для получения 98 мг (выход 85%) соединения, указанного в заголовке, после хроматографии. 1H-ЯМР (500 МГц, 1:1 CDCl3:CD3OD) δ 1,10-1,55 (м, 3Н), 1,38 (с, 9Н), 1,65-2,40 (м, 4Н), 2,60-3,10 (м, 2Н), 3,46-3,88 (м, 2Н), 4,20-4,95 (м, 5Н), 5,62 (д, 0,8Н), 5,78 (д, 0,2Н), 7,15-8,30 (м, 8Н). Аналитическая ВЭЖХ: 11,82 мин. ЖХ-МС (ES+): m/е=613,2 (М+Н+).
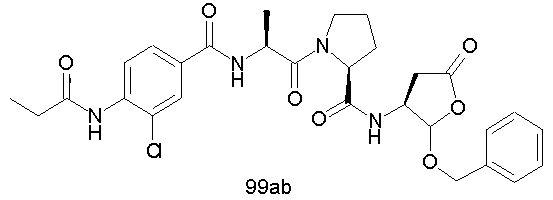
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(3-хлор-4-пропиониламино)бензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98ab).
Получали из 98b и хлорангидрида пропионовой кислоты в соответствии с процедурой, использованной для получения 98аа, для получения 104 мг соединения, указанного в заголовке (выход 95%). 1H-ЯМР (500 МГц, 1:1 CDCl3: CD3OD) δ 1,16 (т, 0,6Н), 1,18 (д, 0,6Н), 1,27 (т, 2,4Н), 1,38 (д, 2,4Н), 1,72-2,35 (м, 4Н), 2,45-2,58 (м, 2Н), 2,58-3,05 (м, 2Н), 3,45-3,85 (м, 2Н), 4,20-4,88 (м, 5Н), 5,64 (д, 0,8Н), 5,76 (д, 0,2Н), 7,20-8,35 (м, 8Н). Аналитическая ВЭЖХ: 9,89 мин. ЖХ-МС (ES+): m/е=585,2 (М+Н-).
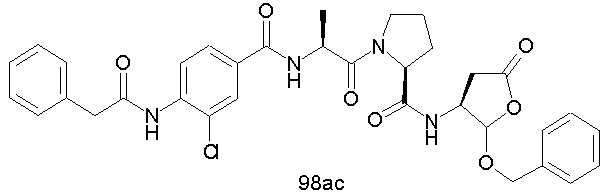
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(3-хлор-4-фенилацетиламино)бензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98ас).
Получали из 98b и хлорангидрида фенилуксусной кислоты в соответствии с процедурой, использованной для получения 98аа, для получения 85 мг соединения, указанного в заголовке (выход 77%). 1H-ЯМР (500 МГц, 1:1 CDCl3: CD3OD) δ 1,18 (д, 0,6Н), 1,40 (д, 2,4Н), 1,72-2,38 (м, 4Н), 2,58-3,05 (м, 2Н), 3,46-3,78 (м, 2Н), 3,85 (с, 2Н), 4,18-4,92 (м, 5Н), 5,63 (д, 0,8Н), 5,75 (д, 0,2Н), 7,15-8,34 (м, 13Н). Аналитическая ВЭЖХ: 11,63 мин. ЖХ-МС (ES+): m/e=647,2 (М+Н+).
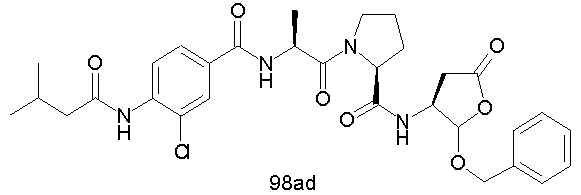
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(3-хлор-4-метилбутириламино)бензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98ad).
Получали из 98b и хлорангидрида изовалериановой кислоты в соответствии с процедурой, использованной для получения 98аа, для получения 60 мг соединения, указанного в заголовке (выход 58%). 1H-ЯМР (500 МГц, 1:1 CDCl3:CD3OD) δ 1,07 (д, 5Н), 1,15 (д, 0,8Н), 1,27 (д, 1Н), 1,45 (д, 2,2Н), 1,67-2,30 (м, 5Н), 2,34 (д, 2Н), 2,58-3,05 (м, 2Н), 3,48-3,88 (м, 2Н), 4,10-4,98 (м, 5Н), 5,68 (д, 0,7Н), 5,78 (м, 0,3Н), 7,18-8,33 (м, 8Н). Аналитическая ВЭЖХ: 10,74 мин. ЖХ-МС (ES+): m/e=613,2 (М+Н+).
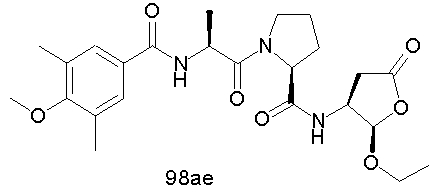
(2-Этокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-метокси-3,5-диметилбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98ае).
Получали из трет-бутилового эфира 1-[2-(4-метокси-3,5-диметилбензоиламино)пропионил]пирролидин-2-карбоновой кислоты и аллилового эфира син-(2-этокси-5-оксо-тетрагидрофуран-3-ил)карбаминовой кислоты в соответствии с процедурой, использованной для получения 98а, для получения 174 мг (выход 81%) соединения, указанного в заголовке. 1H-ЯМР (500 МГц, CDCl3): δ 1,04 (т, 0,45Н), 1,27 (т, 2,55Н), 1,34-1,45 (м, 3Н), 1,95-2,45 (м, 10Н), 2,78-2,84 (м, Н), 3,60-3,90 (м, 8Н), 4,50-4,70 (м, 2Н), 4,90-4,94 (м, Н), 5,45 (д, 0,85Н), 5,61 (д, 0,15Н), 6,99 (д, Н), 7,15 (д, Н), 7,45 (с, 2Н). Время задержки при аналитической ВЭЖХ: 10,09 мин. ЖХ-МС: m/z=476 (М+Н+).
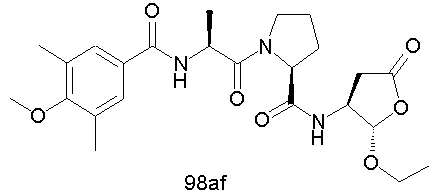
(2-Этокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-метокси-3,5-диметилбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98af).
Получали из трет-бутилового эфира 1-[2-(4-метокси-3,5-диметилбензоиламино)пропионил]пирролидин-2-карбоновой кислоты и аллилового эфира анти-(2-этокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты в соответствии с процедурой, использованной для получения 98а, для получения 168 мг (выход 77%) соединения, указанного в заголовке. 1Н-ЯМР (500 МГц, CDCl3): δ 1,10-1,35 (м, 3Н), 1,35-1,60 (м, 3Н), 1,90-2,45 (м, 10Н), 2,60-3,00 (м, Н), 3,55-3,95 (м, 8Н), 4,15-4,60 (м, 2Н), 4,83-5,00 (м, Н), 5,29 (с, Н), 6,95-7,06 (м, Н), 7,50 (с, 2Н), 7,92 (д, Н). Время задержки при аналитической ВЭЖХ: 10,14 мин. ЖХ-МС: m/z=476 (М+Н+).
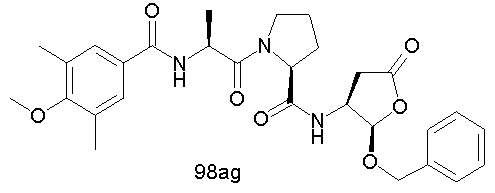
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-метокси-3,5-диметилбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98ag).
Получали из трет-бутилового эфира 1-[2-(4-метокси-3,5-диметилбензоиламино)пропионил]пирролидин-2-карбоновой кислоты и аллилового эфира син-(2-бензилокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты (40) в соответствии с процедурой, использованной для получения 98а, для получения 406 мг (выход 71%) соединения, указанного в заголовке. 1H-ЯМР (500 МГц, CDCl3): δ 1,09 (д, 0,6Н), 1,35 (м, 2,4Н), 1,90-2,20 (м, 3Н), 2,22-2,50 (м, 10Н), 2,84-2,90 (м, Н), 3,52-3,62 (м, 1,6Н), 3,65-3,80 (м, 3,4Н), 4,10-4,40 (м, Н), 4,50-4,75 (м, 3Н), 4,82-4,95 (м, 2Н), 5,54 (д, 0,8Н), 5,80 (д, 0,2Н), 6,87 (д, Н), 7,10-7,40 (м, 6Н), 7,45 (с, 2Н). Время задержки при аналитической ВЭЖХ: 16,71 мин. ЖХ-МС: m/z=538 (М+Н+).
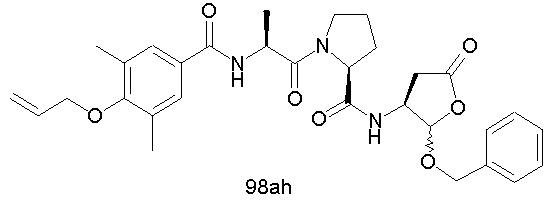
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-аллилокси-3,5-диметилбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98ah).
Получали из трет-бутилового эфира 1-[2-(4-аллилокси-3,5-диметилбензоиламино)пропионил]пирролидин-2-карбоновой кислоты и 40 в соответствии с процедурой, использованной для получения 98a, для получения 264 мг (выход 46%) соединения, указанного в заголовке. 1H-ЯМР (500 МГц, CDCl3): δ 1,09-1,43 (м, 3Н), 1,90-2,20 (м, 3Н), 2,20-2,38 (м, 7Н), 2,38-2,52 (м, Н), 2,80-2,95 (м, Н), 3,52-3,67 (м, Н), 3,70-3,80 (м, Н), 4,10-4,40 (м, 2Н), 4,40-4,95 (м, 5Н), 5,26-5,55 (м, 3Н), 6,00-6,14 (м, Н), 6,87 (д, Н), 7,10-7,70 (м, 8Н). Время задержки при аналитической ВЭЖХ: 18,56 и 18,92 мин. ЖХ-МС: m/z=564 (М+Н+).
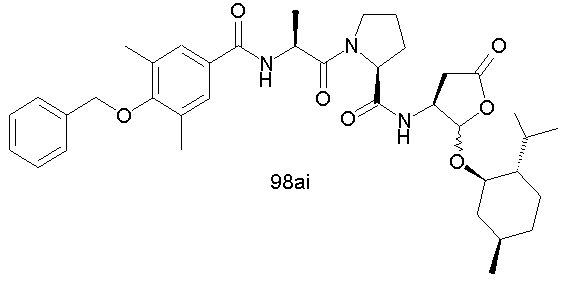
Аллиловый эфир {2-[1R-(2S-изопропил-5R-метилциклогексилокси)]-5-оксотетрагидрофуран-3-ил}карбаминовой кислоты.
Получали из трет-бутилового эфира 3-аллилоксикарбониламино-4-гидроксимасляной кислоты, как описано для 40, используя (1R, 2S, 5R)-(-)-ментол, для получения 0,32 г син-диастереомера (с меньшей отн. подв.) соединения, указанного в заголовке и 4,25 г смеси анти/син-диастереомеров (общий выход 67%). 1H-ЯМР (500 МГц, CDCl3) смеси: δ 0,70-1,05 (м, 13Н), 1,20-1,47 (м, 2Н), 1,60-1,80 (м, 2Н), 1,94-2,20 (м, 2Н), 2,35-2,50 (м, Н), 2,82-3,04 (м, Н), 3,40-3,61 (м, Н), 4,43-4,70 (м, 3Н), 5,15-5,35 (м, 2Н), 5,48-5,61 (м, Н), 5,90-5,94 (м, Н); для син-диастереомера 0,70-1,05 (м, 13Н), 1,20-1,47 (м, 2Н), 1,60-1,80 (м, 2Н), 1,94-2,18 (м, 2Н), 2,40-2,50 (м, Н), 2,82-2,92 (м, Н), 3,54-3,61 (м, Н), 4,45-4,70 (м, 3Н), 5,18-5,35 (м, 2Н), 5,58-5,61 (м, Н), 5,90-5,93 (м, Н). ЖХ-МС: m/z=340 (М+Н+) для смеси анти/син-диастереомеров.
4-Бензилокси-3,5-диметилбензойная кислота.
Получали по способу, использованному для синтеза 4-аллилокси-3,5-диметилбензойной кислоты, для получения 2,43 г (выход 56%) соединения, указанного в заголовке. 1Н-ЯМР (500 МГц, CDCl3): δ 4,87 (с, 2Н), 7,36-7,48 (м, 5Н), 7,92 (с, 2Н). ЖХ-МС: m/z=255 (М-Н+).
{2-[1R-(2S-Изопропил-5R-метилциклогексилокси)]-5-оксотетрагидрофуран-3-ил}амид 1-[2-(4-бензилокси-3,5-диметилбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98ai).
Получали из трет-бутилового эфира 1-[2-(4-бензилокси-3,5-диметилбензоиламино)пропионил]пирролидин-2-карбоновой кислоты и аллилового эфира {2-[1R-(2S-изопропил-5R-метилциклогексилокси)]-5-оксотетрагидрофуран-3-ил}карбаминовой кислоты в соответствии с процедурой, использованной для получения 98а, для получения 130 мг (выход 39%) соединения, указанного в заголовке. 1H-ЯМР (500 МГц, CDCl3): δ 0,45-1,10 (м, 12Н), 1,15-1,90 (м, 8Н), 1,90-2,45 (м, 12Н), 2,80-2,84 (м, Н), 3,50-3,85 (м, 3Н), 4,45-4,70 (м, 2Н), 4,80-4,95 (м, 3Н), 5,62 (д, Н), 7,05 (д, Н), 7,17 (д, Н), 7,30-7,60 (м, 7Н), 7,62-7,75 (м, Н). Время задержки при аналитической ВЭЖХ: 15,90 и 16,08 мин. ЖХ-МС: m/z=662 (М+Н+).
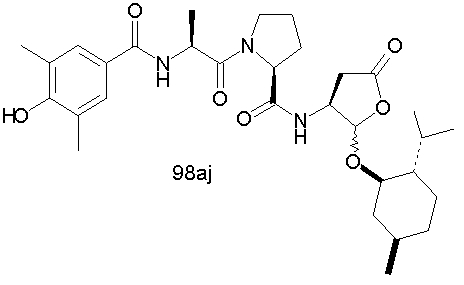
{2-[1R-(2S-Изопропил-5R-метилциклогексилокси)]-5-оксотетрагидрофуран-3-ил}амид 1-[2-{4-гидрокси-3,5-диметилбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98aj).
Раствор {2-[1R-(2S-изопропил-5R-метилциклогексилокси)]-5-оксотетрагидрофуран-3-ил}амида 1-[2-(4-бензилокси-3,5-диметилбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (110 мг, 0,17 ммоль) в этилацетате (2 мл) перемешивали с 10% палладием на угле (20 мг) в атмосфере водорода в течение 24 часов, затем фильтровали через целит и упаривали под вакуумом. Полученный остаток очищали хроматографией с использованием СН2Cl2/метанола (от 99/1 до 96/4) для получения 58 мг соединения, указанного в заголовке. 1H-ЯМР (500 МГц, CDCl3): δ 0,70-1,00 (м, 10Н), 1,20-1,80 (м, 10Н), 1,90-2,40 (м, 11Н), 2,82-2,86 (м, Н), 3,57-3,78 (м, 3Н), 4,55-4,67 (м, 2Н), 4,90-4,94 (м, Н), 5,29 (с, Н), 5,62 (д, Н), 6,90 (д, Н), 7,14 (д, Н), 7,42 (с, 2Н). Время задержки при аналитической ВЭЖХ: 12,84 и 13,05 мин. ЖХ-МС: m/z=572 (М+Н+).
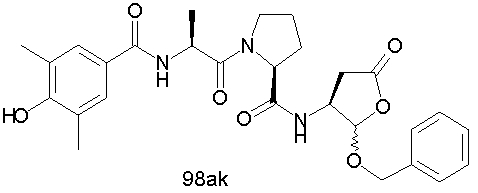
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-гидрокси-3,5-диметилбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98ak).
Раствор 98ah (230 мг, 0,41 ммоль) в CH2Cl2 (10 мл) обрабатывали DMBA (65 мг, 0,42 ммоль) и Pd(PPh3)4 (50 мг) при комнатной температуре в течение 20 часов. Смесь концентрировали досуха под вакуумом и очищали мгновенной хроматографией с использованием СН2Cl2/метанола (от 99,5/0,5 до 97/3) для получения 181 мг соединения, указанного в заголовке. 1H-ЯМР (500 МГц, CDCl3): δ 1,08 (д, 0,75Н), 1,20-1,35 (м, 2,25Н), 1,70-2,50 (м, 12Н), 2,80-2,90 (м, Н), 3,50-3,65 (м, Н), 3,70-3,80 (м, Н), 4,10-4,25 (м, Н), 4,35-4,98 (м, 3Н), 5,53 (д, 0,75Н), 5,85 (д, 0,25Н), 6,81 (д, Н), 7,13-7,60 (м, 8Н). Время задержки при аналитической ВЭЖХ: 10,38 и 10,56 мин. ЖХ-МС: m/z=524 (М+Н+).
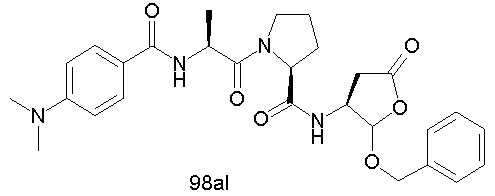
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-диметиламинобензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98аl).
Получали из трет-бутилового эфира 1-[2-(4-диметиламинобензоиламино)пропионил]пирролидин-2-карбоновой кислоты и аллилового эфира син-(2-бензилокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты в соответствии с процедурой, использованной для получения 98а, для получения 60 мг (45% выход). 1H-ЯМР (500 МГц, CDCl3): δ 1,04 (д, 0,75Н), 1,35 (д, 2,25Н), 1,80-2,50 (м, 5Н), 2,75-3,20 (м, 8Н), 3,45-3,75 (м, 2Н), 4,05-4,20 (м, 0,5Н), 4,30-4,80 (м, 3,5Н), 4,80-4,95 (м, 1,5Н), 5,52 (д, Н), 5,75-6,00 (м, 0,5Н), 6,60-6,90 (м, 3Н), 7,10-7,50 (м, 4Н), 7,50-7,80 (м, 2Н). Время задержки при аналитической ВЭЖХ: 10,46 мин. ЖХ-МС: m/z=523 (М+H+).
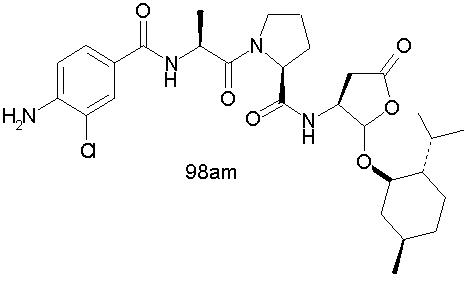
{2R-[1R-(2S-Изопропил-5R-метилциклогексилокси)]-5-оксотетрагидрофуран-3-ил}амид 1-[2-(4-амино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98am).
Получали из трет-бутилового эфира 1-[2-(4-амино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (97а) и аллилового эфира син-{2-[1R-(2S-изопропил-5R-метилциклогексилокси)]-5-оксотетрагидрофуран-3-ил}карбаминовой кислоты в соответствии с процедурой, использованной для получения 98а, для получения 103 мг (выход 67%) соединения, указанного в заголовке. 1H-ЯМР (500 МГц, CDCl3): δ 0,70-1,10 (м, 12Н), 1,20-1,50 (м, 5Н), 1,50-1,85 (м, 2Н), 1,90-2,30 (м, 5Н), 2,75-2,85 (м, Н), 3,50-3,70 (м, 2Н), 3,70-3,82 (м, Н), 4,20-4,65 (м, 4Н), 4,80-4,95 (м, Н), 5,61 (д, Н), 6,70-6,73 (м, Н), 6,95 (д, Н), 7,15 (д, Н), 7,49-7,51 (м, Н), 7,73 (с, Н). Время задержки при аналитической ВЭЖХ: 12,88 мин. ЖХ-МС: m/z=577 (М+Н+).
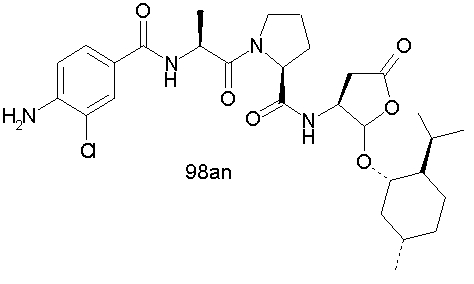
Аллиловый эфир {2-[1S-(2R-изопропил-5S-метилциклогексилокси)]-5-оксотетрагидрофуран-3-ил}карбаминовой кислоты.
Получали из трет-бутилового эфира 3-аллилоксикарбониламино-4-гидроксимасляной кислоты, как описано для 40, с использованием (1S, 2R, 5S)-(+)-ментола для получения 855 мг анти-диастереомера (с большей отн. подв.) соединения, указанного в заголовке, 503 мг син-диастереомера (с меньшей отн. подв.) и 459 мг смеси анти/син-диастереомеров (общий выход 66%). 1H-ЯМР (500 МГц, CDCl3) анти-диастереомер: δ 0,74-1,00 (м, 12Н), 1,20-1,45 (м, 2Н), 1,58-1,72 (м, 2Н), 1,98-2,12 (м, 2Н), 2,18-2,40 (м, Н), 2,98-3,03 (м, Н), 3,49-2,54 (м, Н), 4,17 (уш., Н), 4,59 (уш., 2Н), 4,97 (уш., Н), 5,22-5,33 (м, 2Н), 5,58 (с, Н), 5,87-5,93 (м, Н); для син-диастереомера 0,75-1,02 (м, 12Н), 1,25-1,45 (м, 2Н), 1,57-1,70 (м, 2Н), 2,00-2,16 (м, 2Н), 2,40-2,52 (м, Н), 2,78-2,90 (м, Н), 3,40-3,50 (м, Н), 4,58 (уш., 2Н), 5,24-5,35 (м, 2Н), 5,51-5,52 (д, Н), 5,85-5,98 (м, Н). ЖХ-МС: m/z=340 (М+Н*) для обоих диастереомеров.
{2R-[1S-(2R-Изопропил-5S-метилциклогексилокси)]-5-оксотетрагидрофуран-3-ил}амид 1-[2-(4-амино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98аn).
Получали из 97а и аллилового эфира син-{2-[1S-(2R-изопропил-5S-метилциклогексилокси)]-5-оксотетрагидрофуран-3-ил}карбаминовой кислоты в соответствии с процедурой, использованной для получения 98а, для получения 88 мг (выход 50%) соединения, указанного в заголовке. 1H-ЯМР (500 МГц, CDCl3): δ 0,70-1,10 (м, 12Н), 1,20-1,50 (м, 14Н), 1,50-1,70 (уш., 2Н), 1,90-2,25 (м, 4Н), 2,27-2,37 (м, Н), 2,40-2,50 (м, Н), 2,75-2,79 (м, Н), 3,35-3,80 (м, 3Н), 4,20-4,57 (м, 3Н), 4,60-4,70 (м, Н), 4,88-4,92 (м, Н), 5,53 (д, Н), 6,71-6,75 (м, Н), 6,90 (д, Н), 7,20 (д, Н), 7,50-7,53 (м, Н), 7,75 (д, Н). Время задержки при аналитической ВЭЖХ: 13,20 мин. ЖХ-МС: m/z=577 (М+Н+).
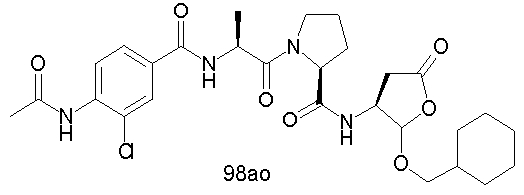
Аллиловый эфир (2-циклогексилметокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты.
Получали из трет-бутилового эфира 3-аллилоксикарбониламино-4-гидроксимасляной кислоты, как описано для 40, с использованием циклогексилметанола для получения 1,04 г (с большей отн. подв.) (выход 35%) анти-диастереомера соединения, указанного в заголовке, и 1,295 г (с меньшей отн. подв.) (выход 44%) син-диастереомера. 1H-ЯМР (500 МГц, CDCl3) для анти-диастереомера: δ 0,90-0,96 (м, 2Н), 1,10-1,30 (м, 3Н), 1,55-1,85 (м, 6Н), 2,37-2,41 (д, Н), 2,97-3,03 (м, Н), 3,34-3,38 (м, Н), 3,58-3,62 (м, Н), 4,55-4,70 (м, 2Н), 4,70-4,73 (м, Н), 5,03 (уш., Н), 5,22-5,37 (м, 3Н), 5,87-5,93 (м, Н); для син-диастереомера 0,91-0,97 (м, 2Н), 1,10-1,31 (м, 3Н), 1,56-1,50 (м, 7Н), 2,44-2,48 (м, Н), 2,81-2,87 (м, Н), 3,35-3,39 (м, Н), 3,63-3,67 (м, Н), 4,53-4,70 (м, 3Н), 5,20-5,50 (м, ЗН), 5,89-5,95 (м, Н). ЖХ-МС: m/z=298 (М+Н+) для обоих диастереомеров.
(2-Циклогексилметокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-ацетиламино-3-хлорбензоиламино)пропионил]-5-пирролидин-2-карбоновой кислоты (98ао).
Получали из 97b и аллилового эфира син-(2-циклогексилметокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты в соответствии с процедурой, использованной для получения 98а, для получения 212 мг (выход 64%) соединения, указанного в заголовке. 1H-ЯМР (500 МГц, CDCl3): δ 0,70-1,30 (м, 5Н), 1,30-1,85 (м, 9Н), 1,85-2,60 (м, 8Н), 2,75-3,00 (м, Н), 3,10-3,80 (м, 4Н), 4,30-4,95 (м, 3Н), 5,42 (д, 0,85Н), 5,62 (д, 0,15Н), 6,87 (д, 0,15Н), 7,08 (д, 0,85Н), 7,25 (д, Н), 7,60-7,90 (м, 3Н), 8,08 (д, 0,15Н), 8,50 (д, 0,85Н). Время задержки при аналитической ВЭЖХ: 11,81 мин. ЖХ-МС: m/z=577 (М+Н+).
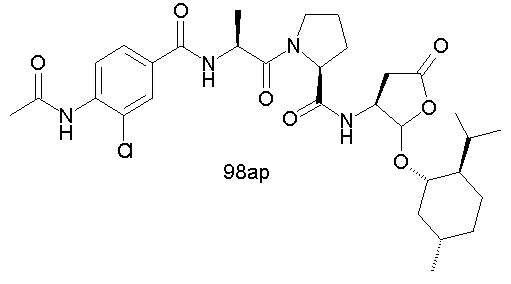
{2R-[1S-(2R-Изопропил-5S-метилциклогексилокси)]-5-оксотетрагидрофуран-3-ил}амид 1-[2-(4-ацетиламино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98ар).
Получали из 97b и аллилового эфира син-{2-[1S-(2R-изопропил-5S-метилциклогексилокси)]-5-оксотетрагидрофуран-3-ил}карбаминовой кислоты в соответствии с процедурой, использованной для получения 98а, для получения 223 мг (выход 63%) соединения, указанного в заголовке. 1H-ЯМР (500 МГц, CDCl3): δ 0,70-1,15 (м, 12Н), 1,20-1,85 (м, 8Н), 1,85-2,60 (м, 9Н), 2,74-2,88 (м, Н), 3,35-3,85 (м, 3Н), 4,40-4,55 (м, Н), 4,65-4,78 (м, Н), 4,88-4,91 (м, Н), 5,53 (д, Н), 7,00-7,25 (м, 2Н), 7,60-7,90 (м, 3Н), 8,50 (д, Н). Время задержки при аналитической ВЭЖХ: 13,31 мин. ЖХ-МС: m/z=619 (М+Н+).
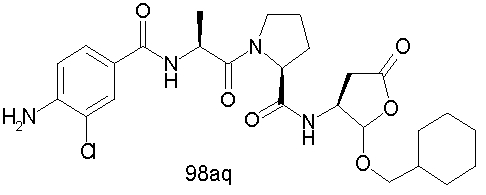
(2-Циклогексилметокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-амино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98aq).
Получали из 97а и аллилового эфира син-(2-циклогексилметокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты в соответствии с процедурой, использованной для получения 98а, для получения 113 мг (выход 56%) соединения, указанного в заголовке. 1H-ЯМР (500 МГц, CDCl3): δ 0,70-1,35 (м, 5Н), 1,35-1,90 (м, 8Н), 1,90-2,20 (м, 3Н), 2,30-2,60 (м, Н), 2,80-3,00 (м, Н), 3,15-3,80 (м, 4Н), 4,28-4,75 (м, 4Н), 4,89-4,93 (м, Н), 5,42 (д, Н), 6,74 (д, Н), 6,87 (д, Н), 7,30 (д, Н), 7,51-7,53 (м, Н), 7,74 (д, Н). Время задержки при аналитической ВЭЖХ: 12,02 мин. ЖХ-МС: m/z=535 (М+H+).
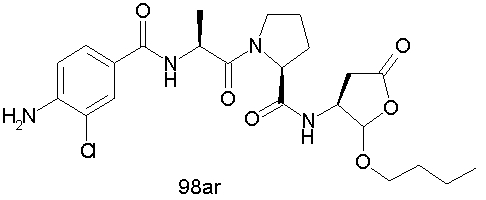
Аллиловый эфир (2-бутокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты.
Получали из трет-бутилового эфира 3-аллилоксикарбониламино-4-гидроксимасляной кислоты, как описано для 40, с использованием н-бутанола для получения 878 мг (выход 29%) соединения, указанного в заголовке (313 мг анти-диастереомера, 260 мг син-диастереомера и 305 мг смеси). 1H-ЯМР (500 МГц, CDCl3) для анти-диастереомера: δ (с большей отн. подв.) 0,89-0,96 (т, 3Н), 1,32-1,40 (м, 2Н), 1,54-1,63 (м, 2Н), 2,37-2,41 (д, Н), 2,98-3,04 (кв, Н), 3,55-3,60 (м, Н), 3,77-3,82 (м, Н), 4,19-4,22 (м, Н), 4,58 (уш., 2Н), 5,03 (уш., Н), 5,23-5,40 (м, 3Н), 5,87-5,93 (м, Н); для син-диастереомера (с меньшей отн. подв.) 0,91-0,95 (т, 3Н), 1,34-1,39 (м, 2Н), 1,56-1,63 (м, 2Н), 2,42-2,50 (м, Н), 2,83-2,87 (м, Н), 4,07-4,11 (т, Н), 4,45-4,50 (м, 0,5Н), 4,51-4,70 (м, 2,5Н), 5,23-5,35 (м, 2Н), 5,42-5,43 (д, Н), 5,80-5,95 (м, Н). ЖХ-МС: m/z=258 (М+Н+) для обоих диастереомеров.
(2-Бутокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-амино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98аr).
Получали из 97а и аллилового эфира син-(2-бутокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты в соответствии с процедурой, использованной для получения 98а, для получения 118 мг (выход 48%) соединения, указанного в заголовке, в виде син-диастереомера. 1H-ЯМР (500 МГц, CDCl3): δ 0,80-1,02 (м, 2Н), 1,35-1,51 (м, 5Н), 1,51-1,70 (м, 2Н), 1,90-2,27 (м, 3Н), 2,30-2,46 (м, Н), 2,80-2,90 (м, Н), 3,55-3,94 (м, 4Н), 4,30-4,75 (м, 4Н), 4,90-5,00 (м, Н), 5,44-5,46 (м, Н), 6,73-6,80 (м, Н), 6,80-6,93 (м, Н), 7,16-7,25 (м, Н), 7,49-7,60 (м, Н), 7,70-7,84 (м, Н). Время задержки при аналитической ВЭЖХ: 9,71 мин. ЖХ-МС: m/z=495 (М+Н+).
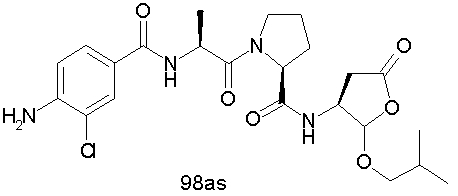
Аллиловый эфир (2-изобутокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты.
Получали из трет-бутилового эфира 3-аллилоксикарбониламино-4-гидроксимасляной кислоты, как описано для 40, с использованием изобутанола для получения 190 мг (выход 7,3%) соединения, указанного в заголовке, в виде анти-диастереомера и 290 мг (выход 11%) син-диастереомера. 1Н-ЯМР (500 МГц, CDCl3) для анти-диастереомера: δ (с большей отн. подв.) 0,85-1,05 (м, 6Н), 1,82-1,98 (м, Н), 2,37-2,42 (д, Н), 2,98-3,04 (м, Н), 3,31-3,35 (м, Н), 3,55-3,58 (м, Н), 4,20-4,30 (т, Н), 4,58 (уш., 2Н), 5,07 (уш., Н), 5,22-5,43 (м, 3Н), 5,84-5,96 (м, Н); для син-диастереомера (с меньшей отн. подв.) 0,85-1,05 (м, 6Н), 1,88-1,95 (м, Н), 2,40-2,51 (м, Н), 2,83-2,90 (м, Н), 3,33-3,36 (м, Н), 3,61-3,65 (м, Н), 3,87-3,88 (д, Н), 4,40-4,68 (м, 3Н), 5,20-5,40 (м, 2Н), 5,42-5,43 (д, Н), 5,80-5,97 (м, Н). ЖХ-МС: m/z=258 (M+Н+) для обоих диастереомеров.
(2-Изобутокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-амино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98as).
Получали из 97а и аллилового эфира син-(2-изобутокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты в соответствии с процедурой, использованной для получения 98а, для получения 93 мг (выход 38%) соединения, указанного в заголовке. lH-ЯМР (500 МГц, CDCl3): δ 0,74-0,76 (т, 0,6Н), 0,80-1,00 (м, 5,4Н), 1,40-1,50 (м, 3Н), 1,90-2,22 (м, 3Н), 2,33-2,45 (м, Н), 2,80-2,90 (м, Н), 3,32-3,38 (м, Н), 3,55-3,80 (м, 3Н), 4,38 (уш., Н), 4,50-4,60 (м, Н), 4,70-4,80 (м, Н), 4,90-5,00 (м, Н), 5,42-5,45 (м, Н), 6,74-6,76 (д, Н), 6,86-6,88 (д, Н), 7,31-7,33 (д, Н), 7,51-7,53 (м, Н), 7,74-7,75 (д, Н). Время задержки при аналитической ВЭЖХ: 9,63 и 9,80 мин. ЖХ-МС: m/z=495 (М+Н+).
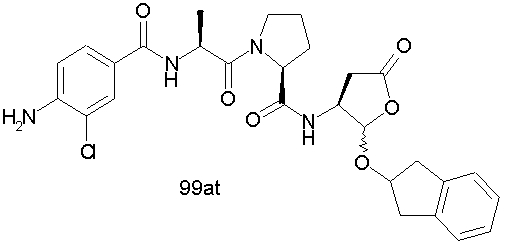
Аллиловый эфир [2-(индан-2-ил)окси-5-оксотетрагидрофуран-3-ил]карбаминовой кислоты.
Получали из трет-бутилового эфира 3-аллилоксикарбониламино-4-гидроксимасляной кислоты (5,2 грамм, 20 ммоль), как описано для 40, с использованием 2-инданола (8,05 грамм, 60 ммоль) для получения 4,10 грамм (выход 65%) соединения, указанного в заголовке, в виде смеси эпимеров. Очистка дала 1,76 грамм (выход 28%) 4(S),5(R) эпимера в виде желтого масла. 1H ЯМР (500 МГц, CDCl3) δ 2,42 (дд, J=17,2, 10,5 Гц, 1Н), 2,79 (дд, J=17,2, 8,4 Гц, 1Н), 2,99 (дд, J=16,7, 4,1 Гц, 1Н), 3,04 (дд, J=16,7, 4,1 Гц, 1Н), 3,22 (дд, J=17,2, 6,6 Гц, 1Н), 3,26 (дд, J=17,2, 6,6 Гц, 1Н), 4,53 (м, 3Н), 4,70 (м, 1Н), 5,20 (м, 2Н), 5,60 (д, J=5,3 Гц, 1Н), 5,87 (м, 1Н), 7,17 (м, 4Н) м.д. ЖХ-МС (ES+): m/e=318 (M+H). Аналитическая ВЭЖХ (колонка С18): 17,094 мин.
Была также выделена смесь эпимеров (0,75 грамм, выход 12%) и 4(S),5(S) эпимер (1,59 грамм, 25%) в виде белого твердого вещества. 1H-ЯМР (500 МГц, CDCl3) δ 2,38 (д, J=17,9 Гц, 1Н), 3,0 (м, 3Н), 3,22 (м, 2Н), 4,13 (м, 1Н), 4,58 (м, 2Н), 4,68 (м, 2Н), 4,98 (уш.с, 1Н), 5,26 (м, 1Н), 5,57 (с, 1Н), 5,88 (ддт, J=18,0, 11,1, 5,4 Гц, 1Н), 7,20 (м, 4Н) м.д. ЖХ-МС (ES+): m/е=318 (M+H). Аналитическая ВЭЖХ (колонка С18): 17,025 (5,5%), 17,325 (94,5%) мин.
[2-(Индан-2-илокси)-5-оксотетрагидрофуран-3-ил]амид 1-[2-(4-амино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98at).
Получали из 97а и аллилового эфира [2-(инданол-2-ил]окси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты в соответствии с процедурой, использованной для получения 98а, для получения соединения, указанного в заголовке, в виде смеси 71:29 эпимеров в форме беловатого твердого вещества (0,20 г, выход 58%). 1H-ЯМР (500 МГц, CDCl3) δ 1,0-1,5 (м, 3Н), 1,6-2,3 (м, 4Н), 2,42 (м, 1Н), 2,6-3,4 (м, 6Н), 3,5-4,1 (м, 3Н), 4,2-4,9 (м, 4Н), 5,65 (д, J=5,0 Гц, 0,80Н), 5,8 (м, 0,07Н), 5,85 (д, J=5,0 Гц, 0,13Н), 6,8-7,3 (м, 6Н), 7,4-7,9 (м, 3Н) м.д. Аналитическая ВЭЖХ (колонка С18) 16,035 (71,4%), 16,476 (28,6%) мин. ЖХ-МС (ES+): m/е=555 (М+H).
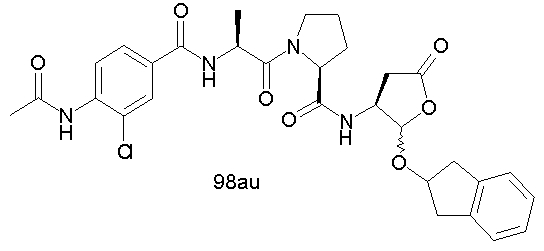
[2-(Индан-2-илокси)-5-оксотетрагидрофуран-3-ил]амид 1-[2-(4-ацетиламино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98аu).
Получали из 97b и аллилового эфира [2-(инданол-2-ил]окси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты в соответствии с процедурой, использованной для получения 98а, для получения соединения, указанного в заголовке, в виде смеси 76:24 эпимеров в форме беловатого твердого вещества (0,22 г, выход 57%). 1Н-ЯМР (500 МГц, CDCl3) δ 1,08 (д, J=6,9 Гц, 0,4H), 1,26 (д, J=6,9 Гц, 0,6H), 1,35 (д, J=6, 9Гц, 2Н), 1,8-2,3 (м, 3Н), 2,28 (с, 2Н), 2,29 (с, 1Н), 2,4 (м, 1Н), 2,8 (м, 1Н), 3,10 (м, 2Н), 3,27 (м, 2Н), 3,58 (м, 2Н), 3,69 (м, 1Н), 4,5-4,9 (м, 4Н), 5,65 (д, J=5,3 Гц, 0,68Н), 5,84 (д, J=5,3 Гц, 0,18Н), 6,38 (уш., 0,14Н), 6,9-7,7 (м, 6Н), 7,6-7,9 (м, 3Н), 8,33 (уш. д, J=6,8, 0,18Н), 8,51 (уш. д, J=8,0 Гц, 0,82Н) м.д. Аналитическая ВЭЖХ (колонка С18) 15,596 (76,2%), 15,932 (23,8%) мин. ЖХ-МС (ES+): m/e=597 (M+H).
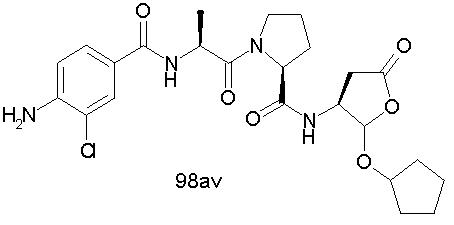
(2-Циклопентилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-амино-3-хлорбензоиламино)пропионил)пирролидин-2-карбоновой кислоты (98av).
Получали из 97а и аллилового эфира син-(2-циклопентилокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты в соответствии с процедурой, использованной для получения 98а, для получения соединения, указанного в заголовке, в виде беловатого твердого вещества (0,19 г, выход 59%). 1H-ЯМР (500 МГц, CDCl3) δ 1,2-2,4 (м, 15Н), 2,4-3,1 (м, 2Н), 3,6-3,9 (м, 2Н), 4,2-4,4 (м, 2Н), 4,5-5,0 (м, 4Н), 5,40 (д, J=5,0 Гц, 0,35Н), 5,55 (д, J=5,0 Гц, 0,65Н), 6,8-8,2 (м, 5Н) м.д. Аналитическая ВЭЖХ (колонка С18) 14,065 мин. ЖХ-МС (ES+): m/е=507 (М+Н).
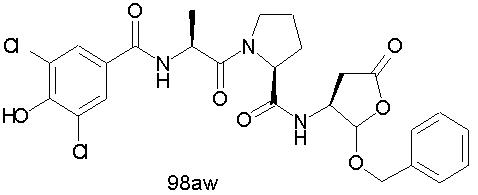
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(3,5-дихлор-4-гидроксибензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98aw).
Получали из трет-бутилового эфира 1-[2-(4-аллилокси-3,5-диметилбензоиламино)пропионил]пирролидин-2-карбоновой кислоты и син-40 в соответствии с процедурой, использованной для получения 98а, для получения соединения, указанного в заголовке, в виде бледно-желтого твердого вещества (1,087 г, выход 64%). 1Н-ЯМР (500 МГц, CDCl3) δ 1,09 (д, J=6,9 Гц, 0,6Н), 1,33 (д, J=6,9 Гц, 2,4Н), 1,96 (м, 1Н), 2,03 (м, 1Н), 2,10 (м, 1Н), 2,28 (м, 0,8Н), 2,40 (дд, J=17,3, 10,2 Гц, 0,8Н), 2,56 (м, 0,2Н), 2,85 (дд, J=17,3, 8,5 Гц, 0,8Н), 3,09 (дд, J=17,7, 10,2 Гц, 0,2Н), 3,57 (м, 1Н), 3,73 (дт, J=9,2, 7,9 Гц, 0,8Н), 4,09 (м, 0,2Н), 4,21 (д, J=7,9 Гц, 0,2H), 4,44 (д, J=9,8 Гц, 0,2Н), 4,55 (дд, J=8,0, 3,0 Гц, 0,8Н), 4,62 (д, J=11,6 Гц, 1Н), 4,70 (м, 1Н), 4,80 (м, 1Н), 4,89 (д, J=11,6 Гц, 0,8Н), 5,52 (д, J=5,2 Гц, 0,8Н), 5,82 (д, J=5,2 Гц, 0,2Н), 6,51 (уш., 0,2Н), 6,62 (уш., 0,8Н), 7,0-7,4 (м, 7Н), 7,43 (с, 0,4Н), 7,66 (д, J=1,0 Гц, 1,6Н) м.д. Аналитическая ВЭЖХ (колонка С18) 10,135 мин. ЖХ-МС (ES+): m/е=564, 566 (6:4) (М+Н).
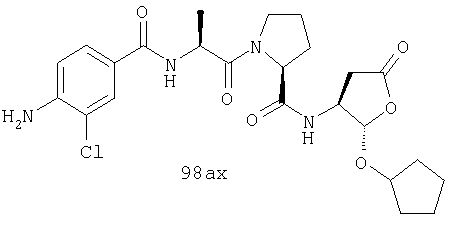
(2-Циклопентилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-амино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98ах).
Получали в соответствии с процедурой, использованной для получения (98av), с использованием анти-(2-циклопентилокси-5-оксотетрагидрофуран-3-ил)амида для получения соединения, указанного в заголовке, в виде беловатого твердого вещества (0,24 г, выход 74%). 1H-ЯМР (500 МГц, CDCl3) δ 1,41 (д, J=6,5 Гц, 3Н), 1,7 (м, 7Н), 1,98 (уш., 2Н), 2,13 (уш., 2Н), 2,27 (м, 1Н), 2,69 (м, 1Н), 2,86 (дд, J=18,0, 6,8 Гц, 0,7H), 2,98 (дд, J=18,3, 8,2 Гц, 0,3Н), 3,60 (уш., 1,4Н), 3,77 (уш., 0,6Н), 4,1-4,6 (м, 5Н), 4,82 (м, 1Н), 5,27 (м, 0,65Н), 5,51 (д, J=5,3 Гц, 0,05Н), 5,59 (уш. с, 0,3Н), 6,76 (уш., 1Н), 7,00 (уш., 1Н), 7,49 (уш., 1Н), 7,74 (уш., 1Н), 7,89 (уш., 1H) м.д. Аналитическая ВЭЖХ (колонка С18) 5,756 мин. ЖХ-МС (ES+): m/е=507 (М+Н).
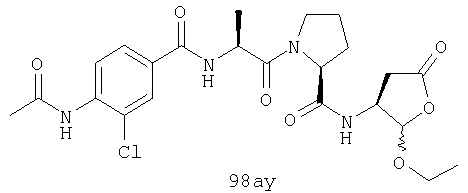
(2-Этокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-ацетиламино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98ay).
Получали из аллилового эфира (2-этокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты и 97b, следуя способу, использованному для 98а. Соединение, указанное в заголовке, выделяли в виде белого твердого вещества (51 мг, выход 18%). 1H-MMR (500 МГц, 1:1 CDCl3:CD3OD) δ 1,08-1,35 (м, 3Н), 1,35-1,55 (м, 3Н), 1,75-2,44 (м, 4Н), 2,26 (с, 3Н), 2,44-3,07 (м, 2Н), 3,48-3,97 (м, 2Н), 4,18-4,92 (м, 5Н), 5,32 (д, 0,4H), 5,47 (д, 0,1Н), 5,58 (д, 0,4Н), 5,64 (д, 0,1Н), 7,70-8,35 (м, 3Н). Аналитическая ВЭЖХ 10,37, 10,54 мин. ЖХ-МС (ES+) m/е=509,2 (М+Н+).
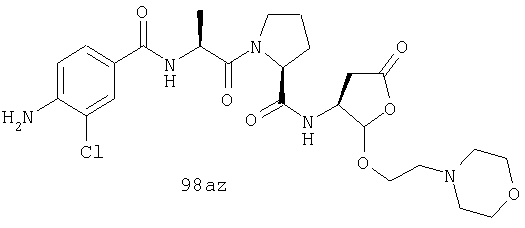
Аллиловый эфир [2-(2-хлорэтокси)-5-оксотетрагидрофуран-3-ил]карбаминовой кислоты.
Получали из трет-бутилового эфира 3-аллилоксикарбониламино-4-гидроксимасляной кислоты (5,2 г, 20 ммоль), как описано для 40, с использованием хлорэтанола (4,05 мл, 60 ммоль) для получения 1,84 г (выход 35%) соединения, указанного в заголовке, в виде смеси эпимеров. Для анти-диастереомера: 1H-ЯМР (500 МГц, CDCl3) δ 2,42 (дд, J=18,1 Гц, 1Н), 3,00 (дд, J=18,1, 7,8 Гц, 1Н), 3,63 (м, 2Н), 3,85 (м, 1Н), 4,02 (м, 1Н), 4,23 (м, 1Н), 4,57 (уш. с, 2Н), 5,17 (уш. с, 1Н), 5,22 (д, Н=11,5 Гц, 1Н), 5,29 (д, J=16,8 Гц, 1Н), 5,44 (с, 1Н), 5,89 (м, 1Н) м.д. ЖХ-МС (ES+): m/е=264 (М+Н). Для син-диастереомера: 1H-ЯМР (500 МГц, CDCl3) δ 2,47 (дд, J=17,3, 10,7 Гц, 1Н), 2,83 (дд, J=17,3, 8,4 Гц, 1Н), 3,65 (м, 2Н), 3,83 (м, 1Н), 4,11 (м, 1Н), 4,57(м, 3Н), 5,22 (д, Н=10,4 Гц, 1Н), 5,30 (д, J=17,2 Гц, 1Н), 5,33, (м, 1Н), 5,47 (д, J=5,2 Гц, 1Н), 5,89 (ддт, J=17,1, 11,0, 5,4 Гц, 1Н) м.д. ЖХ-МС (ES+): m/e=264 (М+Н).
Аллиловый эфир [2-(2-морфолин-4-илэтокси)-5-оксотетрагидрофуран-3-ил]карбаминовой кислоты.
Получают из аллилового эфира [2-(2-хлорэтокси)-5-оксотетрагидрофуран-3-ил]карбаминовой кислоты с помощью реакции с морфолином (2 экв.) и KI (1 экв.) в DMF.
[2-(2-Морфолин-4-илэтокси)-5-оксотетрагидрофуран-3-ил]амид 1-[2-(4-амино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98az).
Получают из 97а и аллилового эфира син-[2-(2-морфолин-4-илэтокси)-5-оксотетрагидрофуран-3-ил]карбаминовой кислоты, следуя способу, использованному для 98а.
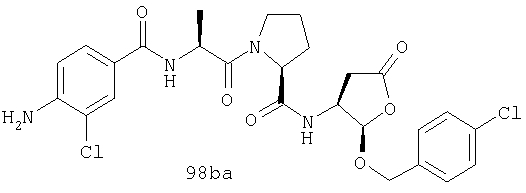
Аллиловый эфир [2-(4-хлорбензилокси)-5-оксотетрагидрофуран-5-ил]карбаминовой кислоты
Получали из трет-бутилового эфира 3-аллилоксикарбониламино-4-гидроксимасляной кислоты, как описано для 40, с использованием 4-хлорбензилового спирта для получения соединения, указанного в заголовке, в виде белого твердого вещества. Анти-диастереомер: ВЭЖХ (колонка С18) 10,924 мин. 1H-ЯМР (500 МГц, CDCl3) δ 2,41 (д, J=8,0 Гц, 1Н), 3,02 (дд, J=18,1, 7,8 Гц, 1Н), 4,25 (уш., 1Н), 4,56 (м, 2Н), 4,58 (д, J=11,7 Гц, 1Н), 4,75 (д, J=11,7 Гц, 1Н), 4,99 (уш., 1Н), 5,22 (дд, J=10,4, 1,1 Гц, 1Н), 5,28 (дд, J=17,2, 1,3 Гц, 1Н), 5,44 (с, 1Н), 5,86 (м, 1Н), 7,25 (д, J=8,4 Гц, 2H), 7,32 (д, J=8,4 Гц, 2Н) м.д. ЖХ-МС (ES+): m/е=326 (М+Н). Син-диастереомер: ВЭЖХ (колонка С18) 10,780 мин. 1H-ЯМР (500 МГц, CDCl3) δ 2,47 (дд, J=17,3, 10,5 Гц, 1Н), 2,85 (дд, J=17,3, 8,4 Гц, 1Н), 4,55 (м, 3Н), 4,58 (д, J=11,7 Гц, 1Н), 4,84 (д, J=11,7 Гц, 1Н), 5,23 (дд, Н=10,4, 1,1 Гц, 1Н), 5,30 (д, J=16,6 Гц, 1Н), 5,49 (д, J=5,0 Гц, 1Н), 5,89 (ддт, J=17,1, 11,0, 5,4 Гц, 1Н), 7,23 (д, J=8,3 Гц, 2H), 7,31 (д, J=8,3 Гц, 2H) м.д. ЖХ-МС (ES+): m/е=326 (М+Н).
[2-(4-Хлорбензилокси)-5-оксотетрагидрофуран-3-ил]амид 1-[2-(4-амино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98ba).
Получали из 97а и аллилового эфира син-[2-(4-хлорбензилокси)-5-оксотетрагидрофуран-3-ил]карбаминовой кислоты, следуя способу, использованному для 98а, для получения 154 мг (выход 65%) соединения, указанного в заголовке, в виде бледно-розового твердого вещества. ВЭЖХ (колонка С18) 10,597 мин. 1Н-ЯМР (500 МГц, CDCl3) δ 1,14 (д, J=6, 8 Гц, 0,75Н), 1,34 (д, J=6,8 Гц, 2,25Н), 1,6 (уш., 0,25Н), 1,91 (м, 1Н), 2,03 (м, 1Н), 2,10 (м, 1Н), 2,29 (м, 0,75Н), 2,40 (дд, J=17,3, 10,3 Гц, 0,75Н), 2,51 (м, 0,25Н), 2,82 (дд, J=17,3, 8,5 Гц, 0,75Н), 3,08 (дд, J=17,9, 10,9 Гц, 0,25Н), 3,58 (м, 1Н), 3,72 (дд, J=16,5, 8,7 Гц, 0,75Н), 4,10 (м, 0,25Н), 4,22 (д, J=8,0 Гц, 0,25Н), 4,39 (д, J=10,8 Гц, 0,25Н), 4,54 (дд, J=9,1, 2,9 Гц, 0,75Н), 4,60 (д, J=11,9 Гц, 0,75Н), 4,68 (м, 1Н), 4,85 (д, J=11,7 Гц, 0,75Н), 4,86 (м, 1Н), 5,49 (д, J=5,2 Гц, 0,75Н), 5,81 (д, J=5,2 Гц, 0,25Н), 6,2 (уш., 0,25Н), 6,74 (м, 2Н), 7,05 (д, J=8,5 Гц, 0,5Н), 7,17 (д, J=8,4 Гц, 0,5Н), 7,30 (м, 3,25Н), 7,48 (дд, J=8,4, 2,0 Гц, 0,75Н), 7,56 (д, J=1,9 Гц, 0,25H), 7,73 (д, J=1,9 Гц, 0,75Н), 8,42 (д, J=5,7 Гц, 0,25Н) м.д. ЖХ-МС (ES+): m/е=563, 565 (М+Н).
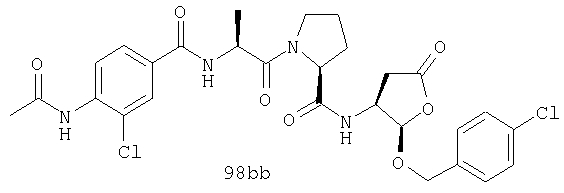
[2-(4-Хлорбензилокси)-5-оксотетрагидрофуран-3-ил]амид 1-[2-(4-ацетиламино-3-хлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (98bb).
Получали из 97b и аллилового эфира син-[2-(4-хлорбензилокси)-5-оксотетрагидрофуран-3-ил]карбаминовой кислоты в соответствии с процедурой, использованной для получения 98a, для получения 165 мг (выход 64%) соединения, указанного в заголовке, в виде бледно-желтого твердого вещества. ВЭЖХ (колонка С18) 10,491 мин. 1H-ЯМР (500 МГц, CDCl3) δ 1,16 (д, J=6,8 Гц, 0,6Н), 1,35 (д, J=6,8 Гц, 2,4Н), 1,94 (м, 1Н), 2,04 (м, 1Н), 2,10 (м, 1Н), 2,25 (с, 3Н), 2,28 (м, 1Н), 2,40 (дд, J=17,3, 10,4 Гц, 0,8Н), 2,53 (м, 0,2Н), 2,84 (дд, J=17,3, 8,5 Гц, 0,8Н), 3,02 (дд, J=17,5, 10,5 Гц, 0,2Н), 3,58 (м, 1Н), 3,72 (ддд, J=17,2, 8,3, 8,3 Гц, 0,8Н), 4,13 (м, 0,2Н), 4,22 (д, J=8,2 Гц, 0,2Н), 4,40 (д, J=10,9 Гц, 0,2Н), 4,54 (дд, J=8,1, 3,0 Гц, 0,8Н), 4,60 (д, J=11,8 Гц, 0,8Н), 4,69 (м, 1Н), 4,85 (д, J=11,8 Гц, 0,8Н), 4,87 (м, 1Н), 5,49 (д, J=5,2 Гц, 0,8Н), 5,80 (д, J=5,2 Гц, 0,2Н), 6,47 (уш., 0,2Н), 6,95 (д, J=8,3 Гц, 0,8Н), 7,05 (д, J=8,3 Гц, 0,4Н), 7,18 (д, J=8,3 Гц, 0,4Н), 7,29 (м, 3,2Н), 7,49 (дд, J=8,6, 1,9 Гц, 0,2Н), 7,63 (дд, J=8,6, 1,9 Гц, 0,8Н), 7,74 (д, J=1,9 Гц, 1Н), 7,85 (д, J=1,9 Гц, 0,8Н), 8,25 (д, J=6,4 Гц, 0,2Н), 8,51 (м, 0,8Н) м.д. ЖХ-МС (ES+): m/е=605, 607 (М+Н).
Схема XVIII
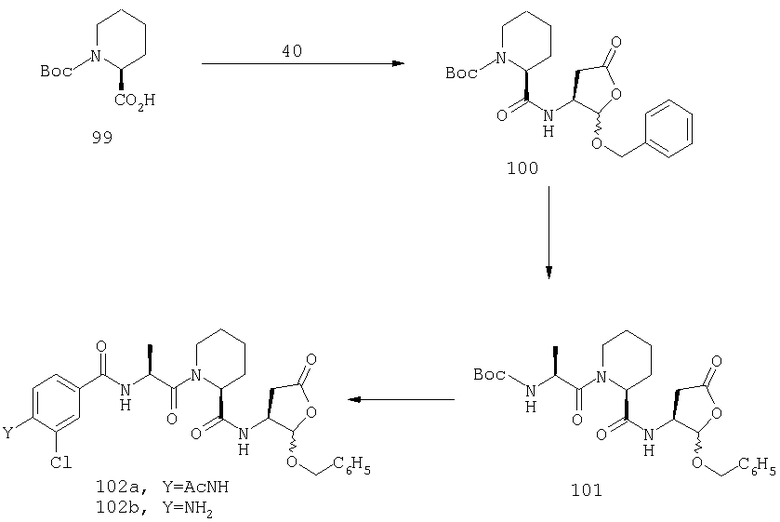
трет-Бутиловый эфир 2-(2-бензилокси-5-оксотетрагидрофуран-3-илкарбамоил)пиперидин-1-карбоновой кислоты (100).
Получали из 1-трет-бутилового эфира пиперидин-1,2-дикарбоновой кислоты 99 и 40, следуя способу, использованному при получении 75, для получения соединения, указанного в заголовке, в виде желтого твердого вещества (2,63 г, выход 57%). 1H-ЯМР (500 МГц, CDCl3) δ 1,15-1,79 (м, 15Н), 2,12-2,50 (м, 2Н), 2,56-2,83 (м, 1Н), 2,89 (дд, 0,5 Н), 3,05 (дд, 0,5Н), 3,81-4,15 (уш. с, 1Н), 4,36-4,97 (м, 3Н), 5,37-5,61 (м, 1Н), 6,42-6,89 (уш. с, 1Н), 7,17-7,51 (м, 5Н). ЖХ-МС (ES+): m/e=419,4 (МН+).
трет-Бутиловый эфир {2-[2-(2-бензилокси-5-оксотетрагидрофуран-3-илкарбамоил)пиперидин-1-ил]-1-метил-2-оксоэтил}карбаминовой кислоты (101).
трет-Бутиловый эфир 2-(2-бензилокси-5-оксотетрагидрофуран-3-илкарбамоил)пиперидин-1-карбоновой кислоты (100) растворяли в 20% TFA в CH2Cl2 (25 мл) и перемешивали при комнатной температуре в течение 50 мин. Растворитель упаривали и оставшуюся кислоту азеотропировали с CH2Cl (4х). Полученное масле растворяли в CH2Cl2 (20 мл) и DMF (5 мл), охлаждали до 0°С, обрабатывали DIEA (4,7 мл, 27,0 ммоль), Вос-аланином (970 мг, 5,1 ммоль), НОВТ (924 мг, 6,8 ммоль) и EDC (1,31 г, 6,8 ммоль) и раствор перемешивали в атмосфере N2 в течение 18 часов. Растворитель концентрировали под вакуумом, затем растворяли в EtOAc и промывали 0,5 н. NaHSO4 (2x), насыщенным NaHCO3 (2x) и насыщенным солевым раствором. Органический слой сушили над безводным Na2SO4 и упаривали для получения оранжевого твердого вещества, которое растворяли в CH2Cl2 и добавляли по каплям к диэтиловому эфиру для получения белого осадка. Соединение, указанное в заголовке, в виде белого твердого вещества (1,21 г, выход 73%). 1H-ЯМР (500 МГц, CDCl3) δ 1,10-1,79 (м, 18Н), 1,98-2,19 (м, 0,5Н), 2,28-2,88 (м, 3Н), 2,89-3,13 (м, 0,5Н), 3,78-3,95 (м, 0,5Н), 4,21-5,16 (м, 5,5Н), 5,38-5,59 (м, 0,3Н), 5,66 (д, 0,4Н), 5,80 (д, 0,3Н), 7,24-7,40 (м, 5Н). ЖХ-МС (ES+): m/e=490,3 (MH+).
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-ацетиламино-3-хлорбензоиламино)пропионил]пиперидин-2-карбоновой кислоты (102а).
Получали из трет-бутилового эфира {2-[2-(2-бензилокси-5-оксотетрагидрофуран-3-илкарбамоил)пиперидин-1-ил]-1-метил-2-оксоэтил}карбаминовой кислоты и 4-ацетиламино-3-хлорбензойной кислоты с помощью процедуры, использованной при получении 98а, для получения соединения, указанного в заголовке (71 мг, выход 47%). 1H-ЯМР (500 МГц, CDCl3) δ 1,10-1,97 (м, 10Н), 2,10-2,68 (м, 5Н), 2,73-3,24 (м, 2Н), 3,62-3,92 (м, 1Н), 4,24-5,27 (м, 5Н), 5,48-5,59 (м, 0,5Н), 5,75-5,85 (м, 0,5Н), 6,51-6,61 (д, 1Н), 7,05-7,45 (м, 4Н), 7,52-8,12 (м, 4Н). Аналитическая ВЭЖХ: 8,30 мин. ЖХ-МС (ES+): m/e=585,3 (МН-).
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-амино-3-хлорбензоиламино)пропионил]пиперидин-2-карбоновой кислоты (102b).
Получали, как описано выше для 102а, для получения соединения, указанного в заголовке (0,06 г, выход 27%), в виде желтого твердого вещества. 1H-ЯМР (500 МГц, CDCl3) δ 1,2-1,8 (м, 7Н), 2,1-2,6 (м, 2Н), 2,7-3,2 (м, 4Н), 3,6-4,0 (м, 1Н), 4,3-4,9 (м, 7Н), 5,0-5,8 (м, 2Н), 6,5-7,0 (м, 2Н), 7,2-7,8 (м, 8Н) м.д. Аналитическая ВЭЖХ (колонка циано): 14,559 (39,6%), 15,198 (60,4%). ЖХ-МС (ES+): m/e=543 (M+H).
Схема XIX
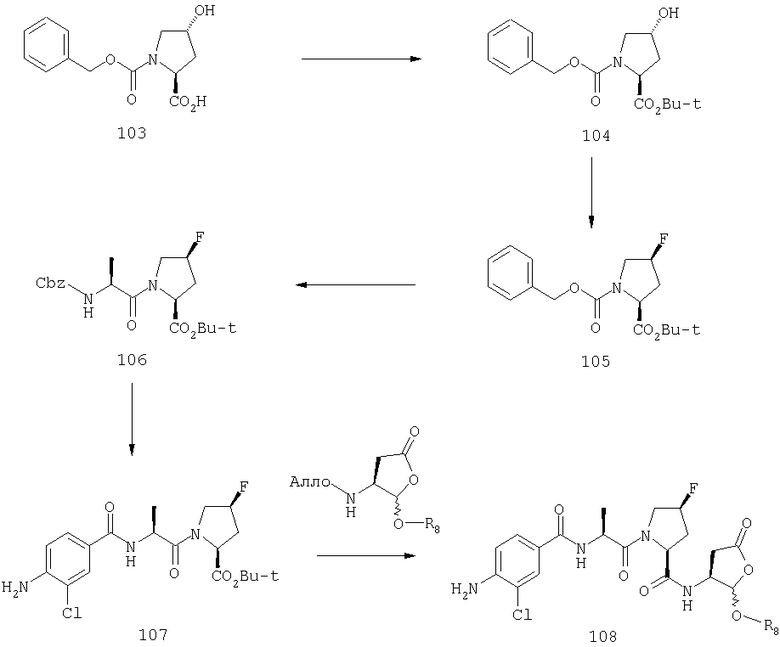
1-Бензиловый эфир, 2-трет-бутиловый эфир 4-гидроксипирролидин-1,2-дикарбоновой кислоты (104).
Соединение 104 получали в соответствии с процедурой, использованной для получения соединения 95.
Суспензия Cbz-Hyp-OH (4,854 г, 18 ммоль) в DMA (135 мл), хлористого бензилтриэтиламмония (4,105 г, 18 ммоль), К2СО3 (64 г, 46 ммоль) и 2-бром-2-метилпропана (99 мл, 859 ммоль) перемешивали при 55°С в течение 18 часов. Смесь разводили водой со льдом и экстрагировали EtOAc (3х). Органическую фазу промывали водой, раствором 0,5 н. NaHSO4 и насыщенным солевым раствором, сушили и растворитель удаляли под вакуумом для получения соединения, указанного в заголовке, в виде желтого масла (5,368 г, выход 98%). 1H-ЯМР (500 МГц, CDCl3) δ 1,33 (с, 5Н), 1,47 (с, 4Н), 2,01-2,14 (м, 1Н), 2,22-2,38 (м, 1Н), 3,50-3,72 (м, 2Н), 4,34-4,45 (м, 1Н), 4,45-4,53 (м, 1Н), 5,04-5,20 (м, 2Н), 7,22-7,42 (м, 5Н). Аналитическая ВЭЖХ: 10,14 мин. ЖХ-МС (ES+): m/e=322,2 (MH+).
1-Бензиловый эфир, 2-трет-бутиловый эфир 4-фторпирролидин-1,2-дикарбоновой кислоты (105).
Раствор 104 (4,262, 13,96 ммоль) в CH2Cl2 (100 мл) при -78°С обрабатывали DAST (1,80 мл, 13,6 ммоль), перемешивали в течение 10 мин, затем нагревали до комнатной температуры и перемешивали в течение 60 ч в атмосфере N2. Смесь выливали в ледяной NaHCO3 (10% раствор, 350 мл) и экстрагировали CH2Cl2 (2х). Органическую фазу промывали водой, насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали для получения коричневого масла (4,299 г), которое очищали мгновенной колоночной хроматографией на силикагеле с использованием гексанов/EtOAc (от 90/10 до 80/20%). Соединение, указанное в заголовке, получали в виде желтого масла (2,805 г, выход 64%). 1H-ЯМР (500 МГц, CDCl3) δ 1,37 (с, 4,5H), 1,45 (с, 4,5Н, 2,20-2,55 (м, 2Н), 3,61-3,93 (м, 2Н), 4,41 (д, 0,5Н), 4,49 (д, 0,5Н), 5,03-5,21 (м, 3Н), 7,23-7,44 (м, 5Н). Аналитическая ВЭЖХ: 12,15 мин. ЖХ-МС (ES+): m/е=324,2 (МН+).
1-Бензиловый эфир, 2-трет-бутиловый эфир 1-(2-бензилоксикарбониламинопропионил)-4-фторпирролидин-1,2-дикарбоновой кислоты (106).
Раствор 105 (2,72 г, 8,42 ммоль) в МеОН (50 мл) и 10% Pd/C (1,27 г) перемешивали в атмосфере Н2 в течение 2 часов, затем фильтровали через целит и растворитель упаривали для получения желтого масла (1,526 г). Это масло растворяли в СН2Cl2 (30 мл) и обрабатывали DIEA (1,5 мл, 8,6 ммоль), Cbz-ala-OH (2,34 г, 10,5 ммоль) и EDC (2,32 г, 12 ммоль) при 0°С. Смесь перемешивали еще в течение 10 мин при 0°C, затем давали ей нагреться до комнатной температуры и перемешивали в течение 18 часов. Растворитель концентрировали под вакуумом, остаток растворяли в EtOAc, затем промывали 0,5 н. NaHSO4 (2х), насыщенным NaHCO3 (2х) и насыщенным солевым раствором. Органический слой сушили над безводным Na2SO4 и упаривали для получения белого твердого вещества, которое очищали мгновенной колоночной хроматографией, с использованием для элюции гексанов/EtOAc (от 80/20 до 60/40%). Соединение, указанное в заголовке, выделяли в виде белого твердого вещества (286 г, 86% из 1-бензилового эфира, 2-трет-бутилового эфира 4-фторпирролидин-1,2-дикарбоновой кислоты). 1H-ЯМР (500 МГц, CD3OD) δ 1,26-1,59 (м, 12Н), 2,20-2,67 (м, 2Н), 3,45-4,13 (м, 2Н), 4,25-4,47 (м, 1H), 4,58-4,71 (м, 1Н), 4,96-5,17 (м, 2Н), 5,19-5,45 (м, 1H), 7,23-7,48 (м, 5Н). Аналитическая ВЭЖХ: 16,36 мин. ЖХ-МС (ES+): m/e=395,3 (МН+).
трет-Бутиловый эфир 1-[2-(4-амино-3-хлорбензоиламино)пропионил]-4-фторпирролидин-2-карбоновой кислоты (107).
Суспензия 106 (2,65 г, 6,72 ммоль) в МеОН (40 мл) и 10% Pd/C (1,32 г) перемешивали в атмосфере Н2 в течение 1,5 часов, фильтровали через целит и концентрировали для получения воскообразного твердого вещества (1,694 г). Твердое вещество растворяли в CH2Cl2 (25 мл) и обрабатывали DIEA (3,4 мл, 19,5 ммоль), 4-амино-3-хлорбензойной кислотой (1,362 г, 7,9 ммоль), НОВТ (1,164 г, 8,62 ммоль) и EDC (1,645 г, 8,57 ммоль) при 0°С в атмосфере N2. Смеси давали нагреться до комнатной температуры и перемешивали в течение 18 часов. Растворитель концентрировали под вакуумом. Остаток растворяли в EtOAc, промывали водой (4х), 0,5 н. NaHSO4 (2х), насыщенным NaHCO3 (2x) и насыщенным солевым раствором. Органический слой сушили над безводным Na2SO4 и упаривали для получения белого твердого вещества, которое очищали мгновенной колоночной хроматографией с использованием СН2Cl2/МеОН (от 99/1 до 98/2%). Продукт получали в виде белого твердого вещества (2,705 г, 97%). 1H-ЯМР (500 МГц, CD3OD) δ 1,33 (с, 9Н), 1,48 (д, 3Н), 2,31-2,55 (м, 2Н), 3,93 (дд, 1H), 4,02-4,21 (м, 1H), 4,59-4,76 (м, 1H), 5,31 (уш. с, 0,5Н), 5,41 (уш. с, 0,5Н), 6,78 (д, 1H), 7,57 (дд, 1H), 7,78 (с, 1H), 8,31 (д, 1H). Аналитическая ВЭЖХ: 14,14 мин. ЖХ-МС (ES+): m/е=414,2 (МН+).
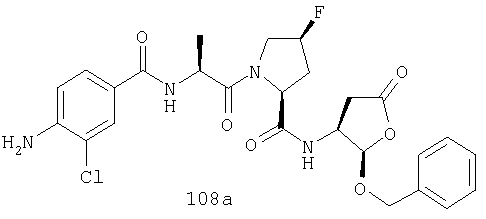
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-амино-3-хлорбензоиламино)пропионил]-4-фторпирролидин-2-карбоновой кислоты (108а).
Получали из аллилового эфира син-(2-бензилокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты и 107а, следуя способу, использованному для синтеза 98а. Соединение, указанное в заголовке, выделяли в виде белого твердого вещества (41 мг, выход 15%). 1H-ЯМР (500 МГц, CD3OD) δ 0,94 (д, 0,3Н), 1,07 (д, 1Н), 1,40 (м, 1,7Н), 2,21-2,65 (м, 2,2Н), 2,70-2,85 (м, 1,4Н), 2,96-3,08 (м, 1,4Н), 2,96-3,08 (дд, 0,4Н), 3,57-4,24 (м, 3Н), 4,41-4,93 (м, 4Н), 5,14-5,45 (м, 1Н), 5,60-5,67 (м, 0,6Н), 5,77 (д, 0,4Н), 6,77 (дд, 1Н), 7,15-7,41 (м, 5Н), 7,51-7,62 (м, 1Н), 7,77 (дд, 1Н). Аналитическая ВЭЖХ: 12,83 мин. ЖХ-МС (ES+): m/e=547,1 (МН+).
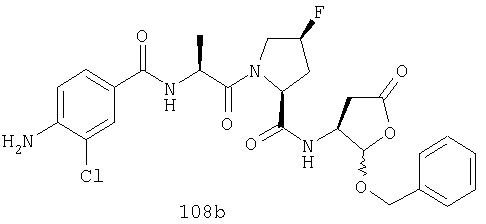
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-амино-3-хлорбензоиламино)пропионил]-4-фторпирролидин-2-карбоновой кислоты (108b).
Получали из аллилового эфира (2-бензилокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты 107а, следуя способу, использованному для синтеза 98а. Соединение, указанное в заголовке, выделяли в виде белого твердого вещества (654 мг, выход 54%). 1H-ЯМР (500 МГц, CD3OD) δ 1,07 (д, 0,5H), 1,25-1,56 (м, 2,5Н), 2,21-2,65 (м, 2,3Н), 2,63-2,39 (м, 1Н), 2,91-3,10 (м, 0,7Н), 3,57-4,23 (м, 2Н), 4,32-4,95 (м, 5Н), 5,16-5,52 (м, 1Н), 5,45-5,50 (м, 0,3Н), 5,54-5,58 (м, 0,2Н), 5,61-5,67 (м, 0,ЗН), 5,77 (д, 0,2Н), 6,72-6,84 (м, 1Н), 7,16-7,41 (м, 5Н), 7,50-7,65 (м, 1Н), 7,71-7,87 (м, 1Н). Аналитическая ВЭЖХ: 12,83 мин. ЖХ-МС (ES+): m/е=547,1 (MH+).
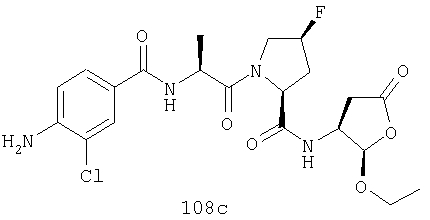
(2-Этокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-амино-3-хлорбензоиламино)пропионил]-4-фторпирролидин-2-карбоновой кислоты (108с).
Получали из аллилового эфира син-(2-этокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты и 107а, следуя способу, использованному для синтеза 98а, для получения соединения, указанного в заголовке (100,3 мг, выход 38%). 1H-ЯМР (500 МГц, CD3OD) δ 1,09 (т, 1,2Н), 1,25 (т, 1,8Н), 1,40 (д, 1Н), 1,49 (д, 2Н), 2,33-2,61 (м, 2Н), 2,65-2,95 (м, 2Н), 3,44-4,30 (м, 4Н), 4,47-4,79 (м, 3Н), 5,18-5,25 (м, 0,2Н), 5,27-5,36 (м, 0,5Н), 5,39-5,46 (м, 0,3Н), 5,56 (м, 1Н), 6,72-6,94 (м, 0,8Н), 7,54-7,69 (м, 0,8Н), 7,79 (д, 0,55Н), 8,06 (д, 0,55Н), 9,00 (д, 0,3Н). Аналитическая ВЭЖХ: 3,46 мин. ЖХ-МС (ES+): m/е=485,2 (МН+).
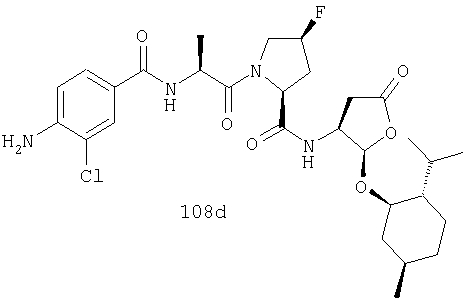
[2-(2-Изопропил-5-метилциклогексил)-5-оксотетрагидрофуран-3-ил]амид 1-[2-(4-амино-3-хлорбензоиламино)пропионил]-4-фторпирролидин-2-карбоновой кислоты (108d).
Получали из аллилового эфира {2-[1R-(2S-изопропил-5R-метилциклогексилокси)]-5-оксотетрагидрофуран-3-ил}карбаминовой кислоты и 107а, следуя способу, использованному для синтеза 98а, для получения соединения, указанного в заголовке (95 мг, выход 31%). 1H-ЯМР (500 МГц, CD3OD) δ 0,42 (д, 2Н), 0,57 (д, 2Н), 0,60-1,10 (м, 10Н), 1,22-1,76 (м, 6Н), 1,96-2,17 (м, 1Н), 2,29-2,60 (м, 2Н), 2,61-2,88 (м, 1,5Н), 3,02-3,23 (дд, 0,5Н), 3,37-3,47 (м, 0,5Н), 3,50-3,61 (м, 0,5Н), 3,63-4,24 (м, 2H), 4,48-4,62 (м, 3Н), 5,18-5,48 (м, 1Н), 5,72 (д, 0,4Н), 5,82 (д, 0,6Н), 6,77-6,84 (м, 1Н), 7,53-7,67 (м, 1Н), 7,78 (д, 0,4Н), 7,84 (д, 1Н). Аналитическая ВЭЖХ: 8,34 мин. ЖХ-МС (ES+): m/е=595 (МН+).
Схема XX
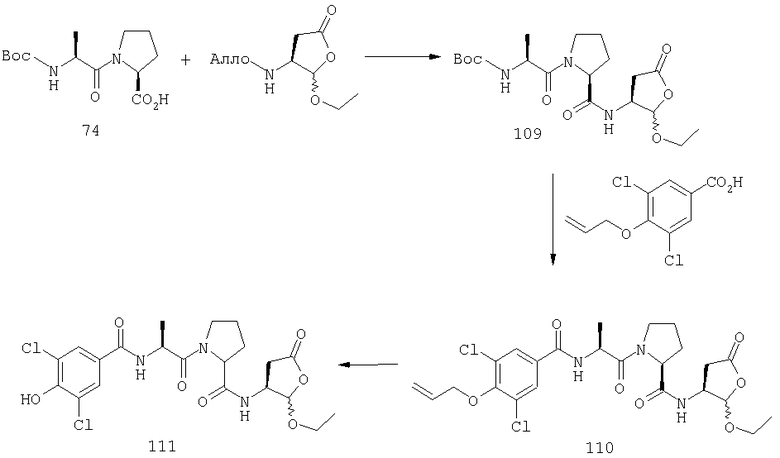
трет-Бутиловый эфир {2-[2-(2-этокси-5-оксотетрагидрофуран-3-илкарбамоил)пирролидин-1-ил]-1-метил-2-оксоэтил)карбаминовой кислоты (109).
Получали из аллилового эфира (2-этокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты 74, следуя способу, использованному для синтеза 75, для получения соединения, указанного в заголовке, в виде бледно-желтого твердого вещества (660 мг, выход 73%). 1H-ЯМР (500 МГц, CD3OD) δ 1,14-1,36 (м, 6Н), 1,42 (с, 9Н), 1,75-2,29 (м, 4Н), 2,48 (дд, 0,5Н), 2,58 (дд, 0,5Н), 2,72-2,85 (м, 0,5Н), 2,99 (дд, 0,5Н), 3,43-3,91 (м, 4Н), 4,07-4,52 (м, 2,5Н), 4,53-4,72 (м, 0,5Н), 5,37 (с, 0,5Н), 5,57 (д, 0,5Н). Аналитическая ВЭЖХ (смесь 2 диастереомеров): 7,92, 8,14 мин. ЖХ-МС (ES+): m/e=414,3 (MH+).
(2-Этокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-аллилокси-3,5-дихлорбензоиламино)пропионил]пирролидин-2-карбоновой кислоты (110).
Получали из 109 и 4-аллилокси-3,5-дихлорбензойной кислоты, следуя способу, использованному для синтеза 82, для получения соединения, указанного в заголовке, в виде белого твердого вещества (228 мг, 65%). 1H-ЯМР (500 МГц, CD3OD) δ 1,10-1,30 (м, 4Н), 1,32-1,52 (м, 3Н), 1,63-2,31 (м, 4Н), 2,41-2,50 (д, 0,5Н), 2,52-2,61 (дд, 0,5Н), 2,67-2,81 (м, 0,5Н), 2,94-3,05 (дд, 0,5Н), 3,47-3,96 (м, 4Н), 4,21-4,81 (м, 5Н), 5,22-5,32 (м, 1Н), 5,35-5,49 (м, 1,5Н), 5,55-5,63 (м, 0,5Н), 6,06-6,21 (м, 1Н), 7,90 (с, 2Н). Аналитическая ВЭЖХ (смесь 2 диастереомеров): 12,56 мин. ЖХ-МС (ES+): m/e=542,3 (МН+).
(2-Этокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(3,5-дихлор-4-гидроксибензоиламино)пропионилпирролидин-2-карбоновой кислоты (111).
К раствору 110 (194 мг, 0,36 ммоль) в СН2Cl2 (5 мл) добавляли DMBA (70,7 мг, 0,45 ммоль) и Pd(PPh3)4 (50,3 мг, 0,044 ммоль) при 0°С. Через 15 мин раствор нагревали до комнатной температуры, перемешивали в течение 2 часов, разводили CH2Cl2, затем промывали водой (2х) и насыщенным солевым раствором. Органический слой сушили над безводным Na2SO4 и упаривали для получения сырого продукта. Мгновенная хроматография с использованием CH2Cl2/MeOH (от 99/1 до 95/5%) дала соединение, указанное в заголовке (138,6 мг, выход 77%). 1H-ЯМР (500 МГц, CD3OD) δ 1,13-1,31 (м, 3Н), 1,35-1,49 (м, 3Н), 1,84-2,35 (м, 4Н), 2,43-3,05 (м, 2Н), 3,48-3,93 (м, 4Н), 4,22-4,80 (м, 3Н), 5,38 (д, 0,4Н), 5,46 (с, 0,1Н), 5,55-5,61 (м, 0,5Н), 7,76-7,94 (м, 2Н). Аналитическая ВЭЖХ: 8,70 мин. ЖХ-МС (ES+): m/e=502,2 (MH+).
Схема XXI
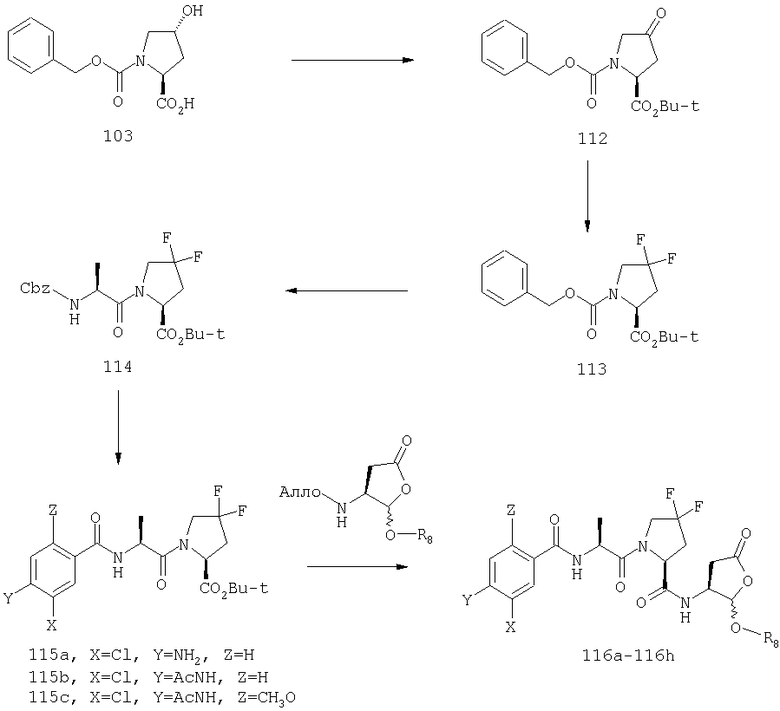
Соединения 116а-116h получали, как описано выше для соединений 98, лишь заменяя трет-бутиловый эфир 1-(2-бензилоксикарбониламинопропионил)пирролидин-2-карбоновой кислоты (95) трет-бутиловым эфиром 1-(2-бензилоксикарбониламинопропионил)-4,4-дифторпирролидин-2-карбоновой кислоты (114).
Получение трет-бутилового эфира 1-(2-бензилоксикарбониламинопропионил)-4,4-дифторпирролидин-2-карбоновой кислоты (114).
Раствор 1-бензилового эфира, 2-трет-бутилового эфира 4,4-дифторпирролидин-1,2-дикарбоновой кислоты (113) (Karanewsky et al., J. Med. Chem. 33, pp.1459-1469 (1990)) (0,42 г, 1,23 ммоль) и 10% палладия на угле (0,22 г) в метаноле (6 мл) перемешивали при давлении водорода 1 атм в течение 3 ч. Смесь фильтровали через целит и упаривали. Остаток растворяли в CH2Cl2 (4 мл) и DMF (2 мл) и охлаждали до 0°С. Добавляли 2-бензилоксикарбониламинопропионовую кислоту (0,30 г, 1,35 ммоль), EDC (0,30, 1,54 ммоль), DIEA 0,65 мл) и HOBt (0,17 г, 1,23 ммоль) и реакционную смесь перемешивали 0,5 ч при 0°С, затем 16 ч при комнатной температуре в атмосфере азота. Растворитель удаляли под вакуумом м остаток растворяли в этилацетате, затем промывали 10% бисульфатом натрия, насыщенным бикарбонатом натрия, водой и насыщенным солевым раствором, сушили над сульфатом натрия и упаривали. Очистка мгновенной хроматографией на двуокиси кремния с элюцией 25:75 этилацетатом : гексанами дала трет-бутиловый эфир 1-(2-бензилоксикарбониламинопропионил)-4,4-дифторпирролидин-2-карбоновой кислоты (0,39 г, выход 77%) в виде бесцветного масла.
lH-ЯМР (500 МГц, CDCl3) δ 1,3-1,6 (м, 12Н), 2,5 (м, 0,8Н), 2,7 (м, 1,2Н), 3,9 (м, 1Н), 4,1 (м, 1Н), 4,4 (м, 1Н), 4,7 (м, 1Н), 5,1 (м, 2Н), 5,59 (уш. д, J=7,7 Гц, 0,8Н), 5,7 (уш. д, J=7,7 Гц, 0,2Н), 7,35 (м, 5Н) м.д. Аналитическая ВЭЖХ (колонка циано) 17,069 мин. ЖХ-МС (ES+): m/e=413 (M+H), 357 (М+Н-трет-бутил), 313 [M+H-(СО2 -трет-бутил)].
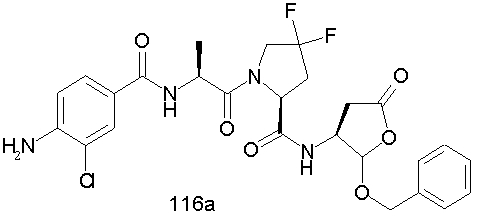
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-амино-3-хлорбензоиламино)пропионил]-4,4-дифторпирролидин-2-карбоновой кислоты (116а).
Получали из 115а и син-40 для получения соединения, указанного в заголовке, в виде беловатого твердого вещества (0,14 г, выход 73%). 1H-ЯМР (500 МГц, CD3OD) δ 1,0-1,5 (м, 3Н), 2,0-3,5 (м, 4Н+СН3ОН), 3,5-5,5 (М, 6Н+Н2O), 5,6-5,8 (м, 1Н), 6,7-6,8 (м, 1Н), 7,1-7,8 (м, 8Н), 8,2-8,6 (м, 1Н) м.д. Аналитическая ВЭЖХ (колонка циано): 13,744 мин. ЖХ-МС (ES+): m/е=565 (М+Н).
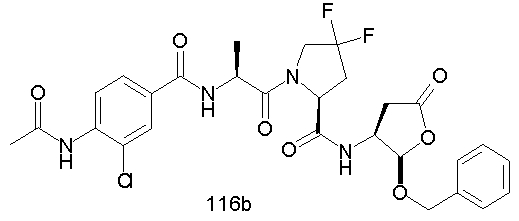
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-ацетиламино-3-хлорбензоиламино)пропионил]-4,4-дифторпирролидин-2-карбоновой кислоты (116b).
Получали из 115b и син-40 для получения соединения, указанного в заголовке, в виде беловатого твердого вещества (0,08 г, выход 38%). 1H-ЯМР (500 МГц, CDCl3) δ 1,03 (д, J=6,9 Гц, 0,4Н), 1,30 (д, J=6,9 Гц, 0,6Н), 2,25 (д, J=2,9 Гц, 3Н), 2,4-3,2 (м, 4Н), 3,6-4,4 (м, 4Н), 4,6-4,9 (м 3Н), 5,52 (д, J=5,2 Гц, 0,6Н), 5,78 (д, J=5,2 Гц, 0,4Н), 6,6 (уш. с, 1Н), 6,9-7,9 (м, 8Н), 8,39 (д, J=8,1 Гц, 0,4Н), 8,44 (д, J=8,3 Гц, 0,6Н), 8,74 (д, J=6,8 Гц, 1Н) м.д. Аналитическая ВЭЖХ (колонка циано): 11,830 мин. ЖХ-МС (ES+): m/е=607 (М+Н).
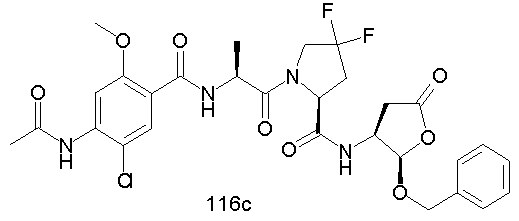
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-ацетиламино-5-хлор-2-метоксибензоиламино)пропионил]-4,4-дифторпирролидин-2-карбоновой кислоты (116с).
Получали из 115с и син-40 для получения соединения, указанного в заголовке, в виде беловатого (0,07 г, выход 29%). 1H-ЯМР (500 МГц, CDCl3) δ 0,99 (д, J=6, 9 Гц, 1,35Н), 1,32 (д, J=6,9 Гц, 1,65Н), 2,25 (с, 1,5Н), 2,26 (с, 1,5Н), 2,3-3,2 (м, 4Н), 3,95 (с, 0,55Н), 3,98 (с, 0,45Н), 3,7-4,1 (м, 2,5Н), 4,2-4,5 (м, 1,5Н), 4,6-4,9 (м, 3Н), 5,52 (д, J=5,3 Гц, 0,55Н), 5,80 (д, J=5,3 Гц, 0,45Н), 7,0-7,4 (м, 4Н), 7,7-7,9 (м, 2Н), 8,0-8,4 (м, 2Н), 8,49 (д, J=6,5 Гц, 1Н), 8,93 (д, J=6,7 Гц, 1Н) м.д. Аналитическая ВЭЖХ (колонка циано): 12,959 мин. ЖХ-МС (ES+): m/е=637 (М+Н).
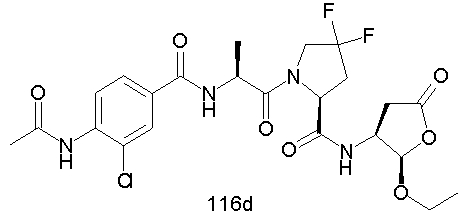
(2-Этокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-ацетиламино-3-хлорбензоиламино)пропионил]-4,4-дифторпирролидин-2-карбоновой кислоты (116d).
Получали из 115b и аллилового эфира син-(2-этокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты для получения соединения, указанного в заголовке, в виде смеси 92:8 эпимеров. Беловатое твердое вещество (0,27 г, выход 66%). 1H-ЯМР (500 МГц, CDCl3) δ 1,0-1,5 (м, 6Н), 2,25 (с, 1,8Н), 2,26 (с, 1,2Н), 2,3-3,1 (м, 4Н), 3,3-4,3 (м, 4Н), 4,5-4,9 (м, 3Н), 5,45 (д, J=5,3 Гц, 0,75Н), 5,59 (д, J=5,2 Гц, 0,25Н), 6,7-7,1 (м, 2Н), 7,62 (дд, J=8,7, 2,0 Гц, 1Н), 7,76 (м, 1Н), 7,85 (д, J=2,0 Гц, 1Н), 8,48 (м, 1Н) м.д. Аналитическая ВЭЖХ (колонка С18): 13,300 (91,8%), 14,046 (8,2%) мин. ЖХ-МС (ES+): m/e 545 (М+Н).
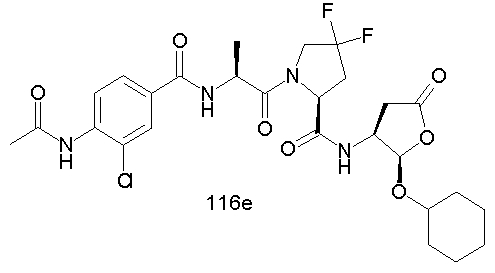
(2-Циклогексилокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-ацетиламино-3-хлорбензоиламино)пропионил]-4,4-дифторпирролидин-2-карбоновой кислоты (116е).
Получали из 115b и аллилового эфира син-(2-циклогексилокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты для получения соединения, указанного в заголовке, в виде смеси 93:7 эпимеров. 1H-ЯМР (500 МГц, CDCl3) δ 1,0-2,0 (м, 13Н), 2,25 (с, 2Н), 2,26 (с, 1Н), 2,40 (дд, J=17,3, 10,1 Гц, 1Н), 2,84 (дд, J=17,3, 8,5 Гц, 1Н), 2,5-3,0 (м, 2Н), 3,5-4,3 (м, 3,5Н), 4,5-4,9 (м, 2,5Н), 5,59 (д, J=5,3 Гц, 0,75Н), 5,76 (д, J=5,2 Гц, 0,25 Н), 6,74 (уш. д, J=5,7 Гц, 0,25Н), 6,93 (уш. д, J=7,1 Гц, 1Н), 7,06 (уш.д, J=7,8 Гц, 0,75Н), 7,62 (дд, J=8,6, 2,0 Гц, 1Н), 7,78 (м, 1Н), 7,85 (д, J=2,0 Гц, 1Н), 8,35 (уш. д, J=6,6 Гц, 0,25Н), 8,50 (уш. д, J=8,2 Гц, 0,75Н) м.д. Аналитическая ВЭЖХ (колонка С18): 17,112 (93%), 17,433 (7%) мин. ЖХ-МС (ES+): m/e=599 (M+H).
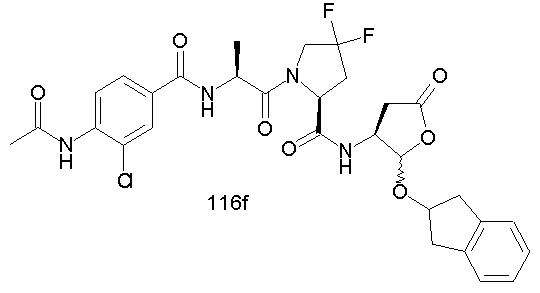
[2-(Инданол-2-ил)окси-5-оксотетрагидрофуран-3-ил]амид 1-[2-(4-ацетиламино-3-хлорбензоиламино)пропионил]-4,4-дифторпирролидин-2-карбоновой кислоты (116f).
Получали из 115b и аллилового эфира [2-(инданол-2-ил]окси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты для получения соединения, указанного в заголовке, в виде смеси 62:38 эпимеров. Беловатое твердое вещество (0,34 г, выход 71%). 1Н-ЯМР (500 МГц, CDCl3) δ 1,09 (д, J=6, 9 Гц, 0,6Н), 1,21 (д, J=6,9 Гц, 0,9Н), 1,33 (д, J=6, 9 Гц, 0,9Н), 1,42 (д, J=6,9 Гц, 0,6Н), 2,28 (с, 2Н), 2,29 (с, 1Н), 2,40 (дд, J=17,4, 10,3 Гц, 1Н), 2,4-3,3 (м, 7Н), 3,6-4,2 (м, 2Н), 4,5-4,8 (м, 4Н), 5,66 (м, 0,6Н), 5,84 (д, J=4,3 Гц, 0,2Н), 6,22 (м, 0,2Н), 6,7-7,0 (м, 2Н), 7,2-7,3 (м, 4Н), 7,5-7,7 (м, 1Н), 7,8-8,0 (м, 2Н), 8,52 (м, 0,6Н), 8,62 (уш. д, J=6,5 Гц, 0,4Н) м.д. Аналитическая ВЭЖХ (колонка С18): 16,556 (62,0%), 16,824 (38,0%) мин. ЖХ-МС (ES+): m/e=633 (M+H).
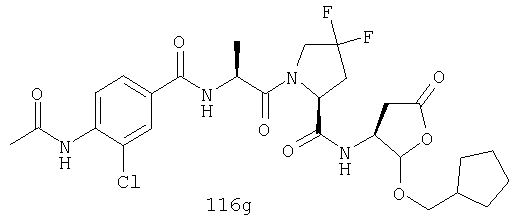
(2-Циклопентилметокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-ацетиламино-3-хлорбензоиламино)пропионил]-4,4-дифторпирролидин-2-карбоновой кислоты (116g).
Получали из 115b и аллилового эфира син-(2-циклопентилметокси-5-оксотетрагидрофуран-3-ил)карбаминовой кислоты для получения соединения, указанного в заголовке, в виде беловатого твердого вещества (0,20 г, выход 44%). 1H-ЯМР (500 МГц, CDCl3) δ 1,0-1,8 (м, 11Н), 1,9-3,0 (м, 5Н), 2,26 (с, 3Н), 3,29 (м, 0,25Н), 3,47 (м, 0,75Н), 3,58 (м, 0,25Н), 3,74 (м, 0,75Н), 3,8 (м, 0,75Н), 4,1 (м, 0,25Н), 4,25 (м, 1Н), 4,4-4,8 (м, 3Н), 5,44 (д, J=5,2 Гц, 0,75Н), 5,62 (д, J=5,2 Гц, 0,25Н), 6,7 (уш., 0,25Н), 6,91 (д, J=7,1 Гц, 1Н), 7,1 (м, 0,75Н), 7,59 (д, J=8,5 Гц, 0,25Н), 7,63 (дд, J=8,5, 2,5 Гц, 0,75Н), 7,75 (м, 1Н), 7,86 (д, J=1,8 Гц, 1Н), 8,33 (уш. д, J=6,5 Гц, 0,25Н), 8,49 (уш.д, J=8,4 Гц, 0,75Н) м.д. Аналитическая ВЭЖХ (колонка С18) 17,705 мин. ЖХ-МС (ES+): m/е=599 (М+Н).
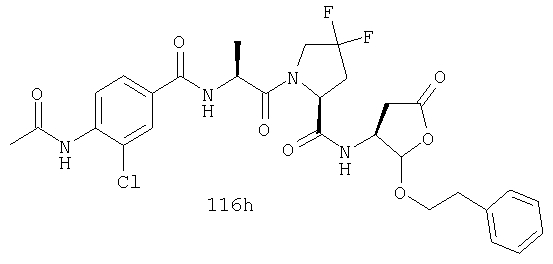
(2-Фенилэтокси-5-оксотетрагидрофуран-3-ил)амид 1-[2-(4-ацетиламино-3-хлорбензоиламино)пропионил]-4,4-дифторпирролидин-2-карбоновой кислоты (116h).
Получали из 115b и аллилового эфира син-5-оксо-2-фенэтилокситетрагидрофуран-3-ил)карбаминовой кислоты для получения соединения, указанного в заголовке, в виде беловатого твердого вещества (0,15 г, выход 24%). 1H-ЯМР (500 МГц, CDCl3) δ 1,29 (д, J=6, 9 Гц, 0,75Н), 1,40 (д, J=6,9 Гц, 2,25Н), 2,25 (с, 2,25Н), 2,26 (с, 0,75Н), 2,3-3,0 (м, 6Н), 3,7-4,8 (м, 7Н), 5,38 (д, J=5,3 Гц, 0,75Н), 5,67 (д, J=5,1 Гц, 0,25Н), 6,65 (м, 1Н), 6,90 (д, J=7,0 Гц, 0,75Н), 7,06 (д, J=7,6 Гц, 0,25Н), 7,1-7,3 (м, 5Н), 7,57 (д, J=8,6 Гц, 0,25Н), 7,63 (д, J=8,6 Гц, 0,75Н), 7,75 (м, 1H), 7,86 (д, J=1,8 Гц, 1Н), 8,35 (д, J=6,2 Гц, 0,25Н), 8,49 (д, J=8,3 Гц, 0,75Н) м.д. Аналитическая ВЭЖХ (колонка С18): 17,265 мин. ЖХ-МС (ES+): m/е=621 (М+Н).
Схема XXII
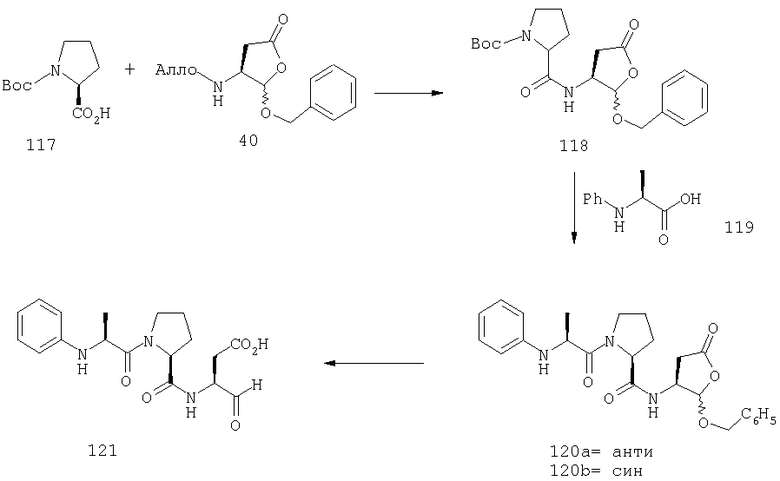
трет-Бутиловый эфир 2-(2-бензилокси-5-оксотетрагидрофуран-3-илкарбамоил)пирролидин-1-карбоновой кислоты (118).
Получали из 40 (1,16 г, 4,0 ммоль) и Вос-Pro-ОН в соответствии с процедурой, применяемой для получения 100 (схема XVIII,) для получения 1,53 г (выход 94%) соединения, указанного в заголовке, в виде белого твердого вещества. 1H-ЯМР (500 МГц, CDCl3): δ 1,61 (уш., 9Н), 1,88 (уш., 2Н), 2,00-2,50 (м, 3Н), 2,80-3,10 (м, Н), 3,20-3,60 (м, 2Н), 4,05-4,45 (м, 1,5Н), 4,58-4,80 (м, 1,5Н), 4,83-4,98 (м, Н), 5,43-5,53 (м, Н), 7,26-7,45 (м, 5Н), 7,60-7,80 (д, Н). Аналитическая ВЭЖХ: 11,32 мин. ЖХ-МС: m/е=405 (М+Н+).
2-Фениламинопропионовая кислота (119).
Смесь аланина (356 мг, 4,0 ммоль), иодбензола (816 мг, 4,0 ммоль), транс-дихлорбис(три-о-толилфосфин)палладия (II) {Pd[P(o-Tol)3]2Cl2} (160 мг, 0,2 ммоль), иодида меди (I) (40 мг, 0,2 ммоль), К2СО3 (552 мг, 4,0 ммоль), хлорида бензилтриэтиламмония (160 мг, 0,8 ммоль), триэтиламина (1,6 мл) и воды (0,8 мл) в DMF (8 мл) перемешивали в атмосфере азота при 100°С в течение 20 часов. Смесь охлаждали до комнатной температуры, разводили этилацетатом (50 мл) и водой (50 мл), подкисляли 6 н. HCl до рН от 2 до 3. Водный слой экстрагировали этялацетатом (50 мл×4). Объединенные органические слои промывали водой, насыщенным солевым раствором, сушили над безводным Na2SO4, фильтровали и упаривали под вакуумом, что дало красное масло. Мгновенная хроматография с применением гексана/этилацетата/уксусной кислоты (от 95/5/0,5 до 80/20/0,5) дала 300 мг (выход 45%) соединения, указанного в заголовке, в виде розового твердого вещества. 1H-ЯМР (500 МГц, CDCl2/CD3OD=0,5 мл/3 капли): δ 1,45 (д, 3Н), 4,02-4,15 (м, Н), 6,57-6,70 (м, 3Н), 7,11-7,25 (м, 2Н). Аналитическая ВЭЖХ: 6,10 мин. ЖХ-МС: m/е=166 (М+H+).
(2-Бензилокси-5-оксотетрагидрофуран-3-ил)амид 1-(2-фениламинопропионил)пирролидин-2-карбоновой кислоты (120а и 120b).
Раствор 118 (405 мг, 1,0 ммоль) обрабатывали TFA (2 мл) в СН2Cl2 (2 мл) в течение одного часа. Реакционный раствор упаривали под вакуумом и азеотропировали СН2Cl2 четыре раза для получения (2-бензилокси-5-оксотетрагидрофуран-3-ил)амида пирролидин-2-карбоновой кислоты в виде бледно-желтого твердого вещества. 1H-ЯМР (500 МГц, CDCl3): δ 1,87-2,15 (м, 4Н), 2,30-2,70 (м, 2Н), 2,80-3,08 (м, Н), 3,45 (уш., 2Н), 4,35-4,98 (м, 3Н), 5,30-5,56 (м, Н), 7,10-7,60 (м, 5Н). Аналитическая ВЭЖХ: 7,78/8,20 мин. ЖХ-МС: m/е=305 (M+H-).
2-Фениламинопропионовую кислоту (119) (300 мг, 1,8 ммоль) в СН2Cl2 (10 мл) обрабатывали НОВТ (270 мг, 2,0 ммоль) и EDC (2,1 г, 11 ммоль) при 0°С в течение 10 мин. Добавляли диизопропилэтиламин (2 мл), затем раствор (2-бензилокси-5-оксотетрагидрофуран-3-ил)амида пирролидин-2-карбоновой кислоты в СН2Cl2 (10 мл). Смесь перемешивали при комнатной температуре в течение 4 часов, разводили СН2Cl2 (40 мл), промывали водой, затем насыщенным солевым раствором. Органический слой сушили над безводным Na2SO4, фильтровали и упаривали под вакуумом, что дало бледно-желтое твердое вещество. Мгновенная хроматография с применением СН2Cl2/метанола (от 99/1 до 98/2) дала 151 мг (выход 33%) анти-диастереомера соединения, указанного в заголовке, (120а) и 129 мг (выход 29%) син-диастереомера (120b) в виде белого твердого вещества. 1H-ЯМР (500 МГц, CDCl3) для анти-диастереомера: δ 1,37-1,41 (м, 3Н), 1,50-2,45 (м, 4Н), 2,60-2,70 (м, 0,3Н), 2,89-2,94 (м, 0,7Н), 3,40-3,80 (м, 2Н), 4,10-4,50 (м, 3Н), 4,50-4,90 (м, 3Н), 5,26 (с, 0,3Н), 5,38 (с, 0,7Н), 6,45-6,60 (м, 2,3Н), 6,65-6,80 (м, Н), 7,10-7,20 (м, 2,5Н), 7,25-7,50 (м, 4,5Н), 7,53-7,70 (м, 0,7Н), 7,82 (д, Н); для син-диастереомера: δ 0,86-0,89 (м, Н), 1,20-1,40 (м, 4Н), 1,80-2,45 (м, 4Н), 2,80-2,86 (м, Н), 3,58-3,65 (м, 2Н), 4,20-4,40 (м, Н), 4,50-4,75 (м, 2Н), 4,90 (д, Н), 5,52 (д, Н), 6,45-6,70 (м, 3Н), 6,75-6,85 (м, Н), 7,10-7,20 (м, 2,3Н), 7,30-7,50 (м, 5,7Н). Аналитическая ВЭЖХ: 10,55 мин для анти-диастереомера и 10,62 мин для син-диастереомера. ЖХ-МС: m/е=452 (М+Н+) для обоих диастереомеров.
4-Оксо-3-{[1-(2-фениламинопропионил)пирролидин-2-карбонил]амино}масляная кислота (121).
Получали из 120 (151 мг, 0,33 ммоль), используя способ гидролиза А для получения 101 мг (выход 83%) соединения, указанного в заголовке, в виде белого твердого вещества. 1H-ЯМР (500 МГц, CDCl2, CD3OD=1/1): δ 1,20-1,65 (м, 2Н), 1,65-2,35 (м, 3Н), 2,40-3,00 (м, Н), 3,20-3,80 (м, 2Н), 3,90-4,90 (м, 7Н), 7,25-7,80 (м, 5Н). Аналитическая ВЭЖХ: 6,38 мин. ЖХ-МС: m/е=362 (М+Н+).
Общие процедуры для получения соединений осуществления С формулы I (схемы XXIII-XXV)
Схема XXIII
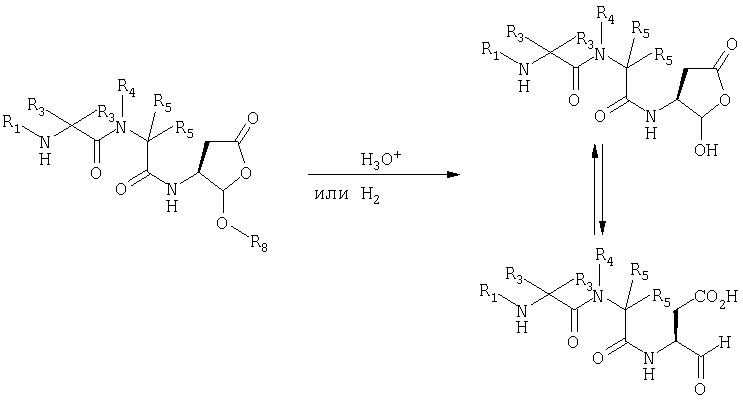
Способ гидролиза A
Образец алкилгемиацеталя в количестве 0,005-50 ммоль растворяли в 2,5 н. HCl/СН3CN (10/1) и перемешивали при комнатной температуре до завершения реакции. Полученный водный слой промывали диэтиловым эфиром (2×20 мл) и лиофилизировали для получения продукта.
Способ гидролиза В
Образец алкилгемиацеталя в количестве 0,005-50 ммоль помещали в неразбавленную муравьиную кислоту и перемешивали в течение ночи при комнатной температуре. Смесь растирали с со смесью 3:1 гексан/диэтиловый эфир для получения преципитата. Растворитель декантировали и преципитат промывали диэтиловым эфиром для получения продукта.
Способ гидролиза С
Образец алкилгемиацеталя в количестве 0,005-50 ммоль растворяли в СН3ОН и 20% Pd(OH)2/C и перемешивали в атмосфере H2 до завершения реакции. Полученную суспензию фильтровали и раствор концентрировали под вакуумом, затем растирали со смесью 3:1 гексан/диэтиловый эфир для получения преципитата. Растворитель декантировали и преципитат промывали диэтиловым эфиром для получения продукта.
Способ гидролиза D
Образец алкилгемиацеталя в количестве 0,005-50 ммоль в СН3CN/вода (1/2) трясли с кислой смолой (Dowex 50w×2, тип Н+) до завершения реакции. Раствор фильтровали и смолу промывали СН3CN/вода (1/4). Полученный водный слой промывали диэтиловым эфиром, концентрировали до меньшего объема под вакуумом, затем лиофилизировали для получения продукта.
Схема XXIV
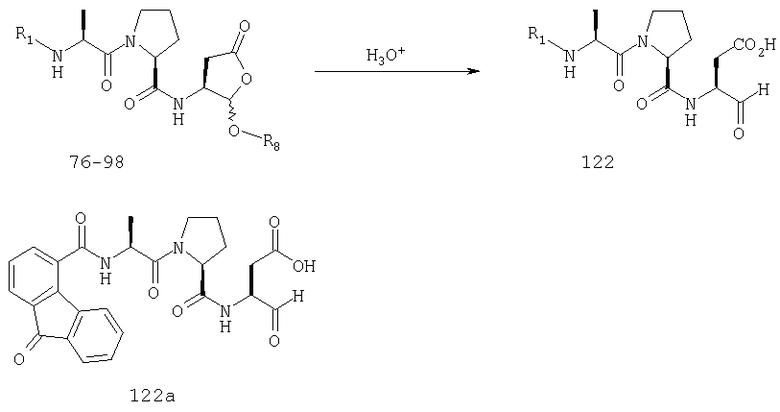
4-Оксо-3-[(1-{2-[9-оксо-9Н-флуорен-4-карбонил)амино]пропионил}пирролидин-2-карбонил)амино]масляная кислота (122а).
109,0 мг (0,19 ммоль) образца 91 гидролизовали в соответствии со способом А для получения 88 мг (выход 96%) соединения, указанного в заголовке. Аналитическая ВЭЖХ 7,15 мин. ЖХ-МС (ES+): m/е=492,2 (М+Н).
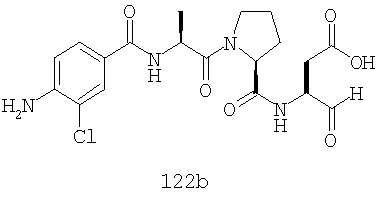
3-({1-[2-(4-Амино-3-хлорбензоиламино)пропионил]пирролидин-2-карбонил}амино)-4-оксомасляная кислота (122b).
51,0 мг (0,096 ммоль) образца 76 гидролизовали в соответствии со способом А для получения 43,0 мг (выход 100%) соединения, указанного в заголовке. 1H-ЯМР (500 МГц, CD3OD/D2O: 0,5 мл/10 капель): δ 1,37-1,52 (м, 3Н), 1,80-2,20 (м, 3Н), 2,20-2,37 (м, Н), 2,49-2,60 (м, Н), 2,60-2,75 (м, Н), 3,70-3,80 (м, Н), 3,80-3,95 (м, Н), 4,20-4,35 (м, Н), 4,40-4,50 (м, Н), 4,50-4,70 (м, Н), 4,70-4,85 (м, Н), 6,85-6,87 (д, Н), 7,58-7,60 (м, Н), 7,77 (с, Н). Время удерживания при аналитической ВЭЖХ: 6,54 мин. ЖХ-МС: m/z=439 (М+Н+).
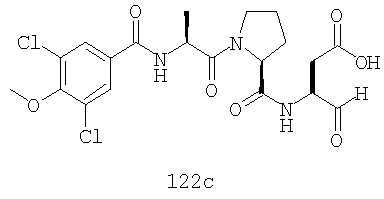
3-({1-[2-(3,5-Дихлор-4-метоксибензоиламино)пропионил]пирролидин-2-карбонил)амино)-4-оксомасляная кислота (122с).
51,0 мг (0,088 ммоль) образца 92 гидролизовали в соответствии со способом А для получения 24,0 мг (выход 56%) соединения, указанного в заголовке. Аналитическая ВЭЖХ 6,41 мин. ЖХ-МС (ES+): m/e=488,3 (M+H).
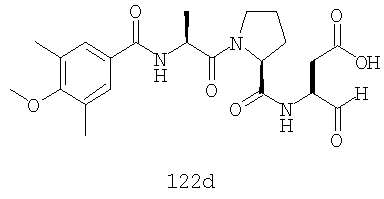
3-({1-[2-(4-Метокси-3,5-диметилбензоиламино)пропионил]пирролидин-2-карбонил}амино)-4-оксомасляная кислота (122d).
55,0 мг (0,102 ммоль) образца 77 гидролизовали в соответствии со способом А для получения 44,0 мг (выход 96%) соединения, указанного в заголовке. Аналитическая ВЭЖХ (С18) 8,70 мин. 1H-HMR (CDCl3, 500 МГц): δ 1,23-1,70 (м, 3Н), 1,80-2,70 (м, 10Н), 2,70-3,15 (м, 2Н), 3,58-4,20 (м, 5Н), 4,32-5,50 (м, 3Н), 5,60-6,00 (м, Н), 6,80-7,90 (м, 4Н). ЖХ-MC (ES-): m/е=448,2 (М+Н).
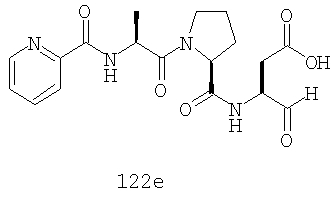
4-Оксо-3-[(1-{2-[пиридин-2-карбонил)амино]пропионил}пирролидин-2-карбонил)амино]масляная кислота (122е).
55,0 мг (0,114 ммоль) образца 88 гидролизовали в соответствии со способом А для получения 30,0 мг (выход 67%) соединения, указанного в заголовке. Аналитическая ВЭЖХ 4,60 мин. ЖХ-МС (ES+): m/е=391,3 (М+Н).
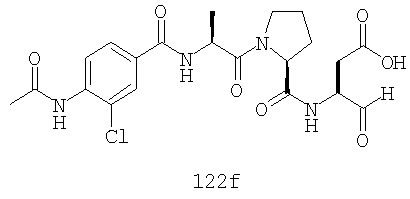
3-({1-[2-(4-Ацетиламино-3-хлорбензоиламино)пропионил]пирролидин-2-карбонил}амино)-4-оксомасляная кислота (122f).
52,0 мг (0,091 ммоль) образца 78 гидролизовали в соответствии со способом А для получения 40,0 мг (выход 91%) соединения, указанного в заголовке. 1H-ЯМР (500 МГц, CD3OD) δ 1,08-1,61 (м, 3Н), 1,77-2,41 (м, 3Н), 2,21 (с, 3Н), 2,41-2,77 (м, 2Н), 3,43-3,63 (м, 0,3Н), 3,65-3,76 (м, 1Н), 3,81-3,94 (м, 1Н), 4,18-4,34 (м, 1Н), 4,42-4,64 (м, 1,7Н), 4,77 (кв, 1Н), 7,79 (дд, 1Н). Аналитическая ВЭЖХ: 4,97 мин. ЖХ-МС (ES+): m/e=481,3 (М+Н).
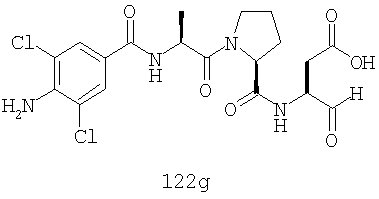
3-({1-[2-(4-Амино-3,5-дихлорбензоиламино)пропионил]пирролидин-2-карбонил}амино)-4-оксомасляная кислота (122g).
44,3 мг (0,079 ммоль) образца 89 гидролизовали в соответствии со способом А для получения 30 мг (выход 81%) соединения, указанного в заголовке. Аналитическая ВЭЖХ 5,40 мин. ЖХ-МС (ES+): m/e=473,2 (М+Н).
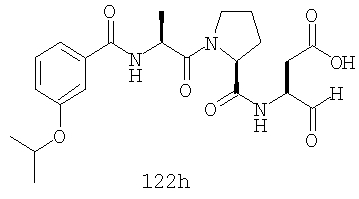
3-({1-[2-(3-Изопропоксибензоиламино)пропионил]пирролидин-2-карбонил}амино)-4-оксомасляная кислота (122h).
52,0 мг (0,097 ммоль) образца 79 гидролизовали в соответствии со способом А для получения 30 мг (выход 69%) соединения, указанного в заголовке. Аналитическая ВЭЖХ 8,92 мин. ЖХ-МС (ES+): m/e=448,3 (М+Н).
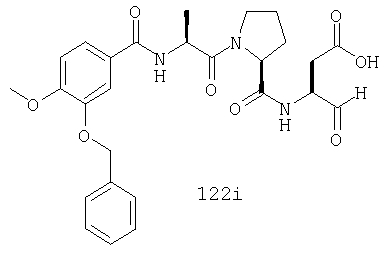
3-({1-[2-(3-Бензилокси-4-метоксибензоиламино)пропионил]пирролидин-2-карбонил}амино)-4-оксомасляная кислота (122i).
50,8 мг (0,082 ммоль) образца 81 гидролизовали соответствии со способом А для получения 22,4 мг (выход 52%) соединения, указанного в заголовке. Аналитическая ВЭЖХ 6,72 мин. ЖХ-МС (ES+): m/е=526,3 (М+Н).
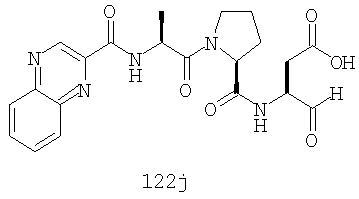
4-Оксо-3-[(1-{2-[(хиноксалин-2-карбонил)амино]пропионил}пирролидин-2-карбонил)амино]масляная кислота (122j).
38,0 мг (0,072 ммоль) образца 80 гидролизовали в соответствии со способом А для получения 32,0 мг (выход 100%) соединения, указанного в заголовке. Аналитическая ВЭЖХ 5,95 мин. ЖХ-МС (ES+): m/e=442,3 (M+H).
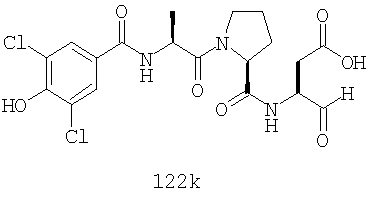
3-({1-[2-(3,5-Дихлор-4-гидроксибензоиламино)пропионил]пирролидин-2-карбонил}амино)-4-оксомасляная кислота (122k).
35 мг (0,060 ммоль) образца 83 гидролизовали в соответствии со способом А для получения 29,4 мг (выход 75%) соединения, указанного в заголовке. Аналитическая ВЭЖХ: 7,91 мин. 1H-ЯМР (500 МГц, CD3OD) δ 1,47 (м, 3Н), 1,8-2,3 (м, 4Н), 2,49 (м, 1Н), 2,61 (м, 1Н), 3,5 (уш. м, 0,2Н), 3,69 (уш. м, 0,9Н), 3,34 (уш. м, 0,9Н), 4,27 (м, 1Н), 4,46 (м, 1Н), 4,57 (м, 1Н), 4,73 (м, 1Н), 7,83 (м, 2Н) м.д. ЖХ-МС (ES+): m/e=474,1 (M+H).
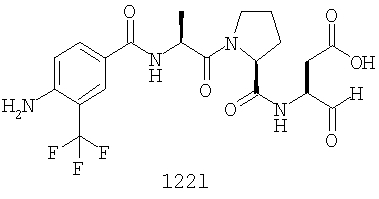
3-({1-[2-(4-Амино-3-трифторметилбензоиламино)пропионил]пирролидин-2-карбонил}амино)-4-оксомасляная кислота (122l).
10 мг (0,021 ммоль) образца 98w гидролизовали в соответствии со способом А для получения 7,9 мг (выход 94%) соединения, указанного в заголовке. Аналитическая ВЭЖХ: 6,64 мин. ЖХ-МС (ES+): m/e=473,3 (М+Н).
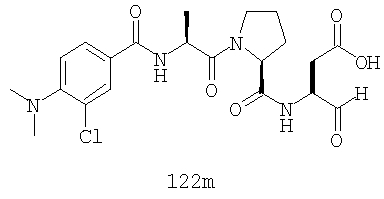
3-({1-[2-(3-Хлор-4-диметиламинобензоиламино)пропионил]пирролидин-2-карбонил}амино)-4-оксомасляная кислота (122m).
10,0 мг (0,021 ммоль) образца 98х гидролизовали в соответствии со способом А для получения 7,0 мг (выход 84%) соединения, указанного в заголовке. Аналитическая ВЭЖХ: 5,15 мин. ЖХ-МС (ES+): m/e=467,3 (M+H).
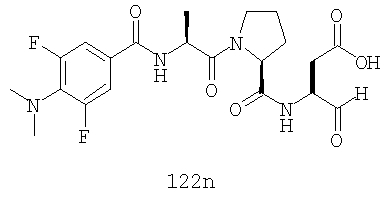
3-({1-[2-(4-Диметиламино-3,5-дифторбензоиламино)пропионил]пирролидин-2-карбонил}амино)-4-оксомасляная кислота (122n).
20,0 мг (0,043 ммоль) образца 98y гидролизовали в соответствии со способом А для получения 16,8 мг (выход 100%) соединения, указанного в заголовке. Аналитическая ВЭЖХ: 5,86 мин. ЖХ-МС (ES+): m/e=469,3 (M+H).
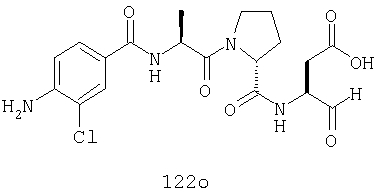
3-({1-[2-(4-Амино-3-хлорбензоиламино)пропионил]пирролидин-2-карбонил}амино)-4-оксомасляная кислота (122о).
20,0 мг (0,046 ммоль) образца 98m гидролизовали в соответствии со способом А для получения 16,7 мг (выход 100%) соединения, указанного в заголовке. Аналитическая ВЭЖХ: 8,47 мин. ЖХ-МС (ES+): m/e=439,2 (M+H).
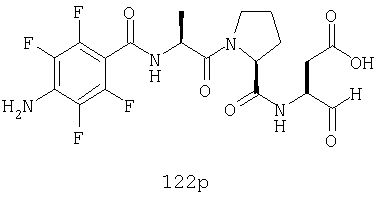
3-({1-[2-(4-Амино-2,3,5,6-тетрафторбензоиламино)пропионил]пирролидин-2-карбонил}амино)-4-оксомасляная кислота (122р).
20,0 мг (0,042 ммоль) образца 98z гидролизовали в соответствии со способом А для получения 15,3 мг (выход 91%) соединения, указанного в заголовке. Аналитическая ВЭЖХ: 7,90 мин. ЖХ-МС (ES+): m/e=477,2 (M+H).
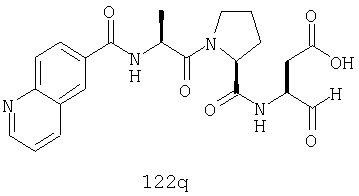
4-Оксо-3-[(1-{2-[хинолин-6-карбонил)амино]пропионил}пирролидин-2-карбонил)амино]масляная кислота (122q).
44 мг (0,080 ммоль) образца 93 гидролизовали в соответствии со способом А для получения 41 мг (выход 100%) соединения, указанного в заголовке. 1H-ЯМР (500 МГц, CD3OD) δ 1,24-1,69 (м, 3Н), 1,75-2,37 (м, 4Н), 2,39-2,87 (м, 2Н), 3,46-4,04 (м, 2Н), 4,11-4,77 (м, 3Н), 8,19 (дд, 1Н), 8,33 (д, 1Н), 8,56-8,58 (м, 1Н), 8,85 (с, 1Н), 9,27-9,39 (м, 2Н). Аналитическая ВЭЖХ: 4,91 мин. ЖХ-МС (ES+): m/e=441,2 (M+H).
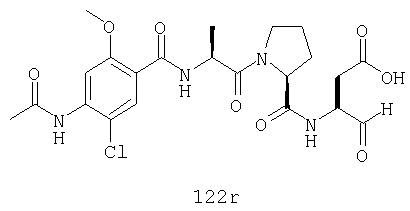
3-({1-[2-(4-Ацетиламино-5-хлор-2-метоксибензоиламино)пропионил]пирролидин-2-карбонил}амино)-4-оксомасляная кислота (122r).
44,5 мг (0,074 ммоль) образца 87 гидролизовали в соответствии со способен А для получения 34,5 мг (выход 91%) соединения, указанного в заголовке. Аналитическая ВЭЖХ: 6,88 мин. ЖХ-МС (ES+): m/e=511,2 (М+Н).
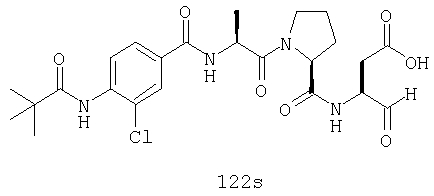
3-[(1-{2-[3-Хлор-4-(2,2-диметилпропиониламино)бензоиламино]пропионил}пирролидин-2-карбонил)амино]-4-оксомасляная кислота (122s).
19,0 мг (0,036 ммоль) образца 98аа гидролизовали в соответствии со способом А для получения 14,5 мг (выход 90%) соединения, указанного в заголовке. Аналитическая ВЭЖХ: 7,28 мин. ЖХ-МС (ES+): m/e=523,3 (M+H).
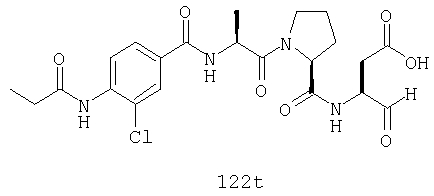
3-({1-[2-(3-Хлор-4-пропиониламинобензоиламино)пропионил]пирролидин-2-карбонил}амино)-4-оксомасляная кислота (122t).
21,0 мг (0,042 ммоль) образца 98ab гидролизовали в соответствии со способом А для получения 17,5 мг (выход 97%) соединения, указанного в заголовке. Аналитическая ВЭЖХ: 5,72 мин. ЖХ-МС (ES+): m/e=495,2 (М+Н).
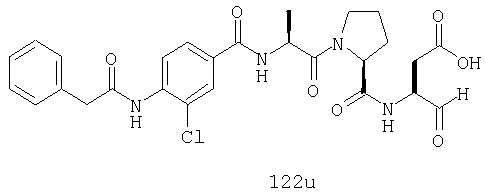
3-({1-[2-(3-Хлор-4-фенилацетиламинобензоиламино)пропионил]пирролидин-2-карбонил}амино)-4-оксомасляная кислота (122u).
10,0 мг (0,017 ммоль) образца 98ас гидролизовали в соответствии со способом А для получения 7,9 мг (выход 85%) соединения, указанного в заголовке. Аналитическая ВЭЖХ: 7,52 мин. ЖХ-МС (ES+): m/e=557,2 (М+Н).
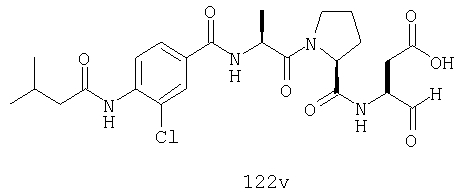
3-[(1-{2-[3-{Хлор-4-(3-метилбутириламино)бензоиламино]пропионил}пирролидин-2-карбонил}амино]-4-оксомасляная кислота (122v).
8,0 мг (0,015 ммоль) образца 98ad гидролизовали в соответствии со способом А для получения 6,5 мг (выход 96%) соединения, указанного в заголовке. Аналитическая ВЭЖХ: 6,92 мин. ЖХ-МС (ES+): m/e=523,2 (M+H).
Схема XXV
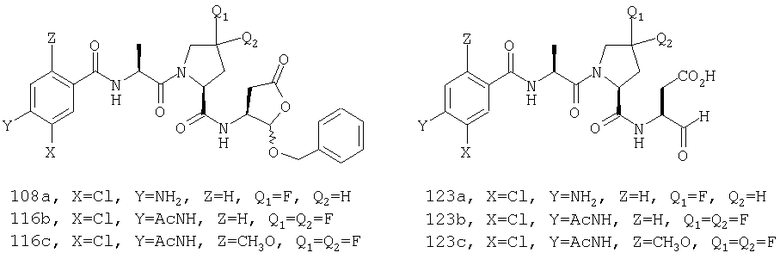
3-({1-[2-(4-Амино-3-хлорбензоиламино)пропионил]-4-фторпирролидин-2-карбонил}амино)-4-оксомасляная кислота (123а).
12,4 мг (0,022 ммоль) образца 108b гидролизовали в соответствии со способом А для получения 9,6 мг (выход 93%) соединения, указанного в заголовке. Аналитическая ВЭЖХ: 6,99 мин. ЖХ-МС (ES+): m/e=473,2 (M+H).
3-({1-[2-(4-Ацетиламино-3-хлорбензоиламино)пропионил]-4,4-дифторпирролидин-2-карбонил}амино)-4-оксомасляная кислота (123b).
26,2 мг (0,043 ммоль) образца 116b гидролизовали в соответствии со способом А для получения 10,8 мг (выход 49%) соединения, указанного в заголовке. Аналитическая ВЭЖХ: 9,89 мин. ЖХ-МС (ES+): m/e=517,2.
3-({1-[2-(4-Ацетиламино-3-хлор-2-метоксибензоиламино)пропионил]-4,4-дифторпирролидин-2-карбонил}амино)-4-оксомасляная кислота (123с).
23,1 мг (0,036 ммоль) образца 116с гидролизовали в соответствии со способом А для получения 1,8 мг (выход 9%) соединения, указанного в заголовке. Аналитическая ВЭЖХ: 11,87 мин. ЖХ-МС (ES+): m/e=547,1 (M+H).
Биологические методы
Заявители получили in vitro, ex vivo и in vivo данные для отдельных соединений настоящего изобретения с применением способов, описанных ниже. Результаты представлены в таблицах 2-8. Обозначение "не опр." обозначает, что данное соединение не изучали в описанном тесте.
В тестах каспазы ICE категория "А" обозначает ингибирование при <10 нМ. Категория "В" обозначает ингибирование при 10-1000 нМ. Категория "С" обозначает ингибирование при >1000 нМ. Смотри таблицы 2 и 3.
В тесте РВМС категория "А" обозначает ингибирование при <500 нМ. Категория "В" обозначает ингибирование при 500-1000 нМ. Категория "С" обозначает ингибирование при 1001-2000 нМ. Категория "D" обозначает ингибирование при >2000 нМ. Смотри таблицу 4.
В тесте на цельной крови категория "А" обозначает ингибирование при <2500 нМ. Категория "В" обозначает ингибирование при 2500-7500 нМ. Категория "С" обозначает ингибирование при >7500 нМ. Смотри таблицу 5.
В тесте метаболизма in situ величины [f(g) X f(h)] раскрыты следующим образом: категория "А" обозначает <0,25, категория "В" обозначает 0,25-0,49, категория "С" обозначает 0,5-0,75, категория "D" обозначает >0,75. При измерении экскреции желчи категория "А" обозначает <5%. Категория "В" обозначает 5-10%. Категория "С" обозначает >10%. Смотри таблицу 6.
В тесте в/в клиренса величины представлены следующим образом: категория "А" обозначает <50, категория "В" обозначает 50-80, категория "С" обозначает >80. Смотри таблицу 7.
В тесте биологической доступности величины Cmax (мкг/мл) раскрыты следующим образом: категория "А" обозначает <2,5, категория "В" обозначает 2,5-5,0, категория "С" обозначает >5,0. Величины AUC (мкг×час/мл) раскрыты следующим образом: категория "А" обозначает <2,5, категория "В" обозначает 2,5-5,0, категория "С" обозначает >5,0. Диапазоны полужизни (час) раскрыты следующим образом: категория "А" обозначает <1,5, категория "В" обозначает 1,5-2,0, категория "С" обозначает >2,0. Величины F (%) раскрыты следующим образом: категория "А" обозначает <33, категория "В" обозначает 33-67, категория "С" обозначает >67. Смотри таблицу 8.
Тесты in vitro
Ингибирование ферментов
Величины Ki для тестируемых соединений с различными каспазами были получены по методу Margolin et al. (J. Biol. Chem., 272 pp.7223-7228 (1997)). Тесты проводили в 10 мМ трис (Sigma Corp, St Louis МО), рН 7,5, 1 мМ дитиотреитол (ДТТ, Research Organic INC, Cleveland, ОН) и 0,1% CHAPS (Pierce, Rockford IL) при 37°С. Для каспазы-3 к тестирующему буферу добавляли раствор 8% глицерола для повышения стабильности фермента. В 96-луночный планшет, обработанный 10 мкл каспазы, вносили 65 мкл аликвоту тестирующего буфера и 5 мкл аликвоту соответствующих разведений ингибитора в ДМСО и затем разводили в тестирующем буфере (0,5-40 нМ активного белка по титрованию активного сайта). В каждое определение включали контроль, содержащий ДМСО, но не соединение изобретения. Планшеты затем инкубировали в течение 15 минут при 37°С перед добавлением соответствующего субстрата (20 мкл, конечная концентрация 1-4 Х KМ, конечный объем смеси 100 мкл) для инициации реакции. Скорости реакции измеряли при 37°С либо следя за зависимым от времени увеличением поглощения при 405 нМ (для субстратов pNA) или флуоресценции (возб. 390, эмисс. 460) (для субстратов АМС). Полученные скорости откладывали против концентрации ингибитора и данные анализировали в соответствии с уравнением для прочного связывания Morrison для конкурентных ингибиторов (Morrison, J.F., Biochem. Biophys. Acta, 185 pp. 269-286 (1969)). Для индивидуальных тестов использовали следующие субстраты:
Каспаза-1 Suc-YVAD-pNA (Bachem, King of Prussia, PA) (конечная концентрация в тесте 80 мкМ),
Каспаза-3 Ac-DEVD-pNA (Bachem, King of Prussia, PA) (конечная концентрация в тесте 60 мкМ),
Каспаза-4 Ac-WEHD-AMC (Synpep, Dublin, CA) (конечная концентрация в тесте 20 мкМ),
Каспаза-7 Ac-DEVD-AMC (Bachem, King of Prussia, PA) (конечная концентрация в тесте 50 мкМ),
Каспаза-8 Ac-DEVD-pNA (Bachem, King of Prussia, PA) (конечная концентрация в тесте 80 мкМ).
Тест на РВМС клетках
Тест IL-1β со смешанной популяцией мононуклеарных клеток периферической крови человека (РВМС) или с обогащенной клейкими мононуклеарными клетками популяцией
Процессинг пре-IL-1β с помощью ICE может быть измерен в клеточной культуре с использованием множества источников клеток. Человеческие РВМС, полученные от здоровых доноров, представляют собой смешанную популяцию подтипов лимфоцитов и мононуклеарных клеток, которые образуют спектр интерлейкинов и цитокинов в ответ на многие классы физиологических стимуляторов. Клейкие мононуклеарные клетки из PBMC представляют собой обогащенный источник нормальных моноцитов для отдельных исследований образования цитокина, активированными клетками.
Экспериментальная процедура
Готовят серии исходных разведений исследуемого соединения в ДМСО или этаноле с последующим разведением в среде RPMI-10% FBS (содержащей 2 мМ L-глутамина, 10 мМ HEPES, 50 U и 50 мкг/мл пен/сетреп) соответственно для получения лекарств с конечной концентрацией ×4 при тестировании при содержании 0,4% ДМСО или 0,4% этанола. Конечная концентрация ДМСО составляет 0,1% для всех разведений лекарства. Концентрация при титровании, которая охватывает кажущуюся Ki для тестируемого соединения, определенная в тесте ингибирования ICE, обычно используется для предварительного скрининга соединения.
Обычно тестируют 5-6 разведений соединения и клеточный компонент теста выполняют в двух параллелях с двумя параллельными определениями ИФА для каждого супернатанта клеточной культуры.
Выделение РВМС и тест IL-1
Белые клетки кровяного сгустка, выделенные из одной пинты (0,57 л)крови человека (с выходом 40-45 мл конечного объема плазмы плюс клетки), разводили средой до 80 мл и каждую из LeukoPREP пробирок для разделения (Becton Dickinson). покрывали 10 мл клеточной суспензии. После центрифугирования в течение 15 мин при 1500-1800×g слой плазмы/среды отсасывали и затем собирали слой мононуклеарных клеток с помощью пастеровских пипеток и переносили его в 15 мл коническую центрифужную пробирку (Corning). Для доведения объема до 15 мл добавляли среду, осторожно перемешивали клетки путем опрокидывания пробирки и центрифугировали при 300×g в течение 15 мин. Осадок РВМС ресуспендировали в небольшом объеме среды, клетки подсчитывали и доводили до 6×106 клеток/мл.
Для клеточного теста к каждой лунке 24-луночного плоскодонного планшета для культивирования тканей (Corning) добавляли 1,0 мл клеточной суспензии, 0,5 мл разведения тестируемого соединения и 0,5 мл раствора LPS (Sigma #L-3012; 20 нг/мл раствора, полученного в полной среде RPMI; конечная концентрация LPS 5 нг/мл). Добавления 0,5 мл тестируемого соединения и LPS является обычно достаточным для смешивания содержимого в лунках. В эксперимент включали три контрольные смеси, или только с LPS, с контролем на применяемый растворитель, и/или с дополнительной средой для доведения конечного объема культуры до 2,0 мл. Клеточные культуры инкубировали в течение 16-18 часов при 37°С в присутствии 5% CO2.
В конце инкубационного периода клетки собирали и переносили в 15 мл конические центрифужные пробирки. После центрифугирования в течение 10 мин при 200×g супернатанты собирали и переносили в 1,5 мл пробирки Eppendorf. Следует отметить, что клеточный осадок может быть использован для биохимической оценки содержания в цитозольном экстракте пре-IL-1β или зрелого IL-1β с помощью иммуноблоттинга или ИФА с антисывороткой, специфичной для пре-IL-1β.
Выделение клейких мононуклеарных клеток
РВМС выделяли и получали, как описано выше. Сначала к лункам добавляли среду (1,0 мл), затем 0,5 мл РВМС суспензии. После инкубации в течение одного часа планшеты осторожно перемешивали и неприкрепившиеся клетки отсасывала из каждой лунки. Затем лунки осторожно промывали три раза 1,0 мл среды и окончательно ресуспендировали в 1,0 мл среды. Обогащение клейкими клетками обычно составляло 2,5-5,0×105 клеток на лунку. Добавление тестируемых соединений, LPS, условия инкубации клеток и продолжение обработки супернатантов, как описано выше.
ИФА
Наборы Quantikine (R&D Systems) могут быть использованы для измерения зрелого IL-1β. Определения проводят в соответствии с инструкциями производителя. Выявлены уровни зрелого IL-1β порядка 1-3 нг/мл как в РВМС, так и в позитивных контролях с липкими мононуклеарными клетками. ИФА определения выполняли при разведениях 1:5, 1:10 и 1:20 супернатантов из LPS-позитивных контролей для выбора оптимального разведения для супернатантов тестируемой панели.
Ингибиторный потенциал соединений может быть представлен с помощью величины IC50, которая представляет собой концентрацию ингибитора, при которой в супернатанте определяют 50% зрелого IL-1β по отношению к позитивным контролям.
Опытному специалисту известно, что величины, полученные в клеточных тестах, могут зависеть от множества факторов. Величины необязательно представляют собой точные количественные результаты.
Тест на продукцию IL-1β на цельной крови
Величины IC50, определенные на цельной крови, получены для соединений настоящего изобретения с применением метода, описанного ниже.
Цель
Исследование на цельной крови является простым методом для измерения продукции IL-1β (или других цитокинов) и активности потенциальных ингибиторов. Комплексность этой системы тестирования с ее полным составом лимфоидных и воспалительных типов клеток, спектром белков плазмы и красными клетками крови, является идеалом для представления in vitro о физиологических состояниях человека in vivo.
Материалы
Непирогенные шприцы (˜ 30 сс)
Непирогенные стерильные вакуумные пробирки, содержащие лиофилизированную Na2EDTA (4,5 мг/10 мл пробирка)
Образец цельной крови человека (˜ 30-50 сс)
Пробирки Eppendorf на 1,5 мл
Маточные растворы тестируемых соединений (˜ 25 мМ в ДМСО или другом растворителе)
Свободный от эндотоксина раствор хлористого натрия (0,9%) и HBSS
Маточный раствор липополисахарида (Sigma; Cat. # L-3012) с концентрацией 1 мг/мл в HBSS
Набор ИФА для IL-1β (R&D System; Cat # DLB50)
Набор ИФА для TNFα (R&D System; Cat # DTA50)
Водяная баня или инкубатор
Экспериментальная процедура теста на цельной крови:
Установить инкубатор или водяную баню на 30°С.
Внести 0,25 мл аликвоты крови в пробирки Eppendorf на 1,5 мл.
Замечание: обязательно переворачивать пробирки с образцами цельной крови после каждых двух аликвот. Различия в параллельных пробах могут быть результатом осаждения клеток и их неоднородного суспендирования. Применение пипетки с позитивным вытеснением также должно свести к минимуму различия между параллельными аликвотами.
Получить разведения лекарств в стерильном непирогенном солевом растворе с помощью серийных разведений. Серии разведений, которые стоят в ряду кажущейся Ki для тестируемого соединения, определенной в тесте ингибирования ICE, обычно применяют для первичного скрининга соединений. Для крайне гидрофобных соединений получают разведения соединений в свежей плазме, полученной от того же самого донора, или в содержащем 3ФР 5% ДМСО для увеличения растворимости.
Добавить 25 мкл разведенного тестируемого соединения или контрольного растворителя и осторожно перемешать образец. Затем добавить 5,0 мкл раствора LPS (250 нг/мл свежеприготовленного маточного раствора: конечная концентрация LPS 5,0 нг/мл) и снова перемешать. Инкубировать пробирки при 30°С в водяной бане в течение 16-18 часов с периодическим перемешиванием. В противоположном варианте пробирки могут быть помещены в ротор, установленный на 4 об/мин, в течение того же инкубационного периода. Этот тест необходимо проводить в двух или трех параллельных пробах со следующими контролями: негативный контроль - нет LPS; позитивный контроль - нет тестируемого ингибитора; контроль на растворитель - наивысшая концентрация ДМСО или растворителя соединения, применяемая в эксперименте. Во все контрольные пробирки добавляют дополнительный солевой раствор для приведения к одному уровню объемов контрольных и экспериментальных образцов в тесте на цельной крови.
После инкубационного периода образцы цельной крови центрифугируют в течение 10 минут при ˜ 2000 об/мин в микроцентрифуге, плазму переносят в новую микроцентрифужную пробирку и центрифугируют при 1000×g для осаждения остатков тромбоцитов, если это необходимо. Образцы плазмы можно хранить при -70°С перед тестированием уровня цитокинов с помощью ИФА.
ИФА
Наборы Quantikine от R&G Systems (614 McKinley Place N.E. Minneapolis, MN 55413) могут быть использованы для измерения IL-1β и TNF-α. Определения проводят в соответствии с инструкциями производителя. Уровни IL-1β ˜1-5 нг/мл могут быть обнаружены в позитивном контроле среди диапазона индивидуальных данных. Разведение плазмы 1:200 обычно достаточно для всех образцов в экспериментах по ИФА, что дает линейный участок стандартных кривых ИФА. Может возникнуть необходимость в оптимизации стандартных разведений, если наблюдаются различия в тесте на цельной крови. Nerad, J.L. et al., J. Leukocyte Bol., 52, pp.687-692 (1992).
Тесты ex vivo
Проводили исследования однократной перфузии у крыс для оценки метаболизма стенки желудочно-кишечного (GI) тракта (f(g)), метаболизма печени (f(h)) и желчной экскреции. Используемый метод описан в Pang, C.S., J. Pharmacol. Exp. Therapeutics, 333, pp.788-798 (1984).
Тесты in vivo
Тест in vivo клиренса у крыс - скорости клиренса
Скорость клиренса у крысы (мл/мин/кг) для соединений настоящего изобретения может быть получена с применением способа, описанного ниже.
Типичная процедура
За один день до начала фармакокинетического исследования проводили введение канюль в яремную и сонную артерии крыс. M.J.Free, R.A.Jaffee. "Cannulation techniques for the collection blood and other bodily fluids"; in: Animal Models; p.480-495; N.J.Alexander, Ed.; Academic Press (1978). Лекарство (10 мг/мл) вводили через яремную вену в растворителе, обычно состоящем из пропиленгликоль/солевого раствора, содержащего 100 мМ бикарбоната натрия в отношении 1:1. Доза для животного составляла 10-20 мг лекарства/кг и образцы крови отбирали через 0, 2, 5, 7, 10, 15, 20, 30, 60 и 90 минут после вживления катетера в сонную артерий. Кровь центрифугировали до плазмы и хранили при -20°С до анализа. Фармакокинетический анализ данных выполняли с помощью нелинейной регрессии, применяя стандартное программное сбеспечение, такое как Rstrip (MicroMath Software, UT), и/или Pcnonlin (SCI Software, NC) для получения величин клиренса.
Типичные аналитические методы
Плазму крыс экстрагировали равным объемом ацетонитрила (содержащего 0,1% TFA). Образцы затем центрифугировали при приблизительно 1000×g и супернатант анализировали с помощью градиентной ВЭЖХ. Обычная процедура тестирования описана ниже.
200 мкл плазмы осаждали 200 мкл 0,1% трифторуксусной кислоты (TFA) в ацетонитриле и 10 мкл 50% водного раствора хлористого цинка, перемешивали вращением, затем центрифугировали при ˜ 1000×g и супернатант собирали и анализировали с помощью ВЭЖХ.
Процедура ВЭЖХ
Температура колонки: 50°С
Кривая охватывает концентрации 20, 10, 5, 2 и 1 мкг/мл.
Биологическая доступность
Фармакокинетические исследования при пероральном введении
Самцы Spraque-Dawley крыс (Harlan, Indianapolis, IN, 300-350 г) анастезировали с помощью внутримышечной инъекции смеси кетамина/ромпуна. В правую сонную артерию вставляли канюлю PE-50 для отбора образцов артериальной крови. Крысам давали отойти от операции в течение ночи (>16 часов) до использования в исследовании. Тестируемые соединение вводили перорально в 25% Cremofor EL/воде (вес/вес) или 100% пропиленгликоле (PG) в объемной дозе 10 мл/кг. Образцы крови (˜0,30 мл) отбирали через 0,25, 0,50, 1,0, 1,5, 2, 3, 4, 6 и 8 часов после введения дозы. плазму отделяли центрифугированием и хранили при -20°С до анализа. Количественное определение образцов плазмы проводили с применением ВЭЖХ/МС/МС или ферментативного метода, подробно описанных ниже.
ВЭЖХ/МС/МС метод для количественного определения ингибиторов ICE в плазме крыс
Получение образца
- Аликвоты 50 мкл плазмы разносят в центризужные флаконы Eppendorf.
- Для осаждения белков плазмы к плазме добавляют разный объем ацетонитрила.
- Образцы перемешивают вращением в течение 5 минут и центрифугируют при 14000 об/мин в течение 5 минут.
- На 12 мм сосуды для ВЭЖХ жидких образцов наносят 75 мкл супернатанта.
- Вводят 50 мкл образца для анализа через масс-спектрометр.
Параметры оборудования для ВЭЖХ
ВЭЖХ: Hewlett Packard HP1100 Binary solvent Delivery System.
Условия градиента ВЭЖХ
А=H2O 0,2% муравьиной кислоты
В=ацетонитрил 0,2% муравьиной кислоты
Подвижная фаза
Аналитическая колонка ВЭЖХ: Keystone Phenyl -2 Hypersil 2,0×100 мм, 5 мк размер пор 120 Å, P/N# 105-39-2
Инъецируемый объем: 50 мкл
Скорость тока: 0,20 мл/мин.
Параметры оборудования для масс-спектрометрии
Определение ферментативной активности ICE для количественной оценки действия ингибиторов ICE в плазме крыс
50 мкл плазмы экстрагировали 150 мкл ацетонитрила, сонифицировали, перемешивали вращением, центрифугировали при 10000с×g и 180 мкл супернатанта сушили в роторном испарителе Sorvall при комнатной температуре. Образцы реконструировали в 100 мкл буфера (10 мМ трис-HCl, рН 7,5, с 0,1% CHAPS, 1 мМ DTT) с сонификацией. 10 мкл каждого образца смешивали с 10 мкл ICE (1,1 мг/мл) в планшете для микротитрования с 60 мкл буфера. Образцы инкубировали в течение 15 мин при комнатной температуре, затем добавляли 20 мкл Succ YVAD-pNA (400 мкМ, предварительно нагретый до 37°С) и проводили измерение планшета при 405 нм в течение 20 мин при 37°С с помощью ридера Spectramax. Результаты анализировали, применяя 4-параметрический анализ с помощью программного обеспечения Spectramax с использованием выбранной стандартной кривой. Определение ложилось на линейный участок в интервале от 0,15 до 2,0-3,0 мкг/мл альдегида.
Фармакокинетические параметры
Фармакокинетический анализ этих данных о концентрации в плазме проводили с применением методов без разбиения. Область под кривой (AUC(0-t)) определяли от нулевой временной точки до последней измеряемой временной точки, применяя правило линейной трапеции. Скорость исчезновения (ke) определяли с помощью логарифмической-линейной регрессии из конечной фазы кривых концентрация в плазме-время. Область под конечным участком кривой определяли как отношение последней измеряемой концентрации к ke. Область под кривой от нулевой временной точки до бесконечности (AUC(0-∞)) получали путем добавления области под конечным участком (AUC(0-t)). Полупериод исчезновения был определен как 0,693/ke. Полученные величины для пика концентрации в плазме (Смакс) записывали.
Для исследования пролекарств: доступность альдегида (биологическая доступность) рассчитывалась как (AUCальд/пролекарство р.о.)/(AUCальд/альд. в/в)×(доза альд., альд. в/в/доза пролекарства, пролекарство р.о.)×(М.в. пролекарства/М.в. альдегида).
Тесты на противовирусную активность
Эффективность соединений настоящего изобретения при лечении или антивирусной профилактике заболеваний, нарушений или состояний, связанных с вирусной инфекцией, может быть оценена с помощью различных методов in vitro и in vivo. Например, могут быть выполнены тесты для определения способности данных соединений тормозить воспалительные ответы, связанные с вирусными инфекциями. При исследованиях in vitro могут быть применены целые клетки или выделенные клеточные компоненты. Тесты in vivo включают животные модели для вирусных заболеваний. Примеры таких животных моделей включают, но не ограничиваются этим, модели грызунов для HBV или HCV инфекции, модель Woodchuck для HBV инфекции и модель шимпанзе для HCV инфекции.
Соединения настоящего изобретения могут также оцениваться по животным моделям для заболевания, индуцированного приемом алкоголя.
Другие тесты, которые могут быть использованы для оценки соединений настоящего изобретения, раскрыты в заявке РСТ PCT/US96/20843, опубликованной 26 июня 1997 под номером публикации WO 97/22619. Такие тесты включают фармакокинетическиие исследования на мышах in vivo, ингибирование гомологов ICE, ингибирование апоптоза, острый опыт in vivo по эффективности противовоспалительного действия, измерение уровня лекарств в крови, тесты IGIF, тест воспаления брюшины мышей, вызванного ирландским мхом и артрит, индуцированный коллагеном типа II.
Поскольку соединения настоящего изобретения способны тормозить каспазы, особенно ICE, in vitro и, более того, могут доставляться у млекопитающих перорально, очевидно, что они имеют клиническое применение для лечения заболеваний, опосредованных IL-1, апоптозом, IGIF и IFN-γ.
Несмотря на то, что заявители описали ряд осуществлений настоящего изобретения, очевидно, что основные конструкции заявителей могут быть изменены для обеспечения других осуществлений, которые используют продукты и процессы настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНГИБИТОРЫ ИНТЕРЛЕЙКИН-1 БЕТА-ПРЕВРАЩАЮЩЕГО ФЕРМЕНТА | 1995 |
|
RU2242480C2 |
| ЗАМЕЩЕННОЕ ПРОИЗВОДНОЕ 2Н-ПИРАЗОЛА | 2016 |
|
RU2722363C2 |
| ИНГИБИТОРЫ ФЕРМЕНТА, КОНВЕРТИРУЮЩЕГО ИНТЕРЛЕЙКИН-1-β | 1996 |
|
RU2249598C2 |
| ПИРИДИН-2-ИЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИММУНОМОДУЛИРУЮЩИХ АГЕНТОВ | 2009 |
|
RU2494099C2 |
| МАКРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ПИРИДАЗИНОНА | 2014 |
|
RU2660435C2 |
| БОРСОДЕРЖАЩИЕ МАЛЫЕ МОЛЕКУЛЫ В КАЧЕСТВЕ ПРОТИВОВОСПАЛИТЕЛЬНЫХ АГЕНТОВ | 2009 |
|
RU2547441C2 |
| АНТАГОНИСТЫ TLR7/8 И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2758686C2 |
| ДИАМИНОТРИАЗОЛЫ, ПРИГОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ПРОТЕИНКИНАЗ | 2003 |
|
RU2350606C2 |
| Бензотиофены и родственные соединения в качестве агонистов STING | 2019 |
|
RU2806274C2 |
| АЛКИНИЛ-ЗАМЕЩЕННОЕ ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2017 |
|
RU2729069C1 |
Изобретение относится к новым соединениям, которые представляют собой ингибиторы каспаз, в частности ингибиторы интерлейкин-1β-превращающего фермента, и к их фармацевтическим композициям. Соединения настоящего изобретения могут успешно применяться в качестве агентов, направленных против заболеваний, опосредованных интерлейкином-1, апоптозом, фактором, индуцирующим интерферон-γ, или интерфероном-γ. 12 н. и 23 з.п. ф-лы, 8 табл.
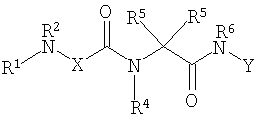
где
Y представляет собой
(а)
 или
или
(b)
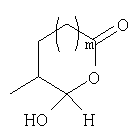
Х представляет собой -C(R3)2- или -N(R3)-;
m равно 0 или 1;
R1 представляет собой -Н, -C(O)R8, -C(O)C(O)R8, -S(O)2R8, -С(О)OR8 или -C(O)N(H)R8;
R2 представляет собой -Н, а каждый R3 независимо является -Н, боковой цепью аминокислоты или -R8;
один R5 представляет собой -Н, а R4 и один R5 вместе с атомами, к которым они присоединены, образуют кольцевую систему, выбранную из:
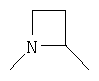
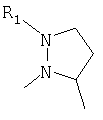
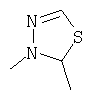 или
или
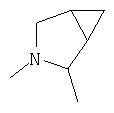
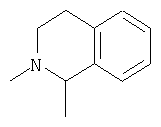
где атом водорода, связанный с любым атомом азота кольцевой системы, может быть замещен на R1 или R4 и один R5 вместе с атомами, к которым они присоединены, образуют кольцевую систему
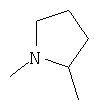
R6 представляет собой -Н;
R7 представляет собой -ОН или -OR8;
каждый R8 независимо представляет собой -алкил, -циклоалкил, -арил, -гетероарил, -гетероциклил, -алкилциклоалкил, -алкиларил, -алкилгетероарил или алкилгетероциклил, где атом водорода, связанный с атомом углерода любого -алкила или -циклоалкила, может быть замещен на R10, атом водорода, связанный с атомом углерода любого -арила или -гетероарила, может быть замещен на R11 и атом водорода, связанный с любым атомом азота, может быть замещен на R1;
каждый R10 независимо представляет собой -ОН, -SH, -F, -Cl, -Br, -I, -NO2, -CN, -NH2, -CO2H, -С(O)NH2, -N(H)C(O)H, -N(Н)С(О)NH2, -перфторалкил, -O-алкил, -O-арил, -O-алкиларил, -N(H)алкил, -N(Н)арил, -N(Н)алкиларил, -N(алкил)2, -C(O)N(H)алкил, -С(О)N(алкил)2, -N(Н)С(О)алкил, -N(Н)С(O)N(Н)алкил, -N(Н)С(О)N(алкил)2, -S-алкил, -S-арил, -S-алкиларил, -S(O)2алкил, -S(О)алкил, -С(О)алкил, -CH2NH2, -CH2N(Н)алкил или -CH2N(алкил)2, -алкил, -циклоалкил, -арил, -гетероарил, -гетероциклил, -алкилциклоалкил, -алкиларил, -алкилгетероарил или -алкилгетероциклил, где атом водорода, связанный с атомом углерода любого -арила или -гетероарила, может быть замещен на R11 и атом водорода, связанный с любым атомом азота, может быть замещен на R1;
каждый R11 независимо представляет собой -ОН, -SH, -F, -Cl, -Br, -I, -NO2, -CN, -NH2, -CO2H, -C(O)NH2, -N(H)C(O)H, -N(Н)С(О)NH2, -алкил, -циклоалкил, -перфторалкил, -O-алкил, -O-арил, -O-алкиларил, -N(H)алкил, -N(Н)арил, -N(Н)-алкиларил, -N(алкил)2, -С(O)N(H)алкил, -С(О)N(алкил)2, -N(Н)С(О)алкил, -N(Н)С(O)N(Н)алкил, -N(Н)С(O)N(алкил)2, -S-алкил, -S-арил, -S-алкиларил, -S(О)2алкил, -S(O)алкил, -С(О)алкил, -CH2NH2, -CH2N(Н)алкил или -CH2N(алкил)2.
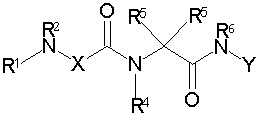
где
Y представляет собой
(а)
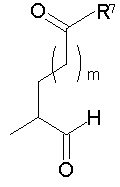 или
или
(b)
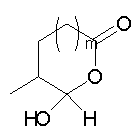
m равно 0 или 1;
Х представляет собой -C(R3)2-;
R1 представляет собой -Н, -C(O)R8, -C(O)C(O)R8, -S(O)2R8, -С(О)OR8 или -C(O)N(H)R8;
R2 представляет собой -Н, и каждый R3 независимо представляет собой -Н, боковую цепь аминокислоты или -R8;
один R5 представляет собой -Н, и R4 и один R5 вместе с атомами, к которым они присоединены, образуют кольцевую систему, выбранную из
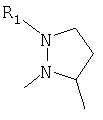
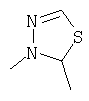 или
или
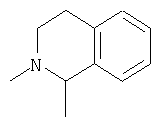
где атом водорода, связанный с любым атомом азота кольцевой системы, может быть замещен на R1 или R4 и один R5 вместе с атомами, к которым они присоединены, образуют кольцевую систему:

R6 представляет собой -Н;
R7 представляет собой -ОН или -OR8;
каждый R8 независимо представляет собой -алкил, -циклоалкил, -арил, -гетероарил, -гетероциклил, -алкилциклоалкил, -алкиларил, -алкилгетероарил или -алкилгетероциклил, где атом водорода, связанный с атомом углерода любого -алкила или -циклоалкила, может быть замещен на R10, атом водорода, связанный с атомом углерода любого -арила или -гетероарила, может быть замещен на R11 и атом водорода, связанный с любым атомом азота, может быть замещен на R1;
каждый R10 независимо представляет собой -ОН, -SH, -F, -Cl, -Br, -I, -NO2, -CN, -NH2, -CO2Н, -С(О)NH2, -N(H)C(O)H, -N(Н)С(O)NH2, -перфторалкил, -O-алкил, -O-арил, -O-алкиларил, -N(H)алкил, -N(H)арил, -N(H)алкиларил, -N(алкил)2, -С(O)N(Н)алкил, -С(О)N(алкил)2, -N(Н)С(О)алкил, -N(H)C(O)N(H)алкил, -N(Н)С(О)N(алкил)2, -S-алкил, -S-арил, -S-алкиларил, -S(O)2алкил, -S(O)алкил, -С(О)алкил, -CH2NH2, -CH2N(Н)алкил или -CH2N(алкил)2, -алкил, -циклоалкил, -арил, -гетероарил, -гетероциклил, -алкилциклоалкил, -алкиларил, -алкилгетероарил или -алкилгетероциклил, где атом водорода, связанный с атомом углерода любого -арила или -гетероарила, может быть замещен на R11 и атом водорода, связанный с любым атомом азота, может быть замещен на R1;
каждый R11 независимо представляет собой -ОН, -SH, -F, -Cl, -Br, -I, -NO2, -CN, -NH2, -СО2Н, -C(O)NH2, -N(H)C(O)H, -N(H)С(О)NH2, -алкил, -циклоалкил, -перфторалкил, -O-алкил, -O-арил, -O-алкиларил, -N(H)алкил, -N(H)арил, -N(H)-алкиларил, -N(алкил)2, -С(O)N(H)алкил, -С(О)N(алкил)2, -N(Н)С(О)алкил, -N(H)C(O)N(H)алкил, -N(Н)С(О)N(алкил)2, -S-алкил, -S-арил, -S-алкиларил, -S(O)2алкил, -S(O)алкил, -С(О)алкил, -CH2NH2, -CH2N(Н)алкил или -CH2N(алкил)2;
при условии, что если один R3 представляет собой -Н, то другой R3 не является -Н.

где Y представляет собой
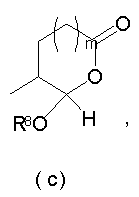
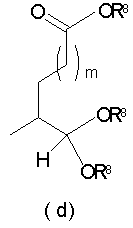 или
или 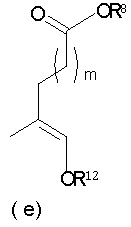
m равно 0 или 1;
X представляет собой -C(R3)2;
R1 представляет собой -Н, -C(O)R8, -C(O)C(O)R8, -S(O)2R8, -С(О)OR8 или -C(O)N(H)R8;
R2 представляет собой -Н, и каждый R3 независимо представляет собой -Н, боковую цепь аминокислоты или -R8;
один R5 представляет собой -Н, и R4 и один R5 вместе с атомами, к которым они присоединены, образуют кольцевую систему, выбранную из:
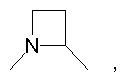
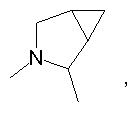
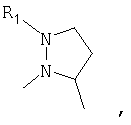
 или
или
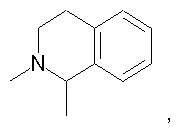
где атом водорода, связанный с любым атомом азота кольцевой системы, может быть замещен на R1, или R4 и один R5 вместе с атомами, к которым они присоединены, образуют кольцевую систему:

R6 представляет собой -Н;
каждый R8 независимо представляет собой -алкил, -циклоалкил, -арил, -гетероарил, -гетероциклил, -алкилциклоалкил, -алкиларил, -алкилгетероарил или -алкилгетероциклил, где атом водорода, связанный атомом углерода с любого -алкила или -циклоалкила, может быть замещен на R10, атом водорода, связанный с атомом углерода любого -арила или -гетероарила, может быть замещен на R11 и атом водорода, связанный с любым атомом азота, может быть замещен на R1;
каждый R10 независимо представляет собой -ОН, -SH, -F, -Cl, -Br, -I, -NO2, -CN, -NH2, -CO2Н, -C(O)NH2, -N(H)C(O)H, -N(Н)С(О)NH2, -перфторалкил, -O-алкил, -O-арил, -О-алкиларил, -N(H)алкил, -N(Н)арил, -N(Н)алкиларил, -N(алкил)2, -С(O)N(Н)алкил, -С(О)N(алкил)2, -N(Н)С(О)алкил, -N(Н)С(O)N(Н)алкил, -N(Н)С(О)N(алкил)2, -S-алкил, -S-арил, -S-алкиларил, -S(O)2алкил, -S(O)алкил, -С(О)алкил, -CH2NH2, -CH2N(Н)алкил или -CH2N(алкил)2, -алкил, -циклоалкил, -арил, -гетероарил, -гетероциклил, -алкилциклоалкил, -алкиларил, -алкилгетероарил или -алкилгетероциклил, где атом водорода, связанный с атомом углерода любого -арила или -гетероарила, может быть замещен на R11 и атом водорода, связанный с любым атомом азота, может быть замещен на R1;
каждый R11 независимо представляет собой -ОН, -SH, -F, -Cl, -Br, -I, -NO2, -CN, -NH2, -CO2Н, -С(О)NH2, -N(H)C(O)H, -N(Н)С(О)NH2, -алкил, -циклоалкил, -перфторалкил, -O-алкил, -O-арил, -O-алкиларил, -N(H)алкил, -N(H)арил, -N(H)-алкиларил, -N(алкил)2, -С(O)N(H)алкил, -С(О)N(алкил)2, -N(Н)С(О)алкил, -N(H)C(O)N(H)алкил, -N(Н)С(О)N(алкил)2, -S-алкил, -S-арил, -S-алкиларил, -S(O)2алкил, -S(О)алкил, -С(О)алкил, -CH2NH2, -CH2N(Н)алкил или -CH2N(алкил)2;
R12 представляет собой -С(О)алкил, -С(О)циклоалкил, -С(О)алкенил, -С(О)алкиларил, -С(О)алкилгетероарил, -С(О)гетероциклил или -С(О)алкилгетероциклил.
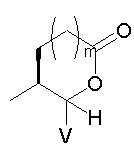
и V представляет собой СН3О,
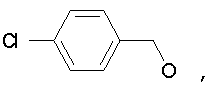
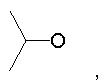

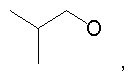
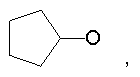
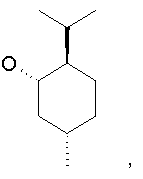
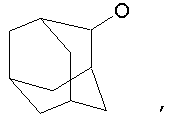
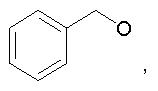
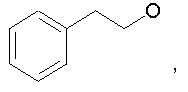
 ,
,
 или
или 
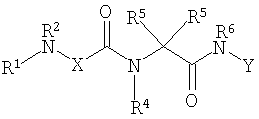
где
Y представляет собой
(а)
 или
или
(b)
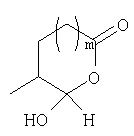
Х представляет собой -C(R3)2- или -N(R3)-;
m равно 0 или 1;
R1 представляет собой -Н, -C(O)R8, -C(O)C(O)R8, -S(O)2R8, -С(О)OR8 или -C(O)N(H)R8;
R2 представляет собой -Н, а каждый R3 независимо является -Н, боковой цепью аминокислоты или -R8;
один R5 представляет собой -Н, а R4 и один R5 вместе с атомами, к которым они присоединены, образуют кольцевую систему, выбранную из:



 или
или

где атом водорода, связанный с любым атомом азота кольцевой системы, может быть замещен на R1, или R4 и один R5 вместе с атомами, к которым они присоединены, образуют кольцевую систему:

R6 представляет собой -Н;
R7 представляет собой -ОН или -OR8;
каждый R8 независимо представляет собой -алкил, -циклоалкил, -арил, -гетероарил, -гетероциклил, -алкилциклоалкил, -алкиларил, -алкилгетероарил или алкилгетероциклил, где атом водорода, связанный с атомом углерода любого -алкила или -циклоалкила, может быть замещен на R10, атом водорода, связанный с атомом углерода любого -арила или -гетероарила, может быть замещен на R11 и атом водорода, связанный с любым атомом азота, может быть замещен на R1;
каждый R10 независимо представляет собой -N(Н)С(О)Оалкил, -N(H)С(О)Оарил, -N(H)C(О)Оалкиларил, -N(Н)С(О)Огетероарил, -N(Н)С(О)Оалкилгетероарил, -N(Н)С(О)Оциклоалкил, -N(H)C(O)N(H)арил или -N(Н)С(О)N(Н)алкиларил, где атом водорода, связанный с атомом углерода любого -арила или -гетероарила, может быть замещен на R11 и атом водорода, связанный с любым атомом азота, может быть замещен на R1;
каждый R11 независимо представляет собой -ОН, -SH, -F, -Cl, -Br, -I, -NO2, -CN, -NH2, -CO2Н, -C(O)NH2, -N(H)C(O)H, -N(Н)С(О)NH2, -алкил, -циклоалкил, -перфторалкил, -O-алкил, -O-арил, -O-алкиларил, -N(H)алкил, -N(Н)арил, -N(H)-алкиларил, -N(алкил)2, -С(O)N(Н)алкил, -С(О)N(алкил)2, -N(Н)С(О)алкил, -N(H)C(O)N(H)алкил, -N(H)C(О)N(алкил)2, -S-алкил, -S-арил, -S-алкиларил, -S(O)2алкил, -S(O)алкил, -С(О)алкил, -CH2NH2, -CH2N(Н) алкил или -CH2N(алкил)2.
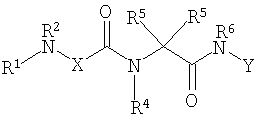
где
Y представляет собой
(а)
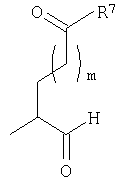 или
или
(b)
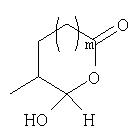
Х представляет собой -C(R3)2- или -N(R3)-;
m равно 0 или 1;
R1 представляет собой -Н, -R8, -C(O)R8, -C(O)C(O)R8, или -S(O)2R8;
R2 представляет собой -Н, а каждый R3 независимо является -Н, боковой цепью аминокислоты или -R8;
один R5 представляет собой -Н, а R4 и один R5 вместе с атомами, к которым они присоединены, образуют кольцевую систему, выбранную из:



 или
или

где атом водорода, связанный с любым атомом азота кольцевой системы, может быть замещен на R1, или R4 и один R5 вместе с атомами, к которым они присоединены, образуют кольцевую систему:

R6 представляет собой -Н;
R7 представляет собой -ОН или -OR8;
каждый R8 независимо представляет собой -алкил, -циклоалкил, -арил, -гетероарил, -гетероциклил, -алкилциклоалкил, -алкиларил, -алкилгетероарил или алкилгетероциклил, где атом водорода, связанный с атомом углерода любого -алкила или -циклоалкила, может быть замещен на R10, атом водорода, связанный с атомом углерода любого -арила или -гетероарила, может быть замещен на R11 и атом водорода, связанный с любым атомом азота, может быть замещен на R1;
каждый R10 независимо представляет собой -ОН, -SH, -F, -Cl, -Br, -I, -NO2, -CN, -NH2, -CO2Н, -C(O)NH2, -N(H)C(O)H, -N(Н)С(О)NH2, -перфторалкил, -O-алкил, -O-арил, -O-алкиларил, -N(H)алкил, -N(Н)арил, -N(Н)алкиларил, -N(алкил)2, -С(O)N(H)алкил, -С(О)N(алкил)2, -N(Н)С(О)алкил, -N(H)С(O)N(H)алкил, -N(Н)С(O)N(алкил)2, -S-алкил, -S-арил, -S-алкиларил, -S(O)2алкил, -S(O)алкил, -С(О)алкил, -CH2NH2, -CH2N(Н)алкил или -CH2N(алкил)2, -алкил, -циклоалкил, -арил, -гетероарил, -гетероциклил, -алкилциклоалкил, -алкиларил, -алкилгетероарил или -алкилгетероциклил, где атом водорода, связанный с атомом углерода любого -арила или -гетероарила, может быть замещен на R11 и атом водорода, связанный с любым атомом азота, может быть замещен на R1;
каждый R11 независимо представляет собой -ОН, -SH, -F, -Cl, -Br, -I, -NO2, -CN, -NH2, -CO2Н, -С(О)NH2, -N(H)C(O)H, -N(H)С(О)NH2, -алкил, -циклоалкил, -перфторалкил, -O-алкил, -O-арил, -O-алкиларил, -N(H)алкил, -N(Н)арил, -N(Н)-алкиларил, -N(алкил)2, -С(O)N(Н)алкил, -С(О)N(алкил)2, -N(Н)С(О)алкил, -N(H)C(O)N(H)алкил, -N(Н)С(O)N(алкил)2, -S-алкил, -S-арил, -S-алкиларил, -S(O)2алкил, -S(O)алкил, -С(О)алкил, -CH2NH2, -CH2N(Н) алкил или -CH2N(алкил)2.
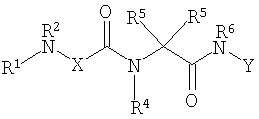
где
Y представляет собой
(а)
 или
или
(b)
m равно 0 или 1;
Х представляет собой -C(R3)2 -;
R1 представляет собой -Н, -C(O)R8, -C(O)C(O)R8, -S(O)2R8, -С(О)OR8 или -C(O)N(H)R8;
R2 представляет собой -Н и каждый R3 независимо представляет собой -Н, боковую цепь аминокислоты или -R8;
один R5 представляет собой -Н и R4 и один R5 вместе с атомами, к которым они присоединены, образуют кольцевую систему, выбранную из:



 или
или

где атом водорода, связанный с любым атомом азота кольцевой системы, может быть замещен на R1, или R4 и один R5 вместе с атомами, к которым они присоединены, образуют кольцевую систему:

R представляет собой -Н;
R7 представляет собой -ОН или -OR8;
каждый R8 независимо представляет собой -алкил, -циклоалкил, -арил, -гетероарил, -гетероциклил, -алкилциклоалкил, -алкиларил, -алкилгетероарил или -алкилгетероциклил, где атом водорода, связанный с атомом углерода любого -алкила или -циклоалкила, может быть замещен на R10, атом водорода, связанный с атомом углерода любого -арила или -гетероарила, может быть замещен на R11 и атом водорода, связанный с любым атомом азота, может быть замещен на R1;
каждый R10 независимо представляет собой -N(Н)С(О)Оалкил, -N(Н)С(O)Оарил, -N(Н)С(O)Оалкиларил, -N(Н)С(О)Огетероарил, -N(Н)С(О)Оалкилгетероарил, -N(Н)С(О)Оциклоалкил, -N(Н)С(O)N(Н)арил или -N(Н)С(О)N(Н)алкиларил, где атом водорода, связанный с атомом углерода любого -арила или -гетероарила, может быть замещен на R11 и атом водорода, связанный с любым атомом азота, может быть замещен на R1;
каждый R11 независимо представляет собой -ОН, -SH, -F, -Cl, -Br, -I, -NO2, -CN, -NH2, -CO2H, -C(O)NH2, -N(H)C(O)H, -N(H)С(O)NH2, -алкил, -циклоалкил, -перфторалкил, -O-алкил, -O-арил, -O-алкиларил, -N(H)алкил, -N(Н)арил, -N(Н)-алкиларил, -N(алкил)2, -C(O)N(H)алкил, -С(О)N(алкил)2, -N(Н)С(О)алкил, -N(Н)С(O)N(Н)алкил, -N(H)C(O)N(алкил)2, -S-алкил, -S-арил, -S-алкиларил, -S(O)2алкил, -S(O)алкил, -С(О)алкил, -CH2NH2, -CH2N(H) алкил или -CH2N(алкил)2;
при условии, что если один R3 представляет собой -Н, то другой R3 не является -Н.
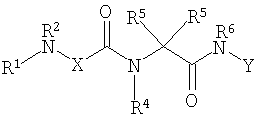
где
Y представляет собой
(а)
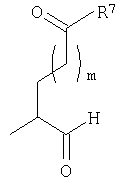 или
или
(b)
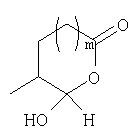
m равно 0 или 1;
Х представляет собой -С(R3)2-;
R1 представляет собой -Н, -R8; -C(O)R8, -C(O)C(O)R8, или -S(O)2R8;
R2 представляет собой -Н и каждый R3 независимо представляет собой -Н, боковую цепь аминокислоты или -R8;
один R5 представляет собой -Н, и R4 и один R5 вместе с атомами, к которым они присоединены, образуют кольцевую систему, выбранную из:



 или
или

где атом водорода, связанный с любым атомом азота кольцевой системы, может быть замещен на R1, или R4 и один R5 вместе с атомами, к которым они присоединены, образуют кольцевую систему:

R представляет собой -Н;
R7 представляет собой -ОН или -OR8;
каждый R8 независимо представляет собой -алкил, -циклоалкил, -арил, -гетероарил, -гетероциклил, -алкилциклоалкил, -алкиларил, -алкилгетероарил или -алкилгетероциклил, где атом водорода, связанный с атомом углерода любого -алкила или -циклоалкила, может быть замещен на R10, атом водорода, связанный с атомом углерода любого -арила или -гетероарила, может быть замещен на R11 и атом водорода, связанный с любым атомом азота, может быть замещен на R1;
каждый R10 независимо представляет собой -ОН, -SH, -F, -Cl, -Br, -I, -NO2, -CN, -NH2, -CO2Н, -С(О)NH2, -N(H)C(O)H, -N(Н)С(O)NH2, -перфторалкил, -O-алкил, -O-арил, -O-алкиларил, -N(H)алкил, -N(H)арил, -N(Н)алкиларил, -N(алкил)2, -С(O)N(Н)алкил, -С(О)N(алкил)2, -N(Н)С(О)алкил, -N(H)C(O)N(Н)алкил, -N(Н)С(О)N(алкил)2, -S-алкил, -S-арил, -S-алкиларил, -S(O)2алкил, -S(O)алкил, -С(О)алкил, -CH2NH2, -CH2N(Н)алкил или -CH2N(алкил)2, -алкил, -циклоалкил, -арил, -гетероарил, -гетероциклил, -алкилциклоалкил, -алкиларил, -алкилгетероарил или -алкилгетероциклил, где атом водорода, связанный с атомом углерода любого -арила или -гетероарила, может быть замещен на R11 и атом водорода, связанный с любым атомом азота, может быть замещен на R1; и
каждый R11 независимо представляет собой -ОН, -SH, -F, -Cl, -Br, -I, -NO2, -CN, -NH2, -CO2Н, -C(O)NH2, -N(H)C(O)H, -N(Н)С(О)NH2, -алкил, -циклоалкил, -перфторалкил, -O-алкил, -O-арил, -O-алкиларил, -N(H)алкил, -N(H)арил, -N(H)-алкиларил, -N(алкил)2, -С(О)N(Н)алкил, -С(О)N(алкил)2, -N(Н)С(О)алкил, -N(H)C(O)N(H)алкил, -N(H)C(O)N(алкил)2, -S-алкил, -S-арил, -S-алкиларил, -S(O)2алкил, -S(O)алкил, -С(О)алкил, -CH2NH2, -CH2N(Н)алкил или -CH2N(алкил)2;
при условии, что если один R3 представляет собой -Н, то другой R3 не является -Н.


 или
или


а другой R5 представляет собой -Н, где атом водорода, связанный атомом углерода с любого -алкила или -циклоалкила, может быть замещен на R10.
 а другой R5 представляет собой -Н.
а другой R5 представляет собой -Н.
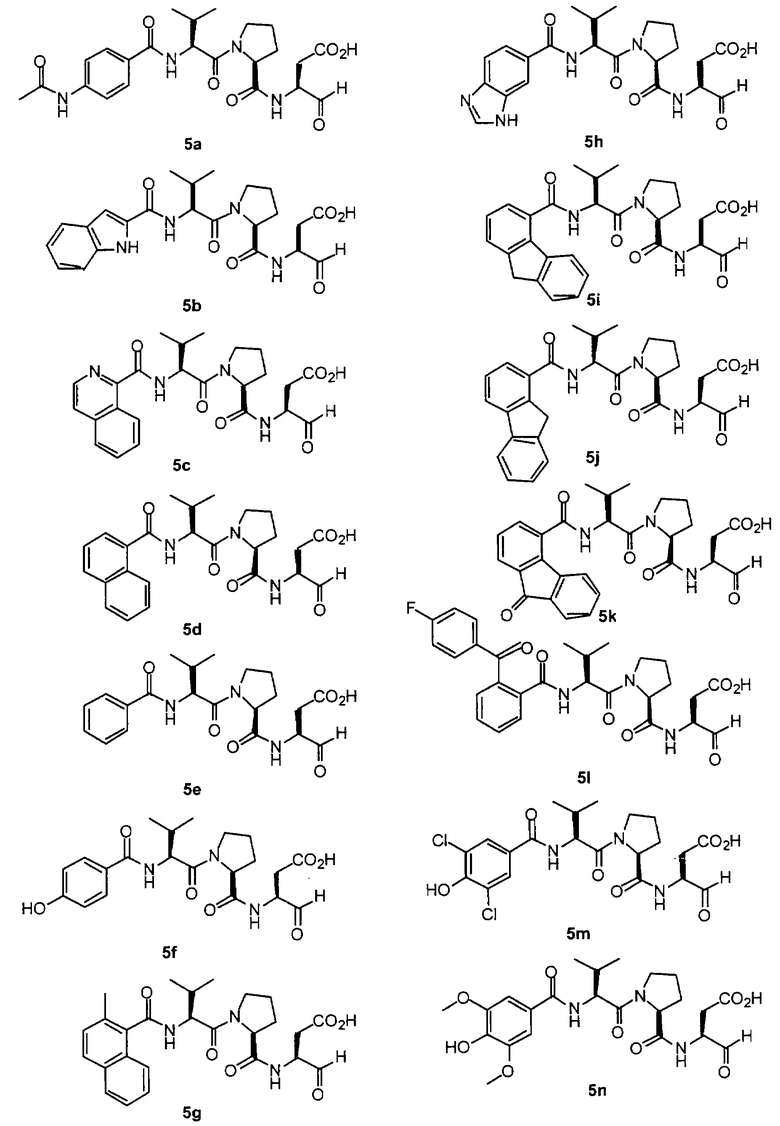
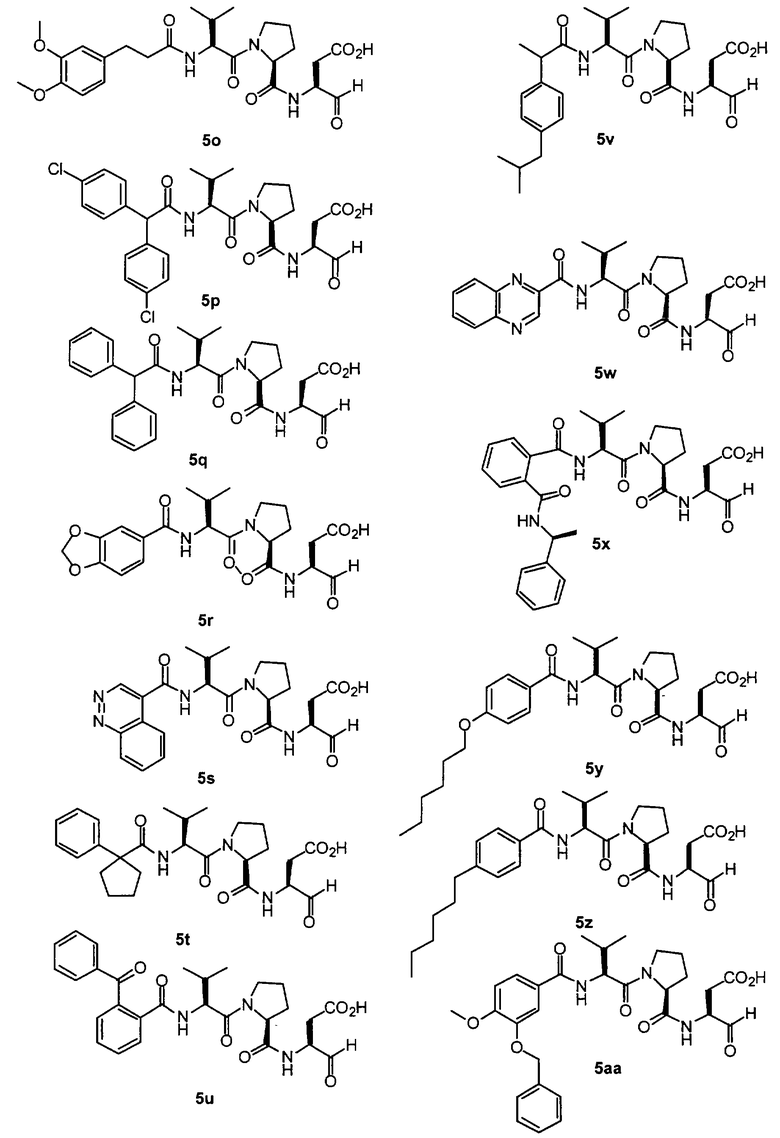

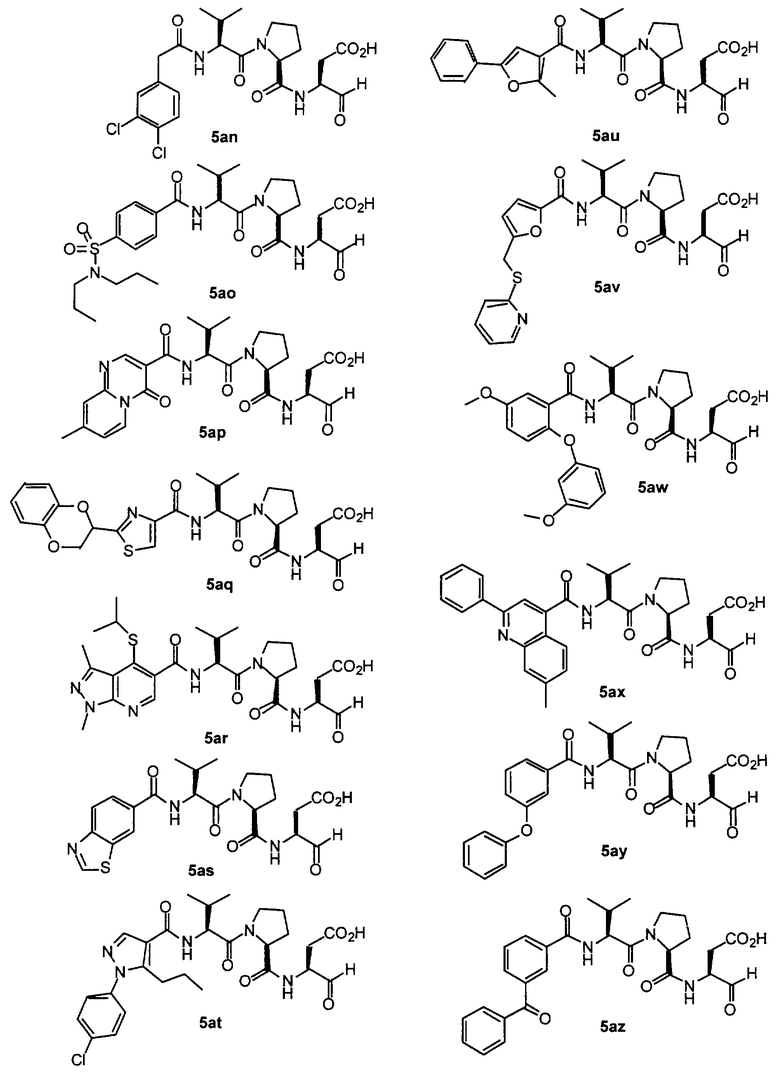
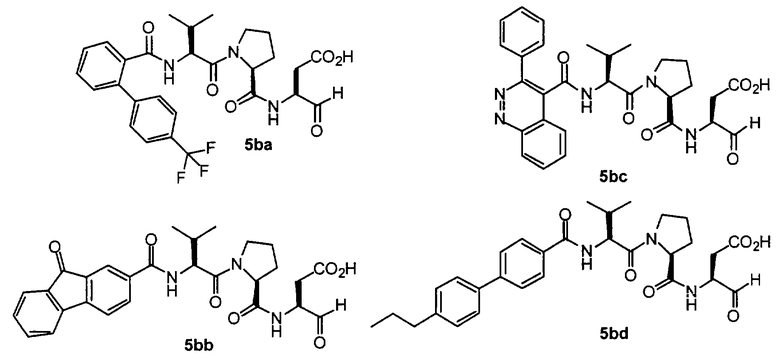
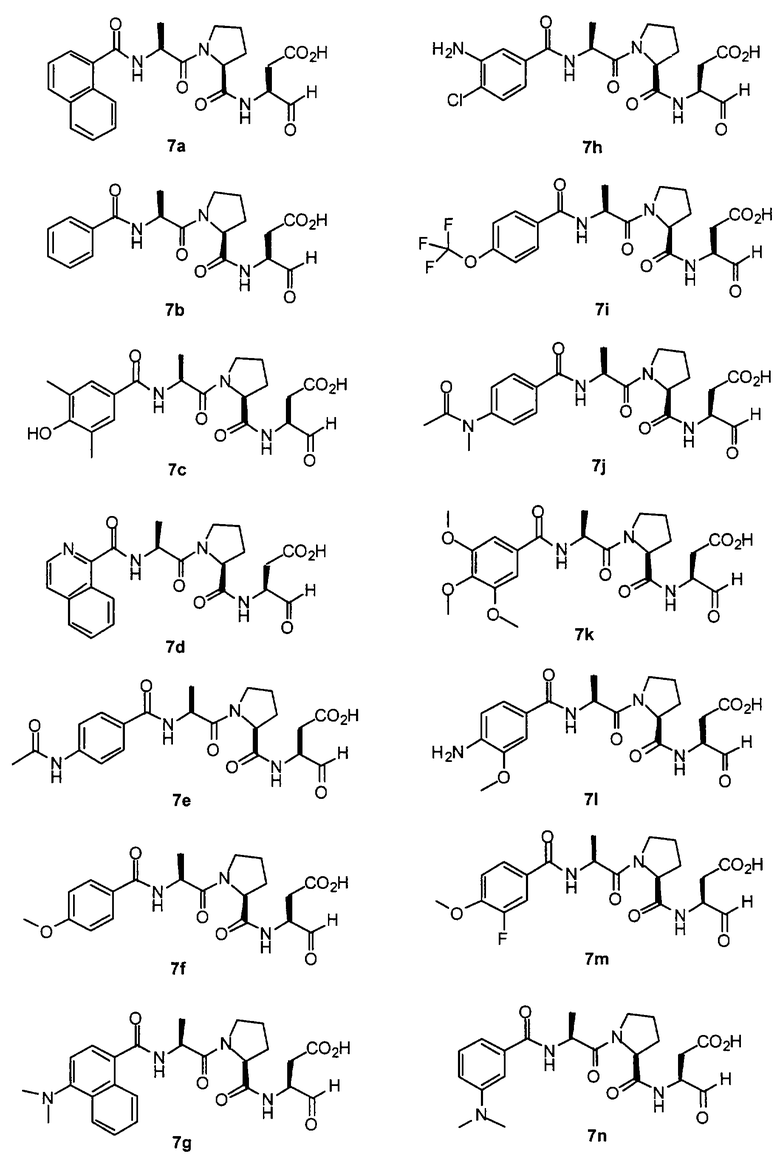
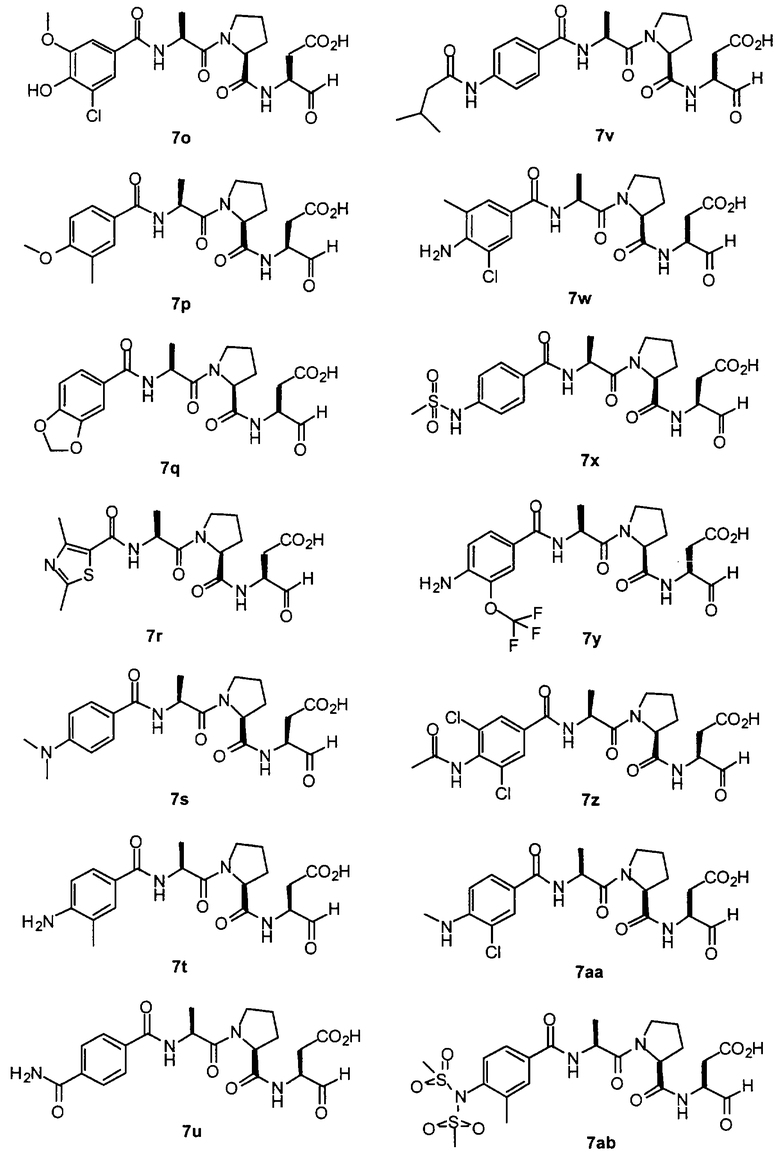
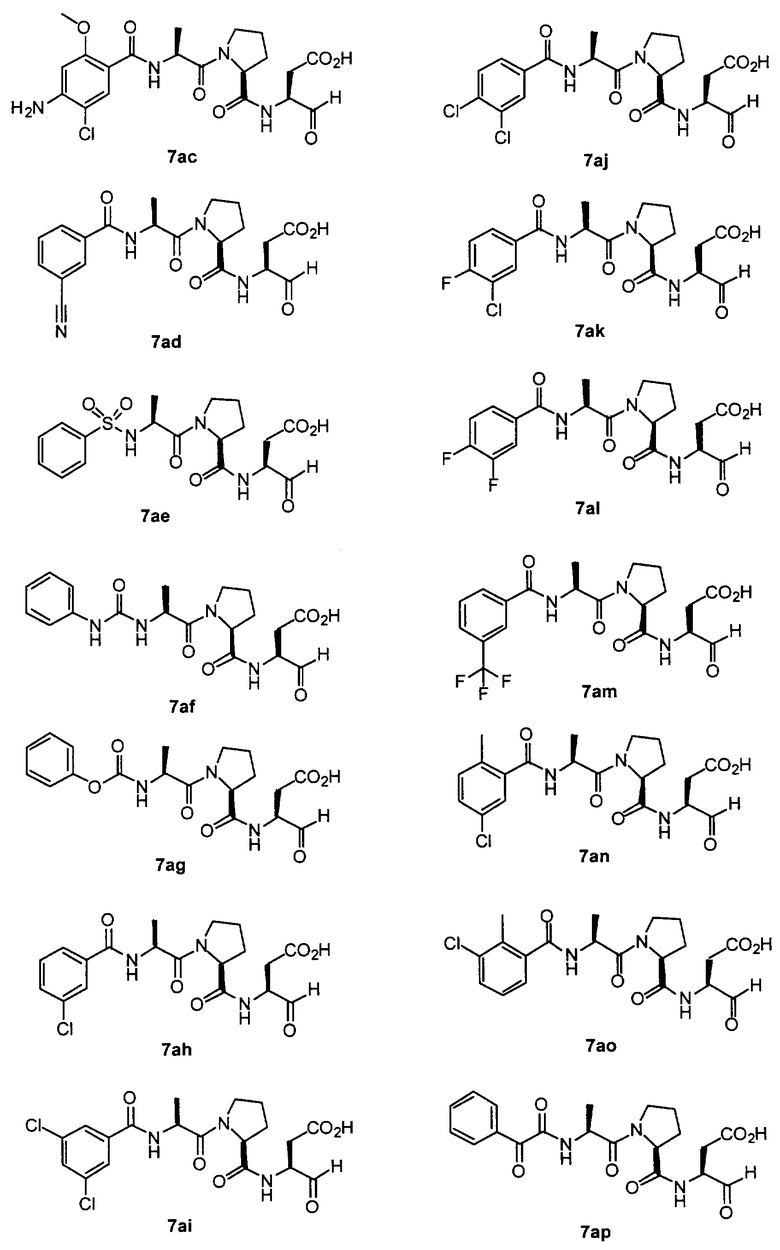
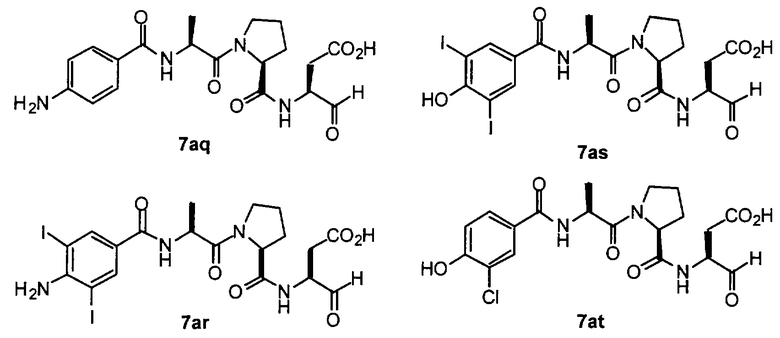
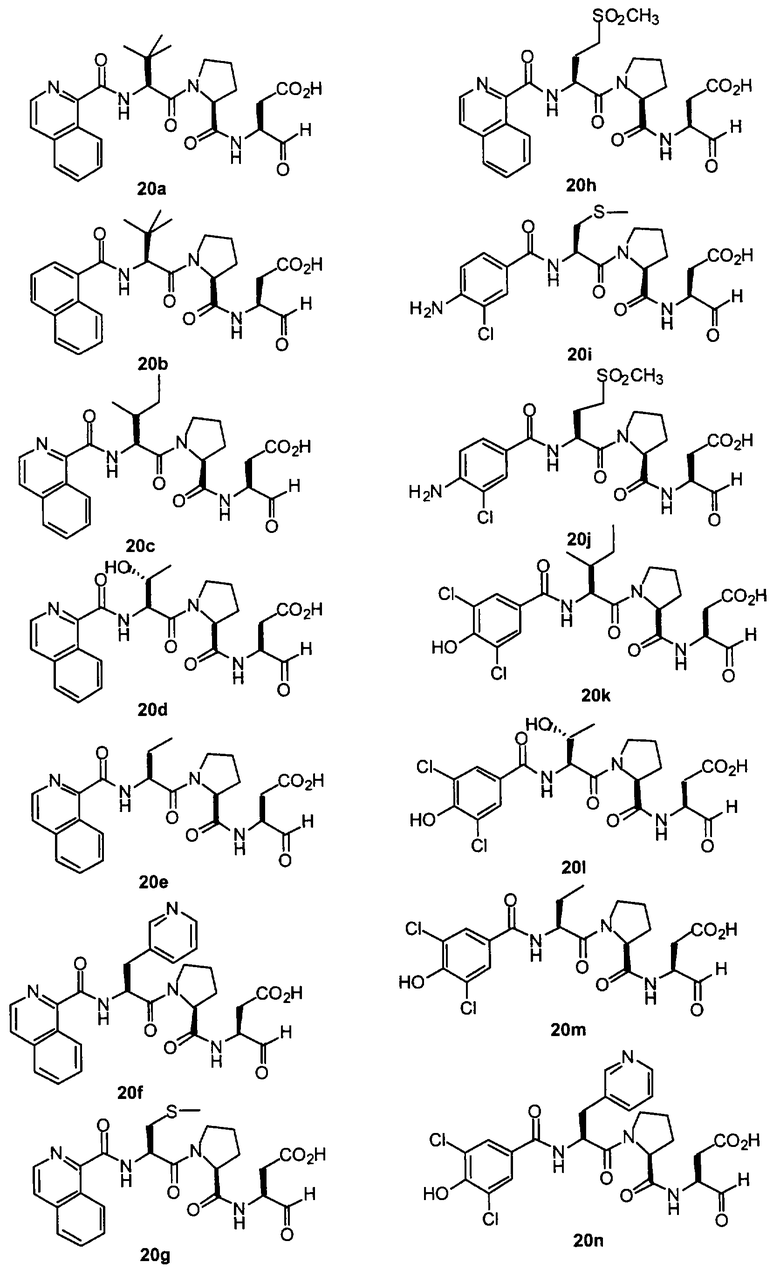
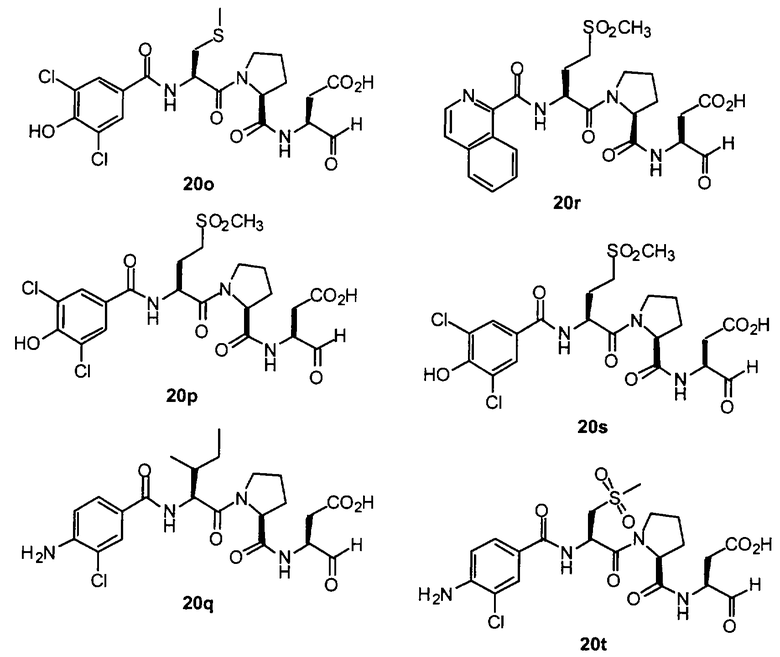
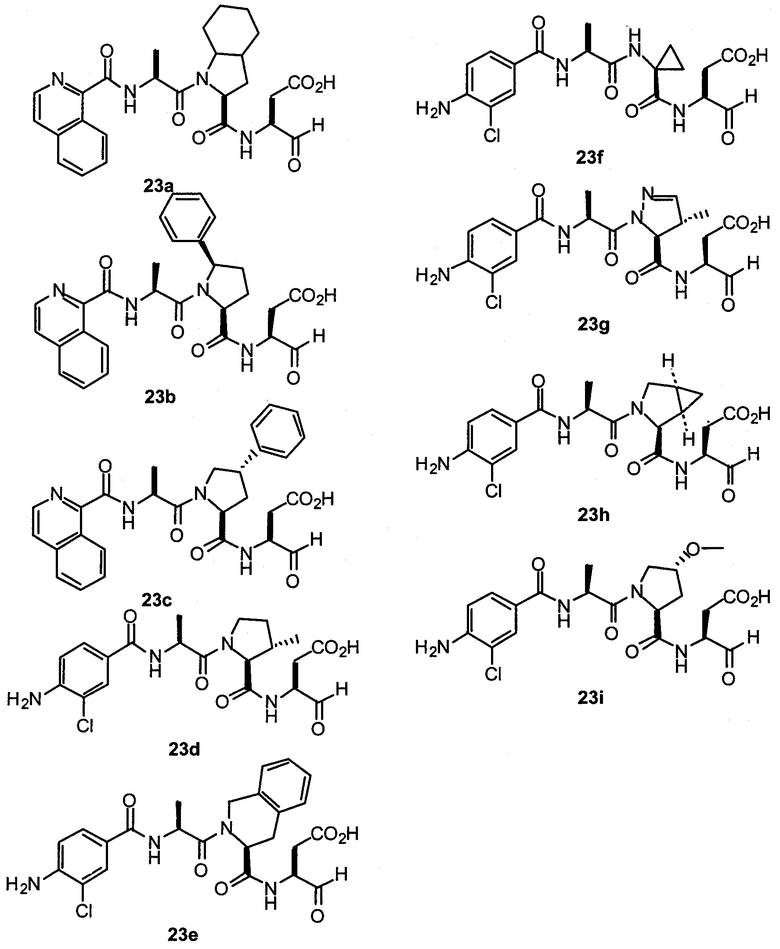
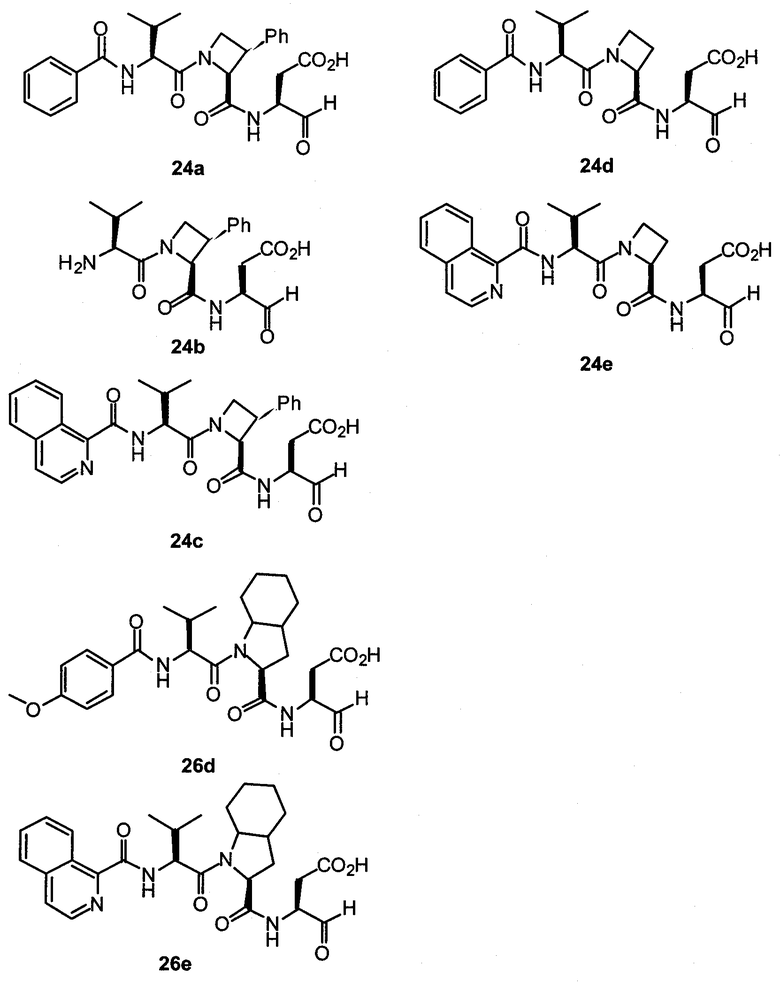
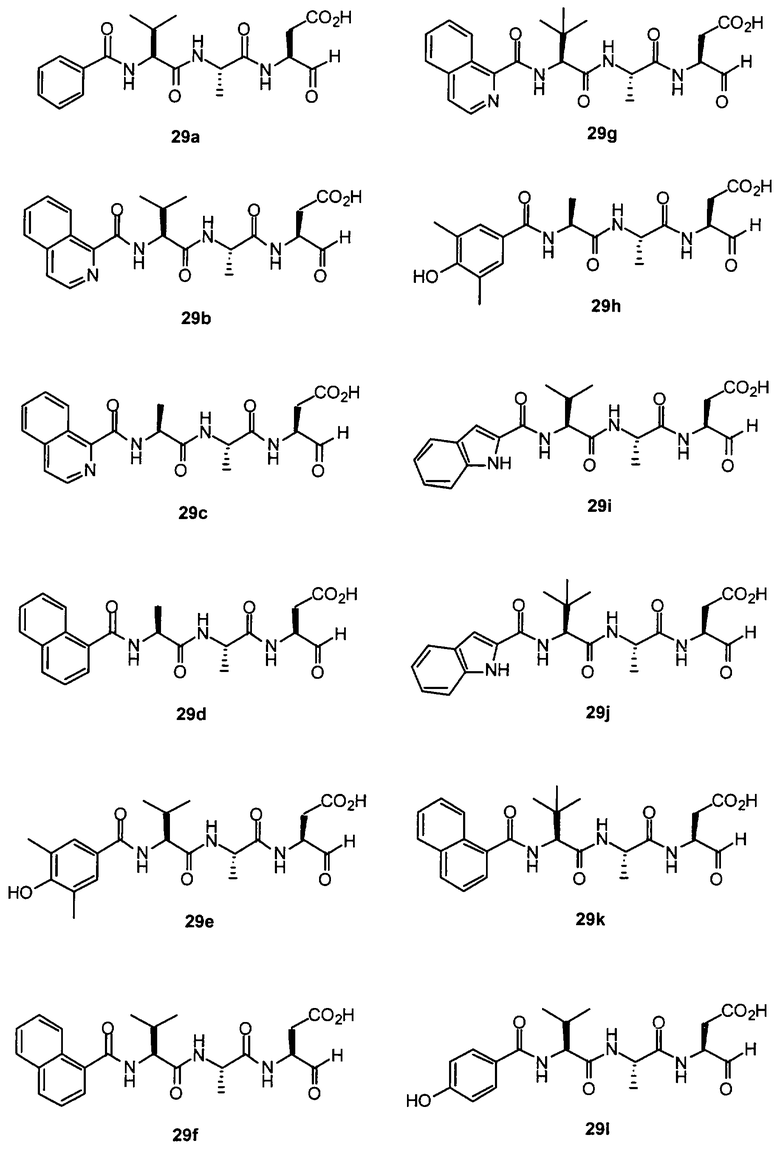
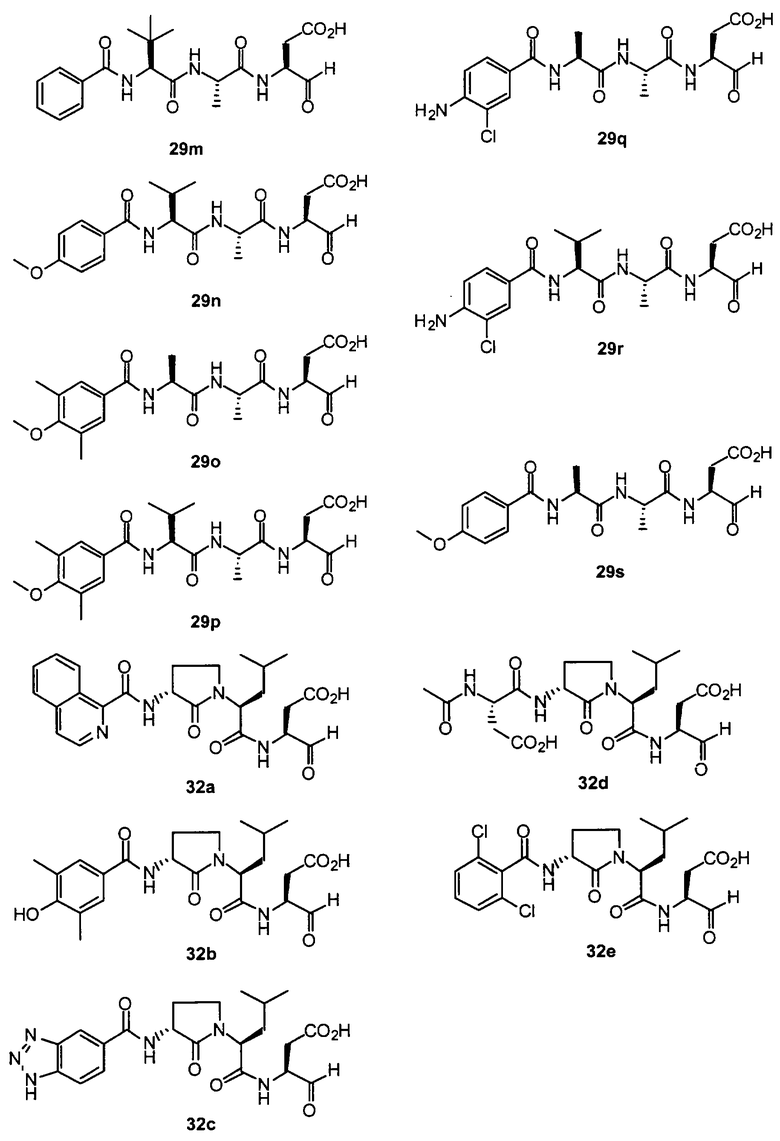
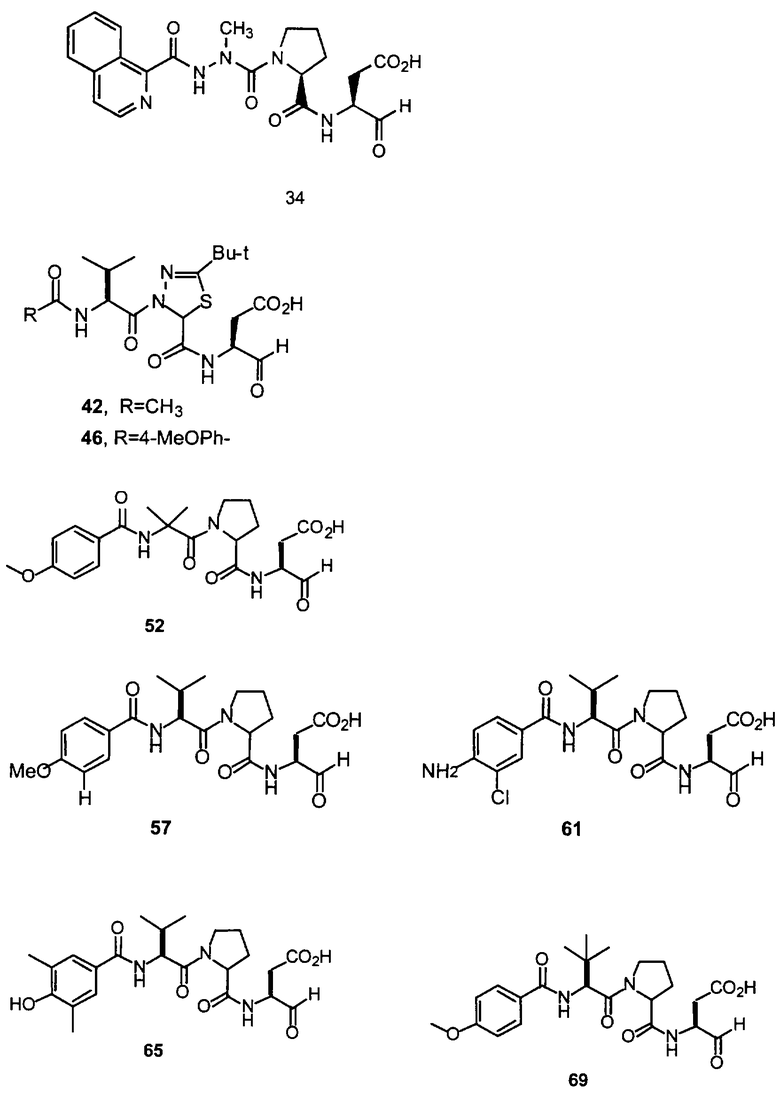
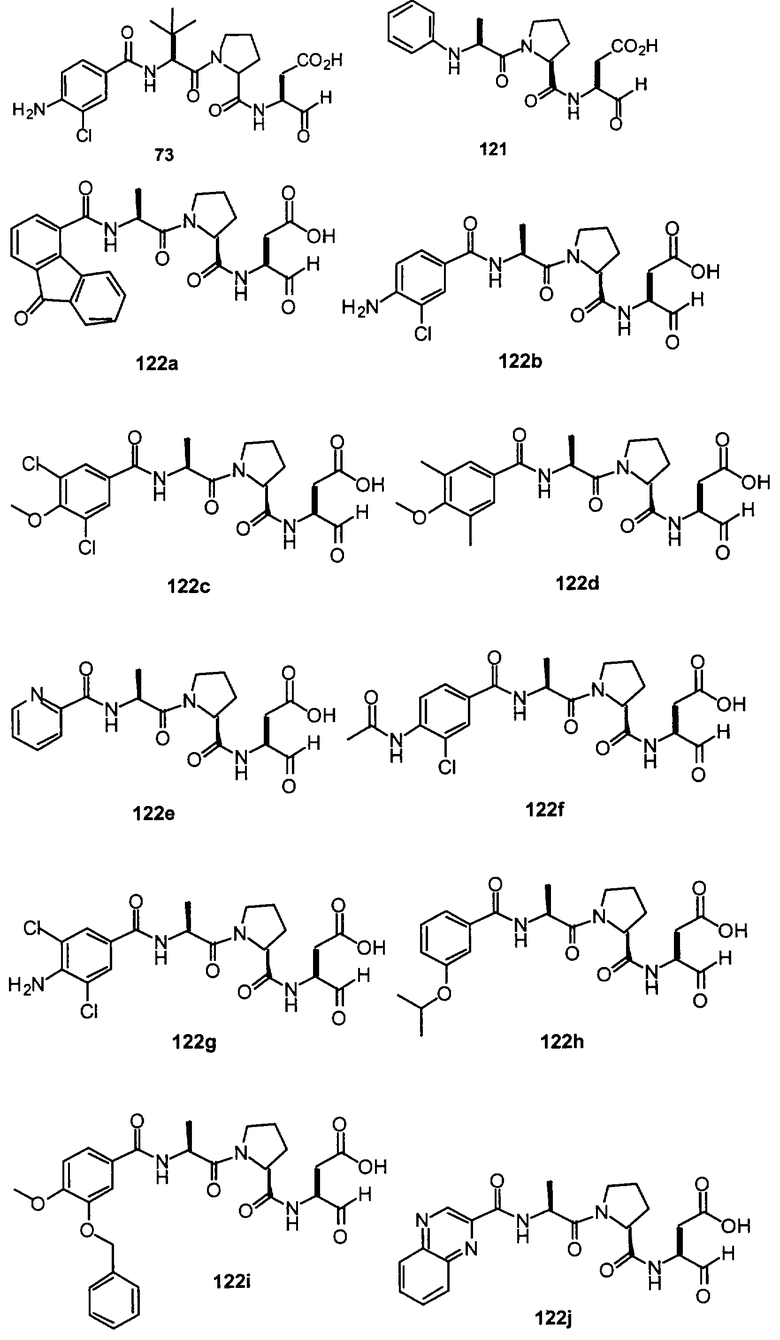
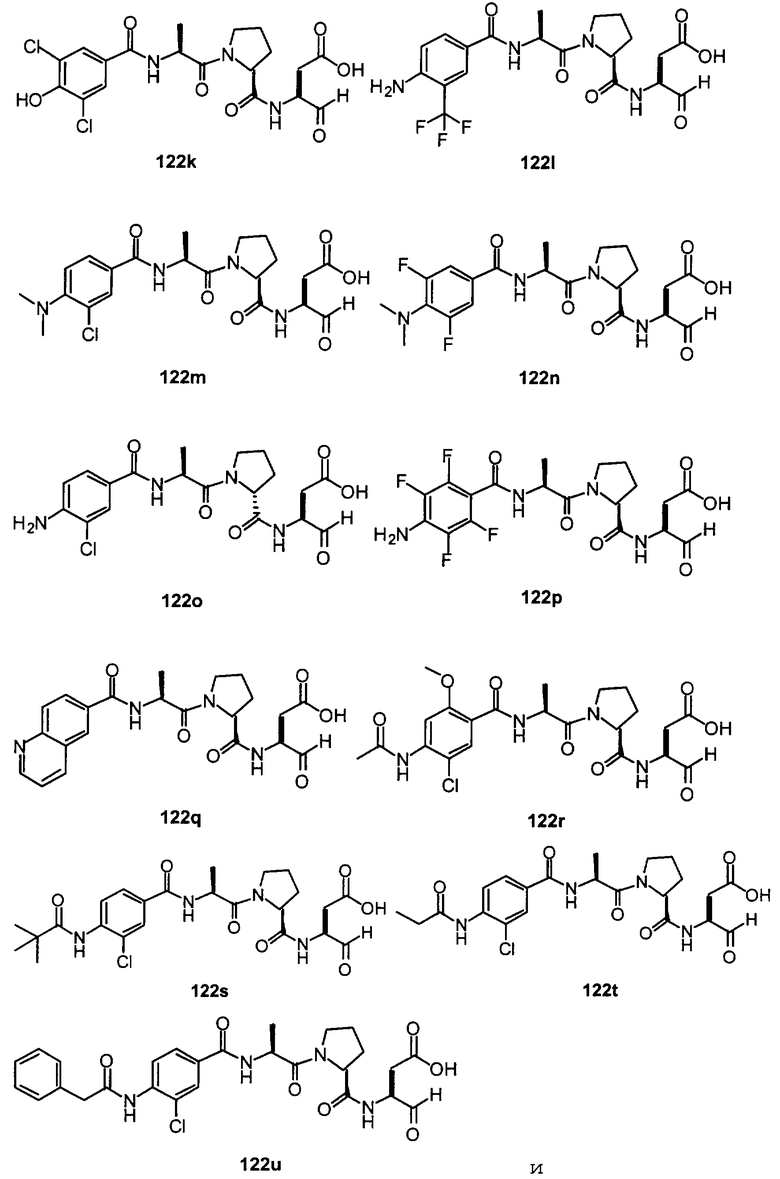
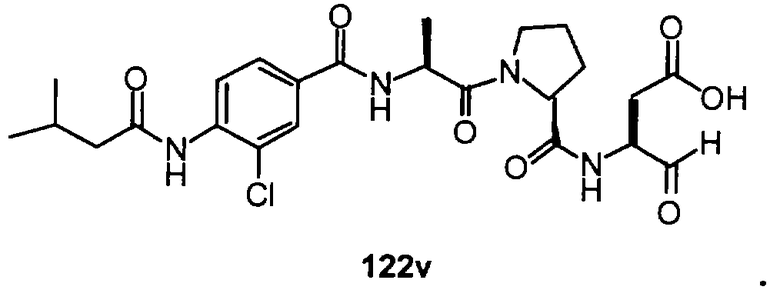
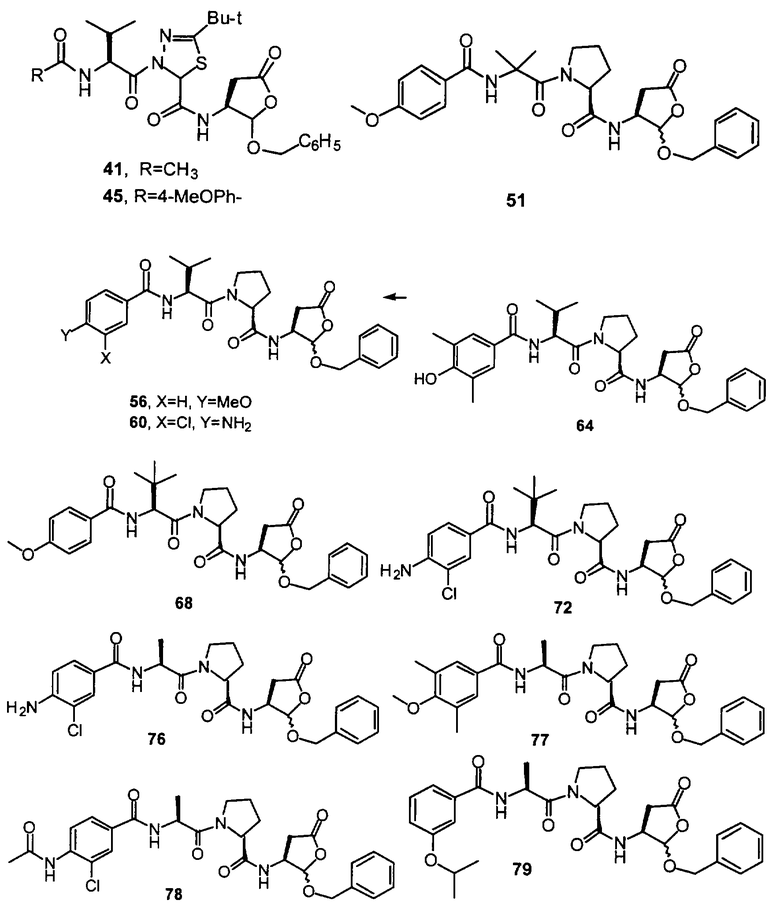
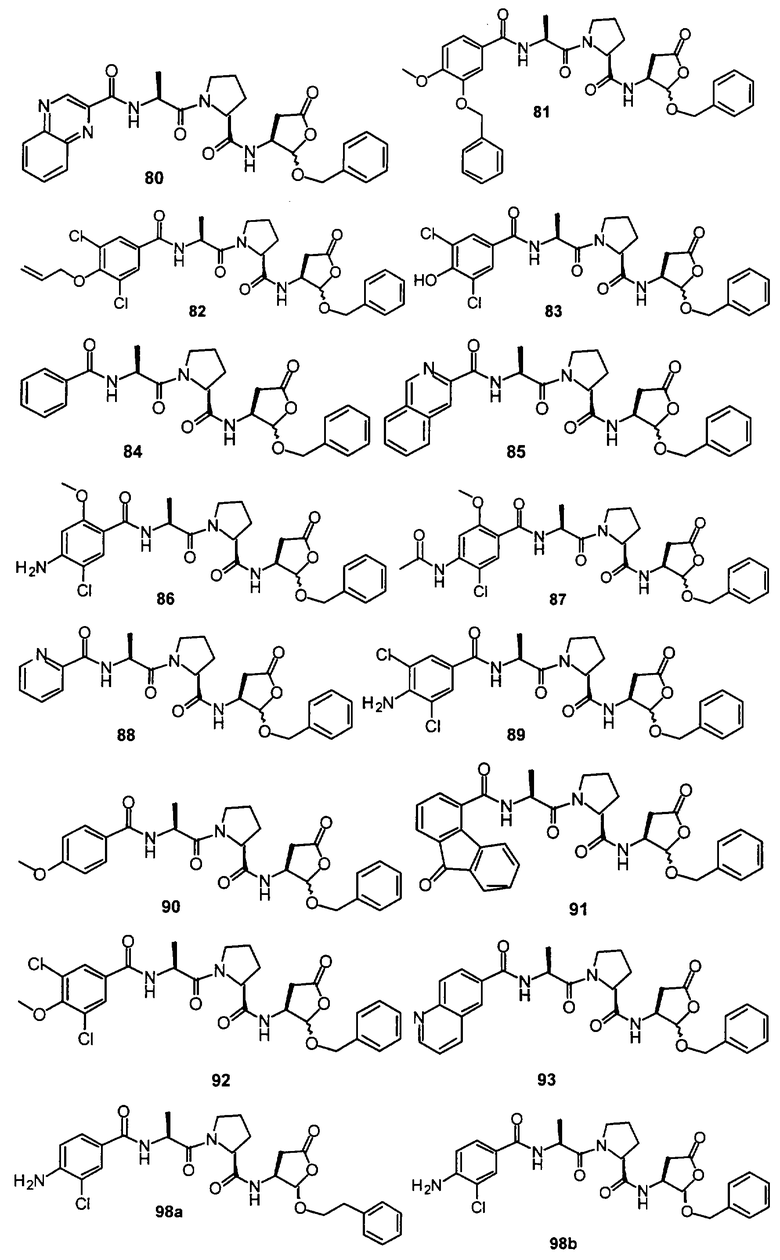
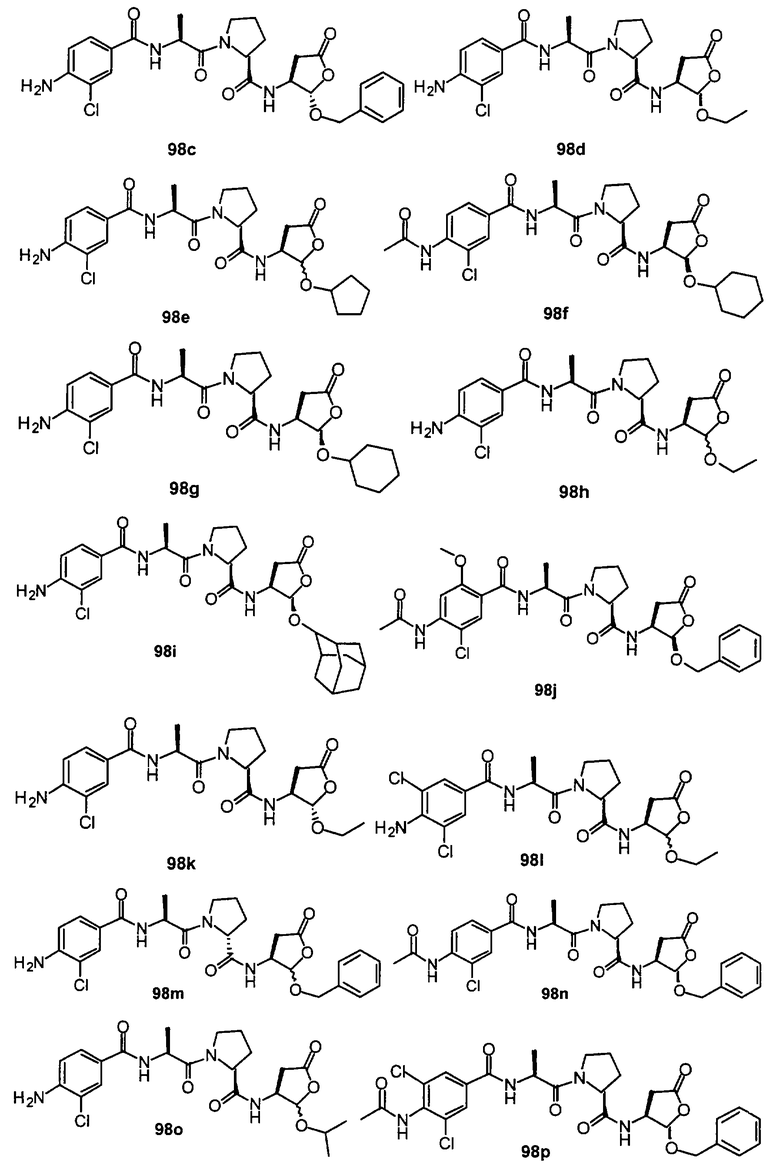
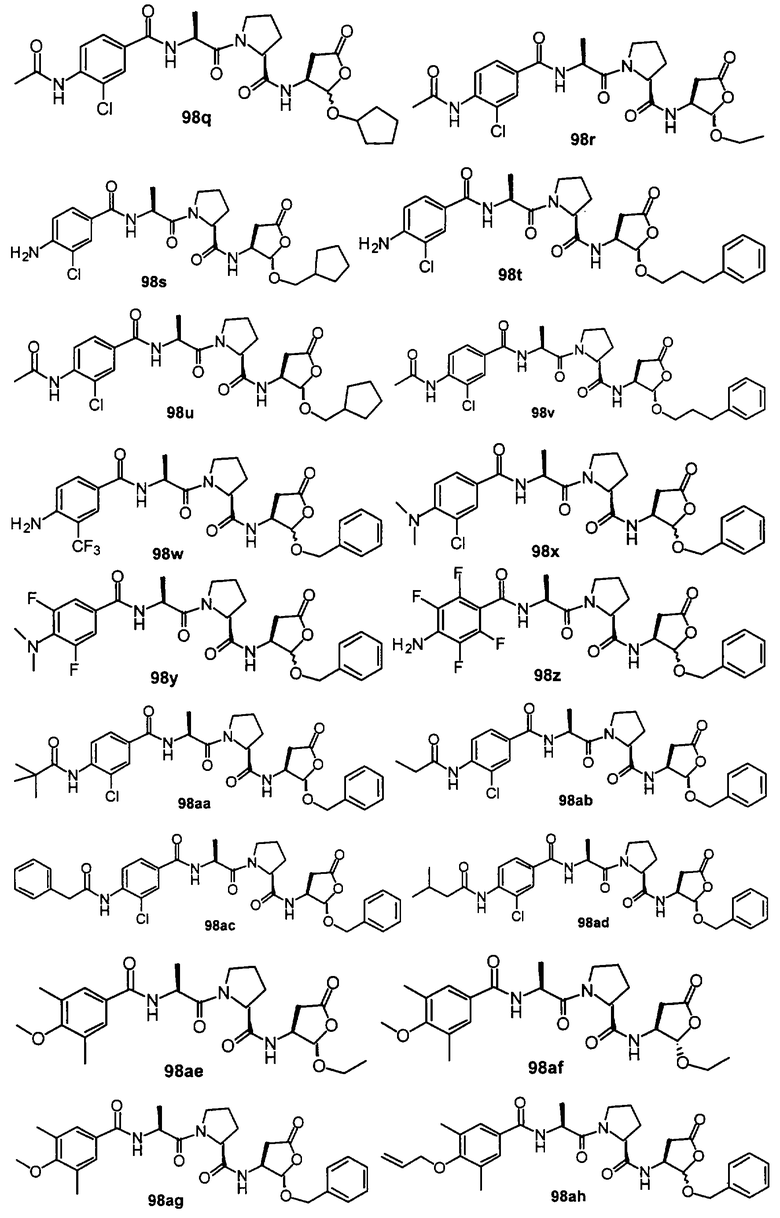
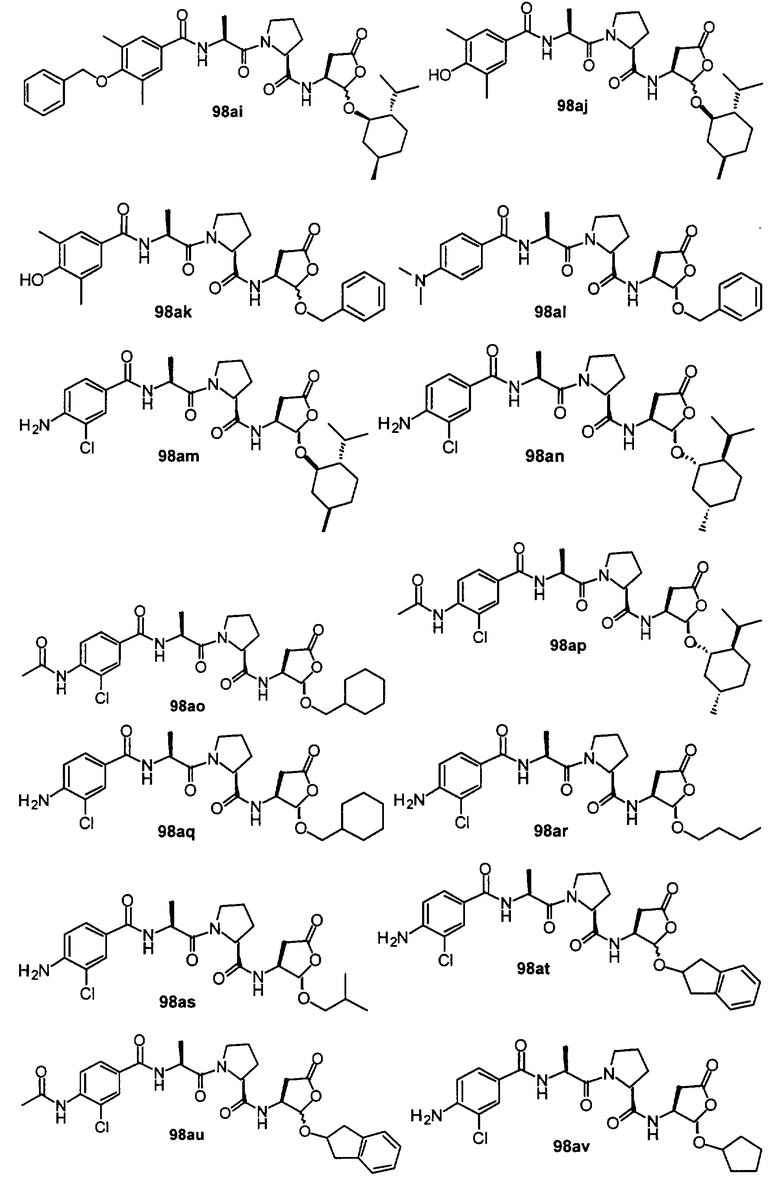
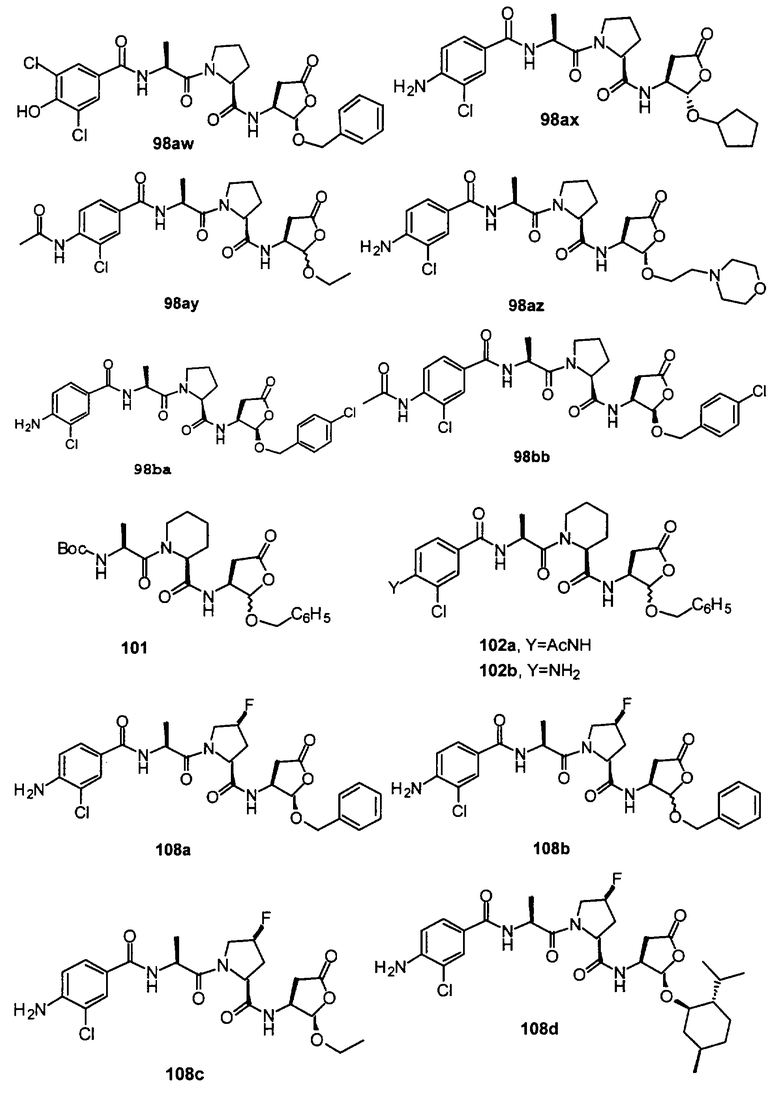
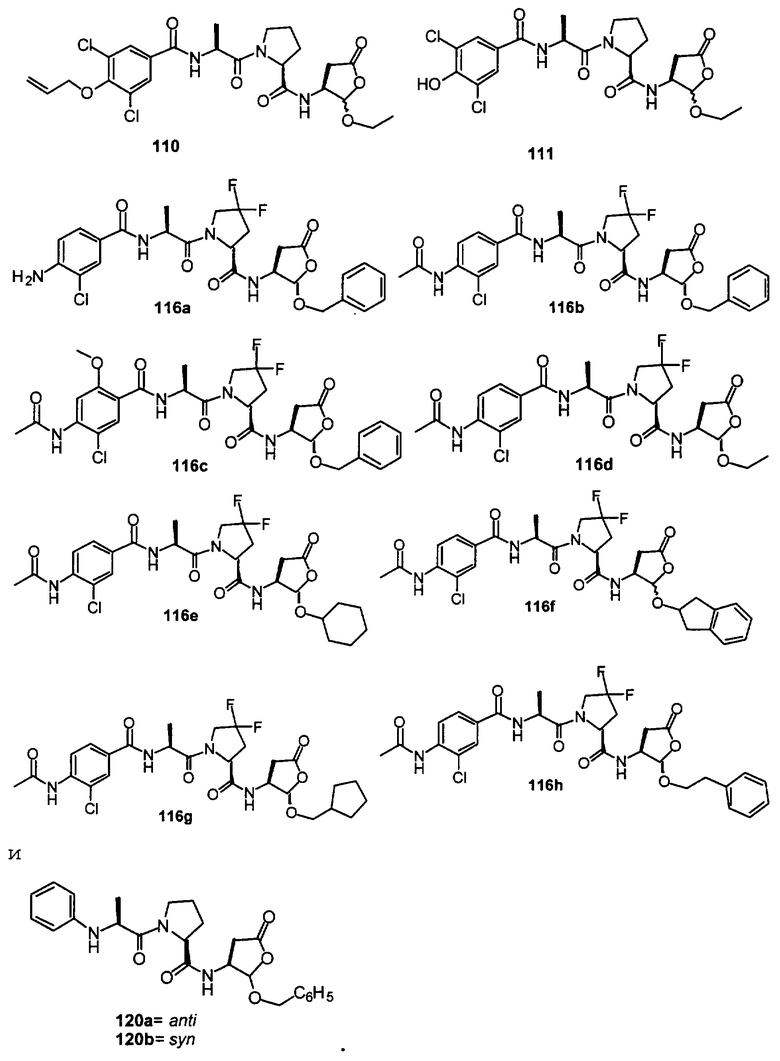
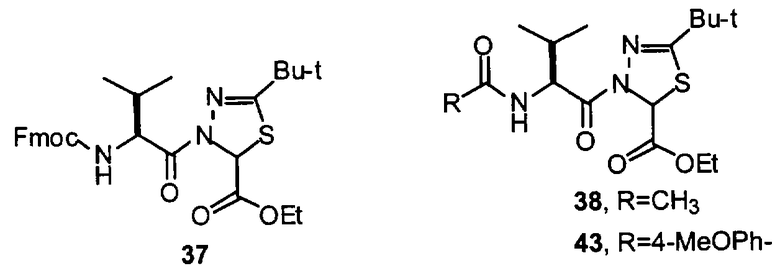
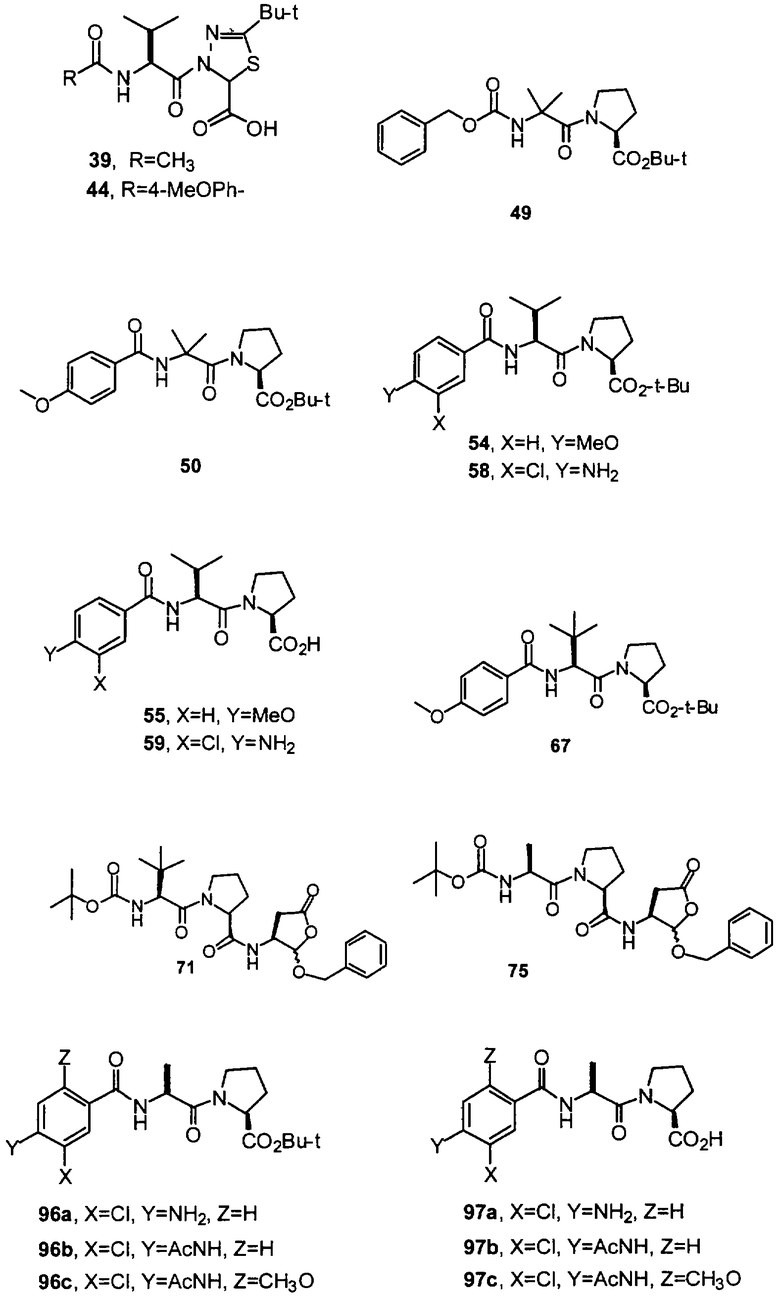
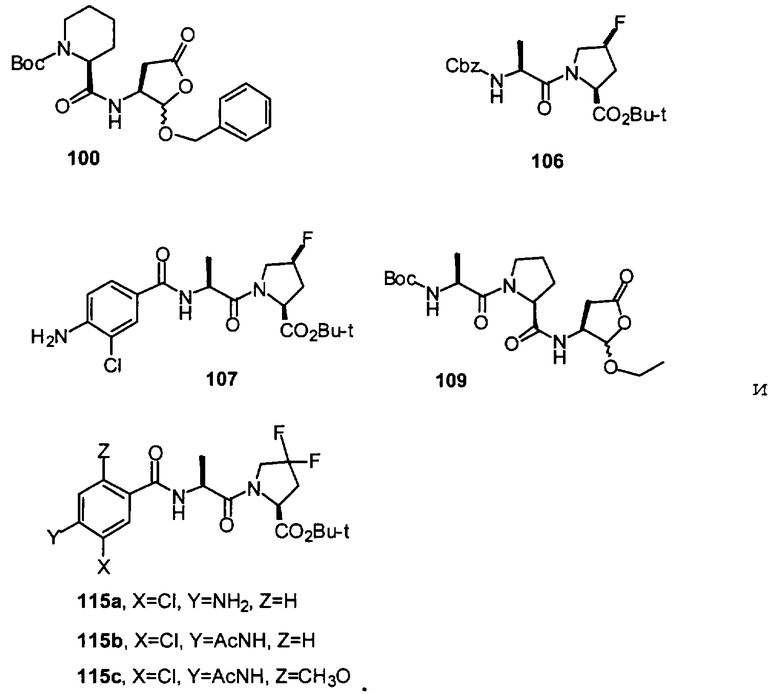
| RU 94019984 A1, 10.04.1997 | |||
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
Авторы
Даты
2006-04-20—Публикация
1999-03-19—Подача