УТВЕРЖДЕНИЕ, КАСАЮЩЕЕСЯ СПИСКА ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Список последовательностей, прилагаемый к настоящей заявке, предоставлен в текстовом формате вместо бумажной копии и, таким образом, включен в настоящее описание в качестве ссылки. Текстовый файл, содержащий список последовательностей, имеет название MP_1_0220_PCT_Sequence_Listing_20141015_ST25.txt. Текстовый файл имеет размер 115 Кбайт; он был создан 15 октября 2014 года; и предоставлен через EFS-Web при подаче описания.
УРОВЕНЬ ТЕХНИКИ
Система комплемента обеспечивает механизм раннего действия для инициации, усиления и координации иммунного ответа на микробную инфекцию и другие острые повреждения (M.K. Liszewski and J.P. Atkinson, 1993, Fundamental Immunology, Third Edition, edited by W.E. Paul, Raven Press, Ltd., New York), у человека и других позвоночных. Хотя активация комплемента обеспечивает ценную защиту первой линии против потенциальных патогенов, активность комплемента, которая стимулирует защитный иммунный ответ, также может представлять потенциальную угрозу хозяину (K.R. Kalli, et al., Springer Semin. Immunopathol. 15:417-431, 1994; B.P. Morgan, Eur. J. Clinical Investig. 24:219-228, 1994). Например, продукты протеолиза C3 и C5 привлекают и активируют нейтрофилы. Хотя они необходимы для защиты хозяина, активированные нейтрофилы неизбирательны в отношении высвобождения деструктивных ферментов и могут вызывать повреждение органа. Кроме того, активация комплемента может вызывать депонирование литических компонентов комплемента на близлежащих клетках-хозяевах, а также на микробных мишенях, что вызывает лизис клеток-хозяев.
Система комплемента также вовлечена в патогенез многочисленных острых и хронических болезненных состояний, включающих: инфаркт миокарда, инсульт, ARDS, реперфузионное повреждение, септический шок, капиллярную утечку после термических ожогов, воспаление после искусственного кровообращения, отторжение трансплантата, ревматоидный артрит, рассеянный склероз, миастению и болезнь Альцгеймера. Практически во всех из этих состояний комплемент является не причиной, а одним из нескольких факторов, вовлеченных в патогенез. Тем не менее, активация комплемента может представлять собой основной патологический механизм и являться эффективной точкой для клинического контроля при многих из этих болезненных состояний. Растущее признание важности опосредуемого комплементом повреждения тканей при различных болезненных состояниях подчеркивает потребность в эффективных лекарственных средствах, ингибирующих комплемент. На сегодняшний день, экулизумаб (Solaris®), антитело против C5, является единственным нацеленным на комплемент лекарственным средством, которое одобрено для применения у человека. Тем не менее, C5 является одной из нескольких эффекторных молекул, являющихся "нижерасположенными" в системе комплемента, и блокада C5 не ингибирует активацию системы комплемента. Таким образом, ингибитор стадий инициации активации комплемента может иметь значительные преимущества над ингибитором "нижерасположенного" компонента комплемента.
В настоящее время широко признано, что система комплемента может активироваться через три различных пути: классический путь, лектиновый путь и альтернативный путь. Классический путь обычно запускается комплексом, состоящим из антител хозяина, связанных с чужеродной частицей (т.е. антигеном) и, таким образом, он требует предшествующего воздействия антигена для индукции специфического антительного ответа. Поскольку активация классического пути зависит от предшествующего адаптивного иммунного ответа хозяина, классический путь является частью приобретенной иммунной системы. Напротив, как лектиновый, так и альтернативный пути не зависят от адаптивного иммунитета и являются частью врожденной иммунной системы.
Активация системы комплемента приводит к последовательной актиации проферментов сериновых протеаз. Первой стадией активации классического пути является связывание специфической распознающей молекулой C1q со связанными с антигеном молекулами IgG и IgM. C1q ассоциирует с проферментами сериновых протеаз Clr и Cls в комплекс, называемый C1. При связывании C1q с иммунным комплексом происходит аутопротеолитическое расщепление участка Arg-Ile Clr, а затем опосредуемое Clr расщепление и активация Cls, который тем самым приобретает способность расщеплять C4 и C2. C4 расщепляется на два фрагмента, обозначаемых как C4a и C4b, и, аналогично, C2 расщепляется на C2a и C2b. Фрагменты C4b способны образовывать ковалентные связи с соседними гидроксильными или аминогруппами и формировать C3-конвертазу (C4b2a) через нековалентное взаимодействие с фрагментом C2a активированного C2. C3-конвертаза (C4b2a) активирует C3 путем протеолитичесокго расщепления на субкомпоненты C3a и C3b, что приводит к образованию C5-конвертазы (C4b2a3b), которая путем расщепления C5 обеспечивает образование мембраноатакующего комплекса (C5b в комбинации с C6, C7, C8 и C-9, также обозначаемый как "MAC"), который может разрушать клеточные мембраны, вызывая лизис клеток. Активированные формы C3 и C4 (C3b и C4b) ковалентно депонируются на поверхностях чужеродных мишеней, а затем распознаются рецепторами комплемента на множестве фагоцитов.
Независимо от этого, первая стадия активации системы комплемента через лектиновый путь также представляет собой связывание специфических распознающих молекул, после чего происходит активация ассоциированных с ними проферментов сериновых протеаз. Однако, в отличие от связывания иммунных комплексов с C1q, распознающие молекулы в лектиновом пути включают группу углевод-связывающих белков (маннан-связывающий лектин (MBL), H-фиколин, M-фиколин, L-фиколин и лектин C-типа CL-11), в совокупности называемых лектинами. См. J. Lu et al., Biochim. Biophys. Acta 1572:387-400, (2002); Holmskov et al., Annu. Rev. Immunol. 21:547-578 (2003); Teh et al., Immunology 101:225-232 (2000)). См. also J. Luet et al., Biochim Biophys Acta 1572:387-400 (2002); Holmskov et al, Annu Rev Immunol 21:547-578 (2003); Teh et al., Immunology 101:225-232 (2000); Hansen et al, J. Immunol 185(10):6096-6104 (2010).
Ikeda et al. впервые продемонстрировали, что, подобно C1q, MBL может активировать систему комплемента при связывании с эритроцитами, покрытыми дрожжевым маннаном, зависимым от C4 образом (Ikeda et al., J. Biol. Chem. 262:7451-7454, (1987)). MBL, представитель семейства белков коллектинов, представляет собой кальций-зависимый лектин, который связывает углеводы с 3- и 4-гидроксигруппами, ориентированными в экваториальной плоскости кольца пиранозы. Таким образом, основными лигандами MBL являются D-манноза и N-ацетил-D-глюкозамин, в то время как углеводы, не удовлетворяющие этому пространственному требованию, обладают не поддающейся обнаружению аффинностью в отношении MBL (Weis et al., Nature 360:127-134, (1992)). Взаимодействие между MBL и одновалентными сахарами является чрезвычайно слабым с константами диссоциации, обычно находящимися в одноразрядном миллимолярном диапазоне. MBL достигает прочного специфического связывания с гликановыми лигандами вследствие авидности, т.е. вследствие взаимодействия одновременно с несколькими моносахаридными остатками, расположенными вблизи друг от друга (Lee et al., Archiv. Biochem. Biophys. 299:129-136, (1992)). MBL распознает паттерны углеводов, которые обычно присутствуют у микроорганизмов, таких как бактерии, дрожжи, паразиты и определенные вирусы. Напротив, MBL не распознает D-галактозу и сиаловую кислоту, предпоследний и последний сахара, которые обычно присутствуют в "зрелых" комплексных гликоконъюгатах, находящихся на гликопротеинах плазмы и клеточной поверхности. Полагают, что эта специфичность связывания способствует распознаванию "чужеродных" поверхностей и помогает защитить от "самоактивации". Однако, MBL связывается с высокой аффинностью с кластерами гликанов-"предшественников" с высоким содержанием маннозы на N-связанных гликопротеинах и гликолипидах, секвестрированных в эндоплазматической сети и аппарате Гольджи клеток млекопитающих (Maynard et al., J. Biol. Chem. 257:3788-3794, (1982)). Таким образом, поврежденные клетки являются потенциальными мишенями для активации лектинового пути через связывание MBL.
Фиколины обладают лектиновым доменом отличающегося типа от MBL, называемым фибриноген-подобным доменом. Фиколины связывают остатки сахаров независимым от Ca++ образом. У человека идентифицировано три типа фиколинов (L-фиколин, M-фиколин и H-фиколин). Два сывороточных фиколина: L-фиколин и H-фиколин, имеют общую специфичность к N-ацетил-D-глюкозамину; однако H-фиколин также связывает N-ацетил-D-галактозамин. Отличия в специфичности к сахарам у L-фиколина, H-фиколина, CL-11 и MBL означают, что различные лектины могут быть взаимодополняющими и могут нацеливаться на различные, хотя и перекрывающиеся, гликоконъюгаты. Эта идея подтверждается недавним сообщением, что среди известных лектинов в лектиновом пути только L-фиколин специфически связывается с липотейхоевой кислотой - гликоконъюгатом клеточной стенки, встречающимся на всех грамположительных бактериях (Lynch et al., J. Immunol. 172:1198-1202, (2004)). Коллектины (т.е. MBL) и фиколины не обладают существенным сходством аминокислотной последовательности. Однако эти две группы белков имеют сходные организации доменов и, подобно C1q, собираются в олигомерные структуры, которые максимизируют возможность связывания множества участков.
Сывороточные концентрации MBL являются в высокой степени вариабельными в здоровых популяциях и это генетически контролируется полиморфизмами/мутациями как в промоторной, так и в кодирующей областях гена MBL. Экспрессия MBL в качестве белка острой фазы, кроме того, активируется в процессе воспаления. L-фиколин присутствует в сыворотке в концентрациях, сходных с концентрациями MBL. Таким образом, ветвь L-фиколина в лектиновом пути потенциально сравнима по силе с ветвью MBL. MBL и фиколины также могут функционировать в качестве опсонинов, которые позволяют фагоцитам нацеливаться на поверхности, на которых присутствуют MBL и фиколин (см. Jack et al., J Leukoc Biol., 77(3):328-36 (2004), Matsushita and Fujita, Immunobiology, 205(4-5):490-7 (2002), Aoyagi et al., J Immunol, 174(1):418-25(2005). Эта опсонизация требует взаимодействия этих белков с рецепторами фагоцитов (Kuhlman et al., J. Exp. Med. 169:1733, (1989); Matsushita et al., J. Biol. Chem. 271:2448-54, (1996)), тип которых не установлен.
MBL человека осуществляет специфическое и высокоаффинное взаимодействие через его коллаген-подобный домен с уникальными C1r/Cls-подобными сериновыми протеазами, называемыми MBL-ассоциированными сериновыми протеазами (MASP). На сегодняшний день описано три MASP. Во-первых, единый фермент "MASP" был идентифицирован и охарактеризован в качестве фермента, ответственного за инициацию каскада комплемента (т.е. расщепление C2 и C4) (Matsushita et al., J Exp Med 176(6):1497-1502 (1992); Ji et al., J. Immunol. 150:571-578, (1993)). Затем было определено, что активность MASP в действительности обеспечивалась смесью: MASP-1 и MASP-2 (Thiel et al., Nature 386:506-510, (1997)). Однако было продемонстрировано, что комплекс MBL-MASP-2 отдельно является достаточным для активации комплемента (Vorup-Jensen et al., J. Immunol. 165:2093-2100, (2000)). Более того, только MASP-2 расщепляла C2 и C4 на высоких скоростях (Ambrus et al., J. Immunol. 170:1374-1382, (2003)). Таким образом, MASP-2 представляет собой протеазу, ответственную за активацию C4 и C2 для образования C3-конвертазы C4b2a. Это является существенным отличием от комплекса C1 классического пути, где скоординированное действие двух специфических сериновых протеаз (C1r и C1s) приводит к активации системы комплемента. Кроме того, выделена третья новая протеаза MASP-3 (Dahl, M.R., et al., Immunity 15:127-35, 2001). MASP-1 и MASP-3 представляют собой альтернативно сплайсируемые продукты одного и того же гена.
MASP имеют идентичные организации доменов с доменами Clr и Cls, являющихся ферментативными компонентами комплекса Cl (Sim et al., Biochem. Soc. Trans. 28:545, (2000)). Эти домены включают N-концевой домен Clr/Cls/VEGF морского ежа/морфогенетического белка костей (CUB), домен, подобный эпидермальному фактору роста, второй домен CUB, тандем доменов белков контроля комплемента и домен сериновой проетазы. Как и в протеазах C1, активация MASP-2 происходит посредством расщепления связи Arg-I1e рядом с доменом сериновой протеазы, которая разделяет фермент на связанные дисульфидной связью цепи A и B, последняя из которых состоит из домена сериновой протеазы.
MBL также связывается с альтернативно сплайсированной формой MASP-2, известной как MBL-ассоциированный белок массой 19 кДа (MAp19) или малый MBL-ассоциированный белок (sMAP), который лишен каталитической активности MASP2. (Stover, J. Immunol. 162:3481-90, (1999); Takahashi et al., Int. Immunol. 11:859-863, (1999)). MAp19 содержит первые два домена MASP-2, за которыми следует дополнительная последовательность из четырех уникальных аминокислот. Функция Map19 неясна (Degn et al., J Immunol. Methods, 2011). Гены MASP-1 и MASP-2 расположены на хромосомах 3 и 1 человека, соответственно (Schwaeble et al., Immunobiology 205:455-466, (2002)).
Несколько данных указывают на то, что существуют различные комплексы MBL-MASP и значительная доля MASP в сыворотке находится не в комплексе с MBL (Thiel, et al., J. Immunol. 165:878-887, (2000)). Как H-фиколин, так и L-фиколин, связываются со всеми MASP и активируют лектиновый путь комплемента, как и MBL (Dahl et al., Immunity 15:127-35, (2001); Matsushita et al., J. Immunol. 168:3502-3506, (2002)). Как лектиновый, так и классический пути образуют общую C3-конвертазу (C4b2a), и на этой стадии эти два пути сходятся.
Широко полагают, что лектиновый путь имеет существенную роль в защите против инфекции у наивного хозяина. Убедительные доказательства вовлечения MBL в защиту хозяина получены в результате анализа пациентов со сниженными сывороточными уровнями функционального MBL (Kilpatrick, Biochim. Biophys. Acta 1572:401-413, (2002)). Такие пациенты подвержены рецидивирующим бактериальным и грибковым инфекциям. Эти симптомы обычно проявляются на ранних этапах жизни во время наблюдаемого окна уязвимости, когда титр материнских антител исчезает, а полный репертуар антительных ответов еще не развился. Этот синдром часто является результатом мутаций в нескольких участках коллагеновой части MBL, которые препятствуют надлежащему формированию олигомеров MBL. Однако, поскольку MBL может функционировать в качестве независимого от опсонинов комплемента, не известно, до какой степени увеличенная предрасположенность к инфекции является следствием сниженной активации комплемента.
В противоположность классическому и лектиновому путям, не было обнаружено ингибиторов альтернативного пути, которые воздействовали бы на функции распознавания, которые C1q и лектины выполняют в других двух путях. В настоящее время является общепризнанным, что альтернативный путь самопроизвольно претерпевает активацию обновления на низком уровне, которая может быстро усиливаться на чужеродных или других аномальных поверхностях (бактерии, дрожжи, инфицированные вирусами клетки или поврежденная ткань), которые лишены надлежащих молекулярных элементов, которые контролируют самопроизвольную активацию комплемента. Существует четыре белка плазмы, прямо вовлеченных в активацию альтернативного пути: C3, факторы B и D и пропердин.
Хотя существуют многочисленные доказательства вовлечения как классического, так и альтернативного, путей комплемента в патогенез неинфекционных заболеваний человека, роль лектинового пути только начинают оценивать. Недавние исследования обеспечили доказательства того, что активация лектинового пути может быть ответственной за активацию комплемента и связанное с ней воспаление при ишемическом/реперфузионном повреждении. Collard et al. (2000) описали, что культивируемые эндотелиальные клетки под воздействием окислительного стресса связывают MBL и демонстрируют депонирование C3 под действием сыворотки человека (Collard et al., Am. J. Pathol. 156:1549-1556, (2000)). Кроме того, обработка сыворотки человека блокирующими моноклональными антителами против MBL ингибировала связывание MBL и активацию комплемента. Эти данные были расширены на модель ишемии-реперфузии миокарда на крысах, в которой крысы, которым вводили блокирующее антитело, направленное против MBL, демонстрировали значительно меньшее повреждение миокарда при окклюзии коронарной артерии, чем крысы, которым вводили контрольное антитело (Jordan et al., Circulation 104:1413-1418, (2001)). Молекулярный механизм связывания MBL с эндотелием сосудов после окислительного стресса неясен; недавнее исследование указывает на то, что активация лектинового пути после окислительного стресса может опосредоваться связыванием MBL с цитокератинами эндотелия сосудов, но не с гликоконъюгатами (Collard et al., Am. J. Pathol. 159:1045-1054, (2001)). Вовлечение классического и альтернативного путей было показано в других исследованиях, и роль лектиновго пути в этом заболевании остается сомнительной (Riedermann, N.C., et al., Am. J. Pathol. 162:363-367, 2003).
В недавнем исследовании было показано, что MASP-1 (и также возможно MASP-3) требуется для конвертирования фермента активации альтернативного пути, фактора D, из его формы профермента в его ферментативно активную форму (см. Takahashi M. et al., J Exp Med 207(1):29-37 (2010)). Физиологическая важность этого процесса подчеркивается отсутствием функциональной активности альтернативного пути в плазме мышей с дефицитом MASP-1/3. Для функционирования альтернативного пути требуется протеолитическое образование C3b из нативного C3. Поскольку C3-конвертаза (C3bBb) альтернативного пути содержит C3b в качестве необходимой субъединицы, вопрос, касающийся источника первого C3b через альтернативный путь, озадачивает и привел к значительным исследованиям.
C3 принадлежит семейству белков (вместе с C4 и α-2-макроглобулином), которое включает редкую посттрансляционную модификацию, известную как сложная тиоэфирная связь. Сложная тиоэфирная группа состоит из глутамина, у которого концевая карбонильная группа образует ковалентную сложную тиоэфирную связь с сульфгидрильной группой цистеина через три аминокислоты от нее. Эта связь является нестабильной и электрофильный глутамилтиоэфир может реагировать с нуклеофильными частями, такими как гидроксильные или аминогруппы и, таким образом, образует ковалентную связь с другими молекулами. Сложная тиоэфирная связь является довольно стабильной, когда она изолирована в гидрофобном кармане интактного C3. Однако протеолитическое расщепление C3 на C3a и C3b приводит к экспонированию в высокой степени реакционноспособной сложной тиоэфирной связи на C3b и после нуклеофильной атаки соседних частей, содержащих гидроксильные или аминогруппы, C3b становится ковалентно связанным с мишенью. В дополнение к его документально подтвержденной роли в ковалентном связывании C3b с мишенями комплемента, полагают, что сложный тиоэфир C3 также имеет ключевую роль в запуске альтернативного пути. Согласно широко признанной "теории холостого хода", альтернативный путь инициируется образованием жидкофазной конвертазы iC3Bb, которая образуется из C3 с гидролизованным сложным тиоэфиром (iC3; C3(H2O)) и фактора B (Lachmann, P.J., et al., Springer Semin. Immunopathol. 7:143-162, (1984)). C3b-подобный C3(H2O) образуется из нативного C3 посредством медленного самопроизвольного гидролиза внутреннего сложного тиоэфира в белке (Pangburn, M.K., et al., J. Exp. Med. 154:856-867, 1981). Посредством активности конвертазы C3(H2O)Bb молекулы C3b депонируются на поверхности мишени, тем самым инициируя альтернативный путь.
Очень мало известно об инициаторах активации альтернативного пути. Полагают, что активаторы включают клеточные стенки дрожжей (зимозан), многие чистые полисахариды, эритроциты кролика, определенные иммуноглобулины, вирусы, грибы, бактерии, опухолевые клетки животных, паразиты и поврежденные клетки. Единственным признаком, являющимся общим для этих активаторов, является присутствие углевода, однако комплексность и разнообразие углеводных структур затруднила установление общих молекулярных детерминант, которые распознаются. Является широко признанным, что активация альтернативного пути контролируется тонким балансом между ингибиторными регуляторными компонентами этого пути, такими как фактор H, фактор I, DAF и CR1, и пропердином, который является единственным положительным регулятором альтернативного пути (см. Schwaeble W.J. and Reid K.B., Immunol Today 20(1):17-21 (1999)).
В дополнение к по всей видимости нерегулируемому механизму активации, описанному выше, альтернативный путь также может обеспечить мощную петлю усиления для C3-конвертазы (C4b2a) лектинового/классического пути, поскольку любой образовавшийся C3b может вместе с фактором B участвовать в формировании дополнительной C3-ковентазы (C3bBb) альтернативного пути. C3-конвертаза альтернативного пути стабилизируется связыванием пропердина. Пропердин продлевает время полужизни C3-конвертазы альтернативного пути в шесть-десять раз. Присоединение C3b к C3-конвертазе альтернативного пути приводит к образованию C5-конвертазы альтернативного пути.
Полагают, что все три пути (т.е. классический, лектиновый и альтернативный) сходятся в C5, который расщепляется с образованием продуктов с множеством провоспалительных эффектов. Путь после схождения называют терминальным путем комплемента. C5a представляет собой самый мощный анафилатоксин, индуцирующий изменения тонуса гладких мышц и сосудов, а также проницаемости сосудов. Также он является мощным хемотаксином и активатором как нейтрофилов, так и моноцитов. C5a-опосредуемая активация клеток может значительно усиливать воспалительные ответы путем индукции высвобождения множества дополнительных медиаторов воспаления, включая цитокины, гидролитические ферменты, метаболиты арахидоновой кислоты и активные формы кислорода. Расщепление C5 приводит к образованию C5b-9, также известного как мембраноатакующий комплекс (MAC). В настоящее время существуют убедительные доказательства того, что сублитическое депонирование MAC может играть важную роль в воспалении, в дополнение к его роли в качестве литического порообразующего комплекса.
В дополнение к ее незаменимой роли в иммунной защите, система комплемента вносит вклад в повреждение тканей при многих клинических состояниях. Таким образом, существует острая необходимость в разработке терапевтически эффективных ингибиторов комплемента для предупреждения этих неблагоприятных эффектов.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Это краткое описание предоставлено для предоставления совокупности идей в упрощенной форме, которые дополнительно описаны ниже в подробном описании. Это краткое изложение не предназначено для идентификации ключевых признаков заявленного объекта, также как и не предназначена для применения для облегчения определения объема заявленного объекта.
В одном аспекте настоящее изобретение относится к способу ингибирования MASP-2-зависимой активации комплемента у индивидуума, страдающего или имеющего риск развития тромботической микроангиопатии (TMA), где TMA является по меньшей мере одной из (i) TMA на фоне злокачественной опухоли; (ii) TMA на фоне химиотерапии или (iii) TMA на фоне трансплантации, включающему введение индивидууму композиции, содержащей количество средства, ингибирующего MASP-2, эффективное для ингибирования MASP-2-зависимой активации комплемента. В некоторых вариантах осуществления индивидуум страдает от или имеет риск развития TMA на фоне злокачественной опухоли, и средство, ингибирующее MASP-2, вводят системно индивидууму в количестве, эффективном для снижения риска развития TMA или для снижения тяжести TMA. В некоторых вариантах осуществления индивидуум страдает от или имеет риск развития TMA на фоне химиотерапии, и средство, ингибирующее MASP-2, вводят системно индивидууму до, в процессе или после химиотерапии, в количестве, эффективном для снижения риска развития TMA, или снижения тяжести TMA. В некоторых вариантах осуществления индивидуум страдает или имеет риск развития TMA на фоне трансплантации, и средство, ингибирующее MASP-2, вводят системно индивидууму до, в процессе или после трансплантации в количестве, эффективном для снижения риска развития TMA или снижения тяжести TMA. В некоторых вариантах осуществления трансплантация представляет собой трансплантацию аллогенных гемопоэтических стволовых клеток. В некоторых вариантах осуществления индивидуум ранее подвергался или подвергается на текущий момент лечению ингибитором терминального пути комплемента, который ингибирует расщепление белка C5 комплемента. В некоторых вариантах осуществления способ дополнительно включает введение индивидууму ингибитора терминального пути комплемента, который ингибирует расщепление белка C5 комплемента, такого как гуманизированное антитело против C5 или его антигенсвязывающий фрагмент, такой как экулизумаб.
В другом аспекте изобретение относится к способу ингибирования MASP-2-зависимой активации комплемента у индивидуума, страдающего или имеющего риск развития синдрома Апшо-Шульмана (USS), включающему введение индивидууму композиции, содержащей количество средства, ингибирующего MASP-2, эффективное для ингибирования MASP-2-зависимой активации комплемента. В некоторых вариантах осуществления способ включает лечение индивидуума, имеющего риск развития USS, где способ включает введение количества средства, ингибирующего MASP-2, в течение периода времени, эффективного для смягчения или предупреждения одного из нескольких клинических симптомов, ассоциированных с TTP. В некоторых вариантах осуществления способ дополнительно включает периодический мониторинг индивидуума и введение средства, ингибирующего MASP-2, при наличии события, о котором известно, что оно ассоциировано с запуском клинических симптомов TTP. В некоторых вариантах осуществления способ дополнительно включает периодический мониторинг индивидуума и введение средства, ингибирующего MASP-2, в случае определения наличия анемии, тромбоцитопении или повышения уровня креатинина. В некоторых вариантах осуществления индивидуум ранее подвергался или подвергается на текущий момент лечению ингибитором терминального пути комплемента, который ингибирует расщепление белка C5 комплемента. В некоторых вариантах осуществления способ дополнительно включает введение индивидууму ингибитора терминального пути комплемента, который ингибирует расщепление белка C5 комплемента, такого как гуманизированное антитело против C5 или его антигенсвязывающий фрагмент, такой как экулизумаб.
В другом аспекте изобретение относится к способу ингибирования MASP-2-зависимой активации комплемента у индивидуума, страдающего болезнью Дегоса, включающему введение индивидууму композиции, содержащей количество средства, ингибирующего MASP-2, эффективное для ингибирования MASP-2-зависимой активации комплемента. В некоторых вариантах осуществления индивидуум ранее подвергался или подвергается на текущий момент лечению ингибитором терминального пути комплемента, который ингибирует расщепление белка C5 комплемента. В некоторых вариантах осуществления способ дополнительно включает введение индивидууму ингибитора терминального пути комплемента, который ингибирует расщепление белка C5 комплемента, такого как гуманизиованное антитело против C5 или его антигенсвязывающий фрагмент, такой как экулизумаб.
В другом аспекте изобретение относится к способу ингибирования MASP-2-зависимой активации комплемента у индивидуума, страдающего катастрофическим антифосфолипидным синдромом (CAPS), включающему введение индивидууму композиции, содержащей количество средства, ингибирующее MASP-2, эффективное для ингибирования MASP-2-зависимой активации комплемента. В некоторых вариантах осуществления индивидуум ранее подвергался или подвергается на текущий момент лечению ингибитором терминального пути комплемента, который ингибирует расщепление белка C5 комплемента. В некоторых вариантах осуществления способ дополнительно включает введение индивидууму ингибитора терминального пути комплемента, который ингибирует расщепление белка C5 комплемента, такого как гуманизированное антитело против C5 или его антигенсвязывающий фрагмент, такой как экулизумаб.
В некоторых вариантах осуществления любого из описанных способов по изобретению, средство, ингибирующее MASP-2, представляет собой ингибирующее MASP-2 антитело или его фрагмент. В некоторых вариантах осуществления ингибирующее MASP-2 антитело обладает сниженной эффекторной функцией. В некоторых вариантах осуществления ингибирующее MASP-2 антитело по существу не ингибирует классический путь. В некоторых вариантах осуществления средство, ингибирующее MASP-2, представляет собой моноклональное антитело против MASP-2 или его фрагмент, которые специфически связываются с частью SEQ ID NO:6. В некоторых вариантах осуществления антитело против MASP-2 или его фрагмент выбраны из группы, состоящей из рекомбинантного антитела, антитела, обладающего сниженной эффекторной функцией, химерного антитела, гуманизированного антитела и антитела человека. В некоторых вариантах осуществления ингибирующее MASP-2 антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fv, Fab, Fab', F(ab)2 и F(ab')2. В некоторых вариантах осуществления ингибирующее MASP-2 антитело представляет собой одноцепочечную молекулу. В некоторых вариантах осуществления ингибирующее MASP-2 антитело выбрано из группы, состоящей из молекулы IgG1, молекулы IgG2 и молекулы IgG4. В некоторых вариантах осуществления ингибирующее MASP-2 антитело представляет собой молекулу IgG4, имеющую мутацию S228P. В некоторых вариантах осуществления ингибирующее MASP-2 антитело связывает MASP-2 человека с KD 10 нМ или менее. В некоторых вариантах осуществления ингибирующее MASP-2 антитело связывает эпитоп в домене CCP1 MASP-2. В некоторых вариантах осуществления ингибирующее MASP-2 антитело ингибирует депонирование C3b в анализе in vitro в 1% сыворотке человека с IC50 10 нМ или менее. В некоторых вариантах осуществления ингибирующее MASP-2 антитело ингибирует депонирование C3b в 90% сыворотке человека с IC50 30 нМ или менее.
В некоторых вариантах осуществления любого из описанных способов по изобретению ингибирующее MASP-2 моноклональное антитело или его антигенсвязывающий фрагмент содержат: (a) вариабельную область тяжелой цепи, содержащую: i) CDR-H1 тяжелой цепи, содержащую аминокислотную последовательность положений 31-35 SEQ ID NO:67; и ii) CDR-H2 тяжелой цепи, содержащую аминокислотную последовательность положений 50-65 SEQ ID NO:67; и iii) CDR-H3 тяжелой цепи, содержащую аминокислотную последовательность положений 95-102 SEQ ID NO:67 и (b) вариабельную область легкой цепи, содержащую: i) CDR-L1 легкой цепи, содержащую аминокислотную последовательность положений 24-34 SEQ ID NO:70; и ii) CDR-L2 легкой цепи, содержащую аминокислотную последовательность положений 50-56 SEQ ID NO:70; и iii) CDR-L3 легкой цепи, содержащую аминокислотную последовательность положений 89-97 SEQ ID NO:70. В некоторых вариантах осуществления ингибирующее MASP-2 моноклональное антитело содержит вариабельную область тяжелой цепи, указанную в качестве SEQ ID NO:67, и вариабельную область легкой цепи, указанную в качестве SEQ ID NO:70. В некоторых вариантах осуществления ингибирующее MASP-2 антитело или его антигенсвязывающий фрагмент специфически распознает по меньшей мере часть эпитопа, распознаваемого эталонным антителом, содержащим вариабельную область тяжелой цепи, как указано в SEQ ID NO:67, и вариабельную область легкой цепи, как указано в SEQ ID NO:70.
В другом аспекте изобретения предусматриваются способы ингибирования образования тромба у индивидуума, страдающего атипичным гемолитическим уремическим синдромом (aHUS), включающие введение индивидууму количества ингибирующего MASP-2 антитела или его связывающего фрагмента, эффективное для ингибирования MASP-2-зависимой активации комплемента. В некоторых вариантах осуществления ингибирующее MASP-2 антитело ингибирует образование тромба в сыворотке индивидуума, страдающего aHUS, по меньшей мере на 40% по сравнению с необработанной сывороткой. В некоторых вариантах осуществления ингибирующее MASP-2 антитело ингибирует образование тромба в сыворотке индивидуума, страдающего aHUS, на уровне, по меньшей мере на 20% превышающем (например, по меньшей мере на 30% превышающем, по меньшей мере на 40% превышающем, или по меньшей мере на 50% превышающем) его ингибиторный эффект в отношении депонирования 5b-9 в сыворотке того же индивидуума. В некоторых вариантах осуществления индивидуум имеет aHUS в острой фазе. В некоторых вариантах осуществления индивидуум имеет aHUS в фазе ремиссии. В некоторых вариантах осуществления ингибирующее MASP-2 антитело представляет собой моноклональное антитело или его фрагмент, которые специфически связываются с частью SEQ ID NO:6. В некоторых вариантах осуществления ингибирующее MASP-2 антитело или его фрагмент выбраны из группы, состоящей из рекомбинантного антитела, антитела, имеющего сниженную эффекторную функцию, химерного антитела, гуманизированного антитела и антитела человека. В некоторых вариантах осуществления ингибирующее MASP-2 антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fv, Fab, Fab', F(ab)2 и F(ab')2. В некоторых вариантах осуществления ингибирующее MASP-2 антитело представляет собой одноцепочечную молекулу. В некоторых вариантах осуществления ингибирующее MASP-2 антитело выбрано из группы, состоящей из молекулы IgG1, молекулы IgG2 и молекулы IgG4. В некоторых вариантах осуществления ингибирующее MASP-2 антитело представляет собой молекулу IgG4, содержащую мутацию S228P. В некоторых вариантах осуществления ингибирующее MASP-2 антитело связывает MASP-2 человека с KD 10 нМ или менее. В некоторых вариантах осуществления ингибирующее MASP-2 антитело связывает эпитоп в домене CCP1 MASP-2. В некоторых вариантах осуществления ингибирующее MASP-2 антитело ингибирует депонирование C3b в анализе in vitro в 1% сыворотке человека с IC50 10 нМ или менее. В некоторых вариантах осуществления ингибирующее MASP-2 антитело ингибирует депонирование C3b в 90% сыворотке человека с IC50 30 нМ или менее. В некоторых вариантах осуществления ингибирующее MASP-2 моноклональное антитело или его антигенсвязывающий фрагмент содержат: (a) вариабельную область тяжелой цепи, содержащую: i) CDR-H1 тяжелой цепи, содержащую аминокислотную последовательность положений 31-35 SEQ ID NO:67; и ii) CDR-H2 тяжелой цепи, содержащую аминокислотную последовательность положений 50-65 SEQ ID NO:67; и iii) CDR-H3 тяжелой цепи, содержащую аминокислотную последовательность положений 95-102 SEQ ID NO:67 и (b) вариабельную область легкой цепи, содержащую: i) CDR-L1 легкой цепи, содержащую аминокислотную последовательность положений 24-34 SEQ ID NO:70; и ii) CDR-L2 легкой цепи, содержащую аминокислотную последовательность положений 50-56 SEQ ID NO:70; и iii) CDR-L3 легкой цепи, содержащую аминокислотную последовательность положений 89-97 SEQ ID NO:70. В некоторых вариантах осуществления ингибирующее MASP-2 моноклональное антитело содержит вариабельную область тяжелой цепи, указанную в качестве SEQ ID NO:67, и вариабельную область легкой цепи, указанную в качестве SEQ ID NO:70. В некоторых вариантах осуществления ингибирующее MASP-2 антитело или его антигенсвязывающий фрагмент специфически распознают по меньшей мере часть эпитопа, распознаваемого эталонным антителом, содержащим вариабельную область тяжелой цепи, как указано в SEQ ID NO:67, и вариабельную область легкой цепи, как указано в SEQ ID NO:70.
В другом аспекте настоящее изобретение относится к композициям для ингибирования неблагоприятных эффектов MASP-2-зависимой активации комплемента, включающим терапевтически эффективное количество средства, ингибирующего MASP-2, такого как ингибирующее MASP-2 антитело и фармацевтически приемлемый носитель. Также предусматриваются способы производства лекарственного средства для применения для ингибирования неблагоприятных эффектов MASP-2-зависимой активации комплемента у живых индивидуумов, нуждающихся в этом, включающего терапевтически эффективное количество средства, ингибирующего MASP-2, в фармацевтическом носителе. Также предусматриваются способы производства лекарственных средств для применения для ингибирования MASP-2-зависимой активации комплемента для лечения каждого из состояний, заболеваний и нарушений, описанных ниже.
Способы, композиции и лекарственные средства по изобретению пригодны для ингибирования неблагоприятных эффектов MASP-2-зависимой активации комплемента in vivo у млекопитающих, включая человека, страдающего или имеющего риск развития тромботической микроангиопатии (TMA), как дополнительно описано в настоящем описании.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
Описанные выше аспекты и многие из дополнительных преимуществ настоящего изобретения будут в большей степени оценены, если станут более понятными, ввиду представленного ниже подробного описания с учетом прилагаемых чертежей, где:
На фиг.1 представлен график, иллюстрирующий геномную структуру MASP-2 человека;
На фиг.2A представлена схематическая диаграмма, иллюстрирующая доменную структуру белка MASP-2 человека;
На фиг.2B представлена схематическая диаграмма, иллюстрирующая доменную структуру белка MAp19 человека;
На фиг.3 представлена диаграмма, иллюстрирующая стратегию нокаута MASP-2 мыши;
На фиг.4 представлена диаграмма, иллюстрирующая конструкцию минигена MASP-2 человека;
На фиг.5A представлены результаты, демонстрирующие, что дефицит MASP-2 ведет к утрате опосредуемой лектиновым путем активации C4 при измерении по отсутствию депонирования C4b на маннане, как описано в примере 2;
На фиг.5B представлены результаты, демонстрирующие, что дефицит MASP-2 ведет к утрате опосредуемой лектиновым путем активации C4 при измерении по отсутствию депонирования C4b на зимозане, как описано в примере 2;
На фиг.5C представлены результаты, демонстрирующие относительные уровни активации C4 в образцах сыворотки, полученных из линий MASP-2+/-; MASP-2-/- и дикого типа при измерении по депонированию C4b на маннане и на зимозане, как описано в примере 2;
На фиг.6 представлены результаты, демонстрирующие, что добавление рекомбинантного MASP-2 мыши к образцам сыворотки MASP-2-/- восстанавливает опосредуемую лектиновым путем активацию C4 зависимым от концентрации белка образом при измерении по депонированию C4b на маннане, как описано в примере 2;
На фиг.7 представлены результаты, демонстрирующие, что классический путь является функциональным в линии MASP-2-/-, как описано в примере 8;
На фиг.8A представлены результаты, демонстрирующие, что Fab2-антитело против MASP-2 #11 ингибирует образование C3-конвертазы, как описано в примере 10;
На фиг.8B представлены результаты, демонстрирующие, что Fab2-антитело против MASP-2 #11 связывается с нативным MASP-2 крысы, как описано в примере 10;
На фиг.8C представлены результаты, демонстрирующие, что Fab2-антитело против MASP-2 #41 ингибирует расщепление C4, как описано в примере 10;
На фиг.9 представлены результаты, демонстрирующие, было обнаружено, что все из исследованных Fab2-антител против MASP-2, которые ингибировали образование C3-конвертазы, также ингибируют расщепление C4, как описано в примере 10;
На фиг.10 представлена диаграмма, иллюстрирующая рекомбинантные полипептиды, происходящие из MASP-2 крысы, которые использовали для картирования эпитопов блокирующих Fab2-антител против MASP-2, как описано в примере 11;
На фиг.11 представлены результаты, демонстрирующие связывание Fab2 против MASP-2 #40 и #60 с полипептидами MASP-2 крысы, как описано в примере 11;
На фиг.12 представлены результаты, демонстрирующие клиренс азота мочевины в крови для мышей дикого типа (+/+) и MASP-2 (-/-) через 24 и 48 часов после реперфузии в модели ишемического/реперфузионного повреждения почек, как описано в примере 12;
На фиг.13A представлены результаты, демонстрирующие исходные уровни белка VEGF в RPE-хориоидном комплексе, извлеченном из мышей дикого типа (+/+) и MASP-2 (-/-), как описано в примере 13;
На фиг.13B представлены результаты, демонстрирующие уровни белка VEGF в RPE-хориоидном комплексе у мышей дикого типа (+/+) и MASP-2 (-/-)через 3 суток после индуцируемого лазером повреждения в модели дегенерации желтого пятна, как описано в примере 13;
На фиг.14 представлены результаты, демонстрирующие средний объем хориоидной неоваскуляризации (CNV) на седьмые сутки после индуцируемого лазером повреждения у мышей дикого типа (+/+) и MASP-2 (-/-), как описано в примере 13;
На фиг.15A и 15B представлены кривые доза-эффект для ингибирования депонирования C4b (фиг.15A) и ингибирования активации тромбина (фиг.15B) после введения Fab2-антитела против MASP-2 в нормальной сыворотке крысы, как описано в примере 14;
На фиг.16A и 16B представлена измеренная агрегация тромбоцитов (выражаемая в площади агрегата) у мышей MASP-2 (-/-) (фиг.16B) по сравнению с агрегацией тромбоцитов у мышей дикого типа без введения и мышей дикого типа, у которых путь комплемента ингибировали истощающим фактором яда кобры (CVF) и ингибитором терминального пути (антагонист C5aR) (фиг.16A) в модели локализованной реакции Шварцмана для диссеминированного внутрисосудистого свертывания, как описано в примере 15;
На фиг.17 графически иллюстрируются уровни азота мочевины в крови (BUN), измеренные у мышей либо WT (+/+) (B6), либо MASP-2 (-/-), являющихся реципиентами трансплантатов донорных почек WT (+/+), как описано в примере 16;
На фиг.18 графически иллюстрируется процентная выживаемость мышей WT (+/+) и MASP-2 (-/-) в зависимости от количества суток после микробного инфицирования в модели лигирования и прокола слепой кишки (CLP), как описано в примере 17;
На фиг.19 графически иллюстрируется количество бактерий, измеренных у мышей WT (+/+) и MASP-2 (-/-) после микробного инфицирования в модели лигирования и прокола слепой кишки (CLP), как описано в примере 17;
На фиг.20 представлен график Каплана-Мейера, иллюстрирующий процентную выживаемость мышей WT (+/+), MASP-2 (-/-) и C3 (-/-) через шесть суток после заражения путем интраназального введения Pseudomonas aeruginosa, как описано в примере 18;
На фиг.21 графически иллюстрируется уровень депонирования C4b, измеренный в качестве % от контроля, в образцах, взятых в различные моменты времени после подкожного введения либо 0,3 мг/кг либо 1,0 мг/кг моноклонального антитела мыши против MASP-2 у мышей WT, как описано в примере 19;
На фиг.22 графически иллюстрируется уровень депонирования C4b, измеренный в качестве % от контроля, в образцах, взятых в различные моменты времени после в/б введения 0,6 мг/кг моноклонального антитела мыши против MASP-2 у мышей WT как описано в примере 19;
На фиг.23 графически иллюстрируется средний объем хориоидной неоваскуляризации (CNV) на седьмые сутки после индуцированного лазером повреждения у мышей WT (+/+), которым предварительно проводили однократную в/б инъекцию 0,3 мг/кг или 1,0 мг/кг моноклонального антитела мыши против MASP-2; как описано в примере 20;
На фиг.24A графически иллюстрируется процентная выживаемость мышей MASP-2 (-/-) и WT (+/+) после инфицирования 5×108/100 мкл к.о.е. N. meningitidis, как описано в примере 21;
На фиг.24B графически иллюстрируется log к.о.е./мл N. meningitides, выделенных в различные моменты времени из образцов крови, взятых от мышей MASP-2 KO (-/-) и WT (+/+), инфицированных 5×108 к.о.е./100 мкл N. meningitidis, как описано в примере 21;
На фиг.25A графически иллюстрируется процентная выживаемость мышей MASP-2 KO (-/-) и WT (+/+) после инфицирования 2×108 к.о.е./100 мкл N. meningitidis, как описано в примере 21;
На фиг.25B графически иллюстрируется log к.о.е./мл N. meningitides, выделенных в различные моменты времени из образцов крови, взятых от мышей WT (+/+), инфицированных 2×108 к.о.е./100 мкл N. meningitidis, как описано в примере 21;
На фиг.25C графически иллюстрируется log к.о.е./мл N. meningitides, выделенных в различные моменты времени из образцов крови, взятых от мышей MASP-2 (-/-), инфицированных 2×108 к.о.е./100 мкл N. meningitidis, как описано в примере 21;
На фиг.26A графически иллюстрируются результаты анализа депонирования C3b, демонстрирующие, что у мышей MASP-2 (-/-) сохраняется функциональный классический путь, как описано в примере 22;
На фиг.26B графически иллюстрируются результаты анализа депонирования C3b на покрытых зимозаном планшетах, демонстрирующие, что у мышей MASP-2 (-/-) сохраняется функциональный альтернативный путь, как описано в примере 22;
На фиг.27A графически иллюстрируется индуцируемая ишемическим/реперфузионным повреждением миокарда (MIRI) потеря тканей после лигирования левой передней нисходящей ветви коронарной артерии (LAD) и реперфузии у мышей C4 (-/-) (n=6) и соответствующих однопоментных контрольных животных WT (n=7), демонстрирующая площадь риска (AAR) и размер инфаркта (INF), как описано в примере 22;
На фиг.27B графически иллюстрируется размер инфаркта (INF) в зависимости от площади риска (AAR) у мышей C4 (-/-) и WT, которым проводили введение, как описано на фиг.42A, демонстрирующий, что мыши C4 (-/-) являются настолько же подверженными MIRI, как и контроли WT (пунктирная линия), как описано в примере 22;
На фиг.28A графически иллюстрируются результаты анализа депонирования C3b с использованием сыворотки от мышей WT, мышей C4 (-/-) и сыворотки от мышей C4 (-/-), предварительно инкубированной с маннаном, как описано в примере 22;
На фиг.28B графически иллюстрируются результаты анализа депонирования C3b в сыворотке от мышей WT, C4 (-/-) и MASP-2 (-/-), смешанной с различными концентрациями mAb против MASP-2 мыши (mAbM11), как описано в примере 22;
На фиг.28C графически иллюстрируются результаты анализа депонирования C3b в сыворотке человека для сыворотки WT (с достаточным содержанием C4) и сыворотки с дефицитом C4 и сыворотки от индивидуумов с дефицитом C4, предварительно инкубированной с маннаном, как описано в примере 22;
На фиг.28D графически иллюстрируются результаты анализа депонирования C3b в сыворотке человека для индивидуумов WT (с достаточным содержанием C4) и индивидуумов с дефицитом C4, смешанной с mAb против MASP-2 человека (mAbH3), как описано в примере 22;
На фиг.29A графически иллюстрируется сравнительный анализ активности C3-конвертазы в плазме различных линий мышей с дефицитом комплемента, исследованных либо в условиях анализа, специфических для лектинового пути активации, либо в условиях анализа, специфических для классического пути активации, как описано в примере 22;
На фиг.29B графически иллюстрируется кинетика с течением времени для активности C3-конвертазы в плазме различных линий мышей с дефицитом комплемента, исследованных в условиях, специфических для лектинового пути активации, как описано в примере 22;
На фиг.30 иллюстрируются результаты анализа с использованием вестерн-блоттинга, демонстрирующие активацию C3 человека, на которую указывает присутствие a'-цепи, субстратами тромбина FXIa и FXa, как описано в примере 23;
На фиг.31 показаны результаты анализы депонирования C3 в образцах сыворотки, полученных от WT, MASP-2 (-/-), F11(-/-), F11(-/-)/C4 (-/-) и C4 (-/-), как описано в примере 23;
На фиг.32A представлен график Каплана-Мейера для выживаемости, демонстрирующий процентную выживаемость с течением времени после воздействия облучения 7,0 Гр у контрольных мышей и у мышей, которым вводили антитело против MASP-2 мыши (mAbM11) или антитело против MASP-2 человека (mAbH6), как описано в примере 29;
На фиг.32B представлен график Каплана-Мейера для выживаемости, демонстрирующий процентную выживаемость с течением времени после воздействия облучения 6,5 Гр у контрольных мышей и у мышей, которым вводили антитело против MASP-2 мыши (mAbM11) или антитело против MASP-2 человека (mAbH6), как описано в примере 29;
На фиг.33 представлен график Каплана-Мейера, графически иллюстрирующий процентную выживаемость мышей MASP-2 KO и WT после введения инфекционной дозы 2,6×107 к.о.е. N. meningitidis серогруппы A Z2491, демонстрирующий, что мыши с дефицитом MASP-2 защищены от индуцируемой N. meningitidis смертности, как описано в примере 30;
На фиг.34 представлен график Каплана-Мейера, графически иллюстрирующий процентную выживаемость мышей MASP-2 KO и WT после инфекционной дозы 6×106 к.о.е. N. meningitidis серогруппы B штамма MC58, демонстрирующий, что мыши с дефицитом MASP-2 защищены от индуцируемой N. meningitidis серогруппы B штамма MC58 смертности, как описано в примере 30;
На фиг.35 графически иллюстрируется log к.о.е./мл N. meningitidis серогруппы B штамма MC58, выделенных в различные моменты времени из образцов крови, взятых от мышей MASP-2 KO и WT после в/б инфицирования 6×106 к.о.е. N. meningitidis серогруппы B штамма MC58 (n=3 в различные моменты времени для обеих групп мышей, результаты выражены в качестве средних значений ± SEM), где продемонстрировано, что, хотя мышей MASP-2 KO инфицировали той же дозой N. meningitidis серогруппы B штамма MC58, что и мышей WT, мыши MASP-2 KO имеют усиленное устранение бактериемии по сравнению с WT, как описано в примере 30;
На фиг.36 графически иллюстрируется средний показатель нездоровья мышей MASP-2 и WT через 3, 6, 12 и 24 часов после инфицирования 6×106 к.о.е./100 мкл N. meningitidis серогруппы B штамма MC58, демонстрирующий, что мыши с дефицитом MASP-2 продемонстрировали высокую устойчивость к инфицированию со значительно более низкими показателями нездоровья через 6 часов, как описано в примере 30;
На фиг.37 представлен график Каплана-Мейера, графически иллюстрирующий процентную выживаемость мышей после введения инфекционной дозы 4×106/100 мкл к.о.е. N. meningitidis серогруппы B штамма MC58, с последующим введением через 3 часа после инфицирования либо ингибиторного антитела против MASP-2 (1 мг/кг), либо изотипического контрольного антитела, демонстрирующую, что антитело против MASP-2 является эффективным для лечения и повышения выживаемости у индивидуумов, инфицированных N. meningitidis, как описано в примере 31;
На фиг.38 графически иллюстрируются количества жизнеспособных клеток N. meningitidis серогруппы B-MC58 в log к.о.е./мл, выделенных в различные моменты времени из сыворотки в концентрации 20% после в/б инфицирования 6,5×106 к.о.е./100 мкл N. meningitidis серогруппы B штамма MC58 через 0, 30, 60 и 90 минут после инкубации в присутствии: (A) нормальной сыворотки человека (NHS) плюс антитело человека против MASP-2; (B) нормальной сыворотки человека (NHS) плюс изотипическое контрольное антитело; (C) сыворотки человека MBL-/-; (D) нормальной сыворотки человека (NHS) и (E) инактивированной нагреванием нормальной сыворотки человека (NHS), где продемонстрировано, что зависимое от комплемента уничтожение N. meningitidis в сыворотке человека значительно усиливалось добавлением антитела человека против MASP-2, как описано в примере 32;
На фиг.39 графически иллюстрируются количества жизнеспособных клеток N. meningitidis серогруппы B-MC58 в log к.о.е./мл, выделенных в различные моменты времени из образцов сыворотки мышей, демонстрирующие, что сыворотки мышей MASP-2 -/- обладают более высоким уровнем бактерицидной активности в отношении N. meningitides, чем сыворотки мышей WT, как описано в примере 32;
На фиг.40 графически иллюстрируется гемолиз (при измерении по высвобождению гемоглобина лизированных эритроцитов мыши (Crry/C3-/-) в супернатант, измеряемому фотометрией) покрытых маннаном эритроцитов мыши под действием сыворотки человека в диапазоне концентраций сыворотки. Исследованные сыворотки включали инактивированную нагреванием (HI) NHS, MBL-/-, NHS + антитело против MASP-2 и контрольную NHS, как описано в примере 33;
На фиг.41 графически иллюстрируется гемолиз (при измерении по высвобождению гемоглобина лизированных эритроцитов мыши WT в супернатант, измеряемому фотометрией) непокрытых эритроцитов мыши под действием сыворотки человека в диапазоне концентраций сыворотки. Исследованные сыворотки включали инактивированную нагреванием (HI) NHS, MBL-/-, NHS + антитело против MASP-2 и контрольную NHS, и демонстрируется, что ингибирование MASP-2 ингибирует опосредуемый комплементом лизис несенсибилизированных эритроцитов WT мыши, как описано в примере 33;
На фиг.42 графически иллюстрируется гемолиз (при измерении по высвобождению гемоглобина лизированных эритроцитов мыши (CD55/59 -/-) в супернатант, измеренному фотометрией) непокрытых эритроцитов мыши под действием сыворотки человека в диапазоне концентраций сыворотки. Исследованные сыворотки включали инактивированную нагреванием (HI) NHS, MBL-/-, NHS +антитело против MASP-2 и контрольную NHS, и демонстрируется, что ингибирование MASP-2 ингибирует опосредуемый комплементом лизис несенсибилизированных эритроцитов WT мыши, как описано в примере 33;
На фиг.43 графически иллюстрируется процентная выживаемость с течением времени (сутки) после воздействия облучения 8,0 Гр у контрольных мышей и мышей, которым вводили антитело против MASP-2 человека (mAbH6), как описано в примере 34;
На фиг.44 графически иллюстрируется время до возникновения микрососудистой окклюзии после инъекции LPS у мышей MASP-2-/- и WT, и демонстрируется процент мышей с образованием тромба, измеряемым на протяжении 60 минут, указывающий на то, что образование тромба обнаруживалось через 15 минут у мышей WT, причем вплоть до 80% мышей WT демонстрировали образование тромба через 60 минут; напротив, ни одна из мышей MASP-2-/- не продемонстрировала какого-либо образования тромбов в течение 60 минут (логарифмический ранговый критерий: p=0,0005), как описано в примере 35;
На фиг.45 графически иллюстрируется процентная выживаемость контрольных мышей, которым вводили физиологический раствор, (n=5) и мышей, которым вводили антитело против MASP-2 (n=5), в индуцируемой STX/LPS модели HUS с течением времени (часы), демонстрирующая, что все из контрольных мышей погибли в течение 42 часов, в то время как, напротив, 100% мышей, которым вводили антитело против MASP, выжили на протяжении всего эксперимента, как описано в примере 36;
На фиг.46 графически иллюстрируется процент мышей с микрососудистой окклюзией в зависимости от времени после индукции повреждения в УФ-модели с FITC/декстраном после введения изотипического контроля или антитела MASP-2 человека mAbH6 (10 мг/кг), вводимых за 16 часов и 1 час до инъекции FITC/декстрана, как описано в примере 37;
На фиг.47 графически иллюстрируется время окклюзии в минутах для мышей, которым вводили антитело против MASP-2 человека (mAbH6) и изотипическое контрольное антитело, где данные представлены в качестве точек разброса со средними величинами (горизонтальные планки) и стандартными планками погрешностей (вертикальные планки). Статистический критерий, использованный для анализа, представлял собой непарный t-критерий; где обозначение "*" указывает на p=0,0129, как описано в примере 37; и
На фиг.48 графически иллюстрируется время до окклюзии в минутах у мышей дикого типа, мышей MASP-2 KO и мышей дикого типа, которым предварительно вводили антитело против MASP-2 человека (mAbH6), вводимое в/б в дозе 10 мг/кг за 16 часов до и вновь за 1 час до индукции тромбоза в модели тромбоза с индуцируемым FITC-декстраном/светом повреждением клеток эндотелия при низкой интенсивности света (800-1500), как описано в примере 37;
На фиг.49 представлен график Каплана-Мейера, демонстрирующий процент мышей с тромбами в зависимости от времени при индуцируемой FITC-декстраном тромботической микроангиопатии у мышей, которым вводили возрастающие дозы ингибирующего MASP-2 человека антитела (mAbH6) или изотипического контрольного антитела, как описано в примере 39;
На фиг.50 графически иллюстрируется срединное время до начала (минуты) образования тромба в зависимости от дозы mAbH6 (*p<0,01 по сравнению с контролем), как описано в примере 39;
На фиг.51 представлен график Каплана-Мейера, демонстрирующий процент мышей с микрососудистой окклюзией в зависимости от времени при индуцируемой FITC-декстраном тромботической микроангиопатии у мышей, которым вводили возрастающие дозы ингибиторного антитела против MASP-2 человека (mAbH6) или изотипического контрольного антитела, как описано в примере 39;
На фиг.52 графически иллюстрируется срединное время до микрососудистой окклюзии в зависимости от дозы mAbH6 (*p<0,05 по сравнению с контролем), как описано в примере 39;
На фиг.53A графически иллюстрируется уровень депонирования MAC в присутствии или в отсутствие моноклонального антитела против MASP-2 человека (OMS646) в условиях анализа, специфического для лектинового пути, демонстрирующий, что OMS646 ингибирует лектин-опосредованное депонирование MAC с величиной IC50 приблизительно 1 нМ, как описано в примере 40;
На фиг.53B графически иллюстрируется уровень депонирования MAC в присутствии или в отсутствие моноклонального антитела против MASP-2 человека (OMS646) в условиях анализа, специфического для классического пути, демонстрирующий, что OMS646 не ингибирует опосредуемое классическим путем депонирование MAC, как описано в примере 40;
На фиг.53C графически иллюстрируется уровень депонирования MAC в присутствии или в отсутствие моноклонального антитела против MASP-2 человека (OMS646) в условиях анализа, специфического для альтернативного пути, демонстрирующий, что OMS646 не ингибирует опосредуемое альтернативным путем депонирование MAC, как описано в примере 40;
На фиг.54 графически иллюстрируется фармакокинетический (PK) профиль моноклонального антитела против MASP-2 человека (OMS646) у мышей, демонстрирующий концентрацию OMS646 (среднее значение для n=3 животных/группа) в зависимости от времени после введения указанной дозы, как описано в примере 40;
На фиг.55A графически иллюстрируется фармакодинамический (PD) ответ моноклонального антитела против MASP-2 человека (OMS646), измеренный в качестве снижения системной активности лектинового пути у мышей после внутривенного введения, как описано в примере 40;
На фиг.55B графически иллюстрируется фармакодинамический (PD) ответ моноклонального антитела против MASP-2 человека (OMS646), измеренный в качестве снижения системной активности лектинового пути у мышей после подкожного введения, как описано в примере 40;
На фиг.56 графически иллюстрируется ингибиторный эффект антитела против MASP-2 (OMS646) по сравнению с sCR1 в отношении депонирования C5b-9 на активированных ADP клетках HMEC-1, индуцируемого сывороткой при aHUS, как описано в примере 41; и
На фиг.57 графически иллюстрируется ингибиторный эффект антитела против MASP-2 (OMS646) по сравнению с sCR1 на образование тромбов на ADP-активированных клетках HMEC-1, индуцируемое сывороткой при aHUS, как описано в примере 42.
ОПИСАНИЕ СПИСКА ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO:1, кДНК MAp19 человека
SEQ ID NO:2, белок MAp19 человека (с лидерной последовательностью)
SEQ ID NO:3, белок MAp19 человека (зрелый)
SEQ ID NO:4, кДНК MASP-2 человека
SEQ ID NO:5, белок MASP-2 человека (с лидерной последовательностью)
SEQ ID NO:6, белок MASP-2 человека (зрелый)
SEQ ID NO:7, гДНК MASP-2 человека (экзоны 1-6)
АНТИГЕНЫ: (ОТНОСИТЕЛЬНО ЗРЕЛОГО БЕЛКА MASP-2)
SEQ ID NO:8, последовательность CUBI (а.к.1-121)
SEQ ID NO:9, последовательность CUBEGF (а.к.1-166)
SEQ ID NO:10, CUBEGFCUBII (а.к.1-293)
SEQ ID NO:11, область EGF (а.к.122-166)
SEQ ID NO:12, домен сериновой протеазы (а.к.429-671)
SEQ ID NO:13, неактивный домен сериновой протеазы (а.к.610-625 с мутацией Ser618 на Ala)
SEQ ID NO:14, TPLGPKWPEPVFGRL (пептид CUB1)
SEQ ID NO:15, TAPPGYRLRLYFTHFDLELSHLCEYDFVKLSSGAKVLATLCGQ (пептид CUBI)
SEQ ID NO:16, TFRSDYSN (центральная часть связывающей области MBL)
SEQ ID NO:17, FYSLGSSLDITFRSDYSNEKPFTGF (связывающая область MBL)
SEQ ID NO:18, IDECQVAPG (ПЕПТИД EGF)
SEQ ID NO:19, ANMLCAGLESGGKDSCRGDSGGALV (связывающая центральная часть сериновой протеазы) Подробное описание
ПЕПТИДНЫЕ ИНГИБИТОРЫ:
SEQ ID NO:20, полноразмерная кДНК MBL
SEQ ID NO:21, полноразмерный белок MBL
SEQ ID NO:22, OGK-X-GP (консенсусная связывающая последовательность)
SEQ ID NO:23, OGKLG
SEQ ID NO:24, GLR GLQ GPO GKL GPO G
SEQ ID NO:25, GPO GPO GLR GLQ GPO GKL GPO GPO GPO
SEQ ID NO:26, GKDGRDGTKGEKGEPGQGLRGLQGPOGKLGPOG
SEQ ID NO:27, GAOGSOGEKGAOGPQGPOGPOGKMGPKGEOGDO (h-фиколин человека)
SEQ ID NO:28, GCOGLOGAOGDKGEAGTNGKRGERGPOGPOGKAGPOGPNGAOGEO (фиколин p35 человека)
SEQ ID NO:29, LQRALEILPNRVTIKANRPFLVFI (участок расщепления C4)
ИНГИБИТОРЫ ЭКСПРЕССИИ:
SEQ ID NO:30, кДНК домена CUBI-EGF (нуклеотиды 22-680 SEQ ID NO:4)
SEQ ID NO:31
5' CGGGCACACCATGAGGCTGCTGACCCTCCTGGGC 3', нуклеотиды 12-45 SEQ ID NO:4. включающие участок начала трансляции MASP-2 (смысловая)
SEQ ID NO:32
5'GACATTACCTTCCGCTCCGACTCCAACGAGAAG3', нуклеотиды 361-396 SEQ ID NO:4, кодирующие область, содержащую участок связывания MBL MASP-2 (смысловая)
SEQ ID NO:33
5'AGCAGCCCTGAATACCCACGGCCGTATCCCAAA3', нуклеотиды 610-642 SEQ ID NO:4, кодирующие область, содержащую домен CUBII
ПРАЙМЕРЫ ДЛЯ КЛОНИРОВАНИЯ:
SEQ ID NO:34 CGGGATCCATGAGGCTGCTGACCCTC (5' ПЦР для CUB)
SEQ ID NO:35 GGAATTCCTAGGCTGCATA (3' ПЦР для CUB)
SEQ ID NO:36 GGAATTCCTACAGGGCGCT (3' ПЦР для CUBIEGF)
SEQ ID NO:37 GGAATTCCTAGTAGTGGAT (3' ПЦР для CUBIEGFCUBII)
SEQ ID NO:38-47 представляют собой праймеры для клонирования гуманизированного антитела
SEQ ID NO:48 представляет собой пептидную связь из 9 а.к.
ЭКСПРЕССИРУЮЩИЙ ВЕКТОР:
SEQ ID NO:49 представляет собой вставку минигена MASP-2
SEQ ID NO:50 представляет собой кДНК MASP-2 мыши
SEQ ID NO:51 представляет собой белок MASP-2 мыши (с лидерной последовательностью)
SEQ ID NO:52 представляет собой зрелый белок MASP-2 мыши
SEQ ID NO:53 кДНК MASP-2 крысы
SEQ ID NO:54 представляет собой белок MASP-2 крысы (с лидерной последовательностью)
SEQ ID NO:55 представляет собой зрелый белок MASP-2 крысы
SEQ ID NO:56-59 представляют собой олигонуклеотиды для сайт-направленного мутагенеза MASP-2 человека, использованного для получения MASP-2A человека
SEQ ID NO:60-63 представляют собой олигонуклеотиды для сайт-направленного мутагенеза MASP-2 мыши, использованного для получения MASP-2A мыши
SEQ ID NO:64-65 представляют собой олигонуклеотиды для сайт-направленного мутагенеза MASP-2 крысы, использованного для получения MASP-2A крысы
SEQ ID NO:66, ДНК, кодирующая вариабельную область тяжелой цепи (VH) 17D20_dc35VH21N11VL (OMS646) (без сигнального пептида)
SEQ ID NO:67, полипептид вариабельной области тяжелой цепи (VH) 17D20_dc35VH21N11VL (OMS646)
SEQ ID NO:68, полипептид вариабельной области тяжелой цепи (VH) 17N16mc
SEQ ID NO:69, ДНК, кодирующая вариабельную область легкой цепи (VL) 17D20_dc35VH21N11VL (OMS646)
SEQ ID NO:70, полипептид вариабельной области легкой цепи (VL) 17D20_dc35VH21N11VL (OMS646)
SEQ ID NO:71, полипептид вариабельной области легкой цепи (VL) 17N16_dc17N9
ПОДРОБНОЕ ОПИСАНИЕ
Настоящее изобретение основано на неожиданном открытии авторов настоящего изобретения, что является возможным ингибирование опосредуемого лектинами пути MASP-2, сохраняя классический путь интактным. Настоящее изобретение также относится к применению MASP-2 в качестве терапевтической мишени для ингибирования клеточного повреждения, ассоциированного с активацией опосредуемого лектинами пути комплемента, сохраняя компонент иммунной системы, представляющий собой классический (C1q-зависимый) путь, интактным.
I. ОПРЕДЕЛЕНИЯ
Если не определено в настоящем описании конкретно, все термины, используемые в настоящем описании, имеют то же значение, которое подразумевают специалисты в области настоящего изобретения. Следующие ниже определения предоставлены для обеспечения ясности терминов, поскольку они используются в описании и формуле изобретения для описания настоящего изобретения.
Как используют в рамках изобретения, термин "MASP-2-зависимая активация комплемента" включает MASP-2-зависимую активацию лектинового пути, которая происходит в физиологических условиях (т.е. в присутствии Ca++), что приводит к образованию C3-конвертазы C4b2a лектинового пути и при накоплении C3b, являющегося продуктом расщепления C3, впоследствии к образованию C5-конвертазы C4b2a(C3b)n, для которой было определено, что она является основной причиной опсонизации.
Как используют в рамках изобретения, термин "альтернативный путь" относится к активации компонентов, которая запускается, например, зимозаном из клеточных стенок грибов и дрожжей, липополисахаридом (LPS) из грамотрицательных наружных мембран и эритроцитами кролика, а также многими чистыми полисахаридами, эритроцитами кролика, вирусами, бактериями, опухолевыми клетками животных, паразитами и поврежденными клетками, и которая, как традиционно считают, возникает в результате самопроизвольного протеолитического образования C3b из фактора C3 комплемента.
Как используют в рамках изобретения, термин "лектиновый путь" относится к активации комплемента, которая происходит посредством специфического связывания сывороточных и несывороточных углевод-связывающих белков, включающих маннан-связывающий лектин (MBL), CL-11 и фиколины (H-фиколин, M-фиколин или L-фиколин).
Как используют в рамках изобретения, термин "классический путь" относится к активации комплемента, которая запускается антителом, связанным с чужеродной частицей, и требует связывания распознающей молекулы C1q.
Как используют в рамках изобретения, термин "средство, ингибирующее MASP-2" относится к любому средству, которое связывается или прямо взаимодействует с MASP-2 и эффективно ингибирует MASP-2-зависимую активацию комплемента, включая антитела против MASP-2 и их MASP-2-связывающие фрагменты, природные и синтетические пептиды, низкомолекулярные соединения, растворимые рецепторы MASP-2, ингибиторы экспрессии и выделенные природные ингибиторы, а также охватывает пептиды, которые конкурируют с MASP-2 за связывание с другой распознающей молекулой (например, MBL, H-фиколин, M-фиколин или L-фиколин) в лектиновом пути, но не охватывает антитела, которые связываются с такими другими распознающими молекулами. Средства, ингибирующие MASP-2, пригодные в способе по изобретению, могут снижать MASP-2-зависимую активацию комплемента более чем на 20%, например, более чем на 50%, например, более чем на 90%. В одном варианте осуществления средство, ингибирующее MASP-2, снижает MASP-2-зависимую активацию комплемента более чем на 90% (т.е. это приводит к активации комплемента MASP-2 только на 10% или менее).
Как используют в рамках изобретения, термин "антитело" охватывает антитела и их фрагменты, источником которых является любое продуцирующее антитела млекопитающее (например, мышь, крыса, кролик и примат, в том числе человек), или гибридома, фаговая селекция, рекомбинантная экспрессия или трансгенные животные (или другие способы продуцирования антител или фрагментов антител), которые специфически связываются с полипептидом-мишенью, например, такими как MASP-2, его полипептиды или части. Не подразумевается, что термин "антитело" ограничен в отношении источника антитела или способа его получения (например, посредством гибридом, фаговой селекции, рекомбинантной экспрессии, трансгенного животного, пептидного синтеза и т.д.). Иллюстративные антитела включают поликлональные, моноклональные и рекомбинантные антитела; панспецифические, мультиспецифические антитела (например, биспецифические антитела, триспецифические антитела); гуманизированные антитела; антитела мыши; химерные моноклональные антитела мыши-человека, мыши-примата, примата-человека; и антиидиотипичские антитела, и оно может представлять собой любое интактное антитело или его фрагмент. Как используют в рамках изобретения, термин "антитело" охватывает не только интактные поликлональные или моноклональные антитела, но также и их фрагменты (такие как dAb, Fab, Fab', F(ab')2, Fv), одноцепочечные антитела (ScFv), их синтетические варианты, их встречающиеся в природе варианты, слитые белки, содержащие часть антитела с антигенсвязывающим фрагментом требуемой специфичности, гуманизированные антитела, химерные антитела и любую другую модифицированную конфигурацию молекулы иммуноглобулина, которая содержит антигенсвязывающий центр или фрагмент (распознающий эпитоп участок) требуемой специфичности.
"Моноклональное антитело" относится к однородной совокупности антител, где моноклональное антитело состоит из аминокислот (встречающихся в природе и не встречающихся в природе), которые вовлечены в селективное связывание эпитопа. Моноклональные антитела являются высокоспецифичными в отношении антигена-мишени. Термин "моноклональное антитело" охватывает не только интактные моноклональные антитела и полноразмерные моноклональные антитела, но также их фрагменты (такие как Fab, Fab', F(ab')2, Fv), одноцепочечные антитела (ScFv), их варианты, слитые белки, содержащие антигенсвязыващую часть, гуманизированные моноклональные антитела, химерные моноклональные антитела и любую другую модифицированную конфигурацию молекулы иммуноглобулина, которая содержит антигенсвязывающий фрагмент (распознающий эпитоп участок) с требуемой специфичностью и способностью связываться с эпитопом. Подразумевают, что он не ограничивается в отношении источника антитела или способа, посредством которого его получают (например, с использованием гибридом, фаговой селекции, рекомбинантной экспрессии, трансгенных животных и т.д.). Термин включает целые иммуноглобулины, а также фрагменты и т.д., описанные выше под определением "антитело".
Как используют в рамках изобретения, термин "фрагмент антитела" относится к части, происходящей из или родственной полноразмерному антителу, например, такому как антитело против MASP-2, обычно включающей его антигенсвязывающую или вариабельную область. Иллюстративные примеры фрагментов антител включают фрагменты Fab, Fab', F(ab)2, F(ab')2 и Fv, фрагменты scFv, диантитела, линейные антитела, одноцепочечные молекулы антител и мультиспецифические антитела, образованные из фрагментов антител.
Как используют в рамках изобретения, "одноцепочечный Fv" или фрагмент антитела "scFv" содержит домены VH и VL антитела, где эти домены присутствуют в одной полипептидной цепи. Как правило полипептид Fv, кроме того, содержит полипептидный линкер между доменами VH и VL, который позволяет scFv образовывать желаемую структуру для связывания антигена.
Как используют в рамках изобретения, "химерное антитело" представляет собой рекомбинантный белок, который содержит вариабельные домены и определяющие комплементарность области, происходящие из антитела не являющегося человеком вида (например, грызуна), в то время как остальная часть молекулы антитела происходит из антитела человека.
Как используют в рамках изобретения, "гуманизированное антитело" представляет собой химерное антитело, которое содержит минимальную последовательность, которая соответствует конкретным определяющим комплементарность областям, происходящим из не являющегося человеческим иммуноглобулина, которые трансплантированы в каркасную область антитела человека. Гуманизированные антитела, как правило, представляют собой рекомбинантные белки, в которых только определяющие комплементарность области антител происходят не из человека.
Как используют в рамках изобретения, термин "маннан-связывающий лектин" ("MBL") эквивалентен маннан-связывающему белку ("MBP").
Как используют в рамках изобретения, "мембраноатакующий комплекс" ("MAC") относится к комплексу из терминальных пяти компонентов комплемента (C5b в комбинации с C6, C7, C8 и C-9), который встраивается и разрушает мембраны (также обозначаемый как C5b-9).
Как используют в рамках изобретения, "индивидуум" включает всех млекопитающих, включая, но не ограничиваясь ими, человека, не являющихся человеком приматов, собак, кошек, лошадей, овец, коз, коров, кроликов, свиней и грызунов.
Как используют в рамках изобретения, аминокислотные остатки сокращенно обозначают следующим образом: аланин (Ala; A), аспарагин (Asn; N), аспарагиновая кислота (Asp;D), аргинин (Arg; R), цистеин (Cys; C), глутаминовая кислота (Glu; E), глутамин (Gln; Q), глицин (Gly; G), гистидин (His; H), изолейцин (Ile; I), лейцин (Leu; L), лизин (Lys; K), метионин (Met; M), фенилаланин (Phe; F), пролин (Pro; P), серин (Ser; S), треонин (Thr; T), триптофан (Trp; W), тирозин (Tyr; Y) и валин (Val; V).
В наиболее широком значении встречающиеся в природе аминокислоты могут быть подразделены на группы на основе химических характеристик боковой цепи соответствующих аминокислот. Под "гидрофобной" аминокислотой подразумевают любую из Ile, Leu, Met, Phe, Trp, Tyr, Val, Ala, Cys или Pro. Под "гидрофильной" аминокислотой подразумевают любую из Gly, Asn, Gln, Ser, Thr, Asp, Glu, Lys, Arg или His. Эти группы аминокислот могут быть далее подразделены следующим образом. Под "незаряженной гидрофильной" аминокислотой подразумевают любую из Ser, Thr, Asn или Gln. Под "кислотной" аминокислотой подразумевают любую из Glu или Asp. Под "основной" аминокислотой подразумевают любую из Lys, Arg или His.
Как используют в рамках изобретения, термин "консервативная аминокислотная замена" иллюстрируется заменой среди аминокислот в каждой из следующих групп: (1) глицин, аланин, валин, лейцин и изолейцин, (2) фенилаланин, тирозин и триптофан, (3) серин и треонин, (4) аспартат и глутамат, (5) глутамин и аспарагин, и (6) лизин, аргинин и гистидин.
Термин "олигонуклеотид", как используют в рамках изобретения, относится к олигомеру или полимеру рибонуклеиновой кислоты (РНК) или дезоксирибонуклеиновой кислоты (ДНК) или их миметика. Этот термин также охватывает олигонуклеотиды, состоящие из встречающихся в природе нуклеотидов, сахаров и ковалентных межнуклеозидных (в остове) связей, а также олигонуклеотиды, имеющие не встречающиеся в природе модификации.
Как используют в рамках изобретения, "эпитоп" относится к участку на белке (например, белке MASP-2 человека), который связывается антителом. "Перекрывающиеся эпитопы" включают по меньшей мере один (например, два, три, четыре, пять или шесть) общий аминокислотный остаток(ов), включая линейные и нелинейные эпитопы.
Как используют в рамках изобретения, термины "полипептид", "пептид" и "белок" используют взаимозаменяемо, и они означают любую связанную пептидной связью цепь аминокислот независимо от длины или посттрансляционной модификации. Белок MASP-2, описанный в настоящем описании, может содержать или представлять собой белок дикого типа, или он может представлять собой варианты, которые обладают не более чем 50 (например, не более чем одной, двумя, тремя, четырьмя, пятью, шестью, семью, восемью, девятью, десятью, 12, 15, 20, 25, 30, 35, 40 или 50) консервативными аминокислотными заменами. Консервативные замены, как правило, включают замены в пределах следующих групп: глицин и аланин; валин, изолейцин и лейцин; аспарагиновая кислота и глутаминовая кислота; аспарагин, глутамин, серин и треонин; лизин, гистидин и аргинин; и фенилаланин и тирозин.
В некоторых вариантах осуществления белок MASP-2 человека может иметь аминокислотную последовательность, которая на или более чем на 70% (например, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100%) идентична белку MASP-2 человека, имеющему аминокислотную последовательность, указанную в SEQ ID NO:5.
В некоторых вариантах осуществления пептидные фрагменты могут иметь длину по меньшей мере 6 (например, по меньшей мере 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 250, 300, 350, 400, 450, 500, или 600 или более) аминокислотных остатков (например, по меньшей мере 6 последовательно расположенных аминокислотных остатков SEQ ID NO:5). В некоторых вариантах осуществления антигенный пептидный фрагмент белка MASP-2 человека имеет длину менее 500 (например, менее 450, 400, 350, 325, 300, 275, 250, 225, 200, 190, 180, 170, 160, 150, 140, 130, 120, 110, 100, 95, 90, 85, 80, 75, 70, 65, 60, 55, 50, 49, 48, 47, 46, 45, 44, 43, 42, 41, 40, 39, 38, 37, 36, 35, 34, 33, 32, 31, 30, 29, 28, 27, 26, 25, 24, 23, 22, 21, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7 или 6) аминокислотных остатков (например, менее 500 последовательно расположенных аминокислотных остатков в любой из SEQ ID NO:5).
Процентную (%) идентичность аминокислотных последовательностей определяют как процент аминокислот в последовательности-кандидате, которые идентичны аминокислотам в эталонной последовательности после выравнивания последовательностей и внесения пропусков, если необходимо, для достижения максимальной процентной идентичности последовательностей. Выравнивание для целей определения процентной идентичности последовательностей можно осуществлять различными способами, которые входят в пределы квалификации в данной области, например, с использованием общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, ALIGN, ALIGN-2 или Megalign (DNASTAR). Соответствующие параметры для проведения выравнивания, включая любые алгоритмы, требуемые для достижения максимального выравнивания на протяжении полной длины сравниваемых последовательностей, можно определять известными способами.
II. Обзор изобретения
Лектины (MBL, M-фиколин, H-фиколин, L-фиколин и CL-11) представляют собой специфические распознающие молекулы, которые запускают врожденную систему комплемента, и эта система включает каскад лектиновой инициации и ассоциированную с ним петлю усиления терминального пути, которая усиливает инициируемую лектинами активацию терминальных эффекторных молекул комплемента. C1q представляет собой специфическую распознающую молекулу, которая запускает приобретенную систему комплемента, и эта система включает классический путь инициации и ассоциированную с ним петлю усиления терминального пути, которая усиливает инициируемую C1q активацию терминальных эффекторных молекул комплемента. Авторы настоящего изобретения упоминают эти две основных системы активации комплемента как лектин-зависимая система комплемента и C1q-зависимая система комплемента, соответственно.
Помимо неотъемлемой роли в иммунной защите, система комплемента вносит вклад в повреждение тканей при многих клинических состояниях. Таким образом, существует острая необходимость в разработке терапевтически эффективных ингибиторов комплемента для предупреждения этих неблагоприятных эффектов. После установления того, что является возможным ингибирование опосредуемого лектинами пути MASP-2, сохраняя классический путь интактным, становится понятным, что было бы в высокой степени желательным ингибирование только системы активации комплемента, вызывающей конкретную патологию, без полного выключения способностей комплемента к иммунной защите. Например, при болезненных состояниях, при которых активация комплемента опосредуется в основном лектин-зависимой системой комплемента, было бы предпочтительным специфическое ингибирование только этой системы. Это сохранило бы систему C1q-зависимой активации комплемента интактной для осуществления процессинга иммунных комплексов и для способствования защите хозяина против инфекции.
Предпочтительным белковым компонентом для нацеливания при разработке лекарственных средств для специфического ингибирования лектин-зависимой системы комплемента является MASP-2. Среди всех известных белковых компонентов лектин-зависимой системы комплемента (MBL, H-фиколин, M-фиколин, L-фиколин, MASP-2, C2-C9, фактор B, фактор D и пропердин), только MASP-2 является как уникальной для лектин-зависимой системы комплемента, так и необходимой для функционирования системы. Лектины (MBL, H-фиколин, M-фиколин, L-фиколин и CL-11) также являются уникальными компонентами в лектин-зависимой системе комплемента. Однако утрата любого из лектиновых компонентов не обязательно обеспечит ингибирование системы вследствие избыточности лектинов. Чтобы гарантировать ингибирование лектин-зависимой системы активации комплемента, было бы необходимо ингибировать все пять лектинов. Более того, поскольку известно, что MBL и фиколины обладают опсонистической активностью, независимой от комплемента, ингибирование функции лектинов привело бы к утрате этого полезного механизма защиты хозяина против инфекций. Напротив, эта независимая от комплемента опсонистическая активность лектинов останется интактной, если мишенью ингибирования будет MASP-2. Дополнительная польза MASP-2 в качестве терапевтической мишени для ингибирования лектин-зависимой системы активации комплемента состоит в том, что концентрация MASP-2 в плазме является одной из наиболее низких среди всех белков комплемента (≈ 500 нг/мл); таким образом, соответственно, низкие концентрации высокоаффинных ингибиторов MASP-2 могут быть достаточными для достижения полного ингибирования (Moller-Kristensen, M., et al., J. Immunol Methods 282:159-167, 2003).
III. РОЛЬ MASP-2 В ТРОМБОТИЧЕСКИХ МИКРОАНГИОПАТИЯХ И ТЕРАПЕВТИЧЕСКИЕ СПОСОБЫ С ИСПОЛЬЗОВАНИЕМ СРЕДСТВ, ИНГИБИРУЮЩИХ MASP-2
Обзор
Тромботическая микроангиопатия (TMA) представляет собой патологию, характеризующуюся сгустками крови в небольших кровеносных сосудах (Benz, K.; et al., Curr Opin Nephrol Hypertens 19(3):242-7 (2010)). Полагают, что основным пусковым фактором является стресс или повреждение подлежащего сосудистого эндотелия. Клинические и лабораторные данные TMA включают тромбоцитопению, анемию, пурпуру и почечную недостаточность. Классическими TMA являются гемолитический уремический синдром (HUS) и тромботическая тромбоцитопеническая пурпура (TTP). Характерным основополагающим патологическим признаком TMA являются активация тромбоцитов и образование микротромбов в небольших артериолах и венулах. Активация комплемента, инициируемая, по меньшей мере частично, повреждением или стрессом эндотелия микрососудов, также вовлечена в другие TMA, включая катастрофический антифосфолипидный синдром (CAPS), системную болезнь Дегоса и TMA на фоне злокачественной опухоли, химиотерапии злокачественной опухоли и трансплантации.
Прямые доказательства патологической роли комплемента у хозяина нефрита предоставлены в исследованиях пациентов с генетическим дефицитом конкретных компонентов комплемента. В ряде сообщений описана ассоциация повреждения почек с дефицитом регуляторного фактора H комплемента (Ault, B.H., Nephrol. 14:1045-1053, 2000; Levy, M., et al., Kidney Int. 30:949-56, 1986; Pickering, M.C., et al., Nat. Genet. 31:424-8, 2002). Дефицит фактора H приводит к низким уровням факторов B и C3 в плазме вследствие связанного с активацией расхода этих компонентов. Циркулирующие уровни C5b-9 также повышены в сыворотке этих пациентов, что указывает на активацию комплемента. Мембранопролиферативный гломерулонефрит (MPGN) и идиопатический гемолитический уремический синдром (HUS) ассоциированы с дефицитом фактора H или мутациями фактора H. Свиньи с дефицитом фактора H (Jansen, J.H., et al., Kidney Int. 53:331-49, 1998) и мыши с нокаутом фактора H (Pickering, M.C., 2002) проявляют MPGN-подобные симптомы, подтверждая важность фактора H в регуляции комплемента. Дефицит других компонентов комплемента ассоциирован с заболеванием почек на фоне развития системной красной волчанки (SLE) (Walport, M.J., Davies, et al., Ann. N.Y. Acad. Sci. 815:267-81, 1997). Дефицит C1q, C4 и C2 вызывает высокую предрасположенность к развитию SLE через механизмы, связанные с дефектным выведением иммунных комплексов и апоптотического материала. У многих из этих пациентов с SLE возникает волчаночный нефрит, характеризующийся депонированием иммунных комплексов в гломерулах.
aHUS
Атипичный гемолитический уремический синдром (aHUS) является частью группы состояний, называемых "тромботическими микроангиопатиями". При атипичной форме HUS (aHUS) заболевание ассоциировано с дефектной регуляцией комплемента, и может быть либо спорадическим, либо семейным. Семейные случаи aHUS ассоциированы с мутациями в генах, кодирующих белки активации комплемента или регуляторные белки комплемента, включая фактор H, фактор I, фактор B комплемента, мембранный кофактор CD46, а также белок 1, родственный фактору H комплемента, (CFHR1) и белок 3, родственный фактору H комплемента (CFHR3). (Zipfel, P.F., et al., PloS Genetics 3(3):e41 (2007)). Унифицирующим признаком этого разнообразного набора генетических мутаций, ассоциированных с aHUS, является предрасположенность к усиленной активации комплемента на поверхностях клеток или тканей. Таким образом, один аспект настоящего изобретения включает лечение пациента, страдающего aHUS, который ассоциирован с дефицитом фактора H, путем введения эффективного количества средства, ингибирующего MASP-2. Другой аспект настоящего изобретения относится к лечению пациента, страдающего HUS, который ассоциирован с дефицитом фактора I, фактора B, мембранного кофактора CD46, CFHR1 или CFHR3, путем введения эффективного количества средства, ингибирующего MASP-2.
Недавно был достигнут значительный прогресс в направлении понимания молекулярной патофизиологии, лежащей в основе усиленной активации комплемента при aHUS, вызываемом разнообразным набором мутантных факторов комплемента. Этот механизм лучше всего понятен для мутаций фактора H. Фактор H представляет собой встречающийся в изобилии сывороточный белок, содержащий 20 доменов коротких консенсусных повторов (SCR), которые выступают в качестве отрицательного регулятора активации комплемента как в растворе, а также на поверхностях клеток-хозяев. Он нацелен на активированную форму C3 и, вместе с фактором I и другими кофакторами, стимулирует его инактивацию, предупреждая дальнейшую активацию комплемента. Для эффективного контроля активации комплемента на поверхностях клеток-хозяев фактор H должен взаимодействовать с клетками-хозяевами, что опосредуется доменами 16-20 SCR. Все мутации фактора H, ассоциированные с aHUS, описанные на сегодняшний день, кластеризованы на C-концевой области, охватывающей домены 16-20 (SCR). Эти мутантные белки фактора H полностью функциональны в отношении контроля активации C3 в растворе, но не способны взаимодействовать с поверхностями клеток-хозяев и, следовательно, не могут контролировать активацию C3 на клеточных поверхностях (Exp Med 204(6):1249-56 (2007)). Таким образом, определенные мутации фактора H ассоциированы с aHUS, поскольку мутантный белок фактора H не взаимодействует с поверхностями клеток-хозяев и, таким образом, не может эффективно подавлять активацию комплемента на поверхностях клеток-хозяев, включая эндотелий микрососудов. В результате, после первоначальной активации C3 у пациентов с мутациями фактора H происходит неугасающая последующая активация комплемента на поверхностях эндотелия микрососудов. Эта неконтролируемая активация комплемента в итоге приводит к прогрессирующему повреждению сосудистого эндотелия, последующей агрегации тромбоцитов и коагуляции микрососудов, и гемолизу, вызываемому сдвиговыми усилиями при прохождении RBC через частично закупоренные микрососуды. Таким образом, проявления заболевания aHUS и клинические и лабораторные данные прямо связаны с дефектом отрицательной регуляции комплемента на поверхности эндотелия микрососудов.
Аналогично мутации фактора H мутации с потерей функции в отрицательных модуляторах комплемента факторе I и мембранном кофакторном белке (CD46) также связаны с aHUS. Обратное наблюдали для фактора B и белка C3, поскольку было обнаружено, что aHUS ассоциирован с мутациями с приобретением функции в этих белках (Pediatr Nephrol 25(12):2431-42 (2010)). Таким образом, набор сходящихся данных предполагает активацию комплемента в патогенезе aHUS. Это мнение наиболее убедительно подтверждается терапевтической эффективностью экулизумаба - моноклонального антитела, которое блокирует белок C5 терминального комплемента - при лечении aHUS.
Хотя центральная роль комплемента в качестве эффекторного механизма в aHUS широко признана, пусковые факторы, инициирующие активацию комплемента, и вовлеченные молекулярные каскады не установлены. Не у всех индивидуумов, имеющих описанные выше мутации, развивается aHUS. В действительности, исследования показали, что пенетрантность aHUS составляет только ~50% (Ann Hum Genet 74(1):17-26 (2010)). Естественное течение заболевания указывает на то, что aHUS наиболее часто развивается после инициирующего события, такого как инфекционный эпизод или травма. Хорошо известно, что инфекционные агенты активируют систему комплемента. В отсутствие заранее существующего адаптивного иммунитета, активация комплемента инфекционными агентами может в основном инициироваться через лектиновый путь. Таким образом, активация лектинового пути, запускаемая инфекцией, может представлять собой инициирующий пусковой фактор для последующего патологического усиления активации комплемента у предрасположенных к aHUS индивидуумов, которая в итоге может привести к прогрессированию заболевания. Таким образом, другой аспект настоящего изобретения относится к лечению пациента, страдающего aHUS на фоне инфекции, путем введения эффективного количества средства, ингибирующего MASP-2.
Через лектиновый путь комплемент активируют и другие формы повреждения ткани хозяина, в частности, повреждение эндотелия сосудов. Эндотелиальные клетки сосудов человека, подвергающиеся окислительному стрессу, например, отвечают экспрессией поверхностных частей, которые связывают лектины и активируют лектиновый путь комплемента (Am J. Pathol 156(6):1549-56 (2000)). Повреждение сосудов после ишемии/реперфузии также активирует комплемент через лектиновый путь in vivo (Scand J Immunol 61(5):426-34 (2005)). Активация лектинового пути в этих условиях обладает патологическими последствиями для хозяина, и ингибирование лектинового пути посредством блокирования MASP-2 препятствует дальнейшему повреждению тканей хозяина и неблагоприятным исходам (Schwaeble PNAS 2011).
Таким образом, также известно, что лектиновый путь комплемента активируют другие процессы, которые вызывают aHUS. Следовательно, вероятно, что лектиновый путь может представлять собой первоначальный активирующий комплемент механизм, который ненадлежащим образом усиливается вследствие нарушения регуляции у индивидуумов с генетической предрасположенностью к aHUS, таким образом, инициируя патогенез aHUS. Следовательно, ожидается, что средства, которые блокируют активацию комплемента через лектиновый путь, включая антитела против MASP-2, будут предотвращать прогрессирование заболевания или уменьшать число обострений у предрасположенных к aHUS индивидуумов.
Для дальнейшего подтверждения этой идеи в недавних исследованиях были идентифицированы S. pneumonia в качестве важного этиологического фактора в педиатрических случаях aHUS. (Nephrology (Carlton), 17:48-52 (2012); Pediatr Infect Dis J. 30(9):736-9 (2011)). Эта конкретная этиология, по-видимому, имеет неблагоприятный прогноз со значительной смертностью и большой продолжительностью заболевания. Примечательно, что эти случаи вовлекали некишечные инфекции, приводящие к проявлениям микроангиопатии, уремии и гемолиза без признаков сопутствующих мутаций в генах комплемента, о которых известно, что они предрасполагают к aHUS. Важно отметить, что S. pneumonia являются особенно эффективными в отношении активации комплемента, и они осуществляют это в основном через лектиновый путь. Таким образом, в случаях некишечного HUS, ассоциированного с пневмококковой инфекцией, полагают, что проявления микроангиопатии, уремии и гемолиза запускаются в основном активацией лектинового пути, и полагают, что средства, которые блокируют лектиновый путь, включая антитела против MASP-2, будут предупреждать прогрессирование aHUS или снижать тяжесть заболевания у этих пациентов. Таким образом, другой аспект настоящего изобретения включает лечение пациента, страдающего некишечным aHUS, который ассоциирован с инфекцией S. pneumonia, путем введения эффективного количества средства, ингибирующего MASP-2.
В соответствии с вышесказанным, в некоторых вариантах осуществления в случае индивидуума, имеющего риск развития почечной недостаточности, ассоциированной с aHUS, предусматривается способ уменьшения вероятности развития aHUS или развития почечной недостаточности, ассоциированной с aHUS, включающий введение количества средства, ингибирующего MASP-2, в течение периода времени, эффективного для смягчения или предупреждения у индивидуума почечной недостаточности. В некоторых вариантах осуществления способ дополнительно включает стадию определения того, имеет ли индивидуум риск развития aHUS до возникновения каких-либо симптомов, ассоциированных с aHUS. В других вариантах осуществления способ включает определение того, имеет ли индивидуум риск развития aHUS при возникновении по меньшей мере одного или нескольких симптомов, указывающих на aHUS (например, присутствие анемии, тромбоцитопения и/или почечная недостаточность), и/или присутствии тромботической микроангиопатии в биоптате, полученном от индивидуума. Определение того, имеет ли индивидуум риск развития aHUS, включает определение того, имеет ли индивидуум генетическую предрасположенность к развитию aHUS, которое можно проводить путем оценки генетической информации (например, из базы данных, содержащей генотип индивидуума) или проведения по меньшей мере одного генетического скринингового теста у индивидуума для определения присутствия или отсутствия генетического маркера, ассоциированного с aHUS (т.е. определение присутствия или отсутствия генетической мутации, ассоциированной с aHUS, в генах, кодирующих фактор H (CFH), фактор I (CFI), фактор B (CFB) комплемента, мембранный кофактор CD46, C3, белок 1, родственный фактору H комплемента (CFHR1), или THBD (кодирующий антикоагулянтный белок тромбомодулин) или белок 3, родственный фактору H комплемента (CFHR3), или белок 4, родственный фактору H комплемента (CFHR4)) либо посредством геномного секвенирования, либо посредством ген-специфического анализа (например, анализа способом ПЦР), и/или определение того, имеет ли индивидуум aHUS в семейном анамнезе. Способы генетического скрининга присутствия или отсутствия генетической мутации, ассоциированной с aHUS, являются общеизвестными, например, см. Noris M et al. "Atypical Hemolytic-Uremic Syndrome," 2007 Nov 16 [Updated 2011 Mar 10]. Pagon RA, Bird TD, Dolan CR, et al., editors. GeneReviews™, Seattle (WA): University of Washington, Seattle.
Например, общая пенетрантность заболевания у индивидуумов с мутациями фактора H комплемента (CFH) составляет 48%, и пенетрантность в случае мутаций в CD46 составляет 53%, для мутаций в CFI она составляет 50%, для мутаций в C3 она составляет 56% и для мутаций в THBD она составляет 64% (Caprioli J. et al., Blood, 108:1267-79 (2006); Noris et al., Clin J Am Soc Nephrol 5:1844-59 (2010)). Как описано в Caprioli et al., (2006), выше, у существенного количества индивидуумов с мутацией фактора H комплемента (CFH) никогда не развивается aHUS, и утверждается, что субоптимальная активность CFH у этих индивидуумов является достаточной для защиты хозяина от эффектов активации комплемента в физиологических условиях, однако субоптимальная активность CFH не является достаточной для предотвращения депонирования C3b на эндотелиальных клетках сосудов под воздействием агента, который активирует комплемент и продуцирует количества C3b выше нормальных.
Таким образом, в одном варианте осуществления предусматривается способ ингибирования MASP-2-зависимой активации комплемента у индивидуума, страдающего или имеющего риск развития не зависимого от фактора H атипичного гемолитического уремического синдрома, включающий введение индивидууму композиции, содержащей количество средства, ингибирующего MASP-2, эффективное для ингибирования MASP-2-зависимой активации комплемента. В другом варианте осуществления предусматривается способ ингибирования MASP-2-зависимой активации комплемента у индивидуума, имеющего риск развития зависимого от фактора H атипичного гемолитического уремического синдрома, включающий периодический мониторинг индивидуума для определения наличия или отсутствия анемии, тромбоцитопении или повышения уровня креатинина, и введение средства, ингибирующего MASP-2, при определении наличия анемии, тромбоцитопении или повышения уровня креатинина. В другом варианте осуществления предусматривается способ уменьшения вероятности того, что индивидуум, имеющий риск развития зависимого от фактора H aHUS, будет иметь клинические симптомы, ассоциированные с aHUS, включающий введение средства, ингибирующего MASP-2, до, или одновременно, или после события, о котором известно, что оно ассоциировано с запуском клинических симптомов aHUS, например, воздействия лекарственного средства (например, химиотерапии), инфекции (например, бактериальной инфекции), злокачественной опухоли, травмы, трансплантации органа или ткани, или беременности.
В одном варианте осуществления предусматривается способ уменьшения вероятности того, что индивидуум с риском развития aHUS, будет иметь клинические симптомы, ассоциированные с aHUS, включающий периодический мониторинг индивидуума для определения наличия или отсутствия анемии, тромбоцитопении или увеличения уровня креатинина, и введение средства, ингибирующего MASP-2, при определении наличия анемии, тромбоцитопении или увеличения уровня креатинина.
В другом варианте осуществления предусматривается способ уменьшения вероятности того, что индивидуум с риском развития aHUS будет иметь клинические симптомы, ассоциированные с aHUS, включающий введение средства, ингибирующего MASP-2, до, или одновременно, или после события, о котором известно, что оно ассоциировано с запуском клинических симптомов aHUS, например, воздействия лекарственного средства (например, химиотерапии), инфекции (например, бактериальной инфекции), злокачественной опухоли, травмы, трансплантации органа или ткани, или беременности.
В некоторых вариантах осуществления средство, ингибирующее MASP-2, вводят в течение периода времени, составляющего по меньшей мере одни, двое, трое, четверо суток или более до, одновременно или после события, ассоциированного с запуском клинических симптомов aHUS, и введение можно повторять в соответствии с мнением врача до тех пор, пока состояние не разрешиться или не будет под контролем. В случае до aHUS средство, ингибирующее MASP-2, можно вводить индивидууму системно, как например, посредством внутриартериального, внутривенного, внутримышечного, ингаляционного, назального, подкожного или другого парентерального введения.
В некоторых вариантах осуществления в случае первоначального диагноза aHUS или у индивидуума, проявляющего один или несколько симптомов, согласующихся с диагнозом aHUS (например, присутствие анемии, тромбоцитопении и/или почечной недостаточности), индивидуума лечат эффективным количеством средства, ингибирующего MASP-2, (например, антитела против MASP-2) в качестве терапии первой линии в отсутствие плазмафереза, или в комбинации с плазмаферезом. В качестве терапии первой линии средство, ингибирующее MASP-2, можно вводить индивидууму системно, как например, посредством внутриартериального, внутривенного, внутримышечного, ингаляционного, назального, подкожного или другого парентерального введения. В некоторых вариантах осуществления средство, ингибирующее MASP-2, вводят индивидууму в качестве терапии первой линии в отсутствие плазмафереза во избежание потенциальных осложнений плазмафереза, включающих геморрагию, инфекцию и воздействие нарушений и/или аллергии, присущих донору плазмы, или в случае, когда индивидуум имеет противопоказания к плазмаферезу, или в случае, когда плазмаферез не доступен.
В некоторых вариантах осуществления способ включает введение средства, ингибирующего MASP-2, индивидууму, страдающему aHUS, через катетер (например, внутривенно) в течение первого периода времени (например, по меньшей мере от одних суток до недели или двух недель) с последующим введением средства, ингибирующего MASP-2, индивидууму подкожно в течение второго периода времени (например, длительная фаза из по меньшей мере двух недель или более). В некоторых вариантах осуществления введение в первый и/или второй период времени происходит в отсутствие плазмафереза. В некоторых вариантах осуществления способ дополнительно включает определение уровня по меньшей мере одного фактора комплемента (например, C3, C5) у индивидуума до лечения и необязательно в процессе лечения, где определение сниженного уровня по меньшей мере одного фактора комплемента по сравнению со стандартной величиной или здоровым контрольным индивидуумом указывает на необходимость в продолжении лечения средством, ингибирующим MASP-2.
В некоторых вариантах осуществления способ включает введение средства, ингибирующего MASP-2, такого как антитело против MASP-2, индивидууму, страдающему или имеющему риск развития aHUS, внутривенно, внутримышечно или, предпочтительно, подкожно. Лечение может быть длительным и может осуществляться посредством введения каждые сутки или каждый месяц, но предпочтительно каждые две недели. Антитело против MASP-2 можно вводить отдельно или в комбинации с ингибитором C5, таким как экулизумаб.
HUS
Подобно атипичному HUS, типичная форма HUS проявляет все клинические и лабораторные данные TMA. Однако типичный HUS часто является педиатрическим заболеванием и обычно не имеет семейного компонента или прямой ассоциации с мутациями в генах комплемента. Этиология типичного HUS тесно связана с инфекцией определенными патогенами кишечника. У пациентов, как правило, присутствует острая почечная недостаточность, гемоглобинурия и тромбоцитопения, после которых, как правило, следует эпизод геморрагической диареи. Это состояние вызывается кишечной инфекцией Shigella dissenteria, Salmonella или энтерогемморагическими штаммами E. Coli, продуцирующими токсин, подобный шига-токсину, такими как E.Coli O157:H7. Патогены передаются из зараженной пищи или источника воды. HUS представляет собой неотложное состояние и смертность от него достигает 5-10%. У значительной части выживших развивается хроническое заболевание почек (Corrigan and Boineau, Pediatr Rev 22 (11): 365-9 (2011)), и им может потребоваться трансплантация почки.
Микрососудистое свертывание при типичном HUS происходит в основном, но не исключительно, в микрососудах почек. Основополагающая патофизиология опосредуется шига-токсином (STX). Экскретируемый энтеропатическими микроорганизмами в просвет кишечника, STX проходит через кишечный барьер, проникает в кровоток и связывается с эндотелиальными клетками сосудов через рецептор глоботриаозилцерамида CD77 (Boyd and Lingwood Nephron 51:207 (1989)), который предпочтительно экспрессируется на эндотелии гломерул и опосредует токсический эффект STX. После связывания с эндотелием STX индуцирует серию событий, которые повреждают эндотелий сосудов, активируют лейкоциты и вызывают vWF-зависимое образование тромба (Forsyth et al., Lancet 2: 411-414 (1989); Zoja et al., Kidney Int. 62: 846-856 (2002); Zanchi et al., J. Immunol. 181:1460-1469 (2008); Morigi et al., Blood 98: 1828-1835 (2001); Guessou et al., Infect. Immun., 73: 8306-8316 (2005)). Эти микротромбы блокируют или закупоривают артериолы и капилляры почки и других органов. Блокирование кровотока в артериолах и капиллярах микротромбами увеличивает сдвиговое усилие, прилагаемое RBC, когда они проталкиваются через суженные кровеносные сосуды. Это может приводить к разрушению RBC под действием сдвигового усилия и к образованию фрагментов RBC, называемых шизоцитами. Присутствие шизоцитов является характерным признаком HUS. Этот механизм известен как микроангиопатический гемолиз. Кроме того, блокирование кровотока приводит к ишемии, инициирующей комплемент-опосредуемый воспалительный ответ, который вызывает дополнительное повреждение пораженного органа.
Лектиновый путь комплемента вносит вклад в патогенез HUS посредством двух основных механизмов: 1) MASP-2-опосредумая прямая активация каскада свертывания, вызываемая повреждением эндотелия, и 2) лектин-опосредуемая последующая активация комплемента, индуцируемая ишемией вследствие первоначального закупоривания микрососудистого кровотока.
STX повреждает эндотелиальные клетки микрососудов и известно, что поврежденные эндотелиальные клетки активируют систему комплемента. Как подробно описано выше, активация комплемента после повреждения эндотелиальных клеток запускается в основном по лектиновому пути. Эндотелиальные клетки сосудов человека, подвергнутые окислительному стрессу, отвечают экспрессией поверхностных структур, которые связывают лектины и активируют лектиновый путь комплемента (Collard et al., Am J Pathol. 156(5):1549-56 (2000)). Повреждение сосудов после ишемии-реперфузии также активирует комплемент через лектиновый путь in vivo (Scand J Immunol 61(5):426-34 (2005)). Активация лектинового пути в этом случае имеет патологические последствия для хозяина, и ингибирование лектинового пути посредством блокады MASP-2 препятствует дальнейшему повреждению у хозяина и неблагоприятным исходам (Schwaeble et al., PNAS (2011)). В дополнение к активации комплемента, показано, что лектин-зависимая активация MASP-2 приводит к расщеплению протромбина с образованием тробмина и стимуляцией свертывания. Таким образом, активация лектинового пути комплемента поврежденными эндотелиальными клетками может прямо активировать систему свертывания. Лектиновый путь комплемента посредством опосредуемой MASP-2 активации протромбина, таким образом, вероятно, является преобладающим молекулярным путем, связывающим первоначальное повреждение эндотелия посредством STX со свертыванием и микрососудистым тромбозом, которые происходят при HUS. Таким образом, ожидается, что ингибиторы лектинового пути, включая, но не ограничиваясь ими, антитела, которые блокируют функцию MASP-2, будут препятствовать или смягчать микрососудистое свертывание, тромбоз и гемолиз у пациентов, страдающих HUS. Действительно, введение антитела против MASP-2 надежно защищает мышей в модели типичного HUS. Как описано в примере 36 и показано на фиг.45, у всех контрольных мышей, подвергнутых воздействию STX и LPS, развивался тяжелый HUS, и они становились умирающими или погибали в пределах 48 часов. С другой стороны, как показано на фиг.45, все мыши, которым вводили антитело против MASP-2, а затем подвергали воздействию STX и LPS, выжили (точный критерий Фишера, p<0,01; N=5). Таким образом, терапия против MASP-2 надежно защищает мышей в этой модели HUS. Ожидается, что введение средства, ингибирующего MASP-2, такого как антитело MASP-2, будет эффективным для лечения пациентов с HUS и обеспечения защиты от микрососудистого свертывания, тромбоза и гемолиза, вызываемых инфекцией энтеропатическими E. coli или другими продуцирующими STX патогенами.
Хотя в настоящем описании показано для HUS, вызываемого STX, ожидается, что терапия против MASP-2 также будет полезной против HUS-подобных синдромов вследствие эндотелиального повреждения, вызываемого другими токсическими агентами. Они включают такие агенты, как митомицин, тиклопидин, цисплатин, хинин, циклоспорин, блеомицин, а также другие химиотерапевтические средства и иммунодепрессивные средства. Таким образом, ожидается, что терапия антителом против MASP-2 или другими средствами, которые ингибируют активность MASP-2, будет эффективно препятствовать или ограничивать свертывание, образование тромба и разрушение RBC, и будет предупреждать почечную недостаточность при HUS и других связанных с TMA заболеваний (т.е. aHUS и TTP).
У пациентов, страдающих HUS, часто имеется диарея и рвота, их количество тромбоцитов обычно является сниженным (тромбоцитопения) и количество RBC является сниженным (анемия). Фаза диареи перед HUS, как правило, длится в течение приблизительно четырех суток, в ходе которых у индивидуумов с риском развития HUS, как правило, проявляются один или несколько из следующих симптомов, в дополнение к тяжелой диарее: уровень гематокрита ниже 30% с признаками внутрисосудистого разрушения эритроцитов в мазке, тромбоцитопения (количество тромбоцитов <150×103/мм3) и/или присутствие нарушенной функции почек (концентрация креатинина в сыворотке превышает верхний предел нормального диапазона для данного возраста). Присутствие олигоурии (диурез ≤0,5 мл/кг/ч в течение >1 суток) может использоваться в качестве меры прогрессирования в направлении развития HUS (см. C. Hickey et al., Arch Pediatr Adolesc Med 165(10):884-889 (2011)). Как правило, проводят исследование присутствия инфекции бактериями видов E. coli (E.coli O157:H7), или Shigella или Salmonella. У индивидуума с положительными результатами тестов в отношении инфекции энтерогенными E. coli (например, E. coli 0157:H7), применение антибиотиков противопоказано, поскольку применение антибиотиков может увеличить риск развития HUS через увеличенную продукцию STX (См. Wong C. et al., N Engl J. Med 342:1930-1936 (2000). Для индивидуумов с положительными результатами тестов на Shigella или Salmonella, антибиотики, как правило, вводят для устранения инфекции. Другая общепринятая терапия HUS первой линии включает увеличение объема крови, диализ и плазмаферез.
В соответствии с вышесказанным, в некоторых вариантах осуществления для индивидуума, страдающего одним или несколькими симптомами, ассоциированными с фазой, предшествующей HUS, и имеющего риск развития HUS (т.е. индивидуум проявляет один или несколько из следующих: диарея, уровень гематокрита ниже 30% с признаками внутрисосудистого разрушения эритроцитов в мазке, тромбоцитопения (количество тромбоцитов <150×103/мм3), и/или присутствие нарушенной функции почек (концентрация креатинина в сыворотке превышает верхний предел нормального диапазона для данного возраста), предусматривается способ снижения риска развития HUS или уменьшения вероятности почечной недостаточности у индивидуума, включающий введение количества средства, ингибирующего MASP-2, в течение периода времени, эффективного для смягчения функции почек. В некоторых вариантах осуществления средство, ингибирующее MASP-2, вводят в течение периода времени, составляющего по меньшей мере одни, двое, трое, четверо или более суток, и введение можно повторять в соответствии с мнением врача до тех пор, пока состояние не разрешиться или не будет под контролем. В условиях до HUS средство, ингибирующее MASP-2, можно вводить индивидууму системно, как например, посредством внутриартериального, внутривенного, внутримышечного, ингаляционного, назального, подкожного или другого парентерального введения.
Лечение инфекции E. coli 0157:H7 бактерицидными антибиотиками, в частности, β-лактамами, ассоциировано с увеличенным риском развития HUS (Smith et al., Pediatr Infect Dis J 31(1):37-41 (2012). В некоторых вариантах осуществления в случае индивидуума, страдающего симптомами, ассоциированными с фазой, предшествующей HUS, где известно, что индивидуум имеет инфекцию энтерогенными E. coli, для которой применение антибиотиков противопоказано (например, E. coli 0157:H7), предусматривается способ снижения риска развития HUS или снижения вероятности почечной недостаточности у индивидуума, включающий введение некоторого количества средства, ингибирующего MASP-2, в течение первого периода времени, эффективного для ингибирования или предупреждения олигоурии у индивидуума (например, в течение по меньшей мере одних, двух, трех или четырех суток), где введение средства, ингибирующего MASP-2, в течение первого периода времени, происходит в отсутствие антибиотика. В некоторых вариантах осуществления способ дополнительно включает введение средства, ингибирующего MASP-2, индивидууму в комбинации с антибиотиком в течение второго периода времени (такого как по меньшей мере от одной до двух недель).
В других вариантах осуществления в случае индивидуума, страдающего симптомами, ассоциированными с фазой, предшествующей HUS, где известно, что индивидуум имеет инфекцию Shigella или Salmonella, предусматривается способ снижения риска развития HUS или снижения вероятности почечной недостаточности у индивидуума, включающий введение количества средства, ингибирующего MASP-2, в течение периода времени, эффективного для ингибирования или предупреждения присутствия олигоурии у индивидуума, где введение средства, ингибирующего MASP-2, осуществляют либо в присутствии, либо в отсутствие подходящего антибиотика.
В некоторых вариантах осуществления в случае первоначального диагноза HUS или у индивидуума, проявляющего один или несколько симптомов, согласующихся с диагнозом HUS (например, присутствие почечной недостаточности или микроангиопатической гемолитической анемии в отсутствие низкого содержания фибриногена или тромбоцитопении), индивидуума лечат эффективным количеством средства, ингибирующего MASP-2, (например, антитела против MASP-2) в качестве терапии первой линии в отсутствие плазмафереза, или в комбинации с плазмаферезом. В качестве терапии первой линии средство, ингибирующее MASP-2, можно вводить индивидууму системно, как например, посредством внутриартериального, внутривенного, внутримышечного, ингаляционного, назального, подкожного или другого парентерального введения. В некоторых вариантах осуществления средство, ингибирующее MASP-2, вводят индивидууму в качестве терапии первой линии в отсутствие плазмафереза во избежание потенциальных осложнений плазмафереза, включающих геморрагию, инфекцию и воздействие нарушений и/или аллергии, присущих донору плазмы, или в случае, когда индивидуум имеет противопоказания к плазмаферезу, или в случае, когда плазмаферез не доступен.
В некоторых вариантах осуществления способ включает введение средства, ингибирующего MASP-2, индивидууму, страдающему HUS, через катетер (например, внутривенно) в течение первого периода времени (например, острая фаза, длящаяся по меньшей мере от одних суток до одной недели или двух недель) с последующим введением средства, ингибирующего MASP-2, индивидууму подкожно в течение второго периода времени (например, длительная фаза из по меньшей мере двух недель или более). В некоторых вариантах осуществления введение в первый и/или второй период времени происходит в отсутствие плазмафереза. В некоторых вариантах осуществления способ дополнительно включает определение уровня по меньшей мере одного фактора комплемента (например, C3, C5) у индивидуума до лечения и необязательно в процессе лечения, где определение сниженного уровня по меньшей мере одного фактора комплемента по сравнению со стандартной величиной или здоровым контрольным индивидуумом указывает на необходимость в лечении, и где определение нормального уровня указывает на улучшение.
В некоторых вариантах осуществления способ включает введение средства, ингибирующего MASP-2, такого как антитело против MASP-2, индивидууму, страдающему или имеющему риск развития HUS либо подкожно, либо внутривенно. Лечение предпочтительно проводят путем введения каждые сутки, однако оно может быть нечастым вплоть до раза в неделю или раза в месяц. Лечение может продолжаться в течение по меньшей мере одной недели и вплоть до 3 месяцев. Антитело против MASP-2 можно вводить отдельно или в комбинации с ингибитором C5, таким как экулизумаб.
TTP:
Тромботическая тромбоцитопеническая пурпура (TTP) представляет собой угрожающее жизни нарушение системы свертывания крови, вызываемое аутоиммунными или наследственными дисфункциями, которые активируют каскад свертывания или систему комплемента (George, JN, N Engl J Med; 354:1927-35 (2006)). Это приводит к многочисленным микроскопическим сгусткам или тромбам в небольших кровеносных сосудах по всему организму. Эритроциты подвергаются сдвиговой нагрузке, которая повреждает их мембраны, что приводит к внутрисосудистому гемолизу. Сниженный в результате этого кровоток и повреждение эндотелия приводят к повреждению органов, включая головной мозг, сердце и почки. TTP клинически характеризуется тромбоцитопенией, микроангиопатической гемолитической анемией, неврологическими изменениями, почечной недостаточностью и лихорадкой. В эру до плазмообмена уровень смертности в ходе острых эпизодов составлял 90%. Даже после появления плазмообмена, выживаемость в течение шести месяцев составляет приблизительно 80%.
TTP может возникать в результате генетического или приобретенного ингибирования фермента ADAMTS-13 - металлопротеиназы, ответственной за расщепление больших мультимеров фактора Виллебранда (vWF) на меньшие элементы. Ингибирование или дефицит ADAMTS-13 в конечном итоге приводит к повышению свертываемости (Tsai, H. J Am Soc Nephrol 14: 1072-1081, (2003)). ADAMTS-13 регулирует активность vWF; в его отсутствие vWF формирует большие мультимеры, которые с большей вероятностью связывают тромбоциты и вызывают предрасположенность у пациентов к агрегации тромбоцитов и тромбозу в микрососудах.
Синдром Апшо-Шульмана (USS, также описываемый как врожденная TTP) представляет собой врожденный дефицит активности ADAMTS13 вследствие мутаций в гене ADAMTS13 (Schulman et al., Blood, 16(1):943-57, 1960; Upshaw et al., New Engl. J. Med, 298 (24):1350-2, 1978). У индивидуумов с врожденной TTP обнаружены многочисленные мутации в ADAMTS13 (Kinoshita et al., International Journal of Hematology, 74:101-108 (2001); Levy et al., Nature, 413 (6855):488-494 (2001); Kokame et al., PNAS 99(18):11902-11907 (2002); Savasan et al., Blood, 101:4449-4451 (2003); Matsumoto et al., Blood, 103:1305-1310 (2004) и Fujimura et al., Brit. J. Haemat 144:742-754 (2008)). Индивидуумы с USS, как правило, обладают активностью ADAMTS13, составляющей 5-10% от нормы (Kokame et al., PNAS 99(18):11902-11907, 2002). Хотя приобретенная TTP и USS имеют некоторые сходства, USS имеет некоторые важные отличия клинических признаков. USS обычно появляется в младенческом или детском возрасте и характеризуется тяжелой гипербилирубинемией с отрицательным тестом Кумбса вскоре после рождения, ответом на инфузию свежей плазмы и частыми рецидивами (Savasan et al., Blood, 101:4449-4451, 2003). В некоторых случаях, пациенты с врожденным дефицитом ADAMTS13 имеют мягкий фенотип при рождении, и симптомы, ассоциированные с TTP, развиваются у них только в клинических ситуациях с увеличенными уровнями фактора Виллебранда, такими как инфекция или беременность. Например, Fujimura et al. описали 9 японских женщин из 6 семей с генетически подтвержденным USS, у которых нарушение было диагностировано во время первой беременности. Тромбоцитопения возникала на втором и третьем семестрах при каждой из их 15 беременностей, после чего часто следовала TTP. У всех из этих женщин был обнаружен тяжелый дефицит активности ADAMTS13 (Fujimura et al., Brit. J. Haemat 144:742-754, 2008).
В соответствии с вышесказанным, в некоторых вариантах осуществления в случае индивидуума с синдромом Апшо-Шульмана (USS) (т.е. известно, что индивидуум имеет дефицит активности ADAMTS13 и/или известно, что индивидуум имеет одну или несколько мутацию(ий) в гене ADAMTS13), предусматривается способ снижения вероятности развития клинических симптомов, ассоциированных с врожденной TTP (например, тромбоцитопения, анемия, лихорадка и/или почечная недостаточность), включающий введение количества средства, ингибирующего MASP-2, (например, антитела против MASP-2) в течение периода времени, эффективного для смягчения или предупреждения одного или нескольких клинических симптомов, ассоциированных с TTP. В некоторых вариантах осуществления способ дополнительно включает стадию определения того, имеет ли индивидуум риск развития симптомов, ассоциированных с врожденной TTP, перед возникновением каких-либо симптомов, ассоциированных с TTP, или после возникновения по меньшей мере одного или нескольких симптомов, указывающих на TTP (например, наличие анемии, тромбоцитопении и/или почечной недостаточности). Определение того, имеет ли индивидуум риск развития симптомов, ассоциированных с врожденной TTP (т.е. индивидуум имеет USS), включает определение того, имеет ли индивидуум мутацию в гене, кодирующем ADAMTS13, и/или определение того, имеет ли индивидуум дефицит активности ADAMTS13, и/или определение того, имеет ли индивидуум USS в семейном анамнезе. Способы генетической оценки присутствия или отсутствия генетической мутации, ассоциированной с USS, являются общеизвестными, например см. Kinoshita et al., International Journal of Hematology, 74:101-108 (2001); Levy et al., Nature, 413 (6855):488-494 (2001); Kokame et al., PNAS 99(18):11902-11907 (2002); Savasan et al., Blood, 101:4449-4451 (2003); Matsumoto et al., Blood, 103:1305-1310 (2004) и Fujimura et al., Brit. J. Haemat 144:742-754 (2008).
В одном варианте осуществления предусматривается способ уменьшения вероятности того, что индивидуум, у которого диагностирован USS, будет иметь клинические симптомы, ассоциированные с TTP, включающий периодический мониторинг индивидуума для определения наличия или отсутствия анемии, тромбоцитопения или повышения уровня креатинина, и лечение средством, ингибирующим MASP-2, (например, антителом против MASP-2) при определении наличия анемии, тромбоцитопении или повышения уровня креатинина, или при наличии события, о котором известно, что оно ассоциировано с запуском клинических симптомов TTP, например, воздействия лекарственного средства (например, химиотерапия), инфекции (например бактериальная инфекция), злокачественной опухоли, травмы, трансплантата или беременности.
В другом варианте осуществления предусматривается способ лечения индивидуума с USS, страдающего от клинических симптомов, ассоциированных с TTP, включающий введение некоторого количества средства, ингибирующего MASP-2 (например, антитела против MASP-2), в течение периода времени, эффективного для смягчения или предупреждения одного или нескольких клинических симптомов, ассоциированных с TTP.
TTP также может развиваться вследствие аутоантител против ADAMTS-13. Кроме того, TTP может развиваться при раке молочной железы, желудочно-кишечного тракта или предстательной железы (George JN., Oncology (Williston Park). 25:908-14 (2011)), беременности (второй триместр или после родов), George JN., Curr Opin Hematol 10:339-344 (2003)), или она может быть ассоциирована с заболеваниями, такими как ВИЧ или аутоиммунные заболевания, такие как системный волчаночный эритематоз (Hamasaki K, et al., Clin Rheumatol.22:355-8 (2003)). TTP также может вызываться определенными медикаментозными терапиями, включающими гепарин, хинин, иммуноопосредованный ингредиент, химиотерапевтические средства против злокачественной опухоли (блеомицин, цисплатин, цитозин арабинозид, дауномицин гемцитабин, митомицин C и тамоксифен), циклоспорин A, пероральные контрацептивы, пенициллин, рифампин и антитромбоцитарные лекарственные средства, включающие тиклопидин и клопидогрел (Azarm, T. et al., J Res Med Sci., 16: 353-357 (2011)). Другими факторами или состояниями, ассоциированными с TTP, являются токсины, такие как пчелиный яд, сепсис, секвестрация селезенки, трансплантация, васкулит, сосудистая хирургия и инфекции, такие как Streptococcus pneumonia и цитомегаловирус (Moake JL., N Engl J Med., 347:589-600 (2002)). TTP вследствие временного функционального дефицита ADAMTS-13 может возникать в результате повреждения эндотелиальных клеток, ассоциированного с инфекцией S. pneumonia (Pediatr Nephrol., 26:631-5 (2011)).
Плазмообмен является стандартным способом лечения TTP (Rock GA, et al., N Engl J Med 325:393-397 (1991)). Плазмообмен заменяет активность ADAMTS-13 у пациентов с генетическими дефектами и устраняет аутоантитела ADAMTS-13 у пациентов с приобретенной аутоиммунной TTP (Tsai, H-M, Hematol Oncol Clin North Am., 21(4): 609-v (2007)). Часто к терапии добавляют дополнительные средства, такие как иммунодепрессивные лекарственные средства (George, JN, N Engl J Med, 354:1927-35 (2006)). Однако плазмообмен не является успешным приблизительно у 20% пациентов, более чем у трети пациентов возникает рецидив, и плазмаферез является дорогостоящим и технически трудным. Более того, многие пациенты не способны переносить плазмообмен. Следовательно, существует критическая потребность в дополнительных у усовершенствованных способах лечения TTP.
Поскольку TTP представляет собой нарушение каскада свертывания крови, лечение антагонистами системы комплемента может облегчать стабилизацию и коррекцию заболевания. Хотя патологическая активация альтернативного пути комплемента связана с aHUS, роль активации комплемента в TTP менее ясна. Функциональный дефицит ADAMTS13 является важным для предрасположенности к TTP, однако он не является достаточным, чтобы вызывать острые эпизоды. Факторы окружающей среды и/или другие генетические изменения могут вносить вклад в проявления TTP. Например, гены, кодирующие белки, вовлеченные в каскад свертывания, vWF, тромбоцитарную функцию, компоненты поверхности эндотелия сосудов или систему комплемента, могут быть вовлечены в развитие острой тромботической микроангиопатии (Galbusera, M. et al., Haematologica, 94: 166-170 (2009)). В частности, показано, что активация комплемента играет ключевую роль; показано, что сыворотка от пациента с тромботической микроангиопатией, ассоциированной с дефицитом ADAMTS-13, вызывает депонирование C3 и MAC и последующую активацию нейтрофилов, которую можно предотвратить инактивацией комплемента (Ruiz-Torres MP, et al., Thromb Haemost, 93:443-52 (2005)). Кроме того, недавно было показано, что в ходе острых эпизодов TTP возрастают уровни C4d, C3bBbP и C3a (M. Réti et al., J Thromb Haemost. Feb 28.(2012) doi: 10,1111/j.1538-7836.2012.04674.x. [Epub ahead of print]), что согласуется с активацией классического/лектинового и альтернативного путей. Этот увеличенный уровень активации комплемента при острых эпизодах может инициировать активацию терминального пути и может быть ответственным за дальнейшее обострение TTP.
Очевидно, что роль ADAMTS-13 и vWF в TTP ответственна за активацию и агрегацию тромбоцитов их последующую роль в сдвиговой нагрузке и депонировании при микроангиопатии. Активированные тромбоциты взаимодействуют с и запускают как классический, так и альтернативный пути комплемента. Опосредуемая тромбоцитами активация комплемента увеличивает уровни медиаторов воспаления C3a и C5a (Peerschke E et al., Mol Immunol, 47:2170-5 (2010)). Таким образом, тромбоциты могут выступать в качестве мишеней для активации классического пути комплемента при врожденной и аутоиммунной TTP.
Как описано выше, лектиновый путь комплемента посредством опосредуемой MASP-2 активации протромбина является преобладающим молекулярным каскадом, связывающим повреждение эндотелия со свертыванием и микрососудистым тромбозом, который происходит при HUS. Аналогично, активация лектинового пути комплемента может прямо запускать систему свертывания при TTP. Активация лектинового может инициироваться в ответ на первоначальное повреждение эндотелия, вызываемое дефицитом ADAMTS-13, при TTP. Таким образом, полагают, что ингибиторы лектинового пути, включая, но не ограничиваясь ими, антитела, которые блокируют функцию MASP-2, будут смягчать микроангиопатии, ассоциированные с микрососудистым свертыванием, тромбозом и гемолизом у пациентов, страдающих TTP.
Пациенты, страдающие TTP, как правило, находятся в отделении интенсивной терапии с одним или несколькими из следующих: пурпура, почечная недостаточность, низкий уровень тромбоцитов, анемия и/или тромбоз, включая инсульт. Современный стандарт лечения TTP вовлекает внутрикатетерное проведение (например, внутривенно или через другую форму катетера) заместительного плазмафереза в течение двух недель или более, как правило, три раза в неделю, но в плоть до каждых суток. Если индивидуум имеет положительные результаты теста на присутствие ингибитора ADAMTS13 (т.е. эндогенное антитело против ADAMTS13), тогда плазмаферез можно проводить в комбинации с иммунодепрессивной терапией (например, кортикостероиды, ритуксан или циклоспорин). Индивидуумы с рефрактерной TTP (приблизительно 20% пациентов с TTP) не отвечают на терапию плазмаферезом в течение по меньшей мере двух недель.
В соответствии с вышесказанным, в одном варианте осуществления в случае первоначального диагноза TTP или у индивидуума, проявляющего один или несколько симптомов, согласующихся с диагнозом TTP (например, вовлечение центральной нервной системы, тяжелая тромбоцитопения (количество тромбоцитов, меньшее или равное 5000/мкл без аспирина, меньшее или равное 20000/мкл с аспирином), тяжелое вовлечение сердечной системы, тяжелое вовлечение легочной системы, желудочно-кишечный инфаркт или гангрена), предусматривается способ лечения индивидуума эффективным количеством средства, ингибирующего MASP-2 (например, антитело против MASP-2) в качестве терапии первой линии в отсутствие плазмафереза, или в комбинации с плазмаферезом. В качестве терапии первой линии средство, ингибирующее MASP-2, можно вводить индивидууму системно, как например, посредством внутриартериального, внутривенного, внутримышечного, ингаляционного, назального, подкожного или другого парентерального введения. В некоторых вариантах осуществления средство, ингибирующее MASP-2, вводят индивидууму в качестве терапии первой линии в отсутствие плазмафереза во избежание потенциальных осложнений плазмафереза, включающих геморрагию, инфекцию и воздействие нарушений и/или аллергии, присущих донору плазмы, или в случае, когда индивидуум имеет противопоказания к плазмаферезу, или в случае, когда плазмаферез не доступен. В некоторых вариантах осуществления средство, ингибирующее MASP-2, вводят индивидууму, страдающему TTP, в комбинации (включая совместное введение) с иммунодепрессивным средством (например, кортикостероиды, ритуксан или циклоспорин) и/или в комбинации с концентрированным ADAMTS-13.
В некоторых вариантах осуществления способ включает введение средства, ингибирующего MASP-2, индивидууму, страдающему TTP, через катетер (например, внутривенно) в течение первого периода времени (например, острая фаза, длящаяся по меньшей мере от одних суток до одной недели или двух недель) с последующим введением средства, ингибирующего MASP-2, индивидууму подкожно в течение второго периода времени (например, длительная фаза из по меньшей мере двух недель или более). В некоторых вариантах осуществления введение в первый и/или второй период времени происходит в отсутствие плазмафереза. В некоторых вариантах осуществления способ используют для поддержания индивидуума, чтобы предупредить появление у индивидуума одного или нескольких симптомов, ассоциированных с TTP.
В другом варианте осуществления предусматривается способ лечения индивидуума, страдающего рефрактерной TTP (т.е. индивидуум, который не отвечает на терапию плазмаферезом в течение по меньшей мере двух недель), путем введения количества ингибитора MASP-2, эффективного для уменьшения одного или нескольких симптомов TTP. В одном варианте осуществления ингибитор MASP-2 (например, антитело против MASP-2) вводят индивидууму с рефрактерной TTP длительно в течение по меньшей мере двух недель или более посредством подкожного или другого парентерального введения. Введение можно повторять в соответствии с мнением врача до тех пор, пока состояние не разрешиться или не будет под контролем.
В некоторых вариантах осуществления способ дополнительно включает определение уровня по меньшей мере одного фактора комплемента (например, C3, C5) у индивидуума до лечения и необязательно в ходе лечения, где определение сниженного уровня по меньшей мере одного фактора комплемента по сравнению со стандартной величиной или здоровым контрольным индивидуумом указывает на необходимость в продолжении лечения средством, ингибирующим MASP-2.
В некоторых вариантах осуществления способ включает введение средства, ингибирующего MASP-2, такого как антитело против MASP-2, индивидууму, страдающему или имеющему риск развития TTP либо подкожно, либо внутривенно. Лечение предпочтительно проводят каждые сутки, но оно может быть и более редким вплоть до раза в две недели. Лечение продолжают до тех пор, пока количество тромбоцитов не будет превышать 150000/мл в течение по меньшей мере двух последовательных дней. Антитело против MASP-2 можно вводить отдельно или в комбинации с ингибитором C5, таким как экулизумаб.
В одном варианте осуществления ингибирующее MASP-2 антитело проявляет по меньшей мере одну или несколько из следующих характеристик: указанное антитело связывает MASP-2 человека с KD 10 нМ или менее, указанное антитело связывает эпитоп в домене CCP1 MASP-2, указанное антитело ингибирует депонирование C3b в анализе in vitro в 1% сыворотке человека с IC50 10 нМ или менее, указанное антитело ингибирует депонирование C3b в 90% сыворотке человека с IC50 30 нМ или менее, где антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fv, Fab, Fab', F(ab)2 и F(ab')2, где антитело представляет собой одноцепочечную молекулу, где указанное антитело представляет собой молекулу IgG2, где указанное антитело представляет собой молекулу IgG1, где указанное антитело представляет собой молекулу IgG4, где молекула IgG4 содержит мутацию S228P, и/или где антитело по существу не ингибирует классический путь. В одном варианте осуществления антитело связывается с MASP-2 и селективно ингибирует лектиновый путь и по существу не ингибирует альтернативный путь. В одном варианте осуществления антитело связывается с MASP-2 и селективно ингибирует лектиновый путь и по существу не ингибирует классический путь или альтернативный путь (т.е. ингибирует лектиновый путь, сохраняя классический и альтернативный пути комплемента интактными).
В одном варианте осуществления ингибирующее MASP-2 антитело ингибирует образование тромбов в сыворотке индивидуума, страдающего TTP по меньшей мере на 30%, как например, по меньшей мере на 40%, как например, по меньшей мере на 50%, как например, по меньшей мере на 60%, как например, по меньшей мере на 70%, как например, по меньшей мере на 80%; как например, по меньшей мере на 85%, как например, по меньшей мере на 90%, как например, по меньшей мере на от 95% вплоть до 99%, по сравнению с необработанной сывороткой. В некоторых вариантах осуществления ингибирующее MASP-2 антитело ингибирует образование тромбов в сыворотке индивидуума, страдающего TTP на уровне, по меньшей мере 20 процентов или более (как например, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%) превышающем ингибиторный эффект на депонирование C5b-9 в сыворотке.
В одном варианте осуществления ингибирующее MASP-2 антитело ингибирует образование тромбов в сыворотке от пациента с TTP по меньшей мере на 30%, как например, по меньшей мере на 40%, как например, по меньшей мере на 50%, как например, по меньшей мере на 60%, как например, по меньшей мере на 70%, как например, по меньшей мере на 80%, как например, по меньшей мере на 85%, как например, по меньшей мере на 90%, как например, по меньшей мере на от 95% вплоть до 99%, по сравнению с необработанной сывороткой.
В одном варианте осуществления ингибирующее MASP-2 антитело вводят индивидууму через внутривенный катетер или другой способ доставки через катетер.
В одном варианте осуществления изобретение относится к способу ингибирования образования тромбов у индивидуума, страдающего TTP, включающему введение индивидууму композиции, содержащей некоторое количество ингибирующего MASP-2 антитела или его антигенсвязывающего фрагмента, содержащих (I) (a) вариабельную область тяжелой цепи, содержащую: i) CDR-H1 тяжелой цепи, содержащую аминокислотную последовательность положений 31-35 SEQ ID NO:67; и ii) CDR-H2 тяжелой цепи, содержащую аминокислотную последовательность положений 50-65 SEQ ID NO:67; и iii) CDR-H3 тяжелой цепи, содержащую аминокислотную последовательность положений 95-102 SEQ ID NO:67 и b) вариабельную область легкой цепи, содержащую: i) CDR-L1 легкой цепи, содержащую аминокислотную последовательность положений 24-34 SEQ ID NO:70; и ii) CDR-L2 легкой цепи, содержащую аминокислотную последовательность положений 50-56 SEQ ID NO:70; и iii) CDR-L3 легкой цепи, содержащую аминокислотную последовательность положений 89-97 SEQ ID NO:70, или (II) их вариант, содержащий вариабельную область тяжелой цепи по меньшей мере с 90% идентичностью с SEQ ID NO:67 (например, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% идентичность с SEQ ID NO:67) и вариабельную область легкой цепи меньшей мере с 90% идентичностью (например, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% идентичность) с SEQ ID NO:70.
В некоторых вариантах осуществления способ включает введение индивидууму композиции, содержащей некоторое количество ингибирующего MASP-2 антитела или его антигенсвязывающего фрагмента, содержащих вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, указанную в качестве SEQ ID NO:67. В некоторых вариантах осуществления способ включает введение индивидууму композиции, содержащей некоторое количество ингибирующего MASP-2 антитела или его антигенсвязывающего фрагмента, содержащих вариабельную область легкой цепи, содержащую аминокислотную последовательность, указанную в качестве SEQ ID NO:70.
В некоторых вариантах осуществления способ включает введение индивидууму композиции, содержащей ингибирующее MASP-2 антитело или его антигенсвязывающий фрагмент, которые специфически распознают по меньшей мере часть эпитопа на MASP-2 человека, распознаваемого эталонным антителом OMS646, содержащим вариабельную область тяжелой цепи, как указано в SEQ ID NO:67, и вариабельную область легкой цепи, как указано в SEQ ID NO:70.
Болезнь Дегоса
Болезнь Дегоса, также известная как злокачественный атрофический папулез, представляет собой очень редкую форму TMA, поражающую эндотелий мелких сосудов кожи, желудочно-кишечного тракта и ЦНС. Эта васкулопатия вызывает окклюзию венул и артериол, что приводит к очагам повреждения на коже, ишемии кишечника и нарушениям ЦНС, включая инсульты, эпилепсию и когнитивные нарушения. В коже некроз соединительной ткани является результатом тромботической окклюзии мелких артерий. Однако причина болезни Дегоса неизвестна. Вовлечены васкулит, коагулопатия или первичная дисфункция эндотелиальных клеток. Болезнь Дегоса имеет 50% выживаемость, составляющую только от двух до трех лет. Отсутствует эффективный способ лечения болезни Дегоса, хотя для смягчения симптомов используют антитромбоцитарные лекарственные средства, антикоагулянты и иммунодепрессанты.
Хотя механизм болезни Дегоса неизвестен, каскад комплемента вовлечен в него. Margo et al., идентифицировали выраженные отложения C5b-9 в коже, желудочно-кишечном тракте и кровеносных сосудов четырех пациентов на терминальной стадии болезни Дегоса (Margo et al., Am J Clin Pathol 135(4):599-610, 2011). Экспериментальное лечение экулизумабом первоначально было эффективным для лечения повреждений кожи и кишечника, но не предупреждало прогрессирование заболевания (см. Garrett-Bakelman F. et al., "C5b-9 is a potential effector in the pathophysiology of Degos disease; a case report of treatment with eculizumab" (Abstract), Jerusalem: International Society of Hematology; 2010, Poster #156; и Polito J. et al, "Early detection of systemic Degos disease (DD) or malignant atrophic papulosis (MAP) may increase survival" (Abstract), San Antonio, TX: American College of Gastroenterology; 2010, Poster #1205).
Многие пациенты, страдающие болезнью Дегоса, имеют дефекты свертывания крови. Характерной чертой заболевания является тромботическая окклюзия мелких артерий в коже. Поскольку в это заболевание вовлечен путь комплемента, как описано в настоящем описании для других TMA, ожидается, что ингибиторы лектинового пути, включая, но не ограничиваясь ими, антитела, которые блокируют функцию MASP-2, будут полезными для лечения пациентов, страдающих болезнью Дегоса.
Таким образом, в другом варианте осуществления изобретение относится к способам лечения болезни Дегоса путем введения, композиции, содержащей терапевтически эффективное количество средства, ингибирующего MASP-2, такого как антитело против MASP-2, в фармацевтическом носителе индивидууму, страдающему болезнью Дегоса или состоянием, являющимся следствием болезни Дегоса. Средство, ингибирующее MASP-2, системно вводят индивидууму, страдающему болезнью Дегоса или состоянием, являющимся следствием болезни Дегоса, например, посредством внутриартериального, внутривенного, внутримышечного, ингаляционного, подкожного или другого парентерального введения, или потенциально посредством перорального введения для непептидергических средств. Антитело против MASP-2 можно вводить отдельно или в комбинации с ингибитором C5, таким как экулизумаб.
В одном варианте осуществления ингибирующее MASP-2 антитело обладает по меньшей мере одной из следующих характеристик: указанное антитело связывает MASP-2 человека с KD 10 нМ или менее, указанное антитело связывает эпитоп в домене CCP1 MASP-2, указанное антитело ингибирует депонирование C3b в анализе in vitro в 1% сыворотке человека с IC50 10 нМ или менее, указанное антитело ингибирует депонирование C3b в 90% сыворотке человека с IC50 30 нМ или менее, где антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fv, Fab, Fab', F(ab)2 и F(ab')2, где антитело представляет собой одноцепочечную молекулу, где указанное антитело представляет собой молекулу IgG2, где указанное антитело представляет собой молекулу IgG1, где указанное антитело представляет собой молекулу IgG4, где молекула IgG4 содержит мутацию S228P, и/или где антитело по существу не ингибирует классический путь. В одном варианте осуществления антитело связывается с MASP-2 и селективно ингибирует лектиновый путь и по существу не ингибирует альтернативный путь. В одном варианте осуществления антитело связывается с MASP-2 и селективно ингибирует лектиновый путь и по существу не ингибирует классический путь или альтернативный путь (т.е. ингибирует лектиновый путь, сохраняя классический и альтернативный пути комплемента интактными).
В одном варианте осуществления ингибирующее MASP-2 антитело ингибирует образование тромбов в сыворотке индивидуума, страдающего болезнью Дегоса, по меньшей мере на 30%, как например, по меньшей мере на 40%, как например, по меньшей мере на 50%, как например, по меньшей мере на 60%, как например, по меньшей мере на 70%, как например, по меньшей мере на 80%, как например, по меньшей мере на 85%, как например, по меньшей мере на 90%, как например, по меньшей мере на от 95% вплоть до 99%, по сравнению с необработанной сывороткой. В некоторых вариантах осуществления ингибирующее MASP-2 антитело ингибирует образование тромбов в сыворотке индивидуума, страдающего болезнью Дегоса на уровне, по меньшей мере на 20 процентов или более (как например, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%) превышающем ингибиторный эффект на депонирование C5b-9 в сыворотке.
В одном варианте осуществления ингибирующее MASP-2 антитело ингибирует образование тромбов в сыворотке от пациента с болезнью Дегоса по меньшей мере на 30%, как например, по меньшей мере на 40%, как например, по меньшей мере на 50%, как например, по меньшей мере на 60%, как например, по меньшей мере на 70%, как например, по меньшей мере на 80%, как например, по меньшей мере на 85%, как например, по меньшей мере на 90%, как например, по меньшей мере на от 95% вплоть до 99%, по сравнению с необработанной сывороткой.
В одном варианте осуществления ингибирующее MASP-2 антитело вводят индивидууму через внутривенный катетер или посредством другого способа доставки через катетер.
В одном варианте осуществления изобретение относится к способу ингибирования образования тромбов у индивидуума, страдающего болезнью Дегоса, включающему введение индивидууму композиции, содержащей некоторое количество ингибирующего MASP-2 антитела или его антигенсвязывающего фрагмента, содержащих (I) (a) вариабельную область тяжелой цепи, содержащую: i) CDR-H1 тяжелой цепи, содержащую аминокислотную последовательность положений 31-35 SEQ ID NO:67; и ii) CDR-H2 тяжелой цепи, содержащую аминокислотную последовательность положений 50-65 SEQ ID NO:67; и iii) CDR-H3 тяжелой цепи, содержащую аминокислотную последовательность положений 95-102 SEQ ID NO:67 и b) вариабельную область легкой цепи, содержащую: i) CDR-L1 легкой цепи, содержащую аминокислотную последовательность положений 24-34 SEQ ID NO:70; и ii) CDR-L2 легкой цепи, содержащую аминокислотную последовательность положений 50-56 SEQ ID NO:70; и iii) CDR-L3 легкой цепи, содержащую аминокислотную последовательность положений 89-97 SEQ ID NO:70, или (II) их вариант, содержащий вариабельную область тяжелой цепи по меньшей мере с 90% идентичностью с SEQ ID NO:67 (например, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% идентичность с SEQ ID NO:67) и вариабельную область легкой цепи меньшей мере с 90% идентичностью (например, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% идентичность) с SEQ ID NO:70.
В некоторых вариантах осуществления способ включает введение индивидууму композиции, содержащей некоторое количество ингибирующего MASP-2 антитела или его антигенсвязывающего фрагмента, содержащих вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, указанную в качестве SEQ ID NO:67. В некоторых вариантах осуществления способ включает введение индивидууму композиции, содержащей некоторое количество ингибирующего MASP-2 антитела или его антигенсвязывающего фрагмента, содержащих вариабельную область легкой цепи, содержащую аминокислотную последовательность, указанную в качестве SEQ ID NO:70.
Катастрофический антифосфолипидный синдром (CAPS)
Катастрофический антифосфолипидный синдром (CAPS) представляет собой самый тяжелый вариант синдрома антифосфолипидных антител (APLA). CAPS характеризуется венозным и артериальным тромбозом вследствие патогенных антител. CAPS представляет собой TMA с множественным тромбозом органов, ишемией и недостаточностью органов. Подобно другим TMA, характерна окклюзия мелких сосудов различных органов. При CAPS смертность является высокой, составляя приблизительно 50%, и часто он ассоциирован с инфекцией или травмой. Пациенты имеют антифосфолипидные антитела, как правило, IgG.
Клинически, CAPS вовлекает по меньшей мере три органа или ткани с гистопатологическими признаками окклюзии мелких сосудов. Периферический тромбоз может вовлекать вены и артерии в ЦНС, сердечно-сосудистой, почечной или легочной системах. Пациентов лечат антибиотиками, антикоагулянтами, кортикостероидам, плазмообменом и внутривенным иммуноглобулином. Тем не менее, может наступить смерть в результате полиорганной недостаточности.
Путь комплемента вовлечен в CAPS. Например, исследования моделей на животных указывают на то, что ингибирование комплемента может быть эффективным средством предупреждения тромбоза, ассоциированного с CAPS (Shapira L. et al., Arthritis Rheum 64(8):2719-23, 2012). Более того, как далее описано Shapira et al., введение экулизумаба индивидууму, страдающему CAPS, в дозах, которые блокировали путь комплемента, прерывало острые прогрессирующие тромботические события и обращало вспять тромбоцитопению (также см. Lim W., Curr Opin Hematol 18(5):361-5, 2011). Таким образом, как описано в настоящем описании для других TMA, ожидается, что ингибиторы лектинового пути, включая, но не ограничиваясь ими, антитела, которые блокируют функцию MASP-2, будут полезными для лечения пациентов, страдающих CAPS.
Таким образом, в другом варианте осуществления изобретение относится к способам лечения CAPS путем введения композиции, содержащей терапевтически эффективное количество средства, ингибирующего MASP-2, такого как антитело против MASP-2, в фармацевтическом носителе индивидууму, страдающему CAPS или состоянием, являющимся следствием CAPS. Средство, ингибирующее MASP-2, системно вводят индивидууму, страдающему CAPS или состоянием, являющимся следствием CAPS, например, посредством внутриартериального, внутривенного, внутримышечного, ингаляционного, подкожного или другого парентерального введения, или потенциально посредством перорального введения для непептидергических средств. Антитело против MASP-2 можно вводить отдельно или в комбинации с ингибитором C5, таким как экулизумаб.
В одном варианте осуществления ингибирующее антитело против MASP-2 обладает по меньшей мере одной из следующих характеристик: указанное антитело связывает MASP-2 человека с KD 10 нМ или менее, указанное антитело связывает эпитоп в домене CCP1 MASP-2, указанное антитело ингибирует депонирование C3b в анализе in vitro в 1% сыворотке человека с IC50 10 нМ или менее, указанное антитело ингибирует депонирование C3b в 90% сыворотке человека с IC50 30 нМ или менее, где антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fv, Fab, Fab', F(ab)2 и F(ab')2, где антитело представляет собой одноцепочечную молекулу, где указанное антитело представляет собой молекулу IgG2, где указанное антитело представляет собой молекулу IgG1, где указанное антитело представляет собой молекулу IgG4, где молекула IgG4 содержит мутацию S228P, и/или где антитело по существу не ингибирует классический путь. В одном варианте осуществления антитело связывается с MASP-2 и селективно ингибирует лектиновый путь и по существу не ингибирует альтернативный путь. В одном варианте осуществления антитело связывается с MASP-2 и селективно ингибирует лектиновый путь и по существу не ингибирует классический путь или альтернативный путь (т.е. ингибирует лектиновый путь, сохраняя классический и альтернативный пути комплемента интактными).
В одном варианте осуществления ингибирующее MASP-2 антитело ингибирует образование тромбов в сыворотке индивидуума, страдающего CAPS по меньшей мере на 30%, как например, по меньшей мере на 40%, как например, по меньшей мере на 50%, как например, по меньшей мере на 60%, как например, по меньшей мере на 70%, как например, по меньшей мере на 80%, как например, по меньшей мере на 85%, как например, по меньшей мере на 90%, как например, по меньшей мере на от 95% вплоть до 99%, по сравнению с необработанной сывороткой. В некоторых вариантах осуществления ингибирующее MASP-2 антитело ингибирует образование тромбов в сыворотке индивидуума, страдающего CAPS на уровне по меньшей мере 20 процентов или более (как например, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%) превышающем ингибиторный эффект на депонирование C5b-9 в сыворотке.
В одном варианте осуществления ингибирующее MASP-2 антитело ингибирует образование тромбов в сыворотке от пациента CAPS по меньшей мере на 30%, как например, по меньшей мере на 40%, как например, по меньшей мере на 50%, как например, по меньшей мере на 60%, как например, по меньшей мере на 70%, как например, по меньшей мере на 80%, как например, по меньшей мере на 85%, как например, по меньшей мере на 90%, как например, по меньшей мере на от 95% вплоть до 99%, по сравнению с необработанной сывороткой.
В одном варианте осуществления ингибирующее MASP-2 антитело вводят индивидууму через внутривенный катетер или посредством другого способа доставки через катетер.
В одном варианте осуществления изобретение относится к способу ингибирования образования тромбов у индивидуума, страдающего CAPS включающему введение индивидууму композиции, содержащей некоторое количество ингибирующего MASP-2 антитела или его антигенсвязывающего фрагмента, содержащих (I) (a) вариабельную область тяжелой цепи, содержащую: i) CDR-H1 тяжелой цепи, содержащую аминокислотную последовательность положений 31-35 SEQ ID NO:67; и ii) CDR-H2 тяжелой цепи, содержащую аминокислотную последовательность положений 50-65 SEQ ID NO:67; и iii) CDR-H3 тяжелой цепи, содержащую аминокислотную последовательность положений 95-102 SEQ ID NO:67 и b) вариабельную область легкой цепи, содержащую: i) CDR-L1 легкой цепи, содержащую аминокислотную последовательность положений 24-34 SEQ ID NO:70; и ii) CDR-L2 легкой цепи, содержащую аминокислотную последовательность положений 50-56 SEQ ID NO:70; и iii) CDR-L3 легкой цепи, содержащую аминокислотную последовательность положений 89-97 SEQ ID NO:70, или (II) их вариант, содержащий вариабельную область тяжелой цепи по меньшей мере с 90% идентичностью с SEQ ID NO:67 (например, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% идентичность с SEQ ID NO:67) и вариабельную область легкой цепи меньшей мере с 90% идентичностью (например, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% идентичность) с SEQ ID NO:70.
В некоторых вариантах осуществления способ включает введение индивидууму композиции, содержащей некоторое количество ингибирующего MASP-2 антитела или его антигенсвязывающего фрагмента, содержащих вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, указанную в качестве SEQ ID NO:67. В некоторых вариантах осуществления способ включает введение индивидууму композиции, содержащей некоторое количество ингибирующего MASP-2 антитела или его антигенсвязывающего фрагмента, содержащих вариабельную область легкой цепи, содержащую аминокислотную последовательность, указанную в качестве SEQ ID NO:70.
В некоторых вариантах осуществления способ включает введение индивидууму композиции, содержащей ингибирующее MASP-2 антитело или его антигенсвязывающий фрагмент, которые специфически распознают по меньшей мере часть эпитопа на MASP-2 человека, распознаваемого эталонным антителом OMS646, содержащим вариабельную область тяжелой цепи, как указано в SEQ ID NO:67, и вариабельную область легкой цепи, как указано в SEQ ID NO:70.
TMA на фоне злокачественной опухоли
Системная злокачественная опухоль любого типа может приводить к клиническим и патологическим проявлениям TMA (см. например, Batts and Lazarus, Bone Marrow Transplantation 40:709-719, 2007). Ассоциированная со злокачественной опухолью TMA часто встречается в легких и, по-видимому, ассоциирована с опухолевыми эмболами (Francis KK et al., Commun Oncol 2:339-43, 2005). Опухолевые эмболы могут снижать кровоток и, таким образом, приводить к состоянию гипоперфузии в пораженных артериолах и венулах. Полагают, что стресс и повреждение тканей в результате этого активируют лектиновый путь комплемента локализованным образом. Активированный лектиновый путь в свою очередь может активировать каскад свертывания через MASP-2-зависимое расщепление протромбина на тробмин, что приводит к протромботическому состоянию, характерному для TMA. Полагают, что ингибирование MASP-2 в этих условиях снизит локализованную активацию тромбина и, тем самым, смягчит протромботическое состояние.
Таким образом, как описано в настоящем описании для других TMA, ожидается, что ингибиторы лектинового пути, включая, но не ограничиваясь ими, антитела, которые блокируют функцию MASP-2, будут полезными для лечения пациентов, страдающих TMA на фоне злокачественной опухоли.
Таким образом, в другом варианте осуществления изобретение относится к способам лечения или предупреждения TMA на фоне злокачественной опухоли путем введения композиции, содержащей терапевтически эффективное количество средства, ингибирующего MASP-2, такого как антитело против MASP-2, в фармацевтическом носителе индивидууму, страдающему или имеющему риск развития TMA на фоне злокачественной опухоли. Средство, ингибирующее MASP-2, системно вводят индивидууму, страдающему или имеющему риск развития TMA на фоне злокачественной опухоли, например, посредством внутриартериального, внутривенного, внутримышечного, ингаляционного, подкожного или другого парентерального введения, или потенциально посредством перорального введения для непептидергических средств. Антитело против MASP-2 можно вводить отдельно или в комбинации с ингибитором C5, таким как экулизумаб.
В одном варианте осуществления ингибирующее MASP-2 антитело обладает по меньшей мере одной из следующих характеристик: указанное антитело связывает MASP-2 человека с KD 10 нМ или менее, указанное антитело связывает эпитоп в домене CCP1 MASP-2, указанное антитело ингибирует депонирование C3b в анализе in vitro в 1% сыворотке человека с IC50 10 нМ или менее, указанное антитело ингибирует депонирование C3b в 90% сыворотке человека с IC50 30 нМ или менее, где антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fv, Fab, Fab', F(ab)2 и F(ab')2, где антитело представляет собой одноцепочечную молекулу, где указанное антитело представляет собой молекулу IgG2, где указанное антитело представляет собой молекулу IgG1, где указанное антитело представляет собой молекулу IgG4, где молекула IgG4 содержит мутацию S228P, и/или где антитело по существу не ингибирует классический путь. В одном варианте осуществления антитело связывается с MASP-2 и селективно ингибирует лектиновый путь и по существу не ингибирует альтернативный путь. В одном варианте осуществления антитело связывается с MASP-2 и селективно ингибирует лектиновый путь и по существу не ингибирует классический путь или альтернативный путь (т.е. ингибирует лектиновый путь, сохраняя классический и альтернативный пути комплемента интактными).
В одном варианте осуществления ингибирующее MASP-2 антитело ингибирует образование тромбов в сыворотке индивидуума, страдающего TMA на фоне злокачественной опухоли по меньшей мере на 30%, как например, по меньшей мере на 40%, как например, по меньшей мере на 50%, как например, по меньшей мере на 60%, как например, по меньшей мере на 70%, как например, по меньшей мере на 80%, как например, по меньшей мере на 85%, как например, по меньшей мере на 90%, как например, по меньшей мере на от 95% вплоть до 99%, по сравнению с необработанной сывороткой.
В одном варианте осуществления ингибирующее MASP-2 антитело ингибирует образование тромбов в сыворотке от пациента, страдающего TMA на фоне злокачественной опухоли по меньшей мере на 30%, как например, по меньшей мере на 40%, как например, по меньшей мере на 50%, как например, по меньшей мере на 60%, как например, по меньшей мере на 70%, как например, по меньшей мере на 80%, как например, по меньшей мере на 85%, как например, по меньшей мере на 90%, как например, по меньшей мере на от 95% вплоть до 99%, по сравнению с необработанной сывороткой.
В одном варианте осуществления ингибирующее MASP-2 антитело вводят индивидууму через внутривенный катетер или посредством другого способа доставки через катетер.
В одном варианте осуществления изобретение относится к способу ингибирования образования тромбов у индивидуума, страдающего TMA на фоне злокачественной опухоли включающему введение индивидууму композиции, содержащей некоторое количество ингибирующего MASP-2 антитела или его антигенсвязывающего фрагмента, содержащих (I) (a) вариабельную область тяжелой цепи, содержащую: i) CDR-H1 тяжелой цепи, содержащую аминокислотную последовательность положений 31-35 SEQ ID NO:67; и ii) CDR-H2 тяжелой цепи, содержащую аминокислотную последовательность положений 50-65 SEQ ID NO:67; и iii) CDR-H3 тяжелой цепи, содержащую аминокислотную последовательность положений 95-102 SEQ ID NO:67 и b) вариабельную область легкой цепи, содержащую: i) CDR-L1 легкой цепи, содержащую аминокислотную последовательность положений 24-34 SEQ ID NO:70; и ii) CDR-L2 легкой цепи, содержащую аминокислотную последовательность положений 50-56 SEQ ID NO:70; и iii) CDR-L3 легкой цепи, содержащую аминокислотную последовательность положений 89-97 SEQ ID NO:70, или (II) их вариант, содержащий вариабельную область тяжелой цепи по меньшей мере с 90% идентичностью с SEQ ID NO:67 (например, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% идентичность с SEQ ID NO:67) и вариабельную область легкой цепи меньшей мере с 90% идентичностью (например, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% идентичность) с SEQ ID NO:70.
В некоторых вариантах осуществления способ включает введение индивидууму композиции, содержащей некоторое количество ингибирующего MASP-2 антитела или его антигенсвязывающего фрагмента, содержащих вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, указанную в качестве SEQ ID NO:67. В некоторых вариантах осуществления способ включает введение индивидууму композиции, содержащей некоторое количество ингибирующего MASP-2 антитела или его антигенсвязывающего фрагмента, содержащих вариабельную область легкой цепи, содержащую аминокислотную последовательность, указанную в качестве SEQ ID NO:70.
В некоторых вариантах осуществления способ включает введение индивидууму композиции, содержащей ингибирующее MASP-2 антитело или его антигенсвязывающий фрагмент, которые специфически распознают по меньшей мере часть эпитопа на MASP-2 человека, распознаваемого эталонным антителом OMS646, содержащим вариабельную область тяжелой цепи, как указано в SEQ ID NO:67, и вариабельную область легкой цепи, как указано в SEQ ID NO:70.
TMA на фоне химиотерапии злокачественной опухоли
Обусловленная химиотерапией TMA представляет собой состояние, вовлекающее тромбоцитопению, микроангиопатическую гемолитическую анемию и дисфункцию почек, которая развивается у 2-10% пациентов со злокачественными новообразованиями в анамнезе, которых лечили химиотерапевтическими средствами, такими как гемцитабин, митомицин, оксалиплатин и другие. Ассоциированная с химиотерапией TMA ассоциирована с плохими клиническими исходами с высокой смертностью (см., например, Blake-Haskins et al., Clin Cancer Res 17(18):5858-5866, 2011).
Полагают, что обусловленная химиотерапией TMA охватывает неспецифическое токсическое повреждение эндотелия микрососудов. прямое повреждение эндотелиальных клеток было показано в модели индуцируемой митомицином TMA на животных (Dlott J. et al., Ther Apher Dial 8:102-11, 2004). Показано, что повреждение эндотелиальных клеток через различные механизмы активирует лектиновый путь комплемента. Например, Stahl et al. показали, что эндотелиальные клетки, подвергнутые окислительному стрессу, активируют лектиновый путь комплемента как in vitro, так и in vivo (Collard et al., Am J Pathol. 156(5):1549-56, 2000; La Bonte et al, J Immunol. 15;188(2):885-91, 2012). In vivo этот процесс приводит к тромбозу и показано, что ингибирование лектинового пути препятствует тромбозу (La Bonte et al. J Immunol. 15;188(2):885-91, 2012). Кроме того, как продемонстрировано в примерах 37-39 настоящего описания, в модели TMA на мышах, в которой использовали локализованное фотовозбуждение FITC-Dex для индукции локализованного повреждения микрососудов с последующим развитием ответа TMA, авторы настоящего изобретения показали, что ингибирование MASP-2 может препятствовать TMA. Таким образом, повреждение эндотелия микрососудов химиотерапевтическими средствами может активировать лектиновый путь комплемента, который затем создает локализованное протромботическое состояние и стимулирует ответ TMA. Поскольку активация лектинового пути и создание протромботического состояния являются MASP-2-зависимыми, полагают, что ингибиторы MASP-2, включая, но не ограничиваясь ими, антитела, которые блокируют функцию MASP-2, будут смягчать ответ TMA и снижать риск обусловленной химиотерапией TMA.
Таким образом, в другом варианте осуществления изобретение относится к способам лечения или предупреждения TMA на фоне химиотерапии путем введения композиции, содержащей терапевтически эффективное количество средства, ингибирующего MASP-2, такого как антитело против MASP-2, в фармацевтическом носителе индивидууму, страдающему или имеющему риск развития TMA на фоне химиотерапии. Средство, ингибирующее MASP-2, вводят системно индивидууму, который подвергался, или подвергается, или будет подвергаться химиотерапии, как например, посредством внутриартериального, внутривенного, внутримышечного, ингаляционного, подкожного или другого парентерального введения, или потенциально путем перорального введения для непептидергических средств. Антитело против MASP-2 можно вводить отдельно или в комбинации с ингибитором C5, таким как экулизумаб.
В одном варианте осуществления ингибирующее MASP-2 антитело обладает по меньшей мере одной из следующих характеристик: указанное антитело связывает MASP-2 человека с KD 10 нМ или менее, указанное антитело связывает эпитоп в домене CCP1 MASP-2, указанное антитело ингибирует депонирование C3b в анализе in vitro в 1% сыворотке человека с IC50 10 нМ или менее, указанное антитело ингибирует депонирование C3b в 90% сыворотке человека с IC50 30 нМ или менее, где антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fv, Fab, Fab', F(ab)2 и F(ab')2, где антитело представляет собой одноцепочечную молекулу, где указанное антитело представляет собой молекулу IgG2, где указанное антитело представляет собой молекулу IgG1, где указанное антитело представляет собой молекулу IgG4, где молекула IgG4 содержит мутацию S228P, и/или где антитело по существу не ингибирует классический путь. В одном варианте осуществления антитело связывается с MASP-2 и селективно ингибирует лектиновый путь и по существу не ингибирует альтернативный путь. В одном варианте осуществления антитело связывается с MASP-2 и селективно ингибирует лектиновый путь и по существу не ингибирует классический путь или альтернативный путь (т.е. ингибирует лектиновый путь, сохраняя классический и альтернативный пути комплемента интактными).
В одном варианте осуществления ингибирующее MASP-2 антитело ингибирует образование тромбов в сыворотке индивидуума, страдающего TMA на фоне злокачественной опухоли, по меньшей мере на 30%, как например, по меньшей мере на 40%, как например, по меньшей мере на 50%, как например, по меньшей мере на 60%, как например, по меньшей мере на 70%, как например, по меньшей мере на 80%, как например, по меньшей мере на 85%, как например, по меньшей мере на 90%, как например, по меньшей мере на от 95% вплоть до 99%, по сравнению с необработанной сывороткой.
В одном варианте осуществления ингибирующее MASP-2 антитело ингибирует образование тромбов в сыворотке пациента, страдающего TMA на фоне химиотерапии злокачественной опухоли по меньшей мере на 30%, как например, по меньшей мере на 40%, как например, по меньшей мере на 50%, как например, по меньшей мере на 60%, как например, по меньшей мере на 70%, как например, по меньшей мере на 80%, как например, по меньшей мере на 85%, как например, по меньшей мере на 90%, как например, по меньшей мере на от 95% вплоть до 99%, по сравнению с необработанной сывороткой.
В одном варианте осуществления ингибирующее MASP-2 антитело вводят индивидууму через внутривенный катетер или посредством другого способа доставки через катетер.
В одном варианте осуществления изобретение относится к способу ингибирования образования тромбов у индивидуума, страдающего TMA на фоне химиотерапии злокачественной опухоли, включающему введение индивидууму композиции, содержащей некоторое количество ингибирующего MASP-2 антитела или его антигенсвязывающего фрагмента, содержащих (I) (a) вариабельную область тяжелой цепи, содержащую: i) CDR-H1 тяжелой цепи, содержащую аминокислотную последовательность положений 31-35 SEQ ID NO:67; и ii) CDR-H2 тяжелой цепи, содержащую аминокислотную последовательность положений 50-65 SEQ ID NO:67; и iii) CDR-H3 тяжелой цепи, содержащую аминокислотную последовательность положений 95-102 SEQ ID NO:67 и b) вариабельную область легкой цепи, содержащую: i) CDR-L1 легкой цепи, содержащую аминокислотную последовательность положений 24-34 SEQ ID NO:70; и ii) CDR-L2 легкой цепи, содержащую аминокислотную последовательность положений 50-56 SEQ ID NO:70; и iii) CDR-L3 легкой цепи, содержащую аминокислотную последовательность положений 89-97 SEQ ID NO:70, или (II) их вариант, содержащий вариабельную область тяжелой цепи по меньшей мере с 90% идентичностью с SEQ ID NO:67 (например, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% идентичность с SEQ ID NO:67) и вариабельную область легкой цепи меньшей мере с 90% идентичностью (например, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% идентичность) с SEQ ID NO:70.
В некоторых вариантах осуществления способ включает введение индивидууму композиции, содержащей некоторое количество ингибирующего MASP-2 антитела или его антигенсвязывающего фрагмента, содержащих вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, указанную в качестве SEQ ID NO:67. В некоторых вариантах осуществления способ включает введение индивидууму композиции, содержащей некоторое количество ингибирующего MASP-2 антитела или его антигенсвязывающего фрагмента, содержащих вариабельную область легкой цепи, содержащую аминокислотную последовательность, указанную в качестве SEQ ID NO:70.
В некоторых вариантах осуществления способ включает введение индивидууму композиции, содержащей ингибирующее MASP-2 антитело или его антигенсвязывающий фрагмент, которые специфически распознают по меньшей мере часть эпитопа на MASP-2 человека, распознаваемого эталонным антителом OMS646, содержащим вариабельную область тяжелой цепи, как указано в SEQ ID NO:67, и вариабельную область легкой цепи, как указано в SEQ ID NO:70.
TMA на фоне трансплантации
Обусловленная трансплантацией TMA (TA-TMA) представляет собой истощающий синдром, который может возникать у пациентов после трансплантации, таких как реципиенты аллогенного трансплантата гемопоэтических стволовых клеток (см. например, Batts and Lazarus, Bone Marrow Transplantation 40:709-719, 2007). Патогенез этого состояния малопонятен, однако, вероятно, вовлекает совокупность ответов, которые завершаются повреждением эндотелиальных клеток (Laskin B.L. et al., Blood 118(6):1452-62, 2011). Как рассмотрено выше, повреждение эндотелиальных клеток является прототипным стимулом для активации лектинового пути и формирования протромботического окружения.
Последние данные далее подтверждают роль активации комплемента через лектиновый путь в патогенезе TA-TMA. Laskin et al., продемонстрировали, что депонирование C4d в артериолах почек было значительно более распространено у индивидуумов с гистологической TA-TMA (75%) по сравнению с контролями (8%) (Laskin B.L., et al., Transplantation, 27; 96(2):217-23, 2013). Таким образом, C4d может быть патологическим маркером TA-TMA, вовлекающим локализованную фиксацию комплемента через лектиновый или классический путь.
Поскольку активация лектинового пути и создание протромботического состояния зависят от MASP-2, ожидается, что ингибиторы MASP-2, включая, но не ограничиваясь ими, антитела, которые блокируют функцию MASP-2, будут смягчать ответ TMA и снижать риск обусловленной трансплантацией TMA (TA-TMA).
Таким образом, в другом варианте осуществления изобретение относится к способам лечения или предупреждения TMA на фоне трансплантации путем введения композиции, содержащей терапевтически эффективное количество средства, ингибирующего MASP-2, такого как антитело против MASP-2, в фармацевтическом носителе индивидууму, страдающему или имеющему риск развития TMA на фоне трансплантации. Средство, ингибирующее MASP-2, системно вводят индивидууму, который подвергался, подвергается или будет подвергаться процедуре трансплантации, например, посредством внутриартериального, внутривенного, внутримышечного, ингаляционного, подкожного или другого парентерального введения, или потенциально посредством перорального введения для непептидергических средств. Антитело против MASP-2 можно вводить отдельно или в комбинации с ингибитором C5, таким как экулизумаб. В некоторых вариантах осуществления изобретение относится к способам лечения или предупреждения TMA на фоне трансплантации аллогенных стволовых клеток, включающим введение композиции, содержащей некоторое количество средства, ингибирующего MASP-2, такого как ингибирующее MASP-2 антитело, индивидууму до, в процессе или после трансплантации аллогенных стволовых клеток.
В одном варианте осуществления ингибирующее MASP-2 антитело обладает по меньшей мере одной из следующих характеристик: указанное антитело связывает MASP-2 человека с KD 10 нМ или менее, указанное антитело связывает эпитоп в домене CCP1 MASP-2, указанное антитело ингибирует депонирование C3b в анализе in vitro в 1% сыворотке человека с IC50 10 нМ или менее, указанное антитело ингибирует депонирование C3b в 90% сыворотке человека с IC50 30 нМ или менее, где антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fv, Fab, Fab', F(ab)2 и F(ab')2, где антитело представляет собой одноцепочечную молекулу, где указанное антитело представляет собой молекулу IgG2, где указанное антитело представляет собой молекулу IgG1, где указанное антитело представляет собой молекулу IgG4, где молекула IgG4 содержит мутацию S228P, и/или где антитело по существу не ингибирует классический путь. В одном варианте осуществления антитело связывается с MASP-2 и селективно ингибирует лектиновый путь и по существу не ингибирует альтернативный путь. В одном варианте осуществления антитело связывается с MASP-2 и селективно ингибирует лектиновый путь и по существу не ингибирует классический путь или альтернативный путь (т.е. ингибирует лектиновый путь, сохраняя классический и альтернативный пути комплемента интактными).
В одном варианте осуществления ингибирующее MASP-2 антитело ингибирует образование тромбов в сыворотке индивидуума, страдающего TMA на фоне трансплантации, по меньшей мере на 30%, как например, по меньшей мере на 40%, как например, по меньшей мере на 50%, как например, по меньшей мере на 60%, как например, по меньшей мере на 70%, как например, по меньшей мере на 80%, как например, по меньшей мере на 85%, как например, по меньшей мере на 90%, как например, по меньшей мере на от 95% вплоть до 99%, по сравнению с необработанной сывороткой.
В одном варианте осуществления ингибирующее MASP-2 антитело ингибирует образование тромбов в сыворотке от пациента, страдающего TMA на фоне трансплантации, по меньшей мере на 30%, как например, по меньшей мере на 40%, как например, по меньшей мере на 50%, как например, по меньшей мере на 60%, как например, по меньшей мере на 70%, как например, по меньшей мере на 80%, как например, по меньшей мере на 85%, как например, по меньшей мере на 90%, как например, по меньшей мере на от 95% вплоть до 99%, по сравнению с необработанной сывороткой.
В одном варианте осуществления ингибирующее MASP-2 антитело вводят индивидууму через внутривенный катетер или посредством другого способа доставки через катетер.
В одном варианте осуществления изобретение относится к способу ингибирования образования тромбов у индивидуума, страдающего TMA на фоне трансплантации, включающему введение индивидууму композиции, содержащей некоторое количество ингибирующего MASP-2 антитела или его антигенсвязывающего фрагмента, содержащих (I) (a) вариабельную область тяжелой цепи, содержащую: i) CDR-H1 тяжелой цепи, содержащую аминокислотную последовательность положений 31-35 SEQ ID NO:67; и ii) CDR-H2 тяжелой цепи, содержащую аминокислотную последовательность положений 50-65 SEQ ID NO:67; и iii) CDR-H3 тяжелой цепи, содержащую аминокислотную последовательность положений 95-102 SEQ ID NO:67 и b) вариабельную область легкой цепи, содержащую: i) CDR-L1 легкой цепи, содержащую аминокислотную последовательность положений 24-34 SEQ ID NO:70; и ii) CDR-L2 легкой цепи, содержащую аминокислотную последовательность положений 50-56 SEQ ID NO:70; и iii) CDR-L3 легкой цепи, содержащую аминокислотную последовательность положений 89-97 SEQ ID NO:70, или (II) их вариант, содержащий вариабельную область тяжелой цепи по меньшей мере с 90% идентичностью с SEQ ID NO:67 (например, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% идентичность с SEQ ID NO:67) и вариабельную область легкой цепи меньшей мере с 90% идентичностью (например, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% идентичность) с SEQ ID NO:70.
В некоторых вариантах осуществления способ включает введение индивидууму композиции, содержащей некоторое количество ингибирующего MASP-2 антитела или его антигенсвязывающего фрагмента, содержащих вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, указанную в качестве SEQ ID NO:67. В некоторых вариантах осуществления способ включает введение индивидууму композиции, содержащей некоторое количество ингибирующего MASP-2 антитела или его антигенсвязывающего фрагмента, содержащих вариабельную область легкой цепи, содержащую аминокислотную последовательность, указанную в качестве SEQ ID NO:70.
В некоторых вариантах осуществления способ включает введение индивидууму композиции, содержащей ингибирующее MASP-2 антитело или его антигенсвязывающий фрагмент, которые специфически распознают по меньшей мере часть эпитопа на MASP-2 человека, распознаваемого эталонным антителом OMS646, содержащим вариабельную область тяжелой цепи, как указано в SEQ ID NO:67, и вариабельную область легкой цепи, как указано в SEQ ID NO:70.
IV. РОЛЬ MASP-2 В ДРУГИХ ЗАБОЛЕВАНИЯХ И СОСТОЯНИЯХ И ТЕРАПЕВТИЧЕСКИХ СПОСОБАХ С ИСПОЛЬЗОВАНИЕМ СРЕДСТВ, ИНГИБИРУЮЩИХ MASP-2
ПОЧЕЧНЫЕ СОСТОЯНИЯ
Активация системы комплемента вовлечена в патогенез широкого множества почечных заболеваний; включая мезангиопролиферативный гломерулонефрит (IgA-нефропатия, болезнь Бергера) (Endo, M., et al., Clin. Nephrology 55:185-191, 2001), мембранозный гломерулонефрит (Kerjashki, D., Arch B Cell Pathol. 58:253-71, 1990; Brenchley, P.E., et al., Kidney Int., 41:933-7, 1992; Salant, D.J., et al., Kidney Int. 35:976-84, 1989), мембранопролиферативный гломерулонефрит (мезангиокапиллярный гломерулонефрит) (Bartlow, B.G., et al., Kidney Int. 15:294-300, 1979; Meri, S., et al., J. Exp. Med. 175:939-50, 1992), острый постинфекционный гломерулонефрит (постстрептококовый гломерулонефрит), криоглобулинемический гломерулонефрит (Ohsawa, I., et al., Clin Immunol. 101:59-66, 2001), волчаночный нефрит (Gatenby, P.A., Autoimmunity 11:61-6, 1991) и нефрит при пурпуре Геноха-Шенлейна (Endo, M., et al., Am. J. Kidney Dis. 35:401-407, 2000). Вовлечение комплемента в заболевания почек признается на протяжении нескольких десятилетий, однако все еще обсуждается его точная роль в фазе возникновения, развития и разрешения заболеваний почек. В нормальных условиях комплемент является полезным для хозяина, однако ненадлежащая активация и депонирование комплемента могут приводить к повреждению тканей.
Существуют убедительные доказательства того, что гломерулонефрит, воспаление гломерул, часто инициируется депонированием иммунных комплексов на структурах гломерул или канальцев, которые затем запускают активацию комплемента, воспаление и повреждение тканей. Kahn и Sinniah продемонстрировали увеличенное депонирование C5b-9 в базальных мембранах канальцев в биоптатах, полученных от пациентов с различными формами гломерулонефрита (Kahn, T.N., et al., Histopath. 26:351-6, 1995). В исследовании пациентов с обусловленной IgA нефрологией (Alexopoulos, A., et al., Nephrol. Dial. Transplant 10:1166-1172, 1995) депонирование C5b-9 в структурах эпителия/базальной мембраны канальцев коррелировало с уровнями креатинина в плазме. Другое исследование мембранозной нефропатии продемонстрировало взаимосвязь между клиническим исходом и уровнями sC5b-9 в моче (Kon, S.P., et al., Kidney Int. 48:1953-58, 1995). Была установлена положительная корреляция повышенных уровней sC5b-9 с плохим прогнозом. Lehto et al. выявили повышенные уровни CD59, фактора регуляции комплемента, который ингибирует мембраноатакующий комплекс в плазматических мембранах, а также C5b-9 в моче пациентов с мембранозным гломерулонефритом (Lehto, T., et al., Kidney Int. 47:1403-11, 1995). Гистопатологический анализ биоптатов, полученных от тех же пациентов, продемонстрировал депонирование белков C3 и C9 в гломерулах, в то время как экспрессия CD59 в этих тканях была снижена по сравнению с нормальной тканью почек. Эти различные исследования указывают на то, что продолжающийся опосредуемый комплементом гломерулонефрит приводит к экскреции с мочой белков комплемента, которая коррелирует со степенью повреждения ткани и прогнозом заболевания.
Ингибирование активации комплемента в различных моделях гломерулонефрита на животных также продемонстрировало важность активации комплемента в этиологии заболевания. В модели мембранопролиферативного гломерулонефрита (MPGN) инфузия антисыворотки против Thy1 у крысы с дефицитом C6 (у которых не может образовываться C5b-9) приводила к 90% снижению пролиферации гломерулярных клеток, 80% снижению инфильтрации тромбоцитов и макрофагов, снижению синтеза коллагена типа IV (маркер экспансии мезангиального матрикса) и 50% снижению протеинурии по сравнению с C6+ нормальными крысами (Brandt, J., et al., Kidney Int. 49:335-343, 1996). Эти результаты указывают на вовлечение C5b-9 в качестве основного медиатора повреждения тканей в этой модули с антисывороткой против тимоцитов на крысах. В другой модели гломерулонефрита инфузия ступенчатых дозировок антител кролика против базальной мембраны гломерул крысы приводила к дозозовисимому притоку полиморфноядерных лейкоцитов (PMN), который был ослабленным в случае предшествующей обработке фактором яда кобры (для истощения комплемента) (Scandrett, A.L., et al., Am. J. Physiol. 268:F256-F265, 1995). Крысы, которым вводили фактор яда кобры, также демонстрировали меньшую гистопатологию, снижение долговременной протеинурии и более низкие уровни креатинина, чем контрольные крысы. С использованием трех моделей GN на крысах (антисыворотка против тимоцитов, Con A - антитело против Con A, и пассивный нефрит Хеймана), Couser et al., продемонстрировали потенциальную терапевтическую эффективность подходов ингибирования комплемента с использованием рекомбинантного белка sCR1 (Couser, W.G., et al., J. Am. Soc. Nephrol. 5:1888-94, 1995). Крысы, которым вводили sCR1, продемонстрировали значительно уменьшенный приток PMN, тромбоцитов и макрофагов, сниженные мезангиолизис и протеинурию по сравнению с контрольными крысами. Кроме того, доказательства важности активации комплемента при гломерулонефрите были предоставлены с использованием MoAb против C5 в модели на мышах NZB/W F1. MoAb против C5 ингибирует расщепление C5, таким образом, блокируя образование C5a и C5b-9. Непрерывная терапия MoAb против C5 в течение 6 месяцев привела к значительному смягчению течения гломерулонефрита. Гуманизированное моноклональное антитело MoAb против C5 (5G1.1), которое препятствует расщеплению компонента C5 комплемента человека на его провоспалительные компоненты, в настоящее время проходит стадию разработки Alexion Pharmaceuticals, Inc., New Haven, Connecticut, в качестве потенциального способа лечения гломерулонефрита.
Прямые доказательства патологической роли комплемента в повреждении тканей были предоставлены путем исследования пациентов с генетическим дефицитом определенных компонентов комплемента. В ряде сообщений была описана ассоциация заболевания почек с дефицитом регулирующего комплемент фактора H (Ault, B.H., Nephrol. 14:1045-1053, 2000; Levy, M., et al., Kidney Int. 30:949-56, 1986; Pickering, M.C., et al., Nat. Genet. 31:424-8, 2002). Дефицит фактора H приводит к низким уровням фактора B и C3 в плазме и к истощению C5b-9. Как атипичный мембранопролиферативный гломерулонефрит (MPGN), так и идиотипический гемолитический уремический синдром (HUS), ассоциированы с дефицитом фактора H. Свиньи с дефицитом фактора H (Jansen, J.H., et al., Kidney Int. 53:331-49, 1998) и мыши с нокаутом фактора H (Pickering, M.C., 2002) проявляют MPGN-подобные симптомы, подтверждая важность фактора H в регуляции комплемента. Дефицит других компонентов комплемента ассоциирован с заболеванием почек на фоне развития системной красной волчанки (SLE) (Walport, M.J., Davies, et al., Ann. N.Y. Acad. Sci. 815:267-81, 1997). Дефицит C1q, C4 и C2 вызывает высокую предрасположенность к развитию SLE через механизмы, связанные с дефектным выведением иммунным комплексов и апоптотического материала. У многих из этих пациентов с SLE возникает волчаночный нефрит, характеризующийся депонированием иммунных комплексов в гломерулах.
Кроме того, доказательства связи активации комплемента и заболевания почек были получены путем идентификации у пациентов аутоантител против компонентов комплемента, некоторые из которых прямо связаны с заболеванием почек (Trouw, L.A., et al., Mol. Immunol. 38:199-206, 2001). Ряд из этих аутоантител демонстрирует такую высокую степень корреляции с заболеваниями почек, что был введен термин нефритический фактор (NeF) для указания на эту активность. В клинических испытаниях приблизительно у 50% пациентов с положительными результатами по нефритическим факторам развивался MPGN (Spitzer, R.E., et al., Clin. Immunol. Immunopathol. 64:177-83, 1992). C3NeF представляет собой аутоантитело, направленное против C3-конвертазы (C3bBb) альтернативного пути, и оно стабилизирует эту конвертазу, тем самым, стимулируя активацию альтернативного пути (Daha, M.R., et al., J. Immunol. 116:1-7, 1976). Аналогично, аутоантитело, обладающее специфичностью к C3-конвертазе классического пути (C4b2a), называемое C4NeF, стабилизирует эту конвертазу и, тем самым, стимулирует активацию классического пути (Daha, M.R. et al., J. Immunol. 125:2051-2054, 1980; Halbwachs, L., et al., J. Clin. Invest. 65:1249-56, 1980). Было описано, что аутоантитела против C1q связаны с нефритом у пациентов с SLE (Hovath, L., et al., Clin. Exp. Rheumatol. 19:667-72, 2001; Siegert, C., et al., J. Rheumatol. 18:230-34, 1991; Siegert, C., et al., Clin. Exp. Rheumatol. 10:19-23, 1992) и описано, что повышение титра этих аутоантител против C1q прогнозирует вспышку нефрита (Coremans, Т.Е. et al., Am. J. Kidney Dis. 26:595-601, 1995). Иммунные отложения, элюированные с посмертных почек пациентов с SLE, продемонстрировали накопление этих аутоантител против C1q (Mannick, M., et al., Arthritis Rheumatol. 40:1504-11, 1997). Все эти факты указывают на патологическую роль этих аутоантител. Однако не у всех пациентов с аутоантителами против C1q развивается заболевание почек, а также некоторые здоровые индивидуумы имеют низкие титры антител против C1q (Siegert, C.E., et al., Clin. Immunol. Immunopathol. 67:204-9, 1993).
В дополнение к альтернативному и классическому путям активации комплемента, лектиновый путь также может иметь важную патологическую роль в заболевании почек. Повышенные уровни MBL, MBL-ассоциированной сериновой протеазы и продуктов активации комплемента были обнаружены иммуногистохимическими способами на материале биоптатов, полученных от пациентов, у которых было диагностировано несколько различных заболеваний почек, включая нефрит при пурпуре Геноха-Шенлейна (Endo, M., et al., Am. J. Kidney Dis. 35:401-407, 2000), криоглобулинемический гломерулонефрит (Ohsawa, I., et al., Clin. Immunol. 101:59-66, 2001) и IgA-невропатию (Endo, M., et al., Clin. Nephrology 55:185-191, 2001). Таким образом, несмотря на тот факт, что ассоциация между комплементом и заболеваниями почек известна в течение нескольких десятилетий, данные о том, как в точности комплемент влияет на эти заболевания почек, далеки от завершенных.
НАРУШЕНИЯ КРОВИ
Сепсис вызывается чрезвычайной реакцией пациента на вторгшиеся микроорганизмы. Основной функцией системы комплемента является координация воспалительного ответа на вторгшиеся бактерии и другие патогены. В соответствии с этой физиологической ролью в многочисленных исследованиях было показано, что активация комплемента имеет значительную роль в патогенезе сепсиса (Bone, R.C., Annals. Internal. Med. 115:457-469, 1991). Определение клинических проявлений сепсиса постоянно модифицируется. Сепсис обычно определяют как системный ответ хозяина на инфекцию. Однако во многих случаях у пациентов с симптомами сепсиса не обнаруживается клинических признаков инфекции (например, положительных бактериальных культур в крови). Это несоответствие сначала было учтено на Consensus Conference в 1992 году, когда был принят термин "синдром системного воспалительного ответа" (SIRS), и для которого не требовалось присутствия бактериальной инфекции (Bone, R.C., et al., Crit. Care Med. 20:724-726, 1992). В настоящем время существует общее согласие в том, что сепсис и SIRS сопровождаются неспособностью регулировать воспалительный ответ. Для целей этого краткого обзора авторы в настоящее время все еще рассматривают определение сепсиса как включающее также тяжелый сепсис, септический шок и SIRS.
Основным источником инфекции у пациентов с сепсисом до поздних 1980-ых годов были грамотрицательные бактерии. Известно, что липополисахарид (LPS), основной компонент клеточной стенки грамотрицательных бактерий, стимулирует высвобождение медиаторов воспаления из различных типов клеток и индуцирует острые инфекционные симптомы при инъекции животным (Haeney, M.R., et al., Antimicrobial Chemotherapy 41(Suppl. A):41-6, 1998). Интересно, что спектр ответственных микроорганизмов, по-видимому, сдвинулся от в основном грамотрицательных бактерий в поздние 1970-ые и 1980-ые к в основном грамположительным бактериям в настоящее время по причинам, которые на сегодняшний день не ясны (Martin, G.S., et al., N. Eng. J. Med. 348:1546-54, 2003).
Многие исследования продемонстрировали важность активации комплемента в опосредовании воспаления и участии в признаках шока, в частности, септического и геморрагического шока. Как грамотрицательные, так и грамположительные организмы часто вызывают септический шок. LPS является мощным активатором комплемента, в основном через альтернативный путь, хотя также происходит активация классического пути, опосредуемая антителами (Fearon, D.T., et al., N. Engl. J. Med. 292:937-400, 1975). Основными компонентами клеточной стенки грамположительных бактерий являются пептидогликан и липотейхоевая кислота, и оба эти компонента являются мощными активаторами альтернативного пути комплемента, хотя в присутствии специфических антител они также могут активировать классический путь комплемента (Joiner, K.A., et al., Ann. Rev. Immunol. 2:461-2, 1984).
Вовлечение системы комплемента в патогенез сепсиса первоначально было предположено, когда исследователи отметили, что анафилатоксины C3a и C5a опосредуют различные воспалительные реакции, которые также могут происходить при сепсисе. Эти анафилатоксины провоцируют расширение сосудов и повышают проницаемость микрососудов, которые являются событиями, играющими центральную роль в септическом шоке (Schumacher, W.A., et al., Agents Actions 34:345-349, 1991). Кроме того, анафилатоксины индуцируют бронхоспазм, высвобождение гистамина из тучных клеток и агрегацию тромбоцитов. Более того, они проявляют многочисленные эффекты на гранулоциты, такие как хемотаксис, агрегация, адгезия, высвобождение лизосомальных ферментов, образование токсического супероксидного аниона и образование лейкотриенов (Shin, H.S., et al., Science 162:361-363, 1968; Vogt, W., Complement 3:177-86, 1986). Полагают, что эти биологические эффекты играют роль в развитии осложнений сепсиса, таких как шок или острый респираторный дистресс-синдром (ARDS) (Hammerschmidt, D.E., et al., Lancet 1:947-949, 1980; Slotman, G.T., et al., Surgery 99:744-50, 1986). Более того, повышенные уровни анафилатоксина C3a ассоциированы с фатальным исходом сепсиса (Hack, C.E., et al., Am. J. Med. 86:20-26, 1989). В некоторых моделях шока на животных определенные штаммы с дефицитом комплемента (например, штаммы с дефицитом C5) являются более устойчивыми к эффектам инфузий LPS (Hseuh, W., et al., Immunol. 70:309-14, 1990).
Было показано, что блокада образования C5a посредством антител при возникновении сепсиса у грызунов значительно повышала выживаемость (Czermak, B.J., et al., Nat. Med. 5:788-792, 1999). Аналогичные данные были получены, когда блокировали рецептор C5a (C5aR), либо антителами, либо низкомолекулярным ингибитором (Huber-Lang, M.S., et al., FASEB J. 16:1567-74, 2002; Riedemann, N.C., et al., J. Clin. Invest. 110:101-8, 2002). Более ранние экспериментальные исследования на обезьянах также показали, что блокада антителом C5a ослабляла индуцируемый E. coli септический шок и взрослый респираторный дистресс-синдром (Hangen, D.H., et al., J. Surg. Res. 46:195-9, 1989; Stevens, J.H., et al., J. Clin. Invest. 77:1812-16, 1986). У людей с сепсисом уровень C5a был повышенным, и он ассоциировался со значительно сниженными показателями выживаемости вместе с полиорганной недостаточностью, по сравнению с его уровнем у пациентов с менее тяжелым сепсисом и выживших пациентов (Nakae, H., et al., Res. Commun. Chem. Pathol. Pharmacol. 84:189-95, 1994; Nakae, et al., Surg. Today 26:225-29, 1996; Bengtson, A., et al., Arch. Surg. 123:645-649, 1988). Механизмы, посредством которых C5a проявляет его вредоносные эффекты при сепсисе, еще предстоит исследовать более детально, однако последние данные указывают на то, что образование C5a при сепсисе значительно ухудшает врожденные иммунные функции нейтрофилов крови (Huber-Lang, M.S., et al., J. Immunol. 169:3223-31, 2002), их способность проявлять дыхательный взрыв и их способность образовывать цитокины (Riedemann, N.C., et al., Immunity 19:193-202, 2003). Кроме того, образование C5a при сепсисе, по-видимому, имеет прокоагулянтные эффекты (Laudes, I.J., et al., Am. J. Pathol. 160:1867-75, 2002). Модулирующий комплемент белок CI INH также продемонстрировал эффективность в моделях сепсиса и ARDS на животных (Dickneite, G., Behring Ins. Mitt. 93:299-305, 1993).
Лектиновый путь также может играть роль в патогенезе сепсиса. Показано, что MBL связывается с рядом клинически важных микроорганизмов, включая как грамотрицательные, так и грамположительные бактерии, и активирует лектиновый путь (Neth, O., et al., Infect. Immun. 68:688, 2000). Липотейхоевая кислота (LTA) все в большей степени воспринимается как аналог LPS у грамположительных бактерий. Она является мощным иммуностимулятором, который индуцирует высвобождение цитокинов из мононуклеарных фагоцитов и цельной крови (Morath, S., et al., J. Exp. Med. 195:1635, 2002; Morath, S., et al., Infect. Immun. 70:938, 2002). Недавно было продемонстрировано, что L-фиколин специфически связывается с LTA, выделенной из многочисленных видов грамположительных бактерий, включая Staphylococcus aureus, и активирует лектиновый путь (Lynch, N.J., et al., J. Immunol. 172:1198-02, 2004). Также было показано, что MBL связывается с LTA из Enterococcus spp, в которой полиглицерофосфатная цепь замещена гликозильными группами, но не с LTA из девяти других видов, в том числе S. aureus (Polotsky, V.Y., et al., Infect. Immun. 64:380, 1996).
Таким образом, аспект изобретения относится к способу лечения сепсиса или состояния в результате сепсиса путем введения композиции, содержащей терапевтически эффективное количество средства, ингибирующего MASP-2, в фармацевтическом носителе индивидууму, страдающему сепсисом или состоянием, являющимся следствием сепсиса, включая, но не ограничиваясь ими, тяжелый сепсис, септический шок, острый респираторный дистресс-синдром в результате сепсиса и синдром системного воспалительного ответа. Сходные способы предусматриваются для лечения других нарушений крови, включая геморрагический шок, гемолитическую анемию, аутоиммунную тромботическую тромбоцитопеническую пурпуру (TTP), гемолитический уремический синдром (HUS), атипичный гемолитический уремический синдром (aHUS), или другие деструктивные состояния костного мозга/крови, путем введения композиции, содержащей терапевтически эффективное количество средства, ингибирующего MASP-2, в фармацевтическом носителе индивидууму, страдающему таким состоянием. Средство, ингибирующее MASP-2, вводят индивидууму системно, например, посредством внутриартериального, внутривенного, внутримышечного, ингаляционного (в частности, в случае ARDS), подкожного или другого парентерального введения, или потенциально посредством перорального введения для непептидергических средств. Композицию средства, ингибирующего MASP-2, можно комбинировать с одним или несколькими дополнительными лекарственными средствами для борьбы с осложнениями сепсиса и/или шока. Для развернутого сепсиса, или шока, или дистресс-состояния, являющегося их результатом, ингибирующую MASP-2 композицию в подходящем случае можно вводить в быстродействующей дозированной форме, например, посредством внутривенной или внутриартериальной доставки болюса раствора, содержащего средство, ингибирующее MASP-2, композиция. Можно проводить повторное введение по решению врача до тех пор, пока состояние не разрешится.
КОАГУЛОПАТИИ
Были получены доказательства роли системы комплемента в диссеминированном внутрисосудистом свертывании ("DIC"), таком как DIC на фоне значительной травмы организма.
В предшествующих исследованиях было показано, что мыши C4-/- не защищены от реперфузионного повреждения почек (Zhou, W., et al, "Predominant role for C5b-9 in renal ischemia/reperfusion injury," J Clin Invest 105:1363-1371 (2000)) Для исследования того, способны ли мыши C4-/- все еще активировать комплемент через либо классический, либо лектиновый путь, измеряли обновление C3 в плазме C4-/- в анализах, специфических либо для классического, либо для лектинового пути активации. Хотя не могли наблюдать расщепления C3 при запуске активации через классический путь, в сыворотке с дефицитом C4 наблюдали высокоэффективную зависимую от лектинового пути активацию C3 (фиг.30). Можно было видеть, что отложение C3b на маннане и зимозане было значительно снижено у мышей MASP-2-/-, даже в экспериментальных условиях, которые согласно многим опубликованным статьям по альтернативному пути активации должны допускать все три каскада. При использовании тех же сывороток в лунках, покрытых комплексами иммуноглобулинов вместо маннана или зимозана, наблюдали депонирование C3b и расщепление фактора B в сыворотке мышей MASP-2+/+ и сыворотке мышей MASP-2-/-, но не в сыворотке, лишенной C1q. Это указывает на то, что активация альтенативного пути облегчается в сыворотках MASP-2-/-, когда первоначальный C3b предоставляется через классическую активность. На фиг.30C представлены неожиданные данные, что C3 может эффективно активироваться зависимым от лектинового пути образом в плазме с дефицитом C4.
Это "шунт C4" устраняется посредством ингибирования активации лектинового пути путем предварительной инкубации плазму с растворимым маннаном или маннозой.
Аберрантная неиммунная активация системы комплемента является потенциально вредоносной для человека и также может играть важную роль в активации гематологического каскада, в частности, в тяжелых травматических ситуациях, при которых активируются как воспалительные, так и гематологические каскады. При нормальном здоровье конвертирование C3 составляет <5% от общего белка C3 в плазме. При угрожающей инфекции, в том числе септицемии и иммунокомплексном заболевании, конвертирование C3 изменяется до уровня приблизительно 30% с уровнями комплемента, часто ниже нормальных, вследствие увеличенной утилизации и изменений совокупного распределения. Немедленная активация каскада C3 более чем на 30% обычно вызывает явные клинические признаки расширения сосудов и потери жидкости в ткани. При более чем 30% конвертировании C3 инициирующие механизмы в основном являются неиммунными и итоговые клинические проявления являются вредоносными для пациента. Уровни C5 комплемента в состоянии здоровья и при контролируемом заболевании оказались значительно более стабильными, чем уровни C3. Значительное снижение уровней C5 и/или конвертирования C5 ассоциированы с ответом пациента на аномальную множественную травму (например, дорожно-транспортные происшествия) и, возможно, развитием синдрома шокового легкого. Таким образом, любые признаки либо активации C3 комплемента выше 30% в сосудистом русле или любого вовлечения C5, или оба из них, могут считаться вероятными предвестниками вредоносного патологического изменения у пациента.
Как C3, так и C5 высвобождают анафилатоксины (C3a и C5a), которые воздействуют на тучные клетки и базофилы, высвобождая сосудорасширяющие химические вещества. Они формируют хемотактические градиенты для направления полиморфноядерных клеток (PMN) в центр иммунологических нарушений (благоприятный ответ), однако там они действуют иначе, поскольку C5a имеет специфический эффект группирования (агрегации) на эти фагоцитарные клетки, препятствуя их случайному перемещению от области реакции. При нормальном контроле инфекции C3 активирует C5. Однако при множественной травме C5, по-видимому, широко активируется, образуя анафилотоксины C5a системно. Эта неконтролируемая активность приводит к агрегации полиморфноядерных клеток в сосудистой системе, а затем эти агрегаты переносятся в капилляры легких, которые они закупоривают и формируют локальные повреждающие эффекты в результате высвобождения супероксида. Не ограничиваясь теорией, этот механизм, возможно, является важным в патогенезе острого респираторного дистресс-синдрома (ARDS), хотя эта точка зрения недавно была подвергнута сомнению. In vitro может быть показано, что анафилотоксины C3a являются мощными факторами, агрегирующими тромбоциты, однако их вовлечение in vivo является менее определенным и высвобождение тромбоцитарных веществ и плазмина при репарации раны может только вторично вовлекать C3 комплемента. Является возможным, что для инициации DIC необходимо длительное повышение активации C3.
В дополнение к клеточным и сосудистым эффектам активированных компонентов комплемента, описанным выше, которые могут объяснить связь между травмой и DIC, появляющиеся научные открытия идентифицировали прямые молекулярные связи и функциональные взаимодействия между системами комплемента и свертывания. Подтверждающие данные были получены в исследованиях на мышах с дефицитом C3. Поскольку C3 является общим компонентом для каждого из путей комплемента, спрогнозировано, что у мышей с дефицитом C3 будет отсутствовать вся функция комплемента. Однако неожиданно мыши с дефицитом C3 способны в полной мере активировать терминальные компоненты комплемента. (Huber-Lang, M., et al., "Generation of C5a in the absence of C3: a new complement activation pathway," Nat. Med 12:682-687 (2006)). Детальные исследования выявили, что независимая от C3 активация терминальных компонентов комплемента опосредуется тромбином, скорость-лимитирующим ферментом каскада свертывания (Huber et al., 2006). Молекулярные компоненты, опосредующие активацию тромбина после первоначальной активации комплемента, остаются неясными.
Авторы настоящего изобретения выяснили то, что предположительно является молекулярной основой взаимодействия между каскадами комплемента и свертывания, и идентифицировали MASP-2 в качестве центральной контрольной точки, связывающей эти две системы. Биохимические исследования субстратной специфичности MASP-2 идентифицировали протромбин в качестве возможного субстрата, в дополнение к хорошо известным белкам комплемента C2 и C4. MASP-2 специфически расщепляет протромбин в функционально значимых участках, образуя тромбин, скорость-лимитирующий фермент каскада свертывания (Krarup, A., et al., "Simultaneous Activation of Complement and Coagulation by MBL-Associated Serine Protease 2", PLoS. ONE. 2:e623 (2007)). Образующийся посредством MASP-2 тромбин способен индуцировать депонирование фибрина в определенной реконструированной системе in vitro, демонстрируя функциональную значимость расщепления MASP-2. (Krarup et al., 2007). Как рассмотрено в примерах настоящего описания ниже, авторы изобретения далее подтвердили физиологическую значимость этого открытия, зафиксировав активацию тромбина в нормальной сыворотке грызунов после активации лектинового пути, и продемонстрировали, что этот процесс блокируется нейтрализующими моноклональными антителами против MASP-2.
MASP-2 может представлять собой центральную точку ветвления в лектиновом пути, способную индуцировать активацию систем как комплемента, так и свертывания. Поскольку активация лектинового пути является физиологическим ответом на множество типов травматического повреждения, авторы настоящего изобретения полагают, что сопутствующее системное воспаление (опосредуемое компонентами комплемента) и диссеменированная коагуляция (опосредуемая каскадом свертывания) могут быть объяснены способностью MASP-2 активировать оба пути. Эти данные отчетливо указывают на роль MASP-2 в индукции DIC и терапевтическую пользу ингибирования MASP-2 при лечении или предупреждении DIC. MASP-2 может обеспечить молекулярную связь между системой комплемента и свертывания, и активация лектинового пути, которая происходит в условиях травмы, может прямо инициировать активацию системы свертывания через ось MASP-2-тромбин, обеспечивая механистическую связь между травмой и DIC. В соответствии с аспектом настоящего изобретения, ингибирование MASP-2 может ингибировать активацию лектинового пути и снизить образование обоих анафилатоксинов, C3a и C5a. Полагают, что длительное повышение активации C3 является необходимым для индукции DIC.
Микроциркуляторное свертывание (сгустки крови в капиллярах и мелких кровеносных сосудах) происходит в таких условиях, как септический шок. Роль лектинового пути в септическом шоке установлена, о чем свидетельствует защищенный фенотип мышей MASP-2 (-/-) в моделях сепсиса, описанных в примере 17 и на фиг.18 и 19. Более того, как продемонстрировано в примере 15 и на фиг.16A и 16B, мыши MASP-2 (-/-) защищены в модели диссеминированного внутрисосудистого свертывания (DIC) в микрососудах с использованием локализованной реакции Шварцмана.
V. ИНГИБИРУЮЩИЕ MASP-2 СРЕДСТВА
В одном аспекте настоящее изобретение относится к способам ингибирования MASP-2-зависимой активации комплемента у индивидуума, страдающего или имеющего риск развития тромботической микроангиопатии. Средства, ингибирующие MASP-2, вводят в количестве, эффективном для ингибирования MASP-2-зависимой активации комплемента у живого индивидуума. При применении на практике этого аспекта изобретения, репрезентативные средства, ингибирующие MASP-2, включают: молекулы, которые ингибируют биологическую активность MASP-2 (такие как низкомолекулярные ингибиторы, антитела против MASP-2 или блокирующие пептиды, которые взаимодействуют с MASP-2 или препятствуют белок-белковому взаимодействию), и молекулы, которые снижают экспрессию MASP-2 (такие как антисмысловые молекулы нуклеиновых кислот против MASP-2, MASP-2-специфические молекулы РНК-i и рибозимы MASP-2), тем самым, препятствуя активации MASP-2 лектинового пути комплемента. Средства, ингибирующие MASP-2, можно использовать отдельно в качестве первичной терапии или в комбинации с другими терапевтическими средствами в качестве вспомогательной терапии для усиления терапевтической пользы других медикаментозных способов лечения.
Ингибирование MASP-2-зависимой активации комплемента характеризуется по меньшей мере одним из следующих изменений компонента системы комплемента, которое происходит в результате введения средства, ингибирующего MASP-2, в соответствии со способами по изобретению: ингибирование образования или продуцирования продуктов MASP-2-зависимой активации системы комплемента C4b, C3a, C5a и/или C5b-9 (MAC) (измеряемое, например, как описано в примере 2), снижение активации комплемента, оцениваемое в анализе гемолиза с использованием несенсибилизированных эритроцитов кролика или морской свинки (измеряемое, например, как описано в примере 33), снижение расщепления C4 и депонирования C4b (измеряемое, например как описано в примере 2), или снижение расщепления C3 и депонирования C3b (измеряемое, например, как описано в примере 2).
В соответствии с настоящим изобретением, используют средства, ингибирующие MASP-2, которые являются эффективными в отношении ингибирования MASP-2-зависимой активации системы комплемента. Средства, ингибирующие MASP-2, пригодные для применения на практике этого аспекта изобретения, включают, например, антитела против MASP-2 и их фрагменты, ингибирующие MASP-2 пептиды, низкомолекулярные соединения, растворимые рецепторы MASP-2 и ингибиторы экспрессии. Средства, ингибирующие MASP-2, могут ингибировать MASP-2-зависимую активацию системы комплемента путем блокирования биологической функции MASP-2. Например, ингибиторное средство может эффективно блокировать белок-белковые взаимодействия MASP-2, препятствовать димеризации или сборке MASP-2, блокировать связывание Ca2+, препятствовать активному центру сериновой протеазы MASP-2 или снижать экспрессию белка MASP-2.
В некоторых вариантах осуществления средства, ингибирующие MASP-2, селективно ингибируют активацию комплемента посредством MASP-2, оставляя C1q-зависимую активацию системы комплемента функционально интактной.
В одном варианте осуществления средство, ингибирующее MASP-2, пригодное в способах по изобретению, представляет собой специфическое средство, ингибирующее MASP-2, которое специфически связывается с полипептидом, содержащим SEQ ID NO:6, с аффинностью, по меньшей мере в десять раз превышающей аффинность в отношении других антигенов в системе комплемента. В другом варианте осуществления средство, ингибирующее MASP-2, специфически связывается с полипептидом, содержащим SEQ ID NO:6, с аффинностью связывания, по меньшей мере в 100 раз превышающей аффинность связывания с другими антигенами в системе комплемента. Аффинность связывания средства, ингибирующего MASP-2, можно определять с использованием подходящего анализа связывания.
Полипептид MASP-2 обладает молекулярной структурой, сходной с MASP-1, MASP-3, и C1r и C1s, протеазами системы комплемента C1. Молекула кДНК, представленная в SEQ ID NO:4, кодирует репрезентативный пример MASP-2 (состоящий из аминокислотной последовательности, указанной в SEQ ID NO:5) и обеспечивает полипептид MASP-2 человека с лидерной последовательностью (а.к.1-15), которая расщепляется после секреции, что приводит к зрелой форме MASP-2 человека (SEQ ID NO:6). Как показано на фиг.2, ген MASP 2 человека охватывает двенадцать экзонов. кДНК MASP-2 человека кодируется экзонами B, C, D, F, G, H, I, J, K и L. Альтернативный сплайсинг приводит к белку размером 20 кДа, называемому MBL-ассоциированным белком 19 ("MAp19", также обозначаемый как "sMAP") (SEQ ID NO:2), кодируемому (SEQ ID NO:1), образованному экзонами B, C, D и E, как показано на фиг.2. Молекула кДНК, указанная в SEQ ID NO:50, кодирует MASP-2 мыши (состоящий из аминокислотной последовательности, указанной в SEQ ID NO:51) и обеспечивает полипептид MASP-2 мыши с лидерной последовательностью, которая отщепляется после секреции, что приводит к зрелой форме MASP-2 мыши (SEQ ID NO:52). Молекула кДНК, указанная в SEQ ID NO:53, кодирует MASP-2 крысы (состоящий из аминокислотной последовательности, указанной в SEQ ID NO:54) и обеспечивает полипептид MASP-2 крысы с лидерной последовательностью, которая отщепляется после секреции с образованием зрелой формы MASP-2 крысы (SEQ ID NO:55).
Специалистам в данной области будет понятно, что последовательности, описанные в SEQ ID NO:4, SEQ ID NO:50 и SEQ ID NO:53, представляют собой отдельные аллели MASP-2 человека, мыши и крысы, соответственно, и что можно ожидать аллельных вариаций и альтернативного сплайсинга. Аллельные варианты нуклеотидных последовательностей, показанные в SEQ ID NO:4, SEQ ID NO:50 и SEQ ID NO:53, включая аллельные варианты, содержащие молчащие мутации, и аллельные варианты, в которых мутации приводят к изменениям аминокислотной последовательности, входят в объем настоящего изобретения. Аллельные варианты последовательности MASP-2 можно клонировать путем исследования кДНК или геномных библиотек от различных индивидуумов в соответствии со стандартными методиками.
Домены белка MASP-2 человека (SEQ ID NO:6) представлены на фиг.1 и 2A, и они включают N-концевой домен Clr/Cls/VEGF морского ежа/морфогенетического белка костей (CUB) (а.к.1-121 SEQ ID NO:6), домен, подобный эпидермальному фактору роста (а.к.122-166), второй домен CUB (а.к.167-293), а также тандем доменов белков контроля комплемента и домен сериновой проетазы Альтернативный сплайсинг гена MASP 2 приводит к MAp19, показанному на фиг.1. MAp19 представляет собой неферментативный белок, содержащий N-концевую область CUB1-EGF MASP-2 с четырьмя дополнительными остатками (EQSL), происходящими из экзона E, как показано на фиг.1.
Было показано, что несколько белков связываются или взаимодействуют с MASP-2 через белок-белковые взаимодействия. Например, известно, что MASP-2 связывается с и образует Ca2+-зависимые комплексы с лектиновыми белками MBL, H-фиколином и L-фиколином. Было показано, что каждый комплекс MASP-2/лектин активирует комплемент через MASP-2-зависимое расщепление белков C4 и C2 (Ikeda, K., et al., J. Biol. Chem. 262:7451-7454, 1987; Matsushita, M., et al., J. Exp. Med. 176:1497-2284, 2000; Matsushita, M., et al., J. Immunol. 168:3502-3506, 2002). Исследования показали, что домены CUB1-EGF MASP-2 необходимы для связывания MASP-2 с MBL (Thielens, N.M., et al., J. Immunol. 166:5068, 2001). Также было показано, что домены CUB1EGFCUBII опосредуют димеризацию MASP-2, которая требуется для образования активного комплекса MBL (Wallis, R., et al., J. Biol. Chem. 275:30962-30969, 2000). Таким образом, могут быть идентифицированы средства, ингибирующие MASP-2, которые связываются с или препятствуют областям-мишеням MASP-2, о которых известно, что они являются важными для MASP-2-зависимой активации комплемента.
АНТИТЕЛА ПРОТИВ MASP-2
В некоторых вариантах осуществления этого аспекта изобретения средство, ингибирующее MASP-2, включает антитело против MASP-2, которое ингибирует MASP-2-зависимую активацию системы комплемента. Антитела против MASP-2, пригодные в этом аспекте изобретения, включают поликлональные, моноклональные или рекомбинантные антитела, происходящие из любого продуцирующего антитела животного, и они могут представлять собой мультиспецифические, химерные, гуманизированные, антиидиотипические антитела и фрагменты антител. Фрагменты антител включают Fab, Fab', F(ab)2, F(ab')2, Fv-фрагменты, scFv-фрагменты и одноцепочечные антитела, как дополнительно описано в настоящем описании.
В литературе описано несколько антител против MASP-2, некоторые из которых приведены ниже в таблице 1. Эти ранее описанные антитела против MASP-2 можно подвергать скринингу в отношении способности ингибировать MASP-2-зависимую активацию системы комплемента с использованием анализов, описанных в настоящем описании. Например, идентифицированы Fab2-антитела против MASP-2 крысы, которые блокируют MASP-2-зависимую активацию комплемента, как более подробно описано в примерах 10 и 11 настоящего описания. После идентификации антитела против MASP-2, которое функционирует в качестве средства, ингибирующего MASP-2, его можно использовать для получения антиидиотипических антител и использовать для идентификации других связывающих MASP-2 молекул, как дополнительно описано ниже.
MASP-2-СПЕЦИФИЧЕСКИЕ АНТИТЕЛА ИЗ ЛИТЕРАТУРЫ
NimoAb104, продуцируемое гибридомной клеточной линией M0545YM035 (DSMZ)
NimoAb108, продуцируемое гибридомной клеточной линией M0545YM029 (DSMZ)
NimoAb109, продуцируемое гибридомной клеточной линией M0545YM046 (DSMZ)
NimoAb110, продуцируемое гибридомной клеточной линией M0545YM048 (DSMZ)
АНТИТЕЛА ПРОТИВ MASP-2 СО СНИЖЕННОЙ ЭФФЕКТОРНОЙ ФУНКЦИЕЙ
В некоторых вариантах осуществления этого аспекта изобретения антитела против MASP-2 имеют сниженную эффекторную функцию для снижения воспаления, которое может возникать вследствие активации классического пути комплемента. Было показано, что способность молекул IgG запускать классический путь, обусловлена Fc-частью молекулы (Duncan, A.R., et al., Nature 332:738-740 1988). Молекулы IgG, в которых Fc-часть молекулы удалена путем ферментативного расщепления, лишены этой эффекторной функции (см. Harlow, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory, New York, 1988). Таким образом, можно получать антитела со сниженной эффекторной функцией в результате отсутствия Fc-части молекулы, наличия генетически модифицированной последовательности Fc, которая минимизирует эффекторную функцию, или принадлежности либо к изотипу IgG2, либо к изотипу IgG4 человека.
Антитела со сниженной эффекторной функцией можно получать стандартным молекулярно-биологическим манипулированием Fc-частями тяжелых цепей IgG, как описано в примере 9 настоящего описания, а также описано в Jolliffe et al., Int'l Rev. Immunol. 10:241-250, 1993, и Rodrigues et al., J. Immunol. 151:6954-6961, 1998. Антитела со сниженной эффекторной функцией также включают изотипы IgG2 и IgG4 человека, которые обладают сниженной способностью активировать комплемент и/или взаимодействовать с Fc-рецепторами (Ravetch, J.V., et al., Annu. Rev. Immunol. 9:457-492, 1991; Isaacs, J.D., et al., J. Immunol. 148:3062-3071, 1992; van de Winkel, J.G., et al., Immunol. Today 14:215-221, 1993). Гуманизированные или полностью человеческие антитела, специфичные к MASP-2 человека, имеющие изотипы IgG2 или IgG4, можно получать любым из нескольких способов, известных специалисту в данной области, как описано в Vaughan, T.J., et al., Nature Biotechnical 16:535-539, 1998.
ПОЛУЧЕНИЕ АНТИТЕЛ ПРОТИВ MASP-2
Антитела против MASP-2 можно получать с использованием полипептидов MASP-2 (например, полноразмерный MASP-2) или с использованием пептидов, содержащих антигенный эпитоп MASP-2 (например, часть полипептида MASP-2). Иммуногенные пептиды могут быть небольшими, имея только пять аминокислотных остатков. Например, полипептид MASP-2, включая всю аминокислотную последовательность SEQ ID NO:6, можно использовать для индукции антител против MASP-2, пригодных в способе по изобретению. Конкретные домены MASP-2, о которых известно, что они вовлечены в белок-белковые взаимодействия, такие как домены CUBI и CUBIEGF, а также область, охватывающую активный центр сериновой протеазы, можно экспресировать в качестве рекомбинантных полипептидов, как описано в примере 3, и использовать в качестве антигенов. Кроме того, пептиды, содержащие часть полипептида MASP-2 по меньшей мере из 6 аминокислот (SEQ ID NO:6), также пригодны для индукции антител против MASP-2. Дополнительные примеры происходящих из MASP-2 антигенов, пригодных для индукции антител против MASP-2, представлены ниже в таблице 2. Пептиды и полипептиды MASP-2, используемые для индукции антител, можно выделять в качестве природных полипептидов, или рекомбинантных или синтетических пептидов и каталитически неактивных рекомбинантных полипептидов, таких как MASP-2A, как дополнительно описано в примерах 5-7. В некоторых вариантах осуществления этого аспекта изобретения, антитела против MASP-2 получают с использованием трансгенной линии мышей, как описано в примерах 8 и 9 и дополнительно описано ниже.
Антигены, пригодные для продуцирования антител против MASP-2, также включают слитые полипептиды, такие как слитые полипептиды MASP-2 или его части с иммуноглобулиновым полипептидом или с мальтоза-связывающим белком. Полипептидный иммуноген может представлять собой полноразмерную молекулу или ее часть. Если полипептидная часть является гаптен-подобной, такую часть можно преимущественно соединять или связывать с макромолекулярным носителем (таким как гемоцианин лимфы улитки (KLH), бычий сывороточный альбумин (BSA) или столбнячный токсоид) для иммунизации.
ПРОИСХОДЯЩИЕ ИЗ MASP-2 АНТИГЕНЫ
TFRSDYSN
ПОЛИКЛОНАЛЬНЫЕ АНТИТЕЛА
Поликлональные антитела против MASP-2 можно получать путем иммунизации животного полипептидом MASP-2 или его иммуногенной частью с использованием способов, хорошо известных средним специалистам в данной области. См., например, Green et al., "Production of Polyclonal Antisera", Immunochemical Protocols (Manson, ed.), page 105, и как дополнительно описано в примере 6. Иммуногенность полипептида MASP-2 можно повышать с использованием адъюванта, включая минеральные гели, такие как гидроксид алюминия или адъювант Фрейнда (полный или неполный), поверхностно-активные вещества, такие как лизолецитин, полиолы плюроника, полианионы, масляные эмульсии, гемоцианин лимфы улитки и динитрофенол. Поликлональные антитела, как правило, индуцируют у животных, таких как лошади, коровы, собаки, куры, крысы, мыши, кролики, морские свинки, козы или овцы. Альтернативно антитело против MASP-2, пригодное в рамках настоящего изобретения, также может происходить из человекообразных обезьян. Общие способы индукции диагностически и терапевтически пригодных антител у павианов могут быть найдены, например, в Goldenberg et al., международная публикация патента № WO 91/11465, и Losman, M.J., et al., Int. J. Cancer 46:310, 1990. Затем из крови таких иммунизированных животных получают сыворотки, содержащие иммунологически активные антитела, с использованием стандартных методик, хорошо известных в данной области.
МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА
В некоторых вариантах осуществления средство, ингибирующее MASP-2, представляет собой моноклональное антитело против MASP-2. Моноклональные антитела против MASP-2 являются высокоспецифическими и направлены против одного эпитопа MASP-2. Как используют в рамках изобретения определение "моноклональный" указывает на тот признак антитела, что оно получено из по существу однородной совокупности антител, и его не следует истолковывать как требование, чтобы антитело продуцировалось каким-либо конкретным способом. Моноклональные антитела можно получать с использованием любого способа, который обеспечивает продуцирование молекул антител стабильными клеточными линиями в культуре, такого как способ гибридом, описанный Kohler, G., et al., Nature 256:495, 1975, или их можно получать способами рекомбинантных ДНК (см., например, патент США № 4816567, выданный Cabilly). Моноклональные антитела также можно выделять из библиотек фагового дисплея с использованием способов, описанных в Clackson, T., et al., Nature 352:624-628, 1991, и Marks, J.D., et al., J. Mol. Biol. 222:581-597, 1991. Такие антитела могут принадлежать любому классу иммуноглобулинов, включая IgG, IgM, IgE, IgA, IgD, и любому их подклассу.
Например, моноклональные антитела можно получать путем инъекции подходящему млекопитающему (например, мыши BALB/c) композиции, содержащей полипептид MASP-2 или его часть. После заданного периода времени спленоциты извлекают из мыши и суспендируют в клеточной культуральной среде. Затем спленоциты подвергают слиянию с иммортализованной клеточной линией с образованием гибридомы. Полученные гибридомы выращивают в клеточной культуре и подвергают скринингу в отношении их способности продуцировать моноклональное антитело против MASP-2. Пример, далее описывающий получение моноклональных антител против MASP-2, представлен в примере 7 (также см. Current Protocols in Immunology, Vol. 1., John Wiley & Sons, pages 2,5,1-2,6,7, 1991).
Моноклональные антитела человека можно получать с использованием трансгенных мышей, модифицированных способами инженерии для продукции специфических антител человека в ответ на антигенную нагрузку. В этом способе элементы локуса тяжелой и легкой цепей иммуноглобулина человека вводят линиям мышей, происходящим из линий эмбриональных стволовых клеток, которые содержат заданные повреждения эндогенных локусов тяжелой цепи и легкой цепи иммуноглобулина. Трансгенные мыши могут синтезировать антитела человека, специфичные к антигенам человека, таким как антигены MASP-2, описанные в настоящем описании, и мышей можно использовать для получения гибридом, секретирующих антитело против MASP-2 человека, путем слияния B-клеток из таких животных с подходящими миеломными клеточными линиями с использованием общепринятой технологии Kohler-Milstein, как дополнительно описано в примере 7. Трансгенные мыши с геномом иммуноглобулинов человека являются коммерчески доступными (например, от Abgenix, Inc., Fremont, CA, и Medarex, Inc., Annandale, N.J.). Способы получения антител человека из трансгенных мышей описаны, например, Green, L.L., et al., Nature Genet. 7:13, 1994; Lonberg, N., et al., Nature 368:856, 1994; и Taylor, L.D., et al., Int. Immun. 6:579, 1994.
Моноклональные антитела можно выделять и очищать из гибридомных культур различными общепризнанными способами. Такие способы выделения включают аффинную хроматографию с сефарозой с белком-A, эксклюзионную хроматографию и ионообменную хроматографию (см., например, Coligan at pages 2.7.1-2.7.12 и pages 2.9.1-2.9.3; Baines et al., "Purification of Immunoglobulin G (IgG)", Methods in Molecular Biology, The Humana Press, Inc., Vol. 10, pages 79-104, 1992).
После получения поликлональные, моноклональные или фаговые антитела сначала исследуют в отношении специфического связывания MASP-2. Специалистам в данной области известны и ими могут использоваться различные анализы для обнаружения антител, которые специфически связываются с MASP-2. Иллюстративные анализы включают анализ с использованием вестерн-блоттинга или иммунопреципитации стандартными способами (например, как описано в Ausubel et al.), иммуноэлектрофорез, твердофазные иммуноферментные анализы, дот-блоттинг, ингибиторные и конкурентные анализы и сэндвич-анализы (как описано в Harlow and Land, Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, 1988). После идентификации антител, которые специфически связываются с MASP-2, антитела против MASP-2 исследуют в отношении способности функционировать в качестве средства, ингибирующего MASP-2, в одном из нескольких анализов, например, таком как анализ лектин-специфического расщепления C4 (описанный в примере 2), анализ депонирования C3b (описанный в примере 2) или анализ депонирования C4b (описанный в примере 2).
Аффинность моноклональных антител против MASP-2 может без труда определить специалист в данной области (см., например, Scatchard, A., NY Acad. Sci. 51:660-672, 1949). В одном варианте осуществления моноклональные антитела против MASP-2, пригодные в способах по изобретению, связываются с MASP-2 с аффинностью связывания <100 нМ, предпочтительно <10 нМ и наиболее предпочтительно <2 нМ. В некоторых вариантах осуществления ингибиторное моноклональное антитело против MASP-2, пригодное в способах по изобретению, представляет собой ингибиторное моноклональное антитело против MASP-2 или его антигенсвязыващий фрагмент, содержащее (I) (a) вариабельную область тяжелой цепи, содержащую: i) CDR-H1 тяжелой цепи, содержащую аминокислотную последовательность положений 31-35 SEQ ID NO:67; и ii) CDR-H2 тяжелой цепи, содержащую аминокислотную последовательность положений 50-65 SEQ ID NO:67; и iii) CDR-H3 тяжелой цепи, содержащую аминокислотную последовательность положений 95-102 SEQ ID NO:67 и b) вариабельную область легкой цепи, содержащую: i) CDR-L1 легкой цепи, содержащую аминокислотную последовательность положений 24-34 SEQ ID NO:70; и ii) CDR-L2 легкой цепи, содержащую аминокислотную последовательность положений 50-56 SEQ ID NO:70; и iii) CDR-L3 легкой цепи, содержащую аминокислотную последовательность положений 89-97 SEQ ID NO:70, или (II) их вариант, содержащий вариабельную область тяжелой цепи по меньшей мере с 90% идентичностью с SEQ ID NO:67 (например, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% идентичность с SEQ ID NO:67) и вариабельную область легкой цепи меньшей мере с 90% идентичностью (например, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% идентичность) с SEQ ID NO:70.
ХИМЕРНЫЕ/ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА
Моноклональные антитела, пригодные в способе по изобретению, включают химерные антитела, в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, происходящих из конкретного вида или принадлежащих конкретному классу или подклассу антител, в то время как другая цепь(и) идентична или гомологичная соответствующим последовательностям в антителах, происходящих из другого вида или принадлежащих другому классу или подклассу антител, а также фрагменты таких антител (патент США № 4816567, выданный Cabilly; и Morrison, S.L., et al., Proc. Nat'l Acad. Sci. USA 81:6851-6855, 1984).
Одной из форм химерного антитела, пригодного в рамках настоящего изобретения, является гуманизированное моноклональное антитело против MASP-2. Гуманизированные формы не являющихся человеческими антител (например, мыши) представляют собой химерные антитела, которые содержат минимальную последовательность, происходящую из не являющегося человеческим иммуноглобулина. Гуманизированные моноклональные антитела получают путем переноса не являющихся человеческими определяющих комплементарность областей (CDR) (например, мыши), из вариабельных областей тяжелой и легкой цепей иммуноглобулина мыши в вариабельный домен человека. Как правило, затем остатки антитела человека заменяют в каркасных областях не являющимися человеческими аналогами. Более того, гуманизированные антитела могут содержать остатки, которые не встречаются в реципиентном антителе или в донорном антителе. Эти модификации вносят для дальнейшего улучшения характеристик антител. Как правило, гуманизированное антитело содержит по существу все из по меньшей мере одного и, как правило, двух вариабельных доменов, в которых все или по существу все из гипервариабельных петель соответствуют гипервариабельным петлям не являющегося человеческим иммуноглобулина и все или по существу все из каркасных областей Fv представляют собой каркасные области последовательности иммуноглобулина человека. Гуманизированное антитело необязательно также содержит по меньшей мере часть константной области иммуноглобулина (Fc), как правило, иммуноглобулина человека. Для более подробного описания см. Jones, P.T., et al., Nature 321:522-525, 1986; Reichmann, L., et al., Nature 332:323-329, 1988; и Presta, Curr. Op. Struct. Biol. 2:593-596, 1992.
Гуманизированные антитела, пригодные в рамках изобретения, включают моноклональные антитела человека, включающие по меньшей мере связывающую MASP-2 область CDR3. Кроме того, Fc-области могут быть заменены так, чтобы помимо IgG-антител человека продуцировались IgA или IgM. Такие гуманизированные антитела имеют конкретную клиническую применимость, поскольку они специфически распознают MASP-2 человека, но не индуцируют иммунный ответ у человека против самого антитела. Следовательно, они лучше подходят для введения in vivo у человека, особенно, если необходимо многократное или длительное введение.
Пример получения гуманизированного антитела против MASP-2 из моноклонального антитела мыши против MASP-2 представлен в примере 6. Способы получения гуманизированных моноклональных антител также описаны, например, в Jones, P.T., et al., Nature 321:522, 1986; Carter, P., et al., Proc. Nat'l. Acad. Sci. USA 89:4285, 1992; Sandhu, J.S., Crit. Rev. Biotech. 12:437, 1992; Singer, I.I., et al., J. Immun. 150:2844, 1993; Sudhir (ed.), Antibody Engineering Protocols, Humana Press, Inc., 1995; Kelley, "Engineering Therapeutic Antibodies", Protein Engineering: Principles and Practice, Cleland et al. (eds.), John Wiley & Sons, Inc., pages 399-434, 1996; и в патенте США № 5693762, выданному Queen, 1997 год. Кроме того, существуют коммерческие организации, которые синтезируют гуманизированные антитела из конкретных областей антител мыши, такие как Protein Design Labs (Mountain View, CA).
РЕКОМБИНАНТНЫЕ АНТИТЕЛА
Антитела против MASP-2 также можно получать с использованием рекомбинантных способов. Например, антитела человека можно получать с использованием экспрессирующих библиотек иммуноглобулинов человека (доступных, например, от Stratagene, Corp., La Jolla, CA) для получения фрагментов антител человека (VH, VL, FV, Fd, Fab или F(ab')2). Затем эти фрагменты используют для конструирования целых антител человека с использованием способов, сходных со способами получения химерных антител.
АНТИИДИОТИПИЧЕСКИЕ АНТИТЕЛА
После идентификации антител против MASP-2 с желаемой ингибиторной активностью, эти антитела можно использовать для получения антиидиотипических антител, которые сходны с частью MASP-2, с использованием способов, которые хорошо известны в данной области. См., например, Greenspan, N.S., et al., FASEB J. 7:437, 1993. Например, антитела, которые связываются с MASP-2 и конкурентно ингибируют взаимодействие белка MASP-2, требуемое для активации комплемента, можно использовать для получения антиидиотипических антител, которые сходны с участком связывания MBL на белке MASP-2 и, таким образом, связывают и нейтрализуют лиганд, связывающий MASP-2, например, такой как MBL.
ФРАГМЕНТЫ ИММУНОГЛОБУЛИНОВ
Средства, ингибирующие MASP-2, пригодные в способе по изобретению, охватывают не только интактные молекулы иммуноглобулинов, но также хорошо известные фрагменты, включая Fab, Fab', F(ab)2, F(ab')2 и Fv-фрагменты, scFv-фрагменты, диантитела, линейные антитела, одноцепочечные молекулы антител и полиспецифические антитела, образованные из фрагментов антител.
В данной области хорошо известно, что только малая часть молекулы антитела, паратоп, вовлечена в связывание антитела с его эпитопом (см., например, Clark, W.R., The Experimental Foundations of Modern Immunology, Wiley & Sons, Inc., NY, 1986). pFc'- и Fc-области антитела являются эффекторами классического пути комплемента, но не вовлечены в связывание антигена. Антитело, из которого ферментативно вырезана pFc'-область, или которое продуцируется без pFc'-области, обозначают как F(ab')2-фрагмент, и оно сохраняет оба антигенсвязывающих центра интактного антитела. Выделенный F(ab')2-фрагмент называют двухвалентным моноклональным фрагментом вследствие наличия у него двух антигенсвязывающих центров. Аналогично, антитело, из которого ферментативно вырезана Fc-область, или которое продуцируется без Fc-области, обозначают как Fab-фрагмент, и оно сохраняет один из антигенсвязывающих центров интактной молекулы антитела.
Фрагменты антител можно получать протеолитическим гидролизом, таким как расщепление пепсином или папаином целых антител общепринятыми способами. Например, фрагменты антител можно получать путем ферментативного расщепления антител пепсином с образованием 5S-фрагмента, обозначаемого как F(ab')2. Этот фрагмент можно далее расщеплять с использованием средства, восстанавливающего тиольную группу, с получением одновалентных 3,5S Fab'-фрагментов. Необязательно, реакцию расщепления можно проводить с использованием блокирующей группы для сульфгидрильных групп, которые образуются в результате расщепления дисульфидных связей. В качестве альтернативы ферментативное расщепление с использованием пепсина прямо образует два одновалентных Fab-фрагмента и Fc-фрагмент. Эти способы описаны, например, в патенте США № 4331647, выданном Goldenberg; Nisonoff, A., et al., Arch. Biochem. Biophys. 89:230, 1960; Porter, R.R., Biochem. J. 73:119, 1959; Edelman, et al., Methods in Enzymology 1:422, Academic Press, 1967; и Coligan на страницах 2.8.1-2.8.10 и 2.10.-2.10.4.
В некоторых вариантах осуществления использование фрагментов антител, лишенных Fc-области, является предпочтительным, чтобы избежать активации классического пути комплемента, который инициируется связыванием Fc с Fcγ-рецептором. Существует несколько способов, посредством которых можно получать MoAb, которое лишено взаимодействий Fcγ-рецепторов. Например, Fc-область моноклонального антитела можно удалять химически с использованием частичного расщепления протеолитическими ферментами (такого как расщепление фицином), тем самым получая, например, антигенсвязывающие фрагменты антител, такие как Fab- или F(ab)2-фрагменты (Mariani, M., et al., Mol. Immunol. 28:69-71, 1991). Альтернативно изотип γ4 IgG человека, который не связывает Fcγ-рецепторы, можно использовать в процессе конструирования гуманизированного антитела, как описано в настоящем описании. Антитела, одноцепочечные антитела и антигенсвязывающие домены, которые лишены Fc-домена, также можно модифицировать способами инженерии с использованием рекомбинантных способов, описанных в настоящем описании.
ОДНОЦЕПОЧЕЧНЫЕ ФРАГМЕНТЫ АНТИТЕЛ
Альтернативно можно создавать связывающие молекулы с одной пептидной цепью, специфичные к MASP-2, в которых Fv-области тяжелой и легкой цепей связаны. Fv-фрагменты могут быть связаны пептидным линкером с образованием одноцепочечного антигенсвязывающего белка (scFv). Эти одноцепочечные антигенсвязывающие белки получают путем конструирования структурного гена, содержащего последовательности ДНК, кодирующие домены VH и VL, которые связаны олигонуклеотидом. Структурный ген встраивают в экспрессирующий вектор, который затем вводят в клетку-хозяина, такую как E. coli. Рекомбинантные клетки-хозяева синтезируют одну полипептидную цепь с линкерным пептидом, связывающим два V-домена. Способы получения scFv описаны, например, Whitlow, et al., "Methods: A Companion to Methods in Enzymology" 2:97, 1991; Bird, et al., Science 242:423, 1988; патент США № 4946778, выданный Ladner; Pack, P., et al., Bio/Technology 11:1271, 1993.
В качестве иллюстративного примера специфичный к MASP-2 scFv можно получать путем воздействия на лимфоциты полипептида MASP-2 in vitro и селекции в библиотеках дисплея антител в фаговых или сходных векторах (например, с использованием иммобилизованного или меченого белка или пептида MASP-2). Гены, кодирующие полипептиды, обладающие потенциальными связывающими полипептид MASP-2 доменами, можно получать путем скрининга случайных пептидных библиотек дисплея на фагах или бактериях, таких как E. coli. Эти случайные библиотеки дисплея пептидов можно использовать для скрининга пептидов, которые взаимодействуют с MASP-2. Способы получения и скрининга таких случайных библиотек дисплея пептидов хорошо известны в данной области (патент США № 5223409, выданный Lardner; патент США № 4946778, выданный Ladner; патент США № 5403484, выданный Lardner; патент США № 5571698, выданный Lardner; и Kay et al., Phage Display of Peptides and Proteins Academic Press, Inc., 1996) и случайные библиотеки дисплея пептидов и наборы для скрининга таких библиотек являются коммерчески доступными, например от CLONTECH Laboratories, Inc. (Palo Alto, Calif.), Invitrogen Inc. (San Diego, Calif.), New England Biolabs, Inc. (Beverly, Mass.), и Pharmacia LKB Biotechnology Inc. (Piscataway, N.J.).
Другой формой фрагмента антитела против MASP-2, пригодной в этом аспекте изобретения, является пептид, кодирующий единичную определяющую комплементарность область (CDR), которая связывается с эпитопом на антигене MASP-2 и ингибирует MASP-2-зависимую активацию комплемента. Пептиды CDR ("минимальные распознающие элементы") можно получать путем конструирования генов, кодирующих CDR представляющего интерес антитела. Такие гены получают, например, с использованием полимеразной цепной реакции для синтеза вариабельной области из РНК продуцирующих антитело клеток (см., например, Larrick et al., Methods: A Companion to Methods in Enzymology 2:106, 1991; Courtenay-Luck, "Genetic Manipulation of Monoclonal Antibodies", Monoclonal Antibodies: Production, Engineering and Clinical Application, Ritter et al. (eds.), page 166, Cambridge University Press, 1995; и Ward et al., "Genetic Manipulation and Expression of antibodies", Monoclonal Antibodies: Principles and Applications, Birch et al. (eds.), page 137, Wiley-Liss, Inc., 1995).
Антитела против MASP-2, описанные в настоящем описании, вводят индивидууму, нуждающемуся в этом, для ингибирования MASP-2-зависимой активации комплемента. В некоторых вариантах осуществления средство, ингибирующее MASP-2, представляет собой высокоаффинное антитело человека или гуменизированное антитело против MASP-2 со сниженной эффекторной функцией.
ПЕПТИДНЫЕ ИНГИБИТОРЫ
В некоторых вариантах осуществления этого аспекта изобретения, средство, ингибирующее MASP-2, содержит выделенные пептидные ингибиторы MASP-2, включая выделенные природные пептидные ингибиторы и синтетические пептидные ингибиторы, которые ингибируют MASP-2-зависимую активацию системы комплемента. Как используют в рамках изобретения, термин "выделенные пептидные ингибиторы MASP-2" относится к пептидам, которые ингибируют MASP-2-зависимую активацию комплемента посредством связывания, конкуренции с MASP-2 за связывание с другой распознающей молекулой (например, MBL, H-фиколин, M-фиколин, или L-фиколин) в лектиновом пути, и/или прямого взаимодействия с MASP-2 для ингибирования MASP-2-зависимой активации комплемента, которые являются по существу чистыми и практически свободны от других веществ, с которыми они могут встречаться в природе, в той степени, чтобы это было практичным и приемлемым для их предполагаемого применения.
Пептидные ингибиторы успешно используют in vivo для препятствования белок-белковым взаимодействиям и каталитическим центрам. Например, пептидные ингибиторы молекул адгезии, структурно родственных LFA-1, недавно были одобрены для применения в коагулопатиях (Ohman, E.M., et al., European Heart J. 16:50-55, 1995). Описаны короткие линейные пептиды (<30 аминокислоты), которые предотвращают или препятствуют интегрин-зависимую адгезию (Murayama, O., et al., J. Biochem. 120:445-51, 1996). Более длинные пептиды, имеющие длину в диапазоне от 25 до 200 аминокислотных остатков, также успешно используют для блокирования интегрин-зависимой адгезии (Zhang, L., et al., J. Biol. Chem. 271(47):29953-57, 1996). Как правило, более длинные пептидные ингибиторы обладают более высокой аффинностью и/или более низкими константами скорости диссоциации, чем короткие пептиды, и, таким образом, они могут быть более мощными ингибиторами. Также было показано, что циклические пептидные ингибиторы являются эффективными ингибиторами интегринов in vivo для лечения воспалительного заболевания человека (Jackson, D.Y., et al., J. Med. Chem. 40:3359-68, 1997). Один из способов получения циклических пептидов вовлекает синтез пептидов, в которых концевые аминокислоты пептида представляют собой остатки цистеина, тем самым позволяя пептиду существовать в циклической форме посредством образования дисульфидной связи между концевыми аминокислотами, и для которых было показано, что они повышают аффинность и время полужизни in vivo, для лечения новообразований кроветворной системы (например, патент США № 6649592, выданный Larson).
СИНТЕТИЧЕСКИЕ ПЕПТИДНЫЕ ИНГИБИТОРЫ MASP-2
Пептидные ингибиторы MASP-2, пригодные в способах этого аспекта изобретения, иллюстрируются аминокислотными последовательностями, которые имитируют области-мишени, важные для функции MASP-2. Пептидные ингибиторы, пригодные для применения способов по изобретению на практике, имеют длину в диапазоне от приблизительно 5 аминокислот до приблизительно 300 аминокислот. В таблице 3 представлен перечень иллюстративных ингибиторных пептидов, которые могут быть пригодными для применения на практике этого аспекта настоящего изобретения. Пептидный ингибитор MASP-2 можно исследовать в отношении способности функционировать в качестве средства, ингибирующего MASP-2, в одном из нескольких анализов, включая, например, анализ лектин-специфического расщепления C4 (описанный в примере 2) и анализ депонирования C3b (описанный в примере 2).
В некоторых вариантах осуществления пептидные ингибиторы MASP-2 происходят из полипептидов MASP-2 и выбраны из полноразмерного зрелого белка MASP-2 (SEQ ID NO:6) или из конкретного домена белка MASP-2, например, такого как домен CUBI (SEQ ID NO:8), домен CUBIEGF (SEQ ID NO:9), домен EGF (SEQ ID NO:11) и домен сериновой протеазы (SEQ ID NO:12). Как описано ранее, было показано, что области CUBEGFCUBII необходимы для димеризации и связывания с MBL (Thielens et al., выше). В частности, было показано, что пептидная последовательность TFRSDYN (SEQ ID NO:16) в домене CUBI MASP-2 вовлечена в связывание MBL в исследовании, в котором были идентифицирован человек, имеющий гомозиготную мутацию в участке Asp105 на Gly105, которая привела к утрате MASP-2 из комплекса MBL (Stengaard-Pedersen, K., et al., New England J. Med. 349:554-560, 2003).
В некоторых вариантах осуществления пептидные ингибиторы MASP-2 происходят из лектиновых белков, которые связываются с MASP-2 и вовлечены в лектиновй путь комплемента. Было идентифицировано несколько различных лектинов, которые вовлечены в этот путь, включая маннан-связывающий лектин (MBL), L-фиколин, M-фиколин и H-фиколин. (Ikeda, K., et al., J. Biol. Chem. 262:7451-7454, 1987; Matsushita, M., et al., J. Exp. Med. 176:1497-2284, 2000; Matsushita, M., et al., J. Immunol. 168:3502-3506, 2002). Эти лектины присутствуют в сыворотке в качестве олигомеров гомотримерых субъединиц, каждая из которых имеет N-концевые коллаген-подобные волокна с распознающими углеводы доменами. Было показано, что эти различные лектины связываются с MASP-2, и комплекс лектин/MASP-2 активирует комплемент через расщепление белков C4 и C2. H-фиколин имеет N-концевую область из 24 аминокислот, коллаген-подобный домен с 11 повторами Gly-Xaa-Yaa, шеечный домен из 12 аминокислот и фибриноген-подобный домен из 207 аминокислот (Matsushita, M., et al., J. Immunol. 168:3502-3506, 2002). H-фиколин связывается с GlcNAc и агглютинирует эритроциты человека, покрытые LPS, происходящим из S. typhimurium, S. minnesota и E. coli. Было показано, что H-фиколин ассоциирован с MASP-2 и MAp19 и активирует лектиновый путь, ниже. L-фиколин/P35 также связывается с GlcNAc и показано, что он ассоциирован с MASP-2 и MAp19 в сыворотке человека, и этот комплекс, как было показано, активирует лектиновый путь (Matsushita, M., et al., J. Immunol. 164:2281, 2000). Таким образом, пептидные ингибиторы MASP-2, пригодные в рамках настоящего изобретения, могут содержать область по меньшей мере из 5 аминокислот, выбранную из белка MBL (SEQ ID NO:21), белка H-фиколина (номер доступа Genbank NM_173452), белка M-фиколина (номер доступа Genbank O00602) и белка L-фиколина (номер доступа Genbank NM_015838).
Более конкретно, ученые идентифицировали участок связывания MASP-2 на MBL, находящийся в 12 триплетах Gly-X-Y "GKD GRD GTK GEK GEP GQG LRG LQG POG KLG POG NOG PSG SOG PKG QKG DOG KS" (SEQ ID NO:26), который расположен между шарнирной областью и шеечной областью в C-концевой части коллаген-подобного домена MBP (Wallis, R., et al., J. Biol. Chem. 279:14065, 2004). Эта область участка связывания MASP-2 также является высококонсервативной в H-фиколине человека и L-фиколине человека. Был описан консенсусный участок, который находится во всех трех лектиновых белках, содержащих аминокислотную последовательность "OGK-X-GP" (SEQ ID NO:22), где буква "O" означает гидроксипролин и буква "X" означает гидрофобный остаток (Wallis et al., 2004, выше). Таким образом, в некоторых вариантах осуществления пептидные ингибиторы MASP-2, пригодные в этом аспекте изобретения, имеют длину по меньшей мере 6 аминокислот и содержат SEQ ID NO:22. Было показано, что пептиды, происходящие из MBL, которые включают аминокислотную последовательность "GLR GLQ GPO GKL GPO G" (SEQ ID NO:24) связывают MASP-2 in vitro (Wallis, et al., 2004, выше). Для усиления связывания с MASP-2 можно синтезировать пептиды, которые фланкируются двумя триплетами GPO на каждом конце ("GPO GPO GLR GLQ GPO GKL GPO GGP OGP O" SEQ ID NO:25), способствующие образованию тройных спиралей, встречающихся в нативном белке MBL (как далее описано в Wallis, R., et al., J. Biol. Chem. 279:14065, 2004).
Пептидные ингибиторы MASP-2 также могут происходить из H-фиколина человека, который включает последовательность "GAO GSO GEK GAO GPQ GPO GPO GKM GPK GEO GDO" (SEQ ID NO:27) из консенсусной связывающей MASP-2 области в H-фиколине. Также они включают пептиды, происходящие из L-фиколина человека, которые включают последовательность "GCO GLO GAO GDK GEA GTN GKR GER GPO GPO GKA GPO GPN GAO GEO" (SEQ ID NO:28) из консенсусной связывающей MASP-2 области в L-фиколине.
Пептидные ингибиторы MASP-2 также могут происходить из участка расщепления C4, такого как "LQRALEILPNRVTIKANRPFLVFI" (SEQ ID NO:29), который представляет собой участок расщепления C4, связанный с C-концевой частью антитромбина III (Glover, G.I., et al., Mol. Immunol. 25:1261 (1988)).
ИЛЛЮСТРАТИВНЫЕ ПЕПТИДНЫЕ ИНГИБИТОРЫ MASP-2
OGK-X-GP, где "O"=гидроксипролин и "X" представляет собой гидрофобный аминокислотный остаток
OGKLG
GLR GLQ GPO GKL GPO G
GPOGPOGLRGLQGPOGKLGPOGGPOGPO
GKDGRDGTKGEKGEPGQGLRGLQGPOGKLGPOGNOGPSGSOGPKGQKGDOGKS
GAOGSOGEKGAOGPQGPOGPOGKMGPKGEOGDO
GCOGLOGAOGDKGEAGTNGKRGERGPOGPOGKAGPOGPNGAOGEO
LQRALEILPNRVTIKANRPFLVFI
Пептиды, происходящие из участка расщепления C4, а также другие пептиды, которые ингибируют участок сериновой протеазы MASP-2, могут быть химически модифицированными таким образом, чтобы они были необратимыми ингибиторами протеазы. Например, соответствующие модификации могут включать, но не обязательно ограничиваться ими, галометилкетоны (Br, Cl, I, F) на C-конце, Asp или Glu, или присоединенные к функциональным боковым цепям; галоацетильные (или другие α-галоацетильные) группы на аминогруппах или других функциональных боковых цепях; содержащие эпоксид- или имин-содержащие группы на N- или С-концах или на функциональных боковых цепях; или имидатные сложные эфиры на Т- или C-концах или на функциональных боковых цепях. Такие модификации могут обеспечить преимущество постоянного ингибирования фермента посредством ковалентного связывания пептида. Это может привести к более низким эффективным дозам и/или необходимости в менее частом введении пептидного ингибитора.
В дополнение к ингибиторным пептидам, описанным выше, пептидные ингибиторы MASP-2, пригодные в способе по изобретению, включают пептиды, содержащие связывающую MASP-2 область CDR3 MoAb против MASP-2, полученную, как описано в настоящем описании. Последовательность областей CDR для применения для синтеза пептидов можно определять способами, известными в данной области. Вариабельная область тяжелой цепи представляет собой пептид, который обычно имеет длину в диапазоне от 100 до 150 аминокислот. Вариабельная область легкой цепи представляет собой пептид, длина которого обычно находится в диапазоне от 80 до 130 аминокислот. Последовательности CDR в вариабельных областях тяжелых и легких цепей включают только приблизительно 3-25 аминокислотных последовательностей, которые может без труда секвенировать специалист в данной области.
Специалистам в данной области будет понятно, что по существу гомологичные вариации пептидных ингибиторов MASP-2, описанных выше, также проявляют активность ингибирования MASP-2. Иллюстративные вариации включают, но не обязательно ограничиваются ими, пептиды, имеющие вставки, делеции, замены и/или дополнительные аминокислоты на С-концевой или N-концевой частях рассматриваемых пептидов и их смесей. Таким образом, гомологичные пептиды, обладающие активностью ингибирования MASP-2, считаются пригодными в способах по настоящему изобретению. Описанные пептиды также могут включать дупликацию мотивов и другие модификации с консервативными заменами. Консервативные варианты описаны в настоящем описании и включают замену аминокислоты другой аминокислотой со сходным зарядом, размером или гидрофобностью и т.п.
Пептидные ингибиторы MASP-2 можно модифицировать для повышения растворимости и/или для максимизации положительного или отрицательного заряда для большего сходства с сегментом в интактном белке. Производное может иметь или может не иметь точную первичную аминокислотную структуру пептида, описанного в настоящем описании, при условии, что производное функционально сохраняет желаемое свойство ингибирования MASP-2. Модификации могут включать аминокислотную замену на одну из двадцати общеизвестных аминокислот или других аминокислот, дериватизированную или замещенную аминокислоту с дополнительными желаемыми характеристиками, такими как устойчивость к ферментативной деградации, или D-аминокислоту, или замену другой молекулой или соединением, таким как углевод, который имитирует природную конформацию и функцию аминокислоты, аминокислот или пептида; делецию аминокислоты; инсерцию одной из двадцати широко известных аминокислот или другой аминокислоты, дериватизированной или замещенной аминокислоты с дополнительными желаемыми характеристиками, такими как устойчивость к ферментативной деградации, или D-аминокислоты, или замещение другой молекулой или соединением, такими как углевод, который имитирует природную конформацию и функцию аминокислоты, аминокислот или пептида; или замещение другой молекулой или соединением, такими как мономер углевода или нуклеиновой кислоты, которые имитируют природную конформацию, распределение заряда и функцию родительского пептиды. Пептиды также могут быть модифицированы ацетилированием или амидированием.
Синтез производных ингибиторных пептидов может быть основан на известных способах биосинтеза пептидов, биосинтеза углеводов и т.п. В качестве исходной точки специалист может использовать подходящую компьютерную программу для определения конформации представляющего интерес пептида. После определения конформации пептида, описанного в настоящем описании, специалист может определить посредством рационального конструирования, какой тип замен можно вносить в один или несколько участков, чтобы получить производное, которое сохраняет основную конформацию и распределение заряда исходного пептида, но которое может обладать характеристиками, которые не присутствуют или усилены относительно характеристик, встречающихся в исходном пептиде. После идентификации производных молекул производные можно исследовать для определения того, функционируют ли они как средства, ингибирующие MASP-2, с использованием анализов, описанных в настоящем описании.
СКРИНИНГ ПЕПТИДНЫХ ИНГИБИТОРОВ MASP-2
Также можно использовать молекулярное моделирование и рациональное конструирование молекул для получения и скрининга пептидов, которые имитируют молекулярные структуры ключевых связывающих областей MASP-2 и ингибируют активность MASP-2 в отношении комплемента. Молекулярные структуры, используемые для моделирования, включают области CDR моноклональных антител против MASP-2, а также области-мишени, о которых известно, что они важны для функции MASP-2, включая область, требуемую для димеризации, область, вовлеченную в связывание MBL, и активный центр сериновой протеазы, как описано ранее. Способы идентификации пептидов, которые связываются с конкретной мишенью, хорошо известны в данной области. Например, для конструирования de novo макромолекулярных структур, таких как пептиды, которые связываются с конкретной молекулой, можно использовать молекулярный импринтинг. См., например, Shea, K.J., "Molecular Imprinting of Synthetic Network Polymers: The De Novo synthesis of Macromolecular Binding and Catalytic Sties", TRIP 2(5) 1994.
В качестве иллюстративного примера, один из способов получения миметиков связывающих MASP-2 пептидов является следующим. Функциональные мономеры известного связывающего MASP-2 пептида или связывающей области антитела против MASP-2, которое проявляет ингибирование MASP-2 (матрица), полимеризуют. Затем матрицу удаляют, а затем проводят полимеризацию второго класса мономеров в полости, оставленной матрицей, чтобы получить новую молекулу, которая проявляет одно или несколько желаемых свойств, которая сходна с матрицей. В дополнение к получению пептидов таким образом, также можно получать другие связывающие MASP-2 молекулы, которые представляют собой средства, ингибирующие MASP-2, такие как полисахариды, нуклеозиды, лекарственные средства, нуклеопротеины, липопротеины, углеводы, гликопротеины, стероиды, липиды и другие биологически активные материалы. Этот способ является пригодным для конструирования широкого множества биологических миметиков, которые являются более стабильными, чем их природные аналоги, поскольку их обычно получают свободно-радикальной полимеризацией функциональных мономеров, что приводит к соединению с небиодеградируемым остовом.
ПЕПТИДНЫЙ СИНТЕЗ
Пептидные ингибиторы MASP-2 можно получать с использованием способов, хорошо известных в данной области, таких как способ твердофазного синтеза, первоначально описанный Merrifield, J. Amer. Chem. Soc. 85:2149-2154, 1963. Автоматизированный синтез можно осуществлять, например, с использованием устройства для синтеза пептидов Applied Biosystems 431A Peptide Synthesizer (Foster City, Calif.) в соответствии с инструкциями, предоставляемыми изготовителем. Другой способ может быть найден, например, в Bodanszky, M., et al., Peptide Synthesis, второе издание, John Wiley & Sons, 1976, а также в другой справочной литературе, известной специалистам в данной области.
Пептиды также можно получать с использованием стандартных способов генной инженерии, известных специалистам в данной области. Например, пептид можно получать ферментативно путем встраивания нуклеиновой кислоты, кодирующей пептид, в экспрессирующий вектор, экспрессирующий ДНК, и трансляции ДНК в пептид в присутствии требуемых аминокислот. Затем пептид очищают с использованием хроматографических или электрофоретических способов, или посредством белка-носителя, который может быть слит с пептидом, а затем отщеплен от него, посредством встраивания в экспрессирующий вектор в рамке считывания кодирующей пептид последовательности и последовательности нуклеиновой кислоты, кодирующей белок-носитель. Слитую конструкцию белок-пептид можно выделять с использованием хроматографических, электрофоретических или иммунологических способов (таких как связывание со смолой через антитело к белку-носителю). Пептид можно отщеплять с использованием химической технологии или ферментативно, например, посредством гидролаз.
Пептидные ингибиторы MASP-2, которые являются пригодными в способе по изобретению, также можно продуцировать в рекомбинантных клетках-хозяевах в соответствии с общепринятыми способами. Для экспрессии последовательности, кодирующей пептидный ингибитор MASP-2, молекулу нуклеиновой кислоты, кодирующую пептид, функционально связывают с регуляторными последовательностями, которые контролируют транскрипционную экспрессию в экспрессирующем векторе, а затем вводят в клетку. В дополнение к регулирующим транскрипцию последовательностям, таким как промоторы и энхансеры, экспрессирующие векторы могут включать регулирующие трансляцию последовательности и маркерный ген, который пригоден для селекции клеток, которые содержат экспрессирующий вектор.
Молекулы нуклеиновой кислоты, которые кодируют пептидный ингибитор MASP-2, можно синтезировать с использованием "генных машин" с использованием протоколов, таких как способ фосфорамидитов. Если требуется химически синтезированная двухцепочечная ДНК для такого применения, как синтез гена или фрагмента гена, то каждую комплементарную цепь изготавливают отдельно. Получение коротких генов (от 60 до 80 пар оснований) является технически простым, и его можно проводить посредством синтеза комплементарных цепей, а затем их отжига. Для получения более длинных генов синтетические гены (двухцепочечные) собирают в модульной форме из одноцепочечных фрагментов, которые имеют длину от 20 до 100 нуклеотидов. Для обзора синтеза полинуклеотидов, см., например, Glick and Pasternak, "Molecular Biotechnology, Principles and Applications of Recombinant DNA", ASM Press, 1994; Itakura, K., et al., Annu. Rev. Biochem. 53:323, 1984; и Climie, S., et al., Proc. Nat'l Acad. Sci. USA 87:633, 1990.
НИЗКОМОЛЕКУЛЯРНЫЕ ИНГИБИТОРЫ
В некоторых вариантах осуществления средства, ингибирующие MASP-2, представляют собой низкомолекулярные ингибиторы, включающие природные и синтетические вещества, которые имеют низкую молекулярную массу, например, такие как пептиды, пептидомиметикы и непептидные ингибиторы (включая олигонуклеотиды и органические соединения). Низкомолекулярные ингибиторы MASP-2 можно получать, исходя из молекулярной структуры вариабельных областей антител против MASP-2.
Низкомолекулярные ингибиторы также можно конструировать и получать на основе кристаллической структуры MASP-2 с использованием компьютерного моделирования лекарственных средств (Kuntz I.D., et al., Science 257:1078, 1992). Кристаллическая структура MASP-2 крысы описана (Feinberg, H., et al., EMBO J. 22:2348-2359, 2003). С использованием способа, описанного Kuntz et al., координаты кристаллической структуры MASP-2 используют в качестве выходных данных для компьютерной программы, такой как DOCK, которая выдает перечень низкомолекулярных структур, для которых ожидается, что они будут связываться с MASP-2. Применение таких компьютерных программ хорошо известно специалисту в данной области. Например, кристаллическую структуру ингибитора протеазы ВИЧ-1 использовали для идентификации уникальных непептидных лигандов, которые являются ингибиторами протеазы ВИЧ-1, посредством оценки соответствия соединений, встречающихся в базе данных Cambridge Crystallographic database, участку связывания фермента с использованием программы DOCK (Kuntz, I.D., et al., J. Mol. Biol. 161:269-288, 1982; DesJarlais, R.L., et al., PNAS 87:6644-6648, 1990).
Набор низкомолекулярных структур, которые идентифицированы с использованием вычислительного способа в качестве потенциальных ингибиторов MASP-2, подвергают скринингу с использованием анализа связывания MASP-2, как описано в примере 10. Затем низкомолекулярные соединения, для которых обнаружено, что они связываются с MASP-2, анализируют в функциональном анализе, как описано в примере 2, для определения того, ингибируют ли они MASP-2-зависимую активацию комплемента.
РАСТВОРИМЫЕ РЕЦЕПТОРЫ MASP-2
Полагают, что другие пригодные средства, ингибирующие MASP-2, включают растворимые рецепторы MASP-2, которые можно получать с использованием способов, известных средним специалистам в данной области.
ИНГИБИТОРЫ ЭКСПРЕССИИ MASP-2
В другом варианте осуществления этого аспекта изобретения средство, ингибирующее MASP-2, представляет собой ингибитор экспрессии MASP-2, способный ингибировать MASP-2-зависимую активацию комплемента. При применении на практике этого аспекта изобретения репрезентативные ингибиторы экспрессии MASP-2 включают антисмысловые молекулы нуклеиновых кислот против MASP-2 (такие как антисмысловая мРНК, антисмысловая ДНК или антисмысловые олигонуклеотиды), рибозимы MASP-2 и молекулы РНК-i против MASP-2.
Антисмысловые молекулы РНК и ДНК действуют, прямо блокируя трансляцию мРНК MASP-2 посредством гибридизации с мРНК MASP-2 и препятствования трансляции белка MASP-2. Антисмысловую молекулу нуклеиновой кислоты можно конструировать рядом различных способов при условии, что она способна препятствовать экспрессии MASP-2. Например, антисмысловую молекулу нуклеиновой кислоты можно конструировать путем инвертирования кодирующей области (или ее части) кДНК MASP-2 (SEQ ID NO:4) относительно ее нормальной ориентации для транскрипции, чтобы обеспечить транскрипцию комплемента.
Антисмысловая молекула нуклеиновой кислоты обычно по существу идентична по меньшей мере части гена-мишени или генов-мишеней. Однако нуклеиновая кислота не должна быть абсолютно идентична для ингибирования экспрессии. Как правило, более высокую гомологию можно использовать для компенсации применения более короткой антисмысловой молекулы нуклеиновой кислоты. Минимальная процентная идентичность, как правило, превышает приблизительно 65%, однако более высокая процентная идентичность может проявлять более эффективную репрессию экспрессии эндогенной последовательности. Предпочтительной является существенно более высокая процентная идентичность, составляющая более чем приблизительно 80%, хотя наиболее предпочтительной является идентичность от приблизительно 95% до абсолютной идентичности.
Антисмысловая молекула нуклеиновой кислоты не должна иметь тот же паттерн интронов или экзонов, что и ген-мишени, и некодирующие сегменты гена-мишени могут быть в той же степени эффективными для достижения антисмыслового подавления экспрессии гена-мишени, что и кодирующие сегменты. В качестве антисмысловой молекулы нуклеиновой кислоты можно использовать последовательность ДНК размером по меньшей мере приблизительно 8 нуклеотидов или около того, хотя предпочтительной является более длинная последовательность. В рамках настоящего изобретения репрезентативным примером пригодного ингибирующего MASP-2 средства является антисмысловая молекула нуклеиновой кислоты MASP-2, которая по меньшей мере на девяносто процентов идентична комплементарной последовательности кДНК MASP-2, состоящей из последовательности нуклеиновой кислоты, указанной в SEQ ID NO:4. Последовательность нуклеиновой кислоты, указанная в SEQ ID NO:4, кодирует белок MASP-2, состоящий из аминокислотной последовательности, указанной в SEQ ID NO:5.
Нацеливание антисмысловых олигонуклеотидов для связывания мРНК MASP-2 является другим механизмом, который можно использовать для уменьшения уровня синтеза белка MASP-2. Например, синтез полигалактуроназы и мускаринового рецептора ацетилхолина 2 типа ингибируется антисмысловыми олигонуклеотидами, направленными на его соответствующие последовательности мРНК (патент США № 5739119, выданный Cheng, и патент США № 5759829, выданный Shewmaker). Более того, продемонстрированы примеры антисмыслового ингибирования для ядерного белка циклина, гена множественной устойчивости к лекарственным средствам (MDG1), ICAM-1, E-селектина, STK-1, стриарного рецептора GABAA и EGF человека (см., например, патент США № 5801154, выданный Baracchini; патент США № 5789573, выданный Baker; патент США № 5718709, выданный Considine; и патент США № 5610288, выданный Reubenstein).
Была описана система, которая позволяет специалисту в данной области определить, какие олигонуклеотиды являются пригодными для изобретения, и которая вовлекает исследование подходящих участков в мРНК-мишени с использованием расщепления РНК-азой H в качестве индикатора доступности последовательностей в транскриптах. Scherr, M., et al., Nucleic Acids Res. 26:5079-5085, 1998; Lloyd, et al., Nucleic Acids Res. 29:3665-3673, 2001. Смесь антисмысловых олигонуклеотидов, которые комплементарны определенным областям транскрипта MASP-2, добавляют к экстрактам клеток, экспрессирующих MASP-2, таких как гепатоциты, и гибридизуют для внесения участка уязвимости для РНК-азы H. Этот способ можно комбинировать с компьютеризованным выбором последовательности, который может прогнозировать выбор оптимальной последовательности для антисмысловых композиций на основе их относительной способности образовывать димеры, шпильки или другие вторичные структуры, которые могут снизить или предотвратить специфическое связывание с мРНК-мишенью в клетке-хозяине. Этот анализ вторичной структуры и оценку для выбора участка-мишени можно проводить с использованием программного обеспечения для анализа праймеров OLIGO (Rychlik, I., 1997) и программного обеспечения с алгоритмом BLASTN 2.0.5 (Altschul, S.F., et al., Nucl. Acids Res. 25:3389-3402, 1997). Антисмысловые соединения, направленные против последовательности-мишени, предпочтительно содержат от приблизительно 8 до приблизительно 50 нуклеотидов в длину. Особенно предпочтительными являются олигонуклеотиды, содержащие от приблизительно 9 до приблизительно 35 нуклеотидов или около того. Авторы изобретения подразумевают, что все композиции олигонуклеотидов в диапазоне от 9 до 35 нуклеотидов (т.е. олигонуклеотиды длиной 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, или 35 оснований или около того) являются в высокой степени предпочтительными для применения на практике способов на основе антисмысловых олигонуклеотидов по изобретению. Высокопредпочтительные области-мишени для мРНК MASP-2 представляют собой области, находящиеся в или вблизи кодона инициации трансляции AUG, и последовательности, которые по существу комплементарны 5'-областям мРНК, например, областям между -10 и +10 нуклеотидной последовательности гена MASP-2 (SEQ ID NO:4). Иллюстративные ингибиторы экспрессии MASP-2 представлены в таблице 4.
ИЛЛЮСТРАТИВНЫЕ ИНГИБИТОРЫ ЭКСПРЕССИИ MASP-2
Как отмечалось выше, термин "олигонуклеотид", как используют в рамках изобретения, относится к олигомеру или полимеру рибонуклеиновой кислоты (РНК) или дезоксирибонуклеиновой кислоты (ДНК) или их миметику. Этот термин также охватывает олигонуклеотидные основания, состоящие из встречающихся в природе нуклеотидов, сахаров и ковалентных межнуклеозидных (остов) связей, а также олигонуклеотиды, имеющие не встречающиеся в природе модификации. Эти модификации позволяют внесение определенных желаемых свойств, которые не обеспечиваются встречающимися в природе олигонуклеотидами, таких как снижение токсичности, увеличение устойчивости к деградации нуклеазами и усиление клеточного захвата. В иллюстративных вариантах осуществления антисмысловые соединения по изобретению отличаются от нативной ДНК модификацией фосфодиэфирного остова для продления времени полужизни антисмыслового олигонуклеотида, в котором фосфатные заместители заменены фосфоротиоатами. Аналогично, один или оба конца олигонуклеотида могут быть замещены одним или несколькими производными акридина, которые интеркалируют между соседними парами оснований в цепи нуклеиновой кислоты.
Другой альтернативой антисмысловой молекуле является использование "РНК-интерференции" (РНК-i). Двухцепочечные РНК (дцРНК) могут вызывать сайленсинг генов у млекопитающих in vivo. Природной функцией РНК-i и косуспрессии, по-видимому, является защита генома от вторжения подвижных генетических элементов, таких как ретротранспозоны и вирусы, которые продуцируют аберрантную РНК или дцРНК в клетке-хозяине, когда они становятся активными (см., например, Jensen, J., et al., Nat. Genet. 21:209-12, 1999). Двухцепочечную молекулу РНК можно получать путем синтеза двух цепей РНК, способных образовывать двухцепочечную молекулу РНК, каждая из которых имеет длину приблизительно от 19 до 25 (например, 19-23) нуклеотидов. Например, молекула дцРНК, пригодная в способах по изобретению, может содержать РНК, соответствующую последовательности, приведенной в таблице 4, и комплементарной ей последовательности. Предпочтительно, по меньшей мере одна цепь РНК имеет 3'-выступающий конец из 1-5 нуклеотидов. Синтезированные цепи РНК объединяются в условиях, которые формируют двухцепочечную молекулу. Последовательность РНК может содержать часть SEQ ID NO:4 из по меньшей мере 8 нуклеотидов с общей длиной 25 нуклеотидов или менее. Конструирование последовательностей миРНК для данной мишени входит в пределы квалификации специалиста в данной области. Доступны коммерческие службы, которые конструируют последовательность миРНК и гарантируют по меньшей мере 70% нокдаун экспрессии (Qiagen, Valencia, Calif).
дцРНК можно вводить в качестве фармацевтической композиции, и это можно осуществлять известными способами, которые вводят нуклеиновую кислоту в желаемую клетку-мишень. Широко используемые способы переноса генов включают способы с фосфатом кальция, DEAE-декстраном, электропорацию, микроинъекцию и вирусные способы. Такие способы описаны в Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons, Inc., 1993.
Также для уменьшения количества и/или биологической активности MASP-2 можно использовать рибозимы, такие как рибозимы, которые нацелены на мРНК MASP-2. Рибозимы представляют собой каталитические молекулы РНК, которые могут расщеплять молекулы нуклеиновой кислоты, имеющие последовательность, которая полностью или частично гомологична последовательности рибозима. Является возможным конструирование трансгенов рибозимов, которые кодируют РНК-рибозимы, которые специфически образуют пару с РНК-мишенью и расщепляют фосфодиэфирный остов в конкретном положении, тем самым функционально инактивируя РНК-мишень. При проведении этого расщепления рибозим сам по себе не изменяется, и, таким образом, способен рециклировать и расщеплять другие молекулы. Включение последовательностей рибозимов в антисмысловые РНК сообщает им активность расщепления РНК, тем самым повышая активность антисмысловых конструкций.
Рибозимы, пригодные для применения изобретения на практике, как правило, содержат гибридизующуюся область по меньшей мере приблизительно из девяти нуклеотидов, нуклеотидная последовательность которой комплементарна по меньшей мере части мРНК MASP-2, являющейся мишенью, и каталитическую область, которая адаптирована для расщепления мРНК MASP-2, являющейся мишенью (см., главным образом, EPA № 0 321 201; WO88/04300; Haseloff, J., et al., Nature 334:585-591, 1988; Fedor, M.J., et al., Proc. Natl. Acad. Sci. USA 87:1668-1672, 1990; Cech, T.R., et al., Ann. Rev. Biochem. 55:599-629, 1986).
Рибозимы могут быть либо нацелены на клетки в форме РНК-олигонуклеотидов, включающих последовательности рибозимов, либо они могут быть введены в клетку в качестве экспрессирующего вектора, кодирующего желаемую рибозимную РНК. Рибозимы можно использовать и применять в основном аналогично тому, как описано для антисмысловых полинуклеотидов.
Антисмысловые РНК и ДНК, рибозимы и молекулы РНК-i, пригодные в способах по изобретению, можно получать любым способом синтеза молекул ДНК и РНК, известным в данной области. Они включают способы химического синтеза олигодезоксирибонуклеотидов и олигорибонуклеотидов, хорошо известные в данной области, например, такие как твердофазный химический синтез с фосфорамидитами. Альтернативно молекулы РНК можно получать посредством транскрипции in vitro и in vivo последовательностей ДНК, кодирующих антисмысловую молекулу РНК. Такие последовательности ДНК можно включать в широкое множество векторов, которые включают пригодные промоторы РНК-полимеразы, такие как промоторы полимеразы T7 или SP6. Альтернативно антисмысловые конструкции кДНК, которые синтезируют антисмысловую РНК конститутивно или индуцибельно, в зависимости от используемого промотора, можно стабильно встраивать в клеточные линии.
Различные хорошо известные модификации молекул ДНК можно вносить в качестве средств повышения стабильности и времени полужизни. Пригодные модификации включают, но не ограничиваются ими, добавление фланкирующих последовательностей рибонуклеотидов или дезоксирибонуклеотидов на 5'- и/или 3'-концы молекулы или применение фосфоротиоата или 2' O-метила вместо фосфодиэстеразных связей в олигодезоксирибонуклеотидном остове.
VI. ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБЫ ДОСТАВКИ
ДОЗИРОВАНИЕ
В другом аспекте изобретение относится к композициям для ингибирования неблагоприятных эффектов MASP-2-зависимой активации комплемента у индивидуума, страдающего заболеванием или состоянием, как описано в настоящем описании, в том числе к введению индивидууму композиции, содержащей терапевтически эффективное количество средства, ингибирующего MASP-2, и фармацевтически приемлемый носитель. Средства, ингибирующие MASP-2, можно вводить индивидууму, нуждающемся в этом, в терапевтически эффективных дозах для лечения или смягчения состояний, ассоциированных с MASP-2-зависимой активацией комплемента. Терапевтически эффективная доза относится к количеству средства, ингибирующего MASP-2, достаточному для смягчения симптомов, ассоциированных с заболеванием или состоянием.
Токсичность и терапевтическую эффективность средств, ингибирующих MASP-2, можно определять с использованием стандартных фармацевтических методик, в которых используются экспериментальные модели на животных, такие как модель на мышах MASP-2-/-, экспрессирующих трансген MASP-2 человека, описанная в примере 1. С использованием таких моделей на животных NOAEL (отсутствие наблюдаемого уровня неблагоприятных эффектов) и MED (минимально эффективная доза) можно определять с использованием стандартных способов. Соотношение доз между эффектами NOAEL и MED представляет собой терапевтическое соотношение, которые выражают как соотношение NOAEL/MED. Средства, ингибирующие MASP-2, которые проявляют большие терапевтические отношения или индексы, являются наиболее предпочтительными. Данные, полученные из анализа клеточных культур и исследований на животных, можно использовать при составлении ряда дозировок для применения у человека. Дозировка средства, ингибирующего MASP-2, предпочтительно лежит в диапазоне циркулирующих концентраций, которые включают MED с небольшой токсичностью или без токсичности. Дозировка может варьироваться в этом диапазоне в зависимости от используемой дозированной формы и используемого пути введения.
Для любого состава соединения терапевтически эффективная доза может быть оценена с использованием моделей на животных. Например, дозу можно составлять в модели на животных для достижения диапазона циркулирующих концентраций в плазме, который включает MED. Количественные уровни средства, ингибирующего MASP-2, в плазме также можно измерять, например, с использованием высокоэффективной жидкостной хроматографии.
В дополнение к исследованиям токсичности, эффективную дозировку также можно оценивать, исходя из количества белка MASP-2, присутствующего у живого индивидуума, и аффинности средства, ингибирующего MASP-2. Было показано, что уровни MASP-2 у нормальных людей присутствуют в сыворотке на низких уровнях в диапазоне 500 нг/мл, и уровни MASP-2 у конкретного индивидуума можно определять с использованием количественного анализа MASP-2, описанного в Moller-Kristensen M., et al., J. Immunol. Methods 282:159-167, 2003.
Как правило, дозировка вводимых композиций, содержащих средства, ингибирующие MASP-2, варьируется в зависимости от таких факторов, как возраст индивидуума, масса тела, рост, пол, общее медицинское состояние и предшествующий медицинский анамнез. В качестве иллюстрации, средства, ингибирующие MASP-2, такие как антитела против MASP-2, можно вводить в диапазонах дозировок приблизительно от 0,010 до 10,0 мг/кг, предпочтительно от 0,010 до 1,0 мг/кг, более предпочтительно от 0,010 до 0,1 мг/кг массы тела индивидуума. В некоторых вариантах осуществления композиция содержит комбинацию антител против MASP-2 и пептидных ингибиторов MASP-2.
Терапевтическую эффективность ингибирующих MASP-2 композиций и способов по настоящему изобретению у данного индивидуума и соответствующие дозировки можно определять в соответствии с анализами комплемента, хорошо известными специалистам в данной области. Комплемент продуцирует многочисленные специфические продукты. В ходе последнего десятилетия были разработаны чувствительные и специфические анализы, и они являются коммерчески доступными для большинства из этих продуктов активации, включая малые фрагменты активации C3a, C4a и C5a, и большие фрагменты активации iC3b, C4d, Bb и sC5b-9. В большинстве из этих анализов используются моноклональные антитела, которые реагируют с новыми антигенами (неоантигены), экспонированными на фрагменте, но не на нативных белках, из которых они образованы, что делает эти анализы очень простыми и специфическими. Большинство из них основаны на технологии ELISA, хотя для C3a и C5a все еще иногда используют радиоиммунный анализ. Эти последние анализы измеряют как непроцессированные фрагменты, так и их фрагменты "дез-Arg", которые являются основными формами, встречающимися в кровотоке. Непроцессированные фрагменты и C5aдез-Arg быстро выводятся посредством связывания с рецепторами клеточной поверхности и, таким образом, присутствуют в очень низких концентрациях, в то время как C3aдез-Arg не связывается с клетками и накапливается в плазме. Измерение C3a обеспечивает чувствительный независимый от каскада индикатор активации комплемента. Активация альтернативного пути может быть оценена путем измерения Bb-фрагмента. Обнаружение жидкофазного продукта активации мембраноатакующего пути, sC5b-9, обеспечивает доказательство того, что комплемент активируется вплоть до завершения. Поскольку как лектиновый, так и классический, пути образуют одни и те же продукты активации C4a и C4d, количественное этих двух фрагментов не дает никакой информации о том, какие из этих двух путей привели к продуктам активации.
Ингибирование MASP-2-зависимой активации комплемента характеризуется по меньшей мере одним из следующих изменений в компоненте системы комплемента, которое происходит в результате введения средства, ингибирующего MASP-2, в соответствии со способами по изобретению: ингибирование образования или продукции продуктов MASP-2-зависимой активации системы комплемента C4b, C3a, C5a и/или C5b-9 (MAC) (при измерении, например, как описано в примере 2), снижение расщепления C4 и депонирования C4b (измеряемые, например, как описано в примере 10), или снижение расщепления C3 и депонирования C3b (измеряемые, например, как описано в примере10).
ДОПОЛНИТЕЛЬНЫЕ СРЕДСТВА
Композиции и способы, содержащие средства, ингибирующие MASP-2, необязательно могут содержать одно или несколько дополнительных лекарственных средств, которые могут усиливать активность средства, ингибирующего MASP-2, или которые обеспечивают сходные терапевтические функции аддитивно или синергически. Например, в контексте лечения индивидуума, страдающего TTP, где индивидуум является положительным по ингибитору ADAM-TS13, одно или несколько средств, ингибирующих MASP-2, можно вводить в комбинации (включая совместное введение) с одним или несколько иммунодепрессивными средствами. Пригодные иммунодепрессивные средства включают: кортикостероиды, ритуксан, циклоспорин и т.п. В контексте лечения индивидуума, страдающего или имеющего риск развития HUS или aHUS, одно или несколько средств, ингибирующих MASP-2, можно вводить в комбинации (включая совместное введение) с подходящим антибиотиком. В контексте лечения индивидуума, страдающего или имеющего риск развития aHUS, оно или несколько средств, ингибирующих MASP-2, можно вводить в комбинации (включая совместное введение) с другими средствами, ингибирующими комплемент, такими как экулизумаб (Soliris), TT-30, антитело к фактору B или другие средства, которые ингибируют терминальные компоненты комплемента или усиление альтернативного пути.
Включение и выбор дополнительного средства(средств) будут определяться так, чтобы достигнуть желаемого терапевтического результата. В некоторых вариантах осуществления средство, ингибирующее MASP-2, можно вводить в комбинации с одним или несколькими противовоспалительными и/или болеутоляющими средствами. Пригодные противовоспалительные и/или болеутоляющие средства включают: антагонисты серотониновых рецепторов; агонисты серотониновых рецепторов; антагонисты гистаминовых рецепторов; антагонисты брадикининовых рецепторов; ингибиторы калликреина; антагонисты рецептора тахикинина, включая антагонисты подтипов рецепторов нейрокинина1 и нейрокинина2; антагонисты рецептора пептида, родственного гену кальцитонина (CGRP); антагонисты рецепторов интерлейкинов; ингибиторы ферментов, активных в путях синтеза метаболитов арахидоновой кислоты, включая ингибиторы фосфолипазы, включая ингибиторы изоформы PLA2 и ингибиторы изоформы PLCγ, ингибиторы циклооксигеназы (COX) (которые могут представлять собой ингибиторы COX-1, COX-2 или неселективные ингибиторы COX-1 и -2), ингибиторы липооксигеназы; антагонисты простаноидных рецепторов, включая антагонисты подтипов рецепторов эйкозаноидов EP-1 и EP-4 и антагонисты подтипов тромбоксановых рецепторов; антагонисты рецепторов лейкотриенов, включая антагонисты подтипа рецептора лейкотриена B4 и антагонисты подтипа рецептора лейкотриена D4; агонисты опиоидных рецепторов, включая агонисты подтипа μ-опиоидных, δ-опиоидных и κ-опиоидных рецепторов; агонисты и антагонисты пуринергическых рецепторов, включая антагонисты рецептора P2X и агонисты рецептора P2Y; средства, открывающие трифосфат (ATP)-чувствительные калиевые каналы; ингибиторы MAP-киназы; никотиновые ингибиторы ацетилхолина и агонисты альфа-адренергических рецепторов (включая агонисты альфа-1, альфа-2 и неселективные агонисты альфа-1 и 2).
Средства, ингибирующие MASP-2, по настоящему изобретению также можно вводить в комбинации с одним или несколькими другими ингибиторами комплемента, такими как ингибитор C5. В настоящее время экулизумаб (Solaris®), антитело против C5, является единственным нацеленным на комплемент лекарственным средством, которое было одобрено для применения у человека. Однако для некоторых фармакологических средств было показано, что они блокируют комплемент in vivo. K76COOH и нафамстат мезилат представляют собой два средства, которые продемонстрировали некоторую эффективность в моделях трансплантации на животных (Miyagawa, S., et al., Transplant Proc. 24:483-484, 1992). Также показано, что низкомолекулярные гепарины являются эффективными в отношении регуляции активности комплемента (Edens, R.E., et al., Complement Today, pp. 96-120, Basel: Karger, 1993). Полагают, что эти низкомолекулярные ингибиторы могут быть полезными средствами для применения в комбинации со средствами, ингибирующими MASP-2, по настоящему изобретению.
В комбинации со средствами, ингибирующими MASP-2, по настоящему изобретению можно использовать другие встречающиеся в природе ингибиторы комплемента. Биологические ингибиторы комплемента включают растворимый фактор комплемента 1 (sCR1). Они представляют собой встречающийся в природе ингибитор, который может быть найден на наружной мембране клеток человека. Другие мембранные ингибиторы включают DAF, MCP и CD59. Рекомбинантные формы исследовали в отношении их активности против комплемента in vitro и in vivo. Показано, что sCR1 является эффективным при ксенотрансплантации, где система комплемента (как альтернативная, так и классическая) обеспечивает пусковой механизм для синдрома гиперактивного отторжения в пределах нескольких минут после начала перфузии крови через новый трансплантированный орган (Platt, J.L., et al., Immunol. Today 11:450-6, 1990; Marino, I.R., et al., Transplant Proc. 1071:6, 1990; Johnstone, P.S., et al., Transplantation 54:573-6, 1992). Применение sCR1 защищает и продлевает время выживаемости трансплантированного органа, что указывает на вовлечение пути комплемента в патогенез выживания органа (Leventhal, J.R., et al., Transplantation 55:857-66, 1993; Pruitt, S.K., et al., Transplantation 57:363-70, 1994).
Подходящие дополнительные ингибиторы комплемента для применения в комбинации с композициями по настоящему изобретению также включают, в качестве примера, MoAb, такие как антитело против C5 (например, экулизумаб), разработанное Alexion Pharmaceuticals, Inc., New Haven, Connecticut, и MoAb против пропердина.
ФАРМАЦЕВТИЧСКИЕ НОСИТЕЛИ И ПЕРЕНОСЧИКИ ДЛЯ ДОСТАВКИ
Как правило, композиции средств, ингибирующих MASP-2, по настоящему изобретению в комбинации с любыми другими выбранными лекарственными средствами, в подходящем случае содержатся в фармацевтически приемлемом носителе. Носитель является нетоксичным, биологически совместимым и выбран таким образом, чтобы он не оказывал отрицательного эффекта на биологическую активность средства, ингибирующего MASP-2 (и любых других лекарственных средств, комбинируемых с ним). Иллюстративные фармацевтически приемлемые носители для пептидов описаны в патенте США № 5211657, выданным Yamada. Антитела против MASP-2 и ингибиторные пептиды, пригодные в рамках изобретения, можно составлять в качестве препаратов в твердой, полутвердой, гелеобразной, жидкой или газообразной формах, таких как таблетки, капсулы, порошки, гранулы, мази, растворы, депо-составы, ингалируемые средства и инъекции, позволяющие пероральное, парентеральное или хирургическое введение. Также изобретение предусматривает местное введение композиций посредством покрытия медицинских устройств и т.п.
Подходящие носители для парентеральной доставки посредством инъекции, инфузии или ирригации включают дистиллированную воду, физиологический фосфатно-солевой буфер, нормальные или лактатные растворы Рингера, раствор декстрозы, раствор Хенкса или пропандиол. Кроме того, в качестве растворителя или суспендирующей среды можно использовать стерильные жирные масла. Для этой цели можно использовать любое биосовместимое масло, включая синтетические моно- или диглицериды. Кроме того, для получения инъекционных препаратов пригодны жирные кислоты, такие как олеиновая кислота. Носитель и средство можно составлять в качестве жидкости, суспензии, полимеризующегося или неполимеризующегося геля, пасты или мази.
Носитель также может содержать носитель для доставки, чтобы обеспечить (т.е. пролонгировать, отсрочить или регулировать) доставку средства(средств) или чтобы усилить доставку, всасывание, стабильность или фармакокинетику лекарственного средства(средств). Такой носитель для доставки может включать, в качестве неограничивающего примера микрочастицы, микросферы, наносферы или наночастицы, состоящие из белков, липосом, углеводов, синтетических органических соединений, неорганических соединений, полимерных или сополимерных гидрогелей и полимерных мицелл. Пригодные системы доставки на основе гидрогелей и мицелл включают сополимеры PEO:PHB:PEO и комплексы сополимер/циклодекстрин, описанные в WO 2004/009664 A2, и комплексы PEO и PEO/циклодекстрин, описанные в публикации патентной заявки США № 2002/0019369 A1. Такие гидрогели можно инъецировать локально в область предполагаемого действия, или подкожно или внутримышечно для получения депо с замедленным высвобождением.
Для внутрисуставной доставки средство, ингибирующее MASP-2, может содержаться в описанных выше жидких или гелеобразных носителях, которые являются инъекционными, описанных выше носителях для доставки с замедленным высвобождением, которые являются инъекционными, или гиалуроновой кислоте или производном гиалуроновой кислоты.
Для перорального введения непептидергических средств, средство, ингибирующее MASP-2, может содержаться в инертном наполнителе или разбавителе, таком как сахароза, кукурузный крахмал или целлюлоза.
Для местного введения средство, ингибирующее MASP-2, может содержаться в мази, лосьоне, креме, геле, каплях, суппозитории, спрее, жидкости или порошке, или в геле или микрокапсульных системах доставки через трансдермальный пластырь.
Различные назальные и легочные системы доставки, включая аэрозоли, ингаляторы отмеренной дозы, ингаляторы сухого порошка и небулайзеры, находятся на стадии разработки и могут быть пригодным образом адаптированы для доставки по настоящему изобретению в аэрозоле, ингаляционном носителе или распыляемом носителе для доставки, соответственно.
Для интратекальной (IT) или интрацеребровентрикулярной (ICV) доставки можно использовать должным образом стерильные системы доставки (например, жидкости; гели, суспензии и т.д.) для введения настоящего изобретения.
Композиции по настоящему изобретению также могут включать биосовместимые эксципиенты, такие как диспергирующие или смачивающие вещества, суспендирующие вещества, разбавители, буферы, усилители проникновения, эмульгаторы, связующие вещества, загустители, вкусовые добавки (для перорального введения).
ФАРМАЦЕВТИЧЕСКИЕ НОСИТЕЛИ ДЛЯ АНТИТЕЛ И ПЕПТИДОВ
Более конкретно, что касается антител против MASP-2 и ингибиторных пептидов, иллюстративные составы можно вводить парентерально в качестве инъекционных дозировок раствора или суспензии соединения в физиологически приемлемом разбавителе с фармацевтическим носителем, который может представлять собой стерильную жидкость, такую как вода, масла, физиологический раствор, глицерин или этанол. Кроме того, в композициях, содержащих антитела против MASP-2 и ингибиторные пептиды, могут присутствовать вспомогательные вещества, такие как смачивающие средства или эмульгаторы, поверхностно-активные вещества, pH-буферные вещества и т.п. Дополнительные компоненты фармацевтических композиций включают вазелин (такой как вазилин животного, растительного или синтетического происхождения), например, соевое масло и минеральное масло. Как правило, предпочтительными жидкими носителями для инъекционных растворов являются гликоли, такие как пропиленгликоль или полиэтиленгликоль.
Антитела против MASP-2 и ингибиторные пептиды также можно вводить в форме депо-инъекции или имплантируемого препарата, который может быть составлен таким образом, чтобы обеспечить замедленное или импульсное высвобождение активных веществ.
ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ НОСИТЕЛИ ДЛЯ ЭКСПРЕССИИ ИНГИБИТОРОВ
Более конкретно, что касается ингибиторов экспрессии, пригодных в способах по изобретению, предусматриваются композиции, которые содержат ингибитор экспрессии, как описано выше, и фармацевтически приемлемый носитель или разбавитель. Кроме того, композиция может содержать коллоидную дисперсионную систему.
Фармацевтические композиции, которые включают ингибиторы экспрессии, могут включать, но не ограничиваться ими, растворы, эмульсии и содержащие липосомы составы. Эти композиции можно получать из различных компонентов, которые включают, но не ограничиваются ими, предварительно сформированные жидкости, самоэмульгирующиеся твердые вещества и самоэмульгирующиеся полутвердые вещества. Получение таких композиций, как правило, вовлекает комбинирование ингибитора экспрессии с одним или несколькими из следующих: буферы, антиоксиданты, низкомолекулярные полипептиды, белки, аминокислоты, углеводы, включая глюкозу, сахарозу или декстрины, хелатирующие агенты, такие как EDTA, глутатион и другие стабилизаторы и эксципиенты. Примерами пригодных разбавителей являются нейтральный забуференный физиологический раствор или физиологический раствор, смешанный с неспецифическим сывороточным альбумином.
В некоторых вариантах осуществления композиции можно получать и составлять в качестве эмульсий, которые обычно представляют собой гетерогенные системы из одной жидкости, диспергированной в другой, в форме капель (см., Idson, Pharmaceutical Dosage Forms, Vol. 1, Rieger and Banker (eds.), Marcek Dekker, Inc., N.Y., 1988). Примеры встречающихся в природе эмульгаторов, используемых в эмульсионных составах, включают гуммиарабик, пчелиный воск, ланолин, лецитин и фосфатиды.
В одном варианте осуществления композиции, включающие нуклеиновые кислоты, можно составлять в качестве микроэмульсий. Микроэмульсия, как используют в рамках изобретения, относится к системе воды, масла и амфифильного вещества, которая представляет собой простой оптически изотропный и термодинамический стабильный жидкий раствор (см. Rosoff, Pharmaceutical Dosage Forms, Vol. 1). В способе по изобретению также могут использоваться липосомы для переноса и доставки антисмысловых олигонуклеотидов в желаемую область.
Фармацевтические композиции и составы ингибиторов экспрессии для местного введения могут включать трансдермальные пластыри, мази, лосьоны, кремы, гели, капли, суппозитории, спреи, жидкости и порошки. Можно использовать общепринятые фармацевтические носители, а также водные, порошковые и масляные основы и загустители и т.п.
СПОСОБЫ ВВЕДЕНИЯ
Фармацевтические композиции, содержащие средства, ингибирующие MASP-2, можно вводить рядом путей, в зависимости от того, местный или системный способ введения является наиболее подходящим для подвергаемого лечению состояния. Кроме того, как описано в настоящем описании выше в отношении процедур экстракорпоральной реперфузии, средства, ингибирующие MASP-2, можно вводить путем введения композиций по настоящему изобретению в рециркулирующую кровь или плазму. Кроме того, композиции по настоящему изобретению можно доставлять путем нанесения или включения композиции на или в имплантируемое медицинское устройство.
СИСТЕМНАЯ ДОСТАВКА
Как используют в рамках изобретения, термины "системная доставка" и "системное введение" включают, но не ограничиваются ими, пероральный и парентеральный пути, включая внутримышечный (в/м), подкожный, внутривенный (в/в), внутриартериальный, ингаляционный, сублингвальный, буккальный, местный, трансдермальный, назальный, ректальный, вагинальный и другие пути введения, которые эффективно приводят к распределению доставляемого средства в одну или несколько областей предполагаемого терапевтического действия. Предпочтительные пути системной доставки для настоящих композиций включают внутривенный, внутримышечный, подкожный и ингаляционный. Будет понятно, что конкретный системный путь введения используемых выбранных средств в конкретных композициях по настоящему изобретению будет частично определяться с учетом чувствительности средства к путям метаболической трансформации, ассоциированным с данным путем введения. Например, для пептидергических средств наиболее пригодными путями введения являются пути, отличные от перорального.
Ингибиторные антитела и полипептиды против MASP-2 можно доставлять индивидууму, нуждающемуся в этом, любыми подходящими способами. Способы доставки антител и полипептидов против MASP-2 включают введение посредством перорального, легочного, парентерального (например, внутримышечная, внутрибрюшинная, внутривенная (в/в) или подкожная инъекция), ингаляционного (например, посредством состава в виде тонкого порошка), трансдермального, назального, вагинального, ректального или сублингвального путей введения, и их можно доставлять в дозированных формах, пригодных для каждого пути введения.
В качестве репрезентативного примера, ингибиторные антитела и пептиды против MASP-2 можно вводить в живой организм с путем нанесения на оболочку организма, способную всасывать полипептиды, например, назальную, желудочно-кишечную и ректальную оболочки. Полипептиды, как правило, наносят на всасывающую оболочку совместно со средством, усиливающим проникновение (см., например, Lee, V.H.L., Crit. Rev. Ther. Drug Carrier Sys. 5:69, 1988; Lee, V.H.L., J. Controlled Release 13:213, 1990; Lee, V.H.L., Ed., Peptide and Protein Drug Delivery, Marcel Dekker, New York (1991); DeBoer, A.G., et al., J. Controlled Release 13:241, 1990.) Например, STDHF представляет собой синтетическое производное фусидовой кислоты - стероидного поверхностно-активного вещества, которое имеет сходную структуру с желчными солями, и его используют в качестве средства, усиливающее проникновение, для назальной доставки (Lee, W.A., Biopharm. 22, Nov./Dec. 1990).
Ингибиторные антитела и полипептиды против MASP-2 можно вводить совместно с другой молекулой, такой как липид, для защиты полипептидов от ферментативной деградации. Например, ковалентное связывание полимеров, особенно полиэтиленгликоля (PEG), используют для защиты определенных белков от ферментативного гидролиза в организме и, таким образом, продления времени полужизни (Fuertges, F., et al., J. Controlled Release 11:139, 1990). Для доставки белков описано множество полимерных систем (Bae, Y.H., et al., J. Controlled Release 9:271, 1989; Hori, R., et al., Pharm. Res. 6:813, 1989; Yamakawa, I., et al., J. Pharm. Sci. 79:505, 1990; Yoshihiro, I., et al., J. Controlled Release 10:195, 1989; Asano, M., et al., J. Controlled Release 9:111, 1989; Rosenblatt, J., et al., J. Controlled Release 9:195, 1989; Makino, K., J. Controlled Release 12:235, 1990; Takakura, Y., et al., J. Pharm. Sci. 78:117, 1989; Takakura, Y., et al., J. Pharm. Sci. 78:219, 1989).
Недавно были разработаны липосомы с увеличенной стабильностью в сыворотке и временем полужизни в кровотоке (см., например, патент США № 5741516, выданный Webb). Более того, были описаны различные способы с липосомами или подобными липосомам препаратами в качестве потенциальных носителей лекарственных средств (см., например, патент США № 5567434, выданный Szoka; патент США № 5552157, выданный Yagi; патент США № 5565213, выданный Nakamori; патент США № 5738868, выданный Shinkarenko; и патент США № 5795587, выданный Gao).
Для трансдермальных применений ингибиторные антитела против и полипептиды против MASP-2 можно комбинировать с другими подходящими ингредиентами, такими как носители и/или адъюванты. Отсутствуют ограничения на природу таких других ингредиентов, за исключением того, что они должны быть фармацевтически приемлемыми для их предполагаемого введения и не могут нарушать активность активных ингредиентов композиции. Примеры пригодных носителей включают мази, кремы, гели или суспензии, с очищенным коллагеном или без него. Ингибиторными антителами и полипептидами против MASP-2 также можно пропитывать трансдермальные пластыри, гипсы и повязки, предпочтительно в жидкой или полужидкой форме.
Композиции по настоящему изобретению можно системно вводить периодически с интервалами, определенными так, чтобы поддерживать желаемый уровень терапевтического эффекта. Например, композиции можно вводить, например посредством подкожной инъекции, каждые от двух до четырех недель или с менее частыми интервалами. Режим дозирования будет определять врач с учетом различных факторов, которые могут влиять на действие комбинации средств. Эти факторы включают степень прогрессирования состояния, подвергаемого лечению, возраст, пол и массу тела пациента и другие клинические факторы. Дозировка каждого индивидуального средства варьируется в зависимости от функции средства, ингибирующего MASP-2, которое включено в композицию, а также присутствия и природы любого носителя для доставки лекарственного средства (например, носитель для доставки с замедленным высвобождением). Кроме того, величину дозировки можно корректировать, чтобы учитывать варьирование частоты введения и фармакокинетическое поведение доставляемого средства(средств).
МЕСТНАЯ ДОСТАВКА
Как используют в рамках изобретения, термин "местный" охватывает применение лекарственного средства в или в области предполагаемого действия, и он включает, например, локальную доставку на кожу или другие поврежденные ткани, офтальмологическую доставку, интратекальное (IT), интацеребровентрикулярное (ICV), внутрисуставное, внутриполостное, внутричерепное или внутрипузырное введение, установку или ирригацию. Местное введение может быть предпочтительным для обеспечения введения более низкой дозы, чтобы избежать системных побочных эффектов, и для более точного контроля времени доставки и концентрации активных веществ в области местной доставки. Локальное введение обеспечивает известную концентрацию в заданной области независимо от вариабельности метаболизма, кровотока и т.д. между пациентами. Также посредством прямого способа доставки обеспечивается усовершенствованный контроль дозирования.
Местную доставку средства, ингибирующего MASP-2, можно осуществлять в контексте хирургических способов для лечения заболевания или состояния, как например, в ходе таких процедур, как хирургическая операция по артериальному шунтированию, атерэктомия, лазерные процедуры, ультразвуковые процедуры, баллонная ангиопластика и установка стента. Например, ингибитор MASP-2 можно вводить индивидууму совместно с процедурой баллонной ангиопластики. Процедура баллонной ангиопластики вовлекает установку катетера, имеющего ненакачанный баллон, в артерию. Ненакачанный баллон располагают вблизи атеросклеротической бляшки и надувают так, чтобы бляшка прижималась к сосудистой стенке. В результате поверхность баллона находится в контакте со слоем эндотелиальных клеток сосудов на поверхности кровеносного сосуда. Средство, ингибирующее MASP-2, может быть связано с катетером для баллонной ангиопластики так, чтобы позволить высвобождение средства в области атеросклеротической бляшки. Средство можно связывать с баллонным катетером стандартными методиками, известными в данной области. Например, средство может храниться в отделении баллонного катетера до тех пор, пока баллон не начинают надувать, и в этот момент оно высвобождается в локальную окружающую среду. Альтернативно поверхность баллонного катетера может быть пропитана средством, так что оно контактирует с клетками стенки артерий, когда баллон надувают. Средство также можно доставлять в перфорированном баллонном катетере, таком как катетеры, описанные в Flugelman, M.Y., et al., Circulation 85:1110-1117, 1992. Также см. опубликованную заявку PCT WO 95/23161 для иллюстративной методики связывания терапевтического белка с катетером для баллонной ангиопластики. Аналогично, средство, ингибирующее MASP-2, может быть включено в гель или полимерное покрытие, наносимое на стент, или может быть включено в материал стента, так что стент элюирует средство, ингибирующее MASP-2, после установки в сосуд.
Ингибирующие MASP-2 композиции, используемые для лечения артритов и других скелетно-мышечных нарушений, можно локально доставлять посредством внутрисуставной инъекции. Такие композиции в подходящем случае могут включать носитель для доставки с замедленным высвобождением. В качестве следующего примера случаев, при которых может быть желательной местная доставка, ингибирующие MASP-2 композиции, используемые для лечения состояний мочеполовой системы, в подходящем случае можно капельно вливать внутрь мочевого пузыря или внутрь другой структуры мочеполовой системы.
ПОКРЫТИЕ МЕДИЦИНСКОГО УСТРОЙСТВА
Ингибирующие MASP-2 средства, такие как антитела и ингибиторные пептиды, можно иммобилизовывать на (или в) поверхности имплантируемого или прикрепляемого медицинского устройства. Модифицированная поверхность, как правило, находится в контакте с живой тканью после имплантации в организм животного. Под "имплантируемым или прикрепляемым медицинским устройством" подразумевают любое устройство, которое имплантируют в или прикрепляют на ткань организма животного, в процессе нормального функционирования устройства (например, стенты и имплантируемые устройства для доставки лекарственных средств). Такие имплантируемые или прикрепляемые медицинские устройства могут быть изготовлены, например, из нитроцеллюлозы, диазоцеллюлозы, стекла, полистирола, поливинилхлорида, полипропилена, полиэтилена, декстрана, сефарозы, агара, крахмала, нейлона, нержавеющей стали, титана и биодеградируемых и/или биосовместимых полимеров. Связывание белка с устройством можно осуществлять любым способом, который не нарушает биологическую активность связанного белка, например, путем связывания одного или обоих из N- или C-концевых остатков белка с устройством. Также связывание можно осуществлять в одном или нескольких внутренних участках белка. Также можно использовать множественное связывание (как внутреннее, так и на концах белка). Поверхность имплантируемого или прикрепляемого медицинского устройства может быть модифицирована так, чтобы она включала функциональные группы (например, карбоксильную, амидную, амино, простую эфирную, гидроксильную, циано, нитридо, сульфонамидо, ацетилиновую, эпоксидную, силановую, ангидридную, сукциниминовую, азидо) для иммобилизации на ней белка. Химия связывания включает, но не ограничиваются ими, образование сложных эфиров, простых эфиров, амидов, азидо и сульфонамидопроизводных, цианатных и других связей с функциональными группами, доступными на антителах против MASP-2 или ингибиторных пептидах. Антитела против MASP-2 или ингибиторные фрагменты также могут быть нековалентно связаны посредством присоединения последовательности аффинной метки к белку, такому как GST (D.B. Smith and K.S. Johnson, Gene 67:31, 1988), полигистидину (E. Hochuli et al., J. Chromatog. 411:77, 1987) или биотину. Такие аффинные метки можно использовать для обратимого присоединения белка к устройству.
Белки также можно ковалентно связывать с поверхностью корпуса устройства, например, посредством ковалентной активации поверхности медицинского устройства. В качестве репрезентативного примера, матриклеточный белок(белки) можно связывать с корпусом устройства посредством любой из следующих пар реакционноспособных групп (один член пары присутствует на поверхности корпуса устройства, а другой член пары присутствует на матриклеточном белке(ах): гидроксил/карбоновая кислота с образованием сложноэфирной связи; гидроксил/ангидрид с образованием сложноэфирной связи; гидроксил/изоцианат с образованием уретановой связи. Поверхность корпуса устройства, которая не обладает пригодными реакционноспособными группами, можно обрабатывать посредством гравировки с использованием плазмы высокочастотного разряда (RFGD) для образования реакционноспособных групп, чтобы обеспечить депонирование матриклеточного белка(ов) (например, обработка кислородной плазмой для внесения кислородсодержащих групп; обработка пропиламиновой плазмой для внесения аминогрупп).
Ингибирующие MASP-2 средства, содержащие молекулы нуклеиновой кислоты, такие как антисмысловые молекулы, РНК-i или ДНК, кодирующие пептидные ингибиторы, могут быть заключены в пористые матрицы, связанные с корпусом устройства. Репрезентативные пористые матрицы, пригодные для получения поверхностного слоя, представляют собой матрицы, получаемые из коллагена сухожилий или кожи, которые могут быть получены от различных коммерческих поставщиков (например, Sigma and Collagen Corporation), или коллагеновые матрицы, получаемые, как описано в патентах США № 4394370, выданном Jefferies, и 4975527, выданном Koezuka. Один коллагеновый материал называется UltraFiber™, и его получают от Norian Corp. (Mountain View, California).
Также если желательно можно использовать определенные полимерные матрицы, и они включают акриловые полимеры сложных эфиров и полимеры молочной кислоты, как описано, например, в патентах США № 4526909 и 4563489, выданных Urist. Конкретные примеры пригодных полимеров представляют собой полимеры сложных ортоэфиров, ангидридов, сополимеры пропилена и фумаратов, или полимер из одного или нескольких мономеров α-гидрокси карбоновых кислот, (например, α-гидроксиуксусная кислота (гликолевая кислота) и/или α-гидроксипропионовая кислота (молочная кислота)).
РЕЖИМЫ ЛЕЧЕНИЯ
При профилактических применениях фармацевтические композиции вводят индивидууму, предрасположенному или имеющему иной риск состояния, ассоциированного с MASP-2-зависимой активацией комплемента, в количестве, достаточном для устранения или снижения риска развития симптомов состояния. При терапевтических применениях фармацевтические композиции вводят индивидууму, предрасположенному или уже страдающему состоянием, ассоциированным с MASP-2-зависимой активацией комплемента, в терапевтически эффективном количестве, достаточном для смягчения или по меньшей мере частичного снижения симптомов состояния. Как в профилактическом, так и в терапевтическом режимах, композиции, содержащие средства, ингибирующие MASP-2, можно вводить в нескольких дозировках до тех пор, пока не будет достигнут желаемый терапевтический исход у индивидуума. Применение ингибирующих MASP-2 композиций по настоящему изобретению можно осуществлять посредством однократного введения композиции или ограниченной последовательности введений для лечения острого состояния, например, реперфузионного повреждения или другого травматического повреждения. Альтернативно композицию можно вводить с периодическими интервалами на протяжении длительного периода времени для лечения хронических состояний, например, артрита или псориаза.
Способы и композиции по настоящему изобретению можно использовать для ингибирования воспаления и родственных процессов, которые, как правило, являются результатом диагностических и терапевтических медицинских и хирургических процедур. Для ингибирования таких процессов ингибирующую MASP-2 композицию по настоящему изобретению можно использовать во время проведения процедуры. Как используют в рамках изобретения "во время процедуры" относится к введению ингибиторной композиции до процедуры и/или в ходе процедуры и/или после процедуры, т.е. до процедуры, до и во время процедуры и после процедуры, до, в процессе и после процедуры, в процессе процедуры и после процедуры или после процедуры. Применение во время процедуры можно осуществлять посредством локального введения композиции в область хирургической операции или процедуры, например, путем инъекции или непрерывной или прерывистой ирригации области, или путем системного введения. Пригодные способы для местной доставки во время операции растворов средства, ингибирующего MASP-2, описаны в патентах США № 6420432, выданном Demopulos, и 6645168, выданном Demopulos. Пригодные способы локальной доставки хондропротекторных композиций, включающих средство(а), ингибирующее MASP-2, описаны в международной патентной заявке PCT WO 01/07067 A2. Пригодные способы и композиции для направленной системной доставки хондропротекторных композиций, включающих средство(а), ингибирующее MASP-2, описаны в международной патентной заявке PCT WO 03/063799 A2.
В одном аспекте изобретения фармацевтические композиции вводят индивидууму, страдающему или имеющему риск развития тромботической микроангиопатии (TMA). В одном варианте осуществления TMA выбрана из группы, состоящей из гемолитического уремического синдрома (HUS), тромботической тромбоцитопенической пурпуры (TTP) и атипичного гемолитического уремического синдрома (aHUS). В одном варианте осуществления TMA представляет собой aHUS. В одном варианте осуществления композицию вводят пациенту с aHUS в ходе острой фазы заболевания. В одном варианте осуществления композицию вводят пациенту с aHUS в ходе фазы ремиссии (т.е. у индивидуума, который выздоровел или частично выздоровел после эпизода aHUS острой фазы, о такой ремиссии свидетельствует, например, увеличенное количество тромбоцитов и/или сниженные концентрации LDH в сыворотке, например, как описано в Loirat C et al., Orphanet Journal of Rare Diseases 6:60, 2011, включенной в настоящее описание в качестве ссылки). В одном варианте осуществления индивидуум страдает или имеет риск развития TMA, которая представляет собой (i) TMA на фоне злокачественной опухоли; (ii) TMA на фоне химиотерапии; или (iii) TMA на фоне трансплантации (например, трансплантации органа, такой как трансплантация почки или трансплантация аллогенных гемопоэтических стволовых клеток). В одном варианте осуществления индивидуум страдает или имеет риск развития синдрома Апшо-Шульмана (USS). В одном варианте осуществления индивидуум страдает или имеет риск развития болезни Дегоса. В одном варианте осуществления индивидуум страдает или имеет риск развития катастрофического антифосфолипидного синдрома (CAPS). При терапевтических применениях фармацевтические композиции вводят индивидууму, страдающему или имеющему риск развития TMA в терапевтически эффективном количестве, достаточном для ингибирования образования тромба, смягчения или по меньшей мере частичного снижения симптомов состояния.
Как в профилактическом, так и в терапевтическом режимах, композиции, содержащие средства, ингибирующие MASP-2, можно вводить в нескольких дозировках до тех пор, пока у индивидуума не будет достигнут достаточный терапевтический исход. В одном варианте осуществления изобретения средство, ингибирующее MASP-2, содержит антитело против MASP-2, которое в подходящем случае можно вводить взрослому пациенту (например, средняя масса тела взрослого человека 70 кг) в дозировке от 0,1 мг до 10000 мг, более предпочтительно от 1,0 мг до 5000 мг, более предпочтительно от 10,0 мг до 2000 мг, более предпочтительно от 10,0 мг до 1000 мг и еще более предпочтительно от 50,0 мг до 500 мг. Для педиатрических пациентов дозировку можно корректировать пропорционально массе тела пациента. Применение ингибирующих MASP-2 композиций по настоящему изобретению можно осуществлять посредством однократного введения композиции или ограниченной последовательности введений для лечения TMA. Альтернативно композицию можно вводить с периодическими интервалами, такими как каждые сутки, два раза в неделю, раз в неделю, раз в две недели, раз в месяц или раз в два месяца на протяжении длительного периода времени для лечения TMA.
В некоторых вариантах осуществления индивидуум, страдающий или имеющий риск развития TMA, ранее подвергался или в настоящее время подвергается лечению ингибитором терминального пути комплемента, который ингибирует расщепление белка C5 комплемента. В некоторых вариантах осуществления способ включает введение индивидууму композиции по изобретению, содержащей ингибитор MASP-2 и последующее введение индивидууму ингибитора терминального пути комплемента, который ингибирует расщепление белка C5 комплемента. В некоторых вариантах осуществления ингибитор терминального пути комплемента представляет собой гуманизированное антитело против C5 или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления ингибитор терминального пути комплемента представляет собой экулизумаб.
В одном аспекте изобретения фармацевтические композиции вводят индивидууму, предрасположенному или имеющему иной риск aHUS, в количестве, достаточном для устранения или снижения риска развития симптомов состояния. В терапевтических применениях фармацевтические композиции вводят индивидууму, предположительно страдающему или уже страдающему aHUS в терапевтически эффективном количестве, достаточном для смягчения или по меньшей мере частичного уменьшения симптомов состояния. В одном аспекте изобретения перед введением индивидуума можно исследовать для определения того, проявляет ли индивидуум один или несколько симптомов aHUS, включающих (i) анемию, (ii) тромбоцитопению, (iii) почечную недостаточность и (iv) повышение уровня креатинина, а затем композицию по настоящему изобретению можно вводить в эффективном количестве и в течение достаточного периода времени для улучшения этого симптома(ов).
В другом аспекте изобретения ингибирующие MASP-2 композиции по настоящему изобретению можно использовать для профилактического лечения индивидуума, который имеет повышенный риск развития aHUS, и тем самым снижения вероятности того, что у индивидуума разовьется aHUS. Сначала определяют присутствие генетического маркера у индивидуума, о котором известно, что он ассоциирован с aHUS, путем проведения генетического скринингового теста на образце, полученном от индивидуума, и идентификации наличия по меньшей мере одного генетического маркера, ассоциированного с aHUS, фактора H комплемента (CFH), фактор I (CFI), фактор B (CFB), мембранного кофактора CD46, C3, белка, родственного фактору H комплемента (CFHR1), антикоагулянтного белка тромбомодулина (THBD), белка 3, родственного фактору H комплемента (CFHR3) или белка 4, родственного фактору H комплемента (CFHR4). Затем периодически проводят мониторинг индивидуума (например, раз в месяц, раз в три месяца, два раза в год или каждый год) для определения наличия или отсутствия по меньшей мере одного симптома aHUS, такого как анемия, тромбоцитопения, почечная недостаточность и повышение уровня креатинина. После определения присутствия по меньшей мере одного из этих симптомов индивидууму можно вводит количество средства, ингибирующего MASP-2, эффективное для ингибирования MASP-2-зависимой активации комплемента, в эффективном количестве и в течение достаточного периода времени для улучшения указанных одного или нескольких симптомов. В следующим аспекте настоящего изобретения индивидуума с увеличенным риском развития aHUS после скрининга и определения наличия одного из генетических маркеров, ассоциированных с aHUS, можно подвергать мониторингу в отношении появления события, ассоциированного с запуском клинических симптомов aHUS, включая воздействие лекарственного средства, инфекцию (например, бактериальную инфекцию), злокачественную опухоль, травму, трансплантацию органа или ткани или беременность.
В следующем аспекте настоящего изобретения композицию, содержащую количество средства, ингибирующего MASP-2, эффективное для ингибирования MASP-2-зависимой активации комплемента, можно вводить индивидууму, страдающему или имеющему риск развития атипичного гемолитического уремического синдрома (aHUS) на фоне инфекции. Например, пациента, страдающего или имеющего риск развития некишечного aHUS, ассоциированного с инфекцией S. pneumonia, можно лечить композициями по настоящему изобретению.
В следующем аспекте настоящего изобретения индивидуума, страдающего aHUS, можно первоначально лечить ингибирующей MASP-2 композицией по настоящему изобретению, которую вводят через катетер, такой как внутривенный катетер или подкожный катетер, в течение первого периода времени, такого как один час, двенадцать часов, одни сутки, двое суток или трое суток. Затем индивидуума можно лечить в течение второго периода времени ингибирующей MASP-2 композицией, вводимой посредством регулярных подкожных инъекций, как например, инъекции каждые сутки, два раза в неделю, раз в неделю, раз в две недели, раз в месяц, раз в два месяца.
В следующем аспекте настоящего изобретения ингибирующую MASP-2 композицию по настоящему изобретению можно вводить индивидууму, страдающему aHUS, в отсутствие плазмафереза (т.е. индивидууму, у которого симптомы aHUS не лечили плазмаферезом и не лечат плазмаферезом во время лечения ингибирующей MASP-2 композицией), чтобы избежать потенциальных осложнений плазмафереза, включающих геморрагию, инфекцию и воздействие нарушений и/или аллергии, присущих донору плазмы, или в случае, когда индивидуум имеет противопоказания к плазмаферезу, или в случае, когда плазмаферез не доступен.
В следующем аспекте настоящего изобретения ингибирующую MASP-2 композицию по настоящему изобретению можно вводить индивидууму, страдающему aHUS, совместно с лечением пациента плазмаферезом. Например, индивидууму, которому проводят лечение плазмаферезом, можно вводить ингибирующую MASP-2 композицию после или поочередно с плазмообменом.
В следующем аспекте настоящего изобретения индивидуума, страдающего или имеющего риск развития aHUS, и подвергаемого лечению ингибирующей MASP-2 композицией по настоящему изобретению, можно подвергать мониторингу путем периодического определения, например, каждые двенадцать часов или каждые сутки, уровня по меньшей мере одного фактора комплемента, где определение сниженного уровня по меньшей мере одного фактора комплемента по сравнению со стандартной величиной или со здоровым индивидуумом указывает на необходимость в продолжении лечения композицией.
Как в профилактических, так и в терапевтических режимах, композиции, содержащие средства, ингибирующие MASP-2, можно вводить в нескольких дозировках до тех пор, пока у индивидуума не будет достигнут достаточный терапевтический исход. В одном варианте осуществления изобретения средство, ингибирующее MASP-2, содержит антитело против MASP-2, которое в подходящем случае можно вводить взрослому пациенту (например, средняя масса тела взрослого человека 70 кг) в дозировке от 0,1 мг до 10000 мг, более предпочтительно от 1,0 мг до 5000 мг, более предпочтительно от 10,0 мг до 2000 мг, более предпочтительно от 10,0 мг до 1000 мг и еще более предпочтительно от 50,0 мг до 500 мг. Для педиатрических пациентов дозировку можно корректировать пропорционально массе тела пациента. Применение ингибирующих MASP-2 композиций по настоящему изобретению можно осуществлять посредством однократного введения композиции или ограниченной последовательности введений для лечения aHUS. Альтернативно композицию можно вводить с периодическими интервалами, такими как каждые сутки, два раза в неделю, раз в неделю, раз в две недели, раз в месяц или раз в два месяца на протяжении длительного периода времени для лечения aHUS.
В одном аспекте изобретения фармацевтические композиции вводят индивидууму, предрасположенному или имеющему иной риск HUS в количестве, достаточном для устранения или снижения риска развития симптомов состояния. В терапевтических применениях фармацевтические композиции вводят индивидууму, предположительно страдающему или уже страдающем HUS в терапевтически эффективном количестве, достаточном для смягчения или по меньшей мере частичного уменьшения симптомов состояния.
В другом аспекте настоящего изобретения вероятность развития нарушения функции почек у индивидуума, имеющего риск развития HUS, можно снижать путем введения индивидууму ингибирующей MASP-2 композиции по настоящему изобретению в количестве, эффективном для ингибирования MASP-2-зависимой активации комплемента. Например, индивидуум, имеющий риск развития HUS и подлежащий лечению ингибирующей MASP-2 композицией по настоящему изобретению, может проявлять один или несколько симптомов, ассоциированных с HUS, включая диарею, уровень гематокрита ниже 30% с признаками внутрисосудистого разрушения эритроцитов в мазке, тромбоцитопению и повышение уровня креатинина. В качестве следующего примера, индивидуум, имеющий риск развития HUS и подлежащий лечению ингибирующими MASP-2 композициями по настоящему изобретению, может быть инфицирован E. coli, шигеллами или сальмонеллами. Таких индивидуумов, инфицированных E. coli, шигеллами или сальмонеллами, можно лечить ингибирующей MASP-2 композицией по настоящему изобретению одновременно с лечением антибиотиками, или альтернативно их можно лечить ингибирующей MASP-2 композицией без сопутствующего лечения антибиотиком, в частности, для энтерогенных E. coli, для которых лечение антибиотиками противопоказано. Индивидуум, инфицированный энтерогенными E. coli, которого лечат антибиотиком, может иметь повешенный риск развития HUS, и его в подходящем случае можно лечить ингибирующей MASP-2 композицией по настоящему изобретению для снижения этого риска. Индивидуума, инфицированного энтерогенными E. coli, можно лечить в течение первого периода времени ингибирующей MASP-2 композицией по настоящему изобретению в отсутствие антибиотика, а затем в течение второго периода времени как ингибирующей MASP-2 композицией по настоящему изобретению, так и антибиотиком.
В следующем аспекте настоящего изобретения индивидуума, страдающего HUS, можно сначала лечить ингибирующей MASP-2 композицией по настоящему изобретению, которую вводят через катетер, такой как внутривенный катетер или подкожный катетер, в течение первого периода времени, такого как один час, двенадцать часов, одни сутки, двое суток или трое суток. Затем индивидуума можно лечить в течение второго периода времени ингибирующей MASP-2 композицией, вводимой посредством регулярных подкожных инъекций, как например, инъекции каждые сутки, два раза в неделю, раз в неделю, раз в две недели, раз в месяц, раз в два месяца.
В следующем аспекте настоящего изобретения ингибирующую MASP-2 композицию по настоящему изобретению можно вводить индивидууму, страдающему HUS, в отсутствие плазмафереза (т.е. индивидууму, у которого симптомы HUS не лечили плазмаферезом и не лечили плазмаферезом во время лечения ингибирующей MASP-2 композицией), чтобы избежать потенциальных осложнений плазмафереза, включающих геморрагию, инфекцию и воздействие нарушений и/или аллергии, присущих донору плазмы, или в случае, когда индивидуум имеет противопоказания к плазмаферезу, или в случае, когда плазмаферез не доступен.
В следующем аспекте настоящего изобретения, ингибирующую MASP-2 композицию по настоящему изобретению можно вводить индивидууму, страдающему HUS, совместно с лечением пациента плазмаферезом. Например, индивидууму, которому проводят лечение плазмаферезом, можно вводить ингибирующую MASP-2 композицию после или поочередно с плазмообменом.
В следующем аспекте настоящего изобретения индивидуума, страдающего или имеющего риск развития HUS, и подвергаемого лечению ингибирующей MASP-2 композицией по настоящему изобретению, можно подвергать мониторингу путем периодического определения, например, каждые двенадцать часов или каждые сутки, уровня по меньшей мере одного фактора комплемента, где определение сниженного уровня по меньшей мере одного фактора комплемента по сравнению со стандартной величиной или со здоровым индивидуумом указывает на необходимость в продолжении лечения композицией.
Как в профилактических, так и в терапевтических режимах, композиции, содержащие средства, ингибирующие MASP-2, можно вводить в нескольких дозировках до тех пор, пока у индивидуума не будет достигнут достаточный терапевтический исход. В одном варианте осуществления изобретения средство, ингибирующее MASP-2, содержит антитело против MASP-2, которое в подходящем случае можно вводить взрослому пациенту (например, средняя масса тела взрослого человека 70 кг) в дозировке от 0,1 мг до 10000 мг, более предпочтительно от 1,0 мг до 5000 мг, более предпочтительно от 10,0 мг до 2000 мг, более предпочтительно от 10,0 мг до 1000 мг и еще более предпочтительно от 50,0 мг до 500 мг. Для педиатрических пациентов дозировку можно корректировать пропорционально массе тела пациента. Применение ингибирующих MASP-2 композиций по настоящему изобретению можно осуществлять посредством однократного введения композиции или ограниченной последовательности введений для лечения HUS. Альтернативно композицию можно вводить с периодическими интервалами, такими как каждые сутки, два раза в неделю, раз в неделю, раз в две недели, раз в месяц или раз в два месяца на протяжении длительного периода времени для лечения HUS.
В некоторых вариантах осуществления индивидуум, страдающий или имеющий риск развития HUS, ранее подвергался или в настоящее время подвергается лечению ингибитором терминального пути комплемента, который ингибирует расщепление белка C5 комплемента. В некоторых вариантах осуществления способ включает введение индивидууму композиции по изобретению, содержащей ингибитор MASP-2 и последующее введение индивидууму ингибитора терминального пути комплемента, который ингибирует расщепление белка C5 комплемента. В некоторых вариантах осуществления ингибитор терминального пути комплемента представляет собой гуманизированное антитело против C5 или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления ингибитор терминального пути комплемента представляет собой экулизумаб.
В одном аспекте изобретения фармацевтические композиции вводят индивидууму, предрасположенному или имеющему иной риск TTP в количестве, достаточном для устранения или снижения риска развития симптомов состояния. В терапевтических применениях фармацевтические композиции вводят индивидууму, предположительно страдающему или уже страдающему TTP в терапевтически эффективном количестве, достаточном для смягчения или по меньшей мере частичного уменьшения симптомов состояния.
В другом аспекте настоящего изобретения индивидуума, проявляющего один или несколько симптомов TTP, включая вовлечение центральной нервной системы, тромбоцитопению, тяжелое вовлечение сердечной системы, тяжелое вовлечение легочной системы, желудочно-кишечный инфаркт и гангрену, можно лечить ингибирующей MASP-2 композицией по настоящему изобретению. В другом аспекте настоящего изобретения индивидуума, у которого определено наличие сниженного уровня ADAMTS13 и который также имеет положительные результаты тестирования в отношении присутствия ингибитора (т.е. антитела) ADAMTS13, можно лечить ингибирующей MASP-2 композицией по настоящему изобретению. В следующем аспекте настоящего изобретения, индивидуума с положительными результатами тестирования в отношении присутствия ингибитора ADAMTS13, можно лечить иммунодепрессивным средством (например, кортикостероиды, ритуксан или циклоспорин) одновременно с лечением ингибирующей MASP-2 композицией по настоящему изобретению. В следующем аспекте настоящего изобретения индивидуума, для которого определено, что он имеет сниженный уровень ADAMTS13 и положительные результаты тестирования в отношении присутствия ингибитора ADAMTS13, можно лечить ADAMTS13 одновременно с лечением ингибирующей MASP-2 композицией по настоящему изобретению.
В следующем аспекте настоящего изобретения индивидуума, страдающего TTP, можно сначала лечить ингибирующей MASP-2 композицией по настоящему изобретению, которую вводят через катетер, такой как внутривенный катетер или подкожный катетер, в течение первого периода времени, такого как один час, двенадцать часов, одни сутки, двое суток или трое суток. Затем индивидуума можно лечить в течение второго периода времени ингибирующей MASP-2 композицией, вводимой посредством регулярных подкожных инъекций, как например, инъекции каждые сутки, два раза в неделю, раз в неделю, раз в две недели, раз в месяц, раз в два месяца.
В следующем аспекте настоящего изобретения ингибирующую MASP-2 композицию по настоящему изобретению можно вводить индивидууму, страдающему TTP, в отсутствие плазмафереза (т.е. индивидууму, у которого симптомы TTP не лечили плазмаферезом и не лечат плазмаферезом во время лечения ингибирующей MASP-2 композицией), чтобы избежать потенциальных осложнений плазмафереза, включающих геморрагию, инфекцию и воздействие нарушений и/или аллергии, присущих донору плазмы, или в случае, когда индивидуум имеет противопоказания к плазмаферезу, или в случае, когда плазмаферез не доступен.
В следующем аспекте настоящего изобретения, ингибирующую MASP-2 композицию по настоящему изобретению можно вводить индивидууму, страдающему TTP, совместно с лечением пациента плазмаферезом. Например, индивидууму, которому проводят лечение плазмаферезом, можно вводить ингибирующую MASP-2 композицию после или поочередно с плазмообменом.
В следующем аспекте настоящего изобретения, индивидуума, страдающего рефрактерной TTP, т.е. симптомами TTP, которые не отвечают в достаточной степени на другие способы лечения, такие как плазмаферез, можно лечить ингибирующей MASP-2 композицией по настоящему изобретению с дополнительным плазмаферезом или без него.
В следующем аспекте настоящего изобретения индивидуума, страдающего или имеющего риск развития TTP, и подвергаемого лечению ингибирующей MASP-2 композицией по настоящему изобретению, можно подвергать мониторингу путем периодического определения, например, каждые двенадцать часов или каждые сутки, уровня по меньшей мере одного фактора комплемента, где определение сниженного уровня по меньшей мере одного фактора комплемента по сравнению со стандартной величиной или со здоровым индивидуумом указывает на необходимость в продолжении лечения композицией.
Как в профилактических, так и в терапевтических режимах, композиции, содержащие средства, ингибирующие MASP-2, можно вводить в нескольких дозировках до тех пор, пока у индивидуума не будет достигнут достаточный терапевтический исход. В одном варианте осуществления изобретения средство, ингибирующее MASP-2, содержит антитело против MASP-2, которое в подходящем случае можно вводить взрослому пациенту (например, средняя масса тела взрослого человека 70 кг) в дозировке от 0,1 мг до 10000 мг, более предпочтительно от 1,0 мг до 5000 мг, более предпочтительно от 10,0 мг до 2000 мг, более предпочтительно от 10,0 мг до 1000 мг и еще более предпочтительно от 50,0 мг до 500 мг. Для педиатрических пациентов дозировку можно корректировать пропорционально массе тела пациента. Применение ингибирующих MASP-2 композиций по настоящему изобретению можно осуществлять посредством однократного введения композиции или ограниченной последовательности введений для лечения TTP. Альтернативно композицию можно вводить с периодическими интервалами, такими как каждые сутки, два раза в неделю, раз в неделю, раз в две недели, раз в месяц или раз в два месяца на протяжении длительного периода времени для лечения TTP.
В некоторых вариантах осуществления индивидуум, страдающий или имеющий риск развития TTP, ранее подвергался или в настоящее время подвергается лечению ингибитором терминального пути комплемента, который ингибирует расщепление белка C5 комплемента. В некоторых вариантах осуществления способ включает введение индивидууму композиции по изобретению, содержащей ингибитор MASP-2 и последующее введение индивидууму ингибитора терминального пути комплемента, который ингибирует расщепление белка C5 комплемента. В некоторых вариантах осуществления ингибитор терминального пути комплемента представляет собой гуманизированное антитело против C5 или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления ингибитор терминального пути комплемента представляет собой экулизумаб.
VI. ПРИМЕРЫ
Представленные ниже примеры только иллюстрируют наилучший способ, в настоящие время предусматриваемый для применения на практике изобретения, и его не следует истолковывать как ограничивающие изобретение. Все литературные ссылки в настоящем описании включены в качестве ссылок в полном объеме.
ПРИМЕР 1
В этом примере описано получение линии мышей с дефицитом MASP-2 (MASP-2-/-), но с достаточным уровнем MAp19 (MAp19+/+).
Материалы и способы: Нацеливающий вектор pKO-NTKV 1901 конструировали для разрушения трех экзонов, кодирующих C-конец MASP-2 мыши, включая экзон, которые кодирует домен сериновой протеазы, как показано на фиг.3. PKO-NTKV 1901 использовали для трансфекции клеточной линии E14.1a мышей ES (SV129 Ola). Отбирали устойчивые к неомицину и чувствительные к тимидинкиназе клоны. Был проведен скрининг 600 клонов ES и из них было идентифицировано четыре различных клона и было подтверждено с использованием саузерн-блоттинга, что они имеют ожидаемое селективное событие нацеливания и рекомбинации, как показано на фиг.3. Из этих четырех положительных клонов получали химеры с использованием переноса эмбрионов. Затем химеры подвергали обратному скрещиванию в генетическом фоне C57/BL6 для получения трансгенных самцов. Трансгенных самцов скрещивали с самками для получения F1 с 50% потомков, демонстрирующих гетерозиготность по разрушенному гену MASP-2. Гетерозиготных мышей подвергали скрещиванию с получением гомозиготных потомков с дефицитом MASP-2, гетерозиготных мышей и мышей дикого типа в соотношении 1:2:1, соответственно.
Результаты и фенотип: Было обнаружено, что полученные гомозиготные мыши с дефицитом MASP-2-/- являются жизнеспособными и фертильными, и было подтверждено, что они являются дефицитными по MASP-2, с использованием саузерн-блоттинга для подтверждения правильного события нацеливания, с использованием нозерн-блоттинга для подтверждения отсутствия мРНК MASP-2, и с использованием вестерн-блоттинга для подтверждения отсутствия белка MASP-2 (данные не представлены). Присутствие мРНК MAp19 и отсутствие мРНК MASP-2 далее подтверждали с использованием ОТ-ПЦР с временным разрешением на устройстве LightCycler. Мыши MASP-2-/- продолжают экспрессировать мРНК и белок MAp19, MASP-1 и MASP-3, как и ожидалось (данные не представлены). Присутствие и повсеместная распространенность мРНК у мышей MASP-2-/- пропердина, фактора B, фактора D, C4, C2 и C3 оценивали с использованием анализа LightCycler, и было обнаружено, что они идентичны этим показателям у однопометных контрольных животных дикого типа (данные не представлены). Плазма от гомозиготных мышей MASP-2-/- является полностью дефицитной по опосредуемой лектиновым путем активации комплемента, как далее описано в примере 2.
Получение линии MASP-2-/- на чистом фоне C57BL6: мышей MASP-2-/- подвергали обратному скрещиванию с чистой линией C57BL6 на протяжении девяти поколений перед применением линии MASP-2-/- в качестве экспериментальной модели на животных.
Также получали трансгенную линию мышей, которая представляет собой мышей MASP-2-/-, MAp19+/+ и которая экспрессирует трансген MASP-2 человека (нокаут MASP-2 мыши и нокин MASP-2 человека) следующим образом:
Материалы и способы: Конструировали миниген, кодирующий MASP-2 человека, называемый "мини-hMASP-2" (SEQ ID NO:49), как показано на фиг.4, который включает промоторную область гена MASP 2 человека, включая первые 3 экзона (с 1 экзона по 3 экзон), за которой следует последовательность кДНК, которая представляет собой кодирующую последовательность из следующих 8 экзонов, таким образом, он кодировал полноразмерный белок MASP-2, контролируемый его эндогенным промотором. Конструкцию мини-hMASP-2 инъецировали в оплодотворенные яйцеклетки MASP-2-/- для замены дефицитного гена MASP 2 мыши трансгенно экспрессируемым MASP-2 человека.
ПРИМЕР 2
В этом примере продемонстрировано, что MASP-2 требуется для активации комплемента через лектиновый путь.
Способы и материалы:
Анализ специфического для лектинового пути расщепления C4: Анализ расщепления C4 описан Petersen, et al., J. Immunol. Methods 257:107 (2001), и в нем измеряется активация лектинового пути посредством липотейхоевой кислоты (LTA) из S. aureus, которая связывает L-фиколин. Анализ, описанный Petersen et al., (2001), был адаптирован для измерения активации лектинового пути через MBL путем покрытия планшета LPS и маннаном или зимозаном перед добавления сыворотки мышей MASP-2-/-, как описано ниже. Анализ также был модифицирован для устранения возможности расщепления C4 посредством классическому пути. Этого достигали с использованием буфера для разбавления образца, содержавшего 1 M NaCl, который обеспечивает высокоаффинное связывание компонентов распознавания лектинового пути с их лигендами, которое препятствует активации эндогенного C4, тем самым, исключая участие классического пути посредством диссоциации комплекса C1. В кратком изложении, модифицированные образцы сыворотки для анализа (разбавленные в буфере с высоким содержанием соли (1 M NaCl)) добавляют в покрытые лигандами планшеты, а затем добавляют постоянное количество очищенного C4 в буфере с физиологической концентрацией соли. Связанные комплексы распознавания, содержащие MASP-2, расщепляют C4, что приводит к депонированию C4b.
Способы анализа:
1) Микропланшеты для титрования Nunc Maxisorb (Maxisorb, Nunc, Cat. No. 442404, Fisher Scientific) покрывали 1 мкг/мл маннана (M7504 Sigma) или любого другого лиганда (например, такого как лиганды, приведенные ниже), разбавленного в буфере для нанесения покрытия (15 мМ Na2CO3, 35 мМ NaHCO3, pH 9,6).
В анализе использовали следующие реагенты:
a. маннан (1 мкг/лунка маннана (M7504 Sigma) в 100 мкл буфера для нанесения покрытия):
b. зимозан (1 мкг/лунка зимозана (Sigma) в 100 мкл буфера для нанесения покрытия);
c. LTA (1 мкг/лунка в 100 буфере для нанесения покрытия или 2 мкг/лунка в 20 мкл метанола)
d. 1 мкг Mab 4H5, специфичного к H-фиколину в буфере для нанесения покрытия
e. PSA из Aerococcus viridans (2 мкг/лунка в 100 мкл буфера для нанесения покрытия)
f. 100 мкл/лунка фиксированных формалином S. aureus DSM20233 (OD550=0,5) в буфере для нанесения покрытия.
2) Планшеты инкубировали в течение ночи при 4°C.
3) После инкубации в течение ночи остаточные участки связывания белка насыщали путем инкубации планшетов с 0,1% блокирующим буфером HSA-TBS (0,1% (масс./об.) HSA в 10 мМ Tris-CL, 140 мМ NaCl, 1,5 мМ NaN3, pH 7,4) в течение 1-3 часов, а затем промывания планшетов 3X посредством TBS/tween/Ca2+ (TBS с 0,05% Tween 20 и 5 мМ CaCl2, 1 мМ MgCl2, pH 7,4).
4) Образцы сыворотки, подлежащие исследованию, разбавляли в MBL-связывающем буфере (1 M NaCl) и разбавленные образцы добавляли в планшеты и инкубировали в течение ночи при 4°C. В качестве отрицательных контролей использовали лунки, в которые добавляли только буфер.
5) После инкубации в течение ночи при 4°C планшеты промывали 3X посредством TBS/tween/Ca2+. Затем в планшеты добавляли C4 человека (100 мкл/лунка разбавленного до 1 мкг/мл в BBS (4 мМ барбитал, 145 мМ NaCl, 2 мМ CaCl2, 1 мМ MgCl2, pH 7,4)) и инкубировали в течение 90 минут при 37°C. Планшеты вновь промывали 3X посредством TBS/tween/Ca2+.
6) Депонирование C4b выявляли с использованием конъюгированного с щелочной фосфатазой антитела курицы против C4c человека (разбавленного 1:1000 в TBS/tween/Ca2+), которое добавляли в планшеты и инкубировали в течение 90 минут при комнатной температуре. Затем планшеты вновь промывали 3X посредством TBS/tween/Ca2+.
7) Щелочную фосфатазу выявляли добавлением 100 мкл раствора субстрата п-нитрофенилфосфата, инкубацией при комнатной температуре в течение 20 минут и считыванием OD405 в устройстве для считывания микропланшетов для титрования.
Результаты: На фиг.5A-B показан уровень депонирования C4b на маннане (фиг.5A) и зимозане (фиг.5B) в разбавленных сыворотках от MASP-2+/+ (кресты), MASP-2+/- (закрашенные круги) и MASP-2-/- (закрашенные треугольники). На фиг.5C показана относительная активность C4-конвертазы на планшетах, покрытых зимозаном (белые столбики) или маннаном (закрашенные столбики) от мышей MASP-2-/+ (n=5) и мышей MASP-2-/- (n=4) относительно мышей дикого типа (n=5) на основе измерения уровня депонирования C4b, нормализованного к сыворотке дикого типа. Планка погрешностей соответствует стандартному отклонению. Как показано на фиг.5A-C, плазма от мышей MASP-2-/- является полностью дефицитной в отношении опосредуемой лектиновым путем активации комплемента на планшетах, покрытых маннаном и зимозаном. Эти результаты отчетливо демонстрируют, что MASP-2 является эффекторным компонентом лектинового пути.
Рекомбинантный MASP-2 восстанавливает зависимую от лектинового пути активацию C4 в сыворотке мышей MASP-2-/-
Для установления того, что отсутствие MASP-2 было непосредственной причиной утраты зависимой от лектинового пути активации C4 у мышей MASP-2-/-, исследовали эффект добавления рекомбинантного белка MASP-2 в образцы сыворотки в анализе расщепления C4, описанном выше. Рекомбинантные белки, представляющие собой функционально активный MASP-2 мыши и каталитически неактивный MASP-2A мыши (в котором остаток серина активного центра в домене сериновой протеазы заменен остатком аланина) продуцировали и очищали, как описано ниже в примере 3. Объединенную сыворотку от 4 мышей MASP-2-/- предварительно инкубировали с возрастающими концентрациями рекомбинантного белка MASP-2 мыши или неактивного рекомбинантного белка MASP-2A мыши, и активность C4-конвертазы анализировали, как описано выше.
Результаты: как показано на фиг.6, добавление функционально активного рекомбинантного белка MASP-2 мыши (показан в качестве незакрашенных треугольников) в сыворотку, полученную от мышей MASP-2-/-, восстанавливало зависимую от лектинового пути активацию C4 зависимым от концентрации белка образом, в то время как каталитически неактивный белок MASP-2A мыши (показан звездочками) не восстанавливал активацию C4. Результаты, показанные на фиг.6, нормализованы к активации C4, наблюдаемой для объединенной сыворотки мыши дикого типа (показано пунктирной линией).
ПРИМЕР 3
В этом примере описана рекомбинантная экспрессия и продукция рекомбинантного полноразмерного MASP-2 человека, крысы и мыши, происходящих из MASP-2 полипептидов и каталитически инактивированных мутантных форм MASP-2.
Экспрессия полноразмерного MASP-2 человека, мыши и крысы:
Полноразмерную последовательность кДНК MASP-2 человека (SEQ ID NO:4) также субклонировали в экспрессирующий вектор млекопитающих pCI-Neo (Promega), который запускает эукариотическую экспрессию под контролем энхансерной/промоторной области CMV (описана в Kaufman R.J. et al., Nucleic Acids Research 19:4485-90, 1991; Kaufman, Methods in Enzymology, 185:537-66 (1991)). Каждую из полноразмерной кДНК мыши (SEQ ID NO:50) и кДНК MASP-2 крысы (SEQ ID NO:53) субклонировали в экспрессирующий вектор pED. Затем экспрессирующими векторами MASP-2 трансфицировали прикрепляющуюся линию клеток яичника китайского хомяка DXB1 с использованием стандартной методики трансфекции с фосфатом кальция, описанной в Maniatis et al., 1989. Клетки, трансфицированные этими конструкциями, росли очень медленно, что подразумевает, что кодируемая протеаза является цитотоксической.
В другом подходе конструкцией минигена (SEQ ID NO:49), содержащей кДНК MASP-2 человека, контролируемой ее эндогенным промотором, временно трансфицируют клетки яичника китайского хомячка (CHO). Белок MASP-2 человека секретируется в культуральные среды и его выделяют, как описано ниже.
Экспрессия полноразмерного каталитически неактивного MASP-2:
Обоснование: MASP-2 активируется аутокаталитическим расщеплением после связывания распознающих субкомпонентов MBL или фиколинов (любой из L-фиколина, H-фиколина или M-фиколина) с их соответствующим углеводным паттерном. Часто в процессе выделения MASP-2 из сыворотки или в процессе очистки после рекомбинантной экспрессии происходит аутокаталитическое расщепление, приводящее к активации MASP-2. Для получения более стабильного белкового препарата для применения в качестве антигена, создавали каталитически неактивную форму MASP-2, обозначаемую как MASP-2A, путем замены остатка серина, который присутствует в каталитической триаде домена протеазы, остатком аланина у крысы (SEQ ID NO:55, Ser617 на Ala617); у мыши (SEQ ID NO:52, Ser617 на Ala617); или у человека (SEQ ID NO:3, Ser618 на Ala618).
Для получения каталитически неактивных белков MASP-2A человека и мыши, проводили сайт-направленный мутагенез с использованием олигонуклеотидов, показанных в таблице 5. Олигонуклеотиды, представленные в таблице 5, конструировали для отжига с областью кДНК человека и мыши, кодирующей ферментативно активный остаток серина, и олигонуклеотиды содержали несоответствие оснований для замены кодона серина на кодон аланина. Например, олигонуклеотиды для ПЦР SEQ ID NO:56-59 использовали в комбинации с кДНК MASP-2 человека (SEQ ID NO:4) для амплификации области от инициирующего кодона до ферментативно активного серина и от серина до стоп-кодона для получения полной открытой рамки считывания мутантного MASP-2A, содержащего мутацию Ser618 на Ala618. Продукты ПЦР очищали после агарозного гель-электрофореза и вырезания полос, и обеспечивали перекрывание на один остаток аденозина с использованием стандартной методики удлинения концов. Затем MASP-2A, удлиненный аденозином, клонировали в вектор pGEM-T easy, и трансформировали в E. coli.
Получали каталитически неактивный белок MASP-2A посредством обработки киназами и отжига SEQ ID NO:64 и SEQ ID NO:65 путем комбинирования этих двух олигонуклеотидов в эквимолярных количествах, нагревания до 100°C в течение 2 минут и медленного охлаждения до комнатной температуры. Полученный подвергнутый отжигу фрагмент имел совместимые лиганды с Pst1 и Xba1, и его встраивали вместо фрагмента Pst1-Xba1 кДНК MASP-2 крысы дикого типа (SEQ ID NO:53) с получением MASP-2A крысы.
5 'GAGGTGACGCAGGAGGGGCATTAGTGTTT 3' (SEQ ID NO:64)
5' CTAGAAACACTAATGCCCCTCCTGCGTCACCTCTGCA 3' (SEQ ID NO:65)
Каждый из MASP-2A человека, мыши и крысы далее субклонировали в любой из экспрессирующих векторов млекопитающих pED или pCI-Neo и трансфицировали в линию клеток яичника китайского хомячка DXB1, как описано ниже.
В другом подходе конструируют каталитически неактивную форму MASP-2 с использованием способа, описанного в Chen et al., J. Biol. Chem., 276(28):25894-25902, 2001. В кратком изложении, плазмиду, содержащую полноразмерную кДНК MASP-2 человека (описана в Thiel et al., Nature 386:506, 1997) расщепляют Xho1 и EcoR1, и кДНК MASP-2 (описанную в настоящем описании как SEQ ID NO:4) клонируют в соответствующие участки рестрикции вектора переноса в бакуловирус pFastBac1 (Life Technologies, NY). Затем активный центр сериновой протеазы MASP-2 изменяют в участке Ser618 на Ala618 путем замены двухцепочечных олигонуклеотидов, кодирующих аминокислоты 610-625 пептидной области (SEQ ID NO:13) на аминокислоты 610-625 нативной области с получением полноразмерного полипептида MASP-2 с неактивным протеазным доменом.
Конструирование экспрессирующих плазмид, содержащих полипептидные области, происходящие из Masp-2 человека.
Следующие конструкции получают с использованием сигнального пептида MASP-2 (остатки 1-15 SEQ ID NO:5) для секреции различных доменов MASP-2. Конструкцию, экспрессирующую домен CUBI MASP-2 человека (SEQ ID NO:8) получают посредством амплификации способом ПЦР области, кодирующей остатки 1-121 MASP-2 (SEQ ID NO:6) (соответствующие N-концевому домену CUB1). Конструкцию, экспрессирующую домен CUBIEGF MASP-2 человека (SEQ ID NO:9), получают посредством амплификации способом ПЦР области, кодирующей остатки 1-166 MASP-2 (SEQ ID NO:6) (соответствующие N-концевому домену CUB1EGF). Конструкцию, экспрессирующую домен CUBIEGFCUBII MASP-2 человека (SEQ ID NO:10) получают посредством амплификации способом ПЦР области, кодирующей остатки 1-293 MASP-2 (SEQ ID NO:6) (соответствующие N-концевому домену CUBIEGFCUBII). Упомянутые выше домены амплифицируют способом ПЦР с использованием полимеразы VentR и pBS-MASP-2 в качестве матрицы в соответствии с общепринятыми способами ПЦР. Последовательность смыслового 5'-праймера (5'-CGGGATCCATGAGGCTGCTGACCCTC-3' SEQ ID NO:34) вносит участок рестрикции BamHI (подчеркнут) на 5'-конце продуктов ПЦР. Антисмысловые праймеры для каждого из доменов MASP-2, показанные ниже в таблице 5, конструируют для внесения стоп-кодона (полужирный шрифт), а затем участка EcoRI (подчеркнут) на конце каждого продукта ПЦР. После амплификации фрагменты ДНК расщепляют BamHI и EcoRI и клонируют в соответствующие участки вектора pFastBac1. Полученные конструкции охарактеризовывают рестрикционным картированием и подтверждают секвенированием дцДНК.
ПЦР-ПРАЙМЕРЫ ДЛЯ MASP-2
CUBI (а.к.1-121 SEQ ID NO:6)
CUBIEGF (а.к.1-166 SEQ ID NO:6)
CUBIEGFCUBII (а.к.1-293 SEQ ID NO:6)
MASP-2 человека
кДНК MASP-2 человека
кДНК MASP-2 мыши
кДНК MASP-2 мыши
Рекомбинантная эукариотическая экспрессия MASP-2 и продукция ферментативно неактивного белка MASP-2A мыши, крысы и человека
Экспрессирующие конструкции MASP-2 и MASP-2A, описанные выше, трансфицировали в клетки DXB1 с использованием стандартной методики трансфекции с фосфатом кальция (Maniatis et al., 1989). MASP-2A продуцировали в бессывороточной среде, чтобы гарантировать, что препараты не содержали примесей других сывороточных белков. Среды собирали из монослоя клеток каждые сутки (всего четыре раза). Уровень рекомбинантного MASP-2A, в среднем составлял приблизительно 1,5 мг/литр культуральной среды для каждого из трех видов.
Очистка белка MASP-2A: MASP-2A (мутант Ser-Ala, описанный выше) очищали аффинной хроматографией на колонках с MBP-A-агарозой. Эта стратегия обеспечила быструю очистку без применения посторонних меток. MASP-2A (100-200 мл среды, разбавленной равным объемом нагрузочного буфера (50 мМ Tris-Cl, pH 7,5, содержащий 150 мМ NaCl и 25 мМ CaCl2)) наносили на аффинную колонку с MBP-агарозой (4 мл), предварительно уравновешенную 10 мл нагрузочного буфера. После промывания дополнительными 10 мл нагрузочного буфера белок элюировали фракциями 1 мл с использованием 50 мМ Tris-Cl, pH 7,5, содержавшего 1,25 M NaCl и 10 мМ EDTA. Фракции, содержавшие MASP-2A, идентифицировали с использованием SDS-полиакриламидного гель-электрофореза. Когда это было необходимо, MASP-2A далее очищали ионообменной хроматографией на колонке MonoQ (HR 5/5). Белок подвергали диализу 50 мМ Tris-Cl pH 7,5, содержавшего 50 мМ NaCl, и наносили на колонку, уравновешенную тем же буфером. После промывания связанный MASP-2A эллюировали с использованием 0,05-1 M градиента NaCl в объеме 10 мл.
Результаты: Из 200 мл среды выход белка MASP-2A составлял 0,25-0,5 мг. Молекулярная масса 77,5 кДа, определенная с использованием MALDI-MS, превышает вычисленную величину для немодифицированного полипептида (73,5 кДа) вследствие гликозилирования. Присоединение гликанов в каждом из участков N-гликозилирования объясняет наблюдаемую массу. MASP-2A мигрирует в качестве единой полосы на SDS-полиакриламидных гелях, демонстрируя, что он не подвергается протеолитическому процессингу в ходе биосинтеза. Средневзвешенная молекулярная масса, определенная с использованием равновесного ультрацентрифугирования, согласуется с вычисленной величиной для гомодимеров гликозилированного полипептида.
ПОЛУЧЕНИЕ РЕКОМБИНАНТНЫХ ПОЛИПЕПТИДОВ MASP-2 ЧЕЛОВЕКА
Другой способ получения рекомбинантных происходящих из MASP-2 и MASP2A полипептидов описан в Thielens, N.M., et al., J. Immunol. 166:5068-5077, 2001. В кратком изложении, клетки насекомых Spodoptera frugiperda (клетки Sf9 Ready-Plaque, полученные от Novagen, Madison, WI) выращивают и поддерживают в бессывороточной среде Sf900II (Life Technologies), дополненной 50 МЕ/мл пенициллина и 50 мг/мл стрептомицина (Life Technologies). Клетки насекомых Trichoplusia ni (High Five) (предоставленные Jadwiga Chroboczek, Institut de Biologie Structurale, Grenoble, Франция) поддерживают в среде TC100 (Life Technologies), содержащей 10% FCS (Dominique Dutscher, Brumath, Франция), дополненной 50 МЕ/мл пенициллина и 50 мг/мл стрептомицина. Рекомбинантные бакуловирусы получают с использованием системы Bac-to-Bac (Life Technologies). ДНК бакмиды очищают с использованием системы для очистки Qiagen midiprep (Qiagen) и используют для трансфекции клеток насекомых Sf9 с использованием Cellfectin в среде Sf900 II SFM (Life Technologies), как описано в протоколе изготовителя. Рекомбинантные вирусные частицы собирают через 4 суток, титруют с использованием вирусологического анализа бляшкообразования, и амплифицируют, как описано King and Possee, The Baculovirus Expression System: A Laboratory Guide, Chapman and Hall Ltd., London, pp. 111-114, 1992.
Клетки High Five (1,75×107 клеток/флакон для культивирования тканей объемом 175 см2) инфицируют рекомбинантными вирусами, содержащими полипептиды MASP-2, при множественности инфекции 2 в среде Sf900 II SFM при 28°C в течение 96 ч. Супернатанты собирают посредством центрифугирования и добавляют диизопропилфосфорофлуоридат до конечной концентрации 1 мМ.
Обеспечивают секрецию полипептидов MASP-2 в культуральную среду. Культуральные супернатанты подвергают диализу против мМ NaCl, 1 мМ CaCl2, 50 мМ триэтаноламина гидрохлорида, pH 8,1, и нагружают при скорости 1,5 мл/мин на колонку Q-Sepharose Fast Flow (Amersham Pharmacia Biotech) (2,8×12 см), уравновешенную тем же буфером. Элюирование проводят с использованием линейного градиента в объеме 1,2 до 350 мМ NaCl в том же буфере. Фракции, содержащие рекомбинантные полипептиды MASP-2, идентифицируют анализом с использованием вестерн-блоттинга, преципитируют добавлением (NH4)2SO4 до 60% (масс./об.) и оставляют на ночь при 4°C. Осадки ресуспендируют в 145 мМ NaCl, 1 мМ CaCl2, 50 мМ гидрохлориде триэтаноламина, pH 7,4, и наносят на колонку TSK G3000 SWG (7,5×600 мм) (Tosohaas, Montgomeryville, PA), уравновешенную тем же буфером. Затем очищенные полипептиды концентрируют до 0,3 мг/мл посредством ультрафильтрации на микроконцентраторах Microsep (пороговое значение ММ=10000) (Filtron, Karlstein, Германия).
ПРИМЕР 4
В этом примере описан способ получения поликлональных антител против полипептидов MASP-2.
Материалы и способы:
Антигены MASP-2: Поликлональную антисыворотку против MASP-2 человека получают путем иммунизации кроликов следующими выделенными полипептидами MASP-2: MASP-2 человека (SEQ ID NO:6), выделенный из сыворотки; рекомбинантный MASP-2 человека (SEQ ID NO:6), MASP-2A, содержащий неактивный протеазный домен (SEQ ID NO:13), как описано в примере 3; и рекомбинантный CUBI (SEQ ID NO:8), CUBEGFI (SEQ ID NO:9) и CUBEGFCUBII (SEQ ID NO:10), экспрессируемые, как описано выше в примере 3.
Поликлональные антитела: кроликов в возрасте шести недель, первично иммунизированных BCG (вакцина на основе бациллы Кальметта-Герена) иммунизируют инъекцией 100 мкг полипептида MASP-2 в количестве 100 мкг/мл в стерильном физиологическом растворе. Инъекции проводят каждые 4 недели и мониторинг титра антител проводят с использованием анализа ELISA, как описано в примере 5. Культуральные супернатанты собирают для очистки антител с использованием аффинной хроматографии с белком A.
ПРИМЕР 5
В этом примере описан способ получения моноклональных антител мыши против полипептидов MASP-2 крысы или человека
Материалы и способы:
Самцам мышей A/J (Harlan, Houston, Tex.) в возрасте 8-12 недель инъецируют подкожно 100 мкг полипептидов rMASP-2 или rMASP-2A человека или крысы (полученных, как описано в примере 3) в полном адъюванте Фрейнда (Difco Laboratories, Detroit, Mich.) в 200 мкл фосфатно-солевого буфера (PBS) pH 7,4. C интервалами две недели мышам два раза подкожно инъецируют 50 мкг полипептида rMASP-2 или rMASP-2A человека или крысы в неполном адъюванте Фрейнда. На четвертой неделе мышам инъецируют 50 мкг полипептида rMASP-2 или rMASP-2A человека или крысы PBS и подвергают слиянию через 4 суток.
Для каждого слияния суспензии отдельных клеток получают из селезенки иммунизированной мыши и используют для слияния с клетками миеломы Sp2/0. 5×108 Sp2/0 и 5×108 клеток селезенки подвергают слиянию в среде, содержащей 50% полиэтиленгликоль (M.W. 1450) (Kodak, Rochester, N.Y.) и 5% диметилсульфоксид (Sigma Chemical Co., St. Louis, Mo.). Затем клетки доводят до концентрации 1,5×105 клеток селезенки на 200 мкл суспензии в среде Iscove (Gibco, Grand Island, N.Y.), дополненной 10% эмбриональной телячьей сывороткой, 100 единиц/мл пенициллина, 100 мкг/мл стрептомицина, 0,1 мМ гипоксантином, 0,4 мкМ аминоптерином и 16 мкМ тимидином. В каждую лунку приблизительно двадцати 96-луночных планшетов для микрокультивирования добавляют двести микролитров суспензии клеток. Приблизительно через десять суток супернатанты отбирают для скрининга в отношении реактивности в отношении очищенного фактора MASP-2 в анализе ELISA.
Анализ ELISA: Лунки микропланшетов для тестирования Immulon 2 (Dynatech Laboratories, Chantilly, Va.) покрывают добавлением 50 мкл очищенного hMASP-2 в количестве 50 нг/мл или rMASP-2 крысы (или rMASP-2A) в течение ночи при комнатной температуре. Низкая концентрация MASP-2 для нанесения покрытия обеспечивает селекцию высокоаффинных антител. После удаления раствора для нанесения покрытия посредством стряхивания с планшета, в каждую лунку добавляют 200 мкл BLOTTO (обезжиренное сухое молоко) в PBS в течение одного часа для блокирования неспецифических участков. Через один час лунки промывают буфером PBST (PBS, содержащий 0,05% Tween 20). Пятьдесят микролитров культуральных супернатантов из каждой лунки, в которой проводят слияние, собирают и смешивают с 50 мкл BLOTTO, а затем добавляют в индивидуальные лунки микропланшетов для тестирования. После инкубации в течение одного часа лунки промывают PBST. Затем связавшиеся антитела мыши выявляют путем реакции с конъюгированным с пероксидазой хрена (HRP) антителом козы против IgG мыши (Fc-специфических) (Jackson ImmunoResearch Laboratories, West Grove, Pa.) и разбавляют в соотношении 1:2000 в BLOTTO. В лунки добавляют раствор субстрата пероксидазы, содержащий 0,1% 3,3,5,5 тетраметилбензидин (Sigma, St. Louis, Mo.) и 0,0003% пероксид водорода (Sigma) для развития окраски в течение 30 минут. Реакцию завершают добавлением 50 мкл 2 M H2SO4 на лунку. Оптическую плотность реакционной смеси при 450 нм считывают с использованием устройства для считывания BioTek ELISA (BioTek Instruments, Winooski, Vt.).
Анализ связывания MASP-2:
Культуральные супернатанты, которые имеют положительные результаты исследования в анализе ELISA для MASP-2, описанном выше, можно исследовать в анализе связывания для определения аффинности связывания ингибирующих MASP-2 средств с MASP-2. Также можно использовать сходный анализ для определения того, связываются ли ингибиторные средства с другими антигенами в системе комплемента.
Лунки полистироловых микропланшетов для титрования (96-луночные планшеты среднего связывания, Corning Costar, Cambridge, MA) покрывают MASP-2 (20 нг/100 мкл/лунка, Advanced Research Technology, San Diego, CA) в фосфатно-солевом буфере (PBS), pH 7,4, в течение ночи при 4°C. После аспирирования раствора MASP-2 лунки блокируют PBS, содержащим 1% бычий сывороточный альбумин (BSA; Sigma Chemical) в течение 2 ч при комнатной температуре. Лунки без покрытия MASP-2 служат в качестве контролей фонового уровня. В лунки добавляют аликовты супернатантов гибридом или очищенных MoAb против MASP-2 в различных концентрациях в блокирующем растворе. После инкубации в течение 2 ч при комнатной температуре лунки тщательно промывают PBS. Связанное с MASP-2 MoAb против MASP-2 выявляют добавлением конъюгированного с пероксидазой антитела козы против IgG мыши (Sigma Chemical) в блокирующем растворе, которому позволяют инкубироваться в течение 1 ч при комнатной температуре. Планшет вновь тщательно промывают PBS и добавляют 100 мкл субстрата - 3,3',5,5'-тетраметилбензидина (TMB) (Kirkegaard and Perry Laboratories, Gaithersburg, MD). Реакцию TMB гасят добавлением 100 мкл 1 M фосфорной кислоты и считывание планшета проводят при 450 нм в устройстве для считывания микропланшетов (SPECTRA MAX 250, Molecular Devices, Sunnyvale, CA).
Затем культуральные супернатанты из положительных лунок исследуют в отношении способности ингибировать активацию комплемента в функциональном анализе, таком как анализ расщепления C4, как описано в примере 2. Затем клетки в положительных лунках клонируют способом лимитирующих разведений. MoAb вновь исследуют на реактивность в отношении hMASP-2 в анализе ELISA, как описано выше. Выбранные гибридомы выращивают во вращающихся флаконах и использованный культуральный супернатант собирают для очистки антител с использованием аффинной хроматографии с белком A.
ПРИМЕР 6
В этом примере описано получение и продукция гуманизированных антител и фрагментов антител мыши против MASP-2.
Моноклональное антитело мыши против MASP-2 продуцируют у мышей Male A/J, как описано в примере 5. Затем антитело мыши подвергают гуманизации, как описано ниже, для снижения его иммуногенности, путем замены константных областей мыши их аналогами из человека для получения химерного IgG и Fab-фрагмента антитела, которые являются пригодными для ингибирования неблагоприятных эффектов MASP-2-зависимой активации комплемента у человека в соответствии с настоящим изобретением.
1. Клонирование генов вариабельной области антител против MASP-2 из клеток гибридомы мыши. Тотальную РНК выделяют из гибридомных клеток, секретирующих MoAb против MASP-2 (полученных, как описано в примере 7) с использованием RNAzol в соответствии с протоколом изготовителя (Biotech, Houston, Tex.). кДНК первой цепи синтезируют с тотальной РНК с использованием олиго-dT в качестве праймеров. ПЦР проводят с использованием 3'-праймеров для константной C-области иммуноглобулинов и наборов вырожденных праймеров для лидерного пептида или первой каркасной области генов VH или VK мыши в качестве 5'-праймеров. ПЦР с заякориванием проводят, как описано Chen and Platsucas (Chen, P.F., Scand. J. Immunol. 35:539-549, 1992). Для клонирования гена VK двухцепочечную кДНК получают с использованием праймера Notl-MAK1 (5'-TGCGGCCGCTGTAGGTGCTGTCTTT-3' SEQ ID NO:38). Гибридизованные адаптеры AD1 (5'-GGAATTCACTCGTTATTCTCGGA-3' SEQ ID NO:39) и AD2 (5'-TCCGAGAATAACGAGTG-3' SEQ ID NO:40) лигируют как с 5'-, так и с 3'-концами двухцепочечной кДНК. Адаптеры на 3'-концах удаляют посредством расщепления Notl. Затем расщепленный продукт используют в качестве матрицы в ПЦР с олигонуклеотидом AD1 в качестве 5'-праймера и MAK2 (5'-CATTGAAAGCTTTGGGGTAGAAGTTGTTC-3' SEQ ID NO:41) в качестве 3'-праймера. Фрагменты ДНК длиной приблизительно 500 п.н. клонируют в pUC19. Несколько клонов отбирают для анализа последовательности для подтверждения того, что клонированная последовательность охватывает ожидаемую константную область иммуноглобулина мыши. Олигонуклеотиды Not1-MAK1 и MAK2 происходят из области VK и они располагаются на 182 и 84 п.о., соответственно, ниже первой пары оснований гена C-каппа. Выбирают клоны, которые включают полную VK и лидерный пептид.
Для клонирования гена VH, двухцепочечную кДНК получают с использованием праймера Not1 MAG1 (5'-CGCGGCCGCAGCTGCTCAGAGTGTAGA-3' SEQ ID NO:42). Гибридизованные адапторы AD1 и AD2 лигируют как с 5'-, так и с 3'-концами двухцепочечной кДНК. Адапторы на 3'-концах удаляют расщеплением Notl. Расщепленный продукт используют в качестве матрицы в ПЦР с олигонуклеотидом AD1 и MAG2 (5'-CGGTAAGCTTCACTGGCTCAGGGAAATA-3' SEQ ID NO:43) в качестве праймеров. Фрагменты ДНК длиной от 500 до 600 п.о. клонируют в pUC19. Олигонуклеотиды Notl-MAG1 и MAG2 происходят из области Cγ.7.1 мыши, и они на 180 и 93 п.о., соответственно, ниже первой п.о. гена Cγ.7.1. Выбирают клоны, которые охватывают полную VH и лидерный пептид.
2. Конструирование экспрессирующих векторов для химерного IgG и Fab против MASP-2. Клонированные гены VH и VK, описанные выше, используют в качестве матриц в реакции ПЦР для добавления консенсусной последовательности Козака на 5'-конец и донора сплайсинга на 3'-конец нуклеотидной последовательности. После анализа последовательностей для подтверждения отсутствия ошибок ПЦР, гены VH и VK встраивают в кассеты экспрессирующых векторов, содержащих C.γ1 и C.каппа человека, соответственно, с получением pSV2neoVH-huCγ1 и pSV2neoV-huCγ. Очищенные в градиенте CsCl плазмидные ДНК векторов тяжелой и легкой цепей используют для трансфекции клеток COS электропорацией. Через 48 часов культуральный супернатант исследуют с использованием ELISA для подтверждения наличия приблизительно 200 нг/мл химерной IgG. Клетки собирают и получают тотальную РНК. С тотальной РНК синтезируют кДНК первой цепи с использованием олиго-dT в качестве праймера. Эту кДНК используют в качестве матрицы в ПЦР для получения фрагментов ДНК Fd и каппа. Для гена Fd ПЦР проводят с использованием 5'-AAGAAGCTTGCCGCCACCATGGATTGGCTGTGGAACT-3' (SEQ ID NO:44) в качестве 5'-праймера и 3'-праймера для CH1 (5'-CGGGATCCTCAAACTTTCTTGTCCACCTTGG-3' SEQ ID NO:45). Подтверждают, что последовательность ДНК содержит полный домен VH и CH1 IgG1 человека. После расщепления надлежащими ферментами фрагменты ДНК Fd встраивают в участки рестрикции HindIII и BamHI кассеты экспрессирующего вектора pSV2dhfr-TUS с получением pSV2dhfrFd. Плазмида pSV2 является коммерчески доступной и состоит из сегментов ДНК из различных источников: ДНК pBR322 (тонкая линия) содержит ориджин pBR322 репликации ДНК (pBR ori) и ген лактамазы для устойчивости к ампициллину (Amp); ДНК SV40, обозначенная более широким штрихом и отмеченная, содержит ориджин SV40 репликации ДНК (SV40 ori), ранний промотор (с 5'-стороны от генов dhfr и neo), и сигнал полиаденилирования (с 3'-стороны для генов dhfr и neo). Происходящий из SV40 сигнал полиаденилирования (pA) также помещают на 3'-конец гена Fd.
Для гена каппа ПЦР проводят с использованием 5'- AAGAAAGCTTGCCGCCACCATGTTCTCACTAGCTCT-3' (SEQ ID NO:46) в качестве 5'-праймера и 3'-праймера для CK (5'-CGGGATCCTTCTCCCTCTAACACTCT-3' SEQ ID NO:47). Подтверждают, что последовательность ДНК содержит полные области VK и CK человека. После расщепления надлежащими ферментами рестрикции фрагменты ДНК каппа встраивают в участки рестрикции HindIII и BamHI кассеты экспрессирующего вектора pSV2neo-TUS с получением pSV2neoK. Экспрессия как генов Fd, так и генов каппа, контролируется происходящими из HCMV энхансерными и промоторными элементами. Поскольку ген Fd не включает аминокислотного остатка цистеина, вовлеченного в межцепочечную дисульфидную связь, этот рекомбинантный химерный Fab содержит связанные нековалентно тяжелые и легкие цепи. Этот химерный Fab обозначат как cFab.
Для получения рекомбинантного Fab с дисульфидной связью между тяжелой и легкой цепью, описанный выше ген Fd можно удлинять включением кодирующей последовательности для дополнительных 9 аминокислот (EPKSCDKTH SEQ ID NO:48) из шарнирной области IgG1 человека. Сегмент ДНК BstEII-BamHI, кодирующий 30 аминокислот на 3'-конце гена Fd, может быть заменен сегментами ДНК, кодирующими удлиненный Fd, что приводит к pSV2dhfrFd/9aa.
3. Экспрессия и очистка химерного IgG против MASP-2
Для получения клеточных линий, секретирующих химерный IgG против MASP-2, клетки NSO трансфицируют очищенными плазмидными ДНК pSV2neoVH-huC.γ1 и pSV2neoV-huC каппа посредством электропорации. Селекцию трансфицированных клеток проводят в присутствии 0,7 мг/мл G418. Клетки выращивают во вращающихся флаконах объемом 250 мл с использованием содержащей сыворотку среды.
Культуральный супернатант 100 мл культуры во вращающемся флаконе наносят на 10-мл колонку PROSEP-A (Bioprocessing, Inc., Princeton, N.J.). Колонку промывают 10 объемами слоя PBS. Связавшееся антитело элюируют 50 мМ цитратным буфером, pH 3,0. К фракции, содержащей очищенное антитело, добавляют равный объем 1 M Hepes, pH 8,0, для доведения pH до 7,0. Остаточные соли удаляют посредством обмена буфера на PBS с использованием ультрафильтрации через мембрану Millipore (пороговое значение ММ: 3000). Концентрацию белка очищенного антитела определяют способом BCA (Pierce).
4. Экспрессия и очистка химерного Fab против MASP-2
Для получения клеточных линий, секретирующих химерный Fab против MASP-2, клетки CHO трансфицируют очищенными плазмидными ДНК pSV2dhfrFd (или pSV2dhfrFd/9aa) и pSV2neokappa посредством электропорации. Селекцию трансфицированных клеток проводят в присутствии G418 и метотрексата. Затем субклонированные клеточные линии единичных клеток с высокой продукцией выращивают в 100 мл культуре во вращающемся флаконе с использованием быссывороточной среды.
Химерное Fab против MASP-2 очищают посредством аффинной хроматографии с использованием антиидиотипического MoAb мыши к MoAb против MASP-2. Антиидиотипическое антитело к MoAb против MASP-2 можно получать путем иммунизации мышей MoAb против MASP-2, конъюгированным с гемоцианином лимфы улитки (KLH), и скрининга в отношении специфического связывания MoAb, которое может быть осуществлено с использованием MASP-2 человека. Для очистки 100 мл супернатанта культур клеток CHO во вращающихся флаконах, продуцирующих cFab или cFab/9aa, загружают в аффинную колонку с антиидиотипическим антителом к MoAb против MASP-2. Затем колонку тщательно промывают PBS, а затем связавшийся Fab элюируют с использованием 50 мМ диэтиламина, pH 11,5. Остаточные соли удаляют путем обмена буфера, как описано выше. Концентрацию очищенного белка Fab определяют способом BCA (Pierce).
Способность химерного IgG, cFab и cFAb/9aa против MASP-2 ингибировать MASP-2-зависимые пути комплемента, можно определять с использованием ингибиторных анализов, описанных в примере 2 или примере 7.
ПРИМЕР 7
В этом примере описан анализ расщепления C4 in vitro, использованный в качестве функционального скрининга для идентификации средств, ингибирующих MASP-2, способных блокировать MASP-2-зависимую активацию комплемента через L-фиколин/P35, H-фиколин, M-фиколин или маннан.
Анализ расщепления C4: анализ расщепления C4 описан Petersen, et al., J. Immunol. Methods 257:107 (2001), в котором измеряется активация лектинового пути посредством липотейхоевой кислоты (LTA) из S. aureus, которая связывает L-фиколин.
Реагенты: Фиксированные в формалине S. aureous (DSM20233) получают следующим образом: бактерии выращивают в течение ночи при 37°C в кровяной среде с триптическим гидролизатом сои, промывают три раза PBS, затем фиксируют в течение 1 ч при комнатной температуре в PBS/0,5% формалине и далее промывают три раза посредством PBS, а затем ресуспендируют в буфере для нанесения покрытия (15 мМ Na2CO3, 35 мМ NaHCO3, pH 9,6).
Анализ: Лунки микропланшета для титрования Nunc MaxiSorb (Nalgene Nunc International, Rochester, NY) покрывают: 100 мкл фиксированных в формалине S. aureus DSM20233 (OD550 = 0,5) в буфере для нанесения покрытия с 1 мкг L-фиколина в буфере для нанесения покрытия. После инкубации в течение ночи лунки блокируют 0,1% сывороточным альбумином человека (HSA) в TBS (10 мМ Tris-HCl, 140 мМ NaCl, pH 7,4), а затем промывают TBS, содержащим 0,05% Tween 20 и 5 мМ CaCl2 (буфер для промывания). Образцы сыворотки человека разбавляют в 20 мМ Tris-HCl, 1 M NaCl, 10 мМ CaCl2, 0,05% Triton X-100, 0,1% HSA, pH 7,4, который препятствует активации эндогенного C4 и диссоциирует комплекс C1 (состоящий из C1q, C1r и C1s). К образцам сыворотки добавляют средства, ингибирующие MASP-2, включая MoAb против MASP-2 и ингибиторные пептиды, в различных концентрациях. Разбавленные образцы добавляют в планшет и инкубируют в течение ночи при 4°C. Через 24 часов планшеты тщательно промывают буфером для промывания, а затем в каждую лунку добавляют 0,1 мкг очищенного C4 (полученного, как описано Dodds, A.W., Methods Enzymol. 223:46, 1993) в 100 мкл 4 мМ барбитала, 145 мМ NaCl, 2 мМ CaCl2, 1 мМ MgCl2, pH 7,4. После 1,5 ч при 37°C планшеты вновь промывают и выявляют депонирование C4b с использованием конъюгированного с щелочной фосфатазой антитела курицы против C4c человека (полученного от Immunsystem, Uppsala, Швеция) и измеряют с использованием колориметрического субстрата - п-нитрофенилфосфата.
Анализ C4 на маннане: анализ, описанный выше, адаптирован для измерения активации лектинового пути через MBL путем покрытия планшета LSP и маннаном перед добавлением сыворотки, смешанной с различными средствами, ингибирующими MASP-2.
Анализ C4 на H-фиколине (Hakata Ag): анализ, описанный выше, адаптирован для измерения активации лектинового пути, через H-фиколин путем нанесения на планшет LPS и H-фиколина перед добавлением сыворотки, смешанной с различными средствами, ингибирующими MASP-2.
ПРИМЕР 8
Следующий анализ демонстрирует присутствие активации классического пути у мышей дикого типа и мышей MASP-2-/-.
Способы: Иммунные комплексы получали in situ путем нанесения на микропланшеты для титрования (Maxisorb, Nunc, каталожный номер № 442404, Fisher Scientific) 0,1% сывороточного альбумина человека в 10 мМ Tris, 140 мМ NaCl, pH 7,4, в течение 1 часа при комнатной температуре, а затем проводили инкубацию в течение ночи при 4°C с антисывороткой овцы против цельной сыворотки (Scottish Antibody Production Unit, Carluke, Scotland), разбавленной 1:1000 в TBS/tween/Ca2+. Образцы сыворотки получали от мышей дикого типа и MASP-2-/- и добавляли в покрытые планшеты. Получали контрольные образцы, в которых C1q был устранен из образцов сыворотки дикого типа и MASP-2-/-. Лишенную C1q сыворотку мыши получали с использованием Dynabeads, связанных с белком A (Dynal Biotech, Oslo, Норвегия), покрытых IgG кролика против C1q человека (Dako, Glostrup, Denmark), в соответствии с инструкциями поставщика. Планшеты инкубировали в течение 90 минут при 37°C. Связанный C3b обнаруживали с использованием поликлонального антитела против C3c человека (Dako A 062), разбавленного в TBS/tw/ Ca++ в соотношении 1:1000. Вторичное антитело представляет собой антитело козы против IgG кролика.
Результаты: на фиг.7 представлены относительные уровни депонирования C3b на планшетах, покрытых IgG, в сыворотке дикого типа, сыворотке MASP-2-/-, сыворотке дикого типа, лишенной C1q, и сыворотке MASP-2-/-, лишенной C1q. Эти результаты демонстрируют, что классический путь является интактным в линии мышей MASP-2-/-.
ПРИМЕР 9
Представленный ниже анализ используют для тестирования того, блокирует ли средство, ингибирующее MASP-2, классический путь, путем анализа эффекта средства, ингибирующего MASP-2, в условиях, при которых классический путь ингибируется иммунными комплексами.
Способы: для исследования эффекта средства, ингибирующего MASP-2, на условия активации комплемента, где классический путь инициируется иммунными комплексами, три реплики образцов по 50 мкл, содержащие 90% NHS, инкубируют при 37°C в присутствии 10 мкг/мл иммунного комплекса (IC) или PBS, и также включают параллельные образцы в трех экземплярах (+/-IC), которые содержат 200 нМ моноклонального антитела против пропердина, в ходе инкубации при 37°C. После инкубации в течение двух часов при 37°C во все образцы добавляют 13 мМ EDTA для остановки дальнейшей активации комплемента и образцы сразу охлаждают до 5°C. Затем образцы хранят при -70°C, а затем анализируют в отношении продуктов активации комплемента (C3a и sC5b-9) с использованием наборов ELISA (Quidel, каталожные номера № A015 и A009) в соответствии с инструкциями изготовителя.
ПРИМЕР 10
В этом примере описана идентификация высокоаффинного Fab2-антитела против фрагментов MASP-2, которые блокируют активность MASP-2.
Предпосылки и обоснование: MASP-2 представляет собой комплексный белок с многими отдельными функциональными доменами, включающими: участок(участки) связывания для MBL и фиколинов, каталитический участок сериновой протеазы, участок связывания для протеолитического субстрата C2, участок связывания для протеолитического субстрата C4, участок расщепления MASP-2 для аутоактивации профермента MASP-2, и два участка связывания Ca++. Были идентифицированы Fab2-фрагменты антител, которые связываются с высокой аффинностью с MASP-2, и идентифицированные Fab2-фрагменты исследовали в функциональном анализе для определения того, способны ли они блокировать функциональную активность MASP-2.
Для блокирования функциональной активности MASP-2, антитело или Fab2-фрагмент антитела должны связываться и препятствовать структурному эпитопу на MASP-2, который требуется для функциональной активности MASP-2. Таким образом, многие или все из высокоаффинных связывающих Fab2 против MASP-2 могут не ингибировать функциональную активность MASP-2, если они не связываются со структурными эпитопами на MASP-2, которые прямо вовлечены в функциональную активность MASP-2.
Функциональный анализ, который измеряет ингибирование образования C3-конвертазы лектинового пути, использовали для оценки "активности блокирования" у Fab2 против MASP-2. Известно, что основная физиологическая роль MASP-2 в лектиновом пути состоит в образовании следующего функционального компонента лектин-опосредуемого пути комплемента, а именно, C3-конвертазы лектинового пути. C3-конвертаза лектинового пути представляет собой ключевой ферментативный комплекс (C4bC2a), который протеолитически расщепляет C3 на C3a и C3b. MASP-2 не является структурным компонентом C3-конвертазы лектинового пути (C4bC2a); однако функциональная активность MASP-2 необходима для образования двух белковых компонентов (C4b, C2a), которые содержат C3-конвертазу лектинового пути. Более того, все из отдельных функциональных видов активности MASP-2, приведенных выше, по-видимому, требуются MASP-2 для образования C3-конвертазы лектинового пути. По этим причинам полагают, что предпочтительным анализом для оценки "блокирующей активности" у Fab2 против MASP-2 является функциональный анализ, который измеряет ингибирование образования C3-конвертазы лектинового пути.
Получение высокоаффинных Fab2: Библиотеку фагового дисплея последовательностей антител вариабельной области легкой и тяжелой цепи человека и технологию автоматизированной селекции антител для идентификации Fab2, которые реагируют с выбранными представляющими интерес лигандами, использовали для получения высокоаффинных Fab2 к белку MASP-2 крысы (SEQ ID NO:55). Для скрининга антител использовали известное количество MASP-2 крысы (~1 мг, чистый на >85%). Для селекции антител с наилучшей аффинностью использовали три раунда амплификации. Приблизительно 250 различных фагов с наилучшими результатами, экспрессирущих фрагменты антител, отбирали для скрининга с использованием ELISA. Фрагменты с высокоаффинными положительными результатами далее секвенировали для определения уникальности различных антител.
Было очищено пятьдесят уникальных антител против MASP-2 и 250 мкг каждого очищенного Fab2-антитела использовали для охарактеризации аффинности связывания MASP-2 и функционального тестирования пути комплемента, как более подробно описано ниже.
Анализы, использованные для оценки ингибиторной (блокирующей) активности Fab2 против MASP-2
1. Анализ для измерения ингибирования образования C3-конвертазы лектинового пути:
Уровень техники: C3-конвертаза лектинового пути представляет собой ферментативный комплекс (C4bC2a), который протеолитически расщепляет C3 на два сильнодействующих провоспалительных фрагмента: анафилатоксин C3a и опсонистический C3b. Образование C3-конвертазы, по-видимому, является ключевой стадией лектинового пути с точки зрения опосредования воспаления. MASP-2 не является структурным компонентом C3-конвертазы лектинового пути (C4bC2a); таким образом антитела против MASP-2 (или Fab2) не ингибируют прямо активность существовавшей ранее C3-конвертазы. Однако для образования двух белковых компонентов (C4b, C2a), которые содержат C3-конвертазу лектинового пути, требуется активность сериновой протеазы MASP-2. Таким образом, Fab2 против MASP-2, которое ингибирует функциональную активность MASP-2 (т.е. блокирование Fab2 против MASP-2) будет ингибировать образование de novo C3-конвертазы лектинового пути. C3 содержит необычную и в высокой степени реакционноспособную сложную тиэофирную группу в качестве части ее структуры. При расщеплении C3 C3-конвертазой в этом анализе сложная тиоэфирная группа на C3b может образовывать ковалентную связь с гидроксильными или аминогруппами на макромолекулах, иммобилизованных на дне пластмассовых лунок, через сложноэфирные или амидные связи, таким образом, облегчая обнаружение C3b в анализе ELISA.
Маннан дрожжей является известным активатором лектинового пути. В представленном ниже способе измерения образования C3-конвертазы лунки пластмассовых планшетов, покрытые маннаном, инкубировали в течение 30 мин при 37°C с разбавленной сывороткой крысы для активации лектинового пути. Затем лунки промывали и анализировали в отношении C3b, иммобилизованного на лунках с использованием стандартных способов ELISA. Количество C3b, образовавшегося в этом анализе, является прямым отражением образования de novo C3-конвертазы лектинового пути. Fab2 против MASP-2 в выбранных концентрациях исследовали в этом анализе в отношении их способности ингибировать образование C3-конвертазы и последующее образование C3b.
Способы:
96-луночные связывающие планшеты Costar Medium Binding Plates инкубировали в течение ночи при 5°C с маннаном, разбавленным в 50 мМ карбонатном буфере, pH 9,5, в количестве 1 мкг/50 мкл/лунка. После инкубации в течение ночи каждую лунку промывали три раза посредством 200 мкл PBS. Затем лунки блокировали 100 мкл/лунка 1% бычьего сывороточного альбумина в PBS и инкубировали в течение одного часа при комнатной температуре при осторожном перемешивании. Затем каждую лунку промывали три раза 200 мкл PBS. Образцы Fab2 против MASP-2 разбавляли до выбранных концентраций в буфере GVB, содержавшем Ca++ и Mg++ (4,0 мМ барбитал, 141 мМ NaCl, 1,0 мМ MgCl2, 2,0 мМ CaCl2, 0,1% желатин, pH 7,4), при 5°C. К описанным выше образцам добавляли 0,5% сыворотку крысы при 5°C и 100 мкл переносили в каждую лунку. Планшеты накрывали и инкубировали в течение 30 минут на водяной бане при 37° для обеспечения активации комплемента. Реакцию останавливали переносом планшетов с водяной бани при 37° в контейнер, содержавший смесь лед-вода. Каждую лунку промывали пять раз 200 мкл PBS-Tween 20 (0,05% Tween 20 в PBS), затем промывали два раза 200 мкл PBS. Добавляли 100 мкл/лунка первичного антитела (антитело кролика против C3c человека, DAKO A0062) в разведении 1:10000 в PBS, содержавшем 2,0 мг/мл бычий сывороточный альбумин, и инкубировали в течение 1 ч при комнатной температуре при осторожном перемешивании. Каждую лунку промывали 5x 200 мкл PBS. Добавляли 100 мкл/лунка вторичного антитела в разведении 1:10000 (конъюгированное с пероксидазой антитело козы против IgG кролика, American Qualex A102PU) в PBS, содержавшем 2,0 мг/мл бычьего сывороточного альбумина, и инкубировали в течение одного часа при комнатной температуре на устройстве для встряхивания при осторожном перемешивании. Каждую лунку промывали пять раз 200 мкл PBS. Добавляли 100 мкл/лунка субстрата пероксидазы TMB (Kirkegaard & Perry Laboratories) и инкубировали при комнатной температуре в течение 10 мин. Реакцию пероксидазы останавливали добавлением 100 мкл/лунка 1,0 M H3PO4 и измеряли OD450.
2. Анализ для измерения ингибирования MASP-2-зависимого расщепления C4
Предпосылки: активность сериновой протеазы у MASP-2 является высокоспецифической, и идентифицировано только два белковых субстрата MASP-2: C2 и C4. Расщепление C4 приводит к образованию C4a и C4b. Fab2 против MASP-2 может связываться со структурными эпитопами на MASP-2, которые прямо вовлечены в расщепление C4 (например, участок связывания MASP-2 для C4; каталитический центр сериновой протеазы на MASP-2) и тем самым ингибируют функциональную активность MASP-2 в отношении расщепления C4.
Дрожжевой маннан представляет собой известный активатор лектинового пути. В представленном ниже способе измерения активности MASP-2 в отношении расщепления C4 лунки пластмассовых планшетов, покрытые маннаном, инкубировали в течение 30 мин при 37°C с разбавленной сывороткой крысы для активации лектинового пути. Поскольку первичное антитело, используемое в этом анализе ELISA, распознает только C4b человека, разбавленную сыворотку крысы также дополняли C4 человека (1,0 мкг/мл). Затем лунки промывали и анализировали в отношении C4 человека, иммобилизованного на лунках, с использованием стандартных способов ELISA. Количество C4b, образовавшегося в этом анализе, является мерой MASP-2-зависимой активности расщепления C4. Fab2 против MASP-2 в выбранных концентрациях исследовали в этом анализе в отношении их способности ингибировать расщепление C4.
Способы: 96-луночные связывающие планшеты Costar Medium Binding Plate инкубировали в течение ночи при 5°C с маннаном, разбавленным в 50 мМ карбонатном буфере, pH 9,5, в количестве 1 мкг/50 мкл/лунка. Каждую лунку промывали 3X посредством 200 мкл PBS. Затем лунки блокировали 100 мкл/лунка 1% бычьего сывороточного альбумина в PBS и инкубировали в течение одного часа при комнатной температуре при осторожном перемешивании. Затем каждую лунку промывали 3X посредством 200 мкл PBS. Образцы Fab2 против MASP-2 разбавляли до выбранных концентраций в буфере GVB, содержащем Ca++ и Mg++ (4,0 мМ барбитал, 141 мМ NaCl, 1,0 мМ MgCl2, 2,0 мМ CaCl2, 0,1% желатин, pH 7,4) при 5°C. В образцы также было включено 1,0 мкг/мл C4 человека (Quidel). К описанным выше образцам добавляли 0,5% сыворотку крысы при 5°, и 100 мкл переносили в каждую лунку. Планшеты накрывали и инкубировали в течение 30 минут на водяной бане при 37° для обеспечения активации комплемента. Реакцию останавливали переносом планшетов с водяной бани при 37° в контейнер, содержавший смесь лед-вода. Каждую лунку промывали 5x 200 мкл PBS-Tween 20 (0,05% Tween 20 в PBS), затем промывали 2X посредством 200 мкл PBS. Добавляли 100 мкл/лунка конъюгированного с биотином антитела курицы против C4c человека (Immunsystem AB, Uppsala, Швеция), разбавленного в 1:700 в PBS, содержавшем 2,0 мг/мл бычьего сывороточного альбумина (BSA), и инкубировали в течение одного часа при комнатной температуре при осторожном перемешивании. Каждую лунку промывали 5x 200 мкл PBS. Добавляли 100 мкл/лунка конъюгированного с пероксидазой стрептавидина (Pierce Chemical #21126) в концентрации 0,1 мкг/мл в PBS, содержавшем 2,0 мг/мл BSA, и инкубировали в течение одного часа при комнатной температуре на устройстве для встряхивания при осторожном перемешивании. Каждую лунку промывали 5x посредством 200 мкл PBS. Добавляли 100 мкл/лунка субстрата пероксидазы TMB (Kirkegaard & Perry Laboratories) и инкубировали при комнатной температуре в течение 16 мин. Реакцию пероксидазы останавливали добавлением 100 мкл/лунка 1,0 M H3PO4 и измеряли OD450.
3. Анализ связывания Fab2 против MASP-2 крысы с "нативным" MASP-2 крысы
Предпосылки: MASP-2 обычно присутствует в плазме в качестве димерного комплекса MASP-2, который также включает специфические лектиновые молекулы (манноза-связывающий белок (MBL) и фиколины). Таким образом, если представляет интерес исследование связывания Fab2 против MASP-2 с физиологически значимой формой MASP-2, является важной разработка анализа связывания, в котором используется взаимодействие между Fab2 и "нативным" MASP-2 в плазме вместо очищенного рекомбинантного MASP-2. В этом анализе связывания комплекс "нативный" MASP-2-MBL из 10% сыворотки крысы сначала иммобилизовывали на покрытых маннаном лунках. Затем исследовали аффинность связывания различных Fab2 против MASP-2 с иммобилизованным MASP-2 с использованием стандартной методологии ELISA.
Способы: 96-луночные связывающие планшеты Costar Medium Binding Plate инкубировали в течение ночи при 5°C с маннаном, разбавленным в 50 мМ карбонатном буфере, pH 9,5, в количестве 1 мкг/50 мкл/лунка. Каждую лунку промывали 3X посредством 200 мкл PBS. Лунки блокировали 100 мкл/лунка 0,5% обезжиренного сухого молока в PBST (PBS с 0,05% Tween 20) и инкубировали в течение одного часа при комнатной температуре при осторожном перемешивании. Каждую лунку промывали 3X посредством 200 мкл промывочного буфера TBS/Tween/Ca++ (Tris-забуференный солевой раствор, 0,05% Tween 20, содержащий 5,0 мМ CaCl2, pH 7,4. 10% сыворотку крысы в связывающем буфере с высоким содержанием солей (20 мМ Tris, 1,0 M NaCl, 10 мМ CaCl2, 0,05% Triton-X100, 0,1% (масс./об.) бычий сывороточный альбумин, pH 7,4), который был приготовлен на льду. Добавляли 100 мкл/лунка и инкубировали в течение 5°C. Лунки промывали 3X посредством 200 мкл промывочного буфера TBS/Tween/Ca++. Затем лунки промывали 2X посредством 200 мкл PBS. Добавляли 100 мкл/лунка выбранной концентрации Fab2 против MASP-2, разбавленного в буфере GVB, содержащем Ca++ и Mg++ (4,0 мМ барбитал, 141 мМ NaCl, 1,0 мМ MgCl2, 2,0 мМ CaCl2, 0,1% желатин, pH 7,4) и инкубировали в течение одного часа при комнатной температуре при осторожном перемешивании. Каждую лунку промывали 5x200 мкл PBS. Добавляли 100 мкл/лунка конъюгированного с HRP антитела козы против Fab2 (Biogenesis, каталожный номер № 0500-0099), разбавленного 1:5000 в 2,0 мг/мл бычьего сывороточного альбумина в PBS, и инкубировали в течение одного часа при осторожном перемешивании. Каждую лунку промывали 5x200 мкл PBS. Добавляли 100 мкл/лунка субстрата пероксидазы TMB (Kirkegaard & Perry Laboratories) и инкубировали при комнатной температуре в течение 70 мин. Реакцию пероксидазы останавливали добавлением 100 мкл/лунка 1,0 M H3PO4 и измеряли OD450.
РЕЗУЛЬТАТЫ:
Приблизительно 250 различных Fab2, которые реагировали с высокой аффинностью с белком MASP-2 крысы, отбирали для скрининга ELISA. Эти высокоаффинные Fab2 секвенировали для определения уникальности различных антител, и 50 уникальных антител против MASP-2 очищали для дальнейшего анализа. 250 мкг каждого очищенного Fab2-антитела использовали для охарактеризации аффинности связывания MASP-2 и функционального исследования пути комплемента. Результаты анализа представлены ниже в таблице 6.
FAB2 ПРОТИВ MASP-2, КОТОРЫЕ БЛОКИРУЮТ ЛЕКТИНОВЫЙ ПУТЬ АКТИВАЦИИ КОМПЛЕМЕНТА
(IC50 (нМ)
IC50 (нМ)
Как показано выше в таблице 6, среди 50 исследованных Fab2 против MASP-2, семнадцать Fab2 были идентифицированы в качестве блокирующих MASP-2 Fab2, которые потенциально ингибируют образование C3-конвертазы с IC50, равной или меньшей 10 нМ Fab2 (34% частота положительных результатов). Восемь из семнадцати идентифицированных Fab2 имеют IC50 в субнаномолярном диапазоне. Более того, все семнадцать из блокирующих MASP-2 Fab2, показанных в таблице 6, обеспечили по существу полное ингибирование образования C3-конвертазы в анализе C3-конвертазы лектинового пути. На фиг.8A графически иллюстрируются результаты анализа образования C3-конвертазы для Fab2-антитела #11, которое является репрезентативным антителом для других исследованных Fab2-антител, результаты для которых представлены в таблице 6. Это является важным фактором, поскольку является теоретически возможным, что "блокирующий" Fab2 может только частично ингибировать функцию MASP-2, даже когда каждая молекула MASP-2 связывается Fab2.
Хотя маннан представляет собой известный активатор лектинового пути, теоретически является возможным, что присутствие антител против маннана в сыворотке крысы также может активировать классический путь и образовать C3b через C3-конвертазу классического пути. Однако каждый из семнадцати блокирующих Fab2 против MASP-2 в этом примере эффективно ингибирует образование C3b (>95%), таким образом, демонстрируя специфичность этого анализа в отношении C3-конвертазы лектинового пути.
Анализы связывания также проводили для всех семнадцати блокирующих Fab2 для вычисления кажущейся Kd для каждого из них. Результаты анализов связывания Fab2 против MASP-2 крысы с нативным MASP-2 крысы для шести блокирующих Fab2 также показаны в таблице 6. На фиг.8B графически иллюстрируются результаты анализа связывания с Fab2-антителом #11. Сходные анализы связывания также проводили для других Fab2, для которых результаты представлены в таблице 6. Как правило, кажущиеся Kd, полученные для связывания каждого из шести Fab2 с "нативным" MASP-2, соответствуют довольно хорошо IC50 для Fab2 в функциональном анализе C3-конвертазы. Существуют доказательства, что MASP-2 претерпевает конформационное изменение из "неактивной" в "активную" форму при активации его протеазной активности (Feinberg et al., EMBO J 22:2348-59 (2003); Gal et al., J. Biol. Chem. 280:33435-44 (2005)). В нормальной плазме крысы, используемой для анализа образования C3-конвертазы, MASP-2 присутствует в основном в "неактивной" конформации профермента. Напротив, в анализе связывания MASP-2 присутствует в качестве части комплекса с MBL, связанным с иммобилизованным маннаном; таким образом, MASP-2 находится в "активной" конформации (Petersen et al., J. Immunol Methods 257:107-16, 2001). Следовательно, не обязательно ожидать точного соответствия между IC50 и Kd для каждого из семнадцати блокирующих Fab2, исследованных в этих двух функциональных анализах, поскольку в каждом анализе Fab2 связывает отличающуюся конформационную форму MASP-2. Тем не менее, за исключением Fab2 #88, оказалось, что существует высокое соответствие между IC50 и кажущейся Kd для каждого из других шестнадцати Fab2, исследованных в этих двух анализах (см. таблицу 6).
Несколько блокирующих Fab2 оценивали в отношении ингибирования опосредуемого MASP-2 расщепления C4. На фиг.8C графически иллюстрируются результаты анализа расщепления C4, демонстрирующие ингибирование посредством Fab2 #41 с IC50=0,81 нМ (см. таблицу 6). Как показано на фиг.9, было обнаружено, что все из исследованных Fab2 ингибируют расщепление C4 с IC50, сходными с IC50, полученными в анализе C3-конвертазы (см. таблицу 6).
Хотя маннан является известным активатором лектинового пути, теоретически возможно, что присутствие антител против маннана в сыворотке крысы также может активировать классический путь и, тем самым, образовывать C4b посредством опосредуемого C1s расщепления C4. Однако было идентифицировано несколько Fab2 против MASP-2, которые эффективно ингибируют образование C4b (>95%), таким образом, демонстрируя специфичность этого анализа в отношении опосредуемого MASP-2 расщепления C4. C4, подобно C3, содержит необычную и в высокой степени реакционноспособную сложную тиоэфирную группу в качестве части его структуры. При расщеплении C4 посредством MASP-2 в этом анализе сложная тиоэфирная группа на C4b может образовывать ковалентную связь с гидроксильными или аминогруппами на макромолекулах, иммобилизованных на дне лунок пластмассовых планшетов, через сложноэфирные или амидные связи, таким образом, облегчая обнаружение C4b в анализе ELISA.
Эти исследования отчетливо демонстрируют получение высокоаффинных FAB2 к белку MASP-2 крысы, которые функционально блокируют активность как C4-, так и C3-конвертазы, тем самым, препятствуя активации лектинового пути.
ПРИМЕР 11
В этом примере описано картирование эпитопов для нескольких из блокирующих Fab2-антител против MASP-2 крысы, которые были получены, как описано в примере 10.
Способы:
Как показано на фиг.10, следующие белки, все из которых имели N-концевые 6X His-метки, экспрессировали в клетках CHO с использованием вектора pED4:
MASP-2A крысы, полноразмерный белок MASP-2, инактивируемый путем изменения серина в активном центре на аланин (S613A);
MASP-2K крысы, полноразмерный белок MASP-2, измененный для снижения аутоактивации (R424K);
CUBI-II, N-концевой фрагмент MASP-2 крысы, который содержит только домены CUBI, EGF-подобный и CUBII; и
CUBI/EGF-подобный, N-концевой фрагмент MASP-2 крысы, который содержит только CUBI и EGF-подобный домены.
Эти белки очищали из культуральных супернатантов посредством никель-аффинной хроматографии, как описано ранее (Chen et al., J. Biol. Chem. 276:25894-02 (2001)).
C-концевой полипептид (CCPII-SP), содержавший CCPII и домен сериновой протеазы MASP-2 крысы, экспрессировали в E. coli в качестве слитого с тиоредоксином белка с использованием pTrxFus (Invitrogen). Белок очищали из клеточных лизатов с использованием аффинной смолы Thiobond. Партнер тиоредоаксина по слиянию экспрессировали с пустого pTrxFus в качестве отрицательного контроля.
Все рекомбинантные белки подвергали диализу в буфер TBS, и их концентрации определяли путем измерения OD при 280 нм.
АНАЛИЗ С ИСПОЛЬЗОВАНИЕМ ДОТ-БЛОТТИНГА:
Серийные разведения пяти рекомбинантных полипептидов MASP-2, описанных выше и показанных на фиг.10 (и полипептид тиоредоксина в качестве отрицательного контроля для полипептида CCPII-сериновая протеаза) наносили пятнами на нитроцеллюлозную мембрану. Количество нанесенного пятнами белка находилось в диапазоне от 100 нг до 6,4 пг с пятикратными шагами. В последующих экспериментах количество нанесенного пятнами белка находилось в диапазоне от 50 нг до 16 пг, вновь с пятикратными шагами. Мембраны блокировали 5% обезжиренным сухим молоком в TBS (блокирующий буфер), затем инкубировали с 1,0 мкг/мл Fab2 против MASP-2 в блокирующем буфере (содержавшем 5,0 мМ Ca2+). Связанные Fab2 выявляли с использованием конъюгированного с HRP антитела против Fab человека (AbD/Serotec; разбавленное 1/10000) и набора для выявления ECL (Amersham). Одну мембрану инкубировали с поликлональным Ab кролика против MASP-2 человека (описанное в Stover et al., J Immunol 163:6848-59 (1999)) в качестве положительного контроля. В этом случае, связавшееся Ab выявляли с использованием конъюгированного с HRP антитела козы против IgG кролика (Dako; разбавленное 1/2000).
Анализ связывания MASP-2
Планшеты для ELISA покрывали 1,0 мкг/лунка рекомбинантного полипептида MASP-2A или CUBI-II в карбонатном буфере (pH 9,0) в течение ночи при 4°C. Лунки блокировали 1% BSA в TBS, а затем добавляли серийные разведения Fab2 против MASP-2 в TBS, содержавшем 5,0 мМ Ca2+. Планшеты инкубировали в течение одного часа при к.т. После промывания три раза посредством TBS/tween/Ca2+, добавляли конъюгированное с HRP антитело против Fab человека (AbD/Serotec), разбавленное 1/10000 в TBS/ Ca2+, и планшеты инкубировали в течение дополнительного одного часа при к.т. Связанное антитело выявляли с использованием набора субстрата пероксидазы TMB (Biorad).
РЕЗУЛЬТАТЫ:
Результаты анализа с использованием дот-блоттинга, демонстрирующие реактивность Fab2 в отношении различных полипептидов MASP-2, представлены ниже в таблице 7. Числовые величины, представленные в таблице 7, указывают на количество нанесенного белка, требуемое для получения приблизительно полумаксимальной силы сигнала. Как показано, все полипептиды (за исключением только партнера по слиянию тиоредоксина) распознавались положительным контрольным Ab (поликлональная антисыворотка против MASP-2 человека, индуцированная у кроликов).
РЕАКТИВНОСТЬ В ОТНОШЕНИИ РАЗЛИЧНЫХ РЕКОМБИНАНТНЫХ ПОЛИПЕПТИДОВ MASP-2 КРЫСЫ НА ДОТ-БЛОТАХ
Все Fab2 реагировали с MASP-2A, а также с MASP-2K (данные не представлены). Большинство Fab2 распознавали полипептид CCPII-SP, но не N-концевыве фрагменты. Двумя исключениями являются Fab2 #60 и Fab2 #57. Fab2 #60 распознает MASP-2A и фрагмент CUBI-II, но не полипептид CUBI/EGF-подобный или полипептид CCPII-SP, что указывает на то, что он связывается с эпитопом в CUBII или охватывает CUBII и EGF-подобный домен. Fab2 # 57 распознает MASP-2A, но не любой из протестированных фрагментов MASP-2, что указывает на то, что этот Fab2 распознает эпитоп в CCP1. Fab2 #40 и #49 связывались только с полным MASP-2A. В анализе связывания ELISA, показанном на фиг.11, Fab2 #60 также связывался с полипептидом CUBI-II, хотя и с немного более низкой кажущейся аффинностью.
Эти данные демонстрируют идентификацию уникальных блокирующих Fab2 к множеству областей белка MASP-2
ПРИМЕР 12
В этом примере описан анализ мышей MASP-2-/- в модели ишемии/реперфузии почек
Предпосылки/обоснование: Повреждение при ишемии-реперфузии (I/R) в почках при температуре тела имеет значение при ряде клинических состояний, включая гиповолемический шок, окклюзию почечных артерий и процедуры с пережатием.
Ишемия-реперфузия (I/R) почек является важной причиной острой почечной недостаточности, ассоциированной с уровнем смертности вплоть до 50% (Levy et al., JAMA 275:1489-94, 1996; Thadhani et al., N. Engl. J. Med. 334:1448-60, 1996). Почечная недостаточность после трансплантации представляет собой распространенное и угрожающее жизни осложнение после трансплантации почки (Nicholson et al., Kidney Int. 58:2585-91, 2000). Эффективный способ лечения для I/R-повреждения почек в настоящее время не доступен, и единственным доступным способом лечения является гемодиализ. Патофизиология I/R-повреждения почек является сложной. В недавних исследованиях было показано, что лектиновый путь активации комплемента может играть важную роль в патогенезе I/R-повреждения почек (deVries et al., Am. J. Path. 165:1677-88, 2004).
Способы:
Мышей MASP-2(-/-) получали, как описано в примере 1, и подвергали обратному скрещиванию на протяжении по меньшей мере 10 поколений с C57Bl/6. Шести самцам MASP-2(-/-) и шести мышам дикого типа (+/+) с массой тела 22-25 г проводили внутрибрюшинную инъекцию Hypnovel (6,64 мг/кг; Roche products Ltd. Welwyn Garden City, Великобритания), а затем их подвергали анестезии посредством ингаляции изофлурана (Abbott Laboratories Ltd., Kent, UK). Изофлуран был выбран, поскольку он является мягким ингаляционным анестетиком с минимальной токсичностью в отношении печени; концентрации обеспечиваются точно и животное быстро восстанавливается даже после длительной анестезии. Hypnovel вводили, поскольку он вызывает состояние нейролептаналгезии у животного, что означает, что требуется меньшее введение изофлурана. Под животное клали теплую подушку, чтобы поддерживать постоянную температуру тела. Далее проводили абдоминальный разрез по средней линии и полость тела держали открытой с использованием пары ретракторов. Соединительную ткань удаляли выше и ниже почечной вены и артерии как правой, так и левой почек, и ножку почки зажимали с использованием зажимов для микроаневризм в течение 55 минут. Этот период ишемии был основан первоначально на предшествующем исследовании, проведенном в этой лаборатории (Zhou et al., J. Clin. Invest. 105:1363-71 (2000)). Кроме того, стандартное время ишемии 55 минут было выбрано после ишемического титрования и было обнаружено, что 55 минут дают устойчивое повреждение, которое также было обратимым, с низкой смертностью, составляющей менее 5%. После окклюзии 0,4 мл теплого физиологического раствора (37°C) помещали в брюшную полость и живот закрывали на период ишемии. После удаления зажимов для микроаневризмы почки наблюдали до тех пор, пока не произойдет изменение цвета, что является признаком возвращения кровотока в почки. В брюшную полость помещали следующие 0,4 мл теплого физиологического раствора и разрыв зашивали, после чего животных возвращали в клетки. Взятие образцов крови проводили через 24 часа после удаления зажимов и через 48 часов мышей умерщвляли и проводили дополнительное взятие образцов крови.
Оценка повреждения почек: Функцию почек оценивали через 24 и 48 часов после реперфузии у шести самцов MASP-2(-/-) и шести мышей WT (+/+). Измерение уровня креатинина в крови проводили с использованием масс-спектрометрии, которая обеспечивает воспроизводимый индекс почечной функции (чувствительность < 1,0 мкмоль/л). На фиг.12 графически иллюстрируется выведения азота мочевины из крови для контролей дикого типа C57Bl/6 и MASP-2 (-/-) через 24 часа и 48 часов после реперфузии. Как показано на фиг.12, мыши MASP-2(-/-) проявляли значительное снижение уровня мочевины в крови через 24 и 48 часов по сравнению с контрольными мышами дикого типа, что указывает на защитный функциональный эффект против повреждения почек в модели повреждения посредством ишемии-реперфузии.
В целом, увеличенный уровень мочевины в крови наблюдали как у мышей WT (+/+), так и у мышей MASP-2 (-/-), через 24 и 48 часов после хирургической процедуры и ишемического повреждения. Уровни мочевины в крови у животных WT (+/+) с хирургической операцией без ишемии был определен как 5,8 ммоль/л. В дополнение к данным, представленным на фиг.12, одно животное MASP-2 (-/-) продемонстрировало практически полную защиту от ишемического повреждения с величинами 6,8 и 9,6 ммоль/л через 24 и 48 часов, соответственно. Это животное было исключено из группы анализа как потенциальный результат, значительно отличающийся от остальных, где ишемическое повреждение могло отсутствовать. Таким образом, конечный анализ, показанный на фиг.12, включал 5 мышей MASP-2(-/-) и 6 мышей WT (+/+) и у мышей MASP-2 (-/-) наблюдали статистически значимое снижение мочевины в крови через 24 и 48 часов (t-критерий Стьюдента p<0,05). Эти данные указывают на то, что можно ожидать, что ингибирование активности MASP-2 будет иметь защитный или терапевтический эффект на повреждение почек вследствие ишемического повреждения.
ПРИМЕР 13
В этом примере описаны результаты MASP-2-/- в модели дегенерации желтого пятна на мышах
Предпосылки/обоснование: Связанная со старением дегенерация желтого пятна (AMD) является основной причиной слепоты в возрасте после 55 лет в промышленно развитых странах. AMD встречается в двух основных формах: неоваскулярная (влажная) AMD и атрофическая (сухая) AMD. Неоваскулярная (влажная) форма ответственна за 90% тяжелого снижения зрения, ассоциированного с AMD, даже несмотря на то, что только у ~20% индивидуумов с AMD развивается влажная форма. Клинические признаки AMD включают множественные друзы, географическую атрофию и хориоидную неоваскуляризацию (CNV). В декабре 2004 года FDA одобрила макуген (пегаптаниб), новый класс офтальмологических лекарственных средств для специфического нацеливания и блокирования эффектов сосудисто-эндотелиального фактора роста (VEGF), для лечения влажной (неоваскулярной) формы AMD (Ng et al., Nat Rev. Drug Discov 5:123-32 (2006)). Хотя макуген представляет собой перспективный новый терапевтический вариант для подгруппы пациентов с AMD, остается острая необходимость в разработке дополнительных средств для лечения этого комплексного заболевания. Множество независимых линий исследования предполагают центральную роль активации комплемента в патогенезе AMD. Патогенез хориоидной неоваскуляризации (CNV), наиболее тяжелой формы AMD, может вовлекать активацию путей комплемента.
Более двадцати пяти лет назад Ryan описал модель индуцируемого повреждения лазером у животных для CNV (Ryan, S.J., Tr. Am. Opth. Soc. LXXVII:707-745, 1979). Эта модель первоначально была разработана с использованием макаков-резус, однако с тех пор та же технология использовалась для разработки сходных моделей CNV на различных экспериментальных животных, включая мышей (Tobe et al., Am. J. Pathol. 153:1641-46, 1998). В этой модели используют лазерную фотокоагуляцию для разрушения мембраны Бруха, что является действием, которое приводит к образованию CNV-подобных мембран. Индуцируемая лазером модель охватывает множество важных признаков состояния человека (для последнего обзора см. Ambati et al., Survey Ophthalmology 48:257-293, 2003). Модель индуцируемого лазером повреждения на мышах в настоящее время является общепризнанной, и ее используют в качестве экспериментальной основы в большом и возрастающем количестве научных проектов. Является общепризнанным, что индуцируемая лазером модель обладает достаточным биологическим сходством с CNV у человека, чтобы доклинические испытания патогенеза и ингибирования лекарственными средствами с использованием этой модели были применимыми для CNV у человека.
Способы:
Мышь MASP-2-/- получали, как описано в примере 1, и подвергали обратному скрещиванию на протяжении 10 поколений с C57Bl/6. В данном исследовании сравнивали результаты оценки самцов мышей MASP-2 (-/-) и MASP-2 (+/+)в ходе индуцируемой лазером CNV, которая является ускоренной моделью неоваскулярной AMD, сфокусированной на объеме индуцируемой лазером CNV, определяемой посредством сканирующей лазерной конфокальной микроскопии в качестве меры повреждения тканей и определения уровней VEGF, мощного ангиогенного фактора, вовлеченного в CNV, в пигментном эпителии сетчатки (RPE)/хориоиде с использованием ELISA после лазерного повреждения.
Индукция хориоидной неоваскуляризации (CNV): Лазерная фотокоагуляция (532 нм, 200 мВт, 100 мс, 75 мкм; Oculight GL, Iridex, Mountain View, CA) проводилась на обоих глазах каждого животного на нулевые сутки индивидуумом, которому было неизвестно назначение лекарственного средства. Лазерные пятна наносили стандартизованным образом вокруг оптического нерва с использованием системы доставки с щелевой лампой и покровного стекла в качестве контактных линз. Морфологическим конечным результатом лазерного повреждения было появление кавитационного пузырька, являющегося признаком, предположительно коррелирующим с разрушением мембраны Бруха. Подробное описание способов и оцениваемых результатов представлено ниже.
Ангиография с флуоресцеином: ангиографию с флуоресцеином проводили с использованием камеры и системы визуализации (камера TRC 50 1A; система ImageNet 2.01; Topcon, Paramus, NJ) через 1 неделю после лазерной фотокоагуляции. Фотографии получали с использованием линзы 20-D в контакте с линзой фундус-камеры после внутрибрюшинной инъекции 0,1 мл 2,5% флуоресцеина натрия. Эксперт по сетчатке, не вовлеченный в лазерную фотокоагуляцию и ангиографию, оценивал ангиограммы с флуоресцеином за один сеанс слепым способом.
Объем хориоидальной неоваскуляризация (CNV): Через одну неделю после лазерного повреждения глаза извлекали и фиксировали с использованием 4% параформальдегида в течение 30 мин при 4°C. Получали глазные чаши путем удаления передних сегментов и промывали три раза PBS с последующей дегадратацией и регидратацией с использованием серии обработок метанолом. После блокирования два раза буфером (PBS, содержащий 1% бычий сывороточный альбумин и 0,5% Triton X-100) в течение 30 минут при комнатной температуре, глазные чаши инкубировали в течение ночи при 4°C с 0,5% FITC-изолектином B4 (Vector laboratories, Burlingame, CA), разбавленным PBS, содержавшим 0,2% BSA и 0,1% Triton X-100, который связывает концевые остатки β-D-галактозы на поверхности эндотелиальных клеток и осуществляет селективное мечение сосудов мыши. После двух промываний PBS, содержавшим 0,1% Triton X-100, нейросенсорную часть сетчатки осторожно открепляли и отделяли от оптического нерва. Проводили четыре релаксирующих радиальных надреза и оставшийся комплекс RPE-хориоид-склера заливали в плоский препарат в среде против выцветания (Immu-Mount Vectashield Mounting Medium; Vector Laboratories) и накрывали покровным стеклом.
Плоские препараты исследовали с использованием сканирующего лазерного конфокального микроскопа (TCS SP; Leica, Heidelberg, Германия). Сосуды визуализировали путем возбуждений при синей длине волны аргона (488 нм) и фиксации испускания между 515 и 545 нм. Для всех исследований с визуализацией использовали масляно-иммерсионный объектив 40X. Горизонтальные оптические срезы (шаг 1 мкм) получали с поверхности комплекса RPE-хориоид-склера. Наиболее глубокую фокусную плоскость, в которой можно было идентифицировать хориоидальную сосудистую сеть, соединяющую с очагом повреждения, считали дном очага повреждения. Любой сосуд в области, на которую был нацелен лазер, и выше этой эталонной плоскости считали CNV. Изображения каждого среза сохраняли в цифровом формате. Площадь обусловленной CNV флуоресценции измеряли с использованием компьютеризованного анализа изображений с использованием программного обеспечения для микроскопа (TCS SP; Leica). Суммирование всей флуоресцентной области в каждом горизонтальном срезе использовали в качестве показателя объема CNV. Визуализацию проводил оператор, которому не было известно о распределении на группы лечения.
Вследствие вероятности того, что на каждой очаг повреждения, из которого развивается CNV, влияет группа, к которой он принадлежит (мышь, глаз и лазерное пятно), средние объемы очагов повреждения сравнивали с использованием линейной смешанной модели повторяющихся измерений с расщепленными делянками. Фактор целой делянки представлял собой генетическую группу, к которой животное принадлежит, в то время как фактор расщепленной делянки представлял собой глаз. Статистическую значимость определяли на уровне 0,05. Апостериорные сравнения средних значений проводили с поправкой Бонферрони на множественные сравнения.
ELISA для VEGF. Через трое суток после повреждения посредством 12 лазерных пятен комплекс RPE-хориоид обрабатывали ультразвуком в лизизрующем буфере (20 мМ имидазол HCl, 10 мМ KCl, 1 мМ MgCL2, 10 мМ EGTA, 1% Triton X-100, 10 мМ NaF, 1 мМ молибдат Na и 1 мМ EDTA с ингибитором протеаз) на льду в течение 15 мин. Уровни белка VEGF в супернатанте определяли с использованием набора для ELISA (R&D Systems, Minneapolis, MN), который распознает все варианты по спрайсингу, при от 450 до 570 нм (Emax; Molecular Devices, Sunnyvale, CA) и нормализовывали к общему белку. Проводились дублированные измерения слепым образом оператором, не вовлеченным в фотокоагуляцию, визуализацию или ангиографию. Количества VEGF представляли в качестве среднего значения +/- SEM для по меньшей мере трех независимых экспериментов и сравнивали с использованием U-критерия Манна-Уитни. Нуль-гипотезу отклоняли при P<0,05.
РЕЗУЛЬТАТЫ:
Оценка уровней VEGF:
На фиг.13A графически иллюстрируются уровни белка VEGF в комплексе RPE-хориоид, выделенном из мышей C57Bl6 дикого типа и MASP-2(-/-), на нулевые сутки. Как показано на фиг.13A, оценка уровней VEGF указывает на снижение исходных уровней VEGF у мышей MASP-2 (-/-) против контрольных мышей C57bl дикого типа. На фиг.13B графически иллюстрируются уровни белка VEGF, измеренные на третьи сутки после индуцированного лазером повреждения. Как показано на фиг.13B, уровни VEGF были значительно увеличены у мышей дикого типа (+/+) через трое суток после индуцированного лазером повреждения, что согласуется с опубликованными исследованиями (Nozaki et al., Proc. Natl. Acad. Sci. USA 103:2328-33 (2006)). Однако у мышей MASP-2(-/-) наблюдали неожиданно очень низкие уровни VEGF.
Оценка хориоидальной неоваскуляризации (CNV):
В дополнение к снижению уровней VEGF после индуцируемой лазером дегенерации желтого пятна площадь CNV определяли до и после повреждения лазером. На фиг.14 графически иллюстрируется объем CNV, измеренный у мышей C57bl дикого типа и мышей MASP-2(-/-) на седьмые сутки после индуцированного лазером повреждения. Как показано на фиг.14, мыши MASP-2 (-/-) проявляли приблизительно 30% снижение площади CNV после индуцируемого лазером повреждения на седьмые сутки по сравнению с контрольными мышами дикого типа.
Эти данные указывают на снижение уровня VEGF и CNV, как видно у мышей MASP(-/-) против контроля дикого типа (+/+), и на то, что блокада MASP-2 ингибитором имеет профилактический или терапевтический эффект при лечении дегенерации желтого пятна.
ПРИМЕР 14
Этот пример демонстрирует, что активация тромбина может происходить после активации лектинового пути в физиологических условиях, и демонстрирует степень вовлечения MASP-2. В нормальной сыворотке крысы активация лектинового пути приводит к активации тромбина (оцениваемой как депонирование тромбина) одновременно с активацией комплемента (оцениваемой как депонирование C4). Как можно видеть на фиг.15A и 15B, активация тромбина в этой системе ингибируется блокирующим MASP-2 антителом (формат Fab2), имея кривую ингибирующая концентрация-ответ (фиг.15B), параллельную кривой для активации комплемента (фиг.15A). Эти данные указывают на то, что активация лектинового пути, возникающая при травме, приводит к активации как системы комплемента, так и системы свертывания, в процессе, который полностью зависит от MASP-2. Следовательно, блокирующие MASP2 антитела могут оказаться эффективными в отношении смягчения случаев чрезмерного системного свертывания, например, диссеминированного внутрисосудистого свертывания, которое является одним из признаков, ведущих к смертности в случае обширной травмы.
ПРИМЕР 15
В этом примере представлены результаты, полученные с использованием модели диссеминированного внутрисосудистого свертывания ("DIC") с локализованной реакцией Шварцмана у мышей с дефицитом MASP-2-/- и мышей с достаточным уровнем MASP-2+/+ для оценки роли лектинового пути в DIC.
Предпосылки/обоснование:
Как описано выше, блокада MASP-2 ингибирует активацию лектинового пути и снижает образование как анафилатоксина C3a, так и анафилатоксина C5a. Может быть показано, что анафилотоксины C3a являются мощными факторами агрегации тромбоцитов in vitro, однако их вовлечение in vivo значительно в меньшей степени определено, и высвобождение тромбоцитарных веществ и плазмина при репарации раны может только вторично вовлекать C3 комплемента. В этом примере роль лектинового пути анализировали у мышей MASP-2 (-/-) и WT (+/+) для оценки того, является ли необходимым длительное повышение активации C3 для индукции диссеминированного внутрисосудистого свертывания.
Способы:
Мышей MASP-2 (-/-), использованных в этом исследовании, получали, как описано в примере 1, и подвергали обратному скрещиванию в течение по меньшей мере 10 поколений с C57Bl/6.
В этом эксперименте использовали модель локализованной реакции Шварцмана. Локализованная реакция Шварцмана (LSR) представляет собой индуцируемый липополисахаридом (LPS) ответ с хорошо охарактеризованным вкладом клеточных и гуморальных элементов врожденной иммунной системы. Зависимость LSR от комплемента твердо установлена (Polak, L., et al., Nature 223:738-739 (1969); Fong J.S. et al., J Exp Med 134:642-655 (1971)). В модели LSR мышей подвергали первичной иммунизации за 4 часа посредством TNF альфа (500 нг, внутримошоночно), затем мышей подвергали анестезии и подготавливали для прижизненной микроскопии мышцы, поднимающей яичко. Для наблюдения выбирали сеть посткапиллярных венул (диаметром 15-60 мкм) с хорошим кровотоком (1-4 мм/с). Животным вводили флуоресцентные антитела для селективного мечения нейтрофилов или тромбоцитов. Сеть сосудов последовательно сканировали и изображения всех сосудов записывали в цифровом формате для последующего анализа. После регистрации базального состояния микроциркуляции мышам проводили однократную внутривенную инъекцию LPS (100 мкг), либо отдельно, либо с использованием средств, описанных выше. Затем ту же сосудистую сеть сканировали каждые 10 минут в течение 1 часа. Специфическое накопление флуорофоров идентифицировали путем вычитания фоновой флуоресценции и усиливали путем задания порога для изображений. Из полученных изображений определяли степень реакции. Первичным показателем реакций Шварцмана были данные об агрегатах.
Исследования сравнивали мышей с достаточным уровнем MASP-2 +/+ или дикого типа, подвергнутых воздействию либо известного средства, истощающего путь комплемента - фактора яда кобры (CVF), либо ингибитора терминального пути (антагонист C5aR). Результаты (фиг.16A) демонстрируют, что как CVF, так и антагонист C5aR, препятствовали появлению агрегатов в сосудах. Кроме того, мыши с дефицитом MASP-2-/- (фиг.16B) также продемонстрировали полное ингибирование локализованной реакции Шварцмана, подтверждая вовлечение лектинового пути. Эти исследования отчетливо демонстрируют роль MASP-2 в формировании DIC и служат в поддержку применения ингибиторов MASP-2 для лечения и профилактики DIC.
ПРИМЕР 16
В этом примере описан анализ мышей MASP-2 (-/-) в модели трансплантации почки на мышах
Предпосылки/обоснование:
Роль MASP-2 в функциональном исходе трансплантации почки оценивали с использованием модели на мышах.
Способы:
Функциональный исход трансплантации почки оценивали с использованием изотрансплантации одной почки реципиентным мышам с одной удаленной почкой, с шестью реципиентами трансплантата WT (+/+) (B6), и шестью реципиентами трансплантата MASP-2 (-/-). Для оценки функции трансплантированной почки, оставшуюся нативную почку удаляли из реципиента через 5 суток после трансплантации и функцию почки оценивали через 24 часа посредством измерения уровней азота мочевины в крови (BUN).
Результаты:
На фиг.17 графически иллюстрируются уровни азота мочевины в крови (BUN) в почке через 6 суток после трансплантации почки у реципиентов WT (+/+) и у реципиентов MASP-2 (-/-). Как показано на фиг.17, сильно повышенные уровни BUN наблюдали у реципиентов трансплантата WT (+/+) (B6) (нормальные уровни BUN у мышей составляют <5 мМ), что указывает на почечную недостаточность. Напротив, мыши, являвшиеся реципиентами изотрансплантата MASP-2 (-/-), продемонстрировали существенно более низкие уровни BUN, что указывает на улучшенную функцию почек. Следует отметить, что эти результаты были получены с использованием трансплантатов от доноров почек WT (+/+), что указывает на то, что отсутствие функционального лектинового пути отдельно у реципиента трансплантата является достаточным для достижения терапевтической пользы.
Взятые вместе, эти результаты указывают на то, что временное ингибирование лектинового пути посредством ингибирования MASP-2 обеспечивает способ снижения заболеваемости и отсроченную функцию трансплантата при трансплантации почки, и что этот подход, вероятно, является пригодным в других вариантах трансплантации.
ПРИМЕР 17
Этот пример демонстрирует, что мыши MASP-2 (-/-) являются устойчивыми к септическому шоку в модели полимикробного септического перитонита на мышах
Предпосылки/обоснование:
Для оценки потенциальных эффектов MASP-2 (-/-) при инфекции оценивали модель лигирования и прокола слепой кишки (CLP), которая является моделью полимикробного септического перитонита. Считается, что эта модель наиболее точно имитирует течение септического перитонита у человека. Модель лигирования и прокола слепой кишки (CLP) представляет собой модель, в которой слепую кишку лигируют и прокалывают иглой, что приводит к непрерывной утечке бактерий в брюшную полость, которые достигают крови через лимфодренаж и распределяются в органы брюшной полости, что приводит к полиорганной недостаточности и септическому шоку (Eskandari et al., J Immunol 148(9):2724-2730 (1992)). Модель CLP имитирует течение сепсиса, наблюдаемое у пациентов, и индуцирует ранний гипервоспалительный ответ с последующей выраженной гиповоспалительной фазой. В ходе этой фазы животные являются высокочувствительными к бактериальным заражениям (Wichterman et al., J. Surg. Res. 29(2):189-201 (1980)).
Способы:
Смертность от полимикробной инфекции с использованием модели с лигированием и проколом слепой кишки (CLP) измеряли у мышей WT (+/+) (n=18) и MASP-2 (-/-) (n=16). В кратком изложении, мышей с дефицитом MASP-2 и их однопометных животных дикого типа подвергали анестезии и слепую кишку выводили на поверхность и лигировали на 30% выше дистального конца. После этого слепую кишку прокалывали один раз иглой диаметром 0,4 мм. Затем слепую кишку помещали в брюшную полость и кожу закрывали зажимами. Мониторинг выживаемости мышей, подвергнутых CLP, проводили в течение 14 суток после CLP. Перитонеальный смыв собирали у мышей через 16 часов после CLP для измерения бактериальной нагрузки. Получали серийные разведения перитонеального смыва в PBS и инокулировали в чашки Мюллера-Хинтона с последующей инкубацией при 37°C в анаэробных условиях в течение 24 часов, после чего определяли бактериальную нагрузку.
Также у мышей WT (+/+) и MASP-2 (-/-) измеряли ответ цитокина TNF-альфа на бактериальную инфекцию через 16 часов после CLP в легких и селезенках с использованием количественной полимеразной цепной реакции в реальном времени (q-ОТ-ПЦР). Уровень TNF-альфа в сыворотке через 16 часов после CLP в мышей WT (+/+) и MASP-2 (-/-) также количественно определяли с использованием сэндвич-ELISA.
Результаты:
На фиг.18 графически иллюстрируется процентная выживаемость животных, обработанных посредством CLP, в зависимости от количества суток после процедуры CLP. Как показано на фиг.18, дефицит лектинового пути у мышей MASP-2 (-/-) не увеличивает смертность мышей после полимикробной инфекции с использованием модели с лигированием и проколом слепой кишки по сравнению с мышами WT (+/+). Однако, как показано на фиг.19, мыши MASP-2 (-/-) продемонстрировали значительно более высокую бактериальную нагрузку (увеличение количества бактерий приблизительно в 1000 раз) в перитонеальном лаваже после CLP по сравнению с их однопометными животными WT (+/+). Эти результаты указывают на то, что мыши с дефицитом MASP-2 (-/-) являются устойчивыми к септическому шоку. Сниженное бактериальное выведение у мышей с дефицитом MASP-2 в этой модели может быть результатом сниженного опосредуемого C3b фагоцитоза, поскольку было продемонстрировано, что депонирование C3 является зависимым от MASP-2.
Было определено, что ответ цитокина TNF-альфа на бактериальную инфекцию не был увеличен у мышей MASP-2 (-/-) по сравнению с контролями WT (+/+) (данные не представлены). Также было определено, что концентрация TNF-альфа была значительно более высокой в сыворотке мышей WT (+/+) через 16 часов после CLP в противоположность мышам MASP-2 (-/-), у которых сывороточный уровень TNF-альфа оставался практически неизмененным. Эти результаты указывают на то, что интенсивный воспалительный ответ на септическое состояние был затруднен у мышей MASP-2 (-/-), и это позволяло животным выжить в присутствии более высоких количеств бактерий.
Взятые вместе, эти результаты демонстрируют потенциальные вредоносные эффекты активации лектинового пути комплемента при септицемии и повышенной смертности у пациентов с генерализованным сепсисом. Эти результаты далее демонстрируют, что дефицит MASP-2 модулирует воспалительный иммунный ответ и снижает уровни экспрессии медиаторов воспаления при сепсисе. Таким образом, полагают, что ингибирование MASP-2 (-/-) посредством введения ингибиторных моноклональных антител против MASP-2 может быть эффективным для снижения воспалительного ответа у индивидуума, страдающего от септического шока.
ПРИМЕР 18
В этом примере описан анализ мышей MASP-2 (-/-) в модели интраназальной инфекционности на мышах
Предпосылки/обоснование:
Pseudomonas aeruginosa представляют собой грамотрицательный оппортунистический бактериальный патоген человека, который вызывает широкий диапазон инфекций, в частности, у индивидуумов с иммунодефицитом. Он является основным источником приобретенных нозокомиальных инфекций, в частности больничной пневмонии. Также он ответственен за значительную заболеваемость и смертность у пациентов с кистозным фиброзом (CF). Легочная инфекция P. aeruginosa характеризуется выраженным привлечением нейтрофилов и значительным воспалением легких, что приводит к обширному повреждению тканей (Palanki M.S. et al., J. Med. Chem 51:1546-1559 (2008)).
В этом примере проводили исследование для определения того, увеличивает ли устранение лектинового пути у мышей MASP-2 (-/-) чувствительность мышей к бактериальным инфекциям.
Способы:
Двадцать две мыши WT (+/+), двадцать две мыши MASP-2 (-/-) и одиннадцать мышей C3 (-/-) заражали посредством интраназального введения бактериального штамма P. aeruginosa. Мониторинг мышей проводили на протяжении шести суток после инфекции и строили графики Каплана-Мейера, демонстрирующие процентную выживаемость.
Результаты:
На фиг.20 представлен график Каплана-Мейера, иллюстрирующий процентную выживаемость мышей WT (+/+), MASP-2 (-/-) и C3 (-/-) через шесть суток после инфицирования. Как показано на фиг.20, не наблюдали отличий у мышей MASP-2 (-/-) против мышей WT (+/+). Однако устранение классического пути (C1q) у мышей C3 (-/-) привело к тяжелой предрасположенности к бактериальной инфекции. Эти результаты демонстрируют, что ингибирование MASP-2 не увеличивает предрасположенность к бактериальной инфекции, что указывает на то, что является возможным снижение нежелательных воспалительных осложнений у пациентов с травмой путем ингибирования MASP-2 без ухудшения способности пациента к борьбе с инфекциями посредством классического пути комплемента.
ПРИМЕР 19
В этом примере описан фармакодинамический анализ репрезентативных высокоаффинных Fab2-антител против MASP-2, которые были идентифицированы, как описано в примере 10.
Предпосылки/обоснование:
Как описано в примере 10, для идентификации высокоаффинных антител, которые блокируют лектиновый путь крысы, белок MASP-2 крысы использовали для сортировки библиотеки фагового дисплея. Эту библиотеку разрабатывали для обеспечения высокого иммунологического разнообразия и конструировали с использованием полностью человеческих последовательностей генов иммуноглобулинов. Как описано в примере 10, было идентифицировано приблизительно 250 индивидуальных фаговых клонов, которые связывались с высокой аффинностью с белком MASP-2 крысы, посредством скрининга с использованием ELISA. Секвенирование этих клонов идентифицировало 50 уникальных фагов, кодирующих антитело против MASP-2. Fab2-белок экспрессировали из этих клонов, очищали и анализировали в отношении аффинности связывания MASP-2 и фукнционального ингибирования лектинового пути комплемента.
Как показано в таблице 6 примера 10, в результате этого анализа было идентифицировано 17 Fab2 против MASP-2 с функциональной блокирующей активностью (уровень положительных результатов 34% для блокирующих антител). Функциональное ингибирование лектинового пути комплемента посредством Fab2 было заметным при уровне депонирования C4, который является прямой мерой расщепления C4 посредством MASP-2. Важно, что ингибирование было в равной степени очевидным, когда оценивали активность C3-конвертазы, что демонстрирует функциональную блокаду лектинового пути комплемента. 17 блокирующих MASP-2 Fab2, идентифицированных, как описано в примере 10, в высокой степени ингибируют образование C3-конвертазы с величинами IC50, равными или меньшими 10 нМ. Восемь из 17 идентифицированных Fab2 имеют величины IC50 в субнаномолярном диапазоне. Более того, все 17 блокирующих MASP-2 Fab2 обеспечили по существу полное ингибирование образования C3-конвертазы в анализе C3-конвертазы лектинового пути, как показано на фиг.8A-C и обобщенно представлено в таблице 6 примера 10. Более того, каждое из 17 блокирующих Fab2 против MASP-2, представленных в таблице 6 эффективно ингибирует образование C3b (>95%), таким образом, демонстрируя специфичность этого анализа в отношении C3-конвертазы лектинового пути.
Полноразмерные изотипические варианты антител IgG2c крысы и IgG2a мыши получали из Fab2 #11. В этом примере описана охарактеризация in vivo этих изотипов в отношении фармакодинамических параметров.
Способы:
Как описано в примере 10, белок MASP-2 крысы использовали для сортировки библиотеки фагового дисплея Fab, из которой был идентифицирован Fab2#11. Полноразмерные изотипические варианты антител IgG2c крысы и IgG2a мыши происходили из Fab2 #11. Как полноразмерный изотип антитела IgG2c крысы, так и IgG2a мыши, охарактеризовывали in vivo в отношении фармакодинамических параметров следующим образом.
Исследования in vivo на мышах:
Фармакодинамическое исследование проводили у мышей для исследования эффекта дозирования антитела против MASP-2 на активность лектинового пути в плазме in vivo. В этом исследовании депонирование C4 измеряли ex vivo в анализе лектинового пути в различные моменты времени после подкожного (п/к) и внутрибрюшинного (в/б) введения 0,3 мг/кг или 1,0 мг/кг MoAb мыши против MASP-2 (полноразмерное изотипическое антитело IgG2a мыши, происходящее из Fab2#11).
На фиг.21 графически иллюстрируется специфичное для лектинового пути депонирование C4b, измеренное ex vivo в неразбавленных образцах сыворотки, полученных от мышей (n=3 мыши/группа) в различные моменты времени после подкожного дозирования либо 0,3 мг/кг, либо 1,0 мг/кг MoAb мыши против MASP-2. Образцы сыворотки от мышей, полученные до дозирования антитела, служили в качестве отрицательных контролей (100% активность), в то время как сыворотку, дополненную in vitro тем же блокирующим антителом против MASP-2 в концентрации 100 нМ, использовали в качестве положительного контроля (активность 0%).
Результаты, показанные на фиг.21, демонстрируют быстрое и полное ингибирование депонирования C4b после подкожного введения дозы 1,0 мг/кг MoAb мыши против MASP-2. Частичное ингибирование депонирования C4b наблюдали после подкожного введения дозы 0,3 мг/кг MoAb мыши против MASP-2.
За восстановлением лектинового пути с течением времени наблюдали в течение трех недель, а затем проводили однократное в/б введение MoAb мыши против MASP-2 в дозе 0,6 мг/кг у мышей. Как показано на фиг.22, после дозирования антитела происходило резкое падение активности лектинового пути с последующим полным ингибированием лектинового пути, которое длилось в течение приблизительно 7 суток после в/б введения. Медленное восстановление активности лектинового пути наблюдали на протяжении второй и третей недель с полным восстановлением лектинового пути у мышей к 17 суткам после введения MoAb против MASP-2.
Эти результаты демонстрируют, что MoAb мыши против MASP-2, происходящее из Fab2 #11, ингибирует лектиновый путь у мышей зависимым от дозы образом при системной доставке.
ПРИМЕР 20
В этом примере описан анализ MoAb мыши против MASP-2, происходящего из Fab2 #11, в отношении эффективности в модели связанной со старением дегенерации желтого пятна на мышах.
Предпосылки/обоснование:
Как описано в примере 10, белок MASP-2 крысы использовали для сортировки библиотеки фагового дисплея Fab, из которой Fab2#11 был идентифицирован в качестве функционально активного антитела. Из Fab2 #11 получали полноразмерные антитела изотипов IgG2c крысы и IgG2a мыши. Полноразмерное антитело против MASP-2 изотипа IgG2a мыши охарактеризовывали в отношении фармакодинамических параметров, как описано в примере 19. В этом примере полноразмерное антитело мыши против MASP-2, происходящее из Fab2 #11, анализировали в модели связанной со старением дегенерации желтого пятна (AMD) на мышах, описанной Bora P.S. et al, J Immunol 174:491-497 (2005).
Способы:
Полноразмерное антитело мыши изотипа IgG2a против MASP-2, происходящее из Fab2 #11, как описано в примере 19, исследовали в модели связанной со старением дегенерации желтого пятна (AMD) на мышах, как описано в примере 13, со следующими модификациями.
Введение MoAb мыши против MASP-2
Две различных дозы (0,3 мг/кг и 1,0 мг/кг) MoAb мыши против MASP-2 вместе с введением изотипического контрольного MoAb инъецировали в/б мышам WT (+/+) (n= 8 мышей на группы) за 16 часов до индукции CNV.
Индукция хориоидной неоваскуляризации (CNV)
Индукцию хориоидной неоваскуляризации (CNV) и измерение объема CNV проводили с использованием лазерной фотокоагуляции, как описано в примере 13.
Результаты:
На фиг.23 графически иллюстрируется площадь CNV, измеренная на 7 сутки после повреждения лазером у мышей, которым вводили либо изотипическое контрольное MoAb, либо MoAb мыши против MASP-2 (0,3 мг/кг и 1,0 мг/кг). Как показано на фиг.23, у мышей, которым предварительно вводили 1,0 мг/кг MoAb против MASP-2, наблюдали статистически значимое (p <0,01) снижение CNV приблизительно 50% через семь суток после обработки лазером. Как дополнительно показано на фиг.23, было выявлено, что доза MoAb против MASP-2, составляющая 0,3 мг/кг, не была эффективной в отношении уменьшения CNV. Следует отметить, что было показано, что доза MoAb против MASP-2 0,3 мг/кг имеет частичное и временное ингибирование депонирования C4b после подкожного введения, как описано в примере 19 и показано на фиг.21.
Результаты, описанные в этом примере, демонстрируют, что блокада MASP-2 ингибитором, таким как MoAb против MASP-2, имеет профилактический и/или терапевтический эффект при лечении дегенерации желтого пятна. Следует отметить, что эти результаты согласуются с результатами, наблюдаемыми в исследовании, проведенном на мышах MASP-2 (-/-), описанном в примере 13, в котором наблюдали 30% снижение CNV через 7 суток после обработки лазером у мышей MASP-2 (-/-) по сравнению с контрольными мышами дикого типа. Более того, результаты в этом примере далее демонстрируют, что системно доставляемое антитело против MASP-2 обеспечивает локальную терапевтическую пользу в глазу, тем самым указывая на потенциал системного пути введения для лечения пациентов с AMD. В целом, эти результаты обеспечивают доказательства, подтверждающие применение MoAb против MASP-2 для лечения AMD.
ПРИМЕР 21
В этом примере продемонстрировано, что мыши с дефицитом MASP-2 защищены от индуцируемой Neisseria meningitidis смертности после инфицирования N. meningitidis и имеют усиленное устранение бактериемии по сравнению с контрольными мышами дикого типа.
Предпосылки: Neisseria meningitidis представляет собой гетеротрофную грамотрицательную диплококковую бактерию, известную по ее роли в менингите и других формах менингококкового заболевания, таких как менингококкемия. N. meningitidis является основной причиной заболеваемости и смертности в детском возрасте. Тяжелые осложнения включают септицемию, синдром Уотерхауза-Фридериксена, недостаточность надпочечников и диссеминированное внутрисосудистое свертывание (DIC). См. например, Rintala E. et al., Critical Care Medicine 28(7):2373-2378 (2000). В этом примере роль лектинового пути анализировали у мышей MASP-2 (-/-) и WT (+/+) для установления того, являются ли мыши с дефицитом MASP-2 предрасположенными к индуцируемой N. meningitidis смертности.
Способы:
Мышей с нокаутом MASP-2 получали, как описано в примере 1, и подвергали обратному скрещиванию на протяжении по меньшей мере 10 поколений с C57Bl/6. Мышам MASP-2 KO (n=10) и мышам C57/B6 дикого типа (n=10) в возрасте 10 недель инокулировали посредством внутривенной инъекции либо дозировку 5×108 к.о.е./100 мкл, либо 2×108 к.о.е./100 мкл, либо 3×107 к.о.е./100 мкл Neisseria meningitidis серогруппы A Z2491 в 400 мг/кг декстрана железа. Мониторинг выживаемости мышей после инфекции проводили в течение периода времени, составляющего 72 часов. Проводили взятие образцов крови от мышей с интервалами в один час после инфекции и анализировали для определения сывороточного уровня (log к.о.е./мл) N. meningitidis для подтверждения инфекции и определения скорости выведения бактерий из сыворотки.
Результаты:
На фиг.24A графически иллюстрируется процентная выживаемость мышей MASP-2 (-/-) и WT (+/+) после введения инфекционной дозы 5×108/100 мкл к.о.е. N. meningitidis. Как показано на фиг.24A, после инфицирования наиболее высокой дозой 5×108/100 мкл к.о.е. N. meningitidis, 100% мышей MASP-2 KO выжили в течение периода, составляющего 72 часа, после инфицирования. Напротив, только 20% мышей WT все еще были живы через 24 часа после инфекции. Эти результаты демонстрируют, что мыши с дефицитом MASP-2 защищены от индуцируемой N. meningitidis смертности.
На фиг.24B графически иллюстрируется log к.о.е./мл N. meningitides, выделенных в различные моменты времени из образцов крови, взятых от мышей MASP-2 KO (-/-) и WT (+/+), инфицированных 5×108 к.о.е./100 мкл N. meningitides. Как показано на фиг.24B, у мышей WT уровень N. meningitidis в крови достигал пика приблизительно 6,5 log к.о.е./мл через 24 часа после инфицирования и падал до нуля к 48 часам после инфицирования. Напротив, у мышей MASP-2 KO, уровень N. meningitidis достигал пика приблизительно 3,5 log к.о.е./мл через 6 часов после инфицирования и падал до нуля через 36 часов после инфекции.
На фиг.25A графически иллюстрируется процентная выживаемость мышей MASP-2 KO и WT после инфицирования 2×108 к.о.е./100 мкл N. meningitidis. Как показано на фиг.25A, после инфицирования дозой 2×108 к.о.е./100 мкл N. meningitidis, 100% мышей MASP-2 KO выжили на протяжении периода, составляющего 72 часа, после инфицирования. Напротив, только 80% мышей WT все еще были живы через 24 часов после инфицирования. В соответствии с результатами, показанными на фиг.24A, эти результаты далее демонстрируют, что мыши с дефицитом MASP-2 защищены от индуцируемой N. meningitidis смертности.
На фиг.25B графически иллюстрируется log к.о.е./мл N. meningitides, выделенных в различные моменты времени из образцов крови, взятых от мышей WT, инфицированных 2×108 к.о.е./100 мкл N. meningitidis. Как показано на фиг.25B, уровень N. meningitidis в крови мышей WT, инфицированных 2×108 к.о.е., достигал пика, составляющего приблизительно 4 log к.о.е./мл, через 12 часов после инфицирования и падал до нуля через 24 часов после инфицирования. На фиг.25C графически иллюстрируется log к.о.е./мл N. meningitides, выделенных в различные моменты времени из образцов крови, взятых от мышей MASP-2 KO, инфицированных 2×108 к.о.е./100 мкл N. meningitidis. Как показано на фиг.25C, уровень N. meningitidis в крови мышей MASP-2 KO, инфицированных 2×108 к.о.е., достигал максимального уровня, составляющего приблизительно 3,5 log к.о.е./мл, через 2 часа после инфицирования и падал до нуля через 3 часа после инфицирования. В соответствии с результатами, показанными на фиг.24B, эти результаты демонстрируют, что, хотя мышей MASP-2 KO инфицировали той же дозой N. meningitides, что и мышей WT, мыши MASP-2 KO имеют увеличенное устранение бактериемии по сравнению с WT.
Процентная выживаемость мышей MASP-2 KO и WT после инфицирования наиболее низкой дозой 3×107 к.о.е./100 мкл N. meningitides, составляла 100% через 72 часа (данные не представлены).
Обсуждение
Эти результаты демонстрируют, что мыши с дефицитом MASP-2 защищены от индуцируемой N. meningitidis смертности и имеют усиленное устранение бактериемии по сравнению с мышами WT. Таким образом, ввиду этих результатов, ожидается, что можно ожидать, что терапевтическое применение ингибиторов MASP-2, таких как MoAb против MASP-2, будет эффективным для лечения, предупреждения или смягчения эффектов инфекции бактериями N. meningitidis (т.е. сепсис и DIC). Кроме того, эти результаты указывают на то, что терапевтическое применение ингибиторов MASP-2, таких как MoAb против MASP-2, не вызывает предрасположенности у индивидуума к увеличенному риску приобретения инфекций N. meningitidis.
ПРИМЕР 22
В этом примере описано открытие новой опосредуемой лектиновым путем и зависимой от MASP-2 активации компонентом C3 комплемента шунта C4.
Обоснование:
Важная терапевтическая польза применения ингибиторов активации комплемента для ограничения повреждения при ишемии/реперфузии миокарда (MIRI) была убедительно продемонстрирована в экспериментальной модели инфаркта миокарда на крысах два десятилетия назад: рекомбинантный sCR1, являющийся растворимым укороченным производным рецептора комплемента 1 типа (CR1) на клеточной поверхности, вводили внутривенно и его эффект оценивали в модели на MIRI крысах in vivo. Введение sCR1 снижало объем инфаркта более чем на 40% (Weisman, H.F., et al., Science 249:146-151 (1990)). Затем терапевтический потенциал этого рекомбинантного ингибитора был продемонстрирован в клинических испытаниях, показавших, что введение sCR1 у пациентов с MI препятствовало нарушению сократимости в сердце после ишемии (Shandelya, S., et al., Circulation 87:536-546 (1993)). Однако основной механизм, ведущий к активации комплемента в ишемизированной ткани, не был окончательно определен, в основном вследствие отсутствия подходящих экспериментальных моделей, ограниченного понимания молекулярных процессов, которые приводят к активации комплемента в лишенных кислорода клетках, и взаимодействий и синергизма между различными путями активации комплемента.
В качестве фундаментального компонента иммунного ответа система комплемента обеспечивает защиту против вторгающихся микроорганизмов посредством как зависимых от антител, так и независимых от антител, механизмов. Она координирует множество клеточных и гуморальных взаимодействий в иммунном ответе, включая хемотаксис, фагоцитоз, адгезию клеток и дифференцировку B-клеток. Каскад комплемента инициируется тремя различными путями: классический путь, альтернативный путь и лектиновый путь. Распознающий субкомпонент C1q классического пути связывается с различными мишенями, наиболее значительно, иммунными комплексами, инициируя пошаговую активацию ассоциированных с ним сериновых протеаз, C1r и C1s, обеспечивающих основной механизм выведения патогенов и иммунных комплексов с последующим вовлечением адаптивной иммунной системы. Связывание C1q с иммунными комплексами конвертирует димер профермента C1r в его активную форму, расщепляя и, тем самым, активируя C1s. C1s транслирует связывание C1q в активацию комплемента на двух стадиях расщепления: сначала он конвертирует C4 в C4a и C4b, а затем расщепляет связанный с C4b C2 с образованием C3-конвертазы C4b2a. Этот комплекс конвертирует имеющийся в изобилии компонент C3 плазмы в C3a и C3b. Накопление C3b вблизи комплекса C4b2a сдвигает субстратную специфичность с C3 на C5 с образованием C5-конвертазы C4b2a(C3b)n. Комплексы C3- и C5-конвертазы, образовавшиеся посредством активации классического пути, являются идентичными комплексам, образовавшимся посредством активации лектинового пути. В альтернативном пути самопроизвольный гидролиз на низком уровне компонента C3 приводит к депонированию белковых фрагментом на клеточных поверхностях, запуская активацию комплемента на чужеродных клетках, в то время как ассоциированные с клетками регуляторные белки на тканях хозяина препятствуют активации, таким образом, предотвращая самоповреждение. Подобно альтернативному пути, лектиновый путь может активироваться в отсутствие иммунных комплексов. Активация инициируется связыванием мультимолекулярного комплекса активации лектинового пути с ассоциированными с патогенами молекулярными паттернами (PAMP), главным образом, углеводными структурами, присутствующими на бактериальных, грибковых или вирусных патогенах, или абберантными паттернами гликозилирования на апоптотических, некротических, злокачественных или лишенных кислорода клетках (Collard, C.D., et al., Am. J. Pathol. 156:1549-1556 (2000); Walport, M.J., N. Engl. J. Med. 344:1058-1066 (2001); Schwaeble, W., et al., Immunobiology 205:455-466 (2002); и Fujita, T., Nat. Rev. Immunol. 2:346-353 (2002)).
Маннан-связывающий лектин (MBL) был первым углеводным распознающим субкомпонентом, для которого было показано, что он образует комплексы с группой новых сериновых протеаз, называемых MBL-ассоциированными сериновыми протеазами (MASP) и нумеруемых в соответствии с последовательностью их открытия (т.е. MASP-1, MASP-2 и MASP-3). У человека комплексы активации лектинового пути могут образовываться с четырьмя альтернативными углеводными распознающими субкомпонентами с различной специфичностью связывания углеводов, т.е. MBL 2 и тремя различными представителями семейства фиколинов, а именно L-фиколином, H-фиколином и M-фиколином и MASP. Две формы MBL: MBL A и MBL C, и фиколин-A образуют комплексы активации лектинового пути с MASP в плазме мыши и крысы. Авторы настоящего изобретения ранее клонировали и охарактеризовали MASP-2 и дополнительный укороченный продукт гена MASP-2 размером 19 кДа, называемый MAp19 или sMAP, у человека, мыши и крысы (Thiel, S., et al., Nature 386:506-510 (1997);. Stover, C.M., et al., J. Immunol. 162:3481-3490 (1999); Takahashi, M., et al., Int. Immunol. 11:859-863 (1999); и Stover, C.M., et al., J. Immunol. 163:6848-6859 (1999)). MAp19/sMAP лишен протеазной активности, однако может регулировать активацию лектинового пути посредством конкуренции за связывание MASP с углеводными распознающими комплексами (Iwaki, D. et al., J. Immunol. 177:8626-8632 (2006)).
Существуют доказательства того, что из трех MASP только MASP-2 требуется для трансляции связывания распознающих комплексов лектинового пути в активацию комплемента (Thiel, S., et al. (1997); Vorup-Jensen, T., et al., J. Immunol. 165:2093-2100 (2000); Thiel, S., et al., J. Immunol. 165:878-887 (2000); Rossi, V., et al., J. Biol. Chem. 276:40880-40887 (2001)). В основе этого заключения лежит фенотип большинства недавно описанных штаммов мышей с дефицитом MASP-1 и MASP-3. За исключением замедления возникновения опосредуемой лектиновым путем активации комплемента in vitro, мыши с дефицитом MASP-1/3 сохраняют функциональную активность лектинового пути. Восстановление сыворотки с дефицитом MASP-1 и MASP-3 с использованием рекомбинантного MASP-1 преодолевает это замедление активации лектинового пути, что подразумевает, что MASP-1 может способствовать активации MASP-2 (Takahashi, M., et al., J. Immunol. 180:6132-6138 (2008)). В самом последнем исследовании было показано, что MASP-1 (и возможно также MASP-3) требуются для конвертирования фермента активации альтернативного пути фактора D из его формы профермента в его ферментативно активную форму (Takahashi, M., et al., J. Exp. Med. 207:29-37 (2010)). Физиологическая важность этого процесса подчеркивается отсутствием функциональной активности альтернативного пути в плазме мышей с дефицитом MASP-1/3.
Недавно созданные линии мышей с комбинированным направленным дефицитом углеводных распознающих субкомпонентов MBL A и MBL C лектинового пути все еще могут инициировать активацию лектинового пути посредством остаточного субкомпонента лектинового пути мыши фиколина A (Takahashi, K., et al., Microbes Infect. 4:773-784 (2002)). Отсутствие какой-либо остаточной функциональной активности лектинового пути у мышей с дефицитом MASP-2 обеспечивает информативную модель для исследования роли этого эффекторного звена врожденного гуморального иммунитета в здоровье и заболеваниях.
Доступность линий мышей с дефицитом C4 и MASP-2 позволила авторам настоящего изобретения определить новый специфичный к лектиновому пути, но зависимый от MASP-2, путь активации компонентом C3 комплемента шунта C4. Важнейший вклад этой нового опосредуемого лектиновым путем пути активации шунта C4 в постишемическую потерю ткани подчеркивается выраженным защитным фенотипом дефицитам MASP-2 при MIRI, то время как мыши с дефицитом C4, исследованные в той же модели, не продемонстрировали защиты.
В этом примере авторы настоящего изобретения описывают новую опосредуемую лектиновым путем и MASP-2-зависимую активацию компонентом C3 компонента шунта C4. Физиологическая значимость этого нового пути активации определяется защитным фенотипом дефицита MASP-2 в экспериментальной модели повреждения при ишемии/реперфузии миокарда (MIRI), в которой животные с дефицитом C4 не являются защищенными.
Способы:
Мыши с дефицитом MASP-2 не демонстрируют выраженных аномалий. Мышей с дефицитом MASP-2 получали, как описано в примере 1. Как гетерозиготные (+/-), так и гомозиготные (-/-) мыши с дефицитом MASP-2 являются здоровыми и фертильными и не демонстрируют выраженных аномалий. Их продолжительность жизни сходна с продолжительностью жизни их однопометных животных WT (>18 месяцев). Перед исследованием фенотипа этих мышей в экспериментальных моделях заболевания, линию MASP-2-/-, полученную авторами настоящего изобретения, подвергали обратному скрещиванию на протяжении одиннадцати поколений с генетическим фоном C57BL/6. Общее отсутствие мРНК MASP-2 подтверждали нозерн-блоттингом отобранных по поли A+ препаратов РНК печени, в то время как мРНК размером 1,2 т.п.о, кодирующая MAp19 или sMAP (укороченный продукт альтернативного сплайсинга гена MASP2) экспрессируется в изобилии.
Анализ способом q-ОТ-ПЦР с использованием пар праймеров, специфичных либо к кодирующей последовательности домена сериновой протеазы MASP-2 (B-цепь), либо к остальной части кодирующей последовательности для A-цепи, продемонстрировал, что мРНК, кодирующая B-цепь, не поддается обнаружению у мышей MASP-2-/-, в то время как встречаемость разрушенного транскрнипта мРНК A-цепи была значительно увеличена. Аналогично, встречаемость мРНК, кодирующей MAp19/sMAP, увеличена у мышей MASP-2+/- и MASP-2-/-. Уровни MASP-2 в плазме, определенные с использованием ELISA для 5 животных каждого генотипа, составляли 300 нг/мл для контролей WT (диапазон 260-330 нг/мл), 360 нг/мл для гетерозиготных мышей (диапазон 330-395 нг/мл) и не подавались обнаружению у мышей МASP-2-/-. С использованием q-ОТ-ПЦР, получали профили экспрессии мРНК, демонстрирующие, что мыши MASP-2-/- экспрессируют мРНК для MBL A, MBL C, фиколина A, MASP-1, MASP-3, C1q, C1rA, C1sA, фактора B, фактора D, C4 и C3 на уровне, сходном с уровнем у их однопоментных животных с достаточным количеством MASP-2 (данные не представлены).
Уровни C3 в плазме MASP-2-/- (n=8) и однопометных животных MASP-2+/+ (n=7) измеряли с использованием коммерчески доступного набора ELISA для C3 (Kamiya, Biomedical, Seattle, WA). Уровни C3 для мышей с дефицитом MASP-2 (среднее значение 0,84 мг/мл, +/- 0,34) были сходными с уровнями у контролей WT (среднее значение 0,92, +/- 0,37).
Результаты:
MASP-2 является необходимым для функциональной активности лектинового пути.
Как описано в примере 2 и показано на фиг.5, анализы in vitro плазмы MASP-2-/- продемонстрировали полное отсутствие функциональный активности лектинового пути на активирующих покрытых маннаном и зимозаном поверхностях в отношении активации C4. Аналогично, ни зависимое от лектинового пути расщепление C4, ни расщепление C3 не обнаруживались в плазме MASP-2-/- на поверхностях, покрытых N-ацетилглюкозамином, который связывается и запускает активацию через MBL A, MBL C и фиколин A (данные не представлены).
Анализы сывороток и плазмы мышей MASP-2-/- отчетливо продемонстрировали, что MASP-2 по существу необходим для активации комплемента через лектиновый путь. Однако общий дефицит функциональной активности лектинового пути оставляет другие пути активации комплемента интактными: плазма MASP-2-/- все еще может активировать комплемент через классический (фиг.26A) и альтернативный путь (фиг.26B). На фиг.26A и 26B, символ "*" указывает на сыворотку от WT (MASP-2 (+/+)); символ "•" указывает на сыворотку WT (лишенную C1q); символ "□" указывает на сыворотку MASP-2 (-/-); символ "Δ" указывает на сыворотку от MASP-2 (-/-) (лишенную C1q).
На фиг.26A графически иллюстрируется, что мыши MASP-2-/- сохраняют функциональный классический путь: депонирование C3b анализировали на микропланшетах для титрования, покрытых иммунными комплексами (полученными in situ путем покрытия посредством BSA, а затем добавления IgG козы против BSA). На фиг.26B графически иллюстрируется, что у мышей с дефицитом MASP-2 сохраняется функциональный альтернативный путь: депонирование C3b анализировали на покрытых зимозаном микропланшетах для титрования в условиях, которые обеспечивают только активацию альтернативного пути (буфер, содержащий Mg2+ и EGTA). Результаты, показанные на фиг.26A и фиг.26B, представляют собой средние значения для двух реплик, и они являются типичными для трех независимых экспериментов. Для источников плазмы использовали одни и те же обозначения. Эти результаты показывают, что у мышей с дефицитом MASP-2 присутствует функциональный альтернативный путь, о чем свидетельствуют результаты, показанные на фиг.26B, в экспериментальных условиях, разработанных для прямого запуска альтернативного пути с одновременной инактивацией как классического пути, так и лектинового пути.
Лектиновый путь активации комплемента вносит критический вклад в воспалительную потерю ткани при повреждении при ишемии/реперфузии миокарда (MIRI).
Для исследования вклада функциональной активности лектинового пути в MIRI, авторы настоящего изобретения сравнивали мышей MASP-2-/- и однопометных контрольных животных WT в модели MIRI после временного лигирования и реперфузии левой передней нисходящей ветви коронарной артерии (LAD). Присутствие или отсутствие компонента C4 комплемента не оказывало влияния на степень ишемической потери тканей при MIRI. Авторы настоящего изобретения оценили влияние дефицита C4 на размеры инфаркта после экспериментального MIRI. Как показано на фиг.27A и фиг.27B, идентичные размеры инфаркта наблюдали как у мышей с дефицитом C4, так и у их однопометных животных WT. На фиг.27A графически иллюстрируется индуцируемая MIRI потеря ткани после лигирования LAD и реперфузии у мышей C4-/- (n=6) и соответствующих контрольных однопометных животных WT (n=7). На фиг.27B графически иллюстрируется INF в качестве функции AAR, что отчетливо демонстрирует, что мыши C4-/- являются настолько же чувствительными к MIRI, как и их контроли WT (пунктирная линия).
Эти результаты демонстрируют, что мыши с дефицитом C4 не защищены от MIRI. Этот результат был неожиданным, поскольку он противоречит широко признанной точке зрения, что основной фрагмент активации C4, C4b, является необходимым компонентом C3-конвертазы C4b2a классического и лектинового пути. Таким образом, авторы настоящего изобретения оценили, может ли остаточная специфическая для лектинового пути активация компонента C3 комплемента обнаруживаться в плазме у мышей с дефицитом C4 и у человека.
Лектиновый путь может активировать C3 комплемента в отсутствие C4 через новый MASP-2-ависимый путь активации шунта C4
Вдохновленные историческими сообщениями, указывающим на существование пути активации шунта C4 в сыворотке морских свинок с дефицитом C4 (May, J.E., и M. Frank, J. Immunol. 111:1671-1677 (1973)), авторы настоящего изобретения анализировали, могут ли мыши с дефицитом C4 иметь остаточную функциональную активность классического или лектинового пути, и провели мониторинг активации C3 в специфических для различных путей условиях анализа, которые исключают вклад альтернативного пути.
Депонирование C3b анализировали на покрытых маннаном микропланшетах для титрования с использованием рекальцифицированной плазмы при концентрациях плазмы, препятствующих активации альтернативного пути (1,25% и ниже). Хотя расщепление C3 не обнаруживалось в плазме с дефицитом C4, исследованной в отношении активации классического пути (данные не представлены), выраженную остаточную активность расщепления C3 наблюдали в плазме мышей с дефицитом C4 при инициации активации комплемента через лектиновый путь. Зависимость от лектинового пути демонстрируется конкурентным ингибированием расщепления C3 после предварительной инкубации разведений плазмы с дефицитом C4 с растворимым маннаном (см. фиг.28A). Как показано на фиг.28A-D, MASP-2-зависимую активацию C3 наблюдали в отсутствие C4. На фиг.28A графически иллюстрируется депонирование C3b в плазме мыши C4+/+ (кресты) и C4-/- (незакрашенные круги). Предварительная инкубация плазмы C4-/- с избытком (1 мкг/мл) жидкофазного маннана перед анализом полностью ингибирует депонирование C3 (закрашенные круги). Результаты являются типичными для 3 независимых экспериментов. На фиг.28B графически иллюстрируются результаты эксперимента, в котором плазму мышей дикого типа, плазму мышей с дефицитом MASP-2 (незакрашенные квадраты) и плазму мыши C4-/- (1%) смешивали с различными концентрациями mAbM11 против MASP-2 крысы (ось абсцисс), и депонирование C3b анализировали на покрытых маннаном планшетах. Результаты представляют собой средние значения (± SD) для 4 анализов (дублированные реплики по 2 образца каждого типа плазмы). На фиг.28C графически иллюстрируются результаты для плазмы человека: объединенная плазма NHS (кресты), плазма C4-/- (незакрашенные круги) и плазма C4-/-, предварительно инкубированная с 1 мкг/мл маннана (закрашенные круги). Результаты являются репрезентативными для трех независимых экспериментов. На фиг.28D графически иллюстрируется ингибирование депонирования C3b в плазме (1%) человека с достаточным содержанием C4 и с дефицитом C4 с использованием mAbH3 против MASP-2 человека (средние значения ±SD для трех реплик). Как показано на фиг.28B, не было обнаружено зависимой от лектинового пути активации C3 в плазме MASP-2-/-, анализированной параллельно, что подразумевает, что этот путь активации посредством C3 шунта C4 является MASP-2-зависимым.
Для дальнейшего подтверждения этих данных авторы настоящего изобретения получали серию рекомбинантных ингибиторных mAb, выделенных из библиотек фагового дисплея антител с использованием аффинного скрининга против рекомбинантного MASP-2A человека и крысы (где остаток серина активного протеазного домена заменен остатком аланина посредством сайт-направленного мутагенеза для предупреждения аутолитической деградации антигена). Рекомбинантные антитела против MASP-2 (AbH3 и AbM11) выделяли из комбинаторных библиотек антител (Knappik, A., et al., J. Mol. Biol. 296:57-86 (2000)), с использованием рекомбинантного MASP-2A человека и крысы в качестве антигенов (Chen, C.B. and Wallis, J. Biol. Chem. 276:25894-25902 (2001)). Антитело против Fab2-фрагмента крысы, которое эффективно ингибировало опосредуемую лектиновым путем активацию C4 и C3 в плазме мыши (IC50 ~1 нМ), конвертировали в полноразмерное IgG2a-антитело. Поликлональную антисыворотку против MASP-2A мыши индуцировали у крысы. Эти инструменты позволили авторам настоящего изобретения подтвердить зависимость от MASP-2 этого нового пути активации посредством шунта C4, специфичного к лектиновому пути, как дополнительно описано ниже.
Как показано на фиг.28B, M211, ингибиторное моноклональное антитело, которое селективно связывается с MASP-2 мыши и крысы, ингибировало активацию посредством C3 шунта C4 у мышей с дефицитом C4, а также активацию C3 плазмы мыши WT через лектиновый путь зависимым от концентрации образом со сходными величинами IC50. Все анализы проводили при высоких разведениях плазмы, что делало путь активации альтернативного пути нефункциональным (с наивысшей концентрацией в плазме, составляющей 1,25%).
Для исследования присутствия аналогичной специфичной к лектиновому пути активации посредством C3 шунта C4 у человека, авторы настоящего изобретения проанализировали плазму донора с наследственным дефицитом обоих генов C4 человека (т.е. C4A и C4B), который приводил к полному отсутствию C4 (Yang, Y., et al., J. Immunol. 173:2803-2814 (2004)). На фиг.28C показано, что плазма пациента эффективно активирует C3 при высоких разведениях плазмы (делающих альтернативный путь нефункциональным). Специфичный к лектиновому пути способ активации C3 на покрытых маннаном планшетах продемонстрирован на плазме мышей с дефицитом C4 (фиг.28A) и плазме человека с дефицитом C4 (фиг.28C) путем добавления избытка концентраций жидкофазного маннана. Зависимость MASP-2 от этого механизма активации C3 в плазме человека с дефицитом C4 оценивали с использованием AbH3, моноклонального антитела, которое специфически связывается с MASP-2 человека и устраняет функциональную активность MASP-2. Как показано на фиг.28D, AbH3 ингибировало депонирование C3b (и C3dg) в плазме человека как с достаточным содержанием C4, так и с дефицитом C4, со сравнимой эффективностью.
Для оценки возможной роли других компонентов комплемента в активации посредством C3 шунта C4, авторы настоящего изобретения протестировали плазму мышей MASP-1/3-/- и Bf/C2-/- наряду с плазмой MASP-2-/-, C4-/- и C1q-/- (в качестве контролей) в условиях анализа, специфических как для лектинового пути, так и для классического пути. Относительный уровень расщепления C3 наносили на график против количества депонированного C3 при использовании плазмы WT.
На фиг.29A графически иллюстрируется сравнительный анализ активности C3-конвертазы в плазме различных линий мышей с дефицитом комплемента, исследованных в условиях анализа, специфических либо для лектинового пути активации, либо для классического пути активации. Разбавленные образцы плазмы (1%) мышей WT (n=6), мышей MASP-2-/- (n=4), мышей MASP-1/3-/- (n=2), мышей C4-/- (n=8), мышей C4/MASP-1/3-/- (n=8), мышей Bf/C2-/- (n=2) и C1q-/- (n=2) исследовали параллельно. Восстановление плазмы Bf/C2-/- посредством 2,5 мкг/мл рекомбинантного C2 крысы (Bf/C2-/- +C2) восстанавливало депонирование C3b. Результаты представляют собой средние значения (±SD). **p<0,01 (по сравнению с плазмой WT). Как показано на фиг.29A, существенное депонирование C3 наблюдали в плазме C4-/-, исследованной в условиях анализа, специфических для лектинового пути, но не в условиях, специфических для классического пути. Вновь, не наблюдали депонирования C3 в плазме с дефицитом MASP-2 через путь активации лектинового пути, в то время как в той же плазме C3 депонировался через классический путь. В плазме MASP-1/3-/- депонирование C3 происходило в условиях анализа, специфичных как для лектинового, так и для классического пути. Не наблюдали депонирования C3 в плазме с комбинированным дефицитом C4 и MASP-1/3, с использованием условий, специфических либо для лектинового пути, либо для классического пути. Депонирование C3 не обнаруживалось в плазме C2/Bf-/-, ни через лектиновый путь, ни через классический путь. Однако восстановление плазмы C2/Bf-/- мыши рекомбинантным C2 восстанавливало как опосредуемое лектиновым путем, так и опосредуемое классическим путем расщепление C3. Условия анализа подтверждали с использованием плазмы C1q-/-.
На фиг.29B графически иллюстрируется кинетика с течением времени для активности C3-конвертазы в плазме от различных линий мышей с дефицитом комплемента WT, fB-/-, C4-/-, MASP-1/3-/- и MASP-2-/-, исследованных в условиях анализа, специфических для лектинового пути активации (1% плазма, результаты являются типичными для трех независимых экспериментов). Как показано на фиг.29B, хотя в плазме MASP-2-/- не наблюдали расщепления C3, в плазме fB-/- C3 расщеплялся с кинетикой, сходной с плазмой WT. Значительное замедление зависимого от лектинового пути конвертирования C3 в C3b (и C3dg) наблюдали в плазме C4-/-, а также в плазме с дефицитом MASP-1/3. Недавно было показано, что это замедление активации C3 в плазме MASP-1/3-/- является зависимым от MASP-1, а не от MASP-3 (Takahashi, M., et al., J. Immunol. 180:6132-6138 (2008)).
Обсуждение:
Результаты, описанные в этом примере, убедительно показывают, что функциональная активность MASP-2 является необходимой для активации C3 через лектиновый путь как в присутствии, так и в отсутствие C4. Более того, C2 и MASP-1 требуются для функционирования этого нового пути активации посредством C3 шунта C4, специфического для лектинового пути. Сравнительный анализ функциональной активности лектинового пути в плазме MASP-2-/-, а также C4-/-, показал существование ранее неизвестного C4-независимого, но MASP-2-зависимого пути активации C3 комплемента и продемонстрировал, что C3 может активироваться зависимым от лектинового пути образом при полном отсутствии C4. Хотя детальный молекулярный состав и последовательность событий активации в этой новой MASP-2-зависимой C3-конвертазы еще не установлены, результаты, полученные авторами настоящего изобретения, показывают, что этот путь активации C4-шунта, кроме того, требует присутствия компонента C2 комплемента, а также MASP-1. Утрата опосредуемой лектиновым путем активности расщепления C3 в плазме мышей с комбинированным дефицитом C4 и MASP-1/3, может быть объяснена совсем недавно описанной ролью MASP-1 в усилении MASP-2-зависимой активации комплемента через прямое расщепление и активацию MASP-2 (Takahashi, M., et al., J. Immunol. 180:6132-6138 (2008)). Аналогично, MASP-1 может способствовать функциональной активности MASP-2 через его способность расщеплять C2 (Moller-Kristensen, et al., Int. Immunol. 19:141-149 (2007)). Оба типа активности могут объяснить сниженную скорость расщепления C3 в плазме с дефицитом MASP-1/3 через лектиновый путь активации и необходимость MASP-1 в поддержании конвертирования C3 через путь активации C4-шунта.
Было показано, что неспособность плазмы C2/fB-/- активировать C3 через лектиновый путь является C2-зависимой, поскольку добавление рекомбинантного C2 крысы в плазму C2/fB-/- восстанавливало способность разбавленной плазмы активировать C3 на покрытых маннаном планшетах.
Открытие, что дефицит C4 специфически нарушает классический путь активации комплемента, в то время как лектиновый путь сохраняет физиологически критический уровень активности C3-конвертазы через MASP-2 зависимый путь активации шунта C4, требует переоценки роли лектинового пути в моделях различных заболеваний, включая экспериментальную инфекцию S. pneumoniae (Brown, J. S., et al., Proc. Natl. Acad. Sci. U. S. A. 99:16969-16974 (2002); экспериментальный аллергический энцефаломиелит (Boos, L.A., et al., Glia 49:158-160 (2005); и модели C3-зависимой регенерации печени мыши (Clark, A., et al., Mol. Immunol. 45:3125-3132 (2008)). Последняя из этих групп продемонстрировала, что у мышей с дефицитом C4 может активироваться C3 независимым от альтернативного пути образом, поскольку ингибирование in vivo альтернативного пути посредством опосредуемого антителами устранения функциональной активности фактора B не влияло на зависимую от расщепления C3 регенерацию печени у мышей C4-/- (Clark, A., et al. (2008)). Этот путь активации посредством C3 шунта C4, опосредуемый лектиновым путем, также может объяснять отсутствие защитного фенотипа дефицита C4 в модели MIRI авторов настоящего изобретения, а также в ранее описанной модели отторжения аллотрансплантата почек (Lin, T., et al., Am. J. Pathol. 168:1241-1248 (2006)). Напротив, недавние результаты авторов настоящего изобретения продемонстрировали выраженный защитный фенотип мышей MASP-2-/- в моделях трансплантации почек (Farrar, C.A., et al., Mol. Immunol. 46:2832 (2009)).
В сущности, результаты этого примера подтверждают точку зрения, что MASP-2-зависимая активация C4-шунта для C3 является физиологически значимым механизмом, который может быть важным в условиях, в которых C4 ограничивает активацию C3.
ПРИМЕР 23
В этом примере описана активация C3 субстратами тромбина и депонированием C3 на маннане у мышей WT (+/+), MASP-2 (-/-), F11 (-/-), F11/C4 (-/-) и C4 (-/-).
Обоснование:
Как описано в примере 14, было определено, что активация тромбина может происходить после активации лектинового пути в физиологических условиях, и демонстрирует степень вовлечения MASP-2. C3 играет центральную роль в активации системы комплемента. Активация C3 требуется как для классического, так и для альтернативного путей активации комплемента. Проводили эксперимент для определения того, активируется ли C3 субстратами тромбина.
Способы:
Активация C3 субстратам тромбина
Активацию C3 измеряли в присутствии следующих активированных форм субстратов тромбина; FCXIa человека, FVIIa человека, FXa животных семейства бычьих, FXa человека, активированный белок C человека и тромбин человека. C3 инкубировали с различными субстратами тромбина, затем разделяли в восстанавливающих условиях на 10% SDS-полиакриламидных гелях. После электрофоретического переноса с использованием целлюлозной мембраны мембрану инкубировали с моноклональным связанным с биотином антителом крысы против C3 мыши, подвергали детекции с использованием набора стрептавидин-HRP и проявляли с использованием реагента ECL.
Результаты:
Активация C3 вовлекает расщепление интактной a-цепи на укороченную a'-цепь и растворимый C3a (не показано на фиг.30). На фиг.30 показаны результаты анализа с использованием вестерн-блоттинга активации C3 человека субстратами тромбина, где нерасщепленная цепь C3-альфа и продукт активации a'-цепи показаны стрелками. Как показано на фиг.30, инкубация C3 с активированными формами фактора свертывания XI и фактора X человека, а также с активированным фактором свертывания X животных семейства бычьих, может расщеплять C3 in vitro в отсутствие каких-либо протеаз комплемента.
Депонирование C3 на маннане
Анализы депонирования C3 проводили на образцах сыворотки, полученных от WT, MASP-2 (-/-), F11(-/-), F11(-/-)/C4(-/-) и C4(-/-). F11 представляет собой ген, кодирующий фактор свертывания XI. Для измерения активации C3 микропланшеты для титрования покрывали маннаном (1 мкг/лунка), затем добавляли антисыворотку овцы против HSA (2 мкг/мл) в TBS/tween/Ca2+. Планшеты блокировали 0,1% HSA в TBS и промывали, как описано выше. Образцы плазмы разбавляли в 4 мМ барбитале, в планшеты добавляли 145 мМ NaCl, 2 мМ CaCl2, 1 мМ MgCl2, pH 7,4, и инкубировали в течение 1,5 ч при 37°C. После промывания связывание C3b выявляли с использованием антитела кролика против C3c человека (Dako), а затем конъюгированного с щелочной фосфатазой антитела козы против IgG кролика и pNPP.
Результаты:
На фиг.31 показаны результаты анализа депонирования C3 в образцах сыворотки, полученных от WT, MASP-2 (-/-), F11(-/-), F11(-/-)/C4 (-/-) и C4 (-/-). Как показано на фиг.31, функциональный лектиновый путь существует даже при полном отсутствии C4. Как далее показано на фиг.31, эта новая зависимая от лектинового пути активация комплемента требует фактора свертывания XI.
Обсуждение:
До результатов, полученных в этом эксперименте, специалисты в данной области полагали, что лектиновый путь комплемента требует C4 для активности. Таким образом, данные для мышей с нокаутом C4 (и людей с дефицитом C4) интерпретировали, предполагая, что такие организмы имели дефицит лектинового пути (в дополнение к дефициту классического пути). Настоящие результаты демонстрируют, что это мнение является неверным. Таким образом, заключения предшествующих исследований, указывающих на то, что лектиновый путь является важным в определенных условиях заболевания на основе фенотипа животных с дефицитом C4, могут быть неверными. Данные, описанные в этом примере, также показывают, что в физиологическом контексте цельной сыворотки лектиновый путь может активировать компоненты каскада свертывания. Таким образом, демонстрируется, что существует взаимодействие между комплементом и свертыванием, вовлекающее MASP-2.
В этом примере описаны способы оценки эффекта антитела против MASP-2 на лизис эритроцитов из образцов крови, полученных от пациентов с пароксизмальной ночной гемоглобинурией (PNH).
Предпосылки/обоснование:
Пароксизамальная ночная гемоглобинурия (PNH), также называемая синдромом Маркиафавы-Микели, представляет собой приобретенное потенциально угрожающее жизни заболевание крови, характеризующееся индуцируемой комплементом внутрисосудистой гемолитической анемией. Признаком PNH является хронический внутрисосудистый гемолиз, который является следствием нерегулируемой активации альтернативного пути комплемента. Lindorfer, M.A., et al., Blood 115(11) (2010). Анемия при PNH является следствием разрушения эритроцитов в кровотоке. Симптомы PNH включают красную мочу вследствие появления гемоглобина в моче и тромбоз. PNH может развиваться сама по себе, и она называется "первичной PNH", или она может развиваться в контексте других нарушений костного мозга, таких как апластическая анемия, и она называется "вторичной PNH". Лечение PNH включает переливание крови от анемии, противосвертывающую терапию от тромбоза и применение моноклонального антитела экулизумаба (Soliris), которое защищает клетки крови от иммунного разрушения посредством ингибирования системы комплемента (Hillmen P. et al., N. Engl. J. Med. 350(6):552-9 (2004)). Однако у значительной части пациентов PNH, которых лечат экулизумабом, сохраняется клинически выраженная иммуноопосредуемая гемолитическая анемия, поскольку антитело не блокирует активацию альтернативного пути комплемента.
В этом примере описаны способы оценки эффекта антитела против MASP-2 на лизис эритроцитов из образцов крови, полученных от пациентов с PNH (которых не лечили Soliris), которые инкубируют с совпадающей по ABO подкисленной нормальной сывороткой человека.
Способы:
Реагенты:
Эритроциты от нормальных доноров и от пациентов, страдающих PNH (которых не лечили Soliris) получают посредством венопункции, и подготавливают, как описано в Wilcox, L.A., et al., Blood 78:820-829 (1991), включенной в настоящее описание в качестве ссылки. Антитела против MASP-2 с функциональной активностью блокирования лектинового пути, можно получать, как описано в примере 10.
Анализ гемолиза:
Способ определения эффекта антител против MASP-2 в отношении способности блокировать гемолиз эритроцитов от пациентов с PNH выполняют с использованием способов, описанных в Lindorfer, M.A., et al., Blood 15(11):2283-91 (2010) и Wilcox, L.A., et al., Blood 78:820-829 (1991), обе из которых включены в настоящее описание в качестве ссылок. Как описано в Lindorfer et al., эритроциты из образцов пациента с PNH центрифугируют, лейкоцитарную пленку аспирируют и клетки промывают желатин-вероналовым буфером (GVB) перед каждым экспериментом. Эритроциты тестируют в отношении чувствительности к опосредуемому APC лизису следующим образом. Совпадающие по ABO нормальные сыворотки человека разбавляют GVB, содержащим 0,15 мМ CaCl2 и 0,5 мМ MgCl2 (GVB+2) и подкисляют до pH 6,4 (подкисленный NHS, aNHS) и используют для разбавления эритроцитов до гематокрита 1,6% в 50% aNHS. Затем смеси инкубируют при 37°C, и через 1 час эритроциты осаждают центрифугированием. Оптическую плотность аликвоты выделенного супернатанта измеряют при 405 нМ и используют для вычисления процентного лизиса. Образцы, разбавленные подкисленной сывороткой-EDTA, обрабатывают аналогичным образом и используют для определения фонового опосредуемого не комплементом лизиса (как правило, менее 3%). Полный лизис (100%) определяют после инкубации эритроцитов в дистиллированной воде.
Для определения эффекта антител против MASP-2 на гемолиз эритроцитов PNH, эритроциты от пациентов PNH инкубируют в aNHS в присутствии возрастающих концентраций антител против MASP-2, а затем количественно определяют присутствие/уровень гемолиза.
Ввиду того факта, что было показано, что антитела против MASP-2 блокируют последующую активацию альтернативного пути комплемента, ожидается, что антитела против MASP-2 будут эффективными в отношении блокирования опосредуемого альтернативным путем гемолиза эритроцитов PNH, и они будут пригодными в качестве терапевтического средства для лечения пациентов, страдающих PNH.
ПРИМЕР 25
В этом примере описаны способы оценки эффекта блокирующего антитела против MASP-2 на активацию комплемента криоглобулинами в образцах крови, полученных от пациентов, страдающих криоглобулинемией.
Предпосылки/обоснование:
Криоглобулинемия характеризуется присутствием криоглобулинов в сыворотке. Криоглобулины представляют собой единичные или смешанные иммуноглобулины (как правило, IgM-антитела), которые претерпевают обратимую агрегацию при низких температурах. Агрегация приводит к активации классического пути комплемента и воспалению в сосудистом русле, в частности, на периферии. Клинические проявления криоглобулинемии включают васкулит и гломерулонефрит.
Криоглобулинемия может быть классифицирована следующим образом на основе состава криоглобулинов: криоглобулинемия типа I, или простая криоглобулинемия, является результатом моноклонального иммуноглобулина, обычно иммуноглобулина M (IgM); криоглобулинемии типов II и III (смешанная криоглобулинемия) включают ревматоидные факторы (RF), которые обычно представляют собой IgM в комплексах с Fc-частью поликлонального IgG.
Состояния, ассоциированные с криоглобулинемией, включают инфицирование гепатитом C, лимфопролиферативные нарушения и другие аутоиммунные заболевания. Криоглобулин-содержащие иммунные комплексы приводят к клиническому синдрому системного воспаления, возможно, вследствие их способности активировать комплемент. Хотя иммунные комплексы IgG обычно активируют классический путь комплемента, IgM-содержащие комплексы также могут активировать комплемент через лектиновый путь (Zhang, M., et al., Mol Immunol 44(1-3):103-110 (2007) и Zhang. M., et al., J. Immunol. 177(7):4727-34 (2006)).
Иммуногистохимические исследования далее продемонстрировали, что иммунные комплексы криоглобулинов содержат компоненты лектинового пути, и биоптаты от пациентов с криоглобулинемическим гломерулонефритом продемонстрировали иммуногистохимические признаки активации лектинового пути in situ (Ohsawa, I., et al., Clin Immunol 101(1):59-66 (2001)). Эти результаты указывают на то, что лектиновый путь может приводить к воспалению и неблагоприятным исходам при криоглобулинемических заболеваниях.
Способы:
Способ определения эффекта антител против MASP-2 на способность блокировать неблагоприятные эффекты криоглобулинемии выполняют с использованием анализа жидкофазного конвертирования C3, как описано в Ng Y.C. et al., Arthritis and Rheumatism 31(1):99-107 (1988), включенного в настоящее описание в качестве ссылки. Как описано в Ng et al., при эссенциальной смешанной криоглолбулинемии (EMC), моноклональный ревматоидный фактор (mRF), обычно IgM, образует комплекс с поликлональным IgG с образованием характерных криопреципитатных иммунных комплексов (IC) (криоглобулин типа II). Иммуноглобулины и C3 были продемонстрированы в стенках сосудов пораженных тканей, таких как кожа, нерв и почка. Как описано в Ng et al., 125I-меченный mRF добавляют в сыворотку (нормальная сыворотка человека и сыворотка, полученная от пациентов, страдающих криоглобулинемией), инкубируют при 37°C и определяют связывание с эритроцитами.
Конвертирование жидкофазного C3 определяют в сыворотке (нормальная сыворотка человека и сыворотка, полученная от пациентов, страдающих криоглобулинемией) в присутствии или в отсутствии следующих IC: BSA-антитело против BSA, mRF, mRF плюс IgG, или криоглобулины, в присутствии или в отсутствие антител против MASP-2. Фиксацию C3 и C4 на IC измеряют с использованием анализа копреципитации с F(ab')2 против C3 и F(ab')2 против C4.
Ввиду того факта, что было показано, что антитела против MASP-2 блокируют активацию лектинового пути, ожидается, что антитела против MASP-2 будут эффективными в отношении блокирования опосредуемых комплементов неблагоприятных эффектов, ассоциированных с криоглобулинемией, и они будут пригодными в качестве терапевтического средства для лечения пациентов, страдающих криоглобулинемией.
ПРИМЕР 26
В этом примере описаны способы оценки эффекта антитела против MASP-2 на образцы крови, полученные от пациентов с болезнью холодовых агглютининов, которая проявляется анемией.
Предпосылки/обоснование:
Болезнь холодовых агглютининов (CAD) представляет собой тип аутоиммунной гемолитической анемии. Антитела к холодовым агглютининам (обычно IgM) активируются холодными температурами и связываются с и агрегируют эритроциты. Антитела к холодовым агглютининам объединяются с комплементом и атакуют антиген на поверхности эритроцитов. Это приводит к опсонизации эритроцитов (гемолиз), которая запускает их выведение ретикулоэндотелиальной системой. Температура, при которой происходит агглютинация, варьируется от пациента к пациенту.
CAD проявляется как анемия. Когда скорость разрушения эритроцитов превышает способность костного мозга продуцировать достаточное количество переносящих кислород клеток, тогда возникает анемия. CAD может быть вызвана основным заболеванием или нарушением, таким как инфекционное заболевание (микоплазменная пневмония, свинка, мононуклеоз), лимфопролиферативное заболевание (лимфома, хронический лимфоцитарный лейкоз) или болезнь соединительных тканей, и она называется "вторичной CAD". Считается, что пациенты с первичной CAD имеют низкозлокачественное лимфопролиферативное нарушение костного мозга. Как первичная, так и вторичная CAD являются приобретенными состояниями.
Способы:
Реагенты:
Эритроциты от нормальных доноров и от пациентов, страдающих CAD, получают посредством венопункции. Антитела против MASP-2 с функциональной активностью блокирования лектинового пути можно получать, как описано в примере 10.
Эффект антител против MASP-2 в отношении блокирования опосредуемой холодовыми агглютининами активации лектинового пути может быть определен следующим образом. Эритроцитов от пациентов с группой крови I, положительная, сенсибилизируют холодовыми агглютининами (т.е. IgM-антитела), в присутствии или в отсутствии антител против MASP-2. Затем эритроциты исследуют в отношении способности активировать лектиновый путь путем измерения связывания C3.
Ввиду того факта, что было показано, что антитела против MASP-2 блокируют активацию лектинового пути, ожидается, что антитела против MASP-2 будут эффективными в отношении блокирования опосредуемых комплементом неблагоприятных эффектов, ассоциированных с болезнью холодовых агглютининов, и они будут пригодными в качестве терапевтического средства для лечения пациентов, страдающих болезнью холодовых агглютининов.
ПРИМЕР 27
В этом примере описаны способы оценки эффекта антитела против MASP-2 на лизис эритроцитов в образцах крови от мышей с атипичным гемолитическим уремическим синдромом (aHUS).
Предпосылки/обоснование:
Атипичный гемолитический уремический синдром (aHUS) характеризуется гемолитической анемией, тромбоцитопенией и почечной недостаточностью, вызываемыми тромбоцитарными тромбами в микроциркуляции почек и других органов. aHUS ассоциирована с дефектной регуляцией комплемента, и она может быть либо спорадической, либо семейной. aHUS ассоциирована с мутациями в генах, кодирующих активацию комплемента, включая фактор H комплемента, мембранный кофактор B и фактор I, а также фактор 1, родственный фактору H комплемента (CFHR1), и фактор3, родственный фактору H комплемента (CFHR3). Zipfel, P.F., et al., PloS Genetics 3(3):e41 (2007). В этом примере описаны способы оценки эффекта антитела против MASP-2 на лизис эритроцитов из образцов крови, полученных от мышей aHUS.
Способы:
Эффект антител против MASP-2 на лечение aHUS можно определять в модели этого заболевания на мышах, в которой эндогенный ген fH мыши заменен гомологом из человека, кодирующим мутантную форму fH, часто встречающуюся у пациентов с aHUS. См. Pickering M.C. et al., J. Exp. Med. 204(6):1249-1256 (2007), включенную в настоящее описание в качестве ссылки. Как описано в Pickering et al., у таких мышей развивается патология, подобная aHUS. Для оценки эффекта антитела против MASP-2 в отношении лечения aHUS, антитела против MASP-2 вводят мутантным мышам с aHUS и сравнивают лизис эритроцитов, полученных от мышей, которым вводили ab против MASP-2, и контролей без введения. Ввиду того факта, что было показано, что антитела против MASP-2 блокируют активацию лектинового пути, ожидается, что антитела против MASP-2 будут эффективными отношении блокирования лизиса эритроцитов у млекопитающих, страдающих aHUS.
ПРИМЕР 28
В этом примере описаны способы оценки эффекта антитела против MASP-2 для лечения глаукомы.
Обоснование/предпосылки:
Было показано, что неконтролируемая активация комплемента вносит вклад в прогрессирование дегенеративного повреждения ганглионарных клеток сетчатки (RGC), синапсов и аксонов при глаукоме. См. Tezel G. et al., Invest Ophthalmol Vis Sci 51:5071-5082 (2010). Например, гистопатологические исследования тканей человека и исследования in vivo с использованием различных моделей на животных продемонстрировали, что в сетчатке при глаукоме компоненты комплемента, включая C1q и C3, синтезируются и образуется терминальный комплекс комплемента (см. Stasi K. et al., Invest Ophthalmol Vis Sci 47:1024-1029 (2006), Kuehn M.H. et al., Exp Eye Res 83:620-628 (2006)). Как дополнительно описано в Kuehn M.H. et al., Experimental Eye Research 87:89-95 (2008), синтез и депонирование комплемента индуцируются I/R сетчатки и нарушение каскада комплемента замедляет дегенерацию RGC. В этом исследовании было обнаружено, что мыши, содержащие направленное разрушение компонента C3 комплемента, проявляют замедленную дегенерацию RGC после временной I/R сетчатки по сравнению с нормальными животными.
Способы:
Способ определения эффекта антител против MASP-2 на дегенерацию RGC выполняют в модели на животных I/R сетчатки, как описано в Kuehn M.H. et al., Experimental Eye Research 87:89-95 (2008), включенной в настоящее описание в качестве ссылки. Как описано в Kuehn et al., ишемию сетчатки индуцируют посредством анестезии животных, а затем установки иглы калибра 30, подсоединенной к резервуару, содержащему фосфатно-солевой буфер, через роговицу в переднюю камеру глаза. Затем резервуар с физиологическим раствором поднимают до достижения внутриглазного давления 104 мм рт. ст. (13,9 кПа), что достаточно для полного препятствования циркуляции через сосуды сетчатки. Повышенную внутриглазную ишемию подтверждают по обесцвечиванию радужной оболочки и сетчатки, и ишемию поддерживают в течение 45 минут только в левом глазу; правый глаз служит в качестве контроля и его канюлирование не осуществляется. Затем мышей умерщвляют либо через 1, либо через 3 недели после ишемического повреждения. Антитела против MASP-2 вводят мышам либо локально в глаз, либо системно, для оценки эффекта антитела против MASP, введенного перед ишемическим повреждением.
Иммуногистохимию глаз проводят с использованием антител против C1q и C3 для обнаружения депонирования комплемента. Повреждение оптического нерва также можно оценивать с использованием стандартных способов электронной микроскопии. Количественное определение выживших RGC сетчатки проводят с использованием мечения гамма-синуклеином.
Результаты:
Как описано в Kuehn et al. у нормальных контрольных мышей временная ишемия сетчатки приводит к дегенеративным изменениям оптического нерва и отложениям на сетчатке C1q и C3, обнаруживаемым иммуногистохимией. Напротив, мыши с дефицитом C3 проявляли выраженное снижение аксональной дегенерации, проявляя только незначительные уровни повреждения оптического нерва через 1 неделю после индукции. Исходя из этих результатов, ожидается, что сходные результаты можно наблюдать, если проводить этот анализ на мышах с нокаутом MASP-2, и если вводить антитела против MASP-2 нормальной мыши перед ишемическим повреждением.
ПРИМЕР 29
В этом примере продемонстрировано, что ингибитор MASP-2, такой как антитело против MASP-2, является эффективным для лечения радиационного воздействия и/или для лечения, смягчения или предупреждения острого лучевого синдрома.
Обоснование:
Воздействие высоких доз ионизирующего излучения вызывает смертность по двум основным механизмам: токсичность костного мозга и желудочно-кишечный синдром. Токсичность костного мозга приводит к снижению уровня всех гематологических клеток, предрасполагая организм к гибели вследствие инфекции и геморрагии. Желудочно-кишечный синдром является более тяжелым и запускается потерей барьерной функции кишечника вследствие разрушения эпителиального слоя кишечника и утраты эндокринной функции кишечника. Это приводит к сепсису и ассоциированному с ним синдрому системного воспалительного ответа, который может привести к гибели.
Лектиновый путь комплемента представляет собой врожденный иммунный механизм, который инициирует повреждение тканей и воздействие чужеродных поверхностей (т.е. бактерий). Блокада этого пути приводит к лучшим исходам в моделях на мышах ишемического повреждения ткани кишечника или септического шока. Полагают, что лектиновый путь может запускать чрезмерное и вредоносное воспаление в ответ на индуцируемое радиационным излучением повреждение тканей. Блокада лектинового пути, таким образом, может снизить вторичное повреждение и увеличить выживаемость после острого радиационного воздействия.
Задачей исследования, проведенного, как описано в этом примере, была оценка эффекта блокады лектинового пути на выживаемость в модели радиационного повреждения на мышах путем введения антител против MASP-2 мыши.
Способы и материалы:
Материалы. Исследуемые изделия, использованные в этом исследовании, представляли собой (i) высокоаффинное антитело против MASP-2 мыши (mAbM11) и (ii) высокоаффинное антитело против MASP-2 человека (mAbH6), которое блокирует белок MASP-2, являющийся компонентом лектинового пути комплемента, которое продуцировано в трансфицированных клетках млекопитающих. Дозируемые концентрации представляли собой 1 мг/кг антитела против MASP-2 мыши (mAbM11), 5 мг/кг антитела против MASP-2 человека (mAbH6) или стерильный физиологический раствор. Для каждой сессии дозирования получали достаточный объем свежих растворов для дозирования.
Животные. Молодых взрослых самцов мышей Swiss-Webster получали от Harlan Laboratories (Houston, TX). Животных содержали в клетках со сплошным дном с подстилкой Alpha-Dri и предоставляли сертифицированный корм для грызунов PMI 5002 (Animal Specialties, Inc., Hubbard OR) и воду без ограничений. Проводили мониторинг температуры и в комнате, в которой содержали животных, поддерживали световой цикл 12 часов на свету/12 часов в темноте.
Облучение. После акклиматизации в помещении в течение 2 недель мышей в группах по 10 животных облучали в дозе 6,5 и 7,0 Гр посредством воздействия на весь организм мощности дозы 0,78 Гр/мин с использованием системы Therapax X-RAD 320, оборудованной высокостабильным 320-кВ генератором рентгеновского излучения, металлокерамической рентгеновской трубкой, коллиматором переменных рентгеновских пучков и фильтром (Precision X-ray Incorporated, East Haven, CT). Уровни доз выбирали на основе предшествующих исследований, проведенных для той же линии мышей, показавших, что LD50/30 составляла между 6,5 и 7,0 Гр (данные не представлены).
Составление и введение лекарственных средств. Подходящий объем концентрированных исходных растворов разбавляли ледяным физиологическим раствором для получения растворов для дозирования 0,2 мг/мл антитела против MASP-2 мыши (mAbM11) или 0,5 мг/мл антитела против MASP-2 человека (mAbH6) в соответствии с протоколом. Введение антитела против MASP-2 mAbM11 и mAbH6 проводили посредством в/б инъекции с использованием иглы калибра 25, исходя из массы животного, для доставки 1 мг/кг mAbM11, 5 мг/кг mAbH6 или носителя в виде физиологического раствора.
Схема исследования. Мышей случайным образом распределяли на группы, как описано в таблице 8. Массу тела и температуру измеряли и регистрировали каждые сутки. Мышей в группах 7, 11 и 13 умерщвляли на 7 сутки после облучения и проводили взятие крови посредством пункции под глубокой анестезией. Выживших животных на 30 сутки после облучения умерщвляли таким же способом и проводили взятие крови. Из собранных образцов крови получали плазму в соответствии с протоколом и возвращали спонсору для анализа.
Исследуемые группы
(mAbM11)
(mAbM11)
(mAbM11)
(mAbH6)
(mAbM11)
(mAbM11)
(mAbM11)
(mAbM11)
(mAbH6)
Статистический анализ. Кривые выживаемости Каплана-Мейера строили и использовали для сравнения среднего времени выживаемости между группами лечения с использованием логарифмического рангового критерия и критерия Вилкоксона. Представлены средние значения со стандартными отклонениями или средние значения со стандартной ошибкой среднего значения. Статистические сравнения проводили с использованием двухстороннего непарного t-критерия между контрольными облученными животными и индивидуальными группами введения.
Результаты
Графики выживаемости Каплана-Мейера для групп воздействия 7,0 и 6,5 Гр представлены на фиг.32A и 32B, соответственно, и обобщенно представлены ниже в таблице 9. В целом, введение антител против MASP-2 мыши (mAbM11) до облучения увеличивало выживаемость облученных мышей по сравнению с контрольными облученными животными, которым вводили носитель на уровне воздействия как 6,5 Гр (20% увеличение), так и 7,0 Гр (30% увеличение). При уровне воздействия 6,5 Гр введение после облучения посредством ab против MASP-2 мыши приводило к умеренному повышению выживаемости (15%) по сравнению с контрольными облученными животными, которым вводили носитель.
Для сравнения, все животные, которым проводили введение на уровне воздействия 7,0 Гр, продемонстрировали увеличение выживаемости по сравнению с контрольными облученными животными, которым вводили носитель. Наиболее высокое изменение выживаемости происходило у животных, которым вводили mAbH6, с 45% увеличением по сравнению с контрольными животными. Кроме того, при уровне воздействия 7,0 Гр, смертность в группе, в которой вводили mAbH6, впервые возникла на 15 сутки после облучения по сравнению с 8 сутками после облучения для контрольных животных, которым вводили носитель, что соответствует увеличению на 7 суток по сравнению к контрольными животными. Среднее время до смерти для мышей, которым вводили mAbH6 (27,3±1,3 суток), было значительно увеличено (p = 0,0087) по сравнению с контрольными животными (20,7±2,0 суток) при уровне воздействия 7,0 Гр.
Процентное изменение массы тела по сравнению с сутками до облучения (сутки -1) регистрировали на протяжении исследования. Временное снижение массы тела происходило у всех облученных животных без признаков отличающихся изменений вследствие введения mAbM11 или mAbH6 по сравнению с контролями (данные не представлены). После завершения исследования все выжившие животные продемонстрировали увеличение массы тела от исходной (сутки -1) массы тела.
Уровни выживаемости исследуемых животных, подвергнутых радиационному облучению
Обсуждение
Острый лучевой синдром состоит из трех определенных подсиндромов: гемопоэтический, желудочно-кишечный и цереброваскулярный. Наблюдаемый синдром зависит от дозы облучения, причем гемопоэтические эффекты наблюдаются у человека со значительными частичными радиационными воздействиями или радиационными воздействиями на весь организм, превышающими 1 Гр. Гемопоэтический синдром характеризуется тяжелым подавлением функции костного мозга, что приводит к панцитопении с изменением формулы крови, количеств эритроцитов и лейкоцитов, и тромбоцитов, которые происходят одновременно с повреждением иммунной системы. Когда происходит наибольшее снижение уровня нейтрофилов, с малым количеством нейтрофилов и тромбоцитов, присутствующим в периферической крови, нейтропения, лихорадка, осложнения сепсиса и неконтролируемая геморрагия приводят к гибели.
В настоящем исследовании было обнаружено, что введение mAbH6 повышает выживаемость после рентгеновского облучения всего организма у самцов мышей Swiss-Webster, облученных в дозе 7,0 Гр. Следует отметить, что при уровне воздействия 7,0 Гр, 80% животных, которым вводили mAbH6, выжили в течение 30 суток по сравнению 35% контрольных облученных животных, которым вводили носитель. Важно, что первый день смерти в этой группе введения не наступал до 15 суток после облучения, что соответствует увеличению, составляющему 7 суток, относительно контрольных облученных животных, которым вводили носитель. Интересно, что при более низком воздействии рентгеновского излучения (6,5 Гр), введение mAbH6, по-видимому, не оказывало влияния на выживаемость или замедление смертности по сравнению с контрольными облученными животными, которым вводили носитель. Может существовать множество причин для этих отличий в ответе между уровнями воздействия, хотя подтверждение любой гипотезы может потребовать дополнительных исследований, включая промежуточное взятие образцов для получения микробиологической культуры и определения гематологических параметров. Одним из объяснений просто может быть то, что количество животных, отнесенных к группам, может исключать выявление каких-либо тонких обусловленных введением различий. Например, при размерах групп n=20, отличие в выживаемости между 65% (mAbH6 при воздействии 6,5 Гр) и 80% (mAbH6 при воздействии 7,0 Гр) составляет 3 животных. С другой стороны, отличие между 35% (контроль в виде носителя при воздействии 7,0 Гр) и 80% (mAbH6 при воздействии 7,0 Гр) составляет 9 животных, и оно обеспечивает убедительные доказательства обусловленных введением отличий.
Эти результаты демонстрируют, что антитела против MASP-2 являются эффективными для лечения млекопитающего, имеющего риск или страдающего вредоносными эффектами острого лучевого синдрома.
ПРИМЕР 30
В этом примере демонстрируется, что мыши с дефицитом MASP-2 защищены от индуцируемой Neisseria meningitidis смертности после инфицирования N. meningitidis серогруппы A или Neisseria meningitidis серогруппы B.
Способы:
Мышей с нокаутом MASP-2 (мыши MASP-2 KO) получали, как описано в примере 1. Мышам MASP-2 KO в возрасте 10 недель (n=10) и мышам C57/BL6 дикого типа (WT) (n=10) инокулировали посредством внутрибрюшинной (в/б) инъекции дозировку 2,6×107 к.о.е. Neisseria meningitidis серогруппы A Z2491 в объеме 100 мкл. Инфекционную дозу вводили мышам совместно с декстраном железа в конечной концентрации 400 мг/кг. Мониторинг выживания мышей после инфицирования осуществляли в течение периода 72 часов.
В отдельном эксперименте мышам MASP-2 KO в возрасте 10 недель (n=10) и мышам C57/BL6 дикого типа (n=10) инокулировали в/б инъекцию в дозировке 6×106 к.о.е. Neisseria meningitidis серогруппы B штамма MC58 в объеме 100 мкл. Инфекционную дозу вводили мышам совместно с декстраном железа в конечной дозе 400 мг/кг. Мониторинг выживаемости мышей после инфицирования проводили в течение 72 часов. Также для мышей WT и MASP-2 KO определяли показатель заболеваемости в течение 72 часов после инфицирования на основе параметров показателя заболеваемости, описанных ниже в таблице 10, которые основаны на схеме Fransen et al. (2010), с небольшими модификациями.
показатели заболеваемости, ассоциированные с клиническими признаками у инфицированных мышей
Взятие образцов крови мышей проводили с интервалами в один час и анализировали для определения сывороточного уровня (log к.о.е./мл) N. meningitidis для подтверждения инфекции и определения скорости выведения бактерий из сыворотки.
Результаты:
На фиг.33 представлен график Каплана-Мейера, графически иллюстрирующий процентную выживаемость мышей MASP-2 KO и WT после введения инфекционной дозы 2,6×107 к.о.е. N. meningitidis серогруппы A Z2491. Как показано на фиг.33, 100% мышей MASP-2 KO выжили в течение 72 часов после инфекции. Напротив, только 80% из мышей WT (p=0,012) все еще были живы через 24 часа после инфекции, и только 50% из мышей WT все еще были живы через 72 часов после инфекции. Эти результаты демонстрируют, что мыши с дефицитом MASP-2 защищены от смертности, индуцируемой N. meningitidis серогруппы A Z2491.
На фиг.34 представлен график Каплана-Мейера, графически иллюстрирующий процентную выживаемость мышей MASP-2 KO и WT после инфекционной дозы 6×106 к.о.е. N. meningitidis серогруппы B штамма MC58. Как показано на фиг.34, 90% мышей MASP-2 KO выжили в течение 72 часов после инфекции. Напротив, только 20% мышей WT (p=0,0022) все еще были живы через 24 часа после инфекции. Эти результаты демонстрируют, что мыши с дефицитом MASP-2 защищены от смертности, индуцируемой N. meningitidis серогруппы B штамма MC58.
На фиг.35 графически иллюстрируется log к.о.е./мл N. meningitidis серогруппы B штамма MC58, выделенных в различные моменты времени из образцов крови, взятых от мышей MASP-2 KO и WT после в/б инфицирования 6×106 к.о.е. N. meningitidis серогруппы B штамма MC58 (n=3 в различные моменты времени для обеих групп мышей). Результаты выражены в качестве средних значений ± SEM. Как показано на фиг.35, у мышей WT уровень N. meningitidis в крови достигал пика приблизительно 6,0 log к.о.е./мл через 24 часа после инфицирования и снижался до приблизительно 4,0 log к.о.е./мл к 36 часам после инфицирования. Напротив, у мышей MASP-2 KO уровень N. meningitidis достигал пика приблизительно 4,0 log к.о.е./мл через 12 часов после инфицирования и снижался до приблизительно 1,0 log к.о.е./мл через 36 часов после инфицирования (обозначение "*" указывает на p<0,05; обозначение "**" указывает на p=0,0043). Эти результаты демонстрируют, что хотя мыши MASP-2 KO были инфицированы той же дозой N. meningitidis серогруппы B штамма MC58, что и мыши WT, мыши MASP-2 KO имели усиленное устранение бактериемии по сравнению с WT.
На фиг.36 графически иллюстрируется средний показатель нездоровья мышей MASP-2 KO и WT через 3, 6, 12 и 24 часов после инфицирования 6×106 к.о.е./100 мкл N. meningitidis серогруппы B штамма MC58. Как показано на фиг.36, мыши с дефицитом MASP-2 продемонстрировали высокую устойчивость к инфицированию со значительно более низкими показателями нездоровья через 6 часов (символ "*" указывает на p=0,0411), 12 часов (символ "**" указывает на p=0,0049) и 24 часов (симпол "***" указывает на p=0,0049) после инфицирования по сравнению с мышами WT. Результаты, представленные на фиг.36 выражены в качестве средних значений ± SEM.
В целом, результаты в этом примере демонстрируют, что мыши с дефицитом MASP-2 защищены от индуцируемой Neisseria meningitides смертности после инфицирования либо N. meningitidis серогруппы A, либо N. meningitidis серогруппы B.
ПРИМЕР 31
В этом примере демонстрируется, что введение антитела против MASP-2 после инфицирования посредством N. meningitidis увеличивает выживаемость мышей, инфицированных N. meningitidis.
Предпосылки/обоснование:
Как описано в примере 10, белок MASP-2 крысы использовали для сортировки библиотеки фагового дисплея Fab, из которой был идентифицирован Fab2 #11 в качестве функционально активного антитела. Из Fab2 #11 получали полноразмерные антитела изотипов IgG2c крысы и IgG2a мыши. Полноразмерное антитело против MASP-2 изотипа IgG2a мыши охарактеризовывали в отношении фармакодинамических параметров (как описано в примере 19).
В этом примере полноразмерное антитело мыши против MASP-2, происходящее из Fab2 #11, анализировали в модели инфекции N. meningitidis на мышах.
Способы:
Полноразмерное антитело мыши против MASP-2 изотипа IgG2a, происходящее из Fab2 #11, полученное, как описано выше, исследовали в модели инфекции N. meningitidis на мышах следующим образом.
Введение моноклональных антител мыши против MASP-2 (MoAb) после инфицирования
Мышам C57/BL6 Charles River в возрасте 9 недель вводили ингибиторное антитело мыши против MASP-2 (1,0 мг/кг) (n=12) или контрольное изотипическое антитело (n=10) через 3 часа после в/б инъекции высокой дозы (4×106 к.о.е.) N. meningitidis серогруппы B штамма MC58.
Результаты:
На фиг.37 представлен график Каплана-Мейера, графически иллюстрирующий процентную выживаемость мышей после введения инфекционной дозы 4×106/100 мкл к.о.е. N. meningitidis серогруппы B штамма MC58, с последующим введением через 3 часа после инфицирования либо ингибиторного антитела против MASP-2 (1,0 мг/кг), либо изотипического контрольного антитела. Как показано на фиг.37, 90% мышей, которым вводили антитело против MASP-2, выжили в течение 72 часов после инфицирования. Напротив, только 50% мышей, которым вводили изотипическое контрольное антитело, выжили в течение 72 часов после инфицирования. Обозначение "*" указывает на p=0,0301 при определении путем сравнения двух кривых выживаемости.
Эти результаты демонстрируют, что введение антитела против MASP-2 является эффективным для лечения и повышения выживаемости у индивидуумов, инфицированных N. meningitidis.
Как продемонстрировано в настоящем описании, применение антитела против MASP-2 для лечения индивидуума, инфицированного N. meningitides, является эффективным при введении в течение 3 часов после инфицирования и ожидается, что оно будет эффективным в течение от 24 часов до 48 часов после инфицирования. Менингококковое заболевание (либо менингококкемия, либо менингит) является неотложным состоянием, и терапию, как правило, начинают сразу, как только подозревают наличие менингококкового заболевания (т.е. до положительной идентификации N. meningitidis в качестве этиологического фактора).
Ввиду результатов на мышах MASP-2 KO, продемонстрированных в примере 30, полагают, что введение антитела против MASP-2 перед инфицированием N. meningitidis также является эффективным для предупреждения или смягчения тяжести инфекции.
ПРИМЕР 32
В этом примере продемонстрировано, что введение антитела против MASP-2 является эффективным для лечения инфекции N. meningitidis в сыворотке человека.
Обоснование:
Пациенты со сниженными сывороточными уровнями функционального MBL проявляют увеличенную чувствительность к рецидивирующим бактериальным и грибковым инфекциям (Kilpatrick et al., Biochim Biophys Acta 1572:401-413 (2002)). Известно, что N. meningitidis распознаются MBL, и было показано, что сыворотки с дефицитом MBL не лизируют Neisseria.
Ввиду результатов, описанных в примерах 30 и 31, проводили серию экспериментов для определения эффективности введения антитела против MASP-2 для лечения инфекции N. meningitidis в сыворотках с дефицитом комплемента и контрольных сыворотках. Эксперименты проводили при высокой концентрации сыворотки (20%) для сохранения каскада комплемента.
Способы:
1. Бактерицидная активность сыворотки в различных сыворотках с дефицитом комплемента и в сыворотках человека, обработанных антителом человека против MASP-2
В этом эксперименте использовали следующие сыворотки с дефицитом комплемента и контрольные сыворотки человека:
Исследованные образцы сыворотки человека (как показано на фиг.38)
Рекомбинантное антитело против MASP-2 человека выделали из комбинаторной библиотеки антител (Knappik, A., et al., J. Mol. Biol. 296:57-86 (2000)), с использованием рекомбинантного MASP-2A человека в качестве антигена (Chen, C.B. и Wallis, J. Biol. Chem. 276:25894-25902 (2001)). scFv-фрагмент, который потенциально ингибировал опосредуемую лектиновым путем активацию C4 и C3 человека в плазме человека (IC50 ~20 нМ), идентифицировали и конвертировали в полноразмерное IgG4-антитело человека.
N. meningitidis серогруппы B-MC58 инкубировали с различными сыворотку, показанными в таблице 11, каждая из которых имела концентрацию 20%, с добавлением ингибиторного антитела человека против MASP-2 или без него (3 мкг в общем объеме 100 мкл) при 37°C при встряхивании. Образцы получали в следующие моменты времени: интервалы 0, 30, 60 и 90 минут, проводили посев, а затем подсчитывали количество жизнеспособных микроорганизмов. В качестве отрицательного контроля использовали инактивированную нагреванием сыворотку человека.
Результаты:
На фиг.38 графически иллюстрируется log к.о.е./мл количества жизнеспособных микроорганизмов N. meningitidis серогруппы B-MC58, выделенного в различные моменты времени в образцах сыворотки человека, представленных в таблице 11. В таблице 12 представлены результаты для фиг.38 с t-критерием Стьюдента.
Результаты для фиг.38 с t-критерием Стьюдента (момент времени 60 минут)
Как показано на фиг.38 и в таблице 12, комплемент-зависимое уничтожение N. meningitidis в 20% сыворотке человека значительно усиливалось посредством добавления ингибиторного антитела человека против MASP-2.
2. Комплемент-зависимое уничтожение N. meningitidis в 20% (об./об.) сыворотках мыши с дефицитом MASP-2.
В этом эксперименте использовали следующие сыворотки мыши с дефицитом комплемента и контрольные сыворотки мыши:
Исследованные образцы сыворотки мыши (как показано на фиг.39)
N. meningitidis серогруппы B-MC58 инкубировали с различными сыворотками мыши с дефицитом, каждая в концентрации в сыворотке 20%, при 37°C при встряхивании. Взятие образцов проводили в следующие моменты времени: интервалы 0, 15, 30, 60, 90 и 120 минут, проводили посев, а затем определяли количество жизнеспособных микроорганизмов. В качестве отрицательного контроля использовали инактивированную нагреванием сыворотку.
Результаты:
На фиг.39 графически иллюстрируется log к.о.е./мл количества жизнеспособных клеток N. meningitidis серогруппы B-MC58, выделенных в различные моменты времени в образцах сыворотки мыши, показанных в таблице 13. Как показано фиг.39, сыворотки мышей MASP-2-/- имеют более высокий уровень бактерицидной активности в отношении N. meningitides, чем сыворотки мыши WT. Символ "**" указывает на p=0,0058, символ "***" указывает на p=0,001. В таблице 14 представлены результаты для фиг.39 с t-критерием Стьюдента.
Результаты для фиг.39 с t-критерием Стьюдента (момент времени 60 минут)
В целом, результаты, приведенные в этом примере, демонстрируют, что сыворотки MASP-2 -/- обладают более высоким уровнем бактерицидной активности в отношении N. meningitides, чем сыворотки WT.
ПРИМЕР 33
В этом примере демонстрируется ингибиторный эффект дефицита MASP-2 на лизис эритроцитов из образцов крови, полученных в модели пароксизмальной ночной гемоглобинурии (PNH) на мышах.
Предпосылки/обоснование:
Пароксизамальная ночная гемоглобинурия (PNH), также называемая синдромом Маркиафавы-Микели, представляет собой приобретенное потенциально угрожающее жизни заболевание крови, характеризующееся индуцируемой комплементом внутрисосудистой гемолитической анемией. Признаком PNH является хронический опосредуемый комплементом внутрисосудистый гемолиз, который является следствием нерегулируемой активации альтернативного пути комплемента из-за отсутствия регуляторов комплемента CD55 и CD59 на эритроцитах при PNH, с последующей гемоглобинурией и анемией. Lindorfer, M.A., et al., Blood 115(11) (2010), Risitano, A.M, Mini-Reviews in Medicinal Chemistry, 11:528-535 (2011). Анемия при PNH является следствием разрушения эритроцитов в кровотоке. Симптомы PNH включают красную мочу вследствие появления гемоглобина в моче, боль в спине, усталость, одышку и тромбоз. PNH может развиваться сама по себе, и она называется "первичной PNH", или она может развиваться в контексте других нарушений костного мозга, таких как апластическая анемия, и она называется "вторичной PNH". Лечение PNH включает переливание крови от анемии, противосвертывающую терапию от тромбоза и применение моноклонального антитела экулизумаба (Soliris®), которое защищает клетки крови от иммунного разрушения посредством ингибирования системы комплемента (Hillmen P. et al., N. Engl. J. Med. 350(6):552-9 (2004)). Экулизумаб (Soliris®) представляет собой гуманизированное моноклональное антитело, которое нацелено на компонент C5 комплемента, блокируя его расщепление C5-конвертазами, тем самым, препятствуя образованию C5a и сборке MAC. Лечение пациентов с PNH экулизумабом приводило к снижению внутрисосудистого гемолиза, измеряемому по лактатдегидрогеназе (LDH), что приводило к стабилизации гемоглобина и независимости от переливания крови приблизительно у половины пациентов (Hillmen P, et al., Mini-Reviews in Medicinal Chemistry, vol 11(6) (2011)). Хотя практически все пациенты, подвергшиеся терапии экулизумабом, достигают нормальных или практически нормальных уровней LDH (вследствие контроля внутрисосудистого гемолиза), только приблизительно треть пациентов достигают уровня гемоглобина выше 11 г/дл, и остальные пациенты, принимающие экулизумаб, продолжают проявлять анемию от умеренной до тяжелой (т.е. зависимые от переливаний), приблизительно в равных соотношениях (Risitano A.M. et al., Blood 113:4094-100 (2009)). Как описано в Risitano et al., Mini-Reviews, Medicinal Chemistry 11:528-535 (2011), было продемонстрировано, что у пациентов PNH, которых лечили экулизумабом, присутствовали фрагменты C3, связанные со значительной частью их эритроцитов PNH (в то время как у пациентов без лечения они отсутствовали), что привело к заключению, что мембраносвязанные фрагменты C3 действуют в качестве опсонинов на эритроциты при PNH, вызывая их захват в ретикулоэндотелиальные клетки через специфические рецепторы C3 и последующий внесосудистый лизис. Таким образом, в дополнение к применению экулизумаба необходимы терапевтические стратегии для пациентов, у которых развивается опосредуемый фрагментом C3 внесосудистый гемолиз, поскольку им продолжают требоваться трансфузии эритроцитов.
В этом примере описаны способы оценки эффекта сыворотки с дефицитом MASP-2 и сыворотки, обработанной средством, ингибирующим MASP-2, на лизис эритроцитов из образцов крови, полученных в модели PNH на мышах и демонстрируется эффективность ингибирования MASP-2 для лечения индивидуумов, страдающих PNH, и также обосновывается применение ингибиторов MASP-2 для смягчения эффектов опосредуемого фрагментом C3 внесосудистого гемолиза у индивидуумов с PNH, подвергающихся терапии ингибитором C5, таким как экулизумаб.
Способы:
Модель PNH на животных:
Образцы крови получали от мышей с направленным воздействием на гены с дефицитом Crry и C3 (Crry/C3-/-) и с дефицитом CD55/CD59. У этих мышей отсутствуют соответствующие поверхностные регуляторы комплемента, и их эритроциты, таким образом, являются чувствительными к самопроизвольному аутолизу под действию комплемента, как и клетки крови человека с PNH.
Для еще большей сенсибилизации этих эритроцитов эти клетки использовали с покрытием и без покрытия маннаном, а затем исследовали в отношении гемолиза в плазме WT C56/BL6, MBL-нулевой плазме, плазме MASP-2 -/-, NHS человека, плазме MBL-/- человека и NHS, обработанной антителом человека против MASP-2.
1. Анализ гемолиза эритроцитов мышей с двойным дефицитом Crry/C3 и CD55/CD59 в дефицитных/лишенных MASP-2 сыворотках и контролях
Сутки 1. Подготовка RBC мыши (± покрытие маннаном)
Материалы включали: свежую кровь мыши, BBS/Mg2+/Ca2+ (4,4 мМ барбитуровая кислота, 1,8 мМ барбитон натрия, 145 мМ NaCl, pH7,4, 5 мМ Mg2+, 5 мМ Ca2+), хлорид хрома, CrCl3·6H20 (0,5 мг/мл в BBS/Mg2+/Ca2+) и маннан, 100 мкг/мл в BBS /Mg2+/Ca2+.
Цельную кровь (2 мл) осаждали в течение 1-2 мин при 2000x g в охлаждаемой центрифуге при 4°C. Плазму и лейкоцитарную пленку аспирировали. Затем образец промывали три раза путем ресуспендировали осадка RBC в 2 мл ледяном BBS/желатине/Mg2+/Ca2+ и повторения стадии центрифугирования. После третьего промывания осадок ресуспендировали в 4 мл BBS/Mg2+/Ca2+. 2-мл аликвоту RBC оставляли без обработки в качестве непокрытого контроля. К остальным 2 мл, добавляли 2 мл CrCl3 и 2 мл маннана и образец инкубировали при осторожном перемешивании при комнатной температуре в течение 5 минут. Реакцию завершали добавлением 7,5 мл BBS/желатина/Mg2+/Ca2+. Образец центрифугировали, как описано выше, ресуспендировали в 2 мл BBS/желатине/Mg2+/Ca2+ и промывали дополнительно два раза, как описано выше, а затем хранили при 4°C.
Сутки 2. Анализ гемолиза
Материалы включали BBS/желатин/Mg2+/Ca2+ (как описано выше), исследуемые сыворотки, 96-луночные круглодонные и плоскодонные планшеты и спектрофотометр, который считывает 96-луночные планшеты при 410-414 нм.
Сначала определяли концентрацию RBC и клетки доводили до 109/мл, и хранили при этой концентрации. Перед применением буфер для анализа разбавляли до 108/мл, а затем использовали 100 мкл на лунку. Измерение гемолиза проводили при 410-414 нм (что обеспечивает более высокую чувствительность, чем 541 нм). Разведения исследуемых сывороток приготавливали в ледяном BBS/желатине/Mg2+/Ca2+. 100 мкл каждого разведения сыворотки отбирали пипеткой в круглодонный планшет (см. планировку планшета). Добавляли 100 мкл соответствующим образом разбавленного препарата RBC (т.е. 108/мл) (см. планировку планшета), инкубировали при 37°C в течение приблизительно 1 часа, и наблюдали в отношении лизиса. (Планшеты можно сфотографировать в этот момент времени). Затем планшет центрифугировли при максимальной скорости в течение 5 минут. 100 мкл жидкой фазы аспирировали, переносили в плоскодонные планшеты и OD регистрировали при 410-414 нм. Осадки RBC сохраняли (их впоследствии можно было лизировать водой для получения обратного результата).
Эксперимент #1:
Свежую кровь получали от мышей с двойным дефицитом CD55/CD59 и мышей с двойным дефицитом Crry/C3 и эритроциты приготавливали, как подробно описано в представленном выше протоколе. Клетки разделяли и половину клеток покрывали маннаном, а другую половину оставляли необработанной с доведением конечная концентрация до 1×108 на мл, из которых 100 мкл использовали для анализа гемолиза, который проводили, как описано выше.
Результаты эксперимента #1: Лектиновый путь вовлечен в лизис эритроцитов в модели PNH на животных
В первоначальном эксперименте было определено, что не покрытые эритроциты мыши WT не лизировались ни в одной сыворотке мышей. Кроме того, было определено, что покрытые маннаном эритрциты мышей Crry-/- медленно лизировались (в течение более чем 3 часов при 37 градусах) в сыворотке мышей WT, однако они не лизировались в MBL-нулевой сыворотке (данные не представлены).
Было определено, что покрытые маннаном эритроциты мышей Crry-/- быстро лизировались в сыворотке человека, но не в инактивированной нагреванием NHS. Важно, что покрытые маннаном эритроциты мышей Crry-/- лизировались в NHS, разбавленной до 1/640 (т.е. лизировались во всех из разведений 1/40, 1/80, 1/160, 1/320 и 1/640) (данные не представлены). В этом разведении альтернативный путь не функционирует (функциональная активность AP значительно снижена при концентрации сыворотке ниже 8%).
Заключения эксперимента #1
Покрытые маннаном эритроциты мышей Crry-/- очень хорошо лизируются в высокоразбавленной сыворотке человека с MBL, но не в сыворотке без MBL. Эффективный лизис при каждой исследованной концентрации вы сыворотке подразумевает, что альтернативный путь не вовлечен в этот лизис или не требуется. Неспособность сыворотки мышей с дефицитом MBL и сыворотки человека лизировать покрытые маннаном эритроциты мыши Crry-/- указывает на то, что классический путь не имеет отношения к наблюдаемому лизису. Поскольку требуются распознающие молекулы лектинового пути (т.е. MBL), этот лизис опосредуется лектиновым путем.
Эксперимент #2:
Свежую кровь получали от мышей с двойным дефицитом Crry/C3 и CD55/CD59 и покрытые маннаном эритроциты мышей Crry-/- анализировали в анализе гемолиза, как описано выше, в присутствии следующих сывороток человека: MBL-нулевая; WT; NHS, предварительно обработанная антителом человека против MASP-2; и инактивированная нагреванием NHS в качестве контроля.
Результаты эксперимента #2: ингибиторы MASP-2 препятствуют лизису эритроцитов в модели PNH на животных
C покрытыми маннаном эритроцитами мышей Crry-/- инкубировали NHS в разведениях вплоть до 1/640 (т.е. 1/40, 1/80, 1/160, 1/320 и 1/640), сыворотку MBL-/- человека, NHS, предварительно обработанную mAb против MASP-2, и инактивированную нагреванием NHS в качестве контроля.
Микропланшет для титрования для ELISA центрифугировали и нелизированные эритроциты собирали со дна круглодонного планшета. Супернатант каждой лунки собирали и количество гемоглоблина, высвобожденного из лизированных эритроцитов, измеряли путем считывания OD415 нм в устройстве для считывания данных ELISA.
В контрольной инактивированной нагреванием NHS (отрицательный контроль), как и ожидалось, не наблюдали лизиса. Сыворотка MBL-/- человека лизировала покрытые маннаном эритроциты мыши в разведениях 1/8 и 1/16. Предварительно обработанная антителом против MASP-2 NHS лизировала покрытые маннаном эритроциты в разведениях 1/8 и 1/16, в то время как сыворотка WT человека лизировала покрытые маннаном эритроциты мышей вплоть до разведений 1/32.
На фиг.40 графически иллюстрируется гемолиз (при измерении по высвобождению гемоглобина лизированными эритроцитами мышей (Cryy/C3-/-) в супернатант, измеряемому фотометрией) покрытых маннаном эритроцитов мыши сывороткой человека на протяжении диапазона концентраций сывороток: инактивированной нагреванием (HI) NHS, MBL-/-, NHS, предварительно обработанной антителом против MASP-2, и контрольной NHS.
Из результатов, показанных на фиг.40, было продемонстрировано, что ингибирование MASP-2 антителом против MASP-2 значительно сдвигало CH50 и ингибировало опосредуемый комплементом лизис сенсибилизированных эритроцитов с дефицитом защиты вследствие аутологичной активации комплемента.
Эксперимент #3
Свежую кровь, полученную от мышей с двойным дефицитом Crry/C3 и CD55/CD59, с непокрытыми эритроцитами мышей Crry-/- анализировали в анализе гемолиза, как описано выше, в присутствии следующих сывороток: MBL -/-; сыворотка WT; NHS, обработанная антителом человека против MASP-2 и инактивированная нагреванием NHS в качестве контроля.
Результаты:
На фиг.41 графически иллюстрируется гемолиз (при измерении по высвобождению гемоглобина лизированных эритроцитов мыши WT в супернатант, измеряемому фотометрией) непокрытых эритроцитов мыши под действием сыворотки человека в диапазоне концентраций сывороток в сыворотках: инактивированная нагреванием (HI) NHS, MBL-/-, NHS, предварительно обработанная антителом MASP-2 и контрольная NHS. Как показано на фиг.41, было продемонстрировано, что ингибирование MASP-2 ингибирует опосредуемый комплементом лизис несенсибилизированных эритроцитов мыши WT.
На фиг.42 графически иллюстрируется гемолиз (при измерении по высвобождению гемоглобина лизированных эритроцитов мыши (CD55/59 -/-) в супернатант, измеренному фотометрией) непокрытых эритроцитов мыши под действием сыворотки человека в диапазоне концентраций сыворотки в сыворотках: инактивированная нагреванием (HI) NHS, MBL-/-, NHS, предварительно обработанная антителом против MASP-2 и контрольная NHS.
Величины CH50, выраженные в качестве сывороточных концентраций
(с дефицитом MBL)
Следует отметить: "CH50" является точкой, в которой опосредуемый комплементом гемолиз достигает 50%.
В целом, результаты этого примера демонстрируют, что ингибирование MASP-2 ингибирует опосредуемый комплементом лизис сенсибилизированных и несенсибилизированных эритроцитов с дефицитом защиты от аутологичной активации комплемента. Таким образом, ингибиторы MASP-2 можно использовать для лечения индивидуумов, страдающих PNH, а также можно использовать для смягчения (т.е. ингибирования, предупреждения или снижения тяжести) внесосудистого гемолиза у пациентов PNH, подвергающихся лечению ингибитором C5, таким как экулизумаб (Soliris®).
ПРИМЕР 34
В этом примере описано продолжение исследования, описанного выше в примере 29, предоставляющее дополнительные доказательства, подтверждающие, что ингибитор MASP-2, такой как антитело против MASP-2, является эффективным для лечения радиационного облучения и/или для лечения, смягчения или предупреждения острого лучевого синдрома.
Обоснование: В первоначально исследовании, описанном в примере 29, было продемонстрировано, что лечение антителом против MASP-2 у мышей повышало выживаемость облученных мышей по сравнению с контрольными облученными животными, которым вводили носитель, при уровнях обучения как 6,5 Гр, так и 7,0 Гр. Кроме того, в примере 29 было продемонстрировано, что при уровне воздействия 6,5 Гр введение антитела против MASP-2 после обработки радиационным облучением приводило к умеренному увеличению выживаемости по сравнению с облученными животными с контролем в виде носителя. В этом примере описано второе исследование с радиационным облучением, которое проводили для подтверждения первого исследования.
Способы:
Схема исследования A:
Мышей Swiss Webster (n=50) подвергали воздействию ионизирующего излучения (8,0 Гр). Оценивали эффект терапии антителом против MASP-2 (mAbH6, 5 мг/кг), вводимым за 18 часов до и через 2 часа после радиационного воздействия, и еженедельно после этого, на смертность.
Результаты исследования A:
Как показано на фиг.43, было определено, что введение антитела против MASP-2 mAbH6 увеличивало выживаемость у мышей, подвергнутых облучению в дозе 8,0 Гр, причем скорректированная средняя выживаемость возрастала с 4 по 6 суток по сравнению с мышами, которым вводили контроль в виде носителя, и смертность снижалась на 12% по сравнению с мышами, которым вводили контроль в виде носителя (логарифмический ранговый критерий, p=0,040).
Схема исследования B :
Мышей Swiss Webster (n=50) подвергали воздействию ионизирующего излучения (8,0 Гр) в следующих группах: (I: носитель) контроль в виде физиологического раствора; (II: низкая доза) антитело против MASP-2 mAbH6 (5 мг/кг), вводимое за 18 часов до облучения и через 2 часа после облучения; (III: высокая доза) mAbH6 (10 мг/кг), вводимые за 18 часов до облучения и через 2 часа после облучения; и (IV: высокая доза, вводимая после) mAbH6 (10 мг/кг), вводимое только через 2 часа после облучения.
Результаты исследования B:
Введение антитела против MASP-2 до и после облучения изменяло среднюю выживаемость на от 4 до 5 суток по сравнению с животными, которым вводили контроль в виде носителя. Смертность у мышей, которым вводили антитело против MASP-2, была снижена на 6-12% по сравнению с мышами, которым вводили контроль в виде носителя. Кроме того, следует отметить, что не наблюдали значительных неблагоприятных эффектов введения (данные не представлены).
В целом, результаты, показанные в этом примере, согласуются с результатами, показанными в примере 29, и, кроме того, демонстрируют, что антитела против MASP-2 являются эффективными для лечения млекопитающего, имеющего риск или страдающего от неблагоприятных эффектов острого лучевого синдрома.
ПРИМЕР 35
В этом исследовании исследуется эффект дефицита MASP-2 в модели индуцируемого LPS (липополисахаридом) тромбоза на мышах.
Обоснование:
Гемолитический уремический синдром (HUS), который вызывается инфекцией E. coli, продуцирующими шига-токсин, является основной причиной острой почечной недостаточности у детей. В этом примере осуществляли модель Шварцмана для LPS-индуцируемого тромбоза (микрососудистое свертывание) у мышей MASP-2-/- (KO) для определения того, является ли ингибирование MASP-2 эффективным для ингибирования или предупреждения образования внутрисосудистых тромбов.
Способы:
Мышей MASP-2-/- (n=9) и WT (n=10) анализировали в модели Шварцмана для индуцируемого LPS тромбоза (микрососудистое свертывание). Мышам вводили LPS Serratia и проводили мониторинг образования тромбов с течением времени. Проводили сравнение встречаемости микротромбов и индуцируемого LPS микрососудистого свертывания.
Результаты:
Следует отметить, что у всех исследованных мышей MASP-2 -/- (9/9) не образовывались внутрисосудистые тромбы после введения LPS Serratia. Напротив, микротромбы обнаруживались у 7 из 10 мышей WT, исследованных параллельно (p=0,0031, точный критерий Фишера). Как показано на фиг.44, время до возникновения микрососудистой окклюзии после введения LPS измеряли у мышей MASP-2-/- и WT, демонстрируя процент мышей WT с образованием тромбов, измеренным в течение 60 минут, причем образование тромбов обнаруживалось уже приблизительно через 15 минут. Вплоть до 80% мышей WT продемонстрировали образование тромбов через 60 минут. Напротив, как показано на фиг.44, ни одна из мышей MASP-2-/- не имела образования тромбов через 60 минут (логарифмический ранговый критерий: p=0,0005).
Эти результаты демонстрируют, что ингибирование MASP-2 защищает от развития внутрисосудистых тромбов в модели HUS.
ПРИМЕР 36
В этом примере описан эффект антител против MASP-2 в модели HUS на мышах с использованием внутрибрюшинной совместной инъекции очищенного шига-токсина 2 (STX2) и LPS.
Предпосылки:
Модель HUS на мышах была разработана с использованием внутрибрюшинной совместной инъекции очищенного шига-токсина 2 (STX2) и LPS. Биохимический анализ и анализ на микрочипах почек мыши показал, что нагрузка STX2 плюс LPS отличается от эффектов каждого из этих средств по отдельности. Анализ крови и сыворотки этих мышей продемонстрировал нейтрофилию, тромбоцитопению, гемолиз эритроцитов и увеличенный креатинин в сыворотке и азот мочевины в крови. Кроме того, гистологический анализ и электронная микроскопия почек мыши продемонстрировали гломерулярное депонирование фибрина, скопление эритроцитов, образование микротромбов и ультраструктурные изменения гломерул. Было установлено, что эта модель HUS индуцирует все клинические симптомы патологии HUS человека у мышей C57BL/6, включая тромбоцитопению, гемолитическую анемию и почечную недостаточность, которые определяют заболевание у человека (J. Immunol 187(1):172-80 (2011)).
Способы:
Самок мышей C57BL/6, которые имели массу от 18 до 20 г, приобретали от Charles River Laboratories и делили на 2 группы (5 мышей в каждой группе). Одной группе мышей предварительно проводили внутрибрюшинную (в/б) инъекцию рекомбинантного антитела против MASP-2 mAbM11 (100 мкг на мышь; что соответствует конечной концентрации 5 мг/кг массы тела), разбавленного в общем объеме 150 мкл физиологического раствора. В контрольной группе вводили физиологический раствор без какого-либо антитела. Через шесть часов после в/б инъекции антитела против MASP-2 mAbM11, всем мышам проводили комбинированную в/б инъекцию сублетальной дозы (3 мкг/животное; соответствующая 150 мкг/кг массы тела) LPS Serratia marcescens (L6136; Sigma-Aldrich, St. Louis, MO) и дозы 4,5 нг/животное (соответствующая 225 нг/кг) STX2 (двукратная доза LD50) в общем объеме 150 мкл. В качестве контроля использовали инъекцию физиологического раствора.
Мониторинг выживаемости мышей проводили каждые 6 часов после дозирования. Мышей умерщвляли, как только они достигали летаргической стадии патологии HUS. Через 36 часов всех мышей умерщвляли и обе почки извлекали для иммуногистохимии и сканирующей электронной микроскопии. В конце эксперимента проводили взятие образцов крови посредством пункции сердца. Сыворотку отделяли с хранили замороженной при -80°C для измерения BUN и уровней креатинина в сыворотке в группах как лечения, так и контроля.
Иммуногистохимия
Одну треть каждой почки мыши фиксировали в 4% параформальдегиде в течение 24 ч, обрабатывали и заключали в парафин. Получали срезы толщиной три микрометра и помещали их на заряженные предметные стекла для последующего окрашивания красителем H & E.
Электронная микроскопия
Срединный срез почек нарезали на блоки размером приблизительно 1-2 мм3, и фиксировали в течение ночи при 4°C в 2,5% глутаральдегиде в 1x PBS. Затем фиксированную ткань обрабатывали на установке электронной микроскопии University of Leicester.
Криостатные срезы
Другую треть почек нарезали на блоки размером приблизительно 1-2 мм3 и быстро замораживали в жидком азоте и держали при -80°C для криостатных срезов и анализа мРНК.
Результаты:
На фиг.45 графически иллюстрируется процентная выживаемость контрольных мышей, которым вводили физиологический раствор, (n=5) и мышей, которым вводили антитело против MASP-2 (n=5), в индуцируемой STX/LPS модели HUS в течение времени (часов). Примечательно, что, как показано на фиг.45, все из контрольных мышей погибли в течение 42 часов. В противоположность этому, 100% мышей, которым вводили антитело против MASP, выжили на протяжении всего эксперимента. В соответствии с результатами, представленными на фиг.45, было выявлено, что все мыши, которым не проводили введения, которые либо погибли, либо должны были быть умерщвлены с признаками тяжелого заболевания, имели значительные гломерулярные повреждения, в то время как гломерулы всех мышей, которым вводили MASP-2, выглядели нормальными (данные не представлены). Эти результаты демонстрируют, что ингибиторы MASP-2, такие как антитела против MASP-2, можно использовать для лечения индивидуумов, страдающих или имеющих риск развития тромботической микроангиопатии (TMA), такой как гемолитический уремический синдром (HUS), атипичная HUS (aHUS) или тромботическая тромбоцитопеническая пурпура (TTP).
ПРИМЕР 37
В этом примере описан эффект дефицита MASP-2 и ингибирования MASP-2 в модели тромбоза на мышах с индуцируемым FITC-декстраном/светом повреждением эндотелиальных клеток
Предпосылки/обоснование: как продемонстрировано в примерах 35 и 36, дефицит MASP-2 (MASP-2 KO) и ингибирование MASP-2 (посредством введения ингибиторного антитела против MASP-2) защищают мышей в модели типичной HUS, в то время как у всех мышей, подвергнутых воздействию STX и LPS, развивалась тяжелая HUS и они становились умирающими или погибали в течение 48 часов. Например, как показано на фиг.54, все мыши, которым вводили ингибирующее MASP-2 антитело, а затем подвергали воздействию STX и LPS, выжили (точный критерий Фишера p<0,01; N=5). Таким образом, терапия против MASP-2 защищает мышей в этой модели HUS.
Следующие эксперименты проводили для анализа эффекта дефицита MASP-2 и ингибирования MASP-2 в модели тромботической микроангиопатии (TMA) с индуцируемым флуоресцеинизотиоцианат (FITC)-декстраном эндотелиальным повреждением клеток для дальнейшей демонстрации пользы ингибиторов MASP-2 для лечения HUS, aHUS, TTP и TMA с другими этиологиями.
Способы:
Прижизненная микроскопия
Мышей подготавливали для прижизненной микроскопии, как описано Frommhold et al., BMC Immunology 12:56-68, 2011. В кратком изложении, мышей подвергали анестезии посредством внутрибрюшинной (в/б) инъекции кетамина (125 мг/кг массы тела, Ketanest, Pfitzer GmbH, Karlsruhe, Германия) и ксилазина (12,5 мг/кг массы тела; Rompun, Bayer, Leverkusen, Германия) и помещали их на нагревающую подушку для поддержания температуры тела 37°C. Прижизненную микроскопию проводили на прямо микроскопе (Leica, Wetzlar, Германия) с иммерсионном объективом с физиологическим раствором (SW 40/числовая апертура 0,75, Zeiss, Jena, Германия). Для облегчения дыхания мышей интубировали с использованием трубки PE 90 (Becton Dickson и Company, Sparks, MD, США). Левую сонную артерию канюлировали трубкой PE10 (Becton Dickson и Company, Sparks, MD, США) Для взятия образцов крови и системного введения моноклонального антитела (mAb).
Препарирование мышцы, поднимающей яичко
Хирургическое препарирование мышцы, поднимающей яичко, для прижизненной микроскопии проводили, как описано Sperandio et al., Blood, 97:3812-3819, 2001. В кратком изложении, мошонку вскрывали и мышцу, поднимающую яичко, извлекали. После продольного разреза и распределения мышцы на покровном стекле, эпидидимис и семенник смещали и прикалывали сбоку, обеспечивая полный микроскопический доступ к микроциркуляции мышцы, поднимающей яичко. Венулы мышцы, поднимающей яичко, регистрировали с использованием камеры CCD (CF8/1; Kappa, Gleichen, Германия) на записывающее устройство Panasonic S-VHS. Мышцу, поднимающую яичко, ополаскивали термически контролируемым (35°C) забуференным бикарбонатом солевым раствором, как описано ранее Frommhold et al., BMC Immunology 12:56-68, 20112011.
Модель повреждения FITC-декстраном с возбуждением светом
Контролируемое зависимое от дозы света повреждение эндотелия венул и артериол мышцы, поднимающей яичко, индуцировали посредством светового возбуждения фототоксического (FITC)-декстрана (каталожный номер № FD150S, Sigma Aldrich, Poole, Великобритания). Эта процедура инициировала локализованный тромбоз. В качестве фототоксического реагента 60 мкл 10% масс./об. раствора FITC-декстрана инъецировали через доступ в левой сонной артерии и позволяли ему распределиться через циркулирующую кровь в течение 10 минут. После выбора хорошо перфузированной венулы галогеновый свет с интенсивностью от низкого до умеренного диапазона (800-1500) фокусировали на представляющем интерес сосуде для индукции флуоресценции FITC-декстрана и фототоксичности от мягкой до умеренной на поверхности эндотелия для стимуляции тромбоза воспроизводимым контролируемым образом. Необходимую фототоксическую интенсивность света для возбуждения FITC-декстрана обеспечивали с использованием галогеновой лампы (12 В, 100 Вт, Zeiss, Oberkochen, Германия). Фототоксичность вследствие индуцируемого светом возбуждения флуорохрома требует интенсивности света и/или длительности облучения и вызывается либо вследствие прямого нагревания поверхности эндотелия, либо путем образования активных форм кислорода, как описано Steinbauer et al., Langenbecks Arch Surg 385:290-298, 2000.
Интенсивность света, примененная в отношении каждого сосуда, измеряли для коррекции корректирующим длину волны диодным детектором для измерений при низкой мощности (Labmaster LM-2, Coherent, Auburn, США). Анализ видеосканнограмм не в режиме реального времени проводили с помощью компьютерной системы анализа микроциркуляции (CAMAS, Dr. Zeintl, Heidelberg) и скорость эритроцитов измеряли, как описано Zeintl et al., Int J Microcirc Clin Exp, 8(3):293-302, 2000.
Применение моноклонального ингибиторного антитела против MASP-2 человека (mAbH6) и контроля в виде носителя перед индукцией тромбоза
С использованием слепой схемы исследования, самцам однопометных животных C57BL/6 WT в возрасте 9 недель проводили в/б инъекции рекомбинантного моноклонального антитела против MASP-2 человека (mAbH6), ингибитора функциональной активности MASP-2 (вводимого в конечной концентрации 10 мг/кг массы тела), или того же количества изотипического контрольного антитела (без активности ингибирования MASP-2) за 16 часов до фототоксической индукции тромбоза в модели прижизненной микроскопии мышцы, поднимающей яичко. За один час до индукции тромбоза вводили вторую дозу либо mAbH6, либо контрольного антитела. Также в этой модели оценивали мышей с нокаутом MASP-2 (KO).
mAbH6 (полученное против рекомбинантного MASP-2 человека) является мощным ингибитором функциональной активности MASP-2 человека, который перекрестно реагирует, связывается с ингибирует MASP-2 мыши, но с более низкой аффинностью ввиду его видовой специфичности (данные не представлены). Для компенсации более низкой аффинности mAbH6 к MASP-2 мыши, mAbH6 вводили в высокой концентрации (10 мг/кг массы тела) для преодоления варьирования видовой специфичности и меньшей аффинности в отношении MASP-2 мыши, чтобы обеспечить эффективную блокаду функциональной активности MASP-2 мыши в условиях in vivo.
В этом слепом исследовании регистрировали время, требуемое для полной окклюзии каждой индивидуальной исследуемой венулы (критериями выбора были сравнимые диаметры и низкая скорость кровотока).
Процент мышей с окклюзией микрососудов, время начала и время до окклюзии оценивали на протяжении периода наблюдения в течение 60 минут с использованием видеозаписей прижизненной микроскопии.
Результаты:
На фиг.46 графически иллюстрируется в качестве функции времени после индукции повреждения процент мышей с окклюзей микрососудов в УФ-модели с FITC/дектраном после введения изотипического контроля или антитела против MASP-2 человека mAbH6 (10 мг/кг), вводимого через 16 часов и за 1 час до инъекции FITC/декстрана. Как показано на фиг.46, у 85% мышей дикого типа, которым вводили изотипическое контрольное антитело, происходила окклюзия в течение 30 минут или менее, в то время только у 19% из мышей дикого типа, которым предварительно вводили антитело против MASP-2 человека (mAbH6), происходила окклюзия в течение того же периода времени, и время до окклюзии было более длительным у мышей, у которых в конечном итоге происходила окклюзия в группе введения антитела против MASP-2 человека. Кроме того, следует отметить, что у трех мышей, которым вводили mAbH6 против MASP-2, окклюзия не происходила вовсе в течение периода наблюдения, составляющего 60 минут (т.е. они были защищены от тромботической окклюзии).
На фиг.47 графически иллюстрируется время окклюзии в минутах для мышей, которым вводили антитело против MASP-2 человека (mAbH6) и изотипическое контрольное антитело. Данные представлены в качестве точек разброса со средними величинами (горизонтальные планки) и стандартными планками погрешностей (вертикальные планки). На этой фигуре показано время окклюзии у мышей, у которых наблюдалась окклюзия. Таким образом, у трех мышей, которым вводили антитело против MASP-2, не происходило окклюзии в ходе периода наблюдения в этом анализе, составляющего 60 минут (отсутствовали мыши, которым вводили контроль, у которых не было окклюзии). Статистический критерий, использованный для анализа, представлял собой непарный t-критерий; где обозначение "*" указывает на p=0,0129. Как показано на фиг.47, у четырех мышей, которым вводили антитело против MASP-2 (mAbH6), у которых происходила окклюзия, введение антитела MASP-2 значительно повышало время окклюзии вен в модели тромбоза с индуцируемым FITC-декстраном/светом повреждением эндотелиальных клеток с низкой интенсивностью света (800-1500) по сравнению с мышами, которым вводили изотипическое контрольное антитело. Среднее время полной окклюзии в случае изотипического контроля составляло 19,75 минуты, в то время как среднее время полной окклюзии для группы, в которой вводили антитело против MASP-2, составляло 32,5 минуты.
На фиг.48 графически иллюстрируется время до окклюзии в минутах для мышей дикого типа, мышей MASP-2 KO и мышей дикого типа, которым предварительно вводили антитело против MASP-2 человека (mAbH6), вводимое в/б в дозе 10 мг/кг за 16 часов до и вновь в/в за 1 час до индукции тромбоза в модели тромбоза с индуцируемым FITC-декстраном/светом повреждением клеток эндотелия при низкой интенсивности света (800-1500). Только животные, у которых происходила окклюзия, были включены на фиг.48; n=2, для мышей дикого типа, которым вводили изотипическое контрольное антитело; n=2 для MASP-2 KO; и n=4 для мышей дикого типа, которым вводили антитело против MASP-2 человека (mAbH6). Символ "*" указывает p<0,01. Как показано на фиг.48, дефицит MASP-2 и ингибирование MASP-2 (mAbH6 в дозе 10 мг/кг) увеличивали время окклюзии вены в модели тромбоза с индуцируемым FITC-декстраном/светом повреждением клеток эндотелия при низкой интенсивности света (800-1500).
Заключения:
Результаты в этом примере далее демонстрируют, что средство, ингибирующее MASP-2, которое блокирует лектиновый путь (например, антитела, которые блокируют функцию MASP-2), ингибирует микрососудистое свертывание и тромбоз, которые являются признаками множественных микроангиопатических нарушений в модели TMA на мышах. Таким образом, ожидается, что введение средства, ингибирующего MASP-2, такого как ингибирующее MASP-2 антитело, будет эффективным способом терапии у пациентов, страдающих HUS, aHUS, TTP или другими микроангиопатическими нарушениями и обеспечит защиту от микрососудистого свертывания и тромбоза.
ПРИМЕР 38
В этом примере описано исследование, демонстрирующее, что ингибирующее MASP-2 человека антитело (mAbH6) не имеет эффекта на функцию тромбоцитов в обогащенной тромбоцитами плазме человека.
Предпосылки/обоснование: Как описано в примере 37, было продемонстрировано, что ингибирование MASP-2 ингибирующим MASP-2 человека антителом (mAbH6) увеличивало время окклюзии вен в модели тромбоза с индуцируемым FITC-декстраном/светом повреждением клеток эндотелия. Следующий эксперимент проводили для определения того, имеет ли ингибирующее антитело против MASP-2 (mAbH6) эффект на функцию тромбоцитов.
Способы: исследовали эффект антитела против MASP-2 человека mAbH6 в отношении ADP-индуцируемой агрегации тромбоцитов следующим образом. mAbH6 против MASP-2 человека в концентрации либо 1 мкг/мл, либо 0,1 мкг/мл добавляли в 40 мкл раствора к 360 мкл свежеприготовленной обогащенной тромбоцитами плазмы человека. В качестве отрицательного контроля использовали изотипическое контрольное антитело. После добавления антител в плазму активацию тромбоцитов индуцировали добавлением ADP в конечной концентрации 2 мкМ. Анализ начинали путем перемешивания растворов с использованием небольшого магнита в 1-мл кювете. Агрегацию тромбоцитов измеряли на двухканальном Chrono-log Platelet Aggregometer Model 700 Whole Blood/Optical Lumi-Aggregometer.
Результаты:
Процентную агрегацию в растворах измеряли в течение пяти минут. Результаты представлены в таблице 13.
Агрегация тромбоцитов на протяжении пяти минут
(процентная агрегация)
(процентная агрегация с течением времени)
(1 мкг/мл)
(1 мкг/мл)
(0,1 мкг/мл)
(0,1 мкг/мл)
Как показано выше в таблице 13, не наблюдали значимых отличий между агрегацией индуцируемых ADP тромбоцитов, обработанных контрольным антителом или антителом mAbH6 против MASP-2. Эти результаты демонстрируют, что антитело против MASP-2 человека (mAbH6) не имеет эффекта на функцию тромбоцитов. Таким образом, результаты, описанные в примере 37, демонстрирующие ингибирование MASP-2 ингибирующим MASP-2 человека антителом (mAbH6) увеличивало время окклюзии вен в модели тромбоза с индуцируемым FITC-декстраном/светом повреждением клеток эндотелия, не были следствием эффекта mAbH6 на функцию тромбоцитов. Таким образом, ингибирование MASP-2 препятствует тромбозу без прямого влияния на функцию тромбоцитов, раскрывая терапевтический механизм, который отличается от существующих антитромботических средств.
ПРИМЕР 39
В этом примере описан эффект ингибирования MASP-2 на образование тромбов и окклюзию сосудов в модели TMA на мышах
Предпосылки/обоснование: Лектиновый путь играет доминирующую роль в активации системы комплемента в условиях стресса или повреждения эндотелиальных клеток. Эта активация быстро усиливается альтернативным путем, регуляция которого нарушена у многих пациентов, имеющих aHUS. Таким образом, ожидают, что предупреждение активации MASP-2 и лектинового пути остановит последовательность ферментативных реакций, которые приводят к образованию мембраноатакующего комплекса, активации тромбоцитов и привлечению лейкоцитов. Этот эффект ограничивает повреждение тканей.
Кроме того, MASP-2 обладает активностью, подобной фактору Xa, и расщепляет протромбин с образованием тромбина. Эта запускаемая MASP-2 система свертывания может нарушать баланс гемостаза и может приводить к патологии TMA. Таким образом, ожидается, что ингибирование MASP-2 с использованием ингибитора MASP-2, такого как ингибирующее MASP-2 антитело, которое блокирует активацию систем комплемента и свертывания, улучшит исходы при aHUS и других родственных TMA состояний.
Как описано в примере 37, было продемонстрировано, что ингибирование MASP-2 ингибирующим MASP-2 человека антителом (mAbH6) увеличивало время окклюзии вен в модели тромбоза с индуцируемым FITC-декстраном/светом повреждением клеток эндотелия. В этой модели TMA мышей сенсибилизировали посредством в/в инъекции FITC-декстрана, а затем проводили локализованную фотоактивацию FITC-декстрана в микрососудах мышцы, поднимающей яичко, мышей (Thorlacius H et al., Eur J Clin. Invest 30(9):804-10, 2000; Agero et al., Toxicon 50(5):698-706, 2007).
Следующий эксперимент проводили для определения того, имеет ли ингибирующее MASP-2 антитело (mAbH6) эффект ответа на дозу в отношении образования тромбов и окклюзии сосудов в модели TMA на мышах.
Способы: Локализованный тромбоз индуцировали посредством фотоактивации меченного флуоресцеинизотиоцианатом декстрана (FITC-декстран) в микрососудах мышцы, поднимающей яичко, мышей C57 Bl/6 и прижизненную микроскопию использовали для определения начала образования тромбов и окклюзии сосудов с использованием способов, описанных в примере 37, со следующими модификациями. В группах мышей дозировали mAbH6 (2 мг/кг, 10 мг/кг или 20 мг/кг) или вводили изотипическое контрольное антитело (20 мг/кг) посредством внутривенной (в/в) инъекции за один час до индукции TMA. Время до начала образования тромба и время до полной окклюзии сосуда регистрировали. Анализ видеозаписи визуализации прижизненной микроскопии, зарегистрированной на протяжении от 30 до 60 минут, использовали для оценки размера сосудов, скорости кровотока, интенсивности света, скорости начала образования тромбов в качестве эквивалента адгезии тромбоцитов, времени до возникновения образования тромба, скорости общей окклюзии сосудов и времени до полной окклюзии сосудов. Статистический анализ проводили с использованием SigmaPlot v12.0.
Результаты:
Начало образования тромбов
На фиг.49 представлен график Каплана-Мейера, демонстрирующий процент мышей с тромбами в зависимости от времени при индуцируемой FITC-декстраном тромботической микроангиопатии у мышей, которым вводили возрастающие дозы ингибирующего MASP-2 человека антитела (mAbH6) или изотипического контрольного антитела. Как показано на фиг.49, начало образования тромбов замедлялось у мышей, которым вводили mAbH6, дозозависимым образом относительно мышей, которым вводили контроль.
На фиг.50 графически иллюстрируется срединное время до начала (минуты) образования тромба в зависимости от дозы mAbH6 (*p<0,01 по сравнению с контролем). Как показано на фиг.50, срединное время до начала образования тромба увеличивалось при увеличении доз mAbH6 от 6,8 минут в контрольной группе до 17,7 минут в группе введения 20 мг/кг mAbH6 (p<0,01). Основные экспериментальные данные и статистический анализ представлены в таблицах 14 и 15.
Время до начала образования тромба у индивидуальных мышей регистрировали на основе оценки видеографических записей, как подробно представлено в таблице 14.
Время до возникновения образования тромба после индуцируемого светом-красителем повреждения
(минуты)
Статистический анализ, сравнивающий время до начала окклюзии между контрольными животными и животными, которым вводили mAbH6, представлен ниже в таблице 15.
Время до начала: данные из исследований ответа на дозу FITC-декстрана
(2 мг/кг)
(10 мг/кг)
(20 мг/кг)
(100%)
(100%)
(100%)
(80,0%)
(2,4, 8,5)
(5,9, 12,8)
(2,5, 15,8)
(10,0, 22,7)
Среднее значение (минуты) и его 95% CI были основаны на оценке методом Каплана-Мейера
NE=не поддается оценке
*в значения p была внесена поправка на множественное сравнение Даннета-Хсу
Микрососудистая окклюзия
На фиг.51 представлен график Каплана-Мейера, демонстрирующий процент мышей с микрососудистой окклюзией в зависимости от времени при индуцируемой FITC-декстраном тромботической микроангиопатии у мышей, которым вводили возрастающие дозы ингибиторного антитела против MASP-2 человека (mAbH6 в дозе 2 мг/кг, 10 мг/кг или 20 мг/кг) или изотипического контрольного антитела. Как показано на фиг.51, полная окклюзия микрососудов замедлялась в группе, в которой проводили введение mAbH6, по сравнению с контрольными мышами.
На фиг.52 графически иллюстрируется срединное время до микрососудистой окклюзии в зависимости от дозы mAbH6 (*p<0,05 по сравнению с контролем). Как показано на фиг.52, срединное время до полной микрососудистой окклюзии возрастало от 23,3 минут в контрольной группе до 38,6 минут в группе введения 2 мг/кг mAbH6 (p<0,05). Дозы 10 мг/кг или 20 мг/кг mAbH6 имели сходную эффективность (срединное время полной микрососудистой окклюзии составляло 40,3 и 38 минут, соответственно) с группой введения 2 мг/кг mAbH6. Основные экспериментальные данные и статистический анализ представлены в таблицах 16 и 17.
Время до полной окклюзии сосудов у индивидуальных мышей, зарегистрированное на основе первичной оценки видеографических записей, подробно представлено ниже в таблице 16.
время до полной окклюзии после индуцируемого светом-красителем повреждения
(минуты)
Статистический анализ, сравнивающий время до полной окклюзии между животными, которым вводили контроль и mAbH6, представлен ниже в таблице 17.
Время до полной микрососудистой окклюзии: данные исследования ответа на дозу FITC-декстрана
(2 мг/кг)
(10 мг/кг)
(20 мг/кг)
(81,8%)
(66,7%)
(77,8%)
(70,0%)
(16,5, 37,5)
(21,9, NE)
(17,5, NE)
(28,0, 40,6)
Среднее значение (минуты) и его 95% CI были основаны на оценке методом Каплана-Мейера
NE=не поддается оценке
*в значения p была внесена поправка на множественное сравнение Даннета-Хсу
Обобщение
Как обобщенно представлено в таблице 18, начало образования тромба замедлялось у мышей, которым вводили mAbH6, дозозависимым образом относительно мышей, которым вводили контроль (срединное время до начала от 10,4 до 17,7 минут против 6,8 минут). Срединное время до полной окклюзии было значительно более длительным во всех группах, в которых вводили mAbH6, относительно групп, в которых вводили контроль (таблица 18).
Срединное время до начала образования тромбов и полной окклюзии
(2 мг/кг)
(10 мг/кг)
(20 мг/кг)
*p<0,05 по сравнению с контролем (критерий Вилкоксона с поправкой на множественные сравнения Даннета-Хсу)
Эти результаты демонстрируют, что mAbH6, моноклональное антитело человека, которое связывается с MASP-2 и блокирует лектиновый путь системы комплемента, снижает тромбоз микрососудов дозозависимым образом в экспериментальной модели TMA на мышах. Таким образом, ожидается, что введение средства, ингибирующего MASP-2, такого как ингибирующее MASP-2 антитело, будет эффективной терапией у пациентов, страдающих HUS, aHUS, TTP или другими микроангиопатическими нарушениями, такими как другие TMA, включающие катастрофический антифосфолипидный синдром (CAPS), системную болезнь Дегоса и TMA на фоне злокачественной опухоли, химиотерапии злокачественной опухоли и трансплантации, и обеспечит защиту от микрососудистого свертывания и тромбоза.
ПРИМЕР 40
В этом примере описана идентификация с использованием фагового дисплея полностью человеческих scFv-антител, которые связываются с MASP-2 и ингибируют опосредуемую лектином активацию комплемента, оставляя компоненты классического (C1q-зависимого) пути и альтернативного пути иммунной системы интактными.
Обзор:
Полностью человеческие высокоаффинные антитела против MASP-2 идентифицировали посредством скрининга библиотеки фагового дисплея. Фрагменты вариабельной области легкой и тяжелой цепей антител выделяли как в формате scFv, так и в полноразмерном формате IgG. Антитела против MASP-2 человека являются пригодными для ингибирования клеточного повреждения, ассоциированного с опосредуемой лектиновым путем активации альтернативного пути комплемента, в то время как компонент иммунной системы, представляющий собой классический (C1q-зависимый) путь, остается интактным. В некоторых вариантах осуществления рассматриваемые ингибирующие MASP антитела имеют следующие характеристики: (a) высокая аффинность в отношении MASP-2 человека (например, KD 10 нМ или менее), и (b) ингибирование MASP-2-зависимой активности комплемента в 90% сыворотке человека с IC50 30 нМ или менее.
Способы:
Экспрессия полноразмерного каталитически неактивного MASP-2 :
Полноразмерную последовательность кДНК MASP-2 человека (SEQ ID NO:4), кодирующую полипептид MASP-2 человека с лидерной последовательностью (SEQ ID NO:5), субклонировали в экспрессирующий вектор млекопитающих pCI-Neo (Promega), который запускает экспрессию в эукариотах под контролем энхансерной/промоторной области CMV (описанной в Kaufman R.J. et al., Nucleic Acids Research 19:4485-90, 1991; Kaufman, Methods in Enzymology, 185:537-66 (1991)).
Для получения каталитически неактивного белка MASP-2A человека проводили сайт-направленный мутагенез, как описано в US2007/0172483, включенной в настоящее описание в качестве ссылки. Продукты ПЦР очищали после агарозного гель-электрофорезе и вырезания полосы, и вносили перекрывания на один остаток аденозина с использованием стандартной методики удлинения. Затем MASP-2A с удлинением на остаток аденозина клонировали в вектор pGEM-T и трансформировали в E. coli. MASP-2A человека далее субклонировали в экспрессирующие векторы млекопитающих либо pED, либо pCI-Neo.
Экспрессирующую MASP-2A конструкцию, описанную выше, трансфицировали в клетки DXB1 с использованием стандартной методики трансфекции с фосфатом кальция (Maniatis et al., 1989). MASP-2A продуцировали в бессывороточной среде, чтобы убедиться, что препараты не были загрязнены другими сывороточными белками. Среды собирали со смыкающегося монослоя клеток (всего четыре раза). Уровень рекомбинантного MASP-2A достигал в среднем приблизительно 1,5 мг/литр культуральной среды. MASP-2A (мутант Ser-Ala, описанный выше) очищали на аффинной хроматографией на колонках MBP-A-агароза.
ELISA для MASP-2A на клонах-кандидатах ScFv, идентифицированных пэннингом/конверсией scFv и фильтрующим скринингом
Библиотеку фагового дисплея последовательностей вариабельной области легкой и тяжелой цепей иммуноглобулинов человека подвергали пэннингу антигенов с последующим автоматизированным скринингом антител и селекцией для идентификации высокоаффинных scFv-антител к белку MASP-2 человека. Проводили три раунда пэннинга фаговой библиотеки scFv против HIS-меченного или меченного биотином MASP-2A. В третьем раунде пэниннга элюирование сначала проводили посредством MBL, а затем посредством TEA (щелочь). Для мониторинга специфического увеличения в количестве фагов, экспонирующих фрагменты scFv против MASP-2A-мишени, проводили поликлональный ELISA фагов против иммобилизованного MASP-2A. Гены scFv из 3 раунда пэннинга клонировали в экспрессирующий вектор pHOG и анализировали в мелкомасштабном фильтрующем скрининге для поиска специфических клонов против MASP-2A.
Бактериальные колонии, содержавшие плазмиды, кодирующие scFv-фрагменты из третьего раунда пэннинга, отбирали, переносили на нитроцеллюлозные мембраны и выращивали в течение ночи на неиндуцирующей среде для получения исходных планшетов. Всего 18000 колоний было отобрано из третьего раунда пэннинга и проанализировано, причем половина была отобрана из конкурентного элюирования, а другая половина из последующего элюирования TEA. Пэннинг фагмидной библиотеки scFv против MASP-2A с последующей конверсией scFv и фильтрующим скринингом обеспечил 137 положительных клонов. Клоны 108/137 были положительными в анализе ELISA в отношении связывания MASP-2 (данные не представлены), и 45 из этих клонов далее анализировали в отношении способности блокировать активность MASP-2 в нормальной сыворотке человека.
Анализ для измерения ингибирования образования C3-конвертазы лектинового пути
Функциональный анализ, который измеряет ингибирование образования C3-конвертазы лектинового пути, использовали для оценки "блокирующей активности" клонов-кандидатов для scFv против MASP-2. Активность сериновой протеазы MASP-2 требуется для образования двух белковых компонентов (C4b, C2a), которые содержат C3-конвертазу лектинового пути. Таким образом, scFv против MASP-2, который ингибирует функциональную активность MASP-2 (т.е. блокирующее scFv против MASP-2), ингибирует образование de novo C3-конвертазы лектинового пути. C3 содержит необычную и в высокой степени реакционноспособную сложную тиоэфирную группу в качестве части его структуры. При расщеплении C3 C3-конвертазой в этом анализе сложная тиоэфирная группа на C3b может образовывать ковалентную связь с гидроксильными или аминогруппами на макромолекулах, иммобилизованных на дне лунок пластмассовых планшетов посредством сложноэфирных или амидных связей, таким образом, облегчая обнаружение C3b в анализе ELISA.
Дрожжевой маннан представляет собой известный активатор лектинового пути. В следующем способе для измерения образования C3-конвертазы пластмассовые лунки, покрытые маннаном, инкубировали с разбавленной сывороткой человека для активации лектинового пути. Затем лунки промывали и анализировали в отношении C3b, иммобилизованного на лунках, с использованием стандартных способов ELISA. Количество C3b, образовавшегося в этом анализе, является прямым отражением образования de novo C3-конвертазы лектинового пути. Клоны scFv против MASP-2 в выбранных концентрациях исследовали в этом анализе в отношении их способности ингибировать образование C3-конвертазы и последующее образование C3b.
Способы:
45 клонов-кандидатов, идентифицированных, как описано выше, экспрессировали, очищали и разбавляли в одной и той же исходной концентрации, которую вновь разбавляли в буфере GVB, содержавшем Ca++ и Mg++ (4,0 мМ барбитал, 141 мМ NaCl, 1,0 мМ MgCl2, 2,0 мМ CaCl2, 0,1% желатин, pH 7,4), чтобы убедиться, что все клоны имели одно и то же количество буфера. Каждый из клонов scFv исследовали в трех экземплярах в концентрации 2 мкг/мл. Положительный контроль представлял собой Fab2 OMS100, и его исследовали в дозе 0,4 мкг/мл. Мониторинг образования C3c проводили в присутствии и в отсутствие клонов scFv/IgG.
Маннан разбавляли до концентрации 20 мкг/мл (1 мкг/лунка) 50 мМ карбонатном буфере (15 мМ Na2CO3 + 35 мМ NaHCO3 + 1,5 мМ NaN3), pH 9,5, и наносили на планшет для ELISA в течение ночи 4°C. На следующие сутки покрытые маннаном планшеты промывали 3 раза посредством 200 мкл PBS. Затем в лунки добавляли 100 мкл 1% блокирующего раствора HSA и инкубировали в течение 1 часа при комнатной температуре. Планшеты промывали 3 раза посредством 200 мкл PBS, и хранили на льду с 200 мкл PBS до добавления образцов.
Нормальную сыворотку человека разбавляли до 0,5% в буфере CaMgGVB, и клоны scFv или положительный контроль Fab2 OMS100 положительный контроль добавляли в трех репликах в количестве 0,01 мкг/мл; 1 мкг/мл (только контроль в виде OMS100) и 10 мкг/мл в этот буфер и предварительно инкубировали в течение 45 минут на льду, а затем добавляли в заблокированный планшет для ELISA. Реакцию инициировали посредством инкубации в течение одного часа при 37°C и останавливали посредством переноса планшетов на ледяную баню. Депонирование C3b выявляли с использованием антитела кролика против C3c мыши, а затем антитела козы против антител кролика с HRP. Отрицательный контроль представлял собой буфер без антитела (нет антитела = максимальное депонирование C3b), и положительный контроль представлял собой буфер с EDTA (нет депонирования C3b). Фоновый уровень определяли путем проведения того же анализа, за исключением того, что лунки не содержали маннана. Фоновый сигнал против планшетов без маннана вычитали из сигналов в маннан-содержащих лунках. Пороговый критерий был установлен на уровне половины активности постороннего клона scFv (VZV) и буфера отдельно.
Результаты: На основе порогового критерия, было обнаружено всего 13 клонов, которые блокировали активность MASP-2. Все 13 клонов, обеспечивающие подавление каскада > 50%, отбирали и секвенировали с получением 10 уникальных клонов. Было обнаружено, что все десять клонов имеют один и тот же подкласс легкой цепи, λ3, но три различных подкласса тяжелой цепи: VH2, VH3 и VH6. В функциональном анализе пять из десяти клонов-кандидатов для scFv, дали значения IC50 в нМ, меньшие чем заданный критерий 25 нМ, с использованием 0,5% сыворотки человека.
Для идентификации антител с увеличенной эффективностью, три исходных клона scFv, идентифицированных, как описано выше, подвергали шаффлингу легких цепей. Этот процесс вовлекал образование комбинаторной библиотеки, состоящей из VH каждого из исходных клонов в паре с библиотекой наивных легких цепей лямбда человека (VL), полученных от шести здоровых доноров. Затем эту библиотеку подвергали скринингу в отношении клонов scFv с увеличенной аффинностью связывания и/или функциональностью.
Сравнение функциональной эффективности в значениях IC50 (нМ) для лидирующих дочерних клонов и их соответствующих материнских клонов (все в формате scFv)
анализ C3
(IC50 нМ)
анализ C3
(IC50 нМ)
анализ C4
(IC50 нМ)
Ниже представлены последовательности вариабельной области тяжелой цепи (VH) для исходных клонов и дочерних клонов, показанных выше в таблице 19, и приведенных ниже в таблицах 20A-F.
CDR по Kabat (31-35 (H1), 50-65 (H2) и 95-102 (H3)) выделены полужирным шрифтом; и CDR по Chothia (26-32 (H1), 52-56 (H2) и 95-101 (H3)) подчеркнуты.
Вариабельная область тяжелой цепи 17D20_35VH-21N11VL (VH) (SEQ ID NO:67, кодируемая SEQ ID NO:66)
QVTLKESGPVLVKPTETLTLTCTVSGFSLSRGKMGVSWIRQPPGKALEWLAHIFSSDEK SYRTSLKSRLTISKDTSKNQVVLTMTNMDPVDTATYYCARIRRGGIDYWGQGTLVTVSS
Вариабельная область тяжелой цепи d17N9 (VH) (SEQ ID NO:68)
QVQLQQSGPGLVKPSQTLSLTCAISGDSVSSTSAAWNWIRQSPSRGLEWLGRTYYRSKW YNDYAVSVKSRITINPDTSKNQFSLQLNSVTPEDTAVYYCARDPFGVPFDIWGQGTMVTVSS
Вариабельная область тяжелой цепи
тяжелая цепь (а.к.1-20)
(SEQ:67)
(SEQ:68)
Тяжелая цепь (а.к.21-40)
(SEQ:67)
(SEQ:68)
Тяжелая цепь (а.к.41-60)
(SEQ:67)
(SEQ:68)
Тяжелая цепь (а.к.61-80)
(SEQ:67)
(SEQ:68)
Тяжелая цепь (а.к.81-100)
(SEQ:67)
(SEQ:68)
тяжелая цепь (а.к.101-118)
(SEQ:67)
(SEQ:68)
Ниже представлены последовательности вариабельной области легкой цепи (VL) для исходных клонов, приведенных в таблицах 21A-F.
CDR по Kabat (24-34 (L1); 50-56 (L2) и 89-97 (L3) выделены полужирным шрифтом; и CDR по Chothia (24-34 (L1); 50-56 (L2) и 89-97 (L3) подчеркнуты. Эти области являются одинаковыми в системе нумерации как Kabat, так Chothia.
Вариабельная область легкой цепи 17D20m_d3521N11 (VL) (SEQ ID NO:70, кодируемая SEQ ID NO:69)
QPVLTQPPSLSVSPGQTASITCSGEKLGDKYAYWYQQKPGQSPVLVMYQDKQRPSGIPERFSGSNSGNTATLTISGTQAMDEADYYCQAWDSSTAVFGGGTKLTVL
Вариабельная область легкой цепи 17N16m_d17N9 (VL) (SEQ ID NO:71)
SYELIQPPSVSVAPGQTATITCAGDNLGKKRVHWYQQRPGQAPVLVIYDDSDRPSGIPDRFSASNSGNTATLTITRGEAGDEADYYCQVWDIATDHVVFGGGTKLTVLAAAGSEQKLISE
Легкая цепь (а.к.1-20)
(SEQ:70)
(SEQ:71)
Легкая цепь (а.к.21-40)
(SEQ:70)
(SEQ:71)
Легкая цепь (а.к.41-60)
(SEQ:70)
(SEQ:71)
Легкая цепь (а.к.61-80)
(SEQ:70)
(SEQ:71)
Легкая цепь (а.к.81-100)
(SEQ:70)
(SEQ:71)
Легкая цепь (а.к.101-120)
(SEQ:70)
(SEQ:71)
Антитела против MASP-2 OMS100 и MoAb_d3521N11VL (содержащие вариабельную область тяжелой цепи, указанную в качестве SEQ ID NO:67, и вариабельную область легкой цепи, указанную в качестве SEQ ID NO:70, также обозначенную как "OMS646" и "mAbH6"), для которой продемонстрировано, что она связывается с MASP-2 человека с высокой аффинностью и обладает способностью блокировать функциональную активность комплемента, анализировали в отношении связывания эпитопа с использованием дот-блоттинга. Результаты показывают, что антитела против OMS646 и OMS100 являются высокоспецифическими в отношении MASP-2 и не связываются с MASP-1/3. Ни антитело, связанное с MAp19, ни фрагменты MASP-2, которые не содержали домен CCP1 MASP-2, не позволили сделать заключение, что участки связывания охватывают CCP1.
Было определено, что антитело против MASP-2 OMS646 с авидностью связывается с рекомбинантным MASP-2 (Kd 60-250 аМ) с селективностью >5000 раз превышающей селективность в отношении C1s, C1r или MASP-1 (см. таблицу 22):
Аффинность и специфичность взаимодействия антитело против MASP-2 OMS646-MASP-2 при оценке с использованием твердофазных исследований ELISA
OMS646 специфически блокирует лектин-зависимую активацию терминальных компонентов комплемента
Способы:
Эффект OMS646 на депонирование мембраноатакующего комплекса (MAC) анализировали с использованием специфических условий для лектинового пути, классического пути и альтернативного пути. Для этой цели использовали набор для скрининга комплемента Wieslab Comp300 (Wieslab, Lund, Швеция) в соответствии с инструкциями изготовителя.
Результаты :
На фиг.53A графически иллюстрируется уровень депонирования MAC в присутствии или в отсутствие антитела против MASP-2 (OMS646) в условиях, специфических для лектинового пути. На фиг.53B графически иллюстрируется уровень депонирования MAC в присутствии или в отсутствие антитела против MASP-2 (OMS646) в условиях анализа, специфических для классического пути. На фиг.53C графически иллюстрируется уровень депонирования MAC в присутствии или в отсутствие антитела против MASP-2 (OMS646) в условиях, специфических для альтернативного пути.
Как показано на фиг.53A, OMS646 блокирует опосредуемую лектиновым путем активацию депонирования MAC с величиной IC50 приблизительно 1 нМ. Однако OMS646 не имел эффекта на депонирование MAC, индуцированное при опосредуемой классическим путем активации (фиг.53B) или при опосредуемой альтернативным путем активации (фиг.53C).
Фармакокинетика и фармакодинамика OMS646 после внутривенного (в/в) или подкожного (п/к) введения мышам
Фармакокинетику (PK) и фармакодинамику (PD) OMS646 оценивали в исследовании PK/PD для однократной дозы у мышей в течение 28 суток. В исследовании тестировали уровни доз 5 мг/кг и 15 мг/кг OMS646, вводимые подкожно (п/к), а также уровень дозы 5 мг/кг OMS646, вводимый внутривенно (в/в).
Что касается профиля PK для OMS646, на фиг.54 графически иллюстрируется концентрация OMS646 (среднее значение n=3 животных/группа) в зависимости от времени после введения OMS646 в указанной дозе. Как показано на фиг.54, в дозе 5 мг/кг п/к, OMS646 достигало максимальной концентрации в плазме, составляющей 5-6 мкг/мл, приблизительно через 1-2 суток после дозирования. Биодоступность OMS646 в дозе 5 мг/кг п/к составляла приблизительно 60%. Как дополнительно показано на фиг.54, в дозе 15 мг/кг п/к, OMS646 достигало максимальной концентрации в плазме 10-12 мкг/мл приблизительно через 1-2 суток после дозирования. Для всех групп OMS646 медленно выводилось из системного кровотока с терминальным временем полужизни приблизительно 8-10 суток. Профиль OMS646 является типичным для антител человека у мышей.
Активность PD для OMS646 графически проиллюстрирована на фиг.55A и 55B. На фиг.55A и 55B показан ответ PD (снижение системной активности лектинового пути) для каждой мыши группах дозы 5 мг/кг в/в (фиг.55A) и 5 мг/кг п/к (фиг.55B). Пунктирной линией указан исходный уровень анализа (максимальное ингибирование; сыворотку наивных мышей обрабатывали in vitro избытком OMS646 перед анализом). Как показано на фиг.55A, после в/в введения 5 мг/кг OMS646, системная активность лектинового пути сразу снижалась до практически не поддающихся обнаружению уровней, и активность лектинового пути продемонстрировала только умеренное восстановление в течение периода наблюдения, составляющего 28 суток. Как показано на фиг.55B, у мышей, которым вводили 5 мг/кг OMS646 п/к, наблюдали зависимое от времени ингибирование активности лектинового пути. Активность лектинового пути снижалась до практически не поддающихся обнаружению уровней в пределах 24 часов от введения лекарственного средства и оставалась на низких уровнях в течение по меньшей мере 7 суток. Активность лектинового пути постепенно возрастала с течением времени, но не возвращалась к уровням до введения дозы в течение периода наблюдения, составлявшего 28 суток. Профиль активности лектинового пути против времени, наблюдаемый после введения 15 мг/кг п/к был сходным с дозой 5 мг/кг п/к (данные не представлены), что указывает на насыщение конечной точки PD. Кроме того, данные показали, что еженедельные дозы 5 мг/кг OMS646, вводимые либо в/в, либо п/к, являются достаточными для достижения непрерывного подавления системной активности лектинового пути у мышей.
ПРИМЕР 41
В этом примере продемонстрировано, что ингибирующее MASP-2 антитело (OMS646) ингибирует индуцируемое сывороткой при aHUS депонирование C5b-9 комплемента на поверхности активированных микрососудистых эндотелиальных клеток человека (HMEC-1) после воздействия сыворотки от пациентов с атипичным гемолитическим уремическим синдромом (aHUS), полученной в острую фазу и в фазу ремиссии заболевания.
Предпосылки/обоснование: Следующее исследование проводили для анализа индуцируемого сывороткой при aHUS депонирования C5b-9 комплемента на поверхности активированных клеток HMEC-1 после воздействия сыворотки пациента с aHUS, полученной (1) в ходе острой фазы и (2) в ходе фазы ремиссии заболевания в присутствии или в отсутствие OMS646 - антитела MASP-2, которое специфически связывается с MASP-2 и ингибирует активацию лектинового пути.
Способы:
Пациенты: Для этого исследования было отобрано четыре пациента с aHUS, исследованных в ходе острой фазы заболевания и при ремиссии, среди пациентов, включенных в международный реестр HUS/TTP, и было проведено их генотипирование в Laboratory of Immunology and Genetics of Transplantation and Rare Diseases, Mario Negri Institute. Один пациент с aHUS имел гетерозиготную мутацию p.R1210C фактора H комплемента (CFH), а один имел аутоантитела против CFH, В то время как у других двух пациентов с aHUS не было обнаружено мутаций или антител к CFH.
В таблицах 23 и 24 обобщенно представлены результаты скрининга мутаций генов комплемента и антител против CFH у четырех пациентов с aHUS, проанализированных в этом исследовании, вместе с клиническими и биохимическими данными, измеренными либо в ходе острой фазе, либо при ремиссии.
Клинические параметры четырех пациентов с aHUS в этом исследовании
(266-500 МЕ/л)
(14-18 г/дл)
(0,55-1,25 мг/дл)
Параметры комплемента четырех пациентов с aHUS в этом исследовании
(83-180 мг/дл)
(127-400 нг/мл)
Экспериментальные способы: Клетки клеточной линии микрососудов человека (HMEC-1), происходящие из дермы, высевали на предметные стекла и использовали, когда они достигали смыкания монослоя. Монослой клеток HMEC-1 активировали посредством 10 мкМ ADP (аденозиндифосфат) в течение 10 минут, а затем инкубировали в течение четырех часов с сывороткой от четырех пациентов с aHUS, описанных выше в таблицах 23 и 24, взятой либо в ходе острой фазы заболевания, либо от тех же пациентов с aHUS на стадии ремиссии, или от 4 здоровых контрольных индивидуумов. Сыворотку разбавляли 1:2 средой для исследования (HBSS с 0,5% BSA) в присутствии или в отсутствие ингибирующего MASP-2 антитела OMS646 (100 мкг/мл), полученного, как описано выше в примере 40, или в присутствии растворимого рецептора комплемента 1 (sCR1) (150 мкг/мл), в качестве положительного контроля ингибирования комплемента. В конце стадии инкубации клетки HMEC-1 обрабатывали антителом кролика против C5b-9 комплемента человека, а затем конъюгированным с FITC вторичным антителом. В каждом эксперименте сыворотку от здорового контроля тестировали параллельно с сывороткой от пациента с aHUS (острая фаза и ремиссия). Для осуществления флуоресцентного окрашивания поверхности эндотелиальных клеток использовали инвертационный конфокальный лазерный микроскоп. Получали пятьдесят полей на образец и площадь, занимаемую флуоресцентным окрашиванием, оценивали с использованием автоматизированной детекции краев с использованием встроенных специализированных функций программного обеспечения Image J и выражали в количестве пикселей2 на анализируемое поле. Поля, демонстрирующие наиболее низкие и наиболее высокие величины, исключали из вычисления.
Для статистического анализа (односторонний ANOVA, а затем критерий Тьюки для множественных сравнений) использовали результаты в количестве пикселей2 для 13 полей, исследуемых для каждого экспериментального состояния для каждого пациента и контроля.
Результаты:
Результаты анализа депонирования комплемента с использованием сывороток четырех пациентов с aHUS, обобщенно представлены ниже в таблице 25A, и результаты с использованием сывороток от четырех здоровых индивидуумов обобщенно представлены ниже в таблице 25B.
Эффект ингибиторов комплемента на индуцируемое сывороткой при aHUS депонирование C5b-9 на активированных ADP клетках HMEC-1
(нет мутации, нет ab против CFH)
(CFH-R1210C)
(ab против CFH)
(нет мутаций, нет ab против CFH)
Эффект ингибиторов комплемента на сыворотки четырех здоровых контрольных индивидуумов (не страдающих aHUS) в отношении депонирования C5b-9 на активированных ADP клетках HMEC-1
№ индивидуума
(анализированный параллельно с индивидуумом с aHUS #1)
(анализированный параллельно с индивидуумом с aHUS #2)
(анализированный параллельно с индивидуумом с aHUS #3)
(анализированный параллельно с индивидуумом с aHUS #4)
Для таблиц 25A и 25B: данные представляют собой среднее значение ± SE. P<0,001 против контроля; *P<0,001, **P<0,01 против aHUS в острой фазе без обработки; §P<0,001, §§P<0,01, §§§P<0,05 против aHUS в фазе ремиссии без обработки.
На фиг.56 графически иллюстрируется ингибиторный эффект антитела против MASP-2 (OMS646) и sCR1 в отношении индуцируемого сывороткой при aHUS депонирования C5b-9 на активированных ADP клетках HMEC-1. На фиг.56, данные представляют собой среднее значение ± SE. P<0,0001 против контроля; *P<0,0001 против aHUS в острой фазе без обработки; ^P<0,0001 против aHUS в острой фазе + sCR1; §P<0,0001 против aHUS в фазе ремиссии без обработки и #P<0,0001 против aHUS в фазе ремиссии + sCR1.
Как показано в таблице 25A, 25B и на фиг.56, стимулированные ADP клетки HMEC-1, подвергнутые воздействию сыворотки от пациентов с aHUS (взятой либо в острую фазу, либо в фазу ремиссии) в течение четырех часов в статических условиях продемонстрировали интенсивное депонирование C5b-9 на поверхности клеток, обнаруженное с использованием конфокальной микроскопии. Путем измерения площади, охватываемой C5b-9, значительно более высокий уровень депонирования C5b-9 наблюдали на клетках от пациентов с aHUS, чем на клетках, подвергнутых воздействию сыворотки от здоровых контрольных индивидуумов, независимо от того, была ли сыворотка при aHUS получена в ходе острой фазы или в ходе ремиссии. Не наблюдали отличий в индуцируемых сывороткой эндотелиальных отложениях C5b-9 между острой фазой и фазой ремиссии.
Как дополнительно показано в таблице 25A, 25B и на фиг.56, добавление антитела против MASP-2 OMS646 к сыворотке при aHUS (каждая из которых была получен от пациентов в острую фазу или в фазу ремиссии) привело к значительному снижению депонирования C5b-9 на поверхности эндотелиальных клеток по сравнению с необработанной сывороткой при aHUS. Однако ингибиторный эффект OMS646 на депонирование C5b-9 был менее выраженным, что эффект, который проявлял общий ингибитор комплемента sCR1. Действительно, статистически значимое отличие наблюдали между индуцируемыми сывороткой при C5b-9 депозитами в присутствии OMS646 против sCR1 (фиг.56 и таблицы 25A и 25B).
При вычислении в качестве среднего значения для четырех пациентов с aHUS, процентное снижение уровня отложений C5b-9 (по сравнению с отложениями C5b-9, индуцируемыми необработанной сывороткой от тех же пациентов, взятыми за 100%), наблюдаемое в присутствии ингибиторов комплемента, было следующим:
Острая фаза:
sCR1 (150 мкг/мл): 91% снижение отложений C5b-9
OMS646 (100 мкг/мл): 40% снижение отложений C5b-9
Фаза ремиссии:
sCR1 (150 мкг/мл): 91% снижение отложений C5b-9
OMS646 (100 мкг/мл): 54% снижение отложений C5b-9
Заключение: Результаты, описанные в этом примере, демонстрируют, что лектиновый путь комплемента стимулируется активированными микрососудистыми эндотелиальными клетками и что эта стимуляция является существенным пусковым механизмом повышенного ответа активации комплемента в ответ на aHUS. Также продемонстрировано, что та стимуляция лектинового пути и в результате повышенный ответ активации комплемента происходят в ходе острой фазы и при клинической ремиссии aHUS. Более того, эти данные не ограничиваются каким-либо конкретным дефектом комплемента, ассоциированным с aHUS. Как далее продемонстрировано в этом примере, селективное ингибирование лектинового пути посредством ингибирующего MASP-2 антитела, такого как OMS646, снижает депонирование комплемента у пациентов с aHUS с различной этиологией.
ПРИМЕР 42
В этом примере демонстрируется, что ингибирующее MASP-2 антитело (OMS646) ингибирует индуцируемую сывороткой при aHUS агрегацию тромбоцитов и образование тромбов на поверхности активируемых эндотелиальных клеток микрососудов человека (HMEC-1) после воздействия сыворотки пациента с aHUS, полученной в ходе (1) острой фазы и (2) фазы ремиссии aHUS.
Способы:
Пациенты: Трех пациентов (пациенты #1, #2 и #4, как описано в таблицах 23, 24, 25A и 25B примера 41) с aHUS (один пациент имел гетерозиготную мутацию p.R1210C CFH, в то время как у других двух пациентов не было выявлено мутации или антител против CFH) исследовали в ходе острой фазы заболевания и в ходе ремиссии. Пациентов выбирали для этого исследования среди пациентов, включенных в международный реестр HUS/TTP, и их генотипирование проводили в Laboratory of Immunology и Genetics of Transplantation and Rare Diseases, Mario Negri Institute. Также было выбрано пять здоровых индивидуумов в качестве доноров крови для экспериментов с перфузией.
Способы: Монослой клеток HMEC-1 активировали посредством 10 мкМ ADP в течение 10 минут, а затем инкубировали в течение четырех часов с сывороткой от трех пациентов с aHUS (пациенты #1, 2 и 4, описанные в примере 41), взятой либо в ходе острой фазы заболевания, либо от тех же пациентов на стадии ремиссии, или с контрольной сывороткой здоровых индивидуумов. Сыворотку разбавляли 1:2 средой для исследования (HBSS с 0,5% BSA) в присутствии или в отсутствие ингибирующего MASP-2 антитела OMS646 (100 мкг/мл), полученного, как описано выше в примере 40, или в присутствии sCR1 (150 мкг/мл) в качестве положительного контроля ингибирования комплемента. Для пациентов #1 и #2 дополнительные лунки инкубировали с сыворотками (из острой фазы и ремиссии), разбавленными 1:2 средой для исследования, содержавшей 100 мкг/мл постороннего изотипического контрольного антитела или 20 мкг/мл OMS646 (для последнего случай #1 исследовали только в ремиссии и случай #2 исследовали как в ходе острой фазы, так и в ходе ремиссии).
В конце стадии инкубации клетки HMEC-1 перфузировали в проточной камере гепаринизированной цельной кровью (10 МЕ/мл), полученной от здоровых индивидуумов (содержавшей флуоресцентный краситель мепакрин, который метит тромбоциты) при сдвиговой нагрузке, встречающейся в микроциркуляции (60 дин/см2, три минуты). После перфузии в течение трех минут монослои эндотелиальных клеток фиксировали в ацетоне. Получали пятнадцать изображений на образец тромбоцитарных тромбов на поверхности эндотелиальных клеток с использованием конфокального инвертационного лазерного микроскопа и площади, занятые тромбами, оценивали с использованием программного обеспечения Image J. Области, демонстрирующие наиболее низкие и наиболее высокие величины, исключали из вычисления.
Для статистического анализа (односторонний ANOVA, а затем критерий Тьюки для множественных сравнений) использовали результаты в количестве пикселей2 для 13 полей, исследуемых для каждого экспериментального состояния для каждого пациента и контроля.
Результаты:
Результаты экспериментов по изучению образования тромбов с сыворотками от трех пациентов с aHUS обобщенно представлены ниже в таблице 26A, и результаты для сывороток от пяти здоровых индивидуумов обобщенно представлены ниже в таблице 26B.
Эффект ингибиторов комплемента на индуцируемое сывороткой при aHUS образование тромбов (пиксели2 ± SE) на активированных ADP клетках HMEC-1
образование тромба (пиксели2 ± SE)
(нет мутации, нет ab против CFH)
образование тромба (пиксели2 ± SE)
(CFH-R1210C)
образование тромба (пиксели2 ± SE)
(нет мутации, нет ab против CFH)
(150 мкг/мл)
(20 мкг/мл)
(100 мкг/мл)
Эффект ингибиторов комплемента на сыворотку от пяти здоровых контрольных индивидуумов (не страдающих aHUS) в анализе образования тромбов (пиксели2 ± SE) на активированных ADP клетках HMEC-1
образование тромба (пиксели2 ± SE)
образование тромба (пиксели2 ± SE)
образование тромба (пиксели2 ± SE)
образование тромба (пиксели2 ± SE)
образование тромба (пиксели2 ± SE)
(150 мкг/мл)
(100 мкг/мл)
Для таблиц 26A и 26B: данные представляют собой среднее значение ± SE. P<0,001 против контроля; *P<0,001, ***P<0,05 против острой фазы aHUS без обработки; §P<0,001, §§§P<0,05 против фазы ремиссии aHUS без обработки.
На фиг.57 графически иллюстрируется эффект антитела против MASP-2 (OMS646) и sCR1 на индуцируемое сывороткой при aHUS образование тромба на активированных ADP клетках HMEC-1. На фиг.57, представленные данные представляют собой среднее значение ± SE. °P<0,0001, °°P<0,01 против контроля; *P<0,0001, **P<0,01 против острой фазы aHUS без обработки; §P<0,0001 против фазы ремиссии aHUS без обработки.
Как показано в таблице 26A и на фиг.57, выраженное увеличение площади, охватываемой тромбами, наблюдали на клетках HMEC-1, обработанных сывороткой при aHUS, взятой либо в острой фазе, либо в фазе ремиссии, по сравнению с клетками, подвергнутыми воздействию сыворотки от здоровых контрольных индивидуумов (таблица 26B и фиг.57). Как показано на фиг.57 и в таблице 26A, OMS646 (как в дозе 100 мкг/мл, так в дозе 20 мкг/мл) продемонстрировало частичное ингибирование образования тромбов на клетках, предварительно подвергнутых воздействию сыворотки aHUS, полученной в ходе острой фазы. Антитромбогенный эффект был сравнимым между двумя различными дозами OMS646 и не отличался от эффекта sCR1 (фиг.57 и таблица 26A). Добавление постороннего изотипического контрольного антитела не имело ингибиторного эффекта на индуцируемое сывороткой при aHUS образование тромбов.
Как дополнительно показано на фиг.57 и в таблице 26A, ингибиторный эффект OMS646 был еще более очевидным для сыворотки при aHUS, взятой в фазу ремиссии. Действительно, добавление OMS646, как в дозе 100 мкг/мл и 20 мкг/мл, в сыворотку пациента с aHUS, взятую на стадии ремиссии, привело практически к полному ингибированию образования тромбов, аналогично тому, что наблюдали при добавлении CR1. Постороннее изотипическое контрольное антитело не продемонстрировало значительного ингибиторного эффекта.
При вычислении в качестве среднего значения для трех пациентов aHUS, процент снижения поверхности HMEC-1, покрытой депозитами тромбов (по сравнению с площадью тромба, индуцированной необработанной сывороткой от тех же пациентов, взятой за 100%), зарегистрированный с использованием ингибиторов комплемента, был следующим:
Острая фаза:
sCR1 (150 мкг/мл): 60% снижение
OMS646 (100 мкг/мл): 57% снижение
OMS646 (20 мкг/мл): 45% снижение
Фаза ремиссии:
sCR1 (150 мкг/мл): 85% снижение
OMS646 (100 мкг/мл): 79% снижение
OMS646 (20 мкг/мл): 89% снижение
Обсуждение результатов:
Результаты в этом примере демонстрируют, что ингибирующее MASP-2 антитело, такое как OMS646 (полученное, как описано в примере 40), имеет выраженный ингибиторный эффект на индуцируемое сывороткой при aHUS образование тромбов на клетках HMEC-1. Неожиданно, ингибиторный эффект OMS646 на образование тромба был более высоким, чем его эффект на депозиты C5b-9, индуцированные на HMEC-1 (как описано в примере 41). Также является неожиданным, что добавление OMS646, в дозах как 100 мкг/мл, так и 20 мкг/мл, в сыворотку пациента с aHUS, взятую на стадии ремиссии, привело практически к полному ингибированию образования тромба. Другим неожиданным открытием является наблюдение, что OMS646, как в острую фазу, так и на стадии ремиссии, было настолько же эффективным, как положительный контроль sCR1, который представляет собой широкий и практически полный ингибитор системы комплемента (Weisman H. et al., Science 249:146-151, 1990; Lazar H. et al., Circulation 100:1438-1442, 1999).
Следует отметить, что контрольная сыворотка от здоровых индивидуумов также индуцировала умеренное образование тромбов на клетках HMEC-1. Авторы настоящего изобретения не наблюдали стабильного ингибиторного эффекта на индуцируемое контрольной сывороткой образование тромбов либо с OMS646, либо с sCR1. Без связи с какой-либо конкретной теорией, полагают, что индуцируемые контролем тромбы не зависят от комплемента, что подтверждается очень низкими уровнями депозитов C5b-9, наблюдаемыми на HMEC-1, инкубированных с контрольной сывороткой (см. пример 41).
Заключение:
В заключение, наблюдаемый антитромботический эффект ингибирующего MASP-2 антитела, такого как OMS646, оказался по существу более высоким, чем можно было ожидать, исходя из ингибиторного эффекта OMS646 на депонирование C5b-9, наблюдаемого в этой экспериментальной системе (как описано в примере 41 и показано на фиг.56). Например, как описано в Gastoldi et al., Immunobiology 217:1129-1222 Abstract 48 (2012) под названием "C5a/C5aR interaction mediates complement activation and thrombosis on endothelial cells in atypical hemolytic uremic syndrome (aHUS)", было определено, что добавление антитела против C5, ингибирующего депозиты C5b-9 (60% снижение) ограничивало образование тромба на HMEC-1 в сравнимой степени (60% снижение). Напротив, ингибирующее MASP-2 антитело (OMS646 в дозе 100 мкг/мл) ингибировало депозиты C5b-9 со средними величинами (острая фаза = 40% снижение; фаза ремиссии = 54% снижение); и ингибировало образованием тромбов по существу с более высоким процентом (острая фаза = 57% снижение; фаза ремиссии = 79% снижение). Для сравнения, OMS646 ингибировало депонирование с более низком процентом, чем положительный контрольный ингибитор комплемента (sCR1 в дозе 150 мкг/мл, ингибирование депонирования C5b-9 в острой фазе = 91% снижение; в фазе ремиссии = 91% снижение), но, тем не менее, было в равной степени эффективным с положительным контролем sCR1 в отношении ингибирования образования тромбов (sCR1 в дозе 150 мкг/мл, острая фаза = 60% снижение; фаза ремиссии = 85% снижение). Эти результаты демонстрируют, что ингибирующее MASP-2 антитело (например, OMS646) неожиданно является эффективным в отношении ингибирования образования тромбов в сыворотке, полученной от индивидуумов aHUS как в острой фазе, так и в фазе ремиссии.
В соответствии с вышесказанным, в одном варианте осуществления изобретение относится к способу ингибирования образования тромбов у индивидуума, страдающего или имеющего риск развития тромботической микроангиопатии (TMA), включающему введение индивидууму композиции, содержащей количество ингибирующего MASP-2 антитела, эффективное для ингибирования MASP-2-зависимой активации комплемента. В одном варианте осуществления TMA выбрана из группы, состоящей из гемолитического уремического синдрома (HUS), тромботической тромбоцитопенической пурпуры (TTP) и атипичного гемолитического уремического синдрома (aHUS). В одном варианте осуществления TMA представляет собой aHUS. В одном варианте осуществления композицию вводят пациенту с aHUS в ходе острой фазы заболевания. В одном варианте осуществления композицию вводят пациенту с aHUS в ходе фазы ремиссии (т.е. у индивидуума, который выздоровел или частично выздоровел от эпизода острой фазы aHUS, о такой ремиссии свидетельствует, например, увеличенное количество тромбоцитов и/или сниженные концентрации LDH в сыворотке, например как описано в Loirat C et al., Orphanet Journal of Rare Diseases 6:60, 2011, включенной в настоящее описание в качестве ссылки).
В одном варианте осуществления ингибирующее MASP-2 антитело обладает по меньшей мере одной из следующих характеристик: указанное антитело связывает MASP-2 человека с KD 10 нМ или менее, указанное антитело связывает эпитоп в домене CCP1 MASP-2, указанное антитело ингибирует депонирование C3b в анализе in vitro в 1% сыворотке человека с IC50 10 нМ или менее, указанное антитело ингибирует депонирование C3b в 90% сыворотке человека с IC50 30 нМ или менее, где антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fv, Fab, Fab', F(ab)2 и F(ab')2, где антитело представляет собой одноцепочечную молекулу, где указанное антитело представляет собой молекулу IgG2, где указанное антитело представляет собой молекулу IgG1, где указанное антитело представляет собой молекулу IgG4, где молекула IgG4 содержит мутацию S228P, и/или где антитело по существу не ингибирует классический путь. В одном варианте осуществления антитело связывается с MASP-2 и селективно ингибирует лектиновый путь и по существу не ингибирует альтернативный путь. В одном варианте осуществления антитело связывается с MASP-2 и селективно ингибирует лектиновый путь и по существу не ингибирует классический путь или альтернативный путь (т.е. ингибирует лектиновый путь, сохраняя классический и альтернативный пути комплемента интактными).
В одном варианте осуществления ингибирующее MASP-2 антитело ингибирует образование тромбов в сыворотке индивидуума, страдающего TMA, такой как aHUS (острая фаза или фаза ремиссии), по меньшей мере на 30%, как например, по меньшей мере на 40%, как например, по меньшей мере на 50%, как например, по меньшей мере на 60%, как например, по меньшей мере на 70%, как например, по меньшей мере на 80%, как например, по меньшей мере на 85%, как например, по меньшей мере на 90%, как например, по меньшей мере на от 95% вплоть до 99%, по сравнению с необработанной сывороткой. В некоторых вариантах осуществления ингибирующее MASP-2 антитело ингибирует образование тромбов в сыворотке индивидуума, страдающего aHUS на уровне по меньшей мере на 20 процентов или более (как например, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%) превышающем ингибиторный эффект на депонирование C5b-9 в сыворотке.
В одном варианте осуществления ингибирующее MASP-2 антитело ингибирует образование тромбов в сыворотке от пациента с aHUS в фазе ремиссии по меньшей мере на 30%, как например, по меньшей мере на 40%, как например, по меньшей мере на 50%, как например, по меньшей мере на 60%, как например, по меньшей мере на 70%, как например, по меньшей мере на 80%, как например, по меньшей мере на 85%, как например, по меньшей мере на 90%, как например, по меньшей мере на от 95% вплоть до 99%, по сравнению с необработанной сывороткой. В некоторых вариантах осуществления ингибирующее MASP-2 антитело ингибирует образование тромбов в сыворотке у пациента с aHUS в фазе ремиссии на уровне по меньшей мере на 20 процентов или более (как например, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%) превышающем ингибиторный эффект на депонирование C5b-9 в сыворотке.
В одном варианте осуществления ингибирующее MASP-2 антитело вводят индивидууму через внутривенный катетер или посредством другого способа доставки через катетер.
В одном варианте осуществления изобретение относится к способу ингибирования образования тромбов у индивидуума, страдающего TMA, включающему введение индивидууму композиции, содержащей некоторое количество ингибирующего MASP-2 антитела или его антигенсвязывающего фрагмента, содержащих (I) (a) вариабельную область тяжелой цепи, содержащую: i) CDR-H1 тяжелой цепи, содержащую аминокислотную последовательность положений 31-35 SEQ ID NO:67; и ii) CDR-H2 тяжелой цепи, содержащую аминокислотную последовательность положений 50-65 SEQ ID NO:67; и iii) CDR-H3 тяжелой цепи, содержащую аминокислотную последовательность положений 95-102 SEQ ID NO:67 и b) вариабельную область легкой цепи, содержащую: i) CDR-L1 легкой цепи, содержащую аминокислотную последовательность положений 24-34 SEQ ID NO:70; и ii) CDR-L2 легкой цепи, содержащую аминокислотную последовательность положений 50-56 SEQ ID NO:70; и iii) CDR-L3 легкой цепи, содержащую аминокислотную последовательность положений 89-97 SEQ ID NO:70, или (II) их вариант, содержащий вариабельную область тяжелой цепи по меньшей мере с 90% идентичностью с SEQ ID NO:67 (например, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% идентичность с SEQ ID NO:67) и вариабельную область легкой цепи меньшей мере с 90% идентичностью (например, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% идентичность) с SEQ ID NO:70.
В одном варианте осуществления TMA выбрана из группы, состоящей из атипичного гемолитического уремического синдрома (aHUS) (либо острая фаза, либо фаза ремиссии), HUS и TTP. В одном варианте осуществления индивидуум имеет aHUS в острой фазе. В одном варианте осуществления индивидуум имеет aHUS в фазе ремиссии.
В некоторых вариантах осуществления способ включает введение индивидууму композиции, содержащей некоторое количество ингибирующего MASP-2 антитела или его антигенсвязывающего фрагмента, содержащих вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, указанную в качестве SEQ ID NO:67. В некоторых вариантах осуществления способ включает введение индивидууму композиции, содержащей некоторое количество ингибирующего MASP-2 антитела или его антигенсвязывающего фрагмента, содержащих вариабельную область легкой цепи, содержащую аминокислотную последовательность, указанную в качестве SEQ ID NO:70.
В некоторых вариантах осуществления способ включает введение индивидууму композиции, содержащей ингибирующее MASP-2 антитело или его антигенсвязывающий фрагмент, которые специфически распознают по меньшей мере часть эпитопа на MASP-2 человека, распознаваемого эталонным антителом OMS646, содержащим вариабельную область тяжелой цепи, как указано в SEQ ID NO:67, и вариабельную область легкой цепи, как указано в SEQ ID NO:70. Конкуренцию между связывающими представителями можно без труда анализировать либо in vitro, например с использованием ELISA, и/или путем мечения специфической репортерной молекулы одного связывающего представителя, который может быть обнаружен в присутствии другого связывающего представителя(ей), для обеспечения идентификации специфических связывающих представителей, которые связывают тот же эпитоп или перекрывающийся эпитоп. Таким образом, в настоящем описании предусматривается специфическое антитело или его антигенсвязывающий фрагмент, содержащие участок связывания антитела человека, который конкурирует с эталонным антителом OMS646 за связывание с MASP-2 человека.
ПРИМЕР 43
В этом примере демонстрируется, что ингибирующее MASP-2 человека антитело (OMS646) способно ингибировать опосредуемую плазмой пациента с TMA индукцию апоптоза первичных эндотелиальных клеток микрососудов человека (MVEC) дермального происхождения.
Предпосылки/обоснование:
Известно, что патофизиология TMA вовлекает повреждение эндотелиальных клеток, индуцируемое различными факторами, после которого происходит окклюзия мелких сосудов (например, мелких артериол и капилляров) тромбоцитарными пробками и/или фибриновыми тромбами (Hirt-Minkowsk P. et al., Nephron Clin Pract 114:c219-c235, 2010; Goldberg R.J. et al., Am J Kidney Dis 56(6):1168-1174, 2010). Было показано, что MVEC претерпевают апоптотическое повреждение под действием in vitro плазмы от пациентов с нарушениями, родственными TMA (см. Stefanescu et al., Blood Vol 112 (2):340-349, 2008; Mitra D. et al., Blood 89:1224-1234, 1997). Апоптотическое повреждение, ассоциированное с TMA, было документально подтверждено для MVEC, полученных из биоптатов тканей (кожа, кость, костный мозг, селезенка, почка, подвздошная кишка) таких пациентов. Также было показано, что апоптотические повреждения MVEC снижают уровни мембраносвязанных регулирующих комплемент белков в MVEC (см. например, Mold & Morris, Immunology 102:359-364, 2001; Christmas et al., Immunology 119:522, 2006).
Полагают, что в патофизиологию TMA, включая атипичный гемолитический уремический синдром (aHUS), вовлечена цепь положительной обратной связи, вовлекающая терминальные компоненты комплемента, и известно или полагают, что каждое из TMA, ассоциированной с катастрофическим антифосфолипидным синдромом (CAPS), болезни Дегоса и TMA на фоне злокачественной опухоли, химиотерапии злокачественной опухоли, аутоиммунитета и трансплантации отвечают на терапию против C5 посредством mAb экулизумаба (Chapin J. et al., Brit. J. Hematol 157:772-774, 2012; Tsai et al., Br J Haematol 162(4):558-559, 2013); Magro C. M. et al., Journal of Rare Diseases 8:185, 2013).
Следующий эксперимент проводили для анализа способности ингибирующего MASP-2 человека антитела (OMS646) блокировать опосредуемую плазмой пациента с TMA индукцию апоптоза в первичных MVEC кожи человека в образцах плазмы, полученных от пациентов, страдающих aHUS, обусловленной дефицитом ADAMTS13 тромботической тромбоцитопенической пурпурой (TTP), CAPS и системной болезнью Дегоса, а также TMA на фоне злокачественной опухоли, трансплантации, аутоиммунного заболевания и химиотерапии.
Способы:
Анализ in vitro проводили для анализа эффективности ингибирующего MASP-2 антитела (OMS646) в отношении блокирования опосредуемой плазмой пациента с TMA индукции апоптоза в первичных MVEC человека дермального происхождения, как описано в Stefanescu R. et al., Blood Vol 112 (2):340-349, 2008, которая включена в настоящее описание в качестве ссылки. Образцы плазмы, использованные для этого анализа, получали от здоровых контрольных индивидуумов и от индивидуумов с тромботическими микроангиопатиями либо в острой фазе, либо в фазе выздоровления. Наличие микроангиопатии у пациентов с TMA оценивали по обнаружению шизоцитов в мазке периферической крови. Кроме того, TTP диагностировали, как описано в Stefanescu R. et al., Blood Vol 112 (2):340-349, 2008.
Культура эндотелиальных клеток (EC)
Как описано в Stefanescu et al., первичные MVEC человека дермального происхождения приобретали от ScienCell Research Labs (San Diego, CA). MVEC экспрессировали CD34 вплоть до пассажей 5 и 6 (Blood 89:1224-1234, 1997). MVEC поддерживали в полистироловых флаконах, покрытых 0,1% желатином в воде в среде ECM1001 (ScienCell Research Labs), содержавшей добавку для роста эндотелиальных клеток, пенициллин, стрептомицин и 15% эмбриональную телячью сыворотку. Все MVEC использовали в пассажах с 2 по 6. Субкультуры вовлекали от 5 до 10 минутное воздействие 0,25% трипсин-EDTA.
Анализ апоптоза
Репрезентативные первичные MVEC человека дермального происхождения, о которых известно, что они являются чувствительными к индуцируемому плазмой при TTP/HUS апоптозу, промывали фосфатно-солевым буфером (PBS) и высевали в камеры 12-ячеечных планшетов, покрытых 0,1% желатином в воде, в количестве 0,15×106 жизнеспособных клеток/мл. Посеянные клетки MVEC подвергали голоданию в полной среде в течение 24 часов, а затем подвергали воздействию различных концентраций (от 2% до 20% об./об.) образцов плазмы пациента с TMA или плазмы здорового донора в течение 18 часов в присутствии или в отсутствие mAb против MASP-2 OMS646 (150 мкг/мл), а затем клетки собирали трипсинизацией. Каждый образец пациента с TMA анализировали в двух экземплярах. Степень опосредуемого плазмой апоптоза оценивали с использованием окрашивания йодидом пропидия (PI), причем >5×103 клеток анализировали в цитофлуорографе и пики A0 определяли с использованием компьютерного программного обеспечения (MCycle Av, Phoenix Flow Systems, San Diego, CA). Количественное определение на основе твердофазного иммуноферментного анализа (ELISA) цитоплазматических ассоциированных с гистонами фрагментов ДНК из клеточного лизата также проводили в соответствии с инструкциями изготовителя (Roche Diagnostics, Mannheim, Германия).
Результаты:
Результаты анализа апоптоза MVEC, индуцируемого плазмой пациента с TMA, в присутствии mAb против MASP-2 (OMS646) представлены в таблице 27.
Плазма пациентов с TMA, исследованная на первичных MVEC человека дермального происхождения в присутствии MASP-2 mAb (OMS646)
Пол
злокачественная опухоль,
TTP
болезнь Дегоса,
SLE
SLE, нефрит, транс-плантат почки s/p
SLE
"APLA" = антифосфолипидные антитела, ассоциированные с катастрофическим антифосфолипидным синдромом (CAPS).
"SLE" = системная красная волчанка
"CVA" = острое расстройство мозгового кровообращения (инсульт)
В соответствии с результатами, описанными Stefanescu R. et al., Blood Vol 112 (2):340-349, 2008, значительный апоптоз наблюдали для первичных MVEC дермального происхождения в присутствии тридцати образцов плазмы пациента с TMA в отсутствие антитела против MASP-2. Контрольные образцы плазмы от здоровых людей анализировали параллельно, и они не индуцировали апоптоз в MVEC (данные не представлены). Как показано в таблице 27, ингибирующее MASP-2 mAb (OMS646) ингибировало опосредуемую плазмой пациента с TMA индукцию апоптоза в первичных MVEC ("отвечающие" в таблице 27) в 6 из 13 исследованных образцах плазмы пациентов (46%). В частности, следует отметить, что ингибирующее MASP-2 mAb (OMS646) ингибировало апоптоз в плазме, полученной от пациентов, страдающих aHUS, TTP, болезнью Дегоса, SLE, имеющих трансплантат и страдающих APLA (CAPS). Что касается образцов семи пациентов, исследованных в этом анализе, в которых mAb против MASP-2 не блокировало апоптоз ("неотвечающие" в таблице 27), отмечается, что апоптоз может индуцироваться несколькими путями, не все из которых зависимы от комплемента. Например, как отмечалось в Stefanescu R. et al., Blood Vol 112 (2):340-349, 2008, апоптоз в анализе EC зависим от базального состояния активации EC, на которое влияют факторы плазмы, которые могут играть роль в определении уровня повреждения, требуемого для индукции апоптоза. Как далее отмечалось в Stefanescu R. et al., дополнительные факторы, способные модулировать апоптоз, могут присутствовать в плазме пациента с TMA, такие как цитокины и различные компоненты системы комплемента. Таким образом, вследствие этих затрудняющих факторов, не является неожиданным, что антитело против MASP-2 не демонстрировало блокирующего эффекта во всех образцах плазмы, которые проявляли индуцируемого плазмой при TMA апоптоза.
Кроем того, в этом отношении, отмечается, что сходный анализ проводили с использованием анализа индуцируемого плазмой при TMA апоптоза с антителом против C5 экулизумабом и наблюдали очень сходные результаты (см. Chapin et al., Blood (ASH Annual Meeting Abstracts): Abstract #3342, 120: 2012). Клиническая эффективность экулизумаба, в высокой степени успешного коммерческого продукта, оказалось более высокой, чем эффективность, продемонстрированная в этой модели, что указывает на то, что эта модель in vitro может преуменьшать клинический потенциал ингибирующих комплемент лекарственных средств.
Эти результаты демонстрируют, что ингибирующее MASP-2 антитело, такое как OMS646, является эффективным в отношении ингибирования индуцируемого плазмой при TMA апоптоза в плазме, полученной от пациентов, страдающих TMA, такой как aHUS, TTP, болезнь Дегоса, SLE, имеющих трансплантат и страдающих APLA (CAPS). Известно, что эндотелиальное повреждение и апоптоз играют ключевую роль в патологии TMA, такой как идиопатическая TTP и спорадический HUS (Kim et al., Microvascular Research vol 62(2):83-93, 2001). Как описано Dang et al., апоптоз был продемонстрирован в красной пульпе селезенки пациентов с TTP, но не у здоровых контрольных индивидуумов (Dang et al., Blood 93(4):1264-1270, 1999). Признаки апоптоза также наблюдали в клетках гломерул почек, происходящих из MVEC, у пациента с HUS (Arends M. J. et al., Hum Pathol 20:89, 1989). Таким образом, ожидается, что введение средства, ингибирующего MASP-2, такого как ингибирующее MASP-2 антитело (например, OMS646), будет эффективной терапией у пациентов, страдающих TMA, такой как aHUS, TTP или другое микроангиопатическое нарушение, такое как другие TMA, включающие CAPS, системную болезнь Дегоса и TMA на фоне злокачественной опухоли; TMA на фоне химиотерапии или TMA на фоне трансплантации.
В соответствии с вышесказанным, в одном варианте осуществления изобретение относится к способу ингибирования повреждения эндотелиальных клеток и/или апоптоза эндотелиальных клеток, и/или образования тромбов у индивидуума, страдающего или имеющего риск развития тромботической микроангиопатии (TMA), включающему введение индивидууму композиции, содержащей количество ингибирующего MASP-2 антитела, эффективное для ингибирования MASP-2-зависимой активации комплемента. В одном варианте осуществления TMA выбрана из группы, состоящей из атипичного гемолитического уремического синдрома (aHUS), тромботической тромбоцитопенической пурпуры (TTP) и гемолитического уремического синдрома (HUS). В одном варианте осуществления TMA представляет собой aHUS. В одном варианте осуществления композицию вводят пациенту с aHUS в ходе острой фазы заболевания. В одном варианте осуществления композицию вводят пациенту с aHUS в ходе фазы ремиссии (т.е. у индивидуума, который выздоровел или частично выздоровел после эпизода aHUS острой фазы, о такой ремиссии свидетельствует, например, увеличенное количество тромбоцитов и/или сниженные концентрации LDH в сыворотке, например, как описано в Loirat C et al., Orphanet Journal of Rare Disease 6:60, 2011, включенной в настоящее описание в качестве ссылки).
В одном варианте осуществления индивидуум страдает или имеет риск развития TMA, которая представляет собой (i) TMA на фоне злокачественной опухоли; (ii) TMA на фоне химиотерапии или (iii) TMA на фоне трансплантации (например, трансплантации органа, такой как трансплантация почки или трансплантация аллогенных гемопоэтических стволовых клеток). В одном варианте осуществления индивидуум страдает или имеет риск развития синдрома Апшо-Шульмана (USS). В одном варианте осуществления индивидуум страдает или имеет риск развития болезни Дегоса. В одном варианте осуществления индивидуум страдает или имеет риск развития катастрофического антифосфолипидного синдрома (CAPS).
В соответствии с любым из описанных в настоящем описании вариантов осуществления, ингибирующее MASP-2 антитело обладает по меньшей мере одной из следующих характеристик: указанное антитело связывает MASP-2 человека с KD 10 нМ или менее, указанное антитело связывает эпитоп в домене CCP1 MASP-2, указанное антитело ингибирует депонирование C3b в анализе in vitro в 1% сыворотке человека с IC50 10 нМ или менее, указанное антитело ингибирует депонирование C3b в 90% сыворотке человека с IC50 30 нМ или менее, где антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fv, Fab, Fab', F(ab)2 и F(ab')2, где антитело представляет собой одноцепочечную молекулу, где указанное антитело представляет собой молекулу IgG2, где указанное антитело представляет собой молекулу IgG1, где указанное антитело представляет собой молекулу IgG4, где молекула IgG4 содержит мутацию S228P, и/или где антитело по существу не ингибирует классический путь. В одном варианте осуществления антитело связывается с MASP-2 и селективно ингибирует лектиновый путь и по существу не ингибирует альтернативный путь. В одном варианте осуществления антитело связывается с MASP-2 и селективно ингибирует лектиновый путь и по существу не ингибирует классический путь (т.е. ингибирует лектиновый путь, сохраняя классический путь комплемента интактным).
В одном варианте осуществления ингибирующее MASP-2 антитело ингибирует индуцируемый плазмой апоптоз MVEC в сыворотке индивидуума, страдающего TMA, такой как aHUS (острая фаза или фаза ремиссии), гемолитический уремический синдром (HUS), тромботическая тромбоцитопеническая пурпура (TTP), TMA на фоне злокачественной опухоли; TMA на фоне химиотерапии; TMA на фоне трансплантации (например, трансплантации органа, такого как трансплантация почки или трансплантация аллогенных гемопоэтических стволовых клеток), или в сыворотке индивидуума, страдающего синдромом Апшо-Шульмана (USS), или в сыворотке индивидуума, страдающего болезнью Дегоса, или у индивидуума, страдающего катастрофическим антифосфолипидным синдромом (CAPS), где индуцируемый плазмой апоптоз MVEC ингибируется по меньшей мере на 5%, как например, по меньшей мере на 10%, как например, по меньшей мере на 20%, как например, по меньшей мере на 30%, как например, по меньшей мере на 40%, как например, по меньшей мере на 50%, как например, по меньшей мере на 60%, как например, по меньшей мере на 70%, как например, по меньшей мере на 80%, как например, по меньшей мере на 85%, как например, по меньшей мере на 90%, как например, по меньшей мере на от 95% вплоть до 99%, по сравнению с необработанной сывороткой. В некоторых вариантах осуществления ингибирующее MASP-2 антитело ингибирует образование тромбов в сыворотке индивидуума, страдающего TMA (например, такой как aHUS (острая фаза или фаза ремиссии), гемолитический уремический синдром (HUS), тромботическая тромбоцитопеническая пурпура (TTP), TMA на фоне злокачественной опухоли; TMA на фоне химиотерапии; TMA на фоне трансплантации (например, трансплантации органа, такой как трансплантация почки или аллогенная трансплантация гемопоэтических стволовых клеток), или в сыворотке индивидуума, страдающего синдромом Апшо-Шульмана (USS), или в сыворотке индивидуума, страдающего болезнью Дегоса, или у индивидуума, страдающего катастрофическим антифосфолипидным синдромом (CAPS)), на уровне по меньшей мере 20 процентов или более (как например, по меньшей мере 30%, по меньшей мере 40%, по меньшей мере 50%) превышающем ингибиторный эффект на депонирование C5b-9 в сыворотке.
В одном варианте осуществления ингибирующее MASP-2 антитело вводят индивидууму через внутривенный катетер или посредством другого способа доставки через катетер.
В одном варианте осуществления изобретение относится к способу ингибирования образования тромбов у индивидуума, страдающего TMA (такой как aHUS (в острой фазе или в фазе ремиссии), гемолитический уремический синдром (HUS), тромботическая тромбоцитопеническая пурпура (TTP), TMA на фоне злокачественной опухоли; TMA на фоне химиотерапии; TMA на фоне трансплантации (например, трансплантации органа, такой как трансплантация почки или трансплантация аллогенных гемопоэтических стволовых клеток), или в сыворотке индивидуума, страдающего синдромом Апшо-Шульмана (USS), или в сыворотке индивидуума, страдающего болезнью Дегоса, или у индивидуума, страдающего катастрофическим антифосфолипидным синдромом (CAPS)), включающему введение индивидууму композиции, содержащей некоторое количество ингибирующего MASP-2 антитела или его антигенсвязывающего фрагмента, содержащих (I) (a) вариабельную область тяжелой цепи, содержащую: i) CDR-H1 тяжелой цепи, содержащую аминокислотную последовательность положений 31-35 SEQ ID NO:67; и ii) CDR-H2 тяжелой цепи, содержащую аминокислотную последовательность положений 50-65 SEQ ID NO:67; и iii) CDR-H3 тяжелой цепи, содержащую аминокислотную последовательность положений 95-102 SEQ ID NO:67 и b) вариабельную область легкой цепи, содержащую: i) CDR-L1 легкой цепи, содержащую аминокислотную последовательность положений 24-34 SEQ ID NO:70; и ii) CDR-L2 легкой цепи, содержащую аминокислотную последовательность положений 50-56 SEQ ID NO:70; и iii) CDR-L3 легкой цепи, содержащую аминокислотную последовательность положений 89-97 SEQ ID NO:70, или (II) их вариант, содержащий вариабельную область тяжелой цепи по меньшей мере с 90% идентичностью с SEQ ID NO:67 (например, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% идентичность с SEQ ID NO:67) и вариабельную область легкой цепи меньшей мере с 90% идентичностью (например, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% идентичность) с SEQ ID NO:70.
В одном варианте осуществления индивидуум страдает TMA, выбранной из группы, состоящей из TMA на фоне злокачественной опухоли; TMA на фоне химиотерапии; TMA на фоне трансплантации (например, трансплантации органа, такой как трансплантация почки или трансплантация аллогенных гемопоэтических стволовых клеток), синдрома Апшо-Шульмана (USS), болезни Дегоса и катастрофического антифосфолипидного синдрома (CAPS).
В некоторых вариантах осуществления способ включает введение индивидууму композиции, содержащей некоторое количество ингибирующего MASP-2 антитела или его антигенсвязывающего фрагмента, содержащих вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, указанную в качестве SEQ ID NO:67. В некоторых вариантах осуществления способ включает введение индивидууму композиции, содержащей некоторое количество ингибирующего MASP-2 антитела или его антигенсвязывающего фрагмента, содержащих вариабельную область легкой цепи, содержащую аминокислотную последовательность, указанную в качестве SEQ ID NO:70.
В некоторых вариантах осуществления способ включает введение индивидууму композиции, содержащей ингибирующее MASP-2 антитело или его антигенсвязывающий фрагмент, которые специфически распознают по меньшей мере часть эпитопа на MASP-2 человека, распознаваемого эталонным антителом OMS646, содержащим вариабельную область тяжелой цепи, как указано в SEQ ID NO:67, и вариабельную область легкой цепи, как указано в SEQ ID NO:70.
Хотя иллюстративные варианты осуществления проиллюстрированы и описаны, будет понятно, что можно вносить различные изменения без отклонения от сущности и объема изобретения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Omeros Corporаtion
University of Leicester
Demopulos, Gregory A.
Dudler, Thomas
Schwaeble, Hans-Wilhelm
<120> СПОСОБЫ ЛЕЧЕНИЯ СОСТОЯНИЙ, АССОЦИИРОВАННЫХ С MASP-2-ЗАВИСИМОЙ АКТИВАЦИЕЙ КОМПЛЕМЕНТА
<130> MP.1.0220.PCT
<150> US 62/020,845
<151> 2014-07-03
<150> US 61/892,283
<151> 2013-10-17
<160> 71
<170> PatentIn version 3.5
<210> 1
<211> 725
<212> ДНК
<213> Homo sapiens
<220>
<221> CDS
<222> (27)..(584)
<400> 1
ggccaggcca gctggacggg cacacc atg agg ctg ctg acc ctc ctg ggc ctt 53
Met Arg Leu Leu Thr Leu Leu Gly Leu
1 5
ctg tgt ggc tcg gtg gcc acc ccc ttg ggc ccg aag tgg cct gaa cct 101
Leu Cys Gly Ser Val Ala Thr Pro Leu Gly Pro Lys Trp Pro Glu Pro
10 15 20 25
gtg ttc ggg cgc ctg gca tcc ccc ggc ttt cca ggg gag tat gcc aat 149
Val Phe Gly Arg Leu Ala Ser Pro Gly Phe Pro Gly Glu Tyr Ala Asn
30 35 40
gac cag gag cgg cgc tgg acc ctg act gca ccc ccc ggc tac cgc ctg 197
Asp Gln Glu Arg Arg Trp Thr Leu Thr Ala Pro Pro Gly Tyr Arg Leu
45 50 55
cgc ctc tac ttc acc cac ttc gac ctg gag ctc tcc cac ctc tgc gag 245
Arg Leu Tyr Phe Thr His Phe Asp Leu Glu Leu Ser His Leu Cys Glu
60 65 70
tac gac ttc gtc aag ctg agc tcg ggg gcc aag gtg ctg gcc acg ctg 293
Tyr Asp Phe Val Lys Leu Ser Ser Gly Ala Lys Val Leu Ala Thr Leu
75 80 85
tgc ggg cag gag agc aca gac acg gag cgg gcc cct ggc aag gac act 341
Cys Gly Gln Glu Ser Thr Asp Thr Glu Arg Ala Pro Gly Lys Asp Thr
90 95 100 105
ttc tac tcg ctg ggc tcc agc ctg gac att acc ttc cgc tcc gac tac 389
Phe Tyr Ser Leu Gly Ser Ser Leu Asp Ile Thr Phe Arg Ser Asp Tyr
110 115 120
tcc aac gag aag ccg ttc acg ggg ttc gag gcc ttc tat gca gcc gag 437
Ser Asn Glu Lys Pro Phe Thr Gly Phe Glu Ala Phe Tyr Ala Ala Glu
125 130 135
gac att gac gag tgc cag gtg gcc ccg gga gag gcg ccc acc tgc gac 485
Asp Ile Asp Glu Cys Gln Val Ala Pro Gly Glu Ala Pro Thr Cys Asp
140 145 150
cac cac tgc cac aac cac ctg ggc ggt ttc tac tgc tcc tgc cgc gca 533
His His Cys His Asn His Leu Gly Gly Phe Tyr Cys Ser Cys Arg Ala
155 160 165
ggc tac gtc ctg cac cgt aac aag cgc acc tgc tca gag cag agc ctc 581
Gly Tyr Val Leu His Arg Asn Lys Arg Thr Cys Ser Glu Gln Ser Leu
170 175 180 185
tag cctcccctgg agctccggcc tgcccagcag gtcagaagcc agagccagcc 634
tgctggcctc agctccgggt tgggctgaga tggctgtgcc ccaactccca ttcacccacc 694
atggacccaa taataaacct ggccccaccc c 725
<210> 2
<211> 185
<212> БЕЛОК
<213> Homo sapiens
<400> 2
Met Arg Leu Leu Thr Leu Leu Gly Leu Leu Cys Gly Ser Val Ala Thr
1 5 10 15
Pro Leu Gly Pro Lys Trp Pro Glu Pro Val Phe Gly Arg Leu Ala Ser
20 25 30
Pro Gly Phe Pro Gly Glu Tyr Ala Asn Asp Gln Glu Arg Arg Trp Thr
35 40 45
Leu Thr Ala Pro Pro Gly Tyr Arg Leu Arg Leu Tyr Phe Thr His Phe
50 55 60
Asp Leu Glu Leu Ser His Leu Cys Glu Tyr Asp Phe Val Lys Leu Ser
65 70 75 80
Ser Gly Ala Lys Val Leu Ala Thr Leu Cys Gly Gln Glu Ser Thr Asp
85 90 95
Thr Glu Arg Ala Pro Gly Lys Asp Thr Phe Tyr Ser Leu Gly Ser Ser
100 105 110
Leu Asp Ile Thr Phe Arg Ser Asp Tyr Ser Asn Glu Lys Pro Phe Thr
115 120 125
Gly Phe Glu Ala Phe Tyr Ala Ala Glu Asp Ile Asp Glu Cys Gln Val
130 135 140
Ala Pro Gly Glu Ala Pro Thr Cys Asp His His Cys His Asn His Leu
145 150 155 160
Gly Gly Phe Tyr Cys Ser Cys Arg Ala Gly Tyr Val Leu His Arg Asn
165 170 175
Lys Arg Thr Cys Ser Glu Gln Ser Leu
180 185
<210> 3
<211> 170
<212> БЕЛОК
<213> Homo sapiens
<400> 3
Thr Pro Leu Gly Pro Lys Trp Pro Glu Pro Val Phe Gly Arg Leu Ala
1 5 10 15
Ser Pro Gly Phe Pro Gly Glu Tyr Ala Asn Asp Gln Glu Arg Arg Trp
20 25 30
Thr Leu Thr Ala Pro Pro Gly Tyr Arg Leu Arg Leu Tyr Phe Thr His
35 40 45
Phe Asp Leu Glu Leu Ser His Leu Cys Glu Tyr Asp Phe Val Lys Leu
50 55 60
Ser Ser Gly Ala Lys Val Leu Ala Thr Leu Cys Gly Gln Glu Ser Thr
65 70 75 80
Asp Thr Glu Arg Ala Pro Gly Lys Asp Thr Phe Tyr Ser Leu Gly Ser
85 90 95
Ser Leu Asp Ile Thr Phe Arg Ser Asp Tyr Ser Asn Glu Lys Pro Phe
100 105 110
Thr Gly Phe Glu Ala Phe Tyr Ala Ala Glu Asp Ile Asp Glu Cys Gln
115 120 125
Val Ala Pro Gly Glu Ala Pro Thr Cys Asp His His Cys His Asn His
130 135 140
Leu Gly Gly Phe Tyr Cys Ser Cys Arg Ala Gly Tyr Val Leu His Arg
145 150 155 160
Asn Lys Arg Thr Cys Ser Glu Gln Ser Leu
165 170
<210> 4
<211> 2460
<212> ДНК
<213> Homo sapiens
<220>
<221> CDS
<222> (22)..(2082)
<400> 4
ggccagctgg acgggcacac c atg agg ctg ctg acc ctc ctg ggc ctt ctg 51
Met Arg Leu Leu Thr Leu Leu Gly Leu Leu
1 5 10
tgt ggc tcg gtg gcc acc ccc ttg ggc ccg aag tgg cct gaa cct gtg 99
Cys Gly Ser Val Ala Thr Pro Leu Gly Pro Lys Trp Pro Glu Pro Val
15 20 25
ttc ggg cgc ctg gca tcc ccc ggc ttt cca ggg gag tat gcc aat gac 147
Phe Gly Arg Leu Ala Ser Pro Gly Phe Pro Gly Glu Tyr Ala Asn Asp
30 35 40
cag gag cgg cgc tgg acc ctg act gca ccc ccc ggc tac cgc ctg cgc 195
Gln Glu Arg Arg Trp Thr Leu Thr Ala Pro Pro Gly Tyr Arg Leu Arg
45 50 55
ctc tac ttc acc cac ttc gac ctg gag ctc tcc cac ctc tgc gag tac 243
Leu Tyr Phe Thr His Phe Asp Leu Glu Leu Ser His Leu Cys Glu Tyr
60 65 70
gac ttc gtc aag ctg agc tcg ggg gcc aag gtg ctg gcc acg ctg tgc 291
Asp Phe Val Lys Leu Ser Ser Gly Ala Lys Val Leu Ala Thr Leu Cys
75 80 85 90
ggg cag gag agc aca gac acg gag cgg gcc cct ggc aag gac act ttc 339
Gly Gln Glu Ser Thr Asp Thr Glu Arg Ala Pro Gly Lys Asp Thr Phe
95 100 105
tac tcg ctg ggc tcc agc ctg gac att acc ttc cgc tcc gac tac tcc 387
Tyr Ser Leu Gly Ser Ser Leu Asp Ile Thr Phe Arg Ser Asp Tyr Ser
110 115 120
aac gag aag ccg ttc acg ggg ttc gag gcc ttc tat gca gcc gag gac 435
Asn Glu Lys Pro Phe Thr Gly Phe Glu Ala Phe Tyr Ala Ala Glu Asp
125 130 135
att gac gag tgc cag gtg gcc ccg gga gag gcg ccc acc tgc gac cac 483
Ile Asp Glu Cys Gln Val Ala Pro Gly Glu Ala Pro Thr Cys Asp His
140 145 150
cac tgc cac aac cac ctg ggc ggt ttc tac tgc tcc tgc cgc gca ggc 531
His Cys His Asn His Leu Gly Gly Phe Tyr Cys Ser Cys Arg Ala Gly
155 160 165 170
tac gtc ctg cac cgt aac aag cgc acc tgc tca gcc ctg tgc tcc ggc 579
Tyr Val Leu His Arg Asn Lys Arg Thr Cys Ser Ala Leu Cys Ser Gly
175 180 185
cag gtc ttc acc cag agg tct ggg gag ctc agc agc cct gaa tac cca 627
Gln Val Phe Thr Gln Arg Ser Gly Glu Leu Ser Ser Pro Glu Tyr Pro
190 195 200
cgg ccg tat ccc aaa ctc tcc agt tgc act tac agc atc agc ctg gag 675
Arg Pro Tyr Pro Lys Leu Ser Ser Cys Thr Tyr Ser Ile Ser Leu Glu
205 210 215
gag ggg ttc agt gtc att ctg gac ttt gtg gag tcc ttc gat gtg gag 723
Glu Gly Phe Ser Val Ile Leu Asp Phe Val Glu Ser Phe Asp Val Glu
220 225 230
aca cac cct gaa acc ctg tgt ccc tac gac ttt ctc aag att caa aca 771
Thr His Pro Glu Thr Leu Cys Pro Tyr Asp Phe Leu Lys Ile Gln Thr
235 240 245 250
gac aga gaa gaa cat ggc cca ttc tgt ggg aag aca ttg ccc cac agg 819
Asp Arg Glu Glu His Gly Pro Phe Cys Gly Lys Thr Leu Pro His Arg
255 260 265
att gaa aca aaa agc aac acg gtg acc atc acc ttt gtc aca gat gaa 867
Ile Glu Thr Lys Ser Asn Thr Val Thr Ile Thr Phe Val Thr Asp Glu
270 275 280
tca gga gac cac aca ggc tgg aag atc cac tac acg agc aca gcg cag 915
Ser Gly Asp His Thr Gly Trp Lys Ile His Tyr Thr Ser Thr Ala Gln
285 290 295
cct tgc cct tat ccg atg gcg cca cct aat ggc cac gtt tca cct gtg 963
Pro Cys Pro Tyr Pro Met Ala Pro Pro Asn Gly His Val Ser Pro Val
300 305 310
caa gcc aaa tac atc ctg aaa gac agc ttc tcc atc ttt tgc gag act 1011
Gln Ala Lys Tyr Ile Leu Lys Asp Ser Phe Ser Ile Phe Cys Glu Thr
315 320 325 330
ggc tat gag ctt ctg caa ggt cac ttg ccc ctg aaa tcc ttt act gca 1059
Gly Tyr Glu Leu Leu Gln Gly His Leu Pro Leu Lys Ser Phe Thr Ala
335 340 345
gtt tgt cag aaa gat gga tct tgg gac cgg cca atg ccc gcg tgc agc 1107
Val Cys Gln Lys Asp Gly Ser Trp Asp Arg Pro Met Pro Ala Cys Ser
350 355 360
att gtt gac tgt ggc cct cct gat gat cta ccc agt ggc cga gtg gag 1155
Ile Val Asp Cys Gly Pro Pro Asp Asp Leu Pro Ser Gly Arg Val Glu
365 370 375
tac atc aca ggt cct gga gtg acc acc tac aaa gct gtg att cag tac 1203
Tyr Ile Thr Gly Pro Gly Val Thr Thr Tyr Lys Ala Val Ile Gln Tyr
380 385 390
agc tgt gaa gag acc ttc tac aca atg aaa gtg aat gat ggt aaa tat 1251
Ser Cys Glu Glu Thr Phe Tyr Thr Met Lys Val Asn Asp Gly Lys Tyr
395 400 405 410
gtg tgt gag gct gat gga ttc tgg acg agc tcc aaa gga gaa aaa tca 1299
Val Cys Glu Ala Asp Gly Phe Trp Thr Ser Ser Lys Gly Glu Lys Ser
415 420 425
ctc cca gtc tgt gag cct gtt tgt gga cta tca gcc cgc aca aca gga 1347
Leu Pro Val Cys Glu Pro Val Cys Gly Leu Ser Ala Arg Thr Thr Gly
430 435 440
ggg cgt ata tat gga ggg caa aag gca aaa cct ggt gat ttt cct tgg 1395
Gly Arg Ile Tyr Gly Gly Gln Lys Ala Lys Pro Gly Asp Phe Pro Trp
445 450 455
caa gtc ctg ata tta ggt gga acc aca gca gca ggt gca ctt tta tat 1443
Gln Val Leu Ile Leu Gly Gly Thr Thr Ala Ala Gly Ala Leu Leu Tyr
460 465 470
gac aac tgg gtc cta aca gct gct cat gcc gtc tat gag caa aaa cat 1491
Asp Asn Trp Val Leu Thr Ala Ala His Ala Val Tyr Glu Gln Lys His
475 480 485 490
gat gca tcc gcc ctg gac att cga atg ggc acc ctg aaa aga cta tca 1539
Asp Ala Ser Ala Leu Asp Ile Arg Met Gly Thr Leu Lys Arg Leu Ser
495 500 505
cct cat tat aca caa gcc tgg tct gaa gct gtt ttt ata cat gaa ggt 1587
Pro His Tyr Thr Gln Ala Trp Ser Glu Ala Val Phe Ile His Glu Gly
510 515 520
tat act cat gat gct ggc ttt gac aat gac ata gca ctg att aaa ttg 1635
Tyr Thr His Asp Ala Gly Phe Asp Asn Asp Ile Ala Leu Ile Lys Leu
525 530 535
aat aac aaa gtt gta atc aat agc aac atc acg cct att tgt ctg cca 1683
Asn Asn Lys Val Val Ile Asn Ser Asn Ile Thr Pro Ile Cys Leu Pro
540 545 550
aga aaa gaa gct gaa tcc ttt atg agg aca gat gac att gga act gca 1731
Arg Lys Glu Ala Glu Ser Phe Met Arg Thr Asp Asp Ile Gly Thr Ala
555 560 565 570
tct gga tgg gga tta acc caa agg ggt ttt ctt gct aga aat cta atg 1779
Ser Gly Trp Gly Leu Thr Gln Arg Gly Phe Leu Ala Arg Asn Leu Met
575 580 585
tat gtc gac ata ccg att gtt gac cat caa aaa tgt act gct gca tat 1827
Tyr Val Asp Ile Pro Ile Val Asp His Gln Lys Cys Thr Ala Ala Tyr
590 595 600
gaa aag cca ccc tat cca agg gga agt gta act gct aac atg ctt tgt 1875
Glu Lys Pro Pro Tyr Pro Arg Gly Ser Val Thr Ala Asn Met Leu Cys
605 610 615
gct ggc tta gaa agt ggg ggc aag gac agc tgc aga ggt gac agc gga 1923
Ala Gly Leu Glu Ser Gly Gly Lys Asp Ser Cys Arg Gly Asp Ser Gly
620 625 630
ggg gca ctg gtg ttt cta gat agt gaa aca gag agg tgg ttt gtg gga 1971
Gly Ala Leu Val Phe Leu Asp Ser Glu Thr Glu Arg Trp Phe Val Gly
635 640 645 650
gga ata gtg tcc tgg ggt tcc atg aat tgt ggg gaa gca ggt cag tat 2019
Gly Ile Val Ser Trp Gly Ser Met Asn Cys Gly Glu Ala Gly Gln Tyr
655 660 665
gga gtc tac aca aaa gtt att aac tat att ccc tgg atc gag aac ata 2067
Gly Val Tyr Thr Lys Val Ile Asn Tyr Ile Pro Trp Ile Glu Asn Ile
670 675 680
att agt gat ttt taa cttgcgtgtc tgcagtcaag gattcttcat ttttagaaat 2122
Ile Ser Asp Phe
685
gcctgtgaag accttggcag cgacgtggct cgagaagcat tcatcattac tgtggacatg 2182
gcagttgttg ctccacccaa aaaaacagac tccaggtgag gctgctgtca tttctccact 2242
tgccagttta attccagcct tacccattga ctcaagggga cataaaccac gagagtgaca 2302
gtcatctttg cccacccagt gtaatgtcac tgctcaaatt acatttcatt accttaaaaa 2362
gccagtctct tttcatactg gctgttggca tttctgtaaa ctgcctgtcc atgctctttg 2422
tttttaaact tgttcttatt gaaaaaaaaa aaaaaaaa 2460
<210> 5
<211> 686
<212> БЕЛОК
<213> Homo sapiens
<400> 5
Met Arg Leu Leu Thr Leu Leu Gly Leu Leu Cys Gly Ser Val Ala Thr
1 5 10 15
Pro Leu Gly Pro Lys Trp Pro Glu Pro Val Phe Gly Arg Leu Ala Ser
20 25 30
Pro Gly Phe Pro Gly Glu Tyr Ala Asn Asp Gln Glu Arg Arg Trp Thr
35 40 45
Leu Thr Ala Pro Pro Gly Tyr Arg Leu Arg Leu Tyr Phe Thr His Phe
50 55 60
Asp Leu Glu Leu Ser His Leu Cys Glu Tyr Asp Phe Val Lys Leu Ser
65 70 75 80
Ser Gly Ala Lys Val Leu Ala Thr Leu Cys Gly Gln Glu Ser Thr Asp
85 90 95
Thr Glu Arg Ala Pro Gly Lys Asp Thr Phe Tyr Ser Leu Gly Ser Ser
100 105 110
Leu Asp Ile Thr Phe Arg Ser Asp Tyr Ser Asn Glu Lys Pro Phe Thr
115 120 125
Gly Phe Glu Ala Phe Tyr Ala Ala Glu Asp Ile Asp Glu Cys Gln Val
130 135 140
Ala Pro Gly Glu Ala Pro Thr Cys Asp His His Cys His Asn His Leu
145 150 155 160
Gly Gly Phe Tyr Cys Ser Cys Arg Ala Gly Tyr Val Leu His Arg Asn
165 170 175
Lys Arg Thr Cys Ser Ala Leu Cys Ser Gly Gln Val Phe Thr Gln Arg
180 185 190
Ser Gly Glu Leu Ser Ser Pro Glu Tyr Pro Arg Pro Tyr Pro Lys Leu
195 200 205
Ser Ser Cys Thr Tyr Ser Ile Ser Leu Glu Glu Gly Phe Ser Val Ile
210 215 220
Leu Asp Phe Val Glu Ser Phe Asp Val Glu Thr His Pro Glu Thr Leu
225 230 235 240
Cys Pro Tyr Asp Phe Leu Lys Ile Gln Thr Asp Arg Glu Glu His Gly
245 250 255
Pro Phe Cys Gly Lys Thr Leu Pro His Arg Ile Glu Thr Lys Ser Asn
260 265 270
Thr Val Thr Ile Thr Phe Val Thr Asp Glu Ser Gly Asp His Thr Gly
275 280 285
Trp Lys Ile His Tyr Thr Ser Thr Ala Gln Pro Cys Pro Tyr Pro Met
290 295 300
Ala Pro Pro Asn Gly His Val Ser Pro Val Gln Ala Lys Tyr Ile Leu
305 310 315 320
Lys Asp Ser Phe Ser Ile Phe Cys Glu Thr Gly Tyr Glu Leu Leu Gln
325 330 335
Gly His Leu Pro Leu Lys Ser Phe Thr Ala Val Cys Gln Lys Asp Gly
340 345 350
Ser Trp Asp Arg Pro Met Pro Ala Cys Ser Ile Val Asp Cys Gly Pro
355 360 365
Pro Asp Asp Leu Pro Ser Gly Arg Val Glu Tyr Ile Thr Gly Pro Gly
370 375 380
Val Thr Thr Tyr Lys Ala Val Ile Gln Tyr Ser Cys Glu Glu Thr Phe
385 390 395 400
Tyr Thr Met Lys Val Asn Asp Gly Lys Tyr Val Cys Glu Ala Asp Gly
405 410 415
Phe Trp Thr Ser Ser Lys Gly Glu Lys Ser Leu Pro Val Cys Glu Pro
420 425 430
Val Cys Gly Leu Ser Ala Arg Thr Thr Gly Gly Arg Ile Tyr Gly Gly
435 440 445
Gln Lys Ala Lys Pro Gly Asp Phe Pro Trp Gln Val Leu Ile Leu Gly
450 455 460
Gly Thr Thr Ala Ala Gly Ala Leu Leu Tyr Asp Asn Trp Val Leu Thr
465 470 475 480
Ala Ala His Ala Val Tyr Glu Gln Lys His Asp Ala Ser Ala Leu Asp
485 490 495
Ile Arg Met Gly Thr Leu Lys Arg Leu Ser Pro His Tyr Thr Gln Ala
500 505 510
Trp Ser Glu Ala Val Phe Ile His Glu Gly Tyr Thr His Asp Ala Gly
515 520 525
Phe Asp Asn Asp Ile Ala Leu Ile Lys Leu Asn Asn Lys Val Val Ile
530 535 540
Asn Ser Asn Ile Thr Pro Ile Cys Leu Pro Arg Lys Glu Ala Glu Ser
545 550 555 560
Phe Met Arg Thr Asp Asp Ile Gly Thr Ala Ser Gly Trp Gly Leu Thr
565 570 575
Gln Arg Gly Phe Leu Ala Arg Asn Leu Met Tyr Val Asp Ile Pro Ile
580 585 590
Val Asp His Gln Lys Cys Thr Ala Ala Tyr Glu Lys Pro Pro Tyr Pro
595 600 605
Arg Gly Ser Val Thr Ala Asn Met Leu Cys Ala Gly Leu Glu Ser Gly
610 615 620
Gly Lys Asp Ser Cys Arg Gly Asp Ser Gly Gly Ala Leu Val Phe Leu
625 630 635 640
Asp Ser Glu Thr Glu Arg Trp Phe Val Gly Gly Ile Val Ser Trp Gly
645 650 655
Ser Met Asn Cys Gly Glu Ala Gly Gln Tyr Gly Val Tyr Thr Lys Val
660 665 670
Ile Asn Tyr Ile Pro Trp Ile Glu Asn Ile Ile Ser Asp Phe
675 680 685
<210> 6
<211> 671
<212> БЕЛОК
<213> Homo sapiens
<400> 6
Thr Pro Leu Gly Pro Lys Trp Pro Glu Pro Val Phe Gly Arg Leu Ala
1 5 10 15
Ser Pro Gly Phe Pro Gly Glu Tyr Ala Asn Asp Gln Glu Arg Arg Trp
20 25 30
Thr Leu Thr Ala Pro Pro Gly Tyr Arg Leu Arg Leu Tyr Phe Thr His
35 40 45
Phe Asp Leu Glu Leu Ser His Leu Cys Glu Tyr Asp Phe Val Lys Leu
50 55 60
Ser Ser Gly Ala Lys Val Leu Ala Thr Leu Cys Gly Gln Glu Ser Thr
65 70 75 80
Asp Thr Glu Arg Ala Pro Gly Lys Asp Thr Phe Tyr Ser Leu Gly Ser
85 90 95
Ser Leu Asp Ile Thr Phe Arg Ser Asp Tyr Ser Asn Glu Lys Pro Phe
100 105 110
Thr Gly Phe Glu Ala Phe Tyr Ala Ala Glu Asp Ile Asp Glu Cys Gln
115 120 125
Val Ala Pro Gly Glu Ala Pro Thr Cys Asp His His Cys His Asn His
130 135 140
Leu Gly Gly Phe Tyr Cys Ser Cys Arg Ala Gly Tyr Val Leu His Arg
145 150 155 160
Asn Lys Arg Thr Cys Ser Ala Leu Cys Ser Gly Gln Val Phe Thr Gln
165 170 175
Arg Ser Gly Glu Leu Ser Ser Pro Glu Tyr Pro Arg Pro Tyr Pro Lys
180 185 190
Leu Ser Ser Cys Thr Tyr Ser Ile Ser Leu Glu Glu Gly Phe Ser Val
195 200 205
Ile Leu Asp Phe Val Glu Ser Phe Asp Val Glu Thr His Pro Glu Thr
210 215 220
Leu Cys Pro Tyr Asp Phe Leu Lys Ile Gln Thr Asp Arg Glu Glu His
225 230 235 240
Gly Pro Phe Cys Gly Lys Thr Leu Pro His Arg Ile Glu Thr Lys Ser
245 250 255
Asn Thr Val Thr Ile Thr Phe Val Thr Asp Glu Ser Gly Asp His Thr
260 265 270
Gly Trp Lys Ile His Tyr Thr Ser Thr Ala Gln Pro Cys Pro Tyr Pro
275 280 285
Met Ala Pro Pro Asn Gly His Val Ser Pro Val Gln Ala Lys Tyr Ile
290 295 300
Leu Lys Asp Ser Phe Ser Ile Phe Cys Glu Thr Gly Tyr Glu Leu Leu
305 310 315 320
Gln Gly His Leu Pro Leu Lys Ser Phe Thr Ala Val Cys Gln Lys Asp
325 330 335
Gly Ser Trp Asp Arg Pro Met Pro Ala Cys Ser Ile Val Asp Cys Gly
340 345 350
Pro Pro Asp Asp Leu Pro Ser Gly Arg Val Glu Tyr Ile Thr Gly Pro
355 360 365
Gly Val Thr Thr Tyr Lys Ala Val Ile Gln Tyr Ser Cys Glu Glu Thr
370 375 380
Phe Tyr Thr Met Lys Val Asn Asp Gly Lys Tyr Val Cys Glu Ala Asp
385 390 395 400
Gly Phe Trp Thr Ser Ser Lys Gly Glu Lys Ser Leu Pro Val Cys Glu
405 410 415
Pro Val Cys Gly Leu Ser Ala Arg Thr Thr Gly Gly Arg Ile Tyr Gly
420 425 430
Gly Gln Lys Ala Lys Pro Gly Asp Phe Pro Trp Gln Val Leu Ile Leu
435 440 445
Gly Gly Thr Thr Ala Ala Gly Ala Leu Leu Tyr Asp Asn Trp Val Leu
450 455 460
Thr Ala Ala His Ala Val Tyr Glu Gln Lys His Asp Ala Ser Ala Leu
465 470 475 480
Asp Ile Arg Met Gly Thr Leu Lys Arg Leu Ser Pro His Tyr Thr Gln
485 490 495
Ala Trp Ser Glu Ala Val Phe Ile His Glu Gly Tyr Thr His Asp Ala
500 505 510
Gly Phe Asp Asn Asp Ile Ala Leu Ile Lys Leu Asn Asn Lys Val Val
515 520 525
Ile Asn Ser Asn Ile Thr Pro Ile Cys Leu Pro Arg Lys Glu Ala Glu
530 535 540
Ser Phe Met Arg Thr Asp Asp Ile Gly Thr Ala Ser Gly Trp Gly Leu
545 550 555 560
Thr Gln Arg Gly Phe Leu Ala Arg Asn Leu Met Tyr Val Asp Ile Pro
565 570 575
Ile Val Asp His Gln Lys Cys Thr Ala Ala Tyr Glu Lys Pro Pro Tyr
580 585 590
Pro Arg Gly Ser Val Thr Ala Asn Met Leu Cys Ala Gly Leu Glu Ser
595 600 605
Gly Gly Lys Asp Ser Cys Arg Gly Asp Ser Gly Gly Ala Leu Val Phe
610 615 620
Leu Asp Ser Glu Thr Glu Arg Trp Phe Val Gly Gly Ile Val Ser Trp
625 630 635 640
Gly Ser Met Asn Cys Gly Glu Ala Gly Gln Tyr Gly Val Tyr Thr Lys
645 650 655
Val Ile Asn Tyr Ile Pro Trp Ile Glu Asn Ile Ile Ser Asp Phe
660 665 670
<210> 7
<211> 4900
<212> ДНК
<213> Homo sapiens
<400> 7
cctgtcctgc ctgcctggaa ctctgagcag gctggagtca tggagtcgat tcccagaatc 60
ccagagtcag ggaggctggg ggcaggggca ggtcactgga caaacagatc aaaggtgaga 120
ccagcgtagg actgcagacc aggccaggcc agctggacgg gcacaccatg aggtaggtgg 180
gcgccacagc ctccctgcag ggtgtggggt gggagcacag gcctgggcct caccgcccct 240
gccctgccca taggctgctg accctcctgg gccttctgtg tggctcggtg gccaccccct 300
taggcccgaa gtggcctgaa cctgtgttcg ggcgcctggc atcccccggc tttccagggg 360
agtatgccaa tgaccaggag cggcgctgga ccctgactgc accccccggc taccgcctgc 420
gcctctactt cacccacttc gacctggagc tctcccacct ctgcgagtac gacttcgtca 480
aggtgccgtc agacgggagg gctggggttt ctcagggtcg gggggtcccc aaggagtagc 540
cagggttcag ggacacctgg gagcaggggc caggcttggc caggagggag atcaggcctg 600
ggtcttgcct tcactccctg tgacacctga ccccacagct gagctcgggg gccaaggtgc 660
tggccacgct gtgcgggcag gagagcacag acacggagcg ggcccctggc aaggacactt 720
tctactcgct gggctccagc ctggacatta ccttccgctc cgactactcc aacgagaagc 780
cgttcacggg gttcgaggcc ttctatgcag ccgagggtga gccaagaggg gtcctgcaac 840
atctcagtct gcgcagctgg ctgtgggggt aactctgtct taggccaggc agccctgcct 900
tcagtttccc cacctttccc agggcagggg agaggcctct ggcctgacat catccacaat 960
gcaaagacca aaacagccgt gacctccatt cacatgggct gagtgccaac tctgagccag 1020
ggatctgagg acagcatcgc ctcaagtgac gcagggactg gccgggcgcg gcagctcacg 1080
cctgtaattc cagcactttg ggaggccgag gctggcttga taatttgagg gtcaggagtt 1140
caaggccagc cagggcaaca cggtgaaact ctatctccac taaaactaca aaaattagct 1200
gggcgtggtg gtgcgcacct ggaatcccag ctactaggga ggctgaggca ggagaattgc 1260
ttgaacctgc gaggtggagg ctgcagtgaa cagagattgc accactacac tccacctggg 1320
cgacagacta gactccgtct caaaaaacaa aaaacaaaaa ccacgcaggg ccgagggccc 1380
atttacaagc tgacaaagtg ggccctgcca gcgggagcgc tgcaggatgt ttgattttca 1440
gatcccagtc cctgcagaga ccaactgtgt gacctctggc aagtggctca atttctctgc 1500
tccttagaag ctgctgcaag ggttcagcgc tgtagccccg ccccctgggt ttgattgact 1560
cccctcatta gctgggtgac ctcggccgga cactgaaact cccactggtt taacagaggt 1620
gatgtttgca tctttctccc agcgctgctg ggagcttgca gcgaccctag gcctgtaagg 1680
tgattggccc ggcaccagtc ccgcacccta gacaggacct aggcctcctc tgaggtccac 1740
tctgaggtca tggatctcct gggaggagtc caggctggat cccgcctctt tccctcctga 1800
cggcctgcct ggccctgcct ctcccccaga cattgacgag tgccaggtgg ccccgggaga 1860
ggcgcccacc tgcgaccacc actgccacaa ccacctgggc ggtttctact gctcctgccg 1920
cgcaggctac gtcctgcacc gtaacaagcg cacctgctca ggtgagggag gctgcctggg 1980
ccccaacgca ccctctcctg ggatacccgg ggctcctcag ggccattgct gctctgccca 2040
ggggtgcgga gggcctgggc ctggacactg ggtgcttcta ggccctgctg cctccagctc 2100
cccttctcag ccctgcttcc cctctcagca gccaggctca tcagtgccac cctgccctag 2160
cactgagact aattctaaca tcccactgtg tacctggttc cacctgggct ctgggaaccc 2220
ctcatgtagc cacgggagag tcggggtatc taccctcgtt ccttggactg ggttcctgtt 2280
ccctgcactg ggggacgggc cagtgctctg gggcgtgggc agccccaccc tgtggcgctg 2340
accctgctcc cccgactcgg tttctcctct cggggtctct ccttgcctct ctgatctctc 2400
ttccagagca gagcctctag cctcccctgg agctccggct gcccagcagg tcagaagcca 2460
gagccaggct gctggcctca gctccgggtt gggctgagat gctgtgcccc aactcccatt 2520
cacccaccat ggacccaata ataaacctgg ccccacccca cctgctgccg cgtgtctctg 2580
gggtgggagg gtcgggaggc ggtggggcgc gctcctctct gcctaccctc ctcacagcct 2640
catgaacccc aggtctgtgg gagcctcctc catggggcca cacggtcctt ggcctcaccc 2700
cctgttttga agatggggca ctgaggccgg agaggggtaa ggcctcgctc gagtccaggt 2760
ccccagaggc tgagcccaga gtaatcttga accaccccca ttcagggtct ggcctggagg 2820
agcctgaccc acagaggaga caccctggga gatattcatt gaggggtaat ctggtccccc 2880
gcaaatccag gggtgattcc cactgcccca taggcacagc cacgtggaag aaggcaggca 2940
atgttggggc tcctcacttc ctagaggcct cacaactcaa atgcccccca ctgcagctgg 3000
gggtggggtg gtggtatggg atggggacca agccttcctt gaaggataga gcccagccca 3060
acaccccgcc ccgtggcagc agcatcacgt gttccagcga ggaaggagag caccagactc 3120
agtcatgatc actgttgcct tgaacttcca agaacagccc cagggcaagg gtcaaaacag 3180
gggaaagggg gtgatgagag atccttcttc cggatgttcc tccaggaacc agggggctgg 3240
ctggtcttgg ctgggttcgg gtaggagacc catgatgaat aaacttggga atcactgggg 3300
tggctgtaag ggaatttagg ggagctccga aggggccctt aggctcgagg agatgctcct 3360
ctcttttccc gaattcccag ggacccagga gagtgtccct tcttcctctt cctgtgtgtc 3420
catccacccc cgccccccgc cctggcagag ctggtggaac tcagtgctct agcccctacc 3480
ctggggttgc gactctggct caggacacca ccacgctccc tgggggtgtg agtgagggcc 3540
tgtgcgctcc atcccgagtg ctgcctgttt cagctaaagc ctcaaagcaa gagaaacccc 3600
ctctctaagc ggcccctcag ccatcgggtg ggtcgtttgg tttctgggta ggcctcaggg 3660
gctggccacc tgcagggccc agcccaaccc agggatgcag atgtcccagc cacatccctg 3720
tcccagtttc ctgctcccca aggcatccac cctgctgttg gtgcgagggc tgatagaggg 3780
cacgccaagt cactcccctg cccttccctc cttccagccc tgtgctccgg ccaggtcttc 3840
acccagaggt ctggggagct cagcagccct gaatacccac ggccgtatcc caaactctcc 3900
agttgcactt acagcatcag cctggaggag gggttcagtg tcattctgga ctttgtggag 3960
tccttcgatg tggagacaca ccctgaaacc ctgtgtccct acgactttct caaggtctgg 4020
ctcctgggcc cctcatcttg tcccagatcc tcccccttca gcccagctgc accccctact 4080
tcctgcagca tggcccccac cacgttcccg tcaccctcgg tgaccccacc tcttcaggtg 4140
ctctatggag gtcaaggctg gggcttcgag tacaagtgtg ggaggcagag tggggagggg 4200
caccccaatc catggcctgg gttggcctca ttggctgtcc ctgaaatgct gaggaggtgg 4260
gttacttccc tccgcccagg ccagacccag gcagctgctc cccagctttc atgagcttct 4320
ttctcagatt caaacagaca gagaagaaca tggcccattc tgtgggaaga cattgcccca 4380
caggattgaa acaaaaagca acacggtgac catcaccttt gtcacagatg aatcaggaga 4440
ccacacaggc tggaagatcc actacacgag cacagtgagc aagtgggctc agatccttgg 4500
tggaagcgca gagctgcctc tctctggagt gcaaggagct gtagagtgta gggctcttct 4560
gggcaggact aggaagggac accaggttta gtggtgctga ggtctgaggc agcagcttct 4620
aaggggaagc acccgtgccc tcctcagcag cacccagcat cttcaccact cattcttcaa 4680
ccacccattc acccatcact catcttttac ccacccaccc tttgccactc atccttctgt 4740
ccctcatcct tccaaccatt catcaatcac ccacccatcc atcctttgcc acacaaccat 4800
ccacccattc ttctacctac ccatcctatc catccatcct tctatcagca tccttctacc 4860
acccatcctt cgttcggtca tccatcatca tccatccatc 4900
<210> 8
<211> 136
<212> БЕЛОК
<213> Homo sapiens
<400> 8
Met Arg Leu Leu Thr Leu Leu Gly Leu Leu Cys Gly Ser Val Ala Thr
1 5 10 15
Pro Leu Gly Pro Lys Trp Pro Glu Pro Val Phe Gly Arg Leu Ala Ser
20 25 30
Pro Gly Phe Pro Gly Glu Tyr Ala Asn Asp Gln Glu Arg Arg Trp Thr
35 40 45
Leu Thr Ala Pro Pro Gly Tyr Arg Leu Arg Leu Tyr Phe Thr His Phe
50 55 60
Asp Leu Glu Leu Ser His Leu Cys Glu Tyr Asp Phe Val Lys Leu Ser
65 70 75 80
Ser Gly Ala Lys Val Leu Ala Thr Leu Cys Gly Gln Glu Ser Thr Asp
85 90 95
Thr Glu Arg Ala Pro Gly Lys Asp Thr Phe Tyr Ser Leu Gly Ser Ser
100 105 110
Leu Asp Ile Thr Phe Arg Ser Asp Tyr Ser Asn Glu Lys Pro Phe Thr
115 120 125
Gly Phe Glu Ala Phe Tyr Ala Ala
130 135
<210> 9
<211> 181
<212> БЕЛОК
<213> Homo sapiens
<400> 9
Met Arg Leu Leu Thr Leu Leu Gly Leu Leu Cys Gly Ser Val Ala Thr
1 5 10 15
Pro Leu Gly Pro Lys Trp Pro Glu Pro Val Phe Gly Arg Leu Ala Ser
20 25 30
Pro Gly Phe Pro Gly Glu Tyr Ala Asn Asp Gln Glu Arg Arg Trp Thr
35 40 45
Leu Thr Ala Pro Pro Gly Tyr Arg Leu Arg Leu Tyr Phe Thr His Phe
50 55 60
Asp Leu Glu Leu Ser His Leu Cys Glu Tyr Asp Phe Val Lys Leu Ser
65 70 75 80
Ser Gly Ala Lys Val Leu Ala Thr Leu Cys Gly Gln Glu Ser Thr Asp
85 90 95
Thr Glu Arg Ala Pro Gly Lys Asp Thr Phe Tyr Ser Leu Gly Ser Ser
100 105 110
Leu Asp Ile Thr Phe Arg Ser Asp Tyr Ser Asn Glu Lys Pro Phe Thr
115 120 125
Gly Phe Glu Ala Phe Tyr Ala Ala Glu Asp Ile Asp Glu Cys Gln Val
130 135 140
Ala Pro Gly Glu Ala Pro Thr Cys Asp His His Cys His Asn His Leu
145 150 155 160
Gly Gly Phe Tyr Cys Ser Cys Arg Ala Gly Tyr Val Leu His Arg Asn
165 170 175
Lys Arg Thr Cys Ser
180
<210> 10
<211> 293
<212> БЕЛОК
<213> Homo sapiens
<400> 10
Met Arg Leu Leu Thr Leu Leu Gly Leu Leu Cys Gly Ser Val Ala Thr
1 5 10 15
Pro Leu Gly Pro Lys Trp Pro Glu Pro Val Phe Gly Arg Leu Ala Ser
20 25 30
Pro Gly Phe Pro Gly Glu Tyr Ala Asn Asp Gln Glu Arg Arg Trp Thr
35 40 45
Leu Thr Ala Pro Pro Gly Tyr Arg Leu Arg Leu Tyr Phe Thr His Phe
50 55 60
Asp Leu Glu Leu Ser His Leu Cys Glu Tyr Asp Phe Val Lys Leu Ser
65 70 75 80
Ser Gly Ala Lys Val Leu Ala Thr Leu Cys Gly Gln Glu Ser Thr Asp
85 90 95
Thr Glu Arg Ala Pro Gly Lys Asp Thr Phe Tyr Ser Leu Gly Ser Ser
100 105 110
Leu Asp Ile Thr Phe Arg Ser Asp Tyr Ser Asn Glu Lys Pro Phe Thr
115 120 125
Gly Phe Glu Ala Phe Tyr Ala Ala Glu Asp Ile Asp Glu Cys Gln Val
130 135 140
Ala Pro Gly Glu Ala Pro Thr Cys Asp His His Cys His Asn His Leu
145 150 155 160
Gly Gly Phe Tyr Cys Ser Cys Arg Ala Gly Tyr Val Leu His Arg Asn
165 170 175
Lys Arg Thr Cys Ser Ala Leu Cys Ser Gly Gln Val Phe Thr Gln Arg
180 185 190
Ser Gly Glu Leu Ser Ser Pro Glu Tyr Pro Arg Pro Tyr Pro Lys Leu
195 200 205
Ser Ser Cys Thr Tyr Ser Ile Ser Leu Glu Glu Gly Phe Ser Val Ile
210 215 220
Leu Asp Phe Val Glu Ser Phe Asp Val Glu Thr His Pro Glu Thr Leu
225 230 235 240
Cys Pro Tyr Asp Phe Leu Lys Ile Gln Thr Asp Arg Glu Glu His Gly
245 250 255
Pro Phe Cys Gly Lys Thr Leu Pro His Arg Ile Glu Thr Lys Ser Asn
260 265 270
Thr Val Thr Ile Thr Phe Val Thr Asp Glu Ser Gly Asp His Thr Gly
275 280 285
Trp Lys Ile His Tyr
290
<210> 11
<211> 41
<212> БЕЛОК
<213> Homo sapiens
<400> 11
Glu Asp Ile Asp Glu Cys Gln Val Ala Pro Gly Glu Ala Pro Thr Cys
1 5 10 15
Asp His His Cys His Asn His Leu Gly Gly Phe Tyr Cys Ser Cys Arg
20 25 30
Ala Gly Tyr Val Leu His Arg Asn Lys
35 40
<210> 12
<211> 242
<212> БЕЛОК
<213> Homo sapiens
<400> 12
Ile Tyr Gly Gly Gln Lys Ala Lys Pro Gly Asp Phe Pro Trp Gln Val
1 5 10 15
Leu Ile Leu Gly Gly Thr Thr Ala Ala Gly Ala Leu Leu Tyr Asp Asn
20 25 30
Trp Val Leu Thr Ala Ala His Ala Val Tyr Glu Gln Lys His Asp Ala
35 40 45
Ser Ala Leu Asp Ile Arg Met Gly Thr Leu Lys Arg Leu Ser Pro His
50 55 60
Tyr Thr Gln Ala Trp Ser Glu Ala Val Phe Ile His Glu Gly Tyr Thr
65 70 75 80
His Asp Ala Gly Phe Asp Asn Asp Ile Ala Leu Ile Lys Leu Asn Asn
85 90 95
Lys Val Val Ile Asn Ser Asn Ile Thr Pro Ile Cys Leu Pro Arg Lys
100 105 110
Glu Ala Glu Ser Phe Met Arg Thr Asp Asp Ile Gly Thr Ala Ser Gly
115 120 125
Trp Gly Leu Thr Gln Arg Gly Phe Leu Ala Arg Asn Leu Met Tyr Val
130 135 140
Asp Ile Pro Ile Val Asp His Gln Lys Cys Thr Ala Ala Tyr Glu Lys
145 150 155 160
Pro Pro Tyr Pro Arg Gly Ser Val Thr Ala Asn Met Leu Cys Ala Gly
165 170 175
Leu Glu Ser Gly Gly Lys Asp Ser Cys Arg Gly Asp Ser Gly Gly Ala
180 185 190
Leu Val Phe Leu Asp Ser Glu Thr Glu Arg Trp Phe Val Gly Gly Ile
195 200 205
Val Ser Trp Gly Ser Met Asn Cys Gly Glu Ala Gly Gln Tyr Gly Val
210 215 220
Tyr Thr Lys Val Ile Asn Tyr Ile Pro Trp Ile Glu Asn Ile Ile Ser
225 230 235 240
Asp Phe
<210> 13
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 13
Gly Lys Asp Ser Cys Arg Gly Asp Ala Gly Gly Ala Leu Val Phe Leu
1 5 10 15
<210> 14
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 14
Thr Pro Leu Gly Pro Lys Trp Pro Glu Pro Val Phe Gly Arg Leu
1 5 10 15
<210> 15
<211> 43
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 15
Thr Ala Pro Pro Gly Tyr Arg Leu Arg Leu Tyr Phe Thr His Phe Asp
1 5 10 15
Leu Glu Leu Ser His Leu Cys Glu Tyr Asp Phe Val Lys Leu Ser Ser
20 25 30
Gly Ala Lys Val Leu Ala Thr Leu Cys Gly Gln
35 40
<210> 16
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 16
Thr Phe Arg Ser Asp Tyr Ser Asn
1 5
<210> 17
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 17
Phe Tyr Ser Leu Gly Ser Ser Leu Asp Ile Thr Phe Arg Ser Asp Tyr
1 5 10 15
Ser Asn Glu Lys Pro Phe Thr Gly Phe
20 25
<210> 18
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 18
Ile Asp Glu Cys Gln Val Ala Pro Gly
1 5
<210> 19
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 19
Ala Asn Met Leu Cys Ala Gly Leu Glu Ser Gly Gly Lys Asp Ser Cys
1 5 10 15
Arg Gly Asp Ser Gly Gly Ala Leu Val
20 25
<210> 20
<211> 960
<212> ДНК
<213> Homo sapiens
<220>
<221> CDS
<222> (51)..(797)
<400> 20
attaactgag attaaccttc cctgagtttt ctcacaccaa ggtgaggacc atg tcc 56
Met Ser
1
ctg ttt cca tca ctc cct ctc ctt ctc ctg agt atg gtg gca gcg tct 104
Leu Phe Pro Ser Leu Pro Leu Leu Leu Leu Ser Met Val Ala Ala Ser
5 10 15
tac tca gaa act gtg acc tgt gag gat gcc caa aag acc tgc cct gca 152
Tyr Ser Glu Thr Val Thr Cys Glu Asp Ala Gln Lys Thr Cys Pro Ala
20 25 30
gtg att gcc tgt agc tct cca ggc atc aac ggc ttc cca ggc aaa gat 200
Val Ile Ala Cys Ser Ser Pro Gly Ile Asn Gly Phe Pro Gly Lys Asp
35 40 45 50
ggg cgt gat ggc acc aag gga gaa aag ggg gaa cca ggc caa ggg ctc 248
Gly Arg Asp Gly Thr Lys Gly Glu Lys Gly Glu Pro Gly Gln Gly Leu
55 60 65
aga ggc tta cag ggc ccc cct gga aag ttg ggg cct cca gga aat cca 296
Arg Gly Leu Gln Gly Pro Pro Gly Lys Leu Gly Pro Pro Gly Asn Pro
70 75 80
ggg cct tct ggg tca cca gga cca aag ggc caa aaa gga gac cct gga 344
Gly Pro Ser Gly Ser Pro Gly Pro Lys Gly Gln Lys Gly Asp Pro Gly
85 90 95
aaa agt ccg gat ggt gat agt agc ctg gct gcc tca gaa aga aaa gct 392
Lys Ser Pro Asp Gly Asp Ser Ser Leu Ala Ala Ser Glu Arg Lys Ala
100 105 110
ctg caa aca gaa atg gca cgt atc aaa aag tgg ctc acc ttc tct ctg 440
Leu Gln Thr Glu Met Ala Arg Ile Lys Lys Trp Leu Thr Phe Ser Leu
115 120 125 130
ggc aaa caa gtt ggg aac aag ttc ttc ctg acc aat ggt gaa ata atg 488
Gly Lys Gln Val Gly Asn Lys Phe Phe Leu Thr Asn Gly Glu Ile Met
135 140 145
acc ttt gaa aaa gtg aag gcc ttg tgt gtc aag ttc cag gcc tct gtg 536
Thr Phe Glu Lys Val Lys Ala Leu Cys Val Lys Phe Gln Ala Ser Val
150 155 160
gcc acc ccc agg aat gct gca gag aat gga gcc att cag aat ctc atc 584
Ala Thr Pro Arg Asn Ala Ala Glu Asn Gly Ala Ile Gln Asn Leu Ile
165 170 175
aag gag gaa gcc ttc ctg ggc atc act gat gag aag aca gaa ggg cag 632
Lys Glu Glu Ala Phe Leu Gly Ile Thr Asp Glu Lys Thr Glu Gly Gln
180 185 190
ttt gtg gat ctg aca gga aat aga ctg acc tac aca aac tgg aac gag 680
Phe Val Asp Leu Thr Gly Asn Arg Leu Thr Tyr Thr Asn Trp Asn Glu
195 200 205 210
ggt gaa ccc aac aat gct ggt tct gat gaa gat tgt gta ttg cta ctg 728
Gly Glu Pro Asn Asn Ala Gly Ser Asp Glu Asp Cys Val Leu Leu Leu
215 220 225
aaa aat ggc cag tgg aat gac gtc ccc tgc tcc acc tcc cat ctg gcc 776
Lys Asn Gly Gln Trp Asn Asp Val Pro Cys Ser Thr Ser His Leu Ala
230 235 240
gtc tgt gag ttc cct atc tga agggtcatat cactcaggcc ctccttgtct 827
Val Cys Glu Phe Pro Ile
245
ttttactgca acccacaggc ccacagtatg cttgaaaaga taaattatat caatttcctc 887
atatccagta ttgttccttt tgtgggcaat cactaaaaat gatcactaac agcaccaaca 947
aagcaataat agt 960
<210> 21
<211> 248
<212> БЕЛОК
<213> Homo sapiens
<400> 21
Met Ser Leu Phe Pro Ser Leu Pro Leu Leu Leu Leu Ser Met Val Ala
1 5 10 15
Ala Ser Tyr Ser Glu Thr Val Thr Cys Glu Asp Ala Gln Lys Thr Cys
20 25 30
Pro Ala Val Ile Ala Cys Ser Ser Pro Gly Ile Asn Gly Phe Pro Gly
35 40 45
Lys Asp Gly Arg Asp Gly Thr Lys Gly Glu Lys Gly Glu Pro Gly Gln
50 55 60
Gly Leu Arg Gly Leu Gln Gly Pro Pro Gly Lys Leu Gly Pro Pro Gly
65 70 75 80
Asn Pro Gly Pro Ser Gly Ser Pro Gly Pro Lys Gly Gln Lys Gly Asp
85 90 95
Pro Gly Lys Ser Pro Asp Gly Asp Ser Ser Leu Ala Ala Ser Glu Arg
100 105 110
Lys Ala Leu Gln Thr Glu Met Ala Arg Ile Lys Lys Trp Leu Thr Phe
115 120 125
Ser Leu Gly Lys Gln Val Gly Asn Lys Phe Phe Leu Thr Asn Gly Glu
130 135 140
Ile Met Thr Phe Glu Lys Val Lys Ala Leu Cys Val Lys Phe Gln Ala
145 150 155 160
Ser Val Ala Thr Pro Arg Asn Ala Ala Glu Asn Gly Ala Ile Gln Asn
165 170 175
Leu Ile Lys Glu Glu Ala Phe Leu Gly Ile Thr Asp Glu Lys Thr Glu
180 185 190
Gly Gln Phe Val Asp Leu Thr Gly Asn Arg Leu Thr Tyr Thr Asn Trp
195 200 205
Asn Glu Gly Glu Pro Asn Asn Ala Gly Ser Asp Glu Asp Cys Val Leu
210 215 220
Leu Leu Lys Asn Gly Gln Trp Asn Asp Val Pro Cys Ser Thr Ser His
225 230 235 240
Leu Ala Val Cys Glu Phe Pro Ile
245
<210> 22
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<221> ДОПОЛНИТЕЛЬНЫЙ ПРИЗНАК
<222> (1)..(1)
<223> Wherein X at position 1 представляет собой hydroxyproline
<220>
<221> ДОПОЛНИТЕЛЬНЫЙ ПРИЗНАК
<222> (4)..(4)
<223> Wherein X at position 4 представляет собой hydrophobic residue
<400> 22
Xaa Gly Lys Xaa Gly Pro
1 5
<210> 23
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<221> ДОПОЛНИТЕЛЬНЫЙ ПРИЗНАК
<222> (1)..(1)
<223> Wherein X представляет собой hydroxyproline
<400> 23
Xaa Gly Lys Leu Gly
1 5
<210> 24
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<221> ДОПОЛНИТЕЛЬНЫЙ ПРИЗНАК
<222> (9)..(15)
<223> Где X в положениях 9 and 15 представляет собой hydroxyproline
<400> 24
Gly Leu Arg Gly Leu Gln Gly Pro Xaa Gly Lys Leu Gly Pro Xaa Gly
1 5 10 15
<210> 25
<211> 27
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<221> ДОПОЛНИТЕЛЬНЫЙ ПРИЗНАК
<222> (3)..(27)
<223> Где X в положениях 3, 6, 15, 21, 24, 27 представляет собой гидроксипролин
<400> 25
Gly Pro Xaa Gly Pro Xaa Gly Leu Arg Gly Leu Gln Gly Pro Xaa Gly
1 5 10 15
Lys Leu Gly Pro Xaa Gly Pro Xaa Gly Pro Xaa
20 25
<210> 26
<211> 53
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<221> дополнительный признак
<222> (26)..(26)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (32)..(32)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (35)..(35)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (41)..(41)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<220>
<221> дополнительный признак
<222> (50)..(50)
<223> Xaa может представлять собой любую встречающуюся в природе аминокислоту
<400> 26
Gly Lys Asp Gly Arg Asp Gly Thr Lys Gly Glu Lys Gly Glu Pro Gly
1 5 10 15
Gln Gly Leu Arg Gly Leu Gln Gly Pro Xaa Gly Lys Leu Gly Pro Xaa
20 25 30
Gly Asn Xaa Gly Pro Ser Gly Ser Xaa Gly Pro Lys Gly Gln Lys Gly
35 40 45
Asp Xaa Gly Lys Ser
50
<210> 27
<211> 33
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<221> ДОПОЛНИТЕЛЬНЫЙ ПРИЗНАК
<222> (3)..(33)
<223> Где X в положениях 3, 6, 12, 18, 21, 30, 33 представляет собой гидроксипролин
<400> 27
Gly Ala Xaa Gly Ser Xaa Gly Glu Lys Gly Ala Xaa Gly Pro Gln Gly
1 5 10 15
Pro Xaa Gly Pro Xaa Gly Lys Met Gly Pro Lys Gly Glu Xaa Gly Asp
20 25 30
Xaa
<210> 28
<211> 45
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<221> ДОПОЛНИТЕЛЬНЫЙ ПРИЗНАК
<222> (3)..(45)
<223> Где X в положениях 3, 6, 9, 27, 30, 36, 42, 45 представляет собой гидроксипролин
<400> 28
Gly Cys Xaa Gly Leu Xaa Gly Ala Xaa Gly Asp Lys Gly Glu Ala Gly
1 5 10 15
Thr Asn Gly Lys Arg Gly Glu Arg Gly Pro Xaa Gly Pro Xaa Gly Lys
20 25 30
Ala Gly Pro Xaa Gly Pro Asn Gly Ala Xaa Gly Glu Xaa
35 40 45
<210> 29
<211> 24
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 29
Leu Gln Arg Ala Leu Glu Ile Leu Pro Asn Arg Val Thr Ile Lys Ala
1 5 10 15
Asn Arg Pro Phe Leu Val Phe Ile
20
<210> 30
<211> 559
<212> ДНК
<213> Homo sapiens
<400> 30
atgaggctgc tgaccctcct gggccttctg tgtggctcgg tggccacccc cttgggcccg 60
aagtggcctg aacctgtgtt cgggcgcctg gcatcccccg gctttccagg ggagtatgcc 120
aatgaccagg agcggcgctg gaccctgact gcaccccccg gctaccgcct gcgcctctac 180
ttcacccact tcgacctgga gctctcccac ctctgcgagt acgacttcgt caagctgagc 240
tcgggggcca aggtgctggc cacgctgtgc gggcaggaga gcacagacac ggagcgggcc 300
cctggcaagg acactttcta ctcgctgggc tccagcctgg acattacctt ccgctccgac 360
tactccaacg agaagccgtt cacggggttc gaggccttct atgcagccga ggacattgac 420
gagtgccagg tggccccggg agaggcgccc acctgcgacc accactgcca caaccacctg 480
ggcggtttct actgctcctg ccgcgcaggc tacgtcctgc accgtaacaa gcgcacctgc 540
tcagccctgt gctccggcc 559
<210> 31
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 31
cgggcacacc atgaggctgc tgaccctcct gggc 34
<210> 32
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 32
gacattacct tccgctccga ctccaacgag aag 33
<210> 33
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 33
agcagccctg aatacccacg gccgtatccc aaa 33
<210> 34
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 34
cgggatccat gaggctgctg accctc 26
<210> 35
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 35
ggaattccta ggctgcata 19
<210> 36
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 36
ggaattccta cagggcgct 19
<210> 37
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 37
ggaattccta gtagtggat 19
<210> 38
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 38
tgcggccgct gtaggtgctg tcttt 25
<210> 39
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 39
ggaattcact cgttattctc gga 23
<210> 40
<211> 17
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 40
tccgagaata acgagtg 17
<210> 41
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 41
cattgaaagc tttggggtag aagttgttc 29
<210> 42
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 42
cgcggccgca gctgctcaga gtgtaga 27
<210> 43
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 43
cggtaagctt cactggctca gggaaata 28
<210> 44
<211> 37
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 44
aagaagcttg ccgccaccat ggattggctg tggaact 37
<210> 45
<211> 31
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 45
cgggatcctc aaactttctt gtccaccttg g 31
<210> 46
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 46
aagaaagctt gccgccacca tgttctcact agctct 36
<210> 47
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 47
cgggatcctt ctccctctaa cactct 26
<210> 48
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 48
Glu Pro Lys Ser Cys Asp Lys Thr His
1 5
<210> 49
<211> 4960
<212> ДНК
<213> Homo Sapiens
<400> 49
ccggacgtgg tggcgcatgc ctgtaatccc agctactcgg gaggctgagg caggagaatt 60
gctcgaaccc cggaggcaga ggtttggtgg ctcacacctg taatcccagc actttgcgag 120
gctgaggcag gtgcatcgct ttggctcagg agttcaagac cagcctgggc aacacaggga 180
gacccccatc tctacaaaaa acaaaaacaa atataaaggg gataaaaaaa aaaaaaagac 240
aagacatgaa tccatgagga cagagtgtgg aagaggaagc agcagcctca aagttctgga 300
agctggaaga acagataaac aggtgtgaaa taactgcctg gaaagcaact tctttttttt 360
tttttttttt tttgaggtgg agtctcactc tgtcgtccag gctggagtgc agtggtgcga 420
tctcggatca ctgcaacctc cgcctcccag gctcaagcaa ttctcctgcc tcagcctccc 480
gagtagctgg gattataagt gcgcgctgcc acacctggat gatttttgta tttttagtag 540
agatgggatt tcaccatgtt ggtcaggctg gtctcaaact cccaacctcg tgatccaccc 600
accttggcct cccaaagtgc tgggattaca ggtataagcc accgagccca gccaaaagcg 660
acttctaagc ctgcaaggga atcgggaatt ggtggcacca ggtccttctg acagggttta 720
agaaattagc cagcctgagg ctgggcacgg tggctcacac ctgtaatccc agcactttgg 780
gaggctaagg caggtggatc acctgagggc aggagttcaa gaccagcctg accaacatgg 840
agaaacccca tccctaccaa aaataaaaaa ttagccaggt gtggtggtgc tcgcctgtaa 900
tcccagctac ttgggaggct gaggtgggag gattgcttga acacaggaag tagaggctgc 960
agtgagctat gattgcagca ctgcactgaa gccggggcaa cagaacaaga tccaaaaaaa 1020
agggaggggt gaggggcaga gccaggattt gtttccaggc tgttgttacc taggtccgac 1080
tcctggctcc cagagcagcc tgtcctgcct gcctggaact ctgagcaggc tggagtcatg 1140
gagtcgattc ccagaatccc agagtcaggg aggctggggg caggggcagg tcactggaca 1200
aacagatcaa aggtgagacc agcgtagggc tgcagaccag gccaggccag ctggacgggc 1260
acaccatgag gtaggtgggc gcccacagcc tccctgcagg gtgtggggtg ggagcacagg 1320
cctgggccct caccgcccct gccctgccca taggctgctg accctcctgg gccttctgtg 1380
tggctcggtg gccaccccct tgggcccgaa gtggcctgaa cctgtgttcg ggcgcctggc 1440
atcccccggc tttccagggg agtatgccaa tgaccaggag cggcgctgga ccctgactgc 1500
accccccggc taccgcctgc gcctctactt cacccacttc gacctggagc tctcccacct 1560
ctgcgagtac gacttcgtca aggtgccgtc aggacgggag ggctggggtt tctcagggtc 1620
ggggggtccc caaggagtag ccagggttca gggacacctg ggagcagggg ccaggcttgg 1680
ccaggaggga gatcaggcct gggtcttgcc ttcactccct gtgacacctg accccacagc 1740
tgagctcggg ggccaaggtg ctggccacgc tgtgcgggca ggagagcaca gacacggagc 1800
gggcccctgg caaggacact ttctactcgc tgggctccag cctggacatt accttccgct 1860
ccgactactc caacgagaag ccgttcacgg ggttcgaggc cttctatgca gccgagggtg 1920
agccaagagg ggtcctgcaa catctcagtc tgcgcagctg gctgtggggg taactctgtc 1980
ttaggccagg cagccctgcc ttcagtttcc ccacctttcc cagggcaggg gagaggcctc 2040
tggcctgaca tcatccacaa tgcaaagacc aaaacagccg tgacctccat tcacatgggc 2100
tgagtgccaa ctctgagcca gggatctgag gacagcatcg cctcaagtga cgcagggact 2160
ggccgggcgc agcagctcac gcctgtaatt ccagcacttt gggaggccga ggctggctga 2220
tcatttgagg tcaggagttc aaggccagcc agggcaacac ggtgaaactc tatctccact 2280
aaaactacaa aaattagctg ggcgtggtgg tgcgcacctg gaatcccagc tactagggag 2340
gctgaggcag gagaattgct tgaacctgcg aggtggaggc tgcagtgaac agagattgca 2400
ccactacact ccagcctggg cgacagagct agactccgtc tcaaaaaaca aaaaacaaaa 2460
acgacgcagg ggccgagggc cccatttaca gctgacaaag tggggccctg ccagcgggag 2520
cgctgccagg atgtttgatt tcagatccca gtccctgcag agaccaactg tgtgacctct 2580
ggcaagtggc tcaatttctc tgctccttag gaagctgctg caagggttca gcgctgtagc 2640
cccgccccct gggtttgatt gactcccctc attagctggg tgacctcggg ccggacactg 2700
aaactcccac tggtttaaca gaggtgatgt ttgcatcttt ctcccagcgc tgctgggagc 2760
ttgcagcgac cctaggcctg taaggtgatt ggcccggcac cagtcccgca ccctagacag 2820
gacgaggcct cctctgaggt ccactctgag gtcatggatc tcctgggagg agtccaggct 2880
ggatcccgcc tctttccctc ctgacggcct gcctggccct gcctctcccc cagacattga 2940
cgagtgccag gtggccccgg gagaggcgcc cacctgcgac caccactgcc acaaccacct 3000
gggcggtttc tactgctcct gccgcgcagg ctacgtcctg caccgtaaca agcgcacctg 3060
ctcagccctg tgctccggcc aggtcttcac ccagaggtct ggggagctca gcagccctga 3120
atacccacgg ccgtatccca aactctccag ttgcacttac agcatcagcc tggaggaggg 3180
gttcagtgtc attctggact ttgtggagtc cttcgatgtg gagacacacc ctgaaaccct 3240
gtgtccctac gactttctca agattcaaac agacagagaa gaacatggcc cattctgtgg 3300
gaagacattg ccccacagga ttgaaacaaa aagcaacacg gtgaccatca cctttgtcac 3360
agatgaatca ggagaccaca caggctggaa gatccactac acgagcacag cgcacgcttg 3420
cccttatccg atggcgccac ctaatggcca cgtttcacct gtgcaagcca aatacatcct 3480
gaaagacagc ttctccatct tttgcgagac tggctatgag cttctgcaag gtcacttgcc 3540
cctgaaatcc tttactgcag tttgtcagaa agatggatct tgggaccggc caatgcccgc 3600
gtgcagcatt gttgactgtg gccctcctga tgatctaccc agtggccgag tggagtacat 3660
cacaggtcct ggagtgacca cctacaaagc tgtgattcag tacagctgtg aagagacctt 3720
ctacacaatg aaagtgaatg atggtaaata tgtgtgtgag gctgatggat tctggacgag 3780
ctccaaagga gaaaaatcac tcccagtctg tgagcctgtt tgtggactat cagcccgcac 3840
aacaggaggg cgtatatatg gagggcaaaa ggcaaaacct ggtgattttc cttggcaagt 3900
cctgatatta ggtggaacca cagcagcagg tgcactttta tatgacaact gggtcctaac 3960
agctgctcat gccgtctatg agcaaaaaca tgatgcatcc gccctggaca ttcgaatggg 4020
caccctgaaa agactatcac ctcattatac acaagcctgg tctgaagctg tttttataca 4080
tgaaggttat actcatgatg ctggctttga caatgacata gcactgatta aattgaataa 4140
caaagttgta atcaatagca acatcacgcc tatttgtctg ccaagaaaag aagctgaatc 4200
ctttatgagg acagatgaca ttggaactgc atctggatgg ggattaaccc aaaggggttt 4260
tcttgctaga aatctaatgt atgtcgacat accgattgtt gaccatcaaa aatgtactgc 4320
tgcatatgaa aagccaccct atccaagggg aagtgtaact gctaacatgc tttgtgctgg 4380
cttagaaagt gggggcaagg acagctgcag aggtgacagc ggaggggcac tggtgtttct 4440
agatagtgaa acagagaggt ggtttgtggg aggaatagtg tcctggggtt ccatgaattg 4500
tggggaagca ggtcagtatg gagtctacac aaaagttatt aactatattc cctggatcga 4560
gaacataatt agtgattttt aacttgcgtg tctgcagtca aggattcttc atttttagaa 4620
atgcctgtga agaccttggc agcgacgtgg ctcgagaagc attcatcatt actgtggaca 4680
tggcagttgt tgctccaccc aaaaaaacag actccaggtg aggctgctgt catttctcca 4740
cttgccagtt taattccagc cttacccatt gactcaaggg gacataaacc acgagagtga 4800
cagtcatctt tgcccaccca gtgtaatgtc actgctcaaa ttacatttca ttaccttaaa 4860
aagccagtct cttttcatac tggctgttgg catttctgta aactgcctgt ccatgctctt 4920
tgtttttaaa cttgttctta ttgaaaaaaa aaaaaaaaaa 4960
<210> 50
<211> 2090
<212> ДНК
<213> Мышь
<220>
<221> CDS
<222> (33)..(2090)
<400> 50
ggcgctggac tgcagagcta tggtggcaca cc atg agg cta ctc atc ttc ctg 53
Met Arg Leu Leu Ile Phe Leu
1 5
ggt ctg ctg tgg agt ttg gtg gcc aca ctt ctg ggt tca aag tgg cct 101
Gly Leu Leu Trp Ser Leu Val Ala Thr Leu Leu Gly Ser Lys Trp Pro
10 15 20
gaa cct gta ttc ggg cgc ctg gtg tcc cct ggc ttc cca gag aag tat 149
Glu Pro Val Phe Gly Arg Leu Val Ser Pro Gly Phe Pro Glu Lys Tyr
25 30 35
gct gac cat caa gat cga tcc tgg aca ctg act gca ccc cct ggc tac 197
Ala Asp His Gln Asp Arg Ser Trp Thr Leu Thr Ala Pro Pro Gly Tyr
40 45 50 55
cgc ctg cgc ctc tac ttc acc cac ttt gac ctg gaa ctc tct tac cgc 245
Arg Leu Arg Leu Tyr Phe Thr His Phe Asp Leu Glu Leu Ser Tyr Arg
60 65 70
tgc gag tat gac ttt gtc aag ttg agc tca ggg acc aag gtg ctg gcc 293
Cys Glu Tyr Asp Phe Val Lys Leu Ser Ser Gly Thr Lys Val Leu Ala
75 80 85
aca ctg tgt ggg cag gag agt aca gac act gag cag gca cct ggc aat 341
Thr Leu Cys Gly Gln Glu Ser Thr Asp Thr Glu Gln Ala Pro Gly Asn
90 95 100
gac acc ttc tac tca ctg ggt ccc agc cta aag gtc acc ttc cac tcc 389
Asp Thr Phe Tyr Ser Leu Gly Pro Ser Leu Lys Val Thr Phe His Ser
105 110 115
gac tac tcc aat gag aag ccg ttc aca ggg ttt gag gcc ttc tat gca 437
Asp Tyr Ser Asn Glu Lys Pro Phe Thr Gly Phe Glu Ala Phe Tyr Ala
120 125 130 135
gcg gag gat gtg gat gaa tgc aga gtg tct ctg gga gac tca gtc cct 485
Ala Glu Asp Val Asp Glu Cys Arg Val Ser Leu Gly Asp Ser Val Pro
140 145 150
tgt gac cat tat tgc cac aac tac ttg ggc ggc tac tat tgc tcc tgc 533
Cys Asp His Tyr Cys His Asn Tyr Leu Gly Gly Tyr Tyr Cys Ser Cys
155 160 165
aga gcg ggc tac att ctc cac cag aac aag cac acg tgc tca gcc ctt 581
Arg Ala Gly Tyr Ile Leu His Gln Asn Lys His Thr Cys Ser Ala Leu
170 175 180
tgt tca ggc cag gtg ttc aca gga aga tct ggg tat ctc agt agc cct 629
Cys Ser Gly Gln Val Phe Thr Gly Arg Ser Gly Tyr Leu Ser Ser Pro
185 190 195
gag tac ccg cag cca tac ccc aag ctc tcc agc tgc acc tac agc atc 677
Glu Tyr Pro Gln Pro Tyr Pro Lys Leu Ser Ser Cys Thr Tyr Ser Ile
200 205 210 215
cgc ctg gag gac ggc ttc agt gtc atc ctg gac ttc gtg gag tcc ttc 725
Arg Leu Glu Asp Gly Phe Ser Val Ile Leu Asp Phe Val Glu Ser Phe
220 225 230
gat gtg gag acg cac cct gaa gcc cag tgc ccc tat gac tcc ctc aag 773
Asp Val Glu Thr His Pro Glu Ala Gln Cys Pro Tyr Asp Ser Leu Lys
235 240 245
att caa aca gac aag ggg gaa cac ggc cca ttt tgt ggg aag acg ctg 821
Ile Gln Thr Asp Lys Gly Glu His Gly Pro Phe Cys Gly Lys Thr Leu
250 255 260
cct ccc agg att gaa act gac agc cac aag gtg acc atc acc ttt gcc 869
Pro Pro Arg Ile Glu Thr Asp Ser His Lys Val Thr Ile Thr Phe Ala
265 270 275
act gac gag tcg ggg aac cac aca ggc tgg aag ata cac tac aca agc 917
Thr Asp Glu Ser Gly Asn His Thr Gly Trp Lys Ile His Tyr Thr Ser
280 285 290 295
aca gca cgg ccc tgc cct gat cca acg gcg cca cct aat ggc agc att 965
Thr Ala Arg Pro Cys Pro Asp Pro Thr Ala Pro Pro Asn Gly Ser Ile
300 305 310
tca cct gtg caa gcc acg tat gtc ctg aag gac agg ttt tct gtc ttc 1013
Ser Pro Val Gln Ala Thr Tyr Val Leu Lys Asp Arg Phe Ser Val Phe
315 320 325
tgc aag aca ggc ttc gag ctt ctg caa ggt tct gtc ccc ctg aaa tca 1061
Cys Lys Thr Gly Phe Glu Leu Leu Gln Gly Ser Val Pro Leu Lys Ser
330 335 340
ttc act gct gtc tgt cag aaa gat gga tct tgg gac cgg ccg atg cca 1109
Phe Thr Ala Val Cys Gln Lys Asp Gly Ser Trp Asp Arg Pro Met Pro
345 350 355
gag tgc agc att att gat tgt ggc cct ccc gat gac cta ccc aat ggc 1157
Glu Cys Ser Ile Ile Asp Cys Gly Pro Pro Asp Asp Leu Pro Asn Gly
360 365 370 375
cat gtg gac tat atc aca ggc cct caa gtg act acc tac aaa gct gtg 1205
His Val Asp Tyr Ile Thr Gly Pro Gln Val Thr Thr Tyr Lys Ala Val
380 385 390
att cag tac agc tgt gaa gag act ttc tac aca atg agc agc aat ggt 1253
Ile Gln Tyr Ser Cys Glu Glu Thr Phe Tyr Thr Met Ser Ser Asn Gly
395 400 405
aaa tat gtg tgt gag gct gat gga ttc tgg acg agc tcc aaa gga gaa 1301
Lys Tyr Val Cys Glu Ala Asp Gly Phe Trp Thr Ser Ser Lys Gly Glu
410 415 420
aaa ctc ccc ccg gtt tgt gag cct gtt tgt ggg ctg tcc aca cac act 1349
Lys Leu Pro Pro Val Cys Glu Pro Val Cys Gly Leu Ser Thr His Thr
425 430 435
ata gga gga cgc ata gtt gga ggg cag cct gca aag cct ggt gac ttt 1397
Ile Gly Gly Arg Ile Val Gly Gly Gln Pro Ala Lys Pro Gly Asp Phe
440 445 450 455
cct tgg caa gtc ttg ttg ctg ggt caa act aca gca gca gca ggt gca 1445
Pro Trp Gln Val Leu Leu Leu Gly Gln Thr Thr Ala Ala Ala Gly Ala
460 465 470
ctt ata cat gac aat tgg gtc cta aca gcc gct cat gct gta tat gag 1493
Leu Ile His Asp Asn Trp Val Leu Thr Ala Ala His Ala Val Tyr Glu
475 480 485
aaa aga atg gca gcg tcc tcc ctg aac atc cga atg ggc atc ctc aaa 1541
Lys Arg Met Ala Ala Ser Ser Leu Asn Ile Arg Met Gly Ile Leu Lys
490 495 500
agg ctc tca cct cat tac act caa gcc tgg ccc gag gaa atc ttt ata 1589
Arg Leu Ser Pro His Tyr Thr Gln Ala Trp Pro Glu Glu Ile Phe Ile
505 510 515
cat gaa ggc tac act cac ggt gct ggt ttt gac aat gat ata gca ttg 1637
His Glu Gly Tyr Thr His Gly Ala Gly Phe Asp Asn Asp Ile Ala Leu
520 525 530 535
att aaa ctc aag aac aaa gtc aca atc aac gga agc atc atg cct gtt 1685
Ile Lys Leu Lys Asn Lys Val Thr Ile Asn Gly Ser Ile Met Pro Val
540 545 550
tgc cta ccg cga aaa gaa gct gca tcc tta atg aga aca gac ttc act 1733
Cys Leu Pro Arg Lys Glu Ala Ala Ser Leu Met Arg Thr Asp Phe Thr
555 560 565
gga act gtg gct ggc tgg ggg tta acc cag aag ggg ctt ctt gct aga 1781
Gly Thr Val Ala Gly Trp Gly Leu Thr Gln Lys Gly Leu Leu Ala Arg
570 575 580
aac cta atg ttt gtg gac ata cca att gct gac cac caa aaa tgt acc 1829
Asn Leu Met Phe Val Asp Ile Pro Ile Ala Asp His Gln Lys Cys Thr
585 590 595
acc gtg tat gaa aag ctc tat cca gga gta aga gta agc gct aac atg 1877
Thr Val Tyr Glu Lys Leu Tyr Pro Gly Val Arg Val Ser Ala Asn Met
600 605 610 615
ctc tgt gct ggc tta gag act ggt ggc aag gac agc tgc aga ggt gac 1925
Leu Cys Ala Gly Leu Glu Thr Gly Gly Lys Asp Ser Cys Arg Gly Asp
620 625 630
agt ggg ggg gca tta gtg ttt cta gat aat gag aca cag cga tgg ttt 1973
Ser Gly Gly Ala Leu Val Phe Leu Asp Asn Glu Thr Gln Arg Trp Phe
635 640 645
gtg gga gga ata gtt tcc tgg ggt tcc att aat tgt ggg gcg gca ggc 2021
Val Gly Gly Ile Val Ser Trp Gly Ser Ile Asn Cys Gly Ala Ala Gly
650 655 660
cag tat ggg gtc tac aca aaa gtc atc aac tat att ccc tgg aat gag 2069
Gln Tyr Gly Val Tyr Thr Lys Val Ile Asn Tyr Ile Pro Trp Asn Glu
665 670 675
aac ata ata agt aat ttc taa 2090
Asn Ile Ile Ser Asn Phe
680 685
<210> 51
<211> 685
<212> БЕЛОК
<213> Мышь
<400> 51
Met Arg Leu Leu Ile Phe Leu Gly Leu Leu Trp Ser Leu Val Ala Thr
1 5 10 15
Leu Leu Gly Ser Lys Trp Pro Glu Pro Val Phe Gly Arg Leu Val Ser
20 25 30
Pro Gly Phe Pro Glu Lys Tyr Ala Asp His Gln Asp Arg Ser Trp Thr
35 40 45
Leu Thr Ala Pro Pro Gly Tyr Arg Leu Arg Leu Tyr Phe Thr His Phe
50 55 60
Asp Leu Glu Leu Ser Tyr Arg Cys Glu Tyr Asp Phe Val Lys Leu Ser
65 70 75 80
Ser Gly Thr Lys Val Leu Ala Thr Leu Cys Gly Gln Glu Ser Thr Asp
85 90 95
Thr Glu Gln Ala Pro Gly Asn Asp Thr Phe Tyr Ser Leu Gly Pro Ser
100 105 110
Leu Lys Val Thr Phe His Ser Asp Tyr Ser Asn Glu Lys Pro Phe Thr
115 120 125
Gly Phe Glu Ala Phe Tyr Ala Ala Glu Asp Val Asp Glu Cys Arg Val
130 135 140
Ser Leu Gly Asp Ser Val Pro Cys Asp His Tyr Cys His Asn Tyr Leu
145 150 155 160
Gly Gly Tyr Tyr Cys Ser Cys Arg Ala Gly Tyr Ile Leu His Gln Asn
165 170 175
Lys His Thr Cys Ser Ala Leu Cys Ser Gly Gln Val Phe Thr Gly Arg
180 185 190
Ser Gly Tyr Leu Ser Ser Pro Glu Tyr Pro Gln Pro Tyr Pro Lys Leu
195 200 205
Ser Ser Cys Thr Tyr Ser Ile Arg Leu Glu Asp Gly Phe Ser Val Ile
210 215 220
Leu Asp Phe Val Glu Ser Phe Asp Val Glu Thr His Pro Glu Ala Gln
225 230 235 240
Cys Pro Tyr Asp Ser Leu Lys Ile Gln Thr Asp Lys Gly Glu His Gly
245 250 255
Pro Phe Cys Gly Lys Thr Leu Pro Pro Arg Ile Glu Thr Asp Ser His
260 265 270
Lys Val Thr Ile Thr Phe Ala Thr Asp Glu Ser Gly Asn His Thr Gly
275 280 285
Trp Lys Ile His Tyr Thr Ser Thr Ala Arg Pro Cys Pro Asp Pro Thr
290 295 300
Ala Pro Pro Asn Gly Ser Ile Ser Pro Val Gln Ala Thr Tyr Val Leu
305 310 315 320
Lys Asp Arg Phe Ser Val Phe Cys Lys Thr Gly Phe Glu Leu Leu Gln
325 330 335
Gly Ser Val Pro Leu Lys Ser Phe Thr Ala Val Cys Gln Lys Asp Gly
340 345 350
Ser Trp Asp Arg Pro Met Pro Glu Cys Ser Ile Ile Asp Cys Gly Pro
355 360 365
Pro Asp Asp Leu Pro Asn Gly His Val Asp Tyr Ile Thr Gly Pro Gln
370 375 380
Val Thr Thr Tyr Lys Ala Val Ile Gln Tyr Ser Cys Glu Glu Thr Phe
385 390 395 400
Tyr Thr Met Ser Ser Asn Gly Lys Tyr Val Cys Glu Ala Asp Gly Phe
405 410 415
Trp Thr Ser Ser Lys Gly Glu Lys Leu Pro Pro Val Cys Glu Pro Val
420 425 430
Cys Gly Leu Ser Thr His Thr Ile Gly Gly Arg Ile Val Gly Gly Gln
435 440 445
Pro Ala Lys Pro Gly Asp Phe Pro Trp Gln Val Leu Leu Leu Gly Gln
450 455 460
Thr Thr Ala Ala Ala Gly Ala Leu Ile His Asp Asn Trp Val Leu Thr
465 470 475 480
Ala Ala His Ala Val Tyr Glu Lys Arg Met Ala Ala Ser Ser Leu Asn
485 490 495
Ile Arg Met Gly Ile Leu Lys Arg Leu Ser Pro His Tyr Thr Gln Ala
500 505 510
Trp Pro Glu Glu Ile Phe Ile His Glu Gly Tyr Thr His Gly Ala Gly
515 520 525
Phe Asp Asn Asp Ile Ala Leu Ile Lys Leu Lys Asn Lys Val Thr Ile
530 535 540
Asn Gly Ser Ile Met Pro Val Cys Leu Pro Arg Lys Glu Ala Ala Ser
545 550 555 560
Leu Met Arg Thr Asp Phe Thr Gly Thr Val Ala Gly Trp Gly Leu Thr
565 570 575
Gln Lys Gly Leu Leu Ala Arg Asn Leu Met Phe Val Asp Ile Pro Ile
580 585 590
Ala Asp His Gln Lys Cys Thr Thr Val Tyr Glu Lys Leu Tyr Pro Gly
595 600 605
Val Arg Val Ser Ala Asn Met Leu Cys Ala Gly Leu Glu Thr Gly Gly
610 615 620
Lys Asp Ser Cys Arg Gly Asp Ser Gly Gly Ala Leu Val Phe Leu Asp
625 630 635 640
Asn Glu Thr Gln Arg Trp Phe Val Gly Gly Ile Val Ser Trp Gly Ser
645 650 655
Ile Asn Cys Gly Ala Ala Gly Gln Tyr Gly Val Tyr Thr Lys Val Ile
660 665 670
Asn Tyr Ile Pro Trp Asn Glu Asn Ile Ile Ser Asn Phe
675 680 685
<210> 52
<211> 670
<212> БЕЛОК
<213> Мышь
<400> 52
Thr Leu Leu Gly Ser Lys Trp Pro Glu Pro Val Phe Gly Arg Leu Val
1 5 10 15
Ser Pro Gly Phe Pro Glu Lys Tyr Ala Asp His Gln Asp Arg Ser Trp
20 25 30
Thr Leu Thr Ala Pro Pro Gly Tyr Arg Leu Arg Leu Tyr Phe Thr His
35 40 45
Phe Asp Leu Glu Leu Ser Tyr Arg Cys Glu Tyr Asp Phe Val Lys Leu
50 55 60
Ser Ser Gly Thr Lys Val Leu Ala Thr Leu Cys Gly Gln Glu Ser Thr
65 70 75 80
Asp Thr Glu Gln Ala Pro Gly Asn Asp Thr Phe Tyr Ser Leu Gly Pro
85 90 95
Ser Leu Lys Val Thr Phe His Ser Asp Tyr Ser Asn Glu Lys Pro Phe
100 105 110
Thr Gly Phe Glu Ala Phe Tyr Ala Ala Glu Asp Val Asp Glu Cys Arg
115 120 125
Val Ser Leu Gly Asp Ser Val Pro Cys Asp His Tyr Cys His Asn Tyr
130 135 140
Leu Gly Gly Tyr Tyr Cys Ser Cys Arg Ala Gly Tyr Ile Leu His Gln
145 150 155 160
Asn Lys His Thr Cys Ser Ala Leu Cys Ser Gly Gln Val Phe Thr Gly
165 170 175
Arg Ser Gly Tyr Leu Ser Ser Pro Glu Tyr Pro Gln Pro Tyr Pro Lys
180 185 190
Leu Ser Ser Cys Thr Tyr Ser Ile Arg Leu Glu Asp Gly Phe Ser Val
195 200 205
Ile Leu Asp Phe Val Glu Ser Phe Asp Val Glu Thr His Pro Glu Ala
210 215 220
Gln Cys Pro Tyr Asp Ser Leu Lys Ile Gln Thr Asp Lys Gly Glu His
225 230 235 240
Gly Pro Phe Cys Gly Lys Thr Leu Pro Pro Arg Ile Glu Thr Asp Ser
245 250 255
His Lys Val Thr Ile Thr Phe Ala Thr Asp Glu Ser Gly Asn His Thr
260 265 270
Gly Trp Lys Ile His Tyr Thr Ser Thr Ala Arg Pro Cys Pro Asp Pro
275 280 285
Thr Ala Pro Pro Asn Gly Ser Ile Ser Pro Val Gln Ala Thr Tyr Val
290 295 300
Leu Lys Asp Arg Phe Ser Val Phe Cys Lys Thr Gly Phe Glu Leu Leu
305 310 315 320
Gln Gly Ser Val Pro Leu Lys Ser Phe Thr Ala Val Cys Gln Lys Asp
325 330 335
Gly Ser Trp Asp Arg Pro Met Pro Glu Cys Ser Ile Ile Asp Cys Gly
340 345 350
Pro Pro Asp Asp Leu Pro Asn Gly His Val Asp Tyr Ile Thr Gly Pro
355 360 365
Gln Val Thr Thr Tyr Lys Ala Val Ile Gln Tyr Ser Cys Glu Glu Thr
370 375 380
Phe Tyr Thr Met Ser Ser Asn Gly Lys Tyr Val Cys Glu Ala Asp Gly
385 390 395 400
Phe Trp Thr Ser Ser Lys Gly Glu Lys Leu Pro Pro Val Cys Glu Pro
405 410 415
Val Cys Gly Leu Ser Thr His Thr Ile Gly Gly Arg Ile Val Gly Gly
420 425 430
Gln Pro Ala Lys Pro Gly Asp Phe Pro Trp Gln Val Leu Leu Leu Gly
435 440 445
Gln Thr Thr Ala Ala Ala Gly Ala Leu Ile His Asp Asn Trp Val Leu
450 455 460
Thr Ala Ala His Ala Val Tyr Glu Lys Arg Met Ala Ala Ser Ser Leu
465 470 475 480
Asn Ile Arg Met Gly Ile Leu Lys Arg Leu Ser Pro His Tyr Thr Gln
485 490 495
Ala Trp Pro Glu Glu Ile Phe Ile His Glu Gly Tyr Thr His Gly Ala
500 505 510
Gly Phe Asp Asn Asp Ile Ala Leu Ile Lys Leu Lys Asn Lys Val Thr
515 520 525
Ile Asn Gly Ser Ile Met Pro Val Cys Leu Pro Arg Lys Glu Ala Ala
530 535 540
Ser Leu Met Arg Thr Asp Phe Thr Gly Thr Val Ala Gly Trp Gly Leu
545 550 555 560
Thr Gln Lys Gly Leu Leu Ala Arg Asn Leu Met Phe Val Asp Ile Pro
565 570 575
Ile Ala Asp His Gln Lys Cys Thr Thr Val Tyr Glu Lys Leu Tyr Pro
580 585 590
Gly Val Arg Val Ser Ala Asn Met Leu Cys Ala Gly Leu Glu Thr Gly
595 600 605
Gly Lys Asp Ser Cys Arg Gly Asp Ser Gly Gly Ala Leu Val Phe Leu
610 615 620
Asp Asn Glu Thr Gln Arg Trp Phe Val Gly Gly Ile Val Ser Trp Gly
625 630 635 640
Ser Ile Asn Cys Gly Ala Ala Gly Gln Tyr Gly Val Tyr Thr Lys Val
645 650 655
Ile Asn Tyr Ile Pro Trp Asn Glu Asn Ile Ile Ser Asn Phe
660 665 670
<210> 53
<211> 2091
<212> ДНК
<213> Крыса
<220>
<221> CDS
<222> (10)..(2067)
<400> 53
tggcacaca atg agg cta ctg atc gtc ctg ggt ctg ctt tgg agt ttg gtg 51
Met Arg Leu Leu Ile Val Leu Gly Leu Leu Trp Ser Leu Val
1 5 10
gcc aca ctt ttg ggc tcc aag tgg cct gag cct gta ttc ggg cgc ctg 99
Ala Thr Leu Leu Gly Ser Lys Trp Pro Glu Pro Val Phe Gly Arg Leu
15 20 25 30
gtg tcc ctg gcc ttc cca gag aag tat ggc aac cat cag gat cga tcc 147
Val Ser Leu Ala Phe Pro Glu Lys Tyr Gly Asn His Gln Asp Arg Ser
35 40 45
tgg acg ctg act gca ccc cct ggc ttc cgc ctg cgc ctc tac ttc acc 195
Trp Thr Leu Thr Ala Pro Pro Gly Phe Arg Leu Arg Leu Tyr Phe Thr
50 55 60
cac ttc aac ctg gaa ctc tct tac cgc tgc gag tat gac ttt gtc aag 243
His Phe Asn Leu Glu Leu Ser Tyr Arg Cys Glu Tyr Asp Phe Val Lys
65 70 75
ttg acc tca ggg acc aag gtg cta gcc acg ctg tgt ggg cag gag agt 291
Leu Thr Ser Gly Thr Lys Val Leu Ala Thr Leu Cys Gly Gln Glu Ser
80 85 90
aca gat act gag cgg gca cct ggc aat gac acc ttc tac tca ctg ggt 339
Thr Asp Thr Glu Arg Ala Pro Gly Asn Asp Thr Phe Tyr Ser Leu Gly
95 100 105 110
ccc agc cta aag gtc acc ttc cac tcc gac tac tcc aat gag aag cca 387
Pro Ser Leu Lys Val Thr Phe His Ser Asp Tyr Ser Asn Glu Lys Pro
115 120 125
ttc aca gga ttt gag gcc ttc tat gca gcg gag gat gtg gat gaa tgc 435
Phe Thr Gly Phe Glu Ala Phe Tyr Ala Ala Glu Asp Val Asp Glu Cys
130 135 140
aga aca tcc ctg gga gac tca gtc cct tgt gac cat tat tgc cac aac 483
Arg Thr Ser Leu Gly Asp Ser Val Pro Cys Asp His Tyr Cys His Asn
145 150 155
tac ctg ggc ggc tac tac tgc tcc tgc cga gtg ggc tac att ctg cac 531
Tyr Leu Gly Gly Tyr Tyr Cys Ser Cys Arg Val Gly Tyr Ile Leu His
160 165 170
cag aac aag cat acc tgc tca gcc ctt tgt tca ggc cag gtg ttc act 579
Gln Asn Lys His Thr Cys Ser Ala Leu Cys Ser Gly Gln Val Phe Thr
175 180 185 190
ggg agg tct ggc ttt ctc agt agc cct gag tac cca cag cca tac ccc 627
Gly Arg Ser Gly Phe Leu Ser Ser Pro Glu Tyr Pro Gln Pro Tyr Pro
195 200 205
aaa ctc tcc agc tgc gcc tac aac atc cgc ctg gag gaa ggc ttc agt 675
Lys Leu Ser Ser Cys Ala Tyr Asn Ile Arg Leu Glu Glu Gly Phe Ser
210 215 220
atc acc ctg gac ttc gtg gag tcc ttt gat gtg gag atg cac cct gaa 723
Ile Thr Leu Asp Phe Val Glu Ser Phe Asp Val Glu Met His Pro Glu
225 230 235
gcc cag tgc ccc tac gac tcc ctc aag att caa aca gac aag agg gaa 771
Ala Gln Cys Pro Tyr Asp Ser Leu Lys Ile Gln Thr Asp Lys Arg Glu
240 245 250
tac ggc ccg ttt tgt ggg aag acg ctg ccc ccc agg att gaa act gac 819
Tyr Gly Pro Phe Cys Gly Lys Thr Leu Pro Pro Arg Ile Glu Thr Asp
255 260 265 270
agc aac aag gtg acc att acc ttt acc acc gac gag tca ggg aac cac 867
Ser Asn Lys Val Thr Ile Thr Phe Thr Thr Asp Glu Ser Gly Asn His
275 280 285
aca ggc tgg aag ata cac tac aca agc aca gca cag ccc tgc cct gat 915
Thr Gly Trp Lys Ile His Tyr Thr Ser Thr Ala Gln Pro Cys Pro Asp
290 295 300
cca acg gcg cca cct aat ggt cac att tca cct gtg caa gcc acg tat 963
Pro Thr Ala Pro Pro Asn Gly His Ile Ser Pro Val Gln Ala Thr Tyr
305 310 315
gtc ctg aag gac agc ttt tct gtc ttc tgc aag act ggc ttc gag ctt 1011
Val Leu Lys Asp Ser Phe Ser Val Phe Cys Lys Thr Gly Phe Glu Leu
320 325 330
ctg caa ggt tct gtc ccc ctg aag tca ttc act gct gtc tgt cag aaa 1059
Leu Gln Gly Ser Val Pro Leu Lys Ser Phe Thr Ala Val Cys Gln Lys
335 340 345 350
gat gga tct tgg gac cgg ccg ata cca gag tgc agc att att gac tgt 1107
Asp Gly Ser Trp Asp Arg Pro Ile Pro Glu Cys Ser Ile Ile Asp Cys
355 360 365
ggc cct ccc gat gac cta ccc aat ggc cac gtg gac tat atc aca ggc 1155
Gly Pro Pro Asp Asp Leu Pro Asn Gly His Val Asp Tyr Ile Thr Gly
370 375 380
cct gaa gtg acc acc tac aaa gct gtg att cag tac agc tgt gaa gag 1203
Pro Glu Val Thr Thr Tyr Lys Ala Val Ile Gln Tyr Ser Cys Glu Glu
385 390 395
act ttc tac aca atg agc agc aat ggt aaa tat gtg tgt gag gct gat 1251
Thr Phe Tyr Thr Met Ser Ser Asn Gly Lys Tyr Val Cys Glu Ala Asp
400 405 410
gga ttc tgg acg agc tcc aaa gga gaa aaa tcc ctc ccg gtt tgc aag 1299
Gly Phe Trp Thr Ser Ser Lys Gly Glu Lys Ser Leu Pro Val Cys Lys
415 420 425 430
cct gtc tgt gga ctg tcc aca cac act tca gga ggc cgt ata att gga 1347
Pro Val Cys Gly Leu Ser Thr His Thr Ser Gly Gly Arg Ile Ile Gly
435 440 445
gga cag cct gca aag cct ggt gac ttt cct tgg caa gtc ttg tta ctg 1395
Gly Gln Pro Ala Lys Pro Gly Asp Phe Pro Trp Gln Val Leu Leu Leu
450 455 460
ggt gaa act aca gca gca ggt gct ctt ata cat gac gac tgg gtc cta 1443
Gly Glu Thr Thr Ala Ala Gly Ala Leu Ile His Asp Asp Trp Val Leu
465 470 475
aca gcg gct cat gct gta tat ggg aaa aca gag gcg atg tcc tcc ctg 1491
Thr Ala Ala His Ala Val Tyr Gly Lys Thr Glu Ala Met Ser Ser Leu
480 485 490
gac atc cgc atg ggc atc ctc aaa agg ctc tcc ctc att tac act caa 1539
Asp Ile Arg Met Gly Ile Leu Lys Arg Leu Ser Leu Ile Tyr Thr Gln
495 500 505 510
gcc tgg cca gag gct gtc ttt atc cat gaa ggc tac act cac gga gct 1587
Ala Trp Pro Glu Ala Val Phe Ile His Glu Gly Tyr Thr His Gly Ala
515 520 525
ggt ttt gac aat gat ata gca ctg att aaa ctc aag aac aaa gtc aca 1635
Gly Phe Asp Asn Asp Ile Ala Leu Ile Lys Leu Lys Asn Lys Val Thr
530 535 540
atc aac aga aac atc atg ccg att tgt cta cca aga aaa gaa gct gca 1683
Ile Asn Arg Asn Ile Met Pro Ile Cys Leu Pro Arg Lys Glu Ala Ala
545 550 555
tcc tta atg aaa aca gac ttc gtt gga act gtg gct ggc tgg ggg tta 1731
Ser Leu Met Lys Thr Asp Phe Val Gly Thr Val Ala Gly Trp Gly Leu
560 565 570
acc cag aag ggg ttt ctt gct aga aac cta atg ttt gtg gac ata cca 1779
Thr Gln Lys Gly Phe Leu Ala Arg Asn Leu Met Phe Val Asp Ile Pro
575 580 585 590
att gtt gac cac caa aaa tgt gct act gcg tat aca aag cag ccc tac 1827
Ile Val Asp His Gln Lys Cys Ala Thr Ala Tyr Thr Lys Gln Pro Tyr
595 600 605
cca gga gca aaa gtg act gtt aac atg ctc tgt gct ggc cta gac cgc 1875
Pro Gly Ala Lys Val Thr Val Asn Met Leu Cys Ala Gly Leu Asp Arg
610 615 620
ggt ggc aag gac agc tgc aga ggt gac agc gga ggg gca tta gtg ttt 1923
Gly Gly Lys Asp Ser Cys Arg Gly Asp Ser Gly Gly Ala Leu Val Phe
625 630 635
cta gac aat gaa aca cag aga tgg ttt gtg gga gga ata gtt tcc tgg 1971
Leu Asp Asn Glu Thr Gln Arg Trp Phe Val Gly Gly Ile Val Ser Trp
640 645 650
ggt tct att aac tgt ggg ggg tca gaa cag tat ggg gtc tac acg aaa 2019
Gly Ser Ile Asn Cys Gly Gly Ser Glu Gln Tyr Gly Val Tyr Thr Lys
655 660 665 670
gtc acg aac tat att ccc tgg att gag aac ata ata aat aat ttc taa 2067
Val Thr Asn Tyr Ile Pro Trp Ile Glu Asn Ile Ile Asn Asn Phe
675 680 685
tttgcaaaaa aaaaaaaaaa aaaa 2091
<210> 54
<211> 685
<212> БЕЛОК
<213> Крыса
<400> 54
Met Arg Leu Leu Ile Val Leu Gly Leu Leu Trp Ser Leu Val Ala Thr
1 5 10 15
Leu Leu Gly Ser Lys Trp Pro Glu Pro Val Phe Gly Arg Leu Val Ser
20 25 30
Leu Ala Phe Pro Glu Lys Tyr Gly Asn His Gln Asp Arg Ser Trp Thr
35 40 45
Leu Thr Ala Pro Pro Gly Phe Arg Leu Arg Leu Tyr Phe Thr His Phe
50 55 60
Asn Leu Glu Leu Ser Tyr Arg Cys Glu Tyr Asp Phe Val Lys Leu Thr
65 70 75 80
Ser Gly Thr Lys Val Leu Ala Thr Leu Cys Gly Gln Glu Ser Thr Asp
85 90 95
Thr Glu Arg Ala Pro Gly Asn Asp Thr Phe Tyr Ser Leu Gly Pro Ser
100 105 110
Leu Lys Val Thr Phe His Ser Asp Tyr Ser Asn Glu Lys Pro Phe Thr
115 120 125
Gly Phe Glu Ala Phe Tyr Ala Ala Glu Asp Val Asp Glu Cys Arg Thr
130 135 140
Ser Leu Gly Asp Ser Val Pro Cys Asp His Tyr Cys His Asn Tyr Leu
145 150 155 160
Gly Gly Tyr Tyr Cys Ser Cys Arg Val Gly Tyr Ile Leu His Gln Asn
165 170 175
Lys His Thr Cys Ser Ala Leu Cys Ser Gly Gln Val Phe Thr Gly Arg
180 185 190
Ser Gly Phe Leu Ser Ser Pro Glu Tyr Pro Gln Pro Tyr Pro Lys Leu
195 200 205
Ser Ser Cys Ala Tyr Asn Ile Arg Leu Glu Glu Gly Phe Ser Ile Thr
210 215 220
Leu Asp Phe Val Glu Ser Phe Asp Val Glu Met His Pro Glu Ala Gln
225 230 235 240
Cys Pro Tyr Asp Ser Leu Lys Ile Gln Thr Asp Lys Arg Glu Tyr Gly
245 250 255
Pro Phe Cys Gly Lys Thr Leu Pro Pro Arg Ile Glu Thr Asp Ser Asn
260 265 270
Lys Val Thr Ile Thr Phe Thr Thr Asp Glu Ser Gly Asn His Thr Gly
275 280 285
Trp Lys Ile His Tyr Thr Ser Thr Ala Gln Pro Cys Pro Asp Pro Thr
290 295 300
Ala Pro Pro Asn Gly His Ile Ser Pro Val Gln Ala Thr Tyr Val Leu
305 310 315 320
Lys Asp Ser Phe Ser Val Phe Cys Lys Thr Gly Phe Glu Leu Leu Gln
325 330 335
Gly Ser Val Pro Leu Lys Ser Phe Thr Ala Val Cys Gln Lys Asp Gly
340 345 350
Ser Trp Asp Arg Pro Ile Pro Glu Cys Ser Ile Ile Asp Cys Gly Pro
355 360 365
Pro Asp Asp Leu Pro Asn Gly His Val Asp Tyr Ile Thr Gly Pro Glu
370 375 380
Val Thr Thr Tyr Lys Ala Val Ile Gln Tyr Ser Cys Glu Glu Thr Phe
385 390 395 400
Tyr Thr Met Ser Ser Asn Gly Lys Tyr Val Cys Glu Ala Asp Gly Phe
405 410 415
Trp Thr Ser Ser Lys Gly Glu Lys Ser Leu Pro Val Cys Lys Pro Val
420 425 430
Cys Gly Leu Ser Thr His Thr Ser Gly Gly Arg Ile Ile Gly Gly Gln
435 440 445
Pro Ala Lys Pro Gly Asp Phe Pro Trp Gln Val Leu Leu Leu Gly Glu
450 455 460
Thr Thr Ala Ala Gly Ala Leu Ile His Asp Asp Trp Val Leu Thr Ala
465 470 475 480
Ala His Ala Val Tyr Gly Lys Thr Glu Ala Met Ser Ser Leu Asp Ile
485 490 495
Arg Met Gly Ile Leu Lys Arg Leu Ser Leu Ile Tyr Thr Gln Ala Trp
500 505 510
Pro Glu Ala Val Phe Ile His Glu Gly Tyr Thr His Gly Ala Gly Phe
515 520 525
Asp Asn Asp Ile Ala Leu Ile Lys Leu Lys Asn Lys Val Thr Ile Asn
530 535 540
Arg Asn Ile Met Pro Ile Cys Leu Pro Arg Lys Glu Ala Ala Ser Leu
545 550 555 560
Met Lys Thr Asp Phe Val Gly Thr Val Ala Gly Trp Gly Leu Thr Gln
565 570 575
Lys Gly Phe Leu Ala Arg Asn Leu Met Phe Val Asp Ile Pro Ile Val
580 585 590
Asp His Gln Lys Cys Ala Thr Ala Tyr Thr Lys Gln Pro Tyr Pro Gly
595 600 605
Ala Lys Val Thr Val Asn Met Leu Cys Ala Gly Leu Asp Arg Gly Gly
610 615 620
Lys Asp Ser Cys Arg Gly Asp Ser Gly Gly Ala Leu Val Phe Leu Asp
625 630 635 640
Asn Glu Thr Gln Arg Trp Phe Val Gly Gly Ile Val Ser Trp Gly Ser
645 650 655
Ile Asn Cys Gly Gly Ser Glu Gln Tyr Gly Val Tyr Thr Lys Val Thr
660 665 670
Asn Tyr Ile Pro Trp Ile Glu Asn Ile Ile Asn Asn Phe
675 680 685
<210> 55
<211> 670
<212> БЕЛОК
<213> Крыса
<400> 55
Thr Leu Leu Gly Ser Lys Trp Pro Glu Pro Val Phe Gly Arg Leu Val
1 5 10 15
Ser Leu Ala Phe Pro Glu Lys Tyr Gly Asn His Gln Asp Arg Ser Trp
20 25 30
Thr Leu Thr Ala Pro Pro Gly Phe Arg Leu Arg Leu Tyr Phe Thr His
35 40 45
Phe Asn Leu Glu Leu Ser Tyr Arg Cys Glu Tyr Asp Phe Val Lys Leu
50 55 60
Thr Ser Gly Thr Lys Val Leu Ala Thr Leu Cys Gly Gln Glu Ser Thr
65 70 75 80
Asp Thr Glu Arg Ala Pro Gly Asn Asp Thr Phe Tyr Ser Leu Gly Pro
85 90 95
Ser Leu Lys Val Thr Phe His Ser Asp Tyr Ser Asn Glu Lys Pro Phe
100 105 110
Thr Gly Phe Glu Ala Phe Tyr Ala Ala Glu Asp Val Asp Glu Cys Arg
115 120 125
Thr Ser Leu Gly Asp Ser Val Pro Cys Asp His Tyr Cys His Asn Tyr
130 135 140
Leu Gly Gly Tyr Tyr Cys Ser Cys Arg Val Gly Tyr Ile Leu His Gln
145 150 155 160
Asn Lys His Thr Cys Ser Ala Leu Cys Ser Gly Gln Val Phe Thr Gly
165 170 175
Arg Ser Gly Phe Leu Ser Ser Pro Glu Tyr Pro Gln Pro Tyr Pro Lys
180 185 190
Leu Ser Ser Cys Ala Tyr Asn Ile Arg Leu Glu Glu Gly Phe Ser Ile
195 200 205
Thr Leu Asp Phe Val Glu Ser Phe Asp Val Glu Met His Pro Glu Ala
210 215 220
Gln Cys Pro Tyr Asp Ser Leu Lys Ile Gln Thr Asp Lys Arg Glu Tyr
225 230 235 240
Gly Pro Phe Cys Gly Lys Thr Leu Pro Pro Arg Ile Glu Thr Asp Ser
245 250 255
Asn Lys Val Thr Ile Thr Phe Thr Thr Asp Glu Ser Gly Asn His Thr
260 265 270
Gly Trp Lys Ile His Tyr Thr Ser Thr Ala Gln Pro Cys Pro Asp Pro
275 280 285
Thr Ala Pro Pro Asn Gly His Ile Ser Pro Val Gln Ala Thr Tyr Val
290 295 300
Leu Lys Asp Ser Phe Ser Val Phe Cys Lys Thr Gly Phe Glu Leu Leu
305 310 315 320
Gln Gly Ser Val Pro Leu Lys Ser Phe Thr Ala Val Cys Gln Lys Asp
325 330 335
Gly Ser Trp Asp Arg Pro Ile Pro Glu Cys Ser Ile Ile Asp Cys Gly
340 345 350
Pro Pro Asp Asp Leu Pro Asn Gly His Val Asp Tyr Ile Thr Gly Pro
355 360 365
Glu Val Thr Thr Tyr Lys Ala Val Ile Gln Tyr Ser Cys Glu Glu Thr
370 375 380
Phe Tyr Thr Met Ser Ser Asn Gly Lys Tyr Val Cys Glu Ala Asp Gly
385 390 395 400
Phe Trp Thr Ser Ser Lys Gly Glu Lys Ser Leu Pro Val Cys Lys Pro
405 410 415
Val Cys Gly Leu Ser Thr His Thr Ser Gly Gly Arg Ile Ile Gly Gly
420 425 430
Gln Pro Ala Lys Pro Gly Asp Phe Pro Trp Gln Val Leu Leu Leu Gly
435 440 445
Glu Thr Thr Ala Ala Gly Ala Leu Ile His Asp Asp Trp Val Leu Thr
450 455 460
Ala Ala His Ala Val Tyr Gly Lys Thr Glu Ala Met Ser Ser Leu Asp
465 470 475 480
Ile Arg Met Gly Ile Leu Lys Arg Leu Ser Leu Ile Tyr Thr Gln Ala
485 490 495
Trp Pro Glu Ala Val Phe Ile His Glu Gly Tyr Thr His Gly Ala Gly
500 505 510
Phe Asp Asn Asp Ile Ala Leu Ile Lys Leu Lys Asn Lys Val Thr Ile
515 520 525
Asn Arg Asn Ile Met Pro Ile Cys Leu Pro Arg Lys Glu Ala Ala Ser
530 535 540
Leu Met Lys Thr Asp Phe Val Gly Thr Val Ala Gly Trp Gly Leu Thr
545 550 555 560
Gln Lys Gly Phe Leu Ala Arg Asn Leu Met Phe Val Asp Ile Pro Ile
565 570 575
Val Asp His Gln Lys Cys Ala Thr Ala Tyr Thr Lys Gln Pro Tyr Pro
580 585 590
Gly Ala Lys Val Thr Val Asn Met Leu Cys Ala Gly Leu Asp Arg Gly
595 600 605
Gly Lys Asp Ser Cys Arg Gly Asp Ser Gly Gly Ala Leu Val Phe Leu
610 615 620
Asp Asn Glu Thr Gln Arg Trp Phe Val Gly Gly Ile Val Ser Trp Gly
625 630 635 640
Ser Ile Asn Cys Gly Gly Ser Glu Gln Tyr Gly Val Tyr Thr Lys Val
645 650 655
Thr Asn Tyr Ile Pro Trp Ile Glu Asn Ile Ile Asn Asn Phe
660 665 670
<210> 56
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Homo Sapiens
<400> 56
atgaggctgc tgaccctcct gggccttc 28
<210> 57
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Homo Sapiens
<400> 57
gtgcccctcc tgcgtcacct ctg 23
<210> 58
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Homo Sapiens
<400> 58
cagaggtgac gcaggagggg cac 23
<210> 59
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Homo Sapiens
<400> 59
ttaaaatcac taattatgtt ctcgatc 27
<210> 60
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Мышь
<400> 60
atgaggctac tcatcttcct gg 22
<210> 61
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Мышь
<400> 61
ctgcagaggt gacgcagggg ggg 23
<210> 62
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Мышь
<400> 62
ccccccctgc gtcacctctg cag 23
<210> 63
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Мышь
<400> 63
ttagaaatta cttattatgt tctcaatcc 29
<210> 64
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Крыса
<400> 64
gaggtgacgc aggaggggca ttagtgttt 29
<210> 65
<211> 37
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Крыса
<400> 65
ctagaaacac taatgcccct cctgcgtcac ctctgca 37
<210> 66
<211> 354
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 66
caggtcacct tgaaggagtc tggtcctgtg ctggtgaaac ccacagagac cctcacgctg 60
acctgcaccg tctctgggtt ctcactcagc aggggtaaaa tgggtgtgag ctggatccgt 120
cagcccccag ggaaggccct ggagtggctt gcacacattt tttcgagtga cgaaaaatcc 180
tacaggacat cgctgaagag caggctcacc atctccaagg acacctccaa aaaccaggtg 240
gtccttacaa tgaccaacat ggaccctgtg gacacagcca cgtattactg tgcacggata 300
cgacgtggag gaattgacta ctggggccag ggaaccctgg tcactgtctc ctca 354
<210> 67
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 67
Gln Val Thr Leu Lys Glu Ser Gly Pro Val Leu Val Lys Pro Thr Glu
1 5 10 15
Thr Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Arg Gly
20 25 30
Lys Met Gly Val Ser Trp Ile Arg Gln Pro Pro Gly Lys Ala Leu Glu
35 40 45
Trp Leu Ala His Ile Phe Ser Ser Asp Glu Lys Ser Tyr Arg Thr Ser
50 55 60
Leu Lys Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Arg Ile Arg Arg Gly Gly Ile Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 68
<211> 121
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 68
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Thr
20 25 30
Ser Ala Ala Trp Asn Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly Arg Thr Tyr Tyr Arg Ser Lys Trp Tyr Asn Asp Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Asp Pro Phe Gly Val Pro Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 69
<211> 318
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<220>
<221> дополнительный признак
<222> (246)..(246)
<223> n is a, c, g, or t
<400> 69
cagccagtgc tgactcagcc cccctcactg tccgtgtccc caggacagac agccagcatc 60
acctgctctg gagagaaatt gggggataaa tatgcttact ggtatcagca gaagccaggc 120
cagtcccctg tgttggtcat gtatcaagat aaacagcggc cctcagggat ccctgagcga 180
ttctctggct ccaactctgg gaacacagcc actctgacca tcagcgggac ccaggctatg 240
gatgangctg actattactg tcaggcgtgg gacagcagca ctgcggtatt cggcggaggg 300
accaagctga ccgtccta 318
<210> 70
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 70
Gln Pro Val Leu Thr Gln Pro Pro Ser Leu Ser Val Ser Pro Gly Gln
1 5 10 15
Thr Ala Ser Ile Thr Cys Ser Gly Glu Lys Leu Gly Asp Lys Tyr Ala
20 25 30
Tyr Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Val Leu Val Met Tyr
35 40 45
Gln Asp Lys Gln Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Gly Thr Gln Ala Met
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Ala Trp Asp Ser Ser Thr Ala Val
85 90 95
Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 71
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая
<400> 71
Ser Tyr Glu Leu Ile Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Thr Ile Thr Cys Ala Gly Asp Asn Leu Gly Lys Lys Arg Val
20 25 30
His Trp Tyr Gln Gln Arg Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Asp Asp Ser Asp Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser Ala Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Thr Arg Gly Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Ile Ala Thr Asp His
85 90 95
Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Ala Ala Ala Gly
100 105 110
Ser Glu Gln Lys Leu Ile Ser Glu
115 120
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ЛЕЧЕНИЯ СОСТОЯНИЙ, АССОЦИИРОВАННЫХ С MASP-2-ЗАВИСИМОЙ АКТИВАЦИЕЙ КОМПЛЕМЕНТА | 2014 |
|
RU2830289C2 |
| СПОСОБЫ ЛЕЧЕНИЯ СОСТОЯНИЙ, СВЯЗАННЫХ С MASP-2 ЗАВИСИМОЙ АКТИВАЦИЕЙ КОМПЛЕМЕНТА | 2012 |
|
RU2743409C2 |
| КОМПОЗИЦИИ ДЛЯ ИНГИБИРОВАНИЯ MASP-2-ЗАВИСИМОЙ АКТИВАЦИИ КОМПЛЕМЕНТА | 2017 |
|
RU2725958C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРЕДНАЗНАЧЕННАЯ ДЛЯ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРЕДУПРЕЖДЕНИЯ СВЯЗАННОГО С C5 ЗАБОЛЕВАНИЯ, И СПОСОБ ЛЕЧЕНИЯ ИЛИ ПРЕДУПРЕЖДЕНИЯ СВЯЗАННОГО С C5 ЗАБОЛЕВАНИЯ | 2019 |
|
RU2832946C2 |
| АНТИТЕЛА К С5 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2789788C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРЕДНАЗНАЧЕННАЯ ДЛЯ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРЕДУПРЕЖДЕНИЯ СВЯЗАННОГО С С5 ЗАБОЛЕВАНИЯ, И СПОСОБ ЛЕЧЕНИЯ ИЛИ ПРЕДУПРЕЖДЕНИЯ СВЯЗАННОГО С С5 ЗАБОЛЕВАНИЯ | 2019 |
|
RU2789389C2 |
| АНТИ-C5 АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2774716C2 |
| АНТИТЕЛА К С5 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2746356C2 |
| ДОЗИРОВКА И СХЕМА ВВЕДЕНИЯ ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРЕДУПРЕЖДЕНИЯ СВЯЗАННЫХ С С5 ЗАБОЛЕВАНИЙ ПОСРЕДСТВОМ ПРИМЕНЕНИЯ АНТИТЕЛА ПРОТИВ С5 КРОВАЛИМАБА | 2020 |
|
RU2832188C2 |
| МОНОВАЛЕНТНЫЕ АНТИТЕЛА К ПРОПЕРДИНУ И ФРАГМЕНТЫ АНТИТЕЛ | 2018 |
|
RU2790103C2 |
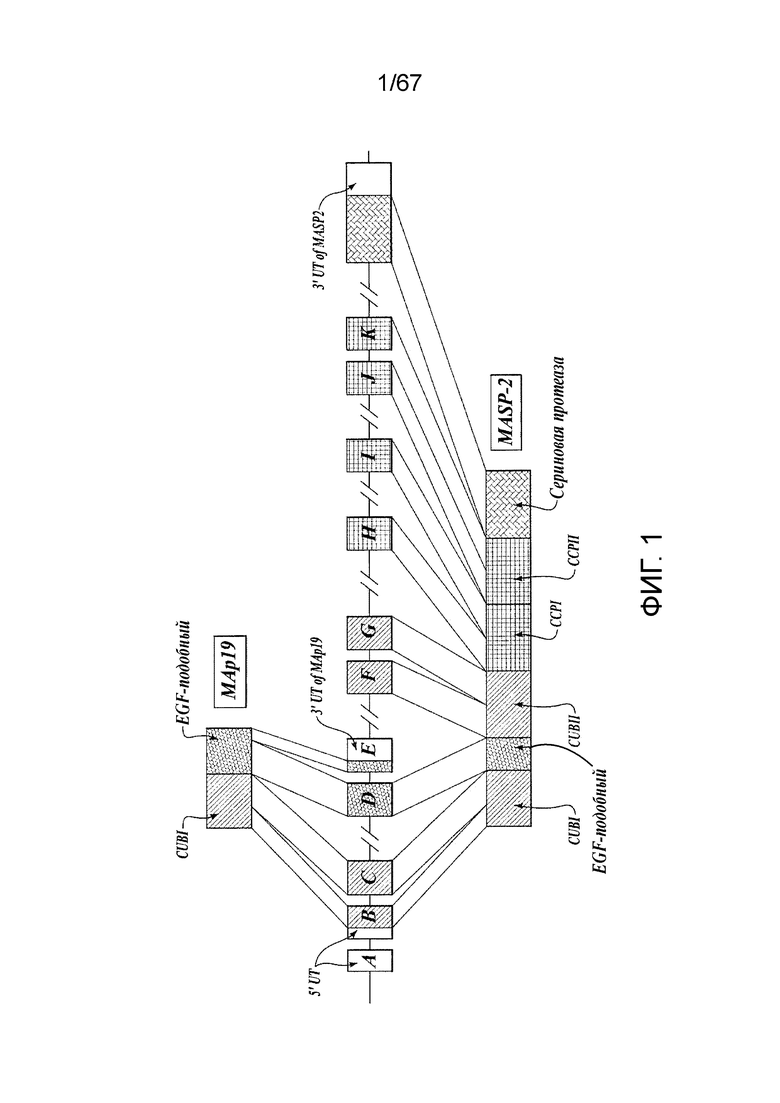
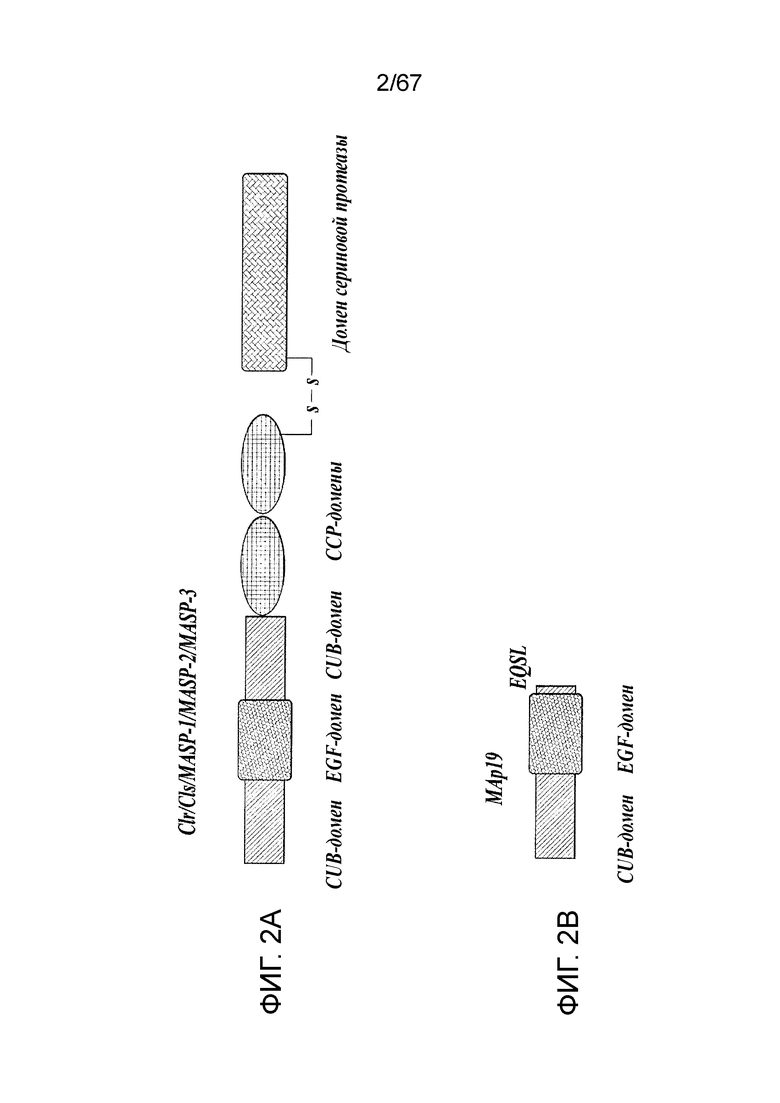
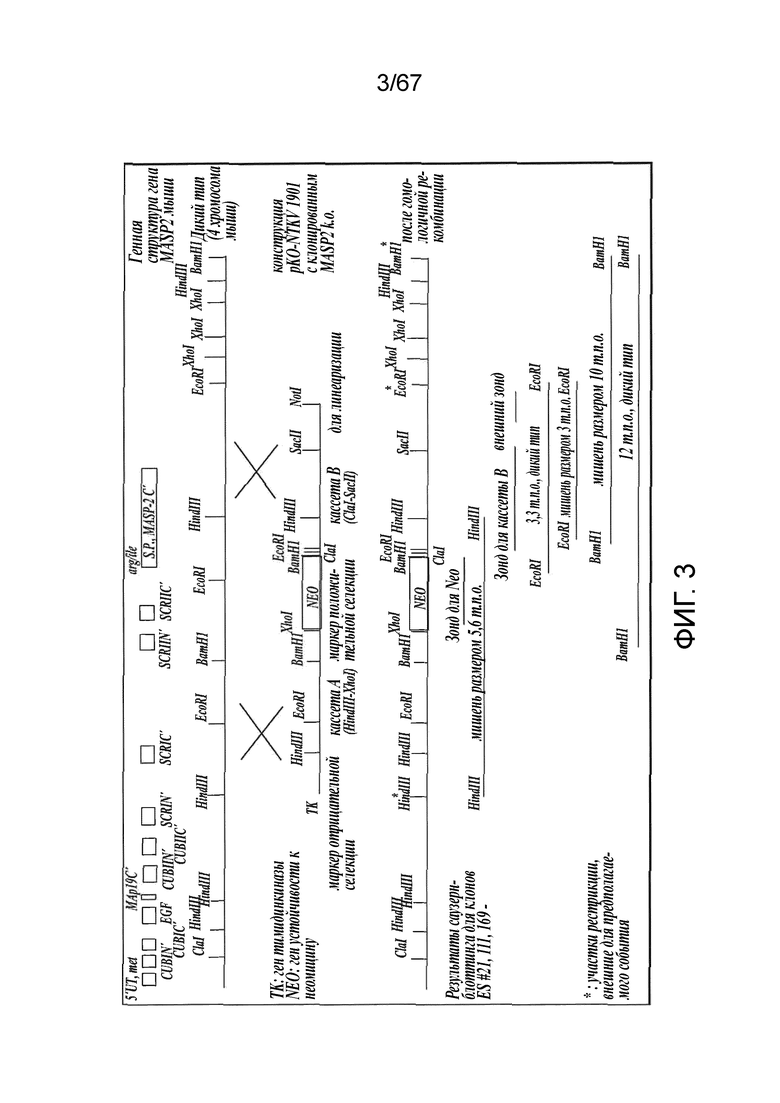
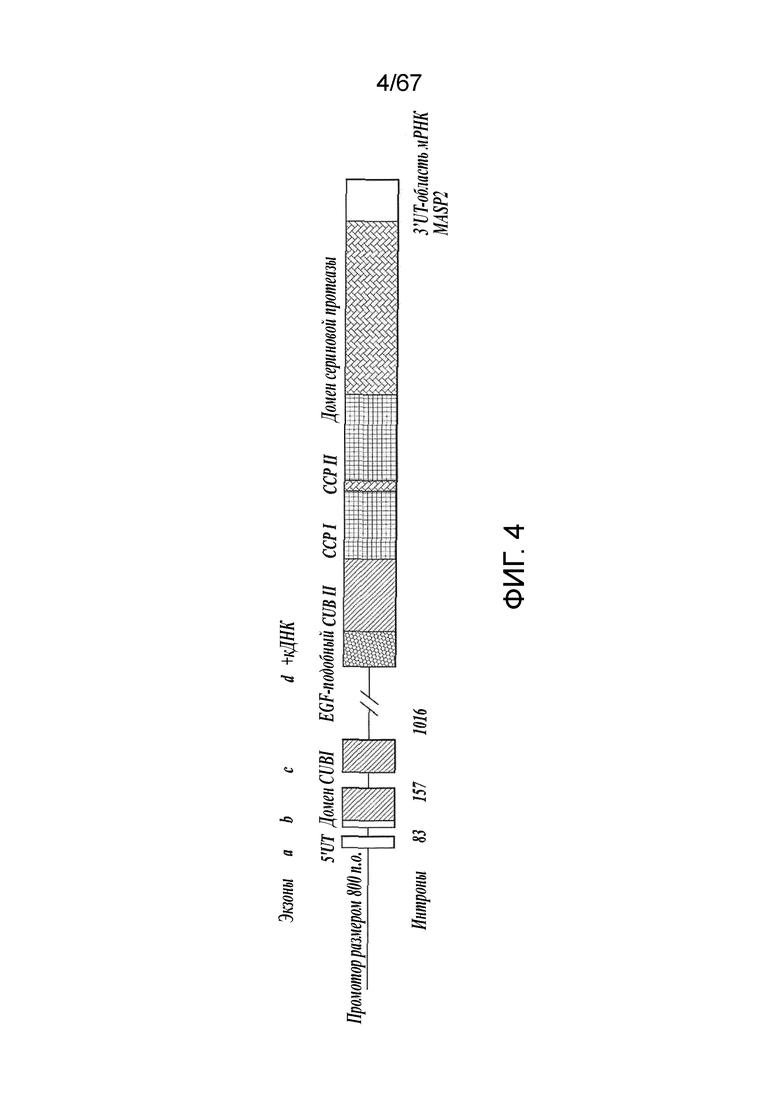
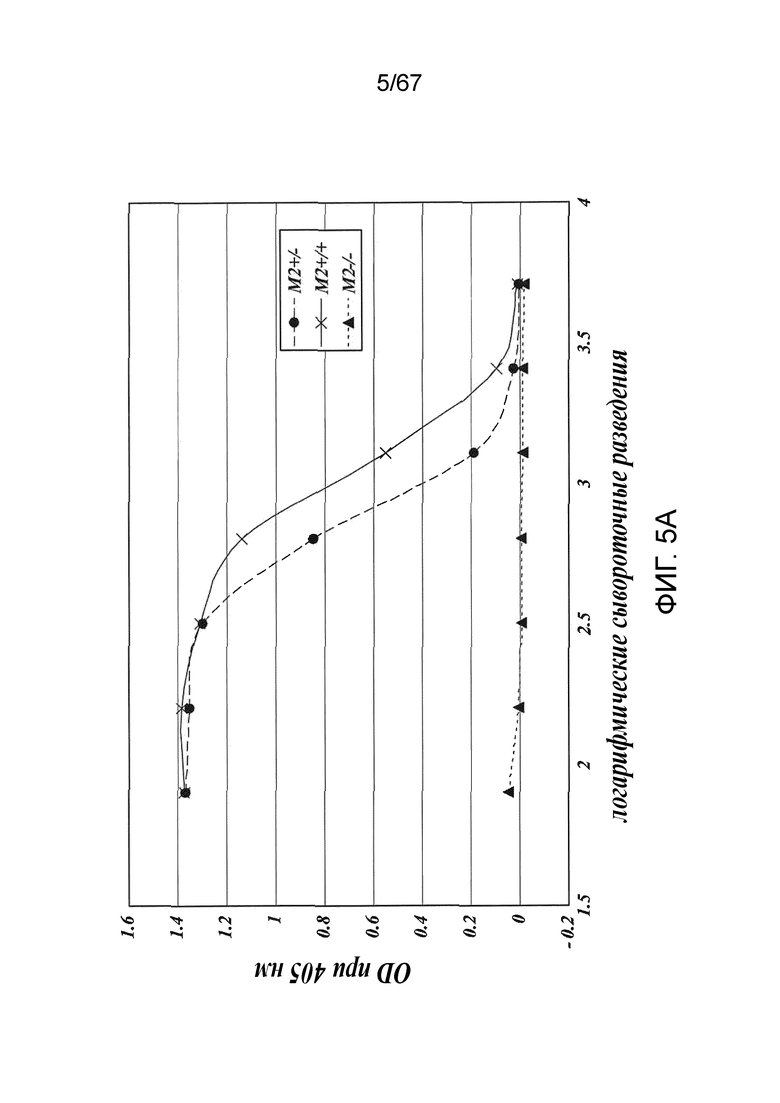
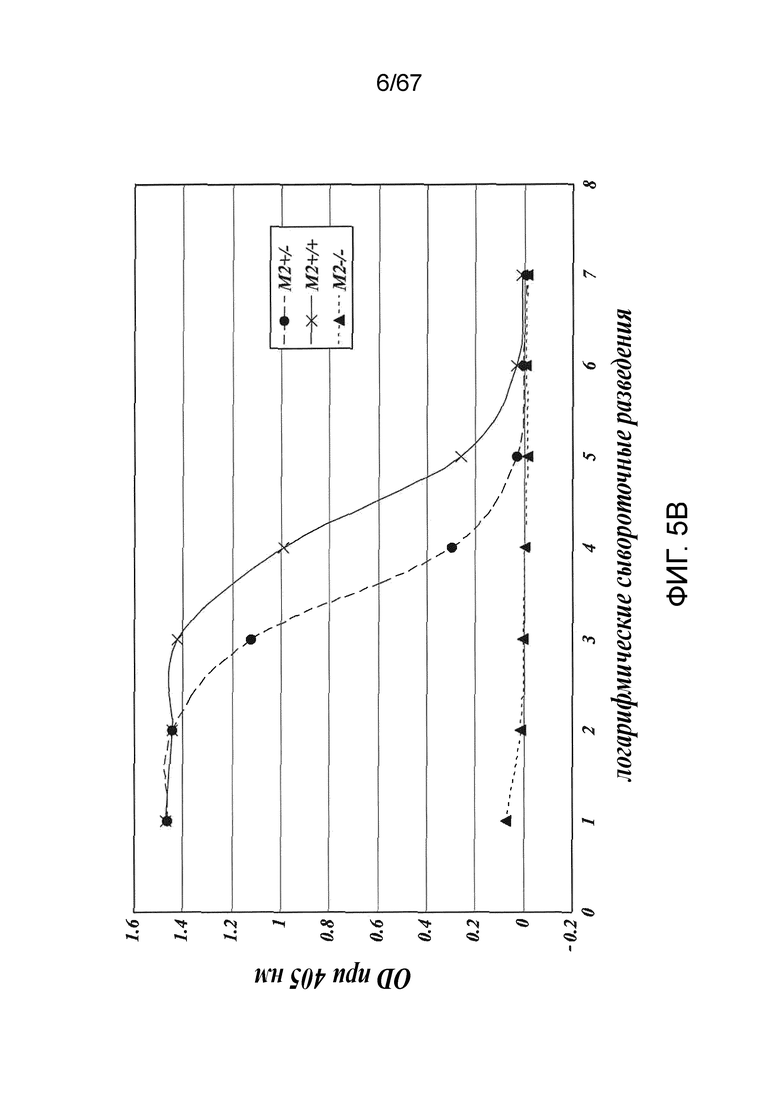
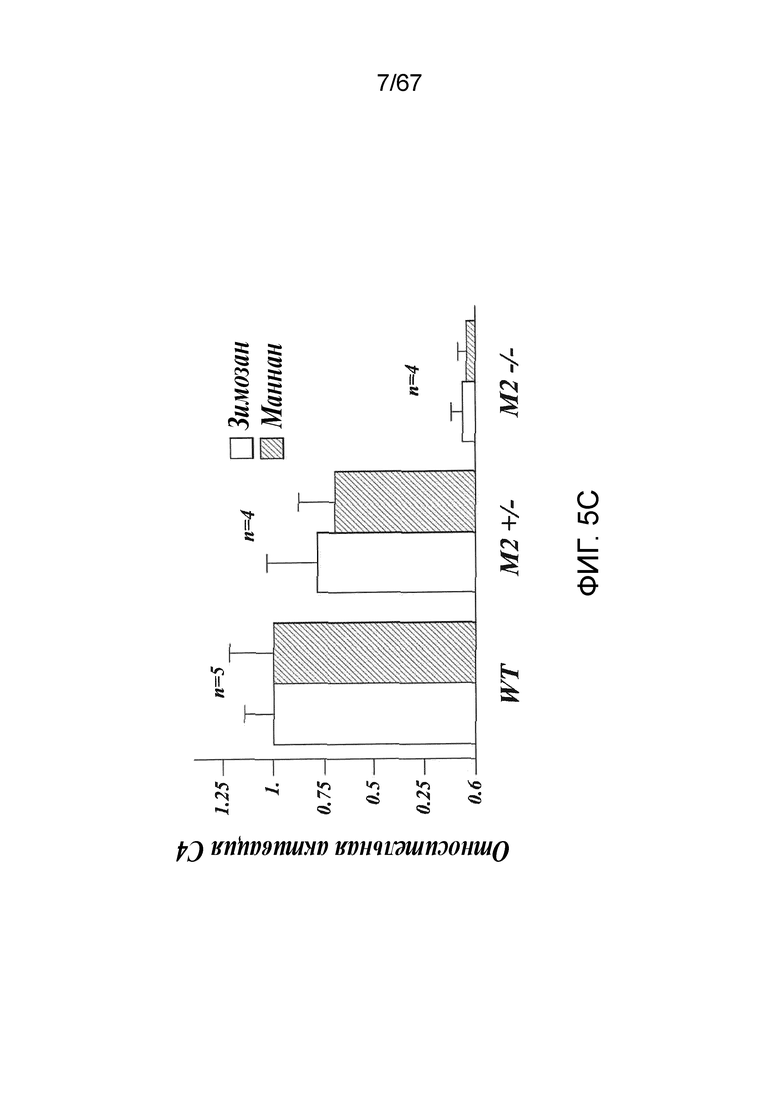
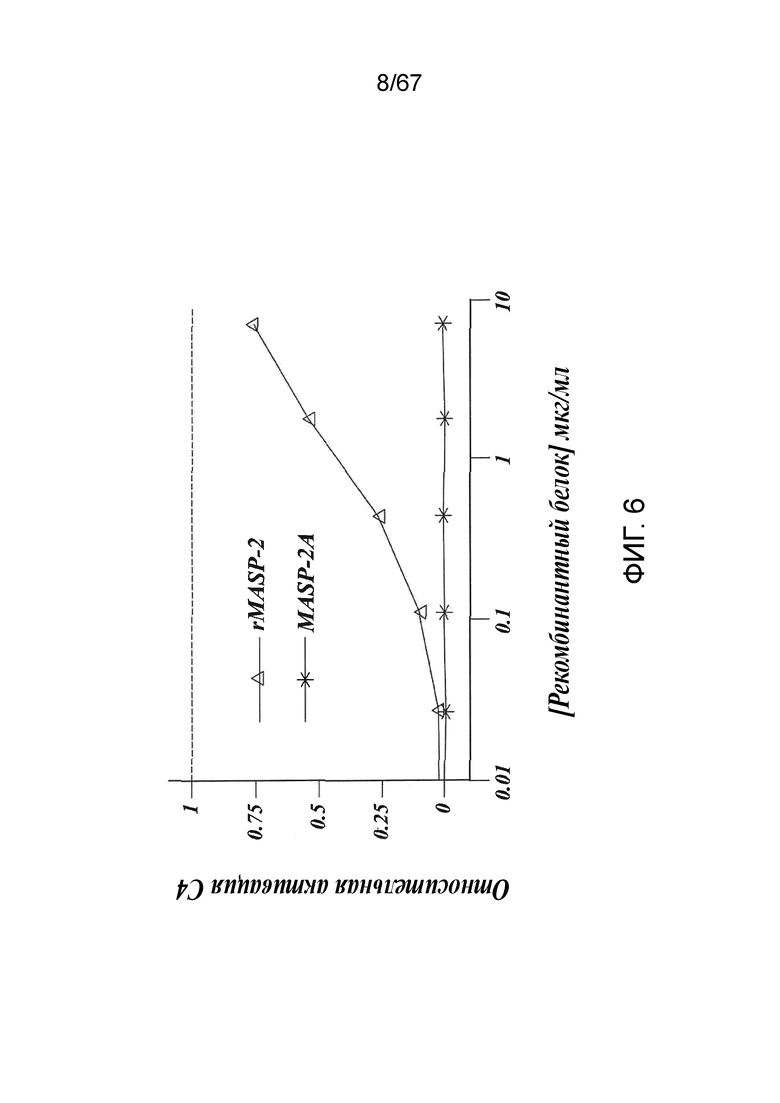
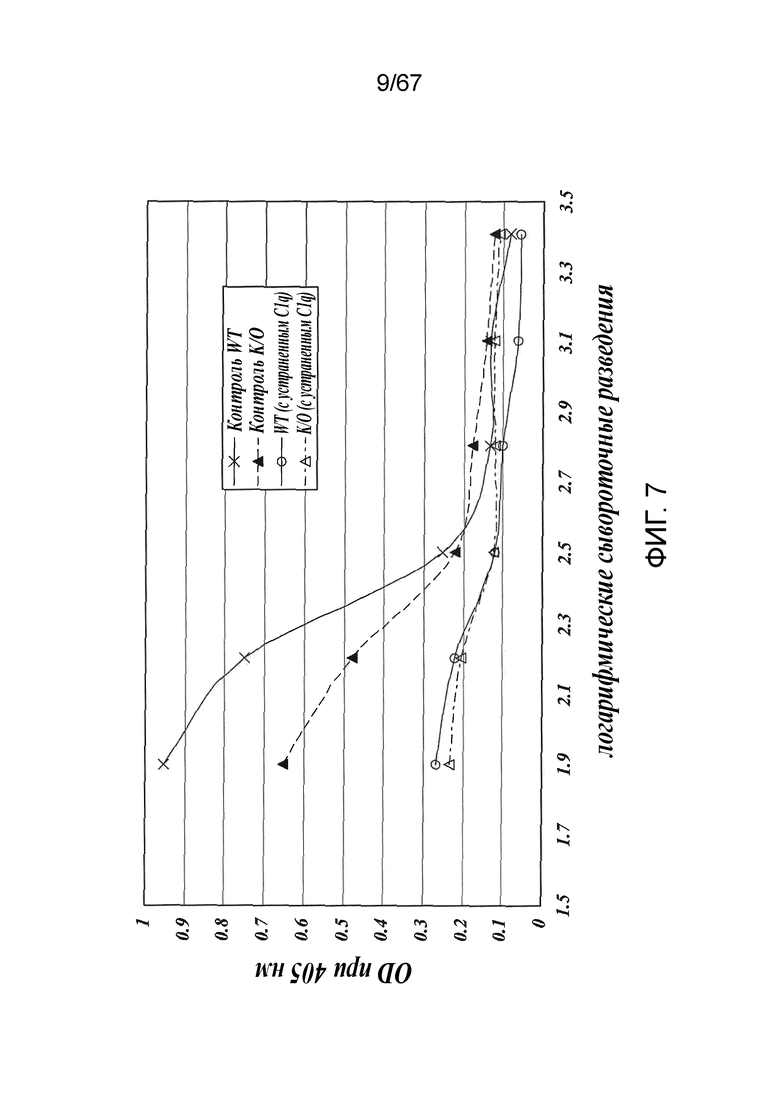
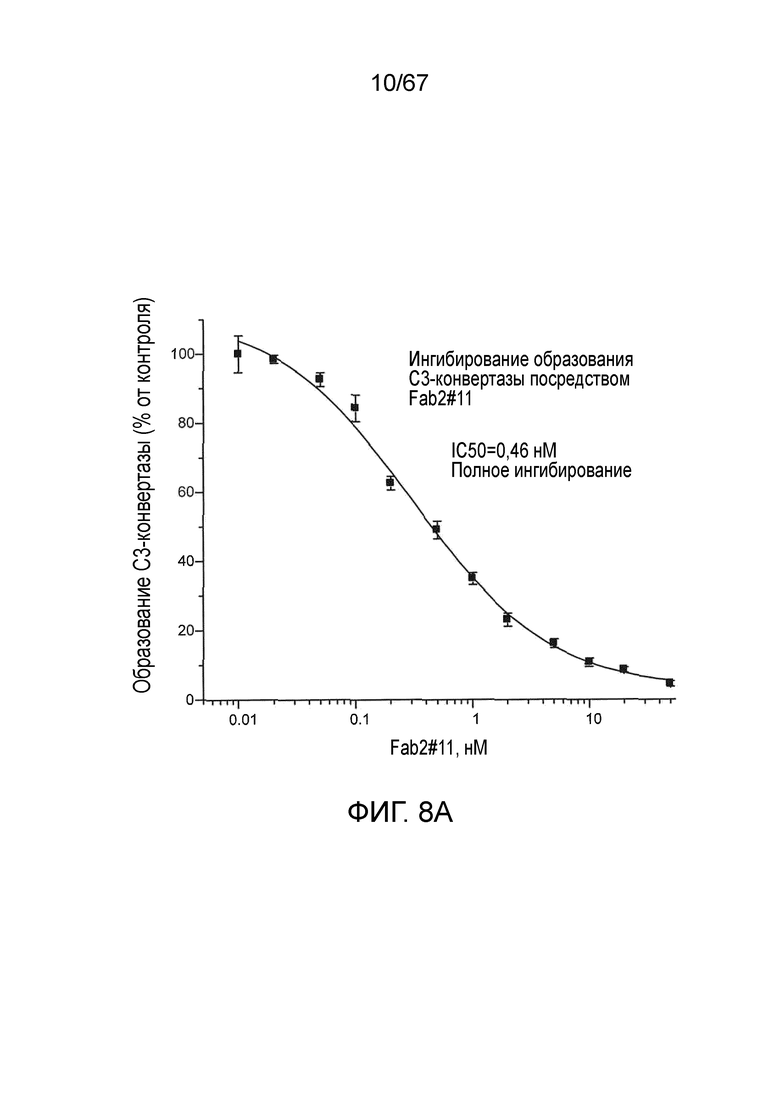
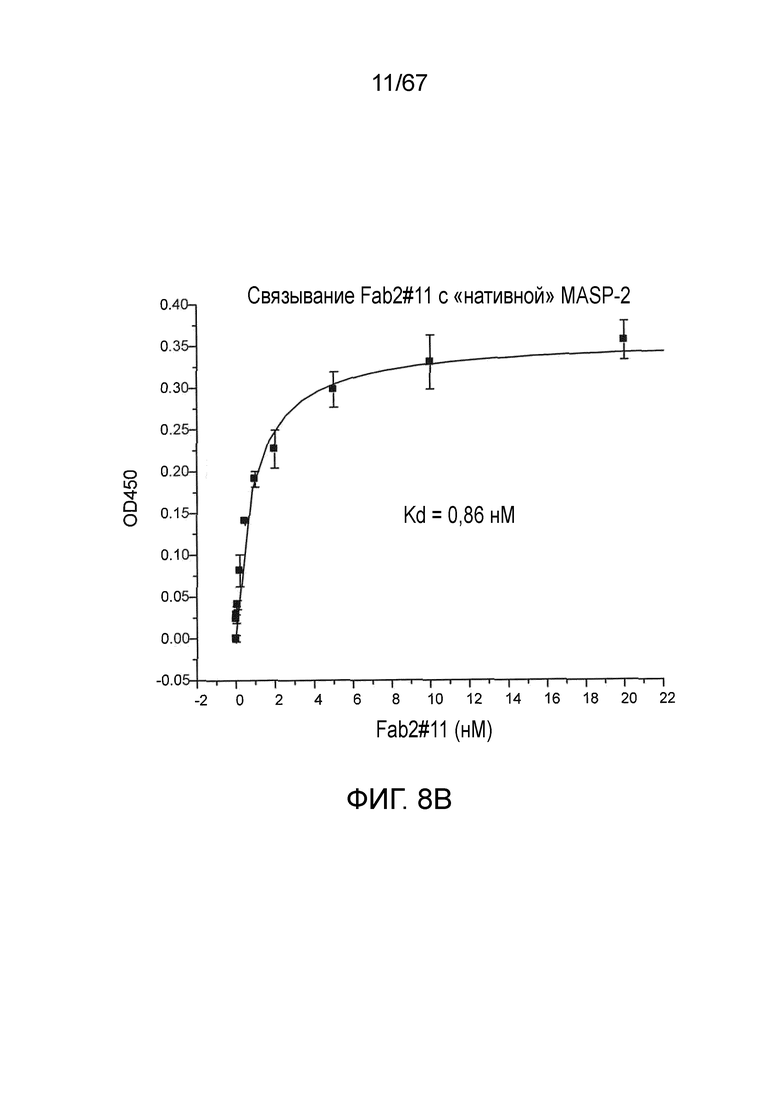
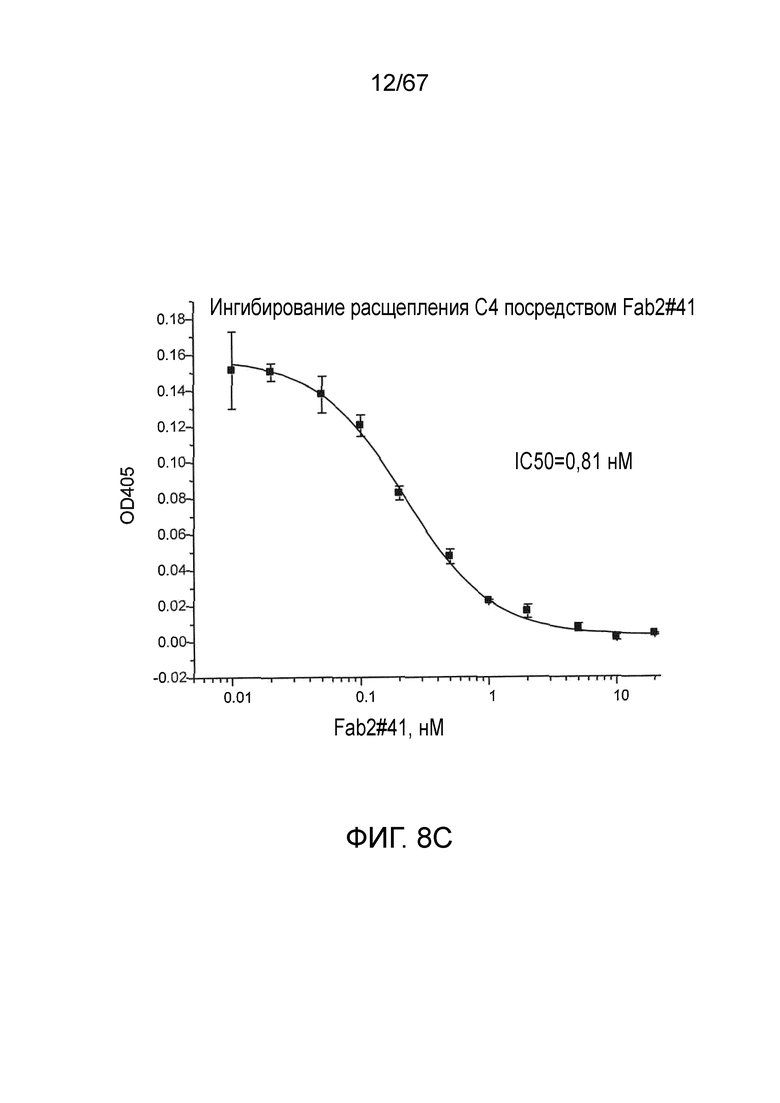
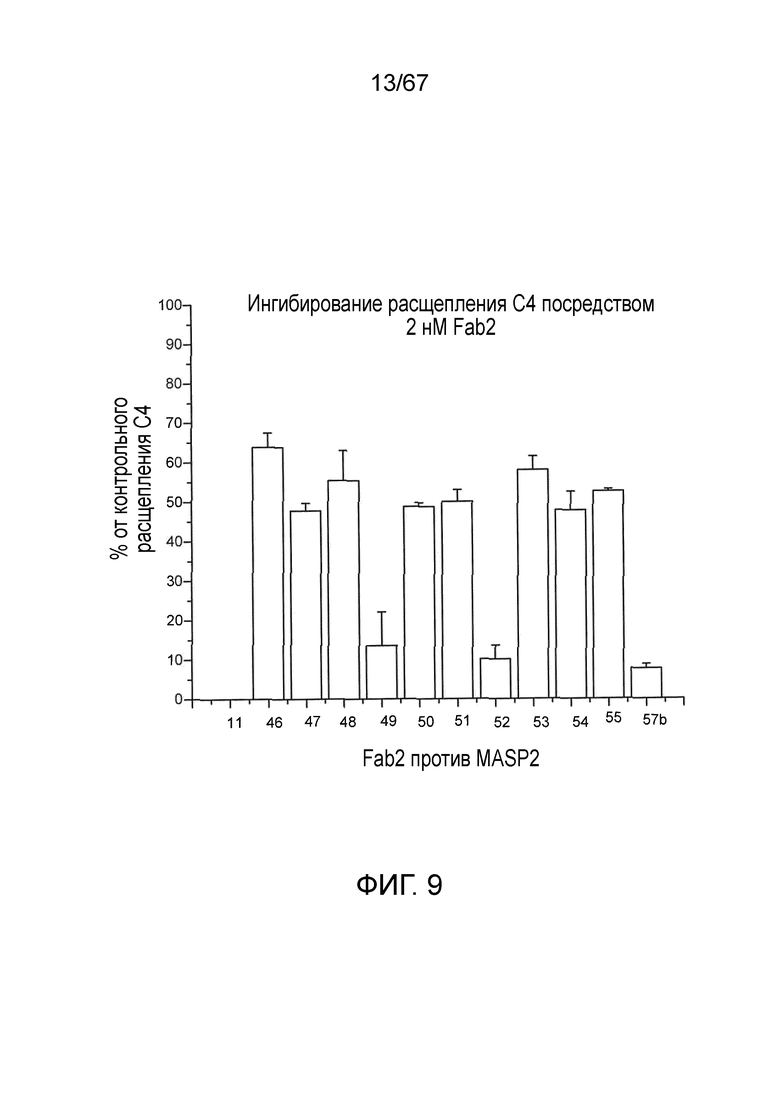
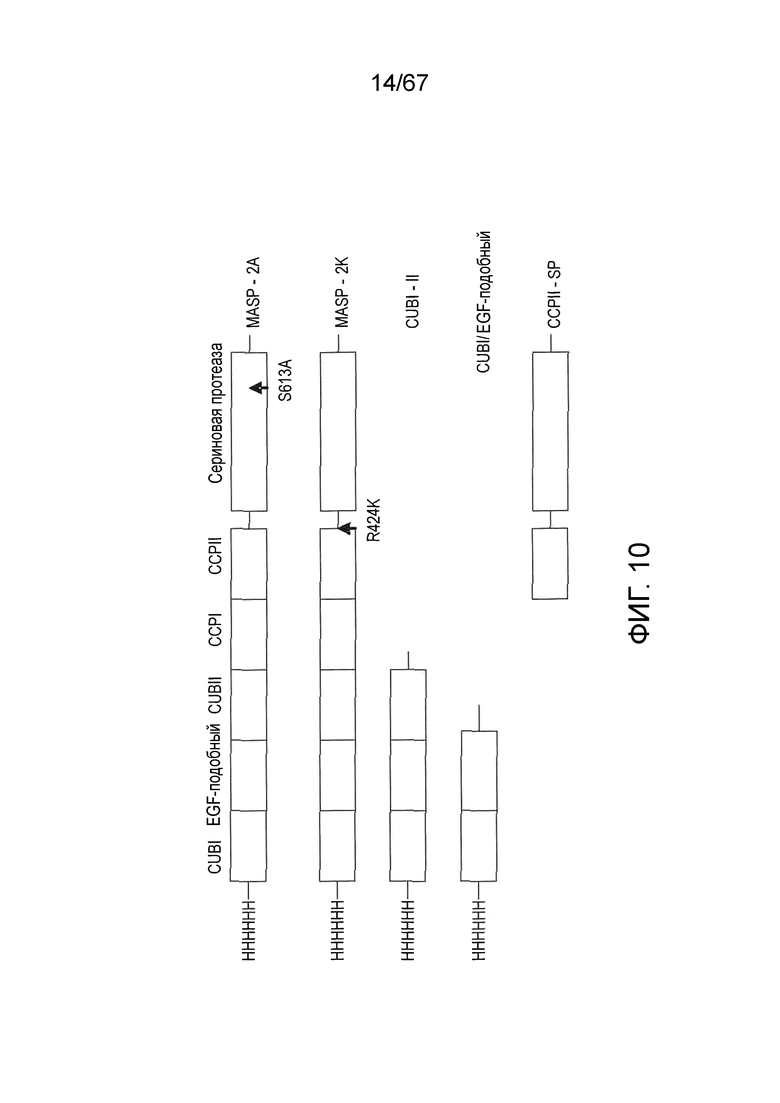
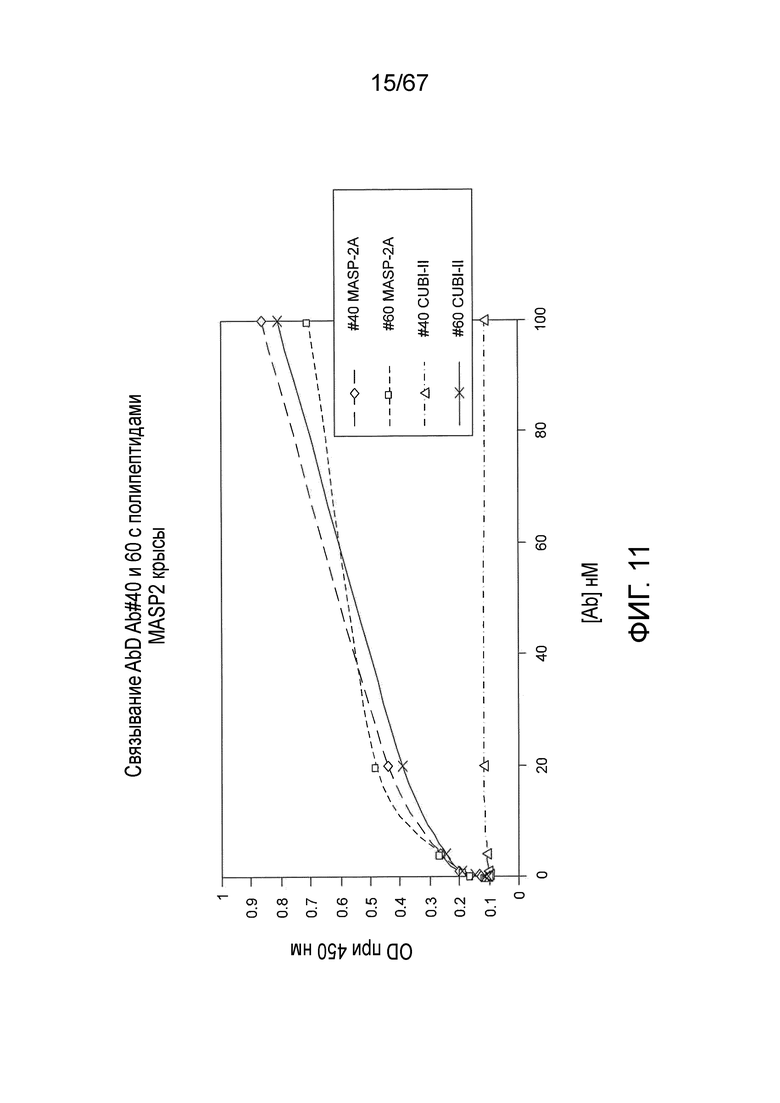
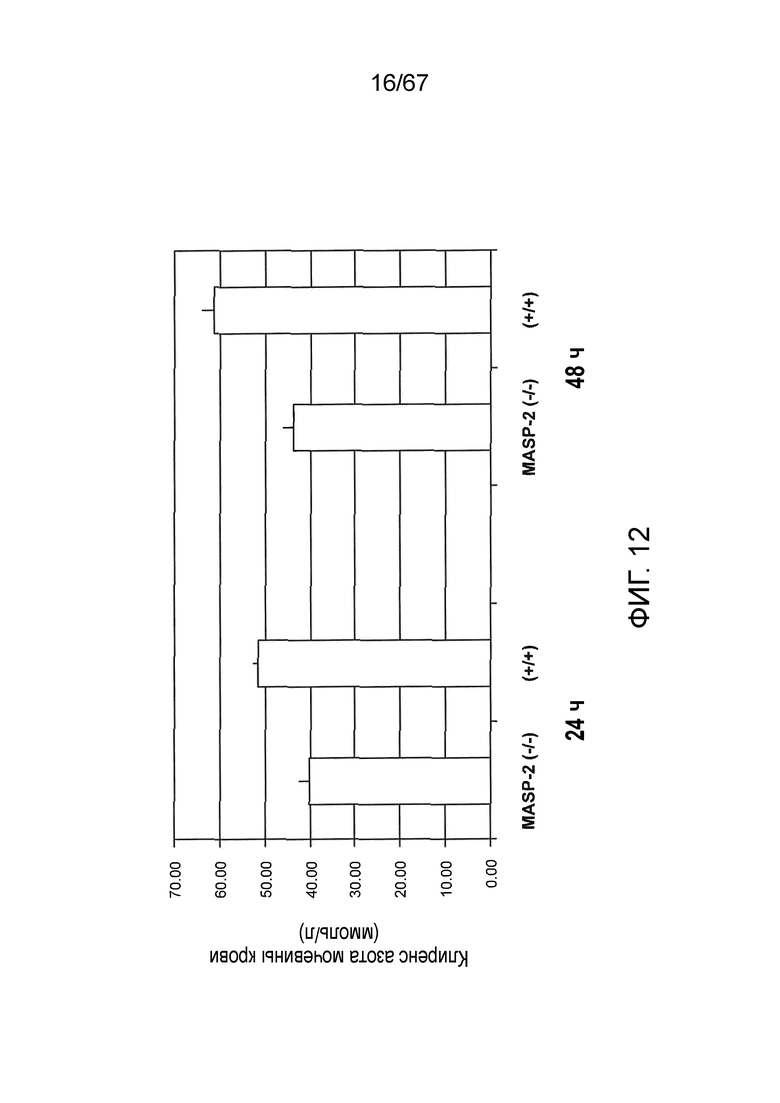
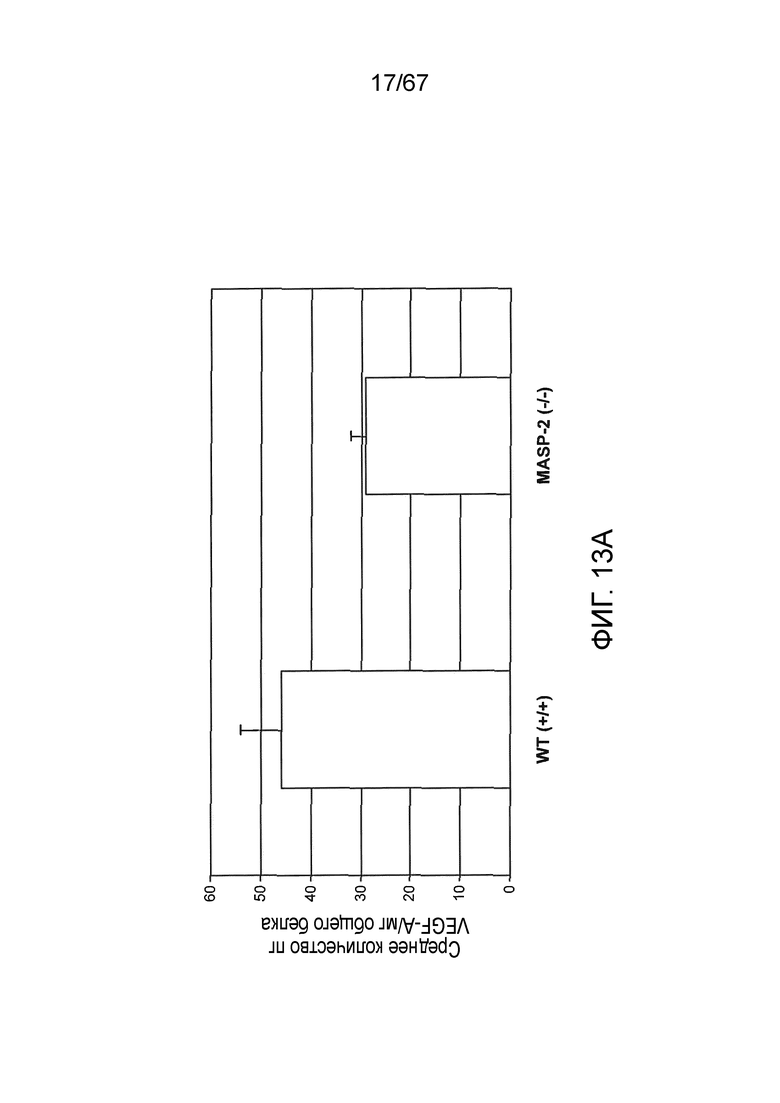
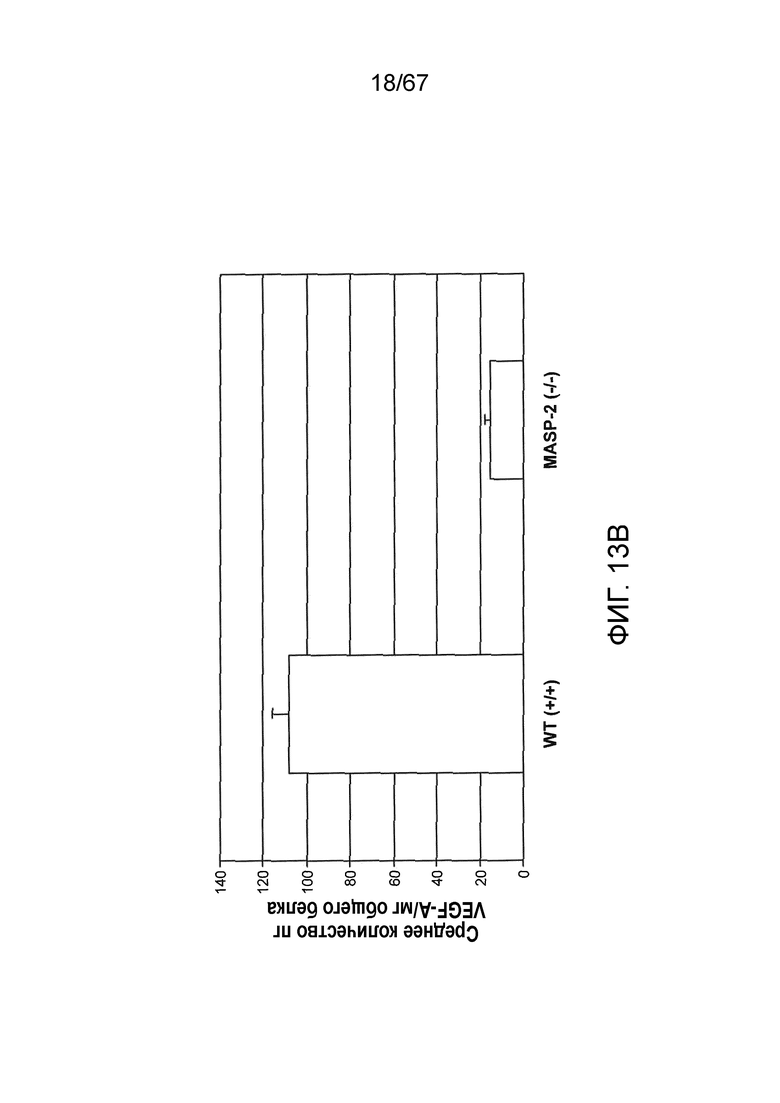
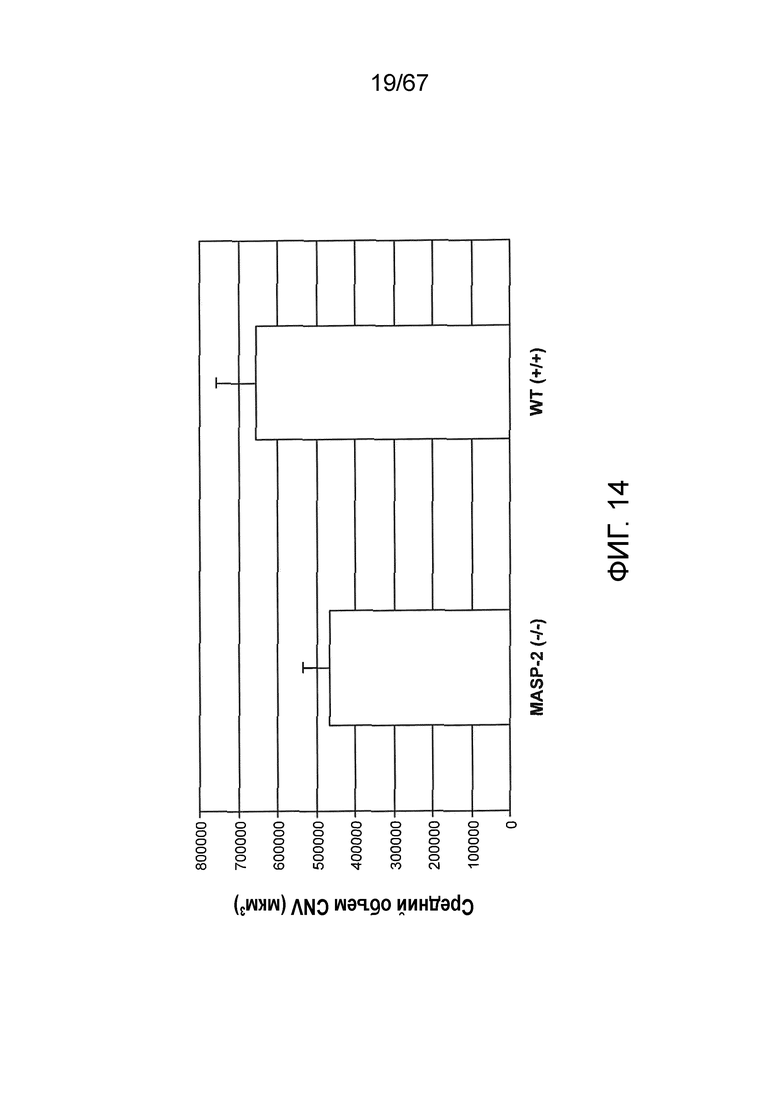
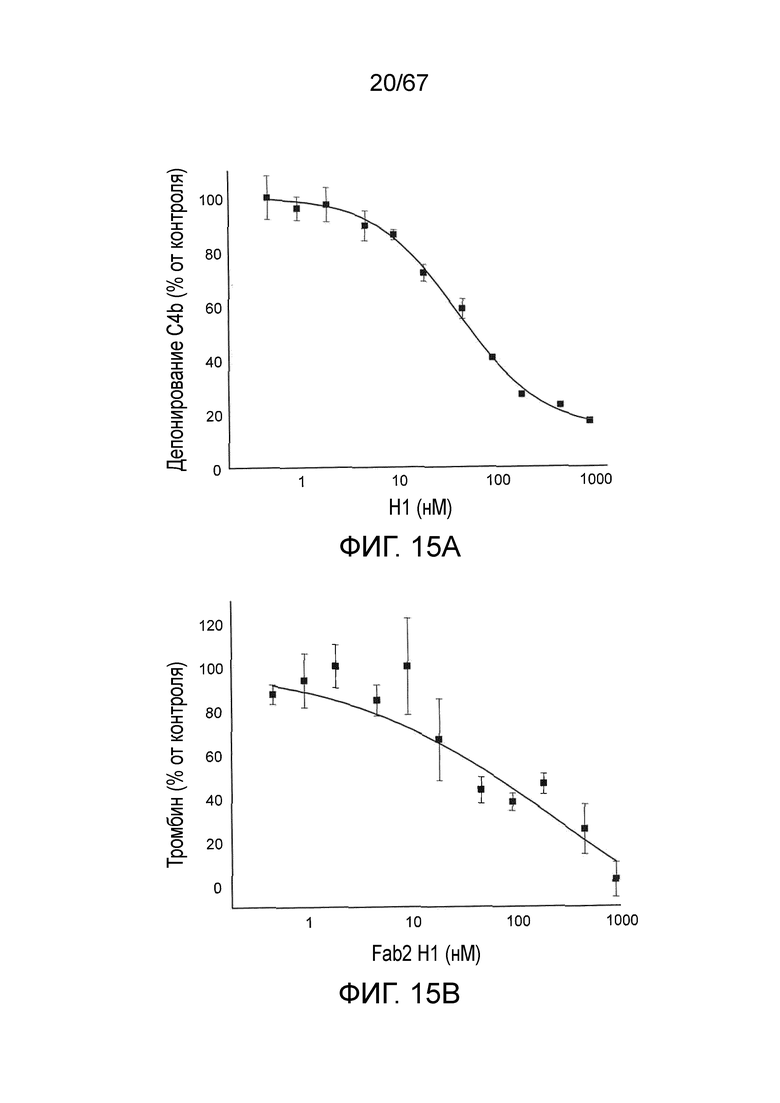
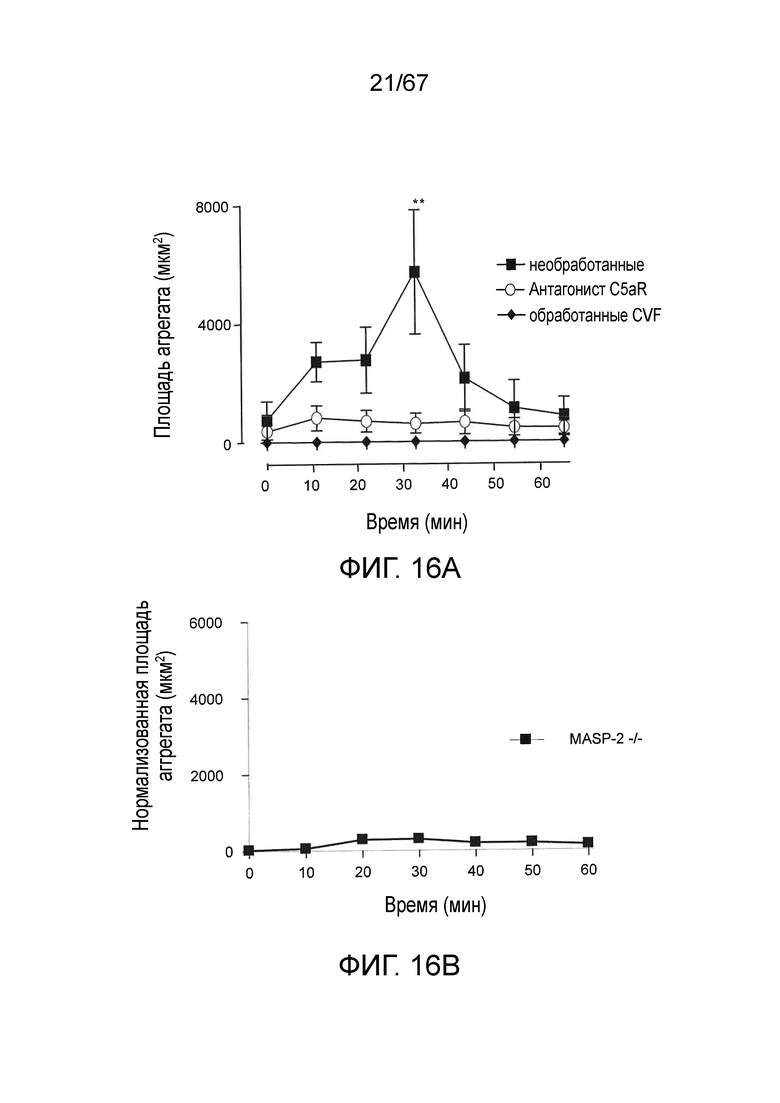
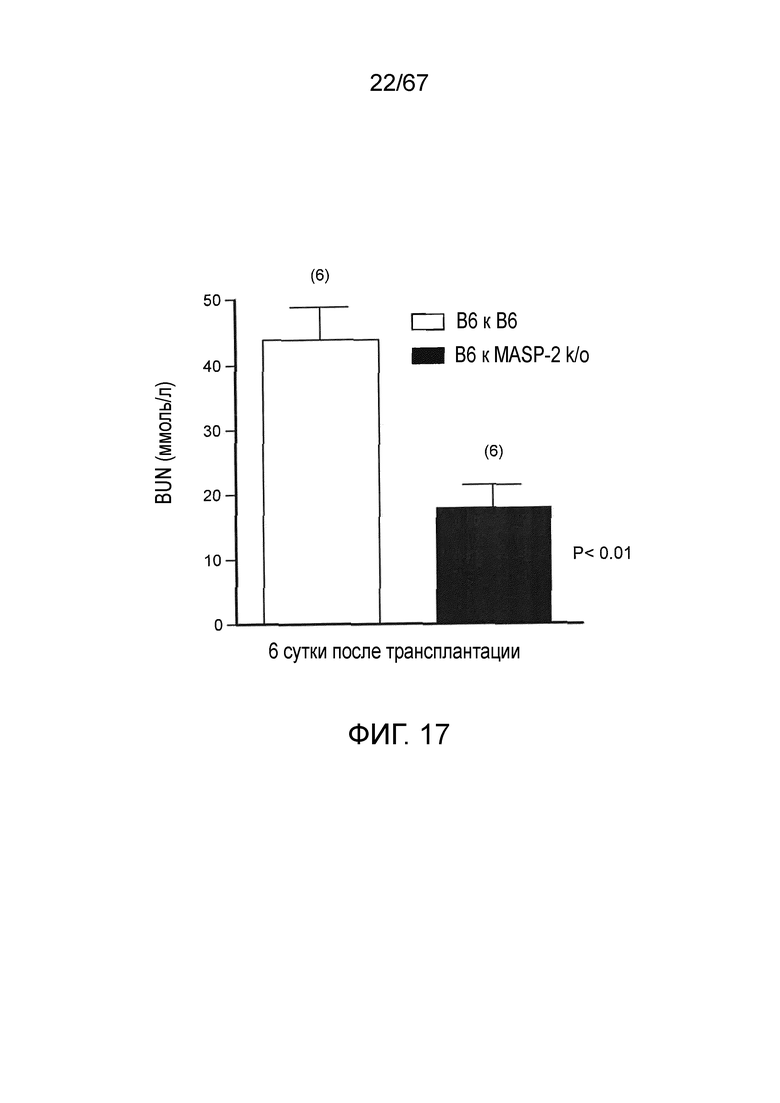
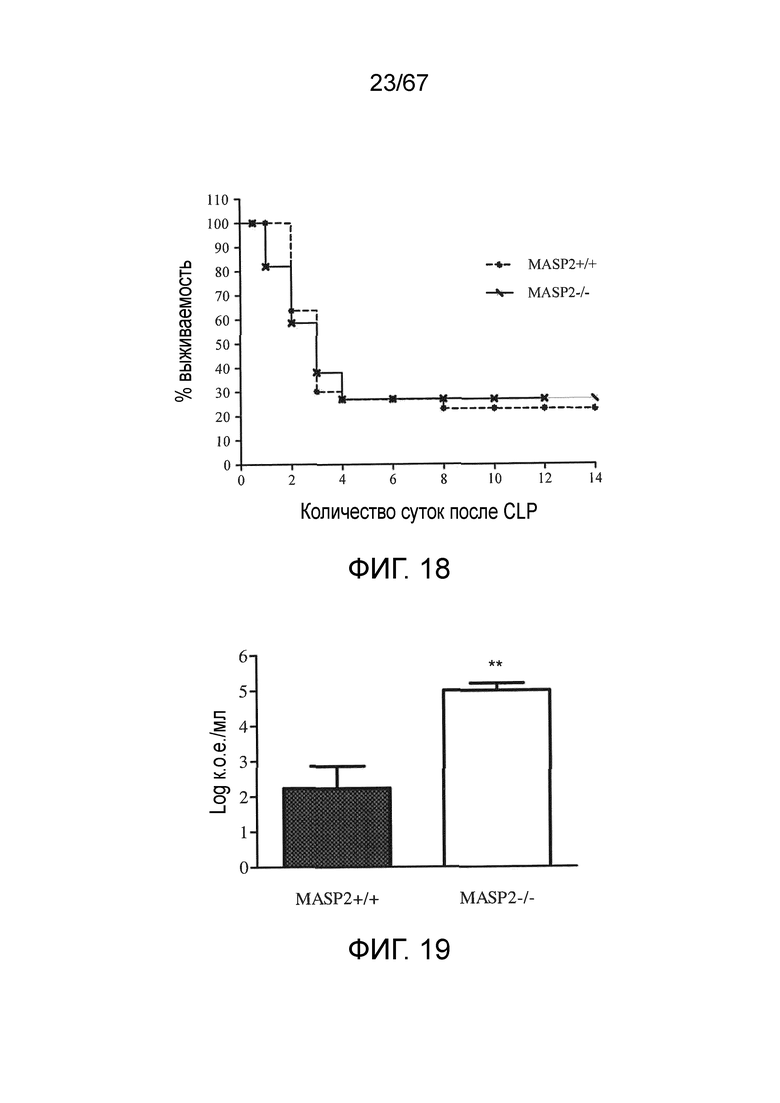
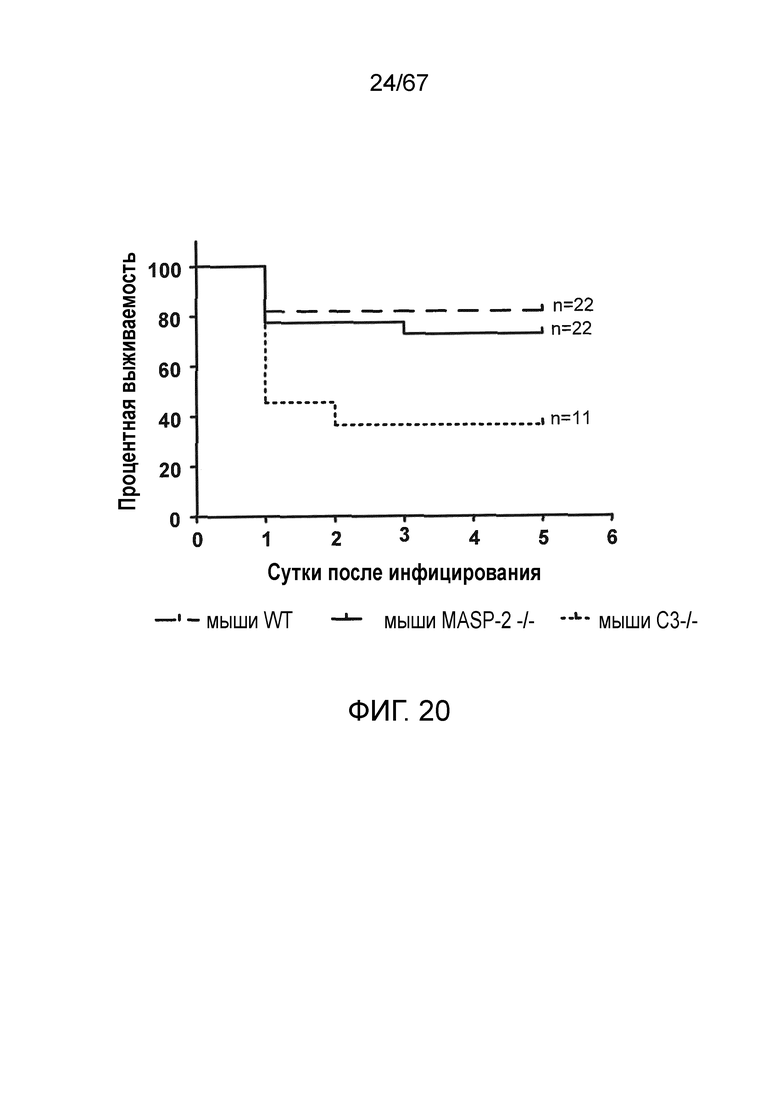
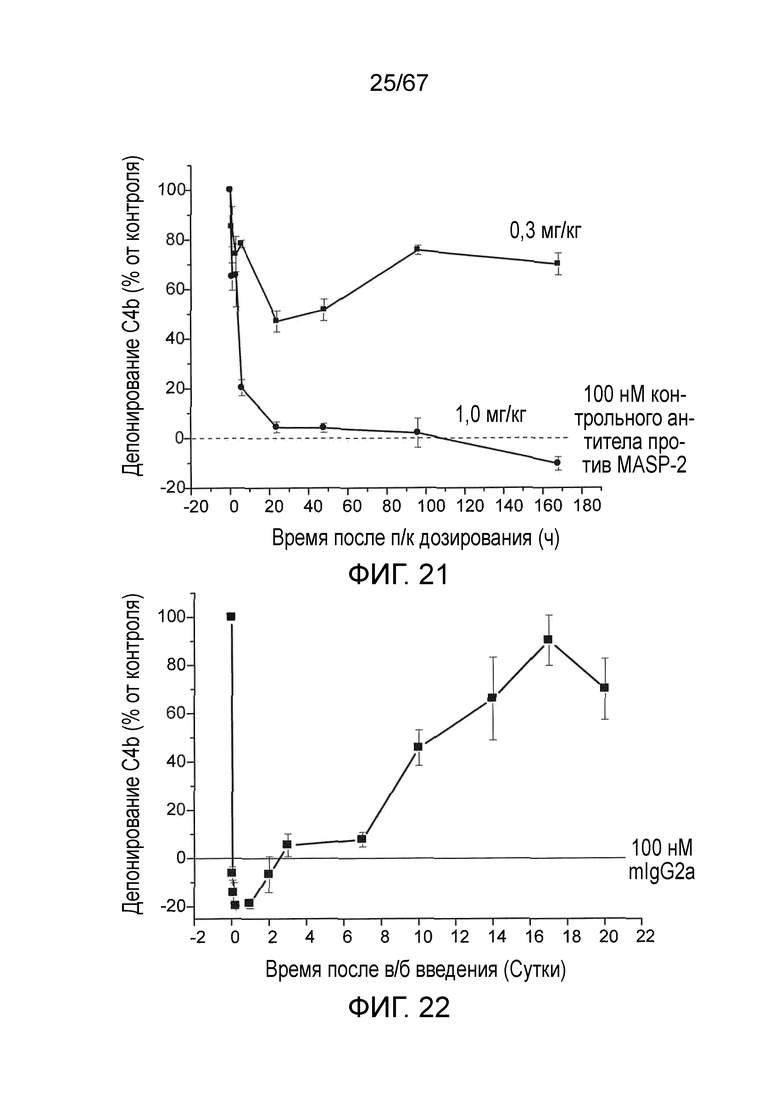
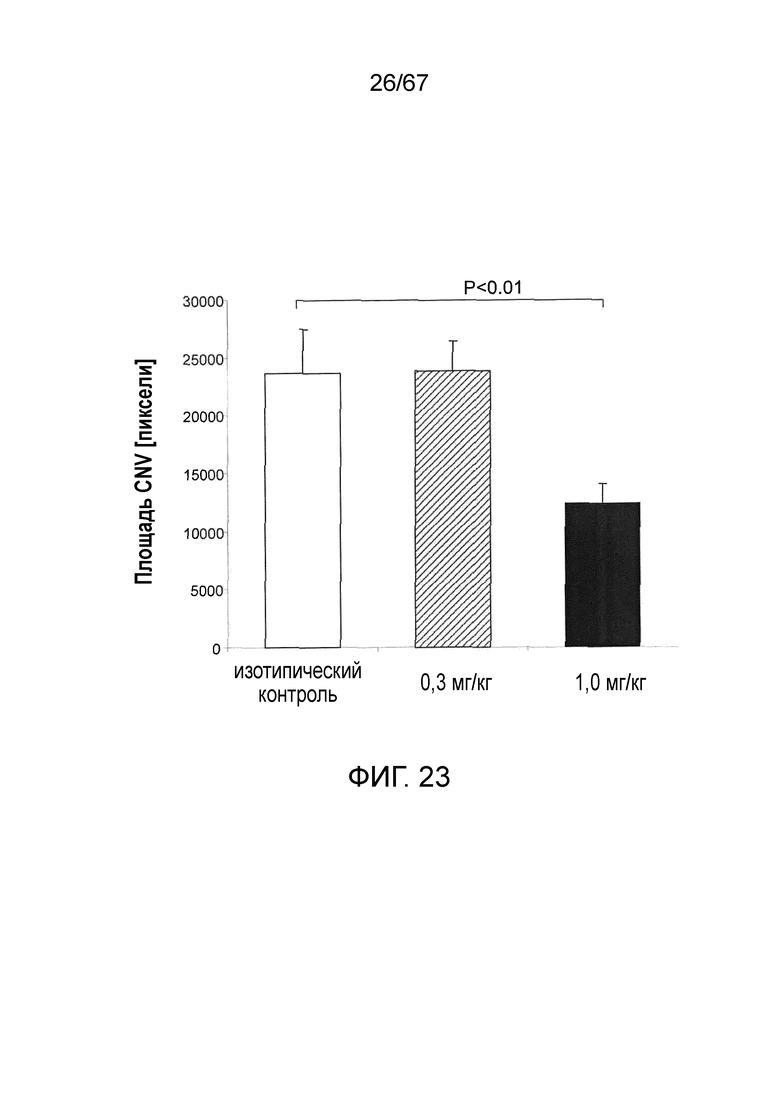
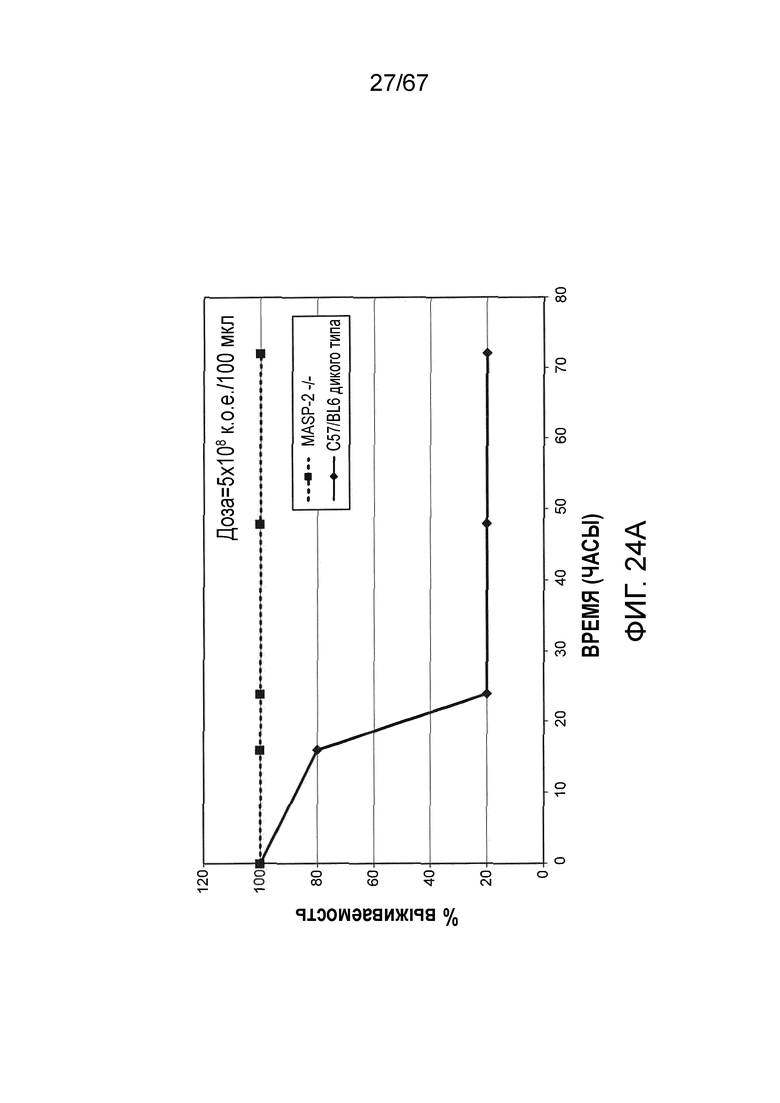
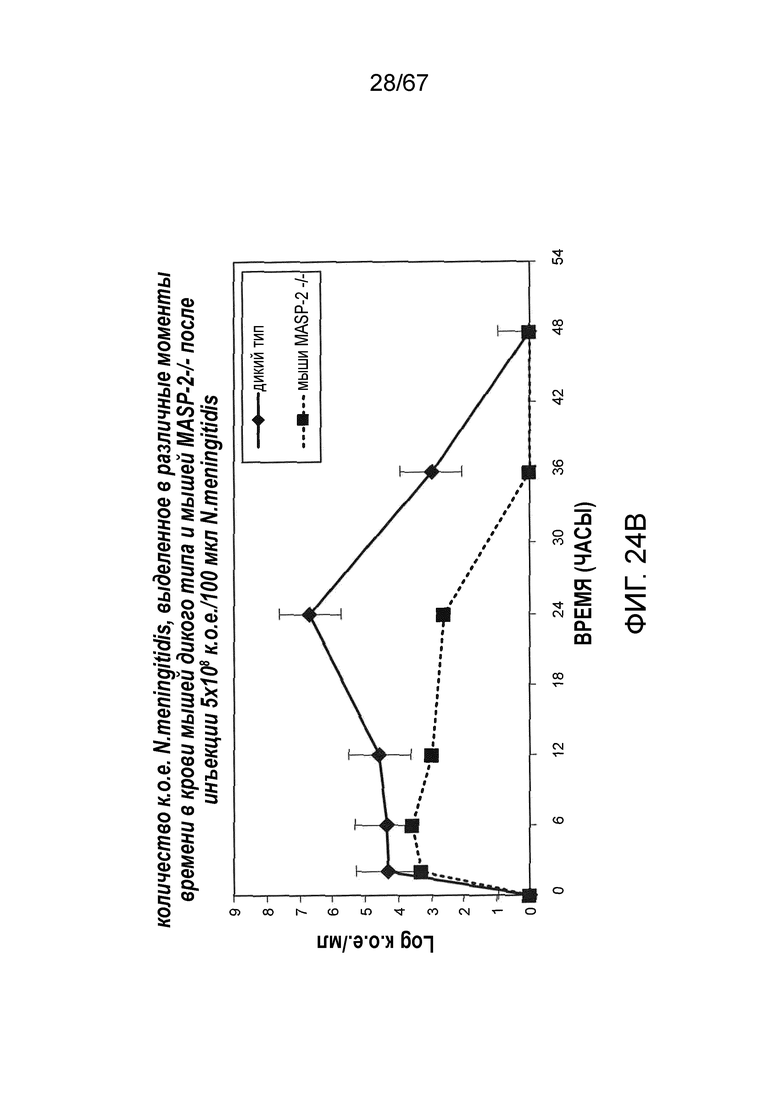
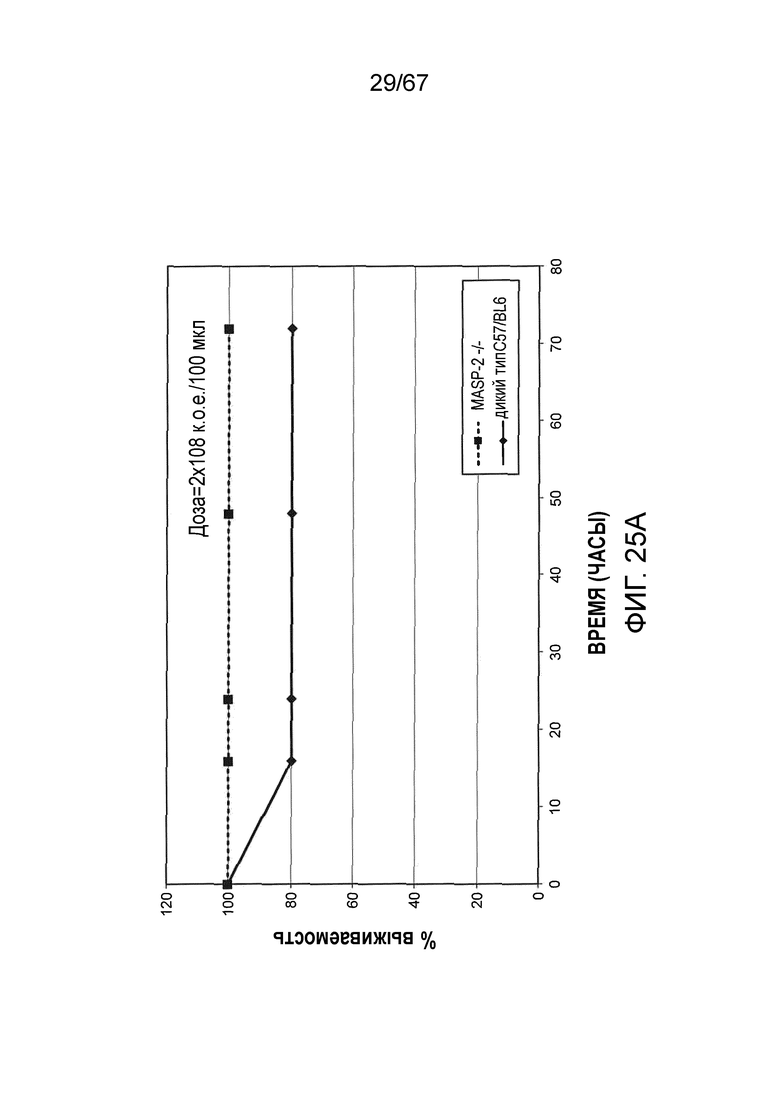
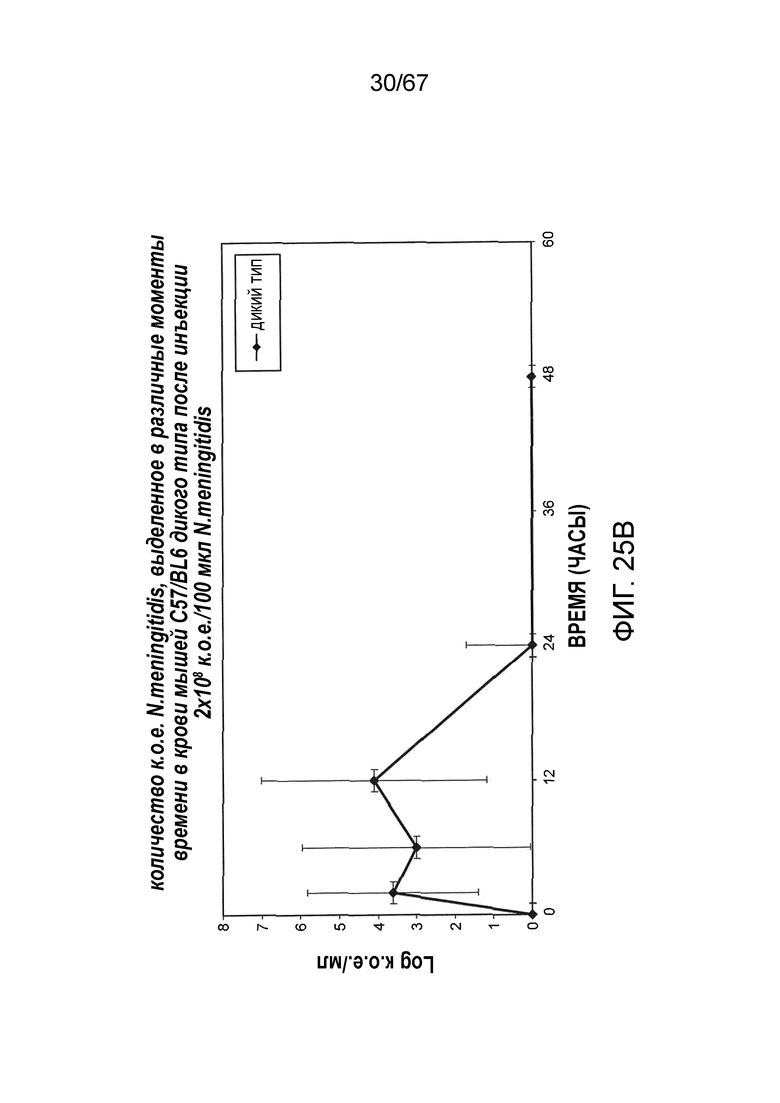
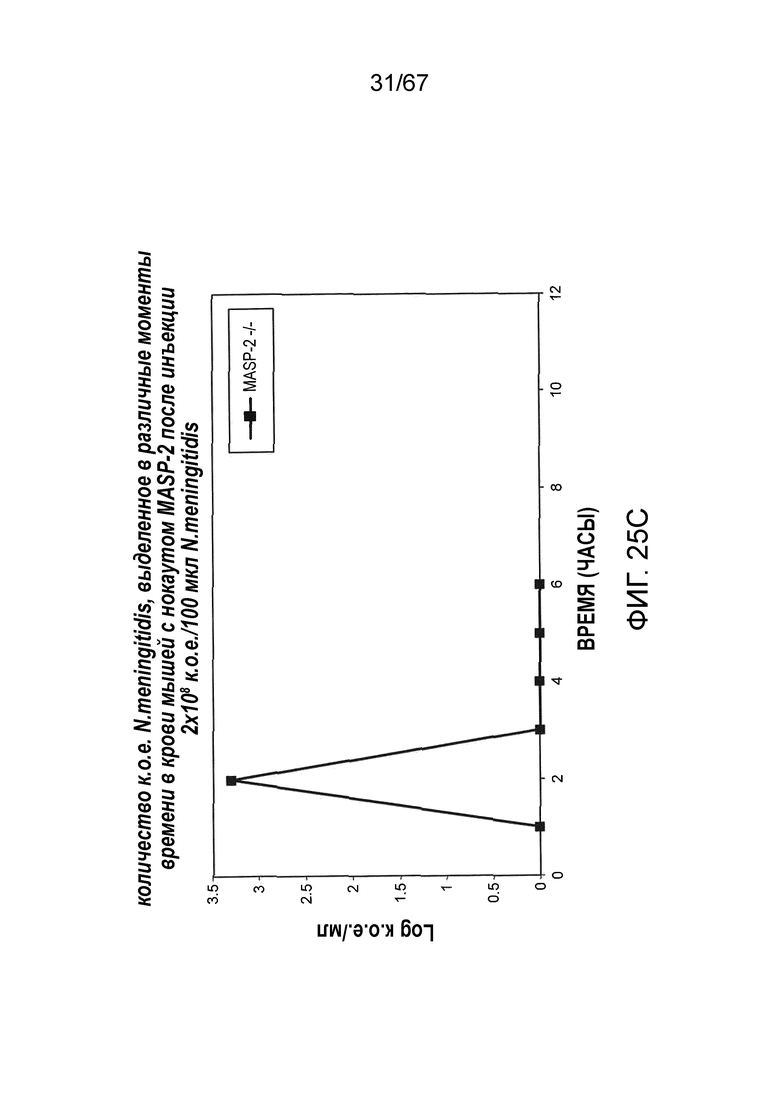
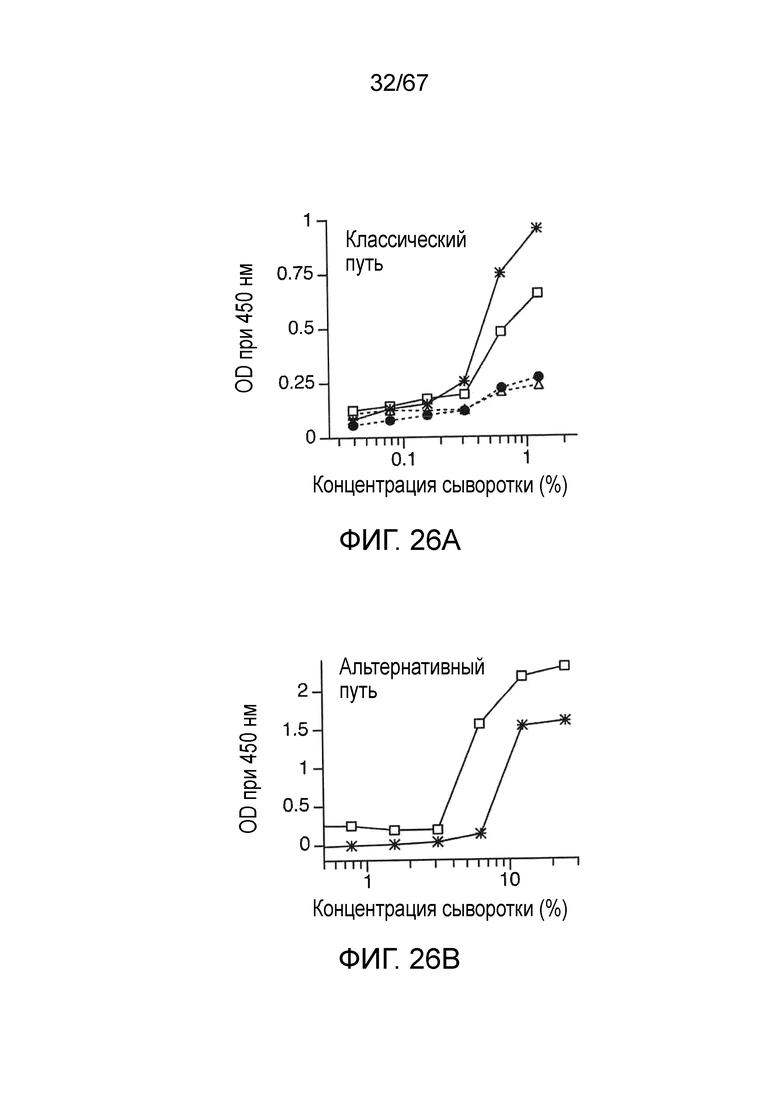
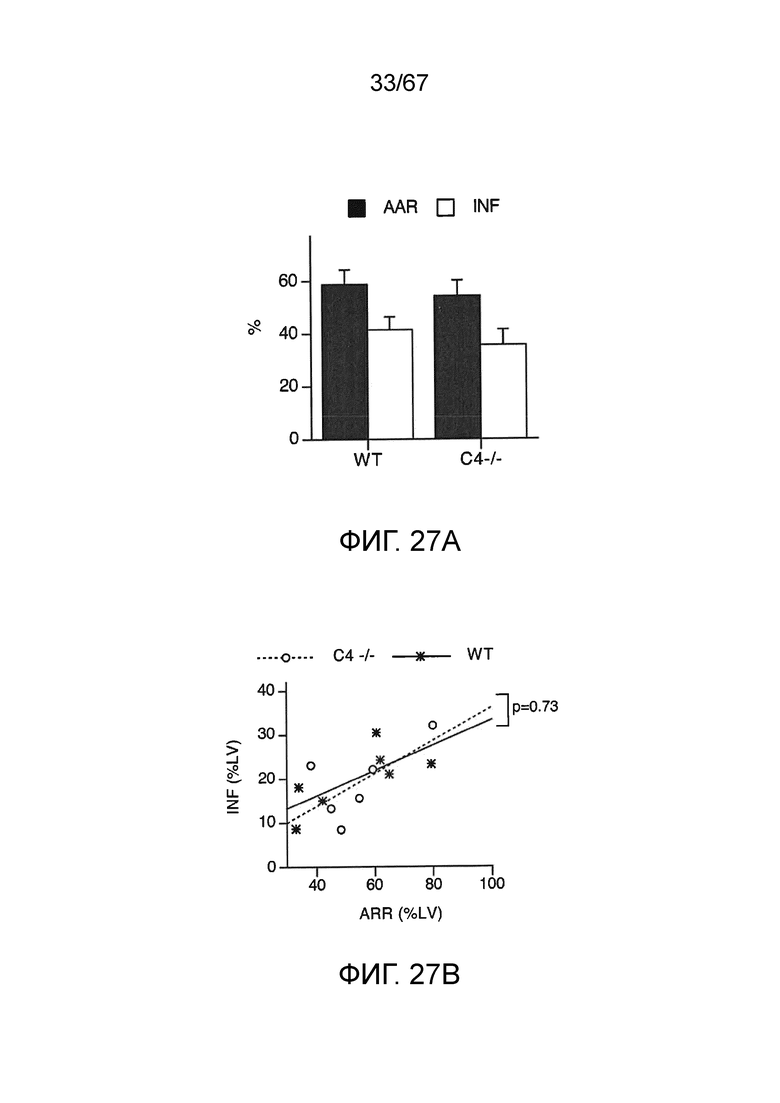
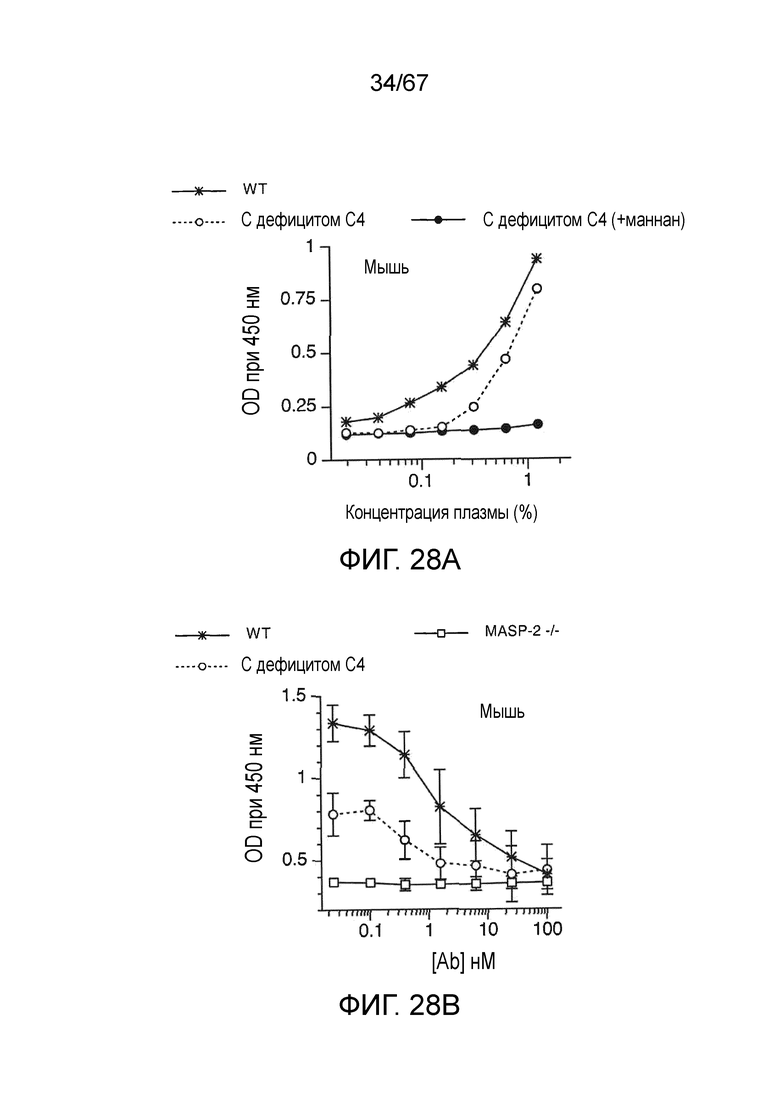
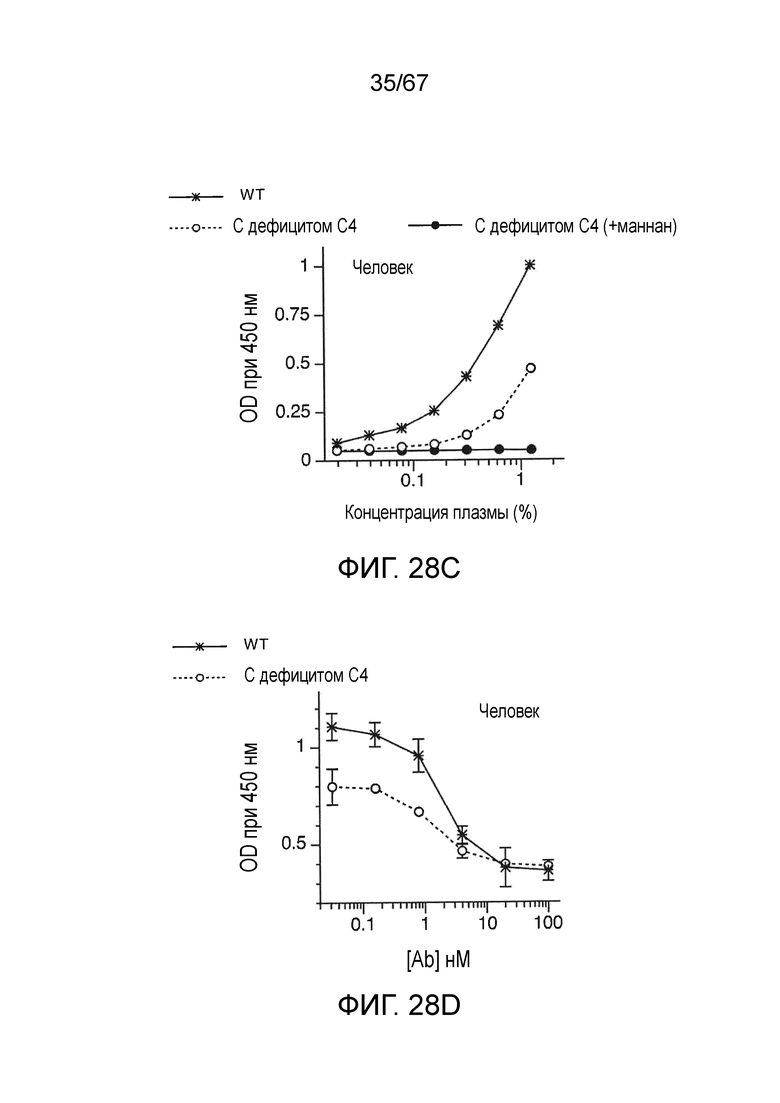
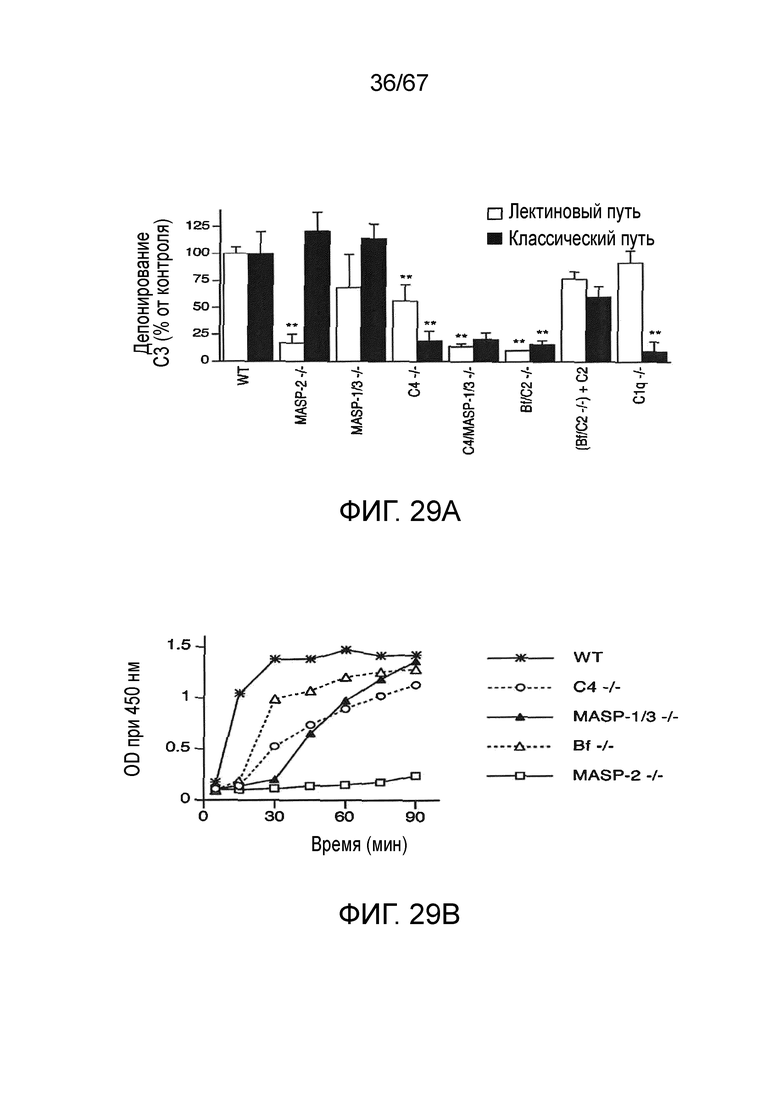
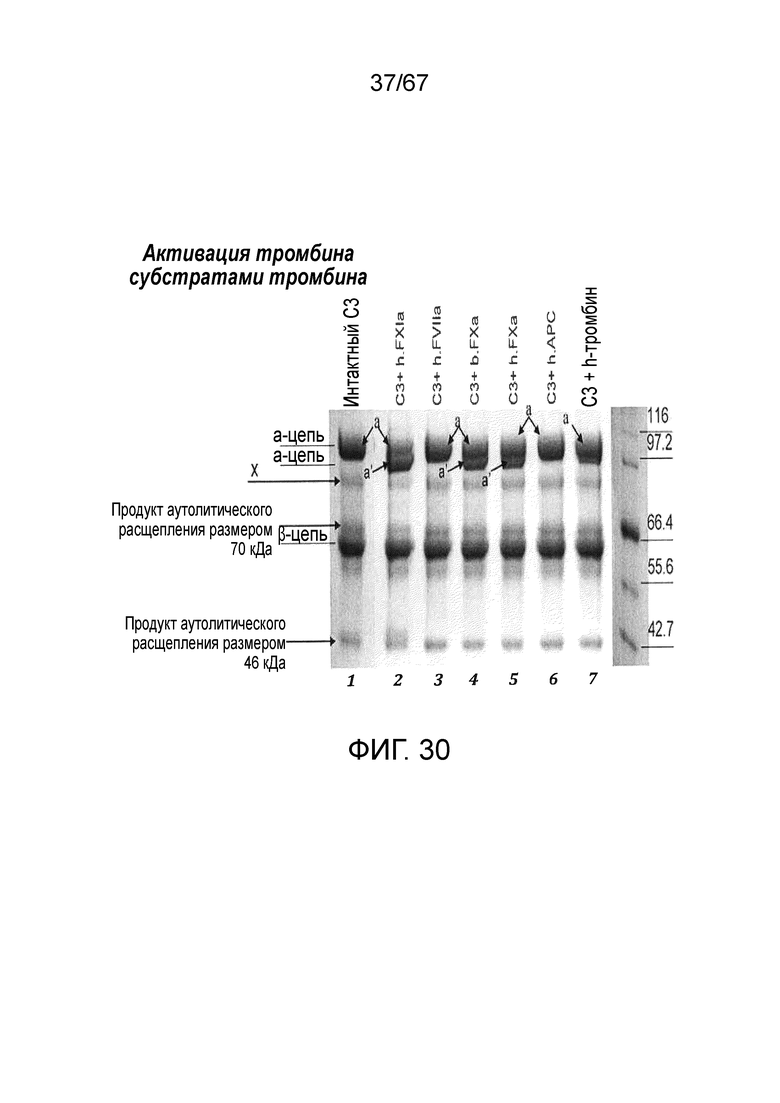
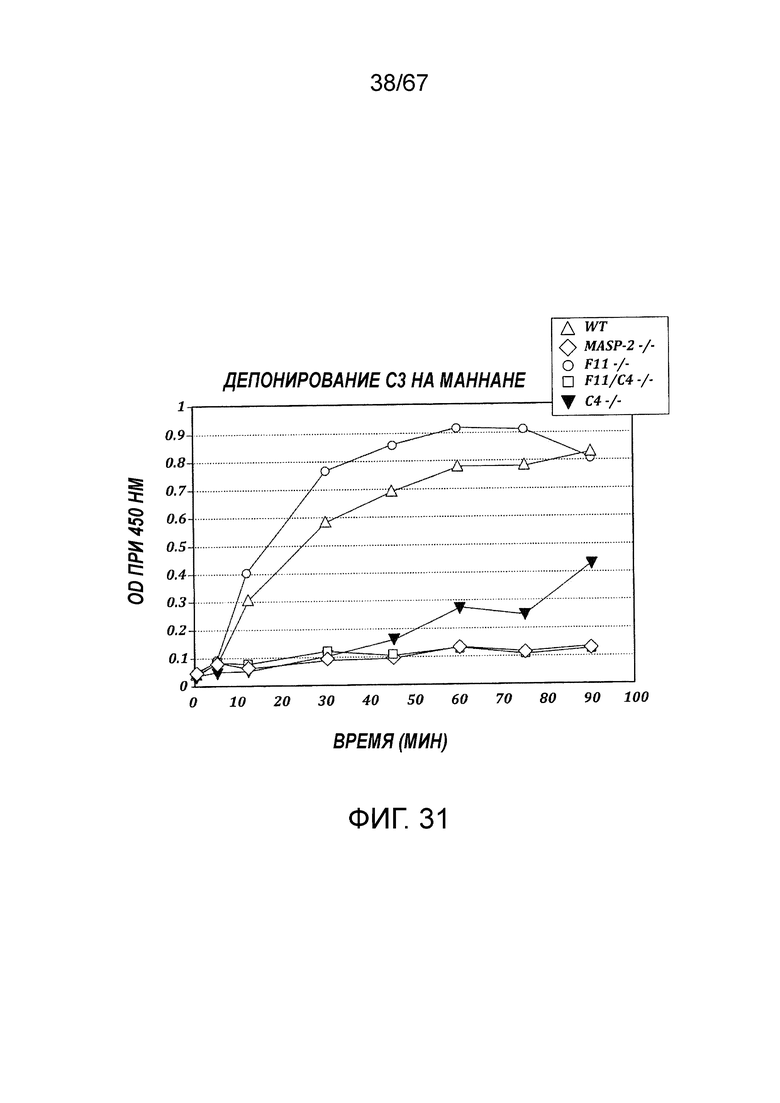
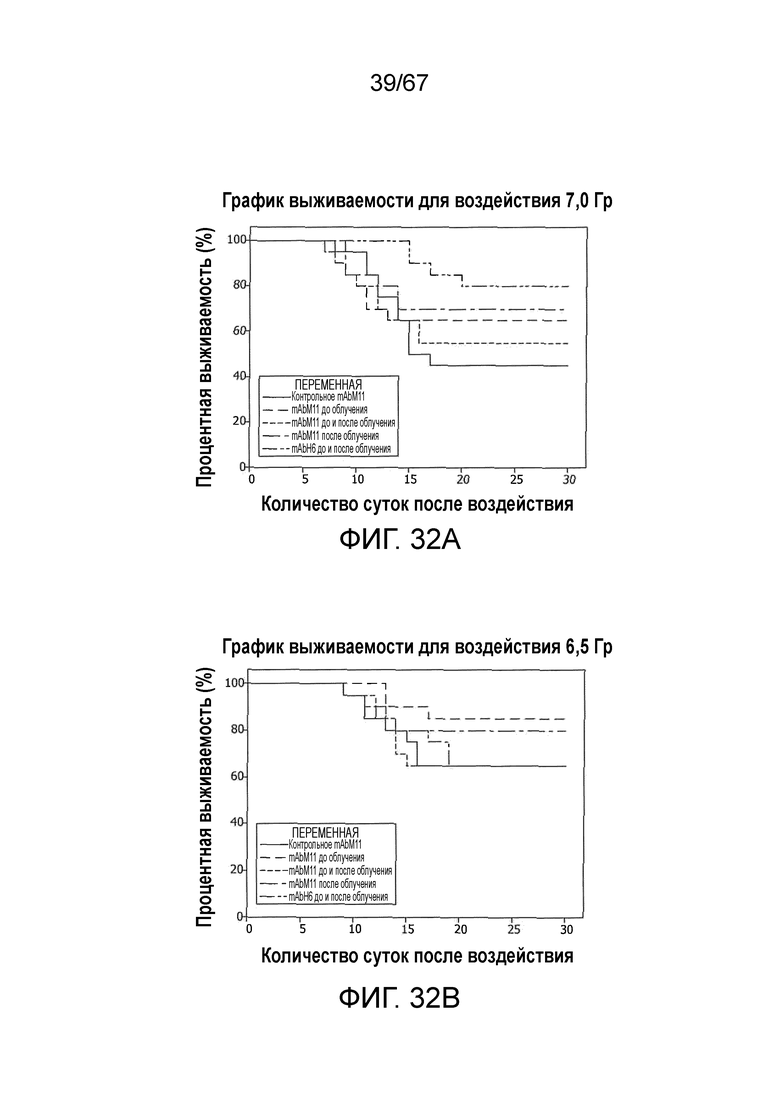
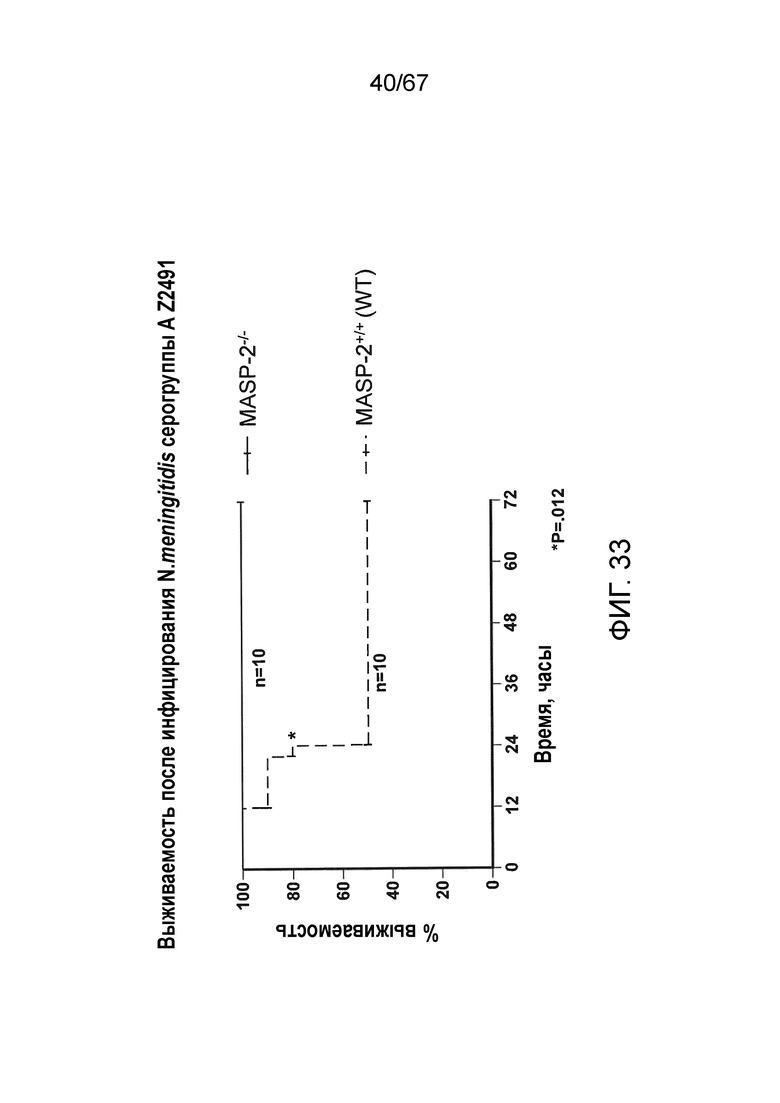
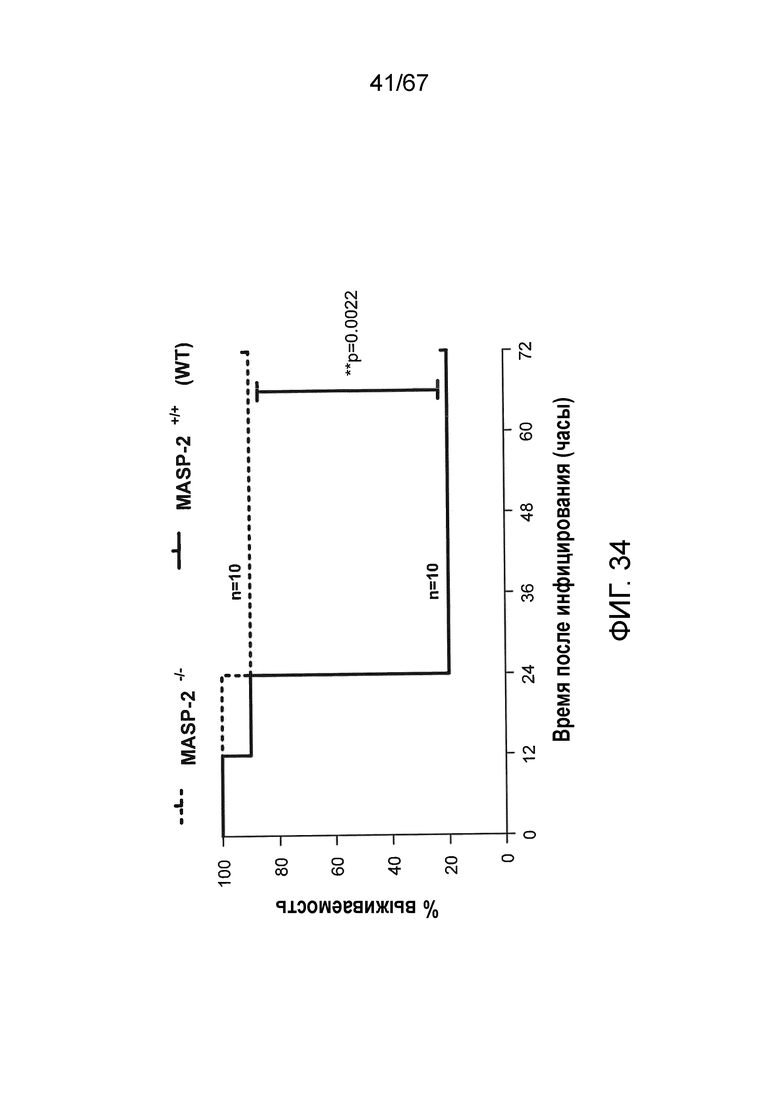
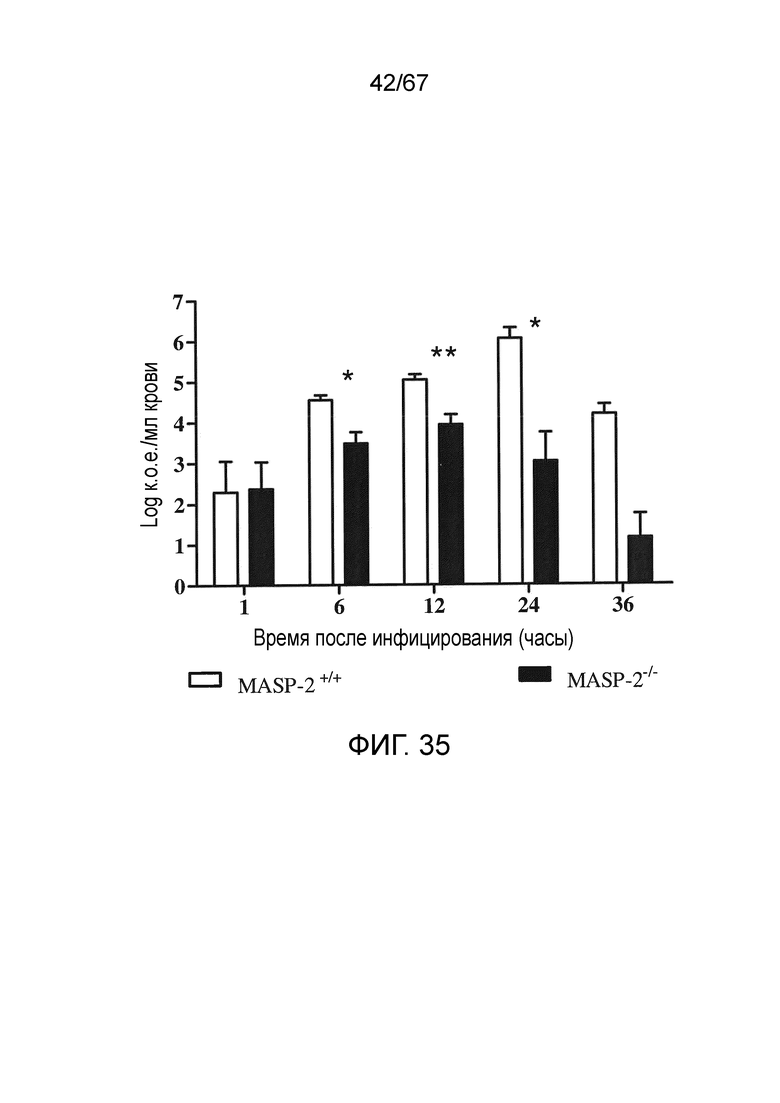
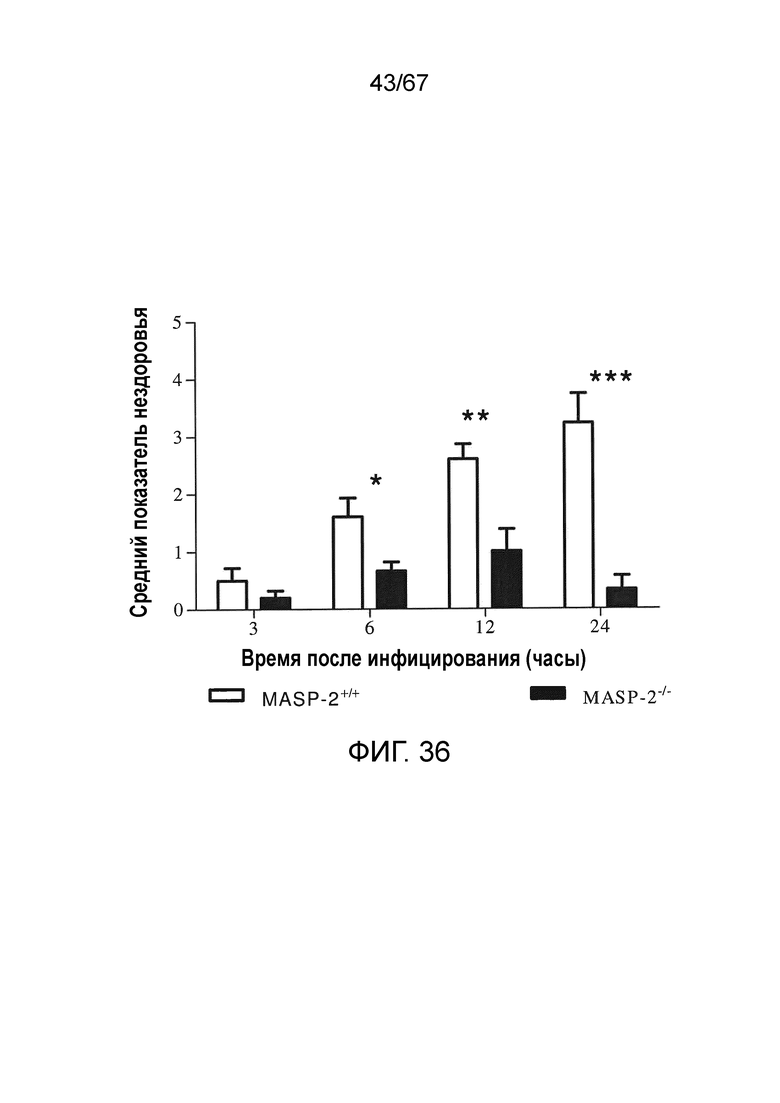
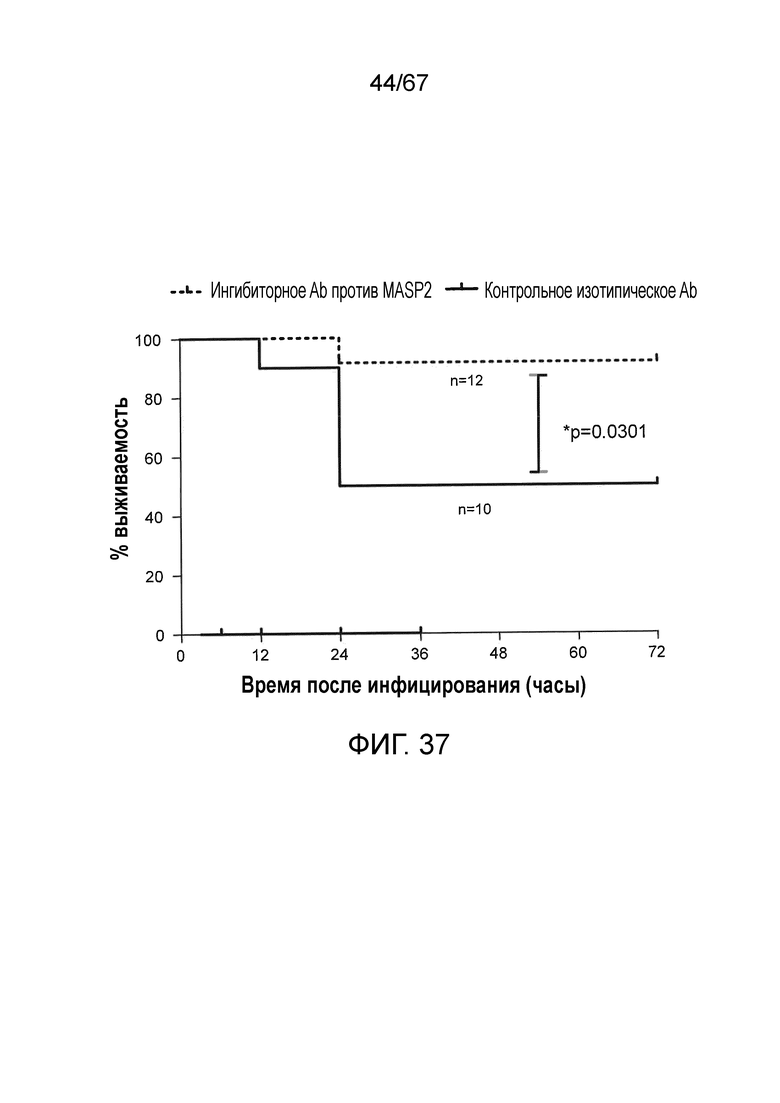
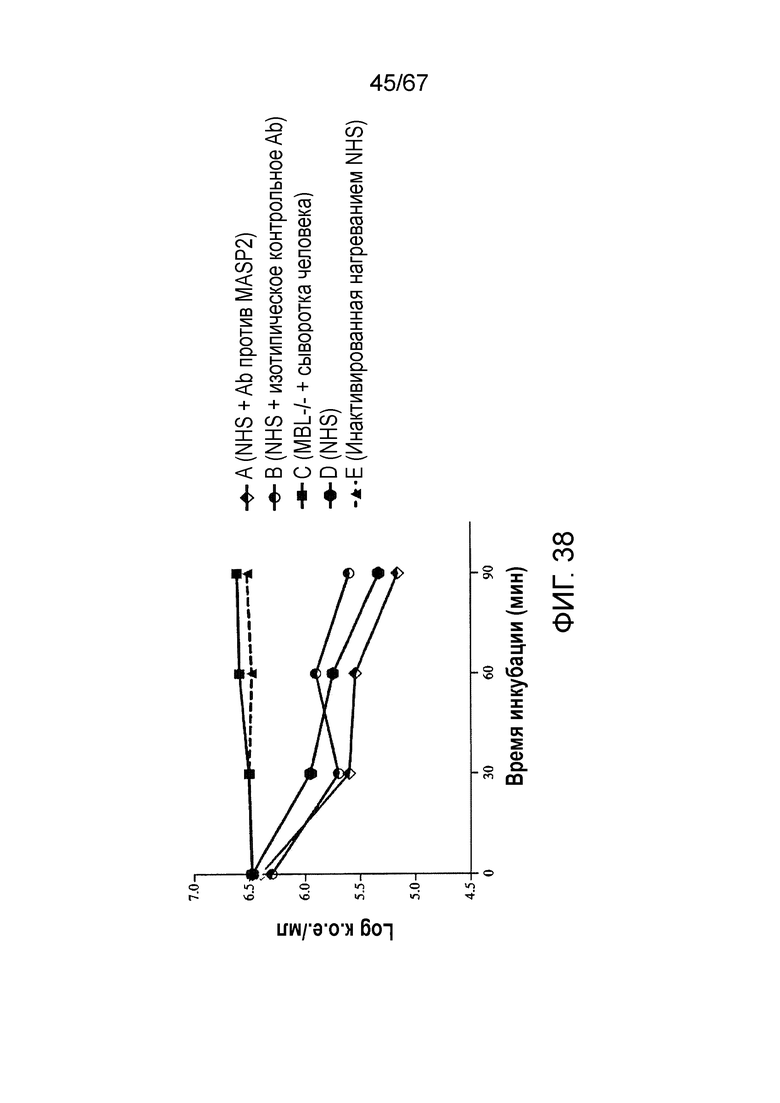
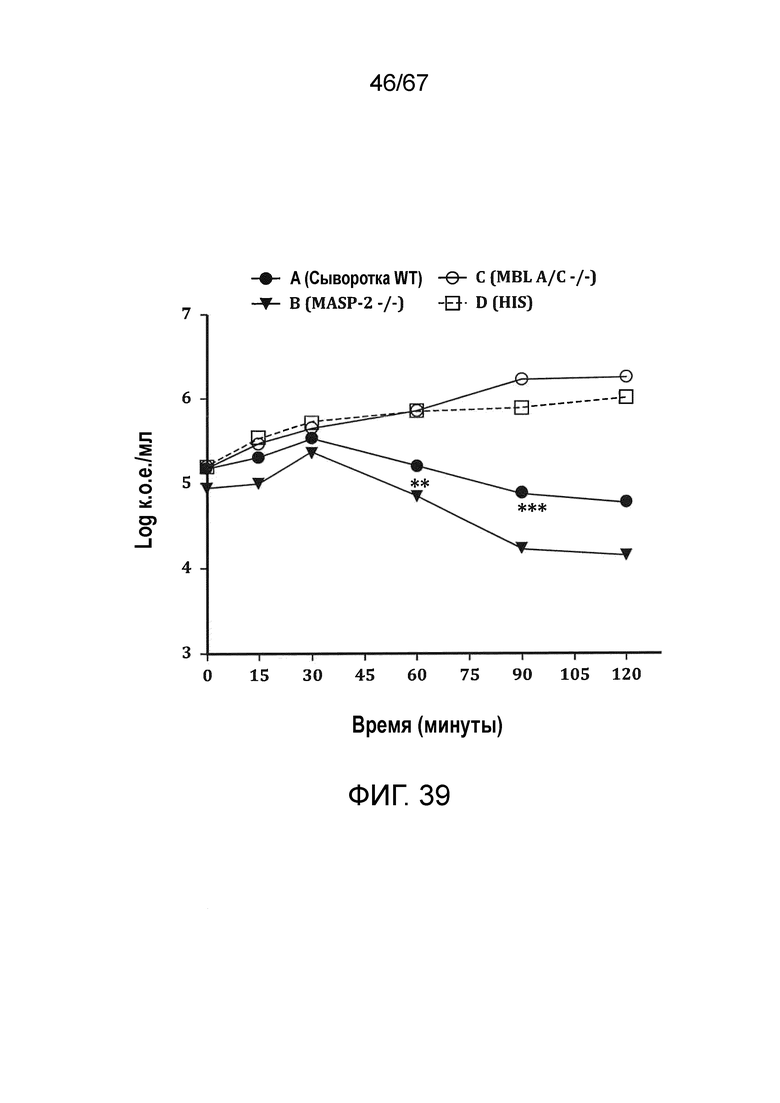
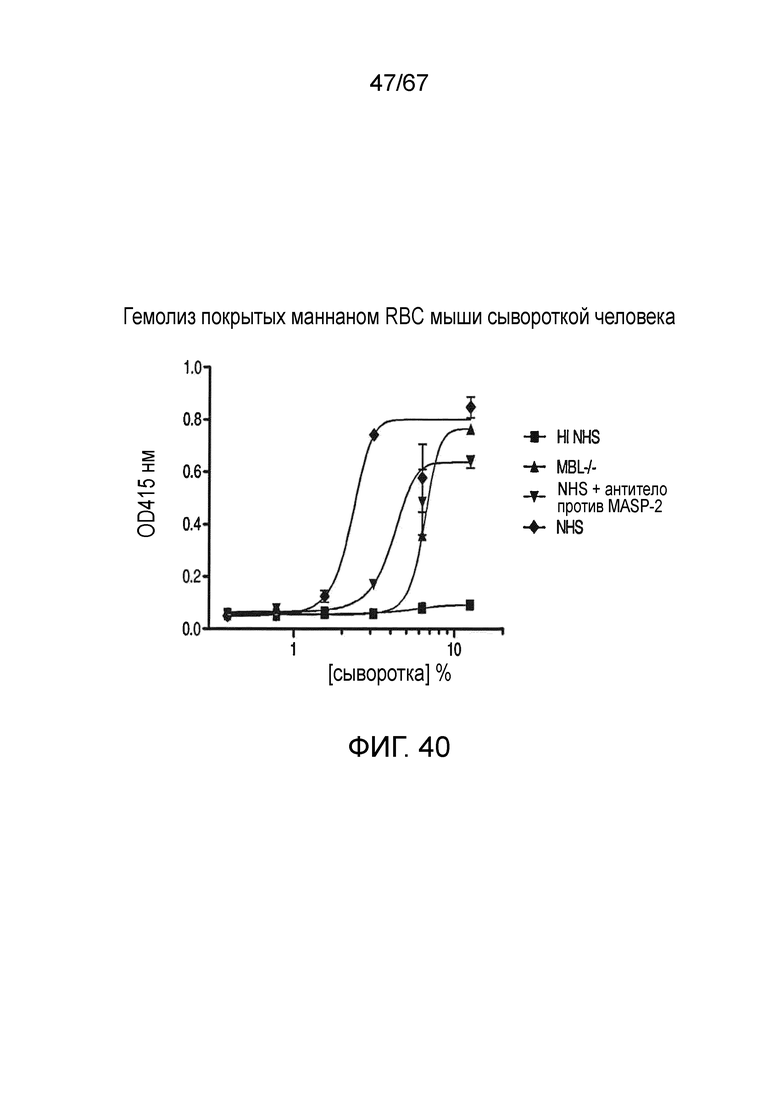
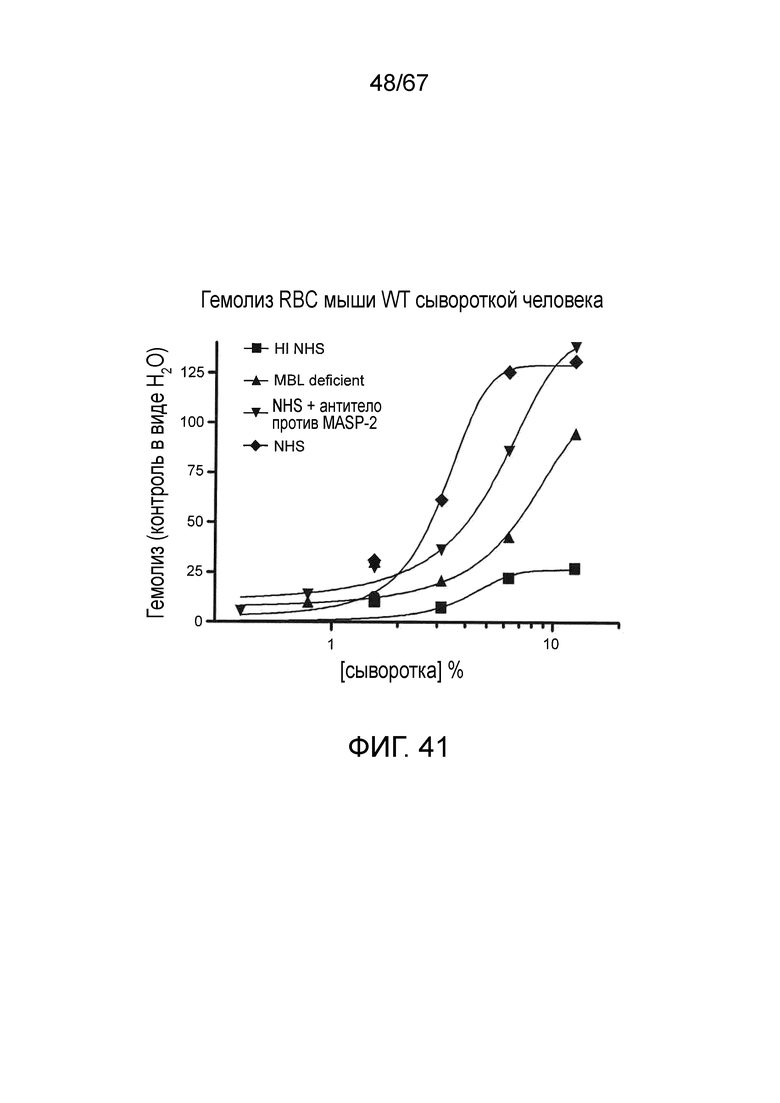
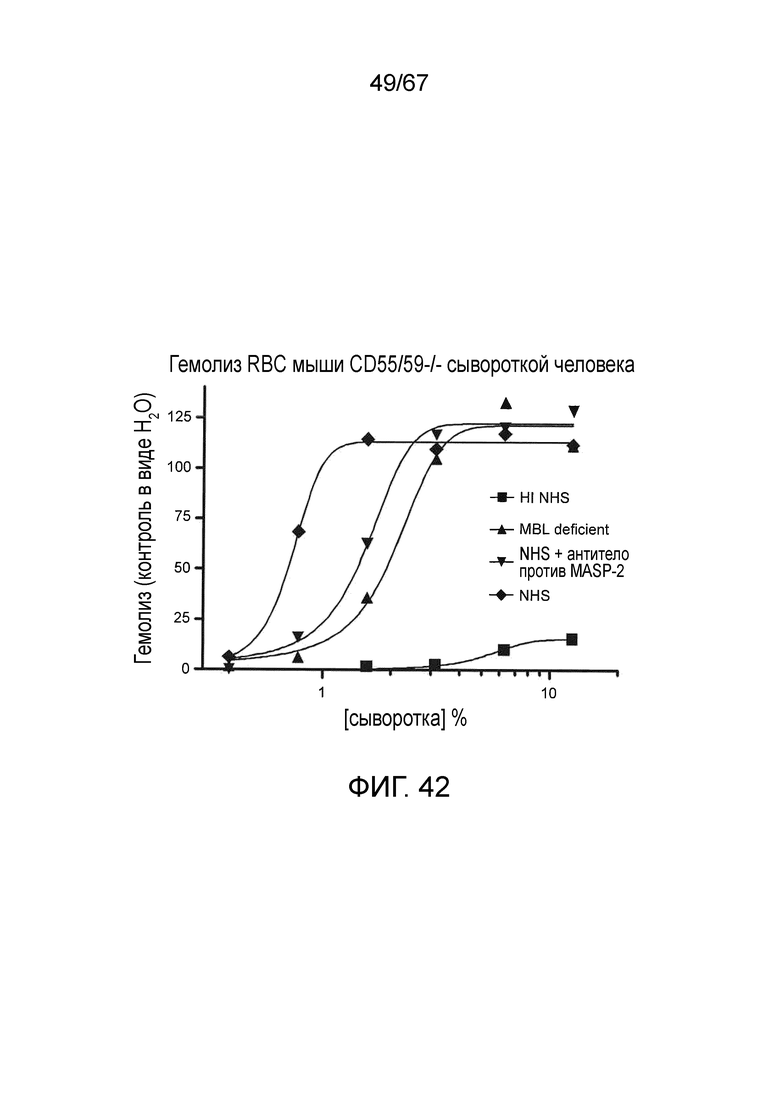
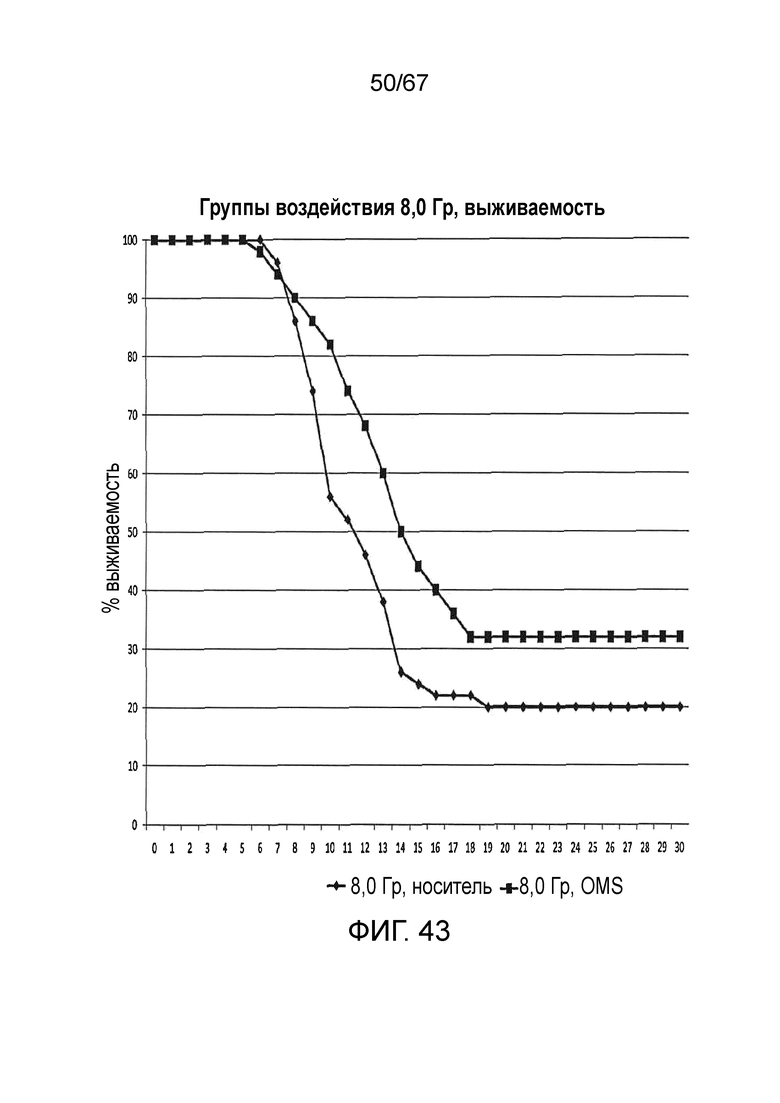
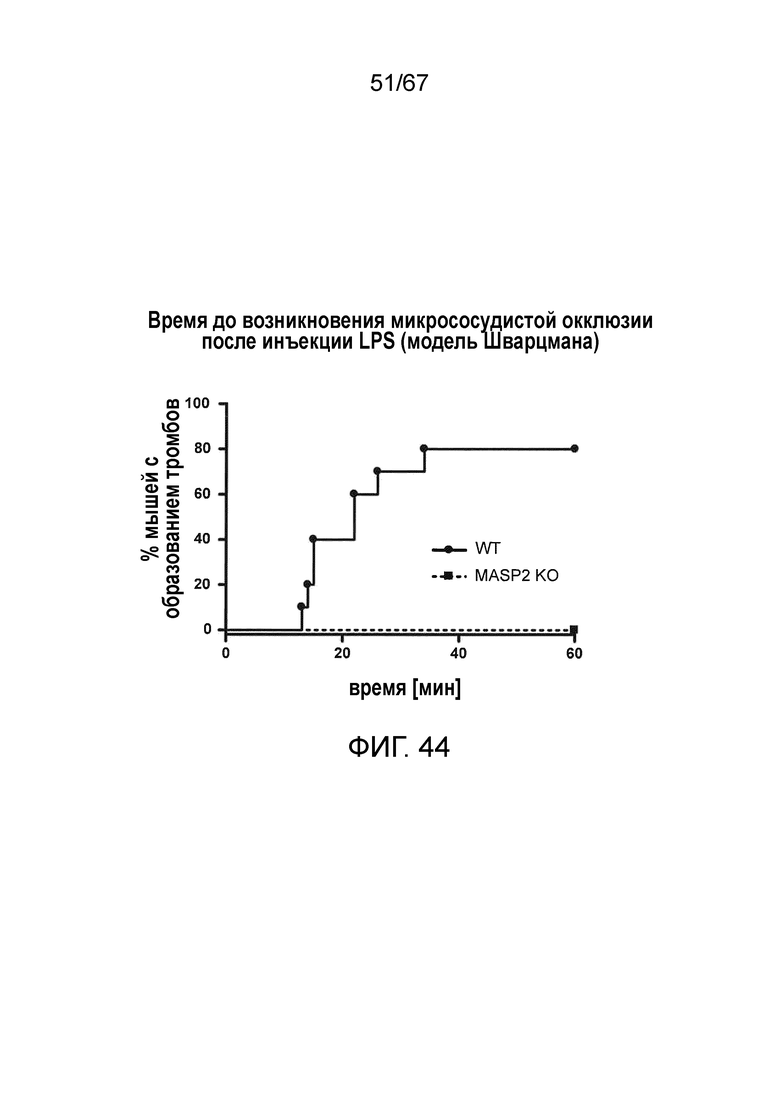
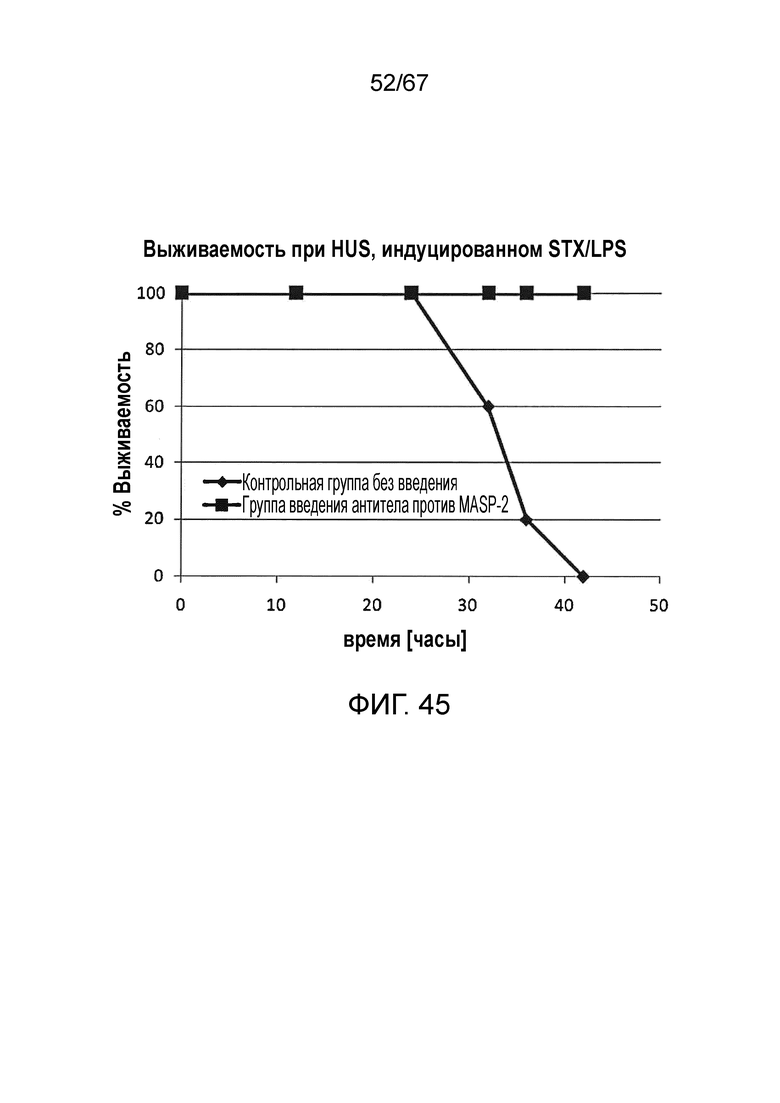
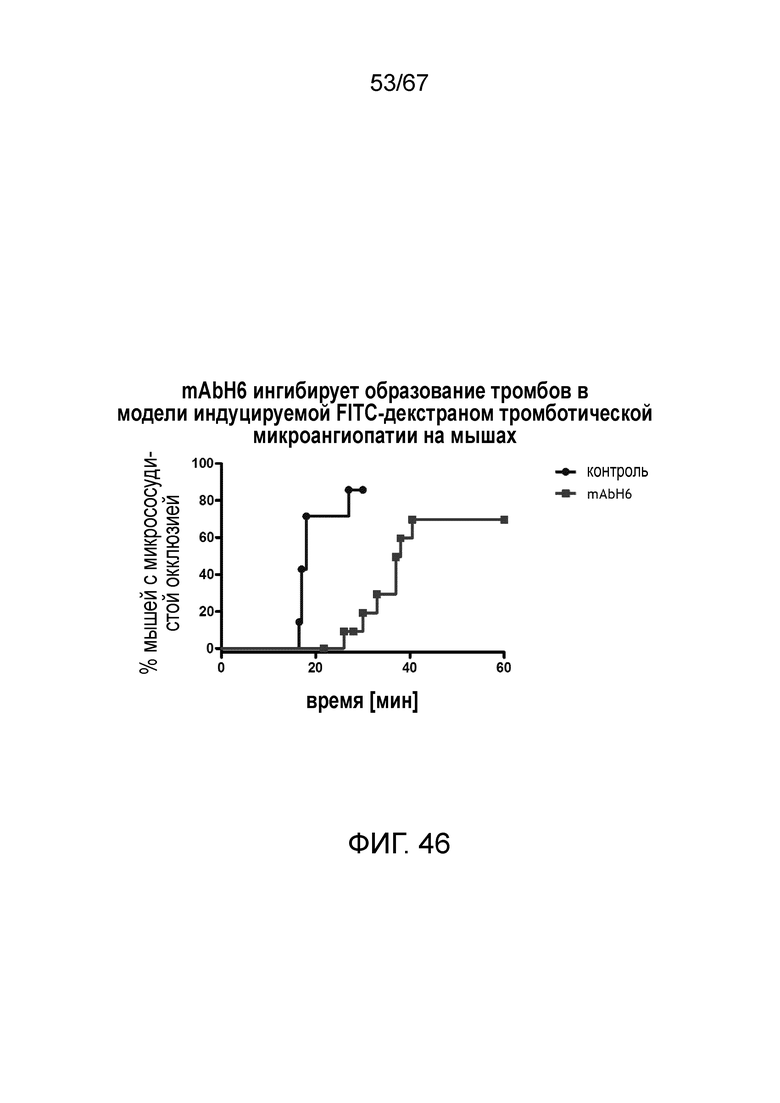
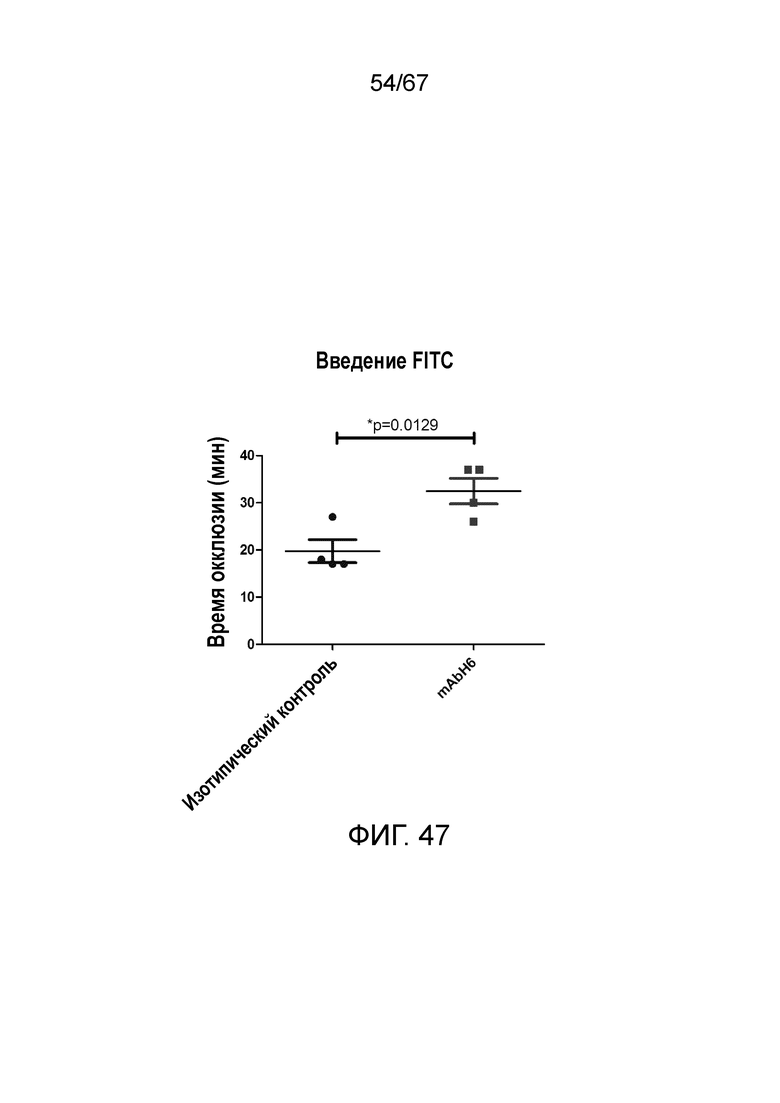
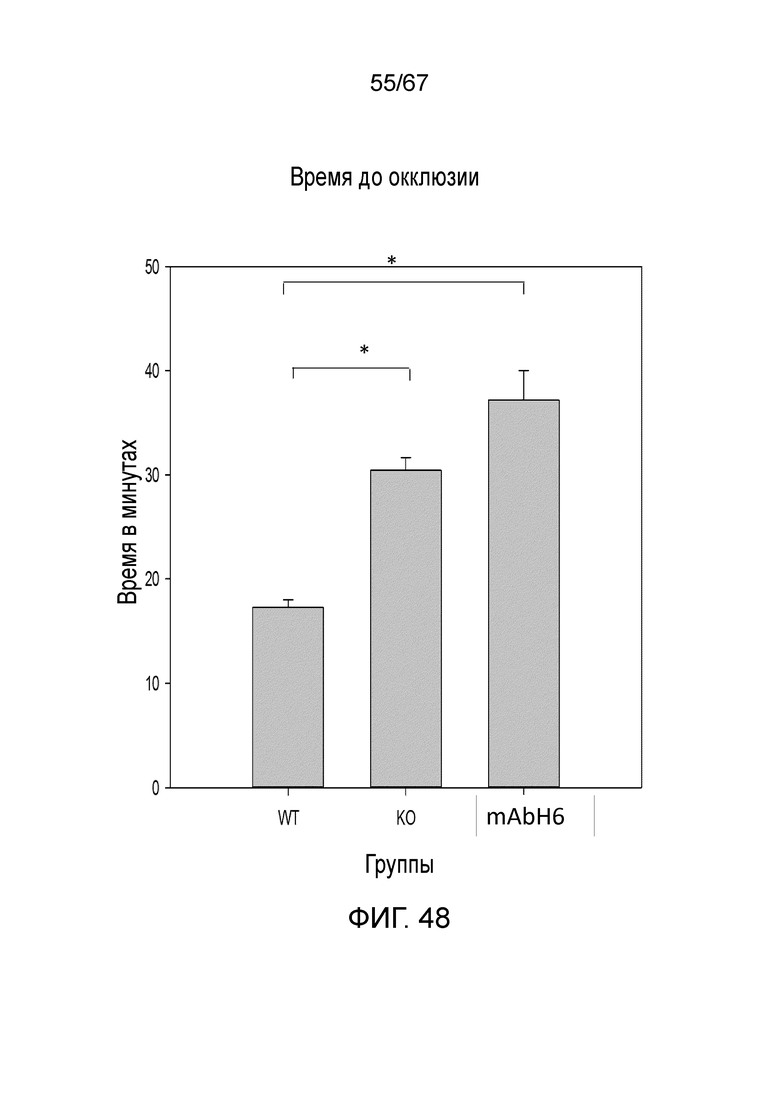
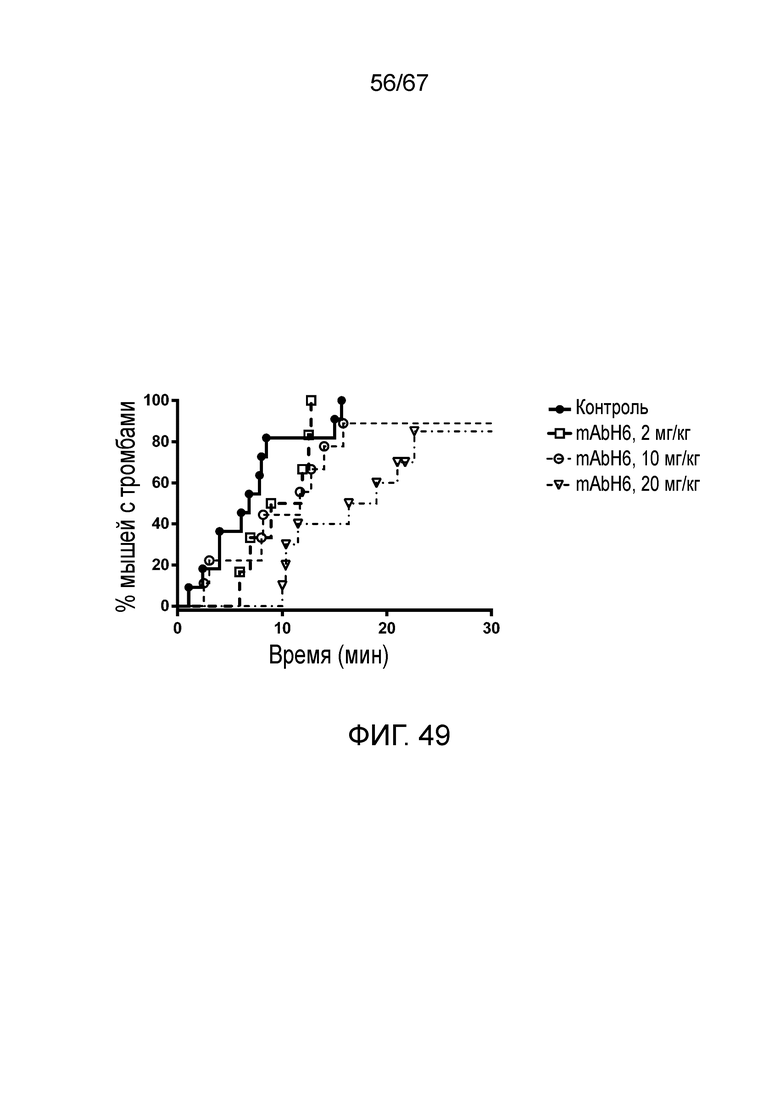
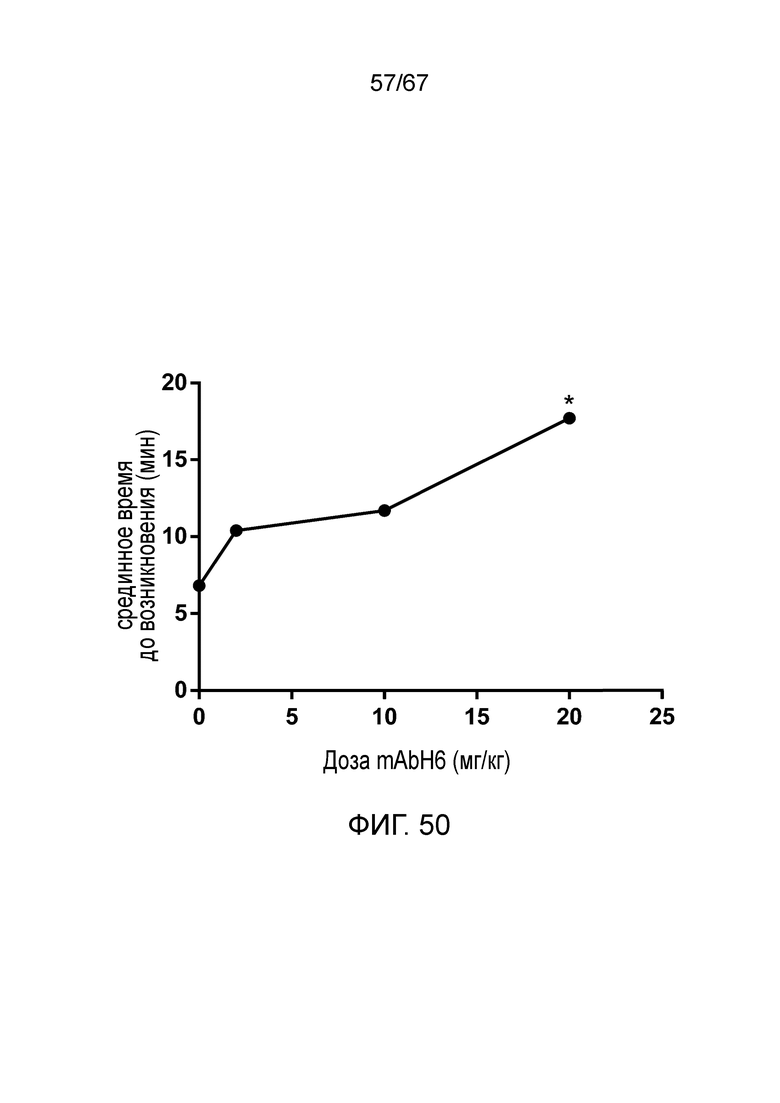
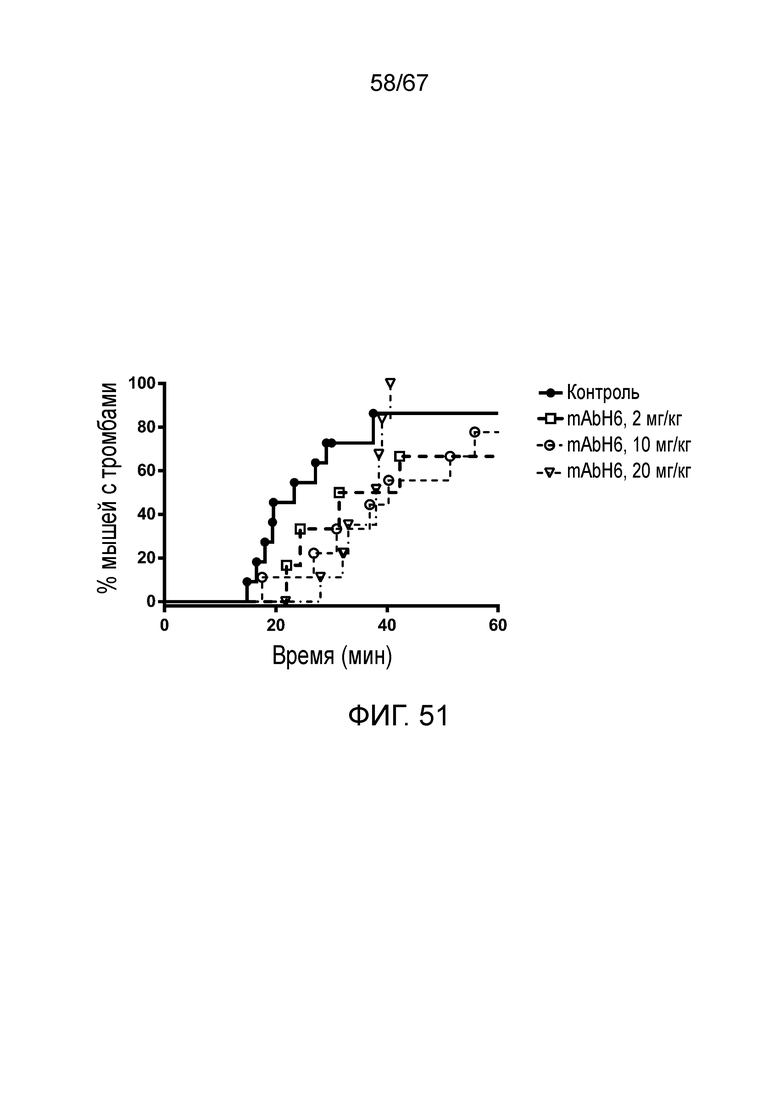
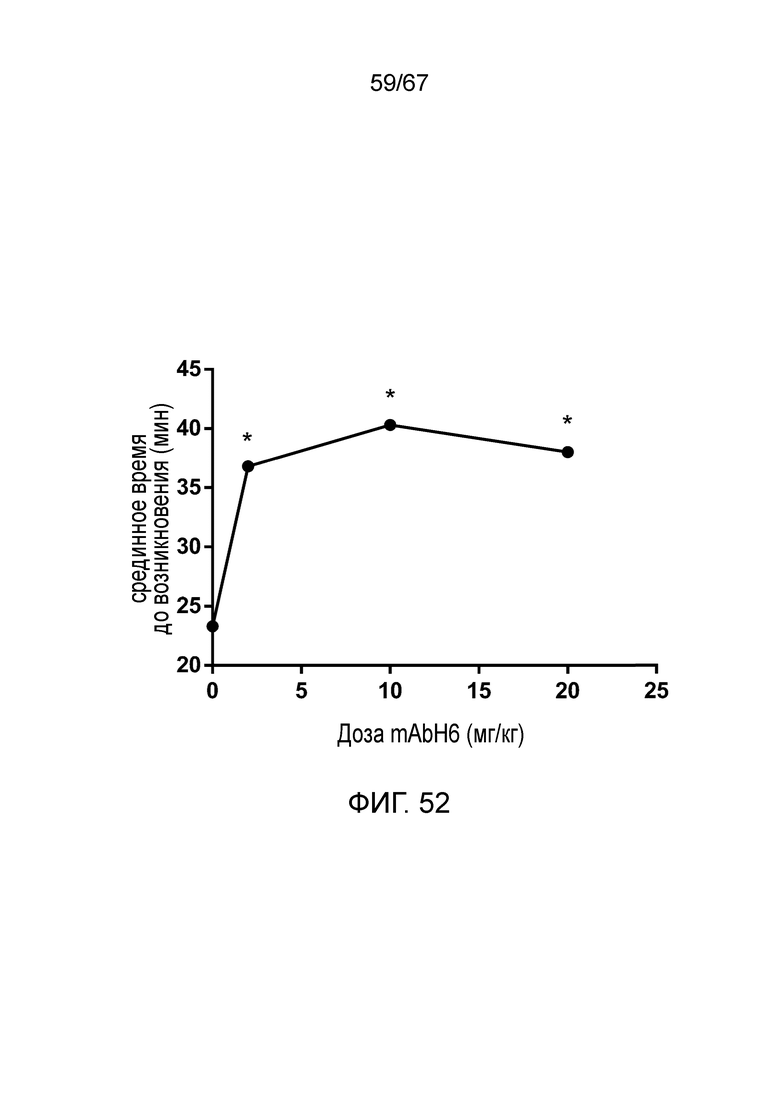
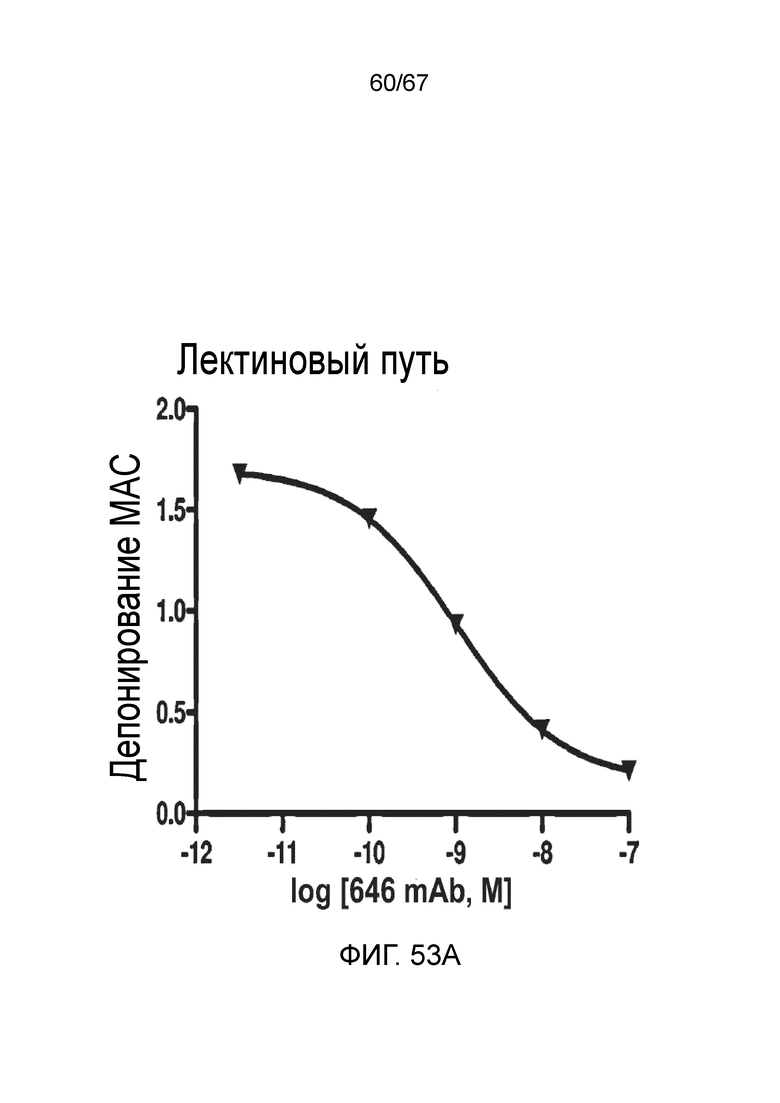
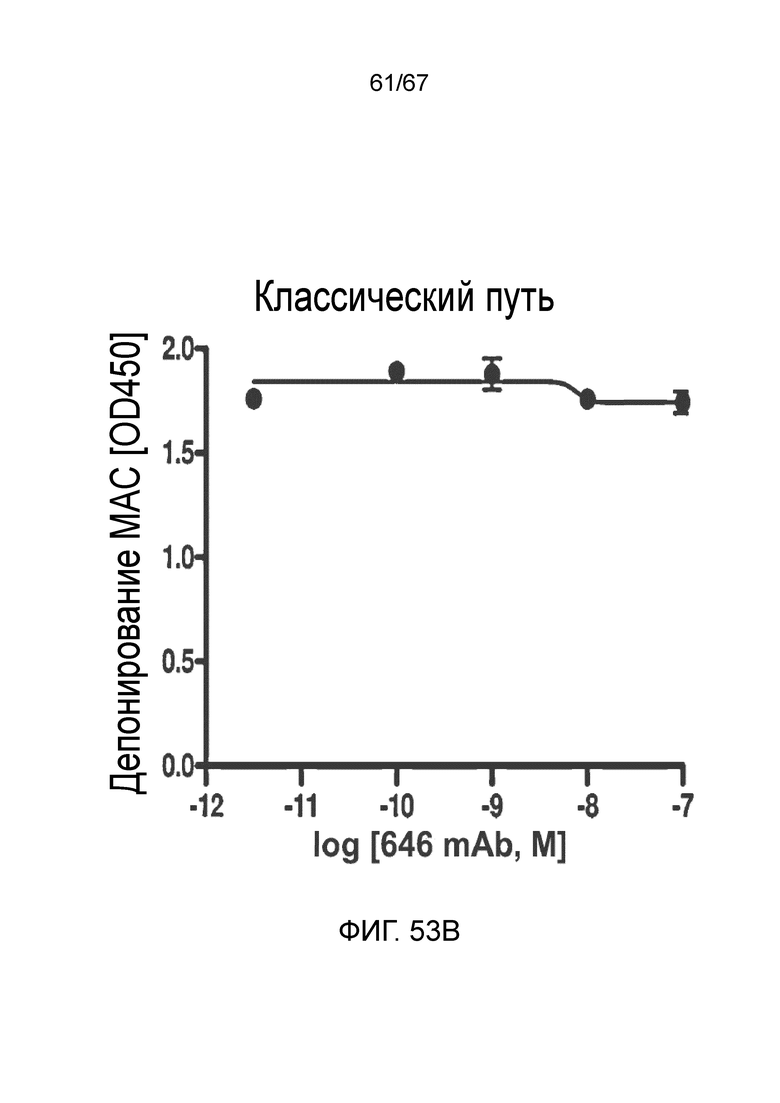
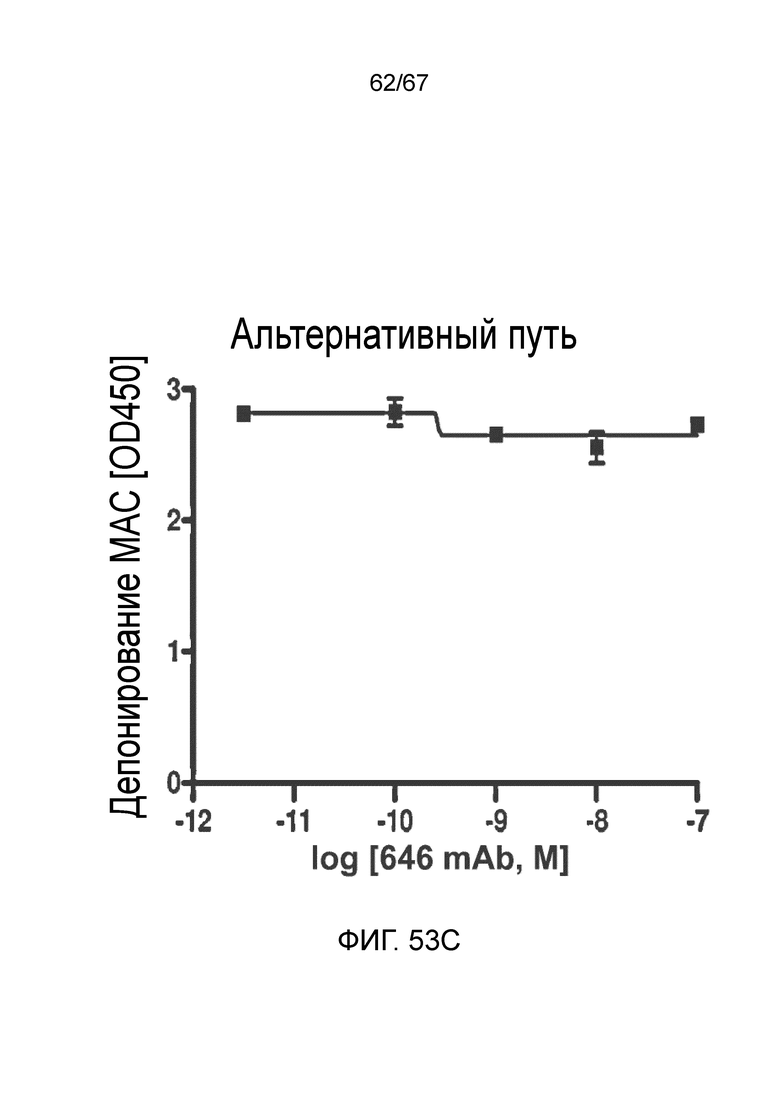
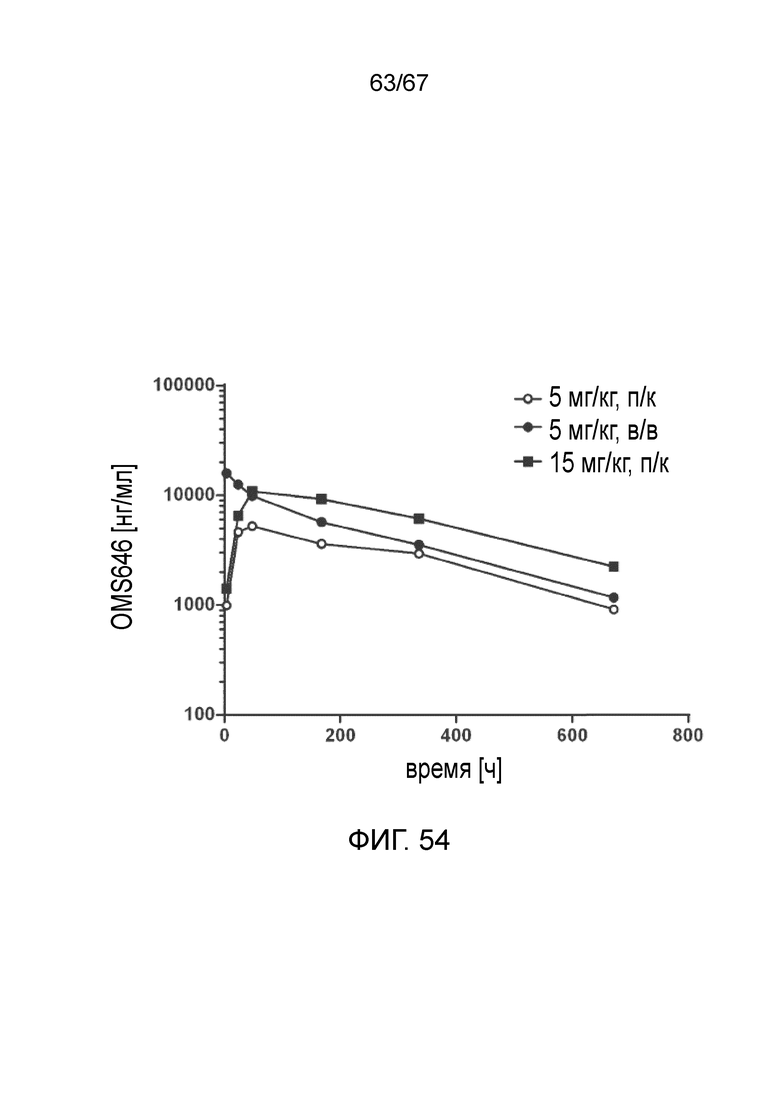
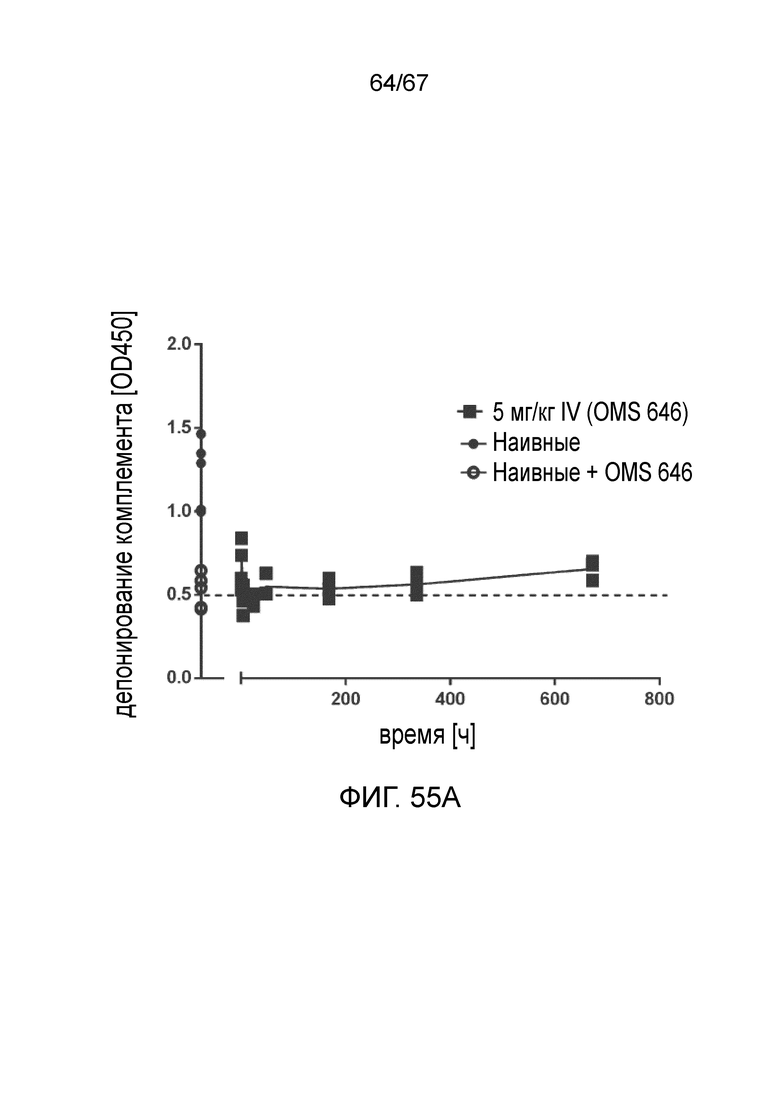
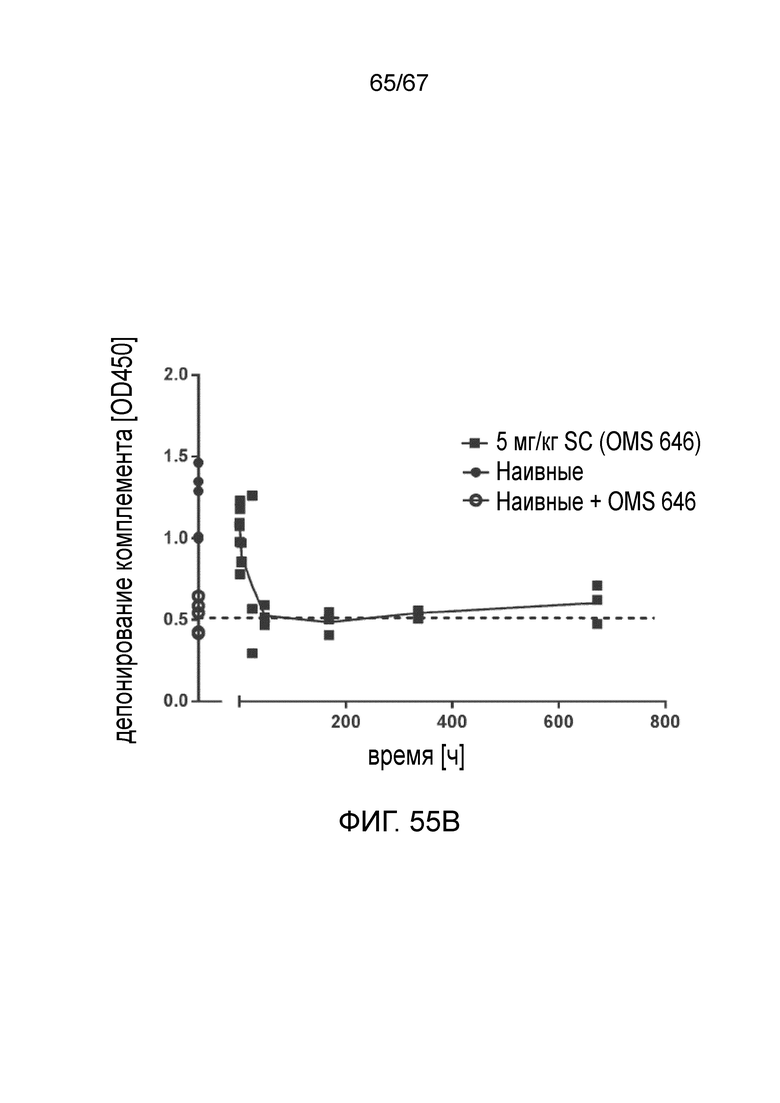
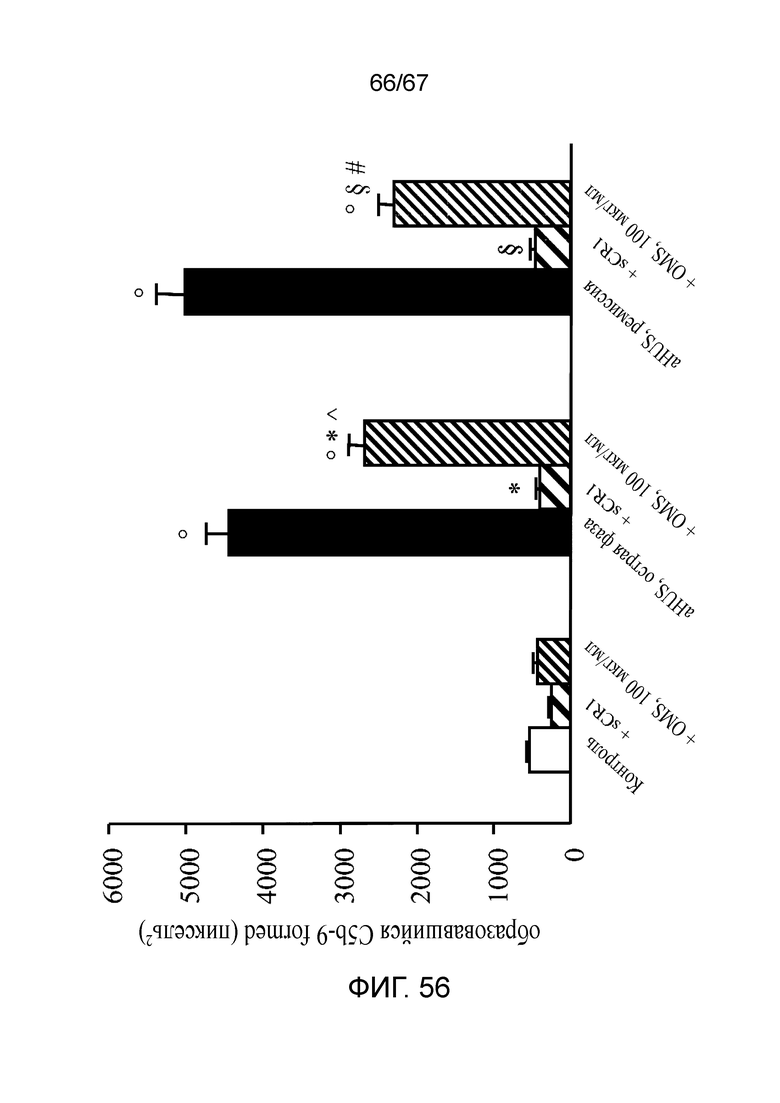
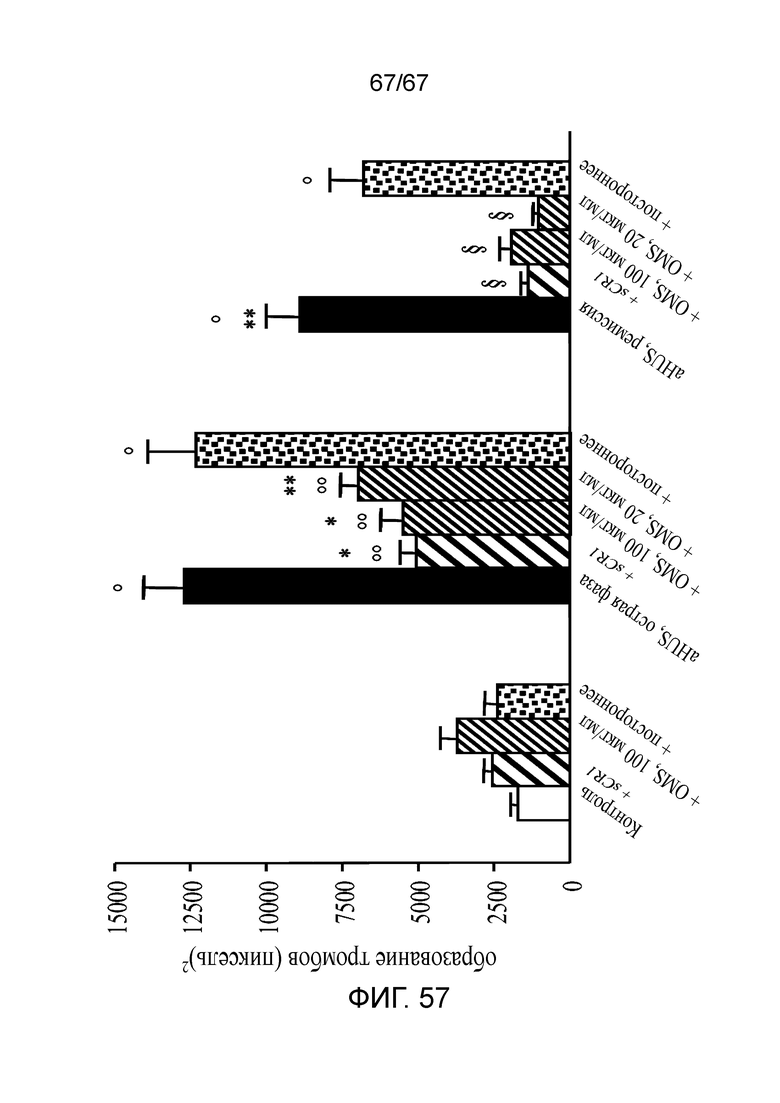
Изобретение относится к области биотехнологии. Предложено применение композиции, содержащей количество ингибирующего MASP-2 антитела, которое ингибирует MASP-2-зависимую активацию комплемента при получении лекарственного средства для лечения или снижения риска развития или снижения тяжести тромботической микроангиопатии (TMA) на фоне трансплантации стволовых клеток, у субъекта, получившего аллогенную трансплантацию гемопоэтических стволовых клеток. Ингибирующее MASP-2 антитело представляет собой моноклональное антитело против MASP-2 или его антигенсвязывающий фрагмент, который селективно ингибирует активацию комплемента MASP-2 без существенного ингибирования C1q-зависимого классического пути комплемента. Изобретение позволяет ингибировать клеточное повреждение, ассоциированное с опосредуемой MASP-2 активацией альтернативного пути комплемента, сохраняя компонент иммунной системы, представляющий собой классический (C1q-зависимый) путь, интактным. 15 з.п. ф-лы, 76 ил., 42 табл., 43 пр.
1. Применение композиции, содержащей количество ингибирующего MASP-2 антитела, которое ингибирует MASP-2-зависимую активацию комплемента при получении лекарственного средства для лечения или снижения риска развития или снижения тяжести тромботической микроангиопатии (TMA) на фоне трансплантации стволовых клеток, у субъекта, который получил аллогенную трансплантацию гемопоэтических стволовых клеток, где ингибирующее MASP-2 антитело представляет собой моноклональное антитело против MASP-2 или его антигенсвязывающий фрагмент, который специфически связывается с частью SEQ ID NO: 6 и селективно ингибирует активацию комплемента MASP-2 без существенного ингибирования C1q-зависимого классического пути комплемента.
2. Применение по п.1, где лекарственное средство дополнительно включает ингибитор терминального пути комплемента, который ингибирует расщепление белка C5 комплемента.
3. Применение по п.2, где ингибитор терминального пути комплемента представляет собой гуманизированное антитело против C5 или его антигенсвязывающий фрагмент.
4. Применение по п.2, где ингибитор терминального пути комплемента представляет собой экулизумаб.
5. Применение по п.1, где антитело или его фрагмент выбраны из группы, состоящей из рекомбинантного антитела, антитела, имеющего сниженную эффекторную функцию, химерного антитела, гуманизированного антитела и антитела человека.
6. Применение по п.1, где лекарственное средство составлено для доставки подкожно, внутримышечно, артериально, внутривенно или в качестве ингалируемого средства.
7. Применение по п.1, где указанное ингибирующее MASP-2 антитело связывает человеческий MASP-2 с KD 10 нМ или менее.
8. Применение по п.1, где указанное ингибирующее MASP-2 антитело связывает эпитоп в домене CCP1 MASP-2.
9. Применение по п.1, где указанное ингибирующее MASP-2 антитело ингибирует депонирование C3b в анализе in vitro в 1% человеческой сыворотке с IC50 10 нМ или менее.
10. Применение по п.1, где указанное ингибирующее MASP-2 антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fv, Fab, Fab', F(ab)2 и F(ab')2.
11. Применение по п.1, где указанное ингибирующее MASP-2 антитело является одноцепочечной молекулой.
12. Применение по п.1, где указанное ингибирующее антитело MASP-2 выбрано из группы, состоящей из молекулы IgG1, IgG2 и молекулы IgG4.
13. Применение по п.12, где молекула IgG4 содержит мутацию S228P.
14. Применение по п.1, где ингибирующее MASP-2 моноклональное антитело или его антигенсвязывающий фрагмент содержит:
(a) вариабельный участок тяжелой цепи, содержащий: i) CDR-H1 тяжелой цепи, содержащий аминокислотную последовательность положений 31-35 SEQ ID NO:67; и ii) CDR-H2 тяжелой цепи, содержащий аминокислотную последовательность положений 50-65 SEQ ID NO:67; и iii) CDR-H3 тяжелой цепи, содержащий аминокислотную последовательность положений 95-102 SEQ ID NO:67, и
(b) вариабельный участок легкой цепи, содержащий: i) CDR-L1 легкой цепи, содержащий аминокислотную последовательность положений 24-34 SEQ ID NO:70; и ii) CDR-L2 легкой цепи, содержащий аминокислотную последовательность положений 50-56 SEQ ID NO:70; и iii) CDR-L3 легкой цепи, содержащий аминокислотную последовательность положений 89-97 SEQ ID NO: 70.
15. Применение по п.1, где ингибирующее моноклональное антитело MASP-2 содержит вариабельный участок тяжелой цепи, содержащий аминокислотную последовательность, имеющую по меньшей мере 95% идентичность аминокислотной последовательности, представленной как SEQ ID NO:67, и вариабельный участок легкой цепи, содержащий аминокислотную последовательность, имеющую по меньшей мере 95% идентичность с аминокислотной последовательностью, представленной как SEQ ID NO:70.
16. Применение по п.1, в котором ингибирующее антитело MASP-2 или его связывающий антиген фрагмент содержит вариабельный участок тяжелой цепи, указанный в SEQ ID NO:67, и вариабельный участок легкой цепи, указанный в SEQ ID NO:70.
| US 20120225056 A1, 06.09.2012 | |||
| US 20110311549 A1, 22.12.2011 | |||
| US 20120282263 A1, 08.11.2012 | |||
| WO 2004106384 A1, 09.12.2004 | |||
| JACQUET M | |||
| et al., Deciphering complement receptor type 1 interactions with recognition proteins of the lectin complement pathway, J IMMUNOL., April 1, 2013, vol.190, no.7, pp.3721-3731 | |||
| КУДРЯВЦЕВ И.В | |||
| и др., Эволюция каскада |
Авторы
Даты
2020-04-15—Публикация
2014-10-17—Подача