Настоящее изобретение относится к дозировке и схеме введения антител против С5, в частности, антитела против С5 кровалимаба, для применения в способе лечения или предупреждения у субъекта связанного с С5 заболевания, включающего пароксизмальную ночную гемоглобинурию (PNH). Дозировка и схема введения по настоящему изобретению включает введение антитела против С5, предпочтительно антитела против С5 кровалимаба, с ударными дозами, с последующим введением субъекту (а) поддерживающей(щих) дозы(доз) антитела против С5, где исходно вводимая ударная доза дается субъекту внутривенно, а остальные ударные и поддерживающие дозы вводятся подкожно в меньшей дозировке, чем вводимая внутривенно ударная доза.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Система комплемента играет центральную роль в клиренсе иммунных комплексов и в иммунных ответах на инфекционные агенты, чужеродные антигены, инфицированные вирусом клетки и опухолевые клетки. Имеются примерно 25-30 белков комплемента, которые находятся в виде набора комплексов белков плазмы и мембранных кофакторов. Компоненты комплемента достигают их иммунозащитных функций посредством взаимодействия в ряде сложных событий ферментативных расщеплений и связывания с мембраной. Образующиеся каскады комплемента приводят к образованию продуктов с опсоническими, и ммуно регулирующим и и литическими функциями.
Система комплемента может активироваться посредством трех отличных путей: классического пути, лектинового пути и альтернативного пути. Данные пути имеют многие общие компоненты и, в то время как они отличаются по их исходным стадиям, они сходятся и имеют те же самые общие конечные компоненты комплемента (от С5 до С9), ответственные за активацию и разрушение клеток-мишеней.
Классический путь обычно активируется посредством образования комплексов антиген-антитело. Независимо первой стадией в активации лектинового пути является связывание специфичных лектинов, таких как маннансвязывающий лектин (MBL), Н-фиколин, М-фиколин, L-фиколин и лектин С-типа CL-11. В отличие от этого, при альтернативном пути спонтанно осуществляется низкий уровень активации обмена, который может легко усиливаться на чужеродных или других ненормальных поверхностях (бактерии, дрожжи, инфицированные вирусом клетки или поврежденная ткань). Данные пути сходятся в точке, где компонент комплемента С3 расщепляется активной протеазой с образованием С3а и C3b.
С3а представляет собой анафилотоксин. C3b связывается с бактериальными и другими клетками, а также с определенными вирусами и иммунными комплексами, и метит их для удаления из системы кровообращения (роль, известная как опсонин). C3b также образует комплекс с другими компонентами с образованием конвертазы С5, которая расщепляет С5 до С5а и C5b.
С5 представляет собой 190 кДа белок, находящийся в нормальной сыворотке в концентрации приблизительно 80 мкг/мл (0,4 мкМ). С5 является гликозилированным, причем примерно 1,5-3,0% его массы приписывается углеводу. Зрелый С5 представляет собой гетеродимер из 115 кДа альфа-цепи, которая связывается дисульфидом с 75 кДа бета-цепью. С5 синтезируется в виде одноцепочечного белка-предшественника (про-С5 предшественника) из 1676 аминокислот (см., например, US-B1 6355245 и US-B1 7432356). Данный про-С5 предшественник расщепляется с образованием бета-цепи в виде аминоконцевого фрагмента и альфа-цепи в виде карбоксиконцевого фрагмента. Полипептидные фрагменты - альфа-цепь и бета-цепь - соединяются друг с другом посредством дисульфидной связи и составляют зрелый белок С5.
Терминальный путь системы комплемента начинается с захвата и расщепления С5. Зрелый С5 расщепляется на фрагменты С5а и C5b во время активации путей комплемента. С5а отщепляется от альфа-цепи С5 конвертазой С5 в виде аминоконцевого фрагмента, содержащего первые 74 аминокислоты альфа-цепи. Остальная часть зрелого С5 представляет собой фрагмент C5b, который содержит остальную альфа-цепь, связанную дисульфидной связью с бета-цепью. Приблизительно 20% от 11 кДа массы С5а приписываеся углеводу.
С5а представляет собой другой анафилатоксин. C5b объединяется с С6, С7, С8 и С9 с образованием комплекса атаки мембраны (MAC, C5b-9, терминального комплекса комплемента (ТСС)) на поверхности клетки-мишени. При вставке в мембраны клеток-мишеней достаточного числа MAC образуются поры MAC для опосредования быстрого осмотического лизиса клеток-мишеней.
Как упомянуто выше, С3а и С5а представляют собой анафилатоксины. Они могут запускать дегранулирование тучных клеток, что высвобождает гистамин и другие медиаторы воспаления, приводя к сокращению гладких мышц, повышенной проницаемости сосудов, активации лейкоцитов и другим воспалительным явлениям, включающим пролиферацию клеток, приводящую к гиперцеллюлярности. С5а также функционирует в качестве хемотаксического пептида, который служит для привлечения гранулоцитов, таких как нейтрофилы, эозинофилы, базофилы и моноциты, к сайту активации комплемента.
Активность С5а регулируется плазматическим ферментом карбоксипептидазой N, который удаляет карбокси конце вой аргинин от С5а, образуя С5а-дез-Агд производное. С5а-дез-Агд демонстрирует только 1% анафилактической активности и полиморфоядерной хемотаксической активности немодифицированного С5а.
В то время как правильно функционирующая система комплемента обеспечивает надежную защиту против инфицирующих микробов, неподходящая регуляция или активация комплемента вовлекалась в патогенез целого ряда расстройств, включающих, например, пароксизмальную ночную гемоглобинурию (PNH); ревматоидный артрит (RA); волчаночный нефрит; ишемическое реперфузионное повреждение; атипический гемолитический уремический синдром (aHUS); болезнь плотного осадка (DDD); макулодистрофию (например, возрастную макулодистрофию (AMD)); синдром гемолиза, повышенного уровня ферментов печени и уменьшенного числа тромбоцитов (HELLP); тромботическую тромбоцитопеническую пурпуру (ТТР); спонтанную потерю плода; слабоиммунный васкулит; буллезный эпидермолиз; рецидивирующую потерю плода; рассеянный склероз (MS); травматическое повреждение мозга и повреждение, возникающее из-за инфаркта миокарда, сердечно-легочного шунтирования и гемодиализа (см., например, Holers et al., Immunol. Rev. (2008), Vol. 223, pp. 300-316). Следовательно, ингибирование избыточных или неконтролируемых активаций каскада комплемента может давать клиническую пользу пациентам с такими расстройствами.
Пароксизмальная ночная гемоглобинурия (PNH) представляет собой необычное расстройство крови, при котором красные кровяные клетки (эритроциты) подвергаются риску и, таким образом, разрушаются быстрее, чем нормальные эритроциты. PNH возникает из-за клонального размножения гематопоэтических стволовых клеток с соматическими мутациями в гене PIG-A (фосфатидилинозитолгликан класса А), который расположен на X хромосоме.
Мутации в PIG-A приводят к ранней блокировке в синтезе гликозилфосфатидилинозитола (GPI) - молекулы, которая требуется для заякоривания многих белков на поверхностях клеток. Следовательно, кровяные клетки PNH являются дефицитными по GPI-заякоренным белкам, которые включают комплемент-регулирующие белки CD55 и CD59. При нормальных обстоятельствах данные комплемент-регулирующие белки блокируют образование MAC на поверхностях клеток, предотвращая, посредством этого, лизис эритроцитов. Отсутствие GPI-заякоренных белков вызывает опосредованный комплементом гемолиз при PNH.
PNH отличается гемолитической анемией (пониженное число эритроцитов), гемоглобинурией (присутствие гемоглобина в моче, особенно очевидное после сна) и гемоглобинемией (присутствие гемоглобина в кровотоке). Известно, что субъекты, пораженные PNH, имеют приступы, которые здесь определяются как возникновения случаев темноокрашенной мочи. Гемолитическая анемия обусловлена внутрисосудистым разрушением эритроцитов компонентами комплемента. Другие известные симптомы включают дисплазию, слабость, эректильную дисфункцию, тромбоз и рецидивирующую абдоминальную боль.
Экулизумаб представляет собой гуманизированное моноклональное антитело, направленное против белка комплемента С5, и первую терапию, одобренную для лечения пароксизмальной ночной гемоглобинурии (PNH) и атипического гемолитического уремического синдрома (aHUS) (см., например, Dmytrijuk et al, The Oncologist (2008), 13(9), pp. 993-1000). Экулизумаб ингибирует расщепление C5 на C5a и C5b посредством C5 конвертазы, что предотвращает образование терминального комплекса комплемента C5b-9. И С5а, и C5b-9 вызывают события, опосредованные терминальным комплементом, которые характерны для PNH и aHUS (см., например, WO-A2 2005/074607, WO-А1 2007/106585, WO-A2 2008/069889 и WO-A2 2010/054403). Для лечения PNH антитела против С5 экулизумаб или равулизумаб представляют собой обычную терапию. Однако вплоть до 3,5% индивидов азиатского происхождения несут полиморфизмы в С5, влияющие на Arg885, который соответствует сайту связывания экулизумаба или равулизумаба (Nishimura era/., N Engl J Med, Vol.370, pp.632-639 (2014); DOI: 10.1056/NEJMoa 1311084). Пациенты с PNH с данными полиморфизмами испытывают плохой контроль внутрисосудистого гемолиза экулизумабом или равулизумабом, таким образом, составляя группу с высокой неудовлетворенной медицинской потребностью.
В нескольких сообщениях были описаны антитела против С5. Например, в WO 95/29697 было описано антитело против С5, которое связывается с альфа-цепью С5, но не связывается с С5а и блокирует активацию С5. В WO-A2 2002/30985 описано моноклональное антитело против С5, которое ингибирует образование С5а. С другой стороны, в WO-A1 2004/007553 описано антитело против С5, которое распознает протеолитический сайт для С5 конвертазы на альфа-цепи С5 и ингибирует превращение С5 до С5а и C5b. В WO-A1 2010/015608 описано антитело против С5, которое имеет константу аффинности по меньшей мере 1×107 М-1. Кроме того, в WO-A1 2017/123636 и WO-A1 2017/132259 описаны антитела против С5. Кроме того, в WO-A 2016/098356 раскрыто получение антитела против С5, отличающегося связыванием с эпитопом в пределах бета-цепи С5 с более высокой аффинностью при нейтральном рН, чем при кислотном рН. Одно из антител против С5, раскрытое в WO-A1 2016/098356, относится к антителу против С5 кровалимабу (см. Пример 1 ниже относительно подробностей). Кровалимаб представляет собой антитело против С5, которое связывается с отличным эпитопом на бета-субъединице С5, который является отличным от эпитопа связывания экулизумаба/равулизумаба. Исследования in vitro продемонстрировали то, что антитело против С5 кровалимаб одинаково связывается с и ингибирует активность С5 дикого типа и мутанта по Arg885 (Fukuzawa er al., Sci Rep, 7(1): 1080. doi: 10.1038/s41598-017-01087-7 (2017)). В отличие от этого в WO-A1 2017/104779 на Фиг. 21 приводится то, что антитело против С5 экулизумаб не ингибирует мутант С5 по Arg855. Кроме того, WO-A1 2018/143266 относится к фармацевтическим композициям для применения в лечении или предупреждении заболевания, связанного с С5. Кроме того, в WO-A1 2018/143266 раскрыты дозировки и схемы введения антитела против С5 кровалимаба в том виде, в котором они используются в исследовании COMPOSER (ВР39144). Исследование COMPOSER относится к глобальному, многоцентровому открытому исследованию фазы I/II для оценки безопасности и эффективности, фармакокинетики (РК) и фармакодинамики (PD) антитела против С5 кровалимаба у здоровых субъектов и субъектов с PNH. Исследование COMPOSER содержало три части: часть 1 у здоровых участников, часть 2 и часть 3 у пациентов с пароксизмальной ночной гемоглобинурией (PNH). Дополнительно пациенты, охватываемые в части 3 данного исследования, были пациентами, которых лечили антителом против С5 экулизумабом в течение по меньшей мере 3 месяцев. Было задумано так, что участники части 1 исследования COMPOSER включали три группы здоровых пациентов: согласно исходному замыслу протокола первая группа представляет собой группу пациентов, которым антитело против С5 кровалимаб вводится внутривенно (в.в.) один раз в дозе 75 мг/организм; вторая группа пациентов представляет собой группу участников, которым антитело против С5 кровалимаб вводится внутривенно (в.в.) один раз в дозе 150 мг/организм, и третья группа представляет собой группу субъектов, которым антитело против С5 кровалимаб вводится подкожно (п.к.) один раз в дозе 170 мг/организм. Поскольку часть 1 исследования COMPOSER является адаптивной по природе (на основе продолжающейся оценки данных безопасности, переносимости, фармакокинетики (РК) и фармакодинамики (PD)), фактические дозы, которые давали для части 1, составляли: 75 мг в.в. для первой группы пациентов, 125 мг в.в. для второй группы пациентов, и 100 мг п. к. для третьей группы пациентов, зарегистрированных в части 1 исследования COMPOSER.
Часть 2 исследования COMPOSER была разработана для включения группы субъектов, которым антитело против С5 кровалимаб вводится внутривенно три раза: согласно исходному замыслу протокола антитело против С5 кровалимаб исходно вводилось в дозе 300 мг/организм (в.в.), затем - 500 мг/организм (в.в.) через неделю после исходного введения и наконец - 1000 мг/организм (в.в.) через две недели после второго введения. Начиная с двух недель после последнего внутривенного введения, антитело против С5 кровалимаб вводится подкожно один раз в неделю в дозе 170 мг/организм. На основе возникающих клинических данных из части 1 и симуляции РК исходная доза для пациентов в части 2 исследования COMPOSER была изменена от 300 мг до 375 мг в.в. Таким образом, фактические дозы, которые дают в части 2 исследования COMPOSER являются следующими: антитело против С5 кровалимаб исходно вводится внутривенно (в.в.) в дозе 375 мг/организм, с последующей дозой 500 мг/организм (в.в.) через неделю после исходного введения и, наконец, 1000 мг/организм (в.в.) через две недели после второго введения. Начиная с двух недель после конечного внутривенного введения, антитело против С5 кровалимаб вводится подкожно (п.к.) один раз в неделю в дозе 170 мг/организм.
Часть 3 данного исследования включала пациентов, которых лечили антителом против С5 экулизумабом в течение трех месяцев до регистрации в данном испытании, и данные пациенты должны были получать регулярные инфузии экулизумаба. Часть 3 данного исследования была спланирована для включения трех групп субъектов. Антитело против С5 кровалимаб исходно вводится субъектам всех групп внутривенно один раз в дозе 1000 мг/организм. Начиная с одной недели после исходного внутривенного введения (сутки 8 после исходного в.в. введения), антитело против С5 кровалимаб подкожно вводится субъектам первой группы один раз каждую неделю в дозе 170 мг/организм, субъектам второй группы один раз каждые две недели в дозе 340 мг/организм и субъектам третьей группы один раз каждые четыре недели в дозе 680 мг/организм. В части 3 COMPOSER у всех пациентов с PNH, которые переключились с антитела против С5 экулизумаба на кровалимаб, были выявлены комплексы лекарственное средство-мишень-лекарственное средство (DTDC) между кровалимабом, человеческим С5 и антителом экулизумабом. DTDC запускают временное увеличение клиренса кровалимаба, что может потенциально увеличивать риск временной потери полного ингибирования терминального пути комплемента (см. Roth et al., Blood (2020), Vol.135, pp.912-920; doi: 10.1182/blood.2019003399 и Sostelly et al., Blood (2019), Vol.134, p.3745).
Кроме того, в WO-A1 2018/143266 описано то, что иммунокомплексы (лекарственное средство-мишень-лекарственное средство) между кровалимабом, человеческим С5 и антителом экулизумабом могли образоваться у субъектов, которых лечили экулизумабом. При переключении субъектов, особенно субъектов, для которых необходимо сохраняющееся полное ингибирование С5, таких как пациенты с PNH или aHUS, с антитела против С5 экулизумаба на кровалимаб, оба антитела против С5 присутствуют в системе кровообращения и образуют комплексы лекарственное средство-мишень-лекарственное средство (DTDC), так как они связываются с разными эпитопами человеческого С5. Данные DTDC строятся из повторения цепи молекул экулизумаб-С5-кровалимаб-С5 и могут расти при сборке двух DTDC с образованием большего DTDC. Целью лечения пациентов, охватываемых в части 3 исследования COMPOSER, кровалимабом является обеспечение быстрого и сохраняющегося полного ингибирования терминального пути комплемента. Однако комплексы лекарственное средство-мишень-лекарственное средство (DTDC), состоящие из кровалимаба, человеческого С5 и экулизумаба, были выявлены у всех пациентов, переключающихся с экулизумаба в части 3 COMPOSER. DTDC и особенно большие DTDC более медленно подвергаются клиренсу и с большей вероятностью вызывают токсичность. Поскольку образование таких DTDC может вызывать потенциальные риски, такие как ухудшение кровообращения, риск васкулита из-за размеров комплексов, реакции гиперчувствительности типа III или ненормальную активацию системы комплемента, следует избегать образования таких DTDC (см. также Roth et al., Blood (2020), Vol., 135, pp.912-920; doi: 10.1182/blood.2019003399).
Кроме того, антитело против С5 кровалимаб на основе его механизма действия ингибирует опосредованный комплементом лизис красных кровяных клеток (эритроцитов), не имеющих регуляторных белков комплемента. Если терминальный путь комплемента временно не блокируется во время интервала лечения, данные красные кровяные клетки (эритроциты) будут лизированы, и это может приводить к прорывному гемолизу, который является тяжелым клиническим осложнением у пациентов с PNH. Биологический стресс (инфекция, хирургическое вмешательство, беременность) приводит к физиологической активации пути комплемента с повышающей регуляцией С5 (Schutte et al., Int Arch Allergy Appl Immunol. (1975), Vol. 48(5), pp.706-720). У пациентов с PNH, следовательно, важно не только поддерживать полную блокаду активности терминального комплемента во всем интервале дозирования, но также сохранять резерв свободных сайтов связывания кровалимаба для минимизации появления прорывного гемолиза.
Соответственно, существует потребность в идентификации дозировки и схемы введения, которая (1) минимизирует образование DTDC у пациентов, страдающих от заболеваний, связанных с С5, и, в частности, у пациентов, переключающихся с антитела против С5 экулизумаба на кровалимаб, (2) максимизирует уровень свободных сайтов связывания кровалимаба и (3) обеспечивает то, что у пациентов сохраняется превышение целевой пороговой концентрации антитела против С5, требующейся для ингибирования терминального комплемента, несмотря на вариабельность между индивидами.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Данная потребность решается настоящим изобретением посредством предоставления воплощений, как определено в формуле изобретения.
Настоящее изобретение относится к антителу против С5 для применения в способе лечения или предупреждения связанного с С5 заболевания у субъекта, где данный способ включает следующие последовательные стадии:
(а) внутривенное введение субъекту ударной дозы 1500 мг антитела против С5 один раз, с последующим подкожным введением данному субъекту по меньшей мере одной ударной дозой 340 мг антитела против С5; и
(б) подкожное введение данному субъекту по меньшей мере одной поддерживающей дозы 1020 мг антитела против С5.
В контексте настоящего изобретения субъект, подлежащий лечению, предпочтительно представляет собой пациента с массой тела, равной или большей, чем 100 кг. В контексте настоящего изобретения субъект, подлежащий лечению, представляет(ют) собой субъекта (то в), который(рые) страдает(ют) от связанного с С5 заболевания, которое требует ингибирования активности комплемента (например, PNH и aHUS). Кроме того, данное изобретение направлено на применение антитела против С5 для лечения или предупреждения связанного с С5 заболевания, в частности, PNH. В контексте настоящего изобретения настоящее изобретение направлено на лечение или предупреждение связанного с С5 заболевания, в частности, PNH, у пациентов, которых лечили одним пригодным фармацевтическим продуктом для лечения или предупреждения связанного с С5 заболевания, в частности, PNH, и где вводимая внутривенно ударная доза антитела против С5 вводится субъекту после последней дозы фармакологического продукта. Соответственно, описанная в данном документе дозировка и схема введения антитела против С5, в частности, антитела против С5 кровалимаба, дается пациентам, которых лечили одним полезным фармацевтическим продуктом для лечения или предупреждения связанного с С5 заболевания, в частности, PNH. Как более подробно объясняется ниже, полезный фармацевтический продукт для лечения связанного с С5 заболевания, который давали субъектам до начала заявленной дозировки и схемы лечения, относится к антителу против С5 экулизумабу или равулизумабу, предпочтительно - к антителу против С5 экулизумабу.
Как показано в приложенных Примерах, доза и схема лечения, как определено в формуле изобретения, обеспечивают длительную и согласованную блокаду активности терминального комплемента (с приблизительно больше, чем 95% субъектов, поддерживаемых выше целевого порога 100 мкг/мл); см. Фиг. 4 и 7. Кроме того, ингибирование терминального комплемента достигалось немедленно после исходной дозы и обычно поддерживалось на протяжении всего интервала дозирования; см. Фиг. 8. Кроме того, дозировка и схема лечения по настоящему изобретению также обеспечивают достаточный резерв свободных сайтов связывания для большей части интервала дозирования как у не получавших лечения, так и у подвергавшихся предварительному лечению экулизумабом пациентов; см. Фиг. 2. Кровалимаб и экулизумаб связываются с разными эпитопами С5, и, таким образом, ожидается то, что образуются DTDC. Ожидается, что DTDC развиваются, если пациенты одновременно подвергаются воздействию кровалимаба и экулизумаба (см. Фиг. 5), во время периода переключения от экулизумаба на антитело против С5 кровалимаб. Образование DTDC может способствовать увеличению клиренса кровалимаба и может вызывать потенциальные риски, такие как реакции гиперчувствительности типа III, как объясняется выше. У пациентов, переключающихся с экулизумаба на кровалимаб, ожидается, что доза и схема лечения, как определено в формуле изобретения, уменьшают образование DTDC; см. Фиг. 3 и 12. Соответственно, описанные в данном документе дозировка и схема лечения описывают новую и улучшенную схему дозировки антител против С5, предпочтительно антитела против С5 кровалимаба, для лечения или предупреждения связанного с С5 заболевания, предпочтительно PNH. Безопасность и терапевтическая эффективность заявленной дозировки и схемы лечения дополнительно описываются на Фиг. 9-11.
Соответственно, настоящее изобретение относится к антителу против С5, предпочтительно антителу против С5 кровалимабу, для применения в способе лечения или предупреждения связанного с С5 заболевания у субъекта, предпочтительно у субъекта с массой тела, равной или большей, чем 100 кг, где данный способ включает следующие последовательные стадии:
(а) внутривенное введение субъекту ударной дозы 1500 мг антитела против С5 один раз, с последующим подкожным введеннием данному субъекту по меньшей мере одной ударной дозой 340 мг антитела против С5; и
(б) подкожное введение данному субъекту по меньшей мере одной поддерживающей дозы 1020 мг антитела против С5.
Термин «ударная доза» относится к дозе антитела против С5, введенной субъекту, страдающему от связанного с С5 заболевания, предпочтительно PNH, в начале лечения, т.е. в начале схемы лечения. В фармакокинетике (РК) «ударная доза» представляет собой исходную более высокую дозу лекарственного средства, которую можно давать пациенту в начале курса лечения перед снижением до меньшей дозы. В контексте настоящего изобретения ударную дозу сперва дают субъектам, подлежащим лечению посредством внутривенного введения, с последующим подкожным введением. В контексте настоящего изобретения ударную дозу дают один раз в дозе 1500 мг. Соответственно, в контексте настоящего изобретения ударную дозу композиции, приготовленной для внутривенного введения, дают субъекту внутривенно один раз перед тем, как подкожно дается одна ударная доза или более чем одна ударная доза фармацевтической композиции, приготовленной для подкожного введения.
В контексте настоящего изобретения одна ударная доза или более чем одна ударная доза антитела против С5 вводится пациентам подкожно после внутривенного введения ударной дозы 1500 мг антитела против С5. Подкожно вводимая(ые) ударная(ные) доза(зы) вводится(дятся) подкожно в дозе 340 мг антитела против С5 по меньшей мере один раз данному субъекту от 1 суток до 3 недель (21 суток) после начала внутривенного введения антитела против С5. Соответственно, в контексте настоящего изобретения ударная доза 340 мг антитела против С5 вводится субъекту подкожно по меньшей мере один раз через 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или 21 сутки после начала внутривенного введения антитела против С5. Предпочтительно ударная доза 340 мг антитела против С5 вводится субъекту через 1 сутки после начала внутривенного введения антитела против С5. Более предпочтительно одна ударная доза 340 мг антитела против С5 вводится подкожно через 1 сутки после начала внутривенного введения. В контексте настоящего изобретения по меньшей мере одна дополнительная ударная доза 340 мг антитела против С5 вводится субъекту подкожно через 1 неделю (7 суток), 2 недели (14 суток) или 3 недели (21 сутки) после начала внутривенного введения антитела против С5. Наиболее предпочтительно дополнительные ударные дозы 340 мг антитела против С5 вводятся подкожно через 1 неделю (7 суток), 2 недели (14 суток) и 3 недели (21 сутки) после начала внутривенного введения антитела против С5. Соответственно, в пределах контекста настоящего изобретения 1, 2, 3, 4 и/или 5 ударных доз дается(ются) субъекту, где одна ударная доза, предпочтительно исходная ударная доза вводится субъекту внутривенно в дозе 1500 мг, и где 1, 2, 3 или 4 ударные дозы дается(ются) пациенту подкожно в дозе 340 мг. В контексте настоящего изобретения предпочтительным является подкожное введение 4 ударных доз, причем каждая имеет дозировку 340 мг антитела против С5, где дополнительные ударные дозы вводятся подкожно через 1 сутки после начала внутривенного введения антитела против С5, с последующим подкожным введением ударных доз один раз в неделю через 1 неделю, 2 недели и 3 недели после начала внутривенного введения антитела против С5. Соответственно, пациенту с использованием ударных доз может вводиться общее количество 2860 мг антитела против С5. Данное общее количество относится к общим дозам антитела против С5, введенного после 22 суток лечения, т.е. к дозе, достигаемой в конце суток 22 лечения, которая рассчитывается посредством сложения ударных доз в сутки 1 (ударная доза 1500 мг, исходно введенная внутривенно), 2 (первая подкожно вводимая ударная доза 340 мг, которая дается пациенту через 1 сутки после начала внутривенного введения антитела против С5), 8 (вторая подкожно вводимая ударная доза 340 мг, которая дается через 1 неделю после начала внутривенного введения), 15 (третья подкожно вводимая ударная доза 340 мг, которая дается через 2 недели после начала внутривенного введения) и 22 (четвертая подкожно вводимая ударная доза 340 мг, которая дается через 3 недели после начала внутривенного введения). Например, общее количество антитела против С5, которое дается через (а) ударную(ные) дозу(зы), соответствующую(щие) внутривенному введению 1500 мг (сутки 1), с последующим подкожным введением 340 мг (сутки 2), 340 мг (сутки 8), 340 мг (сутки 15) и 340 мг (сутки 22) составляет 2860 мг.
Согласно настоящему изобретению после исходной дозы или доз следует(ют) последующие дозы равных или меньших количеств антитела против С5 с достаточно близкими интервалами для поддержания концентрации антитела против С5 на уровне или выше эффективного целевого уровня. Соответственно, в контексте настоящего изобретения (а) поддерживающая(щие) доза(зы) вводится(дятся) пациентам после ударной(ных) дозы(доз). «Поддерживающая доза» относится к дозе антитела против С5, которую дают субъекту, страдающему от связанного с С5 заболевания, для поддержания концентрации антитела против С5 выше определенного эффективного порога концентрации антитела против С5. В контексте настоящего изобретения целевой уровень антитела против С5 составляет приблизительно 100 мкг/мл или больше. Целевой уровень концентрации антитела против С5 в пределах настоящего изобретения может определяться в биологическом образце субъекта, подлежащего лечению. Средства и способы для определения концентрации антитела против С5 в биологическом образце находятся в пределах обычного знания специалиста, и она, например, может определяться посредством иммуноанализа. Предпочтительно в контексте настоящего изобретения иммуноанализ представляет собой ELISA (твердофазный иммуноферментный анализ). Подобным образом, гемолитическую активность можно использовать в качестве параметра для эффективного лечения пациентов, страдающих от связанного с С5 заболевания, посредством заявленной дозировки и схемы лечения. В данном контексте гемолитическая активность может быть определена в биологическом образце пациента, подлежащего лечению. В контексте настоящего изобретения полное ингибирование терминального комплемента (полное ингибирование терминального пути системы комплемента) может определяться по гемолитической активности, которая составляет меньше, чем 10 U/мл. Предпочтительным является то, что гемолитическая активность составляет меньше, чем 10 U/мл, т.е. 10, 9, 8, 7, 6, 5, 4, 3, 2, 1 или 0 U/мл. Средства и способ для определения гемолитической активности в биологическом образце пациентов, подлежащих лечению, посредством дозировки и схемы введения по изобретению известны специалисту. В качестве примера, гемолитическую активность можно определять иммуноанализом. Предпочтительно в контексте настоящего изобретения иммуноанализ представляет собой липосомный иммуноанализ ex vivo (LIA). В контексте настоящего изобретения биологический образец представляет собой образец крови. Предпочтительно образец крови представляет собой образец красной крови (эритроцитов). Предпочтительно поддерживающую(щие) дозу(зы) вводят пациентам подкожно в дозе или дозах 1020 мг антитела против С5. Соответственно, в пределах контекста настоящего изобретения субъекту дают по меньшей мере одну поддерживающую или более чем одну поддерживающую дозу, где данную(ные) поддерживающую(щие) дозу(зы) вводят подкожно в дозе 1020 мг. В контексте настоящего изобретения по меньшей мере одну поддерживающую дозу 1020 мг антитела против С5 вводят субъекту подкожно через 4 недели (28 суток) после начала внутривенного введения антитела против С5. Предпочтительно поддерживающая доза 1020 мг вводится субъектам подкожно один раз через 4 недели после начала внутривенного введения антитела против С5. Соответственно, в пределах контекста настоящего изобретения по меньшей мере одна поддерживающая доза 1020 мг вводится пациенту подкожно через 4 недели (28 суток) после начала внутривенного введения антитела против С5, т.е. на сутки 29 схемы лечения. Соответственно, в контексте настоящего изобретения поддерживающая доза 1020 мг вводится подкожно, предпочтительно один раз в 4 недели (28 суток) после начала внутривенного введения антитела против С5. В контексте настоящего изобретения пациенту может вводиться общее количество 3880 мг антитела против С5 с ударными дозами и поддерживающей дозой согласно настоящему изобретению. Данное общее количество относится к общим дозам антитела против С5, введенным после 29 суток лечения, т.е. дозе, достигаемой в конце суток 29 лечения, которая рассчитывается путем сложения ударных доз в сутки 1 (ударная доза 1500 мг, исходно вводимая внутривенно), 2 (первая вводимая подкожно ударная доза 340 мг, которую дают пациенту через 1 сутки после начала внутривенного введения антитела против С5), 8 (вторая вводимая подкожно ударная доза 340 мг, которую дают через 1 неделю после начала внутривенного введения), 15 (третья вводимая подкожно ударная доза 340 мг, которую дают через 2 недели после начала внутривенного введения), 22 (четвертая вводимая подкожно ударная доза 340 мг, которую дают через 3 недели после начала внутривенного введения) и подкожно вводимой поддерживающей дозы 1020 мг (сутки 29). Например, общее количество антитела против С5, которое дают посредством ударной дозы и поддерживающей дозы, соответствующей внутривенному введению 1500 мг (сутки 1), с последующим подкожным введением 340 мг (сутки 2), 340 мг (сутки 8), 340 мг (сутки 15), 340 мг (сутки 22) и 1020 мг (сутки 29) составляет 3880 мг.
Подкожное введение поддерживающей дозы 1020 мг можно повторять несколько раз с интервалами времени 4 недели (Q4W). В контексте настоящего изобретения предпочтительно то, что поддерживающую дозу 1020 мг повторяют по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 24, 36, 48 месяцев. Предпочтительным в контексте настоящего изобретения является повторение поддерживающей дозы 1020 мг с интервалами времени 4 недели и продолжение в течение всей жизни пациента.
В частности, настоящее изобретение относится к антителу против С5 для применения в способе лечения или предупреждения связанного с С5 заболевания у субъекта, предпочтительно у субъекта с массой тела, равной или большей, чем 100 кг, где данный способ включает следующие последовательные стадии:
(i) внутривенное введение ударной дозы 1500 мг антитела против С5 субъекту один раз;
(ii) подкожное введение ударной дозы 340 мг антитела против С5 субъекту через 1 сутки после начала внутривенного введения антитела против С5;
(iii) подкожное введение ударной дозы 340 мг антитела против С5 субъекту через 1 неделю (7 суток), 2 недели (14 суток) и 3 недели (21 сутки) после начала внутривенного введения антитела против С5 один раз в неделю;
(iv) подкожное введение поддерживающей дозы 1020 мг антитела против С5 субъекту через 4 недели (28 суток) после начала внутривенного введения антитела против С5; и
(v) повторение стадии (iv) несколько раз с интервалами времени 4 недели (28 суток).
Термины «внутривенное введение» / «осуществление внутривенного введения» относятся в контексте настоящего изобретения к введению антитела против С5 в вену субъекта таким образом, что организм пациента, подлежащего лечению, получает антитело против С5 за приблизительно 15 минут или меньше, предпочтительно за 5 минут или меньше. Для внутривенного введения антитело против С5 должно быть приготовлено таким образом, что его следует вводить посредством подходящего устройства, такого как шприц (но не ограничиваясь им). В контексте настоящего изобретения препарат для внутривенного введения содержит от 50 до 350 мг антитела против С5, от 1 до 100 мМ буферизующего агента, такого как гистидин/аспарагиновая кислота, имеющего рН 5,5 плюс/минус 1,0, от 1 до 100 мМ аминокислоты, такой как аргинин, и от 0,01 до 0,1% неионного поверхностно-активного вещества, такого как полоксамер. Предпочтительно в контексте настоящего изобретения предложен препарат для внутривенного введении в 2 мл стеклянном флаконе, содержащий следующие компоненты: 170 мг/мл кровалимаба, 30 мМ гистидин/аспарагиновую кислоту (рН 5,8), 100 мМ аргинина гидрохлорид и 0,05% Poloxamer 188™. Данный препарат затем вводится пациенту в пределах переносимого периода времени, такого как 5 минут, 15 минут, 30 минут, 90 минут или меньше. Кроме того, препарат для внутривенного введения дается пациентам, подлежащим лечению, с объемом инъекции от 1 мл до 15 мл, предпочтительно примерно 9 мл.
Термины «подкожное введение»/«осуществление подкожного введения» относятся в контексте настоящего изобретения к введению антитела против С5 под кожу животного или человеческого пациента, предпочтительно в пределы кармана между кожей и подлежащей тканью, посредством относительно медленной, замедленной доставки из вместилища лекарственного средства. Данный карман может быть создан посредством сжатия или оттягивания кожи вверх и от подлежащей ткани. Для подкожного введения антитело против С5 должно быть приготовлено таким образом, что его можно вводить посредством подходящего устройства, такого как (но не ограничиваясь) шприцем, предварительно заполненным шприцем, инъецирующим устройством, инфузионным насосом, инъекционным шприцем-ручкой, безыгольным устройством или посредством системы доставки на основе трансдермального пластыря. В контексте настоящего изобретения препарат для подкожного введения содержит от 50 до 350 мг антитела против С5, от 1 до 100 мМ буферизующего агента, такого как гистидин/аспарагиновая кислота, имеющего рН 5,5 плюс/минус 1,0, от 1 до 100 мМ аминокислоты, такой как аргинин, и от 0,01 до 0,1% неионного поверхностно-активного вещества, такого как полоксамер. Предпочтительно в контексте настоящего изобретения предложен препарат для внутривенного введения в 2,25 мл предварительно заполненном шприце, содержащем следующие компоненты: 170 мг/мл кровалимаба, 30 мМ гистидин/аспарагиновая кислота (рН 5,8), 100 мМ аргинина гидрохлорид и 0,05% Poloxamer 188™. В контексте настоящего изобретения препарат для подкожного введения предложен в виде предварительно заполненного шприца с приспособлением для безопасности иглы. Инъекционные устройства для подкожного введения содержат примерно от 1 до 15 мл или более, предпочтительно 2,25 мл препарата для подкожного введения, содержащего антитело против С5. При нормальных условиях инъекционный объем, подлежащий подкожному введению, составляет от 1 до 15 мл, предпочтительно либо 2 мл (340 мг кровалимаба), либо 6 мл (1020 мг кровалимаба). В контексте настоящего изобретения подкожное введение относится к введению антитела против С5 под кожу пациента, подлежащего лечению, посредством относительно медленной, замедленной доставки из вместилища лекарственного средства в течение периода времени, включающего 30 минут или меньше, 90 минут или меньше, но не ограничиваясь ими. Возможно введение может осуществляться посредством подкожной имплантации насоса для доставки лекарственного средства, имплантированного под кожу пациента, подлежащего лечению, где данный насос доставляет заданное количество антитела против С5 в течение заданного периода времени, такого как 30 минут, 90 минут, или периода времени, охватывающего продолжительность схемы лечения.
В контексте настоящего изобретения приведенные выше дозировки и схемы лечения могут быть полезными для лечения или предупреждения связанного с С5 заболевания у субъекта, которого лечили по меньшей мере одним фармакологическим продуктом для применения в лечении или предупреждении заболевания один или более чем один раз. Например, схема лечения по настоящему изобретению может быть полезна для лечения пациента, имеющего связанное с С5 заболевание, который получал предшествующее лечение по меньшей мере одним фармакологическим продуктом для применения в способе лечения или предупреждения заболевания, но ожидается, что он будет лучше отвечать на схему лечения согласно настоящему изобретению. В таких случаях может производиться переключение лекарственного средства от данного фармакологического продукта на антитела против С5 для применения в лечении или предупреждении связанного с С5 заболевания согласно настоящему изобретению. Предпочтительно вводимая внутривенно ударная доза антитела против С5 дается субъекту, подлежащему лечению, после конечной дозы данного фармацевтического продукта. Данная вводимая внутривенно ударная доза антитела против С5 предпочтительно имеет дозу 1500 мг.
В контексте настоящего изобретения фармакологический продукт содержит активное вещество, которое отличается от антитела против С5, которое дают согласно настоящему изобретению либо внутривенно, либо подкожно. Данное активное вещество фармакологического продукта в контексте настоящего изобретения может представлять собой миРНК (малая интерферирующая РНК), нацеленную на мРНК С5, или антитело против С5, которое отличается от антитела против С5, вводимого подкожно или внутривенно субъекту, подлежащему лечению согласно настоящему изобретению. Данный фармакологический продукт может содержать антитело против С5, которое представляет собой отличное антитело от антитела против С5, которое дают пациентам в контексте настоящего изобретения. Антитело, содержащееся в данном фармацевтическом продукте, которое использовали в предшествующем лечении, может представлять собой равулизумаб или экулизумаб, или их варианты. Предпочтительно антитело, содержащееся в данном фармакологическом продукте, которое использовали в предшествующем лечении, представляет собой экулизумаб или его варианты. Типичные варианты последовательности антитела против С5 экулизумаба показаны в SEQ ID NO: 11 и 12.
Вариантами антитела в контексте настоящего изобретения могут быть антитела против С5, которые содержат вариант области Fc, в который была введена одна или более чем одна модификация аминокислоты в область Fc антитела с природной последовательностью. Данный вариант области Fc может содержать последовательность человеческой области Fc (например, области Fc человеческого lgG1, lgG2, lgG3 или lgG4), содержащую аминокислотную модификацию (например, замену) в одном или более чем одном положении аминокислоты. В контексте настоящего изобретения вариант антитела обладает некоторыми, но не всеми эффекторными функциями, что делает его желательным кандидатом для применений, при которых период полувыведения антитела in vivo является важным, тем не менее определенные эффекторные функции (такие как комплемент и ADCC (антителозависимая клеточная цитотоксичность)) являются необязательными или вредными. Можно проводить анализы цитотоксичности in vitro и/или in vivo для подтверждения уменьшения/истощения активностей CDC (комплементзависимая цитотоксичность) и/или ADCC. Например, можно проводить анализы связывания с рецептором Fc (FcR) для обеспечения того, что данное антитело не имеет связывания с R (рецептор) Fc гамма (следовательно, вероятно не имеет активности ADCC), но сохраняет способность к связыванию с FcRn. Первичные клетки для опосредования ADCC - клетки NK (природные киллеры) -экспрессируют только Rill Fc гамма, тогда как моноциты экспрессируют RI Fc гамма, RII Fc гамма и RIII Fc гамма. Экспрессия FcR на гематопоэтических клетках обобщается в Таблице 3 на странице 464 Ravetch and Kinet, Annu. Rev. Immunol. 9:457-492 (1991). Неограничивающие примеры анализов in vitro для оценки активности ADCC интересующей молекулы описываются в US-B1 5500362 (см., например, Hellstrom et al., Proc. Nat'l Acad. Sci. USA (1983), Vol.83, pp.7059-7063) и Hellstrom et al, Proc. Nat'l Acad. Sci. USA (1985), Vol.82, pp.1499-1502; US-B1 5821337 (см. Bruggemann et al., J. Exp.Med. (1987), Vol.166, pp.1351-1361). В качестве альтернативы, можно использовать нерадиоактивные способы анализа (см., например, нерадиоактивный анализ цитотоксичности ACTI™ для проточной цитометрии (CellTechnology, Inc. Mountain View, CA) и нерадиоактивный анализ цитотоксичности CytoTox 96 (зарегистрированный товарный знак) (Promega, Madison, WI)). Полезные эффекторные клетки для таких анализов включают одноядерные клетки периферической крови (РВМС) и клетки-природные киллеры (NK). Альтернативно или дополнительно, активность ADCC интересующей молекулы может оцениваться in vivo, например, в животной модели, такой как модель, раскрытая в dynes era/., Proc. Nat'l Acad. Sci. USA (1998), Vol.95, pp.652-656. Анализы связывания C1q также могут проводиться для подтверждения того, что антитело не способно связываться с C1q и, следовательно, не имеет активности CDC. См., например, ELISA (твердофазный иммуноферментный анализ) связывания с C1q и С3с в WO-A2 2006/029879 и WO-A1 2005/100402. Для оценки активации комплемента можно проводить анализ CDC (см., например, Gazzano-Santoro et al., J. Immunol. Methods (1996), Vol.202, pp.163; Cragg et al., Blood (2003), Vol.101, pp.1045-1052 и Cragg et al., Blood (2004), Vol.103, pp.2738-2743). Определения связывания с FcRn и клиренса/периода полувыведения in vivo также можно осуществлять с использованием способов, известных в данной области (см., например, Petkova era/., Int'l. Immunol. (2006), Vol.18(12), pp.1759-1769).
Антитела с пониженной эффекторной функцией включают антитела с заменой одного или более чем одного остатка области Fc 238, 265, 269, 270, 297, 327 и 329 (US-B1 6737056). Такие мутанты Fc включают мутантов Fc с заменами по двум или более чем двум положениям аминокислот 265, 269, 270, 297 и 327, включая так называемого мутанта Fc "DANA" с заменой остатков 265 и 297 на аланин (US-B1 7332581).
Описываются определенные варианты антител с улучшенным или уменьшенным связыванием с FcRn. (См., например, US-B1 6737056; WO-A2 2004/056312 и Shields et al., J. Biol. Chem. (2001), Vol.9(2), pp.6591-6604).
В некоторых воплощениях вариант антитела содержит область Fc с одной или более чем одной аминокислотной заменой, которая улучшает ADCC, например, с заменами в положениях 298, 333 и/или 334 области Fc (нумерация остатков EU).
В некоторых воплощениях в области Fc делаются изменения, которые приводят к измененному (т.е. либо улучшенному, либо уменьшенному) связыванию с C1q и/или комплементзависимой цитотоксичности (CDC), например, как описано в US-B1 6194551, WO 1999/51642 и Idusogie et al., J. Immunol. (2000), Vol.164, pp.4178-4184.
Антитела с увеличенными периодами полувыведения и улучшенным связыванием с неонатальным рецептором Fc (FcRn), который отвечает за перенос материнских IgG в плод (Guyer et al., J. Immunol. (1976), Vol.117, pp.587 и Kim et al., J. Immunol. (1994), Vol.24, pp.249), описываются в US 2005/0014934. Данные антитела содержат область Fc с одной или более чем одной заменой в ней, которая улучшает связывание области Fc с FcRn. Такие варианты Fc включают варианты с заменами в одном или более чем одном остатке области Fc: 238, 256, 265, 272, 286, 303, 305, 307, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424 или 434, например, замену остатка 434 области Fc (US-B1 7371826). См. также Duncan, Nature (1988), Vol.322, pp.738-740, US-B1 5648260; US-B15624821 и WO 1994/29351 относительно дургих примеров вариантов области Fc.
В контексте настоящего изобретения исходная доза композиции для внутривенной инъекции в настоящем изобретении вводится в те же самые сутки или через 1 сутки, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 7 суток (1 неделя), 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 14 суток (две недели), 15 суток, 16 суток, 17 суток, 18 суток, 19 суток, 20 суток, 21 сутки (3 недели) или больше суток после того, как пациенту, подлежащему лечению, вводится последняя доза фармакологического продукта. Предпочтительно в контексте настоящего изобретения вводимая внутривенно ударная доза антитела против С5 вводится в сутки 3 или через 3 суток, 4 суток, 5 суток, 6 суток, 7 суток (1 неделя), 8 суток, 9 суток, 10 суток, 11 суток, 12 суток, 13 суток, 14 суток (две недели), 15 суток, 16 суток, 17 суток, 18 суток, 19 суток, 20 суток, 21 сутки (3 недели) или больше суток после конечной дозы фармакологического продукта. Предпочтительно вводимая внутривенно ударная доза антитела против С5 дается пациенту через 7 суток (1 неделя) или больше суток после последней дозы фармакологического продукта. Также предпочтительным в контексте настоящего изобретения является внутривенное введение ударной дозы через 14 суток (2 недели) или больше суток после конечной дозы фармакологического продукта. Наиболее предпочтительным в контексте настоящего изобретения является внутривенное введение антитела против С5 через 21 сутки (3 недели) после последней дозы фармакологического продукта.
В контексте настоящего изобретения термин «неделя» относится к периоду времени 7 суток.
В контексте настоящего изобретения термин «месяц» относится к периоду времени 4 недели.
Термин «лечение» в контексте настоящего изобретения включает последовательный ряд «индуцирующего лечения» и по меньшей мере одного «поддерживающего лечения». Типично лечение согласно данному изобретению включает «индуцирующее лечение» и по меньшей мере одно «поддерживающее лечение». Типично лечение согласно данному изобретению может продолжаться 1 месяц, 2 месяца, 3 месяца, 4 месяца, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев, 1 год (12 месяцев), 2 года (24 месяца), 3 года (36 месяцев) или 4 года (48 месяцев). Предпочтительным в контексте настоящего изобретения является лечение, которое продолжается в течение всей жизни пациента.
«Индуцирующее лечение» состоит из последовательного ряда (i) внутривенного введения субъекту ударной дозы, предпочтительно дозы 1500 мг, антитела против С5 и (ii) подкожного введения субъекту по меньшей мере одной ударной дозы, предпочтительно дозы 340 мг, антитела против С5. Как объясняется в данном документе выше, в пределах контекста настоящего изобретения предпочтительным является то, что ударная доза 340 мг антитела против С5 дается субъекту через 1 сутки, 1 неделю (7 суток), 2 недели (14 суток) и 3 недели (21 сутки) после вводимой внутривенно ударной дозы. Предпочтительно ударная доза, подлежащая введению внутривенно, имеет дозу 1500 мг. Ударная доза, которая дается субъекту, подлежащему лечению, подкожно, имеет дозу 1360 мг. Таким образом, в контексте настоящего изобретения во время индуцирующего лечения субъекту, подлежащему лечению, вводится ударная доза 2860 мг либо внутривенно, либо подкожно. «Поддерживающее лечение» состоит из последовательного ряда (i) поддерживающего периода, где субъектам подкожно дается одна или более чем одна поддерживающая доза. В контексте настоящего изобретения предпочтительным является то, что субъекту дается поддерживающая доза 1020 мг антитела против С5 предпочтительно один раз через 4 недели (1 месяц) после начала внутривенного введения ударной дозы антитела против С5. Как объясняется выше, подкожное введение поддерживающей дозы 1020 мг можно повторять несколько раз с интервалами времени 4 недели (Q4W). Предпочтительным в контексте настоящего изобретения является повторение поддерживающей дозы 1020 мг с интервалами времени 4 недели и продолжающееся в течение всей жизни пациента.
В контексте настоящего изобретения связанное с С5 заболевание представляет собой опосредованное комплементом заболевание или состояние, которое включает избыточную или неконтролируемую активацию С5. В некоторых воплощениях связанное с С5 заболевание представляет собой по меньшей мере одно, выбранное из группы, состоящей из пароксизмальной ночной гемоглобинурии (PNH), ревматоидного артрита (RA), волчаночного нефрита, ишемического реперфузионного повреждения, атипического гемолитического уремического синдрома (aHUS), болезни плотного осадка (DDD), макулодистрофии, синдрома гемолиза, повышенного уровня ферментов печени и уменьшенного числа тромбоцитов (HELLP), тромботической тромбоцитопенической пурпуры (ТТР), спонтанной потери плода, слабоиммунного васкулита, буллезного эпидермолиза, рецидивирующей потери плода, рассеянного склероза (MS), травматического повреждения мозга, повреждения, возникающего из-за инфаркта миокарда, сердечно-легочного шунтирования и гемодиализа, рефрактерной генерализованной тяжелой миастении (gMG) и оптиконевромиелита (NMO). Предпочтительно в контексте настоящего изобретения связанное с С5 заболевание представляет собой по меньшей мере одно, выбранное из группы, состоящей из PNH, aHUS, gMG и NMO. Наиболее предпочтительно связанное с С5 заболевание представляет собой PNH. Кроме того, в контексте настоящего изобретения субъект, страдающий от связанного с С5 заболевания PNH, может быть подвергнут анализу на присутствие мутации Arg885 С5. Соответственно, раскрытую в данном документе схему дозировки также можно использовать для лечения и/или предупреждения у субъектов, страдающих от PNH, отличающихся тем, что данные субъекты имеют мутацию Arg885 С5. В данном контексте мутация Arg885 означает генетическое изменение С5, где Arg в положении 885 заменяется His. В данном контексте термин «С5» относится к белку, имеющему аминокислотную последовательность, как показано в SEQ ID NO: 13.
В контексте настоящего изобретения антитело против С5 предпочтительно представляет собой кровалимаб. Подробности о последовательности антитела против С5 кровалимаба (номер CAS: 1917321-26-6) раскрываются в списке №119 предложенных международных непатентованных названий для фармацевтических веществ (INN), как опубликовано на страницах 302 и 303 WHO Drug Information (2018), Vol.32, №2. Последовательности антитела против С5 кровалимаба также демонстрируются в SEQ ID NO: 3 (тяжелая цепь) и SEQ ID NO: 4 (легкая цепь). Получение антитела против С5 кровалимаба, используемого в настоящем изобретении, описывается в WO 2016/098356 (см. Пример 1 относительно подробностей). Кроме того, в контексте настоящего изобретения антитело против С5 кровалимаб вводится пациентам посредством препарата либо для внутривенного, либо для подкожного введения. Предпочтительным в контексте настоящего изобретения является внутривенное или подкожное введение предложенных в данном документе дозировок в виде (а) фиксированной(ных) дозы(доз).
Препарат для внутривенного введения содержит от 50 до 350 мг антитела против С5 кровалимаба, от 1 до 100 мМ буферизующего агента, такого как гистидин/аспарагиновая кислота, имеющего рН 5,5 плюс/минус 1,0, от 1 до 100 мМ аминокислоты, такой как аргинин, и от 0,01 до 0,1% неионного поверхностно-активного вещества, такого как полоксамер. Предпочтительный в контексте настоящего изобретения препарат для внутривенного введения предложен в 2 мл стеклянном флаконе, содержащем следующие компоненты: 170 мг/мл кровалимаба, 30 мМ гистидин/аспарагиновая кислота (рН 5,8), 100 мМ аргинина гидрохлорид и 0,05% Poloxamer 188™.
Препарат для подкожного введения содержит от 50 до 350 мг антитела против С5 кровалимаба, от 1 до 100 мМ буферизующего агента, такого как гистидин/аспарагиновая кислота, имеющего рН 5,5 плюс/минус 1,0, от 1 до 100 мМ аминокислоты, такой как аргинин, и от 0,01 до 0,1% неионного поверхностно-активного вещества, такого как полоксамер. Предпочтительный в контексте настоящего изобретения препарат для внутривенного введения предложен в 2,25 мл предварительно заполненном шприце, содержащем следующие компоненты: 170 мг/мл кровалимаба, 30 мМ гистидин/аспарагиновая кислота (рН 5,8), 100 мМ аргинина гидрохлорид и 0,05% Poloxamer 188™.
Антитело против С5 экулизумаб продается под торговым наименованием Солирис® компанией Alexion Pharmaceuticals, Inc. Последовательности антитела против С5 экулизумаба показаны в SEQ ID NO: 1 (тяжелая цепь) и SEQ ID NO: 2 (легкая цепь). Кроме того, варианты последовательности антитела против С5 экулизумаба показаны в SEQ ID NO: 11 и 12.
Последовательности антитела против С5 равулизумаба продаются под торговым наименованием Ультомирис® компанией Alexion Pharmaceuticals, Inc. Последовательности антитела против С5 равулизумаба (номер CAS: 1803171-55-2) раскрываются в списке №117 предложенных международных непатентованных названий фармацевтических веществ (INN), как опубликовано на страницах 319 и 320 WHO Drug Information (2017), Vol.31, №2. Последовательности антитела против С5 равулизумаба также показаны в SEQ ID NO: 5 (тяжелая цепь) и SEQ ID NO: 6 (легкая цепь).
Пациенты, описанные в контексте настоящего изобретения, представляют собой пациентов, страдающих от связанного с С5 заболевания. Предпочтительными пациентами в контексте настоящего изобретения являются пациенты с массой тела, равной или большей, чем 100 кг. В контексте настоящего изобретения связанное с С5 заболевание представляет собой опосредованное комплементом заболевание или состояние, которое включает избыточную или неконтролируемую активацию С5. В некоторых воплощениях связанное с С5 заболевание представляет собой по меньшей мере одно, выбранное из группы, состоящей из пароксизмальной ночной гемоглобинурии (PNH), ревматоидного артрита (RA), волчаночного нефрита, ишемического реперфузионного повреждения, атипического гемолитического уремического синдрома (aHUS), болезни плотного осадка (DDD), макулодистрофии, синдрома гемолиза, повышенного уровня ферментов печени и уменьшенного числа тромбоцитов (HELLP), тромботической тромбоцитопенической пурпуры (ТТР), спонтанной потери плода, слабоиммунного васкулита, буллезного эпидермолиза, рецидивирующей потери плода, рассеянного склероза (MS), травматического повреждения мозга, повреждения, возникающего из-за инфаркта миокарда, сердечно-легочного шунтирования или гемодиализа, рефрактерной генерализованной тяжелой миастении (gMG) и оптиконевромиелита (NMO). Предпочтительно в контексте настоящего изобретения связанное с С5 заболевание представляет собой по меньшей мере одно, выбранное из группы, состоящей PNH, aHUS, gMG и NMO. Наиболее предпочтительно связанное с С5 заболевание представляет собой PNH.
Кроме того, настоящее изобретение относится к способу лечения или предупреждения связанного с С5 заболевания у субъекта, где данный способ включает следующие последовательные стадии:
(а) осуществление внутривенного введения ударной дозы 1500 мг антитела против С5 субъекту один раз, с последующим подкожным введением по меньшей мере одной ударной дозы 340 мг антитела против С5 субъекту; и
(б) подкожное введение по меньшей мере одной поддерживающей дозы 1020 мг антитела против С5 субъекту.
В контексте настоящего изобретения является предпочтительным то, что способ лечения или предупреждения связанного с С5 заболевания у субъекта проводится посредством следующих стадий введения:
(i) внутривенное введение ударной дозы 1500 мг антитела против С5 субъекту один раз;
(ii) подкожное введение ударной дозы 340 мг антитела против С5 субъекту через 1 сутки после начала внутривенного введения антитела против С5;
(iii) подкожное введение ударной дозы 340 мг антитела против С5 субъекту через 1 неделю, 2 недели и 3 недели после начала внутривенного введения антитела против С5 один раз в неделю;
(iv) подкожное введение поддерживающей дозы 1020 мг антитела против С5 субъекту через 4 недели после начала внутривенного введения антитела против С5; и
(v) повторение стадии (iv) несколько раз с интервалами времени 4 недели. Как объясняется выше, в контексте настоящего изобретения является
предпочтительным то, что антитело против С5, используемое в контексте дозировки и схемы введения, представляет собой кровалимаб. Кроме того, приведенное выше определение подобным образом применимо к приведенным выше способам лечения или предупреждения связанного с С5 заболевания. В контексте настоящего изобретения также предпочтительно, что субъект, подлежащий лечению, имеет массу тела, равную или большую, чем 100 кг. На Фиг. показано:
Фиг. 1: связь между антителом против С5 кровалимабом и гемолитической активностью, измеренная липосомным иммуноанализом (LIA), у здоровых субъектов и субъектов со связанным с С5 заболеванием - пароксизмальной ночной гемоглобинурией (PNH)
Оценка связи воздействие-ответ демонстрирует то, что для достижения полного ингибирования терминального комплемента требуется приблизительно 100 мкг/мл кровалимаба. Полное ингибирование терминального комплемента (полное ингибирование терминального пути системы комплемента) определяется как гемолитическая активность меньше 10 U/мл. Вертикальная пунктирная линия отмечает порог фармакодинамики (PD) 100 мкг/мл кровалимаба.
Фиг. 2: доступные свободные сайты связывания антитела против С5 кровалимаба
Серые линии соответствуют симуляции 15 индивидов на основе параметров, оцениваемых из данных COMPOSER (ВР39144). Для симуляций использовали данные исследования COMPOSER. По ординате показана концентрация антитела против С5 кровалимаба (R07112689; SKY59). По абсциссе показано время в сутках. Темно-серые линии соответствуют значениям медианы для данных 15 пациентов: SO: схема части 3 COMPOSER; S5: предложенная схема в части 4 исследования COMPOSER и фазе III.
Фиг. 3: профиль во времени комплекса лекарственное средство-мишень-лекарственное средство (DTDC)
Серые линии соответствуют симуляции 15 индивидов на основе параметров, оцениваемых из данных COMPOSER (ВР39144). Для симуляций использовали данные исследования COMPOSER. Темно-серые линии соответствуют значениям медианы для данных 15 пациентов: SO: схема части 3 COMPOSER; S5: предложенная схема в части 4 исследования COMPOSER и фазе III; R07112689: кровалимаб (SKY59).
Фиг. 4: симулированные профили концентрация-время кровалимаба при лечении не получавших лечения пациентов (верхняя панель) и пациентов с PNH, переключающихся с лечения экулизумабом на кровалимаб (нижняя панель)
Серый интервал соответствует интервалу 90%-ного прогнозирования, а серая линия - прогнозируемой медиане. Черная пунктирная линия соответствует целевому уровню концентрации 100 мкг/мл антитела против С5 кровалимаба.
Фиг. 5: модель, описывающая как комплексы лекарственное средство-мишень-лекарственное средство (DTDC) между кровалимабом, человеческим С5 и антителом экулизумабом подвергаются клиренсу, рециклируют и последовательно строятся из меньших DTDC
При переключении пациентов от антитела против С5 экулизумаба на кровалимаб в системе кровообращения присутствуют оба антитела против С5 и образуют DTDC, так как они связываются с разными эпитопами человеческого С5. Данные DTDC строятся из повторения цепи молекул экулизумаб-С5-кровалимаб-С5 и растут с течением времени при сборке двух DTDC с образованием большего DTDC. Данная модель (Фиг. 5) описывает как DTDC подвергаются клиренсу и рециклируют посредством рецепторов FcRn антитела против С5 кровалимаба. (1) DTDC развиваются, если пациенты одновременно подвергаются воздействию кровалимаба и экулизумаба во время периода переключения с 1 лекарственного средства на другое из-за дифференциального распознавания эпитопа С5 данными антителами. Данные DTDC поглощаются в эндосомы посредством фагоцитоза. (2) Антитело кровалимаб, которое рН-зависимо связывается с человеческим С5, диссоциирует от растворимого человеческого С5, который был связан с антителом против С5 кровалимабом, при кислотных условиях (рН 6,0) в эндосоме, в то время как антитело против С5 экулизумаб все еще связано с растворимым человеческим С5 при кислотных условиях в эндосоме. (3) Антитела против С5 (антитело против С5 кровалимаб и комплекс С5-экулизумаб) поглощаются клетками посредством связывания с FcRn, экспрессируемым на клеточной мембране. Комплекс С5-экулизумаб транслоцируется в лизосому для деградации или рециклирования с белком С5, все еще связанным с антителом. В отличие от этого, антитело против С5 кровалимаб имеет улучшенную функциональность/эффективность, так как оно диссоциирует от FcRn в эндосоме при кислотных условиях для высвобождения обратно в плазму без белка С5. (4), (5) Высвобожденное антитело против С5 кровалимаб вновь доступно для связывания с человеческим С5 и для создания других, меньших DTDC. Это имеет эффект «рециклирования» антитела против С5 кровалимаба. DTDC и, в частности, комплексы С5-экулизумаб затем вновь деградируют посредством эндосом, тогда как антитело против С5 кровалимаб вновь рециклирует с построением меньших DTDC.
Фиг. 6: часть 4 COMPOSER включала пациентов с PNH
В части 4 COMPOSER оценивали эффекты на безопасность, фармакокинетику (РК) и фармакодинамику (PD) оптимизированной схемы введения кровалимаба у пациентов с PNH, которые не получали терапии против С5, предпочтительно терапии кровалимабом, или которые переключались с экулизумаба, с первичной оценкой через 20 недель. Из 15 зарегистрированных пациентов 8 (53%) ранее не получали терапию ингибитором С5, а 7 (47%) переключались с экулизумаба на кровалимаб.
Фиг. 7: воздействие кровалимаба у пациентов, зарегистрированных в части 4 исследования COMPOSER
У всех пациентов поддерживались уровни кровалимаба больше значения Ctrough (минимальная концентрация) приблизительно 100 мкг/мл, что ассоциировано с ингибированием активности терминального комплемента. Линии представляют среднее значение, и затемненная область показывает доверительный интервал 95%.
Фиг. 8: ход липосомного иммуноанализа (LIA), показывающего медианную активность комплемента у пациентов, зарегистрированных в части 4 исследования COMPOSER
Ингибирование терминального комплемента достигалось сразу после исходной дозы и обычно сохранялось на протяжении всего периода исследования. Линии представляют значение медианы, а усы показывают 95%-ный доверительный интервал. Нижняя граница количественного измерения анализа LIA составляет 10 U/мл. LIA-липосомный иммуноанализ.
Фиг.9: измерение общего уровня и уровня свободного С5 у пациентов, зарегистрированных в части 4 исследования COMPOSER
(А) У не получавших лечения пациентов наблюдали ограниченное общее накопление С5, а у пациентов с переключением наблюдали снижение. (В) Уровни свободного С5 быстро снижались после исходной дозы и оставались низкими на протяжении всего периода последующего наблюдения.
Фиг. 10: измерение нормированного уровня лактатдегидрогеназы (LDH) у пациентов, зарегистрированных в части 4 исследования COMPOSER
У наивных пациентов медианные уровни лактатдегидрогеназы (LDH) снижались до уровней, меньших или равных 1,5х верхней границы нормы (ULN) к суткам 15 и оставались ниже этого уровня на протяжении всего периода наблюдения. У пациентов, которые переключались с экулизумаба на кровалимаб, медианный исходный уровень LDH был меньше или равен 1,5х ULN и оставался таким на протяжении всего периода наблюдения. LDH - лактатдегидрогеназа; ULN - верхняя граница нормы.
Фиг. 11: краткое изложение неблагоприятных событий (АЕ), связанных с лечением кровалимабом
Кровалимаб хорошо переносился, и не наблюдали серьезных неблагоприятных событий (АЕ), связанных с лечением.
Фиг. 12: наблюдаемые профили DTDC с течением времени с частью 3 и частью 4 схем с кровалимабом исследования COMPOSER
Сплошные линии представляют собой сумму медианных процентных содержаний кровалимаба, элюированного во фракциях 1-4 (левые панели) и фракциях 5-6 (правые панели) гель-фильтрации (SEC). Схема дозировки части 3 исследования COMPOSER показана светло-серым, и схема дозировки части 4 показана темно-серым.
Фиг. 13: нормированные уровни LDH пациентов с PNH, несущих мутацию С5 Arg885His, которых лечили кровалимабом
Кровалимаб достигал поддерживающегося ингибирования терминального комплемента у пациентов с PNH с полиморфизмом Arg885. У всех пациентов достигалось полное ингибирование терминального комплемента при измерении посредством липосомного иммуноанализа (LIA). Уровни LIA варьировали от 32-42 U/мл в начале исследования, снижались до меньше, чем 10 U/мл к суткам 2 и поддерживались далее. Нижняя граница количественного измерения для анализа LIA составляет 10 U/мл. LIA - липосомный иммуноанализ.
Следующие примеры иллюстрируют данное изобретение
Пример 1: антитела против С5
Последовательности антитела против С5 кровалимаба демонстрируются в SEQ ID NO: 3 (тяжелая цепь) и SEQ ID NO: 4 (легкая цепь). Кроме того, получение антитела против С5 кровалимаба, используемого в настоящем изобретении, описывается в WO 2016/098356. Вкратце, гены, кодирующие вариабельный домен тяжелой цепи (VH) 305LO15 (SEQ ID NO: 7)), объединяли с генами, кодирующими модифицированный вариант SG115 константного домена (СН) тяжелой цепи человеческого lgG1 (SEQ ID NO: 8). Гены, кодирующие вариабельный домен легкой цепи (VL) 305LO15 (SEQ ID NO: 9)), объединяли с генами, кодирующими константный домен челевеческой легкой цепи (CL) (SK1, SEQ ID NO: 10). Антитела экспрессировались в клетках НЕК293, сотрансфицированных комбинацией экспрессионных векторов тяжелой и легкой цепи, и очищали посредством белка.
Пример 2: дозировки и схемы введения, использованные в исследовании COMPOSER (ВР39144; идентификатор ClinicalTrials.gov: NCT03157635)
Для определения подходящих дозировок и схемы введения инициировали исследование фазы I/II COMPOSER (ВР39144). Данное исследование исходно состояло из трех частей: часть 1 - у здоровых участников, часть 2 и часть 3 - у пациентов с пароксизмальной ночной гемоглобинурией (PNH). Кроме того, пациенты, охватываемые в части 3 данного исследования, представляли собой пациентов, которых лечили антителом против С5 экулизумабом в течение по меньшей мере 3 месяцев.
Часть 1 данного исследования была разработана для включения трех групп здоровых пациентов. Первая группа представляет собой группу пациентов, кому антитело против С5 кровалимаб вводится внутривенно (в.в.) один раз в дозе 75 мг/организм. Вторая группа пациентов представляет собой группу участников, кому антитело против С5 кровалимаб вводится внутривенно (в.в.) один раз в дозе 150 мг/организм. Третья группа представляет собой группу субъектов, кому антитело против С5 кровалимаб вводится подкожно (п.к.) один раз в дозе 170 мг/организм. Поскольку часть 1 исследования COMPOSER является адаптивной по природе (на основе продолжающейся оценки данных по безопасности, переносимости, фармакокинетике (РК) и фармакодинамике (PD)), фактические дозы, приведенные для части 1, составляли: 75 мг в.в. для первой группы пациентов, 125 мг в.в. для второй группы пациентов и 100 мг п. к. для третьей группы пациентов, зарегистрированных в части 1 исследования COMPOSER.
Часть 2 данного исследования была разработана для включения группы субъектов, кому антитело против С5 кровалимаб вводится внутривенно три раза: согласно исходной схеме протокола антитело против С5 кровалимаб исходно вводилось в дозе 300 мг/организм (в.в.), затем 500 мг/организм (в.в.) через неделю после исходного введения и, наконец, 1000 мг/организм (в.в.) через две недели после второго введения. Начиная с двух недель после последнего внутривенного введения, антитело против С5 кровалимаб вводится подкожно (п.к.) один раз в неделю в дозе 170 мг/организм. На основе появляющихся клинических данных из части 1 и симуляции РК исходная доза для пациентов в части 2 исследования COMPOSER была заменена от 300 мг до 375 мг в.в. Таким образом, фактические дозы, приведенные в части 2 исследования COMPOSER, являются следующими: антитело против С5 кровалимаб исходно вводится внутривенно (в.в.) в дозе 375 мг/организм, с последующей дозой 500 мг/организм (в.в.) через неделю после исходного введения и, наконец - 1000 мг/организм (в.в.) через две недели после второго введения. Начиная с двух недель после последнего внутривенного введения, антитело против С5 кровалимаб вводится подкожно (п.к.) один раз в неделю в дозе 170 мг/организм.
Часть 3 данного исследования включала пациентов, которых лечили антителом против С5 экулизумабом в течение по меньшей мере трех месяцев до регистрации в данном клиническом испытании, и данные пациенты должны были получать регулярные инфузии экулизумаба. Часть 3 данного исследования была разработана для включения трех групп субъектов. Антитело против С5 кровалимаб исходно вводится субъектам во всех группах внутривенно один раз в дозе 1000 мг/организм. Начиная с одной недели после исходного внутривенного введения (сутки 8 после в.в. введения), антитело против С5 кровалимаб подкожно (п.к.) вводится субъектам первой группы один раз каждую неделю в дозе 170 мг/организм, субъектам второй группы один раз каждые две недели в дозе 340 мг/организм и субъектам третьей группы один раз каждые четыре недели в дозе 680 мг/организм. 15 здоровых пациентов регистрировали в части 1 исследования COMPOSER. Часть 1 была рандомизированной таким образом, что только 9 из исходных 15 пациентов получали кровалимаб. 19 пациентов регистрировали в части 3 исследования COMPOSER, но три пациента прервали участие.
Пример 3: определение схемы дозирования для достижения полного и поддерживающегося ингибирования терминального комплемента на всем протяжении лечения антителом против С5 кровалимабом
Целью лечения для кровалимаба при связанных: с С5 заболеваниях, таких как предпочтительно пароксизмальная ночная гемоглобинурия (PNH), является обеспечения быстрого и поддерживающегося полного ингибирования терминального пути комплемента. У пациентов, переключающихся от экулизумаба на кровалимаб, период отмывки является клинически неподходящим. Следовательно, по замыслу, остаточные концентрации экулизумаба присутствуют при инициации дозирования кровалимаба. Комплексы лекарственное средство-мишень-лекарственное средство (DTDC), состоящие из кровалимаба, человеческого С5 и экулизумаба, были выявлены у всех пациентов, переключающихся с экулизумаба в части 3 COMPOSER с использованием мультиплексного анализа, объединяющего гель-фильтрацию (SEC) с твердофазным иммуноферментным анализом (ELISA). SEC представляет собой методику разделения на основе различия радиуса Стокса и геометрии белков: SEC разделяет молекулы согласно различиям в размере по мере того, как они проходят через среду гель-фильтрации, упакованную в колонку, с образованием упакованного слоя. В отличие от ионообменной или аффинной хроматографии молекулы не связываются с хроматографической средой таким образом, что состав буферизованной среды прямо не влияет на разрешение (степень разделения между пиками). Среда представляет собой пористую матрицу сферических частиц с химической и физической стабильностью и инертностью (отсутствием реакционной способности и адсорбционных свойств). SEC использовали в режиме фракционирования для разделения многочисленных компонентов в образце на основе различий в их размере. Для состава сложного образца с разными белками, подобного сыворотке, комбинация SEC с ELISA, специфичной в отношении аналита (кровалимаба), обеспечивала желательную специфичность и чувствительность для выявления концентраций кровалимаба в каждой из разделенных фракций. Для обеспечения выявления концентраций кровалимаба с использованием ELISA разделение SEC фракционируется на восемь фракций. Для каждого индивида с использованием данного подхода описывали профиль DTDC с течением времени. Для определения схемы дозирования, для которой ожидается достижение полного и поддерживаемого ингибирования терминального комплемента на протяжении всего интервала дозирования, разработали два дополняющих информированных о модели подхода разработки лекарственного средства (MIDD) для рекомендации дозы, подлежащей применению в данном клиническом испытании (доза фазы III):
• Эмпирическая модель популяционной фармакокинетики, использованная для рекомедации подкожной (п.к.) дозы и схемы поддержания концентраций кровалимаба выше целевой пороговой концентрации 100 мкг/мл на протяжении всего интервала дозирования у пациентов.
• Биохимическая модель, одновременно описывающая кинетику общего и свободного С5, фармакокинетику кровалимаба и экулизумаба, и кинетику DTDC, использованную для рекомендации дозы и схемы, минимизирующей образование больших DTDC у пациентов, переключающихся с экулизумаба на кровалимаб, и максимизирующей уровень свободных сайтов связывания кровалимаба у всех пациентов.
3.1 Модель популяционной фармакокинетики
Профили концентрация-время антитела против С5 кровалимаба лучше всего описывались с использованием двухкомпартментной открытой модели с устранением первого порядка и адсорбцией первого порядка для описания подкожного (п.к.) введения (см. Betts A. et al, mAbs (2018), Vol.10, No. 5, pp.751-764). Профили фармакокинетики (РК) у пациентов, переключающихся с лечения экулизумабом в части 3 COMPOSER, демонстрируют кратковременное более быстрое выведение, не наблюдаемое у здоровых добровольцев и не получавших лечение пациентов с PNH. Для описания фармакокинетики (РК) для пациентов, переключающихся с лечения экулизумабом на антитело против С5 кровалимаб, выведение кровалимаба моделировали как комбинацию выведения первого порядка, использованного для не получавших лечение пациентов, и более быстрого клиренса, который экспоненциально снижается во времени. Массу тела (медиана: 72,3 (40,6-131,5) [кг]) анализировали в качестве независимой переменной для клиренсов и объемов, и обнаружили то, что она значимо влияет на данные параметры при включении с использованием аллометрического масштабирования с коэффициентом, зафиксированным на уровне 0,75 для клиренсов и 1 для объемов. Параметр «клиренс» является мерой способности организма выводить лекарственное средство. Клиренс выражается как объем в единицу времени. Параметр «объемы» обозначает объем распределения - меру кажущегося пространства в организме, доступного для содержания антитела против С5 кровалимаба. Возраст также был обнаружен в качестве независимой переменной, влияющей на скорость поглощения, и был введен в модель в качестве категориальной независимой переменной. Пациенты в возрасте, большем или равном 50 лет, по-видимому, имеют меньшую скорость поглощения, чем более молодые пациенты. Биодоступность после подкожного (п.к.) введения оценивается как составляющая приблизительно 100%.
Данная модель могла точно оценивать РК параметры и имеет хорошую прогностическую эффективность, которая определяет ее применение в целях симуляции.
3.2 Биохимическая модель комплексов лекарственное средство-мишень-лекарственное средство (DTDC)
Разработали биохимическую математическую модель для исследования кинетики образования и выведения DTDC при предположении того, что комплексы увеличенного размера образуются посредством обратимого связывания меньших комплексов (см. Фиг. 5). Данная модель учитывает все комплексы, образованные повторением звена Ab1-Ag-Ab2 (антитело 1 (Ab1M), антитело 2 (Ab2) и антиген (Ag) представляют собой кровализумаб, экулизумаб и С5 соответственно), начиная с наименьших комплексов (Ab1-Ag-Ab2) вплоть до наибольших комплексов, содержащих 4 Ab1, 4 Ab2 и 8 Ag (например, комплекс Ab1-Ag-Ab2-Ag-Ab1-Ag-Ab2-Ag-Ab1-Ag-Ab2-Ag-Ab1-Ag-Ab2-Ag) в том виде, в котором он наблюдается в анализах SEC in vitro. Каждую возможную биохимическую реакцию, описывающую образование комплекса через связывание 2 меньших комплексов, описывали с использованием модели связывания лиганда. В каждой реакции связывания также учитывали клиренс комплексов и рециклирование свободного кровалимаба из DTDC (из-за SMART-lg Recycling®, высвобождающего С5 от кровалимаба в кислотных условиях лизосомы). Подробности системы SMART-lg Recycling® были описаны Fukuzawa et al., Sci Rep.(2017), Vol.7(1): 1080; doi: 10.1038/s41598-017-01087-7. Параметры модели оценивали с использованием нелинейного подхода со смешанными эффектами с использованием данных, собранных в исследовании COMPOSER. Для разработки модели использовали общий уровень кровалимаба, общий уровень С5 и 8 фракций SEC, где DTDC выявляются согласно их молекулярной массе. Оценка адекватности модели была удовлетворительной для целей симуляции. Данную модель калибровали с использованием концентраций экулизумаба во время переключения, профилей во времени общего уровня кровалиаба, общих концентраций С5 и основанных на хроматографии измерений распределения размера DTDC, полученных из исследования COMPOSER фазы I/II (см. Roth et al., Blood (2020), Vol., 135, pp.912-920; doi: 10.1182/blood.2019003399).
3.3 Определение дозы фазы III
Параллельное применение обеих моделей - модели популяционной фармакокинетики и биохимической модели DTDC - обеспечивало идентификацию фиксированной дозы и схемы дозирования, которая (1) минимизирует образование больших DTDC у пациентов, переключающихся с экулизумаба на кровалимаб, (2) максимизирует уровень свободных сайтов связывания кровалимаба и (3) обеспечивает то, что пациенты остаются выше целевой пороговой концентрации, требующейся для ингибирования комплемента (целевая Cthrough выше приблизительно 100 мкг/мл кровалимаба), несмотря на присущую вариабельность между индивидами.
На основе его механизма действия кровалимаб ингибирует опосредованный комплементом лизис эритроцитов, не имеющих регуляторных белков комплемента. Если терминальный путь комплемента временно не блокируется во время интервала обработки, данные эритроциты будут лизироваться, и это может приводить к прорывному гемолизу, который является тяжелым клиническим осложнением у пациентов с PNH. Биологический стресс (инфекция, хирургия, беременность) приводит к физиологической активации пути комплемента с повышающей регуляцией С5 (Schutte et al., Int Arch Allergy Appl Immunol (1975), Vol. 48(5), pp.706-720.). У пациентов с PNH, следовательно, важно не только поддерживать полную блокаду активности терминального комплемента посредством интервала дозирования, но также поддерживать резерв свободных сайтов связывания кровалимаба для минимизации появления прорывного гемолиза.
Доступные данные фармакокинетики (РК) и фармакодинамики (PD) из частей 1, 2 и 3 из исследования COMPOSER интегрировали для обеспечения характеристики связи PK/PD кровалимаба после в.в. и п.к. введения и для идентификации уровней воздействия, требующихся для полного ингибирования активности системы терминального комплемента. Посредством объединения данных РК и PD от 9 здоровых волонтеров в части 1,10 пациентов с PNH в части 2 и 16 пациентов с PNH в части 3 было показано то, что кровалимаб индуцирует зависимое от концентрации ингибирование сывороточной гемолитической активности при измерении посредством липосомного иммуноанализа ex vivo (LIA). Оценка связи воздействие-ответ демонстрирует то, что требуется приблизительно 100 мкг/мл кровалимаба для достижения полного ингибирования терминального комплемента, определяемого как гемолитическая активность меньше 10 U/мл (см. Фиг. 1).
В модели популяционной РК массу тела анализировали в качестве независимой переменной для клиренса кровалимаба и объема распределения, и обнаружили, что она статистически влияет на данные параметры при включении с использованием алло метрического масштабирования. Как следствие, для данной дозы большие пациенты имеют тенденцию к тому, чтобы иметь меньшее воздействие для того, чтобы быть подвергнутыми недостаточному воздействию по сравнению с меньшими пациентами. Для учета компенсации на эффект массы тела предлагается ярусный подход дозирования на основе массы для обеспечения того, что у всех получивших пациентов достигается сравнимое воздействие кровалимаба по всему интервалу дозирования.
Были определены следующие две схемы дозирования:
• Для пациентов с массой тела больше 40 кг, но меньше 100 кг
Ударные дозы: 1000 мг кровалимаба, введенного внутривенно (в.в.) в сутки 1, с последующими 340 мг кровалимаба, введенными подкожно (п.к.) в сутки 2, 8, 15 и 22.
Поддерживающие дозы: 680 мг кровалимаба п. к. в сутки 29, с последующим подкожным введением 680 мг кровалимаба п. к. один раз каждые 4 недели (Q4W) далее.
• Для пациентов с массой тела, большей или равной 100 кг
Ударные дозы: 1500 мг кровалимаба в.в. в сутки 1, с последующими 340 мг кровалимаба п. к. в сутки 2, 8, 15 и 22.
Поддерживающие дозы: 1020 мг кровалимаба п. к. в сутки 29, с последующим подкожным введением 680 мг кровалимаба п. к. один раз каждые 4 недели (Q4W) далее.
Пример 4: результаты симуляций модели DTDC
Симуляции, проведенные от данной модели были нацелены на идентификацию дозы и схемы дозирования, минимизирующих образование больших DTDC у пациентов, переключающихся с экулизумаба на кровалимаб, и обеспечивающих достаточные резервы свободных сайтов связывания кровалимаба у пациентов, переключающихся с экулизумаба, или не получавших лечения пациентов с PNH. Последний критерий обеспечивает объективную оценку границы контроля гемолиза, которую обеспечивает схема дозирования для защиты от прорывного гемолиза. Симуляции проводили только с использованием оценок параметров от пациентов в части 3 COMPOSER, которые переключались с экулизумаба на кровалимаб. Схема дозирования, обеспечивающая достаточный резерв свободных эпитопов кровалимаба у пациентов, которых предварительно лечили экулизумабом, также подходит для лечения пациентов, не получавших лечения. Как показано на Фиг. 2 и Фиг. 3, ожидается то, что вышеупомянутые схемы дозирования максимизируют доступность свободных эпитопов при минимизации образования наибольших DTDC.
Пример 5: результаты симуляций модели популяционной фармакокинетики
Проводили симуляции из модели популяционной РК для рекомендации дозы и схемы дозирования для обеспечения быстрого установления стационарных концентраций, а также поддержки наименьших концентраций выше 100 мкг/мл у большинства пациентов во всем интервале дозирования как у наивных в отношении лечения, так и у подвергавшихся предварительному лечению экулизумабом пациентов с PNH.
Профили концентрации кровалимаба относительно времени симулировали для 20000 не получавших лечения пациентов с PNH и 20000 пациентов с PNH, которые переключали лечение с экулизумаба на кровалимаб, с медианной массой тела 75,6 кг (стандартное отклонение плюс/минус 20,3; с 42,2 кг и 109,0 кг 5-ым и 95-ым процентилями соответственно). Симуляции объясняли эффект возраста с 50% симулированной популяции, находящейся в возрасте младше 50 лет, и с 50% симулированной популяции, находящейся в возрасте старше 50 лет.Выбор распределения массы тела основывается на наблюдаемом распределении в исследовании COMPOSER.
На основе результатов симуляции (Фиг. 4) прогнозируется, что вышеупомянутые дозировки и схема лечения приведут к быстрому установлению стационарных концентраций и поддерживаемым значениям Ctrough больше, чем 100 мкг/мл у приблизительно 95% индивидов во всем интервале дозирования, независимо от массы тела. Прогнозируется то, что данная схема дозирования будет поддерживать концентрации выше 100 мкг/мл как у не получавших лечения пациентов, так и у пациентов, переключающихся с экулизумаба, несмотря на наблюдаемое кратковременное увеличение клиренса кровалимаба и являющееся следствием этого более длительное время для достижения стационарных концентраций у последних.
Ожидается, что предложенные выше доза и схема дозирования обеспечивают полную и устойчивую блокаду активности терминального комплемента (причем поддерживаемую выше целевого порога у приблизительно 95% пациентов) и также обеспечивают достаточный резерв свободных сайтов связывания для большей части интервала дозирования как у не получавших лечения, так и у подвергавшихся предварительному лечению экулизумабом пациентов. Также ожидается, что у пациентов, переключающихся с экулизумаба, будет снижаться образование больших DTDC. Приведенные выше дозировки были подтверждены в части 4 исследования COMPOSER у семи пациентов, переключающихся с экулизумаба на кровалимаб. Часть 4 оценивала эффекты на безопаснось, фармакокинетику (РК) и фармакодинамику (PD) приведенной выше оптимизированной схемы с кровалимабом у 15 пациентов (дата отсечения - 29 января 2020 г.) с PNH, которые не получали терапию антителом против С5 (8 пациентов (53%)), или которых ранее лечили антителом против С5 экулизумабом (7 пациентов (47%)). Исходные характеристики пациентов, зарегистрированных в части 4 исследования COMPOSER, показаны на Фиг. 6. Самая подходящая дозировка для уменьшения сохранения DTDC, в частности, больших DTDC, состояла из серии ударных доз (1000 мг кровалимаба, введенного внутривенно (в.в.) в сутки 1, с последующими 340 мг кровалимаба, введенного подкожно (п.к.) в сутки 2, 8, 15 и 22), с последующим поддерживающим дозированием (680 мг кровалимаба п. к. в сутки 29, с последующим подкожным введением 680 мг кровалимаба п.к. один раз каждые 4 недели (Q4W) далее). Данные части 4 COMPOSER подтвердили то, что распределение размера DTDC сдвигалось к меньшим комплексам с использованием заявленной оптимизированной схемы дозирования. Дальнейшие результаты в отношении описанных выше дозы и схемы введения кровалимаба (1000 мг кровалимаба, введенного внутривенно (в.в.) в сутки 1, с последующими 340 мг кровалимаба, введенного подкожно (п.к.) в сутки 2, 8, 15 и 22), с последующим поддерживающим дозированием (680 мг кровалимаба п.к. в сутки 29, с последующим подкожным введением 680 мг кровалимаба п. к. один раз каждые 4 недели (Q4W) далее) приводятся на Фиг. 7-11.
Как показано на Фиг. 7, с данной оптимизированной схемой дозирования воздействие кровалимаба устойчиво поддерживалось выше значения Chough приблизительно 100 мкг/мл (уровень, ассоциированный с ингибированием комплемента) на протяжении всего периода последующего наблюдения 20 недель (140 суток).
Кроме того, ингибирование терминального комплемента достигалось сразу после исходной дозы и сохранялось на протяжении всего периода исследования (см. Фиг. 8). Кроме того, ограниченное общее накопление С5 наблюдали у пациентов с PNH, которые не получали терапии антителом против С5 (8 пациентов; Фиг. 9(A)), а снижение уровней С5 наблюдали у переключившихся пациентов (пациенты с PNH, которых ранее лечили антителом против С5 экулизумабом (7 пациентов; Фиг. 9(B)). Кроме того, на Фиг. 10 описано то, что внутрисосудистый гемолиз контролировался, большинство пациентов имели стабилизацию уровня гемоглобина и избегали переливания крови: всего у 10 (67%) пациентов, включая 5 из 8 пациентов, не получавших лечения, и 5 из 7 переключившихся пациентов, достигалась стабилизация гемоглобина (избежание большего или равного 2 г/дл снижения уровня гемоглобина от исходного в отсутствие переливания крови) в неделю 20. От исходного момента времени до недели 20 11 (73%) пациентов, включая 5 из 8 пациентов, не получавших лечения, и 6 из 7 переключившихся пациентов, освобождались от переливания крови. Свыше 7,2 общих лет подвергания пациентов риску ни один из пациентов не испытывал событий прорывного гемолиза (ВТН), как определяется в Kulasekararaj era/., Blood (2019), Vol.33, pp.540-549.
Кроме того, выявили то, что приведенная выше доза и схема лечения антитела против С5 кровалимаба хорошо переносилась, и не наблюдали серьезных связанных с лечением нежелательных явлений (АЕ) (см. Фиг. 11).
Таким образом, описанный в данном документе подход моделирования доказывает то, что заявленная схема дозировки является превосходной для лечения или предупреждения связанного с С5 заболевания, такого как PNH, как у не получавших лечения, так и, в частности, у получавших предварительное лечение экулизумабом субъектов.
Пример 6: результаты сравнения распределения размера DTDC между частью 3 и частью 4 исследования COMPOSER
В части 3 COMPOSER комплексы лекарственное средство-мишень-лекарственное средство (DTDC) между кровалимабом, человеческим С5 и антителом экулизумабом были выявлены у всех пациентов с PNH, которые переключились с антитела против С5 экулизумаба на кровалимаб. Целью настоящего примера является описание результатов сравнения распределения размера DTDC между схемой дозировки части 3 и части 4 исследования COMPOSER. В части 3 исследования COMPOSER антитело против С5 кровалимаб исходно вводится субъектам внутривенно один раз в дозе 1000 мг/организм. Начиная с одной недели после исходного внутривенного введения (сутки 8 после в.в. введения) антитело против С5 кровалимаб вводится подкожно (п.к.) один раз в каждую неделю в дозе 170 мг/организм, один раз каждые две недели в дозе 340 мг/организм или один раз каждые четыре недели в дозе 680 мг/организм. В части 4 исследования COMPOSER кровалимаб вводили согласно приведенной выше схеме дозирования и лечения: данными оптимизированной дозой и схемой были серия ударных доз 1000 мг в сутки 1 и 340 мг п.к. в сутки 2, 8, 15 и 22, с последующим поддерживающим дозированием 680 мг п. к. каждые 4 недели, начиная с суток 29 (неделя 5). Серия ударных доз увеличивала общую дозу кровалимаба, полученную во время первого месяца лечения, с уменьшением образования больших DTDC, в соответствии с теорией «решетки» образования комплексов. Эту оптимизированную стратегию дозирования исследовали в части 4 на пациентах, которые переключали лечения, и сравнивали с 19 пациентами с PNH, которые были зарегистрированы в части 3 и переключались с экулизумаба на кровалимаб. Распределения размера DTDC измеряли с использованием гель-фильтрации (SEC) в сочетании с ELISA. SEC разделяла DTDC на фракции согласно их размеру: большие DTDC находятся во фракциях 1-4, а меньшие комплексы, такие как одиночные мотивы и не DTDC, находятся во фракциях 5-6. DTDC наблюдали у всех пациентов из части 3 (Фиг. 12; большие DTDC находятся во фракциях 1-4, а меньшие комплексы, такие как одиночные мотивы и не DTDC находятся во фракциях 5-6). Два пациента из части 3 испытывали клинические проявления, сравнимые с реакциями гиперчувствительности типа III, которые были приписаны DTDC. Распределение размера DTDC у пациентов в части 4, которые получали оптимизированную стратегию дозирования, изменялось по-другому, чем у пациентов в части 3, согласно предсказаниям модели. У переключившихся пациентов из части 4 (n равно 7; дата отсечения 29 января 2020 г.) сумма DTDC во фракции 1-4 начинала снижаться в сутки 8 и продолжала снижаться, в отличие от части 3. В сутки 22 средняя процентная доля наибольших DTDC снижалась на 56% у пациентов в части 4 относительно пациентов в части 3. Кроме того, сывороточные концентрации кровалимаба оставались выше 100 мкг/мл для пациентов части 4, на уровне, ассоциированном с ингибированием комплемента. Несмотря на то, что DTDC наблюдаются у всех пациентов части 4, которые переключились с экулизумаба, не происходило нежелательных явлений, свидетельствующих о реакции гиперчувствительности типа III. В заключение, оптимизированная схема с кровалимабом приводила к меньшей концентрации больших DTDC, чем у пациентов, которые получали схему части 3.
Пример 7: результаты ответа на кровалимаб пациентов с PNH с полиморфизмом С5
Пароксизмальная ночная гемоглобинурия (PNH) отличается потерей эндогенных регуляторов комплемента CD59 и CD55 на гематопоэтических клетках. Периферические элементы крови являются чувствительными к разрушению комплементом, приводя к внутрисосудистому гемолизу и тромбозу. Стандартная терапия представляет собой ингибирование терминального комплемента экулизумабом - моноклональным антителом против С5 (mAb). Однако вплоть до 3,5% индивидов азиатского происхождения несут полиморфизмы в С5, влияющие на Arg885, который соответствует сайту связывания экулизумаба и равулизумаба (см. Nishimura et al., N Engl J Med, Vol.370, pp.632-639 (2014); DOI: 10.1056/NEJMoa 1311084). Пациенты с PNH с данными полиморфизмами испытывают плохой контроль над внутрисосудистым гемолизом с использованием экулизумаба, таким образом, составляя группу с большой неудовлетворенной медицинской потребностью. Кровалимаб представляет собой новое mAb (моноклональное антитело) против С5, которое связывается с отличным эпитопом на бета-субъединице С5. Исследования in vitro продемонстрировали то, что кровалимаб одинаково связывается и ингибирует активность С5 дикого типа и мутанта по Arg885 (Fukuzawa et al., Sci Rep, 7(1): 1080. doi: 10.1038/s41598-017-01087-7 (2017)).
Цели: целью настоящего примера является описание ответа на кровалимаб пациентов с PNH с полиморфизмом С5.
Способы: приведенную выше дозу и схему введения кровалимаба (1000 мг кровалимаба, введенного внутривенно (в.в.) в сутки 1, с последующими 340 мг введенного подкожно (п.к.) в сутки 2, 8, 15 и 22), с последующим поддерживающим дозированием (680 мг кровалимаба п. к. в сутки 29, с последующим подкожным введением 680 мг кровалимаба п. к. один раз каждые 4 недели (Q4W) далее) вводили пациентам с PNH с полиморфизмом С5 (мутация Arg885 С5 (SEQ ID NO: 13)). При каждом посещении определяли плазматическую концентрацию кровалимаба, лактатдегидрогеназы (LDH), свободного и общего С5, и активность комплемента. Пациентов отслеживали на наличие переливаний крови, событий прорывного гемолиза (ВТН) и на безопасность.
Результаты: из 44 пациентов, зарегистрированных в части 2 (n равно 10), части 3 (п равно 19) и части 4 (n равно 15) исследования COMPOSER (идентификатор ClinicalTrials.gov: NCT03157635), четыре имели полиморфизм нуклеотидов c.2654G->A, предсказывающий замену Arg885His. В дату отсечения -в сентябре 2019 г. период последующего наблюдения варьировал от 12,4 до 98,3 недель. Все четыре пациента были мужчинами, продиагностированными за 44-734 недели до регистрации с размером клона гранулоцитов PNH, варьирующим от 89 до 95%. При регистрации один пациент переключался с продолжающейся терапии экулизумабом, тогда как три ранее прервали лечение экулизумабом. Все пациенты имели уровень LDH, в 3 раза превышающий верхнюю границу нормы (ULN) при регистрации, который быстро падал и поддерживался на уровне меньше, чем 1,5× ULN на протяжении всего последующего периода наблюдения (Фиг. 13). Для одного пациента требовались переливания после регистрации (12 единиц эритроцитов (RBC) на протяжении 6 месяцев); данный пациент имел лежащий в основе диагноз апластической анемии, и ему требовалось 198 единиц RBC за 12 месяцев до регистрации. Ни один из четырех пациентов на испытывал событий прорывного гемолиза (ВТН). У всех четырех пациентов достигалось полное ингибирование терминального комплемента при измерении посредством липосомного иммуноанализа (LIA). Уровни LIA варьировали от 32 до 42 U/мл на входе в исследование, падали до меньше 10 U/мл (нижний уровень количественного измерения) к суткам 2 и затем поддерживались. Аналогичным образом, свободный С5 поддерживался на уровне меньше 0,5 мкг/мл после недели 6 (сутки 43). Профиль безопасности данных пациентов был аналогичным для остальных участников. Было описано три серьезных нежелательных явления (SAE), ни одно из которых не было связано с исследуемым лечением. Один пациент имел два SAE: камни желчных протоков и желчекаменную болезнь. Второй пациент имел SAE в виде инфекции верхних дыхательных путей с госпитализацией, которая происходила через 20 месяцев и завершалась во время нахождения на лечении.
Заключения: кровалимаб достигал полного и устойчивого ингибирования терминального комплемента у пациентов с PNH с полиморфизмом Arg885. Таким образом, кровалимаб представляет собой многообещающее антитело против С5 для лечения и/или предупреждения у пациентов, страдающих от PNH, где данные пациенты отличаются наличием мутации Arg885His С5.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> F. Hoffmann-La Roche AG
<120> ДОЗИРОВКА И СХЕМА ВВЕДЕНИЯ ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРЕДУПРЕЖДЕНИЯ СВЯЗАННЫХ С С5 ЗАБОЛЕВАНИЙ ПОСРЕДСТВОМ ПРИМЕНЕНИЯ АНТИТЕЛА ПРОТИВ С5 КРОВАЛИМАБА
<130> AC2429 PCT S3
<150> EP 20 17 9591.1
<151> 2020-06-11
<150> EP 20 17 4790.4
<151> 2020-05-14
<150> EP 19 18 9442.7
<151> 2019-07-31
<160> 13
<170> BiSSAP 1.3.6
<210> 1
<211> 448
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> тяжелая цепь экулизумаба
<400> 1
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ile Phe Ser Asn Tyr
20 25 30
Trp Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Ile Leu Pro Gly Ser Gly Ser Thr Glu Tyr Thr Glu Asn Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Phe Phe Gly Ser Ser Pro Asn Trp Tyr Phe Asp Val Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Asn Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys
210 215 220
Cys Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro
260 265 270
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 2
<211> 214
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> легкая цепь экулизумаба
<400> 2
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gly Ala Ser Glu Asn Ile Tyr Gly Ala
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Thr Asn Leu Ala Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Asn Val Leu Asn Thr Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 3
<211> 451
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> тяжелая цепь кровалимаба
<400> 3
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Val His Ser Ser
20 25 30
Tyr Tyr Met Ala Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
35 40 45
Val Gly Ala Ile Phe Thr Gly Ser Gly Ala Glu Tyr Lys Ala Glu Trp
50 55 60
Ala Lys Gly Arg Val Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Ser Asp Ala Gly Tyr Asp Tyr Pro Thr His Ala Met His Tyr
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
115 120 125
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
130 135 140
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
145 150 155 160
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
165 170 175
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
180 185 190
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
195 200 205
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys
210 215 220
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
225 230 235 240
Arg Arg Gly Pro Lys Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
245 250 255
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
260 265 270
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
275 280 285
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
290 295 300
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
305 310 315 320
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
325 330 335
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
340 345 350
Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln
355 360 365
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
370 375 380
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
385 390 395 400
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
405 410 415
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
420 425 430
Val Leu His Glu Ala Leu His Ala His Tyr Thr Arg Lys Glu Leu Ser
435 440 445
Leu Ser Pro
450
<210> 4
<211> 217
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> легкая цепь кровалимаба
<400> 4
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Ser
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Glu Thr Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Asn Thr Lys Val Gly Ser Ser
85 90 95
Tyr Gly Asn Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr
100 105 110
Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu
115 120 125
Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro
130 135 140
Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly
145 150 155 160
Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr
165 170 175
Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His
180 185 190
Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val
195 200 205
Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 5
<211> 448
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> тяжелая цепь равулизумаба
<400> 5
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly His Ile Phe Ser Asn Tyr
20 25 30
Trp Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Ile Leu Pro Gly Ser Gly His Thr Glu Tyr Thr Glu Asn Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Phe Phe Gly Ser Ser Pro Asn Trp Tyr Phe Asp Val Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Asn Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys
210 215 220
Cys Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro
260 265 270
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Leu His Glu Ala
420 425 430
Leu His Ser His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 6
<211> 214
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> легкая цепь равулизумаба
<400> 6
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gly Ala Ser Glu Asn Ile Tyr Gly Ala
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Thr Asn Leu Ala Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Asn Val Leu Asn Thr Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 7
<211> 123
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 7
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Val His Ser Ser
20 25 30
Tyr Tyr Met Ala Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
35 40 45
Val Gly Ala Ile Phe Thr Gly Ser Gly Ala Glu Tyr Lys Ala Glu Trp
50 55 60
Ala Lys Gly Arg Val Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Ser Asp Ala Gly Tyr Asp Tyr Pro Thr His Ala Met His Tyr
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 8
<211> 328
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 8
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Arg Arg Gly Pro Lys Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
225 230 235 240
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Leu His Glu Ala Leu His Ala His Tyr Thr
305 310 315 320
Arg Lys Glu Leu Ser Leu Ser Pro
325
<210> 9
<211> 110
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 9
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Ser
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Glu Thr Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Asn Thr Lys Val Gly Ser Ser
85 90 95
Tyr Gly Asn Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 10
<211> 107
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Искусственно синтезированная последовательность
<400> 10
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 11
<211> 650
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Иммуноглобулин, анти-(α-цепь C5 комплемента человека); тяжелая цепь;
CAS-регистрационный номер: 219685-50-4
<400> 11
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ile Phe Ser Asn Tyr
20 25 30
Trp Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Ile Leu Pro Gly Ser Gly Ser Thr Glu Tyr Thr Glu Asn Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Phe Phe Gly Ser Ser Pro Asn Trp Tyr Phe Asp Val Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Asn Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Thr Val Gly Glu Arg Pro
210 215 220
Ala Gln Gly Gly Arg Val Ser Ala Gly Ser Gln Ala Gln Pro Ser Cys
225 230 235 240
Leu Asp Ala Pro Arg Leu Cys Ser Pro Ser Pro Gly Gln Gln Gly Arg
245 250 255
Pro His Leu Ser Pro His Pro Glu Ala Ser Ala Arg Pro Thr His Ala
260 265 270
Gln Gly Glu Gly Leu Leu Ala Phe Ser Thr Arg Leu Gln Ala Gly Thr
275 280 285
Gly Trp Val Pro Leu Pro Gln Ala Leu His Thr Gln Gly Gln Val Leu
290 295 300
Gly Ser Asp Leu Pro Lys Ala Ile Ser Gly Arg Thr Leu Pro Pro Asp
305 310 315 320
Leu Ser Arg Pro Gln Gly Gln Thr Val His Ser Leu Ser Ser Asp Thr
325 330 335
Phe Leu Ser Ser Gln Ile Arg Val Thr Pro Asn Leu Leu Ser Ala Glu
340 345 350
Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro Gly Lys Pro Ala Gln
355 360 365
Ala Ser Pro Ser Ser Ser Arg Arg Asp Arg Cys Pro Arg Val Ala Cys
370 375 380
Ile Gln Gly Gln Pro Gln Leu Gly Ala Asp Thr Ser Thr Ser Ile Ser
385 390 395 400
Ser Ser Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro
405 410 415
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
420 425 430
Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp
435 440 445
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
450 455 460
Glu Gln Phe Asn Ser Thr Asp Arg Val Val Ser Val Leu Thr Val Leu
465 470 475 480
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Thr
485 490 495
Lys Ala Ser Arg Pro Pro Ser Arg Lys Pro Ser Pro Lys Pro Lys Val
500 505 510
Gly Pro Thr Gly Cys Glu Gly His Met Asp Arg Gly Gln Leu Gly Pro
515 520 525
Pro Ser Ala Leu Gly Val Thr Ala Val Pro Thr Ser Val Pro Thr Gly
530 535 540
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu
545 550 555 560
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Leu Tyr
565 570 575
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
580 585 590
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
595 600 605
Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn
610 615 620
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
625 630 635 640
Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
645 650
<210> 12
<211> 214
<212> ПРТ
<213> Искусственная последовательность
<220>
<223> Иммуноглобулин, анти-(α-цепь C5 комплемента человека; легкая цепь;
CAS-регистрационный номер: 219685-50-4
<400> 12
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gly Ala Ser Glu Asn Ile Tyr Gly Ala
20 25 30
Leu Asn Trp Tyr Gln Arg Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Thr Asn Leu Ala Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Asn Val Leu Asn Thr Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 13
<211> 1676
<212> ПРТ
<213> Homo sapiens
<400> 13
Met Gly Leu Leu Gly Ile Leu Cys Phe Leu Ile Phe Leu Gly Lys Thr
1 5 10 15
Trp Gly Gln Glu Gln Thr Tyr Val Ile Ser Ala Pro Lys Ile Phe Arg
20 25 30
Val Gly Ala Ser Glu Asn Ile Val Ile Gln Val Tyr Gly Tyr Thr Glu
35 40 45
Ala Phe Asp Ala Thr Ile Ser Ile Lys Ser Tyr Pro Asp Lys Lys Phe
50 55 60
Ser Tyr Ser Ser Gly His Val His Leu Ser Ser Glu Asn Lys Phe Gln
65 70 75 80
Asn Ser Ala Ile Leu Thr Ile Gln Pro Lys Gln Leu Pro Gly Gly Gln
85 90 95
Asn Pro Val Ser Tyr Val Tyr Leu Glu Val Val Ser Lys His Phe Ser
100 105 110
Lys Ser Lys Arg Met Pro Ile Thr Tyr Asp Asn Gly Phe Leu Phe Ile
115 120 125
His Thr Asp Lys Pro Val Tyr Thr Pro Asp Gln Ser Val Lys Val Arg
130 135 140
Val Tyr Ser Leu Asn Asp Asp Leu Lys Pro Ala Lys Arg Glu Thr Val
145 150 155 160
Leu Thr Phe Ile Asp Pro Glu Gly Ser Glu Val Asp Met Val Glu Glu
165 170 175
Ile Asp His Ile Gly Ile Ile Ser Phe Pro Asp Phe Lys Ile Pro Ser
180 185 190
Asn Pro Arg Tyr Gly Met Trp Thr Ile Lys Ala Lys Tyr Lys Glu Asp
195 200 205
Phe Ser Thr Thr Gly Thr Ala Tyr Phe Glu Val Lys Glu Tyr Val Leu
210 215 220
Pro His Phe Ser Val Ser Ile Glu Pro Glu Tyr Asn Phe Ile Gly Tyr
225 230 235 240
Lys Asn Phe Lys Asn Phe Glu Ile Thr Ile Lys Ala Arg Tyr Phe Tyr
245 250 255
Asn Lys Val Val Thr Glu Ala Asp Val Tyr Ile Thr Phe Gly Ile Arg
260 265 270
Glu Asp Leu Lys Asp Asp Gln Lys Glu Met Met Gln Thr Ala Met Gln
275 280 285
Asn Thr Met Leu Ile Asn Gly Ile Ala Gln Val Thr Phe Asp Ser Glu
290 295 300
Thr Ala Val Lys Glu Leu Ser Tyr Tyr Ser Leu Glu Asp Leu Asn Asn
305 310 315 320
Lys Tyr Leu Tyr Ile Ala Val Thr Val Ile Glu Ser Thr Gly Gly Phe
325 330 335
Ser Glu Glu Ala Glu Ile Pro Gly Ile Lys Tyr Val Leu Ser Pro Tyr
340 345 350
Lys Leu Asn Leu Val Ala Thr Pro Leu Phe Leu Lys Pro Gly Ile Pro
355 360 365
Tyr Pro Ile Lys Val Gln Val Lys Asp Ser Leu Asp Gln Leu Val Gly
370 375 380
Gly Val Pro Val Thr Leu Asn Ala Gln Thr Ile Asp Val Asn Gln Glu
385 390 395 400
Thr Ser Asp Leu Asp Pro Ser Lys Ser Val Thr Arg Val Asp Asp Gly
405 410 415
Val Ala Ser Phe Val Leu Asn Leu Pro Ser Gly Val Thr Val Leu Glu
420 425 430
Phe Asn Val Lys Thr Asp Ala Pro Asp Leu Pro Glu Glu Asn Gln Ala
435 440 445
Arg Glu Gly Tyr Arg Ala Ile Ala Tyr Ser Ser Leu Ser Gln Ser Tyr
450 455 460
Leu Tyr Ile Asp Trp Thr Asp Asn His Lys Ala Leu Leu Val Gly Glu
465 470 475 480
His Leu Asn Ile Ile Val Thr Pro Lys Ser Pro Tyr Ile Asp Lys Ile
485 490 495
Thr His Tyr Asn Tyr Leu Ile Leu Ser Lys Gly Lys Ile Ile His Phe
500 505 510
Gly Thr Arg Glu Lys Phe Ser Asp Ala Ser Tyr Gln Ser Ile Asn Ile
515 520 525
Pro Val Thr Gln Asn Met Val Pro Ser Ser Arg Leu Leu Val Tyr Tyr
530 535 540
Ile Val Thr Gly Glu Gln Thr Ala Glu Leu Val Ser Asp Ser Val Trp
545 550 555 560
Leu Asn Ile Glu Glu Lys Cys Gly Asn Gln Leu Gln Val His Leu Ser
565 570 575
Pro Asp Ala Asp Ala Tyr Ser Pro Gly Gln Thr Val Ser Leu Asn Met
580 585 590
Ala Thr Gly Met Asp Ser Trp Val Ala Leu Ala Ala Val Asp Ser Ala
595 600 605
Val Tyr Gly Val Gln Arg Gly Ala Lys Lys Pro Leu Glu Arg Val Phe
610 615 620
Gln Phe Leu Glu Lys Ser Asp Leu Gly Cys Gly Ala Gly Gly Gly Leu
625 630 635 640
Asn Asn Ala Asn Val Phe His Leu Ala Gly Leu Thr Phe Leu Thr Asn
645 650 655
Ala Asn Ala Asp Asp Ser Gln Glu Asn Asp Glu Pro Cys Lys Glu Ile
660 665 670
Leu Arg Pro Arg Arg Thr Leu Gln Lys Lys Ile Glu Glu Ile Ala Ala
675 680 685
Lys Tyr Lys His Ser Val Val Lys Lys Cys Cys Tyr Asp Gly Ala Cys
690 695 700
Val Asn Asn Asp Glu Thr Cys Glu Gln Arg Ala Ala Arg Ile Ser Leu
705 710 715 720
Gly Pro Arg Cys Ile Lys Ala Phe Thr Glu Cys Cys Val Val Ala Ser
725 730 735
Gln Leu Arg Ala Asn Ile Ser His Lys Asp Met Gln Leu Gly Arg Leu
740 745 750
His Met Lys Thr Leu Leu Pro Val Ser Lys Pro Glu Ile Arg Ser Tyr
755 760 765
Phe Pro Glu Ser Trp Leu Trp Glu Val His Leu Val Pro Arg Arg Lys
770 775 780
Gln Leu Gln Phe Ala Leu Pro Asp Ser Leu Thr Thr Trp Glu Ile Gln
785 790 795 800
Gly Val Gly Ile Ser Asn Thr Gly Ile Cys Val Ala Asp Thr Val Lys
805 810 815
Ala Lys Val Phe Lys Asp Val Phe Leu Glu Met Asn Ile Pro Tyr Ser
820 825 830
Val Val Arg Gly Glu Gln Ile Gln Leu Lys Gly Thr Val Tyr Asn Tyr
835 840 845
Arg Thr Ser Gly Met Gln Phe Cys Val Lys Met Ser Ala Val Glu Gly
850 855 860
Ile Cys Thr Ser Glu Ser Pro Val Ile Asp His Gln Gly Thr Lys Ser
865 870 875 880
Ser Lys Cys Val Arg Gln Lys Val Glu Gly Ser Ser Ser His Leu Val
885 890 895
Thr Phe Thr Val Leu Pro Leu Glu Ile Gly Leu His Asn Ile Asn Phe
900 905 910
Ser Leu Glu Thr Trp Phe Gly Lys Glu Ile Leu Val Lys Thr Leu Arg
915 920 925
Val Val Pro Glu Gly Val Lys Arg Glu Ser Tyr Ser Gly Val Thr Leu
930 935 940
Asp Pro Arg Gly Ile Tyr Gly Thr Ile Ser Arg Arg Lys Glu Phe Pro
945 950 955 960
Tyr Arg Ile Pro Leu Asp Leu Val Pro Lys Thr Glu Ile Lys Arg Ile
965 970 975
Leu Ser Val Lys Gly Leu Leu Val Gly Glu Ile Leu Ser Ala Val Leu
980 985 990
Ser Gln Glu Gly Ile Asn Ile Leu Thr His Leu Pro Lys Gly Ser Ala
995 1000 1005
Glu Ala Glu Leu Met Ser Val Val Pro Val Phe Tyr Val Phe His Tyr
1010 1015 1020
Leu Glu Thr Gly Asn His Trp Asn Ile Phe His Ser Asp Pro Leu Ile
1025 1030 1035 1040
Glu Lys Gln Lys Leu Lys Lys Lys Leu Lys Glu Gly Met Leu Ser Ile
1045 1050 1055
Met Ser Tyr Arg Asn Ala Asp Tyr Ser Tyr Ser Val Trp Lys Gly Gly
1060 1065 1070
Ser Ala Ser Thr Trp Leu Thr Ala Phe Ala Leu Arg Val Leu Gly Gln
1075 1080 1085
Val Asn Lys Tyr Val Glu Gln Asn Gln Asn Ser Ile Cys Asn Ser Leu
1090 1095 1100
Leu Trp Leu Val Glu Asn Tyr Gln Leu Asp Asn Gly Ser Phe Lys Glu
1105 1110 1115 1120
Asn Ser Gln Tyr Gln Pro Ile Lys Leu Gln Gly Thr Leu Pro Val Glu
1125 1130 1135
Ala Arg Glu Asn Ser Leu Tyr Leu Thr Ala Phe Thr Val Ile Gly Ile
1140 1145 1150
Arg Lys Ala Phe Asp Ile Cys Pro Leu Val Lys Ile Asp Thr Ala Leu
1155 1160 1165
Ile Lys Ala Asp Asn Phe Leu Leu Glu Asn Thr Leu Pro Ala Gln Ser
1170 1175 1180
Thr Phe Thr Leu Ala Ile Ser Ala Tyr Ala Leu Ser Leu Gly Asp Lys
1185 1190 1195 1200
Thr His Pro Gln Phe Arg Ser Ile Val Ser Ala Leu Lys Arg Glu Ala
1205 1210 1215
Leu Val Lys Gly Asn Pro Pro Ile Tyr Arg Phe Trp Lys Asp Asn Leu
1220 1225 1230
Gln His Lys Asp Ser Ser Val Pro Asn Thr Gly Thr Ala Arg Met Val
1235 1240 1245
Glu Thr Thr Ala Tyr Ala Leu Leu Thr Ser Leu Asn Leu Lys Asp Ile
1250 1255 1260
Asn Tyr Val Asn Pro Val Ile Lys Trp Leu Ser Glu Glu Gln Arg Tyr
1265 1270 1275 1280
Gly Gly Gly Phe Tyr Ser Thr Gln Asp Thr Ile Asn Ala Ile Glu Gly
1285 1290 1295
Leu Thr Glu Tyr Ser Leu Leu Val Lys Gln Leu Arg Leu Ser Met Asp
1300 1305 1310
Ile Asp Val Ser Tyr Lys His Lys Gly Ala Leu His Asn Tyr Lys Met
1315 1320 1325
Thr Asp Lys Asn Phe Leu Gly Arg Pro Val Glu Val Leu Leu Asn Asp
1330 1335 1340
Asp Leu Ile Val Ser Thr Gly Phe Gly Ser Gly Leu Ala Thr Val His
1345 1350 1355 1360
Val Thr Thr Val Val His Lys Thr Ser Thr Ser Glu Glu Val Cys Ser
1365 1370 1375
Phe Tyr Leu Lys Ile Asp Thr Gln Asp Ile Glu Ala Ser His Tyr Arg
1380 1385 1390
Gly Tyr Gly Asn Ser Asp Tyr Lys Arg Ile Val Ala Cys Ala Ser Tyr
1395 1400 1405
Lys Pro Ser Arg Glu Glu Ser Ser Ser Gly Ser Ser His Ala Val Met
1410 1415 1420
Asp Ile Ser Leu Pro Thr Gly Ile Ser Ala Asn Glu Glu Asp Leu Lys
1425 1430 1435 1440
Ala Leu Val Glu Gly Val Asp Gln Leu Phe Thr Asp Tyr Gln Ile Lys
1445 1450 1455
Asp Gly His Val Ile Leu Gln Leu Asn Ser Ile Pro Ser Ser Asp Phe
1460 1465 1470
Leu Cys Val Arg Phe Arg Ile Phe Glu Leu Phe Glu Val Gly Phe Leu
1475 1480 1485
Ser Pro Ala Thr Phe Thr Val Tyr Glu Tyr His Arg Pro Asp Lys Gln
1490 1495 1500
Cys Thr Met Phe Tyr Ser Thr Ser Asn Ile Lys Ile Gln Lys Val Cys
1505 1510 1515 1520
Glu Gly Ala Ala Cys Lys Cys Val Glu Ala Asp Cys Gly Gln Met Gln
1525 1530 1535
Glu Glu Leu Asp Leu Thr Ile Ser Ala Glu Thr Arg Lys Gln Thr Ala
1540 1545 1550
Cys Lys Pro Glu Ile Ala Tyr Ala Tyr Lys Val Ser Ile Thr Ser Ile
1555 1560 1565
Thr Val Glu Asn Val Phe Val Lys Tyr Lys Ala Thr Leu Leu Asp Ile
1570 1575 1580
Tyr Lys Thr Gly Glu Ala Val Ala Glu Lys Asp Ser Glu Ile Thr Phe
1585 1590 1595 1600
Ile Lys Lys Val Thr Cys Thr Asn Ala Glu Leu Val Lys Gly Arg Gln
1605 1610 1615
Tyr Leu Ile Met Gly Lys Glu Ala Leu Gln Ile Lys Tyr Asn Phe Ser
1620 1625 1630
Phe Arg Tyr Ile Tyr Pro Leu Asp Ser Leu Thr Trp Ile Glu Tyr Trp
1635 1640 1645
Pro Arg Asp Thr Thr Cys Ser Ser Cys Gln Ala Phe Leu Ala Asn Leu
1650 1655 1660
Asp Glu Phe Ala Glu Asp Ile Phe Leu Asn Gly Cys
1665 1670 1675
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРЕДНАЗНАЧЕННАЯ ДЛЯ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРЕДУПРЕЖДЕНИЯ СВЯЗАННОГО С С5 ЗАБОЛЕВАНИЯ, И СПОСОБ ЛЕЧЕНИЯ ИЛИ ПРЕДУПРЕЖДЕНИЯ СВЯЗАННОГО С С5 ЗАБОЛЕВАНИЯ | 2019 |
|
RU2789389C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРЕДНАЗНАЧЕННАЯ ДЛЯ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРЕДУПРЕЖДЕНИЯ СВЯЗАННОГО С C5 ЗАБОЛЕВАНИЯ, И СПОСОБ ЛЕЧЕНИЯ ИЛИ ПРЕДУПРЕЖДЕНИЯ СВЯЗАННОГО С C5 ЗАБОЛЕВАНИЯ | 2019 |
|
RU2832946C2 |
| АНТИТЕЛА К С5 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2746356C2 |
| АНТИТЕЛА К С5 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2789788C2 |
| ДОЗЫ И ВВЕДЕНИЕ АНТИТЕЛ ПРОТИВ C5 ДЛЯ ЛЕЧЕНИЯ АТИПИЧНОГО ГЕМОЛИТИКО-УРЕМИЧЕСКОГО СИНДРОМА (аГУС) | 2020 |
|
RU2822664C2 |
| АНТИ-C5 АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2774716C2 |
| СПОСОБЫ ЛЕЧЕНИЯ СОСТОЯНИЙ, СВЯЗАННЫХ С MASP-2 ЗАВИСИМОЙ АКТИВАЦИЕЙ КОМПЛЕМЕНТА | 2012 |
|
RU2743409C2 |
| С5-связующие полипептиды | 2014 |
|
RU2714156C2 |
| КОМБИНИРОВАННЫЕ СПОСОБЫ ЛЕЧЕНИЯ АНТАГОНИСТАМИ PD-L1 | 2016 |
|
RU2766890C2 |
| ВЫСОКОКОНЦЕНТРИРОВАННЫЕ СОСТАВЫ АНТИТЕЛ К C5 | 2018 |
|
RU2787595C2 |
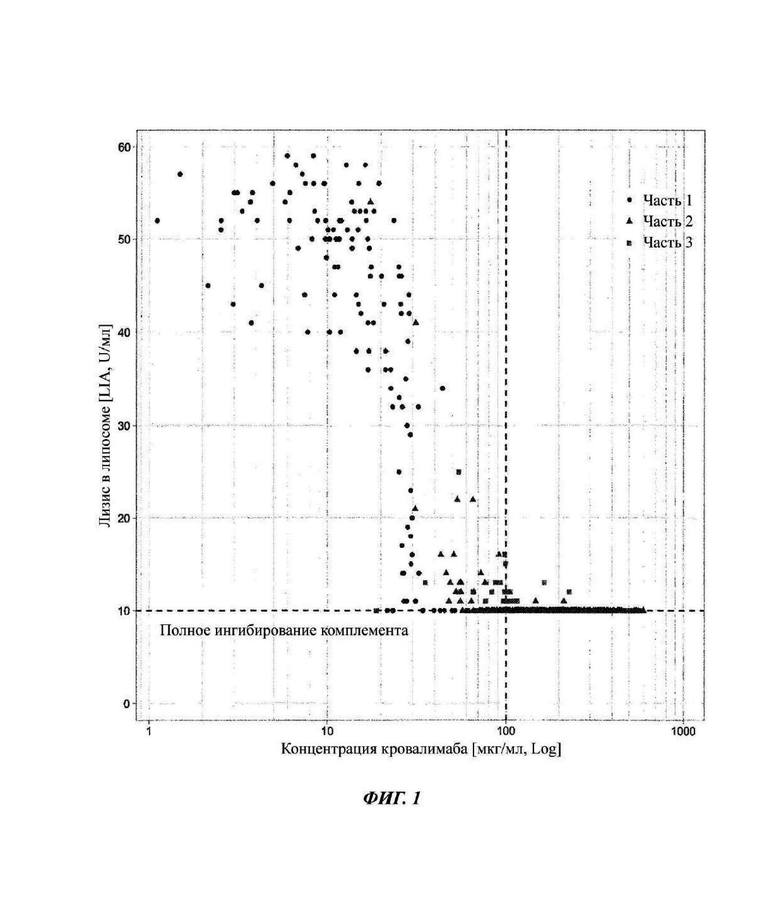
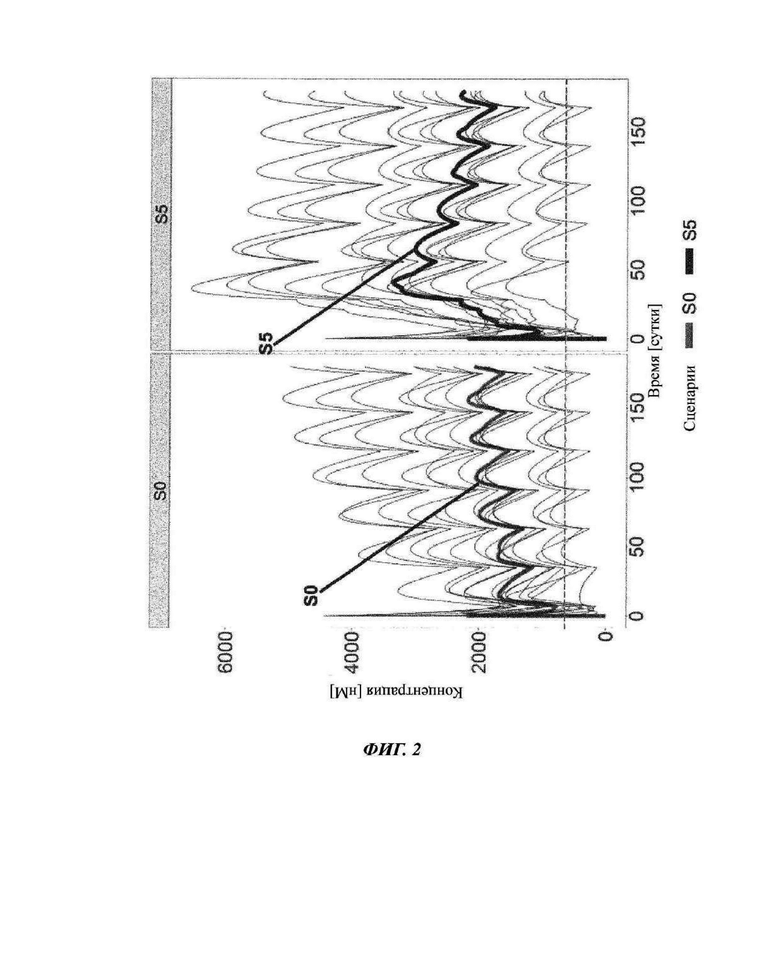
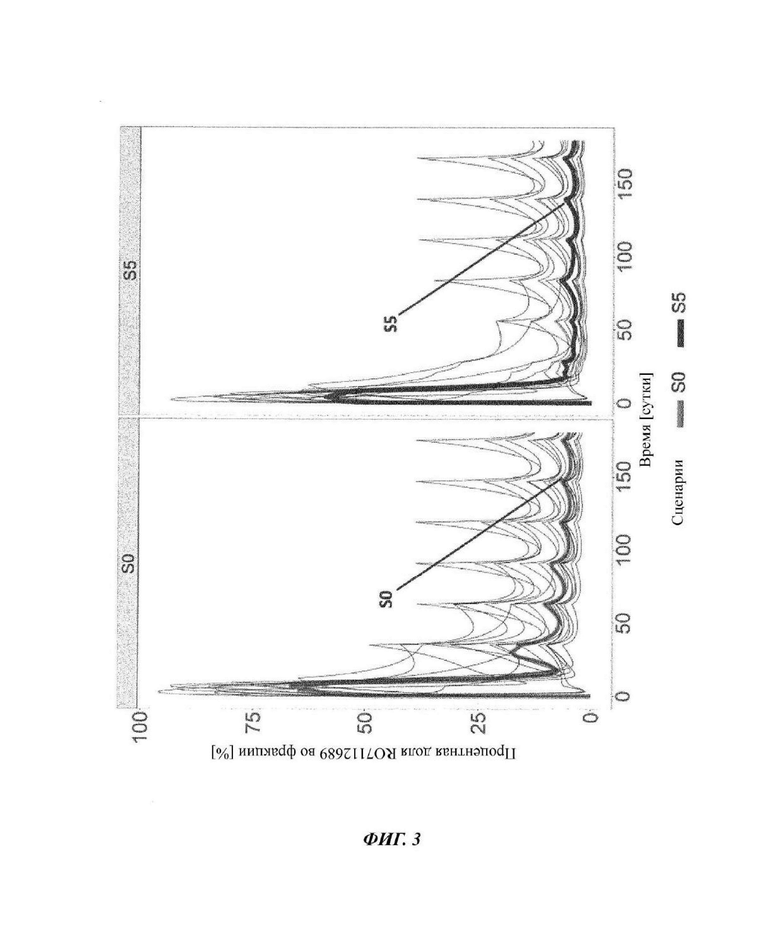
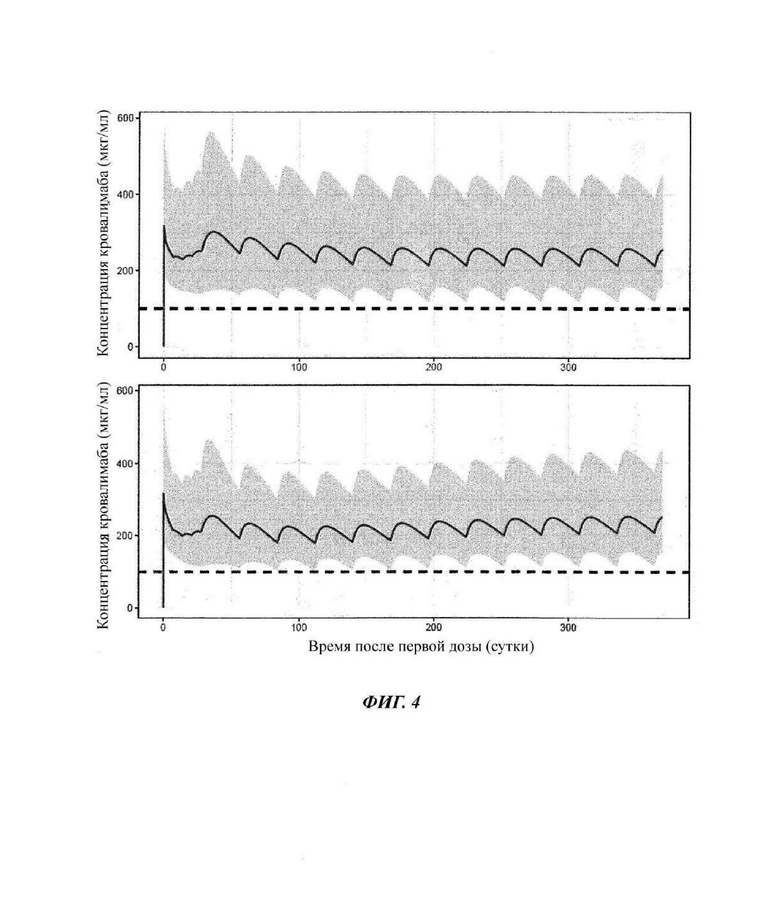
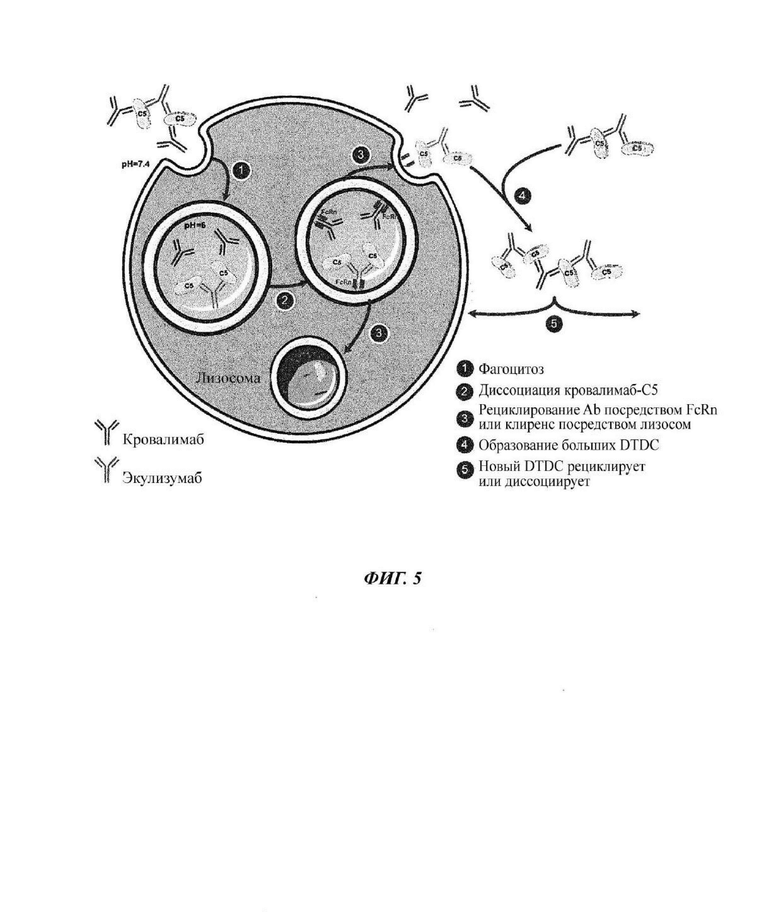
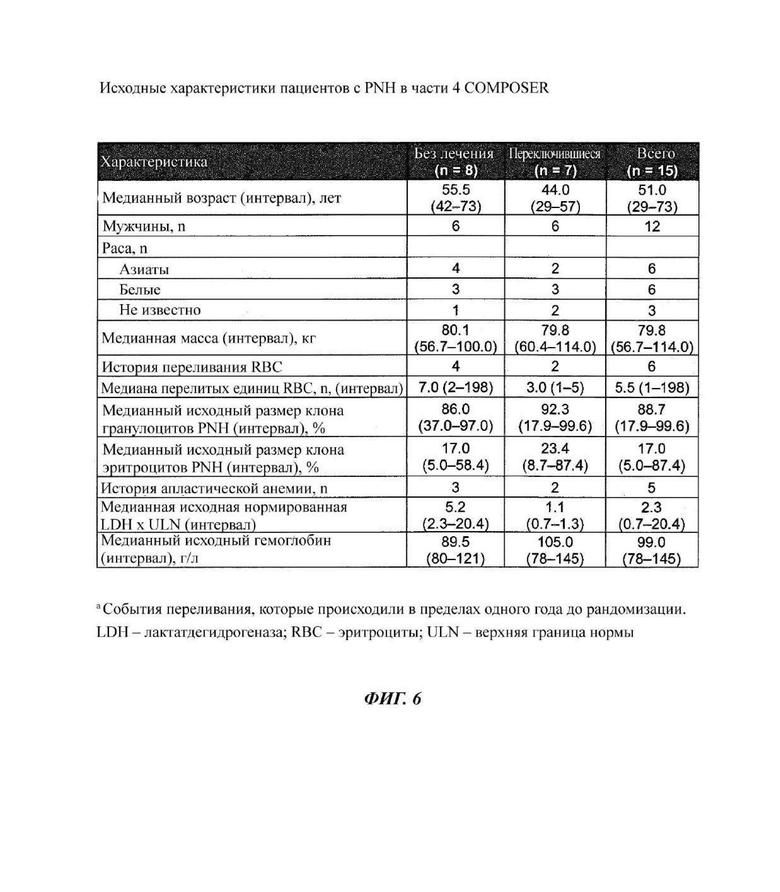
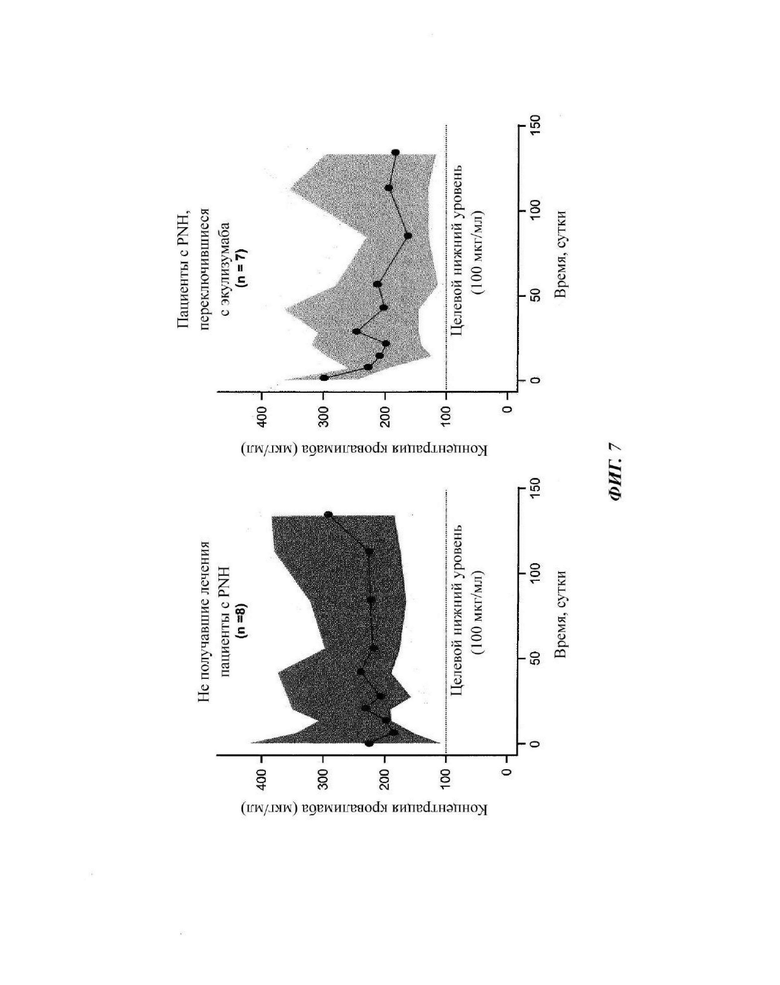
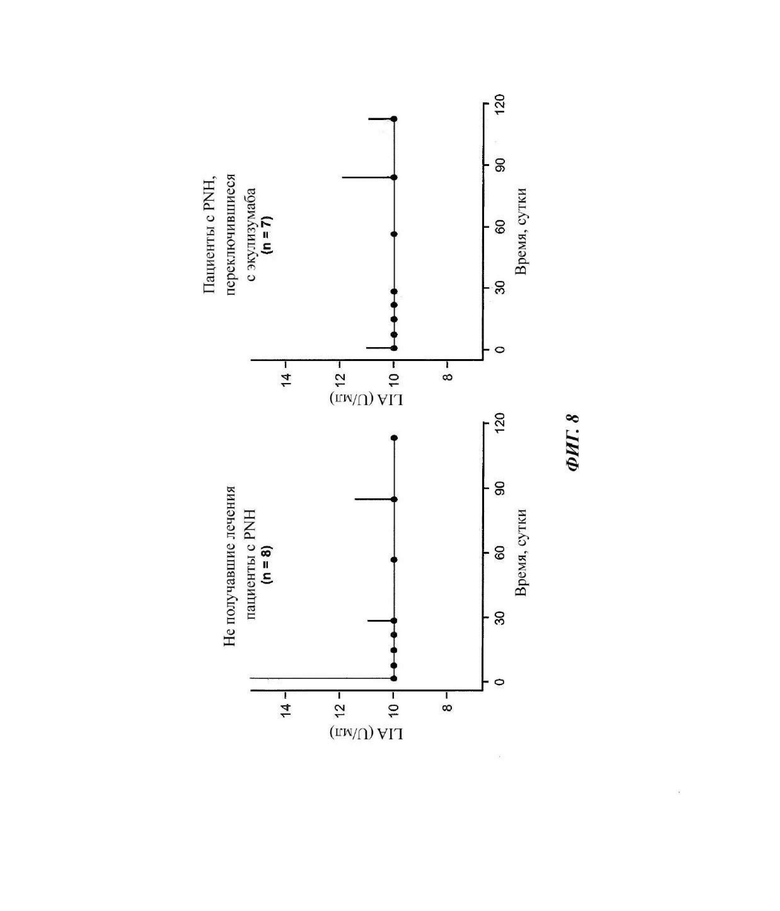
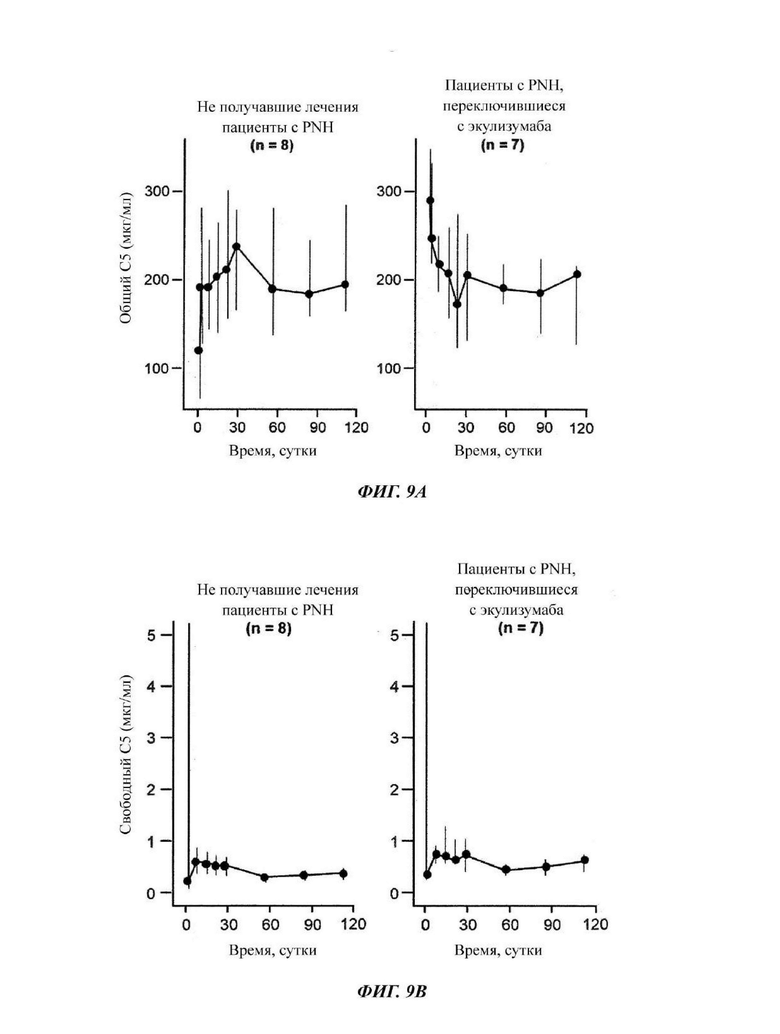
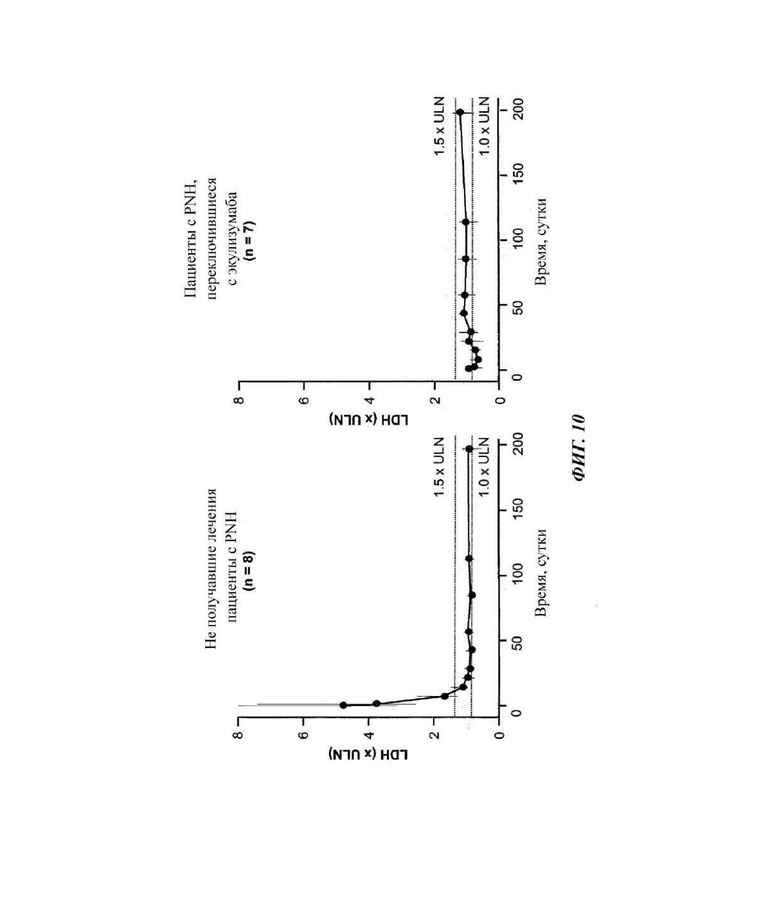

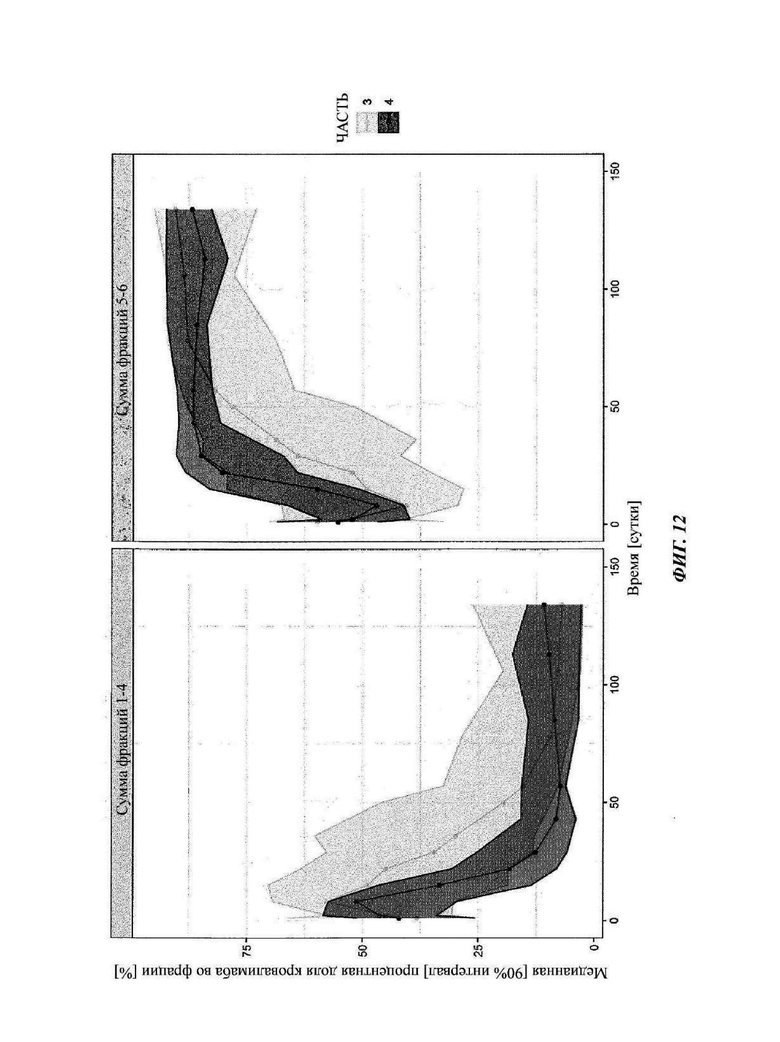
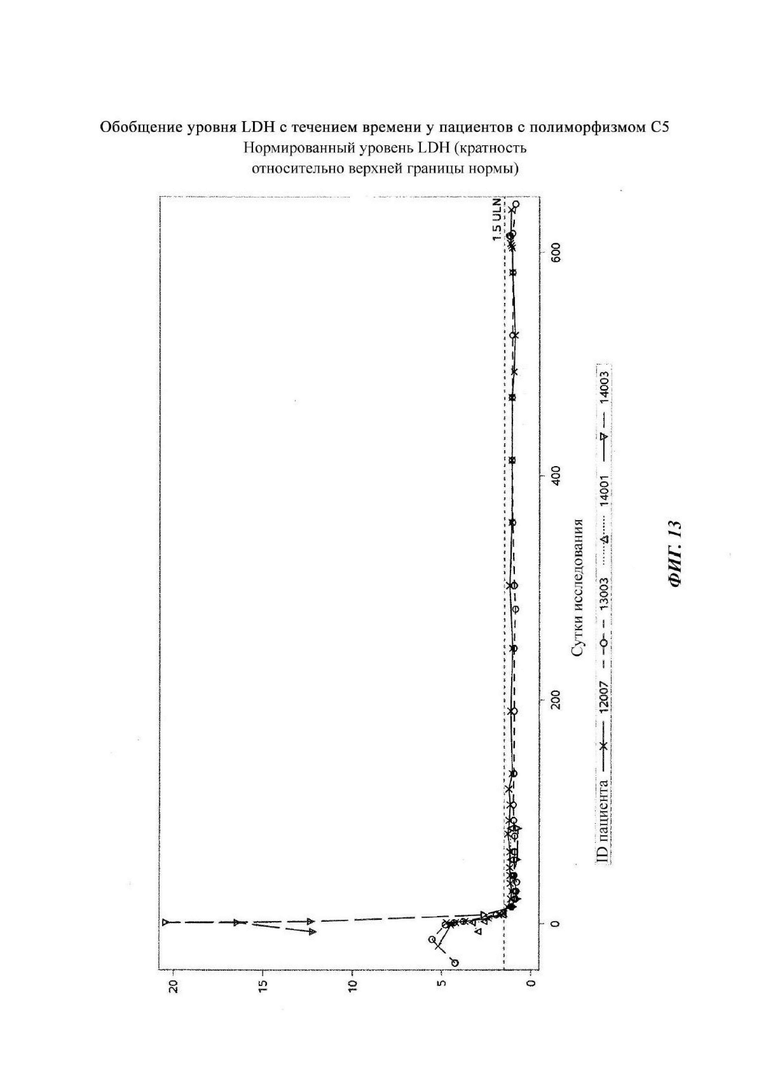
Изобретение относится к области медицины и фармацевтики, а именно к способу лечения или предупреждения пароксизмальной ночной гемоглобинурии (PNH) у субъекта, который имеет массу тела, равную или большую чем 100 кг, включающему (i) внутривенное введение ударной дозы 1500 мг антитела против С5 субъекту один раз; (ii) подкожное введение ударной дозы 340 мг антитела против С5 субъекту через 1 сутки после начала внутривенного введения антитела против С5; (iii) подкожное введение ударной дозы 340 мг антитела против С5 субъекту через 1 неделю, 2 недели и 3 недели после начала внутривенного введения антитела против С5 один раз в неделю; (iv) подкожное введение поддерживающей дозы 1020 мг антитела против С5 субъекту через 4 недели после начала внутривенного введения антитела против С5; и (v) подкожное введение поддерживающей дозы 1020 мг антитела против С5 субъекту несколько раз с интервалами времени 4 недели, где антитело против С5 представляет собой кровалимаб. Технический результат заключается в обеспечении перехода от внутривенного к подкожному введению, снижении образования комплексов лекарственное средство-мишень-лекарственное средство (DTDC) у пациентов. 7 з.п. ф-лы, 13 ил., 1 табл., 7 пр.
1. Способ лечения или предупреждения пароксизмальной ночной гемоглобинурии (PNH) у субъекта, где указанный способ проводят посредством следующих стадий введения:
(i) внутривенное введение ударной дозы 1500 мг антитела против С5 субъекту один раз;
(ii) подкожное введение ударной дозы 340 мг антитела против С5 субъекту через 1 сутки после начала внутривенного введения антитела против С5;
(iii) подкожное введение ударной дозы 340 мг антитела против С5 субъекту через 1 неделю, 2 недели и 3 недели после начала внутривенного введения антитела против С5 один раз в неделю;
(iv) подкожное введение поддерживающей дозы 1020 мг антитела против С5 субъекту через 4 недели после начала внутривенного введения антитела против С5; и
(v) подкожное введение поддерживающей дозы 1020 мг антитела против С5 субъекту несколько раз с интервалами времени 4 недели,
где субъект имеет массу тела, равную или большую чем 100 кг, и
где антитело против С5 представляет собой кровалимаб.
2. Способ по п. 1, где указанный субъект получал предшествующее лечение по меньшей мере одним фармакологическим продуктом, пригодным для лечения или предупреждения связанного с С5 заболевания, где вводимую внутривенно ударную дозу 1500 мг антитела против С5 вводят субъекту после последней дозы фармакологического продукта.
3. Способ по п. 2, где внутривенно вводимую ударную дозу 1500 мг антитела против С5 вводят субъекту в третьи сутки или через 3 суток после введения последней дозы фармакологического продукта.
4. Способ по п. 2 или 3, где указанный фармакологический продукт содержит миРНК, нацеленную на мРНК С5, или антитело против С5, которое отличается от антитела против С5, содержащегося в композиции для подкожной или внутривенной инъекции.
5. Способ по любому из пп. 2-4, где указанный фармакологический продукт содержит экулизумаб, равулизумаб или их варианты.
6. Способ по любому из пп. 1-5, где концентрация антитела против С5, определенная в биологическом образце указанного субъекта, составляет 100 мкг/мл или более.
7. Способ по любому из пп. 1-5, где гемолитическая активность, определенная в биологическом образце указанного субъекта, составляет менее 10 U/мл.
8. Способ по п. 6 или 7, где указанный биологический образец представляет собой образец крови, предпочтительно образец красной крови.
| WO 2018143266 A1, 09.08.2018 | |||
| WO 2019084438 A1, 02.05.2019 | |||
| WO 2018195034 A1, 25.10.2018 | |||
| WO 2018106859 A1, 14.06.2018. |
Авторы
Даты
2024-12-23—Публикация
2020-07-30—Подача