Перекрестная ссылка на родственную заявку
В настоящей заявке испрашивается приоритет предварительной заявки на патент США No. 62/467498, поданной 6 марта 2017, и содержание этой заявки включено в настоящее изобретение в полном объеме.
Заявление об исследованиях или разработках, проводимых на средства Федерального правительства, выступаемого в качестве спонсора
Настоящее изобретение было разработано при поддержке Правительства на грант NIH AI44970, выданный Национальным Институтом Здравоохранения (NIH). Правительство имеет определенные права на это изобретение.
Предпосылки создания изобретения
Система комплемента представляет собой часть природной иммунной системы, которая играет ключевую роль в защите хозяина. Однако, было обнаружено, что активированный комплемент может также вызывать серьезные повреждения и деструкцию ткани, и что нарушение регуляции активности комплемента ассоциируется с развитием ряда редких и широко распространенных заболеваний, таких как пароксизмальная ночная гемоглобинурия (PNH), атипический гемолитический уремический синдром, ревматоидный артрит, возрастная дегенерация желтого пятна и т.п. Таким образом, терапия антителами против комплемента является перспективным способом лечения этих заболеваний у человека.
Комплемент C5 представляет собой белок, играющий ключевую роль в терминальном пути активации комплемента и представляет собой белок-предшественник, продуцирующий сильный провоспалительный медиатор C5a, а также цитолитический мембрано-атакующий комплекс (MAC).
Ряд воспалительных и аутоиммунных заболеваний у человека опосредуется C5a и/или MAC, а блокирование активации C5 должно предупреждать образование C5a и MAC, а поэтому имеет терапевтическую ценность. Гуманизированное мышиное mAb против С5 человека, экулизумаб, было использовано для лечения двух комплемент-опосредуемых заболеваний, таких как пароксизмальная ночная гемоглобинурия (PNH) и атипический гемолитический уремический синдром (aHUS). Однако, не все пациенты с PNH являются восприимчивыми к лечению экулизумабом, и одной из причин такого отсутствия восприимчивости является генетический полиморфизм С5 человека, ассоциированный с потерей эпитопа, связывающегося с экулизумабом.
Таким образом, необходимо получить mAb против С5 человека, которые могли бы ингибировать терминальную активность комплемента посредством различных механизмов и сайтов приведения в контакт на C5, что позволило бы проводить более эффективное лечение патологий, зависящих от комплемента. Настоящее изобретение направлено на решение и удовлетворение этих и других потребностей.
Сущность изобретения
В одном из своих вариантов, настоящее изобретение включает антитело, которое специфически связывается с C5. В одном из вариантов осуществления изобретения, C5 представляет собой человеческий C5. В одном из вариантов осуществления изобретения, антителом является моноклональное антитело. В одном из вариантов осуществления изобретения, антителом является гуманизированное антитело. В одном из вариантов осуществления изобретения, антителом является химерное антитело. В некоторых вариантах осуществления изобретения, антителом является полноразмерное антитело. В некоторых вариантах осуществления изобретения, антитело представляет собой фрагмент антитела, которым является, но не ограничивается ими, Fab, Fab’, F(ab)2, F(ab’)2 и scFv. В некоторых вариантах осуществления изобретения, антитело представляет собой часть конструкции, например, гибридной конструкции, содержащей антитело и нацеливающую молекулу или эффекторную молекулу. В некоторых вариантах осуществления изобретения, антитело представляет собой часть конструкции-конъюгата, такой как конструкция конъюгата «антитело-лекарственное средство».
В одном из вариантов осуществления изобретения, антитело включает по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO:3; VH-CDR2: SEQ ID NO:4; VH-CDR3: SEQ ID NO:5; VL-CDR1: SEQ ID NO:8; VL-CDR2: SEQ ID NO:9; и VL-CDR3: SEQ ID NO:10 или их варианта или вариантов. В одном из вариантов осуществления изобретения, антитело включает CDR: VH-CDR1: SEQ ID NO:3; VH-CDR2: SEQ ID NO:4; VH-CDR3: SEQ ID NO:5; VL-CDR1: SEQ ID NO:8; VL-CDR2: SEQ ID NO:9; и VL-CDR3: SEQ ID NO:10 или их вариант или варианты.
В одном из вариантов осуществления изобретения, антитело включает тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:2 или ее вариант. В одном из вариантов осуществления изобретения, антитело включает легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:7 или ее вариант. В одном из вариантов осуществления изобретения, антитело включает тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:2, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:7, или их вариант или варианты.
В одном из вариантов осуществления изобретения, антитело включает по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO:13; VH-CDR2: SEQ ID NO:14; VH-CDR3: SEQ ID NO:15; VL-CDR1: SEQ ID NO:18; VL-CDR2: SEQ ID NO:19; и VL-CDR3: SEQ ID NO:20 или их варианта или вариантов. В одном из вариантов осуществления изобретения, антитело включает CDR: VH-CDR1: SEQ ID NO:13; VH-CDR2: SEQ ID NO:14; VH-CDR3: SEQ ID NO:15; VL-CDR1: SEQ ID NO:18; VL-CDR2: SEQ ID NO:19; и VL-CDR3: SEQ ID NO:20 или их вариант или варианты.
В одном из вариантов осуществления изобретения, антитело включает тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:12 или ее вариант. В одном из вариантов осуществления изобретения, антитело включает легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:17 или ее вариант. В одном из вариантов осуществления изобретения, антитело включает тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:12, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:17, или ее вариант или варианты.
В одном из вариантов осуществления изобретения, антитело включает по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO:23; VH-CDR2: SEQ ID NO:24; VH-CDR3: SEQ ID NO:25; VL-CDR1: SEQ ID NO:28; и VL-CDR2: SEQ ID NO:29 или их варианта или вариантов. В одном из вариантов осуществления изобретения, антитело включает CDR: VH-CDR1: SEQ ID NO:23; VH-CDR2: SEQ ID NO:24; VH-CDR3: SEQ ID NO:25; VL-CDR1: SEQ ID NO:28; и VL-CDR2: SEQ ID NO:29 или их вариант или варианты.
В одном из вариантов осуществления изобретения, антитело включает тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:22 или ее вариант. В одном из вариантов осуществления изобретения, антитело включает легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:27 или ее вариант. В одном из вариантов осуществления изобретения, антитело включает тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:22, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:27, или их вариант или варианты.
В одном из вариантов осуществления изобретения, антитело включает по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO:32; VH-CDR2: SEQ ID NO:33; VH-CDR3: SEQ ID NO:34; VL-CDR1: SEQ ID NO:37; VL-CDR2: SEQ ID NO:38, VL-CDR3: SEQ ID NO:39 или их варианта или вариантов. В одном из вариантов осуществления изобретения, антитело включает CDR: VH-CDR1: SEQ ID NO:32; VH-CDR2: SEQ ID NO:33; VH-CDR3: SEQ ID NO:34; VL-CDR1: SEQ ID NO:37; VL-CDR2: SEQ ID NO:38, VL-CDR3: SEQ ID NO:39 или их вариант или варианты.
В одном из вариантов осуществления изобретения, антитело включает тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:31 или ее вариант. В одном из вариантов осуществления изобретения, антитело включает легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:36 или ее вариант. В одном из вариантов осуществления изобретения, антитело включает тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:31, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:36, или их вариант или варианты.
В одном из вариантов осуществления изобретения, антитело включает по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO:42; VH-CDR2: SEQ ID NO:43; VH-CDR3: SEQ ID NO:44; VL-CDR1: SEQ ID NO:47; VL-CDR2: SEQ ID NO:48, VL-CDR3: SEQ ID NO:49 или их варианта или вариантов. В одном из вариантов осуществления изобретения, антитело включает CDR: VH-CDR1: SEQ ID NO:42; VH-CDR2: SEQ ID NO:43; VH-CDR3: SEQ ID NO:44; VL-CDR1: SEQ ID NO:47; VL-CDR2: SEQ ID NO:48, VL-CDR3: SEQ ID NO:49 или их вариант или варианты.
В одном из вариантов осуществления изобретения, антитело включает тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:41 или ее вариант. В одном из вариантов осуществления изобретения, антитело включает легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:46 или ее вариант. В одном из вариантов осуществления изобретения, антитело включает тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:41, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:46, или их вариант или варианты.
В одном из вариантов осуществления изобретения, антитело включает по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO:52; VH-CDR2: SEQ ID NO:53; VH-CDR3: SEQ ID NO:54; VL-CDR1: SEQ ID NO:57; VL-CDR2: SEQ ID NO:58, VL-CDR3: SEQ ID NO:59 или их варианта или вариантов. В одном из вариантов осуществления изобретения, антитело включает CDR: VH-CDR1: SEQ ID NO:52; VH-CDR2: SEQ ID NO:53; VH-CDR3: SEQ ID NO:54; VL-CDR1: SEQ ID NO:57; VL-CDR2: SEQ ID NO:58, VL-CDR3: SEQ ID NO:59 или их вариант или варианты.
В одном из вариантов осуществления изобретения, антитело включает тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:51 или ее вариант. В одном из вариантов осуществления изобретения, антитело включает легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:56 или ее вариант. В одном из вариантов осуществления изобретения, антитело включает тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:51, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:56, или их вариант или варианты.
В одном из вариантов осуществления изобретения, антителом является по меньшей мере одно антитело, выбранное из группы, состоящей из 2G1, 8E1, 4E7, 9G6, 11C5 и 11D6.
В одном из своих вариантов, настоящее изобретение относится к способу лечения заболевания или расстройства, опосредуемого путями комплемента у индивидуума, где указанный способ включает стадию введения указанному индивидууму заявленного анти-С5 антитела. В одном из вариантов осуществления изобретения, заболевание или расстройство по меньшей мере выбрано из группы, состоящей из: дегенерации желтого пятна (MD), возрастной дегенерации желтого пятна (AMD), ишемического реперфузионного повреждения, артрита, ревматоидного артрита, астмы, аллергической астмы, волчанки, язвенного колита, инсульта, постхирургического системного воспалительного синдрома, астмы, аллергической астмы, хронической обструктивной болезни легких (ХОБЛ), синдрома пароксизмальной ночной гемоглобинурии (PNH), тяжелой миастении, нейромиелита зрительного нерва (NMO), рассеянного склероза, замедления функции трансплантата, отторжения, опосредуемого антителом, атипического гемолитического уремического синдрома (aHUS), окклюзии центральной вены сетчатки (CRVO), окклюзии центральной артерии сетчатки (CRAO), буллезного эпидермолиза, сепсиса, трансплантации органов, воспаления (включая, но не ограничиваясь ими, воспаление, ассоциированное с операцией по сердечно-легочному шунтированию и с почечным диализом), С3-гломерулопатии, мембранозной нефропатии, IgA-нефропатии, гломерулонефрита (включая, но не ограничиваясь ими, гломерулонефрит, опосредуемый цитоплазматическим антителом против нейтрофилов (ANCA), волчаночный нефрит и их комбинации), ANCA-опосредованного васкулита, HUS, индуцированного Шига-токсином, и потери плода, индуцированной антифосфолипидным антителом или любых их комбинаций. В некоторых вариантах осуществления изобретения, AP-опосредованным заболеванием является C3-гломерулопатия. В некоторых вариантах осуществления изобретения, AP-опосредованным заболеванием является дегенерация желтого пятна, такая как возрастная дегенерация желтого пятна. В одном из вариантов осуществления изобретения, введение анти-C5 антитела ингибирует продуцирование белка C5a или C5b.
В одном из своих вариантов, настоящее изобретение относится к способу снижения активности системы комплемента у индивидуума, где указанный способ включает введение антитела индивидууму способом, выбранным из группы, состоящей из энтерального введения, парентерального введения и их комбинации, и где антитело содержит шесть гипервариабельных областей, имеющих следующие аминокислотные последовательности: SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:8, SEQ ID NO:9 и SEQ ID NO:10 или их вариант или варианты. В одном из вариантов осуществления изобретения, антителом является фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В одном из своих вариантов, настоящее изобретение относится к способу снижения активности системы комплемента у индивидуума, где указанный способ включает введение антитела индивидууму способом, выбранным из группы, состоящей из энтерального введения, парентерального введения и их комбинации, и где антитело содержит шесть гипервариабельных областей, имеющих следующие аминокислотные последовательности: SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:18, SEQ ID NO:19 и SEQ ID NO:20 или их вариант или варианты. В одном из вариантов осуществления изобретения, антителом является фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В одном из своих вариантов, настоящее изобретение относится к способу снижения активности системы комплемента у индивидуума, где указанный способ включает введение антитела индивидууму способом, выбранным из группы, состоящей из энтерального введения, парентерального введения и их комбинации, и где антитело содержит шесть гипервариабельных областей, имеющих следующие аминокислотные последовательности: SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:28, SEQ ID NO:29 или их вариант или варианты. В одном из вариантов осуществления изобретения, антителом является фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В одном из своих вариантов, настоящее изобретение относится к способу снижения активности системы комплемента у индивидуума, где указанный способ включает введение антитела индивидууму способом, выбранным из группы, состоящей из энтерального введения, парентерального введения и их комбинации, и где антитело содержит шесть гипервариабельных областей, имеющих следующие аминокислотные последовательности: SEQ ID NO:32, SEQ ID NO:33, SEQ ID NO:34, SEQ ID NO:37, SEQ ID NO:38 и SEQ ID NO:39 или их вариант или варианты. В одном из вариантов осуществления изобретения, антителом является фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В одном из своих вариантов, настоящее изобретение относится к способу снижения активности системы комплемента у индивидуума, где указанный способ включает введение антитела индивидууму способом, выбранным из группы, состоящей из энтерального введения, парентерального введения и их комбинации, и где антитело содержит шесть гипервариабельных областей, имеющих следующие аминокислотные последовательности: SEQ ID NO:42, SEQ ID NO:43, SEQ ID NO:44, SEQ ID NO:47, SEQ ID NO:48 и SEQ ID NO:49 или их вариант или варианты. В одном из вариантов осуществления изобретения, антителом является фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В одном из своих вариантов, настоящее изобретение относится к способу снижения активности системы комплемента у индивидуума, где указанный способ включает введение антитела индивидууму способом, выбранным из группы, состоящей из энтерального введения, парентерального введения и их комбинации, и где антитело содержит шесть гипервариабельных областей, имеющих следующие аминокислотные последовательности: SEQ ID NO:52, SEQ ID NO:53, SEQ ID NO:54, SEQ ID NO:57, SEQ ID NO:58, и SEQ ID NO:59 или их вариант или варианты. В одном из вариантов осуществления изобретения, антителом является фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления изобретения, антителом согласно изобретению является антитело против С5 человека, где указанное антитело имеет вариабельную область тяжелой цепи (vH), имеющую аминокислотную последовательность, которая приблизительно более, чем на 90% (например, более, чем на любые из 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) идентична SEQ ID NO:2 или ее варианту. В одном из вариантов осуществления изобретения, антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления изобретения, антителом согласно изобретению является антитело против С5 человека, где указанное антитело имеет вариабельную область легкой цепи (vL), имеющую аминокислотную последовательность, которая приблизительно более, чем на 90% (например, более, чем на любые из 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) идентична SEQ ID NO:7 или ее варианту. В одном из вариантов осуществления изобретения, антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых своих вариантах, настоящее изобретение относится к антителу против С5 человека, где указанное антитело имеет вариабельную область тяжелой цепи (vH) и вариабельную область легкой цепи (VL), где область vH имеет аминокислотную последовательность, которая приблизительно более, чем на 90% (например, более, чем на любые из 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) идентична SEQ ID NO:2, и где область vL имеет аминокислотную последовательность, которая приблизительно более, чем на 90% (например, более, чем на любые из 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) идентична SEQ ID NO:7. В одном из вариантов осуществления изобретения, антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых своих вариантах, настоящее изобретение относится к антителу против С5 человека, где указанное антитело имеет вариабельную область тяжелой цепи (vH), имеющую аминокислотную последовательность, которая приблизительно более, чем на 90% (например, более, чем на любые из 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) идентична SEQ ID NO:12. В одном из вариантов осуществления изобретения, антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых своих вариантах, настоящее изобретение относится к антителу против С5 человека, где указанное антитело имеет вариабельную область легкой цепи (vL), имеющую аминокислотную последовательность, которая приблизительно более, чем на 90% (например, более, чем на любые из 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) идентична SEQ ID NO:17. В одном из вариантов осуществления изобретения, антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых своих вариантах, настоящее изобретение относится к антителу против С5 человека, где указанное антитело имеет вариабельную область тяжелой цепи (vH) и вариабельную область легкой цепи (vL), где область vH имеет аминокислотную последовательность, которая приблизительно более, чем на 90% (например, более, чем на любые из 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) идентична SEQ ID NO:12, и где область vL имеет аминокислотную последовательность, которая приблизительно более, чем на 90% (например, более, чем на любые из 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) идентична SEQ ID NO:17. В одном из вариантов осуществления изобретения, антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых своих вариантах, настоящее изобретение относится к антителу против С5 человека, где указанное антитело имеет вариабельную область тяжелой цепи (vH), имеющую аминокислотную последовательность, которая приблизительно более, чем на 90% (например, более, чем на любые из 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) идентична SEQ ID NO:22. В одном из вариантов осуществления изобретения, антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых своих вариантах, настоящее изобретение относится к антителу против С5 человека, где указанное антитело имеет вариабельную область легкой цепи (vL), имеющую аминокислотную последовательность, которая приблизительно более, чем на 90% (например, более, чем на любые из 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) идентична SEQ ID NO:27. В одном из вариантов осуществления изобретения, антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых своих вариантах, настоящее изобретение относится к антителу против С5 человека, где указанное антитело имеет вариабельную область тяжелой цепи (vH) и вариабельную область легкой цепи (vL), где область vH имеет аминокислотную последовательность, которая приблизительно более, чем на 90% (например, более, чем на любые из 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) идентична SEQ ID NO:22, и где область vL имеет аминокислотную последовательность, которая приблизительно более, чем на 90% (например, более, чем на любые из 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) идентична SEQ ID NO:27. В одном из вариантов осуществления изобретения, антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых своих вариантах, настоящее изобретение относится к антителу против С5 человека, где указанное антитело имеет вариабельную область тяжелой цепи (vH), имеющую аминокислотную последовательность, которая приблизительно более, чем на 90% (например, более, чем на любые из 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) идентична SEQ ID NO:31. В одном из вариантов осуществления изобретения, антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых своих вариантах, настоящее изобретение относится к антителу против С5 человека, где указанное антитело имеет вариабельную область легкой цепи (vL), имеющую аминокислотную последовательность, которая приблизительно более, чем на 90% (например, более, чем на любые из 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) идентична SEQ ID NO:36. В одном из вариантов осуществления изобретения, антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых своих вариантах, настоящее изобретение относится к антителу против С5 человека, где указанное антитело имеет вариабельную область тяжелой цепи (vH) и вариабельную область легкой цепи (vL), где область vH имеет аминокислотную последовательность, которая приблизительно более, чем на 90% (например, более, чем на любые из 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) идентична SEQ ID NO:31, и где область vL имеет аминокислотную последовательность, которая приблизительно более, чем на 90% (например, более, чем на любые из 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) идентична SEQ ID NO:36. В одном из вариантов осуществления изобретения, антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых своих вариантах, настоящее изобретение относится к антителу против С5 человека, где указанное антитело имеет вариабельную область тяжелой цепи (vH), имеющую аминокислотную последовательность, которая приблизительно более, чем на 90% (например, более, чем на любые из 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) идентична SEQ ID NO:41. В одном из вариантов осуществления изобретения, антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых своих вариантах, настоящее изобретение относится к антителу против С5 человека, где указанное антитело имеет вариабельную область легкой цепи (vL), имеющую аминокислотную последовательность, которая приблизительно более, чем на 90% (например, более, чем на любые из 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) идентична SEQ ID NO:46. В одном из вариантов осуществления изобретения, антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций
В некоторых своих вариантах, настоящее изобретение относится к антителу против С5 человека, где указанное антитело имеет вариабельную область тяжелой цепи (vH) и вариабельную область легкой цепи (vL), где область vH имеет аминокислотную последовательность, которая приблизительно более, чем на 90% (например, более, чем на любые из 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) идентична SEQ ID NO:41, и где область vL имеет аминокислотную последовательность, которая приблизительно более, чем на 90% (например, более, чем на любые из 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) идентична SEQ ID NO:46. В одном из вариантов осуществления изобретения, антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых своих вариантах, настоящее изобретение относится к антителу против С5 человека, где указанное антитело имеет вариабельную область тяжелой цепи (vH), имеющую аминокислотную последовательность, которая приблизительно более, чем на 90% (например, более, чем на любые из 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) идентична SEQ ID NO:51. В одном из вариантов осуществления изобретения, антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых своих вариантах, настоящее изобретение относится к антителу против С5 человека, где указанное антитело имеет вариабельную область легкой цепи (vL), имеющую аминокислотную последовательность, которая приблизительно более, чем на 90% (например, более, чем на любые из 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) идентична SEQ ID NO:56. В одном из вариантов осуществления изобретения, антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций
В некоторых своих вариантах, настоящее изобретение относится к антителу против С5 человека, где указанное антитело имеет вариабельную область тяжелой цепи (vH) и вариабельную область легкой цепи (vL), где область vH имеет аминокислотную последовательность, которая приблизительно более, чем на 90% (например, более, чем на любые из 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) идентична SEQ ID NO:51, и где область vL имеет аминокислотную последовательность, которая приблизительно более, чем на 90% (например, более, чем на любые из 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) идентична SEQ ID NO:56. В одном из вариантов осуществления изобретения, антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В одном из своих вариантов, настоящее изобретение относится к клетке, содержащей по меньшей мере одно из описанных в настоящем документе антител. В некоторых вариантах осуществления изобретения, клетка продуцирует по меньшей мере одно из описанных в настоящем документе антител. В одном из вариантов осуществления изобретения, клеткой является гибридома.
В одном из своих вариантов, настоящее изобретение относится к клеточной линии, содержащей по меньшей мере одно из описанных в настоящем документе антител. В некоторых вариантах осуществления изобретения, клеточная линия продуцирует по меньшей мере одно из описанных в настоящем документе антител. В некоторых вариантах осуществления изобретения, клеточной линией является гибридомная клеточная линия.
Краткое описание чертежей
Описанное выше общее, а также нижеследующее подробное описание репрезентативных вариантов изобретения приводится со ссылкой на прилагаемые чертежи для лучшего понимания настоящего изобретения. Однако, следует отметить, что настоящее изобретение не ограничивается конкретными устройствами и оборудованием согласно изобретению, описанными в чертежах. В этих чертежах:
На фигуре 1 представлены результаты ELISA-анализа, иллюстрирующие связывание mAb против С5 человека 4E7, 9G6, 11C5, 2G1, 11D9 и 8E1 с С5 человека. Описан ELISA-анализ на прямое связывание с антигеном, где mAb были серийно разведены во всех микротитрационных планшетах, покрытых очищенным человеческим C5. Все шесть mAb обнаруживали способность реагировать с С5 человека на высоком уровне.
На фигурах 2-7 представлены результаты экспериментов по оценке аффинностей связывания анти-C5 mAb 2G1, 8E1, 4E7, 9G6, 11C5 и 11D9 с C5. Очищенное αm-mAb против кроличьих IgG (RAMFc) связывали с чипом CM4 методом присоединения амина. Затем, анти-C5 mAb захватывали на иммобилизованном RAMFc. Анализы Biacore проводили на оборудовании Biacore-2000.
На фигуре 8 проиллюстрировано дозозависимое ингибирование LPS-индуцированного продуцирования C5a mAb против С5 человека 4E7, 9G6, 11C5, 2G1, 11D9 и 8E1. Для оценки влияния mAb против С5 человека на LPS-индуцированное продуцирование C5a была использована комбинация из двух анализов: анализа на LPS-индуцированное продуцирование C5a и «сэндвич»-ELISA на человеческий C5a. Все шесть mAb эффективно ингибировали LPS-индуцированное продуцирование C5a при добавлении к 10% нормальной человеческой сыворотке (NHS) в конечной концентрации 12,5 мкг/мл.
На фигуре 9, включающей фигуру 9A и фигуру 9B, проиллюстрировано влияние mAb против С5 человека 4E7, 9G6, 11C5, 2G1, 11D9 и 8E1 на гемолиз, опосредуемый комплементом. На фигуре 9A проиллюстрирован лизис эритроцитов (RBC), определенный путем измерения оптической плотности OD405 после инкубирования овечьих RBC, сенсибилизированных антителом, с 50% NHS, содержащей серийные разведения каждого анти-C5 mAb при 37°C в течение 1 часа. Лизис RBC определяли путем измерения оптической плотности на 405 нм. При 120 мкг/мл, все mAb ингибировали лизис овечьих эритроцитов, опосредуемый 50% NHS. При более низких дозах (например, 30-60 мкг/мл), 9G6 было менее активным в предупреждении гемолиза, чем другие mAb. На фигуре 9B проиллюстрировано, что при 30 мкг/мл, mAb 2G1 и 8E1 более активно ингибировали опосредуемый комплементом гемолиз, чем 4E7, 9G6, 11C5 и 11D9.
На фигуре 10 представлены результаты экспериментов по оценке влияния mAb против С5 человека 4E7, 9G6, 11C5, 2G1, 11D9, 8E1 на опосредуемый комплементом гемолиз при использовании сыворотки, взятой у животных различных видов. Куриные RBC, сенсибилизированные антителом, инкубировали с 50% NHS, с нормальной кроличьей сывороткой, сывороткой макак-резуса или с сывороткой собакоподобных обезьян, каждая из которых содержит анти-C5 mAb (конечная концентрация: 50 мкг/мл) при 37°C в течение 1 часа. Лизис RBC определяли путем измерения оптической плотности на 405 нм, и нормализовали на сыворотку плюс EDTA в качестве негативного контроля (0%), и на сыворотку, не содержащую антитела, в качестве позитивного контроля (100%). В анализе на гемолиз с использованием NHS, пять из шести mAb против С5 человека в значительной степени ингибировали гемолиз, то есть, более, чем на 50%. В частности, пробы NHS, содержащие 2G1, указывали на почти полное ингибирование гемолиза. При обработке mAb 9G6 или 2G1, гемолитическая активность в кроличьей сыворотке значительно снижалась. С другой стороны, ни одно из mAb существенно не ингибировало комплемент-спосредуемый гемолиз при использовании обезьяньей сыворотки (макак-резуса и собакоподобных обезьян).
На фигуре 11 представлены результаты экспериментов по оценке влияния mAb против С5 человека 2G1 и 8E1 на опосредуемый комплементом гемолиз. Куриные RBC, сенсибилизированные антителом, инкубировали с 50% NHS, содержащей серийные разведения 2G1 или 8E1 или контрольного mAb (MOPC, мышиного IgG1) при 37°C в течение 1 часа. Лизис RBC определяли путем оценки оптической плотности OD405нм. В этом анализе, mAb 2G1 и 8E1 имели аналогичные активности.
На фигуре 12 представлены результаты экспериментов по оценке влияния mAb против С5 человека 2G1 на гемолиз RBC при PNH. RBC, взятые у пациентов с пароксизмальной ночной гемоглобинурией (PNH), подвергали тестированию с использованием подкисленной сыворотки Хэмса в присутствии или в отсутствии mAb 2G1. RBC инкубировали с 50% NHS, содержащей серийные разведения 2G1, при 37°C в течение 1 часа. Лизис RBC определяли путем оценки оптической плотности OD405нм. В отсутствии mAb, приблизительно 35% RBC подвергались лизису под действием подкисленной сыворотки, а обработка mAb 2G1 приводила к 70% снижению гемолитической активности при 25 мкг/мл и к 85% снижению при 40 мкг/мл.
На фигуре 13 представлены последовательности вариабельной области тяжелой и легкой цепей mAb 2G1.
На фигуре 14 представлены последовательности вариабельной области тяжелой и легкой цепей mAb 8E1.
На фигуре 15 представлены последовательности вариабельной области тяжелой и легкой цепей mAb 4E7.
На фигуре 16 представлены последовательности вариабельной области тяжелой и легкой цепей mAb 9G6.
На фигуре 17 представлены последовательности вариабельной области тяжелой и легкой цепей mAb 11C5.
На фигуре 18 представлены последовательности вариабельной области тяжелой и легкой цепей mAb 11D9.
На фигуре 19 представлены аминокислотные последовательности константной области тяжелой цепи IgG4 человека с заменой серина 228 на пролин (то есть, S228P) и константной области человеческой легкой цепи каппа. Эти последовательности были использованы для конструирования химерного (мышиная вариабельная область+человеческие константные области) и гуманизированного (гуманизированная мышиная вариабельная область+человеческие константные области) антитела против С5 человека (2G1).
На фигуре 20 представлены результаты экспериментов по оценке реакции взаимодействия химерного mAb 2G1 против человеческого IgG4 с С5 человека. Химерное 2G1 было получено путем присоединения вариабельных областей mAb 2G1 к константной области тяжелой цепи человеческого IgG4, несущей мутацию S228P, и к константной области человеческой легкой цепи каппа. Планшет покрывали человеческим C5. После инкубирования с серийно разведенным химерным mAb 2G1, связанное химерное mAb детектировали с использованием ПХ-конъюгированного антитела против человеческого IgG4. Химерное 2G1 связывалось с С5 человека в зависимости от дозы.
На фигуре 21 представлены результаты экспериментов по оценке влияния химерного mAb «2G1-человеческий IgG4» на гемолиз, опосредуемый классическими путями комплемента. Сенсибилизированные овечьи RBC инкубировали с 50% NHS, содержащей серийно разведенное химерное 2G1 при 37°C в течение 1 часа. Лизис RBC определяли путем оценки оптической плотности OD405нм. Результат показал, что при 30 мкг/мл и при более высоких концентрациях, химерное mAb 2G1 эффективно ингибировало NHS-опосредуемый лизис овечьих эритроцитов.
На фигуре 22 представлены нуклеотидные и аминокислотные последовательности гуманизированной вариабельной тяжелой цепи (VH) mAb 2G1 (гуманизированного 2G1 VH-11801). Гуманизация была достигнута путем присоединения CDR VH мышиного mAb 2G1 к кодируемой человеческой VH зародышевой линии с сохранением рамки считывания (11801). Аминокислотная последовательность сигнального пептида подчеркнута, а последовательность CDR1, CDR2 и CDR3 выделена жирным шрифтом и заштрихована.
На фигуре 23 представлены нуклеотидные и аминокислотные последовательности другой гуманизированной VH mAb 2G1 (гуманизированного 2G1 VH-16901). Гуманизация была достигнута путем присоединения CDR VH мышиного mAb 2G1 к кодируемой человеческой VH зародышевой линии с сохранением рамки считывания (16901). Аминокислотная последовательность сигнального пептида подчеркнута, а последовательность CDR1, CDR2 и CDR3 выделена жирным шрифтом и заштрихована.
На фигуре 24 представлены нуклеотидные и аминокислотные последовательности гуманизированной вариабельной легкой цепи (VL) mAb 2G1 (гуманизированного 2G1 VL-1901). Гуманизация была достигнута путем присоединения CDR VL мышиного mAb 2G1 к кодируемой человеческой VL зародышевой линии с сохранением рамки считывания (1901). Аминокислотная последовательность сигнального пептида подчеркнута, а последовательность CDR1, CDR2 и CDR3 выделена жирным шрифтом и заштрихована.
На фигуре 25 представлены результаты экспериментов по оценке реакции взаимодействия гуманизированного 2G1 (VH-11801/VL-1901) с С5 человека. Гуманизированное 2G1 (VH-11801/VL-1901) экспрессировалось как mAb против человеческого IgG4 с мутацией S228P в Fc-домене. Планшет покрывали человеческим C5. После инкубирования с серийно разведенным гуманизированным 2G1 (VH-11801/VL-1901), связанное mAb детектировали с использованием ПХ-конъюгированного антитела против человеческого IgG4. Гуманизированное 2G1 (VH-11801/VL-1901) связывалось с С5 человека в зависимости от дозы.
На фигуре 26 представлены результаты экспериментов по оценке реакции взаимодействия гуманизированного 2G1 (VH-16901/VL-1901) с С5 человека. Гуманизированное 2G1 (VH-16901/VL-1901) экспрессировалось как mAb против человеческого IgG4 с мутацией S228P в Fc-домене. Планшет покрывали человеческим C5. После инкубирования с серийно разведенным гуманизированным 2G1 (VH-16901/VL-1901), связанное mAb детектировали с использованием ПХ-конъюгированного антитела против человеческого IgG4. Гуманизированное 2G1 (VH-16901/VL-1901) связывалось с С5 человека в зависимости от дозы.
На фигуре 27 представлены результаты экспериментов по оценке влияния гуманизированного 2G1 (VH-11801/VL-1901) на гемолиз, опосредуемый классическими путями комплемента. Гуманизированное 2G1 (VH-11801/VL-1901) экспрессировалось как mAb против человеческого IgG4 с мутацией S228P в Fc-домене. Овечьи RBC, сенсибилизированные антителом, инкубировали с 10% NHS, содержащей серийно разведенное гуманизированное 2G1 (VH-11801/VL-1901) при 37°C в течение 1 часа. Лизис RBC определяли путем оценки оптической плотности OD405нм. Гуманизированное 2G1 (VH-11801/VL-1901) значительно ингибировало лизис овечьих эритроцитов, опосредуемый 10% NHS при концентрациях mAb 10 мкг/мл и при более высоких концентрациях mAb.
На фигуре 28 представлены результаты экспериментов по оценке влияния гуманизированного 2G1 (VH-16901/VL-1901) на гемолиз, опосредуемый классическими путями комплемента. Гуманизированное 2G1 (VH-16901/VL-1901) экспрессировалось как mAb против человеческого IgG4 с мутацией S228P в Fc-домене. Овечьи RBC, сенсибилизированные антителом, инкубировали с 10% NHS, содержащей серийно разведенное гуманизированное 2G1 (VH-16901/VL-1901) при 37°C в течение 1 часа. Лизис RBC определяли путем оценки оптической плотности OD405нм. Гуманизированное 2G1 (VH-16901/VL-1901) значительно ингибировало лизис овечьих эритроцитов, опосредуемый 10% NHS, при концентрациях mAb 10 мкг/мл и при более высоких концентрациях.
На фигуре 29, включающей фигуры 29A и 29B, представлены результаты экспериментов, проводимых с помощью Вестерн-блоттинга для детектирования С5 человека с использованием mAb 2G1-3 (Фигура 29A) и контрольного mAb QDC5 (Фигура 29B), и эти результаты показали, что mAb 2G1-3 связывается с β-цепью С5 человека. Человеческий C5 (был использован 1 мкг на дорожку, от Comptech, cat#A120) подвергали электрофорезу в ДСН-ПААГ в невосстанавливающих (NR) или в восстанавливающих (R) условиях. Контрольное mAb QDC5 представляет собой рекомбинантное mAb против человеческого IgG4, несущее последовательности VH и VL гуманизированного мышиного mAb против С5 человека, как описано Thomas et al. (Mol. Immunol. 1996 Dec;33(17-18):1389-401). Известно, что это mAb связывается с эпитопом в α-цепи С5 человека. Как и ожидалось, оба mAb 2G1-3 и QDC5 связываются с невосстановленным человеческим C5 аналогичным образом. В восстанавливающих условиях, как и ожидалось, QDC5 связывается с α-цепью С5 человека, тогда как mAb 2G1-3 связывается с другой полосой, соответствующей β-цепи С5 человека. После электрофореза в ДСН-ПААГ, белки переносили на PVDF-мембрану и блокировали 5% обезжиренным сухим молоком в TBS в течение 1 часа при комнатной температуре. Мембраны инкубировали с 10 мкг/мл 2G1-3 или QDC5 в течение 1 часа при комнатной температуре. После промывки TBS с 0,1% Твином-20 (TBST) в течение 6 × 5 минут, к мембранам добавляли кроличье ПХ-конъюгированное антитело против α-цепи мышиного IgG или ПХ-конъюгированное антитело против α-цепи человеческого IgG при разведении 1:4000 и инкубировали в течение 1 часа при комнатной температуре. После последней промывки, белки детектировали с использованием субстрата для вестерн-блот-анализа Pierce™ ECL 2 в соответствии с инструкциями производителей.
На фигуре 30, включающей фигуры 30A и 30B, представлены структура домена и последовательности С5 человека. Человеческий C5 состоит из α- и β-цепей, разделенных небольшим сегментом C5a, который высвобождается после активации C5 (Фигура 30A). В свою очередь, β-цепь С5 человека состоит из 6 доменов MG с перечисленными аминокислотными последовательностями (Фигура 30B).
На фигуре 31, включающей фигуры 31A и 31B, представлены результаты детектирования с помощью Вестерн-блот-анализа β-цепи человеческого С5 и мутантов с делецией β-цепи С5 человека, не содержащих отдельных доменов MG (Фигура 31A). Вестерн-блот-анализ, проводимый с использованием козьего поликлонального антитела против С5 человека, выявил присутствие интактной β-цепи и мутантов с делецией 6 доменов MG, транзиентно экспрессируемых в клетках HEK. Супернатанты трансфецированных клеток HEK использовали для анализа. Числа 1, 2, 3, 4, 5, 6 соответствуют мутантам с делециями MG1, MG2, MG3, MG4, MG5 и MG6. Супернатант нетрансфецированных клеток HEK (контрольных) использовали в качестве негативного контроля. Полученные результаты указывали на экспрессию всех мутантов с делециями (Фигура 31B). Вычисленные молекулярные массы в кДа для β-цепи С5 человека и мутантов с 6 делециями MG соответствовали детектированнным полосам в Вестерн-блот-анализе.
На фигуре 32 представлены результаты «сэндвич»-ELISA-анализа для оценки ключевых доменов MG с β-цепью С5 человека на связывание с mAb 2G1-3. mAb 2G1-3 наносили на 96-луночный планшет и добавляли супернатанты нетрансфецированных или трансфецированных клеток HEK. После инкубирования и промывки, связанную β-цепь или мутантные белки с делециями детектировали с использованием «второго» mAb SKY59 против человеческого С5 (Fukuzawa et al., Sci Rep. 2017 Apr 24;7(1):1080. doi: 10.1038/s41598-017-01087-7), которое, как известно, связывается с последовательностями в домене MG1 С5 человека. Полученные данные продемонстрировали, что сигналы для мутантов с делециями MG2, MG3, MG5 и MG6 еще детектировались, что позволяет предположить, что эти домены не участвуют в связывании с 2G1-3 или SKY59. С другой стороны, мутанты с делециями MG1 и MG4 теряли свою способность к связыванию, что позволяет предположить, что они играют важную роль в связывании С5 человека под действием 2G1-3 или SKY59 или того и другого. Нормальную человеческую сыворотку (NHS) и супернатант клеток, трансфецированных интактной β-цепью, использовали в качестве позитивного контроля, а супернатант нетрансфецированных клеток HEK (контрольных) использовали в качестве негативного контроля.
На фигуре 33 представлены результаты «сэндвич»-ELISA-анализа с использованием поликлонального анти-C5 антитела для детектирования, и эти результаты показали, что домен MG4 в β-цепи С5 человека играет ключевую роль в связывании mAb 2G1-3. 2G1-3 наносили на 96-луночный планшет и добавляли супернатанты нетрансфецированных или трансфецированных клеток HEK. После инкубирования и промывки, связанную β-цепь или мутантные белки с делециями в супернатантах после трансфекции детектировали с использованием козьего поликлонального антитела против человеческого С5. Сигналы детектировались в нормальной человеческой сыворотке (NHS) и в супернатантах интактной человеческой β-цепи и в мутантах с делецией MG1, но не в мутантах с делецией MG4, что позволяет предположить, что в связывании 2G1-3 ключевую роль играет MG4, но не MG1 в β-цепи.
Подробное описание изобретения
Настоящее изобретение относится к ингибированию передачи сигнала комплемента с использованием анти-С5 антитела. В своих различных вариантах, настоящее изобретение относится к композициям и способам для лечения комплемент-опосредуемого заболевания или комплемент-опосредуемого расстройства у индивидуума посредством приведения в контакт индивидуума с анти-C5 антителом. Комплемент-опосредуемыми патологиями и состояниями, которые могут быть подвергнуты лечению с применением композиций и способов согласно изобретению, являются, но не ограничиваются ими, дегенерация желтого пятна (MD), возрастная дегенерация желтого пятна (AMD), ишемическое реперфузионное повреждение, артрит, ревматоидный артрит, волчанка, язвенный колит, инсульт, постхирургический системный воспалительный синдром, астма, аллергическая астма, хроническая обструктивная болезнь легких (ХОБЛ), синдром пароксизмальной ночной гемоглобинурии (PNH), тяжелая миастения, нейромиелит зрительного нерва (NMO), рассеянный склероз, замедление функции трансплантата, отторжение, опосредуемое антителом, атипический гемолитический уремический синдром (aHUS), окклюзия центральной вены сетчатки (CRVO), окклюзия центральной артерии сетчатки (CRAO), буллезный эпидермолиз, сепсис, трансплантация органов, воспаление (включая, но не ограничиваясь ими, воспаление, ассоциированное с операцией по сердечно-легочному шунтированию и с почечным диализом), С3-гломерулопатия, мембранозная нефропатия, IgA-нефропатия, гломерулонефрит (включая, но не ограничиваясь ими, гломерулонефрит, опосредуемый цитоплазматическим антителом против нейтрофилов (ANCA), волчаночный нефрит и их комбинации), ANCA-опосредованный васкулит, HUS, индуцированный Шига-токсином, и потеря плода, индуцированная антифосфолипидным антителом или любые их комбинации.
Определения
Если это не оговорено особо, то все технические и научные термины, используемые в настоящей заявке, имеют общепринятые значения, понятные специалисту в области, к которой относится настоящее изобретение. Хотя для практического применения изобретения или проведения тестов могут быть использованы любые методы и материалы, аналогичные или эквивалентные описанным в настоящем документе методам или материалам, однако, в настоящем изобретении описаны репрезентативные методы и материалы.
Каждый из используемых в настоящем документе терминов имеет значение, соответствующее этому разделу.
Используемые в настоящем документе термины «ингибировать» и «ингибирование» означают снижение, подавление, ослабление или блокирование активности или функции по меньшей мере приблизительно на 10% по сравнению с контрольной величиной. В некоторых вариантах осуществления изобретения, активность подавляется или блокируется по меньшей мере приблизительно на 50% по сравнению с контрольной величиной. В некоторых вариантах осуществления изобретения, активность подавляется или блокируется по меньшей мере приблизительно на 75%. В некоторых вариантах осуществления изобретения, активность подавляется или блокируется по меньшей мере приблизительно на 95%.
Термины «эффективное количество» и «фармацевтически эффективное количество» означают количество агента, достаточное для достижения желаемого биологического результата. Таким результатом может быть снижение и/или ослабленияе прзнаков, симптомов или факторов, вызывающих заболевание или расстройство, или любое другое желаемое изменение биологической системы. Соответствующее эффективное количество в любом конкретном случае может быть определено специалистом в данной области посредством рутинного экспериментирования.
Используемые в настоящем документе термины «пациент», «субъект», «индивидуум» и т.п. являются синонимами и относятся к любому животному, а в некоторых вариантах осуществления изобретения, к млекопитающему и человеку, имеющему систему комплемента, включая человека, нуждающегося в лечении состояния или его последствий или восприимчивого к лечению такого состояния или его последствий. Индивидуумами могут быть, например, собаки, кошки, свиньи, коровы, овцы, козы, лошади, крысы, обезьяны, мыши и люди.
Используемый в настоящем документе термин «аномальный», если он употребляется по отношению к организмам, тканям, клеткам или их компонентам, относится к организмам, тканям, клеткам или их компонентам, которые отличаются по меньшей мере одним наблюдаемым или детектируемым признаком (например, возрастом, лечением, временем в днях и т.п.) от организмов, тканей, клеток или их компонентов, которые имеют «нормальный» (ожидаемый/гомеостатический) соответствующий признак. Признаки, которые являются нормальными или ожидаемыми для клеток, тканей или индивидуумов одного типа, могут быть аномальными для клеток или тканей других типов.
«Заболевание» представляет собой состояние здоровья индивидуума, при котором у индивидуума не может поддерживаться гомеостаз, и если это заболевание не ослабляется, то состояние здоровья индивидуума продолжает ухудшаться.
В противоположность этому, «расстройством» у индивидуума является состояние здоровья индивидуума, при котором у индивидуума поддерживается гомеостаз, но, при этом, состояние здоровья индивидуума несколько ухудшается по сравнению с состоянием индивидуума в отсутствии такого расстройства. Невылеченное расстройство необязательно приводит к последующему ухудшению состояния здоровья индивидуума.
Заболевание или расстройство считается «ослабленным», если снижается тяжесть их признаков или симптомов, а также частота появления у пациента такого признака или симптома, или то и другое.
«Эффективное количество» или «терапевтически эффективное количество» соединения означает количество соединения, достаточное для достижения желаемого эффекта у индивидуума, которому вводят это соединение.
Используемый в настоящем документе термин «пояснительный материал» включает публикацию, запись, диаграмму или любую другую информацию, которая может быть использована в наборе как руководство по применению соединения, композиции, вектора или системы доставки согласно изобретению для эффективного ослабления различных описанных в настоящем документе заболеваний или расстройств. Необязательно или альтернативно, в пояснительном материале могут быть описаны один или более способов ослабления заболеваний или расстройств в клетках или тканях млекопитающего. Пояснительный материал набора согласно изобретению может быть, например, наклеен на контейнер, содержащий идентифицированные соединение, композицию, вектор или систему доставки согласно изобретению, либо он может быть вложен в контейнер, содержащий идентифицированные соединение, композицию, вектор или систему доставки. Альтернативно, пояснительный материал может поставляться отдельно от контейнера, причем, предусматривается, что пояснительный материал поставляется реципиенту вместе с соединением.
Используемый в настоящем документе термин «функционально связанный» или «функционально присоединенный» может означать, что экспрессия гена находится под контролем промотора, к которому он пространственно присоединен. Промотор может быть расположен со стороны 5’-конца (выше) или 3’-конца (ниже) от гена, который находится под его контролем. Расстояние между промотором и геном может быть приблизительно равно расстоянию между промотором и геном, находящимся под контролем промотора, который происходит от этого гена. Как известно специалистам, изменение такого расстояния может быть достигнуто без потери функции промотора.
«Терапевтическое лечение» означает лечение индивидуума, у которого наблюдаются признаки заболевания или расстройства, в целях снижения или устранения этих признаков.
Используемое в настоящем документе выражение «лечение заболевания или расстройства» означает снижение частоты и/или тяжести признака и/или симптома заболевания или расстройства у пациента.
Используемый в настоящем документе термин «биологический образец», «образец» или «проба» включает любой образец, содержащий клетку, ткань или физиологическую жидкость, в которых может детектироваться экспрессия нуклеиновой кислоты или полипептида. Биологический образец может содержать любой биологический материал, подходящий для детектирования нужных биомарверов, и может содержать клеточный и/или неклеточный материал, взятый у индивидуума. Примерами таких биологических обрацов являются, но не ограничиваются ими, кровь, лимфа, костный мозг, биоптаты и мазки. Образцы, которые являются жидкими по своей природе, называются в настоящем документе «физиологическими жидкостями». Биологические образцы могут быть взяты у пациента различными методами, включая, например, соскабливание или тампонирование определенной площади или использование иглы для получения физиологических жидкостей. Методы взятия различных образцов из организма хорошо известны специалистам.
Используемый в настоящем документе термин «антитело» означает молекулу иммуноглобулина, способную специфически связываться со специфическим эпитопом антигена. Антитела могут представлять собой интактные иммуноглобулины, происходящие от природных источников или от рекомбинантных источников, и могут представлять собой иммунореактивные части интактных иммуноглобулинов. Антитела согласно изобретению могут присутствовать в различных формах, включая, например, поликлональные антитела, моноклональные антитела, внутриклеточные антитела («интраантитела»), Fv, Fab, Fab’, F(ab)2 и F(ab’)2, а также одноцепочечные антитела (scFv), антитела с тяжелой цепью, такие как верблюжьи антитела, и гуманизированные антитела (Harlow et al., 1999, Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, NY; Harlow et al., 1989, Antibodies: A Laboratory Manual, Cold Spring Harbor, New York; Houston et al., 1988, Proc. Natl. Acad. Sci. USA 85:5879-5883; Bird et al., 1988, Science 242:423-426).
Используемый в настоящем документе термин «синтетическое антитело» означает антитело, которое было получено методами рекомбинантных ДНК, например, антитело, экспрессируемое бактериофагом. Этот термин должен также означать антитело, которое было получено путем синтеза молекулы ДНК, кодирующей антитело и экспрессирующей антитело-белок или аминокислотную последовательность, определяющую это антитело, где ДНК или аминокислотная последовательность были получены с применением технологии синтеза ДНК или аминокислотных последовательностей, которые являются доступными и хорошо известны специалистам.
Используемый в настоящем документе термин «антитело с тяжелой цепью» или «антитела с тяжелой цепью» включает молекулы иммуноглобулина, происходящие от животных семейства верблюжьих и полученные либо путем иммунизации пептидом с последующим выделением сыворотки, либо путем клонирования и экспрессии последовательностей нуклеиновой кислоты, кодирующих такие антитела. Термин «антитело с тяжелой цепью» или «антитела с тяжелой цепью» также охватывает молекулы иммуноглобулина, выделенные у индивидуума с «болезнью тяжелых цепей» или полученные путем клонирования и экспрессии генов VH (вариабельной области тяжелой цепи иммуноглобулина) индивидуума.
«Химерное антитело» означает сконструированное антитело определенного типа, которое содержит природную вариабельную область (легкой цепи и тяжелых цепей), происходящую от донорного антитела, в комбинации с константными областями легкой и тяжелой цепей, происходящими от акцепторного антитела.
«Гуманизированное антитело» означает сконструированное антитело определенного типа, имеющее CDR, происходящее от не-человеческого донорного иммуноглобулина, при этом, остальные части, происходящие от молекулы иммуноглобулина, происходят от одного или более человеческих иммуноглобулинов. Кроме того, остатки каркасного носителя могут быть модифицированы так, чтобы они сохраняли аффинность связывания (см., например, 1989, Queen et al., Proc. Natl. Acad Sci USA, 86:10029-10032; 1991, Hodgson et al., Bio/Technology, 9:421). Подходяще человеческое акцепторное антитело может быть взято из общедоступной базы данных, например, из базы данных KABAT, базы данных Los Alamos и базы данных белков Swiss Protein, в соответствии с гомологией нуклеотидных и аминокислотных последовательностей донорного антитела. Человеческое антитело, охарактеризованное по гомологии с каркасными областями донорного антитела (на основе аминокислот), может быть подходящим для получения константной области тяжелой цепи и/или вариабельной каркасной области тяжелой цепи для встраивания донорных CDR. Подходящее акцепторное антитело, способное отдавать константные области легкой цепи или вариабельные каркасные области легкой цепи, может быть отобрано аналогичным образом. Следует отметить, что тяжелые и легкие цепи акцепторного антитела необязательно должны происходить от одного и того же акцепторного антитела. В литературе описано несколько способов продуцирования таких гуманизированных антител (см., например, EP-A-0239400 и EP-A-054951).
Термин «донорное антитело» означает антитело (моноклональное и/или рекомбинантное антитело), которое вводит аминокислотные последовательности его вариабельных областей, CDR или других функциональных фрагментов или аналогов первому иммуноглобулину-партнеру с последующей модификацией кодирующей области иммуноглобулина и экспрессией модифицированного антитела с антигенной специфичностью и нейтрализующей активностью, характерной для донорного антитела.
Термин «акцепторое антитело» означает антитело (моноклональное и/или рекомбинантное антитело), которое является гетерологичным донорному антителу, которое вводит все (или любую часть, но не все, в некоторых вариантах) аминокислотные последовательности, содержащие каркасные области тяжелой и/или легкой цепей и/или константные области тяжелой и/или легкой цепей, первому иммуноглобулину-партнеру. В некоторых вариантах осуществления изобретения, человеческим антителом является акцепторное антитело.
«CDR» определены как аминокислотные последовательности гипервариабельной области антитела, которые представляют собой гипервариабельные области тяжелой и легкой цепей иммуноглобулина. См., например, Kabat et al., Sequences of Proteins of Immunological Interest, 4th Ed., U.S. Department of Health and Human Services, National Institutes of Health (1987). В вариабельной области иммуноглобулина присутствуют три CDR тяжелой цепи и три CDR легкой цепи (или области CDR). Таким образом, используемый в настоящем документе термин «CDR» означает все три CDR тяжелой цепи или все три CDR легкой цепи (или все CDR тяжелой цепи и все CDR легкой цепи, если они присутствуют). Структура и укладка белка антитела может означать, что другие остатки рассматриваются как часть антигенсвязывающей области и известны специалистам. См., например, Chothia et al., (1989) Conformations of immunoglobulin hypervariable regions; Nature 342, p 877-883.
Используемый в настоящем документе термин «иммуноанализ» означает любой анализ на связывание, в котором используется антитело, способное специфически связываться с молекулой-мишенью, для детектирования и количественной оценки молекулы-мишени.
Используемый в настоящем документе термин «специфически связывается», если он употребляется по отношению к антителу, относится к антителу, которое распознает специфическую молекулу-мишень или связывается с нею, но, по существу, не распознает другие молекулы или не связывается с ними в образце. В некоторых случаях, используемые в настоящем документе термины «специфическое связывание» или «специфически связывается», означают, что распознавание и связывание зависит от присутствия конкретной структуры (например, антигенной детерминанты или эпитопа) на молекуле-мишени. Если, например, антитело специфически связывается с эпитопом «А», то присутствие немеченной молекулы, содержащей эпитоп A (или свободной, то есть, немеченной A) в реакционной смеси, содержащей меченную «А» и антитело, будет снижать количество меченного А, связанного с антителом.
«Кодирующая область» гена состоит из нуклеотидных остатков кодирующей цепи гена и нуклеотидов не кодирующей цепи гена, которые гомологичны или комплементарны, соответственно, кодирующей области молекулы мРНК, которая продуцируется посредством транскрипции гена.
«Кодирующая область» молекулы мРНК также состоит из нуклеотидных остатков молекулы мРНК, которые соответствуют антикодонной области молекулы переноса РНК в процессе трансляции молекулы мРНК, или которые кодируют стоп-кодон. Таким образом, кодирующая область может включать нуклеотидные остатки, содержащие кодоны аминокислотных остатков, которые не присутствуют в зрелом белке, кодируемом молекулой мРНК (например, аминокислотные остатки в экспортной сигнальной последовательности белка).
«Дифференциальное снижение экспрессии» или «негативная регуляция» относится к уровням продукта биомаркера, которые по меньшей мере на 10% или более, например, на 20%, 30%, 40% или 50%, 60%, 70%, 80%, 90% ниже или менее, и/или в 2,0 раза, 1,8 раза, 1,6 раза, 1,4 раза, 1,2 раза, 1,1 раза ниже или менее, чем уровни у контроля, и составляет любые и все целые числа или частные приращения этих чисел.
«Дифференциальное повышение экспрессии» или «позитивная регуляция» относится к уровням продукта биомаркера, которые по меньшей мере на 10% или более, например, на 20%, 30%, 40% или 50%, 60%, 70%, 80%, 90% выше или более, и/или в 1,1 раза, 1,2 раза, 1,4 раза, 1,6 раза, 1,8 раза, 2,0 раза выше или более, чем уровни у контроля, и составляет любые и все целые числа или частные приращения этих чисел.
Используемый в настоящем документе термин «комплементарный», относящийся к нуклеиновой кислоте, представляет собой широкое понятие комплементарности последовательностей областей двух цепей нуклеиновых кислот или двух областей одной и той же цепи нуклеиновой кислоты. Известно, что адениновый остаток первой области нуклеиновой кислоты способен образовывать специфические водородные связи («спаривание оснований») с остатком второй области нуклеиновой кислоты, которая является антипараллельной первой области, если остатком является тимин или урацил. Аналогичным образом, известно, что цитозиновый остаток первой цепи нуклеиновой кислоты способен образовывать пары оснований с остатком второй цепи нуклеиновой кислоты, которая является антипараллельной первой цепи, если остатком является гуанин. Первая область нуклеиновой кислоты является комплементарной второй области одной и той же или другой нуклеиновой кислоты, и если две области расположены антипараллельно друг другу, то по меньшей мере один нуклеотидный остаток первой области способен образовывать пары оснований с остатком второй области. В некоторых вариантах осуществления изобретения, первая область содержит первую часть, а вторая область содержит вторую часть, и если первая и вторая части расположены антипараллельно друг другу, то по меньшей мере приблизительно 50%, и/или по меньшей мере приблизительно 75%, или по меньшей мере приблизительно 90%, или по меньшей мере приблизительно 95% нуклеотидных остатков первой части способны образовывать пары оснований с нуклеотидными остатками во второй части. В некоторых вариантах осуществления изобретения, все нуклеотидные остатки первой части способны образовывать пары оснований с нуклеотидными остатками во второй части.
Используемый в настоящем документе термин «ДНК» определен как дезоксирибонуклеиновая кислота.
Термин «кодирующий» относится к специфическим последовательностям нуклеотидов в полинуклеотиде, таким как ген, кДНК или мРНК, имеющим природное свойство, позволяющее им служить в качестве матриц для синтеза других полимеров и макромолекул в биологических процессах, имеющих определенную последовательность нуклеотидов (то есть, рРНК, тРНК и мРНК) или определенную последовательность аминокислот и обладающих биологическими свойствами этих нуклеотидов и аминокислот. Таким образом, ген кодирует белок, если транскрипция и трансляция мРНК, соответствующей этому гену, способствует продуцированию белка в клетке или в другой биологической системе. Обе кодирующих цепи, нуклеотидные последовательности которых идентичны последовательности мРНК, и которые обычно имеются в списках последовательностей, и не кодирующая цепь, используемая в качестве матрицы для транскрипции гена или кДНК, могут рассматриваться в настоящем документе как цепи, кодирующие белок или другой продукт этого гена или кДНК.
Если это не оговорено особо, то выражение «нуклеотидная последовательность, кодирующая аминокислотную последовательность» включает все нуклеотидные последовательности, которые представляют собой вырожденные варианты, и которые кодируют одну и ту же аминокислотную последовательность. Выражение «нуклеотидная последовательность, которая кодирует белок или РНК», может также включать интроны, если только нуклеотидная последовательность, кодирующая белок, может в некоторых вариантах содержать интрон(ы).
Термин «выделенный» означает «модифицированный» или «удаленный» из природного окружения. Так, например, нуклеиновая кислота или пептид, которые обычно присутствуют в нормальной среде у живого индивидуума, не являются «выделенными», но та же самая нуклеиновая кислота или пептид, которые были частично или полностью отделены от окружения, в котором они обычно присутствуют в природе, являются «выделенными». Выделенная нуклеиновая кислота или белок могут присутствовать, в основном, в очищенной форме, либо они могут присутствовать в неприродном окружении, таком как, например, клетка-хозяин.
Используемый в настоящем документе термин «гибридома» означает клетку, происходящую от гибрида B-лимфоцита и его партнера по слиянию, такого как миеломная клетка. Гибридома может быть клонирована и может сохраняться бесконечно долгое время в клеточной культуре и обладает способностью продуцировать моноклональные антитела. Гибридома может также рассматриваться как гибридная клетка.
«Выделенная нуклеиновая кислота» означает сегмент или фрагмент нуклеиновой кислоты, который был отделен от последовательностей, фланкирующих этот сегмент в природе, то есть, фрагмент ДНК, который был удален из последовательностей, которые по своей природе являются смежными с этим фрагментом, то есть, последовательностей, смежных с фрагментом в геноме, в котором они присутствуют по своей природе. Этот термин также относится к нуклеиновым кислотам, которые были, по существу, очищены от других компонентов, связанных с нуклеиновой кислотой в природе, то есть, РНК или ДНК или белков, присутствующих в этой клетке в природе. Следовательно, этот термин включает, например, рекомбинантную ДНК, которую вводят в вектор, в автономно реплицирующуюся плазмиду или вирус, или в геномную ДНК прокариота или эукариота, или которая существует как отдельная молекула (то есть, как кДНК или фрагмент геномной ДНК или кДНК, продуцированный посредством ПЦР или посредством гидролиза рестриктирующими ферментами) независимо от других последовательностей. Этот термин также включает рекомбинантную ДНК, которая является частью гибридного гена, кодирующего дополнительную полипептидную последовательность.
В контексте настоящего изобретения, широко распространенные основания нуклеиновых кислот имеют следующие сокращения. «A» означает аденозин, «C» означает цитозин, «G» означает гуанозин, «Т» означает тимидин, а «U» означает уридин.
Используемый в настоящем документе термин «полинуклеотид» определен как цепь нуклеотидов. Кроме того, нуклеиновые кислоты представляют собой нуклеотидные полимеры. Таким образом, используемые в настоящем документе термины «нуклеиновые кислоты» и «полинуклеотиды» являются синонимами. Исходя из общих знаний, специалисту известно, что нуклеиновые кислоты представляют собой полинуклеотиды, которые могут быть гидролизованы с образованием мономерных «нуклеотидов». Мономерные нуклеотиды могут быть гидролизованы в нуклеозиды. Используемыми в настоящем документе полинуклеотидами являются, но не ограничиваются ими, все последовательности нуклеиновой кислоты, полученные любыми методами, известными специалистам, включая, но не ограничиваясь ими, рекомбинантные методы, то есть, клонирование последовательностей нуклеиновой кислоты из рекомбинантной библиотеки или клеточного генома с применением стандартных методов клонирования и ПЦР и т.п., и методы синтеза.
Используемые в настоящем документе термины «пептид», «полипептид» и «белок» являются синонимами и означают соединение, состоящее из аминокислотных остатков, ковалентно связанных пептидными связями. Белок или пептид должен содержать по меньшей мере две аминокислоты, но максимальное число аминокислот, которое может содержать последовательность белка или пептида, не имеет конкретных ограничений. Полипептиды включает любой пептид или белок, содержащий две или более аминокислот, связанных друг с другом пептидными связями. Этот используемый в настоящем документе термин означает две коротких цепи, которые также обычно называются пептидами, олигопептидами и олигомерами и, например, более длинные цепи, которые в литературе называются белками многих типов. «Полипептидами» являются, например, биологически активные фрагменты, по существу, гомологичные полипептиды, олигопептиды, гомодимеры, гетеродимеры, варианты полипептидов, модифицированные полипептиды, производные, аналоги, гибридные белки и т.п. Полипептидами являются природные пептиды, рекомбинантнные пептиды, синтетические пептиды или их комбинации.
Используемый в настоящем документе термин «потомство» означает последующее поколение или потомки и включает потомство млекопитающего, а также дифференцированные или недифференцированные клетки-потомки, происходящие от родительской клетки. В одном из применений, термин «потомство» означает клетки-потомки, которые являются генетически идентичными родительским клеткам. В другом применении, термин «потомство» означает клетки-потомки, которые являются генетически и фенотипически идентичными родительским клеткам. В еще одном применении, термин «потомство» означает клетки-потомки, которые были дифференцированы из родительской клетки.
Используемый в настоящем документе термин «РНК» определен как рибонуклеиновая кислота.
Используемый в настоящем документе термин «рекомбинантная ДНК» определен как ДНК, полученная путем присоединения фрагментов ДНК от различных источников.
Используемый в настоящем документе термин «рекомбинантный полипептид» определен как полипептид, полученный методами рекомбинантных ДНК.
Используемый в настоящем документе термин «конъюгированый» относится к ковалентному связыванию одной молекулы с другой молекулой.
Используемый в настоящем документе термин «вариант» означает последовательность нуклеиновой кислоты или пептидную последовательность, которая отличается от эталонной последовательности нуклеиновой кислоты или пептидной последовательности, соответственно, но сохраняет основные биологические свойства эталонной молекулы. Изменения в последовательности варианта нуклеиновой кислоты могут не приводить к модификации аминокислотной последовательности пептида, кодируемого эталонной нуклеиновой кислотой, или могут приводить к аминокислотным заменам, добавлениям, делециям, лигированию и усечениям. Изменения в последовательности пептидных вариантов обычно являются ограниченными или консервативными, а поэтому последовательности эталонного пептида и варианта, в целом, являются очень похожими, а во многих областях, идентичными. Аминокислотные последовательности варианта и эталонного пептида могут отличаться одной или более заменами, добавлениями и делециями в любых комбинациях. Вариант нуклеиновой кислоты или пептида может представлять собой природный вариант, такой как аллельный вариант, либо вариант, о котором не известно, существует ли он в природе. Не-природные варианты нуклеиновых кислот и пептидов могут быть получены методами мутагенеза или посредством прямого синтеза. В различных вариантах осуществления изобретения, последовательность варианта по меньшей мере на 99%, по меньшей мере на 98%, по меньшей мере на 97%, по меньшей мере на 96%, по меньшей мере на 95%, по меньшей мере на 94%, по меньшей мере на 93%, по меньшей мере на 92%, по меньшей мере на 91%, по меньшей мере на 90%, по меньшей мере на 89%, по меньшей мере на 88%, по меньшей мере на 87%, по меньшей мере на 86%, по меньшей мере на 85% идентична эталонной последовательности.
Используемый в настоящем документе термин «регуляция» может означать любой метод изменения уровня или активности субстрата. Неограничивающими примерами регуляции, если она относится к белку, являются воздействие на экспрессию (включая транскрипцию и/или трансляцию), воздействие на укладку, воздействие на разложение или метаболизм белка и воздействие на локализацию белка. Неограничивающими примерами регуляции, если она относится к ферменту, также является воздействие на ферментативную активность. «Регулятор» означает молекулу, активность которой включает воздействие на уровень или активность субстрата. Регулятор может быть прямым или опосредованным. Функция регулятора может заключаться в активации или ингибировании или какой-либо другой модуляции его субстрата.
Используемый в настоящем документе термин «окно скнанирования» означает сегмент из ряда смежных положений, в котором последовательность может быть оценена независимо от любых фланкирующих последовательностей. Окно скнанирования обычно сдвигают пошагово по всей длине оцениваемой последовательности для каждого нового и независимо оцениваемого сегмента. Пошаговый сдвиг может быть сделан на 1 или более, чем одно положение.
Используемый в настоящем документе термин «вектор» может означать последовательность нуклеиновой кислоты, содержащую ориджин репликации. Вектором могут быть плазмида, бактериофаг, бактериальная искусственная хромосома или дрожжевая искусственная хромосома. Вектором может быть ДНК- или РНК-вектор. Вектор может представлять собой аутореплицирующийся внехромосомный вектор или вектор, который интегрируется в геном хозяина.
Интервалы: во всем описании изобретения, различные аспекты изобретения могут быть представлены в виде интервалов. Следует отметить, что описание в виде интервалов приводится лишь для удобства и краткости и не должно рассматриваться как строгое ограничение объема изобретения. В соответствии с этим, описание интервалов должно рассматриваться как конкретное описание всех возможных субинтервалов, а также отдельных численных величин, входящих в этот интервал. Так, например, описание интервала, такого как интервал от 1 до 6 должно рассматриваться как конкретно описанные субинтервалы, такие как интервалы от 1 до 3, от 1 до 4, от 1 до 5, от 2 до 4, от 2 до 6, от 3 до 6 и т.п., а также численные величины, входящие в этот интервал, например, 1, 2, 2,7, 3, 4, 5, 5,3 и 6. Это применимо независимо от широты интервала.
Описание
Настоящее изобретение относится к ингибированию передачи сигнала комплемента и к подавлению развития комплемент-опосредуемых расстройств с использованием антитела против С5 человека. В одном из своих вариантов, настоящее изобретение относится к ингибированию каскада передачи сигнала комплемента посредством специфического нацеливания на белок компонента комплемента C5, или на фрагмент белка C5a или C5b. В одном из своих вариантов, настоящее изобретение относится к способам лечения и профилактики воспалительных и аутоиммунных заболеваний, опосредуемых нежелательной, неконтролируемой и избыточной активацией комплемента. В одном из своих вариантов, настоящее изобретение относится к лечению комплемент-опосредуемого заболевания или комплемент-опосредуемого расстройства у индивидуума посредством приведения в контакт индивидуума с анти-C5 антителом.
В одном из своих вариантов, настоящее изобретение относится к способу лечения комплемент-опосредуемого заболевания или расстройства у индивидуума, включающему стадию введения указанному индивидууму анти-C5 антитела и, тем самым, ингибирования образования белка C5a или C5b и образования MAC. Примерами комплемент-опосредуемых патологий, которые могут быть подвергнуты лечению способами согласно изобретению, являются, но не ограничиваются ими, дегенерация желтого пятна (MD), возрастная дегенерация желтого пятна (AMD), ишемическое реперфузионное повреждение, артрит, ревматоидный артрит, волчанка, язвенный колит, инсульт, постхирургический системный воспалительный синдром, астма, аллергическая астма, хроническая обструктивная болезнь легких (ХОБЛ), синдром пароксизмальной ночной гемоглобинурии (PNH), тяжелая миастения, нейромиелит зрительного нерва (NMO), рассеянный склероз, замедление функции трансплантата, отторжение, опосредуемое антителом, атипический гемолитический уремический синдром (aHUS), окклюзия центральной вены сетчатки (CRVO), окклюзия центральной артерии сетчатки (CRAO), буллезный эпидермолиз, сепсис, трансплантация органов, воспаление (включая, но не ограничиваясь ими, воспаление, ассоциированное с операцией по сердечно-легочному шунтированию и с почечным диализом), С3-гломерулопатия, мембранозная нефропатия, IgA-нефропатия, гломерулонефрит (включая, но не ограничиваясь ими, гломерулонефрит, опосредуемый цитоплазматическим антителом против нейтрофилов (ANCA), волчаночный нефрит и их комбинации), ANCA-опосредованный васкулит, HUS, индуцированный Шига-токсином, и потеря плода, индуцированная антифосфолипидным антителом или любые их комбинации. В некоторых вариантах осуществления изобретения, композиции и способы согласно изобретению могут быть применены для лечения индивидуума, включая индивидуумов, страдающих PNH, которые являются невосприимчивыми к лечению экулизумабом. В неограничивающем примере, некоторые индивидуумы могут иметь мутацию в альфа-цепи C5, которая может сообщать резистентность к лечению экулизумабом (см., Genetic variants in C5 and poor response to eculizumab. Nishimura J, et al., N Engl J Med. 2014 Feb 13;370(7):632-9).
Способность иммунной системы различать «свои» и «не свои» антигены является жизненно важной функцией иммунной системы как специфической защиты против инвазивных микроорганизмов. «Не свои» антигены представляют собой антигены на веществах, проникающих в организм или присутствующих в организме, которые имеют детектируемые отличия от собственных компонентов индивидуума или являются чужеродными для индивидуума, тогда как «свои» антигены представляют собой антигены, которые, у здорового индивидуума, не имеют детектируемых отличий от собственных компонентов индивидуума или не являются чужеродными для индивидуума. В различных вариантах способов, активация комплемента, которая ингибируется, представляет собой активацию комплемента, запускаемую по меньшей мере одной из групп, состоящих из микробного антигена, небиологической чужеродной поверхности, модифицированной собственной ткани или их комбинациями. Одним из примеров небиологической чужеродной поверхности являются сосудистые трансплантаты, используемые в хирургической операции по кардиопульмонарному шунтированию или для почечного диализа. Примерами измененных собственных тканей являются апоптотические, некротические и ишемические ткани и клетки или их комбинации.
В некоторых вариантах осуществления изобретения, анти-C5 антитела согласно изобретению ингибируют последующие эффекты активации альтернативного пути (AP), классического пути (CP) или лектинового пути (LP) комплемента. Вообще говоря, CP инициируются комплексами «антиген-антитело», LP активируется посредством связывания лектинов с молекулами сахара на микробных поверхностях, а AP является конститутивно активным на низком уровне, но может быстро амплифицироваться на поверхностях бактериальных клеток, вирусов и паразитарных клеток из-за отсутствия регуляторных белков. Клетки-хозяева обычно защищены от активации комплемента AP регуляторными белками. Но в некоторых случаях, например, в случае повреждения или отсутствия регуляторных белков, AP может также неконтролируемо активироваться на клеток-хозяевах, что может приводить к развитию заболевания или расстройства, опосредуемого комплементом. CP состоит из компонентов C1, C2, C4 и сходится с AP на стадии активации C3. LP состоит из лектинов, связывающихся с маннозой (MBL), и MBL-ассоциированных сериновых протеаз (Masps), и имеет общие положения с CP, состоящим из компонентов C4 и C2. AP состоит из компонентов C3 и нескольких факторов, таких как фактор B, фактор D, пропердин, C5 и жидкофазный фактор-регулятор H. Активация комплемента состоит из трех стадий: (a) распознавания, (b) ферментативной активации и (c) мембранной атаки, приводящей к гибели клеток. Первая фаза активации комплемента CP начинается с C1. C1 состоит из трех различных белков: субъединицы распознавания, C1q, и субкомпонентов сериновой протеазы, C1r и C1s, которые связываются друг с другом в тетрамерном комплексе, зависящем от кальция, C1r2s2. Интактный комплекс C1 необходим для физиологической активации C1. Активация достигается в том случае, если интактный комплекс C1 связывается с иммуноглобулином, образующим комплекс с антигеном. Такое связывание активирует C1s, что в свою очередь, приводит к расщеплению белков C4 и C2 и к образованию C4a и C4b, а также C2a и C2b. Фрагменты C4b и C2a объединяются с образованием C3-конвертазы, C4b2a, что в свою очередь, приводит к расщеплению C3 и к образованию C3a и C3b. Активация LP инициируется MBL, связывающимся с некоторыми сахарами на поверхности-мишени и запускает активацию MBL-ассоциированных сериновых протеаз (MASP), что будет приводить к расщеплению C4 и C2 по механизму, аналогичному активации C1s в CP, и к образованию C3-конвертазы C4b2a. Таким образом, CP и LP активируются по различным механизмам, но все они имеют одинаковые компоненты C4 и C2 и оба эти пути приводят к образованию одной и той же C3-конвертазы, C4b2a. Расщепление C3 под действием C4b2a с образованием C3b и C3a является ключевым событием пути комплемента по двум причинам. Во-первых, оно инициирует петлю амплификации AP, поскольку C3b, осаждаемый на поверхности, представляет собой центральное промежуточное вещество AP. Оба C3a и C3b играют биологически важную роль. C3a представляет собой провоспалительный белок, а C3a вместе с C5a представляют собой анафилатоксины. C3b и продукты его последующего расщепления также связываются с рецепторами комплемента, присутствующими на нейтрофилах, эозинофилах, моноцитах и макрофагах, что облегчает фагоцитоз и клиренс C3b-опсонизированных частиц. И наконец, C3b может ассоциироваться с C4b2a с образованием C5-конвертазы CP и LP и с активацией терминальной последовательности комплемента, что будет приводить к продуцированию C5a, то есть, сильного провоспалительного медиатора, и к сборке литического мембрано-атакующего комплекса (MAC), C5-C9.
В одном из вариантов осуществления изобретения, активность пути комплемента, которая ингибируется способом согласно изобретению, представляет собой активацию пути комплемента, индуцированную по меньшей мере одной из групп, выбранных из липополисахарида (LPS), липоолигосахарида (LOS), молекулярных паттернов, ассоциированных с патогеном (PAMP) и молекулярных паттернов, ассоциированных с риском (DAMP). В другом варианте осуществления изобретения, активность передачи сигнала комплемент, которая ингибируется способом согласно изобретению, представляет собой образование белка C5a. В другом варианте осуществления изобретения, активность передачи сигнала комплемента, которая ингибируется способом согласно изобретению, представляет собой образование белка C5b. В другом варианте осуществления изобретения, активность передачи сигнала комплемента, которая ингибируется способом согласно изобретению, представляет собой образование MAC. В другом варианте осуществления изобретения, активность передачи сигнала комплемента, которая ингибируется способом согласно изобретению, зависит от C5.
В одном из своих вариантов, настоящее изобретение относится к способу ингибирования инициации терминальной активации комплемента у индивидуума, включающему стадию введения указанному индивидууму анти-C5 антитела, и тем самым, ингибирования инициации терминальной активации комплемента в результате активации CP, LP или AP у индивидуума. Примерами этих вариантов являются пациенты с PNH, страдающие гемолизом, опосредуемым комплементом, и индивидуумы, страдающие комплемент-опосредуемым aHUS, астмой, ишемическим/реперфузионным повреждением, ревматоидным артритом и ANCA-опосредуемыми болезнями почек. В различных вариантах осуществления изобретения, заболеваниями и расстройствами, которые могут быть подвергнуты лечению с использованием композиций и способов согласно изобретению, являются, но не ограничиваются ими, комплемент-опосредуемый гемолиз, комплемент-опосредуемый aHUS, C3-гломерулопатия, нейромиелит зрительного нерва, тяжелая миастения, астма, ишемическое/реперфузионное повреждение, ревматоидный артрит и ANCA-опосредуемые заболевания или расстройства почек.
В различных своих других вариантах, настоящее изобретение относится к способам идентификации потенциального анти-C5 антитела, обладающего действием, ингибирующим передачу сигнала комплемента. Один из таких способов включает стадии: a) покрытия планшета липополисахаридом (LPS); b) промывки планшета для удаления несвязанного LPS; c) добавления альбумина бычьей сыворотки (BSA) в забуференном фосфатом физиологическом растворе (PBS); d) промывки планшета для удаления несвязанного BSA; e) добавления смеси соединения анти-C5 антитела-кандидата, которое было предварительно инкубировано с сывороткой и смешано, в нормальную человеческую сыворотку; f) промывки планшета; g) добавления ПХ-конъюгированного антитела против человеческого C3; h) промывки планшета для удаления несвязанного антитела; i) добавления реагента, который является субстратом для ПХ; j) добавления серной кислоты для прекращения реакции; k) измерения оптической плотности на 450 нм; l) сравнения оптической плотности планшета, содержащего соединение анти-C5 антитела-кандидата, с оптической плотностью позитивного контроля для сравнения и негативного контроля для сравнения; причем, анти-C5 антитело идентифицируют по снижению оптической плотности по сравнению с оптической плотностью позитивного контроля для сравнения.
Анти -C5 антитела
В некоторых своих вариантах, настоящее изобретение включает композиции, содержащие антитело, которое специфически связывается с C5. В одном из вариантов осуществления изобретения, анти-C5 антителом является поликлональное антитело. В другом варианте осуществления изобретения, анти-C5 антителом является моноклональное антитело. В некоторых вариантах осуществления изобретения, анти-C5 антителом является химерное антитело. В других вариантах осуществления изобретения, анти-C5 антителом является гуманизированное антитело. В некоторых вариантах осуществления изобретения, антителом является фрагмент антитела. В некоторых вариантах осуществления изобретения, C5 представляет собой человеческий C5.
В некоторых вариантах осуществления изобретения, связывание антитела или фрагмента антитела с С5 человека ассоциируется со снижением образования C5a или C5b и образования MAC в пути активации комплемента в интектном организме. В некоторых своих вариантах, настоящее изобретение относится к белку или полипептиду, способному связываться с С5 человека. В некоторых вариантах осуществления изобретения, антитело или фрагмент антитела, белок или полипептид связываются с соответствующей частью или фракцией или с эпитопом С5 человека; и связывание антитела или его антигенсвязывающего фрагмента или белка или полипептида с соответствующей частью С5 человека ассоциируется со снижением образования C5a или C5b и образования MAC в интактном организме.
В некоторых вариантах осуществления изобретения, антитело, связывающееся с С5 человека или фрагмент антитела, связывающегося с C5, дополнительно конъюгируют с белком, пептидом или другим соединением. В некоторых вариантах осуществления изобретения, антитело, связывающееся с С5 человека, или его фрагмент конъюгируют с белком, пептидом или другим соединением. В некоторых вариантах осуществления изобретения, белок, пептид или другое соединение, с которыми конъюгировано антитело, связывающееся с С5 человека, или фрагмент этого антитела, представляют собой нацеливающую молекулу (то есть, нацеливающую молекулу, специфически связывающуюся с молекулой, не являющейся человеческим C5). В некоторых вариантах осуществления изобретения, белок, пептид или другое соединение, с которыми конъюгировано антитело, связывающееся с С5 человека, или фрагмент этого антитела, представляют собой эффекторную молекулу (например, цитотоксическую молекулу).
В одном из вариантов осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO:3; VH-CDR2: SEQ ID NO:4; VH-CDR3: SEQ ID NO:5; VL-CDR1: SEQ ID NO:8; VL-CDR2: SEQ ID NO:9; и VL-CDR3: SEQ ID NO:10, или их варианта или вариантов. В другом варианте осуществления изобретения, анти-C5 антитело содержит все CDR, выбранные из группы, состоящей из: VH-CDR1: SEQ ID NO:3; VH-CDR2: SEQ ID NO:4; VH-CDR3: SEQ ID NO:5; VL-CDR1: SEQ ID NO:8; VL-CDR2: SEQ ID NO:9; и VL-CDR3: SEQ ID NO:10, или их варианта или вариантов.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, включающую аминокислотную последовательность SEQ ID NO:3 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR1: SEQ ID NO:8 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, включающую аминокислотную последовательность SEQ ID NO:3; и VL-CDR1: SEQ ID NO:8.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR2, включающую аминокислотную последовательность SEQ ID NO:4 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR2: SEQ ID NO:9 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR2, включающую аминокислотную последовательность SEQ ID NO:4; и VL-CDR2: SEQ ID NO:9.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR3, включающую аминокислотную последовательность SEQ ID NO:5 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR3: SEQ ID NO:10 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR3, включающую аминокислотную последовательность SEQ ID NO:5; и VL-CDR3: SEQ ID NO:10.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, включающую аминокислотную последовательность SEQ ID NO:3 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VH-CDR2, включающую аминокислотную последовательность SEQ ID NO:4 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VH-CDR3, включающую аминокислотную последовательность SEQ ID NO:5 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VL-CDR1, включающую аминокислотную последовательность SEQ ID NO:8 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VL-CDR2, включающую аминокислотную последовательность SEQ ID NO:9 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR3, включающую аминокислотную последовательность SEQ ID NO:10 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, включающую аминокислотную последовательность SEQ ID NO:3 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VH-CDR2, включающую аминокислотную последовательность SEQ ID NO:4 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VH-CDR3, включающую аминокислотную последовательность SEQ ID NO:5; VL-CDR1, включающую аминокислотную последовательность SEQ ID NO:8 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VL-CDR2, включающую аминокислотную последовательность SEQ ID NO:9 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR3, включающую аминокислотную последовательность SEQ ID NO:10.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:3; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:4; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:5; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO:8; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO:9; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO:10.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент включают тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:2, или ее вариант. В других вариантах осуществления изобретения, анти-C5 антитело включает легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:7, или ее вариант. В другом варианте осуществления изобретения, анти-C5 антителом является mAb 2G1 или его вариант. Моноклональное анти-C5 антитело mAb 2G1 включают тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:2 и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:7. В некоторых вариантах осуществления изобретения, моноклональное анти-C5 антитело является гуманизированным. В некоторых вариантах осуществления изобретения, моноклональным анти-C5 антителом является химерное антитело.
В одном из вариантов осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO:13; VH-CDR2: SEQ ID NO:14; VH-CDR3: SEQ ID NO:15, VL-CDR1: SEQ ID NO:18; VL-CDR2: SEQ ID NO:19; и VL-CDR3: SEQ ID NO:20, или их варианта или вариантов. В другом варианте осуществления изобретения, анти-C5 антитело содержит все CDR, выбранные из группы, состоящей из: VH-CDR1: SEQ ID NO:13; VH-CDR2: SEQ ID NO:14; VH-CDR3: SEQ ID NO:15, VL-CDR1: SEQ ID NO:18; VL-CDR2: SEQ ID NO:19; и VL-CDR3: SEQ ID NO:20, или их варианта или вариантов.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, включающую аминокислотную последовательность SEQ ID NO:13 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR1: SEQ ID NO:18 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, включающую аминокислотную последовательность SEQ ID NO:13; и VL-CDR1: SEQ ID NO:18.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR2, включающую аминокислотную последовательность SEQ ID NO:14 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR2: SEQ ID NO:19 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR2, включающую аминокислотную последовательность SEQ ID NO:14; и VL-CDR2: SEQ ID NO:19.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR3, включающую аминокислотную последовательность SEQ ID NO:15 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR3: SEQ ID NO:20 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR3, включающую аминокислотную последовательность SEQ ID NO:15; и VL-CDR3: SEQ ID NO:20.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, включающую аминокислотную последовательность SEQ ID NO:13 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VH-CDR2, включающую аминокислотную последовательность SEQ ID NO:14 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VH-CDR3, включающую аминокислотную последовательность SEQ ID NO:15 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VL-CDR1, включающую аминокислотную последовательность SEQ ID NO:18 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VL-CDR2, включающую аминокислотную последовательность SEQ ID NO:19 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR3, включающую аминокислотную последовательность SEQ ID NO:20 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, включающую аминокислотную последовательность SEQ ID NO:13 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VH-CDR2, включающую аминокислотную последовательность SEQ ID NO:14 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VH-CDR3, включающую аминокислотную последовательность SEQ ID NO:15; VL-CDR1, включающую аминокислотную последовательность SEQ ID NO:18 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VL-CDR2, включающую аминокислотную последовательность SEQ ID NO:19 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR3, включающую аминокислотную последовательность SEQ ID NO:20.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:13; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:14; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:15; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO:18; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO:19; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO:20.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент включают тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:12, или ее вариант. В других вариантах осуществления изобретения, анти-C5 антитело включает легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:17, или ее вариант. В другом варианте осуществления изобретения, анти-C5 антителом является mAb 8Е1 или его вариант. Моноклональное анти-C5 антитело mAb 8Е1 включают тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:12 и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:17. В некоторых вариантах осуществления изобретения, моноклональное анти-C5 антитело является гуманизированным. В некоторых вариантах осуществления изобретения, моноклональным анти-C5 антителом является химерное антитело.
В одном из вариантов осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO:23; VH-CDR2: SEQ ID NO:24; VH-CDR3: SEQ ID NO:25, VL-CDR1: SEQ ID NO:28; и VL-CDR3: SEQ ID NO:29, или их варианта или вариантов. В другом варианте осуществления изобретения, анти-C5 антитело содержит все CDR, выбранные из группы, состоящей из: VH-CDR1: SEQ ID NO:23; VH-CDR2: SEQ ID NO:24; VH-CDR3: SEQ ID NO:25; VL-CDR1: SEQ ID NO:28; и VL-CDR3: SEQ ID NO:29, или их варианта или вариантов.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, включающую аминокислотную последовательность SEQ ID NO:23 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR1: SEQ ID NO:28 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, включающую аминокислотную последовательность SEQ ID NO:23; и VL-CDR1: SEQ ID NO:28.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR2, включающую аминокислотную последовательность SEQ ID NO:24 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR2: SEQ ID NO:29 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR2, включающую аминокислотную последовательность SEQ ID NO:24; и VL-CDR2: SEQ ID NO:29.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR3, включающую аминокислотную последовательность SEQ ID NO:25 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR3, включающую аминокислотную последовательность SEQ ID NO:25.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, включающую аминокислотную последовательность SEQ ID NO:23 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VH-CDR2, включающую аминокислотную последовательность SEQ ID NO:24 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VH-CDR3, включающую аминокислотную последовательность SEQ ID NO:25 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VL-CDR1, включающую аминокислотную последовательность SEQ ID NO:28 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VL-CDR2, включающую аминокислотную последовательность SEQ ID NO:29 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, включающую аминокислотную последовательность SEQ ID NO:23 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VH-CDR2, включающую аминокислотную последовательность SEQ ID NO:24 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VH-CDR3, включающую аминокислотную последовательность SEQ ID NO:15; VL-CDR1, включающую аминокислотную последовательность SEQ ID NO:28 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VL-CDR2, включающую аминокислотную последовательность SEQ ID NO:29 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:23; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:24; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:25; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO:28; и VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO:29.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент включают тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:22, или ее вариант. В других вариантах осуществления изобретения, анти-C5 антитело включает легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:27, или ее вариант. В другом варианте осуществления изобретения, анти-C5 антителом является mAb 4Е7 или его вариант. Моноклональное анти-C5 антитело mAb 4Е7 включают тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:22 и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:27. В некоторых вариантах осуществления изобретения, моноклональное анти-C5 антитело является гуманизированным. В некоторых вариантах осуществления изобретения, моноклональным анти-C5 антителом является химерное антитело.
В одном из вариантов осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO:32; VH-CDR2: SEQ ID NO:33; VH-CDR3: SEQ ID NO:34; VL-CDR1: SEQ ID NO:37; VL-CDR2: SEQ ID NO:38; и VL-CDR3: SEQ ID NO:39, или их варианта или вариантов. В другом варианте осуществления изобретения, анти-C5 антитело содержит все CDR, выбранные из группы, состоящей из VH-CDR1: SEQ ID NO:32; VH-CDR2: SEQ ID NO:33; VH-CDR3: SEQ ID NO:34; VL-CDR1: SEQ ID NO:37; VL-CDR2: SEQ ID NO:38; and VL-CDR3: SEQ ID NO:39, или их варианта или вариантов.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, включающую аминокислотную последовательность SEQ ID NO:32 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR1: SEQ ID NO:37 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, включающую аминокислотную последовательность SEQ ID NO:32; и VL-CDR1: SEQ ID NO:37.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR2, включающую аминокислотную последовательность SEQ ID NO:33 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR2: SEQ ID NO:38 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR2, включающую аминокислотную последовательность SEQ ID NO:33; и VL-CDR2: SEQ ID NO:38.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR3, включающую аминокислотную последовательность SEQ ID NO:34 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR3: SEQ ID NO:39 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR3, включающую аминокислотную последовательность SEQ ID NO:34; и VL-CDR3: SEQ ID NO:39.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, включающую аминокислотную последовательность SEQ ID NO:32 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VH-CDR2, включающую аминокислотную последовательность SEQ ID NO:33 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VH-CDR3, включающую аминокислотную последовательность SEQ ID NO:34 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VL-CDR1, включающую аминокислотную последовательность SEQ ID NO:37 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VL-CDR2, включающую аминокислотную последовательность SEQ ID NO:38 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR3, включающую аминокислотную последовательность SEQ ID NO:39 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, включающую аминокислотную последовательность SEQ ID NO:32 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VH-CDR2, включающую аминокислотную последовательность SEQ ID NO:33 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VH-CDR3, включающую аминокислотную последовательность SEQ ID NO:34; VL-CDR1, включающую аминокислотную последовательность SEQ ID NO:37 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VL-CDR2, включающую аминокислотную последовательность SEQ ID NO:38 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR2, включающую аминокислотную последовательность SEQ ID NO:39.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:32; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:33; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:34; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO:37; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO:38; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO:39.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент включают тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:31, или ее вариант. В других вариантах осуществления изобретения, анти-C5 антитело включает легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:36, или ее вариант. В другом варианте осуществления изобретения, анти-C5 антителом является mAb 9G6 или его вариант. Моноклональное анти-C5 антитело mAb 9G6 включают тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:31 и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:36. В некоторых вариантах осуществления изобретения, моноклональное анти-C5 антитело является гуманизированным. В некоторых вариантах осуществления изобретения, моноклональным анти-C5 антителом является химерное антитело.
В одном из вариантов осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO:42; VH-CDR2: SEQ ID NO:43; VH-CDR3: SEQ ID NO:44; VL-CDR1: SEQ ID NO:47; VL-CDR2: SEQ ID NO:48; и VL-CDR3: SEQ ID NO:49, или их варианта или вариантов. В другом варианте осуществления изобретения, анти-C5 антитело содержит все CDR, выбранные из группы, состоящей из VH-CDR1: SEQ ID NO:42; VH-CDR2: SEQ ID NO:43; VH-CDR3: SEQ ID NO:44; VL-CDR1: SEQ ID NO:47; VL-CDR2: SEQ ID NO:48; и VL-CDR3: SEQ ID NO:49, или их варианта или вариантов.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, включающую аминокислотную последовательность SEQ ID NO:42 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR1: SEQ ID NO:47 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, включающую аминокислотную последовательность SEQ ID NO:42; и VL-CDR1: SEQ ID NO:47.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR2, включающую аминокислотную последовательность SEQ ID NO:43 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR2: SEQ ID NO:48 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR2, включающую аминокислотную последовательность SEQ ID NO:43; и VL-CDR2: SEQ ID NO:48.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR3, включающую аминокислотную последовательность SEQ ID NO:44 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR3: SEQ ID NO:49 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR3, включающую аминокислотную последовательность SEQ ID NO:44; и VL-CDR3: SEQ ID NO:49.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, включающую аминокислотную последовательность SEQ ID NO:42 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VH-CDR2, включающую аминокислотную последовательность SEQ ID NO:43 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VH-CDR3, включающую аминокислотную последовательность SEQ ID NO:44 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VL-CDR1, включающую аминокислотную последовательность SEQ ID NO:47 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VL-CDR2, включающую аминокислотную последовательность SEQ ID NO:48 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR3, включающую аминокислотную последовательность SEQ ID NO:49 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, включающую аминокислотную последовательность SEQ ID NO:42 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VH-CDR2, включающую аминокислотную последовательность SEQ ID NO:43 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VH-CDR3, включающую аминокислотную последовательность SEQ ID NO:44; VL-CDR1, включающую аминокислотную последовательность SEQ ID NO:47 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VL-CDR2, включающую аминокислотную последовательность SEQ ID NO:48 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR2, включающую аминокислотную последовательность SEQ ID NO:49.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:42; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:43; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:44; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO:47; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO:48; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO:49.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент включают тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:41, или ее вариант. В других вариантах осуществления изобретения, анти-C5 антитело включает легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:46, или ее вариант. В другом варианте осуществления изобретения, анти-C5 антителом является mAb 11С5 или его вариант. Моноклональное анти-C5 антитело mAb 11С5 включают тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:41 и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:46. В некоторых вариантах осуществления изобретения, моноклональное анти-C5 антитело является гуманизированным. В некоторых вариантах осуществления изобретения, моноклональным анти-C5 антителом является химерное антитело.
В одном из вариантов осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO:52; VH-CDR2: SEQ ID NO:53; VH-CDR3: SEQ ID NO:54; VL-CDR1: SEQ ID NO:57; VL-CDR2: SEQ ID NO:58; и VL-CDR3: SEQ ID NO:59, или их варианта или вариантов. В другом варианте осуществления изобретения, анти-C5 антитело содержит все CDR, выбранные из группы, состоящей из VH-CDR1: SEQ ID NO:52; VH-CDR2: SEQ ID NO:53; VH-CDR3: SEQ ID NO:54; VL-CDR1: SEQ ID NO:57; VL-CDR2: SEQ ID NO:58; и VL-CDR3: SEQ ID NO:59, или их варианта или вариантов.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, включающую аминокислотную последовательность SEQ ID NO:52 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR1: SEQ ID NO:57 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, включающую аминокислотную последовательность SEQ ID NO:52; и VL-CDR1: SEQ ID NO:57.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR2, включающую аминокислотную последовательность SEQ ID NO:53 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR2: SEQ ID NO:58 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR2, включающую аминокислотную последовательность SEQ ID NO:53; и VL-CDR2: SEQ ID NO:58.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR3, включающую аминокислотную последовательность SEQ ID NO:54 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR3: SEQ ID NO:59 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR3, включающую аминокислотную последовательность SEQ ID NO:54; и VL-CDR3: SEQ ID NO:59.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, включающую аминокислотную последовательность SEQ ID NO:52 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VH-CDR2, включающую аминокислотную последовательность SEQ ID NO:53 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VH-CDR3, включающую аминокислотную последовательность SEQ ID NO:54 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VL-CDR1, включающую аминокислотную последовательность SEQ ID NO:57 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VL-CDR2, включающую аминокислотную последовательность SEQ ID NO:58 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR3, включающую аминокислотную последовательность SEQ ID NO:59 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, включающую аминокислотную последовательность SEQ ID NO:52 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VH-CDR2, включающую аминокислотную последовательность SEQ ID NO:53 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VH-CDR3, включающую аминокислотную последовательность SEQ ID NO:54; VL-CDR1, включающую аминокислотную последовательность SEQ ID NO:57 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VL-CDR2, включающую аминокислотную последовательность SEQ ID NO:58 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR2, включающую аминокислотную последовательность SEQ ID NO:59.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:52; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:53; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:54; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO:57; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO:58; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO:59.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент включают тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:51, или ее вариант. В других вариантах осуществления изобретения, анти-C5 антитело включает легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:56, или ее вариант. В другом варианте осуществления изобретения, анти-C5 антителом является mAb 11D9 или его вариант. Моноклональное анти-C5 антитело mAb 11D9 включают тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:51 и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:56. В некоторых вариантах осуществления изобретения, моноклональное анти-C5 антитело является гуманизированным. В некоторых вариантах осуществления изобретения, моноклональным анти-C5 антителом является химерное антитело.
В одном из вариантов осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO:64; VH-CDR2: SEQ ID NO:65; VH-CDR3: SEQ ID NO:66; VL-CDR1: SEQ ID NO:74; VL-CDR2: SEQ ID NO:75; и VL-CDR3: SEQ ID NO:76, или их варианта или вариантов. В другом варианте осуществления изобретения, анти-C5 антитело содержит все CDR, выбранные из группы, состоящей из VH-CDR1: SEQ ID NO:64; VH-CDR2: SEQ ID NO:65; VH-CDR3: SEQ ID NO:66; VL-CDR1: SEQ ID NO:74; VL-CDR2: SEQ ID NO:75; и VL-CDR3: SEQ ID NO:76, или их варианта или вариантов.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, включающую аминокислотную последовательность SEQ ID NO:64 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR1: SEQ ID NO:74 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, включающую аминокислотную последовательность SEQ ID NO:64; и VL-CDR1: SEQ ID NO:74.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR2, включающую аминокислотную последовательность SEQ ID NO:65 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR2: SEQ ID NO:75 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR2, включающую аминокислотную последовательность SEQ ID NO:65; и VL-CDR2: SEQ ID NO:75.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR3, включающую аминокислотную последовательность SEQ ID NO:66 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR3: SEQ ID NO:76 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR3, включающую аминокислотную последовательность SEQ ID NO:66; и VL-CDR3: SEQ ID NO:76.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, включающую аминокислотную последовательность SEQ ID NO:64 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VH-CDR2, включающую аминокислотную последовательность SEQ ID NO:65 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VH-CDR3, включающую аминокислотную последовательность SEQ ID NO:66 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VL-CDR1, включающую аминокислотную последовательность SEQ ID NO:74 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VL-CDR2, включающую аминокислотную последовательность SEQ ID NO:75 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR3, включающую аминокислотную последовательность SEQ ID NO:76 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, включающую аминокислотную последовательность SEQ ID NO:64 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VH-CDR2, включающую аминокислотную последовательность SEQ ID NO:65 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VH-CDR3, включающую аминокислотную последовательность SEQ ID NO:66; VL-CDR1, включающую аминокислотную последовательность SEQ ID NO:74 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VL-CDR2, включающую аминокислотную последовательность SEQ ID NO:75 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR2, включающую аминокислотную последовательность SEQ ID NO:76.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:64; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:65; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:66; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO:74; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO:75; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO:76.
В одном из вариантов осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO:69; VH-CDR2: SEQ ID NO:70; VH-CDR3: SEQ ID NO:71; VL-CDR1: SEQ ID NO:74; VL-CDR2: SEQ ID NO:75; и VL-CDR3: SEQ ID NO:76, или их варианта или вариантов. В другом варианте осуществления изобретения, анти-C5 антитело содержит все CDR, выбранные из группы, состоящей из VH-CDR1: SEQ ID NO:69; VH-CDR2: SEQ ID NO:70; VH-CDR3: SEQ ID NO:71; VL-CDR1: SEQ ID NO:74; VL-CDR2: SEQ ID NO:75; и VL-CDR3: SEQ ID NO:76, или их варианта или вариантов.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, включающую аминокислотную последовательность SEQ ID NO:69 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR1: SEQ ID NO:74 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, включающую аминокислотную последовательность SEQ ID NO:69; и VL-CDR1: SEQ ID NO:74.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR2, включающую аминокислотную последовательность SEQ ID NO:70 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR2: SEQ ID NO:75 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR2, включающую аминокислотную последовательность SEQ ID NO:70; и VL-CDR2: SEQ ID NO:75.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR3, включающую аминокислотную последовательность SEQ ID NO:71 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR3: SEQ ID NO:76 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR3, включающую аминокислотную последовательность SEQ ID NO:71; и VL-CDR3: SEQ ID NO:76.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, включающую аминокислотную последовательность SEQ ID NO:69 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VH-CDR2, включающую аминокислотную последовательность SEQ ID NO:70 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VH-CDR3, включающую аминокислотную последовательность SEQ ID NO:71 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VL-CDR1, включающую аминокислотную последовательность SEQ ID NO:74 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VL-CDR2, включающую аминокислотную последовательность SEQ ID NO:75 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR3, включающую аминокислотную последовательность SEQ ID NO:76 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, включающую аминокислотную последовательность SEQ ID NO:69 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VH-CDR2, включающую аминокислотную последовательность SEQ ID NO:70 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VH-CDR3, включающую аминокислотную последовательность SEQ ID NO:71; VL-CDR1, включающую аминокислотную последовательность SEQ ID NO:74 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; VL-CDR2, включающую аминокислотную последовательность SEQ ID NO:75 или ее вариант, содержащие приблизительно до 3 (например, приблизительно любые из 1, 2 или 3) аминокислотных замен; и VL-CDR2, включающую аминокислотную последовательность SEQ ID NO:76.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент содержат: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO:69; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO:70; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO:71; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO:74; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO:75; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO:76.
В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент включают тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:68, или ее вариант. В других вариантах осуществления изобретения, анти-C5 антитело включает легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:73, или ее вариант. В другом варианте осуществления изобретения, анти-C5 антителом является mAb 2G1 или его вариант. Моноклональное анти-C5 антитело mAb 2G1 включают тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:68 и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:73. В некоторых вариантах осуществления изобретения, моноклональное анти-C5 антитело является гуманизированным. В некоторых вариантах осуществления изобретения, моноклональным анти-C5 антителом является химерное антитело. В некоторых вариантах осуществления изобретения, анти-C5 антитело или его антигенсвязывающий фрагмент включают тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:63 или ее вариант. В других вариантах осуществления изобретения, анти-C5 антитело включает легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:73 или ее вариант. В другом варианте осуществления изобретения, анти-C5 антителом является mAb 2G1 или его вариант. Моноклональное анти-C5 антитело mAb 2G1 включают тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:63 и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:73. В некоторых вариантах осуществления изобретения, моноклональное анти-C5 антитело является гуманизированным. В некоторых вариантах осуществления изобретения, моноклональным анти-C5 антителом является химерное антитело.
В некоторых вариантах осуществления изобретения, антителами являются химерные антитела. В некоторых вариантах осуществления изобретения, антитело против С5 человека может содержать константные домены человеческой легкой цепи и человеческой тяжелой цепи в комбинации с последовательностями CDR вариабельной области, описанными выше. Специалист в данной области может получить и синтезировать химерное антитело известными методами замены соответствующих доменов представляющих интерес специфических антител. Такое антитело может быть легко получено путем присоединения гетерогенных доменов антитела и включения одной или более последовательностей CDR, описанных в настоящей заявке. С применением известной рекомбинантной технологии можно получить и синтезировать рекомбинантное антитело, содержащее константные области тяжелой и легкой цепей, кодируемые последовательностями нуклеиновой кислоты константных областей человеческой тяжелой и легкой цепей; и вариабельные области тяжелой и легкой цепей, содержащие CDR, кодируемые последовательностями нуклеиновой кислоты, соответствующими последовательностям CDR, описанным в настоящей заявке. Специалист в данной области может получить антитело против С5 человека, содержащее одну или более последовательностей CDR, описанных в настоящей заявке, где части легкой цепи или части тяжелой цепи, взятые отдельно, заменяют областями антитела, принадлежащего к другому виду, такому как например, человек. Человеческое антитело против С5 человека, содержащее вариабельные области, имеющие одну или более последовательностей CDR, выбранных из SEQ ID NN: 3-5, 8-10, 13-15, 18-20, 23-25, 28-29, 32-34, 37-39, 42-44, 47-49, 52-54 и 57-59, или их варианта или вариантов в комбинации со структурными элементами мышиного или не-мышиного антитела, находящимися за пределами областей CDR, могут быть получены рутинными методами, известными специалистам. В некоторых вариантах осуществления изобретения, антитела или фрагменты антител также подвергают гуманизации известными методами.
В различных вариантах осуществления изобретения, любое из описанных в настоящем документе антител согласно изобретению, имеющих любые описанные в настоящем документе вариабельные области, может содержать константную тяжелую цепь человеческого IgG4. SEQ ID NO:104 представляет собой пример аминокислотной последовательности константной тяжелой цепи человеческого IgG4. В некоторых вариантах осуществления изобретения, антитело согласно изобретению содержит константную тяжелую цепь человеческого IgG4, имеющую мутацию S228P. SEQ ID NO:60 является примером аминокислотной последовательности константной тяжелой цепи человеческого IgG4, имеющей мутацию S228P.
В некоторых вариантах осуществления изобретения, анти-C5 антитело включает антитело, имеющее аминокислотную последовательность, которая по меньшей мере приблизительно на 85% (например, по меньшей мере приблизительно на любые из 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%) идентична последовательностям CDR, описанным и перечисленным в настоящей заявке в SEQ ID NN 3-5, 8-10, 13-15, 18-20, 23-25, 28-29, 32-34, 37-39, 42-44, 47-49, 52-54 и 57-59.
В одном из своих вариантов, настоящее изобретение охватывает анти-C5 антитело, имеющее последовательности CDR, которые по меньшей мере приблизительно на 85% (например, по меньшей мере приблизительно на любые из 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%) идентичны последовательностям CDR, описанным выше. В одном из вариантов осуществления изобретения, антитело против С5 человека имеет вариабельную (vH) область тяжелой цепи и вариабельную (vL) область легкой цепи, где область vH имеет аминокислотную последовательность, которая более, чем приблизительно на 90% (например, более, чем приблизительно на любые из 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%) идентична последовательностям, выбранным из SEQ ID NN 2, 12, 22, 31, 41, 51, 63 и 68, и где область vL имеет аминокислотную последовательность, которая более, чем приблизительно на 90% (например, более, чем приблизительно на любые из 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%) идентична последовательностям, выбранным из SEQ ID NN 7, 17, 27, 36, 46, 56 и 73.
В некоторых вариантах осуществления изобретения, антитело или фрагмент антитела являются модифицированными. В некоторых вариантах осуществления изобретения, модификации включают присоединение антитела или его антигенсвязывающего фрагмента к частям другого белка или фрагмента белка. В некоторых вариантах осуществления изобретения, антитело или его фрагмент согласно изобретению модифицируют для увеличения его времени полужизни в кровотоке in vivo. Так, например, фрагмент антитела может быть присоединен к молекуле FcRn, которая также известна как неонатальный Fc-рецептор для стабилизации антитела in vivo (Nature Reviews Immunology 7:715-725). В некоторых вариантах осуществления изобретения, антитело или его антигенсвязывающий фрагмент конъюгируют (например, связывают) с эффекторной молекулой и/или с другой нацеливающей молекулой (такой как антитело или фрагмент антитела, распознающие другую молекулу, другой антиген или другой эпитоп).
Специалист в данной области может получить одноцепочечный вариабельный фрагмент, связывающийся с С5 человека (scFv) и содержащий по меньшей мере одну специфическую последовательность CDR, выбранную из SEQ ID NN 3-5, 8-10, 13-15, 18-20, 23-25, 28-29, 32-34, 37-39, 42-44, 47-49, 52-54 и 57-59 или их варианта или вариантов. scFv может содержать последовательности вариабельной области тяжелой цепи, представленные в SEQ ID NN 3-5, или их вариант или варианты, и последовательности вариабельных областей легкой цепи, представленные в SEQ ID NN 8-10, или их вариант или варианты. scFv может содержать последовательности вариабельной области тяжелой цепи, представленные в SEQ ID NN 13-15, или их вариант или варианты, и последовательности вариабельных областей легкой цепи, представленные в SEQ ID NN 18-20, или их вариант или варианты. scFv может содержать последовательности вариабельной области тяжелой цепи, представленные в SEQ ID NN 23-25, или их вариант или варианты, и последовательности вариабельных областей легкой цепи, представленные в SEQ ID NN 28-29, или их вариант или варианты. scFv может содержать последовательности вариабельной области тяжелой цепи, представленные в SEQ ID NN 32-34, или их вариант или варианты, и последовательности вариабельных областей легкой цепи, представленные в SEQ ID NN 37-39, или их вариант или варианты. scFv может содержать последовательности вариабельной области тяжелой цепи, представленные в SEQ ID NN 42-44, или их вариант или варианты, и последовательности вариабельных областей легкой цепи, представленные в SEQ ID NN 47-49, или их вариант или варианты. scFv может содержать последовательности вариабельной области тяжелой цепи, представленные в SEQ ID NN 52-54, или их вариант или варианты, и последовательности вариабельных областей легкой цепи, представленные в SEQ ID NN 57-59, или их вариант или варианты. Последовательности CDR, включенные в scFv, имеющий аминокислотные последовательности, которые по меньшей мере приблизительно на 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичны последовательностям CDR, описанным в настоящей заявке, входят в объем настоящего изобретения.
В некоторых вариантах осуществления изобретения, выделенное антитело связывается с С5 человека, где указанное антитело связывается с эпитопом С5 человека. В некоторых вариантах осуществления изобретения, антитело против С5 человека согласно изобретению представляет собой антитело, которое связывается со специфическим эпитопом С5 человека. В некоторых вариантах осуществления изобретения, эпитоп включает по меньшей мере одну аминокислоту в α-цепи C5. В некоторых вариантах осуществления изобретения, эпитоп включает по меньшей мере одну аминокислоту в β-цепи C5.
В некоторых вариантах осуществления изобретения, эпитоп включает по меньшей мере одну аминокислоту в домене MG7 α-цепи C5. В некоторых вариантах осуществления изобретения, эпитоп включает по меньшей мере одну аминокислоту в домене CUB α-цепи C5. В некоторых вариантах осуществления изобретения, эпитоп включает по меньшей мере одну аминокислоту в домене C5d α-цепи C5. В некоторых вариантах осуществления изобретения, эпитоп включает по меньшей мере одну аминокислоту в домене MG8 α-цепи C5. В некоторых вариантах осуществления изобретения, эпитоп включает по меньшей мере одну аминокислоту в домене C345C α-цепи C5.
В некоторых вариантах осуществления изобретения, эпитоп включает по меньшей мере одну аминокислоту в домене MG1 β-цепи C5. В некоторых вариантах осуществления изобретения, эпитоп включает по меньшей мере одну аминокислоту в домене MG2 β-цепи C5. В некоторых вариантах осуществления изобретения, эпитоп включает по меньшей мере одну аминокислоту в домене MG3 β-цепи C5. В некоторых вариантах осуществления изобретения, эпитоп включает по меньшей мере одну аминокислоту в домене MG4 β-цепи C5. В некоторых вариантах осуществления изобретения, эпитоп включает по меньшей мере одну аминокислоту в домене MG5 β-цепи C5. В некоторых вариантах осуществления изобретения, эпитоп включает по меньшей мере одну аминокислоту в домене MG6 β-цепи C5.
В некоторых вариантах осуществления изобретения, антитело или его связывающая часть связываются по меньшей мере с одной аминокислотой в домене MG7 α-цепи C5. В некоторых вариантах осуществления изобретения, антитело или его связывающая часть связываются по меньшей мере с одной аминокислотой в домене CUB α-цепи C5. В некоторых вариантах осуществления изобретения, антитело или его связывающая часть связываются по меньшей мере с одной аминокислотой в домене C5d α-цепи C5. В некоторых вариантах осуществления изобретения, антитело или его связывающая часть связываются по меньшей мере с одной аминокислотой в домене MG8 α-цепи C5. В некоторых вариантах осуществления изобретения, антитело или его связывающая часть связываются по меньшей мере с одной аминокислотой в домене C345C α-цепи C5.
В некоторых вариантах осуществления изобретения, антитело или его связывающая часть связываются по меньшей мере с одной аминокислотой в домене MG1 β-цепи C5. В некоторых вариантах осуществления изобретения, антитело или его связывающая часть связываются по меньшей мере с одной аминокислотой в домене MG2 β-цепи C5. В некоторых вариантах осуществления изобретения, антитело или его связывающая часть связываются по меньшей мере с одной аминокислотой в домене MG3 β-цепи C5. В некоторых вариантах осуществления изобретения, антитело или его связывающая часть связываются по меньшей мере с одной аминокислотой в домене MG4 β-цепи C5. В некоторых вариантах осуществления изобретения, антитело или его связывающая часть связываются по меньшей мере с одной аминокислотой в домене MG5 β-цепи C5. В некоторых вариантах осуществления изобретения, антитело или его связывающая часть связываются по меньшей мере с одной аминокислотой в домене MG6 β-цепи C5.
В одном из вариантов осуществления изобретения, по меньшей мере одна (например, по меньшей мере 1, 2, 3 или 4) аминокислота SEQ ID NO:84 присутствует в эпитопе антитела против С5 человека. В одном из вариантов осуществления изобретения, по меньшей мере одна (например, по меньшей мере 1, 2, 3 или 4) аминокислота SEQ ID NO:85 присутствует в эпитопе антитела против С5 человека. В одном из вариантов осуществления изобретения, по меньшей мере одна (например, по меньшей мере 1, 2, 3 или 4) аминокислота SEQ ID NO:86 присутствует в эпитопе антитела против С5 человека. В одном из вариантов осуществления изобретения, по меньшей мере одна (например, по меньшей мере 1, 2, 3 или 4) аминокислота SEQ ID NO:87 присутствует в эпитопе антитела против С5 человека. В одном из вариантов осуществления изобретения, по меньшей мере одна (например, по меньшей мере 1, 2, 3 или 4) аминокислота SEQ ID NO:88 присутствует в эпитопе антитела против С5 человека. В одном из вариантов осуществления изобретения, по меньшей мере одна (например, по меньшей мере 1, 2, 3 или 4) аминокислота SEQ ID NO:89 присутствует в эпитопе антитела против С5 человека.
В одном из вариантов осуществления изобретения, антитело или его связывающий фрагмент согласно изобретению связываются по меньшей мере с одной (например, по меньшей мере с 1, 2, 3 или 4) из аминокислот SEQ ID NO:84. В одном из вариантов осуществления изобретения, антитело или его связывающий фрагмент согласно изобретению связываются по меньшей мере с одной (например, по меньшей мере с 1, 2, 3 или 4) из аминокислот SEQ ID NO:85. В одном из вариантов осуществления изобретения, антитело или его связывающий фрагмент согласно изобретению связываются по меньшей мере с одной (например, по меньшей мере с 1, 2, 3 или 4) из аминокислот SEQ ID NO:86. В одном из вариантов осуществления изобретения, антитело или его связывающий фрагмент согласно изобретению связываются по меньшей мере с одной (например, по меньшей мере с 1, 2, 3 или 4) из аминокислот SEQ ID NO:87. В одном из вариантов осуществления изобретения, антитело или его связывающий фрагмент согласно изобретению связываются по меньшей мере с одной (например, по меньшей мере с 1, 2, 3 или 4) из аминокислот SEQ ID NO:88 В одном из вариантов осуществления изобретения, антитело или его связывающий фрагмент согласно изобретению связываются по меньшей мере с одной (например, по меньшей мере с 1, 2, 3 или 4) из аминокислот SEQ ID NO:89.
Скрининг -анализы
Настоящее изобретение было применено в различных скрининг-анализах, включая определение того факта, может ли анти-C5 антитело-кандидат ингибировать активность комплемента.
В некоторых вариантах осуществления изобретения, уровень активности комплемента в присутствии анти-C5 антитела-кандидата сравнивают с активностью комплемента, детектируемой в позитивном контроле для сравнения. Позитивный контроль для сравнения включает активацию комплемента в отсутствии добавленного тестируемого соединения. В некоторых вариантах осуществления изобретения, анти-C5 антитело-кандидат идентифицируют как ингибитор комплемента, если активность комплемента в присутствии анти-C5 антитела-кандидата составляет менее, чем приблизительно 70% от активности комплемента, детектируемой в позитивном контроле для сравнения; и это соответствует более, чем приблизительно 30% ингибированию активности комплемента в присутствии тестируемого соединения. В других вариантах осуществления изобретения, анти-C5 антитело-кандидат идентифицируют как ингибитор комплемента, если активность комплемента в присутствии анти-C5 антитела-кандидата составляет менее, чем приблизительно 80% от активности комплемента, детектируемой в позитивном контроле для сравнения; и это соответствует более, чем приблизительно 20% ингибированию активности комплемента в присутствии тестируемого соединения. В других вариантах осуществления изобретения, анти-C5 антитело-кандидат идентифицируют как ингибитор комплемента, если активность комплемента в присутствии анти-C5 антитела-кандидата составляет менее, чем приблизительно 90% от активности комплемента, детектируемой в позитивном контроле для сравнения; и это соответствует более, чем приблизительно 10% ингибированию активности комплемента в присутствии тестируемого соединения. В некоторых вариантах осуществления изобретения, уровень ингибирования комплемента анти-C5 антителом-кандидатом сравнивают с уровнем ингибирования, детектируемым в негативном контроле для сравнения.
Подходящими способами согласно изобретению являются иммуноанализы в различных форматах, включая иммуноанализы на конкурентное и неконкурентное связывание, анализы на захват антигена, «сэндвич»-анализы с двумя антителами и «сэндвич»-анализы с тремя антителами (Self et al., 1996, Curr. Opin. Biotechnol. 7:60-65). Настоящее изобретение не должно ограничиваться известными или неизвестными анализами любого типа, при условии, что такой анализ будет подходящим для детектирования ингибирования комплемента.
В способах согласно изобретению используются твердофазные иммуноферментные анализы (ELISA). Фермент, такой как, но не ограничивающийся ими, пероксидаза хрена (ПХ), щелочная фосфатаза, бета-галактозидаза или уреаза, может быть присоединен, например, к анти-C3 антителу или ко «второму» антителу для применения в способе согласно изобретению. Система детектирования с использованием пероксидазы хрена может быть использована, например, вместе с хромогенным субстратом тетраметилбензидином (TMB), в результате чего может быть получен растворимый продукт в присутствии пероксида водорода, который детектируется на 450 нм. Другими подходящими системами на основе ферментов являются, например, система детектирования на основе щелочной фосфатазы, которая может быть использована вместе с хромогенным субстратом п-нитрофенилфосфатом, в результате чего может быть получен растворимый продукт, легко детектируемый на 405 нм. Аналогичным образом, может быть использована система детектирования на основе бета-галактозидазы вместе с хромогенным субстратом o-нитрофенил-бета-D-галактопиранозидом (ONPG), в результате чего может быть получен растворимый продукт, детектируемый на 410 нм. Альтернативно, система детектирования на основе уреазы может быть использован вместе с субстратом, таким как мочевина-бромкрезоловый пурпурный (Sigma Immunochemicals, St. Louis, MO). Используемые в настоящем документе «первые» и «вторые» антитела, связанные с ферментом, могут быть получены из любых различных коммерчески доступных источников.
Для детектирования ингибирования AP также применяется хемилюминесцентное детектирование. Хемилюминесцентные «вторые» антитела могут быть получены из любых различных коммерчески доступных источников.
Для детектирования ингибирования AP также применяется флуоресцентное детектирование. Подходящими флуорохромами являются, но не ограничиваются ими, DAPI, флуоресцеин, Hoechst 33258, R-фикоцианин, B-фикоэритрин, R-фикоэритрин, родамин, техасский красный и антитела, меченные лиссамином, флуоресцеином или родамином.
В способах согласно изобретению также применяются радиоиммуноанализы (РИА). Такие анализы хорошо известны специалистам и описаны, например, Brophy et al. (1990, Biochem. Biophys. Res. Comm. 167:898-903) и Guechot et al. (1996, Clin. Chem. 42:558-563). Радиоиммуноанализы осуществляют, например, с использованием «первого» или «второго» антитела, меченного иодом-125 (Harlow et al., supra, 1999).
Сигнал, подаваемый детектируемым антителом, анализируют, например, на спектрофотометре для детектирования цвета, который дает хромогенный субстрат; на счетчике радиации для детектирования излучения, таком как гамма-счетчик для детектирования иода-125; или на флуориметре для детектирования флуоресценции в присутствии света на определенной длине волны. В случае иммуноферментного анализа, количественный анализ проводят на спектрофотометре. Следует отметить, что анализы согласно изобретению могут быть осуществлены вручную или, при необходимости, они могут быть осуществлены автоматически, а передача сигнала множеством образцов может быть детектирована одновременно во многих коммерчески доступных системах.
Способы согласно изобретению также включают применение иммуноанализов на основе капиллярного электрофореза (CEIA), который может быть проведен автоматически, если это необходимо. Иммуноанализы могут быть также проведены в комбинации с флуоресцентным анализом с лазерной индукцией, как описано, например, Schmalzing et al. (1997, Electrophoresis 18:2184-2193) and Bao (1997, J. Chromatogr. B. Biomed. Sci. 699:463-480). Иммуноанализы на основе липосом, такие как иммуноанализы, проводимые путем введения липосом в проточном режиме, и иммуносенсорные анализы на основе липосом могут быть также проведены в соответствии со способами согласно изобретению (Rongen et al., 1997, J. Immunol. Methods 204:105-133).
Для определения уровня ингибирования комплемента в способах согласно изобретению может быть также применен количественный Вестерн-блот-анализ. Вестерн-блоты количественно оценивают хорошо известными методами, такими как сканирующая денситометрия (Parra et al., 1998, J. Vasc. Surg. 28:669-675).
Способы введения
Способы согласно изобретению включают введение терапевтически эффективного количества по меньшей мере одного анти-C5 антитела или его связывающего фрагмента (таких как любые антитела или их фрагменты, описанные в настоящей заявке) индивидууму, идентифицированному как индивидуум, страдающий заболеванием или расстройством, опосредуемым комплементом. В одном из вариантов осуществления изобретения, индивидуумом является млекопитающее, имеющее систему комплемента. В одном из вариантов осуществления изобретения, индивидуумом является человек. В различных вариантах осуществления изобретения, по меньшей мере одно анти-C5 антитело или его связывающий фрагмент вводят местно, регионарно или системно.
В различных вариантах осуществления изобретения, заболевание или расстройство представляет собой заболевание или расстройство, по меньшей мере выбранное из группы, состоящей из: дегенерации желтого пятна (MD), возрастной дегенерации желтого пятна (AMD), ишемического реперфузионного повреждения, артирта, ревматоидного артрита, астмы, аллергической астмы, волчанки, язвенного колита, инсульта, постхирургического системного воспалительного синдрома, астмы, аллергической астмы, хронической обструктивной болезни легких (ХОБЛ), синдрома пароксизмальной ночной гемоглобинурии (PNH), тяжелой миастении, нейромиелита зрительного нерва (NMO), рассеянного склероза, замедления функции трансплантата, отторжения, опосредуемого антителом, атипического гемолитического уремического синдрома (aHUS), окклюзии центральной вены сетчатки (CRVO), окклюзии центральной артерии сетчатки (CRAO), буллезного эпидермолиза, сепсиса, трансплантации органов, воспаления (включая, но не ограничиваясь ими, воспаление, ассоциированное с операцией по сердечно-легочному шунтированию и почечным диализом), С3-гломерулопатии, мембранозной нефропатии, IgA-нефропатии, гломерулонефрита (включая, но не ограничиваясь ими, гломерулонефрит, опосредуемый цитоплазматическим антителом против нейтрофилов (ANCA), волчаночный нефрит и их комбинации), ANCA-опосредованного васкулита, HUS, индуцированного Шига-токсином, и потери плода, индуцированной антифосфолипидным антителом или любых их комбинаций. В некоторых вариантах осуществления изобретения, AP-опосредованным заболеванием является C3-гломерулопатия. В некоторых вариантах осуществления изобретения, AP-опосредованным заболеванием является дегенерация желтого пятна, такая как возрастная дегенерация желтого пятна. В одном из вариантов осуществления изобретения, введение анти-C5 антитела ингибирует продуцирование белка C5a или C5b. В некоторых вариантах осуществления изобретения, композиции и способы согласно изобретению могут быть применены для лечения индивидуума, включая индивидуумов, страдающих PNH, которые являются невосприимчивыми к лечению экулизумабом. В неограничивающем примере, некоторые индивидуумы могут иметь мутацию в альфа-цепи C5, которая может сообщать резистентность к лечению экулизумабом (см., Genetic variants in C5 and poor response to eculizumab. Nishimura J, et al., N Engl J Med. 2014 Feb 13;370(7):632-9).
Способы согласно изобретению могут включать введение по меньшей мере одного анти-C5 антитела или его связывающего фрагмента, однако, настоящее изобретение никоим образом не должно ограничиваться описанными в настоящем документе анти-C5 антителами и может включать любое анти-C5 антитело, как известное, так и неизвестное, которое ослабляет и снижает активацию комплемента.
Способ согласно изобретению включает введение терапевтически эффективного количества по меньшей мере одного анти-C5 антитела или его связывающего фрагмента индивидууму, где композиция согласно изобретению включает по меньшей мере одно анти-C5 антитело или его связывающий фрагмент, отдельно или в комбинации по меньшей мере с одним другим терапевтическим средством. Настоящее изобретение может быть использовано в комбинации с другими способами лечения, такими как, например, противовоспалительная терапия и т.п. Примерами противовоспалительной терапии, которая может быть использована в комбинации со способами согласно изобретению, являются, например, терапия с использованием стероидных лекарственных средств, а также терапия с использованием нестероидных лекарственных средств.
Способ согласно изобретению включает введение индивидууму терапевтически эффективного количества анти-C5 антитела или его антигенсвязывающего фрагмента. В некоторых своих вариантах, настоящее изобретение включает способ лечения С5-ассоциированных заболеваний посредством подавления регуляции сигнала комплемента путем введения терапевтически эффективного количества антитела согласно изобретению или терапевтически эффективного количества его антигенсвязывающего фрагмента так, чтобы у индивидуума наблюдалось снижение образования C5a или C5b или MAC. В некоторых вариантах осуществления изобретения, настоящее изобретение включает способ лечения С5-ассоциированных заболеваний посредством подавления регуляции сигнала комплемента путем введения терапевтически эффективного количества антитела или фрагмента антитела. В некоторых вариантах осуществления изобретения, настоящее изобретение включает способ лечения С5-ассоциированных заболеваний посредством подавления регуляции сигнала комплемента путем введения индивидууму эффективного количества антитела, фрагмента антитела, полипептида, пептида и конъюгированного пептида так, чтобы у индивидуума наблюдалось снижение активности пути активации комплемента. В некоторых вариантах осуществления изобретения, способ лечения включает системное введение индивидууму эффективной дозы антитела или фрагмента антитела так, чтобы у индивидуума наблюдалось системное снижение образования C5a или C5b или MAC.
Фармацевтические композиции, подходящие для осуществления изобретения, могут быть введены для доставки дозы, составляющей по меньшей мере приблизительно 1 нг/кг, по меньшей мере приблизительно 5 нг/кг, по меньшей мере приблизительно 10 нг/кг, по меньшей мере приблизительно 25 нг/кг, по меньшей мере приблизительно 50 нг/кг, по меньшей мере приблизительно 100 нг/кг, по меньшей мере приблизительно 500 нг/кг, по меньшей мере приблизительно 1 мкг/кг, по меньшей мере приблизительно 5 мкг/кг, по меньшей мере приблизительно 10 мкг/кг, по меньшей мере приблизительно 25 мкг/кг, по меньшей мере приблизительно 50 мкг/кг, по меньшей мере приблизительно 100 мкг/кг, по меньшей мере приблизительно 500 мкг/кг, по меньшей мере приблизительно 1 мг/кг, по меньшей мере приблизительно 5 мг/кг, по меньшей мере приблизительно 10 мг/кг, по меньшей мере приблизительно 25 мг/кг, по меньшей мере приблизительно 50 мг/кг, по меньшей мере приблизительно 100 мг/кг, по меньшей мере приблизительно 200 мг/кг, по меньшей мере приблизительно 300 мг/кг, по меньшей мере приблизительно 400 мг/кг, и по меньшей мере приблизительно 500 мг/кг массы тела индивидуума. В одном из вариантов осуществления изобретения, в соответствии с настоящим изобретением, индивидууму вводят дозу так, чтобы концентрация анти-C5 антитела согласно изобретению составляла по меньшей мере приблизительно 1 пМ, по меньшей мере приблизительно 10 пМ, по меньшей мере приблизительно 100 пМ, по меньшей мере приблизительно 1 нМ, по меньшей мере приблизительно 10 нМ, по меньшей мере приблизительно 100 нМ, по меньшей мере приблизительно 1 мкM, по меньшей мере приблизительно 2 мкM, по меньшей мере приблизительно 3 мкM, по меньшей мере приблизительно 4 мкM, по меньшей мере приблизительно 5 мкM, по меньшей мере приблизительно 6 мкM, по меньшей мере приблизительно 7 мкM, по меньшей мере приблизительно 8 мкM, по меньшей мере приблизительно 9 мкM и по меньшей мере приблизительно 10 мкM. В другом варианте осуществления изобретения, в настоящем изобретении рассматривается введение дозы индивидууму так, чтобы концентрация анти-C5 антитела согласно изобретению в плазме составляла в пределах по меньшей мере приблизительно 1 пМ, по меньшей мере приблизительно 10 пМ, по меньшей мере приблизительно 100 пМ, по меньшей мере приблизительно 1 нМ, по меньшей мере приблизительно 10 нМ, по меньшей мере приблизительно 100 нМ, по меньшей мере приблизительно 1 мкM, по меньшей мере приблизительно 2 мкM, по меньшей мере приблизительно 3 мкM, по меньшей мере приблизительно 4 мкM, по меньшей мере приблизительно 5 мкM, по меньшей мере приблизительно 6 мкM, по меньшей мере приблизительно 7 мкM, по меньшей мере приблизительно 8 мкM, по меньшей мере приблизительно 9 мкM и по меньшей мере приблизительно 10 мкM.
В некоторых вариантах осуществления изобретения, фармацевтическая композиция, используемая для осуществления настоящего изобретения, может быть введена для доставки дозы, составляющей не более, чем приблизительно 1 нг/кг, не более, чем приблизительно 5 нг/кг, не более, чем приблизительно 10 нг/кг, не более, чем приблизительно 25 нг/кг, не более, чем приблизительно 50 нг/кг, не более, чем приблизительно 100 нг/кг, не более, чем приблизительно 500 нг/кг, не более, чем приблизительно 1 мкг/кг, не более, чем приблизительно 5 мкг/кг, не более, чем приблизительно 10 мкг/кг, не более, чем приблизительно 25 мкг/кг, не более, чем приблизительно 50 мкг/кг, не более, чем приблизительно 100 мкг/кг, не более, чем приблизительно 500 мкг/кг, не более, чем приблизительно 1 мг/кг, не более, чем приблизительно 5 мг/кг, не более, чем приблизительно 10 мг/кг, не более, чем приблизительно 25 мг/кг, не более, чем приблизительно 50 мг/кг, не более, чем приблизительно 100 мг/кг, не более, чем приблизительно 200 мг/кг, не более, чем приблизительно 300 мг/кг, не более, чем приблизительно 400 мг/кг, и не более, чем приблизительно 500 мг/кг массы тела индивидуума. В одном из вариантов осуществления изобретения, в соответствии с настоящим изобретением, индивидууму вводят дозу так, чтобы концентрация анти-C5 антитела согласно изобретению у индивидуума составляла не более, чем приблизительно 1 пМ, не более, чем приблизительно 10 пМ, не более, чем приблизительно 100 пМ, не более, чем приблизительно 1 нМ, не более, чем приблизительно 10 нМ, не более, чем приблизительно 100 nM, не более, чем приблизительно 1 мкM, не более, чем приблизительно 2 мкM, не более, чем приблизительно 3 мкM, не более, чем приблизительно 4 мкM, не более, чем приблизительно 5 мкM, не более, чем приблизительно 6 мкM, не более, чем приблизительно 7 мкM, не более, чем приблизительно 8 мкM, не более, чем приблизительно 9 мкM и не более, чем приблизительно 10 мкM. В другом варианте осуществления изобретения, в настоящем изобретении рассматривается введение дозы индивидууму так, чтобы концентрация анти-C5 антитела согласно изобретению в плазме индивидуума составляла в пределах не более, чем приблизительно 1 пМ, не более, чем приблизительно 10 пМ, не более, чем приблизительно 100 пМ, не более, чем приблизительно 1 нМ, не более, чем приблизительно 10 нМ, не более, чем приблизительно 100 нМ, не более, чем приблизительно 1 мкM, не более, чем приблизительно 2 мкM, не более, чем приблизительно 3 мкM, не более, чем приблизительно 4 мкM, не более, чем приблизительно 5 мкM, не более, чем приблизительно 6 мкM, не более, чем приблизительно 7 мкM, не более, чем приблизительно 8 мкM, не более, чем приблизительно 9 мкM и не более, чем приблизительно 10 мкM. Также рассматриваются интервалы доз между любыми указанными в настоящем документе дозами.
Обычно, дозы, которые могут быть введены способом согласно изобретению индивидууму, а в некоторых вариантах, человеку, составляют в пределах от 0,5 мкг до приблизительно 50 мг на килограмм массы тела индивидуума. Точно вводимая доза варьируется в зависимости от любого ряда факторов, включая, но не ограничиваясь ими, тип индивидуума и тип патологического состояния, подвергаемого лечению, возраст индивидуума и способ введения. В некоторых вариантах осуществления изобретения, доза соединения варьируется приблизительно от 1 мкг до приблизительно 10 мг на килограмм массы тела индивидуума. В других вариантах осуществления изобретения, доза варьируется приблизительно от 3 мкг до приблизительно 1 мг на килограмм массы тела индивидуума.
Антитело может быть введено с частотой несколько раз в день, либо оно может быть введено менее часто, например, один раз в день, два раза в день, три раза в день, один раз в две недели, два раза в две недели, три раза в две недели, один раз в месяц, два раза в месяц, три раза в месяц или даже еще реже, например, один раз в несколько месяцев или даже один или несколько раз в год или реже. Частота введения дозы может быть определена самим специалистом и зависит от любого ряда факторов, таких как, но не ограничивающихся ими, тип и тяжесть заболевания, подвергаемого лечению, тип и возраст индивидуума и т.п. Состав фармацевтических композиций может быть приготовлен любым методом, известным специалистам в области фармакологии, или методом, который будет разработан в будущем. В общих чертах, такие способы приготовления включают стадию приведения в контакт активного ингредиента с носителем или с одним или более другими вспомогательными ингредиентами, а затем, если это необходимо или желательно, придания формы продукту или его упаковки в виде нужной одноразовой или дробной унифицированной дозы.
Хотя приведенное в настоящем документе описание фармацевтических композиций относится, главным образом, к фармацевтическим композициям, которые являются подходящими для введения патентованного лекарственного средства человеку, однако, следует отметить, что такие композиции могут быть введены индивидуумам всех видов. Модификация фармацевтических композиций, подходящих для введения человеку так, чтобы эти композиции могли быть введены другим индивидуумам, хорошо известна специалистам, и фармаколог-ветеринар общей практики может самостоятельно разработать и осуществить такую модификацию путем простого экспериментирования, если это необходимо. Индивидуумами, которым вводят фармацевтические композиции согласно изобретению, являются, но не ограничиваются ими, человек и другие приматы, млекопитающие, включая млекопитающих, представляющих коммерческий интерес, таких как приматы, не являющиеся человеком, крупный рогатый скот, свиньи, лошади, овцы, кошки и собаки.
Фармацевтические композиции, которые могут быть использованы в способах согласно изобретению, могут быть приготовлены, упакованы или проданы в виде препаратов, подходящих для офтальмического, перорального, ректального, вагинального, парентерального, местного, внутрилегочного, интраназального, трансбуккального, внутриглазного, интравитреального, внутримышечного, интрадермального и внутривенного введения. Другие рассматриваемые препараты включает исследуемые наночастицы, липосомные препараты, повторно запаянные в пробирку эритроциты, содержащие активный ингредиент, и иммунологические препараты.
Фармацевтическая композиция согласно изобретению может быть получена, упакована или приготовлена для продажи оптом в виде разовой унифицированной дозы или в виде множества разовых унифицированных доз. Унифицированная доза представляет собой дискретное количество фармацевтической композиции, содержащей предварительно определенное количество активного ингредиента. Количество активного ингредиента обычно равно дозе активного ингредиента, которая должна быть введена индивидууму, или соответствующей части такой дозы, например, половине или одной трети такой дозы.
Относительные количества активного ингредиента, фармацевтически приемлемого носителя и любых дополнительных ингредиентов в фармацевтической композиции согласно изобретению могут варьироваться в зависимости от особенностей, массы и состояния индивидуума, подвергаемого лечению, а также от способа введения композиции. Так, например, композиция может содержать от 0,1% до 100% (масс./масс.) активного ингредиента. В различных вариантах осуществления изобретения, композиция содержит по меньшей мере приблизительно 1%, по меньшей мере приблизительно 2%, по меньшей мере приблизительно 3%, по меньшей мере приблизительно 4%, по меньшей мере приблизительно 5%, по меньшей мере приблизительно 6%, по меньшей мере приблизительно 7%, по меньшей мере приблизительно 8%, по меньшей мере приблизительно 9%, по меньшей мере приблизительно 10%, по меньшей мере приблизительно 11%, по меньшей мере приблизительно 12%, по меньшей мере приблизительно 13%, по меньшей мере приблизительно 14%, по меньшей мере приблизительно 15%, по меньшей мере приблизительно 16%, по меньшей мере приблизительно 17%, по меньшей мере приблизительно 18%, по меньшей мере приблизительно 19%, по меньшей мере приблизительно 20%, по меньшей мере приблизительно 21%, по меньшей мере приблизительно 22%, по меньшей мере приблизительно 23%, по меньшей мере приблизительно 24%, по меньшей мере приблизительно 25%, по меньшей мере приблизительно 26%, по меньшей мере приблизительно 27%, по меньшей мере приблизительно 28%, по меньшей мере приблизительно 29%, по меньшей мере приблизительно 30%, по меньшей мере приблизительно 31%, по меньшей мере приблизительно 32%, по меньшей мере приблизительно 33%, по меньшей мере приблизительно 34%, по меньшей мере приблизительно 35%, по меньшей мере приблизительно 36%, по меньшей мере приблизительно 37%, по меньшей мере приблизительно 38%, по меньшей мере приблизительно 39%, по меньшей мере приблизительно 40%, по меньшей мере приблизительно 41%, по меньшей мере приблизительно 42%, по меньшей мере приблизительно 43%, по меньшей мере приблизительно 44%, по меньшей мере приблизительно 45%, по меньшей мере приблизительно 46%, по меньшей мере приблизительно 47%, по меньшей мере приблизительно 48%, по меньшей мере приблизительно 49%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 51%, по меньшей мере приблизительно 52%, по меньшей мере приблизительно 53%, по меньшей мере приблизительно 54%, по меньшей мере приблизительно 55%, по меньшей мере приблизительно 56%, по меньшей мере приблизительно 57%, по меньшей мере приблизительно 58%, по меньшей мере приблизительно 59%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 61%, по меньшей мере приблизительно 62%, по меньшей мере приблизительно 63%, по меньшей мере приблизительно 64%, по меньшей мере приблизительно 65%, по меньшей мере приблизительно 66%, по меньшей мере приблизительно 67%, по меньшей мере приблизительно 68%, по меньшей мере приблизительно 69%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 71%, по меньшей мере приблизительно 72%, по меньшей мере приблизительно 73%, по меньшей мере приблизительно 74%, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 76%, по меньшей мере приблизительно 77%, по меньшей мере приблизительно 78%, по меньшей мере приблизительно 79%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 81%, по меньшей мере приблизительно 82%, по меньшей мере приблизительно 83%, по меньшей мере приблизительно 84%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 86%, по меньшей мере приблизительно 87%, по меньшей мере приблизительно 88%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98%, по меньшей мере приблизительно 99%, или по меньшей мере приблизительно 100% (масс./масс.) активного ингредиента.
Фармацевтическая композиция согласно изобретению, помимо активного ингредиента, может также содержать один или более дополнительных фармацевтически активных агентов.
Препараты фармацевтической композиции согласно изобретению с регулируемым или пролонгированным высвобождением могут быть получены с применением стандартной технологии.
Парентеральное введение фармацевтической композиции включает любой способ введения, характеризующийся физическим разрушением ткани индивидуума, и введения фармацевтической композиции посредством разрушения ткани. Парентеральное введение может быть местным, регионарным или системным. Таким образом, парентеральное введение включает, но не ограничиваются ими, введение фармацевтической композиции путем инъекции композиции, путем введения композиции через хирургический разрез, путем введения композиции через нехирургическую рану для доставки лекарственного препарата в ткань и т.п. В частности, рассматривается парентеральное введение, которое включает, но не ограничиваются ими, внутривенную, внутриглазную, интревитреальную, подкожную, внутрибрюшинную, внутримышечную, интрадермальную, интрастернальную инъекцию и введение вовнутрь опухоли.
Состав фармацевтической композиции, подходящей для парентерального введения, включает активный ингредиент в комбинации с фармацевтически приемлемым носителем, таким как стерильная вода или стерильный изотонический физиологический раствор. Такие препараты могут быть приготовлены, упакованы или проданы в форме, подходящей для введения ударной дозы или для непрерывного введения. Инъецируемые препараты могут быть приготовлены, упакованы или проданы в виде унифицированной лекарственной формы, например в ампулах или в контейнерах для многоразового введения, содержащих консервант. Препараты для парентерального введения включают, но не ограничиваются ими, суспензии, растворы, эмульсии в масляных или водных носителях, пасты и имплантируемые препараты пролонгированного высвобождения или биоразлагаемые препараты. Такие препараты могут также содержать один или более дополнительных ингредиентов, включая, но не ограничиваясь ими, суспендирующие, стабилизирующие или диспергирующие агенты. В одном из вариантов препарата для парентерального введения, активный ингредиент содержится в сухой форме (то есть, в виде порошка или гранул) для разведения подходящим носителем (например, стерильной апирогенной водой) перед парентеральным введением разведенной композиции.
Фармацевтические композиции могут быть приготовлены, упакованы или проданы в виде стерильной водной или масляной суспензии или раствора для инъекций. Эта суспензия или раствор могут быть приготовлены известными методами и могут включать, помимо активного ингредиента, дополнительные ингредиенты, такие как диспергирующие агенты, смачивающие агенты или суспендирующие агенты. Такие стерильные препараты для инъекций могут быть получены с использованием нетоксичного парентерально приемлемого разбавителя или растворителя, такого как, например, вода или 1,3-бутандиол. Другими приемлемыми разбавителями и растворителями являются, но не ограничиваются ими, раствор Рингера, изотонический раствор хлорида натрия и жирные масла, такие как синтетические моно- или диглицериды. Другими парентерально вводимыми препаратами, которые могут быть использованы, являются препараты, содержащие активный ингредиент в микрокристаллической форме, в форме липосомного препарата или в качестве компонента биоразлагаемых полимерных систем. Композиции для пролонгированного высвобождения или имплантации могут содержать фармацевтически приемлемые полимерные или гидрофобные вещества, такие как эмульсия, ионообменная смола, слаборастворимый полимер или слаборастворимая соль.
Фармацевтическая композиция согласно изобретению может быть приготовлена, упакована или продана в виде препарата, подходящего для введения в легкие через ротовую полость. Такой препарат может включать сухие частицы, которые содержат активный ингредиент, и которые имеют диаметр в пределах приблизительно от 0,5 до приблизительно 7 нанометров, а в некоторых вариантах осуществления изобретения, приблизительно от 1 до приблизительно 6 нанометров. Такие композиции обычно приготавливают в форме сухих порошков для введения с использованием устройства, содержащего резервуар для сухих порошков, в который может быть направлен поток пропеллента для диспергирования порошка, или с использованием контейнера для диспергирования самораспыляющегося растворителя/порошка, такого как устройство, содержащее активный ингредиент, растворенный или суспендированный в пропелленте с низкой температурой кипения в герметично закрытом контейнере. В некоторых вариантах осуществления изобретения, такие порошки содержат частицы, где по меньшей мере 98% частиц по массе имеют диаметр более, чем 0,5 нанометра, и по меньшей мере 95% от всего количества частиц имеют диаметр менее, чем 7 нанометров. В некоторых вариантах осуществления изобретения, по меньшей мере 95% частиц по массе имеют диаметр более, чем 1 нанометр, и по меньшей мере 90% от всего количества частиц имеют диаметр менее, чем 6 нанометров. В некоторых вариантах осуществления изобретения, сухие порошковые композиции включают твердый тонкодисперсный порошоковый разбавитель, такой как сахар, и их обычно приготавливают в виде унифицированной лекарственной формы.
Пропелленты с низкой температурой кипения обычно включают жидкие пропелленты, имеющие точку кипения ниже 65°F при атмосферном давлении. Как правило, пропеллент может составлять от 50 до 99,9% (масс./масс.) композиции, а активный ингредиент может составлять от 0,1 до 20% (масс./масс.) композиции. Пропеллент может также включать дополнительные ингредиенты, такие как жидкое неионное или твердое анионное поверхностно-активное вещество или твердый разбавитель (в некоторых вариантах осуществления изобретения, имеющий частицы такого же размера, как и частицы, содержащие активный ингредиент).
Фармацевтические композиции согласно изобретению, приготовленные для доставки в легкие, могут также содержать активный ингредиент в форме капелек раствора или суспензии. Такие композиции могут быть приготовлены, упакованы или проданы в виде водных или разведенных спиртовых растворов или суспензий, необязательно стерильных и содержащих активный ингредиент, и такие препараты обычно вводят с помощью любого устройства для распыления или тонкодисперсного распыления. Такие препараты могут также содержать один или более дополнительных ингредиентов, включая, но не ограничиваясь ими, ароматизатор, такой как натрий-содержащий сахарин, летучее масло, буферный агент, поверхностно-активное вещество или консервант, такой как метилгидроксибензоат. В некоторых вариантах осуществления изобретения, капельки, доставляемые таким способом введения, имеют средний диаметр в пределах приблизительно от 0,1 до приблизительно 200 нанометров.
Препараты могут быть также использованы для интраназальной доставки фармацевтической композиции согласно изобретению.
Другим препаратом, подходящим для интраназального введения, является крупнозернистый порошок, содержащий активный ингредиент и имеющий средний размер частиц приблизительно от 0,2 до 500 микрометров. Такой препарат вводят так, чтобы лекарственный порошок для вдыхания через нос доставлялся посредством быстрой ингаляции через носовой проход из контейнера с порошком, подносимым близко к ноздрям.
Препараты, подходящие для интраназального введения, могут, например, содержать приблизительно по меньшей мере 0,1% (масс./масс.) и максимум 100% (масс./масс.) активного ингредиента, и могут также содержать один или более дополнительных ингредиентов.
Фармацевтическая композиция согласно изобретению может быть приготовлена, упакована или продана в виде препарата, подходящего для трансбуккального введения. Такие препараты могут, например, быть приготовлены в форме таблеток или пастилок, изготовленных обычными методами, и могут, например, содержать от 0,1 до 20% (масс./масс.) активного ингредиента, а остальная часть композиции содержит растворимые или разлагаемые ингредиенты для перорального введения и, необязательно, один или более дополнительных ингредиентов. Альтернативно, препараты, подходящие для трансбуккального введения, могут содержать порошок или аэрозольный или тонкодисперный раствор или суспензию, содержащие активный ингредиент. В некоторых вариантах осуществления изобретения, такие порошковые, аэрозольные или тонкодисперные препараты, при распылении, имеют средний размер частиц или капелек в пределах приблизительно от 0,1 до приблизительно 200 нанометров, и могут также содержать один или более дополнительных ингредиентов.
Используемые в настоящем документе «дополнительные ингредиенты» включают, но не ограничиваются ими, один или более из следующих ингредиентов: наполнители; поверхностно-активные вещества; диспергирующие агенты; инертные разбавители; гранулирующие и дезинтегрирующие агенты; связывающие агенты; замасливатели; подсластители; ароматизаторы; красители; консерванты; физиологически разлагаемые композиции, такие как желатин; водные носители и растворители; масляные носители и растворители; суспендирующие агенты; диспергирующие или смачивающие агенты; эмульгаторы, мягчители; буферы; соли; загустители; наполнители; эмульгирующие агенты; антиоксиданты; антибиотики; противогрибковые средства; стабилизирующие агенты и фармацевтически приемлемые полимерные или гидрофобные вещества. Другие «дополнительные ингредиенты», которые могут быть включены в фармацевтические композиции согласно изобретению, известны специалистам в данной области и описаны, например, в руководстве Remington's Pharmaceutical Sciences (1985, Genaro, ed., Mack Publishing Co., Easton, PA), которое вводится в настоящее изобретение посредством ссылки.
Клетки, продуцирующие антитела и их антигенсвязывающие фрагменты
В некоторых своих вариантах, настоящее изобретение включает клетку или клеточную линию (например, клетки-хозяева), которые продуцируют по меньшей мере одно из описанных в настоящем документе анти-С5-антител или их антигенсвязывающих фрагментов. В одном варианте осуществления изобретения, клетка или клеточная линия представляет собой генетически модифицированную клетку, которая продуцирует по меньшей мере одно из описанных в настоящем документе анти-С5-антител или их антигенсвязывающих фрагментов. В одном варианте осуществления изобретения, клетка или клеточная линия представляет собой гибридому, которая продуцирует по меньшей мере одно из описанных в настоящем документе анти-С5-антител или их антигенсвязывающих фрагментов.
Гибридные клетки (гибридомы) обычно получают из массы слитых мышиных спленоцитов, которые в высокой степени обогащены В-лимфоцитами, и миеломных «клеток-партнеров по слиянию» (Alberts et al., Molecular Biology of the Cell (Garland Publishing, Inc. 1994); Harlow et al., Antibodies. A Laboratory Manual (Cold Spring Harbor Laboratory, Cold Spring Harbor, 1988). Затем слитые клетки распределяют в пулы, которые могут быть проанализированы на продуцирование антител с нужной специфичностью. Пулы, которые давали позитивный результат в тесте, могут затем дополнительно подразделяться до тех пор, пока не будут идентифицированы моноклеточные клоны, продуцирующие антитела с нужной специфичностью. Антитела, продуцируемые такими клонами, называются моноклональными антителами.
Настоящее изобретение также относится к нуклеиновым кислотам, кодирующим любые описанные в настоящем документе антитела или фрагменты антител, а также к векторам, содержащим нуклеиновые кислоты. Таким образом, антитела и фрагменты согласно изобретению могут быть получены посредством экспрессии нуклеиновой кислоты в клетке или в клеточной линии, такой как клеточные линии, обычно используемые для экспрессии рекомбинантных или гуманизированных иммуноглобулинов. Таким образом, антитела и их фрагменты согласно изобретению могут быть также получены путем клонирования нуклеиновых кислот в одном или более экспрессионных векторах и переноса этого вектора в клеточную линию, такую как клеточые линии, обычно используемые для экспрессии рекомбинантных или гуманизированных иммуноглобулинов.
Гены, кодирующие тяжелые и легкие цепи иммуноглобулинов или их фрагментов, могут быть сконструированы способами, включая, но не ограничиваясь ими, полимеразную цепную реакцию (ПЦР), известную специалистам (см., например, Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor, N.Y., 1989; Berger & Kimmel, Methods in Enzymology, Vol. 152: Guide to Molecular Cloning Techniques, Academic Press, Inc., San Diego, Calif., 1987; Co et al., 1992, J. Immunol. 148:1149). Так, например, гены, кодирующие тяжелые и легкие цепи, или их фрагменты, могут быть клонированы из геномной ДНК клетки, секретирующей антитело, либо кДНК получают посредством обратной транскрипции РНК клетки. Клонирование осуществлют стандартными методами, включающими использование ПЦР-праймеров, которые гибридизуются с последовательностями, фланкирующими или перекрывающими гены или сегменты клонируемых генов.
Нуклеиновые кислоты, кодирующие антитело согласно изобретению или его тяжелую цепь или легкую цепь или фрагменты, могут быть получены и использованы в соответствии с методами рекомбинантных нуклеиновых кислот для продуцирования специфического иммуноглобулина, цепи иммуноглобулина или его фрагмента или варианта в различных клетках-хозяевах или в системе трансляции in vitro. Так, например, антитело-кодирующие нуклеиновые кислоты или их фрагменты могут быть помещены в подходящие прокариотические или эукариотические векторы, например, экспрессионные векторы, и введены в подходящую клетку-хозяина соответствующим методом, например, путем трансформации, трансфекции, электропорации и инфицирования так, чтобы нуклеиновая кислота была функционально присоединена к одному или более элементам регуляции экспрессии, например, в векторе, или была интегрирована в геном клетки-хозяина.
В некоторых вариантах осуществления настоящего изобретения, тяжелые и легкие цепи или их фрагменты могут быть собраны в двух различных экспрессионных векторах, которые могут быть использованы для совместного переноса в клетку-реципиента. В некоторых вариантах осуществления изобретения, каждый вектор может содержать два или более селективных генов, один для отбора в бактериальной системе и один для отбора в эукариотической системе. Эти векторы позволяют продуцировать и амплифицировать гены в бактериальной системе с последующей котрансфекцией в эукариотические клетки и отбором котрансфицированных клеток. Процедура отбора может быть применена для отбора на экспрессию антитело-кодирующих нуклеиновых кислот, введенных в два различных ДНК-вектора в эукариотической клетке.
Альтернативно, нуклеиновые кислоты, кодирующие тяжелые и легкие цепи или их фрагменты, могут быть экспрессированы из одного вектора. Хотя легкие и тяжелые цепи кодируются отдельными генами, однако, они могут быть присоединены рекомбинантными методами. Так, например, два полипептида могут быть соединены посредством синтетического линкера, который позволяет получить одну белковую цепь, где пара областей VL и VH образует одновалентные молекулы (известные как одноцепочечный Fv (scFv); см., например, Bird et al., 1988, Science 242: 423-426; и Huston et al., 1988, Proc. Natl. Acad. Sci. USA 85:5879-5883).
Настоящее изобретение относится к выделенной молекуле нуклеиновой кислоты, содержащей последовательность нуклеиновой кислоты, кодирующую тяжелую цепь и/или легкую цепь, а также их фрагменты. Молекула нуклеиновой кислоты, содержащая последовательности, кодирующие легкую и тяжелую цепи или их фрагменты, может быть сконструирована так, чтобы она содержала синтетическую сигнальную последовательность для секреции антитела или его фрагмента, если она продуцируется в клетке. Кроме того, молекула нуклеиновой кислоты может содержать специфические ДНК-связи, которые позволяют встраивать другие последовательности антител и сохранять трансляционную рамку считывания так, чтобы аминокислоты, обычно присутствующие в последовательностях антител, не изменялись.
В соответствии с настоящим изобретением, антитело- кодирующие последовательности нуклеиновой кислоты могут быть встроены в соответствующий экспрессионный вектор. В различных вариантах осуществления изобретения, экспрессионный вектор содержит элементы, необходимые для транскрипции и трансляции встроенной антитело-кодирующей нуклеиновой кислоты с получением рекомбинантных молекул ДНК, которые направляют экспрессию последовательностей антител для образования антитела или его фрагмента.
Антитело-кодирующие нуклеиновые кислоты или их фрагменты могут быть получены различными методами рекомбинантных нуклеиновых кислот, известными специалистам в данной области, такими как сайт-направленный мутагенез.
Для экспрессии нуклеиновых кислот в клетке могут быть применены различные методы. Нуклеиновые кислоты могут быть клонированы в векторы различных типов. Однако, настоящее изобретение не должно ограничиваться каким-либо конкретным вектором. Наоборот, настоящее изобретение должно охватывать векторы широкого спектра, которые являются легко доступными и/или известными специалистам. Так, например, нуклеиновая кислота согласно изобретению может быть клонирована в вектор, включая, но не ограничиваясь ими, плазмиду, фагмиду, производное фага, вирус животного и космиду. Конкретными представляющими интерес векторами являются экспрессионные векторы, векторы для репликации, векторы для образования зонда и секвенирующие векторы.
В конкретных вариантах осуществления изобретения, экспрессионный вектор выбран из группы, состоящей из вирусного вектора, бактериального вектора и вектора клеток млекопитающих. Сущетвует множество систем экспрессионных векторов, которые включают по меньшей мере часть композиций или все композиции, обсуждаемые выше. Системы на основе прокариотического и/или эукариотического вектора могут быть использованы для их применения в настоящем изобретении в целях получения полинуклеотидов или их когнатных полипептидов. Многие такие системы являются коммерчески доступными и широко применяются.
Технология с использованием вирусных векторов хорошо известна специалистам и описана, например, Sambrook et al. (2012) и in Ausubel et al. (1999), а также в других руководствах по вирусологии и молекулярной биологии. Вирусами, которые могут быть использованы в качестве векторов, являются, но не ограничиваются ими, ретровирусы, аденовирусы, аденоассоциированные вирусы, вирусы герпеса и лентивирусы. В некоторых вариантах осуществления изобретения, для экспрессии нужной нуклеиновой кислоты используется вектор на основе вируса мышиных стволовых клеток (MSCV). MSCV-векторы продемонстрировали эффективную экспрессию нужных нуклеиновых кислот в клетках. Однако, настоящее изобретение не должно ограничиваться использованием только MSCV-вектора, и настоящее изобретение может включать любой метод экспрессии ретровирусов. Другими примерами вирусных векторов являются векторы на основе вируса мышиного лейкоза Молони (MoMuLV) и ВИЧ. В некоторых вариантах осуществления изобретения, подходящий вектор содержит ориджин репликации, который является функциональным по меньшей мере в одном организме, промоторную последовательность, стандартные сайты рестрикции эндонуклеазой и один или более селективных маркеров. (См., например, WO 01/96584, WO 01/29058 и патент США № 6326193).
Дополнительные регуляторные элементы, например, энхансеры, могут быть использованы для модуляции частоты инициации транскрипции. Промотором может быть промотор, обычно ассоциированный с последовательностью гена или нуклеиновой кислоты, которая может быть получена путем выделения 5’-некодирующих последовательностей, расположенных выше кодирующего сегмента и/или экзона. Такой промотор может называться «эндогенным». Аналогичным образом, энхансером может быть энхансер, обычно ассоциированный с последовательностью нуклеиновой кислоты и расположенный либо ниже, либо выше этой последовательности. Альтернативно, некоторые преимущества могут быть достигнуты путем помещения кодирующего сегмента нуклеиновой кислоты под контроль рекомбинантного или гетерологичного промотора, который представляет собой промотор, обычно не ассоциированный с последовательностью нуклеиновой кислоты в ее природном окружении. Рекомбинантный или гетерологичный энхансер также представляет собой энхансер, обычно не ассоциированный с последовательностью нуклеиновой кислоты в ее природном окружении. Такие промоторы или энхансеры могут включать промоторы или энхансеры других генов и промоторы или энхансеры, выделенные из любых других прокариотических клеток, вирус-содержащих клеток или эукариотических клеток, и промоторы или энхансеры, «не присутствующие в природе», например, содержащие различные элементы различных областей регуляции транскрипции, и/или мутации, которые изменяют экспрессию. Помимо синтеза последовательностей промоторов и энхансеров нуклеиновой кислоты, последовательности могут быть получены методами рекомбинантного клонирования и/или амплификации нуклеиновой кислоты, включая ПЦР, в комбинации с описанными в настоящем документе композициями (патент США. No. 4683202, патент США. No. 5928906). Кроме того, могут быть также использованы регуляторные последовательности, которые напрявляют транскрипцию и/или экспрессию последовательностей в не-ядерные органеллы, такие как митохондрии, хлоропласты и т.п.
Обычно необходимо использовать промотор и/или энхансер, который эффективно направляет экспрессию сегмента ДНК в клетках различных типов, в органеллах и в организме, выбранном для экспрессии. Специалистам в области молекулярной биологии обычно известно каким образом можно использовать промоторы, энхансеры и комбинации клеток различных типов для экспрессии белка, см., например, Sambrook et al., (2012). Используемые промоторы могут быть конститутивными, тканеспецифическими, индуцибельными и/или подходящими, в соответствующих условиях, для направления экспрессии введенного ДНК-фрагмента на высоком уровне, что является преимуществом при проведении крупномасштабного продуцирования рекомбинантных белков и их фрагментов.
Примером промотора является последовательность промотора предраннего цитомегаловируса (CMV). Эта последовательность промотора представляет собой в высокой степени конститутивную последовательность промотора, способную инициировать экспрессию любой полинуклеотидной последовательности, функционально присоединенной к этой последовательности, на высоком уровне. Однако, могут быть также использованы и другие конститутивные промоторные последовательности, включая, но не ограничиваясь ими, ранний промотор обезьяньего вируса 40 (SV40), промотор вируса мышиной опухоли молочной железы (MMTV), промотор длинных концевых повторов (LTR) вируса иммунодефицита человека (ВИЧ), промотор вируса Молони, промотор вируса птичьего лейкоза, предранний промотор вируса Эпштейна-Барра, промотор вируса саркомы Рауса, а также промоторы человеческих генов, такие как, но не ограничивающиеся ими, промотор актина, промотор миозина, промотор гемоглобина и промотор мышечного креатина. Кроме того, настоящее изобретение не должно ограничиваться применением конститутивных промоторов. В настоящее изобретение также входят и индуцибельные промоторы. Применение индуцибельных промоторов в настоящем изобретени позволять осуществлять переключение молекулы на экспрессию полинуклеотидной последовательности, функционально присоединенной к этой молекуле, если такая экспрессия необходима, или выключение экспрессии, если она не является необходимой. Примерами индуцибельных промоторов являются, но не ограничиваются ими, промотор металлотионеина, промотор глюкокортикоида, промотор прогестерона и промотор тетрациклина. Кроме того, изобретение включает применение тканеспецифического промотора или промотора, специфичного к клеткам конкретного типа, и такой промотор представляет собой промотор, который является активным только в нужной ткани или клетке. Тканеспецифические промоторы хорошо известны специалистам в данной области и включают, но не ограничиваются ими, промотор HER-2 и промоторные последовательности, ассоциированные с PSA.
Для оценки экспрессии нуклеиновых кислот, экспрессионный вектор, вводимый в клетку, может также содержать селективный маркерный ген или репортерный ген или оба этих гена для облегчения идентификации и отбора экспрессирующих клеток из популяции клеток, которые, предположительно, были трансфицированы или инфицированы вирусными векторами. В других вариантах осуществления изобретения, селективный маркер может присутствовать на отдельной нуклеиновой кислоте и может использоваться в процедуре котрансфекции. Селективные маркерные гены и репортерные гены могут быть фланкированы соответствующими регуляторными последовательностями для обеспечения экспрессии в клетках-хозяевах. Используемые селективные маркеры известны специалистам в данной области и включают, например, гены резистентности к антибиотикам, такие как neo и т.п.
Репортерные гены используются для идентификации потенциально трансфицированных клеток и для оценки функциональности регуляторных последовательностей. Репортерные гены, которые кодируют легко анализируемые белки, хорошо известны специалистам в данной области. Вообще говоря, репортерным геном является ген, который не присутствует в организме или в ткани реципиента или не экспрессируется в них, и кодирует белок, экспрессия которого идентифицируется по некоторым легко детектируемым свойствам, например, по ферментативной активности. Экспрессию репортерного гена анализируют в подходящее время после введения ДНК в клетки реципиента.
Подходящими репортерными генами могут быть гены, кодирующие люциферазу, бета-галактозидазу, хлорамфениколацетилтрансферазу, секретируемую щелочную фосфатазу или белок, флуоресцирующий в зеленом диапазоне спектра (см., например, Ui-Tei et al., 2000 FEBS Lett 479: 79-82). Подходящие экспрессионные системы хорошо известны и могут быть получены хорошо известными методами, либо они могут быть закуплены. Вообще говоря, конструкция с минимальной 5’-фланкирующей областью, показывающая наивысший уровень экспрессии репортерного гена, была идентифицирована как промотор. Такие промоторные области могут быть присоединены к репортерному гену и использованы для оценки агентов на способность модулировать транскрипцию, индуцированную промотором.
Методы введения нуклеиновых кислот в клетку и их экспрессии в клетке известны специалистам. Что касается экспрессионного вектора, то такой вектор может быть легко введен в клетку-хозяина, например, в клетку млекопитающего, бактерии, дрожжей или насекомого любым известным методом. Так, например, экспрессионный вектор может быть перенесен в клетку-хозяина физическими, химическими или биологическими методами.
Физические методы введения полинуклеотида в клетку-хозяина включают преципитацию фосфатом кальция, липофекцию, бомбардировку частицами, микроинжекцию, электропорацию, лазерное облучение и т.п. Методы получения клеток, содержащих векторы и/или экзогенные нуклеиновые кислоты, хорошо известны специалистам в данной области. См., например, Sambrook et al., (2012) и Ausubel et al., (1999).
Биологические методы введения представляющей интерес нуклеиновой кислоты в клетку-хозяина включают использование ДНК- и РНК-векторов. Вирусные векторы, а в частности, ретровирусные векторы стали наиболее широко использоваться в методах встраивания генов в клетки млекопитающего, например, человека. Другие вирусные векторы могут происходить от лентивирусов, поксвирусов, вируса простого герпеса I, аденовирусов и адено-ассоциированных вирусов и т.п. См., например, патенты США №№ 5350674 и 5585362.
Химические средства для введения нуклеиновой кислоты в клетку-хозяина включают использование коллоидных дисперсионных систем, таких как макромолекулярные комплексы, нанокапсулы, микросферы, гранулы и липидные системы, включая эмульсии типа «масло в воде», мицеллы, смешанные мицеллы и липосомы. Предпочтительной коллоидной системой для ее использования в качестве носителя для доставки in vitro и in vivo является липосома (например, искусственная мембранная везикула). Получение и применение таких систем хорошо известны специалистам в данной области.
Независимо от метода, применяемого для введения экзогенных нуклеиновых кислот в клетку-хозяина или какой-либо другой обработки клетки нуклеиновой кислотой согласно изобретению, для подтверждения присутствия рекомбинантной последовательности ДНК в клетке-хозяине, могут быть проведены различные анализы. Такие анализы включают, например, «молекулярно-биологические анализы», хорошо известные специалистам в данной области, такие как Саузерн- и Нозерн-блот-анализы, ОТ-ПЦР и ПЦР; «биохимические анализы», такие как детектирование присутствия или отсутствия конкретного пептида, например, иммунологическими средствами (с помощью ELISA и Вестерн-блот-анализов), или с помощью описанных в настоящем документе анализов для идентификации агентов, входящих в объем настоящего изобретения.
Наборы
Настоящее изобретение также включает набор, содержащий анти-C5 антитело или его комбинации согласно изобретению и пояснительный материал, в котором описано, например, введение анти-C5 антитела или его комбинаций индивидууму в качестве терапевтического лечения или нетерапевтического применения, как описано в настоящей заявке. В одном из вариантов осуществления изобретения, этот набор также содержит (необязательно стерильный) фармацевтически приемлемый носитель, подходящий для растворения или суспендирования терапевтической композиции, содержащей анти-C5 антитело или их комбинации согласно изобретению, например, до введения индивидууму антитела. Набор содержит, но необязательно, аппликатор для введения антитела.
Экспериментальные примеры
Настоящее изобретение описано со ссылкой на нижеследующие примеры. Эти примеры приводятся лишь в иллюстриративных целях, и настоящее изобретение никоем образом не ограничивается этими примерами, и в него также могут быть включены любые и все варианты, которые будут очевидны для специалиста исходя из приведенного в настоящем документе описания.
Без дополнительного описания, специалист в данной области может на основе предшествующего описания и нижеследующих иллюстриративных примеров получить и использовать соединения согласно изобретению и осуществить заявленные способы на практике. Нижеследующие примеры представляют собой рабочие примеры, а поэтому их никоим образом не следует рассматривать как ограничение объема остальной части раскрытия изобретения.
Пример 1
Система комплемента является частью врожденного иммунитета, который играет ключевую роль в защите хозяина. Тем не менее, активированный комплемент может также вызывать значительное повреждение и деструкцию тканей, и было обнаружено, что нарушение регуляции активности комплемента ассоциируется с развитием ряда редких и распространенных заболеваний, таких как пароксизмальная ночная гемоглобинурия (PNH), атипический гемолитический уремический синдром, ревматоидный артрит, возрастная дегенерация желтого пятна и т.п. Таким образом, терапия антителами против комплемента представляет собой перспективный способ лечения этих расстройств у человека.
Комплемент С5 представляет собой белок, играющий ключевую роль в терминальном пути активации комплемента, и является белком-предшественником для образования сильного провоспалительного медиатора С5а, а также цитолитического мембрано-атакующего комплекса (MAC).
Было получено и охарактеризовано шесть (6) мышиных моноклональных антител против человеческого С5, и было подтверждено, что эти антитела представляют собой mAb против С5 человека, блокирующие функцию, то есть, блокирующие образование С5а и MAC, если комплемент активируется по классическому, лектиновому или альтернативному пути. Эти mAb имеют следующие обозначения: mAb 4E7, 9G6, 11C5, 2G1, 11D9 и 8E1.
Кроме того, были определены подтипы тяжелых и легких цепей вышупомянутых антител Ig, и были клонированы кДНК вариабельных областей тяжелых цепей 6 mAb.
Методы и материалы, применяемые в этом примере, описаны ниже.
Анализ на аффинность анти-С5 mAb:
Был проведен анализ методом поверхностного плазмонного резонанса в целях измерения константы скорости ассоциации и диссоциации для связывания С5 человека с анти-C5 mAb с использованием устройства BIAcore 3000 (Biacore AB, Uppsala, Sweden), и все эксперименты Biacore были проведены при 25°C. Карбоксилированная декстрановая матрица сенсорного чипа CM5 была использована для связывания очищенного кроличьего mAb против α-цепи мышиного IgG (RAMFc) химическим методом присоединения амина до достижения поверхностной плотности 1000 RU, и анти-C5 mAb захватывали на иммобилизованных RAMFc. После стабилизации связывания с анти-C5 mAb, на поверхность чипа в HBSET (в буфере HEPES, содержащем физиологический раствор вместе с EDTA и Твином 20) впрыскивали различные концентрации С5 человека в пределах 100, 50, 25, 12,5, 6,25 и 0 нМ, и образцы впрыскивали на поверхность антитела со скоростью 30 мкл/мин (60 мкл-инъекция) в течение 180 секунд, а затем осуществляли диссоциацию связанного аналита в течение 900 сек. Данные были проанализированы с помощью компьютерной программы для оценки BIA 3.2 на модели связывания 1:1. Регенерация поверхности была достигнута путем впрыскивания 50 мкл (50 мкл/мин) 10 мM Гликона-HCl при pH 1,5.
Анализ на LPS-индуцированное продуцирование C5a:
Нормальную 10% человеческую сыворотку (NHS) предварительно инкубировали с различными концентрациями 4E7, 9G6, 11C5, 2G1, 11D9 и 8E1 при 4°C в течение 1 часа. Образцы, обработанные антителом, инкубировали с LPS в Mg-EGTA GVB2+ при 37°C в течение 1 часа, а затем реакцию завершали путем добавления 40 мМ EDTA в PBS.
«Сэндвич»-ELISA для детектирования С5 человека:
6-луночные планшеты покрывали мышиным антителом против С5 человека (R&D systems # MAB2037) в конечной концентрации 1 мкг/мл при 4°C в течение ночи. После трех промывок PBS, содержащим 0,05% Твин-20, планшеты инкубировали с пробами сыворотки, разведенными 1/8 (из анализа на LPS-индуцированное продуцирование C5a) при комнатной температуре в течение 1 часа. После другой промывки, планшеты инкубировали с соответствующим биотинилированным mAb против С5 человека (R&D systems # BAM20371) при комнатной температуре в течение 1 часа, а затем снова промывали и инкубировали со стрептавидином, конъюгированным с пероксидазой хрена (BD pharmagen # 554058) при комнатной температуре в течение 1 часа. После последней промывки, планшет проявляли субстратом для ПХ в течение 6-10 минут. Реакцию завершали добавлением 2н H2SO4, и планшет считывали на 450 нм в микропланшет-ридере.
Анализ на связывание С5 человека и mAb:
Полистироловые микротитрационные планшеты покрывали очищенным человеческим C5 (50 нг/лунку) в PBS при 37°C в течение 1 часа. После аспирации раствора C5, лунки блокировали PBS, содержащим 1% BSA в PBS при комнатной температуре в течение 1 часа. Лунки без покрытия C5 служили в качестве фонового контроля. Затем в лунки добавляли различные концентрации 4E7, 9G6, 11C5, 2G1, 11D9 и 8E1, 50 мкл/лунку в блокирующем растворе. После инкубирования в течение 1 часа при комнатной температуре, лунки тщательно промывали PBST. mAb, связанное с С5 человека, детектировали путем добавления ПХ-конъюгированного антитела против мышиного IgG или ПХ-конъюгированного антитела против человеческого IgG4 HRP при разведении 1:4000 в блокирующем растворе, и инкубировали в течение 1 часа при комнатной температуре. После промывки PBST, планшет проявляли субстратом для ПХ в течение 6-10 минут. Реакцию завершали добавлением 2н H2SO4, и планшет считывали на 450 нм в микропланшет-ридере.
Получение mAb против С5 человека:
Самок мышей B10.D2/oSnJ (Stock # 000461, Jackson laboratory) иммунизировали 30 мкг очищенного С5 человека (# A120, Complement Technology Inc), эмульгированного в адъюванте. На день 14, мышей снова иммунизировали 30 мкг очищенного С5 человека, эмульгированного в адъюванте. До слияния, мышам три раза вводили бустер-инъекцию 33 мкг очищенного С5 человека. Затем мышей умерщвляли путем смещения шейных позвонков, и селезенку выделяли путем механической дизрупции для получения моноклеточной суспензии. Суспензию клеток селезенки один раз промывали средой HYB-SFM (Invitrogen) + 10% FBS, и клетки подсчитывали, а затем смешивали с миеломными клетками X63-Ag8.653 (ATCC) в отношении 2:1. Клеточную смесь снова промывали средой HYB-SFM, и клеточный осадок получали путем центрифугирования (1000 об./мин. × 5 мин.). Клеточный осадок осторожно разрушали и разрыхляли, а затем индуцировали слияние клеток путем медленного добавления полиэтиленгликоля (ПЭГ 1500) (1,5 мл ПЭГ для 3 × 108 клеток). Клетки оставляли на 1 минуту при 37°C, а затем к клеткам добавляли 20 мл среды HYB-SFM в течение 3 минут (1 мл в течение первой минуты, 3 мл в течение второй минуты, и 16 мл в течение третьей минуты). Смесь центрифугировали при 1000 об./мин. в течение 5 минут, и клетки высевали в 24-луночные планшеты в среде HAT (10 мл HAT [Sigma H0262], 5 мл пенициллина/стрептомицина, 500 мкл гентамицина и 10% FBS в 500 мл среды HYB-SFM). Через 2 недели, супернатанты лунок с визуально наблюдаемыми колониями брали для ELISA-скрининга на способность реагировать с очищенным человеческим C5. Позитивные клоны собирали и высевали в 96-луночные планшеты методом лимитирующего разведения с получением одиночных клонов после второго раунда скрининга с помощью ELISA. Позитивные клоны размножали в HT-среде (10 мл HT, 5 мл пенициллина/стрептомицина, 500 мкл гентамицина и 10% FBS в 500 мл среды HYB-SFM). Перед сбором антител, гибридомные клетки переносили в бессывороточную среду (ΗΎβ-SFM) на 2-3 дня. Клеточную культуральную среду собирали для очистки mAb с помощью аффинной хромотографии на G-белке.
Клонирование mAb:
Для клонирования кДНК 4E7, 9G6, 11C5, 2G1, 11D9 и 8E1, все РНК выделяли из гибридомных клеток с использованием реагента TRizol (Sigma). кДНК первой цепи синтезировали посредством обратной транскрипции с использованием олиго(dT)-праймера. Для амплификации кДНК тяжелой цепи (для IgGl, IgG2a/b), в ПЦР использовали следующие праймеры: 5’- GAGGTGAAGCTGGTGGAG(T/A)C(T/A)GG-3’ (SEQ ID NO:77) и 5’GGGGCCAGTGGATAGAC-3’ (SEQ ID NO:78). Для амплификации легкой цепи k использовали следующие праймеры: смесь из 4 вышерасположенных праймеров: 5’-CCAGTTCCGAGCTCCAGATGACCCAGACTCCA-3’ (SEQ ID NO:79); 5’-CCAGTTCCGAGCTCGTGCTCACCCAGTCTCCA-3’ (SEQ ID NO:80); 5’- CCAGTTCCGAGCTCCAGATGACCCAGTCTCCA-3’ (SEQ ID NO:81); 5’-CCAGTTCCGAGCTCGTGATGACACAGTCTCCA-3’ (SEQ 1D NO: 82); и нижерасположенного праймера: 5’-GTTGGTGCAGCATCAGC-3’ (SEQ ID NO:83). ПЦР-ампликоны клонировали в вектор pCR TOPO TA 2.1 (Invitrogen) и секвенировали. Для получения сигнальной пептидной (лидерной) последовательности mAb был применени метод 5’-RACE с использованием набора (GeneRacer) от Invitrogen. Полноразмерные кДНК вариабельной области амплифицировали с использованием специфических праймеров, определенных по данным 5’-RACE и данным исходного секвенирования.
Конструирование и экспрессия химерного mAb 2G1
кДНК тяжелой цепи химерного 2G1 конструировали путем клонирования вариабельной области mAb 2G1 в вектор pFUSE-CHIg-hG4 (от InvivoGen, содержащий константную область тяжелой цепи человеческого IgG4 с заменой серина 229 на пролин (SEQ ID NO:60) с использованием EcoRI/NheI-сайтов. кДНК легкой цепи химерного 2G1 конструировали путем клонирования вариабельной области mAb 2G1 в вектор pFUSE2-CLIg-hk (от InvivoGen, содержащий константную область человеческой легкой цепи k (SEQ ID NO 61)) с использованием AgeI/BsiWI-сайтов. Клетки CHO котрансфецировали тяжелой и легкой цепями химерного 2G1 или тяжелой и легкой цепями гуманизированного 2G1 (две гуманизированных тяжелых цепи были спарены с той же самой гуманизированной легкой цепью) с использованием реагента липофектамина. После трансфекции, клетки CHO отбирали с использованием геоцина (l мг/мл) и бластицидина (10 мкг/мл) приблизительно в течение 7 дней. Клеточные колонии, резистентные к лекарственному средству, собирали, трипсинизировали и подвергали лимитирующему разведению в культуре в 96-луночных планшетах в присутствии тех же самых лекарственных средств для отбора. После того, как клетки становились конфлюэнтными в 96-луночных планшетах, среду тестировали на способность реагировать с С5 человека с помощью ELISA, и позитивные клоны размножали. Для продуцирования антитела, стабильные линии трансфецированных клеток CHO культивировали в среде DMEM:F12 с 10% FBS в 150 см-колбах для культивирования, и после достижения конфлюэнтности, их переносили в бессывороточную среду CD-CHO (Invitrogen). Через 3 дня, среду собирали, и Ab очищали с помощью хромотографии на G-белке. Аликвоты очищенных Ab анализировали с помощью электрофореза в ДСН-ПААГ.
Конструирование и экспрессия гуманизированного mAb 2G1
CDR VH и VL mAb 2G1 присоединяли к каркасным областям сегментов гена вариабельной области зародышевой линии и сегментов гена стыка (V, J) тяжелой и легкой цепей человеческого Ig, соответственно, после чего был проведен отбор исходя из сходства CDR человеческих иммуноглобулинов и mAb 2G1 (Hwang et al, Method, 2005). Преимущество этого подхода заключается в возможности получения гуманизированных Ab, которые сохраняют аффинность связывания с когнатным антигеном и значительно снижают потенциальную иммуногенность не-человеческих Ab, поскольку все остатки в каркасных областях происходят от последовательностей человеческих Ab зародышевой линии. кДНК тяжелой цепи гуманизированного 2G1 конструировали путем клонирования вариабельной области гуманизированной тяжелой цепи 2G1 (синтезированной Genescript) в вектор pFUSE-CHIg-hG4 (от InvivoGen, содержащий содержащий константную область тяжелой цепи человеческого IgG4 с заменой серина 229 на пролин (SEQ ID NO:60)) с использованием EcoRI/NheI-сайтов. кДНК легкой цепи гуманизированного 2G1 конструировали путем клонирования вариабельной области гуманизированной легкой цепи 2G1 (синтезированной Genescript) в вектор pFUSE2-CLIg-hk (от InvivoGen, содержащий константную область человеческой легкой цепи k (SEQ ID NO 61)) с использованием AgeI/BsiWI-сайтов. Клетки CHO котрансфецировали тяжелой и легкой цепями химерного 2G1 или тяжелой и легкой цепями гуманизированного 2G1 (две гуманизированных тяжелых цепи были спарены с той же самой гуманизированной легкой цепью) с использованием реагента липофектамина. После трансфекции, клетки CHO отбирали с использованием геоцина (l мг/мл) и бластицидина (10 мкг/мл) приблизительно в течение 7 дней. Клеточные колонии, резистентные к лекарственному средству, собирали, трипсинизировали и подвергали лимитирующему разведению в культуре в 96-луночных планшетах в присутствии тех же самых лекарственных средств для отбора. После того, как клетки становились конфлюэнтными в 96-луночных планшетах, среду тестировали на способность реагировать с С5 человека с помощью ELISA, и позитивные клоны размножали. Для продуцирования антитела, стабильные линии трансфецированных клеток CHO культивировали в среде DMEM:F12 с 10% FBS в 150 см-колбах для культивирования, и после достижения конфлюэнтности, их переносили в бессывороточную среду CD-CHO (Invitrogen). Через 3 дня, среду собирали, и Ab очищали с помощью хромотографии на G-белке. Аликвоты очищенных Ab анализировали с помощью электрофореза в ДСН-ПААГ.
Анализ на гемолиз:
Анализ на лизис овечьих эритроцитов (RBC): Овечьи RBC (1 × 107 или 1 × 108 клеток; Complement Technology Inc) инкубировали при 37°C в течение 20 минут с 10% или 50% NHS (Complement Technology Inc) в буфере с желатином и вероналом (GVB2+, Sigma). Перед добавлением к овечьим RBC, NHS предварительно инкубировали с mAb (4E7, 9G6, 11C5, 2G1, 11D9, 8E1 и контрольным mAb 7A12) или с химерными 2G1 и 7A12 или гуманизированным 2G1 в течение 1 часа при 4°C. Реакцию лизиса прекращали путем добавления охлажденного льдом 40 мM EDTA в PBS. Смеси для инкубирования центрифугировали в течение 5 минут при 1500 об./мин., и супернатант собирали и определяли OD405нм. Образцы без NHS или с добавленным EDTA использовали в качестве негативного контроля лизиса, и образец полностью лизированных овечьих RBC с дистилированной водой использовали в качестве позитивного контроля (100% лизис), по которому нормализовали % лизиса в других образцах.
Анализ на лизис куриных RBC: Куриные RBC (1 × 107 или 1 × 108 клеток; Complement Technology Inc) инкубировали при 37°C в течение 1 часа с 50% сывороткой (Complement Technology Inc) в GVB2+. Перед добавлением к куриным RBC, сыворотку, взятую у животных различных видов, включая человека, собак, кроликов, хомячков, коз, свиней, овец, макак-резусов или собакоподобных обезьян, предварительно инкубировали с 50 мкг/мл 4E7, 9G6, 11C5, 2G1, 11D9 или 8E1 в течение 1 часа при 4°C. В некоторых экспериментах, NHS предварительно инкубировали с серийно разведенными 2G1 или 8Е1 в течение 1 часа при 4°C. Реакцию лизиса прекращали путем добавления охлажденного льдом 40 мM EDTA в PBS. Смеси для инкубирования центрифугировали в течение 5 минут при 1500 об./мин., и супернатант собирали и определяли OD405нм. Собранные данные нормализовали по данным для сыворотки плюс EDTA в качестве негативного контроля (0%) и для сыворотки без антитела в качестве позитивного контроля (100%).
Анализ на лизис RBC при PNH: NHS разводили буфером GVB2+, подкисляли до pH 6,4 (подкисленная нормальная человеческая сыворотка: aNHS) и использовали для анализов на лизис RBC при PNH. 5 × 106 клеток добавляли в 50% aNHS. Затем инкубировали при 37°C, и через 30 минут, реакцию прекращали путем добавления 200 мкл холодного 20 мМ EDTA в PBS. mAb 2G1 инкубировали с aNHS в течение 30 минут при 4°C, а затем добавляли к RBC при PNH. RBC осаждали путем центрифугирования, и оптическую плотность аликвоты выделенного супернатанта на 405 нм использовали для вычисления процента лизиса. RBC при PNH, лизированные в воде, использовали в качестве 100% стандарта лизиса.
Экспрессия β-цепи С5 человека и мутантов с делецией доменов:
кДНК С5 человека (hC5) в векторе pGEM-T закупали у Sino Biologicals Inc. (Cat#HG13416-G). Нуклеотидную последовательность C5, полученную от Sino Biologicals Inc., подтверждали с использованием праймеров, специфичных к гену и вектору. Нуклеотидную и белковую последовательность β-цепи hC5 идентифицировали с использованием PubMed (NM_001735.2) и Uniprot Id-P01031. β-цепь от hC5 амплифицировали и клонировали в вектор pCAGGS. Мутанты с делецией доменов макроглобулина (MG) β-цепи (MG1, MG, MG3, MG4, MG5 и MG6) получали в векторе hC5-pGEM-T посредством инверсной ПЦР, а делецию подтверждали путем секвенирования. Мутанты доменов MG β-цепи hC5 аналогичным образом клонировали в вектор pCAGGS. Праймеры, используемые для конструирования и клонирования мутантов с делециями MG, перечислены ниже в Таблице 1.
Таблица 1. Праймеры, используемые для конструирования и клонирования мутантов MG
CCTTTTGGGAATAC
TGATGGTGGAGAATTTCTTTACAAGGTTC
Трансфекция hC5β и hC5β с делециями MG:
кДНК интактной β-цепи и различных мутантов с делециями доменов MG переносили в клетки HEK с использованием липофектамина 2000 (Invitrogen). Через 48 часов, супернатанты собирали и использовали для анализа.
Электрофорез в ДСН-ПААГ и Вестерн-блот-анализ:
Для Вестерн-блот-анализа, 40 мкл супернатанта клеток HEK, трансфецированных β-цепью hC5 и мутантом с делециями доменов MG, или супернатанта нетрансфецированных клеток HEK (негативный контроль) добавляли в пробирки, содержащие буфер для образцов и β-меркаптоэтанол. Очищенный человеческий C5 использовали в качестве позитивного контроля. Образцы кипятили при 100°C в течение 7 минут и загружали на 4-12% градиентный гель, а затем белки переносили на PVDF-мембрану с размером пор 0,2 мкм. Мембрану блокировали 5% обезжиренным сухим молоком в TBS в течение 1 часа при комнатной температуре. Затем, мембрану инкубировали с «первым» антителом (козьим поликлональным анти-C5 антителом от Comptech, cat#A220 или биотинилированным mAb 2G1-3 или QDC5) в 5% обезжиренном сухом молоке в TBST при 4°C в течение ночи. Мембрану промывали TBS с 0,1% Твина-20 (TBST) в течение 6 × 5 минут и инкубировали с кроличьим антикозьим ПХ-конъюгированным антителом при разведении 1:4000 (Bio-Rad, Cat#172-1034) в течение 1 часа при комнатной температуре. Белки детектировали с использованием субстрата для Вестерн-блот-анализа Pierce™ ECL 2 в соответствии с инструкциями производителя. mAb QDC5 представляет собой рекомбинантное mAb против человеческого IgG4, имеющее последовательности VH и VL гуманизированного мышиного mAb против С5 человека, описанного Thomas et al. (Mol Immunol., 1996 Dec;33(17-18):1389-401). Это антитело экспрессировалось в клетках Expi-CHO (Invitrogen) и было очищено с помощью аффинной хромотографии на белке A.
«Сэндвич»-ELISA для детектирования β-цепи hC5 и мутантов с делецией MG:
Для проведения «сэндвич»-ELISA, 96-луночные планшеты покрывали mAb 2G1-3 mAb в конечной концентрации 2 мкг/мл при 4°C в течение ночи. После трех промывок PBS, содержащим 0,05% Твин-20, планшеты блокировали 3% альбумином бычьей сыворотки (BSA) в течение 1 часа при комнатной температуре. После промывки, планшеты инкубировали 200 мкл супернатантов трансфецированных клеток HEK или 20% NHS в течение 1 часа при комнатной температуре. После второй промывки, планшеты инкубировали с детектирующим антителом SKY59 в конечной концентрации 2 мкг/мл при комнатной температуре в течение 1 часа, а затем снова промывали и инкубировали ПХ-конъюгированным «вторым» антителом, специфичным к человеческому IgG4 (Invitrogen # MA1-34437) при комнатной температуре в течение 1 часа. mAb SKY59 было определно как экспрессировалось как рекомбинантное mAb IgG4, как было определно исходя из опубликованных последовательностей VH/VL (Fukuzawa et al., Sci Rep., 2017 Apr 24;7(1):1080. doi: 10.1038/s41598-017-01087-7). В случае Вестерн-блот-анализа, проводимого с использованием козьего поликлонального антитела против С5 человека, это антитело было использовано при разведении 1:500 при комнатной температуре в течение 1 часа. После дополнительной промывки, лунки инкубировали с ПХ-конъюгированым кроличьим антителом против козьих IgG (1:4000) в течение 1 часа. Планшеты проявляли субстратом для ПХ в течение 6-10 минут. Реакцию завершали добавлением 2н H2SO4, и планшет считывали на 450 нм в микропланшет-ридере.
Результаты этого примера описаны ниже.
Результаты ELISA-анализа, которые продемонстрировали связывание mAb против С5 человека 4E7, 9G6, 11C5, 2G1, 11D9 и 8E1 с С5 человека, представлены на фигуре 1. Был проведен прямой ELISA-анализ на связывание с антигеном, в котором mAb были серийно разведены во всех микротитрационных планшетах, покрытых очищенным человеческим C5. Все шесть mAb показали высокий уровень реактивности с С5 человека.
Результаты экспериментов, которые продемонстрировали высокую аффинность связывания анти-C5 mAb 2G1, 8E1, 4E7, 9G6, 11C5 и 11D9 с C5, представлены на фигурах 2-7. Очищенное кроличье mAb против α-цепи мышиного IgG (RAMFc) связывали с чипом CM4 методом присоединения аминов. Затем анти-C6 mAb захватывали на иммобилизованном RAMFc. Анализы Biacore осуществляли на устройстве Biacore-2000.
Дозозависимое ингибирование LPS-индуцированного продуцирования C5a под действием mAb против С5 человека 4E7, 9G6, 11C5, 2G1, 11D9 и 8E1 проиллюстрировано на фигуре 8. Для оценки влияния mAb против С5 человека на LPS-индуцированное продуцирование C5a была использована комбинация из двух анализов: «сэндвич»-ELISA на LPS-индуцированное продуцирование C5a и на человеческий C5a. Все шесть mAb эффективно ингибировали LPS-индуцированное продуцирование C5a при добавлении к 10% нормальной человеческой сыворотке (NHS) в конечной концентрации 12,5 мкг/мл.
Влияние mAb против С5 человека 4E7, 9G6, 11C5, 2G1, 11D9 и 8E1 на комплемент-опосредуемый гемолиз показано на фигуре 9. На фигуре 9A проиллюстрирован лизис RBC, определенный путем измерения оптической плотности OD405нм после инкубирования овечьих RBC с 50% NHS, содержащей серийные разведения каждого анти-C5 mAb при 37°C в течение 1 часа. Лизис RBC определяли путем измерения оптической плотности OD405нм. При 120 мкг/мл, все mAb ингибировали лизис овечьих эритроцитов, опосредуемый 50% NHS. При более низких дозах (например, 30-60 мкг/мл), 9G6 менее активно предотвращало гемолиз, чем другие mAb. На фигуре 9B показано, что при 30 мкг/мл, mAb 2G1 и 8E1 более активно ингибировали комплемент-опосредуемый гемолиз, чем 4E7, 11C5 и 11D9.
Влияние mAb против С5 человека 4E7, 9G6, 11C5, 2G1, 11D9 и 8E1 на комплемент-опосредуемый гемолиз с использованием сыворотки, взятой у животных различных видов, показано на фигуре 10. Куриные RBC инкубировали с 50% NHS, нормальной кроличьей сывороткой, сывороткой макак-резуса или сывороткой собакоподобных обезьян, содержащей каждое анти-C5 mAb (конечная концентрация 50 мкг/мл), при 37°C в течение 1 часа. Лизис RBC определяли путем измерения оптической плотности OD405нм и нормализовали на сыворотку с EDTA в качестве негативного контроля (0%) и на сыворотку без антитела в качестве позитивного контроля (100%). В анализе на гемолиз с использованием NHS, пять из шести mAb против С5 человека в значительной степени ингибировали гемолиз, то есть, более, чем на 50%. В частности, образцы NHS, содержащие 2G1, почти полностью ингибировали гемолиз. При обработке mAb 9G6 или 2G1, гемолитическая активность в кроличьей сыворотке значительно снижалась. С другой стороны, ни одно mAb не ингибировало комплемент-опосредуемый гемолиз при использовании сыворотки обезьян (макак-резуса и собакоподобных обезьян), коз, свиней и овец.
Влияние mAb против С5 человека 2G1 и 8E1 на комплемент-опосредуемый гемолиз показано на фигуре 11. Куриные RBC инкубировали с 50% NHS, содержащей серийные разведения 2G1 или 8E1 или контрольного mAb (MOPC, мышиного IgG1) при 37°C в течение 1 часа. Лизис RBC определяли путем измерения оптической плотности OD405нм.
Влияние mAb против С5 человека 2G1 на гемолиз RBC при PNH показано на фигуре 12. RBC, взятые у пациентов с пароксизмальной ночной гемоглобинурией (PNH), тестировали с использованием подкисленной сыворотки Хэмса в присутствии или в отсутствии mAb 2G1. RBC инкубировали с 50% NHS, содержащей серийные разведения 2G1 при 37°C в течение 1 часа. Лизис RBC определяли путем измерения оптической плотности OD405нм. В отсутствии mAb, приблизительно 35% RBC подвергались лизису под действием подкисленной сыворотки, а обработка mAb 2G1 приводила к 70% снижению гемолитической активности при 25 мкг/мл и к 85% снижению при 40 мкг/мл.
Последовательности шести антител представлены на фигурах 13-18. На фигуре 13 представлены последовательности вариабельной области тяжелой и легкой цепей mAb 2G1. На фигуре 14 представлены последовательности вариабельной области тяжелой и легкой цепей mAb 8E1. На фигуре 15 представлены последовательности вариабельной области тяжелой и легкой цепей mAb 4E7. На фигуре 16 представлены последовательности вариабельной области тяжелой и легкой цепей mAb 9G6. На фигуре 17 представлены последовательности вариабельной области тяжелой и легкой цепей mAb 11C5. На фигуре 18 представлены последовательности вариабельной области тяжелой и легкой цепей mAb 11D9.
Аминокислотные последовательности константной области тяжелой цепи человеческого IgG4 с заменой серина 228 на пролин (то есть, S228P) и константной области человеческой легкой цепи каппа представлены на фигуре 19. Эти последовательности были использованы для конструирования химерного (мышиная вариабельная область+человеческая константная область) и гуманизированного (гуманизированная мышиная вариабельная область+человеческая константная область) антитела против С5 человека (2G1).
Способность химерного mAb 2G1 против человеческого IgG4 реагировать с С5 человека показана на фигуре 20. Химерное 2G1 получали путем присоединения вариабельных областей mAb 2G1 к константной области тяжелой цепи человеческого IgG4, несущей мутацию S228P, и к константной области человеческой легкой цепи каппа. Планшет покрывали человеческим С5. После инкубирования с серийно разведенным химерным 2G1, связанное химерное mAb детектировали с использованием ПХ-конъюгированного антитела против человеческого IgG4. Химерное 2G1 связывалось с С5 человека в зависимости от дозы.
Влияние химерного mAb 2G1 против человеческого IgG4 на гемолиз, опосредуемый классическими путями комплемента, показано на фигуре 21. Сенсибилизированные овечьи RBC инкубировали с NHS, содержащей серийно разведенное химерное 2G1, при 37°C в течение 1 часа. Лизис RBC определяли путем измерения оптической плотности OD405нм. Результаты показали, что при 30 мкг/мл и при более высоких концентрациях, химерное mAb 2G1 ингибировало лизис овечьих эритроцитов, опосредуемый 50% NHS.
Нуклеотидные и аминокислотные последовательности вариабельной области тяжелой цепи (VH) гуманизированного mAb 2G1 (гуманизированного 2G1 VH-11801) представлены на фигуре 22. Гуманизация была достигнута путем присоединения CDR VH мышиного mAb 2G1 к кодируемой человеческой VH зародышевой линии с сохранением рамки считывания (11801). Аминокислотная последовательность сигнального пептида подчеркнута, а последовательность CDR1, CDR2 и CDR3 выделена жирным шрифтом и заштрихована.
Нуклеотидные и аминокислотные последовательности другой гуманизированной VH mAb 2G1 (гуманизированного 2G1 VH-16901) представлены на фигуре 23. Гуманизация была достигнута путем присоединения CDR VH мышиного mAb 2G1 к кодируемой человеческой VH зародышевой линии с сохранением рамки считывания (16901). Аминокислотная последовательность сигнального пептида подчеркнута, а последовательность CDR1, CDR2 и CDR3 выделена жирным шрифтом и заштрихована.
Нуклеотидные и аминокислотные последовательности гуманизированной вариабельной области легкой цепи (VL) mAb 2G1 (гуманизированного 2G1 VL-1901) представлены на фигуре 24. Гуманизация была достигнута путем присоединения CDR VL мышиного mAb 2G1 к кодируемой человеческой VL зародышевой линии с сохранением рамки считывания (1901). Аминокислотная последовательность сигнального пептида подчеркнута, а последовательность CDR1, CDR2 и CDR3 выделена жирным шрифтом и заштрихована.
Способность гуманизированного 2G1 (VH-11801/VL-1901) реагировать с С5 человека показана на фигуре 25. Гуманизированное 2G1 (VH-11801/VL-1901) экспрессировалось как mAb против человеческого IgG4 с мутацией S228P в Fc-домене. Планшет покрывали человеческим С5. После инкубирования с серийно разведенным гуманизированным 2G1 (VH-11801/VL-1901), связанное mAb детектировали с использованием ПХ-конъюгированного антитела против человеческого IgG4. Гуманизированное 2G1 (VH-11801/VL-1901) связывалось с С5 человека в зависимости от дозы.
Способность гуманизированного 2G1 (VH-16901/VL-1901) реагировать с С5 человека показана на фигуре 26. Гуманизированное 2G1 (VH-16901/VL-1901) экспрессировалось как mAb против человеческого IgG4 с мутацией S228P в Fc-домене. Планшет покрывали человеческим С5. После инкубирования с серийно разведенным гуманизированным 2G1 (VH-16901/VL-1901), связанное mAb детектировали с использованием ПХ-конъюгированного антитела против человеческого IgG4. Гуманизированное 2G1 (VH-16901/VL-1901) связывалось с С5 человека в зависимости от дозы.
Влияние гуманизированного 2G1 (VH-11801/VL-1901) на гемолиз, опосредуемый классическими путями комплемента, показано на фигуре 27. Гуманизированное 2G1 (VH-11801/VL-1901) экспрессировалось как mAb против человеческого IgG4 с мутацией S228P в Fc-домене. Сенсибилизированные овечьи RBC инкубировали с 10% NHS, содержащей серийно разведенное гуманизированное 2G1 (VH-11801/VL-1901), при 37°C в течение 1 часа. Лизис RBC определяли путем измерения оптической плотности OD405нм. Гуманизированное 2G1 (VH-11801/VL-1901) в значительной степени ингибировало лизис овечьих эритроцитов, опосредуемый 10% NHS, при 10 мкг/мл и при более высоких концентрациях mAb.
Влияние гуманизированного 2G1 (VH-16901/VL-1901) на гемолиз, опосредуемый классическими путями комплемента, показано на фигуре 28. Гуманизированное 2G1 (VH-16901/VL-1901) экспрессировалось как mAb против человеческого IgG4 с мутацией S228P в Fc-домене. Сенсибилизированные овечьи RBC инкубировали с 10% NHS, содержащей серийно разведенное гуманизированное 2G1 (VH-16901/VL-1901), при 37°C в течение 1 часа. Лизис RBC определяли путем измерения оптической плотности OD405нм. Гуманизированное 2G1 (VH-16901/VL-1901) в значительной степени ингибировало лизис овечьих эритроцитов, опосредуемый 10% NHS, при 10 мкг/мл и при более высоких концентрациях mAb.
Раскрытие каждого и всех цитируемых в настоящем документе патентов, патентных заявок и публикаций включено в настоящее описание в полном объеме посредством ссылки.
Хотя настоящее изобретение раскрыто со ссылкой на конкретные варианты его осуществления, однако, очевидно, что в него могут быть внесены и другие варианты и изменения другими специалистами в данной области, и эти варианты и изменения не должны выходить за рамки истинного существа и объема изобретения. Прилагаемая формула изобретения должна включать все такие варианты и эквивалентные изменения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ДЗЕ ТРАСТИЗ ОФ ДЗЕ ЮНИВЕРСИТИ ОФ ПЕНСИЛЬВАНИЯ
СУН, Вэньчао
САТО, Саяка
МИВА, Такаси
Гуллипалли, Дамодар
<120> АНТИ-C5 АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ
<130> 046483-6156-00-WO.607244
<150> US 62/467,498
<151> 2017-03-06
<160> 104
<170> PatentIn version 3.5
<210> 1
<211> 432
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность VH mAb 2G1
<400> 1
atgggatgga gctggatctt tctcctcttc ctgtcaggaa ctgcaggtgt cctctctgag 60
gtccagctgc aacagtctgg accagagctg gtgaagcctg gggcttcagt gaagatatcc 120
tgcaaggctt ctggatacac aatcacagac tacaatttgg actgggtgaa gcagagccat 180
ggaaagagcc ttgagtggat tggagatatt agtcctaact atggttatac tatctacaac 240
cagaaattca aggacaaggc cacattgact gtagacaggt cctccagcac agcctacatg 300
gagctccgca gcctgacatc tgaggacact gcagtttatt actgtgcaag aagggacatt 360
cgttactccg gtaattccta caaatggtac ttcgatgtct ggggcacagg gaccacggtc 420
accgtctcct ca 432
<210> 2
<211> 144
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность VH mAb 2G1
<400> 2
Met Gly Trp Ser Trp Ile Phe Leu Leu Phe Leu Ser Gly Thr Ala Gly
1 5 10 15
Val Leu Ser Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys
20 25 30
Pro Gly Ala Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Ile
35 40 45
Thr Asp Tyr Asn Leu Asp Trp Val Lys Gln Ser His Gly Lys Ser Leu
50 55 60
Glu Trp Ile Gly Asp Ile Ser Pro Asn Tyr Gly Tyr Thr Ile Tyr Asn
65 70 75 80
Gln Lys Phe Lys Asp Lys Ala Thr Leu Thr Val Asp Arg Ser Ser Ser
85 90 95
Thr Ala Tyr Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Arg Asp Ile Arg Tyr Ser Gly Asn Ser Tyr Lys
115 120 125
Trp Tyr Phe Asp Val Trp Gly Thr Gly Thr Thr Val Thr Val Ser Ser
130 135 140
<210> 3
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR1 VH mAb 2G1
<400> 3
Gly Tyr Thr Ile Thr Asp Tyr Asn Leu Asp
1 5 10
<210> 4
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR2 VH mAb 2G1
<400> 4
Asp Ile Ser Pro Asn Tyr Gly Tyr Thr Ile Tyr Asn Gln Lys Phe Lys
1 5 10 15
Asp
<210> 5
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR3 VH mAb 2G1
<400> 5
Arg Asp Ile Arg Tyr Ser Gly Asn Ser Tyr Lys Trp Tyr Phe Asp Val
1 5 10 15
<210> 6
<211> 381
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность VL mAb 2G1
<400> 6
atgaggttcc aggttcaggt tctggggctc cttctgctct ggatatcagg tgcccagtgt 60
gatgtccaga taacccagtc tccatcttat cttgctgcat ctcctggaga aaccattact 120
attaattgca ggacaagtaa gagcataagc aaatatttag cctggtatca agagaaacct 180
gggaaaacta ataagcttct tatctactct ggatccacct tgcaatctgg aattccatca 240
aggttcaggg gcagtggatc tggtacagat ttcactctca ccatcagtag cctggagcct 300
gaagattttg caatgtatta ctgtcaacaa cataatgaat acccgtacac gttcggaggg 360
gggaccaagc tggaaataaa a 381
<210> 7
<211> 127
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность VL mAb 2G1
<400> 7
Met Arg Phe Gln Val Gln Val Leu Gly Leu Leu Leu Leu Trp Ile Ser
1 5 10 15
Gly Ala Gln Cys Asp Val Gln Ile Thr Gln Ser Pro Ser Tyr Leu Ala
20 25 30
Ala Ser Pro Gly Glu Thr Ile Thr Ile Asn Cys Arg Thr Ser Lys Ser
35 40 45
Ile Ser Lys Tyr Leu Ala Trp Tyr Gln Glu Lys Pro Gly Lys Thr Asn
50 55 60
Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro Ser
65 70 75 80
Arg Phe Arg Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
85 90 95
Ser Leu Glu Pro Glu Asp Phe Ala Met Tyr Tyr Cys Gln Gln His Asn
100 105 110
Glu Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
115 120 125
<210> 8
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR1 VL mAb 2G1
<400> 8
Arg Thr Ser Lys Ser Ile Ser Lys Tyr Leu Ala
1 5 10
<210> 9
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR2 VL mAb 2G1
<400> 9
Ser Gly Ser Thr Leu Gln Ser
1 5
<210> 10
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR3 VL mAb 2G1
<400> 10
Gln Gln His Asn Glu Tyr Pro Tyr Thr
1 5
<210> 11
<211> 414
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность VH mAb 8E1
<400> 11
atggctgtcc tggggctgct tctctgcctg gtgactttcc caagctgtgt cctgtcccag 60
gtgcagctga aggagtcagg acctggcctg gtggcgccct cacagagcct gtccatcaca 120
tgcaccgtct cagggttccc tttaaacaac tatggaatac actgggttcg ccagcctcca 180
ggaaagggtc tggagtggct ggcagtgata tggagtgatg gaagaacaac ctataattca 240
gctctcaact ccagactgag catcagcaag gacaactcca agagccaagt tttctttaaa 300
atgaacagtc tccaaactga tgacacagcc atgtactatt gtgccagaca tgatggtcgg 360
ggggactata gtatggacta ctggggtcaa ggaacctcag tcaccgtctc ctca 414
<210> 12
<211> 138
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность VH mAb 8E1
<400> 12
Met Ala Val Leu Gly Leu Leu Leu Cys Leu Val Thr Phe Pro Ser Cys
1 5 10 15
Val Leu Ser Gln Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala
20 25 30
Pro Ser Gln Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Pro Leu
35 40 45
Asn Asn Tyr Gly Ile His Trp Val Arg Gln Pro Pro Gly Lys Gly Leu
50 55 60
Glu Trp Leu Ala Val Ile Trp Ser Asp Gly Arg Thr Thr Tyr Asn Ser
65 70 75 80
Ala Leu Asn Ser Arg Leu Ser Ile Ser Lys Asp Asn Ser Lys Ser Gln
85 90 95
Val Phe Phe Lys Met Asn Ser Leu Gln Thr Asp Asp Thr Ala Met Tyr
100 105 110
Tyr Cys Ala Arg His Asp Gly Arg Gly Asp Tyr Ser Met Asp Tyr Trp
115 120 125
Gly Gln Gly Thr Ser Val Thr Val Ser Ser
130 135
<210> 13
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR1 VH mAb 8E1
<400> 13
Gly Phe Pro Leu Asn Asn Tyr Gly Ile His
1 5 10
<210> 14
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR2 VH mAb 8E1
<400> 14
Val Ile Trp Ser Asp Gly Arg Thr Thr Tyr Asn Ser Ala Leu Asn Ser
1 5 10 15
<210> 15
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR3 VH mAb 8E1
<400> 15
His Asp Gly Arg Gly Asp Tyr Ser Met Asp Tyr
1 5 10
<210> 16
<211> 390
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность VL mAb 8E1
<400> 16
atggagacag acacactcct gttatgggta ctgctgctct gggcccttag ttccgagctc 60
gtgatgacac agtctcctgc ttccttagtt gtatctctgg ggcagagggc caccatctca 120
tgcagggcca gcaaaggtgt cagtacatct gtctacagtt atatgcactg gtaccaacag 180
aaaccaggac agccacccaa actcctcatc tatcttgcat ccaacctaga atctggggtc 240
cctgccaggt tcagtggcag tgggtctggg acagacttct ccctcaacat ccatcctgtg 300
gaggaggagg atgctgcaac ctattactgt cagcaaagtg gggagcttcc gctcacgttc 360
ggtgctggga ccaagctgga gctgaaacgg 390
<210> 17
<211> 130
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность VL mAb 8E1
<400> 17
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Ala Leu
1 5 10 15
Ser Ser Glu Leu Val Met Thr Gln Ser Pro Ala Ser Leu Val Val Ser
20 25 30
Leu Gly Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Lys Gly Val Ser
35 40 45
Thr Ser Val Tyr Ser Tyr Met His Trp Tyr Gln Gln Lys Pro Gly Gln
50 55 60
Pro Pro Lys Leu Leu Ile Tyr Leu Ala Ser Asn Leu Glu Ser Gly Val
65 70 75 80
Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Ser Leu Asn
85 90 95
Ile His Pro Val Glu Glu Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln
100 105 110
Ser Gly Glu Leu Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu
115 120 125
Lys Arg
130
<210> 18
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR1 VL mAb 8E1
<400> 18
Arg Ala Ser Lys Gly Val Ser Thr Ser Val Tyr Ser Tyr Met His
1 5 10 15
<210> 19
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR2 VL mAb 8E1
<400> 19
Leu Ala Ser Asn Leu Glu Ser
1 5
<210> 20
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR3 VL mAb 8E1
<400> 20
Gln Gln Ser Gly Glu Leu Pro Leu Thr
1 5
<210> 21
<211> 429
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность VH mAb 4E7
<400> 21
atgtcctctc ctcagacact gaacacactg actctaacca tgggatggag ctggatcttt 60
ctctttctcc tgtcagaaac tgcaggagtc ctctctgagg tccagctgca acagggggct 120
tcagtgaaga tgtcctgtaa gacttctcga tactcattca ctgactacat catgcactgg 180
gtgaagctga gccatggaaa gagccttgag tggattggat atattaaccc taacaatggt 240
ggtactatct acaaccagaa gttcaaggac aaggccacat tgactgtaaa caagtcctcc 300
agcacagcct acatggaatt ccgcagcctg acatcggagg attctgcagt ctatttctgt 360
tcaagagggg gggtttatta ccgggggttt gcttactggg gccaagggac actggtcact 420
gtctctgca 429
<210> 22
<211> 143
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность VH mAb 4E7
<400> 22
Met Ser Ser Pro Gln Thr Leu Asn Thr Leu Thr Leu Thr Met Gly Trp
1 5 10 15
Ser Trp Ile Phe Leu Phe Leu Leu Ser Glu Thr Ala Gly Val Leu Ser
20 25 30
Glu Val Gln Leu Gln Gln Gly Ala Ser Val Lys Met Ser Cys Lys Thr
35 40 45
Ser Arg Tyr Ser Phe Thr Asp Tyr Ile Met His Trp Val Lys Leu Ser
50 55 60
His Gly Lys Ser Leu Glu Trp Ile Gly Tyr Ile Asn Pro Asn Asn Gly
65 70 75 80
Gly Thr Ile Tyr Asn Gln Lys Phe Lys Asp Lys Ala Thr Leu Thr Val
85 90 95
Asn Lys Ser Ser Ser Thr Ala Tyr Met Glu Phe Arg Ser Leu Thr Ser
100 105 110
Glu Asp Ser Ala Val Tyr Phe Cys Ser Arg Gly Gly Val Tyr Tyr Arg
115 120 125
Gly Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ala
130 135 140
<210> 23
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR1 VH mAb 4E7
<400> 23
Arg Tyr Ser Phe Thr Asp Tyr Ile Met
1 5
<210> 24
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR2 VH mAb 4E7
<400> 24
Tyr Ile Asn Pro Asn Asn Gly Gly Thr Ile Tyr Asn Gln Lys Phe Lys
1 5 10 15
Asp
<210> 25
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR3 VH mAb 4E7
<400> 25
Gly Gly Val Tyr Tyr Arg Gly Phe Ala Tyr
1 5 10
<210> 26
<211> 411
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность VL mAb 4E7
<400> 26
atggcctgga tttcacttat actctctctc ctggctctca gctcaggggc catttcccag 60
gctgttgtga ctcaggaatc tgcactcacc acatcacctg gtgaaacagt cacattcact 120
tgtcgctcaa gtactggggc tgttacaaac agtaactatg ccaactgggt ccaagaaaaa 180
ccagatcatt ttttcactgg tctaataggt gttaccaaca accgaggtcc aggtgttcct 240
gcccgattct caggctccct gattggagac aaggctgccc tcaccatcac aggggcacag 300
actgaggatg aggcaatata tttctgtgct ctatggtaca gcaaccactt gggtgttcgg 360
tggaggaacc aaactgactg tcctaggcca gcccaagtct tcgccatcag t 411
<210> 27
<211> 137
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность VL mAb 4E7
<400> 27
Met Ala Trp Ile Ser Leu Ile Leu Ser Leu Leu Ala Leu Ser Ser Gly
1 5 10 15
Ala Ile Ser Gln Ala Val Val Thr Gln Glu Ser Ala Leu Thr Thr Ser
20 25 30
Pro Gly Glu Thr Val Thr Phe Thr Cys Arg Ser Ser Thr Gly Ala Val
35 40 45
Thr Asn Ser Asn Tyr Ala Asn Trp Val Gln Glu Lys Pro Asp His Phe
50 55 60
Phe Thr Gly Leu Ile Gly Val Thr Asn Asn Arg Gly Pro Gly Val Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Leu Ile Gly Asp Lys Ala Ala Leu Thr Ile
85 90 95
Thr Gly Ala Gln Thr Glu Asp Glu Ala Ile Tyr Phe Cys Ala Leu Trp
100 105 110
Tyr Ser Asn His Leu Gly Val Arg Trp Arg Asn Gln Thr Asp Cys Pro
115 120 125
Arg Pro Ala Gln Val Phe Ala Ile Ser
130 135
<210> 28
<211> 14
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR1 VL mAb 4E7
<400> 28
Arg Ser Ser Thr Gly Ala Val Thr Asn Ser Asn Tyr Ala Asn
1 5 10
<210> 29
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR2 VL mAb 4E7
<400> 29
Val Thr Asn Asn Arg Gly Pro
1 5
<210> 30
<211> 423
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность VH mAb 9G6
<400> 30
atggattggg tgtggacctt ggtattcctg atagcagctg cccaaagtgc ccaagcacag 60
atccagttgg tgcagtctgg acctgagctg aagaagcctg gagagacagt caagatctcc 120
tgcaaggctt ctgggtatac cttcacagaa tatccaatgc actgggtgaa gcaggctcca 180
ggaaagagtt tcaagtggat gggcatccta tacaccgaca ctggagagcc aacatatgct 240
gaagagttca ggggacggtt tgccttctct ttggagacct ctgccagcac tgcctatttg 300
cagatcaaca acctcaaaaa tgaggacacg gctacatatt tctgtgttca ctcaggctac 360
gtaggctact ggggccaagg caccactctc acagtctcat cagccaaaac aacaccccca 420
tca 423
<210> 31
<211> 134
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность VH mAb 9G6
<400> 31
Met Asp Trp Val Trp Thr Leu Val Phe Leu Ile Ala Ala Ala Gln Ser
1 5 10 15
Ala Gln Ala Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys
20 25 30
Pro Gly Glu Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe
35 40 45
Thr Glu Tyr Pro Met His Trp Val Lys Gln Ala Pro Gly Lys Ser Phe
50 55 60
Lys Trp Met Gly Ile Leu Tyr Thr Asp Thr Gly Glu Pro Thr Tyr Ala
65 70 75 80
Glu Glu Phe Arg Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser
85 90 95
Thr Ala Tyr Leu Gln Ile Asn Asn Leu Lys Asn Glu Asp Thr Ala Thr
100 105 110
Tyr Phe Cys Val His Ser Gly Tyr Val Gly Tyr Trp Gly Gln Gly Thr
115 120 125
Thr Leu Thr Val Ser Ser
130
<210> 32
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR1 VH mAb 9G6
<400> 32
Gly Tyr Thr Phe Thr Glu Tyr Pro Met His
1 5 10
<210> 33
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR2 VH mAb 9G6
<400> 33
Ile Leu Tyr Thr Asp Thr Gly Glu Pro Thr Tyr Ala Glu Glu Phe Arg
1 5 10 15
Gly
<210> 34
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR3 VH mAb 9G6
<400> 34
Ser Gly Tyr Val Gly Tyr
1 5
<210> 35
<211> 384
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность VL mAb 9G6
<400> 35
atgagtgtgc ccactcaggt cctggggttg ctgctgctgt ggcttacagg tgccagatgt 60
gacatccaga tgactcagtc tccagcctcc ctatcagcat ctgtgggaga aactgtcacc 120
ttcacatgtc gggcaagtga gattatttac agttatttag tttggtatca gcagaaacag 180
ggaaaatctc ctcagctcct ggtctctaat gcaaaaacct tagcagaggg tgtgccatca 240
aggttcagtg gcagtggatc aggcacacag ttttctctga agatcaatag cctgcagcct 300
gaagattttg ggagttatta ctgtcaacat tattatggta atcctcccac gttcggaggg 360
gggaccaagc tggaaataaa acgg 384
<210> 36
<211> 128
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность VL mAb 9G6
<400> 36
Met Ser Val Pro Thr Gln Val Leu Gly Leu Leu Leu Leu Trp Leu Thr
1 5 10 15
Gly Ala Arg Cys Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser
20 25 30
Ala Ser Val Gly Glu Thr Val Thr Phe Thr Cys Arg Ala Ser Glu Ile
35 40 45
Ile Tyr Ser Tyr Leu Val Trp Tyr Gln Gln Lys Gln Gly Lys Ser Pro
50 55 60
Gln Leu Leu Val Ser Asn Ala Lys Thr Leu Ala Glu Gly Val Pro Ser
65 70 75 80
Arg Phe Ser Gly Ser Gly Ser Gly Thr Gln Phe Ser Leu Lys Ile Asn
85 90 95
Ser Leu Gln Pro Glu Asp Phe Gly Ser Tyr Tyr Cys Gln His Tyr Tyr
100 105 110
Gly Asn Pro Pro Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
115 120 125
<210> 37
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR1 VL mAb 9G6
<400> 37
Arg Ala Ser Glu Ile Ile Tyr Ser Tyr Leu Val
1 5 10
<210> 38
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR2 VL mAb 9G6
<400> 38
Asn Ala Lys Thr Leu Ala Glu
1 5
<210> 39
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR3 VL mAb 9G6
<400> 39
Gln His Tyr Tyr Gly Asn Pro Pro Thr
1 5
<210> 40
<211> 447
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность VH mAb 11C5
<400> 40
atgagcactg aacacggacc cctcaccatg aacttcgggc tcagcttgat tttccttgtc 60
cttgttttaa aaggtgtcca gtgtgaagtg cagctagtgg agtctggggg aggcttagtg 120
aagcctggag ggtccctgaa actctcctgt gcagcctctg gattcacttt cactacctat 180
gccatgtctt gggttcgcca gactccggaa aagaggctgg agtgggtcgc aaccattagt 240
gctggtggta cttacaccta ctattcagac aatgtaaagg gccgattcac catctccaga 300
gacaatgcca agaacaacct gtacctgcaa atgagccatc tgaagtctga ggacacagcc 360
atgttttact gtgcaagaga tcccgattac tacggtagaa gcccgtttgc ttactggggc 420
caagggactc tggtcactgt ctctgca 447
<210> 41
<211> 149
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность VH mAb 11C5
<400> 41
Met Ser Thr Glu His Gly Pro Leu Thr Met Asn Phe Gly Leu Ser Leu
1 5 10 15
Ile Phe Leu Val Leu Val Leu Lys Gly Val Gln Cys Glu Val Gln Leu
20 25 30
Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly Ser Leu Lys Leu
35 40 45
Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Thr Tyr Ala Met Ser Trp
50 55 60
Val Arg Gln Thr Pro Glu Lys Arg Leu Glu Trp Val Ala Thr Ile Ser
65 70 75 80
Ala Gly Gly Thr Tyr Thr Tyr Tyr Ser Asp Asn Val Lys Gly Arg Phe
85 90 95
Thr Ile Ser Arg Asp Asn Ala Lys Asn Asn Leu Tyr Leu Gln Met Ser
100 105 110
His Leu Lys Ser Glu Asp Thr Ala Met Phe Tyr Cys Ala Arg Asp Pro
115 120 125
Asp Tyr Tyr Gly Arg Ser Pro Phe Ala Tyr Trp Gly Gln Gly Thr Leu
130 135 140
Val Thr Val Ser Ala
145
<210> 42
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR1 VH mAb 11C5
<400> 42
Gly Phe Thr Phe Thr Thr Tyr Ala Met Ser
1 5 10
<210> 43
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR2 VH mAb 11C5
<400> 43
Thr Ile Ser Ala Gly Gly Thr Tyr Thr Tyr Tyr Ser Asp Asn Val Lys
1 5 10 15
Gly
<210> 44
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR3 VH mAb 11C5
<400> 44
Asp Pro Asp Tyr Tyr Gly Arg Ser Pro Phe Ala Tyr
1 5 10
<210> 45
<211> 384
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность VL mAb 11C5
<400> 45
atggttttca cacctcagat acttggactt atgctttttt ggatttcagc ctccagaggt 60
gaaattgtgc tcactcagtc tccagccacc ctgtctgtga ctccaggaga gagcgtcagt 120
ctttcctgta gggccagcca aagtattagc aacaacctac agtggtatca acaaaaatca 180
catgagtctc caagacttct catcaaatat gcttcccagt ccatctctgg gatcccctcc 240
aggttcagtg gcagtggatc agggacagat ttcactctca gtatcaacag tgtggagact 300
gaagattttg gaatgtattt ctgtcaacag agtaacagct ggcctctcac gttcggtggt 360
gggaccaagg tggagctgaa acgg 384
<210> 46
<211> 128
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность VL mAb 11C5
<400> 46
Met Val Phe Thr Pro Gln Ile Leu Gly Leu Met Leu Phe Trp Ile Ser
1 5 10 15
Ala Ser Arg Gly Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser
20 25 30
Val Thr Pro Gly Glu Ser Val Ser Leu Ser Cys Arg Ala Ser Gln Ser
35 40 45
Ile Ser Asn Asn Leu Gln Trp Tyr Gln Gln Lys Ser His Glu Ser Pro
50 55 60
Arg Leu Leu Ile Lys Tyr Ala Ser Gln Ser Ile Ser Gly Ile Pro Ser
65 70 75 80
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Ser Ile Asn
85 90 95
Ser Val Glu Thr Glu Asp Phe Gly Met Tyr Phe Cys Gln Gln Ser Asn
100 105 110
Ser Trp Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Leu Lys Arg
115 120 125
<210> 47
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR1 VL mAb 11C5
<400> 47
Arg Ala Ser Gln Ser Ile Ser Asn Asn Leu Gln
1 5 10
<210> 48
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR2 VL mAb 11C5
<400> 48
Tyr Ala Ser Gln Ser Ile Ser
1 5
<210> 49
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR3 VL mAb 11C5
<400> 49
Gln Gln Ser Asn Ser Trp Pro Leu Thr
1 5
<210> 50
<211> 465
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность VH mAb 11D9
<400> 50
atgtcctcac cacagacact gaacacactg actctaacca tgggatggag ctggatcttt 60
ctctttctcc tgtcaggaac tgcaggtgtc ctctctgagg tccagctgca acaatctgga 120
cctgaggtgg tgaagcctgg ggcttcagtg aagatatcct gtaaggcttc tggatacacg 180
ttcactgact tctacatgaa ctgggtgaaa cagagccatg gaaagagcct tgagtggatt 240
ggatatatta atcctaacaa tggtgatact agttacaacc agaagttcaa gggcaaggcc 300
acatcgactg tagacaggtc ctccaacaca gcctacatgg agctccgcag cctgacatct 360
gaggactctg cagtctatta ctgtgcaaga ctcatcttct atggtaactg gtactttgat 420
gtctggggca cagggaccac ggtcaccgtc tcctcagcca aaaca 465
<210> 51
<211> 155
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность VH mAb 11D9
<400> 51
Met Ser Ser Pro Gln Thr Leu Asn Thr Leu Thr Leu Thr Met Gly Trp
1 5 10 15
Ser Trp Ile Phe Leu Phe Leu Leu Ser Gly Thr Ala Gly Val Leu Ser
20 25 30
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Val Val Lys Pro Gly Ala
35 40 45
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Phe
50 55 60
Tyr Met Asn Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
65 70 75 80
Gly Tyr Ile Asn Pro Asn Asn Gly Asp Thr Ser Tyr Asn Gln Lys Phe
85 90 95
Lys Gly Lys Ala Thr Ser Thr Val Asp Arg Ser Ser Asn Thr Ala Tyr
100 105 110
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
115 120 125
Ala Arg Leu Ile Phe Tyr Gly Asn Trp Tyr Phe Asp Val Trp Gly Thr
130 135 140
Gly Thr Thr Val Thr Val Ser Ser Ala Lys Thr
145 150 155
<210> 52
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR1 VH mAb 11D9
<400> 52
Gly Tyr Thr Phe Thr Asp Phe Tyr Met Asn
1 5 10
<210> 53
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR2 VH mAb 11D9
<400> 53
Tyr Ile Asn Pro Asn Asn Gly Asp Thr Ser Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 54
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR3 VH mAb 11D9
<400> 54
Leu Ile Phe Tyr Gly Asn Trp Tyr Phe Asp Val
1 5 10
<210> 55
<211> 393
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность VL mAb 11D9
<400> 55
atggattttc agatgcagat tatcagcttg ctgctaatca gtgtcacagt catagtgtct 60
aatggagaaa ttgtgctcac ccagtctcca cccaccatgg ctgcatctcc cggggagaag 120
atcactatca cctgcagtgc cagctcaagt ataagttcca attacgtgca ttggtatcag 180
cagaagccag gattctcccc taaactcttg atttatagga catccaatct ggcttctgga 240
gtcccagttc gcttcagtgg cagtgggtct gggacctctt actctctcac aattggcacc 300
atggaggctg aagatgttgc cacttactac tgccagcagg gtactagtat accgtggacg 360
ttcggtggag gcaccaaggt ggaaattaat cgg 393
<210> 56
<211> 131
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность VL mAb 11D9
<400> 56
Met Asp Phe Gln Met Gln Ile Ile Ser Leu Leu Leu Ile Ser Val Thr
1 5 10 15
Val Ile Val Ser Asn Gly Glu Ile Val Leu Thr Gln Ser Pro Pro Thr
20 25 30
Met Ala Ala Ser Pro Gly Glu Lys Ile Thr Ile Thr Cys Ser Ala Ser
35 40 45
Ser Ser Ile Ser Ser Asn Tyr Val His Trp Tyr Gln Gln Lys Pro Gly
50 55 60
Phe Ser Pro Lys Leu Leu Ile Tyr Arg Thr Ser Asn Leu Ala Ser Gly
65 70 75 80
Val Pro Val Arg Phe Ser Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu
85 90 95
Thr Ile Gly Thr Met Glu Ala Glu Asp Val Ala Thr Tyr Tyr Cys Gln
100 105 110
Gln Gly Thr Ser Ile Pro Trp Thr Phe Gly Gly Gly Thr Lys Val Glu
115 120 125
Ile Asn Arg
130
<210> 57
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR1 VL mAb 11D9
<400> 57
Ser Ala Ser Ser Ser Ile Ser Ser Asn Tyr Val His
1 5 10
<210> 58
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR2 VL mAb 11D9
<400> 58
Arg Thr Ser Asn Leu Ala Ser
1 5
<210> 59
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR3 VL mAb 11D9
<400> 59
Gln Gln Gly Thr Ser Ile Pro Trp Thr
1 5
<210> 60
<211> 327
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность константной области
тяжелой цепи человеческого IgG4 с мутацией S228P
<400> 60
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Pro Gly Lys
325
<210> 61
<211> 106
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность константной области
человеческой легкой цепи каппа
<400> 61
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
1 5 10 15
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
20 25 30
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
35 40 45
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
50 55 60
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
65 70 75 80
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
85 90 95
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 62
<211> 432
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность гуманизованного 2G1 VH-11801
<400> 62
atggactgga cctgggtctt tctcttcctc ctgtcagtaa ctgcaggtgt ccactcccag 60
gttcagctgg tgcagtctgg agctgaggtg aagaagcctg gggcctcagt gaaggtctcc 120
tgcaaggctt ctggatacac aatcacagac tacaatttgg actgggtgcg acaggcccct 180
ggacaagggc ttgagtggat gggagatatt agtcctaact atggttatac tatctacaac 240
cagaaattca aggacagagt caccatgacc acagacacat ccacgagcac agcctacatg 300
gagctgagga gcctgagatc tgacgacacg gccgtgtatt actgtgcgag aagggacatt 360
cgttactccg gtaattccta caaatggtac ttcgatgtct ggggccaagg gacaatggtc 420
accgtctctt ca 432
<210> 63
<211> 144
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность гуманизованного 2G1 VH-11801
<400> 63
Met Asp Trp Thr Trp Val Phe Leu Phe Leu Leu Ser Val Thr Ala Gly
1 5 10 15
Val His Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
20 25 30
Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Ile
35 40 45
Thr Asp Tyr Asn Leu Asp Trp Val Arg Gln Ala Pro Gly Gln Gly Leu
50 55 60
Glu Trp Met Gly Asp Ile Ser Pro Asn Tyr Gly Tyr Thr Ile Tyr Asn
65 70 75 80
Gln Lys Phe Lys Asp Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser
85 90 95
Thr Ala Tyr Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Arg Asp Ile Arg Tyr Ser Gly Asn Ser Tyr Lys
115 120 125
Trp Tyr Phe Asp Val Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
130 135 140
<210> 64
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR1 гуманизованного 2G1 VH-11801
<400> 64
Gly Tyr Thr Ile Thr Asp Tyr Asn Leu Asp
1 5 10
<210> 65
<211> 18
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR2 гуманизованного 2G1 VH-11801
<400> 65
Gly Asp Ile Ser Pro Asn Tyr Gly Tyr Thr Ile Tyr Asn Gln Lys Phe
1 5 10 15
Lys Asp
<210> 66
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR3 гуманизованного 2G1 VH-11801
<400> 66
Arg Asp Ile Arg Tyr Ser Gly Asn Ser Tyr Lys Trp Tyr Phe Asp Val
1 5 10 15
<210> 67
<211> 432
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность гуманизованного 2G1 VH-16901
<400> 67
atggactgga cctgggtctt tctcttcctc ctgtcagtaa ctgcaggtgt ccactcccag 60
gtgcagctgg tgcagtctgg ggctgaggtg aagaagcctg ggtcctcggt gaaggtctcc 120
tgcaaggctt ctggatacac aatcacagac tacaatttgg actgggtgcg acaggcccct 180
ggacaagggc ttgagtggat gggagatatt agtcctaact atggttatac tatctacaac 240
cagaaattca aggacagagt cacgattacc gcggacgaat ccacgagcac agcctacatg 300
gagctgagca gcctgagatc tgaggacacg gccgtgtatt actgtgcgag aagggacatt 360
cgttactccg gtaattccta caaatggtac ttcgatgtct ggggccaagg gacaatggtc 420
accgtctctt ca 432
<210> 68
<211> 144
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность гуманизованного 2G1 VH-16901
<400> 68
Met Asp Trp Thr Trp Val Phe Leu Phe Leu Leu Ser Val Thr Ala Gly
1 5 10 15
Val His Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
20 25 30
Pro Gly Ser Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Ile
35 40 45
Thr Asp Tyr Asn Leu Asp Trp Val Arg Gln Ala Pro Gly Gln Gly Leu
50 55 60
Glu Trp Met Gly Asp Ile Ser Pro Asn Tyr Gly Tyr Thr Ile Tyr Asn
65 70 75 80
Gln Lys Phe Lys Asp Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser
85 90 95
Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Arg Asp Ile Arg Tyr Ser Gly Asn Ser Tyr Lys
115 120 125
Trp Tyr Phe Asp Val Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
130 135 140
<210> 69
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR1 гуманизованного 2G1 VH-16901
<400> 69
Gly Tyr Thr Ile Thr Asp Tyr Asn Leu Asp
1 5 10
<210> 70
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR2 гуманизованного 2G1 VH-16901
<400> 70
Asp Ile Ser Pro Asn Tyr Gly Tyr Thr Ile Tyr Asn Gln Lys Phe Lys
1 5 10 15
Asp
<210> 71
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR3 гуманизованного 2G1 VH-16901
<400> 71
Arg Asp Ile Arg Tyr Ser Gly Asn Ser Tyr Lys Trp Tyr Phe Asp Val
1 5 10 15
<210> 72
<211> 381
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность гуманизованного 2G1 VL-1901
<400> 72
atggaagccc cagctcagct tctcttcctc ctgctactct ggctcccaga taccaccgga 60
gacatccagt tgacccagtc tccatccttc ctgtctgcat ctgtaggaga cagagtcacc 120
atcacttgca ggacaagtaa gagcataagc aaatatttag cctggtatca gcaaaaacca 180
gggaaagccc ctaagctcct gatctattct ggatccacct tgcaatctgg ggtcccatca 240
aggttcagcg gcagtggatc tgggacagaa ttcactctca caatcagcag cctgcagcct 300
gaagattttg caacttatta ctgtcaacaa cataatgaat acccgtacac gtttggccag 360
gggaccaagc tggagatcaa a 381
<210> 73
<211> 127
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность гуманизованного 2G1 VL-1901
<400> 73
Met Glu Ala Pro Ala Gln Leu Leu Phe Leu Leu Leu Leu Trp Leu Pro
1 5 10 15
Asp Thr Thr Gly Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser
20 25 30
Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Lys Ser
35 40 45
Ile Ser Lys Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
50 55 60
Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Ser
65 70 75 80
Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser
85 90 95
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Asn
100 105 110
Glu Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
115 120 125
<210> 74
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR1 гуманизованного 2G1 VL-1901
<400> 74
Arg Thr Ser Lys Ser Ile Ser Lys Tyr Leu Ala
1 5 10
<210> 75
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR2 гуманизованного 2G1 VL-1901
<400> 75
Ser Gly Ser Thr Leu Gln Ser
1 5
<210> 76
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR3 гуманизованного 2G1 VL-1901
<400> 76
Gln Gln His Asn Glu Tyr Pro Tyr Thr
1 5
<210> 77
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220
<223> ПЦР-праймер
<220>
<221> misc_feature
<222> (19)..(19)
<223> A или T
<220>
<221> misc_feature
<222> (21)..(21)
<223> A или T
<400> 77
gaggtgaagc tggtggagnc nagg 24
<210> 78
<211> 17
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПЦР-праймер
<400> 78
ggggccagtg gatagac 17
<210> 79
<211> 32
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПЦР-праймер
<400> 79
ccagttccga gctccagatg acccagactc ca 32
<210> 80
<211> 32
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПЦР-праймер
<400> 80
ccagttccga gctcgtgctc acccagtctc ca 32
<210> 81
<211> 32
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПЦР-праймер
<400> 81
ccagttccga gctccagatg acccagtctc ca 32
<210> 82
<211> 32
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПЦР-праймер
<400> 82
ccagttccga gctcgtgatg acacagtctc ca 32
<210> 83
<211> 17
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПЦР-праймер
<400> 83
gttggtgcag catcagc 17
<210> 84
<211> 104
<212> PRT
<213> Homo sapiens
<400> 84
Gln Glu Gln Thr Tyr Val Ile Ser Ala Pro Lys Ile Phe Arg Val Gly
1 5 10 15
Ala Ser Glu Asn Ile Val Ile Gln Val Tyr Gly Tyr Thr Glu Ala Phe
20 25 30
Asp Ala Thr Ile Ser Ile Lys Ser Tyr Pro Asp Lys Lys Phe Ser Tyr
35 40 45
Ser Ser Gly His Val His Leu Ser Ser Glu Asn Lys Phe Gln Asn Ser
50 55 60
Ala Ile Leu Thr Ile Gln Pro Lys Gln Leu Pro Gly Gly Gln Asn Pro
65 70 75 80
Val Ser Tyr Val Tyr Leu Glu Val Val Ser Lys His Phe Ser Lys Ser
85 90 95
Lys Arg Met Pro Ile Thr Tyr Asp
100
<210> 85
<211> 101
<212> PRT
<213> Homo sapiens
<400> 85
Asn Gly Phe Leu Phe Ile His Thr Asp Lys Pro Val Tyr Thr Pro Asp
1 5 10 15
Gln Ser Val Lys Val Arg Val Tyr Ser Leu Asn Asp Asp Leu Lys Pro
20 25 30
Ala Lys Arg Glu Thr Val Leu Thr Phe Ile Asp Pro Glu Gly Ser Glu
35 40 45
Val Asp Met Val Glu Glu Ile Asp His Ile Gly Ile Ile Ser Phe Pro
50 55 60
Asp Phe Lys Ile Pro Ser Asn Pro Arg Tyr Gly Met Trp Thr Ile Lys
65 70 75 80
Ala Lys Tyr Lys Glu Asp Phe Ser Thr Thr Gly Thr Ala Tyr Phe Glu
85 90 95
Val Lys Glu Tyr Val
100
<210> 86
<211> 127
<212> PRT
<213> Homo sapiens
<400> 86
Leu Pro His Phe Ser Val Ser Ile Glu Pro Glu Tyr Asn Phe Ile Gly
1 5 10 15
Tyr Lys Asn Phe Lys Asn Phe Glu Ile Thr Ile Lys Ala Arg Tyr Phe
20 25 30
Tyr Asn Lys Val Val Thr Glu Ala Asp Val Tyr Ile Thr Phe Gly Ile
35 40 45
Arg Glu Asp Leu Lys Asp Asp Gln Lys Glu Met Met Gln Thr Ala Met
50 55 60
Gln Asn Thr Met Leu Ile Asn Gly Ile Ala Gln Val Thr Phe Asp Ser
65 70 75 80
Glu Thr Ala Val Lys Glu Leu Ser Tyr Tyr Ser Leu Glu Asp Leu Asn
85 90 95
Asn Lys Tyr Leu Tyr Ile Ala Val Thr Val Ile Glu Ser Thr Gly Gly
100 105 110
Phe Ser Glu Glu Ala Glu Ile Pro Gly Ile Lys Tyr Val Leu Ser
115 120 125
<210> 87
<211> 108
<212> PRT
<213> Homo sapiens
<400> 87
Pro Tyr Lys Leu Asn Leu Val Ala Thr Pro Leu Phe Leu Lys Pro Gly
1 5 10 15
Ile Pro Tyr Pro Ile Lys Val Gln Val Lys Asp Ser Leu Asp Gln Leu
20 25 30
Val Gly Gly Val Pro Val Thr Leu Asn Ala Gln Thr Ile Asp Val Asn
35 40 45
Gln Glu Thr Ser Asp Leu Asp Pro Ser Lys Ser Val Thr Arg Val Asp
50 55 60
Asp Gly Val Ala Ser Phe Val Leu Asn Leu Pro Ser Gly Val Thr Val
65 70 75 80
Leu Glu Phe Asn Val Lys Thr Asp Ala Pro Asp Leu Pro Glu Glu Asn
85 90 95
Gln Ala Arg Glu Gly Tyr Arg Ala Ile Ala Tyr Ser
100 105
<210> 88
<211> 108
<212> PRT
<213> Homo sapiens
<400> 88
Ser Leu Ser Gln Ser Tyr Leu Tyr Ile Asp Trp Thr Asp Asn His Lys
1 5 10 15
Ala Leu Leu Val Gly Glu His Leu Asn Ile Ile Val Thr Pro Lys Ser
20 25 30
Pro Tyr Ile Asp Lys Ile Thr His Tyr Asn Tyr Leu Ile Leu Ser Lys
35 40 45
Gly Lys Ile Ile His Phe Gly Thr Arg Glu Lys Phe Ser Asp Ala Ser
50 55 60
Tyr Gln Ser Ile Asn Ile Pro Val Thr Gln Asn Met Val Pro Ser Ser
65 70 75 80
Arg Leu Leu Val Tyr Tyr Ile Val Thr Gly Glu Gln Thr Ala Glu Leu
85 90 95
Val Ser Asp Ser Val Trp Leu Asn Ile Glu Glu Lys
100 105
<210> 89
<211> 107
<212> PRT
<213> Homo sapiens
<400> 89
Cys Gly Asn Gln Leu Gln Val His Leu Ser Pro Asp Ala Asp Ala Tyr
1 5 10 15
Ser Pro Gly Gln Thr Val Ser Leu Asn Met Ala Thr Gly Met Asp Ser
20 25 30
Trp Val Ala Leu Ala Ala Val Asp Ser Ala Val Tyr Gly Val Gln Arg
35 40 45
Gly Ala Lys Lys Pro Leu Glu Arg Val Phe Gln Phe Leu Glu Lys Ser
50 55 60
Asp Leu Gly Cys Gly Ala Gly Gly Gly Leu Asn Asn Ala Asn Val Phe
65 70 75 80
His Leu Ala Gly Leu Thr Phe Leu Thr Asn Ala Asn Ala Asp Asp Ser
85 90 95
Gln Glu Asn Asp Glu Pro Cys Lys Glu Ile Leu
100 105
<210> 90
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПЦР-праймер
<400> 90
tccccaggtt ttccccagga agat 24
<210> 91
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПЦР-праймер
<400> 91
aatggatttc tcttcattca tac 23
<210> 92
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПЦР-праймер
<400> 92
gtcataggtt attggcattc tt 22
<210> 93
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПЦР-праймер
<400> 93
ttgccacatt tttctgtctc aatc 24
<210> 94
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПЦР-праймер
<400> 94
gacatattct ttaacttcaa aatatg 26
<210> 95
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПЦР-праймер
<400> 95
ccctacaaac tgaatttggt tg 22
<210> 96
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПЦР-праймер
<400> 96
agagaggaca tatttgatgc cag 23
<210> 97
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПЦР-праймер
<400> 97
tctctcagcc aaagttacct t 21
<210> 98
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПЦР-праймер
<400> 98
tgagtatgct attgctcggt aac 23
<210> 99
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПЦР-праймер
<400> 99
tgtggcaacc agctccaggt tc 22
<210> 100
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПЦР-праймер
<400> 100
tttttcttca atatttaacc ag 22
<210> 101
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПЦР-праймер
<400> 101
aggccaagaa gaacgctgca aaag 24
<210> 102
<211> 41
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПЦР-праймер
<400> 102
ttttggcaaa gaattcgcca ccatgggcct tttgggaata c 41
<210> 103
<211> 58
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ПЦР-праймер
<400> 103
cctgaggagt gaattcttaa tggtgatggt gatggtggag aatttcttta caaggttc 58
<210> 104
<211> 327
<212> PRT
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность константной области
тяжелой цепи человеческого IgG4
<400> 104
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Pro Gly Lys
325
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ГУМАНИЗИРОВАННЫЕ АНТИ-C5 АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2792237C2 |
| АНТИ-C5a-АНТИТЕЛА И ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2773779C2 |
| EGFL6-СПЕЦИФИЧЕСКИЕ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2779902C2 |
| АНТИТЕЛА К ПОВЕРХНОСТНЫМ ДЕТЕРМИНАНТАМ S. AUREUS | 2013 |
|
RU2698131C2 |
| АНТИТЕЛА К ПОВЕРХНОСТНЫМ ДЕТЕРМИНАНТАМ S. AUREUS | 2013 |
|
RU2808018C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА К TIM-3 ЧЕЛОВЕКА | 2019 |
|
RU2777336C1 |
| Новые моноклональные антитела к LAM и PIM6/LAM для диагностики и лечения инфекций, вызванных Mycobacterium tuberculosis | 2017 |
|
RU2732502C2 |
| АНТИТЕЛА, СПЕЦИФИЧЕСКИЕ К РЕЦЕПТОРУ ПОЛИОВИРУСА (PVR) ЧЕЛОВЕКА | 2017 |
|
RU2756275C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА К ИНТЕРЛЕЙКИНУ-31 ДЛЯ ВЕТЕРИНАРНОГО ПРИМЕНЕНИЯ | 2019 |
|
RU2795411C2 |
| НЕВИРУСНЫЙ ИММУНОТАРГЕТИНГ | 2020 |
|
RU2833379C2 |
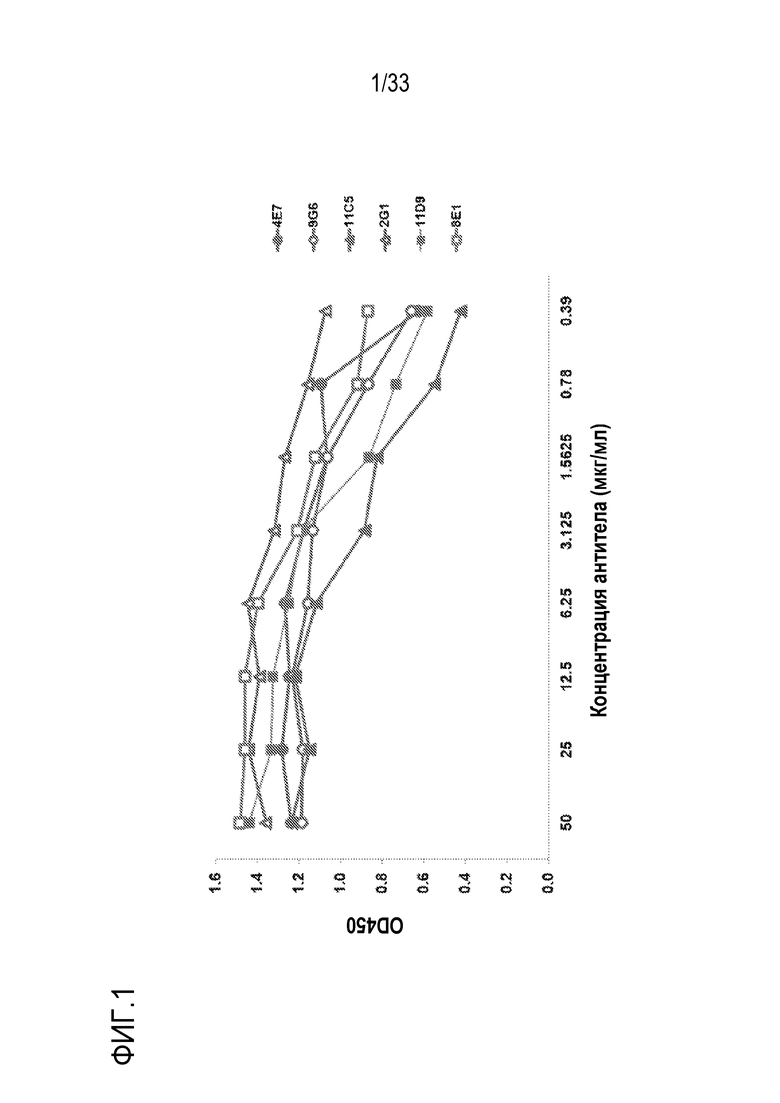
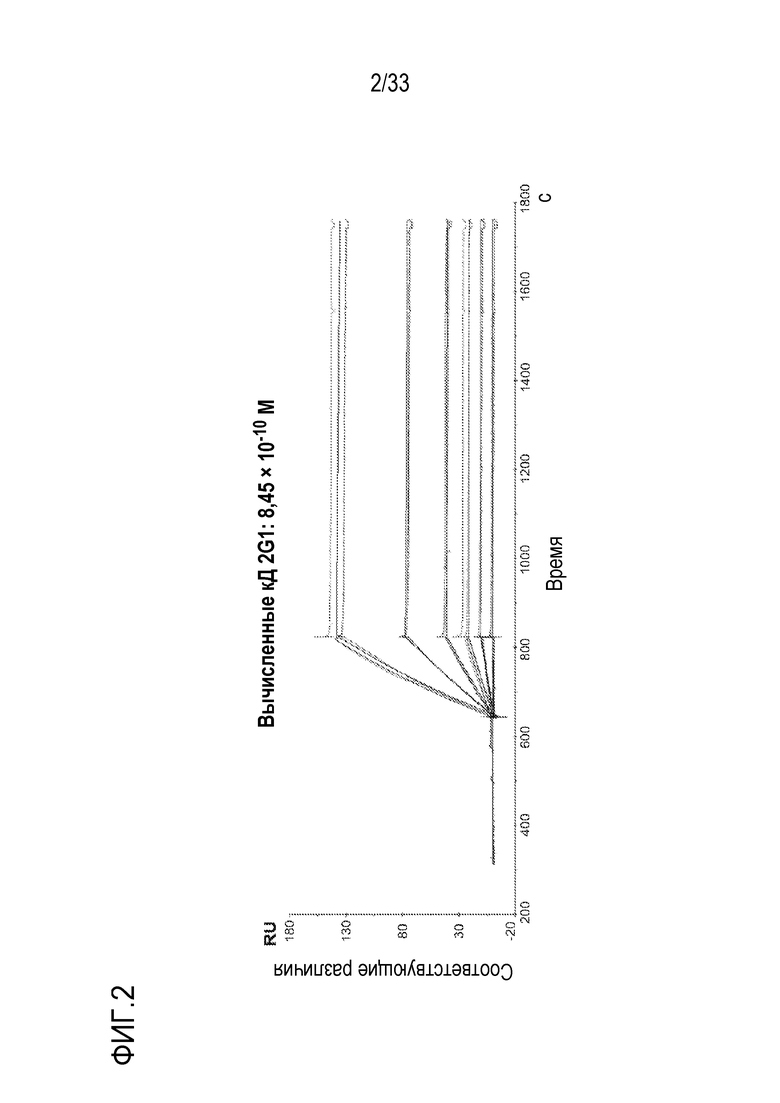
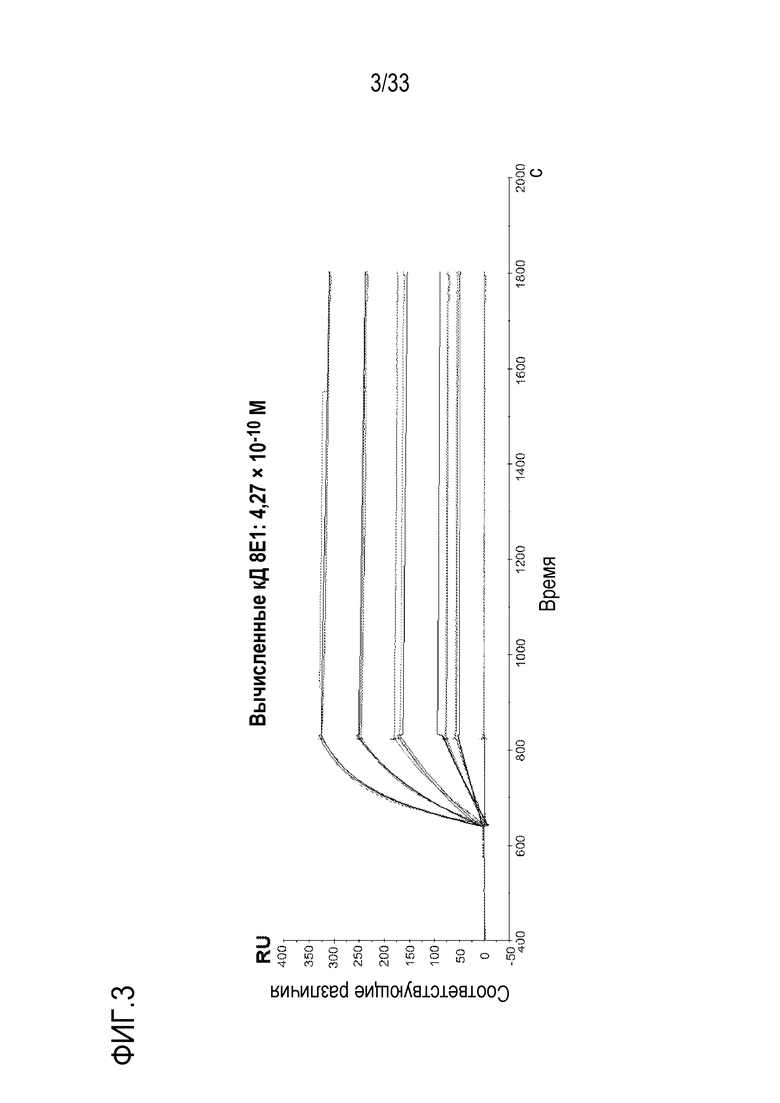
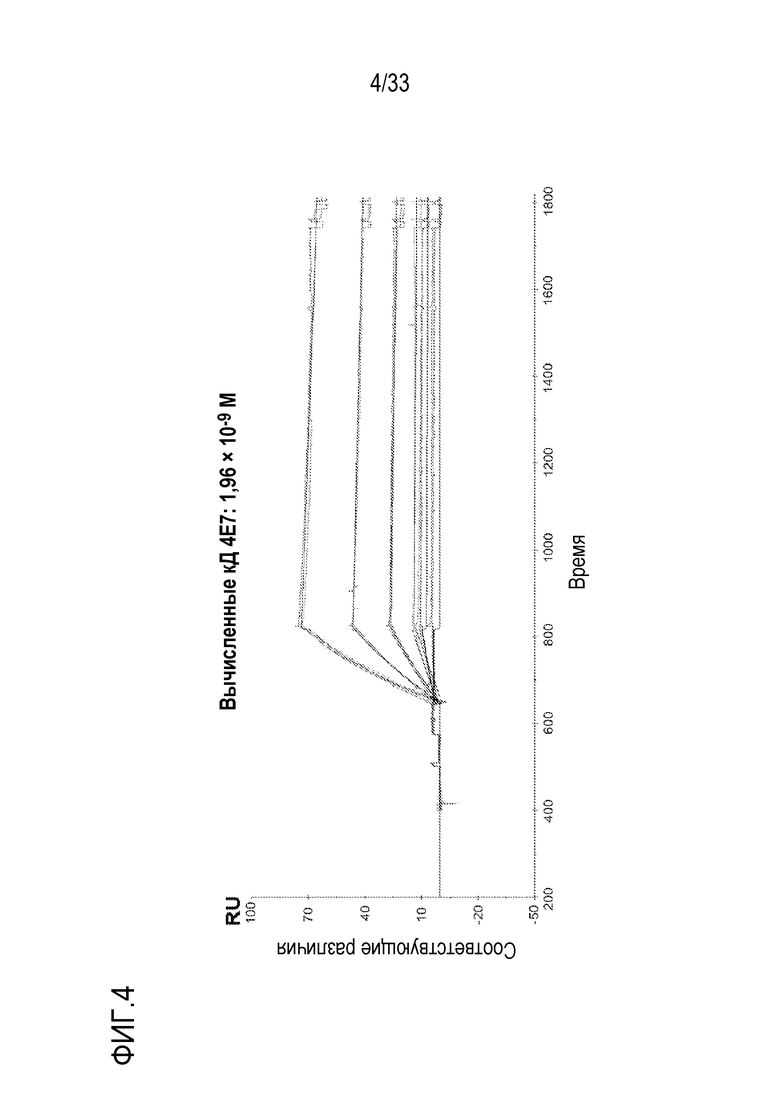


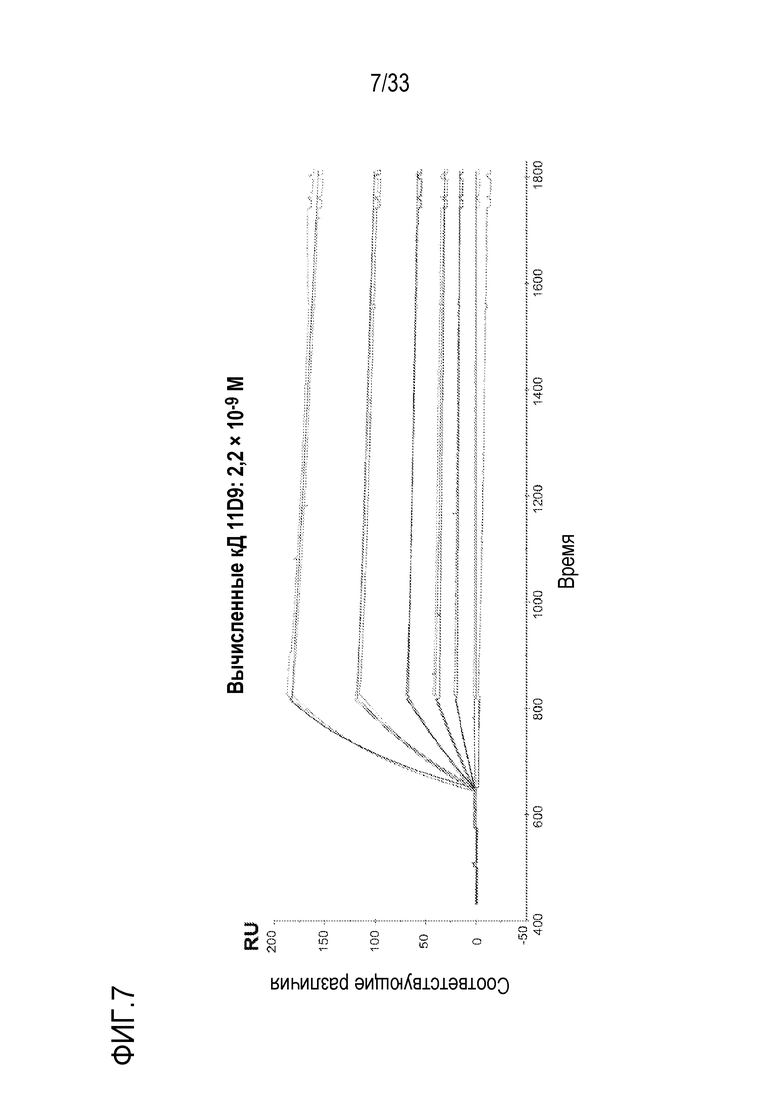
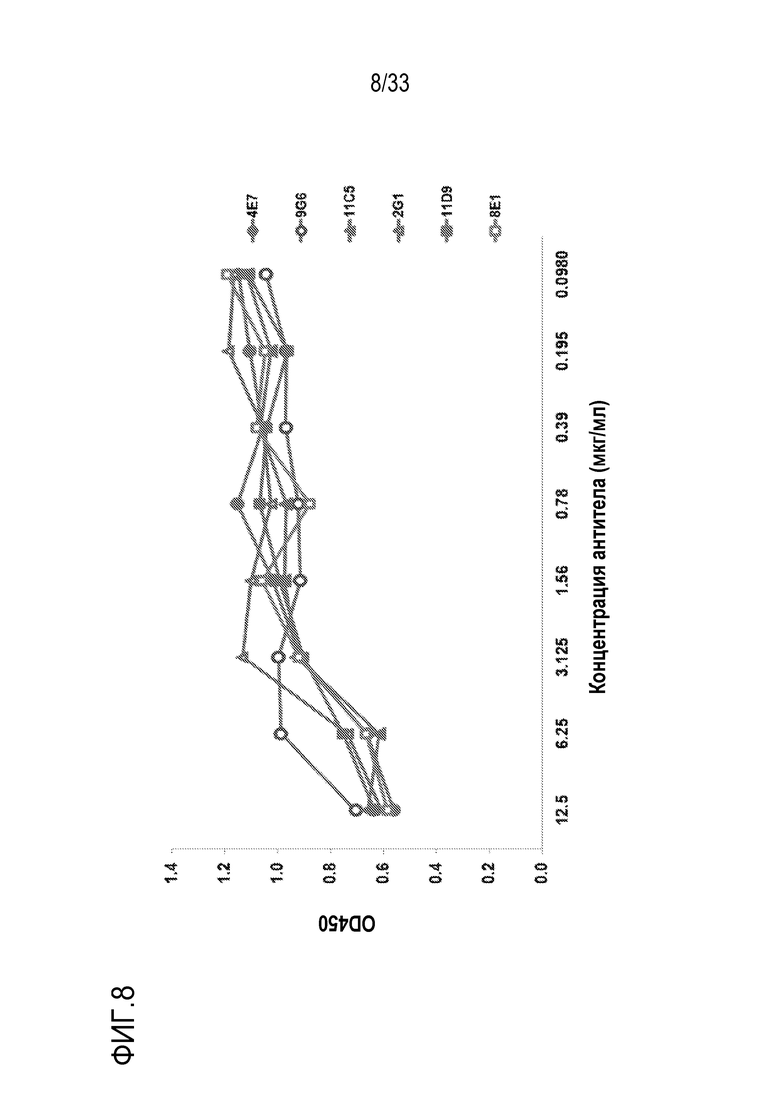
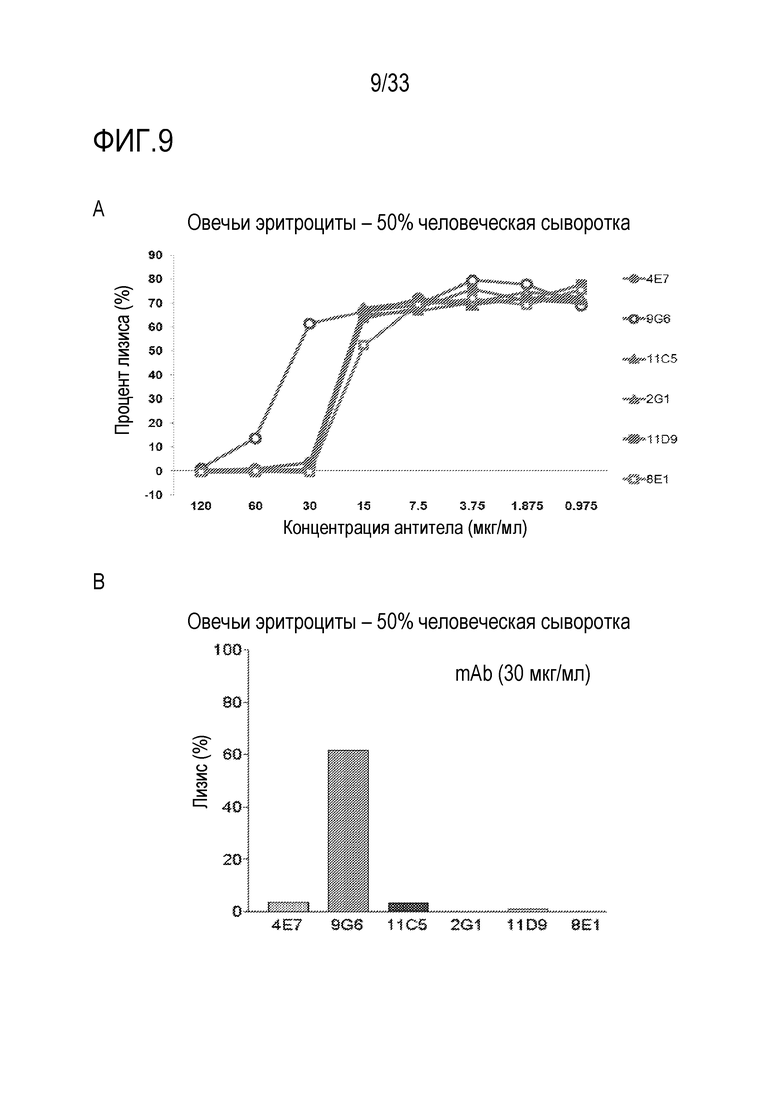
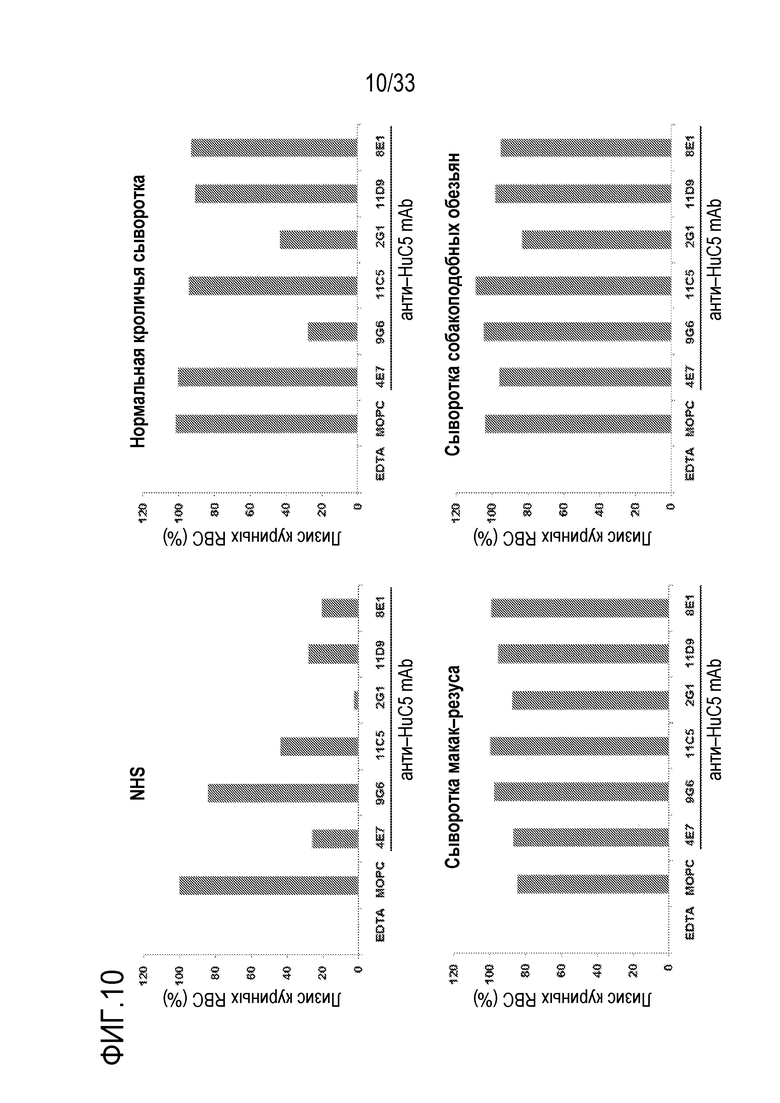
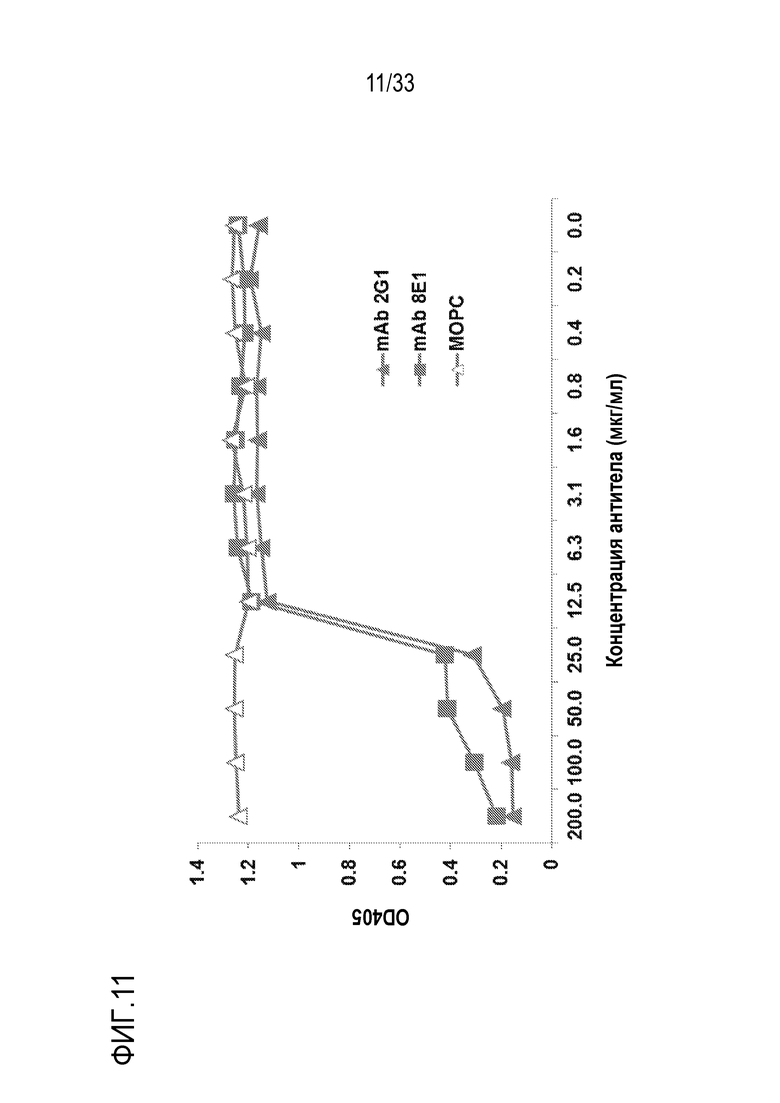
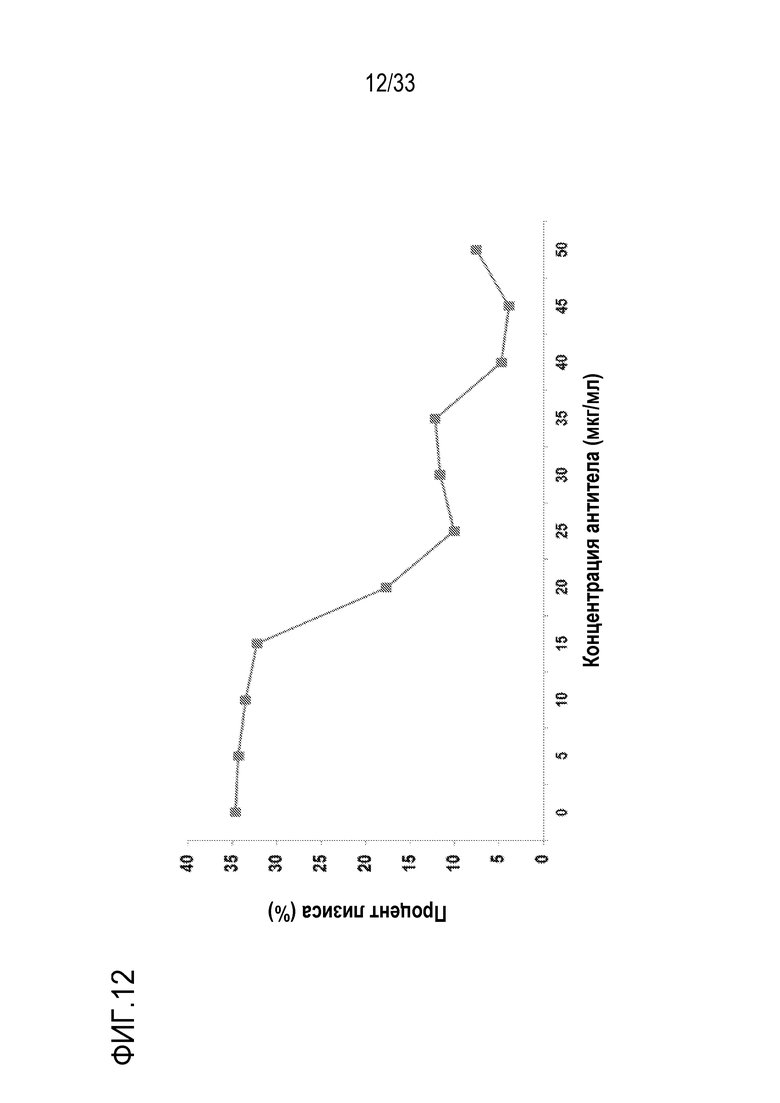


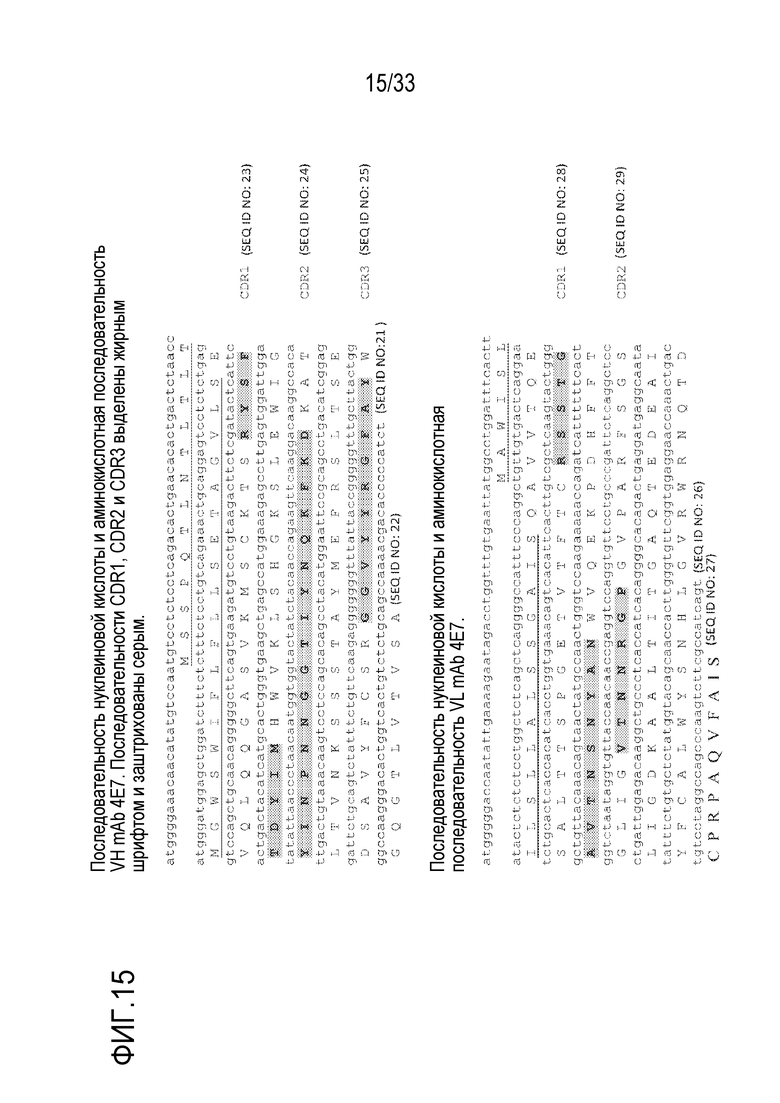

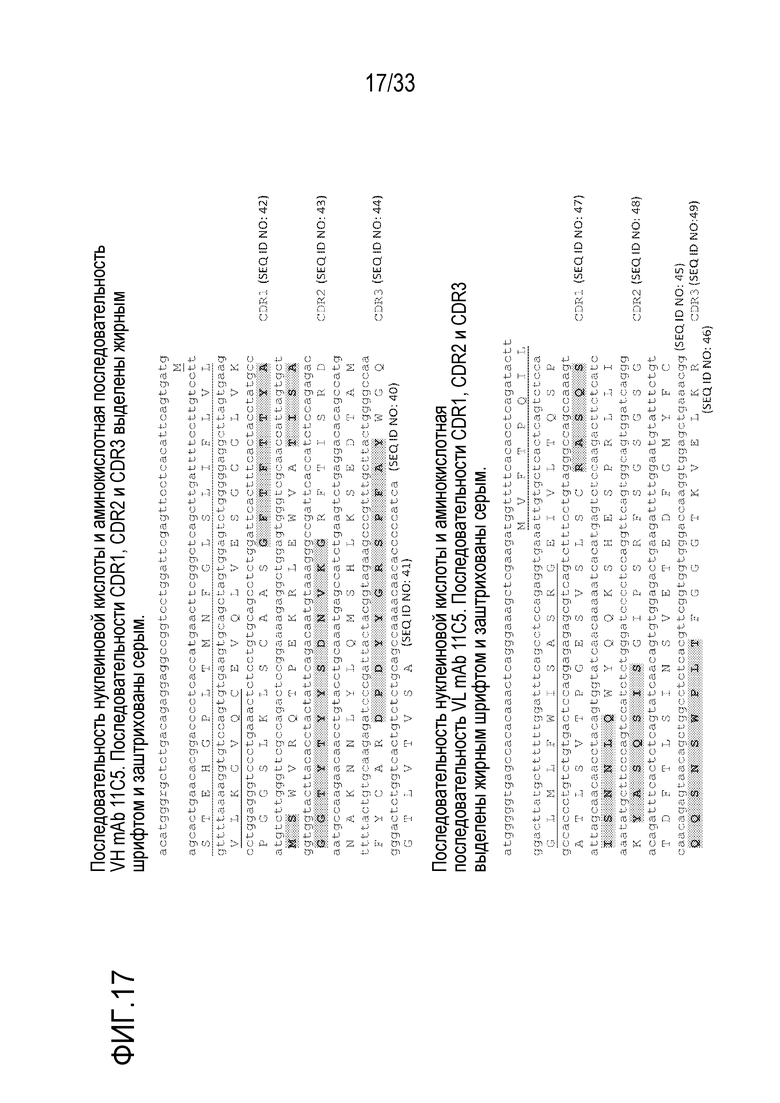


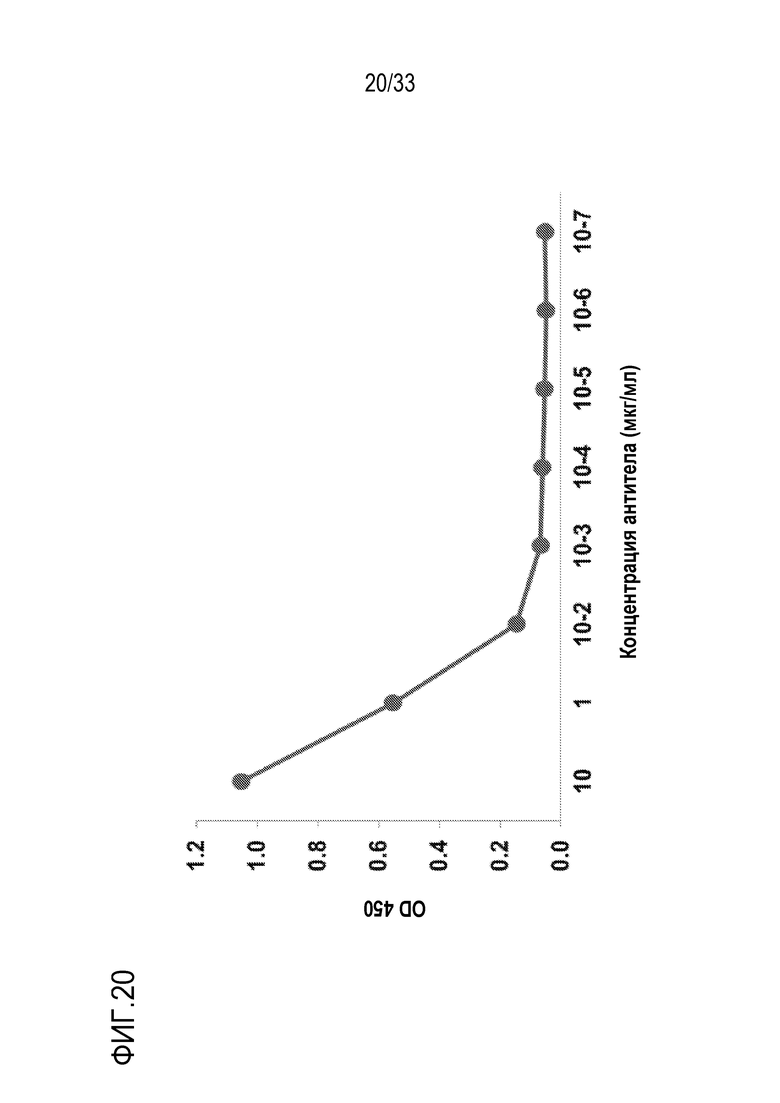



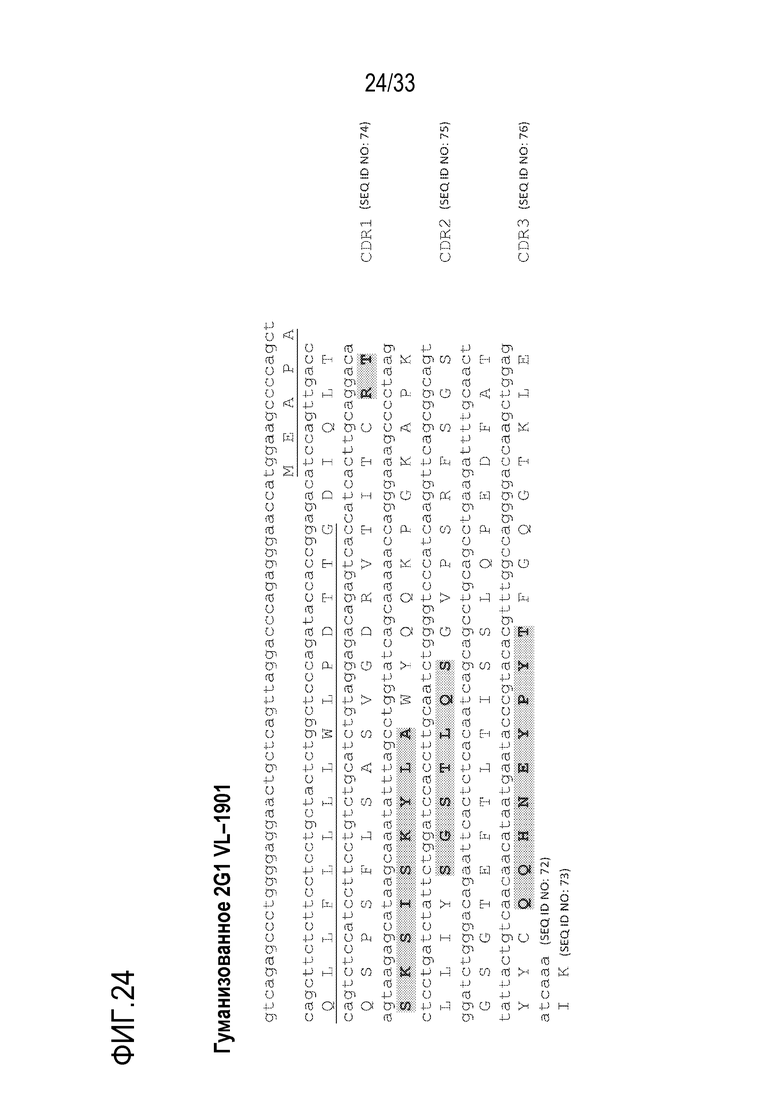
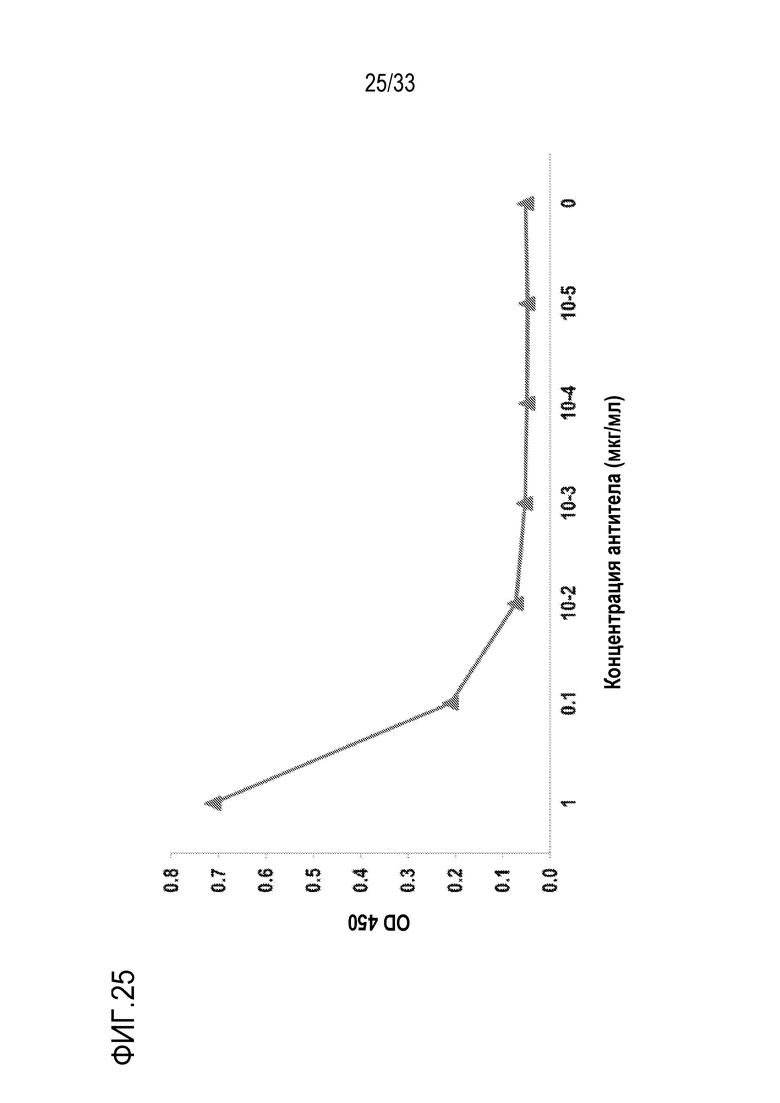
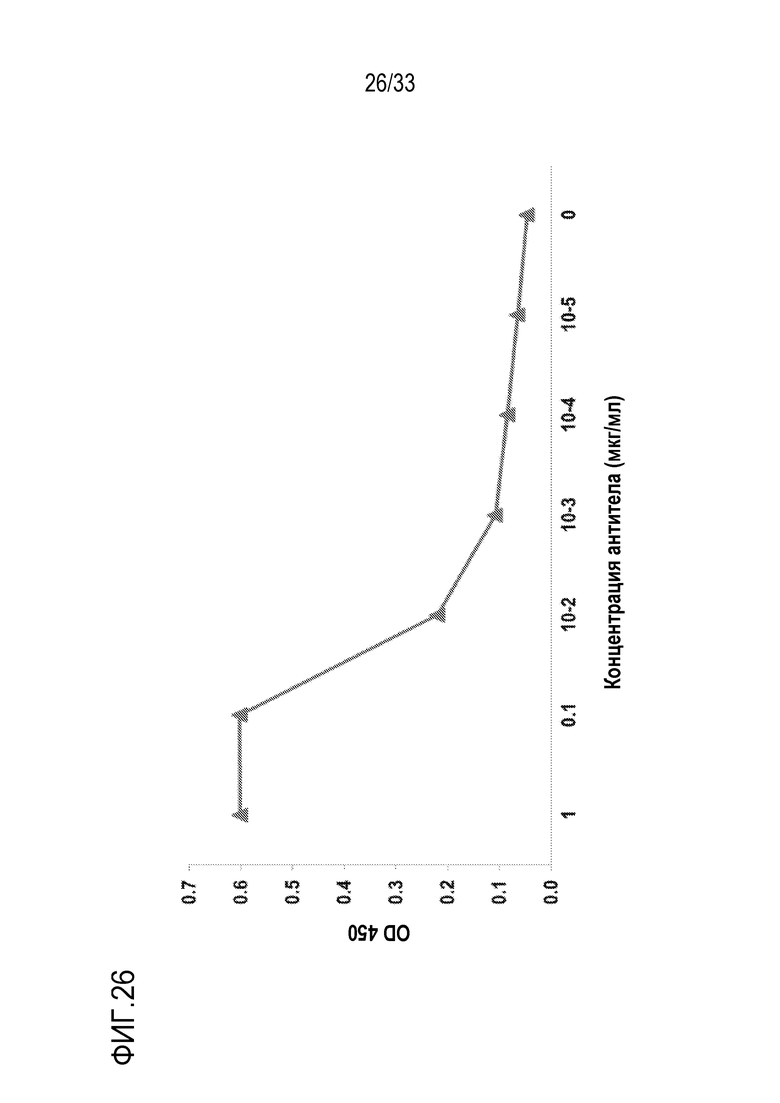




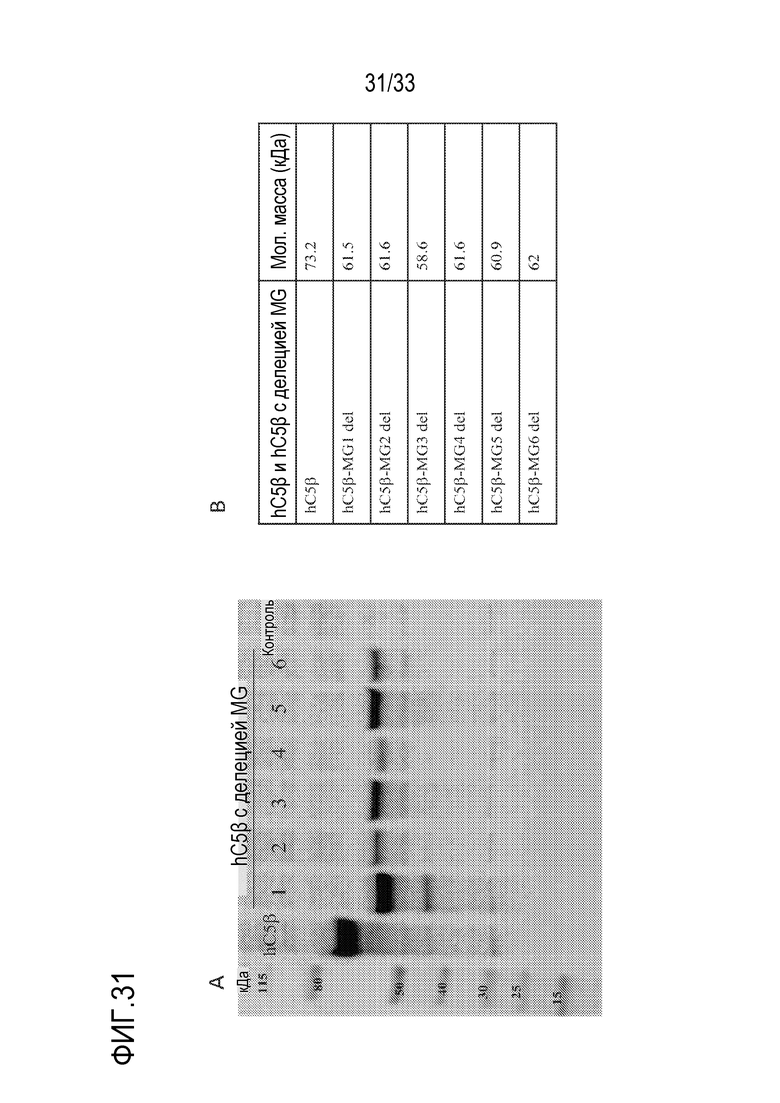
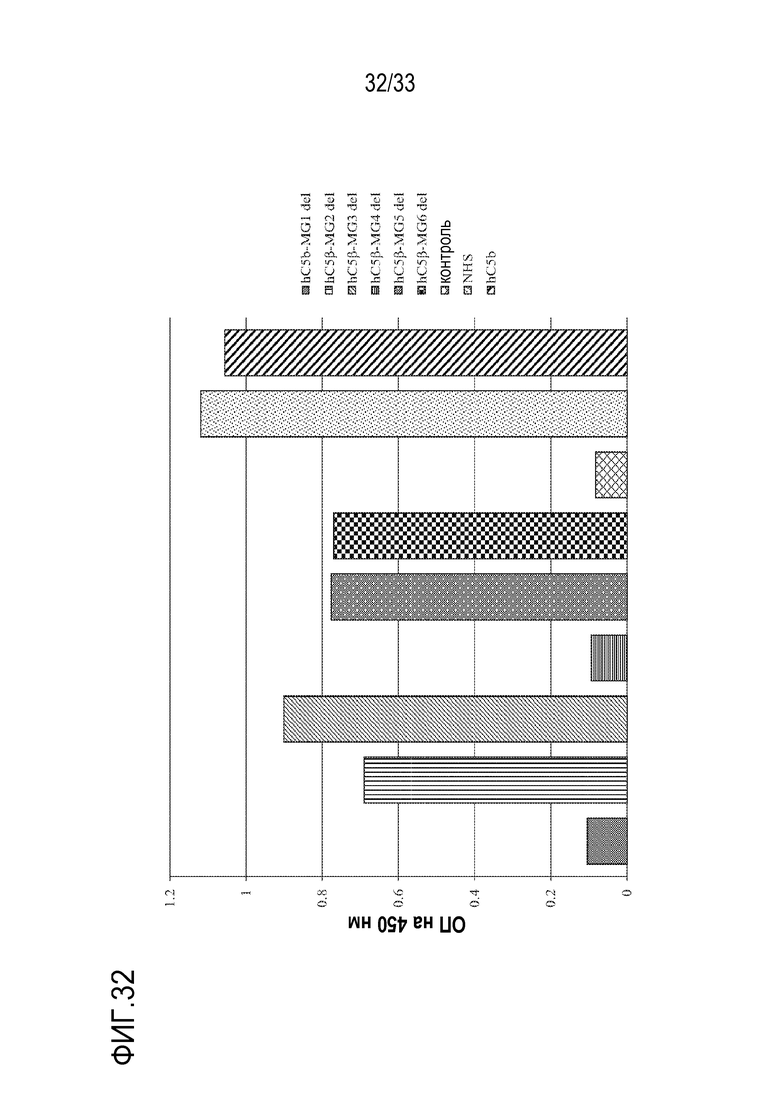

Группа изобретений относится к биотехнологии. Представлены: антитело, которое специфически связывается с С5 человека, способ лечения заболевания или расстройства, опосредованного путями комплемента, у индивидуума, включающий стадию введения указанному индивидууму анти–С5 антитела, способ снижения активности системы комплемента у индивидуума, вектор экспрессии и клетка для продукции антитела. Изобретение позволяет путем ингибирования передачи сигнала комплемента с использованием анти–C5 антитела эффективно лечить комплементопосредуемое расстройство у индивидуума посредством приведения в контакт индивидуума с анти–C5 антителом. 5 н. и 34 з.п. ф-лы, 33 ил., 1 табл., 1 пр.
1. Антитело, которое специфически связывается с С5 человека,
где антитело включает по меньшей мере одно антитело, выбранное из группы, состоящей из:
a) антитело, содержащее вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL),
где VH содержит:
i) VH-CDR1, содержащий аминокислотную последовательность SEQ ID NO:3, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
ii) VH-CDR2, содержащий аминокислотную последовательность SEQ ID NO:4, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены; и
iii) VH-CDR3, содержащий аминокислотную последовательность SEQ ID NO:5, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены; и
где VL содержит:
i) VL-CDR1, содержащий аминокислотную последовательность SEQ ID NO:8, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
ii) VL-CDR2, содержащий аминокислотную последовательность SEQ ID NO:9, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены; и
iii) VL-CDR3, содержащий аминокислотную последовательность SEQ ID NO:10, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
b) антитело, содержащее вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL),
где VH содержит:
i) VH-CDR1, содержащий аминокислотную последовательность SEQ ID NO:13, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
ii) VH-CDR2, содержащий аминокислотную последовательность SEQ ID NO:14, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены; и
iii) VH-CDR3, содержащий аминокислотную последовательность SEQ ID NO:15, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены; и
где VL содержит:
i) VL-CDR1, содержащий аминокислотную последовательность SEQ ID NO:18, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
ii) VL-CDR2, содержащий аминокислотную последовательность SEQ ID NO:19, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены; и
iii) VL-CDR3, содержащий аминокислотную последовательность SEQ ID NO:20, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
c) антитело, содержащее вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL),
где VH содержит:
i) VH-CDR1, содержащий аминокислотную последовательность SEQ ID NO:23, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
ii) VH-CDR2, содержащий аминокислотную последовательность SEQ ID NO:24, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены; и
iii) VH-CDR3, содержащий аминокислотную последовательность SEQ ID NO:25, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены; и
где VL содержит:
i) VL-CDR1, содержащий аминокислотную последовательность SEQ ID NO:28, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены; и
ii) VL-CDR2, содержащий аминокислотную последовательность SEQ ID NO:29, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
d) антитело, содержащее вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL),
где VH содержит:
i) VH-CDR1, содержащий аминокислотную последовательность SEQ ID NO:32, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
ii) VH-CDR2, содержащий аминокислотную последовательность SEQ ID NO:33, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены; и
iii) VH-CDR3, содержащий аминокислотную последовательность SEQ ID NO:34, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены; и
где VL содержит:
i) VL-CDR1, содержащий аминокислотную последовательность SEQ ID NO:37, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
ii) VL-CDR2, содержащий аминокислотную последовательность SEQ ID NO:38, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены; и
iii) VL-CDR3, содержащий аминокислотную последовательность SEQ ID NO:39, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
e) антитело, содержащее вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL),
где VH содержит:
i) VH-CDR1, содержащий аминокислотную последовательность SEQ ID NO:42, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
ii) VH-CDR2, содержащий аминокислотную последовательность SEQ ID NO:43, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены; и
iii) VH-CDR3, содержащий аминокислотную последовательность SEQ ID NO:44, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены; и
где VL содержит:
i) VL-CDR1, содержащий аминокислотную последовательность SEQ ID NO:47, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
ii) VL-CDR2, содержащий аминокислотную последовательность SEQ ID NO:48, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены; и
iii) VL-CDR3, содержащий аминокислотную последовательность SEQ ID NO:49, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены; и
f) антитело, содержащее вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL),
где VH содержит:
i) VH-CDR1, содержащий аминокислотную последовательность SEQ ID NO:52, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
ii) VH-CDR2, содержащий аминокислотную последовательность SEQ ID NO:53, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены; и
iii) VH-CDR3, содержащий аминокислотную последовательность SEQ ID NO:54, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены; и
где VL содержит:
i) VL-CDR1, содержащий аминокислотную последовательность SEQ ID NO:57, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
ii) VL-CDR2, содержащий аминокислотную последовательность SEQ ID NO:58, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены; и
iii) VL-CDR3, содержащий аминокислотную последовательность SEQ ID NO:59, или его вариант, содержащий до 3, 2 или 1 аминокислотных замен, где вариант сохраняет основные биологические свойства и содержит консервативные замены,
или его антигенсвязывающий фрагмент.
2. Антитело по п.1, где антитело представляет собой химерное антитело.
3. Антитело по п.1, где антитело содержит CDR:
VH–CDR1: SEQ ID NO:3, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
VH–CDR2: SEQ ID NO:4, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
VH–CDR3: SEQ ID NO:5, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
VL–CDR1: SEQ ID NO:8, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
VL–CDR2: SEQ ID NO:9, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены; и
VL–CDR3: SEQ ID NO:10, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены.
4. Антитело по п.1, где антитело содержит CDR:
VH–CDR1: SEQ ID NO:3;
VH–CDR2: SEQ ID NO:4;
VH–CDR3: SEQ ID NO:5;
VL–CDR1: SEQ ID NO:8;
VL–CDR2: SEQ ID NO:9; и
VL–CDR3: SEQ ID NO:10.
5. Антитело по п.1, где антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:2, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены.
6. Антитело по п.1, где антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:7, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены.
7. Антитело по п.1, где антитело содержит:
тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:2, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены, и
легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:7, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены.
8. Антитело по п.1, где антитело содержит CDR:
VH–CDR1: SEQ ID NO:13, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
VH–CDR2: SEQ ID NO:14, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
VH–CDR3: SEQ ID NO:15, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
VL–CDR1: SEQ ID NO:18, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
VL–CDR2: SEQ ID NO:19, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены; и
VL–CDR3: SEQ ID NO:20, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены.
9. Антитело по п.1, где антитело содержит CDR:
VH–CDR1: SEQ ID NO:13;
VH–CDR2: SEQ ID NO:14;
VH–CDR3: SEQ ID NO:15;
VL–CDR1: SEQ ID NO:18;
VL–CDR2: SEQ ID NO:19; и
VL–CDR3: SEQ ID NO:20.
10. Антитело по п.1, где антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:12, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены.
11. Антитело по п.1, где антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:17, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены.
12. Антитело по п.1, где антитело содержит:
тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:12, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены и
легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:17, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены.
13. Антитело по п.1, где антитело содержит CDR:
VH–CDR1: SEQ ID NO:23, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
VH–CDR2: SEQ ID NO:24, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
VH–CDR3: SEQ ID NO:25, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
VL–CDR1: SEQ ID NO:28, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены; и
VL–CDR2: SEQ ID NO:29, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены.
14. Антитело по п.1, где антитело содержит CDR:
VH–CDR1: SEQ ID NO:23;
VH–CDR2: SEQ ID NO:24;
VH–CDR3: SEQ ID NO:25;
VL–CDR1: SEQ ID NO:28; и
VL–CDR2: SEQ ID NO:29.
15. Антитело по п.1, где антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:22, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены.
16. Антитело по п.1, где антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:27, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены.
17. Антитело по п.1, где антитело содержит:
тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:22, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены, и
легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:27, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены.
18. Антитело по п.1, где антитело содержит CDR:
VH–CDR1: SEQ ID NO:32, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
VH–CDR2: SEQ ID NO:33, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
VH–CDR3: SEQ ID NO:34, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
VL–CDR1: SEQ ID NO:37, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
VL–CDR2: SEQ ID NO:38, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены; и
VL–CDR3: SEQ ID NO:39, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены.
19. Антитело по п.1, где антитело содержит CDR:
VH–CDR1: SEQ ID NO:32;
VH–CDR2: SEQ ID NO:33;
VH–CDR3: SEQ ID NO:34;
VL–CDR1: SEQ ID NO:37;
VL–CDR2: SEQ ID NO:38; и
VL–CDR3: SEQ ID NO:39.
20. Антитело по п.1, где антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:31, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены.
21. Антитело по п.1, где антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:36, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены.
22. Антитело по п.1, где антитело содержит:
тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:31, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены, и
легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:36, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены.
23. Антитело по п.1, где антитело содержит CDR:
VH–CDR1: SEQ ID NO:42, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
VH–CDR2: SEQ ID NO:43, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
VH–CDR3: SEQ ID NO:44, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
VL–CDR1: SEQ ID NO:47, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
VL–CDR2: SEQ ID NO:48, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены; и
VL–CDR3: SEQ ID NO:49, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены.
24. Антитело по п.1, где антитело содержит CDR:
VH–CDR1: SEQ ID NO:42;
VH–CDR2: SEQ ID NO:43;
VH–CDR3: SEQ ID NO:44;
VL–CDR1: SEQ ID NO:47;
VL–CDR2: SEQ ID NO:48; и
VL–CDR3: SEQ ID NO:49.
25. Антитело по п.1, где антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:41, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены.
26. Антитело по п.1, где антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:46, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены.
27. Антитело по п.1, где антитело содержит:
тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:41, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены, и
легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:46, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены.
28. Антитело по п.1, где антитело содержит CDR:
VH–CDR1: SEQ ID NO:52, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
VH–CDR2: SEQ ID NO:53, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
VH–CDR3: SEQ ID NO:54, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
VL–CDR1: SEQ ID NO:57, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены;
VL–CDR2: SEQ ID NO:58, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены; и
VL–CDR3: SEQ ID NO:59, или его вариант, содержащий до 3, 2 или 1 аминокислот, где вариант сохраняет основные биологические свойства и содержит консервативные замены.
29. Антитело по п.1, где антитело содержит CDR:
VH–CDR1: SEQ ID NO:52;
VH–CDR2: SEQ ID NO:53;
VH–CDR3: SEQ ID NO:54;
VL–CDR1: SEQ ID NO:57;
VL–CDR2: SEQ ID NO:58; и
VL–CDR3: SEQ ID NO:59.
30. Антитело по п.1, где антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:51, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены.
31. Антитело по п.1, где антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:56, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены.
32. Антитело по п.1, где антитело содержит:
тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO:51, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены, и
легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:56, или ее вариант, где вариант сохраняет основные биологические свойства и содержит консервативные замены.
33. Способ лечения заболевания или расстройства, опосредованного путями комплемента, у индивидуума, включающий стадию введения указанному индивидууму анти–С5–антитела или его антигенсвязывающего фрагмента по любому из пп.1–32.
34. Способ по п.33, где заболевание или расстройство по меньшей мере выбрано из группы, состоящей из: дегенерации желтого пятна (MD), возрастной дегенерации желтого пятна (AMD), ишемического реперфузионного повреждения, артрита, ревматоидного артрита, волчанки, язвенного колита, инсульта, постхирургического системного воспалительного синдрома, астмы, аллергической астмы, хронической обструктивной болезни легких (ХОБЛ), синдрома пароксизмальной ночной гемоглобинурии (PNH), тяжелой миастении, нейромиелита зрительного нерва (NMO), рассеянного склероза, замедления функции трансплантата, отторжения, опосредуемого антителом, атипического гемолитического уремического синдрома (aHUS), окклюзии центральной вены сетчатки (CRVO), окклюзии центральной артерии сетчатки (CRAO), буллезного эпидермолиза, сепсиса, трансплантации органов, воспаления, воспаления, связанного с операцией по сердечно–легочному шунтированию и с почечным диализом, С3–гломерулопатии, мембранозной нефропатии, IgA–нефропатии, гломерулонефрита, гломерулонефрита, опосредованного цитоплазматическим антителом против нейтрофилов (ANCA), волчаночного нефрита, ANCA–опосредованного васкулита, HUS, индуцированного Шига–токсином, и потери плода, индуцированной антифосфолипидным антителом, или любых их комбинаций.
35. Способ снижения активности системы комплемента у индивидуума, где указанный способ включает введение антитела индивидууму способом, выбранным из группы, состоящей из энтерального введения, парентерального введения и их комбинации, и где антитело представляет собой антитело или антигенсвязывающий фрагмент по любому из пп.1–32.
36. Способ по п.35, где фрагмент антитела выбран из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
37. Вектор экспрессии, содержащий нуклеиновую кислоту, кодирующую антитело по меньшей мере по одному из пп.1–32.
38. Клетка для продукции антитела по меньшей мере по одному из пп.1–32, где клетка содержит вектор экспрессии по п.37.
39. Клетка по п.37 где клетка представляет собой гибридому.
| US 20160176954 A1, 23.06.2016 | |||
| US 20150239966 A1, 27.08.2015 | |||
| US 20160355580 A1, 08.12.2016 | |||
| US 20160251433 A1, 01.09.2016 | |||
| US20160229908 A1, 11.08.2016 | |||
| СВЯЗЫВАЮЩИЕ КОМПЛЕМЕНТ АПТАМЕРЫ И СРЕДСТВА ПРОТИВ С5, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ ГЛАЗНЫХ НАРУШЕНИЙ | 2007 |
|
RU2477137C2 |
Авторы
Даты
2022-06-22—Публикация
2018-03-06—Подача