Область техники, к которой относится изобретение
Настоящее изобретение относится к антителам к С5 и способам их применения.
Предпосылки создания изобретения
Система комплемента играет центральную роль в клиренсе иммунных комплексов и иммунных ответах на инфекционные агенты, чужие антигены, инфицированные вирусом клетки и опухолевые клетки. Известно примерно 25-30 белков комплемента, которые присутствуют в виде сложной группы плазматических белков и мембранных кофакторов. Компоненты комплемента осуществляют свои иммунные защитные функции путем участия в серии сложных ферментативных расщеплений и случаев связываний с мембраной. В результате каскады системы комплемента приводят к получению продуктов, обладающих опсоническими, иммунорегуляторными и литическими функциями.
В настоящее время общепринято считать, что система комплемента может активироваться тремя различными путями: классическим путем, лектиновым путем и альтернативным путем. В этих путях участвует много компонентов, и хотя они различаются своими начальными стадиями, затем они сходятся и включают одни и те же терминальные компоненты системы комплемента (с С5 по С9), которые ответственны за активацию и деструкцию клеток-мишеней.
Классический путь, как правило, активируется при образовании комплексов антиген-антитело. Независимо от этого первая стадия активации лектинового пути представляет собой связывание специфических лектинов, таких как маннан-связывающий лектин (MBL), Н-фиколин, М-фиколин, L-фиколин и лектин С-типа CL-11. В отличие от этого, альтернативный путь подвергается активации спонтанно с низким уровнем турновера, которая легко может повышаться на чужих или других аномальных поверхностях (бактерии, дрожжи, инфицированные вирусом клетки или поврежденная ткань). Эти пути сходятся в точке, в которой происходит расщепление компонента комплемента С3 активной протеазой с образованием С3а и C3b.
С3а представляет собой анафилатоксин. C3b связывается с бактериальными и другими клетками, а также с определенными вирусами и иммунными комплексами, и метит их для удаления из кровотока (играет роль опсонина). C3b формирует также комплекс с другими компонентами с образованием конвертазы С5, которая расщепляет С5 с образованием С5а и C5b.
С5 представляет собой белок с молекулярной массой 190 кДа, который присутствует в сыворотке здорового индивидуума в концентрации примерно 80 мкг/мл (0,4 мкМ). С5 является гликозилированным, при этом примерно 1,5-3% его массы приходится на долю углевода. Зрелый С5 представляет собой гетеродимер, в котором альфа-цепь с молекулярной массой 115 кДа сцеплена дисульфидом с бета-цепью с молекулярной массой 75 кДа. С5 синтезируется в виде одноцепочечного белка-предшественника (предшественник про-С5), состоящего из 1676 аминокислот (см., например, PTL 1 и PTL 2). Предшественник про-С5 расщепляется с высвобождением бета-цепи в виде амино-концевого фрагмента и альфа-цепи в виде карбокси-концевого фрагмента. Полипептидные фрагменты, представляющие собой альфа-цепь и бета-цепь, соединяются друг с другом посредством дисульфидной связи с образованием зрелого белка С5.
Зрелый С5 расщепляется с образованием С5а- и C5b-фрагмента в процессе активации путей системы комплемента. В результате воздействия С5-конвертазы С5а отщепляется от альфа-цепи С5 в виде амино-концевого фрагмента, содержащего первые 74 аминокислоты альфа-цепи. Оставшаяся часть зрелого С5 представляет собой C5b-фрагмент, который содержит остаток альфа-цепи, соединенный дисульфидом с бета-цепью. Примерно 20% массы С5а, составляющей 11 кДа, приходится на долю углевода.
С5а представляет собой другой анафилатоксин. C5b объединяется с С6, С7, С8 и С9 с образованием мембраноатакующего комплекса (MAC, C5b-9, комплекс терминальных компонентов системы комплемента (ТСС)) на поверхности клетки-мишени. Когда в мембраны клеток-мишеней встраиваются в достаточном количестве MAC, то поры, образованные MAC, опосредуют быстрый осмотический лизис клеток-мишеней.
Как указано выше, С3а и С5а являются анафилатоксинами. Они могут запускать дегрануляцию тучных клеток, что вызывает высвобождение гистамина и других медиаторов воспаления, которые приводят к сокращению гладких мышц, повышению проницаемости сосудов, активации лейкоцитов и другим проявлениям воспаления, включая клеточную пролиферацию, приводящую к повышенному содержанию паренхиматозных клеток. С5а функционирует также в качестве хемотаксического пептида, который служит для привлечения гранулоцитов, таких как нейтрофилы, эозинофилы, базофилы и моноциты, к области активации комплемента.
Активность С5а регулируется плазматическим ферментом карбоксипептидазой N, которая удаляет карбокси-концевой аргинин из С5а, что приводит к образованию производного C5a-des-Arg. C5a-des-Arg обладает лишь 1% анафилактической активности и полиморфоядерной хемотаксической активности, присущей немодифицированному С5а.
В то время как правильно функционирующая система комплемента обеспечивает эффективную защиту от инфицирующих микроорганизмов, неправильная регуляция или активация системы комплемента участвует в патогенезе различных нарушений, включая, например, ревматоидный артрит (RA); волчаночный нефрит; повреждение, вызываемое ишемией-реперфузией; пароксизмальную ночную гемоглобинурию (PNH); атипичный гемолитико-уремический синдром (aHUS); болезнь плотных депозитов (DDD); дегенерацию желтого пятна (например, возрастную дегенерацию желтого пятна (AMD)); синдром: гемолиз, повышение активности ферментов печени и тромбоцитопения (HELLP); тромботическую тромбоцитопеническую пурпуру (ТТР); спонтанную потерю плода; васкулит с гипокомплементемией; буллезный эпидермолиз; повторную потерю плода; рассеянный склероз (MS); травматическое повреждение головного мозга и повреждение, обусловленное инфарктом миокарда, сердечно-легочным шунтированием и гемодиализом (см., например, NPL 1). Таким образом, ингибирование избыточной или неконтролируемой активации каскада комплемента может оказывать благоприятное клиническое действие на пациентов с указанными нарушениями.
Пароксизмальная ночная гемоглобинурия (PNH) представляет собой редкое нарушение крови, при котором эритроциты имеют дефекты и поэтому разрушаются быстрее, чем здоровые эритроциты. PNH обусловлена клональной экспансией гематопоэтических стволовых клеток с соматическими мутациями в гене PIG-A (фосфатидилинозитолгликан класса А), локализованном на X-хромосоме. Мутации в PIG-A приводят к ранней блокаде синтеза гликозилфосфатидилинозитола (GPI), молекулы, которая требуется для «заякоривания» многих белков на клеточных поверхностях. В результате при PNH кровяные клетки характеризуются дефицитом GPI-заякоренных белков, которые включают комплемент-регулирующие белки CD55 и CD59. В нормальных ситуациях эти комплемент-регулирующие белки блокируют образование MAC на клеточных поверхностях, предупреждая тем самым лизис эритроцитов. Отсутствие GPI-заякоренных белков вызывает опосредуемый системой комплемента гемолиз при PNH.
PNH характеризуется гемолитической анемией (пониженное количество эритроцитов), гемоглобинурией (присутствие гемоглобина в моче, что особенно проявляется после сна) и гемоглобинемией (присутствие гемоглобина в кровотоке). Известно, у что пораженных PNH индивидуумов имеют место пароксизмы, которые в данном случае представляют собой случаи появления темно-окрашенной мочи. Гемолитическая анемия обусловлена внутрисосудистой деструкцией эритроцитов компонентами системы комплемента. Другие известные симптомы включают дисплазию, усталость, эректильную дисфункцию, тромбоз и повторяющуюся боль в брюшной области.
Экулизумаб представляет собой гуманизированное моноклональное антитело к белку С5 системы комплемента, и он является терапевтическим средством первой линии, которое разрешено для лечения пароксизмальной ночной гемоглобинурии (PNH) и атипического гемолитико-уремического синдрома (aHUS) (см., например, NPL 2). Экулизумаб ингибирует расщепление С5 С5-конвертазой с образованием С5а и C5b, что предупреждает образование комплекса терминальных компонентов системы комплемента C5b-9. И С5а, и C5b-9 вызывают опосредуемые терминальным комплексом системы комплемента события, характерные для PNH и aHUS (см. также PTL 3, PTL 4, PTL 5 и PTL 6).
В нескольких публикациях описаны антитела к С5. Например, в PTL 7 описано антитело к С5, которое связывается с альфа-цепью С5, но не связывается с С5а, и блокирует активацию С5, а в PTL 8 описано моноклональное антитело к С5, которое ингибирует образование С5а. С другой стороны, в PTL 9 описано антитело к С5, которое распознает сайт протеолитического расщепления конвертазой С5 на альфа-цепи С5 и ингибирует превращение С5 в С5а и C5b. В PTL 10 описано антитело к С5, которое характеризуется константой аффинности, составляющей по меньшей мере 1×107 M-1.
Антитела (IgG) связываются с неонатальным Fc-рецептором (FcRn) и характеризуются продолжительными временами удерживания в плазме. Связывание IgG с FcRn, как правило, имеет место в кислых условиях (например, при рН 6,0) и редко происходит в нейтральных условиях (например, при рН 7,4). Как правило, IgG неспецифически встраиваются в клетки посредством эндоцитоза и возвращаются на клеточные поверхности посредством связывания с эндосомальным FcRn в кислых условиях в эндосомах. Затем IgG отделяются от FcRn в результате диссоциации в нейтральных условиях в плазме. IgG, которым не удалось связаться с FcRn, расщепляются в лизосомах. Если способность IgG к связыванию с FcRn в кислых условиях устраняют путем интродукции мутаций в его Fc-область, то IgG не возвращается из эндосом в плазму, что приводит к заметному снижению удерживания IgG в плазме. Опубликован метод, позволяющий повышать его связывание с FcRn в кислых условиях, предназначенный для повышения удерживания IgG в плазме. Когда связывание IgG с FcRn в кислых условиях повышают путем интродукции аминокислотной замены в его Fc-область, то IgG более эффективно возвращается из эндосом в плазму, и в результате повышается его удерживание в плазме. Кроме того, опубликованы также данные о том, что IgG с повышенной способностью к связыванию с FcRn в нейтральных условиях не отделяется путем диссоциации от FcRn в нейтральных условиях в плазме, даже если он возвращается на клеточную поверхность благодаря его связыванию с FcRn в кислых условиях в эндосомах, и следовательно, его удерживание в плазме не изменяется или, скорее, ухудшается (см., например, NPL 3; NPL 4; NPL 5).
В последние годы были описаны антитела, которые связываются с антигенами pH-зависимым образом (см., например, PTL 11 и PTL 12). Указанные антитела более сильно связываются с антигенами в нейтральных условиях в плазме и отделяются путем диссоциации от антигенов в кислых условиях, которые имеют место в эндосомах. После отделения путем диссоциации от антигенов антитела вновь приобретают способность связываться с антигенами, когда они возвращаются в плазму посредством FcRn. Таким образом, одна молекула антитела может повторно связываться с несколькими молекулами антигена. В целом, время удерживания антигена в плазме намного короче, чем время удерживания антитела, которое обладает указанным выше FcRn-опосредуемым механизмом рециклинга. Таким образом, когда антиген связан с антителом, то антиген в норме характеризуется пролонгированным удерживанием в плазме, что приводит к повышению концентрации антигена в плазме. С другой стороны, было установлено, что описанные выше антитела, которые связываются с антигенами pH-зависимым образом, позволяют элиминировать антигены из плазмы быстрее, чем типичные антитела, поскольку они отделяются путем диссоциации от антигенов в эндосомах в процессе FcRn-опосредуемого рециклинга. В PTL 13 описан также основанный на компьютерном моделировании анализ, демонстрирующий, что антитело к С5, обладающее pH-зависимым связыванием, может усиливать выключение антигена.
Перечень ссылок
Патентная литература
PTL 1: патент США №6355245,
PTL 2: патент США №7432356,
PTL3: WO 2005/074607,
PTL 4: WO 2007/106585,
PTL 5: WO 2008/069889,
PTL 6: WO 2010/054403,
PTL 7: WO 95/29697,
PTL 8: WO 02/30985,
PTL 9: WO 2004/007553,
PTL 10: WO 2010/015608,
PTL 11: WO 2009/125825,
PTL 12: WO 2011/122011,
PTL 13: WO 2011/111007,
Непатентная литература
NPL 1: Holers и др., Immunol. Rev. 223, 2008, cc. 300-316,
NPL 2: Dmytrijuk и др., The Oncologist 13(9), 2008, cc. 993-1000,
NPL 3: Yeung и др., J Immunol. 182(12), 2009, cc. 7663-7671,
NPL 4: Datta-Mannan и др., J Biol. Chem. 282(3), 2007, cc. 1709-1717,
NPL 5: Dall'Acqua и др., J. Immunol. 169(9), 2002, cc. 5171-5180.
Краткое изложение сущности изобретения
Техническая задача, положенная в основу настоящего изобретения
Задача настоящего изобретения заключалась в том, чтобы разработать антитела к С5 и способы их применения.
Решение задачи
В некоторых вариантах осуществления изобретения выделенное антитело к С5, предлагаемое в настоящем изобретении, связывается с эпитопом на бета-цепи С5. В некоторых вариантах осуществления изобретения выделенное антитело к С5, предлагаемое в настоящем изобретении, связывается с эпитопом в MG1-MG2-домене бета-цепи С5. В некоторых вариантах осуществления изобретения выделенное антитело к С5, предлагаемое в настоящем изобретении, связывается с эпитопом во фрагменте, состоящем из аминокислот 33-124 бета-цепи (SEQ ID NO: 40) С5. В некоторых вариантах осуществления изобретения выделенное антитело к С5, предлагаемое в настоящем изобретении, связывается с эпитопом в бета-цепи (SEQ ID NO: 40) С5, который содержит по меньшей мере один фрагмент, выбранный из группы, состоящей из аминокислот 47-57, 70-76 и 107-110. В некоторых вариантах осуществления изобретения выделенное антитело к С5, предлагаемое в настоящем изобретении, связывается с эпитопом во фрагменте бета-цепи (SEQ ID NO: 40) С5, который содержит по меньшей мере один аминокислотный остаток, выбранный из группы, состоящей из Glu48, Asp51, His70, His72, Lys109 и His110 SEQ ID NO: 40. В других вариантах осуществления изобретения антитело связывается с С5 с более высокой аффинностью при нейтральном рН, чем при кислом рН. В других вариантах осуществления изобретения антитело связывается с С5 с более высокой аффинностью при рН 7,4, чем при рН 5,8. В другом варианте осуществления изобретения выделенное антитело к С5, предлагаемое в настоящем изобретении, связывается с тем же эпитопом, что и антитело, описанное в таблице 2. В других вариантах осуществления изобретения антитело связывается с тем же эпитопом, что и антитело, описанное в таблице 2, с более высокой аффинностью при рН 7,4, чем при рН 5,8. В следующем варианте осуществления изобретения антитело к С5, предлагаемое в настоящем изобретении, связывается с тем же эпитопом, что и антитело, описанное в таблице 7 или 8. В других вариантах осуществления изобретения антитело связывается тем же эпитопом, что и антитело, описанное в таблице 7 или 8, с более высокой аффинностью при рН 7,4, чем при рН 5,8.
В некоторых вариантах осуществления изобретения антитело к С5, предлагаемое в настоящем изобретении, конкурирует за связывание с С5 с антителом, содержащим пару VH и VL, которая выбрана из: (a) VH, имеющей SEQ ID NO: 1, и VL, имеющей SEQ ID NO: 11; (б) VH, имеющей SEQ ID NO: 5, и VL, имеющей SEQ ID NO: 15; (в) VH, имеющей SEQ ID NO: 4, и VL, имеющей SEQ ID NO: 14; (г) VH, имеющей SEQ ID NO: 6, и VL, имеющей SEQ ID NO: 16; (д) VH, имеющей SEQ ID NO: 2, и VL, имеющей SEQ ID NO: 12; (e) VH, имеющей SEQ ID NO: 3, и VL, имеющей SEQ ID NO: 13; (ж) VH, имеющей SEQ ID NO: 9, и VL, имеющей SEQ ID NO: 19; (з) VH, имеющей SEQ ID NO: 7, и VL, имеющей SEQ ID NO: 17; (и) VH, имеющей SEQ ID NO: 8, и VL, имеющей SEQ ID NO: 18; и (к) VH, имеющей SEQ ID NO: 10, и VL, имеющей SEQ ID NO: 20. В других вариантах осуществления изобретения антитело к С5 связывается с С5 с более высокой аффинностью при нейтральном рН, чем при кислом рН. В других вариантах осуществления изобретения антитело к С5 связывается с С5 с более высокой аффинностью при рН 7,4, чем при рН 5,8.
В некоторых вариантах осуществления изобретения выделенное антитело к С5, предлагаемое в настоящем изобретении, обладает характеристикой, выбранной из группы, состоящей из следующих характеристик: (а) антитело контактирует с аминокислотами D51 и K109 С5 (SEQ ID NO: 39); (б) аффинность антитела к С5 (SEQ ID NO: 39) выше, чем аффинность антитела к мутантному С5, содержащую замену Е48А в SEQ ID NO: 39; или (в) антитело связывается с белком С5, имеющим аминокислотную последовательность SEQ ID NO: 39, при рН 7,4, но не связывается с белком С5, имеющим аминокислотную последовательность SEQ ID NO: 39 с заменой H72Y, при рН 7,4. В других вариантах осуществления изобретения антитело связывается с С5 с более высокой аффинностью при нейтральном рН, чем при кислом рН. В других вариантах осуществления изобретения антитело связывается с С5 с более высокой аффинностью при рН 7,4, чем при рН 5,8.
В некоторых вариантах осуществления изобретения выделенное антитело к С5, предлагаемое в настоящем изобретении, ингибирует активацию С5. В некоторых вариантах осуществления изобретения выделенное антитело к С5 предлагаемое в настоящем изобретении, ингибирует активацию Р885Н-варианта С5. В некоторых вариантах осуществления изобретения, выделенное антитело к С5, предлагаемое в настоящем изобретении, представляет собой моноклональное антитело. В некоторых вариантах осуществления изобретения выделенное антитело к С5 предлагаемое в настоящем изобретении, представляет собой человеческое, гуманизированное или химерное антитело. В некоторых вариантах осуществления изобретения выделенное антитело к С5, предлагаемое в настоящем изобретении, представляет собой фрагмент антитела, которое связывается с С5. В некоторых вариантах осуществления изобретения выделенное антитело к С5, предлагаемое в настоящем изобретении, представляет собой полноразмерное антитело IgG1 - или IgG4-класса.
В некоторых вариантах осуществления изобретения выделенное антитело к С5, предлагаемое в настоящем изобретении, содержит (a) HVR-H3, содержащий аминокислотную последовательность DX1GYX2X3PTHAMX4X5, в которой X1 обозначает G или А, Х2 обозначает V, Q или D, Х3 обозначает Т или Y, X4 обозначает Y или Н, Х5 обозначает L или Y (SEQ ID NO: 128), (б) HVR-L3, содержащий аминокислотную последовательность QX1TX2VGSSYGNX3, в которой X1 обозначает S, С, N или Т, Х2 обозначает F или K, Х3 обозначает А, Т или Н (SEQ ID NO: 131), и (в) HVR-H2, содержащий аминокислотную последовательность X1IX2TGSGAX3YX4AX5WX6KG, в которой X1 обозначает С, А или G, Х2 обозначает Y или F, Х3 обозначает Т, D или Е, X4 обозначает Y, K или Q, Х5 обозначает S, D или Е, Х6 обозначает А или V (SEQ ID NO: 127).
В некоторых вариантах осуществления изобретения выделенное антитело к С5, предлагаемое в настоящем изобретении, содержит (a) HVR-H1, содержащий аминокислотную последовательность SSYYX1X2, в которой X1 обозначает М или V, Х2 обозначает С или A (SEQ ID NO: 126), (б) HVR-H2, содержащий аминокислотную последовательность X1IX2TGSGAX3YX4AX5WX6KG, в которой X1 обозначает С, А или G, Х2 обозначает Y или F, Х3 обозначает Т, D или Е, X4 обозначает Y, K или Q, Х5 обозначает S, D или Е, X6 обозначает А или V (SEQ ID NO: 127), и (в) HVR-H3, содержащий аминокислотную последовательность DX1GYX2X3PTHAMX4X5, в которой X1 обозначает G или А, Х2 обозначает V, Q или D, Х3 обозначает Т или Y, X4 обозначает Y или Н, Х5 обозначает L или Y (SEQ ID NO: 128). В других вариантах осуществления изобретения антитело содержит (a) HVR-L1, содержащий аминокислотную последовательность X1ASQX2IX3SX4LA, в которой X1 обозначает Q или R, Х2 обозначает N, Q или G, Х3 обозначает G или S, X4 обозначает D, K или S (SEQ ID NO: 129); (б) HVR-L2 содержит аминокислотную последовательность GASX1X2X3S, в которой X1 обозначает K, Е или Т, Х2 обозначает L или Т, Х3 обозначает А, Н, Е или Q (SEQ ID NO: 130); и (в) HVR-L3, содержащий аминокислотную последовательность QX1TX2VGSSYGNX3, в которой X1 обозначает S, С, N или Т, Х2 обозначает F или K, Х3 обозначает А, Т или Н (SEQ ID NO: 131).
В некоторых вариантах осуществления изобретения выделенное антитело к С5, предлагаемое в настоящем изобретении, содержит (a) HVR-L1, содержащий аминокислотную последовательность X1ASQX2IX3SX4LA, в которой X1 обозначает Q или R, Х2 обозначает N, Q или G, Х3 обозначает G или S, X4 обозначает D, K или S (SEQ ID NO: 129); (б) HVR-L2, содержащий аминокислотную последовательность GASX1X2X3S, в которой X1 обозначает K, Е или Т, Х2 обозначает L или Т, Х3 обозначает А, Н, Е или Q (SEQ ID NO: 130); и (в) HVR-L3, содержащий аминокислотную последовательность QX1TX2VGSSYGNX3, в которой X1 обозначает S, С, N или Т, Х2 обозначает F или K, Х3 обозначает А, Т или Н (SEQ ID NO: 131).
В некоторых вариантах осуществления изобретения выделенное антитело к С5, предлагаемое в настоящем изобретении, содержит каркасный участок вариабельного домена тяжелой цепи FR1, содержащий одну из аминокислотных последовательностей SEQ ID NO: 132-134; FR2, содержащий одну из аминокислотных последовательностей SEQ ID NO: 135-136; FR3, содержащий одну из аминокислотных последовательностей SEQ ID NO: 137-139; и FR4, содержащий одну из аминокислотных последовательностей SEQ ID NO: 140-141. В некоторых вариантах осуществления изобретения выделенное антитело к С5 предлагаемое в настоящем изобретении, содержит каркасный участок вариабельного домена легкой цепи FR1, содержащий одну из аминокислотных последовательностей SEQ ID NO: 142-143; FR2, содержащий одну из аминокислотных последовательностей SEQ ID NO: 144-145; FR3, содержащий одну из аминокислотных последовательностей SEQ ID NO: 146-147; и FR4, содержащий аминокислотную последовательность SEQ ID NO: 148.
В некоторых вариантах осуществления изобретения выделенное антитело к С5, предлагаемое в настоящем изобретении, содержит (а) последовательность VH, идентичную по меньшей мере на 95% одной из аминокислотных последовательностей SEQ ID NO: 10, 106-110; (б) последовательность VL, идентичную по меньшей мере на 95% одной из аминокислотных последовательностей SEQ ID NO: 20, 111-113; или (в) последовательность VH, указанную в (а), и последовательность VL, указанную в (б). В других вариантах осуществления изобретения антитело содержит VH, имеющую одну из последовательностей SEQ ID NO: 10, 106-110. В других вариантах осуществления изобретения антитело содержит VL, имеющую одну из последовательностей SEQ ID NO: 20, 111-113.
В изобретении предложено антитело, содержащее VH, имеющую одну из последовательностей SEQ ID NO: 10, 106-110 и VL, имеющую одну из последовательностей SEQ ID NO: 20, 111-113.
В изобретении предложены также выделенные нуклеиновые кислоты, которые кодируют антитело к С5, предлагаемое в настоящем изобретении. В изобретении предложены также клетки-хозяева, которые содержат нуклеиновую кислоту, предлагаемую в настоящем изобретении. В изобретении предложен также способ получения антитела, включающий культивирование клетки-хозяина, предлагаемой в настоящем изобретении, в результате чего получают антитело.
В изобретении предложен также способ получения антитела к С5. В некоторых вариантах осуществления изобретения способ включает иммунизацию животное полипептидом, который содержит MG1-MG2-домен (SEQ ID NO: 43) бета-цепи С5. В некоторых вариантах осуществления изобретения способ включает иммунизацию животное полипептидом, который содержит область, соответствующую аминокислотам в положениях 33-124 бета-цепи (SEQ ID NO: 40) С5. В некоторых вариантах осуществления изобретения способ включает иммунизацию животное полипептидом, который содержит по меньшей мере один фрагмент, выбранный из аминокислот 47-57, 70-76 и 107-110 бета-цепи (SEQ ID NO: 40) C5. В некоторых вариантах осуществления изобретения способ включает иммунизацию животное полипептидом, содержащим фрагмент бета-цепи (SEQ ID NO: 40) C5, который содержит по меньшей мере одну аминокислоту, выбранную из Glu48, Asp51, His70, His72, Lys109 и His110.
В изобретении предложена также фармацевтическая композиция, которая содержит антитело к C5, предлагаемое в настоящем изобретении, и фармацевтически приемлемый носитель.
Антитела к C5, предлагаемые в настоящем изобретении, можно применять в качестве лекарственного средства. Антитела к C5, предлагаемые в настоящем изобретении, можно применять для лечения опосредуемого комплементом заболевания или состояния, которое включает избыточную или неконтролируемую активацию C5. Антитела к C5, предлагаемые в настоящем изобретении, можно применять для усиления клиренса C5 из плазмы.
Антитела к C5, предлагаемые в настоящем изобретении, можно применять для приготовления лекарственного средства. В некоторых вариантах осуществления изобретения лекарственное средство предназначено для лечения опосредуемого комплементом заболевания или состояния, которое включает избыточную или неконтролируемую активацию C5. В некоторых вариантах осуществления изобретения лекарственное средство предназначено для усиления клиренса C5 из плазмы.
Изобретение относится также к способу лечения индивидуума, имеющего опосредуемое комплементом заболевание или состояние, которое включает избыточную или неконтролируемую активацию C5. В некоторых вариантах осуществления изобретения способ включает введение индивидууму в эффективном количестве антитела к C5, предлагаемого в настоящем изобретении. В изобретении предложен также способ усиления клиренса C5 из плазмы у индивидуума. В некоторых вариантах осуществления изобретения способ включает введение индивидууму в эффективном количестве антитела к C5, предлагаемого в настоящем изобретении, для усиления клиренса C5 из плазмы.
Краткое описание чертежей
На чертежах показано:
на фиг 1 - группировка антител к С5 в зависимости от эпитопа, процедура которой описана в примере 2.2. Антитела, сгруппированные в «корзины» для одного и того же эпитопа, заключены в прямоугольники, выделенные жирными линиями;
на фиг. 2А - полученные методом BIACORE® сенсограммы для антител к С5 при рН 7,4 (сплошная линия) и при рН 5,8 (штриховая линия) для оценки зависимости от рН, как описано в примере 3.2. CFA0305, CFA0307, CFA0366, CFA0501, CFA0538 и CFA0599 представляют собой антитела, входящие в группу эпитопа В, как описано в примере 2.2;
на фиг. 2Б - полученные методом BIACORE® сенсограммы для антител к С5 при рН 7,4 (сплошная линия) и при рН 5,8 (штриховая линия) для оценки зависимости от рН, как описано в примере 3.2. CFA0666, CFA0672 и CFA0675 представляют собой антитела, входящие в группу эпитопа В, a CFA0330 и CFA0341 представляют собой антитела, входящие в группу эпитопа Б, как описано в примере 2.2. 305LO5 представляет собой гуманизированное антитело CFA0305, описанное в примере 2.3;
на фиг. 3 - результаты анализа методом вестерн-блоттинга связывания полученных из бета-цепи С5 фрагментов (аминокислоты 19-180, 161-340, 321-500 и 481-660 SEQ ID NO: 40), слитых с GST-меткой, как описано в примере 4.1. CFA0305, CFA0307, CFA0366, CFA0501, CFA0538, CFA0599, CFA0666, CFA0672 и CFA0675 представляют собой антитела, входящие в группу эпитопа В. Антитело к GST служило в качестве положительного контроля. Положения слитых с GST фрагментов С5 (46-49 кДа) указаны стрелкой;
на фиг. 4 - полученные методом BIACORE® сенсограммы, характеризующие связывание антител к С5 с MG1-MG2-доменом бета-цепи С5, как описано в примере 4.3. На верхней панели представлены результаты для CFA0305 (сплошная линия), CFA0307 (штриховая линия), CFA0366 (пунктирно-штриховая линия) и экулизумаба (пунктирная линия). На средней панели представлены результаты для CFA0501 (сплошная линия), CFA0599 (штриховая линия), CFA0538 (пунктирно-штриховая линия) и экулизумаба (пунктирная линия). На нижней панели представлены результаты для CFA0666 (сплошная линия), CFA0672 (штриховая линия), CFA0675 (пунктирно-штриховая линия) и экулизумаба (пунктирная линия). CFA0305, CFA0307, CFA0366, CFA0501, CFA0538, CFA0599, CFA0666, CFA0672 и CFA0675 представляют собой антитела, входящие в группу эпитопа В. Экулизумаб применяли в качестве контрольного антитела к С5;
на фиг. 5А - результаты анализа методом вестерн-блоттинга связывания полученных из MG1-MG2-домена пептидных фрагментов (аминокислоты 33-124, 45-124, 52-124, 33-111, 33-108 и 45-111 SEQ ID NO: 40), слитых с GST-меткой, как описано в примере 4.4. Антитело к GST использовали в качестве антитела, применяемого в реакции. Положения слитых с GST С5-фрагментов (35-37 кДа) указаны стрелкой;
на фиг. 5Б - результаты анализа методом вестерн-блоттинга связывания полученных из MG1-MG2-домена пептидных фрагментов (аминокислоты 33-124, 45-124, 52-124, 33-111, 33-108 и 45-111 SEQ ID NO: 40), слитых с GST-меткой, как описано в примере 4.4. Антитело CFA0305 использовали в качестве антитела, применяемого в реакции;
на фиг. 5В - обобщение результатов реакций связывания антител к С5, с полученными из бета-цепи С5 фрагментами, как описано в примере 4.4. Фрагменты, с которыми связывались антитела к С5, входящие в группу эпитопа В (CFA0305, CFA0307, CFA0366, CFA0501, CFA0538, CFA0599, CFA0666, CFA0672 и CFA0675), выделены серым цветом, а фрагменты, с которыми они не связывались, обозначены белым цветом;
на фиг. 6 - результаты анализа методом вестерн-блоттинга связывания содержащих точечные мутации мутантов С5, в которых Е48, D51 и K109 в бета-цепи заменены на аланин (Е48А, D51A и K109А соответственно), как описано в примере 4.5. На левой панели: экулизумаб (антитело к С5, связывающий альфа-цепь агент) использовали в качестве антитела, применяемого в реакции, положение альфа-цепи С5 (примерно 113 кДа) указано стрелкой. На правой панели: CFA0305 (антитело, входящее в группу эпитопа В, агент, связывающий бета-цепь) использовали в качестве антитела, применяемого в реакции, положение бета-цепи С5 (примерно 74 кДа) обозначено наконечником стрелки;
на фиг. 7 - полученные методом BIACORE® сенсограммы, на которых продемонстрировано взаимодействие экулизумаба-Р76004 (верхняя панель) или 305LO5 (нижняя панель) с мутантами С5 как описано в примере 4.6. Сенсограммы получали путем инъекции C5-wt (жирная сплошная кривая), С5-Е48А (кривая из коротких штрихов), C5-D51A (кривая из длинных штрихов) и С5-K109A (тонкая сплошная кривая) соответственно на поверхность сенсора, на которой иммобилизован экулизумаб-F760G4 или 305LO5. Экулизумаб представляет собой контрольное антитело к С5. 305LO5 представляет собой гуманизированное антитело CFA0305 (входящее в группу эпитопа С) как описано в примере 2.3;
на фиг. 8 - полученные методом BIACORE® сенсограммы, на которых продемонстрировано взаимодействие 305LO5 с мутантами C5-His для оценки зависимости от рН, как описано в примере 4.7. Сенсограммы получали путем инъекции C5-wt (жирная сплошная кривая), C5-H70Y (кривая из длинных штрихов), C5-H72Y (кривая из коротких штрихов), C5-H110Y (пунктирная кривая) и C5-H70Y+H110Y (тонкая сплошная кривая) соответственно на поверхность сенсора, на которой иммобилизовано 305LO5. Комплексам антитело/антиген давали диссоциировать при рН 7,4, а затем дополнительно диссоциировать при рН 5,8 (указано стрелкой) для оценки рН-зависимых взаимодействий;
на фиг. 9А - данные, демонстрирующие ингибирование активируемого комплементом лизиса липосом антителами к С5, как описано в примере 5.1. Представлены результаты для CFA0305, CFA0307, CFA0366, CFA0501, CFA0538, CFA0599, CFA0666, CFA0672 и CFA0675, входящих в группу эпитопа В, как описано в примере 2.2;
на фиг. 9Б - данные, демонстрирующие ингибирование активируемого комплементом лизиса липосом антителами к С5, как описано в примере 5.1. Представлены результаты для антител CFA0330 и CFA0341, входящих в группу эпитопа Б, как описано в примере 2.2;
на фиг. 10А - данные, демонстрирующие ингибирование образования С5а антителами к С5, как описано в примере 5.2. Концентрации С5а количественно оценивали в супернатантах, полученных при анализе лизиса липосом, результаты которого проиллюстрированы на фиг. 9А;
на фиг. 10Б - данные, демонстрирующие ингибирование образования С5а антителами к С5, как описано в примере 5.2. Концентрации С5а количественно оценивали в супернатантах, полученных при анализе лизиса липосом, результаты которого проиллюстрированы на фиг. 9Б;
на фиг. 11 - данные, демонстрирующие ингибирование активируемого комплементом гемолиза антителами к С5, как описано в примере 5.3. Активация комплемента происходила классическим путем;
на фиг. 12 - данные, демонстрирующие ингибирование активируемого комплементом гемолиза антителами к С5, как описано в примере 5.4. Активация комплемента происходила альтернативным путем;
на фиг. 13 - зависимость от времени концентрации в плазме человеческого С5 после внутривенного введения мышам человеческого С5 индивидуально или человеческого С5 и антитела к человеческому С5, установленная путем оценки клиренса С5 с помощью метода, описанного в примере 6.2. CFA0305, CFA0307, CFA0366, CFA0501, CFA0538, CFA0599, CFA0666, CFA0672 и CFA0675 представляют собой антитела, входящие в группу эпитопа В, a CFA0330 и CFA0341 представляют собой антитела, входящие в группу эпитопа Б, как описано в примере 2.2;
на фиг. 14 - зависимость от времени концентрации в плазме антитела к человеческому С5 после внутривенного введения мышам человеческого С5 и антитела к человеческому С5, установленная путем оценки фармакокинетики антитела согласно методу, описанному в примере 6.3. CFA0305, CFA0307, CFA0366, CFA0501, CFA0538, CFA0599, CFA0666, CFA0672 и CFA0675 представляют собой антитела, входящие в группу эпитопа В, а CFA0330 и CFA0341 представляют собой антитела, входящие в группу эпитопа Б, как описано в примере 2.2;
на фиг. 15 - данные, демонстрирующие ингибирование активируемого комплементом лизиса липосом антителами к С5, как описано в примере 9.1. Представлены результаты для антител 305LO15-SG422, 305LO16-SG422, 305LO18-SG422, 305LO19-SG422, 305LO20-SG422 и 305LO20-SG115;
на фиг. 16 - данные, демонстрирующие ингибирование активируемого комплементом лизиса липосом антителами к С5, как описано в примере 9.1. Представлены результаты для антител 305LO15-SG115 и 305LO23-SG429;
на фиг. 17 - данные, демонстрирующие ингибирование активируемого комплементом лизиса липосом антителами к С5, как описано в примере 9.1. Представлены результаты для антител 305LO22-SG115, 305LO22-SG422, 305LO23-SG115 и 305LO23-SG422;
на фиг. 18 - данные, демонстрирующие ингибирование образования С5а антителами к С5, как описано в примере 9.2. Концентрации С5а количественно оценивали в супернатантах, полученных при анализе лизиса липосом, результаты которого проиллюстрированы на фиг. 15;
на фиг. 19 - данные, демонстрирующие ингибирование образования С5а антителами к С5, как описано в примере 9.2. Концентрации С5а количественно оценивали в супернатантах, полученных при анализе лизиса липосом, результаты которого проиллюстрированы на фиг. 16;
на фиг. 20 - данные, демонстрирующие ингибирование активности комплемента в плазме обезьян антителами к С5, как описано в примере 9.3. Антитела к С5 вводили обезьянам циномолгус и измеряли активность комплемента в плазме обезьян путем анализа гемолиза;
на фиг. 21 - данные, демонстрирующие ингибирование биологической активности С5 дикого типа (WT) и вариантов С5 (V145I, R449G, V802I, R885H, R928Q, D966Y, S1310N и E1437D) антителом к С5 (экулизумаб), как описано в примере 9.4;
на фиг. 22 - данные, демонстрирующие ингибирование биологической активности С5 дикого типа (WT) и вариантов С5 (V145I, R449G, V802I, R885H, R928Q, D966Y, S1310N и E1437D) антителом к С5 (вариант 305), как описано в примере 9.4;
на фиг. 23 - данные, демонстрирующие ингибирование активируемого комплементом лизиса липосом антителами к С5 (BNJ441 и вариант 305), как описано в примере 9.5;
на фиг. 24 - зависимость от времени концентрации в плазме С5 обезьян циномолгус после внутривенного введения обезьянам циномолгус антитела к человеческому С5, установленная путем оценки клиренса С5 с помощью метода, описанного в примере 10.2;
на фиг. 25 - зависимость от времени концентрации в плазме антитела к человеческому С5 после внутривенного введения обезьянам циномолгус антитела к человеческому С5, установленная путем оценки фармакокинетики антитела с помощью метода, описанного в примере 10.3;
на фиг. 26А и 26Б - изображение кристаллической структуры 305 Fab, связанного с MG1-доменом человеческого С5 (hC5), которая описана в примере 11.6. На фиг. 26А представлено изображение асимметричной элементарной ячейки. MG1 изображен в виде поверхности, а 305 Fab изображен с помощью полосок (темно-серый цвет: тяжелая цепь, светло-серый цвет: легкая цепь). На фиг. 26Б представлено наложение молекул 1 и 2 (темно-серый цвет: молекула 1, светло-серый цвет: молекула 2);
на фиг. 27А - иллюстрация эпитопа для контактной области 305 Fab в MG1-домене, описанные в примере 11.6. На фиг. 27А представлены данные о картировании MG1 в аминокислотной последовательности (темно-серый цвет: расстояние меньше чем 3,0 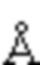 , светло-серый цвет: расстояние меньше чем 4,5
, светло-серый цвет: расстояние меньше чем 4,5 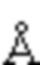 );
);
на фиг. 27Б - иллюстрация эпитопа для контактной области 305 Fab в MG1-домене, описанные в примере 11.6. На фиг. 27Б представлены данные о картировании в кристаллической структуре (темно-серые сферы: расстояние меньше чем 3,0 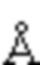 , светло-серые сферы: расстояние меньше чем 4,5
, светло-серые сферы: расстояние меньше чем 4,5 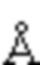 );
);
на фиг. 28А - укрупненное изображение, иллюстрирующее взаимодействия Е48, D51 и K109 (изображены палочками) с 305 Fab (изображен в виде поверхности), что описано в примере 11.7;
на фиг. 28Б - иллюстрация взаимодействий между Е48 и его окружением (темно-серая пунктирная линия: водородная связь с Fab, светло-серая пунктирная линия: опосредуемая водой водородная связь), что описано в примере 11.7;
на фиг. 28В - иллюстрация взаимодействий между D51 и его окружением (темно-серая пунктирная линия: водородная связь с Fab), что описано в примере 11.7;
на фиг. 28Г - иллюстрация взаимодействий между K109 и его окружением (темно-серая пунктирная линия: водородная связь с Fab, светло-серая пунктирная линия: соляная мостиковая связь с H-CDR3_D95), что описано в примере 11.7;
на фиг. 29А - укрупненное изображение, иллюстрирующее взаимодействия Н70, Н72 и Н110 (изображены палочками) с 305 Fab (изображен в виде поверхности), которые описаны в примере 11.8, в той же самой ориентации, что и на фиг. 28А;
на фиг. 29Б - иллюстрация взаимодействий между Н70 и его окружением, что описано в примере 11.8. Этот гистидиновый остаток изображен с помощью палочек и сетки. Водородная связь изображена пунктирной линией;
на фиг. 29В - иллюстрация взаимодействий между Н72 и его окружением, что описано в примере 11.8. Этот гистидиновый остаток изображен с помощью палочек и сетки. Водородная связь изображена пунктирной линией;
на фиг. 29Г - иллюстрация взаимодействий между Н110 и его окружением, что описано в примере 11.8. Этот гистидиновый остаток изображен с помощью палочек и сетки. Расстояние между Н110 и H-CDR3_H100c указано пунктирной линией.
Описание вариантов осуществления изобретения
Технологии и процедуры, которые описаны или на которые сделаны ссылки в настоящем описании, в целом хорошо известны специалистам в данной области, и их широко применяют с использованием общепринятых методологий, таких, например, как описанные у Sambrook и др., Molecular Cloning: A Laboratory Manual, 3-е изд., изд-во Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. 2001; Current Protocols in Molecular Biology (под ред. F.М. Ausubel и др., 2003); серии Methods in Enzymology (изд-во Academic Press, Inc.): PCR 2: A Practical Approach (под ред. M.J. MacPherson, B.D. Hames и G.R. Taylor, 1995), Antibodies, A Laboratory Manual, под ред. Harlow и Lane, 1988 и Animal Cell Culture (под ред. R.I. Freshney 1987); Oligonucleotide Synthesis (под ред. M.J. Gait, 1984); Methods in Molecular Biology, изд-во Humana Press; Cell Biology: A Laboratory Notebook (под ред. J.E. Cellis, 1998) из-во Academic Press; Animal Cell Culture (под ред. R.I. Freshney, 1987); Introduction to Cell and Tissue Culture (J.P. Mather и Р.Е. Roberts, 1998), изд-во Plenum Press; Cell and Tissue Culture: Laboratory Procedures (под ред. A. Doyle, J.B. Griffiths и D.G. Newell, 1993-8), изд-во J. Wiley and Sons; Handbook of Experimental Immunology (под ред. D.M. Weir и С.С. Blackwell); Gene Transfer Vectors for Mammalian Cells (под ред. J.M. Miller и М.Р. Calos, 1987); PCR: The Polymerase Chain Reaction, (под ред. Mullis и др., 1994); Current Protocols in Immunology (под ред. J.E. Coligan и др., 1991); Short Protocols in Molecular Biology (изд-во Wiley and Sons, 1999); Immunobiology (C.A. Janeway и Р. Travers, 1997); Antibodies (P. Finch, 1997); Antibodies: A Practical Approach (под ред. D. Catty., изд-во IRL Press, 1988-1989); Monoclonal Antibodies: A Practical Approach (под ред. P. Shepherd и С. Dean, изд-во Oxford University Press, 2000); Using Antibodies: A Laboratory Manual (E. Harlow и D. Lane, изд-во Cold Spring Harbor Laboratory Press, 1999); The Antibodies (под ред. M. Zanetti и J.D. Capra, изд-во Harwood Academic Publishers, 1995); и Cancer: Principles and Practice of Oncology (под ред. V.T. De Vita и др., изд-во J.B. Lippincott Company, 1993).
I. Определения
Если не указано иное, то технические и научные понятия, применяемые в настоящем описании, имеют значения, хорошо известные обычному специалисту в области, в которой относится настоящее изобретение. У Singleton и др., Dictionary of Microbiology and Molecular Biology 2-ое изд., изд-во J. Wiley & Sons, New York, N.Y. 1994 и March, Advanced Organic Chemistry Reactions, Mechanisms and Structure 4-ое изд., изд-во John Wiley & Sons, New York, N.Y. 1992, в целом представлено предназначенное для специалистов в данной области толкование многих понятий, применяемых в настоящей заявке. Все процитированные в настоящем описании ссылки, включая заявки на патент и публикации патентов, полностью включены в него в качестве ссылки.
Для интерпретации настоящего описания изобретения следует применять приведенные ниже понятия, и, когда это возможно, понятия, применяемые в единственном числе, включают также их применение во множественном числе и наоборот. Должно быть очевидно, что применяемая в настоящем описании терминология представлена только для цели описания конкретных вариантов осуществления изобретения и не направлена на ограничение его объема. В случае если любое указанное ниже определение вступает в противоречие с указанным в любом документе, включенном в описание в качестве ссылки, то следует использовать указанное ниже определение.
Для целей настоящего описания «акцепторный человеческий каркасный участок» означает каркасный участок, который содержит аминокислотную последовательность каркасного участка вариабельного домена легкой цепи (VL) или каркасный участок вариабельного домена тяжелой цепи (VH), происходящую из каркасного участка человеческого иммуноглобулина или человеческого консенсусного каркасного участка, указанного ниже. Акцепторный человеческий каркасный участок, «происходящий из» каркасного участка человеческого иммуноглобулина или человеческого консенсусного каркасного участка, может иметь такую же аминокислотную последовательность или может содержать изменения в аминокислотной последовательности. В некоторых вариантах осуществления изобретения количество аминокислотных изменений составляет 10 или менее, 9 или менее, 8 или менее, 7 или менее, 6 или менее, 5 или менее, 4 или менее, 3 или менее или 2 или менее. В некоторых вариантах осуществления изобретения последовательность человеческого акцепторного каркасного участка VL идентична последовательности каркасного участка VL человеческого иммуноглобулина или последовательности человеческого консенсусного каркасного участка.
Понятие «аффинность» относится к суммарной силе всех нековалентных взаимодействий между одним сайтом связывания молекулы (например, антитела) и ее партнером по связыванию (например, антигеном). В контексте настоящего описания, если не указано иное, «аффинность связывания» относится к присущей молекуле аффинности связывания, отражающей взаимодействие по типу 1:1 между компонентами связывающейся пары (например, антителом и антигеном). Аффинность молекулы Х к ее партнеру Y, как правило, можно характеризовать с помощью константы диссоциации (Kd). Аффинность можно оценивать с помощью общепринятых методов, известных в данной области, включая те, которые представлены в настоящем описании. Ниже в качестве иллюстрации представлены конкретные варианты измерения аффинности связывания.
Антитело «с созревшей аффинностью» обозначает антитело с одним или несколькими изменениями в одном или нескольких гипервариабельных участках (HVR) по сравнению с родительским антителом, которое не содержит указанных изменений, указанные изменения приводят к повышению аффинности антитела к антигену.
Понятия «антитело к С5» и «антитело, которое связывается с С5» относятся к антителу, которое обладает способностью связываться с С5 с аффинностью, достаточной для того, чтобы антитело можно было применять в качестве диагностического и/или терапевтического агента, мишенью которого является С5. В одном из вариантов осуществления изобретения уровень связывания антитела к С5 с неродственным не представляющим собой С5 белком составляет менее чем примерно 10% от связывания антитела с С5 по данным измерений, полученным, например, с помощью радиоиммуноанализа (РИА). В некоторых вариантах осуществления изобретения антитело, которое связывается с С5, имеет константу диссоциации (Kd) 1 мкМ или менее, 100 нМ или менее, 10 нМ или менее, 1 нМ или менее, 0,1 нМ или менее, 0,01 нМ или менее или 0,001 нМ или менее (например, 10-8 М или менее, например, от 10-8 М до 10-13 М, например, от 10-9 М до 10-13 М). В некоторых вариантах осуществления изобретения антитело к С5 связывается с эпитопом С5, который является консервативным для С5 из различных видов.
В контексте настоящего описания понятие «антитело» используется в его наиболее широком смысле и относится к различным структурам антител, включая (но, не ограничиваясь только ими) моноклональные антитела, поликлональные антитела, мультиспецифические антитела (например, биспецифические антитела) и фрагменты антител, при условии, что они обладают требуемой антигенсвязывающей активностью.
Понятие «фрагмент антитела» относится к молекуле, отличной от интактного антитела, которая содержит часть интактного антитела, связывающуюся с антигеном, с которым связывается интактное антитело. Примеры фрагментов антитела включают (но, не ограничиваясь только ими) Fv, Fab, Fab', Fab'-SH, F(ab')2; димерные антитела (диабоди); линейные антитела; молекулы одноцепочечных антител (например, scFv) и мультиспецифические антитела, образованные из фрагментов антител.
Понятие «антитело, которое связывается с тем же эпитопом», что и референс-антитело, относится к антителу, которое блокирует связывание референс-антитела с его антигеном при оценке с помощью анализа в условиях конкуренции (конкурентный анализ) и/или, наоборот, референс-антитело блокирует связывание антитела с его антигеном при оценке с помощью конкурентного анализа. Пример конкурентного анализа представлен в настоящем описании.
Понятие «химерное» антитело относится к антителу, в котором часть тяжелой и/или легкой цепи происходит из конкретного источника или конкретных видов, а остальная часть тяжелой и/или легкой цепи происходит из другого источника или других видов.
Понятие «класс» антитела относится к типу константного домена или константной области, который/которая входит в его тяжелую цепь. Известно пять основных классов антител: IgA, IgD, IgE, IgG и IgM и некоторые из них можно подразделять дополнительно на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелой цепи, которые соответствуют различным классам иммуноглобулина, обозначают как альфа, дельта, эпсилон, гамма и мю (α, δ, ε, γ и μ) соответственно.
Понятие "цитотоксический агент» в контексте настоящего описания относится к субстанции, которая ингибирует клеточную функцию или препятствует ей и/или вызывает клеточную гибель или деструкцию. Цитотоксические агенты включают (но, не ограничиваясь только ими) радиоактивные изотопы (например. At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 и радиоактивные изотопы Lu); химиотерапевтические агенты или лекарственные средства (например, метотрексат, адриамицин, алкалоиды барвинка (винкристин, винбластин, этопозид), доксорубицин, мелфалан, митомицин С, хлорамбуцил, даунорубицин или другие интеркалирующие агенты); ингибирующие рост агенты; ферменты и их фрагменты, такие как нуклеолитические ферменты; антибиотики; токсины, такие как низкомолекулярные токсины или ферментативно активные токсины бактериального, грибного, растительного или животного происхождения, включая их фрагменты и/или варианты; и различные противоопухолевые или противораковые агенты, указанные ниже.
Понятие «эффекторные функции» относится к тем видам биологической активности, которые связаны с Fc-областью антитела, которые варьируются в зависимости от изотипа антитела. Примеры эффекторных функций антитела включают: связывание C1q и комплементзависимую цитотоксичность (CDC); связывание Fc-рецептора; антитело-обусловленную клеточнозависимую цитотоксичность (ADCC); фагоцитоз; понижающую регуляцию рецепторов клеточной поверхности (например, B-клеточного рецептора) и активацию В-клеток.
Понятие «эффективное количество» агента, например, фармацевтической композиции, означает количество, эффективное в дозах и в течение периода времени, необходимых для достижения требуемого терапевтического или профилактического результата.
Понятие «эпитоп» включает любую детерминанту, обладающую способностью связываться антителом. Эпитоп представляет собой область антигена, которая связывается с антителом, мишенью которого является антиген, и включает специфические аминокислоты, которые непосредственно контактируют с антителом. Эпитопные детерминанты могут включать химически активные поверхностные группы молекул, таких как аминокислоты, боковые сахарные цепи, фосфорильные или сульфонильные группы, и могут иметь специфически характеристики трехмерной структуры и/или специфические характеристики зарядов. Как правило, антитела, специфические в отношении конкретного антигена-мишени, должны предпочтительно распознавать эпитоп на антигене-мишени в сложной смеси белков и/или макромолекул.
Понятие «Fc-область» в контексте настоящего описания относится к С-концевой области тяжелой цепи иммуноглобулина, которая содержит по меньшей мере часть константной области. Понятие включает нативную последовательность Fc-областей и вариант Fc-областей. В одном из вариантов осуществления изобретения Fc-область тяжелой цепи человеческого IgG простирается с Cys226 или с Pro230 до карбоксильного конца тяжелой цепи. Однако С-концевой лизин (Lys447) Fc-области может присутствовать или отсутствовать. Если специально не указано иное, то нумерация аминокислотных остатков в Fc-области или константной области соответствует системе нумерации EU, которую обозначают также как EU-индекс, описанной у Kabat Е.А. и др., Sequences of Proteins of Immunological Interest, 5-ое изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991.
Понятие «каркасный участок» или «FR», означает остатки вариабельного домена, отличные от остатков гипервариабельного участка (HVR). FR вариабельного домена, как правило, состоит из четырех FR-доменов: FR1, FR2, FR3 и FR4. Таким образом, последовательности HVR и FR, как правило, имеют следующее расположение в VH (или VL): FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
Понятия «полноразмерное антитело», «интактное антитело» и «цельное антитело» в контексте настоящего описания используют взаимозаменяемо для обозначения антитела, имеющего структуру, практически сходную с нативной структурой антитела, или имеющего тяжелые цепи, которые содержат представленную в настоящем описании Fc-область.
Понятия «клетка-хозяин», «линия клеток-хозяев» и «культура клеток-хозяев» используют взаимозаменяемо, и они относятся к клеткам, в которые интродуцирована экзогенная нуклеиновая кислота, включая потомство указанных клеток. К клеткам-хозяевам относятся «трансформанты» и «трансформированные клетки», которые включают первично трансформированную клетку и полученное из нее потомство безотносительно к количеству пересевов. Потомство может не быть полностью идентичным по составу нуклеиновых кислот родительской клетке, но может содержать мутации. Под объем изобретения подпадает мутантное потомство, которое обладает такой же функцией или биологической активностью, которая обнаружена в результате скрининга или отобрана у исходной трансформированной клетки.
«Человеческое антитело» представляет собой антитело, имеющее аминокислотную последовательность, которая соответствует последовательности антитела, продуцируемого в организме человека или человеческими клетками, или происходящее из нечеловеческого источника, в котором использован спектр человеческих антител или другие кодирующие человеческое антитело последовательности. Из указанного определения человеческого антитела специально исключено гуманизированное антитело, содержащее нечеловеческие антигенсвязывающие остатки.
«Человеческий консенсусный каркасный участок» представляет собой каркасный участок, в который входят наиболее часто встречающиеся аминокислотные остатки в выбранных последовательностях каркасных участков VL или VH человеческого иммуноглобулина. Как правило, выбор последовательностей VL или VH человеческого иммуноглобулина осуществляют из подгруппы последовательностей вариабельных доменов. Как правило, подгруппа последовательностей представляет собой подгруппу, описанную у Kabat и др., Sequences of Proteins of Immunological Interest, 5-ое изд., публикация NIH 91-3242, Bethesda MD, т.т. 1-3, 1991. В одном из вариантов осуществления изобретения касательно VL подгруппа представляет собой подгруппу каппа I согласно Kabat и др., выше. В одном из вариантов осуществления изобретения касательно VH подгруппа представляет собой подгруппу III согласно Kabat и др., выше.
Понятие «гуманизированное» антитело относится к химерному антителу, которое содержит аминокислотные остатки из нечеловеческих HVR и аминокислотные остатки из человеческих FR. В некоторых вариантах осуществления изобретения гуманизированное антитело может содержать практически все из по меньшей мере одного и, как правило, двух вариабельных доменов, в которых все или практически все HVR (например, CDR) соответствуют участкам нечеловеческого антитела, а все или практически все FR соответствуют участкам человеческого антитела. Гуманизированное антитело необязательно может содержать по меньшей мере часть константной области антитела, происходящей из человеческого антитела. Понятие «гуманизированная форма» антитела, например, нечеловеческого антитела, относится к антителу, которое подвергали гуманизации.
Понятие «гипервариабельный участок» или «HVR» в контексте настоящего описания относится к каждому из участков вариабельного домена антитела, последовательности которых являются гипервариабельными («определяющие комплементарность участки» или «CDR») и/или формируют петли определенной структуры («гипервариабельные петли»), и/или содержат контактирующие с антигеном остатки («контакты с антигеном»). Как правило, антитела содержат шесть HVR; три в VH (H1, Н2, Н3) и три в VL (L1, L2, L3). Согласно настоящему описанию примеры HVR включают (а) гипервариабельные петли, включающие аминокислотные остатки 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (H1), 53-55 (Н2) и 96-101 (Н3) (Chothia и Lesk, J. Mol. Biol. 196, 1987, cc. 901-917); (б) CDR, включающие аминокислотные остатки 24-34 (L1), 50-56 (L2), 89-97 (L3), 31-35b (H1), 50-65 (Н2) и 95-102 (Н3) (Kabat и др., Sequences of Proteins of Immunological Interest, 5-ое изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991, публикация NIH 91-3242); (в) области контакта с антигеном, включающие аминокислотные остатки 27с-36 (L1), 46-55 (L2), 89-96 (L3), 30-35b (H1), 47-58 (Н2) и 93-101 (Н3) (MacCallum и др., J. Mol. Biol. 262, 1996, сс. 732-745); и (г) комбинации остатков, указанных в подпунктах (а), (б) и/или (в), включающие аминокислотные остатки HVR 46-56 (L2), 47-56 (L2), 48-56 (L2), 49-56 (L2), 26-35 (H1), 26-35b (H1), 49-65 (H2), 93-102 (Н3) и 94-102 (Н3).
Если специально не указано иное, то остатки в HVR и другие остатки в вариабельном домене (например, остатки в FR) нумеруют согласно Kabat и др., выше.
«Иммуноконъюгат» представляет собой антитело, конъюгированное с одной или несколькими гетерологичной(ыми) молекулой(ами), включая (но, не ограничиваясь только им) цитотоксический агент.
«Индивидуум» или «субъект» представляет собой млекопитающее. К млекопитающим относятся (но, не ограничиваясь только ими) одомашненные животные (например, коровы, овцы, кошки, собаки и лошади), приматы (например, человек и приматы кроме человека, например, обезьяны), кролики и грызуны (например, мыши и крысы). В некоторых вариантах осуществления изобретения индивидуум или субъект представляет собой человека.
«Выделенное» антитело представляет собой антитело, которое отделено от компонента его естественного окружения. В некоторых вариантах осуществления изобретения антитело очищают до чистоты, превышающей 95% или 99% по данным, например, электрофоретических анализов (таких, например, как ДСН-ПААГ, изоэлектрическое фокусирование (ИЭФ), капиллярный электрофорез) или хроматографических анализов (таких, например, как ионообменная хроматография или ЖХВР с обращенной фазой). Обзор методов оценки чистоты антител см., например, у Flatman и др., J. Chrom. В 848, 2007, сс. 79-87.
«Выделенная» нуклеиновая кислота представляет собой молекулу нуклеиновой кислоты, которая отделена от компонента ее естественного окружения. Выделенная нуклеиновая кислота включает молекулу нуклеиновой кислоты, содержащуюся в клетке, которая в норме включает молекулу нуклеиновой кислоты, но в которой молекула нуклеиновой кислоты присутствует вне хромосомы или в которой ее локализация на хромосоме отличается от ее встречающейся в естественных условиях локализации на хромосоме.
Понятие «выделенная нуклеиновая кислота, кодирующая антитело к С5» относится к одной или нескольким молекулам нуклеиновых кислот, кодирующих тяжелые и легкие цепи антитела (или их фрагменты), включая указанную(ые) молекулу(ы) в одном векторе или в различных векторах, и указанную(ые) молекулу(ы) нуклеиновой(ых) кислоты(т), присутствующую(ие) в одном или нескольких положениях в клетке-хозяине.
Понятие «моноклональное антитело» в контексте настоящего описания относится к антителу, полученному из популяции практически гомогенных антител, т.е. индивидуальные антитела, входящие в популяцию, идентичны и/или связываются с одним и тем же эпитопом, за исключением возможных вариантов антител, например, содержащих мутации, встречающиеся в естественных условиях или возникающие в процессе производства препарата моноклонального антитела, указанные варианты, как правило, присутствуют в минорных количествах. В отличие от препаратов поликлональных антител, которые, как правило, включают различные антитела к различным детерминантам (эпитопам), каждое моноклональное антитело из препарата моноклонального антитела направлено против одной детерминанты антигена. Таким образом, прилагательное «моноклональный» определяет особенность антитела, характеризуя его как полученное из практически гомогенной популяции антител, а не сконструированное в соответствии с требованиями к получению антитела с помощью какого-либо конкретного метода. Например, моноклональные антитела, которые можно применять согласно настоящему изобретению, можно создавать с помощью различных технологий, включая (но, не ограничиваясь только ими) метод гибридом, методы рекомбинантной ДНК, методы фагового дисплея и методы, основанные на использовании трансгенных животных, которые содержат все или часть локусов человеческого иммуноглобулина, указанные методы и другие, приведенные в качестве примера методы получения моноклональных антител, представлены в настоящем описании.
Понятие «голое антитело» относится к антителу, неконъюгированному с гетерологичным фрагментом (например, цитотоксическим фрагментом) или радиоактивной меткой. Голое антитело может присутствовать в фармацевтической композиции.
Понятие «нативные антитела» относится к встречающимся в естественных условиях молекулам иммуноглобулинов с различными структурами. Например, нативные антитела в виде IgG представляют собой гетеротетрамерные гликопротеины с молекулярной массой примерно 150000 Да, состоящие из двух идентичных легких цепей и двух идентичных тяжелых цепей, связанных дисульфидными мостиками. В направлении от N-конца к С-концу, каждая тяжелая цепь имеет вариабельную область (VH), которую называют также вариабельным тяжелым доменом или вариабельным доменом тяжелой цепи, за которой следует три константных домена (СН1, СН2 и СН3). Аналогично этому, в направлении от N-конца к С-концу, каждая легкая цепь имеет вариабельную область (VL), которую называют также вариабельным легким доменом или вариабельным доменом легкой цепи, за которой следует константный домен легкой цепи (CL). Легкая цепь антитела в зависимости от аминокислотной последовательности ее константного домена может принадлежать к одному из двух типов, которые обозначают каппа (κ) и лямбда (λ).
Понятие «листовка-вкладыш в упаковку» относится к инструкциям, которые обычно входят в поступающие в продажу упаковки терапевтических продуктов, содержащим информацию о показаниях, применении, дозе, пути введения, комбинированной терапии, противопоказаниях и/или мерах предосторожности, которые связаны с применением указанных терапевтических продуктов.
«Процент (%) идентичности аминокислотной последовательности» относительно полипептидной референс-последовательности определяют как процент аминокислотных остатков в последовательности-кандидате, которые идентичны аминокислотным остаткам в полипептидной референс-последовательности, после выравнивая последовательностей и при необходимости интродукции брешей для достижения максимального процента идентичности последовательностей, и не рассматривая какие-либо консервативные замены в качестве компонента при оценке идентичности последовательностей. Сравнительный анализ для целей определения процента идентичности аминокислотных последовательностей можно осуществлять различными путями, известными в данной области, используя, например, публично доступные компьютерные программы, такие как программа BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области могут определять соответствующие параметры для выравнивания последовательностей, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Однако для целей настоящего изобретения величину % идентичности аминокислотной последовательности определяют, используя компьютерную программу для сравнения последовательностей ALIGN-2. Авторство компьютерной программы для сравнения последовательностей ALIGN-2 принадлежит фирме Genentech, Inc., и исходный код был представлен в комплекте с документацией для пользователей в U.S. Copyright Office, Washington D.C., 20559, где он зарегистрирован как U.S. Copyright Registration № TXU510087. Программа ALIGN-2 публично доступна от фирмы Genentech, Inc., Южный Сан-Франциско, шт. Калифорния, или ее можно компилировать на основе исходного кода. Программу ALIGN-2 можно компилировать для применения в операционной системе UNIX, включая цифровую систему UNIX V4.0D. Все параметры, требуемые для сравнения последовательностей, устанавливаются программой ALIGN-2 и не должны изменяться.
В ситуациях, в которых ALIGN-2 применяют для сравнения аминокислотных последовательностей, % идентичности аминокислотных последовательностей данной аминокислотной последовательности А по сравнению, с или относительно данной аминокислотной последовательности Б (что в альтернативном варианте можно обозначать как данная аминокислотная последовательность А, которая имеет или содержит определенный % идентичности аминокислотной последовательности по сравнению, с или относительно данной аминокислотной последовательности Б), рассчитывают следующим образом: 100 × дробь X/Y, где Х обозначает количество аминокислотных остатков, определенных как идентичные совпадения при оценке с помощью программы для сравнительного анализа последовательностей ALIGN-2, где с помощью программы осуществляли сравнение А и Б, и где Y обозначает общее количество аминокислотных остатков в Б. Должно быть очевидно, что, если длина аминокислотной последовательности А не равна длине аминокислотной последовательности Б, то % идентичности аминокислотных последовательностей А относительно Б не может быть равен % идентичности аминокислотной последовательности Б относительно А. Если специально не указано иное, то все величины % идентичности аминокислотных последовательностей, указанные в настоящем описании, получали с использованием описанной в предыдущем параграфе компьютерной программы ALIGN-2.
Понятие «фармацевтическая композиция» относится к препарату, который находится в такой форме, что он обеспечивает биологическую активность входящего в его состав действующего вещества, которое должно обладать эффективностью, и который не содержит дополнительных компонентов, обладающих неприемлемой токсичностью для индивидуума, которому следует вводить композицию.
«Фармацевтически приемлемый носитель» относится к ингредиенту в фармацевтической композиции, отличному от действующего вещества, который является нетоксичным для индивидуума. Фармацевтически приемлемые носители включают (но, не ограничиваясь только ими) буфер, эксципиент, стабилизатор или консервант.
Понятие «С5» в контексте настоящего описания может относиться к любому нативному С5 из любого позвоночного животного, включая млекопитающих, таких как приматы (например, человек и обезьяны) и грызуны (например, мыши и крысы). Если специально не указано иное, понятие «С5» относится к человеческому белку С5, имеющему аминокислотную последовательность, представленную в SEQ ID NO: 39, и содержащему последовательность бета-цепи, представленную в SEQ ID NO: 40. Понятие относится к «полноразмерному» непроцессированному С5, а также к любой форме С5, которая образуется в результате процессинга в клетке. Под понятие подпадают также встречающиеся в естественных условиях варианты С5, например, сплайсинговые варианты или аллельные варианты. Аминокислотную последовательность приведенного в качестве примера человеческого С5 представлена в SEQ ID NO: 39 (С5 «дикого типа» или «WT»). Аминокислотная последовательность приведенной в качестве примера бета-цепи человеческого С5 представлена в SEQ ID NO: 40. Аминокислотные последовательности приведенных в качестве примера MG1-, MG2- и MG1-MG2-доменов бета-цепи человеческого С5 представлены в SEQ ID NO: 41, 42 и 43 соответственно. Аминокислотные последовательности приведенных в качестве примера С5 обезьян циномолгус и мышей представлены в SEQ ID NO: 44 и 105 соответственно. Аминокислотные остатки 1-19 SEQ ID NO: 39, 40, 43, 44 и 105 соответствуют сигнальной последовательности, которая удаляется в результате процессинга в клетке, и поэтому отсутствуют в соответствующих приведенных в качестве примера аминокислотных последовательностях.
В контексте настоящего описания понятие «лечение» (и его грамматические вариации, такие как «лечить» или «процесс лечения») относится к клиническому вмешательству с целью изменения естественного течения болезни у индивидуума, подлежащего лечению, и его можно осуществлять либо для профилактики, либо в процессе развития клинической патологии. Требуемыми действиями лечения являются (но, не ограничиваясь только ими) предупреждение возникновения или рецидива болезни, облегчение симптомов, уменьшение любых прямых или косвенных патологических последствий болезни, предупреждение метастазов, снижение скорости развития болезни, облегчение или временное ослабление болезненного состояния и ремиссия или улучшение прогноза. В некоторых вариантах осуществления изобретения антитела, предлагаемые в изобретении, применяют для задержки развития болезни или замедления прогрессирования болезни.
Понятие «вариабельная область» или «вариабельный домен» относится к домену тяжелой или легкой цепи антитела, который участвует в связывании антитела с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL соответственно) нативного антитела, как правило, имеют сходные структуры, при этом каждый домен содержит четыре консервативных каркасных участка (FR) и три гипервариабельных участка (HVR) (см., например, Kindt и др., Kuby Immunology, 6-ое изд., изд-во W.H. Freeman and Co., 2007, с. 91). Одного VH- или VL-домена может быть достаточно для обеспечения специфичности связывания антигена. Кроме того, антитела, которые связываются с конкретным антигеном, можно выделять, используя VH- или VL-домен из антитела, которое связывается с антигеном, для скрининга библиотеки комплементарных VL- или VH-доменов соответственно (см., например, Portolano и др., J. Immunol. 150, 1993, cc. 880-887; Clarkson и др., Nature 352, 1991, cc. 624-628).
Понятие «вектор» в контексте настоящего описания относится к молекуле нуклеиновой кислоты, которая обладает способностью к размножению другой нуклеиновой кислоты, с которой она связана. Понятие включает вектор в виде самореплицирующейся структуры нуклеиновой кислоты, а также вектор, включенный в геном клетки-хозяина, в которую он интродуцирован. Некоторые векторы обладают способностью контролировать экспрессию нуклеиновых кислот, с которыми они функционально связаны. Указанные векторы в контексте настоящего описания обозначают как «экспрессионные векторы».
II. Композиции и способы
Одним из объектов изобретения являются, в частности, антитела к С5 и их применения. Некоторыми вариантами осуществления изобретения являются антитела, которые связываются с С5. Антитела, предлагаемые в изобретении, можно применять, например, для диагностирования или лечения опосредуемого комплементом заболевания или состояния, которое включает избыточную или неконтролируемую активацию С5.
А. Примеры антител к С5
Одним из объектов изобретения являются выделенные антитела, которые связываются с С5. В некоторых вариантах осуществления изобретения, антитело к С5, предлагаемое в настоящем изобретении, связывается с эпитопом в бета-цепи С5. В некоторых вариантах осуществления изобретения антитело к С5 связывается с эпитопом в MG1-MG2-домене бета-цепи С5. В некоторых вариантах осуществления изобретения антитело к С5 связывается с эпитопом во фрагменте, состоящем из аминокислот 19-180 бета-цепи С5. В некоторых вариантах осуществления изобретения антитело к С5 связывается с эпитопом в MG1-домене (аминокислоты 20-124 SEQ ID NO: 40 (SEQ ID NO: 41)) бета-цепи С5. В некоторых вариантах осуществления изобретения антитело к С5 связывается с эпитопом во фрагменте, состоящем из аминокислот 33-124 бета-цепи С5 (SEQ ID NO: 40). В другом варианте осуществления изобретения антитело не связывается с фрагментом, более коротким, чем фрагмент, состоящий из аминокислот 33-124 бета-цепи С5, например, с фрагментом, состоящим из аминокислот 45-124, 52-124, 33-111, 33-108 или 45-111 бета-цепи С5 (SEQ ID NO: 40).
Другим объектом изобретения являются антитела к С5, обладающие рН-зависимыми характеристиками связывания. В контексте настоящего описания понятие «рН-зависимое связывание» означает, что антитело обладает «пониженной способностью связываться с С5 при кислом рН по сравнению с его связыванием при нейтральном рН» (для целей настоящего описания оба понятия можно использовать взаимозаменяемо). Например, антитела с «с рН-зависимыми характеристиками связывания» включают антитела, которые связываются с С5 с более высокой аффинностью при нейтральном рН, чем при кислом рН. В некоторых вариантах осуществления изобретения антитела, предлагаемые в настоящем изобретении, связываются с С5 с аффинностью, по меньшей мере в 2, 3, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 200, 400, 1000, 10000 или более раз более высокой при нейтральном рН, чем при кислом рН. В некоторых вариантах осуществления изобретения антитела связываются с С5 с более высокой аффинностью при рН 7,4, чем при рН 5,8. В других вариантах осуществления изобретения антитела, предлагаемые в настоящем изобретении, связываются с С5 с аффинностью, по меньшей мере в 2, 3, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 200, 400, 1000, 10000 или более раз более высокой при рН 7,4, чем при рН 5,8.
Для целей настоящего описания «аффинность» антитела к С5 выражают в понятиях KD антитела. KD антитела означает константу равновесия диссоциации взаимодействия антитело-антиген. Чем выше величина KD, характеризующая связывание антитела с его антигеном, тем слабее его аффинность связывания с указанным конкретным антигеном. Таким образом, в контексте настоящего описания понятие «более высокая аффинность при нейтральном рН, чем при кислом рН» (или эквивалентное понятие «рН-зависимое связывание») означает, что KD, характеризующая связывание антитела с С5 при кислом рН, выше, чем KD, характеризующая связывание антитела с С5 при нейтральном рН. Например, в контексте настоящего изобретения считается, что антитело связывается с С5 с более высокой аффинностью при нейтральном рН, чем при кислом рН, если KD, характеризующая связывание антитела с С5 при кислом рН, по меньшей мере в 2 раза выше, чем KD, характеризующая связывание антитела с С5 при нейтральном рН. Таким образом, настоящее изобретение включает антитела, связывание которых с С5 при кислом рН характеризуется величиной KD, которая по меньшей мере в 2, 3, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 200, 400, 1000, 10000 или более раз превышает KD, характеризующую связывание с С5 при нейтральном рН. В другом варианте осуществления изобретения величина KD антитела при нейтральном рН может составлять 10-7, 10-8, 10-9, 10-10, 10-11, 10-12 М или менее. В другом варианте осуществления изобретения величина KD антитела при кислом рН может составлять 10-9 М, 10-8 М, 10-7 М, 10-6 М или более.
В других вариантах осуществления изобретения считается, что антитело связывается с С5 с более высокой аффинностью при нейтральном рН, чем при кислом рН, если величина KD, характеризующая связывание антитела с С5 при рН 5,8, по меньшей мере в 2 раза выше, чем KD, характеризующая связывание антитела с С5 при рН 7,4. В некоторых вариантах осуществления изобретения связывание предложенных антител с С5 при рН 5,8 характеризуются величиной KD, которая по меньшей мере в 3, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 200, 400, 1000, 10000 или более раз превышает KD, характеризующую связывание антитела с С5 при рН 7,4. В другом варианте осуществления изобретения величина KD антитела при рН 7,4 может составлять 10-7, 10-8, 10-9, 10-10, 10-11, 10-12 М или менее. В другом варианте осуществления изобретения величина KD антитела при рН 5,8 может составлять 10-9, 10-8, 10-7, 10-6 М или более.
Характеристики связывания антитела с конкретным антигеном можно выражать также в виде kd антитела. Величина kd антитела означает константу скорости диссоциации антитела относительно конкретного антигена и ее выражают в виде величин, обратных секунде (т.е., с-1). Повышенная величина kd означает более слабое связывание антитела с его антигеном. Таким образом, настоящее изобретение включает антитела, связывание которых с С5 характеризуется более высокой величиной kd при кислом рН, чем при нейтральном рН. Настоящее изобретение включает антитела, связывание которых с С5 при кислом рН характеризуется величиной kd, которая по меньшей мере в 2, 3, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 200, 400, 1000, 10000 или более раз превышает kd, характеризующую связывание антитела с С5 при нейтральном рН. В другом варианте осуществления изобретения величина kd антитела при нейтральном рН может составлять 10-2, 10-3, 10-4, 10-5, 10-6 1/с или менее. В другом варианте осуществления изобретения величина kd антитела при кислом рН может составлять 10-3, 10-2, 10-1 1/с или более. Изобретение включает также антитела, связывание которых с С5 характеризуется более высокой величиной kd при рН 5,8, чем при рН 7,4. Изобретение включает антитела, связывание которых с С5 при рН 5,8 характеризуется величиной kd, которая по меньшей мере в 3, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 200, 400, 1000, 10000 или более раз превышает kd, характеризующую связывание антитела с С5 при рН 7,4. В другом варианте осуществления изобретения величина kd антитела при рН 7,4 может составлять 10-2, 10-3, 10-4, 10-5, 10-6 1/с или менее. В другом варианте осуществления изобретения величина kd антитела при рН 5,8 может составлять 10-3, 10-2, 10-1 1/с или более.
В некоторых случаях «пониженную способность связываться с С5 при кислом рН по сравнению со способностью связываться при нейтральном рН» выражают в виде соотношения величины KD, характеризующей связывание антитела с С5 при кислом рН, и величины KD, характеризующей связывание антитела с С5 при нейтральном рН (или наоборот). Например, антитело может рассматриваться как обладающее «пониженной способностью связываться с С5 при кислом рН по сравнению со способностью связываться при нейтральном рН» для целей настоящего изобретения, если для антитела соотношение KD при кислом/нейтральном рН составляет 2 или более. В некоторых вариантах осуществления изобретения соотношение KD при рН 5,8/рН 7,4 для антитела, предлагаемого в настоящем изобретении, составляет 2 или более. В некоторых вариантах осуществления изобретения соотношение KD при кислом/нейтральном рН для антитела, предлагаемого в настоящем изобретении, может составлять 2, 3, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 200, 400, 1000, 10000 или более. В другом варианте осуществления изобретения величина KD антитела при нейтральном рН может составлять 10-7, 10-8, 10-9, 10-10, 10-11, 10-12 М или менее. В другом варианте осуществления изобретения величина KD антитела при кислом рН может составлять 10-9, 10-8, 10-7, 10-6 М или более. В других случаях антитело может рассматриваться как обладающее «пониженной способностью связываться с С5 при кислом рН по сравнению со способностью связываться при нейтральном рН», если для антитела характерно соотношение KD при рН 5,8/рН 7,4, составляющее 2 или более. В некоторых приведенных в качестве примеров вариантах осуществления изобретения соотношение KD при рН 5,8/рН 7,4 для антитела может составлять 3, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 200, 400, 1000, 10000 или более. В другом варианте осуществления изобретения величина KD антитела при рН 7,4 может составлять 10-7, 10-8, 10-9, 10-10, 10-11, 10-12 М или менее. В другом варианте осуществления изобретения величина KD антитела при рН 5,8 может составлять 10-9, 10-8, 10-7, 10-6 М или более.
В некоторых случаях «пониженную способность связываться с С5 при кислом рН по сравнению со способностью связываться при нейтральном рН» выражают в виде соотношения величины kd, характеризующей связывание антитела с С5 при кислом рН, и величины kd, характеризующей связывание антитела с С5 при нейтральном рН (или наоборот). Например, антитело может рассматриваться как обладающее «пониженной способностью связываться с С5 при кислом рН по сравнению со способностью связываться при нейтральном рН» для целей настоящего изобретения, если для антитела соотношение kd при кислом/нейтральном рН составляет 2 или более. В некоторых вариантах осуществления изобретения соотношение kd при рН 5,8/рН 7,4 для антитела к С5, предлагаемого в настоящем изобретении, составляет 2 или более. В некоторых вариантах осуществления изобретения соотношение kd при кислом/нейтральном рН для антитела, предлагаемого в настоящем изобретении, может составлять 2, 3, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 200, 400, 1000, 10000 или более. В другом варианте осуществления изобретения величина kd антитела при нейтральном рН может составлять 10-2, 10-3, 10-4, 10-5, 10-6 1/с или менее. В другом варианте осуществления изобретения величина kd антитела при кислом рН может составлять 10-3, 10-2, 10-1 1/с или более. В некоторых приведенных в качестве примеров вариантах осуществления изобретения соотношение kd при рН 5,8/рН 7,4 для антитела может составлять 2, 3, 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 200, 400, 1000, 10000 или более. В другом варианте осуществления изобретения величина kd антитела при рН 7,4 может составлять 10-2, 10-3, 10-4, 10-5, 10-6 1/с или менее. В другом варианте осуществления изобретения величина kd антитела при рН 5,8 может составлять 10-3, 10-2, 10-1 1/с или более.
В контексте настоящего описании понятие «кислый рН» означает рН от 4,0 до 6,5. Понятие «кислый рН» включает одно из следующих значений рН 4,0, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9, 5,0, 5,1, 5,2, 5,3, 5,4, 5,5, 5,6, 5,7, 5,8, 5,9, 6,0, 6,1, 6,2, 6,3, 6,4 и 6,5. В конкретных объектах изобретения «кислый рН» соответствует 5,8.
В контексте настоящего описании понятие «нейтральный рН» означает рН от 6,7 до примерно 10,0. Понятие «нейтральный рН» включает одно из следующих значений рН 6,7, 6,8, 6,9, 7,0, 7,1, 7,2, 7,3, 7,4, 7,5, 7,6, 7,7, 7,8, 7,9, 8,0, 8,1, 8,2, 8,3, 8,4, 8,5, 8,6, 8,7, 8,8, 8,9, 9,0, 9,1, 9,2, 9,3, 9,4, 9,5, 9,6, 9,7, 9,8, 9,9, и 10,0. В конкретных объектах изобретения «нейтральный рН» соответствует 7,4.
Указанные в настоящем описании величины KD и kd можно определять с помощью биосенсора на основе метода поверхностного плазменного резонанса для характеризации взаимодействий антитело-антиген (см., например, пример 7 в настоящем описании). Величины KD и величины kd можно определять при 25°С или 37°С.
В некоторых вариантах осуществления изобретения антитело к С5, предлагаемое в настоящем изобретении, связывается с эпитопом в бета-цепи С5, который состоит из MG1-домена (SEQ ID NO: 41). В некоторых вариантах осуществления изобретения антитело к С5, предлагаемое в настоящем изобретении, связывается с эпитопом в бета-цепи (SEQ ID NO: 40) С5, который содержит по меньшей мере один фрагмент, выбранный из группы, которая состоит из аминокислот 47-57, 70-76 и 107-110. В некоторых вариантах осуществления изобретения антитело к С5, предлагаемое в настоящем изобретении, связывается с эпитопом во фрагменте бета-цепи (SEQ ID NO: 40) С5, который содержит по меньшей мере одну аминокислоту, выбранную из группы, которая состоит из Thr47, Glu48, Ala49, Phe50, Asp51, Ala52, Thr53, Lys57, His70, Val71, His72, Ser74, Glu76, Val107, Ser108, Lys109 и His110. В некоторых вариантах осуществления изобретения антитело к С5, предлагаемое в настоящем изобретении, связывается с эпитопом во фрагменте бета-цепи (SEQ ID NO: 40) С5, который содержит по меньшей мере одну аминокислоту, выбранную из группы, которая состоит из Glu48, Asp51, His70, His72, Lys109 и His110. В некоторых вариантах осуществления изобретения связывание антитела к С5, предлагаемого в настоящем изобретении, с мутантом С5 снижено по сравнению с его связыванием с С5 дикого типа, где мутант С5 имеет по меньшей мере одну аминокислотную замену в положении, выбранном из группы, которая состоит из Glu48, Asp51, His72 и Lys109. В другом варианте осуществления изобретения рН-зависимое связывание антитела к С5, предлагаемого в настоящем изобретении, с мутантом С5 снижено по сравнению с его рН-зависимым связыванием с С5 дикого типа, где мутант С5 имеет по меньшей мере одну аминокислотную замену в положении, выбранном из группы, которая состоит из His70, His72 и His110. В следующем варианте осуществления изобретения в мутанте С5 аминокислота в положении, выбранном из Glu48, Asp51 и Lys109, заменена на аланин и аминокислота в положении, выбранном из His70, His72 и His110, заменена на тирозин.
В некоторых вариантах осуществления изобретения антитело к С5, предлагаемое в настоящем изобретении, конкурирует за связывание с С5 с антителом, содержащим пару VH и VL, которая выбрана из: (a) VH, имеющей SEQ ID NO: 1, и VL, имеющей SEQ ID NO: 11; (б) VH, имеющей SEQ ID NO: 22, и VL, имеющей SEQ ID NO: 26; (в) VH, имеющей SEQ ID NO: 21, и VL, имеющей SEQ ID NO: 25; (г) VH, имеющей SEQ ID NO: 5, и VL, имеющей SEQ ID NO: 15; (д) VH, имеющей SEQ ID NO: 4, и VL, имеющей SEQ ID NO: 14; (e) VH, имеющей SEQ ID NO: 6, и VL, имеющей SEQ ID NO: 16; (ж) VH, имеющей SEQ ID NO: 2, и VL, имеющей SEQ ID NO: 12; (з) VH, имеющей SEQ ID NO: 3, и VL, имеющей SEQ ID NO: 13; (и) VH, имеющей SEQ ID NO: 9, и VL, имеющей SEQ ID NO: 19; (к) VH, имеющей SEQ ID NO: 7, и VL, имеющей SEQ ID NO: 17; (л) VH, имеющей SEQ ID NO: 8, и VL, имеющей SEQ ID NO: 18; (м) VH, имеющей SEQ ID NO: 23, и VL, имеющей SEQ ID NO: 27, и (н) VH, имеющей SEQ ID NO: 10, и VL, имеющей SEQ ID NO: 20.
В некоторых вариантах осуществления изобретения антитело к С5, предлагаемое в настоящем изобретении, связывается с С5 и контактирует с аминокислотой Asp51 (D51) SEQ ID NO: 39. В дополнительных вариантах осуществления изобретения антитело к С5, предлагаемое в настоящем изобретении, связывается с С5 и контактирует с аминокислотой Lys109 (K109) SEQ ID NO: 39. В следующем варианте осуществления изобретения антитело к С5, предлагаемое в настоящем изобретении, связывается с С5 и контактирует с аминокислотой Asp51 (D51) и аминокислотой Lys109 (K109) SEQ ID NO: 39.
В некоторых вариантах осуществления изобретения связывание антитела к С5, предлагаемого в настоящем изобретении, с мутантом С5 снижено по сравнению с его связыванием с С5 дикого типа, где мутант С5 имеет замену Glu48Ala (Е48А) в SEQ ID NO: 39. В другом варианте осуществления изобретения рН-зависимое связывание антитела к С5, предлагаемого в настоящем изобретении, с мутантом С5 снижено по сравнению с его рН-зависимым связыванием с С5 дикого типа, где мутант С5 имеет замену Glu48Ala (Е48А) в SEQ ID NO: 39.
В следующем варианте осуществления изобретения антитело к С5 связывается с белком С5, состоящим из аминокислотной последовательности SEQ ID NO: 39, но не связывается с белком С5, состоящим из аминокислотной последовательности SEQ ID NO: 39 с заменой H72Y, где белок С5 и имеющий замену H72Y белок С5 получают и подвергают скринингу в одних и тех же условиях. В следующем варианте осуществления изобретения антитело к С5 связывается с белком С5, состоящим из аминокислотной последовательности SEQ ID NO: 39, при рН 7,4, но не связывается с имеющим замену H72Y белком С5 при рН 7,4.
Не вдаваясь в какую-либо конкретную теорию, можно предположить, что связывание антитела к С5 с С5 снижается (или практически утрачивается), когда аминокислотный остаток на С5 заменяют на другую аминокислоту, это означает, что аминокислотный остаток на С5 имеет решающее значение для взаимодействия между антителом к С5 и С5 и что антитело может распознавать эпитоп в С5, внутри которого находится аминокислотный остаток.
При создании настоящего изобретения было обнаружено, что группа антител к С5, которые конкурируют друг с другом или связываются с одним и тем же эпитопом, может обладать рН-зависимыми характеристиками связывания. Среди аминокислот гистидин, для которого величина pKa составляет примерно 6,0-6,5, может обладать различными состояниями протонной диссоциации при нейтральном и кислом рН. Следовательно остаток гистидина в С5 может вносить вклад в рН-зависимые взаимодействия между антителом к С5 и С5. Не вдаваясь в какую-либо конкретную теорию, можно предположить, что антитело к С5 может распознавать конформационную структуру вокруг остатка гистидина в С5, которая изменяется в зависимости от значения рН. Это предположение может согласоваться с описанными ниже экспериментальными данными, свидетельствующими о том, что: рН-зависимость антитела к С5 снижается (или практически утрачивается), когда остаток гистидина в С5 заменяют на другую аминокислоту (т.е. антитело к С5 с рН-зависимыми характеристиками связывания связывается с мутантом по гистидина С5 (His-мутантом С5) с аффинностью, сходной с аффинностью к С5 дикого типа, при нейтральном рН, в то время как то же самое антитело связывается с His-мутантом С5 с более высокой аффинностью, чем с С5 дикого типа, при кислом рН).
В некоторых вариантах осуществления изобретения антитело к С5, предлагаемое в настоящем изобретении, связывается с С5 из более чем одного вида. В других вариантах осуществления изобретения антитело к С5 связывается с С5 человека и животного кроме человека. В других вариантах осуществления изобретения антитело к С5 связывается с С5 человека и обезьян (например, обезьян циномолгус (яванский макак-крабоед), макак резус, мармозеток, шимпанзе или бабуинов).
Одним из объектов изобретения являются антитела к С5, которые ингибируют активацию С5. В некоторых вариантах осуществления изобретения предложены антитела к С5, который предупреждают расщепление С5, приводящее к образованию С5а и C5b, предупреждая тем самым возникновение анафилатоксической активности, ассоциированной с С5а, а также предупреждают сборку мембраноатакующего комплекса C5b-9 (MAC), ассоциированного с C5b. В некоторых вариантах осуществления изобретения предложены антитела к С5, которые блокируют превращение С5 в С5а и C5b С5-конвертазой. В некоторых вариантах осуществления изобретения предложены антитела к С5, которые блокируют доступ С5-конвертазы к сайту расщепления на С5. В некоторых вариантах осуществления изобретения предложены антитела к С5, которые блокируют гемолитическую активность, обусловленную активацией С5. В других вариантах осуществления изобретения антитела к С5, предлагаемые в настоящем изобретении, ингибируют активацию С5 классическим путем и/или альтернативным путем.
Одним из объектов изобретения являются антитела к С5, которые ингибируют активацию варианта С5. Под вариантом С5 понимается генетический вариант С5, который получен путем генетической вариации, такой как мутация, полиморфизм или аллельная вариация. Генетическая вариация может включать делецию, замену или инсерцию одного или нескольких нуклеотидов. Вариант С5 может содержать одну или несколько генетических вариаций в С5. В некоторых вариантах осуществления изобретения вариант С5 обладает биологической активностью, сходной с биологической активностью С5 дикого типа. Такой вариант С5 может содержать по меньшей мере одну вариацию, выбранную из группы, которая состоит из V145I, R449G, V802I, R885H, R928Q, D966Y, S1310N и E1437D. В контексте настоящего описания R885H, например, обозначает генетическую вариацию, в результате которой аргинин в положении 885 заменен на гистидин. В некоторых вариантах осуществления изобретения антитело к С5, предлагаемое в настоящем изобретении, ингибирует активацию как С5 дикого типа, так и по меньшей мере одного варианта С5, выбранного из группы, которая состоит из V145I, R449G, V802I, R885H, R928Q, D966Y, S1310N и E1437D.
Одним из объектов изобретения является антитело к С5, которое содержит по меньшей мере один, два, три, четыре, пять или шесть HVR, выбранных из (а) HVR-H1, который содержит одну из аминокислотных последовательностей SEQ ID NO: 45-54; (б) HVR-H2, который содержит одну из аминокислотных последовательностей SEQ ID NO: 55-64; (в) HVR-H3, который содержит одну из аминокислотных последовательностей SEQ ID NO: 65-74; (г) HVR-L1, который содержит одну из аминокислотных последовательностей SEQ ID NO: 75-84; (д) HVR-L2, который содержит одну из аминокислотных последовательностей SEQ ID NO: 85-94; и (е) HVR-L3, который содержит одну из аминокислотных последовательностей SEQ ID NO: 95-104.
Одним из объектов изобретения является антитело, которое содержит по меньшей мере одну, по меньшей мере две или все три HVR-последовательности VH, выбранные из (a) HVR-H1, который содержит одну из аминокислотных последовательностей SEQ ID NO: 45-54; (б) HVR-H2, который содержит одну из аминокислотных последовательностей SEQ ID NO: 55-64; и (в) HVR-H3, который содержит одну из аминокислотных последовательностей SEQ ID NO: 65-74. В одном из вариантов осуществления изобретения антитело содержит HVR-H3, который содержит одну из аминокислотных последовательностей 65-74. В другом варианте осуществления изобретения антитело содержит HVR-H3, который содержит одну из аминокислотных последовательностей SEQ ID NO: 65-74. и HVR-L3, который содержит одну из аминокислотных последовательностей SEQ ID NO: 95-104. В следующем варианте осуществления изобретения антитело содержит HVR-H3, который содержит одну из аминокислотных последовательностей SEQ ID NO: 65-74, HVR-L3, который содержит одну из аминокислотных последовательностей SEQ ID NO: 95-104, и HVR-H2, который содержит одну из аминокислотных последовательностей SEQ ID NO: 55-64. В следующем варианте осуществления изобретения антитело содержит (a) HVR-H1, который содержит одну из аминокислотных последовательностей SEQ ID NO: 45-54; (б) HVR-H2, который содержит одну из аминокислотных последовательностей SEQ ID NO: 55-64, и (в) HVR-H3, который содержит одну из аминокислотных последовательностей SEQ ID NO: 65-74.
Другим объектом изобретения является антитело, содержащее по меньшей мере одну, по меньшей мере две или все три последовательности VL HVR, выбранные из (a) HVR-L1, который содержит одну из аминокислотных последовательностей SEQ ID NO: 75-84; (б) HVR-L2, который содержит одну из аминокислотных последовательностей SEQ ID NO: 85-94, и (в) HVR-L3, который содержит одну из аминокислотных последовательностей SEQ ID NO: 95-104. В одном из вариантов осуществления изобретения антитело содержит (a) HVR-L1, который содержит одну из аминокислотных последовательностей SEQ ID NO: 75-84; (б) HVR-L2, который содержит одну из аминокислотных последовательностей SEQ ID NO: 85-94; и (в) HVR-L3, который содержит одну из аминокислотных последовательностей SEQ ID NO: 95-104.
Согласно другому объекту изобретения антитело, предлагаемое в изобретении, содержит (а) VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности VH HVR, выбранные из (I) HVR-H1, который содержит одну из аминокислотных последовательностей SEQ ID NO: 45-54, (II) HVR-H2, который содержит одну из аминокислотных последовательностей SEQ ID NO: 55-64, и (III) HVR-H3, который содержит одну из аминокислотных последовательностей SEQ ID NO: 65-74; и (б) VL-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности VL HVR, выбранные из (I) HVR-L1, который содержит одну из аминокислотных последовательностей SEQ ID NO: 75-84, ((II) HVR-L2, который содержит одну из аминокислотных последовательностей SEQ ID NO: 85-94, и (в HVR-L3, который содержит одну из аминокислотных последовательностей SEQ ID NO: 95-104.
Другим объектом изобретения является антитело, содержащее (a) HVR-H1, который содержит одну из аминокислотных последовательностей SEQ ID NO: 45-54; (б) HVR-H2, который содержит одну из аминокислотных последовательностей SEQ ID NO: 55-64; (в) HVR-H3, который содержит одну из аминокислотных последовательностей SEQ ID NO: 65-74; (г) HVR-L1, который содержит одну из аминокислотных последовательностей SEQ ID NO: 75-84; (д) HVR-L2, который содержит одну из аминокислотных последовательностей SEQ ID NO: 85-94; и (е) HVR-L3, который содержит одну из аминокислотных последовательностей SEQ ID NO: 95-104.
Одним из объектов изобретения является антитело к С5, содержащее по меньшей мере один, два, три, четыре, пять или шесть HVR, выбранных из (а) HVR-H1, который содержит одну из аминокислотных последовательностей SEQ ID NO: 45, 54, 117, 126; (б) HVR-H2, который содержит одну из аминокислотных последовательностей SEQ ID NO: 55, 64, 118-120, 127; (в) HVR-H3, который содержит одну из аминокислотных последовательностей SEQ ID NO: 65, 74, 121, 128; (г) HVR-L1, который содержит одну из аминокислотных последовательностей SEQ ID NO: 75, 84, 122, 129; (д) HVR-L2, который содержит одну из аминокислотных последовательностей SEQ ID NO: 85, 94, 123-124, 130; и (е) HVR-L3, который содержит одну из аминокислотных последовательностей SEQ ID NO 95, 104, 125, 131.
Одним из объектов изобретения является антитело, содержащее по меньшей мере одну, по меньшей мере две или все три последовательности VH HVR, выбранные из (a) HVR-H1, который содержит одну из аминокислотных последовательностей SEQ ID NO: 45, 54, 117, 126; (б) HVR-H2, который содержит одну из аминокислотных последовательностей SEQ ID NO: 55, 64, 118-120, 127; и (в) HVR-H3, который содержит одну из аминокислотных последовательностей SEQ ID NO: 65, 74, 121, 128. В одном из вариантов осуществления изобретения антитело содержит HVR-H3, который содержит одну из аминокислотных последовательностей SEQ ID NO: 65, 74, 121, 128. В другом варианте осуществления изобретения антитело содержит HVR-H3, который содержит одну из аминокислотных последовательностей SEQ ID NO: 65, 74, 121, 128, и HVR-L3, который содержит одну из аминокислотных последовательностей SEQ ID NO: 95, 104, 125, 131. В другом варианте осуществления изобретения антитело содержит HVR-H3, который содержит одну из аминокислотных последовательностей SEQ ID NO: 65, 74, 121, 128, HVR-L3, который содержит одну из аминокислотных последовательностей SEQ ID NO: 95, 104, 125, 131, и HVR-H2, который содержит одну из аминокислотных последовательностей SEQ ID NO: 55, 64, 118-120, 127. В следующем варианте осуществления изобретения антитело содержит (a) HVR-H1, который содержит одну из аминокислотных последовательностей SEQ ID NO: 45, 54, 117, 126; (б) HVR-H2, который содержит одну из аминокислотных последовательностей SEQ ID NO: 55, 64, 118-120, 127; и (в) HVR-H3, который содержит одну из аминокислотных последовательностей SEQ ID NO: 65, 74, 121, 128.
Другим объектом изобретения является антитело, содержащее по меньшей мере одну, по меньшей мере две или все три последовательности VL HVR, выбранные из (a) HVR-L1, который содержит одну из аминокислотных последовательностей SEQ ID NO: 75, 84, 122, 129; (б) HVR-L2, который содержит одну из аминокислотных последовательностей SEQ ID NO: 85, 94, 123-124, 130; и (в) HVR-L3, который содержит одну из аминокислотных последовательностей SEQ ID NO: 95, 104, 125, 131. В одном из вариантов осуществления изобретения антитело содержит (a) HVR-L1, который содержит одну из аминокислотных последовательностей SEQ ID NO: 75, 84, 122, 129; (б) HVR-L2, который содержит одну из аминокислотных последовательностей SEQ ID NO: 85, 94, 123-124, 130; и (в) HVR-L3, который содержит одну из аминокислотных последовательностей SEQ ID NO: 95, 104, 125, 131.
Другим объектом изобретения является антитело, предлагаемое в изобретении, которое содержит (а) VH-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности VH HVR, выбранные из (I) HVR-H1, который содержит одну из аминокислотных последовательностей SEQ ID NO: 45, 54, 117, 126, (II) HVR-H2, который содержит одну из аминокислотных последовательностей SEQ ID NO: 55, 64, 118-120, 127, и (III) HVR-H3, который содержит одну из аминокислотных последовательностей SEQ ID NO: 65, 74, 121, 128; и (б) VL-домен, содержащий по меньшей мере одну, по меньшей мере две или все три последовательности VL HVR, выбранные из (I) HVR-L1, который содержит одну из аминокислотных последовательностей SEQ ID NO: 75, 84, 122, 129, (II) HVR-L2, который содержит одну из аминокислотных последовательностей SEQ ID NO: 85, 94, 123-124, 130, и (в) HVR-L3, который содержит одну из аминокислотных последовательностей SEQ ID NO: 95, 104, 125, 131.
Другим объектом изобретения является антитело, содержащее (a) HVR-H1, который содержит одну из аминокислотных последовательностей SEQ ID NO: 45, 54, 117, 126; (б) HVR-H2, который содержит одну из аминокислотных последовательностей SEQ ID NO: 55, 64, 118-120, 127; (в) HVR-H3, который содержит одну из аминокислотных последовательностей SEQ ID NO: 65, 74, 121, 128; (г) HVR-L1, который содержит одну из аминокислотных последовательностей SEQ ID NO: 75, 84, 122, 129; (д) HVR-L2, который содержит одну из аминокислотных последовательностей SEQ ID NO: 85, 94, 123-124, 130; и (е) HVR-L3, который содержит одну из аминокислотных последовательностей SEQ ID NO: 95, 104, 125, 131.
В некоторых вариантах осуществления изобретения одна или несколько аминокислот антитела к С5, как указано выше, заменены в следующих положениях в HVR: (а) в HVR-H1 (SEQ ID NO: 45) в положениях 5 и 6; (б) в HVR-H2 (SEQ ID NO: 55) в положениях 1, 3, 9, 11, 13 и 15; (в) в HVR-H3 (SEQ ID NO: 65) в положениях 2, 5, 6, 12 и 13; (г) в HVR-L1 (SEQ ID NO: 75) в положениях 1, 5, 7 и 9; (д) в HVR-L2 (SEQ ID NO: 85) в положениях 4, 5 и 6; и (е) в HVR-L3 (SEQ ID NO: 95) в положениях 2, 4 и 12.
В некоторых вариантах осуществления изобретения замены представляют собой консервативные замены, как указано в настоящем описании. В некоторых вариантах осуществления изобретения можно осуществлять одну или несколько из указанных ниже замен в любой комбинации: (а) в HVR-H1 (SEQ ID NO: 45) M5V или С6А; (б) в HVR-H2 (SEQ ID NO: 55) C1A или G, Y3F, T9D или Е, Y11K или Q, S13D или Е, или A15V; (в) в HVR-H3 (SEQ ID NO: 65) G2A, V5Q или D, T6Y, Y12H или L13Y; (г) в HVR-L1 (SEQ ID NO: 75) Q1R, N5Q или G, G7S, D9K или S; (д) в HVR-L2 (SEQ ID NO: 85) K4T или E, L5T или A6H, A6E или A6Q; (е) в HVR-L3 (SEQ ID NO: 95) C2S, C2N или С2Т, F4K; или А12Т, или А12Н.
Все возможные комбинации указанных выше замен входят в консенсусные последовательности SEQ ID NO: 126, 127, 128, 129, 130 и 131 для HVR-H1, HVR-Н2, HVR-H3, HVR-L1, HVR-L2 и HVR-L3 соответственно.
В любом из указанных выше вариантов осуществления изобретения антитело к С5 является гуманизированным. В одном из вариантов осуществления изобретения антитело к С5 содержит HVR, представленные в любом из указанных выше вариантов осуществления изобретения, и содержит также акцепторный человеческий каркасный участок, например, каркасный участок человеческого иммуноглобулина или человеческий консенсусный каркасный участок. В другом варианте осуществления изобретения антитело к С5 содержит HVR, представленные в любом из указанных выше вариантов осуществления изобретения, и содержит также VH или VL, содержащие последовательность FR, где последовательности FR представляют собой следующие последовательности. В случае вариабельного домена тяжелой цепи FR1 содержит одну из аминокислотных последовательностей SEQ ID NO: 132-134, FR2 содержит одну из аминокислотных последовательностей SEQ ID NO: 135-136, FR3 содержит одну из аминокислотных последовательностей SEQ ID NO: 137-139, FR4 содержит одну из аминокислотных последовательностей SEQ ID NO: 140-141. В случае вариабельного домена легкой цепи FR1 содержит одну из аминокислотных последовательностей SEQ ID NO: 142-143, FR2 содержит одну из аминокислотных последовательностей SEQ ID NO: 144-145, FR3 содержит одну из аминокислотных последовательностей SEQ ID NO: 146-147, FR4 содержит одну из аминокислотных последовательностей SEQ ID NO: 148. В другом объекте изобретения антитело к С5 содержит последовательность вариабельного домена тяжелой цепи (VH), которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична одной из аминокислотной последовательностей SEQ ID NO: 1-10. В некоторых вариантах осуществления изобретения последовательность VH, идентичная по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, содержит замены (например, консервативные замены), инсерции или делеции относительно референс-последовательности, но антитело к С5, содержащее указанную последовательность, сохраняет способность связываться с С5. В некоторых вариантах осуществления изобретения в целом от 1 до 10 аминокислот заменено, встроено и/или удалено путем делеции в одной из SEQ ID NO: 13, 16-30 и 32-34. В некоторых вариантах осуществления изобретения замены, инсерции или делеции затрагивают области вне HVR (т.е. FR). Необязательно антитело к С5 содержит последовательность VH, представленную в одной из SEQ ID NO: 1-10, включая пост-трансляционные модификации указанной последовательности. В конкретном варианте осуществления изобретения VH содержит один, два или три HVR, выбранных из: (a) HVR-H1, который содержит одну из аминокислотных последовательностей SEQ ID NO: 45-54, (б) HVR-H2, который содержит одну из аминокислотных последовательностей SEQ ID NO: 55-64, и (в) HVR-H3, который содержит одну из аминокислотных последовательностей SEQ ID NO: 65-74.
В другом объекте изобретения антитело к С5 содержит последовательность VL, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична одной из аминокислотных последовательностей SEQ ID NO: 11-20. В некоторых вариантах осуществления изобретения последовательность VL, идентичная по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, содержит замены (например, консервативные замены), инсерции или делеции относительно референс-последовательности, но антитело к С5, содержащее указанную последовательность, сохраняет способность связываться с С5. В некоторых вариантах осуществления изобретения в целом от 1 до 10 аминокислот заменено, встроено и/или удалено путем делеции в одной из SEQ ID NO: 11-20. В некоторых вариантах осуществления изобретения замены, инсерции или делеции затрагивают области вне HVR (т.е. FR). Необязательно антитело к С5 содержит последовательность VL, представленную в одной из SEQ ID NO: 15, 31, 35-38 и 96-99, включая пост-трансляционные модификации указанной последовательности. В конкретном варианте осуществления изобретения VL содержит один, два или три HVR, выбранных из: (a) HVR-L1, который содержит одну из аминокислотных последовательностей SEQ ID NO: 75-84; ((б) HVR-L2, который содержит одну из аминокислотных последовательностей SEQ ID NO: 85-94; и (в) HVR-L3, который содержит одну из аминокислотных последовательностей SEQ ID NO: 95-104.
Другим объектом изобретения является антитело к С5, где антитело содержит VH, представленную в одном из указанных выше вариантов осуществления изобретения, и VL, представленную в одном из указанных выше вариантов осуществления изобретения. В одном из вариантов осуществления изобретения антитело содержит последовательности VH и VL, представленные в одной из SEQ ID NO: 1-10 и одной из SEQ ID NO: 11-20 соответственно, включая пост трансляционные модификации указанных последовательностей.
В другом объекте изобретения антитело к С5 содержит последовательность вариабельного домена тяжелой цепи (VH), которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична одной из аминокислотных последовательностей: 10, 106-110. В некоторых вариантах осуществления изобретения последовательность VH, идентичная по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, содержит замены (например, консервативные замены), инсерции или делеции относительно референс-последовательности, но антитело к С5, содержащее указанную последовательность, сохраняет способность связываться с С5. В некоторых вариантах осуществления изобретения в целом от 1 до 10 аминокислот заменено, встроено и/или удалено путем делеции в одной из SEQ ID NO: 10, 106-110. В некоторых вариантах осуществления изобретения замены, инсерции или делеции затрагивают области вне HVR (т.е. FR). Необязательно антитело к С5 содержит последовательность VH, представленную в одной из SEQ ID NO: 10, 106-110, включая пост-трансляционные модификации указанной последовательности. В конкретном варианте осуществления изобретения VH содержит один, два или три HVR, выбранных из: (a) HVR-H1, который содержит одну из аминокислотных последовательностей SEQ ID NO: 45, 54, 117, 126, (б) HVR-H2, который содержит одну из аминокислотных последовательностей SEQ ID NO: 55, 64, 118-120, 127, и (в) HVR-H3, который содержит одну из аминокислотных последовательностей: 65, 74, 121, 128.
В другом объекте изобретения антитело к С5 содержит последовательность VH, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична одной из аминокислотных последовательностей: SEQ ID NO: 10, 106-110. В некоторых вариантах осуществления изобретения последовательность VH, идентичная по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, содержит замены (например, консервативные замены), инсерции или делеции относительно референс-последовательности, но антитело к С5, содержащее указанную последовательность, сохраняет способность связываться с С5. В некоторых вариантах осуществления изобретения в целом от 1 до 10 аминокислот заменено, встроено и/или удалено путем делеции в одной из SEQ ID NO: 10, 106-110. В некоторых вариантах осуществления изобретения замены, инсерции или делеции затрагивают области вне HVR (т.е. FR). Необязательно антитело к С5 содержит последовательность VH, представленную в одной из SEQ ID NO: 10, 106-110, включая пост-трансляционные модификации указанной последовательности. В конкретном варианте осуществления изобретения VH содержит один, два или три HVR, выбранных из: (a) HVR-H1, который содержит одну из аминокислотных последовательностей SEQ ID NO: 45, 54, 117, 126, (б) HVR-H2, который содержит одну из аминокислотных последовательностей SEQ ID NO: 55, 64, 118-120, 127, и (в) HVR-H3, который содержит одну из аминокислотных последовательностей: 65, 74, 121, 128.
В другом объекте изобретения антитело к С5 содержит последовательность VH, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 10. В некоторых вариантах осуществления изобретения последовательность VH представляет собой аминокислотную последовательность SEQ ID NO: 10. В некоторых вариантах осуществления изобретения последовательность VH, идентичная по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, содержит замены (например, консервативные замены), инсерции или делеции относительно референс-последовательности, но антитело к С5, содержащее указанную последовательность, сохраняет способность связываться с С5. В некоторых вариантах осуществления изобретения в целом от 1 до 10 аминокислот заменено, встроено и/или удалено путем делеции в SEQ ID NO: 10. В некоторых вариантах осуществления изобретения замены, инсерции или делеции затрагивают области вне HVR (т.е. FR). Необязательно антитело к С5 содержит последовательность VH, представленную в SEQ ID NO: 10, включая пост-трансляционные модификации указанной последовательности. В конкретном варианте осуществления изобретения VH содержит один, два или три HVR, выбранных из: (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 54, (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 64, и (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 74.
В другом объекте изобретения антитело к С5 содержит последовательность VH, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: SEQ ID NO: 106. В некоторых вариантах осуществления изобретения последовательность VH представляет собой аминокислотную последовательность SEQ ID NO: 106. В некоторых вариантах осуществления изобретения последовательность VH, идентичная по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, содержит замены (например, консервативные замены), инсерции или делеции относительно референс-последовательности, но антитело к С5, содержащее указанную последовательность, сохраняет способность связываться с С5. В некоторых вариантах осуществления изобретения в целом от 1 до 10 аминокислот заменено, встроено и/или удалено путем делеции в SEQ ID NO: 106. В некоторых вариантах осуществления изобретения замены, инсерции или делеции затрагивают области вне HVR (т.е. FR). Необязательно антитело к С5 содержит последовательность VH, представленную в SEQ ID NO: 106, включая пост-трансляционные модификации указанной последовательности. В конкретном варианте осуществления изобретения VH содержит один, два или три HVR, выбранных из: (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 117, (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 118, и (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 121.
В другом объекте изобретения антитело к С5 содержит последовательность VH, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: SEQ ID NO: 107. В некоторых вариантах осуществления изобретения последовательность VH представляет собой аминокислотную последовательность SEQ ID NO: 107. В некоторых вариантах осуществления изобретения последовательность VH, идентичная по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, содержит замены (например, консервативные замены), инсерции или делеции относительно референс-последовательности, но антитело к С5, содержащее указанную последовательность, сохраняет способность связываться с С5. В некоторых вариантах осуществления изобретения в целом от 1 до 10 аминокислот заменено, встроено и/или удалено путем делеции в SEQ ID NO: 107. В некоторых вариантах осуществления изобретения замены, инсерции или делеции затрагивают области вне HVR (т.е. FR). Необязательно антитело к С5 содержит последовательность VH, представленную в SEQ ID NO: 107, включая пост-трансляционные модификации указанной последовательности. В конкретном варианте осуществления изобретения VH содержит один, два или три HVR, выбранных из: (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 117, (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 119, и (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 121.
В другом объекте изобретения антитело к С5 содержит последовательность VH, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: SEQ ID NO: 108. В некоторых вариантах осуществления изобретения последовательность VH представляет собой аминокислотную последовательность SEQ ID NO: 108. В некоторых вариантах осуществления изобретения последовательность VH, идентичная по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, содержит замены (например, консервативные замены), инсерции или делеции относительно референс-последовательности, но антитело к С5, содержащее указанную последовательность, сохраняет способность связываться с С5. В некоторых вариантах осуществления изобретения в целом от 1 до 10 аминокислот заменено, встроено и/или удалено путем делеции в SEQ ID NO: 108. В некоторых вариантах осуществления изобретения замены, инсерции или делеции затрагивают области вне HVR (т.е. FR). Необязательно антитело к С5 содержит последовательность VH, представленную в SEQ ID NO: 108, включая пост-трансляционные модификации указанной последовательности. В конкретном варианте осуществления изобретения VH содержит один, два или три HVR, выбранных из: (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 117, (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 118, и (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 121.
В другом объекте изобретения антитело к С5 содержит последовательность VH, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: SEQ ID NO: 109. В некоторых вариантах осуществления изобретения последовательность VH представляет собой аминокислотную последовательность SEQ ID NO: 109. В некоторых вариантах осуществления изобретения последовательность VH, идентичная по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, содержит замены (например, консервативные замены), инсерции или делеции относительно референс-последовательности, но антитело к С5, содержащее указанную последовательность, сохраняет способность связываться с С5. В некоторых вариантах осуществления изобретения в целом от 1 до 10 аминокислот заменено, встроено и/или удалено путем делеции в SEQ ID NO: 109. В некоторых вариантах осуществления изобретения замены, инсерции или делеции затрагивают области вне HVR (т.е. FR). Необязательно антитело к С5 содержит последовательность VH, представленную в SEQ ID NO: 109, включая пост-трансляционные модификации указанной последовательности. В конкретном варианте осуществления изобретения VH содержит один, два или три HVR, выбранных из: (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 117, (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 118, и (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 121.
В другом объекте изобретения антитело к С5 содержит последовательность VH, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: SEQ ID NO: 110. В некоторых вариантах осуществления изобретения последовательность VH представляет собой аминокислотную последовательность SEQ ID NO: 110. В некоторых вариантах осуществления изобретения последовательность VH, идентичная по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, содержит замены (например, консервативные замены), инсерции или делеции относительно референс-последовательности, но антитело к С5, содержащее указанную последовательность, сохраняет способность связываться с С5. В некоторых вариантах осуществления изобретения в целом от 1 до 10 аминокислот заменено, встроено и/или удалено путем делеции в SEQ ID NO: 110. В некоторых вариантах осуществления изобретения замены, инсерции или делеции затрагивают области вне HVR (т.е. FR). Необязательно антитело к С5 содержит последовательность VH, представленную в SEQ ID NO: 110, включая пост-трансляционные модификации указанной последовательности. В конкретном варианте осуществления изобретения VH содержит один, два или три HVR, выбранных из: (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 117, (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 120, и (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 121.
В другом объекте изобретения антитело к С5 содержит последовательность вариабельного домена легкой цепи (VL), которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична одной из аминокислотных последовательностей SEQ ID NO: 20, 111-113. В некоторых вариантах осуществления изобретения последовательность VL, идентичная по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, содержит замены (например, консервативные замены), инсерции или делеции относительно референс-последовательности, но антитело к С5, содержащее указанную последовательность, сохраняет способность связываться с С5. В некоторых вариантах осуществления изобретения в целом от 1 до 10 аминокислот заменено, встроено и/или удалено путем делеции в одной из SEQ ID NO: 20, 111-113. В некоторых вариантах осуществления изобретения замены, инсерции или делеции затрагивают области вне HVR (т.е. FR). Необязательно антитело к С5 содержит последовательность VL, представленную в одной из SEQ ID NO: 20, 111-113, включая пост-трансляционные модификации указанной последовательности. В конкретном варианте осуществления изобретения VL содержит один, два или три HVR, выбранных из: (a) HVR-L1, который содержит одну из аминокислотных последовательностей SEQ ID NO: 75, 84, 122, 129; (б) HVR-L2, который содержит одну из аминокислотных последовательностей SEQ ID NO: 85, 94, 123-124, 130; и (в) HVR-L3, который содержит одну из аминокислотных последовательностей SEQ ID NO: 95, 104, 125, 131.
В другом объекте изобретения антитело к С5 содержит последовательность VL, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 20. В некоторых вариантах осуществления изобретения последовательность VL представляет собой аминокислотную последовательность SEQ ID NO: 20. В некоторых вариантах осуществления изобретения последовательность VL, идентичная по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, содержит замены (например, консервативные замены), инсерции или делеции относительно референс-последовательности, но антитело к С5, содержащее указанную последовательность, сохраняет способность связываться с С5. В некоторых вариантах осуществления изобретения в целом от 1 до 10 аминокислот заменено, встроено и/или удалено путем делеции в SEQ ID NO: 20. В некоторых вариантах осуществления изобретения замены, инсерции или делеции затрагивают области вне HVR (т.е. FR). Необязательно антитело к С5 содержит последовательность VL, представленную в SEQ ID NO: 20, включая пост-трансляционные модификации указанной последовательности. В конкретном варианте осуществления изобретения VL содержит один, два или три HVR, выбранных из: (a) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 84; (б) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 94; и (в) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 104.
В другом объекте изобретения антитело к С5 содержит последовательность VL, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 111. В некоторых вариантах осуществления изобретения последовательность VL представляет собой аминокислотную последовательность SEQ ID NO: 111. В некоторых вариантах осуществления изобретения последовательность VL, идентичная по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, содержит замены (например, консервативные замены), инсерции или делеции относительно референс-последовательности, но антитело к С5, содержащее указанную последовательность, сохраняет способность связываться с С5. В некоторых вариантах осуществления изобретения в целом от 1 до 10 аминокислот заменено, встроено и/или удалено путем делеции в SEQ ID NO: 111. В некоторых вариантах осуществления изобретения замены, инсерции или делеции затрагивают области вне HVR (т.е. FR). Необязательно антитело к С5 содержит последовательность VL, представленную в SEQ ID NO: 111, включая пост-трансляционные модификации указанной последовательности. В конкретном варианте осуществления изобретения VL содержит один, два или три HVR, выбранных из: (a) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 122; (б) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 123; и (в) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 125.
В другом объекте изобретения антитело к С5 содержит последовательность VL, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 112. В некоторых вариантах осуществления изобретения последовательность VL представляет собой аминокислотную последовательность SEQ ID NO: 112. В некоторых вариантах осуществления изобретения последовательность VL, идентичная по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, содержит замены (например, консервативные замены), инсерции или делеции относительно референс-последовательности, но антитело к С5, содержащее указанную последовательность, сохраняет способность связываться с С5. В некоторых вариантах осуществления изобретения в целом от 1 до 10 аминокислот заменено, встроено и/или удалено путем делеции в SEQ ID NO: 112. В некоторых вариантах осуществления изобретения замены, инсерции или делеции затрагивают области вне HVR (т.е. FR). Необязательно антитело к С5 содержит последовательность VL, представленную в SEQ ID NO: 112, включая пост-трансляционные модификации указанной последовательности. В конкретном варианте осуществления изобретения VL содержит один, два или три HVR, выбранных из: (a) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 122; (б) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 123; и (в) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 125.
В другом объекте изобретения антитело к С5 содержит последовательность VL, которая по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 113. В некоторых вариантах осуществления изобретения последовательность VL представляет собой аминокислотную последовательность SEQ ID NO: 113. В некоторых вариантах осуществления изобретения последовательность VL, идентичная по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%, содержит замены (например, консервативные замены), инсерции или делеции относительно референс-последовательности, но антитело к С5, содержащее указанную последовательность, сохраняет способность связываться с С5. В некоторых вариантах осуществления изобретения в целом от 1 до 10 аминокислот заменено, встроено и/или удалено путем делеции в SEQ ID NO: 113. В некоторых вариантах осуществления изобретения замены, инсерции или делеции затрагивают области вне HVR (т.е. FR). Необязательно антитело к С5 содержит последовательность VL, представленную в SEQ ID NO: 113, включая пост-трансляционные модификации указанной последовательности. В конкретном варианте осуществления изобретения VL содержит один, два или три HVR, выбранных из: (a) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 122; (б) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 124; и (в) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 125.
Другим объектом изобретения является антитело к С5, где антитело содержит VH, представленную в одном из указанных выше вариантов осуществления изобретения, и VL, представленную в одном из указанных выше вариантов осуществления изобретения. В одном из вариантов осуществления изобретения антитело содержит последовательности VH и VL, представленные в одной из SEQ ID NO: 10, 106-110 и в одной из SEQ ID NO: 20, 111-113 соответственно, включая пост-трансляционные модификации указанных последовательностей. В одном из вариантов осуществления изобретения антитело содержит последовательность VH, представленную в SEQ ID NO: 10, и последовательность VL, представленную в SEQ ID NO: 20. В одном из вариантов осуществления изобретения антитело содержит последовательность VH, представленную в SEQ ID NO: 106, и последовательность VL, представленную в SEQ ID NO: 111. В другом варианте осуществления изобретения антитело содержит последовательность VH, представленную в SEQ ID NO: 107, и последовательность VL, представленную в SEQ ID NO: 111. В дополнительном варианте осуществления изобретения антитело содержит последовательность VH, представленную в SEQ ID NO: 108, и последовательность VL, представленную в SEQ ID NO: 111. В другом варианте осуществления изобретения антитело содержит последовательность VH, представленную в SEQ ID NO: 109, и последовательность VL, представленную в SEQ ID NO: 111. В другом варианте осуществления изобретения антитело содержит последовательность VH, представленную в SEQ ID NO: 109, и последовательность VL, представленную в SEQ ID NO: 112. В другом варианте осуществления изобретения антитело содержит последовательность VH, представленную в SEQ ID NO: 109, и последовательность VL, представленную в SEQ ID NO: 113. В другом варианте осуществления изобретения антитело содержит последовательность VH, представленную в SEQ ID NO: 110, и последовательность VL, представленную в SEQ ID NO: 113.
Одним из объектов изобретения является антитело к С5, где антитело содержит последовательность VH, содержащую (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 54, (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 64, и (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 74, и последовательность VL, содержащую (a) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 84; (б) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 94; и (в) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 104.
Другим объектом изобретения является антитело к С5, где антитело содержит последовательность VH, содержащую (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 117, (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 118, и (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 121, и последовательность VL, содержащую (a) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 122; (б) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 123; и (в) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 125.
Другим объектом изобретения является антитело к С5, где антитело содержит последовательность VH, содержащую (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 117, (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 119, и (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 121, и последовательность VL, содержащую (a) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 122; (б) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 123; и (в) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 125.
Другим объектом изобретения является антитело к С5, где антитело содержит последовательность VH, содержащую (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 117, (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 118, и (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 121, и последовательность VL, содержащую (a) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 122; (б) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 124; и (в) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 125.
Другим объектом изобретения является антитело к С5, где антитело содержит последовательность VH, содержащую (a) HVR-H1, который содержит аминокислотную последовательность SEQ ID NO: 117, (б) HVR-H2, который содержит аминокислотную последовательность SEQ ID NO: 120, и (в) HVR-H3, который содержит аминокислотную последовательность SEQ ID NO: 121, и последовательность VL, содержащую (a) HVR-L1, который содержит аминокислотную последовательность SEQ ID NO: 122; (б) HVR-L2, который содержит аминокислотную последовательность SEQ ID NO: 124; и (в) HVR-L3, который содержит аминокислотную последовательность SEQ ID NO: 125.
В некоторых вариантах осуществления изобретения антитело к С5, предлагаемое в настоящем изобретении, содержит VH, представленную в одном из указанных выше вариантов осуществления изобретения, и константную область тяжелой цепи, содержащую одну из аминокислотных последовательностей SEQ ID NO: 33, 34, 35, 114, 115 и 116. В некоторых вариантах осуществления изобретения, an антитело к С5 предлагаемое в настоящем изобретении, содержит VL, представленную в одном из указанных выше вариантов осуществления изобретения, и константную область легкой цепи, содержащую одну из аминокислотных последовательностей SEQ ID NO: 36, 37 и 38.
Следующим объектом изобретения является антитело, которое связывается с тем же эпитопом, что и антитело к С5, представленное в настоящем описании. Например, в некоторых вариантах осуществления изобретения предложено антитело, которое связывается с тем же эпитопом, что и антитело, указанное в таблице 2. Как продемонстрировано в представленных ниже примерах осуществления изобретения, все антитела к С5, указанные в таблице 2, сгруппированы в одну «корзину» для указанного эпитопа С5 и обладают рН-зависимыми характеристиками связывания.
Дополнительным объектом изобретения является антитело, которое связывается с тем же эпитопом, что и антитело, представленное в настоящем описании. Другим объектом изобретения является антитело, которое связывается с тем же эпитопом, что и антитело, указанное в таблице 7. В некоторых вариантах осуществления изобретения предложено антитело, которое связывается с эпитопом, присутствующим во фрагменте, который состоит из аминокислот 33-124 бета-цепи С5 (SEQ ID NO: 40). В некоторых вариантах осуществления изобретения предложено антитело, которое связывается с эпитопом в бета-цепи С5 (SEQ ID NO: 40), который содержит по меньшей мере один фрагмент, выбранный из группы, которая состоит из аминокислот 47-57, 70-76 и 107-110. В некоторых вариантах осуществления изобретения предложено антитело, которое связывается с эпитопом во фрагменте бета-цепи С5 (SEQ ID NO: 40), который содержит по меньшей мере одну аминокислоту, выбранную из группы, которая состоит из Thr47, Glu48, Ala49, Phe50, Asp51, Ala52, Thr53, Lys57, His70, Val71, His72, Ser74, Glu76, Val107, Ser108, Lys109 и His110. В другом варианте осуществления изобретения эпитоп для антитела к С5, предлагаемого в настоящем изобретении, представляет собой конформационный эпитоп.
В другом объекте изобретения антитело к С5, предлагаемое в одном из указанных выше вариантов осуществления изобретения, представляет собой моноклональное антитело, включая химерное, гуманизированное или человеческое антитело. В одном из вариантов осуществления изобретения антитело к С5 представляет собой фрагмент антитела, например, Fv, Fab, Fab', scFv, диабоди или F(ab')2-фрагмент. В другом варианте осуществления изобретения антитело представляет собой полноразмерное антитело, например, интактное антитело IgG1- или IgG4-класса, или антитело другого класса или изотипа, указанное в настоящем описании.
Согласно другому объекту изобретения антитело к С5 по одному из указанных выше вариантов осуществления изобретения, может обладать любыми из описанных ниже в разделах 1-7 характеристик индивидуально или в комбинации.
1. Аффинность антител
В некоторых вариантах осуществления изобретения антитело, представленное в настоящем описании, имеет величину константы диссоциации (Kd), составляющую 1 мкМ или менее, 100 нМ или менее, 10 нМ или менее, 1 нМ или менее, 0,1 нМ или менее, 0,01 нМ или менее, или 0,001 нМ или менее (например 10-8 М или менее, например, от 10-8 М до 10-13 М, например, от 10-9 М до 10-13 М).
В одном из вариантов осуществления величину Kd измеряют с помощью анализа связывания несущего радиоактивную метку антигена (РИА). В одном из вариантов осуществления изобретения РИА осуществляют с использованием Fab-версии представляющего интерес антитела и его антигена. Например, измеряют в растворе аффинность связывания Fab с антигеном путем уравновешивания Fab минимальной концентрацией 125I-меченного антигена в присутствии полученных титрованием разведений немеченого антигена, осуществляя затем «захват» связанного антигена на сенсибилизированном антителом к Fab планшете (см., например, Chen и др., J. Mol Biol 293, 1999, сс. 865-881). Для обеспечения условий, необходимых для проведения анализа, многолуночные планшеты MICROTITER® (фирма Thermo Scientific) сенсибилизируют в течение ночи «захватывающим» антителом к Fab (фирма Cappel Labs) в концентрации 5 мкг/мл в 50 мМ карбонате натрия (рН 9,6) и затем блокируют с помощью 2% (мас./об) бычьего сывороточного альбумина в ЗФР в течение 2-5 ч при комнатной температуре (примерно 23°С). В неадсорбирующем планшете (фирма Nunc, №269620) смешивают взятый в концентрации 100 или 26 пМ меченный с помощью 125I антиген с серийными разведениями представляющего интерес Fab (например, пригодного для оценки антитела к VEGF, Fab-12, см. Presta и др., Cancer Res. 57, 1997, сс. 4593-4599). Затем представляющий интерес Fab инкубируют в течение ночи; однако инкубацию можно осуществлять в течение более продолжительного периода времени (например, в течение 65 ч) для того, чтобы гарантировать достижение равновесия. После этого смеси переносят в подготовленный для «захвата» планшет и инкубируют при комнатной температуре (например, в течение 1 ч). Затем раствор удаляют и планшет промывают восемь раз 0,1% полисорбатом 20 (TWEEN-20®) в ЗФР. После просушки планшетов в них добавляют по 150 мкл/лунку сцинтилляционной жидкости ((MICROSCINT-20™; фирма Packard) и осуществляют считывание планшетов с помощью гамма-счетчика TOPCOUNT™ (фирма Packard) в течение 10 мин. Для осуществления анализа связывания в условиях конкуренции выбирают концентрации каждого Fab, обеспечивающие уровень связывания, составляющий менее или равный 20% от максимального.
В другом варианте осуществления изобретения Kd измеряют методом поверхностного плазмонного резонанса с помощью устройства BIACORE®. Например, анализ осуществляют с помощью устройства BIACORE®-2000 или BIACORE®-3000 (фирма GE Healthcare Inc., Пискатавей, шт. Нью-Джерси) при 25°C с использованием антигена, иммобилизованного на СМ5-чипах с уровнем иммобилизации, соответствующим ~10 единицам ответа (RU). В одном из вариантов осуществления изобретения биосенсорные чипы из карбоксиметилированного декстрана (СМ5, фирма GE Healthcare Inc.) активируют с помощью гидрохлорида N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC) и N-гидроксисукцинимида (NHS) согласно инструкциям поставщика. Антиген разводят 10 мМ ацетатом натрия, рН 4,8 до концентрации 5 мкг/мл (~0,2 мкМ) перед инъекцией со скоростью потока 5 мкл/мин для достижения уровня иммобилизации, соответствующего примерно 10 единицам ответа (RU) сшитого белка. После инъекции антигена инъецируют 1 М этаноламин для блокады непрореагировавших групп. Для кинетических измерений инъецируют двукратные серийные разведения Fab (от 0,78 до 500 нМ) в ЗФР, дополненном 0,05% полисорбата 20 (TWEEN-20™) в качестве сурфактанта (ЗФРТ), при 25°С со скоростью потока примерно 25 мкл/мин. Скорость реакции ассоциации (kon) и реакции диссоциации (koff) рассчитывают с использованием простой модели связывания Ленгмюра 1:1 (программное обеспечение Evaluation версия 3.2, BIACORE®) путем одновременной аппроксимации сенсограмм ассоциации и диссоциации. Константу равновесия реакции диссоциации (Kd) рассчитывают как соотношение koff/kon (см., например, Chen и др., J Mol Biol 293, 1999, сс. 865-881). Если скорость реакции ассоциации превышает 106 М-1с-1 при оценке с помощью описанного выше метода поверхностного плазмонного резонанса, то скорость реакции ассоциации можно определять с помощью метода гашения флуоресценции, который позволяет измерять повышение или снижение интенсивности излучения флуоресценции (длина волны возбуждения 295 нм; длина волны испускания 340 нм, полоса пропускания 16 нм) при 25°С применяемого в концентрации 20 нМ антитела к антигену (Fab-формат) в ЗФР, рН 7,2, в присутствии возрастающих концентраций антигена, осуществляя измерения с помощью спектрометра, такого как спектрофотометр, снабженный блоком для остановки потока (фирма Aviv Instruments), или спектрофотометр SLM-AMINCO™ серии 8000 (фирма ThermoSpectronic), при перемешивании содержимого кюветы.
2. Фрагменты антител
В некоторых вариантах осуществления изобретения антитело, предлагаемое в настоящем изобретении, представляет собой фрагмент антитела. Фрагменты антител включают (но, не ограничиваясь только ими) такие фрагменты как Fab, Fab', Fab'-SH, F(ab')2, Fv и scFv и другие описанные ниже фрагменты. Обзор некоторых фрагментов антител см., у Hudson и др., Nat. Med. 9, 2003, сс. 129-134. Обзор scFv-фрагментов см., например, у Plueckthun в: The Pharmacology of Monoclonal Antibodies, под ред. Rosenburg и Moore, изд-во Springer, New York, т. 113, 1994, сс. 269-315; см. также WO 93/16185; и US №№5571894 и 5587458. Обсуждение, касающееся Fab- и F(ab')2-фрагментов, которые содержат остатки эпитопа, связывающегося с рецептором спасения, и обладают удлиненным временем полужизни in vivo, см. в US №5869046.
Димерные антитела представляют собой фрагменты антител с двумя антигенсвязывающими центрами, которые могут быть двухвалентными или биспецифическими (см., например, ЕР 0404097; WO 1993/01161; Hudson и др., Nat. Med. 9, 2003, сс. 129-134; и Holliger и др., Proc. Natl. Acad. Sci. USA 90, 1993, сс. 6444-6448). Тримерные и тетрамерные антитела описаны также у Hudson и др., Nat. Med. 9, 2003, сс. 129-134).
Однодоменные антитела представляют собой фрагменты антител, содержащие весь вариабельный домен тяжелой цепи или его часть, или весь вариабельный домен легкой цепи антитела или его часть. В некоторых вариантах осуществления изобретения однодоменное антитело представляет собой человеческое однодоменное антитело (фирма Domantis, Inc., Уолтхэм, шт. Массачусетс; см., например, US №6248516).
Фрагменты антител можно создавать различными методиками, включая (но, не ограничиваясь только ими) протеолитическое расщепление интактного антитела, а также получать с помощью рекомбинантных клеток-хозяев (например, Е. coli или фаг), указанных в настоящем описании.
3. Химерные и гуманизированные антитела
В некоторых вариантах осуществления изобретения антитело, указанное в настоящем описании, представляет собой химерное антитело. Некоторые химерные антитела описаны, например, в US №4816567; и у Morrison и др., Proc. Natl. Acad. Sci. USA 81, 1984, сс. 6851-6855. В одном из примеров химерное антитело содержит нечеловеческую вариабельную область (например, вариабельную область из антитела мышей, крыс, хомяков, кроликов или приматов кроме человека, таких как обезьяны) и человеческую константную область. В другом примере химерное антитело представляет собой антитело «переключенного класса», класс или подкласс которого был изменен относительно родительского антитела. Химерные антитела включают их антигенсвязывающие фрагменты.
В некоторых вариантах осуществления изобретения химерное антитело представляет собой гуманизированное антитело. Как правило, нечеловеческое антитело гуманизируют для снижения иммуногенности для людей, сохраняя при этом специфичность и аффинность родительского нечеловеческого антитела. Как правило, гуманизированное антитело содержит один или несколько вариабельных доменов, в которых HVR, например, CDR (или их участки), получают из нечеловеческого антитела, a FR (или их участки) получают из последовательностей человеческого антитела. Гуманизированное антитело необязательно может содержать по меньшей мере часть человеческой константной области. В некоторых вариантах осуществления изобретения некоторые остатки FR в гуманизированном антителе заменены на соответствующие остатки из нечеловеческого антитела (например, антитела, из которого происходят остатки HVR), например, для сохранения или улучшения специфичности или аффинности антитела.
Сведения о гуманизированных антителах и методах их создания обобщены, например, у Almagro, Front. Biosci. 13, 2008, сс. 1619-1633, и описаны также у Riechmann и др., Nature 332, 1988, сс. 323-329; Queen и др., Proc. Natl. Acad. Sci. USA 86, 1989, сс. 10029-10033; US №№5821337, 7527791, 6982321 и 7087409; Kashmiri и др., Methods 36, 2005, сс. 25-34 (описание трансплантации SDR (а-CDR)); Padlan, Mol. Immunol. 28, 1991, сс. 489-498 (описание «нанесения нового покрытия»); Dall'Acqua и др., Methods 36, 2005, сс. 43-60 (описание «перестановки FR»); и Osbourn и др., Methods 36, 2005, сс. 61-68 и Klimka и др., Br. J. Cancer 83, 2000, сс. 252-260 (описание подхода «направленной селекции» для перестановки FR).
Человеческие каркасные участки, которые можно применять для гуманизации, включают (но, не ограничиваясь только ими): каркасные участки, выбранные с использованием методов «наилучшего подбора» (см., например, Sims и др., J. Immunol. 151, 1993, сс. 2296-2308; каркасные участки, происходящие из консенсусной последовательности конкретной подгруппы вариабельных областей легких и тяжелых цепей человеческих антител (см., например, Carter и др., Proc. Natl. Acad. Sci. USA 89, 1992, сс. 4285-4289 и Presta и др., J. Immunol. 151, 1993, сс. 2623-2632); человеческие зрелые (с соматическими мутациями) каркасные области или каркасные области человеческой зародышевой линии (см., например, Almagro и Fransson, Front. Biosci. 13, 2008, с. 1619-1633); и каркасные участки, полученные в результате скрининга FR-библиотек (см., например, Васа и др., J. Biol. Chem. 272, 1997, сс. 10678-10684 и Rosok и др., J. Biol. Chem. 271, 1996, сс. 22611-22618).
4. Человеческие антитела
В некоторых вариантах осуществления изобретения антитело, предлагаемое в настоящем изобретении, представляет собой человеческое антитело. Человеческие антитела можно получать, используя различные методики, известные в данной области. Человеческие антитела описаны в целом у van Dijk и van de Winkel, Curr. Opin. Pharmacol. 5, 2001, cc. 368-374 и Lonberg, Curr. Opin. Immunol. 20, 2008, cc. 450-459.
Человеческие антитела можно получать путем введения иммуногена трансгенному животному, модифицированному таким образом, чтобы оно продуцировало интактные человеческие антитела или интактные антитела с человеческими вариабельными областями в ответ на контрольное заражение антигеном. Указанные животные, как правило, содержат все или часть локусов человеческого иммуноглобулина вместо эндогенных иммуноглобулиновых локусов, которые либо присутствуют вне хромосом, либо интегрированы произвольно в хромосомы животного. У таких трансгенных мышей эндогенные иммуноглобулиновые локусы, как правило, инактивированы. Обзор методов получения человеческих антител в трансгенных животных см. у Lonberg, Nat. Biotech. 23, 2005, сс. 1117-1125 (см., например, также в US №6075181 и US №6150584 описание технологии XENOMOUSE™; в US №5770429 описание технологии HUMAB®; в US №7041870 описание технологии K-М MOUSE® и в публикации заявки на патент США 2007/0061900 описание технологии VELOCIMOUSE®). Человеческие вариабельные области из интактных антител, полученных с помощью указанных животных, можно дополнительно модифицировать, например, путем объединения с другой человеческой константной областью.
Человеческие антитела можно создавать с помощью методов на основе гибридом. Описаны клеточные линии человеческой миеломы и мышиной-человеческой гетеромиеломы, предназначенные для получения человеческих моноклональных антител (см., например, Kozbor, J. Immunol. 133, 1984, сс. 3001-3005; Brodeur и др., Monoclonal Antibody Production Techniques and Applications, изд-во Marcel Dekker, Inc., New York, 1987, cc. 51-63 и Boerner и др., J. Immunol. 147, 1991, сс. 86-95). Человеческие антитела, созданные с использованием технологии на основе человеческих В-клеточных гибридом, описаны также у Li и др., Proc. Natl. Acad. Sci. USA 103, 2006, сс. 3557-3562. Дополнительные методы включают методы, описанные, например, в US №7189826 (описание получения моноклональных человеческих антител типа IgM из клеточных линий гибридом), и у Ni, Xiandai Mianyixue 26, 2006, сс. 265-268 (описание человеческих-человеческих гибридом). Технология человеческих гибридом (технология Trioma) описана также у Vollmers и Brandlein, Histology and Histopathology 20, 2005, сс. 927-937 и Vollmers и Brandlein, Methods and Findings in Experimental and Clinical Pharmacology 27, 2005, cc. 185-191.
Человеческие антитела можно создавать также путем выделения последовательностей вариабельных доменов Fv-клонов, выбранных из фаговых дисплейных библиотек, для создания которых использовали человеческие антитела. Указанные последовательности вариабельных доменов затем можно объединять с требуемым человеческим константным доменом. Методики отбора человеческих антител из библиотек антител описаны ниже.
5. Антитела, полученные из библиотек
Антитела, предлагаемые в изобретении, можно выделять путем скрининга комбинаторных библиотек антител с требуемой активностью или видами активности. Например, в данной области известны разнообразные методы для создания фаговых дисплейных библиотек и скрининга указанных библиотек в отношении антител, обладающих требуемыми характеристиками связывания. Указанные методы обобщены, например, у Hoogenboom и др., Methods in Molecular Biology 178, 2001, сс. 1-37, и описаны также, например, у McCafferty и др., Nature 348, 1990, сс. 552-554; Clackson и др., Nature 352, 1991, сс. 624-628; Marks и др., J. Mol. Biol. 222, 1992, сс. 581-597; Marks и Bradbury, Methods in Molecular Biology 248, 2003, cc. 161-175; Sidhu и др., J. Mol. Biol. 338, 2004, cc. 299-310; Lee и др., J. Mol. Biol. 340, 2004, cc. 1073-1093; Fellouse, Proc. Natl. Acad. Sci. USA 101, 2004, cc. 12467-12472 и Lee и др., J. Immunol. Methods 284, 2004, cc. 119-132.
При осуществлении некоторых методов фагового дисплея популяции VH- и VL-генов клонируют по отдельности с помощью полимеразной цепной реакции (ПЦР) и рекомбинируют произвольно в фаговых библиотеках, которые затем подвергают скринингу в отношении антигенсвязывающего фага согласно методу, описанному у Winter и др., Ann. Rev. Immunol. 12, 1994, сс. 433-455. Фаг, как правило, экспонирует фрагменты антител либо в виде одноцепочечных Fv-фрагментов (scFv), либо в виде Fab-фрагментов. Библиотеки, полученные из иммунизированных источников, включают антитела, обладающие высокой аффинностью к иммуногену, при этом отсутствует необходимость в создании гибридом. Альтернативно этому, можно клонировать необработанную («наивную») популяцию (например, из организма человека), получая один источник антител к широкому спектру чужих, а также своих антигенов без какой-либо иммунизации, что описано у Griffiths и др., EMBO J, 12, 1993, сс. 725-734. И, наконец, «наивные» библиотеки можно получать также методами синтеза путем клонирования неперегруппированных сегментов V-гена из стволовых клеток и с помощью ПЦР-праймеров, содержащих случайную последовательность, для кодирования гипервариабельных CDR3-участков и для осуществления перегруппировки in vitro согласно методу, описанному у Hoogenboom и Winter, J. Mol. Biol. 227, 1992, cc. 381-388. Фаговые библиотеки человеческих антител описаны, например, в следующих патентных публикациях: US №5750373 и публикациях заявок на патент США 2005/0079574, 2005/0119455, 2005/0266000, 2007/0117126, 2007/0160598, 2007/0237764, 2007/0292936 и 2009/0002360.
Антитела или фрагменты антител, выделенные из библиотек человеческих антител, рассматриваются как человеческие антитела или фрагменты человеческих антител.
6. Мультиспецифические антитела
В некоторых вариантах осуществления изобретения антитело, указанное в настоящем описании, представляет собой мультиспецифическое антитело, например, биспецифическое антитело. Мультиспецифические антитела представляют собой моноклональные антитела, которые имеют специфичности, связывающиеся по меньше мере с двумя различными сайтами. В некоторых вариантах осуществления изобретения одна из связывающих специфичностей обеспечивает связывание с С5, а другая с любым другим антигеном. В некоторых вариантах осуществления изобретения биспецифические антитела могут связываться с двумя различными эпитопами С5. Биспецифические антитела можно применять также для локализации цитотоксических агентов в клетках, которые экспрессируют С5. Биспецифические антитела можно получать в виде полноразмерных антител или фрагментов антител.
Методики создания мультиспецифических антител включают (но, не ограничиваясь только ими) рекомбинантную совместную экспрессию двух пар тяжелых цепей-легких цепей иммуноглобулинов, обладающих различными специфичностями (см. Milstein и Cuello, Nature 305, 1983, сс. 537-540, WO 93/08829 и Traunecker и др., EMBO J. 10,1991, сс. 3655-3659), и технологию «knob-in-hole» (обеспечение взаимодействия по типу «выступ-во впадину», см., например, US №5731168). Мультиспецифические антитела можно получать также путем создания регулируемых электростатических воздействий для получения молекул антитела с гетеродимерными Fc (WO 2009/089004); перекрестного связывания двух или большего количества антител или фрагментов (см., например, US №4676980 и Brennan и др., Science 229, 1985, сс. 81-83); применения «лейциновых молний» для получения биспецифических антител (см., например, Kostelny и др., J. Immunol. 148, 1992, сс. 1547-1553); применения технологии «димерных антител (диабоди)» для создания фрагментов биспецифических антител (см., например, Holliger и др., Proc. Natl. Acad. Sci. USA 90, 1993, сс. 6444-6448); и применения димеров одноцепочечных Fv (sFv) (см., например, Gruber и др., J. Immunol. 152, 1994, сс. 5368-5374); и получения триспецифических антител согласно методу, описанному, например, у Tutt и др., J. Immunol. 147, 1991, сс. 60-69).
Под объем настоящего изобретения подпадают также сконструированные антитела с тремя или большим количеством функциональных антигенсвязывающих сайтов, включая «антитела-осьминоги» (см., например, US 2006/0025576 А1).
Антитело или его фрагмент может включать также «Fab двойного действия» или «DAF», содержащий антигенсвязывающий сайт, который связывается с С5, а также с другим, отличным от него антигеном (см., например, US 2008/0069820).
7. Варианты антител
Некоторые варианты осуществления изобретения относятся к вариантам аминокислотных последовательностей антител, представленных в настоящем описании. Например, может требоваться повышать аффинность связывания и/или другие биологические свойства антитела. Варианты аминокислотной последовательности антитела можно получать путем интродукции соответствующих модификаций в нуклеотидную последовательность, кодирующую антитело, или путем синтеза пептидов. Указанные модификации включают, например, делеции и/или инсерции, и/или замены остатков в аминокислотных последовательностях антитела. Для получения конечной конструкции можно использовать любую комбинацию делеции, инсерции и замен, при условии, что конечная конструкция обладает требуемыми характеристиками, например, способностью связываться с антигеном.
а) Варианты, полученные путем замены, инсерции и делеции
Некоторыми вариантами осуществления изобретения являются варианты антител, которые имеют одну или несколько аминокислотных замен. Сайты, представляющие интерес для замещающего мутагенеза, включают HVR и FR. Консервативные замены представлены ниже в таблице 1 под заголовком «предпочтительные замены», и они описаны ниже со ссылкой на классы боковых цепей аминокислот. Более важные замены представлены ниже в таблице 1 под заголовком «приведенные в качестве примера замены», и они описаны ниже со ссылкой на классы боковых цепей аминокислот. Аминокислотные замены можно интродуцировать в представляющее интерес антитело и продукты подвергать скринингу в отношении требуемой активности, например, сохранения/повышения способности к связыванию антигена, пониженной иммуногенности или повышенной ADCC или CDC.


Аминокислоты можно группировать на основе общих свойств боковых цепей следующим образом: (1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile; (2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln; (3) кислотные: Asp, Glu; (4)  His, Lys, Arg; (5) остатки, которые влияют на ориентацию цепи: Gly, Pro; (6) ароматические: Trp, Tyr, Phe.
His, Lys, Arg; (5) остатки, которые влияют на ориентацию цепи: Gly, Pro; (6) ароматические: Trp, Tyr, Phe.
Под неконсервативными заменами подразумевают замену представителя одного из указанных классов на представителя из другого класса.
Один из типов полученного в результате замены варианта включает замену одного или нескольких остатков гипервариабельного участка родительского антитела (например, гуманизированного или человеческого антитела). Как правило, полученный(ые) в результате вариант(ы), отобранный(ые) для дополнительного исследования, должен(ы) иметь модификации (например, улучшения) некоторых биологических свойств (например, повышенную аффинность, пониженную иммуногенность) относительно родительского антитела, и/или должен(ы) иметь практически сохраненные определенные биологические свойства родительского антитела. Примером полученного в результате замены варианта является антитело с созревшей аффинностью, которое можно создавать, например, с использованием технологий созревания аффинности на основе фагового дисплея, например, указанных в настоящем описании. В целом, метод состоит в следующем: один или несколько остатков HVR подвергают мутации и варианты антител экспонируют на фаге и подвергают скринингу в отношении конкретной биологической активности (например, аффинности связывания).
Изменения (например, замены) можно осуществлять в HVR, например, для повышения аффинности антитела. Указанные изменения можно делать в «горячих (активных) точках» в HVR, т.е. остатках, кодируемых кодонами, которые с высокой частотой подвергаются мутации в процессе соматического созревания (см., например, Chowdhury, Methods Mol. Biol. 207, 2008, cc. 179-196), и/или в остатках, которые контактируют с антигеном, с последующим тестированием варианта VH или VL в отношении аффинности связывания. Созревание аффинности путем создания и повторной селекции из вторичных библиотек описано, например, у Hoogenboom и др., Methods in Molecular Biology 178, 2002, cc. 1-37. В некоторых вариантах осуществления процесса созревания аффинности интродуцируют разнообразие в гены вариабельной области, выбранные для созревания, с помощью любого из широкого разнообразия методов (например, ПЦР пониженной точности, перестановка цепи или сайтнаправленный мутагенез с использованием олигонуклеотидов). Затем создают вторичную библиотеку. Затем библиотеку подвергают скринингу для идентификации любых вариантов антител с требуемой аффинностью. Другой метод, применяемый для интродукции разнообразия, включает подходы, мишенью которых является HVR, при которых рандомизируют несколько остатков HVR (например, одновременно 4-6 остатков). Остатки HVR, участвующие в связывании антигена, можно специфически идентифицировать, например, используя аланин-сканирующий мутагенез или моделирование. Часто мишенями являются, прежде всего, CDR-H3 и CDR-L3.
В некоторых вариантах осуществления изобретения замены, инсерции или делеции могут затрагивать один или несколько HVR, если указанные изменения не снижают существенно способность антитела связываться с антигеном. Например, в HVR могут быть сделаны консервативные изменения (например, консервативные замены, указанные в настоящем описании), которые не снижают существенно аффинность связывания. Указанные изменения, например, могут находиться вне принимающих участие в контактировании с антигеном остатков HVR. В некоторых вариантах осуществления изобретения в последовательностях вариантов VH и VL, указанных выше, каждый HVR либо является неизмененным, либо содержит не более одной, двух или трех аминокислотных замен.
Ценным методом идентификации остатков или областей антитела, которые можно подвергать мутагенезу, является так называемый «аланин-сканирующий мутагенез», описанный у Cunningham и Wells, Science 244, 1989, cc. 1081-1085. При осуществлении этого метода остаток или группу остатков-мишеней (например, заряженные остатки, такие как arg, asp, his, lys и glu) идентифицируют и заменяют на нейтральную или отрицательно заряженную аминокислоту (например, аланин или полиаланин) для решения вопроса о том, будет ли это влиять на взаимодействие антитела с антигеном. Дополнительные замены можно интродуцировать в те положения аминокислот, для которых продемонстрирована функциональная чувствительность к начальным заменам. В альтернативном или дополнительном варианте изучают кристаллическую структуру комплекса антиген-антитело для идентификации точек контакта между антителом и антигеном. Указанные контактирующие остатки и соседние остатки можно рассматривать в качестве мишеней или исключать из рассмотрения в качестве кандидатов для замены. Варианты можно подвергать скринингу для решения вопроса о том, обладают ли они требуемыми свойствами.
Инсерции в аминокислотные последовательности включают амино- и/или карбоксиконцевые слияния, варьирующие по длине от одного остатка до полипептидов, содержащих сто или большее количество остатков, а также инсерции одного или нескольких аминокислотных остатков внутрь последовательности. Примером результата осуществления концевых инсерции является антитело с N-концевым метионильным остатком. Другие инсерционные варианты молекул антител включают слияние N- или С-концов антитела с ферментом (например, для ADEPT (антитело-направляемый фермент пролекарственной терапии) или полипептидом, который удлиняет время полужизни антитела в сыворотке.
б) Варианты гликозилирования
В некоторых вариантах осуществления изобретения антитело, предлагаемое в изобретении, изменяют с целью повышения или понижения степени гликозилирования антитела. Добавление или делецию сайтов гликозилирования в антителе можно легко осуществлять путем такого изменения аминокислотной последовательности, которое позволяет создавать или удалять один или несколько сайтов гликозилирования.
Если антитело содержит Fc-область, то можно изменять присоединенный к ней углевод. Нативные антитела, которые продуцируются клетками млекопитающих, как правило, содержат разветвленный биантенный олигосахарид, который, как правило, присоединен с помощью N-связи к Asn297 СН2-домена Fc-области (см., например, Wright и др., TIBTECH 15, 1997, сс. 26-32). Олигосахарид может включать различные углеводы, например, маннозу, N-ацетилглюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фукозу, присоединенную к GlcNAc в «стебле» биантенной олигосахаридной структуры. В некоторых вариантах осуществления изобретения модификации олигосахарида в антителе, предлагаемом в изобретении, можно осуществлять для создания вариантов антитела с определенными улучшенными свойствами.
Одним из вариантов осуществления изобретения являются варианты антитела, имеющие углеводную структуру, в которой снижено содержание фукозы, присоединенной (прямо или косвенно) к Fc-области. Например, содержание фукозы в указанной Fc-области может составлять от 1% до 80%, от 1% до 65%, от 5% до 65% или от 20% до 40%. Содержание фукозы определяют путем расчета среднего содержания фукозы в сахарной цепи на Asn297 относительно суммы всех гликоструктур, присоединенных к Asn297 (например, комплексных, гибридных структур и структур с высоким содержанием маннозы), которое измеряют с помощью MALDI-TOF-масс-спектрометрии согласно методу, описанному, например, в WO 2008/077546. Asn297 обозначает остаток аспарагина, присутствующий примерно в положении 297 в Fc-области (EU-нумерация остатков Fc-области); однако вследствие минорных вариаций последовательности антитела Asn297 может располагаться также в положении, находящемся на расстоянии примерно ±3 аминокислоты в прямом или обратном направлении от положения 297, т.е. между положениями 294 и 300. Указанные фукозилированные варианты могут обладать улучшенной ADCC-функцией (см., например, US 2003/0157108 (Presta L.); US 2004/0093621 (фирма Kyowa Hakko Kogyo Co., Ltd). Примерами публикаций, касающихся «дефукозилированных» вариантов антител или вариантов антител «с дефицитом фукозы» являются: US 2003/0157108; WO 2000/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO 2005/053742; WO 2002/031140; Okazaki и др., J. Mol. Biol. 336, 2004, cc. 1239-1249; Yamane-Ohnuki и др., Biotech. Bioeng. 87, 2004, cc. 614-622). Примерами клеточных линий, которые обладают способностью продуцировать дефукозилированные антитела, являются Lec13 СНО-клетки с дефицитом белкового фукозилирования (Ripka и др., Arch. Biochem. Biophys. 249, 1986, cc. 533-545; US 2003/0157108 (Presta L.) и WO 2004/056312 (Adams и др., см., прежде всего, пример 11), и клеточные линии с «выключенным» геном, например, СНО-клетки с «выключенным» геном альфа-1,6-фукозилтрансферазы, FUT8 (см., например, Yamane-Ohnuki и др., Biotech. Bioeng. 87, 2004, сс. 614-622); Kanda и др., Biotechnol. Bioeng., 94(4), 2006, сс. 680-688; и WO 2003/085107).
Кроме того, описаны варианты антител с бисекционными олигосахаридами, например, в которых биантенный олигосахарид, присоединенный к Fc-области антитела, бисекционнируется с помощью GlcNAc. Указанные варианты антител могут отличаться пониженным фукозилированием и/или повышенной ADCC-функцией. Примеры указанных вариантов антител описаны, например, в WO 2003/011878 (Jean-Mairet и др.); US №6602684 (Umana и др.) и US 2005/0123546 (Umana и др.). Предложены также варианты антител по меньшей мере с одним остатком галактозы в олигосахариде, присоединенном к Fc-области. Указанные варианты антител могут обладать повышенной CDC-функцией. Указанные варианты антител описаны, например, в WO 1997/30087 (Patel и др.); WO 1998/58964 (Raju S.); и WO 1999/22764 (Raju S.).
в) Варианты Fc-области
Согласно конкретным вариантам осуществления изобретения можно интродуцировать в Fc-область антитела, представленного в настоящем описании, одну или несколько аминокислотных модификаций, создавая тем самым вариант Fc-области. Вариант Fc-области может содержать последовательность человеческой Fc-области (например, Fc-области человеческого IgG1, IgG2, IgG3 или IgG4), включающую аминокислотную модификацию (например, замену) в одном или нескольких аминокислотных положениях.
Некоторые варианты осуществления изобретения относятся к варианту антитела, который обладает некоторыми, но не всеми эффекторными функциями, что делает его перспективным кандидатом для путей применения, для которых является важным время полужизни антитела in vivo, однако некоторые эффекторные функции (такие как CDC и ADCC) не являются необходимыми или являются вредными. Можно осуществлять анализы цитотоксичности in vitro и/или in vivo для подтверждения снижения/истощения CDC- и/или ADCC-активности. Например, можно осуществлять анализы связывания Fc-рецептора (FcR) для гарантии того, что у антитела отсутствует способность к связыванию с Fc-гамма R (и поэтому, вероятно, отсутствует ADCC-активность), но сохраняется способность связываться с FcRn. Первичные клетки, опосредующие ADCC, т.е. NK-клетки, экспрессируют только Fc-гамма RIII, в то время как моноциты экспрессируют Fc-гамма RI, Fc-гамма RII и Fc-гамма RIII. Данные об экспрессии FcR на гематопоэтических клетках обобщены в таблице 3 на с. 464 у Ravetch и Kinet, Annu. Rev. Immunol. 9, 1991, cc. 457-492. Примерами анализов in vitro ADCC-активности представляющей интерес молекулы являются (но, не ограничиваясь только ими) анализы, описанные в US №5500362 (см., например, Hellstrom и др., Proc. Natl. Acad. Sci. USA 83, 1986, cc. 7059-7063 и Hellstrom и др., Proc. Nat'l Acad. Sci. USA 82, 1985, cc. 1499-1502); US №5821337 (см. Bruggemann и др., J. Exp. Med. 166, 1987, cc. 1351-1361). В альтернативном варианте можно применять нерадиоактивные методы анализа (см., например, нерадиоактивный анализ цитотоксичности ACTI™ на основе проточной цитометрии (фирма CellTechnology, Inc. Маунтин-Вью, шт. Калифорния); и нерадиоактивный анализ цитотоксичности CytoTox 96® (фирма Promega, Мэдисон, шт. Висконсин). Пригодными для таких анализов эффекторными клетками являются мононуклеарные клетки периферической крови (РВМС) и естественные клетки-киллеры (NK). В альтернативном или дополнительном варианте ADCC-активность представляющей интерес молекулы можно оценивать in vivo, например, на животной модели, например, как описано у Clynes и др., Proc. Natl. Acad. Sci. USA 95, 1998, cc. 652-656. Можно осуществлять также анализы связывания C1q для подтверждения того, что антитело не может связывать C1q и поэтому у него отсутствует CDC-активность (см., например, описание ELISA для оценки связывания C1q и С3с в WO 2006/029879 и WO 2005/100402). Для оценки активации комплемента можно осуществлять анализ CDC (см., например, Gazzano-Santoro и др., J. Immunol. Methods 202, 1996, cc. 163-171; Cragg и др., Blood 101, 2003, cc. 1045-1052; и Cragg, Blood 103, 2004, cc. 2738-2743). Определение FcRn-связывания и клиренса/времени полужизни in vivo можно осуществлять также с использованием методов, известных в данной области (см., например, Petkova и др., Int'l. Immunol. 18(12), 2006, cc. 1759-1769).
Антитела с пониженной эффекторной функцией включают антитела с заменой одного или нескольких следующих остатков Fc-области, таких как 238, 265, 269, 270, 297, 327 и 329 (см., например, US №6737056). К указанным мутантам Fc относятся мутанты Fc с заменами в двух или большем количестве из следующих аминокислотных положений: 265, 269, 270, 297 и 327, включая так называемый мутант «DANA» Fc-области, несущий замену остатков 265 и 297 на аланин (US №7332581).
Описаны некоторые варианты антител с повышенной или пониженной способностью связываться с FcR (см., например, US №6737056; WO 2004/056312 и Shields и др., J. Biol. Chem. 276, 2001, сс. 6591-6604).
Согласно конкретным вариантам осуществления изобретения вариант антитела содержит Fc-область с одной или несколькими аминокислотными заменами, которые повышают ADCC, например, замены в положениях 298, 333, и/или 334 Fc-области (EU-нумерация остатков).
В некоторых вариантах осуществления изобретения в Fc-области осуществляют изменения, которые приводят к измененной (т.е. либо повышенной, либо пониженной) способности связывать C1q и/или комплементзависимой цитотоксичности (CDC), что описано, например, в US №6194551, WO 1999/51642 и у Idusogie и др., J. Immunol. 164, 2000, сс. 4178-4184.
Антитела с удлиненным временем полужизни и повышенной способностью к связыванию с неонатальным Fc-рецептором (FcRn), который ответствен за перенос материнских IgG эмбриону (Guyer и др., J. Immunol. 117, 1976, сс. 587-593 и Kim и др., J. Immunol. 24, 1994, сс. 2429-2434), описаны в US 2005/0014934 А1 (Hinton и др.). Эти антитела содержат Fc-область с одной или несколькими заменами, которые повышают связывание Fc-области с FcRn. Указанные варианты Fc-области включают варианты с заменами одного или нескольких следующих остатков Fc-области: 238, 256, 265, 272, 286, 303, 305, 307, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424 или 434, например, замену остатка 434 в Fc-области (US №7371826).
Дополнительные примеры, касающиеся других вариантов Fc-области, описаны также у Duncan, Nature 322, 1988, сс. 738-740; в US №№5648260 и 5624821 и в WO 1994/29351.
г) Варианты антител, сконструированные с помощью цистеина
В некоторых вариантах осуществления изобретения может оказаться желательным создавать антитела, сконструированные с помощью цистеина, например, «тиоМАт», в которых один или несколько остатков в антителе заменены на остатки цистеина. В конкретных вариантах осуществления изобретения замененные остатки находятся в доступных сайтах антитела. Путем замены этих остатков на цистеин реакционноспособные тиольные группы помещаются в доступные сайты антитела и могут использоваться для конъюгации антитела с другими фрагментами, такими как фрагменты, представляющие собой лекарственное средство, или фрагменты, представляющие собой линкер, связанный с лекарственным средством, с созданием иммуноконъюгата, указанного ниже в настоящем описании. В некоторых вариантах осуществления изобретения любой(ые) один или несколько следующих остатков может(гут) быть заменен(ы) на цистеин: V205 (нумерация по Кэботу) легкой цепи; А118 (EU-нумерация) тяжелой цепи и S400 (EU-нумерация) Fc-области тяжелой цепи. Антитела, сконструированные с помощью цистеина, можно создавать согласно методу, например, описанному в US №7521541.
д) Производные антител
В некоторых вариантах осуществления изобретения антитело, представленное в настоящем описании, можно дополнительно модифицировать таким образом, чтобы оно содержало дополнительные небелковые фрагменты, известные в данной области и легко доступные. Фрагменты, пригодные для дериватизации антитела, включают (но, не ограничиваясь только ими) водорастворимые полимеры. Примерами водорастворимых полимеров являются (но, не ограничиваясь только ими) полиэтиленгликоль (ПЭГ), сополимеры этиленгликоля/пропиленгликоля, карбоксиметилцеллюлоза, декстран, поливиниловый спирт, поливинилпирролидон, поли-1,3-диоксолан, поли-1,3,6-триоксан, сополимер этилена/малеинового ангидрида, полиаминокислоты (либо гомополимеры, либо статистические сополимеры) и декстран- или поли(н-винилпиролидон)полиэтиленгликоль, гомополимеры пропиленгликоля, сополимеры пропиленоксида/этиленоксида, полиоксиэтилированные полиолы (например, глицерин), поливиниловый спирт и их смеси. Полиэтиленгликоль пропиональдегид может иметь преимущество при производстве благодаря его стабильности в воде. Полимер может иметь любую молекулярную массу и может быть разветвленным или неразветвленным. Количество полимеров, присоединенных к антителу, может варьироваться и, если присоединено более одного полимера, то они могут представлять собой одинаковые или различные молекулы. В целом, количество и/или тип полимеров, применяемых для дериватизации, можно определять с учетом таких особенностей (но, не ограничиваясь только ими), как конкретные свойства или функции антитела, подлежащие усовершенствованию, предполагается ли применение производного антитела в терапии в определенных условиях, и т.д.
Другим вариантом осуществления изобретения являются конъюгаты антитела и небелкового фрагмента, которые можно избирательно нагревать, воздействуя на него излучением. В одном из вариантов осуществления изобретения небелковый фрагмент представляет собой углеродную нанотрубку (Kam и др., Proc. Natl. Acad. Sci. USA 102, 2005, сс. 11600-11605). Излучение может иметь любую длину волны и включает (но, не ограничиваясь только ими) длины волн, которые не повреждают обычные клетки, но которые нагревают небелковый фрагмент до температуры, при которой уничтожаются клетки, ближайшие к конъюгату: антитело-небелковый фрагмент.
Б. Методы рекомбинации и композиции
Антитела можно получать, используя методы рекомбинации и композиции, например, описанные в US №4816567. Одним из вариантов осуществления изобретения является выделенная нуклеиновая кислота, кодирующая антитело к С5, представленное в настоящем описании. Другим вариантом осуществления изобретения является выделенная нуклеиновая кислота, которая кодирует полипептид, содержащий вариант Fc-области или родительскую Fc-область, указанную в настоящем описании. Указанная нуклеиновая кислота может кодировать аминокислотную последовательность, содержащую VL, и/или аминокислотную последовательность, содержащую VH антитела (например, легкие и/или тяжелые цепи антитела). Следующим вариантом осуществления изобретения является(ются) один или несколько векторов (например, экспрессионных векторов), который(е) содержит(ат) указанную нуклеиновую кислоту. Еще одним вариантом осуществления изобретения является клетка-хозяин, которая содержит указанную нуклеиновую кислоту. В одном из указанных вариантов осуществления изобретения клетка-хозяин содержит (например, в результате трансформации указанными векторами): (1) вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и аминокислотную последовательность, содержащую VH антитела, или (2) первый вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VL антитела, и второй вектор, содержащий нуклеиновую кислоту, которая кодирует аминокислотную последовательность, содержащую VH антитела. В одном из вариантов осуществления изобретения клетка-хозяин представляет собой эукариотическую клетку, например, клетку яичника китайского хомячка (СНО) или лимфоидную клетку (например, Y0-, NS0-, Sp20-клетку). Одним из вариантов осуществления изобретения является способ получения антитела к С5, включающий культивирование клетки-хозяина, содержащей нуклеиновую кислоту, которая кодирует антитело, описанное выше, в условиях, пригодных для экспрессии антитела, и необязательно выделение антитела из клетки-хозяина (или среды для культивирования клетки-хозяина). Другим вариантом осуществления изобретения является способ получения полипептида, который содержит вариант Fc-области или родительскую Fc-область, включающий культивирование клетки-хозяина, которая содержит нуклеиновую(ые) кислоту(ы), кодирующую(ие) полипептид, такой как антитело, Fc-область или вариант Fc-области, указанный выше, в условиях, пригодных для экспрессии полипептида, и необязательно выделение полипептида из клетки-хозяина (или среды для культивирования клетки-хозяина).
Для рекомбинантного получения антитела к С5 нуклеиновые кислоты, кодирующие антитело, например, описанные выше, выделяют и встраивают в один или несколько векторов для дальнейшего клонирования и/или экспрессии в клетке-хозяине. Для рекомбинантного получения Fc-области нуклеиновую кислоту, кодирующую Fc-область, выделяют и встраивают в один или несколько векторов для дальнейшего клонирования и/или экспрессии в клетке-хозяине. Указанную нуклеиновую кислоту легко можно выделять и секвенировать с использованием общепринятых процедур (например, путем использования олигонуклеотидных зондов, которые обладают способностью специфически связываться с генами, кодирующими тяжелые и легкие цепи антитела).
Приемлемые клетки-хозяева для клонирования или экспрессии кодирующих антитело векторов включают прокариотические или эукариотические клетки, представленные в настоящем описании. Например, антитела можно получать в бактериях, в частности, когда не требуется гликозилирование и связанная с Fc эффекторная функция. Сведения об экспрессии фрагментов антитела и полипептидов в бактериях см. например, в US №№5648237, 5789199 и 5840523 (см. также у Charlton в: Methods in Molecular Biology, под ред. Lo В.K.С., изд-во Humana Press, Totowa, NJ, т. 248, 2003, cc. 245-254 описание экспрессии фрагментов антител в Е. coli.) После экспрессии антитело можно выделять из пасты бактериальных клеток в виде растворимой фракции и можно дополнительно очищать.
Помимо прокариотических организмов в качестве хозяев, пригодных для клонирования или экспрессии плазмид, которые кодируют антитела, можно использовать эукариотические микроорганизмы, такие как нитчатые грибы или дрожжи, включая штаммы грибов и дрожжей, пути гликозилирования которых были «гуманизированы», что позволяет получать антитело с частично или полностью человеческой схемой гликозилирования (см. Gerngross, Nat. Biotech. 22, 2004, cc. 1409-1414 и Li и др., Nat. Biotech. 24, 2006, cc. 210-215).
Клетки-хозяева, которые можно использовать для экспрессии гликозилированного антитела, получают также из многоклеточных организмов (беспозвоночных и позвоночных животных). Примерами клеток беспозвоночных являются клетки насекомых, а также можно применять клетки растений. Были выявлены многочисленные штаммы бакуловирусов и соответствующие пригодные для них в качестве хозяев клетки насекомых, прежде всего для трансфекции клеток Spodoptera frugiperda.
В качестве хозяев можно применять также культуры растительных клеток (см., например, US №№5959177, 6040498, 6420548, 7125978 и 6417429 (описание технологии PLANTIBODIES™ для получения антител в трансгенных растениях).
В качестве хозяев можно применять также клетки позвоночных. Например, можно использовать клеточные линии млекопитающих, которые адаптированы к росту в суспензии. Другими примерами приемлемых линий клеток-хозяев млекопитающих являются линия клеток почки обезьяны CV1, трансформированная с помощью ОВ40 (COS-7); линия клеток почки эмбриона человека (HEK 293-клетки или клетки линии 293, описанные, например, у Graham и др., J. Gen. Virol., 36, 1977, сс. 59-74); клетки почки детеныша хомяка (ВНК); клетки Сертоли мыши (ТМ4-клетки, описанные, например, у Mather, Biol. Reprod., 23, 1980, сс. 243-251); клетки почки обезьяны (CV1); клетки почки африканской зеленой мартышки (VERO-76,); клетки карциномы шейки матки человека (HELA); клетки почки собаки (MDCK); клетки печени бычьей крысы (BRL 3А); клетки легкого человека (W138); клетки печени человека (Hep G2); клетки опухоли молочной железы мыши (ММТ 060562); клетки TRI, описанные, например, у Mather и др., Annals N.Y. Acad. Sci., 383, 1982, сс. 44-68); клетки MRC 5 и клетки FS4. Другими ценными линиями клеток-хозяев млекопитающих являются клетки яичника китайского хомячка (СНО), включая DHFR--CHO-клетки (Urlaub и др., Proc. Natl. Acad. Sci. USA, 77, 1980, сс. 4216-4220); и клеточные линии миеломы, такие как Y0, NS0 и Sp2/0. Обзор конкретных линий клеток-хозяев млекопитающих, которые можно применять для производства антител, см., например, у Yazaki и Wu, в: Methods in Molecular Biology под ред. В.K.С. Lo, изд-во Humana Press, Totowa, NJ, т. 248, 2003, сс. 255-268.
Поликлональные антитела предпочтительно вырабатываются у животных после нескольких подкожных (sc) или внутрибрюшинных (ip) инъекций релевантного антитела и адъюванта. Можно конъюгировать релевантный антиген с белком, иммуногенным для подлежащего иммунизации вида, например, гемоцианином лимфы улитки, сывороточным альбумином, бычьим тироглобулином или соевым ингибитором трипсина, с использованием бифункционального или дериватизирующего агента, например, сложного сульфосукцинимидного эфира малеимидобензоила (конъюгация через остатки цистеина), N-гидроксисукцинимида (конъюгация через остатки лизина), глутарового альдегида, янтарного ангидрида, SOCl2 или R1N=C=NR, где R и R1 обозначают различные алкильные группы.
Животных (как правило, млекопитающих кроме человека) иммунизируют с использованием антигена, иммуногенных конъюгатов или производных путем объединения, например, 100 или 5 мкг белка или конъюгата (для кроликов и мышей соответственно) с 3 объемами полного адъюванта Фрейнда, и осуществляют введение раствора внутрикожно в несколько мест. Через 1 месяц животных подвергают бустерной вакцинации (ревакцинации) с использованием от 1/5 до 1/10 исходного количества пептида или конъюгата в полном адъюванте Фрейнда путем подкожной инъекции в несколько мест. Через 7-14 дней получают образцы крови животных и оценивают в сыворотке титр антитела. Животных подвергают ревакцинации вплоть до выхода титра на плато. Предпочтительно животных ревакцинируют с использованием конъюгата, в который входит тот же антиген, но конъюгированный с другим белком и/или через другой перекрестносшивающий реагент. Конъюгаты можно получать также в рекомбинантной клеточной культуре в виде белковых слияний. Кроме того, агрегирующие агенты, такие как квасцы, можно применять для усиления иммунного ответа.
Моноклональные антитела получают из популяции практически гомогенных антител, т.е. индивидуальные антитела, входящие в популяцию, идентичны за исключением возможных встречающихся в естественных условиях мутаций и/или пост-трансляционных модификаций (например, изомеризации, амидирования), которые могут присутствовать в минорных количествах. Прилагательное «моноклональный» свидетельствует о том, что антитело не присутствует в смеси различных антител.
Например, моноклональные антитела можно получать, используя метод гибридом, впервые описанный Kohler и др., Nature 256(5517), 1975, сс. 495-497. При осуществления метода гибрид мышь или другое пригодное в качестве хозяина животное, такое как хомяк, иммунизируют согласно описанному выше методу для выработки лимфоцитов, которые продуцируют или обладают способностью продуцировать антитела, специфически связывающиеся с белком, применяемым для иммунизации. Альтернативно этому, лимфоциты можно иммунизировать in vitro.
Иммунизирующий агент должен, как правило, включать антигенный белок или его слитый вариант. Как правило, применяют либо лимфоциты периферической крови (PBL), если требуются клетки человеческого происхождения, либо применяют селезеночные клетки или клетки лимфатических узлов, если источниками являются млекопитающие кроме человека. Затем лимфоциты сливают с иммортализованной клеточной линией с помощью приемлемого агента для слияния, такого как полиэтиленгликоль, с получением клетки гибридомы (Goding, Monoclonal Antibodies: Principles and Practice, изд-во Academic Press, 1986, cc. 59-103).
Иммортализованные клеточные линии, как правило, представляют собой трансформированные клетки млекопитающих, прежде всего клетки миеломы грызунов, быков и человека. Как правило, применяют крысиные или мышиные клеточные линии миеломы. Полученные таким образом клетки гибридомы высевают и выращивают в приемлемой культуральной среде, которая предпочтительно содержит одну или несколько субстанций, которые ингибируют рост или выживание неслитых родительских клеток миеломы. Например, если в родительских клетках миеломы отсутствует фермент гипоксантингуанинфосфорибозилтрансфераза (HGPRT или HPRT), то культуральная среда для гибридом, как правило, включает гипоксантин, аминоптерин и тимидин (НАТ-среда), т.е. субстанции, которые препятствуют росту клеток с дефицитом HGPRT.
Предпочтительными иммортализованными клетками миеломы являются клетки, которые можно эффективно сливать, которые поддерживают стабильный высокий уровень производства антитела отобранными антителопродуцирующими клетками и обладают чувствительностью к среде, такой как НАТ-среда. Среди них предпочтительными являются мышиные линии миеломы, например, полученные из мышиных опухолей МОРС-21 и МРС-11, которые можно получать от фирмы Salk Institute Cell Distribution Center, Сан-Диего, шт. Калифорния, США, и SP-2-клетки (и их производные, например, Х63-Ag8-653), которые можно получать из Американской коллекции типовых культур, Манассас, шт. Вирджиния, США. Также описаны клеточные линии человеческой миеломы и мышиной-человеческой гетеромиеломы, которые можно применять для производства человеческих моноклональных антител (Kozbor и др., J. Immunol. 133(6), 1984, сс. 3001-3005; Brodeur и др., Monoclonal Antibody Production Techniques and Applications, изд-во Marcel Dekker, Inc., New York, 1987, cc. 51-63).
Культуральную среду, в которой выращивают клетки гибридомы, оценивают в отношении производства моноклональных антител против антигена. Предпочтительно специфичность связывания моноклональных антител, продуцируемых клетками гибридомы, определяют с помощью иммунопреципитации или анализа связывания in vitro, такого как радиоиммуноанализ (РИА) или твердофазный иммуноферментный анализ (ELISA). Указанные методики и анализы известны в данной области. Например, аффинность связывания можно определять с помощью анализа Скэтчарда, описанного у Munson, Anal. Biochem. 107(1), 1980, cc. 220-239.
После того, как установлено, что клетки гибридом продуцируют антитела требуемой специфичности, аффинности и/или активности, клоны можно субклонировать, используя процедуры серийного разведения, и выращивать с помощью стандартных методов (Goding, выше). Приемлемые для этой цели культуральные среды включают, например, среду D-MEM или RPMI-1640. Кроме того, клетки гибридомы можно выращивать in vivo в виде опухолей в млекопитающих.
Моноклональные антитела, секретируемые субклонами, можно отделять от культуральной среды, асцитной жидкости или сыворотки с помощью общепринятых процедур очистки иммуноглобулинов, таких, например, как хроматография на белок А-сефарозе, гидроксиапатите, гель-электрофорез, диализ или аффинная хроматография.
Антитела можно получать путем иммунизации приемлемого животного-хозяина антигеном. В одном из вариантов осуществления изобретения антиген представляет собой полипептид, содержащий полноразмерный С5. В одном из вариантов осуществления изобретения антиген представляет собой полипептид, содержащий бета-цеп (SEQ ID NO: 40) С5. В одном из вариантов осуществления изобретения антиген представляет собой полипептид, содержащий MG1-MG2-домен (SEQ ID NO: 43) бета-цепи С5. В одном из вариантов осуществления изобретения антиген представляет собой полипептид, содержащий MG1-домен (SEQ ID NO: 41) бета-цепи С5. В одном из вариантов осуществления изобретения антиген представляет собой полипептид, содержащий область, соответствующую аминокислотам в положениях 19-180 бета-цепи С5. В одном из вариантов осуществления изобретения антиген представляет собой полипептид, содержащий область, соответствующую аминокислотам в положениях 33-124 бета-цепи С5. В одном из вариантов осуществления изобретения антиген представляет собой полипептид, содержащий по меньшей мере один фрагмент, выбранный из аминокислот 47-57, 70-76 и 107-110 бета-цепи (SEQ ID NO: 40) С5. В одном из вариантов осуществления изобретения антиген представляет собой полипептид, содержащий фрагмент бета-цепи С5, который содержит по меньшей мере одну аминокислоту, выбранную из группы, которая состоит из Thr47, Glu48, Ala49, Phe50, Asp51, Ala52, Thr53, Lys57, His70, Val71, His72, Ser74, Glu76, Val107, Ser108, Lys109 и His110. В одном из вариантов осуществления изобретения антиген представляет собой полипептид, содержащий фрагмент бета-цепи С5, который содержит по меньшей мере одну аминокислоту, выбранную из группы, которая состоит из Glu48, Asp51, His70, His72, Lys109 и His110. Под объем изобретения подпадают также антитела, полученные путем иммунизации животного антигеном. Антитела могут обладать индивидуально или в комбинации любой из особенностей, которые описаны выше в разделе «Примеры антител к С5».
В. Анализы
Представленные в настоящем описании антитела к С5 можно идентифицировать, осуществлять их скрининг или характеризовать их физические/химические свойства и/или виды биологической активности с помощью различных анализов, известных в данной области.
1. Анализы связывания и другие анализы
Согласно одному из объектов изобретения антитело, предлагаемое в изобретении, тестируют в отношении антигенсвязывающей активности с использованием известных методов, таких как ELISA, Вестерн-блоттинг, BIACORE® и т.д. В одном из объектов изобретения полипептид, содержащий вариант Fc-области, предлагаемый в изобретении, тестируют в отношении активности связывания с его Fc-рецептором с помощью известных методов, таких как BIACORE® и т.д.
Согласно другому объекту изобретения можно использовать анализы в условиях конкуренции для идентификации антитела, которое конкурирует за связывание с С5 с любым антителом к С5, представленным в настоящем описании. В некоторых вариантах осуществления изобретения, когда указанное конкурирующее антитело присутствует в избытке, оно блокирует (например, снижает) связывание референс-антитела с С5 по меньшей мере на 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75% или более. В некоторых случаях связывание ингибируется по меньшей мере на 80%, 85%, 90%, 95% или более. В некоторых вариантах осуществления изобретения указанное конкурирующее антитело связывается с таким же эпитопом (например, линейным или конформационным эпитопом), с которым связывается антитело к С5, представленное в настоящем описании (например, антитело к С5, описанное в таблице 2). Подробное описание приведенных в качестве примера методов картирования эпитопа, с которым связывается антитело, представлено у Morris, Epitope Mapping Protocols, в: Methods in Molecular Biology, т. 66, изд-во Humana Press, Totowa, NJ, 1996.
В качестве примера анализа в условиях конкуренции иммобилизованный С5 инкубируют в растворе, содержащем первое меченое антитело, которое связывается с С5, и второе немеченое антитело, подлежащее тестированию с отношении способности конкурировать с первым антителом за связывание с С5. Второе антитело может присутствовать в супернатанте гибридомы. В качестве контроля иммобилизованный С5 инкубируют в растворе, содержащем первое меченое антитело, но не второе немеченое антитело. После инкубации в условиях, приемлемых для связывания первого антитела с С5, избыток несвязанного антитела удаляют и измеряют количество метки, ассоциированной с иммобилизованным С5. Если количество метки, ассоциированной с иммобилизованным С5, существенно снижается в тестируемом образце по сравнению с контрольным образцом, то это свидетельствует о том, что второе антитело конкурирует с первым антителом за связывание с С5 (см., например, Harlow и Lane, Antibodies: A Laboratory Manual, глава 14, изд-во Cold Spring Harbor Laboratory, Cold Spring Harbor, NY, 1988).
Другим примером анализа в условиях конкуренции является BIACORE®-анализ, позволяющий оценивать способность тестируемого антитела к С5 конкурировать за связывание с С5 со вторым (референс) антителом к С5. В следующем варианте осуществления изобретения, в котором применяют устройство BIACORE® (например, BIACORE®3000) согласно рекомендациям производителя, белок С5 «захватывают» на СМ5-чипе BIACORE® с помощью стандартного метода, известного в данной области, для создания покрытой С5 поверхности. Как правило, количество иммобилизованного на чипе С5 должно соответствовать 200-800 резонансным единицам (количество, которое обеспечивает легко измеряемые уровни связывания, но которое может легко насыщаться тестируемым антителом в применяемых концентрациях). Два антитела (т.е. тестируемое и референс-антитело), для которых требуется оценивать способность конкурировать друг с другом, смешивают в молярном соотношении сайтов связывания 1:1 в пригодном буфере, получая смесь для тестирования. При расчете концентраций на основе сайтов связывания за молекулярную массу тестируемого или референс-антитела принимают полную массу соответствующего антитела, деленную на количество сайтов связывания С5 на антителе. Концентрация каждого антитела (т.е. тестируемого и референс-антитела) в смеси для тестирования должна быть достаточно высокой для того, чтобы легко насыщать сайты связывания для этого антитела на молекулах С5, «захваченных» на BIACORE®-чипе. Тестируемое антитело и референс-антитело в смеси присутствуют в одинаковой молярной концентрации (на основе сайтов связывания), как правило, составляющей от 1,00 до 1,5 мкМ (на основе сайтов связывания). Приготавливают также отдельные растворы, содержащие только тестируемое антитело и только референс-антитело. Тестируемое антитело и референс-антитело в этих растворах должны находиться в таком же буфере и в таких же концентрациях и условиях, что и в смеси для тестирования. Смесь для тестирования, содержащую тестируемое антитело и референс-антитело, пропускают по поверхности покрытого С5 BIACORE®-чипа и регистрируют общий уровень связывания. Затем чип обрабатывают таким образом, чтобы удалить связанное тестируемое или референс-антитело без повреждения связанного с чипом С5. Как правило, это осуществляют путем обработки чипа 30 мМ HCl в течение 60 с. Затем пропускают раствор, содержащий только тестируемое антитело, по покрытой С5 поверхности и регистрируют уровень связывания. Чип снова обрабатывают для полного удаления связанного антитела, не повреждая связанный с чипом С5. Затем пропускают раствор, содержащий только референс-антитело, по покрытой С5 поверхности и регистрируют уровень связывания. После этого рассчитывают теоретически максимально возможный уровень связывания для смеси тестируемого антитела и референс-антитела, который представляет собой сумму уровней связывания для каждого антитела (т.е. тестируемого антитела и референс-антитела) при пропускании их по покрытой С5 поверхности индивидуально. Если фактически измеренный уровень связывания для смеси оказывается меньше, чем указанный теоретический максимум, то тестируемое антитело и референс-антитело конкурируют друг с другом за связывание с С5. Так, как правило, конкурирующее тестируемое антитело к С5 представляет собой антитело, которое должно связываться с С5 по данным описанного выше BIACORE®-анализа блокирования таким образом, что при проведении анализа и в присутствии референс-антитела к С5 измеренный уровень связывания составляет от 80% до 0,1% (например, от менее чем 80% до 4%) от теоретического максимального уровня связывания, конкретно, от 75% до 0,1% (например, от 75% до 4%) от теоретического максимального уровня связывания, и более конкретно, от 70% до 0,1% (например, от 70% до 4%) от теоретического максимального уровня связывания (как оно определено выше) для комбинации тестируемого антитела и референс-антитела.
В некоторых вариантах осуществления изобретения антитело к С5, предлагаемое в настоящем изобретении, конкурирует за связывание с С5 с антителом, которое содержит пару VH и VL, выбранную из пар VH и VL антител CFA0341 и CFA0330. В некоторых вариантах осуществления изобретения антитело к С5 конкурирует за связывание с С5 с антителом, выбранным из: CFA0538, CFA0501, CFA0599, CFA0307, CFA0366, CFA0675 и CFA0672. В некоторых вариантах осуществления изобретения антитело к С5 конкурирует за связывание с С5 с антителом CFA0329. В некоторых вариантах осуществления изобретения антитело к С5 конкурирует за связывание с С5 с антителом CFA0666.
В некоторых вариантах осуществления изобретения антитело к С5, предлагаемое в настоящем изобретении, конкурирует за связывание с С5 с антителом, содержащим пару VH и VL из антитела CFA0305 или 305LO5.
В других вариантах осуществления изобретения антитело к С5 связывается с С5 с более высокой аффинностью при нейтральном рН, чем при кислом рН. В некоторых вариантах осуществления изобретения антитело к С5, предлагаемое в настоящем изобретении, конкурирует за связывание с С5 с антителом, которое содержит пару VH и VL, выбранную из пар VH и VL CFA0538, CFA0501, CFA0599, CFA0307, CFA0366, CFA0675 и CFA0672. В некоторых вариантах осуществления изобретения антитело к С5 конкурирует за связывание с С5 с антителом CFA0666. В других вариантах осуществления изобретения антитело к С5 связывается с С5 с более высокой аффинностью при рН 7,4, чем при рН 5,8.
В других вариантах осуществления изобретения антитело к С5 связывается с С5 с более высокой аффинностью при нейтральном рН, чем при кислом рН. В некоторых вариантах осуществления изобретения антитело к С5, предлагаемое в настоящем изобретении, конкурирует за связывание с С5 с антителом, которое содержит пару VH и VL из антитела CFA0305 или 305LO5. В других вариантах осуществления изобретения антитело к С5 связывается с С5 с более высокой аффинностью при рН 7,4, чем при рН 5,8.
В некоторых вариантах осуществления изобретения антитело к С5, предлагаемое в настоящем изобретении, конкурирует за связывание с С5 антителом, которое содержит пару VH и VL, выбранную из VH, имеющей SEQ ID NO: 22, и VL, имеющей SEQ ID NO: 26, или VH, имеющей SEQ ID NO: 21, и VL, имеющей SEQ ID NO: 25. В некоторых вариантах осуществления изобретения антитело к С5 конкурирует за связывание с С5 с антителом, которое содержит пару VH и VL, выбранную из: (a) VH, имеющей SEQ ID NO: 5, и VL, имеющей SEQ ID NO: 15; (б) VH, имеющей SEQ ID NO: 4, и VL, имеющей SEQ ID NO: 14; (в) VH, имеющей SEQ ID NO: 6, и VL, имеющей SEQ ID NO: 16; (г) VH, имеющей SEQ ID NO: 2, и VL, имеющей SEQ ID NO: 12; (д) VH, имеющей SEQ ID NO: 3, и VL, имеющей SEQ ID NO: 13; (e) VH, имеющей SEQ ID NO: 1, и VL, имеющей SEQ ID NO: 11; (ж) VH, имеющей SEQ ID NO: 9, и VL, имеющей SEQ ID NO: 19; (з) VH, имеющей SEQ ID NO: 7, и VL, имеющей SEQ ID NO: 17, и (и) VH, имеющей SEQ ID NO: 8, и VL, имеющей SEQ ID NO: 18. В некоторых вариантах осуществления изобретения антитело к С5 конкурирует за связывание с С5 с антителом, которое содержит VH, имеющую SEQ ID NO: 23, и VL, имеющую SEQ ID NO: 27. В некоторых вариантах осуществления изобретения антитело к С5 конкурирует за связывание с С5 с антителом, которое содержит VH, имеющую SEQ ID NO: 7, и VL, имеющую SEQ ID NO: 17.
В некоторых вариантах осуществления изобретения антитело к С5, предлагаемое в настоящем изобретении, конкурирует за связывание с С5 с антителом, которое содержит пару VH и VL, выбранную из: (a) VH, имеющей SEQ ID NO: 1, VL, имеющей SEQ ID NO: 11; (б) VH, имеющей SEQ ID NO: 22, VL, имеющей SEQ ID NO: 26; (в) VH, имеющей SEQ ID NO: 21, и VL, имеющей SEQ ID NO: 25; (г) VH, имеющей SEQ ID NO: 5, и VL, имеющей SEQ ID NO: 15; (д) VH, имеющей SEQ ID NO: 4, VL, имеющей SEQ ID NO: 14; (e) VH, имеющей SEQ ID NO: 6, и VL, имеющей SEQ ID NO: 16; (ж) VH, имеющей SEQ ID NO: 2, VL, имеющей SEQ ID NO: 12; (з) VH, имеющей SEQ ID NO: 3, и VL, имеющей SEQ ID NO: 13; (и) VH, имеющей SEQ ID NO: 9, и VL, имеющей SEQ ID NO: 19; (к) VH, имеющей SEQ ID NO: 7, и VL, имеющей SEQ ID NO: 17; (л) VH, имеющей SEQ ID NO: 8, и VL, имеющей SEQ ID NO: 18; (м) VH, имеющей SEQ ID NO: 23, и VL, имеющей SEQ ID NO: 27, и (н) VH, имеющей SEQ ID NO: 10, и VL, имеющей SEQ ID NO: 20.
В некоторых вариантах осуществления изобретения антитело к С5, предлагаемое в настоящем изобретении, конкурирует за связывание с С5 с антителом, которое содержит пару VH и VL, выбранную из: (a) VH, имеющей SEQ ID NO: 22, и VL, имеющей SEQ ID NO: 26; (б) VH, имеющей SEQ ID NO: 21, и VL, имеющей SEQ ID NO: 25; (в) VH, имеющей SEQ ID NO: 5, и VL, имеющей SEQ ID NO: 15; (г) VH, имеющей SEQ ID NO: 4, и VL, имеющей SEQ ID NO: 14; (д) VH, имеющей SEQ ID NO: 6, и VL, имеющей SEQ ID NO: 16; (e) VH, имеющей SEQ ID NO: 2, и VL, имеющей SEQ ID NO: 12; (ж) VH, имеющей SEQ ID NO: 3, и VL, имеющей SEQ ID NO: 13; (з) VH, имеющей SEQ ID NO: 9, и VL, имеющей SEQ ID NO: 19; (и) VH, имеющей SEQ ID NO: 7, и VL, имеющей SEQ ID NO: 17; (к) VH, имеющей SEQ ID NO: 8, и VL, имеющей SEQ ID NO: 18; (л) VH, имеющей SEQ ID NO: 23, и VL, имеющей SEQ ID NO: 27.
В некоторых вариантах осуществления изобретения антитело к С5, предлагаемое в настоящем изобретении, конкурирует за связывание с С5 с антителом, которое содержит пару VH и VL, выбранную из VH, имеющей SEQ ID NO: 1, и VL, имеющей SEQ ID NO: 11, или VH, имеющей SEQ ID NO: 10, и VL, имеющей SEQ ID NO: 20.
В других вариантах осуществления изобретения антитело к С5 связывается с С5 с более высокой аффинностью при нейтральном рН, чем при кислом рН. В некоторых вариантах осуществления изобретения антитело к С5 связывается с С5 с более высокой аффинностью при нейтральном рН, чем при кислом рН и конкурирует за связывание с С5 с антителом, которое содержит пару VH и VL, выбранную из: (a) VH, имеющей SEQ ID NO: 1, и VL, имеющей SEQ ID NO: 11; (б) VH, имеющей SEQ ID NO: 5, и VL, имеющей SEQ ID NO: 15; (в) VH, имеющей SEQ ID NO: 4, и VL, имеющей SEQ ID NO: 14; (г) VH, имеющей SEQ ID NO: 6, и VL, имеющей SEQ ID NO: 16; (д) VH, имеющей SEQ ID NO: 2, и VL, имеющей SEQ ID NO: 12; (e) VH, имеющей SEQ ID NO: 3, и VL, имеющей SEQ ID NO: 13; (ж) VH, имеющей SEQ ID NO: 9, и VL, имеющей SEQ ID NO: 19; (з) VH, имеющей SEQ ID NO: 7, и VL, имеющей SEQ ID NO: 17; (и) VH, имеющей SEQ ID NO: 8, и VL, имеющей SEQ ID NO: 18, и (к) VH, имеющей SEQ ID NO: 10, и VL, имеющей SEQ ID NO: 20. В других вариантах осуществления изобретения антитело к С5 связывается с С5 с более высокой аффинностью при рН 7,4, чем при рН 5,8.
В некоторых вариантах осуществления изобретения антитело к С5 связывается с С5 с более высокой аффинностью при нейтральном рН, чем при кислом рН, и конкурирует за связывание с С5 с антителом, которое содержит пару VH и VL, выбранную из: (a) VH, имеющей SEQ ID NO: 5, и VL, имеющей SEQ ID NO: 15; (б) VH, имеющей SEQ ID NO: 4, и VL, имеющей SEQ ID NO: 14; (в) VH, имеющей SEQ ID NO: 6, и VL, имеющей SEQ ID NO: 16; (г) VH, имеющей SEQ ID NO: 2, и VL, имеющей SEQ ID NO: 12; (д) VH, имеющей SEQ ID NO: 3, и VL, имеющей SEQ ID NO: 13; (e) VH, имеющей SEQ ID NO: 1, и VL, имеющей SEQ ID NO: 11; (ж) VH, имеющей SEQ ID NO: 9, и VL, имеющей SEQ ID NO: 19; (з) VH, имеющей SEQ ID NO: 7, и VL, имеющей SEQ ID NO: 17, и (и) VH, имеющей SEQ ID NO: 8, и VL, имеющей SEQ ID NO: 18. В других вариантах осуществления изобретения антитело к С5 связывается с С5 с более высокой аффинностью при рН 7,4, чем при рН 5,8.
В некоторых вариантах осуществления изобретения антитело к С5 связывается с С5 с более высокой аффинностью при нейтральном рН, чем при кислом рН, и конкурирует за связывание с С5 с антителом, которое содержит пару VH и VL, выбранную из VH, имеющей SEQ ID NO: 1, и VL, имеющей SEQ ID NO: 11, или VH, имеющей SEQ ID NO: 10, и VL, имеющей SEQ ID NO: 20. В других вариантах осуществления изобретения антитело к С5 связывается с С5 с более высокой аффинностью при рН 7,4, чем при рН 5,8.
В некоторых вариантах осуществления изобретения можно определять, связывается ли антитело к С5, предлагаемое в настоящем изобретении, с определенным эпитопом, следующим образом: осуществляют экспрессию имеющих точечную мутацию мутантов С5, в которых аминокислота (за исключением аланина) в С5 заменена на аланин, в клетках линии 293 и оценивают связывание антитела к С5 с мутантами С5 методом ELISA, вестерн-блоттинга или BIACORE®; при этом существенное снижение или устранение связывания антитела к С5 с мутантом С5 по сравнению со связыванием с С5 дикого типа свидетельствует о том, что антитело к С5 связывается с эпитопом, содержащим указанную аминокислоту в С5. В некоторых вариантах осуществления изобретения аминокислоту в С5, подлежащую замене на аланин, выбирают из группы, состоящей из Glu48, Asp51, His70, His72, Lys109 и His110 бета-цепи C5 (SEQ ID NO: 40). В других вариантах осуществления изобретения аминокислота в С5, подлежащая замене на аланин представляет собой Asp51 или Lys109 бета-цепи С5 (SEQ ID NO: 40).
В другом варианте осуществления изобретения можно определять, связывается ли характеризующееся рН-зависимым связыванием антитело к С5, с определенным эпитопом, следующим образом: осуществляют экспрессию имеющих точечную мутацию мутантов С5, в которых остаток гистидина в С5 заменен на другую аминокислоту (например, на тирозин), в клетках линии 293 и оценивают связывание антитела к С5 с мутантами С5 методом ELISA, вестерн-блоттинга или BIACORE®; при этом существенное снижение связывания антитела к С5 с С5 дикого типа при кислом рН по сравнению с его связыванием с мутантом С5 при кислом рН, свидетельствует о том, что антитело к С5 связывается с эпитопом, содержащим указанный остаток гистидина на С5. В других вариантах осуществления изобретения связывание антитела к С5 с С5 дикого типа при нейтральном рН не снижается существенно по сравнению с его связыванием с мутантом С5 при нейтральном рН. В некоторых вариантах осуществления изобретения остаток гистидина в С5, подлежащий замене на другую аминокислоту, выбирают из группы, которая состоит из His70, His72 и His110 бета-цепи С5 (SEQ ID NO: 40). В следующем варианте осуществления изобретения остаток гистидина His70 заменяют на тирозин.
2. Анализы активности
Одним из объектов изобретения являются анализы, предназначенные для идентификации антител к С5, которые обладают биологической активностью. Биологическая активность может включать, например, ингибирование активации С5, предупреждение расщепления С5 с образованием С5а и C5b, блокирование доступа С5-конвертазы к сайту расщепления на С5, блокирование гемолитической активности, вызываемой активацией С5, и т.д. Предложены также антитела, обладающие указанной биологической активностью in vivo и/или in vitro.
В некоторых вариантах осуществления изобретения антитело, предлагаемое в изобретении, тестируют в отношении указанной биологической активности.
В некоторых вариантах осуществления изобретения определение того, ингибирует ли тестируемое антитело расщепление С5 с образованием С5а и C5b, осуществляют с помощью методов, описанных, например, у Isenman и др., J Immunol. 124(1), 1980, cc. 326-331. В другом варианте осуществления изобретения, это определяют с помощью методов, позволяющих специфически обнаруживать отщепленные белки С5а и/или C5b, например, с помощью вариантов ELISA или вестерн-блоттинга. Если в присутствии тестируемого антитела (или после контакта с ним) обнаруживают пониженное количество продукта расщепления С5 (т.е. С5а и/или C5b), то тестируемое антитело идентифицируют как антитело, которое может ингибировать расщепление С5. В некоторых вариантах осуществления изобретения концентрацию и/или физиологическую активность С5а можно измерять с помощью таких методов, как, например, хемотаксический анализ, РИА, или ELISA (см., например, у Ward и Zvaifler J. Clin. Invest. 50(3), 1971, cc. 606-616).
В некоторых вариантах осуществления изобретения определение того, блокирует ли тестируемое антитело доступ С5-конвертазы к С5, осуществляют с помощью методов, позволяющих обнаруживать белковые взаимодействия между С5-конвертазой и С5, например, ELISA или BIACORE®. Если в присутствии тестируемого антитела (или после контакта с ним) имеет место снижение взаимодействий, то тестируемое антитело идентифицируют как антитело, которое может блокировать доступ С5-конвертазы к С5.
В некоторых вариантах осуществления изобретения активность С5 можно оценивать по его способности осуществлять лизис клеток в общей воде индивидуума. Способность С5 осуществлять лизис клеток или ее снижение можно оценивать с помощью методов, хорошо известных в данной области, например, с помощью стандартного гемолитического анализа, такого как гемолитический анализ, описанный в Experimental Immunochemistry, под ред. Kabat и Mayer, 2-е изд., 135-240, изд-во CC Thomas, Springfield, IL, 1961, cc. 135-139, или стандартного варианта этого анализа, такого как метод гемолиза куриных эритроцитов, описанный, например, у Hillmen и др., N. Engl. J. Med. 350(6), 2004, cc. 552-559. В некоторых вариантах осуществления изобретения активность С5 или ее ингибирование оценивают количественно с помощью CH50eq-анализа. CH50eq-анализ представляет собой метод измерения общей активности классического пути комплемента в сыворотке. Этот тест представляет собой анализ литической активности, в котором используют сенсибилизированные антителом эритроциты в качестве активатора классического пути комплемента и применяют различные разведения тестируемой сыворотки для определения количества, необходимого для обеспечения 50%-ного лизиса (СН50). Процент гемолиза можно определять, например, с использованием спектрофотометра. CH50eq-анализ представляет собой средство косвенного измерения образования комплекса терминальных компонентов комплемента (ТСС), поскольку сами ТСС непосредственно ответственны за измеряемый гемолиз. Ингибирование активации С5 можно обнаруживать и/или измерять с помощью методов, изложенных и проиллюстрированных в экспериментальных примерах. Применяя анализы указанных или других пригодных типов, можно осуществлять скрининг антител-кандидатов, обладающих способностью ингибировать активацию С5. В некоторых вариантах осуществления изобретения ингибирование активации С5 включает снижение активации С5 по данным анализа по меньшей мере на 5%, 10%, 15%, 20%, 25%, 30%, 35% или 40%, или более по сравнению с воздействием отрицательного контроля в сходных условиях. В некоторых вариантах осуществления изобретения оно относится к ингибированию активации С5 по меньшей мере на 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90% или 95%, или более.
Г. Иммуноконъюгаты
В изобретении предложены также иммуноконъюгаты, содержащие антитело С5, представленное в настоящем описании, конъюгированное с одним или несколькими цитотоксическими агентами, такими как химиотерапевтические агенты или лекарственные средства, ингибирующие рост агенты, токсины (например, белковые токсины, обладающие ферментативной активностью токсины бактериального, грибного, растительного или животного происхождения или их фрагменты) или радиоактивные изотопы.
В одном из вариантов осуществления изобретения иммуноконъюгат представляет собой конъюгат антитело-лекарственное средство (ADC), в котором антитело конъюгировано с одним или несколькими лекарственными средствами, включая (но, не ограничиваясь только ими) майтансиноид (см. US №№5208020, 5416064 и ЕР 0425235 В1); ауристатин, например, фрагменты DE и DF монометилауристатина (ММАЕ и MMAF) (см. US №№5635483, 5780588 и 7498298); доластатин; калихеамицин или его производные (см. US №№5712374, 5714586, 5739116, 5767285, 5770701, 5770710, 5773001 и 5877296; Hinman и др., Cancer Res. 53, 1993, cc. 3336-3342; и Lode и др., Cancer Res. 58, 1998, cc. 2925-2928); антрациклин, такой как дауномицин или доксорубицин (см. Kratz и др., Curr. Med. Chem. 13, 2006, cc. 477-523; Jeffrey и др., Bioorg. Med. Chem. Lett. 16, 2006, cc. 358-362; Torgov и др., Bioconjug. Chem. 16, 2005, cc. 717-721; Nagy и др., Proc. Natl. Acad. Sci. USA 97, 2000, cc. 829-834; Dubowchik и др., Bioorg. & Med. Chem. Letters 12, 2002, cc. 1529-1532; King и др., J. Med. Chem. 45, 2002, cc. 4336-4343; и US №6630579); метотрексат; виндесин; таксан, такой как доцетаксел, паклитаксел, ларотаксел, тесетаксел и ортатаксел; трихотецен и СС1065.
В другом варианте осуществления изобретения иммуноконъюгат содержит антитело, представленное в настоящем описании, конъюгированное с обладающим ферментативной активностью токсином или его фрагментом, включая (но, не ограничиваясь только ими) А-цепь дифтерийного токсина, несвязывающиеся активные фрагменты дифтерийного токсина, А-цепь экзотоксина (из Pseudomonas aeruginosa), А-цепь рицина, А-цепь абрина, А-цепь модецина, альфа-сарцин, белки Aleurites fordii, диантиновые белки, белки Phytolaca americana (PAPI, PAPII и PAP -5), ингибитор из Momordica charantia, курцин, кротин, ингибитор из Sapaonaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин и трихотецены.
В другом варианте осуществления изобретения иммуноконъюгат содержит антитело, представленное в настоящем описании, конъюгированное с радиоактивным атомом с образованием радиоконъюгата. Широкое разнообразие радиоактивных изотопов можно применять для получения радиоконъюгатов.
Примеры включают 211At, 131I, 125I, 90Y, 186Re, 188Re, 153Sm, 212Bi, 32P, 212Pb и радиоактивные изотопы Lu. Когда радиоконъюгат применяют для детекции, то он может содержать радиоактивный атом для сцинтиграфических исследований, например, TC99m или I123, или спиновую метку для визуализации методом ядерного магнитного резонанса (ЯМР) (известный также как магнитно-резонансная визуализация, МРВ), такую как йод-123, иод-131, индий-111, фтор-19, углерод-13, азот-15, кислород-17, гадолиний, марганец или железо.
Конъюгаты антитела и цитотоксического агента можно получать с использованием широкого разнообразия бифункциональных связывающих белки агентов, таких как N-сукцинимидил-3-(2-пиридилдитио)пропионат (SPDP), сукцинимидил-4-(N-малеимидометил)циклогексан-1-карбоксилат (SMCC), иминотиолан (IT), бифункциональные производные сложных имидоэфиров (такие как диметиладипимидат × HLC), активные сложные эфиры (такие как дисукцинимидилсуберат), альдегиды (такие как глутаровый альдегид), бисазидопроизводные (такие как бис(пара-азидобензоил)гександиамин), производные бисдиазония (такие как бис(пара-диазониумбензоил)этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат), и обладающие двойной активностью фторсодержащие соединения (такие как 1,5-дифтор-2,4-динитробензол). Например, иммунотоксин рицин можно получать согласно методу, описанному у Vitetta и др., Science 238, 1987, cc. 1098-1104. Меченная с помощью С14 1-изотиоцианатбензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) является примером хелатирующего агента, применяемого для конъюгации радионуклеотида с антителом (см. WO 94/11026). Линкер может представлять собой «расщепляемый линкер», облегчающий высвобождение цитотоксического лекарственного средства. Например, можно использовать неустойчивый в кислой среде линкер, чувствительный к действию пептидаз линкер, фотолабильный линкер, диметильный линкер или содержащий дисульфид линкер (Chari и др., Cancer Res. 52, 1992, cc. 127-131; US №5208020).
В контексте настоящего описания под иммуноконъюгатами или ADC подразумеваются (но, не ограничиваясь только ими) указанные конъюгаты, полученные с использованием перекрестносшивающих реагентов, которые включают (но, не ограничиваясь только ими) BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, МРВН, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, сульфо-EMCS, сульфо-GMBS, сульфо-KMUS, сульфо-MBS, сульфо-SIAB, сульфо-SMCC и сульфо-SMPB, а также SVSB (сукцинимидил(4-винилсульфон)бензоат), которые поступают в продажу (например, от фирмы Pierce Biotechnology, Inc., Рокфорд, шт. Иллинойс, США).
Д. Способы и композиции для диагностирования и обнаружения
В некоторых вариантах осуществления изобретения любое из антител к С5, представленных в настоящем описании, можно применять для обнаружения присутствия С5 в биологическом образце. Понятие «обнаружение (детекция)» в контексте настоящего описания предусматривает количественное или качественное обнаружение. В одном из вариантов осуществления изобретения биологический образец содержит клетку или ткань, например, сыворотку, цельную кровь, плазму, полученный с помощью биопсии образец, образец ткани, клеточную суспензию, слюну, мокроту, оральную жидкость, спинномозговую жидкость, амниотическую жидкость, асцитную жидкость, молоко, молозиво, секрет молочных желез, лимфу, мочу, пот, слезную жидкость, желудочный сок, синовиальную жидкость, перитонеальную жидкость, жидкость хрусталика глаза или слизь.
Одним из вариантов осуществления изобретения является антитело к С5, представленное в настоящем описании, для применения в способе диагностирования или обнаружения. Другой объект изобретения относится к способу обнаружения присутствия С5 в биологическом образце. В другом варианте осуществления изобретения способ включает приведение в контакт биологического образца с антителом к С5, представленным в настоящем описании, в условиях, обеспечивающих связывание антитела к С5 с С5, и выявление образования комплекса между антителом к С5 и С5. Указанный способ может представлять собой способ in vitro или in vivo. В одном из вариантов осуществления изобретения антитело к С5 применяют для отбора индивидуумов, которых можно лечить с помощью антитела к С5, например, когда С5 является биомаркером для отбора пациентов.
Другим вариантом осуществления изобретения является способ отбора индивидуума, имеющего опосредуемое комплементом заболевание или состояние, которое включает избыточную или неконтролируемую активацию С5, в качестве пригодного для терапии, включающей антитело к С5, предлагаемое в настоящем изобретении. В некоторых вариантах осуществления изобретения способ включает (а) детекцию генетической вариации в С5, полученном из индивидуума, и (б) отбор индивидуума в качестве пригодного для терапии, включающей антитело к С5, предлагаемое в настоящем изобретении, когда генетическая вариация обнаружена в С5, полученном из индивидуума. Другим вариантом осуществления изобретения является способ выбора терапии для индивидуума, имеющего опосредуемое комплементом заболевание или состояние, которое включает избыточную или неконтролируемую активацию С5. В некоторых вариантах осуществления изобретения способ включает (а) детекцию генетической вариации в С5, полученном из индивидуума, и (б) выбор терапии, включающей антитело к С5, предлагаемое в настоящем изобретении, для индивидуума, когда генетическая вариация обнаружена в С5, полученном из индивидуума.
Другим вариантом осуществления изобретения является способ лечения индивидуума, имеющего опосредуемое комплементом заболевание или состояние, которое включает избыточную или неконтролируемую активацию С5. В некоторых вариантах осуществления изобретения способ включает (а) детекцию генетической вариации в С5, полученном из индивидуума, (б) отбор индивидуума в качестве пригодного для терапии, включающей антитело к С5, предлагаемое в настоящем изобретении, когда генетическая вариация обнаружена в С5, полученном из индивидуума, и (в) введение индивидууму антитела к С5, предлагаемого в настоящем изобретении.
Другим вариантом осуществления изобретения является антитело к С5, предлагаемое в настоящем изобретении, предназначенное для применения для лечения индивидуума, имеющего опосредуемое комплементом заболевание или состояние, которое включает избыточную или неконтролируемую активацию С5. В некоторых вариантах осуществления изобретения индивидуума лечат антителом к С5, предлагаемым в настоящем изобретении, когда генетическая вариация обнаружена в С5, полученном из индивидуума.
Другим вариантом осуществления изобретения является применение in vitro генетической вариации в С5 для отбора индивидуума, имеющего опосредуемое комплементом заболевание или состояние, которое включает избыточную или неконтролируемую активацию С5, в качестве пригодного для терапии, включающей антитело к С5, предлагаемое в настоящем изобретении. В некоторых вариантах осуществления изобретения индивидуума выбирают в качестве пригодного для терапии, когда генетическая вариация обнаружена в С5, полученном из индивидуума. Другим вариантом осуществления изобретения является применение in vitro генетической вариации в С5 для выбора терапии для индивидуума, имеющего опосредуемое комплементом заболевание или состояние, которое включает избыточную или неконтролируемую активацию С5. В некоторых вариантах осуществления изобретения терапию, включающую антитело к С5, предлагаемое в настоящем изобретении, выбирают для индивидуума, когда генетическая вариация обнаружена в С5, полученном из индивидуума.
Установлено, что некоторые пациенты, имеющие генетическую вариацию в С5, дают слабый ответ на терапию, включающую существующие антитела к С5 (Nishimura и др., N. Engl. J. Med. 370, 2014, сс. 632-639). Рекомендовано лечить указанного пациента с использованием терапии, включающей антитело к С5, предлагаемое в настоящем изобретении, поскольку такое антитело обладает ингибирующей активностью в отношении активации вариантов С5, а также С5 дикого типа, что продемонстрировано ниже в экспериментальных примерах.
Детекцию генетической вариации в С5 можно осуществлять с использованием метода, известного из существующего уровня техники. Указанный метод включает секвенирование, ПЦР, ОТ-ПЦР и метод на основе гибридизации, такой как саузерн-блоттинг или нозерн-блоттинг (но, не ограничиваясь только ими). Варианты С5 могут содержать по меньшей мере одну генетическую вариацию. Генетическую вариацию можно выбирать из группы, состоящей из V145I, R449G, V802I, R885H, R928Q, D966Y, S1310N и E1437D. В настоящем описании, например, R885H обозначает генетическую вариацию, при которой аргинин в положении 885 заменен на гистидин. В некоторых вариантах осуществления изобретения вариант С5 обладает биологической активностью, сходной с активностью С5 дикого типа.
Примеры нарушений, которые можно диагностировать с использованием антитела, предлагаемого в изобретении, включают ревматоидный артрит (RA); системную красную волчанку (SLE); волчаночный нефрит; повреждение, вызываемое ишемией-реперфузией; астму, пароксизмальную ночную гемоглобинурию (PNH); гемолитико-уремический синдром (HUS) (например, атипичный гемолитико-уремический синдром (aHUS); =болезнь плотных депозитов (DDD); нейромиелит зрительного нерва (NMO); мультифокальную моторную невропатию (MMN); рассеянный склероз (MS); системный склероз; дегенерацию желтого пятна (например, возрастную дегенерацию желтого пятна (AMD)); синдром: гемолиз, повышение активности ферментов печени и тромбоцитопения (HELLP); тромботическую тромбоцитопеническую пурпуру (ТТР); спонтанную потерю плода; буллезный эпидермолиз; повторную потерю плода; преэкламсию; =травматическое повреждение головного мозга; тяжелую псевдопаралитическую миастению; холодовую агглютининовую болезнь; синдром Шегрена; дерматомиозит; буллезный пемфигоид; фототоксические реакции; связанный с продуцируемым Е. coli токсином Шига гемолитико-уремический синдром; типичный или инфекционный гемолитико-уремический синдром (tHUS); С3-гломерулонефрит; ассоциированный с антинейтрофильным цитоплазматическим антителом (ANCA) васкулит; гуморальное и сосудистое отторжение трансплантата; острое опосредуемое антителом отторжение (AMR); дисфункция трансплантата; инфаркт миокарда; аллогенный трансплантат; сепсис; болезнь коронарной артерии; наследственный ангионевротический отек; дерматомиозит; болезнь Грейвса; атеросклероз; болезнь Альцгеймера (AD); болезнь Гентингтона; болезнь Крейтцфельдта-Якоба; болезнь Паркинсона; раки; раны; септический шок; поражение спинного нерва; увеит; связанные с диабетом глазные болезни; ретинопатию недоношенных; гломерулонефрит; мембранный нефрит; ассоциированную с иммуноглобулином А нефропатию; респираторный диспресс-синдром взрослых (ARDS); хроническое обструктивное заболевание легких (COPD); муковисцидоз; гемолитическую анемию; пароксизмальную холодовую гемоглобинурию; анафилактический шок; аллергию; остеопороз; остеоартрит; тиреоидит Хашимото; диабет типа I; псориаз; пузырчатку; аутоиммунную гемолитическую анемию (AIHA); идиопатическую тромбоцитопеническую пурпуру (ITP); синдром Гудпасчера; болезнь Дегоса; антифосфолипидный синдром (APS); катастрофический APS (CAPS); сердечнососудистое нарушение; миокардит; нарушение мозгового кровообращения; заболевание периферических сосудов; реноваскулярное нарушение; заболевание мезентериальных /энтериальных сосудов; васкулит; нефрит при пурпуре Геноха-Шенлейна; болезнь Такаяси; дилатирующую кардиомиопатию; диабетическую ангиопатию; болезнь Кавасаки (артерит); венозную воздушную эмболию (VGE), рестеноз после стентирования; ротационную атерэктомию; мембранозную нефропатию; синдром Гийена-Барре (GBS); синдром Фишера; индуцированный антигеном артрит; синовиальное воспаление; вирусные инфекции; бактериальные инфекции; грибные инфекции; и_повреждение, обусловленное инфарктом миокарда, сердечно-легочным шунтированием и гемодиализом.
Некоторыми вариантами осуществления изобретения являются меченые антитела к С5. Метки включают (но, не ограничиваясь только ими) метки или фрагменты, которые можно обнаруживать непосредственно (такие как флуоресцентные, хромофорные, электронноплотные, хемилюминесцентые и радиоактивные метки), а также фрагменты, такие как ферменты или лиганды, которые подлежат косвенному обнаружению, например, посредством ферментативной реакции или молекулярного взаимодействия. Примеры меток включают (но, не ограничиваясь только ими) радиоизотопы 32Р, 14С, 125I, 3Н и 131I, флуорофоры, такие как хелаты редкоземельных металлов или флуоресцеин и его производные, родамин и его производные, дансил, умбеллиферон, люциферазы, например, люцифераза светляка и бактериальная люцифераза (US №4737456), люциферин, 2,3-дигидрофталазиндионы, пероксидаза из хрена (HRP), щелочная фосфатаза, β-галактозидаза, глюкоамилаза, лизоцим, оксидазы сахаридов, например, глюкозооксидаза, галактозооксидаза и глюкозо-6-фосфатдегидрогеназа, гетероциклические оксидазы, такие как уриказа и ксантиноксидаза, сшитые с ферментом, который использует пероксид водорода для окисления предшественника красителя, такого как HRP, лактопероксидаза или микропероксидаза, биотин/авидин, спиновые метки, метки в виде бактериофагов, стабильные свободные радикалы и т.п.
Е. Фармацевтические композиции
Фармацевтические композиции антитела к С5, представленного в настоящем описании, получают путем смешения указанного антитела, имеющего необходимую степень чистоты, с одним или несколькими необязательными фармацевтически приемлемыми носителями (Remington's Pharmaceutical Sciences, 16-е изд. под ред. Osol А., 1980) в форме лиофилизированных композиций или водных растворов. Фармацевтически приемлемые носители, как правило, являются нетоксичными для реципиентов в используемых дозах и концентрациях, они включают (но, не ограничиваясь только ими): буферы, такие как фосфатный, цитратный буферы, а также буферы на основе других органических кислот; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как хлорид октадецилдиметилбензиламмония; хлорид гексаметония; хлорид бензалкония; хлорид бензетония; фенол; бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол и мета-крезол); полипептиды с низкой молекулярной массой (содержащие менее приблизительно 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поли(винилпирролидон); аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТК; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; содержащие металл комплексы (например, комплексы Zn-белок); и/или неионогенные поверхностно-активные вещества, такие как полиэтиленгликоль (ПЭГ). В контексте настоящего описания примеры фармацевтически приемлемых носителей включают также диспергирующие агенты интерстициальных лекарственных средств, такие как растворимые активные в нейтральной среде гликопротеины гиалуронидаз (sHASEGP), например, человеческие растворимые гликопротеины гиалуронидазы РН-20, такие как rHuPH20 (HYLENEX®, фирма Baxter International, Inc.). Некоторые примеры sHASEGP и методы их применения, в том числе rHuPH20, описаны в публикациях патентов США №№2005/0260186 и 2006/0104968. Согласно одному из объектов изобретения sHASEGP объединяют с одним или несколькими дополнительными гликозаминогликаназами, такими как хондроитиназы.
Примеры лиофилизированных композиций антител описаны в US №6267958. Водные композиции антител включают композиции, описанные в US №6171586 и WO 2006/044908, последние композиции включают гистидин-ацетатный буфер.
Композиция, предлагаемая в изобретении, может содержать также более одного действующего вещества, если это необходимо для конкретного подлежащего лечению показания, предпочтительно вещества с дополнительными видами активности, которые не оказывают отрицательного воздействия друг на друга. Такие действующие вещества должны присутствовать в комбинации в количествах, эффективных для достижения поставленной цели.
Действующие вещества можно включать также в микрокапсулы, например, полученные с помощью методов коацервации или межфазной полимеризации, например в гидроксиметилцеллюлозные или желатиновые микрокапсулы и поли(метилметакрилатные) микрокапсулы соответственно, в коллоидные системы введения лекарственного средства (например в липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методы описаны в Remington's Pharmaceutical Sciences, 16-е изд., под ред. Osol А., 1980.
Можно приготавливать препараты с замедленным высвобождением. Приемлемыми примерами препаратов с замедленным высвобождением являются полупроницаемые матрицы из твердых гидрофобных полимеров, включающие антитело или конъюгат, такие матрицы представляют собой изделия определенной формы, например, пленки или микрокапсулы.
Композиции, предназначенные для применения in vivo, как правило, должны быть стерильными. Стерильность можно легко обеспечивать, например, путем фильтрации через стерильные фильтрующие мембраны.
Ж. Терапевтические способы и композиции
Любое из антител к С5, представленных в настоящем описании, можно применять в терапевтических способах.
Одним из объектов изобретения является антитело к С5, предназначенное для применения в качестве лекарственного средства. Другие объекты изобретения относятся к антителу к С5, предназначенному для применения для лечения опосредуемого комплементом заболевания или состояния, которое включает избыточную или неконтролируемую активацию С5. Некоторые варианты осуществления изобретения относятся к антителу к С5, предназначенному для применения в способе лечения. Некоторые варианты осуществления изобретения относятся к антителу к С5, предназначенному для применения в способе лечения индивидуума, который имеет опосредуемое комплементом заболевание или состояние, которое включает избыточную или неконтролируемую активацию С5, включающем введение индивидууму в эффективном количестве антитела С5. В одном из указанных вариантов осуществления изобретения способ включает введение индивидууму в эффективном количестве по меньшей мере одного дополнительного терапевтического средства. «Индивидуум» в контексте любого из указанных выше вариантов осуществления изобретения предпочтительно представляет собой человека.
Когда антиген представляет собой растворимый белок, то связывание антитела с антигеном может приводить к удлиненному времени полужизни антигена в плазме (т.е. снижению клиренса антигена из плазмы), поскольку само антитело обладает более продолжительным временем полужизни и служит в качестве носителя для антигена. Это является следствием опосредуемого FcRn рециклинга комплекса антиген-антитело посредством эндосомального пути в клетке (Roopenian, Nat. Rev. Immunol. 7(9), 2007, сс. 715-725). Однако ожидается, что антитело с рН-зависимыми характеристиками связывания, которое связывается со своим антигеном в нейтральном внеклеточном окружении, высвобождаясь при этом в кислые условия эндосомальных компартментов после проникновения в клетки, должно обладать улучшенными свойствами с позиции нейтрализации и клиренса антигена относительно его аналога, связывающегося независимым от рН образом (Igawa и др., Nat. Biotech.. 28(11), 2010, сс. 1203-1207; Devanaboyina и др., mAbs 5(6), 2013, сс. 851-859; WO 2009/125825).
Следующими вариантами осуществления изобретения является антитело к С5, предназначенное для применения для усиления клиренса С5 из плазмы. Некоторыми вариантами осуществления изобретения является антитело к С5, предназначенное для применения в способе усиления клиренса С5 из плазмы у индивидуума, включающем введение индивидууму в эффективном количестве антитела к С5 для усиления клиренса С5 из плазмы. В одном из вариантов осуществления изобретения антитело к С5 повышает клиренс С5 из плазмы по сравнению с каноническим антителом к С5, которое не обладает рН-зависимыми характеристиками связывания. «Индивидуум» в контексте любого из указанных выше вариантов осуществления изобретения предпочтительно представляет собой человека.
Следующими вариантами осуществления изобретения является антитело к С5, предназначенное для применения для подавления накопления С5 в плазме. Некоторыми вариантами осуществления изобретения является антитело к С5, предназначенное для применения в способе подавления накопления С5 в плазме у индивидуума, включающем введение индивидууму в эффективном количестве антитела к С5 для подавления накопления С5 в плазме. В одном из вариантов осуществления изобретения накопление С5 в плазме является результатом образования комплекса антиген-антитело. В другом варианте осуществления изобретения антитело к С5 подавляет накопление С5 в плазме по сравнению с каноническим антителом к С5, которое не обладает рН-зависимыми характеристиками связывания. «Индивидуум» в контексте любого из указанных выше вариантов осуществления изобретения предпочтительно представляет собой человека.
Антитело к С5, предлагаемое в настоящем изобретении, может ингибировать активацию С5. Другими вариантами осуществления изобретения является антитело к С5, предназначенное для применения для ингибирования активации С5. Некоторыми вариантами осуществления изобретения является антитело к С5, предназначенное для применения в способе ингибирования активации С5 у индивидуума, включающем введение индивидууму в эффективном количестве антитела к С5 для ингибирования активации С5. В одном из вариантов осуществления изобретения цитотоксичность, опосредуемую С5, подавляют путем ингибирования активации С5. «Индивидуум» в контексте любого из указанных выше вариантов осуществления изобретения предпочтительно представляет собой человека.
Следующим объектом изобретения является применение антитела к С5 для приготовления или получения лекарственного средства. В одном из вариантов осуществления изобретения лекарственное средство предназначено для лечения опосредуемого комплементом заболевания или состояния, которое включает избыточную или неконтролируемую активацию С5. В другом варианте осуществления изобретения лекарственное средство применяют в способе лечения опосредуемого комплементом заболевания или состояния, которое включает избыточную или неконтролируемую активацию С5,_включающем введение индивидууму, имеющему опосредуемое комплементом заболевание или состояние, которое включает избыточную или неконтролируемую активацию С5, в эффективном количестве лекарственного средства. В одном из указанных вариантов осуществления изобретения способ включает также введение индивидууму в эффективном количестве по меньшей мере одного дополнительного терапевтического средства. «Индивидуум» в контексте любого из указанных выше вариантов осуществления изобретения предпочтительно представляет собой человека.
В следующем варианте осуществления изобретения лекарственное средство предназначено для усиления клиренса С5 из плазмы. В другом варианте осуществления изобретения лекарственное средство предназначено для применения в способе усиления клиренса С5 из плазмы у индивидуума, включающем введение индивидууму в эффективном количестве лекарственного средства для усиления клиренса С5 из плазмы. В одном из вариантов осуществления изобретения антитело к С5 повышает клиренс С5 из плазмы по сравнению с каноническим антителом к С5, которое не обладает рН-зависимыми характеристиками связывания. «Индивидуум» в контексте любого из указанных выше вариантов осуществления изобретения может представлять собой человека.
В следующем варианте осуществления изобретения лекарственное средство предназначено для подавления накопления С5 в плазме. В следующем варианте осуществления изобретения лекарственное средство предназначено для применения в способе подавления накопления С5 в плазме у индивидуума, включающем введение индивидууму в эффективном количестве лекарственного средства для подавления накопления С5 в плазме. В одном из вариантов осуществления изобретения накопление С5 в плазме является результатом образования комплекса антиген-антитело. В другом варианте осуществления изобретения антитело к С5 подавляет накопление С5 в плазме по сравнению с каноническим антителом к С5, которое не обладает рН-зависимыми характеристиками связывания. «Индивидуум» в контексте любого из указанных выше вариантов осуществления изобретения может представлять собой человека.
Антитело к С5, предлагаемое в настоящем изобретении, может ингибировать активацию С5. В другом варианте осуществления изобретения лекарственное средство предназначено для применения для ингибирования активации С5. В другом варианте осуществления изобретения лекарственное средство предназначено для применения в способе ингибирования активации С5 у индивидуума, включающем введение индивидууму в эффективном количестве лекарственного средства для ингибирования активации С5 В одном из вариантов осуществления изобретения цитотоксичность, опосредуемую С5, подавляют путем ингибирования активации С5. «Индивидуум» в контексте любого из указанных выше вариантов осуществления изобретения может представлять собой человека.
Другим объектом изобретения является способ лечения опосредуемого комплементом заболевания или состояния, которое включает избыточную или неконтролируемую активацию С5. В одном из вариантов осуществления изобретения способ включает введение индивидууму, имеющему указанное опосредуемое комплементом заболевание или состояние, которое включает избыточную или неконтролируемую активацию С5, в эффективном количестве антитела к С5, представленного в настоящем описании. В одном из вариантов осуществления изобретения способ включает также введение индивидууму в эффективном количестве по меньшей мере одного дополнительного терапевтического средства. «Индивидуум» в контексте любого из указанных выше вариантов осуществления изобретения может представлять собой человека.
Следующим объектом изобретения является способ усиления клиренса С5 из плазмы у индивидуума. В одном из вариантов осуществления изобретения способ включает введение индивидууму в эффективном количестве антитела к С5 для усиления клиренса С5 из плазмы. В одном из вариантов осуществления изобретения антитело к С5 повышает клиренс С5 из плазмы по сравнению с каноническим антителом к С5, которое не обладает рН-зависимыми характеристиками связывания. В одном из вариантов осуществления изобретения «индивидуум» представляет собой человека.
Следующим объектом изобретения является способ подавления накопления С5 в плазме у индивидуума. В одном из вариантов осуществления изобретения способ включает введение индивидууму в эффективном количестве антитела к С5 для подавления накопления С5 в плазме. В одном из вариантов осуществления изобретения накопление С5 в плазме является результатом образования комплекса антиген-антитело. В другом варианте осуществления изобретения антитело к С5 подавляет накопление С5 в плазме по сравнению с каноническим антителом к С5, которое не обладает рН-зависимыми характеристиками связывания. В одном из вариантов осуществления изобретения «индивидуум» представляет собой человека.
Антитело к С5, предлагаемое в настоящем изобретении, может ингибировать активацию С5. Другим объектом изобретения является способ ингибирования активации С5 у индивидуума. В одном из вариантов осуществления изобретения способ включает введение индивидууму в эффективном количестве антитела к С5 для ингибирования активации С5. В одном из вариантов осуществления изобретения цитотоксичность, опосредуемую С5, подавляют путем ингибирования активации С5. В одном из вариантов осуществления изобретения «индивидуум» представляет собой человека.
Другим объектом изобретения являются фармацевтические композиции, содержащие любое из антител к С5, представленных в настоящем описании, которые предназначены, например, для применения в любом из указанных выше терапевтических способов. В одном из вариантов осуществления изобретения фармацевтическая композиция содержит любое из антител к С5, представленных в настоящем описании, и фармацевтически приемлемый носитель. В другом варианте осуществления изобретения фармацевтическая композиция содержит любое из антител к С5, представленных в настоящем описании, и по меньшей мере одно дополнительное терапевтическое средство.
Следующим объектом изобретения является фармацевтическая композиция, предназначенная для лечения опосредуемого комплементом заболевания или состояния, которое включает избыточную или неконтролируемую активацию С5. В следующем варианте осуществления изобретения фармацевтическая композиция предназначена для усиления клиренса С5 из плазмы. В одном из вариантов осуществления изобретения антитело к С5 повышает клиренс С5 из плазмы по сравнению с каноническим антителом к С5, которое не обладает рН-зависимыми характеристиками связывания. В следующем варианте осуществления изобретения фармацевтическая композиция предназначена для подавления накопления С5 в плазме. В одном из вариантов осуществления изобретения накопление С5 в плазме является результатом образования комплекса антиген-антитело. В другом варианте осуществления изобретения антитело к С5 подавляет накопление С5 в плазме по сравнению с каноническим антителом к С5, которое не обладает рН-зависимыми характеристиками связывания. Антитело к С5, предлагаемое в настоящем изобретении, может ингибировать активацию С5. В следующем варианте осуществления изобретения фармацевтическая композиция предназначена для ингибирования активации С5. В одном из вариантов осуществления изобретения цитотоксичность, опосредуемую С5, подавляют путем ингибирования активации С5. В одном из вариантов осуществления изобретения фармацевтическую композицию вводят индивидууму, имеющему опосредуемое комплементом заболевание или состояние, которое включает избыточную или неконтролируемую активацию С5. «Индивидуум» в контексте любого из указанных выше вариантов осуществления изобретения предпочтительно представляет собой человека.
В одном из объектов изобретения индивидуум имеет С5 дикого типа. В другом объекте изобретения индивидуум имеет вариант С5. В некоторых вариантах осуществления изобретения вариант С5 обладает биологической активностью, сходной с активностью С5 дикого типа. Указанный вариант С5 может содержать по меньшей мере одну вариацию, выбранную из группы, состоящей из V145I, R449G, V802I, R885H, R928Q, D966Y, S1310N и E1437D. В настоящем описании, например, R885H обозначает генетическую вариацию, при которой аргинин в положении 885 заменен на гистидин.
Следующим объектом изобретения являются способы приготовления лекарственного средства или фармацевтической композиции, включающие смешение любых антител к С5, представленных в настоящем описании, с фармацевтически приемлемым носителем, например, для применения в любом из указанных выше терапевтических способов. В одном из вариантов осуществления изобретения способы приготовления лекарственного средства или фармацевтической композиции дополнительно включают добавление по меньшей мере одного дополнительного терапевтического средства к лекарственному средству или фармацевтической композиции.
В некоторых вариантах осуществления изобретения опосредуемое комплементом заболевание или состояние, которое включает избыточную или неконтролируемую активацию С5, выбирают из группы, включающей ревматоидный артрит (RA); системную красную волчанку (SLE); волчаночный нефрит; повреждение, вызываемое ишемией-реперфузией; астму, пароксизмальную ночную гемоглобинурию (PNH); гемолитико-уремический синдром (HUS) (например, атипичный гемолитико-уремический синдром (aHUS);=болезнь плотных депозитов (DDD); нейромиелит зрительного нерва (NMO); мультифокальную моторную невропатию (MMN); рассеянный склероз (MS); системный склероз; дегенерацию желтого пятна (например, возрастную дегенерацию желтого пятна (AMD)); синдром: гемолиз, повышение активности ферментов печени и тромбоцитопения (HELLP); тромботическую тромбоцитопеническую пурпуру (ТТР); спонтанную потерю плода; буллезный эпидермолиз; повторную потерю плода; преэкламсию;=травматическое повреждение головного мозга; тяжелую псевдопаралитическую миастению; холодовую агглютининовую болезнь; синдром Шегрена; дерматомиозит; буллезный пемфигоид; фототоксические реакции; связанный с продуцируемым Е. coli токсином Шига=гемолитико-уремический синдром; типичный или инфекционный гемолитико-уремический синдром (tHUS); С3-гломерулонефрит; ассоциированный с антинейтрофильным цитоплазматическим антителом (ANCA) васкулит; гуморальное и сосудистое отторжение трансплантата; острое опосредуемое антителом отторжение (AMR); дисфункция трансплантата; инфаркт миокарда; аллогенный трансплантат; сепсис; болезнь коронарной артерии; наследственный ангионевротический отек; дерматомиозит; болезнь Грейвса; атеросклероз; болезнь Альцгеймера (AD); болезнь Гентингтона; болезнь Крейтцфельдта-Якоба; болезнь Паркинсона; раки; ранения; септический шок; поражение спинного нерва; увеит; связанные с диабетом глазные болезни; ретинопатию недоношенных детей; гломерулонефрит; мембранный нефрит; ассоциированную с иммуноглобулином А нефропатию; респираторный диспресс-синдром взрослых (ARDS); хроническое обструктивное заболевание легких (COPD); муковисцидоз; гемолитическую анемию; пароксизмальную холодовую гемоглобинурию; анафилактический шок; аллергию; остеопороз; остеоартрит; тиреоидит Хашимото; диабет типа I; псориаз; пузырчатку; аутоиммунную гемолитическую анемию (AIHA); идиопатическую тромбоцитопеническую пурпуру (ITP); синдром Гудпасчера; болезнь Дегоса; антифосфолипидный синдром (APS); катастрофический APS (CAPS); сердечнососудистое нарушение; миокардит; нарушение мозгового кровообращения; заболевание периферических сосудов; реноваскулярное нарушение; заболевание мезентериальных/энтериальных сосудов; васкулит; нефрит при пурпуре Геноха-Шенлейна; болезнь Такаяси; дилатирующую кардиомиопатию; диабетическую ангиопатию; болезнь Кавасаки (артерит); венозную воздушную эмболию (VGE), рестеноз после стентирования; ротационную атерэктомию; мембранозную нефропатию; синдром Гийена-Барре (GBS); синдром Фишера; индуцированный антигеном артрит; синовиальное воспаление; вирусные инфекции; бактериальные инфекции; грибные инфекции; и повреждение, обусловленное инфарктом миокарда, сердечно-легочным шунтированием и гемодиализом.
В некоторых вариантах осуществления изобретения опосредуемое комплементом заболевание или состояние представляет собой связанное с глазным заболеванием состояние. В других вариантах осуществления изобретения глазное заболевание представляет собой дегенерацию желтого пятна. В других вариантах осуществления изобретения дегенерация желтого пятна представляет собой AMD. В других вариантах осуществления изобретения AMD представляет собой сухую форму AMD.
В некоторых вариантах осуществления изобретения опосредуемое комплементом заболевание или состояние представляет собой PNH.
В некоторых вариантах осуществления изобретения опосредуемое комплементом заболевание или состояние представляет собой инфаркт миокарда.
В некоторых вариантах осуществления изобретения опосредуемое комплементом заболевание или состояние представляет собой RA.
В некоторых вариантах осуществления изобретения опосредуемое комплементом заболевание или состояние представляет собой остеопороз или остеоартрит.
В некоторых вариантах осуществления изобретения опосредуемое комплементом заболевание или состояние представляет собой воспаление.
В некоторых вариантах осуществления изобретения опосредуемое комплементом заболевание или состояние представляет собой рак.
Антитела, предлагаемые в изобретении, для лечения можно применять либо индивидуально, либо в сочетании с другими агентами. Например, антитело, предлагаемое в изобретении, можно вводить совместно по меньшей мере с одним дополнительным терапевтическим средством.
Такие комбинированные терапии, указанные выше, предусматривают совместное введение (когда два или большее количество терапевтических средств включены в одну и ту же или различные композиции) и раздельное введение, в каждом случае введение антитела или полипептида, содержащего вариант Fc-области, предлагаемый в изобретении, можно осуществлять до, одновременно и/или после введения дополнительного терапевтического средства или средств. В одном из вариантов осуществления изобретения введение антитела к С5 и введение дополнительного терапевтического средства можно осуществлять в пределах примерно месяца или в пределах примерно 1, 2 или 3 недель, или в пределах примерно 1, 2, 3, 4, 5 или 6 дней друг относительно друга.
Антитело, предлагаемое в изобретении (и любое дополнительное терапевтическое средство), можно вводить любыми приемлемыми путями, включая парентеральный, внутрилегочный и интраназальный и при необходимости применять для местной обработки, введения в повреждение. Парентеральные инфузии включают внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. Дозирование можно осуществлять любым приемлемым путем, например, путем инъекций, таких как внутривенные или подкожные инъекции, в зависимости, в том числе, от того, является ли лечение кратковременным или хроническим. Можно применять различные схемы дозирования, включая (но, не ограничиваясь только ими) однократное введение или несколько введений в различные моменты времени, болюсное введение и пульсирующую инфузию.
Антитела, предлагаемые в изобретении, можно включать в состав композиций, дозировать и вводить в соответствии с надлежащей клинической практикой. Рассматриваемые в этом контексте факторы включают конкретное нарушение, подлежащее лечению, конкретное млекопитающее, подлежащее лечению, клиническое состояние индивидуального пациента, причину нарушения, область введения агента, метод введения, схему введения и другие факторы, известные практикующим медикам. Антитело можно, но это не является обязательным, включать в композицию в сочетании с одним или несколькими другими агентами, которые в настоящее время применяют для профилактики и лечения рассматриваемого нарушения. Эффективное количество указанных других агентов зависит от количества антитела, присутствующего в композиции, типа нарушения или лечения и других указанных выше факторов. Их, как правило, применяют в таких же дозах и с использованием таких же путей введения, которые указаны в настоящем описании, или в количестве, составляющем от 1 до 99% от дозы, указанной в настоящем описании, или в любой дозе и с помощью любого пути, которые по данным эмпирической/клинической оценки являются пригодными.
Для предупреждения или лечения заболевания приемлемая доза антитела, предлагаемого в изобретении (при его применении индивидуально или в сочетании с одним или несколькими другими дополнительными терапевтическими средствами), должна зависеть от типа заболевания, подлежащего лечению, типа антитела, типа полипептида, содержащего вариант Fc-области, серьезности и течения болезни, применяют ли антитело или полипептид, содержащий вариант Fc-области, для превентивных или терапевтических целей, предшествующей терапии, истории болезни пациента и ответа на антитело или полипептид, содержащий вариант Fc-области, а также предписания лечащего врача. Антитело или полипептид, содержащий вариант Fc-области, можно вводить пациенту однократно или в виде серий обработок. В зависимости от типа и серьезности заболевания примерно от 1 мкг/кг до 15 мг/кг (например, 0,5-10 мг/кг) антитела может представлять собой начальную возможную дозу для введения пациенту, например, с помощью одной или нескольких отдельных обработок или с помощью непрерывной инфузии. Одним из примеров типичных суточных доз может являться доза, составляющая от примерно 1 мкг/кг до 100 мг/кг или более в зависимости от указанных выше факторов. При использовании повторных введений в течение нескольких дней или более длительного периода времени, в зависимости от состояния, лечение, как правило, следует продолжать до достижения подавления симптомов заболевания. Одним из примеров доз антитела или полипептида, содержащего вариант Fc-области, является доза, составляющая от примерно 0,05 до примерно 10 мг/кг. Так, пациенту можно вводить одну или несколько следующих доз: примерно 0,5, 2,0, 4,0 или 10 мг/кг (или любую их комбинацию). Указанные дозы можно вводить дробно, например, каждую неделю или каждые три недели (например, так, чтобы пациент получал от примерно двух до примерно двадцати, например, примерно шесть доз антитела или полипептида, содержащего вариант Fc-области). Можно применять начальную повышенную ударную дозу с последующим введением одной или нескольких более низких доз. С помощью общепринятых методов и анализов можно легко осуществлять мониторинг действия указанной терапии.
Очевидно, что любые из вышеуказанных композиций или терапевтических способов можно применять с использованием иммуноконъюгата, предлагаемого в изобретении, вместо или в дополнение к антителу к С5.
З. Изделия
Другим объектом изобретения является изделие, которое содержит продукты, применяемые для лечения, предупреждения и/или диагностирования указанных выше нарушений. Изделие представляет собой контейнер и этикетку или листовку-вкладыш в упаковку, которые размещены на контейнере или вложены в него. Приемлемыми контейнерами являются, например банки, пузырьки, шприцы, пакеты для внутривенного раствора и т.д. Контейнеры можно изготавливать из различных материалов, таких как стекло или пластмасса. Контейнер содержит композицию, которая сама или в сочетании с другой композицией является эффективной для лечения, предупреждения и/или диагностирования состояния, и может иметь стерильный порт доступа (например, контейнер может представлять собой пакет для внутривенного раствора или пузырек, снабженный пробкой, которую можно прокалывать с помощью иглы для подкожных инъекций). По меньшей мере одно действующее вещество в композиции представляет собой антитело, предлагаемое в изобретении. На этикетке или листовке-вкладыше в упаковку указано, что композицию применяют для лечения выбранного состояния. Кроме того, изделие может включать (а) первый контейнер с находящейся в нем композицией, где композиция содержит антитело, предлагаемое в настоящем изобретении; и (б) второй контейнер с находящейся в нем композицией, где композиция содержит дополнительное цитотоксическое или иное терапевтическое средство. Согласно этому варианту осуществления изобретения изделие может содержать листовку-вкладыш в упаковку, которая содержит информацию о том, что композиции можно использовать для лечения конкретного состояния. В альтернативном или дополнительном варианте изделие может дополнительно включать второй (или третий) контейнер с фармацевтически приемлемым буфером, таким как бактериостатическая вода для инъекций (БСВИ), забуференный фосфатом физиологический раствор, раствор Рингера и раствор декстрозы. Кроме того, оно может включать другие продукты, необходимые с коммерческой точки зрения и с точки зрения потребителя, в частности, другие буферы, разбавители, фильтры, иглы и шприцы.
Как должно быть очевидно, любое из указанных выше изделий может включать иммуноконъюгат, предлагаемый в изобретении, вместо или в дополнение к антителу к С5.
Примеры
Ниже приведены примеры методов и композиций, предлагаемых в изобретении. Как должно быть очевидно, различные другие варианты осуществления изобретения можно применять на практике на основе общего описания изобретения, представленного выше
Пример 1
Получение С5
1.1. Экспрессия и очистка рекомбинантного С5 человека и обезьян циномолгус
Рекомбинантный человеческий С5 (NCBI GenBank, код доступа: NP_001726.2, SEQ ID NO: 39) кратковременно экспрессировали, используя клеточную линию FreeStyle293-F (фирма Thermo Fisher, Карлсбад, шт. Калифорния, США). Кондиционированные среды, в которых происходила экспрессия человеческого С5, разводили равным объемом воды milliQ, затем вносили в анионообменную колонку с Q-сефарозой FF или Q-сефарозой HP (фирма GE healthcare, Уппсала, Швеция), после чего элюировали с использованием градиента NaCl. Объединяли фракции, содержащие человеческий С5, после чего концентрацию соли и значение рН доводили до 80 мМ NaCl и рН 6,4 соответственно. Полученный образец вносили в катионообменную колонку с SP-сефарозой HP (фирма GE healthcare, Уппсала, Швеция) и элюировали с использованием градиента NaCl. Фракции, содержащие человеческий С5, объединяли и вносили в колонку с керамическим гидроксиапатитом СНТ (фирма Bio-Rad Laboratories, Геркулес, шт. Калифорния, США). Затем содержащий человеческий С5 элюат вносили в колонку с Супердекс 200 для гель-фильтрации (фирма GE healthcare, Уппсала, Швеция). Фракции, содержащие человеческий С5, объединяли и хранили при -150°С.
Экспрессию и очистку рекомбинантного С5 обезьян циномолгус (NCBI GenBank, код доступа: ХР_005580972, SEQ ID NO: 44) осуществляли тем же методом, который применяли для человеческой копии.
1.2. Очистка С5 обезьян циномолгус (cynoC5) из плазмы
Образец плазмы обезьян циномолгус вносили на SSL7-агарозу (фирма Invivogen, Сан-Диего, шт. Калифорния, США), после чего элюировали с использованием 100 мМ ацетата натрия, рН 3,5. Фракции, содержащий cynoC5, немедленно нейтрализовали и вносили в содержащую белок А колонку HP (фирма GE healthcare, Уппсала, Швеция), в тандеме с колонкой с пептид М-агарозой (фирма Invivogen, Сан-Диего, шт. Калифорния, США). Затем проточную фракцию вносили в колонку для гель-фильтрации с Супердекс 200 (фирма GE healthcare, Уппсала, Швеция). Фракции, содержащие cynoC5, объединяли и хранили при -80°С.
Пример 2
Создание антител к С5
2.1. Скрининг антител
Антитела к С5 получали, отбирали и анализировали следующим образом:
Новозеландских белых кроликов (NZW) возрастом 12-16 недель иммунизировали внутрикожно человеческим С5 и/или обезьяньим С5 (50-100 мкг/дозу/кролика). Обработку указанной дозой повторяли 3-5 раз в течение 2-месячного периода. Через 1 неделю после последней иммунизации собирали образцы селезенки и крови иммунизированного кролика. Антигенспецифические В-клетки окрашивали меченым антигеном, сортировали с использованием клеточного FCM-сортера (FACS aria III, фирма BD) и высевали в 96-луночные планшеты с плотностью 1 клетка/лунку вместе с 25000 EL4-клеток/лунку (из Европейской коллекции клеточных культур) и кондиционированной средой для активированных кроличьих Т-клеток, разведенной в 20 раз, и культивировали в течение 7-12 дней. EL4-клетки предварительно обрабатывали митомицином С (фирма Sigma, каталожный номер М4287) в течение 2 ч и промывали 3 раза. Кондиционированную среду для активированных кроличьих Т-клеток получали путем культивирования кроличьих тимоцитов в среде RPMI-1640, содержащей фитогемагглютинин-М (фирма Roche, каталожный номер 1 1082132-001), форбол-12-миристат-13-ацетат (фирма Sigma, каталожный номер Р1585) и 2% FBS. После культивирования супернатанты В-клеточных культур собирали для дополнительного анализа и дебрис криоконсервировали.
ELISA-анализ применяли для оценки специфичности антител в супернатанте В-клеточной культуры. 384-луночные планшеты MAXISorp (фирма Nunc, каталожный номер 164688) сенсибилизировали стрептавидином (фирма GeneScript, каталожный номер Z02043) в концентрации 50 нМ в ЗФР в течение 1 ч при комнатной температуре. Затем планшеты блокировали с помощью реагента Blocking One (фирма Nacalai Tesque, каталожный номер 03953-95), разведенного в 5 раз. Человеческий или обезьяний С5 метили с помощью NHS-ПЭГ4-биотина (фирма PIERCE, каталожный номер 21329) и добавляли в заблокированные планшеты для ELISA, инкубировали в течение 1 ч и промывали. Супернатанты В-клеточных культур вносили в планшеты для ELISA, инкубировали в течение 1 ч и промывали. Связывание выявляли с помощью козьего антикроличьего IgG, конъюгированного с пероксидазой из хрена (фирма BETHYL, каталожный номер А120-111Р), для чего добавляли ABTS (фирма KPL, каталожный номер 50-66-06).
ELISA-анализ применяли для оценки рН-зависимого связывания антител к С5. Козий антикроличий IgG-Fc (фирма BETHYL, каталожный номер А120-111А), разведенный до 1 мкг/мл с использованием ЗФР(-), добавляли в 384-луночный планшет MAXISorp (фирма Nunc, каталожный номер 164688), инкубировали в течение 1 ч при комнатной температуре и блокировали с помощью реагента Blocking One (фирма Nacalai Tesque, каталожный номер 03953-95), разведенного в 5 раз. После инкубации планшеты промывали и добавляли супернатанты В-клеточных культур. Планшеты инкубировали в течение 1 ч, промывали и добавляли 500 пМ биотинилированный человеческий или обезьяний С5, и инкубировали в течение 1 ч. После инкубации планшеты промывали и инкубировали либо с MES-буфером, рН 7,4 (20 мМ MES, 150 мМ NaCl и 1,2 мМ CaCl2), либо с MES-буфером, рН 5,8 (20 мМ MES, 150 мМ NaCl и 1 мМ ЭДТА) в течение 1 ч при комнатной температуре. После инкубации выявляли связывание биотинилированного С5 с помощью конъюгата стрептавидин-пероксидаза из хрена (фирма Thermo Scientific, каталожный номер 21132), для чего добавляли ABTS (фирма KPL, каталожный номер 50-66-06).
Систему Octet RED384 (фирма Pall Life Sciences) применяли для оценки аффинности и рН-зависимого связывания антител к С5. Антитела, секретированные в супернатант культуры В-клеток, наносили на кончик покрытого белком А биосенсора (фирма Pall Life Sciences) и погружали в содержащий 50 нМ человеческий или обезьяний С5 MES-буфер, рН 7,4 для анализа кинетики ассоциации. Кинетику диссоциации анализировали как в MES-буфере с рН 7,4, так и в MES-буфере с рН 5,8.
В целом 41439 В-клеточных линий подвергали скринингу в отношении аффинности и рН-зависимого связывания с человеческим или обезьяньим С5 и отбирали 677 линий, которые обозначали как CFA0001-0677. РНК отобранных линий очищали из криоконсервированных клеточных дебрисов с помощью наборов ZR-96 Quick-RNA (ZYMO RESEARCH, каталожный номер R1053). ДНК, кодирующие вариабельные области тяжелой цепи антител отобранных линий амплифицировали с помощью ПЦР с обратной транскрипцией и осуществляли рекомбинацию с ДНК, кодирующей константную область тяжелой цепи F760G4 (SEQ ID NO: 33) или F939G4 (SEQ ID NO: 34). ДНК, кодирующие вариабельные области легкой цепи антител амплифицировали с помощью ПЦР с обратной транскрипцией и осуществляли рекомбинацию с ДНК, кодирующей константную область легкой цепи k0MTC (SEQ ID NO: 36). Отдельно синтезировали гены тяжелой и легкой цепи существующего гуманизированного антитела к С5, экулизумаба (EcuH-G2G4, SEQ ID NO: 29 и EcuL-k0, SEQ ID NO: 30). ДНК, кодирующую VH (EcuH, SEQ ID NO: 31) сливали в рамке считывания с ДНК, кодирующей СН модифицированного человеческого IgG4 (F760G4, SEQ ID NO: 33), а ДНК, кодирующую VL (EcuL, SEQ ID NO: 32), сливали в рамке считывания с ДНК, кодирующей константную область легкой цепи k0 (SEQ ID NO: 37). Каждую из слитых кодирующих последовательностей клонировали также в экспрессионном векторе. Антитела экспрессировали в FreeStyle™ 293-F-клетках (фирма Invitrogen) и очищали из супернатантов культур для оценки функциональной активности. Нейтрализующие активности антител оценивали путем анализа ингибирования активности комплемента с помощью анализа лизиса липосом, как описано в примере 5.1.
2.2. Группировка в зависимости от эпитопа с помощью сэндвич-ELISA
Антитела к С5, обладающие высокой аффинностью, рН-зависимостью или нейтрализующей активностью, отбирали для дальнейшего анализа. Применяли анализ методом сэндвич-ELISA для группировки отобранных антител, связывающихся с одним и тем же или перекрывающимися эпитопами белка С5, в различные эпитопные «корзины». Немеченые предназначенные для «захвата» антитела разводили до 1 мкг/мл с использованием ЗФР(-) и добавляли в 384-луночные планшеты MAXISorp (фирма Nunc, каталожный номер 164688). Планшеты инкубировали в течение 1 ч при комнатной температуре и блокировали с помощью реагента Blocking One (фирма Nacalai Tesque, каталожный номер 03953-95), разведенного в 5 раз. Планшеты инкубировали в течение 1 ч, промывали, добавляли 2 нМ человеческий С5 и инкубировали в течение 1 ч. После инкубации планшеты промывали и добавляли меченые идентифицирующие антитела (1 мкг/мл, биотинилированные с помощью NHS-PEG4-биотина). После инкубации в течение 1 ч выявляли связывание биотинилированного антитела с помощью конъюгата стрептавидин-пероксидаза из хрена (фирма Thermo Scientific, каталожный номер 21132), для чего добавляли ABTS (фирма KPL, каталожный номер 50-66-06).
Все антитела к С5 применяли как в качестве «захватывающего» антитела, так и в качестве «идентифицирующего» антитела, и проводили всесторонний парный анализ. Как продемонстрировано на фиг. 1, взаимно конкурирующие антитела были сгруппированы в 7 эпитопных «корзин»: CFA0668, CFA0334 и CFA0319 отнесены в группу эпитопа A, CFA0647, CFA0589, CFA0341, CFA0639, CFA0635, CFA0330 и CFA0318 отнесены в группу эпитопа Б, CFA0538, CFA0501, CFA0599, CFA0307, CFA0366, CFA0305, CFA0675, CFA0666 и CFA0672 отнесены в группу эпитопа В, экулизумаб и CFA0322 отнесены в группу эпитопа Г, CFA0329 отнесен в группу эпитопа Е, CFA0359 и CFA0217 отнесены в группу эпитопа Е, a CFA0579, CFA0328 и CFA0272 отнесены в группу эпитопа Ж. На фиг. 1 представлена группировка в зависимости от эпитопа некоторых химерных антител к С5. Последовательности VH и VL антител к С5, входящих в группу эпитопа В, перечислены в таблице 2.
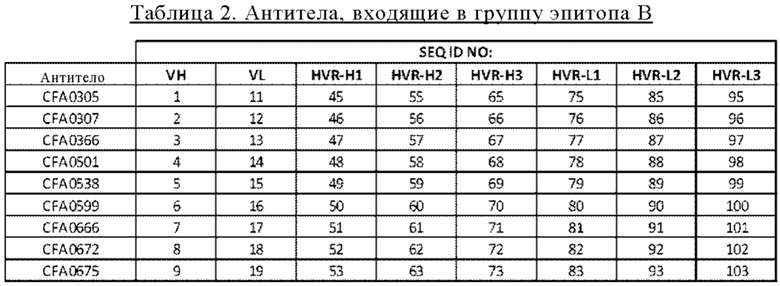
2.3. Гуманизация и оптимизация
Осуществляли гуманизацию вариабельной области некоторых антител к С5 для снижения потенциальной иммунногенности антител. Гипервариабельные участки (CDR) кроличьего антитела к С5 трансплантировали в гомологичные каркасные участки человеческого антитела (FR) с помощью стандартного метода трансплантирования CDR (Nature 321, 1986, сс. 522-525). Синтезировали гены, кодирующие гуманизированные VH и VL, и объединяли с модифицированной СН человеческого IgG4 (SG402, SEQ ID NO: 35) и человеческой CL (SK1, SEQ ID NO: 38) соответственно, и каждую из объединенных последовательностей клонировали в экспрессионном векторе.
Анализировали большое количество мутаций и комбинаций мутаций для идентификации мутаций и комбинаций мутаций, которые улучшают связывающие свойства некоторых перспективных антител. Затем интродуцировали множество мутаций в гуманизированные вариабельные области для повышения аффинности связывания с С5 при нейтральном рН или для снижения аффинности связывания с С5 при кислом рН. Таким путем был создан на основе CFA0305 один из оптимизированных вариантов, 305LO5 (VH, SEQ ID NO: 10; VL, SEQ ID NO: 20; HVR-H1, SEQ ID NO: 54; HVR-H2, SEQ ID NO: 64; HVR-H3, SEQ ID NO: 74; HVR-L1, SEQ ID NO: 84; HVR-L2, SEQ ID NO: 94 и HVR-L3, SEQ ID NO: 104).
Антитела экспрессировали в клетках HEK293, совместно трансфектированных смесью экспрессионных векторов для тяжелой и легкой цепи, и очищали с использованием белка А.
Пример 3
Характеризация связывания антител к С5
3.1. Экспрессия и очистка рекомбинантных антител
Рекомбинантные антитела кратковременно экспрессировали, используя клетки линии FreeStyle293-F (ES293-F-клетки) (фирма Thermo Fisher, Карлсбад, шт. Калифорния, США). Очистку из кондиционированных сред, в которых происходила экспрессия антител, осуществляли с помощью стандартного метода с использованием белка А. При необходимости затем проводили гель-фильтрацию.
3.2. Оценка рН-зависимости
Кинетические параметры антител к С5 в отношении рекомбинантного человеческого С5 оценивали при рН 7,4 и рН 5,8 при 37°С с использованием устройства BIACORE®T200 (фирма GE Healthcare). Белок ProA/G (фирма Pierce) иммобилизовали на сенсорном чипе СМ4 с использованием набора для аминного сочетания (фирма GE Healthcare) в условиях, рекомендованных фирмой GE Healthcare. Антитела и аналиты разводили соответствующими подвижными буферами, ACES рН 7,4 и рН 5,8 (20 мМ ACES, 150 мМ NaCl, 1,2 мМ CaCl2, 0,05% Твин 20, 0,005% NaN3). Каждое антитело «захватывали» на поверхности сенсора с помощью ProA/G. Уровни «захвата» антител, как правило, соответствовали 60-90 резонансным единицам (RU). Затем инъецировали рекомбинантный человеческий С5 в концентрациях 10 и 20 нМ или 20 и 40 нМ, после чего давали пройти диссоциации. Поверхность регенерировали с использованием 25 мМ NaOH. Кинетические параметры при обоих значениях рН определяли путем аппроксимации сенсограмм на основе модели связывания 1:1 с использованием программного обеспечения BIACORE® Т200 Evaluation, версия 2.0 (фирма GE Healthcare). Сенсограммы для всех антител представлены на фиг. 2А и 2Б. Скорость ассоциации (ka), скорость диссоциации (kd) и аффинность связывания (KD) антител представлены в таблице 3. Все антитела за исключением CFA0330 (VH, SEQ ID NO: 21 и VL, SEQ ID NO: 25) и CFA0341 (VH, SEQ ID NO: 22 и VL, SEQ ID NO: 26) характеризовались относительно более быстрой скоростью диссоциации при рН 5,8, чем при рН 7,4.

3.3. Оценка кросс-реактивности
Для выявления кросс-реактивности антител к С5, а именно антител к человеческому С5 (hC5) и антител к С5 обезьян циномолгус (cynoC5), осуществляли кинетический анализ BIACORE®. Анализ проводили в тех же условиях, которые описаны в примере 3.2. Рекомбинантный cynoC5 инъецировали в концентрациях 2, 10 и 50 нМ. Кинетические параметры определяли, осуществляя такую же аппроксимацию данных, которая описана в примере 3.2. Результаты определения кинетических характеристик связывания и аффинности при рН 7,4 представлены в таблице 4. Кинетические параметры в отношении hC5, указанные в таблице 4, представляют собой результаты, полученные в примере 3.2. Все антитела к С5 за исключением CFA0672 характеризовались сопоставимыми величинами KD в отношении hC5 и cynoC5. KD для CFA0672 в отношении cynoC5 была в 8 раз выше (более слабая аффинность), чем в отношении hC5.
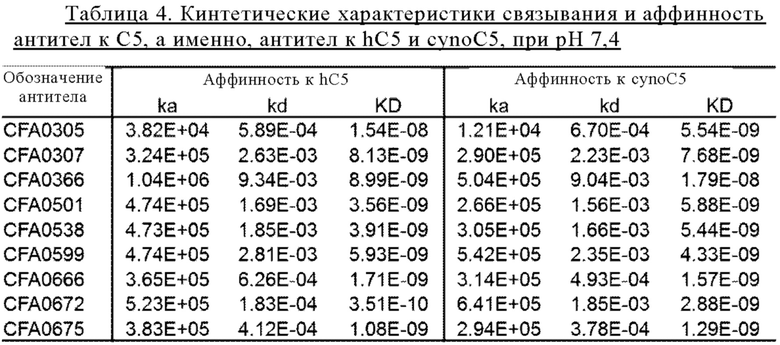
Пример 4
Картирование эпитопов для антител к С5
4.1. Связывание МАт к С5 с пептидами, полученными на основе бета-цепи C5
Моноклональные антитела (МАт) к С5 тестировали в отношении связывания с полученными на основе бета-цепи С5 пептидами путем анализа методом вестерн-блоттинга. С5-пептиды: 19-180, 161-340, 321-500 и 481-660, слитые с GST-меткой (pGEX-4T-1, фирма GE Healthcare Life Sciences, 28-9545-49), экспрессировали в Е. coli (DH5alpha, фирма TOYOBO, DNA-903). Содержащие Е. coli образцы собирали после инкубации с 1 мМ изопропил-бета-D-1-тиогалактопиранозидом (ИПТГ) в течение 5 ч при 37°С и центрифугировали при 20000 × g в течение 1 мин, получая дебрис. Дебрис суспендировали в растворе буфера для образца (2МЕ+) (фирма Wako, 191-13272) и применяли для анализа методом вестерн-блоттинга. Экспрессию каждого пептида подтверждали с использованием антитела к GST (фирма Abcam, ab9085) (фиг. 3). Стрелкой указаны слитые с GST С5-пептиды (46-49 кДа). МАт к С5: CFA0305, CFA0307, CFA0366, CFA0501, CFA0538, CFA0599, CFA0666, CFA0672 и CFA0675 связывались с аминокислотами 19-180 С5 (фиг. 3).
4.2. Экспрессия и очистка MG1-MG2-домена (1-225) человеческого С5
Рекомбинантный MG1-MG2-домен (SEQ ID NO: 43) бета-цепи человеческого С5 кратковременно экспрессировали, используя клетки линии FreeStyle293-F (ES293-F-клетки) (фирма Thermo Fisher, Карлсбад, шт. Калифорния, США). Кондиционированные среды, в которых происходила экспрессия MG1-MG2-домена, разводили, используя 1/2 объема, водой milliQ, после чего вносили в анионообменную колонку с Q-сефарозой FF (фирма GE healthcare, Уппсала, Швеция). Значение рН прошедшей через анионообменную колонку фракции доводили до рН 5,0 и вносили в катионообменную колонку с SP-сефарозой HP (фирма GE healthcare, Уппсала, Швеция), а затем элюировали с использованием градиента NaCl. Фракции, содержащие MG1-MG2-домен, собирали из элюента и затем подвергали гель-фильтрации на колонке с Супердекс 75 (фирма GE healthcare, Уппсала, Швеция) уравновешенной с помощью 1× ЗФР. Затем фракции, содержащие MG1-MG2-домен, объединяли и хранили при -80°С.
4.3. Способность связываться с MG1-MG2-доменом
Способность антитела к С5 связываться с MG1-MG2-доменом оценивали в тех же условиях анализа, которые описаны в примере 3.2, за исключением того, что измерения проводили только в условиях при рН 7,4. MG1-MG2-домен инъецировали в концентрациях 20 нМ и 40 нМ. Как продемонстрировано на фиг. 4, все антитела за исключением экулизумаба-P76G4 характеризовались повышением ответа в виде связывания, это свидетельствовало о том, что указанные антитела являлись связывающими MG1-MG2 агентами. Для экулизумаба-P76G4, который, как известно, представляет собой агент, связывающий альфа-цепь, не было выявлено связывания с MG1-MG2-доменом.
4.4. Связывание МАт к С5 с пептидами, полученными из MG1-MG2-домена С5
МАт к С5 тестировали в отношении связывания с полученными из MG1-МС2-домена пептидами путем анализа методом вестерн-блоттинга. С5-пептиды: 33-124, 45-124, 52-124, 33-111, 33-108 и 45-111 (SEQ ID NO: 40), слитые с GST-меткой, экспрессировали в Е. coli. Содержащие Е. coli образцы собирали после инкубации с 1 мМ ИПТГ в течение 5 ч при 37°С и центрифугировали при 20000 × g в течение 1 мин, получая дебрис. Дебрис суспендировали в растворе буфера для образца (2МЕ+) и применяли для анализа методом вестерн-блоттинга. Экспрессию полученных из С5 пептидов подтверждали с использованием антитела к GST (фиг. 5А). CFA0305 связывалось только с пептидом 33-124 (фиг. 5Б). CFA0305 связывалось с бета-цепью рекомбинантного человеческого С5 (rhC5) (примерно 70 кДа), которую использовали в качестве контроля. На фиг. 5В обобщены данные о взаимодействии МАт к С5 с полученными из С5 пептидами.
4.5. Связывание МАт к С5 с мутантами С5
Поскольку на основе анализа кристаллической структуры было предсказано, что три аминокислотных остатка в бета-цепи С5, а именно Е48, D51 и K109, участвуют в связывании С5 с МАт к С5, то МАт к С5 тестировали в отношении связывания с содержащими точечные мутации мутантами человеческого С5 путем анализа методом вестерн-блоттинга. Содержащие точечные мутации мутанты С5, в которых один из остатков Е48, D51 и K109 был заменен на аланин, экспрессировали в клетках FS293 с использованием липофекции. Культуральные среды собирали через 5 дней после осуществления липофекции и после этого использовали для вестерн-блоттинга. ДСН-ПААГ осуществляли в восстанавливающих условиях. Результаты представлены на фиг. 6. Экулизумаб связывался с альфа-цепью С5 дикого типа (WT) и тремя содержащими точечные мутации мутантами С5, в то время как антитело CFA0305 характеризовалось сильным связыванием с бета-цепью С5 WT, слабым связыванием с Е48А-мутантом С5 и отсутствием связывания с бета-цепью D51A-мутанта и K109A-мутанта С5, это свидетельствует о том, что указанные 3 аминокислотных остатка участвуют во взаимодействиях антитело/антиген. В таблице 5 представлено обобщение результатов анализа методом вестерн-блоттинга МАт к С5 (CFA0305, CFA0307, CFA0366, CFA0501, CFA0538, CFA0599, CFA0666, CFA0672 и CFA0675). МАт к С5 относятся к группе для одного и того же эпитопа Б, однако схемы связывания антител несколько различаются между собой, это позволяет предположить, что области, связывающие С5 с МАт к С5, близки друг к другу, но не являются идентичными.
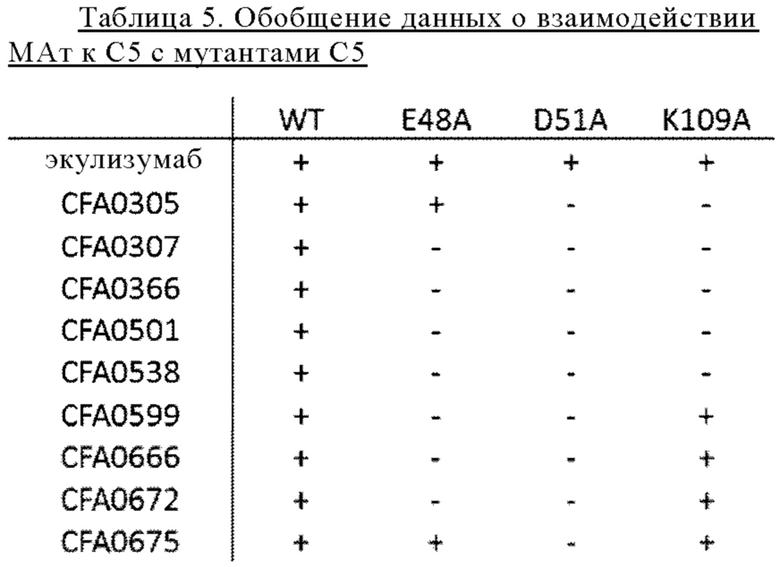
4.6. Анализ связывания антител к С5 с мутантами С5 методом BIACORE®
Для проверки того, участвуют ли действительно остатки Е48, G51 и K109 во взаимодействиях антитело/антиген, проводили анализ связывания методом BIACORE®. Получали три мутанта С5, а именно содержащие мутации Е48А, G51A и K109A, как описано в примере 4.5. Получали образцы супернатантов культур, содержащие сверхэкспрессирующие мутант С5 клетки FS293 с концентрацией мутанта С5 40 мкг/мл. Для анализа связывания методом BIACORE® образец разводили в 10 раз подвижным буфером BIACORE® (ACES рН 7,4, 10 мг/кг БСА, 1 мг/мл карбоксиметилдекстрана) до конечной концентрации мутанта С5 в образце 4 мкг/мл.
Взаимодействия трех мутантов С5 с антителами к С5 оценивали при 37°С с помощью устройства BIACORE® Т200 (фирма GE Healthcare) с использованием условий анализа, описанных в примере 3.2. Буфер ACES рН 7,4, содержащий 10 мг/мл БСА, 1 мг/мл карбоксиметилдекстрана, применяли в качестве подвижного буфера. Экулизумаб-F760G4 и 305LO5 «захватывали» на различных проточных ячейках с помощью моноклонального мышиного антитела к человеческому IgG, Fc-фрагмент специфического (фирма GE Healthcare). Проточную ячейку 1 использовали в качестве референс-поверхности. Белки С5 дикого типа и мутантов С5 инъецировали на поверхность сенсора в концентрации 4 мкг/мл для взаимодействия с «захваченными» антителами. После окончания каждого цикла анализа поверхность сенсора регенерировали с помощью 3М MgCl2. Результаты анализировали с помощью программного обеспечения Bia Evaluation, версия 2.0 (фирма GE Healthcare). Кривые, полученные для проточной референс-ячейки (проточная ячейка 1), и кривые, полученные при использовании «пустых» инъекций подвижного буфера, вычитали из кривых, полученных для проточных ячеек с «захваченными» антителами.
Как продемонстрировано на фиг. 7, все три мутанта С5 могли связываться с экулизумабом, при этом профиль связывания был сопоставим с профилем связывания с С5 дикого типа. В случае 305LO5 для всех трех мутантов был получен более низкий ответ в виде связывания с 305LO5 по сравнению с С5 дикого типа. Мутации D51A и K109A снижали связывание С5 с 305LO5 до фонового уровня.
4.7. Идентификация остатков His в С5, которые участвуют в рН-зависимых взаимодействиях между антителом к С5 и С5
Анализ кристаллической структуры выявил 3 остатка гистидина в человеческом С5, находящихся на поверхности раздела антитело/антиген. Известно, что остаток гистидина с типичным pKa, составляющим примерно 6,0, участвует в рН-зависимых белок-белковых взаимодействиях (Igawa и др., Biochim Biophys Acta 1844(11), 2014, сс. 1943-1950). Для изучения того, участвуют ли остатки His на поверхности раздела антитело/антиген в рН-зависимых взаимодействиях между антителом к С5 и С5, проводили анализ связывания методом BIACORE®. Получали три мутанта человеческого С5 с одной His-мутацией (H70Y, H72Y и H110Y) и мутант с двойной His-мутацией (H70Y+H110Y) следующим образом: несущие одну His-мутацию мутанты, в которых один из Н70, Н72 и Н110 заменен на тирозин, и несущий двойную His-мутацию мутант, в котором оба Н70 и Н110 заменены на тирозин, экспрессировали в клетках FS293 с использованием липофекции. Антигенсвязывающие свойства 305LO5, обладающего рН-зависимостью антитела к С5, в отношении His-мутантов С5 определяли с помощью модифицированного BIACORE®-анализа как описано в примере 4.6. В целом метод заключался в следующем: в BIACORE®-анализ включали дополнительную фазу диссоциации при рН 5,8 сразу после фазы диссоциации при рН 7,4 для оценки рН-зависимой диссоциации антитела и антигена из комплексов, образовавшихся при рН 7,4. Скорость диссоциации при рН 5,8 определяли путем обработки и аппроксимации данных с использованием программного обеспечения для аппроксимации кривых Scrubber 2.0 (фирма BioLogic Software).
Как продемонстрировано на фиг. 8, одна His-мутация Н70 или Н110 и двойная His-мутация (Н70+Н110) С5 не оказывали влияния на связывание С5 с 305LO5 при нейтральном рН. В то же время, одна His-мутация Н72 приводила к значительному снижению связывания С5 с 305LO5. Скорости диссоциации при рН 5,8 для His-мутантов белка С5 и белка C5-wt представлены в таблице 6. Как продемонстрировано в таблице 6, C5-wt характеризовался наиболее быстрой диссоциацией от 305LO5 при рН 5,8 среди протестированных антигенов С5. Одна His-мутация Н70 приводила к почти двукратному замедлению скорости диссоциации при рН 5,8, а одна His-мутация Н110 приводила к небольшому замедлению скорости диссоциации при рН 5,8 по сравнению с C5-wt. Двойная His-мутация и Н70, и Н110, приводила к более выраженному воздействию на рН-зависимое связывание, при этом скорость диссоциации при рН 5,8 была почти в три раза меньше, чем в случае C5-wt.

Пример 5
Активность антител к С5 в отношении ингибирования активации С5
5.1. Ингибирование активируемого комплементом лизиса липосом МАт к С5
МАт к С5 тестировали в отношении ингибирования активности комплемента с помощью анализа лизиса липосом. 30 мкл сыворотки здорового человека (6,7%) (фирма Biopredic, SER018) смешивали с 20 мкл разведенного МАт в 96-луночном планшете и инкубировали на шейкере в течение 30 мин при 25°С. В каждую лунку переносили липосомы, сенсибилизированные антителами к динитрофенилу (Autokit СН50, фирма Wako, 995-40801), и планшет помещали на 2 мин на шейкер при 25°С. В каждую лунку добавляли по 50 мкл раствора субстрата (Autokit СН50) и смешивали путем встряхивания в течение 2 мин при 25°С. Конечную смесь инкубировали при 37°С в течение 40 мин, а затем измеряли ОП смеси при 340 нм. Процент лизиса липосом определяли по формуле 100 × [(ОПМАт - ОПфон, обусловленный сывороткой и липосомами)]/[(ОПбез МАт - ОПфон, обусловленный сывороткой и липосомами)]. На фиг. 9А продемонстрировано, что МАт к С5 CFA0305, 0307, 0366, 0501, 0538, 0599, 0666, 0672 и 0675 ингибировали лизис липосом. Два не обладающих рН-зависимостью антитела CFA0330 и 0341 также ингибировали лизис (фиг. 9Б).
5.2. Ингибирование с помощью МАт к С5 образования С5а
МАт к С5 тестировали в отношении образования С5а в процессе лизиса липосом для подтверждения того, что Мат к С5 ингибируют расщепление С5 с образованием С5а и C5b. Уровень С5а в супернатантах, полученных при анализе лизиса липосом, количественно оценивали с использованием набора для С5а-ELISA (фирма R&D systems, DY2037). Все МАт ингибировали образование С5а в супернатантах в зависимости от дозы (фиг. 10А и 10Б).
5.3. Ингибирование МАт к С5 активируемого комплементом гемолиза
МАт к С5 тестировали в отношении ингибирования активности классического комплемента с помощью гемолитического анализа. Куриные эритроциты (cRBC) (фирма Innovative research, IC05-0810) промывали забуференным желатином/вероналом соляным раствором, содержащим 0,5 мМ MgCl2 и 0,15 мМ CaCl2 (GVB++) (фирма Boston BioProducts, IBB-300X), и после этого сенсибилизировали антителом к куриным RBC (Rockland 103-4139) в концентрации 1 мкг/мл в течение 15 мин при 4°С. Затем клетки промывали GVB++ и суспендировали в том же самом буфере из расчета 5×107 клеток/мл. В отдельном круглодонном 96-луночном планшете смешивали 50 мкл сыворотки здорового человека (20%) (фирма Biopredic, SER019) с 50 мкл разведенного МАт и инкубировали на шейкере при 37°С в течение 30 мин. Затем в лунки, содержащие сыворотку, добавляли по 60 мкл суспензии сенсибилизированных cRBC и содержащую антитело смесь инкубировали при 37°С в течение 30 мин. После инкубации планшет центрифугировали при 1000 × g в течение 2 мин при 4°С. Супернатанты (100 мкл) переносили в лунки плоскодонного 96-луночного планшета для микроанализа для измерений ОП при 415 нм, длина референс-волны составляла 630 нм. Процент гемолиза определяли по формуле: 100 × [(ОПМАт - ОПсыворотка и cRBC)]/[(ОПбез МАт - ОПфон, обусловленный сывороткой и cRBC)]. На фиг. 11 продемонстрировано, что МАт к С5 CFA0305 и 305LO5 ингибировали гемолиз cRBC.
5.4. Ингибирование МАт к С5 альтернативного пути комплемента
Гемолитический анализ в случае альтернативного пути осуществляли аналогично осуществлению гемолитического анализа в случае классического пути. Кровь, собранную у новозеландских белых кроликов (фирма InVivos), смешивали с равным объемом раствора Олсвера (фирма Sigma, А3551), и смесь применяли в качестве кроличьих RBC (rRBC). rRBC промывали с использованием GVB, дополненного 2 мМ MgCl2 и 10 мМ ЭГТА, и суспендировали в том же самом буфере из расчета 7×108 клеток/мл. В круглодонном 96-луночном планшете для микроанализа смешивали 40 мкл сыворотки здорового человека (25%) (фирма Biopredic, SER019) с 40 мкл разведенного МАт и инкубировали на шейкере при 37°С в течение 30 мин. Затем в лунки, содержащие сыворотку, добавляли по 20 мкл суспензии rRBC и содержащую антитело смесь инкубировали при 37°С в течение 60 мин. После инкубации планшет центрифугировали при 1000 × g в течение 2 мин при 4°С. Супернатанты (70 мкл) переносили в лунки плоскодонного 96-луночного планшета для микроанализа для измерения ОП при 415 нм, длина референс-волны составляла 630 нм. На фиг. 12 продемонстрировано, что МАт к С5 CFA0305 и CFA0672 ингибировали гемолиз rRBC, это свидетельствует о том, что указанные антитела ингибируют альтернативные пути комплемента.
Пример 6
Фармакокинетическое изучение моноклональных антител к С5 с использованием человеческого С5 в организме мышей
6.1. Опыт in vivo с применением мышей линии C57BL/6
Кинетический анализ in vivo человеческого С5 (фирма Calbiochem) и антитела к человеческому С5 осуществляли после введения только человеческого С5 или человеческого С5 и антитела к человеческому С5 мышам C57BL/6 (фирма In Vivos or Biological Resource Centre, Сингапур). Раствор человеческого C5 (0,01 мг/мл) или раствор смеси, содержащей человеческий С5 и антитело к человеческому С5 (0,01 мг/мл и 2 мг/мл (CFA0305-F760G4, CFA0307-F760G4, CFA0366-F760G4, CFA0501-F760G4, CFA0538-F760G4, CFA0599-F760G4, CFA0666-F760G4, CFA0672-F760G4 и CFA0675-F760G4) или 0,2 мг/мл (CFA0330-F760G4 и CFA0341-F760G4) соответственно), вводили однократно в дозе 10 мл/кг в каудальную вену. В этом случае антитело к человеческому С5 присутствовало в избытке относительно человеческого С5, и поэтому можно предположить, что каждый человеческий С5 связывался с антителом. Кровь собирали через 5 мин, 7 ч, 1 день, 2 дня, 3 дня и 7 дней после введения. Собранную кровь немедленно центрифугировали при 14000 об/мин и 4°С в течение 10 мин для отделения плазмы. Отделенную плазму хранили в морозильной камере при -80°С до анализа. Применяли описанные выше антитела к человеческому С5: CFA0305-F760G4, CFA0307-F760G4, CFA0330-F760G4, CFA0341-F760G4, CFA0366-F760G4, CFA0501-F760G4, CFA0538-F760G4, CFA0599-F760G4, CFA0666-F760G4, CFA0672-F760G4 и CFA0675-F760G4.
6.2. Измерение общей концентрации в плазме человеческого С5 с помощью электрохемилюминесцентного (ECL) анализа
Общую концентрацию человеческого С5 в плазме мышей измеряли с помощью ECL.
В присутствии в образце плазмы CFA0330-F760G4, CFA0341-F760G4 или только человеческого С5 использовали следующий метод. Антитело к человеческому С5 (фирма Santa Cruz) вносили в пустой 96-луночный планшет MULTI-ARRAY (фирма Meso Scale Discovery) и давали выстояться в течение ночи при 4°С для получения планшетов с иммобилизованными антителами к человеческому С5. Приготавливали образцы для построения калибровочной кривой и образцы мышиной плазмы, разведенные в 100 или более раз, в которые инъецировали антитело в концентрации 1 мкг/мл (CFA0330-F760G4 или CFA0341-F760G4) и инкубировали в течение 30 мин при 37°С. Затем образцы вносили в планшеты с иммобилизованным антителом к человеческому С5 и давали выстояться в течение 1 ч при комнатной температуре. Затем добавляли меченное SULFO-меткой антитело к человеческому IgG (фирма Meso Scale Discovery) и давали прореагировать в течение 1 ч при комнатной температуре, и осуществляли промывку. После этого немедленно вносили буфер для считывания (Read Buffer) Т (×4) (фирма Meso Scale Discovery) и измерения осуществляли с использованием устройства Sector Imager 2400 (фирма Meso Scale Discovery).
В присутствии в образце плазмы CFA0305-F760G4, CFA0307-F760G4, CFA0366-F760G4, CFA0501-F760G4, CFA0538-F760G4, CFA0599-F760G4, CFA0666-F760G4, CFA0672-F760G4 или CFA0675-F760G4 применяли следующий метод. Антитело к человеческому С5 (CFA0329-F939G4; VH, SEQ ID NO: 23 и VL, SEQ ID NO: 27) вносили в пустой 96-луночный планшет MULTI-ARRAY (фирма Meso Scale Discovery) и давали выстояться в течение ночи при 4°С для получения планшетов с иммобилизованными антителами к человеческому С5. Приготавливали образцы для построения калибровочной кривой и образцы мышиной плазмы, разведенные в 100 или более раз кислым раствором (рН 5,5), и инкубировали в течение 30 мин при 37°С. Затем образцы вносили в планшеты с иммобилизованным антителом к человеческому С5 и давали выстояться в течение 1 ч при комнатной температуре. Затем добавляли меченное SULFO-меткой антитело к человеческому С5 (CFA0300-F939G4; VH, SEQ ID NO: 24 и VL, SEQ ID NO: 28) и давали прореагировать в течение 1 ч при комнатной температуре, и осуществляли промывку. После этого немедленно вносили буфер для считывания Т (×4) (фирма Meso Scale Discovery) и измерения осуществляли с использованием устройства Sector Imager 2400 (фирма Meso Scale Discovery).
Концентрацию человеческого С5 рассчитывали на основе ответа, полученного с помощью калибровочной кривой, с применением программного обеспечения SOFTmax PRO (фирма Molecular Devices). График зависимости от времени концентрации в плазме человеческого С5 после внутривенного введения, полученный указанным методом, представлен на фиг. 13. Данные на графике представлены в виде процента оставшегося С5 по сравнению с концентрацией в плазме человеческого С5 через 5 мин.
6.3. Измерение концентрации антитела к человеческому С5 в плазме с помощью ECL-анализа
Концентрацию антитела к человеческому С5 в плазме мышей измеряли с помощью ECL. F(ab')2-фрагмент антитела к человеческому IgG (специфического для гамма-цепи) (фирма Sigma) или антитело к каппа-цепи человеческого IgG (фирма Antibody Solutions) вносили в пустой 96-луночный планшет MULTI-ARRAY (фирма Meso Scale Discovery) и давали выстояться в течение ночи при 4°С для получения планшетов с иммобилизованным антителом к человеческому IgG. Приготавливали образцы для построения калибровочной кривой и образцы мышиной плазмы, разведенные в 100 или более раз. Затем образцы вносили в планшеты с иммобилизованным античеловеческим IgG и давали выстояться в течение 1 ч при комнатной температуре. Затем добавляли биотинилированное антитело к человеческому IgG (фирма Southernbiotech) или меченное SULFO-меткой антитело к человеческому IgG, Fc (фирма Southernbiotech) и давали прореагировать в течение 1 ч при комнатной температуре, и осуществляли промывку. Затем, только в случае, когда использовали биотинилированное антитело к человеческому IgG, добавляли меченный SULFO-меткой стрептавидин (фирма Meso Scale Discovery) и давали прореагировать в течение 1 ч при комнатной температуре, и осуществляли промывку. После этого немедленно вносили буфер для считывания Т (×4) (фирма Meso Scale Discovery) и измерения осуществляли с использованием устройства Sector Imager 2400 (фирма Meso Scale Discovery). Концентрацию человеческого С5 рассчитывали на основе ответа, полученного с помощью калибровочной кривой, с применением программного обеспечения SOFTmax PRO (фирма Molecular Devices). График зависимости от времени концентрации в плазме человеческого С5 после внутривенного введения, полученный указанным методом, представлен на фиг. 14. Данные на графике представлены в виде процента оставшегося С5 по сравнению с концентрацией в плазме человеческого С5 через 5 мин.
6.4. Воздействие рН-зависимого связывания антитела к человеческому С5 на клиренс человеческого С5 in vivo
рН-зависимые антитела к человеческому С5 (CFA0305-F760G4, CFA0307-F760G4, CFA0366-F760G4, CFA0501-F760G4, CFA0538-F760G4, CFA0599-F760G4, CFA0666-F760G4, CFA0672-F760G4 и CFA0675-F760G4) и не обладающие рН-зависимостью антитела к человеческому С5 (CFA0330-F760G4 и CFA0341-F760G4) тестировали in vivo и осуществляли сравнение концентрации в плазме антитела к человеческому С5 и концентрации в плазме человеческого С5. Как продемонстрировано на фиг. 14, экспозиция антител оказалась сопоставимой. При этом клиренс человеческого С5, который вводили одновременно с рН-зависимыми антителами к человеческому С5, повышался по сравнению с клиренсом в присутствии не обладающих рН-зависимостью антител к человеческому С5 (фиг. 13).
Пример 7
Оптимизация моноклональных антител к С5 (варианты антитела 305)
Большое количество мутаций вносили в оптимизированную вариабельную область антитела к С5 305LO5 для дополнительного улучшения его свойств, и создавали оптимизированные вариабельные области 305LO15, 305LO16, 305LO18, 305LO19, 305LO20, 305LO22 и 305LO23. Аминокислотные последовательности VH и VL вариантов 305 представлены в таблицах 7 и 8 соответственно. Гены, кодирующие гуманизированную VH, объединяли с модифицированным вариантом СН человеческого IgG1 SG115 (SEQ ID NO: 114) и модифицированными вариантами СН человеческого IgG4 SG422 (SEQ ID NO: 115) или SG429 (SEQ ID NO: 116). Гены, кодирующие гуманизированную VL, объединяли с человеческой CL (SK1, SEQ ID NO: 38). Отдельно синтезировали гены тяжелой и легкой цепи, кодирующие гуманизированное антитело к С5 BNJ441 (BNJ441H, SEQ ID NO: 149; BNJ441L, SEQ ID NO: 150), и каждый из них клонировали в экспрессионном векторе.
Антитела экспрессировали в клетках HEK293, совместно трансфектированных комбинацией экспрессионных векторов для тяжелой и легкой цепи, и очищали с использованием белка А.
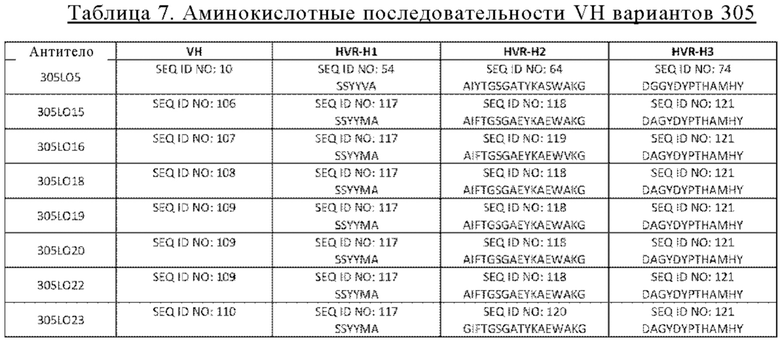

Пример 8
Характеризация связывания антител к С5 (варианты 305)
Кинетические параметры антител к С5, а именно, параметры связывания с рекомбинантным человеческим С5, оценивали при 37°С с использованием устройства BIACORE® Т200 (фирма GE Healthcare) при трех различных условиях: (1) и ассоциация, и диссоциация, имели место при рН 7,4, (2) и ассоциация, и диссоциация, имели место при рН 5,8, и (3) ассоциация имела место при рН 7,4, но диссоциация имела место при рН 5,8. ProA/G (фирма Pierce) иммобилизовали на сенсорном чипе СМ1 с использованием набора для аминного сочетания (фирма GE Healthcare) с применением условий, рекомендованных фирмой GE Healthcare. Антитела и аналиты для условий (1) и (3) разводили в буфере ACES рН 7,4 (20 мМ ACES, 150 мМ NaCl, 1,2 мМ CaCl2, 0,05% Твин 20, 0,005% NaN3), для условия (2) их разводили в буфере ACES рН 5,8 (20 мМ ACES, 150 мМ NaCl, 1,2 мМ CaCl2, 0,05% Твин 20, 0,005% NaN3). Каждое антитело «захватывали» на поверхности сенсора с помощью ProA/G. Уровни «захвата» антител, как правило, соответствовали 60-90 резонансным единицам (RU). Затем инъецировали рекомбинантный человеческий С5 в концентрациях от 3 до 27 нМ или от 13,3 до 120 нМ, полученных трехкратным серийным разведением, после чего осуществляли диссоциацию. Поверхность регенерировали с использованием 25 мМ NaOH. Кинетические параметры для условий (1) и (2) определяли путем аппроксимации сенсограмм на основе модели связывания 1:1, а скорость диссоциации для условия (3) определяли путем аппроксимации сенсограмм на основе модели диссоциации 1:1 для MCK с использованием программного обеспечения BIACORE® Т200 Evaluation, версия 2.0 (фирма GE Healthcare). Зависимость от рН для всех антител представляли в виде отношения скоростей диссоциации для условий (2) и (1).
Скорость ассоциации (ka), скорость диссоциации (kd), аффинность связывания (KD) и зависимость от рН представлены в таблице 9. Все антитела характеризовались большей скоростью диссоциации при рН 5,8, чем при рН 7,4, а их зависимость от рН (изменение при переходе от рН 5,8 к рН 7,4) была примерно 20-кратной.
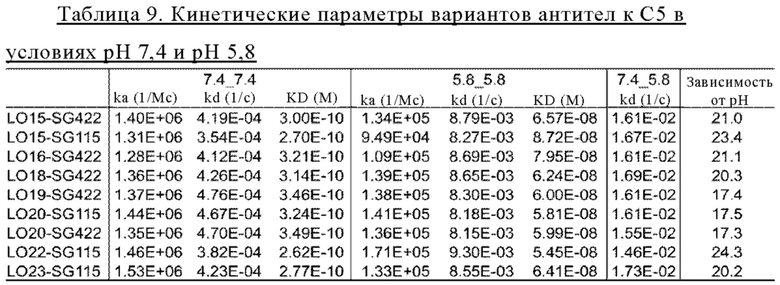
Для оценки влияния рН на связывание антигена определяли аффинность связывания антител к С5 (BNJ441, экулизумаба и варианта 305) с рекомбинантным человеческим С5 при рН 7,4 и рН 5,8 при 37°С с использованием устройства BIACORE® T200 (фирма GE Healthcare). Поликлональное козье антитело к человеческому IgG (Fc) (фирма KPL, №01-10-20) иммобилизовали на сенсорном чипе СМ4 с использованием набора для аминного сочетания (фирма GE Healthcare) с учетом условий, рекомендованных производителем. Антитела и аналиты разводили либо в буфере ACES рН 7,4, либо в буфере ACES рН 5,8, содержащем 20 мМ ACES, 150 мМ NaCl, 1,2 мМ CaCl2, 0,05% Твин 20 и 0,005% NaN3. Антитела «захватывали» на поверхности сенсора согласно методу, основанному на использовании антитела к Fc, уровни «захвата», как правило, соответствовали 50-80 резонансным единицам (RU). Приготавливали образцы рекомбинантного человеческого С5 путем трехкратного серийного разведения, начиная с 27 нМ для анализа в условиях рН 7,4, или с 135 нМ для анализа в условиях рН 5,8. Поверхность регенерировали с использованием 20 мМ HCl, 0,01% Твин 20. Обработку данных и аппроксимацию на основе модели связывания 1:1 осуществляли с использованием программного обеспечения BiaEvaluation 2.0 (фирма GE Healthcare).
Аффинности связывания (KD) BNJ441, экулизумаба и варианта 305 с рекомбинантным человеческим С5 при рН 7,4 и рН 5,8 представлены в таблице 10. Для варианта 305 отношение (KD при рН 5,8)/(KD при рН 7,4) составляло почти 800, т.е. в 8 раз больше, чем для BNJ441, для которого отношение (KD при рН 5,8)/(KD при рН 7,4) составляло лишь 93.

Пример 9
Активность антител к С5 (вариантов 305) в отношении активации С5
9.1. Ингибирование МАт к С5 активируемого комплементом лизиса липосом
МАт к С5 тестировали в отношении ингибирования активности комплемента с помощью анализа лизиса липосом. 30 мкл сыворотки здорового человека (6,7%) (фирма Biopredic, SER019) смешивали с 20 мкл разведенного МАт в 96-луночном планшете и инкубировали на шейкере в течение 30 мин при комнатной температуре. В каждую лунку переносили липосомы, сенсибилизированные антителами к динитрофенилу (Autokit СН50, фирма Wako, 995-40801) и планшет помещали на 2 мин на шейкер при 37°С. В каждую лунку добавляли по 50 мкл раствора субстрата (Autokit СН50) и смешивали путем встряхивания в течение 2 мин при 37°С. Конечную смесь инкубировали при 37°С в течение 40 мин, а затем измеряли ОП смеси при 340 нм. Процент лизиса липосом определяли по формуле 100 × [(ОПМАт - ОПфон, обусловленный сывороткой и липосомами)]/[(ОПбез МАт - ОПфон, обусловленный сывороткой и липосомами)]. На фиг. 15 продемонстрировано, что МАт к С5 305LO15-SG422, 305LO16-SG422, 305LO18-SG422, 305LO19-SG422, 305LO20-SG422 и 305LO20-SG115 ингибировали лизис липосом. Два антитела с вариантами Fc 305LO15-SG115 и 305LO23-SG429 также ингибировали лизис липосом (фиг. 16).
МАт к С5 тестировали в отношении ингибирования рекомбинантного человеческого С5 (SEQ ID NO: 39). Смешивали 10 мкл человеческой сыворотки с дефицитом С5 (фирма Sigma, С1163) с 20 мкл разведенного МАт и 20 мкл рекомбинантного С5 (0,1 мкг/мл) в 96-луночном планшете и инкубировали на шейкере в течение 1 ч при 37°С. В каждую лунку переносили липосомы (Autokit СН50) и помещали на шейкер на 2 мин при 37°С. В каждую лунку добавляли по 50 мкл раствора субстрата (Autokit СН50) и смешивали путем встряхивания в течение 2 мин при 37°С. Конечную смесь инкубировали при 37°С в течение 180 мин и затем измеряли ОП при 340 нм. Процент лизиса липосом определяли согласно указанной выше процедуре. На фиг. 17 продемонстрировано, что МАт к С5 305LO22-SG115, 305LO22-SG422, 305LO23-SG115 и 305LO23-SG422 ингибировали лизис липосом.
9.2. Ингибирование с помощью МАт к С5 образования С5а
МАт к С5 тестировали в отношении их воздействия на образование С5а в процессе лизиса липосом для подтверждения того, что МАт к С5 ингибируют расщепление С5 с образованием С5а и C5b. Уровни С5а в супернатантах, полученных при анализе лизиса липосом, количественно оценивали с использованием набора для ELISA для С5а (фирма R&D systems, DY2037). Все МАт ингибировали образование С5а в супернатантах в зависимости от дозы (фиг. 18 и 19).
9.3. Измерение активности комплемента в плазме обезьян циномолгус
МАт к С5 тестировали в отношении ингибирования активности комплемента в плазме обезьян циномолгус. МАт к С5 вводили обезьянам (20 мг/кг) и периодически собирали образцы плазмы вплоть до дня 56. Куриные эритроциты (cRBC) (фирма Innovative research, IC05-0810) промывали забуференным желатином/вероналом соляным раствором, содержащим 0,5 мМ MgCl2 и 0,15 мМ CaCl2 (GVB++) (фирма Boston BioProducts, IBB-300X), и после этого сенсибилизировали антителом к куриным RBC (Rockland 103-4139) в концентрации 1 мкг/мл в течение 15 мин при 4°С. Затем клетки промывали GVB++ и суспендировали в том же самом буфере из расчета 1×108 клеток/мл. В отдельном круглодонном 96-луночном планшете для микроанализа инкубировали плазму обезьян с сенсибилизированными cRBC при 37°С в течение 20 мин. После инкубации планшет центрифугировали при 1000 × g в течение 2 мин при 4°С. Супернатанты переносили в лунки плоскодонных 96-луночных планшетов для микроанализа для измерений ОП при 415 нм, длина референс-волны составляла 630 нм. Процент гемолиза определяли по формуле: 100 × [(ОПпосле введения - ОПфон, обусловленный плазмой и cRBC)]/[(ОПдо введения - ОПфон, обусловленный плазмой и cRBC)]. На фиг. 20 продемонстрировано, что МАт к С5 305LO15-SG422, 305LO15-SG115, 305LO16-SG422, 305LO18-SG422, 305LO19-SG422, 305LO20-SG422, 305LO20-SG115 и 305LO23-SG115 ингибировали активность комплемента в плазме.
9.4. Ингибирование с помощью МАт к С5 биологической активности вариантов С5
Мат к С5 тестировали в отношении ингибирования следующих вариантов рекомбинантного человеческого С5: V145I, R449G, V802I, R885H, R928Q, D966Y, S1310N и E1437D. Известно, что пациенты с PNH, которые имеют мутацию R885H в С5, дают слабый ответ на экулизумаб (см., например, Nishimura и др., New Engl. J. Med. 370, 2014, cc. 632-639). Каждый из вариантов человеческого С5 экспрессировали в клетках FS293 и супернатанты использовали в описанном ниже исследовании. Смешивали 10 мкл человеческой сыворотки с дефицитом С5 (фирма Sigma, С1163) с 20 мкл разведенного МАт и 20 мкл среды для культуры клеток, содержащей вариант рекомбинантного С5 (2-3 мкг/мл), в 96-луночном планшете и инкубировали на шейкере в течение 0,5 ч при 37°С. В каждую лунку переносили липосомы (Autokit СН50) и помещали на шейкер на 2 мин при 37°С. В каждую лунку добавляли по 50 мкл раствора субстрата (Autokit СН50) и смешивали путем встряхивания в течение 2 мин при 37°С. Конечную смесь инкубировали при 37°С в течение 90 мин и затем измеряли ОП при 340 нм. Процент лизиса липосом определяли согласно описанной выше процедуре. На фиг. 21 продемонстрировано, что МАт к С5 (экулизумаб) не ингибировало R885H - вариант С5, но ингибировало другие протестированные варианты. На фиг. 22 продемонстрировано, что МАт к С5 (вариант 305) ингибировало все протестированные варианты С5.
9.5. Ингибирование с помощью МАт к С5 активируемого комплементом лизиса липосом
МАт к С5 тестировали в отношении ингибирования активности комплемента с помощью анализа лизиса липосом. Смешивали 30 мкл сыворотки здорового человека (6,7%) (фирма Biopredic, SER019) с 20 мкл разведенного МАт в 96-луночном планшете на шейкере в течение 30 мин при комнатной температуре. В каждую лунку переносили раствор липосом, сенсибилизированных антителами к динитрофенилу (Autokit СН50, фирма Wako, 995-40801) и помещали на шейкер на 2 мин при 25°С. В каждую лунку добавляли по 50 мкл раствора субстрата (Autokit СН50) и смешивали путем встряхивания в течение 2 мин при 25°С. Конечную смесь инкубировали при 37°С в течение 45 мин и затем измеряли ОП при 340 нм. Процент ингибирования лизиса липосом определяли по формуле 100 × [(ОПМАт - ОПфон, обусловленный сывороткой и липосомами)]/[(ОПбез МАт - ОПфон, обусловленный сывороткой и липосомами)]. На фиг. 23 продемонстрировано, что МАт к С5 BNJ441 и вариант 305 ингибировали лизис липосом, и что вариант 305 обладал более сильной ингибирующей активностью, чем BNJ441.
Пример 10
Фармакокинетическое исследование моноклональных антител к С5 (варианты 305) с использованием обезьян циномолгус
10.1. Оценка in vivo с использованием обезьян циномолгус
Кинетические анализы in vivo антитела к человеческому С5 осуществляли после введения антитела к человеческому С5 обезьянам циномолгус (фирма Shin Nippon Biomedical Laboratories, Ltd., Япония). Раствор антитела к человеческому С5 (2,5 мг/мл) вводили однократно в дозе примерно 8 мл/кг в цефалическую вену предплечья путем 30-минутной инфузии. Кровь собирали до введения и через 5 мин, 7 ч, 1 день, 2 дня, 3 дня, 7 дней, 14 дней, 21 день, 28 дней, 35 дней, 42 дня, 49 дней и 50 дней после введения. Собранную кровь немедленно центрифугировали при 1700 × g и 4°С в течение 10 мин для отделения плазмы. Отделенную плазму хранили в морозильной камере при -70°С или ниже до анализа. Антитела к человеческому С5 получали согласно методу, описанному в примере 7.
10.2. Измерение общей концентрации С5 в плазме обезьян циномолгус с помощью ELISA-анализа
Общую концентрацию С5 обезьян циномолгус в плазме обезьян циномолгус измеряли с помощью ELISA. Антитело к человеческому С5 (антитело, созданное в лаборатории заявителей с помощью метода, описанного в примере 2) вносили в планшет Nunc-ImmunoPlate MaxiSorp (фирма Nalge Nunc International) и давали выстояться в течение ночи при 4°С для получения планшетов с иммобилизованным С5 обезьян циномолгус. Приготавливали образцы для построения калибровочной кривой и образцы плазмы обезьян циномолгус, разведенные в 2000 раз, в которые инъецировали антитело в концентрации 0,4 мкг/мл, и инкубировали в течение 60 мин при 37°С. Затем образцы вносили в планшеты с иммобилизованным С5 обезьян циномолгус и давали выстояться в течение 1 ч при комнатной температуре. Затем добавляли меченное HRP антитело к человеческому IgG (фирма SouthernBiotech) и давали прореагировать в течение 30 мин при комнатной температуре, и осуществляли промывку. Затем добавляли субстрат ABTS ELISA HRP (фирма KPL). Сигнал измеряли с помощью планшет-ридера при длине волны 405 нм. Концентрацию С5 обезьян циномолгус рассчитывали на основе ответа, полученного с помощью калибровочной кривой, с использованием аналитического программного обеспечения SOFTmax PRO (фирма Molecular Devices). График зависимости от времени концентрации С5 в плазме обезьян циномолгус после внутривенного введения, полученный указанным методом, представлен на фиг. 24. Данные на графике представлены в виде процента оставшегося С5 по сравнению с концентрацией С5 в плазме обезьян циномолгус до введения. При применении рН-зависимых антител к человеческому С5 (305LO15-SG422, 305LO15-SG115, 305LO16-SG422, 305LO18-SG422, 305LO19-SG422, 305LO20-SG422, 305LO20-SG115, 305LO22-SG422, 305LO23-SG422 и 305LO23-SG115) обнаружено меньшее накопление С5 в плазме по сравнению с не обладающими рН-зависимостью антителами к человеческому С5.
10.3. Измерение концентрации в плазме антитела к человеческому С5 с помощью ELISA-анализа
Концентрацию антитела к человеческого С5 в плазме обезьян циномолгус измеряли с помощью ELISA. Антитело к каппа-цепи человеческого IgG (фирма Antibody Solutions) вносили в планшет Nunc-ImmunoPlate MaxiSorp (фирма Nalge Nunc International) и давали выстояться в течение ночи при 4°С для получения планшетов с иммобилизованным античеловеческим IgG. Приготавливали образцы для построения калибровочной кривой и образцы плазмы обезьян циномолгус, разведенные в 100 или более раз. Затем образцы вносили в планшеты с иммобилизованным античеловеческим IgG и давали выстояться в течение 1 ч при комнатной температуре. Затем добавляли меченное HRP антитело к человеческому IgG (фирма SouthernBiotech) и давали прореагировать в течение 30 мин при комнатной температуре, и осуществляли промывку. Затем добавляли субстрат ABTS ELISA HRP (фирма KPL). Сигнал измеряли с помощью планшет-ридера при длине волны 405 нм. Концентрацию антитела к человеческому С5 рассчитывали на основе ответа, полученного с помощью калибровочной кривой, с использованием аналитического программного обеспечения SOFTmax PRO (фирма Molecular Devices). График зависимости от времени концентрации в плазме антитела к человеческому С5 после внутривенного введения, полученный указанным методом, представлен на фиг. 25. рН-зависимые антитела к человеческому С5 (305LO15-SG422, 305LO15-SG115, 305LO16-SG422, 305LO18-SG422, 305LO19-SG422, 305LO20-SG422, 305LO20-SG115, 305LO22-SG422, 305LO23-SG422 и 305LO23-SG115) характеризовались более длительным временем полужизни по сравнению с не обладающими рН-зависимостью антителами к человеческому С5.
Пример 11
Рентгенографический анализ кристаллической структуры комплекса, содержащего Fab варианта 305 и MG1-домен человеческого С5
11.1. Экспрессия и очистка MG1-домена (20-124) человеческого С5
Домен MG1 (аминокислотные остатки 20-124 SEQ ID NO: 39), слитый с GST-меткой посредством расщепляемого тромбином линкера (GST-MG1), экспрессировали в штамме Е. coli BL21 DE3 pLysS (фирма Promega) с использованием вектора pGEX-4T-1 (фирма GE healthcare). Экспрессию белка индуцировали с использованием 0,1 мМ изопропил-бета-D-1-тиогалактопиранозида (ИПТГ) при 25°С в течение 5 ч. Дебрис бактериальных клеток лизировали с использованием реагента Bugbuster (фирма Merck), дополненного лизоназой (фирма Merck) и полным коктейлем ингибиторов протеаз (фирма Roche), после чего осуществляли очистку GST-MG1 из растворимой фракции с использованием колонки GSTrap (фирма GE healthcare) согласно инструкциям производителя. GST-метку отщепляли тромбином (фирма Sigma) и полученный MG1-домен подвергали дальнейшей очистке на колонке для гель-фильтрации с Superdex 75 (фирма GE healthcare). Объединяли фракции, содержащие MG1-домен, и хранили при -80°С.
11.2. Получение Fab-фрагмента варианта 305
Fab-фрагменты одного из оптимизированных вариантов 305 получали с помощью стандартного метода с использованием ограниченного расщепления папаином (фирма Roche Diagnostics, каталожный номер 1047825), после чего вносили в колонку с белком A (MabSlect SuRe, фирма GE Healthcare) для удаления Fc-фрагментов, катионообменную колонку (HiTrap SP HP, фирма GE Healthcare) и колонку для гель-фильтрации (Superdex 200 16/60, фирма GE Healthcare). Объединяли фракции, содержащие Fab-фрагмент, и хранили при -80°С.
11.3. Получение комплекса, содержащего Fab варианта 305 и MG1-домен человеческого С5
Очищенный MG1-домен рекомбинантного человеческого С5 смешивали с очищенным Fab-фрагментом варианта 305 в молярном соотношении 1:1. Комплекс очищали с помощью гель-фильтрации (Superdex 200 Increase 10/300, фирма GE Healthcare) с использованием колонки, уравновешенной 25 мМ HEPES рН 7,5, 100 мМ NaCl.
11.4. Кристаллизация
Очищенные комплексы концентрировали до примерно 10 мг/мл и осуществляли кристаллизацию методом диффузии паров в варианте «сидящей» капли в комбинации с методом затравки при 4°С. Раствор в резервуаре состоял из 0,2 М формиата магния, 15,0% (мас./об.) полиэтиленгликоля 3350. Таким путем через несколько дней получали пластинчатые кристаллы. Кристаллы пропитывали раствором, содержащим 0,2 М дегидрата формиата магния, 25,0% (мас./об.) полиэтиленгликоля 3350 и 20% глицерина.
11.5. Сбор данных и определение структуры
Данные о дифракции рентгеновских лучей получали с помощью устройства BL32XU на синхротроне SPring-8. В процессе измерений кристалл постоянно находился в потоке азота при -178°С для поддержания его в замороженном состоянии, и с использованием MX-225HS CCD-детектора (RAYONIX), помещенного на оси пучка, получали, осуществляя каждый раз поворот кристалла на 1,0 градуса, в общей сложности 180 картин дифракции рентгеновских лучей. Определение параметров элементарных ячеек, индексацию дифракционных пятен и обработку данных о дифракции, полученных из картин дифракции, осуществляли с использованием программы Xia2 (J. Appl. Cryst. 43, 2010, cc. 186-190), пакета программ XDS (Acta. Cryst. D66, 2010, cc. 125-132) и Scala (Acta. Cryst. D62, 2006, cc. 72-82) и в итоге получали данные о дифракционной интенсивности с разрешением вплоть до 2,11  . Результаты статистической обработки кристаллографических данных представлены в таблице 11.
. Результаты статистической обработки кристаллографических данных представлены в таблице 11.
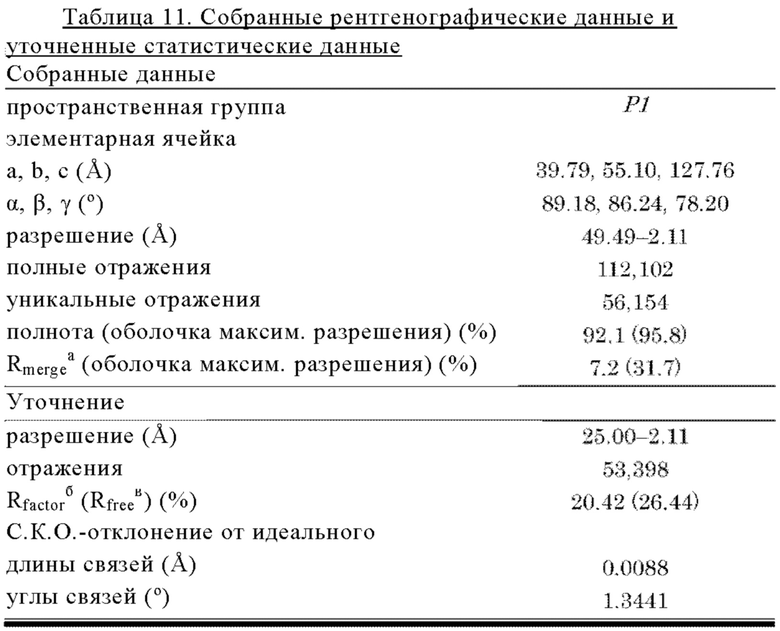
a; 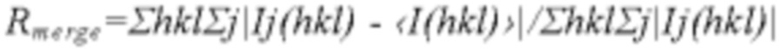 , где
, где 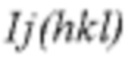 и
и 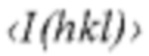 обозначают интенсивность измеряемого параметра j и среднюю интенсивность отражения с индексом
обозначают интенсивность измеряемого параметра j и среднюю интенсивность отражения с индексом 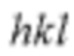 соответственно.
соответственно.
б; фактор 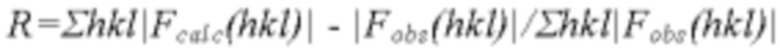 , где Fobs и
, где Fobs и 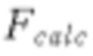 обозначают измеренные и рассчитанные амплитуды структурного фактора соответственно.
обозначают измеренные и рассчитанные амплитуды структурного фактора соответственно.
в; Rƒree рассчитывали с использованием 5% отражений, отобранных случайным образом.
Структуру определяли методом молекулярного замещения с использованием программы Phaser (J. Appl. Cryst. 40, 2007, cc. 658-674). Поисковую (стартовую) модель Fab-домена получали на основе опубликованной кристаллической структуры Fab IgG4 (PDB код:1BBJ), а стартовую модель MG1-домена получали на основе опубликованной кристаллической структуры человеческого С5 (PDB код: 3CU7, Nat. Immunol. 9, 2008, сс. 753-760). Модель строили с использованием программы Coot (Acta Cryst. D66, 2010, сс. 486-501) и уточняли с использованием программы Refmac5 (Acta Cryst. D67, 2011, сс. 355-367). Кристаллографический фактор достоверности (R) для данных о дифракционной интенсивности при разрешении 25-2.11  составлял 20,42%, при этом величина Free R составляла 26,44%. Уточненные статистические данные о структуре представлены в таблице 11.
составлял 20,42%, при этом величина Free R составляла 26,44%. Уточненные статистические данные о структуре представлены в таблице 11.
11.6. Общая структура комплекса, содержащего Fab варианта 305 и MG1-домент С5
Fab-фрагмент оптимизированного варианта 305 («305 Fab»), связанный с MG1-доменом человеческого С5 («MG1») в соотношении 1:1, и асимметричная элементарная ячейка кристаллической структуры, содержащая два комплекса, а именно, молекулы 1 и 2, представлены на фиг. 26А. Молекулы 1 и 2 оказалось возможным хорошо совместить друг с другом с величиной среднеквадратичного отклонения (С.К.О.), составляющей 0,717  , в положении альфа-атома С во всех остатках, как продемонстрировано на фиг. 26Б. Описанные ниже чертежи получали с использованием молекулы 1.
, в положении альфа-атома С во всех остатках, как продемонстрировано на фиг. 26Б. Описанные ниже чертежи получали с использованием молекулы 1.
На фиг. 27А и 27Б картирован эпитоп для контактной области 305 Fab в аминокислотной последовательности и кристаллической структуре MG1 соответственно. Эпитоп включает аминокислотный остаток в MG1, который содержит один или несколько атомов, находящихся на расстоянии до 4,5  от любой части 305 Fab в кристаллической структуре. Кроме того, на фиг. 27А выделен эпитоп, находящийся в пределах 3,0
от любой части 305 Fab в кристаллической структуре. Кроме того, на фиг. 27А выделен эпитоп, находящийся в пределах 3,0  .
.
11.7. Взаимодействия с Е48, D51 и K109
Как описано в примерах 4.5 и 4.6, МАт к С5, которые включали антитела серии 305, тестировали в отношении связывания с тремя содержащими точечные мутации Е48А, D51A и K109A мутантами человеческого С5, с помощью анализов связывания методами вестерн-блоттинга и BIACORE®. В то время как варианты 305 характеризовались сильным связыванием с С5 WT, для них было выявлено лишь слабое связывание с Е48А-мутантом С5 и отсутствие связывания с D51A- и K109A-мутантами. Анализ кристаллической структуры комплекса, содержащего 305 Fab и MG1, позволил установить, что все три аминокислоты Е48, D51 и K109 находятся на расстоянии до 3,0  от 305 Fab, образуя многочисленные водородные связи с Fab, как продемонстрировано на фиг. 28А. При более подробном исследовании было установлено, что остаток K109 MG1 находится в бороздке, образованной на поверхности раздела между MG1 и тяжелой цепью Fab и тесно связан с Fab тремя водородными связями с Н-CDR3_G97, H-CDR3_Y100 и H-CDR3_T100b, и соляным мостиком с Н-CDR3_D95 (фиг. 28Г). D51 находится между MG1 и тяжелой цепью 305 Fab и связан двумя водородными связями с H-CDR1_Ser32 и H-CDR2_Ser54, заполняя тем самым пространство (фиг. 28В). Это свидетельствует о том, что оба остатка, и K109 и D51, С5 являются остатками, имеющими решающее значение для связывания антител серии 305. С другой стороны, Е48 расположен ближе к поверхности и связан лишь одной водородной связью с Fab, это позволяет предположить, что его вклад в связывание антитела должно быть меньше, чем вклад K109 и Е51 (фиг. 28Б). Указанные взаимосвязи согласуются с результатами анализов связывания с помощью методов вестерн-блоттинга и BIACORE® мутантов человеческого С5 (примеры 4.5 и 4.6). Дополнительное замечание: нумерация остатков аминокислот Fab основана на схеме нумерации Кэбота (Kabat и др., Sequences of Proteins of Immunological Interest, 5-е изд., изд-во Public Health Service, National Institutes of Health, Bethesda, Md., 1991).
от 305 Fab, образуя многочисленные водородные связи с Fab, как продемонстрировано на фиг. 28А. При более подробном исследовании было установлено, что остаток K109 MG1 находится в бороздке, образованной на поверхности раздела между MG1 и тяжелой цепью Fab и тесно связан с Fab тремя водородными связями с Н-CDR3_G97, H-CDR3_Y100 и H-CDR3_T100b, и соляным мостиком с Н-CDR3_D95 (фиг. 28Г). D51 находится между MG1 и тяжелой цепью 305 Fab и связан двумя водородными связями с H-CDR1_Ser32 и H-CDR2_Ser54, заполняя тем самым пространство (фиг. 28В). Это свидетельствует о том, что оба остатка, и K109 и D51, С5 являются остатками, имеющими решающее значение для связывания антител серии 305. С другой стороны, Е48 расположен ближе к поверхности и связан лишь одной водородной связью с Fab, это позволяет предположить, что его вклад в связывание антитела должно быть меньше, чем вклад K109 и Е51 (фиг. 28Б). Указанные взаимосвязи согласуются с результатами анализов связывания с помощью методов вестерн-блоттинга и BIACORE® мутантов человеческого С5 (примеры 4.5 и 4.6). Дополнительное замечание: нумерация остатков аминокислот Fab основана на схеме нумерации Кэбота (Kabat и др., Sequences of Proteins of Immunological Interest, 5-е изд., изд-во Public Health Service, National Institutes of Health, Bethesda, Md., 1991).
11.8. Взаимодействия между H70, H72 и Н110 человеческого С5 и антителами серии 305
Анализ кристаллической структуры позволил установить, что три остатка гистидина в человеческом С5, а именно, Н70, Н72 и H110, входят в эпитоп для Fab варианта 305, что проиллюстрировано на фиг. 27А и фиг. 29А. Осуществляли анализ связывания методом BIACORE® для изучения вклада этих остатков гистидина в рН-зависимое белок-белковое взаимодействие между человеческим С5 и Fab варианта 305 с использованием H70Y-, H72Y-, H110Y- и H70Y+H110Y-мутантов человеческого С5 (пример 4.7). Мутация H72Y приводила к полному устранению связывания Fab варианта 305 с С5. Указанный остаток в С5 находится в кармане, образованном CDR2-петлей в тяжелой цепи 305 Fab и петлей в MG1 (L73, S74 и Е76), плотно заполняет это пространство, что проиллюстрировано на фиг. 29В. Кроме того, остаток Н72 в С5 связан водородной связью с H-CDR2_Y58. Не следует ожидать, что мутация H72Y будет допустимой, поскольку не имеется достаточного пространства для включения имеющей больший объем боковой цепи тирозина. Водородная связь с H-CDR2_Y58 также не может сохраняться. Касательно вклада Н70 и Н110 в рН-зависимость, мутации H70Y и H110Y приводят к более медленному отделению в результате диссоциации Fab варианта 305 от С5 при рН 5,8. Н70 образует внутримолекулярную водородную связь с Т53 MG1, которая, как предполагается, должна разрушаться при рН 5,8, когда протонирование Н70 в С5 вызывает конформационное изменение в соответствующем участке участвующей во взаимодействии поверхности раздела MG1 (фиг. 29Б). Для Н110 следует ожидать, что протонирование этого остатка в С5 должно вызывать отталкивание зарядов от 305 Fab, которое может быть усилено в результате протонирования соседнего остатка гистидина, H-CDR3_H100c (фиг. 29Г).
Хотя выше изобретение описано для лучшего понимания с указанием некоторых деталей с целью иллюстрации и примеров, описание и примеры не должны рассматриваться в качестве ограничивающих объем изобретения. Описание всей патентной и научной литературы, процитированной в настоящем описании, специально полностью включено в настоящее описание в качестве ссылки.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ЧУГАИ СЕЙЯКУ КАБУСИКИ КАЙСЯ
<120> АНТИТЕЛА К C5 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ 5
<130> C1-A1606P
<150> JP 2016-120325
<151> 2016-06-17 <160> 150
<170> PatentIn version 3.5
<210> 1
<211> 121
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 1
Gln Ser Leu Glu Glu Ser Gly Gly Asp Leu Val Lys Pro Gly Ala Ser
1 5 10 15
Leu Ala Val Thr Cys Thr Ala Ser Gly Phe Ser Ser Ser Ser Ser Tyr
20 25 30
Tyr Met Cys Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Cys Ile Tyr Thr Gly Ser Gly Ala Thr Tyr Tyr Ala Ser Trp Ala
50 55 60
Lys Gly Arg Phe Thr Ile Ser Lys Thr Ser Ser Thr Thr Val Thr Leu
65 70 75 80
Gln Met Thr Ser Leu Thr Val Ala Asp Thr Ala Thr Tyr Phe Cys Ala
85 90 95
Ser Asp Gly Gly Tyr Val Thr Pro Thr His Ala Met Tyr Leu Trp Gly
100 105 110
Pro Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 2
<211> 117
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 2
Gln Ser Leu Glu Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Ala Ser
1 5 10 15
Leu Thr Leu Thr Cys Lys Ala Ser Gly Ile Asp Phe Ser Asn Phe Tyr
20 25 30
Tyr Ile Cys Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Asp Leu Ile
35 40 45
Ala Cys Ile Tyr Thr Val Ser Gly Tyr Thr Tyr Tyr Ala Ser Trp Ala
50 55 60
Lys Gly Arg Leu Thr Ile Ser Lys Thr Ser Ser Thr Thr Val Thr Leu
65 70 75 80
Gln Met Thr Ser Leu Thr Ala Ala Asp Thr Ala Thr Tyr Phe Cys Ala
85 90 95
Arg Asp Leu His Ala Gly Ile Thr Asn Leu Trp Gly Pro Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 3
<211> 122
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 3
Gln Ser Leu Glu Glu Ser Gly Gly Asp Leu Val Lys Pro Gly Ala Ser
1 5 10 15
Leu Ser Leu Thr Cys Thr Ala Ala Gly Leu Asp Phe Ser Ser Ser Tyr
20 25 30
Tyr Met Cys Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Ala Cys Ile Tyr Ala Gly Ser Ser Gly Ile Ile Tyr Tyr Ala Asn Trp
50 55 60
Ala Lys Gly Arg Phe Thr Ile Ser Arg Pro Ser Ser Thr Thr Val Thr
65 70 75 80
Leu Gln Met Thr Ser Leu Thr Ala Ala Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Thr Tyr Pro Thr Tyr Gly Asp Gly Gly His Ala Phe Asn Leu Trp
100 105 110
Gly Pro Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 4
<211> 117
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 4
Gln Ser Val Glu Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Thr Pro
1 5 10 15
Leu Thr Leu Thr Cys Thr Ala Ser Gly Phe Ser Leu Ser Ser Tyr Tyr
20 25 30
Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Met Ile Tyr Gly Ser Gly Ala Thr Tyr Tyr Ala Ser Trp Ala Lys Gly
50 55 60
Arg Phe Thr Ile Ser Lys Thr Ser Ser Thr Thr Val Asp Leu Lys Met
65 70 75 80
Thr Ser Leu Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala Arg Gln
85 90 95
Ile Tyr Ser Gly Asp Asn Asn Asp Asn Phe Trp Gly Pro Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 5
<211> 117
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 5
Gln Ser Val Glu Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Thr Pro
1 5 10 15
Leu Thr Leu Thr Cys Thr Ala Ser Gly Phe Ser Leu Ser Ser Tyr Tyr
20 25 30
Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Met Ile Tyr Gly Ser Gly Ala Thr Tyr Tyr Ala Ser Trp Ala Lys Gly
50 55 60
Arg Phe Thr Ile Ser Lys Thr Ser Ser Thr Thr Val Asp Leu Lys Met
65 70 75 80
Thr Ser Leu Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala Arg Gln
85 90 95
Ile Tyr Ser Gly Asp Asn Asn Asp Asn Phe Trp Gly Pro Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 6
<211> 117
<212> PRT <213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 6
Gln Ser Val Glu Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Thr Pro
1 5 10 15
Leu Thr Leu Thr Cys Thr Val Ser Gly Leu Ser Leu Ser Asp Asn Thr
20 25 30
Met Thr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Ile Ile Ser Phe Gly Gly Asp Ala Tyr Tyr Ala Ser Trp Ala Lys Gly
50 55 60
Arg Phe Pro Ile Ser Lys Thr Ser Thr Thr Val Asp Leu Arg Ile Thr
65 70 75 80
Ser Pro Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala Arg Val Gly
85 90 95
Ala Gly Asn Ile Phe Trp Tyr Phe Asp Leu Trp Gly Pro Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 7
<211> 116
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 7
Gln Ser Val Glu Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Thr Pro
1 5 10 15
Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Thr Tyr Ala
20 25 30
Met Gly Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Thr Ile Asp Thr Gly Asp Asn Ser Phe Tyr Ala Asn Trp Ala Lys Gly
50 55 60
Arg Phe Thr Ile Ser Lys Thr Ser Thr Thr Val Asp Leu Lys Ile Thr
65 70 75 80
Ser Pro Thr Ala Glu Asp Thr Ala Thr Tyr Phe Cys Ala Arg Asn Asp
85 90 95
Gly Ser Val Tyr Asn Leu Phe Asn Leu Trp Gly Pro Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 8
<211> 110
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 8
Gln Ser Val Glu Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Thr Pro
1 5 10 15
Leu Thr Leu Thr Cys Thr Ala Ser Gly Phe Ser Leu Ser Gly Asn Ala
20 25 30
Ile Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Cys Ile Tyr Thr Gly Ser Asp Thr Thr Tyr Tyr Ala Thr Trp Ala Lys
50 55 60
Gly Arg Phe Thr Ile Ser Lys Thr Ser Thr Thr Val Asp Leu Lys Ile
65 70 75 80
Ala Ser Pro Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala Arg Gly
85 90 95
Ser Gly Leu Trp Gly Pro Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 9
<211> 116 20
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 9
Gln Ser Val Glu Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Thr Pro
1 5 10 15
Leu Thr Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Ser Thr Tyr Ala
20 25 30
Met Gly Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Thr Ile Asp Thr Gly Asp Asn Ser Phe Tyr Ala Asn Trp Ala Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Thr Ser Thr Thr Val Asp Leu Lys Ile Thr
65 70 75 80
Ser Pro Thr Ala Glu Asp Thr Ala Thr Tyr Phe Cys Ala Arg Asn Asp
85 90 95
Gly Ser Val Tyr Asn Leu Phe Asn Leu Trp Gly Pro Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 10
<211> 123
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 10
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Ser His Ser Ser
20 25 30
Tyr Tyr Val Ala Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
35 40 45
Val Gly Ala Ile Tyr Thr Gly Ser Gly Ala Thr Tyr Lys Ala Ser Trp
50 55 60
Ala Lys Gly Arg Phe Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Ser Asp Gly Gly Tyr Asp Tyr Pro Thr His Ala Met His Tyr
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 11
<211> 110
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 11
Asp Val Val Met Thr Gln Thr Pro Ala Ser Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Lys Cys Gln Ala Ser Gln Asn Ile Gly Ser Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Lys Leu Ala Ser Gly Val Ser Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Lys Glu Phe Thr Leu Thr Ile Ser Asp Leu Glu Cys
65 70 75 80
Ala Asp Ala Val Thr Tyr Tyr Cys Gln Cys Thr Phe Val Gly Ser Ser
85 90 95
Tyr Gly Asn Ala Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105 110
<210> 12
<211> 110
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 12
Ala Ile Glu Met Thr Gln Thr Pro Phe Ser Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Lys Cys Gln Ala Ser Gln Asn Ile Tyr Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Arg Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Asn Leu Glu Ser Gly Val Pro Ser Arg Phe Lys Gly
50 55 60
Ser Gly Ser Gly Thr Glu Tyr Thr Leu Thr Ile Ser Asp Leu Glu Cys
65 70 75 80
Ala Asp Ala Ala Thr Tyr Tyr Cys Leu Gln Gly Tyr Ser Tyr Ser Asn
85 90 95
Val Asp Asp Ala Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105 110
<210> 13
<211> 112
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 13
Ala Gln Val Leu Thr Gln Thr Pro Ser Ser Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Gln Ser Ser Gln Ser Val Tyr Ser Ser
20 25 30
Asp Tyr Leu Ser Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu
35 40 45
Leu Ile Tyr Glu Ala Ser Lys Leu Ala Ser Gly Val Pro Pro Arg Phe
50 55 60
Ser Gly Ser Gly Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val
65 70 75 80
Gln Cys Asp Asp Ala Ala Thr Tyr Tyr Cys Gln Gly Thr Tyr Tyr Ser
85 90 95
Ser Gly Trp Tyr Phe Ala Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105 110
<210> 14
<211> 110
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 14
Ala Tyr Asp Met Thr Gln Thr Pro Ala Ser Val Glu Val Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Gln Ala Ser Glu Ser Ile Ser Asn Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Arg Pro Lys Leu Leu Ile
35 40 45
Tyr Arg Ala Ser Thr Leu Ala Ser Gly Val Ser Ser Arg Phe Lys Gly
50 55 60
Ser Gly Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Glu Cys
65 70 75 80
Asp Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Asp Tyr Ser Ser Ser Asn
85 90 95
Val Asp Asn Thr Phe Gly Gly Gly Thr Lys Val Val Val Glu
100 105 110
<210> 15
<211> 110
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 15
Ala Tyr Asp Met Thr Gln Thr Pro Ala Ser Val Glu Val Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Gln Ala Ser Glu Ser Ile Ser Asn Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Arg Pro Lys Leu Leu Ile
35 40 45
Tyr Arg Ala Ser Thr Leu Ala Ser Gly Val Ser Ser Arg Phe Lys Gly
50 55 60
Ser Gly Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Glu Cys
65 70 75 80
Asp Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Asp Tyr Ser Ser Ser Asn
85 90 95
Val Asp Asn Thr Phe Gly Gly Gly Thr Thr Val Val Val Glu
100 105 110
<210> 16
<211> 110
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 16
Ala Tyr Asp Met Thr Gln Thr Pro Ala Ser Val Glu Val Ser Val Gly
1 5 10 15
Gly Thr Val Thr Ile Lys Cys Gln Ala Ser Glu Ser Ile Tyr Ser Ala
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe Lys Gly
50 55 60
Ser Gly Ser Gly Thr Glu Tyr Thr Leu Thr Ile Ser Asp Leu Glu Cys
65 70 75 80
Ala Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Ser Ser Thr Asn
85 90 95
Val His Asn Ser Phe Gly Gly Gly Thr Thr Val Val Val Glu
100 105 110
<210> 17
<211> 110
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 17
Asp Val Val Met Thr Gln Thr Pro Ala Ser Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Lys Cys Gln Ala Ser Glu Asn Ile Tyr Ser Ala
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Leu Arg Pro Arg Leu Leu Ile
35 40 45
Tyr Tyr Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe Lys Gly
50 55 60
Ser Arg Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Asp Leu Glu Cys
65 70 75 80
Ala Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Asp Ile Asn Ser
85 90 95
Val Asp Asn Thr Phe Gly Gly Gly Thr Lys Val Val Val Glu
100 105 110
<210> 18
<211> 111
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 18
Asp Val Val Met Thr Gln Thr Pro Ala Ser Val Ser Ala Pro Val Gly
1 5 10 15
Gly Thr Val Thr Ile Lys Cys Gln Ala Ser Gln Asn Ile Tyr Ser Leu
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile
35 40 45
Tyr His Thr Ser Asp Leu Ala Ser Gly Val Pro Ser Arg Phe Arg Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Asp Leu Glu Cys
65 70 75 80
Ala Asp Ala Ala Thr Tyr Tyr Cys Gln Cys Thr Ala Tyr Gly Ser Ser
85 90 95
Asp Val Gly Gly Thr Phe Gly Gly Gly Thr Thr Val Val Val Glu
100 105 110
<210> 19
<211> 110
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 19
Asp Val Val Met Thr Gln Thr Pro Ala Ser Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Lys Cys Gln Ala Ser Glu Asn Ile Tyr Ser Ala
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Leu Arg Pro Arg Leu Leu Ile
35 40 45
Tyr Tyr Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe Lys Gly
50 55 60
Ser Arg Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Asp Leu Glu Cys
65 70 75 80
Ala Asp Ala Ala Ser Tyr Tyr Cys Gln Gln Tyr Tyr Asp Ile Asn Ser
85 90 95
Val Asp Asn Thr Phe Gly Gly Gly Thr Lys Val Val Val Glu
100 105 110
<210> 20
<211> 110
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 20
Asp Val Val Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Asn Ile Gly Ser Ser
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Lys Thr His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Gln Ser Thr Lys Val Gly Ser Ser
85 90 95
Tyr Gly Asn His Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 21
<211> 117
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 21
Gln Ser Leu Glu Glu Ser Gly Gly Asp Leu Val Glu Pro Gly Ala Ser
1 5 10 15
Leu Thr Leu Thr Cys Thr Ala Ser Gly Phe Ser Trp Asn Ser Gly Tyr
20 25 30
Asp Met Cys Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Ala Cys Ile Tyr Thr Gly Ser Ser Ala Asn Thr Ala Tyr Ala Asn Trp
50 55 60
Ala Lys Gly Arg Phe Thr Ile Ser Lys Thr Ser Ser Thr Thr Val Thr
65 70 75 80
Leu Gln Met Thr Gly Leu Thr Ala Ala Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg His Asp Asp Tyr Phe Phe Asp Leu Trp Gly Pro Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 22
<211> 115
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 22
Gln Ser Val Glu Glu Ser Gly Gly Arg Leu Val Thr Pro Gly Thr Pro
1 5 10 15
Leu Thr Leu Thr Cys Thr Val Ser Gly Ile Asp Leu Ser Ser Tyr Thr
20 25 30
Met Gly Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Cys Ile Gly
35 40 45
Tyr Ile His Ser Phe Gly Ser Thr Tyr Tyr Ala Ser Trp Ala Lys Gly
50 55 60
Arg Phe Thr Ile Ser Lys Thr Ser Thr Thr Val Asp Leu Glu Ile Thr
65 70 75 80
Ser Pro Thr Thr Glu Asp Thr Ala Thr Tyr Phe Cys Ala Arg Asp Val
85 90 95
Gly Gly Ser Ser Gly Trp Asp Leu Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 23
<211> 116
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 23
Gln Ser Leu Glu Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Ala Ser
1 5 10 15
Leu Thr Leu Thr Cys Thr Ala Ser Gly Phe Ser Phe Ser Ser Gly Tyr
20 25 30
Tyr Met Cys Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Cys Ile Gly Thr Ile Ser Asp Ser Thr Tyr Tyr Ala Ser Trp Ala
50 55 60
Lys Gly Arg Phe Pro Ile Ser Lys Ala Ser Ser Thr Thr Val Thr Leu
65 70 75 80
Gln Met Thr Ser Leu Thr Ala Ala Asp Thr Ala Thr Tyr Phe Cys Ala
85 90 95
Arg Asp Pro Tyr Ser Tyr Gly Asp Leu Trp Gly Pro Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 24
<211> 125
<212> PRT
- 21 -
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 24
Gln Glu Gln Leu Glu Glu Ser Gly Gly Asp Leu Val Lys Pro Glu Gly
1 5 10 15
Ser Leu Thr Leu Thr Cys Thr Ala Ser Gly Phe Ser Phe Ser Ser Gly
20 25 30
Asn Trp Ile Cys Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
35 40 45
Ile Ala Cys Ile Tyr Gly Gly Ser Val Gly Gly Thr Asp Tyr Ala Ser
50 55 60
Trp Ala Lys Gly Arg Phe Thr Val Ser Lys Thr Ser Ser Thr Thr Val
65 70 75 80
Thr Leu Gln Met Thr Ser Leu Thr Ala Ala Asp Thr Ala Thr Tyr Phe
85 90 95
Cys Ala Arg Met Glu Asp Gly Tyr Gly Tyr Gly Tyr Asp Thr Tyr Phe
100 105 110
Lys Leu Trp Gly Pro Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 25
<211> 114
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 25
Asp Val Val Met Thr Gln Thr Pro Ala Ser Val Ser Glu Ser Val Gly
1 5 10 15
Gly Thr Val Thr Ile Asn Cys Gln Ala Ser Gln Ser Ile Gly Asn Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Lys Gly
50 55 60
Ser Arg Ser Gly Thr Glu Pro Thr Leu Thr Asn Thr Leu Thr Ile Ser
65 70 75 80
Gly Val Gln Cys Ala Asp Val Ala Thr Tyr Tyr Cys Gln Ser Gly Trp
85 90 95
Tyr Gly Asn Ser Tyr Val Ala Ala Phe Gly Gly Gly Thr Glu Val Val
100 105 110
Val Lys
<210> 26
<211> 112
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 26
Asp Val Val Met Thr Gln Thr Pro Ser Ser Val Ser Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Lys Cys Gln Ala Ser Glu Asn Ile Tyr Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Arg Leu Ile
35 40 45
Tyr Asp Ala Ser Asp Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Tyr Gly Thr Gln Phe Thr Leu Thr Ile Ser Gly Val Gln Cys
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Ala Asn Tyr Asp Ser Thr Ser
85 90 95
Ser Ser Phe Gly Asn Val Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105 110
<210> 27
<211> 110
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 27
Asp Leu Val Met Thr Gln Thr Pro Ala Ser Val Ser Glu Pro Val Gly
1 5 10 15
Gly Thr Val Thr Ile Lys Cys Gln Ala Ser Gln Ser Ile Gly Thr Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile
35 40 45
Tyr Arg Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe Lys Gly
50 55 60
Ser Gly Ser Gly Thr Gln Phe Thr Leu Thr Ile Ser Asp Leu Glu Cys
65 70 75 80
Ala Asp Ala Ala Thr Tyr Tyr Cys Leu Gly Gly Tyr Tyr Gly Phe Ser
85 90 95
Tyr Gly Asn Ala Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105 110
<210> 28
<211> 110
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 28
Asp Ile Val Met Thr Gln Thr Pro Ala Ser Val Glu Ala Ala Val Gly
1 5 10 15
Gly Thr Val Thr Ile Lys Cys Gln Ala Ser Gln Ser Ile Thr Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Leu Gly Gln Pro Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Thr Leu Ala Ser Gly Val Ser Ser Arg Phe Lys Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Asp Leu Glu Cys
65 70 75 80
Ala Asp Ala Ala Thr Tyr Tyr Cys Gln Gly Tyr Tyr Asp Ser Ser Thr
85 90 95
Ser Ser Tyr Val Phe Gly Gly Gly Thr Glu Val Val Val Lys
100 105 110
<210> 29
<211> 448
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 29
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ile Phe Ser Asn Tyr
20 25 30
Trp Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Ile Leu Pro Gly Ser Gly Ser Thr Glu Tyr Thr Glu Asn Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Phe Phe Gly Ser Ser Pro Asn Trp Tyr Phe Asp Val Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Asn Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys
210 215 220
Cys Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro
260 265 270
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser
405 410 415 25
Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
420 425 430
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 30
<211> 214
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 30
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gly Ala Ser Glu Asn Ile Tyr Gly Ala
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Thr Asn Leu Ala Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Asn Val Leu Asn Thr Pro Leu
85 90 95 20
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 31
<211> 122
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 31
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ile Phe Ser Asn Tyr
20 25 30
Trp Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Ile Leu Pro Gly Ser Gly Ser Thr Glu Tyr Thr Glu Asn Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Phe Phe Gly Ser Ser Pro Asn Trp Tyr Phe Asp Val Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 32
<211> 107
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 32
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gly Ala Ser Glu Asn Ile Tyr Gly Ala
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Thr Asn Leu Ala Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Asn Val Leu Asn Thr Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 33
<211> 325
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 33
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Arg Gly Gly Pro Lys Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu
325
<210> 34
<211> 325
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 34
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Arg Gly Gly Pro Lys Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Tyr Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Tyr His Val Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu
325
<210> 35
<211> 325
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 35
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Arg Gly Gly Pro Lys Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Pro
325
<210> 36
<211> 107
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 36
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Cys
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 37
<211> 107
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 37
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 38
<211> 107
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 38
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 39
<211> 1676
<212> PRT
<213> Homo sapiens
<400> 39
Met Gly Leu Leu Gly Ile Leu Cys Phe Leu Ile Phe Leu Gly Lys Thr
1 5 10 15
Trp Gly Gln Glu Gln Thr Tyr Val Ile Ser Ala Pro Lys Ile Phe Arg
20 25 30
Val Gly Ala Ser Glu Asn Ile Val Ile Gln Val Tyr Gly Tyr Thr Glu
35 40 45
Ala Phe Asp Ala Thr Ile Ser Ile Lys Ser Tyr Pro Asp Lys Lys Phe
50 55 60
Ser Tyr Ser Ser Gly His Val His Leu Ser Ser Glu Asn Lys Phe Gln
65 70 75 80
Asn Ser Ala Ile Leu Thr Ile Gln Pro Lys Gln Leu Pro Gly Gly Gln
85 90 95
Asn Pro Val Ser Tyr Val Tyr Leu Glu Val Val Ser Lys His Phe Ser
100 105 110
Lys Ser Lys Arg Met Pro Ile Thr Tyr Asp Asn Gly Phe Leu Phe Ile
115 120 125
His Thr Asp Lys Pro Val Tyr Thr Pro Asp Gln Ser Val Lys Val Arg
130 135 140
Val Tyr Ser Leu Asn Asp Asp Leu Lys Pro Ala Lys Arg Glu Thr Val
145 150 155 160
Leu Thr Phe Ile Asp Pro Glu Gly Ser Glu Val Asp Met Val Glu Glu
165 170 175
Ile Asp His Ile Gly Ile Ile Ser Phe Pro Asp Phe Lys Ile Pro Ser
180 185 190
Asn Pro Arg Tyr Gly Met Trp Thr Ile Lys Ala Lys Tyr Lys Glu Asp
195 200 205
Phe Ser Thr Thr Gly Thr Ala Tyr Phe Glu Val Lys Glu Tyr Val Leu
210 215 220
Pro His Phe Ser Val Ser Ile Glu Pro Glu Tyr Asn Phe Ile Gly Tyr
225 230 235 240
Lys Asn Phe Lys Asn Phe Glu Ile Thr Ile Lys Ala Arg Tyr Phe Tyr
245 250 255
Asn Lys Val Val Thr Glu Ala Asp Val Tyr Ile Thr Phe Gly Ile Arg
260 265 270
Glu Asp Leu Lys Asp Asp Gln Lys Glu Met Met Gln Thr Ala Met Gln
275 280 285
Asn Thr Met Leu Ile Asn Gly Ile Ala Gln Val Thr Phe Asp Ser Glu
290 295 300
Thr Ala Val Lys Glu Leu Ser Tyr Tyr Ser Leu Glu Asp Leu Asn Asn
305 310 315 320
Lys Tyr Leu Tyr Ile Ala Val Thr Val Ile Glu Ser Thr Gly Gly Phe
325 330 335
Ser Glu Glu Ala Glu Ile Pro Gly Ile Lys Tyr Val Leu Ser Pro Tyr
340 345 350
Lys Leu Asn Leu Val Ala Thr Pro Leu Phe Leu Lys Pro Gly Ile Pro
355 360 365
Tyr Pro Ile Lys Val Gln Val Lys Asp Ser Leu Asp Gln Leu Val Gly
370 375 380
Gly Val Pro Val Thr Leu Asn Ala Gln Thr Ile Asp Val Asn Gln Glu
385 390 395 400
Thr Ser Asp Leu Asp Pro Ser Lys Ser Val Thr Arg Val Asp Asp Gly
405 410 415
Val Ala Ser Phe Val Leu Asn Leu Pro Ser Gly Val Thr Val Leu Glu
420 425 430
Phe Asn Val Lys Thr Asp Ala Pro Asp Leu Pro Glu Glu Asn Gln Ala
435 440 445
Arg Glu Gly Tyr Arg Ala Ile Ala Tyr Ser Ser Leu Ser Gln Ser Tyr
450 455 460
Leu Tyr Ile Asp Trp Thr Asp Asn His Lys Ala Leu Leu Val Gly Glu
465 470 475 480
His Leu Asn Ile Ile Val Thr Pro Lys Ser Pro Tyr Ile Asp Lys Ile
485 490 495
Thr His Tyr Asn Tyr Leu Ile Leu Ser Lys Gly Lys Ile Ile His Phe
500 505 510
Gly Thr Arg Glu Lys Phe Ser Asp Ala Ser Tyr Gln Ser Ile Asn Ile
515 520 525
Pro Val Thr Gln Asn Met Val Pro Ser Ser Arg Leu Leu Val Tyr Tyr
530 535 540
Ile Val Thr Gly Glu Gln Thr Ala Glu Leu Val Ser Asp Ser Val Trp
545 550 555 560
Leu Asn Ile Glu Glu Lys Cys Gly Asn Gln Leu Gln Val His Leu Ser
565 570 575
Pro Asp Ala Asp Ala Tyr Ser Pro Gly Gln Thr Val Ser Leu Asn Met
580 585 590
Ala Thr Gly Met Asp Ser Trp Val Ala Leu Ala Ala Val Asp Ser Ala
595 600 605
Val Tyr Gly Val Gln Arg Gly Ala Lys Lys Pro Leu Glu Arg Val Phe
610 615 620
Gln Phe Leu Glu Lys Ser Asp Leu Gly Cys Gly Ala Gly Gly Gly Leu
625 630 635 640
Asn Asn Ala Asn Val Phe His Leu Ala Gly Leu Thr Phe Leu Thr Asn
645 650 655
Ala Asn Ala Asp Asp Ser Gln Glu Asn Asp Glu Pro Cys Lys Glu Ile
660 665 670
Leu Arg Pro Arg Arg Thr Leu Gln Lys Lys Ile Glu Glu Ile Ala Ala
675 680 685
Lys Tyr Lys His Ser Val Val Lys Lys Cys Cys Tyr Asp Gly Ala Cys
690 695 700
Val Asn Asn Asp Glu Thr Cys Glu Gln Arg Ala Ala Arg Ile Ser Leu
705 710 715 720
Gly Pro Arg Cys Ile Lys Ala Phe Thr Glu Cys Cys Val Val Ala Ser
725 730 735
Gln Leu Arg Ala Asn Ile Ser His Lys Asp Met Gln Leu Gly Arg Leu
740 745 750
His Met Lys Thr Leu Leu Pro Val Ser Lys Pro Glu Ile Arg Ser Tyr
755 760 765
Phe Pro Glu Ser Trp Leu Trp Glu Val His Leu Val Pro Arg Arg Lys
770 775 780
Gln Leu Gln Phe Ala Leu Pro Asp Ser Leu Thr Thr Trp Glu Ile Gln
785 790 795 800
Gly Val Gly Ile Ser Asn Thr Gly Ile Cys Val Ala Asp Thr Val Lys
805 810 815
Ala Lys Val Phe Lys Asp Val Phe Leu Glu Met Asn Ile Pro Tyr Ser
820 825 830
Val Val Arg Gly Glu Gln Ile Gln Leu Lys Gly Thr Val Tyr Asn Tyr
835 840 845
Arg Thr Ser Gly Met Gln Phe Cys Val Lys Met Ser Ala Val Glu Gly
850 855 860
Ile Cys Thr Ser Glu Ser Pro Val Ile Asp His Gln Gly Thr Lys Ser
865 870 875 880
Ser Lys Cys Val Arg Gln Lys Val Glu Gly Ser Ser Ser His Leu Val
885 890 895
Thr Phe Thr Val Leu Pro Leu Glu Ile Gly Leu His Asn Ile Asn Phe
900 905 910
Ser Leu Glu Thr Trp Phe Gly Lys Glu Ile Leu Val Lys Thr Leu Arg
915 920 925
Val Val Pro Glu Gly Val Lys Arg Glu Ser Tyr Ser Gly Val Thr Leu
930 935 940
Asp Pro Arg Gly Ile Tyr Gly Thr Ile Ser Arg Arg Lys Glu Phe Pro
945 950 955 960
Tyr Arg Ile Pro Leu Asp Leu Val Pro Lys Thr Glu Ile Lys Arg Ile
965 970 975
Leu Ser Val Lys Gly Leu Leu Val Gly Glu Ile Leu Ser Ala Val Leu
980 985 990
Ser Gln Glu Gly Ile Asn Ile Leu Thr His Leu Pro Lys Gly Ser Ala
995 1000 1005
Glu Ala Glu Leu Met Ser Val Val Pro Val Phe Tyr Val Phe His
1010 1015 1020
Tyr Leu Glu Thr Gly Asn His Trp Asn Ile Phe His Ser Asp Pro
1025 1030 1035
Leu Ile Glu Lys Gln Lys Leu Lys Lys Lys Leu Lys Glu Gly Met
1040 1045 1050
Leu Ser Ile Met Ser Tyr Arg Asn Ala Asp Tyr Ser Tyr Ser Val
1055 1060 1065
Trp Lys Gly Gly Ser Ala Ser Thr Trp Leu Thr Ala Phe Ala Leu
1070 1075 1080
Arg Val Leu Gly Gln Val Asn Lys Tyr Val Glu Gln Asn Gln Asn
1085 1090 1095
Ser Ile Cys Asn Ser Leu Leu Trp Leu Val Glu Asn Tyr Gln Leu
1100 1105 1110
Asp Asn Gly Ser Phe Lys Glu Asn Ser Gln Tyr Gln Pro Ile Lys
1115 1120 1125
Leu Gln Gly Thr Leu Pro Val Glu Ala Arg Glu Asn Ser Leu Tyr
1130 1135 1140
Leu Thr Ala Phe Thr Val Ile Gly Ile Arg Lys Ala Phe Asp Ile
1145 1150 1155
Cys Pro Leu Val Lys Ile Asp Thr Ala Leu Ile Lys Ala Asp Asn
1160 1165 1170
Phe Leu Leu Glu Asn Thr Leu Pro Ala Gln Ser Thr Phe Thr Leu
1175 1180 1185
Ala Ile Ser Ala Tyr Ala Leu Ser Leu Gly Asp Lys Thr His Pro
1190 1195 1200
Gln Phe Arg Ser Ile Val Ser Ala Leu Lys Arg Glu Ala Leu Val
1205 1210 1215
Lys Gly Asn Pro Pro Ile Tyr Arg Phe Trp Lys Asp Asn Leu Gln
1220 1225 1230
His Lys Asp Ser Ser Val Pro Asn Thr Gly Thr Ala Arg Met Val
1235 1240 1245
Glu Thr Thr Ala Tyr Ala Leu Leu Thr Ser Leu Asn Leu Lys Asp
1250 1255 1260
Ile Asn Tyr Val Asn Pro Val Ile Lys Trp Leu Ser Glu Glu Gln
1265 1270 1275
Arg Tyr Gly Gly Gly Phe Tyr Ser Thr Gln Asp Thr Ile Asn Ala
1280 1285 1290
Ile Glu Gly Leu Thr Glu Tyr Ser Leu Leu Val Lys Gln Leu Arg
1295 1300 1305
Leu Ser Met Asp Ile Asp Val Ser Tyr Lys His Lys Gly Ala Leu
1310 1315 1320
His Asn Tyr Lys Met Thr Asp Lys Asn Phe Leu Gly Arg Pro Val
1325 1330 1335
Glu Val Leu Leu Asn Asp Asp Leu Ile Val Ser Thr Gly Phe Gly
1340 1345 1350
Ser Gly Leu Ala Thr Val His Val Thr Thr Val Val His Lys Thr
1355 1360 1365
Ser Thr Ser Glu Glu Val Cys Ser Phe Tyr Leu Lys Ile Asp Thr
1370 1375 1380
Gln Asp Ile Glu Ala Ser His Tyr Arg Gly Tyr Gly Asn Ser Asp
1385 1390 1395
Tyr Lys Arg Ile Val Ala Cys Ala Ser Tyr Lys Pro Ser Arg Glu
1400 1405 1410
Glu Ser Ser Ser Gly Ser Ser His Ala Val Met Asp Ile Ser Leu
1415 1420 1425
Pro Thr Gly Ile Ser Ala Asn Glu Glu Asp Leu Lys Ala Leu Val
1430 1435 1440
Glu Gly Val Asp Gln Leu Phe Thr Asp Tyr Gln Ile Lys Asp Gly
1445 1450 1455
His Val Ile Leu Gln Leu Asn Ser Ile Pro Ser Ser Asp Phe Leu
1460 1465 1470
Cys Val Arg Phe Arg Ile Phe Glu Leu Phe Glu Val Gly Phe Leu
1475 1480 1485
Ser Pro Ala Thr Phe Thr Val Tyr Glu Tyr His Arg Pro Asp Lys
1490 1495 1500
Gln Cys Thr Met Phe Tyr Ser Thr Ser Asn Ile Lys Ile Gln Lys
1505 1510 1515
Val Cys Glu Gly Ala Ala Cys Lys Cys Val Glu Ala Asp Cys Gly
1520 1525 1530
Gln Met Gln Glu Glu Leu Asp Leu Thr Ile Ser Ala Glu Thr Arg
1535 1540 1545
Lys Gln Thr Ala Cys Lys Pro Glu Ile Ala Tyr Ala Tyr Lys Val
1550 1555 1560
Ser Ile Thr Ser Ile Thr Val Glu Asn Val Phe Val Lys Tyr Lys
1565 1570 1575
Ala Thr Leu Leu Asp Ile Tyr Lys Thr Gly Glu Ala Val Ala Glu
1580 1585 1590
Lys Asp Ser Glu Ile Thr Phe Ile Lys Lys Val Thr Cys Thr Asn
1595 1600 1605
Ala Glu Leu Val Lys Gly Arg Gln Tyr Leu Ile Met Gly Lys Glu
1610 1615 1620
Ala Leu Gln Ile Lys Tyr Asn Phe Ser Phe Arg Tyr Ile Tyr Pro
1625 1630 1635
Leu Asp Ser Leu Thr Trp Ile Glu Tyr Trp Pro Arg Asp Thr Thr
1640 1645 1650
Cys Ser Ser Cys Gln Ala Phe Leu Ala Asn Leu Asp Glu Phe Ala
1655 1660 1665
Glu Asp Ile Phe Leu Asn Gly Cys
1670 1675
<210> 40
<211> 673
<212> PRT
<213> Homo sapiens
<400> 40
Met Gly Leu Leu Gly Ile Leu Cys Phe Leu Ile Phe Leu Gly Lys Thr
1 5 10 15
Trp Gly Gln Glu Gln Thr Tyr Val Ile Ser Ala Pro Lys Ile Phe Arg
20 25 30
Val Gly Ala Ser Glu Asn Ile Val Ile Gln Val Tyr Gly Tyr Thr Glu
35 40 45
Ala Phe Asp Ala Thr Ile Ser Ile Lys Ser Tyr Pro Asp Lys Lys Phe
50 55 60
Ser Tyr Ser Ser Gly His Val His Leu Ser Ser Glu Asn Lys Phe Gln
65 70 75 80
Asn Ser Ala Ile Leu Thr Ile Gln Pro Lys Gln Leu Pro Gly Gly Gln
85 90 95
Asn Pro Val Ser Tyr Val Tyr Leu Glu Val Val Ser Lys His Phe Ser
100 105 110
Lys Ser Lys Arg Met Pro Ile Thr Tyr Asp Asn Gly Phe Leu Phe Ile
115 120 125
His Thr Asp Lys Pro Val Tyr Thr Pro Asp Gln Ser Val Lys Val Arg
130 135 140
Val Tyr Ser Leu Asn Asp Asp Leu Lys Pro Ala Lys Arg Glu Thr Val
145 150 155 160
Leu Thr Phe Ile Asp Pro Glu Gly Ser Glu Val Asp Met Val Glu Glu
165 170 175
Ile Asp His Ile Gly Ile Ile Ser Phe Pro Asp Phe Lys Ile Pro Ser
180 185 190
Asn Pro Arg Tyr Gly Met Trp Thr Ile Lys Ala Lys Tyr Lys Glu Asp
195 200 205
Phe Ser Thr Thr Gly Thr Ala Tyr Phe Glu Val Lys Glu Tyr Val Leu
210 215 220
Pro His Phe Ser Val Ser Ile Glu Pro Glu Tyr Asn Phe Ile Gly Tyr
225 230 235 240
Lys Asn Phe Lys Asn Phe Glu Ile Thr Ile Lys Ala Arg Tyr Phe Tyr
245 250 255
Asn Lys Val Val Thr Glu Ala Asp Val Tyr Ile Thr Phe Gly Ile Arg
260 265 270
Glu Asp Leu Lys Asp Asp Gln Lys Glu Met Met Gln Thr Ala Met Gln
275 280 285
Asn Thr Met Leu Ile Asn Gly Ile Ala Gln Val Thr Phe Asp Ser Glu
290 295 300
Thr Ala Val Lys Glu Leu Ser Tyr Tyr Ser Leu Glu Asp Leu Asn Asn
305 310 315 320 20
Lys Tyr Leu Tyr Ile Ala Val Thr Val Ile Glu Ser Thr Gly Gly Phe
325 330 335
Ser Glu Glu Ala Glu Ile Pro Gly Ile Lys Tyr Val Leu Ser Pro Tyr
340 345 350
Lys Leu Asn Leu Val Ala Thr Pro Leu Phe Leu Lys Pro Gly Ile Pro
355 360 365
Tyr Pro Ile Lys Val Gln Val Lys Asp Ser Leu Asp Gln Leu Val Gly
370 375 380
Gly Val Pro Val Thr Leu Asn Ala Gln Thr Ile Asp Val Asn Gln Glu
385 390 395 400
Thr Ser Asp Leu Asp Pro Ser Lys Ser Val Thr Arg Val Asp Asp Gly
405 410 415
Val Ala Ser Phe Val Leu Asn Leu Pro Ser Gly Val Thr Val Leu Glu
420 425 430
Phe Asn Val Lys Thr Asp Ala Pro Asp Leu Pro Glu Glu Asn Gln Ala
435 440 445
Arg Glu Gly Tyr Arg Ala Ile Ala Tyr Ser Ser Leu Ser Gln Ser Tyr
450 455 460
Leu Tyr Ile Asp Trp Thr Asp Asn His Lys Ala Leu Leu Val Gly Glu
465 470 475 480
His Leu Asn Ile Ile Val Thr Pro Lys Ser Pro Tyr Ile Asp Lys Ile
485 490 495
Thr His Tyr Asn Tyr Leu Ile Leu Ser Lys Gly Lys Ile Ile His Phe
500 505 510
Gly Thr Arg Glu Lys Phe Ser Asp Ala Ser Tyr Gln Ser Ile Asn Ile
515 520 525
Pro Val Thr Gln Asn Met Val Pro Ser Ser Arg Leu Leu Val Tyr Tyr
530 535 540
Ile Val Thr Gly Glu Gln Thr Ala Glu Leu Val Ser Asp Ser Val Trp
545 550 555 560
Leu Asn Ile Glu Glu Lys Cys Gly Asn Gln Leu Gln Val His Leu Ser
565 570 575
Pro Asp Ala Asp Ala Tyr Ser Pro Gly Gln Thr Val Ser Leu Asn Met
580 585 590
Ala Thr Gly Met Asp Ser Trp Val Ala Leu Ala Ala Val Asp Ser Ala
595 600 605
Val Tyr Gly Val Gln Arg Gly Ala Lys Lys Pro Leu Glu Arg Val Phe
610 615 620
Gln Phe Leu Glu Lys Ser Asp Leu Gly Cys Gly Ala Gly Gly Gly Leu
625 630 635 640
Asn Asn Ala Asn Val Phe His Leu Ala Gly Leu Thr Phe Leu Thr Asn
645 650 655
Ala Asn Ala Asp Asp Ser Gln Glu Asn Asp Glu Pro Cys Lys Glu Ile
660 665 670
Leu
<210> 41
<211> 105
<212> PRT
<213> Homo sapiens
<400> 41
Glu Gln Thr Tyr Val Ile Ser Ala Pro Lys Ile Phe Arg Val Gly Ala
1 5 10 15
Ser Glu Asn Ile Val Ile Gln Val Tyr Gly Tyr Thr Glu Ala Phe Asp
20 25 30
Ala Thr Ile Ser Ile Lys Ser Tyr Pro Asp Lys Lys Phe Ser Tyr Ser
35 40 45
Ser Gly His Val His Leu Ser Ser Glu Asn Lys Phe Gln Asn Ser Ala
50 55 60
Ile Leu Thr Ile Gln Pro Lys Gln Leu Pro Gly Gly Gln Asn Pro Val
65 70 75 80
Ser Tyr Val Tyr Leu Glu Val Val Ser Lys His Phe Ser Lys Ser Lys
85 90 95
Arg Met Pro Ile Thr Tyr Asp Asn Gly
100 105
<210> 42
<211> 101
<212> PRT
<213> Homo sapiens
<400> 42
Phe Leu Phe Ile His Thr Asp Lys Pro Val Tyr Thr Pro Asp Gln Ser
1 5 10 15
Val Lys Val Arg Val Tyr Ser Leu Asn Asp Asp Leu Lys Pro Ala Lys
20 25 30
Arg Glu Thr Val Leu Thr Phe Ile Asp Pro Glu Gly Ser Glu Val Asp
35 40 45
Met Val Glu Glu Ile Asp His Ile Gly Ile Ile Ser Phe Pro Asp Phe
50 55 60
Lys Ile Pro Ser Asn Pro Arg Tyr Gly Met Trp Thr Ile Lys Ala Lys
65 70 75 80
Tyr Lys Glu Asp Phe Ser Thr Thr Gly Thr Ala Tyr Phe Glu Val Lys
85 90 95
Glu Tyr Val Leu Pro
100
<210> 43
<211> 225
<212> PRT
<213> Homo sapiens
<400> 43
Met Gly Leu Leu Gly Ile Leu Cys Phe Leu Ile Phe Leu Gly Lys Thr
1 5 10 15
Trp Gly Gln Glu Gln Thr Tyr Val Ile Ser Ala Pro Lys Ile Phe Arg
20 25 30
Val Gly Ala Ser Glu Asn Ile Val Ile Gln Val Tyr Gly Tyr Thr Glu
35 40 45
Ala Phe Asp Ala Thr Ile Ser Ile Lys Ser Tyr Pro Asp Lys Lys Phe
50 55 60
Ser Tyr Ser Ser Gly His Val His Leu Ser Ser Glu Asn Lys Phe Gln
65 70 75 80
Asn Ser Ala Ile Leu Thr Ile Gln Pro Lys Gln Leu Pro Gly Gly Gln
85 90 95
Asn Pro Val Ser Tyr Val Tyr Leu Glu Val Val Ser Lys His Phe Ser
100 105 110
Lys Ser Lys Arg Met Pro Ile Thr Tyr Asp Asn Gly Phe Leu Phe Ile
115 120 125
His Thr Asp Lys Pro Val Tyr Thr Pro Asp Gln Ser Val Lys Val Arg
130 135 140
Val Tyr Ser Leu Asn Asp Asp Leu Lys Pro Ala Lys Arg Glu Thr Val
145 150 155 160
Leu Thr Phe Ile Asp Pro Glu Gly Ser Glu Val Asp Met Val Glu Glu
165 170 175
Ile Asp His Ile Gly Ile Ile Ser Phe Pro Asp Phe Lys Ile Pro Ser
180 185 190
Asn Pro Arg Tyr Gly Met Trp Thr Ile Lys Ala Lys Tyr Lys Glu Asp
195 200 205
Phe Ser Thr Thr Gly Thr Ala Tyr Phe Glu Val Lys Glu Tyr Val Leu
210 215 220
Pro
225
<210> 44
<211> 1676
<212> PRT
<213> Macaca fascicularis
<400> 44
Met Gly Leu Leu Gly Ile Leu Cys Phe Leu Ile Phe Leu Gly Lys Thr
1 5 10 15
Trp Gly Gln Glu Gln Thr Tyr Val Ile Ser Ala Pro Lys Ile Phe Arg
20 25 30
Val Gly Ala Ser Glu Asn Ile Val Ile Gln Val Tyr Gly Tyr Thr Glu
35 40 45
Ala Phe Asp Ala Thr Ile Ser Ile Lys Ser Tyr Pro Asp Lys Lys Phe
50 55 60
Ser Tyr Ser Ser Gly His Val His Leu Ser Ser Glu Asn Lys Phe Gln
65 70 75 80
Asn Ser Ala Val Leu Thr Ile Gln Pro Lys Gln Leu Pro Gly Gly Gln
85 90 95
Asn Gln Val Ser Tyr Val Tyr Leu Glu Val Val Ser Lys His Phe Ser
100 105 110
Lys Ser Lys Lys Ile Pro Ile Thr Tyr Asp Asn Gly Phe Leu Phe Ile
115 120 125
His Thr Asp Lys Pro Val Tyr Thr Pro Asp Gln Ser Val Lys Val Arg
130 135 140
Val Tyr Ser Leu Asn Asp Asp Leu Lys Pro Ala Lys Arg Glu Thr Val
145 150 155 160
Leu Thr Phe Ile Asp Pro Glu Gly Ser Glu Ile Asp Met Val Glu Glu
165 170 175
Ile Asp His Ile Gly Ile Ile Ser Phe Pro Asp Phe Lys Ile Pro Ser
180 185 190
Asn Pro Arg Tyr Gly Met Trp Thr Ile Gln Ala Lys Tyr Lys Glu Asp
195 200 205
Phe Ser Thr Thr Gly Thr Ala Phe Phe Glu Val Lys Glu Tyr Val Leu
210 215 220
Pro His Phe Ser Val Ser Val Glu Pro Glu Ser Asn Phe Ile Gly Tyr
225 230 235 240
Lys Asn Phe Lys Asn Phe Glu Ile Thr Ile Lys Ala Arg Tyr Phe Tyr
245 250 255
Asn Lys Val Val Thr Glu Ala Asp Val Tyr Ile Thr Phe Gly Ile Arg
260 265 270
Glu Asp Leu Lys Asp Asp Gln Lys Glu Met Met Gln Thr Ala Met Gln
275 280 285
Asn Thr Met Leu Ile Asn Gly Ile Ala Glu Val Thr Phe Asp Ser Glu
290 295 300
Thr Ala Val Lys Glu Leu Ser Tyr Tyr Ser Leu Glu Asp Leu Asn Asn
305 310 315 320
Lys Tyr Leu Tyr Ile Ala Val Thr Val Ile Glu Ser Thr Gly Gly Phe
325 330 335
Ser Glu Glu Ala Glu Ile Pro Gly Ile Lys Tyr Val Leu Ser Pro Tyr
340 345 350 15
Lys Leu Asn Leu Val Ala Thr Pro Leu Phe Leu Lys Pro Gly Ile Pro
355 360 365
Tyr Ser Ile Lys Val Gln Val Lys Asp Ala Leu Asp Gln Leu Val Gly
370 375 380
Gly Val Pro Val Thr Leu Asn Ala Gln Thr Ile Asp Val Asn Gln Glu
385 390 395 400
Thr Ser Asp Leu Glu Pro Arg Lys Ser Val Thr Arg Val Asp Asp Gly
405 410 415
Val Ala Ser Phe Val Val Asn Leu Pro Ser Gly Val Thr Val Leu Glu
420 425 430
Phe Asn Val Lys Thr Asp Ala Pro Asp Leu Pro Asp Glu Asn Gln Ala
435 440 445
Arg Glu Gly Tyr Arg Ala Ile Ala Tyr Ser Ser Leu Ser Gln Ser Tyr
450 455 460
Leu Tyr Ile Asp Trp Thr Asp Asn His Lys Ala Leu Leu Val Gly Glu
465 470 475 480
Tyr Leu Asn Ile Ile Val Thr Pro Lys Ser Pro Tyr Ile Asp Lys Ile
485 490 495
Thr His Tyr Asn Tyr Leu Ile Leu Ser Lys Gly Lys Ile Ile His Phe
500 505 510
Gly Thr Arg Glu Lys Leu Ser Asp Ala Ser Tyr Gln Ser Ile Asn Ile
515 520 525
Pro Val Thr Gln Asn Met Val Pro Ser Ser Arg Leu Leu Val Tyr Tyr
530 535 540
Ile Val Thr Gly Glu Gln Thr Ala Glu Leu Val Ser Asp Ser Val Trp
545 550 555 560
Leu Asn Ile Glu Glu Lys Cys Gly Asn Gln Leu Gln Val His Leu Ser
565 570 575
Pro Asp Ala Asp Thr Tyr Ser Pro Gly Gln Thr Val Ser Leu Asn Met
580 585 590
Val Thr Gly Met Asp Ser Trp Val Ala Leu Thr Ala Val Asp Ser Ala
595 600 605
Val Tyr Gly Val Gln Arg Arg Ala Lys Lys Pro Leu Glu Arg Val Phe
610 615 620
Gln Phe Leu Glu Lys Ser Asp Leu Gly Cys Gly Ala Gly Gly Gly Leu
625 630 635 640
Asn Asn Ala Asn Val Phe His Leu Ala Gly Leu Thr Phe Leu Thr Asn
645 650 655
Ala Asn Ala Asp Asp Ser Gln Glu Asn Asp Glu Pro Cys Lys Glu Ile
660 665 670
Ile Arg Pro Arg Arg Met Leu Gln Glu Lys Ile Glu Glu Ile Ala Ala
675 680 685 5
Lys Tyr Lys His Leu Val Val Lys Lys Cys Cys Tyr Asp Gly Val Arg
690 695 700
Ile Asn His Asp Glu Thr Cys Glu Gln Arg Ala Ala Arg Ile Ser Val
705 710 715 720
Gly Pro Arg Cys Val Lys Ala Phe Thr Glu Cys Cys Val Val Ala Ser
725 730 735
Gln Leu Arg Ala Asn Asn Ser His Lys Asp Leu Gln Leu Gly Arg Leu
740 745 750
His Met Lys Thr Leu Leu Pro Val Ser Lys Pro Glu Ile Arg Ser Tyr
755 760 765
Phe Pro Glu Ser Trp Leu Trp Glu Val His Leu Val Pro Arg Arg Lys
770 775 780
Gln Leu Gln Phe Ala Leu Pro Asp Ser Val Thr Thr Trp Glu Ile Gln
785 790 795 800
Gly Val Gly Ile Ser Asn Ser Gly Ile Cys Val Ala Asp Thr Ile Lys
805 810 815
Ala Lys Val Phe Lys Asp Val Phe Leu Glu Met Asn Ile Pro Tyr Ser
820 825 830
Val Val Arg Gly Glu Gln Val Gln Leu Lys Gly Thr Val Tyr Asn Tyr
835 840 845
Arg Thr Ser Gly Met Gln Phe Cys Val Lys Met Ser Ala Val Glu Gly
850 855 860
Ile Cys Thr Ser Glu Ser Pro Val Ile Asp His Gln Gly Thr Lys Ser
865 870 875 880
Ser Lys Cys Val Arg Gln Lys Val Glu Gly Ser Ser Asn His Leu Val
885 890 895
Thr Phe Thr Val Leu Pro Leu Glu Ile Gly Leu Gln Asn Ile Asn Phe
900 905 910
Ser Leu Glu Thr Ser Phe Gly Lys Glu Ile Leu Val Lys Ser Leu Arg
915 920 925
Val Val Pro Glu Gly Val Lys Arg Glu Ser Tyr Ser Gly Ile Thr Leu
930 935 940
Asp Pro Arg Gly Ile Tyr Gly Thr Ile Ser Arg Arg Lys Glu Phe Pro
945 950 955 960
Tyr Arg Ile Pro Leu Asp Leu Val Pro Lys Thr Glu Ile Lys Arg Ile
965 970 975
Leu Ser Val Lys Gly Leu Leu Val Gly Glu Ile Leu Ser Ala Val Leu
980 985 990
Ser Arg Glu Gly Ile Asn Ile Leu Thr His Leu Pro Lys Gly Ser Ala
995 1000 1005
Glu Ala Glu Leu Met Ser Val Val Pro Val Phe Tyr Val Phe His
1010 1015 1020
Tyr Leu Glu Thr Gly Asn His Trp Asn Ile Phe His Ser Asp Pro
1025 1030 1035
Leu Ile Glu Lys Arg Asn Leu Glu Lys Lys Leu Lys Glu Gly Met
1040 1045 1050
Val Ser Ile Met Ser Tyr Arg Asn Ala Asp Tyr Ser Tyr Ser Val
1055 1060 1065
Trp Lys Gly Gly Ser Ala Ser Thr Trp Leu Thr Ala Phe Ala Leu
1070 1075 1080
Arg Val Leu Gly Gln Val His Lys Tyr Val Glu Gln Asn Gln Asn
1085 1090 1095
Ser Ile Cys Asn Ser Leu Leu Trp Leu Val Glu Asn Tyr Gln Leu
1100 1105 1110
Asp Asn Gly Ser Phe Lys Glu Asn Ser Gln Tyr Gln Pro Ile Lys
1115 1120 1125
Leu Gln Gly Thr Leu Pro Val Glu Ala Arg Glu Asn Ser Leu Tyr
1130 1135 1140
Leu Thr Ala Phe Thr Val Ile Gly Ile Arg Lys Ala Phe Asp Ile
1145 1150 1155
Cys Pro Leu Val Lys Ile Asn Thr Ala Leu Ile Lys Ala Asp Thr
1160 1165 1170
Phe Leu Leu Glu Asn Thr Leu Pro Ala Gln Ser Thr Phe Thr Leu
1175 1180 1185
Ala Ile Ser Ala Tyr Ala Leu Ser Leu Gly Asp Lys Thr His Pro
1190 1195 1200
Gln Phe Arg Ser Ile Val Ser Ala Leu Lys Arg Glu Ala Leu Val
1205 1210 1215
Lys Gly Asn Pro Pro Ile Tyr Arg Phe Trp Lys Asp Ser Leu Gln
1220 1225 1230
His Lys Asp Ser Ser Val Pro Asn Thr Gly Thr Ala Arg Met Val
1235 1240 1245
Glu Thr Thr Ala Tyr Ala Leu Leu Thr Ser Leu Asn Leu Lys Asp
1250 1255 1260
Ile Asn Tyr Val Asn Pro Ile Ile Lys Trp Leu Ser Glu Glu Gln
1265 1270 1275
Arg Tyr Gly Gly Gly Phe Tyr Ser Thr Gln Asp Thr Ile Asn Ala
1280 1285 1290
Ile Glu Gly Leu Thr Glu Tyr Ser Leu Leu Val Lys Gln Leu Arg
1295 1300 1305
Leu Asn Met Asp Ile Asp Val Ala Tyr Lys His Lys Gly Pro Leu
1310 1315 1320
His Asn Tyr Lys Met Thr Asp Lys Asn Phe Leu Gly Arg Pro Val
1325 1330 1335
Glu Val Leu Leu Asn Asp Asp Leu Val Val Ser Thr Gly Phe Gly
1340 1345 1350
Ser Gly Leu Ala Thr Val His Val Thr Thr Val Val His Lys Thr
1355 1360 1365
Ser Thr Ser Glu Glu Val Cys Ser Phe Tyr Leu Lys Ile Asp Thr
1370 1375 1380
Gln Asp Ile Glu Ala Ser His Tyr Arg Gly Tyr Gly Asn Ser Asp
1385 1390 1395
Tyr Lys Arg Ile Val Ala Cys Ala Ser Tyr Lys Pro Ser Lys Glu
1400 1405 1410
Glu Ser Ser Ser Gly Ser Ser His Ala Val Met Asp Ile Ser Leu
1415 1420 1425
Pro Thr Gly Ile Asn Ala Asn Glu Glu Asp Leu Lys Ala Leu Val
1430 1435 1440
Glu Gly Val Asp Gln Leu Phe Thr Asp Tyr Gln Ile Lys Asp Gly
1445 1450 1455
His Val Ile Leu Gln Leu Asn Ser Ile Pro Ser Ser Asp Phe Leu
1460 1465 1470
Cys Val Arg Phe Arg Ile Phe Glu Leu Phe Glu Val Gly Phe Leu
1475 1480 1485
Ser Pro Ala Thr Phe Thr Val Tyr Glu Tyr His Arg Pro Asp Lys
1490 1495 1500
Gln Cys Thr Met Phe Tyr Ser Thr Ser Asn Ile Lys Ile Gln Lys
1505 1510 1515
Val Cys Glu Gly Ala Thr Cys Lys Cys Ile Glu Ala Asp Cys Gly
1520 1525 1530
Gln Met Gln Lys Glu Leu Asp Leu Thr Ile Ser Ala Glu Thr Arg
1535 1540 1545
Lys Gln Thr Ala Cys Asn Pro Glu Ile Ala Tyr Ala Tyr Lys Val
1550 1555 1560
Ile Ile Thr Ser Ile Thr Thr Glu Asn Val Phe Val Lys Tyr Lys
1565 1570 1575
Ala Thr Leu Leu Asp Ile Tyr Lys Thr Gly Glu Ala Val Ala Glu
1580 1585 1590
Lys Asp Ser Glu Ile Thr Phe Ile Lys Lys Val Thr Cys Thr Asn
1595 1600 1605
Ala Glu Leu Val Lys Gly Arg Gln Tyr Leu Ile Met Gly Lys Glu
1610 1615 1620
Ala Leu Gln Ile Lys Tyr Asn Phe Thr Phe Arg Tyr Ile Tyr Pro
1625 1630 1635
Leu Asp Ser Leu Thr Trp Ile Glu Tyr Trp Pro Arg Asp Thr Thr
1640 1645 1650
Cys Ser Ser Cys Gln Ala Phe Leu Ala Asn Leu Asp Glu Phe Ala
1655 1660 1665
Glu Asp Ile Phe Leu Asn Gly Cys
1670 1675
<210> 45
<211> 6
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 45
Ser Ser Tyr Tyr Met Cys
1 5
<210> 46
<211> 6
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 46
Asn Phe Tyr Tyr Ile Cys
1 5
<210> 47
<211> 6
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 47
Ser Ser Tyr Tyr Met Cys
1 5
<210> 48
<211> 6
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 48
Ser Ser Tyr Tyr Met Asn
1 5
<210> 49
<211> 6
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 49
Ser Ser Tyr Tyr Met Asn
1 5
<210> 50
<211> 5
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 50
Asp Asn Thr Met Thr
1 5
<210> 51
<211> 5
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 51
Thr Tyr Ala Met Gly
1 5
<210> 52
<211> 5
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 52
Gly Asn Ala Ile Asn
1 5
<210> 53
<211> 5
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 53
Thr Tyr Ala Met Gly
1 5
<210> 54
<211> 6
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 54
Ser Ser Tyr Tyr Val Ala
1 5
<210> 55
<211> 17
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 55
Cys Ile Tyr Thr Gly Ser Gly Ala Thr Tyr Tyr Ala Ser Trp Ala Lys
1 5 10 15
Gly
<210> 56
<211> 17
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 56
Cys Ile Tyr Thr Val Ser Gly Tyr Thr Tyr Tyr Ala Ser Trp Ala Lys
1 5 10 15
Gly
<210> 57
<211> 18
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 57
Cys Ile Tyr Ala Gly Ser Ser Gly Ile Ile Tyr Tyr Ala Asn Trp Ala
1 5 10 15
Lys Gly
<210> 58
<211> 16
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 58
Met Ile Tyr Gly Ser Gly Ala Thr Tyr Tyr Ala Ser Trp Ala Lys Gly
1 5 10 15
<210> 59
<211> 16
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 59
Met Ile Tyr Gly Ser Gly Ala Thr Tyr Tyr Ala Ser Trp Ala Lys Gly
1 5 10 15
<210> 60
<211> 16
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 60
Ile Ile Ser Phe Gly Gly Asp Ala Tyr Tyr Ala Ser Trp Ala Lys Gly
1 5 10 15
<210> 61
<211> 16
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 61
Thr Ile Asp Thr Gly Asp Asn Ser Phe Tyr Ala Asn Trp Ala Lys Gly
1 5 10 15
<210> 62
<211> 17
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 62
Cys Ile Tyr Thr Gly Ser Asp Thr Thr Tyr Tyr Ala Thr Trp Ala Lys
1 5 10 15
Gly
<210> 63
<211> 16
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 63
Thr Ile Asp Thr Gly Asp Asn Ser Phe Tyr Ala Asn Trp Ala Lys Gly
1 5 10 15
<210> 64
<211> 17
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 64
Ala Ile Tyr Thr Gly Ser Gly Ala Thr Tyr Lys Ala Ser Trp Ala Lys
1 5 10 15
Gly
<210> 65
<211> 13
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 65
Asp Gly Gly Tyr Val Thr Pro Thr His Ala Met Tyr Leu
1 5 10
<210> 66
<211> 9
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 66
Asp Leu His Ala Gly Ile Thr Asn Leu
1 5
<210> 67
<211> 13
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 67
Tyr Pro Thr Tyr Gly Asp Gly Gly His Ala Phe Asn Leu
1 5 10
<210> 68
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 68
Gln Ile Tyr Ser Gly Asp Asn Asn Asp Asn Phe
1 5 10
<210> 69
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 69
Gln Ile Tyr Ser Gly Asp Asn Asn Asp Asn Phe
1 5 10
<210> 70
<211> 12
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 70
Val Gly Ala Gly Asn Ile Phe Trp Tyr Phe Asp Leu
1 5 10
<210> 71
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 71
Asn Asp Gly Ser Val Tyr Asn Leu Phe Asn Leu
1 5 10
<210> 72
<211> 4
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 72
Gly Ser Gly Leu
1
<210> 73
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 73
Asn Asp Gly Ser Val Tyr Asn Leu Phe Asn Leu
1 5 10
<210> 74
<211> 13
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 74
Asp Gly Gly Tyr Asp Tyr Pro Thr His Ala Met His Tyr
1 5 10
<210> 75
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 75
Gln Ala Ser Gln Asn Ile Gly Ser Asp Leu Ala
1 5 10
<210> 76
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 76
Gln Ala Ser Gln Asn Ile Tyr Ser Asn Leu Ala
1 5 10
<210> 77
<211> 13
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 77
Gln Ser Ser Gln Ser Val Tyr Ser Ser Asp Tyr Leu Ser
1 5 10
<210> 78
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 78
Gln Ala Ser Glu Ser Ile Ser Asn Trp Leu Ala
1 5 10
<210> 79
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 79
Gln Ala Ser Glu Ser Ile Ser Asn Trp Leu Ala
1 5 10
<210> 80
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 80
Gln Ala Ser Glu Ser Ile Tyr Ser Ala Leu Ala
1 5 10
<210> 81
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 81
Gln Ala Ser Glu Asn Ile Tyr Ser Ala Leu Ser
1 5 10
<210> 82
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 82
Gln Ala Ser Gln Asn Ile Tyr Ser Leu Leu Ala
1 5 10
<210> 83
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 83
Gln Ala Ser Glu Asn Ile Tyr Ser Ala Leu Ser
1 5 10
<210> 84
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 84
Gln Ala Ser Gln Asn Ile Gly Ser Ser Leu Ala
1 5 10
<210> 85
<211> 7
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 85
Gly Ala Ser Lys Leu Ala Ser
1 5
<210> 86
<211> 7
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 86
Gly Ala Ser Asn Leu Glu Ser
1 5
<210> 87
<211> 7
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 87
Glu Ala Ser Lys Leu Ala Ser
1 5
<210> 88
<211> 7
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 88
Arg Ala Ser Thr Leu Ala Ser
1 5
<210> 89
<211> 7
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 89
Arg Ala Ser Thr Leu Ala Ser
1 5
<210> 90
<211> 7
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 90
Ser Ala Ser Thr Leu Ala Ser
1 5
<210> 91
<211> 7
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 91
Tyr Ala Ser Thr Leu Ala Ser
1 5
<210> 92
<211> 7
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 92
His Thr Ser Asp Leu Ala Ser
1 5
<210> 93
<211> 7
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 93
Tyr Ala Ser Thr Leu Ala Ser
1 5
<210> 94
<211> 7
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 94
Gly Ala Ser Lys Thr His Ser
1 5
<210> 95
<211> 12
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 95
Gln Cys Thr Phe Val Gly Ser Ser Tyr Gly Asn Ala
1 5 10
<210> 96
<211> 12
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 96
Leu Gln Gly Tyr Ser Tyr Ser Asn Val Asp Asp Ala
1 5 10
<210> 97
<211> 12
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 97
Gln Gly Thr Tyr Tyr Ser Ser Gly Trp Tyr Phe Ala
1 5 10
<210> 98
<211> 12
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 98
Gln Gln Asp Tyr Ser Ser Ser Asn Val Asp Asn Thr
1 5 10
<210> 99
<211> 12
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 99
Gln Gln Asp Tyr Ser Ser Ser Asn Val Asp Asn Thr
1 5 10
<210> 100
<211> 12
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 100
Gln Gln Tyr Tyr Ser Ser Thr Asn Val His Asn Ser
1 5 10
<210> 101
<211> 12
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 101
Gln Gln Tyr Tyr Asp Ile Asn Ser Val Asp Asn Thr
1 5 10
<210> 102
<211> 13
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 102
Gln Cys Thr Ala Tyr Gly Ser Ser Asp Val Gly Gly Thr
1 5 10
<210> 103
<211> 12
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 103
Gln Gln Tyr Tyr Asp Ile Asn Ser Val Asp Asn Thr
1 5 10
<210> 104
<211> 12
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 104
Gln Ser Thr Lys Val Gly Ser Ser Tyr Gly Asn His
1 5 10
<210> 105
<211> 1680
<212> PRT
<213> Mus musculus
<400> 105
Met Gly Leu Trp Gly Ile Leu Cys Leu Leu Ile Phe Leu Asp Lys Thr
1 5 10 15
Trp Gly Gln Glu Gln Thr Tyr Val Ile Ser Ala Pro Lys Ile Leu Arg
20 25 30
Val Gly Ser Ser Glu Asn Val Val Ile Gln Val His Gly Tyr Thr Glu
35 40 45
Ala Phe Asp Ala Thr Leu Ser Leu Lys Ser Tyr Pro Asp Lys Lys Val
50 55 60
Thr Phe Ser Ser Gly Tyr Val Asn Leu Ser Pro Glu Asn Lys Phe Gln
65 70 75 80
Asn Ala Ala Leu Leu Thr Leu Gln Pro Asn Gln Val Pro Arg Glu Glu
85 90 95
Ser Pro Val Ser His Val Tyr Leu Glu Val Val Ser Lys His Phe Ser
100 105 110
Lys Ser Lys Lys Ile Pro Ile Thr Tyr Asn Asn Gly Ile Leu Phe Ile
115 120 125
His Thr Asp Lys Pro Val Tyr Thr Pro Asp Gln Ser Val Lys Ile Arg
130 135 140
Val Tyr Ser Leu Gly Asp Asp Leu Lys Pro Ala Lys Arg Glu Thr Val
145 150 155 160
Leu Thr Phe Ile Asp Pro Glu Gly Ser Glu Val Asp Ile Val Glu Glu
165 170 175
Asn Asp Tyr Thr Gly Ile Ile Ser Phe Pro Asp Phe Lys Ile Pro Ser
180 185 190
Asn Pro Lys Tyr Gly Val Trp Thr Ile Lys Ala Asn Tyr Lys Lys Asp
195 200 205
Phe Thr Thr Thr Gly Thr Ala Tyr Phe Glu Ile Lys Glu Tyr Val Leu
210 215 220
Pro Arg Phe Ser Val Ser Ile Glu Leu Glu Arg Thr Phe Ile Gly Tyr
225 230 235 240
Lys Asn Phe Lys Asn Phe Glu Ile Thr Val Lys Ala Arg Tyr Phe Tyr
245 250 255
Asn Lys Val Val Pro Asp Ala Glu Val Tyr Ala Phe Phe Gly Leu Arg
260 265 270
Glu Asp Ile Lys Asp Glu Glu Lys Gln Met Met His Lys Ala Thr Gln
275 280 285
Ala Ala Lys Leu Val Asp Gly Val Ala Gln Ile Ser Phe Asp Ser Glu
290 295 300
Thr Ala Val Lys Glu Leu Ser Tyr Asn Ser Leu Glu Asp Leu Asn Asn
305 310 315 320
Lys Tyr Leu Tyr Ile Ala Val Thr Val Thr Glu Ser Ser Gly Gly Phe
325 330 335
Ser Glu Glu Ala Glu Ile Pro Gly Val Lys Tyr Val Leu Ser Pro Tyr
340 345 350
Thr Leu Asn Leu Val Ala Thr Pro Leu Phe Val Lys Pro Gly Ile Pro
355 360 365
Phe Ser Ile Lys Ala Gln Val Lys Asp Ser Leu Glu Gln Ala Val Gly
370 375 380
Gly Val Pro Val Thr Leu Met Ala Gln Thr Val Asp Val Asn Gln Glu
385 390 395 400
Thr Ser Asp Leu Glu Thr Lys Arg Ser Ile Thr His Asp Thr Asp Gly
405 410 415
Val Ala Val Phe Val Leu Asn Leu Pro Ser Asn Val Thr Val Leu Lys
420 425 430
Phe Glu Ile Arg Thr Asp Asp Pro Glu Leu Pro Glu Glu Asn Gln Ala
435 440 445
Ser Lys Glu Tyr Glu Ala Val Ala Tyr Ser Ser Leu Ser Gln Ser Tyr
450 455 460
Ile Tyr Ile Ala Trp Thr Glu Asn Tyr Lys Pro Met Leu Val Gly Glu
465 470 475 480
Tyr Leu Asn Ile Met Val Thr Pro Lys Ser Pro Tyr Ile Asp Lys Ile
485 490 495
Thr His Tyr Asn Tyr Leu Ile Leu Ser Lys Gly Lys Ile Val Gln Tyr
500 505 510
Gly Thr Arg Glu Lys Leu Phe Ser Ser Thr Tyr Gln Asn Ile Asn Ile
515 520 525
Pro Val Thr Gln Asn Met Val Pro Ser Ala Arg Leu Leu Val Tyr Tyr
530 535 540
Ile Val Thr Gly Glu Gln Thr Ala Glu Leu Val Ala Asp Ala Val Trp
545 550 555 560
Ile Asn Ile Glu Glu Lys Cys Gly Asn Gln Leu Gln Val His Leu Ser
565 570 575
Pro Asp Glu Tyr Val Tyr Ser Pro Gly Gln Thr Val Ser Leu Asp Met
580 585 590
Val Thr Glu Ala Asp Ser Trp Val Ala Leu Ser Ala Val Asp Arg Ala
595 600 605
Val Tyr Lys Val Gln Gly Asn Ala Lys Arg Ala Met Gln Arg Val Phe
610 615 620
Gln Ala Leu Asp Glu Lys Ser Asp Leu Gly Cys Gly Ala Gly Gly Gly
625 630 635 640
His Asp Asn Ala Asp Val Phe His Leu Ala Gly Leu Thr Phe Leu Thr
645 650 655
Asn Ala Asn Ala Asp Asp Ser His Tyr Arg Asp Asp Ser Cys Lys Glu
660 665 670
Ile Leu Arg Ser Lys Arg Asn Leu His Leu Leu Arg Gln Lys Ile Glu
675 680 685
Glu Gln Ala Ala Lys Tyr Lys His Ser Val Pro Lys Lys Cys Cys Tyr
690 695 700
Asp Gly Ala Arg Val Asn Phe Tyr Glu Thr Cys Glu Glu Arg Val Ala
705 710 715 720
Arg Val Thr Ile Gly Pro Leu Cys Ile Arg Ala Phe Asn Glu Cys Cys
725 730 735
Thr Ile Ala Asn Lys Ile Arg Lys Glu Ser Pro His Lys Pro Val Gln
740 745 750
Leu Gly Arg Ile His Ile Lys Thr Leu Leu Pro Val Met Lys Ala Asp
755 760 765
Ile Arg Ser Tyr Phe Pro Glu Ser Trp Leu Trp Glu Ile His Arg Val
770 775 780
Pro Lys Arg Lys Gln Leu Gln Val Thr Leu Pro Asp Ser Leu Thr Thr
785 790 795 800
Trp Glu Ile Gln Gly Ile Gly Ile Ser Asp Asn Gly Ile Cys Val Ala
805 810 815
Asp Thr Leu Lys Ala Lys Val Phe Lys Glu Val Phe Leu Glu Met Asn
820 825 830
Ile Pro Tyr Ser Val Val Arg Gly Glu Gln Ile Gln Leu Lys Gly Thr
835 840 845
Val Tyr Asn Tyr Met Thr Ser Gly Thr Lys Phe Cys Val Lys Met Ser
850 855 860
Ala Val Glu Gly Ile Cys Thr Ser Gly Ser Ser Ala Ala Ser Leu His
865 870 875 880
Thr Ser Arg Pro Ser Arg Cys Val Phe Gln Arg Ile Glu Gly Ser Ser
885 890 895
Ser His Leu Val Thr Phe Thr Leu Leu Pro Leu Glu Ile Gly Leu His
900 905 910
Ser Ile Asn Phe Ser Leu Glu Thr Ser Phe Gly Lys Asp Ile Leu Val
915 920 925
Lys Thr Leu Arg Val Val Pro Glu Gly Val Lys Arg Glu Ser Tyr Ala
930 935 940
Gly Val Ile Leu Asp Pro Lys Gly Ile Arg Gly Ile Val Asn Arg Arg
945 950 955 960
Lys Glu Phe Pro Tyr Arg Ile Pro Leu Asp Leu Val Pro Lys Thr Lys
965 970 975
Val Glu Arg Ile Leu Ser Val Lys Gly Leu Leu Val Gly Glu Phe Leu
980 985 990
Ser Thr Val Leu Ser Lys Glu Gly Ile Asn Ile Leu Thr His Leu Pro
995 1000 1005
Lys Gly Ser Ala Glu Ala Glu Leu Met Ser Ile Ala Pro Val Phe
1010 1015 1020
Tyr Val Phe His Tyr Leu Glu Ala Gly Asn His Trp Asn Ile Phe
1025 1030 1035
Tyr Pro Asp Thr Leu Ser Lys Arg Gln Ser Leu Glu Lys Lys Ile
1040 1045 1050
Lys Gln Gly Val Val Ser Val Met Ser Tyr Arg Asn Ala Asp Tyr
1055 1060 1065
Ser Tyr Ser Met Trp Lys Gly Ala Ser Ala Ser Thr Trp Leu Thr
1070 1075 1080
Ala Phe Ala Leu Arg Val Leu Gly Gln Val Ala Lys Tyr Val Lys
1085 1090 1095
Gln Asp Glu Asn Ser Ile Cys Asn Ser Leu Leu Trp Leu Val Glu
1100 1105 1110
Lys Cys Gln Leu Glu Asn Gly Ser Phe Lys Glu Asn Ser Gln Tyr
1115 1120 1125
Leu Pro Ile Lys Leu Gln Gly Thr Leu Pro Ala Glu Ala Gln Glu
1130 1135 1140
Lys Thr Leu Tyr Leu Thr Ala Phe Ser Val Ile Gly Ile Arg Lys
1145 1150 1155
Ala Val Asp Ile Cys Pro Thr Met Lys Ile His Thr Ala Leu Asp
1160 1165 1170
Lys Ala Asp Ser Phe Leu Leu Glu Asn Thr Leu Pro Ser Lys Ser
1175 1180 1185
Thr Phe Thr Leu Ala Ile Val Ala Tyr Ala Leu Ser Leu Gly Asp
1190 1195 1200
Arg Thr His Pro Arg Phe Arg Leu Ile Val Ser Ala Leu Arg Lys
1205 1210 1215
Glu Ala Phe Val Lys Gly Asp Pro Pro Ile Tyr Arg Tyr Trp Arg
1220 1225 1230
Asp Thr Leu Lys Arg Pro Asp Ser Ser Val Pro Ser Ser Gly Thr
1235 1240 1245
Ala Gly Met Val Glu Thr Thr Ala Tyr Ala Leu Leu Ala Ser Leu
1250 1255 1260
Lys Leu Lys Asp Met Asn Tyr Ala Asn Pro Ile Ile Lys Trp Leu
1265 1270 1275
Ser Glu Glu Gln Arg Tyr Gly Gly Gly Phe Tyr Ser Thr Gln Asp
1280 1285 1290
Thr Ile Asn Ala Ile Glu Gly Leu Thr Glu Tyr Ser Leu Leu Leu
1295 1300 1305
Lys Gln Ile His Leu Asp Met Asp Ile Asn Val Ala Tyr Lys His
1310 1315 1320
Glu Gly Asp Phe His Lys Tyr Lys Val Thr Glu Lys His Phe Leu
1325 1330 1335
Gly Arg Pro Val Glu Val Ser Leu Asn Asp Asp Leu Val Val Ser
1340 1345 1350
Thr Gly Tyr Ser Ser Gly Leu Ala Thr Val Tyr Val Lys Thr Val
1355 1360 1365
Val His Lys Ile Ser Val Ser Glu Glu Phe Cys Ser Phe Tyr Leu
1370 1375 1380
Lys Ile Asp Thr Gln Asp Ile Glu Ala Ser Ser His Phe Arg Leu
1385 1390 1395
Ser Asp Ser Gly Phe Lys Arg Ile Ile Ala Cys Ala Ser Tyr Lys
1400 1405 1410
Pro Ser Lys Glu Glu Ser Thr Ser Gly Ser Ser His Ala Val Met
1415 1420 1425
Asp Ile Ser Leu Pro Thr Gly Ile Gly Ala Asn Glu Glu Asp Leu
1430 1435 1440
Arg Ala Leu Val Glu Gly Val Asp Gln Leu Leu Thr Asp Tyr Gln
1445 1450 1455
Ile Lys Asp Gly His Val Ile Leu Gln Leu Asn Ser Ile Pro Ser
1460 1465 1470
Arg Asp Phe Leu Cys Val Arg Phe Arg Ile Phe Glu Leu Phe Gln
1475 1480 1485
Val Gly Phe Leu Asn Pro Ala Thr Phe Thr Val Tyr Glu Tyr His
1490 1495 1500
Arg Pro Asp Lys Gln Cys Thr Met Ile Tyr Ser Ile Ser Asp Thr
1505 1510 1515
Arg Leu Gln Lys Val Cys Glu Gly Ala Ala Cys Thr Cys Val Glu
1520 1525 1530
Ala Asp Cys Ala Gln Leu Gln Ala Glu Val Asp Leu Ala Ile Ser
1535 1540 1545
Ala Asp Ser Arg Lys Glu Lys Ala Cys Lys Pro Glu Thr Ala Tyr
1550 1555 1560
Ala Tyr Lys Val Arg Ile Thr Ser Ala Thr Glu Glu Asn Val Phe
1565 1570 1575
Val Lys Tyr Thr Ala Thr Leu Leu Val Thr Tyr Lys Thr Gly Glu
1580 1585 1590
Ala Ala Asp Glu Asn Ser Glu Val Thr Phe Ile Lys Lys Met Ser
1595 1600 1605
Cys Thr Asn Ala Asn Leu Val Lys Gly Lys Gln Tyr Leu Ile Met
1610 1615 1620
Gly Lys Glu Val Leu Gln Ile Lys His Asn Phe Ser Phe Lys Tyr
1625 1630 1635
Ile Tyr Pro Leu Asp Ser Ser Thr Trp Ile Glu Tyr Trp Pro Thr
1640 1645 1650
Asp Thr Thr Cys Pro Ser Cys Gln Ala Phe Val Glu Asn Leu Asn
1655 1660 1665
Asn Phe Ala Glu Asp Leu Phe Leu Asn Ser Cys Glu
1670 1675 1680
<210> 106
<211> 123
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 106
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Val His Ser Ser
20 25 30
Tyr Tyr Met Ala Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
35 40 45
Val Gly Ala Ile Phe Thr Gly Ser Gly Ala Glu Tyr Lys Ala Glu Trp
50 55 60
Ala Lys Gly Arg Val Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Ser Asp Ala Gly Tyr Asp Tyr Pro Thr His Ala Met His Tyr
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 107
<211> 123
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 107
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Val His Ser Ser
20 25 30
Tyr Tyr Met Ala Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
35 40 45
Val Gly Ala Ile Phe Thr Gly Ser Gly Ala Glu Tyr Lys Ala Glu Trp
50 55 60
Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu
65 70 75 80
Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Ser Asp Ala Gly Tyr Asp Tyr Pro Thr His Ala Met His Tyr
100 105 110
Trp Gly Arg Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 108
<211> 123
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 108
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Val His Ser Ser
20 25 30
Tyr Tyr Met Ala Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
35 40 45
Val Gly Ala Ile Phe Thr Gly Ser Gly Ala Glu Tyr Lys Ala Glu Trp
50 55 60
Ala Lys Gly Arg Val Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Ser Asp Ala Gly Tyr Asp Tyr Pro Thr His Ala Met His Tyr
100 105 110
Trp Gly Arg Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 109
<211> 123
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 109
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Val His Ser Ser
20 25 30
Tyr Tyr Met Ala Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
35 40 45
Val Gly Ala Ile Phe Thr Gly Ser Gly Ala Glu Tyr Lys Ala Glu Trp
50 55 60
Ala Lys Gly Arg Val Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Ser Asp Ala Gly Tyr Asp Tyr Pro Thr His Ala Met His Tyr
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 110
<211> 123
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 110
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Val His Ser Ser
20 25 30
Tyr Tyr Met Ala Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
35 40 45
Val Ser Gly Ile Phe Thr Gly Ser Gly Ala Thr Tyr Lys Ala Glu Trp
50 55 60
Ala Lys Gly Arg Val Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val
65 70 75 80
Val Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr
85 90 95
Cys Ala Ser Asp Ala Gly Tyr Asp Tyr Pro Thr His Ala Met His Tyr
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 111
<211> 110
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 111
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Ser
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Glu Thr Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Asn Thr Lys Val Gly Ser Ser
85 90 95
Tyr Gly Asn Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 112
<211> 110
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 112
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Ser
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Glu Thr Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Asn Thr Lys Val Gly Ser Ser
85 90 95
Tyr Gly Asn Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 113
<211> 110
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 113
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Ser
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Thr Thr Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Asn Thr Lys Val Gly Ser Ser
85 90 95
Tyr Gly Asn Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 114
<211> 328
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 114
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Arg Arg Gly Pro Lys Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
225 230 235 240
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Leu His Glu Ala Leu His Ala His Tyr Thr
305 310 315 320
Arg Lys Glu Leu Ser Leu Ser Pro
325
<210> 115
<211> 325
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 115
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Arg Arg Gly Pro Lys Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Leu His Glu Ala Leu His Ala His Tyr Thr Arg Lys Glu
305 310 315 320
Leu Ser Leu Ser Pro
325
<210> 116
<211> 325
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 116
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Arg Arg Gly Pro Lys Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Leu His Glu Ala Leu His Ala His Tyr Thr Arg Lys Glu
305 310 315 320
Leu Ser Leu Ser Pro
325
<210> 117
<211> 6
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 117
Ser Ser Tyr Tyr Met Ala
1 5
<210> 118
<211> 17
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 118
Ala Ile Phe Thr Gly Ser Gly Ala Glu Tyr Lys Ala Glu Trp Ala Lys
1 5 10 15
Gly
<210> 119
<211> 17
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 119
Ala Ile Phe Thr Gly Ser Gly Ala Glu Tyr Lys Ala Glu Trp Val Lys
1 5 10 15
Gly
<210> 120
<211> 17
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 120
Gly Ile Phe Thr Gly Ser Gly Ala Thr Tyr Lys Ala Glu Trp Ala Lys
1 5 10 15
Gly
<210> 121
<211> 13
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 121
Asp Ala Gly Tyr Asp Tyr Pro Thr His Ala Met His Tyr
1 5 10
<210> 122
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 122
Arg Ala Ser Gln Gly Ile Ser Ser Ser Leu Ala
1 5 10
<210> 123
<211> 7
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 123
Gly Ala Ser Glu Thr Glu Ser
1 5
<210> 124
<211> 7
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 124
Gly Ala Ser Thr Thr Gln Ser
1 5
<210> 125
<211> 12
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 125
Gln Asn Thr Lys Val Gly Ser Ser Tyr Gly Asn Thr
1 5 10
<210> 126
<211> 6
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<220>
<221> misc_feature
<222> (5)..(5)
<223> Xaa is Met or Val
<220>
<221> misc_feature
<222> (6)..(6)
<223> Xaa is Cys or Ala
<400> 126
Ser Ser Tyr Tyr Xaa Xaa
1 5
<210> 127
<211> 17
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<220>
<221> misc_feature
<222> (1)..(1)
<223> Xaa is Cys, Ala or Gly
<220>
<221> misc_feature
<222> (3)..(3)
<223> Xaa is Tyr or Phe
<220>
<221> misc_feature
<222> (9)..(9)
<223> Xaa is Thr, Asp or Glu
<220>
<221> misc_feature
<222> (11)..(11)
<223> Xaa is Tyr, Lys or Gln
<220> 15
<221> misc_feature
<222> (13)..(13)
<223> Xaa is Ser, Asp or Glu
<220>
<221> misc_feature
<222> (15)..(15)
<223> Xaa is Ala or Val
<400> 127
Xaa Ile Xaa Thr Gly Ser Gly Ala Xaa Tyr Xaa Ala Xaa Trp Xaa Lys
1 5 10 15
Gly
<210> 128
<211> 13
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<220>
<221> misc_feature
<222> (2)..(2)
<223> Xaa is Gly or Ala
<220>
<221> misc_feature
<222> (5)..(5)
<223> Xaa is Val, Gln or Asp
<220>
<221> misc_feature
<222> (6)..(6)
<223> Xaa is Thr or Tyr
<220>
<221> misc_feature
<222> (12)..(12)
<223> Xaa is Tyr or His
<220>
<221> misc_feature
<222> (13)..(13)
<223> Xaa is Leu or Tyr
<400> 128
Asp Xaa Gly Tyr Xaa Xaa Pro Thr His Ala Met Xaa Xaa
1 5 10
<210> 129
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<220>
<221> misc_feature
<222> (1)..(1)
<223> Xaa is Gln or Arg
<220>
<221> misc_feature
<222> (5)..(5)
<223> Xaa is Asn, Gln or Gly
<220>
<221> misc_feature
<222> (7)..(7)
<223> Xaa is Gly or Ser
<220>
<221> misc_feature
<222> (9)..(9)
<223> Xaa is Asp, Lys or Ser
<400> 129
Xaa Ala Ser Gln Xaa Ile Xaa Ser Xaa Leu Ala
1 5 10
<210> 130
<211> 7
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<220>
<221> misc_feature
<222> (4)..(4)
<223> Xaa is Lys, Glu or Thr
<220>
<221> misc_feature
<222> (5)..(5)
<223> Xaa is Leu or Thr
<220>
<221> misc_feature
<222> (6)..(6)
<223> Xaa is Ala, His, Glu or Gln
<400> 130
Gly Ala Ser Xaa Xaa Xaa Ser
1 5
<210> 131
<211> 12
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<220>
<221> misc_feature
<222> (2)..(2)
<223> Xaa is Ser, Cys, Asn or Thr
<220>
<221> misc_feature
<222> (4)..(4)
<223> Xaa is Phe or Lys
<220>
<221> misc_feature
<222> (12)..(12)
<223> Xaa is Ala, Thr or His
<400> 131
Gln Xaa Thr Xaa Val Gly Ser Ser Tyr Gly Asn Xaa
1 5 10
<210> 132
<211> 30
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 132
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Ser His
20 25 30
<210> 133
<211>
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 133
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Val His
20 25 30
<210> 134
<211>
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 134
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Val His
20 25 30
<210> 135
<211> 14
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 135
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Gly
1 5 10
<210> 136
<211> 14
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 136
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser
1 5 10
<210> 137
<211> 32
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 137
Arg Phe Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val Val Leu Thr
1 5 10 15
Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr Cys Ala Ser
20 25 30
<210> 138
<211> 32
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 138
Arg Val Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val Val Leu Thr
1 5 10 15
Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr Cys Ala Ser
20 25 30
<210> 139
<211> 32
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 139
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
1 5 10 15
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Ser
20 25 30
<210> 140
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 140
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
1 5 10
<210> 141
<211> 11
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 141
Trp Gly Arg Gly Thr Leu Val Thr Val Ser Ser
1 5 10
<210> 142
<211> 23
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 142
Asp Val Val Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys
20
<210> 143
<211> 23
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 143
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys
20
<210> 144
<211> 15
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 144
Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr
1 5 10 15
<210> 145
<211> 15
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 145
Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr
1 5 10 15
<210> 146
<211> 32
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 146
Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
1 5 10 15
Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Val Ala Thr Tyr Tyr Cys
20 25 30
<210> 147
<211> 32
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 147
Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
1 5 10 15
Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys
20 25 30
<210> 148
<211> 10
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 148
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
1 5 10
<210> 149
<211> 448
<212> PRT
<213> Artificial sequence
<220> 30
<223> An artificially synthesized sequence
<400> 149
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly His Ile Phe Ser Asn Tyr
20 25 30
Trp Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Ile Leu Pro Gly Ser Gly His Thr Glu Tyr Thr Glu Asn Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Phe Phe Gly Ser Ser Pro Asn Trp Tyr Phe Asp Val Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
115 120 125
Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr
130 135 140
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
145 150 155 160
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
165 170 175
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
180 185 190
Val Pro Ser Ser Asn Phe Gly Thr Gln Thr Tyr Thr Cys Asn Val Asp
195 200 205
His Lys Pro Ser Asn Thr Lys Val Asp Lys Thr Val Glu Arg Lys Cys
210 215 220
Cys Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser
225 230 235 240
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
245 250 255
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro
260 265 270
Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
275 280 285
Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val
290 295 300
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
305 310 315 320
Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr
325 330 335
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
340 345 350
Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys
355 360 365
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
370 375 380
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
385 390 395 400
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser
405 410 415
Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Leu His Glu Ala
420 425 430
Leu His Ser His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 150
<211> 214
<212> PRT
<213> Artificial sequence
<220>
<223> An artificially synthesized sequence
<400> 150
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gly Ala Ser Glu Asn Ile Tyr Gly Ala
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Gly Ala Thr Asn Leu Ala Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Asn Val Leu Asn Thr Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| МУЛЬТИСПЕЦИФИЧЕСКАЯ АНТИГЕНСВЯЗЫВАЮЩАЯ МОЛЕКУЛА, ОБЛАДАЮЩАЯ ЗАМЕЩАЮЩЕЙ ФУНКЦИОНАЛЬНОЙ АКТИВНОСТЬЮ КОФАКТОРА КОАГУЛИРУЮЩЕГО ФАКТОРА КРОВИ VIII, И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ УКАЗАННУЮ МОЛЕКУЛУ В КАЧЕСТВЕ АКТИВНОГО ИНГРЕДИЕНТА | 2018 |
|
RU2812909C2 |
| АНТИТЕЛА К МИОСТАТИНУ, ПОЛИПЕПТИДЫ, СОДЕРЖАЩИЕ ВАРИАНТЫ FC-ОБЛАСТЕЙ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2789884C2 |
| АНТИ-CD137 АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2829536C2 |
| АНТИТЕЛА К ВИРУСУ ДЕНГЕ, ПОЛИПЕПТИДЫ, СОДЕРЖАЩИЕ ВАРИАНТЫ FC-ОБЛАСТЕЙ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2758596C2 |
| АНТИТЕЛА К МИОСТАТИНУ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2778945C2 |
| АНТИТЕЛА К С5 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2746356C2 |
| АНТИТЕЛА К ВИРУСУ ДЕНГЕ, ОБЛАДАЮЩИЕ ПЕРЕКРЕСТНОЙ РЕАКТИВНОСТЬЮ С ВИРУСОМ ЗИКА | 2019 |
|
RU2811697C2 |
| МЕЖВИДОВЫЕ АНТИТЕЛА К ЛАТЕНТНОМУ TGF-БЕТА 1 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2020 |
|
RU2837609C2 |
| АНТИ-TIGIT АНТИТЕЛА И СПОСОБЫ ПРИМЕНЕНИЯ | 2016 |
|
RU2732591C2 |
| КОМПОЗИЦИЯ ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ СВЯЗАННЫХ С IL-8 ЗАБОЛЕВАНИЙ | 2017 |
|
RU2766112C2 |

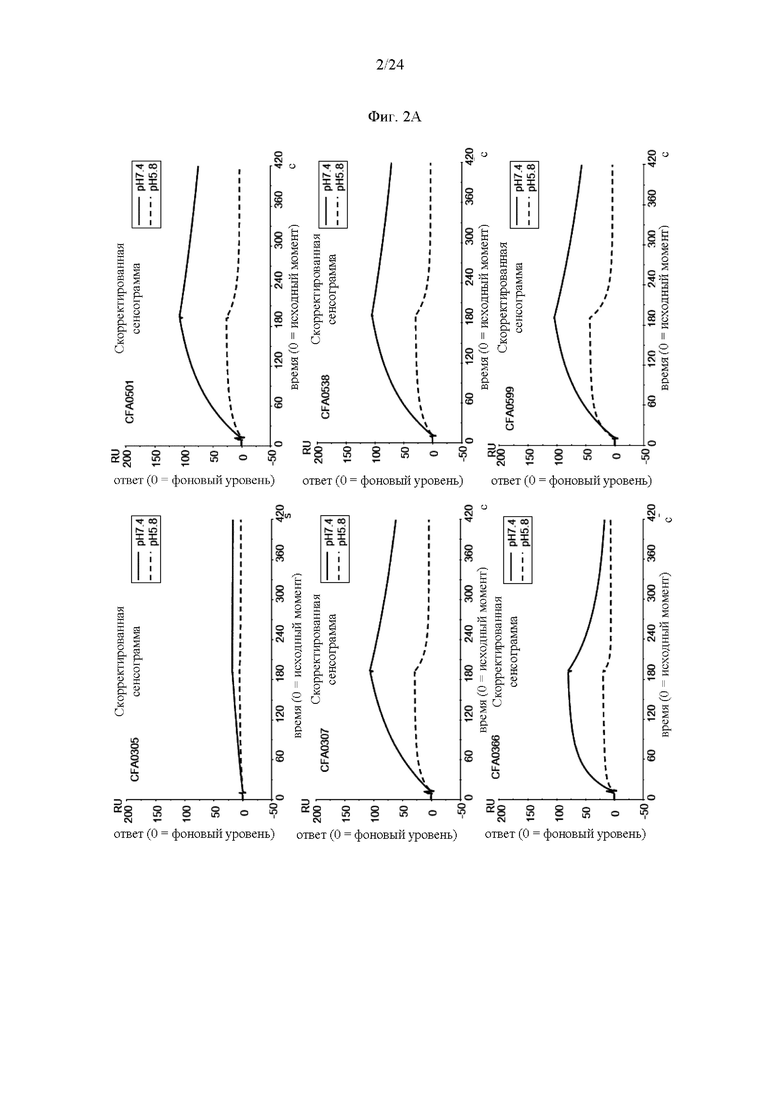
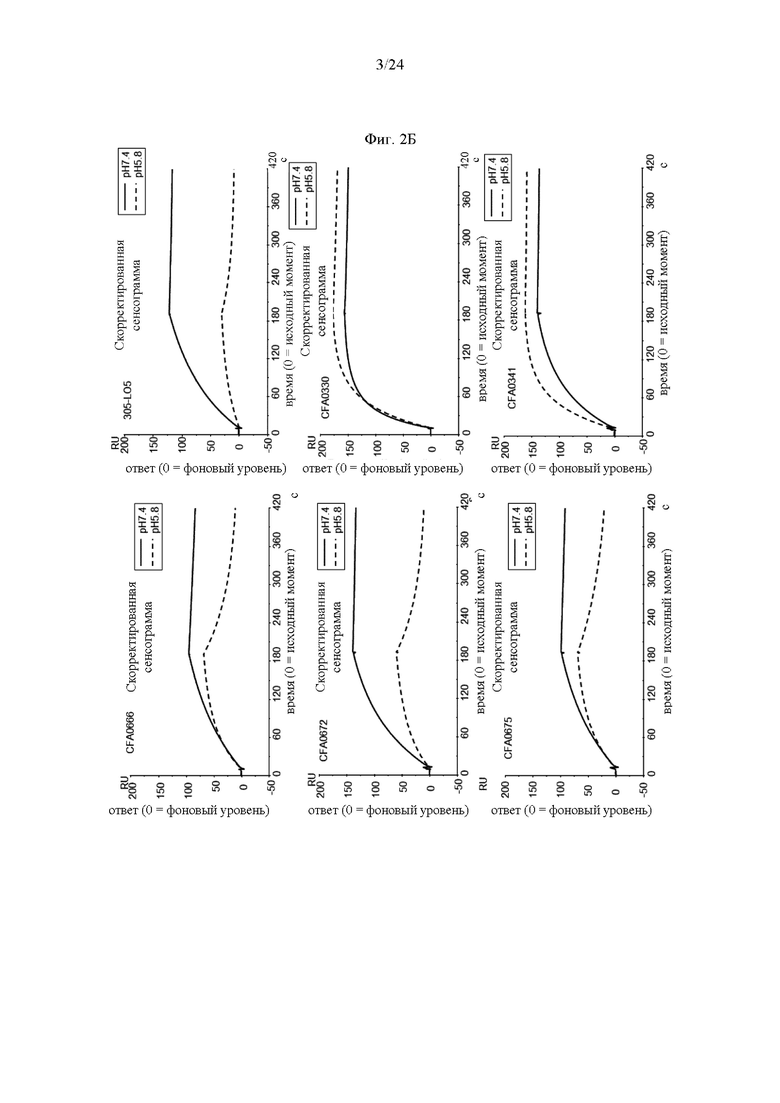
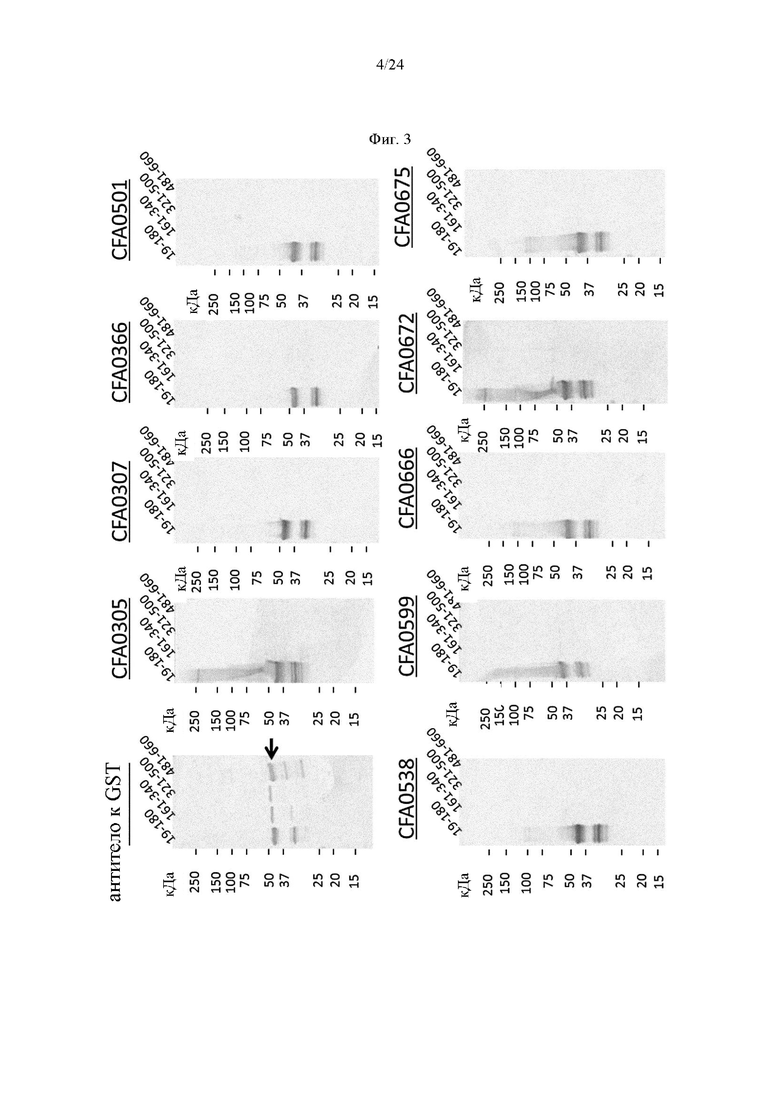

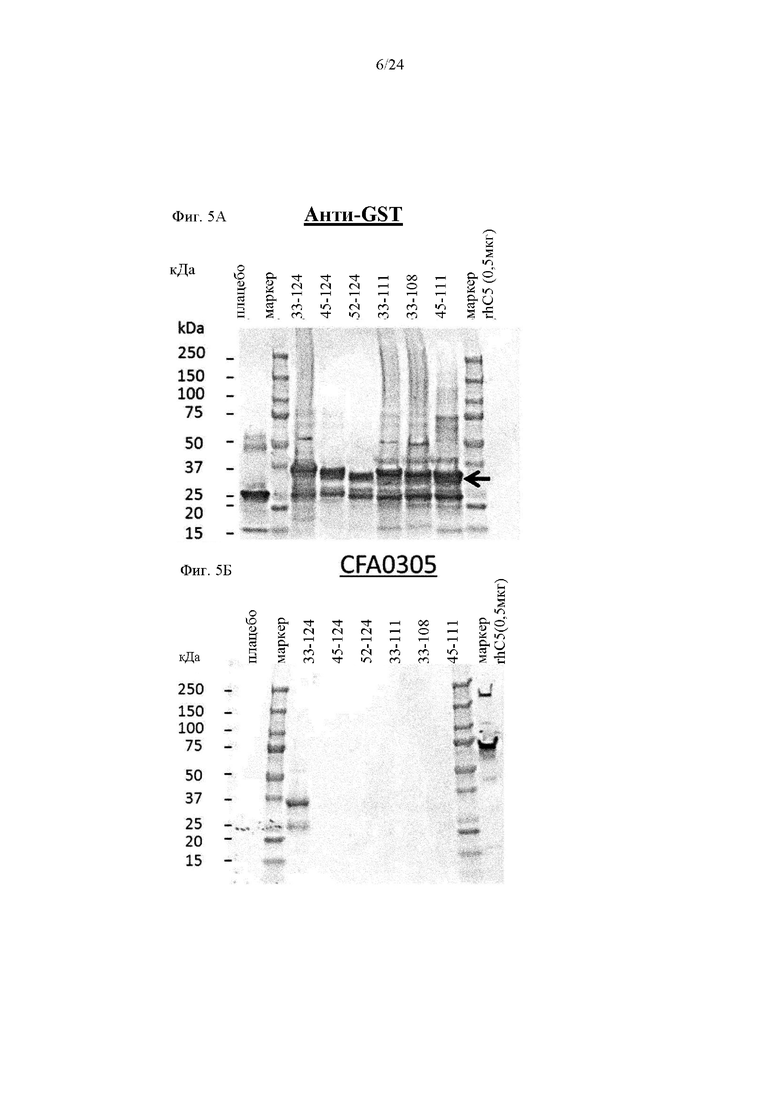
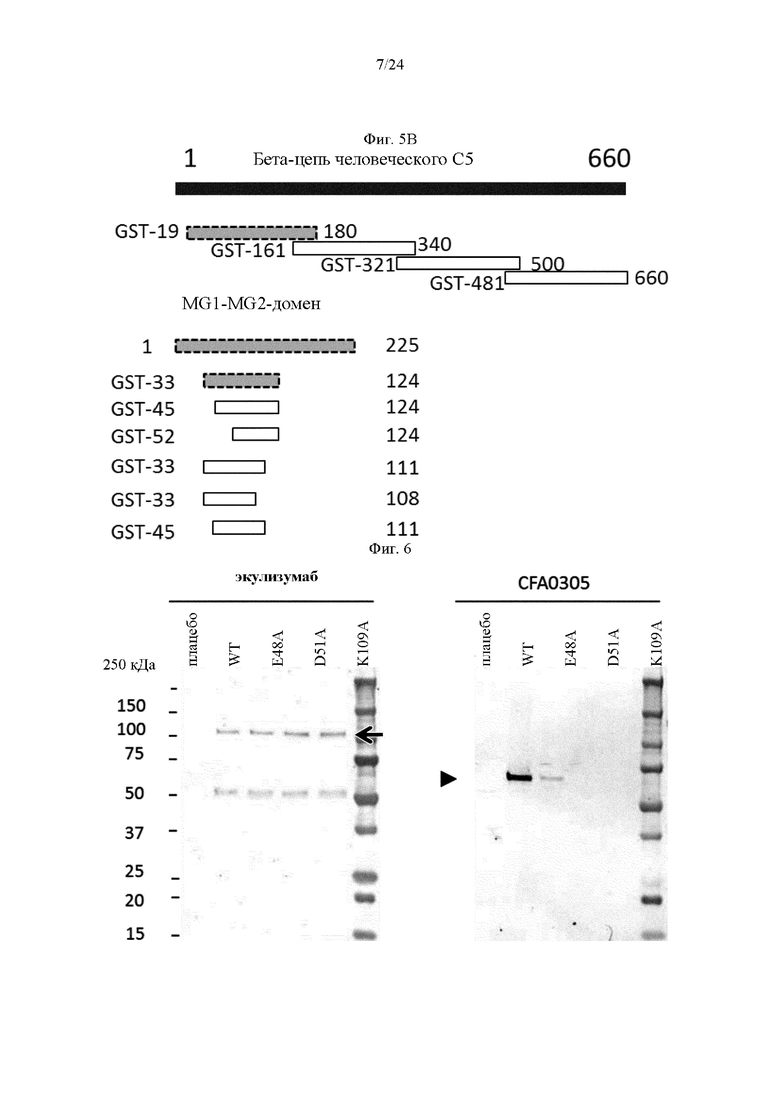
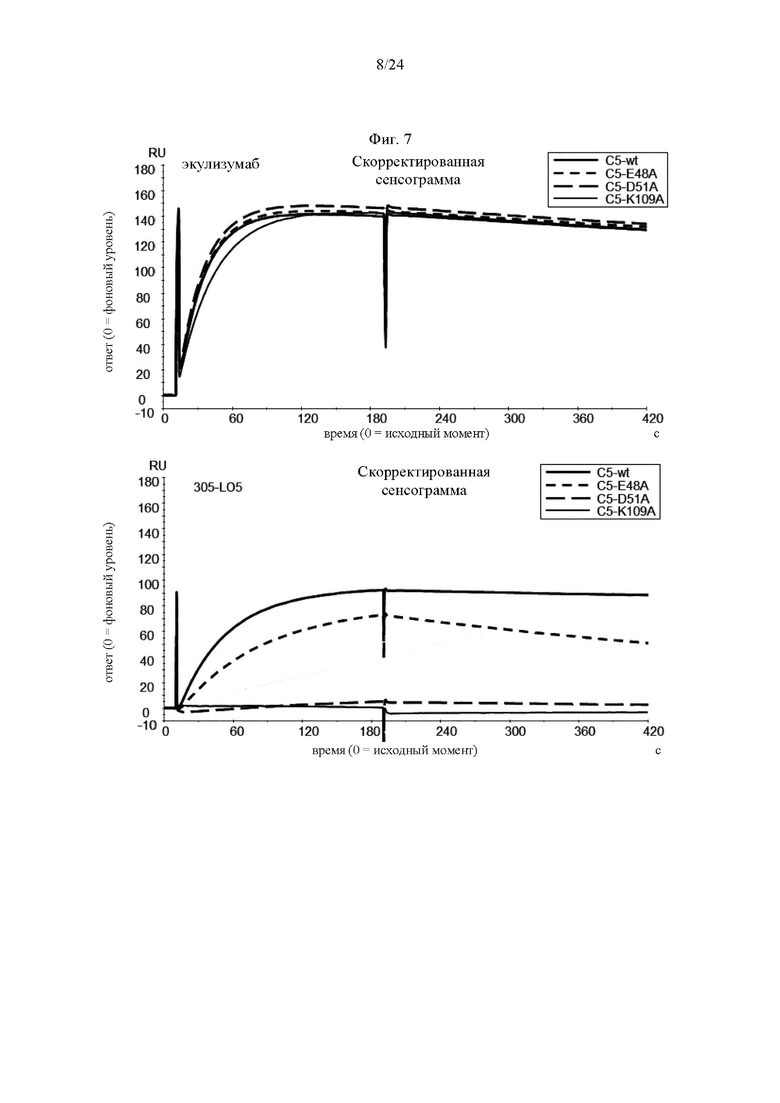
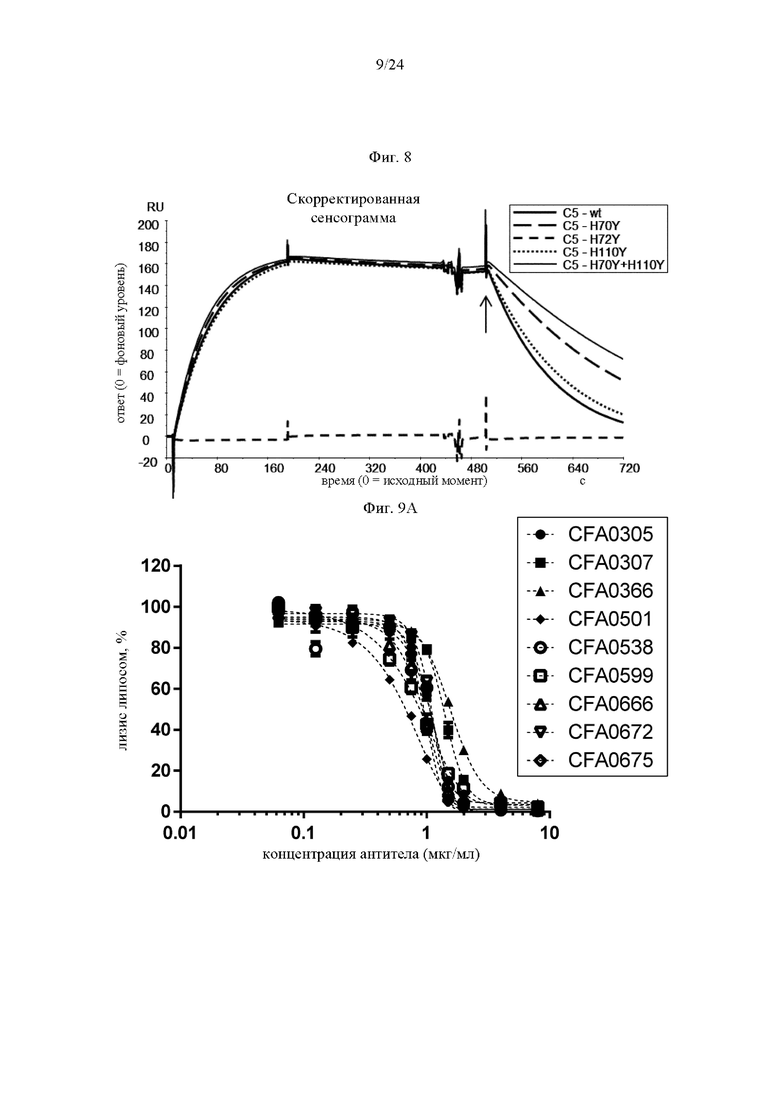
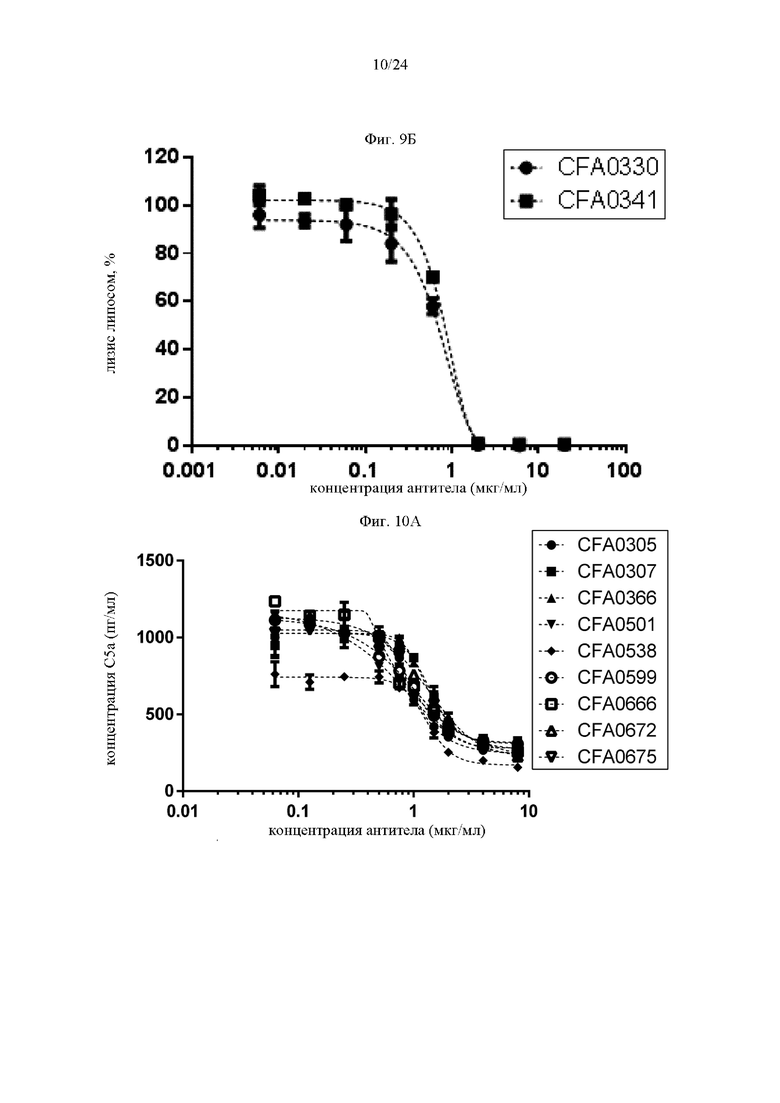
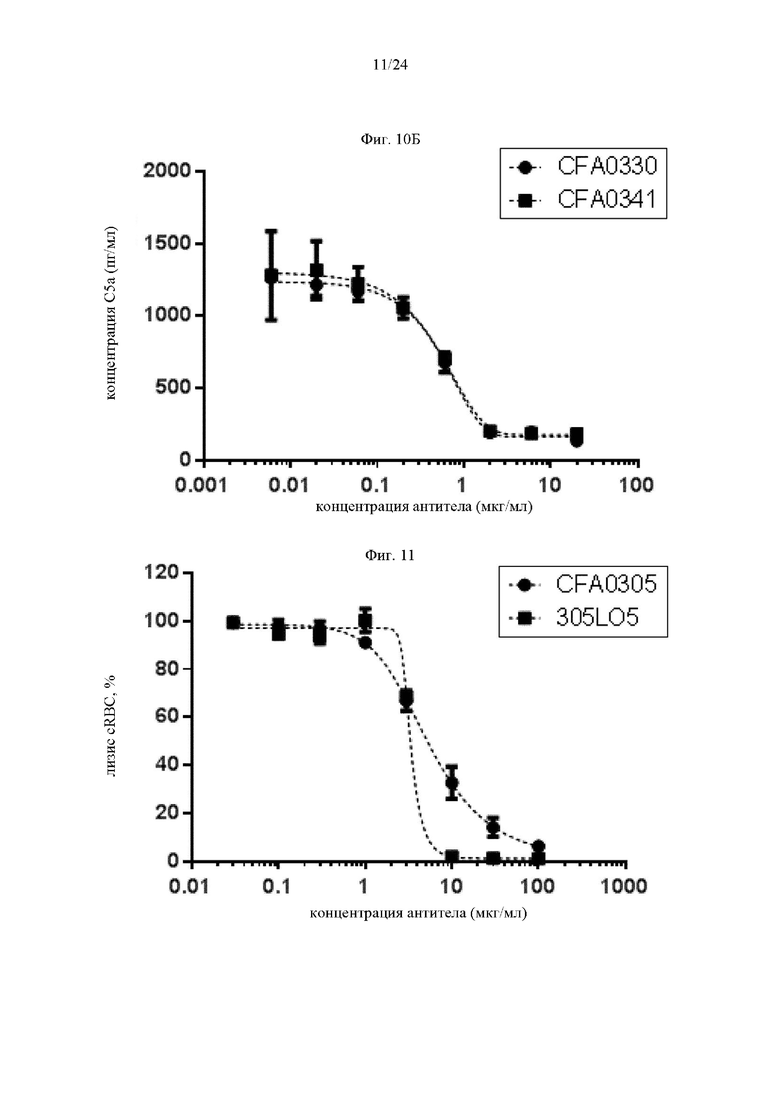
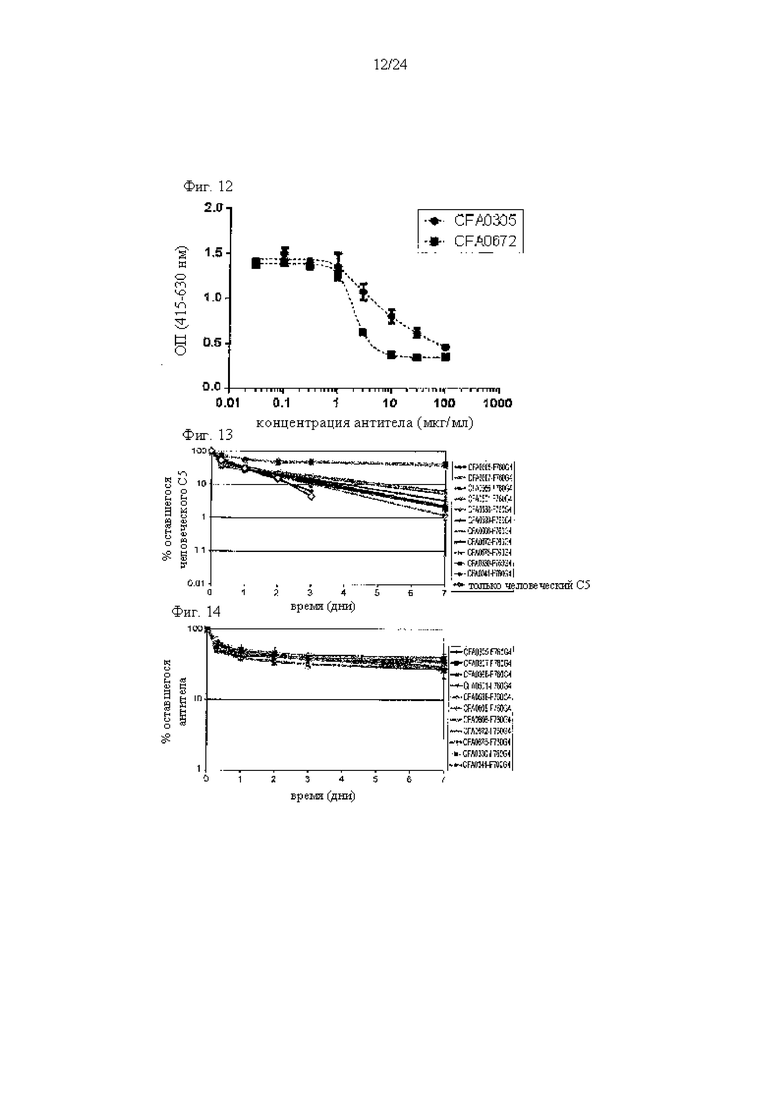
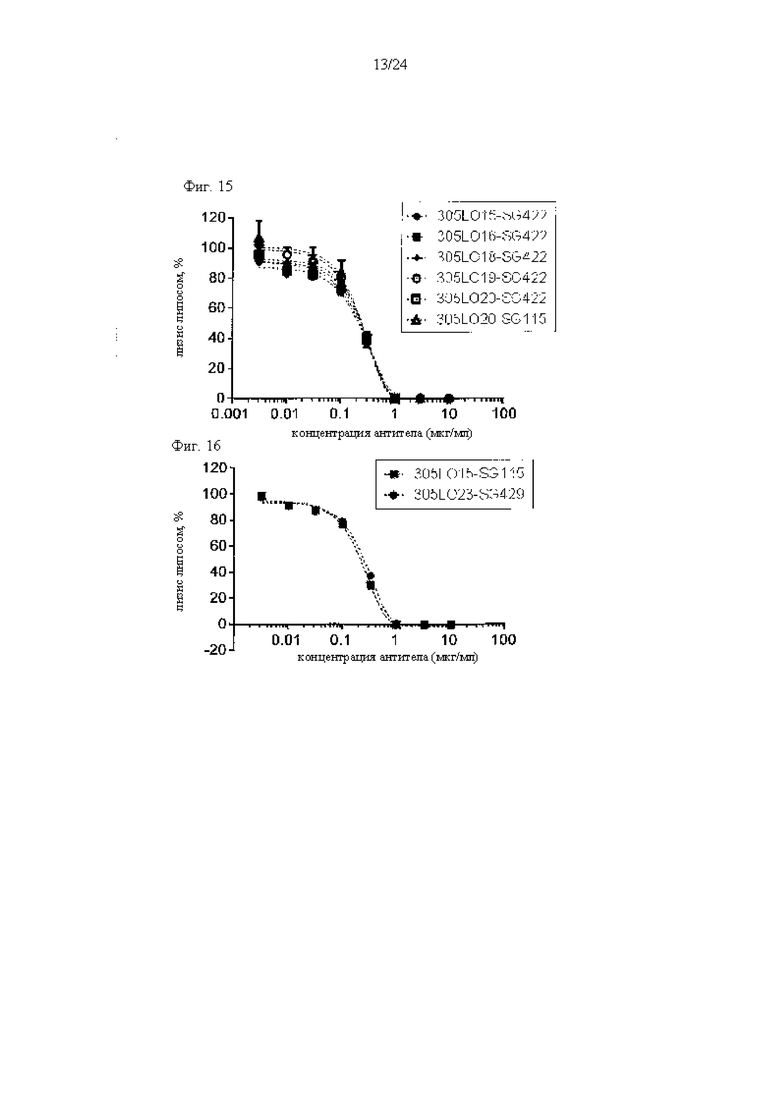
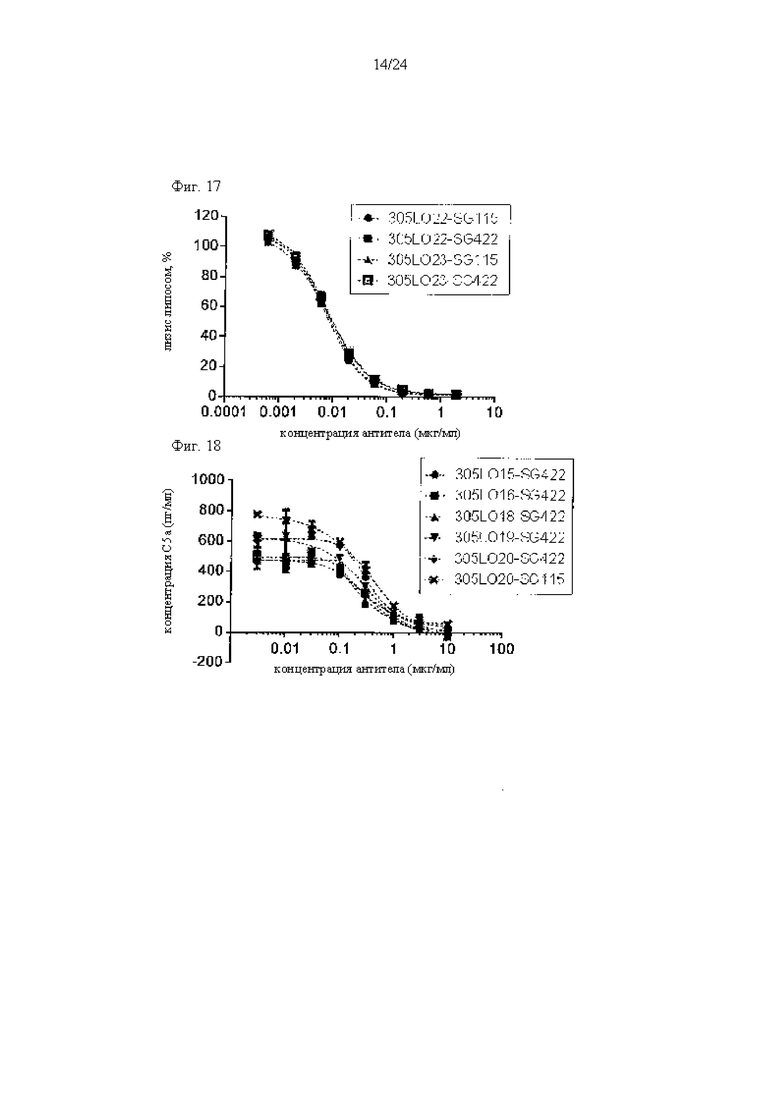
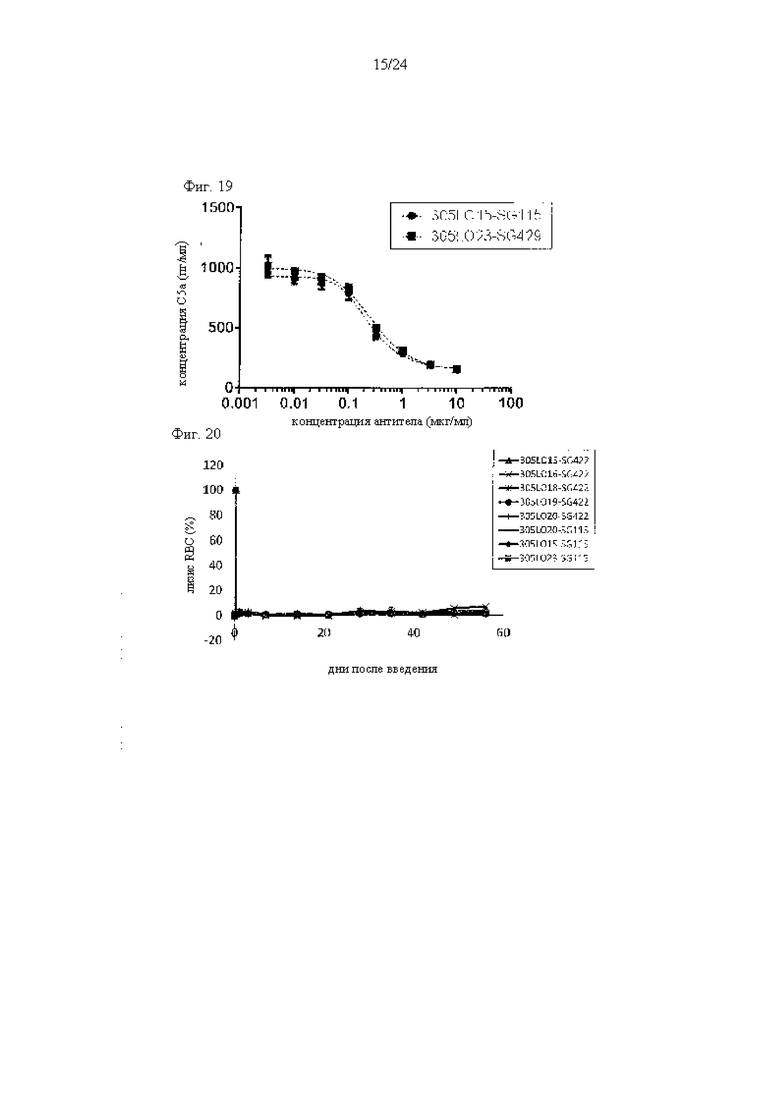
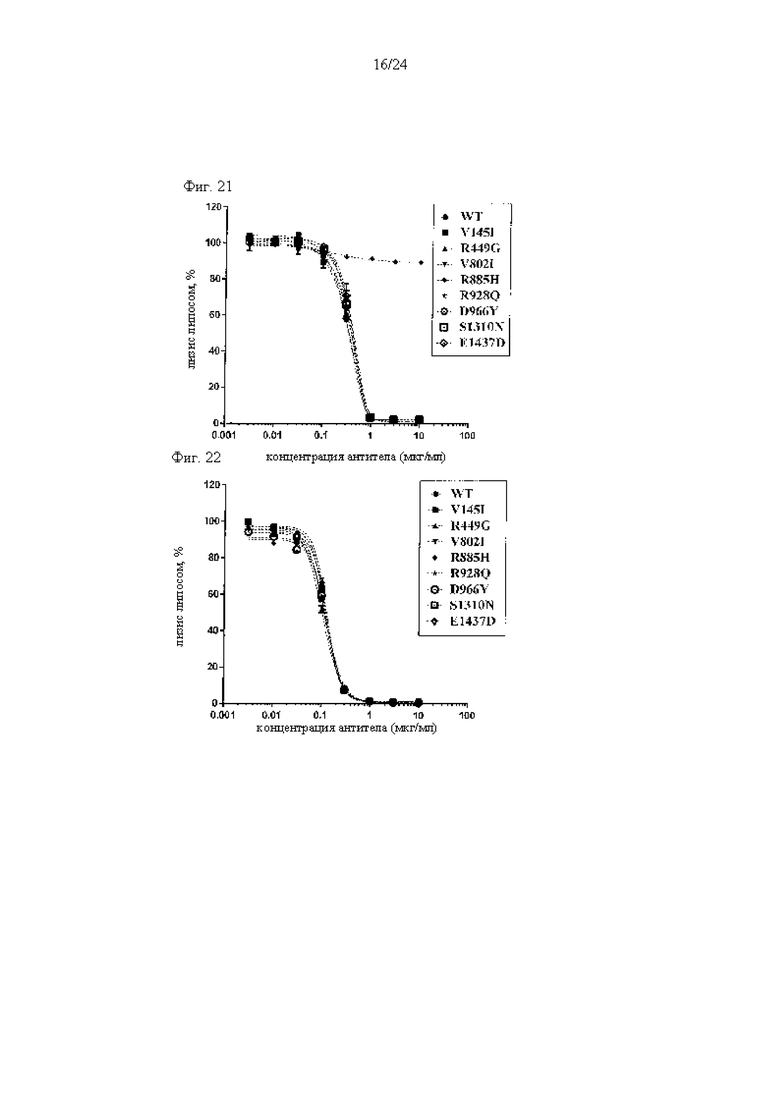
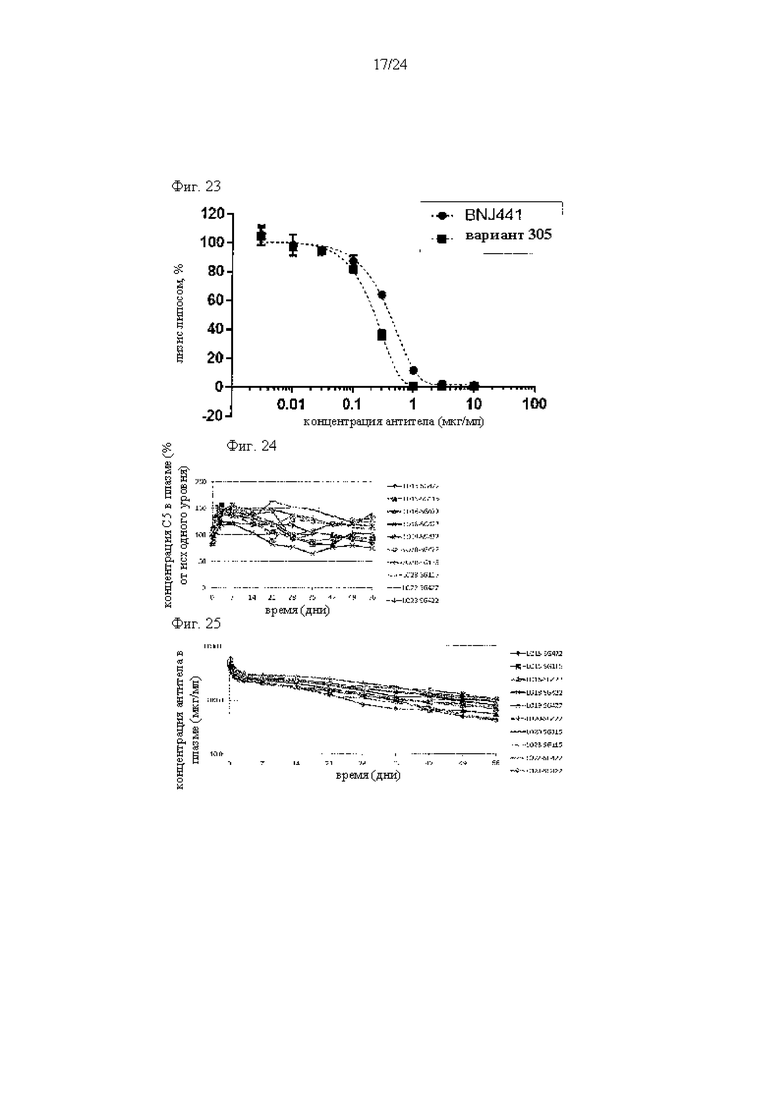
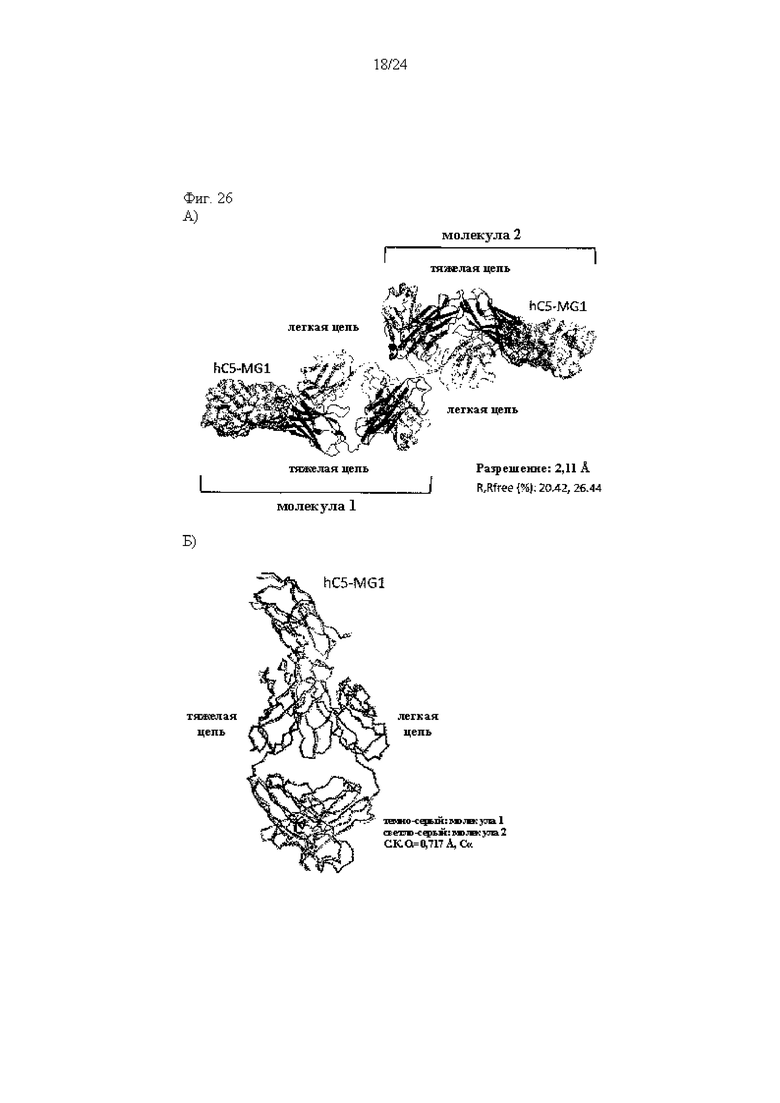

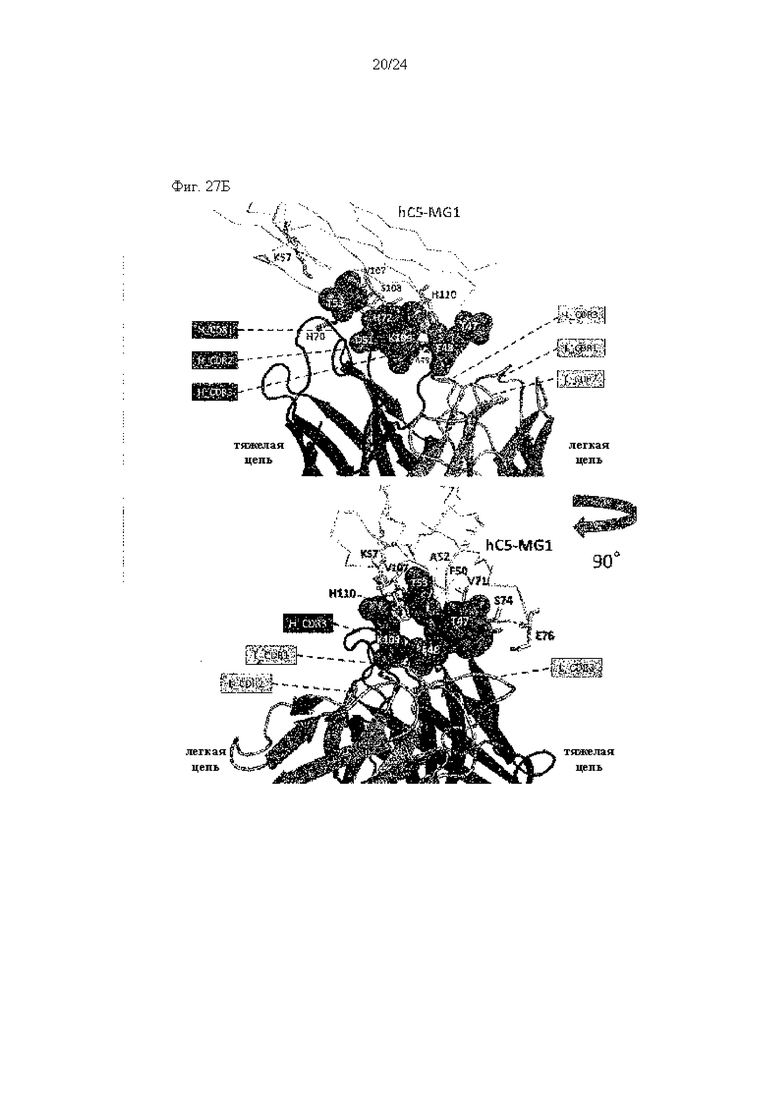
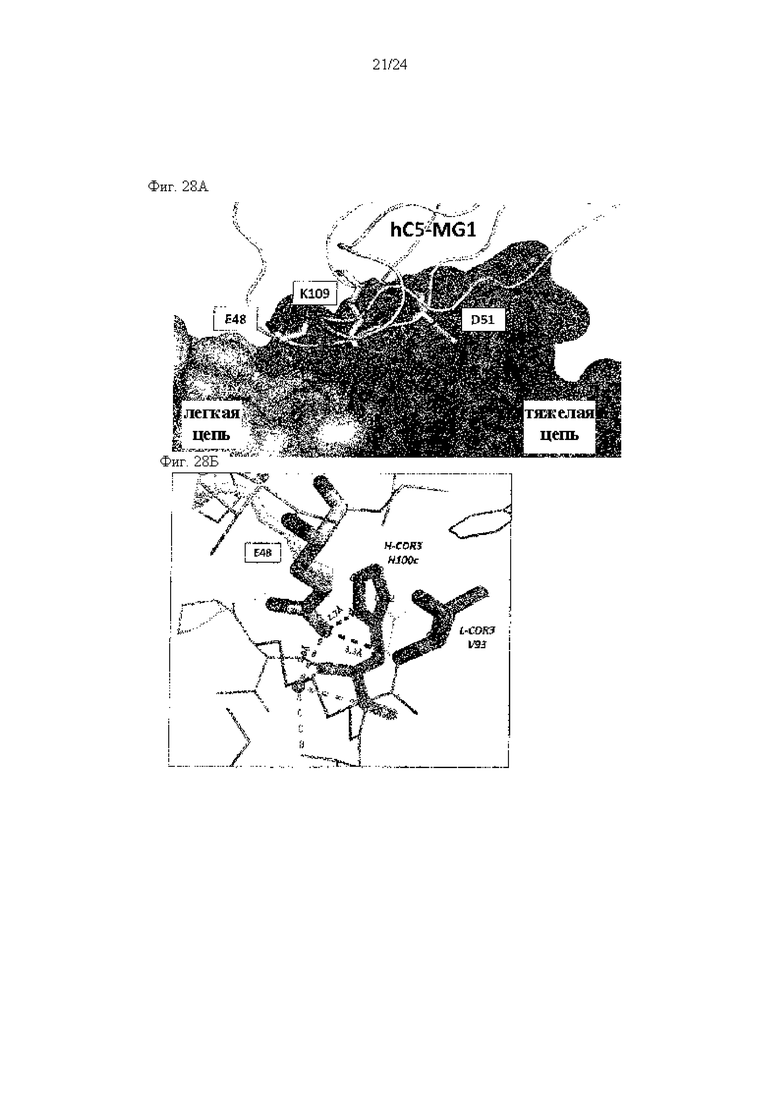
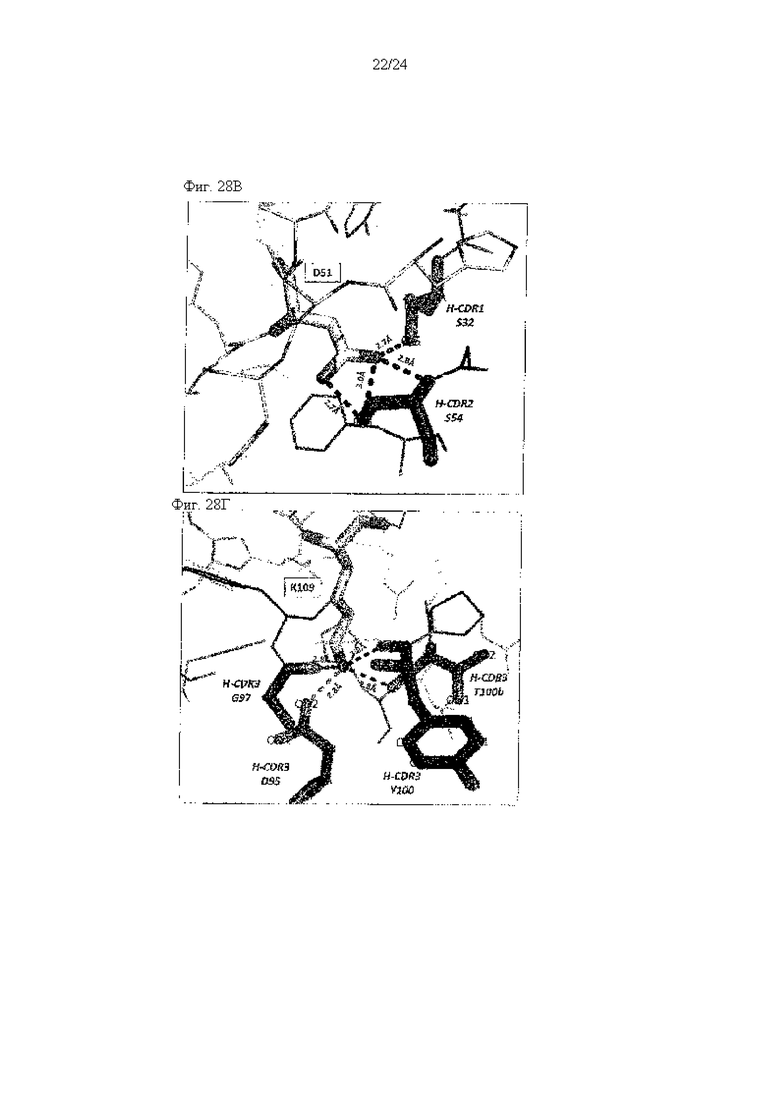
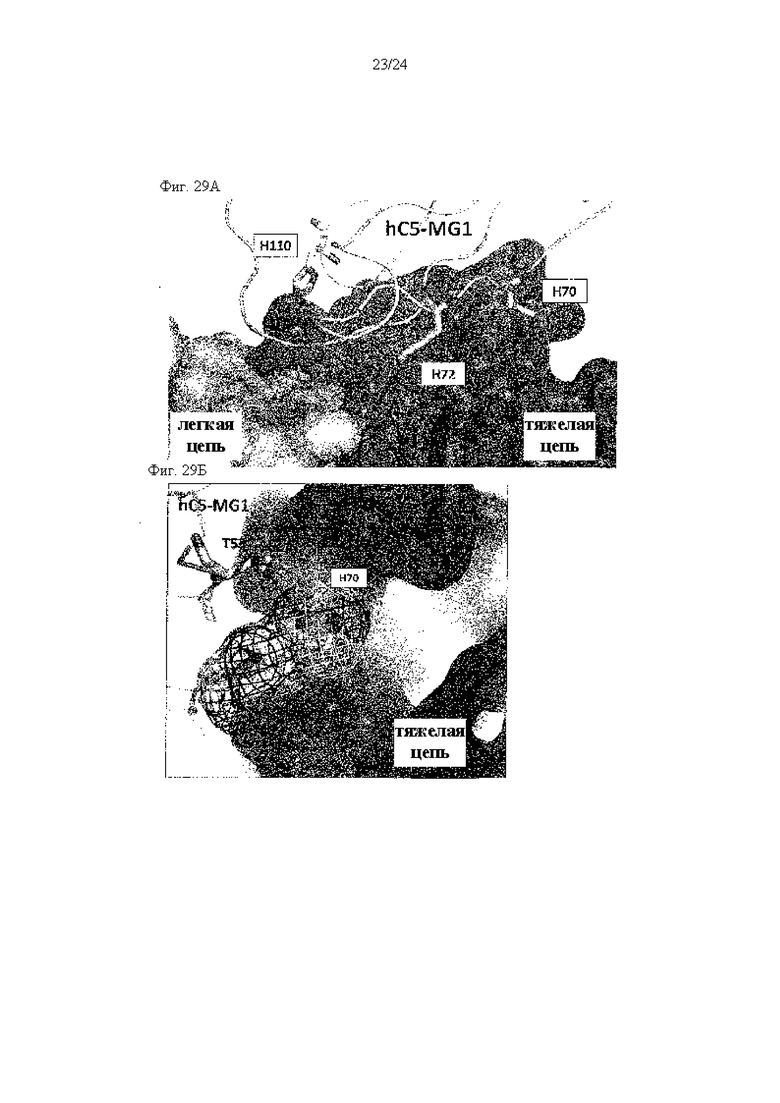
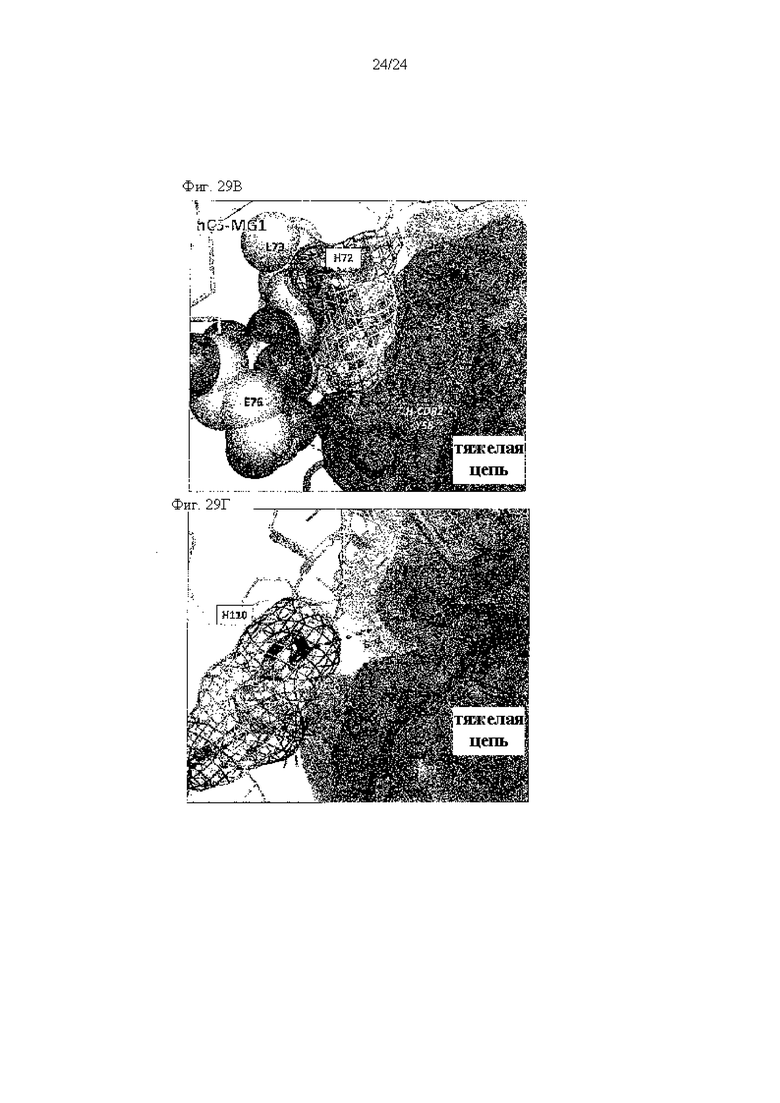
Изобретение относится к биотехнологии. Предложены варианты фармацевтической композиции, содержащей эффективное количество антитела, которое специфически связывается с С5, для лечения опосредуемого комплементом заболевания или состояния, которое включает избыточную или неконтролируемую активацию С5, или для усиления клиренса С5 из плазмы. Также предложено применение антитела, которое специфически связывается с С5, для приготовления лекарственного средства для лечения опосредуемого комплементом заболевания или состояния, которое включает избыточную или неконтролируемую активацию С5 или для усиления клиренса С5 из плазмы. Эффективное количество вариантов антитела, которое специфически связывается с С5, используют в способе лечения индивидуума с опосредуемым комплементом заболеванием или состоянием, которое включает избыточную или неконтролируемую активацию С5, или способе усиления клиренса C5 из плазмы у индивидуума. Изобретение обеспечивает эффективность лечения опосредуемого комплементом заболевания или состояния, которое включает избыточную или неконтролируемую активацию С5. 15 н. и 27 з.п. ф-лы, 29 ил., 11 табл., 11 пр.
1. Фармацевтическая композиция, содержащая эффективное количество антитела, которое специфически связывается с С5, для лечения опосредуемого комплементом заболевания или состояния, которое включает избыточную или неконтролируемую активацию С5, где антитело содержит
(a) VH последовательность SEQ ID NO: 106 и VL последовательность SEQ ID NO: 111;
(b) VH последовательность SEQ ID NO: 107 и VL последовательность SEQ ID NO: 111;
(c) VH последовательность SEQ ID NO: 108 и VL последовательность SEQ ID NO: 111;
(d) VH последовательность SEQ ID NO: 109 и VL последовательность SEQ ID NO: 111;
(e) VH последовательность SEQ ID NO: 109 и VL последовательность SEQ ID NO: 112;
(f) VH последовательность SEQ ID NO: 109 и VL последовательность SEQ ID NO: 113; или
(g) VH последовательность SEQ ID NO: 110 и VL последовательность SEQ ID NO: 113.
2. Фармацевтическая композиция, содержащая эффективное количество антитела, которое специфически связывается с С5, для усиления клиренса С5 из плазмы, где антитело содержит
(a) VH последовательность SEQ ID NO: 106 и VL последовательность SEQ ID NO: 111;
(b) VH последовательность SEQ ID NO: 107 и VL последовательность SEQ ID NO: 111;
(c) VH последовательность SEQ ID NO: 108 и VL последовательность SEQ ID NO: 111;
(d) VH последовательность SEQ ID NO: 109 и VL последовательность SEQ ID NO: 111;
(e) VH последовательность SEQ ID NO: 109 и VL последовательность SEQ ID NO: 112;
(f) VH последовательность SEQ ID NO: 109 и VL последовательность SEQ ID NO: 113; или
(g) VH последовательность SEQ ID NO: 110 и VL последовательность SEQ ID NO: 113.
3. Фармацевтическая композиция, содержащая эффективное количество антитела, которое специфически связывается с С5, для лечения опосредуемого комплементом заболевания или состояния, которое включает избыточную или неконтролируемую активацию С5, где антитело содержит:
(i) (a) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 117; (b) HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 118; (с) HVR-H3, включающую аминокислотную последовательность SEQ ID NO: 121; (d) HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 122; (e) HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 123; и (f) HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 125;
(ii) (a) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 117; (b) HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 119; (c) HVR-H3, включающую аминокислотную последовательность SEQ ID NO: 121; (d) HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 122; (e) HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 123; и (f) HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 125;
(iii) (a) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 117; (b) HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 118; (c) HVR-H3, включающую аминокислотную последовательность SEQ ID NO: 121; (d) HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 122; (e) HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 124; и (f) HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 125; или
(iv) (a) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 117; (b) HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 120; (c) a HVR-H3 включающую аминокислотную последовательность SEQ ID NO: 121; (d) HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 122; (e) HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 124; и (f) HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 125.
4. Фармацевтическая композиция по одному из пп. 1-3, где антитело дополнительно содержит:
[I] тяжелую цепь константной области, включающую любую из аминокислотных последовательностей SEQ ID NOs: 33, 34, 35, 114, 115 и 116; и
[II] легкую цепь константной области, включающую любую из аминокислотных последовательностей SEQ ID NOs: 36, 37 и 38.
5. Фармацевтическая композиция по п. 4, где антитело дополнительно содержит тяжелую цепь константной области, включающую аминокислотную последовательность SEQ ID NO: 114; и легкую цепь константной области, включающую аминокислотную последовательность SEQ ID NO: 38.
6. Фармацевтическая композиция по одному из пп. 1-5, где антитело ингибирует активацию С5.
7. Фармацевтическая композиция по одному из пп. 1-6, где антитело ингибирует активацию R885H-варианта С5.
8. Фармацевтическая композиция по одному из пп. 1-7, где антитело связывается с С5 с более высокой аффинностью при рН 7,4, чем при рН 5,8.
9. Фармацевтическая композиция по одному из пп. 1-8, где антитело представляет собой моноклональное антитело.
10. Фармацевтическая композиция по одному из пп. 1-9, где антитело представляет собой человеческое, гуманизированное или химерное антитело.
11. Фармацевтическая композиция по одному из пп. 1-10, где антитело представляет собой полноразмерное антитело IgG1-класса или IgG4-класса.
12. Фармацевтическая композиция по одному из пп. 1-11, где опосредуемое комплементом заболевание или состояние, которое включает избыточную или неконтролируемую активацию С5, выбрано из группы, состоящей из ревматоидного артрита (RA); системной красной волчанки (SLE); волчаночного нефрита; повреждения, вызываемого ишемией-реперфузией (IRI); астмы; пароксизмальной ночной гемоглобинурии (PNH); гемолитико-уремического синдрома (HUS), атипичного гемолитико-уремического синдрома (aHUS); болезни плотных депозитов (DDD); нейромиелита зрительного нерва (NMO); мультифокальной моторной невропатии (MMN); рассеянного склероза (MS); системного склероза; дегенерации желтого пятна; возрастной дегенерации желтого пятна (AMD); синдрома (HELLP): гемолиз, повышение активности ферментов печени и тромбоцитопения; тромботической тромбоцитопенической пурпуры (ТТР); спонтанной потери плода; буллезного эпидермолиза; повторной потери плода; преэклампсии; травматического повреждения головного мозга; тяжелой псевдопаралитической миастении; холодовой агглютининовой болезни; синдрома Шегрена; дерматомиозита; буллезного пемфигоида; фототоксических реакций; связанного с продуцируемым Е. coli токсином Шига гемолитико-уремического синдрома; типичного или инфекционного гемолитико-уремического синдрома (tHUS); С3-гломерулонефрита; ассоциированного с антинейтрофильным цитоплазматическим антителом (ANCA) васкулита; гуморального и сосудистого отторжения трансплантата; острого опосредуемого антителом отторжения (AMR); дисфункции трансплантата; инфаркта миокарда; аллогенного трансплантата; сепсиса; болезни коронарной артерии; наследственного ангионевротического отека; дерматомиозита; болезни Грейвса; атеросклероза; болезни Альцгеймера (AD); болезни Гентингтона; болезни Крейтцфельдта-Якоба; болезни Паркинсона; рака; ран; септического шока; поражения спинного нерва; увеита; связанных с диабетом глазных болезней; ретинопатии недоношенных; гломерулонефрита; мембранного нефрита; ассоциированной с иммуноглобулином А нефропатии; респираторного дистресс-синдрома взрослых (ARDS); хронического обструктивного заболевания легких (COPD); муковисцидоза; гемолитической анемии; пароксизмальной холодовой гемоглобинурии; анафилактического шока; аллергии; остеопороза; остеоартрита; тиреоидита Хашимото; диабета типа I; псориаза; пузырчатки; аутоиммунной гемолитической анемии (AIHA); идиопатической тромбоцитопенической пурпуры (ITP); синдрома Гудпасчера; болезни Дегоса; антифосфолипидного синдрома (APS); катастрофического APS (CAPS); сердечно-сосудистого нарушения; миокардита; нарушения мозгового кровообращения; заболевания периферических сосудов; реноваскулярного нарушения; заболевания мезентериальных/энтериальных сосудов; васкулита; нефрита при пурпуре Геноха-Шенлейна; болезни Такаяси; дилатирующей кардиомиопатии; диабетической ангиопатии; болезни Кавасаки (артерит); венозной воздушной эмболии (VGE), рестеноза после стентирования; ротационной атерэктомии; мембранозной нефропатии; синдрома Гийена-Барре (GBS); синдрома Фишера; индуцированного антигеном артрита; синовиального воспаления; вирусной инфекции; бактериальной инфекции; грибной инфекции; и повреждения, обусловленного инфарктом миокарда, сердечно-легочным шунтированием и гемодиализом.
13. Фармацевтическая композиция, содержащая эффективное количество антитела, которое специфически связывается с С5, и фармацевтически приемлемый носитель, для применения в лечении опосредуемого комплементом заболевания или состояния, которое включает избыточную или неконтролируемую активацию С5, где антитело имеет VH последовательность, состоящую из SEQ ID NO: 106, VL последовательность, состоящую из SEQ ID NO: 111, константную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 114, и константную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 38, и
где опосредуемое комплементом заболевание или состояние, которое включает избыточную или неконтролируемую активацию С5, выбрано из группы, состоящей из ревматоидного артрита (RA); системной красной волчанки (SLE); волчаночного нефрита; повреждения, вызываемого ишемией-реперфузией (IRI); астмы; пароксизмальной ночной гемоглобинурии (PNH); гемолитико-уремического синдрома (HUS); атипичного гемолитико-уремического синдрома (aHUS); болезни плотных депозитов (DDD); нейромиелита зрительного нерва (NMO); мультифокальной моторной невропатии (MMN); рассеянного склероза (MS); системного склероза; дегенерации желтого пятна; возрастной дегенерации желтого пятна (AMD); синдрома (HELLP): гемолиз, повышение активности ферментов печени и тромбоцитопения; тромботической тромбоцитопенической пурпуры (ТТР); спонтанной потери плода; буллезного эпидермолиза; повторной потери плода; преэклампсии; травматического повреждения головного мозга; тяжелой псевдопаралитической миастении; холодовой агглютининовой болезни; синдрома Шегрена; дерматомиозита; буллезного пемфигоида; фототоксических реакций; связанного с продуцируемым Е. coli токсином Шига гемолитико-уремического синдрома; типичного или инфекционного гемолитико-уремического синдрома (tHUS); С3-гломерулонефрита; ассоциированного с антинейтрофильным цитоплазматическим антителом (ANCA) васкулита; гуморального и сосудистого отторжения трансплантата; острого опосредуемого антителом отторжения (AMR); дисфункции трансплантата; инфаркта миокарда; аллогенного трансплантата; сепсиса; болезни коронарной артерии; наследственного ангионевротического отека; дерматомиозита; болезни Грейвса; атеросклероза; болезни Альцгеймера (AD); болезни Гентингтона; болезни Крейтцфельдта-Якоба; болезни Паркинсона; рака; ран; септического шока; поражения спинного нерва; увеита; связанных с диабетом глазных болезней; ретинопатии недоношенных; гломерулонефрита; мембранного нефрита; ассоциированной с иммуноглобулином А нефропатии; респираторного дистресс-синдрома взрослых (ARDS); хронического обструктивного заболевания легких (COPD); муковисцидоза; гемолитической анемии; пароксизмальной холодовой гемоглобинурии; анафилактического шока; аллергии; остеопороза; остеоартрита; тиреоидита Хашимото; диабета типа I; псориаза; пузырчатки; аутоиммунной гемолитической анемии (AIHA); идиопатической тромбоцитопенической пурпуры (ITP); синдрома Гудпасчера; болезни Дегоса; антифосфолипидного синдрома (APS); катастрофического APS (CAPS); сердечно-сосудистого нарушения; миокардита; нарушения мозгового кровообращения; заболевания периферических сосудов; реноваскулярного нарушения; заболевания мезентериальных/энтериальных сосудов; васкулита; нефрита при пурпуре Геноха-Шенлейна; болезни Такаяси; дилатирующей кардиомиопатии; диабетической ангиопатии; болезни Кавасаки (артерит); венозной воздушной эмболии (VGE), рестеноза после стентирования; ротационной атерэктомии; мембранозной нефропатии; синдрома Гийена-Барре (GBS); синдрома Фишера; индуцированного антигеном артрита; синовиального воспаления; вирусной инфекции; бактериальной инфекции; грибной инфекции; и повреждения, обусловленного инфарктом миокарда, сердечно-легочным шунтированием и гемодиализом.
14. Фармацевтическая композиция, содержащая эффективное количество антитела, которое специфически связывается с С5β, и фармацевтически приемлемый носитель, для применения в лечении опосредуемого комплементом заболевания или состояния, которое включает избыточную или неконтролируемую активацию С5, где антитело имеет VH последовательность, состоящую из SEQ ID NO: 106, VL последовательность, состоящую из SEQ ID NO: 111, константную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 114, и константную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 38, и
где опосредуемое комплементом заболевание или состояние, которое включает избыточную или неконтролируемую активацию С5, выбрано из группы, состоящей из ревматоидного артрита (RA); системной красной волчанки (SLE); волчаночного нефрита; повреждения, вызываемого ишемией-реперфузией (IRI); астмы; пароксизмальной ночной гемоглобинурии (PNH); гемолитико-уремического синдрома (HUS); атипичного гемолитико-уремического синдрома (aHUS); болезни плотных депозитов (DDD); нейромиелита зрительного нерва (NMO); мультифокальной моторной невропатии (MMN); рассеянного склероза (MS); системного склероза; дегенерации желтого пятна; возрастной дегенерации желтого пятна (AMD); синдрома (HELLP): гемолиз, повышение активности ферментов печени и тромбоцитопения; тромботической тромбоцитопенической пурпуры (ТТР); спонтанной потери плода; буллезного эпидермолиза; повторной потери плода; преэклампсии; травматического повреждения головного мозга; тяжелой псевдопаралитической миастении; холодовой агглютининовой болезни; синдрома Шегрена; дерматомиозита; буллезного пемфигоида; фототоксических реакций; связанного с продуцируемым Е. coli токсином Шига гемолитико-уремического синдрома; типичного или инфекционного гемолитико-уремического синдрома (tHUS); С3-гломерулонефрита; ассоциированного с антинейтрофильным цитоплазматическим антителом (ANCA) васкулита; гуморального и сосудистого отторжения трансплантата; острого опосредуемого антителом отторжения (AMR); дисфункции трансплантата; инфаркта миокарда; аллогенного трансплантата; сепсиса; болезни коронарной артерии; наследственного ангионевротического отека; дерматомиозита; болезни Грейвса; атеросклероза; болезни Альцгеймера (AD); болезни Гентингтона; болезни Крейтцфельдта-Якоба; болезни Паркинсона; рака; ран; септического шока; поражения спинного нерва; увеита; связанных с диабетом глазных болезней; ретинопатии недоношенных; гломерулонефрита; мембранного нефрита; ассоциированной с иммуноглобулином А нефропатии; респираторного дистресс-синдрома взрослых (ARDS); хронического обструктивного заболевания легких (COPD); муковисцидоза; гемолитической анемии; пароксизмальной холодовой гемоглобинурии; анафилактического шока; аллергии; остеопороза; остеоартрита; тиреоидита Хашимото; диабета типа I; псориаза; пузырчатки; аутоиммунной гемолитической анемии (AIHA); идиопатической тромбоцитопенической пурпуры (ITP); синдрома Гудпасчера; болезни Дегоса; антифосфолипидного синдрома (APS); катастрофического APS (CAPS); сердечно-сосудистого нарушения; миокардита; нарушения мозгового кровообращения; заболевания периферических сосудов; реноваскулярного нарушения; заболевания мезентериальных/энтериальных сосудов; васкулита; нефрита при пурпуре Геноха-Шенлейна; болезни Такаяси; дилатирующей кардиомиопатии; диабетической ангиопатии; болезни Кавасаки (артерит); венозной воздушной эмболии (VGE), рестеноза после стентирования; ротационной атерэктомии; мембранозной нефропатии; синдрома Гийена-Барре (GBS); синдрома Фишера; индуцированного антигеном артрита; синовиального воспаления; вирусной инфекции; бактериальной инфекции; грибной инфекции; и повреждения, обусловленного инфарктом миокарда, сердечно-легочным шунтированием и гемодиализом.
15. Применение антитела, которое специфически связывается с С5, для приготовления лекарственного средства для лечения опосредуемого комплементом заболевания или состояния, которое включает избыточную или неконтролируемую активацию С5, где антитело содержит:
(a) VH последовательность SEQ ID NO: 106 и VL последовательность SEQ ID NO: 111;
(b) VH последовательность SEQ ID NO: 107 и VL последовательность SEQ ID NO: 111;
(c) VH последовательность SEQ ID NO: 108 и VL последовательность SEQ ID NO: 111;
(d) VH последовательность SEQ ID NO: 109 и VL последовательность SEQ ID NO: 111;
(e) VH последовательность SEQ ID NO: 109 и VL последовательность SEQ ID NO: 112;
(f) VH последовательность SEQ ID NO: 109 и VL последовательность SEQ ID NO: 113; или
(g) VH последовательность SEQ ID NO: 110 и VL последовательность SEQ ID NO: 113.
16. Применение антитела, которое специфически связывается с С5, для приготовления лекарственного средства для усиления клиренса С5 из плазмы, где антитело содержит:
(a) VH последовательность SEQ ID NO: 106 и VL последовательность SEQ ID NO: 111;
(b) VH последовательность SEQ ID NO: 107 и VL последовательность SEQ ID NO: 111;
(c) VH последовательность SEQ ID NO: 108 и VL последовательность SEQ ID NO: 111;
(d) VH последовательность SEQ ID NO: 109 и VL последовательность SEQ ID NO: 111;
(e) VH последовательность SEQ ID NO: 109 и VL последовательность SEQ ID NO: 112;
(f) VH последовательность SEQ ID NO: 109 и VL последовательность SEQ ID NO: 113; или
(g) VH последовательность SEQ ID NO: 110 и VL последовательность SEQ ID NO: 113.
17. Применение антитела, которое специфически связывается с С5, для приготовления лекарственного средства для лечения опосредуемого комплементом заболевания или состояния, которое включает избыточную или неконтролируемую активацию С5, где антитело содержит:
(i) (a) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 117; (b) HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 118; (с) HVR-H3, включающую аминокислотную последовательность SEQ ID NO: 121; (d) HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 122; (e) HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 123; и (f) HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 125;
(ii) (a) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 117; (b) HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 119; (c) HVR-H3, включающую аминокислотную последовательность SEQ ID NO: 121; (d) HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 122; (e) HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 123; и (f) a HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 125;
(iii) (a) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 117; (b) HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 118; (c) HVR-H3, включающую аминокислотную последовательность SEQ ID NO: 121; (d) HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 122; (e) HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 124; и (f) HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 125; или
(iv) (a) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 117; (b) HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 120; (c) HVR-H3, включающую аминокислотную последовательность SEQ ID NO: 121; (d) HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 122; (e) HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 124; (f) HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 125.
18. Применение по одному из пп. 15-17, где антитело дополнительно содержит:
[I] тяжелую цепь константной области, включающую любую из аминокислотных последовательностей SEQ ID NOs: 33, 34, 35, 114, 115 и 116; и
[II] легкую цепь константной области, включающую любую из аминокислотных последовательностей SEQ ID NOs: 36, 37 и 38.
19. Применение по п. 18, где антитело дополнительно содержит тяжелую цепь константной области, включающую аминокислотную последовательность SEQ ID NO: 114 и легкую цепь константной области, включающую аминокислотную последовательность SEQ ID NO: 38.
20. Применение по одному из пп. 15-19, где антитело ингибирует активацию С5.
21. Применение по одному из пп. 15-20, где антитело ингибирует активацию R885H-варианта С5.
22. Применение по одному из пп. 15-21, где антитело связывается с С5 с более высокой аффинностью при рН 7,4, чем при рН 5,8.
23. Применение по одному из пп. 15-22, где антитело является моноклональным антителом.
24. Применение по одному из пп. 15-23, где антитело является человеческим, гуманизированным или химерным антителом.
25. Применение по одному из пп. 15-24, где антитело является полноразмерным IgG1 или IgG4 антителом.
26. Применение по одному из пп. 15-25, где опосредуемое комплементом заболевание или состояние, которое включает избыточную или неконтролируемую активацию С5, выбрано из группы, состоящей из ревматоидного артрита (RA); системной красной волчанки (SLE); волчаночного нефрита; повреждения, вызываемого ишемией-реперфузией (IRI); астмы; пароксизмальной ночной гемоглобинурии (PNH); гемолитико-уремического синдрома (HUS); атипичного гемолитико-уремического синдрома (aHUS); болезни плотных депозитов (DDD); нейромиелита зрительного нерва (NMO); мультифокальной моторной невропатии (MMN); рассеянного склероза (MS); системного склероза; дегенерации желтого пятна; возрастной дегенерации желтого пятна (AMD); синдрома (HELLP): гемолиз, повышение активности ферментов печени и тромбоцитопения; тромботической тромбоцитопенической пурпуры (ТТР); спонтанной потери плода; буллезного эпидермолиза; повторной потери плода; преэклампсии; травматического повреждения головного мозга; тяжелой псевдопаралитической миастении; холодовой агглютининовой болезни; синдрома Шегрена; дерматомиозита; буллезного пемфигоида; фототоксических реакций; связанного с продуцируемым Е. coli токсином Шига гемолитико-уремического синдрома; типичного или инфекционного гемолитико-уремического синдрома (tHUS); С3-гломерулонефрита; ассоциированного с антинейтрофильным цитоплазматическим антителом (ANCA) васкулита; гуморального и сосудистого отторжения трансплантата; острого опосредуемого антителом отторжения (AMR); дисфункции трансплантата; инфаркта миокарда; аллогенного трансплантата; сепсиса; болезни коронарной артерии; наследственного ангионевротического отека; дерматомиозита; болезни Грейвса; атеросклероза; болезни Альцгеймера (AD); болезни Гентингтона; болезни Крейтцфельдта-Якоба; болезни Паркинсона; рака; ран; септического шока; поражения спинного нерва; увеита; связанных с диабетом глазных болезней; ретинопатии недоношенных; гломерулонефрита; мембранного нефрита; ассоциированной с иммуноглобулином А нефропатии; респираторного дистресс-синдрома взрослых (ARDS); хронического обструктивного заболевания легких (COPD); муковисцидоза; гемолитической анемии; пароксизмальной холодовой гемоглобинурии; анафилактического шока; аллергии; остеопороза; остеоартрита; тиреоидита Хашимото; диабета типа I; псориаза; пузырчатки; аутоиммунной гемолитической анемии (AIHA); идиопатической тромбоцитопенической пурпуры (ITP); синдрома Гудпасчера; болезни Дегоса; антифосфолипидного синдрома (APS); катастрофического APS (CAPS); сердечно-сосудистого нарушения; миокардита; нарушения мозгового кровообращения; заболевания периферических сосудов; реноваскулярного нарушения; заболевания мезентериальных/энтериальных сосудов; васкулита; нефрита при пурпуре Геноха-Шенлейна; болезни Такаяси; дилатирующей кардиомиопатии; диабетической ангиопатии; болезни Кавасаки (артерит); венозной воздушной эмболии (VGE), рестеноза после стентирования; ротационной атерэктомии; мембранозной нефропатии; синдрома Гийена-Барре (GBS); синдрома Фишера; индуцированного антигеном артрита; синовиального воспаления; вирусной инфекции; бактериальной инфекции; грибной инфекции; и повреждения, обусловленного инфарктом миокарда, сердечно-легочным шунтированием и гемодиализом.
27. Применение антитела, которое специфически связывается с С5, для приготовления лекарственного средства для лечения опосредуемого комплементом заболевания или состояния, которое включает избыточную или неконтролируемую активацию С5, где антитело имеет VH последовательность, состоящую из SEQ ID NO: 106, VL последовательность, состоящую из SEQ ID NO: 111, константную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 114, и константную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 38, и
где опосредуемое комплементом заболевание или состояние выбрано из группы, состоящей из ревматоидного артрита (RA); системной красной волчанки (SLE); волчаночного нефрита; повреждения, вызываемого ишемией-реперфузией (IRI); астмы; пароксизмальной ночной гемоглобинурии (PNH); гемолитико-уремического синдрома (HUS); атипичного гемолитико-уремического синдрома (aHUS); болезни плотных депозитов (DDD); нейромиелита зрительного нерва (NMO); мультифокальной моторной невропатии (MMN); рассеянного склероза (MS); системного склероза; дегенерации желтого пятна; возрастной дегенерации желтого пятна (AMD); синдрома (HELLP): гемолиз, повышение активности ферментов печени и тромбоцитопения; тромботической тромбоцитопенической пурпуры (ТТР); спонтанной потери плода; буллезного эпидермолиза; повторной потери плода; преэклампсии; травматического повреждения головного мозга; тяжелой псевдопаралитической миастении; холодовой агглютининовой болезни; синдрома Шегрена; дерматомиозита; буллезного пемфигоида; фототоксических реакций; связанного с продуцируемым Е. coli токсином Шига гемолитико-уремического синдрома; типичного или инфекционного гемолитико-уремического синдрома (tHUS); С3-гломерулонефрита; ассоциированного с антинейтрофильным цитоплазматическим антителом (ANCA) васкулита; гуморального и сосудистого отторжения трансплантата; острого опосредуемого антителом отторжения (AMR); дисфункции трансплантата; инфаркта миокарда; аллогенного трансплантата; сепсиса; болезни коронарной артерии; наследственного ангионевротического отека; дерматомиозита; болезни Грейвса; атеросклероза; болезни Альцгеймера (AD); болезни Гентингтона; болезни Крейтцфельдта-Якоба; болезни Паркинсона; рака; ран; септического шока; поражения спинного нерва; увеита; связанных с диабетом глазных болезней; ретинопатии недоношенных; гломерулонефрита; мембранного нефрита; ассоциированной с иммуноглобулином А нефропатии; респираторного дистресс-синдрома взрослых (ARDS); хронического обструктивного заболевания легких (COPD); муковисцидоза; гемолитической анемии; пароксизмальной холодовой гемоглобинурии; анафилактического шока; аллергии; остеопороза; остеоартрита; тиреоидита Хашимото; диабета типа I; псориаза; пузырчатки; аутоиммунной гемолитической анемии (AIHA); идиопатической тромбоцитопенической пурпуры (ITP); синдрома Гудпасчера; болезни Дегоса; антифосфолипидного синдрома (APS); катастрофического APS (CAPS); сердечно-сосудистого нарушения; миокардита; нарушения мозгового кровообращения; заболевания периферических сосудов; реноваскулярного нарушения; заболевания мезентериальных/энтериальных сосудов; васкулита; нефрита при пурпуре Геноха-Шенлейна; болезни Такаяси; дилатирующей кардиомиопатии; диабетической ангиопатии; болезни Кавасаки (артерит); венозной воздушной эмболии (VGE), рестеноза после стентирования; ротационной атерэктомии; мембранозной нефропатии; синдрома Гийена-Барре (GBS); синдрома Фишера; индуцированного антигеном артрита; синовиального воспаления; вирусной инфекции; бактериальной инфекции; грибной инфекции; и повреждения, обусловленного инфарктом миокарда, сердечно-легочным шунтированием и гемодиализом.
28. Применение антитела, которое специфически связывается с С5β, для приготовления лекарственного средства для лечения опосредуемого комплементом заболевания или состояния, которое включает избыточную или неконтролируемую активацию С5, где антитело имеет VH последовательность, состоящую из SEQ ID NO: 106, VL последовательность, состоящую из SEQ ID NO: 111, константную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 114, и константную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 38, и
где опосредуемое комплементом заболевание или состояние, которое включает избыточную или неконтролируемую активацию С5, выбрано из группы, состоящей из ревматоидного артрита (RA); системной красной волчанки (SLE); волчаночного нефрита; повреждения, вызываемого ишемией-реперфузией (IRI); астмы; пароксизмальной ночной гемоглобинурии (PNH); гемолитико-уремического синдрома (HUS); атипичного гемолитико-уремического синдрома (aHUS); болезни плотных депозитов (DDD); нейромиелита зрительного нерва (NMO); мультифокальной моторной невропатии (MMN); рассеянного склероза (MS); системного склероза; дегенерации желтого пятна; возрастной дегенерации желтого пятна (AMD); синдрома (HELLP): гемолиз, повышение активности ферментов печени и тромбоцитопения; тромботической тромбоцитопенической пурпуры (ТТР); спонтанной потери плода; буллезного эпидермолиза; повторной потери плода; преэклампсии; травматического повреждения головного мозга; тяжелой псевдопаралитической миастении; холодовой агглютининовой болезни; синдрома Шегрена; дерматомиозита; буллезного пемфигоида; фототоксических реакций; связанного с продуцируемым Е. coli токсином Шига гемолитико-уремического синдрома; типичного или инфекционного гемолитико-уремического синдрома (tHUS); С3-гломерулонефрита; ассоциированного с антинейтрофильным цитоплазматическим антителом (ANCA) васкулита; гуморального и сосудистого отторжения трансплантата; острого опосредуемого антителом отторжения (AMR); дисфункции трансплантата; инфаркта миокарда; аллогенного трансплантата; сепсиса; болезни коронарной артерии; наследственного ангионевротического отека; дерматомиозита; болезни Грейвса; атеросклероза; болезни Альцгеймера (AD); болезни Гентингтона; болезни Крейтцфельдта-Якоба; болезни Паркинсона; рака; ран; септического шока; поражения спинного нерва; увеита; связанных с диабетом глазных болезней; ретинопатии недоношенных; гломерулонефрита; мембранного нефрита; ассоциированной с иммуноглобулином А нефропатии; респираторного дистресс-синдрома взрослых (ARDS); хронического обструктивного заболевания легких (COPD); муковисцидоза; гемолитической анемии; пароксизмальной холодовой гемоглобинурии; анафилактического шока; аллергии; остеопороза; остеоартрита; тиреоидита Хашимото; диабета типа I; псориаза; пузырчатки; аутоиммунной гемолитической анемии (AIHA); идиопатической тромбоцитопенической пурпуры (ITP); синдрома Гудпасчера; болезни Дегоса; антифосфолипидного синдрома (APS); катастрофического APS (CAPS); сердечно-сосудистого нарушения; миокардита; нарушения мозгового кровообращения; заболевания периферических сосудов; реноваскулярного нарушения; заболевания мезентериальных/энтериальных сосудов; васкулита; нефрита при пурпуре Геноха-Шенлейна; болезни Такаяси; дилатирующей кардиомиопатии; диабетической ангиопатии; болезни Кавасаки (артерит); венозной воздушной эмболии (VGE), рестеноза после стентирования; ротационной атерэктомии; мембранозной нефропатии; синдрома Гийена-Барре (GBS); синдрома Фишера; индуцированного антигеном артрита; синовиального воспаления; вирусной инфекции; бактериальной инфекции; грибной инфекции; и повреждения, обусловленного инфарктом миокарда, сердечно-легочным шунтированием и гемодиализом.
29. Способ лечения индивидуума с опосредуемым комплементом заболеванием или состоянием, которое включает избыточную или неконтролируемую активацию С5, способ, включающий введение индивидууму эффективного количества антитела, которое специфически связывается с С5, где антитело содержит:
(a) VH последовательность SEQ ID NO: 106 и VL последовательность SEQ ID NO: 111;
(b) VH последовательность SEQ ID NO: 107 и VL последовательность SEQ ID NO: 111;
(c) VH последовательность SEQ ID NO: 108 и VL последовательность SEQ ID NO: 111;
(d) VH последовательность SEQ ID NO: 109 и VL последовательность SEQ ID NO: 111;
(e) VH последовательность SEQ ID NO: 109 и VL последовательность SEQ ID NO: 112;
(f) VH последовательность SEQ ID NO: 109 и VL последовательность SEQ ID NO: 113; или
(g) VH последовательность SEQ ID NO: 110 и VL последовательность SEQ ID NO: 113.
30. Способ усиления клиренса C5 из плазмы у индивидуума, включающий введение индивидууму эффективного количества антитела, которое специфически связывается с С5, чтобы усилить клиренс С5 из плазмы, где антитело содержит:
(a) VH последовательность SEQ ID NO: 106 и VL последовательность SEQ ID NO: 111;
(b) VH последовательность SEQ ID NO: 107 и VL последовательность SEQ ID NO: 111;
(c) VH последовательность SEQ ID NO: 108 и VL последовательность SEQ ID NO: 111;
(d) VH последовательность SEQ ID NO: 109 и VL последовательность SEQ ID NO: 111;
(e) VH последовательность SEQ ID NO: 109 и VL последовательность SEQ ID NO: 112;
(f) VH последовательность SEQ ID NO: 109 и VL последовательность SEQ ID NO: 113; или
(g) VH последовательность SEQ ID NO: 110 и VL последовательность SEQ ID NO: 113.
31. Способ лечения индивидуума с опосредуемым комплементом заболеванием или состоянием, которое включает избыточную или неконтролируемую активацию С5, способ, включающий введение индивидууму эффективного количества антитела, которое специфически связывается с С5, где антитело содержит:
(i) (a) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 117; (b) HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 118; (с) HVR-H3, включающую аминокислотную последовательность SEQ ID NO: 121; (d) HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 122; (e) HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 123; и (f) HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 125;
(ii) (a) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 117; (b) HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 119; (c) HVR-H3, включающую аминокислотную последовательность SEQ ID NO: 121; (d) HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 122; (e) HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 123; и (f) HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 125;
(iii) (a) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 117; (b) HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 118; (c) HVR-H3, включающую аминокислотную последовательность SEQ ID NO: 121; (d) HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 122; (e) HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 124; и (f) HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 125; или
(iv) (a) HVR-H1, включающую аминокислотную последовательность SEQ ID NO: 117; (b) HVR-H2, включающую аминокислотную последовательность SEQ ID NO: 120; (c) HVR-H3, включающую аминокислотную последовательность SEQ ID NO: 121; (d) HVR-L1, включающую аминокислотную последовательность SEQ ID NO: 122; (e) HVR-L2, включающую аминокислотную последовательность SEQ ID NO: 124; и (f) HVR-L3, включающую аминокислотную последовательность SEQ ID NO: 125.
32. Способ по одному из пп. 29-31, где антитело дополнительно содержит:
[I] тяжелую цепь константной области, включающую любую из аминокислотных последовательностей SEQ ID NOs: 33, 34, 35, 114, 115 и 116; и
[II] легкую цепь константной области, включающую любую из аминокислотных последовательностей SEQ ID NOs: 36, 37 и 38.
33. Способ по п. 32, где антитело дополнительно содержит тяжелую цепь константной области, включающую аминокислотную последовательность SEQ ID NO: 114, и легкую цепь константной области, включающую аминокислотную последовательность SEQ ID NO: 38.
34. Способ по одному из пп. 29-33, где антитело ингибирует активацию С5.
35. Способ по одному из пп. 29-34, где антитело ингибирует активацию R885H-варианта С5.
36. Способ по одному из пп. 29-35, где антитело связывается с С5 с более высокой аффинностью при рН 7,4, чем при рН 5,8.
37. Способ по одному из пп. 29-36, где антитело является моноклональным антителом.
38. Способ по одному из пп. 29-37, где антитело является человеческим, гуманизированным или химерным антителом.
39. Способ по одному из пп. 29-38, где антитело является полноразмерным IgG1 или IgG4 антителом.
40. Способ по одному из пп. 29-39, где опосредуемое комплементом заболевание или состояние, которое включает избыточную или неконтролируемую активацию С5, выбрано из группы, состоящей из ревматоидного артрита (RA); системной красной волчанки (SLE); волчаночного нефрита; повреждения, вызываемого ишемией-реперфузией (IRI); астмы; пароксизмальной ночной гемоглобинурии (PNH); гемолитико-уремического синдрома (HUS); атипичного гемолитико-уремического синдрома (aHUS); болезни плотных депозитов (DDD); нейромиелита зрительного нерва (NMO); мультифокальной моторной невропатии (MMN); рассеянного склероза (MS); системного склероза; дегенерации желтого пятна; возрастной дегенерации желтого пятна (AMD); синдрома (HELLP): гемолиз, повышение активности ферментов печени и тромбоцитопения; тромботической тромбоцитопенической пурпуры (ТТР); спонтанной потери плода; буллезного эпидермолиза; повторной потери плода; преэклампсии; травматического повреждения головного мозга; тяжелой псевдопаралитической миастении; холодовой агглютининовой болезни; синдрома Шегрена; дерматомиозита; буллезного пемфигоида; фототоксических реакций; связанного с продуцируемым Е. coli токсином Шига гемолитико-уремического синдрома; типичного или инфекционного гемолитико-уремического синдрома (tHUS); С3-гломерулонефрита; ассоциированного с антинейтрофильным цитоплазматическим антителом (ANCA) васкулита; гуморального и сосудистого отторжения трансплантата; острого опосредуемого антителом отторжения (AMR); дисфункции трансплантата; инфаркта миокарда; аллогенного трансплантата; сепсиса; болезни коронарной артерии; наследственного ангионевротического отека; дерматомиозита; болезни Грейвса; атеросклероза; болезни Альцгеймера (AD); болезни Гентингтона; болезни Крейтцфельдта-Якоба; болезни Паркинсона; рака; ран; септического шока; поражения спинного нерва; увеита; связанных с диабетом глазных болезней; ретинопатии недоношенных; гломерулонефрита; мембранного нефрита; ассоциированной с иммуноглобулином А нефропатии; респираторного дистресс-синдрома взрослых (ARDS); хронического обструктивного заболевания легких (COPD); муковисцидоза; гемолитической анемии; пароксизмальной холодовой гемоглобинурии; анафилактического шока; аллергии; остеопороза; остеоартрита; тиреоидита Хашимото; диабета типа I; псориаза; пузырчатки; аутоиммунной гемолитической анемии (AIHA); идиопатической тромбоцитопенической пурпуры (ITP); синдрома Гудпасчера; болезни Дегоса; антифосфолипидного синдрома (APS); катастрофического APS (CAPS); сердечно-сосудистого нарушения; миокардита; нарушения мозгового кровообращения; заболевания периферических сосудов; реноваскулярного нарушения; заболевания мезентериальных/энтериальных сосудов; васкулита; нефрита при пурпуре Геноха-Шенлейна; болезни Такаяси; дилатирующей кардиомиопатии; диабетической ангиопатии; болезни Кавасаки (артерит); венозной воздушной эмболии (VGE), рестеноза после стентирования; ротационной атерэктомии; мембранозной нефропатии; синдрома Гийена-Барре (GBS); синдрома Фишера; индуцированного антигеном артрита; синовиального воспаления; вирусной инфекции; бактериальной инфекции; грибной инфекции; и повреждения, обусловленного инфарктом миокарда, сердечно-легочным шунтированием и гемодиализом.
41. Способ лечения индивидуума, имеющего опосредуемое комплементом заболевание или состояние, которое включает избыточную или неконтролируемую активацию С5, где антитело имеет VH последовательность, состоящую из SEQ ID NO: 106, VL последовательность, состоящую из SEQ ID NO: 111, константную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 114, и константную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 38, и
где опосредуемое комплементом заболевание или состояние, которое включает избыточную или неконтролируемую активацию С5, выбрано из группы, состоящей из ревматоидного артрита (RA); системной красной волчанки (SLE); волчаночного нефрита; повреждения, вызываемого ишемией-реперфузией (IRI); астмы; пароксизмальной ночной гемоглобинурии (PNH); гемолитико-уремического синдрома (HUS); атипичного гемолитико-уремического синдрома (aHUS); болезни плотных депозитов (DDD); нейромиелита зрительного нерва (NMO); мультифокальной моторной невропатии (MMN); рассеянного склероза (MS); системного склероза; дегенерации желтого пятна; возрастной дегенерации желтого пятна (AMD); синдрома(HELLP): гемолиз, повышение активности ферментов печени и тромбоцитопения; тромботической тромбоцитопенической пурпуры (ТТР); спонтанной потери плода; буллезного эпидермолиза; повторной потери плода; преэклампсии; травматического повреждения головного мозга; тяжелой псевдопаралитической миастении; холодовой агглютининовой болезни; синдрома Шегрена; дерматомиозита; буллезного пемфигоида; фототоксических реакций; связанного с продуцируемым Е. coli токсином Шига гемолитико-уремического синдрома; типичного или инфекционного гемолитико-уремического синдрома (tHUS); С3-гломерулонефрита; ассоциированного с антинейтрофильным цитоплазматическим антителом (ANCA) васкулита; гуморального и сосудистого отторжения трансплантата; острого опосредуемого антителом отторжения (AMR); дисфункции трансплантата; инфаркта миокарда; аллогенного трансплантата; сепсиса; болезни коронарной артерии; наследственного ангионевротического отека; дерматомиозита; болезни Грейвса; атеросклероза; болезни Альцгеймера (AD); болезни Гентингтона; болезни Крейтцфельдта-Якоба; болезни Паркинсона; рака; ран; септического шока; поражения спинного нерва; увеита; связанных с диабетом глазных болезней; ретинопатии недоношенных; гломерулонефрита; мембранного нефрита; ассоциированной с иммуноглобулином А нефропатии; респираторного дистресс-синдрома взрослых (ARDS); хронического обструктивного заболевания легких (COPD); муковисцидоза; гемолитической анемии; пароксизмальной холодовой гемоглобинурии; анафилактического шока; аллергии; остеопороза; остеоартрита; тиреоидита Хашимото; диабета типа I; псориаза; пузырчатки; аутоиммунной гемолитической анемии (AIHA); идиопатической тромбоцитопенической пурпуры (ITP); синдрома Гудпасчера; болезни Дегоса; антифосфолипидного синдрома (APS); катастрофического APS (CAPS); сердечно-сосудистого нарушения; миокардита; нарушения мозгового кровообращения; заболевания периферических сосудов; реноваскулярного нарушения; заболевания мезентериальных/энтериальных сосудов; васкулита; нефрита при пурпуре Геноха-Шенлейна; болезни Такаяси; дилатирующей кардиомиопатии; диабетической ангиопатии; болезни Кавасаки (артерит); венозной воздушной эмболии (VGE), рестеноза после стентирования; ротационной атерэктомии; мембранозной нефропатии; синдрома Гийена-Барре (GBS); синдрома Фишера; индуцированного антигеном артрита; синовиального воспаления; вирусной инфекции; бактериальной инфекции; грибной инфекции; и повреждения, обусловленного инфарктом миокарда, сердечно-легочным шунтированием и гемодиализом.
42. Способ лечения индивидуума, имеющего опосредуемое комплементом заболевание или состояние, которое включает избыточную или неконтролируемую активацию С5, способ включает введение индивидууму эффективного количества антитела, которое спицифически связывается с С5β, где антитело имеет VH последовательность, состоящую из SEQ ID NO: 106, VL последовательность, состоящую из SEQ ID NO: 111, константную область тяжелой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 114, и константную область легкой цепи, состоящую из аминокислотной последовательности SEQ ID NO: 38, и
где опосредуемое комплементом заболевание или состояние, которое включает избыточную или неконтролируемую активацию С5, выбрано из группы, состоящей из ревматоидного артрита (RA); системной красной волчанки (SLE); волчаночного нефрита; повреждения, вызываемого ишемией-реперфузией (IRI); астмы; пароксизмальной ночной гемоглобинурии (PNH); гемолитико-уремического синдрома (HUS); атипичного гемолитико-уремического синдрома (aHUS); болезни плотных депозитов (DDD); нейромиелита зрительного нерва (NMO); мультифокальной моторной невропатии (MMN); рассеянного склероза (MS); системного склероза; дегенерации желтого пятна; возрастной дегенерации желтого пятна (AMD); синдрома (HELLP): гемолиз, повышение активности ферментов печени и тромбоцитопения; тромботической тромбоцитопенической пурпуры (ТТР); спонтанной потери плода; буллезного эпидермолиза; повторной потери плода; преэклампсии; травматического повреждения головного мозга; тяжелой псевдопаралитической миастении; холодовой агглютининовой болезни; синдрома Шегрена; дерматомиозита; буллезного пемфигоида; фототоксических реакций; связанного с продуцируемым Е. coli токсином Шига гемолитико-уремического синдрома; типичного или инфекционного гемолитико-уремического синдрома (tHUS); С3-гломерулонефрита; ассоциированного с антинейтрофильным цитоплазматическим антителом (ANCA) васкулита; гуморального и сосудистого отторжения трансплантата; острого опосредуемого антителом отторжения (AMR); дисфункции трансплантата; инфаркта миокарда; аллогенного трансплантата; сепсиса; болезни коронарной артерии; наследственного ангионевротического отека; дерматомиозита; болезни Грейвса; атеросклероза; болезни Альцгеймера (AD); болезни Гентингтона; болезни Крейтцфельдта-Якоба; болезни Паркинсона; рака; ран; септического шока; поражения спинного нерва; увеита; связанных с диабетом глазных болезней; ретинопатии недоношенных; гломерулонефрита; мембранного нефрита; ассоциированной с иммуноглобулином А нефропатии; респираторного дистресс-синдрома взрослых (ARDS); хронического обструктивного заболевания легких (COPD); муковисцидоза; гемолитической анемии; пароксизмальной холодовой гемоглобинурии; анафилактического шока; аллергии; остеопороза; остеоартрита; тиреоидита Хашимото; диабета типа I; псориаза; пузырчатки; аутоиммунной гемолитической анемии (AIHA); идиопатической тромбоцитопенической пурпуры (ITP); синдрома Гудпасчера; болезни Дегоса; антифосфолипидного синдрома (APS); катастрофического APS (CAPS); сердечно-сосудистого нарушения; миокардита; нарушения мозгового кровообращения; заболевания периферических сосудов; реноваскулярного нарушения; заболевания мезентериальных/энтериальных сосудов; васкулита; нефрита при пурпуре Геноха-Шенлейна; болезни Такаяси; дилатирующей кардиомиопатии; диабетической ангиопатии; болезни Кавасаки (артерит); венозной воздушной эмболии (VGE), рестеноза после стентирования; ротационной атерэктомии; мембранозной нефропатии; синдрома Гийена-Барре (GBS); синдрома Фишера; индуцированного антигеном артрита; синовиального воспаления; вирусной инфекции; бактериальной инфекции; грибной инфекции; и повреждения, обусловленного инфарктом миокарда, сердечно-легочным шунтированием и гемодиализом.
| WO 2015134894 Al, 11.05.2015 | |||
| WO 2010015608 Al, 11.02.2010 | |||
| US 20160068592 Al, 10.03.2016 | |||
| WO 2014160958 Al, 02.10.2014 | |||
| МАКАРОВА Т | |||
| И ДР | |||
| Опыт применения экулизумаба у ребенка с атипичным гемолитико-уремическим синдромом | |||
| Нефрология, 2014, Том 18, N 3, C | |||
| Способ приготовления сернистого красителя защитного цвета | 1921 |
|
SU84A1 |
Авторы
Даты
2023-02-10—Публикация
2017-06-16—Подача