[0001] Настоящее изобретение относится к способам и наборам для выявления возбудителя мучнистой росы винограда, гриба Erysiphe necator. Более конкретно способы согласно изобретению являются количественными способами, основанными на количественной полимеразной цепной реакции.
Уровень техники
[0002] Мучнистая роса винограда, вызываемая Erysiphe necator (также известен как Uncinula necator), является одной из наиболее распространенных болезней винограда (Vitis vinifera L.) по всему миру. Erysiphe necator принадлежит к аскомицетам и является облигатным биотрофным грибом, т.е., его рост и размножение полностью зависят от его живого хозяина-винограда (виноградин и листьев). Вследствие этого мучнистую росу винограда невозможно культивировать in vitro, сложно криоконсервировать, а также на данный момент для нее нет надежного протокола трансформации, что вызывает серьезные трудности при ее экспериментальном применении в лабораториях (Spanu и др., 2012, New Phytologist 195: 20-22).
[0003] Несмотря на свою важность, молекулярные характеристики мучнистых рос на виноградниках и информация в генетических базах данных остаются скудными. Не считая Blumeria graminis, для эризифовых в GenBank депонировано только 23 маркерные экспрессируемые последовательности (МЭП) (National Center for Biotechnology Information, 2009). Главным фактором, влияющим на это отсутствие данных об экспрессии мучнистой росы, является сложность изолирования и поддерживания гриба в лабораторной культуре in-vitro (Cadle-Davidson и др., 2010, J. Phytopathol. 158: 69-71). Тем не менее, последние работы по секвенированию генома гриба Е. necator предоставили некоторую информацию о предполагаемых генах, и поиском по NCBI сегодня можно найти более 500 МЭП.
[0004] На винограднике отслеживание симптомов болезни является ключевым компонентом комплексного подхода к управлению виноградником и получению здорового винограда. Однако визуальная оценка мучнистой росы весьма субъективна, особенно когда инфекция на листьях проявлена слабо.
[0005] Целью настоящего изобретения является предоставление молекулярного метода на основе количественной ПЦР для улучшения борьбы с заражением мучнистой росой в полевых условиях, предпочтительно для раннего выявления ДНК Erysiphe necator на листьях винограда до появления видимых симптомов. Такой метод молекулярной диагностики может быть очень полезным инструментом организации и планирования фунгицидных обработок.
[0006] Известны предыдущие попытки выявления Erysiphe necator с помощью кПЦР, в частности, с целью выявления и мониторинга резистентных популяций, напр., разработка праймеров кПЦР, нацеленных на ген CYP51 (Dufour и др., 2011, Pest Manag Sci 67: 60-69; Jones и др., 2014, ВМС Genomics 15:1081).
Описание изобретения
[0007] Настоящим изобретением предоставлены способы и средства выявления или теста на наличие гриба Erysiphe necator в образцах, в частности, в образцах винограда, и более конкретно для количественного измерения уровня наличия гриба Erysiphe necator на виноградной лозе. Одно из преимуществ изобретения заключается в чувствительности способа, с возможностью выявления гриба до появления на растениях каких-либо видимых симптомов.
[0008] В способе согласно изобретению использована технология количественной полимеразной цепной реакции (ПЦР), также известная как кПЦР или ПЦР в реальном времени. ПЦР - это технология, позволяющая быструю амплификацию целевых последовательностей ДНК с использованием специфичных олигонуклеотидов в качестве праймеров для циклично повторяемых реакций амплификации. Эта технология хорошо известна и понятна специалисту в данной области техники. Классическая ПЦР позволяет качественное выявление определенных целевых последовательностей ДНК, тогда как кПЦР позволяет количественное измерение количества целевой последовательности ДНК.
[0009] Как и для классической ПЦР, для кПЦР необходим набор из двух олигонуклеотидов, применяемых в качестве праймеров реакции амплификации. Праймеры индивидуальны для амплифицируемой целевой последовательности ДНК, т.е., они состоят из коротких фрагментов нуклеиновой кислоты, соответствующих участкам целевой последовательности ДНК, предпочтительно участкам непосредственно с концов целевой последовательности ДНК. Один праймер является прямым праймером, а второй - обратным праймером, и каждый из них соответствует, т.е., по последовательности идентичен участку последовательности ДНК с конца целевой последовательности ДНК, таким образом определяя амплифицируемую целевую последовательность ДНК, которая является последовательностью ДНК, расположенной между двумя праймерами (но включая их). Прямой праймер - это олигонуклеотид, соответствующий сенс-цепочке участка последовательности ДНК на одном из концов целевой последовательности ДНК, а обратный праймер - олигонуклеотид, соответствующий комплементарной (антисенс) цепочке участка последовательности ДНК на другом конце целевой последовательности ДНК. Во время каждого цикла ПЦР последовательность ДНК, содержащую целевую последовательность ДНК, денатурируют (расцепляют) при высокой температуре (около 95°С), получая одноцепочечную ДНК, с которой на последующем этапе более низких температур (около 65°С) могут гибридизоваться праймеры, и затем дают термостабильным ДНК-полимеразам возможность продолжить синтез целевой последовательности ДНК от каждого из праймеров. Повторение этого термического цикла (около 30 раз) позволяет создать тысячи копий целевой последовательности ДНК, которые затем можно идентифицировать, напр., методом электрофореза в агарозном геле.
[0010] кПЦР также называют количественной ПЦР или ПЦР в реальном времени, поскольку в дополнение к классической ПЦР в реакцию также включают флуоресцентные репортерные соединения, что делает возможным выявление и измерение количества целевой ДНК, образованной в каждом цикле. Флуоресцентные репортерные соединения могут быть специфичными к ПЦР-амплифицируемой целевой последовательности ДНК (индивидуальный олигонуклеотидный зонд, к которому присоединен флуоресцентный репортер вместе с гасителем) или неспецифичными (флуоресцентный краситель, связывающийся с двухцепочечной ДНК, как, напр., зеленый краситель SYBR). Дальнейшее сравнение измеренной флуоресценции с надлежащими эталонами позволяет точно определить начальное количество целевой ДНК, напр., в образце.
[0011] Важным элементом кПЦР для теста на наличие и количество определенного патогена в некотором образце, напр., образце растения или грунта, является предварительная идентификация пары праймеров, специфичных для искомого патогена. Специфичные для определенного патогена праймеры - это праймеры, позволяющие амплифицировать специфичную для патогена последовательность целевой ДНК, т.е. присутствующую только у искомого патогена, но не или точно не у напр. других видов патогенов.
[0012] Согласно данному изобретению праймеры специфичны для гриба Erysiphe necator, т.е., они позволяют амплифицировать участок ДНК этого вида грибов, который есть только у этого вида грибов, но не у других, даже близкородственных, видов. Только наличие специфичных праймеров позволяет методу кПЦР распознать нужную среди всех последовательностей ДНК различных организмов, которые могут иметься в, напр., образце листа или грунта.
[0013] Согласно конкретного варианта осуществления изобретением обеспечены олигонуклеотидные праймеры, выбранные из группы, состоящей из олигонуклеотидов, включающих нуклеотидные последовательности SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 4 и SEQ ID NO: 5. Изобретение также охватывает олигонуклеотидные праймеры, выбранные из группы, состоящей из олигонуклеотидов, включающих нуклеотидную последовательность, комплементарную нуклеотидным последовательностям SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 4 и SEQ ID NO: 5.
[0014] Предпочтительными вариантами осуществления изобретения являются олигонуклеотидные праймеры, выбранные из группы, состоящей из олигонуклеотидов с нуклеотидными последовательностями SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 4 и SEQ ID NO: 5; либо олигонуклеотидные праймеры, выбранные из группы, состоящей из олигонуклеотидов, нуклеотидная последовательность которых комплементарна нуклеотидным последовательностям SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 4 и SEQ ID NO: 5.
[0015] Олигонуклеотид является короткой молекулой ДНК, как правило, содержащей от не менее 10 нуклеотидов и до 30 нуклеотидов. Оптимальный для применения в качестве праймера ПЦР или зонда олигонуклеотид, как правило, содержит от 18 до 24 нуклеотидов, однако могут применяться и более короткие или длинные олигонуклеотиды, и квалифицированному специалисту известно, какие параметры следует учитывать при выборе олигонуклеотидов подходящей длины для определенной цели. Олигонуклеотид согласно изобретению предпочтительно содержит от 19 до 21 нуклеотидов.
[0016] Таким образом, изобретение также охватывает олигонуклеотидные праймеры, включающие нуклеотидную последовательность по меньшей мере из 10 смежных нуклеотидов олигонуклеотидов с нуклеотидными последовательностями SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4 и SEQ ID NO: 5; либо по меньшей мере из 10 смежных нуклеотидов олигонуклеотидов, нуклеотидная последовательность которых комплементарна нуклеотидным последовательностям SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4 и SEQ ID NO: 5, за исключением (а) конкретного олигонуклеотида с нуклеотидной последовательностью SEQ ID NO: 2 и (б) конкретного олигонуклеотида с нуклеотидной последовательностью tcactctgtc.
[0017] "Смежные нуклеотиды" означают ряд нуклеотидов молекулы ДНК или олигонуклеотида, которые в нуклеотидной последовательности такой молекулы ДНК или олигонуклеотида следуют друг за другом.
[0018] Согласно определенным альтернативным вариантам осуществления олигонуклеотидные праймеры имеют длину не менее чем 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 смежных нуклеотидов. Более конкретно олигонуклеотидные праймеры имеют длину в 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 смежных нуклеотидов.
[0019] Здесь и далее термин "комплементарные" нуклеотидные последовательности" обозначает две нуклеотидные последовательности, нуклеотидные основания которых комплементарны на протяжении определенного последовательного участка их соответствующих последовательностей согласно стандартным правилам комплементарности Уотсона и Крика, и поэтому они способны спариваться или гибридизоваться одна с другой на протяжении своих соответствующих комплементарных участков. А именно, пуриновые основания спариваются с пиримидиновыми, более конкретно гуаниновое основание спаривается с цитозиновым (G:C), а адениновое основание спаривается либо с тиминовым (А:Т) в случае ДНК, либо с урациловым (A:U) в случае РНК.
[0020] Олигонуклеотидный праймер - это олигонуклеотид, применяемый в качестве праймера в процессе амплификации ПЦР (в контексте настоящего изобретения кПЦР). Соответственно, олигонуклеотидный праймер является олигонуклеотидом, соответствующим, т.е. идентичным по последовательности участку целевой ДНК, которую необходимо амплифицировать в процессе ПЦР. В процессе ПЦР, когда две цепочки ДНК расцепляются, олигонуклеотидный праймер связывается с участком целевой ДНК, которому комплементарна его последовательность. После связывания олигонуклеотидного праймера его можно использовать как начальную точку для инициирования ДНК-полимеразой амплификации целевой ДНК.
[0021] Олигонуклеотидные праймеры согласно изобретению специфичны к участку ДНК генома гриба Erysiphe necator. Более конкретно эти олигонуклеотидные праймеры специфичны к ядерным рибосомным внутренним транскрибируемым спейсерам (ВТС) Erysiphe necator. ВТС - это два некодирующих участка ДНК (ВТС1 и ВТС2), которые есть у всех эукариотов и расположены между двумя генами, кодирующими рибосомную РНК малой субъединицы (18S) и рибосомную РНК большой субъединицы (25S или 28S), более конкретно ВТС1 между геном, кодирующим рибосомную РНК малой субъединицы (18S) и геном, кодирующим 5,8S-рибосомную РНК, и ВТС2 между геном, кодирующим 5,8S-рибосомную РНК и геном, кодирующим рибосомную РНК большой субъединицы (25S или 28S).
[0022] В любом процессе ПЦР-амплификации, включая кПЦР, применяют не менее двух олигонуклеотидных праймеров, которые обычно называют парой олигонуклеотидных праймеров. Пара олигонуклеотидных праймеров состоит из одного олигонуклеотидного праймера, который называют прямым олигонуклеотидным праймером, и одного олигонуклеотидного праймера, который называют обратным олигонуклеотидным праймером. Прямой и обратный олигонуклеотидные праймеры расположены соответственно на каждом конце целевой ДНК, амплифицируемой в процессе ПЦР. Последовательность прямого олигонуклеотидного праймера идентична участку сенс-цепочки, соответствующему его концу целевой ДНК, и поэтому во время процесса ПЦР связывается с комплементарным (т.е., антисенс-) участком целевой ДНК, тогда как последовательность обратного олигонуклеотидного праймера идентична участку антисенс-цепочки, соответствующему его концу целевой ДНК (другому концу целевой ДНК), и поэтому во время процесса ПЦР связывается с комплементарным (т.е., сенс-) участком целевой ДНК. Таким образом, пара олигонуклеотидных праймеров состоит из двух олигонуклеотидных праймеров, одного прямого олигонуклеотидного праймера и одного обратного олигонуклеотидного праймера, которые вместе определяют целевую ДНК и необходимы для ее амплификации в процессе ПЦР.
[0023] Предпочтительно изобретением обеспечена пара олигонуклеотидных праймеров, выбранная из группы, состоящей из: (I) пары олигонуклеотидов с нуклеотидными последовательностями SEQ ID NO: 1 для прямого олигонуклеотидного праймера и SEQ ID NO: 2 для обратного нуклеотидного праймера, (II) пары олигонуклеотидов с нуклеотидными последовательностями SEQ ID NO: 3 для прямого олигонуклеотидного праймера и SEQ ID NO: 4 для обратного нуклеотидного праймера, и (III) пары олигонуклеотидов с нуклеотидными последовательностями SEQ ID NO: 3 для прямого олигонуклеотидного праймера и SEQ ID NO: 5 для обратного нуклеотидного праймера.
[0024] Альтернативно изобретением также обеспечена пара олигонуклеотидных праймеров, выбранная из группы, состоящей из: (I) пары олигонуклеотидов, нуклеотидные последовательности которых комплементарны нуклеотидным последовательностям SEQ ID NO: 1 для обратного олигонуклеотидного праймера и SEQ ID NO: 2 для прямого нуклеотидного праймера, (II) пары олигонуклеотидов, нуклеотидные последовательности которых комплементарны нуклеотидным последовательностям SEQ ID NO: 3 для обратного олигонуклеотидного праймера и SEQ ID NO: 4 для прямого нуклеотидного праймера, и (III) пары олигонуклеотидов, нуклеотидные последовательности которых комплементарны нуклеотидным последовательностям SEQ ID NO: 3 для обратного олигонуклеотидного праймера и SEQ ID NO: 5 для прямого нуклеотидного праймера.
[0025] Изобретением также предусмотрены пары олигонуклеотидов, состоящие из олигонуклеотидов, включающих по меньшей мере 10 смежных нуклеотидов из нуклеотидных последовательностей вышеуказанных олигонуклеотидов.
[0026] Предпочтительной парой олигонуклеотидных праймеров для осуществления изобретения является пара олигонуклеотидов, включающих по меньшей мере 10 смежных нуклеотидов из нуклеотидных последовательностей SEQ ID NO: 1 для прямого олигонуклеотидного праймера и SEQ ID NO: 2 для обратного нуклеотидного праймера; или, альтернативно, пара олигонуклеотидов, включающих по меньшей мере 10 смежных нуклеотидов, комплементарных нуклеотидным последовательностям SEQ ID NO: 1 для обратного олигонуклеотидного праймера и SEQ ID NO: 2 для прямого нуклеотидного праймера.
[0027] Предпочтительно пара олигонуклеотидных праймеров состоит из олигонуклеотидов с нуклеотидными последовательностями SEQ ID NO: 1 для прямого олигонуклеотидного праймера и SEQ ID NO: 2 для обратного нуклеотидного праймера; или, альтернативно, олигонуклеотидов с нуклеотидными последовательностями, комплементарными SEQ ID NO: 1 для обратного олигонуклеотидного праймера и SEQ ID NO: 2 для прямого нуклеотидного праймера.
[0028] Применение пар олигонуклеотидных праймеров делает возможной специфичную амплификацию ВТС-участка гриба Erysiphe necator в кПЦР.
[0029] Изобретением также обеспечено применение олигонуклеотидов в качестве зондов для специфичного выявления и измерения количества целевой ДНК, амплифицированной в процессе кПЦР. Олигонуклеотидные зонды согласно изобретению выбраны из олигонуклеотидов, включающих по меньшей мере 10 смежных нуклеотидов из нуклеотидных последовательностей SEQ ID NO: 6 и SEQ ID NO: 7; либо из олигонуклеотидов, включающих по меньшей мере 10 смежных нуклеотидов из последовательностей, комплементарных нуклеотидным последовательностям SEQ ID NO: 6 и SEQ ID NO: 7, за исключением одного конкретного нуклеотида с нуклеотидной последовательностью cgtagagccca.
[0030] Предпочтительным олигонуклеотидом для использования в качестве зонда для выполнения кПЦР согласно изобретению является олигонуклеотид, включающий по меньшей мере 10 смежных нуклеотидов из нуклеотидной последовательности SEQ ID NO: 6. Альтернативно, предпочтительным олигонуклеотидом для использования в качестве зонда для выполнения кПЦР согласно изобретению является олигонуклеотид, включающий по меньшей мере 10 смежных нуклеотидов, комплементарных нуклеотидной последовательности SEQ ID NO: 6.
[0031] Применяемые в качестве зондов олигонуклеотиды на основе нуклеотидной последовательности SEQ ID NO: 6 следует применять вместе с парой применяемых в качестве праймеров олигонуклеотидов на основе нуклеотидных последовательностей SEQ ID NO: 1 и 2. Эта комбинация олигонуклеотидных праймеров и зонда предпочтительна для выполнения кПЦР согласно изобретению.
[0032] Альтернативно, применяемые в качестве зондов олигонуклеотиды на основе нуклеотидной последовательности SEQ ID NO: 7 следует применять либо вместе с парой применяемых в качестве праймеров олигонуклеотидов на основе нуклеотидных последовательностей SEQ ID NO: 3 и 4; либо вместе с парой применяемых в качестве праймеров олигонуклеотидов на основе нуклеотидных последовательностей SEQ ID NO: 3 и 5.
[0033] Предоставленным настоящим изобретением олигонуклеотиды, применяемые в качестве праймеры либо зонда, имеют длину не менее чем 10 смежных нуклеотидов. Согласно определенным альтернативным вариантам осуществления олигонуклеотиды имеют длину 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 нуклеотидов. Предпочтительно олигонуклеотиды согласно изобретению имеют длину от 19 до 21 нуклеотидов.
[0034] Таким образом, изобретением также обеспечен способ специфичного выявления гриба Erysiphe necator, включающий:
(а) подвергание образца количественной полимеразной цепной реакции (кПЦР) с использованием олигонуклеотидных праймеров согласно изобретению; и
(б) определение наличия или отсутствия Erysiphe necator в образце путем визуализации, либо без визуализации целевой ДНК, амплифицированной кПЦР.
[0035] "Специфичное выявление" означает, что способ направлен на выявление в образце, который может содержать и другие живые организмы, конкретно гриба Erysiphe necator и никаких других живых организмов. Во всяком случае, способ согласно изобретению направлен на то, чтобы не обнаруживать какие-либо живые организмы, которые могут наличествовать в образце, отобранном в местах, допускающих наличие Erysiphe necator, т.е. в образцах, отобранных на или вокруг растений рода Vitis, более конкретно Vitis vinifera.
[0036] "Образец" согласно изобретению предпочтительно обозначает небольшое количество материала, отобранного из мест, где допускается наличие Erysiphe necator, однако в принципе может быть отобран где угодно. Поскольку предпочтительными растениями-хозяевами Erysiphe necator являются виды рода Vitis, предпочтительное место, где допускается наличие этого гриба, находится либо на растении рода Vitis, либо является местом выращивания такого растения, напр., окружающим грунтом. Так как одним из подобных растений-хозяев Erysiphe necator является широко культивируемый на виноградниках Vitis vinifera, то предпочтительное место, где допускается наличие этого гриба, находится либо на растении вида Vitis vinifera, напр., на листьях, виноградинах, стволе (или ветвях) или гребнях (стеблях), либо является местом выращивания такого растения, напр., окружающим грунтом. Предпочтительным образцом согласно изобретению, таким образом, является небольшое количество листьев (такое как, напр., диск, вырезанный из целого листа) или винограда растений вида Vitis vinifera, либо же небольшое количество грунта, окружающего место произрастания растений вида Vitis vinifera. Образец согласно изобретению также может быть взят с верхней или нижней поверхности листьев, с поверхности виноградин, ствола (или ветвей) или гребней (стеблей), т.е., без забора растительного материала, подходящими средствами, известными квалифицированному специалисту.
[0037] Чтобы сделать возможным амплифицирование в кПЦР какой-либо целевой ДНК, присутствующей в образце, необходимо обеспечить свободный доступ различных компонентов кПЦР (т.е., праймеров, ДНК-полимеразы, флуоресцентных репортеров) к ДНК любой живой материи в образце, включая споры или любую другую биологическую структуру Erysiphe necator. Соответственно, подвергаемый кПЦР образец может быть использован как есть или же предварительно подвергнут этапу выделения ДНК. При выполнении предварительного выделения ДНК из образца квалифицированный специалист может воспользоваться любым методом выделения ДНК, известным в данной области.
[0038] Изобретение также относится ко способу специфичного количественного определения гриба Erysiphe necator, включающему:
(а) подвергание образца количественной полимеразной цепной реакции (кПЦР) с использованием олигонуклеотидных праймеров согласно изобретению; и
(б) определение количества Erysiphe necator в образце путем сравнения измеренного количества амплифицированной кПЦР целевой ДНК с эталонными данными амплификации ДНК.
[0039] "Специфичное количественное определение" означает, что способ направлен на количественное определение в образце, который может содержать и другие живые организмы, конкретно количества гриба Erysiphe necator и никаких других живых организмов.
[0040] Количество Erysiphe necator в образце определяют согласно способу изобретения, сначала измеряя количество целевой ДНК, амплифицированной кПЦР, затем сравнивая это измеренное количество целевой ДНК, амплифицированной кПЦР, с некоторыми эталонными данными амплификации ДНК. "Эталонные данные амплификации ДНК" состоят из стандартных данных, соответствующих предварительно определенным измеренным количествам целевой ДНК, амплифицированной кПЦР, после определенного числа циклов амплификации из известных начальных количеств целевой ДНК. На основе таких эталонных данных амплификации ДНК можно сделать выводы о том, какое количество целевой ДНК (а значит, гриба Erysiphe necator) было в образце до процесса амплификации кПЦР, на основании измеренного количества целевой ДНК, амплифицированной кПЦР в образце.
[0041] Определение и измерение целевой ДНК во время процесса кПЦР осуществляют либо с помощью олигонуклеотидных зондов согласно изобретению, либо с помощью любого репортера, описанного далее.
[0042] Изобретением также обеспечен диагностический набор для выявления гриба Erysiphe necator, где набор включает либо по меньшей мере один из олигонуклеотидных праймеров, выбранных из группы, состоящей из олигонуклеотидов, включающих по меньшей мере 10 смежных нуклеотидов из нуклеотидных последовательностей SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4 и SEQ ID NO: 5; либо по меньшей мере один из олигонуклеотидных праймеров, выбранных из группы, состоящей из олигонуклеотидов, включающих по меньшей мере 10 смежных нуклеотидов, комплементарных таковым из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4 и SEQ ID NO: 5.
[0043] Предпочтительно диагностический набор для выявления гриба Erysiphe necator включает пару олигонуклеотидных праймеров, выбранную из группы, состоящей из пар олигонуклеотидов, каждый из которых включает по меньшей мере 10 смежных нуклеотидов из нуклеотидных последовательностей SEQ ID NO: 1 для прямого олигонуклеотидного праймера и SEQ ID NO: 2 для обратного нуклеотидного праймера, SEQ ID NO: 3 для прямого олигонуклеотидного праймера и SEQ ID NO: 4 для обратного нуклеотидного праймера, и SEQ ID NO: 3 для прямого олигонуклеотидного праймера и SEQ ID NO: 5 для обратного нуклеотидного праймера.
[0044] Альтернативно диагностический набор для выявления гриба Erysiphe necator включает пару олигонуклеотидных праймеров, выбранную из группы, состоящей из пар олигонуклеотидов, каждый из которых включает по меньшей мере 10 смежных нуклеотидов, комплементарных нуклеотидным последовательностям SEQ ID NO: 1 для обратного олигонуклеотидного праймера и SEQ ID NO: 2 для прямого нуклеотидного праймера, SEQ ID NO: 3 для обратного олигонуклеотидного праймера и SEQ ID NO: 4 для прямого нуклеотидного праймера, и SEQ ID NO: 3 для обратного олигонуклеотидного праймера и SEQ ID NO: 5 для прямого нуклеотидного праймера.
[0045] Наиболее предпочтительно диагностический набор для выявления гриба Erysiphe necator включает пару олигонуклеотидных праймеров, включающих по меньшей мере 10 смежных нуклеотидов из нуклеотидных последовательностей SEQ ID NO: 1 для прямого олигонуклеотидного праймера и SEQ ID NO: 2 для обратного нуклеотидного праймера; или, альтернативно, пару олигонуклеотидных праймеров, включающих по меньшей мере 10 смежных нуклеотидов, комплементарных нуклеотидным последовательностям SEQ ID NO: 1 для обратного олигонуклеотидного праймера и SEQ ID NO: 2 для прямого нуклеотидного праймера.
[0046] Согласно конкретному варианту осуществления диагностический набор включает пару олигонуклеотидных праймеров, состоящую из олигонуклеотидов с нуклеотидными последовательностями SEQ ID NO: 1 для прямого олигонуклеотидного праймера и SEQ ID NO: 2 для обратного нуклеотидного праймера; или, альтернативно, олигонуклеотидов с нуклеотидными последовательностями, комплементарными SEQ ID NO: 1 для обратного олигонуклеотидного праймера и SEQ ID NO: 2 для прямого нуклеотидного праймера.
[0047] Кроме олигонуклеотидных праймеров набор также содержит репортер, предпочтительно флуоресцентный репортер. Репортер - это соединение, связывающееся с ДНК, амплифицированной во время кПЦР, и соответственно позволяющее измерить количество амплифицированной ДНК. Флуоресцентный репортер - это соединение, напр., флуорофор, испускающее специфическое флуоресцентное излучение при возбуждении светом с длиной волны, индивидуальной для соединения.
[0048] Для целей набора и способов согласно изобретению репортер может быть неспецифичным красителем, интеркалирующим в двухцепочечные молекулы ДНК. Флуоресцентный сигнал этих красителей усиливается, когда они связаны с двухцепочечной нуклеиновой кислотой, и может быть обнаружен стандартной системой обнаружения флуоресценции. Для осуществления изобретения подходит любой подобный ДНК-интеркалирующий краситель, известный квалифицированному специалисту, такой как, напр., этидия бромид или зеленый SYBR. Предпочтительным неспецифичным ДНК-интеркалирующим флуоресцентным красителем для осуществления изобретения является зеленый краситель SYBR, также известный под названием IUPAC N',N'-диметил-N-[4-[(Е)-(3-метил-1,3-бензотиазол-2-илиден)метил]-1-фенилхинолин-1-иум-2-ил]-N-пропилпропан-1,3-диамин.
[0049] В качестве альтернативы неспецифичному ДНК-интеркалирующему красителю, флуоресцентный репортер набора согласно изобретению может быть специфичным к последовательности флуоресцентным зондом. Такой зонд является олигонуклеотидом, помеченным флуорофором. При использовании для целей кПЦР такие меченые олигонуклеотидные зонды имеют последовательность, комплементарную по меньшей мере 10 смежным нуклеотидам целевой последовательности, амплифицируемой кПЦР.
[0050] Предпочитаемым зондом для осуществления изобретения является зонд, меченый по системе TaqMan. Система TaqMan - это технология, доступная от изготовителя Life Technologies Inc. Согласно системе TaqMan, олигонуклеотидный зонд, спроектированный специально для связывания с амплифицируемой целевой ДНК, ковалентно связывают с флуорофором на 5'-конце и с гасителем на 3'-конце. Примеры подходящих флуорофоров для применения в системе TaqMan включают 6-карбоксифлуоресцеин (FAM) или тетрахлорофлуоресцеин (ТЕТ). Типичным гасителем является тетраметилродамин (TAMRA). Принцип системы TaqMan заключается в том, что гаситель подавляет флуоресценцию флуорофора, пока они оба находятся в непосредственной близости на зонде. Когда олигонуклеотидный зонд гибридизуется с целевой ДНК во время процесса амплификации кПЦР, он разлагается Taq-полимеразой, так как этот фермент элонгирует олигонуклеотидные праймеры вдоль ДНК, соответствующей целевой ДНК. Эта деградация высвобождает флуорофор и гаситель, который более не находится в непосредственной близости от флуорофора, таким образом позволяя флуорофору испускать свою флуоресценцию, которую можно обнаружить и измерить подходящими средствами, обычно встроенными в устройства для кПЦР (т.е., амплификаторы).
[0051] Предпочтительным олигонуклеотидным зондом для использования в наборе и помечения по системе TaqMan или по любой другой системе, которая известна квалифицированному специалисту как подходящая, является олигонуклеотид, выбранный из олигонуклеотидов, включающих по меньшей мере 10 смежных нуклеотидов из нуклеотидных последовательностей SEQ ID NO: 6 и SEQ ID NO: 7; либо из олигонуклеотидов, включающих по меньшей мере 10 смежных нуклеотидов из последовательностей, комплементарных нуклеотидным последовательностям SEQ ID NO: 6 и SEQ ID NO: 7.
[0052] Предпочтительным олигонуклеотидом для использования в качестве зонда для выполнения кПЦР согласно изобретению является олигонуклеотид, включающий по меньшей мере 10 смежных нуклеотидов из нуклеотидной последовательности SEQ ID NO: 6. Альтернативно, предпочтительным олигонуклеотидом для использования в качестве зонда для выполнения кПЦР согласно изобретению является олигонуклеотид, включающий по меньшей мере 10 смежных нуклеотидов, комплементарных нуклеотидной последовательности SEQ ID NO: 6.
[0053] Применяемые в качестве зондов набора олигонуклеотиды на основе нуклеотидной последовательности SEQ ID NO: 6 следует применять вместе с парой применяемых в качестве праймеров олигонуклеотидов на основе нуклеотидных последовательностей SEQ ID NO: 1 и 2. Эта комбинация олигонуклеотидных праймеров и зонда предпочтительна для применения в наборе и для выполнения кПЦР согласно изобретению.
[0054] Альтернативно, применяемые в качестве зондов олигонуклеотиды на основе нуклеотидной последовательности SEQ ID NO: 7 следует применять либо вместе с парой применяемых в качестве праймеров олигонуклеотидов на основе нуклеотидных последовательностей SEQ ID NO: 3 и 4; либо вместе с парой применяемых в качестве праймеров олигонуклеотидов на основе нуклеотидных последовательностей SEQ ID NO: 3 и 5.
[0055] Олигонуклеотиды, обеспеченные для набора согласно настоящему изобретению, предпочтительно имеют длину не менее чем 10 смежных нуклеотидов. Согласно определенным альтернативным вариантам осуществления олигонуклеотиды имеют длину 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или 21 нуклеотид.
[0056] Набор может дополнительно включать элементы, такие как необходимые для проведения кПЦР реагенты, известные квалифицированному специалисту. В дополнение к паре праймеров и зонду набор может включать один или более ферментов (Taq-полимеразу) или реагентов для использования в реакциях кПЦР. Ферменты могут находиться в лиофилизированной форме или в надлежащих буферах. Кроме того, набор может включать все дополнительные необходимые для проведения кПЦР элементы, такие как буферы, реактивы для выделения, ферменты, пипетки, планшеты, нуклеиновые кислоты, нуклеозидтрифосфаты, фильтровальную бумагу, гелевые материалы, материалы для переноса, материалы для ауторадиографии, инструкции и т.п.
Перечень последовательностей:
SEQ ID NO: 1: праймер BTC-F
SEQ ID NO: 2: праймер BTC-R
SEQ ID NO: 3: праймер ВТС A-F
SEQ ID NO: 4: праймер ВТС A-R
SEQ ID NO: 5: праймер ВТС A-R1
SEQ ID NO: 6: BTC-F зонд
SEQ ID NO: 7: BTC-A-R зонд
[0057] Различные аспекты изобретения можно понять более полно с помощью приведенных ниже экспериментальных примеров.
[0058] Все описанные ниже способы или операции приведены в качестве примеров и соответствуют выбору, сделанному среди разнообразных методов, доступных для достижения того же результата. Этот выбор не влияет на качество результата, и, соответственно, специалистами в данной области для достижения того же результата может применяться любой подходящий метод. В частности, если в примерах не указано иное, все используемые технологии рекомбинантной ДНК выполнены по стандартным протоколам, описанным у Sambrook и Russel (2001, Molecular cloning: A laboratory manual, Third edition, Cold Spring Harbor Laboratory Press, NY), у Ausubel и др. (1994, Current Protocols in Molecular Biology, Current protocols, USA, Volumes 1 and 2) и у Brown (1998, Molecular Biology LabFax, Second edition, Academic Press, UK). Стандартные материалы и методы молекулярной биологии растений описаны у Croy R.D.D. (1993, Plant Molecular Biology LabFax, BIOS Scientific Publications Ltd (UK) and Blackwell Scientific Publications (UK)). Стандартные материалы и методы ПЦР (полимеразной цепной реакции) также описаны у Dieffenbach и Dveksler (1995, PCR Primer: A laboratory manual, Cold Spring Harbor Laboratory Press, NY) и у McPherson и др. (2000, PCR - Basics: From background to bench, First edition, Springer Verlag, Germany).
Примеры
Пример 1: Разработка праймеров, специфичных для Erysiphe necator
[0059] Для разработки метода кПЦР использовали несколько изолятов мучнистой росы. Их очищали и поддерживали на отдельных листьях Vitis Vinifera сорта Сенсо. Инокуляцию для биотеста осуществляли обдуванием верхней поверхности дезинфицированных листьев спорами с 12-14-дневных спорулирующих листьев с помощью воздушного насоса в плексигласовой осадительной колонне. Инфицированные листья инкубировали при 22°С в камере выращивания (фотопериод света/тени 12/12 ч) и переносили на свежую агарную среду каждые 3-4 дня. Грибковый материал, растущий на поверхности листьев, соскабливали в пробирки-эппендорфы, а диски из зараженных листьев замораживали при -20°С.
[0060] Из грибковых изолятов Erysiphe necator выделяли ДНК набором NucleoSpin® plantII (Macherey-Nagel), следуя инструкциям производителя. Выделенную ДНК хранили при -20°С.
[0061] ВТС-участки трех лабораторных изолятов Erysiphe necator ПЦР-амплифицировали и секвенировали с помощью праймеров ВТС1 и ВТС4 (White, T.J. и др. (1990), PCR Protocols: a Guide to Methods and Applications 18, 315-322). Все ПЦР-амплификации осуществляли в 25 мкл реакционной смеси, содержащей 10 мкл смеси GoTaq (Promega, Франция), по 400 пмоль каждого из праймеров и 30 нг шаблонной ДНК. Цикл ПЦР программировали в амплификаторе Eppendorf следующим образом: 94°С на 10 мин и затем 30 циклов при 94°С на 1 мин, температура отжига 58°С на 1 мин, 72°С на 1 мин, затем финальная достройка при 72°С на 10 мин. Амплифицированные продукты подвергали электрофорезу (ТВЕ 0,5Х) в 1,5%-ном агарозном геле, детектировали с помощью SYBR® Safe и фотографировали в УФ-свете.
[0062] ВТС-амплифицированные продукты ПЦР секвенировали для трех проверяемых изолятов Erysiphe necator. Полученные последовательности сравнивали программами для выравнивания с последовательностями, опубликоваными в базе данных NCBI (номер доступа GenBank AF049332.1 и AF011325.1).
[0063] В базе данных доступно множество последовательностей внутренних транскрибируемых спейсеров, амплифицированных из разных изолятов гриба Е. necator. ПЦР-амплификация ВТС-участка на ДНК, выделенной из изолятов чистого мицелия, или на ДНК цельных некротизированных листьевых дисков с праймерами ВТС1 и ВТС4 давала одинаковые результаты. Из трех проверяемых изолятов получили последовательность около 600 нуклеотидов (Приложение 1). Анализ этой последовательности с помощью программного обеспечения для множественного выравнивания последовательностей ClustalW (http://www.ebi.ac.uk/Tools/msa/clustalw2) показал сходство опубликованных последовательностей и последовательности трех изолятов, проверяемых в лаборатории.
[0064] Для разработки кПЦР на консервативных и выравниваемых между собой участках разных изолятов были спроектированы праймеры. Разработанные наборы зондов и праймеров показаны в Таблице 1.

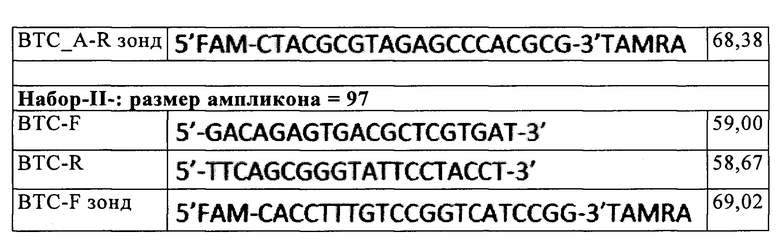
[0065] Все выполненные кПЦР содержали прямой праймер, обратный праймер и либо зонд с 6-карбоксифлуоресцеином (FAM) в качестве репортерного флуорофора на 5'-конце, с N,N,N_,N_тетраметил-6-карбоксиродамином (TAMRA) в качестве гасителя на 3'-конце (Таблица 1), либо неспецифичный репортер (напр., зеленый SYBR). Сконцентрированный в два раза мастер-микс для кПЦР (Platinium MasterMix SybrGreen-Invitrogen и probe MasterMix-Roche), 300 нМ зонда и по 300 нМ каждого праймера соединяли в стерильной безнуклеазной воде (Invitrogen) перед добавлением какого-либо шаблона ДНК. Пробирку с мастер-миксом перемешивали вихревым способом для обеспечения гомогенности раствора и кратко осаждали в микроцентрифуге. В каждый стеклянный капилляр на 20 мкл (Roche, Франция) добавляли по аликвоте (15 мкл) реакционной смеси. Проверяли две репортерные системы: анализ с интеркалирующим зеленым SYBR и систему зондов TaqMan.
[0066] К каждой реакции добавляли шаблонную ДНК (5 мкл) и запечатывали капилляры пластиковым колпачком. Перед анализом кПЦР карусель для образцов LightCycler 2.0 центрифугировали. В капиллярной системе LightCycler (Roche applied science) проверяли три набора праймеров или праймеров/зондов с разными выполняемыми программами (Таблица 1). Во всех анализах концентрации зондов и праймеров были одинаковы. Для экспериментов in-vivo отбирали только набор праймеров и соответствующую программу, дающие высокую эффективность кПЦР (от 90 до 100%) и специфичную амплификацию.
По амплификации целевого гена (ДНК-плазмиды), присутствующего в диапазоне начальных концентраций шаблона, строили калибровальную кривую и определяли значения Ct для каждой концентрации шаблона. После этого строили график простой линейной регрессии этих значений Ct относительно логарифма начального количества копий гена. В каждом эксперименте эффективность амплификации (Е), коэффициент линейной регрессии (r2) и особенно значение точки пересечения с осью у описывают калибровальную кривую и указывают на чувствительность реакции. Из коэффициента наклона калибровальной кривой можно получить эффективность реакции ПЦР по следующему уравнению: Эффективность = 10(-1/наклон) - 1.
Эффективность и специфичность кПЦР
[0067] Чтобы выбрать наилучший набор праймеров среди перечисленных в Таблице 1, плазмидную ДНК, содержащую последовательность ВТС-участка Е. necator, серийно разводили в соотношениях 1:10. Числа копий клонированных последовательностей ВТС определяли из молекулярной массы вектора для клонирования и вставки. Анализ кПЦР выполняли на концентрациях плазмид с использованием разных наборов праймеров с зеленым SYBR или праймеров, соединенных с дополнительной системой гидролизных зондов TaqMan. Характерным показателем высококачественных анализов является эффективность амплификации ПЦР. Оценка эффективности очень важна для каждой процедуры количественного определения генов посредством кПЦР. Оптимальной эффективности амплификации кПЦР достигали с праймерами ВТС-прямым (5'-GACAGAGTGACGCTCGTGAT-3') и ВТС-обратным (5'-ТТСAGCGGGTATTCCTACCT-3') (Набор-II) с зеленым SYBR в качестве флуорофора. Количественное оценивание выполняли со следующими параметрами амплификации: начальное подогревание до 95°С на 15 мин, за ним 40 циклов денатурирования при 95°С на 30 сек, отжиг при 60°С на 60 сек, достройка при 72°С на 20 сек. Дополнительный анализ кривой плавления включал 15 сек предварительного разогрева при 95°C с последующим повышением температуры от 60°С до 95°С, с 15-секундным выдерживанием на каждом 0,1°С шаге повышения. Сбор и анализ данных выполняли по методу максимума вторых производных.
[0068] Рассчитанная эффективность анализа кПЦР с этим набором праймеров (Набор-II) близка к 100%, тогда как другие проверенные праймеры показали низкую эффективность и более высокое сбрасывание ΔСр от одного раствора к другому. Обнаружение с помощью зеленого SYBR дает большую чувствительность, нежели система зондов TaqMan, и мы наблюдали разницу в 3 цикла между двумя проверяемыми системами для той же более высокой концентрации плазмидной ДНК (1,2×106 копий гена). Повторение прогонов калибровальной кривой по плазмидной ДНК с выбранными набором праймеров и программой демонстрирует стабильность и робастность анализа кПЦР.
[0069] Так как зеленый SYBR не специфичен и связывается с любой двухцепочечной ДНК, очень важно использовать пары праймеров, высокоспецифичные к своей целевой последовательности. Чтобы удостовериться, что разработанный метод кПЦР с использованием этих праймеров высокоспецифичен к целевому гену Е. necator, тестировали геномную ДНК другого гриба. 100 нг ДНК, выделенной из мицелия Botrytis cinerea, Alternaria solani, Cladosporium spp., Penicillium spp., Verticilium spp., Fusarium solani и Stachybotrys chartarum, анализировали кПЦР с выбранными праймерами (Набором-II). Все тестированные грибы либо не были выявлены, либо были выявлены с более высоким значением Ct и вне диапазона даже наиболее разведенной шаблонной ДНК (120 копий гена) калибровальной кривой. Так как на практике анализ кПЦР будет осуществляться на общей выделенной из листьев ДНК, эти результаты демонстрируют, что метод кПЦР специфичен по грибку Е. necator, и присутствие других контаминирующих грибов не создает помех количественному определению мучнистой росы на листьях.
Пример 2: Количественное определение ДНК Erysiphe necator in-vivo на листьях винограда
[0070] Для подтверждения чувствительности и точности метода на биологических образцах проводили анализ кПЦР на общей ДНК, выделенной из листьевых дисков, зараженных серийным разведением спор Е. necator в лабораторных биотестах. Из 4 листьевых дисков выделяли общую ДНК и анализировали 100 нг ДНК с помощью метода анализа кПЦР, тестируя каждую концентрацию спор в разные периоды инкубации.
[0071] Количество целевого гена Е. necator определяли по калибровальной кривой плазмидной ДНК. Самая низкая концентрация 2 споры/см2, тестируемая сразу после распыления (d+0), была обнаружена при Ct=27,13 циклов, что эквивалентно 9,4×102 копий гена. Интересно, что количественное определение кПЦР других проверяемых концентраций спор показало пропорциональное увеличение числа копий гена в зависимости от числа спор Е. necator на поверхности листа. Самая высокая проверяемая концентрация спор (С4=175 спор/см2) была выявлена при Ct=21,98 циклов, что соответствует 3,5×104 копий гена. Почти все листьевые диски, инкубируемые в адекватных для роста мучнистой росы условиях, продемонстрировали увеличение определяемого в образцах количества целевого гена Е. necator. Эти результаты подтверждают корреляцию между количеством ДНК, определяемым методом кПЦР, и развитием биомассы гриба на листьях, оцениваемым визуально. Количество ДНК Е. necator, измеренное анализом кПЦР, достигало 1,3×106 копий гена после 12 дней инкубирования листьевых дисков, зараженных спорами в концентрации 175 спор/см2.
[0072] Таким образом, применение метода анализа кПЦР позволяет нам выявить и количественно оценить именно ДНК спор Е. necator на более ранней стадии на листьях винограда, даже до прорастания и появления видимых симптомов. Чувствительность метода в биологических анализах позволяет выявить настолько малое присутствие спор на листьях, как 2 споры/см2.
Пример 3: Оценка ДНК Е. necator с помощью анализа кПЦР при полевом заражении
[0073] С целью проверить достоверность метода кПЦР в полевых условиях на участках винограда в разные дни осуществили искусственное заражение разными дозами подготовленного в лаборатории инокулята.
[0074] Анализы проводили на французском винограднике St Martin  (Gros Manseng) с апреля по август 2013 г. Тест проводили на засаженном участке виноградника с 10-ю растениями, с соседним незаражаемым участком на 5 растений. Листья заражали распылением растворов спор Е. necator в различных концентрациях: С1 (0,1 спор/см2), С2 (1 спора/см2) и С3 (10 спор/см2). Искусственную инокуляцию спор мучнистой росы проводили в три разных дня: 18 апреля, 07 мая и 23 мая. В каждом случае для кПЦР-анализа собирали 5 листьев на d+0, d+7, d+14 и d+30 день после заражения.
(Gros Manseng) с апреля по август 2013 г. Тест проводили на засаженном участке виноградника с 10-ю растениями, с соседним незаражаемым участком на 5 растений. Листья заражали распылением растворов спор Е. necator в различных концентрациях: С1 (0,1 спор/см2), С2 (1 спора/см2) и С3 (10 спор/см2). Искусственную инокуляцию спор мучнистой росы проводили в три разных дня: 18 апреля, 07 мая и 23 мая. В каждом случае для кПЦР-анализа собирали 5 листьев на d+0, d+7, d+14 и d+30 день после заражения.
[0075] Пять листьев отбирали для каждых проверяемых условий и готовили из них пул листьевых дисков. Выделяли общую ДНК и анализировали 100 нг с помощью кПЦР. Таким образом, данные кПЦР отображали количество ДНК Е. necator в пяти листьях на образец.
[0076] Анализ листьев, собранных с участков винограда Gros Manseng для первой даты инокуляции (23 апреля 2013 г.), показал наличие ДНК Е. necator (1,1×103 копий гена) только в образцах, соответствующих листьям, зараженным концентрациями спор С2 (1 спора/см2) и С3 (10 спор/см2), при сборе сразу после заражения (d+0). Целевая ДНК также амплифицировалась (4,2×103 копий гена) в общей ДНК, выделенной из листьев, зараженных С3 (10 спор/см2) и собранных на d+14. В других проверяемых образцах ДНК Е. necator не выявлялась.
[0077] Для второй даты инокуляции (07 мая 2013 г.) наблюдалась значительная амплификация в листьях, зараженных тремя проверяемыми концентрациями спор Е. necator и собранных на d+0 (1,03×103 копий гена для С1, 1,1×103 копий гена для С2 и 1,03×103 копий гена для С3). Собранные на 30-й день после искусственного тестового заражения листья показали наличие ДНК Е. necator в количестве 9,93×103 и 2,38×103 копий гена для С2 (1 спора/см2) и С3 (10 спор/см2), соответственно. Во всех образцах, собранных для даты заражения 23 мая 2013 г., ДНК Е. necator выявлялась только в листьях, зараженных С2 (1 спора/см2) и собранных сразу (d+0).
[0078] Эти результаты доказывают, что ДНК Е. necator можно выявить во время развития гриба на растениях.
Пример 4: Искусственное и естественное полевое заражение 2014: анализ кПЦР и прогрессирование мучнистой росы
[0079] Для дальнейшей оценки метода кПЦР в 2014 году провели другие тесты на двух искусственно зараженных пробах и четырех естественных пробах из разных регионов. Для каждого образца в естественной пробе собирали 10 листьев. В отличие от этого, в тесте с искусственным заражением собирали 5 листьев для каждой распыленной концентрации спор (С1=0,1 спор/см2, С2=1 спора/см2 и С3=10 спор/см2). В обоих тестах анализировали 4 листьевых диска на один лист. В тесте с искусственным заражением, названном "14 00 06-EN", проведенном 09 апреля 2014 г., Е. necator выявили на d+0 (что соответствует свежесобранным листьям) на 5 листах из 15 собранных, при этом 4 из этих листов были заражены самой высокой концентрацией С3, а 1 - концентрацией С1. Половина из собранных через 7 дней (d+7) и 14 дней (d+14) листьев содержат Е. necator. Из проанализированных через 30 дней (d+30) образцов листьев 6 листов дали позитивную реакцию на Е. necator. Для других проверяемых дат мучнистую росу выявляли на листьях в различных пропорциях. Соотношение листьев, содержащих Е. necator на d+0, варьируется от 2 (тест проведен 23 апреля 2014 г.) до 6 листов (тест проведен 07 мая 2014 г.) из 15 собранных листов для трех проверяемых концентраций.
[0080] В то же время проводили мониторинг 4 виноградных лоз без какого-либо внесения спор Е. necator. В этом случае на разных стадиях собирали по 10 листьев и отправляли в лабораторию для ПЦР-анализа. В тесте "14 00 08 EN-B" ДНК Е. necator была выявлена анализом кПЦР в листьях, собранных в день 2 (30 апреля 2014 г.) и в день 3 (13 мая 2015 г.), но не в день 1 (17 апреля 2014 г.). Частота естественного заражения листьев мучнистой росой отличалась в разных тестируемых областях (Зона 1, Зона 2 и Зона 3). В листьях, собранных в Зоне 1, было значительное присутствие ДНК Е. necator в 9 из 10 собранных листьев. В то же время за виноградными лозами осуществлялось визуальное наблюдение, и на этой стадии не наблюдалось никаких видимых симптомов мучнистой росы. Некроз Е. necator начал появляться только через 15 дней (первая визуальная отметка 22 мая 2014).
[0081] Анализ кПЦР листьев, собранных в других мониторинговых тестах, показал присутствие ДНК Е. necator на нескольких листах только на Д1 (23 апреля 2014 г.), но на две другие проверяемые даты (05 и 19 мая 2014 г.) на листьях не было выявлено мучнистой росы. Такие же данные были получены в другом тесте, где только на 2-х листах было определено присутствие ДНК Е. necator в Д1 (22 апреля 2014), а на листьях, собранных в Д2 (05 мая 2014 г.) и Д3 (02 июня 2014 г.), с помощью кПЦР инфекции обнаружено не было.
[0082] Согласно результатам кПЦР, споры Е. necator наличествовали в начале теста с низкой частотой, и на более поздние даты не произошло никакого развития. Визуальная оценка в поле подтвердила эту гипотезу, так как симптомы мучнистой росы наблюдались только в конце сезона. Таким образом, выявление способом согласно изобретению хорошо коррелирует с наличием гриба и его развитием на растениях.
Пример 5: Анализ кПЦР и мониторинг симптомов мучнистой росы в ситуациях естественного заражения
[0083] В 2015 году были проведены дополнительные тесты в условиях естественного заражения в двух регионах Франции (регион Шампань и регион Арманьяк). В каждом регионе анализы осуществляли на нескольких участках (10 участков в регионе Шампань и 9 участков в регионе Арманьяк). Для каждого теста с участков собирали образцы по 10 листьев. Более того, это же количество образцов собирали на трех разных стадиях развития виноградных растений: первый сбор образцов был осуществлен на стадии развития ВВСН 14/15 (от 4 до 5 развитых листов), второй сбор образцов - на стадии ВВСН 53 (от 6 до 7 развитых листов), и третий - на стадии ВВСН 57 (от 8 до 10 развитых листов).
[0084] Параллельно также внимательно отслеживали появление и развитие симптомов на листьях. Это отслеживание выполняли, начиная с 15-го дня после стадии ВВСН 14/15, затем через каждые 15 дней до поздних стадий развития, включая стадию ВВСН 61 (цветение) и стадию ВВСН 71 (образование плодов).
[0085] Одним из важных наблюдений было то, что на участках их обоих регионов способ кПЦР согласно изобретению был способен выявить Е. necator очень рано в процессе развития лоз. В двух регионах было возможно выявить присутствие Е. necator уже на первой проверяемой стадии развития, ВВСН 14/15, задолго до наблюдения каких-либо видимых симптомов.
[0086] В регионе Шампань анализ также показал, что развитие болезни прогрессировало на разных участках (только 3 участка из 10 показали наличие Е. necator на стадии ВВСН 14/15, но на стадии ВВСН 57 его показали уже 8 из 10 участков). Более того, симптомы на листьях начали быть видимы только на стадии ВВСН 57 и затем прогрессировали на разных участках до стадии ВВСН 71. Пробы в регионе Шампань, однако, испытали умеренное заражение благодаря профилактическому применению фунгицидов во время теста. Это более позднее наблюдение по меньшей мере показывает, что профилактическая обработка способна удержать развитие симптомов Е. necator под контролем, хотя наличие гриба выявлялось кПЦР на очень ранних этапах развития виноградной лозы.
[0087] В регионе Арманьяк Е. necator также был рано обнаружен на некоторых участках (на ВВСН 14/15), но не проявил значительного прогрессирования на большем количестве участков по мере развития лоз (только на 3-х участках методом кПЦР обнаружили выявляемые количества Е. necator на стадии ВВСН 57). Это можно объяснить тем фактом, что болезнь прогрессировала медленно, возможно, из-за климатических условий на протяжении теста, так как до стадии ВВСН 61 не наблюдалось никаких видимых симптомов на листьях. Однако на этих участках фунгицидные обработки не проводились, и анализ показал, что болезнь в основном развивалась на протяжении более поздних стадий развития (ВВСН 61 и ВВСН 71). Интересно также, что наиболее видимо зараженные на этих поздних стадиях развития участки были теми же, на которых способом кПЦР Е. necator был выявлен на более ранних стадиях (ВВСН 14/15 и ВВСН 57). Эти результаты дополнительно демонстрируют, что способ кПЦР согласно изобретению является точным способом для выявления Е. necator на виноградниках на очень ранних стадиях развития растений, таким образом делая возможным применение профилактических, однако прицельных обработок до того, как болезнь распространится и действительно повлияет на урожай.


Изобретение относится к области биотехнологии. А именно к: олигонуклеотидному праймеру для выявления гриба Erysiphe necator, выбранному из группы, состоящей из: (I) олигонуклеотидов с нуклеотидной последовательностью SEQ ID NO: 1, 3, 4 или 5; (II) олигонуклеотидов с нуклеотидной последовательностью, комплементарной нуклеотидной последовательности SEQ ID NO: 1, 3, 4 или 5; (III) олигонуклеотидов с нуклеотидной последовательностью из по меньшей мере 10 смежных нуклеотидов олигонуклеотидов SEQ ID NO: 1, 2, 3, 4 или 5 либо из комплементарных им нуклеотидных последовательностей, за исключением (а) конкретного олигонуклеотида с нуклеотидной последовательностью SEQ ID NO: 2 и (б) конкретного олигонуклеотида с нуклеотидной последовательностью tcactctgtc, паре олигонуклеотидных праймеров для выявления гриба Erysiphe necator, состоящей из одного прямого олигонуклеотидного праймера и одного обратного олигонуклеотидного праймера, олигонуклеотидному зонду для выявления гриба Erysiphe necator, способу специфичного количественного определения гриба Erysiphe necator, диагностическому набору, используемому для выявления и/или количественного определения гриба Erysiphe necator, включающему по меньшей мере один олигонуклеотидный праймер по п. 1 либо пару олигонуклеотидных праймеров по пп. 2 и 3. Настоящее изобретение относится к средствам, способам и наборам для специфичного выявления возбудителя мучнистой росы винограда, гриба Erysiphe necator. 6 н. и 11 з.п. ф-лы, 5 пр.
1. Олигонуклеотидный праймер для выявления гриба Erysiphe necator, выбранный из группы, состоящей из:
(I) олигонуклеотидов с нуклеотидной последовательностью SEQ ID NO: 1, 3, 4 или 5;
(II) олигонуклеотидов с нуклеотидной последовательностью, комплементарной нуклеотидной последовательности SEQ ID NO: 1, 3, 4 или 5;
(III) олигонуклеотидов с нуклеотидной последовательностью из по меньшей мере 10 смежных нуклеотидов олигонуклеотидов SEQ ID NO: 1, 2, 3, 4 или 5 либо из комплементарных им нуклеотидных последовательностей, за исключением (а) конкретного олигонуклеотида с нуклеотидной последовательностью SEQ ID NO: 2 и (б) конкретного олигонуклеотида с нуклеотидной последовательностью tcactctgtc.
2. Пара олигонуклеотидных праймеров для выявления гриба Erysiphe necator, состоящая из одного прямого олигонуклеотидного праймера и одного обратного олигонуклеотидного праймера, выбранных из группы, состоящей из:
(I) пар олигонуклеотидов с нуклеотидными последовательностями SEQ ID NO: 1 для прямого праймера и SEQ ID NO: 2 для обратного праймера, SEQ ID NO: 3 для прямого праймера и SEQ ID NO: 4 для обратного праймера, SEQ ID NO: 3 для прямого праймера и SEQ ID NO: 5 для обратного праймера;
(II) пар олигонуклеотидов с нуклеотидными последовательностями, комплементарными нулеотидным последовательностям SEQ ID NO: 1 для обратного праймера и SEQ ID NO: 2 для прямого праймера, SEQ ID NO: 3 для обратного праймера и SEQ ID NO: 4 для прямого праймера, SEQ ID NO: 3 для обратного праймера и SEQ ID NO: 5 для прямого праймера;
(III) любой пары олигонуклеотидов с нуклеотидными последовательностями из по меньшей мере 10 смежных нуклеотидов пар олигонуклеотидов (I) и (II).
3. Пара олигонуклеотидных праймеров по п. 2, отличающаяся тем, что пара состоит из:
(I) пары олигонуклеотидов с нуклеотидными последовательностями SEQ ID NO: 1 для прямого праймера и SEQ ID NO: 2 для обратного праймера;
(II) пары олигонуклеотидов с нуклеотидными последовательностями, комплементарными нуклеотидным последовательностям SEQ ID NO: 1 для обратного праймера и SEQ ID NO: 2 для прямого праймера;
(III) любой пары олигонуклеотидов с нуклеотидными последовательностями из по меньшей мере 10 смежных нуклеотидов пар олигонуклеотидов (I) и (II).
4. Олигонуклеотидный зонд для выявления гриба Erysiphe necator, выбранный из группы, состоящей из:
(I) олигонуклеотидов с нуклеотидными последовательностями SEQ ID NO: 6 и SEQ ID NO: 7;
(II) олигонуклеотидов с нуклеотидными последовательностями, комплементарными нуклеотидным последовательностям SEQ ID NO: 6 и SEQ ID NO: 7;
(III) любого олигонуклеотида с нуклеотидной последовательностью из по меньшей мере 10 смежных нуклеотидов олигонуклеотидов (I) и (II), за исключением конкретного олигонуклеотида с нуклеотидной последовательностью cgtagagccca.
5. Олигонуклеотидный зонд по п. 4, выбранный из группы, состоящей из:
(I) олигонуклеотида с нуклеотидной последовательностью SEQ ID NO: 6;
(II) олигонуклеотида с нуклеотидной последовательностью, комплементарной нуклеотидной последовательности SEQ ID NO: 6.
6. Способ специфичного выявления гриба Erysiphe necator, включающий:
(а) подвергание образца амплификации в количественной полимеразной цепной реакции (кПЦР) с использованием пары олигонуклеотидных праймеров, (I) включающей олигонуклеотидный праймер по п. 1 либо (II) состоящей из пары олигонуклеотидных праймеров по пп. 2 и 3; и
(б) определение наличия или отсутствия Erysiphe necator в образце путем визуализации либо без визуализации целевой ДНК, амплифицированной кПЦР.
7. Способ специфичного количественного определения гриба Erysiphe necator, включающий:
(а) подвергание образца количественной полимеразной цепной реакции (кПЦР) с использованием пары олигонуклеотидных праймеров, (I) включающей олигонуклеотидный праймер по п. 1 либо (II) состоящей из пары олигонуклеотидных праймеров по пп. 2 и 3; и
(б) определение количества Erysiphe necator, если таковое присутствует в образце, путем сравнения измеренного количества амплифицированной кПЦР целевой ДНК с эталонными данными амплификации ДНК.
8. Способ по любому из пп. 6 или 7, отличающийся тем, что пара олигонуклеотидных праймеров является любой парой по пп. 2 и 3.
9. Способ по любому из пп. 6 или 8, отличающийся тем, что определение наличия или количества Erysiphe necator в образце выполняют с олигонуклеотидным зондом по любому из пп. 4 и 5.
10. Способ по п. 9, отличающийся тем, что образец подвергают амплификации в кПЦР с использованием пары олигонуклеотидных праймеров по п. 3, а определение наличия или количества Erysiphe necator в образце выполняют с олигонуклеотидным зондом по п. 5.
11. Способ по любому из пп. 6-10, отличающийся тем, что амплификация включает амплифицирование по меньшей мере части последовательности внутреннего транскрибируемого спейсера (ВТС) Erysiphe necator.
12. Диагностический набор, используемый для выявления и/или количественного определения гриба Erysiphe necator, включающий по меньшей мере один олигонуклеотидный праймер по п. 1 либо пару олигонуклеотидных праймеров по пп. 2 и 3.
13. Диагностический набор по п. 12, включающий пару олигонуклеотидных праймеров по любому из пп. 2 или 3.
14. Диагностический набор по п. 12, включающий олигонуклеотидный зонд по любому из пп. 4 или 5.
15. Диагностический набор по любому из пп. 12-14, включающий пару олигонуклеотидных праймеров по п. 3 и олигонуклеотидный зонд по п. 5.
16. Диагностический набор по любому из пп. 12 или 14, дополнительно включающий неспецифичный ДНК-интеркалирующий краситель.
17. Диагностический набор по п. 16, отличающийся тем, что неспецифичный ДНК-интеркалирующий краситель является соединением SYBR Green.
| Затвор сосуда высокого давления | 1972 |
|
SU539202A1 |
| КОВТУН И.С., и др | |||
| "Особенности подбора праймеров конститутивного гена для проведения полимеразной цепной реакции после обратной транскрипции", Вестник Томского государственного университета | |||
| Биология | |||
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| DUFOUR M.-C., et al | |||
| "Assessment of fungicide | |||
Авторы
Даты
2020-04-28—Публикация
2016-07-08—Подача