Область техники, к которой относится изобретение
Изобретение относится к медицине, а именно к эндокринологии, радиологии, ядерной медицине, радионуклидной терапии, и предназначено для определения индивидуальной активности (дозировки) радиоактивного 131-йода для проведения радиойодтерапии тиреотоксикоза, включая, диффузный токсический зоб, токсический одноузловой зоб, токсический многоузловой зоб, тиреотоксикоз с эктопией тироидной ткани, а также определения прогноза времени достижения безопасного уровня активности 131-йода в организме пациента после введения индивидуальной активности 131-йода, которое может быть использовано для определения времени госпитализации пациента в специализированном радиационно-защитном стационаре.
Радиойодтерапия как и хирургическое удаление является методом выбора при лечении тиреотоксикоза в отсутствии ответа на медикаментозное лечение.
Уровень техники
Из уровня техники известны различные способы определения индивидуальной активности 131-йода для достижения терапевтического эффекта (гипотиреоза) при лечении тиреотоксикоза. Известные способы основаны на измерении различных параметров - клинических, лабораторных, инструментальных, однако они, как правило, не учитывают особенностей индивидуальной фармакокинетики 131-йода пациента, что приводит к возникновению погрешности при определении индивидуальной активности 131-йода, а это, в свою очередь, негативно сказывается на эффективности лечения, увеличивая количество рецидивов в течение 6 месяцев после проведения радиойодтерапии.
Из уровня техники известен способ определения индивидуальной активности радиоактивного 131-йода при лечении больных диффузным токсическим зобом [Krohn, Т.,  Н.,
Н.,  В., Behrendt, F.F., Heinzel, A., Mottaghy, F.М., & Verburg, F.A. Maximum dose rate is a determinant of hypothyroidism after 131-I therapy of Graves' disease but the total thyroid absorbed dose is not. // Journal of Clinical Endocrinology and Metabolism, 201499(11), 4109-4115], который основан на определении параметров, характеризующих объем тироидной ткани V[мл], определяемый ультразвуковым методом, тироидный захват 131-йода на 48 час U48[%] после введения 131-йода к введенной диагностической активности (до 2 МБк), определяемый с использованием спектрометрического проба. Индивидуальную дозировку 131-йода определяют по следующей формуле с учетом эффективного периода полувыведения Тэф=5,5 дней и назначенной терапевтической поглощенной дозы
В., Behrendt, F.F., Heinzel, A., Mottaghy, F.М., & Verburg, F.A. Maximum dose rate is a determinant of hypothyroidism after 131-I therapy of Graves' disease but the total thyroid absorbed dose is not. // Journal of Clinical Endocrinology and Metabolism, 201499(11), 4109-4115], который основан на определении параметров, характеризующих объем тироидной ткани V[мл], определяемый ультразвуковым методом, тироидный захват 131-йода на 48 час U48[%] после введения 131-йода к введенной диагностической активности (до 2 МБк), определяемый с использованием спектрометрического проба. Индивидуальную дозировку 131-йода определяют по следующей формуле с учетом эффективного периода полувыведения Тэф=5,5 дней и назначенной терапевтической поглощенной дозы 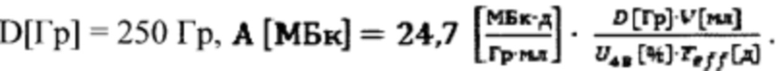
Несмотря на то, что при определении дозировки учитывают такие значимые клинические показатели, как объем щитовидной железы и тироидный захват 131-йода на 48 час после введения 131-йода, по итогам лечения наблюдают рецидивы у больных в среднем не менее чем в 15-20% случаев. Кроме того, в способе использовано фиксированное значение эффективного периода полувыведения 131-йода - 5,5 дней, что не всегда совпадает с истинным значением, которое может варьироваться в широких пределах от 2 до 7 дней и связано, в т.ч. с индивидуальной фармакокинетикой 131-йода у пациента. Кроме того, оценка тироидного захвата 131-йода на 48 час с использованием спектрометрического проба характеризуется определенными сложностями, связанными с позиционированием пациента по отношению к чувствительному объему детектора, а также высокой чувствительностью прибора, которая приводит к регистрации гамма излучения 131-йода от соседних тканей, что увеличивает погрешность определяемого эффективного времени выведения. Кроме того, в способе не указана нижняя граница вводимой диагностической активности 131-йода.
Из уровня техники известен также способ определения индивидуальной дозировки 131-йода при лечении тиреотоксикоза [ Н., Canzi, С., Eschner, W., Flux, G., Luster, M., Strigari, L., & Lassmann, M. (2013). EANM Dosimetry Committee series on standard operational procedures for pre-therapeutic dosimetry II. Dosimetry prior to radioiodine therapy of benign thyroid diseases. // European Journal of Nuclear Medicine and Molecular Imaging, 2013 40(7), 1126-1134], включающий определение массы тироидной ткани V[г] ультразвуковым методом, динамическую оценку (не менее трех оценок) тироидного захвата 131-йода с использованием гамма камеры. Данный способ позволяет визуализировать распределение 131-йода, тем самым проводить лучшую коррекцию счета в зависимости от накопления в соседних с щитовидной железой тканях. Также к достоинству способа стоит отнести использование фактора накопления дозы (S-фактор), который фундаментально отражает воздействие излучения на ткань щитовидной железы. Расчет терапевтической активности производят по формуле
Н., Canzi, С., Eschner, W., Flux, G., Luster, M., Strigari, L., & Lassmann, M. (2013). EANM Dosimetry Committee series on standard operational procedures for pre-therapeutic dosimetry II. Dosimetry prior to radioiodine therapy of benign thyroid diseases. // European Journal of Nuclear Medicine and Molecular Imaging, 2013 40(7), 1126-1134], включающий определение массы тироидной ткани V[г] ультразвуковым методом, динамическую оценку (не менее трех оценок) тироидного захвата 131-йода с использованием гамма камеры. Данный способ позволяет визуализировать распределение 131-йода, тем самым проводить лучшую коррекцию счета в зависимости от накопления в соседних с щитовидной железой тканях. Также к достоинству способа стоит отнести использование фактора накопления дозы (S-фактор), который фундаментально отражает воздействие излучения на ткань щитовидной железы. Расчет терапевтической активности производят по формуле 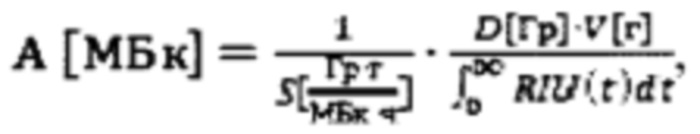 где D[Гр] - назначенная терапевтическая поглощенная доза в тироидной ткани, V[г] - масса тироидной ткани, RIU(t)[%] - отношение тироидного захвата 131-йода в момент времени t к введенной диагностической активности (до 10 МБк).
где D[Гр] - назначенная терапевтическая поглощенная доза в тироидной ткани, V[г] - масса тироидной ткани, RIU(t)[%] - отношение тироидного захвата 131-йода в момент времени t к введенной диагностической активности (до 10 МБк).
Однако, определение дозировки данным способом приводит к рецидивам у больных в среднем не менее чем в 10-15% случаев. Данный способ характеризуется сложностью и использованием дорогостоящего оборудования, а также длительностью процесса проведения измерения тироидного захвата 131-йода под контролем квалифицированного медицинского персонала. В способе не указана нижняя граница вводимой диагностической активности 131-йода, а также отсутствует прогноз времени достижения безопасного уровня излучения от пациента.
Наиболее близким к заявляемому способу определения индивидуальной активности 131-йода для проведения радиойодтерапии тиреотоксикоза является способ определения индивидуальной дозировки 131-йода при лечении диффузного токсического зоба (RU 2417736 C1), согласно которому проводят клиническое обследование пациента, определяют тироидный захват 131-йода через 4 часа и через 24 часа после введения диагностической активности 131-йода, объем щитовидной железы по данным ультразвукового исследования, свободный тироксин крови (пмоль/л), длительность заболевания, пол больного, длительность отмены тиреостатика перед приемом терапевтической дозировки радиоактивного 131-йода, возраст пациента при первом проявлении данной болезни, наличие резекции щитовидной железы в анамнезе, дозировку мерказолила (тирозола) накануне отмены препарата. Далее определяют верхнюю и нижнюю границы диапазона рекомендуемой индивидуальной дозировки 131-йода для данного пациента. При этом определение нижней границы диапазона осуществляют в результате решения задачи прогнозирования дозировки для случаев отрицательных результатов лечения, верхней - для случаев положительных результатов. Осуществляют оценку достоверности положительного или отрицательного исхода лечения в зависимости от назначаемой больному дозировки на основании решения задачи классификации, в которой базу клинических данных по назначенным дозам добавляют в состав входных данных. Результат лечения используют как выходной параметр, а оценку достоверности представляют в виде диапазона чисел от 0 до 1, нулевое значение диапазона интерпретируют как отрицательный исход, единичное значение - как положительный. Уточняют рассчитанный диапазон рекомендуемых доз путем перебора доз в окрестностях границ с заданным шагом для поиска дозировки, обеспечивающей уверенность в успехе терапии 0,5 для левой границы и 0,9 для правой границы. В качестве рекомендуемой дозировки выбирают дозировку, соответствующую правой границе уточненного диапазона рекомендуемых дозировок. Способ позволяет повысить точность определения индивидуальной дозировки за счет учета большого количества показателей больного, оказывающих влияние на исход терапии
Несмотря на то, что при определении дозировки учитывается целый комплекс значимых клинических показателей, что усложняет применение данного способа, определение дозировки данным способом также приводит к значимому проценту рецидивов у больных после лечения, в среднем в 9-10% случаев. Кроме того, в способе отсутствует прогноз времени достижения безопасного уровня излучения от пациента. Кроме того, использованная в способе прогностическая модель определения индивидуальной активности 131-йода применима только к частному случаю тиреотоксикоза - диффузному токсическому зобу.
Наиболее близким к заявляемому способу определения прогноза времени достижения безопасного уровня активности 131-йода в организме пациента после введения индивидуальной активности 131-йода для лечения тиреотоксикоза является способ, представленный в публикации [Rumyantsev, Р.О., Trukhin, A.A., Degtyarev, М.V, Sheremeta, М.S., Nizhegorodova, K.S., Slashchuk, K.Y., Shtotsky, Y.V. Estimated Inpatient Hospital Stay in Individual Wards: Guidelines on Radiation Safety after Radioiodine Therapy. // KnE Energy, 2018 3(2)]. Согласно данному способу на этапе дозиметрического планирования измеряют счет импульсов Z0, Z1 в организме в момент времени t0 (через 2 часа после введения 131-йода) и t1 (через 48 часов после введения 131-йода) после введения диагностической активности 131-йода с использованием спектрометрического метода на гамма камере. Далее определяют эффективное время полувыведения из организма, по формуле 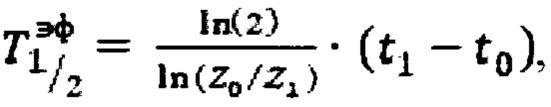 где Z0, Z1 - показания прибора. Прогноз времени достижения безопасного уровня активности 131-йода в организме пациента определяют по формуле
где Z0, Z1 - показания прибора. Прогноз времени достижения безопасного уровня активности 131-йода в организме пациента определяют по формуле 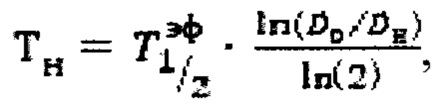 где
где 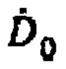 - расчетная начальная мощность эквивалентной дозы на расстоянии 1 метр после введения терапевтической активности А[ГБк] 131-йода,
- расчетная начальная мощность эквивалентной дозы на расстоянии 1 метр после введения терапевтической активности А[ГБк] 131-йода, 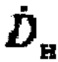 - нормативная безопасная мощность эквивалентной дозы, которая составляет 20 мкЗв/ч по нормам Российской Федерации. Полученные данные массива аппроксимируют линейной зависимостью, получают зависимость времени достижения нормативной активности от введенной активности Тн[день]=6.13⋅А[ГБк]+1.41, которая может быть представлена в графическом виде, для чего наносят полученную линейную зависимость с указанием диапазона погрешности измерения на координатные оси, где ось абсцисс отражает введенную терапевтическую активность 131-йода, ось ординат отражает прогноз времени достижения нормативной безопасной активности в организме при проведении радиойодтерапии тиреотоксикоза, по которой и определяют время достижения безопасной нормативной активности.
- нормативная безопасная мощность эквивалентной дозы, которая составляет 20 мкЗв/ч по нормам Российской Федерации. Полученные данные массива аппроксимируют линейной зависимостью, получают зависимость времени достижения нормативной активности от введенной активности Тн[день]=6.13⋅А[ГБк]+1.41, которая может быть представлена в графическом виде, для чего наносят полученную линейную зависимость с указанием диапазона погрешности измерения на координатные оси, где ось абсцисс отражает введенную терапевтическую активность 131-йода, ось ординат отражает прогноз времени достижения нормативной безопасной активности в организме при проведении радиойодтерапии тиреотоксикоза, по которой и определяют время достижения безопасной нормативной активности.
Однако данный способ не учитывает индивидуальную фармакокинетику 131-йода конкретного пациента, прогнозируемые параметры характеризуются высокой вариабельностью.
Раскрытие изобретения
Технической проблемой, решаемой настоящим изобретением является разработка способа определения индивидуальной дозировки 131-йода при лечении больных тиреотоксикозом, включая, диффузный токсический зоб, токсический одноузловой зоб, токсический многоузловой зоб, тиреотоксикоз с эктопией тироидной ткани, а также прогноза времени достижения безопасного уровня активности 131-йода в организме пациента после введения определенной индивидуальной активности 131-йода, с учетом индивидуальной фармакокинетики.
Техническим результатом способа определения индивидуальной активности 131-йода является снижение количества рецидивов тиреотоксикоза до 5-7%, наблюдаемых в течение 6 месяцев после проведения радиойодтерапии, техническим результатом способа прогнозирования времени достижения безопасного уровня активности 131-йода (Т) - повышение точности определения прогнозируемого времени.
Способ определения индивидуальной активности 131-йода для проведения радиойодтерапии тиреотоксикоза включает определение:
объема участков (k) тироидной ткани (Vk, [мл]);
удельного индекса тироидного захвата 99mTc-пертехнетата(I, [%]);
распределения тироидного захвата 99mTc-пертехнетата по участкам ткани щитовидной железы (Rk, [%]);
а также определение максимального и интегральный тироидного захвата 131-йода, для чего пациенту перорально вводят рабочий раствор объемом от 5 до 10 мл с содержанием активности (А0) 131-йода от 5 до 10 МБк, далее на теле пациента размещают два дозиметра, выполненные с возможностью периодической регистрации мощности гамма-излучения до 2 мЗв/ч и автономной работы до 5 дней: первый - на уровне щитовидной железы, второй - на уровне мочевого пузыря, и регистрируют мощность гамма-излучения 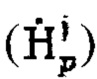 в непрерывном режиме в течение 2-5 суток, где j - номер дозиметра, p - номер зарегистрированного значения через определенный интервал времени из диапазона 2-15 минут, с сохранением зарегистрированных данных в памяти дозиметра, после чего данные значения переводят в значения активности 131-йода с получением массивов данных
в непрерывном режиме в течение 2-5 суток, где j - номер дозиметра, p - номер зарегистрированного значения через определенный интервал времени из диапазона 2-15 минут, с сохранением зарегистрированных данных в памяти дозиметра, после чего данные значения переводят в значения активности 131-йода с получением массивов данных 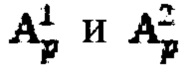 с последующим усреднением данных за каждый час измерений с получением массивов
с последующим усреднением данных за каждый час измерений с получением массивов 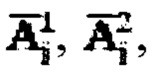 где i - номер часа после введения рабочего раствора, далее определяют лечебную активность тироидной ткани
где i - номер часа после введения рабочего раствора, далее определяют лечебную активность тироидной ткани 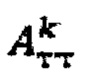 при удельном индексе тироидного захвата 99mTc-пертехнентата менее 0,5%/мл - по формуле
при удельном индексе тироидного захвата 99mTc-пертехнентата менее 0,5%/мл - по формуле 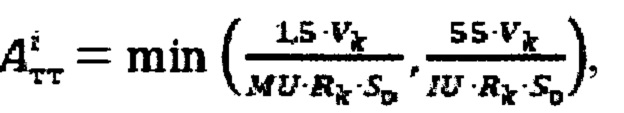 при удельном индексе тироидного захвата 99mTc-пертехнентата более 0,5%/мл - по формуле
при удельном индексе тироидного захвата 99mTc-пертехнентата более 0,5%/мл - по формуле 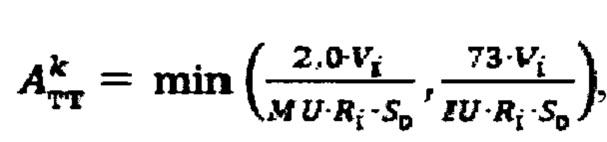 где
где 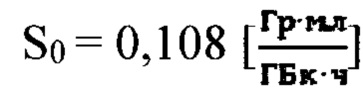 - фактор накопления дозы, и в случае, если k=1 в качестве индивидуальной терапевтической активности 131-йода принимают минимальное значение из
- фактор накопления дозы, и в случае, если k=1 в качестве индивидуальной терапевтической активности 131-йода принимают минимальное значение из 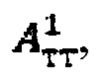 а в случае, если k>1, индивидуальную терапевтическую активность 131-йода определяют по формуле
а в случае, если k>1, индивидуальную терапевтическую активность 131-йода определяют по формуле 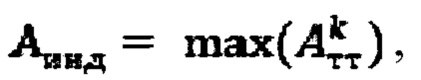
где MU - максимальный тироидный захват 131-йода, а IU - интегральный захват 131-йода, которые определяют по формулам: 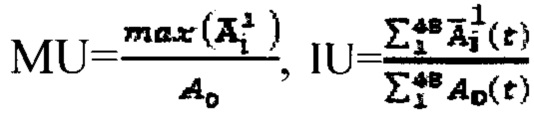 или по формулам:
или по формулам: 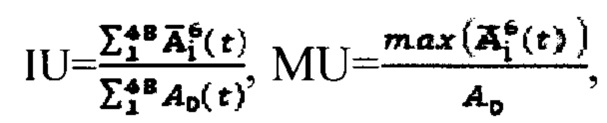 где
где 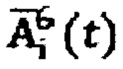 - массив активности в камере «Щитовидная железа», полученный при обработке зарегистрированных данных массивов
- массив активности в камере «Щитовидная железа», полученный при обработке зарегистрированных данных массивов 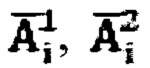 с применением четырехкамерной модели фармакокинетики 131-йода в организме пациента, учитывающей активности в каждый момент времени t в следующих камерах: «Тело», «Щитовидная железа», «Активность 131-йода, выведенная из тела через мочевой пузырь», «Убыль активности 131-йода в результате радиоактивного распада».
с применением четырехкамерной модели фармакокинетики 131-йода в организме пациента, учитывающей активности в каждый момент времени t в следующих камерах: «Тело», «Щитовидная железа», «Активность 131-йода, выведенная из тела через мочевой пузырь», «Убыль активности 131-йода в результате радиоактивного распада».
Для определения объема участков тироидной ткани (k) регистрируют ультразвуковым методом поперечный, продольный, глубинный размеры участков тироидной ткани, а также сцинтиграфическим методом поперечный и продольный размеры участков тироидной ткани, а объем участков тироидной ткани определяют по формуле:
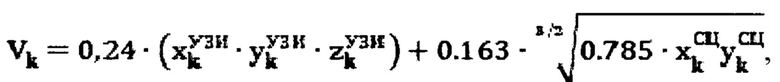
где
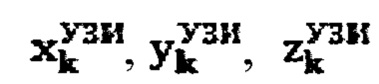 продольный, поперечный и глубинный размер тироидной ткани определенный ультразвуковым методом соответственно,
продольный, поперечный и глубинный размер тироидной ткани определенный ультразвуковым методом соответственно,
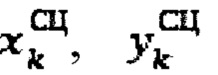 продольный, поперечный размер тироидной ткани определенный сцинтиграфическим методом соответственно.
продольный, поперечный размер тироидной ткани определенный сцинтиграфическим методом соответственно.
Для определения объема участков тироидной ткани (к) при тиреотоксикозе, вызванном эктопией щитовидной железы, объем участков определяют по формуле:
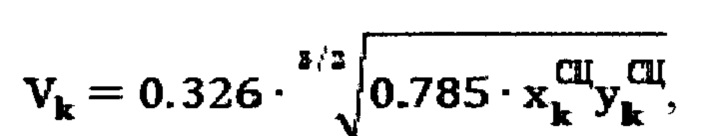
где
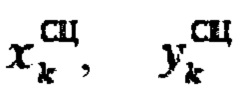 продольный, поперечный размер тироидной ткани определенный сцинтиграфическим методом соответственно
продольный, поперечный размер тироидной ткани определенный сцинтиграфическим методом соответственно
Удельный индекс тироидного захвата 99mTc-пертехнетата I [%] может быть определен сцинтиграфическим методом с использованием гамма-камеры, при этом берут отношение накопленной активности 99mTc-пертехнетата в ЩЖ на 10-15 минуту после введения с поправкой, учитывающей распад 99mTc на момент проведения исследования, к введенной диагностической активности 99mTc-пертехнетата и к полученному ранее объему тироидной ткани.
Измеренные мощности гамма-излучения переводят в значения активности 131-йода по формуле 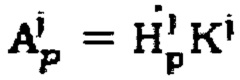 с использованием калибровочных коэффициентов K1 и K2.
с использованием калибровочных коэффициентов K1 и K2.
Прогнозируемое время (на этапе планирования радиойодтерапии) достижения безопасного уровня активности 131-йода (Т) в организме пациента после введения индивидуальной активности 131-йода определяют Т по формуле:
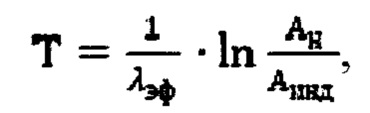
где Ан - нормативной безопасная активности для населения,
λэф. - постоянная эффективного выведения, определяемая аппроксимацией массива активностей в организме пациента  моно-экспоненциальной функцией
моно-экспоненциальной функцией 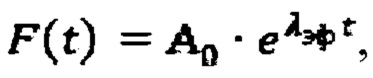 где
где  является суммой активностей
является суммой активностей  и активности в камере «Тело»
и активности в камере «Тело» 
Данный технический результат обусловлен проведением обследования большего количества пациентов с получением наиболее значимых параметров, оказывающих влияние на исход радиойодтерапии, а именно: объемы участков тироидной ткани; удельный индекс тироидного захвата 99mTc-пертехнетата; распределение захвата 99mTc-пертехнетата по участкам тироидной ткани, максимальный и интегральный тироидные захваты 131-йода. Данный технический результат обусловлен также использованием оригинального алгоритма обработки и анализа полученных данных с применением четырехкамерной модели фармакокинетики 131-йода в организме пациента, учитывающей постоянные обмена, определяемые по итогам регистрации мощности гамма-излучения на уровне щитовидной железы и на уровне мочевого пузыря в течение определенного времени.
Наилучшие результаты достигаются при лечении диффузного токсического зоба, при этом повышенный риск рецидива после проведения радиойодтерапии тиреотоксикоза наблюдают в случае, если удельный индекс тироидного захвата 99mTc-пертехнетата по отношению к объему щитовидной железы составляет более 0,5%/мл. Данный факт учтен в заявляемом способе посредством корректировки назначаемой мощности поглощенной дозы и поглощенной дозы за 48 часов в щитовидной железе при проведении радиойодтерапии, полученной по итогам исследования исходов лечения 142 пациентов. Радиойодтерапия токсического одногоузлового или многоузлового зоба сопряжена с трудностью оценки степени интактности (вследствие отсутствия ответа тироидной ткани, выраженного в выработке гормонов щитовидной железы) подавленной тироидной ткани к тиреотропному гормону на фоне повышенной функции узлового либо узловых образований. В этом случае рецидив тиреотоксикоза может быть связан с ответом подавленной до проведения курса радиойодтерапии тироидной ткани на стимуляцию тиреотропным гормоном после лечения. Тиреотоксикоз с эктопией тироидной ткани встречается достаточно редко, при этом под эктопией тироидной ткани в предлагаемом изобретении понимают патологию эмбрионального развития, которую часто ошибочно сопоставляют со случаем загрудинного распространения, который требует иного способа определения дозировки 131-йода, например, с использованием томографического метода, реализуемого на системах однофотонной эмиссионной томографии, совмещенной с рентгеновской компьютерной томографией. Риск рецидива при проведении радиойодтерапии тиреотоксикоза с эктопией тироидной ткани минимален.
Таким образом, заявляемое изобретение снижает количество рецидивов тиреотоксикоза до 5-7%, характеризуется использованием меньшего количества параметров при определении индивидуальной дозировки 131-йода, предлагает применение портативных медицинских дозиметров для измерения мощности гамма-излучения вместо дорогостоящего и сложного оборудования, используемого в способах-аналогах для измерения индексов тироидного захвата 131-йода, что делает заявляемый способ определения индивидуальной активности 131-йода более доступным и простым для пациентов и медицинского персонала. По полученной индивидуальной активности 131-йода изобретение позволяет прогнозировать время достижения безопасной активности 131-йода в организме для населения, и, соответственно, позволяет определить период госпитализации пациента. Последний фактор является важным для организации работы терапевтических отделений ядерной медицины, т.к. позволяет прогнозировать загрузку специализированных радиационно-защитных стационаров данных отделений.
Краткое описание чертежей
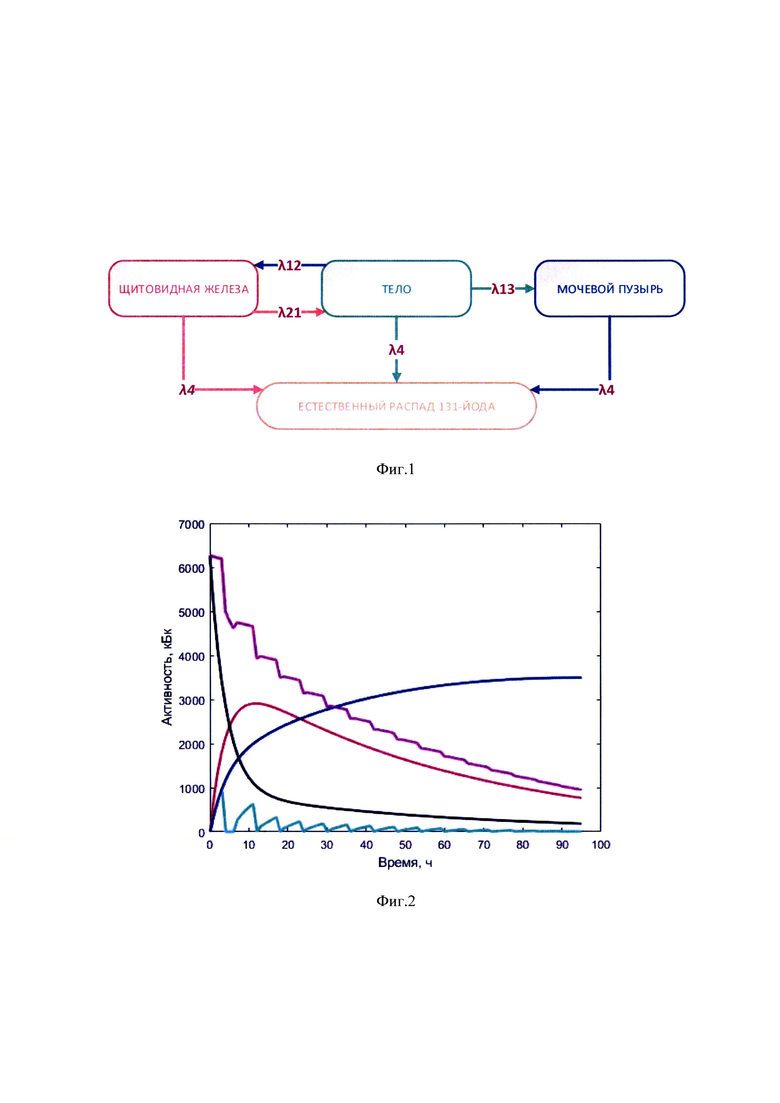
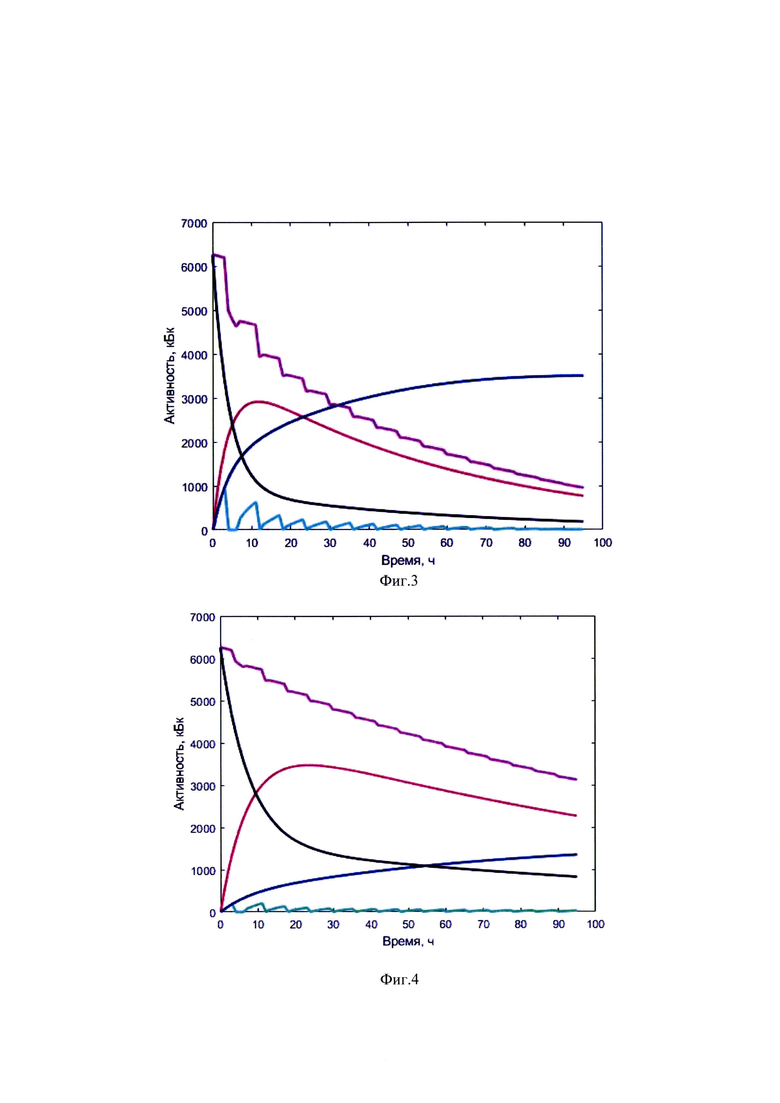
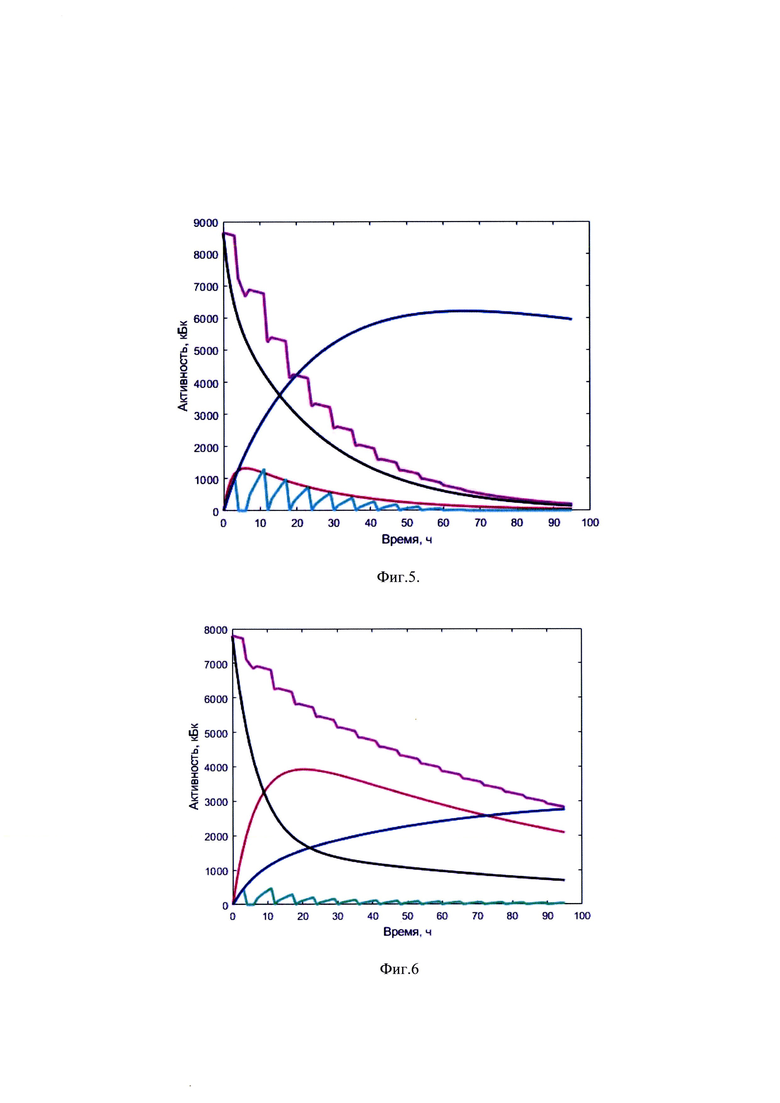
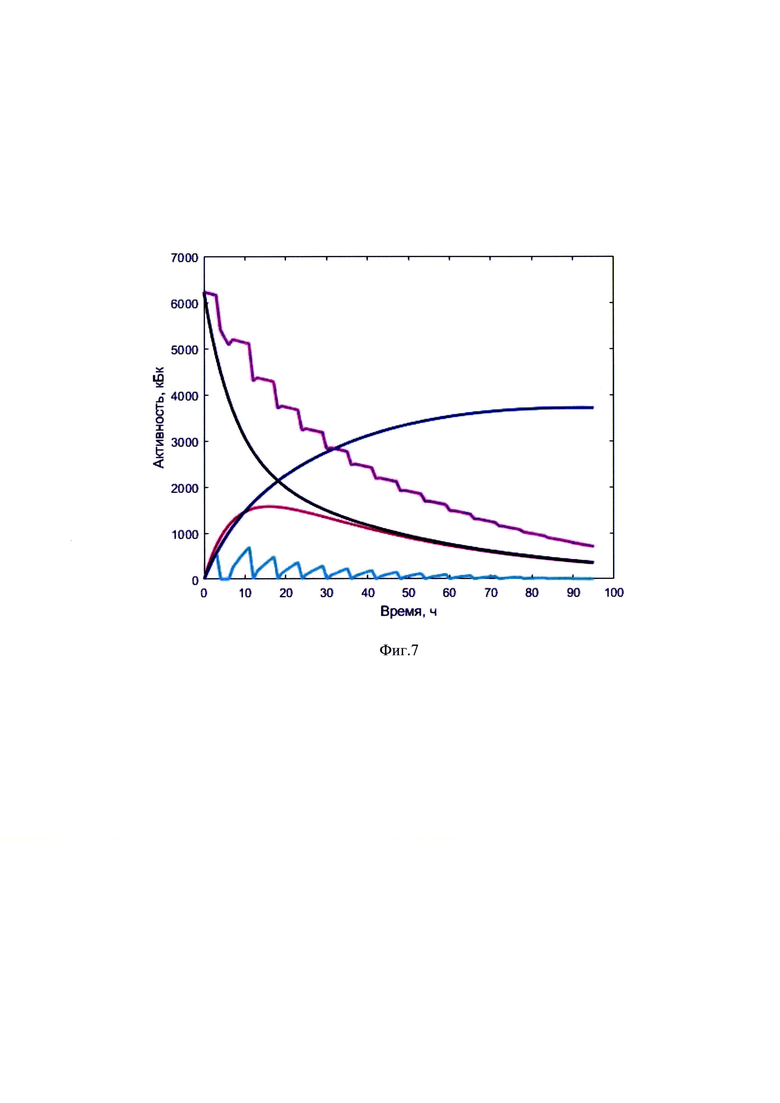
Изобретение поясняется иллюстративным материалом, где на фиг. 1 представлена четырехкамерная модель фармакокинетики 131-йода, которая была использована при обработке результатов измеренных параметров мощности гамма-излучения 131-йода на уровне щитовидной железы и мочевого пузыря; на фиг. 2 показаны графические представления массивов данных фамакокинетики 131-йода, поясняющие возможность реализации заявляемого изобретения, на фиг. 3-7 - графические представления массивов данных фамакокинетики 131-йода конкретных пациентов по примерам №1-6, соответственно, где кривая (1) показывает динамику изменения активности 131-йода в мочевом пузыре; кривая (2) - активность 131-йода в камере «Активность 131-йода, выведенная из тела через мочевой пузырь»; кривая (3) - активность 131-йода в камере «Щитовидная железа»; (4) - активность 131-йода в камере «Тело»; (5) - активность 131-йода в организме пациента.
Осуществление изобретения
Заявляемый способ определения индивидуальной активности 131-йода для проведения радиойодтерапии тиреотоксикоза основан на оценке комплекса наиболее значимых параметров, обеспечивающих наибольшую эффективность лечения:
объем участка тироидной ткани (Vk, [мл]);
удельный индекс тироидного захвата 99mTc-пертехнетата (I, [%]);
распределение тироидного захвата 99mTc-пертехнетата по участкам тироидной ткани (Rk, [%]);
максимальный тироидный захват 131-йода (MU, [%]);
интегральный тироидный захват 131-йода (IU, [%]).
Данный комплекс был получен при проведении исследования, в которое вошли 142 пациента с диагностированным тиреотоксикозом. База данных клинических параметров пациентов включала пол, возраст, объем щитовидной железы, наличие или отсутствие офтальмопатии, длительность тиреостатического лечения или длительность заболевания, наличие рецидива на отмену тиреостатического лечения, уровень ТТГ, свТ3, свТ4, исходно и на 1, 3, 6 месяц, AT-ТТГ исходно и на 3 и 6 месяцы после проведения радиойодтерапии, удельный индекс тироидного захвата 99mTc-пертехнетата, максимальный тироидный захват 131-йода, время достижения максимального тироидного захвата 131-йода, максимальная мощность поглощенной дозы, поглощенная доза за первые 48 часов после введения терапевтической активности, данные достижения гипотиреоидного статуса на 1, 3, 6 месяцы после проведения радиойодтерапии. В ходе анализа данных был применен метод логистического регрессионного анализа с целью подбора оптимального количества предиктивно значимых параметров для построения расчетно-прогностической модели достижения гипотиреоидного статуса. В процессе подбора модели каждый параметр подвергали ROC-анализу, оценивали его значимость. Оптимизацию модели проводили методом ступенчатой регрессии. Оценку чувствительности, специфичности, положительное прогностическое значения, отрицательное прогностическое значения, точности модели и кросс-валидацию проводили с целью обоснования прогностической значимости параметров логистической регрессионной модели. Выявленные наиболее значимые параметры характеризовались следующими значениями отношения шансов (ОШ), доверительных интервалов (ДИ), уровней значимости (p): для параметра «объем участка тироидной ткани» ОШ=0,89, ДИ=0,82÷0,96, р=0.003, для параметра «максимальный тироидный захват 131-йода» ОШ=1,31, ДИ=1,14÷1,50, p<0.001, для параметра «интегральный тироидный захват 131-йода» ОШ=1,62, ДИ=1,32÷1,84, р=0.002, для параметра «удельный индекс тироидного захвата 99mTc-пертехнетата» ОШ<0,001, ДИ=0,001÷0,11, р=0,008. Параметр «распределение тироидного захвата 99mTc-пертехнетата по участкам тироидной ткани» имеет сильную корреляцию (r=0.87) с параметром «удельный индекс тироидного захвата 99mTc-пертехнетата».
Реализацию предлагаемого способа определения индивидуальной активности 131-йода для проведения радиойодтерапии тиреотоксикоза осуществляют следующим образом.
Предварительно изучают медицинскую документацию пациента для обеспечения контроля качества подготовки пациента перед определением индивидуальной терапевтической активности 131-йода (дозиметрическим планированием). Исследование будет эффективным и безопасным при условии, если последний прием тиамазола был не менее, чем за сутки до начала исследования, либо пропилтиуроцила - не менее, чем за 7 дней до начала исследования. В противном случае исследование индивидуальной фармакокинетики будет неэффективным и приведет к необоснованной лучевой нагрузке на организм. В отдельных случаях дозировка тиреостатика может быть снижена до минимально допустимой для пациентов, для которых отмена препарата может привести к осложнениям. Дозиметрическое планирование с расчетом индивидуальной активности 131-йода и времени достижения безопасного уровня активности в организме, а также лечение проводят при одинаковых условиях тиреостатической терапии. Исследование отменяют в случае, если в течение последних двух месяцев пациенту было проведено рентгеновское исследование с введением йодсодержащего контраста, и/или пациент принимал йодосодержащие лекарственные препараты в течении последних двух недель.
Для определения объема участков тироидной ткани (k) регистрируют ультразвуковым методом поперечный, продольный, глубинный размеры участков тироидной ткани, а также сцинтиграфическим методом поперечный и продольный размеры участков тироидной ткани.
Объем участков тироидной ткани определяют по формуле:
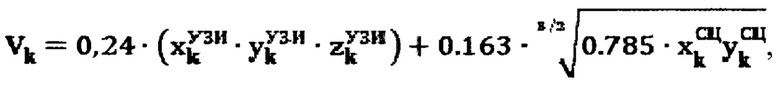
где
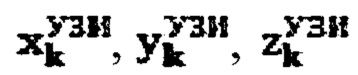 продольный, поперечный и глубинный размер участков тироидной ткани, определенные ультразвуковым методом соответственно,
продольный, поперечный и глубинный размер участков тироидной ткани, определенные ультразвуковым методом соответственно,
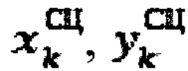 продольный, поперечный размер участков тироидной ткани, определенные сцинтиграфическим методом соответственно.
продольный, поперечный размер участков тироидной ткани, определенные сцинтиграфическим методом соответственно.
В случае отсутствия 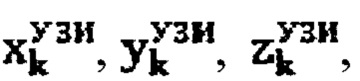 при тиреотоксикозе, вызванном, например, эктопией щитовидной железы, объем участков может быть определен с использованием следующей формулы:
при тиреотоксикозе, вызванном, например, эктопией щитовидной железы, объем участков может быть определен с использованием следующей формулы:
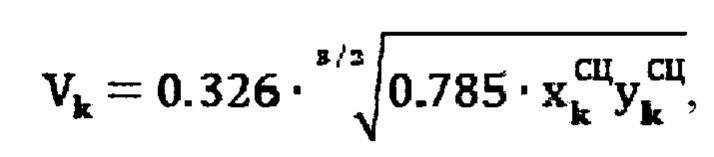
где
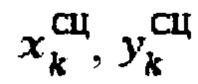 продольный, поперечный размер участков тироидной ткани, определенные сцинтиграфическим методом соответственно.
продольный, поперечный размер участков тироидной ткани, определенные сцинтиграфическим методом соответственно.
Удельный индекс тироидного захвата 99mTc-пертехнетата I [%] определяют сцинтиграфическим методом с использованием гамма-камеры (позиционно чувствительный детектор гамма-излучения). Данный параметр характеризует отношение накопленной активности 99mTc-пертехнетата в ЩЖ на 10-15 минуту после введения с поправкой, учитывающей распад 99mTc на момент проведения исследования, к введенной диагностической активности 99mTc-пертехнетата и к полученному ранее объему тироидной ткани. (A. Moniuszko, D. Patel Nuclear Medicine Technology Study Guide // In Nuclear Medicine Technology Study Guide - 2011).
Далее также с помощью сцинтиграфического метода с использованием гамма-камеры (позиционно чувствительный детектор гамма-излучения) определяют параметр распределения тироидного захвата 99mTc-пертехнетата по участкам ткани щитовидной железы Rk [%]. Rk [%] - отношение счета на сцинтиграмме в проекции участка тироидной ткани к общему счету всех проекций, визуализируемых участков тироидной ткани. Это особенно важно в случае токсического одноузлового и многоузлового зоба.
Далее определяют максимальный тироидный захват и интегральный тироидный захват 131-йода, для чего проводят исследование индивидуальной фармакокинетики 131-йода в организме пациента.
Для исследования индивидуальной фармакокинетики йода-131 перорально под визуальным контролем вводят рабочий раствор объемом от 5 до 10 мл с содержанием активности (А0) 131-йода от 5 до 10 МБк, предварительно подготовленный для введения. Активность измеряют с использованием технического средства для измерения активности радиоизотопа, например, дозкалибратора, с относительной погрешностью измерения не менее 5%. После введения рабочего раствора пациенту перорально вводят 100 мл жидкости, предпочтительно, воды, для обеспечения транспорта рабочего раствора в кишечник и старта процесса всасывания 131-йода и распределения по организму. Далее на теле пациента размещают два дозиметра, выполненные с возможностью периодической регистрации мощности гамма-излучения до 2 мЗв/ч с возможностью автономной работы до 5 дней: первый - на уровне щитовидной железы, второй - на уровне мочевого пузыря с известными калибровочными коэффициентами К1 и К2, необходимыми для перевода показаний дозиметров в активность 131-йода, которые могут быть получены известными методами, например, посредством сопоставления данных с данными существующих эталонных приборов. В качестве эталонных приборов может быть использована гамма-камера, или антропоморфный фантом шеи и области таза. В качестве дозиметров могут быть использованы известные из уровня техники устройства, например, Atom Mini2 (https://atom-shop.ga/models/mini2).
Мощность гамма-излучения 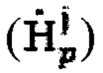 регистрируют дозиметрами в непрерывном режиме в течение 2-5 суток, где j - номер дозиметра, p - номер зарегистрированного значения через определенный интервал времени из диапазона 2-15 минут (например, через каждые 3 мин.) с сохранением зарегистрированных данных в памяти дозиметра.
регистрируют дозиметрами в непрерывном режиме в течение 2-5 суток, где j - номер дозиметра, p - номер зарегистрированного значения через определенный интервал времени из диапазона 2-15 минут (например, через каждые 3 мин.) с сохранением зарегистрированных данных в памяти дозиметра.
Данные, сохраненные в памяти дозиметра, выгружают в систему обработки средствами проводных либо беспроводных интерфейсов. Полученные значения мощности гамма-излучения переводят в значения активности 131-йода по формуле 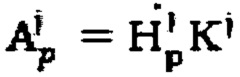 с использованием калибровочных коэффициентов K1 и K2.
с использованием калибровочных коэффициентов K1 и K2.
Далее полученные массивы данных 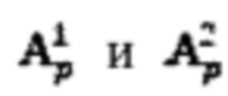 очищают от случайных событий (артефактов), которые могут возникать, например, вследствие влияния дополнительных источников излучения, с последующим усреднением очищенных данных, полученных в течение каждого последовательного часа измерений, и формируют массивы
очищают от случайных событий (артефактов), которые могут возникать, например, вследствие влияния дополнительных источников излучения, с последующим усреднением очищенных данных, полученных в течение каждого последовательного часа измерений, и формируют массивы 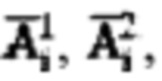 где i - номер часа после введения рабочего раствора.
где i - номер часа после введения рабочего раствора.
Полученные данные массива 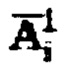 уже могут быть использованы для определения индивидуальной активности 131-йода для проведения радиойодтерапии тиреотоксикоза, при этом данные берут за первые 48 часов измерений. Для чего в массиве
уже могут быть использованы для определения индивидуальной активности 131-йода для проведения радиойодтерапии тиреотоксикоза, при этом данные берут за первые 48 часов измерений. Для чего в массиве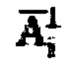 находят максимальное значение активности 131-йода,
находят максимальное значение активности 131-йода, 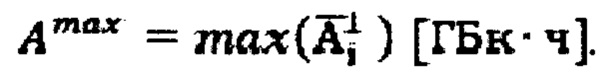 Далее определяют максимальный тироидный захват 131-йода, с учетом введенной пероральной активности А0, по формуле
Далее определяют максимальный тироидный захват 131-йода, с учетом введенной пероральной активности А0, по формуле 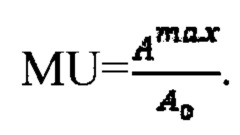 Интегральный захват рассчитывают по формуле
Интегральный захват рассчитывают по формуле 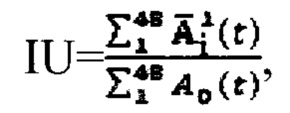 интеграл тироидного захвата 131-йода за период от введения до 48 часов после введения; лечебную активность тироидной ткани
интеграл тироидного захвата 131-йода за период от введения до 48 часов после введения; лечебную активность тироидной ткани 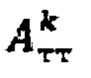 при удельном индексе тироидного захвата 99mTc-пертехнентата менее 0,5%/мл определяют по формуле
при удельном индексе тироидного захвата 99mTc-пертехнентата менее 0,5%/мл определяют по формуле 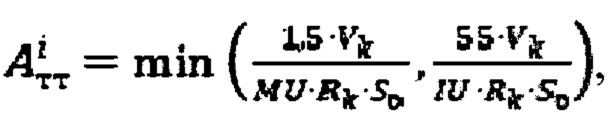 более 0,5%/мл - по формуле
более 0,5%/мл - по формуле 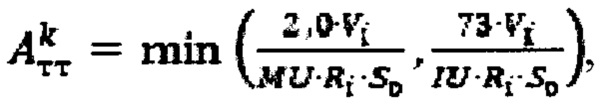 где
где 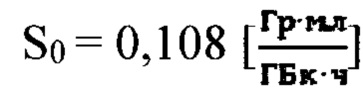 - фактор накопления дозы.
- фактор накопления дозы.
В случае k=1 (для тиреотоксического одноузлового зоба), в качестве индивидуальной терапевтической активности 131-йода принимают минимальное значение из 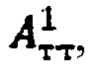 а в случае k>1 индивидуальную терапевтическую активность 131-йода определяют по формуле
а в случае k>1 индивидуальную терапевтическую активность 131-йода определяют по формуле 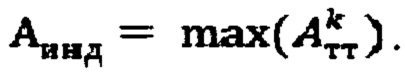
В случае получения значения индивидуальной терапевтической активности 131-йода более 1850 МБк, проведение радиойодтерапии не рекомендуют, предлагают альтернативные методы, например, хирургическое удаление.
Возможен вариант определения индивидуальной терапевтической активности 131-йода с учетом параметров индивидуальной фармакокинетики, полученных в результате обработки массивов данных 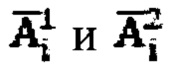 с использованием математической четырехкамерной модели (Матвеев А.В., Носковец Д.Ю. Фармакокинетическое моделирование и дозиметрическое планирование радиойодтерапии тиреотоксикоза // Вестник Омского университета. 2014. №4. С. 57-64; Бондарева И.Б. Математическое моделирование в фармакокинетике и фармакодинамике: дис. д-ра б. наук. М., 2001. 373 с.; Сергиенко В.И., Джеллифф Р., Бондарева И.Б. Прикладная фармакокинетика: основные положения и клиническое применение. М.: Изд-во РАМН, 2003. 208 с.). Блок-схема четырехкамерной модели фармакокинетики 131-йода, которая была использована в заявляемом изобретении, представлена на фиг. 1. Модель включает камеры «Тело», «Щитовидная железа», «Активность 131-йода, выведенная из тела через мочевой пузырь», «Убыль активности 131 -йода в результате радиоактивного распада».
с использованием математической четырехкамерной модели (Матвеев А.В., Носковец Д.Ю. Фармакокинетическое моделирование и дозиметрическое планирование радиойодтерапии тиреотоксикоза // Вестник Омского университета. 2014. №4. С. 57-64; Бондарева И.Б. Математическое моделирование в фармакокинетике и фармакодинамике: дис. д-ра б. наук. М., 2001. 373 с.; Сергиенко В.И., Джеллифф Р., Бондарева И.Б. Прикладная фармакокинетика: основные положения и клиническое применение. М.: Изд-во РАМН, 2003. 208 с.). Блок-схема четырехкамерной модели фармакокинетики 131-йода, которая была использована в заявляемом изобретении, представлена на фиг. 1. Модель включает камеры «Тело», «Щитовидная железа», «Активность 131-йода, выведенная из тела через мочевой пузырь», «Убыль активности 131 -йода в результате радиоактивного распада».
Представленную четырехкамерную модель описывают системой линейных дифференциальных уравнений:
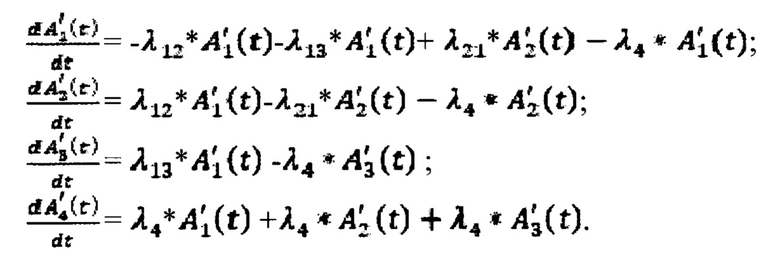
где
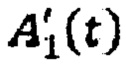 - активность в камере «Тело» в каждый момент времени t;
- активность в камере «Тело» в каждый момент времени t;
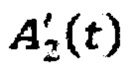 - активность в камере «Щитовидная железа» в каждый момент времени t;
- активность в камере «Щитовидная железа» в каждый момент времени t;
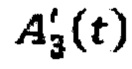 - активность в камере «Активность 131 -йода, выведенная из тела через мочевой пузырь» в каждый момент времени t;
- активность в камере «Активность 131 -йода, выведенная из тела через мочевой пузырь» в каждый момент времени t;
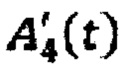 - активность в камере «Убыль активности 131-йода в результате радиоактивного распада» в каждый момент времени t.
- активность в камере «Убыль активности 131-йода в результате радиоактивного распада» в каждый момент времени t.
Обмен 131-йода между камерами описывают постоянные λ12, λ21, λ13, λ4 - захвата 131-йода щитовидной железой, выведения 131-йода щитовидной железой, выведения из тела 131-йода в мочевой пузырь и радиоактвиного распада 131-йода, соответственно.
Общее решение системы дифференциальных уравнений имеет следующий вид:
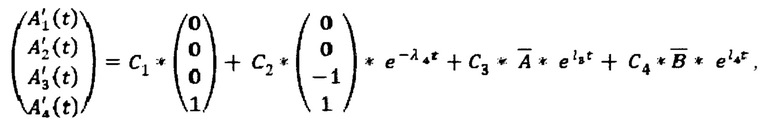
где 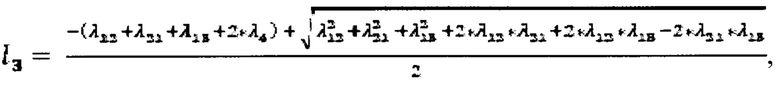
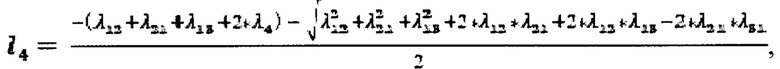
 ненулевые решения однородной системы линейных уравнений:
ненулевые решения однородной системы линейных уравнений:
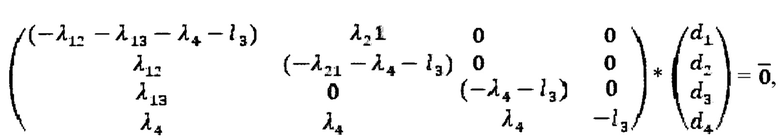
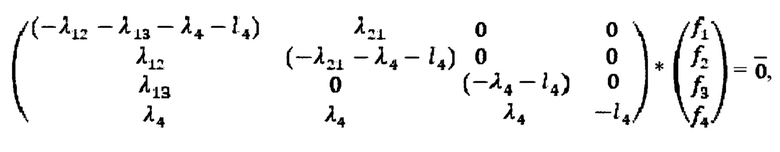
C1, C2, C3, C4 находят при подстановке начальных условий (задача Коши) в общее решение. Начальные условия задают следующим образом:
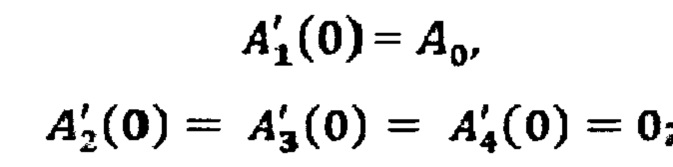
где А0 - введенная пациенту активность.
Далее определяют постоянные обмена λ12, λ21, λ31. Постоянную радиоактивного распада λ4 определяют по табличным данным, которая составляет 0,00361 [1/с]. Для этого в массиве 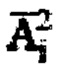 определяют моменты эвакуации мочевого пузыря (резкий отрицательный градиент активности 131-йода в массиве зарегистрированных мощностей гамма-излучения на уровне мочевого пузыря), после чего суммируют значения активностей в найденные моменты времени для формирования массива
определяют моменты эвакуации мочевого пузыря (резкий отрицательный градиент активности 131-йода в массиве зарегистрированных мощностей гамма-излучения на уровне мочевого пузыря), после чего суммируют значения активностей в найденные моменты времени для формирования массива 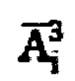 с построением соответствующих кривых (1) и (2) фиг. 2. Массивы данных
с построением соответствующих кривых (1) и (2) фиг. 2. Массивы данных 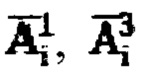 ставят в соответствие
ставят в соответствие 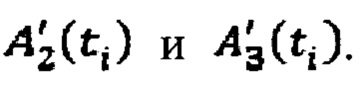 Таким образом, с учетом известных значений активности 131-йода в щитовидной железе
Таким образом, с учетом известных значений активности 131-йода в щитовидной железе 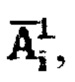 активности 131-йода вышедшей из мочевого пузыря
активности 131-йода вышедшей из мочевого пузыря 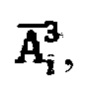 получают системы уравнений
получают системы уравнений 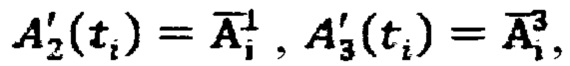 решая которые с использованием всех имеющихся данных в массивах
решая которые с использованием всех имеющихся данных в массивах 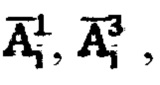 находят значения λ12, λ22, λ13.
находят значения λ12, λ22, λ13.
Подставляя найденные постоянные значения λ12, λ21, λ13 и λ4 в 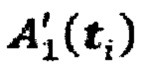 и в
и в 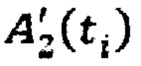 получают массивы данных
получают массивы данных 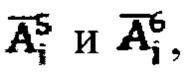 характеризующие сглаженные характеристики поведения йода в камерах «Тело» и «Щитовидная железа», с построением кривых (3) и (4) фиг. 2. Далее формируют массив активности 131-йода в организме пациента
характеризующие сглаженные характеристики поведения йода в камерах «Тело» и «Щитовидная железа», с построением кривых (3) и (4) фиг. 2. Далее формируют массив активности 131-йода в организме пациента 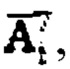 для этого складывают массивы
для этого складывают массивы 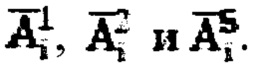 Массив
Массив  также строят на общем графике - кривая (5) фиг. 2.
также строят на общем графике - кривая (5) фиг. 2.
В массиве 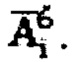 находят максимальное значение активности 131-йода,
находят максимальное значение активности 131-йода, 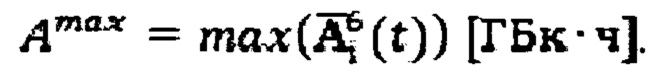 Далее определяют максимальный тироидный захвата 131-йода, с учетом введенной пероральной активности А0, по формуле
Далее определяют максимальный тироидный захвата 131-йода, с учетом введенной пероральной активности А0, по формуле 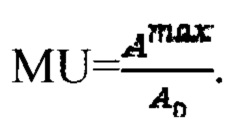 Интегральный захват рассчитывают по формуле
Интегральный захват рассчитывают по формуле 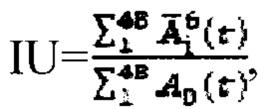 интеграл тироидного захвата 131-йода за период от введения до 48 часов после введения; терапевтическую активность тироидной ткани
интеграл тироидного захвата 131-йода за период от введения до 48 часов после введения; терапевтическую активность тироидной ткани 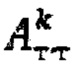 при удельном индексе тироидного захвата 99mTc-пертехнентата менее 0,5%/мл определяют по формуле
при удельном индексе тироидного захвата 99mTc-пертехнентата менее 0,5%/мл определяют по формуле 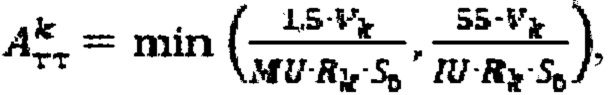 более 0,5%/мл - по формуле
более 0,5%/мл - по формуле 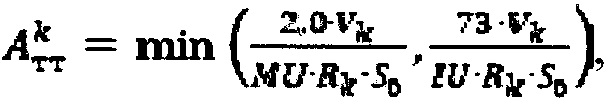 где
где 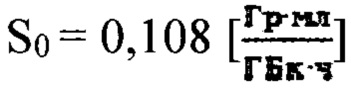 - фактор накопления дозы.
- фактор накопления дозы.
В случае, если k=1 (для тиреотоксического одноузлового зоба), в качестве индивидуальной терапевтической активности 131-йода принимают минимальное значение из 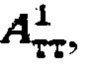 а в случае, если k>1, индивидуальную терапевтическую активность 131-йода определяют по формуле
а в случае, если k>1, индивидуальную терапевтическую активность 131-йода определяют по формуле 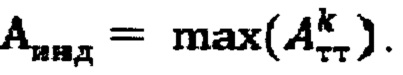
В случае получения значения индивидуальной терапевтической активности 131-йода более 1850 МБк, проведение радиойодтерапии не рекомендуют, предлагают альтернативные методы, например хирургическое удаление.
Далее с учетом полученного значения Аинд, определяют время достижения безопасной активности 131-йода в организме пациента для населения. Для чего определяют постоянную эффективного выведения λэф. Для этого массив  аппроксимируют моно-экспоненциальной функцией
аппроксимируют моно-экспоненциальной функцией 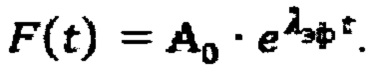 Время достижения безопасной активности 131-йода в организме пациента для населения определяют по формуле
Время достижения безопасной активности 131-йода в организме пациента для населения определяют по формуле 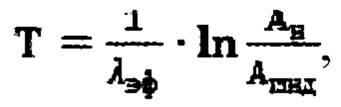 где Ан - нормативной безопасная активности для населения, которая составляет 400 МБк, согласно нормам радиационной безопасности Российской Федерации.
где Ан - нормативной безопасная активности для населения, которая составляет 400 МБк, согласно нормам радиационной безопасности Российской Федерации.
Примеры реализации изобретения
Применение заявляемого способа определения индивидуальной активности 131-йода по сравнению со способом - аналогом продемонстрировало более высокую эффективность проведенной радиойодтерапии. Исследование было проведено на группах пациентов: 76 пациентам (группа 1), в которой диагностированы диффузный токсический зоб - 75%, токсический многоузловой зоб - 20%, токсический одноузловой зоб - 4%, тиреотоксикоз с эктопией тироидной ткани - 1%, индивидуальную активность 131-йода определяли с использованием заявляемого способа с учетом характеристик индивидуальной фармакокинетики, определяемых при применении четырехкамерной модели фармакокинетики 131-йода в организме пациента, 66 пациентам (группа 2), в которой диагностированы диффузный токсический зоб - 72%-, токсический многоузловой зоб - 21%, токсический одноузловой зоб - 6%, тиреотоксикоз с эктопией тироидной ткани - 1%, определяли индивидуальную активность 131-йода с использованием прогностической модели по способу-аналогу. В группе 1 период наблюдения составил 6-32 месяцев (17,2±2,4), объем щитовидной железы варьировался от 9,2 до 86,2 мл (34,2±3,7 мл), захват 99mTc-пертехнетата на 10-15 минуту составил от 1,8 до 33,0% (14,2±1,4%), максимальное поглощение 131-йода составило от 15 до 60% (44,2±1,5%). Предшествующее тиреотоксическое лечение длилось от 3 до 102 месяцев (35,9±3,4). Введенная активность 131-йода, максимальная мощность поглощенной дозы варьировались от 586 до 1256 МБк (877±32 МБк), 0,5 до 2,5 Гр/ ч (1,4±0,1 Гр/ч) соответственно. В группе 2 период наблюдения составил 6-36 месяцев (18,2±2,6), объем щитовидной железы варьировался от 7,2 до 93,2 мл (32,2±2,9 мл), захват 99mTc-пертехнетата на 10-15 минуту составил от 1,8 до 43,0% (16,2±1,7), максимальное поглощение 131-йода составило от 10 до 60% (42,9±1,6%). Предшествующее тиреотоксическое лечение длилось от 6 до 115 месяцев (38,9±3,7). Введенная активность 131-йода, максимальная мощность поглощенной дозы варьировались от 534 до 1396 МБк (896±27 МБк), 0,4 до 2,7 Гр/ ч (1,5±0,1 Гр/ч) соответственно.
В обеих группах проводили ежемесячный контроль уровня ТТГ, свТ3, свТ4 после радиойодтерапии; уровень АТ-рТТГ и УЗИ щитовидной железы - через 3 и 6 месяцев
В результате исследования была подтверждена заявленная эффективность способа, представленного в прототипе, а именно в группе 2 выявлено 7 случаев рецидива, что составляет 10,6±0,7%, и показана эффективность применения способа определения индивидуальной активности с использованием четырехкамерной модели фармакокинетики, а именно в группе 1 выявлено 5 случаев рецидива тиреотоксикоза, что соответствует 6,6±1,7% рецидивов.
Применение заявляемого способа прогнозирования времени достижения безопасного уровня 131-йода по сравнению со способом - аналогом продемонстрировало более высокую точность. На этапе радиойодтерапии в аналогичных группах пациентов 1 и 2 проводили верификацию прогнозируемого времени достижения безопасного уровня активности 131-йода в организме. В частности, получена точность предлагаемого способа в группе 1, равная 89,7% в сравнении с 83,2% полученная в группе 2 с применением способа аналога, известного из уровня техники.
Пример №1 Пациент с диагностированным диффузным токсическим зобом, не принимает тиамазол более 3 дней и пропилтиуроцил более 7 дней, поддерживает низкойодную диету, не проходил рентгенологические исследования с введением контраста с содержанием йода, не принимал лекарственные препараты, содержащие йод более двух месяцев. Проведено УЗИ и получены 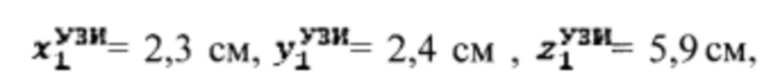
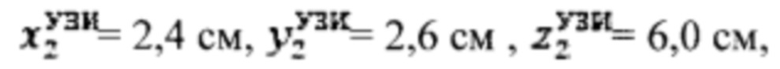 проведена сцинтиграфия щитовидной железы и получены
проведена сцинтиграфия щитовидной железы и получены 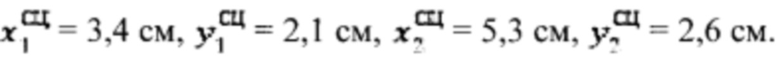 Объемы тироидной ткани составили: V1=10,0 мл, V2=14,8 мл. Удельный индекс тироидного захвата 99мТс-пертерхентата равен 0,64%, распределение по тироидной ткани R1=43%, R2=57%.
Объемы тироидной ткани составили: V1=10,0 мл, V2=14,8 мл. Удельный индекс тироидного захвата 99мТс-пертерхентата равен 0,64%, распределение по тироидной ткани R1=43%, R2=57%.
Пациенту перорально введен подготовленный рабочий раствор дистиллированной воды, объемом 9 мл, содержащий 6.6 МБк 131-йода. По результатам измерения опустошенного флакона имели остаточную активность 0,34 МБк, следовательно, введенная активность А0 составила 6,26 МБк. На уровне щитовидной железы и мочевого пузыря размещена система дозиметров. Пациенту дали выпить 100 мл воды.
Мощность гамма-излучения 131-йода регистрировали в течение 3 дней с помощью системы дозиметров. По итогам обработки данных были найдены постоянные обмена четырехкамерной модели фармакокинетики 131-йода λ12=0,14, λ21=0,05, λ13=0,07, рассчитаны массивы активности 131-йода в организме и щитовидной железе. Построены зависимости активностей в организме, щитовидной железе и мочевом пузыре фиг. 3.
По полученному аппроксимированному массиву данных камеры «Щитовидная железа» были определены максимальная активность 131-йода в щитовидной железе, максимальный и интегральный тироидные захваты 131-йода за период 48 часов после введения 131-йода и рассчитаны терапевтические активности каждого участка тиреоидной ткани. Максимальная активность в щитовидной железе составила 2980 кБк; максимальный индекс тироидного захвата - 48%, интегральный захват - 1738%. Расчетные активности 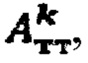 при условии превышения индекса тироидного накопления 131-йода больше 0.5, были равны
при условии превышения индекса тироидного накопления 131-йода больше 0.5, были равны 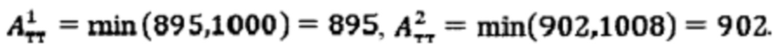
Следовательно, Аинд=max(895,902)=902 МБк.
После аппроксимации массива активностей в организме получена постоянная эффективного выведения 131-йода из организма λэф=0,03. Прогноз времени достижения нормативной безопасной активности в 400 МБк составил 29 часов. Фактическое время достижения нормативной безопасной активности составило 31 час. Ошибка прогноза составила 6,5%, а точность 93,5%.
В результате проведенного лечения пациента при наблюдении в течении 6 месяцев данные за рецидив тиреотоксикоза отсутствовали.
Пример №2 Пациент с диагностированным диффузным токсическим зобом, не принимает тиамазол более 3 дней и пропилтиуроцил более 7 дней, поддерживает низкойодную диету, не проходил рентгенологические исследования с введением контраста с содержанием йода, не принимал лекарственные препараты, содержащие йод более двух месяцев. Проведено УЗИ и получены 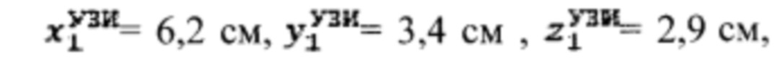
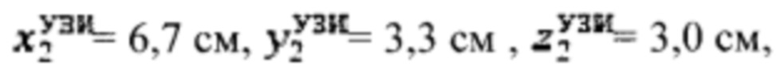 проведена сцинтиграфия щитовидной железы и получены
проведена сцинтиграфия щитовидной железы и получены 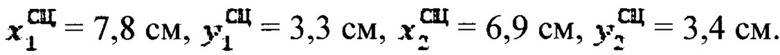 Объемы тироидной ткани равны: V1=29,5 мл, V2=28,8 мл. Удельный индекс тироидного захвата 99мТс-пертерхентата равен 0,16%, распределение по тироидной ткани R1=55%, R2=45%
Объемы тироидной ткани равны: V1=29,5 мл, V2=28,8 мл. Удельный индекс тироидного захвата 99мТс-пертерхентата равен 0,16%, распределение по тироидной ткани R1=55%, R2=45%
Подготовлен рабочий раствор дистиллированной воды, объемом 7 мл, содержащий 10.0 МБк 131-йода. Перорально введен подготовленный рабочий раствор. По результатам измерения опустошенного флакона имеем остаточную активность 0,56 МБк, следовательно введенная активность А0 составила 9,44 МБк. На уровне щитовидной железы и мочевого пузыря размещена система дозиметров. Пациент выпил 100 мл воды.
Система дозиметров регистрировала мощность гамма-излучения 131-йода в течение 2 дней. По итогам обработки данных были найдены постоянные обмена четырехкамерной модели фармакокинетики 131-йода λ12=0,08, λ21=0,03, λ13=0,01, рассчитаны массивы активности 131-йода в организме и щитовидной железе. Построены зависимости активностей в организме, щитовидной железе и мочевом пузыре фиг. 4.
По полученному аппроксимированному массиву данных камеры «Щитовидная железа» были определены максимальная активность 131-йода в щитовидной железе, максимальный и интегральный тироидные захваты 131-йода за период 48 часов после введения 131-йода и рассчитаны терапевтические активности каждого участка тиреоидной ткани. Максимальная активность в щитовидной железе - 5250 кБк; максимальный индекс тироидного захвата - 55%, интегральный захват - 2270%. Расчетные активности 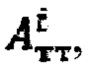 при условии не превышения индекса тироидного накопления 131-йода больше 0.5, были равны
при условии не превышения индекса тироидного накопления 131-йода больше 0.5, были равны 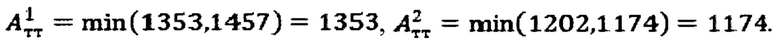
Следовательно, Аинд=max(1353,1174)=1174 МБк.
После аппроксимации массива активностей в организме получена постоянная эффективного выведения 131-йода из организма λэф=0,006. Прогноз времени достижения нормативной безопасной активности в 400 МБк составил 163 часа. Фактическое время достижения нормативной безопасной активности составило 155 часов. Ошибка прогноза составила 4,9%, а точность 95,1%.
В результате проведенного лечения, пациент наблюдения в течении 6 месяцев данные за рецидив тиреотоксикоза отсутствуют.
Пример №3 Пациент с диагностированным диффузным токсическим зобом, не принимает тиамазол более 3 дней, принял пропилтиуроцил за сутки до исследования. В результате чего принято решение не проводить исследование ввиду необоснованного применения 131-йода, которое повлечет к лишнему облучению организма без получения дополнительно, полезной медицинской информации.
Пример №4 Пациент с диагностированным токсическим одноузловым зобом, не принимает тиамазол более 5 дней и пропилтиуроцил более 7 дней, поддерживает низкойодную диету, не проходил рентгенологические исследования с введением контраста с содержанием йода, не принимал лекарственные препараты, содержащие йод более двух месяцев. Проведено УЗИ и получены 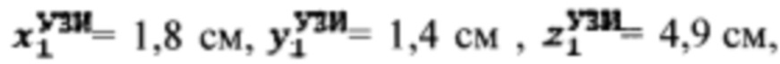
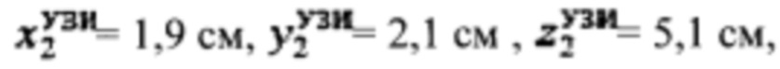 проведена сцинтиграфия щитовидной железы и получены
проведена сцинтиграфия щитовидной железы и получены 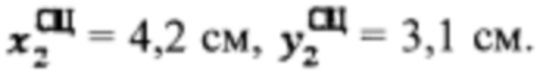 Объемы тироидной ткани равны: V1=5,9 мл, V2=10,2 мл. Удельный индекс тироидного захвата 99мТс-пертерхентата равен 0,05%, распределение по тироидной ткани R1=18%, R2=82%
Объемы тироидной ткани равны: V1=5,9 мл, V2=10,2 мл. Удельный индекс тироидного захвата 99мТс-пертерхентата равен 0,05%, распределение по тироидной ткани R1=18%, R2=82%
Подготовлен рабочий раствор дистиллированной воды, объемом 9 мл, содержащий 9.0 МБк 131-йода. Перорально введен подготовленный рабочий раствор. По результатам измерения опустошенного флакона имеем остаточную активность 0,35 МБк, следовательно введенная активность А0 равна 8,65 МБк. На уровне щитовидной железы и мочевого пузыря размещена система дозиметров. Пациент выпил 100 мл воды.
Система дозиметров регистрировала мощность гамма-излучения 131-йода в течение 3 дней. По итогам обработки данных были найдены постоянные обмена четырехкамерной модели фармакокинетики 131-йода λ12=0,08, λ21=0,03, λ13=0,04 рассчитаны массивы активности 131-йода в организме и щитовидной железе. Построены зависимости активностей в организме, щитовидной железе и мочевом пузыре фиг. 5.
По полученному аппроксимированному массиву данных камеры «Щитовидная железа» были определены максимальная активность 131-йода в щитовидной железе, максимальный и интегральный тироидные захваты 131-йода за период 48 часов после введения 131-йода и рассчитаны терапевтические активности каждого участка тиреоидной ткани. Максимальная активность в щитовидной железе - 1297 кБк; максимальный индекс тироидного захвата - 15%, интегральный захват - 410%. Расчетные активности 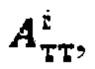 при условии не превышения индекса тироидного накопления 131-йода больше 0.5, были равны
при условии не превышения индекса тироидного накопления 131-йода больше 0.5, были равны 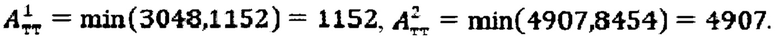
Следовательно, Аинд=max(1152, 4907)=4907 МБк.
В результате полученной расчетной терапевтической активность более 1850 МБк проведенного радиойодтерапии было не рекомендовано. Пациента направили на оперативное удаление. После чего в течении 6 месяцев данные за рецидив тиреотоксикоза отсутствуют.
Пример №5 Пациент с диагностированным токсическим многоузловым зобом на фоне диффузного токсического зоба, не принимает тиамазол более 3 дней и пропилтиуроцил более 7 дней, поддерживает низкойодную диету, не проходил рентгенологические исследования с введением контраста с содержанием йода, не принимал лекарственные препараты, содержащие йод более двух месяцев. Проведено УЗИ и получены 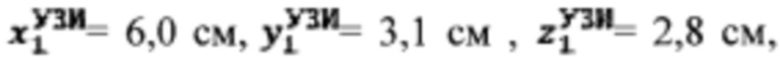
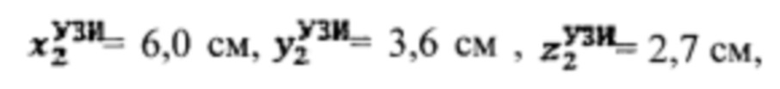 проведена сцинтиграфия щитовидной железы и получены
проведена сцинтиграфия щитовидной железы и получены 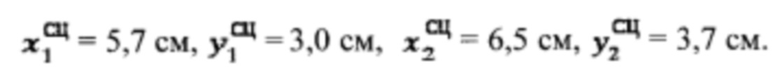 Объемы тироидной ткани равны: V1=20,5 мл, V2=27,4 мл. Удельный индекс тироидного захвата 99мТс-пертерхентата равен 0,5%, распределение по тироидной ткани R1=39%, R2=61%
Объемы тироидной ткани равны: V1=20,5 мл, V2=27,4 мл. Удельный индекс тироидного захвата 99мТс-пертерхентата равен 0,5%, распределение по тироидной ткани R1=39%, R2=61%
Подготовлен рабочий раствор дистиллированной воды, объемом 8 мл, содержащий 8.2 МБк 131-йода. Перорально введен подготовленный рабочий раствор. По результатам измерения опустошенного флакона имеем остаточную активность 0,4 МБк, следовательно введенная активность А0 равна 7,8 МБк. На уровне щитовидной железы и мочевого пузыря размещена система дозиметров. Пациент выпил 100 мл воды.
Система дозиметров регистрировала мощность гамма-излучения 131-йода в течение 3 дней. По итогам обработки данных были найдены постоянные обмена четырехкамерной модели фармакокинетики 131-йода λ12=0,08, λ21=0,02, λ13=0,04 - рассчитаны массивы активности 131-йода в организме и щитовидной железе. Построены зависимости активностей в организме, щитовидной железе и мочевом пузыре фиг. 6.
По полученному аппроксимированному массиву данных камеры «Щитовидная железа» были определены максимальная активность 131-йода в щитовидной железе, максимальный и интегральный тироидные захваты 131-йода за период 48 часов после введения 131-йода и рассчитаны терапевтические активности каждого участка тиреоидной ткани. Максимальная активность в щитовидной железе - 3920 кБк; максимальный индекс тироидного захвата - 50%, интегральный захват - 2040%. Расчетные активности 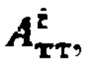 при условии не превышения индекса тироидного накопления 131-йода больше 0.5, были равны
при условии не превышения индекса тироидного накопления 131-йода больше 0.5, были равны 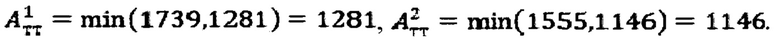
Следовательно, Аинд=max(1281,114-6)=1281 МБк.
После аппроксимации массива активностей в организме получена постоянная эффективного выведения 131-йода из организма λэф=0,006. Прогноз времени достижения нормативной безопасной активности в 400 МБк составило 189 часов. Фактическое время достижения нормативной безопасной активности составило 181 час. Ошибка прогноза составила 4,2%, а точность 95,8%.
В результате проведенного лечения, пациент наблюдения в течении 6 месяцев данные за рецидив тиреотоксикоза отсутствуют.
Пример №6 Пациент с диагностированным тиреотоксикозом, вызванным эктопией щитовидной железы, не принимает тиамазол более 2 дней и пропилтиуроцил более 7 дней, поддерживает низкойодную диету, не проходил рентгенологические исследования с введением контраста с содержанием йода, не принимал лекарственные препараты, содержащие йод более двух месяцев. Проведена сцинтиграфия щитовидной железы и получены 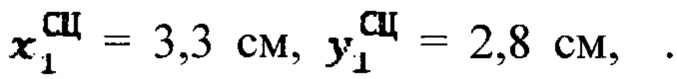 Объемы тироидной ткани равны: V1=7,9 мл. Удельный индекс тироидного захвата 99мТс-пертерхентата равен 0,15%, распределение по тироидной ткани R1=100%.
Объемы тироидной ткани равны: V1=7,9 мл. Удельный индекс тироидного захвата 99мТс-пертерхентата равен 0,15%, распределение по тироидной ткани R1=100%.
Подготовлен рабочий раствор дистиллированной воды, объемом 7 мл, содержащий 6.5 МБк 131-йода. Перорально введен подготовленный рабочий раствор. По результатам измерения опустошенного флакона имеем остаточную активность 0,28 МБк, следовательно введенная активность А0 равна 6,22 МБк. На уровне щитовидной железы и мочевого пузыря размещена система дозиметров. Пациент выпил 100 мл воды.
Система дозиметров регистрировала мощность гамма-излучения в течение 4 дней. По результатам очистки массива данных зарегистрированных мощностей гамма-излучения от артефактов измерения с последующим усреднением очищенных данных в течение каждого часа получен вектор активности в щитовидной железе, по которому получены значения максимального и интегрального тироидного захвата 131-йода, которые составили 32% и 1038% соответственно. Расчетные активности  при условии не превышения индекса тироидного накопления 131-йода больше 0.5, были равны
при условии не превышения индекса тироидного накопления 131-йода больше 0.5, были равны 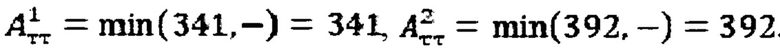
Следовательно, Аинд=max(341,392)=392 МБк.
По итогам обработки данных были найдены постоянные обмена четырехкамерной модели фармакокинетики 131-йода λ12=0,05, λ21=0,07, λ13=0,03 рассчитаны массивы активности 131-йода в организме и щитовидной железе. Построены зависимости активностей в организме, щитовидной железе и мочевом пузыре фиг. 7.
По полученному аппроксимированному массиву данных камеры «Щитовидная железа» были определены максимальная активность 131-йода в щитовидной железе, максимальный и интегральный тироидные захваты 131-йода за период 48 часов после введения 131-йода и рассчитаны терапевтические активности каждого участка тиреоидной ткани. Максимальная активность в щитовидной железе - 1574 кБк; максимальный индекс тироидного захвата - 25%, интегральный захват - 952%. Расчетные активности 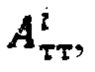 при условии не превышения индекса тироидного накопления 131-йода больше 0.5, были равны
при условии не превышения индекса тироидного накопления 131-йода больше 0.5, были равны 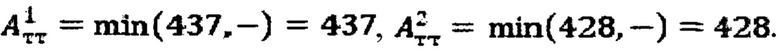
Следовательно, Аинд=max(437,428)=437 МБк.
После аппроксимации массива активностей в организме получена постоянная эффективного выведения 131-йода из организма λэф=0,026. Прогноз времени достижения нормативной безопасной активности в 400 МБк составило 4 часа. Фактическое время достижения нормативной безопасной активности составило 4 часа 15 минут. Ошибка прогноза составила 6,3%, а точность 93,7%.
В настоящем примере показаны два способа определения индивидуальной активности 131-йода. Второй способ имеет преимущество в сравнении с первым, т.к. примененный алгоритм обработки данных с аппроксимацией данных массива активности в щитовидной железе снижает влияние случайных событий, что мы видим на примере повышенного индекса тироидного захвата 131-йода 32% в сравнении с 25%. Это в свою очередь сказывается на снижении индивидуальной терапевтической активности, которая повышает риск возникновения рецидива тирекотоксикоза после проведения радиойодтерапии.
Принято решение назначить индивидуальную активность 131-йода, равную 428 МБк.
В результате проведенного лечения, пациент наблюдения в течении 6 месяцев данные за рецидив тиреотоксикоза отсутствуют.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ ИНДИВИДУАЛЬНОЙ ДОЗЫ РАДИОАКТИВНОГО ЙОДА-131 ПРИ ЛЕЧЕНИИ БОЛЬНЫХ ДИФФУЗНЫМ ТОКСИЧЕСКИМ ЗОБОМ | 2009 |
|
RU2417736C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ИНТЕНСИВНОСТИ НАКОПЛЕНИЯ РАДИОФАРМАЦЕВТИЧЕСКОГО ЛЕКАРСТВЕННОГО ПРЕПАРАТА (РФЛП) В ОБЛАСТЯХ, СООТВЕТСТВУЮЩИХ СЛЕЗООТВОДЯЩИМ ПУТЯМ, ДЛЯ ПРОГНОЗИРОВАНИЯ РИСКА ВОЗНИКНОВЕНИЯ ВТОРИЧНОЙ ОБЛИТЕРАЦИИ СЛЕЗООТВОДЯЩИХ ПУТЕЙ У ПАЦИЕНТОВ ПОСЛЕ ПРОВЕДЕНИЯ РАДИОЙОДТЕРАПИИ | 2023 |
|
RU2834165C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА ВОЗНИКНОВЕНИЯ ВТОРИЧНОЙ ОБЛИТЕРАЦИИ СЛЕЗООТВОДЯЩИХ ПУТЕЙ У ПАЦИЕНТОВ ПОСЛЕ ПРОВЕДЕНИЯ РАДИОЙОДТЕРАПИИ | 2023 |
|
RU2833127C1 |
| СПОСОБ ОБРАБОТКИ СЦИНТИГРАФИЧЕСКИХ ИЗОБРАЖЕНИЙ ГОЛОВЫ И ШЕИ ДЛЯ ПРОГНОЗИРОВАНИЯ РИСКА ВОЗНИКНОВЕНИЯ ВТОРИЧНОЙ ОБЛИТЕРАЦИИ СЛЕЗООТВОДЯЩИХ ПУТЕЙ У ПАЦИЕНТОВ ПОСЛЕ ПРОВЕДЕНИЯ РАДИОЙОДТЕРАПИИ | 2022 |
|
RU2809914C1 |
| Способ диагностики хирургических заболеваний щитовидной железы с использованием динамической двухиндикаторной сцинтиграфии | 2019 |
|
RU2726601C1 |
| СПОСОБ КОНТРОЛЯ ЭФФЕКТИВНОСТИ РАДИОЙОДТЕРАПИИ МЕТАСТАЗОВ РАКА ЩИТОВИДНОЙ ЖЕЛЕЗЫ | 2006 |
|
RU2317115C1 |
| СПОСОБ ОЦЕНКИ РИСКА РЕЦИДИВА ДИФФЕРЕНЦИРОВАННОГО РАКА ЩИТОВИДНОЙ ЖЕЛЕЗЫ ПОСЛЕ ПРОВЕДЕНИЯ РАДИОЙОДТЕРАПИИ | 2020 |
|
RU2743275C1 |
| Способ прогнозирования радиойодтерапии болезни Грейвса | 2022 |
|
RU2791390C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ОБЪЕМА ФУНКЦИОНИРУЮЩЕЙ ТКАНИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ | 2009 |
|
RU2408269C2 |
| СПОСОБ РАННЕЙ ДИАГНОСТИКИ ТЯЖЕСТИ ПОРАЖЕНИЯ ТЕПЛОКРОВНЫХ ЙОДОМ-131 | 1990 |
|
RU2011186C1 |
Группа изобретений относится к медицине, а именно к эндокринологии, радиологии, терапии, и может быть использована для определения индивидуальной активности 131-йода для проведения радиойодтерапии тиреотоксикоза, а также прогнозирования времени достижения безопасного уровня активности 131-йода в организме пациента после введения индивидуальной активности 131-йода. Способ определения индивидуальной активности 131-йода для проведения радиойодтерапии тиреотоксикоза включает определение объема участков (k) тироидной ткани (Vk, [мл]), удельного индекса тироидного захвата 99mTc-пертехнетата (I, [%]), распределения тироидного захвата 99mTc-пертехнетата по участкам ткани щитовидной железы (Rk, [%]), а также определение максимального и интегрального тироидного захвата 131-йода. Пациенту перорально вводят рабочий раствор объемом от 5 до 10 мл с содержанием активности (А0) 131-йода от 5 до 10 МБк. Далее на теле пациента размещают два дозиметра, выполненные с возможностью периодической регистрации мощности гамма-излучения до 2 мЗв/ч и автономной работы до 5 дней: первый - на уровне щитовидной железы, второй - на уровне мочевого пузыря. Регистрируют мощность гамма-излучения 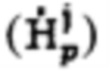 в непрерывном режиме в течение 2-5 суток, где j - номер дозиметра, p - номер зарегистрированного значения через определенный интервал времени из диапазона 2-15 минут, с сохранением зарегистрированных данных в памяти дозиметра. После чего данные значения переводят в значения активности 131-йода с получением массивов данных
в непрерывном режиме в течение 2-5 суток, где j - номер дозиметра, p - номер зарегистрированного значения через определенный интервал времени из диапазона 2-15 минут, с сохранением зарегистрированных данных в памяти дозиметра. После чего данные значения переводят в значения активности 131-йода с получением массивов данных 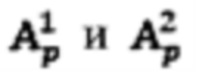 с последующим усреднением данных за каждый час измерений с получением массивов
с последующим усреднением данных за каждый час измерений с получением массивов 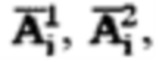 где i - номер часа после введения рабочего раствора. Далее определяют лечебную активность тироидной ткани
где i - номер часа после введения рабочего раствора. Далее определяют лечебную активность тироидной ткани 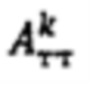 : при удельном индексе тироидного захвата 99mTc-пертехнентата менее 0,5%/мл по формуле
: при удельном индексе тироидного захвата 99mTc-пертехнентата менее 0,5%/мл по формуле 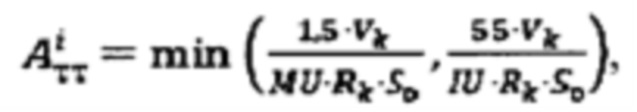 при удельном индексе тироидного захвата 99mTc-пертехнентата более 0,5%/мл - по формуле
при удельном индексе тироидного захвата 99mTc-пертехнентата более 0,5%/мл - по формуле 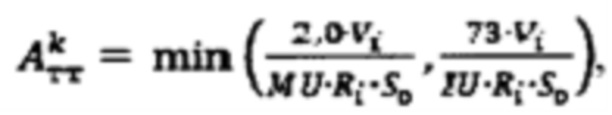 где
где 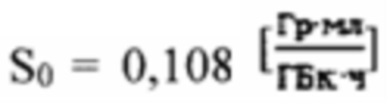 - фактор накопления дозы, и в случае, если k=1, в качестве индивидуальной терапевтической активности 131-йода принимают минимальное значение из
- фактор накопления дозы, и в случае, если k=1, в качестве индивидуальной терапевтической активности 131-йода принимают минимальное значение из  а в случае, если k>1, индивидуальную терапевтическую активность 131-йода определяют по формуле
а в случае, если k>1, индивидуальную терапевтическую активность 131-йода определяют по формуле 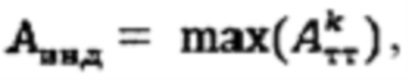 где MU - максимальный тироидный захват 131-йода, а UI - интегральный захват 131-йода, которые определяют по формулам:
где MU - максимальный тироидный захват 131-йода, а UI - интегральный захват 131-йода, которые определяют по формулам: 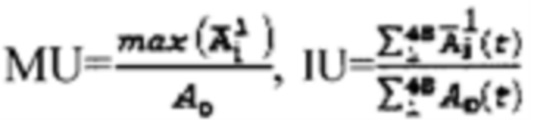 или по формулам:
или по формулам: 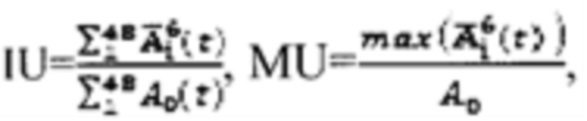 где
где 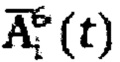 - массив активности в камере «Щитовидная железа»,
- массив активности в камере «Щитовидная железа»,
полученный при обработке зарегистрированных данных массивов 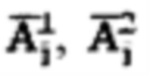 с применением четырехкамерной модели фармакокинетики 131-йода в организме пациента, учитывающей активности в каждый момент времени t в следующих камерах: «Тело», «Щитовидная железа», «Активность 131-йода, выведенная из тела через мочевой пузырь», «Убыль активности 131-йода в результате радиоактивного распада». Прогнозируют время достижения безопасного уровня активности 131-йода (Т) в организме пациента после введения индивидуальной активности 131-йода по формуле:
с применением четырехкамерной модели фармакокинетики 131-йода в организме пациента, учитывающей активности в каждый момент времени t в следующих камерах: «Тело», «Щитовидная железа», «Активность 131-йода, выведенная из тела через мочевой пузырь», «Убыль активности 131-йода в результате радиоактивного распада». Прогнозируют время достижения безопасного уровня активности 131-йода (Т) в организме пациента после введения индивидуальной активности 131-йода по формуле: 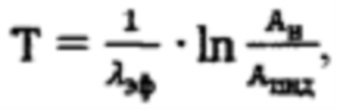
где Ан - нормативная безопасность активности для населения,
λэф. - постоянная эффективного выведения, определяемая аппроксимацией массива активностей в организме пациента 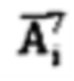 моноэкспоненциальной функцией
моноэкспоненциальной функцией 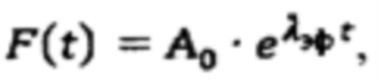 где
где 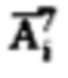 является суммой активностей
является суммой активностей 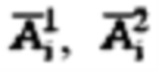 и активности в камере «Тело»
и активности в камере «Тело» 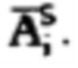 Способ обеспечивает снижение риска возникновения рецидива тиреотоксикоза и повышает точность прогноза времени достижения безопасного уровня активности в организме пациента за счет определения индивидуальной активности 131-йода для проведения радиойодтерапии с учетом индивидуальной фармакокинетики. 2 н. и 4 з.п. ф-лы, 7 ил., 6 пр.
Способ обеспечивает снижение риска возникновения рецидива тиреотоксикоза и повышает точность прогноза времени достижения безопасного уровня активности в организме пациента за счет определения индивидуальной активности 131-йода для проведения радиойодтерапии с учетом индивидуальной фармакокинетики. 2 н. и 4 з.п. ф-лы, 7 ил., 6 пр.
1. Способ определения индивидуальной активности 131-йода для проведения радиойодтерапии тиреотоксикоза, включающий определение:
объема участков (k) тироидной ткани (Vk, [мл]);
удельного индекса тироидного захвата 99mTc-пертехнетата (I, [%]);
распределения тироидного захвата 99mTc-пертехнетата по участкам ткани щитовидной железы (Rk, [%]);
а также определение максимального и интегрального тироидного захвата 131-йода, для чего пациенту перорально вводят рабочий раствор объемом от 5 до 10 мл с содержанием активности (А0) 131-йода от 5 до 10 МБк, далее на теле пациента размещают два дозиметра, выполненные с возможностью периодической регистрации мощности гамма-излучения до 2 мЗв/ч и автономной работы до 5 дней: первый - на уровне щитовидной железы, второй - на уровне мочевого пузыря, и регистрируют мощность гамма-излучения 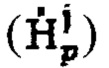 в непрерывном режиме в течение 2-5 суток, где j - номер дозиметра, p - номер зарегистрированного значения через определенный интервал времени из диапазона 2-15 минут, с сохранением зарегистрированных данных в памяти дозиметра, после чего данные значения переводят в значения активности 131-йода с получением массивов данных
в непрерывном режиме в течение 2-5 суток, где j - номер дозиметра, p - номер зарегистрированного значения через определенный интервал времени из диапазона 2-15 минут, с сохранением зарегистрированных данных в памяти дозиметра, после чего данные значения переводят в значения активности 131-йода с получением массивов данных 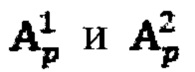 с последующим усреднением данных за каждый час измерений с получением массивов
с последующим усреднением данных за каждый час измерений с получением массивов 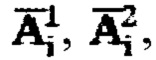 где i - номер часа после введения рабочего раствора, далее определяют лечебную активность тироидной ткани
где i - номер часа после введения рабочего раствора, далее определяют лечебную активность тироидной ткани 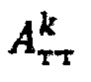 при удельном индексе тироидного захвата 99mTc-пертехнентата менее 0,5%/мл по формуле
при удельном индексе тироидного захвата 99mTc-пертехнентата менее 0,5%/мл по формуле 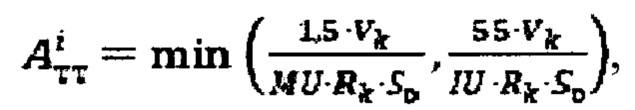 при удельном индексе тироидного захвата 99mTc-пертехнентата более 0,5%/мл - по формуле
при удельном индексе тироидного захвата 99mTc-пертехнентата более 0,5%/мл - по формуле 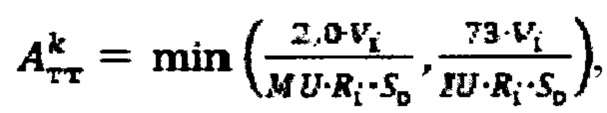 где
где 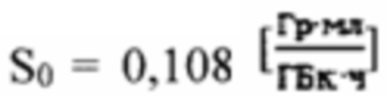 - фактор накопления дозы, и в случае, если k=1, в качестве индивидуальной терапевтической активности 131-йода принимают минимальное значение из
- фактор накопления дозы, и в случае, если k=1, в качестве индивидуальной терапевтической активности 131-йода принимают минимальное значение из  а в случае, если k>1, индивидуальную терапевтическую активность 131-йода определяют по формуле
а в случае, если k>1, индивидуальную терапевтическую активность 131-йода определяют по формуле 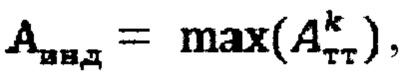 где MU - максимальный тироидный захват 131-йода, а UI - интегральный захват 131-йода, которые определяют по формулам:
где MU - максимальный тироидный захват 131-йода, а UI - интегральный захват 131-йода, которые определяют по формулам: 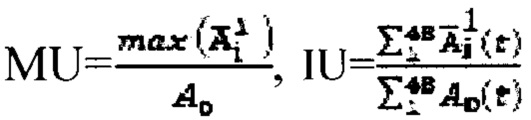 или по формулам:
или по формулам: 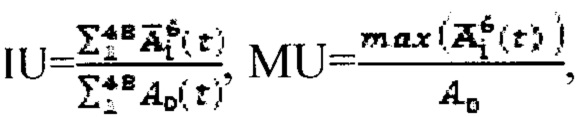 где
где 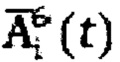 - массив активности в камере «Щитовидная железа», полученный при обработке зарегистрированных данных массивов
- массив активности в камере «Щитовидная железа», полученный при обработке зарегистрированных данных массивов  с применением четырехкамерной модели фармакокинетики 131-йода в организме пациента, учитывающей активности в каждый момент времени t в следующих камерах: «Тело», «Щитовидная железа», «Активность 131-йода, выведенная из тела через мочевой пузырь», «Убыль активности 131-йода в результате радиоактивного распада».
с применением четырехкамерной модели фармакокинетики 131-йода в организме пациента, учитывающей активности в каждый момент времени t в следующих камерах: «Тело», «Щитовидная железа», «Активность 131-йода, выведенная из тела через мочевой пузырь», «Убыль активности 131-йода в результате радиоактивного распада».
2. Способ по п. 1, характеризующийся тем, что для определения объема участков тироидной ткани (k) регистрируют ультразвуковым методом поперечный, продольный, глубинный размеры участков тироидной ткани, а также сцинтиграфическим методом поперечный и продольный размеры участков тироидной ткани, а объем участков тироидной ткани определяют по формуле:
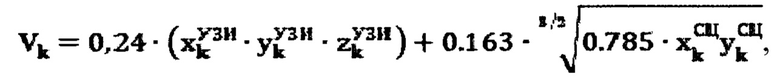
где 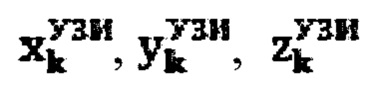 - продольный, поперечный и глубинный размеры тироидной ткани, определенные ультразвуковым методом соответственно,
- продольный, поперечный и глубинный размеры тироидной ткани, определенные ультразвуковым методом соответственно,
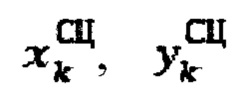 - продольный и поперечный размеры тироидной ткани, определенные сцинтиграфическим методом соответственно.
- продольный и поперечный размеры тироидной ткани, определенные сцинтиграфическим методом соответственно.
3. Способ по п. 1, характеризующийся тем, что для определения объема участков тироидной ткани (k) при тиреотоксикозе, вызванном эктопией щитовидной железы, объем участков определяют по формуле:
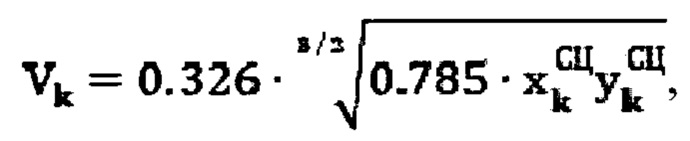
где 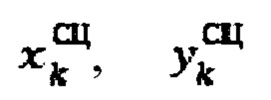 - продольный и поперечный размеры тироидной ткани, определенные сцинтиграфическим методом соответственно
- продольный и поперечный размеры тироидной ткани, определенные сцинтиграфическим методом соответственно
4. Способ по п. 1, характеризующийся тем, что удельный индекс тироидного захвата 99mTc-пертехнетата I [%] определяют сцинтиграфическим методом с использованием гамма-камеры, при этом берут отношение накопленной активности 99mTc-пертехнетата в ЩЖ на 10-15 мин после введения с поправкой, учитывающей распад 99mTc на момент проведения исследования, к введенной диагностической активности 99mTc-пертехнетата и к полученному ранее объему тироидной ткани.
5. Способ по п. 1, характеризующийся тем, что измеренные мощности гамма-излучения переводят в значения активности 131-йода по формуле 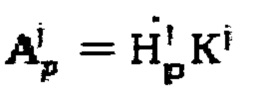 с использованием калибровочных коэффициентов K1 и K2.
с использованием калибровочных коэффициентов K1 и K2.
6. Способ прогнозирования времени достижения безопасного уровня активности 131-йода (Т) в организме пациента после введения индивидуальной активности 131-йода, полученной по п. 1, с последующим определением Т по формуле:
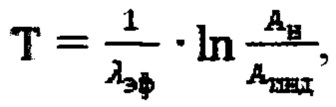
где Ан - нормативная безопасность активности для населения,
λэф. - постоянная эффективного выведения, определяемая аппроксимацией массива активностей в организме пациента 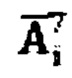 моно-экспоненциальной функцией
моно-экспоненциальной функцией 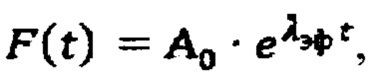 где
где 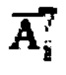 является суммой активностей
является суммой активностей 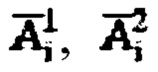 и активности в камере «Тело»
и активности в камере «Тело» 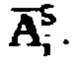
| СПОСОБ ОПРЕДЕЛЕНИЯ ИНДИВИДУАЛЬНОЙ ДОЗЫ РАДИОАКТИВНОГО ЙОДА-131 ПРИ ЛЕЧЕНИИ БОЛЬНЫХ ДИФФУЗНЫМ ТОКСИЧЕСКИМ ЗОБОМ | 2009 |
|
RU2417736C1 |
| DE 69921650 D1, 09.12.2004 | |||
| САМСОНОВ В | |||
| Н | |||
| и др | |||
| Индивидуализация медикаментозных назначений средствами математического моделирования фармакокинетических процессов | |||
| Академический вестник | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| RUMIANTSEV P | |||
| et al | |||
| Estimated Inpatient Hospital Stay in Individual Wards: Guidelines on Radiation | |||
Авторы
Даты
2020-06-01—Публикация
2019-12-31—Подача