Предлагаемый способ относится к медицине, а именно к эндокринологии, радиологии, терапии, и предназначен для определения индивидуальной дозы радиоактивного йода-131 (131I) при лечении больных диффузным токсическим зобом (ДТЗ).
Одним из наиболее эффективных методов лечения больных диффузным токсическим зобом является радиойодтерапия, поэтому особое внимание должно уделяться ее дозиметрическому планированию.
В настоящее время при радиойодтерапии больных ДТЗ нашел применение способ, основанный на введении стандартной (одинаковой для всех пациентов) дозы 131I.
Данный способ экономичен по материальным и временным затратам, однако вопрос по поводу оптимальной дозы все еще открыт: обычно применяют дозы в диапазоне 185-555 МБк. В отдельных случаях большого объема щитовидной железы (ЩЖ) или низкого захвата препарата через 24 часа дозу, как правило, эвристически увеличивают.
К недостаткам способа следует отнести игнорирование всех индивидуальных клинических и лабораторных показателей больного, оказывающих существенное влияние на исход терапии. Назначение низких фиксированных доз (185 МБк) ведет к высокой частоте случаев рецидива (до 40%), в то же время повышение дозы до 555 МБк уменьшает число рецидивов в среднем до 19% [1].
В то же время, наряду с введением стандартной дозы 131I, известны способы определения индивидуальной дозы радиоактивного йода-131 (131I) при лечении больных диффузным токсическим зобом, учитывающие массу ЩЖ (удельная доза) и/или захват радиоактивного йода ЩЖ через 24 часа.
Одним из таких способов является способ определения индивидуальной дозы 131I для лечения больных ДТЗ путем расчета ее по формуле:
величина индивидуальной дозы 131I=296 МБк · 100 / захват 131I щитовидной железой через 24 часа.
При этом данный способ учитывает только один показатель организма больного, а именно: захват 131I щитовидной железой через 24 часа.
Число рецидивов у больных, получивших индивидуальную дозу, определенную данным способом, в годовой период составляет до 14% [2].
Наиболее близким по совокупности существенных признаков, выбранным авторами в качестве прототипа является известный способ определения индивидуальной дозы радиоактивного 131I при лечении больных диффузным токсическим зобом, который включает учет двух клинических показателей больного: массы его щитовидной железы и захвата щитовидной железой 131I через 24 часа, с последующим определением индивидуальной дозы по формуле:
величина индивидуальной дозы 131I=Z·МЩЖ·100/захват 131I через 24 часа (%),
где
Z - значение удельной дозы, обычно выбираемое в диапазоне 3.7-7.4 МБк;
МЩЖ - масса щитовидной железы [1].
Несмотря на то что при определении дозы учитываются такие клинические показатели, как масса ЩЖ и захват ЩЖ 131I через 24 часа, которые предположительно оказывают наиболее существенное влияние на исход радиойодтерапии больных ДТЗ, определение дозы данным способом приводит к рецидивам у больных в среднем не менее чем в 10-15% случаев [1].
Авторами предлагаемого изобретения в клинике был воспроизведен данный способ определения дозы 131I для 52 больных ДТЗ. Полученные результаты показали, что частота гипертиреоза в данной группе больных после лечения оставалась высокой на протяжении года и составляла 30-45% случаев, что в 3-4 раза превышает указанные в источнике данные о рецидивах.
Задачей настоящего изобретения является разработка способа определения индивидуальной дозы радиоактивного йода (131I) при лечении больных ДТЗ, обладающего высокой точностью.
Предлагаемая задача решается предлагаемым способом определения индивидуальной дозы радиоактивного йода-131 при лечении больных диффузным токсическим зобом, включающим проведение клинического обследования пациента с определением его показателей, отобранных на основе имеющейся базы клинических данных, оказывающих существенное влияние на исход лечения (положительный или отрицательный) и обеспечивающих наибольшую точность прогноза исхода лечения, таких как: процент захвата тестовой дозы йода-131 через 4 часа, процент захвата тестовой дозы йода-131 через 24 часа, объем щитовидной железы по данным ультразвукового исследования, свободный тироксин крови (пмоль/л), длительность заболевания, пол больного, длительность отмены тиреостатика перед приемом лечебной дозы радиоактивного йода-131, возраст пациента при первом проявлении данной болезни, наличие резекции щитовидной железы в анамнезе, доза мерказолила (тирозола) накануне отмены препарата, последующее определение верхней и нижней границы диапазона рекомендуемой индивидуальной дозы радиоактивного йода (131I) для данного пациента на основе определенных значений указанных показателей больного, при этом определение нижней границы диапазона осуществляют в результате решения задачи прогнозирования дозы для случаев отрицательных результатов лечения, верхней - для случаев положительных результатов, оценку достоверности положительного или отрицательного исхода лечения в зависимости от назначаемой больному дозы на основании решения задачи классификации, в которой базу клинических данных по назначенным дозам добавляют в состав входных данных, результат лечения используют как выходной параметр, а оценку достоверности представляют в виде диапазона чисел от 0 до 1, при этом нулевое значение диапазона интерпретируют как отрицательный исход, единичное значение - как положительный, затем уточняют рассчитанный диапазон рекомендуемых доз путем перебора доз в окрестностях границ с заданным шагом для поиска дозы, обеспечивающей уверенность в успехе терапии 0.5 для левой границы и 0.9 для правой границы, в результате в качестве рекомендуемой дозы выбирают дозу, соответствующую правой границе уточненного диапазона рекомендуемых доз.
Новым техническим результатом предлагаемого способа является повышение точности определения индивидуальной дозы при лечении больных ДТЗ, что позволяет снизить количество рецидивов при лечении до 9-10%.
Данный результат обусловлен проведением обследования большего количества больных и на основании этого исследования получением дополнительных клинических и лабораторных показателей больных, оказывающих влияние на исход терапии, определением наиболее значимых из всех полученных показателей и расчетом индивидуальной дозы больного с применением точного математического аппарата.
Предлагаемый способ включает проведение обследования большего количества больных и на основании этого исследования получение клинических и лабораторных показателей больного, оказывающих влияние на исход терапии, определение наиболее значимых из них и применение значений клинических и лабораторных показателей больного для расчета индивидуальной дозы с использованием точного математического аппарата, который базируется на использовании полученной базы клинических данных, включающей 373 пациента с заболеванием ДТЗ (болезнью Грейвса). Средний возраст 48 лет (39; 56), длительность заболевания - 5 лет (3; 9), объем щитовидной железы - 27 мл (19,1; 41,0), минимальный объем щитовидной железы - 3,6 мл, максимальный - 185,5 мл. Лечебная доза йода-131 назначалась эмпирически и составила 350 МБк (250; 480), минимальная - 72 МБк, максимальная - 1180 МБк. Через 1 месяц после начала лечения гипотиреоз наблюдался у 64 пациентов, эутиреоз - у 194, гипертиреоз - у 115. Гипотиреоз и эутиреоз оценивались как положительный результат лечения, гипертиреоз - как отсутствие ожидаемого результата.
Математический аппарат, используемый для расчета индивидуальной дозы в предлагаемом способе, включает решение комбинации задач классификации и прогнозирования:
- задача прогнозирования ставится следующим образом: на основе множества известных значений набора показателей больных, представленного в виде таблицы, и известного исхода терапии построить функцию (алгоритм) оценки рекомендуемой для пациента дозы по значениям набора показателей больного и исхода терапии;
- задача классификации ставится аналогичным образом с той разницей, что значения исхода терапии разбиваются на заданное множество классов из двух элементов (положительный и отрицательный), и заключается в построении функции (алгоритма) оценки исхода терапии для больного и ее достоверности.
Одним из наиболее эффективных методов решения задач прогнозирования и классификации является построение гибридных систем искусственного интеллекта (ИИ). Построение таких систем включает в себя два основных шага:
1) Идентификация структуры и параметров системы.
2) Параметрическая оптимизация системы.
Идентификация структуры системы выполняется путем кластеризации имеющихся входных данных и включает: выделение лингвистических переменных (по количеству входных параметров задачи), определения их значений (термов) и генерацией нечетких продукционных правил системы нечеткого логического вывода Такаги-Сугено-Канга 0-порядка (TSK0) вида:
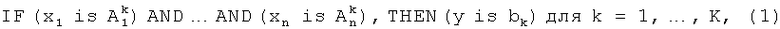
где К - количество нечетких правил, 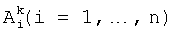 - значения входных лингвистических переменных xi, bk - значения выходного параметра у. Нечеткие продукционные правила формируются с помощью алгоритма сферической кластеризации входных данных на основе модифицированной схемы конкурентного обучения. При этом каждому сформированному кластеру соответствует ровно одно правило.
- значения входных лингвистических переменных xi, bk - значения выходного параметра у. Нечеткие продукционные правила формируются с помощью алгоритма сферической кластеризации входных данных на основе модифицированной схемы конкурентного обучения. При этом каждому сформированному кластеру соответствует ровно одно правило.
Параметрическая идентификация системы состоит в определении параметров cik и a ik гауссовых функций принадлежности значений лингвистических переменных:
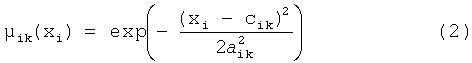
и параметров bk:
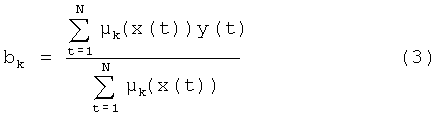
Функции принадлежности определяют степень достоверности утверждения 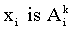 в условиях продукционных правил, a x(t) и y(t) - значения входных и выходного параметра задачи.
в условиях продукционных правил, a x(t) и y(t) - значения входных и выходного параметра задачи.
Схема работы структурированной и параметризованной системы состоит из выполнения шага фаззификации и шага нечеткого продукционного вывода.
На шаге фаззификации вычисляется степень уверенности в условии каждого правила вывода системы. Для определения логической связки AND в правилах используется оператор произведения (оператор Ларсена):
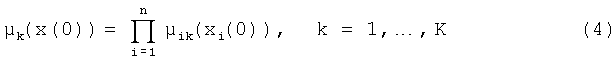
На шаге вывода в соответствии с общей схемой вывода систем типа TSK0 для заданных значений входного вектора х(0) значение выходной переменной y(0) вычисляется по формуле:
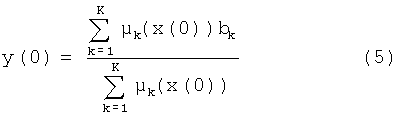
В случае решения задачи классификации формируется совокупность таких систем, выходная переменная каждой из которой отождествляется с отдельным классом задачи, а значения bk задают степень уверенности в принадлежности элемента этому классу.
Параметрическая оптимизация системы состоит в уточнении значений параметров функций принадлежности (2) и параметров bk, составляющих вектор параметров w в пространстве параметров W, путем решения оптимизационной задачи, суть которой сводится к минимизации функционала эмпирического риска
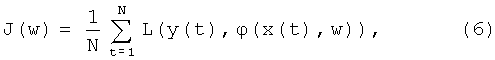
где L(y(t), ϕ(x(t), w))=(y(t)-ϕ(x(t), w))2 - квадратичная функция потерь для конкретного элемента (x(t), y(t)) обучающей выборки DN, функция ϕ:X×W→Y, 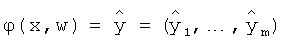 , определенная на пространстве входных переменных X и пространстве параметров W, определяет выход описанной выше системы TSK0 при поступлении на ее вход конкретного элемента x(t) обучающей выборки DN.
, определенная на пространстве входных переменных X и пространстве параметров W, определяет выход описанной выше системы TSK0 при поступлении на ее вход конкретного элемента x(t) обучающей выборки DN.
Для решения этой задачи используется алгоритм оптимизации нечетких систем TSK0, основанный на комбинации иммунного алгоритма и метода роя частиц (Particle Swarm Optimization).
Реализацию предлагаемого способа осуществляют следующим образом.
Первоначально проводят обследование большего количества больных и на основании этого исследования получают набор наиболее значимых клинических и лабораторных показателей больного, оказывающих влияние на исход терапии (положительный или отрицательный). Затем решают задачу прогнозирования значения дозы отдельно для каждого показателя, оценивают точность полученного прогноза и выбирают показатели, обеспечивающие наиболее высокую точность прогноза. На основе полученных результатов решения задачи прогнозирования формируют базу клинических данных для выбранных показателей, которая используется в качестве входных данных для решения дальнейших задач прогнозирования и классификации (см. таблицу). Далее выполняют грубую оценку верхней и нижней границ диапазона рекомендуемых доз 131I в зависимости от значений выбранных на первом этапе клинических и лабораторных показателей больного, полученных в результате его обследования. Для этого сформированную на первом этапе таблицу входных данных разбивают на две части, первая из которых соответствует положительным исходам лечения, а вторая - отрицательным. Прогнозирование дозы осуществляют для обеих частей, при этом результат прогнозирования дозы для отрицательных исходов составляет нижнюю оценку диапазона доз, а для положительных исходов - верхнюю. После чего формируют оценку достоверности положительного или отрицательного исхода лечения в зависимости от назначаемой пациенту дозы. Для этого решают задачу классификации, в которой база клинических данных по назначенным дозам добавляется в состав входных данных, а исход терапии используется как выходной параметр. Результатом этапа является классифицирующая система, которая для каждого пациента и любой заданной дозы предоставляет оценку исхода терапии и значение уверенности в нем в виде числа, лежащего в диапазоне от 0 до 1. При этом нулевое значение интерпретируют как точно отрицательный исход, а единичное значение - как точно положительный исход, значение 0.5 - как «50 на 50».
Для уточнения рассчитанного на втором этапе диапазона рекомендуемых доз путем перебора доз в окрестностях грубых границ с заданным шагом 10 МБк для поиска минимальной дозы, обеспечивающей уверенность в успехе терапии больше 0.5 для левой границы и 0.9 для правой границы, значения уверенностей в исходе терапии для тестируемой дозы определяют с помощью классифицирующей системы, построенной на третьем этапе. В качестве рекомендуемой индивидуальной дозы 131I выбирают дозу, соответствующую правой границе уточненного диапазона рекомендуемых доз.
Кроме того, построенная классифицирующая система для оценки достоверности положительного или отрицательного исхода лечения в зависимости от назначаемой пациенту дозы позволяет путем перебора доз всего допустимого диапазона построить кривую эффективности назначаемых индивидуальных доз для пациента, т.е. зависимость исхода терапии в виде уверенности в ее положительном исходе в диапазоне (0, 1) от назначаемой дозы 131I.
В качестве примера применения расчета индивидуальных доз 131I рассмотрен трехмесячный период прогнозирования. В данном случае имеющаяся база данных статистики содержала 294 записи о пролеченных пациентах. В следующей таблице приведены результаты автоматического определения условных коэффициентов относительной значимости факторов (входных переменных) на исход терапии и подбора оптимального их набора до начала первого этапа расчета индивидуальных доз.
ей гибридной системы
Значения рассчитанных коэффициентов влияния подтверждают, что наибольшее влияние на исход терапии оказывают такие показатели, как величина назначаемой дозы радиоактивного йода-131, а также захват радиоактивного йода-131 щитовидной железой через 24 часа и объем щитовидной железы. Вместе с тем, результаты показывают, что дополнительный учет влияния таких показателей больного, как свободный тироксин крови, длительность заболевания ДТЗ, пол больного, длительность отмены тиреостатика перед приемом лечебной дозы йода-131, возраст пациента при первом проявлении болезни ДТЗ (в годах), процент захвата тестовой дозы йода-131 через 4 часа, наличие резекции щитовидной железы в анамнезе, позволяет повысить точность работы классифицирующей гибридной системы с 79 до 91% и тем самым определяет рекомендуемый для использования при расчете индивидуальной дозы набор показателей. Кроме того, в процессе подбора оптимального набора показателей были автоматически исключены из рассмотрения такие показатели, как возраст и процент захвата тестовой дозы йода-131 через 2 часа, поскольку рассчитанные коэффициенты корреляции Пирсона для них с показателями дебДТЗ и 2 соответственно оказались больше 0.8 и, с другой стороны, последние показатели имели большее значение коэффициента влияния на исход терапии.
Для оценки параметров диагностической информативности предложенного способа применялся метод перекрестной проверки, на каждой итерации которого использовались непересекающиеся обучающие и тестовые выборки исходной базы данных статистики. Обучающая выборка использовалась для построения гибридных систем в соответствии с предложенным четырехэтапным способом расчета индивидуальных доз, а тестовая - для расчета индивидуальных доз пациентам этой выборки. На каждой итерации рассчитывались параметры точности классифицирующей гибридной системы, поскольку именно она по заданным значениям входных показателей и дозе делает заключение об исходе терапии. Также рассчитывались параметры чувствительности, специфичности и эффективности. Все указанные параметры диагностической информативности усреднялись по итерациям перекрестной проверки и выдавались в качестве результирующих для предложенного способа расчета индивидуальных доз. Были получены следующие усредненные значения: точность - 91%, чувствительность - 90%, специфичность - 81%, эффективность - 85%. Высокое значение точности диагностического метода позволяет рассчитывать на процент случаев рецидивов заболевания не больше 9-10%, что, в свою очередь, позволяет повысить эффективность (уменьшить количество рецидивов) лечения больных ДТЗ радиоактивным йодом по сравнению с используемыми в настоящее время способами расчета индивидуальных доз.
Конкретное применение предлагаемого способа
Предлагаемым способом была определена индивидуальная доза радиоактивного йода-131 для лечения 25 больных ДТЗ. Были получены следующие результаты терапии в трехмесячный срок: количество положительных исходов лечения - 24, количество отрицательных исходов терапии - 1. Таким образом, общий процент рецидивов в трехмесячный срок составил 4%, а точность - 96%.
Пример 1. Больная Б., возраст 52 года. Показатели больной были следующие:
- процент захвата тестовой дозы йода-131 через 4 часа (2): 89%;
- процент захвата тестовой дозы йода-131 через 24 часа (3): 92%;
- объем щитовидной железы (VЩЖ): 23.5 мл;
- свободный тироксин крови (свТ4): 18.03 пмоль/л;
- длительность заболевания ДТЗ (длДТЗ): 12 лет;
- пол больного (пол): женский;
- длительность отмены тиростатика перед приемом дозы йода-131 (отм): 12 дней;
- возраст пациента при первом проявлении ДТЗ (дебДТЗ): 40 лет;
- наличие резекции ЩЖ в анамнезе (О): наличие;
- доза мерказолила накануне отмены препарата (СТ): 15.
Доза 131I для лечения больной, определенная предлагаемым способом, составила 288.2 МБк. У больной наблюдался положительный результат терапии (гипотиреоз) к трехмесячному сроку после лечения.
Пример 2. Больная В., возраст 32 года. Показатели больной были следующие:
- процент захвата тестовой дозы йода-131 через 4 часа (2): 58%;
- процент захвата тестовой дозы йода-131 через 24 часа (3): 74%;
- объем щитовидной железы (VЩЖ): 28 мл;
- свободный тироксин крови (свТ4): 5.15 пмоль/л;
- длительность заболевания ДТЗ (длДТЗ): 9 лет;
- пол больного (пол): женский;
- длительность отмены тиростатика перед приемом дозы йода-131 (отм): 9 дней;
- возраст пациента при первом проявлении ДТЗ (дебДТЗ): 23 года;
- наличие резекции ЩЖ в анамнезе (О): отсутствие;
- доза мерказолила накануне отмены препарата (СТ): 15.
Доза 131I для лечения больной, определенная предлагаемым способом, составила 387.2 МБк. У больной наблюдался положительный результат терапии (гипотиреоз) к трехмесячному сроку после лечения.
Пример 3. Больной Г., возраст 54 года. Показатели больного были следующие:
- процент захвата тестовой дозы йода-131 через 4 часа (2): 49%;
- процент захвата тестовой дозы йода-131 через 24 часа (3): 76%;
- объем щитовидной железы (VЩЖ): 26 мл;
- свободный тироксин крови (свТ4): 29.58 пмоль/л;
- длительность заболевания ДТЗ (длДТЗ): 2 года;
- пол больного (пол): мужской;
- длительность отмены тиростатика перед приемом дозы йода-131 (отм): 6 дней;
- возраст пациента при первом проявлении ДТЗ (дебДТЗ): 52 года;
- наличие резекции ЩЖ в анамнезе (О): отсутствие;
- доза мерказолила накануне отмены препарата (СТ): 20.
Доза 131I для лечения больного, определенная предлагаемым способом, составила 553.0 МБк. У больного наблюдался положительный результат терапии (гипотиреоз) к трехмесячному сроку после лечения.
Как видно из полученных результатов, предлагаемый способ определения индивидуальной дозы радиоактивного йода-131 при лечении больных ДТЗ обладает высокой точностью, что позволяет снизить количество рецидивов при лечении до 9-10%.
ИСТОЧНИКИ ИНФОРМАЦИИ
1. Andrei Iagaru and I. Ross McDougall. Treatment of Thyrotoxicosis. J. Nucl. Med. 2007; 48: 379-389.
2. Alexander E., Larsen P.R. High dose of (131)I therapy for the treatment of hyperthyroidism caused by Graves′ disease. J. Clin Endocrinol Metab. 2002; 87: 1073-1077.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ ИНДИВИДУАЛЬНОЙ АКТИВНОСТИ 131-ЙОДА ДЛЯ ПРОВЕДЕНИЯ РАДИОЙОДТЕРАПИИ ТИРЕОТОКСИКОЗА И ПРОГНОЗИРОВАНИЯ ВРЕМЕНИ ДОСТИЖЕНИЯ БЕЗОПАСНОГО УРОВНЯ АКТИВНОСТИ 131-ЙОДА В ОРГАНИЗМЕ ПАЦИЕНТА ПОСЛЕ ВВЕДЕНИЯ ИНДИВИДУАЛЬНОЙ АКТИВНОСТИ 131-ЙОДА | 2019 |
|
RU2722568C1 |
| Способ прогнозирования радиойодтерапии болезни Грейвса | 2022 |
|
RU2791390C1 |
| Способ дифференциальной диагностики йоддефицитного и йодиндуцированного нарушения функции щитовидной железы у лиц, проживающих в регионах с йодным дефицитом | 2019 |
|
RU2728261C2 |
| Способ персонифицированного подхода к выбору метода лечения болезни Грейвса | 2022 |
|
RU2794815C1 |
| СПОСОБ КОНТРОЛЯ ЭФФЕКТИВНОСТИ РАДИОЙОДТЕРАПИИ МЕТАСТАЗОВ РАКА ЩИТОВИДНОЙ ЖЕЛЕЗЫ | 2006 |
|
RU2317115C1 |
| СПОСОБ СОЧЕТАННОЙ РАДИОНУКЛИДНОЙ ТЕРАПИИ ДИФФЕРЕНЦИРОВАННОГО РАКА ЩИТОВИДНОЙ ЖЕЛЕЗЫ С МЕТАСТАТИЧЕСКИМ ПОРАЖЕНИЕМ ЛЕГКИХ И СКЕЛЕТА | 2023 |
|
RU2824276C2 |
| СПОСОБ ОЦЕНКИ ЭФФЕКТИВНОСТИ ТЕРАПИИ ДИФФУЗНОГО ТОКСИЧЕСКОГО ЗОБА РАДИОАКТИВНЫМ ЙОДОМ | 2008 |
|
RU2373848C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ КЛИНИЧЕСКОГО ТЕЧЕНИЯ ЭНДОКРИННОЙ ОФТАЛЬМОПАТИИ У ПАЦИЕНТОВ С БОЛЕЗНЬЮ ГРЕЙВСА НА ОСНОВЕ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К ТИРЕОПЕРОКСИДАЗЕ | 2011 |
|
RU2460072C1 |
| Способ комплексного лечения диффузного токсического зоба | 2016 |
|
RU2614850C1 |
| СПОСОБ ДИАГНОСТИКИ ГИПЕРФУНКЦИИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ | 1994 |
|
RU2106109C1 |
Изобретение относится к медицине, а именно к эндокринологии, радиологии, терапии. Проводят клиническое обследование пациента. Определяют процент захвата тестовой дозы йода-131 через 4 часа, процент захвата тестовой дозы йода-131 через 24 часа, объем щитовидной железы по данным ультразвукового исследования, свободный тироксин крови (пмоль/л), длительность заболевания, пол больного, длительность отмены тиреостатика перед приемом лечебной дозы радиоактивного йода-131, возраст пациента при первом проявлении данной болезни, наличие резекции щитовидной железы в анамнезе, дозу мерказолила (тирозола) накануне отмены препарата. Далее определяют верхнюю и нижнюю границы диапазона рекомендуемой индивидуальной дозы радиоактивного йода (I131) для данного пациента. При этом определение нижней границы диапазона осуществляют в результате решения задачи прогнозирования дозы для случаев отрицательных результатов лечения, верхней - для случаев положительных результатов. Осуществляют оценку достоверности положительного или отрицательного исхода лечения в зависимости от назначаемой больному дозы на основании решения задачи классификации, в которой базу клинических данных по назначенным дозам добавляют в состав входных данных. Результат лечения используют как выходной параметр, а оценку достоверности представляют в виде диапазона чисел от 0 до 1, нулевое значение диапазона интерпретируют как отрицательный исход, единичное значение - как положительный. Уточняют рассчитанный диапазон рекомендуемых доз путем перебора доз в окрестностях границ с заданным шагом для поиска дозы, обеспечивающей уверенность в успехе терапии 0.5 для левой границы и 0.9 для правой границы. В качестве рекомендуемой дозы выбирают дозу, соответствующую правой границе уточненного диапазона рекомендуемых доз. Способ позволяет повысить точность определения индивидуальной дозы за счет учета большого количества показателей больного, оказывающих влияние на исход терапии. 1 табл.
Способ определения индивидуальной дозы радиоактивного йода-131 при лечении больных диффузным токсическим зобом, включающий проведение клинического обследования пациента с определением показателей больного, отобранных на основе имеющейся базы клинических данных, оказывающих существенное влияние на исход лечения (положительный или отрицательный) и обеспечивающих наибольшую точность прогноза исхода лечения, таких как: процент захвата тестовой дозы йода-131 через 4 ч, процент захвата тестовой дозы йода-131 через 24 ч, объем щитовидной железы по данным ультразвукового исследования, свободный тироксин крови (пмоль/л), длительность заболевания, пол больного, длительность отмены тиреостатика перед приемом лечебной дозы радиоактивного йода-131, возраст пациента при первом проявлении данной болезни, наличие резекции щитовидной железы в анамнезе, доза мерказолила (тирозола) накануне отмены препарата, последующее определение верхней и нижней границы диапазона рекомендуемой индивидуальной дозы радиоактивного йода (I131) для данного пациента на основе определенных значений указанных показателей больного, при этом определение нижней границы диапазона осуществляют в результате решения задачи прогнозирования дозы для случаев отрицательных результатов лечения, верхней - для случаев положительных результатов, оценку достоверности положительного или отрицательного исхода лечения в зависимости от назначаемой больному дозы на основании решения задачи классификации, в которой базу клинических данных по назначенным дозам добавляют в состав входных данных, результат лечения используют как выходной параметр, а оценку достоверности представляют в виде диапазона чисел от 0 до 1, при этом нулевое значение диапазона интерпретируют как отрицательный исход, единичное значение - как положительный, затем уточняют рассчитанный диапазон рекомендуемых доз путем перебора доз в окрестностях границ с заданным шагом для поиска дозы, обеспечивающей уверенность в успехе терапии 0,5 для левой границы и 0,9 для правой границы, в результате в качестве рекомендуемой дозы выбирают дозу, соответствующую правой границе уточненного диапазона рекомендуемых доз.
| IAGARU A | |||
| et all | |||
| Treatment of Thyrotoxicosis | |||
| J | |||
| Nucl | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| СПОСОБ ОЦЕНКИ ЭФФЕКТИВНОСТИ ТЕРАПИИ ДИФФУЗНОГО ТОКСИЧЕСКОГО ЗОБА РАДИОАКТИВНЫМ ЙОДОМ | 2008 |
|
RU2373848C1 |
| СПОСОБ ЛЕЧЕНИЯ ДИФФУЗНОГО ТОКСИЧЕСКОГО ЗОБА | 1997 |
|
RU2146884C1 |
| ФАДЕЕВ В.В | |||
| Йододефицитные и аутоиммунные заболевания щитовидной железы в регионе легкого йодного дефицита (эпидемиология, диагностика, лечение) | |||
| Автореферат диссертации д.м.н | |||
| - М., 2004, 41 с. | |||
Авторы
Даты
2011-05-10—Публикация
2009-10-16—Подача