Изобретение относится к медицине, а именно к неврологии, и может быть использовано для определения реабилитационного потенциала пациента, перенесшего острое нарушение мозгового кровообращения, на момент завершения первого этапа лечения и реабилитации.
Идентификация наиболее информативных нейровизуализационных биомаркеров необходима для более точного прогнозирования функционального исхода острого периода ишемического инсульта (Stinear С.М., 2017). Ключевым методом оценки микроструктурных изменений вещества головного мозга является диффузионно-взвешенная МРТ, анализ данных которой основывается на тензорной модели диффузии. Одним из основных параметров оценки микроструктурных изменений служит фракционная анизотропия ( M.D. и соавт., 2017). Методика диффузионной МРТ нашла широкое применении в прогнозировании восстановления двигательных и когнитивных функций после инсульта (Park С.Н. и соавт., 2013; Song J. и соавт., 2015; Kulesh А. и соавт., 2018), хотя роль трактов интактной гемисферы по-прежнему остается противоречивой, а ее использование без учета макроструктурных и перфузионных характеристик головного мозга представляется недостаточным. Гипотеза исследования заключалась в том, что создание диффузионно-перфузионной модели, основанной на оценке фракционной анизотропии в комплексе с данными о скорости мозгового кровотока и влиянии очага, позволит прогнозировать неврологический статус пациентов к концу острого периода ишемического инсульта.
M.D. и соавт., 2017). Методика диффузионной МРТ нашла широкое применении в прогнозировании восстановления двигательных и когнитивных функций после инсульта (Park С.Н. и соавт., 2013; Song J. и соавт., 2015; Kulesh А. и соавт., 2018), хотя роль трактов интактной гемисферы по-прежнему остается противоречивой, а ее использование без учета макроструктурных и перфузионных характеристик головного мозга представляется недостаточным. Гипотеза исследования заключалась в том, что создание диффузионно-перфузионной модели, основанной на оценке фракционной анизотропии в комплексе с данными о скорости мозгового кровотока и влиянии очага, позволит прогнозировать неврологический статус пациентов к концу острого периода ишемического инсульта.
Аналогов способа определения реабилитационного потенциала пациента, перенесшего острое нарушение мозгового кровообращения, на момент завершения первого этапа лечения и реабилитации в доступной литературе нами не обнаружено.
Технический результат, достигаемый изобретением, заключается в объективизации и повышении точности определения реабилитационного потенциала пациента с целью разработки персонифицированной программы реабилитации.
Указанный результат достигается за счет применения комплексной методики, основанной на оценке проведения или не проведения внутривенного тромболизиса, клинических данных по шкале инсульта NIHSS, параметров диффузионно-взвешенной и перфузионной магнитно-резонансной томографии головного мозга с расчетом выраженности неврологического дефицита по формуле.
Способ осуществляется следующим образом: у больного при поступлении в стационар оценивают факт проведения или не проведения внутривенного тромболизиса по данным медицинской карты, выраженность неврологического дефицита по шкале инсульта NIHSS (Т. Brott и соавт., 1989, J. Вiller и соавт., 1990), на 5-10 сутки магнитно-резонансным томографом GE Helthcare Brivo MR 355 (США) проводят мультимодальную магнитно-резонансную томографию головного мозга с оценкой размера очага инфаркта головного мозга, фракционной анизотропии (ФА) цингулярного пучка и скорости мозгового кровотока (СМК) в зоне М2 непораженного полушария. Далее рассчитывают реабилитационный потенциал на момент завершения первого этапа лечения и реабилитации по формуле:
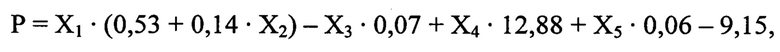 где
где
Р - оценка реабилитационного потенциала пациента на момент завершения первого этапа лечения и реабилитации (баллы),
X1 - результат шкалы NIHSS на момент поступления в стационар (баллы),
Х2 - проведение или не проведение внутривенного тромболизиса (1 или 0),
Х3 - размер очага инфаркта головного мозга (мм),
Х4 - фракционная анизотропия цингулярного пучка непораженного полушария,
Х5 - скорость мозгового кровотока в зоне М2 непораженного полушария по шкале ASPECTS (белое вещество) (мл/ в минуту).
При значении Р от 0 до 4 баллов делают вывод о низком реабилитационном потенциале, 5 и более баллов - о высоком реабилитационном потенциале.
Исследование основывается на результатах, полученных при обследовании 100 пациентов с ишемическим инсультом (ИИ) и 10 лиц группы контроля в возрасте от 42 до 78 лет. Среди включенных в анализ пациентов было 53 мужчины и 47 женщин. Тяжесть инсульта по NIHSS при поступлении составляла от 1 до 26 баллов, достигая в среднем 5,5 (3-8) балла. 30 (30%) пациентам выполнен внутривенный тромболизис. У 18 (18%) пациентов диагностирован атеротромботический, у 19 (19%) - кардиоэмболический, у 14 (14%) - лакунарный и у 49 (49%) - неуточненной этиологии ИИ. Минимальный размер острого инфаркта мозга составил 5 мм, максимальный - 80 мм, средний - 11 (5-24) мм. У 65 (65%) пациентов очаг инфаркта мозга располагался в бассейне средней мозговой артерии, у 13 (13%) - в бассейне задней мозговой артерии и у 22 (22%) - в стволе головного мозга или мозжечке. Всем обследованным проводили МРТ головного мозга. Размер очага инфаркта определяли на DWI по его максимальному диаметру (в мм). С помощью перфузионно-взвешенной последовательности без болюсного введения контрастного препарата (ASL) количественно оценивали СМК в бассейне средней мозговой артерии в 10 зонах мозга в соответствии со шкалой ASPECTS. С целью изучения трактов и вычисления значений фракционной анизотропии была проведена последовательность для получения DTI-изображения с использованием 12 направлений измерения. Полученные данные были обработаны в программе OsiriX v3.6.1 с использованием приложения DTImap для построения карт фракционной анизотропии, приложения ADCmap для вычисления показателей измеряемого коэффициента диффузии, а также программы 3D Sliserv 4.4 для трехмерного построения трактов головного мозга. Оценивали фракционную анизотропию кортикоспинального тракта (КСТ) на уровне задней ножки внутренней капсулы (ЗНВК) и моста, колена внутренней капсулы (КВК), передней ножки внутренней капсулы (ПHBK), поясного (ПП), верхнего продольного (ВПП) и нижнего фронто-окципитального (НФОП) пучков, валика мозолистого тела (ВМТ), очага и зоны в 3 см от него, а также симметричных участков интактного полушария. Неврологический статус оценивали в динамике по шкале инсульта Национального института здоровья (National Institutes of Health Stroke Scale, NIHSS).
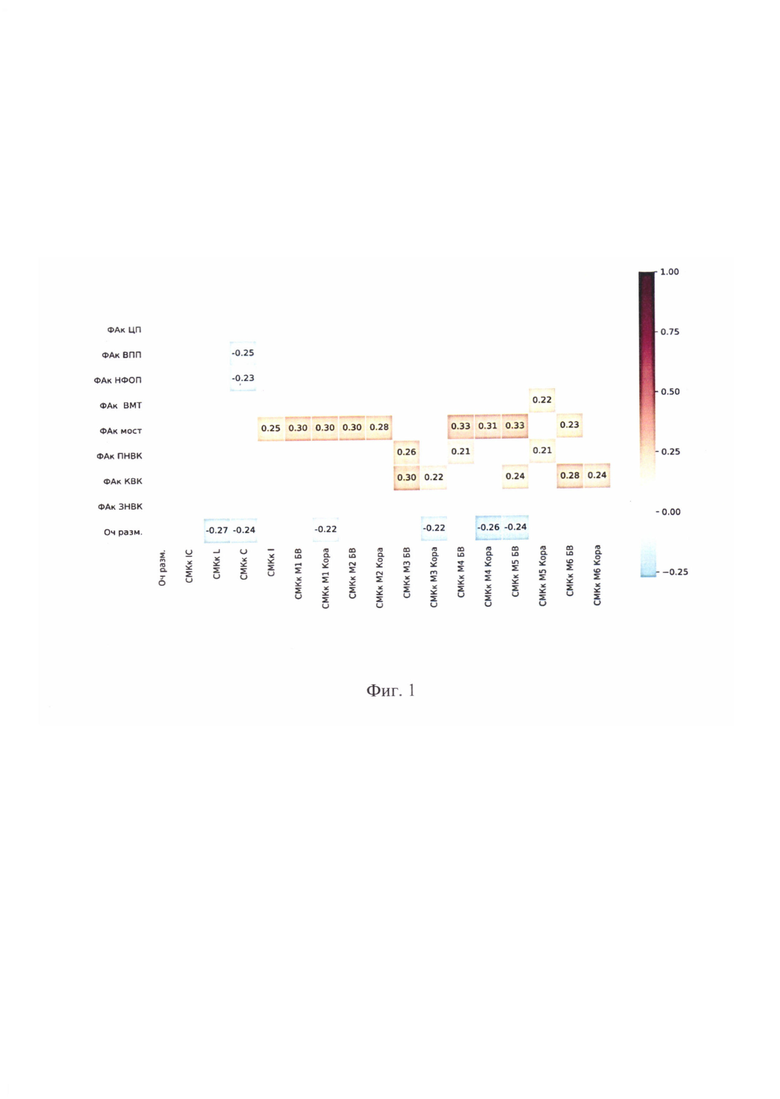
Взаимосвязь ФА и CMK в пределах интактного полушария, а также размера очага инфаркта отражена на фиг.1 в виде корреляционной матрицы перфузионных и диффузионно-тензорных показателей (цветовая шкала соответствует коэффициенту Спирмана при р<0,05).
Исследования показали, что ФА интактного полушария, в отличие от СМК, не связана с размером очага настоящего инсульта. При этом диффузия и перфузия оказались тесно взаимосвязаны. Трактами, микроструктура которых не ассоциирована с перфузией, явились КСТ на уровне ЗНВК и ПП.
Проанализирована роль наиболее сильных классических предикторов. Обнаружено, что возраст пациентов не связан с результатами NIHSS и модифицированной шкалы Рэнкина (МШP) при выписке. При этом отмечена сильная корреляция итоговых показателей шкал с первоначальным уровнем неврологического дефицита (r=0,55; р<0,001; r=0,36; р<0,001), что абсолютно закономерно. Размер очага инфаркта также коррелировал с показателями NIHSS (r=0,42; р<0,001) при выписке.
Далее были проанализированы отдельные корреляции показателей NIHSS при выписке с диффузионными и перфузионными метриками. Результат NIHSS при выписке был ассоциирован с ФА зоны интактного полушария, симметричной очагу инфаркта (r=0,28; р=0,026), ПНВК (r=-0,21; р=0,049), ЦП (r=-0,28; р=0,007) и НФОП (r=-0,21; р=0,047), а также СМК БВ М2 (r=-0,24; р=0,025), коркового вещества и БВ М3 (r=-0,27; р=0,010 и r=-0,23; р=0,029), М4 (r=-0,23; р=0,031 и r=-0,26; р=0,014), коркового вещества М5 (r=-0,21; р=0,048) и Mg (r=-0,26; р=0,013), а также перфузией островка (r=-0,30; р=0,007).
При помощи регрессионного анализа идентифицированы наиболее значимые предикторы результата NIHSS при выписке, влияние которых описано моделью множественной регрессии (табл. 2).
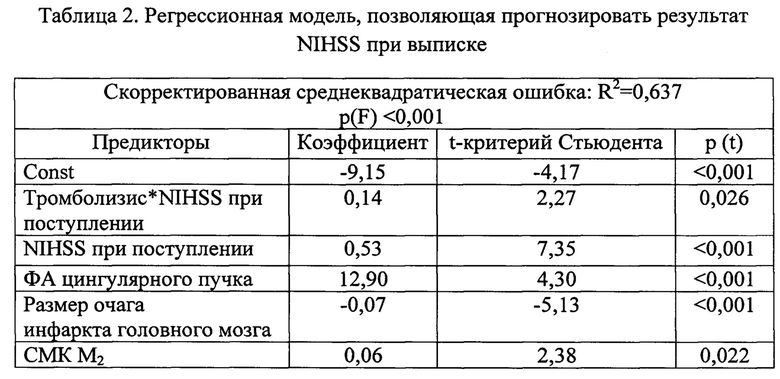
Таким образом, для прогнозирования результата NIHSS при выписке значимыми параметрами являются проведение или не проведение внутривенного тромболизиса, показатели NIHSS при поступлении, размер очага инфаркта головного мозга, ФА контралатерального цингулярного пучка и СМК в БВ М2. Результаты сравнения полученной диффузионно-перфузионной модели (ДИМ) с классической моделью, описывающей влияние значения NIHSS при поступлении и размера инфаркта, представлены в табл. 3. Как показано в табл. 3, разработанная ДИМ обладает меньшей погрешностью, все коэффициенты модели значимы [р (t)<0,05] и она может быть использована для определения реабилитационного потенциала.

Примеры конкретного применения
Пример №1. Больная П., 73 года с диагнозом «ЦВБ. Ишемический инсульт в бассейне правой средней мозговой артерии. Умеренный левосторонний центральный гемипарез, синдром пространственного игнорирования». Пациентке проведен внутривенный тромболизис. Выполнена оценка степени неврологического дефицита по шкале NIHSS. При поступлении результат NIHSS составил 8 баллов, размер очага инфаркта мозга - 78 мм, фракционная анизотропия цингулярного пучка непораженного полушария - 0,76, скорость мозгового кровотока в зоне М2 (белое вещество) - 18,4 мл/мин. На момент завершения первого этапа лечения и реабилитации была рассчитана выраженность неврологического дефицита:
Р=8⋅(0,53+0,14⋅1)-78⋅0,07+0,76⋅12,88+18,4⋅0,06-9,15
Согласно полученному показателю Р=1,5 балла - подтверждается низкий реабилитационный потенциал.
Пример №2. Больной О., 68 лет с диагнозом «ЦВБ. Ишемический инсульт в бассейне правой средней мозговой артерии. Умеренный левосторонний центральный гемипарез, гемигипостезия». Пациенту проведен внутривенный тромболизис. Выполнена оценка степени неврологического дефицита по шкале NIHSS. При поступлении результат NIHSS составил 9 баллов, размер очага инфаркта мозга - 9 мм, фракционная анизотропия цингулярного пучка непораженного полушария - 0,71, скорость мозгового кровотока в зоне М2 (белое вещество) - 19,6 мл/мин. На момент завершения первого этапа лечения и реабилитации была рассчитана выраженность неврологического дефицита:
Р=8⋅(0,53+0,14⋅1)-9⋅0,07+0,71⋅12,88+19,6⋅0,06-9,15
Согласно полученному показателю Р=6,6 балла - подтверждается высокий реабилитационный потенциал.
Пример №3. Больной Т., 65 лет с диагнозом «ЦВБ. Ишемический инсульт в бассейне левой средней мозговой артерии. Умеренный правосторонний центральный гемипарез, легкая сенсомоторная афазия». Пациенту не проводился внутривенный тромболизис. Выполнена оценка степени неврологического дефицита по шкале NIHSS. При поступлении результат NIHSS составил 9 баллов, размер очага инфаркта мозга - 30 мм, фракционная анизотропия цингулярного пучка непораженного полушария - 0,65, скорость мозгового кровотока в зоне М2 (белое вещество) - 23,6 мл/мин. На момент завершения первого этапа лечения и реабилитации была рассчитана выраженность неврологического дефицита:
Р=9⋅(0,53+0,14⋅0)-30⋅0,07+0,65⋅12,88+23,6⋅0,06-9,15
Согласно полученному показателю Р=3,3 балла - подтверждается низкий реабилитационный потенциал.
Пример №4. Больная X., 74 лет с диагнозом «ЦВБ. Ишемический инсульт в бассейне правой средней мозговой артерии. Умеренный левосторонний центральный гемипарез, гемигипостезия». Пациентке проведен внутривенный тромболизис. Выполнена оценка степени неврологического дефицита по шкале NIHSS. При поступлении результат NIHSS составил 10 баллов, размер очага инфаркта мозга - 17 мм, фракционная анизотропия цингулярного пучка непораженного полушария - 0,59, скорость мозгового кровотока в зоне М2 (белое вещество) - 25,1 мл/мин. На момент завершения первого этапа лечения и реабилитации была рассчитана выраженность неврологического дефицита:
Р=8⋅(0,53+0,14⋅1)-17⋅0,07+0,59⋅12,88+25,1⋅0,06-9,15
Согласно полученному показателю Р=5,4 балла - подтверждается высокий реабилитационный потенциал.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ оценки реабилитационного потенциала пациента, перенесшего ишемический инсульт | 2021 |
|
RU2777805C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ВОССТАНОВЛЕНИЯ ДВИГАТЕЛЬНОЙ ФУНКЦИИ У БОЛЬНЫХ В ОСТРОМ ПЕРИОДЕ ИШЕМИЧЕСКОГО ИНСУЛЬТА В БАССЕЙНЕ АРТЕРИЙ КАРОТИДНОЙ СИСТЕМЫ | 2012 |
|
RU2508048C1 |
| Способ проведения тромболитической терапии при инсульте | 2023 |
|
RU2820542C1 |
| Способ прогнозирования восстановления двигательных функций у больных в остром периоде ишемического инсульта | 2022 |
|
RU2792738C1 |
| Способ прогнозирования функционального восстановления у больных с ишемическим инсультом | 2017 |
|
RU2631745C1 |
| СПОСОБ ЛЕЧЕНИЯ БОЛЬНЫХ ИШЕМИЧЕСКИМ ИНСУЛЬТОМ В РАННЕМ ПЕРИОДЕ ЗАБОЛЕВАНИЯ | 2020 |
|
RU2742746C1 |
| Способ прогнозирования функционального восстановления после ишемического инсульта | 2024 |
|
RU2825714C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕЧЕНИЯ ОСТРОГО ПЕРИОДА ИШЕМИЧЕСКОГО ИНСУЛЬТА В ПЕРВЫЕ 24 ЧАСА ПРИ ПРОВЕДЕНИИ ТРОМБОЛИТИЧЕСКОЙ ТЕРАПИИ | 2015 |
|
RU2573801C1 |
| Способ прогнозирования неврологического восстановления с 14-го по 90-й дни ишемического инсульта головного мозга | 2021 |
|
RU2764355C1 |
| Способ прогнозирования восстановления сенсомоторных функций у пациентов с острым ишемическим инсультом после ранней реабилитации | 2021 |
|
RU2753140C1 |
Изобретение относится к области медицины, а именно неврологии и реабилитологии, и может быть использовано для определения реабилитационного потенциала пациента, перенесшего острое нарушение мозгового кровообращения. У больного при поступлении в стационар оценивают факт проведения или не проведения внутривенного тромболизиса, выраженность неврологического дефицита по шкале NIHSS, а на 5-10 сутки проводят мультимодальную магнитно-резонансную томографию головного мозга с оценкой размера очага инфаркта головного мозга, фракционной анизотропии цингулярного пучка и скорости мозгового кровотока в зоне М2 непораженного полушария. Далее рассчитывают реабилитационный потенциал на момент завершения первого этапа лечения и реабилитации по формуле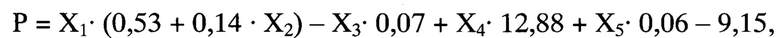 где Р - оценка реабилитационного потенциала пациента на момент завершения первого этапа лечения и реабилитации (баллы), X1 - результат шкалы NIHSS на момент поступления в стационар (баллы), Х2 - проведение или не проведение внутривенного тромболизиса (1 или 0), Х3 - размер очага инфаркта головного мозга (мм), Х4 - фракционная анизотропия цингулярного пучка непораженного полушария, Х5 - скорость мозгового кровотока в зоне М2 непораженного полушария по шкале ASPECTS (белое вещество) (мл/ в минуту). При значении Р от 0 до 4 баллов делают вывод о низком реабилитационном потенциале, 5 и более баллов - о высоком реабилитационном потенциале. Способ обеспечивает объективизацию определения реабилитационного потенциала пациента за счет определения значения реабилитационного потенциала. 2 табл., 1 ил., 4 пр.
где Р - оценка реабилитационного потенциала пациента на момент завершения первого этапа лечения и реабилитации (баллы), X1 - результат шкалы NIHSS на момент поступления в стационар (баллы), Х2 - проведение или не проведение внутривенного тромболизиса (1 или 0), Х3 - размер очага инфаркта головного мозга (мм), Х4 - фракционная анизотропия цингулярного пучка непораженного полушария, Х5 - скорость мозгового кровотока в зоне М2 непораженного полушария по шкале ASPECTS (белое вещество) (мл/ в минуту). При значении Р от 0 до 4 баллов делают вывод о низком реабилитационном потенциале, 5 и более баллов - о высоком реабилитационном потенциале. Способ обеспечивает объективизацию определения реабилитационного потенциала пациента за счет определения значения реабилитационного потенциала. 2 табл., 1 ил., 4 пр.
Способ определения реабилитационного потенциала пациента, перенесшего острое нарушение мозгового кровообращения, заключающийся в том, что у больного при поступлении в стационар оценивают факт проведения или не проведения внутривенного тромболизиса, выраженность неврологического дефицита по шкале NIHSS, а на 5-10 сутки проводят мультимодальную магнитно-резонансную томографию головного мозга с оценкой размера очага инфаркта головного мозга, фракционной анизотропии цингулярного пучка и скорости мозгового кровотока в зоне М2 непораженного полушария далее рассчитывают реабилитационный потенциал на момент завершения первого этапа лечения и реабилитации по формуле
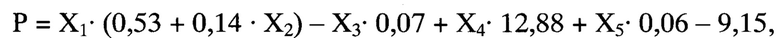 где
где
Р - оценка реабилитационного потенциала пациента на момент завершения первого этапа лечения и реабилитации (баллы),
X1 - результат шкалы NIHSS на момент поступления в стационар (баллы),
Х2 - проведение или не проведение внутривенного тромболизиса - 1 или 0,
Х3 - размер очага инфаркта головного мозга (мм),
Х4 - фракционная анизотропия цингулярного пучка непораженного полушария,
Х5 - скорость мозгового кровотока в зоне М2 непораженного полушария по шкале ASPECTS - белое вещество (мл/ в минуту), и при значении Р от 0 до 4 баллов делают вывод о низком реабилитационном потенциале, 5 и более баллов - о высоком реабилитационном потенциале.
| СПОСОБ ПРОГНОЗИРОВАНИЯ ВОССТАНОВЛЕНИЯ НЕВРОЛОГИЧЕСКИХ ФУНКЦИЙ ПОСЛЕ ИНСУЛЬТА | 2014 |
|
RU2569718C1 |
| Способ прогнозирования функционального восстановления у больных с ишемическим инсультом | 2017 |
|
RU2631745C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ВОССТАНОВЛЕНИЯ ДВИГАТЕЛЬНОЙ ФУНКЦИИ У БОЛЬНЫХ В ОСТРОМ ПЕРИОДЕ ИШЕМИЧЕСКОГО ИНСУЛЬТА В БАССЕЙНЕ АРТЕРИЙ КАРОТИДНОЙ СИСТЕМЫ | 2012 |
|
RU2508048C1 |
| US 20150164403 A1, 18.06.2015 | |||
| КУЛЕШ А | |||
| А | |||
| и др | |||
| Роль церебрального резерва, оцененного с помощью диффузно-взвешенной магнитно-резонансной томографии, в определении реабилитационного потенциала острого периода ишемического инсульта | |||
| Неврология, нейропсихиатрия, | |||
Авторы
Даты
2020-07-17—Публикация
2020-01-20—Подача