Изобретение относится к неврологии, в частности прогнозированию течения ишемического инсульта при проведении тромболитической терапии, и может быть использовано для дифференцированной оценки благоприятного и неблагоприятного функционального исхода острого периода ишемического инсульта в первые 24 часа заболевания.
Главными этиологическими факторами развития ишемического инсульта (ИИ) остаются атеросклероз (АС) и неконтролируемая артериальная гипертония (АГ) (Инсульт: диагностика, лечение, профилактика (Под ред. З.А. Суслиной, М.А. Пирадова. - М.: МЕДпресс-информ, 2008. - 283 с.). В клинической практике исходы острого нарушения мозгового кровообращения (НМК) часто остаются неудовлетворительными.
Основой специфической терапии при ИИ является восстановление кровотока в области «ишемической полутени» - пенумбре. Около 40 лет назад начались исследования эффективности тромболитической терапии (ТЛТ). К настоящему времени эффективность тромболизиса доказана (Jauch Е.С., Saver J.L., Adams Н.Р. et al. Guidelines for the early management of patients with acute ischemic stroke: a guideline for healthcare professionals from the American Heart Association/American Stroke Association // Stroke. - 2013. - Vol. 44 (3). - pp. 870-947). Несмотря на большое количество проведенных исследований по изучению эффективности тромболизиса лишь системный тромболизис имеет доказательную базу и остается приоритетным методом в остром периоде ИИ в соответствии с принятыми критериями.
На современном этапе развития ангионеврологии возрастает значение новейших исследовательских и диагностических методов нейровизуализации. Диффузионно-взвешенная MPT (ДВ МРТ) и КТ-перфузия в остром периоде ИИ позволяют визуализировать область гипоперфузии в ядре инсульта и пенумбре. Четких представлений о соотношении диффузионных и перфузионных изменений, а также состоянии кровоснабжения мозга в остром периоде инсульта нет. Поиск алгоритмов нейровизуализационных исследований для выявления пенумбры и оценки области ишемии в динамике в зависимости от патогенеза ИГМ имеет исключительно важное значение при проведении тромболитической терапии (Суслина З.А., Танашян М.М., Домашенко М.А. Антитромботическая терапия ишемических нарушений мозгового кровообращения с позиций доказательной медицины. - 2-е изд. - М.: «Медицинское информационное агентство», 2009. - 224 с.; Кротенкова М.В. Диагностика острого инсульта: нейровизуализационные алгоритмы: дисс.… д-ра мед. наук: 14.01.13 / - М.: 2011. - 304 с.).
Степень выраженности неврологической симптоматики и возраст больных являются факторами, определяющими течение и исход ИИ при проведении тромболизиса. В исследовании NIHSS (National Institutes of Health Stroke Seal) было показано, что пациенты в возрасте до 75 лет с суммарным баллом по шкале NIHSS менее 20 имели больший потенциал для восстановления нарушенных функций после проведения тромболизиса (NINDS t-PA Stroke Study Group Generalized efficacy of t-PA for acute stroke: subgroup analysis of the NINDS t-PA Stroke Trial // Stroke. - 1997. - Vol. 28. - pp. 2119-25) Также проводили исследования по изучению эффективности тромболизиса, где был отмечен регресс или уменьшение неврологических нарушений по шкале инсульта NIH (National Institutes of Health) на 4 балла и более в течение 24 ч после тромболизиса и к концу 3-го месяца после инсульта. Проведение тромболизиса с рТАП в течение первых 3 ч от начала заболевания позволяет получить улучшение исхода заболевания на 11-13% (The National Institute of Neurological Disorders and Stroke rt-PA Stroke Study Group Tissue plasminogen activator for acute ischemic stroke // The New England Journal of Medicine. - 1995. - Vol. 333, №24. - pp. 1581-87). В имеющейся отечественной и зарубежной литературе нет сведений о раннем прогнозировании благоприятного и неблагоприятного функционального исхода ишемического инсульта при проведении тромболитической терапии.
Отсюда вытекает необходимость выявления прогностически значимых маркеров, определяющих течение и исход ишемического инсульта уже в острейшем периоде его течения при проведении тромболизиса.
ДВ МРТ позволяет дать как визуальную, так и количественную оценку области необратимых изменений с высокой чувствительностью и специфичностью.
Известен способ изучения клинических и томографических факторов течения острого периода инсульта в бассейне артерий каротидной системы в том числе и после системного тромболизиса путем проведения диффузионно-взвешенной магнитно-резонансной томографии (ДВ МРТ) с определением площади инфаркта, оценкой общего балла по шкале инсульта NIH в остром периоде, определением декремента общего балла по шкале инсульта ΔNIH (Коробкова Д.З. и др. Клинические и томографические маркеры течения острого периода инсульта в бассейне каротидной системы. Журнал неврологии им. Б.М. Маньковского, 2014, т. 2, №2, с. 40-43). Этот источник информации рассмотрен нами в качестве ближайшего аналога. Однако в данной работе не обозначены прогностические пороговые значения значимых маркеров, определяющих течение острейшего периода ишемического инсульта при проведении тромболитической терапии. В нашем же исследовании были выявлены пороговые значения наиболее значимых маркеров, обеспечивающих возможность оценки уже в острейшем периоде ишемического инсульта его течения при проведении тромболитической терапии.
Технический результат предложенного способа заключается в более точном прогнозировании неблагоприятного течения ишемического инсульта при применении тромболитической терапии уже в острейшем периоде его развития.
Технический результат достигается тем, что прогноз течения острого периода ишемического инсульта при проведении тромболитической терапии, проводят путем диффузионно-взвешенной магнитно-резонансной томографии (ДВ МРТ) с определением площади инфаркта, оценкой общего балла по шкале инсульта NIH в остром периоде, определением декремента общего балла по шкале инсульта ΔNIH, при этом оценку общего балла по шкале инсульта NIH проводят в первые 4,5 часа (NIH1 cyт) и через 24 часа (NIH2 сут), а декремент общего балла ΔNIH на 2-е сутки определяют по формуле:
ΔNIH2 сут=NIH1 сут - NIH2 сут,
и при значении ΔNIH2 сут менее 2, общего балла по шкале инсульта NIH в первые сутки инсульта более 14 и площади инфаркта более 1429 мм2 течение острого периода ишемического инсульта при проведении тромболитической терапии считают неблагоприятным.
Способ осуществляется следующим образом.
Всем пациентам при поступлении, а также на 2-3 сутки ИИ проводили оценку выраженности неврологического статуса при помощи шкалы инсульта Национальных институтов здоровья (National Institutes of Health Stroke Scale (NIHSS)); степени восстановления при помощи модифицированной шкалы Рэнкина (modified Rankin scale (mRs)) и индекса активности повседневной жизни Бартел (BI). Оценка по шкале NIHSS имеет большое значение для планирования и оценки эффективности системного тромболизиса.
Основными критериями отбора для тромболизиса являлись инсульт в бассейне артерий каротидной системы, время поступления первые 4,5 часа с момента развития неврологической симптоматики, отсутствии противопоказаний для проведения системного тромболизиса в соответствии с рекомендациями Американской ассоциации кардиологов (American Heart Association, AHA), Американской ассоциации инсульта (American Stroke Association, ASA), а также Европейской организации по изучению инсульта (European Stroke Organization); 4) отсутствие противопоказаний к проведению МРТ и КТ головного мозга (установленный кардиостимулятор, металлические имплантанты, ферромагнитные и электронные имплантанты, кровоостанавливающие клипсы, масса тела, превышающая максимальную для прибора, аллергия на КС). Всем пациентам при поступлении, а также на 2-3 сутки ИИ проводили МРТ головного мозга в стандартных режимах для визуализации инфарктов мозга, оценки их величины, локализации, сопутствующих изменений, а также ДВ МРТ для качественной и количественной оценки области необратимых изменений в ткани мозга. Оценку реканализации мозговых артерий определяли с помощью MP- или КТ-ангиографии до проведения, по окончании и через 24 ч после системного тромболизиса.
В исследование было включено 90 больных в остром периоде инфаркта головного мозга в бассейне артерий каротидной системы, поступивших в первые 4,5 ч от момента развития неврологической симптоматики, из них - 55 (61%) мужчин и 35 (39%) женщин в возрасте от 32 и до 85 лет, Me 62 [56; 71].
В основную группу вошел 61 пациент с ИИ в возрасте от 32 до 76 лет, Me 61 [55; 69], из них 41 (67%) мужчина и 20 (33%) женщин, поступивших в первые 4,5 ч с момента развития неврологической симптоматики. Больным проводили системный тромболизис рекомбинантным тканевым активатором плазминогена «Актилизе» в дозе 0,9 мг/кг (не более 90 мг); 10% препарата вводилось в/в струйно в течение 1 мин, остальные 90% препарата в/в капельно в течение 1 ч. Критериями включения пациентов в эту группу являлись время от начала инсульта не более 4,5 часов, возраст от 18 до 80 лет, подтверждение очага ишемии при МРТ в режиме ДВИ, величина очага менее 1/3 бассейна СМА, оценка по шкале инсульта NIH от 5 до 25 баллов, уровень гликемии от 2,7 до 22 ммоль/л, MHO - не выше 1,7 при применении антикоагулянтов, получение письменного информированного согласия больного или его родственников на проведение системного тромболизиса.
В контрольную группу вошли 29 пациентов с ишемическим инсультом в возрасте от 32 до 85 лет, Me 67 лет [57; 71], из них 14 (48%) мужчин и 15 (52%) женщин, поступивших в первые 24 ч с момента развития неврологической симптоматики. Всем пациентам этой группы проводили базисную терапию, включающую гипотензивные средства, антиагреганты, антикоагулянты (при прогрессирующем течении атеротромботического инсульта, при подтвержденном кардиогенном эмболическом инсульте, для профилактики тромбоэмболии артерий легочного ствола), статины, нейропротекторы.
Исследования пациентов проводили на магнитно-резонансном томографе Magnetom Symphony (Siemenes, Германия) с величиной магнитной индукции 1,5 Тесла. МРТ включала в себя стандартные режимы исследования (Т2-ВИ, Т1-ВИ, T2-FLAIR, Т2*-ВИ) и диффузионно-взвешенную МРТ (ДВ МРТ). Общее время исследования составляло 16 мин. Стандартные режимы исследования оценивали с помощью программы для работы с медицинским изображением eFilm Workstation. МРТ выполняли в коронарной, сагиттальной и аксиальной плоскостях. Срезы в аксиальной плоскости были параллельны условной линии между нижним краем гипофиза и дном четвертого желудочка, что позволяло устранить артефакты от цереброспинальной жидкости, влияющие на качество изображений.
Диффузионно-взвешенная МРТ (ДВ МРТ) - технология получения изображений с помощью диффузионно-взвешенной эхо-планарной импульсной последовательности (Diffusion-Weighted Echoplanar Imaging), основанная на оценке скорости диффузии свободной (внеклеточной) воды в каждом участке мозга (вокселе). ДВ МРТ позволяет дать как визуальную, так и количественную оценку области необратимых изменений. ДВ МРТ характеризуется следующими параметрами: TR=4300 ms, ТЕ=119 ms, averages =3, dist. factor (gap) 30% (1,5 mm), FOV=250 mm, matrix 256×256 pixel, slice thickness =5 mm, b-value (0; 500; 1000) с построением ИКД-карт. Время исследования 1 мин 36 с. У обследуемых пациентов с ИИ по данным ДВ МРТ рассчитывали площадь очага ишемии (b=1000) в мм2 в динамике - при поступлении, на 2-3, 10-е сут. Измерение площади необратимых изменений на ДВИ осуществляли путем выделения зоны «интереса» на срезе с максимальным диаметром очага ишемии с последующей обработкой данных при помощи стандартного программного обеспечения.
Статистическую обработку результатов проводили на Intel-совместимом персональном компьютере с применением программ Microsoft Excel, а также пакета компьютерных прикладных программ Statistica 7.0 (StatSoft, 2004). Для количественной оценки данных вычисляли описательные статистические показатели с вычислением абсолютного и относительного (процент) количества пациентов, медианы, 25% и 75%-го квартилей (Me [25%, 75%]). При сравнении групп пациентов применяли следующие непараметрические методы оценки данных: критерий Вилкоксона при сравнении двух связанных признаков, критерий Манна-Уитни при сравнении двух несвязанных между собой признаков. Для сравнения частот бинарного признака в двух независимых группах проводился анализ таблиц 2×2 с вычислением χ2-квадрата. Для анализа связи признаков применялся непараметрический метод Спирмена; при значении коэффициента корреляции |r|≤0,25 связь расценивалась как слабая, при 25<|r|<75, при |r|≥75 - сильная [21]. Для уточнения клинических и томографических маркеров неблагоприятного исхода острого периода инсульта (оценка по шкале Рэнкина 4 балла и более), проводили ROC-анализ (Receiver Operator Characteristic) с применением пакета компьютерных прикладных программ MedCalc 5.00.020 Statistical Software для Windows. С помощью используемой программы были построены ROC кривые для ряда клинических и томографических показателей. Статистически значимыми считались результаты при р<0,05. Также были определены значения характеристик диагностического метода определения маркера неблагоприятного исхода инсульта: чувствительность, специфичность, прогностическая ценность положительного результата (ПЦПР), прогностическая ценность отрицательного результата (ПЦОР). Чувствительность (Specificity) - доля (процент) пациентов с истинно-положительным результатом теста среди всех лиц, имеющих изучаемую патологию. Рассчитывается как отношение истинно-положительных результатов диагностического теста к общему числу заболевших. Специфичность (Sensitivity) - доля (процент) пациентов с истинно-отрицательным результатом теста среди всех лиц, не имеющих изучаемой патологии. Определяется как отношение истинно-отрицательного результата к общему числу пациентов без заболевания. Прогностическая ценность положительного результата (Positive predictive value) - доля (процент) истинно-положительных результатов теста среди всех положительных результатов теста (вероятность наличия заболевания при положительном результате теста). Прогностическая ценность отрицательного результата (Negative predictive value) - доля (процент) истинно-отрицательных результатов теста от общего числа всех отрицательных результатов теста (вероятность отсутствия заболевания при отрицательном результате теста).
Прогностическая ценность зависит от чувствительности и специфичности диагностического теста, а также распространенности заболевания в исследуемой популяции. Чем чувствительнее тест, тем выше прогностическая ценность его отрицательного результата; чем специфичнее тест, тем выше прогностическая ценность его положительного результата.
В основе шкалы NIHSS лежит оценка уровня сознания, зрительных функций, анозогнозии, двигательных, координаторных, речевых и чувствительных нарушений (Brott Т., Adams Н.Р., Olinger С.Р. et al. Measurements of acute cerebral infarction: a clinical examination scale // Stroke. - 1989. - Vol. 20(7). - pp. 864-70). Минимальная оценка по шкале инсульта NIH соответствует 0 баллов, максимальная - 42 балла. Отсутствие неврологического дефицита по шкале инсульта NIH оценивали как 0 баллов; от 1 до 6 баллов - неврологический дефицит определяли как легкой степени тяжести; от 7 до 13 баллов - средней степени тяжести; 14 баллов и более - как значительно выраженный неврологический дефицит, соответствующий тяжелому инсульту. При проведении системного тромболизиса оценку проводили до и через 24 часа после его проведения. Для оценки динамики неврологического дефицита в основной и контрольной группах рассчитывался декремент суммарного балла шкалы инсульта (ΔNIH) на 2 сутки (NIH1 сут - NIH2 сут). Сравнительный анализ декремента суммарного балла по шкале инсульта NIH после тромболизиса в течение всего периода наблюдения выявил более выраженное уменьшение неврологического дефицита в основной группе по сравнению с группой контроля. В основной группе наблюдалось постепенное уменьшение медианы ΔNIH от 1 к 2-7 и 21 суткам инсульта, в группе контроля изменений степени неврологических нарушений к 2 суткам инсульта выявлено не было.
Площадь необратимых изменений по данным диффузионно-взвешенных изображений (ДВИ) МРТ в первые сутки инсульта варьировала от 52,4 до 4502 мм2, Me составила 681 (277; 1428). Площадь инфаркта по данным КТ-перфузии при поступлении колебалась от 0 до 3781 мм2, Me составила 581 (0; 1333), площадь пенумбры преобладала над областью необратимых изменений и варьировала от 0 до 4659 мм2, Me составила 1001 (410; 2134), различия были статистически значимыми, р=0,01. Общая площадь ишемии составила от 0 до 5200 мм2, Me 2036 (347; 4318). Между площадью инфаркта на ДВ МРТ и площадью инфаркта по данным КТ-перфузии (областью гипоперфузии со сниженным CBV<2 мл/100 г) была выявлена сильная прямая корреляция (r=0,87, р<0,001).
Для уточнения клинических и томографических маркеров положительного или отрицательного исхода острого периода ишемического инсульта (оценка по шкале Рэнкина 4 балла и более) был проведен ROC-анализ. Оценивали чувствительность, специфичность, прогностическую ценность положительного результата (ПЦПР), прогностическую ценность отрицательного результата (ПЦОР). В качестве клинических маркеров течения ИИ использовали суммарный балл по шкале инсульта NIH при поступлении, а также декремент суммарного балла ΔNIH при поступлении и через 24 часа после системного тромболизиса. В качестве томографических маркеров - площадь необратимых изменений на ДВ МРТ, площадь ишемии и уровень мозгового кровотока (CBF) по данным КТ-перфузии при поступлении.
Оптимальным пороговым значением ΔNIH на 2 сутки для благоприятного функционального исхода после системного тромболизиса был суммарный балл декремента NIH более 2 (чувствительность 69,6%, специфичность 71,4%, ПЦПР 88,9%, ПЦОР 41,7%). Однако декремент NIH более 6 баллов обладал самой высокой (100%) специфичностью (чувствительность 8,7%, ПЦПР 100%, ПЦОР - 25%) (табл. 1).

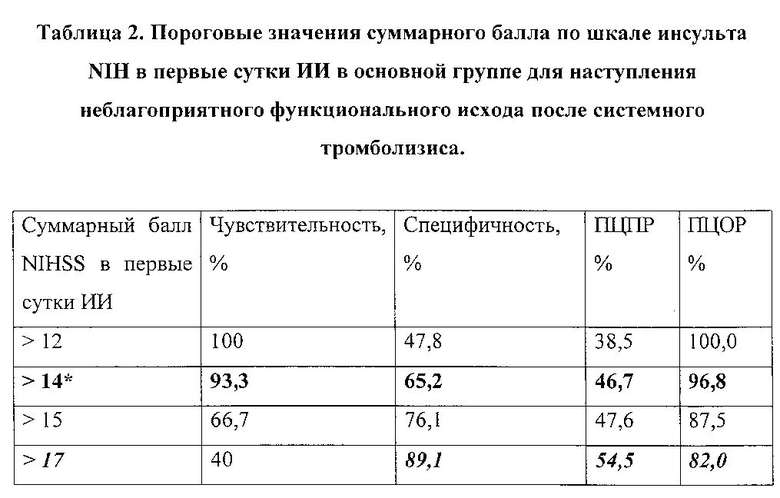
Оптимальным пороговым значением оценки по шкале инсульта NIH для наступления неблагоприятного функционального исхода в случае проведения тромболитической терапии явился суммарный балл более 14 (чувствительность 93%, специфичность 65%, ПЦПР 47%, ПЦОР 97%). Наибольшей ПЦПР (54%) обладала оценка по шкале MHSS более 17 баллов, с низкой чувствительностью 40%, но высокой специфичностью - 89,1% (табл. 2).
Пороговым значением для наступления неблагоприятного функционального исхода явилась величина площади инфаркта на ДВИ более 1429 мм2 (чувствительность 58,3%, специфичность 88,9%, ПЦПР 32,7%, ПЦОР 96,3%). Наибольшая чувствительность (100%) была выявлена при площади инфаркта более 407 мм2 (специфичность 36,1%, ПЦПР - 34,3%, ПЦОР - 100%). Площадь инфаркта более 3121 мм2 имела высокую специфичность (100%), низкую чувствительность (25%), а также высокие ПЦПР и ПЦОР (100% и 80% соответственно).
Таблица 3. Пороговые значения площади ИИ по данным ДВИ для оценки наступления неблагоприятного функционального исхода инсульта при проведении тромболитической терапии.

Таким образом, наиболее информативным клиническим маркером благоприятного функционального исхода в первые сутки инсульта в случае тромболитической терапии является декремент ΔNIH более 2 баллов. Наиболее информативными маркерами неблагоприятного функционального исхода при проведении тромболитической терапии в первые сутки инсульта являются: суммарный балл по шкале инсульта NIH более 14 и площадь инфаркта по данным ДВ МРТ более 1429 мм2 и декремент ΔNIH менее 2 баллов.
Использование предлагаемых клинических и томографических маркеров дифференцированной оценки функционального исхода острого периода ишемического инсульта в первые сутки заболевания при проведении тромболитической терапии позволяет выявлять группу больных с неблагоприятным функциональным исходом, нуждающихся в особенно тщательном мониторинге независимо от вида терапии.
Примеры осуществления способа.
Пример 1.
Пациент Ф., 55 лет, поступил в Научный центр неврологии через 155 минут с момента развития острого инсульта. При поступлении оценка по шкале инсульта NIH1cyт составила 14 баллов (тяжелый инсульт), площадь необратимых изменений по данным ДВ МРТ - 285 мм2 (менее 1429 мм2); при проведении MP-ангиографии (МРА) выявлена окклюзия левой средней мозговой артерии (СМА). Через 185 минут от момента развития неврологической симптоматики пациенту был проведен системный внутривенный тромболизис рекомбинантным тканевым активатором плазминогена «Актилизе» в дозе 0,9 мг/кг. Через 24 часа после тромболитической терапии на фоне реканализации левой СМА было отмечено уменьшение выраженности неврологического дефицита по шкале инсульта NIH2 сут - 6 баллов. Декремент общего балла ΔNIH на 2-е сутки составил 8 баллов (больше 2). Данные показатели соответствуют благоприятному течению острого периода ишемического инсульта при проведении тромболитической терапии.
К концу острого периода ишемического инсульта (21 сутки) неврологическая симптоматика регрессировала полностью, оценка по шкале инсульта NIH составила 0 баллов. Оценка степени восстановления неврологического дефицита по модифицированной шкале Рэнкина на 21 сутки составила 0 баллов, что соответствует и подтверждает благоприятный функциональный исход острого периода ишемического инсульта.
Пример 2.
Пациентка Ш., 76 лет, поступила в Научный центр неврологии через 65 минут с момента развития острого инсульта. При поступлении оценка по шкале инсульта NIH1 сут составила 15 баллов (тяжелый инсульт). Площадь необратимых изменений по данным ДВ МРТ составила 2903 мм2 (больше 1429 мм2). При проведении MP-ангиографии выявлена окклюзия правой средней мозговой артерии. Через 105 минут с момента развития неврологической симптоматики пациентке был проведен системный внутривенный тромболизис рекомбинантным тканевым активатором плазминогена «Актилизе» в дозе 0,9 мг/кг. Через 24 часа после тромболитической терапии на фоне частичной реканализации правой СМА положительной динамики в неврологическом статусе не выявлено. Оценка по шкале инсульта NIH2 сут составила 15 баллов. Декремент общего балла ΔNIH на 2-е сутки составил 0 баллов (менее 2). Данные показатели соответствуют неблагоприятному течению острого периода ишемического инсульта при проведении тромболитической терапии.
В дальнейшем выраженность неврологического дефицита по шкале инсульта NIH к концу острого периода ишемического инсульта (21 сутки) уменьшилась до 11 баллов. Оценка степени восстановления неврологического дефицита по модифицированной шкале Рэнкина на 21 сут составила 4 балла, что соответствует неблагоприятному функциональному исходу острого периода ишемического инсульта.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЯЖЕЛОГО ФУНКЦИОНАЛЬНОГО ИСХОДА ОСТРОГО ИШЕМИЧЕСКОГО ИНСУЛЬТА | 2015 |
|
RU2585139C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ИСХОДА ОСТРОГО ПЕРИОДА ИШЕМИЧЕСКОГО ИНСУЛЬТА, АССОЦИИРОВАННОГО С COVID-19 | 2021 |
|
RU2763834C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПОКАЗАНИЙ ДЛЯ ПРОВЕДЕНИЯ ВНУТРИВЕННОЙ ТРОМБОЛИТИЧЕСКОЙ ТЕРАПИИ В ОСТРОМ ПЕРИОДЕ ИШЕМИЧЕСКОГО ИНСУЛЬТА | 2010 |
|
RU2444990C1 |
| СПОСОБ РЕАБИЛИТАЦИИ БОЛЬНЫХ И ЕЕ ОЦЕНКИ В ОСТРОМ ПЕРИОДЕ ИШЕМИЧЕСКОГО ИНСУЛЬТА | 2005 |
|
RU2284749C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ВОССТАНОВЛЕНИЯ ДВИГАТЕЛЬНОЙ ФУНКЦИИ У БОЛЬНЫХ В ОСТРОМ ПЕРИОДЕ ИШЕМИЧЕСКОГО ИНСУЛЬТА В БАССЕЙНЕ АРТЕРИЙ КАРОТИДНОЙ СИСТЕМЫ | 2012 |
|
RU2508048C1 |
| Способ улучшения раннего функционального неврологического восстановления у больных с ишемическим инсультом и нарушением дыхания во сне | 2017 |
|
RU2645410C1 |
| Способ прогнозирования функционального восстановления у больных с ишемическим инсультом | 2017 |
|
RU2631745C1 |
| Способ определения реабилитационного потенциала пациента, перенесшего острое нарушение мозгового кровообращения | 2020 |
|
RU2727009C1 |
| СПОСОБ ДИАГНОСТИКИ НЕОБРАТИМОСТИ ВОССТАНОВЛЕНИЯ ТЯЖЕЛЫХ ДВИГАТЕЛЬНЫХ НАРУШЕНИЙ У БОЛЬНЫХ С ИШЕМИЧЕСКИМИ ИНСУЛЬТАМИ ПОЛУШАРНОЙ ЛОКАЛИЗАЦИИ В ХРОНИЧЕСКОЙ СТАДИИ | 2011 |
|
RU2477620C1 |
| Способ прогноза неблагоприятного исхода у пациентов с ишемическим инсультом | 2021 |
|
RU2769488C1 |
Изобретение относится к неврологии и может быть использовано при прогнозировании течения острого ишемического инсульта при проведении тромболитической терапии. Проводят диффузионно-взвешенную магнитно-резонансную томографию (ДВ МРТ). Определяют площадь инфаркта. Оценивают общий балл по шкале инсульта NIH в первые 4,5 часа (NIH1 сут) и через 24 часа (NIH2 сут). Определяют декремент общего балла ΔNIH на 2-е сутки по формуле:
ΔNIH2 сут=NIH1 сут - NIH2 сут. При значении ΔNIH2 сут менее 2, общего балла по шкале инсульта NIH в первые сутки инсульта более 14 и площади инфаркта более 1429 мм2 течение острого периода ишемического инсульта при проведении тромболитической терапии считают неблагоприятным. Способ позволяет точно прогнозировать течение ишемического инсульта за счет учета наиболее информативных клинических и томографических маркеров исхода инсульта при тромболитической терапии. 3 табл., 2 пр.
Способ прогнозирования течения острого периода ишемического инсульта при проведении тромболитической терапии, заключающийся в проведении диффузионно-взвешенной магнитно-резонансной томографии (ДВ МРТ) с определением площади инфаркта, оценке общего балла по шкале инсульта NIH в остром периоде, определении декремента общего балла по шкале инсульта ΔNIH, отличающийся тем, что оценку общего балла по шкале инсульта NIH проводят в первые 4,5 часа (NIH1 сут) и через 24 часа (NIH2 сут), а декремент общего балла ΔNIH на 2-е сутки определяют по формуле:
ΔNIH2 сут=NIH1 сут - NIH2 сут
и при значении ΔNIH2 сут менее 2, общего балла по шкале инсульта NIH в первые сутки инсульта более 14 и площади инфаркта более 1429 мм2 течение острого периода ишемического инсульта при проведении тромболитической терапии считают неблагоприятным.
| КОРОБКОВА Д.З | |||
| Клинические и томографические маркеры течения острого периода инсульта в бассейне артерий каротидной системы | |||
| Журнал неврологii iм | |||
| Б.М | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Приспособление с иглой для прочистки кухонь типа "Примус" | 1923 |
|
SU40A1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ВОССТАНОВЛЕНИЯ ДВИГАТЕЛЬНОЙ ФУНКЦИИ У БОЛЬНЫХ В ОСТРОМ ПЕРИОДЕ ИШЕМИЧЕСКОГО ИНСУЛЬТА В БАССЕЙНЕ АРТЕРИЙ КАРОТИДНОЙ СИСТЕМЫ | 2012 |
|
RU2508048C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ИСХОДА ИШЕМИЧЕСКОГО ИНСУЛЬТА | 2002 |
|
RU2233116C2 |
| Способ флотации оловянных руд | 1940 |
|
SU74334A1 |
| US 20090326360 A1 31.12.2009 | |||
| КЛИМОВ Л.В | |||
| Прогноз полушарного ишемического | |||
Авторы
Даты
2016-01-27—Публикация
2015-02-13—Подача