Область техники, к которой относится изобретение
Изобретение относится к области биологии и медицины, конкретно, к области химико-фармацевтической промышленности. Выделена новая композиция полипептидов, обладающая свойством нормализовать функции головного мозга, ноотропным, нейроптротекторным, антиоксидантным и тканеспецифическим действием.
Предшествующий уровень техники
К настоящему времени известен очень широкий спектр исследований, посвященных проблемам нормализации функций головного мозга. Также данные препараты, как правило, используют в качестве ноотропных, нейропротекторных препаратов и лекарственных средств, обладающих антиоксидантным и тканеспецифическим действием. Среди таких препаратов известны: Кортексин (регистрационное удостоверение
Р N003862/02), Церебролизин (регистрационное удостоверение
П N013827/01), Семакс (регистрационное удостоверение ЛС-002553) и другие.
Из всех представленных препаратов пептидной природы наиболее изучен Кортексин. Препарат КОРТЕКСИН® представляет собой полипептидный препарат, выделенный из коры головного мозга крупного рогатого скота и свиней и обладает тканеспецифическим действием на кору головного мозга, оказывает церебропротекторное, ноотропное и противосудорожное действие, снижает токсические эффекты нейротропных веществ, улучшает процессы обучения и памяти, стимулирует репаративные процессы в головном мозге, ускоряет восстановление функций головного мозга после стрессорных воздействий (Лебедев АА., и др., 2006, Психофармакология и биологическая наркология, т. 6, выпуск 3, 1275-1283).
Механизм действия КОРТЕКСИНА® связан с его метаболической активностью: препарат регулирует соотношение тормозных и возбуждающих аминокислот, уровень серотонина и дофамина, оказывает ГАМК-ергическое влияние, обладает антиоксидантной активностью и способностью восстанавливать биоэлектрическую активность головного мозга.
Кортексин представляет собой фармакологическое средство, содержащее в качестве активного начала выделенный целевой продукт в виде комплекса биологически активных полипептидов с молекулярной массой не более 15 000 Да и изоэлектрической точкой 3,5-9,5, и максимумом поглощения в УФ-спектре, при длине волны 275±6 нм. предлагается использовать в медицинской практике для нормализации функций головного мозга (RU 2275924). При этом сам препарат представляет собой лиофилизированный порошок белого или белого с желтоватым оттенком. Ввиду того, что Кортексин получают при выделении из коры головного мозга крупного рогатого скота, он имеет сложный состав, который практически невозможно охарактеризовать через последовательности аминокислот их их содержание. Так, в аминокислотном составе Кортексина имеется широкий спектр аминокислот, в т.ч. протеиногенных: аспарагиновая кислота и глицин, а также треонин, серин, глутаминовая кислота, пролин, аланин, валин, изолейцин, тирозин, фенилаланин, гистидин, лизин, аргинин и другие аминокислоты.
Однако, следует отметить, что Кортексин содержит набор полипептидных фракций различной молекулярной массы и неустановленного состава, при этом может содержать полипептидные фракции, которые могут вызвать побочное действие: непереносимость препарата, аллергию, тошноту, головокружение и др. Дополнительно, при наличии так называемые инертных или балластных фракций в препарате его вводимый объем может возрастать, что не всегда подходит для использования в детской практике. Препарат с таким неустановленным составом достаточно трудно получать и идентифицировать, а также контролировать его качество, т.к. состав точно не определен.
Таким образом, сохраняется потребность в разработке более эффективного препарата для нормализации функции головного мозга, обладающего ноотропным, нейроптротекторным, антиоксидантным и тканеспецифическим действием, при этом имеющего меньшие побочные действия.
Основная причина, ограничивающая эффективность и безопасность всех существующих нейропептидных препаратов, полученных из головного мозга млекопитающих - это их ксеногенное происхождение. При выделении нейропептидов из тканей головного мозга животных для снижения их иммуногенности (антигенных свойств) прибегают к кислотному или ферментативному гидролизу белков и высокомолекулярных полипептидов, тем самым уменьшая количество нейротрофических факторов роста белковой и полипептидной природы [Хабриева. У., 2005]. Пептидный препарат, полученный таким способом, содержит денатурированные продукты кислотного гидролиза белков и полипептидов с нарушенной четвертичной и третичной структурой, что снижает его специфичность и биологическую активность, повышает его иммуногенность, вызывая аллергические реакции при применении. Дополнительной причиной побочных реакций является, как правило, сложный состав таких органических препаратов, включающий разнообразные белки по аминокислотному составу и молекулярной массе. Среди таких белков зачастую есть белки, которые вызывают аллергические и другие побочные реакции, но отделить или очистить от них сам препарат достаточно сложно и трудоемко в виду схожести по свойствам с другими белками в составе, несущими полезную функцию.
Для решения данной проблемы авторами были получены белково-пептидная композиция с выраженным ноотропным, нейроптротекторным, антиоксидантным и тканеспецифическим действием. Данная композиция характеризуется тем, что в ее состав входят белки и полипептиды с молекулярной массой примерно 8300-8500 Да, количество связанных аминокислот составляет: аргинина 19 до 52 мкг/мг сухого остатка композиции, глицина – от 22 до 32 мкг/мг, аспарагина – от 107 до 138 мкг/мг, и глутамина – от 117 до 206 мкг/мг сухого остатка композиции.
В дополнительном варианте реализации количество связанных аминокислот составляет: аланина – от 29 до 50 мкг/мг, пролина – от 52 до 70 мкг/мг, лизина – от 50 до 83 мкг/мг, лейцина – от 34 до 56 мкг/ мг сухого остатка композиции.
Кроме того, предложена фармацевтическая композиция, содержащая композицию полипептидов согласно изобретению и фармацевтически приемлемый носитель.
Дополнительно, предложено применение композиции полипептидов согласно изобретению или фармацевтической композиции, включающей композицию полипептидов согласно изобретению, для купирования судорожного синдрома, восстановления нарушенной рефлекторной деятельности мозга, памяти, координации движений, при инсульте, излияниях в головной мозг или в качестве нейропротектора. Применение в таком случае можно осуществлять путем внутривенной инъекции, внутримышечного введения или ректально. Также композицию полипептидов согласно изобретению или фармацевтическую композицию, включающей композицию полипептидов согласно изобретению, можно применять отдельно или в комбинации с другим нейропротектором. Другой нейропротектор может представлять собой кортексин, церебролизин, актовегин, пирацетам, фенотропил, энцефабол, глиатилин, пантокальцин, глицин, фенибут, цитиколин, пикамилон, семакс, мексидол, цитофлавин, кавинтон, оксибрал, сермион, циннаризин, трентал.
Краткое описание фигур
На фиг. 1 приведена хроматограмма экстракта, полученная гель-фильтрационной хроматографией. Стрелкой показана фракция, которую выделяли.
На фиг. 2 приведен масс-спектр композиции полипептидов.
На фиг. 3 приведен масс-спектр композиции полипептидов, соответствующий времени удерживания 87,5-88,9 мин.
На фиг. 4 приведены результаты исследования биологической активности.
На фиг. 5 приведены результаты исследования биологической активности (гистограмма).
Подробное описание изобретения
Настоящее изобретение заключается в том, что была получена композиция полипептидов, обладающая свойством нормализовать функции головного мозга, ноотропным, нейроптротекторным, антиоксидантным и тканеспецифическим действием, характеризующаяся следующими показателями:
- молекулярная масса полипептидов составляет примерно 8300-8500 Да;
- количество связанных аминокислот составляет: аргинина 19 до 52 мкг/мг сухого остатка композиции, глицина – от 22 до 32 мкг/мг, аспарагина – от 107 до 138 мкг/мг, и глутамина – от 117 до 206 мкг/мг сухого остатка композиции.
В дополнительном варианте реализации количество связанных аминокислот составляет: аланина – от 29 до 50 мкг/мг, проилна – от 52 до 70 мкг/мг, лизина – от 50 до 83 мкг/мг, лейцина – от 34 до 56 мкг/ мг сухого остатка композиции.
Данная композиция получена из экстракта мозга млекопитающих. Экстракт получают из мозга крупного рогатого скота по методике, известной из предшествующего уровня техники. Далее, из полученного экстракта выделяют композицию полипептидов согласно изобретению.
Полученная композиция полипептидов обладает ноотропным, нейроптротекторным, антиоксидантным и тканеспецифическим действием. Дополнительно, данная композиция характеризуется следующими показателями:
- молекулярная масса полипептидов составляет примерно 8300-8500 Да;
- количество связанных аминокислот составляет: аргинина примерно от 19 до 52 мкг/мг сухого остатка композиции, глицина – примерно от 22 до 32 мкг/мг, аспарагина – примерно от 107 до 138 мкг/мг, и глутамина – примерно от 117 до 206 мкг/мг сухого остатка композиции.
Кроме того, в полученной композиции количество связанных аминокислот составляет: аланина – примерно от 29 до 50 мкг/мг, пролина – примерно от 52 до 70 мкг/мг, лизина – примерно от 50 до 83 мкг/мг, лейцина – примерно от 34 до 56 мкг/ мг сухого остатка композиции.
Показано, что композиция полипептидов согласно изобретению обладает нейропротекторным действием. Нейропротекторное действие предполагает, что при остром и хроническом повреждении нейронов происходит снижение цитотоксического отека мозга, нормализация репаративных процессов в головном мозге и процессов ремиелинизации периферической нервной системы, восстановление устойчивой деятельности мозга, снижение поражения нейронов при различных эндогенных нейротоксических факторов и токсических эффектов нейротропных веществ и апоптоза нейронов. Ноотропное действие композиции полипептидов согласно изобретению предполагает сохранение и повышение функций головного мозга, улучшение процессов обучения и памяти, концентрации внимания, общего тонуса нервной системы и сопротивляемости различным стрессовым воздействиям. Антиоксидантное действие предполагает ингибирование перекисного окисления липидов в нейронах и клетках глии, сохранение устойчивого функционирования всех отделов нервной системы, активацию защиты нейронов в условиях оксидантного стресса. Тканеспецифическое действие означает активизацию метаболизма нейронов центральной и периферической нервной системы и нормализациюи функций коры головного мозга.
В целом, композиция полипептидов по свойствам представляет собой нейропептидный препарат, который оказывает влияние на биоэлектрическую активность головного мозга, регулирует соотношение тормозных и возбуждающих аминокислот, обеспечивает ГАМК- ергическое действие, снижает токсичность нейротропных веществ и контролирует экспрессию генов, синтез белка в клетках. Все эти процессы входят в каскад патогенетической коррекции постаноксического состояния и другого рода повреждений, сопровождающихся нарушением ауторегуляции мозгового кровотока и повреждения нейронов.
Водорастворимые полипептиды в контексте данного изобретения означают полипептиды, состоящие из аминокислот, растворимы в воде. Методы определения количественного содержания водорастворимых полипептидов могут быть различными, например, с помощью спектрометрии, например, по методу спектрофотометрического определения по методу Брэдфорда.
Молекулярная масса в контексте данного изобретения означает молекулярный вес полипептида, выраженный в единице измерения дальтон (Да). Полипептиды, входящие в состав композиции полипептидов по изобретению, имеют молекулярную массу примерно от 8300 Да до примерно 8500 Да. Методы определения молекулярной массы известны из предшествующего уровня техники: хроматографическими, физическими, с помощью методом спектрометрии, например, масс-спектрометрии.
Связанные аминокислоты в контексте данного изобретения означает аминокислоты, находящиеся в ассоциированном состоянии (в связи какой-либо природы) с белками и другими структурами или веществами в органе или организме либо в виде непосредственно самих белков или пептидов, образуя их. Ранее было выяснено, что роль связанных аминокислот заключается не только в их нейромедиаторных функциях, но и в модификации белков, а также регуляции метаболических процессов, обеспечивающих адаптацию мозга.
Свободные аминокислоты в контексте данного изобретения относится как к белковым, так и небелковым аминокислотам. Белковые (протеиногенные) аминокислоты могут находиться в несвязанной в белки или пептиды форме.
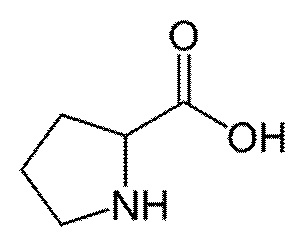
Ниже представлены формулы аминокислот, входящих в состав композиции:
Термин «примерно» используется для указания того, что значение включает характерную погрешность устройства, методики, использующейся для определения значения, и/или колебания, которые присущи исследуемым объектам. Например, но без наложения ограничений, если используется термин "примерно", то указанное значение может быть больше или меньше на 12% или 11%, или 10%, или 9%, или 8%, или 7%, или 6%, или 5%, или 4%, или 3%, или 2%, или 1%.
Композиция полипептидов согласно настоящему изобретению может быть в форме лиофилизата. Способы получения лиофилизата известны из уровня техники. Как правило, лиофилизат получают замораживанием раствора, включающего композицию полипептидов и, возможно, вспомогательные вещества, такие как стабилизаторы, наполнители, консерванты, и подверганием данного раствора сублимационной сушке при пониженном давлении.
Дополнительно, композиция полипептидов согласно изобретению может быть представлена в виде фармацевтической композиции, содержащей композицию полипептидов в эффективном количестве и фармацевтически приемлемый носитель.
Так, фармацевтически эффективное количество может составлять от 1 мг до 50 мг на 1 г фармацевтической композиции. При этом, фармацевтически приемлемый носитель в указанной фармацевтической композиции может составлять остальное, до 1 г. Фармацевтически приемлемый носитель может представлять собой носитель, растворитель или разбавитель, вспомогательные вещества, традиционно используемые для приготовления готовых лекарственных форм. Так, в случае инъекционных форм, например, в случае готовых лекарственных форм в виде инъекции, вводимых внутривенно или внутримышечно, носителем или растворителем может выступать вода для инъекций или любой раствор, в т.ч. и на водной основе, предназначенный для введения таким способом, а вспомогательными веществами могут быть стабилизаторы, вещества, обеспечивающие изотоничность, вещества для регуляции рН. вязкости, консерванты. В случае ректальных форм носитель может представлять собой суппозиторную основу, которая может быть гидрофильной, гидрофобной основой, эмульсионной или основой другого типа, пригодной для приготовления данных готовых лекарственных форм. Ректальная форма также может содержать вспомогательные вещества, традиционно используемые для получения ректальных форм, например, консерванты, эмульгаторы, загустители, пластификаторы и иные вспомогательные вещества.
Кроме того, настоящее изобретение включает также применение композиции полипептидов для купирования судорожного синдрома, восстановления нарушенной рефлекторной деятельности мозга, памяти, координации движений, при инсульте, излияниях в головной мозг или в качестве нейропротектора.
Судорожный синдром представляет собой состояние, которое наступает внезапно и характеризуется непроизвольным сокращением мышц, может сопровождаться изменением сознания человека. Лечение или купирование судорожного синдрома заключается в снижении количества рецидивов, ослаблении симптомов, замедлении или приостановлении прогрессирования данного состояния.
Рефлекторная деятельность мозга заключается в быстрой и адекватной ответной реакции организма на внешнее или внутреннее раздражение. В рефлекторном механизме принято различать три части: чувствующую, центральную и двигательную. Раздражитель вызывает процесс возбуждения в концевых разветвлениях чувствующего нерва. Возбуждение по чувствующему нерву передается в центр (мозг), где переключается на двигательный нерв и по нему достигает рабочего органа, при этом возникает ответная реакция на раздражение. Эти три части рефлекторного механизма вместе называются рефлекторной дугой. При этом в мозге данные механизмы осуществляются за счет различных рецепторов и сигнальных веществ, при участии различных отделов. Таким образом, установить природу и причину нарушения рефлекторной деятельности мозга достаточно сложно. При нарушениях рефлекторной деятельности, как правило, диагностируют отклонения от нормы как в поведении, так и в вегетативной сфере. Они относятся к категории неврозов и выражаются в нарушении ориентировочно-исследовательского рефлекса, в неадекватных реакциях на сигналы из внешней среды, в дефектах памяти, в плохой обучаемости, нестабильном проявлении навыков, недостаточной пространственной ориентации, эмоциональных сдвигах, а также в патологических изменениях со стороны сердечно-сосудистой, пищеварительной, эндокринной и других систем организма.
Восстановление при данном нарушении означает улучшение рефлекторной деятельности по сравнению с состоянием до лечения, ослабление симптомов или замедление их прогрессирования, восстановление функций ориентации в пространстве, повышении эффективности реакций на внешние раздражители, повышении компенсаторных функций организма, улучшение когнитивных функций, более ровного поведения в быту, восстановление нормального психо-эмоциального характера.
Нарушение памяти означает состояние, при котором происходит снижение или утрата способности запоминать, сохранять, узнавать и воспроизводить информацию. При различных заболеваниях могут страдать отдельные компоненты памяти, такие как запоминание, удержание, воспроизведение.
Восстановление при нарушении памяти означает приостановление прогрессирования нарушения памяти, улучшение состояния или ослабление симптомов нарушения памяти, при этом это может выражаться в снижении эпизодов потери памяти, повышении объема запоминаемой информации, улучшение когнитивных навыков.
Нарушение координации движений может выражаться в неустойчивости пациента, раскачивании из стороны в сторону при стоянии или ходьбе, потери равновесия, падениях при ходьбе на ровных поверхностях. В особо тяжелых случаях это состояние может сопровождаться тошнотой и рвотой. Также состояние может приводить к дизартрии и нистагму, тремору конечностей, снижению мышечного тонуса. Восстановление данной функции при приеме средств может выражаться в ослаблении симптомов, облегчении состояния и замедлении его прогрессирования, повышении общего мышечного тонуса и компенсаторных функций.
Инсульт представляет собой острое нарушение кровоснабжения головного мозга (острое нарушение мозгового кровообращения), характеризующееся внезапным (в течение нескольких минут, часов) появлением очаговой и/или общемозговой неврологической симптоматики, которая сохраняется более 24 часов или приводит к смерти больного в более короткий промежуток времени вследствие цереброваскулярной патологии и излиянию в головной мозг. Последствия инсульта и излияния в мозг могут выражаться в парезе мышц лица и тела, нарушении координации и двигательной функции, снижении тонуса мышц, спутанности сознания, нарушении памяти и рефлекторной деятельности мозга и когнитивных расстройств. Лечение заключается в восстановлении утраченных функции и повышении компенсаторных функций организма, снижении последствий данного состояния.
Нейропротекторы представляют собой вещества или фармацевтические препараты, котороые позволяют защитить клетки мозга от повреждающих воздействий, предотвратить их гибель или улучшить их функции, в основном, за счет восстановления связей между нейронами, повышения качества передачи сигнала, что в конечном счете может приводить к улучшению или нормализации умственной активности, ослаблении или восстановлении нарушенных функций, в т.ч. функций памяти, двигательных и координационных функций, когнитивных навыков и рефлекторной деятельности мозга, повышении устойчивости мозга к гипоксии, общей умственной и физической работоспособности.
При этом, применение композиции полипептидов или фармацевтической композиции, содержащей композицию полипептидов согласно изобретению, для лечения или восстановления при указанных выше состояниях возможно в форме внутривенной инъекции, внутримышечной инъекции или композиции в виде ректальной формы.
При этом, композицию полипептидов можно вводить отдельно или в комбинации с другим нейропротектором. Под другим нейропротектором подразумевается препарат, который применяют для восстановления или нормализации деятельности мозга и нервной системы, повышению умственной и физической работоспособности.
В частности, другой нейропротектор может представлять собой кортексин, церебролизин, актовегин, пирацетам, фенотропил, энцефабол, глиатилин, пантокальцин, глицин, фенибут, цитиколин, пикамилон, семакс, мексидол, цитофлавин, кавинтон, оксибрал, сермион, циннаризин, трентал.
Для купирования судорожного синдрома, восстановления нарушенной рефлекторной деятельности мозга, памяти, координации движений, при инсульте, излияниях в головной мозг или в качестве нейропротектора можно использовать не только композицию полипептидов согласно настоящему изобретению, но и фармацевтическую композицию, содержащую данную композицию полипептидов. Применять фармацевтическую композицию можно путем внутривенной инъекции, внутримышечного введения или ректальной формы. При этом, применять фармацевтическую композицию можно отдельно или в комбинации с другим нейропротектором. В частности, другой нейропротектор представляет собой кортексин, церебролизин, актовегин, пирацетам, фенотропил, энцефабол, глиатилин, пантокальцин, глицин, фенибут, цитиколин, пикамилон, семакс, мексидол, цитофлавин, кавинтон, оксибрал, сермион, циннаризин, трентал.
Настоящее изобретение ниже приведено в виде примеров, которые никоим образом не ограничивают объем и предназначены только в иллюстративных целях.
Примеры
Пример 1
Способ получения экстракта мозга млекопитающих
Сырье для выделения композиции полипептидов получали согласно способу, описанному в патенте RU 2275924. Экстракт после получения лиофилизовали, получая белый или желтовато-белый порошок.
Пример 2
Выделение композиции полипептидов с использованием гель-фильтрационной хроматографии
Полученный на предыдущей стадии экстракт представляет собой комплекс водорастворимых полипептидов с молекулярной массой до
10 000 Да. Для разделения на фракции применяли разделение с помощью гель-фильтрационной хроматографии. Условия приведены ниже:
Условия разделения на колонке HiLoad 16/60 Superdex 30 prep grade
Результаты, полученные при анализе полученного экстракта гель-фильтрационной хроматографией, представлены на Фиг. 1.
Была выделена фракция при временах удерживания от примерно 73 до примерно 83 мин. Полученную фракцию высушили до постоянной массы.
Пример 3
Анализ полученной композиции полипептидов
Анализ полипептидов, входящих в полученную ранее фракцию, проводили методами спектрофотометрии, методами ВЭЖХ-УФ-анализа и ВЭЖХ-МС анализа.
Количество водорастворимых пептидов определяли по методу Брэдфорда с применением спектрометрии. Использовали стандартные растворы и реактивы. Измеряли оптическую плотность испытуемого раствора на спектрофотометре на длине волны 595 нм. В качестве калибровочного образца использовали стандартный образец Кортексина (без искусственного глицина) в количестве 50 мг. Количество водорастворимых пептидов составило от примерно 3,1 до примерно 7,0 мг на 1 мг сухого остатка.
Общее количество аминокислот определяли методом кислотного гидролиза с последующей дериватизацией с помощью ВЭЖХ-УФ анализа.
Для определения количества аминокислот, входящих в состав пептидов, необходимо было определить количество свободных аминокислот в образце и общее количество аминокислот в этом же образце. Для определения свободных аминокислот проводили дериватизацию. Для определения общего количества аминокислот проводили дериватизацию образца после предварительно проведенного кислотного гидролиза с последующей нейтрализацией. Для этого в стеклянную виалу автоинжектора хроматографа помещали 10 мкл образца, добавляли 70 мкл AccQ•Tag Ultra Borate buffer (боратный буфер) и 20 мкл раствора AccQ•Tag Ultra reagent (коммерческий реагент). Содержимое виалы с плотно закрытой крышкой немедленно перемешивали на вортексе и выдерживали сначала при комнатной температуре 1 минуту, а затем при 55°С в течение 10 минут. Дериваты были устойчивы при комнатной температуре в течение 1 недели.
Условия хроматографии приведены ниже:

Количество свободных аминокислот определяли методом дериватизации без гидролиза, с помощью ВЭЖХ-УФ анализа. Для расчета количества аминокислот, находящихся в составе пептидов, то есть связанных аминокислот, из общего количества вычитали количество свободных аминокислот.
Количество связанных аминокислот составило:
аргинина – от примерно 19 до примерно 52 мкг/мг сухого остатка композиции,
глицина – от примерно 22 до примерно 32 мкг/мг,
аспарагина – от примерно 107 до примерно 138 мкг/мг, и
глутамина – от примерно 117 до примерно 206 мкг/мг сухого остатка композиции.
Количества других аминокислот составило:
аланина – от примерно 29 до примерно 50 мкг/мг,
пролина – от примерно 52 до примерно 70 мкг/мг,
лизина – от примерно 50 до примерно 83 мкг/мг,
лейцина – от примерно 34 до примерно 56 мкг/ мг сухого остатка композиции.
Молекулярные массы пептидов определяли методом ВЭЖХ-МС с последующим расчетом молекулярной массы характерных пептидов на основании полученных хроматограмм.
Условия проведения анализа представлены ниже:

Параметры масс-детектора:
Результаты масс-хроматографии полученной композиции полипептидов представлены на Фиг. 2.
Для определения молекулярной массы по масс-спектрам низкого разрешения используется метод деконволюции.
Результат определения молекулярной массы основных пептидов композиции полипептидов согласно изобретению после разделения в режиме гель-фильтрационной хроматографии
Кроме того, полученную композицию разводили по полного растворения в воде и определяли рН полученного раствора. рН составил от 5,0 до 6,6.
Пример 4
Определение биологической активности полученной композиции полипептидов на куриных эмбрионах
Биологическую активность композиции полипептидов оценивали по влиянию на рост нервных элементов или выселяющихся клеток в зоне роста в культуре ткани головного мозга куриных эмбрионов при сравнении с контролем.
В качестве биологической тест-системы использовали головной мозг куриных эмбрионов, извлечённых из яиц после 9-12 суток инкубации.
Количественную оценку влияния препарата на рост ткани головного мозга эмбрионов выполняли морфометрическим методом с последующим расчётом индекса площади роста клеток (далее ИП) и расчетного значения ИП%, выражающего разницу площади контрольного и опытного образца, выраженного в процентах.
В качестве эталона активности был принят минимально допустимый ИП% ткани головного мозга после культивирования с ЛП Кортексин® в концентрации 20 нг/мл = 20%.
В результате проведенных исследований было показано, что композиция полипептидов обладает биологической активностью: стимулирует увеличение площади роста нервной ткани не менее, чем на 20% относительно контроля.
Для проведения анализа брали яйцо с куриным эмбрионом возрастом 9-12 суток, мыли яйцо водой с мылом. Извлекали куриный эмбрион. Хирургическими инструментами, обработанными в 96° растворе спирта этилового с последующим пломбированием, разрезали пленку, покрывающую головной мозг, выделяли ткань головного мозга и помещали ее в стерильную чашку Петри с несколькими каплями раствора Хенкса. Прикрепляли к поверхности шести чашек Петри по 12-14 фрагментов нервной ткани размером около 0,5 мм, затем чашки закрывали и выдерживали 2-4 минуты в ламинарном шкафу при комнатной температуре. Далее вносили по 3 мл среды для культивирования без добавления объектов испытания, после чего в опытные чашки вносили объекты испытания концентрации 20 нг/мл в объеме 3 мл.
Опытные и контрольные чашки Петри закрывали крышками и помещали их в СО2-инкубатор с 5% содержанием углекислого газа и температурой (37±1) °С на 50 часов.
Биологическую активность композиции полипептидов определяли по влиянию на рост нервных элементов или выселяющихся клеток в зоне роста в культуре ткани головного мозга куриных эмбрионов при сравнении с контролем. Испытание проводили с помощью светового микроскопа.
Исходную площадь фрагмента нервной ткани измеряли путем его обведения с помощью инструмента «Draw or Erase Feature» модуля TotalLab Colony Counter. Значение параметра "площадь" вносили в таблицу регистрации результатов в графу «min». Площадь всего фрагмента нервной ткани головного мозга, включая периферическую зону роста, измеряли тем же способом и вносили полученный результат в таблицу регистрации результатов в графу «max».
ИП рассчитывали как отношение площади всего фрагмента нервной ткани головного мозга, включая периферическую зону роста, к исходной площади фрагмента нервной ткани (max/min).
Для прогноза биологической активности объектов испытания рассчитывали ИП% с использованием формулы 1.
ИП%=((ИПо-ИПк)/ИПк)×100% (1)
Где: ИП% – индекс площади роста клеток для объекта испытания; ИПо – индекс площади роста клеток опытных образца; ИПк – индекс площади роста клеток контрольного образца.
Объект испытания считали биологически активным, если ИП% ткани головного мозга после культивирования с объектами испытания в концентрации 20 нг/мл был не менее чем на 20 % больше ИП в контроле.
Статистическую обработку результатов расчета ИП проводили c применением t-критерия для независимых выборок с использованием программного обеспечения Prism 6 (GraphPad Software, США). Различия считались статистически значимыми при p<0,05. В отчете результаты представлены в виде гистограмм, отражающих средние значения и стандартное отклонение и статистические отличия, значение n (количество измерений в каждой группе) было равно 14.
На фиг. 4 приведены фотографии роста клеток на курином эмбрионе в случае контроля и композиции полипептидов. Видно, что в случае композиции полипептидов согласно изобретению площадь роста нервных клеток выше.
Таким образом, была показана тканеспецифическая и нейропротекторная активность композиции полипептидов.
Пример 5
Определение хронической токсичности композиции
Для оценки хронической токсичности использовали модель на мышах, при этом был выбран период 3 месяца.
В опытах на грызунах (крысы обоего пола) композицию полипептидов, полученную в примере 2, вводили в/м ежедневно на протяжении 90 дней в 3 дозах: в 10 раз большей терапевтической для человека - 1,5 мг/кг; максимальной 150 мг/кг (в 1000 раз большей терапевтической для человека, не вызывает гибели у крыс при однократном введении) и промежуточной - 15 мг/кг.
Исследования проводились в соответствии с экспериментальной программой:
Животные - крысы самки, крысы самцы.
Путь введения - внутримышечный.
Дозы: 1 доза - 1,5 мг/кг; 2 доза - 15 мг/кг; 3 доза - 150 мг/кг.
Частота введения - в течение 90 дней.
Растворитель - вода для инъекций.
Число животных - 1 доза - 20 самцов, 20 самок;
2 доза - 20 самцов, 20 самок;
3 доза - 20 самцов, 20 самок.
Общее количество - 160, из них 40 - контрольная группа.
В процессе эксперимента проводили оценку следующих показателей: общее состояние, взвешивание, потребление воды, гематологические, биохимические исследования, физиологические исследования, макроскопическое исследование и взвешивание внутренних органов, гистологические исследования.
По итогам исследования было установлено, что композициб полипептидов согласно изобретению у крыс обоих полов в/м один раз в сутки в течение 90 дней в дозах 1,5; 15; 150 мг/кг не влияет на внешний вид, общее состояние и поведение животных, не оказывает негативного влияния на биохимические параметры крови и основные физиологические функции организма, не вызывает патоморфологических изменений. Таким образом, следует сделать вывод, что композиция хорошо переносима, безвредна, не обладает острой и хронической токсичностью.
Пример 6
Исследование биологической активности
Для подтверждения биологической активности заявленного фармацевтического средства и его способности нормализации функций головного мозга были проведены исследования по изучению фармакологической активности на модели острой черепно-мозговой травмы (ОЧМТ).
Для моделирования черепно-мозговой травмы использовали специальную установку, состоящую из металлической трубки длиной 0,5 м, диаметром 2 см и стального шарика весом 0,03 кг. Для фиксации головы крысы помещались в стандартные домики из плексигласа, в передней части которых находилось отверстие, соответствующее диаметру трубки. Травму наносили при падении шарика на теменную область черепа животных. После нанесения травмы у крыс наблюдали мышечную релаксацию, кратковременную потерю сознания, сопорозное состояние и кратковременные судороги. Отмечено, что в течение 30-40 минут у крыс сохранялась атаксия, а рефлекторные реакции были нарушены в течение 1,5-3 часов.
Композицию полипептидов начинали вводить в/м со следующего дня после острой травмы в дозах 1,5 мг/кг 1 раз в день на протяжении 10 дней.
Об эффективности лечения судили по клинической картине, динамике массы тела, относительной массы головного мозга, функциональному состоянию центральной нервной системы, показателям тканевого дыхания, активности метаболических процессов в головном мозге и гистологической картине мозга.
В таблице показано состояние при ОЧМТ функций центральной нервной системы (нарушения процессов обучения, памяти, возбуждения и торможения) без лечения и после применения композиции согласно изобретению.
УРПИ - условный рефлекс пассивного избегания.
Из данных таблицы видно, что композиция полипептидов согласно изобретению нормализует функции центральной нервной системы.
Данные таблицы показывают, что в результате ОЧМТ тонус мышц увеличивался, а величина реакции на механическое раздражение заметно снижалась, что свидетельствует о нарушениях сопряжения рефлекторных процессов в центральной и периферической нервных системах. Применение композицию полипептидов способствует нормализации периферической нервной системы и мышц.
Представленные результаты свидетельствуют о эффективности композиции полипептидов при лечении последствий острой черепно-мозговой травмы. Также, на основании полученных результатах можно говорить об эффективном ноотропном, нейроптротекторном, антиоксидантном и тканеспецифическом действии композиции полипептидов согласно изобретению. Композиция согласно изобретению может быть использована для купирования судорожного синдрома, восстановления нарушенной рефлекторной деятельности мозга, памяти, координации движений, при инсульте, излияниях в головной мозг или в качестве нейропротектора.
Пример 7
Исследование аллергических реакций
В качестве исследования возможных побочных действий выбрали модель на 2-хмесячных крысах породы норвежские коричневые, массой около 150 г. Крыс разделили на 3 группы, по 8 в каждой (контроль (интактные животные); с введением альбумина из яичного желтка 0,1 мг; с введением композиции полипептидов 1,5 мкг/кг). Аллергические реакции вызывали введением перорально альбумин из яичного желтка в течение 10 дней. Композицию полипептидов также вводили перорально в течение 10 дней.
Крыс содержали в чистом помещении, на безаллергенной диете, наблюдали в течение 30 дней. При выявлении кожной аллергии записывали симптомы, делали измерения (если применимо).
Результаты включали следующее описание:
- У интактных животных не отмечено аллергических реакций, в т.ч. в виде кожных.
- У 6 животных из группы, получавшей альбумин из яичного желтка (Группа 1), на 3 день от начала приема развились активные кожные реакции: образование неровностей кожи и раздражение, расчесывания раздраженных мест, зуд и беспокойство животного, дерматит на лапах. На 11 день (1 день спустя завершения приема альбумина) кожные реакции усилились, появилась вялость и сонливость животных. На 15 и далее день у 4 животных из 6 описанных выявлялись кожные реакции, но со сниженным эффектом.
- У 3 животных из группы, получавших композицию полипептидов (Группа 2), диагностировали зуд и раздражение кожи, расчесывание раздраженных участков. К 20 дню данные явления не были отмечены.
Параллельно с внешним осмотром отбирали кровь и проводили клинический анализ крови на наличие базофилов (Б), эузинофилов (Э) и нейтрофилов (Н) (показатели аллергической реакции). Взято среднее из 8 животных, приведено объемное содержание в %.
Э – 0,15
Н - 10
Э – 0,15
Н - 10
Э – 0,15
Н - 10
Э – 0,15
Н - 10
Э – 0,15
Н - 10
Э – 2,0
Н – 17
Э – 1,8
Н – 17
Э – 1,5
Н – 15
Э – 1,5
Н – 13
Э – 1,2
Н – 13
Э – 1,5
Н – 14
Э – 1,5
Н – 13
Э – 1,1
Н – 13
Э – 1,1
Н – 11
Э – 1,0
Н – 10
Как видно из результатов, композиция полипептидов практически не вызывает аллергии на модели крыс.
Пример 8
Получение фармацевтических композиций, включающих композицию полипептидов, в виде инъекций
Полученную в Примере 2 композицию полипептидов лиофилизовали, растворяли в различных количествах в фармацевтическом растворителе (воде, новокаине) и анализировали на стабильность.
Все указанные растворы были стабильны и активны в отношении роста нервных клеток (анализ аналогично Примеру 4).
Данные растворы предназначались для введения внутримышечно или внутривенного введения.
Пример 9
Получение фармацевтических композиций, включающих композицию полипептидов, для ректального введения
Композицию полипептидов в виде лиофилизата из Примера 2 растворяли в небольшом количестве воды и вводили в суппозиторную массу «Witepsol W». WITEPSOL W представляет собой коммерчески доступную суппозиторную основу, содержащую твердые жиры с числом гидроксильных групп 20–50. В состав данной основы входят триглицериды (65-80%), диглицериды (10-35%) и моноглицериды (1-5%). Входящие в состав неполные глицериды замедляют осаждение твердых частиц, способствуют смачиванию слизистых оболочек и улучшают абсорбцию активных компонентов.
Получали фармацевтическую композицию, в виде суппозиториев для ректального введения со следующим составов:
Все композиции были стабильны, плавились при температуре 35-37°С и обеспечивали высвобождение активного вещества в течение 45 мин.





Группа изобретений относится к области биологии и медицины и касается новой композиции полипептидов, выделенных из экстракта коры головного мозга крупного рогатого скота, фармацевтической композиции на ее основе и их применению. Композиция полипептидов обладает ноотропным, нейропротекторным, антиоксидантным, тканеспецифическим действием и характеризуется следующими показателями: молекулярная масса полипептидов составляет примерно 8300-8500 Да; количество связанных аминокислот составляет: аргинина – 19 до 52 мкг/мг, глицина – от 22 до 32 мкг/мг, аспарагина – от 107 до 138 мкг/мг, глутамина – от 117 до 206 мкг/мг, аланина – от 29 до 50 мкг/мг, пролина – от 52 до 70 мкг/мг, лизина – от 50 до 83 мкг/мг, лейцина – от 34 до 56 мкг/мг сухого остатка композиции. Фармацевтическая композиция для нормализации функции головного мозга содержит вышеуказанную композицию полипептидов и фармацевтически приемлемый носитель. Предлагается также применение вышеуказанных композиций для купирования судорожного синдрома, восстановления нарушенной рефлекторной деятельности мозга, памяти, координации движений, при инсульте, излияниях в головной мозг или в качестве нейропротектора. Композиция полипептидов обладает свойствами нормализации функции головного мозга, при этом имеет меньшие побочные действия по сравнению с прототипом при ее применении. 4 н. и 7 з.п. ф-лы, 5 ил., 12 табл., 9 пр.
1. Композиция полипептидов, полученных из экстракта мозга крупного рогатого скота с помощью гель-фильтрации, обладающая ноотропным, нейропротекторным, антиоксидантным и тканеспецифическим действием, характеризующаяся следующими показателями:
- молекулярная масса полипептидов составляет примерно 8300-8500 Да;
- количество связанных аминокислот составляет:
аргинина – 19 до 52 мкг/мг,
глицина – от 22 до 32 мкг/мг,
аспарагина – от 107 до 138 мкг/мг, и
глутамина – от 117 до 206 мкг/мг сухого остатка композиции;
- количество дополнительных связанных аминокислот составляет:
аланина – от 29 до 50 мкг/мг,
пролина – от 52 до 70 мкг/мг,
лизина – от 50 до 83 мкг/мг,
лейцина – от 34 до 56 мкг/ мг сухого остатка композиции.
2. Композиция полипептидов по п. 1 в форме лиофилизата.
3. Фармацевтическая композиция для нормализации функции головного мозга, содержащая композицию полипептидов по пп. 1, 2 и фармацевтически приемлемый носитель.
4. Применение композиции полипептидов по пп. 1, 2 для купирования судорожного синдрома, восстановления нарушенной рефлекторной деятельности мозга, памяти, координации движений, при инсульте, излияниях в головной мозг или в качестве нейропротектора.
5. Применение по п. 4, отличающееся тем, что применение осуществляют путем внутривенной инъекции, внутримышечного введения или ректально.
6. Применение по пп. 4, 5, отличающееся тем, что композицию полипептидов вводят отдельно или в комбинации с другим нейропротектором.
7. Применение по п. 6, отличающееся тем, что другой нейропротектор представляет собой кортексин, церебролизин, актовегин, пирацетам, фенотропил, энцефабол, глиатилин, пантокальцин, глицин, фенибут, цитиколин, пикамилон, семакс, мексидол, цитофлавин, кавинтон, оксибрал, сермион, циннаризин, трентал.
8. Применение фармацевтической композиции по п. 3 для купирования судорожного синдрома, восстановления нарушенной рефлекторной деятельности мозга, памяти, координации движений, при инсульте, излияниях в головной мозг или в качестве нейропротектора.
9. Применение по п. 8, отличающееся тем, что применение осуществляют путем внутривенной инъекции, внутримышечного введения или ректально.
10. Применение по пп. 8, 9, отличающееся тем, что композицию по п. 3 вводят отдельно или в комбинации с другим нейропротектором.
11. Применение по п. 10, отличающееся тем, что другой нейропротектор представляет собой кортексин, церебролизин, актовегин, пирацетам, фенотропил, энцефабол, глиатилин, пантокальцин, глицин, фенибут, цитиколин, пикамилон, семакс, мексидол, цитофлавин, кавинтон, оксибрал, сермион, циннаризин, трентал.
| СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСА БИОЛОГИЧЕСКИ АКТИВНЫХ ПОЛИПЕПТИДОВ ДЛЯ НОРМАЛИЗАЦИИ ФУНКЦИЙ ГОЛОВНОГО МОЗГА И ФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО НА ЕГО ОСНОВЕ | 2004 |
|
RU2275924C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКИ АКТИВНОГО ПЕПТИДНОГО ПРЕПАРАТА, ОБЛАДАЮЩЕГО АДАПТОГЕННЫМИ СВОЙСТВАМИ | 1992 |
|
RU2082429C1 |
| Устройство для испытания манометров и иных приборов переменным давлением | 1928 |
|
SU10720A1 |
| 0 |
|
SU258111A1 | |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
Авторы
Даты
2020-07-21—Публикация
2019-09-17—Подача