Область, к которой относится изобретение
Настоящая заявка относится к области медицины, в частности, к лечению рака. Более конкретно, настоящая заявка относится к фармацевтической композиции для лечения рака, включающей полиинозиновую-полицитидиловую кислоту (PIC), антибиотик или полиаминовое соединение, положительный ион и, необязательно, инактивированный или аттенуированный вирус; и к ее применению для лечения рака.
Предпосылки создания изобретения
Рак обычно относится к злокачественной опухоли. Под влиянием канцерогенных факторов некоторые клетки в тканях утрачивают нормальную регуляцию роста на генетическом уровне, что приводит к аномальной пролиферации и дифференцировке, в конечном итоге к опухоли. По сравнению с доброкачественной опухолью злокачественная опухоль растет быстрее, является инвазивной, имеет склонность к геморрагированию, некрозу, изъязвлению и часто метастазированию.
Существует более 100 различных известных видов рака, которые поражают людей. 5 наиболее распространенных очагов рака представляют собой рак легких, предстательной железы, ободочной и прямой кишки, желудка и печени у мужчин, а также молочной железы, ободочной и прямой кишки, легких, шейки матки и желудка у женщин. Jie He and Wanqing Chen et al опубликовали статью по названием Cancer Statistics in China, 2015 в Cancer Journal for Clinicians. Это исследование проанализировало и предсказало заболеваемость и смертность от злокачественных опухолей в Китае в 2015 году. Данные показали, что в Китае ожидалось 4292000 новых случаев злокачественных опухолей в 2015 году. Пять наиболее распространенных видов рака - это рак легких и бронхов, рак желудка, рак печени, рак пищевода и колоректальный рак у мужчин, и рак молочной железы, рак легких, рак желудка, колоректальный рак и рак пищевода у женщин. Рак легкого является одной из наиболее распространенных злокачественных опухолей в Китае, при этом такие злокачественные опухоли имеют самый высокий показатель смертности.
По данным Всемирной организации здравоохранения (ВОЗ), ежегодно число новых случаев заболевания раком составляет около 14 миллионов, из которых 8,2 миллиона человек умирают от рака, что составляет 13% от всех смертей во всем мире. Рак является основной причиной смерти как в развитых, так и в развивающихся странах. Ожидается, что это бремя будет расти во всем мире, и в ближайшие два десятилетия (ВОЗ) ожидается, что чило новых случаев рака вырастет примерно на 70%. Поэтому растущая тенденция заболеваемости раком заставила человечество больше работать над профилактикой и лечением рака.
В настоящее время основными методами лечения рака являются хирургическое лечение, химиотерапия, которая использует убивающие раковые клетки лекарственные средства, лучевая терапия, которая использует излучение высокой энергии для уничтожения раковых клеток, таргетная терапия, которая использует вещества, нацеленные на конкретные раковые клетки, для доставки целевой терапии, иммунотерапия, которая использует иммунную систему для лечения рака.
Кроме того, постепенно было отмечено применение вируса в лечении рака. В 1912 году DePace обнаружил регрессию опухоли шейки матки после прививки вакцины против бешенства женщине-пациенту, которую укусила собака. С тех пор было опубликовано несколько сообщений об использовании вируса для лечения рака. Особенно в период с 1950 по 1960 год вирусное лечение рака получило быстрое развитие. В 1970-х годах развитие вирусной терапии замедлилось из-за опасений, связанных с вирусной патогенностью, но в 1980-х годах темпы снова увеличились.
Guoqian Kuang et al. описали потенциальный механизм противораковых вирусов, а также выбор и метод в клиническом применении (Current Status and Prospect of Cancer Viroтерапи Clinical Studies, Journal of Guangxi Medical University, 1995 Vol. 12: 617-619). В настоящее время стало понятно, что механизм противораковых вирусов включает прямое онколитическое действие, усиливая иммунную систему и стимулируя выделение цитокинов. Обычно считается, что вирус, используемый при лечении рака, должен быть не-опухолегенным и с хорошей антигенностью. Вирусы, о которых сообщалось для противоракового лечения, включают: NDV, вирус свинки, вирус коровьей оспы, вирус Сендай, HSV (вирус простого герпеса) и парвовирус (Kenney S et al., Viruses as oncolytic agents: a new age для ʺtherapeuticʺ viruses. J Nati Cancer Inst, 1994,86:1185). Lorence et al обнаружили в исследованиях на животных, что живой вирус показал значительно лучший противораковый эффект по сравнению с инактивированным вирусом (полная регрессия ксенотрансплантатов нейробластомы человека у бестимусных мышей после местной вирусной терапии болезни Ньюкасла. J Nati Cancer Inst, 1994, 86: 1228).
Некоторые вирусы могут специфически убивать опухолевые клетки при лечении рака и известны как онколитические вирусы. Онколитические вирусы могут селективно реплицироваться внутри раковых клеток, приводя к цитопатическим эффектам и иммунным ответам, которые приводят к гибели опухолевых клеток, демонстрируя минимальные эффекты на нормальные клетки и ткани (Jiang Zhong, Oncolytic Virus and Tumor Treatment, Foreign Medicine (Microbiology Section), 2004 Vol. 27 Iss. No. 6).
В настоящее время существует большое количество сообщений о онколитических вирусах при лечении рака. Например, в WO2009/016433 описано использование рекомбинантного не-VSV рабдовируса (например, вируса Мараба, вируса Караджаса, вируса Muir Springs и/или вируса Bahia grande) для лечения гиперпролиферативного заболевания (например, рака). В US2010/0297072A1 раскрыта композиция для лечения рака, включающая онколитический вирус (парамиксовирус, реовирус, герпесвирус, аденовирус и вирус леса Семлики) и иммуностимулятор (CTLA-4 блокирующий агент, IL-21, анти-CD40 или гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF)), и введение этой композиции мышам-носителям опухоли MCA205 фибросаркомы или B16 меланомы ингибирует рост опухоли.
Вирус бешенства относится к роду лиссавирусов семейства rhabdoviridae. Вирус бешенства имеет отчетливую форму "пули", спирально-симметричный нуклеокапсид с оболочкой и содержит одноцепочечную РНК внутри. Вирус бешенства является патогеном для болезни бешенства. Иммунизация против бешенства является одним из успешных примеров ранней вакцинации. В 1880-х годах Пастер впервые использовал вакцину. Ранние вакцины против бешенства были получены из нервной ткани, впоследствии были разработаны вакцины на основе куриных эмбрионов, вакцины на основе клеточных культур и субъединичные вакцины. В настоящее время разрабатываются генноинженерные вакцины (Shounan Tan, Fengyu Zhang, Studies on Rabies and Human Rabies Vaccine. Medical Information 2011 Vol. 24:2841-2842). В настоящее время большинство вакцин против бешенства для использования человеком получают путем инокуляции фиксированного вирусного штамма (например, штамма CTN-1V, штамма aG) в клетки Vero, культивирования для получения вируса в жидкости с последующей дезактивацией, концентрацией и очисткой, а затем сушкой вымораживанием после добавления соответствующего количества желатина или сахарозы в качестве защитного агента (Yuhui Zhang, The Establishment of Rabies Vaccine Purification Technology. Chinese Journal of Biologicals 1999 Vol. 12 Iss. No. 4: 231-232).
Jieguang Sun и др. обнаружили, что, используя вакцину против бешенства для человека в качестве единственного активного ингредиента при дозе от 2,5 МЕ до 10 МЕ ежедневно, вводимой внутримышечно, неблагоприятные эффекты лечения злокачественных опухолей улучшались в модели опухолей животных, и это также усиливает фагоцитоз макрофагов (см. CN100341571C). RU2414238C2 также описывает способ повышения резистентности к раку, в котором вакцина против бешенства увеличивает противоопухолевую резистентность организма к 9,10-диметил-1,2-бензантрацену.
Вирусы обладают большим потенциалом в лечении рака. В этой области необходимы более безопасные и эффективные противораковые препараты на основе вирусов.
Сущность изобретения
Настоящее раскрытие обеспечивает композицию для применения в лечении рака, включающую или состоящую из: a) полиинозиновой-полицитидиловой кислоты (PIC), b) по меньшей мере одного антибиотика или по меньшей мере одного полиаминового соединения и c) по меньшей мере одного положительного иона.
В другом аспекте настоящее раскрытие обеспечивает композицию для применения в лечении рака, включающую или состоящую из: a) полирибоинозиновой - полирибоцитидиловой кислоты (PIC), b) по меньшей мере одного антибиотика или по меньшей мере одного полиаминового соединения c) по меньшей мере одного положительного иона и d) необязательно вируса.
В одном варианте осуществления композиция включает a) полирибоинозиновую - полирибоцитидиловую кислоту (PIC), b) по меньшей мере один антибиотик или по меньшей мере одно полиаминовое соединение, c) по меньшей мере один положительный ион и d) вирус.
В некоторых вариантах осуществления вирус является инактивированным, аттенуированным или неспособным к репликации в организме человека. В некоторых конкретных вариантах осуществления вирус является инактивированным.
В некоторых вариантах осуществления вирус выбран из группы, состоящей из rhabdoviridae, adeniviridae, arenaviridae, astroviridae, bunyaviridae, cliciviridae, flaviviridae, вирус гепатита дельта, hepeviridae, mononegavirales, nidovirales, piconaviridae, orthomyxoviridae, papillomaviridae, parvoviridae, polyomaviridae, poxviridae, reoviridae, retroviridae и togaviridae. В некоторых конкретных вариантах осуществления, вирус относится к роду лиссавирусов семейства rhabdoviridae. В некоторых конкретных вариантах осуществления вирус представляет собой вирус бешенства.
В некоторых вариантах осуществления вирус бешенства является инактивированным неочищенным вирусом (например, неочищенный антиген бешенства, инактивированный в культуре почечных клеток хомячка (HKC-ICRA)), или инактивированным очищенным вирусом (например, очищенный антиген бешенства, инактивированный в культуре почечных клеток хомячка (HKC-IPRA)).
В некоторых вариантах осуществления вирус бешенства, подходящий для использования в настоящем изобретении, представляет собой вакцину против бешенства, включая, но не ограничиваясь этим, инактивированную, субъединичную, генетически модифицированную и полипептидую вакцину. В частности, содержащая вирус бешенства вакцина, подходящая для использования в настоящем изобретении, представляет собой человеческую диплоидную клеточную вакцину (HDCV) или очищенную вакцину против бешенства, инактивированную в культуре почечных клеток хомячка (HKC-IPRV), или неочищенную вакцину против бешенства, инактивированную в культуре почечных клеток хомячка (HKC-ICRV), или очищенную вакцину против бешенства, полученную с использованием клеток Vero (PVRV), или очищенную вакцину против бешенства на основе клеток куриного эмбриона (PCEC) или очищенную вакцину против бешенства на основе клеток утиного эмбриона (PDEV).
В некоторых вариантах осуществления PIC гетерогенны по молекулярной массе, где молекулярная масса равна или больше чем 66000 дальтон. Значение 66000 дальтон соответствует молекулярному размеру 6,4 седиментационных единиц (единиц Сведберга). В некоторых вариантах осуществления молекулярная масса PIC составляет от 66000 до 1200000 дальтон (эквивалентна 6,4-24,0 седиментационным единицам). В некоторых других вариантах осуществления молекулярная масса PIC равна или больше чем 150000 дальтон. В некоторых других вариантах осуществления молекулярная масса PIC составляет от 100000 до 200000 дальтон, или от 300000 до 4000000 дальтон, или от 500000 до 1000000 дальтон, или от 1000000 до 1500000 дальтон, или от 1500000 до 2000000 дальтон, или от 2000000 до 2500000 дальтон, или от 2500000 до 3000000 дальтон, или от 3000000 до 3500000 дальтон, или от 3500000 до 4000000 дальтон, или от 4000000 до 4500000 дальтон, или от 4500000 до 5000000 дальтон.
В некоторых конкретных вариантах осуществления антибиотик выбран из группы, состоящей из такроламицина, антрациклина, бутирина сульфата, гентамицина, гигромицина, амикацина, дидезоксиканамицина, небрамицина, β-лактама, неомицина, пуромицина, стрептомицина, стрептозоцина и любой их комбинации. Полиаминовое соединение выбрано из группы, состоящей из соли аргинина, спермидина, N-(3-аминопропил), N-(3-аминопропил)-1,4-бутандиамина, спермина, OS-диметиламинотиофосфата, полилизина, аминогликозида и любой их комбинации.
В некоторых конкретных вариантах осуществления антибиотик представляет собой канамицин. В некоторых вариантах осуществления концентрация антибиотика в композиции составляет от 10 ед./мл до 100000 ед./мл, предпочтительно от 100 ед./мл до 10000 ед./мл, более предпочтительно от 500 ед./мл до 5000 ед./мл.
В некоторых вариантах осуществления положительный ион представляет собой катион и выбран из группы, состоящей из кальция, кадмия, лития, магния, церия, цезия, хрома, кобальта, дейтерия, галлия, иода, железа, цинка и любой их комбинации. В некоторых конкретных вариантах осуществления положительный ион представляет собой кальций. Положительный ион может быть в форме любой подходящей соли или органическго комплекса, включая, но не ограничиваясь этим, хлорид, фторид, гидроксид, фосфат или сульфат. Например, когда положительный ион представляет собой кальций, кальциевый ион может быть в форме карбоната кальция, хлорида кальция, фторида кальция, гидроксида кальция, фосфата кальция или сульфата кальция. В некоторых вариантах осуществления концентрация положительного иона в композиции составляет от 0,01 мкмоль до 10 ммоль/мл, предпочтительно от 0,02 мкмоль до 5 ммоль/мл, более предпочтительно от 0,1 мкмоль до 1 ммоль/мл, наиболее предпочтительно от 0,1 мкмоль до 100 мкмоль/мл.
В некоторых вариантах осуществления отношение вируса к PIC выбрано из группы, состоящей из: 1МЕ/50 мкг, 1МЕ/60 мкг, 1МЕ/7 0мкг, 1МЕ/80 мкг, 1МЕ/90 мкг, 1МЕ/100 мкг, 1МЕ/125 мкг, 1МЕ/200 мкг, 1МЕ/250 мкг, 1МЕ/300 мкг, 1МЕ/350 мкг, 1МЕ/400 мкг, 1МЕ/450 мкг, 1МЕ/500 мкг, 1МЕ/550 мкг, 1МЕ/600 мкг, 1МЕ/700 мкг, 1МЕ/800 мкг, 1МЕ/1000 мкг, 1МЕ/1500 мкг, 1МЕ/2000 мкг, 1МЕ/2500 мкг, 1МЕ/3000 мкг, 1МЕ/4000 мкг, 1МЕ/5000 мкг, 1мЕ/6000 мкг, 1МЕ/7000 мкг, 1МЕ/8000 мкг, 1МЕ/9000 мкг, 1МЕ/10000 мкг и диапазона между любыми двумя из вышеуказанных отношений. В частности, отношение указанного вируса к указанной PIC составляет 1МЕ/500мкг.
В некоторых вариантах осуществления, количество PIC в композиции составляет от 250 мкг до 5000 мкг на стандартную дозу; например, количество PIC выбрано из группы, состоящей из 250 мкг, 500 мкг, 1000 мкг, 1500 мкг, 2000 мкг, 3000 мкг, 4000 мкг, 5000 мкг на стандартную дозу и диапазона между любыми двумя из указанных выше количеств.
В некоторых конкретных вариантах осуществления количество PIC в композиции составляет от 500 мкг до 4000 мкг на стандартную дозу, или от 1000 мкг до 3000 мкг на стандартную дозу, или от 1000 мкг до 2500 мкг на стандартную дозу.
Когда композицию по настоящему изобретению применяют для взрослых, количество PIC в композиции выбрано из группы, состоящей из 500 мкг, 1000 мкг, 1500 мкг, 2000 мкг на стандартную дозу и диапазона между любыми двумя из указанных выше количеств. Когда композицию по настоящему изобретению применяют для несовершеннолетних (например, детей), количество PIC в композиции выбрано из группы, состоящей из 250 мкг, 500 мкг, 1000 мкг, 1250 мкг на стандартную дозу и диапазона между любыми двумя из указанных выше количеств.
В некоторых вариантах осуществления стандартную дозу в настоящем изобретении получают в объеме, который выбран из группы, состоящей из 0,1 мл, 0,15 мл, 0,2 мл, 0,5 мл, 1,0 мл, 1,5 мл, 2,0 мл, 2,5 мл, 3,0 мл, 4,0 мл, 5,0 мл, 10,0 мл, 20,0 мл, 30,0 мл, 40,0 мл, 50,0 мл, 60,0 мл, 70,0 мл, 80,0 мл, 90,0 мл, 100,0 мл, 150,0 мл, 200,0 мл, 250,0 мл и диапазона между любыми двумя из указанных выше объемов. Специалистам в данной области должно быть понятно, что вводимый объем, который является слишком большим или слишком малым, приводит к неудобству в клинической практике. Поэтому, когда композиции по настоящему изобретению вводят субъекту-человеку, стандартная доза предпочтительно находится в диапазоне от 0,5 мл до 1,0 мл для инъекции, предпочтительно в диапазоне от 0,15 мл до 0,2 мл для интраназального введения, предпочтительно в диапазоне от 30,0 мл до 100,0 мл для внутривенной инъекции. Должно быть понятно, что хотя стандартная доза представлена в единицах объема, это не означает, что композиция по настоящему изобретению может быть только в жидкой лекарственной форме. Когда композицию по настоящему изобретению получают в твердой лекарственной форме (сухой или лиофилизированный порошок), объем на стандартную дозу относится к объему раствора после восстановления сухого или лиофилизированного порошка.
В некоторых вариантах осуществления количество вируса в композиции составляет от 0,1 МЕ до 100,0 МЕ на стандартную дозу или от 0,2 до 100,0 МЕ на стандартную дозу. В частности, количество вируса в композиции выбрано из группы, состоящей из 0,2 МЕ, 0,5 МЕ, 1,0 МЕ, 1,5 МЕ, 2,0 МЕ, 2,5 МЕ, 3,0 МЕ, 3,5 МЕ, 4,0 МЕ, 5,0 МЕ, 6,0 МЕ, 7,0 МЕ, 8,0 МЕ, 9,0 МЕ, 10,0 МЕ, 15,0 МЕ, 20,0 МЕ, 30,0 МЕ, 40,0 МЕ, 50,0 МЕ, 60,0 МЕ, 70,0 МЕ, 80,0 МЕ, 90,0 МЕ, 100,0 МЕ на стандартную дозу и диапазона между любыми двумя из указанных выше количеств. В некоторых конкретных вариантах осуществления количество вируса в композиции составляет от 0,5 МЕ до 3,0 МЕ на стандартную дозу; предпочтительно от 1,0 МЕ до 2,5 МЕ на стандартную дозу. В некоторых конкретных вариантах осуществления, при применении для взрослых, количество вируса в композиции составляет от 0,5 МЕ до 10,0 МЕ на стандартную дозу. В некоторых других конкретных вариантах осуществления, при применении для несовершеннолетних, количество вируса в композиции составляет от 0,5 МЕ до 5,0 МЕ на стандартную дозу.
В некоторых вариантах осуществления концентрация вируса в композиции составляет от 0,05 МЕ/мл до 40,0 МЕ/мл; предпочтительно выбрана из группы, состоящей из 0,05 МЕ/мл, 0,1 МЕ/мл, 0,15 МЕ/мл, 0,2 МЕ/мл, 0,5 МЕ/мл, 1,0 МЕ/мл, 2,0 МЕ/мл, 3,0 МЕ/мл, 4,0 МЕ/мл, 5,0 МЕ/мл, 10 МЕ/мл, 15 МЕ/мл, 20 МЕ/мл, 25 МЕ/мл, 30 МЕ/мл, 35 МЕ/мл, 40 МЕ/мл.
В некоторых вариантах осуществления композиция по настоящему изобретению дополнительно включает по меньшей мере одно вспомогательное вещество, такое как эксципиент и стабилизатор. Вспомогательное вещество выбрано из группы, состоящей из желатина, сахарозы, сахара, лактозы, мальтозы, трегалозы, глюкозы, низкомолекулярного дектрана, сорбита, полисорбата 20, маннита полиэтиленгликоля, человеческого сывороточного альбумина, рекомбинантного альбумина, октоата натрия, мочевины, гидроксида алюминия, фенолового красного, хлорида магния, хлорида калия, хлорида натрия, тиосульфата натрия, дигидрофосфата калия, аскорбиновой кислоты, трихлорметана, фенола и тимеросала и любой их комбинации.
В некоторых вариантах осуществления композиция по настоящему изобретению дополнительно включает по меньшей мере один физиологически приемлемый буфер, который выбран из группы, состоящей из ацетатного, трис(гидроксиметил)аминометана (tris), бикарбонатного, карбонатного, фосфатного буфера и любой их комбинации. pH буфера или композиции выбран из группы, состоящей из 6,50, 6,60, 6,70, 6,80, 6,90, 7,00, 7,05, 7,10, 7,15, 7,20, 7,25, 7,30, 7,35, 7,40, 7,45, 7,50, 7,55, 7,60, 7,65, 7,70, 7,75, 7,80, 7,85, 7,90, 7,95, 8,00 и диапазона между любыми двумя указанными выше pH значениями. В одном варианте осуществления pH композиции находится в пределах pH 6,5 - pH 8,0. В некоторых конкретных вариантах осуществления буфер представляет собой PBS, и pH буфера или композиции находится в пределах 7,3-7,5.
Композиции по настоящему изобретению могут быть получены в твердой лекарственной форме или в жидкой лекарственной форме. Композиции по настоящему изобретению могут быть получены в форме, выбранной из группы, состоящей из сухого порошка, жидкого раствора или жидкой лекарственной формы (например, раствор для инъекций, водный или физиологический солевой раствор, суспензия, мазь, капли, эмульсия, гель, сироп или сывороточная жидкость), таблетки, таблетки с покрытием, микрокапсулы, суппозитория, гранулы, таблетки с сахарным покрытием, капсулы. Способ получения в общем виде описан в Vaccine 4th Edition (Stanley A Plotkin et al., W. B. Saunders Company, 2003). Предпочтительно композицию по настоящему изобретению получают в форме инъекционного раствора.
В другом аспекте настоящее раскрытие обеспечивает композицию для применения в лечении рака, которая находится в форме сухого порошка или лиофилизированного порошка.
В другом аспекте настоящее раскрытие обеспечивает применение комбинации PIC, по меньшей мере одного антибиотика (или по меньшей мере одного полиаминового соединения) и по меньшей мере одного положительного иона для получения лекарственного средства для лечения рака.
В другом аспекте настоящее раскрытие обеспечивает применение комбинации, включающей PIC адъювант, раскрытый в CN103405762A, для получения лекарственного средства для лечения рака.
В другом аспекте настоящее раскрытие обеспечивает применение комбинации PIC, по меньшей мере одного антибиотика (или по меньшей мере одного полиаминового соединения), по меньшей мере одного положительного иона и вируса для получения лекарственного средства для лечения рака.
В другом аспекте настоящее раскрытие обеспечивает применение композиции для лечения рака.
Более конкретно, настоящее раскрытие обеспечивает применение композиции для получения лекарственного средства для лечения рака.
В некоторых конкретных вариантах осуществления рак выбран из группы, состоящей из:
орофарингеального рака, назофарингеальной карциномы, эзофагеального рака, гастрального рака, рака прямой кишки, рака печени, холангиокарциномы, рака желчного пузыря, панкреатического рака, рака легкого, рака трахеи, тимомы, рака кости, рака суставов, меланомы, мезотелиального рака, рака молочной железы, цервикального рака, рака яичника, рака предстательной железы, рака головного мозга, миеломы, рака крови;
злокачественной опухоли губы, злокачественной опухоли корня языка, гингивальной злокачественной опухоли, злокачественной опухоли полости рта, злокачественной опухоли неба, злокачественной опухоли околоушной железы, злокачественной опухоли небной миндалины, орофарингеальной злокачественной опухоли, назофарингеальной злокачественной опухоли, злокачественной опухоли грушевидного кармана, злокачественной опухоли гипофаринкса;
злокачественной опухоли пищевода, гастральной злокачественной опухоли, злокачественной опухоли тонкого кишечника, злокачественной опухоли толстой кишки, злокачественной опухоли ректосигмоидного соединения, злокачественной опухоли прямой кишки, злокачественной опухоли ануса и анального канала, злокачественной опухоли печени и внутрипеченочных желчных протоков, злокачественной опухоли желчного пузыря, панкреатической злокачественной опухоли;
злокачественной опухоли носа и среднего уха, злокачественной опухоли назального синуса, ларингеальной злокачественной опухоли, трахеальной злокачественной опухоли, бронхиальной и пульмональной злокачественной опухоли, злокачественной опухоли тимуса, сердечной, медиастинальной и плевральной злокачественной опухоли;
злокачественной опухоли кости и суставного хряща;
злокачественной меланомы кожи;
злокачественной опухоли мезотелия и мягкой ткани;
злокачественной опухоли молочной железы;
генитальной злокачественной опухоли, вагинальной злокачественной опухоли, цервикальной злокачественной опухоли, злокачественной опухоли матки, злокачественной опухоли яичника, плацентарной злокачественной опухоли;
злокачественной опухоли полового члена, злокачественной опухоли предстательной железы, тестикулярной злокачественной опухоли;
злокачественной опухоли мочевыводящих путей;
злокачественной опухоли глаза и придатка глаза;
менингеальной злокачественной опухоли, злокачественной опухоли головного мозга;
злокачественной опухоли спинного мозга, черепного нерва и центральной нервной системы;
злокачественной опухоли эндокринной железы;
болезни Ходжкина, фолликулярной нодулярной не-ходжкинской лимфомы, диффузной не-ходжкинской лимфомы, периферической и кожной T-клеточной лимфомы, множественной миеломы, злокачественной плазмаклеточной опухоли, лимфоидного лейкоза, миелоидного лейкоза, лимфоцитарного лейкоза.
В некоторых особенно предпочтительных вариантах осуществления композицию по настоящему изобретению используют в лечении рака, который выбран из группы, состоящей из рака легкого, рака молочной железы, рак щитовидной железы, рак почки, гастральной аденокарциномы, рака печени, меланомы, рака языка, рака прямой кишки, рака эндометрия и рака яичника.
В другом предпочтительном варианте осуществления композицию по настоящему изобретению используют в лечении метастатической опухоли.
В других вариантах осуществления настоящее раскрытие обеспечивает применение композиции в комбинации с противоопухолевой схемой лечения для получения лекарственного средства для лечения рака;
предпочтительно, указанная противоопухолевая схема лечения выбрана из группы, состоящей из химиотерапии, лучевой терапии, таргетной терапии и иммунотерапии, где терапевтическое средство, используемое в указанной химиотерапии, выбрано из группы, состоящей из алкилирующего средства, антиметаболического противоопухолевого средства, противоопухолевого антибиотика, противоопухолевого средства растительного происхождения, противоопухолевого средства на основе соединения платины, гормонально-балансирующего противоопухолевого средства и противоопухолевых средств других типов, где терапевтическое средство, используемое в указанной таргетной терапии, выбрано из группы, состоящей из ритуксимаба, бевацизумаба, трастузумаба, иматиниба, диноксетина, цетуксимаба, нилотиниба и сорафениба, где терапевтическое средство, используемое в указанной иммунотерапии, выбрано из группы, состоящей из ингибитора PD-1, ингибитора PD-L1 и ингибитора CTLA4;
более предпочтительно, указанное алкилирующее средство выбрано из группы, состоящей из циклофосфамида, ифосфамида и тиотепа, указанное антиметаболическое противоопухолевое средство выбрано из группы, состоящей из метотрексата, меркаптопурина, фторурацила и цитарабина, указанный противоопухолевой антибиотик выбран из группы, состоящей из блеомицина, даунорубицина, актиномицина D, митомицина, доксорубицина и митоксантрона, указанное противоопухолевое средство растительного происхождения выбрано из группы, состоящей из винкристина, этопозида, тенипозида, паклитаксела и доцетаксела, указанное противоопухолевое средство на основе соединения платины выбрано из группы, состоящей из цисплатина, карбоплатина и оксалиплатина, указанное гормон-балансирующее противоопухолевое средство выбрано из группы, состоящей из лейпролида, тамоксифена, флутамида и форместана, указанное противоопухолевое средство другого типа представляет собой триоксид мышьяка.
Альтернативно, настоящее изобретение включает применение композиции, раскрытой в настоящей заявке, для получения лекарственного средства для лечения рака; где лекарственное средство предназначено для применения в комбинации с противоопухолевой схемой лечения. Предпочтительно, указанная противоопухолевая схема лечения выбрана из группы, состоящей из химиотерапии, лучевой терапии, таргетной терапии и иммунотерапии, где терапевтическое средство, используемое в указанной химиотерапии выбрано из группы, состоящей из алкилирующего средства, антиметаболического противоопухолевого средства, противоопухолевого антибиотика, противоопухолевого средства растительного происхождения, противоопухолевого средства на основе соединения платины, гормонально-балансирующего противоопухолевого средства и противоопухолевого средства другого типа, где терапевтическое средство, используемое в указанной таргетной терапии, выбрано из группы, состоящей из ритуксимаба, бевацизумаба, трастузумаба, иматиниба, диноксетина, цетуксимаба, нилотиниба и сорафениба, где терапевтическое средство, используемое в указанной иммунотерапии, выбрано из группы, состоящей из ингибитора PD-1, ингибитора PD-L1 и ингибитора CTLA4;
более предпочтительно, указанное алкилирующее средство выбрано из группы, состоящей из циклофосфамида, ифосфамида и тиотепа, указанное антиметаболическое противоопухолевое средство выбрано из группы, состоящей из метотрексата, меркаптопурина, фторурацила и цитарабина, указанный противоопухолевый антибиотик выбран из группа, состоящей из блеомицина, даунорубицина, актиномицина D, митомицина, доксорубицина и митоксантрона, указанное противоопухолевое средство растительного происхождения выбрано из группа, состоящей из винкристина, этопозида, тенипозида, паклитаксела и доцетаксела, указанное противоопухолевое средство на основе соединения платины выбрано из группа, состоящей из цисплатина, карбоплатина и оксалиплатина, указанное гормон-балансирующее противоопухолевое средство выбрано из группы, состоящей из лейпролида, тамоксифена, флутамида и форместана, указанное противоопухолевое средство другого типа представляет собой триоксид мышьяка.
Настоящее изобретение также включает применение композиции, раскрытой в настоящей заявке, для получения лекарственного средства для лечения рака и применение по меньшей мере одного дополнительного противоопухолевого средства для получения лекарственного средства для лечения рака. Настоящее изобретение также включает применение композиции, раскрытой в настоящей заявке, и по меньшей мере одного дополнительного противоопухолевого средства для получения лекарственного средства для лечения рака.
Предпочтительно, противоопухолевое соединение выбрано из группы, состоящей из химиотерапевтического средства, таргетного терапевтического средства и иммунотерапевтического средства.
Предпочтительно, химиотерапевтическое средство выбрано из группы, состоящей из алкилирующего средства, антиметаболического противоопухолевого средства, противоопухолевого антибиотика, противоопухолевого средства растительного происхождения, противоопухолевого средства на основе соединения платины, гормонально-балансирующего противоопухолевого средства и противоопухолевых средств других типов.
Предпочтительно, указанное таргетное терапевтическое средство выбрано из группы, состоящей из ритуксимаба, бевацизумаба, трастузумаба, иматиниба, диноксетина, цетуксимаба, нилотиниба и сорафениба.
Предпочтительно, указанное иммунотерапевтическое средство выбрано из группы, состоящей из ингибитора PD-1, ингибитора PD-L1 и ингибитора CTLA4;
Предпочтительно, указанное алкилирующее средство выбрано из группы, состоящей из циклофосфамида, ифосфамида и тиотепа.
Предпочтительно, указанное антиметаболическое противоопухолевое средство выбрано из группы, состоящей из метотрексата, меркаптопурина, фторурацила и цитарабина.
Предпочтительно, указанный противоопухолевый антибиотик выбран из группы, состоящей из блеомицина, даунорубицина, актиномицина D, митомицина, доксорубицина и митоксантрона.
Предпочтительно, указанное противоопухолевое средство растительного происхождения выбрано из группы, состоящей из винкристина, этопозида, тенипозида, паклитаксела и доцетаксела.
Предпочтительно, указанное противоопухолевое средство на основе соединения платины выбрано из группы, состоящей из цисплатина, карбоплатина и оксалиплатина.
Предпочтительно, указанное гормон-балансирующее противоопухолевое средство выбрано из группы, состоящей из лейпролида, тамоксифена, флутамида и форместана.
Предпочтительно, указанное противоопухолевое средство другого типа представляет собой триоксид мышьяка.
В контексте настоящего раскрытия, когда композиция по настоящему изобретению включает вирус, рак, подлежащий лечению, не вызван вирусом, содержащимся в композиции. В некоторых конкретных вариантах осуществления рак, подлежащий лечению, не вызван вирусом бешенства.
В другом аспекте настоящее раскрытие обеспечивает способ для лечения рака, включающий стадию введения терапевтически эффективного количества композиции субъекту, например, человеку.
В некоторых вариантах осуществления введение композиции является системным или локализованным. В некоторых вариантах осуществления композицию вводят путем парентеральной инъекции (например, внутримышечной, внутрибрюшинной, внутривенной, подкожной, внутрикожной, интратуморальной, перитуморальной). В некоторых других вариантах осуществления композицию вводят внутрикожно путем, отличным от инъекции (например, путем, который не разрушает эпителиальный клеточный барьер механическими средствами). В некоторых других вариантах осуществления композицию вводят ректальным, вагинальным, назальным (например, интраназальным), пероральным, буккальным, сублингвальным, респираторным, глазным (например, внутриглазным) или чрескожным путем.
В частности, примеры пути введения включают внутримышечный, внутрибрюшинный, внутривенный, подкожный, чрескожный, внутрикожный, интраназальный, внутриглазной, пероральный, сублингвальный, интратуморальный и перитуморальный.
В некоторых вариантах осуществления композицию по настоящему изобретению вводят человеку с частотой, выбранной из группы, включающей один раз в месяц, 2 раза в месяц, 3 раза в месяц, 4 раза в месяц, 5 раз в месяц, 6 раз в месяц, 7 раз в месяц, 8 раз в месяц, один раз в неделю, 2 раза в неделю, 3 раза в неделю, 4 раза в неделю, 5 раз в неделю, 6 раз в неделю, один раз каждые три дня, 2 раза каждые три дня, 3 раза каждые три дня, один раз каждые два дня, 2 раза каждые два дня, один раз в день, 2 раза в день.
В частности, способ включает введение терапевтически эффективного количества композиции в соответствии с изобретением человеку через внутримышечную инъекцию с частотой 2 раза каждые три дня или введение терапевтически эффективного количества композиции в соответствии с изобретением человеку через внутримышечную инъекцию с частотой один раз в неделю.
В другом аспекте настоящее изобретение относится к фармацевтическому набору или набору для применения в осуществлении указанного способа лечения, включающему по меньшей мере один контейнер, причем каждый из указанных контейнеров независимо включает композицию по настоящему изобретению. Композиция и/или количество композиции в разных контейнерах могут быть одинаковыми или разными.
В некоторых вариантах осуществления набор по настоящему изобретению включает по меньшей мере один контейнер, содержащий 2,0 МЕ/мл инактивированного вируса бешенства и 1000 мкг/мл PIC.
В некоторых вариантах осуществления композиция по настоящему изобретению сформулирована в стерильной жидкости и содержится в стерильном контейнере (например, в пробирке, бутыли, ампуле, шприце). В других вариантах осуществления композиция по настоящему изобретению содержится в контейнере в виде сухого или лиофилизированного порошка, который перед использованием восстанавливают в жидкую форму.
В некоторых вариантах осуществления набор по настоящему изобретению дополнительно включает элемент, выбранный из группы, состоящей из иглы, воды для инъекций, инструкций по применению и любой их комбинации.
Определения
В контексте настоящей заявки термин ʺвключающийʺ или ʺвключаяʺ должен интерпретироваться как указание наличия определенных признаков, целых чисел, стадий или компонентов, которые указаны, но не исключает наличия или добавления одного или нескольких признаков, целых чисел, стадий или компонентов или их групп. Однако в контексте настоящего раскрытия термин ʺвключающийʺ или ʺвключаяʺ также включает ʺсостоящий изʺ. Варианты слова ʺвключающийʺ, такие как ʺвключаютʺ и ʺвключаетʺ, такие как ʺвключают в себяʺ и ʺвключает в себяʺ, имеют соответственно изменяющиеся значения.
ʺИнактивированныйʺ относится к удалению вирусной патогенности и/или репликативной способности, но с сохранением способности индуцировать защитный иммунный ответ в организме человека. Стратегии инактивации вирусов известны в данной отрасли. Любой обычный метод можно использовать для инактивации вируса, и подходящий метод может быть выбран для определенного типа вируса. Методы инактивации вирусов, включают, но не ограничиваются этим: использование фотореактивного соединения, окислителя, излучения (например, УФ-излучения, γ-излучения), УФ-излучения в сочетании с рибофлавином, обработка растворителем/детергентом (S/D) (например, с использованием три(н-бутил)фосфата и/или Tween 80), обработка полиэтиленгликолем (ПЭГ), пастеризация (термообработка), обработка до кислотного pH, обработка ферментами (пепсин или трипсин), обработка метиленовым синим на свету с диметилметиленовым синим и видимым светом, производное псоралена S-59 и UVA облучение.
ʺАттенуированныйʺ, аттенуированный вирус по-прежнему жизнеспособен, но вирулентность снижается во время производственного процесса. Аттенуированный вирус сохраняет способность к репликации и стимуляции организма человека для индукции иммунного ответа.
Термин ʺгетерогенныйʺ, как он используется в настоящей заявке в контексте композиции по настоящему изобретению, указывает, что молекулы PIC в композиции не являются однородными по молекулярной массе, размеру или и тому и другому.
Термин ʺстандартная дозаʺ относится к физически дискретным единицам, подходящим в качестве унитарных доз для людей. Каждая единица содержит предопределенное количество композиции по настоящему изобретению, достаточное для получения желаемого эффекта, в комбинации с фармацевтически/физиологически приемлемым разбавителем или носителем.
Термин ʺлечениеʺ, ʺлечащийʺ, ʺлечитьʺ и т.п. используется в настоящей заявке как относящийся в основном к получению желаемого фармакологического и/или физиологического эффекта. Эффект может быть профилактическим, с точки зрения полного или частичного предотвращения заболевания или его симптома, и/или может быть терапевтическим, с точки зрения частичной или полной стабилизации или лечения заболевания и/или неблагоприятного эффекта, связанного с заболеванием. ʺЛечениеʺ, как используется в настоящей заявке, охватывает любое лечение заболевания у субъекта, в частности у человека, и включает: (i) предотвращение возникновения заболевания у субъекта, который может быть предрасположен к заболеванию, но у него еще не диагностировано заболевание; (ii) ингибирование заболевания, то есть прекращение его развития; или (iii) облегчение заболевания, то есть инициирование регрессии заболевания.
В настоящем раскрытии при описании числового диапазона выражение ʺ... до...ʺ, ʺв диапазонеʺ, ʺнаходится в пределахʺ и т.п. включает значения конечной точки.
В контексте настоящей заявки термин ʺвирусʺ относится к полному вирусу или фрагменту вируса и включает вирусную вакцину, а также вирусный антиген.
Следующие примеры и чертежи и описания чертежей предназначены только для конкретной иллюстрации настоящего изобретения и не предназначены для ограничения объема изобретения.
Краткое описание чертежей
Фиг. 1. Структура PIC, антибиотика (или полиаминового соединения) и положительного иона, наблюдаемая под электронным микроскопом.
Фиг. 2A. Объем опухоли у мышей-носителей опухоли LL/2 после лечения. ■ Контрольная группа введения носителя, • группа введения цисплатина, Δ группа введения низкой дозы YS-ON-001, ◊ группа введения высокой дозы YS-ON-001. Прямоугольник представляет SEM. **: p<0,01 против контрольной группы введения носителя.
Фиг. 2B. Относительная скорость пролиферации опухоли (T/C) у мышей-носителей опухоли LL/2 после лечения. • Группа введения цисплатина, Δ группа введения низкой дозы YS-ON-001, ◊ группа введения высокой дозы YS-ON-001.
Фиг. 3. Масса опухоли у мышей-носителей опухоли LL/2 после лечения. **: p<0,01 против контрольной группы введения носителя. #: p<0,05 против группы введения высокой дозы YS-ON-001.
Фиг. 4. Масса тела у мышей-носителей опухоли LL/2 после лечения. ■ Контрольная группа введения носителя, • группа введения цисплатина, Δ группа введения низкой дозы YS-ON-001, ◊ группа введения высокой дозы YS-ON-001. Прямоугольник представляет SEM. **: p<0,01 против контрольной группы введения носителя.
Фиг. 5. Изменение массы тела у мышей-носителей опухоли LL/2 после лечения. ■ Контрольная группа введения носителя, • группа введения цисплатина, Δ группа введения низкой дозы YS-ON-001, ◊ группа введения высокой дозы YS-ON-001. Прямоугольник представляет SEM. *: p<0,05 против контрольной группы введения носителя. **: p<0,01 против контрольной группы введения носителя.
Фиг. 6A&6B. Масса тимуса и тимический индекс у мышей-носителей опухоли LL/2 после лечения. **: p<0,01 против контрольной группы введения носителя.
Фиг. 7A&7B. Масса селезенки и селезеночный индекс у мышей-носителей опухоли LL/2 после лечения. *: p<0,05 против контрольной группы введения носителя.
Фиг. 8. Объем опухоли у мышей-носителей опухоли 4T1 после лечения. ■ Контрольная группа введения носителя, • группа введения доцетаксела, Δ группа введения низкой дозы YS-ON-001, ◊ группа введения высокой дозы YS-ON-001. Прямоугольник представляет SEM. **: p<0,01 против контрольной группы введения носителя. #: p<0,05 против группы введения высокой дозы YS-ON-001. ##: p<0,01 против группы введения высокой дозы YS-ON-001.
Фиг. 9. Относительная скорость пролиферации опухоли (T/C) у мышей-носителей опухоли 4T1 после лечения. • Группа введения доцетаксела, группа введения низкой дозы YS-ON-001, ◊ группа введения высокой дозы YS-ON-001.
Фиг. 10. Масса опухоли у мышей-носителей опухоли 4T1 после лечения. Прямоугольник представляет SEM. **: p<0,01 против контрольной группы введения носителя. #: p<0,05 vs. группы введения высокой дозы YS-ON-001.
Фиг. 11. Масса тела у мышей-носителей опухоли 4T1 после лечения. ■ Контрольная группа введения носителя, • группа введения доцетаксела, Δ группа введения низкой дозы YS-ON-001, ◊ группа введения высокой дозы YS-ON-001. Прямоугольник представляет SEM. *: p<0,05 против контрольной группы введения носителя. **: p<0,01 против контрольной группы введения носителя.
Фиг. 12. Изменение массы тела у мышей-носителей опухоли 4T1 после лечения. ■ Контрольная группа введения носителя, • группа введения доцетаксела, Δ группа введения низкой дозы YS-ON-001, ◊ группа введения высокой дозы YS-ON-001. Прямоугольник представляет SEM. *: p<0,05 против контрольной группы введения носителя. **: p<0,01 против контрольной группы введения носителя.
Фиг. 13A&13B. Масса тимуса и тимический индекс у мышей-носителей опухоли 4T1 после лечения. *: p<0,05 против контрольной группы введения носителя. **: p<0,01 против контрольной группы введения носителя.
Фиг. 14A&14B. Масса селезенки и селезеночный индекс у мышей-носителей опухоли 4T1 после лечения. *: p<0,05 против контрольной группы введения носителя. **: p<0,01 против контрольной группы введения носителя.
Фиг. 15A. Объем опухоли у мышей-носителей опухоли H22 в процессе лечения. Прямоугольник представляет SEM. *: p<0,05 против контрольной группы введения носителя. **: p<0,01 против контрольной группы введения носителя. #: p<0,05 против группы Сорафениб+YS-ON-001. ##: p<0,01 против группы Сорафениб+YS-ON-001.
Фиг. 15B. Относительная скорость пролиферации опухоли (T/C) у мышей-носителей опухоли H22 в процессе лечения.
Фиг. 16A. Объем опухоли у мышей-носителей опухоли LL/2 после лечения. Прямоугольник представляет SEM. **: p<0,01 против контрольной группы введения носителя.
Фиг. 16B. Относительная скорость пролиферации опухоли (T/C) у мышей-носителей опухоли LL/2 после лечения.
Фиг. 17. Масса опухоли у мышей-носителей опухоли LL/2 после лечения. Прямоугольник представляет SEM. **: p<0,01 против контрольной группы введения носителя.
Фиг. 18A&18B. Масса тела у мышей-носителей опухоли B16F10 после лечения. Прямоугольник представляет SEM. *: p<0,05 против контрольной группы введения носителя. **: p<0,01 против контрольной группы введения носителя.
Фиг. 19. Количество метастазов в легких у мышей-носителей опухоли B16F10 после лечения. Прямоугольник представляет SEM. **: p<0,01 против контрольной группы введения носителя.
Фиг. 20A-20D. Масса тимуса и селезенки у мышей-носителей опухоли B16F10 после лечения. Прямоугольник представляет SEM. *: p<0,05 против контрольной группы введения носителя. **: p<0,01 против контрольной группы введения носителя.
Фиг. 21. Объем опухоли у мышей-носителей опухоли S180 в процессе лечения. Прямоугольник представляет SEM. **: p<0,01 против контрольной группы введения носителя.
Фиг. 22. Масса опухоли у мышей-носителей опухоли S180 после лечения. Прямоугольник представляет SEM. **: p<0,01 против контрольной группы введения носителя.
Фиг. 23. Выживаемость у мышей-носителей опухоли S180 в процессе лечения. • Солевой раствор, ■ CTX, ▲ YS-ON-001.
Фиг. 24A&24B. КТ грудной клетки. Фиг. 24A показывает КТ снимок до введения YS-ON-001; Фиг. 24B показывает КТ снимок после двух курсов лечения YS-ON-001.
Примеры
Настоящее изобретение в общем виде описано выше, но его будет легче понять посредством ссылки на следующие примеры, которые приведены в качестве иллюстрации и не предназначены для ограничения настоящего изобретения.
Если не указано иное, исследования на животных, описанные в настоящем описании, проводились в соответствии с Regulations on the Administration of Laboratory Animals. Guidance on the Care of Laboratory Animals, и Китайским национальным стандартом GB/14925.
Пример 1. Способ получения композиции по настоящему изобретению
1. Вирус:
Инактивированный вирус бешенства.
2. Композицию по настоящему изобретению получают в соответствии со следующими компонентами:
Композиция включает инактивированный вирус бешенства, PIC, Канамицин и хлорид кальция. Композиция дополнительно включает вспомогательные вещества, включающие мальтозу, дектран и человеческий сывороточный альбумин.
Где инактивированный вирус бешенства: PIC=2,0МЕ:1000мкг.
В стерильных условиях указанную выше композицию формулируют в физиологически приемлемом буфере. Концентрацию и объем формулируемой композиции регулируют в соответствии с факторами, включающими субъекта, которому требуется введение (включая, но не ограничиваясь этим, возраст, пол, массу тела, состояние здоровья), раковое состояние (включая, но не ограничиваясь этим, тип рака, тяжесть), путь введения и частоту введения. Для одинакового терапевтически эффективного количества, когда концентрация композиции высокая, объем введения низкий; когда концентрация композиции низкая, объем введения высокий.
Когда композицию применяют для мыши, композицию YS-ON-001 получают в концентрации 2,0МЕ/мл инактивированного вируса бешенства, 1000 мкг/мл PIC, 800 МЕ/мл канамицина и 0,16 мкмоль/мл иона кальция.
PIC нестабильна в организме человека и может быстро разлагаться под действием нуклеазы. Антибиотик (или полиаминовое соединение) и положительный ион могут образовывать трехмерную структуру с PIC, повышая таким образом стабильность PIC. Электроный микроскоп показывает конечную структуру на Фиг. 1.
Пример 2. Терапевтические эффекты композиции (YS-ON-001) в животной модели рака легкого
I. Создание опухолевой модели
1. Животные
1.1 Самок C57BL/6 мышей (6-недельного возраста, масса тела 17,5 ± 0,1 г) получали от Shanghai SIPPR-BK Laboratory Animal Co. Ltd.
1.2 Условия содержания животных
Животных кормили в соответствии с SPF условиями кормления животных, и обеспечивали их пищей (Keaoxieli сертифицированный корм для грызунов). Клетку, подстилку, пищу и питьевую воду стерилизовали в автоклаве. Клетки помещали в ламинарный бокс с чистотой 100, по 3-5 животных на клетку, и клетки заменяли два раза в неделю. Температура в помещении для животных была 21-25°С, с относительной влажностью между 40% и 70%.
2. Опухолевая клеточная линия
Мышиную клеточную линию LL/2 рака легкого Lewis (ATCC®CRL-1642™) получали от American Type Culture Collection (ATCC). Клетки поддерживали в DMEM с 10% фетальной бычьей сывороткой в атмосфере 5% CO2 при 37°C. Пересев осуществляли в отношении от 1:5 до 1:8 при частоте 3-4 раза в неделю.
3. Создание модели трансплантации опухоли LL/2
LL/2 мышиную модель опухоли легкого Lewis устанавливали у самок C57BL/6 мышей путем подкожной инокуляции при 1×106 клеток на животное. Опухолеобразование составило 100%. Через три дня после инокуляции клеток мышей с инокулированными клетками рандомизированно распределяли по группам обработки на основании массы тела. Введение животным в каждой группе осуществляли в соответствии с Таблицей 1.
II. Метод испытания
1. Группы испытания
Было 4 группы: Группа введения носителя, группа введения цисплатина, группа введения низкой дозы YS-ON-001 и группа введения высокой дозы YS-ON-001.
План эксперимента для LL/2
YS-ON-001
YS-ON-001
Группа 1: в группе введения носителя DPBS вводили путем инъекции в обе задние лапы при 0,1 мл/введение.
Группа 3: группа введения низкой дозы YS-ON-001, 0,1 мл YS-ON-001 вводили путем инъекции в правую заднюю лапу и 0,1 мл DPBS вводили путем инъекции в левую заднюю лапу при 0,1мл/мышь
Группа 4: группа введения высокой дозы YS-ON-001, YS-ON-001 вводили путем инъекции в обе задние лапы при 0,1 мл/введение, всего 0,2 мл.
2. Исследования прекращали, когда средний объем опухоли в группе введения носителя достигал 2500 мм3
3. В конце испытания опухолевую массу удаляли и фотографировали. Массу опухоли регистрировали. Тимус и селезенку удаляли и взвешивали. И затем рассчитывали индекс органов.
III. Наблюдаемые показатели
1. Объем опухоли
Противоопухолевый эффект испытываемого средства наблюдали путем измерения диаметра опухоли. Объемы опухолей измеряли 3 раза в неделю и рассчитывали относительную скорость пролиферации опухоли T/C (%).
1.1 Объем опухоли (TV) рассчитывали следующим образом:
TV=1/2×a×b2
где a и b означают длину и ширину, соответственно.
1.2 Относительная скорость пролиферации опухоли T/C(%)=TVt/TVc×100%
где TVt означает средний объем опухоли группы лечения, и TVc означает средний объем опухоли контрольной группы введения носителя.
2. Масса опухоли
В конце испытания опухолевую массу удаляли и взвешивали. Регистрировали массу опухоли и рассчитывали процент ингибирования опухоли в соответствии со следующей формулой:
Процент ингибирования опухоли=(TWC-TWT)/TWC×100%
Где TWt означает среднюю массу опухоли группы лечения, и TVc означает среднюю массу опухоли контрольной группы введения носителя.
3. Масса тела
Массу тела(BW) каждой мыши определяли три раза в неделю. Изменение массы тела (BWC) рассчитывали следующим образом:
BWC=(BWn - BW0)/BW0×100%
Где BWn означает BW в День n, и BW0 означает BW в день, когда начинали лечение.
4. Масса тимуса и селезенки
В конце испытания тимус и селезенку удаляли и взвешивали. Индекс органа рассчитывали следующим образом: индекс органа=масса органа/масса тела × 100%.
IV. Представление и анализ данных
Данные представляли как Среднее значение±SEM. Сравнение между группами анализировали с использованием ANOVA.
V. Результаты
1. Объем опухоли
Эффект YS-ON-001 на объем LL/2 мышиной опухоли легкого Lewis графически представлен на Фиг. 2A.
Эффект YS-ON-001 на скорость пролиферации LL/2 мышиной опухоли легкого Lewis графически представлен на Фиг. 2B.
День обнаружения опухоли принимают за День 0. В День 3 животных рандомизировали на основании массы тела и введение осуществляли в соответствии с распределением по группам.
Опухоли в контрольной группе введения носителя росли прогрессивно у всех десяти мышей. В конце испытания средний объем опухоли достигал 2707±257мм3.
Лечение Цисплатином существенно ингибировало рост опухоли, начиная с Дня 10 до окончания испытания, приводя к относительной пролиферации опухоли 53,04%, со значимой разницей по сравнению с контрольной группой введения носителя (p < 0,01).
YS-ON-001 лечение существенно ингибировало рост опухоли, начиная с Дня 10 до окончания испытания, по сравнению с контрольной группой введения носителя (p < 0,01). Объем опухоли в группе введения высокой дозы был меньше, чем в группе введения низкой дозы, однако разница не была значимой (p > 0,05). Относительная пролиферация опухоли в конце испытания была 43,36% и 34,33%, соответственно.
2. Масса опухоли
Эффект YS-ON-001 на массу LL/2 мышиной опухоли легкого Lewis графически представлен на Фиг. 3.
В конце испытания опухолевую массу удаляли и взвешивали. То же касается объема опухоли. Лечение Цисплатином или YS-ON-001 существенно снижало массу опухоли по сравнению с контрольной группой введения носителя (p < 0,01). Масса опухоли в группе введения высокой дозы YS-ON-001 была существенно ниже, чем в группе введения цисплатина и группе введения низкой дозы YS-ON-001 (p < 0,05). Процент ингибирования составил 29,46%, 29,49% и 53,87% для группы введения цисплатина, группы введения YS-ON-001 низкой дозы и высокой дозы, соответственно.
3. Масса тела
Эффект YS-ON-001 на массу тела и изменение массы тела в LL/2 мышиной модели опухоли легкого Lewis графически представлен на Фиг. 4&5.
Лечение Цисплатином существенно влияло на среднюю массу тела (BW) по сравнению с группой введения носителя в День 5 и с Дня 10 до конца испытания (p<0,01). Такой же результат наблюдали на изменение массы тела.
Лечение в двух группах YS-ON-001 не показало явного влияния на массу тела мыши по сравнению с группой введения носителя (p>0,05). Изменение массы тела в группе введения высокой дозы YS-ON-001 было существенно меньше в День 7 по сравнению с контрольной группы введения носителя (p<0,05), при этом не было никакого существенного изменения в других точках времени.
4. Масса тимуса и селезенки
Масса тимуса и селезенки, а также индекс органа в LL/2 мышиной модели опухоли легкого Lewis графически представлены на Фиг. 6&7.
В конце испытания, кроме массы опухоли, удаляли тимус и селезенку и взвешивали. По сравнению с группой введения носителя, лечение Цисплатином существенно уменьшало массу тимуса и массу селезенки. Масса тимуса и тимический индекс существенно уменьшалась по сравнению с контрольной группой введения носителя (p<0,01). Масса селезенки существенно уменьшалась по сравнению с массой селезенки в контрольной группе введения носителя (p<0,05), однако, селезеночный индекс показывал тенденцию к умменьшению, которое не является значимым (p>0,05). На массу тимуса, массу селезенки и их индекс не влияло лечение при помощи YS-ON-001 по сравнению с группой введения носителя.
VI. Обсуждение и выводы
В этом примере, контрольная группа введения носителя имела сильный рост опухоли, а группа введения цисплатина показала существенный ингибиторный эффект на рост опухоли в качестве положительного контроля.
YS-ON-001 показал противоопухолевую активность дозозависимым образом при использовании в качестве отдельного средства при 0,1 мл/мышь и 0,2 мл/мышь.
Кроме того, животные показали хорошую переносимость и не показали никакого существенного эффекта на массу тела, массу селезенки и массу тимуса. Побочные эффекты были существенно ниже, чем в группе введения цисплатина. Противоопухолевый эффект в группе введения высокой дозы YS-ON-001 был лучше, чем в группе введения цисплатина.
Как показывают результаты, YS-ON-001 показал ингибиторный эффект дозозависимым образом на рост опухоли при испытываемом уровне доз в животной модели LL/2 рака легкого Lewis. При этом мыши-опухоленосители не показали никаких явных побочных эффектов.
Пример 3. Терапевтические эффекты композиции (YS-ON-001) в животной модели рака молочной железы
I. Создание опухолевой модели
1. Животные
1.1 Самок Balb/c мышей (6-недельного возраста, масса тела 17,2 ± 0,1 г) получали от Shanghai SIPPR-BK Laboratory Animal Co.Ltd.
2.2. Условия содержания животных
Животных кормили в соответствии с SPF условиями кормления животных и обеспечивали их пищей (Keaoxieli сертифицированный корм для грызунов). Клетку, подстилку, пищу и питьевую воду стерилизовали в автоклаве. Клетки помещали в ламинарный бокс с чистотой 100, по 3-5 животных на клетку, и клетки заменяли два раза в неделю. Температура в помещении для животных была 21- 25°C, с относительной влажностью между 40% и 70%.
2. Опухолевая клеточная линия
Мышиную клеточную линию рака молочной железы 4T1 получали от American Type Culture Collection (ATCC), и поддерживали при помощи HD Biosciences. Клетки поддерживали в DMEM с 10% фетальной бычьей сывороткой в атмосфере 5% CO2 при 37°C. Пересев осуществляли в отношении 1:5 и 1:8 при частоте 3-4 раза в неделю.
3. Создание 4T1 модели трансплантации опухоли
Мышиную модель 4T1 опухоли молочной железы устанавливали у самок Balb/c мышей путем подкожной инокуляции 1×106 клеток на животное. Опухолеобразование составило 100%. Через три дня после инокуляции клеток мышей с инокулированными клетками рандомизированно распределяли по группам обработки на основании массы тела. Введение животным в каждой группе осуществляли в соответствии с Таблицей 2.
План эксперимента для 4T1
YS-ON-001
YS-ON-001
Группа 1: в группе введения носителя DPBS вводили путем инъекции в обе задние лапы при 0,1 мл/введение.
Группа 3: в группе введения низкой дозы YS-ON-001, 0,1 мл YS-ON-001 вводили путем инъекции в правую заднюю лапу и 0,1 мл DPBS вводили путем инъекции в левую заднюю лапу при 0,1 мл/мышь
Группа 4: в группе введения высокой дозы YS-ON-001, YS-ON-001 вводили путем инъекции в обе задние лапы при 0,1 мл/введение, всего 0,2 мл.
II. Метод испытания
1. Группы испытания
Было 4 группы: Группа введения носителя, группа введения доцетаксела, группа введения низкой дозы YS-ON-001 и группа введения высокой дозы YS-ON-001.
2. Исследования прекращали, когда средний объем опухоли в группе введения носителя достигал 2500 мм3
3. В конце испытания опухолевую массу удаляли и фотографировали. Массу опухоли регистрировали. Тимус и селезенку удаляли и взвешивали и затем рассчитывали индекс органов.
III. Наблюдаемые показатели: такие же, как в Примере 2 Раздел III.
IV. Представление и анализ данных
Данные представляли как Среднее значение±SEM. Сравнение между группами анализировали с использованием ANOVA.
V. Результаты
1. Объем опухоли
Эффект YS-ON-001 на объем опухоли в мышиной модели 4T1 опухоли молочной железы графически представлен на Фиг. 8.
Эффект YS-ON-001 на скорость пролиферации опухоли в мышиной модели 4T1 опухоли молочной железы графически представлен на Фиг. 9.
День обнаружения опухоли принимают за День 0. В День 3 животных рандомизировали на основании масса тела и введение осуществляли в соответствии с распределением по группам.
Опухоли в контрольной группе введения носителя росли прогрессивно у всех десяти мышей. В конце испытания средний объем опухоли достигал 2576±108мм3.
Лечение Доцетакселом существенно ингибировало рост опухоли, начиная с Дня 8 до окончания испытания, приводя к относительной пролиферации опухоли 50,12%, со значимой разницей по сравнению с контрольной группой введения носителя. (p < 0,01).
YS-ON-001 лечение существенно ингибировало рост опухоли, начиная с Дня 8 до окончания испытания, по сравнению с контрольной группой введения носителя (p < 0,01). Существует значимая разница между группой введения низкой дозы и группой введения высокой дозы YS-ON-001 с Дня 11 до окончания испытания (p<0,05). Относительный показатель пролиферации опухоли в конце испытания составил 63,43% и 45,87%, соответственно.
2. Масса опухоли
Эффект YS-ON-001 на массу опухоли в мышиной модели 4T1 опухоли молочной железы графически представлен на Фиг. 10.
В конце испытания опухолевую массу удаляли и взвешивали. То же касается объема опухоли. Лечение Доцетакселом существенно снижало массу опухоли по сравнению с контрольной группой введения носителя (p < 0,01). В группе введения высокой дозы YS-ON-001 масса опухоли существенно уменьшалась по сравнению с контрольной группой введения носителя (p<0,01). В группе введения низкой дозы YS-ON-001 масса опухоли немного уменьшалась по сравнению с контрольной группой введения носителя. Масса опухоли в группе введения высокой дозы YS-ON-001 была существенно ниже, чем в группе введения низкой дозы YS-ON-001 (p < 0,05). Процент ингибирования составил 35,55%, 18,21%, и 42,26% для группы введения доцетаксела, группы введения низкой дозы и высокой дозы YS-ON-001, соответственно.
3. Масса тела
Эффект YS-ON-001 на массу тела и изменение массы тела в мышиной модели 4T1 опухоли молочной железы графически представлен на Фиг. 11&12.
Лечение Доцетакселом существенно влияло на среднюю массу тела (BW) по сравнению с группой введения носителя в День 8 и с Дня 13 до окончания испытания (p<0,01). Изменение средней массы тела было существенно меньше при лечении Доцетакселом по сравнению с группой введения носителя с Дня 4 до окончания испытания (p<0,05). В конце испытания масса также имела тенденцию к снижению по сравнению с массой в такой же группе по время распределения по группам.
Явное влияние на массу тела мыши наблюдали в группе введения низкой дозы YS-ON-001 по сравнению с группой введения носителя. Масса тела в группе введения высокой дозы YS-ON-001 была существенно ниже с Дня 15, чем в группе введения носителя (p<0,05). Изменение массы тела в двух YS-ON-001 группах было существенно меньше в День 4 и с Дня 15 до окончания испытания по сравнению с контрольной группой введения носителя (p<0,05 для группы введения низкой дозы, p<0,01 для группы введения высокой дозы). Однако масса тела все же повышалась по сравнению с массой тела в такой же группе по время распределения по группам.
4. Масса тимуса и селезенки
Масса тимуса и селезенки, а также индекс органа в мышиной модели 4T1 опухоли молочной железы графически представлены на Фиг. 13&14.
В конце испытания, кроме массы опухоли, удаляли тимус и селезенку и взвешивали.
По сравнению с группой введения носителя, лечение Доцетакселом существенно снижало массу тимуса и селезенки и тимический и селезеночный индекс (p<0,01). На массу тимуса, массу селезенки и тимический индекс органа не влияло лечение при помощи YS-ON-001 по сравнению с группой введения носителя. В группах введения обеих доз YS-ON-001 селезеночный индекс повышался по сравнению с группой введения носителя значимым образом (p<0,01 для группы введения низкой дозы, p<0,05 для группы введения высокой дозы).
VI. Обсуждение и выводы
В этом примере контрольная группа введения носителя имела сильный рост опухоли, а группа введения доцетаксела показала существенный ингибиторный эффект на рост опухоли в качестве положительного контроля.
YS-ON-001 показал противоопухолевую активность дозозависимым образом при использовании в качестве отдельного средства при 0,1 мл/мышь и 0,2 мл/мышь. Кроме того, животные показали хорошую переносимость и не показали никакого существенного эффекта на массу тимуса. Противоопухолевый эффект в группе введения высокой дозы был сопоставим с эффектом в группе введения доцетаксела, при существенном уменьшении побочных эффектов.
В этом примере селезеночный индекс в двух YS-ON-001 группах повышался по сравнению с контрольной группой введения носителя. Необходим дополнительный анализ для выяснения причины. Предварительно можно предположить, что причиной является повышенная иммунная функция, приводящая к увеличению массы в иммунном органе.
Как показывают результаты, YS-ON-001 показал ингибиторный эффект дозозависимым образом на рост опухоли при испытываемом уровне доз в животной модели 4T1 рака молочной железы. При этом, мыши-опухоленосители не показали никаких явных побочных эффектов.
Пример 4. Терапевтические эффекты композиции (YS-ON-001) отдельно или в комбинации с Сорафенибом в мышиной подкожной модели H22 гепатоцеллюлярной карциномы
I. Создание опухолевой модели
1. Животные и условия содержания животных были такими же, как в Примере 2.
2. Опухолевая клеточная линия
Мышиную клеточную линию гепатоцеллюлярной карциномы H22 получали от China Center for Type Culture Collection (CCTCC) и поддерживали при помощи HD Biosciences. Клетки поддерживали у Balb/c мышей в виде асцитов. Пересев осуществляли с интервалом 7-8 дней.
3. Создание модели трансплантации H22 опухоли
Донорных мышей с H22 асцитами умерщвляли и стерилизовали путем погружения в 75% спирт. Асциты собирали и ресуспендировали в предварительно охлажденном DPBS при подходящей плотности. Опухолевую модель H22 мышиной гепатоцеллюлярной карциномы устанавливали у самок Balb/c мышей путем подкожной инокуляции 5×106 клеток на животное. Опухолеобразование составило 100%. Через три дня после инокуляции клеток мышей с инокулированными клетками рандомизированно распределяли по группам обработки на основании массы тела. Введение животным в каждой группе осуществляли в соответствии с Таблицей 3.
II. Метод испытания
1. Группы испытания
Было 4 группы: Группа введения носителя, группа введения Сорафениба, YS-ON-001 группа и Сорафениб+YS-ON-001 группа.
Экспериментальная группа и доза
YS-ON-001
0,2 мл/мышь
#: Сорафениб вводили через желудочный зонд, носитель и YS-ON-001 вводили путем инъекции 0,1 мл внутримышечно (в.м.) и 0,1 мл подкожно (п.к.).
BID=два раза в день
QD=один раз в день
2. Исследования прекращали, когда средний объем опухоли в группе введения носителя достигал 2500 мм3
3. В конце испытания опухолевую массу удаляли и фотографировали. Массу опухоли регистрировали.
III. Наблюдаемые показатели: такие же, как в Примере 2.
IV. Результаты
1. Объем опухоли
Эффект YS-ON-001 на объем опухоли в мышиной модели H22 гепатоцеллюлярной карциномы графически представлен на Фиг. 15A.
Эффект YS-ON-001 на скорость пролиферации опухоли в мышиной модели H22 гепатоцеллюлярной карциномы графически представлен на Фиг. 15B.
День обнаружения опухоли принимают за День 0. В День 3 животных рандомизировали на основании масса тела и введение осуществляли в соответствии с распределением по группам.
Опухоли в контрольной группе обработки носителем росли прогрессивно у всех десяти мышей. Когда испытание в группе введения носителя завершали в День 12, средний объем опухоли достигал 2120±182 мм3.
Одну мышь в группе введения носителя и двух мышей в группе введения Сорафениба умерщвляли в День 10 и День 19, когда объем их опухоли достигал 2500 мм3. Все испытание завершали в День 21.
Лечение Сорафенибом существенно ингибировало рост опухоли с Дня 3 до конца испытания по сравнению с контрольной группой введения носителя (p<0,01). Относительный показатель пролиферации опухоли в День 12 составил 29,90%.
Лечение комбинацией Сорафениб+YS-ON-001 существенно ингибировало рост опухоли с Дня 1 до конца испытания по сравнению с контрольной группой введения носителя (p<0,01). Относительный показатель пролиферации опухоли в День 12 составил 10,61%.
Существует значимая разница в объеме опухоли между группой введения Сорафениба и группой введения Сорафениб+YS-ON-001 в День 1, День 5 и с Дня 10 до конца испытания (p<0,05 или p<0,01).
Существует значимая разница в объеме опухоли между группой YS-ON-001 и группой Сорафениб+YS-ON-001 в День 5 и с Дня 10 до конца испытания (p<0,05 или p<0,01).
V. Обсуждение и выводы
В этом примере контрольная группа введения носителя имела сильный рост опухоли, а группа введения Сорафениба показала существенный ингибиторный эффект на рост опухоли в качестве положительного контроля. Это указывает на то, что результаты являются достоверными.
YS-ON-001 показал сильную противоопухолевую активность при введении BID при 0,2 мл/мышь. Сорафениб+YS-ON-001 показал очень существенное ингибирование роста опухоли и существенный синергический эффект. Не было никаких случаев смерти животных из-за токсичности лекарственного средства в группе введения одного лекарственного средства или в группе введения комбинации лекарственных средств.
Результаты показали, что группы введения YS-ON-001 и комбинации показали сильную противоопухолевую активность в мышиной модели H22 гепатоцеллюлярной карциномы при испытываемом уровне дозирования. Комбинация YS-ON-001 и Сорафениба индуцировала сильно повышенную противоопухолевую активность по сравнению с любым из этих средств, применяемых отдельно.
Пример 5. Терапевтические эффекты композиции (YS-ON-001) и PIKA отдельно в подкожной LL/2 мышиной модели рака легкого Lewis у самок C57BL/6 мышей
I. Создание опухолевой модели
1. Животные и условия содержания животных были такими же, как в Примере 2
2. Клеточную LL/2 линию мышиного рака легкого Lewis получали, культивировали и LL/2 мышиную модель опухоли легкого Lewis устанавливали так же, как в Примере 2. Введение животным в каждой группе осуществляли в соответствии с Таблицей 4.
II. Метод испытания
1. Группы испытания
Было 6 групп: Группа введения носителя, группа введения цисплатина, YS-ON-001 группа, YS-ON-002 (без вируса) группа, группа введения вакцины против бешенства и группа введения Цисплатин+YS-ON-001. Разница между YS-ON-001 и YS-ON-002 в том, что в YS-ON-002 отсутствует инактивированный вирус бешенства.
Экспериментальная группа и доза
Q2D=раз в два дня
2. Исследования прекращали, когда средний объем опухоли в группе введения носителя достигал 2500 мм3
3. В конце испытания опухолевую массу удаляли и фотографировали. Массу опухоли регистрировали.
III. Наблюдаемые показатели
1. Объем опухоли
Измерение и расчет объема опухоли, массы опухоли осуществляли так же, как в Примере 2.
2. Индекс комбинированного препарата
Q значение рассчитывали в соответствии с формулой Jin, Q=0,85-1,15 для аддитивного эффекта, Q > 1,15 для синергического эффекта:
Q=Ea+b/(Ea+Eb-Ea×Eb)
Где Ea+b означает процент ингибирования опухоли в группе введения комбинации лекарственных средств, Ea и Eb представляют собой проценты ингибирования опухоли в группе введения одного лекарственного средства.
IV. Результаты
1. Объем опухоли
Эффект введения YS-ON-001, YS-ON-002 и комбинации на объем опухоли у мышей с LL/2 мышиной Карциномой легкого Lewis графически представлен на Фиг. 16A.
Эффект введения YS-ON-001, YS-ON-002 и комбинации на скорость пролиферации опухоли у мышей с LL/2 мышиной Карциномой легкого Lewis графически представлен на Фиг. 16B.
День обнаружения опухоли принимают за День 0. В День 3 животных рандомизировали на основании масса тела и введение осуществляли в соответствии с распределением по группам.
Опухоли в контрольной группе введения носителя росли прогрессивно у всех десяти мышей. Когда группа введения носителя завершала испытание, средний объем опухоли достигал 2535 ± 148мм3.
Лечение Цисплатином существенно ингибировало рост опухоли по сравнению с контрольной группой введения носителя с Дня 5 до конца испытания (p< 0,01), приводя к относительной пролиферации опухоли 47,46%.
Лечение при помощи YS-ON-001 и YS-ON-002 существенно ингибировало рост опухоли по сравнению с контрольной группой введения носителя с Дня 5 до конца испытания (p<0,01). Относительный показатель пролиферации опухоли составил 37,02% и 40,56%, соответственно.
Лечение вакциной против бешенства не имело никакого явного эффекта по сравнению с контрольной группой введения носителя (p>0,05). Относительный показатель пролиферации опухоли был 97,87% в конце испытания.
Группа введения комбинации показала существенное ингибирование роста опухоли по сравнению с контрольной группой введения носителя с Дня 5 до конца испытания (p<0,01). Относительный показатель пролиферации опухоли был 28,38% в конце испытания. Относительный показатель пролиферации опухоли был ниже, чем в группах введения отдельно Цисплатина и YS-ON-001. В соответствии с формулой Jin, YS-ON-001 и Цисплатин имели аддитивный эффект, Q=0,87.
Объем опухоли в YS-ON-001 группе был ниже, чем в YS-ON-002 группе, однако, разница была статистически незначимой. Объем опухоли в YS-ON-001 группе был ниже, чем в YS-ON-002 группе с Дня 5 до конца испытания. В соответствии с формулой Jin, вирус бешенства и другие компоненты в композиции имели аддитивный эффект, Q=0,93.
2. Масса опухоли
Эффект введения YS-ON-001, YS-ON-002 и комбинации на массу опухоли у мышей с LL/2 мышиной Карциномой легкого Lewis графически представлен на Фиг. 17.
В конце испытания опухолевую массу удаляли и взвешивали. Подобно эффекту на объем опухоли, в группах введения Цисплатина, YS-ON-001, YS-ON-002 и комбинации масса опухоли существенно уменьшалась по сравнению с контрольной группой введения носителя (p<0,01), приводя к ингибированию опухоли 42,38%, 60,88, 56,04% и 75,44%, соответственно.
В соответствии с формулой Jin, вирус бешенства и другие компоненты в композиции имели аддитивный эффект, Q=0,97.
V. Обсуждение и выводы
В этом примере контрольная группа введения носителя имела сильный рост опухоли, а группа введения цисплатина показала существенный ингибиторный эффект на рост опухоли в качестве положительного контроля. Это указываает на то, что результаты являются достоверными.
YS-ON-001 и YS-ON-002 показали сильную противоопухолевую активность при использовании в качестве отдельного средства при введении 0,2 мл/мышь в.м. на LL/2 мышиную модель опухоли легкого Lewis. Животные показали хорошую переносимость и незначительный эффект на массу тела, однако токсические побочные эффекты были существенно ниже, чем у контрольного лекарственного средства Цисплатина. Противоопухолевый эффект был сопоставим с контрольным лекарственным средством Цисплатином.
Относительный показатель пролиферации опухоли в группе введения комбинации был 28,38%, что было ниже, чем в группах введения Цисплатина и YS-ON-001 отдельно. В соответствии с формулой Jin, YS-ON-001 и Цисплатин имели аддитивный эффект.
Не было никакой статистически значимой разницы между YS-ON-001 и YS-ON-002, что касается эффекта ингибирования опухоли, однако вирус бешенства и другие компоненты в композиции имели аддитивный эффект в соответствии с формулой Jin.
Результаты показали, что YS-ON-001 и YS-ON-002 демонстрируют ингибиторный эффект при испытываемом уровне доз в LL/2 животной модели рака легкого Lewis. Композиция YS-ON-001 и Цисплатина имела аддитивный эффект.
Пример 6. Терапевтические эффекты композиции (YS-ON-001) в модели метастазов опухоли B16F10 у самок C57BL/6 мышей
I. Создание опухолевой модели
1. Животные и условия содержания животных были такими же, как в Примере 2
2. Опухолевая клеточная линия
Клеточную линию B16F10 получали от American Type Culture Collection (ATCC) и поддерживали при помощи HD Biosciences. Клетки поддерживали в DMEM с 10% фетальной бычьей сывороткой в атмосфере 5% CO2 при 37°C. Пересев осуществляли в отношении 1:5 и 1:8 при частоте 3-4 раза в неделю.
12-часовой цикл свет/темнота.
3. Создание модели трансплантации опухоли LL/2
Модель метастазов B16F10 опухоли устанавливали у самок C57BL/6 мышей путем внутривенной инокуляции 5×104/0,2 мл на животное. Через день после инокуляции клеток мышей рандомизированно распределяли по группам обработки на основании массы тела. Введение животным в каждой группе осуществляли в соответствии с Таблицей 5.
II. Метод испытания
1. Группы испытания
Было 3 группы: Группа введения носителя, группа введения цисплатина и YS-ON-001 группа.
Экспериментальная группа и доза
#: Животным в группе введения носителя и YS-ON-001 группе вводили 0,1 мл в.м. (задняя лапа) и п.к. инъекцию, соответственно.
BID=два раза в день
Q4D=раз в 4 дня
2. В конце испытания исследование прекращали в День 15. Легкое удаляли и фотографировали. Количество метастаз подсчитывали. Тимус и селезенку удаляли, взвешивали и рассчитывали индексы органов.
III. Наблюдаемые показатели
1. Масса тела
Массу тела каждой мыши определяли три раза в неделю. Изменение массы тела (BWC) рассчитывали следующим образом:
BWC=(BWn - BW0)/BW0 × 100%
Где BWn означает BW в День n, и BW0 означает BW в день, когда начинали лечение.
2. Количество метастазов в легких
В конце испытания животных умерщвляли и легкое удаляли, затем подсчитывали количество метастазов.
3. Масса тимуса и селезенки
В конце испытания тимус и селезенку удаляли и взвешивали.
IV. Представление и анализ данных
Данные представляли как Среднее значение±SEM. Сравнение между группами анализировали с использованием ANOVA.
V. Результаты
1. Масса тела
Эффект YS-ON-001 на массу тела и изменение массы тела у мышей графически представлен на Фиг. 18A&18B.
Средняя масса тела (BW) существенно снижалась при лечении Цисплатином по сравнению с группой введения носителя (p<0,01) с Дня 5 до конца испытания (за исключением Дня 7). Подобный результат наблюдали для изменения массы тела.
В YS-ON-001 группе масса тела временно немного уменьшалась по сравнению с контрольной группой введения носителя. Однако в День 5 и День 15 масса тела в YS-ON-001 группе была существенно ниже по сравнению с контрольной группой введения носителя.
2 Количество метастазов в легких
Эффект YS-ON-001 на количество метастазов в легких у мышей графически представлен на Фиг. 19.
В конце испытания животных умерщвляли и легкое удаляли. И затем подсчитывали количество метастаз.
По сравнению с группой введения носителя, количество метастазов в легких существенно уменьшалось при лечении Цисплатином и YS-ON-001(p<0,01).
3 Масса тимуса и селезенки
Масса тимуса и селезенки, а также индекс каждого органа мышей графически представлены на Фиг. 20.
В конце испытания, помимо легкого, удаляли тимус и селезенку и взвешивали. Рассчитывали индексы для каждого органа.
По сравнению с группой введения носителя, лечение Цисплатином существенно уменьшало массу тимуса (p<0,01), тимический индекс (p<0,01), тогда как на массу селезенки и селезеночный индекс это не влияло.
По сравнению с группой введения носителя, масса тимуса и тимический индекс существенно уменьшались при введении YS-ON-001(p<0,01), тогда как масса селезенки и селезеночный индекс существенно увеличивались (p<0,01).
VI. Обсуждение и выводы
В этом примере метастазы в легких наблюдали у всех животных в контрольной группы введения носителя, приводящие к среднему количеству метастазов в легких 93,43±1,76. Среднее количество метастазов в легких существенно снижалось в группе введения цисплатина. Это указываает на то, что результаты являются достоверными.
YS-ON-001 показал сильную активность против метастазов, с существенным уменьшением среднего количества метастазов в легких в B16F10 модели метастазов опухоли при испытываемом уровне дозирования.
Пример 7. Терапевтические эффекты композиции (YS-ON-001) в модели опухоли S180 у самок Balb/C мышей
I. Создание опухолевой модели
1. Животные и условия содержания животных были такими же, как в Примере 2
2. Опухолевая клеточная линия
Клеточную линию S180 получали от Cell Bank of Chinese Academy of Medical Sciences и поддерживали в IPE-CAS лаборатории. Клетки поддерживали у Balb/c мышей в виде асцитов. Пересев осуществляли с интервалом 5-6 дней.
3. Создание S180 модели трансплантации опухоли
Balb/c животных кормили в течение 5-7 дней, и S180 опухоль интраперитонеально инокулировали F0 поколению мышей. Асциты извлекали, когда абдоминальная полость достигала определенного объема, и затем инокулировали F1 поколению мышей. В испытаниях использовали мышей F2-F3 поколения. Модель S180 опухоли устанавливали у самок Balb/c мышей путем подкожной инокуляции клеточной суспензии (2×106/0,2 мл/животное). Через два дня после инокуляции клеток мышей с инокулированными клетками рандомизированно распределяли по группам лечения. Введение животным в каждой группе осуществляли в соответствии с Таблицей 6.
II. Метод испытания
1. Группы испытания
Было 3 группы: Группа введения носителя, группа введения Циклофосфамида (CTX) и группа введения YS-ON-001.
Экспериментальная группа и доза
2. В конце испытания исследования прекращали в День 21. Опухоль удаляли и фотографировали. Массу опухоли регистрировали.
III. Наблюдаемые показатели
1. Объем опухоли
Противоопухолевый эффект испытываемого средства наблюдали путем измерения диаметра опухоли. Объемы опухолей измеряли 3 раза в неделю и рассчитывали относительный показатель пролиферации опухоли T/C (%).
1.1 Объем опухоли (TV) рассчитывали следующим образом:
TV=1/2×a×b2
где a и b означают длину и ширину, соответственно.
2. В конце испытания опухолевую массу удаляли и взвешивали.
IV. Представление и анализ данных
Данные представляли как Среднее значение±SEM. Сравнение между группами анализировали с использованием ANOVA.
V. Результаты
1. Объем опухоли
Эффект в YS-ON-001 группе на объем опухоли в модели S180 опухоли у самок Balb/C мышей графически представлен на Фиг. 21.
Опухоли в контрольной группе обработки солевым раствором росли прогрессивно у всех десяти мышей. В День 21 средний объем опухоли достигал 2000 мм3.
Лечение при помощи CTX существенно ингибировало рост опухоли по сравнению с контрольной группой обработки солевым раствором с Дня 4 до конца испытания (p< 0,01).
Лечение при помощи YS-ON-001 существенно ингибировало рост опухоли по сравнению с контрольной группой обработки солевым раствором с Дня 4 до конца испытания (p<0,01). Объем опухоли в YS-ON-001 группе был таким же, как в CTX группе.
2 Масса опухоли
Эффект YS-ON-001 на массу опухоли в модели S180 опухоли у самок Balb/C мышей графически представлен на Фиг. 22.
В конце испытания опухолевую массу удаляли и взвешивали. Подобно эффекту на объем опухоли, группы CTX и YS-ON-001 имели существенно уменьшенную массу опухоли по сравнению с контрольной группой обработки солевым раствором (p<0,01).
VI. Обсуждение и выводы
В этом примере контрольная группа введения носителя имела сильный рост опухоли, а CTX группа показала существенный ингибиторный эффект на рост опухоли в качестве положительного контроля.
Лечение при помощи YS-ON-001 существенно ингибировало рост опухоли, с существенным уменьшением объема опухоли и массы опухоли.
Результаты показали, что YS-ON-001 продемонстрировал сильную противоопухолевую активность в модели S180 опухоли при испытываемом уровне дозирования.
Пример 8. Терапевтические эффекты композиции (YS-ON-001) в модел асцитной раковой опухоли Эрлиха (EAC) у самок Balb/C мышей
I. Создание опухолевой модели
1. Животные
1.1 Самок Kunming мышей (5-6-недельного возраста) получали и испытывали после 5-6 дней адаптационного кормления.
1.2 Условия содержания животных
Животных кормили в соответствии с SPF условиями кормления животных, и обеспечивали их пищей (Keaoxieli сертифицированный корм для грызунов). Клетку, подстилку, пищу и питьевую воду стерилизовали в автоклаве. Клетки помещали в ламинарный бокс с чистотой 100, по 3-5 животных на клетку, и клетки заменяли два раза в неделю. Температура в помещении для животных была 21-25°С, с относительной влажностью между 40% и 70%.
2. Опухолевая клеточная линия
Клеточную линию асцитной опухоли Эрлиха (EAC) EAC получали от Cell Bank of Chinese Academy of Medical Sciences и поддерживали в IPE-CAS лаборатории. Клетки поддерживали у Kunming мышей в виде асцитов. Пересев осуществляли с интервалом 7-8 дней.
3. Создание модели трансплантации опухоли
Животных кормили в течение 5-7 дней и EAC опухоль интраперитонеально инокулировали мышам F0 поколения. Асциты извлекали, когда абдоминальная полость достигала определенного объема, и затем инокулировали F1 поколению мышей. В испытаниях использовали мышей F2-F3 поколения. Модель EAC опухоли устанавливали у самок Kunming мышей путем интраперитонеальной инокуляции клеточной суспензии (1×106/0,2 мл/животное). Через два дня после инокуляции клеток мышей с инокулированными клетками рандомизированно распределяли по группам лечения. Введение животным в каждой группе осуществляли в соответствии с Таблицей 7.
План эксперимента для EAC
Группа 3: в группе введения YS-ON-001, YS-ON-001 вводили путем инъекции в обе задние лапы при 0,1 мл/введение, всего 0,2 мл
II. Метод испытания
1. Группы испытания
Было 3 группы: Группа введения носителя, CTX группа и YS-ON-001 группа.
2. В конце испытания исследования прекращали в День 21. Опухоль удаляли и фотографировали. Массу опухоли регистрировали.
III. Наблюдаемые показатели: продолжительность, замедление роста опухоли
Замедление роста опухоли (TGD) рассчитывали как (TGD)=(T-C)/C×100%, где T и C относятся к средней продолжительности (дни) до смерти индивидуальных мышей для получавших лечение и контрольных групп, соответственно.
IV. Представление и анализ данных
Сравнение между группами анализировали с использованием ANOVA.
V. Результаты
Выживаемость в EAC опухолевой модели у самок Kunming мышей графически представлена на Фиг. 23.
День инокуляции опухоли принимают за День 0. В День 2 животных рандомизировали и введение осуществляли в соответствии с распределением по группам. Опухоли в контрольной группе введения носителя росли прогрессивно у всех десяти мышей. Смерть мышей наблюдали в День 23, и в День 27 все мыши были мертвы. Средняя продолжительность составила 25,5 дней.
По сравнению с группой введения носителя смерть мышей в CTX группе наблюдали в День 27, и все мыши были мертвы в День 30. Замедление роста опухоли (TGD) при лечении CTX было 14,74%, со средней продолжительностью 29 дней.
По сравнению с группой введения носителя, смерть мышей в YS-ON-001 группе наблюдали в День ee, и все мыши были мертвы в День 39. Замедление роста опухоли (TGD) при лечении CTX было 38,65%, со средней продолжительностью 34,5 дней.
VI. Обсуждение и выводы
В этом примере контрольная группа введения носителя имела сильный рост опухоли, а CTX группа в качестве положительного контроля показала эффект существенного замедления роста опухоли.
Лечение композицией YS-ON-001 при 0,2 мл/мышь показало эффект существенного замедления роста опухоли, при этом животные показали хорошую переносимость. Противоопухолевый эффект YS-ON-001 существенно лучше, чем эффект CTX контрольного лекарственного средства.
Результаты показали, что YS-ON-001 продемонстрировал сильную противоопухолевую активность и ингибиторный эффект на рост опухоли в модели EAC опухоли при испытываемои уровне дозирования, при этом мыши-опухоленосители показали хорошую переносимость.
Пример 9. Терапевтические эффекты композиции на рак щитовидной железы с метастазами в легких и лимфоузлах
1. Субъект:
Mao, женщина, возраст 53 года, в августе 2013 года диагностирован рак щитовидной железы с метастазами в легких, подверглась радикальной тиреоидэктомии. Послеоперационная патология показала папиллярную карциному на левой боковой стороне щитовидной железы, метастазы в лимфатические узлы, узловой зоб на правой боковой щитовидной доли. После этого 28 октября 2013 года и 6 февраля 2014 года она дважды подвергалась йод-131 терапии. В 2015 году она прошла 4 цикла радиотерапии Этопозид+Карбоплатин (2015.09.28, 2015.10.20, 2015.11.07, 2015.12.04). После лечения, в то время как 1-2 поражения в легких сжимались, другие 5-6 повреждений не изменялись, побочные эффекты химиотерапии очевидны, физическое состояние плохое.
2. Композиция:
Для введения человеку YS-ON-001 формулируют в стерильной воде для инъекци.
3. Схема введения:
С согласия пациента, YS-ON-001 (1 мл) вводили путем внутримышечной инъекции в плечо, один раз каждые 3 дня, 12 доз всего.
4. Результаты:
В этом примере субъект, которому вводили композицию по настоящему изобретению, не показал никаких явных побочных эффектов, все поражения стабильны, и физическое состояние улучшилось.
Пример 10. Терапевтические эффекты композиции на рак почки
1. Субъект:
Ма, мужчина, возраст 70, в ноябре 2015 года начались периодические симптомы гематурии, иногда боли в пояснице. Было проведено всестороннее обследование, и у него был диагностирован рак левой почки, размер около 11×12×6 см. КТ грудной клетки показала подозрение на рак правого легкого, хроническое воспаление обоих легких, и может быть связано с кистами в печени. Учитывая возраст и мнение семьи пациента, было решено не проводить операцию, лучевую терапию и химиотерапию. Он был выписан после простого противовоспалительного лечения.
2. Композиция:
Для введения человеку YS-ON-001 формулируют в стерильной воде для инъекций.
3. Схема введения:
С согласия пациента и его семьи, YS-ON-001 (2 мл) вводили путем внутримышечной инъекции в плечо с 25-го декабря, один раз каждые 3 дня, 12 доз всего.
4. Результаты:
В этом примере субъект, которому вводили композицию по настоящему изобретению, не показал никаких явных побочных эффектов, симптомы гематурии и боли в пояснице исчезли.
Пример 11. Терапевтические эффекты композиции на гастральную аденокарциному с метастатическим раком печени
1. Субъект:
Нан, женщина, 55 лет, в октябре 2015 года была диагностирована IV стадия аденокарциномы желудка с метастатическим раком печени, подвергалась химиотерапии Оксалиплатин+Лапатиниб. Однако химиотерапию прекратили из-за значительного повреждения печени. После приема лечения для снижения трансаминазы и симптоматического лечения функция печени в основном возвращается к нормальной.
2. Композиция:
Для введения человеку YS-ON-001 формулируют в стерильной воде для инъекций.
3. Схема введения:
3.1 Первый курс лечения:
С согласия пациента, YS-ON-001 (1 мл) вводили путем внутримышечной инъекции в плечо с 25 декабря 2015 года один раз каждые 3 дня. Этот курс прекращали из-за аномального увеличения уровня трансаминазы 29 декабря.
3.2 Второй курс лечения:
2 января 2016 года функция печени восстанавливалась до уровня до введения инъекции. Второй курс лечения YS-ON-001 возобновился с 11 января, дозировка осталась прежней. Пересмотрена 27 января.
4. Результаты:
После первого курса лечения трансаминаза аномально повышена, подозревается некроз ткани печени, вызванный введением композиции, считают, что это неспецифический противоопухолевый ответ.
После второго курса лечения у пациента не было никаких очевидных побочных эффектов. КТ печени показала уменьшение узловой тени, подтверждая предположение первого курса лечения.
Пример 12. Терапевтические эффекты композиции на рак молочной железы с метастазами в лимфоузлах, легких и кости
1. Субъект:
Женщина, возраст 34 года, в мае 2008 года диагностирована левосторонняя инфильтрующая дуктальная карцинома молочной железы, подверглась модифицированной мастэктомии. Предполагались метастазы в лимфатические узлы, иммуногистохимические результаты показали ER-, PR ++, HER2 ++. В июне 2015 года подтвердились метастазы в легких и кости. Краниальная КТ показала множественные метастазы в билатеральном полушарии мозжечка и мозжечке. Состояние оценивалось как прогрессирующее заболевание (PD).
2. Композиция:
Для введения человеку YS-ON-001 формулируют в стерильной воде для инъекций.
3. Схема введения:
3.1 Первый курс лечения:
С согласия пациента, начиная с 29 сентября 2015 года YS-ON-001 вводили внутримышечно, одна доза в неделю (1-я, 3-я, 5-я доза 2 мл, 2-я, 4-я, 6-я доза 1 мл), проходила химиотерапию по рекомендации врача.
3.2 Второй курс лечения:
С 14 декабря второй курс YS-ON-001 вводили через внутримышечную инъекцию, по одной дозе (1 мл) каждые 3 дня.
4. Результаты:
После первого курса лечения КТ грудной клетки показала набухание правых подмышечных лимфатических узлов, плевральный выпот значительно уменьшился, вернулись ткани правого легкого, некроз на тканях обоих легких, метастазы в мозг исчезли. Через неделю заболевание было определено как стабильное заболевание (SD).
После второго курса лечения КТ грудной клетки показала, что как узловая тень в легких явно уменьшилась. Фиг. 24A показывает КТ перед применением YS-ON-001, а Фиг. 24B показывает КТ после двух курсов лечения YS-ON-001. Легочная узловая тень была значительно уменьшена при сравнении этих двух снимков. Композиция по настоящему изобретению обладает значительными противоопухолевыми эффектами.
Пример 13. Терапевтические эффекты композиции на рак языка
1. Субъект:
Чжоу, женщина, возраст 78 лет, диагностирован рак языка в апреле 2015 года, перенесла расширенное иссечение левой части языка+частичная резекция нижней челюсти+удаление зуба. Послеоперационная патология показала хорошо дифференцированную плоскоклеточную карциному. В мае 2016 года рак языка снова рецидивировал, перенесла расширенную резекцию рецидивирующей карциномы левой части языка.
2. Композиция:
Для введения человеку YS-ON-001 формулируют в стерильной воде для инъекций.
3. Схема введения:
С согласия пациента с 26 июля 2016 года YS-ON-001 вводили путем внутримышечной инъекции в ягодицы, 2 дозы в день. После введения в течение 2 дней дозировку увеличивали до 4 раз в день.
4. Результаты:
В этом примере, субъект, которому вводили композицию по настоящему изобретению, не показал никаких явных побочных эффектов. Пациент заявил, что глубина язвы верхней челюсти уменьшилась, улучшение физического состояния, улучшение сна, повышенный аппетит и улучшалась физическая сила.
Пример 14. Терапевтические эффекты композиции на рак предстательной железы с множественными метастазами в кости
1. Субъект:
Сюй, мужчина, возраст 81 год, диагноз рак предстательной железы с множественными метастазами в кости в январе 2013 года.
2. Композиция:
Для введения человеку YS-ON-001 формулируют в стерильной воде для инъекций.
3. Схема введения:
С согласия пациента с 3 июля 2016 года YS-ON-001 вводили через внутримышечную инъекцию через день, по 2 дозы каждый раз. С 3 августа 2016 года количество доз увеличилось до 3. С 5 августа 2016 года инъекция через день, каждый раз 4 дозы. Одновременно использовали Золадекс в качестве комбинированного лечения по рекомендации врача.
4. Результаты:
В этом примере субъект, которому вводили композицию по настоящему изобретению, не показал никаких явных побочных эффектов, за исключением мышечной ригидности из-за длительных инъекций. Во время лечения общий уровень простата-специфического антигена снижался, улучшалось физическое состояние, облегчалась боль. До лечения результат биопсии пункции простаты показал, что все тестированные 10 игл были положительными, и это число уменьшилось до 5 положительных из 10 после лечения.
Пример 15. Терапевтические эффекты композиции на рак прямой кишки
1. Субъект:
Сунь, мужчина, возраст 63 лет, в ноябре 2012 года диагностирован рак прямой кишки, подверался резекции ректального рака+биопсии печени. Послеоперационная патология показала умеренно дифференцированный рак прямой кишки, инфильтрирована вся стенка кишечника, множественные опухолевые узлы, наблюдаемые внутри брыжеечной жировой ткани, видимый метастатический рак в лимфоузлах, метастатические узлы, наблюдаемые в печени. После восстановления после операции с мая 2012 года лечение проходило с использованием Бевацизумаба (600 мг) и Кселокса (OXA 250 мг, Xelod3.0, 14 дней). После 8 циклов принимал только Бевацизумаб до сентября 2015 года. В марте 2016 года КТ-снимок показал множественные внутрипеченочные метастазы, множественные метастазы в кости по всему телу, небольшие узловые метастазы нижней доли левого легкого, требующие подтверждения.
2. Композиция:
Для введения человеку YS-ON-001 формулируют в стерильной воде для инъекций.
3. Схема введения:
С согласия пациента с 25 марта 2016 года YS-ON-001 вводили внутримышечно. В первый месяц 1 дозу (1 мл) вводили через день. На второй месяц вводили 1 дозу каждый день. На третий месяц по 2 дозы в день. С 10 августа по 3 дозы ежедневно.
4. Результаты:
В этом примере субъект, которому вводили композицию по настоящему изобретению, не показал никаких явных побочных эффектов. Во время лечения симптомы пациента не изменялись, болезнь была стабильной без дальнейшего осложнения. Уменьшение отека нижней конечности, вызванного применением Бевацизумаба.
Пример 16. Терапевтические эффекты композиции на рак эндометрия
1. Субъект:
Чжан, женщина, 56 лет, в декабре 2010 года диагностирован рак эндометрия третьей стадии, подверглась обширной абдоминальной гистерэктомии+радикальной хирургии рака яичников. Послеоперационная патология обнаружила аденокарциному эндометрия (гистологическая опухоль 1 класса), рак яичников с двусторонней инфильтрацией, метастазы в правые кресцово-маточные связки. После операции, начиная с января 2011 года начали введение химиотерапии Доцетаксел+Цисплатин. В январе 2015 года был обнаружен печеночный и ректальный рецидив и метастазы, после этого применяли химиотерапию и лечение раковой боли.
2. Композиция:
Для введения человеку YS-ON-001 формулируют в стерильной воде для инъекций.
3. Схема введения:
С согласия пациента, начиная с 10 июня 2016 года YS-ON-001 вводили внутримышечно. В течение первых 10 дней 2 дозы (2 мл) ежедневно, а затем 4 дозы (4 мл) ежедневно.
4. Результаты:
В этом примере субъект, которому вводили композицию по настоящему изобретению, не показал никаких явных побочных эффектов, за исключением мышечной регидности в месте инъекции. После 2-месячного лечения, по сравнению с предыдущим анализом КТ, менее плотные опухоли на левой брюшной стенке слегка уменьшились, явное нерегулярное утолщение вблизи на селезеночном изгибе, немного лучше, чем раньше.
Пример 17. Терапевтические эффекты композиции на рак яичника
1. Субъект:
Чжоу, женщина, 56 лет, в июне 2016 года диагностирован рак яичников IIIc (серозная карцинома высокой степени), подвергалась лапаротомии для циторедуктивной хирургии рака яичников+резекции ректального рака. Послеоперационная патология (левые маточные придатки, правый яичник) соответствовала серозной карциноме высокой степени, ректальным поражениям, раковым тканям, обнаруженным на аппендикулярной серозной оболочке и брюшной стенке.
2. Композиция:
Для введения человеку YS-ON-001 формулируют в стерильной воде для инъекций.
3. Схема введения:
С согласия пациента, начиная с 16 июня 2016 года YS-ON-001 вводили внутримышечно. 2 дозы (2 мл) ежедневно в течение первых 7 дней, затем 4 дозы (4 мл) ежедневно. Одновременно использовали Доцетаксел и Карбоплатин в качестве комбинированного лечения по рекомендации врача.
4. Результаты:
В этом примере субъект, которому вводили композицию по настоящему изобретению, не показал никаких явных побочных эффектов. Во время лечения симптомы пациента оставались неизменными, стабильными без дальнейшего прогрессирования.
Литература
Любое перечисление или обсуждение очевидно ранее опубликованного документа в настоящем описании не должно обязательно восприниматься как подтверждение того, что такой документ является частью известного уровня техники или относится к области общих знаний.
Следующие ссылочные документы могут представлять интерес:
Wanqing Chen, et al. Cancer Statistics in China, 2015. Cancer Journal for Clinicians. 2016 Vol. 66:115-132.
Guoqian Kuang, et al. Current Status and Prospect of Cancer Virotherapy Clinical Studies. Journal of Guangxi Medical University, 1995 Vol. 12: 617-619.
Shounan Tan, Fengyu Zhang. Studies on Rabies and Rabies Vaccine for Human Use. Medical Information 2011 Vol. 24:2841-2842.
Yuhui Zhang. The Establishment of Rabies Vaccine Purification Technology. Chinese Journal of Biologicals 1999 Vol. 12 Iss. No. 4: 231-232.
Jiang Zhong. Oncolytic Virus and Tumor Treatment, Foreign Medicine (Microbiology Section), 2004 Vol. 27 Iss. No. 6.
Kenney S, et al. Viruses as oncolytic agents: a new age for therapeutic virus. J Nati Cancer Inst, 1994,86:1185.
Lorence, et al. Complete regression of human neuroblastoma xenografts in athymic mice after local Newcastle disease virus therapy. J Nati Cancer Inst, 1994, 86:1228.
CN100341571C
RU2414238C2
US2010/0297072A1
WO2009/016433.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПЛЕКС ДЛЯ УСИЛЕНИЯ ИММУННОГО ОТВЕТА | 2019 |
|
RU2779622C2 |
| КОМПОЗИЦИЯ ОТ БЕШЕНСТВА, СОДЕРЖАЩАЯ АДЪЮВАНТ PIKA | 2014 |
|
RU2678981C2 |
| УЛУЧШЕННЫЕ СПОСОБЫ ЛЕЧЕНИЯ ОПУХОЛЕЙ | 2007 |
|
RU2481853C2 |
| ИММУНОГЕННЫЕ ВЕЩЕСТВА, СОДЕРЖАЩИЕ АДЪЮВАНТ НА ОСНОВЕ ПОЛИИНОЗИНОВОЙ КИСЛОТЫ-ПОЛИЦИТИДИЛОВОЙ КИСЛОТЫ | 2006 |
|
RU2462264C2 |
| КОМБИНИРОВАННАЯ ПРОТИВООПУХОЛЕВАЯ ТЕРАПИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ НЕЕ | 2005 |
|
RU2396960C2 |
| Комбинация дегидроксиметилэпоксихиномицина (DHMEQ) и цитостатиков для лечения рака яичника | 2018 |
|
RU2704020C1 |
| ИММУНОГЕННЫЕ ПРОТИВОВОСПАЛИТЕЛЬНЫЕ КОМПОЗИЦИИ | 2011 |
|
RU2722357C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ ПЕПТИДА, ОБЛАДАЮЩЕГО ПРОТИВООПУХОЛЕВЫМ ДЕЙСТВИЕМ | 2007 |
|
RU2362579C1 |
| ИММУНОГЕННЫЕ ПРОТИВОВОСПАЛИТЕЛЬНЫЕ КОМПОЗИЦИИ | 2011 |
|
RU2581922C2 |
| ABX196 ДЛЯ ПРИМЕНЕНИЯ ПРИ ЛЕЧЕНИИ РАКА МОЧЕВОГО ПУЗЫРЯ | 2018 |
|
RU2778812C2 |

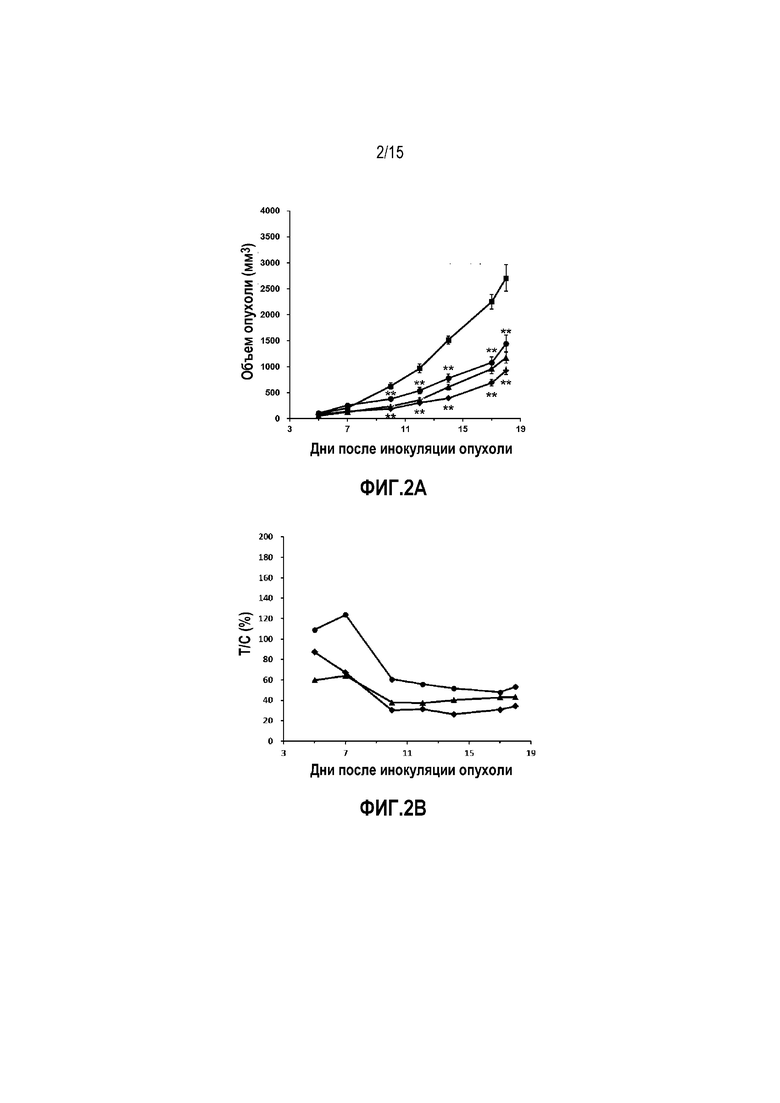

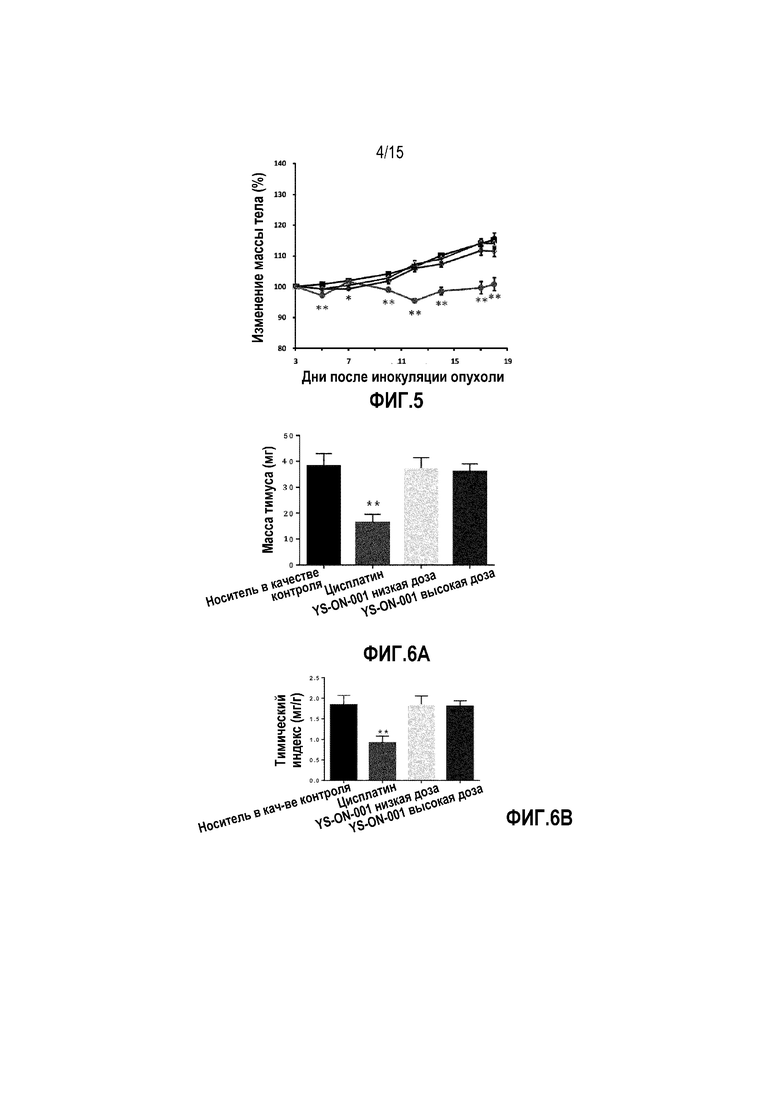
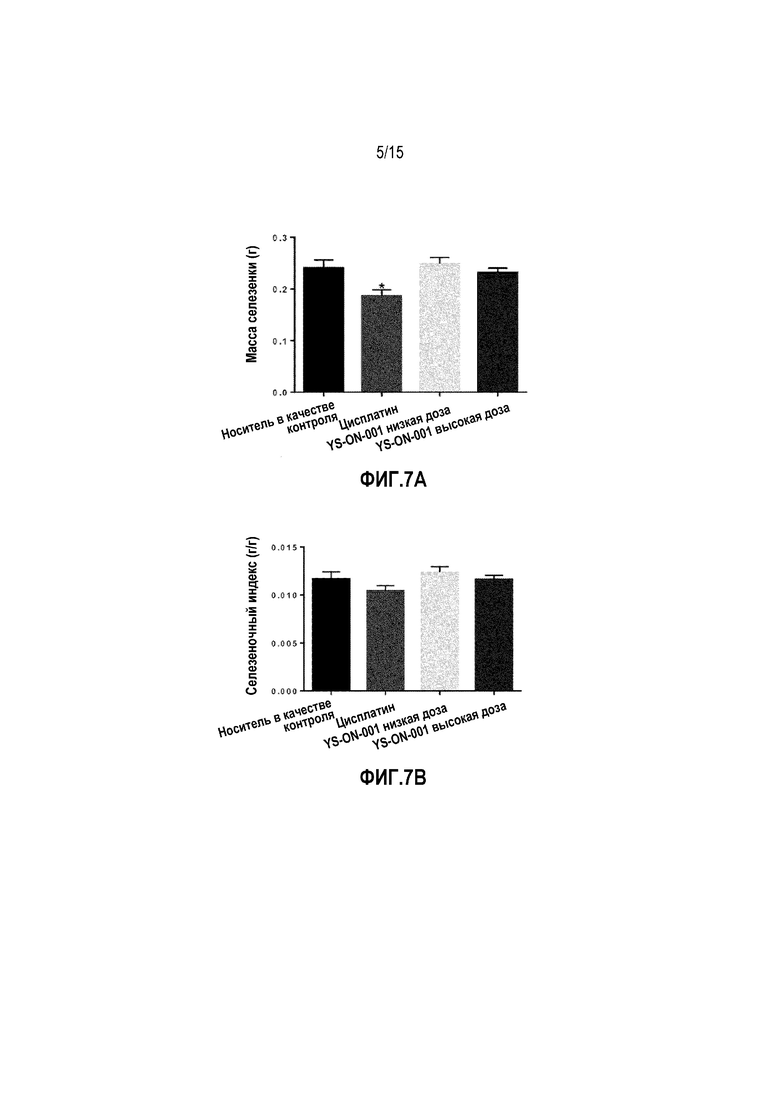
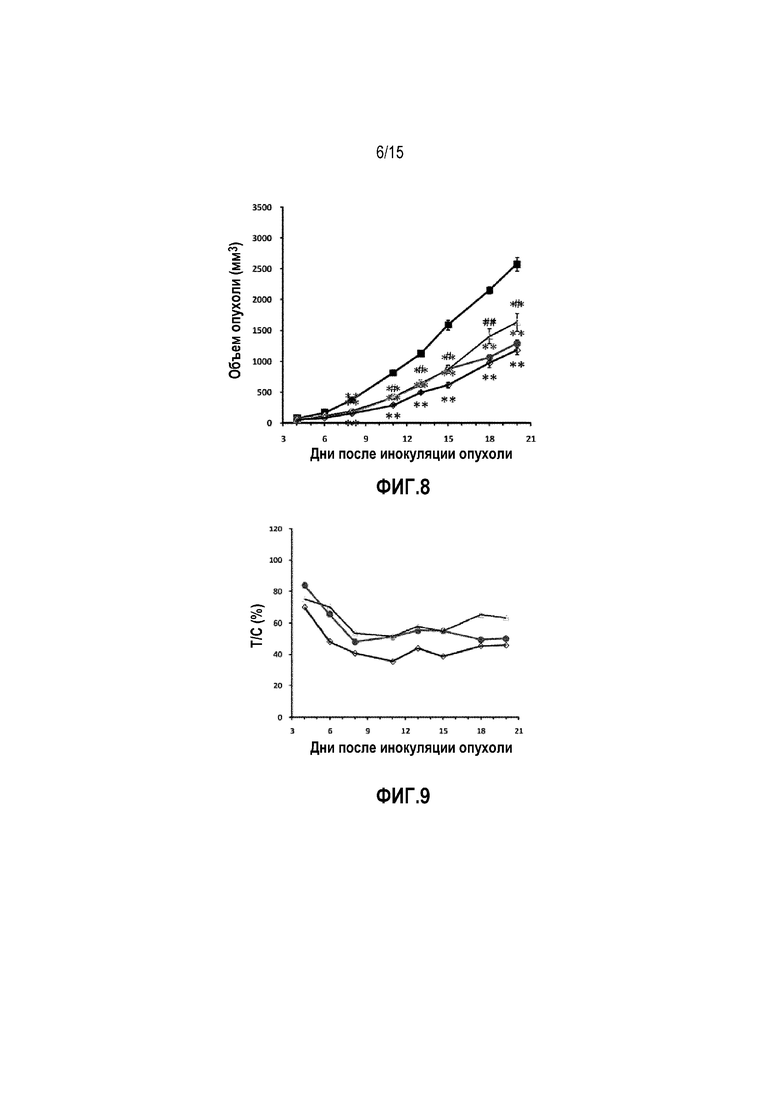
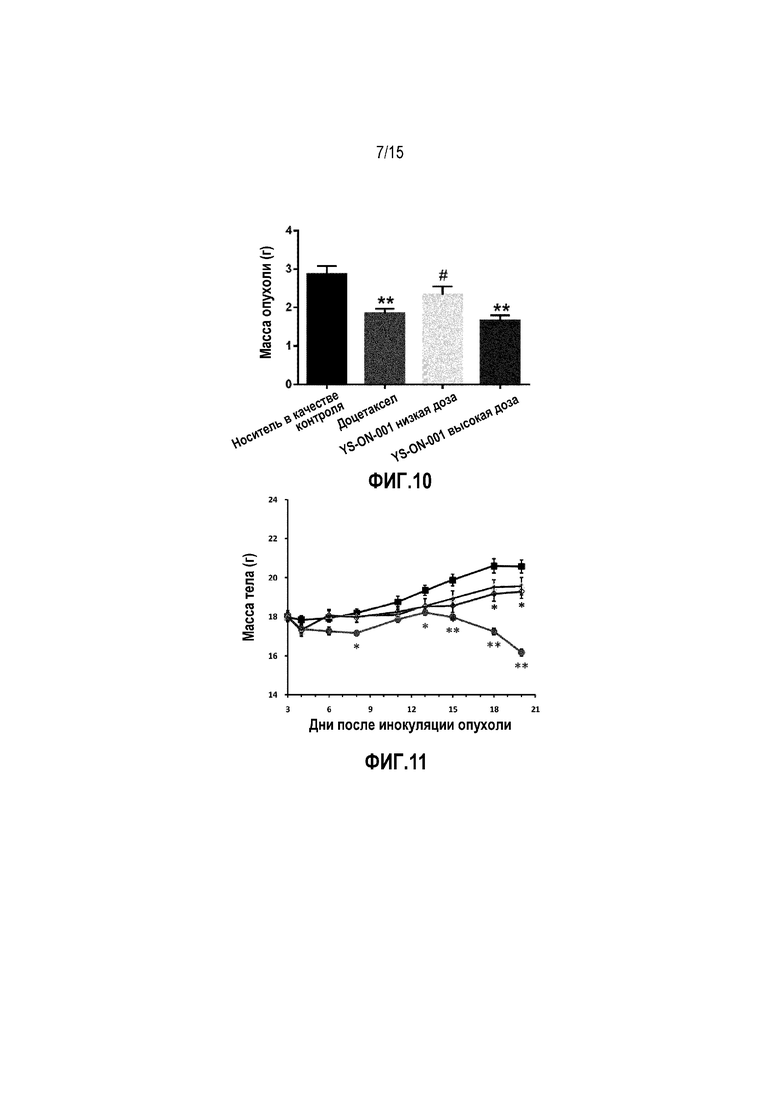
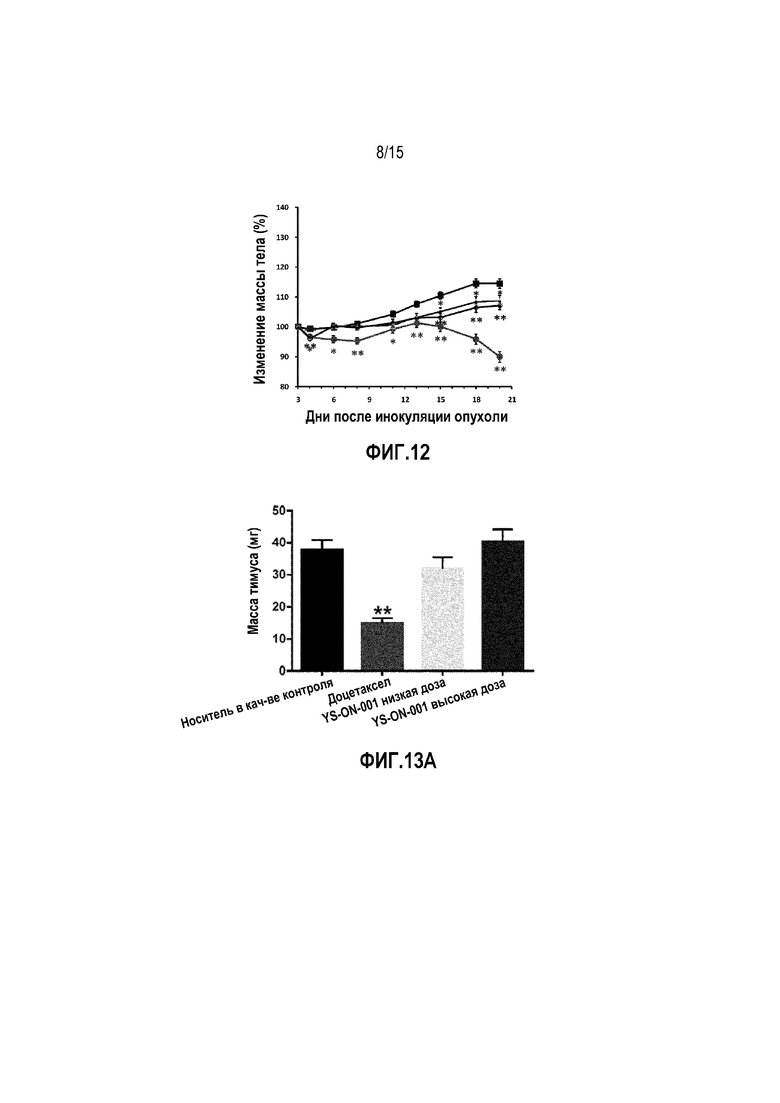
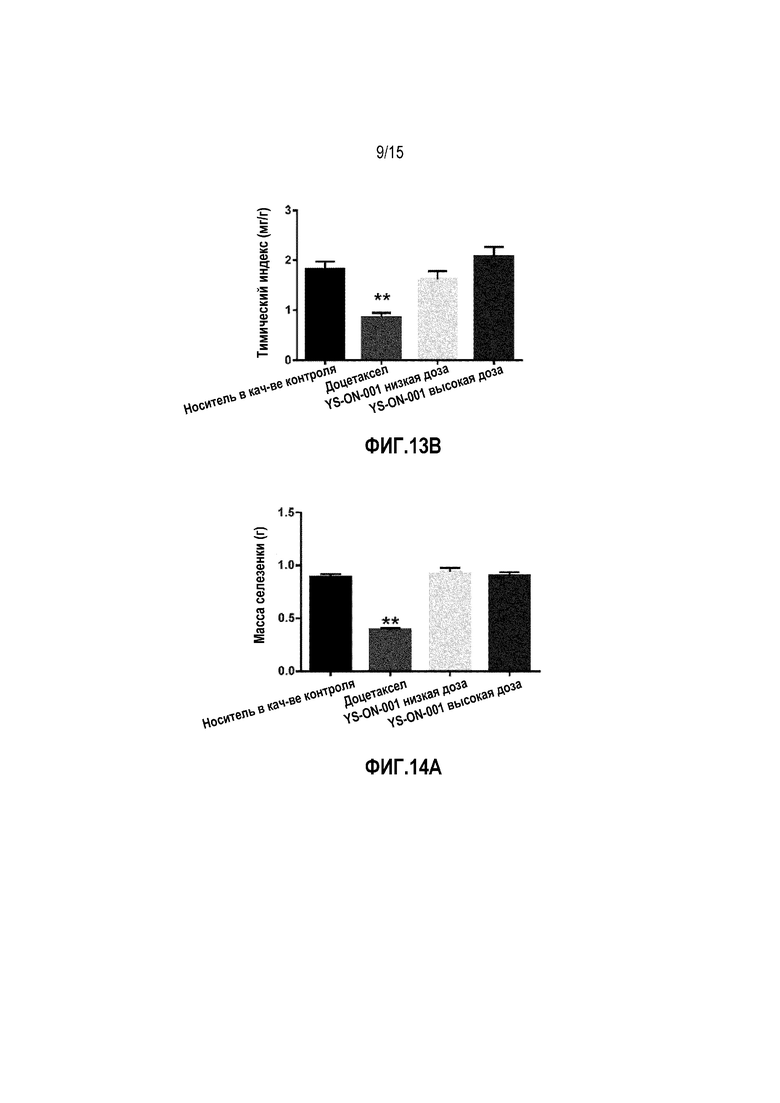
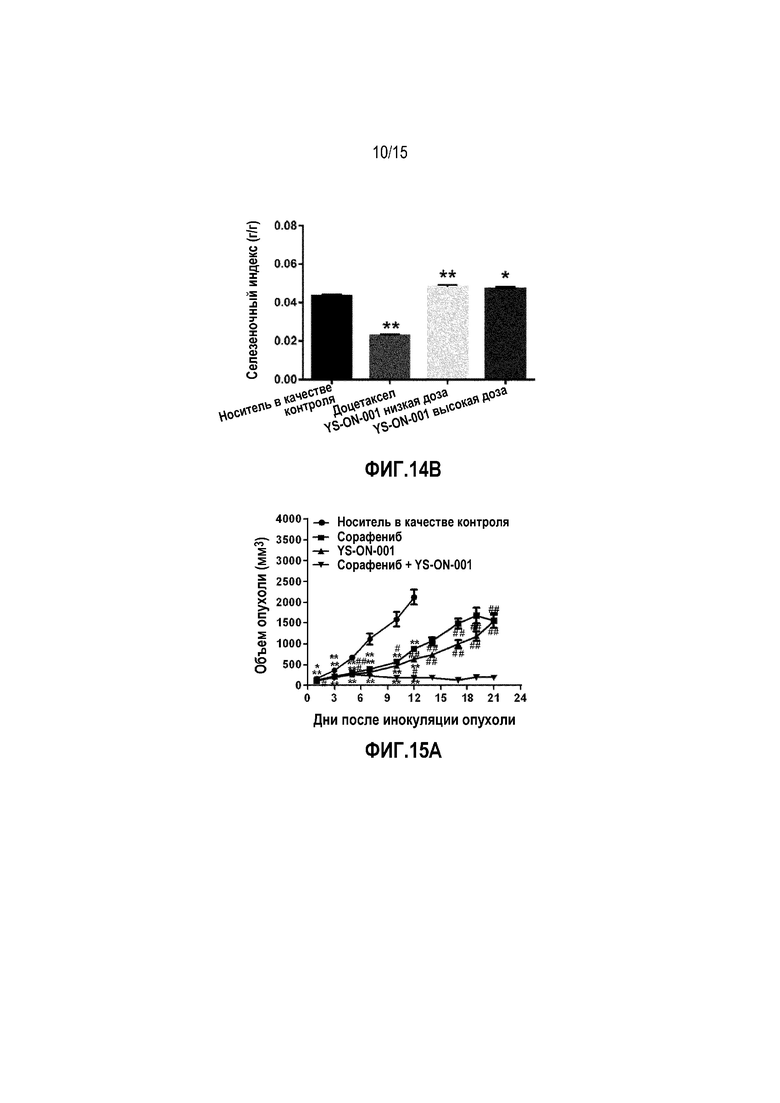

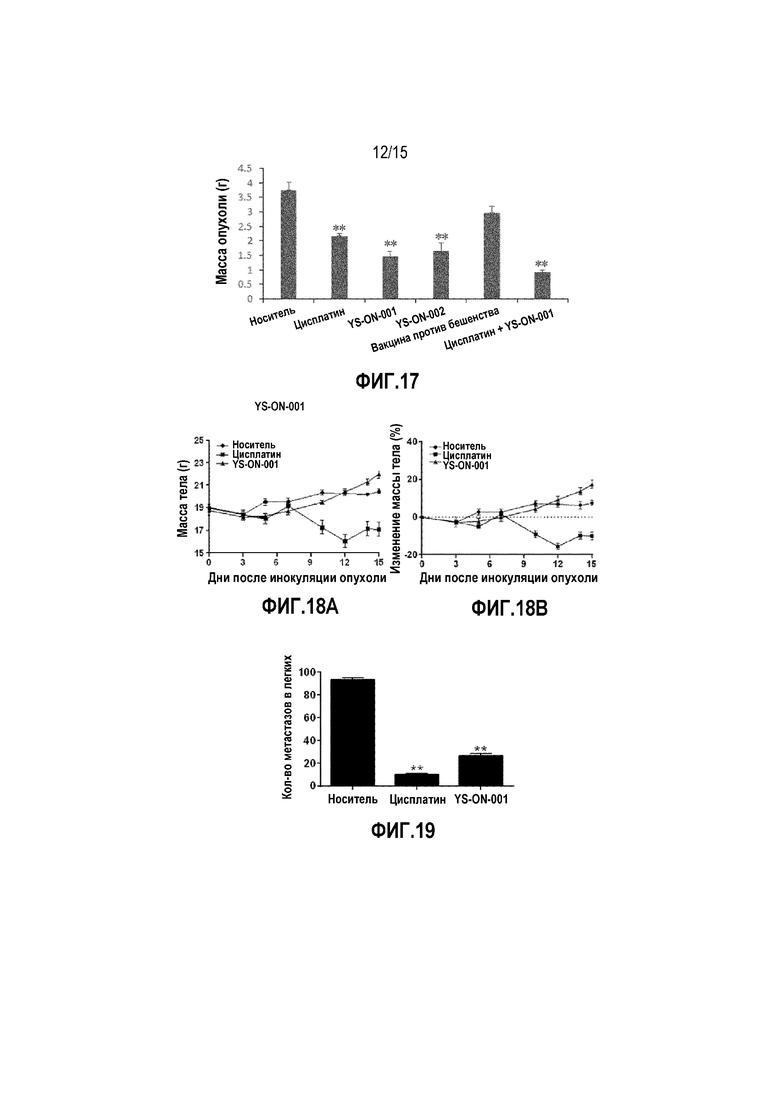

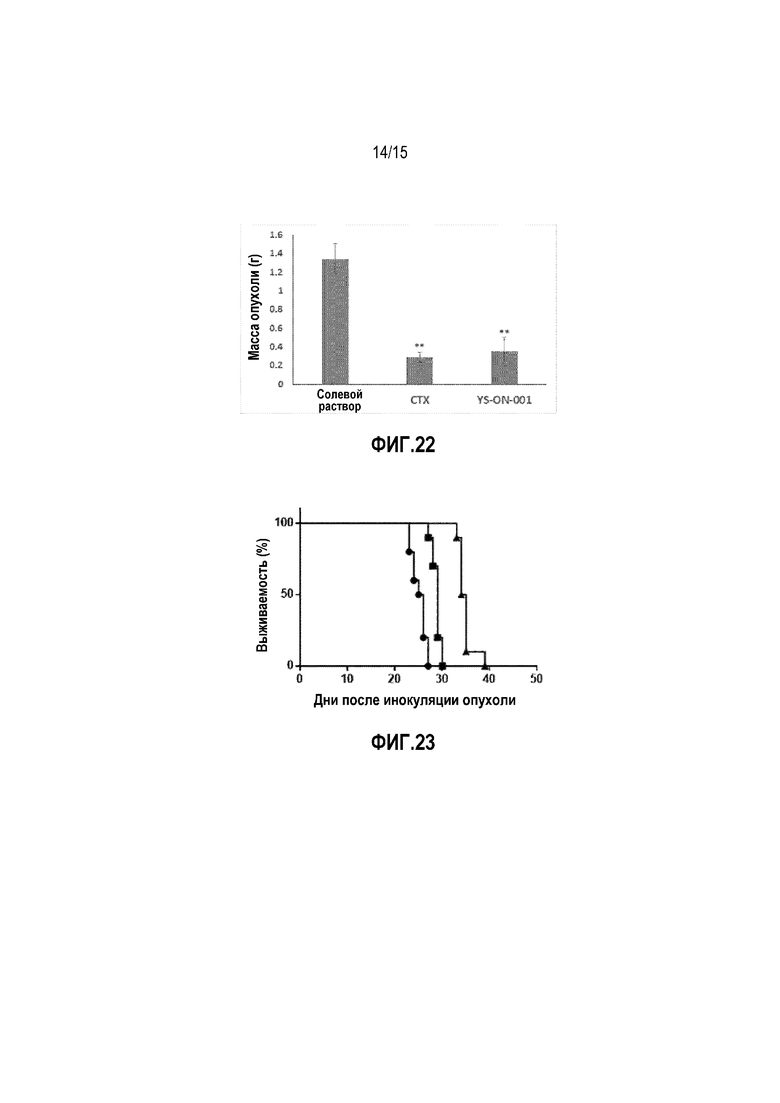
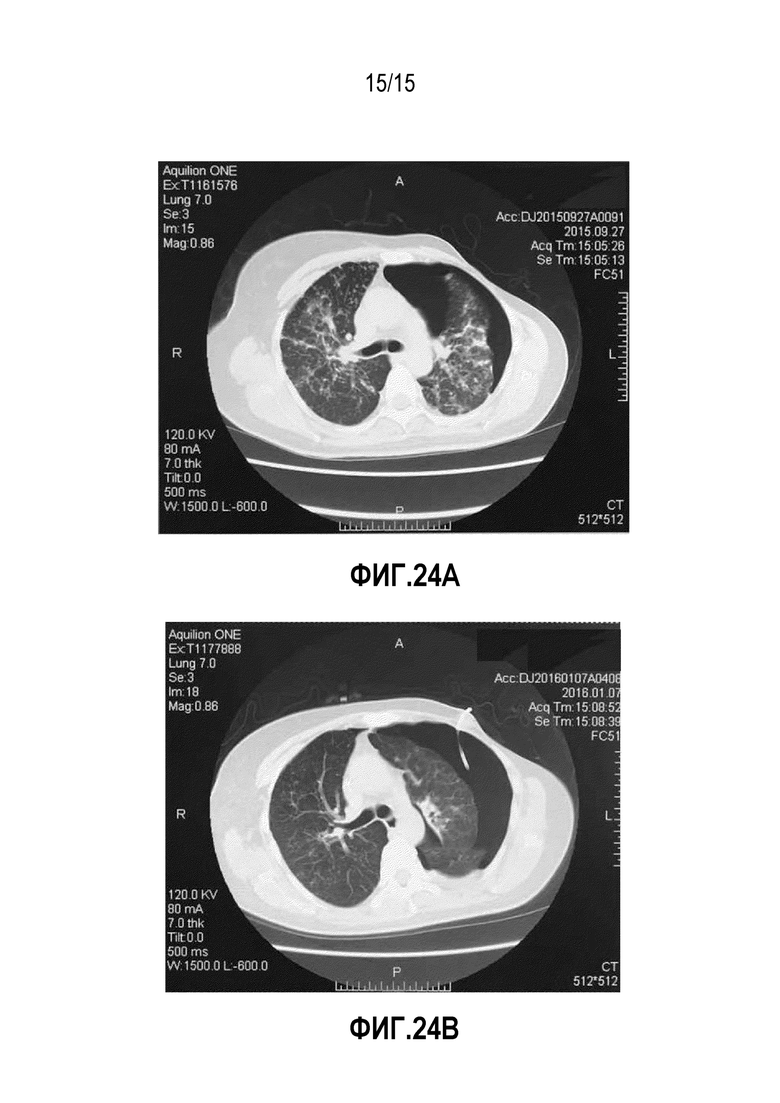
Группа изобретений относится к медицине и касается применения композиции для лечения рака, включающей a) полиинозиновую-полицитидиловую кислоту (PIC) в количестве 1000 мкг/мл, b) канамицин в количестве 800 МЕ/мл, c) ион кальция в количестве 0,16 мкмоль/мл, и d) неактивированный вирус бешенства в количестве 2МЕ/мл. Группа изобретений также касается способа лечения рака, включающего стадию введения субъекту указанной композиции. Группа изобретений обеспечивает лечение рака. 2 н. и 14 з.п. ф-лы, 17 пр., 7 табл., 24 ил.
1. Применение композиции для лечения рака, включающей:
a) полиинозиновую-полицитидиловую кислоту (PIC) в количестве 1000 мкг/мл,
b) канамицин в количестве 800 МЕ/мл,
c) ион кальция в количестве 0,16 мкмоль/мл, и
d) неактивированный вирус бешенства в количестве 2 МЕ/мл.
2. Применение по п. 1, где отношение указанного вируса к указанной PIC 1 МЕ/500 мкг.
3. Применение по любому из пп. 1, 2, где количество указанной PIC составляет 1000 мкг на стандартную дозу.
4. Применение по любому из пп. 1-3, где количество указанного вируса составляет 2,0 МЕ на стандартную дозу.
5. Применение по любому из пп. 3, 4, где стандартную дозу получают в объеме, который выбран из группы, состоящей из 0,1 мл, 0,2 мл, 1,0 мл, 2,0 мл, 3,0 мл, и 4,5 мл, и диапазона между любыми двумя из указанных выше объемов.
6. Применение по п. 4, где количество указанного вируса находится в пределах от 0,05 МЕ/мл до 40,0 МЕ/мл, представленное как концентрация.
7. Применение по п. 1, где указанная композиция дополнительно включает по меньшей мере одно вспомогательное вещество, которое выбрано из группы, состоящей из мальтозы, низкомолекулярного декстрана, человеческого сывороточного альбумина и любой их комбинации.
8. Применение по любому из пп. 1-7, где указанная композиция дополнительно включает по меньшей мере один физиологически приемлемый буфер, который выбран из группы, состоящей из ацетатного, трис(гидроксиметил)аминометанового, бикарбонатного, карбонатного, фосфатного буфера и любой их комбинации.
9. Применение по любому из пп. 1-8, где pH указанной композиции находится в пределах от pH 6,5 до pH 8,0.
10. Применение по п. 1, где указанный рак выбран из группы, состоящей из:
рака легкого, рака молочной железы, гепатоцеллюлярной карциномы, меланомы, саркомы, асцитной опухоли Эрика, щитовидной железы, рака почки, рака эндометрия, гастральной аденокарциномы, рака печени, рака прямой кишки, рака языка, рака предстательной железы, рака кости, лимфомы, ректального рака, рака яичника, панкреатического рака и рака простаты.
11. Применение по п. 1, где, когда композиция по любому из пп. 1-9 содержит вирус, рак не вызван этим вирусом.
12. Способ лечения рака, включающий стадию введения субъекту композиции по любому из пп. 1-9.
13. Способ по п. 12, где путь указанного введения выбран из группы, состоящей из внутримышечного, подкожного и интратуморального.
14. Способ по п. 12, где композицию по любому из пп. 1-9 вводят субъекту-человеку c частотой, выбранной из группы, состоящей из одного раза каждые три дня, 2 раза в день, 4 раза в день, одного раза каждые два дня, одного раза в день, 3 раза в день, один раз в неделю, два раза в неделю.
15. Способ по п. 12, где указанный рак выбран из группы, состоящей из рака легкого, рака молочной железы, рака щитовидной железы, рака почки, рака печени, меланомы, рака простаты, более предпочтительно указанный рак представляет собой метастатическую опухоль.
16. Применение композиции по любому из пп. 1-7 в комбинации с терапевтическим средством, выбранным из группы, состоящей из бевацизумаба, сорафениба, цисплатина и ингибитора PD-1.
| WO2011003883 A1, 13.01.2011 | |||
| FRANZ J.ZEMP ET AL | |||
| Treating brain tumor-initiation cells using a combination of myxoma virus and rapamycin// Neuro-Oncology, 2013, 15(7), p.904-920 | |||
| RU2010102096 A, 10.08.2011. |
Авторы
Даты
2020-07-28—Публикация
2017-03-31—Подача