ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение в целом относится к иммуногенным композициям и к способам их использования. Более конкретно, настоящее изобретение относится к иммуногенной композиции, включающей полинуклеотидный адъювант в сочетании с одним или несколькими антигенными веществами, используемыми для проявления в организме хозяине специфического для заболевания иммунного ответа.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Иммунная система может проявлять как специфические, так и неспецифические иммунные ответы. Неспецифический иммунитет охватывает различные клетки и механизмы, такие как фагоцитоз (захват чужеродных частиц или антигенов) макрофагами или гранулоцитами, и активность природных клеток-киллеров (NK), в числе других. Неспецифический иммунитет связан с механизмами, эволюционно менее развитыми, и не связан с приобретенной специфичностью и памятью, которые являются особенностями специфического иммунного ответа. Ключевые различия между специфическим и неспецифическим иммунитетом определяются специфичностью В- и Т-клеток. Эти клетки преимущественно приобретают свою реактивность после активации специфическим антигеном и обладают механизмами, позволяющими проявлять эффект памяти в случае последующего воздействия указанного специфического антигена. В результате вакцинация (включающая такие параметры, как специфичность и память) является эффективной процедурой для защиты от вредных патогенов.
В основном В- и Т-лимфоциты, которые содержат специфические рецепторы на поверхности своих клеток для данного антигена, генерируют специфическую иммунную реакцию. Специфическая иммунная система может отвечать на различные антигены двумя способами: 1) путем развития гуморального иммунитета, который включает в себя стимуляцию В-клеток и продукцию антител или иммуноглобулина, антигена и хелперных Т-клеток (преимущественно Th2), и 2) путем развития клеточного иммунитета, в который в основном вовлечены Т-клетки, включая цитотоксические Т-лимфоциты (CTL), хотя в образование CTL ответа могут вовлекаться и другие клетки (например, антигенпрезентирущие клетки и Th1-клетки).
В поисках более безопасных и более эффективных вакцин были использованы новые технологии, включающие рекомбинантные методики, методики очистки и синтеза, для повышения качества и специфичности используемых антигенов. Очищенные, субъединичные и синтезированные антигены проявляют повышенную безопасность, но пониженную иммуногенность, которая рассматривалась как один из показателей для идентификации эффективного адъюванта. Таким образом, эффективный адъювант становится все более важным компонентом современных вакцин. Адъюванты в основном представляют собой соединения, которые, при их введении вместе с антигеном (либо в сочетании с ним, либо вводимые до антигена), повышают и/или модифицируют иммунный ответ на конкретный антиген.
Репрезентативные адъюванты, которые были использованы для повышения иммунного ответа, включают соединения алюминия (в целом обозначаемые как «квасцы»), эмульсии типа масло-в-воде (полный адъювант Фрейнда (CFA) представляет собой эмульсию масло-в-воде, содержащую высушенные, термически инактивированные организмы Mycobacterium tuberculosis), сапонин (выделенный из коры Quillaja Saponoria, активный компонент адъюванта, известный как Quile A), CpG ОДН (синтетический олигодезоксинуклеотид, содержащий неметилированные CpG динуклеотиды), монофосфорил-липид А (MPL), полученный из липополисахарида Salmonella minnesota Re595, липосомы (обычно получаемые из биодеградируемых материалов, таких как фосфолипиды) и биодеградируемые полимерные микросферы (получаемые из множества полимеров, таких как полифосфазен и полиангидриды). Адъювантные свойства указанных соединений, оцениваемые с каждым из адъювантов, демонстрировали как достоинства, так и недостатки.
Полинуклеотидные комплексы были исследованы применительно к различным видам использования, включая их свойства в качестве адъювантов. Двуцепочечные РНК (дцРНК) представляют собой очень мощные биологические модификаторы, которые могут оказывать выраженное влияние на клетки в наномолярных концентрациях. Модулирующие эффекты дцРНК включают широкий спектр воздействия на молекулярном и клеточном уровнях.
На молекулярном уровне дцРНК могут проявлять биологические эффекты, такие как синтез интерферона, индукцию протеинкиназы, усиление антигенной гистосовместимости и ингибирование метаболизма. На клеточном уровне дцРНК могут демонстрировать такие биологические эффекты, как пирогенность, митогенность, макрофагальная активация, активация гуморального иммунитета, активация клеточного иммунитета и индукция антивирусного статуса. Иммуномодулирующие эффекты дцРНК были описаны. В патенте США No. 4124702 указано, что двуцепочечные полинуклеотиды вызывают индукцию интерферона в живых клетках животных. В патенте США No. 3906092 описано, что образование антител в ответ на вакцину адъювантного типа повышается при включении в вакцину полинуклеотида или комплекса полинуклеотидов. Хьюстон с соавт. (Houston et al.) установили, что PICLC (комплекс полиинозиновой кислоты - полицитидиловой кислоты - поли-L-лизинкарбоксиметилцеллюлозы) представляет собой мощный адъювант, действующий по механизму повышения первичного антительного ответа, в отсутствие дополнительного адъюванта.
Полиинозиновая - полицитидиловая кислота (PIC), как один из наиболее изученных полинуклеотидных комплексов, не был эффективен при использовании на обезьянах и людях в связи с его нестабильностью в организме после введения. В этой связи, PIC подвергли модификации различными способами, с тем чтобы преодолеть свойственный им один или другой недостаток. Так, например, комплекс полирибоинозиновой-полирибоцитидиловой кислоты с гидробромидом поли-L-лизина примерно в 5-15 раз более устойчив к гидролизу панкреатической рибонуклеазой, чем исходный препарат PIC.
Лин с соавт. (Lin et al.) указывают, что противовирусное средство, включающее в себя полиинозиновую-полицитидиловую кислоту, канамицин и кальций, можно использовать в качестве адъюванта (Lin, et al., A new immunostimulatory complex (PICKCa) in experimental rabies: antiviral and adjuvant effects, Arch Virol, 131: 307-19, 1993; и патент Китая No. 93105862.7). В патенте Китая No. 93105862.7 описано применение основной композиции поли I:C, канамицина и кальция (PICKCa) в качестве адъюванта в составе вакцины для применения у человека и других млекопитающих. Однако Лин обнаружил, что первоначально идентифицированная форма PICKCa не обеспечивает оптимального профиля эффективности/безопасности для применения в качестве адъюванта и, кроме того, в определенных условиях вызывает неприемлемые неблагоприятные побочные эффекты.
Настоящее изобретение относится к новым иммуногенным композициям, которые проявляют улучшенные профили безопасности и эффективности; и к способам применения таких композиций. Целевые иммуногенные композиции включают в себя полинуклеотидный адъювант и антиген.
Цитированная литература
Могут представлять интерес следующие ссылки:
JP1093540A2;
патент США No. 4124702
патент США No. 3692899
патент США No. 3906092
патент США No. 4389395
патент США No. 4349538
патент США No. 4024241
патент США No. 3952097
Houston et al., Infection and Immunity, 14:318-9, 1976C
Wright and Adler-Moore, Biochemical and Biophysical Research Communications, 131:949-45, 1985
Lin, et al., A new immunostimulatory complex (PICKCa) in experimental rabies: antiviral and adjuvant effects, Arch Virol, 131:307-19, 1993
Патент Китая 93105862.7
Gupta R.K. et al., Adjuvants- a balance between toxicity and adjuvanticity, Vaccine 11:293-306, 1993
Arnon, R. (Ed.) Synthetic Vaccines 1:83-92, CRC Press, Inc., Boca Raton, Fla., 1987
Sela, M., Science 166:1365-1374 (1969)
патент США No. 6008200
Ellouz et al., Biochem. & Biophy. Res. Com., 59:1317, 1974
патент США No. 4094971
патент США No. 4101536
патент США No. 4153684
патент США No. 4235771
патент США No. 4323559
патент США No. 4327085
патент США No. 4185089
патент США No. 4082736
патент США No. 4369178
патент США No. 4314998
патент США No. 4082735
патент США No. 4186194
патент США No. 4468558
New Trends and Developments in Vaccines, edited by Voller et al., University Park Press, Baltimore, Md., USA, 1978
Klein, J., et al., Immunology (2nd), Blackwell Science Inc., Boston (1997)
Gupa R.K. and Siber G.R., Adjuvants for human vaccines- current status, problems and future prospects, Vaccine, 13 (14):1263-1276, 1995
Richard T Kenney et al. Meeting Report- 2nd meeting on novel adjuvants currently in/close to human clinical testing, Vaccine 20 2155-2163, 2002
Laboratory Techniques in Rabies Edited by F X Meslin, M M Kaplan, H Koprowski 4th, 1996, Edition ISBN 92 4 1544 1
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В основном настоящее изобретение относится к новым иммуногенным композициям, включающим в себя полинуклеотидную адъювантную композицию вместе с иммуногенным или антигенным веществом, а также к способам использования их для проявления иммунного ответа.
Соответственно, в настоящем изобретении предлагаются иммуногенные композиции, включающие в себя (а) полинуклеотидный адъювант, содержащий полирибоинозиновую-полирибоцитидиловую кислоту (PIC), по меньшей мере, один антибиотик и, по меньшей мере, один положительный ион; и (b), по меньшей мере, один антиген, где указанная композиция изготавливается для введения с целью достижения пролонгированного высвобождения.
Иммуногенная композиция согласно изобретению может включать в себя полинуклеотидную адъювантную композицию с молекулами, гетерогенными по молекулярной массе, где молекулярная масса составляет по меньшей мере 66000 дальтон.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 - выявление по методу ELISPOT мышиных спленоцитов, продуцирующих интерферон γ после иммунизации вакцинами, включающими PIKA и/или HBsAg adw.
Фиг.2 - выявление по методу ELISPOT мышиных спленоцитов, продуцирующих IL-2 после иммунизации вакцинами, включающими PIKA и/или HBsAg adw.
Фиг.3 - выявление по методу ELISPOT IL-4, продуцируемых мышиными спленоцитами после иммунизации вакцинами, включающими PIKA и/или HBsAg adw.
Фиг.4 - определение по методу ИФТФА титров специфических IgG в мышиной сыворотке (в 400-кратном разведении) после иммунизации вакцинами, включающими PIKA и/или HBsAg adw.
Фиг.5 - выявление по методу ELISPOT мышиных спленоцитов, продуцирующих интерферон гамма (γ) после иммунизации вакцинами, включающими PIKA и/или инактивированный субъединичный гриппозный антиген.
Фиг.6 - выявление по методу ELISPOT мышиных спленоцитов, продуцирующих IL-2 после иммунизации вакцинами, включающими PIKA и/или инактивированный субъединичный гриппозный антиген.
Фиг.7 - выявление по методу ELISPOT мышиных спленоцитов, продуцирующих IL-4 после иммунизации вакцинами, включающими PIKA и/или инактивированный субъединичный гриппозный антиген.
Фиг.8 - определение по методу ИФТФА титров специфических IgG в мышиной сыворотке (в 900-кратном разведении) после иммунизации вакцинами, включающими PIKA и/или инактивированный субъединичный гриппозный антиген.
Фиг.9 - выявление по методу ELISPOT мышиных спленоцитов, продуцирующих интерферон гамма (γ) после иммунизации вакцинами, включающими PIKA и/или антиген HIV gp 120.
Фиг.10 - выявление по методу ELISPOT мышиных спленоцитов, продуцирующих IL-2 после иммунизации вакцинами, включающими PIKA и/или антиген HIV gp 120.
Фиг.11 - выявление по методу ELISPOT мышиных спленоцитов, продуцирующих IL-4 после иммунизации вакцинами, включающими PIKA и/или антиген HIV gp 120.
Фиг.12 - анализ с использованием флуоресцентного сортировщика (FACS-анализ) мышиных спленоцитов после иммунизации вакцинами, включающими PIKA и/или антиген HIV gp 120, а также процентного содержания CD4+ клеток, экспрессирующих интерферон γ.
Фиг.13 - выявление по методу ELISPOT мышиных спленоцитов, продуцирующих интерферон γ после иммунизации вакцинами, включающими PIKA и/или rPA антиген сибирской язвы.
Фиг.14 - выявление по методу ELISPOT мышиных спленоцитов, продуцирующих IL-2 после иммунизации вакцинами, включающими PIKA и/или rPA антиген сибирской язвы.
Фиг.15 - выявление по методу ELISPOT мышиных спленоцитов, продуцирующих IL-4 после иммунизации вакцинами, включающими PIKA и/или rPA антиген сибирской язвы.
Фиг.16 - анализ с использованием флуоресцентного сортировщика (FACS-анализ) мышиных спленоцитов после иммунизации вакцинами, включающими PIKA и/или rPA антиген сибирской язвы, а также процентного содержания CD4+ клеток, экспрессирующих интерферон γ.
Фиг.17 - определение по методу ИФТФА титров специфических IgG в мышиной сыворотке (в 400-кратном разведении) после иммунизации вакцинами, включающими PIKA и/или rPA антиген сибирской язвы.
Фиг.18 - определение по методу ИФТФА титров специфических IgG в мышиной сыворотке через 16 недель после иммунизации вакцинами, включающими PIKA и/или rPA антиген сибирской язвы.
Фиг.19 - выявление по методу ELISPOT мышиных спленоцитов, продуцирующих интерферон γ после иммунизации вакцинами, включающими PIKA и/или антиген HSV2-gD.
Фиг.20 - выявление по методу ELISPOT мышиных спленоцитов, продуцирующих IL-2 после иммунизации вакцинами, включающими PIKA и/или антиген HSV2-gD.
Фиг.21 - выявление по методу ELISPOT мышиных спленоцитов, продуцирующих IL-4 после иммунизации вакцинами, включающими PIKA и/или антиген HSV2-gD.
Фиг.22 - анализ с использованием флуоресцентного сортировщика (FACS-анализ) мышиных спленоцитов после иммунизации вакцинами, включающими PIKA и/или антиген HSV2-gD, а также процентного содержания CD4+ клеток, экспрессирующих интерферон γ.
Фиг.23 - определение по методу ИФТФА титров специфических IgG в мышиной сыворотке (в разведении 2700 раз) после иммунизации вакцинами, включающими PIKA и/или антиген HSV2-gD.
Фиг.24 - выявление по методу ELISPOT мышиных спленоцитов, продуцирующих интерферон γ после иммунизации вакцинами, включающими PIKA и/или инактивированный антиген H5N1.
Фиг.25 - выявление по методу ELISPOT мышиных спленоцитов, продуцирующих IL-2 после иммунизации вакцинами, включающими PIKA и/или инактивированный антиген H5N1.
Фиг.26 - выявление по методу ELISPOT мышиных спленоцитов, продуцирующих IL-4 после иммунизации вакцинами, включающими PIKA и/или инактивированный антиген H5N1.
Фиг.27 - анализ с использованием флуоресцентного сортировщика (FACS-анализ) мышиных спленоцитов после иммунизации вакцинами, включающими PIKA и/или инактивированный антиген H5N1, а также процентного содержания CD4+ve клеток, экспрессирующих интерферон γ.
Фиг.28 - определение по методу ИФТФА титров специфических IgG в мышиной сыворотке (в 900-кратном разведении) после иммунизации вакцинами, включающими PIKA и/или инактивированный антиген H5N1.
Фиг.29 - определение по методу ИФТФА титров специфических IgG в мышиной сыворотке (в разведении 16000 раз) после иммунизации вакцинами, включающими PIKA и/или полный инактивированный антиген SARS.
Фиг.30 - определение по методу ИФТФА титров специфических H5 антител в куриной сыворотке после иммунизации вакцинами, включающими PIKA и/или инактивированный антиген H5N1.
Фиг.31 - определение по методу ИФТФА титров специфических H9 антител в куриной сыворотке после иммунизации вакцинами, включающими PIKA и/или инактивированный антиген H9N2.
Фиг.32 - уровень выживания мышей, подвергнутых воздействию вируса бешенства дикого типа с последующей обработкой вакциной против бешенства.
Фиг.33 - определение по методу ИФТФА титров специфических антител в мышиной сыворотке после иммунизации вакцинами, включающими PIKA и/или HBsAg adw.
Фиг.34 - определение по методу ИФТФА титров специфических антител в мышиной сыворотке после иммунизации вакцинами, включающими PIKA и/или инактивированный субъединичный гриппозный антиген.
Фиг.35 - определение по методу ИФТФА титров специфических IgG1 в мышиной сыворотке после иммунизации вакцинами, включающими PIKA и/или HBsAg.
Фиг.36 - определение по методу ИФТФА титров специфических IgG2 в мышиной сыворотке после иммунизации вакцинами, включающими PIKA и/или HBsAg.
Фиг.37 - выявление по методу ELISPOT мышиных спленоцитов, продуцирующих интерферон γ после иммунизации вакцинами, включающими PIKA и/или HBsAg.
Фиг.38 - выявление по методу ELISPOT мышиных спленоцитов (после 6-дневной рестимуляции с использованием 2 мкг/мл пептида IPQ), продуцирующих интерферон γ после иммунизации вакцинами, включающими PIKA и/или HBsAg.
В Таблице 1 приводится перечень репрезентативных вирусных патогенов, которые могут служить в качестве источника антигена, а также описание заболеваний, ассоциированных с этими организмами.
В Таблице 2 приводится перечень репрезентативных бактериальных патогенов, которые могут служить в качестве источника антигена, а также описание заболеваний, ассоциированных с этими организмами.
В Таблице 3 приводится перечень репрезентативных грибковых патогенов, которые могут служить в качестве источника антигена, а также описание заболеваний, ассоциированных с этими организмами.
В Таблице 4 приводится перечень репрезентативных паразитов, которые могут служить в качестве источника антигена, а также описание заболеваний, ассоциированных с этими организмами.
В Таблице 5 приводится перечень репрезентативных видов рака (например, по типу ткани), которые могут служить в качестве источника антигена.
ПОДРОБНОЕ ОПИСАНИЕ РЕПРЕЗЕНТАТИВНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение может быть пояснено лучшим образом с помощью приведенного ниже подробного описания некоторых вариантов осуществления настоящего изобретения и со ссылкой на включенные в текст примеры.
В тексте заявки, когда приводятся ссылки на публикации, раскрытие этих публикаций приводится в данной заявке полностью, в качестве ссылки, для целей более полного описания состояния уровня техники в той области, к которой относится настоящее изобретение.
Перед описанием изобретения следует отметить, что данное изобретение не ограничивается конкретными вариантами его осуществления, поскольку они, разумеется, могут варьировать. Следует также понимать, что терминология, использованная в тексте, приводится только с целью описания конкретных вариантов, но не служит целям ограничения, поскольку область настоящего изобретения определяется лишь прилагаемой формулой изобретения.
Если особо не указано иное, все технические и научные термины, приведенные в настоящем описании, имеют общепринятые значения, используемые специалистами в той области, к которой относится настоящее изобретение. Хотя на практике осуществления или тестирования согласно настоящему изобретения могут также использоваться любые способы и материалы, аналогичные или эквивалентные приведенным в настоящем описании, описываются предпочтительные способы и материалы. Все публикации, приведенные в настоящем тексте, включены в него в качестве ссылки с тем, чтобы более полно раскрыть способы и/или материалы, применительно к которым цитируется настоящая публикация.
Следует также отметить, что несмотря на то, что в тексте и прилагаемой формуле изобретения используются артикли единственного числа, указанный текст и формула изобретения включают множественные варианты, если из контекста четко не следует иное. Так, например, ссылка на «иммуногенную композицию» включает множество таких композиций, а ссылка на «антиген» означает ссылку на один или несколько антигенов и их эквивалентов, известных специалистам в данной области и т.п. Следует также отметить, что описанный материал может быть изменен путем исключения какого-либо необязательного элемента. В этой связи в тексте используются такие ограничительные термины, как «единственно», «только» и т.п., в сочетании с цитированием описываемых элементов или соответствующие варианты сопровождаются терминами «отрицательного» ограничения.
Определение терминов
В начале подробного описания настоящего изобретения может быть полезно дать определение ряду используемых в тексте терминов.
Термин «адъювант» в контексте настоящего описания относится к любому веществу или смеси веществ, которые повышают или диверсифицируют иммунный ответ организма хозяина на антигенное соединение. Конкретно:
1. Термин “PICKCa” в целом относится к композиции, включающей поли I:C, канамицин и кальций, независимо от конкретных физических и иммуногенных свойств.
2. Термин “Av-PICKCa” относится к форме PICKCa, используемой в коммерческом варианте как противовирусное лекарственное средство.
3. Термин “PIKA” относится к композиции согласно изобретению, включающей в себя поли I:C, антибиотик (например, канамицин) и положительный ион (например, ион кальция), где PIKA характеризуется такими физическими свойствами (например, молекулярная масса, размер и т.п.), что при введении PIKA проявляют свойства адъюванта с пониженными побочными эффектами (например, со сниженной токсичностью) относительно, например, PICKCa и большей эффективностью (например, стимулирует усиленный иммунный ответ) относительно, например, Av-PICKCa.
Термин «поли I:C» или «PIC» относится к композиции, включающей в себя полирибоинозиновую и полирибоцитидиловую нуклеиновые кислоты, которые могут также называться как полиинозиновая кислота-полицитидиловая кислота соответственно.
Термин «PIC-содержащая молекула» или «PIC-содержащее соединение» относится, без ограничения, к PIC, который необязательно может образовывать комплекс или иным образом объединяться с антибиотиком (например, канамицином) и положительным ионом (например, ионом кальция), по меньшей мере, с одним из них или с обоими, в композиции, которая включает PIC-содержащую молекулу. В одном варианте осуществления настоящего изобретения PIC-содержащая молекула не включает поли-L-лизин или его производное в составе комплекса.
Термин «гетерогенные» относится в контексте настоящего описания к адъювантным композициям согласно изобретению и обозначает, что компоненты композиции, например, PIC-содержащие молекулы, неоднородны с точки зрения физических характеристик, таких как молекулярная масса, размер или обе указанные характеристики. В том случае, когда композиция указывается как гетерогенная применительно к конкретному физическому параметру и описывается диапазоном значений для данного физического параметра, говорят, что композиция состоит по существу из молекул, характеризующихся молекулами, имеющими физические показатели, которые распределены в пределах указанного диапазона и на его границах. Поскольку композиция не может содержать молекулу, которая описывается физическими параметрами, выходящими за пределы, выше или ниже указанных границ приведенного диапазона, такая композиция включает в себя, по меньшей мере, одну молекулу, обладающую физическими характеристиками на верхнем значении диапазона и на нижнем значении диапазона. Указанная композиция в некоторых вариантах осуществления настоящего изобретения может включать молекулы за пределами указанного диапазона физических характеристик, используемых для описания композиции. Молекулы, которые присутствуют в композиции за пределами указанного диапазона не оказывают заметного материального воздействия на основные и новые характеристики композиции.
Термин «индивидуум», используемый в контексте настоящего описания взаимозаменяемо с терминами «организм хозяин», «субъект» и «животное», включает человека и всех домашних животных, например, домашний скот и комнатных животных, а также диких млекопитающих и птиц, включающих, без ограничения, крупный рогатый скот, лошадей, коров, свиней, овец, коз, собак, кошек, кроликов, оленей, норок, кур, уток, гусей, индюшек, бойцовых петухов и т.п.
Термин «антитело» включает поликлональные и моноклональные антитела, а также антигенное соединение, связывающееся с фрагментами таких антител, включающими Fab, F(ab')2, Fd, Fv и их одноцепочечные производные. Дополнительно, термин «антитело» включает природные антитела, а также неприродные антитела, включающие, например, химерные, бифункциональные и гуманизированные антитела и родственные синтетические изоформы. Термин «антитело» используется взаимозаменяемо с термином «иммуноглобулин».
В контексте настоящего описания термин «антигенное соединение» относится к любому веществу, которое в соответствующих условиях может быть распознано иммунной системой (например, которое связывается с антителом или процессируется таким образом, что вызывает иммунный ответ).
Термин «антиген» в контексте настоящего описания включает, без ограничения, клетки; клеточные экстракты; белки; липопротеины; гликопротеины; нуклеопротеины; полипептиды; пептиды; полисахариды; полисахаридные конъюгаты; пептидные миметики полисахаридов; липиды; гликолипиды; углеводы; вирусы; вирусные экстракты; бактерии; бактериальные экстракты; грибы; грибковые экстракты; многоклеточные организмы, такие как паразиты; и аллергены. Антигены могут быть экзогенными (например, полученными из источника, отличного от того индивидуума, которому антиген будет вводиться, например, из другого вида животных) или эндогенными (например, происходящими из организма хозяина, например, пораженного элемента организма, ракового антигена, вирус-инфицированной клетки, продуцирующей антиген и т.п.). Антигены могут быть нативными (то есть природными); синтетическими; или рекомбинантными. Антигены включают нечищеные экстракты; целые клетки; и очищенные антигены, где термин «очищенный» указывает, что данный антиген находится в форме, которая является обогащенной, относительно того окружения, в котором антиген в норме встречается, и/или относительно неочищенного экстракта, например, в случае культивируемой формы антигена.
Термин «иммуногенная композиция» в контексте настоящего описания относится к сочетанию двух или более веществ (например, антигена и адъюванта), которые вместе вызывают иммунный ответ при введении в организм хозяина.
Термины «полипептид», «пептид», «олигопептид» и «белок» используются в настоящем тексте взаимозаменяемо и относятся к полимерной форме аминокислот любой длины, которые могут включать кодируемые и некодируемые аминокислоты, химически или биохимически модифицированные или дериватизированные аминокислоты, а также полипептиды, содержащие модифицированные пептидные скелеты.
Термин «эффективное количество антигенного соединения» относится к тому количеству антигенного соединения, которое, в случае его необязательного сочетания с адъювантом, будет вызывать у субъекта специфический иммунологический ответ на антигенное соединение.
Термин «иммунный ответ» относится к любому ответу на антигенное или иммуногенное соединение, демонстрируемому иммунной системой позвоночного субъекта. Репрезентативные иммунные ответы включают, без ограничения, местный и системный клеточный и гуморальный иммунитет, такие как ответы цитотоксических Т-лимфоцитов (CTL), включая антиген-специфическую индукцию CD8+ CTL, реакции хелперных Т-клеток, включающие Т-клеточные пролиферативные ответы и высвобождение цитокинов, а также В-клеточные ответы, включающие образование антител.
Термин «проявление иммунного ответа» используется в тексте настоящего описания для обозначения индукции и/или потенцирования иммунного ответа.
Термин «индукция иммунного ответа» относится к иммунному ответу, который стимулируется, инициируется или индуцируется.
Термин «потенцирование иммунного ответа» относится к ранее существовавшему иммунному ответу, который улучшается, продолжается, включает добавление, амплифицируется, усиливается, повышается или пролонгируется.
Выражение «усиленный иммунный ответ» или аналогичный термин означает, что иммунный ответ повышается, улучшается или усиливается для пользы организма хозяина относительно ранее существовавшего статуса иммунного ответа, например, до введения иммуногенной композиции согласно изобретению.
Термины «гуморальный иммунитет» и «гуморальный иммунный ответ» относятся к такой форме иммунитета, при которой в ответ на антигенную стимуляцию продуцируются молекулы антител.
Термины «клеточный иммунитет» и «клеточный иммунный ответ» относятся к иммунологической защите, обеспечиваемой лимфоцитами, такой как защита, обеспечиваемая Т-клеточными лимфоцитами, поступающими в область пораженных клеток. В норме клеточный иммунный ответ включает пролиферацию лимфоцитов. При измерении «пролиферации лимфоцитов» определяют способность лимфоцитов пролиферировать в ответ на специфический антиген. Пролиферация лимфоцитов в контексте настоящего описания относится к пролиферации В-клеток, Т-хелперных клеток или цитотоксических Т-лимфоцитов (CTL).
Термин «иммуногенное количество» относится к такому количеству антигенного соединения, которого достаточно для стимуляции иммунного ответа, при введении субъекту иммуногенной композиции, в сравнении с иммунным ответом, вызываемым антигеном в отсутствие полинуклеотидного адъюванта.
Термин «иммунопотенцирующее количество» относится к такому количеству адъюванта, которое необходимо для целей повышения титра антител и/или клеточного иммунитета, в случае введения антигенного соединения в композиции согласно настоящему изобретению, в сравнении с повышением уровня антител и/или клеточного иммунитета, наблюдаемых в отсутствие полинуклеотидного адъюванта.
Термины «лечение», «подвергать лечению», «лечить» и т.п. в контексте настоящего описания относятся в основном к достижению фармакологического и/или физиологического эффекта. Указанный эффект может представлять собой профилактический, с точки зрения полного или частичного предупреждения заболевания или его симптома и/или может представлять собой терапевтическое воздействие с точки зрения частичной или полной стабилизации или излечивания заболевания и/или устранения побочного эффекта, связанного с заболеванием. Термин «лечение» в контексте настоящего описания охватывает любой вариант лечения субъекта, в частности, млекопитающего, более конкретно человека, и включает: (а) предупреждение заболевания или симптома, которое может развиться у субъекта, предрасположенного к данному заболеванию или симптому, но который еще не был диагностирован как имеющий его; (b) подавление симптома заболевания, например, остановку развития заболевания; или ослабление симптома заболевания, то есть воздействие, вызывающее регрессию заболевания или его симптома; (с) снижение уровня продукта, образуемого инфицирующим агентом данного заболевания (например, уровня токсина, антигена и т.п.); и (d) снижение нежелательного физиологического ответа на инфицирующий агент данного заболевания (например, лихорадки, отека ткани и т.п.).
Термин «смешивание» в контексте настоящего описание включает любой способ, применяемый для объединения компонентов в композиции; такие способы включают, без ограничения, смешивание, диспергирование, растворение, эмульгирование, коагуляцию, суспендирование или другие способы объединения компонентов в составе композиции.
«Фармацевтически приемлемая соль» соединения обозначает соль, которая является фармацевтически приемлемой и которая обладает желательной фармакологической активностью, свойственной исходному соединению. Такие соли включают в себя (1) аддитивные соли кислоты, образуемые с использованием неорганических кислот, таких как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п.; или образуемые с использованием органических кислот, таких как уксусная кислота, пропионовая кислота, гексаноевая кислота, циклопентанпропионовая кислота, гликолевая кислота, пировиноградная кислота, молочная кислота, малоновая кислота, янтарная кислота, яблочная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, 3-(4-гидроксибензоил)бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, 1,2-этандисульфоновая кислота, 2-гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, 4-хлорбензолсульфоновая кислота, 2-нафталинсульфоновая кислота, 4-толуолсульфоновая кислота, камфорсульфоновая кислота, глюкогептоновая кислота, 4,4'-метиленбис-(3-гидрокси-2-ен-1-карбоновая кислота), 3-фенилпропионовая кислота, триметилуксусная кислота, третичная бутилуксусная кислота, лаурилсерная кислота, глюконовая кислота, глютаминовая кислота, гидроксинафтоевая кислота, салициловая кислота, стеариновая кислота, муконовая кислота и т.п.; или (2) соли, образованные в том случае, когда протон кислоты, присутствующий в исходном соединении, замещается ионом металла, например, ионом щелочного металла, ионом щелочноземельного металла или ионом алюминия, или образует координационное соединение с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, трометамин, N-метилглюкамин и т.п.
Термин «стандартная дозированная форма» в контексте настоящего описания относится к физически дискретным единицам, подходящим в качестве стандартных дозировок для применения в случае человека и животных, где каждая стандартная доза содержит заданное количество соединений согласно изобретению, вычисленное как количество, достаточное для продуцирования желательного ответа при сочетании с фармацевтически/физиологически приемлемым разбавителем, носителем или наполнителем.
Репрезентативные варианты осуществления настоящего изобретения
Настоящее изобретение относится к иммуногенным композициям и к способам, используемым для индукции и/или усиления иммунного ответа, который может быть гуморальным и/или клеточным, у человека, животного, отличного от человека, или в клеточной культуре. В основном, иммуногенные для субъекта композиции включают в себя антиген («антигенная композиция») и адъювант. Присутствие адъюванта усиливает или модифицирует иммунный ответ на антиген. Адъювант может менять качество иммунного ответа за счет воздействия на подклассы (изотипы) образуемых иммуноглобулинов, хемокинов и/или цитокинов. В результате, природный иммунитет, гуморальный и/или клеточный иммунный ответы становятся более эффективными при наличии адъюванта.
Особым преимуществом настоящего изобретения является эффективность адъюванта PIKA в сочетании с антигенным веществом с точки зрения индукции специфического гуморального иммунного ответа, что приводит к усилению защитного иммунитета.
Другим важным преимуществом является то, что адъювант PIKA в сочетании с антигеном может индуцировать специфический клеточный иммунный ответ, который необходим для функционирования в качестве терапевтической вакцины, направленной на ограничение и лечение внутриклеточной вирусной, бактериальной или паразитарной инфекции, а также для целей лечения хронических заболеваний, таких как лечение рака или аутоиммунного заболевания.
Соответственно, настоящее изобретение охватывает своими рамками композиции, характеризующиеся уникальными свойствами входящего в них продукта, которые делают их наиболее удобными для использования в качестве вакцин, вводимых животным и/или людям, и которые удовлетворяют потребностям в безопасном адъюванте, вызывающем благоприятный иммунный ответ.
Соответственно, настоящее изобретение относится к адъювантным и иммуногенным композициям, которые могут безопасно использоваться для введения человеку и животным.
Соответственно, настоящее изобретение относится к иммуногенной композиции, которая включает в себя (а) полинуклеотидный адъювант, содержащий полирибоинозиновую-полирибоцитидиловую кислоту (PIC), по меньшей мере, один антибиотик и, по меньшей мере, один положительный ион; и (b), по меньшей мере, один антиген, где указанная композиция изготавливается для введения в качестве композиции с пролонгированным высвобождением.
Иммуногенная композиция согласно изобретению может включать в себя композицию полинуклеотидного адъюванта, молекулы которого гетерогенны по молекулярной массе, где указанная молекулярная масса составляет, по меньшей мере, 66000 дальтон. Масса 66000 дальтон соответствует размеру примерно 6,4 единиц Сведберга. Соответственно, диапазон молекулярных масс от 66000 дальтон до 1200000 дальтон соответствует размерам в диапазоне от 6,4 до 24,0 единиц Сведберга.
В некоторых вариантах осуществления настоящего изобретения композиции на основе адъюванта PIKA включают полинуклеотид, антибиотик и положительный ион, где указанный полинуклеотид может представлять собой полирибоинозиновую-полирибоцитидиловую кислоту (PIC); антибиотик может представлять собой канамицин и указанный ион может представлять собой кальций.
В одном аспекте, представляющем особый интерес, настоящее изобретение относится к иммуногенной композиции, направленной на повышение антигенности антигенного соединения, включающей полинуклеотидную адъювантную композицию, которая способна вызывать антиген-специфический клеточный иммунный ответ.
В одном аспекте, представляющем особый интерес, настоящее изобретение относится к иммуногенной композиции, направленной на повышение антигенности антигенного соединения, включающей полинуклеотидную адъювантную композицию, которая способна вызывать антиген-специфический гуморальный иммунный ответ.
В одном аспекте, представляющем особый интерес, настоящее изобретение относится к иммуногенной композиции, направленной на повышение антигенности антигенного соединения, включающей полинуклеотидную адъювантную композицию, которая способна вызывать объединенный специфический клеточный и гуморальный иммунный ответ.
В одном аспекте, представляющем особый интерес, настоящее изобретение относится к адъювантной композиции или к иммуногенной композиции, включающей адъювантную композицию, где указанная адъювантная композиция или указанная иммуногенная композиция представляет собой лиофильную высушенную композицию.
В одном аспекте, представляющем особый интерес, настоящее изобретение относится к использованию полинуклеотидной адъювантной композиции для получения лекарственного средства, предназначенного для повышения иммуногенного ответа организма хозяина.
Полинуклеотидный адъювант
Рассматриваемая в настоящем изобретении иммуногенная композиция включает в себя PIC-содержащий полинуклеотидный адъювант, например, композицию PIKA, и в основном состоит из полиинозиновой кислоты, полицитидиловой кислоты, антибиотика (например, канамицина) и двухвалентного катиона (например, кальция). Следует понимать, что в тексте настоящего описания ссылка на PIKA дается лишь для целей иллюстрации таких PIC-содержащих адъювантов.
Представляющие интерес PIC-содержащие адъюванты согласно изобретению могут быть изготовлены с помощью методик, доступных в данной области. PIC-содержащая адъювантная композиция может быть изготовлена в рамках любого подходящего процесса. Так, например, полинуклеотидная адъювантная композиция может быть получена при смешивании полиинозиновой кислоты, полицитидиловой кислоты, антибиотика и источника положительного иона в буферном растворе на основе хлорида натрия/фосфата натрия, который имеет рН в диапазоне от рН 6 до рН 8. Полиинозиновую кислоту и полицитидиловую кислоту в основном вводят в концентрации от 0,1 до 10 мг/мл, обычно в концентрации от 0,5 до 5 мг/мл и чаще всего - от 0,5 до 2,5 мг/мл. Показатель гиперхромизма должен быть выше чем 10%, выше чем 15%, выше чем 20% или выше чем 50%. Получение PIC, а также его сочетания с антибиотиком (например, канамицином) и положительным ионом (например, кальцием) в основном осуществляется в условиях, соответствующих Международным требованиям производства качественных продуктов.
В некоторых вариантах осуществления настоящего изобретения антибиотический компонент адъюванта представляет собой канамицин. В том случае, когда антибиотиком является канамицин, в некоторых вариантах осуществления настоящего изобретения канамицин в полинуклеотидной адъювантной композиции используют вместе с одним или несколькими антибиотиками или при замещении одним или несколькими антибиотиками, выбранными из группы, включающей тобрамицин, антрациклины, бутирозина сульфат, гентамицины, гигромицин, амикацин, дибекацин, небрамицин, метрзамид, неомицин, пуромицин, стрептомицин и стрептозоцин. Антибиотик (например, канамицин или аналогичный антибиотик) в полинуклеотидной адъювантной композиции согласно изобретению в основном вводят в концентрации примерно от 10 единиц/мл до 100000 единиц/мл, примерно от 100 единиц/мл до 10000 единиц/мл или примерно от 500 единиц/мл до 5000 единиц/мл.
В некоторых вариантах осуществления настоящего изобретения полинуклеотидная адъювантная композиция также включает положительный ион (катион), обычно двухвалентный катион, в норме это катион щелочного металла. Положительный ион обычно вводят в композицию согласно изобретению в виде источника положительных ионов, такого как соль или комплексное соединение, например, органическая или неорганическая соль или органическое или неорганическое комплексное соединение. Примеры положительных ионов включают, без ограничения, кальций, кадмий, литий, магний, церий, цезий, хром, кобальт, дейтерий, галлий, йод, железо или цинк.
Положительный ион может быть представлен в виде любой подходящей соли или любого подходящего органического комплексного соединения, включающих, без ограничения, хлоридные, фторидные, гидроксидные, фосфатные или сульфатные соли. Например, в том случае, когда положительный ион представлен кальцием, указанный ион может быть в форме карбоната кальция, хлорида кальция, фторида кальция, гидроксида кальция, фосфатов кальция или сульфата кальция.
Положительный ион (например, кальций) может содержаться в композиции согласно изобретению в диапазоне примерно от 10 мкмоль/мл до 10 ммоль/мл, обычно, примерно от 50 мкмоль/мл до 5 ммоль/мл и чаще всего в количестве примерно от 100 мкмоль/мл до 1 ммоль/мл. Термин «мкмоль» обозначает микромоль.
В том случае, когда положительный ион в составе адъювантной композиции согласно изобретению представляет собой кальций, он может использоваться в сочетании с другими положительными ионами или при замещении другими положительными ионами, включающими кадмий, литий, магний, церий, цезий, хром, кобальт, дейтерий, галлий, йод, железо и цинк, где указанные ионы могут быть представлены в форме неорганических солей или органических комплексов.
Полученная композиция представляет собой PIC-содержащий адъювант, который также содержит антибиотик и положительный ион. В одном из вариантов осуществления настоящего изобретения, где антибиотик представлен канамицином и ион представлен кальцием, данный продукт может быть обозначен как PICKCa. В родственном варианте композиция PICKCa может содержать молекулы, и при этом не накладывается каких-либо ограничений на различные характеристики молекул.
Адъювантная композиция PIKA
В конкретных репрезентативных вариантах осуществления настоящего изобретения PIC-содержащий адъювант представляет собой PIKA. PIKA может быть получен на основе множества способов, но получение его из PICKCa представляет особый интерес. PIKA может быть получен из PICKCa в рамках дополнительных процессов производства, которые включают в себя выделение и/или концентрирование молекул определенного размера и определенной молекулярной массы. Выделение и концентрирование полинуклеотидных молекул с конкретными характеристиками проводят при использовании процессов фильтрации, хроматографии, термической обработки, разделения путем центрифугирования, электорофореза и аналогичных методов, представляющих собой стандартные методы, известные специалистам в данном области.
Настоящее изобретение, в тех вариантах его осуществления, которые представляют особый интерес, относится к адъюванту, известному в основном как PIKA, который включает полирибоинозиновую-полирибоцитидиловую кислоту (PIC), антибиотик (например, канамицин) и положительно заряженный ион (например, ион кальция), где указанная композиция содержит молекулы адъюванта, гетерогенные по молекулярной массе, которая составляет примерно от 66000 до 1200000 дальтон. Иными словами, адъювантная композиция включает в себя молекулы с распределением их по массе в диапазоне примерно от 66000 до 1200000 дальтон.
В родственных вариантах осуществления настоящего изобретения молекулы в адъювантной композиции PIKA гетерогенны, что означает, что масса молекул адъюванта распределена в определенном диапазоне значений молекулярных масс, где указанная молекулярная масса составляет примерно от 300000 до 1200000 дальтон, или примерно от 66000 до 660000 дальтон, или примерно от 300000 до 660000 дальтон, или примерно от 300000 до 2000000 дальтон, или примерно от 66000 до 100000 дальтон, от 100000 до 200000 дальтон, примерно от 300000 дальтон до 4000000 дальтон, или примерно от 500000 дальтон до 1000000 дальтон, или примерно от 1000000 дальтон до 1500000 дальтон, или примерно от 1500000 дальтон до 2000000 дальтон, или примерно от 2000000 дальтон до 2500000 дальтон, или примерно от 2500000 дальтон до 3000000 дальтон, или примерно от 3000000 дальтон до 3500000 дальтон, или примерно от 3500000 дальтон до 4000000 дальтон, или примерно от 4000000 дальтон до 4500000 дальтон, или примерно от 4500000 дальтон до 5000000 дальтон.
В родственных вариантах осуществления настоящего изобретения молекулы в адъювантной композиции PIKA характеризуются средним значением молекулярной массы, которая равна или выше чем 66000 дальтон, или равна или выше чем 150000 дальтон, или равна или выше чем 250000 дальтон, или равна или выше чем 350000 дальтон, или равна или выше чем 500000 дальтон, или равна или выше чем 650000 дальтон, или равна или выше чем 750000 дальтон, или равна или выше чем 1000000 дальтон, или равна или выше чем 1200000 дальтон, или равна или выше чем 1500000 дальтон, или равна или выше чем 2000000 дальтон.
В тех вариантах осуществления настоящего изобретения, которые представляют особый интерес, настоящее изобретение относится к адъюванту, который в основном известен как PIKA и который включает в себя полирибоинозиновую-полирибоцитидиловую кислоту (PIC), антибиотик и положительный ион, где указанная композиция содержит молекулы адъюванта, которые гетерогенны, то есть размер указанных молекул адъюванта распределен по диапазону значений молекулярных размеров, так что коэффициент седиментации Сведберга (S) составляет примерно от 6,43 S до 24,03 S.
В родственных вариантах осуществления настоящего изобретения молекулы в адъювантной композиции PIKA гетерогенны, что означает, что размер молекул адъюванта распределен в определенном диапазоне значений размеров молекул, где указанный размер молекул составляет примерно от 12,8S до 24,03S, или примерно от 3S до 12S, или примерно от 6,43S до 18,31S, или примерно от 12,8S до 18,31S, или примерно от 12,8S до 30,31S, или примерно от 12,8S до 41,54S, или примерно от 13,5S до 18,31S, или примерно от 13,5S до 24,03S, или примерно от 16,14S до 22,12S, или примерно от 22,12S до 26,6S, или примерно от 26,6S до 30,31S, или примерно от 30,31S до 33,55S, или примерно от 33,55S до 36,45S, или примерно от 36,45S до 39,1S, или примерно от 39,1S до 41,54S, или примерно от 41,54S до 43,83S, или примерно от 43,83S до 45,95S.
В других родственных вариантах осуществления настоящего изобретения молекулы в адъювантной композиции PIKA характеризуются средним значением коэффициента седиментации (показатель Сведберга), который выше 9, или выше 12, или выше 13,5, или выше 15, или выше 16, или выше 17, или выше 18, или выше 19, или выше 20, или выше 21, или выше 22, или выше 25, или выше 30.
Иммуногенные свойства
Иммуногенная композиция, включающая PIKA и антиген, может в основном индуцировать иммунные ответы по меньшей мере согласно двум механизмам: i) гуморальный иммунитет, который включает стимуляцию В-клеток и продукцию антител или иммуноглобулинов (другие клетки также вовлекаются в генерирование иммунного ответа, например, антигенпрезентирующие клетки, включающие макрофаги и хелперные Т-клетки (Th1 и Th2)), и ii) клеточный иммунитет, который в основном вовлекает Т-клетки, включающие цитотоксические Т-лимфоциты, хотя другие клетки также вовлекаются в генерирование цитотоксического Т-клеточного ответа (например, Th1- и/или Th2-клетки и антигенпрезентирующие клетки).
Кроме того, полинуклеотидная адъювантная композиция может изменять качество иммунного ответа за счет воздействия на подклассы (подтипы) продуцируемых иммуноглобулинов, а также на их аффинность.
Соответственно, уровень и природа иммуногенного ответа, индуцируемые целевой иммуногенной композицией, могут быть определены посредством количественной оценки наличия молекул, продуцируемых клетками иммунной системы, таких как цитокины, хемокины и антитела.
Интерлейкин-4 в основном продуцируется активированными Th2-клетками. Продукция интерлейкина-4 (IL-4) индуцирует активацию В-клеток и, соответственно, IgG1 и IgE иммуноглобулинов (антител), которые могут быть определены в образцах сыворотки крови. IL-4 рассматривается как индуктор и типичный цитокин Th2 иммунного ответа. Th2-клетки способны усиливать образование антител.
Интерлейкин-2 (IL-2) в основном продуцируется активированными Th1-клетками, а также NK и лимфокин-активированными клетками-киллерами (LAK). IL-2 является важным инструментом в процессе пролиферации Т-клеток и в их созревании, представляющем необходимую стадию в механизме эффективного клеточного адаптивного иммунного ответа.
Интерферон γ (IFN-γ), который может продуцироваться множеством клеток, включающих природные клетки-киллеры, а также CD4+ и CD8+ Т-клетки, играет важную роль в адаптивном иммунном ответе, включающем активацию макрофагов до достижения бактерицидных свойств. Кроме того, IFN-γ представляет собой фактор, оказывающий определенное влияние на развитие именно Th1 Т-клеток, действуя, таким образом, в направлении положительной регуляции клеточного адаптивного иммунного ответа.
В настоящем изобретении описываются способы использования рассматриваемого в нем полинуклеотидного адъюванта вместе с антигеном, например, для проявления антиген-специфического гуморального ответа и/или специфического клеточного (например, Т-клеточного) ответа у субъекта. Проявляемый иммунный ответ может представлять собой ответ на антиген у субъекта, который впервые подвергается воздействию такого антигена, или может служить для целей усиления уже имеющегося иммунного ответа (например, в качестве бустера). Было показано, что иммуногенные композиции согласно изобретению, включающие в себя PIKA, обладают особенно полезными свойствами, как будет описано далее в тексте.
Было исследовано множество различных антигенов in vivo на их способность индуцировать иммунные ответы как при наличии адъюванта PIKA, так и без него. Исследуемые антигены включают в себя поверхностный антиген на основе рекомбинантного белка гепатита B, тип adw, инактивированную субъединичную гриппозную вакцину (VAXIGRIP от компании Sanofi Pasteur), синтезированный антиген на основе HIV пептида, антиген на основе рекомбинантного белка вируса herpes simplex, тип 2 gD, антиген на основе рекомбинантного защитного белка возбудителя сибирской язвы, инактивированный полный антиген вируса птичьего гриппа, штамм H5N1 и инактивированный антиген полного инактивированного вируса тяжелого острого респираторного синдрома (ТОРС (SARS)).
В каждом случае присутствие адъюванта PIKA вместе с антигеном усиливало экспрессию цитокинов, в сравнении с одним только антигеном или с одним только PIKA. В частности, усиленная экспрессия цитокинов INF-γ, IL-2 и IL-4 (см. примеры 1.1, 1.2, 1.3, 1.4, 1.5 и 1.6) указывает на стимуляцию специфического адаптивного иммунитета, которая является более высокой при наличии адъюванта PIKA и где специфически более усиленная экспрессия цитокинов INF-γ, IL-2 указывает на то, что доминирование Th1 клеточного иммунитета существенно возрастает в присутствии адъюванта PIKA. Активность клеточного иммунного ответа представляет собой ключевой показатель, необходимый для оценки лечения внутриклеточных вирусных, бактериальных и паразитарных инфекций, и является особенно важным фактором, учитываемым при разработке терапевтической вакцины.
Кроме того, композиция, содержащая PIKA, стимулирует продукцию INF-γ, CD4+ T-клетками (см. примеры 1.3, 1.4, 1.5 и 1.6). Указанное свойство подтверждает тот факт, что PIKA усиливает адаптивный иммунный ответ в организме хозяина.
Наблюдаемая пролиферация антител в сыворотке крови указывает на то, что адъювант PIKA индуцирует благоприятный гуморальный ответ. При добавлении PIKA к иммуногенной композиции наблюдаются повышенные титры специфических антител IgG (примеры 1.1, 1.2, 1.4, 1.5, 1.6, 2, 3, 5 и 6).
Адъювант PIKA усиливает иммунный ответ в организме хозяина, в случае его объединения с инактивированным антигеном (примеры 1.2, 1.6, 2, 3, 4 и 6), пептидным антигеном (пример 1.3) и рекомбинантным антигеном (примеры 1.1, 1.4, 1.5, 5 и 7).
Важнейшей характеристикой адъюванта PIKA является его способность обеспечивать адекватную защиту, позволяющую ограничивать и/или уничтожать инфекцию в организме и/или снижать риск проявления симптомов заболевания, которое может возникнуть за счет инфекции патогеном. Препарат VAXIGRIP (Sanofi Pasteur), используемый в качестве антигена в примерах 1.2 и 6, представляет сам по себе вакцину на основе вируса человеческого гриппа, который демонстрирует степень иммунной активности, достаточную для обеспечения защиты против инфекции вирусом гриппа. Добавление PIKA к VAXIGRIP дополнительно усиливает иммунный ответ, как было показано при оценке уровня полезных цитокинов (IL-2, INF-γ и IL-4) и специфических IgG, экспрессируемых иммунной системой.
В других тестах, проведенных для подтверждения защитных свойств PIKA, 24 десятидневным цыплятам инокулируют композицию, включающую в себя PIKA и инактивированные антигены вируса птичьего гриппа, включающего штаммы H5N1 и H9N2 (пример 3). Указанных цыплят далее подвергают провокации живым вирусом H5N1 и наблюдают в течение двух недель. В конце данной программы уровень выживания цыплят, которым была инокулирована композиция PIKA/антигена, составляет 83% в сравнении всего лишь с 17%, полученными для контрольной группы из 24 цыплят, которым был введен живой вирус, но без инокуляции композиции PIKA/антиген.
В родственном эксперименте, проведенном для оценки усиленных терапевтических свойств адъюванта PIKA, мышей Balb/c провоцируют штаммом вируса бешенства дикого типа (пример 4). После инфекции трем разным группам животных инокулируют различные вакцины против бешенства в режиме лечения. Длительность выживания группы мышей, которым были инокулированы клетки почки хомяка с очищенным инактивированным антигеном вируса бешенства плюс PIKA, составляла 80%. Длительность выживания животных во второй группе мышей, которым вводили клетки почки хомяка с очищенным антигеном вируса бешенства с обычным адъювантом на основе квасцов, составляла 15%. В третьей группе мышей, которым вводили Sanofi-Aventis' «Verorab» - клетки Vero с инактивированной вакциной против бешенства, уровень выживания составил 20%.
В другом тесте, проведенном в рамках примера 7 для демонстрации свойств адъюванта PIKA, было показано, что присутствие PIKA в сочетании с антигеном HBsAg, тип adw, повышает продукцию специфических IgG1 (таблица 26, фиг.35) и генерирует более выраженные титры IgG2a (таблица 27, фиг.36) в сыворотке мышей. Данное наблюдение позволило сделать вывод, согласно которому PIKA усиливает терапевтический иммунный ответ, в частности Th1 иммунный ответ.
В родственном эксперименте (пример 7) наличие PIKA в вакцинных композициях, включающих HBsAG, тип adw, усиливает продукцию интерферона γ спленоцитами, стимулированными CD8 T-клеточным пептидным эпитопом. Это результат указывает на то, что PIKA индуцирует CD8+T-клеточный иммунный ответ (таблица 28, фиг.37).
Кроме того, было показано (пример 7), что наличие PIKA в вакцинных композициях, включающих HBsAG, усиливает продукцию интерферона γ спленоцитами, культивируемыми ex vivo в течение шести дней с 2 мкг/мл CD8 T-клеточным пептидным эпитопом. Это результат показывает, что PIKA индуцирует центральный ответ T-клеток памяти.
Дополнительные особенности
В другом варианте осуществления настоящего изобретения целевая иммуногенная композиция определяется по относительному наличию адъюванта PIKA и одного или нескольких антигенов, где наличие определяется в терминах одной или нескольких характеристик, таких как количество, концентрация, объем, количество молекул или другие выявляемые метрические показатели.
В родственных вариантах осуществления настоящего изобретения целевая иммуногенная композиция включает в себя полинуклеотидную адъювантную композицию и один или несколько адъювантов, где наличие адъюванта и антигена в терминах веса или числа молекул определяется в диапазоне соотношения менее чем 1 к 1000, менее чем 1 к 900, менее чем 1 к 800, менее чем 1 к 700, менее чем 1 к 500, менее чем 1 к 400, менее чем 1 к 300, менее чем 1 к 200, менее чем 1 к 100, менее чем 1 к 50, менее чем 1 к 10, менее чем 1 к 5, менее чем 1 к 2, менее чем 1 к 1, более чем 2 к 1, более чем 5 к 1, более чем 10 к 1, более, чем 50 к 1, более чем 100 к 1, более чем 200 к 1, более, чем 300 к 1, более чем 400 к 1, более чем 500 к 1, более чем 600 к 1, более чем 700 к 1, более чем 800 к 1, более чем 900 к 1, более чем 1000 к 1.
В другом родственном варианте осуществления настоящего изобретения целевая иммуногенная композиция определяется в терминах дозы; которая представляет собой то количество вакцины, которое следует ввести для индукции оптимального благоприятного иммунного ответа или, альтернативно, определяется диапазоном дозы, которая может быть введена, начиная с минимальной, необходимой для проявления иммунного ответа, до максимальной дозы, свыше которой повышение полезного ответа медицински не оправдано, в связи с возможностью развития неблагоприятных побочных эффектов.
В некоторых вариантах осуществления настоящего изобретения, представляющих особый интерес, иммуногенная композиция включает полинуклеотидную адъювантную композицию и антиген, где наличие антигена в стандартной дозе обеспечивается в количестве более чем 0,1 мкг, более чем 0,5 мкг, более чем 0,001 мг, более чем 0,005 мг, более чем 0,01 мг, более чем 0,025 мг, более чем 0,05 мг, более чем 0,075 мг, более чем 0,1 мг, более чем 0,25 мг, более чем 0,5 мг, более чем 1,2 мг, более чем 1,4 мг, более чем 1,6 мг, более чем 1,8 мг, более чем 2,0 мг, более чем 2,5 мг, более чем 3 мг, более чем 3,5 мг, более чем 4 мг, более чем 5 мг, более чем 6 мг, более чем 7 мг, более чем 8 мг, более чем 9 мг, более чем 10 мг, более чем 15 мг, более чем 20 мг, более чем 25 мг, или более чем 50 мг.
Оптимальное количество антигена и оптимальное соотношение антигена и адъюванта PIKA могут быть установлены в рамках стандартных исследований, включающих выявление титров антител и других иммуногенных ответов в организме-хозяине.
Антигены
Настоящее изобретение в том варианте своего осуществления, который представляет особый интерес, относится к полинуклеотидной адъювантной композиции в сочетании с антигеном или вакциной, где источником антигена является человеческий антиген, антиген животного, растительный антиген, один или несколько агентов из инфицирующих факторов, выделенных из вирусов, бактерий, включая микробактерии, грибов или паразитарного организма, раковый антиген, аллергенные агенты и другие антигены, такие как выявляемые при развитии аутоиммунных заболеваний.
В некоторых вариантах осуществления настоящего изобретения антигены могут быть получены из природного источника, в неочищенном или очищенном виде, и используются в виде исходной живой формы, или после их гибели, или в инактивированной форме, или в усеченной форме, или ослабленной форме, или трансформированных в неревертируемую форму, в детоксифицированной форме, или после мутирования в нетоксичную форму, или после фильтрования или очистки.
В некоторых вариантах осуществления настоящего изобретения указанный антиген представляет собой антиген, выделенный из микроорганизма, например, вирусный антиген, бактериальный антиген, грибковый антиген, аллергический антиген, раковый антиген или аутоиммунный антиген. В других вариантах осуществления настоящего изобретения указанный антиген представляют собой полный, инактивированный антиген. Способы инактивации полных антигенов известны в данной области; любой известный способ может использоваться для инактивации антигена и может быть выбран соответствующим образом применительно к типу интересующего антигена. Такие способы инактивации антигенов включают, например, использование фотореактивных соединений; окислителей; облучения (например, УФ-облучение; γ-облучение); сочетания обработки рибофлавином и УФ-облучения; обработку растворителем-детергентом (например, обработку органическим растворителем три-N-бутил-фосфатом с детергентом, таким как Твин-80); обработку полиэтиленгликолем; пастеризацию (термическую обработку) и обработку средой с низким pH; мягкую ферментативную обработку пепсином или трипсином; фотообработку метиленовым синим (MC); обработку диметилметиленовым синим (ДММС) и видимым светом; обработку S-59; обработку производным псоралена и облучение УФ-А; и т.п.
В родственном варианте осуществления настоящего изобретения, представляющем особый интерес, указанный антиген может быть синтезирован по методу твердофазного синтеза, или может быть получен в рамках технологии рекомбинантной генетики, или может быть получен искусственно иным образом, так чтобы имитировались иммуногенные свойства патогена.
Полипептидные антигены могут быть выделены из природных источников с использованием стандартных методик очистки белков, известных в данной области и включающих, без ограничения, жидкостную хроматографию (например, высокоэффективную жидкостную хроматографию, скоростную жидкостную хроматографию белков и т.п.), вытеснительную хроматографию, гель-электрофорез (включая одномерный гель-электрофорез, двумерный гель-электрофорез), аффинную хроматографию или другие способы очистки. Могут быть использованы стратегии твердофазного пептидного синтеза, известные специалистам в данной области. См. Jones, The Chemical Synthesis of Peptides (Clarendon Press, Oxford) (1994). В основном в рамках таких методов пептид получают путем последовательного добавления активированных мономерных единиц к растущей пептидной цепи, связанной с твердой фазой. Могут использоваться хорошо установленные методики рекомбинантных ДНК для получения полипептидов, и такие методы включают, без ограничения, экспрессию конструкции, включающей нуклеотидную последовательность, кодирующую полипептид, которую вводят в соответствующую хозяйскую клетку (например, в эукариотическую хозяйскую клетку, растущую в виде одноклеточной структуры в культуре клеток in vitro, например, дрожжевую клетку, клетку насекомого, клетку млекопитающего и т.п.), или в прокариотическую клетку (например, растущую в культуре клеток in vitro), получение генетически модифицированной клетки-хозяина; в соответствующих условиях культивирования белок получают с использованием генетически модифицированной клетки-хозяина.
В некоторых вариантах осуществления настоящего изобретения указанный антиген представляет собой очищенный антиген, например, очищенный до уровня примерно 25%-50%, очищенный до уровня примерно 50%-75%, очищенный до уровня примерно 75%-85%, очищенный до уровня примерно 85%-90%, очищенный до уровня примерно 90%-95%, очищенный до уровня примерно 95%-98%, очищенный до уровня примерно 98%-99%, или с чистотой выше 99%.
Антиген может представлять собой неклеточный, капсулярный антиген, инфекционный клон, репликон, антиген в составе вектора, он может быть микроинкапсулированным, одновалентным, двухвалентным или поливалентным антигеном.
Полинуклеотидные адъювантные композиции согласно изобретению могут также использоваться для усиления иммунного ответа против антигенов, получаемых при использовании ДНК-содержащих вакцин и/или экспрессирующих белки ДНК. Последовательности ДНК в таких вакцинах, кодирующих антиген, могут быть либо «голыми», либо могут входить в состав системы доставки, такой как липосомы.
В одном аспекте осуществления настоящего изобретения, представляющем особый интерес, целевая иммуногенная композиция может быть определена путем выбора одного или нескольких антигенов, которые используются в сочетании с адъювантом PIKA.
Более конкретно, настоящее изобретение относится к иммуногенной композиции и к способу ее использования, где указанная иммуногенная композиция включает в себя адъювант PIKA вместе с вирусным антигеном и где репрезентативные антигены включают в себя, без ограничения, антигены одного или нескольких вирусов, описанных в таблице 1.
Вирусные патогены и заболевания
Более конкретно, настоящее изобретение относится к иммуногенной композиции и к способу ее использования, где указанная иммуногенная композиция включает в себя адъювант PIKA в сочетании с бактериальным антигеном и где репрезентативные антигены включают в себя, без ограничения, антигены из одного или нескольких видов бактерий, перечисленных в таблице 2.
Бактериальные патогены и заболевания
Более конкретно, настоящее изобретение относится к иммуногенной композиции и к способу ее применения, где указанная иммуногенная композиция включает в себя адъювант PIKA в сочетании с грибковым антигеном и где репрезентативные антигены включают, без ограничения, антигены из одного или нескольких видов грибов, перечисленных в таблице 3.
Грибковые патогены и заболевания
Более конкретно, настоящее изобретение относится к иммуногенной композиции и к способу ее применения, где указанная иммуногенная композиция включает в себя адъювант PIKA в сочетании с паразитарным антигеном и где репрезентативные антигены включают, без ограничения, антигены из одного или нескольких видов паразитарных организмов, перечисленных в таблице 4.
Паразитарные патогены и заболевания
В родственном варианте настоящее изобретение относится к иммуногенной композиции и к способу ее применения, где указанная иммуногенная композиция включает в себя адъювант PIKA вместе с аллергическим антигеном («аллергеном») или вакциной, где для выделения или получения антигена или вакцины, способных имитировать патоген человека или животного, используют следующие источники: растения, животные, грибы, насекомые, пищевые продукты, лекарственные препараты, пыль и клещи и т.п.
Аллергены включают, без ограничения, аэроаллергены окружающей среды; пыльцу растений, таких как амброзия/возбудители сенной лихорадки, аллергены пыльцы сорняков, аллергены пыльцы травы, сорго алепского, аллергены пыльцы деревьев, ржи, аллергены паукообразных, такие как аллергены клещей, обитающих в бытовой пыли (например, Der p I, Der f I и др.), аллергены клещей, обнаруживаемых в условиях хранения продукции, аллергены из пыльцы криптомерии японской/возбудители сенной лихорадки, аллергены из спор плесени, аллергены животных (например, аллергены собаки, морской свинки, хомяка, песчанки, крысы, мыши и т.п.), аллергены пищевых продуктов (например, аллергены ракообразных, аллергены орехов, таких как арахис, аллергены цитрусовых), аллергены насекомых, ядов (например, ядов перепончатокрылых, настоящей осы, пчелы, осы, шершня, муравья Рихтера и т.п.). Рассматриваемые аллергены включают также аллергены других насекомых, обитающих в окружающей среде, такие как аллергены тараканов, блох, комаров и т.п.; бактериальные антигены, такие как антигены стрептококков; паразитарные антигены, такие как антигены аскарид; вирусные антигены; грибковые споры; аллергены лекарственных средств; антибиотики; пенициллины и родственные соединения; другие антибиотики; полноразмерные белки, такие как гормоны (инсулин), ферменты (стрептокиназа); все лекарственные средства и их метаболиты, способные функционировать в качестве неполных антигенов или гаптенов; промышленные химические вещества и их метаболиты, способные функционировать в качестве гаптенов и обладающие активностью, свойственной аллергенам (например, ангидриды кислоты (такие как тримеллитиновый ангидрид) и изоцианаты (например, диизоцианат толуола)); аллергены, вызывающие профессиональные заболевания, такие как мука (например, аллергены, вызывающие астму пекарей); аллергены клещевины обыкновенной, кофейных зерен, промышленные аллергены, описанные выше; аллергены блох; а также человеческие белки в организме животных, отличных от человека.
Рассматриваемые аллергены включают, без ограничения, клетки, клеточные экстракты, белки, полипептиды, пептиды, полисахариды, конъюгаты полисахаридов, пептидные и непептидные миметики полисахаридов и другие молекулы, малые молекулы, липиды, гликолипиды и углеводы.
Примеры специфических природных аллергенов, аллергенов животных и растений включают в себя, без ограничения, белки, специфические для следующих родов: Canine (Canis familiaris); Dermatophagoides (например, Dermatophagoides farinae); Felis (Felis domesticus); Ambrosia (Ambrosia artemiisfolia); Lolium (например, Lolium perenne или Lolium multiflorum); Cryptomeria (Cryptomeria japonica); Alternaria (Alternaria alternata); Alder; Alnus (Alnus gultinoasa); Betula (Betula verrucosa); Quercus (Quercus alba); Olea (Olea europa); Artemisia (Artemisia vulgaris); Plantago (например, Plantago lanceolata); Parietaria (например, Parietaria officinalis или Parietaria judaica); Blattella (например, Blattella germanica); Apis (например, Apis multiflorum); Cupressus (например, Cupressus sempervirens, Cupressus arizonica и Cupressus macrocarpa); Juniperus (например, Juniperus sabinoides, Juniperus virginiana, Juniperus communis и Juniperus ashei); Thuya (например, Thuya orientalis); Chamaecyparis (например, Chamaecyparis obtusa); Periplaneta (например, Periplaneta americana); Agropyron (например, Agropyron repens); Secale (например, Secale cereale); Triticum (например, Triticum aestivum); Dactylis (например, Dactylis glomerata); Festuca (например, Festuca elatior); Poa (например, Poapratensis или Poa compressa); Avena (например, Avena sativa); Holcus (например, Holcus lanatus); Anthoxanthum (например, Anthoxanthum odoratum); Arrhenatherum (например, Arrhenatherum elatius); Agrostis (например, Agrostis alba); Phleum (например, Phleum pratense); Phalaris (например, Phalaris arundinacea); Paspalum (например, Paspalum notatum); Sorghum (например, Sorghum halepensis); и Bromus (например, Bromus inermis).
В родственном варианте настоящее изобретение относится к полинуклеотидной адъювантной композиции и к способу ее использования, где указанная иммуногенная композиция включает в себя адъювант PIKA в сочетании с аутоиммунным антигеном или аутоиммунной вакциной.
В родственном варианте настоящее изобретение относится к иммуногенной композиции и к способу ее применения, где указанная иммуногенная композиция включает в себя адъювант PIKA, один или в сочетании с раковым антигеном, где репрезентативные антигены включают в себя, без ограничения, антигены одного или нескольких видов рака, описанных в таблице 5.
Виды рака
В родственном варианте осуществления изобретения источником ракового антигена могут быть: 1) вирусные белки, например, вирус гепатита B (HBV), вирус Эпштейна-Барр (EBV) и папилломавирус человека (HPV), которые являются особенно важными в развитии гепатоцеллюлярной карциномы, лимфомы и цервикального рака соответственно; 2) целые раковые клетки, которые могут быть инактивированы и/или могут представлять собой неочищенный и/или полуочищенный экстракт этих клеток; 3) опухоле-ассоциированные антигены (ТАА), такие как опухолеспецифические онкогенные белки, гликозилированные белки, ганглиозиды, гликолипид, муцины, пептид, углеводы и антиидиотипические моноклональные антитела.
В родственном варианте осуществления настоящего изобретения используемые иммуногенные композиции, включающие в себя полинуклеотидный адъювант, могут использоваться для лечения раковых опухолей с целью предупреждения дальнейшего роста уже имеющихся раковых опухолей, предупреждения рецидива леченного рака или для уничтожения раковых клеток, сохранившихся после проведения курсов лечения. Лечение может проводиться до, во время введения данной композиции или после других видов терапии индивидууму и может, таким образом, составлять часть общего режима терапии рака.
В родственном аспекте осуществления настоящего изобретения предлагается противораковая вакцина для терапии, направленной на индукцию опухолеспецифических иммунных ответов против первичной опухоли и метастаз. Дополнительно, индукция сильного иммунитета может привести к генерированию иммунной памяти, которая позволяет снизить или ингибировать рецидив опухоли. Противораковая вакцина может индуцировать специфические антитела против опухолеассоциированных поверхностных антигенов и индуцировать клеточные иммунные ответы с преимущественным сдвигом в сторону Th1 иммунного ответа.
Любой из множества известных опухолеспецифических антигенов или опухолеассоциированных антигенов (TAA) может быть включен в целевую иммуногенную композицию. Могут использоваться полные TAA, но это необязательно. Возможно также использование части TAA, например, эпитопа. Опухолеассоциированные антигены (или их эпитопсодержащие фрагменты), которые могут использоваться в YFV, включают в себя, без ограничения, MAGE-2, MAGE-3, MUC-1, MUC-2, HER-2, высокомолекулярный ассоциированный с меланомой антиген MAA, GD2, карциноэмбрионический антиген (CEA), TAG-72, ассоциированные с яичником антигены OV-TL3 и MOV18, TUAN, альфа-фетопротеин (AFP), OFP, CA-125, CA-50, CA-19-9, антиген, ассоциированный с опухолью почки G250, EGP-40 (также известный как EpCAM), S100 (антиген, ассоциированный со злокачественной меланомой), p53 и p21ras. Может использоваться синтетический аналог любого TAA (или его эпитопа), включая любой из указанных выше вариантов. Кроме того, в композицию могут быть включены сочетания одного или нескольких TAA (или их эпитопов).
В некоторых вариантах осуществления настоящего изобретения целевая иммуногенная композиция включает в себя полинуклеотидный адъювант и по меньшей мере два разных антигена, например, в некоторых вариантах осуществления настоящего изобретения целевая иммуногенная композиция включает два антигена, три антигена, четыре антигена, пять антигенов или больше пяти антигенов.
Дополнительные агенты
В некоторых вариантах осуществления настоящего изобретения целевая иммуногенная композиция включает в себя, кроме адъюванта PIKA и антигена, один или несколько дополнительных агентов, например, иммуномодулирующих агентов, носителей и т.п.
В варианте осуществления настоящего изобретения, который представляет особый интерес, настоящее изобретение относится к иммуногенной композиции и к способу ее применения, где указанная иммуногенная композиция включает адъювант PIKA, антиген или вакцину в сочетании с другим иммуномодулирующим соединением, включая адъюванты, где подходящие иммуномодулирующие соединения включают, без ограничения, алюминиевую композицию, такую как гидроксид алюминия; композиции, представляющие собой эмульсии по типу масло-в-воде или эмульсии, содержащие иммуногенные вещества, включающие полный адъювант Фрейнда, эмульсию по типу масло-в-воде, содержащую высушенные инактивированные нагреванием бактерии Mycobacterium tuberculosis; неполный адъювант Фрейнда; эмульсии, включающие компоненты клеточной стенки микобактерий; эмульсии, включающие сквален (MF-59); детоксифицированные эндотоксины, производные липида А, включающие микробный монофосфорил-липид А (MPL); гаптены; белок, абсорбированный на нитроцеллюлозе; сапонины, включающие иммуномодуляторы в форме частиц, выделенные из коры Quillaja Saponoria, например, QS21; эндогенные иммуномодуляторы человека; полученные из бактерий адъюванты, которые включают неметилированные динуклеотиды CpG; олигодезоксинуклеотиды (например, синтетические олигонуклеотиды), содержащие неметилированные динуклеотиды CpG; липосомы (например, липосомы, полученные из биодеградируемых материалов, таких как фосфолипиды); микросферы на основе биодеградируемого полимера (например, микросферы, полученные на основе большого числа полимеров, таких как полимер на основе полимолочной-ко-гликолевой кислоты (PLGA), полифосфазен и полиангидриды); интерлейкин-2; вакцину БЦЖ (Bacillus Calmetto Guerin); гранулоцитарный-моноцитарный колониестимулирующий фактор; монтанид ISA-51; гемоцианин лимфы улитки; ДНК; белки; инкапсулированные антигены; иммуностимулирующие комплексы (ISCOM); холерный токсин; производные холерного токсина; токсин zonula occludens; термолабильный энтеротоксин Eschrichia coli; лабильный токсин, производные лабильного токсина; коклюшный токсин, производные коклюшного токсина; производные мурамилдипептида; seppic серия адъювантов на основе монтанида; поли-ди(карбоксилатофенокси)фосфазен и фактор элонгации из Leishmania.
В том случае, когда целевую иммуногенную композицию вводят в сочетании с другим адъювантом, полинуклеотидный адъювант может вводиться до и/или после другого адъюванта или одновременно с другим адъювантом. Так, например, полинуклеотидный адъювант может вводиться при первоначальном введении антигена, с последующим введением бустерной дозы вакцины, включающей один или оба адъюванта. Альтернативно, исходная доза вводимой вакцины может исключать полинуклеотидные адъюванты, тогда как иммуногенные вещества, включающие в себя полинуклеотидный адъювант, вводят пациенту позже.
В некоторых вариантах осуществления настоящего изобретения целевая иммуногенная композиция может вводиться с цитокинами или другими ко-стимулирующими молекулами, например: IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-10, IL-12, IL-15.
В родственном варианте настоящее изобретение относится к иммуногенному веществу, включающему в себя адъювант PIKA, одно или несколько антигенных веществ, плюс подходящий носитель. Указанный носитель может представлять собой, например, эмульсию масло-в-воде, суспензию, жидкий носитель, соль алюминия, средства, вводимые через улитку, ISCOM композиции, липосомы, векторы на основе живых бактерий, векторы на основе живых вирусов, микросферы, вакцины на основе нуклеиновых кислот, полимеры, полимерные кольца, фторид натрия, трансгенные растения, виросомы, вирусоподобные частицы и другие носители для доставки, известные в данной области.
Полинуклеотидный адъювант может доставляться непосредственно или, альтернативно, может вводиться в сочетании со специальным комплексом для доставки. В том случае, когда используемый для доставки комплекс представляет собой вещество, ассоциированное с целевым средством, например, с молекулой, достигается повышение связывающей аффинности с целевой клеткой, например, с поверхностью дендритной клетки, и/или усиление поглощения целевыми клетками. Примеры специальных комплексов для доставки включают, без ограничения, кислотные комплексы для нуклеиновой кислоты, ассоциированные со стеролом (например, холестерином), с липидом (например, катионным липидом, виросомой или липосомой) или с агентом, который специфически связывается с целевой клеткой (например, с лигандом, распознаваемым специфическим рецептором целевой клетки). Предпочтительно, чтобы комплексы были достаточно стабильными in vivo, что будет препятствовать их значительному распаду до интернализации в целевой клетке. Однако в соответствующих условиях в клетке такой комплекс способен расщепляться.
В одном варианте осуществления настоящего изобретения, представляющем интерес, композиция, включающая в себя адъювант PIKA, не включает поли-L-лизин или его производное.
Наборы
В некоторых вариантах осуществления настоящего изобретения указанное изобретение относится к набору, включающему целевую иммуногенную композицию. В некоторых вариантах осуществления настоящего изобретения указанное изобретение относится к набору, включающему в себя адъювант PIKA и антиген в составе разных композиций.
В родственном варианте осуществления настоящего изобретения рассматривается набор, включающий в себя полинуклеотидный адъювант и иммуногенное соединение, где иммуногенное вещество представляет собой антиген.
В некоторых вариантах целевой набор включает в себя целевую иммуногенную композицию в стерильной жидкости (например, в водной среде), где указанная композиция является стерильной и находится в стерильном контейнере, в стерильном флаконе или в стерильном шприце.
В некоторых вариантах осуществления настоящего изобретения целевой набор включает в себя целевую иммуногенную композицию, изготовленную для целей инъекции. В некоторых вариантах осуществления настоящего изобретения целевой набор включает в себя целевую иммуногенную композицию в стерильной жидкой композиции, введенную в стерильный шприц, и иглу. В некоторых вариантах осуществления настоящего изобретения целевой набор включает целевую иммуногенную композицию в стерильной жидкой композиции в количестве, соответствующем стандартной дозировке (например, в виде однократной дозы), введенную в стерильный шприц, и иглу.
В некоторых вариантах осуществления настоящего изобретения целевой набор включает целевую иммуногенную композицию, которая была лиофилизирована и введена в стерильный контейнер; и контейнер, включающий стерильную жидкость для восстановления лиофилизированной композиции. В некоторых вариантах осуществления настоящего изобретения целевой набор также включает инструкции по восстановлению лиофилизированной композиции.
В некоторых вариантах осуществления настоящего изобретения целевой набор включает иммуногенную композицию, изготовленную для введения ректально, вагинально, назально, орально (включая ингаляцию), офтальмически, местно, легочно, через глаза, или чрескожно, или в составе соответствующих устройств для доставки, например, для введения в составе ингалятора, суппозитория, аппликатора и т.п.
В некоторых вариантах осуществления настоящего изобретения целевой набор включает также инструкции по применению, в которых описываются, например, вводимые дозировки и частота введения доз. В некоторых случаях инструкции печатаются непосредственно на самом наборе. В других вариантах осуществления настоящего изобретения инструкции представляют собой печатные материалы в виде листа-вкладыша. Инструкции могут быть также представлены в виде других форм, например, в электронном виде, в цифровой или аналоговой форме, например, на аудиокассете, на аудиопленке, на компакт-диске, на цифровом диске и т.п.
Композиции
Целевая иммуногенная композиция может быть представлена в виде большого числа различных форм. Так, например, целевая иммуногенная композиция может быть изготовлена в виде инъецируемой формы, сухого порошка, жидкого раствора, например, в виде водного или солевого раствора, или в форме суспензии, крема, эмульсии, таблетки, таблетки, покрытой оболочкой, микрокапсулы, суппозитория, капельных препаратов, пилюли, гранул, драже, капсулы, геля, сиропа или взвеси. Получение композиции желательного иммуногенного препарата в основном описано в руководстве: Vaccine 4th Edition by Stanley A Plotkin et al., W.B. Saunders Company; 4th edition 2003. Соответствующие композиции описаны также в следующих работах: А. Gennaro (2000) «Remington: The Science and Practice of Pharmacy», 20th edition, Lippincott, Williams, & Wilkins; Pharmaceutical Dosage Forms and Drug Delivery Systems (1999) H.C. Ansel et al., eds., 7th ed., Lippincott, Williams, & Wilkins; и Handbook of Pharmaceutical Excipientes (2000) A. H. Kibbe et al., eds., 3rd ed. Amer. Pharmaceutical Assoc., Methods in Molecular Medicine, Vol. 87: Vaccine Protocols, 2nd edition (2003), Humana Press; Mucosal Vaccines (1996), Kiyono et al., eds., Academic Press; и Vaccine Adjuvants: Preparation Methods and Research Protocols (2000) D.T. O'Hagan, Humana Press.
Целевая иммуногенная композиция может быть микроинкапсулирована, введена в состав препарата для улиткового введения, внесена в виде покрытия на микроскопические золотые частицы, введенные в состав липосом, может быть включена в состав аэрозолей в небулайзере, в состав шариков для имплантации в кожу или может быть высушена на остром объекте (например, на игле) для последующего внесения такого препарата на кожу через царапину.
В другом варианте осуществления настоящего изобретения целевое иммуногенное вещество может быть доставлено само по себе или в сочетании с системой дисперсии. В некоторых вариантах осуществления настоящего изобретения система дисперсии выбирается из группы, состоящей, например, из макромолекулярных комплексов, нанокапсул, микросфер, шариков и липидных систем. Липидные системы необязательно включают эмульсии типа масло-в-воде, мицеллы, смешанные мицеллы и липосомы.
В некоторых вариантах осуществления настоящего изобретения целевая иммуногенная композиция, включающая в себя адъювант PIKA, имеет форму фармацевтически приемлемого раствора, который может содержать фармацевтически приемлемые концентрации соли, забуферивающих агентов, консервантов, совместимых носителей, адъювантов и необязательно другие терапевтические ингредиенты. Указанная композиция может содержать такие добавки, как например, средства, способствующие разложению, связующие вещества, агенты покрытия, агенты, применяемые для набухания, замасливатели, вкусовые вещества, подсластители или солюбилизаторы и т.п.
В некоторых вариантах осуществления настоящего изобретения целевая иммуногенная композиция, включающая в себя адъювант PIKA, вводится в чистом виде или в форме фармацевтически приемлемой соли.
Иммуногенная композиция согласно настоящему изобретению может использоваться в таких стерильных и нестерильных формах, как капсулы, жидкие растворы, жидкие капли, эмульсии, суспензии, эликсиры, кремы, суппозитории, гели, мягкие капсулы, спреи, ингалирующие вещества, аэрозоли, порошки, таблетки, покрытые оболочкой таблетки, леденцы, микрокапсулы, суппозитории, драже, сиропы, взвеси, гранулы, клизмы или пилюли. При этом может использоваться любой инертный носитель, такой как солевой раствор или фосфатно-буферный раствор, стабилизаторы, пропелленты, вещества, включенные в состав желатиновой капсулы, или микрокапсулы, или вектора, которые облегчают введение, или такой носитель, в котором соединения, используемые в способе согласно настоящему изобретению, обладают подходящими показателями растворимости для осуществления способов согласно настоящему изобретению.
В некоторых вариантах осуществления настоящего изобретения композицию на основе адъюванта PIKA и иммуногенную композицию, включающую адъювант PIKA и антигенное вещество, подвергают сушке при замораживании (лиофилизации) для достижения длительной стабильности и хранят в твердом виде. Метод лиофильной сушки известен специалистам в данной области.
В одном аспекте, который представляет особый интерес, настоящее изобретение относится к адъювантной композиции или к иммуногенной композиции, где указанная иммуногенная композиция или адъювантная композиция в составе иммуногенной композиции находится в твердой форме или жидкой форме, или имеет вид раствора, или суспензии, или эмульсии.
Целевая иммуногенная композиция может быть введена индивидууму с использованием фармацевтической системы доставки, предназначенной для ингаляции (оральной, интратрахеальной, интраназальной). Соответственно, целевая иммуногенная композиция может быть изготовлена в форме, подходящей для введения путем ингаляции. Фармацевтическая система доставки представляет собой такую систему, которая приемлема для лечения дыхательных путей путем местного введения целевой бактериальной композиции в слизистую выстилку бронхов. В указанных вариантах осуществления настоящего изобретения может использоваться система, которая зависит от силы прессованного газа, выталкивающего бактерии из контейнера. Для этих целей может использоваться аэрозоль или контейнер под давлением.
В контексте данного описания термин «аэрозоль» используется в традиционном смысле и относится к очень тонкоизмельченным твердым частицам или жидкости, переносимым газом-пропелентом под давлением на участок, подлежащий терапевтическому воздействию. В том случае, когда используется фармацевтический аэрозоль согласно настоящему изобретению, указанный аэрозоль содержит иммуногенную композицию, которая может быть растворена, суспендирована или эмульгирована в смеси жидкого носителя и пропеллента. Указанный аэрозоль может иметь вид раствора, суспензии, эмульсии, порошка или полутвердого препарата. Аэрозоли, используемые в рамках настоящего изобретения, предназначены для введения композиции в виде тонкоизмельченных твердых частиц или жидких смесей через дыхательные пути субъекта. При этом могут использоваться различные типы пропеллентов, известные специалистам в данной области. Примеры подходящих пропеллентов включают, без ограничения, углеводороды или другой подходящий газ. В случае аэрозоля, используемого в контейнере под давлением, стандартная дозировка может быть определена с помощью устройства, отмеряющего вводимую дозу.
Известно несколько разных типов стратегий ингаляции, которые могут использоваться в сочетании со способом согласно изобретению. Целевая иммуногенная композиция может быть изготовлена в основном в виде трех разных типов композиций для ингаляции. Во-первых, целевая иммуногенная композиция может быть изготовлена с использованием пропеллентов с низкой точкой кипения. Такие композиции в основном вводят с помощью стандартных ингаляторов с отмеряемой дозой (MDI). Однако, стандартные MDI могут быть модифицированы, с целью их усовершенствования, применительно к воспроизводимости дозировок, за счет использования методики, которая позволяет измерять вдыхаемый объем и скорость потока при введении субъекту, как описано в патентах США 5404871 и 5542410.
Альтернативно, целевая иммуногенная композиция может быть изготовлена в виде водного или этанольного раствора и доставлена с помощью традиционного небулайзера. В некоторых вариантах осуществления настоящего изобретения такие композиции в виде раствора представляют собой аэрозольные композиции, в случае которых используют устройства и системы, аналогичные таковым, описанным в патентах США NoNo. 5497763; 5544646; 5718222 и 5660166.
Кроме того, целевая иммуногенная композиция может быть изготовлена в виде сухих порошковых композиций. Такие композиции могут вводиться просто путем ингаляции сухой порошковой композиции после образования аэрозольной смеси порошка. Соответствующая технология описана, например, в патентах США NoNo. 5775320 и 5740794. Композиции, подходящие для интраназального введения, включают в себя назальные спреи, назальные капли, аэрозольные композиции и т.п.
В некоторых вариантах осуществления настоящего изобретения целевая иммуногенная композиция изготавливается в виде композиции для длительного высвобождения (например, композиции с контролируемым высвобождением). Так, например, в некоторых вариантах осуществления настоящего изобретения целевая иммуногенная композиция изготавливается в виде шариков или цилиндриков и имплантируется внутримышечно или подкожно в виде депо-инъецируемых форм или имплантатов. Такие имплантаты в основном связаны с использованием известных инертных материалов, таких как биодеградируемые полимеры. Инъецируемые депо-формы изготавливают путем создания микрокапсулярных матриц на основе целевой иммуногенной композиции в составе биодеградируемых полимеров, таких как полилактид-полигликолид. Примеры других подходящих биодеградируемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Инъецируемые композиции депо-форм получают также путем встраивания композиции в липосомы или микроэмульсии, которые совместимы с тканью организма. Системы доставки с контролируемым высвобождением могут включать, в качестве примеров, следующие: полимерные системы, микрокапсулы, липиды, системы на основе высвобождения гидрогеля, силастиновые системы, пептидные системы, системы на основе пептидов, восковые покрытия, прессованные таблетки, частично конденсированные имплантаты. Другие формы для доставки с пролонгированным высвобождением также известны специалистам в данной области.
Способы
В одном аспекте, представляющем особый интерес, настоящее изобретение относится к способу создания и/или усиления иммунных ответов на антигенное соединение, включающему введение в организм хозяина целевой иммуногенной композиции. В некоторых вариантах осуществления настоящего изобретения указанный организм хозяина представляет собой организм человека. В других вариантах осуществления настоящего изобретения указанный организм хозяина представляет собой организм животного, отличного от человека, например, млекопитающего, отличного от человека, вид птицы и т.п.
В некоторых вариантах осуществления настоящего изобретения рассматриваемая полинуклеотидная адъювантная композиция может использоваться в качестве вакцины. Необязательно, вакцинная композиция содержит дополнительные адъюванты. Рассматриваемые классы вакцин включают вакцины для использования при инфекционных заболеваниях, противораковые вакцины, антиаллергические вакцины и вакцины, используемые при аутоиммунных заболеваниях.
Кроме того, настоящее изобретение относится к способу усиления иммунных ответов на антигенное соединение путем введения в организм хозяина целевой иммуногенной композиции. Указанный организм хозяина может представлять собой организм человека или животного, отличного от человека.
В некоторых вариантах осуществления настоящего изобретения указанный адъювант вводят вместе с антигеном. Другие варианты осуществления настоящего изобретения относятся к введению адъюванта до или после введения антигена.
В некоторых вариантах осуществления настоящего изобретения целевая иммуногенная композиция доставляется парентерально путем инъекции, такой как внутримышечная, внутрибрюшинная, внутривенная, подкожная или внутрикожная инъекция. В других вариантах осуществления настоящего изобретения целевую иммуногенную композицию вводят внутрикожно в рамках способов, отличных от инъекции, в частности, без нарушения эпителиального барьера механическими способами. В некоторых вариантах осуществления настоящего изобретения указанную иммуногенную композицию вводят ректально, вагинально, назально, орально (включая ингаляцию), офтальмически, внутриглазным способом, местно, легочно или чрескожно.
Указанный субъект может быть подвергнут воздействию антигена посредством контакта с окружающей средой, что сопряжено с риском развития, например, аллергической реакции, инфекционного заболевания, аутоиммунного заболевания или рака. В других вариантах осуществления настоящего изобретения указанный субъект имеет, например, инфекционное заболевание, аутоиммунное заболевание, рак или аллергию в результате предшествующего контакта с антигеном из окружающей среды.
В некоторых вариантах настоящего изобретения, в рамках которых способ введения иммуногенной композиции, включающий полинуклеотидный адъювант, направлен на лечение раковых опухолей, доставка осуществляется путем непосредственной инъекции в опухоль или в ткани рядом с опухолью. В некоторых вариантах осуществления настоящего изобретения иммуногенная композиция доставляется равномерно в область над опухолью или по всей опухоли, с тем чтобы улучшить биологическое распределение и, в этой связи, повысить терапевтический эффект.
Для парентерального введения в водном растворе, например, указанный раствор должен быть, при необходимости, соответствующим образом забуферен и жидкий разбавитель вначале следует сделать изотоничным за счет добавления достаточного количества солевого раствора или глюкозы. Некоторые водные растворы особенно пригодны для внутривенного и внутрибрюшинного введения. В этой связи, в свете приведенного описания, специалисты в данной области смогут оценить стерильные водные среды, которые могут при этом использоваться. Репрезентативные среды для инъекций, которые могут использоваться согласно настоящему изобретению, включают в себя буфер, при наличии или в отсутствие диспергирующих веществ и/или консервантов, а также пищевое масло, минеральное масло, масло из печени трески, сквален, моно-, ди- или триглицерид и их смесь.
Целевую иммуногенную композицию вводят в «эффективном количестве», что представляет собой количество целевой иммуногенной композиции, которая эффективна в рамках выбранного способа введения для проявления, индукции или усиления иммунного ответа. В некоторых вариантах осуществления настоящего изобретения иммунный ответ проявляется на антигены, продуцируемые патогенным микроорганизмом. В некоторых вариантах осуществления настоящего изобретения количество целевой иммуногенной композиции достаточно для эффективного ограничения инфекции, и/или уничтожения инфекции, и/или для снижения симптомов, ассоциированных с инфекцией патогенным организмом.
Так, например, в некоторых вариантах осуществления настоящего изобретения введение целевой иммуногенной композиции индивидууму является эффективным для лечения инфекционного заболевания, где лечение инфекционного заболевания означает достижение одного или нескольких следующих показателей: снижение числа патогенных агентов у индивидуума (например, снижение вирусной нагрузки, снижение бактериальной нагрузки, снижение числа простейших, снижение количества гельминтов) и/или снижение показателя, ассоциированного с инфекционным заболеванием, который включает, без ограничения, снижение уровня продукта, образуемого инфекционным агентом (например, токсина, антигена и т.п.); и снижение нежелательного физиологического ответа на инфицирующий агент (например, лихорадки, отека тканей и т.п.).
Точное требуемое количество таких композиций будет варьировать от субъекта к субъекту, в зависимости от вида, возраста, веса и общего состояния такого субъекта, от тяжести заболевания, от природы инфекции или состояния, которое подлежит лечению или предупреждению, от конкретного используемого соединения, способа его введения и т.п. Соответствующее количество может быть определено специалистом в данной области с использованием всего лишь рутинных экспериментов по приведенной методике. После первоначального введения, субъекту может быть проведена одна или несколько бустерных иммунизаций в адекватном режиме.
В некоторых вариантах осуществления настоящего изобретения вводят серию доз целевой иммуногенной композиции. В этих вариантах первая доза целевой иммуногенной композиции может быть результатом введения вакцины. Вторая доза целевой иммуногенной композиции вводится индивидууму после иммунологического примирования указанного индивидуума первой дозой. Бустерная доза может быть введена через несколько дней, недель или месяцев после первоначальной иммунизации, в зависимости от реакции пациента и его состояния. Так, например, бустерную дозу вводят в период от примерно 2 дней до примерно 12 месяцев после введения начальной дозы, например, в период от примерно 2 дней до примерно 7 дней, от примерно 1 недели до примерно 2 недель, от примерно 2 недель до примерно 4 недель, от примерно 4 недель до примерно 8 недель, от примерно 8 недель до примерно 6 месяцев или от примерно 6 месяцев до примерно 12 месяцев после введения начальной дозы. Настоящее изобретение также относится к использованию третьей, четвертой, пятой, шестой или последующей бустерной иммунизации с использованием, например, третьей, четвертой, пятой, шестой или последующей дозы.
В некоторых вариантах осуществления настоящего изобретения средства введения могут включать сочетание альтернативных способов введения, например, после системного введения дозы (например, путем перитонеального, внутримышечного, подкожного или внутрикожного введения) может следовать доза, вводимая через слизистую (например, путем интраназального введения, введения методом ингаляции), или наоборот.
В некоторых вариантах осуществления настоящего изобретения полинуклеотидный адъювант может вводиться вместе с первой дозой вводимого антигена или с любой из последующих вводимых доз или со всеми дозами, вводимыми пациенту. По меньшей мере, одна из доз, вводимая как часть общего протокола введения, будет включать адъювант PIKA.
В некоторых вариантах осуществления настоящего изобретения состав вводимой иммуногенной композиции может варьировать, если сравнивать исходное введение и бустерное введение и/или варианты введения бустерных доз. В качестве примера можно ответить, что вводимая первоначально доза может включать ДНК-вакцину, тогда как бустерная доза может представлять собой вакцину на основе рекомбинантного белка. По меньшей мере одна из доз, вводимая как часть общего протокола введения, будет включать адъювант PIKA.
Выяснить природу ответа на антиген, происходит ли индукция или усиление образования антител у индивидуума, можно легко с использованием стандартных тестов. Так, например, могут быть проведены иммунологические тесты, такие как иммуноферментный твердофазный анализ (ИФТФА), радиоиммуноанализ (РИА), тесты на иммунопреципитацию и белковый блоттинг (вестерн-блоттинг), а также тесты на нейтрализацию (например, нейтрализацию инфекционности вируса в тесте in vitro или in vivo); с целью выявления наличия антитела, специфического для микробного антигена, в жидкости организма или в биологическом образце, например, в сыворотке, секрете или в другой жидкости, взятой у индивидуума.
Можно легко выявить индукцию CD4 иммунного ответа на антиген у индивидуума с использованием стандартных тестов, например, в формате метода, включающего использование флуоресцентного сортировщика активированных клеток (FACS-анализ) (см., например, Waldrop et al. (1997) J. Clin. Invest. 99: 1739-1750); в рамках тестов на внутриклеточные цитокины, которые позволяют выявить продукцию цитокинов после стимуляции антигена (см., например, Suni et al. (1998) J. Immunol. Methods 212: 89-98; Nomura et al. (2000) Cytometry 40: 60-68; Ghanekar et al. (2001) Clin Diagnostic Lab. Immunol. 8: 628-631); тестов, в которых используется окрашивание мультимерного MHC-пептида, например, с использованием выявляемой метки (например, флуоресцентной метки) растворимых пептидных мультимеров ГКГ (MHC) класса II (см., например, Bill and Kotzin (2002) Arthritis Res. 4: 261-265; Altman et al. (1996) Science 274: 94-96; и Murali-Krishna et al. (1998) Immunity 8: 177-187); по процедуре ферментативного иммуноспот-анализа (ELISPOT) (см., например, Hutchings et al. (1989) J. Immunol. Methods 120: 1-8; и Czerkinsky et al. (1983) J. Immunol. Methods 65: 109-121) и т.п. В качестве одного из неограничивающих примеров теста на внутриклеточные цитокины можно отметить тест, в рамках которого проводят стимуляцию цельной крови антигеном и совместно стимулирующими антителами (например, анти-CD28, анти-CD49d) в течение 2 часов или более; Брефелдин А добавляют для ингибирования секреции цитокинов; и далее клетки подготавливают для проведения FACS-анализа с использованием флуоресцентно меченых антител против CD4 и цитокинов, таких как TNF-α, TFN-γ и IL-2.
Установить наличие индукции антиген-специфических CD8 (например, цитотоксических Т-клеток; «CTL») в ответ на антиген (например, на патоген) можно с использованием любого теста из имеющегося множества методик, известных в данной области, включающих, без ограничения, оценку специфического лизиса под действием CTL целевых клеток, экспрессирующих антиген на своей поверхности, где указанные целевые клетки содержат выявляемую метку, которая высвобождается из целевых клеток при лизисе и, следовательно, может быть измерена с использованием, например, теста на высвобождение 51Cr; в тесте на цитолизис с флуоресцентно меченым лантанидом и т.п.
Субъекты, подлежащие лечению
Субъекты, подлежащие лечению рассматриваемым способом, включающим индукцию иммунного ответа на микробный патоген, а также с использованием способов лечения и профилактики инфекции микробным патогеном, включают индивидуумов, которые были инфицированы патогенным микроорганизмом; индивидуумов, которые являются чувствительными к инфекции патогенным микроорганизмом, но которые еще не были инфицированы, а также индивидуумов, которые имеют риск инфицирования патогенным микроорганизмом, но которые еще не были инфицированы. Соответствующие субъекты включают младенцев, детей, подростков и взрослых людей.
Субъекты, подлежащие лечению рассматриваемым способом индукции иммунного ответа на микробный патоген, а также с использованием способов лечения или ограничения инфекции микробным патогеном, включают целевую группу детского возраста, например, детей в возрасте от примерно 1 года до примерно 17 лет, включая новорожденных детей (например, в возрасте от примерно 1 месяца до примерно 1 года); детей (например, в возрасте от примерно 1 года до примерно 12 лет); и подростков (например, в возрасте от примерно 13 лет до примерно 17 лет).
Субъекты, подлежащие лечению рассматриваемым способом индукции иммунного ответа на микробный патоген, а также с использованием способов лечения или ограничения инфекции микробным патогеном, включают новорожденных, например, индивидуума (в частности, новорожденного человеческого ребенка) в возрасте от 1 дня до примерно 14 дней, например, в возрасте от примерно 1 дня до примерно 2 дней, в возрасте от примерно двух дней до примерно 10 дней, или в возрасте от примерно 10 дней до примерно 14 дней.
В конкретном варианте осуществления настоящего изобретения указанный субъект является человеческим ребенком примерно в возрасте десяти лет или моложе, например, в возрасте примерно пяти лет или моложе, и в этом случае иммуногенные композиции вводят с использованием одного или нескольких указанных временных параметров: в две недели, один месяц, 2 месяца, 3 месяца, 4 месяца, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев, 12 месяцев, 15 месяцев, 18 месяцев или 21 месяц после рождения, или в 2 года, 3 года, 4 года, 5 лет, 6 лет, 7 лет, 8 лет, 9 лет или 10 лет. В некоторых вариантах осуществления настоящего изобретения рассматриваемую иммуногенную композицию вводят индивидууму в возрастном диапазоне от примерно 6 месяцев до примерно 6 лет, где указанный индивидуум получает первую дозу в возрасте примерно 6 месяцев и последующие бустерные дозы, например, 2-3 последующие бустерные дозы, вводят, например, в возрасте 2 лет, 4 лет и 6 лет.
В конкретном варианте осуществления настоящего изобретения указанный субъект является взрослым человеком в возрасте от примерно 17 лет до 49 лет. В некоторых вариантах осуществления настоящего изобретения указанный субъект является пожилым человеком в возрасте от 50 до 65 лет, от 65 до 75 лет, от 75 до 85 лет или старше 85 лет.
В некоторых вариантах осуществления настоящего изобретения целевую иммуногенную композицию вводят индивидууму через небольшой промежуток времени после контакта (например, достаточно быстро после подтвержденного контакта или в случае подозреваемого контакта) с фактическим или возможным источником микробного патогена, например, индивидууму, в отношении которого известно, что имеет инфекцию микробным патогеном, или в отношении которого имеется такое подозрение. Так, например, в некоторых вариантах осуществления настоящего изобретения целевую иммуногенную композицию вводят индивидууму в течение примерно 1 часа, в течение примерно 2 часов, в течение примерно 5 часов, в течение примерно 8 часов, в течение примерно 12 часов, в течение примерно 18 часов, в течение примерно 24 часов, в течение примерно 2 дней, в течение примерно 4 дней, в течение примерно 7 дней, в течение примерно 2 недель или в течение примерно одного месяца после контакта с индивидуумом, в отношении которого известно, что он имеет инфекцию микробным патогеном, или в отношении которого предполагается наличие такой инфекции.
В некоторых вариантах осуществления настоящего изобретения целевую иммуногенную композицию вводят индивидууму, в отношении которого известно или в отношении которого подозревается, что он является носителем микробного патогена, независимо от того, имеются ли у него симптомы данной инфекции или отсутствуют.
Субъекты, подходящие для лечения целевым методом индукции иммунного ответа на микробный патоген и в отношении которых применимы рассматриваемые способы лечения или ограничения инфекции микробным патогеном, включают индивидуумов с недостаточностью CD4+ Т-клеток («CD4+-дефицитные» индивидуумы), в частности, таких индивидуумов, у которых выявлено снижение, относительно нормы, числа функциональных CD4+ Т-лимфоцитов. В контексте настоящего изобретения, термин «нормальный индивидуум» относится к индивидууму, который характеризуется уровнями CD4+ Т-лимфоцитов и одной или несколькими функциями в нормальном для данной популяции диапазоне, например, в случае человека в типичном случае от 600 до 1500 CD4+ Т-лимфоцитов на мм3 крови. CD4+-дефицитные индивидуумы включают в себя таких индивидуумов, которые характеризуются приобретенным иммунодефицитом или первичным иммунодефицитом. Приобретенный иммунодефицит может быть временным CD4+ дефицитом, например, в том случае, когда такой дефицит вызывается лучевой терапией или химиотерапией.
Лечение с использованием способов согласно настоящему изобретению применимо также к индивидуумам со здоровой, интактной иммунной системой, но которые имеют риск стать CD4+ иммунодефицитным («индивидуумы с риском»). Индивидуумы с риском включают, без ограничения, тех индивидуумов, которые характеризуются большей вероятностью, чем в среднем для популяции, стать CD4+ иммунодефицитными. Индивидуумы с риском стать CD4+ иммунодефицитными включают, без ограничения, индивидуумов, имеющих риск ВИЧ-инфекции в связи с наличием половых контактов с ВИЧ-инфицированными индивидуумами; лиц, которым вводят внутривенные препараты; индивидуумов, которые могут получить ВИЧ-инфицированную кровь, продукты крови или другие жидкости организма, загрязненные ВИЧ-компонентами; ребенка, который прошел через родовые пути ВИЧ-инфицированной матери; детей, которых вскармливают ВИЧ-инфицированные матери, и т.п.
Субъекты, подходящие для лечения целевым способом лечения рака, включают индивидуумов, которые контактировали с канцерогенным веществом, индивидуумов, которые чувствительны к раку, но у которых еще не был диагностирован рак; а также индивидуумов, которые имеют риск контакта с источником рака, но у которых еще не был диагностирован рак. Соответствующие субъекты включают новорожденных, детей, подростков и взрослых людей.
Субъекты, подходящие для лечения целевым способом терапии рака, включают индивидуумов, у которых был диагностирован рак; индивидуумов, которые ранее проходили лечение по поводу рака, например, с использованием химиотерапии или лучевой терапии, и которые регулярно проверяются на рецидив ранее леченного рака; а также индивидуумов, которые подвергались пересадке костного мозга или другим процедурам трансплантации органов.
Субъекты, подходящие для лечения композициями и способами согласно изобретению применительно к аллергии, включают индивидуумов, у которых была диагностирована аллергия. Субъекты, подходящие для лечения с использованием способов и агентов согласно настоящему изобретению, включают индивидуумов, в отношении которых известно, что они обладают гиперчувствительностью к одному или нескольким аллергенам. Субъекты, подходящие для данного лечения, включают тех, кто имеет одно из указанных выше аллергических расстройств. Рассматриваемое лечение также применимо для субъектов, которые имеют риск развития аллергической реакции на один или несколько аллергенов. Кроме того, для данного лечения подходят индивидуумы, в случае которых лечение с использованием одной или нескольких стандартных стратегий терапии аллергического расстройства не дали положительного результата.
Субъекты, подходящие для данного лечения, включают индивидуумов, живущих в индустриально развитых странах, индивидуумов, живущих в развивающихся странах, индивидуумов, живущих в сельских районах, индивидуумов, живущих в относительно удаленных районах и т.п.
Целевая популяция, подходящая для применения рассматриваемой иммуногенной композиции, будет варьировать, в зависимости от микробного патогена.
Приведенное выше описание в целом раскрывает настоящее изобретение. Ниже приведены примеры, которые помогут лучше понять настоящее изобретение. Данные примеры приведены только с целью иллюстрации, и их не следует рассматривать как ограничивающие в чем-либо область настоящего изобретения. Изменения по форме, а также замена соответствующими эквивалентами рассматриваются как приемлемые, если условия могут позволить или сделать уместными такие изменения и замены. Несмотря на то что в описании были использованы специфические термины, указанные термины следует рассматривать в описательном смысле, а не с точки зрения возможности ограничения.
ПРИМЕРЫ
Пример 1: PIKA в сочетании с большим числом антигенов индуцирует специфический иммунный ответ
В данном примере используется PIKA в сочетании с большим числом антигенов, с тем чтобы проявить специфические иммунные ответы in vivo. Данное исследование проводится в виде серии независимых экспериментов с общим протоколом, в котором каждый раз используется другой антиген. Исследуемые антигены включают: поверхностный антиген рекомбинантного белка гепатита B тип adw, инактивированную субъединичную противогриппозную вакцину (VAXIGRIP от компании Sanofi Pasteur), синтезированный пептидный антиген ВИЧ, антиген рекомбинантного белка вируса herpes simplex, тип 2 gD, антиген рекомбинантного защитного белка сибирской язвы, инактивированный полный антиген вируса птичьего гриппа, штамм H5N1 и инактивированный полный антиген вируса тяжелого острого респираторного синдрома (ТОРС (SARS)).
Протокол каждого отдельного эксперимента включает инокуляцию мышам Balb/c, по три мыши на группу, композиций, включающих один антиген, антиген с адъювантом PIKA (гетерогенная композиция молекул PIKA с преимущественным распределением веса молекул в диапазоне примерно от 66 кДа до 1200 кДа), один PIKA и контроль, содержащий только фосфатно-буферный раствор (ФБР).
Для каждого антигена были использованы количества, соответствующие фактическим дозировкам. Затем мышам вводят идентичную бустерную дозу вакцины в период времени от десяти до четырнадцати дней после первоначальной инъекции. Через десять-четырнадцать дней после бустерной инъекции отбирают образец крови, после чего мышей умерщвляют и отбирают образцы ткани из селезенки. Представленные данные отражают среднее значение результатов тестирования каждой отдельной мыши в каждой группе.
Получают суспензию клеток селезенки и образец клеточной суспензии от каждой мыши вносят в 6-12 ячеек планшета для ELISPOT и культивируют, где каждая ячейка в планшете ELISPOT содержит по 200 мкл суспензии спленоцитов, примерно от 2×105 до 1×106 клеток/ячейку (см. детали в приведенных ниже таблицах). При культивировании спленоцитов из каждого мышиного образца проводят инкубацию в половине ячеек с культуральной средой, а другую половину ячеек стимулируют с использованием одной из двух разных концентраций конкретного исследуемого антигена. Планшеты инкубируют при температуре 37°С в течение 20 часов в контролируемых условиях перед завершением эксперимента и измерением на стандартном счетчике для планшетов ELISPOT.
Были использованы стандартные тесты ELISPOT, известные специалистам в данной области, которые позволяют выявлять количество клеток, продуцирующих цитокины IL-4, IL-2 и INF-γ.
Используют анализ по методу проточной цитометрии для выявления INF-γ, продуцируемых CD4+ T-клетками. Метод на основе флуоресцентного сортировщика активированных клеток (FACS-анализ) известен специалистам в данной области. Вкратце, процедура состоит в том, что готовят растворы спленоцитов в концентрации 2,5×106 клеток/мл и распределяют в отдельные пробирки по 2 мл на образец. Образцы подвергают стимуляции антигеном и инкубируют при температуре 37°C в контролируемых условиях окружающей среды в течение 5 часов. Затем образцы промывают и окрашивают с последующим измерением на стандартном счетчике FACS.
Был использован стандартный метод ИФТФА, известный специалистам в данной области, для определения титра специфических антител в сыворотке крови, отобранной у животного перед умерщвлением.
Пример 1.1.: Поверхностный рекомбинантный антиген гепатита B (HBsAg) adw
Ниже, в таблице 6 представлены результаты тестирования по методу ELISPOT, проводимого для определения количества клеток, продуцирующих INF-γ, IL-2 и IL-4, с использованием поверхностного рекомбинантного белкового антигена вируса гепатита B (HBsAg), тип adw. В таблице 6 (см. также фиг.1, 2 и 3) приведены результаты измерения по методу ELISPOT, то есть количество спот-формирующих клеток, что в свою очередь представляет непосредственную меру числа клеток, продуцирующих цитокин.
Четкое увеличение числа спот-формирующих клеток при добавлении адъюванта PIKA (в сравнении с вариантом добавления одного антигена) указывает на то, что добавление адъюванта PIKA к поверхностному рекомбинантному антигену вируса гепатита B усиливает экспрессию цитокинов INF-γ, IL-2 и IL-4 культивируемыми клетками селезенки. Наблюдаемая экспрессия цитокинов указывает на то, что при наличии адъюванта PIKA индуцируется усиленный адаптивный иммунный ответ и гуморального, и клеточного звена иммунитета.
Выявление по методу ELISPOT мышиных спленоцитов, продуцирующих цитокины после иммунизации вакцинами, содержащими PIKA и/или HBsAg adw
4 мкг
Стимуляция с использованием HBsAg, 2,0 мкг/мл; Единица: спот-формирующие клетки спленоцитов
Результаты тестирования по методу ИФТФА образца крови, отобранного перед умерщвлением животных (приведенные ниже в таблице 7 и на фиг.4), демонстрируют, что наличие PIKA существенно усиливает иммунный ответ, который показан в таблице в виде титров специфических антител, выявленных в сыворотке крови.
Выявление по методу ИФТФА титров специфических IgG в мышиной сыворотке после иммунизации вакцинами, содержащими PIKA и/или HBsAg adw
Полученные результаты демонстрируют, что добавление адъюванта PIKA усиливает общий иммунный ответ на HBsAg, в частности специфический иммунный ответ, более конкретно, адаптированный иммунитет и, еще более конкретно, сдвиг иммунного ответа в сторону доминирования Th1 и усиления клеточного звена иммунитета.
Пример 1.2: VAXIGRIP (Sanofi Pasteur), инактивированный и очищенный антиген гриппа, включающий: H1N1, H3N2-подобные штаммы и штамм b/Shanghai5/361/2002
Ниже, в таблице 8 показаны результаты тестирования по методу ELISPOT, проводимого для определения количества клеток, продуцирующих INF-γ, IL-2 и IL-4, с использованием вакцины VAXIGRIP, представляющей собой вакцину на основе инактивированного субъединичного вируса гриппа человека, производимую компанией Sanofi Pasteur. Приведенные в таблице 8 данные (см. также фиг.5, 6 и 7) отражают результаты измерения по методу ELISPOT, то есть число спот-формирующих клеток, и представляет собой непосредственную меру продукции цитокинов.
Четкое повышение числа спот-формирующих клеток при добавлении адъюванта PIKA (в сравнении с вариантом использования одного антигена) указывает на то, что добавление адъюванта PIKA к антигену гриппа усиливает экспрессию цитокинов INF-γ, IL-2 и IL-4 культивируемыми клетками селезенки. Наблюдаемая экспрессия цитокинов указывает на усиленный адаптивный иммунный ответ и гуморального, и клеточного звена иммунитета, индуцированного присутствием адъюванта PIKA.
Выявление по методу ELISPOT мышиных спленоцитов, продуцирующих цитокины после иммунизации вакцинами, содержащими PIKA и/или инактивированный субъединичный антиген вируса гриппа
PIKA 50 мкг
Результаты тестирования по методу ИФТФА образца крови, взятого перед умерщвлением животных (приведенные ниже в таблице 9 и фиг.8), показывают, что наличие PIKA существенно усиливает иммунный ответ, который оценивают в виде титра специфических антител, выявленных в сыворотке.
Определение по методу ИФТФА титров специфических IgG в мышиной сыворотке после иммунизации вакцинами, содержащими PIKA, и/или инактивированными субъединичными противогриппозными вакцинами
PIKA 50 мкг
Из приведенного эксперимента был сделан вывод, что добавление адъюванта PIKA усиливает общий иммунный ответ на антиген гриппа, в частности, специфический иммунный ответ, более конкретно, адаптивный иммунный ответ и, еще более конкретно, клеточный иммунный ответ.
VAXIGRIP представляет собой разрешенную противогриппозную вакцину, которая в значительной мере снижает риск заражения гриппом. Добавление PIKA повышает уровень продуцируемых цитокинов, и это указывает на то, что вакцина, содержащая VAXIGRIP и PIKA, также проявляет иммунный ответ, который существенно снижает риск заражения гриппом.
Пример 1.3: Синтезированный пептидный антиген ВИЧ
Ниже, в таблице 10 приведены результаты ELISPOT-тестирования, проводимого для выявления наличия и числа клеток, продуцирующих INF-γ, IL-2 и IL-4, с использованием пептидного антигена ВИЧ. Показанные в таблице 10 данные (см. также фиг.9, 10 и 11) отражают результаты измерения по методу ELISPOT, а именно количество спот-формирующих клеток, что представляет собой непосредственную меру продукции цитокинов.
Явное повышение числа спот-формирующих клеток при добавлении адъюванта PIKA (в сравнении с вариантом использования одного антигена) указывает на то, что добавление адъюванта PIKA к ВИЧ антигену повышает экспрессию цитокинов INF-γ, IL-2 и IL-4 культивируемыми клетками селезенки. Наблюдаемая экспрессия цитокинов указывает на усиленный адаптивный иммунный ответ и гуморального, и клеточного звена иммунитета, индуцированного присутствием адъюванта PIKA.
Выявление по методу ELISPOT мышиных спленоцитов, продуцирующих цитокины после иммунизации вакцинами, содержащими PIKA и/или антиген ВИЧ gp 120
3 мкг+ PIKA 100 мкг
3 мкг
4 мкг/мл
Результаты FACS-анализа показаны ниже в таблице 11 (см. также фиг.12). Наличие CD4+ Т-клеток, экспрессирующих INF-γ, только в композициях, содержащих и PIKA, и ВИЧ антиген, подтверждают тот факт, что адаптивный иммунный ответ достигает стадии иммунокомпетентности и что PIKA является инструментом в данном процессе.
Анализ по методу FACS мышиных спленоцитов после иммунизации вакцинами, содержащими PIKA и/или антиген ВИЧ gp 120
Из приведенного эксперимента был сделан вывод, что добавление адъюванта PIKA с ВИЧ антигеном усиливает общий иммунный ответ, в частности специфический иммунный ответ, более конкретно, адаптивный иммунный ответ и, еще более конкретно, клеточный иммунный ответ.
Пример 1.4: Рекомбинантный защитный антиген сибирской язвы (rPA) (Bacillus Anthracis)
Ниже, в таблице 12, приведены результаты ELISPOT-тестирования, проводимого для выявления наличия INF-γ, IL-2 и IL-4, с использованием рекомбинантного возбудителя сибирской язвы. Показанные в таблице 12 данные (см. также фиг.13, 14 и 15) отражают результаты измерения по методу ELISPOT, а именно количество спот-формирующих клеток, что представляет собой непосредственную меру продукции цитокинов.
Выраженное повышение числа спот-формирующих клеток при добавлении адъюванта PIKA (в сравнении с вариантом использования одного антигена) указывает на то, что добавление адъюванта PIKA к сибироязвенному антигену повышает экспрессию цитокинов INF-γ, IL-2 и IL-4 культивируемыми клетками селезенки. Наблюдаемая экспрессия цитокинов указывает на усиленный адаптивный иммунный ответ, применительно как к гуморальному, так и к клеточному иммунитету, индуцированный в присутствии адъюванта PIKA.
Выявление по методу ELISPOT мышиных спленоцитов, продуцирующих цитокины, после иммунизации вакцинами, содержащими PIKA и/или сибироязвенный антиген rPA
100 мкг
Единицы: спот-формирующие клетки спленоцитов
Результаты FACS-анализа представлены ниже в таблице 13 (см. также фиг.16). Присутствие CD4+ T-клеток, экспрессирующих INF-γ, только в композициях, содержащих и PIKA, и антиген rPA, подтверждает тот факт, что адаптивный иммунный ответ достигает стадии иммунокомпетентности и что PIKA является инструментом в этом процессе.
Анализ по методу FACS мышиных спленоцитов после иммунизации вакцинами, содержащими PIKA и/или сибироязвенный антиген rPA
3 мкг+ PIKA 100 мкг
3 мкг
Результаты тестирования по методу ИФТФА образца крови, взятого перед умерщвлением животных (приведенная ниже таблица 14 и фиг.16 и 17), указывают на то, что присутствие PIKA существенно повышает иммунный ответ, который оценивают в виде титра специфических антител, выявленных в сыворотке.
Соответствующий результат был получен через 16 недель после первоначальной вакцинации, когда образцы крови от мышей из исходных групп А и B оценивали с точки зрения наличия специфических антител по процедуре стандартного теста ИФТФА. И в этом случае наличие PIKA вместе с антигеном сибирской язвы также индуцирует значительно более высокий иммунный ответ, оцениваемый по титру специфических антител в сыворотке крови.
Определение по методу ИФТФА титров специфических IgG в мышиной сыворотке после иммунизации вакцинами, содержащими PIKA и/или сибироязвенный антиген rPA
Из приведенного эксперимента был сделан вывод, что добавление адъюванта PIKA усиливает общий иммунный ответ на rPA, в частности специфический иммунный ответ, более конкретно, адаптивный иммунитет и, еще более конкретно, клеточный иммунный ответ.
Пример 1.5: Антиген рекомбинантного вируса Herpes Simplex 2 gD
Ниже, в таблице 15, приведены результаты ELISPOT-тестирования, проводимого для выявления наличия INF-γ, IL-2 и IL-4, с использованием антигена рекомбинантного вируса Herpes Simplex. В таблице 15 (см. также фиг.19, 20 и 21) приведены результаты измерения по методу ELISPOT, то есть количество спот-формирующих клеток, что представляет собой непосредственную меру продукции цитокинов.
Выраженное увеличение количества спот-формирующих клеток при добавлении адъюванта PIKA (в сравнении с вариантом использования одного антигена) указывает на то, что добавление адъюванта PIKA к антигену вируса Herpes Simplex повышает экспрессию цитокинов INF-γ, IL-2 и IL-4 культивируемыми клетками селезенки. Наблюдаемая экспрессия цитокинов указывает на усиленный адаптивный иммунный ответ, применительно как к гуморальному, так и к клеточному иммунитету, индуцированный в присутствии адъюванта PIKA.
Выявление по методу ELISPOT мышиных спленоцитов, продуцирующих цитокины после иммунизации вакцинами, содержащими PIKA и/или антиген вируса HSV 2 gD
Единицы: спот-формирующие клетки спленоцитов
Результаты FACS-представлены ниже в таблице 16 (см. также фиг.22). Присутствие CD4+ T-клеток, экспрессирующих INF-γ, только в композициях, содержащих и PIKA, и HSV антиген, подтверждает тот факт, что адаптивный иммунный ответ достигает стадии иммунокомпетентности и что PIKA является инструментом в этом процессе.
FACS-анализ мышиных спленоцитов после иммунизации вакцинами, содержащими PIKA и/или HSV2-gD антиген
Результаты тестирования по методу ИФТФА образца крови, взятого перед умерщвлением животных (приведенная ниже таблица 17 и фиг.23), указывают на то, что присутствие PIKA существенно повышает иммунный ответ, который оценивают в виде титра специфических антител, выявленных в сыворотке.
Определение по методу ИФТФА титров специфических IgG у мышей после иммунизации вакцинами, содержащими PIKA и/или HSV2-gD вакцинами
Из приведенного эксперимента был сделан вывод, что добавление адъюванта PIKA усиливает общий иммунный ответ на HSV антиген, в частности, специфический иммунный ответ, более конкретно, адаптивный иммунитет и, еще более конкретно, клеточный иммунный ответ.
Пример 1.6: Антиген инактивированного полного вируса H5N1 (Avian Influenza)
Ниже, в таблице 18 приведены результаты ELISPOT-тестирования, проводимого для выявления наличия INF-γ, IL-2 и IL-4, с использованием инактивированного неочищенного антигена H5N1. В таблице 18 (см. также фиг.24, 25 и 26) приведены результаты измерения по методу ELISPOT, то есть количество спот-формирующих клеток, что представляет собой непосредственную меру продукции цитокинов.
Выраженное повышение числа спот-формирующих клеток при добавлении адъюванта PIKA (в сравнении с вариантом использования одного антигена) указывает на то, что добавление адъюванта PIKA к антигену H5N1 повышает экспрессию цитокинов INF-γ, IL-2 и IL-4 культивируемыми клетками селезенки. Наблюдаемая экспрессия цитокинов указывает на усиленный адаптивный иммунный ответ, применительно как к гуморальному, так и к клеточному иммунитету, индуцированный в присутствии адъюванта PIKA.
Определение по методу ELISPOT мышиных спленоцитов, продуцирующих цитокины, после иммунизации вакцинами, включающими PIKA и/или инактивированный антиген H5N1
Результаты FACS-анализа представлены ниже в таблице 19 (см. также фиг.27). Наличие CD4+ T-клеток, экспрессирующих INF-γ, только в композициях, содержащих и PIKA, и H5N1 антиген, подтверждает тот факт, что адаптивный иммунный ответ достигает стадии иммунокомпетентности и что PIKA является инструментом в этом процессе.
FACS-анализ мышиных спленоцитов после иммунизации вакцинами, содержащими PIKA и/или инактивированный H5N1 антиген
Результаты тестирования по методу ИФТФА образца крови, взятого перед умерщвлением животных (приведенная ниже таблица 20 и фиг.28), указывают на то, что присутствие PIKA существенно повышает иммунный ответ, который оценивают в виде титра специфических антител, выявленных в сыворотке.
Определение по методу ИФТФА титров специфических IgG в мышиной сыворотке после иммунизации вакцинами, содержащими PIKA и/или инактивированный H5N1 антиген
Из приведенного эксперимента был сделан вывод, что добавление адъюванта PIKA усиливает общий иммунный ответ на антиген H5N1, в частности, специфический иммунный ответ, более конкретно, адаптивный иммунитет и, еще более конкретно, клеточный иммунный ответ.
Пример 2: Инактивированный антиген полного вируса ТОРС (SARS)
Целью данного эксперимента является продемонстрировать тот факт, что добавление PIKA к SARS антигену усиливает иммунный ответ, стимулируя иммунную систему организма хозяина для продукции защитных SARS-специфических антител.
В рамках данной программы исследования используют шесть экспериментальных групп мышей Balb/c, по 4 животных в каждой группе, и указанным животным инокулируют (путем перитонеальной инъекции) сочетание антигена SARS, антиген плюс PIKA (гетерогенная композиция молекул PIKA, в которой преобладают молекулы с весом в диапазоне от 66 кДа до 1200 кДа), один PIKA или контроль, см. приведенную ниже таблицу 21 (см. также фиг.29).
Животным в каждой группе вводят идентичные дозы в дни 0, 14 и 28. На шестую неделю у животных отбирают образец крови и в сыворотке определяют IgG, который представляет собой меру наличия специфических антител против данного заболевания. Сыворотку крови разбавляют в 16000 раз и определяют наличие IgG с использованием счетчика для ИФТФА, в соответствии с процедурой, известной специалистам в данной области. Результатом измерения является оптическая плотность (ОП) и чем больше это значение, тем выше уровень IgG.
Среднее значение результата для каждой группы, показанное в таблице 21, демонстрирует наличие корреляции между присутствием адъюванта PIKA и повышением экспрессии IgG.
Определение по методу ИФТФА титров специфических IgG в мышиной сыворотке после иммунизации вакцинами, включающими PIKA и/или полный инактивированный антиген SARS
Из приведенного эксперимента был сделан вывод, что присутствие PIKA вместе с антигеном SARS повышает экспрессию IgG в зависимом от дозы режима, усиливая тем самым общий иммунный ответ организма хозяина.
Пример 3: Вакцина PIKA обеспечивает иммунную защиту против инфекции H5N1 и H9N2
Целью данного эксперимента является продемонстрировать тот факт, что вакцина против птичьего гриппа, включающая адъювант PIKA, способна защитить кур от инфекции живым вирусом птичьего гриппа.
Исследования проводились на двух группах, каждая из которых включала 24 SPF цыплят. В десятидневном возрасте птицам инокулировали подкожно в область шеи дозу вакцины в 700 мкл, включающей PIKA (гетерогенная композиция молекул PIKA, в которой преобладают молекулы с весом в диапазоне от 66 кДа до 660 кДа) и два штамма птичьего гриппа (H5N1 и H9N2). Композиция включала в себя антиген и адъювант PIKA в соотношении примерно 2:1, антиген к адъюванту PIKA.
Образцы крови отбирали из области под крылом в дни 7, 14 и 21. Сыворотку крови каждой птицы тестировали на наличие специфических антител против Н5 и H9.
На 21 день проводили провокацию исследуемых птиц с использованием живого вируса H5N1 и затем наблюдали птиц еще в течение 14 дней. Регистрировали уровень выживания цыплят после 14-дневной экспозиции с живым вирусом H5N1.
Среднее значение результата для каждой группы (таблица 22, см. также фиг.30 и 31) указывает на то, что присутствие PIKA индуцирует продукцию специфических антител против указанного антигена.
Определение по методу ИФТФА титров специфических антител в сыворотке крови цыплят после иммунизации вакцинами, включающими PIKA и/или инактивированный антиген H5N1 и H9N2
Единицы: Оптическая плотность, полученная при анализе по методу ИФТФА
Из 24 цыплят, которые были вакцинированы композицией антиген/PIKA, выжили 21 (83%) на 14 день после экспозиции с живым вирусом H5N1. В контрольной группе из 24 цыплят, которые не получали вакцины, но которые контактировали с живым вирусом H5N1, выжили только 4 (17%) через 14 дней.
Был сделан вывод, что вакцина PIKA создает выраженную иммунную защиту против вируса H5N1.
Пример 4: PIKA вакцина обеспечивает иммунную защиту против инфекции вирусом бешенства
Целью данного эксперимента является продемонстрировать тот факт, что вакцина против бешенства, включающая в себя адъювант PIKA, также способна создавать защиту против вируса бешенства.
В эксперимент были включены четыре группы (обозначенные как i, ii, iii и iv), в каждой по 20 мышей Balb/c SPF Kunming, которым проводили провокацию с использованием 100 мкл вируса бешенства штамм дикого типа CQ92. В каждой группе животных инокулировали разными типами вакцин: i) композицию PIKA (гетерогенную композицию молекул PIKA с преимущественным содержанием молекул с весом в диапазоне от 66 кДа до 660 кДа), и активированный очищенный антиген в клетках почки хомяка в соотношении 1:4, по объему; ii) вакцину Sanofi-Aventis' на основе клеток Veroab vero с инактивированным вирусом бешенства; iii) вакцину на основе очищенных клеток почки хомяка с инактивированным вирусом бешенства и адъювантом в виде квасцов; и iv) контрольной фосфатно-буферный раствор. После инфекции, проведенной путем подкожной инъекции, вводят в бедро 60 мкл вакцины через 30-40 минут, через 3 дня, 6 дней и 9 дней.
В таблице 23 показаны данные по уровню выживания в каждой из исследованных групп (см. также. фиг.32).
Длительность выживания мышей, контактировавших с вирусом бешенства дикого типа, которым впоследствии вводили вакцину против бешенства
Был сделан вывод, что PIKA значительно усиливает иммунную защиту, создаваемую инактивированным очищенным вирусом бешенства антигеном в клетках почки хомяка.
Пример 5: PIKA-содержащая вакцина против гепатита B индуцирует продукцию специфических антител в сыворотке
Протокол проведения данного эксперимента включал вакцинацию подкожной инъекцией мышей Balb/c из трех групп (по три мыши на группу) композициями, включающими: для группы А - 4 мкг только поверхностного антигена против гепатита B, adw; для группы B - 4 мкг антигена с 75 мкг адъюванта PIKA (гетерогенная композиция молекул PIKA, включающая молекулы с преимущественным распределением веса в диапазоне примерно от 66 кДа до 1200 кДа) и для группы С - 100 мкг одного PIKA.
Через десять-четырнадцать дней после первоначальной инъекции мышам вводят идентичную бустерную вакцину путем подкожной инъекции. Через десять-четырнадцать дней после бустерной инъекции отбирают образец крови и тестируют на наличие титров специфических антител в рамках стандартного теста по методу ИФТФА, известного специалистам в данной области.
Среднее значение результатов для каждой группы, показанное ниже в таблице 24 (на фиг.33), указывает на то, что присутствие PIKA усиливает иммунный ответ на антиген гепатита B, по данным определения титра специфических антител в образце сыворотки.
Определение по методу ИФТФА титров специфических антител в мышиной сыворотке после иммунизации вакцинами, включающими PIKA и/или HBsAg adw
Из приведенного эксперимента был сделан вывод, что иммуногенное вещество, включающее PIKA и антиген гепатита B, индуцирует генерирование выраженного иммунного ответа, по данным определения титра специфических антител в сыворотке крови.
Пример 6: PIKA-содержащая противогриппозная вакцина индуцирует продукцию специфических антител в сыворотке
Протокол проведения данного эксперимента включал вакцинацию подкожной инъекцией мышей Balb/c в двух группах (по три мыши на группу) композициями, включающими: для группы А - 4 мкг одной противогриппозной вакцины Sanofi VAXIGRIP, для группы B - 4 мкг антигена со 100 мкг адъюванта PIKA (гетерогенная композиция молекул PIKA с преимущественным содержанием молекул с весом в диапазоне от 66 кДа до 1200 кДа).
Через двадцать дней после первоначальной инъекции мышам вводят идентичную бустерную вакцину путем подкожной инъекции. На 35 день после исходной вакцинации отбирают образец крови и тестируют на наличие титров специфических антител в рамках стандартного теста по методу ИФТФА, известного специалистам в данной области.
Среднее значение результатов для каждой группы, показанное ниже в таблице 25 (на фиг.34), указывает на то, что присутствие PIKA усиливает иммунный ответ на антигены противогриппозной вакцины, по данным измерения титра специфических антител в образце сыворотке.
Определение по методу ИФТФА титров специфических антител в мышиной сыворотке после иммунизации вакцинами, включающими PIKA и/или инактивированный субъединичный антиген гриппа
Из приведенного эксперимента был сделан вывод, что иммуногенное вещество, включающее PIKA и антиген вируса гриппа, индуцирует генерирование выраженного иммунного ответа, по данным определения титра специфических антител в сыворотке крови.
Пример 7: PIKA-содержащая вакцина против гепатита B (поверхностный антиген, тип adw) индуцирует терапевтический иммунный ответ
Протокол проведения данного эксперимента включал инокуляцию 6-10-недельным мышам Balb/c, по четыре в группе, композициями коммерчески доступного HBsAg, тип adw, при наличии или в отсутствие адъюванта PIKA (гетерогенная композиция с преимущественным содержанием молекул с весом в диапазоне от 66 кДа до 1200 кДа), только PIKA и контроль, включающий фосфатно-буферный раствор (ФБР).
Мышей примируют подкожной инъекцией с обеих сторон спины, по 100 мкл с каждой стороны. Фактически вводимые дозы указаны ниже в таблице. Через двадцать один день после первоначальной инъекции мышам вводят идентичную бустерную вакцину. На сорок второй день отбирают образец крови, мышей умерщвляют и отбирают образцы тканей из селезенки для тестирования.
Тесты по методу ELISPOT проводят для определения количества антиген-специфических Т-клеток, секретирующих интерферон γ. Образец спленоцитов от каждой мыши стимулируют ex vivo CD8 T-клеточным пептидным эпитопом из HBsAg (IPQSLDSWWTSL) в концентрации 5 мкг/мл для определения наличия IPQSLDSWWTSL-специфических CD8+ клеток.
Второй образец спленоцитов рестимулируют ex vivo в течение шести дней с использованием 2 мкг/мл HBsAg пептида IPQSLDSWWTSL. Проводят тест по методу ELISPOT с использованием 5 мкг/мл HBsAg пептида IPQSLDSWWTSL, в качестве стимулятора ex vivo, для выявления интерферона γ. Данный тест проводят для оценки центрального вторичного клеточного иммунного ответа после иммунизации.
Используют анализ по методу ИФТФА для определения уровня специфических антител против HBV антигена в сыворотке, а именно: антител IgG1 и IgG2a. На планшеты Nunc Immunoplate Maxisorp наносят слой 4deg C с HBsAg (6 мкг/мл в ФБР/0,01% Твин 20) на ночь. Планшеты промывают с использованием ФБР/Твин и блокируют в течение 2 часов при добавлении 5% ФСТ в ФБР. После промывки добавляют разведения сыворотки в ФБР/Твин на 2 часа. После промывки добавляют моноклональное противомышиное антитело IgG1, конъюгированное с биотином, в разведении 1/3000 или моноклональное противомышиное антитело IgG2a, конъюгированное с биотином, в разведении 1/1500. После промывки добавляют стрептавидин-HRP (пероксидаза хрена) (разведение 1/10000 в ФБР/Твин) на 1 час. После промывки добавляют субстрат ABTS с пероксидом водорода (1000:1) на 20 минут. Затем определяют оптическую плотность (ОП) при длине волны 405 нм и регистрируют результаты, вычисляя среднее значение для каждой группы.
IgG1 ответ для мышей, иммунизированных HBsAg в сочетании с адъювантом PIKA, примерно в 5 раз превосходит ответ, полученный для мышей, которых иммунизировали только HBsAg. Титр IgG1 возрастает в зависимом от дозы режиме (таблица 26, фиг.35).
Определение по методу ИФТФА титров специфических IgG1 в мышиной сыворотке после иммунизации вакцинами, включающими PIKA и/или HBsAg
IgG2a ответ для мышей, иммунизированных HBsAg в сочетании с адъювантом PIKA, значительно превышает ответ, полученный для мышей, которых иммунизировали только HBsAg. Титр IgG2a возрастает в зависимом от дозы режиме, указывая на сдвиг иммунного ответа в сторону Th1 (таблица 27, фиг.36).
Определение по методу ИФТФА титров специфических IgG2a в мышиной сыворотке после иммунизации вакцинами, включающими PIKA и/или HBsAg
Анализ по методу ELISPOT при проведении ex vivo специфической стимуляции CD8 пептидным эпитопом, не выявил ответ для мышей, иммунизированных только HBsAg. Тогда как клетки, экспрессирующие интерферон γ, легко выявляются после иммунизации с использованием HBsAg в сочетании с PIKA в зависимом от дозы режиме, что указывает на то, что PIKA усиливает терапевтический иммунный ответ (таблица 28, фиг.37).
Определение по методу ELISPOT мышиных спленоцитов, продуцирующих интерферон γ после иммунизации вакцинами, включающими PIKA и/или HBsAg
5 мкг/мл
5 мкг/мл
Был проведен дополнительный анализ по методу ELISPOT после культивирования спленоцитов в течение шести дней, который показал, что число спленоцитов, продуцирующих интерферон γ, полученных у мышей, вакцинированных композициями, содержащими HBsAg и адъювант PIKA, в два раза превышает число соответствующих спленоцитов, полученных у мышей, которым вводили только HBsAg. Эти результаты подтверждают, что наличие PIKA усиливает активацию центральных клеток памяти (таблица 28, фиг.38).
| название | год | авторы | номер документа |
|---|---|---|---|
| АДЪЮВАНТ НА ОСНОВЕ ПОЛИИНОЗИНОВОЙ КИСЛОТЫ - ПОЛИЦИТИДИЛОВОЙ КИСЛОТЫ | 2005 |
|
RU2383552C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ТЕРАПЕВТИЧЕСКОГО ПРИМЕНЕНИЯ | 2004 |
|
RU2362586C2 |
| Иммуностимулирующие олигонуклеотиды | 2012 |
|
RU2610690C2 |
| ИММУНОСТИМУЛИРУЮЩИЕ ОЛИГОНУКЛЕОТИДЫ | 2009 |
|
RU2477753C2 |
| УЛУЧШЕННЫЙ ИММУНОЛОГИЧЕСКИЙ СОСТАВ | 2012 |
|
RU2664730C2 |
| ВАКЦИНА ПРОТИВ HCV | 2003 |
|
RU2323744C2 |
| КОМПОЗИЦИЯ ОТ БЕШЕНСТВА, СОДЕРЖАЩАЯ АДЪЮВАНТ PIKA | 2014 |
|
RU2678981C2 |
| КОМПОЗИЦИЯ АДЪЮВАНТА, СОДЕРЖАЩАЯ ПОЛИ-ГАММА-ГЛУТАМИНОВУЮ КИСЛОТУ | 2005 |
|
RU2390352C2 |
| ИММУНОГЕННЫЕ КОМПОЗИЦИИ И СПОСОБЫ | 2008 |
|
RU2468034C2 |
| СПОСОБЫ ВАКЦИНАЦИИ ПРОТИВ МАЛЯРИИ | 2003 |
|
RU2356577C9 |
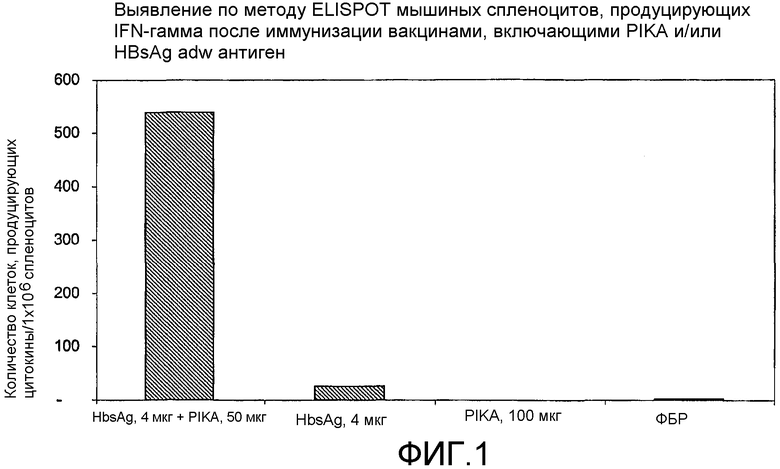

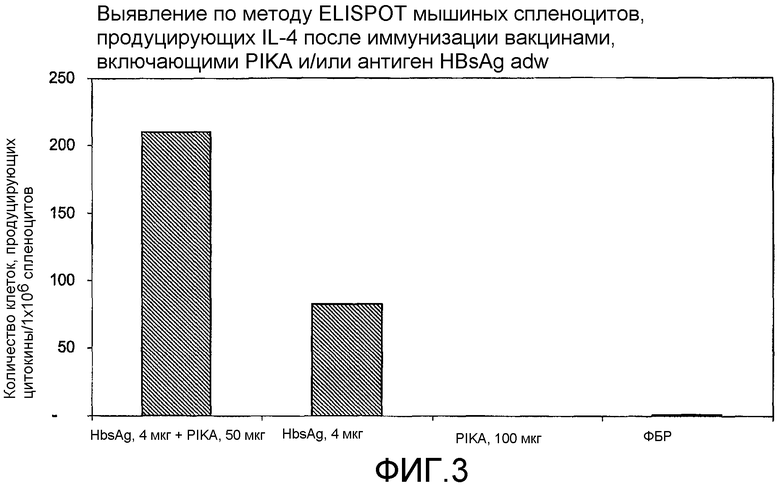
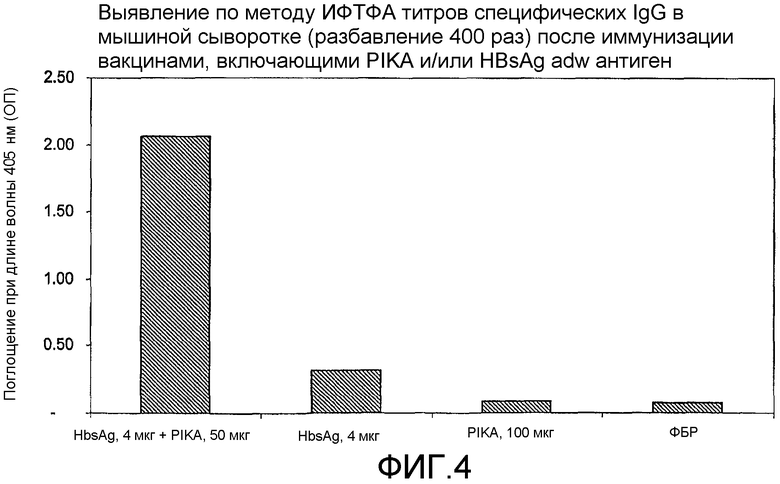
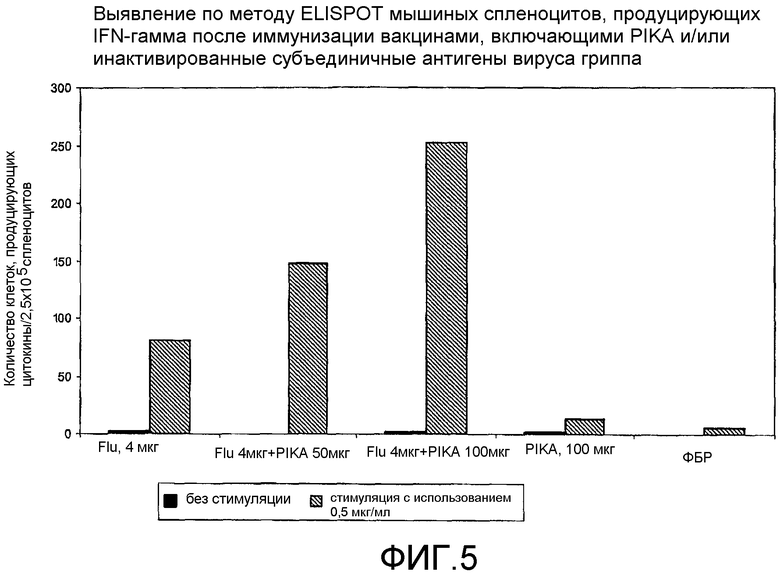
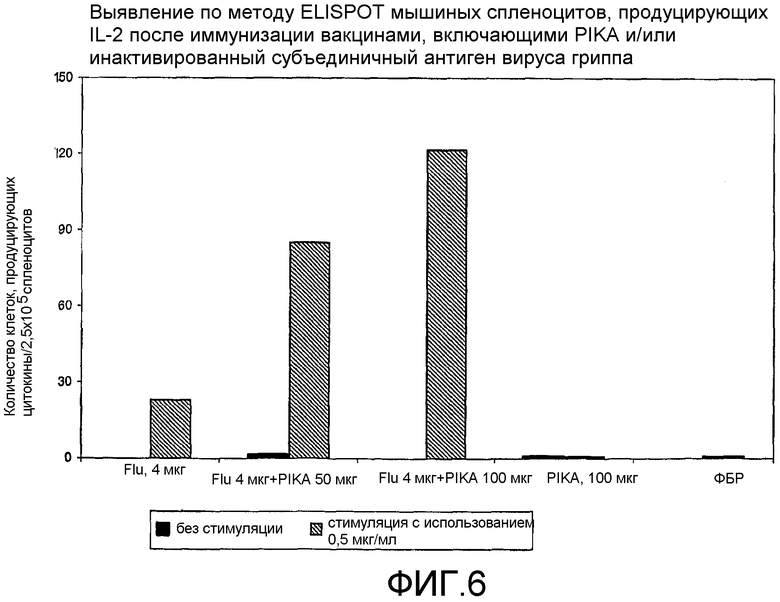
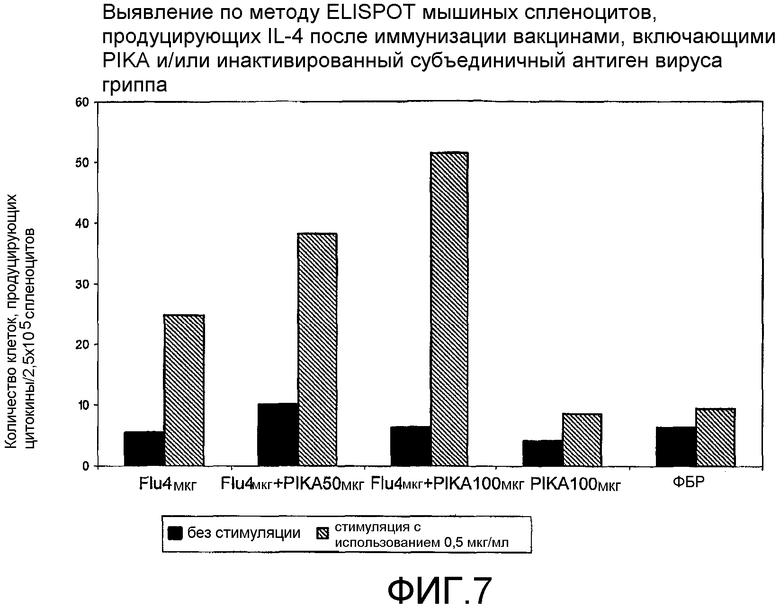
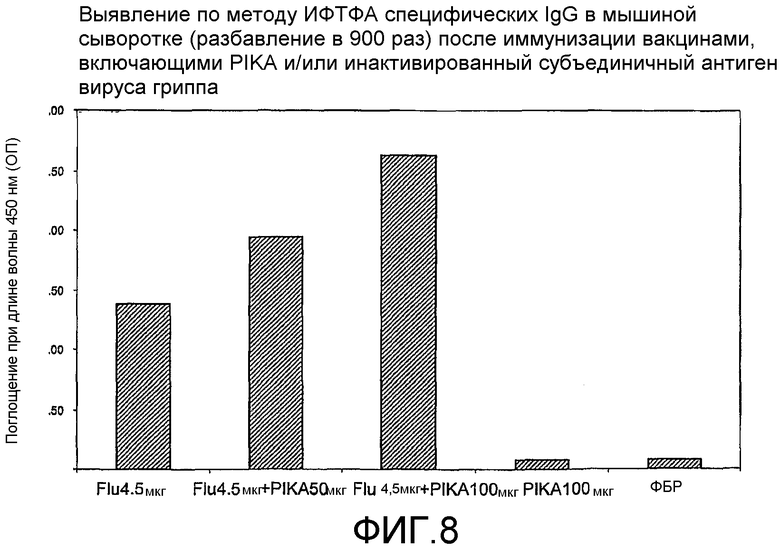
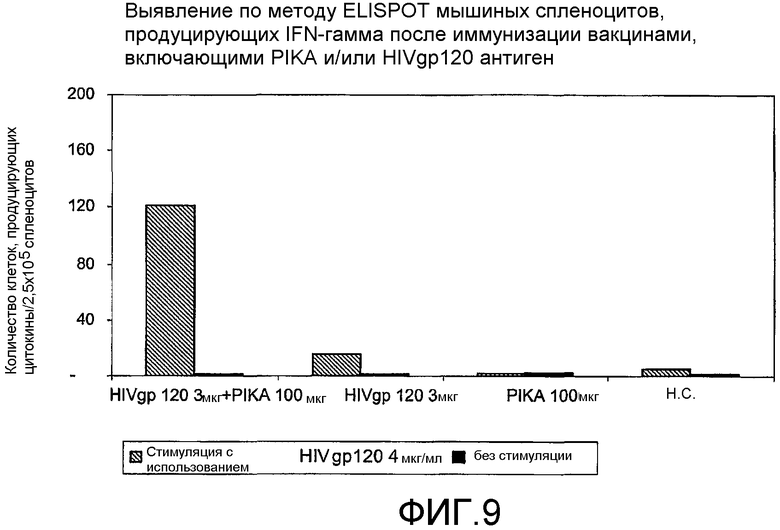
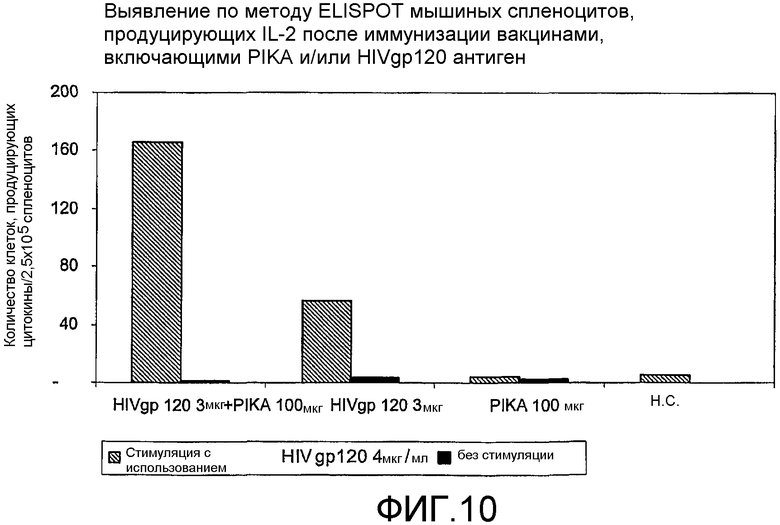
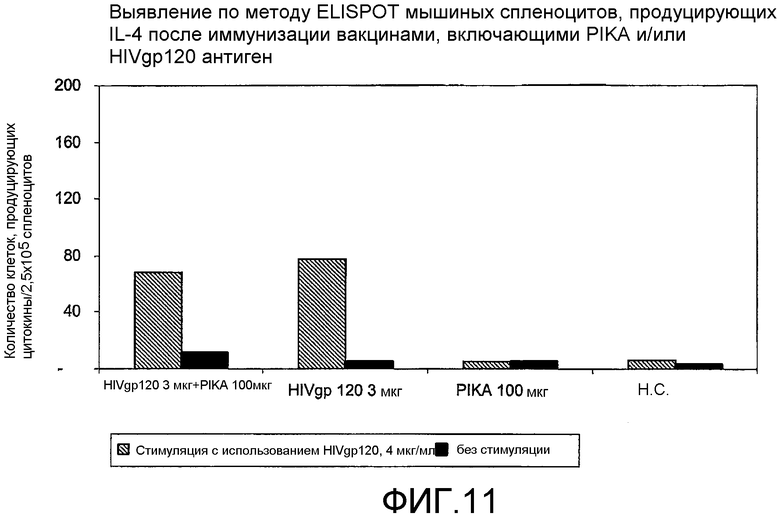
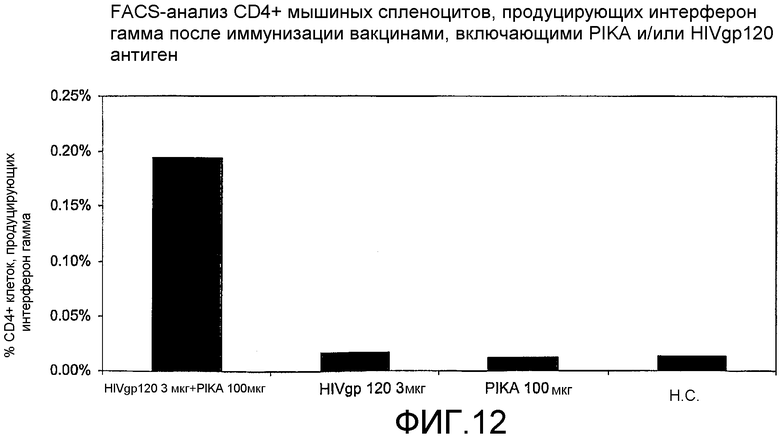

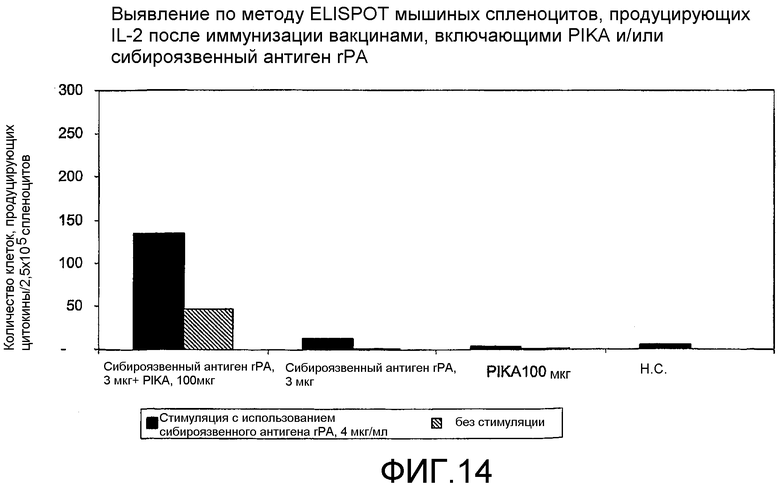
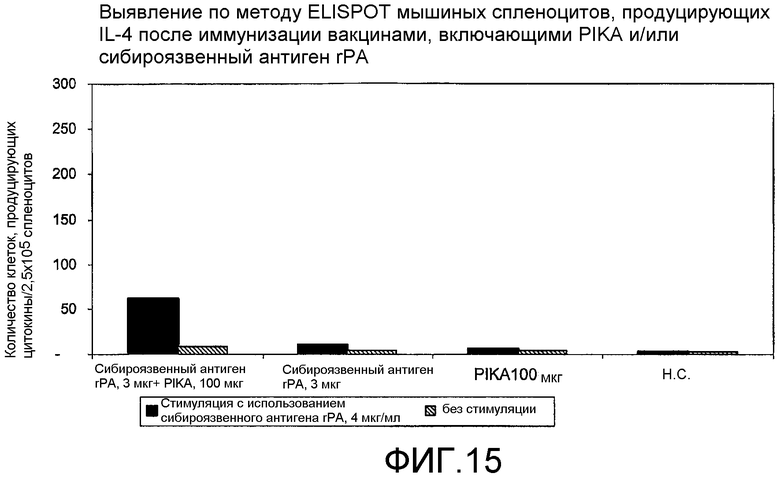
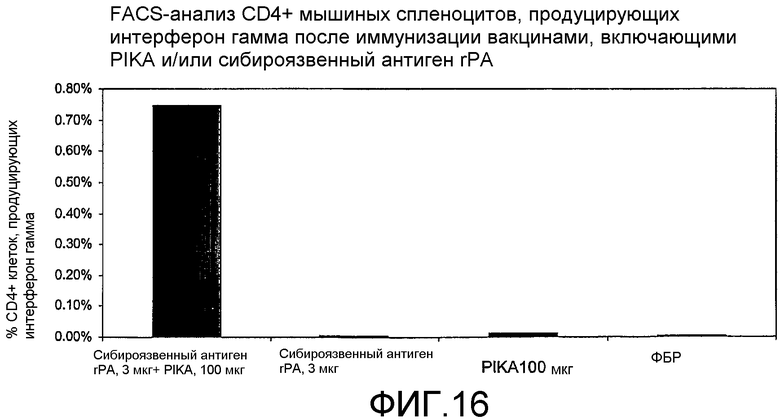
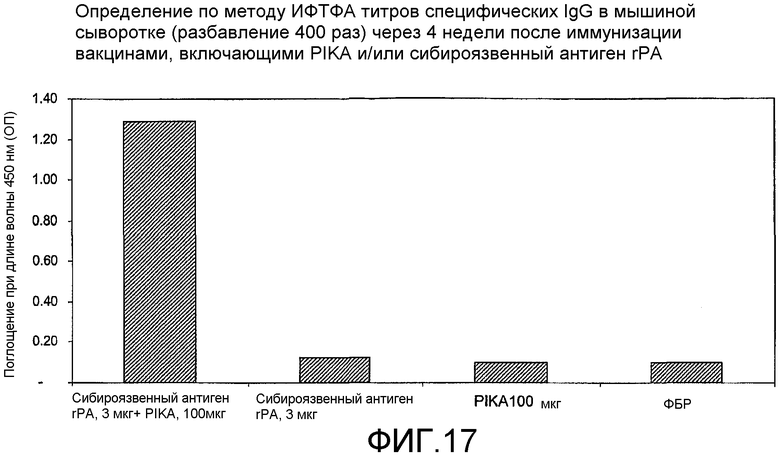

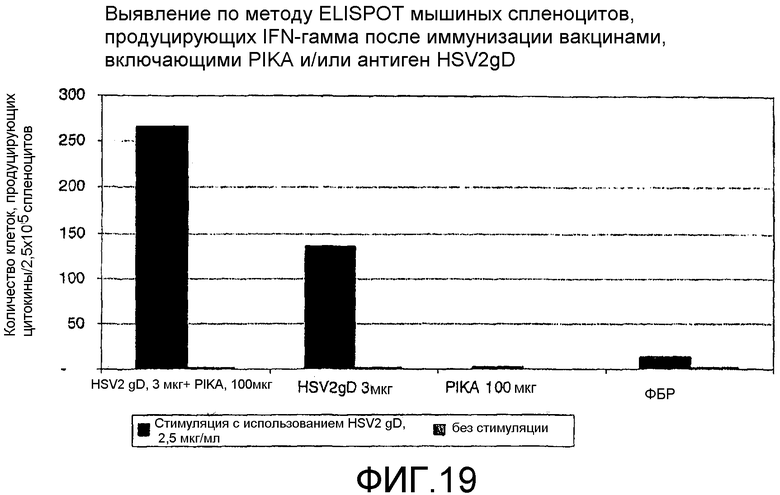
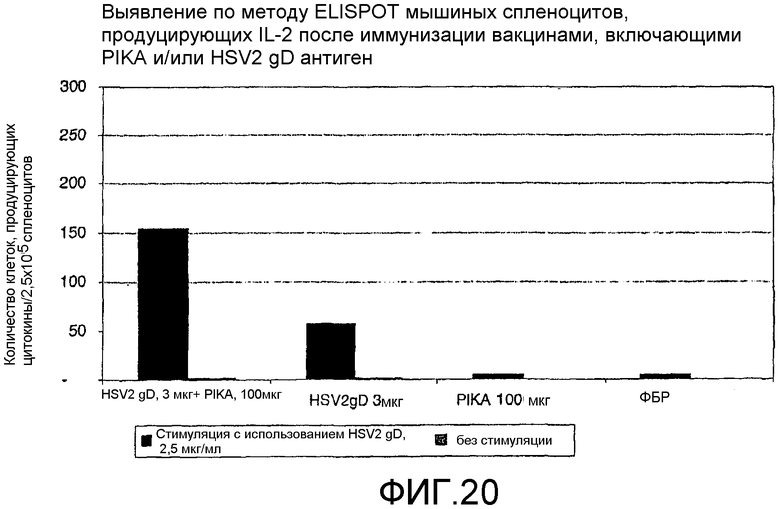
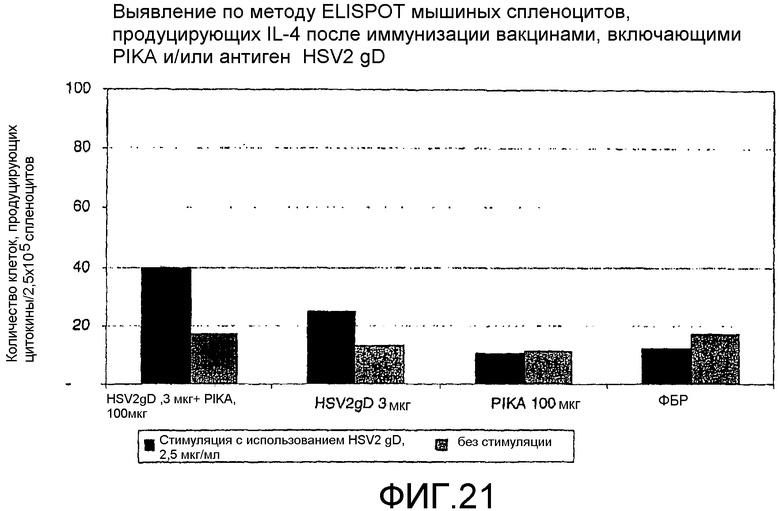
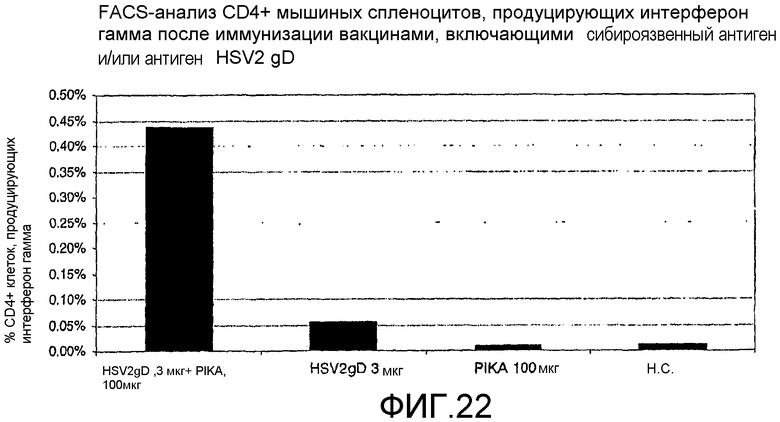

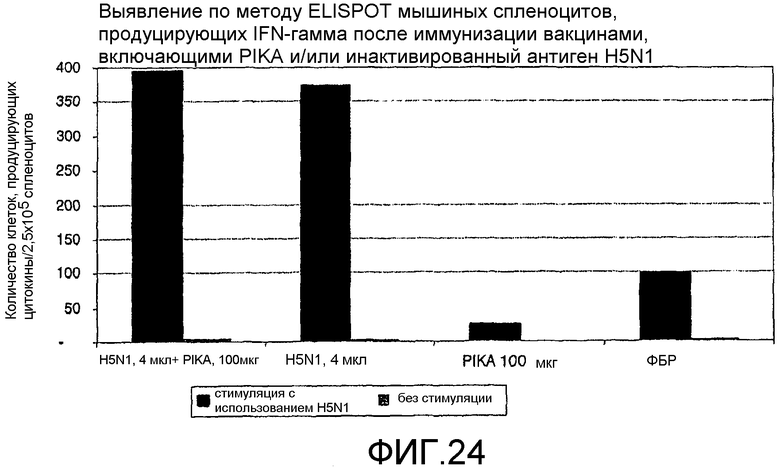
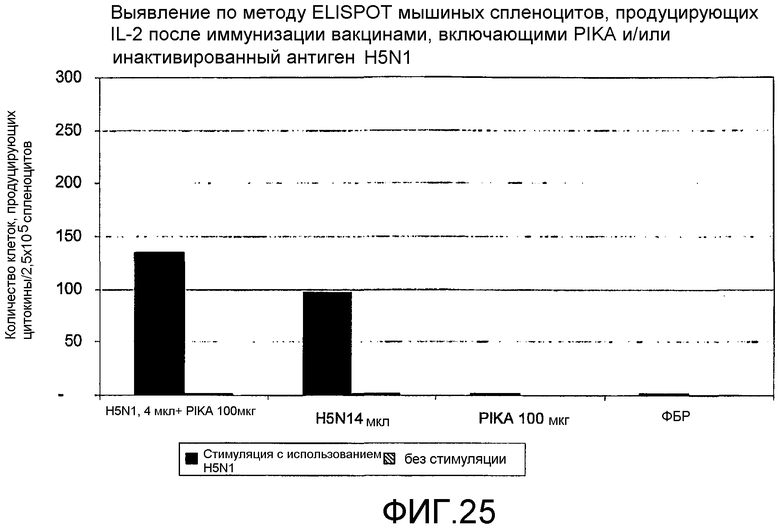
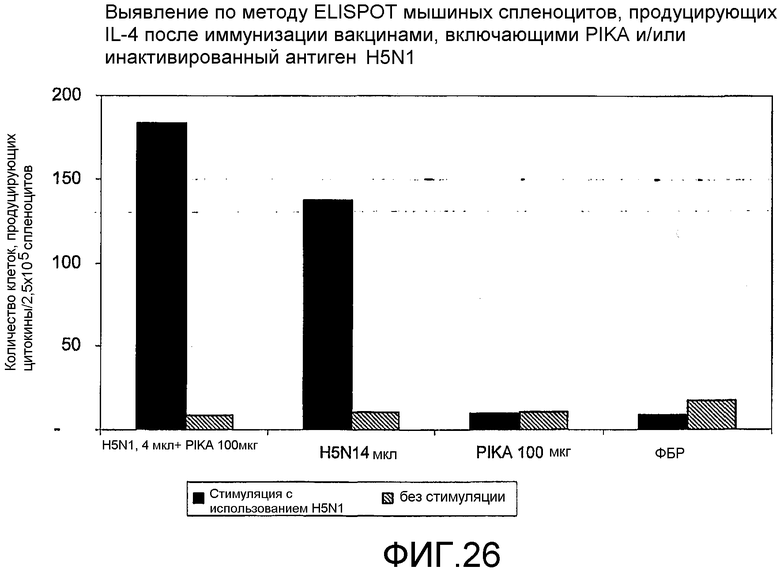

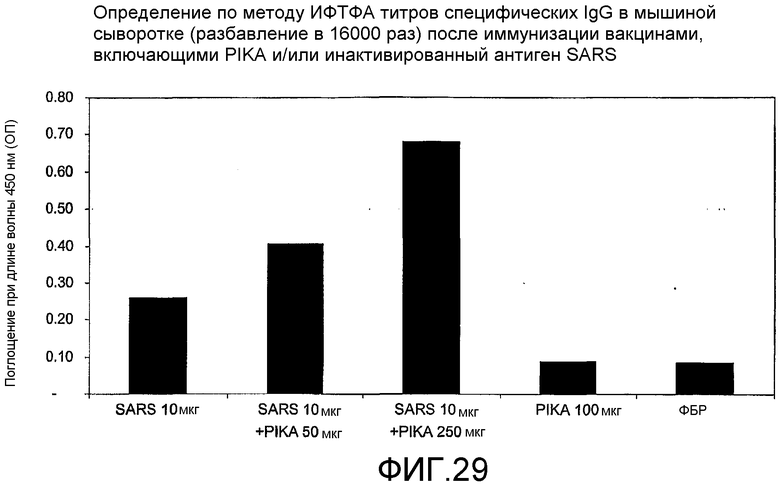

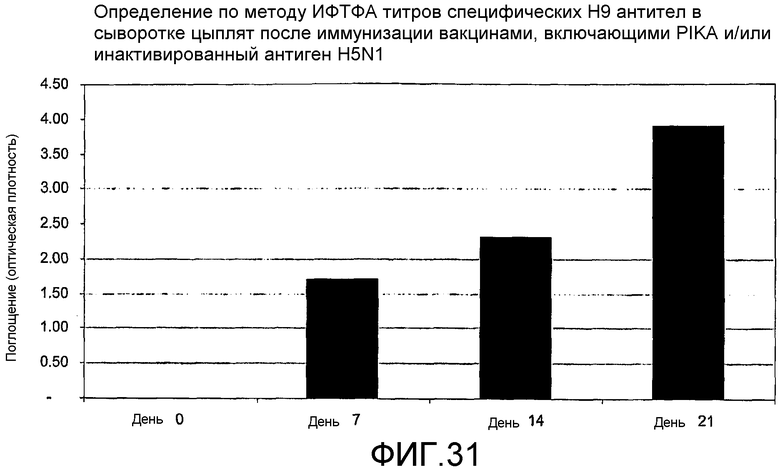
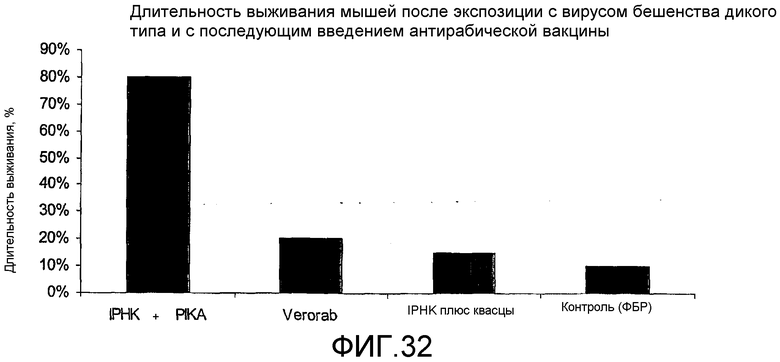
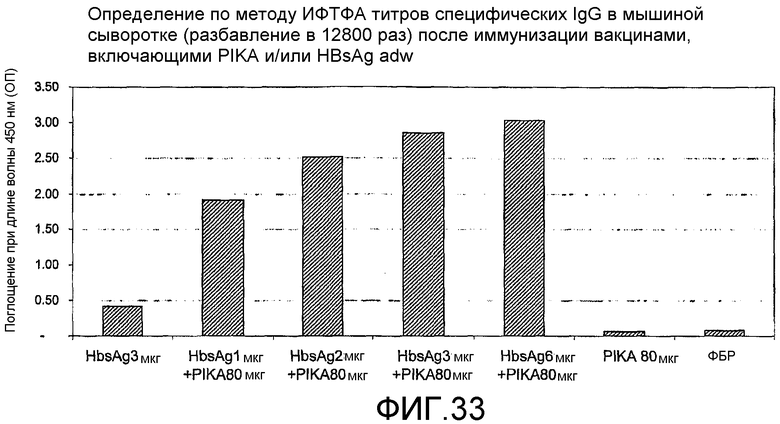
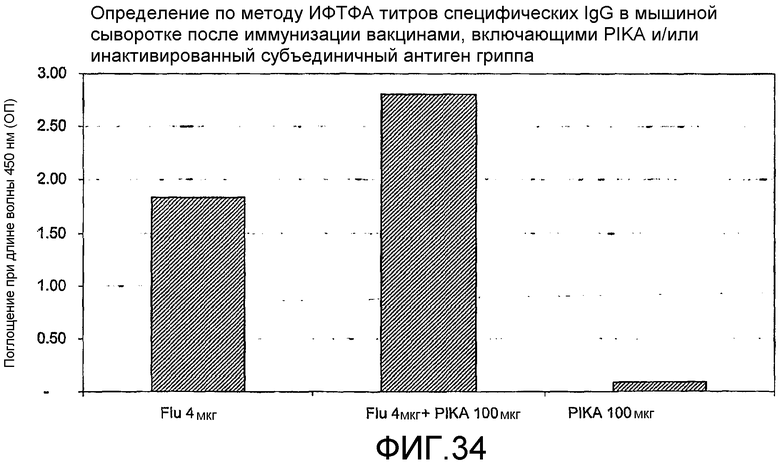
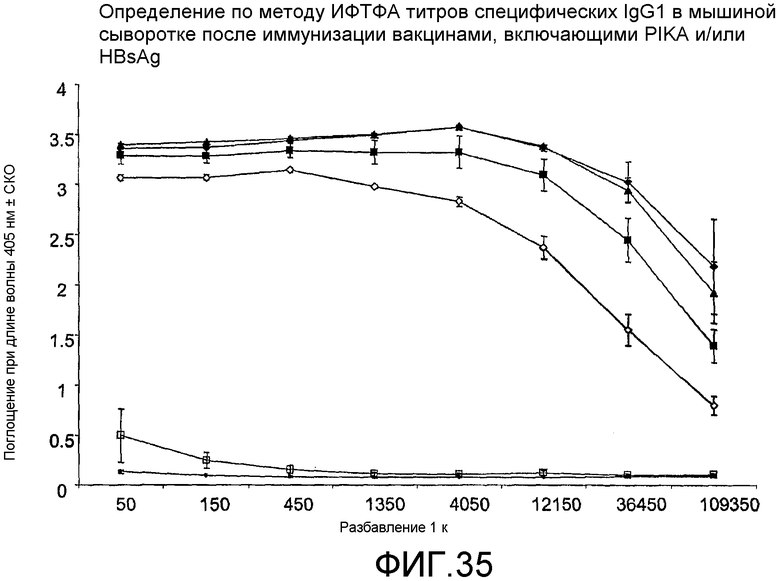
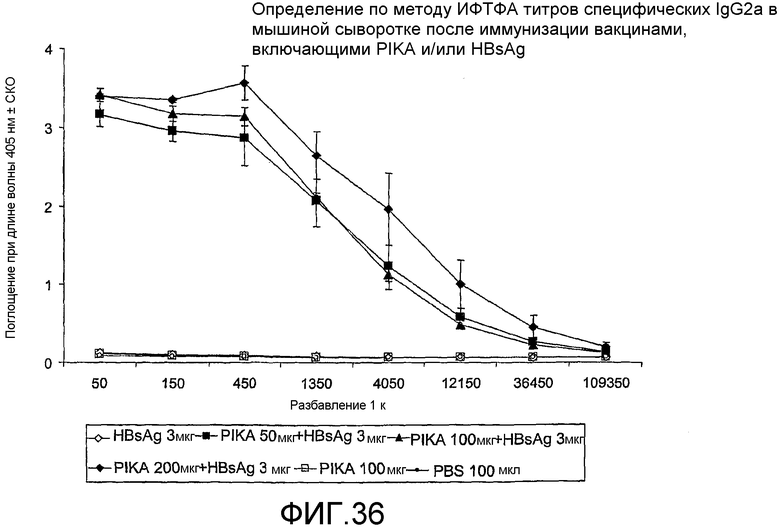


Группа изобретений относится к композиции полинуклеотидного адъюванта (PICKCa) и способам его применения для проявления иммунного ответа. Полинуклеотидный адъювант включает в себя полирибоинозиновую-полирибоцитидиловую кислоту (PIC), где молекулы PIC гетерогенны по молекулярному весу и имеют молекулярный вес от 66000 до 1200000 дальтон, по меньшей мере, один антибиотик и один положительный ион. Изобретение также относится к иммуногенной композиции, включающей полинуклеотидный адъювант вместе с другими иммуногенными композициями, такими как антиген, выбранный из вирусных, бактериальных, грибковых, паразитарных и/или раковых антигенов; также к способам применения таких адъювантных композиций для генерирования иммунного ответа, иммунного ответа слизистой на антигенное соединение. Группа изобретений обеспечивает выработку в организме хозяина специфического для заболевания иммунного ответа. 12 н. и 10 з.п. ф-лы, 38 ил., 28 табл., 7 пр.
1. Иммуногенная композиция, включающая:
(a) полинуклеотидный адъювант, содержащий полирибоинозиновую-полирибоцитидиловую кислоту (PIC), по меньшей мере один антибиотик и по меньшей мере один положительный ион; и
(b) по меньшей мере один вирусный антиген, где указанный антиген представляет собой антиген из coronaviridae, hepadnaviridae, herpesviridae или retroviridae,
где молекулы PIC гетерогенны по молекулярному весу и имеют молекулярный вес от 66000 до 1200000 Да.
2. Иммуногенная композиция, включающая:
(a) полинуклеотидный адъювант, содержащий полирибоинозиновую-полирибоцитидиловую кислоту (PIC), по меньшей мере один антибиотик и по меньшей мере один положительный ион; и
(b) по меньшей мере один бактериальный антиген, где указанный антиген представляет собой антиген из bacillaceae,
где молекулы PIC гетерогенны по молекулярному весу и имеют молекулярный вес от 66000 до 1200000 Да.
3. Иммуногенная композиция, включающая:
(a) полинуклеотидный адъювант, содержащий полирибоинозиновую-полирибоцитидиловую кислоту (PIC), по меньшей мере один антибиотик, по меньшей мере один положительный ион; и
(b) сочетание двух или более антигенов, где указанные антигены представляют собой антигены из coronaviridae, hepadnaviridae, herpesviridae, retroviridae или bacillaceae,
где молекулы PIC гетерогенны по молекулярному весу и имеют молекулярный вес от 66000 до 1200000 Да.
4. Иммуногенная композиция, включающая:
(a) полинуклеотидный адъювант, содержащий полирибоинозиновую-полирибоцитидиловую кислоту (PIC), по меньшей мере один антибиотик и по меньшей мере один положительный ион, причем иммуногенная композиция содержит молекулы, которые гетерогенны по молекулярному весу, который составляет от 66000 до 1200000 Да; и
(b) по меньшей мере один вирусный антиген, где указанный антиген представляет собой антиген из coronaviridae, hepadnaviridae, herpesviridae, orthomyxoviridae или retro viridae.
5. Иммуногенная композиция, включающая:
(a) полинуклеотидный адъювант, содержащий полирибоинозиновую-полирибоцитидиловую кислоту (PIC), по меньшей мере один антибиотик и по меньшей мере один положительный ион, причем иммуногенная композиция содержит молекулы, которые гетерогенны по молекулярному весу, который составляет от 66000 до 1200000 Да; и
(b) по меньшей мере один бактериальный антиген, где указанный антиген представляет собой антиген из bacillaceae.
6. Иммуногенная композиция, включающая:
(a) полинуклеотидный адъювант, содержащий полирибоинозиновую-полирибоцитидиловую кислоту (PIC), по меньшей мере один антибиотик и по меньшей мере один положительный ион, причем иммуногенная композиция содержит молекулы, которые гетерогенны по молекулярному весу, который составляет от 66000 до 1200000 Да; и
(b) комбинацию двух или более антигенов, где указанные антигены представляют собой антигены из coronaviridae, hepadnaviridae, herpesviridae, orthomyxoviridae, retroviridae или bacillaceae.
7. Иммуногенная композиция, включающая:
(a) полинуклеотидный адъювант, содержащий полирибоинозиновую-полирибоцитидиловую кислоту (PIC), по меньшей мере один антибиотик и по меньшей мере один положительный ион; и
(b) по меньшей мере один вирусный антиген, где указанный антиген представляет собой антиген из coronaviridae, hepadnaviridae, herpesviridae, orthomyxoviridae или retroviridae, и
дополнительно включающая по меньшей мере один иммуномодулятор,
где молекулы PIC гетерогенны по молекулярному весу и имеют молекулярный вес от 66000 до 1200000 Да.
8. Иммуногенная композиция, включающая:
(a) полинуклеотидный адъювант, содержащий полирибоинозиновую-полирибоцитидиловую кислоту (PIC), по меньшей мере один антибиотик и по меньшей мере один положительный ион; и
(b) по меньшей мере один бактериальный антиген, где указанный антиген представляет собой антиген из bacillaceae, и
и дополнительно содержащая по меньшей мере один иммуномодулятор,
где молекулы PIC гетерогенны по молекулярному весу и имеют молекулярный вес от 66000 до 1200000 Да.
9. Иммуногенная композиция, включающая:
(a) полинуклеотидный адъювант, содержащий полирибоинозиновую-полирибоцитидиловую кислоту (PIC), по меньшей мере один антибиотик и по меньшей мере один положительный ион; и
(b) комбинацию двух или более антигенов, где указанные антигены представляют собой антигены из coronaviridae, hepadnaviridae, herpesviridae, orthomyxoviridae или bacillaceae, и
дополнительно включающая по меньшей мере один иммуномодулятор,
где молекулы PIC гетерогенны по молекулярному весу и имеют молекулярный вес от 66000 до 1200000 Да.
10. Иммуногенная композиция по любому из пп.1-9, где иммуногенная композиция приготовлена в форме с пролонгированным высвобождением.
11. Иммуногенная композиция по любому из пп.1-9, где указанный антиген представляет собой инактивированный микроорганизм, ослабленный микроорганизм, рекомбинантный полипептид и/или синтетический полипептид.
12. Иммуногенная композиция по любому из пп.1-9, где указанная иммуногенная композиция или адъювант PIKA, содержащийся в иммуногенной композиции, имеет форму жидкости, жидкого раствора, жидких капель, твердого вещества, капсул, эмульсий, суспензий, эликсиров, кремов, суппозиториев, гелей, мягких капсул, спреев, ингаляторов, аэрозолей, таблеток, покрытых оболочкой таблеток, микрокапсул, суппозиториев, драже, сиропов, взвесей, клизм, гранул, порошков, таблеток или леденцов.
13. Иммуногенная композиция по любому из пп.1-9, где по меньшей мере одна из указанных композиций: адъювантная композиция или иммуногенная композиция, является лиофильно высушенной.
14. Набор для усиления иммунного ответа в организме хозяина на антиген, включающий иммуногенную композицию по любому из пп.1-9.
15. Способ усиления иммунного ответа в организме хозяина на антиген, включающий введение в организм хозяина иммуногенной композиции по любому из пп.1-9.
16. Способ по п.15, где указанный организм хозяина имеет инфекционное заболевание, и указанное введение антигенного соединения вызывает иммунный ответ против патогена, вызывающего инфекционное заболевание.
17. Способ по п.15, где введение иммуногенной композиции производят путем парентеральной инъекции, внутримышечной инъекции, внутрибрюшинной инъекции, внутривенной инъекции, подкожной инъекции, местной доставки, трансдермальной доставки или внутрикожной доставки.
18. Применение иммуногенной композиции по любому из пп.1-9 для получения лекарственного средства для усиления иммунного ответа организма хозяина на антиген.
19. Применение по п.18, где хозяин имеет инфекционное заболевание, и где указанное введение антигена в организм хозяина вызывает иммунный ответ против патогена, вызывающего инфекционное заболевание.
20. Применение по п.19, где указанное введение иммуногенной композиции производят путем парентеральной инъекции, внутримышечной инъекции, внутрибрюшной инъекции, внутривенной инъекции, подкожной инъекции, местной доставки, трансдермальной доставки или внутрикожной доставки.
21. Применение по п.18, где организмом-хозяином является человек.
22. Применение по п.18, где организмом-хозяином является организм животного, отличного от человека.
| LIN Н.X., A new immunostimulatory complex (PICKCa) in experimental rabies: antiviral and adjuvant effects, Arch | |||
| Virol., 1993, v.131, pp.307-319 | |||
| Фильтр для разделения суспензий | 1983 |
|
SU1095951A1 |
| US 4400375 A, 23.08.1993 | |||
| US 5230883 A, 27.07.1993. | |||
Авторы
Даты
2012-09-27—Публикация
2006-06-27—Подача