Область техники, к которой относится изобретение
Настоящее изобретение относится к области биотехнологии, в частности к биосенсорам для определения внутриклеточной температуры и вязкости. Группа изобретений может найти свое применение в качестве материалов и красителей для in vivo микроскопии (цитологические и гистологические исследования), метода FLIM (Fluorescence Lifetime Imaging), микроскопии сверхвысокого разрешения (SIM и STORM).
Уровень техники
Лишь недавно было обнаружено, что температура в разных частях живой клетки может отличаться [Okabe, Kohki, Noriko Inada, Chie Gota, Yoshie Harada, Takashi Funatsu, and Seiichi Uchiyama. "Intracellular Temperature Mapping with a Fluorescent Polymeric Thermometer and Fluorescence Lifetime Imaging Microscopy." Nature Communications 3 (2012): 705-9. https://doi.org/10.1038/ncomms1714], эти различия могут составлять от десятых до единиц градусов и отражают функциональную активность различных частей клетки. Детектирование температуры и вязкости на уровне микро- и наноразмерных объектов (в том числе в живых тканях, клетках и органеллах) является важной задачей для многих биотехнологических и биомедицинских задач.
Из уровня техники известны технические решения, обеспечивающие потенциальное измерение температуры и вязкости внутри клетки. Измерение внутриклеточной температуры может быть осуществлено с помощью алмазного нанотермометра [Kucsko, G., Р. С. Maurer, N. Y. Yao, М. Kubo, Н. J. Noh, Р. K. Lo, H. Park, and M. D. Lukin. "Nanometre-Scale Thermometry in a Living Cell." Nature 500, no. 7460 (2013): 54-58. https://doi.org/10.1038/naturel2373]. Диапазон температур измерения составляет от +20 - +30°С с точностью измерения 0,044°С.
Однако алмазный нанотермометр обладает высокой цитотоксичностью и может генерировать активные формы кислорода в процессе измерения, которые могут разрушать компоненты живой клетки. Данный вид внутриклеточного термометра не способен измерять вязкость.
Из уровня техники также известен способ измерять температуру внутри клетки с помощью нанотермометра из квантовой точки QD655 [Yang, Jui-ming, Haw Yang, and Liwei Lin. "Reveal Heterogeneous Local Thermogenesis in Living Cells." Nano Letters, no. 6 (2011): 5067-71. https://doi.org/10.1021/nn201142f]. Диапазон температур измерения составляет от +15 - +37°С с точностью измерения 0,2°С.
Однако нанотермометр из квантовой точки QD655 обладает высокой цитотоксичностью и может генерировать активные формы кислорода (АФК) в процессе измерения температуры оптическими методами. Данный вид внутриклеточного термометра не способен измерять вязкость окружения.
Из уровня техники известно решение по измерению температуры внутри клетки с помощью флуоресцентного полимерного термометра по изменению времен жизни флуоресценции методом FLIM [Okabe, Kohki, Noriko Inada, Chie Gota, Yoshie Harada, Takashi Funatsu, and Seiichi Uchiyama. "Intracellular Temperature Mapping with a Fluorescent Polymeric Thermometer and Fluorescence Lifetime Imaging Microscopy." Nature Communications 3 (2012): 705-9. https://doi.org/10.1038/ncomms1714.]. Он состоит из 3 модулей - модуль чувствительный к температуре, гидрофильный и флуоресцентный модули. Диапазон измерения температур составляет +20 - +50°С с точностью 0,18-0,58°С. Данный термометр может быть использован для измерения вязкости внутри клетки.
Однако, так как флуоресцентный полимерный термометр содержит в своем составе органические модули, он может обладать цитотоксичностью.
Наиболее близким к заявляемому является термометр на основе зеленого флуоресцентного белка (GFP). Диапазон измерения температур составляет +20 - +60°С [Donner, Jon S., Sebastian A. Thompson, Mark P. Kreuzer, Guillaume Baffou, and Romain Quidant. "Mapping Intracellular Temperature Using Green Fluorescent Protein." Nano Letters 12, no. 4 (2012): 2107-11. https://doi.org/10.1021/nl300389y]. Данный термометр обладает чувствительностью к вязкости внутриклеточного пространства и может ее измерять, при этом генерация активных форм кислорода и цитотоксичность отсутствуют.
Однако, точность измерения температуры составляет всего 0,4°С.
Таким образом продолжает существовать потребность в измерении температуры и вязкости внутри клеток с большей точностью, меньшей цитотоксичностью и отсутствием генерации АФК.
Раскрытие изобретения
Задачей настоящего изобретения является создание биосенсора для измерения температуры и вязкости внутри клетки с высокой точностью измерения, низкой цитотоксичностью и способного дезактивировать АФК.
Техническим результатом изобретения является создание биосенсора температуры и вязкости на основе генномодифицированного фотоактивного оранжевого каротиноидного белка (ОКБ) и флуоресцентного зонда (TMR) для измерения температуры и вязкости внутри клетки с точностью от 0,15°С до 0,25°С, не обладающий цитотоксичностью и способного дезактивировать АФК.
Поставленная задача решается тем, что биосенсор для измерения температуры и вязкости внутри клетки включает:
- генетически модифицированный (мутант c84Sc95S) водорастворимый белок ОКБ, с аминокислотной последовательностью SEQ ID NO: 1.
- флуоресцентную метку тетраметилродамин (TMR), сшитую с белком.
Поставленная задача также решается способом определения температуры и вязкости локального окружения биосенсора, заключающийся в измерении флуоресценции от флуоресцентной метки при переходе белка из красной формы в оранжевую после фотоактивации сине-зеленым светом. Для измерения температуры локального окружения биосенсор помещается в физиологическую среду. Температура воздуха при измерении должна быть в диапазоне от 25-37°С. Концентрация биосенсора подбирается таким образом, чтобы соотношение сигнал/шум при измерении флуоресценции было не менее 1:100. Измерения флуоресценции проводят на длине волны 580±10 нм при возбуждении лазером с длиной волны 515 нм с временным разрешением 0,1 секунда. Для фотоактивации биосенсора используется актиничный свет с длиной волны в диапазоне 430-530 нм. После определения скорости затухания флуоресценции температура определяется по заранее известной калибровочной кривой.
Краткое описание чертежей
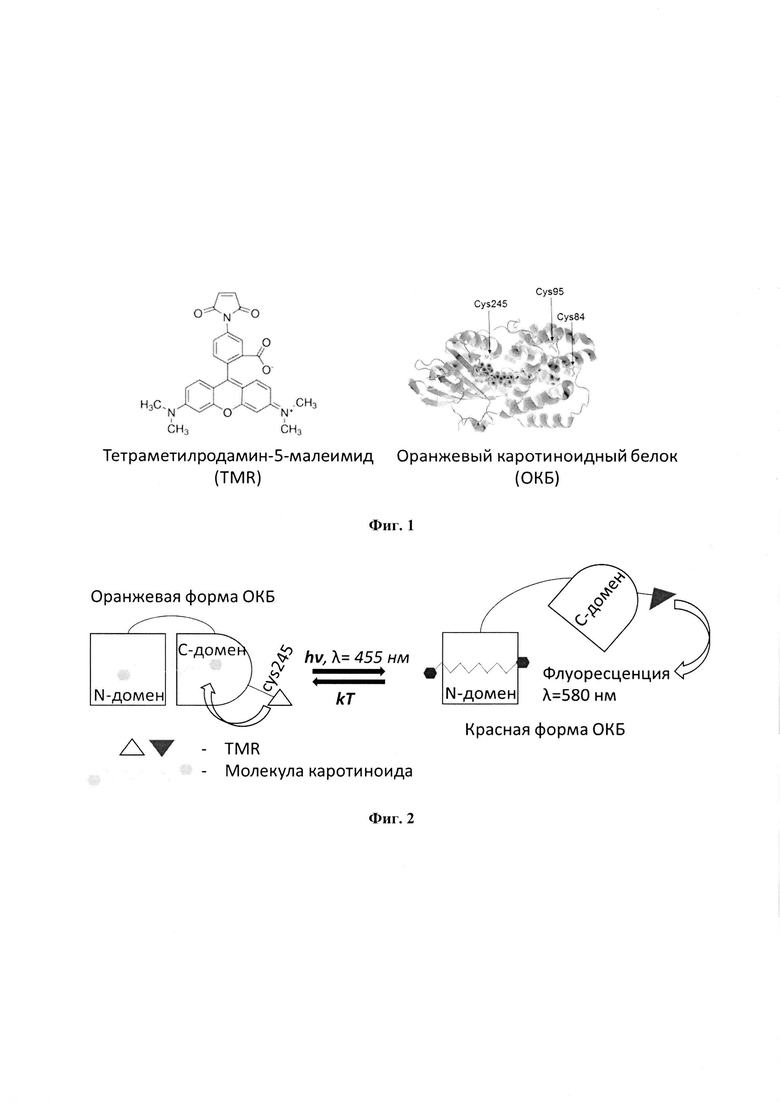
На фиг. 1 представлена флуоресцентная метка TMR (слева) и оранжевый каротиноидный белок ОКБ (справа) с указанием положения цистеинов.
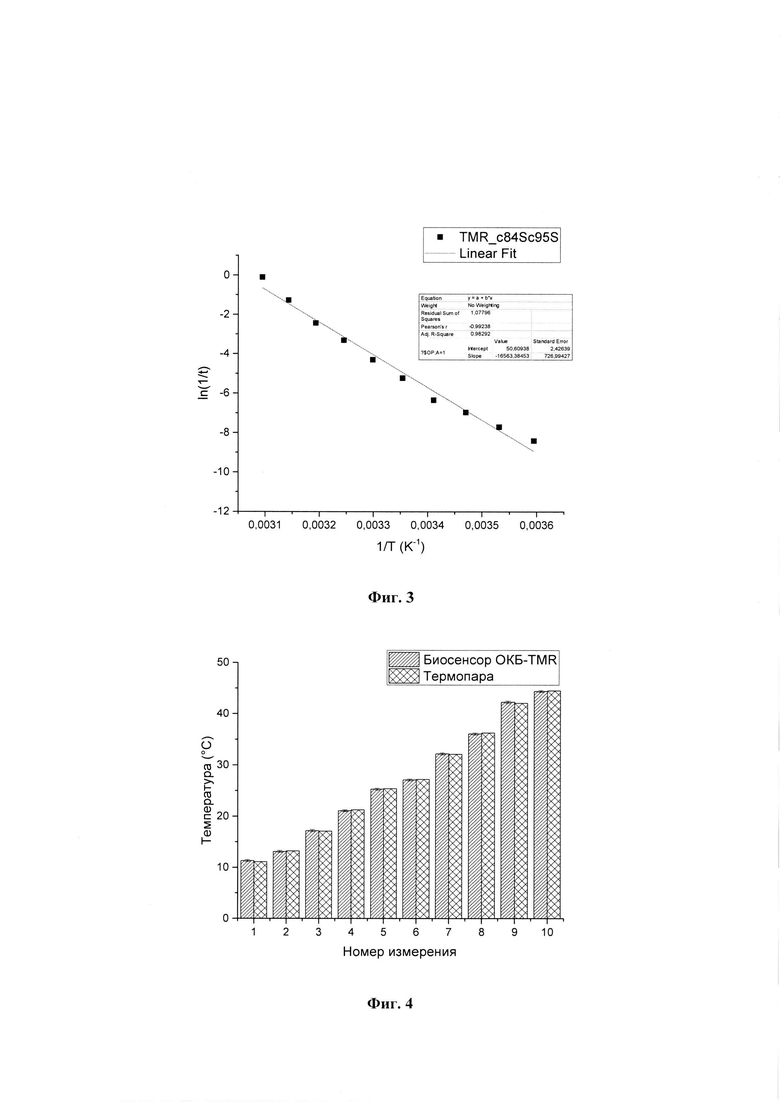
На фиг. 2 представлен биосенсор на основе генномодифицированного фотоактивного оранжевого каротиноидного белка.
На фиг. 3 представлен график температурной зависимости перехода белка мутантного ОКБ из красной формы в оранжевую по флуоресценции TMR на 580 нм в координатах Аррениуса.
На фиг. 4 показана диаграмма измерения температуры буфера SEC с помощью биосенсора ОКБ-TMR ( ) и термопары (
) и термопары ( ).
).
На фиг. 5 представлен график зависимости скорости перехода биосенсора c84Sc95S-TMR из красной формы в оранжевую от вязкости окружения по флуоресценции TMR на длине волны 580 нм при 25°С.
Осуществление изобретения
В норме белок ОКБ имеет 3 цистеина в положениях 84, 95, 245 (фиг. 1). Белок генетически модифицируется таким образом, что остается только один цистеин, а именно в положении 245 (мутант c84Sc95S). Это необходимо для того, чтобы получить наибольший контраст при конъюгации с флуоресцентной меткой. Для экспрессия мутантных белков с одним цистеином из Synechocystis sp. РСС 6803, были использованы плазмиды, несущие модифицированную кДНК ОКБ оптимизированной для использования кодонов искусственного гена для синтеза белков в Escherichia coli. Получение плазмиды с модифицированной кДНК, добавление плазмиды для генетической модификации культуры клеток Escherichia coli, экспрессия белка в модифицированной культуре, выделение модифицированного белка и очистка проводились по стандартной методике, описанной в статье [Е.G. Maksimov, N.N. Sluchanko, K.S. Mironov, Е.А. Shirshin, K.Е. Klementiev, G.V. Tsoraev, М. Moldenhauer, Т. Friedrich, D.A. Los, S.I. Allakhverdiev, V.Z. Paschenko, and A.B. Rubin. Fluorescent labeling preserving ocp photoactivity reveals its reorganization during the photocycle. Biophysical Journal, 112:46-56, 2017.].
Флуоресцентная метка тетраметилродамин-5-малеимид (TMR) сшивается с белком по стандартной методике, описанной в [Kim Y, Но SO, Gassman NR, Korlann Y, Landorf EV, Collart FR, Weiss S. Efficient site-specific labeling of proteins via cysteines. Bioconjug Chem. 2008 Mar; 19(3):786-91. doi: 10.1021/bc7002499. Epub 2008 Feb 15. PubMed PMID: 18275130; PubMed Central PMCID: PMC3086356.] и [E.G. Maksimov, N.N. Sluchanko, K.S. Mironov, E.A. Shirshin, K.E. Klementiev, G.V. Tsoraev, M. Moldenhauer, T. Friedrich, D.A. Los, S.I. Allakhverdiev, V.Z. Paschenko, and A.B. Rubin. Fluorescent labeling preserving ocp photoactivity reveals its reorganization during the photocycle. Biophysical Journal, 112:46-56, 2017.]. В оранжевом состоянии метка потушена за счет миграции энергии на каротиноид.
Таким образом, заявляемый биосенсор для измерения температуры и вязкости внутри клетки включает:
- генетически модифицированный водорастворимый белок ОКБ, который содержит в качестве хромофора молекулу каротиноида (3'-гидроксиэхиненон или кантаксантин) и обладает фотоконверсией, то есть при поглощении сине-зеленого света белок переходит из оранжевого состояния в красное. Белок генетически модифицируется таким образом, что остается только один цистеин в положении 245. Это необходимо для того, чтобы получить наибольший контраст при конъюгации с флуоресцентной меткой. После генетической модификации белок ОКБ имеет аминокислотную последовательность SEQ ID NO: 1. При фотоактивации сине-зеленым светом расстояние между флуоресцентной меткой, конъюгированной с цистеином в положении 245, и молекулой каротиноидом будет максимальным, что обеспечит высокий контраст.
- флуоресцентная метка тетраметилродамин (TMR), которая сшивается с белком. При этом в оранжевом состоянии метка потушена за счет миграции энергии на каротиноид. Спектр флуоресценции TMR имеет перекрывание со спектром поглощения молекулы каротиноида оранжевой формы ОКБ в области 550-600 нм. При поглощении кванта сине-зеленого цвета белок переходит в красную форму, таким образом увеличивается расстояние между флуоресцентной меткой и каротиноидом, нарушается процесс миграции энергии, и метка начинает флуоресцировать. Полученный гибридный комплекс обладает наибольшим контрастом при измерении температуры в растворе.
Для определения температуры и вязкости локального окружения биосенсора необходимо провести измерения изменений интенсивности флуоресценции метки при переходе белка из красной формы в оранжевую. Измерения проводятся с помощью спектрофотометра Ocean Optics Flame на длине волны 580 нм с разрешением 0,1 секунда. В качестве источника использовался лазер светодиодный лазер с длиной волны 515 нм в постоянном режиме. Далее полученные экспериментальные данные аппроксимируется экспоненциальной функцией, из которой определяется время перехода белка из красного состояния в оранжевое. Полученное время, возведенное -1 степень, логарифмируется и находится на калибровочной кривой, по которой определяется температура локального окружения. Аналогичную процедуру можно провести при измерении времен жизни флуоресценции метки с помощью измерительного комплекса на основе системы время-коррелированного счета фотонов Simple Tau 140 (Becker & Hickl, Германия). Для возбуждения флуоресценции использовали светодиодный лазер с длиной волны 515 нм, длительностью импульса 25 пс, частотой следования импульсов 50 МГц и энергией одиночного импульса 13 пДж, ИОС, Россия). Регистрируемые кинетические параметры не связаны с концентрацией, соответственно не требуется дополнительной нормировки. Данные изменения связаны с конформационными перестройками белка ОКБ, то есть характерны только для этого типа молекулярного биосенсора температуры и вязкости, поэтому наличие других флуоресцирующих молекул, не обладающих фотоциклом, не будет влиять на точность измерения скорости конверсии ОКБ и температуры, соответственно. Регистрируемые кинетические параметры не связаны с концентрацией, соответственно не требуется дополнительной нормировки. Точность измерения составляет 0,2°С ± 0,05°С.
При поглощении кванта сине-зеленого света белок переходит в красную форму, таким образом увеличивается расстояние между флуоресцентной меткой и молекулой каротиноида, нарушается процесс миграции энергии, и метка начинает флуоресцировать (фиг. 2). Данный процесс зависит от температуры и вязкости окружения.
Поскольку в составе белковой части присутствует каротиноид, данный биосенсор обладает низкой цитотоксичностью и способен дезактивировать АФК, которые могут образовываться в процессе измерений.
Ниже представлено более детальное описание заявляемого способа, которое не ограничивает объем притязаний заявляемого изобретения, а демонстрирует возможность осуществления изобретения с достижением заявляемого технического результата.
Для экспрессия мутантных белков с одним цистеином из Synechocystis sp. РСС 6803, были использованы плазмиды, несущие модифицированную кДНК ОКБ, оптимизированной для использования кодонов искусственного гена для синтеза белков в Escherichia coli. Кодирующую ДНК вырезали ферментами BamHI и NotI и лигировали в рамке с модифицированным вектором pQE81L (Qiagen, Hilden, Германия), несущим сконструированный сайт рестрикции NotI и несущим ген устойчивости к ампициллину. Для экспрессии белка мы использовали следующую процедуру: колбы с 500 мл лизогенного бульона, дополненного 34 мг/мл хлорамфеникола и 50 мг/мл ампициллина, в каждую из которых была инокулирована культура клеток до оптической плотности (OD) равной 0,1 от исходной культуры. Культуры клеток выращивали при 37°С в орбитальном шейкере при 200 об/мин до достижения OD 0.8. После индукции с помощью 500 мМ изопропил-β-D-1-тиогалактопиранозида, клетки выращивали в течение 48 ч при 25°С. Клетки собирали центрифугированием, получая красноватые гранулы, указывающие на биосинтез каротиноидов. Клеточные гранулы ресуспендировали в фосфатном буфере с лизоцимом 100 мг и Complete (Roche, Basel, Switzerland) ингибитором протеазы, затем лизировали от трех до четырех циклов замораживания/оттаивания на сухом льду с абсолютным этанолом. После удаления клеточного мусора путем центрифугирования (12000g при 4°С), осветленный и интенсивно окрашенный супернатант очищали аффинной хроматографией с системой очистки AKTA FPLC (GE Healthcare, Little Chalfont, Соединенное Королевство) с использованием 5 мл сыворотки HiTrap Talon Со2+-аффинную колонку (GE Healthcare). После элюирования градиентом имидазола из 20 мМ до 500 мМ, был получен раствора белка интенсивно оранжевого/красного цвета. Конечный этап очистки с использованием эксклюзионной хроматографии на колонке Superdex 200 26/60 (GE Healthcare) позволило нам получают не только электрофоретически гомогенные, но и довольно монодисперсные белковые препараты, свободные от агрегатов и неспецифических олигомеров, что важно для последовательной маркировки. После концентрирования с помощью Amicon (Merck Millipore, Billerica, MA), белок обессоливали колонками PD-10 (GE Healthcare) и хранили при -80°С до использования. Концентрацию белка определяли спектрофотометрически.
Очищенные мутантные белки ОКБ помещали в буферный раствор 30 мМ Hepes-NaOH (рН 7,3) и 100 мМ NaCl-буфера (буфер L), а затем подвергали маркировке TMR (Sigma-Aldrich, Сент-Луис, Миссури). Во-первых, 5-10 молярного избытка свежего дитиотреитола добавляли в течение 15 мин при комнатной температуре для обеспечения снижения цистеинов, а затем препарат ОКБ снова помещали в буферный раствор L с использованием колонок NAP-10 (GE Healthcare) для удаления избытка дитиотреитола. Сразу после этого образец (1,2 мл) смешивали с раствором 12 мл 20mM TMR в диметилсульфоксиде и оставляли вначале в течение 30 мин при комнатной температуре, а затем в течение ночи при 4°С для маркировки. Избыток метки тщательно удаляли с помощью шести-семи последовательных раундов 10-кратного разбавления буфером L с последующей концентрацией на единицах Amicon с отсечкой 10 кДа (Merck Millipore) и конечным обменом буфера для буфера L с NAP-10-колонками до получения 1 мл TMR-меченого раствора ОКБ. Цветную фракцию, не содержащую белок, использовали в качестве контроля свободной метки.
Для того чтобы измерить температуру с помощью разрабатываемого биосенсора на основании генетически модифицированного ОКБ была построена калибровочная кривая. Белок ОКБ конъюгированный с флуоресцентной меткой в кювете помещалась в термостат с поддержанием заданной температуры в диапазоне 5-50°С. Далее проводили измерения флуоресценции фотоциклов, то есть переходов из оранжевой формы в красную под действием сине-зеленого света (430-530 нм) и из красной формы в оранжевую в темноте, с шагом 5°С. Калибровочная кривая представлена на фиг. 3. Для проверки работоспособности биосенсора (отсутствие повреждения) перед проведением измерений рекомендуется измерить скорость затухания флуоресценции при 1 заданной температуре. В случае отклонения измеренной температуры от калибровочной кривой более чем 2°С, то есть выявленном повреждении биосенсора, проводится повторная калибровка.
Для измерения температуры в качестве клеточной модели использовали буферный раствор SEC в качестве наиболее физиологически близкого локального окружения клетки.
Для верификации способа измерения температуры раствора брался буферный раствор SEC в который помещался ОКБ с TMR. Измерялись фотоциклы и по калибровочной кривой определялась температура раствора. Измерения температуры буферного раствора SEC с помощью термопары показали 36,3±0,05°С, а с помощью биосенсора вычисленная температура была равна 36,1±0,2°С, фиг. 4.
Поскольку фотоцикл ОКБ коррелирует с существенными перестройками доменов и увеличением гидродинамического радиуса, изменения вязкости растворителя могут оказать влияние на скорость фотоконверсии. Действительно, зависимость скорости сворачивания белка от вязкости растворителя описывается теорией Крамерса, которая предсказывает обратную зависимость скорости перехода от вязкости и может формально применяться к конкретному случаю фотоконверсии ОКБ. Была измерена зависимость скоростей переходов ОКБ от вязкости растворителя, которая варьировалась путем изменения содержания глицерина в буферном растворе. Измерения проводились с помощью спектрофотометра Ocean Optics Flame на длине волны 580 нм с разрешением 0,1 секунда. В качестве источника возбуждающего света использовался светодиодный лазер с длиной волны 515 нм в постоянном режиме. Фотоактивацию белка проводили с помощью актиничного света от диода с длиной волны возбуждающего света 460 нм. При фотоактивации белок переходит в красную форму и интенсивность флуоресценции метки увеличивалась, после выключения света белок релаксировал в оранжевую форму и интенсивность флуоресценции снижалась. Кинетика снижения интенсивности флуоресценции метки аппроксимировались экспоненциальной функцией и определялась скорость затухания флуоресценции. Данная процедура измерений повторялась в диапазоне вязкостей от 1 до 40 сПа. При увеличении концентрации глицерина до 80% наблюдалось снижение констант скорости конверсии ОКБ из красной формы в оранжевую. После этого зависимость скорости затухания флуоресценции от вязкости в обратных координатах Аррениуса аппроксимировалась линейной функцией, которая и является калибровочной кривой для измерения вязкости локального окружения, фиг. 5. Характерные времена превращений показали линейную зависимость от вязкости на двойных логарифмических графиках, в соответствии с теорией Крамерса.
Белок ОКБ способен дезактивировать АФК через спин-спиновый обмен или вступая в химическую реакцию с последующим окислением. Для изучения влияния активных форм кислорода (АФК) на ОКБ была использована фотосенсибилизирующая активность поликатионных фталоцианинов алюминия (АлФЦ). АлФЦ генерируют молекулы синглетного кислорода (1O2) под действием красного света. Чтобы активировать генерацию АФК, раствор АлФЦ освещали красным (λ=635 нм) светодиодом с мощностью 200 мВт (Thorlabs, США). При освещении образца поглощение в видимом диапазоне регистрировали с использованием спектрометра MayaPro (Ocean Optics, США).
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования "Московский государственный университет имени М.В.Ломоносова" (МГУ)
<120> БИОСЕНСОР ВНУТРИКЛЕТОЧНОЙ ТЕМПЕРАТУРЫ И ВЯЗКОСТИ НА ОСНОВЕ ГЕННОМОДИФИЦИРОВАННОГО ФОТОАКТИВНОГО ОРАНЖЕВОГО КАРОТИНОИДНОГО БЕЛКА
<160> SEQ ID NО:1
<210> 1
<211> 323
<213> Natural sequence
<223> Модифицированный оранжевый каротиноидный белок
<400> 1
1 MPFTIDSARG IFPNTLAADV VPATIARFSQ LNAEDQLALI WFAYLEMGKT
51 LTIAAPGAAS MQLAENALKE IQAMGPLQQT QAMSDLANRA DTPLSRTYAS
101 WSPNIKLGFW YRLGELMEQG FVAPIPAGYQ LSANANAVLA TIQGLESGQQ
151 ITVLRNAVVD MGFTAGKDGK RIAEPVVPPQ DTASRTKVSI EGVTNATVLN
201 YMDNLNANDF DTLIELFTSD GALQPPFQRP IVGKENVLRF FREECQNLKL
251 IPERGVTEPA EDGFTQIKVT GKVQTPWFGG NVGMNIAWRF LLNPEGKIFF
301 VAIDLLASPK ELLNFAVHHH HHH
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ДЕТЕКЦИИ ЛОКАЛЬНОЙ ТЕМПЕРАТУРЫ В ЖИВЫХ КЛЕТКАХ И ПОСТРОЕНИЯ ТЕМПЕРАТУРНЫХ КАРТ ЖИВЫХ КЛЕТОК | 2022 |
|
RU2799016C1 |
| НУКЛЕИНОВАЯ КИСЛОТА, КОДИРУЮЩАЯ ОСНОВАННЫЙ НА FRET ДАЛЬНЕ-КРАСНЫЙ БИОСЕНСОР ДЛЯ ИЗМЕРЕНИЯ АКТИВНОСТИ КАСПАЗЫ 3 ВНУТРИ КЛЕТОК | 2013 |
|
RU2535981C1 |
| НОВЫЕ ФЛУОРЕСЦЕНТНЫЕ БЕЛКИ ИЗ ENTACMAEA QUADRICOLOR И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2007 |
|
RU2395581C2 |
| КОМПЛЕКС С АНТИОКСИДАНТНЫМ ДЕЙСТВИЕМ И СПОСОБ ЕГО ПРИМЕНЕНИЯ | 2022 |
|
RU2827772C2 |
| ХИМЕРНЫЙ БЕЛОК, ЯВЛЯЮЩИЙСЯ ФЛУОРЕСЦЕНТНЫМ БИОСЕНСОРОМ ДЛЯ ОДНОВРЕМЕННОЙ ДЕТЕКЦИИ ПЕРОКСИДА ВОДОРОДА И ФОСФАТИДИЛИНОЗИТОЛ-3,4,5-ТРИФОСФАТА, НУКЛЕИНОВАЯ КИСЛОТА, КОДИРУЮЩАЯ ТАКОЙ БЕЛОК, КАССЕТА ЭКСПРЕССИИ И ЭУКАРИОТИЧЕСКАЯ КЛЕТКА-ХОЗЯИН | 2012 |
|
RU2498996C1 |
| КРАСНЫЙ ФЛУОРЕСЦЕНТНЫЙ БИОСЕНСОР ДЛЯ ДЕТЕКЦИИ ПЕРОКСИДА ВОДОРОДА В ЖИВЫХ КЛЕТКАХ | 2013 |
|
RU2535336C1 |
| СПОСОБ ОЦЕНКИ СОДЕРЖАНИЯ ПЕРОКСИДА ВОДОРОДА В ОПУХОЛЕВЫХ КЛЕТКАХ ПРИ ФОТОДИНАМИЧЕСКОМ ВОЗДЕЙСТВИИ | 2018 |
|
RU2700421C1 |
| ВЫДЕЛЕННАЯ НУКЛЕИНОВАЯ КИСЛОТА, КОДИРУЮЩАЯ ФЛУОРЕСЦЕНТНЫЙ БИОСЕНСОР, КАССЕТА ЭКСПРЕССИИ, КЛЕТКА ПРОДУЦИРУЮЩАЯ ФЛУОРЕСЦЕНТНЫЙ БИОСЕНСОР, ВЫДЕЛЕННЫЙ ФЛУОРЕСЦЕНТНЫЙ БИОСЕНСОР | 2012 |
|
RU2515903C2 |
| ДАТЧИК РАЗМОРАЖИВАНИЯ ПРОДУКТОВ НА ОСНОВЕ ОРАНЖЕВОГО КАРОТИНОИДНОГО БЕЛКА | 2015 |
|
RU2585464C1 |
| МОДИФИЦИРОВАННЫЙ БИОСЕНСОР ДЛЯ ДЕТЕКЦИИ ВНУТРИКЛЕТОЧНОЙ РН | 2014 |
|
RU2603060C2 |
Изобретение относится к области биотехнологии, в частности к биосенсорам для измерения внутриклеточной температуры и вязкости. Генетически модифицированный водорастворимый белок ОКБ с одним цистеином в положении 245 содержит в качестве хромофора молекулу каротиноида (3'-гидроксиэхиненон или кантаксантин) и обладает фотоконверсией, то есть при поглощении сине-зеленого света белок переходит из оранжевого состояния в красное. Геномодицированный белок ОКБ конъюгируется с флуоресцентной меткой TMR через цистеин в положении 245 белка. После освещения сине-зеленым светом белок ОКБ переходит в красную, таким образом увеличивается расстояние между флуоресцентной меткой и молекулой каротиноида, нарушается процесс миграции энергии, и метка начинает флуоресцировать. Данный процесс зависит от температуры и вязкости окружения. Точность измерения температуры в растворе составила 0,2°С ± 0,05°С. За счет того, что в составе белковой части присутствует каротиноид, данный биосенсор обладает низкой цитотоксичностью, а также способен дезактивировать АФК, которые могут образовываться в процессе измерений. 2 н. и 4 з.п. ф-лы, 5 ил., 1 пр.
1. Биосенсор внутриклеточной температуры и вязкости, характеризующийся тем, что представляет собой модифицированный оранжевый каротиноидный белок с последовательностью SEQ ID NO:1 с флуоресцентной меткой тетраметилродамин-5-малеимидом по меркапто-группе Cys245 белка.
2. Способ измерения внутриклеточной температуры и вязкости с помощью биосенсора по п. 1, характеризующийся тем, что биосенсор помещают в физиологическую среду, проводят измерение флуоресценции от флуоресцентной метки при переходе белка из красной формы в оранжевую после фотоактивации сине-зеленым светом, после определения скорости затухания флуоресценции температура определяется по заранее построенной калибровочной кривой.
3. Способ по п. 2, характеризующийся тем, что измерение проводят при температуре воздуха в диапазоне от 25-37°С.
4. Способ по п. 2, характеризующийся тем, что концентрация биосенсора подбирается таким образом, чтобы соотношение сигнал/шум при измерении флуоресценции было не менее 1:100.
5. Способ по п. 2, характеризующийся тем, что измерение флуоресценции проводят на длине волны 580±10 нм при возбуждении лазером с длиной волны 515 нм с временным разрешением 0,1 с.
6. Способ по п. 2, характеризующийся тем, что для фотоактивации биосенсора используется актиничный свет с длиной волны в диапазоне 430-530 нм.
| DEEPANKUMAR K | |||
| et al.: Temperature Sensing Using Red Fluorescent Protein, Biotechnology and Bioprocess Engineering, 2015, v.20, p.67-72 | |||
| DONNER J | |||
| S | |||
| et al.: Mapping Intracellular Temperature Using Green Fluorescent Protein, Nano Letters, 2012, v.12, p | |||
| Прибор для проверки веса монет | 1925 |
|
SU2107A1 |
| MAKSIMOV E | |||
| G | |||
| et al.: Fluorescent Labeling Preserving OCP Photoactivity Reveals | |||
Авторы
Даты
2020-07-30—Публикация
2019-05-22—Подача