Изобретение относится к медицине, а именно к онкологии, и может быть использовано для оценки содержания пероксида водорода в опухолевых клетках в ходе развития фотодинамической реакции.
К фотодинамическим реакциям относят окислительно-восстановительные процессы, протекающие при участии трех составляющих - красителя, света и кислорода (Владимиров Ю.А., Потапенко А.Я. Физико-химические основы фотобиологических процессов. М.: Дрофа, 2006, 285 с.). Соответствующие красители получили название фотосенсибилизаторов (ФС), или фотодинамических красителей, чтобы подчеркнуть отличие от фотоактивных красителей, не требующих присутствия кислорода.
При облучении светом фотосенсибилизатор переходит в возбужденное состояние. Возбужденная молекула фотосенсибилизатора может участвовать в реакциях трех типов. К I типу относят реакции, на первичной стадии которых молекула ФС вступает в реакции переноса электронов и протонов с образованием радикальных активных форм кислорода. При II типе реакций триплетно-возбужденная молекула ФС взаимодействует с молекулярным кислородом, давая активный синглетный кислород 1O2. Менее известным является III путь, в котором молекула ФС в триплетном возбужденном состоянии реагирует непосредственно с биомолекулой и образованием ее радикальной формы (Alejandra Martinez De Pinillos Bayona, Pawel Mroz, Connor Thunshelle, Michael R. Hamblin Design features for optimization of tetrapyrrole macrocycles as antimicrobial and anticancer photosensitizers // Chem Biol Drug Des, 2017. V. 89, №2. P. 192-206.). Образовавшиеся первичные продукты фотодинамической реакции запускают каскад реакций, которые необратимо повреждают мембраны, ДНК и другие клеточные структуры, и в конечном итоге приводят к гибели клетки.
Описанные реакции лежат в основе принципа метода фотодинамической терапии (ФДТ) - метода локальной активации накопившегося в ткани флуоресцентного красителя-фотосенсибилизатора видимым светом (Странадко Е.Ф. Исторический очерк развития фотодинамической терапии // Лазерная медицина. 2002. Т. 6. №2. С. 4-8., Moan J., Peng Q., Patrice Т. An outline of the history of PDT // In: Photodynamic Therapy: The Royal Society of Chemistry. 2003. P. 1-18.).
В настоящее время самой обширной областью применения ФДТ является онкология. Основными точками приложения ФДТ являются опухоли, локализованные на поверхности кожи, слизистых, а также внутренней поверхности полых органов, к которым можно доставить излучение с помощью гибкого световода. К таким опухолям относятся новообразования кожи, желудочно-кишечного тракта, мочевого пузыря, легких, шейки матки и простаты (Узденский А.Б. Клеточно-молекулярные механизмы фотодинамической терапии. СПб.: Наука, 2010. 327 с., Салмин P.M., Стенько А.А., Жук И.Г., Врагов М.Ю. Основные направления фотодинамической терапии в медицине // Новости хирургии. 2008. Т. 16. №3. С. 155-162, Странадко Е.Ф., Иванов А.В. Современное состояние проблемы фотодинамической терапии рака и неопухолевых заболеваний // Биофизика. 2004. Т. 49. №2. С. 380-383). Область применения ФДТ не ограничивается лечением онкологических заболеваний, метод активно применяют для терапии инфекционных заболеваний, вызванных бактериальными и грибковыми инфекциями, гиперплазии, метаплазии, а также для лечения и профилактики ряда сердечно-сосудистых заболеваний (Странадко Е.Ф., Иванов А.В. Современное состояние проблемы фото динамической терапии рака и неопухолевых заболеваний // Биофизика. 2004. Т. 49. №2. С. 380-383, Hamblin M.R., Mroz P. History of PDT: The first hundred years // In: Advances in Photodynamic Therapy: Basic, Translational and Clinical, Norwood, MA: Artech House, Inc, 2008).
Несмотря на то, что ФДТ активно развивается и область применения данного вида терапии все время расширяется, молекулярные механизмы, лежащие в основе фотодинамической реакции, до сих пор до конца не изучены. В то же время, знание этих механизмов необходимо для направленной разработки новых эффективных препаратов, снижения побочных эффектов, модификации действия фотосенсибилизатора.
До недавнего времени в качестве основного эффектора фотодинамической реакции рассматривался синглетный кислород (Владимиров Ю.А., Потапенко А.Я. Физико-химические основы фотобиологических процессов. М.: Дрофа, 2006, 285 с., Красновский мл А.А. Первичные механизмы фотоактивации молекулярного кислорода. История развития и современное состояние исследований (обзор) // Биохимия. 2007. Т. 72, №10. С. 1311-1329). Однако все большее количество данных свидетельствует о значительном вкладе других активных форм кислорода, в первую очередь пероксида водорода и его производного гидроксильного радикала (Chekulayeva L.V., Chekulayev V.A., Shevchuk I.N. Active oxygen intermediates in the degradation of hematoporphyrin derivative in tumor cells subjected to photodynamic therapy. // Journal Photochemistry and Photobiology B. 2008. V. 93, №2. P. 94-107., Price M., Reiners J.J., Santiago A.M., Kessel D. Monitoring singlet oxygen and hydroxyl radical formation with fluorescent probes during photodynamic therapy // Photochemistry and Photobiology. 2009. V. 85, №5. P. 1177-1181., H. Chen, J. Tian, W. He, and Z. Guo. H2O2-Activatable and O2-Evolving Nanoparticles for Highly Efficient and Selective Photodynamic Therapy against Hypoxic Tumor Cells // J. Am. Chem. Soc. 2015. V. 137. P. 1539-1547).
Необходимо отметить, что пероксид водорода, наряду со свойствами окислителя, является участником сигнальных путей (Halliwell, В. and Gutteridge, J.M.C. Free Radicals in Biology and Medicine // 4th edn, Clarendon Press, Oxford. 2007. 888 p., Castro A.B., Stockert J.C. In vitro human cell responses to a low-dose photodynamic treatment vs. mild H2O2 exposure // Journal of Photochemistry and Photobiology B: Biology. 2015. V. 143. P. 12-19.). В таком случае, его продукция при фотодинамической реакции может опосредовать локальный тканевой, а возможно, и системный ответ.
Несмотря на очевидную актуальность вопроса, информация о генерации и роли пероксида водорода в развитии фотодинамической реакции отрывочна и противоречива. В первую очередь, это связано с отсутствием динамических исследований, которые позволили бы выявить возможные транзиентные изменения уровня пероксида, а также исследований с высоким пространственным разрешением, позволяющих детектировать локальные изменения уровня пероксида в отдельных клеточных компартментах.
Наиболее распространенные методы определения содержания пероксида водорода основаны на использовании низкомолекулярных флуоресцентных зондов, среди которых широко известны Amplex Red, DCFH-DA, Peroxy Green и ряд других, а также спектрофотометрические методы с использованием ферритиоцианата, субстрата пероксидазы тетраметилбензидина или ксиленолового оранжевого (S.G. Rhee, T.-S. Chang, W. Jeong, and D. Kang. Methods for Detection and Measurement of Hydrogen Peroxide Inside and Outside of Cells // Mol. Cells. 2010. V. 29. P. 539-549.). Перечисленные методы отличаются по чувствительности и специфичности, однако их общим недостатком является необратимость реакции субстрата с пероксидом водорода, что делает невозможным проведение динамических исследований.
Данного недостатка лишены появившееся в последнее десятилетие методы с использованием редокс-чувствительных флуоресцентных белков. В частности, высокой чувствительностью к пероксиду водорода обладает белковый сенсор группы GFP (от англ. green fluorescent proteins) - HyPer. В основе структуры этого биосенсора лежит круговой пермутант флуоресцентного белка YFP (от англ. yellow fluorescent protein), вставленный в последовательность регуляторного домена транскрипционного фактора E.coli OxyR. В присутствии пероксида водорода в регуляторном домене OxyR происходит образование дисульфидной связи между цистеиновыми остатками Cys-199 и Cys-208. Высокая реакционная способность Cys-199 в отношении пероксида водорода обусловлена низким значением pKa его тиоловой группы. Гидрофобное окружение Cys-199 ограничивает доступ заряженных оксидантов к этому остатку. При взаимодействии с амфифильной молекулой пероксида водорода тиоловая группа Cys-199 окисляется до сульфеновой кислоты, после чего окисленный аминокислотный остаток уходит из своего гидрофобного окружения и сближается с Cys-208 с формированием дисульфидной связи, что приводит к конформационным изменениям всей структуры белка HyPer. Сенсор HyPer имеет два пика возбуждения флуоресценции (420 и 500 нм). При возрастании концентрации пероксида водорода, происходит пропорциональное уменьшение пика на длине волны 420 нм и увеличение пика на 500 нм. Изменение формы спектра возбуждения HyPer при взаимодействии с молекулой пероксида водорода позволяет реализовать ратиометрический подход и, соответственно, проводить измерения в сложной внутриклеточной среде при отсутствии информации о концентрации сенсора (Belousov V.V., Fradkov A.F., Lukyanov K.А., Staroverov D.B., Shakhbazov K.S., Terskikh A.V., and Lukyanov S. Genetically encoded fluorescent indicator for intracellular hydrogen peroxide // Nat. Methods. 2006. V. 3. P. 281-286. K.A. Lukyanov, V.V. Belousov. Genetically encoded fluorescent redox sensors // Biochimica et Biophysica Acta. 2014. V. 1840. P. 745-756.).
Наиболее близким по технической сущности и достигаемому результату к предлагаемому изобретению является способ оценки содержания пероксида водорода в опухолевых клетках при воздействии на них противоопухолевого препарата, защищенный патентом RU 2497121 С1, кл. G01N 32/52 (2006.01), опубл. 27.10.2013 г., принятый за ближайший аналог (прототип).
В способе по прототипу на опухолевые клетки, которые представляют собой клеточную линию аденокарциномы шейки матки человека HeLa Kyoto, воздействуют цисплатином при его концентрации 1,85-3,85 мкг/мл. Измеряют внутриклеточное содержания Н2О2 методом лазерной сканирующей микроскопии, определяя интенсивность сигнала флуоресценции при возбуждении сенсора на длинах волн 458 нм и 488 нм. Рассчитывают величину отношения между интенсивностью сигнала флуоресценции на длине волны 488 нм к интенсивности сигнала флуоресценции на длине волны 458 нм (I488/I458), по которой и судят о внутриклеточном содержании пероксида водорода. Для оценки содержания пероксида водорода в динамике осуществляют определение интенсивности сигнала флуоресценции при возбуждении сенсора на длинах волн 458 нм и 488 нм и расчет величины отношения между интенсивностью сигнала флуоресценции на длине волны 488 нм к интенсивности сигнала флуоресценции на длине волны 458 нм, по которой и судят о внутриклеточном содержании пероксида водорода, каждые 60 секунд в течение 30 минут. Способ позволяет выявлять место образования пероксида водорода в клетке, и на основе этого судить о механизмах токсического действия цисплатина на молекулярном уровне, а также позволяет исключить возможную погрешность оценки содержания пероксида водорода, обусловленную неспецифическим накоплением сенсора.
Однако, прототип не лишен недостатков. Во-первых, способ оценки содержания пероксида водорода в опухолевых клетках при воздействии на них противоопухолевого препарата не позволяет оценивать содержание пероксида водорода при фотодинамическом воздействии с применением фотосенсибилизаторов. Во-вторых, способ по прототипу характеризуется низкой чувствительностью, поскольку используемая длина волны 458 нм не соответствует ни одному из максимумов в спектре возбуждения флуоресцентного белка HyPer и на этой длине волны интенсивность сигнала крайне слабо зависит от содержания пероксида водорода. В-третьих, изменения в спектре возбуждения, наблюдаемые при увеличении концентрации пероксида водорода на длинах волн 458 и 488 нм, однонаправлены, что также ведет к снижению чувствительности метода (Belousov V.V., Fradkov A.F., Lukyanov K.А., Staroverov D.B., Shakhbazov K.S., Terskikh A.V., and Lukyanov S. Genetically encoded fluorescent indicator for intracellular hydrogen peroxide // Nat. Methods. 2006. V. 3. P. 281-286.). B-четвертых, описанный способ ориентирован на оценку продукции пероксида водорода только в цитоплазме клеток и не позволяет определять локальные изменения концентрации пероксида в отдельных органеллах клетки, например, в митохондриях, и выявить взаимосвязь между ними.
В задачу изобретения положено создание нового способа оценки содержания пероксида водорода в цитоплазме и митохондриях опухолевых клеток, экспрессирующих флуоресцентный белок HyPer, чувствительный к изменению концентрации пероксида водорода, при фотодинамическом воздействии.
Техническим результатом от использования предлагаемого изобретения является возможность определения места и времени образования пероксида водорода в облученной опухолевой клетке, а также выявление дозовой зависимости.
Поставленная задача достигается тем, что в способе оценки содержания пероксида водорода в опухолевых клетках, включающем воздействие на опухолевые клетки противоопухолевым препаратом, измерение внутриклеточного содержания пероксида водорода методом лазерной сканирующей микроскопии с помощью флуоресцентного сенсора, в качестве которого используют генетически кодируемый белок HyPer, определение интенсивности сигнала флуоресценции при возбуждении сенсора на разных длинах волн, расчет величины отношения между интенсивностью сигнала при возбуждении на разных длинах волн, по которой и судят о внутриклеточном содержании пероксида водорода, в качестве противоопухолевого препарата используют фотосенсибилизатор, после накопления фотосенсибилизатора клетками запускают фотодинамическую реакцию посредством облучения клеток лазером с длиной волны, соответствующей спектральному диапазону поглощения фотосенсибилизатора, возбуждение сенсора осуществляют последовательно на длинах волн 405 нм и 488 нм, регистрируя флуоресценцию в диапазоне 500-560 нм, после чего рассчитывают величину отношения между интенсивностью сигнала флуоресценции при возбуждении на длине волны 488 нм к интенсивности сигнала флуоресценции при возбуждении на длине волны 405 нм (I488/I405); в качестве клеток используют стабильно трансфицированные линии опухолевых клеток, экспрессирующие белок HyPer в цитоплазме и митохондриях клеток, например, клетки эпидермоидной карциномы кожи человека А-431; в качестве фотосенсибилизатора используют макроциклические тетрапиррольные красители с концентрацией 1-10 мкмоль/л; фотодинамическую реакцию запускают через 30-240 минут после добавления фотосенсибилизатора в среду инкубации; облучение клеток лазером осуществляют в дозе от 5 до 50 Дж/см2; регистрацию флуоресценции проводят до фотодинамического воздействия и каждые 1-4 минут после фото динамического воздействия на протяжении времени, в течение которого клетки сохраняют свою жизнеспособность.
На фиг. 1 представлены флуоресцентные изображения, иллюстрирующие внутриклеточную локализацию препарата «Фотосенс» в клетках линии A431-HyPer-cyto (цитоплазма), A431-HyPer-mito (митохондрии) и в клетках линии А431, окрашенных специфическими красителями на органеллы (аппарат Гольджи, лизосомы, ЭПР). Время инкубации с препаратом «Фотосенс» - 30 минут, концентрация - 5 мкмоль/л. Зеленый канал - λex 488 нм, λem 500-550 нм, красный канал - λex 633 нм, λem 650-735 нм. Размер линейки 20 мкм.
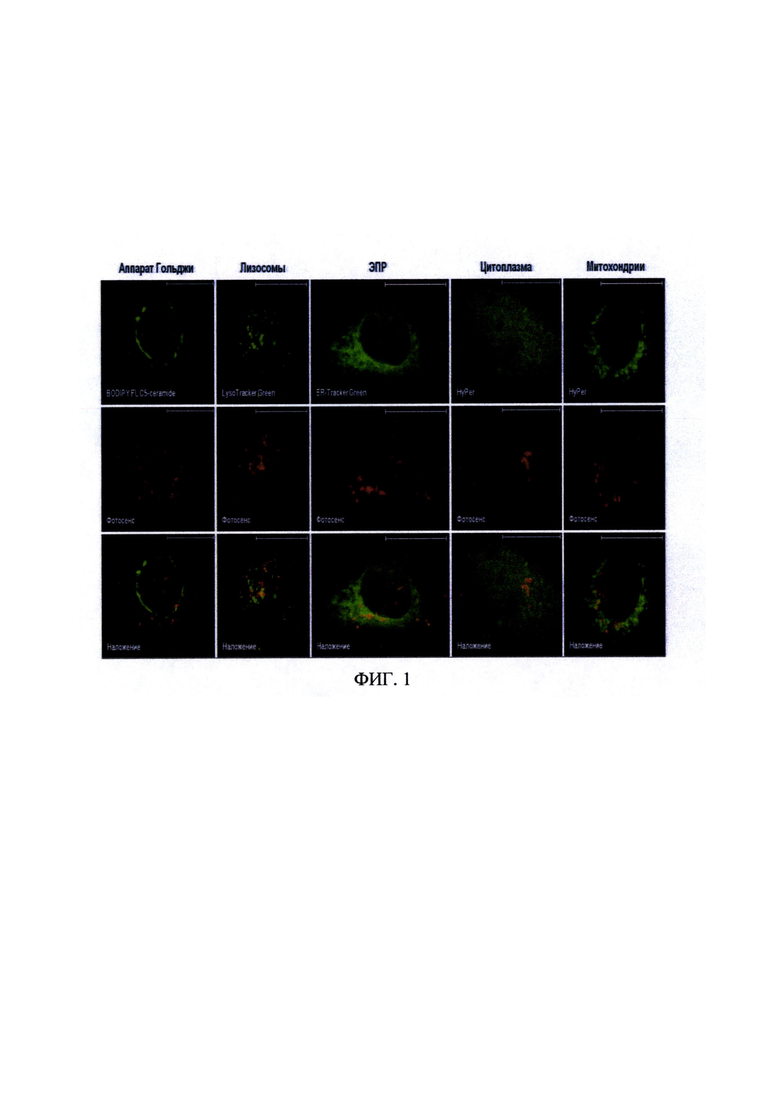
На фиг. 2 представлены флуоресцентные изображения, иллюстрирующие внутриклеточную локализацию тетра(4-бензилоксифенил)тетрацианопорфиразина (Pz I) в клетках линии А431 - HyPer-cyto. Время инкубации с Pz I - 2 часа, концентрация - 5 мкмоль/л. Зеленый канал - λех 488, λem 500-550 нм, красный канал - λex 594, λem 600-670 нм. Размер линейки 20 мкм.
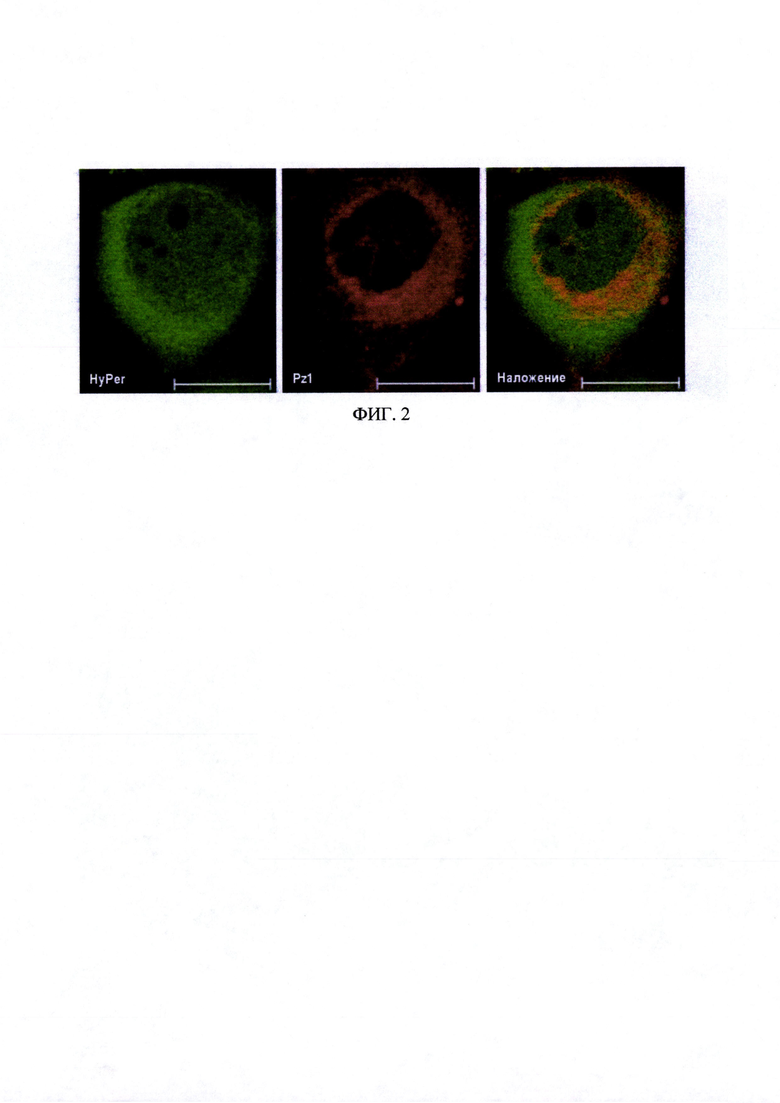
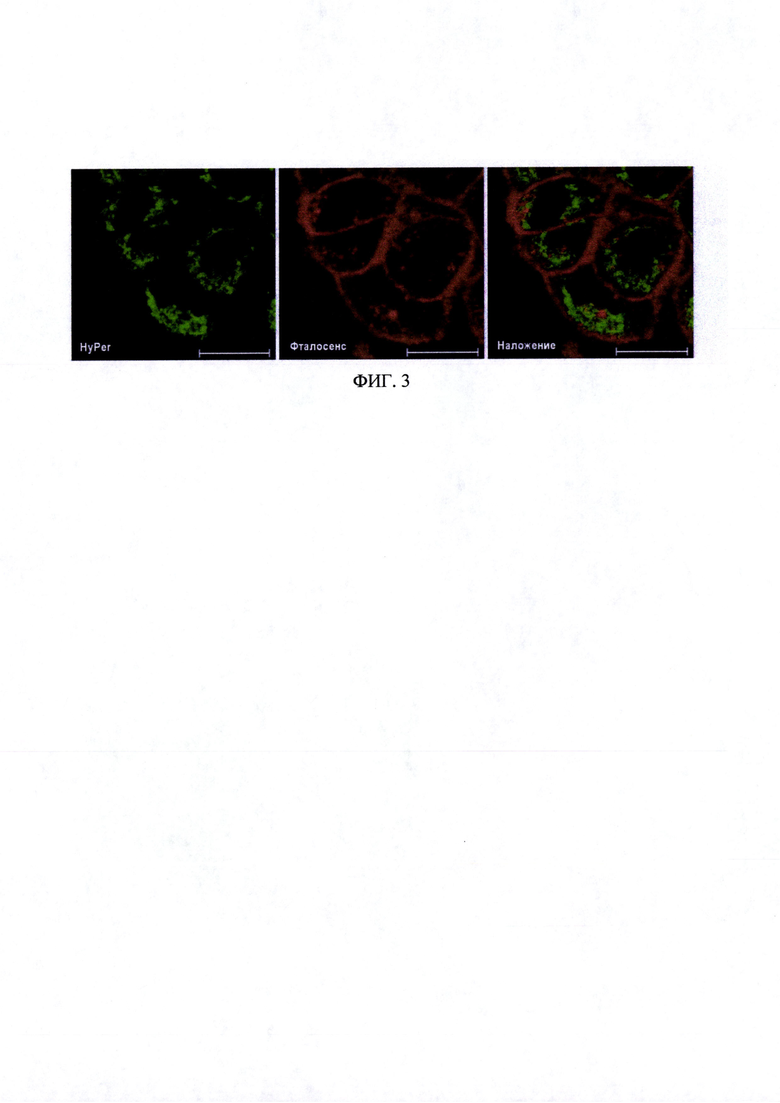
На фиг. 3 представлены флуоресцентные изображения клеток линии A431-HyPer-mito, предынкубированных с препаратом «Фталосенс». Время инкубации с препаратом «Фталосенс» - 30 минут, концентрация - 10 мкг/мл. Зеленый канал - λех 488, λem 500-550 нм, красный канал - λех 488, λem 650-710 нм. Размер линейки 20 мкм.
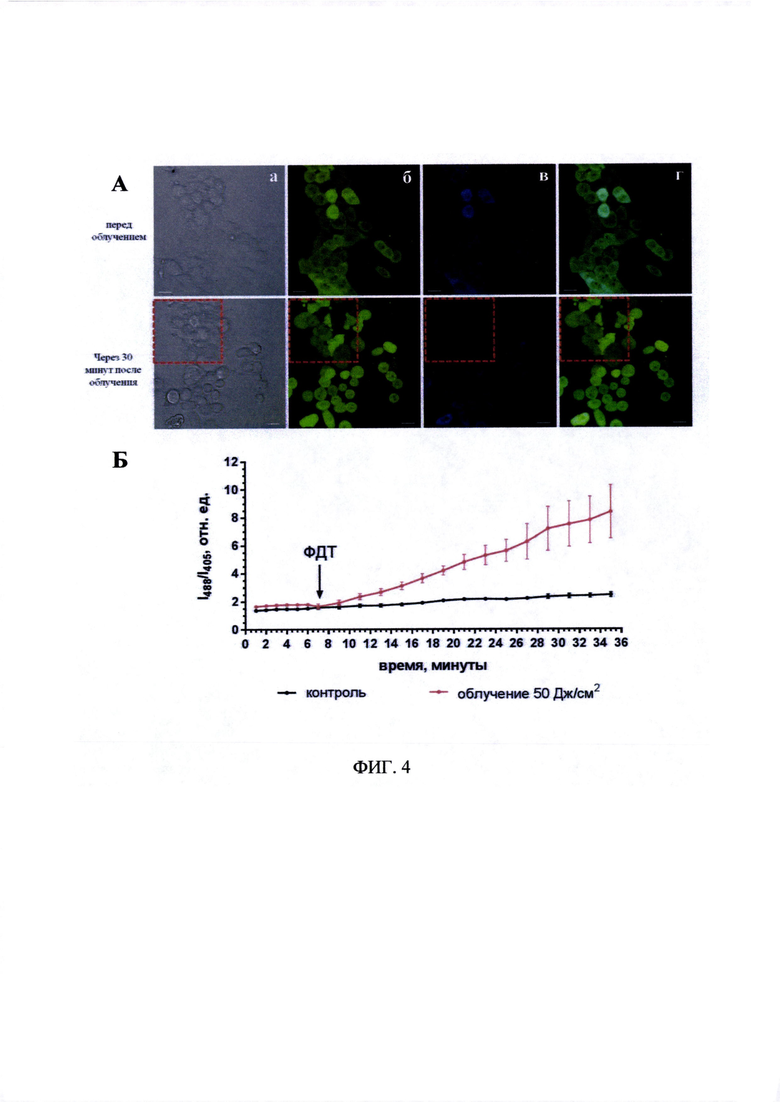
На фиг. 4А представлены флуоресцентные изображения клеток линии A431-HyPer-cyto, предынкубированных с препаратом «Фотосенс», до и через 30 минут после фото динамического воздействия в дозе 50 Дж/см2. Время инкубации с препаратом «Фотосенс» - 30 минут, концентрация - 5 мкмоль/л.
а - клетки в проходящем свете;
б - флуоресценция белка HyPer. Зеленый канал - λех 488, λem 500-550 нм;
в - флуоресценция белка HyPer. Синий канал - λех 405, λem 500-550 нм;
г - флуоресценция белка HyPer. Наложение зеленого и синего каналов - λех 488+405, λem 500-550 нм. Размер линейки 20 мкм. Пунктиром выделена область, которая подвергалась фотодинамическому воздействию.
На фиг. 4Б представлен график изменений относительного уровня пероксида водорода до и после облучения клеток A431-HyPer-cyto, предынкубированных с препаратом «Фотосенс», оцененного по соотношению флуоресценции при разных длинах волн возбуждения (I488/I405). Время инкубации с препаратом «Фотосенс» - 30 минут, концентрация - 5 мкмоль/л, доза облучения - 50 Дж/см2. ФДТ - момент фотодинамического воздействия. Планки погрешностей представлены стандартным отклонением.
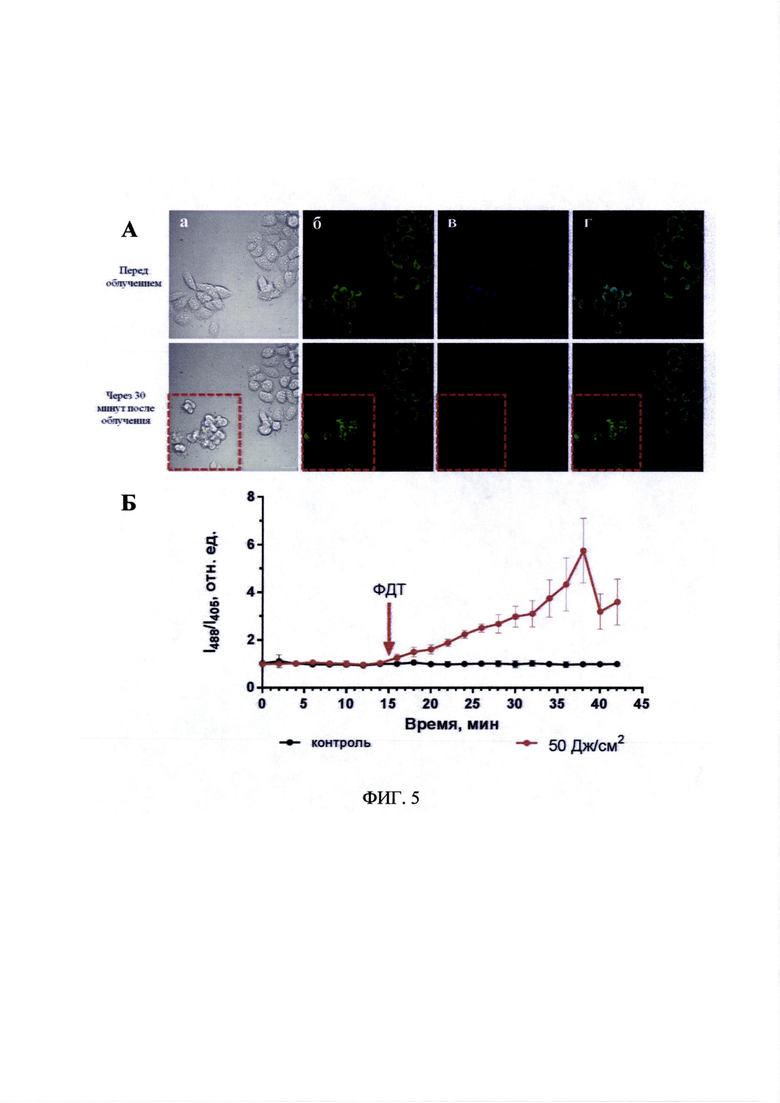
На фиг. 5А представлены изображения клеток линии А431-HyPer-mito, предынкубированных с препаратом «Фталосенс» через 30 минут после облучения. Время инкубации с препаратом «Фталосенс» - 30 минут, концентрация - 10 мкг/мл, доза облучения - 50 Дж/см2.
а - клетки в проходящем свете;
б - флуоресценция белка HyPer. Зеленый канал - λex 488, λem 500-550 нм;
в - флуоресценция белка HyPer. Синий канал - λex 405, λem 500-550 нм;
г - флуоресценция белка HyPer. Наложение зеленого и синего каналов - λex 488+405, λem 500-550 нм.
Размер линейки 20 мкм. Пунктиром выделена область, которая подвергалась фотодинамическому воздействию.
На фиг. 5Б представлен график изменений относительного уровня пероксида водорода до и после облучения клеток A431-HyPer-mito, предынкубированных с препаратом «Фталосенс», оцененного по соотношению флуоресценции при разных длинах волн возбуждения (I488/I405). Время инкубации с препаратом «Фталосенс» - 30 минут, концентрация - 10 мкг/мл, доза облучения - 50 Дж/см2. ФДТ - момент фотодинамического воздействия. Планки погрешностей представлены стандартным отклонением.
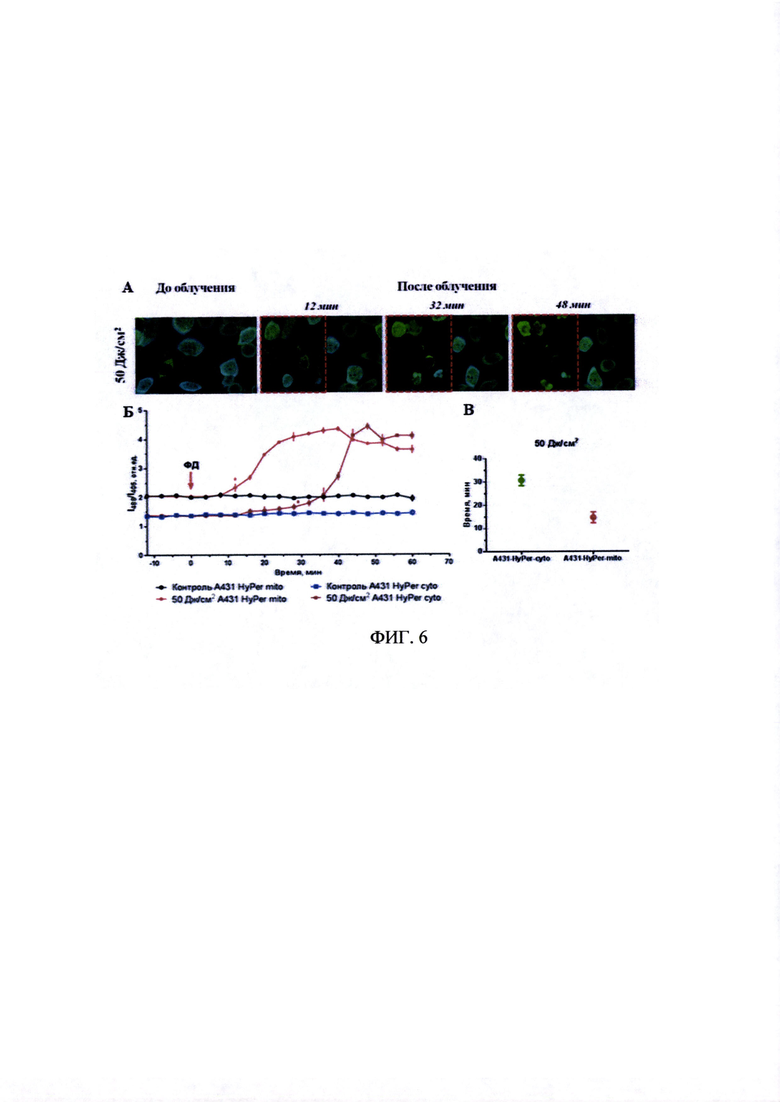
На фиг. 6А представлены флуоресцентные изображения клеток смешанной культуры A431-HyPer-cyto и A431-HyPer-mito, предынкубированных с тетра(4-бензилоксифенил)тетрацианопорфиразином Pz I. Время инкубации с Pz I - 4 часа, концентрация - Pz I - 5 мкмоль/л. Показано наложение синего и зеленого каналов - λех 488+405, λem 500-550 нм. Размер изображений 184×128 мкм.
На фиг. 6Б - график изменений относительного уровня пероксида водорода, оцененного по соотношению I488/I405. ФД - фото динамическое воздействие. Статистически значимое отличие от необлученной области (р<0.0001, критерий Сидака) наблюдалось с временной точки, отмеченной «*», и далее.
На фиг. 6В - представлен график, иллюстрирующий интервал от окончания облучения до момента появления отличий в относительном содержании уровня пероксида водорода между клетками контрольной и облученной областей смешанной культуры A431-HyPer-cyto и А431-HyPer-mito, предынкубированной с тетра(4-бензилоксифенил)тетрацианопорфиразином. Значения статистически значимо отличаются (р<0.001, t-тест).
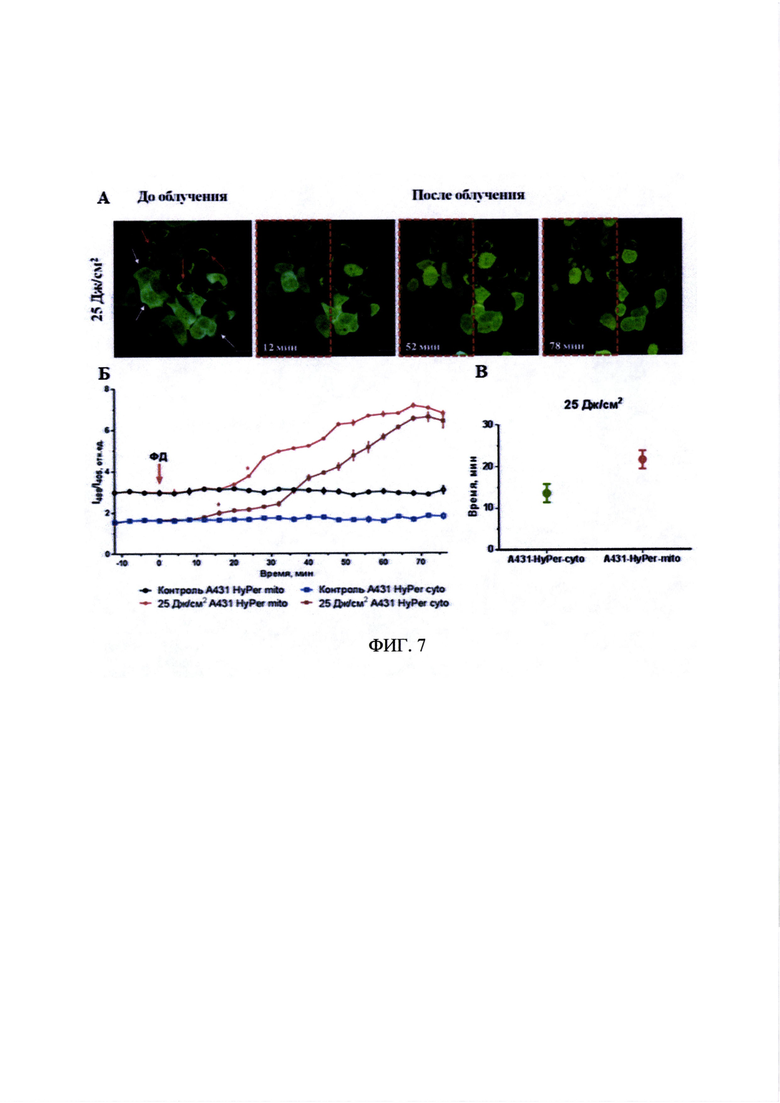
На фиг. 7А представлены изображения смешанной культуры А431-HyPer-cyto и A431-HyPer-mito, предынкубированной с препаратом «Фотосенс», до и через различные промежутки времени после облучения. Время инкубации с препаратом «Фотосенс» - 4 часа, концентрация - 5 мкмоль/л, доза облучения - 25 Дж/см2. Клетки А431 с экспрессией HyPer в цитоплазме клеток отмечены белой стрелкой, клетки А431 с экспрессией HyPer в митохондриях - красной. Размер изображений 212×212 мкм. Показано наложение синего - λex 405, λem 500-550 нм и зеленого - λex 488, λem 500-550 нм каналов. Пунктиром выделена область, которая подвергалась фотодинамическому воздействию.
На фиг. 7Б представлен график изменения относительного уровня пероксида водорода до и после облучения клеток А431-HyPer-cyto и А431-HyPer-mito, предынкубированных с препаратом «Фотосенс», оцененного по соотношению флуоресценции при разных длинах волн возбуждения (I488/I405). Время инкубации с препаратом «Фотосенс» - 4 часа, концентрация - 5 мкмоль/л, доза облучения - 25 Дж/см2. Планки погрешностей представлены стандартным отклонением. Статистически значимое отличие от контроля (р<0.0001, критерий Сидака) наблюдалось с временной точки, отмеченной «*» и далее.
На фиг. 7В представлен график, иллюстрирующий интервал от окончания облучения до момента появления отличий в относительном содержании уровня пероксида водорода между клетками контрольной и облученной областей смешанной культуры А431-HyPer-cyto и А431-HyPer-mito, предынкубированной с препаратом «Фотосенс». Планки погрешностей представлены стандартным отклонением. Значения статистически значимо отличаются (р<0.001, t-тест).
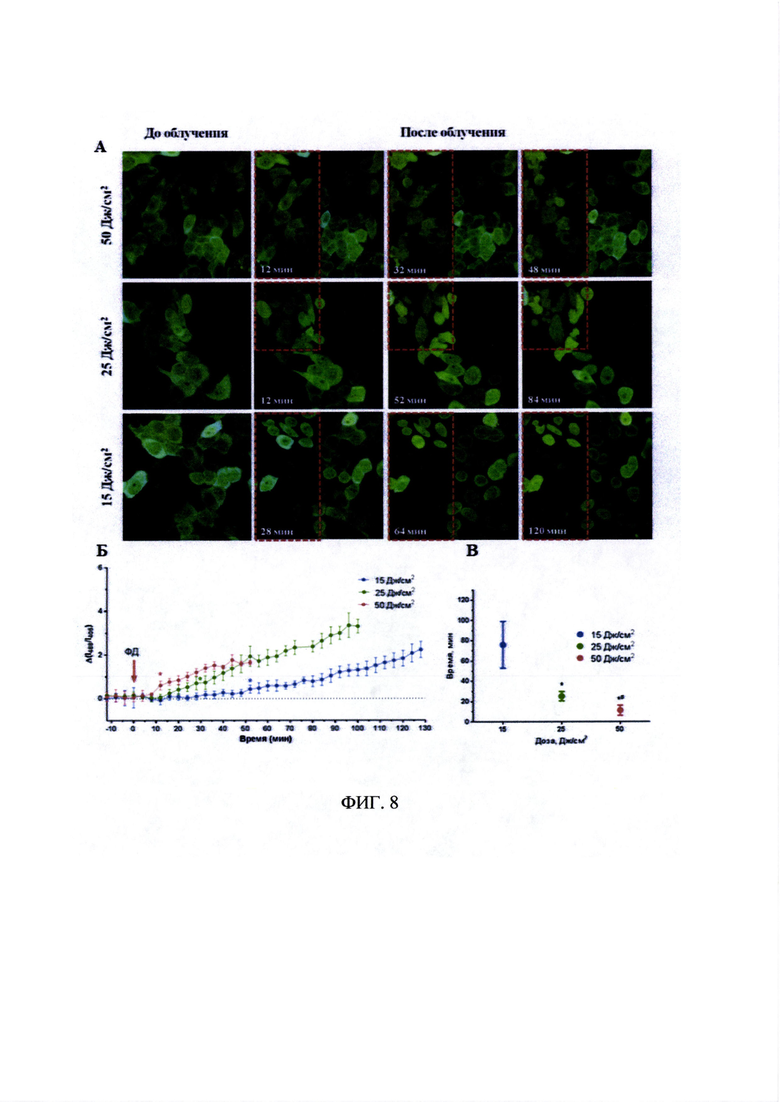
На фиг. 8А представлены изображения клеток А431-HyPer-cyto, предынкубированные с препаратом «Фотосенс» до и через различные промежутки времени после облучения в различных дозах. Время инкубации с препаратом «Фотосенс» - 4 часа, концентрация - 5 мкмоль/л. Размер изображений 212×212 мкм. Показано наложение синего - λех 405, λem 500-550 нм и зеленого - λех 488, λem 500-550 нм каналов. Пунктиром выделена область, которая подвергалась фотодинамическому воздействию.
На фиг.8Б представлен график изменений относительного уровня пероксида водорода до и после облучения клеток А431-HyPer-cyto, предынкубированных с препаратом «Фотосенс», оцененного по соотношению флуоресценции при разных длинах волн возбуждения (I488/I405). Время инкубации с препаратом «Фотосенс» - 4 часа, концентрация - 5 мкмоль/л. Δ(I488/I405)=(I488/I405) облуч - (I488/I405) контр. Показано различие между значениями I488/I405 в облученных клетках по сравнению с необлученными. Планки погрешностей представлены стандартным отклонением. Статистически значимое отличие от контроля (р<0.0001 для 50 Дж/см2; р<0.001 для 25 Дж/см2; р<0.01 для 15 Дж/см2) наблюдалось с временной точки, отмеченной «*» и далее.
На фиг. 8В представлен график, иллюстрирующий интервал от окончания облучения до момента появления отличий в относительном содержании пероксида водорода между клетками контрольной и облученной областей культуры А431-HyPer-cyto, предынкубированной с препаратом «Фотосенс», оцененный по соотношению флуоресценции при разных длинах волн возбуждения (I488/I405). Время инкубации с препаратом «Фотосенс» - 4 часа, концентрация - 5 мкмоль/л. Планки погрешностей представлены стандартным отклонением. * - статистически значимое отличие от дозы в 15 Дж/см2 (р<0.001); # - статистически значимое отличие от дозы в 25 Дж/см2 (р<0.01); ANOVA и критерий Тьюки.
Предлагаемый способ оценки содержания пероксида водорода в опухолевых клетках при фотодинамическом воздействии осуществляют следующим образом.
Для осуществления способа используют стабильно трансфицированные линии клеток эпидермоидной карциномы кожи человека А-431, экспрессирующие белок HyPer в цитоплазме и митохондриях клеток. Выбор клеточной модели обусловлен тем, что наиболее часто фотодинамическая терапия применяется именно при раке кожи. В случае А431 -HyPer-cyto флуоресцентный белок HyPer диффузно распределяется в цитоплазме и ядре клеток. В случае A431-HyPer-mito флуоресцентный белок HyPer локализуется в митохондриях. Флуоресцентного сигнала в других компартментах не наблюдается.
В качестве фотосенсибилизатора используют макроциклические тетрапиррольные красители с концентрацией 1-10 мкмоль/литр, например: «Фотосенс» или «Фталосенс» (ФГУП ГНЦ «НИОПИК», Россия), или фотосенсибилизаторы порфиразинового ряда (RU 2621710 С1, кл. C07D 487/22, C07D F5/00, опубл. 07.06.2017 г.). Анализ внутриклеточной локализации ФС с использованием клеточных линий с экспрессией флуоресцентного белка HyPer в цитоплазме и митохондриях, а также красителей, специфично окрашивающих такие органеллы как аппарат Гольджи, лизосомы и ЭПР показал следующее:
Препарат «Фотосенс» не накапливается в таких органеллах как ЭПР, ядро и митохондрии клеток. В большей степени для препарата «Фотосенс» характерна локализация в везикулах диаметром 1-5 мкм - лизосомах и, по-видимому, эндосомах клетки. Некоторое количество данного красителя присутствует в аппарате Гольджи (фиг. 1).
Тетра(4-бензилоксифенил)тетрацианопорфиразин (Pz 1) накапливается в околоядерной области клетки (фиг. 2).
Препарат «Фталосенс» преимущественно окрашивает плазматическую мембрану клетки (фиг. 3).
Облучение клеток, предынкубированных с фотосенсибилизатором, осуществляют через объектив микроскопа с использованием лазера. Дозу облучения рассчитывают с учетом следующих параметров: время нахождения в пикселе, размер и разрешение кадра, мощность лазера на объективе.
Мониторинг продукции пероксида водорода в клетке осуществляют на установке для лазерной сканирующей микроскопии, например, Axio Observer Z1 LSM-710 DUO NLO (Carl Zeiss, Германия). Для возбуждения флуоресценции HyPer используют лазеры с длиной волны 405 нм и 488 нм, максимально близко соответствующие пикам спектра возбуждения. Возбуждение осуществляют последовательно, флуоресценцию регистрируют в диапазоне 500-560 нм с одинаковыми параметрами усиления. В качестве параметра, характеризующего содержание пероксида водорода, используют отношение регистрируемого сигнала флуоресценции при разных длинах волн возбуждения (I488/I405).
Фотодинамическую реакцию запускают через 30-240 минут после добавления фотосенсибилизатора в среду инкубации.
Облучение клеток лазером осуществляют в дозе от 5 до 50 Дж/см2.
Регистрацию флуоресценции проводят до фотодинамического воздействия и каждые 1-4 минуты после фотодинамического воздействия на протяжении времени, в течение которого клетки сохраняют свою жизнеспособность.
Указанные выше действия позволят определить место и время образования пероксида водорода в облученной опухолевой клетке, а также выявить дозовую зависимость процесса за счет использования клеточных линий, экспрессирующих пероксидчувствительный флуоресцентный белок HyPer в цитоплазме и митохондриях клеток, и применения высокочувствительного ратиометрического подхода, с помощью которого возможно проведение измерения концентрации пероксида водорода в сложной внутриклеточной среде в режиме реального времени методом лазерной сканирующей флуоресцентной микроскопии.
В дальнейшем это позволит судить о роли пероксида водорода в развитии ответа клетки на фотодинамическое воздействие и локальной передаче сигнала. В то же время, это знание будет способствовать направленной разработке новых эффективных противоопухолевых препаратов, снижению их побочных эффектов, модификации существующих фотосенсибилизаторов.
Ниже представлены примеры осуществления предлагаемого изобретения.
Пример 1.
Для мониторинга продукции пероксида водорода клетки А431-HyPer-cyto с экспрессией флуоресцентного белка HyPer в цитоплазме выращивали в тонкодонных чашках Петри в концентрации 100000 клеток на чашку. Все эксперименты проводили в условиях камеры микроскопа, обеспечивающей контроль температуры 37°С и содержания CO2 в атмосфере 5%. В качестве фотосенсибилизатора использовали препарат «Фотосенс». Время инкубации клеток с препаратом «Фотосенс» (5 мкмоль/литр) составляло 30 минут. Для запуска фотодинамической реакции клетки, предынкубированные с препаратом «Фотосенс», облучались в дозе 50 Дж/см2. Облучение клеток осуществляли через объектив микроскопа с использованием лазера с длиной волны 633 нм. Световому воздействию подвергали только 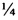 часть поля зрения, что позволило использовать необлученную часть клеток в качестве контроля и учитывать возможное влияние светового воздействия при получении серии изображений, а также при продолжительной инкубации клеток с ФС.
часть поля зрения, что позволило использовать необлученную часть клеток в качестве контроля и учитывать возможное влияние светового воздействия при получении серии изображений, а также при продолжительной инкубации клеток с ФС.
На фиг. 4А хорошо видно, что в облученной области через 30 минут после фотодинамического воздействия наблюдается «ошаривание» клеток (клетки открепляются от субстрата) и «пузырение» мембран клеток, что свидетельствует об их фотоиндуцированном повреждении. Анализ флуоресцентных изображений показал, что в течение всего времени после светового воздействия происходит усиление интенсивности флуоресценции HyPer в зеленом канале (возбуждение при 488 нм) и снижение интенсивности в синем канале (возбуждение при 405 нм), что свидетельствует об увеличении концентрации пероксида водорода в цитоплазме клеток после светового воздействия. Следует отметить, что в необлученной зоне также происходили изменения, однако существенно менее выраженные. Кроме того, подобные изменения были характерны и для клеток, которые длительное время инкубировались с препаратом «Фотосенс», но не мониторировались (находились за пределами поля зрения при динамическом наблюдении). Наблюдаемые явления позволяют говорить о значимом цитотоксическом действии препарата на клетки как при облучении, так и в его отсутствие, несмотря на то, что в длительных экспериментах по определению IC50 использованная концентрация препарата «Фотосенс» (5 мкмоль/литр) не оказывала влияния на жизнеспособность культуры клеток в отсутствие облучения. Кроме этого, нельзя исключать возможность того, что эффекты в клетках, находящихся вблизи от области фотодинамического воздействия, могут быть обусловлены распространением сигналов или повреждающих агентов от облученных клеток.
По результатам мониторинга были проанализированы данные по нескольким из облученных клеток, по усредненным данным построены динамические кривые, отражающие содержание пероксида водорода в клетке при развитии фотодинамического воздействия. На фиг. 4Б хорошо видно, что до светового воздействия соотношение сигналов I488/I405 практически не изменялось. При этом после фотодинамического воздействия в облученной зоне наблюдалось быстрое увеличение соотношение I488/I405 в течение всего времени наблюдения вплоть до 6 раз. В необлученной зоне значение этого показателя увеличивалось незначительно.
Таким образом, предложенный способ позволил провести мониторинг изменения уровня пероксида водорода в клетках А431-HyPer-cyto при фотодинамическом воздействии с использованием препарата «Фотосенс». Зарегистрировано увеличение показателя I488/I405, свидетельствующего о повышении содержания пероксида водорода в цитоплазме клеток и коррелирующего с их фотоиндуцированными изменениями.
Пример 2.
Осуществляли как пример 1, только использовали клетки А431-HyPer-mito с экспрессией флуоресцентного белка HyPer в митохондриях и препарат из группы фталоцианинов - «Фталосенс» - в концентрации 10 мкг/мл.
На фиг. 5А хорошо видно, что в облученной области наблюдалось последовательное ухудшение состояния клеток: мембраны клеток образовывались пузыри, сами клетки сжимались, что можно рассматривать как признаки фотоиндуцированной гибели клеток.
Ухудшение состояния клеток сопровождалось усилением интенсивности флуоресценции HyPer в «зеленом» канале (возбуждение при 488 нм) и снижением интенсивности в «синем» канале (возбуждение при 405 нм), что свидетельствует об увеличении концентрации пероксида водорода.
Была проведена количественная оценка наблюдаемых изменений. Перед облучением клетки в поле зрения микроскопа наблюдали в течение 15 минут, при этом каких-либо значимых изменений I488/I405 за это время обнаружено не было, что подтверждает «щадящий» режим при получении изображений. После фотодинамического воздействия в облученной зоне отношение I488/I405 постепенно увеличивалось вплоть до 5-6 раз относительно исходного (фиг. 5Б, красная линия). Важно отметить, что при этом значения данного показателя в контрольной области оставались неизменными (фиг. 5Б, черная линия).
Таким образом, предложенный подход позволил зарегистрировать в динамике увеличение количества пероксида водорода в клетках в ответ на фотодинамическое воздействие. Снижение I488/I405 в последние минуты наблюдения (фиг. 5Б) обусловлено гибелью облученных клеток.
Пример 3.
Осуществляли как пример 1 и 2, только использовали смешанную культуру А431-HyPer-cyto и A431-HyPer-mito с экспрессией флуоресцентного белка HyPer в цитоплазме и митохондриях клеток соответственно и фотосенсибилизатор из группы порфиразинов - тетра(4-бензилоксифенил)тетрацианопорфиразин в концентрации 5 мкмоль/литр.
На фиг. 6А видно, что уже через 48 минут в облученной области наблюдалось ухудшение состояния клеток, которое выражалось в их «ошаривании», что может свидетельствовать о фотодинамической гибели этих клеток.
На фиг. 6Б и 6В хорошо видно, что значение отношения I488/I405 HyPer для митохондрий превосходит таковое для цитоплазмы, что может отражать особенности окислительного метаболизма этих органелл. Кроме того, HyPer характеризуется выраженной рН-чувствительностью.
Было определено, что порфиразин индуцирует вторичное накопление пероксида водорода, при этом наиболее интересным зарегистрированным эффектом является отставание по времени ответа цитоплазмы на 15-20 минут. Такая задержка согласуется с литературными данными о роли митохондрий в развитии вторичной продукции активных форм кислорода (АФК) при ответе на фотодинамическое воздействие. Ранее в ряде работ отмечалось, что важный вклад в этот процесс вносит нарушение работы электрон-транспортных цепей в мембранах митохондрий (Chernyak B.V., Izyumov D.S., Lyamzaev K.G., Pashkovskaya A.A., Pletjushkina O.Y., Antonenko Y.N., Sakharov D.V., Wirtz K.W.A., Skulachev V.P. 2006. Production of reactive oxygen species in mitochondria of HeLa cells under oxidative stress. Biochimica et Biophysica Acta. 1757, 525-534.; Zhao H, Xing D., Chen Q. 2011. New insights of mitochondria reactive oxygen species generation and cell apoptosis induced by low dose photodynamic therapy. European Journal of Cancer. 47 (18), 2750-2761; Yu Z., Sun Q., Pan W., Li N., Tang B. 2015. A Near-Infrared Triggered Nanophotosensitizer inducing domino effect on mitochondrial reactive oxygen species burst for cancer therapy. ACS Nano. 24; 9 (11), 11064-11074.). Судя no полученным нами результатам, при использовании препарата «Фотосенс» определяющим в увеличении уровня пероксида водорода в клетке может являться не изменение функционирования митохондрий, а другой фактор. В частности, смещению прооксидантно-антиоксидантного баланса может способствовать снижение активности каталазы и других антиоксидантных ферментов (Luo J., Li L., Zhang Y., Spitz D.R., Buettner G.R., Oberley L.W., Domann F.E. 2006. Inactivation of primary antioxidant enzymes in mouse keratinocytes by photodynamically generated singlet oxygen. Antioxid. Redox. Signal. 8 (7-8), 1307-1314), активация ксантиноксидазы (Chekulayeva L.V., Shevchuk I.N., Chekulayev V.A., Ilmarinen K.J. 2006. Hydrogen peroxide, superoxide, and hydroxyl radicals are involved in the phototoxic action of hematoporphyrin derivative against tumor cells. Environ. Pathol. Toxicol. Oncol. 25 (1-2), 51-77), истощение пула низкомолекулярных антиоксидантов.
Пример 4.
Осуществляли, как пример 3, только в качестве фотосенсибилизатора использовали препарат «Фотосенс» и дозу облучения 25 Дж/см2.
После фотодинамического воздействия (ФД) в облученной области наблюдалось постепенное ухудшение состояния клеток, что можно рассматривать как признаки фотоиндуцированной гибели клеток. Ухудшение состояния клеток сопровождалось усилением интенсивности флуоресценции HyPer в зеленом канале (возбуждение при 488 нм) и снижением интенсивности в синем канале (возбуждение при 405 нм), что свидетельствует об увеличении концентрации пероксида водорода (фиг. 7А).
Была проведена также количественная оценка наблюдаемых изменений отношения I488/I405 в облученной и необлученной контрольной областях в нескольких независимых экспериментах (фиг. 7Б). Было показано, что исходно более высокое значение отношений I488/I405 было зарегистрировано в митохондриях по сравнению с клетками с HyPer в цитоплазме.
Накопление пероксида водорода в митохондриях в ответ на фотодинамическое воздействие в дозе 25 Дж/см2 наблюдалось примерно на 10 минут позже, чем в цитоплазме (фиг. 7В).
Увеличение содержания пероксида водорода в течение сравнительно длительного времени после облучения позволяет говорить о его продукции в ходе вторичных процессов, развивающихся как следствие фотодинамического воздействия.
Пример 5.
Осуществляли как пример 1, только использовали различные дозы
облучения: 15 Дж/см2, 25 Дж/см2, 50 Дж/см2.
Для выявления дозового эффекта проанализирована динамика ответа клетки на фотодинамическое воздействие при различных дозах облучения. На клетках с экспрессией HyPer в цитоплазме с препаратом «Фотосенс» (5 мкмоль/литр) были исследованы особенности ответа на облучение в дозах 50, 25 и 15 Дж/см2.
На фиг. 8А хорошо видно, что в облученной области на протяжении всего времени наблюдения после окончания фотодинамического воздействия наблюдалось последовательное ухудшение состояния клеток.
При количественной оценке наблюдаемых изменений в соотношении флуоресценции HyPer при разных длинах волн возбуждения (I488/I405) было показано, что основной эффект варьирования световой дозы заключается в появлении/длительности задержки между облучением сенсибилизированных клеток и ответным увеличением содержания пероксида водорода (фиг. 8Б). Длительность интервала увеличивается с уменьшением дозы светового воздействия (фиг. 8Б). Если увеличение I488/I405 при облучении в дозе 50 Дж/см2 наступает практически сразу (не более 4-12 минут), то при снижении дозы до 25 Дж/см2 интервал составляет около 20-32 минут, а при 15 Дж/см2 он увеличивается до 60-90 минут и более (фиг. 8В).
Такой отложенный ответ на воздействие подтверждает предположение о том, что накопление пероксида водорода является следствием развивающегося вторичного ответа. Это может быть обусловлено истощением пула антиоксидантов, нарушением работы белков-ферментов, увеличением утечки электронов на кислород при работе электрон-транспортных цепей.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЦЕНКИ СОДЕРЖАНИЯ ПЕРОКСИДА ВОДОРОДА В ОПУХОЛЕВЫХ КЛЕТКАХ ПРИ ВОЗДЕЙСТВИИ НА НИХ ПРОТИВООПУХОЛЕВОГО ПРЕПАРАТА | 2012 |
|
RU2497121C1 |
| СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ ОПУХОЛЕЙ | 2012 |
|
RU2519936C2 |
| СПОСОБ ЛЕЧЕНИЯ СУБРЕТИНАЛЬНОЙ НЕОВАСКУЛЯРНОЙ МЕМБРАНЫ | 2008 |
|
RU2376957C1 |
| Способ фотодинамической терапии с контролем эффективности в режиме реального времени | 2017 |
|
RU2672806C1 |
| ФОТОСЕНСИБИЛИЗАТОРЫ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2005 |
|
RU2282646C1 |
| ФОТОСЕНСИБИЛИЗАТОР ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2012 |
|
RU2479585C1 |
| СПОСОБ ФЛУОРЕСЦЕНТНОЙ ДИАГНОСТИКИ И ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ РАКА КОЖИ | 2008 |
|
RU2373976C1 |
| Способ лечения опухолевых и воспалительных заболеваний с применением фотодинамической терапии | 2018 |
|
RU2700407C1 |
| ФОТОСЕНСИБИЛИЗАТОРЫ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2012 |
|
RU2476218C1 |
| КРАСНЫЙ ФЛУОРЕСЦЕНТНЫЙ БИОСЕНСОР ДЛЯ ДЕТЕКЦИИ ПЕРОКСИДА ВОДОРОДА В ЖИВЫХ КЛЕТКАХ | 2013 |
|
RU2535336C1 |
Изобретение относится к медицине, а именно к онкологии, и может быть использовано для оценки содержания пероксида водорода в опухолевых клетках. Для этого изучают воздействие на опухолевые клетки противоопухолевого препарата, в качестве которого используют генетически кодируемый белок HyPer. В качестве противоопухолевого препарата используют фотосенсибилизатор. После накопления фотосенсибилизатора клетками запускают фотодинамическую реакцию посредством облучения клеток лазером с длиной волны, соответствующей спектральному диапазону поглощения фотосенсибилизатора. Флуоресценцию регистрируют в диапазоне 500-560 нм. Затем методом лазерной сканирующей микроскопии с помощью флуоресцентного сенсора измеряют внутриклеточное содержание пероксида водорода последовательно на длинах волн 405 нм и 488 нм. После этого рассчитывают величину отношения между интенсивностью сигнала флуоресценции при возбуждении на длине волны 488 нм к интенсивности сигнала флуоресценции при возбуждении на длине волны 405 нм (I488/I405), по которой судят о внутриклеточном содержании пероксида водорода. Изобретение обеспечивает возможность определения места и времени образования пероксида водорода в облученной опухолевой клетке, а также выявление дозовой зависимости. 5 з.п. ф-лы, 8 ил., 5 пр.
1. Способ оценки содержания пероксида водорода в опухолевых клетках, включающий воздействие на опухолевые клетки противоопухолевым препаратом, измерение внутриклеточного содержания пероксида водорода методом лазерной сканирующей микроскопии с помощью флуоресцентного сенсора, в качестве которого используют генетически кодируемый белок НуРеr, определение интенсивности сигнала флуоресценции при возбуждении сенсора на разных длинах волн, расчет величины отношения интенсивности сигнала при возбуждении на разных длинах волн, по которой и судят о внутриклеточном содержании пероксида водорода, отличающийся тем, что в качестве противоопухолевого препарата используют фотосенсибилизатор, после накопления фотосенсибилизатора клетками запускают фотодинамическую реакцию посредством облучения клеток лазером с длиной волны, соответствующей спектральному диапазону поглощения фотосенсибилизатора, возбуждение сенсора осуществляют последовательно на длинах волн 405 нм и 488 нм, регистрируя флуоресценцию в диапазоне 500-560 нм, после чего рассчитывают величину отношения между интенсивностью сигнала флуоресценции при возбуждении на длине волны 488 нм к интенсивности сигнала флуоресценции при возбуждении на длине волны 405 нм (I488/I405).
2. Способ по п. 1, отличающийся тем, что в качестве опухолевых клеток используют стабильно трансфицированные линии опухолевых клеток, экспрессирующие белок HyPer в цитоплазме и митохондриях клеток.
3. Способ по п. 1, отличающийся тем, что в качестве фотосенсибилизатора используют макроциклические тетрапиррольные красители с концентрацией 1-10 мкмоль/л.
4. Способ по п. 1, отличающийся тем, что фотодинамическую реакцию запускают через 30-240 минут после добавления фотосенсибилизатора в среду инкубации.
5. Способ по п. 1, отличающийся тем, что облучение клеток лазером осуществляют в дозе от 5 до 50 Дж/см2.
6. Способ по п. 1, отличающийся тем, что регистрацию флуоресценции проводят до фотодинамического воздействия и каждые 1-4 мин после фотодинамического воздействия на протяжении времени, в течение которого клетки сохраняют свою жизнеспособность.
| СПОСОБ ОЦЕНКИ СОДЕРЖАНИЯ ПЕРОКСИДА ВОДОРОДА В ОПУХОЛЕВЫХ КЛЕТКАХ ПРИ ВОЗДЕЙСТВИИ НА НИХ ПРОТИВООПУХОЛЕВОГО ПРЕПАРАТА | 2012 |
|
RU2497121C1 |
| Порфиразин, порфиразиновый комплекс гадолиния и их применение | 2016 |
|
RU2621710C1 |
| ФОТОСЕНСИБИЛИЗАТОРЫ | 1994 |
|
RU2159612C2 |
| ЗЛОТИНА М.М | |||
| Флуоресцентные сенсоры, используемые для изучения роли вторичных посредников в клеточной сигнализации | |||
| Вестник СпбГУ, 2011, 3, 2, стр | |||
| Облицовка комнатных печей | 1918 |
|
SU100A1 |
| ЯКУБОВСКАЯ З.И | |||
| и др | |||
| Фталосенс - новый препарат на основе безметального фталоцианина для ФДТ рака | |||
| Российский биотерапевтический журнал, 2004, 2, 3, стр | |||
| Способ получения молочной кислоты | 1922 |
|
SU60A1 |
| Фотосенс® (Photosens®), РЛС, 14.10.2011, найдено 18.07.2019 в Интернете [on line] на сайте https://www.rlsnet.ru/tn_index_id_16351.htm. | |||
Авторы
Даты
2019-09-17—Публикация
2018-07-23—Подача