Область, к которой относится изобретение
Настоящее изобретение относится к композиции, содержащей молочнокислые бактерии, в которой молочнокислая бактерия содержит на своей поверхности происходящий из белка E7 папилломавируса человека (HPV) полипептид, к терапевтической пероральной фармацевтической композиции для по меньшей мере одного из HPV инфекционного заболевания и HPV-ассоциированной опухоли, которая включает композицию, содержащую молочнокислую бактерию, и к средству, стимулирующему мукозальный иммунитет, которое включает композицию, содержащую молочнокислую бактерию.
Предпосылки к созданию изобретения
Папилломавирусы человека (HPV) представляют собой ДНК вирусы. К настоящему времени было описано 100 или более различных типов HPV. HPV инфицируют кожу (например, HPV1 и HPV2) и мукозальную поверхность (например, HPV6 и HPV11), приводя, таким образом, к образованию доброкачественных опухолей (бородавок), существующих от нескольких месяцев до нескольких лет.
Кроме того, 15 типов HPV (например, HPV16, HPV18, HPV31, HPV33, HPV52 и HPV58) инфицируют слизистую оболочку в течение долгого периода времени, вызывая, таким образом, злокачественные опухоли. Поэтому их называют HPV повышенного риска.
Почти 100% случаев рака шейки матки, которые по числу заболеваний занимают второе место по числу заболеваний после рака молочной железы среди раковых заболеваний, специфических для женщин, развиваются в результате HPV инфекций в репродуктивных органах в течение долгого периода времени. Сообщалось о том, что у 530000 людей во всем мире и 15000 людей в Японии первично развивается рак шейки матки каждый год.
Количество смертей в год от рака шейки матки достигает 270000 в мире и 3500 в Японии.
Теоретически, если полностью предотвратить HPV инфекции, рак шейки матки можно искоренить.
Было обнаружено, что HPV инфекция ассоциирована с раком вульвы, раком анального канала, раком полости рта, раком влагалища, раком полового члена, фарингеальным раком и остроконечной кондиломой (остроконечная бородавка), помимо рака шейки матки. Поэтому профилактические вакцины против HPV инфекций считаются эффективными для предотвращения вышеописанных раковых заболеваний и заболеваний, передающихся половым путем. Однако существующие профилактические HPV вакцины могут предотвратить только два типа HPV повышенного риска.
Из HPV вирусов, HPV16 и HPV18 являются основной причиной около 65% случаев рака шейки матки у женщин в Японии, в частности, из них около 90% в двадцатилетнем возрасте.
Также известно, что HPV16 и HPV18 отвечают за немного меньше чем 50% случаев тяжелой степени интраэпителиальной неоплазии вульвы, которая предшествует развитию рака вульвы, и ассоциированы с 85% случаев развития интраэпителиальной неоплазии влагалища, которая может предшествовать раку влагалища.
Интраэпителиальные неоплазии шейки матки (CINs), которые являются поражениями, предшествующими раку шейки матки, являющиеся результатом HPV инфекции, возникают на мукозальном эпителии вагинальной части (нижняя половина или переходящая во влагалище часть шейки). HPV инфекционные заболевания являются вируснными инфекционными заболеваниями, в которых HPV вторгаются в базальные клетки мукозального эпителия (многослойный плоский эпителий) в результате небольших повреждений, вызванных сексуальными практиками, и пролиферируют в плоском эпителии. Когда HPV непрерывно пролиферируют в эпителии в течение долгого периода времени, эпителиальные клетки иммортализуются и перерождаются в рак. Это считается причиной рака шейки матки.
В процессе развития рака шейки матки, как считается, происходят следующие изменения: когда HPV непрерывно распространяется на базальные клетки, некоторые вирусные гены HPV внедряются в гены эпителиальных клеток, и, что касается белков E6 и белков E7, которые недостаточно экспрессировались, их экспрессия постоянно увеличивается.
Экспрессия E6 белков и E7 белков очень низкая в CIN1 (легкая дисплазия), что является признаком инфекции, но их экспрессия очень высокая в CIN2 (умеренная дисплазия) и в CIN3 (тяжелая дисплазия), которые малигнизировались. Поэтому, считают, что именно на CIN2 стадии или позже экспрессия E6 белков и E7 белков непрерывно повышается, как описано выше.
Считается, что E6 белки и E7 белки, особенно E7 белки HPV являются привлекательными мишенями для разработки терапевтических вакцин против HPV-ассоциированных раковых заболеваний. Это потому, что E7 белки являются высокоантигенными у человека.
Хотя уже были разработаны несколько терапевтических вакцин с использованием в качестве антигенов белков E7 HPV (например, см. NPL 1 и PTL 1), они еще не продемонстрировали, что могут устранять предшествующие поражения (CINs) и раковые клетки в шейке матки пациентов. Поэтому существует настоятельная потребность в разработке вакцин, которые демонстрируют терапевтический эффект.
Авторы настоящего изобретения обнаружили, что E7-специфический клеточный иммунный ответ может быть вызван не только в селезенках, но также в слизистых оболочках у мышей при пероральном введении вакцин (LacE7), которые получают путем экспрессии мутантных E7 белков (SEQ ID NO. 2) в Lactobacillus casei, затем подвергают термообработке для убивания и сушке с получением порошка (см. NPL 2). Мутантные белки E7 представляют собой такие, в которых Asp в положении 21, Cys в положении 24 и Glu в положении 26, участвующие в связывании с Rb белками, все заменены на Gly в белках E7 HPV.
Авторы настоящего изобретения также провели исследование, касающееся комбинации HPV E7 полипептидов и Kampo препаратов, обладающих оздоравливающей активностью, в качестве терапевтических пероральных фармацевтических композиций для HPV инфекционных заболеваний (см. PTL 2).
На основании предыдущих исследований, осуществленных авторами настоящего изобретения, терапевтическая вакцина, которая дает некоторый клинический эффект, находится в стадии разработки.
Однако терапевтическая вакцина может только вызвать регрессию от CIN3 (тяжелая дисплазия) до CIN2 (умеренная дисплазия) в стадиях, приводящих к развитию рака шейки матки, и трудно достичь нормального состояния при помощи терапевтической вакцины. Для большего улучшения клинического эффекта у пациентов, страдающих по меньшей мере одним из интраэпителиальной неоплазии шейки матки и ранней стадией рака шейки матки, так чтобы нормализовать рак, существует настоятельная потребность в быстром обеспечении терапевтической пероральной фармацевтической композиции для по меньшей мере одного из HPV инфекционного заболевания и HPV-ассоциированной опухоли, обладающей еще более лучшей способностью индуцировать мукозальный иммунитет.
Перечень цитируемых документов
Патентная литература
PTL 1: Выложенная японская патентная заявка (JP-A) № 2012-514469
PTL 2: Международная публикация № 2013/191225
Непатентная литература
NPL 1: H. Poo et al., Int J. Cancer, 2006, vol. 119, pp. 1702-1709
NPL 2: K. Adachi et al., Vaccine, 2010, vol. 28, pp. 2810-2817
Сущность изобретения
Техническая задача
Настоящее изобретение направлено на решение указанных выше задач и достижение следующей цели. Целью настоящего изобретения является получение композиции, содержащей молочнокислые бактерии, которая обладает отличной индуцирующей мукозальный иммунитет способностью, и терапевтической пероральной фармацевтической композиции для по меньшей мере одного из HPV инфекционного заболевания и HPV-ассоциированной опухоли, которая включает композицию, содержащую молочнокислые бактерии, и средства, индуцирующего мукозальный иммунитет, которое включает композицию, содержащую молочнокислые бактерии.
Решение задачи
Средства для решения указанных выше задач являются следующими.
<1> Содержащая молочнокислую бактерию композиция, включающая
молочнокислую бактерию, содержащую на своей поверхности происходящий из белка E7 папилломавируса человека (HPV) полипептид,
где происходящий из белка E7 HPV полипептид включен в количестве от 0,03 мкг до 1,0 мкг на 1 × 108 молочнокислых бактерий.
<2> Терапевтическая пероральная фармацевтическая композиция для по меньшей мере одного из HPV инфекционного заболевания и HPV-ассоциированной опухоли, включающая
содержащую молочнокислую бактерию композицию в соответствии с <1>.
<3> Средство, индуцирующее мукозальный иммунитет, включающее
содержащую молочнокислую бактерию композицию в соответствии с <1>.
Полезные эффекты изобретения
В соответствии с настоящим изобретением, при помощи нижеследующего можно решить указанные выше задачи и обеспечить достижение указанной выше цели. А именно, настоящее изобретение позволяет получить композицию, содержащую молочнокислые бактерии, которая обладает отличной индуцирующей мукозальный иммунитет способностью, и терапевтическую пероральную фармацевтическую композицию для по меньшей мере одного из HPV инфекционного заболевания и HPV-ассоциированной опухоли, которая включает содержащую молочнокислые бактерии композицию, и средство, индуцирующее мукозальный иммунитет, которое включает содержащую молочнокислые бактерии композицию.
Краткое описание чертежей
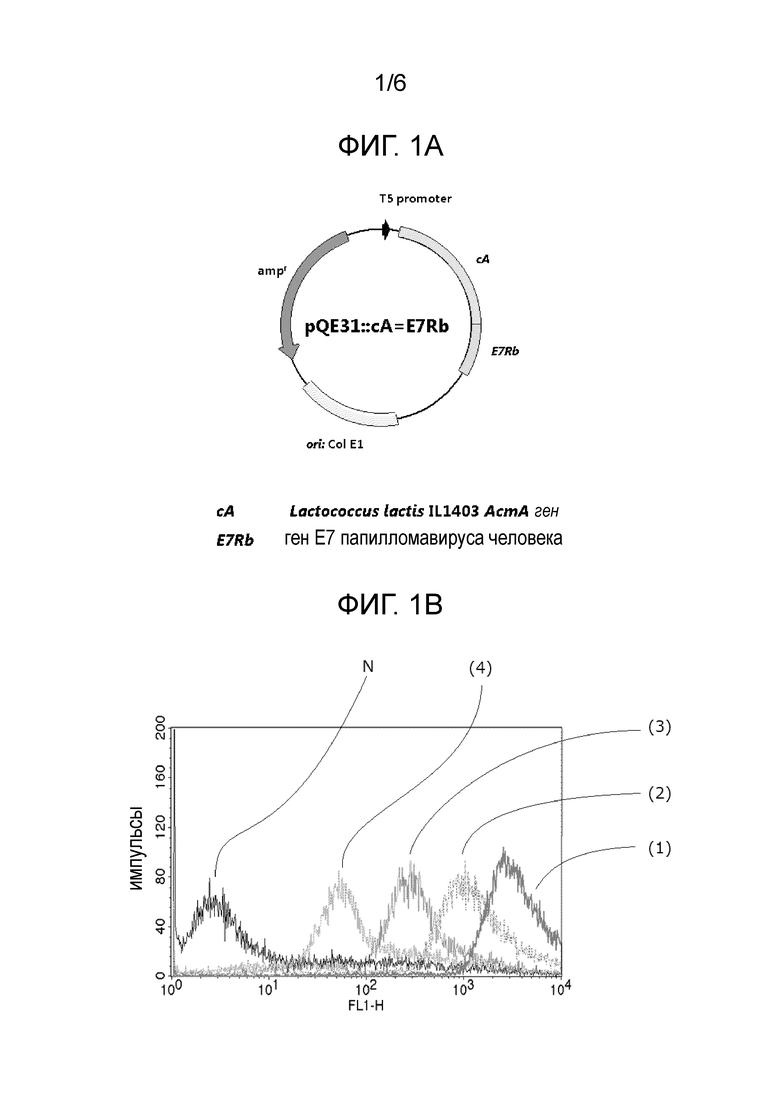
Фиг. 1A представляет схематическую диаграмму pQE31::cA=E7Rb в Примере получения 1.
Фиг. 1B представляет График-1, иллюстрирующий результат FACS анализа в Примере получения 1.
Фиг. 1C представляет График-2, иллюстрирующий результат FACS анализа в Примере получения 1.
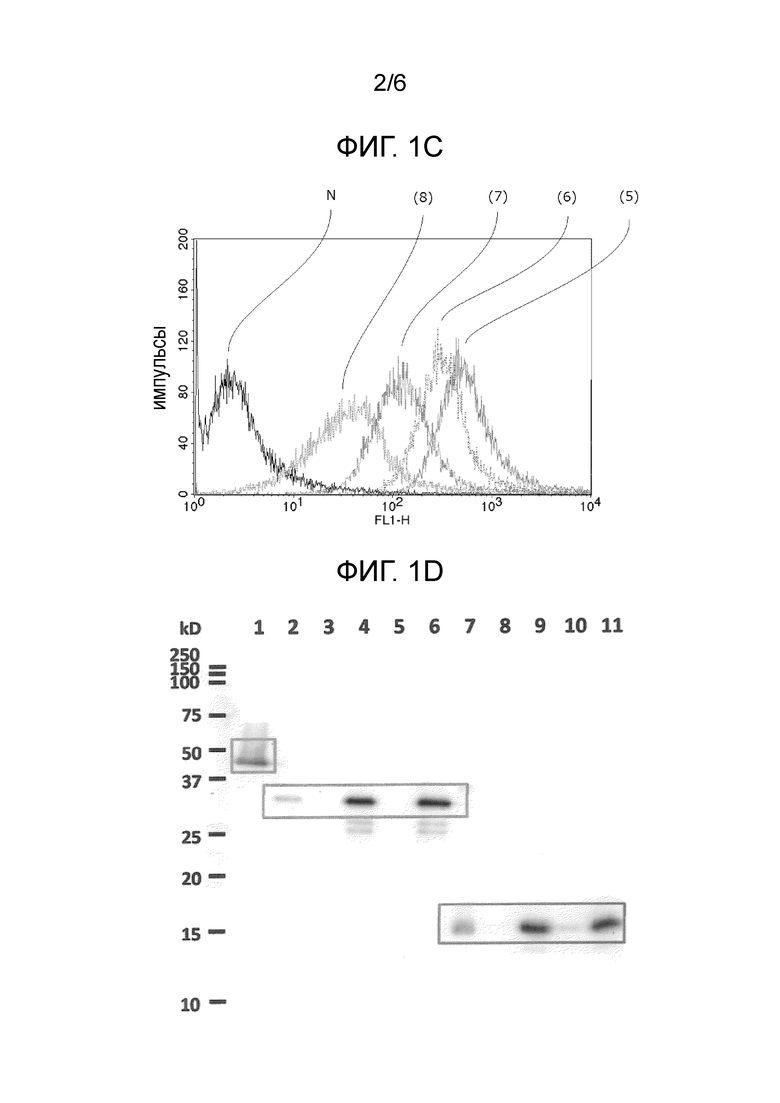
Фиг. 1D представляет изображение, иллюстрирующее один типичный результат вестерн-блоттинга для различных белков.
Фиг. 2A представляет схематическую диаграмму pIGM2::E7Rb=prtP якорь в Примере получения 2.
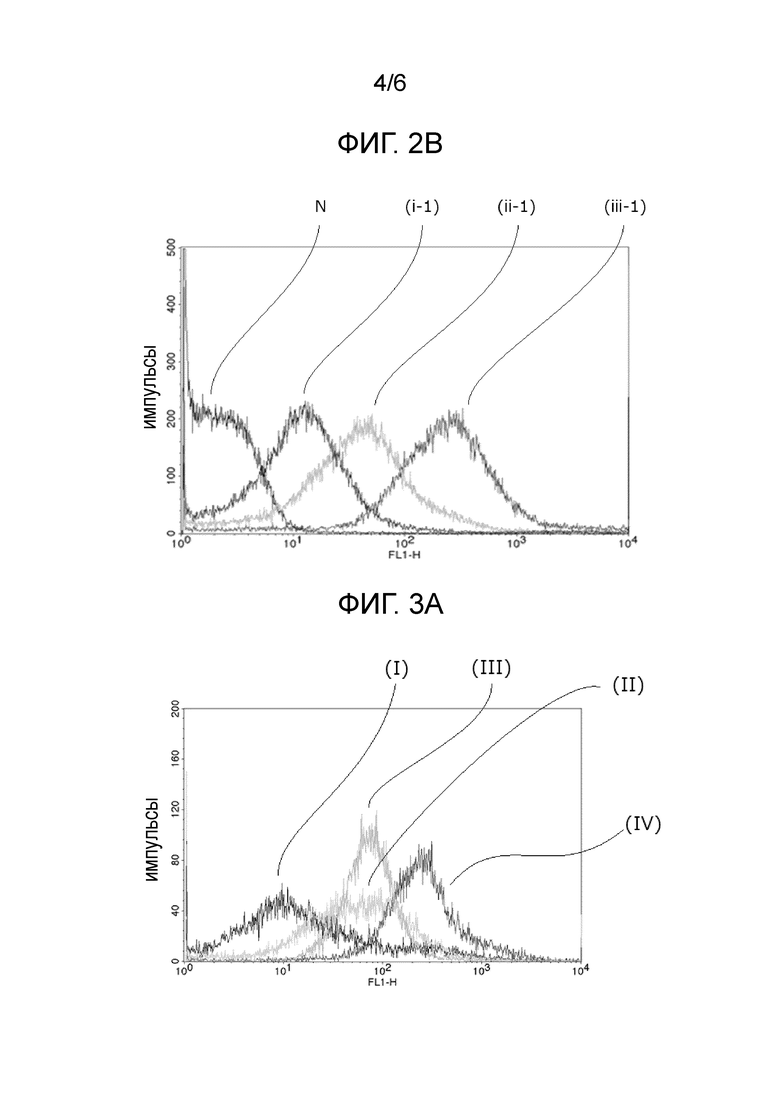
Фиг. 2B представляет график, иллюстрирующий результат FACS анализа в Примере получения 2.
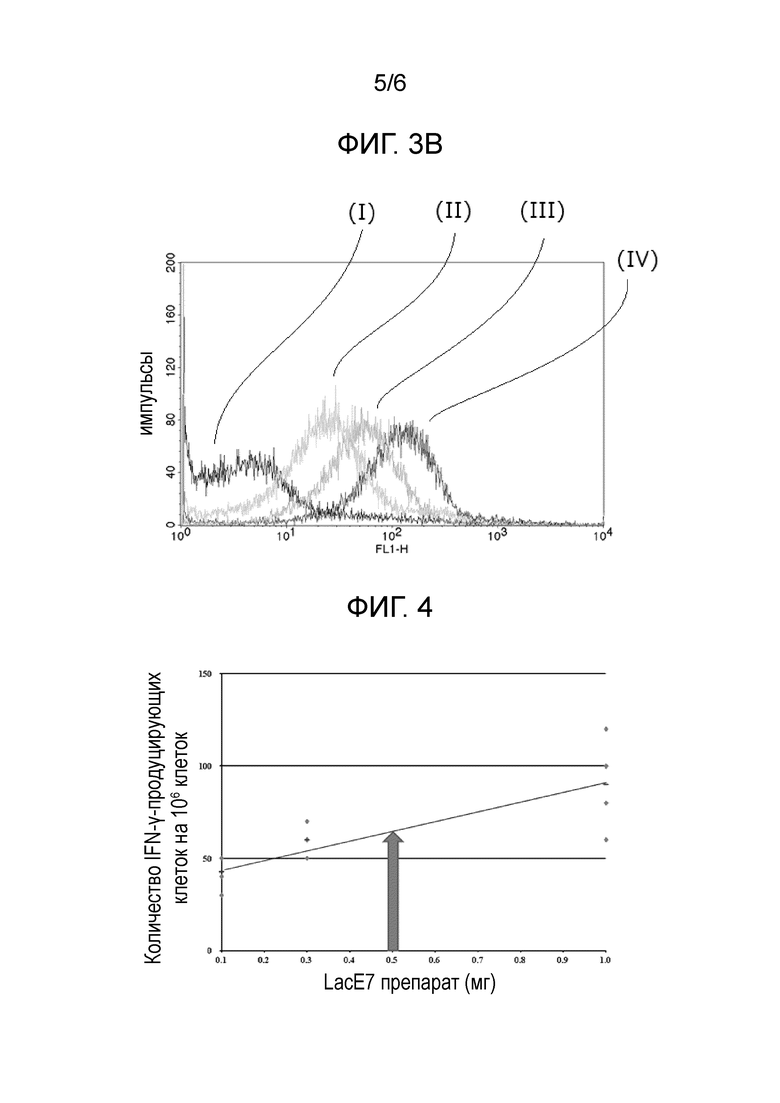
Фиг. 3A представляет график, иллюстрирующий результат FACS анализа (условия измерения: напряжение 525В) в Примере испытания 1.
Фиг. 3B представляет график, иллюстрирующий результат FACS анализа (условия измерения: напряжение 600 В) в Примере испытания 1.
Фиг. 4 представляет график, иллюстрирующий результат ELISPOT анализа Примера испытания 2.
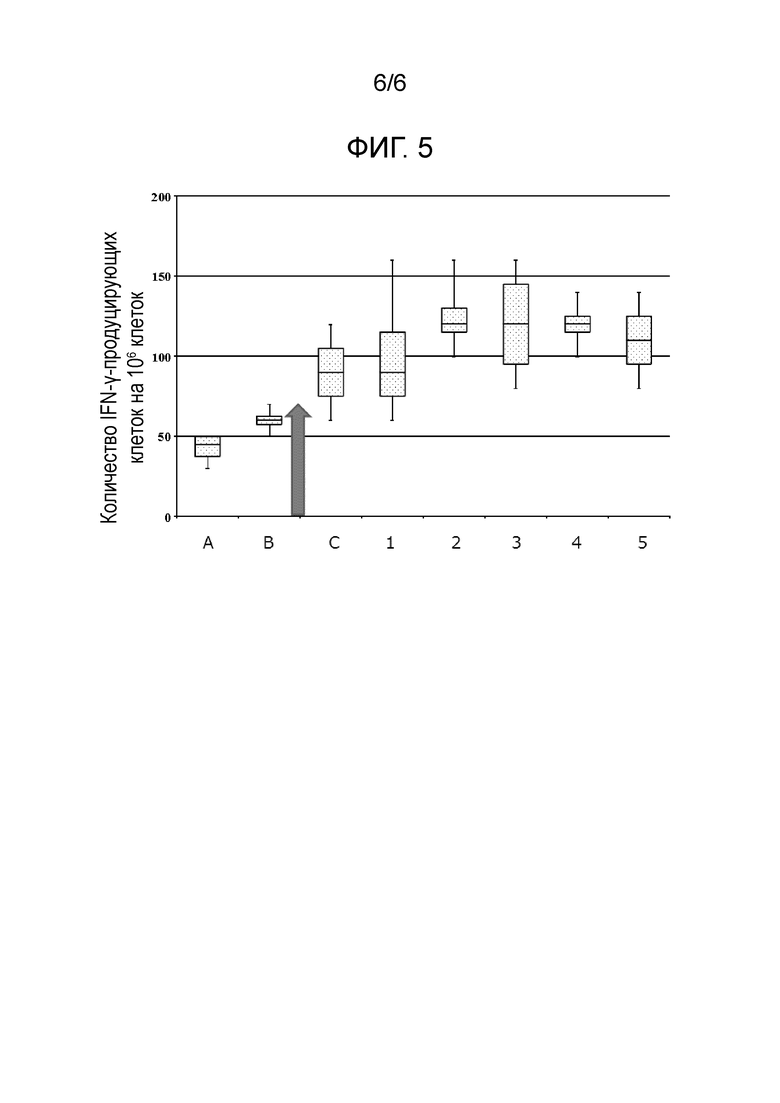
Фиг. 5 представляет график, иллюстрирующий результат ELISPOT анализа Примера испытания 3.
Описание вариантов осуществления
(Композиция, содержащая молочнокислую бактерию)
Композиция, содержащая молочнокислую бактерию, по настоящему изобретению, включает по меньшей мере молочнокислую бактерию, содержащую на своей поверхности происходящий из белка E7 папилломавируса человека (HPV) полипептид, и, если необходимо, дополнительно включает другие компоненты.
<Молочнокислая бактерия>
Молочнокислая бактерия конкретно не ограничивается и может быть подходящим образом выбрана в зависимости от предполагаемого назначения, но предпочтительно представляет собой молочнокислую бактерию, относящуюся к роду Lactobacillus, более предпочтительно Lactobacillus casei, поскольку она, как было подтверждено, индуцирует хелперные T-клетки 1 типа (Th1). Молочнокислую бактерию можно использовать отдельно или в комбинации.
Композиция, содержащая молочнокислую бактерию, может включать молочнокислую бактерию, не содержащую на своей поверхности никакого происходящего из белка E7 HPV полипептида. Однако молочнокислая бактерия, содержащая на своей поверхности происходящий из белка E7 HPV полипептид, предпочтительно содержится в количестве 80% или больше, более предпочтительно 90% или больше, особенно предпочтительно 95% или больше.
<<Происходящий из белка E7 HPV полипептид>>
Происходящий из белка E7 HPV полипептид конкретно не ограничивается и может быть подходящим образом выбран в зависимости от предполагаемого назначения, при условии, что он является антигенным. Происходящий из белка E7 HPV полипептид можно использовать отдельно или в комбинации.
Тип HPV конкретно не ограничивается и может быть подходящим образом выбран в зависимости от предполагаемого назначения, но предпочтительно представляет собой HPV16, HPV18, HPV31, HPV33, HPV35, HPV39, HPV45, HPV51, HPV52, HPV56, HPV58, HPV59, HPV68, HPV73, HPV82, HPV26, HPV53 и HPV63, которые относятся к группе с повышенным риском рака, более предпочтительно HPV16 и HPV18, особенно предпочтительно HPV16. Белок E7 HPV представляет собой раковый антиген, конститутивно экспрессирующийся в раке шейки матки и HPV-ассоциированных раках (например, раке анального канала, фарингеальном раке, раке полового члена, раке вульвы и раке влагалища).
Происходящий из белка E7 HPV полипептид может представлять собой полноразмерный E7 HPV белок или E7 HPV белок, в котором от одной до нескольких аминокислот делетированы, заменены или добавлены.
Происходящий из белка E7 HPV полипептид также может происходить из белка E7 дикого типа или из мутантного белка E7.
Из происходящих из белка E7 HPV полипептидов, предпочтительным является мутантный белок E7, в котором аминокислотные остатки, вовлеченные в связывание с Rb белком, E7 белка (т.е. Asp в положении 21, Cys в положении 24 и Glu в положении 26 белка E7 HPV дикого типа (SEQ ID No. 1)) заменены другими аминокислотными остатками. Более предпочтительным является мутантный E7 белок (SEQ ID No. 2), в котором Asp в положении 21, Cys в положении 24 и Glu в положении 26 белка E7 HPV дикого типа (SEQ ID No. 1) все заменены на Gly.
-Количество-
Количество происходящего из белка E7 HPV полипептида на поверхности бактерии конкретно не ограничивается и может быть подходящим образом выбрано в зависимости от предполагаемого назначения, при условии, что оно составляет от 0,03 мкг до 1,0 мкг на 1 × 108 молочнокислых бактерий. Однако количество предпочтительно составляет от 0,03 мкг до 0,3 мкг, более предпочтительно от 0,06 мкг до 0,3 мкг, особенно предпочтительно от 0,09 мкг до 0,3 мкг. Когда количество находится в указанных выше предпочтительных пределах, это является выгодным, т.к. может обеспечиваться более превосходный фармакологический эффект (способность индуцировать мукозальный иммунитет).
Способ измерения количества происходящего из белка E7 HPV полипептида на поверхности бактерии конкретно не ограничивается и может быть подходящим образом выбран в зависимости от предполагаемого назначения. Его примеры включают метод проточной цитометрии (FACS) с использованием антитела, специфического в отношении E7 HPV белка.
FACS метод можно использовать для измерения количества происходящего из белка E7 HPV полипептида на поверхности бактерии в образце, включающем неизвестное количество происходящего из белка E7 HPV полипептида, путем измерения таким же способом, как для образца, включающего известное количество происходящего из белка E7 HPV полипептида.
<<Аспект>>
Происходящий из белка E7 HPV полипептид может быть связан на поверхности молочнокислой бактерии (далее указывается как "молочнокислая бактерия связанного с E7 белком типа") или экспрессируется на поверхности молочнокислой бактерии (далее указывается как "молочнокислая бактерия типа, экспрессирующего E7 белок"). Молочнокислая бактерия связанного с E7 белком типа и молочнокислая бактерия типа, экспрессирующего E7 белок, могут сосуществовать вместе.
Молочнокислая бактерия может представлять собой живую бактерию или убитую бактерию.
Способ убивания бактерии конкретно не ограничивается и может быть подходящим образом выбран в зависимости от предполагаемого назначения. Его примеры включают способ, в котором бактерию нагревают в автоклаве при 80°C в течение 5 минут.
-Молочнокислая бактерия связанного с E7 белком типа-
Молочнокислую бактерию связанного с E7 белком типа можно получить путем связывания происходящего из белка E7 HPV полипептида, который получают методом генетической рекомбинации с использованием трансформированной бактерии или методом химического синтеза, с поверхностью молочнокислой бактерии.
Происходящий из белка E7 HPV полипептид предпочтительно получают методом генетической рекомбинации с использованием трансформированной бактерии, с точки зрения, например, стоимости.
Бактерия, используемая в качестве хозяина в методе генетической рекомбинации, конкретно не ограничивается и может быть подходящим образом выбрана в зависимости от предполагаемого назначения. Ее примеры включают дрожжи, E. coli, Bacillus subtilis и молочнокислую бактерию.
Вектор экспрессии, подходящий для экспрессии в происходящем из белка E7 HPV полипептиде в бактерии, конкретно не ограничивается и может быть подходящим образом выбран в зависимости от предполагаемого назначения. Его примеры включают pQE31.
Способ трансформации бактерии конкретно не ограничивается и может быть подходящим образом выбран из способов, известных из уровня техники.
Происходящий из белка E7 HPV полипептид, полученный с использованием трансформированной бактерии, может быть очищен подходящим способом, выбранным из способов, известных из уровня техники.
Способ связывания происходящего из белка E7 HPV полипептида с поверхностью молочнокислой бактерии конкретно не ограничивается и может быть подходящим образом выбран из способов, известных из уровня техники, таких как ковалентное связывание и электрическое связывание. Однако предпочтительным является способ, в котором полипептид электрически связывается с поверхностью молочнокислой бактерии через якорный белок.
Якорный белок конкретно не ограничивается и может быть подходящим образом выбран в зависимости от предполагаемого назначения. Его примеры включают связывающийся с клеточной оболочкой белок cA, происходящий из AcmA, который представляет собой пептидогликангидролазу Lactococcus lactis.
Когда происходящий из белка E7 HPV полипептид связывается с поверхностью молочнокислой бактерии через якорный белок, происходящий из белка E7 HPV полипептид предпочтительно сливается с якорным белком с образованием гибридного белка.
Порядок якорного белка и происходящего из белка E7 HPV полипептида в гибридном белке конкретно не ограничивается и может быть подходящим образом выбран в зависимости от предполагаемого назначения. Однако предпочтительно слияние якорного белка и происходящего из белка E7 HPV полипептида происходит в указанном порядке. Конкретные примеры включают последовательность, представленную SEQ ID NO. 3.
Способ электрического связывания (далее именуемый "иммобилизацией") конкретно не ограничивается и может быть подходящим образом выбран в зависимости от предполагаемого назначения. Его примеры включают способ, в котором раствор, включающий происходящий из белка E7 HPV полипептид, добавляют к молочнокислой бактерии и смешивают с ней.
Время смешивания конкретно не ограничивается и может быть подходящим образом выбрано в зависимости от предполагаемого назначения. Его примеры включают время около 1 часа.
В способе электрического связывания можно осуществить предварительную обработку.
Предварительная обработка конкретно не ограничивается и может быть подходящим образом выбрана в зависимости от предполагаемого назначения. Ее примеры включают термообработку. Молочнокислую бактерию убивают при помощи термообработки.
Условия термообработки конкретно не ограничиваются и могут быть подходящим образом выбраны в зависимости от предполагаемого назначения. Примеры включают нагревание при 100°C в течение 30 минут.
Термообработку можно осуществить на молочнокислой бактерии, суспендированной в трихлоруксусной кислоте (TCA), или молочнокислой бактерии, суспендированной в PBS.
-Молочнокислая бактерия типа, экспрессирующего E7 белок-
Молочнокислую бактерию связанного с E7 белком типа можно получить путем культивирования молочнокислой бактерии, которая была трансформирована вектором экспрессии, содержащим нуклеиновую кислоту, кодирующую происходящий из белка E7 HPV полипептид.
Вектор экспрессии конкретно не ограничивается и может быть подходящим образом выбран в зависимости от предполагаемого назначения. Его примеры включают pIGM2. pIGM2 содержит сигнал секреции гена prtP ATCC1559 Lactobacillus brevis ниже от промоторной последовательности белка S-слоя ATCC1559 Lactobacillus brevis и также содержит якорный ген, происходящий из Lacotobacillus casei (последовательность протеиназы L. casei), ниже от него.
Другой пример вектора экспрессии включает вектор, содержащий мутированный repE ген, выделенный из молочнокислой бактерии промотор альдолазы (Pald) и комплексный ген синтазы полиглутаминовой кислоты, выбранный из группы, состоящей из pgsB, pgsC и gsA (см. JP-A Nos. 2012-514468 и 2012-514469).
Способ трансформации конкретно не ограничивается и может быть подходящим образом выбран из способов, известных из уровня техники.
В случае молочнокислой бактерии типа, экспрессирующего E7 белок, нуклеиновую кислоту, кодирующую происходящий из белка E7 HPV полипептид, предпочтительно связывают с якорным геном.
Якорный ген конкретно не ограничивается и может быть подходящим образом выбран в зависимости от предполагаемого назначения, но предпочтительно представляет собой якорный ген, происходящий из Lacotobacillus casei (последовательность протеиназы L. casei).
Порядок нуклеиновой кислоты, кодирующей происходящий из белка E7 HPV полипептид, и якорного гена конкретно не ограничивается и может быть подходящим образом выбран в зависимости от предполагаемого назначения. Однако нуклеиновую кислоту, кодирующую происходящий из белка E7 HPV полипептид, и якорный ген предпочтительно связывают в этом порядке. Примеры включают последовательность, представленную SEQ ID NO. 4.
Молочнокислая бактерия, используемая для молочнокислой бактерии типа, экспрессирующего E7 белок, конкретно не ограничивается и может быть подходящим образом выбрана в зависимости от предполагаемого назначения, но предпочтительно представляет собой Lactobacillus casei IGM393 или Lactobacillus casei IGM394. Lactobacillus casei IGM394 является субкультивированным штаммом, выделенным из the Lactobacillus casei IGM393, и представляет собой мутантный штамм, имеющий высокую эффективность трансформации. Lactobacillus casei IGM393 и Lactobacillus casei IGM394 имеют самую высокую гомологию с полной геномной последовательностью Lactobacillus casei BL23.
Способ культивирования молочнокислой бактерии типа, экспрессирующего E7 белок, конкретно не ограничивается и может быть подходящим образом выбран из способов, известных из уровня техники.
Способ модификации экспрессиуемого количества происходящего из белка E7 HPV полипептида на поверхности бактерии в молочнокислой бактерии типа, экспрессирующего E7 белок, конкретно не ограничивается и может быть подходящим образом выбран в зависимости от предполагаемого назначения. Его примеры включают способ, в котором культуральный раствор доводят до определенного pH.
Как описано в Примере получения 2 ниже, экспрессируемое количество происходящего из белка E7 HPV полипептида на поверхности бактерии можно модифицировать с использованием среды, в которой концентрация гидрокарбоната натрия варьируется, и поэтому pH можно регулировать.
pH культурального раствора конкретно не ограничивается и может быть подходящим образом выбран в зависимости от предполагаемого назначения, но предпочтительно представляет собой около pH 7.
Когда происходящий из белка E7 HPV полипептид представляет собой гибридный белок с якорным белком, количество гибридного белка на поверхности бактерии конкретно не ограничивается и может быть подходящим образом выбрано в зависимости от предполагаемого назначения, но предпочтительно составляет от 0,1 мкг до 3,3 мкг, более предпочтительно от 0,1 мкг до 1,0 мкг, еще более предпочтительно от 0,2 мкг до 1,0 мкг, особенно предпочтительно от 0,3 мкг до 1,0 мкг на 1 × 108 молочнокислых бактерий. Когда количество находится в указанных выше предпочтительных пределах, это является выгодным, поскольку можно получить еще более лучший фармакологический эффект (способность индуцировать мукозальный иммунитет).
<Другие компоненты>
Другие компоненты в композиции, содержащей молочнокислые бактерии, конкретно не ограничиваются и могут быть подходящим образом выбраны в зависимости от предполагаемого назначения, при условии, что они не ухудшают эффекты настоящего изобретения. Их примеры включают фармацевтически приемлемый носитель. Такие компоненты можно использовать отдельно или в комбинации.
Количества других компонентов в композиции, содержащей молочнокислые бактерии, конкретно не ограничиваются и может быть подходящим образом выбрано в зависимости от предполагаемого назначения.
(Терапевтическая пероральная фармацевтическая композици для по меньшей мере одного из HPV инфекционного заболевания и HPV-ассоциированной опухоли)
Терапевтическая пероральная фармацевтическая композиция для по меньшей мере одного из HPV инфекционного заболевания и HPV-ассоциированной опухоли по настоящему изобретению включает по меньшей мере композицию, содержащую молочнокислую бактерию, и, если необходимо, дополнительно включает другие компоненты.
<Композиция, содержащая молочнокислую бактерию>
Композиция, содержащая молочнокислую бактерию, представляет собой вышеописанную композицию, содержащую молочнокислую бактерию по настоящему изобретению.
Количество композиции, содержащей молочнокислую бактерию, включенной в терапевтическую пероральную фармацевтическую композицию для по меньшей мере одного из HPV инфекционного заболевания и HPV-ассоциированной опухоли, конкретно не ограничивается и может быть подходящим образом выбрано в зависимости от предполагаемого назначения.
<Другие компоненты>
Другие компоненты в терапевтической пероральной фармацевтической композиции для по меньшей мере одного из HPV инфекционного заболевания и HPV-ассоциированной опухоли конкретно не ограничиваются и могут быть подходящим образом выбраны в зависимости от предполагаемого назначения. Их примеры включают препарат Kampo, обладающий оздоравливающей активностью (эффект укрепления иммунитета), мукозальный адъювант и фармацевтически приемлемый носитель. Их можно использовать отдельно или в комбинации.
-Препарат Kampo, обладающий оздоравливающей активностью (эффект укрепления иммунитета)-
Препарат Kampo, обладающий оздоравливающей активностью (эффект укрепления иммунитета) конкретно не ограничивается и может быть подходящим образом выбран в зависимости от предполагаемого назначения. Его примеры включают Kakkonto, Juzentaihoto, Hochuekkito, Shosaikoto и Shoseiryuto. Их можно использовать отдельно или в комбинаци.
-Мукозальный адъювант-
Мукозальный адъювант конкретно не ограничивается и может быть подходящим образом выбран в зависимости от предполагаемого назначения. Предпочтительные примеры включают вещества, еще более повышающие гуморальный иммунитет и клеточно-опосредованный иммунитет, специфический для пероральной вакцины, такой как происходящий из белка E7 HPV полипептид, совместно действуя с препаратом Kampo, обладающим оздоравливающей активностью (эффект укрепления иммунитета).
Примеры мукозального адъюванта включают адъювант на основе бактериального токсина, синтетический керамид (αGalCer), CpG олигонуклеотид, SP-C (SURFACTEN), SP-B, IFN-α (дикого типа или мутантный), двухцепочечную РНК и TNF мутант с повышенной активностью. Их можно использовать отдельно или в комбинации.
Адъювант на основе бактериального токсина конкретно не ограничивается и может быть подходящим образом выбран в зависимости от предполагаемого назначения. Его примеры включают выделенный из холерного токсина (CT) полипептид, выделенный из термолабильного энтеротоксина (LT) E.coli полипептид, выделенный веротоксина (VT) полипептид, выделенный из дифтерийного токсина (DT) полипептид и выделенный из коклюшевого токсина (PT) полипептид.
Адъювант на основе бактериального токсина может представлять собой адъювант на основе бактериального токсина дикого типа или адъювант на основе мутантного бактериального токсина. Однако предпочтительным является адъювант на основе мутантного бактериального токсина, в котором мутация введена заранее, чтобы не вызывать серьезных побочных эффектов в случае перорального введения человеку.
-Фармацевтически приемлемый носитель-
Фармацевтически приемлемый носитель конкретно не ограничивается и может быть подходящим образом выбран из носителей, известных из уровня техники, в зависимости от лекарственных форм.
Количества других компонентов в терапевтической пероральной фармацевтической композиции для по меньшей мере одного из HPV инфекционного заболевания и HPV-ассоциированной опухоли конкретно не ограничиваются и могут быть подходящим образом выбраны в зависимости от предполагаемого назначения.
<Применение>
Терапевтическую пероральную фармацевтическую композицию для по меньшей мере одного из HPV инфекционного заболевания и HPV-ассоциированной опухоли можно использовать отдельно или в комбинации с фармацевтическими средствами, включающими другие компоненты в качестве активных компонентов. Терапевтическую пероральную фармацевтическую композицию для по меньшей мере одного из HPV инфекционного заболевания и HPV-ассоциированной опухоли также можно использовать в состоянии, в котором она включена в фармацевтические препараты, включающие другие компоненты в качестве активных компонентов.
<Лекарственная форма>
Лекарственная форма терапевтической пероральной фармацевтической композиции для по меньшей мере одного из HPV инфекционного заболевания и HPV-ассоциированной опухоли конкретно не ограничивается и может быть подходящим образом выбрана в зависимости от предполагаемого назначения, при условии, что ее можно вводить перорально. Ее примеры включают пероральный твердый препарат (например, таблетку, таблетку с покрытием, гранулу, порошок и капсулу) и пероральный раствор (например, принимаемую внутрь жидкость, сироп и эликсир). Терапевтическую пероральную фармацевтическую композицию для по меньшей мере одного из HPV инфекционного заболевания и HPV-ассоциированной опухоли в любой из описанных выше лекарственных форм можно получить в соответствии с традиционными способами.
<Введение>
Вводимое количество, время введения и объект введения терапевтической пероральной фармацевтической композиции для по меньшей мере одного из HPV инфекционного заболевания и HPV-ассоциированной опухоли конкретно не ограничиваются и могут быть подходящим образом выбраны в зависимости от предполагаемого назначения.
Вводимое количество конкретно не ограничивается и может быть подходящим образом выбрано с учетом различных факторов, таких как возраст, масса тела, физическое состояние и симптомы объекта введения, и того, вводят или нет фармацевтические препараты или лекарственные средства, включающие другие компоненты в качестве активных компонентов.
Подходящие примеры объекта введения включают человека.
HPV-ассоциированная опухоль конкретно не ограничивается и может быть подходящим образом выбрана в зависимости от предполагаемого назначения. Ее примеры включают рак шейки матки, рак вульвы, рак анального канала, рак полости рта, рак влагалища, рак полового члена, фарингеальный рак и предшествующие им предканцерогенные поражения.
Терапевтическую пероральную фармацевтическую композицию для по меньшей мере одного из HPV инфекционного заболевания и HPV-ассоциированной опухоли можно использовать как подходящую для лечения по меньшей мере одного из таких состояний, как интраэпителиальная неоплазия шейки матки и ранняя стадия рака шейки матки.
Ранняя стадия рака шейки матки включает микроинвазивную карциному.
Терапевтическая пероральная фармацевтическая композиция для по меньшей мере одного из HPV инфекционного заболевания и HPV-ассоциированной опухоли является подходящей для использования в качестве терапевтической вакцины для HPV инфекционного заболевания путем введения пациенту, страдающему от HPV инфекционного заболевания.
(Способ лечения по меньшей мере одного из HPV инфекционного заболевания и HPV-ассоциированной опухоли)
Терапевтическая пероральная фармацевтическая композиция для по меньшей мере одного из HPV инфекционного заболевания и HPV-ассоциированной опухоли может лечить по меньшей мере одно из HPV инфекционного заболевания и HPV-ассоциированной опухоли у субъекта при пероральном введении субъекту. Поэтому настоящее изобретение также относится к способу лечения по меньшей мере одного из HPV инфекционного заболевания и HPV-ассоциированной опухоли, включающему пероральное введение субъекту терапевтической пероральной фармацевтической композиции для по меньшей мере одного из HPV инфекционного заболевания и HPV-ассоциированной опухоли.
(Средство, индуцирующее мукозальный иммунитет)
Средство, индуцирующее мукозальный иммунитет, по настоящему изобретению включает по меньшей мере композицию, содержащую молочнокислую бактерию, и, если необходимо, дополнительно включает другие компоненты.
<Композиция, содержащая молочнокислую бактерию>
Композиция, содержащая молочнокислую бактерию, представляет собой описанную выше композицию, содержащую молочнокислую бактерию, по настоящему изобретению.
Количество композиции, содержащей молочнокислую бактерию, включенной в средство, индуцирующее мукозальный иммунитет, конкретно не ограничивается и может быть подходящим образом выбрано в зависимости от предполагаемого назначения.
<Другие компоненты>
Другие компоненты в средстве, стимулирующем мукозальный иммунитет, конкретно не ограничиваются и могут быть подходящим образом выбраны в зависимости от предполагаемого назначения. Например, они могут быть такими же, как средства, описанные в разделе, озаглавленном "Другие компоненты", для терапевтической пероральной фармацевтической композиции для по меньшей мере одного из HPV инфекционного заболевания и HPV-ассоциированной опухоли.
Количества других компонентов, включенных в средство, индуцирующее мукозальный иммунитет, конкретно не ограничиваются и может быть подходящим образом выбраны в зависимости от предполагаемого назначения.
<Применение>
Средство, индуцирующее мукозальный иммунитет, можно использовать отдельно или в комбинации с фармацевтическими препаратами, включающими другие компоненты в качестве активных компонентов. Средство, индуцирующее мукозальный иммунитет, также можно использовать в состоянии, в котором оно включено в фармацевтические препараты, включающие другие компоненты в качестве активных компонентов.
<Лекарственная форма>
Лекарственная форма средства, индуцирующего мукозальный иммунитет, конкретно не ограничивается и может быть подходящим образом выбрана в зависимости от предполагаемого назначения, при условии, что ее можно вводить перорально. Ее примеры включают пероральный твердый препарат (например, таблетку, таблетку с покрытием, гранулу, порошок и капсулу) и пероральный раствор (например, принимаемую внутрь жидкость, сироп и эликсир). Средство, индуцирующее мукозальный иммунитет, в любой из описанных выше лекарственных форм можно получить в соответствии с традиционными способами.
<Введение>
Вводимое количество, время введения и объект введения средства, индуцирующего мукозальный иммунитет, конкретно не ограничиваются и могут быть подходящим образом выбраны в зависимости от предполагаемого назначения.
Вводимое количество конкретно не ограничивается и может быть подходящим образом выбрано с учетом различных факторов, таких как возраст, масса тела, физическое состояние и симптомы объекта введения, и с учетом того, вводят или нет фармацевтические препараты или лекарственные средства, включающие другие компоненты в качестве активных компонентов.
Подходящие примеры объекта введения включают человека.
Средство, индуцирующее мукозальный иммунитет, может индуцировать E7 HPV белок-специфический клеточно-опосредованный иммунный ответ в слизистой оболочке.
(Способ индукции мукозального иммунитета)
Средство, индуцирующее мукозальный иммунитет, может индуцировать мукозальный иммунитет у субъекта при пероральном введении субъекту. Поэтому настоящее изобретение также относится к способу индукции мукозального иммунитета, включающему пероральное введение субъекту средства, индуцирующего мукозальный иммунитет.
Примеры
Примеры получения и Примеры испытания настоящего изобретения описаны ниже, но настоящее изобретение никоим образом не ограничивается этим.
(Сравнительный пример получения 1: Получение известного LacE7 препарата)
LacE7 препарат, который является известным препаратом, получали в соответствии со способом, описанным в Poo H. et al., Int. J. Immunol., 2006, vol. 119, pp. 1,702-1,709.
Вкратце, HPV16-происходящий мутантный белок E7, который состоял из аминокислотной последовательности, представленной SEQ ID No. 2, то есть, в котором Asp в положении 21, Cys в положении 24 и Glu в положении 26, вовлеченные в связывание с Rb белком, белка E7 дикого типа все были заменены на Gly, вводили через вектор экспрессии в Lactobacillus casei, которая, как было подтверждено, индуцирует хелперные T-клетки 1 типа (Th1 клетки). Полученный рекомбинантный (LacE7) культивировали в среде и затем убивали нагреванием. LacE7 очищали от среды, промывали дистиллированной водой несколько раз и затем сушили с получением порошка (LacE7 препарат). Полученный препарат хранили при 4°C до использования. LacE7 препарат был нерастворимым в водном растворителе.
(Пример получения 1: Получение молочнокислой бактерии связанного с мутантным E7 белком типа)
Молочнокислую бактерию, связанную с мутантным E7 белком, который связан на ее поверхности, получали следующим способом. Мутантный E7 белок (SEQ ID No. 2) представлял собой происходящий из белка E7 HPV полипептид.
<Получение мутантного E7 белка>
-Конструирование плазмиды для экспрессии белка, в которую встроена слитая последовательность cA и мутантного белка E7-
Белок cA представляет собой якорный белок, и его использовали в качестве инструмента для иммобилизации мутантного E7 белка на поверхности молочнокислой бактерии. cA может иммобилизовывать белки на пептидогликане грам-положительной бактерии через электрический заряд и определенный мотив и представляет собой связывающийся с клеточной оболочкой белок, происходящий из AcmA, который представляет собой пептидогликангидролазу Lactococcus lactis (Tjibbe Bosma, Rolf Kanninga, Jolanda Neef, Sandrine A. L. Audouy, Maarten L. van Roosmalen, Anton Steen, Girbe Buist, Jan Kok, Oscar P. Kuipers, George Robillard, and Kees Leenhouts (2006) Novel Surface Display System for Proteins on Non-Genetically Modified Gram-Positive Bacteria. Appl. Environ. Microbiol. p. 880-889).
Слитую последовательность cA и мутантного E7 белка (см. SEQ ID NO. 3) встраивали в векторную плазмиду pQE31 обычным способом (далее указывается как "pQE31::cA=E7Rb", см. Фиг. 1A).
-Трансформация-
В качестве хозяина для экспрессии гибридного белка cA и мутантного E7 белка использовали CLEARCOLI (зарегистрированная торговая марка) (E. coli BL21DE3 LPS модифицированный штамм, Lucigen).
Сначала CLEARCOLI (зарегистрированная торговая марка) трансформировали методом электропорации для введения таким образом в него pREP4 (invitrogen).
Затем pQE31::cA=E7Rb вводили в полученный трансформант методом с использованием хлорида кальция, с получением, таким образом, E. coli, которая экспрессировала гибридный белок, состоящий из cA и мутантного E7 белка (далее указывается как "CLEARCOLI (зарегистрированная торговая марка) pQE31::cA=E7Rb, pREP4").
-Экспрессия и очистка гибридного белка-
Одну платиновую петлю E. coli инокулировали в Luria-Bertani (LB) жидкую среду (Difco Laboratories), содержащую ампициллин (конечная концентрация: 100 мкг/мл) и канамицин (конечная концентрация: 25 мкг/мл) и культивировали при встряхивании при 37°C в течение ночи.
Культивированную таким образом E. coli собирали и промывали. Затем добавляли PBS в таком же количестве, как используемое для культивирования. Полученную смесь в количестве, равном 1/20 количества LB жидкой среды для основного культивирования, инокулировали в LB жидкую среду для основного культивирования, содержащую ампициллин (конечная концентрация: 100 мкг/мл) и канамицин (конечная концентрация: 25 мкг/мл).
Основное культивирование осуществляли путем культивирования при встряхивании при 37°C. Когда значение O.D.600 достигало 0,5, добавляли IPTG для получения конечной концентрации 1 мМ. Затем полученное культивировали при встряхивании при 37°C в течение 4 часов, чтобы таким образом индуцировать экспрессию гибридного белка.
E.coli собирали из индуцированного таким образом культурального раствора. Добавляли пять миллилитров на грамм E. coli лизисного буфера (100 мМ NaH2PO4, 10 мМ Tris×Cl, 8 M мочевины, pH 8) и затем осторожно перемешивали при комнатной температуре в течение 1 часа. Полученную смесь центрифугировали при 10000 × g в течение 30 минут при 4°C и затем собирали супернатант.
Четыре миллилитра собранного таким образом супернатанта осторожно смешивали при комнатной температуре в течение 40 минут с 1 мл TALON (зарегистрированная торговая марка) металл-аффинной смолы (Clontech), которая была уравновешена лизисным буфером. Полученный смешанный раствор супернатанта и смолы переносили в полипропиленовые колонки (QIAGEN) для удаления супернатанта. Полученное промывали два раза при помощи 4 мл промывочного буфера (100 мМ NaH2PO4, 10 мМ Tris×Cl, 8 M Мочевины, pH 6,3) и His-меченный гибридный белок элюировали элюирующим буфером 1 (100 мМ NaH2PO4, 10 мМ Tris×Cl, 8 M Мочевины, 150 мМ Имидазола, pH 5,9) и элюирующим буфером 2 (100 мМ NaH2PO4, 10 мМ Tris×Cl, 8 M Мочевины, 300 мМ Имидазола, pH 4,5).
Собиранный таким образом раствор белка обессоливали при помощи диализа и концентрировали ультрафильтрацией с использованием ULTRACEL (зарегистрированная торговая марка)-10k (Merck Millipore).
Концентрацию белка в полученном концентрированном растворе белка измеряли с использованием QUICK START (торговая марка) Bradford Protein Assay (BIO-RAD) и затем раствор хранили при -80°C до использования.
-Подтверждение гибридного белка вестерн-блоттингом-
В основном культивировании, описанном в разделе "-Экспрессия и очистка гибридного белка-", полученный культуральный раствор, в который добавляли IPTG и культивировали при 37°C в течение 4 часов, центрифугировали при 10000 × g в течение 3 минут и затем из него собирали E. coli. Супернатант сливали. Полученный после центрифугирования осадок суспендировали в 100 мл 1 × SDS-PAGE буфера для образца. Полученную таким образом жидкую суспензию нагревали при 100°C в течение 5 минут.
Нагретую жидкую суспензию подвергали электрофорезу на SDS-PAGE и переносили на PVDF мембрану (EDM Millipore).
Эту мембрану инкубировали при комнатной температуре в течение 1 часа в растворе первичного антитела (1% BSA, 0,05% Tween 20 в PBS (-), мышиное анти-His IgG (Anti-His-tag mAb, MEDICAL & BIOLOGICAL LABORATORIES CO., LTD.) (1:2000)).
После этого мембрану промывали два раза при помощи PBST.
Затем мембрану инкубировали при комнатной температуре в течение 1 часа в растворе вторичного антитела (1% BSA, 0,05% Tween 20 в PBS (-), козлиное антимышиное IgG HRP (Антимышиное IgG (целая молекула)-Пероксидаза антитело получали в организме козы, SIGMA-ALDRICH) (1:10000)).
После этого мембрану промывали два раза при помощи PBST.
Затем экспрессию желаемого гибридного белка подтверждали детекцией полос с использованием ECL Plus (GE Health care Life Science) и Chemi doc (Bio-Rad Laboratories).
<Связывание с поверхностью молочнокислой бактерии>
Гибридный белок, состоящий из cA и мутантного E7 белка, связывали с поверхностью молочнокислой бактерии (далее указывается как "иммобилизация") следующим способом, описанным в to Tjibbe Bosma, Rolf Kanninga, Jolanda Neef, Sandrine A. L. Audouy, Maarten L. van Roosmalen, Anton Steen, Girbe Buist, Jan Kok, Oscar P. Kuipers, George Robillard and Kees Leenhouts (2006) Novel Surface Display System for Proteins on Non-Genetically Modified Gram-Positive Bacteria. Appl. Environ. Microbiol. p. 880-889.
-Культивирование молочнокислой бактерии-
В качестве молочнокислой бактерии использовали Lactobacillus casei IGM393, которая, как было ранее подтверждено, имела адъювантный эффект в качестве носителя антигена (Kajikawa A, Igimi S (2010) Innate and acquired immune responses induced by recombinant Lactobacillus casei displaying flagellin-fusion antigen on the cell-surface. Vaccine 28: 3409-3415).
Молочнокислую бактерию статически культивировали при 37°C в течение ночи в жидкой среде Манна-Рогоза-Шарпа(MRS) (Difco Laboratories). Молочнокислую бактерию собирали из полученного культурального раствора и промывали два раза при помощи PBS.
-Предварительная обработка для иммобилизации-
Для предварительной обработки для иммобилизации подготавливали два вида молочнокислых бактерий, т.е. "молочнокислую бактерию, обработанную трихлоруксусной кислотой (TCA) (далее именуемая "с TCA обработкой") и "молочнокислую бактерию, обработанную при помощи PBS (далее именуемая "без TCA обработки").
Молочнокислую бактерию обрабатывали при помощи TCA путем ресуспендирования бактерии в 10% TCA в количестве, которое 0,2-кратно количеству культурального раствора, нагревания при 100°C в течение 30 минут и промывки при помощи PBS три раза.
Молочнокислую бактерию обрабатывали при помощи PBS путем ресуспендирования бактерии в PBS в количестве, которое 0,2-кратно количеству культурального раствора, нагревания при 100°C в течение 30 минут и промывки при помощи PBS три раза.
-Иммобилизация-
Гибридный белок добавляли в количестве 1,0 мкг, 0,3 мкг, 0,1 мкг или 0,03 мкг (соответствующем 0,3 мкг, 0,09 мкг, 0,03 мкг, или 0,009 мкг в расчете на мутантный E7 белок, соответственно) на 1,0 × 108 предварительно обработанных молочнокислых бактерий. Полученное смешивали в PBS растворе, содержащем гибридный белок, в течение 1 часа. Как результат, гибридный белок электрически связывался с поверхностью молочнокислой бактерии.
После смешивания полученное промывали при помощи PBS три раза и хранили при -80°C до использования.
Таким образом, получали описанные ниже молочнокислые бактерии связанного с мутантным E7 белком типа:
(1) Молочнокислая бактерия связанного с мутантным E7 белком типа, на поверхности которой было связано 0,3 мкг мутантного E7 белка на 1,0 × 108 молочнокислых бактерий (с TCA обработкой);
(2) Молочнокислая бактерия связанного с мутантным E7 белком типа, на поверхности которой было связано 0,09 мкг мутантного E7 белка на 1,0 × 108 молочнокислых бактерий (с TCA обработкой);
(3) Молочнокислая бактерия связанного с мутантным E7 белком типа, на поверхности которой было связано 0,03 мкг мутантного E7 белка на 1,0 × 108 молочнокислых бактерий (с TCA обработкой);
(4) Молочнокислая бактерия связанного с мутантным E7 белком типа, на поверхности которой было связано 0,009 мкг мутантного E7 белка на 1,0 × 108 молочнокислых бактерий (с TCA обработкой);
(5) Молочнокислая бактерия связанного с мутантным E7 белком типа, на поверхности которой было связано 0,3 мкг мутантного E7 белка на 1,0 × 108 молочнокислых бактерий (без TCA обработки);
(6) Молочнокислая бактерия связанного с мутантным E7 белком типа, на поверхности которой было связано 0,09 мкг мутантного E7 белка на 1,0 × 108 молочнокислых бактерий (без TCA обработки);
(7) Молочнокислая бактерия связанного с мутантным E7 белком типа, на поверхности которой было связано 0,03 мкг мутантного E7 белка на 1,0 × 108 молочнокислых бактерий (без TCA обработки); и
(8) Молочнокислая бактерия связанного с мутантным E7 белком типа, на поверхности которой было связано 0,009 мкг мутантного E7 белка на 1,0 × 108 молочнокислых бактерий (без TCA обработки).
<FACS анализ>
Молочнокислые бактерии связанного с мутантным E7 белком типа (1) - (8) флуоресцентно метили антителом, специфическим в отношении E7 HPV белка, и затем подтверждали иммобилизацию методом проточной цитометрии (FACS, BD).
В частности, каждую из молочнокислых бактерий связанного с мутантным E7 белком типа обратимо смешивали (комнатная температура, 60 мин) в 0,5 мл раствора первичного антитела (1% BSA, 0,05% Tween 20 в PBS (-), анти-HPV16 E7 мышиное IgG (антитело к белку HPV типа 16 E7 [289-17013 (TVG-701Y)], GeneTex) (1:1000)). Затем полученное центрифугировали (15000 × g, 3 мин) и затем промывали два раза при помощи PBS (-) Затем полученное обратимо смешивали с окрашивающим агентом (комнатная температура, 60 мин) в 0,5 мл раствора вторичного антитела (1% BSA, 0,05% Tween 20 в PBS (-), антимышиное IgG Alexa Fluor 488 (Alexa Fluor(R) 488 козлиное антимышиное IgG (H+L), Life technologies) (1:500)). Затем полученное центрифугировали (15000 × g, 3 мин) и затем промывали два раза при помощи PBS (-).
Затем к полученной смеси добавляли PBS (-) до объема 0,6 мл и подвергали FACS анализу для определения флуоресценции.
Необходимо отметить, что, образцы, полученные таким же образом, за исключением того, что не использовали гибридный белок, использовали в качестве отрицательного контроля.
Результаты показаны на Фиг. 1B и 1C.
На Фиг. 1B "N" представляет результат для отрицательного контроля, "(1)" представляет результат для молочнокислой бактерии связанного с мутантным E7 белком типа, на поверхности которой было связано 0,3 мкг мутантного E7 белка на 1,0 × 108 молочнокислых бактерий (с TCA обработкой), "(2)" представляет результат для молочнокислой бактерии связанного с мутантным E7 белком типа, на поверхности которой было связано 0,09 мкг мутантного E7 белка на 1,0 × 108 молочнокислых бактерий (с TCA обработкой), "(3)" представляет результат для молочнокислой бактерии связанного с мутантным E7 белком типа, на поверхности которой было связано 0,03 мкг мутантного E7 белка на 1,0 × 108 молочнокислых бактерий (с TCA обработкой), и "(4)" представляет результат для молочнокислой бактерии связанного с мутантным E7 белком типа, на поверхности которой было связано 0,009 мкг мутантного E7 белка на 1,0 × 108 молочнокислых бактерий (с TCA обработкой).
На Фиг. 1C "N" представляет результат для отрицательного контроля, "(5)" представляет результат для молочнокислой бактерии связанного с мутантным E7 белком типа, на поверхности которой было связано 0,3 мкг мутантного E7 белка на 1,0 × 108 молочнокислых бактерий (без TCA обработки), "(6)" представляет результат для молочнокислой бактерии связанного с мутантным E7 белком типа, на поверхности которой было связано 0,09 мкг мутантного E7 белка на 1,0 × 108 молочнокислых бактерий (без TCA обработки), "(7)" представляет результат для молочнокислой бактерии связанного с мутантным E7 белком типа, на поверхности которой было связано 0,03 мкг мутантного E7 белка на 1,0 × 108 молочнокислых бактерий (без TCA обработки), и "(8)" представляет результат для молочнокислой бактерии связанного с мутантным E7 белком типа, на поверхности которой было связано 0,009 мкг мутантного E7 белка на 1,0 × 108 молочнокислых бактерий (без TCA обработки).
Что касается результатов на Фиг. 1B и 1C, было показано, что интенсивность флуоресценции повышалась с увеличением количества мутантного белка E7.
Необходимо отметить, что, когда количество мутантного белка E7 было 0,9 мкг на 1,0 × 108 молочнокислых бактерий, был получен результат, аналогичный тому, когда количество мутантного белка E7 было 0,3 мкг на 1,0 × 108 молочнокислых бактерий. Поэтому было обнаружено, что количество мутантного белка E7, которое должно быть связано с поверхностью бактерии, является насыщенным при около 0,3 мкг.
Следует указать, что, типичный результат вестерн-блоттинга для белков, описанных ниже, проиллюстрирован на Фиг. 1D.
[Белок]
* His-меченный гибридный белок, состоящий из cA и мутантного белка E7 (48 кДа);
* His-меченный cA (33 кДа); и
* His-меченный мутантный белок E7 (15 кДа).
На Фиг. 1D "1" представляет результат для "His-меченного гибридного белка, состоящего из cA и мутантного белка Е7," "2" представляет результат для "His-меченного cA," "3" и "5" представляют результат для "образца, полученного из E. coli до индукции экспрессии His-меченного cA," "4" и "6" представляют результат для "образца, полученного из E. coli после индукции экспрессии His-меченного cA," "7" представляет результат для "His-меченного мутантного белка E7", "8" и "10" представляют результат для "образца, полученного из E. coli до индукции экспрессии His-меченного мутантного белка E7", "9" и "11" представляют результат для "образца, полученного из E. coli после индукции экспрессии His-меченного мутантного белка E7".
(Пример получения 2: Получение молочнокислой бактерии типа, экспрессирующего мутантный белок E7)
Молочнокислую бактерию связанного с мутантным E7 белком типа, на поверхности которой экспрессировался мутантный белок E7 (SEQ ID No. 2), который представлял собой происходящий из белка E7 HPV полипептид, получали следующим способом.
С использованием pIGM2 в качестве векторной плазмиды (Kajikawa Akinobu, Eiko Ichikawa and Shizunobu Igimi (2010) Development of a Highly Efficient Protein-Secreting System in Recombinant Lactobacillus casei. J. Microbiol. Biotechnol., 20(2), 375-382) получали векторную плазмиду, в которую была встроена последовательность, кодирующая мутантный белок E7 (SEQ ID NO. 2), и якорный ген, происходящий из Lacotobacillus casei (последовательность протеиназы L. casei), которые были связаны в этом порядке (SEQ ID NO. 4), (далее указана как "pIGM2::E7Rb=prtP якорь") (см. Фиг. 2A).
Терминирующую последовательность удаляли из векторной плазмиды. Полученную плазмиду вводили в Lactobacillus casei IGM394 методом электропорации (далее указана как "L. casei IGM394 [pEK7::E7Rb]").
В качестве отрицательного контроля, Lactobacillus casei IGM394 штамм, в который вводили векторную плазмиду, получали таким же способом, как описано выше, за исключением того, что последовательность, кодирующую мутантный белок E7 (SEQ ID NO. 2), и якорный ген, происходящий из Lacotobacillus casei (последовательность протеиназы L. casei), которые были связаны в этом порядке (SEQ ID NO. 4), не вводили в векторную плазмиду (далее указывается как "L. casei IGM394 [pLP пустой]").
Молочнокислую бактерию высевали в жидкую среду (MRSE), которая представляла собой среду Манна-Рогоза-Шарпа (Difco Laboratories), дополненную 5 мкг/мл Em, и затем культивировали при 37°C в течение ночи (около 14 часов). Молочнокислую бактерию собирали из культурального раствора (5000 g × 10 мин) и промывали один раз при помощи PBS (5000 g × 10 мин). Добавляли PBS для доведения таким образом концентрации полученной жидкой клеточной суспензии до 1 × 109 КОЭ/мл.
Доведенную до нужной концентрации жидкую клеточную суспензию высевали в 1 л MRSE ((i) без добавления NaHCO3, pH 6,4, (ii) с добавлением 10 мМ NaHCO3, pH 6,8, или (iii) с добавлением 25 мМ NaHCO3, pH 7,1) в количестве, равном 10% MRSE (1 × 108 КОЭ/мл). Полученное культивировали при 37°C в течение примерно 5 часов при осторожном перемешивании в анаэробных условиях (с использованием ANAEROPACK).
Необходимо отметить, что молочнокислую бактерию, служащую в качестве отрицательного контроля, культивировали в (i) MRSE без добавления NaHCO3.
Молочнокислую бактерию собирали из этого культурального раствора (5000 g × 10 мин) и промывали один раз при помощи PBS (5000 g × 10 мин). Добавляли тридцать миллилитров PBS, чтобы таким образом довести конечную концентрацию полученной жидкой клеточной суспензии до 7,5 × 109 клеток/мл (OD ≈ 7,5). Необходимо отметить, что количество молочнокислых бактерий подсчитывали с использованием гемоцитометра.
Жидкую клеточную суспензию нагревали в автоклаве при 80°C в течение 5 минут, чтобы убить бактерии. Также, бактерии, которые не нагревали в автоклаве, использовали в качестве образца живых бактерий.
Таким образом, были получены описанные ниже молочнокислые бактерии типа, экспрессирующего мутантный белок E7:
(i-1) Молочнокислая бактерия типа, экспрессирующего мутантный E7 белок, которую культивировали в MRSE без добавления NaHCO3 (pH 6,4) и убивали;
(i-2) Молочнокислая бактерия типа, экспрессирующего мутантный E7 белок, которую культивировали в MRSE без добавления NaHCO3 (pH 6,4) и не убивали;
(ii-1) Молочнокислая бактерия типа, экспрессирующего мутантный E7 белок, которую культивировали в MRSE с добавлением 10 мМ NaHCO3 (pH 6,8) и убивали;
(ii-2) Молочнокислая бактерия типа, экспрессирующего мутантный E7 белок, которую культивировали в MRSE с добавлением 10 мМ NaHCO3 (pH 6,8) и не убивали;
(iii-1) Молочнокислая бактерия типа, экспрессирующего мутантный E7 белок, которую культивировали в MRSE с добавлением 25 мМ NaHCO3 (pH 7,1) и убивали; и
(iii-2) Молочнокислая бактерия типа, экспрессирующего мутантный E7 белок, которую культивировали в MRSE с добавлением 25 мМ NaHCO3 (pH 7,1) и не убивали.
<FACS анализ>
Молочнокислые бактерии экспрессирующего мутантный E7 белок типа (i-1), (ii-1) и (iii-1) и отрицательный контроль подвергали FACS анализу таким же способом, как в примере получения 1, для подтверждения таким образом степени экспрессии мутантного белка E7 на поверхностиях бактерий на 1,0 × 108 молочнокислых бактерий. Результаты показаны в Фиг. 2B.
На Фиг. 2B "N" представляет результат для отрицательного контроля (убитая бактерия), "(i-1)" представляет результат для молочнокислой бактерии типа, экспрессирующего мутантный E7 белок, которую культивировали в MRSE без добавления NaHCO3 (pH 6,4) и убивали, "(ii-1)" представляет результат для молочнокислой бактерии типа, экспрессирующего мутантный E7 белок, которую культивировали в MRSE с добавлением 10 мМ NaHCO3 (pH 6,8) и убивали, и "(iii-1)" представляет результат для молочнокислой бактерии типа, экспрессирующего мутантный E7 белок, которую культивировали в MRSE с добавлением 25 мМ NaHCO3 (pH 7,1) и убивали.
Что касается результата, показанного на Фиг. 2B, было показано, что экспрессируемое количество мутантного белка E7 на поверхности бактерии можно модифицировать путем регулирования pH культурального раствора.
(Пример испытания 1: Сравнение количеств мутантных белков E7 на поверхностях бактерий)
Описанные ниже образцы подвергали FACS анализу таким же способом, как в примере получения 1, для сравнения количеств мутантных белков E7 на поверхностиях бактерий на 1,0 × 108 молочнокислых бактерий. Результаты показаны на Фиг. 3A и 3B.
<Образец>
(I) × × × Отрицательный контроль в Примере получения 2 (убитые бактерии);
(II) × × × LacE7 препарат, полученный в Сравнительном примере получения 1;
(III) × × × Молочнокислая бактерия связанного с мутантным E7 белком типа, на поверхности которой 0,03 мкг мутантного E7 белка было связано на 1,0 × 108 молочнокислых бактерий (с TCA обработкой) (3) в Примере получения 1; и
(IV) × × × Молочнокислая бактерия типа, экспрессирующего мутантный E7 белок, которую культивировали в MRSE с добавлением 25 мМ NaHCO3 (pH 7,1) и убивали (iii-1), в Примере получения 2.
На Фиг. 3A и 3B "(I)" представляет результат образца (I), "(II)" представляет результат образца (II), "(III)"ʺ представляет результат образца (III), и "(IV)" представляет результат образца (IV).
Что касается результата, показанного на Фиг. 3A (условия измерения: напряжение 525В), было показано, что в существующем LacE7 препарате интенсивность флуоресценции широко распределялась, т.е. было больше молочнокислых бактерий, на поверхности которых мутантные белки E7 не экспрессировались. Также, что касается результата, показанного на Фиг. 3B (условия измерения: напряжение 600 В), было показано, что в существующем LacE7 препарате экспрессия мутантного белка E7 на поверхности бактерии была ниже.
При этом, в молочнокислой бактерии типа, экспрессирующего мутантный E7 белок, которую культивировали в MRSE с добавлением 25 мМ NaHCO3 (pH 7,1) и убивали, (iii-1) в Примере получения 2, экспрессируемое количество мутантного белка E7 на 1,0 × 108 молочнокислых бактерий было определено как около 0,3 мкг.
(Пример испытания 2: Испытание-1 способности индуцировать мукозальный иммунитет против HPV)
Испытание способности индуцировать мукозальный иммунитет против HPV осуществляли с использованием LacE7 препарата, полученного в Сравнительном примере 1, следующим способом.
<Иммунизация мыши>
Мышей перорально иммунизировали LacE7 препаратом в соответствии с процедурой, описанной в K. Adachi et al., Vaccine, 2010, vol. 28, pp. 2810-2817.
<<Пероральное введение LacE7 препарата мыши>>
Шестинедельных самок SPF C67BL мышей (CLEA Japan, Inc.) иммунизировали LacE7 препаратом через пероральное введение.
LacE7 препарат (0,1 мкг, 0,3 мкг или 1,0 мкг на мышь) вводили в течение в общей сложности 4 циклов в недели 1, 2, 4 и 6. Для всех введений LacE7 препарат суспендировали в 200 мл PBS и вводили через желудочный зонд после 3-часового голодания один раз в день в течение последовательных пяти дней каждую неделю.
<Сбор кишечника>
Через неделю после последней инокуляции LacE7 препарата (неделя 7) пять мышей, которым инокулировали LacE7 препарат, вскрывали и собирали их кишечники. После того, как из кишечников удаляли фекалии, внутренню часть каждого кишечного тракта промывали при помощи 10 мл HBSS, дополненного ингибитором протеазы.
<Препарат лимфоцитов слизистой оболочки мыши >
Каждый кишечник раскрывали в продольном направлении и интенсивно встряхивали в PRMI1640 среде, которая содержала 10% масс. инактивированной фетальной бычьей сыворотки, 2 мМ L-глутамина, 1 мМ пирувата натрия, 1 × не относящихся к незаменимым аминокислот и 50 мМ 2-меркаптоэтанола, дополненной 10% масс. FBS, 100 Ед./мл пенициллина и 100 мкг/мл стрептомицина, при 37°C в течение 30 минут. Жидкую клеточную суспензию собирали, пропускали через BD FALCON (торговая марка) клеточный фильтр (BD Bioscience, USA) для удаления тканевого дебриса и затем подвергали прерывистому центрифугированию в градиенте плотности в 15 мл пробирке, содержащей слой 40% масс. PERCOLL PLUS поверх слоя 70% масс. PERCOLL PLUS. От около 107 до около 108 клеток наслаивали поверх этого, затем осуществляли центрифугирование при 600 × g и комнатной температуре в течение 20 минут. Как результат, мукозальные лимфоциты (жизнеспособность клеток: 95%) были сконцентрированы на границе раздела между 70% масс. PERCOLL PLUS слоем и 40% масс. PERCOLL PLUS слоем. От около 5 × 106 до около 10 × 106 мукозальных лимфоцитов получали от каждой мыши.
<ELISPOT анализ>
Пятьдесят микролитров суспензии кишечных мукозальных лимфоцитов (5 × 106 клеток/мл) инкубировали в течение 24 часов при 37°C вместе с антигенпрезентирующими клетками.
В соответствии с инструкциями изготовителя набора MOUSE IFN-γ ELISPOT KIT (MABTECH AB, Sweden), 10 мл синтетического пептида (1 мкг/мл), состоящего из аминокислот в положениях 49-57 E7 белка, который, согласно сообщениям, является CTL эпитопом для белка E7 HPV (SEQ ID No. 1), митоген (40 нг/мл форболмиристат ацетата плюс 4 мкг/мл иономицина) или только среду (контроль) добавляли по каплям в 96-луночный планшет (например, ELIIP планшет, Millipore, USA), покрытый антимышиными IFN-γ антителами. Количество IFN-γ-положительных пятен на 96-луночном планшете анализировали с использованием полностью атоматизированной компьютерной видео-визуализационной системы анализа, KS ELISPOT (Carl Zeiss Vision, Germany).
<Статистический анализ>
ELISPOT данные представляли как средние значения ± стандартные отклонения. Эти значения или сравнительные значения сравнивали между группами иммунизации (5 мышей/группа) с использованием двустороннего критерия Стьюдента. p-Значение <0,05 считали значимым.
Результаты Примера испытания 2 проиллюстрированы на Фиг. 4.
Как видно из Фиг. 4, количество IFN-γ-продуцирующих клеток на 106 клеток увеличивалось в зависимости от вводимого количества.
Также, что касается результатов, показанных на Фиг. 4, количество IFN-γ-продуцирующих клеток на 106 клеток, согласно подсчетам, составило 65,8 клеток в случае, когда вводили 0,5 мкг LacE7 препарата (как показано стрелкой на Фиг. 4).
(Пример испытания 3: Испытание-2 способности индуцировать мукозальный иммунитет против HPV)
Испытание способности индуцировать мукозальный иммунитет против HPV осуществляли таким же способом, как в Примере испытания 2, за исключением того, что каждый из описанных ниже образцов вводили при 0,5 мкг/мышь.
<Образец>
* Образец-1: Молочнокислая бактерия связанного с мутантным E7 белком типа, на поверхности которой было связано 0,3 мкг мутантного E7 белка на 1,0 × 108 молочнокислых бактерий (с TCA обработкой), (1) в Примере получения 1;
* Образец-2: Молочнокислая бактерия связанного с мутантным E7 белком типа, на поверхности которой было связано 0,09 мкг мутантного E7 белка на 1,0 × 108 молочнокислых бактерий (без TCA обработки), (6) в Примере получения 1;
* Образец-3: Молочнокислая бактерия связанного с мутантным E7 белком типа, на поверхности которой было связано 0,3 мкг мутантного E7 белка на 1,0 × 108 молочнокислых бактерий (без TCA обработки), (5) в Примере получения 1;
* Образец-4: Молочнокислая бактерия типа, экспрессирующего мутантный E7 белок, которую культивировали в MRSE с добавлением 25 мМ NaHCO3 (pH 7,1) и не убивали, (iii-2) в Примере получения 2; и
* Образец-5: Молочнокислая бактерия типа, экспрессирующего мутантный E7 белок, которую культивировали в MRSE с добавлением 25 мМ NaHCO3 (pH 7,1) и убивали, (iii-1) в Примере получения 2.
Результаты показаны на Фиг. 5. На Фиг. 5, цифры 1-5 на горизонтальной оси представляют номера образцов.
На Фиг. 5 также проиллюстрированы результаты Примера испытания 2. На Фиг. 5, A представляет результат в случае, когда LacE7 препарат вводили при 0,1 мкг/мышь в Примере испытания 2, B представляет результат в случае, когда LacE7 препарат вводили при 0,3 мкг/мышь в Примере испытания 2, и C представляет результат в случае, когда LacE7 препарат вводили при 1,0 мкг/мышь в Примере испытания 2.
Стрелка на Фиг. 5 представляет количество IFN-γ-продуцирующих клеток на 106 клеток в случае, когда LacE7 препарат вводили при 0,5 мкг/мышь, рассчитанное из результатов Примера испытания 2.
Что касается результатов, представленных на Фиг. 5, было показано, что образцы 1-5, которые представляли собой молочнокислые бактерии связанного с мутантным E7 белком типа или молочнокислые бактерии типа, экспрессирующего мутантный E7 белок, по настоящему изобретению, имели еще более лучшую способность индукции иммунитета против HPV по сравнению с LacE7 препаратом, являющимся известным препаратом, который вводили в таком же количестве, как и образцы.
В частности, было показано, что способность образцов 2-5 индуцировать иммунитет против HPV была очень высокой, т.е. примерно в два раза выше, чем у LacE7 препарата, являющегося известным препаратом, который вводили в таком же количестве, как и образцы.
В клиническом испытании на людях, являющихся CIN3 пациентами, с использованием известного LacE7 препарата, которое было осуществлено авторами настоящего изобретения, количество IFN-γ-продуцирующих клеток в группе лечения сравнивали с их количеством в группе, не получавшей лечения. Было продемонстрировано, что количество IFN-γ-продуцирующих клеток в группе лечения было примерно в два раза больше, чем в группе, не получавшей лечения (K. Kawana et al., "Oral vaccination against HPV E7 for treatment of cervical intraepithelial neoplasia grade 3 (CIN3) elicits E7-specific mucosal immunity in the cervix of CIN3 patients.", Vaccine, 2014 Oct 29; 32 (47): 6233-9.).
Поэтому, основываясь на том факте, что количество IFN-γ-продуцирующих клеток у тех, кому вводили молочнокислые бактерии связанного с мутантным E7 белком типа или молочнокислые бактерии типа, экспрессирующего мутантный E7 белок, по настоящему изобретению, было примерно в два раза больше, чем у тех, кому вводили известный LacE7 препарат в таком же количестве, можно предположить, что молочнокислая бактерия по настоящему изобретению будет существенно улучшать клинический эффект (процент положительного клинического ответа).
Аспекты настоящего изобретения представляют собой, например, следующие.
<1> Композиция, содержащая молочнокислую бактерию, включающая
молочнокислую бактерию, содержащую на своей поверхности происходящий из белка E7 папилломавируса человека (HPV) полипептид,
где происходящий из белка E7 HPV полипептид включен в количестве от 0,03 мкг до 1,0 мкг на 1 × 108 молочнокислых бактерий.
<2> Композиция, содержащая молочнокислую бактерию, в соответствии с <1>, где происходящий из белка E7 HPV полипептид связан на поверхности молочнокислой бактерии.
<3> Композиция, содержащая молочнокислую бактерию, в соответствии с <1>, где происходящий из белка E7 HPV полипептид экспрессируется на поверхности молочнокислой бактерии.
<4> Композиция, содержащая молочнокислую бактерию, в соответствии с любым из <1> - <3>, где молочнокислая бактерия представляет собой Lactobacillus casei.
<5> Терапевтическая пероральная фармацевтическая композиция для по меньшей мере одного из HPV инфекционного заболевания и HPV-ассоциированной опухоли, включающая
композицию, содержащую молочнокислую бактерию, в соответствии с любым из <1> - <4>.
<6> Терапевтическая пероральная фармацевтическая композиция для по меньшей мере одного из HPV инфекционного заболевания и HPV-ассоциированной опухоли в соответствии с <5>, где композицию применяют для лечения по меньшей мере одного из интраэпителиальной неоплазии шейки матки и ранней стадии рака шейки матки.
<7> Средство, индуцирующее мукозальный иммунитет, включающее
композицию, содержащую молочнокислую бактерию, в соответствии с любым из <1> - <4>.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИННАЯ КОМПОЗИЦИЯ, ПРИГОДНАЯ ПРИ ИНФЕКЦИЯХ HPV И ВИРУСОМ ГЕПАТИТА В, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2009 |
|
RU2509570C2 |
| СТАБИЛЬНЫЙ ВЕКТОР КОНСТИТУТИВНО ВЫСОКОЙ ЭКСПРЕССИИ ДЛЯ ПОЛУЧЕНИЯ ВАКЦИНЫ ПРОТИВ ВПЧ И ТРАНСФОРМИРОВАННЫЕ ЭТИМ ВЕКТОРОМ РЕКОМБИНАНТНЫЕ МОЛОЧНОКИСЛЫЕ БАКТЕРИИ | 2010 |
|
RU2492240C2 |
| ВАКЦИНЫ ПРОТИВ HPV | 2012 |
|
RU2644201C2 |
| ОПТИМИЗИРОВАННАЯ ЭКСПРЕССИЯ HPV 58 L1 В ДРОЖЖАХ | 2004 |
|
RU2370538C2 |
| КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ РАКА, АССОЦИИРОВАННОГО С ИНФЕКЦИЕЙ HPV | 2017 |
|
RU2664466C1 |
| ХИМЕРНАЯ ЧАСТИЦА HPV | 2012 |
|
RU2642287C2 |
| ЛЕЧЕНИЕ ИНФЕКЦИИ, ВЫЗЫВАЕМОЙ ВИРУСОМ ПАПИЛЛОМЫ ЧЕЛОВЕКА | 2001 |
|
RU2282461C2 |
| МУКОЗАЛЬНАЯ ВАКЦИНА ДЛЯ ИММУНОТЕРАПИИ ЗАБОЛЕВАНИЙ, ОБУСЛОВЛЕННЫХ ВИРУСАМИ ПАПИЛЛОМЫ ЧЕЛОВЕКА, И СПОСОБ ЛЕЧЕНИЯ С ЕЕ ИСПОЛЬЗОВАНИЕМ (ВАРИАНТЫ) | 2008 |
|
RU2377305C1 |
| ОПТИМИЗИРОВАННАЯ ЭКСПРЕССИЯ HPV 52 L1 В ДРОЖЖАХ | 2005 |
|
RU2373219C2 |
| ВАКЦИНА ПРОТИВ ВИРУСОВ ПАПИЛЛОМЫ ЧЕЛОВЕКА HPV 16 И HPV 18 И ПО МЕНЬШЕЙ МЕРЕ ЕЩЕ ОДНОГО ТИПА HPV, ВЫБРАННОГО ИЗ HPV 31, 45 ИЛИ 52 | 2005 |
|
RU2420313C2 |

Изобретение относится к медицине, а именно к иммунологии, и может быть использовано для индукции мукозального иммунитета против папилломавируса человека (HPV). Композиция содержит молочнокислую бактерию, содержащую на своей поверхности происходящий из белка E7 папилломавируса человека (HPV) полипептид. Причем происходящий из белка E7 HPV полипептид слит с якорным белком сА, происходящим из AcmA, с формированием слитого белка или экспрессируется из последовательности нуклеиновой кислоты, кодирующей происходящий из белка E7 HPV полипептид, связанной с якорным геном PrtP, где происходящий из белка E7 HPV полипептид включен в количестве от 0,03 до 1,0 мкг на 1×108 молочнокислых бактерий на поверхности бактерии. Использование данного изобретения позволяет получить пероральную композицию против HPV инфекционного заболевания и HPV-ассоциированной опухоли, индуцирующую мукозальный иммунитет, увеличивая количество IFN-γ-продуцирующих клеток. 6 з.п. ф-лы, 3 пр., 5 ил.
1. Композиция, содержащая молочнокислую бактерию, для индукции мукозального иммунитета против папилломавируса человека (HPV), включающая молочнокислую бактерию, содержащую на своей поверхности происходящий из белка E7 папилломавируса человека (HPV) полипептид, причем происходящий из белка E7 HPV полипептид слит с якорным белком сА, происходящим из AcmA, с формированием слитого белка или экспрессируется из последовательности нуклеиновой кислоты, кодирующей происходящий из белка E7 HPV полипептид, связанной с якорным геном PrtP, где происходящий из белка E7 HPV полипептид включен в количестве от 0,03 до 1,0 мкг на 1×108 молочнокислых бактерий на поверхности бактерии.
2. Композиция, содержащая молочнокислую бактерию, по п.1, в которой происходящий из белка E7 вируса папилломы человека (HPV) полипептид представляет собой белок E7 вируса папилломы человека дикого типа или мутант белка E7, в котором Asp в положении 21, Cys в положении 24 и Glu в положении 26 белка Е7 HPV16 дикого типа (SEQ ID No. 1) заменены на Gly.
3. Композиция, содержащая молочнокислую бактерию, по п.1 или 2, где происходящий из белка E7 HPV полипептид связан на поверхности молочнокислой бактерии.
4. Композиция, содержащая молочнокислую бактерию, по п.1 или 2, где происходящий из белка E7 HPV полипептид экспрессируется на поверхности молочнокислой бактерии.
5. Композиция, содержащая молочнокислую бактерию, по любому из пп. 1-4, где молочнокислая бактерия представляет собой Lactobacillus casei.
6. Композиция, содержащая молочнокислую бактерию, по любому из пп. 1-5, предназначенная для перорального введения.
7. Композиция, содержащая молочнокислую бактерию, по любому из пп. 1-6, используемая для лечения по меньшей мере одного заболевания из числа интраэпителиальной неоплазии шейки матки и ранней стадии рака шейки матки.
| WO 2012137071 А1, 11.10.2012 | |||
| РОО Н | |||
| et al | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| RIBELLES P | |||
| et al | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
Авторы
Даты
2020-07-31—Публикация
2016-01-28—Подача