УРОВЕНЬ ТЕХНИКИ
Изобретение относится к химерной вирусоподобной частице (VLP) папилломавируса человека, имеющей диаметр приблизительно 30 нм, и способу лечения и/или профилактике инфекции HPV и/или рака шейки матки введением химерной HPV VLP по изобретению.
Рак шейки матки первично вызывается инфекцией HPV и является третьим наиболее распространенным раком среди женщин во всем мире (Ferlay et al., 2010). В результате, развитие вакцины HPV является приоритетом для профилактического исследования рака. Главным капсидным белком L1 является антиген, предпочитаемый для профилактических вакцин, так как он является иммунодоминантным и самособирается в VLP, которые являются структурно и иммунологически сходными с аутентичными вирионами. Вакцинация с использованием вирусоподобных белков VLP дает высокие титры нейтрализующих антител (NAb) как у животных, так и у людей, и две поливалентные профилактические вакцины на основе HPV L1 VLP были лицензированы и являются высокоэффективными в предотвращении инфекций HPV-16 и 18 вакцинного типа и ассоциированного заболевания (Schiller et at, 2008).
Несмотря на высокую эффективность существующих вакцин на основе L1 VLP HPV, типоспецифичность (Brown et al., 2009; Wheeler et al., 2009), отсутствие терапевтической эффективности (FUTURE H Study Group, 2007; Hildersheim et al, 2007) и высокая стоимость вакцин (Schiller et al., 2008) ограничивали их широкое применение, особенно в развивающихся странах с >80% бременем рака шейки матки (Parkin and Bray, 2006). Таким образом, существует острая необходимость в HPV-вакцинах второго поколения, которые расширяют защиту для включения множественных онкогенных типов HPV и улучшают терапевтическую эффективность, для установления инфекций HPV и раковых поражений.
Профилактические вакцины HPV широкого спектра могут быть разработаны с использованием перекрестной нейтрализации эпитопов L2. Эпитопы L2 могут быть включены в поверхностные области L1 для создания химер L1/L2, несущих пептид L2 на поверхности собранного L1 (WO 03/097673; Kawana et al., 1999, 2003; Slupetzky et al., 2007; Kondo et al., 2007, 2008).
Применение экспрессионных систем растений для широкомасштабного производства чужеродных антигенов было предложено в качестве экономически эффективной альтернативы для получения вакцин (Fischer et al., 2004), с безусловной тенденцией в отношении применения транзиторной экспрессии для экспрессии и оптимизации высокого уровня (Rybicki, 2009). Несколько групп экспрессировали HPV-16 L1 в растениях (Biemelt et al., 2003; WO 2006/119516; Maclean et al., 2007).
Одним ограничением систем растений на практике являются низкие выходы рекомбинантного белка, возможно, являющиеся результатом нестабильности или экспрессии низкого уровня. (Fischer et al., 2004; Obembe et al., 2011). Оценивается, что экспрессируемые растением выходы рекомбинантого белка должны превышать 1% общего растворимого белка (TSP) для рентабельности (Fischer et al., 2004). Это особенно проблематично для экспрессии рекомбинантных белков с использованием ядерно-трансформированных трансгенных растений, так как эти системы часто ассоциированы с низкими выходами рекомбинантного белка (Rybicki, 2009).
HPV-16 L1 экспрессировали трансгенно в ядерно-трансформированных растениях картофеля и табака, но постоянно сообщались низкие уровни экспрессии HPV-16 L1 (<1% TSP), и выявляемые иммунные ответы были относительно слабыми (Biemelt et al., 2003; Varsani et al, 2003b; Varsani et al., 2006a).
Однако оптимизация кодонами человека гена L1 с использованием кодонов человека и нацеливание на хлоропласт значимо улучшали экспрессию HPV-16 L1 как в трансгенных, так и Agrobacterium-опосредованных транзиторных системах экспрессии табака до приблизительно 17% TSP (Maclean et al., 2007).
Одним недавним развитием в произведенных из растений вакцинах HPV была экспрессия первой химеры HPV-16 L1 в растениях. Эта химера L1/E6/E7 состояла из HPV-16 L1, слитого на C-конце с несколькими эпитопами E6 и E7, и она была экспрессирована в трансгенных томатах (Paz De la Rosa et al., 2009). Однако, выходы были низкими (0,05-0,1% TSP) и, следовательно, не были коммерчески рентабельными.
В WO 2011/077371 описан способ получения химерных полипептидов HPV L1 с увеличенными уровнями экспрессии относительно белка HPV L1 в системах экспрессии насекомого, растения или дрожжей. Хотя оптимизированные кодонами человека химеры L1/L2, полученные из HPV L1 и BPV L2 (аминокислоты 1-88) в растениях, образовывали VLP приблизительно 55 нм, другие химеры HPV L1/L2 были способны образовывать только капсомеры с диаметром приблизительно 17 нм.
Хотя капсомеры являются стабильными при комнатной температуре, они способны индуцировать только 20-40-кратно более низкие гуморальные иммунные ответы по сравнению с VLP (Thones er al., 2008). Таким образом, было бы полезным развитие химерного VLP, содержащего L1 и L2, который экспрессируется при коммерчески рентабельных уровнях в системе экспрессии. Такой химерный VLP мог бы легче очищаться и является, по-видимому, более иммуногенным, чем химерный капсомер.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Согласно первому аспекту, изобретение относится к химерной вирусоподобной частице (VLP) папилломавируса человека (HPV), имеющей размер приблизительно 30 нм, причем химерная HPV VLP содержит химерный полипептид HPV 16 L1/L2, кодируемый оптимизированной кодонами человека нуклеотидной последовательностью, причем химерный полипептид HPV 16 L1/L2 дополнительно содержит полипептид HPV L1, который включает пептид HPV L2, между приблизительно 13 - приблизительно 26 аминокислотами, инсертированными от остатка 414 полипептида HPV 16 L1, и где аминокислоты инсертированного пептида HPV L2 заменяют соответствующие аминокислоты полипептида HPV 16 L1.
Например, инсертированный пептид HPV L2 может быть содержащим 13 аминокислот пептидом LVEETSFIDAGAP (SEQ ID NO: 3), кодируемым оптимизированной кодонами человека нуклеотидной последовательностью, представленной в SEQ ID NO: 7, или содержащим 20 аминокислот пептидом QLYKTCKQAGTCPPDIIPKV (SEQ ID NO: 5), кодируемым оптимизированной кодонами человека нуклеотидной последовательностью, представленной в SEQ ID NO: 9, или содержащим 26 аминокислот пептидом GGLGIGTGSGTGGRTGYIPLGTRPPT (SEQ ID NO: 4), кодируемым оптимизированной кодонами человека нуклеотидной последовательностью, представленной в SEQ ID NO: 8.
Предпочтительно, инсертированный пептид HPV L2 является содержащим 13 аминокислот пептидом LVEETSFIDAGAP (SEQ ID NO: 3), кодируемым оптимизированной кодонами человека нуклеотидной последовательностью, представленной в SEQ ID NO: 7.
Белок HPV типа 16 L1 может дополнительно кодироваться нуклеотидной последовательностью, модифицированной таким образом, что он лишен сигнала ядерной локализации.
Предпочтительно, полипептид HPV-16 L1/L2 содержит аминокислотную последовательность, представленную в SEQ ID NO: 22, SEQ ID NO: 23 или SEQ ID NO: 24, или ее вариант, или производное.
Предпочтительно, полипептид HPV-16 L1 представлен в SEQ ID NO: 1, и полипептид HPV-16 L1 кодируется оптимизированной кодонами человека полинуклеотидной последовательностью HPV-16 L1, представленной в SEQ ID NO: 2.
Имеющий диаметр приблизительно 30 нм, химерный HPV VLP может быть экспрессируемым растением химерным HPV VLP, очищенным из системы экспрессии растения. Предпочтительно, экспрессируемый химерный VLP может быть нацелен на хлоропласт растения.
Согласно другому аспекту, изобретение относится к фармацевтической композиции, содержащей имеющий диаметр 30 нм химерный HPV VLP в соответствии с изобретением и фармацевтически приемлемый носитель.
Композиция может также содержать адъювант.
Согласно другому аспекту, изобретение относится к способу получения химерного HPV VLP, имеющего диаметр 30 нм, включающему стадии:
(i) получения химерной оптимизированной кодонами человека нуклеотидной последовательности, кодирующей химерный полипептид HPV 16 L1/L2, причем химерный полипептид HPV 16 L1/L2 содержит полипептид HPV 16 L1, имеющий пептид HPV L2 из приблизительно 13 аминокислот - приблизительно 26 аминокислот, инсертированный от остатка 414 химерного полипептида 16 L1/L2, где аминокислоты инсертированного пептида HPV L2 заменяют соответствующие аминокислоты полипептида HPV 16 L1;
(ii) клонирования химерной оптимизированной кодонами человека нуклеотидной последовательности в экспрессирующий вектор, адаптированный для экспрессии полипептида в растении;
(iii) трансформации или инфильтрации клетки растения экспрессирующим вектором стадии (ii);
(iv) экспрессии химерного полипептида HPV 16 L1/L2 в клетке растения стадии (iii) таким образом, что экспрессируемый химерный полипептид HPV 16 L1/L2 собирается в химерный HPV VLP, имеющий однородную форму и диаметр приблизительно 30 нм; и
(v) извлечения химерного HPV VLP из клетки растения.
Экспрессирующий вектор предпочтительно включает промотор и другие регуляторные последовательности или т.п., которые функционально связаны с кодирующей последовательностью экспрессирующего вектора.
Предпочтительно, экспрессирующий вектор стадии (ii) адаптирован к нацеливанию на хлоропласт клетки растения и на стадии (iv) экспрессированный химерный белок HPV нацелен на хлоропласт растения.
Стадия (iii) может дополнительно включать введение в клетку растения супрессорного белка, адаптированного для ингибирования пост-транскрипционного сайленсинга генов в растении. Предпочтительно супрессорный белок является NS-белком вируса пятнистого увядания (бронзовости) томата или р19 вируса кустистой карликовости томата.
Например, инсертированный пептид HPV 12 может быть пептидом из 13 аминокислот LVEETSFIDAGAP (SEQ ID NO: 3), кодируемым оптимизированной кодонами человека нуклеотидной последовательностью, представленной в SEQ ID NO: 7, или пептидом из 20 аминокислот QLYKTCKQAGTCPPDIIPKV (SEQ ID NO: 5), кодируемым оптимизированной кодонами человека нуклеотидной последовательностью, представленной в SEQ ID NO: 9, или пептидом из 26 аминокислот GGLGIGTGSGTGGRTGYIPLGTRPPT (SEQ ID NO: 4), кодируемым оптимизированной кодонами человека нуклеотидной последовательностью, представленной в SEQ ID NO: 8.
Предпочтительно, инсертированный пептид HPV L2 является пептидом из 13 аминокислот LVEETSFIDAGAP (SEQ ID NO: 3), кодируемым оптимизированной кодонами человека нуклеотидной последовательностью, представленной в SEQ ID NO: 7.
Согласно другому аспекту, изобретение относится к имеющему диаметр приблизительно 30 нм химерному HPV VLP в соответствии с изобретением для применения в способе профилактики и/или лечения инфекции HPV и/или рака шейки матки у пациента.
Более конкретно, химерный HPV VLP может иметь применение в способе индукции иммунного ответа у пациента, такого как ответ нейтрализующего антитела и/или ЦТЛ-ответ. Предпочтительно, химерный HPV VLP находит применение в индукции перекрестно-защитного иммунного ответа на множественные типы HPV у пациента.
Согласно другому аспекту, изобретение относится к применению химерного HPV VLP, имеющего правильную форму, диаметр приблизительно 30 нм, в соответствии с изобретением, в получении лекарственного средства для применения в способе профилактики и/или лечения инфекции HPV и/или рака шейки матки у пациента.
Более конкретно, лекарственное средство может быть использовано в способе индукции иммунного ответа у пациента, такого как ответ нейтрализующего антитела и/или ЦТЛ-ответ. Предпочтительно, лекарственное средство используют в индукции перекрестно-защитного иммунного ответа для множественных типов HPV у пациента.
Согласно другому аспекту, изобретение относится к способу профилактики и/или лечения инфекции и/или рака шейки матки у пациента, включающему стадию введения профилактически или терапевтически эффективного количества химерного HPV VLP соответствии с изобретением, имеющего однородную форму, диаметр приблизительно 30 нм, пациенту.
Более конкретно, способ может включать индукцию иммунного ответа у пациента, такого как ответ нейтрализующего антитела и/или ЦТЛ-ответ. Предпочтительно, способ включает индукцию перекрестно-защитного иммунного ответа для множественных типов HPV у пациента.
Предпочтительно пациентом является человек.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 показывает плазмиды, используемые для создания HPV-химерных конструкций экспрессией в растениях. C) HPV-химерные гены из конструкций pGA4 направленно субклонировали в экспрессирующие векторы растения Agrobacterium; A) pTRAkc-rbcs1-cTP, B) pTRAc и D) pRIC3. На этой фигуре показаны векторные элементы, необходимые для экспрессии в растении. P35SS: промотор CaMV 35S, содержащий дуплицированный транскрипционный энхансер, CHS: 5’-нетранслируемую область халконсинтазы, pA35S: сигнал полиаденилирования CaMV 35S для экспрессии чужеродных генов, ColE1ori: сайт инициации репликации (ориджин) E. coli, RK2ori: ориджин репликации Agrobacterium, bla: ген устойчивости к ампициллину/карбенициллину, и LB/RB: левая и правая границы для интеграции T-DNA. Вектор pTRAc содержит SAR: области присоединения каркаса Rb7 табака, фланкирующие экспрессионную кассету. Кроме того, вектор pTRAkc-rbcs1-cTP содержит npt II: ген устойчивости к канамацину, Pnos/pAnos: промотор/сигнал полиаденирования гена нопалинсинтазы и rbcs1-cTP; последовательность транзитного пептида хлоропласта Solanum tuberosum гена rbcS1 малой субъединицы Rubisco. Вектор pRIC3 содержит LIR: длинную межгенную область BeYDV, SIR: короткую межгенную область и ген Rep/RepA: BeYDV.
Фиг. 2 показывает испытание во времени экспрессии нацеленной на хлороплат химеры L1/L2 в 1-9 дни после инфильтрации (dpi) в N. benthamiana, либо с (+), либо без (-) супрессора сайленсинга NS. Химеры L1/L2 A) L1/L2(108-120), B) L1/L2(56-81), C) L1/L2(17-36) и D) L1/L2 BPV (1-88) в неочищенных экстрактах листьев детектировали вестерн-блот-анализом CamVir1. M = белковый маркер с размером в кДа, указанным слева. NS-отрицательный контроль = pBIN-NS-инфильтрованный неочищенный экстракт растения (5 dpi). Положительные контроли: N. benthamiana (+) = полученный из растения HPV-16 L1. Черные стрелки указывают положение химер L1/L2 (~56 кДа), и серые стрелки указывают на деградированный белок.
Фиг. 3 а) показывает Вестерн-блот химер L1/L2, экспрессированных с использованием 3 экспрессионных векторов растений: pTRAc, pTRAkc-rbcs1-cTP и pRIC3. Химеры коэкспрессировали с NS, экстрагировали при 5 dpi и детектировали с использованием CamVir1. HPV-16 L1 экспрессировали в качестве положительного контроля для pTRAc и pTRAkc-rbcs1-cTP (конструкция pRIC3 не была доступна) и контролем отрицательной экспрессии были NS-инфильтрованные растения. M = белковый маркер с размером белка, указанным в кДа, слева. Черные стрелки указывают положение химер L1/L2 или HPV-16 L1 (~56 кДа); и b) показывает сравнение химер L1/L2, экспрессированных с использованием 3 экспрессирующих векторов растений: pTRAc, pTRAkc-rbcs1-cTP и pRIC3. Стержни (планки) погрешностей показывают стандартное отклонение.
Фиг. 4 показывает сборку химер L1/L2, экспрессированных с использованием 3 различных экспрессирующих векторов растений: pTRAc, pTRAkc-rbcs1-cTP и pRIC3. Белки коэкспрессировали с супрессором сайленсинга NS и экстрагировали при 5 dpi. Химеры, собранные в высокоупорядоченные структуры, такие как капсомеры или VLP (детектируемые с использованием конформационно-специфического H16.V5 MAb), выражены в виде процента общего химерного белка (детектируемого линейно-специфическим H16.J4 MAb). HPV-16 L1 экспрессировали в качестве положительного контроля экспрессии, и отрицательным контролем экспрессии были NS-инфильтрованные растения. Стержни (планки) погрешностей показывают стандартное отклонение.
Фиг. 5 показывает чистоту продуцируемых растением вакцинных антигенов. A) Окрашенный Кумасси гель белков. B) Вестерн-блот-детектирование антигенов HPV. M = белковый маркер с размером в кДА, указанным слева. C = осветленный экстракт растения. P = очищенный антиген. V1 = L1/L2(108-120), V2 = L1/L2(56-81), V3 = L1/L2(17-36), V4 (+) = HPV-16 L1 и V5 (-) = NS-инфильтрованный экстракт растения. Черные стрелки указывают на антигены HPV, и белые стрелки указывают на белок Rubisco растения.
Фиг. 6 показывает общий растворенный белок (TSP) и общий белок HPV в неочищенных и очищенных пробах. TSP определяли с использованием анализа Лоури, и белок HPV детектировали с использованием H16.J4 (линейно-специфического). V1: L1/L2(108-120), V2: L1/L2(56-81), V3: L1/L2(17-36), V4: HPV-16 L1 (положительный контроль), V5: экстракт NS растения (отрицательный контроль). Стержни (планки) погрешностей показывают стандартное отклонение.
Фиг. 7 показывает микрофотографии трансмиссионного электронного микроскопа CamVir1-иммуноуловленных неочищенных и очищенных вакцинных антигенов A) V1: L1/L2(108-120), B) V2: L1/L2(56-81), C) V3: L1/L2(17-36), D) V4: HPV-16 L1 (положительный контроль), E) V5: NS-экстракт растения (отрицательный контроль). Сетки наблюдали на Zeiss 912 Omega Cryo EFTEM. Левый стержень погрешности = 50 нм, правый стержень погрешности = 200 нм. Светло-серые стрелки указывают на HPV-16-капсомеры (~10 нм), белые стрелки обозначают агрегаты капсомеров или малые VLP (~30 нм), и темно-серые стрелки указывают на полноразмерные VLP (~55 нм).
Фиг. 8 показывает микрофотографию трансмисионного электронного микроскопа CamVir1-иммуноуловленного неочищенного вакцинного антигена L1/L2(56-81). Сетки наблюдали на Zeiss 912 Omega Cryo EFTEM. Стержень (планка) погрешности = 100 нм.
Фиг. 9 показывает прямой анализ ELISA мышиных сывороток с использованием продуцируемого клетками насекомого HPV-16 L1 в качестве покрывающего антигена. V1 = L1/L2(108-120), V2 = L1/L2(56-81), V3 = L1/L2(17-36), V4 = HPV L1 (+ вакцинный контроль), V5 = экстракт растения (- вакцинный контроль). A) Титрование мышиных антисывороток для всех вакцин. B) График, показывающий величины, полученные для положительного контроля ELISA MAb H16.V5 и CamVir1. C) Величины оптической плотности перед кровоизвлечением при разведении 1:50. Маркеры представляют среднюю величину трех повторностей проб, и стержни (планки) погрешностей показывают стандартное отклонение.
Фиг. 10 показывает вестерн-блот-детектирование экспрессированного E. coli His-меченного HPV-16 L2 с использованием мышиных сывороток при разведении 1:100. M = белковый маркер с размером белка в кДа. V1 = L1/L2(108-120), V2 = L1 L2(56-81), V3 = L1/L2(17-36), V4 = HPV L1 (+ вакцинный контроль), V5 = экстракт растения (- вакцинный контроль). PB = сыворотки перед кровоизвлечением. FB = конечные извлеченные сыворотки. Для вестерн-блот-контролей: +ve = анти-His мыши (1:2000; Serotec), -ve = без первичного антитела. Черная стрелка указывает на L2 (~80 кДа).
Фиг. 11 показывает анализ нейтрализации HPV-16 PsV. Объединенные сыворотки из мышей, вакцинированных V1-V5, испытывали на их способность нейтрализовать HPV-16 PsV. A) V1 = L1/L2(108-120), B) V2 = L1/L2(56-81), C) V3 = L1/L2(17-36), D) V4 = HPV-16 L1 (+ve вакцинный контроль), E) V5 = NS-инфильтрованный экстракт растения (-ve вакцинный контроль). F) H16.V5 = +ve контроль нейтрализации. Клеточный контроль = -ve инфекция/контроль экспрессии SEAP. PsV-контроль = +ve инфекция/контроль экспрессии SEAP. Пробы анализировали в трех повторностях, и стержни (планки) погрешностей показывают стандартное отклонение.
Фиг. 12 показывает анализ нейтрализации HPV-18 PsV. A) V1 = L1/L2(108-120), B) V2 = L1/L2(56-81), C) V3 = L1/L2(17-36), D) V4 = HPV-16 L1, E) V5 = NS-инфильтрованный экстракт (-ve вакцинный контроль). F) Кроличьи анти-Cervarix сыворотки = +ve вакцинный контроль.
Фиг. 13 показывает анализ нейтрализации HPV-45 PsV. A) V1 = L1/L2(108-120), B) V2 = L1/L2(56-81), C) V3 = L1/L2(17-36), D) V4 = HPV-16 L1, E) V5 = NS-инфильтрованный экстракт растения (-ve вакцинный контроль). F) H45.N5 = +ve контроль нейтрализации.
Фиг. 14 показывает анализ нейтрализации HPV-52 PsV. A) V1 = L1/L2(108-120), B) V2 = L1/L2(56-81), C) V3 = L1/L2(17-36), D) V4 = HPV-16 L1, E) V5 = NS-инфильтрованный экстракт растения (-ve вакцинный контроль). F) H45.N5 = +ve контроль нейтрализации.
Фиг. 15 показывает аминокислотную последовательность (SEQ ID NO:1) HPV-16 L1.
Фиг. 16 показывает оптимизированные кодонами человека нуклеотидные последовательности (SEQ ID NO: 2) HPV-16 L1.
Фиг. 17 показывает аминокислотную последовательность (SEQ ID NO: 3) эпитопа L2 (108-120), который был инсертирован в последовательность HPV L1.
Фиг. 18 показывает аминокислотную последовательность (SEQ ID NO: 4) эпитопа L2 (56-81), который был инсертирован в последовательность HPV L1.
Фиг. 19 показывает аминокислотную последовательность (SEQ ID NO: 5) эпитопа L2 (17-36), который был инсертирован в последовательность HPV L1.
Фиг. 20 показывает аминокислотную последовательность (SEQ ID NO: 6) эпитопа L2 BPV (1-88), который был инсертирован в последовательность HPV L1.
Фиг. 21 показывает оптимизированную кодонами человека нуклеотидную последовательность ДНК (SEQ ID NO: 7) L2 (108-120), которая была инсертирована в последовательность HPV L1.
Фиг. 22 показывает оптимизированную кодонами человека нуклеотидную последовательность ДНК (SEQ ID NO: 8) L2 (56-81), которая была инсертирована в последовательность HPV L1.
Фиг. 23 показывает оптимизированную кодонами человека нуклеотидную последовательность ДНК (SEQ ID NO: 9) L2 (17-36), которая была инсертирована в последовательность HPV L1.
Фиг. 24 показывает оптимизированную кодонами человека нуклеотидную последовательность ДНК (SEQ ID NO: 10) L2 BPV (1-88), которая была инсертирована в последовательность HPV L1.
Фиг. 25 показывает аминокислотную последовательность (SEQ ID NO: 22) химерного полипептида HPV 16 L1/L2(108-120).
Фиг. 26 показывает аминокислотную последовательность (SEQ ID NO: 23) химерного полипептида HPV 16 L1/L2(56-81).
Фиг. 27 показывает аминокислотную последовательность (SEQ ID NO: 24) химерного полипептида HPV 16 L1/L2(17-36).
Фиг. 28 показывает аминокислотную последовательность (SEQ ID NO: 25) химерного полипептида HPV 16 L1/L2 BPV(1-88).
Фиг. 29 показывает оптимизированную кодоном человека нуклеотидную последовательность ДНК (SEQ ID NO: 26), кодирующую химерный полипептид HPV 16 L1/L2(108-120).
Фиг. 30 показывает оптимизированную кодоном человека нуклеотидную последовательность ДНК (SEQ ID NO: 27), кодирующую химерный полипептид HPV 16 L1/L2(56-81).
Фиг. 31 показывает оптимизированную кодонами человека нуклеотидную последовательность ДНК (SEQ ID NO: 28), кодирующую химерный полипептид HPV 16 L1/L2(17-36).
Фиг. 32 показывает оптимизированную кодонами человека нуклеотидную последовательность ДНК (SEQ ID NO: 29), кодирующую химерный полипептид HPV 16 L1/L2 BPV(1-88).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение будет теперь описано более полно после ссылки на сопутствующие фигуры, на которых показаны некоторые, но не все варианты осуществления этого изобретения.
Изобретение, описанное здесь, не должно ограничиваться конкретными описанными вариантами и модификациями, и предполагается, что другие варианты осуществления должны быть включены в объем этого изобретения. Хотя здесь используются конкретные термины, они используются только в общем и описательном смысле, а не для целей ограничения.
Используемые здесь термины имеют значение, признанное в данной области, если нет других указаний.
Данное изобретение обеспечивает химерную вирусоподобную частицу (VLP) папилломавируса человека (HPV), имеющую правильную форму и диаметр приблизительно 30 нм, и способ лечения и/или профилактики инфекции HPV и/или рака шейки матки введением химерной HPV VLP по изобретению. В частности, имеющая правильную форму и диаметр приблизительно 30 нм химерная HPV VLP содержит белок типа HPV 16 L1, в который был инсертирован пептид HPV L2, между приблизительно 13 аминокислотами и приблизительно 26 аминокислотами, кодируемый оптимизированной кодонами человека нуклеотидной последовательностью при аминокислотном остатке 414, заменяющий посредством этого соответствующие аминокислоты HPV L1.
Главный капсидный белок L1 спонтанно самособирается в вирусоподобные частицы (VLP), которые образуют основу существующих профилактических HPV-вакцин (Schiller et al., 2008). Рекомбинантные VLP были экспрессированы в нескольких разных системах хозяев, включающих млекопитающее, насекомое, дрожжи, бактерии и растения.
С-концевая спираль 4 (h4) HPV-16 L1 играет роль в сборке VLP и расположена между остатками 414-426 (Varsani et al., 2003a). Удаление этих мотивов приводит к образованию капсомера и предотвращает дальнейшую самосборку в VLP (Bishop et al., 2007). Кроме того, имеются дисульфидные связи между высококонсервативными остатками цистеина 175 и 428, и мутации этих цистеинов приводят к образованию капсомеров, а не VLP (Li et al., 1998; McCarthy et al., 1998; Sapp et al., 1998; Fiigge et al., 2001; Varsani et al., 2006b). Однако, в этом исследовании было показано, что инсертирование пептида HPV L2 между приблизительно 13 аминокислотами и приблизительно 26 аминокислотами, кодируемыми оптимизированной кодонами человека нуклеотидной последовательностью, при инсертировании при аминокислотном остатке 414, с заменой посредством этого соответствующих аминокислот HPV L1, было способно к успешной сборке в малые, имеющие правильные формы химерные VLP с диаметром приблизительно 30 нм.
Коммерческие вакцины HPV (экспрессируемые в настоящее время в клетках дрожжей и насекомых) являются дорогостоящими (Schiller et al., 2008), отчасти вследствие дорогостоящих протоколов продуцирования и очистки. Кроме того, сложные способы очистки и дорогостоящая предварительная обработка могут влиять на стабильность и извлечение собранного белка L1, и денатурированный белок L1 не индуцирует нейтрализующие антитела. В результате, получение вакцинных антигенов с использованием более дешевых систем экспрессии и простых способов продуцирования и очистки остаются высоко приоритетными в любой системе получения коммерческих белков.
Это изобретение будет описано посредством следующих примеров, которые не должны рассматриваться как ограничение каким бы то ни было способом этого изобретения.
ПРИМЕРЫ
ПРИМЕР 1: ТРАНЗИТОРНАЯ ЭКСПРЕССИЯ РАСТЕНИЕМ ХИМЕР L1
СПОСОБЫ И МАТЕРИАЛЫ
Экспрессирующие векторы растений
Три бинарных экспрессирующих вектора растения Agrobacterium использовали для оптимизации экспрессии химеры HPV: pTRAc и pTRAkc-rbcs1-cTP (обеспеченные профессором Райнером Фишером (Fraunhofer Institute for Molecular Biology and Applied Ecology, Germany) и вектор pRIC3 геминивируса желтой карликовости фасоли (BeYDV) (созданный Richard Halley-Stott). Два из них являются нерепликативными векторами, которые нацелены на экспрессируемый белок либо цитоплазмы (pTRAc), либо хлоропласта (pTRAkc-rbcs1-cTP) (Maclean et al., 2007), а третий является самореплицирующимся нацеливающим на цитоплазму вектором (pRIC3). Вектор pRIC3 является вектором третьей генерации pRIC (Regnard et al., 2010), который был уменьшен в размере и показал сходную амплификацию экспрессии трансгена in planta.
Векторы содержат ряд элементов, необходимых для экспрессии белка в растениях (Фиг. 1). Вектор pTRAkc-rbcs1-cTP (Фиг.1A) является производным pTRAc (Фиг. 1B), и содержит последовательность транзитного пептида хлоропласта гена rbcS1 картофеля. pRIC3 (Фиг. 1D) содержит ассоциированные с репликацией BeYDV белки, необходимые для саморепликации. (Regnard et al., 2010).
Синтез химер L1
Четыре химеры HPV-16 L1/L2, используемые в этом исследовании, описаны в Таблице 1. Эти химеры состоят из последовательности гена изолята South African HPV-16 L1 (SALI: номер доступа в GenBank AY177679) с эпитопом L2, расположенным в спирали h4 при аминокислоте 414 (обозначенной как "F-положение"). Эти химерные гены были сконструированы доктором Inga Hitzeroth (Plant Vaccine Group, UCT), оптимизированы кодонами человека и синтезированы in silico GENEART AG (Regensburg, Germany) с использованием высокопроизводительной сборки. Синтезированные последовательности эпитопа L2 заменяли последовательность L1 в F-положении и не были просто инсертированы в белок L1.
Суммирование химерных конструкций HPV-16 L1
Субклонирование химерных генов L1
Последовательности химеры HPV-16 L1/L2 вырезали из векторов pGA4 с использованием 3ʹ-сайта рестриктазы XhoI и любых из сайтов рестриктаз 5ʹ BspHI, MluI или HindIII, которые фланкируют химерные гены (Фиг. 1C), Гены HPV направленно субклонировали в экспрессирующие векторы растений с использованием AfIIII и XhoI для pTRAc (Фиг.1B), MluI и XhoI для pTRAkc-rbcs1-cTP (Фиг. 1A) и HindIII и XhoI для pRIC3 (Фиг. 1D). DH5-α химически компетентные клетки E.coli (E.cloni™, Lucigen) трансформировали химерными плазмидными конструкциями, и рекомбинанты отбирали, используя устойчивость к ампициллину (100 мкг/мл). Химерные конструкции pTRAc HPV-16 L1/L2 L1/L2(108-120), L1/L2(56-81) и L1/L2(17-36) были обеспечены Mark Whitehead (Plant Vaccine Group, UCT). Используемые в этом изобретении плазмидные конструкции суммированы в таблице 2.
Экспрессионные конструкции Agrobacterium, используемые в этом исследовании
Идентификация рекомбинантных химер L1
Рекомбинантные клоны химеры L1 подвергали скринингу посредством ПЦР колоний с использованием pTRAc вектор-специфических праймеров и химера-специфических праймеров, связывающихся с различными эпитопами L2 (Таблица 3). ПЦР выполняли с использованием набора для ДНК-полимеразы GoTaq Flexi (Promega) согласно инструкциям изготовителя с использованием 1 мкМ каждого праймера в конечной концентрации MgCl2 3 мМ.
Праймеры, используемые в ПЦР и секвенировании химер HPV
ПЦР колоний, использующая вектор-специфические праймеры
Эти pTRAc вектор-специфические праймеры (сконструированные Mark Whitehead) связывают расположенный выше и расположенный ниже сайт множественного клонирования (MCS) для детектирования инсерций генов. Профиль ПЦР состоял из начальной стадии денатурации при 95°C в течение 3 мин, с последующими 25 циклами при 95°C в течение 30 сек, 59°C в течение 30 секунд и 72°C в течение 3 минут, и конечной стадией элонгации при 72°C в течение 3 минут. ПЦР-продукты разделяли на 0,8% TBE-агарозном геле и детектировали с использованием бромида этидия.
ПЦР колоний с использованием эпитоп-специфических праймеров
HPV L2 эпитоп-специфические праймеры (сконструированные Marieta Burger) использовали для подтверждения правильной химерной вставки в рекомбинантных pTRAkc-rbcs1-cTP и pRIC3 клонах. Профиль ПЦР состоял из начальной стадии денатурации при 95°C в течение 2 минут, с последующими 25 циклами при 95°C в течение 30 секунд, 55°C (химеры L1/L2) в течение 20 секунд и 72°C в течение 30 секунд, и конечной стадии элонгации при 72°C в течение 3 мин. Продукты ПЦР разделяли на 1,2% TBE-агарозном геле и детектировали с использованием бромида этидия.
Расщепление рестрикционными ферментами
Рекомбинанты подтверждали расщеплением рестрикционными ферментами с использованием сайтов RE, которые фланкируют химерную вставку гена 1,5 т.п.н. (FcoRI/Xhol для pTRAkc-rbcs1-cTP-клонов или HindIII/XhoI для pRIC3-клонов). Рекомбинантную ДНК (~500 мкг) расщепляли в течение 1-2 часов при 37°C, с использованием 1 Е фермента на реакцию в соответствии с инструкциями изготовителя (Roche/Fermentas). Расщепленную ДНК разделяли на 0,8% TBE-агарозном геле и окрашивали бромидом этидия.
Секвенирование химер L1
Генную вставку химеры HPV в рекомбинантах pTRAkc-rbcs1-cTP секвенировали с использованием pTRAc-вектор-специфических праймеров. Последовательности сопоставляли с химерными последовательностями HPV с использованием программы множественного выравнивания DNAMAN.
Трансформация Agrobacterium
Клетки GV3101::pMP90RK Agrobacterium tumefaciens делали электрокомпетентными с использованием способа, описанного Shen and Forde (1989). Трансформацию Agrobacterium выполняли, как описано Maclean et al. (2007), и рекомбинантные клоны подвергали скринингу при помощи отбора с антибиотиками (50 мкг/мл карбенициллина, 50 мкг/мл рифампицина и 30 мкг/мл канамицина). Успешную трансформацию подтверждали с помощью ПЦР колоний и расщеплением рестриктазами (как описано выше).
Агроинфильтрация N. benthamiana
Культуры рекомбинантных химер A. tumefaciens, а также культуры A. tumefaciens LBA4404, содержащие плазмиду pBIN-NS, кодирующую супрессор NS-сайленсинга вируса пятнистого увядания (бронзовости) томата (TSWV) (Takeda et al., 2002), получали для инфильтрации, как описано Maclean et al. (2007). Клетки Agrobacterium разводили в инфильтрационной среде (10 мМ MgCl2, 10 мМ MES, 3% сахароза и 150 мкМ ацетосирингон в воде, pH 5,6) с получением конечной OD600 0,25 для отдельных химерных штаммов Agrobacterium и объединенной OD600 0,5 для конструкций, ко-инфильтрованных A. tumefaciens LBA4404 (pBIN-NS). Эти штаммы инкубировали при 22°C в течение 2 часов для обеспечения экспрессии генов vir перед инфильтрацией.
Шестинедельные листья N. benthamiana агроинфильтрировали инъекцией бактериальной суспензии в абаксиальные (расположенные на нижней поверхности листа) воздушные пространства из вентральной стороны листа (Maclean et al., 2007). Эти растения выращивали в условиях 16 часов света, 8 часов темноты при 22°C в течение требуемого периода времени. Испытания экспрессии химер во времени проводили 1-9 дней после инфильтрации (dpi), и химеры коэкспрессировали либо с супрессором сайленсинга NS, либо без супрессора сайленсинга NS. Для каждой химеры использовали отдельные растения, и отдельные листья на одном и том же растении инфильтрировали каждой из химерных конструкций pTRAc, pTRAkc-rbcs1-cTP или pRIC3 для сравнительной экспрессии векторов.
Экстракция белка из растений
Диски листьев, вырезанные крышкой от пробирки Эппендорфа, собирали из агроинфильтированных листьев (~10 мг на диск, 3 диска на конструкцию) и измельчали в жидком азоте. Материал листьев ресуспендировали в 250 мкл на диск в буфере для экстракции с высокой концентрацией соли 1,5 М NaCl PBS (HS-PBS), содержащем ингибитор протеаз (не содержащий ЭДТА полный ингибитор протеаз; Roche). Неочищенный экстракт растений осветляли дважды центрифугированием при 13000 об/мин в течение 5 мин, и супернатант хранили при -20°C.
Вестерн-блот-детектирование экспрессируемых растением химер L1
Экстракты растений инкубировали при 95°C в течение 5 минут в загрузочном буфере (Sambrook et al., 1989), разделяли посредством 10% геля ДСН-ПААГ и переносили на нитроцеллюлозную мембрану полусухим электроблоттингом. Эту мембрану блокировали в блокирующем буфере в течение 30 минут при комнатной температуре (5% сепарированное молоко, 0,1% Твин-20 в 1× PBS, pH 7,6) и инкубировали в течение ночи при 4°C в первичном анти-L1-антителе, разведенном в блокирующем буфере. Белок HPV-16 L1 детектировали либо мышиным моноклональным антителом (MAb) CamVir1 (1:10000; Abeam, UK), который связывается с L1 линейным эпитопом GFGAMDF, локализованным при аминокислотах (ак) 230-236 (McLean et al., 1990), либо H16.J4 (1:2500), который связывает линейный эпитоп, локализованный при аминокислотах (ак) 261-280 в FG-петле белка L1 (Christensen et al, 1996). Оба сайта связывания не разрушаются инсертами эпитопа L2.
Мембраны промывали блокирующим буфером 4 раза по 15 минут и инкубировали с использованием вторичных козьих антител против мышиных антител, конъюгированных со щелочной фосфатазой (1:10000; Sigma), разводили в блокирующем буфере в течение 2 часов при комнатной температуре. Наконец, мембраны окончательно промывали промывочным буфером (0,1% Твин-20 в 1× PBS, pH 7,6) в течение 4× 15 минут и проявляли субстратом Нитросиний тетразолийхлорид/5-бром-4-хлор-3-индоилфосфат (субстрат NBT/BCIP; Roche). Экспрессию химер сравнивали измерением плотности полос, детектированных на анти-L1-вестерн-блотах, с использованием GeneTools (SYNGENE).
Количественное измерение химер захватывающим ELISA
Химеры L1, экстрагированные из N. benthamiana, определяли количественно захватывающим ELISA с использованием модифицированного блокирующего поливиниловым спиртом (PVA) способа ELISA (Studentsov et al., 2002). Вкратце, 96-луночный микротитрационный планшет Maxisorp покрывали 1:2000 мышиным антителом (MAb) против HPV-16 L1 (либо CamVir1, либо H16.J4) в течение ночи при 4°C и блокировали PVA. Экстракт растений добавляли в эти лунки и инкубировали в течение 1 часа при 37°C. Эатем следовали стадия промывки и добавление поликлональной кроличьей сыворотки против HPV-16 (1:1000). Планшет инкубировали в течение ночи при 4°C, и белок HPV-16 L1 детектировали с использованием свиных антител против конъюгата кроличьих антител с пероксидазой хрена (HRP) (1:5000; DAKO) и субстрата дигидрохлорида 1,2-фенилендиамина (OPD; DAKO; Denmark).
Коммерческую вакцину HPV Cervarix использовали в качестве положительного контроля ELISA и в качестве стандарта HPV-16 L1 VLP. Каждую пробу анализировали в трех повторностях и количественно определяли с использованием стандартной кривой Cervarix. Количество химерного белка, присутствующего в каждой пробе (мг), выражали как химера на килограмм ткани растения (мг/кг).
Общий растворимый белок (TSP) для каждого неочищенного экстракта листьев определяли с использованием анализа Лоури белка (Biorad DC Protein Assay; Microplate Assay Protocol) в соответствии с инструкциями изготовителя с использованием в качестве стандарта белка IgG гамма-глобина бычьей плазмы (Bio-Rad). Рассчитывали выход соответственной химеры, где количественно измеренный ELISA белок (мг) экспрессировался в виде процента TSP, для учета различий в массе ткани листьев и эффективности экстракции белка.
Статистический анализ выходов экспрессии химер
Статистические различия в экспрессии химер с использованием различных экспрессирующих векторов растений определяли с использованием ANOVA и критерия Фишера LSD Post Hoc. Различия сообщались как статистически значимые при p<0,01.
Сборка химер
Сборку белков HPV в высокоупорядоченные иммуногенные структуры оценивали с использованием H16.J4 и H16.V5 захватывающего ELISA, как описано выше. H16J4 MAb связывается с линейным эпитопом L1, содержащим аминокислоты (ак) 261-280 (Christensen et al., 1996), и таким образом дает общий белок HPV, присутствующий в данном экстракте растения. H16.V5 связывается с конформационным эпитопом L1 (Christensen et al., 1996, 2001), содержащим незаменимые аминокислоты (ак) 260-290 и специфически связывающим остатки L1 Phe-50, Ala-266 и Ser-282 (White et al., 1999), таким образом он был использован для детектирования собранного белка HPV. Для сравнения сборки химер, экспрессируемых различными векторами, количество собранного белка HPV выражали в виде процента от общего белка HPV.
РЕЗУЛЬТАТЫ
Подтверждение химерных клонов L1
Химеры L1 (Таблица 1) успешно клонировали в экспрессирующие векторы растений pTRAkc-rbcs1-cTP и pRIC3 и трансформировали в E.coli и Agrobacterium GV3101.
Рекомбинантные клоны pTRAkc-rbcs1-cTP подвергали скринингу посредством ПЦР колоний с использованием pTRAc-специфических праймеров, связывающихся выше по ходу транскрипции и ниже по ходу транскрипции от MCS, или связывающихся с различными эпитопами L2. Все химеры продуцировали фрагменты ожидаемого размера, как предсказано в таблице 3.
Клоны дополнительно подтверждали расщеплением рестрикционными ферментами (RE) с использованием сайтов RE EcoRI и XhoI, которые фланкируют вставку химерного гена. Как ожидалось, все химеры содержали генную вставку 1,5 т.п.н.. Клоны секвенировали, и отдельные химеры подтверждали с использованием программы выравнивания множественных последовательностей DNAMAN.
Рекомбинантные клоны pRIC3 подтверждали сходным образом посредством ПЦР колоний с использованием специфических для химерного эпитопа праймеров и расщепления рестриктазами HindI/XhoI. Все химеры продуцировали 0,2-0,6 т.п.н.-химера-специфические полосы ПЦР, описанные в Таблице 3, и фрагмент гена 1,5 т.п.н. в RE-продуктах расщепления. Таким образом, все эти химеры HPV успешно субклонировались в экспрессирующие векторы растений pTRAkc-rbcs1-cTP и pRIC3.
Оптимизация экспрессии химеры L1 в N. benthamiana
Коэкспрессия с супрессором сайленсинга NS
Нацеленную на хлоропласт экспрессию HPV-16 L1/L2 в N. bethamiana исследовали во временном испытании в дни 1-9 после инфильтрации (dpi). Химеры экспрессировали либо с (+), либо без (-) супрессорного белка сайленсинга NS для испытания его действий на экспрессию химер. Экспрессию анализировали вестерн-блоттингом с использованием анти-L1-MAb CamVir1. Детектировали все химеры L1/L2, с предсказанной полосой L1 ~56 кДа (Фиг. 2), хотя L1/L2 (108-120) перемещается выше, чем другие химеры.
Все химеры показывали пролонгированное увеличение в экспрессии при коинфильтрации с супрессорным белком сайленсинга NS (Фиг. 2A-D), что позволяет предполагать, что он является эффективным в предотвращении пост-трансляционного сайленсинга генов и усилении накапливания белка в растениях. ELISA-детектирование, использующее линейное эпитоп-специфическое MAb H16.J4, подтверждало эти результаты, с 16-кратным увеличением выходов L1/L2 (данные не показаны). Экспрессия химер без NS детектировалась при 1-3 днях после инфильтрации (dpi) и была максимальной при 3-5 dpi, тогда как химеры, коэкспрессируемые с NS, детектировались при 3 dpi, и экспрессия была максимальной при 5-7 dpi. Имелось небольшое уменьшение в экспрессии между 5-9 dpi, что позволяет предполагать, что имеется медленное снижение в уровнях экспрессии (результаты ELISA, данные не показаны). В результате, все химеры коэкспрессировали с NS в последующих экспериментах.
Несколько высокомолекулярных полос детектировали для химер L1/L2 (17-36), что позволяет предполагать, что сигнальная последовательность хлоропласта (cTP) может быть не отщепленной, или эта химера может быть гликозилированной. Однако, L1/L2 (17-36), анализированная в последующих вестерн-блотах, не показывала этих высокомолекулярных полос, что позволяет предполагать, что этот белок был частично денатурирован на Фигуре 2С.
Химера L1/L2, содержащая эпитоп BPV L2 ак 1-88, имела низкие уровни экспрессии по сравнению с химерами, содержащими эпитопы HPV-16 L2. Полосы на вестерн-блотах L1/L2 BPV (1-88) были видны только после 16 часов проявления (Фиг. 2D), по сравнению со временем, составляющим 15 минут проявления, требуемым для других химер (Фиг. 2A-C). Количественный анализ ELISA оценивал достигаемые максимальные выходы L1/L2 BPV(1-88) как 40 мг/кг ткани растения, тогда как высокие уровни экспрессии 1000-4600 мг/кг были определены для других химер L1/L2 (данные не показаны). Кроме того, экстракт растения L1/L2 BPV(1-88) содержал характерную полосу ~45 кДа (Фиг. 2D), ассоциированную с деградацией L1, что позволяет предположить, что L1/L2 BPV(1-88) является нестабильной в этой системе экспрессии. Эти результаты подтверждались несколькими вестерн-блотами L1/L2 BPV(1-88) из проводимых в разное время испытаний.
Действие нацеливания на хлоропласт на выход химеры L1/L2
Нацеливание белков HPV на хлоропласт может значимо улучшать выходы экспрессии растений. (Maclean et al., 2007). Для определения важности нацеливания на хлоропласт pTRAc (нацеливающей на цитоплазму) и pTRAkc-rbcs1-cTP (нацеливающей на хлоропласт) химерные конструкции L1/L2 коинфильтрировали с pBIN-NS в N. bethamiana в испытании во времени 3-9 dpi. Химера L1/L2 BPV(1-88) не была включена в это исследование, так как она показывает очень низкую экспрессию в N. bethamiana по сравнению с другими химерами L1/L2.
Данные вестерн-блотов и ELISA постоянно демонстрировали низкую экспрессию для нацеленных на цитоплазму химер L1/L2, с максимальной экспрессией химер в 3 dpi и выходы 20-45 мг/кг ткани растения (данные не показаны). Экспрессия направленных на цитоплазму L1/L2(108-120), L1/L2(56-81) и L1/L2(17-36) слабо детектировалась по сравнению с нацеленной на хлоропласт химерой L1/L2(108-120), разведенной в 3 раза перед загрузкой и включенной в качестве положительного контроля. Сравнение выходов химер показывает, что экспрессия химеры L1/L2 увеличивалось в 40-80 раз при нацеливании на хлоропласт. С учетом этих результатов, дальнейшие исследования экспрессии химер проводили с использованием вектора pTRAkc-rbcs1-cTP.
Оптимизация с использованием саморепликативного экспрессирующего вектора растения
В попытке улучшения выходов химер, в частности, для имеющей низкую экспрессию химеры L1/L2 BPV(1-88), экспрессирующий вектор растений pRIC3 (саморепликативный, нацеливающий на цитоплазму вектор) сравнивали с pTRAkc-rbcs1-cTP (нерепликативным, нацеливающим на хлоропласт вектором) в 3-9 dpi-испытании во времени в присутствии NS.
Максимальные выходы химер для обоих векторов получали в 3-5 dpi. Три химеры L1/L2, содержащие эпитопы HPV-16 L2 ак 108-120, 56-81 и 17-36 лучше экспрессировались с использованием нацеливающего на хлоропласт вектора pTRAkc-rbcs-cTP по сравнению с саморепликативным вектором pRIC3. L1/L2 BPV(1-88) не экспрессировался в высокой степени для любого из векторов, и для обеих конструкций наблюдалась деградация.
Количественное определение ELISA показывает, что саморепликативный вектор pRIC3 не улучшал выходы экспрессии для большинства этих химер. Выходы увеличивались в 3 раза с использованием вектора pTRAkc-rbcs1-cTP, что позволяет предполагать, что нацеливание на хлоропласт является более эффективным в химерах с более высокой экспрессией, чем экспрессия вектора pRIC3, который в конечном счете нацеливает экспрессируемый белок в цитоплазму. Уровни экспрессии L1/L2 BPV(1-88) были сходными с отрицательным контролем NS, что позволяет предположить, что эти растения не являются жизнеспособной системой для продуцирования L1/L2 BPV(1-88), и экспрессию L1/L2 BPV(1-88) не включали в исследование в дальнейшем.
Результаты из оптимизации экспрессии с использованием векторов pTRAkc-rbcs1-cTP и pRIC3 суммированы в Таблице 4. L1/L2(108-120), L1/L2(56-81) и L1/L2(17-36) были высокоэкспрессируемыми. Параметрами, которые, как показано, максимизируют экспрессию в предварительных испытаниях во времени, являются: коэкспрессия с NS, экстракция при 5 dpi и использование вектора pTRAkc-rbcs-cTP для нацеливания экспрессируемого белка L1/L2 на хлоропласт.
Суммирование экспрессии и оптимизации химеры L1
Сравнительная экспрессия векторов химер L1/L2
Три высокоэкспрессирующие химеры L1/L2 выбирали в качестве вакцинных антигенов для исследований иммуногенности в мышах: L1/L2(108-120), L1/L2(56-81) и L1/L2(17-36). Одно конечное исследование, включающее три биологические повторности, экспрессии выполняли для подтверждения результатов L1/L2 и получения статистически обоснованных данных. Все три вектора (pTRAc, pTRAkc-rbcs1-cTP и pRIC3) сравнивали непосредственно в отношении экспрессии каждого из L1/L2-вакцинных антигенов, HPV-16 L1 включали в качестве положительного контроля (были доступны конструкции pTRAc и pTRAkc-rbcs1-cTP), и NS-инфильтрованные растения служили в качестве отрицательного контроля. Химеры коэкспрессировали с NS и экстрагировали при 5 dpi (днях после инфильтрации).
Действие экспрессии на растения
Исследование инфильтрованных листьев перед экстракцией при 5 dpi позволяло предположить, что саморепликативный вектор pRIC3 имел вредное воздействие на здоровье растения. Листья, инфильтрованные pRIC3, были желто-коричневыми по цвету, и наблюдался некроз ткани листьев в инфильтрованных зонах. Это наблюдали в меньшей степени в pTRAc-листьях, которые также нацеливали химеры на цитоплазму растения. pTRAkc-rbcs-cTP-листья были, по-видимому, самыми здоровыми, похожими на листья NS-инфильтрованного отрицательного контроля и неинфильтрованные листья, что позволяет предположить, что накапливание этих химер в хлоропласте оказывает меньшее действие на здоровье растения (результаты не показаны). По-видимому, инфильтрация не имеет видимого действия на здоровье растения, так как, NS-инфильтрованный лист выглядит сходно с неинфильтрованным листом (за исключением отметок шприцевой инъекции). Эти результаты постоянно наблюдали для всех испытаний во времени.
Вестерн-блот-детектирование белков HPV
Белок HPV детектировали анти-L1-вестерн-блоттингом (Фиг.3a). NS-инфильтрованный экстракт растения (отрицательный контроль) не детектировали, и полученный из растения HPV-16 L1 (положительный контроль) детектировали с использованием нацеливающего на хлоропласт вектора. Экспрессию с использованием различных векторов непосредственно сравнивали с pTRAkc-rbcs1-cTP с получением постоянно наивысших выходов экспрессии, с последующими pRIC3 и затем pTRAc.
Количественное определение ELISA белков HPV
Захватывающий ELISA анализ использовали для количественного определения химер HPV с использованием CamVir1. Выходы химеры L1/L2 и HPV-16 L1 показаны на Фигуре 3b. Статистические различия в экспрессии химер определяли при помощи ANOVA и критерия Фишера LSD Post Hoc. Различия сообщались как статистически значимые при р<0,01.
Нацеленная на хлоропласт экспрессия химер L1/L2 и HPV-16 L1 с использованием pTRAkc-rbcs1-cTP давала значимо более высокие выходы, чем NS-инфильтрованный отрицательный контроль (p=0,000-0,002) и нацеливающий на цитоплазму вектор pTRAc (p=0,000-0,004). Кроме того, pTRAkc-rbcs1-cTP значимо улучшал экспрессию L1/L2(56-81) по сравнению с pRIC3 (p=0,006). Вектор pRIC3 статистически не улучшал экспрессию любой из химер по сравнению с pTRAc.
По сравнению с экспериментами оптимизации (Фиг.2, Таблица 4), сравнительное испытание во времени продемонстрировало сходные тенденции в экспрессии химер. Нацеленные на хлоропласт химеры L1/L2 давали наивысшие выходы (1040-1310 мг/кг; 2-3% TSP), улучшая экспрессию химер до 28-кратной по сравнению с нацеливающим на цитоплазму вектором pTRAc (50-260 мг/кг; <1% TSP) и до 7-кратной по сравнению с саморепликативным вектором pRIC3 (190-660 мг/кг; <1% TSP).
Выходы нацеленных на цитоплазму химер улучшались до 4-кратных с использованием pRIC3 по сравнению с нерепликативным вектором pTRAc. Это предполагает, что саморепликация улучшает экспрессию химер, хотя нацеливание на хлоропласт является, по-видимому, лучшей стратегией для увеличения экспрессии химер в растениях.
Хотя нацеленный на хлоропласт HPV-16 L1 демонстрировал более высокие средние выходы (1710 мг/кг, 4% TSP), различия между химерами L1/L2 и L1 не были статистически значимыми, показывая, что замены эпитопа L2, по-видимому, не влияют на экспрессию и накапливание рекомбинантного белка в хлоропластах. Однако, данные экспрессии вестерн-блоттинга (3а) и ELISA (Фиг.3b) постоянно обнаруживали более высокие уровни локализованных в цитоплазме L1/L2(108-120) и L1/L2(17-36), чем L1/L2(56-81), что позволяет предполагать, что химеры L1/L2(108-120) и L1/L2(17-36) с более короткими заменами последовательности L2 (13 и 20 аминокислот (ак), соответственно) могут быть лучше экспрессируемыми и имеют большую стабильность, чем L1/L2(56-81) с заменой последовательности 26 аминокислот (ак).
Сборка белков HPV
Сборку химер в структуры более высокого порядка, такие как капсомеры или VLP, оценивали с использованием захватывающего ELISA с H16.J4 (линейное эпитоп-специфическое MAb) и H16.V5 (конформационное эпитоп-специфическое MAb). Количество V5-детектируемого конформационного белка HPV выражали в виде процента J4-детектируемого общего белка HPV для каждого из этих векторных конструкций (Фиг. 4).
Низкий процент экспрессируемых химер, собирался в детектируемые H16.V5 структуры более высокого порядка. Экстракт NS растения, используемый в качестве отрицательного контроля, не связывал MAb H16.J4 или H16.V5 (данные не показаны). Низко экспрессируемые химеры pTRAc, по-видимому, имеют наибольшую долю собранного белка (11-18%), затем следуют высокоэкспрессируемые химеры pTRAkc-rbcs1-cTP (5-9%). Химеры pRiC3 не содержали высокого процента собранного белка (<2%). Хотя химеры pTRAkc-rbcs1-cTP не содержали наивысшего процента собранного белка, более высокие выходы экспрессии приводят к 40-кратно и 4-кратно большему количеству собранного белка, чем pTRAc и pRIC3, соответственно. Это обеспечивает дополнительное доказательство того, что pTRAkc-rbcs1-cTP является наилучшим вектором для применения в получении иммуногенных химер L1/L2.
ОБСУЖДЕНИЕ
Оптимизация транзиторной экспрессии химеры L1 в растениях
Все из химер L1 успешно экспрессировались в растениях с использованием опосредованной Agrodacterium транзиторной системы (Фиг. 2). Несколько способов использовали для оптимизации экспрессии химер в растениях; в том числе применение супрессора сайленсинга NS, применение доставляемого агроинфильтрацией саморепликативного вирусного вектора и нацеливание экспрессируемого белка в хлоропласт.
Коэкспрессия с супрессором сайленсинга NS
Опосредуемая Agrobacterium транзиторная экспрессия обычно достигает высшей точки в течение 60-72 часов (~3 дней) после инфильтрации и затем быстро снижается в результате запуска посттранскрипционного сайленсинга гена (PTGS) в клетке/хозяине (Voinnet, 2001). PTGS является адаптивным антивирусным механизмом защиты растения, в котором чужеродные молекулы РНК распознаются и деградируются последовательность-специфическим образом (Meins, 2000; Sijen and Kooter, 2000). В качестве противозащитной стратегии, многие вирусы растений развивают белки, которые подавляют различные стадии этого механизма (Voinnet, 2001). Хотя ответы PTGS уменьшают накапливание мРНК трансгена в цитоплазме растений и ограничивают эффективность опосредованной Agrobacterium транзиторной экспрессии (de Carvalho et al., 1992; Van Blokland et al., 1994), было показано, что коэкспрессия белков с супрессорами вирусного сайленсинга подавляет ответы PTGS и делает возможной транзиторную экспрессию высокого уровня, приводя к более высоким выходам (50-кратным в некоторых случаях) и пролонгированной экспрессии трансгена (Voinnet et al., 2003).
Коинфильтрация с супрессором сайленсинга NS вируса пятнистого увядания (бронзовости) томата (TSVW) подавляет PTGS и увеличивает транзиторную экспрессию (Takeda et al., 2002). Этот эффект наблюдали сходным образом в транзиторной экспрессии химер L1/L2 (Фиг.2). Химеры обычно проявляли максимальные уровни экспрессии при 3-5 dpi без присутствия вирусных супрессоров сайленсинга. Однако, коэкспрессия с NS обнаруживала пролонгированное увеличение в экспрессии этих химер, посредством чего уровни экспрессии увеличивались до 16-кратных и достигали высшей точки при 5-7 dpi.
Применение саморепликативного вектора BeYDV
Выходы цитоплазматического HPV-16 L1 улучшались на 50% с использованием саморепликативного вектора pRIC (Regnard et al., 2010). В результате, вектор pRIC3 третьей генерации испытывали в качестве потенциальной стратегии для улучшения выходов химер. Испытывали три химеры L1/L2: L1/L2(108-120), L1/L2(56-81) и L1/L2(17-36). Все химеры демонстрировали высокие уровни экспрессии с использованием pRIC3 (саморепликативного вектора), по сравнению с pTRAc (нерепликативным вектором), что позволяет предположить, что амплификация трансгена улучшает выходы L1/L2 в цитоплазме растения (Фиг. 3а и b). Однако, нацеливание на хлоропласт было более эффективным в накапливании высокого уровня химер L1/L2 (Фиг. 3b), и видимый некроз ткани листа наблюдали в pRIC3-инфильтрованных листьях, что позволяет предположить, что саморепликация этого вектора отрицательно влияет на здоровье растения.
Нацеливание на хлоропласт химер L1
Химеры L1 нацеливали на хлоропласт с использованием вектора pTRAkc-rbcs1-cTP. Транзитный пептид хлоропласта (cTP) сливают с экспрессируемыми химерами и расщепляют хлоропластной стромальной пептидазой процессинга (SPP) после вхождения в эту органеллу (Robinson and Ellis, 1984). Имеются несколько факторов, ответственных за накапливание высокого уровня белка в хлоропластах: (a) защита от клеточных протеаз, (b) аппарат гидролиза различных белков в пластидах, и (c) защитные плазмида-специфические шапероны, которые способствуют правильному фолдингу L1 и, следовательно, улучшают стабильность белка (Fernandez-San Millan et al., 2008). В этом исследовании, нацеливание на хлоропласт было высокоэффективным и увеличивало выходы химер L1/L2 40-80-кратно по сравнению с химерами, нацеленными на цитоплазму (Фиг. 3a).
Нацеленные на хлоропласт химеры, детектированные в анти-L1-вестерн-блотах, продуцировали полосы ~56 кДа (Фиг.2), что позволяет предположить, что сигнальный пептид был эффективно удален из накапливаемого белка. Хотя L1/L2(108-120) мигрирует выше, чем другие химеры на вестерн-блоте (Фиг. 2), этот феномен не обусловлен недостаточным отщеплением сигнального пептида, так как локализованный в цитоплазме L1/L2(108-120), экспрессируемый pTRAc, и экспрессируемый клеткой насекомого L1/L2(108-120), анализированные параллельно (данные не показаны), показали сходный характер бэндинга (расположения полос).
Полосы с более высокой молекулярной массой ~65 кДа детектировали для химер L1/L2(17-36) (Фиг. 2), возможно, как результат гликозилирования или недостаточной денатурации химер. Одна гликозилированная форма HPV-16 L1, продуцируемая в клетках почек новорожденного хомяка (BHK), была описана McLean et al. (1990), посредством чего CamVir1 детектировал 2 полосы для L1: большая полоса 56 кДа и малая полоса ~64 кДа. Эту дополнительную полосу затем удаляли из клеточных лизатов при инфицировании в присутствии ингибитора N-гликозилирования туникамицина. Хотя растения не содержат путей гликозилирования (Rybicki, 2009), последующие вестерн-блоты изображали единственную полосу ~56 кДа, что позволяет предположить, что химеры L1/L2(17-36) скорее были частично денатурированы в начальных экспериментах, чем гликозилированы (Фиг. 3а).
Прямое сравнение векторов экспрессии растений
Две стратегии увеличивали выходы экспрессируемого растением L1 до максимума 530-550 мг/кг: (i) нацеливание белка на хлоропласт (Maclean et al., 2007) или (ii) применение доставляемого агроинфильтрацией саморепликативного BeYDV-произведенного экспрессирующего вектора. (Regnard er al., 2010). Это было первым исследованием, которое прямо сравнивало эти стратегии с использованием химер на основе L1. Уровни экспрессии химер с использованием экспрессирующего вектора растения pRIC3 (саморепликативного, нацеливающего на цитоплазму вектора) непосредственно сравнивали с pTRAkc-rbcs1-cTP. Экспрессию с использованием pTRAc (нерепликативного, нацеливающего на цитоплазму вектора) включали для сравнительных целей, и HPV-16 L1 использовали в качестве положительного контроля. (Фиг.3a и b).
Нацеливание на хлоропласт производило наивысшие выходы для большинства химер (Фиг. 3a и b) и улучшало экспрессию химеры L1/L2 до 7-кратной относительно pRIC3 и 28-кратной относительно pTRAc, которые, оба, нацеливают экспрессируемый белок на цитоплазму (Фиг. 3b). Статистический анализ выявил, что выходы L1/L2, нацеленные на хлоропласт, были значимо более высокими, чем выходы L1/L2, нацеленные на цитоплазму (p<0,01). Однако, различия выходов между нацеленными на хлоропласт химерами и химерами, экспрессируемыми с использованием саморепликативного вектора pRlC3, были значимыми только для L1/L2(56-81). Эти результаты обеспечивают доказательство того, что pTRAkc-rbcs1-cTP является наилучшим вектором для применения для продуцирования высокого уровня химер HPV.
Экспрессия химер L1/L2
Высокоэкспрессируемые химеры L1/L2, содержащие эпитопы HPV-16 L2
Химеры L1/L2(108-120), L1/L2(56-81) и L1/L2(17-36) были высокоэкспрессируемыми, с выходами до 20-кратных относительно других химер (Таблица 4). В результате, эти три химеры L1/L2 были выбраны в качестве антигенов для приготовления вакцин для исследований иммуногенности у мышей.
Нацеленные на хлоропласт химеры L1/L2 постоянно демонстрировали наивысшие выходы химер ~1200 мг/кг ткани растения (2-3% TSP). Хотя HPV-16 L1 демонстрировала более высокие выходы, чем химеры L1/L2, эти различия не были статистически значимыми (Фиг.3b). Это указывает на то, что L2-эпитопы не влияют значимо на экспрессию и накапливание белка HPV в хлоропластах. Кроме того, выходы этой химеры являются в ~2 раза более высокими, чем опубликованные выходы HPV-16 L1, получаемые с использованием Agrobacterium-опосредуемой системы экспрессии табака (Maclean et al., 2007; Regnard et al., 2010), и получение этих химер является коммерчески жизнеспособным (>1% TSP; Fischer et al., 2004).
Сборка в структуры более высокого порядка ассоциирована с более низкой чувствительностью к протеолизу (Chen et al., 2000), и была выдвинута гипотеза, что высокое накапливание L1/L2 может быть результатом сборки. Конформационно специфическое антитело H16.V5 MAb связывает собранный белок (Christensen et al., 1996) и может быть использовано для детектирования сборки в структуры более высокого порядка (Carter et al., 2003; Wang et al, 2003; Ryding et al, 2007). Все экспрессируемые растением химеры L1/L2 и контроль HPV-16 L1, по-видимому, содержат низкую долю собранного белка (<20% TSP), что позволяет предполагать, что большая часть этого белка существует в виде несобранных мономеров L1. Однако, как химера L1/L2(56-81), так и химера L1/L2(17-36) содержит последовательности L2, перекрывающие С-концевую область L1 ак 428-483, которая, как было показано, является критичной для связывания H16.V5 (Varsani et al., 2006b), что позволяет предполагать, что это антитело (MAb) может быть неподходящим для детектирования сборки химер и не может быть использовано для сравнительного измерения количества.
Нестабильность химер L1/L2 с эпитопом BPV L2 ак 1-88
Химера L1/L2 BPV(1-88) имела низкие уровни экспрессии по сравнению с химерами, содержащими эпитопы HPV-16 L2 (Фиг.2). Полученные количественным определением ELISA уровни были сходными с отрицательным контролем NS, хотя L1/L2 BPV(1-88) детектировался на вестерн-блотах, зондированных с использованием H16.J4 MAb, и показывал низкие выходы 40 мг/кг ткани растения (Фиг. 2, данные ELISA не показаны). Кроме того, нацеленный на хлоропласт L1/L2 BPV(1-88) был частично деградирован (Фиг. 2D), что было описано ранее в нескольких исследованиях экспрессии HPV L1 (Hagensee et al., 1993; Sasagawa et al., 1995; Li et al., 1997; Kohl et al., 2007).
Эти результаты обеспечивают доказательство того, что L1/L2 BPV(1-88) не экспрессируется хорошо и не является стабильным в данной системе экспрессии растения. Химера L1/L2 BPV(1-88) содержит наивысшую замену последовательности L2 и эпитоп из 88 остатков, заменивший всю C-концевую область L1 (Таблица 1). С-концевая область HPV L1 играет роль в сборке VLP (Zhou et al., 1991b; Varsani et al., 2006b; Bishop et al., 2007), и делеция С-концевой области предотвращает сборку в структуры более высокого порядка, которые являются менее чувствительными к деградации (Chen et al., 2000). Замена С-концевого области L1 последовательностями чужеродного эпитопа не является эффективной стратегией для экспрессии химер HPV и растения не являются жизнеспособной системой для экспрессии L1/L2 BPV(1-88).
ПРИМЕР 2: ОЧИСТКА И СБОРКА АНТИГЕНОВ HPV
СПОСОБЫ И МАТЕРИАЛЫ
Крупномасштабная транзиторная экспрессия и экстракция антигенов
Растения N. benthamiana (в возрасте 2-4 недель) вакуум-инфильтрировали A. tumefaciens LBA4404 (pBIN-NS), кодирующим белок супрессора сайленсинга NS, и штаммом Agrobacterium GV3101, кодирующим химеры HPV-16 L1 или L1/L2, как описано Maclean et al. (2007). Эти растения росли в течение 5 дней при 16 часах света, 8 часах темноты, при 22°C.
Инфильтрованные листья собирали, взвешивали и измельчали в жидком азоте с использованием ступки и пестика. Буфер для экстракции PBS, содержащий 0,5 M NaCl и ингибитор протеаз (Roche Complete EDTA-free), добавляли в соотношении 1:4 (масс/об) и пробы гомогенизировали в блендере Уоринга в течение 10 мин на льду. Гомогенат обрабатывали ультразвуком на льду в течение 6 интервалов по 20 секунд обработки ультразвуком и перерывов (Macrotip sonication; Level 8; Heat Systems - Ultrasonics, Inc. Sonicator Cell Disruptor Model W-225 R) и лизат фильтровали через двойной слой Miracloth (CALBIOCHEM). Этот неочищенный экстракт осветляли дважды центрифугированием при 13000 об/мин в течение 10 минут. Осадки ресуспендировали в 1 мл PBS и хранили при -70°C. Этот супернатант и осадок исследовали вестерн-блоттингом для проверки локализации антигена HPV в супернатанте.
Предварительная (пилотная) очистка антигенов HPV
Несколько способов испытывали для очистки экспрессируемых растением L1-вакцинных антигенов. Испытывали способы на основе размера, такие как перекрестная микроинфильтрация и ультрацентрифугирование, с использованием градиентов плотности сахарозы и хлорида цезия, а также одноступенчатую катионообменную и гепариновую хроматографию для быстрой очистки химер на основе L1 и L2. Белок L1, экстрагированный в PBS, содержащем 0,5 M NaCl, разводили в 10 раз в PBS с низким содержанием соли (LS PBS: 10 мМ NaCl PBS, pH 7,4) перед хроматографией, для возможности связывания L1 с этими колонками. Ультрафильтрацию использовали для концентрирования антигенов и обессоливания фракций хроматографии для последующего применения в исследованиях иммуногенности в мышах.
В целом, очистка при помощи гепариновой хроматографии и диафильтрация с использованием спиновых пробирок для Macrosep®-ультрафильтрации были наилучшими стратегиями для получения частично очищенных L1 и химер на основе L1, и эти способы использовали для получения антигенов для приготовления вакцин для последующих иммунологических экспериментов на мышах.
Очистка антигенов для приготовления вакцин
Приготовление проб
HPV-16 L1 и химеры на основе L1 экспрессировали в N. bethamiana и экстрагировали, как описано выше в Примере 1, с использованием LS PBS в качестве буфера для экстракции. Осветленный дважды неочищенный супернатант для L1/L2(108-120), L1/L2(56-81), L1/L2(17-36), HPV-16 L1 и NS-инфильтрованный экстракт растения (Вакцины 1-5, соответственно) фильтровали через 0,22 мкм Millipore-фильтр перед хроматографией для удаления любых остатков клеток (дебриса).
Гепариновая хроматография
Хроматографию выполняли с использованием AKTA Explorer System 10. Процедуру выполняли в соответствии с рекомендациями в GE Healthcare column instruction manual, и поддерживали скорость потока 0,5 мл/мин. Колонку уравновешивали 10 колоночными объемами (ко) промывочного буфера с низкой концентрацией соли (LS PBS: 10 мМ NaCl PBS) перед загрузкой пробы. Неочищенный экстракт (10-20 мл) наносили на предварительно упакованную 1 мл HiTrap гепариновую катионообменную колонку (GE Healthcare, Amersham Biosciences AB, Sweden), и колонку промывали 10 колоночными объемами (ко) промывочного буфера LS PBS. Профиль элюции для каждого антигена HPV оптимизировали в предварительном (пилотном) эксперименте с использованием линейного градиента ионной силы, посредством чего 10 колоночных объемов (ко) 0-100% буфера для элюции PBS с высокой концентрацией соли (HS PBS), содержащего 1,5 М NaCl, наносили на колонку. Как только было установлено, что все антигены элюировались при нанесении <50% HS PBS на колонку, 50% ступенчатый градиент элюции (0,75 M NaCl) наносили для очистки антигенов для приготовления вакцины. Ступенчатый градиент элюции составлял 10 колоночных объемов 50% HS PBS, с последующими 10 колоночными объемами 100% HS PBS. Наконец, колонку промывали 5 колоночными объемами дистиллированной воды и 5 колоночными объемами 20% этанола. Фракции (1 мл) собирали и анализировали посредством вестерн-дот-блотов.
Вестерн-дот-блот-детектирование очищенных антигенов HPV
Дот-блоты выполняли, как описано выше в Примере 1. CamVir1 (1:10000) использовали для детектирования L1, и Cervarix использовали в качестве положительного контроля. Элюированные фракции, содержащие высокую концентрацию очищенного антигена, объединяли и хранили при -70°C. Для NS-инфильтрованного экстракта растения (V5: отрицательный контроль), фракции, которые соответствуют пику элюированного белка, объединяли и тестировали на дот-блоте L1-положительной контрольной вакцины (V4), для подтверждения что они не содержат L1.
Обессоливание проб очищенного антигена ультрафильтрацией
Очищенные антигены в 50% буфере для элюции HS PBS (0,75 M NaCl), обессоливали перед вакцинациями мышей. Ультрафильтрацию спиновых пробирок с использованием фильтра 10 кДа MWCO (Macrosep® Centrifugal Devices, 10K Omega, PALL Life Sciences) использовали для быстрого концентрирования и обессоливания очищенных фракций L1 центрифугированием проб при 7000 g в течение 15-30 минут. Ретентат (удержанный материал), содержащий антигены L1, разводили в LS PBS и повторно концентрировали ультрафильтрацией несколько раз в соответствии с инструкциями изготовителя, пока пробы не достигали концентрации NaCl, сходной с концентрацией NaCl, обнаруживаемой в коммерческом PBS (~0,15 M NaCl). Испытывали фракции как удержанного материала (ретентата), так и фильтрата.
Анализ чистоты антигена
Окрашивание Кумасси и вестерн-блот-детектирование антигенов HPV для оценивания очистки
Очищенный экстракт и очищенную пробу для каждого из антигенов для приготовления вакцины сравнивали с использованием окрашивания Кумасси и вестерн-блот-анализа. Пробы готовили, как описано в Примере 1 выше, и равные объемы вносили в два 10% ДСН-ПААГ-геля для белков. Один гель окрашивали раствором Кумасси в течение ночи при комнатной температуре и обесцвечивали 2 раза по 2 часа при 37°C. Другой гель помещали для блоттинга на нитроцеллюлозную мембрану и зондировали с использованием CamVir1.
Количественное определение общего белка
Отрицательная контрольная вакцина (V5: экстракт NS-инфильтрованного растения) не может быть количественно определена анти-L1-вестерн-блоттингом. В результате, количество общего растворимого белка (TSP) определяли для каждого вакцинного антигена с использованием анализа Biorad Lowry белка (описанного в Примере 1 выше) для определения, что TSP был сходным для всех вакцин.
Детектирование антигенов HPV с использованием захватывающего ELISA для определения обогащения антигеном относительно TSP
Захватывающий ELISA выполняли, как описано в Примере 1, с использованием специфического для линейного эпитопа моноклонального антитела (MAb) H16J4. Выходы этого антигена HPV, определенные при помощи ELISA, сравнивали с соответствующими выходами TSP как в неочищенных, так и в очищенных пробах для определения обогащения антигеном.
Количественное определение с использованием Вестерн-блота очищенных антигенов, используемых для приготовления вакцин
Серию разведений вакцины Cervarix (содержащей 40 мкг/мл продуцируемого клетками насекомого HPV-16 L1) использовали для количественного определения продуцируемых растением антигенов HPV (V1-4). Несколько разведений этого антигена анализировали для гарантии определения количества, находящегося в линейном диапазоне стандартной кривой. Равные объемы очищенных антигенов и Cervarix-разведений наносили в 10% ДСН-ПААГ-гели, белки подвергали блоттингу на нитроцеллюлозную мембрану, и антигены HPV детектировали с CamVir1 (1:10000).
Денситометрию (GeneTools, Syngene, Synoptics Ltd) использовали для количественного измерения антигенов (в соответствии с описанием в Aires et al., 2006; Bazan et al, 2009), и количество белка HPV, присутствующего в этих пробах, определяли с использованием стандартной кривой, генерированной серией разведений Cervarix. Определенные количественно антигены HPV хранили при -70°C.
Цитоплазматическая экспрессия и экстрагирование антигенов
Для установления, образуются ли малые вирусоподобные частицы также, когда химерные белки HPV L1/L2 нацелены на цитоплазму, в противоположность хлоропластам, растения N. benthamiana инфильтировали рекомбинантной Agrobacterium, несущей pRIC L1/L2 (108-120); L1/L2 (56-81) и L1/L2 (17-36), вместе с супрессором сайленсинга NS, с использованием описанных выше способов. Спустя 3-5 дней инфильтрованные листья собирали, измельчали, и остатки клеток удаляли центрифугированием.
Структурный анализ с использованием трансмиссионной электронной микроскопии
Аликвоты очищенных антигенов для приготовления вакцин предварительно обрабатывали, как если бы их готовили для вакцинаций мышей. Эти антигены размораживали в течение ночи при 4°C, ресуспендировали в PBS до требуемой концентрации и инкубировали при 37°C в течение 30 минут.
Для определения эффекта очистки, предварительно обработанные очищенные антигены и неочищенные экстракты растения для каждого антигена разводили в 10 раз в PBS, иммуноулавливали с использованием CamVir1 (1:1000), линейный эпитоп-специфического антитела HPV-16 L1, которое связывает как мономеры L1, так и собранный белок L1 (McLean et al., 1990), и захватывали на светорассеивающих медных сетках с угольной пленкой. Эти белки отрицательно окрашивались 2% уранилацетатом и наблюдались на Zeiss 912 Omega Cryo EFTEM.
РЕЗУЛЬТАТЫ
Очистка экспрессированых растением антигенов HPV
Детектирование антигенов HPV в осветвленном экстакте
Локализацию L1 и химер L1/L2 в осветленном супернатанте подтверждали вестерн-блот-анализом. Окрашенный Кумасси гель для белков указывал на обильное присутствие Rubisco в супернатанте и удаление нескольких примесных белков, присутствующих в осадке (данные не показаны).
Предварительная (пилотная) очистка антигенов HPV
Очистка с использованием способов на основе размеров была в значительной степени неуспешной и невоспроизводимой между вакцинными антигенами, так как химеры L1/L2, по-видимому, собираются в различные структуры в отличие от L1. Кроме того, детектировали деградацию белков, и, следовательно, в качестве альтернативного способа исследования использовали хроматографию.
Хотя катионообменная хроматография с использованием колонки HiTrap SPFF или POROS 50HS была неуспешной в очистке химер на основе L1, гепариновая аффинная хроматография очищала все вакцинные антигены. Концентрирование и удаление соли в хроматографических фракциях испытывали с использованием двух основанных на ультрафильтрации способах, посредством либо перекрестного фильтрования, либо спиновых колонок для центрифугирования. Хотя перекрестная ультрафильтрация была эффективной, этот способ был дорогим с учетом времени, и детектировали существенную деградацию белка, что приводило к предпочтительному применению спиновых колонок. Таким образом, гепариновая хроматография и ультрафильтрация с использованием центрифугирования считались лучшими стратегиями для очистки антигенов для приготовления вакцин для последующих иммунологических экспериментов на мышах.
Очистка с использованием гепариновой хроматографии
Антигены для приготовления вакцин очищали из осветленного неочищенного супернатанта растений гепариновой хроматографией с использованием высокого градиента NaCl для элюции антигенов HPV. Этот ступенчатый градиент элюции оптимизировали для каждого антигена HPV с использованием линейного градиента 0-100% 1,5 M NaCl. Все антигены HPV элюировались между 0,45-0,75 M NaCl (данные не показаны). В результате, использовали 50% (0,75 M NaCl) ступенчатый градиент для очистки вакцинных антигенов для исследования иммуногенности в мышах. Детектирование очищенных антигенов HPV во фракциях элюата определяли с использованием CamVir1-дот-блотов.
Пик оптической плотности детектировали, когда буфер для элюции HS PBS наносили на колонку, и эти фракции содержали очищенные антигены HPV. Хроматограммы для других вакцинных антигенов были сходными, включающими график для NS-инфильтрованного экстракта растений (отрицательный контроль). Это указывает на то, что антигены HPV совместно очищались с другими примесными белками растений.
Фракции, содержащие частично очищенные антигены HPV (или совместно элюированные белки растений для отрицательного контроля), объединяли и затем обессоливали с использованием ультрафильтрационных спиновых колонок. Вестерн-дот-блоты показали, что эти антигены HPV были успешно удерживаемыми и концентрируемыми (данные не показаны).
Очистка вакцинных антигенов
Чистоту вакцинных антигенов (используемых для приготовления вакцин) испытывали сравнением очищенной пробы с неочищенным экстрактом растения. Это выполняли с использованием окрашивания Кумасси для определения общего белка, присутствующего в пробах (Фиг. 5A), и вестерн-блот-анализа, для детектирования антигенов HPV и определения потери в выходе антигена (Фиг. 5B). Следует отметить, что химера L1/L2(108-120) (V1) мигрирует более высоко, чем другие химеры L1/L2 (V2-3) и контроль L1 (V4).
Фиг. 5 показывает, что очищенные пробы были обогащены L1 в результате этой процедуры очистки. Окрашенный Кумасси гель показывает большое уменьшение общего белка в этих очищенных пробах, тогда как результаты вестерн-блота показывают, что имеется только небольшое увеличение в выходе антигена после очистки. Антиген L1 не детектировали в отрицательном контроле (V5: NS-инфильтрованном экстракте растений).
Пробы были только частично очищенными, так как дополнительные окрашенные Кумасси полосы белков детектировались на Фигуре 5А для очищенных антигенов V1 и V3 (более концентрированных, чем V2 и V4), показывая, что эти очищенные пробы содержат несколько примесных белков растений. Кроме того, хотя NS-отрицательный контроль (V5) не детектировался на вестерн-блоте, несколько сходных Кумасси-полос наблюдали в очищенной NS-пробе.
Обогащение антигенов HPV в очищенных пробах
TSP (общий растворимый белок) очищенных антигенов определяли для: гарантии того, что этот TSP был сходным относительно NS-отрицательного контроля (содержащего белки растений, которые совместно очищались с антигенами HPV) по сравнению с другими вакцинными антигенами, и (b) для определения обогащения антигена HPV после очистки. TSP для очищенных вакцинных антигенов HPV (V1-4) был сходным, однако TSP для NS-отрицательного контроля экстракта растения (V5) был почти в 2 раза более высоким, возможно, в результате объединения большего количества фракций элюата или большей концентрации ультрафильтрации (данные не показаны). В результате его разводят один раз в PBS.
Захватывающий ELISA, использующий линейно-специфическое антитело H16.J4 MAb, использовали для оценки количества антигена HPV, присутствующего в неочищенных и очищенных пробах. Для определения действия очистки на TSP и обогащение антигенов HPV, выход H16.J4-детектированного HPV сравнивали непосредственно с выходом TSP как для неочищенных, так и для очищенных проб (Фиг. 6).
Фиг. 6 демонстрирует, что очистка экстрактов растений уменьшала как TSP, так и общий белок HPV, как и ожидалось. Однако, относительно TSP, имеется 5-кратное обогащение антигена HPV в очищенных пробах (V1-4), что позволяет предположить, что гепариновая хроматография является эффективной в удалении большой доли примесного белка. NS-инфильтрованный экстракт растения (V5) показывал сходное уменьшение в TSP с очисткой, и количество TSP в "очищенном” отрицательном контроле находится в пределах уровней, полученных для вакцинных антигенов HPV (V1-4).
Вестерн-блот-измерение количества очищенных антигенов HPV
Антигены HPV определяли количественно вестерн-блоттингом с использованием денситометрии и коммерческой вакцины Cervarix в качестве стандарта (данные не показаны). Некоторую деградацию белка L1, наблюдаемую в виде полосы ~45 кДа, детектировали в некоторых из групп очищенных антигенов, в частности, после нескольких циклов замораживания-оттаивания. Однако, только полноразмерная полоса L1 56 кДа измерялась количественно в пробах, приготовленных для исследований иммуногенности в мышах.
Структурный анализ очищенных вакцинных антигенов
Структурную сборку химер L1 и L1/L2, продуцируемых в хлоропластах растений, как в неочищенных, так и в очищенных пробах, анализировали иммунозахватывающей трансмиссионной электронной микроскопией (Фиг. 7). Структурную сборку химер L1/L2, продуцируемых в цитоплазме, анализировали иммунозахватывающей трансмиссионной электронной микроскопией из неочищенных проб (Фиг. 8). Очистка антигена приводила к удалению примесного белка фона, в частности, для L1/L2(108-120) и отрицательного контроля (Фиг. 7A и E, соответственно). По сравнению с отрицательным контролем (NS-инфильтрованным экстрактом растения), все из этих антигенов HPV, по-видимому, содержат вторичные структуры HPV, либо капсомеры (~10 нм), капсомеры агрегатов, малые VLP (~30 нм), либо полноразмерные VLP (55 нм).
Очищенные L1/L2(108-120) собирались в малые химерные VLP (cVLP), которые имеют правильную форму, но варьируются по размеру (~30 нм), тогда как L1/L2(56-81), по-видимому, содержат капсомеры и некоторые агрегаты, хотя VLP-подобные структуры наблюдались в неочищенном экстракте. Очищенный L1/L2(17-36) содержал смешанную популяцию аморфных cVLP и высокую долю капсомерных агрегатов в противоположность неочищенному экстракту, что позволяет предположить, что очистка усиливает образование структур более высокого порядка. Очищенные V4, положительный контроль HPV-L1, собирались в различные VLP (~50 нм), как описано в предыдущих исследованиях (Biemelt et al., 2003; Maclean et al., 2007).
ОБСУЖДЕНИЕ
Строгая очистка является необходимой для коммерческого получения вакцин, хотя на стабильность L1 отрицательно влияют множественные стадии очистки. Гепариновая аффинная хроматография может быть использована для селективной очистки собранного L1, и стратегия очистки с использованием способа одноступенчатой хроматографии могла бы быть идеальной для быстрого и недорогостоящего получения вакцин HPV. Это исследование описывает очистку экспрессируемых в растении HPV-16 L1 и трех химер L1/L2 с использованием гепариновой хроматографии для последущих исследований иммуногенности у мышей.
Оптимизация очистки химер L1/L2
Химеры на основе HPV-16 L1 и L1 локализовали в супернатанте неочищенного экстракта и очищали с использованием различных способов. Хотя для очистки экспрессированного в растении HPV L1 использовали зависимые от размера способы очистки (Biemelt et al., 2003; Maclean et al., 2007; Fernandez-San Millan et al., 2008), эти способы были неэффективными для очистки химеры L1/L2 и были невоспроизводимыми между антигенами. Химеры на основе L1 широко детектировались в нескольких фракциях с использованием ультрацентрифугирования с градиентом плотности сахарозы и CsCl, указывая на то, что химеры L1/L2 собирались в гетерологичные структуры более высокого порядка, такие как капсомеры, агрегаты и VLP. Кроме того, степень сборки, по-видимому, была различной между этими химерами и положительным контролем L1. Это подтверждалось трансмиссионной электронной микроскопией (Фиг. 7), которая показала индивидуальные различия между различными химерами и контролем L1.
Хроматография была следующей стратегией для селективной очистки HPV L1; либо на основе заряда поверхности, либо посредством аффинности в отношении протеогликана гепарина. Применение катионообменной хроматографии для очистки экспрессируемого дрожжами HPV L1 демонстрировалось с использованием P-11 фосфоцеллюлозы (Kim et al., 2009, 2010) или колонки POROS 50HS (Cook et al., 1999). В противоположность этому, экспрессируемые растением химеры L1/L2 не очищались эффективно с использованием либо сильной катионообменной колонки HiTrap SPFF, либо колонки POROS 50HS. Большая часть белка L1/L2 не связывалась с любой колонкой, хотя малая доля белка связывалась сильно и необратимо со смолой POROS 50HS. Этот феномен был описан Cook et at. (1999), где 10% HPV-11 L1 не связывались со смолой и 45-65% не могли быть извлечены без снятия покрытия колонки POROS 50HS с использованием 0,5M NaOH.
В результате, катионообменную хроматографию в дальнейшем не проводили, хотя причина слабой очистки химер L1/L2 является невыясненной. Имеются две основные концевые области HPV-16 L1, которые содержат положительно заряженные остатки: ак 473-488 и 492-505 (Zhou et al., 1991b; Sun et al., 1995, 2010). Эти вставки последовательности L2 не перекрывают большие основные области на С-конце L1 и заменяют максимально 26 остатков в ак 414-439. Одним возможным объяснением является то, что на общий заряд поверхности L1 влияли либо аминокислотный состав инсертированных эпитопов, либо различия в сборке белка. Кроме того, неочищенный экстракт растения может содержать несколько примесных белков, которые связывались более сильно в этих колонках и были вне конкуренции за связывание HPV L1.
Очистка вакцинных антигенов
Антигены, используемые для приготовлении вакцины, очищали с использованием гепариновой хроматографии (описанной Joyce et al., 1999; Bazan et al., 2009; Johnson et al., 2009; Kim et al., 2009, 2010) для последующих исследований иммуногенности у мышей. Гепарин обратимо связывался как с L1, так и с химерами L1/L2 одинаковым образом (данные не показаны), и все антигены элюировали 0,75 M NaCl. Это сравнимо с другими исследованиями, где гепарин-связанный HPV-16 L1 элюировался между 0,5-1,2 M NaCl (Bazan et al., 2009; Kim et al., 2010; Baek et al., 2011).
Гепарин селективно очищает собранный белок L1 путем связывания с конформационным мотивом, который не присутствует на С-конце L1 (Fleury et al., 2009), и на него не влияют замены последовательности L2. Это особенно выгодно для получения вакцин, так как денатурированный L1 не вызывает продуцирования нейтрализующих антител (Kirnbauer et al., 1992; Suzich et al., 1995; Breitburd et al., 1995). Кроме того, Kim et al. (2010) продемонстрировал, что очистка HPV-16 L1, использующая гепариновую хроматографию, давала более высокие выходы извлечения (~60%) и продуцировала иммуногенные VLP (с диаметром 25-65 нм).
Чистоту очищенных гепарином проб испытывали окрашиванием Кумасси и вестерн-блот-детектированием L1 с использованием CamVir1 (Фиг. 5). Эти очищенные пробы обогащали L1 или химерами L1/L2, так как было значимое уменьшение общего белка с относительно малым уменьшением выхода антигена по сравнению с неочищенными пробами. Это подтверждали H16.J4 захватывающим ELISA и анализами TSP (Фиг. 6).
Пробы были частично очищенными и содержали несколько примесных белков растения (V1 и V2, Фиг. 5A), также присутствующих в очищенном отрицательном контроле (V5, Фиг. 5A). Примеси наблюдали также в очистке экспрессируемого дрожжами HPV-16 L1 с использованием гепариновой хроматографии (Kim et al., 2010). Таким образом, одностадийный способ, использующий гепариновую хроматографию, не является достаточным для получения высокоочищенного HPV L1 и химер L1/L2. Kim et al., (2010) продемонстрировал, что одновременно очищаемые примесные белки из дрожжей не удалялись дополнительными стадиями катионообменной и гидрофобной хроматографии, что позволяет предполагать, что многие из этих примесей имеют сходные изоэлектрические точки и профили гидрофобности L1. Кроме того, эти дополнительные хроматографические стадии уменьшали извлечение L1 до ~10%. Однако, чистый HPV-16 L1 получали преципитацией сульфатом аммония экспрессируемого дрожжами HPV-16 L1 перед гепариновой хроматографией, способом, который должен быть испытан в дополнительных исследованиях очистки с использованием белков на основе экспрессируемого растением HPV L1.
Количественное вестерн-блот-определение антигенов
Очищенные антигены определяли количественно вестерн-блот-анализом (обсуждаемым Heidebrecht et al., 2009) с использованием денситометрии для измерения интенсивности CamVir1-детектируемых L1 полос и коммерческой вакцины Cervarix в качестве HPV-16 L1-стандарта (данные не показаны).
Деградацию L1 детектировали в некоторых партиях очищенного антигена, в частности, после нескольких циклов замораживания-оттаивания. Она наблюдалась при высоких концентрациях V1, V2 и V4. Однако, большинство этих антигенных белков не деградировались, и только полноразмерную полосу 56 кДа L1 определяли количественно для гарантии, что мыши были иммунизированы одинаковыми дозами полноразмерного антигена. Другие группы сообщали о сходном характере деградации HPV-16 L1 при экспрессии в клетках насекомых (Kirnbauer et al., 1992), дрожжей (Cook et al., 1999) и бактерий (Zhang et al., 1998). Для будущих исследований очистки рассматривается концентрация соли буферов для экстракции и диафильтрации, так как в условиях низкой концентрации соли происходит нарушение сборки VLP (Murata et al., 2009). Увеличение концентрации соли до 0,5 или 1 М NaCl может стабилизировать VLP (Mach et al., 2006) и уменьшать деградацию, наблюдаемую в очищенных пробах.
Сборка вакцинных антигенов
Сборку полученных из растений HPV-16 L1 и химер L1/L2, производимую в хлоропластах, анализировали с использованием иммунозахватывающей электронной микроскопии (Фиг. 7). Очистка, по-видимому, удаляет некий белок фона, и все экспрессируемые в растении химеры L1/L2 и положительный контроль L1 собирались в структуры более высокого порядка, такие как капсомеры, агрегаты и VLP.
Экспрессируемые растением HPV-16 L1 VLP обычно имеют диаметр ~55 нм при локализации в хлоропластах табака (Maclean et al., 2007; Fernandez-San Millan et al., 2008; Lenzi et al., 2008). В этом исследовании HPV-16 L1 собирался в полноразмерные VLP (~50 нм, Фиг.7 Dii).
На сборку химер в VLP влияет, по-видимому, длина эпитопа L2, с L1/L2(108-120), L1/L2(17-36) и L1/L2(56-81), содержащими замену остатков 13, 20 и 26 в эпитопе, соответственно. Экспрессируемый растением L1/L2(108-120), с самым коротким эпитопом L2, успешно собирался в индивидуальные cVLP с диаметром ~30 нм, которые являются меньшими, чем L1 VLP (Chen et al., 2000) Фиг. 7A). В противоположность этому, L1/L2(17-36) преимущественно образовывал агрегаты капсомеров, хотя присутствие больших аморфных VLP-подобных структур позволяет предположить, что может происходить частичная сборка малых cVLP (Фиг. 7C). Наконец, L1/L2(56-81) с наиболее длинным эпитопом L2 преимущественно собирался в капсомеры (Фиг. 7B).
L1/L2(108-120) также экспрессировался в клетках насекомых, и было показано, что CsCl-очищенная химера собиралась в аморфные VLP и агрегаты капсомеров (Varsani et al., 2003a), а не в отдельные cVLP с диаметром ~30 нм.
Химеры, нацеленные на цитоплазму в результате инфильтрации растений с использованием экспрессирующего вектора pRIC, приводили к образованию детектируемых L1/L2(56-81) VLP (Фиг.8). Это указывает на то, что химерные VLP, описанные здесь, могут также образовываться в цитоплазме растений.
ПРИМЕР 3: ИММУНОГЕННОСТЬ ХИМЕР L1/L2
В этом исследовании мышей иммунизировали полученным из растений L1 и тремя химерными L1/L2 кандидатными вакцинами, содержащими перекрестно-нейтрализующие эпитопы L2 ак 108-120, 56-81 и 17-36. Иммуногенность этих химер анализировали в отношении сборки химер, и исследовали их способность индуцировать анти-L1-антитела, анти-L2-антитела и защитные NAb против гомологичного HPV-16 и гетерологичных HPV-18, 45 и 52 PsV.
СПОСОБЫ И МАТЕРИАЛЫ
Иммунизация мышей
Самок мышей C57/BL6 от South African Vaccine Producers Animal Unit (Johannesburg, South Africa) содержали в условиях Biosafty Level 2 (BSL-2) в Animal Unit в Health Science Faculty, University of Cape Town. Разрешение для этого исследования допущено Research Ethics Committee, University of Cape Town (AEC 008/037).
Мышей (в возрасте 7-8 недель) иммунизировали для тестирования гуморальных ответов антител на полученные из растений HPV-16 L1/L2 кандидатные вакцины. Контроли включали экспрессируемый растением HPV-16 L1 (положительный контроль) и NS-инфильтрованный экстракт растения (отрицательный контроль). В лаборатории авторов этого изобретения было показано, что химера L1/L2(108-120) (опубликованная в виде SAF; Varsani et al., 2003a) индуцирует анти-L1-ответы и, следовательно, служит в качестве дополнительного положительного контроля. Детали вакцинации показаны в Таблице 5.
Полученные из растения вакцинные антигены, используемые в исследовании иммуногенности
†TSP = общий растворимый белок
Очищенные вакцинные антигены доводили до содержания дозы 10 мкг в 100 мкл Dulbecco PBS (DPBS; Sigma). Общий растворимый белок (TSP) в каждой вакцине оценивали с использованием анализа белка Бредфорда, как обсуждалось в Примере 1 выше, для гарантии отрицательного контроля вакцины, содержащего сходный TSP по сравнению с другими вакцинами HPV (Таблица 5). Вакцину готовили гомогенизацией вакцинного антигена в неполном адъюванте Фрейнда (FIA) в объемном отношении 1:1 с использованием способа шприцевой экструзии (Koh et al, 2006).
Мышей делили на 2 группы из 5 мышей на вакцину и инъецировали подкожно в правый бок, левый бок или в паховый участок. Предварительные взятия крови выполняли за 12 дней перед вакцинацией (День 0), и мышей ревакцинировали в День 13, 27, 41 и 48 (приблизительно каждые 2 недели, за исключением Дня 48, когда было решено вакцинировать, а не получать тестируемое кровоизвлечение) перед получением конечных извлечений крови в День 62 (~9 недель после вакцинации). Сыворотку выделяли и хранили при -70°C.
ELISA-детектирование анти-L1-антител в сыворотках мыши
Получение продуцируемого клетками насекомых HPV-16 L1
Продуцируемый клетками насекомых HPV-16 L1 использовали в качестве антигена ELISA для детектирования анти-L1-антител в сыворотках мышей. Экспрессируемый клетками насекомых L1 использовали вместо экспрессируемого растением L1 во избежание фонового детектирования антител против примесных белков растений. Клетки Spodoptera frugiperda (Sf-9) выращивали встряхиванием в бессывороточной среде SF90011 при 27°C и инфицировали при множественности заражения (MOI) 1,0 и плотности 1×106 клеток/мл. Клетки собирали после 96 часов центрифугированием (1000× g в течение 5 минут), и осадки промывали DPBS и хранили при -70°C.
HPV-16 L1 экстрагировали ресуспендированием клеток до 4×106 клеток/мл в PBS с высокой концентрацией соли (0,8 M NaCl 1× PBS), содержащем ингибитор протеаз (Roche Complete EDTA-free) и обрабатывали ультразвуком на льду в течение 5 20-секундных интервалов и перерыва (Microtip sonication; Level 5; Heat Systems - Ultrasonics, Inc. Sonicator Cell Disruptor Model W-225 R). Клеточный лизат осветляли центрифугированием (5000 g в течение 5 минут) для удаления клеточных остатков, и стадию центрифугирования повторяли с использованием супернатанта. Коммерческую вакцину Cervarix (20 мкг HPV-16 L1) использовали в качестве стандарта HPV-16 L1 для вестерн-блот-количественного измерения HPV-16 L1 (как описано выше), и L1 детектировали с использованием CamVir1 (1:10000; Abcam®).
ELISA-детектирование анти-L1-антител
Титр анти-L1-антитела определяли прямым ELISA. 96-луночный микротитрационный планшет Maxisorp (Nunc) покрывали 100 мкл на лунку (30 нг) продуцированного клетками насекомых HPV-16 L1, разведенными в 1× PBS, и инкубировали в течение ночи при 4°C. Планшеты блокировали блокирующим буфером (1% сепарированное молоко в 1× PBS; 200 мкл на лунку) в течение 2 часов при комнатной температуре и затем промывали 4× PBS.
Мышиные сыворотки объединяли в вакцины (10 мышей на вакцину) для анализа. Сыворотки конечного кровоизвлечения мышей разводили в блокирующем буфере в 4-кратных сериях в трех повторностях, в диапазоне разведения 1:50-1:51200. Объединенные сыворотки перед кровоизвлечением тестировали при разведении 1:50, и они служили в качестве отрицательного контроля. Разведенные сыворотки добавляли в лунки (100 мкл на лунку) и инкубировали в течение 2 часов при комнатной температуре. Лунки положительных контролей содержали разведение 1:50 анти-L1-антител; как CamVir1 (Abeam®), который связывает как линейные, так и конформационные эпитопы (McLean et al., 1990), так и H16.V5 MAb, который связывает специфически конформационные эпитопы (Christensen et al., 1996). Контрольные лунки без антитела включали в качестве контроля фона.
После стадии промывания 4× PBS, козьи антитела против конъюгата мышиных антител и пероксидазы хрена (1:2000; Sigma), разведенные в блокирующем буфере, добавляли в лунки (100 мкл на лунку) и инкубировали в течение 1 часа при 37°С. Планшеты промывали 4 раза с использованием PBS (200 мкл на лунку) и добавляли 100 мкл О-фенилендиаминдигидрохлорида (OPD) (DAKO; Denmark) на лунку. Планшеты проявляли в темноте в течение 30 минут при комнатной температуре, реакцию останавливали 0,5 M H2SO4, и детектировали оптическую плотность при 490 нм. Титры анти-L1-связывания выражали в виде обратной величины максимального разведения сыворотки, которая продуцирует более высокие считывания оптической плотности, чем оптическая плотность соответствующей сыворотки перед кровоизвлечением, разведенной при 1:50.
Статистический анализ
Двухсторонний, неспаренный t-критерий использовали для расчета статистической значимости анти-L1-реакции конечного кровоизвлечения по сравнению с вакциной отрицательного контроля (p=0,01). Однофакторный дисперсионный анализ One-way (ANOVA) использовали для сравнения вакцин, и для определения значимости (p=0,01) использовали критерии наименьшей значимой разности (LSD) Фишера, HSD Тьюки и критерии Бонферрони.
Вестерн-блот-детектирование анти-L2-антител
Получение продуцируемого E.coli HPV-16 L2
His-меченный белок HPV-16 L2, получаемый с использованием вектора pProEX htb в E.coli, (обеспеченный David Mutepfa), использовали для вестерн-блот-детектирования анти-L2-антител в сыворотках мышей. Культуры E.coli выращивали встряхиванием при 37°C до OD600 0,6 и затем индуцировали добавлением 0,6 мМ изопропил-β-тиогалактозида (IPTG). Спустя 3 часа, клетки собирали центрифугированием (3800 g в течение 15 минут при 4°C), и осадок сохраняли и взвешивали.
Тельца включений экстрагировали ресуспендированием этих клеток в 4 объемах лизисного буфера (50 мМ Трис pH 8,5, 5 мМ β-меркаптоэтанол), и фенилметансульфонилфторид (PMSF) и лизоцим (Roche) добавляли до конечной концентрации 0,4 мМ и 0,08 мкг/мкл, соответственно. Эти клетки инкубировали на льду в течение 20 минут. Добавляли Тритон-Х до 1%, и клетки дополнительно инкубировали на льду в течение 20 минут при 37°C, пока раствор не становился вязким. Добавляли ДНКазу и РНКазу до 4 мкг/мл и 40 мкг/мл, соответственно, и клетки инкубировали в течение 30 минут при комнатной температуре, пока вязкость не осветлялась.
Тельца включения собирали центрифугированием при 13000 об/мин в микроцентрифуге в течение 15 минут при 4°C, и осадок ресуспендировали в 1 мл лизисного буфера (2,5 мМ Трис pH 8,0, 3,125 мМ β-меркаптоэтанол, 0,2 мМ ЭДТА, 0,0025% Тритон-Х) и оставляли для лизиса в течение 10 минут при комнатной температуре. Эту пробу центрифугировали при 13000 об/мин в течение 15 мин при 4°C, и осадки промывали 4 раза PBS. Осадок ресуспендировали в 1 объеме PBS на массу осадка, определяли количественно окрашиванием Кумасси с использованием в качестве стандарта бычьего сывороточного альбумина (BSA) и хранили при -20°C.
Вестерн-блот-детектирование анти-L2-антител
Продуцируемый E.coli антиген HPV-16 L2 инкубировали при 95°C в течение 5 минут в 5× буфере для нанесения и наносили в 10% ДСН-ПААГ гель. Вместо использования 10-луночного гребня использовали 2-луночный гребень: малую лунку для белкового маркера и большую лунку, состоящую из 9 лунок, слитых вместе, с получением таким образом отдельной широкой лунки, которая позволяет белкам распространяться равномерно через эту ширину.
Экспрессируемый E.coli His-меченный антиген HPV-16 L2 (2,5 мг) разделяли на 10% ДСН-ПААГ геле (Sambrook et al., 1989) и переносили на нитроцеллюлозную мембрану с помощью полусухого электроблоттинга, как описано в Примере 1 выше. Затем протокол блоттинга модифицировали, посредством чего часть этой мембраны между 55-130 кДа, содержащая белок L2 (~80 кДа) разделяли на 12 полосок одного размера для зондирования различными сыворотками. Эти полоски мембран переносили в индивидуальные лунки в 25-луночном планшете для культуры ткани и инкубировали в блокирующем буфере в течение 4 часов при комнатной температуре.
Индивидуальные предварительные кровоизвлечения и мышиные сыворотки конечного кровоизвлечения объединяли в вакцины (10 мышей на вакцину), и эти мембранные полоски зондировали мышиным анти-HIS-антителом в качестве положительного контроля (1:2000, Serotech) или объединенными мышиными сыворотками, разведенными 1:100 в блокирующем буфере. Сыворотки добавляли в различные лунки и инкубировали со встряхиванием в течение ночи при комнатной температуре. Затем эти полоски промывали 4 раза 10 минут блокирующим буфером и зондировали вторичным козьим антителом против мышиного IgG, конъюгированного со щелочной фосфатазой (1:5000; Sigma), в течение 2 часов при комнатной температуре. Отдельные полоски промывали опять 4×10 минут промывочным буфером и затем проявляли с использованием NBT/BCiP (Roche).
Для измерения интенсивности оптической плотности каждой полосы L2 использовали денситометрию (GeneTools, Syngene, Synoptics, Ltd). Величины нормализовали в отношении оптической плотности неспецифического фона с использованием величины, ассоциированной с вакциной отрицательного контроля. Сыворотки с полосами L2, имеющие величины оптической плотности >2× величин, наблюдаемых в конечных кровоизвлечениях HPV-16 L1, индуцировали анти-L2 ответ.
Нейтрализующие псевдовирион HPV анализы
Приготовление для анализов нейтрализации
Протоколы, используемые для анализов нейтрализации псевдовириона HPV (PsV), взяты из технических файлов лаборатории клеточной онкологии доктора Джона Шиллера, и плазмиды HPV L1/L2 pSheLL и репортерная плазмида pYSEAP были любезно предоставлены доктором Джоном Шиллером.
Плазмиду pYSEAP проверяли с использованием продукта расщепления рестрикционных ферментов SalI и BamHI (как описано в Примере 1 выше). Плазмиды HPV L1/L2 pSheLL были сходными по размеру и имеют сходные сайты рестриктаз, и, следовательно, эти плазмиды секвенировали для подтверждения их идентичности с использованием двух наборов pSheLL-вектор-специфических праймеров, которые связываются выше и ниже по ходу транскрипции генов HPV L1 и L2 (Таблица 6). Последовательности сопоставляли с последовательностью плазмиды HPV L1/L2 pSheLL и последовательностями генов HPV L1 или L1 с использованием программы анализа последовательности DNAMAN.
pSheLL-вектор-специфические праймеры секвенирования
Свободную от эндотоксинов плазмидную ДНК (NucleoBond® Xtra Midi EF, Macherey-Nagel) получали из культур E.coli, выращенных при подходящем отборе с антибиотиками как для плазмиды pYSEAP, так и для плазмид pShell HPV-16, 18, 45 и 52 (Таблица 7), и ДНК хранили при -70°C.
Плазмидные векторы анализа нейтрализации HPV PsV, использованные в этом исследовании
Трансфекция клеток HEK293TT
Линия клеток HEK293TT была любезно предоставлена доктором Джоном Шиллером. HPV PsV получали, как описано в протоколе "Получение Папилломавирусных Векторов (Псевдовирусов)", переработанном в июне 2010 года.
Клетки HEK293TT культивировали в полной модифицированной по способу Дульбекко среде Игла с высокой концентрацией глюкозы (cDMEM), содержащей 1% GlutaMAX™ (Gibco) и 10%-ную фетальную телячью сыворотку (Gibco). Среда cDMEM была дополнена 1% не-незаменимых аминокислот (Gibco), 100 единицами/мл пенициллина (Gibco), 100 мкг/мл стрептомицина (Gibco), 10 мкг/мл Fungin™ (InvivoGen) и 250 мкг/мл гигромицина B (Roche) для отбора на антиген ТТ (cDMEM-Ab). Оттаивание и пассирование клеток выполняли, как описано в этом протоколе.
Клетки предварительно высевали в cDMEM (без антибиотиков или Гигромицина B) в колбе на 175 см2 для достижения 50-70% конфлюэнтности на следующий день. В день транскрипции к этим клеткам добавляли свежую cDMEM, и аликвоты свободной от эндотоксина плазмидной ДНК оттаивали на льду. Смесь для трансфекции готовили следующим образом: 175 мкл FuGene6 (Roche) добавляли к 5,7 мл DMEM с GlutaMAX (бессывороточная среда) в конических пробирках с белыми крышками (Sterilin) и инкубировали в течение 5 минут при комнатной температуре. Всего добавляли 40 мкг ДНК (20 мкг каждой плазмиды), эту смесь инкубировали в течение дополнительных 30 минут при комнатной температуре и затем добавляли по каплям к этим клеткам. Колбы инкубировали в течение 40-48 часов при 37°C в содержащем 5% СО2 термостате и среду меняли спустя 6 часов после трансфекции (cDMEM).
Экстракция псевдовирионов
Псевдовирионы собирали спустя 40-48 часов после трансфекции. Клетки собирали трипсинизацией 0,05% Трипсин-ЭДТА (Gibco) и инактивировали добавлением cDMEM. Эти клетки переносили в полистироловую пробирку c коническим дном из Стерилина (так как псевдовирионы адсорбируются неспецифически с полипропиленовыми пробирками), считали и центрифугировали при 1200 об/мин в течение 8 минут. Осадок промывали 0,5 мл DPBS (Invitrogen) и ресуспендировали в 1,5 объемах осадка DPBS-Mg (DPBS с дополнительным 9,5 мМ MgCl2) для достижения высокой плотности клеток >100×106 клеток/мл.
10% Brij-58 (Sigma) добавляли к ресуспендированному остатку до конечной концентрации 0,5% (масс/об), и как бензоназу (Sigma), так и Plasmid-Safe™ АТФ-зависимую ДНКазу (Epicentre) добавляли к 0,5% (об/об) и 0,2% (об/об), соответственно. С использованием протокола Chris Buckʹs "Improved Maturation of HPV and Polyomavirus", добавляли стерильный сульфат аммония (1 M, pH 9,0) до конечной концентрации 25 мМ для стимуляции образования межмолекулярных L1-дисульфидных связей. Смесь инкубировали при 37°C в течение 15 минут для возможности лизиса и затем переносили в условия предпочтительной температуры для созревания псевдовирионов в течение ночи (25°C для HPV-16 и 18, 37°C для HPV-45 и 52).
Созревший лизат охлаждали на льду в течение 5 минут, и конечную концентрацию NaCl лизата доводили до 850 мМ и инкубировали на льду в течение дополнительных 10 минут. Лизат осветляли центрифугированием при 3000× g в течение 10 минут при 4°C. Супернатант собирали, и осадок повторно экстрагировали ресуспендированием в равном объеме остатка DPBS с высокой концентрацией соли (0,8 M NaCl) и повторным центрифугированием. Супернатанты объединяли и переносили в полистироловые пробирки с белыми крышками и хранили на льду.
Очистка псевдовирионов
PsV очищают центрифугированием в градиенте плотности Optiprep. Optiprep (60% (масс/об) раствор иодиксанола; Sigma) разводили в DPBS до 46% (масс/об) исходного раствора Optiprep и дополняли 0,625 М NaCl до конечной концентрации 0,8 М NaCl, CaCl2 до 0,9 мМ, MgCl2 до 0,5 мМ и KCI до 2,1 мМ. DPBS с высокой концентрацией соли (0,8 М NaCl) использовали для разведения исходного раствора до 27%, 33% и 39% Optiprep, и 3-ступенчатый градиент готовили подкладыванием разведений Optiprep (27-39%) в 1,5 мл-ступенях в тонкостенных полиалломерных ультрацентрифужных пробирках (Beckman). Этот градиент оставляли диффундировать при комнатной температуре в течение 4 часов. Дважды осветленный супернатант клеток наслаивали на линеаризованный градиент Optiprep и центрифугировали в роторе Beckman SW55ti при 50000 об/мин (234000× g) в течение 3,5 часов при 16°C. Дно этой пробирки прокалывали иглой для шприца, и фракции собирали в полистироловые пробирки с белыми крышками: первая фракция была ~0,75 мл, фракции 2-11 были ~0,25 мл, каждая, и фракция 12 содержала остаток градиента.
Протокол для скрининга фракций модифицировали для детектирования присутствия HPV L1, основного белка, присутствующего в этом капсиде (Buck et al., 2008), с использованием дот-блотов HPV типа-специфического анти-L1. Каждую фракцию помещали в виде пятен на нитроцеллюлозную мембрану (0,5 мкл), и Cervarix (HPV-16 L1), продуцируемый E.coli His-меченный HPV-16 L2 или осветленный супернатант HPV-16, 18, 45 или 52, первоначально нанесенные на этот градиент, использовали в качестве положительных контролей.
Мембраны блокировали в блокирующем буфере в течение 30 минут при комнатной температуре и затем зондировали в течение ночи при комнатной температуре с подходящим первичным анти-L1-антителом, разведенным в блокирующем буфере. CamVir1 (1:5000; Abeam) использовали для детектирования HPV-16. Кроме того, кроличьи анти-HPV-16 L2 сыворотки были доступными и были использованы для детектирования L2 во фракциях HPV-16 (1:2000). H16.123, H45.N5, H52.C1 и H52.D11 MAb, любезно предоставленные доктором Нейлом Кристенсеном, использовали для детектирования HPV-18, 45 и 52, соответственно (1:2000; Christensen et al., 1996). Мембраны зондировали 1:10000 вторичным антителом (козьим антителом против мышиного IgG, конъюгированного со щелочной фосфатазой, или козьим антителом против кроличьего антитела, конъюгированного со щелочной фосфатазой; Sigma), промывали и проявляли, как описано выше. Фракции пиков, содержащие высокую концентрацию L1, объединяли в полистироловых пробирках и хранили при -70°C для титрования.
Электронная микроскопия псевдовирионов
Очищенные HPV PsV анализировали с использованием электронной микроскопии. Эти PsV (1:1000) улавливали на светорассеивающих медных сетках с угольной пленкой, окрашивали 2% уранилацетатом и наблюдали с использованием Zeiss 912 Omega Cryo EFTEM.
Титрование псевдовирионов
Анализы титрований и нейтрализации PsV основывались на протоколе "Papillomavirus Neutralisation Assay", за исключением того, что NAb не включали в это титрование. Исходные растворы PsV титровали перед анализами нейтрализации для определения минимального количества PsV, требуемого для сильного сигнала в SEAP-анализе.
Клетки HEK293TT выращивали в среде cDMEM-Ab до 70-80% конфлюэнтности, собирали, как описано, промывали DPBS и разводили до 3,0×105 клеток/мл в среде для нейтрализации (cDMEM с высоким содержанием глюкозы с HEPES и без фенолового красного красителя или пирувата натрия, дополненная 10% фетальной телячьей сывороткой; Gibco). Клетки предварительно высевали в 96-луночные планшеты для культуры ткани (Corning Costar), обработанные 100 мкл суспензии в каждой внутренней лунке и 150 мкл DMEM с феноловым красным красителем в наружных лунках во избежание испарения из этих внутренних лунок. Клетки инкубировали в течение 3-4 часов при 37°C перед добавлением PsV.
Серийные разведения PsV готовили в средах для нейтрализации (удвоенные разведения от 1:250 до 1:64000) в необработанных стерильных 96-луночных полистироловых планшетах (Nunc) и тестировали в трех повторностях. Эти разведения PsV добавляли к предварительно посеянным клеткам (100 мкл на лунку), как описано в протоколе Шиллера, и каждый планшет содержал 6 лунок отрицательного контроля без псевдовирионов (клеточный контроль). Планшеты инкубировали в течение 72 часов при 37°C в увлажненном CO2-термостате.
Активность SEAP детектировали с использованием набора Great EscAPe™ SEAP Chemiluminescence Kit 2.0 (Clontech Laboratories, inc.) в соответствии с инструкциями справочника, за исключением того, что объемы были скорректированы до 0,6 объемов, указанных в протоколе изготовителя (как указано в пересмотренном Шиллером протоколе). Супернатант (125 мкл) переносили в стерильные необработанные 96-луночные планшеты (Nunc) и центрифугировали при 1000 × g в течение 5 минут. Осветленный супернатант (15 мкл) переносили в белый 96-луночный Optiplate (96F белые maxisorb-планшеты для люминометра; Nunc), 45 мкл 1× буфера для разведения добавляли в каждую лунку, и планшет инкубировали при 65°C в течение 30 минут. Планшеты охлаждали в течение 5 минут на льду и затем 60 мкл субстрата добавляли на лунку и инкубировали при комнатной температуре в течение 20 минут. Продуцирование SEAP детектировали с использованием люминометра для микропланшетов (Digene DML 2000). Разведение PsV, выбираемое для анализа нейтрализации, было разведением, которое использует минимальное количество PsV, встречающееся в линейном диапазоне кривой титрования. Когда титр HPV-52 был очень низким, его повторно титровали от 1:125 до 1:4000.
Анализ нейтрализации псевдовирионов
Анализ нейтрализации in vitro использовали для детектирования ответы HPV-специфических антител в мышиных сыворотках и для определения титров нейтрализации конечных точек.
Контроли включали:
(a) Клеточный контроль (отрицательный контроль инфекции): Клетки инкубировали только со средами нейтрализации (без сывороток или псевдовирионов) с получением считывания фона супернатанта этой культуры клеток. Люминесцентные величины, ассоциированные с этим контролем, представляли 0% нейтрализацию PsV.
(b) PsV-контроль (положительный контроль инфекции PsV): PsV предварительно инкубировали в буфере для нейтрализации перед инфицированием клеток. Величины, ассоциированные с этим контролем, представляли 100% нейтрализацию PsV.
(c) MAb или антисыворотки, о которых известно, что они нейтрализуют PsV HPV-типа, используемые в этом анализе (положительный контроль анализа нейтрализации): PsV предварительно инкубировали с 6 разведениями, которые должны охватывать титр этой предварительной нейтрализации (0-100% нейтрализацию).
(d) Кровоизвлечения: PsV предварительно инкубировали с объединенными предварительными кровоизвлечениями мыши (отрицательный контроль).
Эти NAb-положительные контроли (Таблица 8) титровали перед анализом нейтрализации тест-сывороток для определения диапазона нейтрализующего разведения, который должен использоваться в анализах нейтрализации PsV. Контролями нейтрализации HPV-16, 45 и 52 были H16.V5, H45.N5, H52.C1 и H52.D11 MAb. Контролем HPV-18 были кроличьи сыворотки анти-Cervarix из лаборатории авторов изобретения.
HPV тип-специфические нейтрализующие антитела
Сыворотки от мышей, иммунизированных продуцируемыми растением кандидатными вакцинами химеры HPV-16, объединяли (10 мышей на вакцину) и тестировали на нейтрализацию HPV-16, а также HPV-18, 45 и 52. Объединенные вакцинные сыворотки разводили в 4 раза в трех повторностях в диапазоне от 1:50 до 1:12800. Предварительные кровоизвлечения также объединяли и тестировали в трех повторностях при самой низком разведении 1:50. Серийные разведения сывороток готовили в стерильных необработанных 96-луночных планшетах для культуры ткани (1:10-1:2560).
PsV разводили в буфере нейтрализации до концентрации, предварительно определенной в анализе титрования. В другом необработанном 96-луночном планшете, 100 мкл разведенных PsV добавляли в каждую лунку и 25 мкл разведенных сывороток (или буфера нейтрализации для контрольных лунок PsV) добавляли в лунки трех повторностей с получением дополнительного разведения 1:5 предварительно разведенных сывороток. Эти PsV и сыворотки инкубировали при 4°C в течение 1 часа, чтобы сделать возможной нейтрализацию инфекционных PsV, и затем добавляли 100 мкл к каждой лунке в предварительно засеянном HEK-293TT планшете (буфер нейтрализации для лунок клеточного контроля). Эти планшеты инкубировали в течение дополнительных 72 часов в увлажненном СО2-термостате при 37°C.
Этот супернатант собирали, как описано выше, и анализировали на присутствие SEAP. Титр нейтрализации устанавливали как обратную величину максимального серийного разведения, которое уменьшает активность SEAP по меньшей мере на 50% относительно контрольной пробы, предварительно не инкубированной с сывороткой.
РЕЗУЛЬТАТЫ
Гуморальный иммунный ответ против HPV-6 L1
Детектирование антител, продуцируемых против HPV-16 L1, выполняли прямым анализом ELISA с использованием экспрессируемого в клетках насекомых HPV-16 L1 в качестве покрывающего антигена (Фиг. 9). Титры анти-L1 выражали в виде обратной величины максимального разведения сыворотки, содержащего более высокие считывания оптической плотности, чем оптическая плотность предварительно извлеченной сыворотки при 1:50.
Анти-L1-ответ не детектировали для химеры L1/L2(56-81), и вакцины отрицательного контроля (V2 и V5; Фиг. 9A), а также вакцинных предварительных извлечений. (Фиг. 9С). По сравнению с этим, ELISA MAb (H16.V5, CamVir1, Фиг. 9B) и положительные контроли произведенного растением L1 (V4, Фиг. 9A) показали хороший ответ, и как производимая растением L1/L2(17-36), так и химеры L1/L2(108-120), давали анти-L1-титры 200 и 12800, соответственно, (V3 и V1, Фиг. 9A). Хотя HPV-16 L1 давал наивысшие титры анти-L1 (12800-51200), L1/L2(108-120) обнаруживал сходный ответ (V4 и V1, соответственно, Фиг. 9А), что позволяет предположить, что инсерция эпитопа L2 ак 108-120 имела меньшее действие на иммуногенность L1 по сравнению с другими химерами. Кроме того, анти-L1-ответ L1/L2(108-120) и HPV-16 L1 был статистически значимым относительно их соответствующих предварительных кровоизвлечений и NS-инфильтрованного экстракта растений (p=0,01).
Гуморальный иммунный ответ против эпитопов HPV-16 L2
Анти-L2-ответ против продуцируемого E. coli His-меченного белка HPV-16 L2 определяли с использованием вестерн-блоттинга. Отдельные сыворотки мышей объединяли для каждой из этих вакцин и анализировали на анти-L2-ответы (Фиг. 10).
Одну неспецифическую полосу, сходную с полосой ~80 кДа L2, детектировали в обеих антисыворотках из отрицательного вакцинного контроля (V5; экстракт растения) и контроля вакцины L1 (V4; экспрессируемый в растении HPV-16 L1), которая служит в качестве дополнительного отрицательного контроля L2 в этом эксперименте (Фиг. 10). Все химерные вакцины (V1-3), по-видимому, дают анти-L2-ответ, так как детектировали сильные полосы L2 с использованием этих химерных антисывороток (Фиг.10). Однако, только химеры L1/L2(108-120) и L1/L2(17-36) (V1 и V3, соответственно) давали безусловный анти-L2-ответ, с интенсивностью полос L2, в 2 раза большей, чем интенсивность HPV-16 L1 (V4).
Анализы нейтрализации
Плазмидный анализ
Идентичность pYSEAP и плазмид HPV-16, 18, 45 и 52 L1/L2 pSheLL подтверждали с использованием расщепления рестриктазами и секвенирования (данные не показаны).
Optiprep-очистка и детектирование HPV PsV в очищенных фракциях
HPV PsV очищали из осветвленного супернатанта клеток ультрацентрифугированием с градиентом плотности на линейном градиенте 27-39% Optiprep. Одна светло-серая полоса была слабо видимой в виде третьей в направлении этого градиента, и эти фракции собирали от дна пробирки.
Фракции подвергали скринингу на присутствие PsV с использованием HPV-тип-специфических анти-L1-дот-блотов CamVir1, и кроличьи антисыворотки против HPV-16 L2 использовали для детектирования HPV-16 L1 и L2, с использованием Cervarix и продуцируемого E. coli His-меченного HPV-16 L2 в качестве контролей. H16.I23, H45.N5, H52.C1 и H52.D11 MAb использовали для детектирования HPV-18, 45 и 52, соответственно, с использованием исходного осветленного клеточного супернатанта в качестве HPV-тип-специфического контроля (данные не приведены).
HPV-16 детектировались во фракции 3-5 с использованием H16.V5 и слабо детектировались антисыворотками HPV-16 L2, так как этот белок L2 локализован внутри относительно поверхности капсида L1 в совместно собранных L1/L2 VLP (Buck et al 2008). HPV-18, 45 и 52 L1 в сильной степени детектировались во фракциях 5-7, 4-6 и 6-10, соответственно. Фракции PsV объединяли, исследовали электронной микроскопией и использовали в анализах нейтрализации.
Анализ электронной микроскопией
Объединенные пробы PsV испытывали трансмиссионной электронной микроскопией для определения их сборки, морфологии и очистки (данные не показаны). Все типы HPV собирались в сферические PsV (55 нм). HPV-45 PsV, по-видимому, существуют исключительно в виде полностью собранных частиц PsV. HPV-16 и 18 PsV были преимущественно собранными, хотя были видны некоторые капсомеры и агрегаты. HPV-52 PsV содержали большую долю капсомерных агрегатов и частичных PsV, возможно, вследствие низкой экспрессии HPV-52 L1 и L2 в клетках HEK293TT.
Титрование HPV PsV
Очищенные PsV титровали для определения разведения PsV, подлежащего использованию для анализа нейтрализации. Используемое разведение было минимальным количеством PsV, дающим сильный сигнал в линейном диапазоне титрационной кривой.
Для HPV-16 и 18 PsV, этот линейный диапазон титрационной кривой существовал между разведениями 1:250 - 1:1000 (данные не показаны), и, таким образом, для анализов нейтрализации был выбран 1:500. HPV-45 PsV имели наивысший титр, с линейным диапазоном, встречающимся между разведениями 1:500 и 1:2000, таким образом, выбирали 1:1000 для дальнейшей работы (данные не показаны). HPV-52 PsV подлежали повторному титрованию с более низкими разведениями. Линейный диапазон встречался между разведениями 1:125-1:250 (данные не показаны), и разведение 1:200 использовали в анализе нейтрализации HPV-52.
Титрование нейтрализующих антител положительного контроля
NAb-положительные контроли испытывали перед анализами нейтрализации мышиными антисыворотками, для проверки их нейтрализующей способности и для определения подходящих диапазонов разведения. Все антитела положительного контроля были нейтрализующими и обнаруживали линейное соотношение в испытанном диапазоне разведения (Таблица 9).
Титрование нейтрализующих положительный контроль антител
Анализы нейтрализации HPV PsV
Сыворотки от мышей, иммунизированных продуцируемыми в растениях HPV-16 L1 и химерами L1/L2, испытывали на гомологичную нейтрализацию HPV-16 PsV и гетерологичную перекрестную защиту против HPV-18, 45 и 52 PsV (Фигуры 10-13). Все NAb положительного контроля успешно нейтрализовали HPV-16, 18, 45 и 52 PsV (Фигуры 10-13F), демонстрируя, что результаты анализа нейтрализации были валидными. Титр нейтрализации определяли как наивысшее разведение сыворотки, которое уменьшает активность SEAP на более чем 50% по сравнению с контрольной пробой, которая не была обработана сывороткой.
HPV-16
Результаты из анализов нейтрализации HPV-16 PsV показаны на Фигуре 11. Произведенные в растении сыворотки HPV-16 L1 (V4; Фиг.11D), имитировали положительный контроль H16.V5 (Фиг. 11F) и сильно нейтрализовали HPV-16 PsV, с последующим L1/L2(108-120) со сходной кривой нейтрализации (V1; Фиг. 11A). Как L1/L2(56-81), так и L1/L2(17-36), по-видимому, не вызывают продукцию HPV-16 NAb (V2-3; Фиг. 11B-C), показывая сходные кривые нейтрализации с отрицательным контролем (V5; Фиг. 11E).
HPV-18
Антисыворотки из всех этих вакцин не нейтрализовали HPV-18 PsV (Фиг. 12). Химеры L1/L2(56-81) и L1/L2(17-36) (V2-3, Фиг. 12B-C) представляли кривые нейтрализации, сходные с типоспецифической вакциной HPV-16 L1 и отрицательным контролем (V4-5, Фиг. 12D-E). L1/L2(108-120) имеет, по-видимому, некоторую нейтрализующую активность, с реципрокными разведениями сывороток <800, уменьшающими люминесцентные считывания ниже считываний предварительного извлечения крови и не-нейтрализованного контроля HPV-18 PsV (V1; Фиг. 12А). Однако, эти химеры не уменьшают уровни SEAP >50%.
HPV-45
Эти результаты из анализа нейтрализации HPV-45 PsV (Фиг. 13) позволяют предполагать, что ни одна из этих химерных вакцин L1/L2 (V1, V2 и V3; Фиг. 13А-СА) не давала значимых титров HPV-45 NAb, с нейтрализующими кривыми, сходными с HPV-16 L1, и отрицательным вакцинным контролем (V4-5; Фиг. 13D-E).
HPV-52
Эти анализы нейтрализации HPV-52 PsV (Фиг. 14) обеспечивают доказательство, что сыворотки L1/L2(56-81) не нейтрализовали HPV-52 (L2; Figure 14C), как видно для HPV-16 L1 и сывороток отрицательного контроля (V4-5; Фиг. 14D-E). Химерные вакцины L1/L2(108-120) и L1/L2(17-36), по-видимому, имеют нейтрализующую активность при низких реципрокных разведениях (50-200), уменьшающих уровни SEAP на >50% по сравнению с не-нейтрализованным контролем HPV-52 PsV (V1 и V3; Фиг. 14A и C).
Хотя этот анализ был успешным, как показано контролем H52.C1 NAb (Фиг. 14F), имелось гораздо большее варьирование между пробами в трех повторностях, и было трудно установить направления тенденции. Это может быть отнесено к частичной очистке и низкой концентрации HPV-52 PsV, которые могут иметь преувеличено малые различия между повторностями. Эти величины для контроля инфекции HPV-52 различаются между вакцинами при анализе V1, V2 и V4 (Фиг. 14A-B и D) на другом планшете от V3, V5 и H52.C1 (Фиг. 14C и E-F). Временные ограничения мешали повторению этого анализа.
Таблица 10 суммирует титры нейтрализации антител HPV-16, 18, 45 и 52 PSV, продуцируемыми в растении вакцинами. L1/L2(108-120) вызывала продукцию гомологичных HPV-16 NAb, и эта антисыворотка перекрестно нейтрализовала гетерологичный HPV-52 PsV, что позволяет предполагать, что эта вакцина имеет наибольший потенциал для защиты. Химеры L1/L2(17-36) вызывали продукцию низких уровней перекрестно нейтрализующих HPV-52 NAb, но гомологичные HPV-16 NAb не детектировались, что позволяет предполагать, что иммуногенность против HPV-16 L1 может быть нарушена. L1/L2(56-81) не вызывала продукцию NAb. Ни одна из HPV-вакцин не вызывала продукцию перекрестно нейтрализующих антител против филогенически родственных HPV-типов 18 и 45.
Суммирование титров нейтрализации для произведенных растением химерных кандидатных вакцин L1 и L1/L2
Беглый обзор иммуногенности вакцин
Структурная сборка (см. Пример 2 выше), гуморальные ответы анти-L1 и L2 и HPV-типа NAb, детектируемые в химерных антисыворотках L1/L2, суммированы в Таблице 11. Сборка в VLP ассоциирована, по-видимому, с более высокими титрами нейтрализации анти-L1 и HPV-16 PsV, что позволяет предполагать, что сборка ассоциирована с иммуногенностью L1.
Ответ антител для химерных вакцин L1 и L1/L2
** ELISA-детектирование анти-L1-антител. Y = да, N = нет.
*** Вестерн-блот-детектирование анти-L2-антител.
ОБСУЖДЕНИЕ
Произведенный растением HPV-16 L1 (Maclean et al., 2007; Fernandez-San Millian et al., 2008) и химеры на основе L1 (Paz De la Rosa et al., 2009) собираются в иммуногенные VLP и вызывают продуцирование нейтрализующих антител (NAb). В этом исследовании, анализировали иммуногенность трех произведенных из растений химер L1/L2, содержащих перекрестно нейтрализующих HPV-16 L2 ак 108-120, 56-81 или 17-36 эпитопов в области h4 HPV-16 L1. Мышей иммунизировали подкожно 10 мкг произведенного растением антигена в неполном адъюванте Фрейнда, и они получали 4-бустер-вакцинации в пределах 7 недель.
Гуморальные иммунные ответы
Гуморальные ответы анти-L1 и L2, индуцируемые произведенными растением химерами L1/L2, анализировали в этом исследовании для определения, проявляются ли пептиды L2, и ухудшают ли инсерции L2 иммуногенность L1.
Детектирование антител L1 и L2 в мышиных сыворотках выполняли прямым анализом ELISA (Фиг. 9) и вестерн-блоттингом (Фиг. 10), соответственно, с использованием либо экспрессируемых клетками насекомых HPV-16 L1, либо экспрессируемого E. coli His-меченного антигена L2. Произведенный растением HPV-16 L1 служил в качестве анти-L1-положительного контроля в этом исследовании и индуцировал наивысший анти-L1-ответ, с титрами 12800-51200 (Фиг. 9A). Эти результаты являются сходными с другими исследованиями иммуногенности у мышей, использующими частично очищенные произведенные из растений HPV-16 L1 VLP (титры = 20000-40960; Maclean et al., 2007; Fernandez-San Millan et al., 2008).
Вакцина отрицательного контроля (V5: NS-инфильтрованный экстракт растения) и предварительные вакцинные кровоизвлечения (V1-5 PB) не давали анти-L1-ответов (Фиг.9). Однако, антисыворотки из отрицательных контролей (V4-5, Фиг.10) действительно детектировали E.coli-экспрессированный His-меченный антиген HPV-16 L2, демонстрируя присутствие неспецифических антител в сыворотках, которые связывали His-меченный белок L2. Это является возможным вследствие частичной очистки антигенов, которая приводила к вакцинам, содержащим примесные белки растений. Несмотря на это, полосы отрицательного контроля были менее отчетливыми, чем полосы для химер L1/L2(108-120) и L1/L2(17-36), что позволяет предполагать, что эти химеры L1/L2 индуцировали анти-L2-ответ.
L1/L2(108-120) собирался в характерные ~30 нм cVLP и являлся наиболее успешной химерной вакциной (Таблица 11), индуцирующей наивысшие анти-L1-ответ с титрами ~12800 (Фиг. 9A) и анти-L2-ответ (Фиг. 10). Кроме того, только антисыворотки L1/L2(108-120) и HPV-16 L1 демонстрировали значимые анти-L1-ответы (p=0,01) по сравнению с предварительными кровоизвлечениями и NS-инфильтрованными экстрактами растений (отрицательным контролем). Экспрессируемая клетками насекомых химера L1/L2(108-120), анализированная Varsani et al. (2003a), давала более высокие титры анти-L1 (>204800) по сравнению с производимой растением химерой, однако, была использована в 10 раз более высокая доза (100 мкг против 10 мкг). Взятые вместе, эти данные являются сильным доказательством того, что пептид L2 ак 108-120 является эффективно обнаруживаемым на поверхности L1 cVLP.
Вакцина L1/L2(17-36) индуцировала относительно слабый анти-L1-ответ с титрами ~200 (Фиг. 9A), но индуцировала сильный анти-L2-ответ (Фиг. 10), что позволяет предполагать, что пептид L2 представлен на поверхности собранного L1. Подобным образом, слияние пептида L2 ак 20-38 с бактериальным тиоредоксином (Trx) индуцировало сильный анти-L2-ответ по сравнению с другими пептидами Trx-L2, состоящими из ак 56-120 (Rubio et al., 2009), и было показано, что RG-1 MAb, направленные против пептида HPV-16 L2 ак 17-36, детектируют L2 в вестерн-блоттинге и ELISA (Gambhira et al., 2007).
Капсомерная вакцина L1/L2(56-81) не индуцировала детектируемый анти-L1-ответ при самом низком разведении сывороток 1:50 (Фиг. 9А), и анти-L2-ответ был неубедительным (Фиг. 10), с ответами как анти-L1, так и L2, сходными с предварительными вакцинными кровоизвлечениями (V1-5 PB) и отрицательными контролями (Фиг. 9-10). В результате, производимый растением L1/L2(56-81) является, по-видимому, иммуногенным, в отличие от экспрессируемых E. coli слитых пептидов Trx-L2 (Rubio et al., 2009) и экспрессируемых клетками насекомых химер L1/L2, содержащих сходные L2-эпитопы в петле DE BPV-1 L1 VLP (Slupetzkey et al., 2007; Schellenbacher et al., 2009).
Анализы нейтрализации псевдовирионов
Химеры L1/L2, содержащие эпитопы L2 ак 108-120, 56-81 и 17-36, испытывали на их способность вызывать продукцию антител, которые нейтрализуют PsV HPV-16, 18, 45 и 52. Было показано, что все из L2-эпитопов, анализируемых в этом исследовании, вызывают продукцию антител, которые нейтрализуют гомологичный HPV-16 и перекрестно нейтрализуют HPV-52 (Kawana et al., 2003; Slupetzky et al., 2007; Kondo et al., 2007, 2008; Gambhira et al., 2007; Schellenbacher et al., 2009). Дополнительно, L2 ак 56-81 перекрестно нейтрализует HPV-18, и L2 ак 17-36 перекрестно нейтрализует оба из HPV-18 и 45 (Gambhira et al., 2007; Kondo et al., 2007, 2008; Alphs et al., 2008; Schellenbacher et al., 2009; Rubio et al., 2009).
HPV-16 был выбран, так как HPV-16 L1 является скелетом химерных кандидатных вакцин, и он вызывает большинство типов рака шейки матки, с последующими филогенически родственными HPV-18 и HPV-45. HPV-16, 18 и 45 ассоциированы с 48%, 23% и 10% рака шейки матки в Африке и 61%, 10% и 6% рака шейки матки во всем мире (de Sanjose et al., 2010). Хотя HPV-52 занимает только 5 место в Африке (3%) и 6 место во всем мире (6%), было показано, что HPV-52 является преобладающим в повреждениях шейки матки низкой и высокой степени у женщин Южной Африки, и, следовательно, перекрестная нейтрализация HPV-52 имеет локальную значимость (Allan et al., 2008).
Гомологичная нейтрализация HPV-16
Производимые растениями L1/L2(56-81) и L1/L2(17-36) не дают детектируемые титры HPV-16 NAb, давая результаты, сходные с предварительными кровоизвлечениями и NS-инфильтрованным экстрактом растения (Фиг. 11). Предыдущее исследование показало, что химеры L1/L2, содержащие пептиды HPV-16 L2 ак 17-36, 18-38, 56-75 или 69-81, локализованы в поверхностных областях BPV-1, или HPV-16 L1 вызывала продукцию HPV-16 NAb (Slupeizkey et al., 2007; Kondo et al., 2008; Schellenbacher et al., 2009); однако, сайты инсертирования отличались от сайтов инсертирования в этом исследовании, и эти химеры собирались в cVLP. Кроме того, было обнаружено, что MAb, направленные против HPV-16 L2 ак 73-84, не были нейтрализующими и не нейтрализовали HPV-16 PsV (Gambhira et al., 2007), подобно результатам, полученным для химеры L1/L2(56-81) в этом исследовании.
В этом исследовании, только L1/L2(108-120) и HPV-16 L1 нейтрализовали HPV-16 PsV сходным образом с H16.V5 (положительным контролем нейтрализации), давая титры 50-500 и 500-5000, соответственно (Таблица 10). Эти результаты согласуются с другими исследованиями иммуногенности в мышах с использованием производимых растением антигенов HPV L1. Сходная или более высокая доза производимого растением HPV-16 L1 VLP давала титры HPV-16 NAb 400-1600 (Maclean et al., 2007; Fernandez-San Millan et al., 2008), и производимые растением L1/E6/E7 cVLP давали титры HPV-16 NAb ~400 с использованием анализа гемагглютинации (Paz De la Rosa et al., 2009). Кроме того, было показано, что иммунизация людей пептидом HPV-16 L2 ак 108-120 давала титры HPV-16 NAb 100-1000 (Kawana et al., 2003), и мышиные антисыворотки из химер L1/L2, содержащие эпитопы L2 ак 108-120 (Slupetzkey et al., 2007) или L2 ак 75-112 и 115-154 (Schellenbacher et al., 2009), нейтрализовали гомологичные HPV-16 PsV с титрами <1000. Таким образом, титры, полученные в этом исследовании, находятся в диапазоне, сообщенном для химерных вакцин L1/L2, продуцируемых в других системах экспрессии.
Гетерологичная нейтрализация HPV-18, 45 и 52
Нейтрализующую активность против филогенически-родственных HPV-18 и 45 PsV не детектировали для всех HPV-вакцин (Фиг.12-13). Подобным образом, антисыворотки L1/L2(56-81) не нейтрализовали HPV-52 PsV (Фиг.14). Хотя L1/L2(108-120) и L1/L2(17-36), по-видимому, давала низкие титры HPV-52 NAb (50-200), имелась большое варьирование в этом анализе, возможно, вследствие очистки частично собранных PsV, и этот анализ должен быть повторен для подтверждения результатов.
Предыдущее исследование продемонстрировало, что химеры L1/L2, содержащие пептид L2 ак 56-81, перекрестно нейтрализуют как HPV-18, так и 52 (Kondo et al., 2008). Однако, эти химеры собирались в cVLP не так, как L1/L2(56-81), что позволяет предположить, что сборка VLP является важной для продукции высоких титров NAb. Кроме того, химера L1/L2, содержащая L2 ак 17-36 или 18-36 (Kondo et al., 2008; Schellenbacher et al., 2009), вызывает продукцию NAb против HPV-18, 45 и 52. Однако, L2-пептиды были инсертированы в петлю DE (Schellenbacher et al., 2009), и эта доза не было установлена для исследования, проводимого Kondo et al. (2008). В этом исследовании, низкие титры HPV-52 NAb, вызываемые продуцируемым растением L1/L2(17-36) у мышей, были сравнимы с титрами, вызываемыми сходной химерой L1/L2, экспрессируемой в клетках насекомых (Schellenbacher et aL, 2009), что позволяет предполагать, что эта система экспрессии не влияет на способность этого антигена перекрестно нейтрализовать HPV-52.
Производимая растением химера L1/L2(108-120), по-видимому, вызывает продукцию HPV-52 NAb и может иметь потенциал в качестве перекрестно-защитной вакцины HPV, подтверждаемый доказательством того, что, как было показано, пептид L2 ак 108-120 дает титры HPV-52 NAb 50-1000, соответственно, у людей (Kawana et al., 2003). Нет доказательства того, что HPV-16 L2 ак 108-120 перекрестно-нейтрализует HPV-45, однако химеры L1/L2, содержащие сходные эпитопы L2 ак 96-115 или 75-112, перекрестно-нейтрализуют филогенически-родственный HPV-18 (Kondo et al., 2008; Schellenbacher et al., 2009). Однако титры NAb, сообщаемые в этих исследованиях, были низкими (<100) и, возможно, что продуцируемые HPV-18 NAb были слишком низкими для детектирования в антисыворотках L1/L2(108-120).
ССЫЛКИ
Aires, K.A. et al., (2006) Appl. Environ. Microbiol. 72, 745-52.
Allan, B. et al., (2008) J. Clin. Microbiol. 46, 740-2.
Alphs, H.H. et al., (2008) Proc. Natl. Acad. Sci. U.S.A. 105, 5850-5.
Baek, J.O. et al., (2011) Protein Expr. Purif. 75, 211-7.
Bazan, S.B. et al., (2009) Arch. Virol. 154, 1609-17.
Biemelt, S. et al., (2003) J. Virol. 77, 9211-20.
Bishop, B. et al., (2007) Virol. J. 4, 3.
Breitburd, F. et al., (1995) J. Virol. 69, 3959-63.
Brown, D.R. et al., (2009) J. Infect.Dis. 199, 926-35.
Buck, C.B. et al., (2005) Methods Mol Med. 119, 445-62.
Buck, C.B. et al., (2008) J. Virol. 82, 5190-7.
Carter, J.J. et al., (1991) Virology 182, 513-21.
Carter, J.J. et al., (2003) J. Virol. 77, 11625-32.
Chen, X.S. et al., (2000) Mol. Cell. 5, 557-67.
Christensen, N.D. et al., (1996) Virology 223, 174-84.
Christensen, N.D. et al., (2001) Virology 291, 324-34.
Cook, J.C. et al., (1999) Protein Expr. Purif. 17, 477-84.
de Carvalho, F. et al., (1992) EMBO J. 11, 2595-602.
de Sanjosé, S. et al., (2010) Lancet Oncol. 11, 1048-56.
Embers, M.E. et al., (2002) J. Virol. 76, 9798-805.
Ferlay, J. et al., (2010) Int. J. Cancer 127, 2893-917.
Fernández-San Millán, A. et al., (2008) Plant Biotechnol. J. 6, 427-41.
Fischer, R. et al., (2004) Curr. Opin. Plant Biol. 7, 152-8.
Fleury, M.J. et al., (2009) Protein Sci. 18, 1425-38.
Fligge, C. et al., (2001) Virology 283, 353-7.
FUTURE II Study Group (2007) J. Infect. Dis. 196, 1438-46.
Gambhira, R. et al., (2007) J. Virol. 81, 13927-31.
Hagensee, M.E. et al., (1993) J. Virol. 67, 315-22.
Heidebrecht, F. et al., (2009) J. Immunol. Methods 345, 40-8.
Johnson, K.M. et al., (2009) J. Virol. 83, 2067-74.
Joura, E.A. et al., (2007) Lancet 369, 1693-702.
Joyce, J.G. et al., (1999) J. Biol. Chem. 274, 5810-22.
Kawana, K. et al., (1999) J. Virol. 73, 6188-90.
Kawana, K. et al., (2003) Vaccine 21, 4256-60.
Kim, H.J. et al., (2009) Arch. Pharm. Res. 32, 1759-66.
Kim, H.J. et al., (2010) Protein Expr Purif. 70, 68-74.
Kirnbauer, R. et al., (1992) Proc. Natl. Acad. Sci. U.S.A. 89, 12180-4.
Koh, Y.T. et al., (2006) J. Transl. Med. 4, 42.
Kohl, T.O. et al., (2007) BMC Biotechnol. 7, 56.
Kondo, K. et al., (2007) Virology 358, 266-72.
Kondo, K. et al., (2008) J. Med. Virol. 80, 841-6.
Lenzi, P. et al., (2008) Transgenic Res. 17, 1091-102.
Li, M. et al., (1997) J. Virol. 71, 2988-95.
Li, M. et al., (1998) J. Virol. 72, 2160-7.
Mach, H. et al., (2006) J. Pharm. Sci. 95, 2195-206.
Maclean, J. et al., (2007) J. Gen. Virol. 88, 1460-9.
McCarthy, M.P. et al., (1998) J. Virol. 72, 32-41.
McLean, C.S. et al., (1990) J. Clin. Pathol. 43, 488-92.
Meins, F. Jr. (2000) Plant Mol. Biol. 43, 261-73.
Mucoz, N. et al., (2003) N. Engl. J. Med. 348, 518-27.
Mucoz, N. et al., (2004) Int. J. Cancer 111, 278-285.
Murata, Y. et al., (2009) Virol J. 6, 81.
Obembe, O.O. et al., (2011) Biotechnol. Adv. 29, 210-22.
Parkin, D.M. and Bray, F. (2006) Vaccine 24, S3/11-25.
Paz De la Rosa, G. et al., (2009) Virol. J. 6, 2.
Regnard, G.L. et al., (2010) Plant Biotechnol. J. 8, 38-46.
Robinson, C. and Ellis, R.J. (1984) Eur J Biochem. 142, 337-42.
Rubio, I. et al., (2009) Vaccine 27, 1949-56.
Rybicki, E.P. (2009) Drug Discov. Today 14, 16-24.
Ryding, J. et al., (2007) J. Gen. Virol. 88, 792-802.
Sambrook, J. et al., (1989) Cold Spring Harbor Laboratory Press, New York.
Sapp, M. et al., (1998) J. Virol. 72, 6186-9.
Sasagawa, T. et al., (1995) Virology 206, 126-35.
Schellenbacher, C. et al., (2009) J. Virol. 83, 10085-95.
Schiller, J.T. et al., (2008) Vaccine 26, K53-61.
Shen, W.J. and Forde, B.G. (1989) Nucleic Acids Res. 17, 8385.
Sijen, T. and Kooter, J.M. (2000) Bioessays 22, 520-31.
Slupetzky, K. et al., (2007) Vaccine 25, 2001-10.
Studentsov, Y.Y. et al., (2002) J. Clin. Microbiol. 40, 1755-60.
Sun, X.Y. et al., (1995) Virology 213, 321-7.
Suzich, J.A. et al., (1995) Proc. Natl. Acad. Sci. U.S.A. 92, 11553-7.
Takeda, A. et al., (2002) FEBS Lett. 532, 75-9.
Thönes, N. et al., (2008) J. Virol. 82, 5472-85.
Van Blokland, R. et al., (1994) Plant J. 6, 861-877.
Varsani, A. et al., (2003a) J. Virol. 77, 8386-93.
Varsani, A. et al., (2003b) Arch. Virol. 148, 1771-86.
Varsani, A. et al., (2006a) Virus Res. 120, 91-6.
Varsani, A. et al., (2006b) Virus Res. 122, 154-63.
Voinnet, O. (2001) Trends Genet. 17, 449-59.
Voinnet, O. et al., (2003) Plant J. 33, 949-56.
Wang, X. et al., (2003) Virology 311, 213-21.
Wheeler, C.M. et al., (2009) J. Infect. Dis. 199, 936-44.
White, W.I., et al., (1998) J. Virol. 72, 959-64.
White, W.I. et al., (1999) J. Virol. 73, 4882-9.
Zhang, W. et al., (1998) Virology 243, 423-31.
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИННАЯ КОМПОЗИЦИЯ, ПРИГОДНАЯ ПРИ ИНФЕКЦИЯХ HPV И ВИРУСОМ ГЕПАТИТА В, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2009 |
|
RU2509570C2 |
| ВАКЦИННЫЙ АНТИГЕН, СПОСОБНЫЙ ИНДУЦИРОВАТЬ ПЕРЕКРЕСТНО РЕАГИРУЮЩЕЕ И НЕЙТРАЛИЗУЮЩЕЕ АНТИТЕЛО ПРОТИВ ПАПИЛЛОМАВИРУСА ЧЕЛОВЕКА С ВЫСОКИМ РИСКОМ | 2008 |
|
RU2471807C2 |
| МОЛЕКУЛА НУКЛЕИНОВОЙ КИСЛОТЫ, КОДИРУЮЩАЯ HPV31 L1, ЭКСПРЕССИРУЮЩИЙ ВЕКТОР, КЛЕТКА-ХОЗЯИН, ВИРУСОПОДОБНАЯ ЧАСТИЦА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ, ВАКЦИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБЫ С ИХ ИСПОЛЬЗОВАНИЕМ | 2004 |
|
RU2356943C2 |
| ОПТИМИЗИРОВАННАЯ ЭКСПРЕССИЯ HPV 58 L1 В ДРОЖЖАХ | 2004 |
|
RU2370538C2 |
| ПОЛИНУКЛЕОТИДНАЯ ВАКЦИНА ДЛЯ ВИРУСА ПАПИЛЛОМЫ | 1995 |
|
RU2173170C2 |
| ОПТИМИЗИРОВАННАЯ ЭКСПРЕССИЯ HPV 52 L1 В ДРОЖЖАХ | 2005 |
|
RU2373219C2 |
| Способ получения рекомбинантной вакцины для профилактики папилломавирусной инфекции человека, рекомбинантная вакцина | 2018 |
|
RU2681174C1 |
| ПАПИЛЛОМАВИРУСНЫЕ ВАКЦИНЫ | 1995 |
|
RU2206608C2 |
| РЕКОМБИНАНТНАЯ ВАКЦИНА ДЛЯ ПРОФИЛАКТИКИ ПАПИЛЛОМАВИРУСНОЙ ИНФЕКЦИИ ЧЕЛОВЕКА И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2014 |
|
RU2546243C1 |
| РЕКОМБИНАНТНЫЙ ШТАММ ДРОЖЖЕЙ Hansenula polymorpha - ПРОДУЦЕНТ ГЛАВНОГО КАПСИДНОГО БЕЛКА L1 ВИРУСА ПАПИЛЛОМЫ ЧЕЛОВЕКА ТИПА 56 | 2014 |
|
RU2546240C1 |





















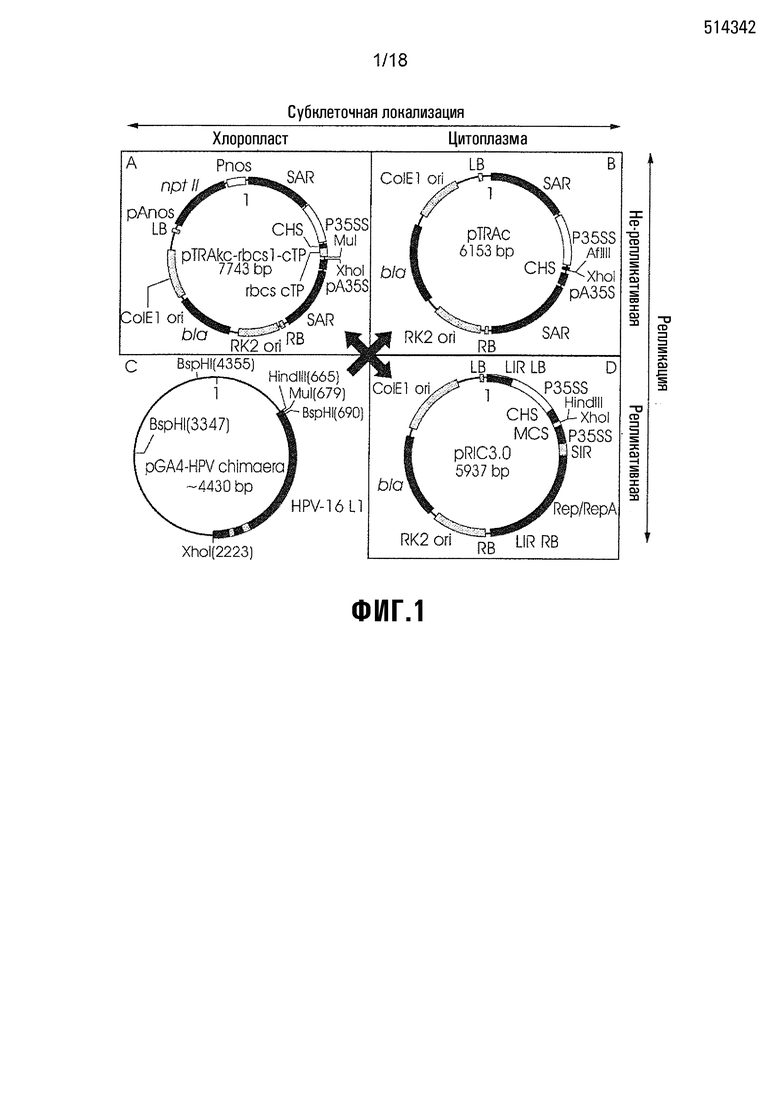
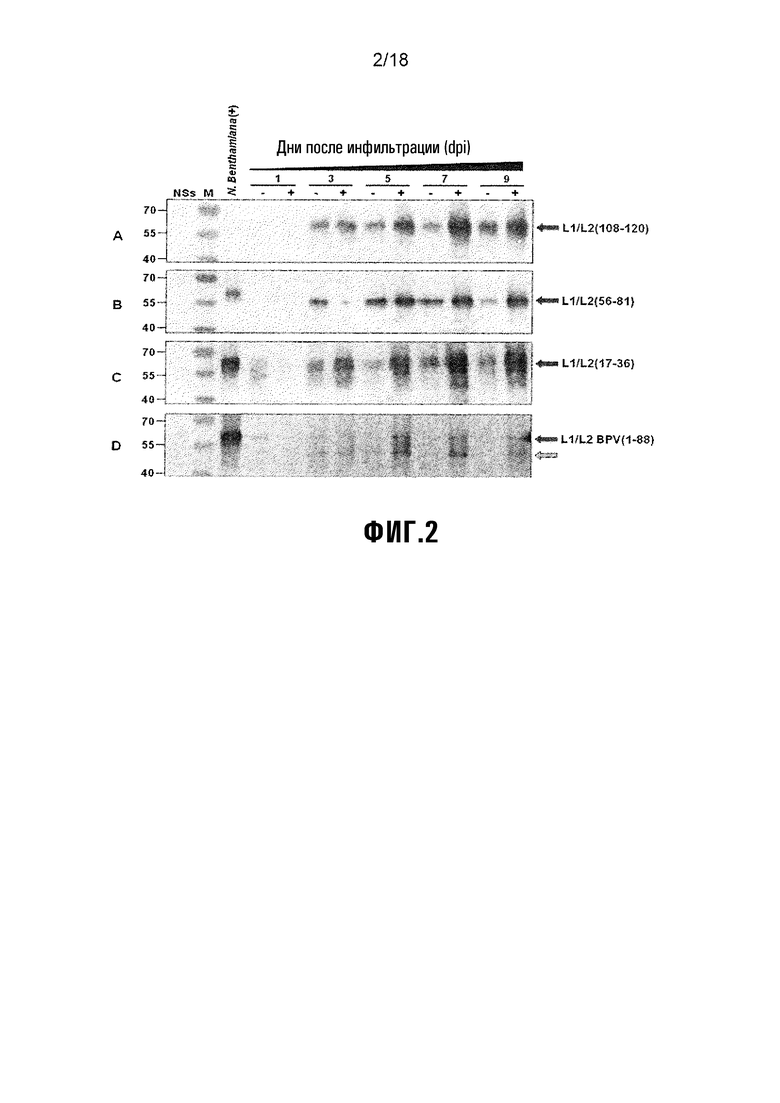
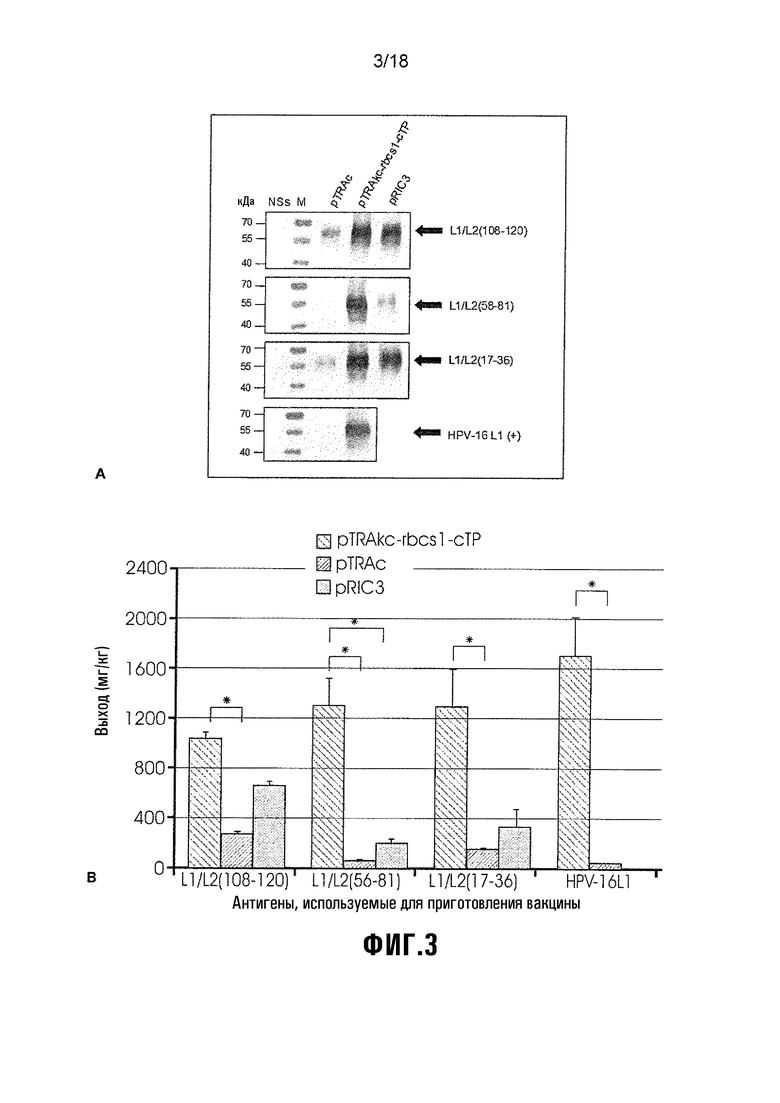
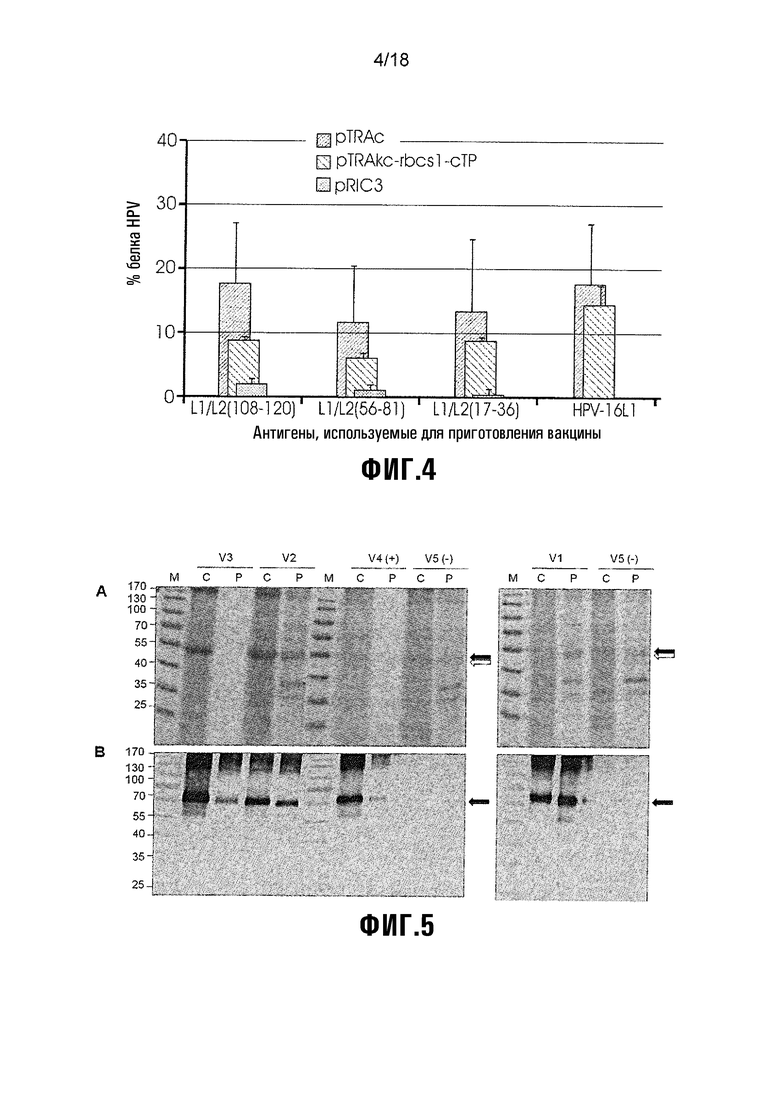
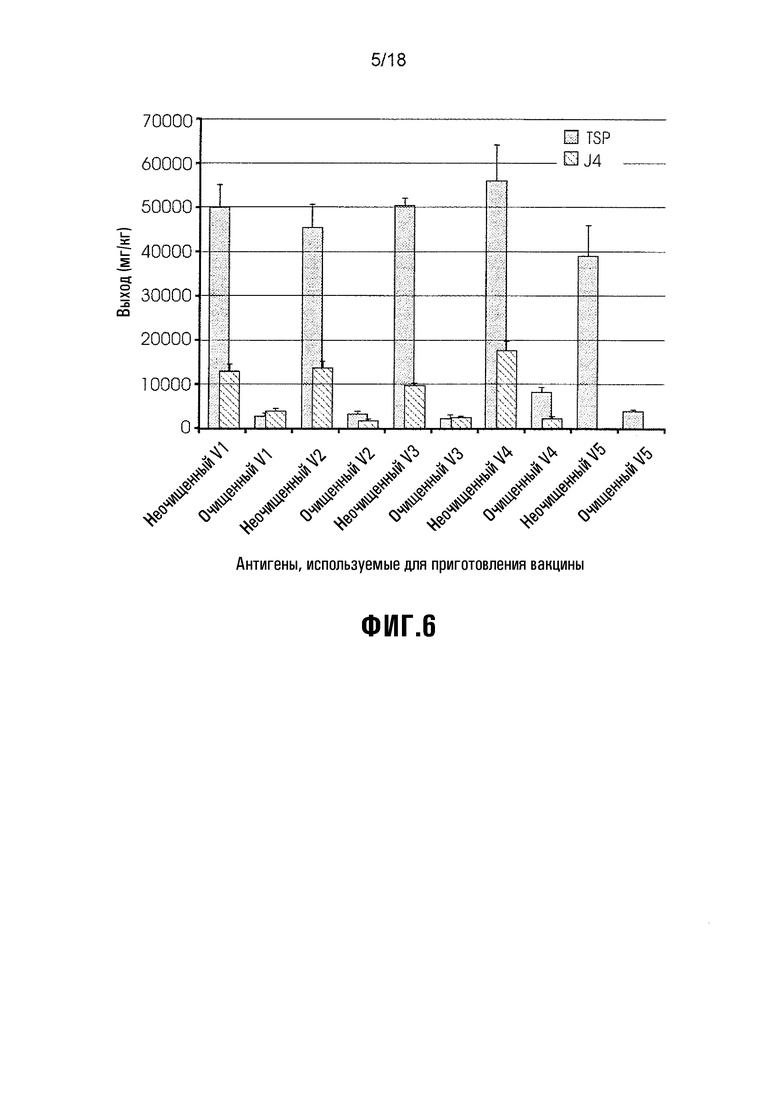
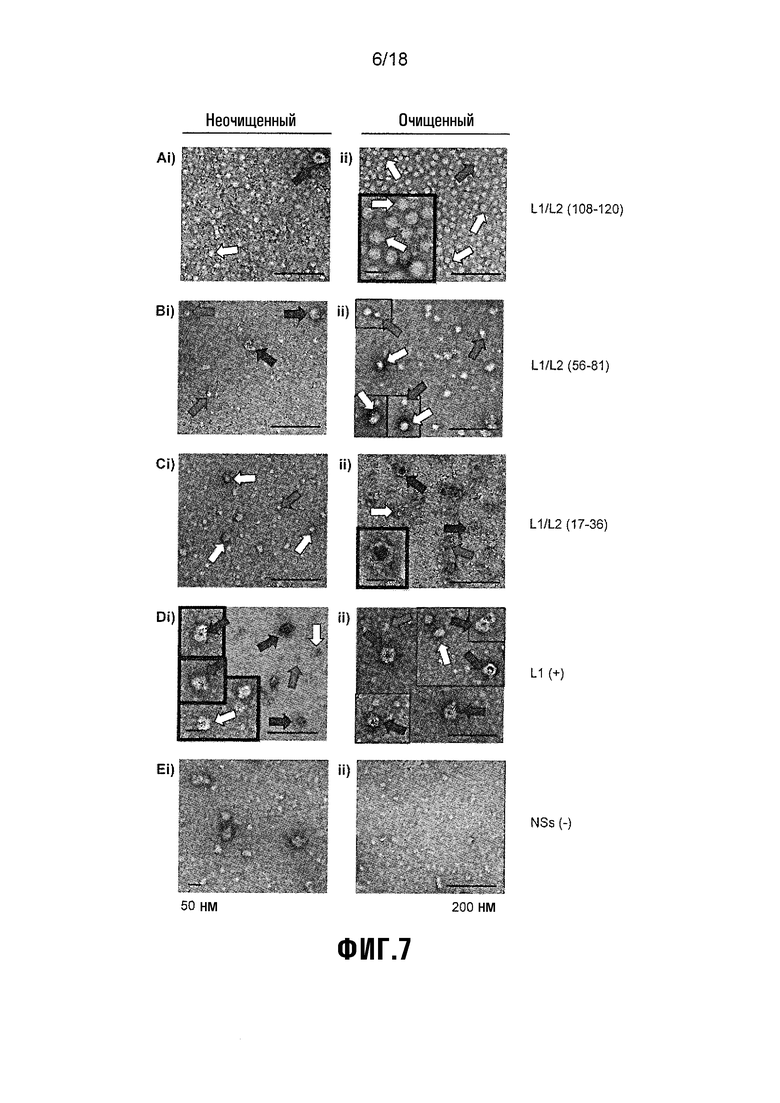

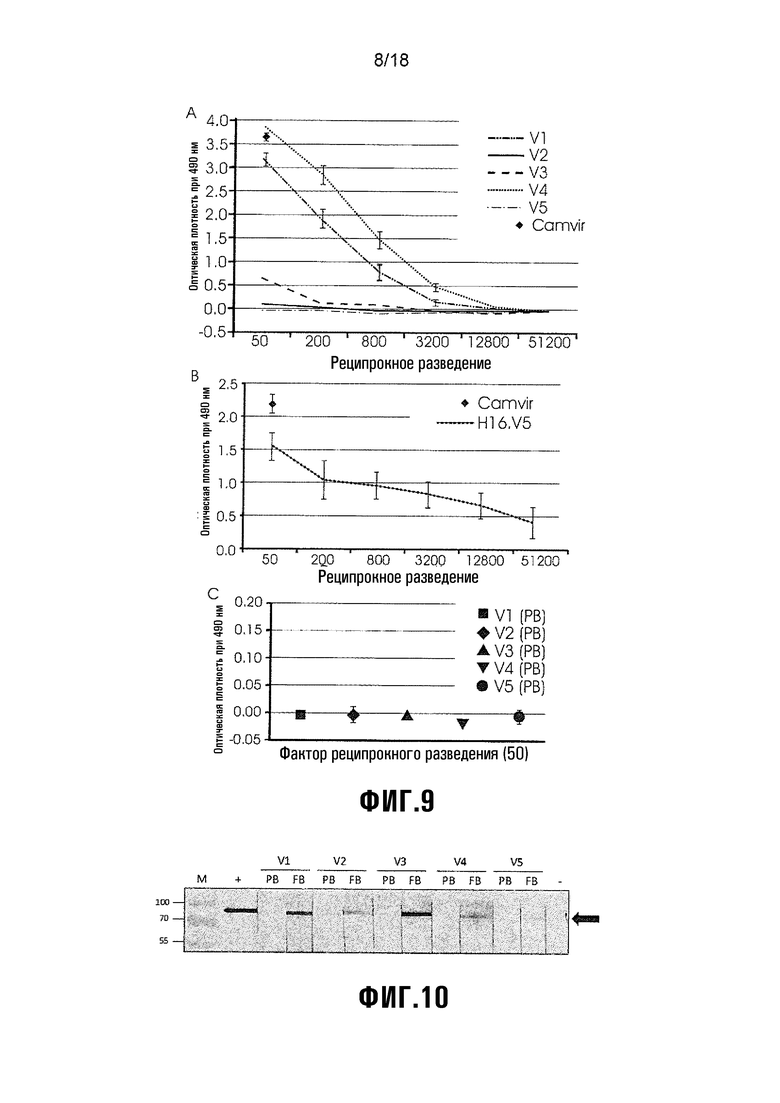
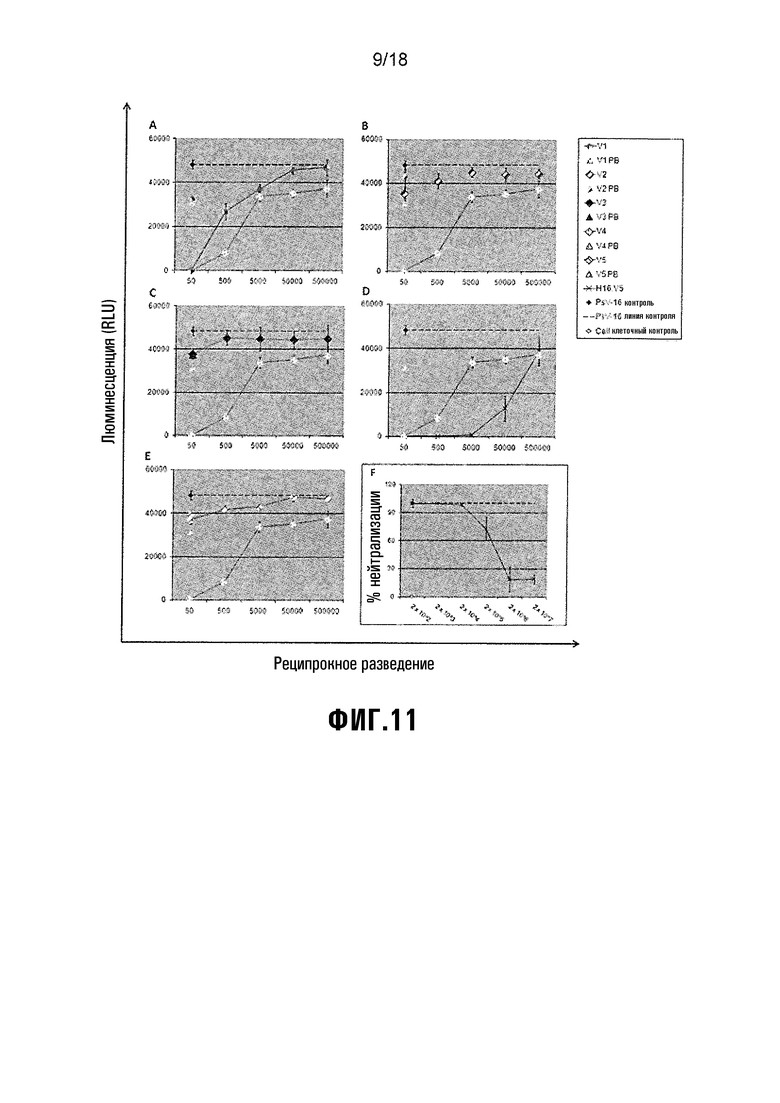
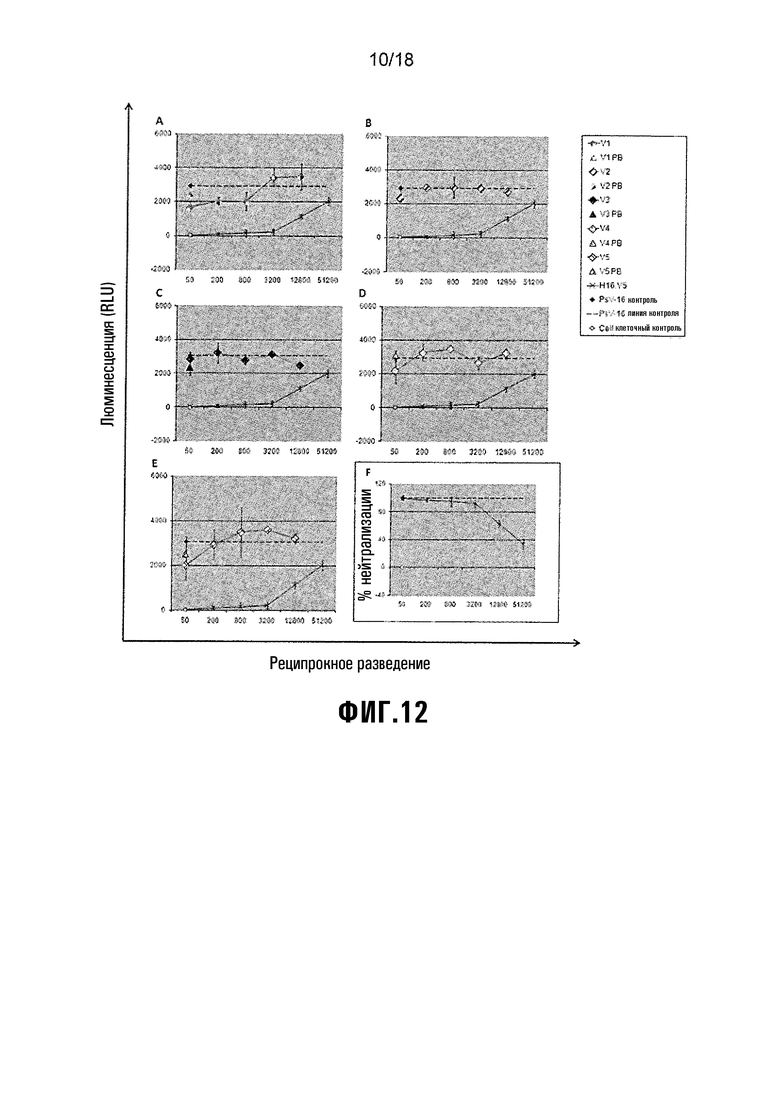
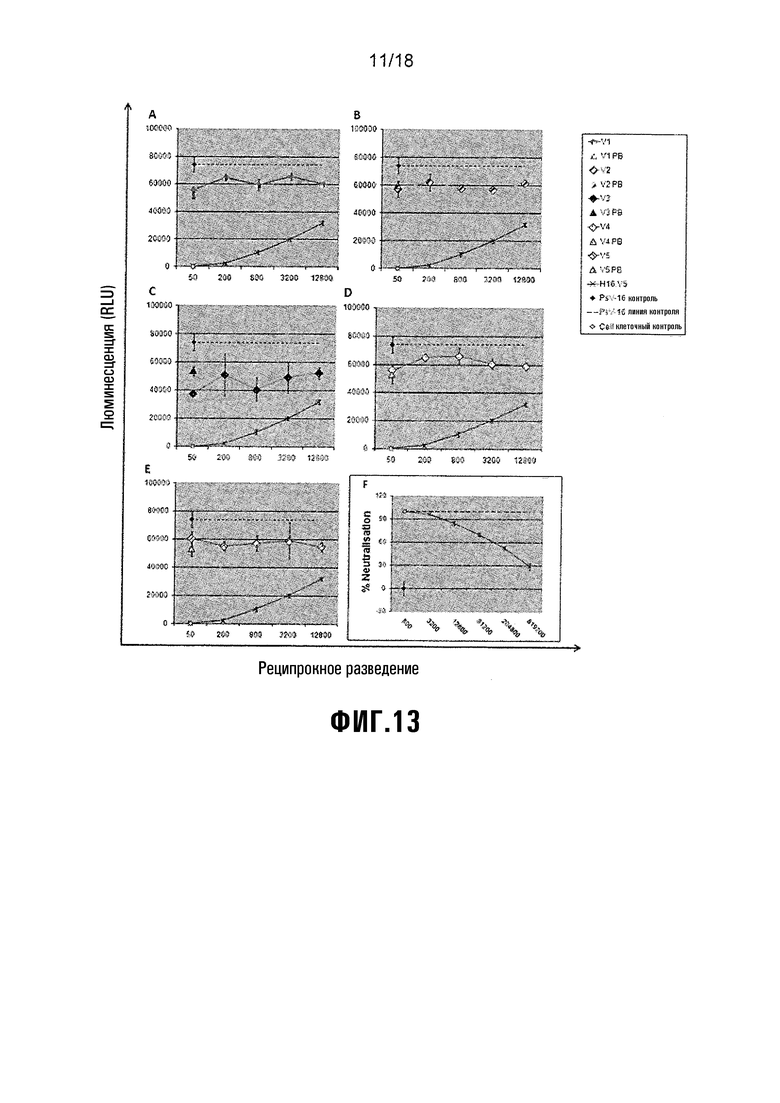
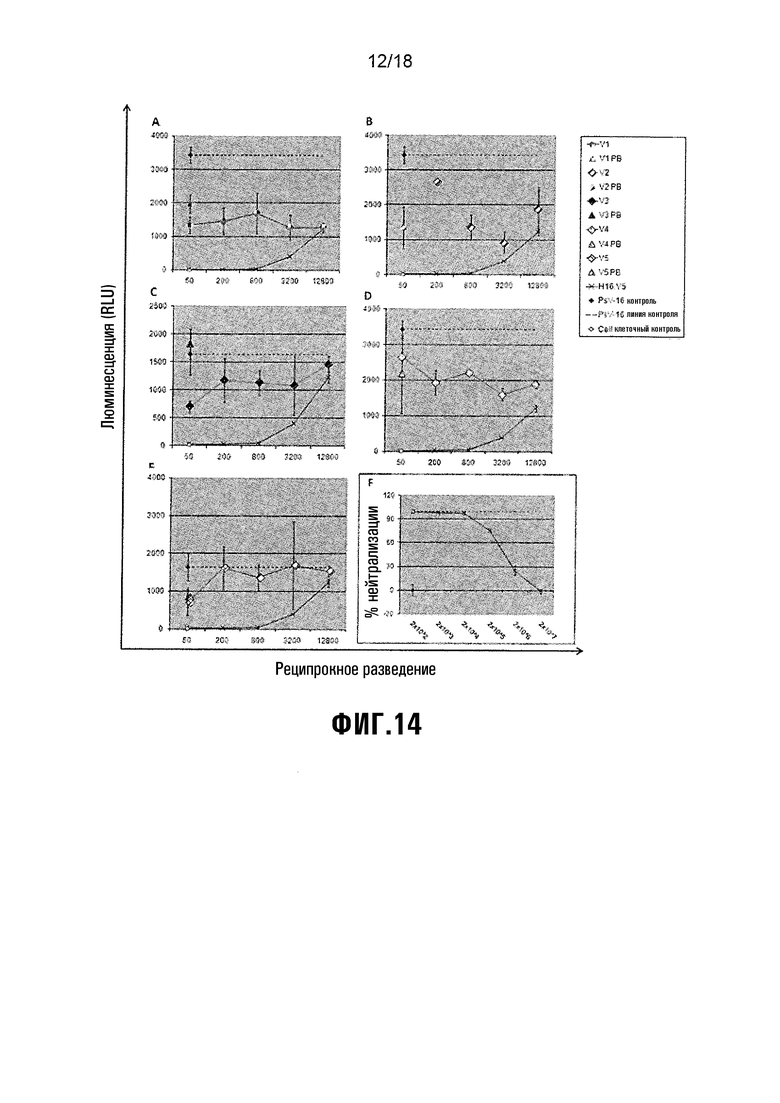






Группа изобретений относится к биотехнологии и медицине. Предложены химерная вирусоподобная частица (VLP) папилломавируса человека (HPV), способ ее получения и извлечения, способы профилактики или лечения инфекции HPV или рака шейки матк, и индукции иммунного ответа у пациента, включающие введение предложенной HPV VLP, а также применение предложенной HPV VLP в указанных способах и в получении лекарственных средств для осуществления указанных способов. Предложенная химерная HPV VLP имеет диаметр около 30 нм и содержит химерный полипептид HPV 16 L1/L2, который состоит из полипептида HPV 16 L1, в который инсертирован от аминокислотного остатка 414 пептид HPV 16 L2, содержащий от 13 до 26 аминокислот, причем аминокислоты инсертированного пептида HPV 16 L2 заменяют соответствующие аминокислоты полипептида HPV 16 L1. Также предложен способ получения указанной HPV VLP в растении, при котором происходит успешная сборка малых химерных HPV VLP, обладающих диаметром 30 нм. Предложенная группа изобретений может быть использована в медицине для профилактики или лечения инфекции HPV или в противоопухолевой терапии рака шейки матки. 8 н. и 20 з.п. ф-лы, 32 ил., 11 табл., 3 пр.
1. Химерная вирусоподобная частица (VLP) папилломавируса человека (HPV), имеющая диаметр приблизительно 30 нм, для индукции иммунного ответа, причем химерную HPV VLP получают согласно способу, включающему стадии:
(i) получения химерной оптимизированной кодонами человека нуклеотидной последовательности, кодирующей химерный полипептид HPV 16 L1/L2, причем химерный полипептид HPV 16 L1/L2 содержит полипептид HPV 16 L1, имеющий пептид HPV L2 из от приблизительно 13 аминокислот до приблизительно 26 аминокислот, инсертированный от остатка 414 полипептида HPV 16 L1/L2, где аминокислоты инсертированного пептида HPV L2 заменяют соответствующие аминокислоты полипептида HPV 16 L1;
(ii) клонирования химерной оптимизированной кодонами человека нуклеотидной последовательности, полученной на стадии (i), в экспрессирующий вектор, адаптированный для экспрессии полипептида в растении;
(iii) трансформации или инфильтрации клетки растения экспрессирующим вектором со стадии (ii);
(iv) экспрессии химерного полипептида HPV 16 L1/L2 в клетке растения со стадии (iii) таким образом, что экспрессируемый химерный полипептид HPV 16 L1/L2 собирается в химерную HPV VLP, имеющую диаметр приблизительно 30 нм; и
(v) извлечения химерной HPV VLP из клетки растения с использованием буфера для экстракции с высокой концентрацией NaCl, составляющей по меньшей мере 1М.
2. Химерная HPV VLP по п. 1, где инсертированный пептид HPV L2 выбран из группы, состоящей из:
(i) 13-аминокислотного пептида SEQ ID NO: 3, кодируемого оптимизированной кодонами человека нуклеотидной последовательностью SEQ ID NO: 7;
(ii) 20-аминокислотного пептида SEQ ID NO: 5, кодируемого оптимизированной кодонами человека нуклеотидной последовательностью SEQ ID NO: 9: и
(iii) 26-аминокислотного пептида SEQ ID NO: 4, кодируемого оптимизированной кодонами человека нуклеотидной последовательностью SEQ ID NO: 8.
3. Химерная HPV VLP по п. 1, где оптимизированная кодонами человека нуклеотидная последовательность, кодирующая химерный полипептид HPV 16 L1/L2, модифицирована таким образом, что она лишена сигнала ядерной локализации.
4. Химерная HPV VLP по п. 1, где химерный полипептид HPV 16 L1/L2 содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 22, SEQ ID NO: 23 и SEQ ID NO: 24.
5. Химерная HPV VLP по п. 4, где химерный полипептид HPV 16 L1/L2 кодируется оптимизированной кодонами человека нуклеотидной последовательностью, выбранной из группы, состоящей из SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28.
6. Химерная HPV VLP по п. 1, где химерный полипептид HPV 16 L1/L2 экспрессируется в растении и извлекается из растения.
7. Химерная HPV VLP по п. 6, где химерный полипептид HPV 16 L1/L2 нацелен на хлоропласт растения.
8. Способ получения и извлечения химерной вирусоподобной частицы (VLP) папилломавируса человека (HPV), имеющей диаметр приблизительно 30 нм, включающий стадии:
(i) получения химерной оптимизированной кодонами человека нуклеотидной последовательности, кодирующей химерный полипептид HPV 16 L1/L2, причем химерный полипептид HPV 16 L1/L2 содержит полипептид HPV 16 L1, имеющий пептид из HPV L2 из приблизительно 13 аминокислот - приблизительно 26 аминокислот, инсертированный от остатка 414 химерного полипептида HPV 16 L1/L2, где аминокислоты инсертированного пептида HPV L2 заменяют соответствующие аминокислоты полипептида HPV 16 L1;
(ii) клонирования химерной оптимизированной кодонами человека нуклеотидной последовательности, полученной на стадии (i), в экспрессирующий вектор, адаптированный для экспрессии полипептида в растении;
(iii) трансформации или инфильтрации клетки растения экспрессирующим вектором со стадии (ii);
(iv) экспрессии химерного полипептида HPV 16 L1/L2 в клетке растения со стадии (iii) таким образом, что экспрессируемый химерный полипептид HPV 16 L1/L2 собирается в химерную HPV VLP, имеющую диаметр 30 нм; и
(v) извлечения химерной HPV VLP из клетки растения с использованием буфера для экстракции с высокой концентрацией NaCl, составляющей по меньшей мере 1М.
9. Способ по п. 8, где экспрессирующий вектор, полученный на стадии (ii), дополнительно включает нацеливающие последовательности, кодирующие полипептид, для направления экспрессируемого химерного полипептида HPV 16 L1/L2 из цитоплазмы в хлоропласт клетки растения.
10. Способ по п. 8, где экспрессирующий вектор включает промоторы и другие регуляторы, функционально связанные с кодирующей последовательностью экспрессирующего вектора.
11. Способ по п. 8, дополнительно включающий стадию совместной инфильтрации или совместной трансформации клетки растения супрессорным белком, адаптированным для ингибирования сайленсинга посттранскрипционного гена в растении.
12. Способ по п. 11, где супрессорным белком является белок NS вируса пятнистого увядания (бронзовости) томата или р19 вируса кустистой карликовости томата.
13. Способ по п. 8, где инсертированный пептид HPV L2 выбран из группы, состоящей из:
(i) 13-аминокислотного пептида SEQ ID NO: 3, кодируемого оптимизированной кодонами человека нуклеотидной последовательностью SEQ ID NO: 7;
(ii) 20-аминокислотного пептида SEQ ID NO: 5, кодируемого оптимизированной кодонами человека нуклеотидной последовательностью SEQ ID NO: 9; и
(iii) 26-аминокислотного пептида SEQ ID NO: 4, кодируемого оптимизированной кодонами человека нуклеотидной последовательностью SEQ ID NO: 8.
14. Способ профилактики или лечения инфекции HPV или рака шейки матки у пациента, включающий введение пациенту терапевтически эффективного количества химерной HPV VLP по любому из пп. 1-7.
15. Способ индукции иммунного ответа у пациента, включающий введение пациенту терапевтически эффективного количества химерной HPV VLP по любому из пп. 1-7.
16. Способ по п. 15, где иммунный ответ является ответом нейтрализирующих антител или ответом цитотоксических Т-лимфоцитов.
17. Способ по п. 15, где иммунный ответ является перекрестно-защитным иммунным ответом на множественные типы HPV, присутствующие у пациента.
18. Способ по любому из пп. 14-17, где пациентом является человек.
19. Применение химерной HPV VLP по любому из пп. 1-7 в способе профилактики или лечения инфекции HPV или рака шейки матки у пациента, причем способ включает введение терапевтически эффективного количества химерной HPV VLP пациенту.
20. Применение химерной HPV VLG по любому из пп. 1-7 в способе индукции иммунного ответа против химерной HPV VLP у пациента, причем способ включает введение терапевтически эффективного количества химерной HPV VLP пациенту.
21. Применение по п. 20, где иммунным ответом является ответ нейтрализующих антител или ответ цитотоксических Т-лимфоцитов.
22. Применение по п. 20, где иммунный ответ является перекрестно-защитным иммунным ответом на множественные типы HPV, присутствующие у пациента.
23. Применение по любому из пп. 19-22, где пациентом является человек.
24. Применение химерного HPV VLP по любому из пп. 1-7 в получении лекарственного средства для применения в способе профилактики или лечения инфекции HPV или рака шейки матки у пациента, причем способ включает введение терапевтически эффективного количества лекарственного средства пациенту.
25. Применение химерного HPV VLP по любому из пп. 1-7 в получении лекарственного средства для применения в способе индукции иммунного ответа у пациента, причем способ включает введение терапевтически эффективного количества лекарственного средства пациенту.
26. Применение по п. 25, где иммунный ответ является ответом нейтрализующих антител или ответом цитотоксических Т-лимфоцитов.
27. Применение по п. 25, где иммунный ответ является перекрестно-защитным иммунным ответом на множественные типы HPV, присутствующие у пациента.
28. Применение по любому из пп. 24-27, где пациентом является человек.
| VARSANI A | |||
| et al | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| JOURNAL OF VIROLOGY | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| Спускная труба при плотине | 0 |
|
SU77A1 |
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
| P | |||
| Патрон для образования газов, преимущественно в огнетушителях | 1926 |
|
SU8386A1 |
| КОРПУС ОСКОЛОЧНОЙ ГРАНАТЫ | 2012 |
|
RU2486450C1 |
| SCHELLENBACHER C | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| JOURNAL OF VIROLOGY | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| Пуговица | 0 |
|
SU83A1 |
| Способ изготовления электрических сопротивлений посредством осаждения слоя проводника на поверхности изолятора | 1921 |
|
SU19A1 |
| P | |||
| Водоотводчик | 1928 |
|
SU10085A1 |
| WO 2010118424 A2, 14.10.2010 | |||
| KIRNBAUER R | |||
| et al | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| JOURNAL OF VIROLOGY | |||
| Способ изготовления фанеры-переклейки | 1921 |
|
SU1993A1 |
| Приспособление для получения кинематографических стерео снимков | 1919 |
|
SU67A1 |
| Способ гальванического снятия позолоты с серебряных изделий без заметного изменения их формы | 1923 |
|
SU12A1 |
| P | |||
| Рычажный клапан | 1927 |
|
SU6929A1 |
| US 2002016372 A1, 14.11.2002 | |||
| WO 2010149752 A2, 29.12.2010 | |||
| ПАПИЛЛОМАВИРУСНЫЕ ВАКЦИНЫ | 1995 |
|
RU2206608C2 |
Авторы
Даты
2018-01-24—Публикация
2012-12-03—Подача