Предлагаемое изобретение имеет междисциплинарный характер и относится как к медицине, так и полимерным материалам биомедицинского назначения. Заявляемые технические решения могут быть использованы в челюстно-лицевой хирургии (ЧЛХ) для лечения пациентов с повреждением тканей лицевой области, в частности, пациентов с инфицированными дефектами в таких тканях. В этом контексте предлагаемое изобретение связано с удовлетворением жизненных потребностей человека, проходящего хирургическое лечение челюстно-лицевого отдела организма, поскольку изобретение способствует профилактике послеоперационных осложнений.
Проблемы хирургического лечения инфицированных дефектов в челюстно-лицевой области не являются пока еще до конца решенными. В частности, большинство послеоперационных осложнений связано с воспалительными процессами, вызываемыми патогенной и условно-патогенной микрофлорой. Например, при введении в такие дефекты металлических имплантатов, которые хотя и являются золотым стандартом в лечении таких пациентов [Козлов В.А., Каган И.И., Матчин А.А., Чемезов С.В. Оперативная челюстно-лицевая хирургия и стоматология. Изд-во "ГЭОТАР-Медиа" 2014. 544 с], часто наблюдаются различные осложнения. Так, если в постоперационной области остается (или туда привносится) даже незначительное число микробных клеток, то они служат очагом для развития инфекционного воспаления, купирование и лечение которого требует применения высоких доз антибиотиков путем перорального или инъекционного введения пациенту или же, в особо неблагоприятных случаях, повторного хирургического вмешательства.
Известен индивидуальный имплантат из диоксида циркония, стабилизированного оксидом иттрия, и способ лечения дефектов нижней челюсти с использованием такого имплантата [Решетов Д.Н., Бойчевская В.А., Калинин М.Р., Арутюнов С.Д., Вельшер Л.З. Способ замещения послеоперационного дефекта нижней челюсти, Пат. РФ №2559916 (10.07.2014) А61С 8/00; БИ №23 (2015)]. Недостатками данных технических решений, т.е. собственно имплантата и способа лечения с его использованием, являются высокая частота развития воспалительных осложнений (от 6 до 10%), в том числе образование свищевого хода и, как следствие, попадание в него инфекционной микрофлоры. Также довольно часто на месте установленного имплантата развиваются пролежни в отдаленном периоде с оголением поверхности протеза.
Другой известный имплантат, а именно, тканевый аутотрансплантат из теменной кости, и соответствующий способ лечения пациентов, перенесших резекцию в челюстно-лицевой области, предусматривает установку такого имплантата на место дефекта [Буцан С.Б., Селезнев В.А., Бинну Ю.С, Гилева К.С. Способ устранения дефекта нижней челюсти. Пат. РФ №2670911 (10.09.2017) А61В 17/24, А61В 17/00; БИ №30 (2018)]. Недостатками этого имплантата и способа лечения с использованием такого имплантата являются дополнительная травма для пациента, возможность резорбции аутотрансплантата и развития на нем инфекционных агентов.
Также для лечения дефектов в челюстно-лицевой области известны имплантаты, изготовленные из гомо- и сополимеров молочной кислоты, например, поли(L-лактата), сополи(лактид-гликолида) и т.п.[Eppley B.L., Morales L., Wood R., Pensler J., Goldstein J., Havlik R.J., Habal M., Losken A., Williams J.K., Burstein F., Rozzelle A.A., Sadove A.M. Resorbable PLLA-PGA plate and screw fixation in pediatric craniofacial surgery: clinical experience in 1883 patients. Plast. Reconstr. Surg. V.114, 850-8577 (2014)]. Эти имплантаты являются резорбируемыми и со временем могут быть замещены вновь образующейся собственной костной тканью организма. Недостатком таких имплантатов является нежелательное закисление областей возле материала органическими кислотами, образующимися при его гидролизе, а также тот факт, что резорбированный материал может вызвать реакцию инородного тела с накоплением макрофагов и гранулоцитов [Bostman О., Partio Е., Hirvensalo Е., Rokkanen P. Foreign-body reactions to polyglycolide screws. Observations in 24/216 malleolar fracture cases. Acta Orthop.Scand. V.63, 173-176 (1992)]
В настоящее время в качестве перспективного направления при хирургическом лечении дефектов в челюстно-лицевой области рассматривается использование гидрогелевых имплантатов, дополнительно содержащих медикаментозные добавки [Hoffman A.S. Hydrogels for biomedical applications. Adv. Drug Deliv. Rev. V.54, 3-12 (2002); Shakya A.K., Kandalam U. Three-dimensional macroporous materials for tissue engineering of craniofacial bone. British J. Oral Maxillofacial Surg. V.55, 875-891 (2017)]. Благодаря биосовместимости, эластическим свойствам и относительной доступности таких имплантатов, их применение часто приводит к благоприятному лечебному эффекту.
Например, известен имплантат в виде салфеток из гидрогеля на основе хитозана, пропитанного антибиотиком (амоксициллином) и лидокаином, а также способ лечения и укрытия мелких дефектов костной и хрящевой частей носа с использованием такого имплантата [Кузнецова B.C., Васильев А.В., Григорьев Т.Е., Загоскин Ю.Д., Чвалун С.Н., Бухарова Т.Б., Гольдштейн Д.В., Кулаков А.А. Перспективы использования гидрогелей в качестве основы для отверждаемых костно-пластических материалов. Стоматология, №6. С. 68-74 (2017)]. Данное техническое решение является наиболее близким к заявленному изобретению по назначению использования гидрогелевого биомедицинского материала и поэтому выбрано нами в качестве прототипа.
Недостатком прототипа являются быстрая биоразлагаемость его полимерной основы, невысокая механическая прочность, низкая осмотическая устойчивость (резкое изменение объема при незначительном изменении рН и ионной силы), возможность синерезиса материалом имплантата жидкости, отделяемой при его хранении и др. Поэтому использование таких имплантатов из гидрогеля и соответствующего способа лечения дефектов челюстно-лицевых тканей ограничено небольшими дефектами в челюстно-лицевой области, т.е. его использование в случаях обширных дефектов фактически невозможно.
Задача настоящего изобретения - создание нового временного имплантата, обладающего противомикробными свойствами, позволяющего уменьшить риск воспалительных осложнений в послеоперационном периоде, способного подавить патогенную микрофлору в инфицированной ране и создать опору для мягких тканей на месте резецированного фрагмента, а также разработка способа лечения пациентов с инфицированными дефектами в челюстно-лицевой области с использованием такого имплантата.
Задача решается временным имплантатом для лечения пациентов с инфицированными дефектами в челюстно-лицевой области, представляющим собой криогель поливинилового спирта с модулем упругости от 2 до 50 кПа, который содержит противомикробный агент или смесь противомикробных агентов в концентрации от 1 до 120 мг/мл, а также способом хирургического лечения таких пациентов, включающим резекцию поврежденных тканей, причем на место резецированного фрагмента устанавливают вышеуказанный временный имплантат, имеющий необходимые форму и размер.
Технический результат - снижение риска развития послеоперационных гнойно-воспалительных явлений, подавление патогенной микрофлоры в инфицированной ране, предотвращение воспалительных процессов в окружающих тканях, создание временной опоры для мягких тканей на месте резецированного фрагмента.
Согласно заявляемому изобретению временный имплантат представляет собой так называемый криогель поливинилового спирта (ПВС), содержащий противомикробный агент или их смесь, например, один или смесь антибиотиков в фармакологически-обоснованной концентрации. Криогель ПВС образуется в результате криогенной обработки (замораживание - выдерживание в замороженном состоянии - оттаивание) водного раствора данного полимера [Лозинский В.И. Криотропное гелеобразование растворов поливинилового спирта. Успехи химии Т. 67, С. 641-655 (1998)]. Поскольку исходной системой для формирования криогеля ПВС является раствор этого полимера, то получаемому криогелю технологически просто придать желаемые форму (цилиндр, диск, трубка, шар, куб, изделие более сложной геометрии) и размеры, осуществляя криотропное гелеобразование исходного полимерного раствора, находящегося в соответствующей литьевой форме. Введение противомикробного агента или их смеси в состав криогеля ПВС после формирования последнего замораживанием-оттаиванием осуществляется пропитыванием этого полимерного материала раствором соответствующего агента, концентрация которого в объеме получаемого имплантата определяется как типом и растворимостью такого агента/агентов, так и требуемой его/их концентрацией в конечном изделии, т.е. имплантате. Предлагаемый способ лечения пациентов с инфицированными дефектами в челюстно-лицевой области, включающий использование вышеуказанного имплантата, благодаря наличию в нем противомикробного агента позволяет достичь стойких хороших функциональных результатов, т.к. создается высокая концентрация противомикробного агента в ране, что обеспечивает там наименьший риск развития послеоперационных гнойно-воспалительных явлений. Кроме того, криогель ПВС, благодаря своим высоким физико-механических характеристикам, выполняет также и опорную функцию для мягких тканей лица. Заявляемое изобретение реализуется следующим образом: 1. Готовят криогель ПВС с требуемыми физико-механическими характеристиками (модулем упругости), а также размером и формой, для чего используют известные приемы формирования таких криогелей (см., например, [В.И. Лозинский, Л.Г. Дамшкалн, Б.Л. Шаскольский, Т.А. Бабушкина, И.Н. Курочкин, И.И. Курочкин. Изучение криоструктурирования полимерных систем. 27. Физико-химические свойства криогелей поливинилового спирта и особенности их макропористой морфологии. // Коллоидн. журн. Т. 69, С. 798-816 (2007)]. Необходимое в каждом конкретном случае значение модуля упругости достигается известным сочетанием концентрации ПВС в исходном растворе и режимами криогенной обработки такого раствора [Лозинский В.И. Криотропное гелеобразование растворов поливинилового спирта. Успехи химии Т. 67, С. 641-655 (1998)]. Заявляемый диапазон от 2 до 50 кПа значений модуля упругости криогеля ПВС, используемого в качестве гелевой основы временного имплантата для хирургического лечения пациентов с инфицированными дефектами в челюстно-лицевой области, найден экспериментально и определяется конкретным клиническим случаем применения такого имплантата. В частности, как показали проведенные исследования, заявляемые временные имплантаты на основе криогеля ПВС невысокой жесткости с модулем упругости 2-10 кПа эффективны при хирургическом лечении гнойно-воспалительных заболеваний мягких тканей челюстно-лицевой области (например, при лечении флегмон), имплантаты на основе криогеля ПВС средней жесткости с модулем упругости 11-30 кПа предпочтительны при хирургическом лечении пострезекционных дефектов костей черепа (например, дефектов в нижней челюсти), а имплантаты на основе криогеля ПВС высокой жесткости с модулем упругости 31-50 кПа требуются при хирургическом лечении патологии костей полости носа, пазух, глазницы. В свою очередь, если криогель ПВС имеет модуль упругости ниже 2 кПа, то соответствующий временный имплантат плохо удерживается в обрабатываемом дефекте тканей челюстно-лицевой области, при использовании временного имплантата на основе криогеля ПВС с модулем упругости выше 50 кПа из-за высокой жесткости материала заметно возрастает вероятность развития пролежня/ей на месте его установки.
2. После завершения процесса приготовления криогеля ПВС, обладающего заданными размером, формой и модулем упругости, его насыщают противомикробным агентом или смесью противомикробных агентов, помещая образец в раствор с известным их содержанием, и инкубируют до достижения концентрационного равновесия. Благодаря макропористой структуре криогелей ПВС [V.I.Lozinsky, O.Okay. Basic principles of cryotropic gelation. // Adv.Polym.Sci. V. 263, P. 49-101 (2014)] обеспечивается незатрудненная диффузия растворенных веществ в объем криогеля, который таким образом насыщается противомикробным агентом или их смесью. Заявляемое техническое решение предусматривает достижение концентрации таких агентов в пределах от 1 до 120 мг/мл, что зависит от природы вещества, его растворимости, специфичности в отношении соответствующих патогенных микроорганизмов и от допускаемой его терапевтической дозы.
3. Последовательность действий в способе лечения с использованием заявляемого временного имплантата определяется медицинскими показаниями, что зависит от возраста, соматического статуса пациента и обсемененности раневой поверхности. Например, скелетируют необходимый участок нижней челюсти, далее с помощью фрез и пил проводят вертикальную остеотомию данной части нижней челюсти, отступя 2 см от края патологического процесса. Остеотомированный свободный фрагмент участка нижней челюсти извлекают из раны. Заранее изготовленный индивидуальный временный имплантат на основе криогеля ПВС, содержащий противомикробный агент или их смесь, вводят в область дефекта костной ткани и фиксируют к мягким тканям и надкостнице, заключая имплантат в полость. Швы снимают по мере заживления раны. Временный имплантат извлекают на 5-7 сутки после установки. Активные движения нижней челюсти начинают на 5-7 сутки, а механотерапию на 10-12 сутки после операции. Далее следует послеоперационная терапия, выполняемая по принятым в ЧЛХ протоколам [Козлов В.А., Каган И.И., Матчин А.А., Чемезов СВ. Оперативная челюстно-лицевая хирургия и стоматология. Изд-во ТЭОТАР-Медиа" 2014, 544 с].
Предлагаемое изобретение отвечает критерию «новизна» не только благодаря физико-механическим и противомикробным свойствам заявляемого временного имплантата, но и из-за того, что обеспечивается индивидуальный подход к лечению пациентов. В частности, при создании литьевой формы для получения криогеля, отвечающего наиболее полному заполнению дефекта в челюстно-лицевой области, предусматривается использование 3D-принтера, работающего по индивидуальной КТ-схеме пациента. Также, создавая объем в мягких тканях, заявляемый временный имплантат предотвращает развитие фибротического процесса между стенками образовавшейся после резекции кости и формирует ложе для будущего эндопротеза участка кости. Кроме того, экспериментально обнаружено, что использование такого имплантата способствует росту кости со здоровых участков, что актуально для участков резекции до 3 см.
Таким образом, заявляемый способ лечения пациентов с инфицированными дефектами в челюстно-лицевой области отличается от аналогов и прототипа тем, что область образовавшегося дефекта после удаления новообразования или резекции участка челюсти заполняют предварительно изготовленным индивидуальным временным имплантатом, который соответствует размерам и форме дефекта. Помимо этого и учитывая превосходные физико-механические показатели и противомикробные свойства заявляемого временного имплантата, он был использован в клинике для лечения пациентов с гнойно-воспалительными заболеваниями и в качестве послеоперационной терапии после риносептопластики.
Предлагаемое изобретение иллюстрируется примерами и фигурами, поясняющими изобретение, но не ограничивающими его объем.
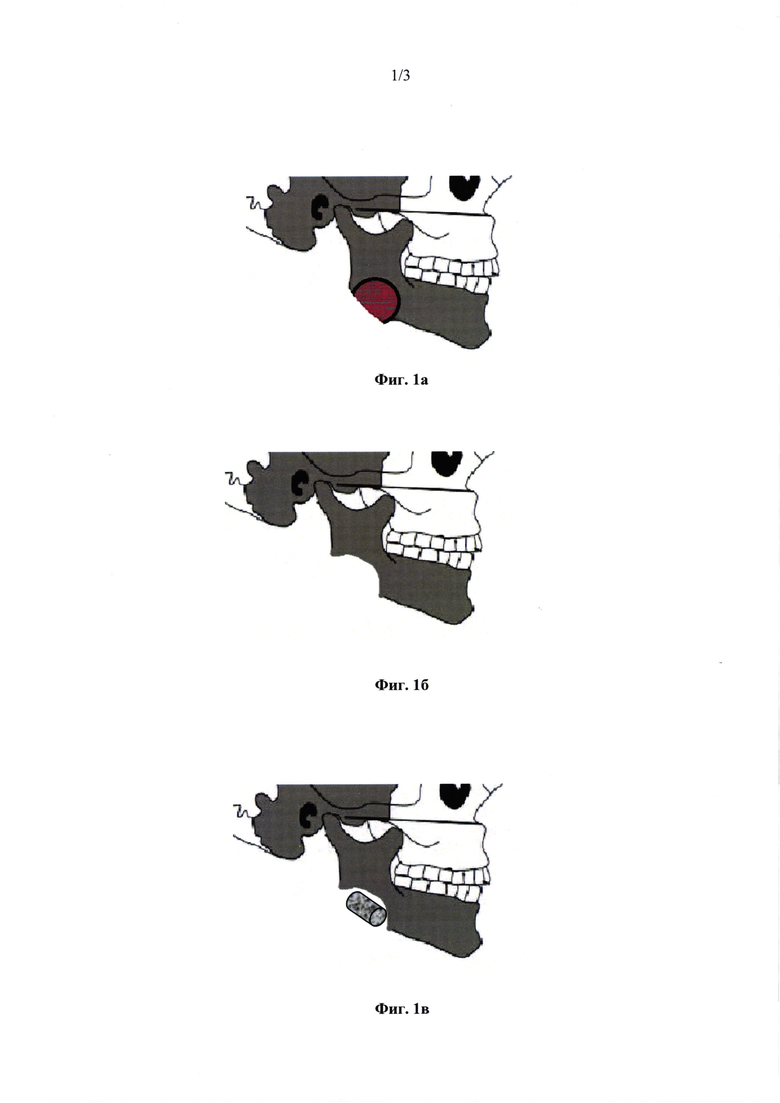
На Фиг. 1 представлена схема лечения инфицированного дефекта в челюстно-лицевой области с использованием заявляемого временного имплантата:
а) этап резекции участка нижней челюсти;
б) этап удаления костного фрагмента, формирования ложа для временного имплантата;
в) установка временного имплантата в область резекции и его фиксация.
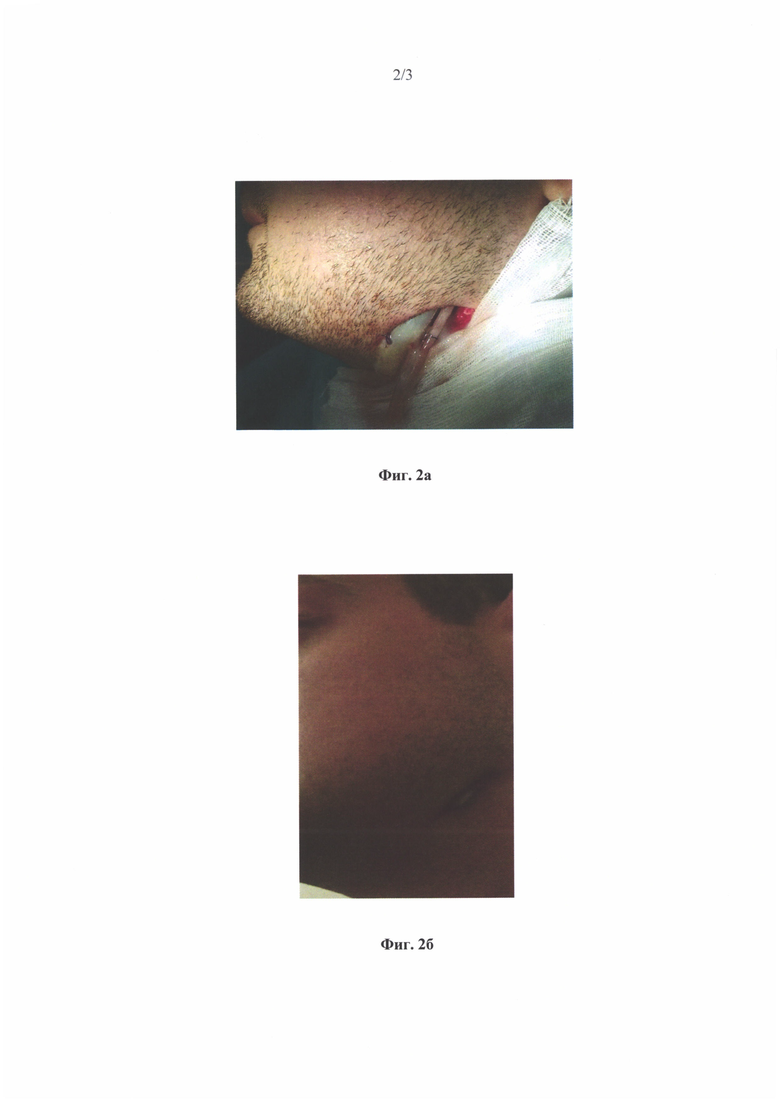
Фиг. 2 иллюстрирует хирургическое лечение остеонекроза нижней челюсти с использованием заявляемого временного имплантата:
а) имплантат установлен в рану на место резецированой кости;
б) результат лечения через 14 дней.
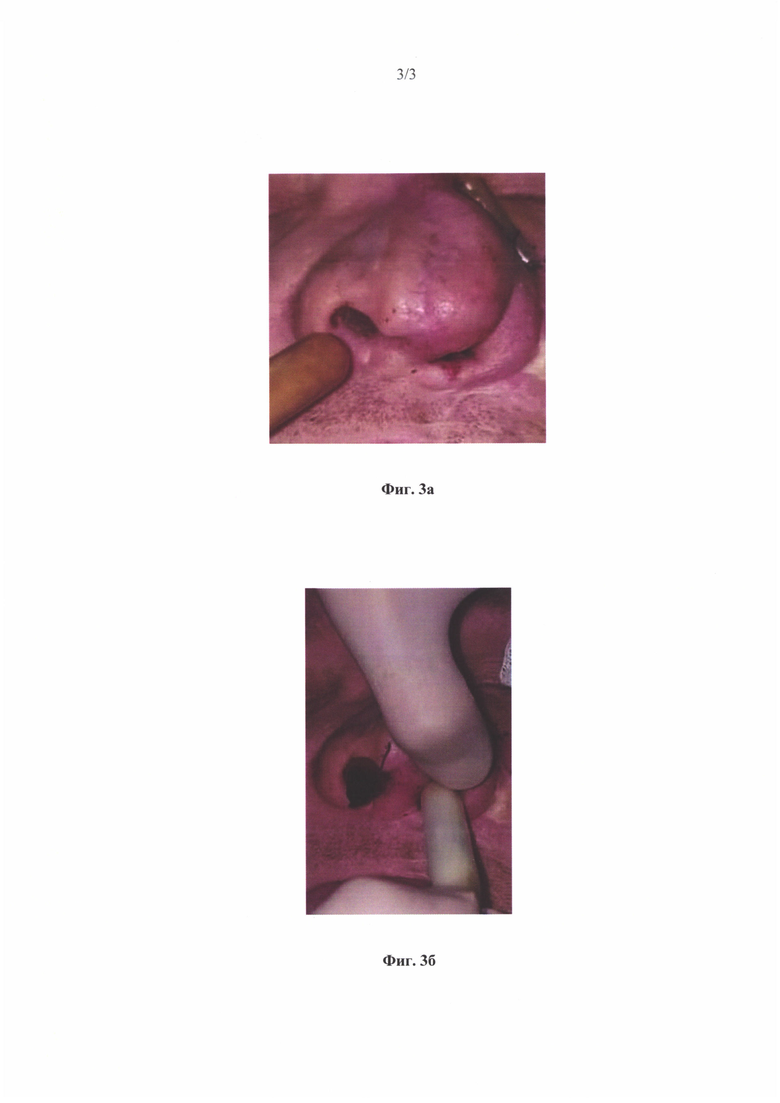
На Фиг. 3 показан пример использования заявляемого временного имплантата для лечения приобретенной деформации носа:
а) установка в правый носовой ход имплантата, содержащего смесь амоксициллина и клавулоновой кислоты в качестве противомикробного агента;
б) установка в левый носовой имплантата, содержащего цефтриаксон в качестве противомикробного агента.
Пример 1
а) Временный имплантат на основе криогеля ПВС, содержащий цефтриаксон в качестве противомикробного агента.
Криогель ПВС формируют в пластиковой литьевой форме с внутренней цилиндрической полостью диаметром 2 см. Исходный раствор полимера в эту форму заливают высотой 6 см. Формирование криогеля осуществляют в камере программируемого криостата FP 45 HP (Julabo, Германия) в известных условиях замораживания-оттаивания [В.И.Лозинский, Л.Г.Дамшкалн, И.Н.Курочкин, И.И. Курочкин. Изучение криоструктурирования полимерных систем. 28. Физико-химические свойства и морфология криогелей поливинилового спирта, сформированных многократным замораживанием-оттаиванием. Колоидн. журн. Т. 70, С. 212-222 (2008)], обеспечивающих получение конечного материала, имеющего модуль упругости 50 кПа. Определение этого показателя проводят с помощью автоматического анализатора текстуры TA-Plus (Lloyd Instruments Ltd., Великобритания). Насыщение сформированного в результате криогеля ПВС противомикробным агентом проводят выдерживанием цилиндрического образца в течение 48 ч при 6°С в равном объеме раствора цефтриаксона концентрацией 240 мг/мл, что после установления равновесия обеспечивает содержание противомикробного агента в получаемом таким образом временном имплантате, равное 120 мг/мл. Имплантат хранят в том же растворе при 4-6°С в затемненных условиях.
б) Лечение инфицированного дефекта в челюстно-лицевой области с использованием полученного временного имплантата.
Пациент А., 25 лет. Диагноз: хронический остеомиелит угла и ветви нижней челюсти слева (остеонекроз).
Жалобы на болезненный отек в области нижней челюсти слева, гнойное отделяемое из свищевого хода в поднижнечелюстной области слева. Из анамнеза: со слов пациента, ранее перенес травматичное удаление зуба 3.8. За 3 месяца до обращения произведено вскрытие абсцесса субмассетериального слева. Был выписан с улучшением в поликлинику по месту жительства. После чего отметил появление свищевых ходов с гнойным отделяемым в области угла и тела нижней челюсти, которые появились за 1 месяц до обращения.
Под эндотрахеальным наркозом был выполнен внеротовой доступ к углу нижней челюсти. По ходу гемостаз. Скелетированы угол, ветвь и тело нижней челюсти до уровня зуба 4.4. Обнаружено пораженная наружная кортикальная пластинка в области угла и тела. Произведена экономная резекция в пределах здоровой костной ткани с сохранением непрерывности нижней челюсти. Зона резекции обработана шаровидным бором, промыта растворами антисептиков. В рану установлен и фиксирован одиночным швом временный имплантат (Фиг. 2а) цилиндрической формы длинной 6 см и диаметром 2 см, изготовленный по методике пункта (а). Края операционной раны сближены узловыми швами. На 1, 3 и 5 день после операции проводилась замена временного имплантата, который был удален на 7 сутки. Ранний послеоперационный период протекал без осложнений. Отмечалась положительная динамика (Фиг. 26). В результате проведенного лечения пациент был выписан с улучшением на 7 сутки после операции в удовлетворительном состоянии, на 14 сутки - полное отсутствие воспаления (Фиг. 26).
Таким образом, при использовании заявляемого временного имплантата, пропитанного антибиотиком, получены положительные результаты в заживлении костного дефекта без воспалительного процесса после резекции, что показывает эффективность данного изобретения.
Пример 2.
а) Временные имплантаты на основе криогеля ПВС, содержащие смесь амоксициллина и клавулоновой кислоты или цефтриаксон в качестве противомикробного агента.
Криогель ПВС формируют в пластиковой криопробирке с внутренним диаметром 1.5 см. Исходный раствор полимера в пробирку заливают высотой 4 см. Формирование криогеля осуществляют в камере программируемого криостата F 32 МН (Julabo, Германия) в известных условиях замораживания-оттаивания [В.И.Лозинский, Л.Г.Дамшкалн, Б.Л.Шаскольский, Т.А. Бабушкина, И.Н.Курочкин, И.И.Курочкин. Изучение криоструктурирования полимерных систем. 27. Физико-химические свойства криогелей поливинилового спирта и особенности их макропористой морфологии. Коллоидн. журн. Т. 69, С. 798-816 (2007)], обеспечивающих получение конечного материала, имеющего модуль упругости 23.5 кПа. Определение модуля упругости проводят с помощью автоматического анализатора текстуры TA-Plus (Lloyd Instruments Ltd., Великобритания). Насыщение сформированного в результате криогеля ПВС смесью противомикробных агентов проводят выдерживанием образца в течение 48 ч при 6°С в равном объеме раствора смеси амоксициллина (60 мг/мл) и клавулоновой кислоты (20 мг/мл) что после установления равновесия обеспечивает суммарное содержание противомикробных агентов в получаемом таким образом временном имплантате, равное 40 мг/мл. Второй аналогичный по форме и размерам образец криогеля ПВС насыщали раствором цефтриаксона до достижения его концентрации в имплантате 50 мг/мл. Имплантаты хранят в растворе соответствующего противомикробного агента при 4-6°С в затемненных условиях.
б) Лечение инфицированного дефекта в челюстно-лицевой области с использованием полученных имплантатов.
Пациент В, 49 лет, диагноз: посттравматическая деформация носа.
Жалобы: на затруднение дыхания и косметический дефект.
После стандартной процедуры риносептопластики пациенту в носовые ходы были установлены временные имплантаты (по одному в каждую ноздрю) цилиндрической формы длиной 4 см и диаметром 1.5 см и полусферическим торцом одной из вершин (Фиг. 3а и 36). У данного пациента указанные временные имплантаты функционировали как опорные структуры для мягких тканей носа для профилактики стриктуры носового хода. Имплантаты были пропитаны по методике пункта (а) раствором противомикробных агентов, в качестве которых использовались смесь амоксициллина с клавулоновой кислотой (Фиг. 3а) или цефтриаксон (Фиг. 36). Были взяты мазки из полости носа посевом на 1, 2 и 3 сутки с заменой имплантата в эти дни. В результате данных посева микробное обсеменение в ране снизилось на вторые сутки с 7 КОЕ до 1 КОЕ, на третьи сутки - рана стерильна. В результате чего на 5 день имплантат был изъят, и пациент выписан с выздоровлением. Благодаря заявляемому имплантату у пациента не развилось гнойно-воспалительных и фибротических осложнений. У данного пациента имплантат, помимо противомикробной функции, являлся также опорой для мягких тканей носа, предупреждая развитие фиброзных сращений между стенками носа.
Пример 3
а) Временный имплантат на основе криогеля ПВС, содержащий смесь цефтриаксона и амоксиклава в качестве противомикробного агента.
Криогель ПВС формируют в пластиковой литьевой форме с внутренней полостью овального сечения 2×1 см. Сама литьевая форма изготовлена с помощью 3D-принтера, работавшего по индивидуальной КТ-схеме пациента. Исходный раствор полимера в эту форму заливают высотой 5 см. Формирование криогеля осуществляют в камере ультракриостата МРС-К20 (Huber, Германия) в известных условиях замораживания-оттаивания [V.I.Lozinsky, E.S.Vainerman, L.V.Domotenko, A.M.Mamtsis, E.F.Titova, E.M.Belavtseva, S.V.Rogozhin. Study of cryostructurization of polymer systems. VII. Structure formation under freezing of poly(vinyl alcohol) aqueous solutions. Colloid & Polymer Sci. V.264, P.19-24 (1986)], обеспечивающих получение конечного материала, имеющего модуль упругости 2 кПа, определение которого проводят с помощью автоматического анализатора текстуры TA-Plus (Lloyd Instruments Ltd., Великобритания). Насыщение сформированного в результате криогеля ПВС смесью противомикробных агентов осуществляют выдерживанием цилиндрического образца в течение 24 ч при 8-10°С в равном объеме раствора смеси цефтриаксона и амоксиклава с концентрацией каждого из антибиотиков 65 мг/мл, что после установления равновесия обеспечивает суммарное содержание противомикробного агента в получаемом таким образом временном имплантате, равное 65 мг/мл. Имплантат хранят в том же растворе при 4-6°С в затемненных условиях.
б) Лечение инфицированного дефекта в челюстно-лицевой области с использованием полученного имплантата.
Пациентка С. 53 года, диагноз: Флегмона поднижнечелюстной области.
Жалобы: на лихорадку, боли, отек и покраснение поднижнечелюстной области, затруднение глотания.
В этом случае временный имплантат овального сечения 2×1 см и длиной 5 см, пропитанный раствором смеси цефтриаксона и амоксиклава по методике пункта (а), помещали в полость гнойного распада тканей (флегмона). Рана не ушивалась, была наложена стерильная давящая повязка. Были взяты мазки из гнойной полости с посевом на 1, 2 и 3 сутки с заменой имплантата в эти дни. В результате данных посева микробное обсеменение в ране снизилось на вторые сутки с 7 КОЕ до 1 КОЕ, на третьи сутки - рана стерильна. В результате чего пациентке на 5 день был изъят имплантат и она выписана с выздоровлением.
Этот клинический пример демонстрирует способность заявляемого временного имплантата служить эффективным проводником противомикробных средств в рану, а также абсорбировать токсины и продукты обмена бактерий и пораженных тканей. В результате применения такого имплантата произошло более быстрое выздоровление пациента со значительным снижением наличия микрофлоры в гнойной ране, что свидетельствует об эффективности данного способа лечения.
Пример 4
а) Временный имплантат на основе криогеля ПВС, содержащий амоксиклав в качестве противомикробного агента.
Криогель ПВС формируют в пластиковой криопробирке с внутренним диаметром 1 см, имеющей внутренний стержень диаметром 0,4 см. Исходный раствор полимера в пробирку заливают высотой 3,5 см. Формирование криогеля осуществляют в камере программируемого криостата F 32 МН (Julabo, Германия) в известных условиях замораживания-оттаивания [O.Yu.Kolosova, I.N.Kurochkin, I.I.Kurochkin, V.I.Lozinsky. Cryostructuring of poly-meric systems. 48. Influence of organic chaotropes and kosmotropes on the cryotropic gel-formation of aqueous polyvinyl alcohol) solutions. Eur. Polym. J. V.102, P.169-177 (2018)], обеспечивающих получение конечного материала, имеющего модуль упругости 9.7 кПа. Определение модуля упругости проводят с помощью автоматического анализатора текстуры TA-Plus (Lloyd Instruments Ltd., Великобритания). Сформированный таким образом криогель ПВС имеет форму трубки с внешним диаметром 1 см. и диаметром внутреннего канала 0,4 см. Насыщение этого криогеля ПВС противомикробным агентом проводят выдерживанием трубки в течение 36 ч при 6°С в равном объеме раствора амоксиклава (2 мг/мл), что после установления равновесия обеспечивает содержание противомикробного агента в получаемом таким образом временном имплантате, равное 1 мг/мл. Имплантат хранят в том же растворе при 4-6°С в затемненных условиях.
б) Лечение инфицированного дефекта в челюстно-лицевой области с использованием полученного имплантата.
Пациент В, 15 лет, диагноз: гнойный периостит.
Жалобы: на боль, отечность в области края нижней челюсти слева.
В условиях эндотрахеального наркоза и после антисептической обработки операционного поля выполнен доступ к краю нижней челюсти. Выполнена ревизия. Рана промыта растворами антисептиков. В рану был установлен временный имплантат в виде трубки длиной 3,5 см и диаметром 1 см, полученный по протоколу пункта (а). Имплантат выполнял местную противомикробную функцию, а также производил дренаж отделяемого из послеоперационной раны. На 3 сутки имплантат был изъят, рана санирована и ушита. Пациент выписан на 4 сутки с выздоровлением.
Таким образом, заявляемое изобретение имеет следующие преимущества по сравнению с аналогами и прототипом:
1. Использование заявляемого временного имплантата, содержащего противомикробный агент или смесь противомикробных агентов, для хирургического лечения пациентов с инфицированными дефектами в челюстно-лицевой области позволяет получить положительные результаты в заживлении дефектов без воспалительного процесса после резекции (примеры 1-4), показывая эффективность данного технического решения.
2. Заявляемый временный имплантат обладает способностью служить эффективным проводником противомикробных агентов в рану, а также абсорбировать токсины и продукты обмена бактерий и пораженных тканей, что способствует эффективности применения такого имплантата (пример 2).
3. Заявляемый временный имплантат способен выполнять дренажную функцию отделяемого полости носа и послеоперационной раны (пример 3).
4. Работоспособность и эффективность заявляемого временного имплантата была продемонстрирована в исследованиях на пациентах, давая положительную быструю динамику выздоровления без воспаления и обострения за счет снижения бактериальной флоры в поврежденных участках в челюстно-лицевой области организма (примеры 1-4).
5. В противоположность прототипу заявляемый временный имплантат не подвергается биодеструкции в организме пациента, т.е. не меняет своих характеристик во время пребывания в области установки, обладает высокими прочностными показателями и осмотической стабильностью, может применяться при хирургическом лечении обширных челюстно-лицевых дефектов.
6. По сравнению с аналогами и прототипом заявляемое изобретение обеспечивает антимикробную и противовоспалительную функцию, а также заявляемый имплантат, как показали исследования, не вызывает развития пролежней мягких тканей и образования свищей, что является положительным моментом в сравнении с аналогами.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПЛЕНКООБРАЗУЮЩЕЕ АНТИСЕПТИЧЕСКОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ГНОЙНО-ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ ЧЕЛЮСТНО-ЛИЦЕВОЙ ОБЛАСТИ | 2009 |
|
RU2410092C1 |
| ИМПЛАНТАТ-ЭНДОПРОТЕЗ ДЛЯ ЗАМЕЩЕНИЯ ОБЪЕМНОГО КОСТНОГО ДЕФЕКТА НИЖНЕЙ ЧЕЛЮСТИ | 2012 |
|
RU2491899C1 |
| ИМПЛАНТАТ ДЛЯ ПРОТЕЗИРОВАНИЯ ЧЕЛЮСТИ | 2024 |
|
RU2835641C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ИНДИВИДУАЛЬНОГО ЧЕЛЮСТНО-ЛИЦЕВОГО ИМПЛАНТАТА | 2022 |
|
RU2789580C1 |
| Способ устранения дефекта средней зоны лица после резекции тканей челюстно-лицевой области | 2023 |
|
RU2828548C1 |
| СПОСОБ ПРОФИЛАКТИКИ ГНОЙНО-ВОСПАЛИТЕЛЬНЫХ ОСЛОЖНЕНИЙ ПОСЛЕ ОПЕРАЦИЙ В ЧЕЛЮСТНО-ЛИЦЕВОЙ ОБЛАСТИ | 2015 |
|
RU2593901C1 |
| УСТРОЙСТВО ДЛЯ ВОССТАНОВЛЕНИЯ УТРАЧЕННОЙ КОСТНОЙ ТКАНИ ВОКРУГ ОБНАЖЕННОЙ ПОВЕРХНОСТИ ИМПЛАНТАТА И СПОСОБ ЕГО ИСПОЛЬЗОВАНИЯ | 2015 |
|
RU2604049C1 |
| СПОСОБ ВОССТАНОВЛЕНИЯ ДЕСНЫ В ОБЛАСТИ ОБНАЖЕННОЙ ПОВЕРХНОСТИ ИМПЛАНТАТА И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2015 |
|
RU2597145C1 |
| СПОСОБ УСКОРЕНИЯ РЕГЕНЕРАЦИИ КОСТНОЙ ТКАНИ ПРИ ПРОВЕДЕНИИ ОСТЕОСИНТЕЗА | 2009 |
|
RU2410050C2 |
| СПОСОБ УСТРАНЕНИЯ КОМБИНИРОВАННЫХ ДЕФЕКТОВ ВЕРХНЕЙ ЧЕЛЮСТИ С ИСПОЛЬЗОВАНИЕМ ИНДИВИДУАЛЬНОГО ЭНДОПРОТЕЗА | 2024 |
|
RU2831787C1 |
Группа изобретений относится к медицине, а именно к челюстно-лицевой хирургии, и раскрывает временный имплантат для пациентов с инфицированными дефектами в челюстно-лицевой области, а также способ хирургического лечения пациентов. Имплантат представляет собой криогель поливинилового спирта, который содержит противомикробный агент в концентрации от 1 до 120 мг/мл. Для изготовления имплантата используют криогель с модулем упругости от 2 до 50 кПа. Способ хирургического лечения инфицированных дефектов с использованием указанного имплантата характеризуется тем, что способствует вводу противомикробного агента в рану и выводу токсинов путем их адсорбции. Имплантат не подвергается биодеструкции в организме пациента. Группа изобретений обеспечивает снижение риска развития послеоперационных гнойно-воспалительных явлений, снятие воспаления в инфицированной ране, предотвращение воспалительных процессов в окружающих тканях, создание временной опоры для мягких тканей на месте резецированного фрагмента и может быть использована для лечения пациентов с повреждением тканей в челюстно-лицевой области, в частности с инфицированными дефектами в таких тканях. 2 н.п. ф-лы, 3 ил., 4 пр.
1. Временный имплантат для пациентов с инфицированными дефектами в челюстно-лицевой области, представляющий собой криогель поливинилового спирта с модулем упругости от 2 до 50 кПа, который содержит противомикробный агент или смесь противомикробных агентов в концентрации от 1 до 120 мг/мл.
2. Способ хирургического лечения пациентов с инфицированными дефектами в челюстно-лицевой области, включающий резекцию поврежденных тканей, отличающийся тем, что на место резецированного фрагмента устанавливают временный имплантат по п. 1, имеющий необходимые форму и размер.
| Кузнецова B.C | |||
| и др | |||
| Перспективы использования гидрогелей в качестве основы для отверждаемых костно-пластических материалов | |||
| Стоматология, 2017 | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| С | |||
| Способ получения смеси хлоргидратов опийных алкалоидов (пантопона) из опийных вытяжек с любым содержанием морфия | 1921 |
|
SU68A1 |
| Временный съемный зубной протез на период остеоинтеграции дентальных имплантатов | 2018 |
|
RU2693240C1 |
| ИМПЛАНТАТ ДЛЯ ЗАМЕЩЕНИЯ ДЕФЕКТОВ НИЖНЕЙ ЧЕЛЮСТИ | 1995 |
|
RU2127568C1 |
| US 10342897 B2, 09.07.2019 | |||
| Lee, K | |||
| Y., & Mooney, D | |||
| J | |||
| Hydrogels for Tissue Engineering | |||
| Chemical Reviews, 2001 | |||
| Приспособление для записи звуковых явлений на светочувствительной поверхности | 1919 |
|
SU101A1 |
Авторы
Даты
2020-08-13—Публикация
2020-02-18—Подача