Область техники, к которой относится изобретение
[0001] Настоящее изобретение, в целом, касается новых препаратов адъювантов для усиления иммунного ответа на антигены для применения в иммуногенных и вакцинных композициях. Настоящее изобретение также касается способов получения и применения композиций адъюванта, иммуногенных и вакцинных композиций.
Предпосылки создания изобретения
[0002] Бактериальные, вирусные и паразитарные инфекции являются широко распространенными в организме человека и животных. Заболевания, вызванные данными инфекционными агентами, часто являются резистентными к противомикробной фармацевтической терапии, не оставляя никаких эффективных средств лечения. Как следствие, вакцинологический подход все больше и больше применяют для контроля над инфекционным заболеванием. Целостный инфекционный возбудитель может быть приемлемым для применения в вакцинном препарате после химической инактивации или соответствующей генетической манипуляции. Альтернативно, протеиновая субъединица возбудителя может быть экспрессирована в рекомбинантной экспрессионной системе, и очищена для применения в вакцинном препарате. Вакцины могут быть сделаны более эффективными за счет включения соответствующего адъюванта в композицию.
[0003] Термин «адъювант», в целом, относится к любому веществу, которое повышает гуморальный или клеточный иммунный ответ на антиген. Адъюванты используют для достижения двух целей: Они замедляют высвобождение антигенов с места инъекции, и они усиливают стимуляцию иммунной системы. Традиционные вакцины, в целом, состоят из неочищенного препарата инактивированных, или убитых, или модифицированных живых патогенных микроорганизмов. Примеси, связанные с данными культурами патологических микроорганизмов, могут действовать в качестве адъюванта для усиления иммунного ответа. Однако, иммунитет, который вызывается вакцинами, которые используют гомогенные препараты патологических микроорганизмов или очищенные протеиновые субъединицы, как антигены, часто является слабым. Поэтому, добавление некоторых экзогенных веществ, таких как адъювант, становится необходимым. Кроме того, в некоторых случаях, синтетические и субъединичные вакцины могут быть дорогими в производстве. Кроме того, в некоторых случаях, возбудитель может не быть выращенным в промышленном масштабе, и, таким образом, синтетические/субъединичные вакцины представляют собой единственный приемлемый вариант. Добавление адъюванта может позволить применение меньших доз антигена, чтобы стимулировать подобный иммунный ответ, тем самым, снижая стоимость производства вакцины. Таким образом, эффективность некоторых инъекционных лекарственных средств может быть значительно увеличена, когда агент объединяют с адъювантом.
[0004] Многие факторы должны быть приняты во внимание при выборе адъюванта. Адъювант должен вызывать относительно низкую скорость высвобождения и абсорбцию антигена эффективным способом с минимальным токсическим, аллергенным, раздражающим и другими нежелательными эффектами для хозяина. Для того, чтобы быть приемлемым, адъювант должен быть невирулицидным, способным к биоразложению, способным последовательно создавать высокий уровень иммунитета, способным стимулировать перекрестную защиту, совместимым со многими антигенами, эффективным во многих видах, нетоксичным и безопасным для хозяина (например, не вызывать никаких реакций в месте инъекции). Другими желаемыми характеристиками адъюванта является то, что он способен к микродозированию, является умеренной дозой, имеет превосходную стабильность при хранении, поддается сушке, может быть сделан без масла, может существовать или в виде твердого или жидкого вещества, является изотоническим, легким в производстве, и является недорогим в получении. Наконец, очень необходимым для адъюванта является то, что он способен к настройке, таким образом, индуцируя или гуморальный или клеточный иммунный ответ или оба, в зависимости от требований сценария вакцинации. Однако, количество адъювантов, которые могут удовлетворить указанные выше требования, ограничено.
[0005] Выбор адъюванта зависит от потребностей для вакцины, будь то увеличение величины или функции ответа антитела, увеличение клеточно-опосредованного иммунного ответа, индуцирование мукозального иммунитета, или уменьшения дозы антигена. Было предложено ряд адъювантов, однако, ни один, как показано, не является идеально приемлемым для всех вакцин. Первым адъювантом, о котором сообщалось в литературе, был полный адъювант Фрейнда (FCA), который содержит эмульсию вода-в-масле и экстракты микобактерии. К сожалению, FCA плохо переносится и это может привести к неконтролируемому воспалению. Поскольку с момента открытия FCA прошло более 80 лет, были предприняты усилия уменьшить нежелательные побочные эффекты адъювантов.
[0006] Некоторые другие материалы, которые используются в качестве адъювантов, включают оксиды металлов (например, гидроксид алюминия), алюмокалиевый галун, неорганические хелаты солей, желатины, различные парафинового типа масла, синтезированные смолы, альгинаты, мукоидные и полисахаридные соединения, казеинаты, и вещества, производные крови, такие как фибриновые сгустки. В то время как, данные материалы, в целом, являются эффективными по стимулированию иммунной системы, ни один, как было обнаружено, не был полностью удовлетворительным из-за побочных эффектов у хозяина (например, возникновение стерильного абсцесса, повреждения органов, канцерогенность или аллергические реакции) или нежелательные фармацевтические свойства (например, быстрое рассасывание или плохой контроль над рассасыванием с места инъекции, или отек материала).
Сущность изобретения
[0007] Настоящее изобретение предусматривает новые вакцинные композиции и композиции адъюванта, полезные для вакцин.
[0008] В первом аспекте, изобретение предусматривает композицию адъюванта, которая содержит масляную фазу и водную фазу, где масляная фаза содержит, по меньшей мере, 50% препарата об./об., где указаный препарат содержит, по меньшей мере, один монофосфорильный липид A (MPL-A) или его аналог и иммуностимулирующий олигонуклеотид, при условии, что а) если указанный иммуностимулирующий олигонуклеотид отсутствует, то препарат содержит поли I:С, гликолипид, и, необязательно, четвертичный амин; или поликатионный носитель; и b) если указанный монофосфорильный липид A (MPL-A), или его аналог, отсутствует, то препарат содержит источник алюминия, и, необязательно, поликатионный носитель.
[0009] В различных вариантах осуществления, масляная фаза может содержать масло и, необязательно, растворимый в масле эмульгатор.
[0010] В некоторых вариантах осуществления, также указанный монофосфорильный липид A (MPL-A) или его аналог присутствует в композиции адъюванта. В данных вариантах осуществления, композиция дополнительно содержит стерин (например, холестерин), поли I:С, или их комбинацию.
[0011] В определенном наборе вариантов осуществления, в дополнение к маслу и необязательного(ых) эмульгатора(ов), композиции адъюванта включают комбинацию монофосфорильного липида A (MPL-A) или его аналога, стерина и иммуностимулирующего олигонуклеотида («ТСМО»). Композиция адъюванта также может необязательно содержать поли I:С («ТСМYО») и/или сапонин («QTCMO» или «QTCMYO», соответственно).
[0012] В следующих альтернативных вариантах осуществления, в дополнение к маслу и необязательного(ых) эмульгатора(ов), композиции адъюванта также включают комбинацию четвертичного амина, гликолипида, MPL-A или его аналога, и поли I:С («ODYRM»).
[0013] В следующем наборе вариантов осуществления, в дополнение к маслу и необязательного(ых) эмульгатора(ов), композиции адъюванта также включают комбинацию сапонина, стерина, четвертичного амина, поликатионного носителя, при условии, что, если указанный поликатионный носитель представляет собой декстран DEAE, то антиген не является бактерином Е coli J-5 («QCDXO»).
[0014] В следующих вариантах осуществления, в дополнение к маслу и необязательного(ых) эмульгатора(ов), адъювант может включать иммуностимулирующий олигонуклеотид, источник алюминия, и, необязательно поликатионный носитель («ТОА» и «ТХО-А», соответственно).
[0015] В другом аспекте, композиция адъюванта согласно любому из вариантов осуществления, указанная выше, может включать антигенный компонент, таким образом, образуя вакцинную композицию, при условии, что антиген не является протеином E coli J-5, если композиция адъюванта состоит из (или в основном состоит из) DEAE декстрана, Quil А, холестерина и DDA, или если композиция адъюванта состоит из (или в основном состоит из) DEAE декстрана и иммуностимулирующего олигонуклеотида. В некоторых вариантах осуществления, вакцины данного аспекта содержат антиген(ы), которые происходят от возбудителей, действующих на крупный рогатый скот, овец, лошадей, или свиней. В других вариантах осуществления, вакцины данного аспекта содержат антиген(ы), которые происходят от возбудителей, действующих на птицу или кошачьих животных.
[0016] В дополнительных аспектах изобретения, предусмотрены различные комбинации антигенного соединения и композиции адъюванта.
[0017] Более конкретно, в третьем аспекте, изобретение предусматривает вакцинную композицию, которая содержит Eimeria maxima и/или Clostridium perfringens антиген и композицию адъюванта. В различных вариантах осуществления третьего аспекта, композиция адъюванта может включать масляную фазу, где указанная масляная фаза присутствует в количестве, по меньшей мере, 50% об./об. композиции; поликатионный носитель, и, необязательно, иммуностимулирующий олигонуклеотид. В других вариантах осуществления данного аспекта изобретения, изобретение предусматривает вакцинную композицию, которая содержит адъювантный компонент, содержащий масляную фазу, где указанная масляная фаза присутствует в количестве, по меньшей мере, 50% об./об. композиции; иммуностимулирующий олигонуклеотид, стерины, и монофосфорильный липид A (MPL-A) или его аналог.
[0018] В четвертом аспекте, изобретение предусматривает вакцинную композицию, которая содержит Neospora антиген и композицию адъюванта. В различных вариантах осуществления изобретения в соответствии с данным аспектом, композиция адъюванта содержит масляную фазу, где указанная масляная фаза присутствует в количестве, по меньшей мере, 50% об./об. композиции; и монофосфорильный липид A (MPL-A) или его аналог. В других вариантах осуществления, композиция адъюванта содержит масляную фазу, где указанная масляная фаза присутствует в количестве, по меньшей мере, 50% об./об. композиции, иммуностимулирующий олигонуклеотид и поликатионный носитель.
[0019] В пятом аспекте, изобретение предусматривает вакцинную композицию, которая содержит Chlamydophila abortis антиген и композицию адъюванта, которая содержит масляную фазу, где указанная масляная фаза присутствует в количестве, по меньшей мере, 50% об./об. композиции; стерин; иммуностимулирующий олигонуклеотид; монофосфорильный липид A (MPL-A) или его аналог; и поли I:С.
[0020] В шестом аспекте, изобретение предусматривает вакцинную композицию, которая содержит Streptococcus uberis (S. uberis) антиген и композицию адъюванта, которая содержит масляную фазу, где указанная масляная фаза присутствует в количестве, не менее 50% об./об. композиции; и поликатионный носитель. В различных вариантах осуществления данного шестого аспекта изобретения, композиция адъюванта также включает иммуностимулирующий олигонуклеотид. Альтернативно, или дополнительно, композиции адъюванта могут включать сапонин, стерин, и четвертичный амин.
[0021] В седьмом аспекте, изобретение предусматривает вакцинную композицию, которая содержит миостатин как антигенный компонент, и композицию адъюванта, где указанная композиция адъюванта содержит масляную фазу, где указанная масляная фаза присутствует в количестве, по меньшей мере, 50% об./об. композиции; иммуностимулирующий олигонуклеотид и или: поликатионный носитель; или MPL-A или его аналог. В наборе вариантов осуществления в соответствии с данным аспектом изобретения, композиция адъюванта содержит MPL-A или его аналог. В некоторых вариантах осуществления данного набора, композиция адъюванта содержит меньше, чем 0,5 мкг стерина на 50 мкл указанной вакцинной композиции, и в основном не содержит холестерин. Выбор миостатина зависит от вида субъекта. В одном выбранном варианте осуществления, выбранным видом является курица, и источником миостатина является куриный миостатин.
[0022] В восьмом аспекте, изобретение предусматривает вакцинную композицию, которая содержит A. pyogenes (ранее известный как Arcanobacterium pyogenes, Actinomyces pyogenes или Corynebacterium pyogenes; сейчас известен как Trueperella pyogenes) антиген и композицию адъюванта, где композиция адъюванта содержит масляную фазу, где указанная масляная фаза присутствует в количестве, по меньшей мере, 50% об./об. композиции; иммуностимулирующий олигонуклеотид и поликатионный носитель.
[0023] В девятом аспекте, изобретение предусматривает вакцинную композицию, которая содержит Е coli антиген, BRV антиген или BCV антиген, и композицию адъюванта, где указанная композиция адъюванта содержит масляную фазу, присутствующую в количестве, по меньшей мере, 50% об./об. указанной вакцинной композиции, иммуностимулирующий олигонуклеотид и, по меньшей мере, один из поликатионного носитель и источник алюминия.
[0024] В десятом аспекте, изобретение предусматривает вакцинную композицию, которая содержит Rhipicephalus microplus антиген и адъювант, где указанный адъювант выбирают из группы, состоящей из: а) водного адъюванта, содержащего иммуностимулирующий олигонуклеотид, сапонин, стерин, четвертичный амин, полиакриловый полимер, и гликолипиды; и b) на масляной основе адъювант, содержащий масляную фазу, присутствующую в количестве, по меньшей мере, 50% об./об. вакцинной композиции, и который содержит иммуностимулирующий олигонуклеотид и поликатионный носитель.
[0025] В одиннадцатом аспекте, изобретение предусматривает вакцинную композицию, которая содержит антиген вируса ящура (FMDV) и композицию адъюванта, где указанная композиция адъюванта содержит масляную фазу, присутствующую в количестве, по меньшей мере, 50% об./об. указанной вакцинной композиции, иммуностимулирующий олигонуклеотид и поликатионный носитель. В различных вариантах осуществления, антиген вируса ящура может представлять собой или немутантний тип FMDV, генетически модифицированные и/или ослабленные штаммы FMDV, или рекомбинантно экспрессированные структурные протеины FMDV, такие как вирусоподобные частицы (VLP) серотипов A, C, О, Asia1, SAT1, SAT2 или SAT3.
[0026] В двенадцатом аспекте, изобретение предусматривает способ генерирования диагностических или терапевтических антител, где способ включает иммунизацию животного-источника композицией адъюванта, согласно любому из вариантов осуществления, согласно первому аспекту изобретения, и антигеном, с последующим экстрагированием источника антител с животного-источника, и, если необходимо, очистки антител.
[0027] В некоторых вариантах осуществления животное-источник является крысой, мышью, морской свинкой, хомячком, крупным рогатым скотом, козой, кроликом, лошадью, свиньей или бараном. В некоторых вариантах осуществления животное-источник является кошкой или собакой.
[0028] В некоторых вариантах осуществления, особенно приемлемым для поликлональных антител, источником антител является сыворотка или молоко. В вариантах осуществлений, приемлемых для моноклональных антител, пригодным источником антител является клетка селезенки.
[0029] В некоторых вариантах осуществления, композиция адъюванта содержит иммуностимулирующий олигонуклеотид и поликатионный носитель. Адъювант необязательно может содержать источник алюминия, включающий источник алюминия, которое может представлять собой гель гидроксида алюминия. В некоторых вариантах осуществления, иммуностимулирующий олигонуклеотид представляет собой CpG, и поликатионный носитель представляет собой DEAE декстран.
[0030] В некоторых вариантах осуществления, антиген может быть выбран из FeLVgp70, Бычьего парагриповируса-3 BPI-3 (HN протеин), Histophilus somni р31, Bordetella FHA, Parapox, BVDV1 gp53, BVDV2 gp53, токсинов клостридии, собачьего цирковируса, антигенов Brachyspira hyodysenteriae (виды свиней); инактивированных цельных клеток и инактивированного пепсинового гидролизата.
[0031] Изобретение, кроме того, предусматривает способы применения вакцин в соответствии с от третьего до двенадцатого аспектов представленного изобретения.
Детальное описание выбранных вариантов осуществления
[0032] «Около» или «приблизительно», когда используется в связи с измеряемой числовой переменной, касается указанного значения переменной и всех значений переменной, которые находятся в пределах экспериментальной погрешности указанного значения (например, в пределах 95% доверительного интервала для среднего значения) или в пределах 10 процентов от указанного значения, в зависимости от того, что является большим, кроме тех случаев, когда примерно используется для ссылки на временные интервалы в неделях, где «примерно 3 недели,» составляет от 17 до 25 дней, и от примерно 2 до примерно 4 недель составляет от 10 до 40 дней.
[0033] «Адъювант» означает любое вещество, которое усиливает гуморальный или клеточный иммунный ответ на антиген. Адъюванты в целом используют для достижения двух целей: контролируемое высвобождение антигенов из места инъекции, и стимулирования иммунной системы.
[0034] «Композиция адъюванта» касается композиций, которые имеют повышающие антигенность антител свойства.
[0035] «Алкил» касается как линейных, так и разветвленных насыщенных углеводородных фрагментов.
[0036] «Амин» касается химического соединения, которое содержит азот. Амины представляют собой группу соединений, которые происходят из аммиака за счет замещения атомов водорода на углеводородные группы. «Четвертичный амин» касается соединения на основе аммония с четырьмя углеводородными группами.
[0037] «Антитело» касается молекулы иммуноглобулина, которая может связываться со специфическим антигеном в результате иммунного ответа на данный антиген. Иммуноглобулины представляют собой сывороточные протеины, которые состоят из «легких» и «тяжелых» полипептидных цепей, которые имеют «константный» и «вариабельный» участки и делятся на классы (например, IgA, IgD, IgE, IgG и IgM), основываясь на составе константных участков.
[0038] «Антиген» или «иммуноген» касается любого вещества, которое распознается иммунной системой животного и генерирует иммунный ответ. Термин включает убитые, инактивированные, ослабленные или модифицированные живые бактерии, вирусы или паразиты. Термин «антиген» также включает полинуклеотиды, полипептиды, рекомбинантные протеины, синтетические пептиды, протеиновые экстракты, клетки (включая клетки опухоли), ткани, полисахариды или липиды, или их фрагменты, индивидуально или в любой их комбинации. Термин антиген также включает антитела, такие как антиидиопатические антитела или их фрагменты, и синтетические пептидные мимеотопы, которые могут имитировать антиген или антигенный детерминант (эпитоп).
[0039] «Бактерии» означает суспензию из одного или нескольких убитых бактерий, которая может быть использована как компонент вакцины или иммуногенной композиции.
[0040] «Буфер» означает химическую систему, которая предотвращает изменение концентрации другого химического вещества, например, системы донора и акцептора протона служат как буферы, которые предотвращают заметные изменения в концентрации ионов водорода (pH). Дополнительный пример буфера представляет собой раствор, содержащий смесь слабой кислоты и ее соли (коньюгатная основа) или слабой основы и ее соли (коньюгатная кислота).
[0041] «Клеточный иммунный ответ» или «клеточно-опосредованный иммунный ответ» является ответом, опосредованным Т-лимфоцитами или другими белыми клетками крови или обоими, и включает продуцирование цитокинов, хемокинов и подобных молекул, продуцируемых активированными Т-клетками, белыми клетками крови, или обоими; или Т-лимфоцитом, или другим иммунным клеточным ответом, который убивает инфицированную клетку.
[0042] «Домашние животные» касаются собак, кошек и лошадей.
[0043] «Фактически состоящий», как применяется к композициям адъюванта, касается композиции, не содержащей неописанных дополнительных агентов, повышающих иммуногенность антител, или иммуномодулирующих агентов в количествах, при которых указанный агент осуществляет значительные повышающие иммуногенность антител или иммуномодулирующие эффекты.
[0044] «Гиперчувствительность замедленного типа (DTH)» касается воспалительного ответа, который развивается через от 24 до 72 часов после воздействия на антиген, который иммунная система распознает как чужеродный. Данный тип иммунного ответа включает, главным образом, Т клетки, а не антитела (продуцируемые В-клетками).
[0045] «Доза» касается вакцинной или иммуногенной композиции, которая предоставляется субъекту. «Первая доза» или «примирование вакцинное» касается дозы такой композиции, которая предоставляется в день 0. «Вторая доза» или «третья доза», или «ежегодная доза» касается количества такой композиции, которая предоставляется после первой дозы, которая может или не может быть такой же самой вакцинной или иммуногенной композицией, как первая доза.
[0046] Термин «эмульгатор» используется в широком смысле в представленном раскрытии. Он включает вещества, в целом, общепринятые как эмульгаторы, например, различные продукты TWEEN® или SPAN® линии продуктов (сложные эфиры жирных кислот полиэтоксилированного сорбита и поверхностно-активные вещества замещенного жирными кислотами сорбитана, соответственно), и различные повышающие растворимость вещества, такие как ПЭГ-40 касторовое масло или другое ПЭГилированное гидрогенизированное масло.
[0047] «Гуморальный иммунный ответ» касается ответа, который опосредуется антителами.
[0048] «Иммунный ответ» у субъекта касается развития гуморального иммунного ответа, клеточного иммунного ответа, или гуморального и клеточного иммунного ответа на антиген. Иммунные ответы, как правило, могут быть определены с использованием стандартных иммунологических анализов и анализов на нейтрализацию, которые известны в данной области из уровня техники.
[0049] «Иммунологически защитное количество» или «иммунологически эффективное количество» или «эффективное количество по продуцированию иммунного ответа» антигена является количеством, эффективным для индуцирования иммуногенного ответа у реципиента. Имуногенный ответ может быть достаточным для диагностических целей или иного исследования, или может быть достаточным для предупреждения проявлений или симптомов заболевания, в том числе неблагоприятных последствий для здоровья или их осложнений, вызванных инфекцией патогенного фактора заболевания. Индуцированными могут быть или гуморальный иммунитет, или клеточно-опосредованный иммунитет, или оба. Имуногенный ответ животного на иммуногенную композиция может быть оценен, например, опосредованно через измерения титров антител, по анализам пролиферации лимфоцитов, или непосредственно путем мониторинга проявлений и симптомов после заражения штаммом дикого типа, в то время как защитный иммунитет, который предоставляется вакциной, может быть оценен измерением, например, уменьшения клинических признаков, таких как смертность, заболеваемость, температурный показатель, общее физическое состояние, и общее состояние здоровья и активность субъекта. Иммунный ответ может содержать, без ограничения, индуцирование клеточного и/или гуморального иммунитета.
[0050] «Иммуногенные» означает такие, которые вызывают иммунный или антигенный ответ. Таким образом, имуногенная композиция будет любой композицией, вызывающей иммунный ответ.
[0051] «Иммуностимулирующая молекула» касается молекулы, которая стимулирует неантиген-специфический иммунный ответ.
[0052] «Липиды» касаются какой-либо из групп органических соединений, включающей жиры, масла, воски, стерины и триглицериды, которые являются нерастворимыми в воде, но растворимыми в неполярных органических растворителях, являются маслянистыми на ощупь, и вместе с углеводами и протеинами составляют основной структурный материал живых клеток.
[0053] «Фармацевтически приемлемый» касается веществ, которые находятся в пределах объема, с медицинской точки зрения, приемлемых для применения в контакте с тканями субъектов без чрезмерной токсичности, раздражения, аллергической реакции и т.д., соответствующие рациональному соотношению выгоды-к-риску, и эффективные для их использования по назначению.
[0054] Термин «Поли I:С» касается полимеров, которые встречаются в природе, полиинозиновой : полицитадиловой кислот, а также их синтетических форм, например, со стабилизированным скелетом и преимущественно, которые имеют TLR-3 агонистическую активность.
[0055] «Реактогенность» касается побочных эффектов, которые вызывают у субъекта ответ на введение адъюванта, иммуногенной или вакцинной композиции. Это может происходить в месте введения, и, как правило, оценивается с точки зрения развития целого ряда симптомов. Данные симптомы могут включать воспаление, покраснение и абсцесс. Кроме того, она оценивается с точки зрения возникновения, продолжительности и тяжести. «Низкая» реакция будет, например, включать отек, который можно обнаружить только при пальпации и не на глаз, или должна быть краткосрочной. Более тяжелая реакция была бы, например, реакцией, которая просматривается глазом или является долговременной.
[0056] «Комнатная температура» означает температуру от 18 до 25°C.
[0057] «Сапонин» касается группы поверхностно-активных гликозидов растительного происхождения, которая состоит из гидрофильного участка (как правило, несколько сахарных цепей) в сочетании с гидрофобным участком, или стероидной или тритерпеноидной структуры.
[0058] «Стероиды» касаются любой группы органических соединений, которые относятся к биохимическому классу липидов, которые легко растворяются в органических растворителях и в незначительной степени в воде. Стероиды содержат четырехкольцевую анелированную систему из трех анелированных циклогексановых (шестиуглеродных) колец плюс четвертое циклопентановое (пятиуглеродное) кольцо.
[0059] «Стерины» касаются соединений у животных, которые биологически продуцируются из терпеноидных предшественников. Они содержат стероидную кольцевую структуру, которая имеет гидроксильную (ОН) группу, как правило, присоединенную к углероду-3. Углеводородная цепь жирнокислотного заместителя варьирует по длине, как правило, от 16 до 20 атомов углерода, и может быть насыщенной или ненасыщенной. Стерины, как правило, содержат одну или более двойных связей в кольцевой структуре и также различные заместители, присоединенные к кольцам. Стерины и их сложные эфиры с жирными кислотами являются фактически нерастворимыми в воде.
[0060] «Субъект» касается любого животного, для которого введение адъювантной композиции является желательным. Он включает млекопитающих и не млекопитающих, включая приматов, домашний скот, домашних животных, лабораторных подопытных животных, диких животных, живущих в неволе, пернатых (в том числе в яйцах), рептилий и рыб. Таким образом, данный термин включает, но не ограничивается этим, обезьян, людей, свиней; крупный рогатый скот, овец, коз, лошадей, мышей, крыс, морских свинок, хомяков, кроликов, кошек, собак, кур, индеек, уток и других птиц, лягушек и ящериц.
[0061] «TCID50» касается «инфицирующей дозы для тканевой культуры» и определяется как такое разбавление вируса, которое необходимо для инфицирования 50% данной партии инокулированных клеточных культур. Различные способы могут быть использованы для расчета TCID50, в том числе способ Спирмена-Карбера, который используется по всему данному описанию. Для описания способа Спирмена-Карбера, смотри В.W. Mahy & Н.О. Kangro, Virology Methods Manual, p. 25-46 (1996).
[0062] «Терапевтически эффективное количество» касается количества антигена или вакцины, которое будет индуцировать иммунный ответ у субъекта, который получает антиген или вакцину, которое является достаточным для предупреждения или снижения проявлений или симптомов заболеваний, включая неблагоприятные последствия для здоровья или их осложнений, вызванных инфекцией с патогеном, таким как вирус или бактерии. Индуцированным может быть гуморальный иммунитет или клеточно-опосредованный иммунитет, или как гуморальный, так и клеточно-опосредованный иммунитет. Имуногенный ответ животного на вакцину может быть оценен, например, опосредовано путем измерения титров антител, по анализам пролиферации лимфоцитов, или непосредственно путем мониторинга проявлений и симптомов после заражения штаммом дикого типа. Защитный иммунитет, который предоставляется вакциной, может быть оценен измерением, например, уменьшением клинических признаков, таких как смертность, заболеваемость, температурный показатель, общее физическое состояние, и общее состояние здоровья и активность субъекта. Количество вакцины, которая является терапевтически эффективной, может варьировать в зависимости от конкретного адъюванта, который применяется, конкретного антигена, который применяется, или состояния субъекта, и может быть определено квалифицированным специалистом в данной области.
[0063] «Лечение» касается предупреждения расстройства, состояния или заболевания, к которому этот термин применяется, или для предупреждения или уменьшения одного или более симптомов такого расстройства, состояния или заболевания.
[0064] «Лечение» касается действия «лечение», как это определено выше.
[0065] «Тритерпеноиды» касаются большого и разнообразного класса органических молекул, которые встречаются в природе, которые получают из шести пятиуглеродных изопреновых (2-метил-1,3-бутадиеновых) единиц, которые могут быть собраны и модифицированы тысячами способов. Большинство из них являются многоциклическими структурами, которые отличаются друг от друга функциональными группами, и своими основными углеродными скелетами. Данные молекулы могут быть найдены во всех классах живых существ.
[0066] «Вакцина» касается композиции, включающей антиген, как определено в данном документе. Введение вакцины субъекту в результате приводит к иммунному ответу, как правило, против одного или нескольких конкретных заболеваний. Количество вакцины, которое является терапевтически эффективным, может варьировать в зависимости от конкретного антигена, который применяют, или состояния субъекта, и может быть определено квалифицированным специалистом в данной области.
Композиции адъювантов и способы получения
[0067] Настоящая заявка раскрывает несколько композиций адъювантов, приемлемых для настоящего изобретения. Общим признаком данных адъювантов является присутствие масла и одного или более эмульгаторов, где масляная фаза содержит более, чем 50% вакцинной композиции, включающей композиции адъювантов, раскрытые в данном документе.
[0068] Различные масла и их комбинации являются приемлемыми для применения в настоящем изобретении. Данные масла включают, без ограничения, животные жиры, растительные масла, а также масла, которые не метаболизируются. Неограничивающими примерами растительных масел, приемлемых согласно представленному изобретению, являются кукурузное масло, арахисовое масло, соевое масло, кокосовое масло и оливковое масло. Неограничивающим примером животных жиров является сквален. Приемлемые неограничивающие примеры масел, которые не метаболизируется, включают легкое минеральное масло, насыщенные масла с линейной или разветвленной цепью, и тому подобное.
[0069] В наборе вариантов осуществления, масло, которое используют в композициях адъювантов в настоящем изобретении, представляет собой легкое минеральное масло. Как используется в данном документе, термин «минеральное масло» касается смеси жидких углеводородов, полученных из вазелина, применяя методики дистилляции. Термин является синонимом «жидкого парафина», «жидкого вазелина» и «белого минерального масла». Термин также предусматривает включение «легкого минерального масла», то есть, масла, которое получают аналогичным образом путем дистилляции вазелина, но которое имеет несколько более низкую удельную плотность, чем белое минеральное масло. Смотри, например, Remington's Pharmaceuticals Sciences, 18th Edition (Easton, Pa.: Mack Publishing Company, 1990, страницы 788 и 1323). Минеральное масло могут получать из разных коммерческих источников, например, J.Т. Baker (Phillipsburg, Pa.), USB Corporation (Cleveland, Ohio). Предпочтительное минеральное масло представляет собой легкое минеральное масло, коммерчески доступное под названием DRAKEOL®.
[0070] Как правило, масляная фаза присутствует в количествах от 50% до 95% по объему; преимущественно, в количествах от более, чем 50% до 85%; более предпочтительно в количествах от более, чем 50% до 60%, и более предпочтительно в количестве более, чем 50-52%о об./об. вакцинной композиции. Масляная фаза включает масло и эмульгаторы (например, SPAN® 80, TWEEN® 80 и т.д.), если любые такие эмульгаторы присутствуют. Объем масляной фазы рассчитывают как сумму объемов масла и эмульгатора(ов). Таким образом, например, если объем масла составляет 40% и объем эмульгатора(ов) составляет 12% композиции, то масляная фаза должна присутствовать в количестве 52% об./об. композиции. Аналогичным образом, если масло присутствует в количестве примерно 45% и эмульгатор(ы) присутствует(ют) в количестве примерно 6% композиции, то масляная фаза присутствует в количестве примерно 51% об./об. композиции.
[0071] К тому же, следует понимать, что поскольку адъюванты в настоящем изобретении образуют только часть вакцины настоящего изобретения, масляная фаза присутствует в количествах от 50% до 95% по объему; преимущественно, в количествах от более, чем 50% до 85%; более предпочтительно в количествах от 50% до 60%, и более предпочтительно в количестве 50-52% об./об. каждого из адъювантов настоящего изобретения.
[0072] В подгруппе вариантов осуществления, которые применяются ко всем адъювантам/вакцинам в настоящем изобретении, объемный процент масла и растворимого в масле эмульгатора вместе составляет как минимум 50%, например, от 50% до 95% по объему; преимущественно, в количествах от более, чем 50% до 85%; более предпочтительно в количествах от 50% до 60%, и более предпочтительно в количестве 50-52%» об./об. вакцинной композиции. Таким образом, например, и без ограничения, масло может присутствовать в количестве 45%, и растворимый в липидах эмульгатор должен присутствовать в количестве более 5% об./об. Таким образом, объемный процент масла и растворимого в масле эмульгатора вместе должен составлять как минимум 50%.
[0073] Еще в другой подгруппе, которая применяется ко всем вакцинам изобретения, объемный процент масла составляет свыше 40%, например, от 40% до 90% по объему; от 40% до 85% от 43% до 60%, 44-50%) об./об. вакцинной композиции.
[0074] Эмульгаторы, приемлемые для применения в представленных эмульсиях, включают природные биологически совместимые эмульгаторы и неестественные синтетические поверхностно-активные вещества. Биологически совместимые эмульгаторы включают фосфолипидные соединения или смесь фосфолипидов. Предпочтительные фосфолипиды представляют собой фосфатидилхолин (лецитин), такой как соевый или яичный лецитин. Лецитин могут получать как смесь фосфатидов и триглицеридов путем промывания водой сырых растительных масел, и разделения и сушки полученных в результате гидратированных смол. Очищенный продукт могут получать путем фракционирования смеси в нерастворимые в ацетоне фосфолипиды и гликолипиды, которые остаются после удаления триглицеридов и растительного масла за счет промывания ацетоном. Альтернативно, лецитин могут получать из разных коммерческих источников. Другие приемлемые фосфолипиды включают фосфотидилглицерин, фосфотидилинозитол, фосфотидилсерин, фосфатидную кислоту, кардиолипин, и фосфотидилэтаноламин. фосфолипиды могут быть выделены из природных источников или синтезированы традиционным способом.
[0075] В дополнительных вариантах, эмульгаторы, которые используют в данном документе, не включают лецитин, или используют лецитин в количествах, которые не являются иммунологически эффективными.
[0076] Неестественные, синтетические эмульгаторы, приемлемые для применения в композициях адъювантов согласно представленному изобретению, включают на основе сорбитана неионные поверхностно-активные вещества, например, замещенные жирными кислотами на основе сорбитана поверхностно-активные вещества (коммерчески доступные под названием SPAN® или ARLACEL®), сложные эфиры жирных кислот с полиэтоксилированным сорбитом (TWEEN®), сложные эфиры полиэтиленгликоля и жирных кислот из источников, таких как касторовое масло (EMULFOR®); полиэтоксилированной жирной кислоты (например, стеариновой кислоты, доступной под названием SIMULSOL® М-53), полиэтоксиллированньгй изооктилфенол/ формальдегидный полимер (TYLOXAPOL®), простые эфиры полиоксиэтилен жирного спирта (BRIJ®) полиоксиэтилен-нефенильные простые эфиры (TRITON® N), полиоксиэтилен изооктилфениловые простые эфиры (TRITON® X). Предпочтительные синтетические поверхностно-активные вещества представляют собой поверхностно-активные вещества, доступные под названием SPAN® и TWEEN®, такие как TWEEN®-80 (полиоксиэтилен (20) сорбитана моноолеат) и SPAN®-80 (сорбитана моноолеат).
[0077] Вообще говоря, эмульгатор(ы) может присутствовать в вакцинных композиции в количествах от 0,01% до 40% по объему, преимущественно, от 0,1% до 15%, более предпочтительно от 2% до 10%.
[0078] Дополнительные ингредиенты, присутствующие в представленных композициях адъювантов, включают катионные носители, иммуностимулирующие олигонуклеотиды, монофосфолипид A и их аналоги (MPL-A), полиинозиновую : полицитидиловую кислоту (поли I:С), сапонины, четвертичный аммоний, стерины, гликолипиды, источник алюминия (например, REHYDRAGEL® или VAC 20® влажный гель) и их комбинации.
[0079] Приемлемые катионные носители включают, без ограничения, декстран, декстран DEAE (и их производные), ПЭГ, гуаровые смолы, производные хитозана, производные полицеллюлозы, такие как гидроксиэтилцеллюлоза (НЕС) полиэтилэнимин, полиамины, такие как полилизин, и тому подобное.
[0080] Приемлемые иммуностимулирующие олигонуклеотиды включают ODN (на основе ДНК), ORN (на основе РНК) олигонуклеотиды или химерные ODN-ORN структуры, которые могут иметь модифицированный скелет, включая, без ограничения, фосфоротиоатные модификации, галогенирование, алкилирование (например, этил- или метил модификации), и фосфодискладноэфирные модификации. В некоторых вариантах осуществления использованной может быть поли-инозиновая - цитидилова кислота или ее производная (поли I:С).
[0081] CpG олигонуклеотиды представляет собой недавно описанный класс фармакотерапевтических агентов, которые характеризуются присутствием неметилированного CG динуклеотида в специфических контекстах базовой последовательности (CpG мотив). (Hansel ТТ, Barnes PJ (eds): New Drugs for Asthma, Allergy и COPD. Prog Respir Res. Basel, Karger, 2001, vol 31, pp 229-232, которая включена в данный документ в виде ссылки). Данные CpG мотивы не обнаружены в эукариотической ДНК, в которой супресируются CG динуклеотиды, и, когда присутствуют, как правило, метилированные, но присутствуют в бактериальной ДНК, которой они оказывают иммуностимулирующие свойства.
[0082] В выбранных вариантах осуществления, адъюванты согласно представленному изобретению используют так называемый иммуностимулирующий олигонуклеотид Р-класса, более предпочтительно, модифицированные иммуностимулирующие олигонуклеотиды Р-класса, еще более предпочтительно, Е-модифицированные олигонуклеотиды Р-класса. Иммуностимулирующие олигонуклеотиды Р-класса являются CpG олигонуклеотидами, которые характеризуются присутствием палиндромов, в целом длиной в 6-20 нуклеотидов. Олигонуклеотиды P-класса обладают способностью спонтанно самоорганизовываться в конкатемеры или in vitro и/или in vivo. Данные олигонуклеотиды являются, в узком смысле, одноцепочными, но присутствие палиндромов позволяет образование конкатемеров или, возможно, стволовых-и-петельных структур. Общая длина иммуностимулирующих олигонуклеотидов P-класса составляет от 19 до 100 нуклеотидов, например, 19-30 нуклеотидов, 30-40 нуклеотидов, 40-50 нуклеотидов, 50-60 нуклеотидов, 60-70 нуклеотидов, 70-80 нуклеотидов, 80-90 нуклеотидов, 90-100 нуклеотидов.
[0083] В одном аспекте изобретения иммуностимулирующий олигонуклеотид содержит 5' TLR активационный домен и, по меньшей мере, два палиндромных участка, где один палиндромный участок является 5' палиндромным участком с, по меньшей мере, 6 нуклеотидами в длину и присоединенным к 3' палиндромному участку с, по меньшей мере 8 нуклеотидами в длину или непосредственно или через спейсер.
[0084] Иммуностимулирующие олигонуклеотиды P-класса могут быть модифицированы в соответствии со способами, известными в данной области из уровня техники. Например, J-модификация касается йодо-модифицированных нуклеотидов. Е-модификация касается этил-модифицированного(ых) нуклеотида(ов). Таким образом, Е-модифицированные иммуностимулирующие олигонуклеотиды P-класса представляют собой иммуностимулирующие олигонуклеотиды P-класса, в которых, по меньшей мере, один нуклеотид (преимущественно 5' нуклеотид) является этилированным. Дополнительные модификации включают присоединение 6-нитро-бензимидазола, O-метилирование, модификацию с проинин-dU, инозиновую модификацию, 2-бромвиниловое присоединение (преимущественно к уридину).
[0085] Иммуностимулирующие олигонуклеотиды P-класса, кроме того, могут содержать модифицированную межнуклеотидную связь, включая, без ограничения, фосфодискладноэфирные связи и фосфоротиоатные связи. Олигонуклеотиды согласно представленному изобретению могут быть синтезированы или получены из коммерческих источников.
[0086] Олигонуклеотиды P-класса и модифицированные олигонуклеотиды Р-класса дополнительно раскрыты в опубликованной заявке РСТ№WO2008/068638, опубликованой 12 июня 2008. Приемлемые неограничивающие примеры модифицированных иммуностимулирующих олигонуклеотидов P-класса представлены ниже (в SEQ ID NO 1-10, «*» касается фосфоротиоатной связи и «_» касается фосфодисложноэфирной связи). В 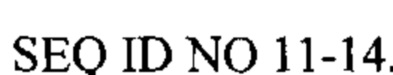 , все связи представляют собой фосфодисложноэфирные связи.
, все связи представляют собой фосфодисложноэфирные связи.

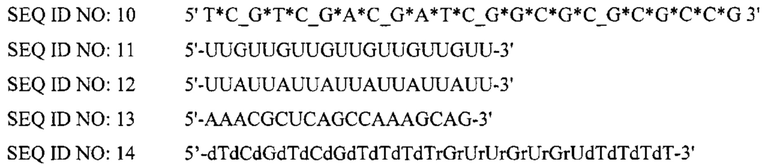
[0087] Количество иммуностимулирующего олигонуклеотида P-класса для применения в композициях адъювантов зависит от природы иммуностимулирующего олигонуклеотида P-класса, который используется, и предусмотреных видов.
[0088] Приемлемые аналоги MPL-A включают, без ограничения, природные LPS, которые могут быть бактериального происхождения, измененной или неизмененной стуктуры, или синтетический, глюкопиранозильный липидный адъювант (GLA), пертактин, варьируя заместителями в 3-О-положении восстанавливающего сахара, синтетические формы аналога липида А с низкой эндотоксичностью.
[0089] Стерины имеют совместное общее химическое ядро, представляющее собой стероидную кольцевую структуру [и], которые имеют гидроксильную (ОН) группу, как правило, присоединенная к углероду-3. Углеводородная цепь жирнокислотного заместителя варьирует в длину, как правило, от 16 до 20 атомов углерода, и может быть насыщенной или ненасыщенной. Стерины, как правило, содержат одну или более двойных связей в кольцевой структуре и также ряд заместителей, присоединенных к кольцам. Стерины и их сложные эфиры с жирными кислотами являются фактически нерастворимыми в воде. С точки зрения данных химических подобий, таким образом, возможно, что стерины, которые имеют общее данное химическое ядро, будут иметь подобные свойства, когда их применяют в вакцинных композициях согласно представленному изобретению. Стерины хорошо известны в данной области из уровня техники и могут быть приобретены на коммерческой основе. Например, холестерин раскрыт в Merck Index, 12th Ed., p. 369. Приемлемые стерины включают, без ограничения, β-ситостерин, стигмастерин, эргостерин, эргокальциферол и холестерин.
[0090] Приемлемые сапонины включают тритерпеноидные сапонины. Данные тритерпеноиды представляют собой группу поверхностно-активных гликозидов растительного происхождения и имеют совместное общее химическое ядро, состоящее из гидрофильного участка (как правило несколько сахарных цепей) в сочетании с гидрофобным участком или стероидной или тритерпеноидной структурой. Из-за этого сходства, сапонины, которые имеют общее данное химическое ядро, являются вероятно такими, которые имеют аналогичные повышающие иммуногенность антител свойства. Тритерпеноиды, приемлемые для применения в адъювантной композиции, могут поступать из различных источников, или растительного происхождения или синтетические эквиваленты, включая, но не ограничиваясь этим, экстракт коры панама дерева, томатин, экстракты женьшеня, грибы и алкалоидный гликозид, структурно схожий со стероидными сапонинами.
[0091] Если используется сапонин, адъювантные композиции в целом содержат фракцию иммунологически активного сапонина из коры панама дерева. Сапонин может быть, например, Quil А или другой очищенный или частично очищенный препарат сапонина, который может быть получен на коммерческой основе. Таким образом, экстракты сапонина могут использоваться как смеси или очищенные индивидуальные компоненты, такие как QS-7, QS-17 QS-18 и QS-21. В одном варианте осуществления Quil А имеет, по меньшей мере, 85% чистоты. В других вариантах осуществления Quil А имеет, по меньшей мере, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% чистоты.
[0092] Четвертичные аминные соединения представляют собой соединения на основе аммония с четырьмя углеводородными группами. На практике, углеводородные группы в целом ограничиваются алкильными или арильными группами. В наборе вариантов осуществления, четвертичные аминные соединения состоят из четырех алкильных цепей, две из которых являются С10-С20 алкилами, и последние две являются С1-С4 алкилами. В одном наборе вариантов осуществления, четвертичный амин является диметилдиоктадециламмония бромидом, хлоридом или фармацевтически приемлемым противоионом (DDA).
[0093] Приемлемые гликолипиды, в целом, являются такими, которые активируют Th2 ответ. Гликолипиды включают, без ограничения, те, которые охватываются формулой I и которые, в целом, описаны в публикации US 20070196384 (Ramasamy et al).
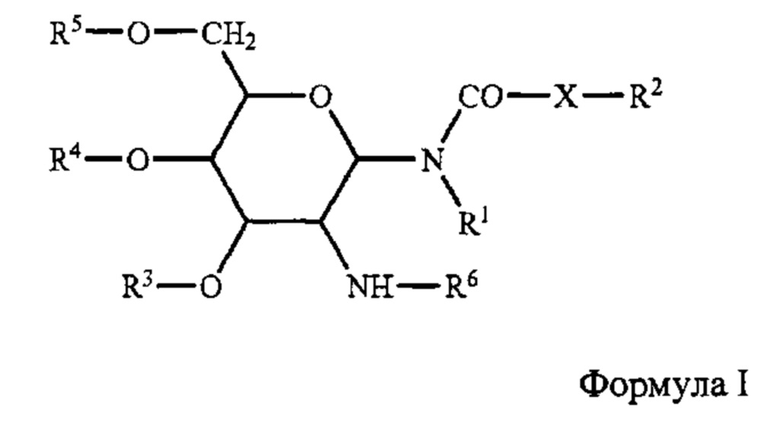
[0094] В структуре формулы I, R1 и R2 независимо являются водородом или насыщенным алкильным радикалом, который имеет до 20 атомов углерода; X является -CH2-, -О- или -NH-; R2 является водородом, или насыщенным или ненасыщенным алкильным радикалом, который имеет аж до 20 атомов углерода; R3, R4, и R5 независимо являются водородом, -SO42-, -РО42-, -COC1-10 алкилом; R6 является L-аланином, L-альфа-аминобутилом, L-арганилом, L-аспаргинилом, L-аспартилом, L-цистеинилом, L-глутамилом, L-глицилом, L-гистидилом, L-гидроксипропилом, L-изолейцилом, L-лейцилом, L-лизилом, L-метионилом, L-орнитилом, L-фенилаланилом, L-пролилом, L-серилом, L-треонилом, L-тирозилом, L-триптофанилом и L-валилом или их D-изомерами.
[0095] В наборе вариантов осуществления, приемлемый гликолипид представляет собой N-(2-дезокси-2-L-лейциламино-b-D-глюкопиранозил)-N-октадецилдодеканоиламид или его ацетат.
[0096] Алюминий является известным адъювантом или компонентом композиции адъювантов и является коммерчески доступным в таких формах как Reheis, Inc, Brentag алюмогидрогель REHYDRAGEL® или VAC 20® влажный гель. REHYDRAGEL® является кристаллическим оксигидроксидом алюминия, известным из минералогии как бемит. Он является эффективным в вакцинах, когда существует необходимость связывать отрицательно заряженные протеины. Содержание Al2O3 находится в диапазоне от 2% до 10% в зависимости от сорта, и его вязкость составляет 1000-1300 сП. В целом, он может быть описан как адсорбент гельгидрат оксида алюминия. VAC® 20 влажный гель представляет собой белый или почти белый, прозрачный, вязкий коллоидный гель. В некоторых вариантах осуществления, содержание Al2O3 составляет примерно 2% масс./об.
[0097] В других вариантах осуществления, источник алюминия также может быть получен за счет процессов осажденного гидроксида алюминия.
[0098] В некотором наборе вариантов осуществления, в дополнение к маслу и необязательного одного или более эмульгаторов, композиции адъювантов также содержат (или фактически состоят, или состоят) комбинацию из монофосфорильного липида А (MPL-A) или его аналога, стерина и иммуностимулирующего олигонуклеотида. Адъюванты, которые содержат данные ингредиенты упоминаются как «ТСМО». ТСМО композиция адъюванта, кроме того, может необязательно включать поли I:С («TCMYO») и/или сапонин. Таким образом, композиции адъювантов, которые содержат или фактически состоят из, или состоят из комбинации монофосфорильного липида A (MPL-A) или его аналога, стерина и иммуностимулирующего олигонуклеотида и сапони на, называются как «QTCMO». Кроме того, композиции адъювантов также могут включать поли I:С. Такие адъюванты называются как «QTCMYO».
[0099] В наборе вариантов осуществления, ТСМО адъюванты содержат легкое минеральное масло в количестве от 40% до 50% об./об. от общего объема вакцинной композиции. Эмульгаторы включают TWEEN-80 и SPAN-80, в количестве от 0,1% до 40% об./об. от общего объема вакцинной композиции, при условии, что сорбитана моноолеат и масло вместе составляют от примерно 50,5% до 52% об./об. композиции. Иммуностимулирующий олигонуклеотид представляет собой ODN преимущественно палиндром, который содержит ODN, необязательно, с модифицированным скелетом.
[00100] В некоторых вариантах осуществления, одна доза ТСМО содержит от примерно 1 мкг до примерно 400 мкг иммуностимулирующего олигонуклеотида, от примерно 1 мкг до примерно 1000 мкг стерина, от примерно 0,1 мкг до 500 мкг MPL-A или его аналога.
[00101] Количества других соединений на дозу выбирают на основании видов субъектов.
[00102] Например, в некоторых вариантах осуществления приемлемая для крупного рогатого скота, овец или взрослых свиней одна доза ТСМО будет содержать от примерно 50 до 400 мкг (например, 50-300, или 100-250 мкг, или от примерно 50 до примерно 100 мкг для взрослых свиней и от примерно 100 до примерно 250 мкг для крупного рогатого скота) иммуностимулирующего олигонуклеотида, от примерно 100 до примерно 1000 мкг (например, 200-1000, 250-700 мкг, или примерно 400-500 мкг) стерина, такого как холестерин, и от примерно 5 до примерно 500 мкг (например, 5-100 мкг, или 5-50 мкг, или 10-25 мкг) MPL-A или его аналога.
[00103] В некоторых вариантах осуществления приемлемая для домашних животных или поросят одна доза ТСМО будет содержать от примерно 5 до 100 мкг (например, 10-80 или 20-50 мкг) иммуностимулирующего олигонуклеотида, от примерно 5 до 100 мкг (например, 10 80, или 20-50 мкг) стерина, такого как холестерин, и от примерно 0,5 до примерно 200 мкг (например, 1-100 мкг, или 5-50 мкг, или 5-20 мкг) MPL-A или его аналога.
[00104] В некоторых вариантах осуществления приемлемая для домашней птицы одна доза ТСМО адъюванта будет содержать от примерно 0,1 до примерно 5 мкг (например, 0,5-3 мкг, или 0,9-1,1 мкг) иммуностимулирующего олигонуклеотида, от примерно 0,5 до примерно 50 мкг (например, 1-20 мкг, или 1-10 мкг) стерина, такого как холестерин, и от примерно 0,1 до 10 мкг (например, 0,5-5 мкг, или 1-5 мкг) MPLA или его аналога). MPL-A присутствует в количестве от 0,1 мкг/доза до 2000 мкг/доза.
[00105] В некоторых вариантах осуществления ТСМО адъюванты получают следующим способом:
a) Сорбитана моноолеат, MPL-A и холестерин растворяют в легком минеральном масле. Полученный в результате раствор масла подвергают стерильной фильтрации;
b) Иммуностимулирующий олигонуклеотид и полиоксиэтилен (20) сорбитана моноолеат растворяют в водной фазе, таким образом, образуя водный раствор;
c) Водный раствор добавляют к раствору масла при непрерывной гомогенизации, таким образом, создавая композицию адъюванта ТСМО.
[00106] В TCMYO адъювант холестерин, масло, необязательные эмульгаторы, MPL-A и иммуностимулирующие олигонуклеотиды присутствуют как в ТСМО композиции адъюванта для соответствующих видов. Поли I:С может присутствовать, в целом, в количестве от примерно 1 мкг до примерно 100 мкг на дозу.
[00107] Более конкретно, поли I:C может присутствовать в количестве 5-100 мкг на дозу (например, 5-50 мкг, или 10-30 мкг) в некоторых вариантах осуществления приемлемые для крупного рогатого скота, взрослых свиней, или овец. В некоторых вариантах осуществления приемлемая для домашних животных или поросят одна доза TCMYO содержит от примерно 1 до примерно 50 мкг (например, 5-50 мкг, или 10-20 мкг) поли I:С. В некоторых вариантах осуществления приемлемые для вакцин для домашней птицы одна доза TCMYO содержит от примерно 1 до примерно 10 мкг (например, 1-5 мкг, или 3-5 мкг) поли I:С.
[00108] В некоторых вариантах осуществления, TCMYO адъюванты получают аналогично ТСМО адъювантов, и поли I:C добавляют к водному раствору.
[00109] В наборе вариантов осуществления, в QTCMO адъювантах холестерин, масло, необязательные эмульгаторы, MPL-A, и иммуностимулирующие олигонуклеотиды присутствуют как в ТСМО композиции адъюванта для соответствующих видов. Сапонин преимущественно представляет собой Quil А или его очищенную фракцию, и может присутствовать в количествах от примерно 0,1 мкг до примерно 1000 мкг на дозу.
[00110] Более конкретно, в некоторых вариантах осуществления в приемлемых вакцинах для домашней птицы сапонин может присутствовать в количестве от 0,1 до 5 мкг на 50 мкл вакцинной композиции (например, 0,5-30 мкг на 50 мкл композиции, или более преимущественно 1-10 мкг) на дозу. В некоторых вариантах осуществления приемлемых для применения у домашних животных и поросят, сапонин, например, Quil А или его очищенная фракция, присутствует в количествах от примерно 10 до примерно 100 мкг на дозу (например, 10-50 мкг или 20-50 мкг на дозу). В некоторых вариантах осуществления приемлемый для крупного рогатого скота, взрослых свиней или овец, сапонин, такой как Quil А или его очищенная фракция, присутствует в количестве от примерно 100 до примерно 1000 мкг на дозу (например, 200-800 мкг, или 250-500 мкг на дозу).
[00111] В некоторых вариантах осуществления QTCMO адъюванты получают аналогично ТСМО адъювантов, и сапонин добавляют к водному раствору.
[00112] В наборе вариантов осуществления, в QTCMYO адъювантах, сапонин присутствует как в QTCMO адъюванте, и последние из ингредиентов присутствуют как в TCMYO для соответствующих видов.
[00113] В некоторых вариантах осуществления QTCMYO адъюванты получают аналогично TCMYO адъювантов, и сапонин добавляют к водному раствору.
[00114] В альтернативных вариантах осуществления, в дополнение к маслу и необязательного(ых) эмульгатора(ов), композиции адъювантов также содержат (или фактически состоят из, или состоят из) комбинацию из монофосфорильного липида A (MPL-A) или его аналога и поликатионного носителя. Данные адъюванты называются как «ХОМ».
[00115] В наборе вариантов осуществления, в ХОМ адъювантах для домашних животных или поросят, поликатионный носитель присутствует в количестве 1-50 мг на дозу (например, 1-25 мг на дозу, или 10-25 мг на дозу), и MPL-A или его аналог присутствует в количестве примерно 1-50 мкг на дозу (например, 1-25 мкг на дозу, или 10-25 мкг на дозу).
[00116] В некоторых вариантах осуществления приемлемый для крупного рогатого скота, овец и взрослых свиней, поликатионный носитель присутствует в количестве от примерно 5 до примерно 500 мг на дозу (например, 10-500 мг, или 10-300 мг, или 50-200 мг на дозу) и MPL-A или его аналог присутствует в количестве от примерно 1 до примерно 100 мкг на дозу (например, 5-100 мкг, или 5-50 мкг, или 10-30 мкг).
[00117] В некоторых вариантах осуществления приемлемый для домашних животных и поросят, поликатионный носитель присутствует в количестве от примерно 1 до примерно 50 мг на дозу (например, 1-25 мг на дозу, или 10-25 мг на дозу), и MPL-А или его аналог присутствует в количестве от примерно 0,5 до примерно 200 мкг (например, 1-100 мкг, или 5-50 мкг, или 5-20 мкг) на дозу.
[00118] В некоторых вариантах осуществления в приемлемых вакцинах для домашней птицы, поликатионный носитель присутствует в количестве от 0,5 до 25 мг на дозу (например, 1-20 мг, 1-10 мг 5-10 мг), и MPL-A или его аналог присутствует в количестве от примерно 0,5 и 10 мкг на дозу (например, 1-10 мкг, или 1-5 мкг, или 2-5 мкг).
[00119] В некоторых вариантах осуществления, ХОМ адъюванты получают следующим способом:
a) Сорбитана моноолеат, MPL-A и холестерин растворяют в легком минеральном масле. Полученный в результате раствор масла подвергают стерильной фильтрации;
b) Декстран DEAE и полиоксиэтилен (20) сорбитана моноолеат растворяют в водной фазе, таким образом создавая водный раствор;
c) Водный раствор добавляют к раствору масла при непрерывной гомогенизации, таким образом, создавая композицию адъюванта ХОМ.
[00120] В дополнительных альтернативных вариантах осуществления, в дополнение к маслу и эмульгатору(ам), композиции адъювантов также содержат (или фактически состоят из, или состоят из) комбинацию из иммуностимулирующего олигонуклеотида и поликатионного носителя, при условии, что если указанный поликатионный носитель является декстраном DEAE, то антиген не является бактерином Е coli J-5. Данные адъюванты называются как «ТХО». В некоторых вариантах осуществления вакцины, в которые добавляют адъювант с ТХО, содержащие антиген(ы), который(ые) содержит возбудители, которые инфицируют крупный рогатый скот, овец, лошадей или свиней. В других вариантах осуществления антигены получают из указанных возбудителей. В других вариантах осуществления, вакцины, в которые добавляют адъювант с ТХО содержат антиген(ы), который(ые) содержит возбудители, которые инфицируют птицу или кошек, или антигены могут получать из таких возбудителей. В наборе вариантов осуществления, ТХО адъюванты также могут включать источник алюминия, такой как гель Al(OH)3. ТХО адъюванты с алюминием называются как «ТХО-А».
[00121] В наборе вариантов осуществления, в ТХО адъювантах, иммуностимулирующий олигонуклеотид, преимущественно ODN, который преимущественно содержит палиндромную последовательность, и необязательно с модифицированным скелетом, может присутствовать в количестве 0,5-400 мкг на дозу, и поликатионный носитель может присутствовать в количестве 0,5-400 мг на дозу. Дозировку варьируют в зависимости от вида субъекта.
[00122] Например, в некоторых вариантах осуществления, приемлемая для крупного рогатого скота, овец или взрослых свиней одна доза ТХО будет содержать от примерно 50 до 400 мкг (например, 50-300, или 100-250 мкг, или от примерно 50 до примерно 100 мкг для взрослых свиней и от примерно 100 до примерно 250 мкг для крупного рогатого скота) иммуностимулирующего олигонуклеотида, и поликатионный носитель может присутствовать в количестве от примерно 5 до примерно 500 мг на дозу (например, 10-500 мг, или 10-300 мг или 50-200 мг на дозу).
[00123] В некоторых вариантах осуществления, приемлемая для домашних животных или поросят одна доза ТХО будет содержать от примерно 5 до 100 мкг (например, 10-80 мкг, или 20-50 мкг) иммуностимулирующего олигонуклеотида, тогда как поликатионный носитель может присутствовать в количестве 1-50 мг на дозу (например, 1-25 мг на дозу, или 10-25 мг на дозу).
[00124] В некоторых вариантах осуществления, приемлемая для домашней птицы одна доза ТХО адъюванта будет содержать от примерно 0,1 до примерно 5 мкг (например, 0,5-3 мкг, или 0,9-1,1 мкг) иммуностимулирующего олигонуклеотида, и поликатионный носитель может присутствовать в количестве от 0,5 до 25 мг на дозу (например, 1-20 мг, 1-10 мг, 5-10 мг).
[00125] В некоторых вариантах осуществления ТХО адъюванты получают следующим способом:
a) Сорбитана моноолеат растворяют в легком минеральном масле. Полученный в результате раствор масла подвергают стерильной фильтрации;
b) Иммуностимулирующий олигонуклеотид, декстран DEAE и полиоксиэтилен (20) сорбитана моноолеат растворяют в водной фазе, таким образом, образуя водный раствор; и
c) Водный раствор добавляют к раствору масла при непрерывной гомогенизации, таким образом, создавая композицию адъюванта ТХО.
[00126] В наборе вариантов осуществления, в ТХО-А адъювантах, иммуностимулирующий олигонуклеотид присутствует как ТХО адъювант, источник алюминия присутствует в количестве до 40% об./об. (Например, 35%, 30%, 25%, 20%, 15%, 10%, 5%, 1%). В наборе вариантов осуществления, источник алюминия присутствует в количестве 2%-20% об./об. от вакцинной композиции, более предпочтительно от примерно 5% до примерно 17% об./об.
[00127] В некоторых вариантах осуществления, ТХО-А адъюванты получают аналогично ТХО адъювантам, и источник алюминия добавляют к водному раствору.
[00128] В дополнительных вариантах осуществления, адъюванты согласно представленному изобретению содержат масло, необязательный(ые) эмульгатор(ы), иммуностимулирующий олигонуклеотид и источник алюминия. Данные соединения присутствуют в диапазонах, раскрытых для ТХО-А адъюванта, за исключением того, что поликатионный носитель отсутствует в ТОА. ТОА адъювант получают аналогично ТХО адъюванта, за исключением того, что водная фаза содержит источник алюминия, а не DEAE декстран.
[00129] В некоторых вариантах осуществления, в дополнение к маслу и эмульгатору(ам), композиции адъювантов также содержат (или фактически состоят из, или состоят из) комбинацию из поликатионного носителя и источника алюминия. Данный адъювант называется АХО. Данные соединения могут присутствовать в количествах аналогичных тем, которые присутствуют в адъюванте ТХО-А для соответствующих видов, и адъювант АХО могут получить аналогично ТХО-А, но без добавления иммуностимулирующего олигонуклеотида.
[00130] В некоторых других вариантах осуществления, в дополнение к маслу и эмульгатору(ам), композиции адъювантов также содержат (или фактически состоят из, или состоят из) комбинацию сапонина и стерина. Данный адъювант называется как QCO. Природа и количество ингредиентов QCO являются аналогичными количеству сапонина, стерина, масла и эмульгатора(ов) в адъюванте QTCMO. QCO могут получить путем добавления водного раствора, содержащего сапонин, стерин и, преимущественно, растворимый в воде эмульгатор в масляной фазе, содержащий масло и, преимущественно, растворимый в масле эмульгатор при непрерывной гомогенизации.
[00131] Еще в следующих альтернативных вариантах осуществления, в дополнение к маслу и эмульгатору(ам), композиции адъювантов также содержат (или фактически состоят из, или состоят из) комбинацию из четвертичного амина, гликолипидов, MPL-A или его аналога, и поли I:С. Данные адъюванты называются как «ODYRM».
[00132] В ODYRM адъювантах, масло, в целом, представляет собой смесь фосфолипидов, таких как фосфотидилхолины. AMPHIGEN® представляет собой приемлемый пример такого масла, и должнен присутствовать в количестве аналогичном количеству масла, как описано выше.
[00133] В наборе вариантов осуществления, в ODYRM адъювантах, четвертичный амин, например, DDA, присутствует в количестве от примерно 1 мкг до примерно 200 мкг на дозу, поли I:С присутствует в количестве от примерно 0,5 мкг до 100 мкг на дозу, гликолипиды присутствуют в количестве от примерно 0,5 мкг до примерно 2000 мкг на дозу, и MPL-A или его аналог присутствует в количестве от примерно 0,5 мкг до 100 мкг на дозу.
[00134] Более конкретно, в некоторых вариантах осуществления, приемлемый для введения крупному рогатому скоту, взрослым свиньям или овцам, четвертичный амин может присутствовать в количестве от примерно 50 мкг до примерно 200 мкг на дозу (например, 50-150 мкг, или примерно 100 мкг), поли I:С может присутствовать в количествах от примерно 1 мкг до примерно 100 мкг на дозу (например, 1-50 мкг или 5-50 мкг), гликолипиды могут присутствовать в количестве от примерно 500 мкг до примерно 2000 мкг на дозу (например, 500-100 мкг или примерно 1000 мкг), и MPLA или его аналог может присутствовать в количестве от примерно 5 мкг до примерно 100 мкг на дозу (например, 5-50 мкг, или 10-50 мкг).
[00135] В некоторых вариантах осуществления, приемлемый для введения домашним животным и поросятам, четвертичный амин может присутствовать в количестве от примерно 5 до примерно 500 мкг на дозу (например, 10-100 мкг на дозу, или 20-50 мкг на дозу), поли I:С может присутствовать в количестве от примерно 5 мкг до примерно 25 мкг на дозу (например, 50-20 мкг, или примерно 10 мкг), гликолипиды могут присутствовать в количестве от примерно 10 до примерно 100 мкг на дозу (например, 20-100 мкг или 25-50 мкг) и MPL-A или его аналог может присутствовать в количестве от примерно 5 до примерно 50 мкг на дозу (например, 5-20 мкг, или 10-20 мкг).
[00136] В некоторых других вариантах осуществления, в приемлемых вакцинах для домашней птицы, одна доза будет содержать от примерно 1 мкг до примерно 10 мкг четвертичного аминного соединения (например, 5-10 мкг, или примерно 5 мкг), от примерно 0,5 до примерно 10 мкг поли I:С (например, 1-10 мкг или 1-5 мкг), от примерно 0,5 и 10 мкг гликолипидов (например, 1-10 мкг, или 5-10 мкг, или 1-5 мкг), и от примерно 0,5 мкг до примерно 5 мкг MPL-A или его аналога (например, 0,5-5 мкг или 1-5 мкг).
[00137] В некоторых вариантах осуществления, OSYM адъюванты получают следующим способом:
a) Сорбитана моноолеат, MPL-A растворяют в легком минеральном масле. Полученный в результате раствор масла подвергают стерильной фильтрации и диспергируют в воде с некоторым количеством поверхностно-активного вещества, этанола и уксусной кислоты;
b) Полиоксиэтилен (20) сорбитана моноолеат, четвертичный амин, например, DDA, и поли I:С растворяют в водной фазе, таким образом, образуя водный раствор; и
c) Водный раствор добавляют к раствору масла при непрерывной гомогенизации, таким образом, создавая композицию адъюванта ODYRM.
[00138] Еще в следующем наборе вариантов осуществления, в дополнение к маслу и эмульгатору(ам), композиции адъювантов также содержат (или фактически состоят из, или состоят из) комбинацию из сапонина, стерина, четвертичного амина, поликатионного носителя, при условии, что, если указанный поликатионный носитель является декстраном DEAE, то антиген не является бактерином Е coli J-5. Данные адъюванты называются как «QCDXO».
[00139] В QCDXO адъювантах, в некоторых вариантах осуществления, сапонин, например, Quil А, может присутствовать в количестве от примерно 0,1 мкг до примерно 1000 мкг на дозу, стерин, например, холестерин, присутствует от примерно 1 мкг до примерно 1000 мкг на дозу, четвертичный амин, например, DDА, присутствует в количестве от примерно 1 мкг до примерно 200 мкг на дозу, и поликатионный носитель может присутствовать в количестве 0,5-400 мг на дозу. Дозировку варьируют в зависимости от вида субъекта.
[00140] В некоторых вариантах осуществления приемлемый для крупного рогатого скота, овец и взрослых свиней сапонин присутствует в количестве от примерно 100 до примерно 1000 мкг на дозу (например, 200-800 мкг, или 250-500 мкг на дозу), стерин присутствует в количестве от примерно 100 до примерно 1000 мкг (например, 200-1000, 250-700 мкг, или примерно 400-500 мкг), четвертичный амин может присутствовать в количестве от примерно 50 мкг до примерно 200 мкг на дозу (например, 50-150 мкг, или примерно 100 мкг) и поликатионный носитель может присутствовать в количестве от примерно 5 до примерно 500 мг на дозу (например, 10-500 мг, или 10-300 мг, или 50-200 мг на дозу).
[00141] В некоторых вариантах осуществления, приемлемый для применения у домашних животных и поросят, сапонин, например, Quil A или его очищенная фракция, присутствует в количестве от примерно 10 до примерно 100 мкг на дозу (например, 10-50 мкг или 20-50 мкг на дозу), стерин присутствует в количестве от примерно 5 до 100 мкг (например, 10-80 или 20-50 мкг), четвертичный амин может присутствовать в количестве от примерно 5 до примерно 500 мкг на дозу (например, 10-100 мкг на дозу, или 20-50 мкг на дозу), и поликатионный носитель может присутствовать в количестве 1-50 мг на дозу (например, 1-25 мг на дозу, или 10-25 мг на дозу).
[00142] В некоторых вариантах осуществления, в приемлемых вакцинах для домашней птицы, сапонин может присутствовать в количестве от 0,1 до 5 мкг на 50 мкл вакцинной композиции (например, 0,5-30 мкг на 50 мкл композиции, или более предпочтительно 1-10 мкг) на дозу, стерин может присутствовать в количестве от примерно 0,5 до примерно 50 мкг (например, 1-20 мкг, или 1-10 мкг), четвертичный амин может присутствовать в количестве от примерно 5 до примерно 500 мкг на дозу (например, 10-100 мкг на дозу, или 20-50 мкг на дозу), и поликатионный носитель может присутствовать в количестве от 0,5 до 25 мг на дозу (например, 1-20 мг, или 1-10 мг или 5-10 мг).
[00143] В некоторых вариантах осуществления, QCDXO адъюванты получают следующим способом:
a) Сорбитана моноолеат растворяют в масле. Полученный в результате раствор масла подвергают стерильной фильтрации;
b) Полиоксиэтилен (20) сорбитана моноолеат, четвертичный амин, например, DDA, поликатионный носитель, стерин и сапонин растворяют в водной фазе, таким образом, образуя водный раствор; и
c) Водный раствор добавляют к раствору масла при непрерывной гомогенизации, таким образом, создавая композицию адъюванта QCDXO.
[00144] В некоторых случаях, невозможным или нецелесообразным является концентрировать антиген, в частности, в масштабах коммерческих применений, и должны использоваться низкие концентрации антигеновых растворов. Таким образом, в некоторых вариантах осуществления, вакцинные композиции согласно представленному изобретению содержат композиции адъювантов, как описано выше, где разбавляют содержание масляной фазы в данных композициях адъювантов, и где вакцинная композиция представляет собой эмульсию вода-в-масле.
[00145] На практике, возможно создать эмульсию вода-в-масле, в которой масляная фаза составляет менее 50% об./об.
[00146] Коротко говоря, во-первых, композицию адъюванта в представленном изобретением получают, как описано выше. В указанном адъювантном препарате масляная фаза содержит более 50% об./об. композиции адъюванта. Количество других ингредиентов, кроме масла и эмульгатора(ов), увеличивают, соответственно, основываясь на конечной целевой концентрации и необходимом разбавлении. Например, если один нацелен на получение вакцинной композиции, где композиция адъюванта содержит 80% об./об., количество других ингредиентов, кроме масла увеличивают по показателю 1,25 (1/0,8). Количество эмульгаторов, если таковые имеются (например, TWEEN®80 и/или SPAN®80) не обязательно должно быть увеличено, но в основном, объемное соотношение между маслом и эмульгатором(ами) сохраняется таким же в композиции адъюванта и в конечной вакцинной композиции.
[00147] Раствор антигена затем добавляют к композиции адъюванта.
[00148] Целостность эмульсии вода-в-масле может быть сохранена до тех пор, пока диспергированные сферические капли воды не присутствуют в более концентрированной форме, чем максимальная фракция упаковки для случайной упаковки монодисперсных капель, то есть: 0,64. Смотри Tadros, Emulsion Formation, Stability and Rheology, 1st ed. 2013, Wiley-VCH GmbH & Co KGaA. До тех пор, пока общий объем фракции, который занимается водными каплями не превышает 0,64, то есть: 64% об./об. С другой стороны это означает, что масляная фаза не должна падать ниже 36% об./об.
[00149] Соответственно, в различных вариантах осуществления, данного аспекта изобретения, предусмотренными являются вакцинные препараты, содержащие антигенное соединение, и разбавленную композицию адъюванта в соответствии с ранее описанными вариантами осуществления, где масляная фаза составляет более 36% вакцинной композиции, об./об., и где вакцинная композиция представляет собой эмульсию вода-в-масле. Без ограничения, композиции адъювантов, приемлемые для данного аспекта изобретения, включают ТСМО, TCMYO, QTCMO, QTCMYO, ХОМ, ТХО, ТХО-А, ТАО, АХО, QCO, ODYRM, QCDXO. Объем масляной фазы составляет, в разных вариантах, 37% об./об., 38% об./об., 39% об./об., 40% об./об., 41% об./об., 42% об./об., 43% об./об., 44% об./об., 45% об./об., 46% об./об., 47% об./об., 48% об./об., 49% об./об. или 50% об./об. вакцинной композиции.
[00150] Концентрация масляной фазы должна быть достаточно высокой, чтобы создать эффект депо и защитить антиген и иммуномодулятор(ы) от быстрого разложения иммунной системой хозяина, преимущественно 20% или более об./об. вакцинной композиции.
[00151] Соответственно, в другом аспекте, в вакцинных композициях согласно представленному изобретению, количество масляной фазы в композициях адъювантов разбавляют таким образом, что вакцинный препарат представляет собой эмульсию масло-вводе или эмульсию вода-в-масле-в-воде с масляной фазой, которая составляет 20% или более об./об. вакцинной композиции. Количество других ингредиентов, кроме масла и эмульгаторов, увеличиваются, соответственно, основываясь на конечной целевой концентрации и необходимом разбавлении. Например, для получения вакцинной композиции, где композиция адъюванта составляет 33,3% об./об., количество других ингредиентов, кроме масла и эмульгатора(ов) увеличивается по показателю 3 (1/0,333). Количество эмульгаторов, если таковые имеются (например, TWEEN®80 и/или SPAN®80), не должно увеличиваться, но в основном, объемное соотношение между маслом и эмульгатором(ами) сохраняется таким же в композиции адъюванта и в конечной вакцинной композиции.
[00152] В различных вариантах осуществления, вакцинная композиция представляет эмульсию масло-в-воде или эмульсию вода-в-масле-в-воде, где масляная фаза составляет 21% об./об., 22% об./об., 23% об./об., 24% об./об., 25% об./об., 26% об./об., 27% об./об., 28% об./об., 29% об./об., 30% об./об., 31% об./об., 32% об./об., 33% об./об., 34% об./об., 35% об./об., 36% об./об., 37% об./об., 38% об./об., 39% об./об., 40% об./об., 41% об./об., 42% об./об., 43% об./об., 44% об./об., 45% об./об., 46% об./об., 47% об./об., 48% об./об., 49% об./об., или 50% об./об. вакцинной композиции.
[00153] Композиции адъювантов, приемлемые для данного аспекта изобретения, включают ТСМО, TCMYO, QTCMO, QTCMYO, ХОМ, ТХО, ТХО-А, TAO, АХО, QCO, ODYRM, QCDXO, при условии, что масляная фаза в композиции адъюванта может составлять менее 50% об./об., но более 20% об./об. от конечной вакцинной композиции.
Антигены и заболевания
[00154] Композиции могут содержать один или более антигенов. Антиген может представлять собой любое из широкого спектра веществ, способных продуцировать нужный иммунный ответ у субъекта, включая, без ограничения, один или несколько из вирусов (инактивированных, ослабленных и модифицированных живых), бактерий, паразитов, нуклеотидов (включая, без ограничения, антигены на основе нуклеиновой кислоты, например, ДНК вакцины), полинуклеотидов, пептидов, полипептидов, рекомбинантных белков, синтетических пептидов, протеиновых экстрактов, клеток (включая клетки опухоли), тканей, полисахаридов, углеводов, жирных кислот, тейхоевой кислоты, пептидогликанов, липидов или гликолипидов, индивидуально или в любых их комбинациях.
[00155] Антигены, которые используются с адъювантами изобретения, также включают иммуногенные фрагменты нуклеотидов, полинуклеотидов, пептидов, полипептидов, которые могут быть выделены из организмов, которые указаны в данном документе.
[00156] Живые, модифицированные живые, и ослабленные вирусные штаммы, которые не вызывают заболевание у субъекта, выделяли в невирулентной форме или ослабляли, применяя способы, хорошо известные в данной области из уровня техники, включая серийный пассаж в приемлемой клеточной линии или подверженности действия ультрафиолетового света или химического мутагена. Инактивированные или убитые вирусные штаммы являются такими, которые были инактивированны способами, известными квалифицированному специалисту в данной области, включая обработку формалином, бетапроприолактоном (BPL), бинарным этиленимином (BEI), стерилизующим облучением, нагреванием или другими такими способами.
[00157] Два или более антигенов могут быть объединены для получения поливалентной композиции, которая может защитить субъекта от широкого спектра заболеваний, вызванных патогенными микроорганизмами. В настоящее время, коммерческие производители вакцин, а также конечные пользователи, отдают предпочтение поливалентным вакцинным продуктам. Тогда как традиционные адъюванты часто ограничены в различных антигенах, с которыми они могут быть эффективно использованы (или моновалентно или поливалентно), адъюванты, описанные в данном документе, могут быть эффективно использованы с широким спектром антигенов, как моновалентно, так и поливалентно. Таким образом, антигены, описанные в данном документе, могут быть объединены в одной композиции, которая содержит адъюванты, описанные в данном документе.
[00158] Некоторые примеры бактерий, которые могут использовать как антигены с адъювантными композициями включают, но не ограничиваются этим, Aceinetobacter calcoaceticus, Acetobacter paseruianus, Actinobacillus pleuropneumoniae, Aeromonas hydrophila, Alicyclobacillus acidocaldarius, Arhaeglobus fulgidus, Bacillus pumilus, Bacillus stearothermophillus, Bacillus subtilis, Bacillus thermocatenulatus, Bordetella bronchiseptica, Burkholderia cepacia, Burkholderia glumae, Campylobacter coli, Campylobacter fetus, Campylobacter jejuni, Campylobacter hyointestinalis, Chlamydia psittaci, Chlamydia trachomatis, Chlamydophila spp., Chromobacterium viscosum, Erysipelothrix rhusiopathieae, Listeria monocytogenes, Ehrlichia canis, Escherichia coli, Haemophilus influenzae, Haemophilus somnus, Helicobacter suis, Lawsonia intracellularis, Legionella pneumophilia, Moraxellsa sp., Mycobactrium bovis, Mycoplasma hyopneurnoniae, Mycoplasma mycoides subsp. mycoides LC, Clostridium perfringens, Odoribacter denticanis, Pasteurella (Mannheimia) haemolytica, Pasteurella multocida, Photorhabdus luminescens, Porphyromonas gulae, Porphyromonas gingivalis, Porphyromonas salivosa, Propionibacterium acnes, Proteus vulgaris, Pseudomonas wisconsinensis, Pseudomonas aeruginosa, Pseudomonas fluorescens C9, Pseudomonas fluorescens SIKW1, Pseudomonas tragi, Pseudomonas luteola, Pseudomonas oleovorans, Pseudomonas sp B11-1, Alcaliges eutrophus, Psychrobacter immobilis, Rickettsia prowazekii, Rickettsia rickettsia, Salmonella enterica all serovars, включая например: Salmonella enterica Typhimurium, Salmonella enterica Bongori, Salmonella enterica Dublin, Salmonella enterica Choleraseuis, и Salmonella enterica Newport, Serratia marcescens, Spirlina platensis, Staphlyoccocus aureus, Staphyloccoccus epidermidis, Staphylococcus hyicus, Streptomyces albus, Streptomyces cinnamoneus, Streptococcus uberis, Streptococcus suis, Streptomyces exfoliates, Streptomyces scabies, Sulfolobus кислотаосаЫагшз, Syechocystis sp., Vibrio cholerae, Borrelia burgdorferi, Treponema denticola, Treponema minutum, Treponema phagedenis, Treponema refringens, Treponema vincentii, Treponema palladium, Trueperella pyogenes и Leptospira species, такие как известные возбудители Leptospira canicola, Leptospira grippotyposa, Leptospira hardjo, Leptospira borgpetersenii hardjo-bovis, Leptospira borgpetersenii hardjo-prajitno, Leptospira interrogans, Leptospira icterohaemorrhagiae, Leptospira pomona и Leptospira bratislava, и их комбинации.
[00159] Как инактивированные вирусы, так и ослабленные живые вирусы могут использоваться в адъювантных композициях. Некоторые примеры вирусов, которые могут быть использованы как антигены включают, но не ограничиваются этим, птичьи герпесвирусы, бычьи герпесвирусы, собачьи герпесвирусы, лошадиные герпесвирусы, вирус кошачьего вирусного ринотрахеита, вирус болезни Марека, овечьи герпесвирусы, свиные герпесвирусы, свиной вирус эпидемической диареи (PEDv), вирус псевдобешенства, птичьи парамиксовирусы, бычий респираторно-синцитиальный вирус, собачий вирус чумки, собачий парагрипповирус, собачий аденовирус, собачий парвовирус, бычий парагрипповирус 3, овечий парагрипповирус 3, вирус чумы крупного рогатого скота, вирус пограничного заболевания овец, вирус бычьей вирусной диареи (BVDV), BVDV типа I, BVDV типа II, вирус классической чумы свиней, птичий лейкозный вирус, вирус иммунодефицита крупного рогатого скота, вирус лейкемии крупного рогатого скота, туберкулез крупного рогатого скота, вирус инфекционной анемии лошадей, вирус иммунодефицита кошачьих, кошачий вирус лейкемии (FeLV), вирус болезни Ньюкасла, овечий вирус прогрессивной пневмонии, овечий вирус легочной аденокарциномы, собачий коронавирус (CCV), пантропный CCV, собачий респираторный коронавирус, бычий коронавирус, кошачий калицивирус, кошачий кишечный коронавирус, кошачий вирус инфекционного перитонита, свиной вирус эпидемической диареи, свиной гемагтлютинирующий энцефаломиэлито-вирус, свиной парвовирус, свиной цирковирус (PCV) типа I, PCV типа II, свиной вирус репродуктивного и респираторного синдрома (PRRS), вирус трансмиссивного гастроэнтерита, индюшачий коронавирус, бычий вирус эфемерной лихорадки, бешенство, ротовирус, вирус везикулярного стоматита, лентивирус, птичий грипп, риновирусы, вирус гриппа лошадей, вирус гриппа свиней, собачий вирус гриппа, кошачий вирус гриппа, вирус гриппа человека, вирус восточного конского энцефалита (ЕЕЕ), вирус венесуэльского конского энцефалита, вирус Западного Нила, Западный вирус конского энцефалита, вирус иммунодефицита человека, вирус папилломы человека, вирус ветряной оспы, вирус геппатита В, риновирусы и вирус кори, а также их комбинации.
[00160] Примеры пептидных антигенов включают Bordetella bronchiseptica р68, GnRH, IgE пептиды, Fel d1, и антигены рака, и их комбинации. Примеры других антигенов включают нуклеотиды, углеводы, липиды, гликолипиды, пептиды, жирные кислоты, липотейхоевую и тейхоевую кислоту, и пептидогликаны, и их комбинации.
[00161] Некоторые примеры паразитов, которые могут быть использованы как антигены с адъювантными композициями включают, но не ограничиваются этим, Anaplasma, Fasciola hepatica (печеночная двуустка), Coccidia, Eimeria spp., Neospora caninum, Toxoplasma gondii, Giardia, Dirofilaria (сердечный гельминт), Ancylostoma (анкилостоматиды), Cooperia, Haemonchus contortus (Barber pole гельминт) Ostertagia ostertagi (желудочный гельминт), Dictyocaulus viviparous (легочные гельминты), Trypanosoma spp., Leishmania spp., Trichomonas spp., Cryptosporidium parvum, Babesia, Schistosoma, Taenia, Strongyloides, Ascaris, Trichinella, Sarcocystis, Hammondia, и Isopsora, и их комбинации. Кроме того, рассматриваются внешние паразиты включая, но не ограничиваясь этим, клещи, включая Ixodes, Rhipicephalus, Dermacentor, Amblyomma, Boophilus, Hyalomma, и Haemaphysalis species, и их комбинации.
[00162] Количество антигена, который используют для индуцирования иммунного ответа, будет варьироваться в значительной степени в зависимости от антигена, который используют, субъекта и уровня желаемого ответа, и может быть определено квалифицированным специалистом в данной области. Для вакцин, содержащих модифицированные живые вирусы или ослабленные вирусы, терапевтически эффективное количество антигена, в целом, находится в диапазоне от примерно 102 инфекционной дозы для тканевой культуры (TCID)50 до примерно 1010 TCID50, включительно. Для многих таких вирусов, терапевтически эффективная доза, в целом, находится в диапазоне от примерно 102 TCID50 до примерно 108 TCID50, включительно. В некоторых вариантах осуществления, диапазоны терапевтически эффективных доз составляют от примерно 103 TCID50 до примерно 106 TCID50, включительно. В других вариантах осуществления диапазоны терапевтически эффективных доз составляют от примерно 104 TCID50 до примерно 105 TCID50 включительно.
[00163] Для вакцин, содержащих инактивированные вирусы, терапевтически эффективное количество антигена, в целом, составляет, по меньшей мере, около 100 относительных единиц на дозу, и часто находится в диапазоне от примерно 1,000 до примерно 4,500 относительных единиц на дозу, включительно. В других вариантах осуществления, терапевтически эффективное количество антигена находится в диапазоне от приблизительно 250 до приблизительно 4000 относительных единиц на дозу, включая, от примерно 500 до примерно 3000 относительных единиц на дозу, включая, от примерно 750 до примерно 2000 относительных единиц на дозу, включая, или от примерно 1000 до примерно 1500 относительных единиц на дозу, включительно.
[00164] Терапевтически эффективное количество антигена в вакцинах, содержащих инактивированные вирусы, также могут измерять с точки зрения относительной активности (RP) на мл. Терапевтически эффективное количество часто находится в диапазоне от приблизительно 0,1 до приблизительно 50 RP на мл, включительно. В других вариантах осуществления, терапевтически эффективное количество антигена находится в диапазоне от приблизительно 0,5 до приблизительно 30 RP на мл, включая, от примерно 1 до примерно 25 RP на мл, включая, от примерно 2 до примерно 20 RP на мл, включая, от примерно 3 до примерно 15 RP на мл, включая, или от примерно 5 до примерно 10 RP на мл, включительно.
[00165] Количество клеток для бактериального антигена, которое вводят в вакцину, находится в диапазоне от приблизительно 1×106 до приблизительно 5×1010 колониеобразующих единиц (КОЕ) на дозу, включительно. В других вариантах осуществления, количество клетки находится в диапазоне от приблизительно 1×107 до 5×1010 KОЕ/доза, включая, или от примерно 1×108 до 5×1010 КОЕ/доза, включительно. Еще в других вариантах осуществления, количество клетки находится в диапазоне от приблизительно 1×102 до 5×1010 KОЕ/доза, включая, или от примерно 1×104 до 5×109 KОЕ/доза, включая, или от примерно 1×105 до 5×109 KОЕ/доза, включая, или от примерно 1×106 до 5×109 KОЕ/доза, включая, или от примерно 1×106 до 5×108 KОЕ/доза, включая, или от примерно 1×107 до 5×109 KОЕ/доза, включительно.
[00166] Количество клетки для паразитарного антигена, которое вводят в вакцину, находится в диапазоне от приблизительно 1×102 до приблизительно 1×1010 на дозу, включительно. В других вариантах осуществления, количество клетки находится в диапазоне от приблизительно 1×103 до приблизительно 1×109 на дозу, включая, или от примерно 1×104 до примерно 1×108 на дозу, включая, или от примерно 1×105 до примерно 1×107 на дозу, включая, или от примерно 1×106 до примерно 1×108 на дозу, включительно.
[00167] Хорошо известным в данной области из уровня техники является то, что с общепринятыми адъювантами, фактически большее количество инактивированных вирусов, чем модифицированных живых или ослабленных вирусов является нужной для стимулирования сопоставимого уровня серологического ответа. Однако, неожиданно обнаружено, что с адъювантными композициями, описанными в данном документе, примерно одинаковые количества инактивированного вируса и модифицированного живого вируса стимулируют аналогичные уровни серологического ответа. Кроме того, небольшое количество модифицированного живого, ослабленного и инактивированного вируса являются нужным с адъювантами, описанными в данном документе, по сравнению с общепринятыми адъювантами, чтобы достичь одинакового уровня серологического ответа. Данные неожиданные результаты демонстрируют сохранение ресурсов и снижение затрат при приготовлении иммуногенных и вакцинных композиций. Для вакцин с широким применением, необходимо производство миллионов доз в год, поэтому данная экономия может быть существенной.
Введение композиций
[00168] Размеры дозы композиций, как правило, находятся в диапазоне от примерно 1 мл до примерно 5 мл, включительно, в зависимости от субъекта и антигена. Например, для собачьих или кошачьих, как правило, используют дозу примерно 1 мл, тогда как для крупного рогатого скота, как правило, используют дозу примерно 2-5 мл. Однако, данные адъюванты также могут быть сформулированы как микродозы, где могут использовать дозы примерно 100 мкл.
[00169] Пути введения для адъювантных композиций включают парентеральное, пероральное, ороназальное, интраназальное, интратрахеальное, местное, подкожное, внутримышечное, транскутанное, интрадермальное, внутрибрюшное, внутриглазное, введение и в яйца. Любое приемлемое устройство могут использовать для введения композиции, включая шприцы, капельницы, безиголочные инъекционные устройства, пластыри и тому подобное. Путь и устройства, использованные для применения, будут зависеть от состава адъюванта, антигена и субъекта, и они являются хорошо известными квалифицированному специалисту в данной области.
Применение композиций
[00170] Одним из требований для любого препарата вакцинного адъюванта для коммерческого применения является установление стабильности раствора адъюванта в течение длительного периода хранения. Предусмотренными в данном документе являются композиции адъювантов, которые являются простыми в производстве и стабильными в течение, по меньшей мере, 18 месяцев. В одном варианте осуществления, препараты являются стабильными в течение примерно 18 месяцев. В другом варианте осуществления, препараты являются стабильными в течение от примерно 18 до примерно 24 месяцев. В другом варианте осуществления, препараты являются стабильными в течение примерно 24 месяцев. Ускоренные процедуры тестирования также показывают, что препараты, описанные в данном документе, являются стабильными.
[00171] Преобладающим отличительным признаком представленных адъювантных композиций является то, что они могут быть безопасно и эффективно введены широкому диапазону субъектов. Из уровня техники, следует ожидать, что комбинации адъювантов будут демонстрировать большую реактогенность, чем отдельные компоненты. Однако, композиции, описанные в данном документе, показывают пониженную реактогенность по сравнению с композициями, в которых используют любой один или два из компонентов, тогда как эффект адъюванта сохраняется. Кроме того, было неожиданно обнаружено, что адъювантные композиции, описанные в данном документе, демонстрируют повышение безопасности по сравнению с другими адъювантными композициями.
[00172] Адъювантные композиции, описанные в данном документе, являются полезными для индуцирования нужного иммунного ответа у субъекта. Они эффективны для нескольких видов. Приемлемым субъектом является любое животное, для которого необходимо введение адъювантной композиции. Это включает млекопитающих и немлекопитающих, включая приматов, домашний скот, домашних животных, лабораторных подопытных животных, диких животных, содержащихся в неволе, пернатых (включая в яйцах), рептилий и рыб. Таким образом, данный термин включает, но не ограничивается этим обезьян, людей, свиней; крупный рогатый скот, овец, коз, лошадей, мышей, крыс, морских свинок, хомяков, кроликов, кошек, собак, кур, индеек, уток, другие птиц, лягушек и ящериц.
[00173] Адъюванты, описанные в данном документе, могут использовать, чтобы показать серологическую дифференциацию между инфицированными и вакцинированными животными. Таким образом, они могут быть использованы в меркерной вакцине, в которой антиген в вакцине вызывает у вакцинированных животных различные конфигурации антитела от вируса немутантного типа. Меркерные вакцины, в целом, используют в сочетании с дополнительным диагностическим тестом, который измеряет разницу в конфигурациях антител и демонстрирует, какие животные были вакцинированы, и какие животные являются инфицированными вирусом немутантного типа. Такая технология является полезной для контроля и ликвидации вирусов в популяции субъектов.
[00174] Представленое изобретение также предусматривает новые вакцинные композиции полезные для защиты от инфекции и заболевания, вызванного вирусом Нипах и/или вирусом Хендра, применяя антиген, который обеспечивается протеином G вируса Хендра (и фрагментами, дилерами, мультимерами и их модифицированными формами), все из которых являются добавленными в качестве адъюванта, как описано в данном документе. В некоторых вариантах осуществления, адъювант выбирают из группы, состоящей из ТХО, ТАО и ТХО-А. Такие вакцины могут использоваться в предупреждении инфекции и заболевания у, например, лошадей, собак, свиней и людей. В наиболее предпочтительном варианте осуществления, как свиней, так и собак защищают от вируса Хендра и Нипах.
[00175] Периодические вспышки NiV, которые в итоге приводят к значительному числу смертельных случаев у людей, в последнее время были проблематичными, смотри, например, Butler, Nature, vol. 429, at page 7 (2000); и Gurley et al., Emerging Infectious Diseases, vol. 13 (7), pp. 1031-1037 (2007). Тематические исследования связывают заболевание у людей с зоонотической передачей от свиней, смотри Parashar et al., J. Infect. Dis. vol 181, pp. 1755-1759 (2000). Вирус Хендра, кроме того, явно был связан с смертями у людей, из-за передачи от лошадей. На данный момент существует одна лицензированная вакцина для профилактики инфекции или заболевания, вызванного вирусом Хендра (Equivac® HeV; Zoetis) утвержденая для использования у лошадей, хотя лицензированной вакцины для профилактики вирусной инфекции Нипах не существует. Поэтому, остается потребность в вакцинах вируса Нипах или вируса Хендра, которые могут быть клинически эффективными.
[00176] Парамиксовирусы, такие как вирус Хендра и вирус Нипах имеют два основных зафиксированных на мембране гликопротеина в оболочке вирусной частицы. Один гликопротеин необходим для присоединения вириона к рецепторам на клетках-хозяевах и обозначается как или гемагглютинин-нейраминидазный протеин (HN) или гемагтлютинированньш протеин (Н), и другой является гликопротеином (G), который не имеет ни гемагглютинационной, ни нейраминидазной активностей. Гликопротеины присоединения представляют собой мембранные белки типа II, где амино (N) конец молекулы ориентируется в направлении цитоплазмы, и карбоксы (С) конец протеина является внеклеточным. Другой основной гликопротеин является слитым (F) гликопротеином, который представляет собой триммерный класс I фузогенный оболочечный гликопротеин, который содержит два гептадных повторяющихся (HR) участка и гидрофобный слившийся пептид. Вирус Хендра и вирус Нипах инфицирует клетки через pH-независимый процесс мембранного слияния в восприимчивых клетках-хозяевах, за счет согласованных действий их присоединения G гликопротеина и F гликопротеина после связывания с рецептором.
[00177] Такой G гликопротеин вируса Хендра может потенциально проходить через защиту против инфекции и заболевания, вызванного вирусом Нипах допускается K. Bossart et al., Journal of Virology, vol. 79, pp. 6690-6702 (2005), и В. Mungall et al., Journal of Virology, vol. 80, pp. 12293-12302 (2006). Однако, предыдущая работа не обеспечивает вакцинные композиции, которые на самом деле являются клинически эффективными в этом отношении, для любых видов млекопитающих. Соответственно, настоящее изобретение охватывает иммуногенную композицию, которая содержит G протеин вируса Хендра, адъювант, как описано в соответствии с практикой согласно представленному изобретению, и один или более эксципиентов, в количествах эффективных, чтобы вызвать клинически эффективную защиту против вируса Хендра и/или Нипах.
[00178] Относительно G гликопротеиновых полипептидов вируса Хендра, которые используются на практике согласно представленному изобретению, и их рекомбинантная экспрессия, делается ссылка на полное раскрытие опубликованных международных заявок на патент WO 2012/158643 и WO 2006/085979, где такая информация является четко представленной. Преимущественные примеры конкретных G протеиновых полипептидов вируса Хендра, которые используются в данном документе, является раскрытыми в WO 2012/158643, и включают, например G протеин полной длины (его SEQ ID NO: 2); его растворимый фрагмент (кодирующий аминокислоты 73-604 с SEQ ID NO: 2 WO 2012/158643) и дополнительный фрагмент, раскрытый в данном документе, имеет Ig (капа) лидерную последовательность (SEQ ID NO 16 из WO 2012/158643). В целом, растворимые формы G гликопротеина вируса Хендра содержат все или часть эктодомена, и производятся путем удаления всего или части трансмембранного домена гликопротеина G, и всего или части цитоплазматического хвоста. Преимущественно, последовательность, кодирующая ген, представляет собой кодон, оптимизированный для экспрессии.
[00179] В некоторых вариантах осуществления, G гликопротеин Хендра может быть в димерной и/или тетрамерной форме. Такие димеры зависят от образования дисульфидных связей, образующихся между остатками цистеина в G гликопротеина. Такие дисульфидные связи могут соответствовать тем, которые образуются в нативном G гликопротеине, или дисульфидные связи могут образовываться в результате получая различные димерные и/или тетрамерные формы G гликопротеина, которые повышают антигенность. Кроме того, не-димеризованые и тетрамеризованые формы также могут быть использованы в соответствии с практикой согласно представленному изобретению, снова принимая во внимание то, что G гликопротеин обеспечивает многочисленные конформационно зависимые эпитопы (т.е. возникающие из третичной трехмерной структуры), и что сохранение многочисленных таких природных эпитопов являются соответственно очень преимущественным для того, чтобы предоставить нейтрализуя антительный ответ.
[00180] В целом, конструирование векторов экспрессии для G протеинов Хендра может быть таким, как описано в примере 1 из WO 2012/158643, из полученого в результате экспрессии протеина из СНО клеток, которые являются, как описано в их примере 2, или альтернативно, применяя вакцинную систему (смотри их пример 3) или 293 клетки (смотри их пример 4). В конкретном преимущественном примере, предусмотренным является растворимый G протеин, как аминокислоты 73-604 нативного G гликопротеина вируса Хендра (смотри SEQ ID NO: 2 в WO 2012/158643). Их димеризация происходит спонтанно, одновременно с экспрессией с СНО клеток, и полученный в результате G протеин содержит примерно 50% димера и 50% тетрамера, с небольшим количеством мономера, что остается. Экспрессия в 293F клетках приводит к примерно 70% димера. Полученные в результате протеиновые фракции смешивают с адъювантами, как описано в представленном описании. Как описано в WO 2012/158643, предпочтительные дозы антигена для крупных животных находятся в диапазоне 50-200 микроорганизмов на дозу, со 100 микрограммами, которая является наиболее предпочтительной дозой. Для небольших животных, таких как собаки, необходимым является меньшее количество, такое как 25-50 микрограммов, как будет понятно специалистам в данной области.
[00181] Кроме того, адъюванты согласно любому из вариантов осуществления, описанных выше могут быть использованы для создания диагностических или терапевтических антител. В данном аспекте изобретения, животный источник иммунизируют препаратом, который содержит адъювантные композиции согласно настоящему изобретению и антиген. Выбор антигена определяется личностью, которая нуждается в получении указанного терапевтического или диагностического антитела и включает, без ограничения, вирусы, бактерии, вирусные частицы, экстракты, рекомбинантные антигены, структуры клеточных стенок и др. Антигены могут также включать яды для приготовления лекарственных средств против змеиных укусов.
[00182] Антигены, приемлемые для данного аспекта изобретения, могут быть кошачьего, собачьего, конского, свиного, бычьего, овечьего или птичьего происхождения. В некоторых вариантах осуществления, антиген может быть выбран из FeLVgp70, бычьего парагрипповируса-3 BPI-3 (HN протеина), Histophilus somni p31, Bordetella FHA, Parapox, BVDV1 gp53, BVDV2 gp53, токсинов клостридии, собачьего цирковируса, Brachyspira hyodysenteriae (виды свиней) антигенов; инактивированных цельных клеток и инактивированного пепсинового гидролизата.
[00183] Некоторое время после иммунизации, источник антител экстрагируют из животного-источника (например, мышей, крыс, хомяков, свиней, морских свинок, кроликов, коз, овец, домашней птицы, крупного рогатого скота, лошадей). В других вариантах осуществления, животное-источник является котом или собакой. Источник антител в конечном счете зависит от того, необходимы ли моноклональные или поликлональные антитела. Для поликлональных антител, антитело может рассматриваться с использованием сыворотки или молока. Для моноклональных антител, клетки селезенки являются приемлемым источником. Такие антитела могут использовать для диагностики, научных исследований или терапевтических целей, включая, без ограничения, противоядия, лекарственные средства от отторжения трансплантата, анализы сывороточной нейтрализации, ИФА, ELISPOT, Вестерн-блот, анализы на основе клеток, анализы эффективности, и иммуногистохимию. Изобретение предусматривает моноклональные и поликлональные антитела, экстрагированые из животного-источника для использования в диагностических и терапевтических применениях, включая без ограничения, противоядия, лекарственные средства от отторжения трансплантата, анализы сывороточной нейтрализации, ИФА, ELISPOT, Вестерн-блот, анализы на основе клеток, анализы эффективности и иммуногистохимию.
[00184] В некоторых вариантах осуществления, иммунизация композициями согласно представленному изобретению будет вызывать достаточно высокие серологические титры желаемого антигена (более 1000, или более предпочтительно, более 5000, или более предпочтительно, более 10000, или более предпочтительно, более 50000, или более предпочтительно, более 100000, или более предпочтительно, более 250000, или более предпочтительно, более 500000, или более предпочтительно, более 1000000) у, по меньшей мере, одного животного (преимущественно, по меньшей мере, 2 животных, или, по меньшей мере, у трех животных, или у 50% обработанных или у, по меньшей мере, 75% обработанных животных, или, наиболее предпочтительно, у каждого обработанного животного), таким образом, получая в результате достаточное количество антител для диагностических или исследовательских применений.
[00185] Как правило, антитела изотипа иммуноглобулина G (IgG) используют в данных применениях, хотя антитела других изотипов, например, иммуноглобулин М (IgM), также используют. Источник антител, в конечном счете, зависит от того, является ли желательным поликлональное, или моноклональное антитело. Для поликлональных антител, как источник антител могут использовать сыворотку или молоко. Для моноклональных антител, макрофаги селезенки являются свойственным источником антитела. Дополнительная очистка антител, если необходимо, или получение моноклональных антител является широко описанными в литературе, и специалист в данной области не будет иметь никаких чрезмерных трудностей в осуществлении данных процедур. Кроме того, антитела могут быть адаптированы к целевым видам, если необходимо (например, канонизированными или фелинизироваными). Более того, способы для такой практики хорошо известны в данной области из уровня техники и не существует необходимости их описывать в данной заявке.
Применение антител
[00186] Антитела были бы приемлемыми как реагенты для анализов сывороточной нейтрализации, ИФА, ELISPOT, Вестерн-блот, анализов на основе клеток, анализов эффективности, и иммуногистохимии. Данные методы являются хорошо известными в данной области.
[00187] Антитела согласно представленного изобретения также могут быть использованы как терапевтические агенты, например, в отторжении трансплантата, например, для генерации антитимоцитарных глобулиновых (ATG) агентов. В настоящее время, на рынке присутствуют два таких агента: Atgam® и Thymoglobulin®. Способы получения антитимоцитарных глобулинов в целом были описаны в US 20040023340.
[00188] Кроме того, их могут использовать для получения противоядных лекарственных средств. В данных вариантах, компоненты яда змеи будут использоваться как антигены. Яды и их компоненты также хорошо известны в данной области из уровня техники.
[00189] Животные многих видов могут быть использованы как животные источники, включая, без ограничений, виды птицы, мышей, крыс, хомяков, морских свинок, кроликов, собак, кошек, овец, коз, свиней, крупный рогатый скот и лошадей. Выбор животного источника зависит от поставленной задачи и суждения личности, специалиста в данной области техники.
[00190] Конкретные неограничивающие варианты осуществления следующие:
[00191] В первом варианте осуществления, изобретение предусматривает композицию адъюванта, которая содержит масляную фазу и водную фазу, где масляная фаза составляет, по меньшей мере, 50% препарата об./об., где указанный препарат содержит, по меньшей мере, один монофосфорильный липид A (MPL-A) или его аналог и иммуностимулирующий олигонуклеотид, при условии, что:
a) если указанный иммуностимулирующий олигонуклеотид отсутствует, то препарат содержит:
i. поли I:С, гликолипиды, и, необязательно, четвертичный амин; или
ii. поликатионный носитель;
b) если указанный монофосфорильный липид A (MPL-A) или его аналог отсутствует, то препарат содержит источник алюминия.
[00192] Во втором варианте осуществления, изобретение предусматривает композицию адъюванта по первому варианту осуществления, где иммуностимулирующий олигонуклеотид, если присутствует, представляет собой CpG или олигорибонуклеотид; поликатионный носитель, если присутствует, выбирают из группы, состоящей из декстрана, декстрана DEAE (и их производных), ПЭГ, гуаровых смол, хитозановых производных, полицелюлозных производных, таких как гидроксиэтилцеллюлоза (НЕС), полиэтилэнимин, полиамины; и четвертичный амин, если присутствует, выбирают из группы, состоящей из DDA и авридина.
[00193] В третьем варианте осуществления, изобретение предусматривает композицию адъюванта согласно первому или второму варианту осуществления, где иммуностимулирующий олигонуклеотид, если присутствует, представляет собой CpG, поликатионный носитель, если присутствует, представляет собой декстран DEAE и четвертичный амин, если присутствует, представляет собой DDA.
[00194] В четвертом варианте осуществления, изобретение предусматривает композицию адъюванта согласно любого одного с первого по третий варианты осуществления, где гликолипид, если присутствует, содержит соединение формулы I
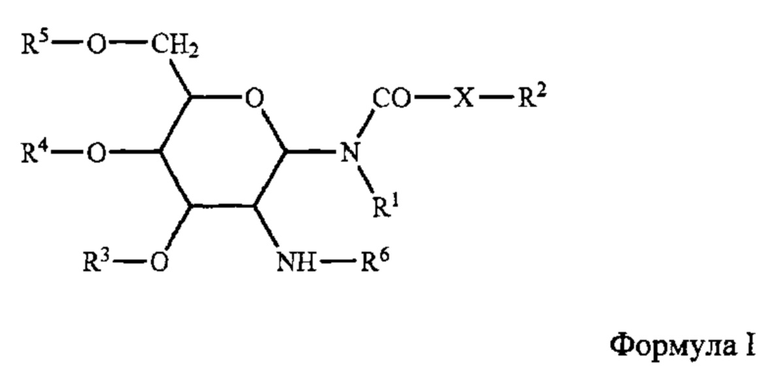
где, R1 и R2 независимо являются водородом или насыщенным алкильным радикалом, который имеет аж до 20 атомов углерода; X является -CH2-, -O- или -NH-; R2 является водородом или насыщенным или ненасыщенным алкильным радикалом, который имеет аж до 20 атомов углерода; R3, R4 и R5 независимо являются водородом, -SO42-, -РО42-, -COC1-10 алкилом; R6 является L-аланином, L-альфа-аминобутилом, L-аргинилом, L-аспаргинилом, L-аспартилом, L-цистеинилом, L-глутамилом, L-глицилом, L-гистидилом, L-гидроксипропилом, L-изолейцилом, L-лейцилом, L-лизилом, L-метионилом, L-орнитилом, L-фенилаланилом, L-пролилом, L-серилом, L-треонилом, L-тирозилом, L-триптофанилом, и L-валилом или их D-изомерами.
[00195] В пятом варианте осуществления, изобретение предусматривает композицию адъюванта по четвертому варианту осуществления, в которой гликолипид представляет собой N-(2-дезокси-2-L-лейциламино-b-D-глюкопиранозил)-N-октадецилдодеканоиламид или его соль.
[00196] В шестом варианте осуществления, изобретение предусматривает композицию адъюванта по пятому варианту осуществления, где соль является ацетатом.
[00197] В седьмом варианте осуществления, изобретение предусматривает композицию адъюванта по какому-либо одному с первого по четвертый варианты осуществления, которая содержит как указанный монофосфорильный липид A (MPL-A) или его аналог, так и дополнительный, который содержит, по меньшей мере, один из стерина и поли I:С.
[00198] В восьмом варианте осуществления, изобретение предусматривает композицию адъюванта в соответствии с седьмым вариантом осуществления, которая содержит стерин, и которая дополнительно содержит сапонин.
[00199] В девятом варианте осуществления, изобретение предусматривает композицию адъюванта по какому-либо одному с седьмого и восьмого вариантов осуществления, в которой сапонин, если присутствует, представляет собой тритерпеноидный сапонин, и стерин, если присутствует, выбирают из группы, состоящей из эргостерина, ланостерина и холестерина.
[00200] В десятом варианте осуществления, изобретение предусматривает композицию адъюванта в соответствии с девятым вариантом осуществления, в которой сапонин, если присутствует, представляет собой Quil А, и стерин, если присутствует, представляет собой холестерин.
[00201] В одиннадцатом варианте осуществления, изобретение предусматривает композицию адъюванта в соответствии с седьмым вариантом осуществления, которая содержит поли I:С, и дополнительно содержит, по меньшей мере, один из четвертичного амина и гликолипида.
[00202] В двенадцатом варианте осуществления, изобретение предусматривает композицию адъюванта по какому-либо одному с первого-одиннадцатого вариантов осуществления, содержащая MPL-A или его аналог в количестве 0,5-100 мкг на дозу.
[00203] В тринадцатом варианте осуществления, изобретение предусматривает композицию адъюванта в соответствии с двенадцатым вариантом осуществления, в которой MPL-A или его аналог присутствует в количестве 5-50 мкг на дозу, или 5-20 мкг на дозу, или 1-5 мкг на дозу.
[00204] В четырнадцатом варианте осуществления, изобретение предусматривает композицию адъюванта по какому-либо одному с первого-тринадцатого вариантов осуществления, которая содержит иммуностимулирующий олигонуклеотид в количестве от 0,5 до 400 мкг на дозу.
[00205] В пятнадцатом варианте осуществления, изобретение предусматривает композицию адъюванта по четырнадцатому варианту осуществления, в которой иммуностимулирующий олигонуклеотид присутствует в количестве от примерно 100 до примерно 250 мкг на дозу или от примерно 20 до примерно 50 мкг на дозу, или примерно 1 мкг на дозу.
[00206] В шестнадцатом варианте осуществления, изобретение предусматривает композицию адъюванта по какому-либо одному с первого по пятнадцатый варианты осуществления, которая содержит поликатионный носитель в количестве от примерно 0,5 до примерно 400 мг на дозу.
[00207] В семнадцатом варианте осуществления, изобретение предусматривает композицию адъюванта по шестнадцатому варианту осуществления, в которой указаний поликатионный носитель присутствует в количестве 50-300 мг на дозу или 1-25 мг на дозу, или 1-10 мг на дозу.
[00208] В восемнадцатом варианте осуществления, изобретение предусматривает композицию адъюванта по какому-либо одному с первого-семнадцатый вариант осуществления, которая содержит гликолипид в количестве от примерно 0,5 до примерно 2000 мкг на дозу.
[00209] В девятнадцатом варианте осуществления, изобретение предусматривает композицию адъюванта по восемнадцатому варианту осуществления, в которой гликолипид присутствует в количестве примерно 1000 мкг на дозу, или 25-50 мкг на дозу, или 1-10 мкг на дозу.
[00210] В двадцатом варианте осуществления, изобретение предусматривает композицию адъюванта по какому-либо одному с первого-девятнадцатый вариант осуществления, которая содержит стерин в количестве от примерно 0,1 до примерно 1000 мкг на дозу.
[00211] В двадцать первом варианте осуществления, изобретение предусматривает композицию адъюванта в соответствии с двадцатым вариантом осуществления, в которой стерин присутствует в количестве 250-500 мкг на дозу, или 20-50 мкг на дозу, или 1-10 мкг на дозу.
[00212] В двадцать втором варианте осуществления, изобретение предусматривает композицию адъюванта по какому-либо одному с первого по двадцать первый вариант осуществления, которая содержит сапонин в количестве от 0,1 до 1000 мкг на дозу.
[00213] В двадцать третьем варианте осуществления, изобретение предусматривает композицию адъюванта по двадцать второму варианту осуществления, в которой сапонин присутствует в количестве 250-500 мкг на дозу, или 20-50 мкг на дозу, или 1-10 мкг на дозу.
[00214] В двадцать четвертом варианте осуществления, изобретение предусматривает композицию адъюванта по какому-либо одному с первого по двадцать третий вариант осуществления, которая содержит поли I:С в количестве от примерно 0,5 до примерно 100 мкг на дозу.
[00215] В двадцать пятом варианте осуществления, изобретение предусматривает композицию адъюванта по двадцать четвертому варианту осуществления, в которой поли I:C присутствует в количестве 5-50 мкг на дозу, или 5-20 мкг на дозу, или 1-5 мкг на дозу.
[00216] В двадцать шестом варианте осуществления, изобретение предусматривает композицию адъюванта по какому-либо одному с первого по двадцать пятый вариант осуществления, которая содержит источник алюминия, который представляет собой гель гидроксида алюминия.
[00217] В двадцать седьмом варианте осуществления, изобретение предусматривает композицию адъюванта по двадцать шестому варианту осуществления, в которой указаний источник алюминия присутствует в количестве 5%-20% об./об. препарата.
[00218] В двадцать восьмом варианте осуществления, изобретение предусматривает композицию адъюванта по двадцать седьмому варианту осуществления, в которой указаный источник алюминия присутствует в количестве 10% об./об. препарата.
[00219] В двадцать девятом варианте осуществления, изобретение предусматривает композицию адъюванта по какому-либо одному с первого по двадцать восьмой вариант осуществления, в которой масляная фаза содержит масло и растворимый в масле эмульгатор.
[00220] В тридцатом варианте осуществления, изобретение предусматривает композицию адъюванта по какому-либо одному с первого по двадцать девятый вариант осуществления, в которой указана масляная фаза присутствует в количестве до 85% об./об.
[00221] В тридцать первом варианте осуществления, изобретение предусматривает композицию адъюванта в соответствии с тридцатым вариантом осуществления, в которой указана масляная фаза присутствует в количестве 51%.
[00222] В тридцать втором варианте осуществления, изобретение предусматривает композицию адъюванта по какому-либо одному с двадцать девятого по тридцать первый вариант осуществления, в которой масло составляет 40-84% об./об. препарата, и растворимый в масле эмульгатор составляет 1-11% об./об. препарата.
[00223] В тридцать третьем варианте осуществления, изобретение предусматривает композицию адъюванта по тридцать второму варианту осуществления, в которой масло составляет 45% об./об. препарата, и растворимый в масле эмульгатор составляет 6% об./об. препарата.
[00224] В тридцать четвертом варианте осуществления, изобретение предусматривает композицию адъюванта в соответствии с каким-либо одним с первого по тридцать третий вариант осуществления, в которой указанное масло выбирают из группы, состоящей из сквалана, растительных масел, триглицеридов, неметаболизующих масел с алкановой линейной цепью, и любой их комбинации.
[00225] В тридцать пятом варианте осуществления, изобретение предусматривает композицию адъюванта в соответствии с тридцать четвертым вариантом осуществления, в которой указаное масло является легким минеральным маслом.
[00226] В тридцать шестом варианте осуществления, изобретение предусматривает вакцинную композицию, которая содержит эффективное количество антигена и композицию адъюванта в соответствии с каким-либо одним с первого по тридцать пятый вариант осуществления, в которой масляная фаза композиции составляет по меньшей мере 50% об./об.
[00227] В тридцать седьмом варианте осуществления, изобретение предусматривает вакцинную композицию, которая содержит эффективное количество антигена и композицию адъюванта, которая содержит масляную фазу и водную фазу, в которой масляная фаза составляет, по меньшей мере, 50% препарата об./об., поликатионный носитель, и
a. комбинацию сапонина и стерина, и необязательно, четвертичный амин; при условии, что, если указанная композиция адъюванта фактически состоит из DEAE декстрана, Quil А, холестерина и DDA, антигеном не является бактерии Е coli J-5; или
b. иммуностимулирующий олигонуклеотид, при условии, что, если указанная композиция адъюванта фактически состоит из DEAE декстрана и иммуностимулирующего олигонуклеотида, антиген содержит возбудитель негативно влияющий на крупный рогатый скот, овец, лошадей или свиней, или является производной указанного возбудителя, и не является бактерином Е coli J-5.
[00228] В тридцать восьмом варианте осуществления, изобретение предусматривает вакцинную композицию в соответствии с тридцать седьмым вариантом осуществления, в которой сапонин, если присутствует, представляет собой тритерпеноидный сапонин, стерин, если присутствует, выбирают из группы, состоящей из эргостерина, ланостерина и холестерина, поликатионный носитель, если присутствует, выбирают из группы, состоящей из декстрана, декстрана DEAE (или его производных), ПЭГ, гуаровых смол, хитозановых производных, полицелюлозных производных, таких как гидроксиэтилцеллюлоза (НЕС), полиэтиленимин, полиамины, и четвертичный амин, если присутствует, выбирают из группы, состоящей из DDA и авридицина.
[00229] В тридцать девятом варианте осуществления, изобретение предусматривает вакцинную композицию в соответствии с тридцать восьмым вариантом осуществления, в которой сапонин представляет собой Quil А, стерин представляет собой холестерин, поликатионный носитель представляет собой декстран DEAE и четвертичный амин представляет собой DDA.
[00230] В сороковом варианте осуществления, изобретение предусматривает вакцинную композицию по какому-либо одному с тридцать седьмого по тридцать девятый вариант осуществления, в которой иммуностимулирующий олигонуклеотид представляет собой CpG.
[00231] В сорок первом варианте осуществления, изобретение предусматривает вакцинную композицию по какому-либо одному с тридцать седьмого по сороковой вариант осуществления, в которой указаный поликатионный носитель присутствует в количестве от примерно 0,5 до примерно 400 мг на дозу.
[00232] В сорок втором варианте осуществления, изобретение предусматривает вакцинную композицию по сорок первому варианту осуществления, в которой указаный поликатионный носитель присутствует в количестве 50-300 мг на дозу или 1-25 мг на дозу, или 1-10 мг на дозу.
[00233] В сорок третьем варианте осуществления, изобретение предусматривает вакцинную композицию по какому-либо одному с тридцать седьмого по сорок второй вариант осуществления, которая содержит сапонин в количестве от примерно 0,1 до примерно 1000 мкг на дозу.
[00234] В сорок четвертом варианте осуществления, изобретение предусматривает вакцинную композицию по сорок третьему варианту осуществления, в которой сапонин присутствует в количестве 250-500 мкг на дозу, или 20-50 мкг на дозу, или 1-10 мкг на дозу.
[00235] В сорок пятом варианте осуществления, изобретение предусматривает вакцинную композицию по какому-либо одному с тридцать седьмого по сорок четвертый вариант осуществления, которая содержит стерин в количестве от примерно 0,1 до примерно 1000 мкг на дозу.
[00236] В сорок шестом варианте осуществления, изобретение предусматривает вакцинную композицию по сорок пятому варианту осуществления, в которой стерин присутствует в количестве 250-500 мкг на дозу, или 20-50 мкг на дозу, или 1-10 мкг на дозу.
[00237] В сорок седьмом варианте осуществления, изобретение предусматривает вакцинную композицию по какому-либо одному с тридцать седьмого по сорок шестой вариант осуществления, которая содержит четвертичный амин в количестве от примерно 1 до примерно 200 мкг на дозу.
[00238] В сорок восьмом варианте осуществления, изобретение предусматривает вакцинную композицию по сорок седьмому варианту осуществления, в которой четвертичный амин присутствует в количестве примерно 100 мкг на дозу, или от примерно 10 до примерно 100 мкг на дозу, или примерно 5 мкг на дозу.
[00239] В сорок девятом варианте осуществления, изобретение предусматривает вакцинную композицию по какому-либо одному с тридцать седьмого по сорок восьмой вариант осуществления, которая содержит иммуностимулирующий олигонуклеотид в количестве от примерно 0,5 мкг до примерно 400 мкг на дозу.
[00240] В пятидесятом варианте осуществления, изобретение предусматривает вакцинную композицию по сорок девятому варианту осуществления, в которой иммуностимулирующий олигонуклеотид присутствует в количестве 100-250 мкг на дозу, или 20-50 мкг на дозу, или приблизительно 1 мкг на дозу.
[00241] В пятьдесят первом варианте осуществления, изобретение предусматривает вакцинную композицию по какому-либо одному с тридцать седьмого по пятидесятый вариант осуществления, в которой масляная фаза содержит масло и растворимый в масле эмульгатор.
[00242] В пятьдесят втором варианте осуществления, изобретение предусматривает вакцинную композицию по какому-либо одному с тридцать седьмого по пятьдесят первый вариант осуществления, в которой указаная масляная фаза присутствует в количестве до 85% об./об.
[00243] В пятьдесят третьем варианте осуществления, изобретение предусматривает вакцинную композицию по пятьдесят второму варианту осуществления, в которой указаная масляная фаза присутствует в количестве 51% об./об.
[00244] В пятьдесят четвертом варианте осуществления, изобретение предусматривает вакцинную композицию по какому-либо одному с пятьдесят первого по пятьдесят третий вариант осуществления, в которой масло составляет 40-84% об./об. вакцинной композиции, и растворимый в масле эмульгатор содержит 1-11% об./об. вакцинной композиции.
[00245] В пятьдесят пятом варианте осуществления, изобретение предусматривает вакцинную композицию по пятьдесят третьему варианту осуществления, в которой масло составляет 45% об./об. препарата, и растворимый в масле эмульгатор составляет 6% об./об. препарата.
[00246] В пятьдесят шестом варианте осуществления, изобретение предусматривает вакцинную композицию, которая содержит Eimeria maxima или Clostridium perfringens антиген и композицию адъюванта, которая содержит:
a) масляную фазу, где указанная масляная фаза присутствует в количестве, по меньшей мере, 50% об./об. композиции; поликатионный носитель, и необязательно, иммуностимулирующий олигонуклеотид; или
b) масляную фазу, где указанная масляная фаза присутствует в количестве, по меньшей мере, 50% об./об. композиции; иммуностимулирующий олигонуклеотид, стерин и монофосфорильный липид A (MPL-A) или его аналог.
[00247] В пятьдесят седьмом варианте осуществления, изобретение предусматривает вакцинную композицию по пятьдесят шестому варианту осуществления, которая содержит антигены против Eimeria maxima и Clostridium perfringens.
[00248] В пятьдесят восьмом варианте осуществления, изобретение предусматривает вакцинную композицию по пятьдесят шестому варианту осуществления или пятьдесят седьмому варианту осуществления, в которой указаный поликатионный носитель представляет собой DEAE-Декстран.
[00249] В пятьдесят девятом варианте осуществления, изобретение предусматривает применение вакцинной композиции в соответствии с пунктами с пятьдесят шестого по пятьдесят восьмой вариант осуществления для лечения или предупреждения инфекций, вызванных Eimeria maxima или Clostridium perfringens у домашней птицы.
[00250] В шестидесятом варианте осуществления, изобретение предусматривает вакцинную композицию, которая содержит Neospora антиген и композицию адъюванта, которая содержит масляную фазу, где указанная масляная фаза присутствует в количестве, по меньшей мере, 50% об./об. композиции; и
a) монофосфорильный липид A (MPL-А) или его аналог; или
b) комбинацию из иммуностимулирующего олигонуклеотида и поликатионного носителя.
[00251] В шестьдесят первом варианте осуществления, изобретение предусматривает вакцинную композицию по шестидесятому варианту осуществления, которая содержит комбинацию из иммуностимулирующего олигонуклеотида и декстрана DEAE.
[00252] В шестьдесят втором варианте осуществления, изобретение предусматривает вакцинную композицию по шестидесятому варианту осуществления, которая содержит монофосфорильный липид A (MPL-A) или его аналог, и которая дополнительно содержит иммуностимулирующий олигонуклеотид.
[00253] В шестьдесят третьем варианте осуществления, изобретение предусматривает вакцину по шестьдесят второму варианту осуществления, которая дополнительно содержит стерин.
[00254] В шестьдесят четвертом варианте осуществления, изобретение предусматривает вакцину по шестьдесят третьему варианту осуществления, в которой стерин является холестерином.
[00255] В шестьдесят пятом варианте осуществления, изобретение предусматривает вакцину в соответствии с любым одним с шестидесятого по шестьдесят четвертый вариант осуществления, в которой Neospora антиген представляет собой Neospora caninum антиген.
[00256] В шестьдесят шестом варианте осуществления, изобретение предусматривает применение вакцины в соответствии с каким-либо одним с шестидесятого по шестьдесят пятый вариант осуществления для лечения или предупреждения инфекции, вызванной Neospora.
[00257] В шестьдесят седьмом варианте осуществления, изобретение предусматривает вакцинную композицию, которая содержит Chlamydophila abortis антиген и композицию адъюванта, которая содержит масляную фазу, где указанная масляная фаза присутствует в количестве, по меньшей мере, 50% об./об. композиции; стерин; иммуностимулирующий олигонуклеотид; монофосфорильный липид A (MPL-A) или его аналог; и поли I:С.
[00258] В шестьдесят восьмом варианте осуществления, изобретение предусматривает применение вакцины в соответствии с шестьдесят седьмым вариантом осуществления для лечения или предупреждения выкидыша, вызванного С. abortis у овцематок.
[00259] В шестьдесят девятом варианте осуществления, изобретение предусматривает вакцинную композицию, которая содержит миостатин и композицию адъюванта, где указанная композиция адъюванта содержит масляную фазу, где указанная масляная фаза присутствует в количестве, по меньшей мере, 50% об./об. композиции, иммуностимулирующий олигонуклеотид и или:
a) поликатионный носитель; или
b) MPL-A или его аналог.
[00260] В семидесятом варианте осуществления, изобретение предусматривает вакцинную композицию по шестьдесят девятому варианту осуществления, которая содержит MPL-A или его аналог, в которой указанный препарат содержит меньше, чем 0,5 мкг стерина на 50 мкл указанной композиции.
[00261] В семьдесят первом варианте осуществления, изобретение предусматривает вакцинную композицию по семидесятому варианту осуществления, которая не содержит стерин.
[00262] В семьдесят втором варианте осуществления, изобретение предусматривает вакцинную композицию по семидесятому варианту осуществления, в которой стерин является холестерином.
[00263] В семьдесят третьем варианте осуществления, изобретение предусматривает применение вакцины в соответствии с каким-либо одним из вариантов осуществления от 69 по 72 для уменьшения количества миостатина у животного.
[00264] В семьдесят четвертом варианте осуществления, изобретение предусматривает применение в соответствии с семьдесят третьим вариантом осуществления, в которой указанное животное является домашней птицей.
[00265] В семьдесят пятом варианте осуществления, изобретение предусматривает вакцинную композицию, которая содержит Trueperella pyogenes антиген и композицию адъюванта, в которой композиция адъюванта содержит масляную фазу, где указанная масляная фаза присутствует в количестве, по меньшей мере, 50% об./об. композиции; иммуностимулирующий олигонуклеотид и поликатионный носитель.
[00266] В семьдесят шестом варианте осуществления изобретение предусматривает вакцинную композицию по семьдесят пятому варианту осуществления, в которой Trueperella pyogenes антиген является пиолизином.
[00267] В семьдесят седьмом варианте осуществления, изобретение предусматривает применение вакцинной композиции по семьдесят четвертому или семьдесят пятому варианту осуществления, для лечения или предупреждения инфекции, вызванной Trueperella pyogenes.
[00268] В семьдесят восьмом варианте осуществления, изобретение предусматривает вакцинную композицию, которая содержит антиген Е coli, антиген BRV или антиген BCV, и композицию адъюванта, в которой указаная композиция адъюванта содержит масляную фазу, присутствующую в количестве, по меньшей мере, 50% об./об. указанной вакцинной композиции, иммуностимулирующий олигонуклеотид и, по меньшей мере, один из поликатионного носителя и источника алюминия.
[00269] В семьдесят девятом варианте осуществления, изобретение предусматривает вакцинную композицию по семьдесят восьмому варианту осуществления, которая содержит антиген Е coli, антиген BRV и антиген BCV.
[00270] В восьмидесятом варианте осуществления, изобретение предусматривает вакцинную композицию по семьдесят восьмому или семьдесят девятому варианту осуществления в которой:
a. антиген Е coli, если присутствует, выбирают из группы, состоящей из Е coli К99, Е coli F41 и их комбинации;
b. антиген BRV, если присутствует, выбирают из группы, состоящей из BRV G6, BRV G10 и их комбинации.
[00271] В восемьдесят первом варианте осуществления, изобретение предусматривает вакцинную композицию в соответствии с каким-либо одним с семьдесят восьмого по восьмидесятый вариант осуществления, в которой поликатионный носитель, если присутствует, представляет собой декстран DEAE и иммуностимулирующий олигонуклеотид представляет собой CpG.
[00272] В восемьдесят втором варианте осуществления, изобретение предусматривает вакцинную композицию в соответствии с каким-либо одним с семьдесят восьмого по восемьдесят первый вариант осуществления, которая содержит источник алюминия, который представляет собой гель гидроксида алюминия.
[00273] В восемьдесят третьем варианте осуществления, изобретение предусматривает вакцинную композицию по восемьдесят второму варианту осуществления, в которой указанный источник алюминия присутствует в количестве 5%-20% об./об.
[00274] В восемьдесят четвертом варианте осуществления, изобретение предусматривает вакцинную композицию по восемьдесят третьему варианту осуществления, в которой указанный источник алюминия присутствует в количестве 10%-17% об./об.
[00275] В восемьдесят пятом варианте осуществления, изобретение предусматривает применение вакцинной композиции в соответствии с каким-либо одним с семьдесят восьмого по восемьдесят четвертый вариант осуществления для лечения или предупреждения энтерита, вызванного Е coli, BCV или BRV у бычьего животного.
[00276] В восемьдесят шестом варианте осуществления, изобретение предусматривает применение в соответствии с девяносто первым вариантом осуществления, где указанная вакцина вызывает, по меньшей мере, продолжительностью в шесть месяцев иммунитет к указанному(ым) антигену(ам).
[00277] В восемьдесят седьмом варианте осуществления, изобретение предусматривает вакцинную композицию, которая содержит антиген Rhipicephalus microplus и адъювант, где указанный адъювант выбирают из группы, состоящей из:
а) водного адъюванта, содержащего иммуностимулирующий олигонуклеотид, сапонин, стерин, четвертичный амин, полиакриловый полимер, и гликолипид; и
b) адъювант на масляной основе, содержащий масляную фазу, присутствующую в количестве, по меньшей мере, 50% об./об. вакцинной композиции, и которая содержит иммуностимулирующий олигонуклеотид и поликатионный носитель.
[00278] В восемьдесят восьмом варианте осуществления, изобретение предусматривает вакцинную композицию по восемьдесят седьмому варианту осуществления, в которой сапонин представляет собой Quil А, стерин представляет собой холестерин, четвертичный амин представляет собой DDA, гликолипид представляет собой N-(2-дезокси-2-L-лейциламино-b-D-глюкопиранозил)-N-октадецилдодеканоиламид или его соль, и иммуностимулирующий олигонуклеотид представляет собой CpG.
[00279] В восемьдесят девятом варианте осуществления, изобретение предусматривает вакцинную композицию по восемьдесят седьмому варианту осуществления, в которой поликатионный носитель представляет собой декстран DEAE и иммуностимулирующий олигонуклеотид представляет собой CpG.
[00280] В девяностом варианте осуществления, изобретение предусматривает вакцинную композицию по какому-либо одному с восемьдесят седьмого по восемьдесят девятый вариант осуществления, в которой Rhipicephalus microplus антиген представляет собой Bm86 протеин.
[00281] В девяносто первом варианте осуществления, изобретение предусматривает применение вакцинной композиции в соответствии с каким-либо одним с восемьдесят седьмого по девяностый вариант осуществления для лечения или предупреждения инфекции, вызванной Rhipicephalus microplus.
[00282] В девяносто втором варианте осуществления, изобретение предусматривает вакцинную композицию, которая содержит антиген вируса ящура (FMD) и композицию адъюванта, где указанная композиция адъюванта содержит масляную фазу, присутствующую в количестве, по меньшей мере, 36% об./об. указанной вакцинной композиции, иммуностимулирующий олигонуклеотид и поликатионный носитель, где указанная вакцинная композиция представляет собой эмульсию вода-в-масле. В различных вариантах осуществления, указанный антиген вируса ящура может быть либо немутантного типа FMDV, генетически модифицированным и/или ослабленным FMDV штаммами, или рекомбинантно экспрессированным FMDV структурными белками, такими как вирусоподобные частицы (VLP) серотипов A, C, О, Asia1, SAT1, SAT2 или SAT3.
[00283] В девяносто третьем варианте осуществления, изобретение предусматривает вакцинную композицию по девяносто второму варианту осуществления, в которой иммуностимулирующий олигонуклеотид представляет собой CpG, и поликатионный носитель представляет собой DEAE декстран.
[00284] В девяносто четвертом варианте осуществления, изобретение предусматривает вакцинную композицию по девяносто второму или девяносто третьему варианту осуществления, в которой антиген представляет собой изобретение, которое предусматривает вакцинную композицию по девяносто восьмому или девяносто девятому варианту осуществления, в которой антиген получают из генетически модифицированного вируса на платформе FMD-LL3B3D, который является ослабленным у крупного рогатого скота и свиней, особенно, FMD-LL3B3D-A24 Cruzeiro.
[00285] В девяносто пятом варианте осуществления, изобретение предусматривает применение вакцинной композиции по какому-либо одному с девяносто второго или девяносто четвертого варианта осуществления для лечения или предупреждения FMD у крупного рогатого скота.
[00286] В девяносто шестом варианте осуществления, изобретение предусматривает вакцинную композицию, которая содержит антиген Streptococcus uberis (S. uberis) и композицию адъюванта, которая содержит масляную фазу, где указанная масляная фаза присутствует в количестве, по меньшей мере, 50% об./об. композиции; поликатионный носитель; и
a) иммуностимулирующий олигонуклеотид;
b) комбинацию, которая содержит сапонин, стерин и четвертичный амин; или
c) их комбинацию.
[00287] В девяносто седьмом варианте осуществления, изобретение предусматривает вакцинную композицию по девяносто шестому варианту осуществления, в которой антиген представляет собой адгезионную молекулу S. uberis или ее иммуногенный фрагмент.
[00288] В девяносто восьмом варианте осуществления, изобретение предусматривает применение вакцины в соответствии с каким-либо одним с девяносто шестого или девяносто седьмого варианта осуществления для лечения или предупреждения инфекции, вызванной S. uberis.
[00289] Следующие примеры представлены как иллюстративные варианты осуществления, их не следует рассматривать как ограничивающие объем изобретения. Много изменений, вариаций, модификаций и других использований и применений данного изобретения будут очевидными для специалиста в данной области техники.
ПРИМЕРЫ
Пример 1. Разработка рекомбинантной стратегии вакцинации для повышения иммунитета против некротического энтерита свиней.
[00290] Цель исследования состояла в том, чтобы оценить влияние вакцинации in vivo адъювантной рекомбинантной клостридиевой вакциной против живого контрольного заражения инфекцией Eimeria maxima и Clostridium perfringens в модели заболевания некротического энтерита. Материалы и способы
[00291] Рекомбинантные протеины: Кодирующие последовательности полной длины для генов, кодирующих С.perfringens (АТСС 13124, Американская коллекция типовых культур, Manassas, VA) NetB и EF-Tu клонировали, применяя ПЦР в рЕТ32а(+) векторе с NH2-терминальным полигистидиновым эпитопным тегом. Клонированные гены трансформировали в компетент Escherichia coli, бактерии культивировали в течение 16 ч. при 37°C, и индуцировали в течение 5 ч. при 37°C 1,0 мМ изопропил β-D-тиогалактопиранозидом (Amresco, Cleveland, ОН). Бактерии собирали, применяя центрифугирование на 10000 обор./мин. в течение 10 мин. при 4°C, снова суспендировали в PBS, разрушали ультразвуком, и центрифугировали на 10000 обор./мин. в течение 15 мин. Супернатант инкубировали в течение 1 ч. при 22°C с Ni-NTA агарозой (Qiagen, Valencia, СА), смолу промывали PBS, и очищенные клостридиевые протеины элюировали 250 мМ имидазола в PBS, pH 9.2. Чистота протеина purity была подтверждена на Кумасси окрашенных синим SDS-акриламидных гелях. Концентрацию протеина определяли с использованием коммерческого набора от Sigma.
[00292] Животные: Однодневного возраста бройлеры птицы (Ross/Ross), которые вылупились в инкубатории Longeneckers (Elizabethtown, РА) транспортировали в BARC-East, Building 1082, и птенцы были размещены в Petersime стартерные брудер-единицы в соответствии с установленным руководством BARC комитета по уходу за маленькими животными. Птиц содержали в брудерных местах в свободных от Eimeria средства и переносили в большие подвесные клетки в отдельном месте, где их инфицировали и удерживали до конца экспериментального периода для исследования живого контрольного заражения инфекцией. Все процедуры, касающиеся транспортировки, измерения массы тела, инфекции, и сбора крови и селезенки были одобрены BARC комитетом по уходу за маленькими животными (SOP прилагается). ARS BARC комитет по уходу за маленькими животными установил руководство для экспериментов на животных при BARC и проводит регулярные инспекции всех средств для животных.
[00293] Иммунизация: Первичную иммунизацию проводили путем подкожной инъекции однодневного возраста цыплят-бройлеров 100 мкл вакцины (Ag 100 мкг/доза). Вторичную иммунизацию проводили путем подкожной инъекции семидневного возраста цыплят-бройлеров, которым подкожно инъекционно вводили 100 мкл вакцины (Ag 100 мкг/доза).
[00294] Контрольное заражение Eimeria: BARC штаммы Eimeria spp., которые хранились в паразитарной лаборатории заболеваний животных и распространяли в соответствии с установленной процедурой. Е. maxima (41А) чистили за счет флотации с 5% раствором гипохлорита натрия, промывали трижды PBS, и жизнеспособность подсчитывали с помощью трипанового синего, применяя гемоцитометр. Количество ооциста основывается на только спорулированных ооцистах. Через шесть дней после бустер-иммунизации, куры были привиты пищеводно 10000 Е. Maxima применяя инокуляционную иглу.
[00295] Контрольное заражение С. perfringens: Через четыре дня после инфекионированния Eimeria, птиц с NE группы прививали пищеводно 1×109 КОЕ Clostridium perfringens каждому, применяя инокуляционную иглу.
[00296] Анализы: Птицы были взвешены в день прибытия, сразу перед контрольным заражением ЕМ, перед контрольным заражением С. perfringens, через 2 дня после С.Р., и 10 дней после С.Р. контрольного заражения, чтобы рассчитывать увеличение веса.
[00297] Для подсчета кишечных поражений, птиц (5 птиц/группа) умертвляли через два дня после С.Р. инфицирования. Примерно 20 см кишечные сегменты, которые растягиваются на 10 см от переднего отдела и заднего к дивертикулу, получали и разрезали в продольном направлении. Баллы поражения оценивались 2 независимыми наблюдателями от 0 до 4 в порядке возрастания степени тяжести поражения.
[00298] Двумя основными факторами С. perfringens вирулентности у кур является альфатоксин и NetB (В-подобный некротический энтерит) токсин, оба из которых участвуют в патогенезе NE. Дополнительные С. perfringens протеины, которые могут быть включены в бактериальный патогенез и защитный иммунитет хозяина, включая пируват: ферредоксин оксидоредуктаза (PFO) и фактор элонгации G (EF-G), как ранее сообщалось, индуцирует защитный иммунитет против экспериментального контрольного заражения инфекцией с С. perfringens. Соответственно, титры антитела к данным факторам определяли, как описано ниже.
[00299] Пять птиц в каждой группе выбирали случайным образом для крови, которую собирали с помощью пункции сердца сразу же после эвтаназии. Сыворотку получали центрифугированием с низкой скоростью и использовали в твердофазном иммуноферментном анализе (ИФА), чтобы измерить уровни α-токсин-, NetB-, EF, и PFO-специфического антитела. Коротко говоря, 96-луночные планшеты для микротитрования покрывали в течение ночи 1,0 мкг/лунка очищенных рекомбинантных протеинов α-токсина-, NetB-, EF, и PFO. Планшеты промывали PBS, содержащий 0,05% Tween (PBS-T) и блокировали PBS, содержащий 1% BSA. Сыворотку (100 мкл/лунка) инкубировали в течение 2 ч. при комнатной температуре с осторожным перемешиванием. Планшеты промывали PBS-T, и связаное антитело детектировали с использованием конъюгированного с пероксидазой кроличьего анти-куриного IgG (Sigma, St. Louis, МО) и пероксидаза-специфический субстрат. Оптическую плотность (OD) на 450 нм измеряли применяя автоматизированный микропланшетном ридер (Bio-Rad, Richmond, СА).
[00300] Статистические анализы: Все значения выраженые в виде среднего значения ± SEM. Среднее значения для увеличения веса тела и баллы поражения сравниваются между группами с помощью теста Турции после ANOVA с использованием SPSS 15.0 для Windows (SPSS Inc., Chicago, IL). Различия между средними значениями будут считаться значимыми при p<0,05.
[00301] Экспериментальный дизайн иллюстрируется в таблице 1.
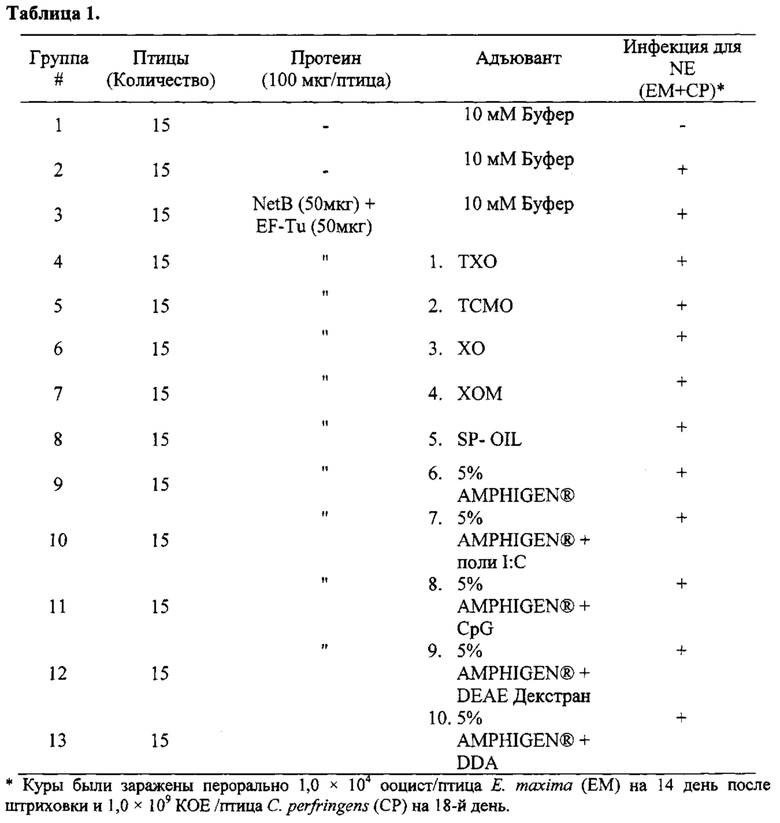
[00302] Композиции адъювантов были следующими (на 50 мкл):
[00303] ТХО: SEQ ID NO: 8 присутствовала в количестве 1 мкг, декстран DEAE присутствовал в количестве 5 мкг, легкое минеральное масло присутствовало в количестве 51% об./об. композиции.
[00304] ТСМО: SEQ ID NO: 8 присутствовала в количестве 1 мкг, холестерин присутствовал в количестве 1 мкг, MPL-A присутствовал в количестве 1 мкг/50 мкл доза легкое минеральное масло присутствовало в количестве 51% об./об. композиции.
[00305] ХО: Декстран DEAE присутствовал в количестве 5 мкг, легкое минеральное масло присутствовало в количестве 51% об./об. композиции.
[00306] ХОМ: Декстран DEAE присутствовал в количестве 5 мкг, легкое минеральное масло присутствовало в количестве 51% об./об. композиции, MPL-A присутствовал в количестве 1 мкг.
[00307] 5% AMPHIGEN® + поли I:С: поли I:С присутствовал в количестве 1 мкг.
[00308] 5% AMPHIGEN® + CpG: SEQ ID NO: 8 присутствовал в количестве 1 мкг.
[00309] 5% AMPHIGEN® + DEAE Декстран: DEAE декстран присутствовал в количестве 25 мкг.
[00310] 5% AMPHIGEN® + DDA: DDA присутствовал в количестве 1 мкг.
[00311] Увеличение массы тела было значительно снижено при ЕМ и CP инфекции в контрольной группе NE (Р<0.05). Однако, увеличение массы тела, в целом, повышалось в группах, иммунизированных рекомбинантными CP протеинами (Net В + EF) на 4~21%. Значительное различие с контролем NE было обнаружено в Prot ТСМО группе, которая была иммунизирована CP протеинами, конъюгированным с ТСМО адъювантом.
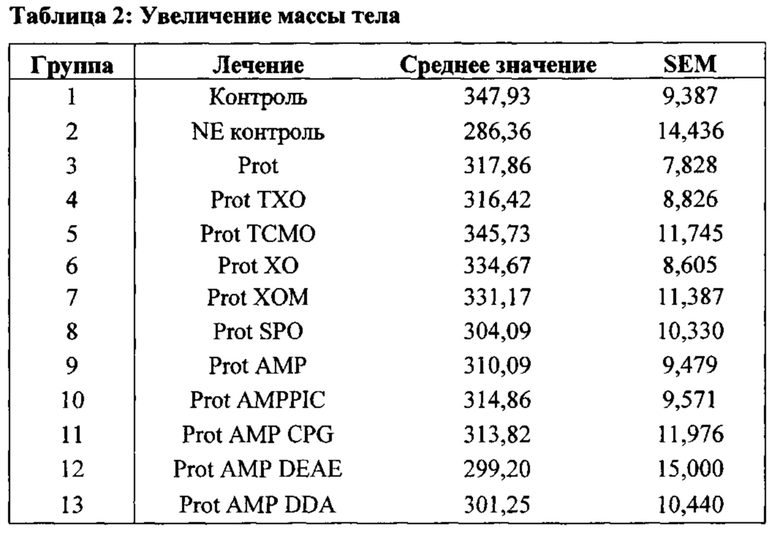
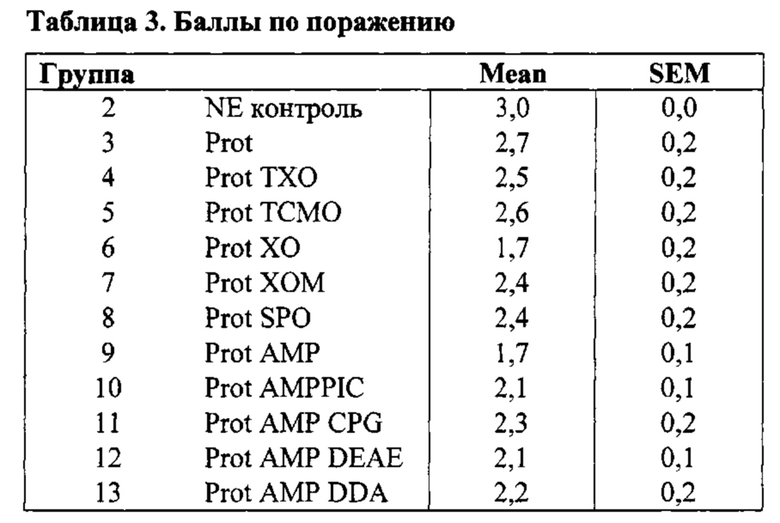
[00312] Через шесть дней после ЕМ инфицирования и через 2 дня после CP инфицирования оценивали антительные ответы в сыворотке против α-токсина, Net-B, EF и PFO. Результаты представлены в таблице 4. Коротко говоря, CP протеин в целом повышал Ab титры против CP антигенов у птиц, иммунизированных CP протеинами. Ab ответы к Net В, EF и PFO антигенов были значительно выше, чем в α-токсина.
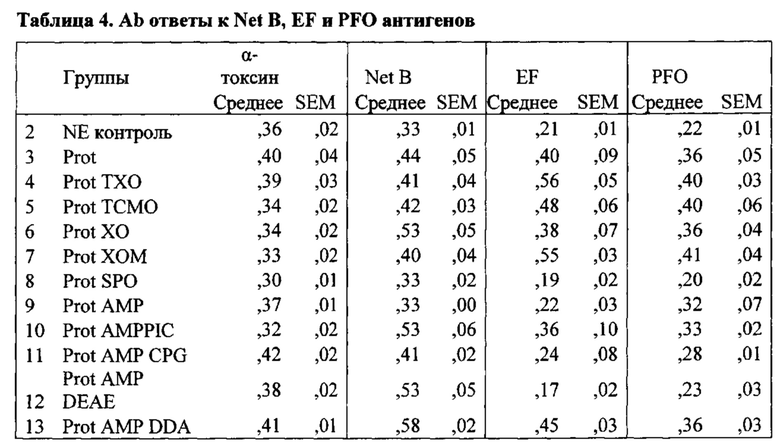
Пример 2: Куриная антимиостатиновая вакцина.
[00313] Миостатин является секретируемым фактором дифференциации роста, который является членом семьи TGF бета-протеина, которая ингибирует мышечное дифференцирование и рост. Миостатин продуцируется в основном в клетках скелетных мышц, циркулирует в крови и влияет на мышечную ткань, путем связывания клеточно-связываемого рецептора, который называется рецептором активина типа II. Соответственно, ингибирование миостатина в результате приводит к животным, которые имеют, повышенное количество мяса/мышц. Одним из подходов к снижению количества миостатину у животного является генерировать анти-миостатиновый иммунный ответ, который могут удобно измерять, используя титры анти-миостатинового антитела. В данном примере использовали куриную модель.
[00314] Куры Cobb 500 Parent Stock и Ross 308 (в возрасте 12-10 недель, соответственно) инициировали вакциной, содержащей миостатин-конъюгированньш пептид и композицию адъюванта. Композиции адъюванта, которые использовали в исследовании, показанны в таблице 5.
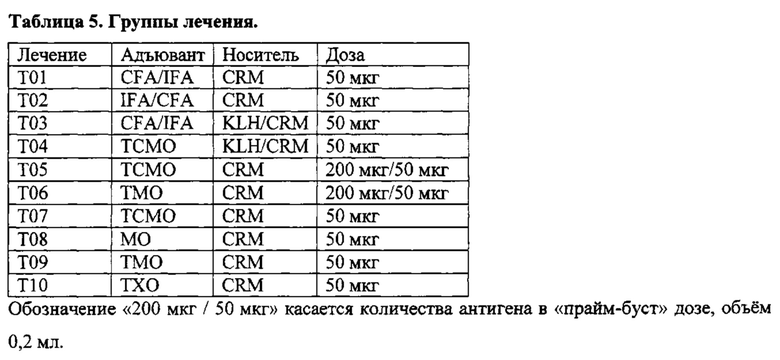
[00315] Компоненты в адъювантах являются такими, как описано в таблице 6.
[00316] Куры Cobb 500 Parent Stock и Ross 308 инициировали на неделях 12 или 10 и увеличивали на неделю 18. Титры сыворотки анти-миостатинового антитела измеряли, применяя ИФА перед вакцинированием и каждые две недели после первичной обработки до 22 и 20 недельного возраста, соответственно.
[00317] Группы Т06, Т07, Т09 и Т10 продуцировали самые высокие ответы (средне геометрическое титров антител составляет от 50000 до 15000 на 22 недели). Среди этих четырех групп, птицы Cobb 500 в группах Т06 и Т07 продемонстрировали средне геометрические титры выше 100000.
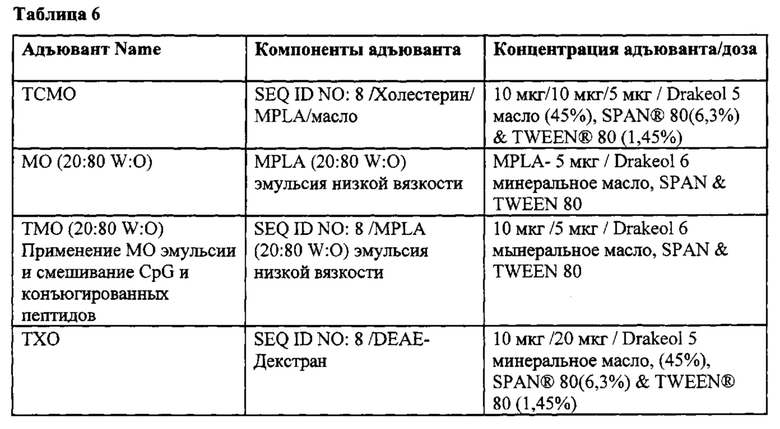
Пример 3. Вакцины против Т. pyogenes
[00318] Truepurella pyogenes (ранее Arcanobacterium pyogenes, и ранее Actinomyces pyogenes и также Corynebacterium pyogenes) часто приводят к тяжелому клиническому метриту у крупного рогатого скота, которая характеризуется густой, гнойной секреции. Неприятный запах, иногда связанный с данным состоянием, вероятно, является вызванным анаэробными бактериями, которые также присутствуют, но не выявляются обычными культуральными методами. Заболевание наиболее часто встречается у сухих коров или телок до или во время периода отела, и иногда происходит в период лактации животных, как следствие травмы сосков или вымени. Экономически важные заболевания, вызванные данным организмом включают метрит, и выкидыш у молочных коров и абсцессов печени у крупного рогатого скота, содержащегося на пастбищных участках. Пиолизин (PLO), холестерин-зависимый цитолизин, экспрессированый Truepurella pyogenes, является важным хозяин-защитным антигеном.
[00319] Ангус кросбред крупного рогатого скота примерно в возрасте 14 месяцев использовали в данном исследовании. Животные были в целом с хорошим здоровьем и не имели каких-либо заболеваний, которые бы усложняли включение в исследование. Животные имели вволю доступ к корму и воде.
[00320] Препараты: Все бактерии (Е. coli и Т. pyogenes) с 1×109 на дозу. Пиолизин вводили 150 микроорганизмов на дозу животным в группах Т02-Т07. Группу Т01 использовали в качестве контроля.
[00321] Композиции адъювантов, которые исследовали в данном исследовании, были следующими:
ISC/Поли I:C - ISC 1000 мкг / Поли I: С 50 мкг в 2 мл дозы
ISC/CpG - ISC 1000 мкг/100 мкг CpG (SEQ ID NO: 8) в 2 мл дозы
ТХО - CpG 100 мкг (SEQ ID NO: 8)/DEAE Декстран/Минеральное масло 5LT NF в 2 мл дозы
QCDCRT - Quil А 150 мкг/холестерин 150 мкг/DDA 100 мкг/CARBOPOL® (Полиакриловый полимер) 0,0375%/ R1005 1000 мкг/CpG (SEQ ID NO: 8) 100 мкг в 2 мл дозы
QAC - Quil А 500 мкг/холестерин 500 мкг/AMPHIGEN® (эмульсия лецитинового масла) 2,5% в 2 мл дозы
[00322] Пиолизиновое антитело измеряли применяя опосредованное ИФА, антиген на планшете с последующим образцом сыворотки (первичное антитело), с последующим антибычьим IgG конъюгатом измеряли в дни 0, 28 и 56.
[00323] Все образцы и контроли разбавляли 1:2000, и ответ определяли путем расчета соотношения OD образца к OD положительного контроля (поз. контр, был пул сыворотки от выздоравливающих животных). Антитело детектировали HRP-конъюгированными с овечьим анти-бычьим IgG.
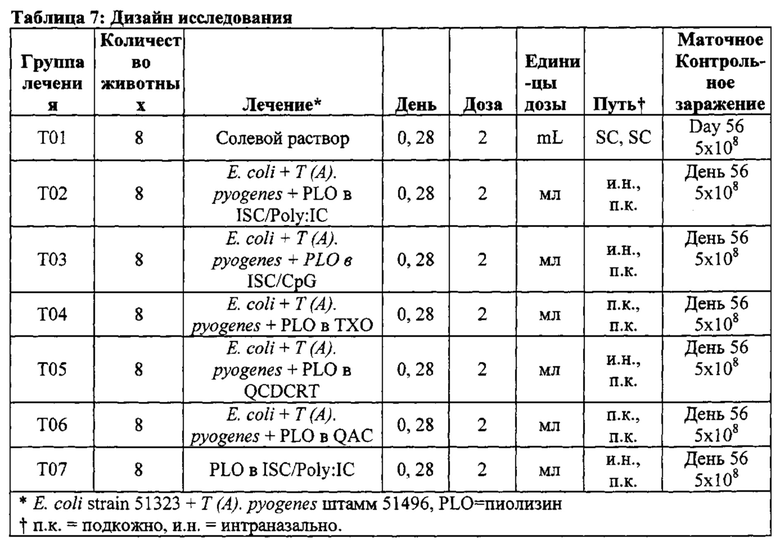
[00324] Результаты приведены в таблице 8
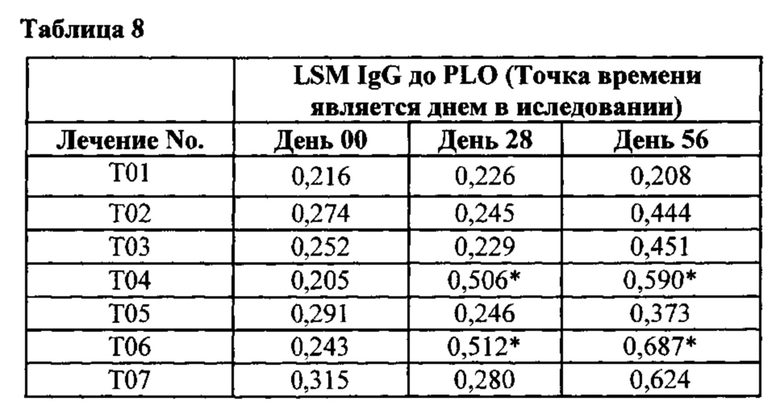
[00325] Группы Т04 и Т06 (адъюванты ТХО и QAC) осуществляли значительно лучше, чем контроль (P<0,05). Кроме того, были выявленны многочисленные тенденции среди различных групп лечения (избранные как разницы, где P<0,1). Данные тенденции представлены в таблице 9.

Пример 4. Оценка пиолизинового вакцинного препарата у дойных коров против метрита, контрольное заражение.
[00326] Цель данного исследования состояла в том, чтобы оценить эффективность нативных и рекомбинантных пиолизиновых вакцинных препаратов, с адъювантом ТХО, у небеременных лактирующих гольштинських или гольштинських перекрестных молочных коров, применяя модель искусственного контрольного заражения метритом.
[00327] Животные имели в целом хорошее здоровье, не имели каких-либо осложняющих заболеваний, и не получали никакой химиотерапии, системный антибиотик или другие противовоспалительные лекарственные средства в течение семи (7) дней, предшествовавших и после вакцинации и контрольное заражение. Они были в своей 1ой-3ей четности, ранее в истории не имели метрита, и не давали положительный результат на культуру Т. pyogenes до контрольного заражения (день -1 или 0). Животные, у которых развивались клинически значимые параллельные заболевания во время исследования, были удалены.
[00328] Животные имели вволю доступ к корму в течение, по меньшей мере, 20 часов в каждый 24-часовой период, за единственным исключением, когда их доили. Использовали базальный, изготовленный на заказ смешанный рацион питания, представитель промышленности для лактации. Животные акклиматизировались в течение не менее 7 дней до начала исследования. Сформулированые вакцины, которые вводили коровам (n=20 на группу), содержали следующие компоненты: Т01- Солевой раствор; Т02- ТХО + нативный пиолизин (nPLO) Т03- ТХО + рекомбинантный пиолизин (rPLO). Рекомбинантный пиолизин получали клонированием, экспрессией, и очисткой антигена с Corynebacterium glutamicum. Очищенный протеин затем инактивировали путем обработки формалином. Нативный пиолизин, экспрессированный и очищенный с Trueperella pyogenes, также инактивировали путем обработки формалином. ТХО адъювант содержал CpG олигонуклеотиды, DEAE-Декстран, минеральное масло, и поверхностно-активные вещества Span 80 и Tween 80.
[00329] В день вакцинации, соответствующий IVP (Таблица 10) вводили подкожным способом. Вакцины вводили в шею в день 0, и на противоположной стороне шеи в день 28 Место введения вакцины оценивали в дни исследования 0, 1,2, 3, 7, 28, 29, 30, 31, 35, 49 и 77 реакции в местах инъекции. В день вакцинации, место введения оценивали, чтобы подтвердить, что никаких отеков не присутствовало до введения вакцины. В день исследования 28, 49 и 77 осматривали с обеих сторон шеи. Оценки места инъекции регистрировали. Кроме того, измеряли ректальные температуры и регистрировали в дни исследования 0 (до 1ой вакцинации), 1, 2, 3, 7, 28 (до 2ой вакцинации), 29, 30, 31 и 35 во время фазы вакцинации. Кроме того, измеряли ректальную температуру и регистрировали в контрольном заражении с дня 0 до 28.
[00330] Клинические наблюдения после вакцинации регистрировали в дни исследования 0, 1, 2, 3, 7, 28, 29, 30, 31 и 35 (во время фазы вакцинации). Кроме того, клинические наблюдения наблюдали и регистрировали во время фазы контрольного заражения начиная со дня 49 до 77.
[00331] Антительные ответы на пиолизин определяли, используя ИФА в дни исследования 0, 28, 49, и последний день исследования (d77). Гемолитический анализ ингибирования также проводили на каждом образце сыворотки. Данный анализ измеряет анти-пиолизиновый антительный ответ, который коррелирует с биологической активностью (защитой).

[00332] До контрольного заражения, овариальный цикл всех коров был синхронизирован. Прогестерон вводили перед контрольным заражением, и каждый день на протяжении всей фазы 28дневного контрольного заражения. Применяя стерильную канюлю подобную селекционной канюли, 10 мл Escherichia coli штамма контрольного заражения и 10 мл Trueperella pyogenes штамма контрольного заражения (предварительно определенные дозы контрольного заражения), каждый помещали в отдельный шприц, инфузионно вводили в матку всем коровам при контрольном заражении в день 0. Для обеспечения полной доставки материала контрольного заражения, канюлю промывали 10 мл стерильной культуральной среды.
[00333] Контрольное заражение было признано успешным, если, по меньшей мере у 60% животных в группе лечения Т01 (контрольная группа) развивался метрит. Присутствие метрита будет определяться присутствием слизисто-гнойных маточных/вагинальных выделений с оценкой ≥2 (Данная система подсчета баллов была принята из способа, описанного Sheldon et al., Theriogenology, 65:1516-1530, 2006; в котором оценки 0 и 1 считались нормальными.)
[00334] Первичная переменная была присутствием слизисто-гнойных маточных/вагинальных выделений с оценкой ≥2, которая показывает наличие метрита. Маточное/вагинальное выделение собирали, используя асептическое Simcro MetriCheck™ устройство с асептической чашкой, и оценено начало контрольного заражения в день 0 до 28 (день исследования 49 до 77).
[00335] Лечение считалось эффективным, если только в Т01 коров развивался клинический метрит, или если продолжительность и/или часть дней с слизисто-гнойными вагинальными выделениями (оценка ≥2) была значительно короче (p=<0,1) по сравнению с контрольной группой. Если бы не было никаких существенных различий между группами по продолжительности и частью дней с метритом, то частота Т. pyogenes выделения с помощью маточного бактериального тампона использовали как вспомогательные данные для эффективности вакцины. Безопасность соответствующих вакцин оценивали на основе оценки места инъекции, ректальных температур и любых неблагоприятных последствий для лактации.
[00336] Собранные данные относительно метрита (присутствие вагинальных/маточных выделений, Да/Нет; оценка вагинальных/маточных выделений) суммировали для каждого животного в каждой временной точке, и использовали для определения распределения частоты каждой категории для каждой обработки в каждый момент времени точечный. Распределение частот для любого животного было Нормальное/анормальное (Нормальное является счетом = 0 или 1; анормальное является счетом ≥2) для каждого признака метрита (например, оценка вагинальных/маточных выделений) были обобщены за обработкой и точкой времени. Когда животное имело анормальную (оценка ≥2) оценку маточных выделения суммировали за обработкой, применяя обобщенную линейную смешанную модель (Proc Glimmix), с биномиальным распределением ошибок и функцией логит-связь. Статистическая модель включала фиксированный эффект лечения, и рандомизированный эффект партии. Контрасты были сделаны между группами лечения. Это повторялось для каждого вариабельного метрита, описанного в данном параграфе. Если Proc Glimmix не сходились для вариабельного метрита, затем использовали точный критерий Фишера вместо того, чтобы сравнить группы лечения.
[00337] Продолжительность анормальной оценки (для каждого вариабельного метрита) определяли для каждого животного, и рассчитывали как «(последняя анормальная точка времени минус первая анормальная точка времени) + 1». Продолжительность анормальной оценки была установлена на ноль для животных, не имеющих никаких точек времени с анормальной оценкой для такого вариабельного метрита. Продолжительность анормальной оценки рассчитывали как «(последняя запланированая точка времени коллекции данных минус первая анормальная точка времени) + 1» для животных, которые были удалены из исследования до последней запланированной точки времени коллекции данных для такого вариабельного метрита. Продолжительность анормальной оценки (для каждого вариабельного метрита) превращали в log, и затем анализировали с помощью обобщенной линейной смешанной модели с фиксированным эффектом: лечение, и случайным эффект: остаток. Линейные комбинации оценок параметров были использованы в a priori контрастах после исследования для значительного эффекта лечения (P≤0,10). Сравнения были сделаны между лечением. Обратно превращали средние значения, полученные методом наименьших квадратов, их стандартные погрешности и их 90% доверительные интервалы рассчитывали для каждой группы лечения, оценки параметров по методу наименьших квадратов получали из анализа.
[00338] Часть дней с анормальной оценки (для каждого вариабельного метрита), а также часть дней с нормальным отсутствием Е. coli и Т. pyogenes в выделениях (отсутствие считается значением <=1+), определяли для каждого животного. Каждый затем трансформировали, применяя arc sin преобразование квадратного корня к анализам. Данную трансформированную вариабельную часть дней после каждого анализировали по обобщенной линейной смешанной модели с фиксированным эффектом: лечение, и случайным эффект: остаток. Линейные комбинации оценок параметров использовали в а priori контрастах после исследования для значительного эффекта лечения (Р≤0,10). Сравнения были сделаны между лечениями. Обратно превращали средние значения, полученные методом наименьших квадратов, их стандартные погрешности, и их 90% доверительные интервалы рассчитывали для каждой группы лечения, оценки параметров по методу наименьших квадратов получали из анализа. Частотные распределения любого животного имели Е. coli присутствуют (присутствуют считается значением >1+), Т. pyogenes присутствуют (присутствуют считается значением >1+), и оба Е. coli и Т. pyogenes присутствуют (присутствуют считается значением >1+), суммировались по обработке в каждой временной точке.
[00339] Результаты. Антительный ответ к пиолизину оценивали, используя ИФА, измерения уровней сыворотки IgG. Результаты (Таблица 11), представленые как средние титры по методу наименьших квадратов (LSM), показывают, что титры были значительно выше у коров в Т02 и Т03, по сравнению с Т01, в дни исследования 28, 49 и 77. Они также предполагают, что не было статистически существенного различия между титрами групп Т02 и Т03. По отношению к титрам антитела в матке также оценивали, используя ИФА, результаты (Таблица 12) продемонстрировали, что титры были значительно выше в дни 49 и 77 у коров в пределах Т02 и Т03, по сравнению с теми, которые в Т01, в те же дни. Относительно гемолитического ингибирования антител, результаты в таблице 13 показывают, что животные в Т02 имели значительно более высокие титры в дни исследования 49 и 77, чем те, которые в группах Т01 и Т03.
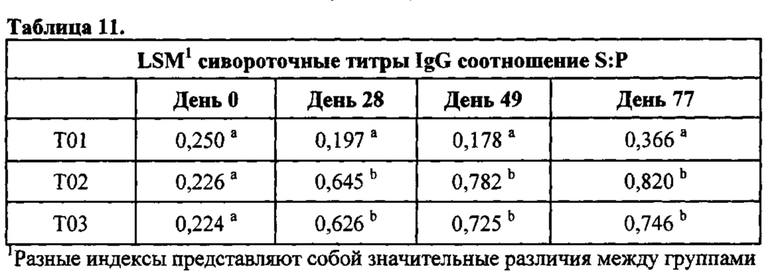

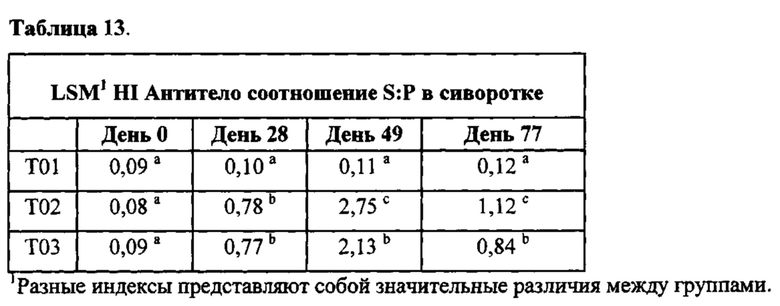
[00340] В отношении первичной переменной, оцененной по уровню слизисто-гнойных маточных/вагинальных выделений (оценка вагинального выделения, или VDS), когда измеряли продолжительность метрита, она была значительно короче в группе Т02, по сравнению с группами Т01 и Т03, как измеряли в дни 7 и 10 после контрольного заражения бактериями (таблицы 14, 15).


[00341] Относительно % дней, в которые метрит был очевидным (то есть VDS>2) в течение 10 дней после контрольного заражения (Таблицы 16 и 17), является очевидным, что группа Т02 имела меньше анормальных дней, по сравнению с группами Т01 и Т03. Кроме того, было продемонстрировано, что Т. pyogenes наиболее часто выделялся у коров в группе Т03 (данные не показаны). Таким образом, эффект вакцины был наиболее заметным в группе Т02 (нативный пиолизин + ТХО).

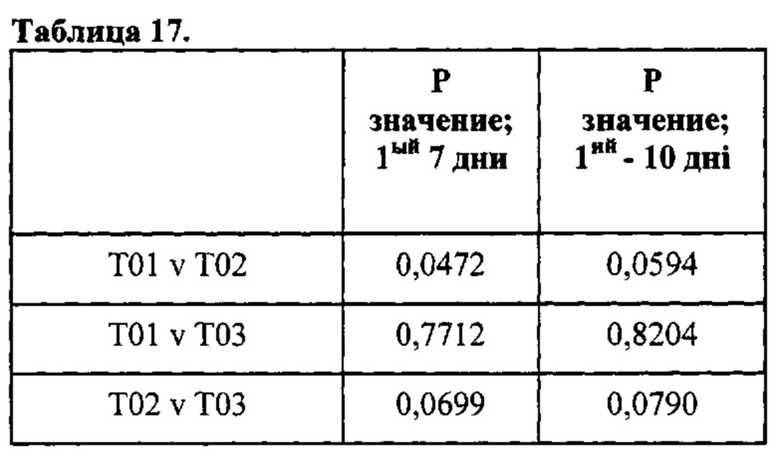
[00342] Дополнительное исследование было проведено с целью оценки эффективности экспериментальных метритовых вакцин, в новых композициях адъювантов, у беременных молочных коров. В данном исследовании беременных коров вакцинировали во время сухого периода. Эффективность измеряли в течение первых 10 дней после отела (родов).
[00343] Беременность гольштинських или гольштинських перекрестных коров, в их с 1ой по 3ю лактацию, были отобраны для исследования. Все отобранные коровы имели в целом хорошее здоровье, не было в истории никакого метрита, и имели известную предполагаемую дату отела. Они также не имели никаких осложняющих заболеваний, и не получали никакой химиотерапии, системного антибиотика или других противовоспалительных лекарственных средств в течение семи (7) дней до и после вакцинации. Животные, у которых развивались клинически значимые параллельные заболевания в любое время в ходе исследования были удалены. В ходе исследования, животные имели вволю доступ к корму, по меньшей мере, 20 часов в каждый 24-часовой период, за единственным исключением во время доения. Животные также имели вволю доступ к воде в течение всего исследования.
[00344] Вакцины вводили группам (n=15/группа) как указано далее: животные в Т01 получали 2 мл вакцины, которая содержит солевой раствор; те, которые в Т02 получали 2 мл вакцины, которая содержит ISCOMS/Поли I:C + nPLO; те, которые в Т03 получали 2 мл вакцины, которая содержит ТХО + nPLO; те, которые в Т04 получали 2 мл вакцины, которая содержит ТХО + Escherichia coli + Trueperella pyogenes + nPLO. (Все вакцинные антигены были формалин - инактивированными.)
[00345] После их прибытия, животным давали акклиматизироваться в течение 7 дней. Примерно за 2 месяца до отела (день исследования 0), животные получали первую вакцинацию, подкожно в левую сторону шеи, за исключением того, что животные в группе Т02 получали вакцину интраназально (Таблица 18). Через двадцать восемь дней, все животные получали вторую вакцинацию, подкожно в правую сторону шеи (Таблица 18). Начиная с первой вакцинации, все коровы были сухими.

[00346] Начиная со дня отела, и продолжительностью в течение 21 дней после этого, оценивали наличие маточных/вагинальных выделений, и если присутствуют, собирали и присваивали оценку, где оценка ≥2 показывала наличие метрита. Примерно 30 мл крови собирали (Дни исследования 0, 28 и 49), для определения антительных ответов к Е. coli, Т. pyogenes, и пиолизин, применяя ИФА. Любые побочные реакции, которые не попали в пределы процедурного сбора данных, были задокументированы.
[00347] Первичная переменная была наличием слизисто-гнойного маточного/влагалищного виделения; оценка ≥2 будет указывать на наличие метрита. Лечение считалось эффективным, если только в Т01 коров развивался клинический метрит, или если продолжительность слизисто-гнойного влагалищного выделения (оценка ≥2) была значительно короче (p=<0.1) по сравнению с контрольными группами. Если присутствует, слизисто-гнойное выделение собирали после родов.
[00348] Сравнения были сделаны между лечениями в каждую точку времени. Рассчитывали средние значения, полученные методом наименьших квадратов (обратно превращали для серологических данных), их стандартные погрешности, и их 90% доверительные интервалы, оценки параметров по методу наименьших квадратов получали из анализа. Диапазоны и количество животных по данным рассчитывали для каждой группы лечения в каждую точку времени.
[00349] Собранные метритные данные (присутствующее вагинальное/маточное выделение, Да/Нет; оценка вагинального/маточного выделения; клинические признаки) суммировались для каждого животного в каждую точку времени, и применяли для определения частотного распределения каждой категории для каждого лечения в каждую точку времени. Частотное распределение любого животного было Нормальное/анормальное (нормальное является оценкой = 0 или 1; анормальное является оценкой ≥2) для каждой метритного признака (например, оценка вагинального/маточного выделения) суммировали по лечениею и точкой времени. Любое животное имело анормальную оценку (оценка ≥2) маточного выделения, суммированную по лечениу, и анализировали, используя обобщенную линейную смешанную модель (Proc Glimmix), с биномиальным распределением погрешностей и функцией логит-связь. Статистическая модель включала фиксированный эффект лечения и случайные эффекты партии, и блок внутри партии. Контрасты были сделаны между группами лечения (повторяли для каждого вариабельного метрита, описанного в данном параграфе). Если Proc Glimmix не сходится для вариабельного метрита, то точный критерий Фишера использовали вместо того, чтобы сравнивать группы лечения.
[00350] Продолжительность анормальной оценки (для каждого вариабельного метрита) определяли для каждого животного, и рассчитывали как «(последняя анормальная точка времени минус первую анормальную точку времени) + 1». Продолжительность анормальной оценки была установлена на ноль для животных, которые не имели никаких точек времени с анормальной оценки для такого вариабельного метрита. Продолжительность анормальной оценки рассчитывали как «(последняя запланированая точка времени коллекции данных минус первая анормальная точка времени) + 1» для животных, которых удаляли из исследования перед последней запланированной точкой времени коллекции данных для такого вариабельного метрита. Продолжительность анормальной оценки анализировали по обобщенной линейной смешанной модели с фиксированным эффектом: лечение, и случайными эффектами партии, блоком внутри партии и остаток. Линейные комбинации оценок параметров использовали в a priori контрастах после исследования для значительного (P≤0.10) эффекта лечения. Сравнения были сделаны между лечением. Средние значения, полученные методом наименьших квадратов, их стандартные погрешности, и их 90% доверительные интервалы рассчитывали для каждой группы лечения оценки параметров по методу наименьших квадратов получали из анализа.
[00351] Результаты. Все коровы, которые рожали близнецов, были удалены из исследования, поскольку такое событие провоцировало у коровы метрит, и могло исказить данные. Коров, которых удаляли, включали 6 из контрольной группы Т01, 2 каждые из групп Т02 и Т03, и 1 из группы Т04. Из оставшихся коров в каждой группе, заболеваемость метритом, и рассчитывали установленные дни метрита. Как можно увидеть в таблице 19, заболеваемость метритом в группах Т03 и Т04 была численно ниже по сравнению с другими группами. Кроме того, данные показывают, что группы Т03 и Т04 имели короткую продолжительность метрита в первые 10 дней после отела, чем имели животные в группах Т01 и Т02. Таким образом, можно сделать вывод о том, что нативный пиолизин, будь то самостоятельно или в комбинации с бактеринами Е. coli и Т. pyogenes, когда как адъювант является ТХО, является эффективным в снижении частоты заболеваемости естественным метритом у крупного рогатого скота.
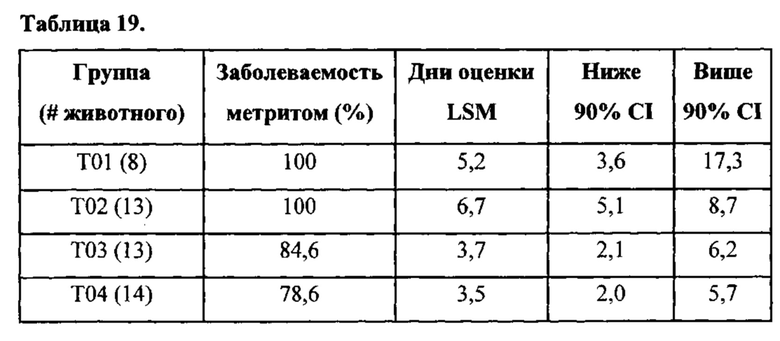
Пример 5. Вакцины против мастита у крупного рогатого скота
[00352] Бактерии Е. Coli J-5 представляет собой известный антиген для лечения мастита. В данном исследовании, различные адъюванты, комбинированые с бактеринами J-5 оценивали относительно анти-маститных эффектов.
[00353] Дизайн исследования является суммированным таблице 20. Отел произошел на ~ день 49. Образцы крови и молока были взяты в дни ноль, 7, 28, 35, 49, 63, 70 и 84. Коровы были контрольно заражены в день70.

[00354] Продолжительность инфекции, вызванной Е Coli в группах Т01-Т06 была следующей: Т01 - 252,1 ч., Т02 - 213 ч., Т03 - 191,6 ч., Т04 - 190,2 ч., Т05 - 198,7 ч. Обработки VACCIMAX® обеспечивали наиболее короткую продолжительность инфицирования. VACCIMAX® представляет собой эмульсию масло-в-воде, которая содержит многослойные липосомы, в которых антиген является упакованным между двумя слоями липосомы.
[00355] Защитные эффекты лечения были также оценены путем определения стратифицированной смягченной фракции. Чем выше стратифицированная смягченая фракция, тем больший защитный эффект. Опять же, препараты с VACCIMAX® имели наибольший эффект (в 13,95-17,19 раз больше по сравнению с контролем), но лечение с ТХО также было эффективным (в 6,24 раз больше по сравнению с контролем).
[00356] Общие антительные ответы на специфическую IgG в цельноклеточной сыворотке J-5 измеряли, применяя опосредованный захват ИФА. Результаты суммировали в таблицах 21 и 22.

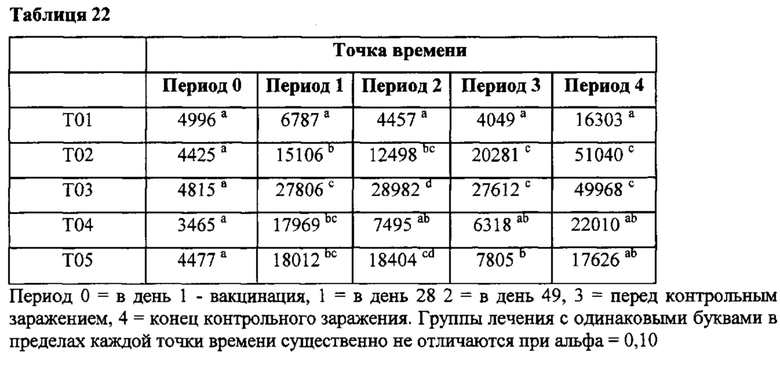
Пример 6: Neospora Caninum вакцина.
[00357] Neospora caninum представляет собой кокцидный паразит, который был идентифицирован как вид в 1988 году. Он является основной причиной самопроизвольного аборта у зараженных животных. Кроме того, являясь основной причиной абортов у крупного рогатого скота, неоспороз является значимым заболеванием у собак во всем мире. Если заболевание поймано рано, собаки могут быть успешно вылеченный с помощью клиндамицина и других антипротозойных лекарственных средств. Однако, заболевание часто имеет смертельные последствия для маленьких щенков. Профилактические вакцины были испытаны на крупном рогатом скоте. Инактивированная вакцина была коммерчески доступной, но имела смешанные результаты. Живая вакцина с использованием ослабленных N. caninum тахизоитов была более успешной, но является более дорогостоящей в производстве. В данном исследовании, авторы изобретения определяли эффекты различных адъювантов на свойства вакцины против N. Canimum с использованием N. caninum циклофилина (NcCYP) и профилина (NcPro) как антигенов.
[00358] Для этого эксперимента использовали самок мышей линии BALB/c в возрасте от восьми до 10 недель. Все животные были иммунизированы дважды с 3-недельными интервалами rNcCyP и rNcProf в присутствии указанного адъюванта. Через три недели после второй иммунизации, всех животных эвтанизировали и собирали селезенку и кровь. NcCyP/NcProf-специфический спленоцитарный пролиферативный ответ определяли по пролиферационному анализу (с 3 до 4 дня). NcCyP/NcProf-специфический спленоцитарный цитокиновый ответ определяли путем стимулирования селезеночных макрофагов Neospora антигеном в течение 48 часов и определяли уровни цитокинов в супернатанте, применяя цитокин-специфический ИФА. Уровни антитела в сыворотке определяли, используя ИФА. Животных обрабатывали как подытожено в таблице 23.
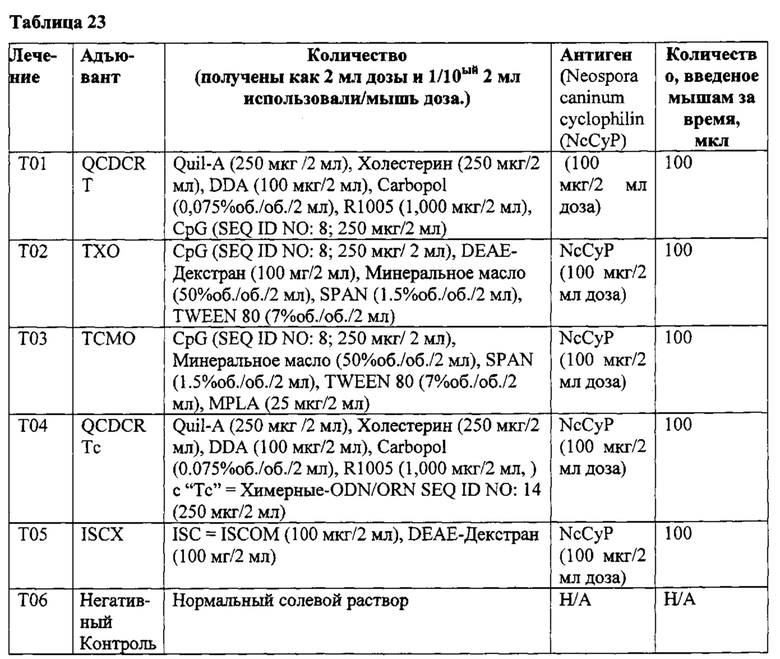
[00359] Свойства групп лечения, указанных выше, подытожены в таблице 24.
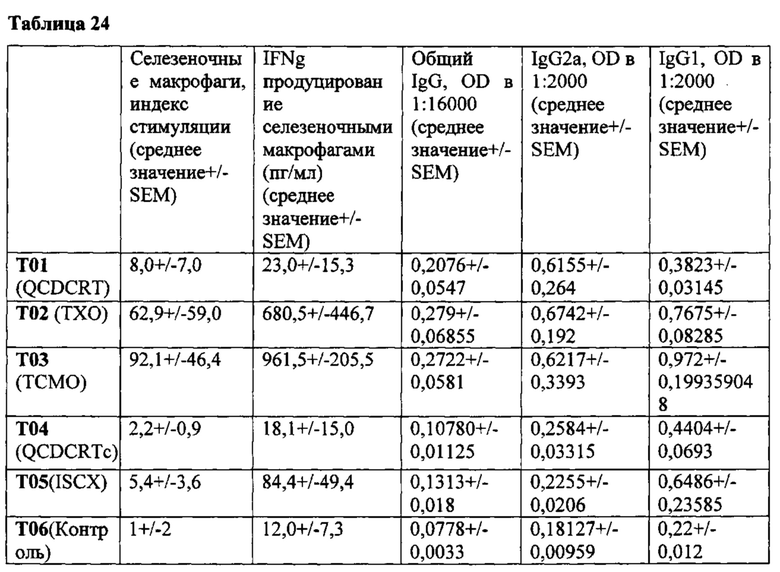
[00360] Взятые вместе, эти данные демонстрируют превосходные результаты, полученные с использованием ТХО и ТСМО.
Пример 7. Эффекты различных адъювантов на иммунные ответы на инфекции половых путей с Chlamydophila abortus
[00361] С. abortus является внутриклеточной бактерией, вызывающей аборт у овец и коз. Инфицирование обычно происходит во время экспозиции наивных овцематок абортным материалом (например, плацентой, жидкостью, плодом). Участок бактерии был латентным в инфицировании овцематок до разведения и в течение середины или поздней беременности, он присутствует в плаценте и вызывает некротическое воспаление плаценты даже несмотря на антительный ответ. После аборта, овцематки, как правило, имеют иммунитет к повторному заражению.
[00362] Считается, что вакцинация может быть полезной перед воздействием поскольку она предотвращает первичное инфицирование и предотвращает хоминг бактерий к плаценте. Высший IFNg, связанный с антительным ответом при после-обортном иммунитете, является ключевым коррелятом защиты. IFNg также может быть связан с персистенцией, которую наблюдали у небеременных овцематок.
[00363] Овцематки были вакцинированы в дни ноль и 28 и проводили контрольное заражение в день 49. Животных умертвляли в день 63 и проводили некропсию. В день ноль, отбирали вагинальные образцы и образцы цельной крови для qПЛР. Кровь отбирали еженедельно для серологических результатов и в дни ноль, 7, 28 и 35 для измерения цитокинов и Elispot измерения.
[00364] Группы лечения представлены в таблице 25.
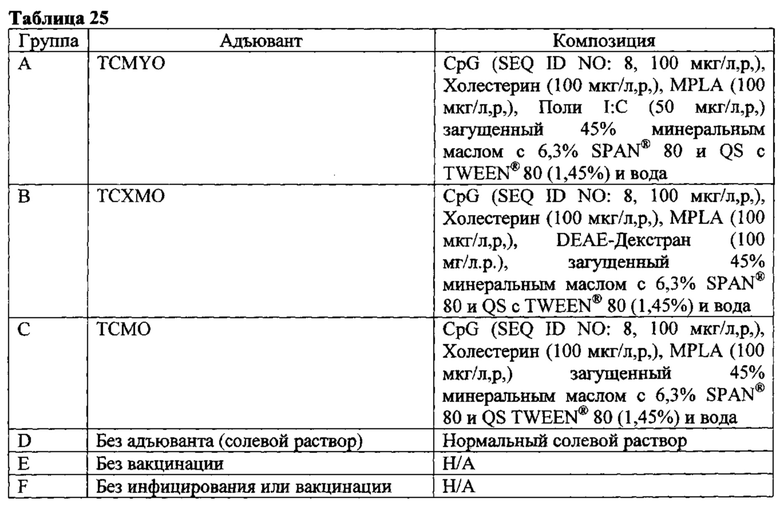
[00365] Антиген получали из почки абортированного овечьего плода и размножали на клетках McCoy. Элементарные тела были очищены центрифугированием и обрабатывали ультразвуком. Антиген фиксировали на уровне 100 мкг/доза в 0,1% формальдегиде в 0,9% хлориде натрия для вакцинация.
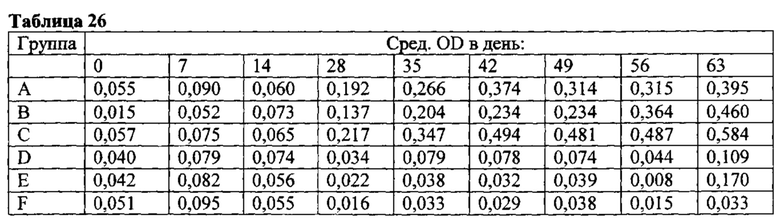
[00366] Серологические результаты получали, применяя набор Check-it ИФА, которые суммированы в таблице 26 выше.
[00367] Определяли уровни экспрессии IFNg, IL-2 и IL-4 в овечьей РМВС, стимулированных Chlamydia AG. Результаты представлены в таблице 27.
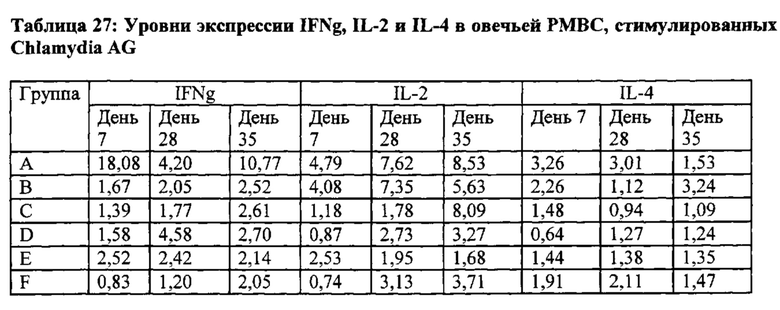
[00368] Ответ овечьих РВМС на антиген Chlamydia abortus подытожен в таблице 28.
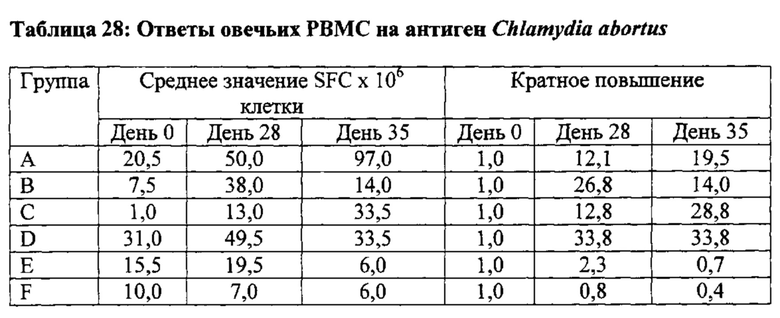
[00369] Кроме того, анализировали количество белых кровяных клеток (данные не показаны). 2-полосная ANOVA указывает на то, что группа F имела значительно более высокое количество WBC, чем группа A и B, и что группа Е имела значительно более высокую количество WBC, чем группа В.
[00370] Узлы во время инъекций также анализировали. Как и следовало ожидать, группы A-C имели более крупные узлы, чем группы C-D. Среди трех адъювантов, которые использовали (группы A-C), группа C имела самый большой размер узла, с последующей группой В, с последующей группой А.
[00371] Определяли объем узлов. Опять, группы A-C имели более крупные объемы узлов, чем группы D-F. Среди групп A-C, группа A имела наименьший объем. Узлы в группах А и В имели больше кровоизлияний и/или некротические ткани. Узлы в группе C имел больший фиброз. Клеточные характеристики являются аналогичными у всех трех узлов, хотя группа C может иметь более лимфоцитарный компонент.
Пример 8. Добавление алюминия в ТХО давало в результате улучшенную стабильность
[00372] На данный момент ТХО смешанный препарат содержит 50 мг/мл DEAE Декстран. Декстран, когда он присутствует в высоких концентрациях в подкожных инъекциях, может вызвать реакции в месте инъекции у животных. Итак, предлагается попробовать различные концентрации для DEAE Декстрана, чтобы проверить, можно ли получить безопасность и хорошее терапевтическое значение без ущерба для стабильности вакцинного препарата.
[00373] Исследование характеристики и стабильности является важным, поскольку они сообщают нам о том, может ли данная вакцина быть сформулирована последовательно и с хорошим сроком годности для изготовления. Исследование вязкости проводят в диапазоне скоростей сдвига для того, чтобы искать уменьшения вязкости при сдвиге (резкое снижение динамической вязкости, поскольку скорость смещения идет вверх) или утолщение сдвига (увеличение динамической вязкости, поскольку скорость смещения идет вверх), что является характеристикой потока неньютовських жидкостей. Силовые испытания шприца проводятся, чтобы гарантировать, что вакцина будет легко вытягиваться и легко вводиться из-за большого количества доз в области.
[00374] Поскольку неожидалось, что иммуностимулирующий олигонуклеотид изменит стабильность препарата, его добавляли к адъювантным смесям в данном примере. АХО (Алюминий + Декстран + Масло) смешивают с различными REHYDRAGEL® (от 5% до 16%) и концентрации DEAE Декстрана (50 мг/мл-10 мг/мл) определяют для исследования на вязкость, шприцевую силу и осаждение, применяя ХО (Декстран + Масло) смесь в качестве контроля. Исследуемые композиции были следующими:
[00375] Примерно 10 мл образца загружали в каждую из пяти 15-мл центрифужные пробирки Corning и оставили еще в течение недели для того, чтобы наблюдать за влиянием на ускоренное оседание эмульсий через узкие размеры пробирок и коническое дно. Образцы также исследовали на способность прохождения через иглу шприца и вязкость. Результаты приведены ниже.

[00376] Эти данные указывают на то, что при подвержении действию ускоренного осаждения в центрифужных пробирках, смесь из 16% REHYDRAGEL® является наиболее стабильной. Кроме того, с предыдущей работы авторов изобретения, было известно, что более высокая концентрация DEAE Декстрана является связанной с более высокими вязкостями и возможным разрежением при сдвиге. Результаты данных экспериментов показывают, что добавление REHYDRAGEL® являются большими, чем компенсируются ожидаемые потери вьязкосних при сдвиге (псевдопластических жидкости) свойств, предоставляемых DEAE Декстраном. Кроме того, наблюдалось, что хотя 16% REHYDRAGEL® препарат имел более высокую шприцевую силу, было не заметно, что его труднее инъекционно вводить (шприцевая сила для воды составляет 3Н).
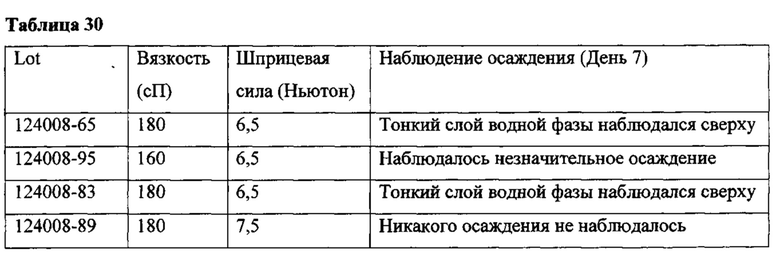
[00377] Из общих данных, очевидно, что смесь из 16% REHYDRAGEL® и 10 мг/мл DEAE Декстрана является оптимальной для применения в вакцинных препаратах, особенно тех, которые требуют связывания свободного эндотоксина и/или где может потребоваться больший срок годности эмульсии.
Пример 9. BRV, BCV и E coli антигены
[00378] В данном примере, авторы изобретения исследуют применение адъювантов по представленому изобретению в вакцинах против энтерита. Энтерит вызывается бактериальными, вирусными и/или паразитарными инфекциями. Крупный рогатый скот, в частности, новорожденные молочные и мясные телята являются уязвимыми к поносу телят, так как они подвергаются воздействию многих стрессов в течение первых нескольких часов жизни, когда их иммунные системы полностью не развиты. Потеря жидкости через понос телят в результате приводит к дегидратации и часто к смерти. Животные, которые переживают понос телят, часто остаются слабыми и плохо работают в течение всей своей жизни. Агенты, связанные с поносом, включают бактерии, в частности, Е coli K99 и F41, и вирусы, такие как бычий коронавирус (BCV) и бычий ротавирус (BRV).
[00379] В данном исследовании использовали гольштинские бычки в возрасте десять месяцев. Животные были серонегативными или имели низкие титры по E coli (K99 и F41), BRV (В223 и Lincoln) и BCV.
[00380] Группы лечения были следующими:
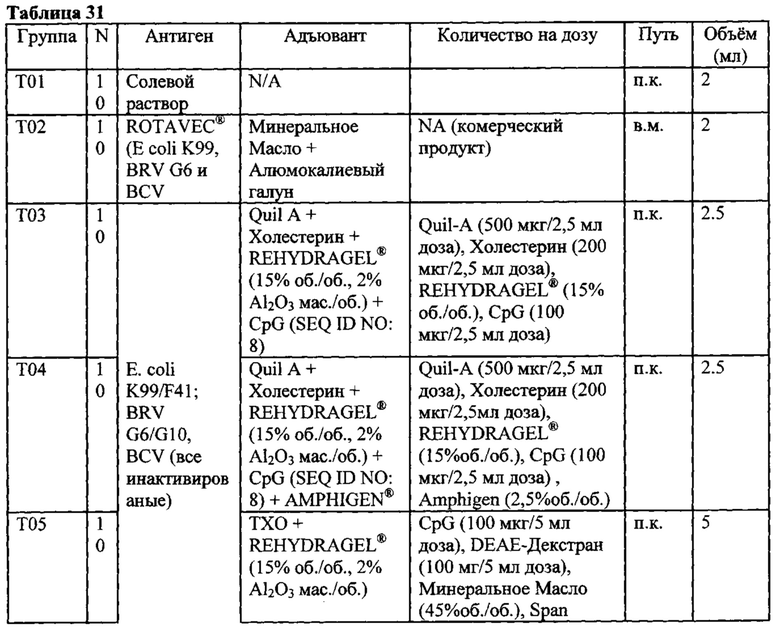

[00381] Образцы крови собирали каждый 21 день в течение шести месяцев для серологии. Реакции места инъекции измеряли в дни 0 (перед вакцинацией), 1, 2, 3, 7, 14, 21 и каждый 21 день после этого. Ответы на E coli K96, Е coli F41, BRV Lincoln, BRV В223 и BCV измеряли путем количественного определения титра антител в выбранные дни. Результаты подсуммированны ниже (различные буквы указывают на различия при α=0,1):
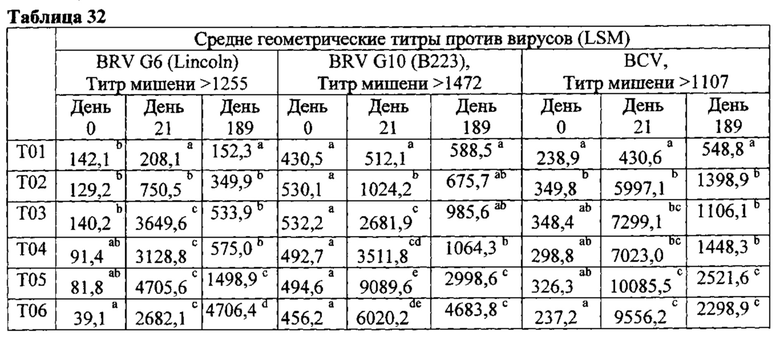
[00382] Лечение Т05 и Т06 в результате приводило к наивысшим титрам антител со дня 21 до конца исследования (день 189). Следует отметить, что коммерческая вакцина (ROTAVEC®) не давала хорошие результаты, а также Т05 и Т06 в индукции антител против вирусных компонентов энтерита.


[00383] Лечение Т02 и Т05-Т06 давало результаты аналогично хорошие, вызывая ответ против K 99. Лечение Т02 вызвало лучший ответ к E coli F41. Лечение Т05 было вторым наиболее эффективным в вызывании ответы к такому антигену.
[00384] Взятые вместе, эти данные показывают, что Т05 и Т06, как представляется, являются наиболее перспективными препаратами. Оба имеют доставленые ответы мишени IgG для нескольких фракций в день 189. Оба Т05 и Т06, как представляется, обеспечивают более высокую или эквивалентную серологическую эффективность по сравнению с ROTAVEC® (Т02, IM) путем п.к. введения. Т03 и Т04 сохраняли повышенные серологические титры за более короткие сроки, чем Т05 и Т06. С единичной дозой вакцинация Т03, Т04, Т05 и Т06 доставляла более высокие целевые титры уровней в сыворотке для BRV G6, BRV G10 и BCV. С единичной дозой вакцинация Т04, Т05 и Т06 доставляла более высокие целевые титры уровней в сыворотке для Е. coli K99. Т04, Т05 и Т06 сохраняли анти-вирусные титры в сыворотке более высокие чем целевые уровни в течение 6 месяцев. Т05 и Т06 сохраняли титры анти-Е. coli К99 в сыворотке более высокие чем целевые уровни в течение 6 месяцев. Все оцененные препараты продемонстрировали достаточную безопасность у гольштинских бычков.
[00385] Ректальные температуры измеряли в дни ноль, 1, 2 и 3. В то же время были статистически значимые различия между группами Т01 (контроль) и группами Т02-Т06, различия в температурах (LSM) не являлись большими (в пределах одного градуса F).
[00386] Предыдущее исследование препаратов у беременных молочных коров продемонстрировало безопасность. Группы Т01, Т03 и Т05 исследовали, 5 коров в каждой группе. Тринадцать из 15 коров отелились, 12 телят были нормальными, один был мертворожденным.
Пример 10. Анти-Tick вакцина.
Экспериментальный дизайн
[00387] Исследовали два вакцинных препарата на основе антигена Вт86. Один препарат содержал водный адъювант (QCDCRT) и другой адъювант на масляной основе (ТХО), как преведено ниже.

[00388] Поскольку адъюванты использовали в объеме 80%, как описано выше, одну дозу вакцинной композиции вводили группе Т03, которая содержит 100 мкг SEQ ID NO: 8/100 мг DEAE-Декстран, 36% об./об. минерального масла, 4,8% об./об. SPAN® 80, и 1,16% об./об. TWEEN® 80. Поскольку не было никакого масла в QCDCRT, концентрации ингредиентов были такими же, как в таблице 35.
[00389] Двадцать четыре теленка рандомизированно распределяли в одну из трех групп лечения по восемь телят каждая. Телят из каждой группы лечения индивидуально вакцинировали 2сс или одним из двух Bm86 + композицию адъювантов или солевой раствор (контроль группа). Вакцинации осуществляли в день 0 и 28. В день 41, крупный рогатый скот помещали в подпорку, и в день 42 инфицировали 250 мг личинки R. annulatus. Клещей, которых использовали в данном исследовании, сначала собирали с ранчо в Val Verde County, Texas. Все отщепленные наполненые взрослые самки собирались ежедневно с индивидуальных телят на 63-84 день. Телята были удалены из подпорки в день 85. Собранных клещей подсчитывали и до 10 с каждого теленка взвешивали и помещали в климатическую камеру каждый день сбора в течение 13 дней. Отработанные самки были отброшены через 14 дней после сбора и массу полученного яйца взвешивали. Через четырнадцать дней после первого вылупления, количество вылупившихся и интактных яиц регистрировали и рассчитывали определенный процент вылупления. Перед каждой инъекцией вакцины и в течение следующих трех дней после инъекции, проверяли место инъекции у каждого теленка относительно припухлостей, и измеряли ректальные температуры. Сыворотку крови собирали с каждого теленка в дни -7, 0, 14, 28, 42, и 85 для определения титров Вт86 антитела в течение всего исследования, как определено используя ИФА. Результаты
[00390] Предварительные результаты показывают 98,6 и 99,6% контроль с Т02 и Т03 препаратов, соответственно, который значительно выше, чем Т01. Данные расчеты процентного контроля учитывают только снижение массы наполненных самок и массы яиц. Снижение процента вылупления будут определять в более поздний срок и добавлять к конечным результатам. Однин из 24 телят в исследовании дает небольшую припухлость после каждой инъекции (препарат, содержащий масляный адъювант). Припухлости являются меньше чем 10 см в длину и 3 см в ширину. Припухлости являются мягкими и не кажутся болезненными для животного. Повышение ректальной температуры у обработанных животных в течение всего исследования не происходило.
[00391] Серологические результаты демонстрируют статистически значимые различия между каждой из обработок в соответствующие временные точки за исключением тех, которые не имели никакой статистической значимости (p=0,114) между обработками QCDCRT и ТХО в точку времени день 14. Как QCDCRT, так и ТХО эффективно повышают титры ВМ86 антитела в каждой точке времени, которые исследовали. ТХО был лучше QCDCRT (p<0,05) в каждую точку времени, которое исследовали, за исключением дня14 (р=0,114).

Пример 11. Заболевание ящура (морские свинки)
[00392] Цель данного исследования состояла в том, чтобы сравнить гуморальные иммунные ответы у морских свинок, вакцинированных трехвалентными FMD дополненными с адъювантами вакцинами, с различными композициями адъювантов. Морских свинок вакцинировали в дни ноль и 28 как подытожено в таблице 37.
[00393] В каждой дозе Т03-Т07, антиген представлял собой комбинацию из FMVD типа O (9 мкг), А (5 мкг) и Asia 1 (5 мкг/мл). Антигенная композиция в Т02 является собственной информацией производителя и, таким образом, была недоступной.
[00394] Образцы крови собирали для серологического исследования в дни -3, 25 и 53. Титры сыворотки антител против серотипов O, А и Asia 1 подытожены ниже.
[00395] В то время как ответы против серотипов O и A были низкими даже в положительной контрольной группе (Т02), ответ против Asia 1 был выше в Т07 (ТХО адъювант), чем в группе положительного контроля, и больше, чем в любом другом лечении. Низкие ответы против серотипов O и A могут быть погибшими в присутствии низких уровней О и А антигенов в препарате.
[00396] Следует отметить, что на основе липосом группы VACCIMAX® (Т03-Т05) не демонстрировали значительного ответа против любых антигенов (О, A, Asia 1).
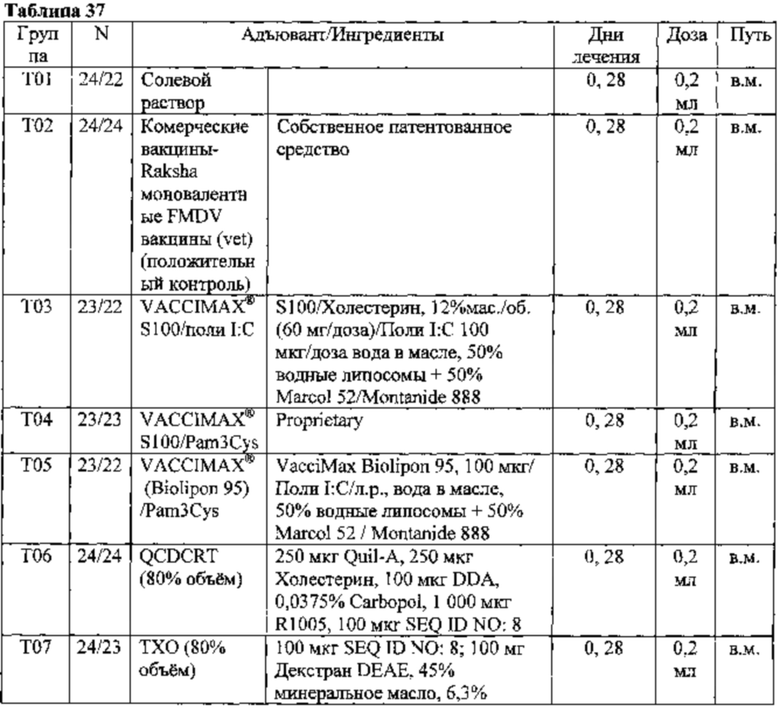
[00397] Поскольку адъюванты ТХО и QCDCRT использовали в 80% объеме, как описано выше, одну дозу вакцинной композиции вводили группе Т07, которая содержала 100 мкг SEQ ID NO: 8/100 мг DEAE-Декстран, 36% об./об. минерального масла, 5,04% об./об. SPAN® 80, и 1,16% об./об. TWEEN® 80. Поскольку не было никакого масла в QCDCRT, концентрации ингредиентов были такими же, как и в таблице 37.
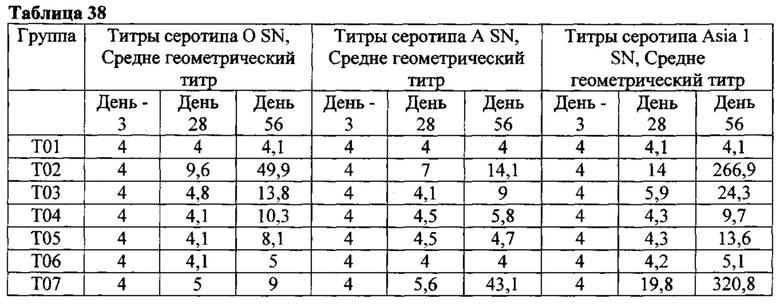
Пример 12. Заболевание ящура (крупный рогатый скот)
[00398] В данном исследовании определяли эффект различных адъювантов, которые использовали в вакцине против FMD в моделе контрольного заражения. Исследовали три адъюванта. Вакцина представляла собой ARS экспериментальная вакцина против FMD в моделе контрольного заражения, разработанная PLADC. FMD-LL3B3D-A24 Cruzeiro использовали как антигенный компонент вакцины (10 мкг), и немутантный тип FMDV А-24 Cruzeiro использовали как вирус контрольного заражения. Антиген был описан ранее, например, в US 20120315295 (Rieder at al, представленная 9 июня 2011 и опубликованная 13 декабря 2012). Коротко говоря, FMD-LL3B3D-A24 Cruzeiro содержит генетически модифицированный FMDV (вирус заболевания ящура). FMDV является генетически модифицированным, то есть, который представляюет собой безлидерный вирус, содержащий делецию лидерного (Lpro) протеина, который кодирует участок таким образом, что FMD вирусы, которые потеряли данный протеин являются ослабленными у крупного рогатого скота и свиней. Кроме того, он содержит мутации (отрицательные маркеры), введенные в два неструктурные вирусные протеины, что в результате приводит к ликвидации двух антигенных эпитопов, которые распознаются специфическими антителами, один, расположенный в протеине 3В, и другой в протеине 3D (замененые на соответствующую последовательность бычьего риновируса, что служит как негативный антигенный эпитоп в данных протеинах), таким образом, обеспечивая две возможные мишени для DIVA (дифференциация естественно инфицированных с вакцинированных животных) серологические тесты.
[00399] В каждой группе использовали от четырех до семи коров. Общий объем инъекции составлял 2 мл. Животные были вакцинированы в день ноль путем в.м. инъекции (2,0 мл на дозу) и проводили контрольное заражение в день 21 интрадермальным путем немутантным типом FMDV. Клинические оценки выставляли в дни 0, 3, 7 и 10, соответственно, к следующей шкале: без клинических признаков: 0, везикулярные поражения стопы: 1 балл за каждое поражение стопы. Максимальный балл равен 4. Результаты эксперимента заключаются в следующем:
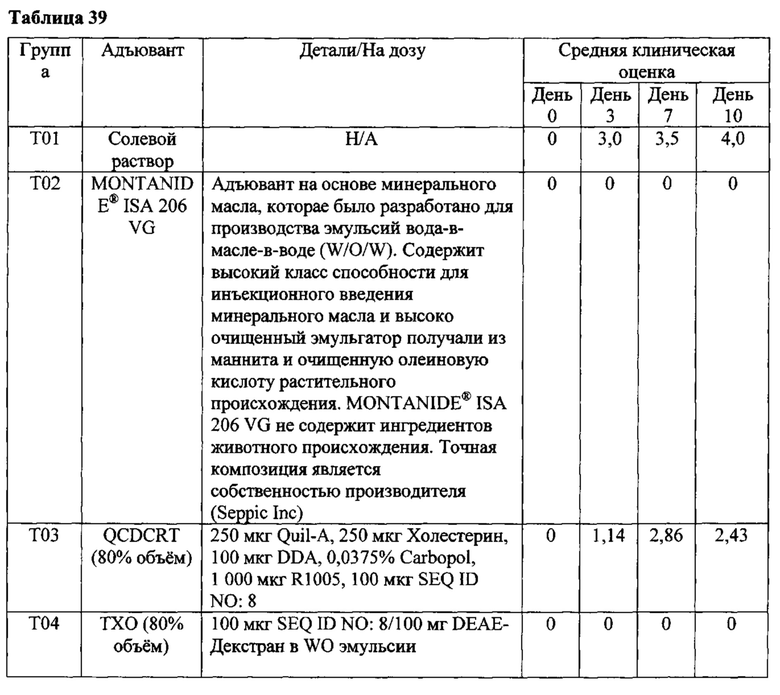
[00400] Различия между Т01 и Т02 и между Т01 и Т04 были статистически значимыми.
[00401] Из приведенной выше таблицы, можно сделать вывод о том, что, по меньшей мере, на основании клинических показателей, адъюванты ТХО и MONTANIDE®ISA 206 VG имеют примерно одинаковую эффективность. Однако, серологические анализы относительно измерения сыворотки, которые нейтрализуют активность против FMDV-A24, показывает, что группа Т04 (адъювант ТХО) имели более высокие титры, чем в группе Т02 (MONTANIDE®ISA 206 VG).
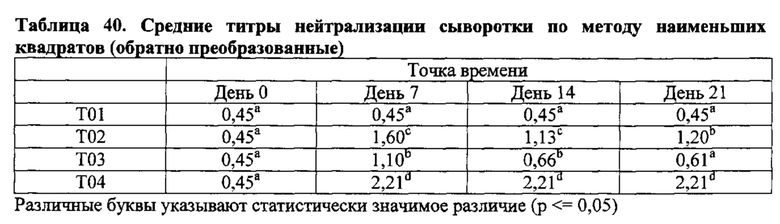
[00402] Данные результаты показывают, что ТХО адъювант был способен обеспечить 100% защиту от контрольного заражения FMD, вызванного агентом у крупного рогатого скота и предоставляют более высокие титры антител, чем контрольный солевой раствор и другие два адъюванта, которые исследовали.
[00403] Количество РНК FMDV (копий на мл) определяли в назальных мазках и в сыворотке. Данные представлены в таблицах 41-44. Коротко говоря, эти данные показывают, что группы Т02 и Т04 в результате дают меньшие количества FMDV в назальных мазках. Среди Т02 и Т04, следует отметить, что животные в группе Т04 демонстрировали более раннее уменьшение (или отсутствие увеличения) FMDV RNA количества, таким образом, снова демонстрируя лучшие свойства адъюванта ТХО.
Пример 12: ТХО активирует клеточно-опосредованный иммунитет
[00404] Тогда как все животные в группе Т01 демонстрировали лихорадку после контрольного заражения, ни у одного из животных в группе Т04 не наблюдалось лихорадки. Ответы в группах Т02 и Т03 были противоречивыми (некоторые животные демонстрировали лихорадку и некоторые нет). Данное наблюдение подтверждает вывод общего преимущества ТХО по сравнению с другими адъювантами, которые использовали в данном исследовании.
Пример 13: ТХО активирует клеточно-опосредованный иммунитет
[00405] Применяя FMD как иллюстративный антиген в животной модели, описанной в предыдущем примере, анализировали эффект адъювантов на клеточно-опосредованный иммунитет. Мононуклеарные клетки периферической крови (РВМС) были очищены от бычьей цельной крови, собранной в дни 4, 7, 14 и 21 после вакцинации. FMDV-специфические Т клеточные пролиферативные ответы оценивали, применяя покраску диацетатом карбоксифлуоресцеина сукцинимидилового сложного эфира (CFSE).
[00406] Результаты представлены в таблице 45.

[00407] Эти данные демонстрируют лучший эффект ТХО на клеточно-опосредованный иммунитет как на 14-й день, так и на день 21. Эти данные также показывают, что, поскольку клеточно-опосредованный иммунитет отвечает за продолжительность вне иммунитета, адъювант ТХО возможно может обеспечить большую продолжительность иммунитета, чем MONTANIDE®ISA 206 VG.
Пример 14. Получение антител для применения в диагностике
[00408] Адъювант ТХО относительно данного изобретения использовали для получения антител для применения в диагностике. Коротко говоря, животные источники были иммунизированы каждые 2-4 недели препаратами, содержащими выбранные рекомбинантные антигены с добавленным как адъювант ТХО, композиция из которого была следующей: SEQ ID NO: 8-125 мкг DEAE декстран - 125 мг Минеральное масло -46,56% об./об. препарата; TWEEN® 80 - 1,5% об./об. препарата; SPAN® 80 - 6,518% об./об. препарата.
[00409] Композицию адъюванта использовали в количестве 80% об./об. вакцинной композиции. Соответственно, конечная концентрация компонентов композиций адъювантов была следующей: SEQ ID NO: 8 - 100 мкг DEAE декстран-100 мг Минеральное масло - 37,248% об./об. вакцинной композиции; TWEEN® 80 - 1,2% об./об. вакцинной композиции; SPAN® 80 - 5,214% об./об. вакцинной композиции. Конечный объем составлял 2 мл.
[00410] Наблюдались видимые реакции в месте инъекции после инъекции, которые находились в пределах ожидаемого размера реакций. На основании ежедневных наблюдений, реакции, которые наблюдались по ребрам, как оказалось, не были болезненными для коз.
[00411] Образцы крови собирали через 2-3 недели после каждой иммунизации, и проводили различные анализы, чтобы оценить титр антитела. Серологический титр по ИФА более 1000, признавался достаточным, чтобы собирать антитела.
[00412] У животных брали кровь каждую неделю (7,5% объема крови на основе массы тела). После окончания исследования, коз умертвляли терминальным кровопусканием, и эту кровь также собирали для сбора антител. При необходимости животных переориентировали для дополнительных исследований.
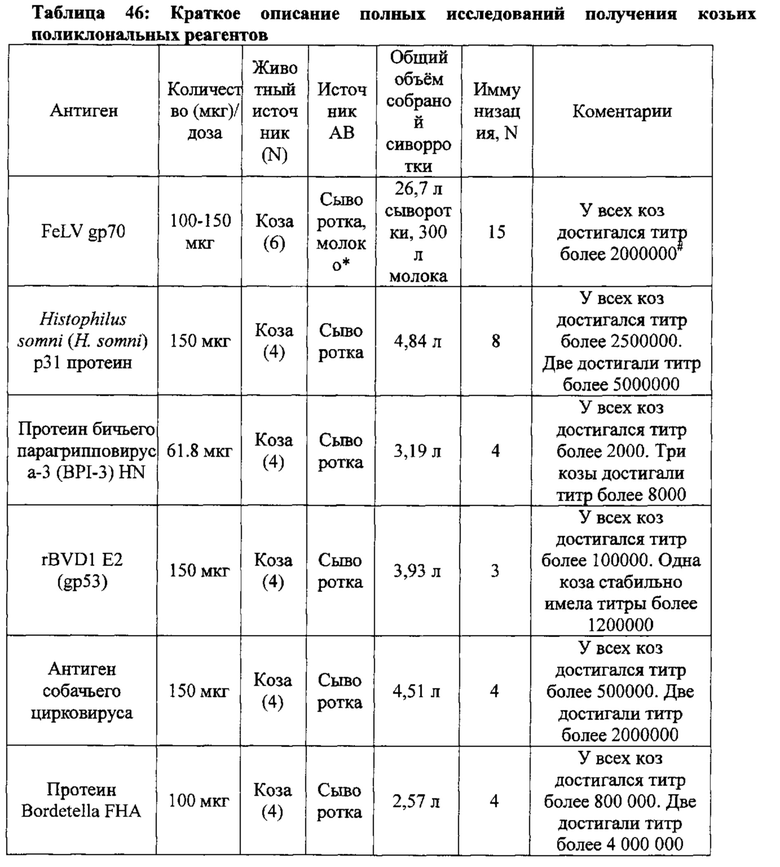

[00413] Сыворотка антител для FeLV gp70 была успешно очищена, применяя или Протеин A, или Протеин G фирменные колонки, для небольшого масштаба очистки или Протеин G хроматографию для крупномасштабной очистки, в Maine Biotechnology Services (MBS), Portland, ME. Поликлональные антитела концентрировали, применяя Millipore 30K Ultra Filter Units до конечной концентрации примерно 1 мг/мл. Антитела против других антигенов, раскрытые в таблице 46 не очищали.
[00414] Антитела выделяли из молока, полученного от спонтанно лактирующей козы, иммунизированной FeL Vgp70 в соответствии со способом, который включает следующие стадии:
a) pH молока титровали к 4,6 2 М раствором HCl и перемешивали при комнатной температуре в течение 30 минут для осаждения казеина;
b) молоко центрифугировали на 17000×g в течение 30 минут и собирали супернатант;
c) буфер для уравновешивания добавляли к супернатанту с 3,3 М NaCl, 0,3 М глицина и 0,2 М Tris основания;
d) супернатант освещали центрифугированием на 3000×g в течение 15 минут;
e) освещенный супернатант молока загружали в колонку MabSelect, уравновешенную буфером со стадии 'с';
f) колонку промывали уравновешивающим буфером и элюировали 0,15 М глицином pH 3,0;
g) фракции элюирования нейтрализовали 0,2 М раствором фосфата Na.
[00415] Как неограничивающие примеры, способы получения анти-РI-3 и анти-FeLV gp70 представленны ниже.
[00416] Одной из задач было создание козьей поликлональной антисыворотки к очищенному протеину бычьего парагрипповируса-3 (BPI-3) HN для применения в анализах in-vitro. Данное исследование было разработано, чтобы вакцинировать коз очищенным протеином бычьего парагрипповируса-3 (BPI-3) HN, сформулированным с ТХО адъювантом протеина бычьего парагрипповируса-3 (BPI-3) HN, который использовали как антиген.
[00417] Спустя примерно семь недель после первой инъекции, определили, что все четыре козы имели достаточно высокие концентрации антитела в сыворотке (SN более 1000), чтобы начать делать кровопускание для сыворотки. Кровопускание начинали делать через одну неделю после четвертой иммунизации. Кровь для сыворотки собирали с интервалом в неделю в течение трех недель. Сыворотку от каждой козы объединяли для отдельных производственных кровопусканий. В общей сложности собрали 3187,50 мл сыворотки в течение примерно 3 недель от начала кровопускания. Сыворотку обрабатывали и хранили при -80°C для оценки а анализах на основе BPI-3 HN.
[00418] Всю сыворотку, собранную с трех коз (#30, 31 и 35) размораживали при комнатной температуре. Сыворотку с козы по номеру 34 не использовали из-за низкой реакции антител в скрининге ИФА. Смотри таблицу 47 (продуцирование PI3-NH поликлонального антитела: SN ответ и эффективность антигена с ИФА).
[00419] Коза номер 35, собрали 20 13 ноября, имела самый низкий объем доступной сыворотки, 117 мл. Таким образом, 117 мл с каждой козы в коллекции было собрано в стерильную 1 л Nalgene PETG емкость. Примерно 1053 мл (9×117 мл) сыворотки разливали в аликвотах 20, 50 мл в стерильные 60 мл Nalgene PETG емкости и в аликвотах 50, 1,0 мл.
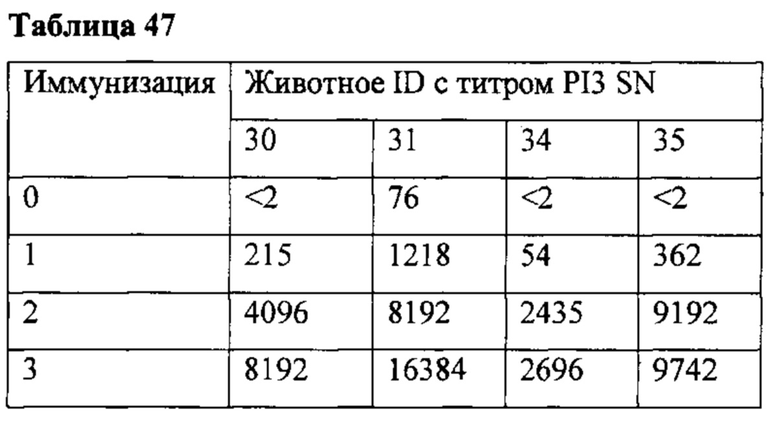
[00420] В результате, данное исследование при завершении успешно генерировало всего 3187,5 мл цельной крови, собранной из четырех коз, которых неоднократно иммунизировали очищенным BPI-3 протеином, сформулированным с ТХО, в течение трехнедельного периода кровопускания. Хорошие титры поликлонального антитела были сгенерированы в сыворотке. Достаточное количество очищенного реагента получали для применения в назначенном анализе in-vitro.
[00421] В 2010 году, USDA сообщил промышленности, что FeLV gp85/70 реагент захвата, который используется для LEUKOCELL® и VERSIFEL® анализов не будет больше поставляться. Таким образом, цель данного исследования состояла в том, чтобы создать козьи поликлональные антисыворотки с рекомбинантным FeLV gp70 протеином для применения в анализах in-vitro.
[00422] Предыдущие попытки получения антител после вакцинации с адъювантом Фрейнда не увенчались успехом. Данное исследование было разработано, чтобы вакцинировать коз 444 аминокислотным фрагментом рекомбинантного Е. coli-экспрессированного FeLV gp70 протеина, сформулированного с адъювантом. Начиная с 4ой инъекции, дозу инъекция уменьшали до 100 мкг FeLV gp70 протеина (вместо исходной дозы 282 мкг FeLV gp70 протеина). Изменение дозы было сделано потому, что начальная доза в 282 мкг/мл вызвала высокую частоту реакций в месте инъекции. Дозу сначала уменьшали до 100 мкг/мл, но потом повышали до 150 мкг/мл для седьмой иммунизации и оставляли на таком уровне до конца исследования (всего 15 иммунизации). PBS буфер использовали, чтобы компенсировать разницу в объеме дозы, которая оставалась в 1 мл.
[00423] Кровь собирали с козы, и однаразово титры антитела определяли с помощью прямого ИФА анализа и сэндвич-анализа ИФА, чтобы быть достаточно высокими, сыворотку собирали и поликлональные антитела очищали.
[00424] Шесть здоровых самок коз пород LaMancha и альпийских пород, в возрасте 1-3 года и весом >100 фунтов были получены для применения в данном исследовании. Коз кормили сеном и зерном, а также козы имели вволю доступ к воде в течение всего исследования. Общие обследования состояния здоровья проводили один раз в день. Доза 1 мл экспериментальной вакцины вводили подкожно каждой козе с интервалами 21 день, всего 15 иммунизации вводили каждой из пяти коз, которые завершили исследование. Сначала иммунизации проводили в шею или заднюю ногу, меняя стороны и места для следующих иммунизации. После иммунизации наблюдались небольшие реакции, видимые в месте инъекции. Когда иммунизацию проводили козам в рыхлую кожу только краниальной правой задней ноги, то сообщали о случае небольшого отека, чувствительности и умеренную хромота у всех коз на следующий день. Последующие инъекции вводили в альтернативные стороны шеи или участка над ребрами и как правило, хорошо переносились. Однако, участки над ребрами, как оказалось в конечном счете, были таким расположением, где инъекции лучше переносились козами.
[00425] Спустя примерно восемь недель после первой инъекции определили, что четыре из шести коз (21, 22, 24, 25) имели достаточно высокие концентрации антитела в сыворотке, чтобы начать делать кровопускание для сыворотки. Кровопускание из оставшихся двух коз, (23, 26) были начаты пять недель спустя. Кровь собирали для сыворотки с интервалом в неделю. Коза 25 была удалена из исследования после шести недель проведения сбора крови. Она была хромой по прибытии и отражалась постоянная хромота, несмотря на лечение Banamine. Эвтаназия была специфической для терминального кровопускания и введенной в место процедуры, чтобы обеспечить максимальный сбор объема крови. Сыворотку с каждой козы объединяли для отдельного производства кровопусканий. В общей сложности 26,7 л сыворотки собирали в течение приблизительно 7 месяцев производства кровопусканий.
[00426] Неожиданно оказалось, что у козы 24 развилась псевдо беременность во время исследования. В течение >3 месяцев, у данной козы собирали молоко, всего собрали 300 л молока, доступного для сбора антитела. Протокол был разработан для очистки высокого уровня FeLV gp70 поликлонального антитела из молока.
[00427] Антитела были очищены из двух разных дат с 500 мл объединенной сыворотки от козы 24, применяя Протеин G аффинную хроматографию в Maine Biotechnology Services. Всего 6388 мг (321 мл 19,9 мг/мл) и 7343 мг (348 мл 21,1 мг/мл) очищенных козьих анти-FeLV gp70 антител получали для оценки в анализах на основе FeLV.
[00428] Образцы крови (примерно 25 мл/образец) собирали в 12,5 мл пробирки сепаратора для сыворотки (SST) через четырнадцать дней после каждой вакцинации для определения концентраций антител к FeLV gp70. SST помечали ID козы и датой сбора. После того, как анализы определили, что титры антител gp70 FeLV на основе интенсивности сигнала ИФА для животного были в приемлемой концентрации, производство коллекции начинали с этого животного. Объемы крови, отобранные от каждой козы были определены на основе массы козы, чтобы получить максимальный объем крови. Рекомендации IACUC позволяют собирать до 7,5% от объема крови еженедельно.
[00429] Кровь собирали в 12,5 мл SST для создания коллекций. После окончания исследования, коз подвергали эвтаназии путем терминального кровопускания и такую кровь также собирали для сбора антитела. Все пробирки маркировали ID козы и датой сбора.
[00430] Крови давали свернуться при комнатной температуре. После центрифугирования, сыворотку собирали и переносили в полипропиленовые флаконы. Собирали сыворотку, собранную из разных SST, от одной козы в день сбора. Сыворотку держали на льду пока не передавали для очистки. Краткая информация о продукции представлена в таблице 48.


[00431] Коза 24 производила сыворотку с высокими концентрациями антитела из всех коз.
[00432] Очищенные антитела в сыворотке от козы 24 в сравнении с USDA 94-06 как реагентом захвата, применяя FeLV gp70 C11D8, детектирование mAb в сэндвич-анализе ИФА показало аналогичную дозу-ответ. Очищенную сыворотку от козы 24 сравнивали с USDA 94-06 реагентом, применяя Вестерн-блот из-за способности детектировать FeLV gp85/70 протеин. Аналогичный Вестерн-блот профиль наблюдали между текущим захватом, 94-06 и новым захватом козы 24 за исключением того, что дополнительная ~15 кДа полоса наблюдалась из захвата козы 24. Данные с использованием нового антитела захвата показали, что текущий эталон имеет различные формы кривых доза-ответ, чем текущий реагент, когда его применяют для захвата эталона и серий, которые исследуют.
[00433] Оба anrendati-FeLV gp70, очищенные от сыворотки, и молоко функционировали хорошо как реагент захвата в анализах FeLV ИФА.
[00434] Дополнительные исследования ведутся, как это предусмотрено в таблице 49.
[00435] Ожидается, что каждый из препаратов (антигенов, раскрытых в таблице 49 и с добавленным как адеювант ТХО) будут вызывать достаточно высокие серологические титры (более 1000, или более предпочтительно более 5000, или более предпочтительно более 10000, или более предпочтительно, более 50000, или более предпочтительно более 100000, или более предпочтительно более 250000, или более предпочтительно более 500000, или более предпочтительно более 1000000) у, по меньшей мере, одного животного (преимущественно, по меньшей мере, у 2 животных, или более предпочтительно по меньшей мере у трех животных, или наиболее предпочтительно у каждого обработанного животного), таким образом, давая в результате достаточное количество антител для диагностических или исследовательских применений.
[00436] Все публикации, цитируемые в описании, как патентные публикации, так и непатентные публикации, свидетельствуют о высокой квалификации специалистов в данной области, к которой относится изобретение. Все эти публикации являются полностью включенными в виде ссылки в той же степени, как если бы каждая отдельная публикация была конкретно и индивидуально указана как включенная посредством ссылки.
[00437] Хотя изобретение в данном документе было описано со ссылкой на конкретные варианты осуществления, следует понимать, что данные варианты осуществления являются лишь иллюстрациями принципов и применений относительно представленного изобретения. Поэтому следует понимать, что многочисленные модификации могут быть сделаны на иллюстративные варианты осуществления, и что другие механизмы могут быть разработаны без отступления от сути и объема представленного изобретения как определено приведенной ниже формулой изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ZOETIS LLC
MOREDUN RESEARCH INSTITUTE
DOMINOWSKI, Paul Joseph
WILMES, Lauren
FOSS, Dennis L
MOHR, Kaori
GALLO, Guillermo
HARDHAM, John Morgan
KREBS, Richard Lee
LIGHTLE, Sandra Ann Marie
MAHAN, Suman
MEDIRATTA, Sangita
MWANGI, Duncan
RAI, Sharath K
SALMON, Sarah A
VORA, Shaunak
FONTAINE, Michael Christopher
SMITH, David George Emslie
FITZPATRICK, Julie Lydia
DONACHIE, William
JAGLARZ, Anita DorotaAM
<120> Адъюванты на основе масла
<130> ZP000025A
<141> 2014-09-19
<150> 61/879959
<151> 2013-09-19
<160> 14
<170> PatentIn version 3.5
<210> 1
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ДНК
<210> 1
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> CpG олигонуклеотид
<400> 1
tcgtcgacga tcggcgcgcg ccg 23
<210> 2
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> CpG олигонуклеотид
<400> 2
tcgacgtcga tcggcgcgcg ccg 23
<210> 3
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> CpG олигонуклеотид
<400> 3
tcgacgtcga tcggcgcgcg ccgt 24
<210> 4
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> CpG олигонуклеотид
<220> ПРизнак
<221> модифицированное_основание
<222> (1)..(1)
<223> 5'-Йод-2'-дезоксиуридин
<400> 4
ncgacgtcga tcggcgcgcg ccg 23
<210> 5
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> CpG олигонуклеотид
<220> Признак
<221> модифицированное_основание
<222> (1)..(1)
<223> 5'-Йод-2'-дезоксиуридин
<400> 5
ncgacgtcga tcggcgcgcg ccgt 24
<210> 6
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> CpG олигонуклеотид
<220> Признак
<221> модифицированное_основание
<222> (1)..(1)
<223> 5'-Йод-2'-дезоксиуридин
<400> 6
ncgacgtcga tcggcgcgcg ccgt 24
<210> 7
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> CpG олигонуклеотид
<220> Признак
<221> модифицированное_основание
<222> (1)..(1)
<223> 5'-Этил-2'-дезоксиуридин
<400> 7
ncgacgtcga tcggcgcgcg ccg 23
<210> 8
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> CpG олигонуклеотид
<220> Признак
<221> модифицированное_основание
<222> (1)..(1)
<223> 5'-Йод-2'-дезоксиуридин
<400> 8
ncgtcgacga tcggcggccg ccgt 24
<210> 9
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> CpG олигонуклеотид
<220> Признак
<221> модифицированное_основание
<222> (1)..(1)
<223> 5'-Йод-2'-дезоксиуридин
<400> 9
ncgtcgacga tcggcggccg ccgt 24
<210> 10
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> CpG олигонуклеотид
<400> 10
tcgtcgacga tcggcgcgcg ccg 23
<210> 11
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> РНК
<400> 11
uuguuguugu uguuguuguu 20
<210> 12
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> РНК
<400> 12
uuauuauuau uauuauuauu 20
<210> 13
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> РНК
<400> 13
aaacgcucag ccaaagcag 19
<210> 14
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ДНК/РНК
<220> Признак
<221> Name/Key: смеш_признак
<222> (11)..(17)
<223> рибонуклеотиды
<400> 14
tcgtcgtttt guuguguttt t 21
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АДЪЮВАНТЫ НА МАСЛЯНОЙ ОСНОВЕ | 2014 |
|
RU2816849C2 |
| АДЪЮВАНТЫ НА МАСЛЯНОЙ ОСНОВЕ | 2014 |
|
RU2816851C2 |
| Противоящурная вакцина | 2016 |
|
RU2698305C2 |
| ВАКЦИНА ПРОТИВ ИНФЕКЦИОННОГО БРОНХИТА | 2017 |
|
RU2781143C2 |
| Новые вакцинные композиции, содержащие иммуностимулирующие олигонуклеотиды | 2014 |
|
RU2627447C2 |
| ВАКЦИНА ПРОТИВ ИНФЕКЦИОННОГО БРОНХИТА | 2021 |
|
RU2838435C2 |
| ЛИПОСОМАЛЬНЫЕ АДЪЮВАНТНЫЕ КОМПОЗИЦИИ | 2016 |
|
RU2736642C2 |
| МИКРОФЛЮИДИЗИРОВАННЫЕ ЭМУЛЬСИИ ТИПА "МАСЛО В ВОДЕ" И ВАКЦИННЫЕ КОМПОЗИЦИИ | 2005 |
|
RU2347586C2 |
| ВАКЦИНЫ ПРОТИВ EHRLICHIA И ИММУНОГЕННЫЕ КОМПОЗИЦИИ | 2020 |
|
RU2824881C2 |
| ВЕЗИКУЛЫ НАРУЖНОЙ МЕМБРАНЫ | 2013 |
|
RU2662970C2 |





Группа изобретений относится к области фармацевтики, а именно к вакцинной композиции для лечения и предупреждения энтеритов и способу лечения или предупреждения энтеритов, вызванных BCV или BRV, у крупного рогатого скота. Вакцинная композиция содержит эффективное количество, по меньшей мере, одного из антигена BRV и BCV и адъювантную композицию, содержащую минеральное масло, эмульгатор, CpG-содержащий иммуностимулирующий олигонуклеотид, источник алюминия и, необязательно, поликатионный носитель, взятые в определенном соотношении. Способ лечения или предупреждения энтеритов у крупного рогатого скота включает введение вакцинной композиции. Группа изобретений обеспечивает создание эффективной стабильной вакцинной композиции для лечения или предупреждения энтеритов, вызванных BCV или BRV. 2 н. и 5 з.п. ф-лы, 49 табл., 15 пр.
1. Вакцинная композиция для лечения и предупреждения энтеритов, содержащая эффективное количество, по меньшей мере, одного из антигена BRV или антигена BCV и адъювантную композицию, причем указанная адъювантная композиция содержит минеральное масло, присутствующее в количестве, по меньшей мере, 45% об./об. от указанной вакцинной композиции, один или больше эмульгаторов, CpG-содержащий иммуностимулирующий олигонуклеотид, источник алюминия и, необязательно, поликатионный носитель, и где:
a) поликатионный носитель, если присутствует, представляет собой декстран DEAE в количестве 10-300 мг на дозу;
b) источник алюминия представляет собой гель гидроксида алюминия в количестве 5-20% об./об.;
c) CpG-содержащий иммуностимулирующий олигонуклеотид присутствует в количестве от приблизительно 100 до приблизительно 250 мкг на дозу; и
d) указанная вакцинная композиция представляет собой эмульсию вода-в-масле.
2. Вакцинная композиция по п. 1, в которой декстран DEAE присутствует в количестве приблизительно 100 мг на дозу.
3. Вакцинная композиция по п. 1, в которой указанный источник алюминия присутствует в количестве 17% об./об.
4. Вакцинная композиция по какому-либо одному из пп. 1-3, в которой CpG-содержащий иммуностимулирующий олигонуклеотид присутствует в количестве приблизительно 100 мкг на дозу.
5. Вакцинная композиция по п. 4, которая дополнительно содержит SPAN®80 в количестве 6,3% об./об. и TWEEN®80 в количестве 1,45% об./об.
6. Способ лечения или предупреждения энтеритов, вызванных BCV или BRV, у крупного рогатого скота, который включает введение указанному животному вакцинной композиции по п. 4 или 5.
7. Способ по п. 6, по которому указанная вакцина вызывает, по меньшей мере, шестимесячный иммунитет к указанному(ым) антигену(ам).
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Susan L | |||
| Baldwin et al | |||
| The Importance of Adjuvant Formulation in the Development of a Tuberculosis Vaccine.// J Immunol, 2012, том 188, выпуск 5 с.2189-2197 | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Gonzalez D.D | |||
| et al | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
Авторы
Даты
2020-08-14—Публикация
2014-09-19—Подача