Область техники
[0001] Настоящее изобретение относится к способам продуцирования белков в растениях. Данное изобретение предусматривает также способы увеличения продуцирования одного или более белков в растениях.
Уровень техники
[0002] Платформы экспрессии белков на основе растений во всем мире являются успешным ответом на возрастающие требования к биологическим терапевтикам и к диагностике. Растительные клетки, в отличие от бактериальных и дрожжевых клеток, могут корректно складывать, собирать и модифицировать комплексы белков млекопитающих, такие как терапевтические и диагностические антитела. Растения также имеют преимущества, касающиеся безопасности, капиталовложений и легкости перехода к промышленному производству, по сравнению с системами продуцирования на основе клеток млекопитающих.
[0003] Следовательно, растения являются подходящими хозяевами для продуцирования белков, которые в настоящее время применяются в медико-биологических науках, таких как, например, mAbs или вирусные антигены, такие как НА вируса гриппа.
[0004] В международной заявке WO 07016276 описан способ стабильной трансформации растений путем разрезания проростка в месте, где встречаются обе семядоли, для удаления обеих семядолей и инициальных настоящих листьев и для появления молодого побега из разрезанной поверхности. Этот способ включает поранение растения для облегчения введения Agrobacterium в месте поранения и для повышения эффективности трансформации. Разрезанные проростки встряхиваются в суспензии бактерий, которая содержит трансформированную плазмиду, которая содержит желательную транспортную ДНК. Стадия поранения требуется до стадии трансформации. Точная, опосредованная разрезанием трансформация может привести к стабильной трансформации молодых побегов, которые появляются из разрезанной поверхности проростков. Эти побеги могут развиваться в надземных частях растения и, соответственно, давать толчок развитию трансформированному потомству.
[0005] Spokevicus et al (Functional Plant Biology 2006) описывают in vivo трансформацию пассивных дремлющих почек (DLBs) в тополях Populus. DLBs были или ранены путем центрального вертикального разреза, или верхушки растений были удалены и оставшиеся DLBs подвергали комбинации вертикального разреза, добавления защитного покрытия или добавления A. tumefaciens. При проведении этого способа стадию поранения необходимо осуществлять до стадии трансформации.
[0006] В международной заявке WO 2008/151444 раскрыт способ синтеза белка, представляющего интерес, в растении с использованием системы транзиентной экспрессии. Растения обрезали перед инфильтрацией конструкции желательной нуклеиновой кислоты. Верхушечные и пазушные почки растений N. benthamiana или механически удаляли из растений путем прищипывания, или химически удаляли перед вакуумной инфильтрацией листьев со штаммами Agrobacterium, трансформированными соответствующими плазмидами.
[0007] Wydro et al. 2006 (Acta Biochimica Polonica, Vol 53 No. 2/2006 289-298) указывают, что самый высокий уровень транзиентной экспрессии гена зеленого флуоресцентного белка (GFP) обнаруживается в самых молодых листьях (расположенных на верхушке растения) N. benthamiana, инфильтрованных A. tumefaciens, в то время как степень экспрессии в более старых листьях, находящихся в средней и нижней части, ниже. Halfhill et al. (Plant Cell Rep 22: 338-343, 2003) предположили, что изменения флуоресценции GFP были связаны с изменениями концентрации растворимых белков в процессе старения листа. Уровень экспрессии гена gfp и концентрация растворимых белков уменьшались в одно и то же время и в равной степени в отдельных листьях в различных положениях. Wydro et al. предполагают, что тесная взаимосвязь между этими двумя факторами свидетельствует о том, что уменьшение экспрессии GFP явилось результатом общих изменений в физиологии листьев.
[0008] Экспрессия клинически полезных белков в растениях усилилась путем создания высокопроизводительных систем для транзиентной экспрессии белков с использованием агроинфильтрации. Существует необходимость в оптимизации экспрессии и повышении количества и качества рекомбинантных белков в растениях.
Сущность изобретения
[0009] Настоящее изобретение относится к способам продуцирования белка в растениях. Данное изобретение предусматривает также способы повышения продуцирования одного или более белков в растениях.
[0010] Цель данного изобретения заключается в создании усовершенствованного способа продуцирования белка в растениях.
[0011] Настоящее изобретение предусматривает способ продуцирования белка, представляющего интерес, в растении или в части растения, включающий:
a) обработку растения или части растения для увеличения вторичной продукции биомассы листьев в растении или в части растения;
b) введение одной или более, чем одной нуклеиновой кислоты в растение или в часть растения, при этом такая нуклеиновая кислота содержит нуклеотидную последовательность, кодирующую белок, представляющий интерес, и нуклеотидная последовательность функционально связана с регуляторной областью, которая является активной в растении;
c) выращивание (инкубацию) растения или части растения в условиях, которые обеспечивают экспрессию нуклеотидной последовательности, кодирующей белок, представляющий интерес, продуцирующей при этом белок, представляющий интерес, причем выход белка, представляющего интерес, повышается по сравнению с выходом белка, представляющего интерес, полученного из той же растительной ткани похожего растения, которое выращено в тех же самых условиях, но которое не было обработано для увеличения вторичной биомассы листьев.
[0012] Белок, представляющий интерес, который может быть использован в способе, описанном выше, может быть антителом, антигеном, вакциной или ферментом. Белок, представляющий интерес, может быть белком НА вируса гриппа, и НА может образовывать вирусоподобную частицу гриппа (VLP) при экспрессии в растении или в части растения.
[0013] Одна или более, чем одна нуклеиновая кислота может быть введена в растение или в часть растения, которое имеет величину отношения вторичной биомассы к первичной биомассе листьев между 0.2:1 и 3:1.
[0014] Настоящее изобретение предусматривает также способ, описанный выше, где стадия обработки, стадия а), проводится в течение периода от примерно 40 дней до стадии введения одной или более, чем одной нуклеиновой кислоты до дня введения одной или более, чем одной нуклеиновой кислоты, или от примерно 40 дней до стадии введения одной или более, чем одной нуклеиновой кислоты до дня сбора растения или части растения. Данное изобретение включает способ, описанный выше, где стадия обработки растения, стадия а), включает увеличение освещенности во время роста растения, повышение интенсивности освещенности во время роста растения, выбор длин волн, которые воздействуют на растение, во время роста, удаления верхушечной почки на первичном стебле растения, культивацию растения в присутствии агента, гормона или их комбинации, что увеличивает развитие вторичного побега, применение химического соединения, которое снижает апикальное доминирование, механическое удаление, химическое удаление, генетическую модификацию методом нокин, нокаут генов и селекцию растений для увеличения вторичного роста или их комбинацию.
[0015] При осуществлении способа, описанного выше, растение может быть культивировано в присутствии фитогормона. Например, растение может быть культивировано в присутствии от примерно 50 част./млн до 900 част./млн фитогормона. Фитогормон может быть синтетическим цитокином, например, 6-бензиламинопурином (ВАР).
[0016] Настоящее изобретение включает также способ, описанный выше, где этот способ включает также стадию сбора растения и, необязательно, очистку белка, представляющего интерес. Во время осуществления стадии сбора могут быть собраны вторичные листья или первичные листья и вторичные листья. Кроме того, могут быть собраны вторичные листья, промежуточные листья первичных стеблей (Р2), и молодые листья первичных стеблей (Р1), или промежуточные листья первичных стеблей (Р2), молодые листья первичных стеблей (Р1), старые листья вторичных стеблей (S3), промежуточные листья вторичных стеблей (S2) и молодые листья вторичных стеблей (S1). Кроме того, на стадии сбора могут быть исключены старые листья (Р3) первичных стеблей растения.
[0017] Настоящее изобретение предусматривает способ, описанный выше, где на стадии введения, стадии b), нуклеиновая кислота транзиентно экспрессируется в растении или нуклеиновая кислота стабильно экспрессируется в растении.
[0018] Путем увеличения вторичной биомассы листьев можно достигнуть увеличения выхода белка из первичной и вторичной биомассы по сравнению с выходом белка, представляющего интерес, полученного из такой же растительной ткани растения, которое не было обработано для увеличения вторичной биомассы и было выращено в таких же условиях.
[0019] Этот раздел описания изобретения необязательно раскрывает все признаки изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0020] Эти и другие признаки изобретения станут более очевидными после следующего описания, в котором даны ссылки на прилагаемые рисунки, где:
[0021] На Фигуре 1 показана продукция биомассы растениями, выращенными в теплице перед инфильтрацией при различных длинах светового дня (16 ч и 24 ч) и различных величинах интенсивностей освещенности (80 и 160 мкмол/м2⋅с). Осуществляли сбор молодых (Р1), зрелых (Р2) и старых (Р3) листьев на основном стебле и молодых (S1), зрелых (S2) и старых (S3) листьев на вторичных стеблях и определяли биомассу.
[0022] На Фигуре 2 показано продуцирование НА в молодых (Р1), зрелых (Р2) и старых (Р3) листьях на основном стебле и молодых (S1), зрелых (S2) и старых (S3) листьях вторичных стеблей при различных длинах светового дня (16 ч и 24 ч) и различных величинах интенсивностей освещенности (80 и 160 мкмол/м2⋅с).
[0023] На Фигуре 3 показан общий выход НА (НА на растение) в молодых (Р1), зрелых (Р2) и старых (Р3) листьях на основном стебле и молодых (S1), зрелых (S2) и старых (S3) листьях вторичных стеблей при различных длинах светового дня (16 ч и 24 ч) и различных величинах интенсивностей освещенности (80 и 160 мкмол/м2⋅с).
[0024] На Фигуре 4 показан общий выход НА в листьях на основном стебле (нижних (Р)) и в листьях на вторичных стеблях (верхушечных (S)) при различных длинах светового дня (16 ч и 24 ч) и различных величинах интенсивностей освещенности (80 и 160 мкмол/м2⋅с).
[0025] На Фигуре 5 показана продукция биомассы растениями, выращенными в климатической камере или при низкой интенсивности освещенности, или при высокой интенсивности освещенности. Собирали молодые (Р1), зрелые (Р2) и старые (Р3) листья на основном стебле и молодые (S1), зрелые (S2) и старые (S3) листья на вторичных стеблях и определяли биомассу.
[0026] На Фигуре 6 показан общий выход НА в расчете на растение, выращенное в климатической камере или при низкой интенсивности освещенности, или при высокой интенсивности освещенности. Собирали молодые (Р1), зрелые (Р2) и старые (Р3) листья на основном стебле и молодые (S1), зрелые (S2) и старые (S3) листья на вторичных стеблях и определяли общий выход НА в расчете на растение.
[0027] На Фигуре 7 показана схематическая диаграмма растения с первичными (Р1, Р2, Р3) и вторичными листьями (S1, S2, S3).
[0028] На Фигуре 8 показано влияние прищипывания, в этом случае удаления верхушечной почки у растений через 5, 7 или 12 дней после трансплантации сеянцев, на количество общей первичной биомассы (Р) по сравнению с количеством вторичной биомассы (S) в расчете на растение.
[0029] На Фигуре 9А показано влияние 6-бензиламинопурина (ВАР) на общее количество первичной биомассы (Р) у растений, обработанных бензиламинопурином (ВАР) при концентрации 100, 500 или 1,000 част./млн, через 7 и/или 12 дн после трансплантации сеянцев. Фигура 9 В показывает влияние 6-бензиламинопурина (ВАР) на общее количество вторичной биомассы (Р) у растений, обработанных бензиламинопурином (ВАР) при концентрации 100, 500 или 1,000 част./млн, через 7 и/или 12 дн после трансплантации сеянцев.
[0030] На Фигуре 10 показана средняя скорость продуцирования НА (в единицах НА на г сырого продукта) в растениях, обработанных бензиламинопурином (ВАР) при концентрациях 100,500 или 1,000 част./млн, через 7 и/или 12 дн после трансплантации сеянцев.
[0031] На Фигуре 11 показан общий выход НА (выход НА в расчете на растение) в растениях, обработанных бензиламинопурином (ВАР) при концентрациях 100, 500 или 1,000 част./млн, через 7 и/или 12 дн после трансплантации сеянцев.
[0032] На Фигурах 12А и 12В показаны праймеры IF-PDI.S1+3c (SEQ ID NO: 1) и IF-H1cTMCT.S1-4r (SEQ ID NO: 2), соответственно.
[0033] На Фигуре 13 показана нуклеотидная последовательность PDISP/H1 California (SEQ ID NO:3).
[0034] На Фигуре 14 схематически показана конструкция 1191.
[0035] На Фигуре 15 показана нуклеотидная последовательность для конструкции 1191 (SEQ ID NO: 4). tDNA-границы подчеркнуты.
[0036] На Фигуре 16 показана нуклеотидная последовательность для экспрессионной кассеты 484. Последовательность, кодирующая PDISP/H1 California подчеркнута.
[0037] На Фигуре 17 показана аминокислотная последовательность PDISP/H1 California (SEQ ID NO: 6).
[0038] На Фигуре 18 схематически представлена конструкция номер 484 (2X35S/CPMV НТ).
Подробное описание
[0039] Настоящее изобретение относится к способам и композициям для продуцирования белка в растениях. Данное изобретение предусматривает также способы и композиции для продуцирования белков, представляющих интерес, в растениях. Предусмотрен также способ продуцирования белка, представляющего интерес, в растении или в части растения.
[0040] Данное изобретение предусматривает способ продуцирования белка, представляющего интерес, в растении или в части растения, включающий:
a) обработку растения или части растения для увеличения вторичной продукции биомассы листьев в растении или в части растения;
b) введение одной или более, чем одной нуклеиновой кислоты в растение или в часть растения, при этом такая нуклеиновая кислота содержит нуклеотидную последовательность, кодирующую белок, представляющий интерес, и нуклеотидная последовательность функционально связана с регуляторной областью, которая является активной в растении;
c) инкубацию растения или части растения в условиях, которые обеспечивают экспрессию нуклеотидной последовательности, кодирующей белок, представляющий интерес, и продуцирующей при этом белок, представляющий интерес, причем выход белка, представляющего интерес, повышается по сравнению с выходом белка, представляющего интерес, полученного из той же растительной ткани похожего растения, которое выращено в тех же самых условиях, но которое не было обработано для увеличения вторичной биомассы листьев.
[0041] Может быть собрана растительная ткань и из растения экстрагирован белок, представляющий интерес. Если это желательно, белок, представляющий интерес, может быть очищен с использованием стандартных методов, которые хорошо известны из уровня техники. Альтернативно, может быть собрано растение и использовано в качестве пищевого продукта, питательного вещества или медицинской добавки, или растение может быть частично обработано для получения экстракта растения, обработанного в минимальной степени для применения в качестве пищевого продукта, питательного вещества или медицинской добавки.
[0042] Под термином "похожее растение" подразумевают растение, которое является растением того же рода, вида и разновидности, что и растение, которое обрабатывается для увеличения продукции вторичной биомассы.
[0043] Одна или более, чем одна нуклеиновая кислота может быть введена в растение или в часть растения, когда отношение вторичной биомассы к первичной биомассе листьев составляет величину между 0.2:1 и 3:1 или любое отношение в этом интервале. Например, отношение вторичной биомассы к первичной биомассе листьев может составлять примерно 0.2:1, 0.3:1, 0.4:1, 0.5:1, 0.6:1, 0.7:1, 0.8:1, 0.9:1, 1:1, 1.2:1, 1.4:1, 1.6:1, 1.8:1, 2:1, 2.2:1, 2.4:1, 2.6:1, 2.8:1, 3:1 или любое отношение в этих интервалах.
[0044] Белок, представляющий интерес, может быть любым белком, например, ферментом, фармацевтически активным белком, фактором свертывания крови, антителом, антигеном, вакциной, пищевой добавкой, питательной добавкой, промышленно важным ферментом или одним, или более белками, которые могут образовывать "вирусоподобную частицу" в растении.
[0045] Термины "вирусоподобная частица" (VLP) или "вирусоподобные частицы" или "VLPs" относятся к структурам, которые самособираются и содержат структурные белки, такие как белок НА вируса гриппа. VLPs обычно морфологически и антигенно похожи на вирионы, образующиеся при инфекции, но не содержат генетической информации, достаточной для репликации, и поэтому не являются инфицирующими. В некоторых случаях VLPs могут содержать один вид белков или более, чем один вид белков. См., например, заявки WO 2009/009876; WO 2009/076778; WO 2010/003225 (каждая из которых включена в данную заявку посредством отсылки).
[0046] Следовательно, настоящее изобретение относится также к способам продуцирования VLPs в растениях. Данное изобретение предусматривает также способы и композиции для продуцирования VLPs в растениях. Например, предусмотрен способ продуцирования вирусоподобных частиц (VLPs) в растении или в части растения, который включает:
a) обработку растения или части растения для увеличения вторичной продукции биомассы листьев в растении или в части растения;
b) введение одной или более, чем одной нуклеиновой кислоты в растение или в часть растения, при этом такая нуклеиновая кислота содержит нуклеотидную последовательность, кодирующую гемагглютинин (НА), и эта нуклеотидная последовательность функционально связана с регуляторной областью, которая является активной в растении;
c) инкубацию растения или части растения в условиях, которые обеспечивают экспрессию нуклеотидной последовательности, кодирующей НА, продуцирующей при этом НА, причем выход НА повышается по сравнению с выходом НА, полученного из той же растительной ткани похожего растения, которое выращено в тех же самых условиях, но которое не было обработано для увеличения вторичной биомассы листьев.
[0047] Растительная ткань может быть собрана и VLPs могут быть экстрагированы из растения. Если это желательно, VLPs могут быть очищены с использованием стандартных методов, которые хорошо известны в предшествующем уровне техники (см., например, заявки WO 2009/009876; WO 2009/076778; WO 2010/003225; каждая из которых включена в данную заявку посредством отсылки). Альтернативно, растение может быть собрано и использовано в качестве пищевой, питательной или медицинской добавки, или растение может быть обработано частично с целью получения экстракта обработанного в минимальной степени растения для применения в качестве пищевой, питательной или медицинской добавки.
[0048] Одна или более, чем одна нуклеиновая кислота может быть введена в растение или в часть растения, когда отношение вторичной биомассы к первичной биомассе листьев составляет величину между 0.2:1 и 3:1 или любое отношение в этом интервале. Например, отношение вторичной биомассы к первичной биомассе листьев может составлять примерно 0.2:1, 0.3:1, 0.4:1, 0.5:1, 0.6:1, 0.7:1, 0.8:1, 0.9:1, 1:1, 1.2:1, 1.4:1, 1.6:1, 1.8:1, 2:1, 2.2:1, 2.4:1, 2.6:1, 2.8:1, 3:1 или любое отношение в этих интервалах.
[0049] Как показано на Фигуре 7, растение 10 содержит первичный стебель 20, верхушечную почку 40 и листья (P1, Р2, Р3 и S1, S2 и S3), которые выступают из первичного стебля 20. Новые листья, которые появляются вблизи верхушки 40 растения 10 обозначены как Р1. Листья Р1 или верхние листья все еще растут и увеличивают биомассу. Листья Р1 расположены над листьями Р2 вдоль основного стебля и включают очень молодые листья 'верхушечного комплекса' (а именно, верхушечную почку и любые вновь образующиеся листья), когда этот комплекс имеется. Листья Р1 молодых растений, например, растения в возрасте 25-30 дней, обычно соответствуют листу 1, листу 2 и верхушечному комплексу. Листья Р2 относятся к зрелым листьям, которые еще не начали стареть. Листья Р2 включают листья, которые близки к завершению или завершили свою фазу развития. Если смотреть на растение сверху, то листья Р2 являются самыми большими, которые видны, и могут замаскировать или закрыть листья P3. Листья Р2 обычно соответствуют листу 3, листу 4 и листу 5 на основном стебле (нумерация листьев начинается сверху или от верхушки растения; см. Фигуру 2А в публикации Robert et al. 2013, PLoS ONE 8(7): e70203, doi:10.1371/journal.pone.0070203; которая включена в данную заявку посредством отсылки). Листья P3 или нижние листья представляют собой листья, которые расположены ниже листьев Р2 на основном стебле. Листья P3 включают, но без ограничения, стареющие листья, которые могут в некоторой степени желтеть. Листья P3 часто включают лист 5, лист 6, лист 7 и более старые листья растения. Симптомы старения (например, потеря хлорофилла) часто видны, начиная с листа 7 или листа 8. Листья 5 и 6 не выглядят стареющими, но часто содержат небольшие количества белка.
[0050] Листья S1, S2 и S3 прикреплены к вторичным (и иногда третичным) стеблям. Листья S1 являются теми листьями, которые прикреплены к вторичным стеблям, которые выступают из листьев Р1. Эти вторичные листья находятся вблизи верхушки, и они моложе, чем листья S2 и S3. Листья S2 прикреплены к вторичным стеблям, выходящим из листьев Р2, и листья S3 прикреплены к вторичным стеблям, выходящим из листьев P3. Листья S3 являются самыми старыми вторичными листьями, но поскольку они моложе, они более эффективны, чем листья P3 при продуцировании белков.
[0051] Было установлено, что путем увеличения вторичной биомассы листьев в растении достигается повышение общего выхода белка, представляющего интерес. При использовании способов, описанных в данной заявке, были получены высокие выходы белка, представляющего интерес, когда продуцирование белка, представляющего интерес, сравнивается с продуцированием такого же белка, представляющего интерес, с применением похожего протокола трансформации для растения, выращенного в похожих условиях роста, но без обработки растения или части растения для увеличения вторичной биомассы листьев перед стадией введения нуклеиновой кислоты в растение.
[0052] Как показано на Фигуре 8, удаление верхушки растения (прищипывание растения) приводит к увеличению выхода белка, представляющего интерес (гемагглютинина; НА), в расчете на растение во вторичных стеблях (S) и уменьшению выхода белка, представляющего интерес (НА) в расчете на растение в первичных стеблях (Р), при сравнении с растениями, у которых верхушка не была удалена. Кроме того, удаление верхушки растения привело к 2.1 - кратному увеличению вторичной биомассы листьев, уменьшению первичной биомассы листьев, при увеличении отношения вторичной биомассы листьев к первичной биомассе листьев от 0.4:1 до 1.6:1 (см. Таблицу 3; Пример 5).
[0053] Увеличение выхода белка, представляющего интерес, означает увеличение выхода белка, представляющего интерес, на величину от примерно 5% до примерно 500% (то есть, до 5-кратного увеличения), или на любую величину в этом интервале, как определено с использованием стандартных методов, известных в предшествующем уровне техники, например, от примерно 10% до примерно 50% или на любую величину в этом интервале, например, на примерно 5, 8, 10, 12, 15, 18, 20, 22, 24, 25, 26, 28, 30, 32, 34, 35, 36, 38, 40, 42, 44, 45, 46, 48, 50, 52, 54, 55, 56, 58, 60, 65, 70, 75, 80, 85, 90, 95, 100, 110, 120, 130, 140, 150, 160, 170, 180, 200, 220, 240, 260, 280, 300, 320, 340, 360, 380, 400, 420, 440, 460, 480 или 500%, по сравнению с выходом белка, представляющего интерес, экспрессированного в растении, которое не было обработано для увеличения вторичной биомассы листьев.
[0054] Под увеличением вторичной биомассы листьев подразумевают увеличение вторичной биомассы листьев на величину равную от примерно 2% до примерно 300%, или на любое количество в этом интервале (то есть, до 3-кратного увеличения), как определено с использованием стандартных методов, известных в предшествующем уровне техники, например, от примерно 10% до примерно 200% или на любую величину в этом интервале, например, на примерно 2, 5, 8, 10, 12, 15, 18, 20, 22, 24, 25, 26, 28, 30, 32, 34, 35, 36, 38, 40, 42, 44, 45, 46, 48, 50, 52, 54, 55, 56, 58, 60, 65, 70, 75, 80, 85, 90, 95, 100, 110, 120, 130, 140, 150, 160, 170, 180, 200, 220, 240, 260, 280 или 300%, по сравнению с похожим растением (то есть, растением похожей разновидности), выращенным в тех же условиях, но не обработанным для увеличения вторичной биомассы листьев. Величина биомассы может быть определена с использованием любой методики, которая известна специалисту в данной области, и эта методика может включать определение массы свежих листьев, сухих листьев, содержания белка, объемного водоизмещения и т. Если не указано иное, "биомасса листьев" означает биомассу листа и его черешка. Увеличение вторичной биомассы листьев может быть результатом увеличения количества вторичных стеблей и листьев, увеличения длины вторичных стеблей и листьев, увеличения объема листа, увеличения поверхности листа или их комбинации.
[0055] После стадии обработки растения, стадии а) способа, описанного выше, вторичная биомасса листьев может составлять величину между 20% до 50% от общей биомассы растения или любую величину в этом интервале. Например, содержание вторичной биомассы листьев (по отношению к общей биомассе растения) может составлять 21%, 22%, 23%, 24%, 25%, 26%, 27%, 28%, 29%, 30%, 31%, 32%, 33%, 34%, 35%, 36%, 37%, 38%, 39%, 40%, 41%, 42%, 43%, 44%, 45%, 46%, 47%, 48% или 49% или любое количество между этими величинами.
[0056] Как можно видеть на Фигурах 2 - 6 и 8, на уровень накопления белка в растении или в части растения влияет отношение вторичной биомассы листьев к первичной биомассе листьев, например, это может быть отношение от примерно 0.2:1 до примерно 1:1 (вторичной биомассы листьев к первичной биомассе листьев), или любая величина в этом интервале, например, величина от примерно 0.2:1, 0.3:1, 0.4:1, 0.5:1, 0.6:1, 0.7:1, 0.8:1, 0.9:1, 1:1, 1.2:1, 1.4:1, 1.6:1, 1.8:1, 2:1, 2.2:1, 2.4:1, 2.6:1, 2.8:1, 3:1 или любое отношение в указанных интервалах (вторичной биомассы листьев к первичной биомассе листьев), или любая величина в этих интервалах.
[0057] Отношение вторичной биомассы листьев к первичной биомассе листьев в растении может быть изменено путем увеличения вторичной биомассы листьев по сравнению с первичной биомассой листьев, например, путем увеличения продолжительности освещения во время роста растения, увеличения интенсивности освещенности во время роста растения, прищипывания верхушечной почки (Фигура 7) растения, культивации растения в присутствии агента, который увеличивает содержание вторичной биомассы листьев, гормона, который увеличивает образование вторичной биомассы листьев, применения химического соединения, которое уменьшает доминирование верхушки или путем комбинации этих приемов.
[0058] Следовательно, настоящее изобретение предусматривает также способ повышения выхода белка, представляющего интерес, путем модуляции отношения вторичной биомассы листьев к первичной биомассе листьев при обработке растения для увеличения вторичной биомассы листьев по сравнению с похожим растением, которое не было обработано.
[0059] Под первичной биомассой листьев (или первичной биомассой подразумевают биомассу растения, которая охватывает биомассу первичных листьев (Р1, Р2, P3 и их черешков). Следовательно, первичная биомасса листьев не содержит ни биомассу вторичных листьев или третичных листьев, ни биомассу корней.
[0060] Обычно стебель (который может быть также назван побегом) обеспечивает ось для почек, плодов и листьев. Одной из основных структурных осей сосудистого растения является основной или первичный стебель (20, на Фигуре 7). Первичный стебель 20 обычно обеспечивает опору для первичных листьев (P1, Р2, Р3), цветов, почек, плодов и вторичных стеблей 30. Первичная биомасса листьев содержит биомассу из первичных листьев (P1, Р2, Р3) и их черешков.
[0061] Под "образованием вторичного стебля" подразумевают или начало образования новых вторичных стеблей, развитие уже образующихся вторичных стеблей, или как начало образования, так и развитие уже образующихся вторичных стеблей, которые приводят к образованию увеличенного количества вторичной биомассы листьев.
[0062] Первичный стебель растения может иметь листья разного возраста, непосредственно выходящие из первичного стебля 20. Листья на первичном стебле могут классифицироваться на старые (Р3), промежуточные (Р2) или молодые (Р1), в зависимости от возраста листа.
[0063] Под вторичной биомассой листьев (или вторичной биомассой) подразумевают биомассу листьев и черешков, полученных на вторичных стеблях 30. Более конкретно, вторичная биомасса листьев представляет собой биомассу, которая не содержит биомассу из первичных листьев, цветов, верхушечной почки 40 или корней. Вторичная биомасса листьев может также включать биомассу листьев, полученную из третичных или других стеблей, которые выходят из вторичного стебля 30.
[0064] "Вторичные", "вспомогательные", "пазушные" или "боковые" стебли могут также простираться от основного или первичного стебля 20 растения. Следовательно, вторичный стебель 30 может содержать один или более вторичных стеблей и один или более вторичных листьев (S1, S2, S3). Кроме того, вторичный стебель может содержать один или более третичных или других стеблей. Вторичный стебель 30 растения может иметь листья разного возраста, и эти листья могут классифицироваться на молодые листья (S1), промежуточные листья (S2) или старые листья (S3).
[0065] Было обнаружено, что обработка растения для увеличения вторичной биомассы листьев перед инфильтрацией нуклеиновой кислоты, содержащей нуклеотидную последовательность, кодирующую белок, представляющий интерес, повышает уровень экспрессии белка, представляющего интерес (в виде количества в % от общего синтезированного белка) и выход (в мг белка/кг веса свежих листьев). Обработка растения для увеличения содержания вторичной биомассы листьев может включать, но без ограничения, увеличение интенсивности освещенности растения во время его роста и приводить к увеличению вторичного роста, увеличение времени действия света на растение (продолжительности освещения) во время роста, которое приводит в увеличению вторичного роста, выбор длин волн, которые воздействуют на растение во время его роста таким образом, что наблюдается увеличение вторичного роста, изменение температурного режима день/ночь, которое приводит к увеличению вторичного роста, например, изменение температуры на величину от примерно +/- 1 градус С до примерно +/- 15 градусов С, или на любую величину в этом интервале от исходных 20 градусов С, изменение температуры на величину от примерно +/- 1 градус С до примерно +/- 15 градусов С, или на любую величину в этом интервале от исходных 20 градусов С, в течение промежутка времени от примерно 5 мин до примерно 16 ч, или любого промежутка в этом интервале, если обеспечивается температурный импульс, который меньше, чем период без освещения или период освещения, этот импульс может быть обеспечен в начале или в конце фотопериода, например, обеспечен импульс различной температуры в течение периода от примерно 30 мин до примерно 2 ч в начале или в конце фотопериода, или в конце фотопериода.
[0066] Кроме того, обработка растения для увеличения вторичной биомассы листьев может включать, но без ограничения, культивацию растений в присутствии агента, вызывающего образование вторичного стебля, образование вторичной биомассы, или и то, и другое, гормона, вызывающего образование вторичного стебля, образование вторичной биомассы, или и то, и другое, применение химического соединения, который уменьшает доминирование верхушки, прищипывание первичной верхушечной почки 40 для образования вторичного стебля, образования вторичной биомассы, или и того, и другого, генетическую модификацию, например, методом нокин или нокаут генов, которые приводят к ускорению образования вторичного стебля, образования вторичной биомассы, или того, и другого, селекцию растений в комбинации с выбором растений, характеризующихся ускорением вторичного роста по сравнению с их родительскими штаммами, или комбинацию указанных приемов.
[0067] Под термином "свет" подразумевают свет, содержащий спектр длин волн, которые используются листьями растения, например, длин волн от примерно 400 до примерно 700 нм или любых длин волн в этом интервале, и он может включать голубую, зеленую и красную, и, если это требуется, инфракрасную части электромагнитного спектра. Любой подходящий источник света, который испускает длины волн, которые могут быть использованы растением, включает, например, источник естественного света, металлокерамический галогеновый источник света, металлогалогенный источник света, натриевую лампу высокого давления, светодиоды (LEDs), флуоресцентный источник, источник света с нитью накала или их комбинацию.
[0068] Стадию обработки растения для увеличения вторичной биомассы листьев перед инфильтрацией можно проводить в течение цикла роста растения от начала прорастания (а именно, с дня 0) до инфильтрации (а именно, введения рекомбинантного вектора в растение), или до дня сбора растения, или в течение любого промежутка времени в указанном интервале. Например, если обработка включает фотопериод, составляющий 24 ч, тогда проросший саженец может подвергаться обработке в течение этого фотопериода, которая длится от дня прорастания через стадию трансформации растения или инфильтрации, инкубации трансформированного растения и до дня сбора. Однако могут быть также использованы более короткие периоды обработки.
[0069] Подобным образом стадия обработки растения для увеличения вторичного роста может включать увеличение интенсивности освещения, воздействующего на растение во время роста, и это приводит к увеличению вторичного роста. Эта обработка может использоваться во время роста растения от начала прорастания через трансформацию растения или инфильтрацию, до дня сбора растения, или в любое время в этом интервале. Подобным образом, выбор длин волн, воздействующих на растение во время роста таким образом, что это приводит к увеличению вторичного роста, может применяться во время роста растения от начала прорастания (то есть, от дня 0) через инфильтрацию (то есть, введение рекомбинантного вектора в растение), или до дня сбора растения, или в любое время в этом интервале. Предусмотрено изменение температурного режима день/ночь (например, могут быть предусмотрены изменение температуры на величину от примерно +/- 1 градус С до примерно +/- 15 градусов С, или на любую величину в этом интервале от исходных 20 градусов С, или импульсы температуры) для увеличения вторичного роста растений, растение может быть подвергнуто этой обработке в течение цикла роста растения от прорастания (то есть, от дня 0) через инфильтрацию (то есть, введение рекомбинантного вектора в растение, или до дня сбора растения или в любое время в этом интервале.
[0070] Альтернативно, перед стадией трансформации или инфильтрации могут быть применены другие способы обработки для увеличения вторичной биомассы растений в течение периода от примерно 20 дней до дня инфильтрации, или в течение любого времени в этом интервале, например, в течение 20 дней перед инфильтрацией, до дня инфильтрации, или в течение любого времени в этом интервале, например, начиная от 20 дней, 19 дней, 18 дней, 17 дней, 16 дней, 15 дней, 14 дней, 13 дней, 12 дней, 11 дней, 10 дней, 9 дней, 8 дней, 7 дней, 6 дней, 5 дней, 4 дней, 3 дней, 2 дней, 1 дня до дня инфильтрации, или в течение любого времени в этом интервале.
[0071] Применение увеличения продолжительности освещения с целью увеличения вторичной биомассы листьев включает воздействие света на растение в течение промежутка времени от примерно 12 ч до примерно 24 ч или в течение любого промежутка времени в этом интервале, например, в течение примерно 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или 24 ч. Например, продолжительность освещения может составлять 24 ч, таким образом растение подвергается постоянному действию света до стадии инфильтрации.
[0072] Увеличение продолжительности освещения можно осуществлять примерно от дня прорастания до дня инфильтрации или до дня сбора растения, или в течение любого промежутка времени в этом интервале. Например, но без ограничения, в течение 40 дней, 35 дней, 30 дней, 25 дней, 20 дней, 19 дней, 18 дней, 17 дней, 16 дней, 15 дней, 14 дней, 13 дней, 12 дней, 11 дней, 10 дней, 9 дней, 8 дней, 7 дней, 6 дней, 5 дней, 4 дней, 3 дней, 2 дней до инфильтрации, дня инфильтрации, дня сбора, или любого промежутка времени в этих интервалах. Специалист легко может определить соответствующий интервал до прищипывания.
[0073] Свет может включать природный солнечный свет или природный солнечный свет, дополненный искусственным светом, или искусственный свет. Если используется только искусственный свет или он применяется в дополнение к природному солнечному свету, можно использовать интенсивность освещения от примерно 60 (мкмол/м2⋅с) до примерно 200 (мкмол/м2⋅с) или любую величину в этом интервале, например, величину равную примерно 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190 или 200 (мкмол/м2⋅с) или любую величину среди указанных. Например, интенсивность освещения может составлять 160 (мкмол/м2 с). Увеличение интенсивности освещения может проводиться в течение цикла роста растения от начала прорастания (то есть, со дня 0) до инфильтрации (то есть, введения рекомбинантного вектора в растение), или дня сбора растения или в любой промежуток времени в этом интервале, например, в течение 40 дней, 35 дней, 30 дней, 25 дней, 20 дней, 19 дней, 18 дней, 17 дней, 16 дней, 15 дней, 14 дней, 13 дней, 12 дней, 11 дней, 10 дней, 9 дней, 8 дней, 7 дней, 6 дней, 5 дней, 4 дней, 3 дней, 2 дней до инфильтрации, дня инфильтрации, дня сбора растения, или любого промежутка времени в этих интервалах. Специалист легко может определить соответствующий интервал до прищипывания.
[0074] Под прищипыванием подразумевают удаление одной или более, чем одной верхушечной почки 40 или удаление верхушки или верхней части стебля, который включает верхушечную почку 40. Прищипывание может также включать срезание, индуцирование некроза или уменьшение роста верхушечных почек без удаления почек у растения. Под уменьшением роста почки (или сокращением роста почки) подразумевают то, что почка проявляет уменьшение, например, метаболической активности, или увеличение размера в течение определенного периода времени от величины равной примерно от 50% до 100%, или на любую величину в этих пределах, по сравнению с почкой, которую не обрабатывали. Прищипывание можно осуществлять путем применения химического соединения, которое снижает доминирование верхушки. Если химическое соединение используется для прищипывания, его применяют в дозах, обычно рекомендуемых производителем этого химического соединения.
[0075] Прищипывание можно осуществлять любыми средствами, которые известны специалисту в данной области, оно включает, но без ограничения, механическое удаление почки, например, но без ограничения, обрезание, разрезание, пинцировку, сдавливание, например, с использованием щипцов и т., локализованное замораживание, например, путем направления локализованного потока жидкого азота на почку, или обхватывание почки щипцами или другим приспособлением, которое было охлаждено с применением соответствующего охлаждающего источника, включая жидкий азот, сухой лед, этанол-сухой лед, лед и т.п., таким образом, чтобы температура почки снижалась для уменьшения роста почки или для гибели почки.
[0076] Прищипывание включает также химическое удаление, например, применение гербицида (химического соединения; агента для прищипывания), который убивает или уменьшает рост почки, или применение регулятора роста, который приводит к гибели или уменьшает рост почки. Использование химического удаления позволяет осуществить эффективный способ прищипывания, поскольку растения могут быть легко обработаны путем распыления, туманообразования, замачивания растения химическим соединением или окунания растений в раствор, содержащий химическое соединение. Растения могут быть обработаны один раз перед стадией инфильтрации или обработаны более, чем один раз перед стадией инфильтрации. Агент, химическое соединение или гормон увеличивают образование вторичных стеблей, образование вторичной биомассы или того и другого, или уменьшают доминирование верхушки или вызывают комбинацию этих явлений. Например, растение можно культивировать или обрабатывать цитокинами или фитогормонами, которые способствуют образованию вторичных стеблей или уменьшают доминирование верхушки или вызывают комбинацию этих явлений. Например, растение может быть обработано фитогормоном, таким как, например, цитокинин (СК), для увеличения (способствования) образования вторичных стеблей. Такой цитокинин может быть, например, синтетическим цитокинином, таким как 6-бензиламинопурин (ВАР), известный также как бензиладенин.
[0077] Растение может быть обработано фитогормоном в количестве от примерно 50 част./млн до примерно 900 част./млн или в любом количестве в указанном интервале, например, в количестве 100 част./млн, 150 част./млн, 200 част./млн, 250 част./млн, 300 част./млн, 350 част./млн, 400 част./млн, 450 част./млн, 500 част./млн, 550 част./млн, 600 част./млн, 650 част./млн, 700 част./млн, 750 част./млн, 800 част./млн, 850 част./млн, 900 част./млн или в любом количестве в этих пределах. Например, растение может быть обработано примерно 100 част./млн - 500 част./млн фитогормона, например, ВАР.
[0078] Как показано на Фигурах 9, 10 и 11 обработка растений ВАР оказывает небольшое влияние на первичную биомассу, но значительно повышает продукцию вторичной биомассы (см. Фигуру 9b).
[0079] Кроме того, на растение может быть нанесен агент или химическое соединение, которое уменьшает доминирование верхушки, например, растение может
быть подвергнуто химическому прищипыванию или обработано другим образом для уменьшения доминирования верхушки. Примеры химических соединений, которые могут быть использованы, включают, но без ограничения, гербициды, например, регуляторы роста растений Этефон (Ethephon) (например, Bromeflor, Cerone, Chlorethephon Ethrel, Florel, Prep и Flordimex), Daminozide (бутандионовой кислоты моно-2,2-диметилгидразин, сукциновой кислоты 2,2-диметилгидразид; например, B-nine; Alar, Kylar, SADH, B-nine, B-995, аминозид), атриммек (дикегулака натриевая соль), гидразид малеиновой кислоты (1,2,-дигидро-3,6-пиридазиндион), и включают ингибиторы синтеза гиббереллиновой кислоты, например, но без ограничения, Cycocel (хлормеквата хлорид), A-Rest (анцимидол), триазолы, например, Bonzi (паклобутразол), Sumagic (униконазол) или 3-амино-1,2,4-триазол (3-АТ). Эти соединения могут быть использованы в известных дозировках для модификации роста растений, например, используемый диапазон доз может быть таким, который рекомендован производителями химического соединения. Эти соединения могут быть также использованы в диапазонах доз, которые ниже, чем известные дозы для модификации роста растений, например, могут быть использованы дозы, которые составляют 75%, 50%, 25%, 10% от величин, рекомендованных производителем химического соединения. Эти соединения могут быть использованы в количестве от примерно 0.2 част./млн до примерно 5,000 част./млн, и в любом количестве в указанном интервале, в зависимости от вида выбранного регулятора роста. Кроме того, агент для прищипывания (химическое соединение) может применяться один раз, или может быть дополнительное применение, если это требуется. Например, химическое соединение может применяться один раз или химическое соединение может применяться более, чем один раз, для достижения химического прищипывания растения перед инфильтрацией или после нее. Если используется химическое прищипывание, тогда химическое соединение может применяться в течение периода от примерно 20 дней до инфильтрации до примерно 2 дней после инфильтрации или в течение любого промежутка времени в этом интервале, например, химическое соединение может быть эффективно использовано в течение периода, составляющего 14 дней, 7 дней или 5 дней до инфильтрации.
[0080] Прищипывание верхушечной почки может быть осуществлено в течение периода от примерно 20 дней до инфильтрации до примерно 2 дней до инфильтрации или в течение любого промежутка времени в этом интервале, например, от примерно 19 дней до инфильтрации до примерно 2 дней до инфильтрации, или в течение любого промежутка времени в этом интервале, например, от 18 дней до инфильтрации до примерно 2 дней до инфильтрации, или в течение любого промежутка времени в этом интервале, например, от 17 дней до инфильтрации до примерно 2 дней до инфильтрации, или в течение любого промежутка времени в этом интервале, например, от 16 дней до инфильтрации до примерно 2 дней до инфильтрации, или в течение любого промежутка времени в этом интервале, например, от 15 дней до инфильтрации до примерно 2 дней до инфильтрации, или в течение любого промежутка времени в этом интервале, например, от 14 дней до инфильтрации до примерно 2 дней до инфильтрации, или в течение любого промежутка времени в этом интервале, например, от 15 дней до инфильтрации до примерно 2 дней до инфильтрации, или в течение любого промежутка времени в этом интервале, например, от 14 дней до инфильтрации до примерно 2 дней до инфильтрации, или в течение любого промежутка времени в этом интервале, например, от 13 дней до инфильтрации до примерно 2 дней до инфильтрации, или в течение любого промежутка времени в этом интервале, например, от 12 дней до инфильтрации до примерно 2 дней до инфильтрации, или в течение любого промежутка времени в этом интервале, например, от 11 дней до инфильтрации до примерно 2 дней до инфильтрации, или в течение любого промежутка времени в этом интервале, например, от 10 дней до инфильтрации до примерно 2 дней до инфильтрации, или в течение любого промежутка времени в этом интервале, например, от 9 дней до инфильтрации до примерно 2 дней до инфильтрации, или в течение любого промежутка времени в этом интервале, например, от 8 дней до инфильтрации до примерно 2 дней до инфильтрации, или в течение любого промежутка времени в этом интервале, например, от 7 дней до инфильтрации до примерно 2 дней до инфильтрации, или в течение любого промежутка времени в этом интервале, например, от 6 дней до инфильтрации до примерно 2 дней до инфильтрации, или в течение любого промежутка времени в этом интервале, например, от 5 дней до инфильтрации до примерно 2 дней до инфильтрации, или в течение любого промежутка времени в этом интервале, например, от 4 дней до инфильтрации до примерно 2 дней до инфильтрации, или в течение любого промежутка времени в этом интервале, например, от 3 дней до инфильтрации до примерно 2 дней до инфильтрации, или в течение любого промежутка времени в этом интервале или в течение промежутка от 20 дней, 19 дней, 18 дней, 17 дней, 16 дней, 15 дней, 14 дней, 13 дней, 12 дней, 11 дней, 10 дней, 9 дней, 8 дней, 7 дней, 6 дней, 5 дней, 4 дней, 3 дней до инфильтрации до примерно 2 дней до инфильтрации, или в течение любого промежутка времени в этих пределах. Специалист легко может определить соответствующий интервал до прищипывания.
[0081] Такой способ может также включать сбор растения или части растения. Например, может быть собрано целое растение, содержащее первичные и вторичные стебли. Альтернативно, может быть собрана часть растения, содержащая вторичную биомассу, первичную биомассу или их комбинацию. Например, могут быть собраны листья S1, S2, S3, P1, Р2, P3, листья S1, S2, S3, P1, Р2, P3 с черешками или любая их комбинация. Если это желательно, старые листья (Р3) растения могут быть исключены во время сбора.
[0082] Под термином "часть растения" подразумевают любую часть растения, включая ткань, полученную из растения, например, но без ограничения, листья, листья и стебель, корни, воздушную часть, включая листья, стебель и необязательно цветущую часть растения, клетки, протопласты или любую их комбинацию, полученную из растения. Например, "часть растения" может относиться к листьям или стеблям растения. Часть растения может также включать вторичную биомассу, первичную биомассу или их комбинацию, например, листья S1, S2, S3, P1, Р2, P3, листья S1, S2, S3, P1, Р2, P3 с их черешками или любую их комбинацию.
[0083] Под термином "растительный материал" подразумевают любой материал, полученный из растения. Растительный материал может включать целое растение, ткань, клетки или любую их часть. Кроме того, растительный материал может включать внутриклеточные растительные компоненты, внеклеточные растительные компоненты, жидкие или твердые экстракты из растений, или их комбинацию. Кроме того, растительный материал может включать растения, растительные клетки, ткань, жидкий экстракт или их комбинацию из листьев растений, стеблей, плодов, корней или их комбинацию. Растительный материал может включать растение или его часть, которые не подвергались какой-либо стадии обработки. Однако предусматривается также, что растительный материал может подвергаться минимальной обработке, определенной ниже, или более жесткой обработке, включая частичную или существенную очистку белка, методами, обычно известными из предшествующего уровня техники, включая, но без ограничения, хроматографию, электрофорез и т.
[0084] Белок, представляющий интерес, полученный в соответствии с настоящим изобретением, может быть очищенным, частично очищенным белком из растения, части растения или растительного материала, или может быть введен в виде оральной вакцины, с использованием способов, известных специалисту в данной области. Очистка может включать получение фракции апопластов, как описано в заявке WO 2011/035422 (которая включена в данную заявку посредством отсылки). В случае препаративной эксклюзионной хроматографии может быть получен препарат, содержащий белок, представляющий интерес, и нерастворимый материал, удаляемый методом центрифугирования. Может быть также использовано осаждение при помощи PEG. Выделенный белок можно определить количественно с применением обычных способов (например, метода анализа Бредфорда, ВСА), из экстракта, прошедщего через колонку при эксклюзионной хроматографии с использованием, например, SEPHACRYLTM, SEPHADEXTM или подобной среды, затем собирают фракции. В качестве калибровочного стандарта можно использовать голубой декстран 2000 или подходящий белок. Экстракт может быть также пропущен через колонку с катионообменной смолой, активные фракции собирают. После хроматографии фракции можно затем подвергнуть анализу методом электрофореза белков, иммуноблоттинга или обоими методами, для подтверждения наличия белка, представляющего интерес, и белков комплемента фракции.
[0085] Под термином "минимальная обработка" подразумевают обработку растительного материала, например, растения или его части, содержащих белок, представляющий интерес, который частично очищен с получением растительного экстракта, гомогената, фракции растительного гомогената или т.п. (то есть он обработан в минимальной степени). Частичная очистка может включать, но без ограничения, разрушение растительных клеточных структур с получением при этом композиции, содержащей растворимые растительные компоненты и нерастворимые растительные компоненты, которые могут быть отделены, например, но без ограничения, путем центрифугирования, фильтрации или их комбинации. В этом отношении белки, секретированные во внеклеточное пространство листа или других тканей, могут быть легко получены с использованием вакуумной экстракции или экстракции центрифугированием, или ткани могут быть экстрагированы под давлением при пропускании через валки или при размельчении или т.п. для сжатия или высвобождения свободного белка из внеклеточного пространства. Минимальная обработка может также включать получение сырых экстрактов растворимых белков, так как эти препараты имеют незначительное загрязнение вторичными растительными продуктами. Кроме того, минимальная обработка может включать водную экстракцию растворимого белка из листьев с последующим осаждением при помощи любой подходящей соли. Другие методы могут включать крупномасштабную мацерацию и экстрагирование сока для того, чтобы добиться непосредственного применения экстракта.
[0086] Под терминами "нуклеотидная последовательность (или последовательность нуклеиновой кислоты), представляющая интерес", или "кодирующая область, представляющая интерес", подразумевают любую нуклеотидную последовательность или кодирующую область (эти термины могут быть использованы как взаимозаменяемые), которая должна быть экспрессирована в организме хозяина, например, в растении, для продуцирования белка, представляющего интерес. Такая нуклеотидная последовательность, представляющая интерес, может кодировать, но без ограничения, нативные или модифицированные белки, имеющий промышленное значение фермент или имеющий промышленное значение модифицированный фермент, имеющий сельскохозяйственное значение белок или модифицированный имеющий сельскохозяйственное значение белок, хелперный белок, протеиновую добавку, фармацевтически активный белок, нутрицевтик, продукт с добавленной стоимостью или его фрагмент для использования в качестве корма, пищи или в качестве корма и пищи.
[0087] Белок, представляющий интерес, может экспрессироваться в любом подходящем растении-хозяине, которое трансформируется нуклеотидной последовательностью, или конструкциями, или векторами согласно данному изобретению. Примеры подходящих хозяев включают, но без ограничения, Arabidopsis, сельскохозяйственные культуры, включая, например, канолу, Brassica spp., маис, Nicotiana spp., (тобак), например, Nicotiana benthamiana, альфальфу, картофель, сладкий картофель (Ipomoea batatus), женьшень, горох, овес, рис, соевые бобы, пшеницу, ячмень, подсолнух, хлопок, кукурузу, рис (Secale cereale), сорго {Sorghum bicolor, Sorghum vulgare), сафлор (Carthamus tinctorius).
[0088] Термин "экспрессионная кассета" относиться к нуклеотидной последовательности, содержащей нуклеиновую кислоту, представляющую интерес, находящуюся под контролем и функционально (или оперативно) связанную с соответствующим промотором или другими регуляторными элементами для транскрипции нуклеиновой кислоты, представляющей интерес, в хозяйской клетке, например, клетке растения.
[0089] Под терминами "регуляторная область" "регуляторный элемент" или "промотор" подразумевают часть нуклеиновой кислоты, обычно, но не всегда расположенную в 3'-5' направлении белка, кодирующего область гена, которая может состоять или из ДНК, или РНК, или и из ДНК, и РНК.
[0090] Под термином "оперативно связанные" подразумевают, что конкретные области взаимодействуют или непосредственно, или косвенно для выполнения заданной функции, такой как опосредование или модуляция экспрессии генов. Взаимодействие оперативно связанных последовательностей может быть, например, опосредовано белками, которые взаимодействуют с оперативно связанными последовательностями. Транскрипционная регуляторная область и последовательность, представляющая интерес, функционально связаны таким образом, чтобы обеспечить опосредование или модуляцию транскрипции последовательности, представляющей интерес, при помощи транскрипционной регуляторной области.
[0091] Когда регуляторная область является активной и находится в оперативной связи или функционально связана с геном, представляющим интерес, это может привести к экспрессии гена, представляющего интерес. Регуляторный элемент может быть способным к опосредованию специфичности органа или контролированию эволюционной или временной активации гена. "Регуляторная область" включает элементы промотора, элементы сердцевины промотора, проявляющие активность основного промотора, элементы, которые являются индуцибельными в ответ на внешний раздражитель, элементы, которые опосредуют активность промотора, такие как отрицательные регуляторные элементы или транскрипционные энхансеры. Термин "регуляторная область", используемый в данной заявке, включает также элементы, которые являются активными после транскрипции, например, регуляторные элементы, которые модулируют экспрессию генов, такие как трансляционные и транскрипционные энхансеры, трансляционные и транскрипционные репрессоры, активирующие последовательности против хода транскрипции, и детерминанты нестабильности мРНК. Некоторые из этих последних элементов могут быть расположены проксимально к кодирующей области.
[0092] В контексте данной заявки термин "регуляторный элемент" или "регуляторная область" обычно относится к последовательности ДНК, обычно, но не всегда, в положении против хода транскрипции (5') к кодирующей последовательности структурного гена, который контролирует экспрессию кодирующей области, обеспечивая распознавание РНК-полимеразы и/или других факторов, требующихся для того, чтобы транскрипция началась в конкретном сайте. Однако следует понимать, что другие нуклеотидные последовательности, расположенные внутри интронов, или в положении 3' последовательности, также могут вносить свой вклад в регуляцию экспрессии кодирующей области, представляющей интерес. Примером регуляторного элемента, который обеспечивает распознавание РНК-полимеразы и/или других транскрипционных факторов для обеспечения инициирования в конкретном сайте, является элемент промотора.
[0093] Большая часть, но не все, из элементов эукариотных промоторов содержит TATA-бокс, консервативную нуклеотидную последовательность, состоящую из пар нуклеотидных оснований аденозина и тимидина, обычно расположенных в количестве примерно 25 пар оснований вверх по течению от сайта начала транскрипции. Элемент промотора включает базальный элемент промотора, который отвечает за инициирование транскрипции, а также другие регуляторные элементы (которые перечислены выше), которые модифицируют экспрессию генов.
[0094] Конститутивная регуляторная область осуществляет экспрессию гена через различные части растения непрерывно благодаря развитию растения. Примеры известных конститутивных регуляторных элементов включают промоторы, ассоциированные с транскриптом CaMV 35S. (Odell et al., 1985, Nature, 313: 810-812), актином 1 риса (Zhang et al, 1991, Plant Cell, 3: 1155-1165), актином 2 (An et al., 1996, Plant J., 10: 107-121) или tms 2 (патент США №5428147, этот источник включен в данную заявку посредством отсылки), и генами триозофосфат - изомеразы 1 (Xu et. al., 1994, Plant Physiol. 106: 459-467), геном убиквитина 1 маиса (Comejo et al, 1993, Plant Mol. BioL, 29: 637-646), генами убиквитина 1 и 6 e Arabidopsis (Holtorf et al, 1995, Plant Mol. BioL, 29: 637-646), и геном фактора 4A трансляционной инициации из табака (MandEl et al, 1995, Plant Mol. Biol. 29: 995-1004). Термин "конститутивный", используемый в данной заявке, не необходимо указывает на то, что ген под контролем конститутивной регуляторной области экспрессируется с тем же самым уровнем в клетках всех типов, но что ген экспрессируется в большом количестве клеток, даже хотя часто наблюдается вариация его количества.
[0095] Согласно другому примеру белок, представляющий интерес, может экспрессироваться в экспрессионной системе, которая включает элементы амплификации и/или регуляторные элементы или области (также называемые в данной заявке элементами энхансера). Например, элемент амплификации на основе геминивируса, такой как, например, элемент амплификации на основе вируса желтой карликовости бобов (BeYDV) может быть использован для экспрессии белка, представляющего интерес. BeYDV относится к роду Mastreviruses, адаптированному для двудольных растений. BeYDV является однокомпонентным, имеющим геном, представленный однонитевой кольцевой ДНК и может реплицироваться с образованием очень большого количества копий по механизму "катящегося кольца". Векторные системы репликона ДНК на основе BeYDV были использованы для быстрого получения белов с высокой производительностью в растениях.
[0096] Использованный в данной заявке термин "элемент амплификации" относится к сегменту нуклеиновой кислоты, содержащему по меньшей мере часть одной или более межгенных областей (LIR) генома геминивируса. Использованный в данной заявке термин "длинная межгенная область" относится к участку длинной межгенной области, который содержит повторяющийся сайт связывания, способный к опосредованию эксцизии и репликации при помощи повторяющегося белка геминивируса. Согласно некоторым аспектам сегмент нуклеиновой кислоты, содержащий одну или более LIRs, может также включать короткую межгенную область (SIR) генома геминивируса. Использованный в данной заявке термин "короткая межгенная область" относится к комплементарной нити (короткой IR (SIR) Mastreviruses). Любой подходящий элемент амплификации на основе геминивируса может быть использован в данной заявке. См., например, заявки WO 2000/20557; WO 2010/025285; публикации Zhang X. et al. (2005, Biotechnology and Bioengineering, Vol. 93, 271-279), Huang Z. et al. (2009, Biotechnology and Bioengineering, Vol. 103, 706-714), Huang Z. et al. (2009, Biotechnology and Bioengineering, Vol. 106, 9-17); которые включены в данную заявку посредством отсылки. Если в конструкции используется более, чем одна LIR, например, две LIRs, тогда промотор, области CMPV-HT и последовательность нуклеиновой кислоты, представляющая интерес, и терминатор ограничены каждой из двух LIRs.
[0097] Элементы энхансера могут быть использованы для достижения высокого уровня транзиентной экспрессии белка, представляющего интерес. Элементы энхансера могут быть основаны на РНК вирусов растений, включая комовирусы, такие как вирус мозаики коровьего гороха Cowpea mosaic virus (CPMV; см., например, заявки WO 2007/135480; WO 2009/087391; США 2010/0287670, публикации Sainsbury F. et al., 2008, Plant Physiology; 148: 121-1218; Sainsbury F. et al., 2008, Plant Biotechnology Journal; 6: 82-92; Sainsbury F. et al., 2009, Plant Biotechnology Journal; 7: 682-693; Sainsbury F. et al. 2009, Methods in Molecular Biology, Recombinant Proteins From Plants, vol. 483: 25-39), "CPMV HT+", описанный в заявке США 61/971,274, все из указанных источников включены в данную заявку посредством отсылки, или "CPMVX" (называемый также "CPMV 160")  "CPMVX+" (называемый также "CPMV 160+"), как описано в заявке США 61/925,852, которая включена в данную заявку посредством отсылки.
"CPMVX+" (называемый также "CPMV 160+"), как описано в заявке США 61/925,852, которая включена в данную заявку посредством отсылки.
[0098] Посттранскрипционный сайленсинг гена (PTGS) может быть вовлечен в ограничение экспрессии трансгенов в растениях, и коэкспрессия супрессора сайленсинга на основе Y-вируса картофеля (HcPro) может быть использована для противодействия специфической деградации трансгенных мРНК (публикация Brigneti et al., 1998, EMBO J. 17, 6739-6746, которая включена в данную заявку посредством отсылки). Альтернативные супрессоры сайленсинга хорошо известны из предшествующего уровня техники и могут быть использованы, как описано в данной заявке (публикация Chiba et al., 2006, Virology 346:7-14; которая включена в данную заявку посредством отсылки), например, но без ограничения, это могут быть TEV-p1/HC-Pro (вирус гравировки табака-p1/HC-Pro), BYV-р21, р19 вируса кустистой карликовости томата (TBSV р19; конструкция р19 описана в заявке WO 2010/0003225, которая включена в данную заявку посредством отсылки), капсидный белок вируса курчавости томата (TCV-CP), белок 2b вируса огуречной мозаики; CMV-2b), р25 Х-вируса картофеля (PVX-p25), p11 М-вируса картофеля (PVM-p11), p11 S-вируса картофеля (PVS-p11), р16 вируса ожога голубики, (BScV-р16), р23 вируса тристеца цитрусовых (CTV-p23), р24 вируса-2 скручивания листьев винограда, (GLRaV-2 р24), р10 А-вируса винограда, (GVA-p10), р14 В-вируса винограда (GVB-p14), р10 латентного вируса Heracleum (HLV-p10) или р16 латентного обычного вируса чеснока (GCLV-p16).
[0099] Следовательно, один или более супрессоров сайленсинга, например, но без ограничения, НсРго, TEV -p1/HC-Pro, BYV-p21, TBSV р19, TCV-CP, CMV-2b, PVX-p25, rgscam, В2-белок FHV, малый белок оболочки вируса CPMV и белок оболочки вируса на основе TCV, PVM-p11, PVS-p11, BScV-p16, CTV-p23, GLRaV-2 p24, GBV-p14, HLV-p10, GCLV-p16 или GVA-p10 могут быть коэкспрессированы вместе с экспрессионной кассетой на основе комовируса, элементом амплификации на основе геминивируса и последовательностью нуклеиновой кислоты, кодирующей белок, представляющий интерес, для дальнейшего обеспечения высоких уровней продуцирования белка в растении.
[00100] Конструкции согласно настоящему изобретению могут быть введены в клетки растений с использованием Ti-плазмид, Ri-плазмид, растительных вирусных векторов, прямой трансформации ДНК, микроинъекции, электропорации и т.п. Обзор таких методов можно найти в публикациях, например, Weissbach and Weissbach, Methods for Plant Molecular Biology, Academy Press, New York VIII, pp. 421-463 (1988); Geierson and Corey, Plant Molecular Biology, 2d Ed. (1988); and Miki and Iyer, Fundamentals of Gene Transfer in Plants. In Plant Metabolism, 2d Ed. DT. Dennis, DH Turpin, DD Lefebrve, DB Layzell (eds), Addison Wesly, Langmans Ltd. London, p.p. 561-579 (1997). Другие методы включают прямое поглощение ДНК, использование липосом, электропорацию, например, применение протопластов, микроинъекцию, бомбардировку микрочастицами или вискерсами и вакуумную инфильтрацию. См., например, публикации Bilang, et al. (1991, Gene 100: 247-250), Scheid et al. (1991, Mol. Gen. Genet. 228: 104-112), Guerche et al. (1987, Plant Science 52: 111-116), Neuhause et al. (1987, Theor. Appl Genet. 75: 30-36), Klein et al, (2987, Nature 327: 70-73); Freeman et al. (1984, Plant Cell Physiol. 29: 1353), Howell et al. (1980, Science 208: 1265), Horsch et al. (1985, Science 227: 1229-1231), DeBlock et al., (1989, Plant Physiology 91: 694-701), Methods for Plant Molecular Biology (Weissbach and Weissbach, eds., Academic Press Inc., 1988), Methods in Plant Molecular Biology (Schuler and Zielinski, eds., Academic Press Inc., 1989), WO 92/09696, WO 94/00583, EP 331083, EP 175966, Liu and Lomonossoff (2002, J Virol Meth, 105:343-348), EP 290395; WO 8706614; патенты США №№4,945,050; 5,036,006; and 5,100,792, заявки США на патент 08/438,666, поданную 10 мая 1995 г and 07/951,715, поданную 25 сентября 1992 г (все из которых включены в данную заявку посредством отсылки).
[00101] Для экспрессии конструкций согласно настоящему изобретению могут быть использованы способы транзиентной экспрессии (см. публикации D'Aoust et al., 2009, Methods in molecular biology, Vol 483, pages 41-50; Liu and Lomonossoff, 2002, Journal of Virological Methods, 105:343-348; которые включены в данную заявку посредством отсылки). Альтернативно могут быть использованы способ транзиентной экспрессии с применением вакуума, описанный Kapila et al., (в публикации 1997, Plant Sci. 122, 101-108; которая включена в данную заявку посредством отсылки), или в заявках WO 00/063400, WO 00/037663 (которые включены в данную заявку посредством отсылки). Эти способы могут включать, например, но без ограничения, метод агроинокуляции или агроинфильтрации, инфильтрацию при помощи шприца, однако, как отмечено выше, можно применять и другие транзиентные способы. В случаях агроинокуляции, агроинфильтрации, инфильтрации при помощи шприца смесь Agrobacteria, содержащая желаемую нуклеиновую кислоту, попадает в межклеточные пространства ткани, например, листьев, воздушной части растения (включая стебель, листья и цветы), в другую часть растения (стебель, корень, цветок) или всего растения. После прохождения через эпидермис Agrobacteria инфицируют и передают копии тДНК в клетки. тДНК эписомально транскрибируется, и мРНК транслируется, приводя к продуцированию белка, представляющего интерес, в инфицированных клетках, однако, перенос тДНК внутри ядра является транзиентным.
[00102] Часть данного изобретения составляют также трансгенные растения, растительные клетки или семена, содержащие генную конструкцию согласно настоящему изобретению, которая может быть использована в качестве растительной платформы, подходящей для транзиентной экспрессии белков, описанной в данной заявке. Способы регенерации целых растений из растительных клеток также хорошо известны из предшествующего уровня техники (см., например, Guerineau and Mullineaux (1993, Plant transformation and expression vectors. In: Plant Molecular Biology Labfax (Croy RRD ed) Oxford, BIOS Scientific Publishers, p.p. 121-148). В общем клетки трансформированного растения культивируют в соответствующей среде, которая может содержать селективные агенты, такие как антибиотики, где выбираемые маркеры используются для облегчения идентификации клеток трансформированного растения. Как только образуется каллюс, в соответствии с известными способами может быть ускорено образование побега путем применения соответствующих растительных гормонов, и побеги передаются в среду для укоренения растений для регенерации растений. Затем эти растения могут быть использованы для получения повторяющихся генераций или из семян, или с использованием методов вегетативного размножения. Могут быть также получены трансгенные растения без использования тканевой культуры. Из предшествующего уровня техники специалисту в данной области известны способы стабильной трансформации и регенерации этих организмов. Обзор доступных методик приведен в публикациях Vasil et al., (Cell Culture and Somatic Cell Genetics of Plants, VoI I, Il and III, Laboratory Procedures and Their Applications, Academic Press, 1984) и Weissbach and Weissbach, (Methods for Plant Molecular Biology, Academic Press, 1989). Способ получения трансформированных и регенерированных растений не является критическим для настоящего изобретения.
[00103] Если растения, часть растения или растительная клетка должны быть трансформированы или котрансформированы при помощи двух или более конструкций нуклеиновой кислоты, конструкция нуклеиновой кислоты может быть введена в агробактерии Agrobacterium в процессе одной трансфекции, когда нуклеиновые кислоты собираются в пул, и бактериальные клетки трансфецируются, как описано. Альтернативно, конструкции могут быть введены последовательно. В этом случае первая конструкция вводится в агробактерии Agrobacterium, как описано, клетки растут в селективных условиях (например, в присутствии антибиотика), где может расти только трансформированная однажды бактерия. После этой первой стадии селекции вторая конструкция нуклеиновой кислоты вводится в Agrobacterum, как описано, и клетки растут в дважды выбранных условиях, где может расти только дважды трансформированная бактерия. Дважды трансформированная бактерия затем может быть использована для трансформации растения, части растения или растительной клетки, как описано в данной заявке, или может быть подвергнута последующей стадии трансформации для введения третьей конструкции нуклеиновой кислоты.
[00104] Альтернативно, если растения или часть растения, или растительная клетка должны быть трансформированы или котрансформированы при помощи двух или более конструкций нуклеиновой кислоты, конструкция нуклеиновой кислоты может быть введена в растение путем коинфильтрации смеси клеток агробактерий Agrobacterium с растением, частью растения или растительной клеткой, причем каждая клетка Agrobacterium может содержать одну или более конструкций, которые должны вводиться в растение. Для того, чтобы менять относительные уровни экспрессии нуклеотидной последовательности, представляющей интерес, в конструкте в растении, части растения или в растительной клетке, во время стадии инфильтрации, может меняться концентрация различных популяций Agrobacteria, содержащих желательные конструкции.
[00105] Белок, представляющий интерес, может содержать нативный или ненативный сигнальный пептид; ненативный сигнальный пептид может иметь растительное происхождение. Например, сигнальный пептид может представлять собой сигнальный пептид протеин-дисульфидизомеразы (PDI). Нативный сигнальный пептид может соответствовать нативному сигнальному пептиду белка, представляющего интерес, который экспрессируется. Нуклеотидная последовательность, представляющая интерес, или кодирующая область, представляющая интерес, может также включать нуклеотидную последовательность, которая кодирует фармацевтически активный белок, например, факторы роста, регуляторы роста, антитела, антигены и их фрагменты, или их производные, подходящие для иммунизации или вакцинации и т.п., такие белки включают, но без ограничения, белок, который является человеческим патогеном, вирусный белок, например, но без ограничения, один или более белков респираторно-синцитиального вируса (RSV), ротавируса, вируса гриппа, вируса иммунодефицита человека (HIV), вируса бешенства, вируса папилломы человека (HPV), энтеровируса 71 (EV71) или интерлейкинов, например, одного или более, чем одного из IL-1 - IL-24, IL-26 и IL-27, цитокинов, эритропоэтина (ЕРО), инсулина, G-CSF, GM-CSF, hPG-CSF, M-CSF или их комбинации, интерфероны, например, интерферон-альфа, интерферон-бета, интерферон-гамма, факторы свертывания крови, например, фактор VIII, фактор IX или tPA hGH, рецепторы, агонисты рецепторов, антитела, например, но без ограничения, ритуксан, нейрополипептиды, инсулин, вакцины, факторы роста, например, но без ограничения, эпидермальный фактор роста, фактор роста кератиноцитов, трансформирующий фактор роста, регуляторы роста, антигены, аутоантигены, их фрагменты или их комбинации.
[00106] Белок, представляющий интерес, может также включать гемагглютинин вируса гриппа (НА; см. заявку WO 2009/009876, которая включена в данную заявку посредством отсылки). НА представляет собой гомотримерный гликопротеин мембраны типа I, обычно содержащий сигнальный пептид, домен НА1 и домен НА2, включающий трансмембранный якорный сайт на С-конце и малый цитоплазматический хвост. Нуклеотидные последовательности, кодирующие НА, хорошо известны и доступны (см., например, базу данных BioDefense and Public Health Database (Influenza Research Database; Squires et al., 2008 Nucleic Acids Research 36:D497-D503) at URL: biohealthbase.org/GSearch/home.do?decorator=Influenza; или базы данных, поддерживаемые National Center for Biotechnology Information (Национальным центром биотехнологической информации США) (см. URL: ncbi.nlm.nih.gov), обе базы данных включены в данную заявку посредством отсылки).
[00107] Белок НА может быть белком вируса гриппа типа А, вируса гриппа типа В или подтипа НА вируса гриппа А, выбранным из группы подтипов H1, Н2, Н3, Н4, Н5, Н6, Н7, Н8, Н9, Н10, Н11, Н12, Н13, Н14, Н15 и Н16. Согласно некоторым аспектам данного изобретения НА может быть белком вируса гриппа типа А, выбранным из группы H1, Н2, Н3, Н5, Н6, Н7 и Н9. Фрагменты HAs, перечисленных выше, могут также рассматриваться как белки, представляющие интерес. Кроме того, домены белка НА типа или подтипа, перечисленных выше, могут быть объединены для получения химерного HA's (см., например, заявку WO 2009/076778, которая включена в данную заявку посредством отсылки).
[00108] Примеры подтипов, содержащих белки НА включают A/New Caledonia/20/99 (H1N1), A/Indonesia/5/2006 (H5N1), A/chicken/New York/1995, A/herring gull/DE/677/88 (H2N8), A/Texas/32/2003, A/mallard/MN/33/00, A/duck/Shanghai/1/2000, A/northern pintail/TX/828189/02, A/Turkey/Ontario/6118/68(H8N4), A/shoveler/Iran/G54/03, A/chicken/Germany/N/1949(H10N7),A/duck/England/56(H11N6), A/duck/Alberta/60/76(H12N5), A/Gull/Maryland/704/77(H13N6), A/Mallard/Gurjev/263/82, A/duck/Australia/341/83 (H15N8), A/black-headed gull/Sweden/5/99(H16N3), B/Lee/40, C/Johannesburg/66, A/PuertoRico/8/34 (H1N1), A/Brisbane/59/2007 (H1N1), A/Solomon Islands 3/2006 (H1N1), A/Brisbane 10/2007 (H3N2), A/Wisconsin/67/2005 (H3N2), B/Malaysia/2506/2004, B/Florida/4/2006, A/Singapore/1/57 (H2N2), A/Anhui/1/2005 (H5N1), A/Vietnam/1194/2004 (H5N1), A/Teal/HongKong/W312/97 (H6N1), A/Equine/Prague/56 (H7N7), A/HongKong/1073/99 (H9N2)).
[00109] Белок НА может быть подтипом H1, H2, Н3, Н5, Н6, Н7 или Н9. Например, белок HI может быть белком вирусов гриппа штаммов A/New Caledonia/20/99 (H1N1), A/PuertoRico/8/34 (H1N1), A/Brisbane/59/2007 (H1N1), A/Solomon Islands 3/2006 (H1N1), A/California/04/2009 (H1N1) or A/California/07/2009 (H1N1). Белок Н3 может также быть белком вирусов гриппа штаммов A/Brisbane 10/2007 (H3N2), A/Wisconsin/67/2005 (H3N2), A/Victoria/361/2011 (H3N2), A/Texas/50/2012 (H3N2), A/Hawaii/22/2012 (H3N2), A/New York/39/2012 (H3N2) или A/Perth/16/2009 (H3N2). Согласно другому аспекту данного изобретения белок Н2 может быть белком вируса штамма A/Singapore/1/57 (H2N2). Белок Н5 может белком вируса штамма A/Anhui/1/2005 (H5N1), A/Vietnam/1194/2004 (H5N1) или A/Indonesia/5/2005. Согласно одному из аспектов данного изобретения белок Н6 может быть белком вируса штамма A/Teal/HongKong/W312/97 (H6N1). Белок Н7 может быть белком вируса штаммов A/Equine/Prague/56 (H7N7) или Н7 A/Hangzhou/1/2013, A/Anhui/1/2013 (H7N9), или A/Shanghai/2/2013 (H7N9). Согласно одному из аспектов данного изобретения белок Н9 может быть белком вируса штамма A/HongKong/1073/99 (H9N2). Согласно другому аспекту данного изобретения НА может быть белком вируса гриппа типа В, включая B/Malaysia/2506/2004, B/Florida/4/2006, B/Brisbane/60/08, B/Massachusetts/2/2012 -подобный вирус (линия Yamagata), или B/Wisconsin/1/2010 (линия Yamagata). Неограничивающие примеры аминокислотных последовательностей белков НА подтипов H1, Н2, Н3, Н5, Н6, Н7, Н9 или типа В включают последовательности, описанные в заявках WO 2009/009876, WO 2009/076778, WO 2010/003225 (которые включены в данную заявку посредством отсылки). Белок НА вируса гриппа может быть подтипом Н5 Indonesia.
[00110] НА может включать нативный или ненативный сигнальный пептид, ненативный сигнальный пептид может иметь растительное происхождение. Например, the сигнальный пептид может быть сигнальным пептидом протеин-дисульфидизомеразы (PDI). Нативный сигнальный пептид может соответствовать нативному сигнальному пептиду гемагглютинина, который экспрессируется или может соответствовать второму гемагглютинину.
[00111] Настоящее изобретение предусматривает также молекулы нуклеиновой кислоты, содержащие последовательности, кодирующие белок НА. Молекулы нуклеиновой кислоты могут также содержать одну или более регуляторных областей, функционально связанных с последовательностью, кодирующей белок НА. Молекулы нуклеиновой кислоты могут содержать последовательность, кодирующую белки H1, Н2, Н3, Н4, Н5, Н6, Н7, Н8, Н9, Н10, Н11, Н12, Н13, Н14, Н15, Н16 или НА вируса гриппа типа В. Например, белок НА, кодируемый молекулой нуклеиновой кислоты, может быть белком вирусов подтипа H1, Н2, Н3, Н5, Н6, Н7, Н9 типа В. Белок H1, кодируемый нуклеиновой килотой, может быть белком вирусов штамма A/New Caledonia/20/99 (H1N1), A/PuertoRico/8/34 (H1N1), A/Brisbane/59/2007 (H1N1), A/Solomon Islands 3/2006 (H1N1), A/California/04/2009 (H1N1) или A/California/07/2009 (H1N1). Белок Н3, кодируемый нуклеиновой кислотой, может быть белком вирусов штамма A/Brisbane 10/2007 (H3N2), A/Wisconsin/67/2005 (H3N2), A/Victoria/361/2011 (H3N2), A/Texas/50/2012 (H3N2), A/Hawaii/22/2012 (H3N2), A/New York/39/2012 (H3N2), или A/Perth/16/2009 (H3N2). Белок H2, кодируемый нуклеиновой кислотой, может быть белком вирусов штамма A/Singapore/1/57 (H2N2). Белок Н5, кодируемый нуклеиновой кислотой, может быть белком вирусов штамма A/Anhui/1/2005 (H5N1), A/Vietnam/1194/2004 (H5N1) или A/Indonesia/5/2005. Белок Н6, кодируемый нуклеиновой кислотой, может быть белком вирусов штамма A/Teal/HongKong/W312/97 (H6N1). Белок Н7, кодируемый нуклеиновой кислотой, может быть белком вирусов штамма A/Equine/Prague/56 (H7N7) или Н7 A/Hangzhou/1/2013, A/Anhui/1/2013 (H7N9), или A/Shanghai/2/2013 (H7N9). Дополнительно, белок Н9, кодируемый нуклеиновой кислотой, может быть белком вирусов штамма A/HongKong/1073/99 (H9N2). Белок НА, кодируемый нуклеиновой кислотой, может быть белком вируса гриппа типа В, включая B/Malaysia/2506/2004, B/Florida/4/2006, B/Brisbane/60/08, B/Massachusetts/2/2012-подобный вирус (линия Yamagata), или B/Wisconsin/1/2010 (линия Yamagata). Неограничивающие примеры аминокислотных последовательностей белков НА подтипов H1, Н2, Н3, Н5, Н6, Н7, Н9 или В включают последовательности, описанные в заявках WO 2009/009876, WO 2009/076778, WO 2010/003225 (которые включены в данную заявку посредством отсылки). Белок НА вируса гриппа может быть белком вируса подтипа Н5 Indonesia.
[00112] Растительный материал в виде растительного материала или ткани может быть доставлен субъекту перорально. Растительный материал может быть введен как часть диетической добавки, вместе с другой пищей или в инкапсулированном виде. Растительный материал или ткань могут быть сконцентрированы для улучшения или увеличения съедобности, или быть вместе с другими материалами, ингредиентами или фармацевтическими эксципиентами, как это требуется.
[00113] Предполагается, что растение, содержащее белок, представляющий интерес, может быть введено субъекту, например, животному или человеку, различными путями в зависимости от необходимости и ситуации. Например, белок, представляющий интерес, полученный из растения, может быть экстрагирован перед его использованием или в сырой, или в частично очищенной, или в очищенной форме. Если белок должен быть очищен, тогда его можно продуцировать или в съедобных, или в несъедобных растениях. Кроме того, если белок вводится перорально, растительная ткань может быть собрана и непосредственно в виде пищи введена субъекту, или собранная ткань может быть высушена до применения для питания, или животному позволяют жевать это растение прежде, чем оно будет собрано. В рамках настоящего изобретения предусматриваются также собранные растительные ткани в качестве пищевой добавки в корме для животных. Если растительная ткань скармливается животному после дальнейшей небольшой переработки или без переработки, предпочтительно, чтобы вводимая растительная ткань была съедобной.
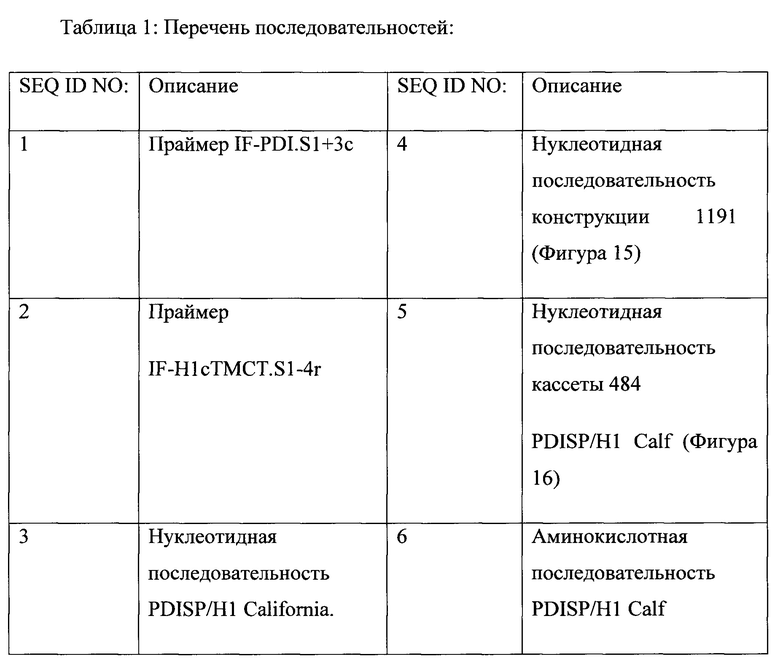
Примеры
[00114] Пример 1: А-2X35S/CPMV-HT/PDISP/H1 California/ NOS (конструкция номер 484)
[00115] Последовательность, кодирующая HI вируса гриппа A/California/7/2009, в которой нативный сигнальный пептид был заменен нативным сигнальным пептидом альфа-протеин-дисульфидизомеразы (PDISP/H1 California), клонировали в экспрессионную кассету 2X35S-CPMV-HT-NOS, используя следующий метод на основе ПЦР. Фрагмент, содержащий кодирующую последовательность PDISP/H1 California, амплифицировали, используя праймеры IF-PDI.S1+3с (Фигура 12А, SEQ ID NO: 1) и IF-H1cTMCT.S1-4r (Фигура 12В, SEQ ID NO: 2) и последовательность PDISP/H1 California (Фигура 13, SEQ ID NO: 3) в качестве темплата. Продукт ПЦР клонировали в экспрессионную систему 2X35S/CPMV-HT/NOS, используя систему клонирования In-Fusion (Clontech, Mountain View, CA). Конструкцию номер 1191 (Фигура 14) расщепляли рестрикционными ферментами SacII и StuI и линеаризованную плазмиду использовали для реакции сборки In-Fusion. Конструкция номер 1191 является плазмидным акцептором, предназначенным для "In Fusion" клонирования генов, представляющих интерес, в экспрессионную кассету на основе CPMV-HT. Она также обеспечивает генетическую конструкцию для коэкспрессии супрессора сайленсинга TBSV PI9 в присутствии промотора гена альфальфа-пластоцианина и терминатора. Остовом является бинарная плазмида pCAMBIA и последовательность от левой до правой границ тДНК представлена на Фигуре 15 (SEQ ID NO: 4). Полученная конструкция получила номер 484 (Фигура 16, SEQ ID NO: 5). Аминокислотная последовательность зрелого H1 вируса гриппа Influenza A/California/7/2009, слитая с PDISP, представлена на Фигуре 17 (SEQ ID NO: 6). Плазмида 484 представлена на Фигуре 18.
[00116] Пример 2: Трансфекция агробактерий
[00117] Штамм агробактерий AGL1 трансфецировали путем электропорации с помощью ДНК конструкций с использованием способов, описанных в публикации D'Aoust et al., 2008 (Plant Biotechnology Journal 6:930-940). Трансфецированные агробактерии выращивали в среде YEB, дополненной 10 мМ 2-(N-морфолин)этансульфоновой кислоты (MES), 20 мкМ ацетосирингона, 50 мкг/мл канамицина и 25 мкг/мл карбенициллина, рН 5.6, до достижения величины OD600 между 0.6 и 1.6. Перед использованием суспензии агробактерий центрифугировали и ресуспендировали в среде для инфильтрации (10 мМ MgCl2 и 10 мМ MES, рН 5.6).
[00118] Приготовление биомассы растений, инокулюма и агроинфильтрация
[00119] Растения Nicotiana benthamiana (табак Бентхама) выращивали из семян в плашках с плоским дном, заполненных коммерческим мхом сфагнум в качестве субстрата. Растениям давали расти в теплице при фотопериоде 16/8 и при температуре 28°С днем/24°С ночью. Через три недели после посева отбирали отдельные сеянцы, пересаживали их в горшочки и оставляли расти в теплице еще на 3 недели в тех же условиях окружающей среды.
[00120] Агробактерии, трансфецированные с помощью каждой конструкции, выращивали в среде YEB, дополненной 10 мМ 2-(N-морфолин)этансульфоновой кислоты (MES), 20 мкм ацетосирингона, 50 мкг/мл канамицина и 25 мкг/мл карбенициллина, рН 5.6, до достижения величины OD600 между 0.6 и 1.6. Перед использованием суспензии агробактерий центрифугировали, ресуспендировали в среде для инфильтрации (10 мМ MgCl2 и 10 мМ MES, рН 5.6) и хранили в течение ночи при 4°С. В день инфильтрации порции культуры разбавляли в 2.5 раза и давали нагреться перед использованием. Целые растения N. benthamiana помещали в перевернутом положении в бактериальную суспензию в воздухонепроницаемый контейнер из нержавеющей стали под вакуумом 20-40 торр на 2 мин. Инфильтрованные растения помещали в камеру для роста PGR15 СМР 5090 Conviron (Conviron, Winnipeg MB, Canada) на 6-7 дневную инкубацию до момента сбора
[00121] Пример 3: Аналитические методы
[00122] Белки листьев экстрагировали из первичных листьев P1, Р2, P3 и их черешков и вторичных листьев S1, S2, S3 и их черешков, показанных на Фигуре 7. Собранные листья взвешивали для определения образования биомассы в ткани свежих листьев. Белки листьев экстрагировали в 50 мМ Tris-HCl, рН 8.0, содержащего 500 мМ NaCl, 1 мМ PMSF и 0.04% (вес/об) метабисульфита натрия (буфер для экстракции), используя для разрушения растительной ткани гомогенизатор Omni bead Ruptor 24 и циркониевые гранулы размером 2.8 мм (OMNI International, Kennesaw GA, U.S.A.). Собранные ткани листьев замораживали при - 80°С и измельчали в жидком азоте, разбавляли буфером для экстракции (1.5 г порошка свежих листьев в 3 мл буфера для экстракции, содержащего 10 циркониевых гранул), и гомогенизировали в гомогенизаторе Omni bead Ruptor в соответствии с инструкциями производителя. Один миллилитр смеси помещали в микротрубку объемом 1.5 мл, центрифугировали при 20,000 г в течение 10 мин при температуре 4°С и выделяли супернатант для дальнейшего анализа. Содержание белка в супернатанте определяли в соответствии с методом Брэдфорда (Bradford М. М. (1976) Analytical Biochemistry 72, 248-254), применяя бычью сыворотку в качестве стандартного белка. До анализа гемагглютинина образцы выдерживали на льду или замораживали при -80°С.
[00123] Анализ гемагглютинина был основан на способе, описанном Nayak and Reichl (2004). Вкратце, этот способ включает серийные двойные разведения испытуемых образцов (100 мкл) в 96-луночных микропланшетах с V-образным дном, содержащих 100 мкл PBS, в каждую лунку вносили 100 мкл разведенного образца. В каждую лунку добавляли 100 мкл 0.25% суспензии красных кровяных телец индейки (Bio Link Inc., Syracuse, NY; для всех штаммов вируса типа В, подтипов H1, Н5 и Н7) или or 0.5% суспензию красных кровяных телец морской свинки (для Н3), и планшеты инкубировали в течение 2 ч при комнатной температуре. Величину, обратную самому большому разведению, показывающую полную гемагглютинацию, регистрировали как активность НА.
[00124] РНК листьев экстрагировали из первичных листьев P1, Р2, P3 и их черешков и вторичных листьев S1, S2, S3 и их черешков, показанных на Фигуре 7. МРНК-транскрипты кодирующей последовательности НА анализировали методом ПЦР в режиме реального времени, RT PCR, используя прибор ABI PRISM 7500 Fast real-time PCR, версию системы 2.0.1 (Applied Biosystems). Общая РНК была экстрагирована, как описано ранее Robert et al. (PLoS One, 8: e70203), с использованием мининабора Qiagen RNeasy plant mini kit (Qiagen) в соответствии с инструкциями производителя. Образцы РНК обрабатывали DNase I (Roche Diagnostics) для удаления загрязняющей ДНК и определяли ее качество и количество, используя спектрофотометр Nanodrop® ND-1000 (NanoDrop Technologies, Wilmington DE, USA). кДНК с первой нитью была синтезирована из 500 нг общей РНК с использованием 4 единиц обратной транскриптазы Omniscript (Qiagen) и 1 мкМ of олиго-dТ(15)нуклеотидов (Roche). ПЦР-смеси содержали 10 мкл смеси Fast SYBR Green PCR Master Mix (Applied Biosystems), 2 мкл темплата кДНК и 2.5 мкл каждого из соответствующих прямого и обратного праймеров в конечной концентрации 625 нМ. Контрольную смесь без темплата помещали в каждую лунку 96-луночного планшета. Раунды амплификации состояли из стадии денатурации в течение 20 с при температуре 95°С с последующими двухстадийными циклами в течение 3 с при 95°С и 30 с при 60°С. Анализ кривой диссоциации проводили после амплификации со смесью SYBR Green Master Mix, и пороговый цикл для каждого образца сравнивали затем со стандартной кривой ДНК, построенной для каждой пары праймеров. Стандартные кривые были получены с 2 мкл темплата кДНК после осуществления обычного протокола NEB Taq polymerase routine protocol (New England Biolabs). Продукты амплификации очищали, используя набор Illustra GFX kit (GE Healthcare), и стандартные кривые для ДНК получали с серийными разведениями очищенных продуктов ПЦР в воде, не содержащей нуклеазы, (от 107 до 102 копий на мкл). Данные Ct откладывали в зависимости от соответствующего количества копий транскрипта. Все циклы амплификации проводили в двух повторностях.
[00125] Пример 4: Анализы освещения
[00126] Для продукции биомассы использовали до агроинфильтрации различные режимы освещения, со стандартными условиями в камере для роста (как указано в Примере 2 выше) для сравнения. Сеянцы в возрасте 3 нед пересаживали в горшочки, как описано в Примере 2, выше, и оставляли для получения биомассы на три недели в теплице (Фигуры 1-4) или в камерах для роста Conviron PGW36 3224 (Фигуры 5 и 6). Затем проводили агроинфильтрацию растений при помощи штамма Agrobacterium, трансформированного конструкцией 484 для экспрессии H1 вируса гриппа Influenza A/California/7/2009 (НА; Пример 1), оставляли для экспрессии белка, представляющего интерес (НА), на 6-7 дн и определяли биомассу и продукцию НА, как описано в Примерах 2 и 3. Световая обработка в теплице и в камере для роста производилась при помощи разных приборов для освещения, включая натриевые лампы высокого давления (HPS) (Philips) мощностью 1,000 Вт, металлогалоидные лампы (МН) мощностью 1,000 Вт (Sylvania) и светодиодные лампы GreenPower LED lamps (Phillips)
[00127] В теплице применяли следующие режимы освещения:
(1) фотопериод 16 ч днем/8 ч ночью, интенсивность освещенности 80 мкмол/м2⋅с;
(2) фотопериод 16 ч днем/8 ч ночью, интенсивность освещенности 160 мкмол/м2⋅с;
(3) фотопериод 24 ч в сутки, интенсивность освещенности 80 мкмол/м2⋅с;
(4) фотопериод 24 ч в сутки, интенсивность освещенности 160 мкмол/м2⋅с;
[00128] В камерах для роста применяли следующие режимы освещения:
(1) фотопериод 24 ч в сутки, интенсивность освещенности 175 мкмол/м2⋅с; (низкая интенсивность освещенности - контроль);
(2) фотопериод 24 ч в сутки, интенсивность освещенности 350 мкмол/м2⋅с; (высокая интенсивность освещенности).
[00129] Результаты опытов показаны на Фигурах 1-6.
[00130] При проведении опытов в теплице (Фигуры 1-4) с увеличением интенсивности освещенности (от 80 до 160 мкмол/м2⋅с) наблюдалось соответствующее увеличение общей биомассы листьев для растений, для которых применяли фотопериод 16 ч или 24 ч (Фигура 1). Кроме того, отношение вторичной биомассы листьев к первичной биомассе листьев увеличивалось при увеличении продолжительности фотопериода и с увеличением интенсивности освещенности, отношение вторичной биомассы листьев к первичной биомассе листьев (S/P): отношение S/P 0.27:1 составляло в условиях обработки 16 ч - 80; отношение S/P составляло 0.39:1 при условиях обработки: 16 ч - 160; отношение S/P составляло 0.44:1 при условиях обработки: 24 ч - 80, и отношение S/P составляло 0.53:1 при условиях обработки: 24 ч - 160, что показывает увеличение содержания вторичной биомассы листьев, полученное после этих применения двух режимов освещения (увеличения интенсивности освещенности и увеличения продолжительности фотопериода).
[00131] Выход белка, представляющего интерес (НА), во вторичной биомассе листьев также повышается как результат использования интенсивности освещенности и указанного фотопериода (Фигуры 2, 3 и 4). Кроме того, отношение выхода белка НА, полученного из вторичной биомассы листьев, к выходу белка из первичной биомассы листьев (НА отношение S/P), увеличивалось, начиная от НА отношения S/P 0.33:1 при освещении при условиях: 16 ч - 80, до НА отношения S/P 0.35:1 при освещении при условиях: 16 ч - 160, отношения НА S/P 0.62:1 при освещении при условиях: 24 ч - 80, и НА отношения S/P 0.89:1 при освещении при условиях: 24 ч - 160, что показывает повышение выхода белка, представляющего интерес, во вторичной биомассе листьев, получаемое в результате этих двух циклов освещения (увеличения интенсивности освещенности и увеличения продолжительности фотопериода). Выход белка, представляющего интерес, из общей биомассы листьев (первичной и вторичной) повышался с увеличением интенсивности освещенности и увеличением продолжительности фотопериода (Фигуры 3 и 4).
[00132] Похожие результаты были получены при выращивании растений в камере для роста (Фигуры 5 и 6, и Таблица 2). Как показано на Фигуре 5, с увеличением интенсивности освещенности наблюдается соответствующее увеличение общей биомассы листьев. Наблюдалось также повышение выхода НА из вторичной биомассы листьев при сравнении с выходом НА из первичной биомассы листьев (Фигура 6). Это было связано с большим количеством мРНК - транскриптов для биосинтеза НА в самых старых вторичных листьях (S3) по сравнению с соответствующим количеством в самых старых первичных листьях (Р3) (Таблица 2).
[00133] Все эти данные демонстрируют, что путем увеличения роста вторичной биомассы листьев перед стадией инфильтрации и сбора приводит к увеличению содержания вторичной биомассы листьев наряду с повышением скорости биосинтеза и выхода белка, представляющего интерес. Следует понимать, что белок, представляющий интерес, может быть получен из вторичной биомассы листьев, первичной биомассы листьев или и из вторичной биомассы листьев и первичной биомассы листьев.
[00134]

[00135] Пример 5: Физическое прищипывание после трансплантации сеянцев
[00136] Относительная важность вторичных побегов по сравнению с общей собранной биомассой была показана при удалении верхушечной почки (основного стебля) 40 (см. 'А' на Фигуре 7) через 5, 7 или 12 дн после трансплантации сеянцев, что соответствовало, соответственно, 16, 14 или 9 дн до инфильтрации. Сеянцы в возрасте трех недель переносили в горшочки, оставляли для продуцирования биомассы на одну неделю в теплице и удаляли верхушку для получения прищипанных растений. Прищипанные растения оставляли в теплице еще на 16, 14 или 9 дн. Затем проводили агроинфильтрацию прищипанных растений при помощи штамма Agrobacterium, трансформированного конструкцией 484 для экспрессии H1 вируса гриппа A/California/7/2009 (НА; Пример 1)), как описано в Примере 2, и помещали растения в камеру PGR15 СМР 5090 Conviron (в условиях, указанных в Примере 2), и оставляли там на 6-7 дн. Через этот промежуток времени у прищипанных растений определяли биомассу, как писано в Примере 3. Через этот промежуток времени у прищипанных растений определяли биомассу и получение НА, как описано в Примере 3. Для проведения этого опыта применяли следующие условия: фотопериод 24 ч в сутки/0 ч ночью, интенсивность освещенности составляла 160 мкмол/м2⋅с, использовали лампы HPS (Philips) и МН (Sylvania), температурный режим был: 28°С днем/24°С ночью и плотность полога растений составляла 33 растения/м2.
[00137] Результаты прищипывания верхушечной почки перед трансформацией растительной биомассы показаны в Таблице 3 и на Фигуре 8. Прищипывание не изменило содержания общей биомассы листьев (то есть, объединенных первичной и вторичной биомассы листьев), за исключением раннего прищипывания через 5 дн после трансплантации, что значительно повлияло на рост растений (Фигура 8). В результате прищипывания количество биомассы листьев сдвинулось в сторону вторичной биомассы листьев (см. на Фигуре 8 количество биомассы, собранной после инкубации НА). Например, количество вторичной биомассы листьев, определенное перед инфильтрацией, увеличилось с 10.4 г в контрольных растениях (не прищипанных) до 23.0 г в прищипанных растениях, в то время как количество первичной биомассы листьев снизилось от 26.3 г (контроль) до 14.5 г (прищипанные растения), причем отношение вторичной биомассы листьев к первичной биомассе листьев возросло от 0.4:1 до 1.6:1.
[00138] Эти данные совместно демонстрируют, что механическое прищипывание после трансплантации сеянцев представляет собой способ увеличения сравнительной важности вторичной биомассы листьев в целых растениях перед инфильтрацией для увеличенного продуцирования белка, представляющего интерес. Следует понимать, что белок, представляющий интерес, может быть получен из вторичной биомассы листьев, первичной биомассы листьев или и из вторичной биомассы листьев, и из первичной биомассы листьев.
[00139]
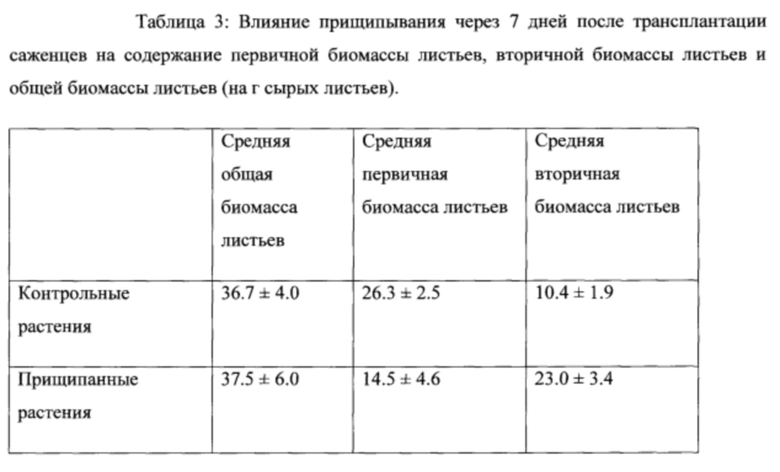
[00140] Пример 6: Химическая обработка синтетическим гормоном бензиламинопурином (ВАР) после трансплантации сеянцев
[00141] Относительное значение вторичных побегов по отношению к общей собранной биомассе было увеличено путем обработки растений синтетическим гормоном растений бензиламинопурином (ВАР) через 7 или 12 дн после трансплантации сеянцев, то есть, за 14 или 9 дн до инфильтрации для экспрессии НА. Сеянцы в возрасте трех недель пересаживали в горшочки, оставляли для получения биомассы на 7 или 12 дн в теплице и обрабатывали через 7 и/или 12 дн синтетическим гормоном в "рабочих" дозах в воде равных 100 част./млн, 500 част./млн или 1,000 част./млн Обработанные растения оставляли в теплице еще на 14 или 9 дн, затем осуществляли агрофильтрацию посредством штамма Agrobacterium, трансформированного конструкцией 484 для экспрессии вируса гриппа подтипа H1 A/California/7/2009 (НА; Пример 1)), как описано в Примере 2, помещали в камеру PGR15 СМР 5090 Conviron (в условиях, указанных в Примере 2), и оставляли там на 6-7 дн. Через этот промежуток времени у прищипанных растений определяли биомассу и получение НА, как описано в Примере 3. Для проведения этого опыта применяли следующие условия: фотопериод 24 ч в сутки/0 ч ночью, интенсивность освещенности составляла 160 мкмол/м2⋅с, использовали лампы HPS (Philips) и МН (Sylvania), температурный режим был: 28°С днем/24°С ночью и плотность полога растений составляла 33 растения/м2.
[00142] Результаты влияния обработки растения ВАР перед трансплантацией растений на содержание биомассы растений и выход НА показаны на фигурах 9, 10 и 11. Обработка при помощи ВАР оказывала небольшое влияние на количество первичной биомассы, но оказало значительный положительный эффект на продукцию вторичной биомассы, за исключением обработки в дозе 1,000 част./млн, которая не оказала положительного влияния (Фигура 9). Например, около 22 г вторичной биомассы листьев было собрано у растений, обработанных 500 част./млн, через 7 дн после трансплантации по сравнению с примерно 16 г у контрольных (необработанных) растений, что составило относительное увеличение примерно на 37.5% по сравнению с увеличением первичной биомассы менее, чем на 10%.
[00143] Повышенное содержание вторичной биомассы в растениях, обработанных ВАР, было связано с общим консолидированным увеличением продуцирования НА на г свежих растений (Фигура 10) и соответствующим увеличением общего выхода НА на растение (Фигура 11). Например, выход НА на г свежего растения в контрольных (необработанных) растениях был меньше 200,000 единиц по сравнению с более, чем 300,000 единицами на г свежего растения в растениях, обработанных ВАР в дозе 500 част./млн черезг 7 и 12 дн (Фигура 10), причем общий выход на растение увеличился на 45-50%.
[00144] Эти данные совместно показывают эффективность обработки синтетическим цитокинином ВАР после трансплантации сеянцев для увеличения сравнительной важности содержания вторичной биомассы листьев в целом растении до инфильтрации и для увеличения продуцирования белка, представляющего интерес, после инфильтрации. Следует иметь в виду, что белок, представляющий интерес, может быть получен из вторичной биомассы листьев, первичной биомассы листьев или и из вторичной биомассы листьев, и из первичной биомассы листьев.
[00145] Все указанные ссылки включены в данную заявку посредством отсылки.
[00146] Настоящее изобретение было описано на примере одного или более вариантов. Однако специалисту в данной области является очевидным, что может быть сделан ряд вариаций и модификаций, без выхода за рамки данного изобретения, объем которого определяется формулой изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Мишо, Доминик
Д’АУ, Марк-Андре
Мартел, Мишель
Пепин, Стив
Этьер, Жильбер
Бехтольд, Николь
Гуле, Мари-Клэр
Гагнэ, Мариэлль
Годро, Линда
Госселин, Андрэ
<120> МОДИФИКАЦИЯ ПРОДУЦИРОВАНИЯ БЕЛКОВ В РАСТЕНИЯХ
<130> V87783wo
<150> US 62/023,718
<151> 2014-07-11
<160> 6
<170> PatentIn version 3.5
<210> 1
<211> 48
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer IF-PDI.S1+3c
<400> 1
aaatttgtcg ggcccatggc gaaaaacgtt gcgattttcg gcttattg 48
<210> 2
<211> 46
<212> DNA
<213> Artificial Sequence
<220>
<223> Primer IF-H1cTMCT.S1-4r
<400> 2
actaaagaaa ataggccttt aaatacatat tctacactgt agagac 46
<210> 3
<211> 1722
<212> DNA
<213> Artificial Sequence
<220>
<223> PDISP/H1 California
<400> 3
atggcgaaaa acgttgcgat tttcggctta ttgttttctc ttcttgtgtt ggttccttct 60
cagatcttcg ctgacacatt atgtataggt tatcatgcga acaattcaac agacactgta 120
gacacagtac tagaaaagaa tgtaacagta acacactctg ttaaccttct agaagacaag 180
cataacggga aactatgcaa actaagaggg gtagccccat tgcatttggg taaatgtaac 240
attgctggct ggatcctggg aaatccagag tgtgaatcac tctccacagc aagctcatgg 300
tcctacattg tggaaacacc tagttcagac aatggaacgt gttacccagg agatttcatc 360
gattatgagg agctaagaga gcaattgagc tcagtgtcat catttgaaag gtttgagata 420
ttccccaaga caagttcatg gcccaatcat gactcgaaca aaggtgtaac ggcagcatgt 480
cctcatgctg gagcaaaaag cttctacaaa aatttaatat ggctagttaa aaaaggaaat 540
tcatacccaa agctcagcaa atcctacatt aatgataaag ggaaagaagt cctcgtgcta 600
tggggcattc accatccatc tactagtgct gaccaacaaa gtctctatca gaatgcagat 660
gcatatgttt ttgtggggtc atcaagatac agcaagaagt tcaagccgga aatagcaata 720
agacccaaag tgagggatca agaagggaga atgaactatt actggacact agtagagccg 780
ggagacaaaa taacattcga agcaactgga aatctagtgg taccgagata tgcattcgca 840
atggaaagaa atgctggatc tggtattatc atttcagata caccagtcca cgattgcaat 900
acaacttgtc aaacacccaa gggtgctata aacaccagcc tcccatttca gaatatacat 960
ccgatcacaa ttggaaaatg tccaaaatat gtaaaaagca caaaattgag actggccaca 1020
ggattgagga atatcccgtc tattcaatct agaggactat ttggggccat tgccggtttc 1080
attgaagggg ggtggacagg gatggtagat ggatggtacg gttatcacca tcaaaatgag 1140
caggggtcag gatatgcagc cgacctgaag agcacacaga atgccattga cgagattact 1200
aacaaagtaa attctgttat tgaaaagatg aatacacagt tcacagcagt aggtaaagag 1260
ttcaaccacc tggaaaaaag aatagagaat ttaaataaaa aagttgatga tggtttcctg 1320
gacatttgga cttacaatgc cgaactgttg gttctattgg aaaatgaaag aactttggac 1380
taccacgatt caaatgtgaa gaacttatat gaaaaggtaa gaagccagct aaaaaacaat 1440
gccaaggaaa ttggaaacgg ctgctttgaa ttttaccaca aatgcgataa cacgtgcatg 1500
gaaagtgtca aaaatgggac ttatgactac ccaaaatact cagaggaagc aaaattaaac 1560
agagaagaaa tagatggggt aaagctggaa tcaacaagga tttaccagat tttggcgatc 1620
tattcaactg tcgccagttc attggtactg gtagtctccc tgggggcaat cagtttctgg 1680
atgtgctcta atgggtctct acagtgtaga atatgtattt aa 1722
<210> 4
<211> 4903
<212> DNA
<213> Artificial Sequence
<220>
<223> Construct 1191 2X35S/CPMV-HT/NOS
<400> 4
tggcaggata tattgtggtg taaacaaatt gacgcttaga caacttaata acacattgcg 60
gacgttttta atgtactgaa ttaacgccga atcccgggct ggtatattta tatgttgtca 120
aataactcaa aaaccataaa agtttaagtt agcaagtgtg tacattttta cttgaacaaa 180
aatattcacc tactactgtt ataaatcatt attaaacatt agagtaaaga aatatggatg 240
ataagaacaa gagtagtgat attttgacaa caattttgtt gcaacatttg agaaaatttt 300
gttgttctct cttttcattg gtcaaaaaca atagagagag aaaaaggaag agggagaata 360
aaaacataat gtgagtatga gagagaaagt tgtacaaaag ttgtaccaaa atagttgtac 420
aaatatcatt gaggaatttg acaaaagcta cacaaataag ggttaattgc tgtaaataaa 480
taaggatgac gcattagaga gatgtaccat tagagaattt ttggcaagtc attaaaaaga 540
aagaataaat tatttttaaa attaaaagtt gagtcatttg attaaacatg tgattattta 600
atgaattgat gaaagagttg gattaaagtt gtattagtaa ttagaatttg gtgtcaaatt 660
taatttgaca tttgatcttt tcctatatat tgccccatag agtcagttaa ctcattttta 720
tatttcatag atcaaataag agaaataacg gtatattaat ccctccaaaa aaaaaaaacg 780
gtatatttac taaaaaatct aagccacgta ggaggataac aggatccccg taggaggata 840
acatccaatc caaccaatca caacaatcct gatgagataa cccactttaa gcccacgcat 900
ctgtggcaca tctacattat ctaaatcaca cattcttcca cacatctgag ccacacaaaa 960
accaatccac atctttatca cccattctat aaaaaatcac actttgtgag tctacacttt 1020
gattcccttc aaacacatac aaagagaaga gactaattaa ttaattaatc atcttgagag 1080
aaaatggaac gagctataca aggaaacgac gctagggaac aagctaacag tgaacgttgg 1140
gatggaggat caggaggtac cacttctccc ttcaaacttc ctgacgaaag tccgagttgg 1200
actgagtggc ggctacataa cgatgagacg aattcgaatc aagataatcc ccttggtttc 1260
aaggaaagct ggggtttcgg gaaagttgta tttaagagat atctcagata cgacaggacg 1320
gaagcttcac tgcacagagt ccttggatct tggacgggag attcggttaa ctatgcagca 1380
tctcgatttt tcggtttcga ccagatcgga tgtacctata gtattcggtt tcgaggagtt 1440
agtatcaccg tttctggagg gtcgcgaact cttcagcatc tctgtgagat ggcaattcgg 1500
tctaagcaag aactgctaca gcttgcccca atcgaagtgg aaagtaatgt atcaagagga 1560
tgccctgaag gtactcaaac cttcgaaaaa gaaagcgagt aagttaaaat gcttcttcgt 1620
ctcctattta taatatggtt tgttattgtt aattttgttc ttgtagaaga gcttaattaa 1680
tcgttgttgt tatgaaatac tatttgtatg agatgaactg gtgtaatgta attcatttac 1740
ataagtggag tcagaatcag aatgtttcct ccataactaa ctagacatga agacctgccg 1800
cgtacaattg tcttatattt gaacaactaa aattgaacat cttttgccac aactttataa 1860
gtggttaata tagctcaaat atatggtcaa gttcaataga ttaataatgg aaatatcagt 1920
tatcgaaatt cattaacaat caacttaacg ttattaacta ctaattttat atcatcccct 1980
ttgataaatg atagtacacc aattaggaag gagcatgctc gcctaggaga ttgtcgtttc 2040
ccgccttcag tttgcaagct gctctagccg tgtagccaat acgcaaaccg cctctccccg 2100
cgcgttggga attactagcg cgtgtcgaca agcttgcatg ccggtcaaca tggtggagca 2160
cgacacactt gtctactcca aaaatatcaa agatacagtc tcagaagacc aaagggcaat 2220
tgagactttt caacaaaggg taatatccgg aaacctcctc ggattccatt gcccagctat 2280
ctgtcacttt attgtgaaga tagtggaaaa ggaaggtggc tcctacaaat gccatcattg 2340
cgataaagga aaggccatcg ttgaagatgc ctctgccgac agtggtccca aagatggacc 2400
cccacccacg aggagcatcg tggaaaaaga agacgttcca accacgtctt caaagcaagt 2460
ggattgatgt gataacatgg tggagcacga cacacttgtc tactccaaaa atatcaaaga 2520
tacagtctca gaagaccaaa gggcaattga gacttttcaa caaagggtaa tatccggaaa 2580
cctcctcgga ttccattgcc cagctatctg tcactttatt gtgaagatag tggaaaagga 2640
aggtggctcc tacaaatgcc atcattgcga taaaggaaag gccatcgttg aagatgcctc 2700
tgccgacagt ggtcccaaag atggaccccc acccacgagg agcatcgtgg aaaaagaaga 2760
cgttccaacc acgtcttcaa agcaagtgga ttgatgtgat atctccactg acgtaaggga 2820
tgacgcacaa tcccactatc cttcgcaaga cccttcctct atataaggaa gttcatttca 2880
tttggagagg tattaaaatc ttaataggtt ttgataaaag cgaacgtggg gaaacccgaa 2940
ccaaaccttc ttctaaactc tctctcatct ctcttaaagc aaacttctct cttgtctttc 3000
ttgcgtgagc gatcttcaac gttgtcagat cgtgcttcgg caccagtaca acgttttctt 3060
tcactgaagc gaaatcaaag atctctttgt ggacacgtag tgcggcgcca ttaaataacg 3120
tgtacttgtc ctattcttgt cggtgtggtc ttgggaaaag aaagcttgct ggaggctgct 3180
gttcagcccc atacattact tgttacgatt ctgctgactt tcggcgggtg caatatctct 3240
acttctgctt gacgaggtat tgttgcctgt acttctttct tcttcttctt gctgattggt 3300
tctataagaa atctagtatt ttctttgaaa cagagttttc ccgtggtttt cgaacttgga 3360
gaaagattgt taagcttctg tatattctgc ccaaatttgt cgggcccgcg gatggcgaaa 3420
aacgttgcga ttttcggctt attgttttct cttcttgtgt tggttccttc tcagatcttc 3480
gcctgcaggc tcctcagcca aaacgacacc cccatctgtc tatccactgg cccctggatc 3540
tgctgcccaa actaactcca tggtgaccct gggatgcctg gtcaagggct atttccctga 3600
gccagtgaca gtgacctgga actctggatc cctgtccagc ggtgtgcaca ccttcccagc 3660
tgtcctgcag tctgacctct acactctgag cagctcagtg actgtcccct ccagcacctg 3720
gcccagcgag accgtcacct gcaacgttgc ccacccggcc agcagcacca aggtggacaa 3780
gaaaattgtg cccagggatt gtggttgtaa gccttgcata tgtacagtcc cagaagtatc 3840
atctgtcttc atcttccccc caaagcccaa ggatgtgctc accattactc tgactcctaa 3900
ggtcacgtgt gttgtggtag acatcagcaa ggatgatccc gaggtccagt tcagctggtt 3960
tgtagatgat gtggaggtgc acacagctca gacgcaaccc cgggaggagc agttcaacag 4020
cactttccgc tcagtcagtg aacttcccat catgcaccag gactggctca atggcaagga 4080
gcgatcgctc accatcacca tcaccatcac catcaccatt aaaggcctat tttctttagt 4140
ttgaatttac tgttattcgg tgtgcatttc tatgtttggt gagcggtttt ctgtgctcag 4200
agtgtgttta ttttatgtaa tttaatttct ttgtgagctc ctgtttagca ggtcgtccct 4260
tcagcaagga cacaaaaaga ttttaatttt attaaaaaaa aaaaaaaaaa agaccgggaa 4320
ttcgatatca agcttatcga cctgcagatc gttcaaacat ttggcaataa agtttcttaa 4380
gattgaatcc tgttgccggt cttgcgatga ttatcatata atttctgttg aattacgtta 4440
agcatgtaat aattaacatg taatgcatga cgttatttat gagatgggtt tttatgatta 4500
gagtcccgca attatacatt taatacgcga tagaaaacaa aatatagcgc gcaaactagg 4560
ataaattatc gcgcgcggtg tcatctatgt tactagatct ctagagtctc aagcttggcg 4620
cgcccacgtg actagtggca ctggccgtcg ttttacaacg tcgtgactgg gaaaaccctg 4680
gcgttaccca acttaatcgc cttgcagcac atcccccttt cgccagctgg cgtaatagcg 4740
aagaggcccg caccgatcgc ccttcccaac agttgcgcag cctgaatggc gaatgctaga 4800
gcagcttgag cttggatcag attgtcgttt cccgccttca gtttaaacta tcagtgtttg 4860
acaggatata ttggcgggta aacctaagag aaaagagcgt tta 4903
<210> 5
<211> 3462
<212> DNA
<213> Artificial Sequence
<220>
<223> Cassette 484 from 2X35S promoter to NOS terminator
<400> 5
gtcaacatgg tggagcacga cacacttgtc tactccaaaa atatcaaaga tacagtctca 60
gaagaccaaa gggcaattga gacttttcaa caaagggtaa tatccggaaa cctcctcgga 120
ttccattgcc cagctatctg tcactttatt gtgaagatag tggaaaagga aggtggctcc 180
tacaaatgcc atcattgcga taaaggaaag gccatcgttg aagatgcctc tgccgacagt 240
ggtcccaaag atggaccccc acccacgagg agcatcgtgg aaaaagaaga cgttccaacc 300
acgtcttcaa agcaagtgga ttgatgtgat aacatggtgg agcacgacac acttgtctac 360
tccaaaaata tcaaagatac agtctcagaa gaccaaaggg caattgagac ttttcaacaa 420
agggtaatat ccggaaacct cctcggattc cattgcccag ctatctgtca ctttattgtg 480
aagatagtgg aaaaggaagg tggctcctac aaatgccatc attgcgataa aggaaaggcc 540
atcgttgaag atgcctctgc cgacagtggt cccaaagatg gacccccacc cacgaggagc 600
atcgtggaaa aagaagacgt tccaaccacg tcttcaaagc aagtggattg atgtgatatc 660
tccactgacg taagggatga cgcacaatcc cactatcctt cgcaagaccc ttcctctata 720
taaggaagtt catttcattt ggagaggtat taaaatctta ataggttttg ataaaagcga 780
acgtggggaa acccgaacca aaccttcttc taaactctct ctcatctctc ttaaagcaaa 840
cttctctctt gtctttcttg cgtgagcgat cttcaacgtt gtcagatcgt gcttcggcac 900
cagtacaacg ttttctttca ctgaagcgaa atcaaagatc tctttgtgga cacgtagtgc 960
ggcgccatta aataacgtgt acttgtccta ttcttgtcgg tgtggtcttg ggaaaagaaa 1020
gcttgctgga ggctgctgtt cagccccata cattacttgt tacgattctg ctgactttcg 1080
gcgggtgcaa tatctctact tctgcttgac gaggtattgt tgcctgtact tctttcttct 1140
tcttcttgct gattggttct ataagaaatc tagtattttc tttgaaacag agttttcccg 1200
tggttttcga acttggagaa agattgttaa gcttctgtat attctgccca aatttgtcgg 1260
gcccatggcg aaaaacgttg cgattttcgg cttattgttt tctcttcttg tgttggttcc 1320
ttctcagatc ttcgctgaca cattatgtat aggttatcat gcgaacaatt caacagacac 1380
tgtagacaca gtactagaaa agaatgtaac agtaacacac tctgttaacc ttctagaaga 1440
caagcataac gggaaactat gcaaactaag aggggtagcc ccattgcatt tgggtaaatg 1500
taacattgct ggctggatcc tgggaaatcc agagtgtgaa tcactctcca cagcaagctc 1560
atggtcctac attgtggaaa cacctagttc agacaatgga acgtgttacc caggagattt 1620
catcgattat gaggagctaa gagagcaatt gagctcagtg tcatcatttg aaaggtttga 1680
gatattcccc aagacaagtt catggcccaa tcatgactcg aacaaaggtg taacggcagc 1740
atgtcctcat gctggagcaa aaagcttcta caaaaattta atatggctag ttaaaaaagg 1800
aaattcatac ccaaagctca gcaaatccta cattaatgat aaagggaaag aagtcctcgt 1860
gctatggggc attcaccatc catctactag tgctgaccaa caaagtctct atcagaatgc 1920
agatgcatat gtttttgtgg ggtcatcaag atacagcaag aagttcaagc cggaaatagc 1980
aataagaccc aaagtgaggg atcaagaagg gagaatgaac tattactgga cactagtaga 2040
gccgggagac aaaataacat tcgaagcaac tggaaatcta gtggtaccga gatatgcatt 2100
cgcaatggaa agaaatgctg gatctggtat tatcatttca gatacaccag tccacgattg 2160
caatacaact tgtcaaacac ccaagggtgc tataaacacc agcctcccat ttcagaatat 2220
acatccgatc acaattggaa aatgtccaaa atatgtaaaa agcacaaaat tgagactggc 2280
cacaggattg aggaatatcc cgtctattca atctagagga ctatttgggg ccattgccgg 2340
tttcattgaa ggggggtgga cagggatggt agatggatgg tacggttatc accatcaaaa 2400
tgagcagggg tcaggatatg cagccgacct gaagagcaca cagaatgcca ttgacgagat 2460
tactaacaaa gtaaattctg ttattgaaaa gatgaataca cagttcacag cagtaggtaa 2520
agagttcaac cacctggaaa aaagaataga gaatttaaat aaaaaagttg atgatggttt 2580
cctggacatt tggacttaca atgccgaact gttggttcta ttggaaaatg aaagaacttt 2640
ggactaccac gattcaaatg tgaagaactt atatgaaaag gtaagaagcc agctaaaaaa 2700
caatgccaag gaaattggaa acggctgctt tgaattttac cacaaatgcg ataacacgtg 2760
catggaaagt gtcaaaaatg ggacttatga ctacccaaaa tactcagagg aagcaaaatt 2820
aaacagagaa gaaatagatg gggtaaagct ggaatcaaca aggatttacc agattttggc 2880
gatctattca actgtcgcca gttcattggt actggtagtc tccctggggg caatcagttt 2940
ctggatgtgc tctaatgggt ctctacagtg tagaatatgt atttaaaggc ctattttctt 3000
tagtttgaat ttactgttat tcggtgtgca tttctatgtt tggtgagcgg ttttctgtgc 3060
tcagagtgtg tttattttat gtaatttaat ttctttgtga gctcctgttt agcaggtcgt 3120
cccttcagca aggacacaaa aagattttaa ttttattaaa aaaaaaaaaa aaaaagaccg 3180
ggaattcgat atcaagctta tcgacctgca gatcgttcaa acatttggca ataaagtttc 3240
ttaagattga atcctgttgc cggtcttgcg atgattatca tataatttct gttgaattac 3300
gttaagcatg taataattaa catgtaatgc atgacgttat ttatgagatg ggtttttatg 3360
attagagtcc cgcaattata catttaatac gcgatagaaa acaaaatata gcgcgcaaac 3420
taggataaat tatcgcgcgc ggtgtcatct atgttactag at 3462
<210> 6
<211> 573
<212> PRT
<213> Artificial Sequence
<220>
<223> Amino acid sequence of PDISP/H1 California
<400> 6
Met Ala Lys Asn Val Ala Ile Phe Gly Leu Leu Phe Ser Leu Leu Val
1 5 10 15
Leu Val Pro Ser Gln Ile Phe Ala Asp Thr Leu Cys Ile Gly Tyr His
20 25 30
Ala Asn Asn Ser Thr Asp Thr Val Asp Thr Val Leu Glu Lys Asn Val
35 40 45
Thr Val Thr His Ser Val Asn Leu Leu Glu Asp Lys His Asn Gly Lys
50 55 60
Leu Cys Lys Leu Arg Gly Val Ala Pro Leu His Leu Gly Lys Cys Asn
65 70 75 80
Ile Ala Gly Trp Ile Leu Gly Asn Pro Glu Cys Glu Ser Leu Ser Thr
85 90 95
Ala Ser Ser Trp Ser Tyr Ile Val Glu Thr Pro Ser Ser Asp Asn Gly
100 105 110
Thr Cys Tyr Pro Gly Asp Phe Ile Asp Tyr Glu Glu Leu Arg Glu Gln
115 120 125
Leu Ser Ser Val Ser Ser Phe Glu Arg Phe Glu Ile Phe Pro Lys Thr
130 135 140
Ser Ser Trp Pro Asn His Asp Ser Asn Lys Gly Val Thr Ala Ala Cys
145 150 155 160
Pro His Ala Gly Ala Lys Ser Phe Tyr Lys Asn Leu Ile Trp Leu Val
165 170 175
Lys Lys Gly Asn Ser Tyr Pro Lys Leu Ser Lys Ser Tyr Ile Asn Asp
180 185 190
Lys Gly Lys Glu Val Leu Val Leu Trp Gly Ile His His Pro Ser Thr
195 200 205
Ser Ala Asp Gln Gln Ser Leu Tyr Gln Asn Ala Asp Ala Tyr Val Phe
210 215 220
Val Gly Ser Ser Arg Tyr Ser Lys Lys Phe Lys Pro Glu Ile Ala Ile
225 230 235 240
Arg Pro Lys Val Arg Asp Gln Glu Gly Arg Met Asn Tyr Tyr Trp Thr
245 250 255
Leu Val Glu Pro Gly Asp Lys Ile Thr Phe Glu Ala Thr Gly Asn Leu
260 265 270
Val Val Pro Arg Tyr Ala Phe Ala Met Glu Arg Asn Ala Gly Ser Gly
275 280 285
Ile Ile Ile Ser Asp Thr Pro Val His Asp Cys Asn Thr Thr Cys Gln
290 295 300
Thr Pro Lys Gly Ala Ile Asn Thr Ser Leu Pro Phe Gln Asn Ile His
305 310 315 320
Pro Ile Thr Ile Gly Lys Cys Pro Lys Tyr Val Lys Ser Thr Lys Leu
325 330 335
Arg Leu Ala Thr Gly Leu Arg Asn Ile Pro Ser Ile Gln Ser Arg Gly
340 345 350
Leu Phe Gly Ala Ile Ala Gly Phe Ile Glu Gly Gly Trp Thr Gly Met
355 360 365
Val Asp Gly Trp Tyr Gly Tyr His His Gln Asn Glu Gln Gly Ser Gly
370 375 380
Tyr Ala Ala Asp Leu Lys Ser Thr Gln Asn Ala Ile Asp Glu Ile Thr
385 390 395 400
Asn Lys Val Asn Ser Val Ile Glu Lys Met Asn Thr Gln Phe Thr Ala
405 410 415
Val Gly Lys Glu Phe Asn His Leu Glu Lys Arg Ile Glu Asn Leu Asn
420 425 430
Lys Lys Val Asp Asp Gly Phe Leu Asp Ile Trp Thr Tyr Asn Ala Glu
435 440 445
Leu Leu Val Leu Leu Glu Asn Glu Arg Thr Leu Asp Tyr His Asp Ser
450 455 460
Asn Val Lys Asn Leu Tyr Glu Lys Val Arg Ser Gln Leu Lys Asn Asn
465 470 475 480
Ala Lys Glu Ile Gly Asn Gly Cys Phe Glu Phe Tyr His Lys Cys Asp
485 490 495
Asn Thr Cys Met Glu Ser Val Lys Asn Gly Thr Tyr Asp Tyr Pro Lys
500 505 510
Tyr Ser Glu Glu Ala Lys Leu Asn Arg Glu Glu Ile Asp Gly Val Lys
515 520 525
Leu Glu Ser Thr Arg Ile Tyr Gln Ile Leu Ala Ile Tyr Ser Thr Val
530 535 540
Ala Ser Ser Leu Val Leu Val Val Ser Leu Gly Ala Ile Ser Phe Trp
545 550 555 560
Met Cys Ser Asn Gly Ser Leu Gln Cys Arg Ile Cys Ile
565 570
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АКТИВАТОР СИГНАЛЬНОГО ПУТИ ЖАСМОНОВОЙ КИСЛОТЫ | 2016 |
|
RU2728472C2 |
| МУТАНТЫ ГЕМАГГЛЮТИНИНА ВИРУСА ГРИППА | 2019 |
|
RU2809237C2 |
| МУТАНТЫ ГЕМАГГЛЮТИНИНА ВИРУСА ГРИППА | 2019 |
|
RU2801708C2 |
| ТРАНСГЕННОЕ РАСТЕНИЕ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2018 |
|
RU2758722C2 |
| ГЕН АХМ1554, КОДИРУЮЩИЙ ДЕЛЬТА-ЭНДОТОКСИН, И СПОСОБЫ ЕГО ПРИМЕНЕНИЯ | 2016 |
|
RU2755282C2 |
| ИНСЕКТИЦИДНЫЕ ПОЛИПЕПТИДЫ С ШИРОКИМ СПЕКТРОМ АКТИВНОСТИ И ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2750459C2 |
| СПОСОБ УВЕЛИЧЕНИЯ ФОТОСИНТЕТИЧЕСКОЙ ФИКСАЦИИ УГЛЕРОДА С ИСПОЛЬЗОВАНИЕМ БЕЛКА СЛИЯНИЯ ИЗ МНОГИХ СУБЪЕДИНИЦ ГЛИКОЛАТДЕГИДРОГЕНАЗЫ | 2011 |
|
RU2651501C2 |
| КОМПОЗИЦИИ И СПОСОБЫ КОНТРОЛЯ ВРЕДИТЕЛЕЙ РАСТЕНИЙ | 2015 |
|
RU2745322C2 |
| СПОСОБЫ УСОВЕРШЕНСТВОВАНИЯ ОДНОДОЛЬНЫХ РАСТЕНИЙ | 2015 |
|
RU2727428C2 |
| РАСТЕНИЯ СО СНИЖЕННЫМ СОДЕРЖАНИЕМ АСПАРАГИНА | 2016 |
|
RU2742725C2 |
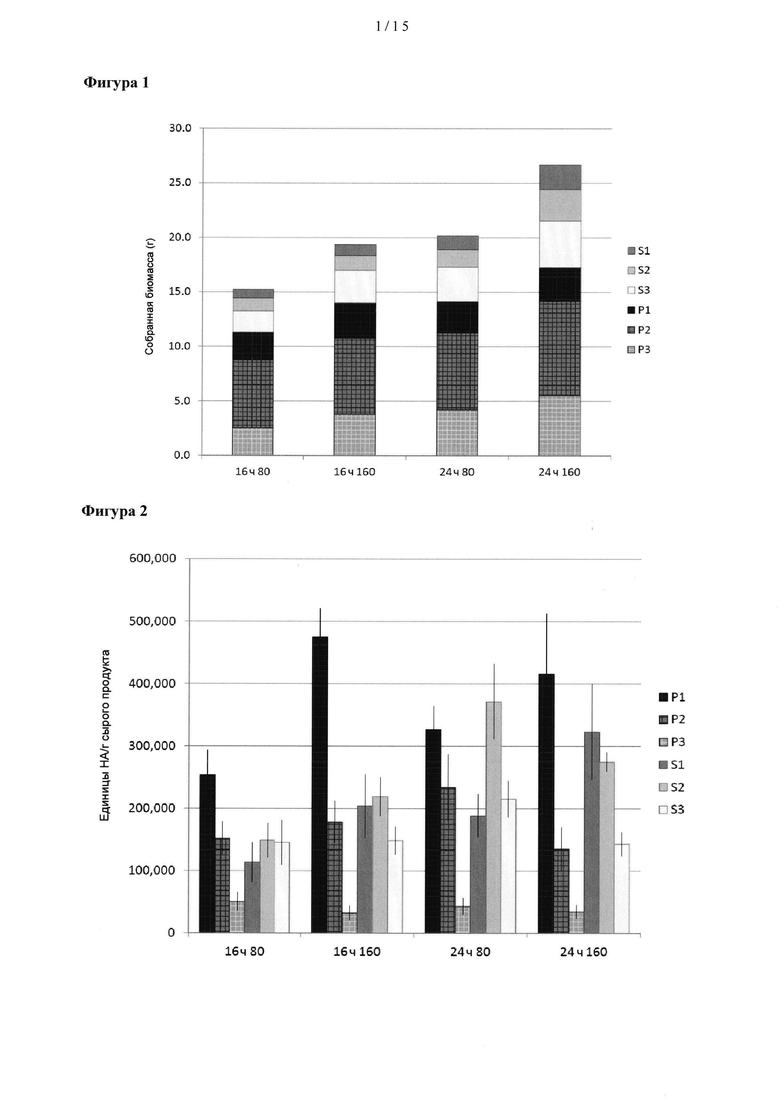
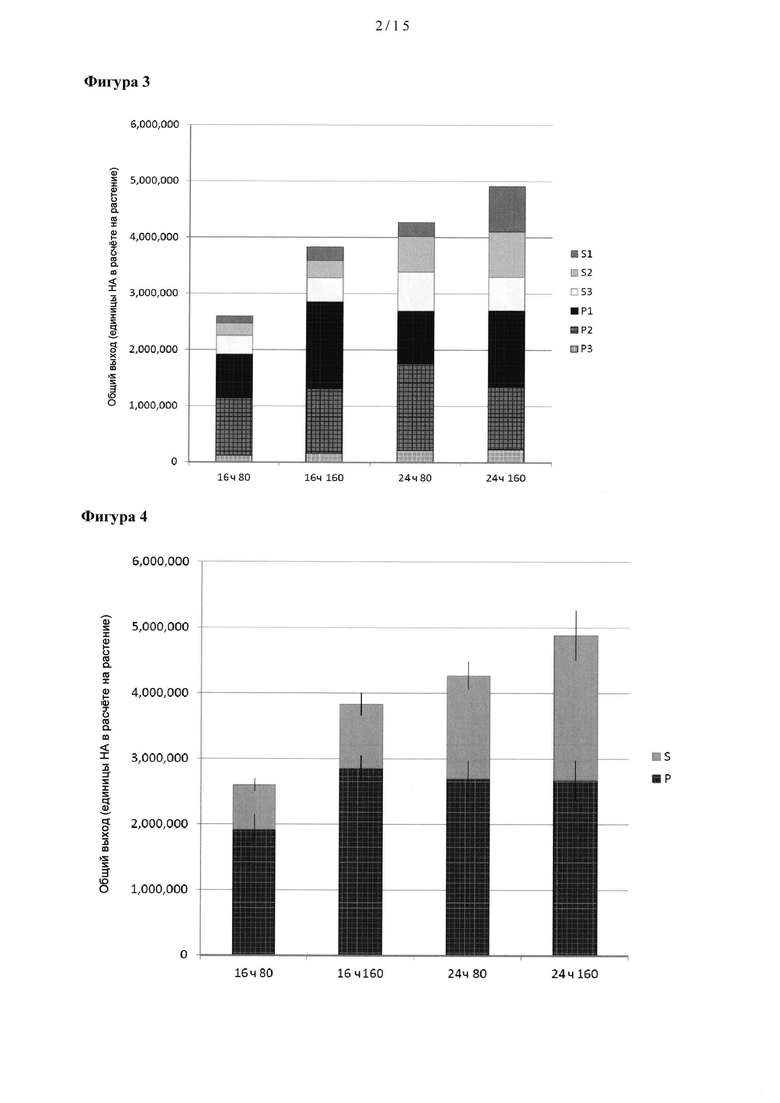
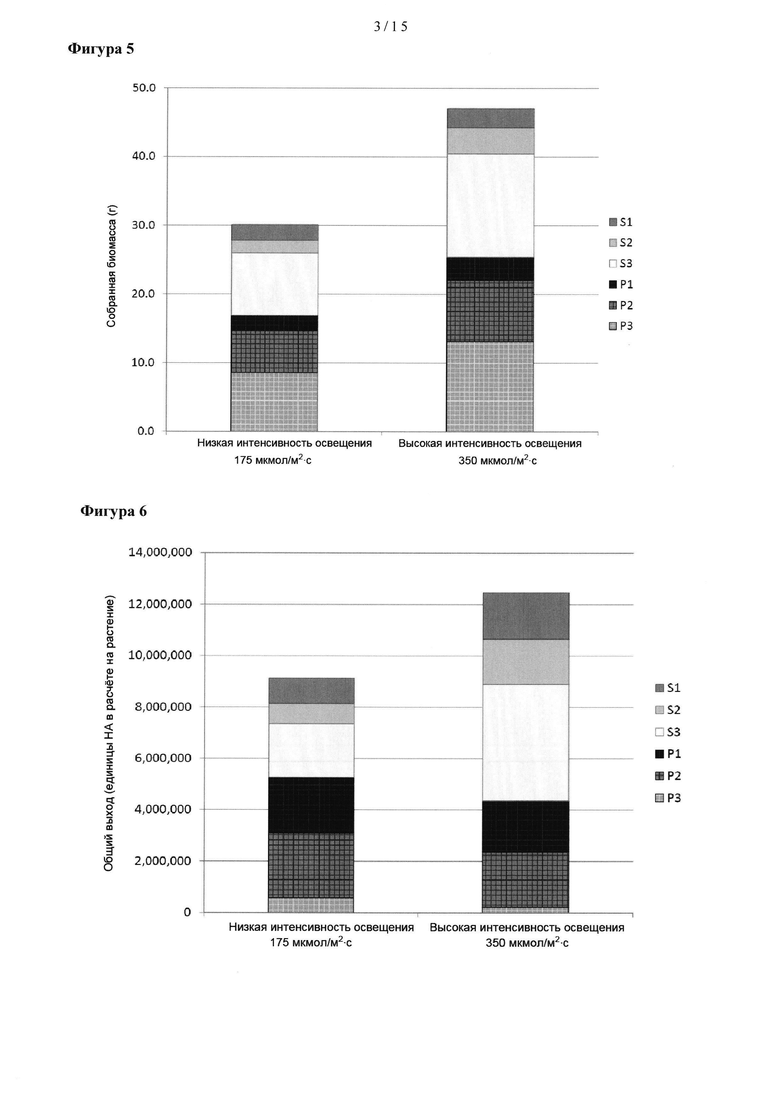
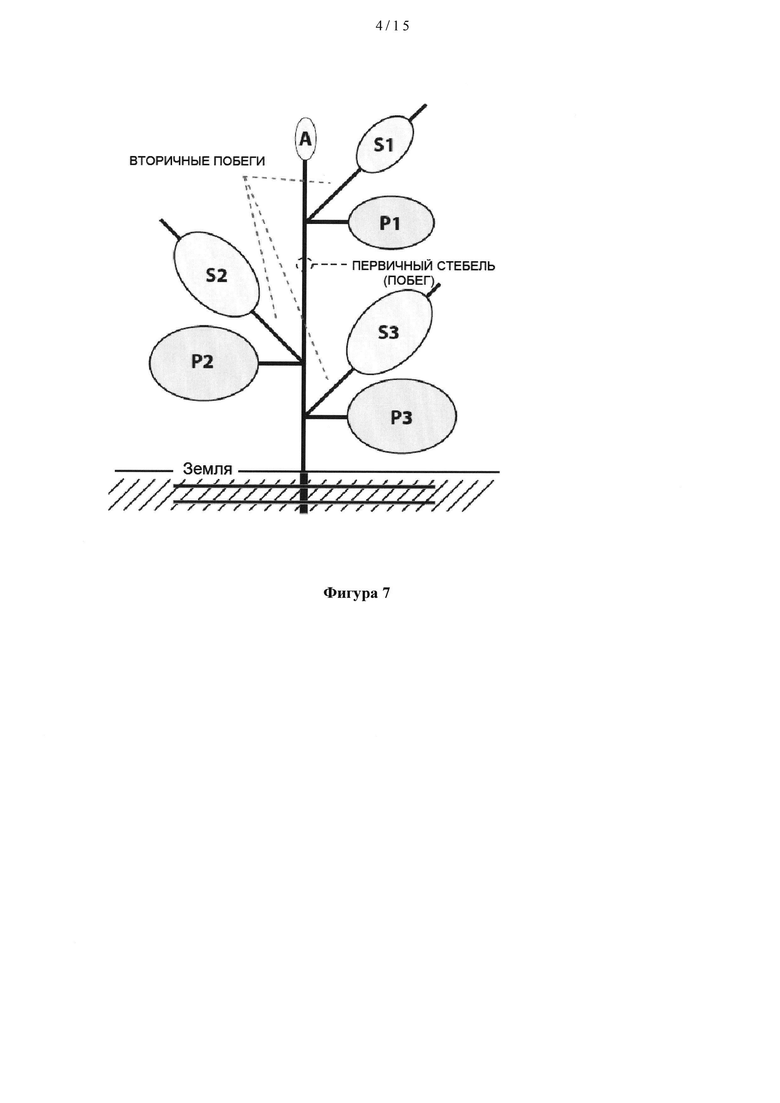
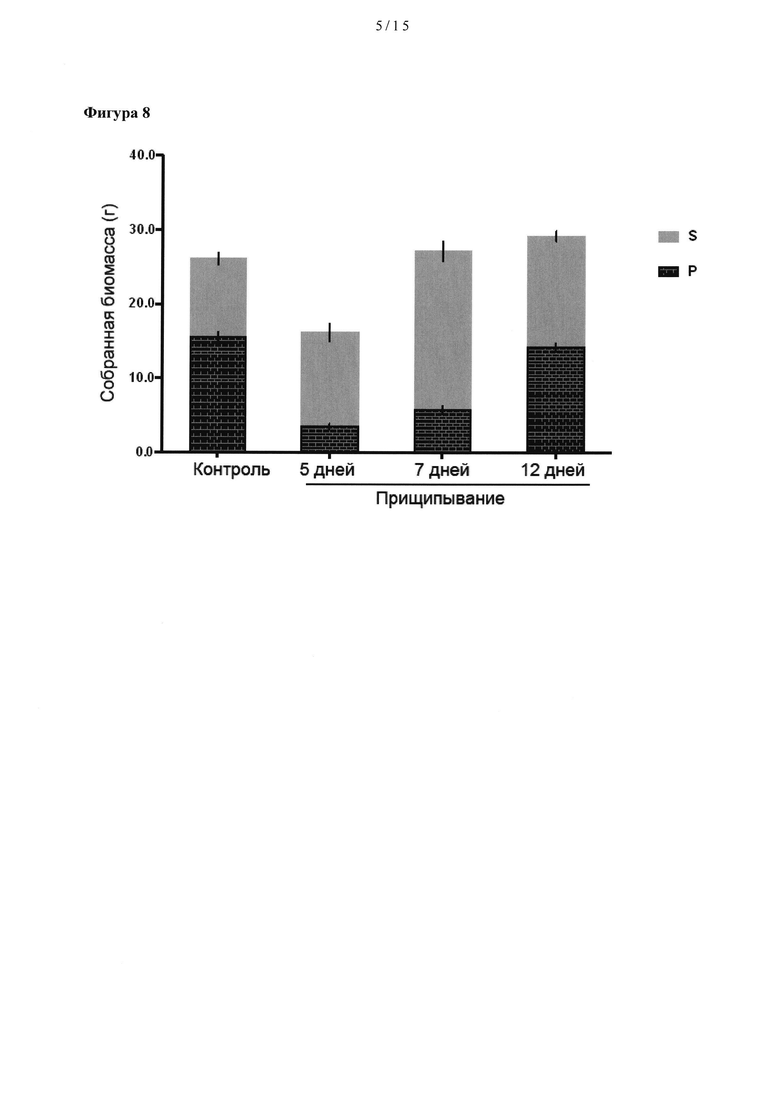
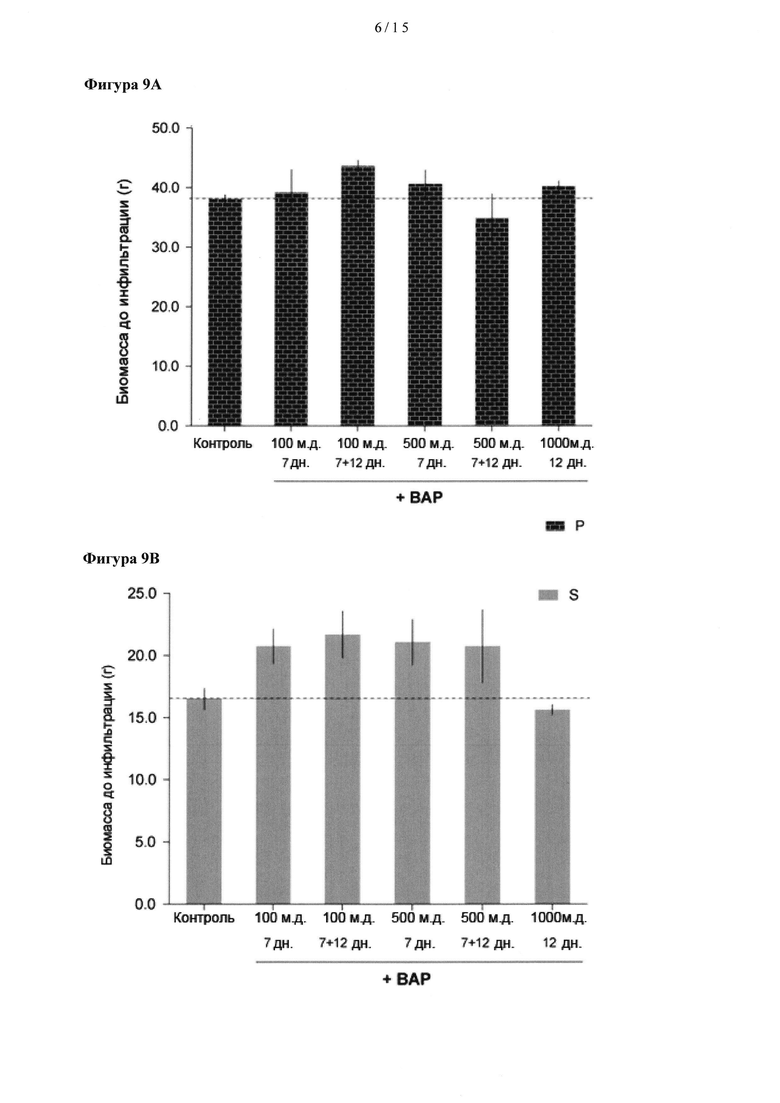
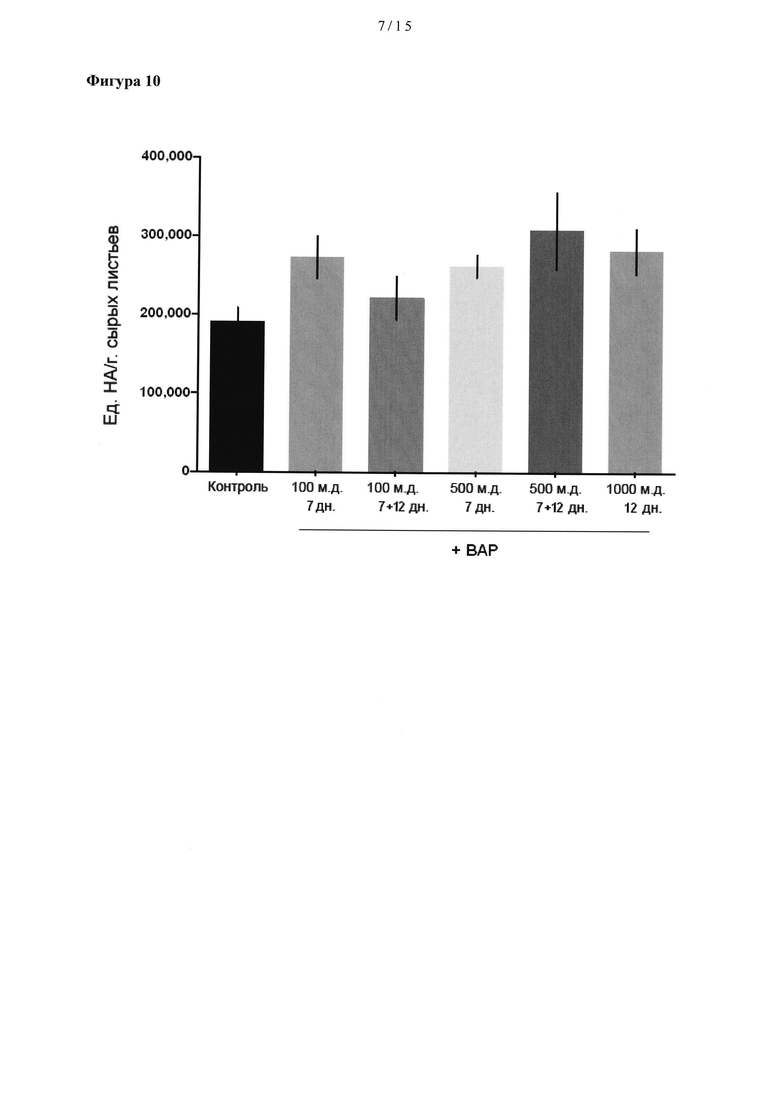
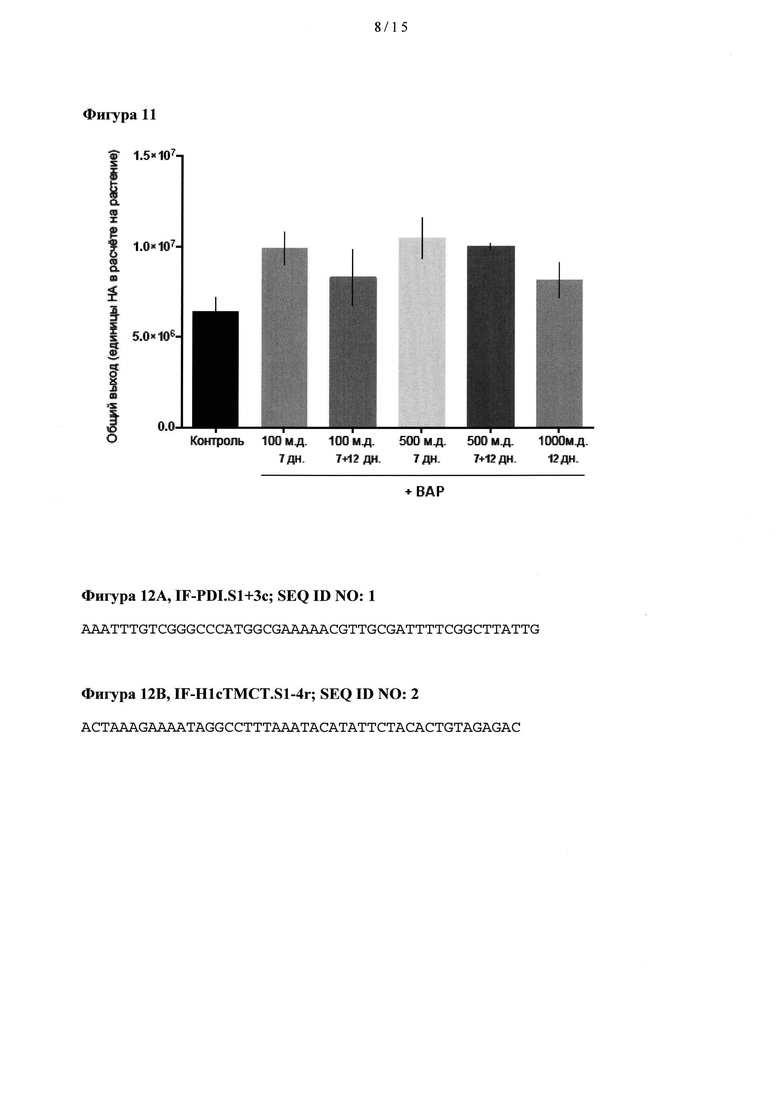




Изобретение относится к биотехнологии и представляет собой способ синтеза белка, представляющего интерес, в растении или в части растения. Такой способ включает обработку растения для увеличения получения вторичной биомассы листьев с последующим введением в растение одной или более, чем одной нуклеиновой кислоты, кодирующей белок, представляющий интерес, функционально связанной с регуляторной областью, которая является активной в растении. Затем это растение выдерживают в условиях, которые обеспечивают экспрессию в растении или в части растения последовательности нуклеиновой кислоты, кодирующей белок, представляющий интерес. Растение или часть растения необязательно могут быть собраны и белок, представляющий интерес, может быть экстрагирован. 18 з.п. ф-лы, 18 ил., 3 табл., 6 пр.
1. Способ продуцирования гетерологичного белка, представляющего интерес, включающий:
a) обработку растения или части растения для увеличения образования вторичной биомассы листьев в растении или в части растения, причем часть растения содержит стебли, листья и/или корни, где обработка включает одно или более, выбранное из: увеличения продолжительности освещения во время роста растения, повышения интенсивности освещенности во время роста растения и культивации растения в присутствии фитогормона, который способствует образованию вторичных стеблей, способствует образованию вторичной биомассы, уменьшает доминирование верхушки или вызывает комбинацию этих явлений, для получения обработанного растения или части растения;
b) введение одной или более чем одной нуклеиновой кислоты в обработанное растение или часть растения, причем нуклеиновая кислота содержит нуклеотидную последовательность, кодирующую гетерологичный белок, представляющий интерес, и нуклеотидная последовательность функционально связана с регуляторной областью, которая является активной в растении;
c) выращивание обработанного растения или части растения в условиях, которые обеспечивают экспрессию нуклеотидной последовательности, кодирующей гетерологичный белок, представляющий интерес, тем самым продуцируя гетерологичный белок, представляющий интерес, причем выход гетерологичного белка, представляющего интерес, повышается по сравнению с выходом гетерологичного белка, представляющего интерес, полученного из той же растительной ткани похожего растения, которое выращено в тех же самых условиях, но которое не было обработано для увеличения вторичной биомассы листьев,
где стадия обработки, стадия а), проводится в течение промежутка времени от примерно 40 дней до стадии введения, стадии b), вплоть до примерно 9 дней до стадии введения, стадии b).
2. Способ по п. 1, где на стадии обработки, стадии а), в обрабатываемом растении или в части растения отношение вторичной биомассы листьев к первичной биомассе листьев составляет величину между 0,2:1 и 1:1.
3. Способ по п. 1, где стадия обработки растения или части растения, стадия а), проводится в течение примерно от 20 дней до стадии введения одной или более чем одной нуклеиновой кислоты, стадии b), вплоть до 9 дней до дня введения одной или более, чем одной нуклеиновой кислоты, стадии b).
4. Способ по п. 1, где растение культивируется в присутствии фитогормона в течение промежутка времени от примерно 9 дней, примерно 10 дней, примерно 11 дней, примерно 12 дней, примерно 13 дней или примерно 14 дней до стадии введения, стадии b), или где увеличение продолжительности освещения или повышение интенсивности освещенности проводится в течение промежутка времени по меньшей мере примерно 20 дней до стадии введения, стадии b).
5. Способ по п. 1, включающий также стадию d) сбора растения.
6. Способ по п. 1, включающий также стадию d) сбора растения и очистки гетерологичного белка, представляющего интерес.
7. Способ по п. 5, где собирают первичные стебли и вторичные стебли.
8. Способ по п. 5, где собирают вторичные стебли.
9. Способ по п. 8, где собирают также промежуточные листья с первичных стеблей (Р2) и молодые листья с первичных стеблей (Р1).
10. Способ по п. 5, где собирают также промежуточные листья с первичных стеблей (Р2), молодые листья с первичных стеблей (Р1), старые листья со вторичных стеблей (S3), промежуточные листья со вторичных стеблей (S2) и молодые листья со вторичных стеблей (S1).
11. Способ по п. 5, где старые листья (Р3) с первичных стеблей растения исключают из сбора.
12. Способ по п. 1, где нуклеотидная последовательность кодирует фармацевтически активный белок, антитело, антиген, вакцину, фермент или имеющий промышленное значение фермент.
13. Способ по п. 1, где нуклеотидная последовательность кодирует белок НА вируса гриппа.
14. Способ по п. 1, где на стадии с), нуклеиновая кислота транзиентно экспрессируется в растении.
15. Способ по п. 1, где на стадии с), нуклеиновая кислота стабильно экспрессируется в растении.
16. Способ по п. 13, где гетерологичный белок, представляющий интерес, который получают из растения, является вирусоподобной частицей (VLP), содержащей белок НА.
17. Способ по п. 1, где увеличение вторичной биомассы листьев представляет собой результат увеличения количества вторичных стеблей и листьев, увеличения длины вторичных стеблей или листьев, или того, и другого.
18. Способ по п. 1, где фитогормон является синтетическим цитокином.
19. Способ по п. 18, где синтетический цитокин представляет собой 6-бензиламинопурин (ВАР).
| DORAN P | |||
| M., Foreign protein production in plant tissue cultures, Current Opinion in Biotechnology, 2000, Vol.11, N2, pp.199-204 | |||
| MARSIAN J | |||
| et al., Molecular pharming — VLPs made in plants, Current Opinion in Biotechnology, 2016, Vol | |||
| Пишущая машина | 1922 |
|
SU37A1 |
| GIDDINGS G., Transgenic plants as protein factories, Current Opinion in Biotechnology, 2001, | |||
Авторы
Даты
2020-09-01—Публикация
2015-07-10—Подача