ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Изобретение относится к солям, включающим соли соединения фенилалкиламина, которые имеют неожиданно высокую растворимость в водном растворе. Соли по настоящему изобретению являются проверенными антагонистами кальциевых каналов L-типа и создают новую терапевтическую платформу для лечения сердечных аритмий, таких как пароксизмальная наджелудочковая тахикардия, стабильной стенокардии, а также мигреней.
Сердечная аритмия
Сердечная аритмия, или аномальный сердечный ритм, вызывается аномальной возбудимостью и проводимостью сердечной мышцы. Нормальное сердцебиение регулируется синоатриальным (СА) узлом, группой клеток, находящихся в правом предсердии, ближе к верхней полой вене. В нормальных физиологических состояниях СА узел спонтанно инициирует потенциалы действия через регулярные промежутки времени и распространяет эти электрохимические сигналы из правого предсердия в левое предсердие. Каждый скоординированный импульс индуцирует приток ионов кальция (Ca2+) в кардиомиоцитарные волокна СА узла через потенциал-чувствительные кальциевые каналы, что в конечном итоге позволяет ткани сердечной мышцы сокращаться и выталкивать кровь из предсердий в желудочки. Этот сигнал затем распространяется в атриовентрикулярный (АВ) узел, который распространяет потенциал действия на правый и левый желудочки. Этот сигнал вызывает приток внеклеточного кальция, который, в свою очередь, способствует сокращению желудочковых кардиомиоцитов и выталкиванию крови из сердца в систему кровообращения.
Точная координация этих событий имеет жизненно важное значение для поддержания нормального сердечного ритма, и аберрантная активность этой электрохимической системы проводимости приводит к аритмии. Рецидивирующую аритмию с внезапным началом и завершением называют пароксизмальной. Симптомы пароксизмальной наджелудочковой тахикардии (ПНЖТ) включают эпизоды нормального и пароксизмального сердцебиения с внезапным началом и завершением (Blomstrom-Lundqvist et al., J. Am. Coll. Cardiol., 2003, 42: 1493-531). Механизмы сигнализации, лежащие в основе ПНЖТ, включают инициирование и распространение потенциалов действия по вспомогательным узлам, что вызывает аномальные сокращения кардиомиоцитов, препятствующие скоординированному предсердно-желудочковому кровотоку. Наиболее распространенной формой ПНЖТ является АВ узловая реципрокная тахикардия (АВУРТ), заболевание, характеризующееся развитием проводящей ткани вблизи АВ узла. Эта ткань образует замкнутый контур, известный как контур циркуляции возбуждения, что позволяет потенциалам действия распространяться по сердцу циркулярно, а не линейно. В результате пациенты испытывают учащенное сердцебиение и сильно повышенную частоту сердечных сокращений. Эпизоды тахикардии часто сопровождаются резким снижением артериального давления, что может вызвать головокружение или обморок. По оценкам, от ПНЖТ страдают более 1,7 миллионов получающих лечение пациентов в США, и ежегодно регистрируется более 89000 новых случаев заболевания. Поразительно, что многие из этих пациентов не проявляют других признаков сердечно-сосудистых заболеваний. Эпизоды ПНЖТ могут быть вызваны разными факторами, включая физический и психологический стресс, инфекцию, анемию, менструацию и беременность (Lee, et al., Curr. Probl. Cardiol., 2008, 33: 467-546).
Современные методы лечения
В настоящее время для пациентов с ПНЖТ доступно несколько методов лечения. Однако эти методы, как правило, страдают определенными недостатками, главными из которых являются инвазивность или неэффективность. Пациенты могут часто обращаться в отделение неотложной помощи для немедленного вмешательства во время эпизода, однако данная стратегия обеспечивает лишь временное облегчение. Такие пациенты могут продолжать испытывать эпизоды тахикардии на протяжении всей жизни. У пациентов, страдающих хроническими эпизодами ПНЖТ, могут быть удалены узловые волокна, распространяющие аномальные потенциалы действия, чтобы навсегда нарушить механизм, лежащий в основе нерегулярных сокращений кардиомиоцитов. Для данной процедуры, как правило, необходимо вводить катетер в горло пациента, чтобы добраться до сердца, где низковольтный электрический импульс подается в аберрантную сигнальную ткань. Этот процесс является чрезвычайно инвазивным, и пациенты часто боятся подвергаться такому лечению.
Альтернативно, пациенты, страдающие хронической ПНЖТ, могут принимать пероральные препараты для снижения степени тяжести или уменьшения частоты эпизодов аритмии. Блокаторы кальциевых каналов представляют собой класс соединений, которые функционально хорошо подходят для ослабления симптомов тахикардии, поскольку эти соединения способны уменьшать поступление внеклеточного кальция в кардиомиоциты, которое в конечном итоге приводит к мышечному сокращению. Наиболее известные примеры антагонистов кальциевых каналов включают верапамил и дилтиазем, оба из которых являются сильными ингибиторами притока кальция и широко используются для лечения ПНЖТ. Однако, невзирая на повсеместное использование этих терапевтических средств, пациенты, принимающие эти препараты, могут продолжать испытывать эпизоды тахикардии.
В настоящее время не существует коммерчески доступного терапевтического препарата, который можно вводить самостоятельно во время эпизода ПНЖТ с целью ослабления симптомов во время эпизода. Хотя использование блокаторов кальциевых каналов является надежной стратегией для купирования таких эпизодов, разработка такого продукта является проблематичной из-за точного фармакокинетического профиля, необходимого для быстрого облегчения симптомов без потенцирования побочной токсичности. Нужное терапевтическое средство должно обладать свойствами, необходимыми для его быстрой инфузии в кровоток пациента в терапевтически эффективном количестве и, следовательно, быстрого купирования эпизода ПНЖТ. Лекарственное средство впоследствии должно быть быстро метаболизировано и инактивировано для восстановления нормальной частоты сердечных сокращений в состоянии покоя. Современные препараты блокаторов кальциевых каналов предназначены для перорального введения. Попадание этих соединений в желудочно-кишечный тракт и последующий метаболизм препятствует быстрому поступлению этих лекарственных средств в кровоток и делает идеальный фармакокинетический профиль недостижимым. Вместо этого, данные лекарственные средства высвобождаются в течение более длительного периода времени за счет абсорбции через кишечный эпителий, что задерживает их поступление к патологической ткани сердечной мышцы.
Изобретение, описанное в настоящем документе, предлагает инновационную стратегию лечения сердечных аритмий, таких как ПНЖТ. Настоящее изобретение относится к новому препарату блокатора кальциевых каналов, обеспечивающему быструю доставку активного соединения в кровоток с целью достижения максимальной концентрации в плазме пациентов с ПНЖТ в пределах нескольких минут после введения. Это способствует быстрому купированию эпизодов ПНЖТ. Препарат обладает дополнительным преимуществом, заключающимся в том, что активный блокатор кальциевых каналов впоследствии быстро метаболизируется и инактивируется, после того, как достигнута максимальная концентрация в плазме. Такой фармакокинетический профиль является идеальным для лекарственного средства, способного купировать ПНЖТ непосредственно во время эпизода. Таким образом, препарат по настоящему изобретению представляет собой новую терапевтическую парадигму для точного и быстрого устранения патологической сигнализации в сердце.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к применению водного раствора, содержащего фармацевтически эффективное количество соли антагониста кальциевых каналов, в лечении стабильной стенокардии, мигрени и сердечной аритмии, такой как ПНЖТ. Соли по настоящему изобретению сформулированы для назального введения, которое представляет собой путь введения, ранее не используемый для лечения ПНЖТ. Одной из проблем, связанных с назальным введением, является ограничение объема, налагаемое размером носовой полости. Объем, вводимый с помощью назальных спреев, как правило, ограничен примерно 150-200 мкл, жидкий препарат в объемах, превышающих эти значения, вводят через горло. Это обстоятельство, в свою очередь, налагает ограничения на количество фармацевтически активного средства, которое можно доставлять на эпителиальную выстилку носовой полости. Соли по настоящему изобретению имеют неожиданно высокую растворимость в водном растворе, что позволяет создавать концентрированные жидкие растворы, способные доставлять терапевтически эффективные количества активного средства на назальный эпителий. Назальное введение активного средства имеет преимущества для достижения идеального фармакокинетического профиля, поскольку способность терапевтического соединения проходить через слизистую оболочку носа и быстро поступать в кровоток позволяет лекарственному средству быстро устранять патологическую сигнализацию в мышечной ткани. Новые препараты, описанные в настоящем документе, предоставляют новые терапевтические возможности для ослабления симптомов стабильной стенокардии, мигрени и сердечной аритмии, такой как ПНЖТ, непосредственно во время эпизода.
Варианты осуществления изобретения относятся к водной композиции, сформулированной для назального введения, содержащей фармацевтически приемлемую соль или свободное основание соединения, выбранного из группы, состоящей из соединения формулы
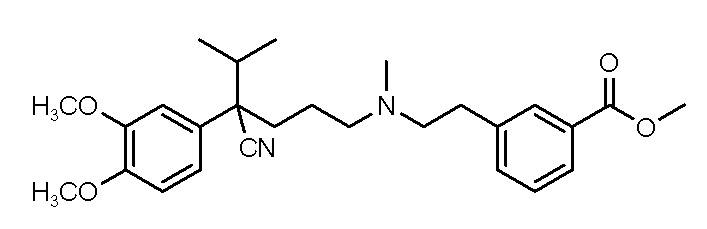 (I),
(I),
верапамила (2-(3,4-диметоксифенил)-5-[2-(3,4-диметоксифенил)этилметиламино]-2-пропан-2-илпентаннитрила), представленного формулой
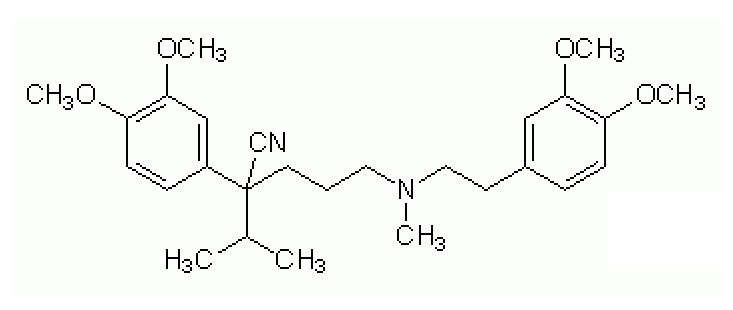 ,
,
галлопамила (5-[2-(3,4-диметоксифенил)этилметиламино]-2-пропан-2-ил-2-(3,4,5-триметоксифенил)пентаннитрила), представленного формулой
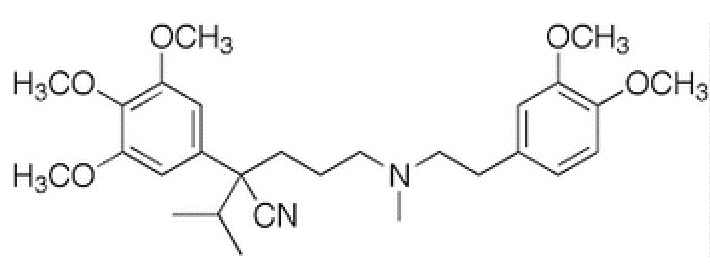 ,
,
и девапамила (2-(3,4-диметоксифенил)-2-изопропил-5-((м-метоксифенэтил)метиламино)валеронитрила), представленного формулой
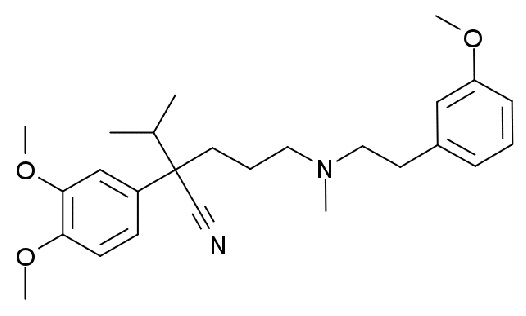 ,
,
либо его рацемат или энантиомер, при этом соединение растворено в водной композиции в концентрации от 150 мг/мл до 600 мг/мл.
В конкретных вариантах осуществления соединение, которое растворяется в водной композиции, представляет собой соединение I. В предпочтительных вариантах осуществления соединение, которое растворяется в водной композиции, представляет собой S-энантиомер соединения I.
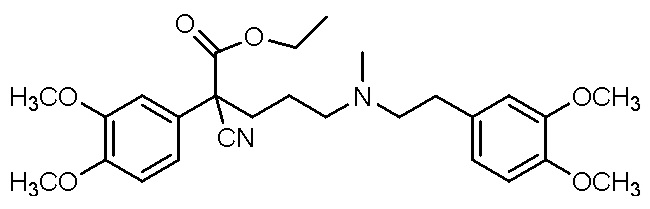
Варианты осуществления настоящего изобретения относятся к водной композиции, сформулированной для назального введения, содержащей фармацевтически приемлемую соль или свободное основание соединения, выбранного из группы, состоящей из
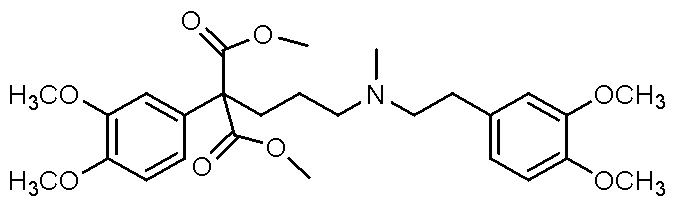 ,
, ,
, ,
, ,
,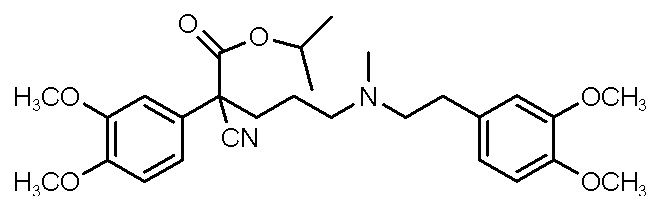 ,
,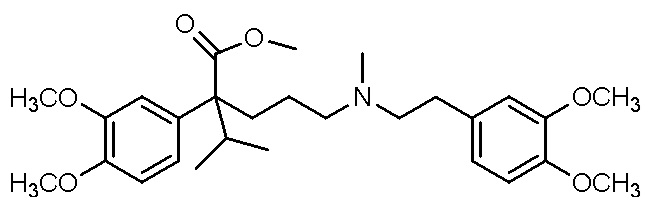 ,
,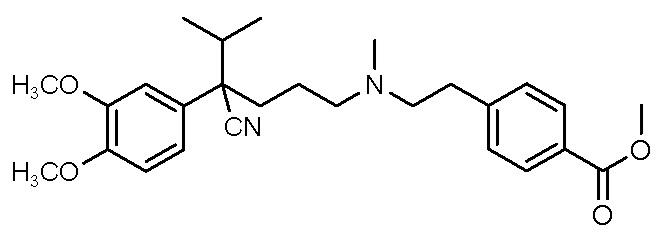 ,
,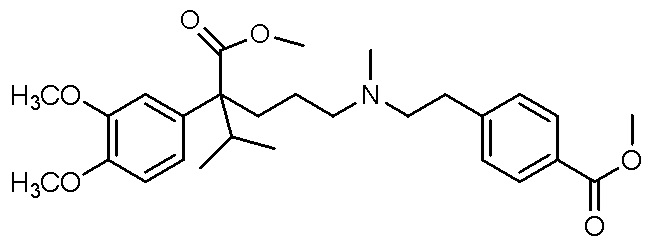 ,
,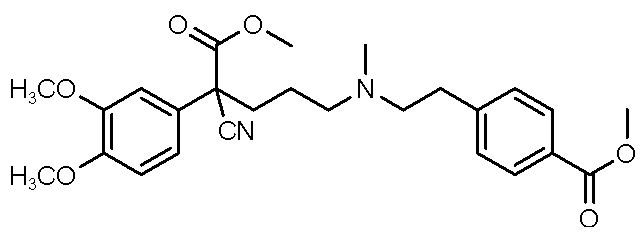 ,
,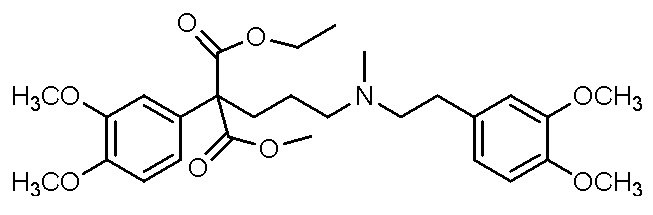 ,
,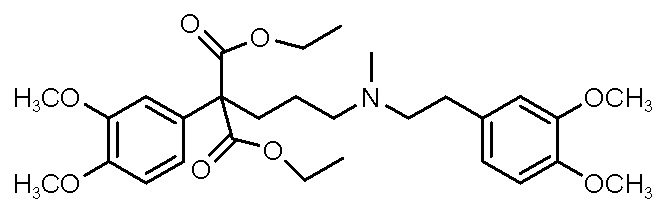 ,
,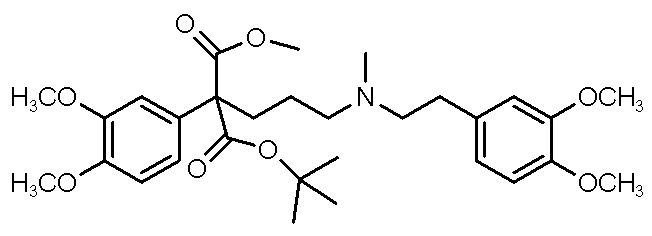 ,
,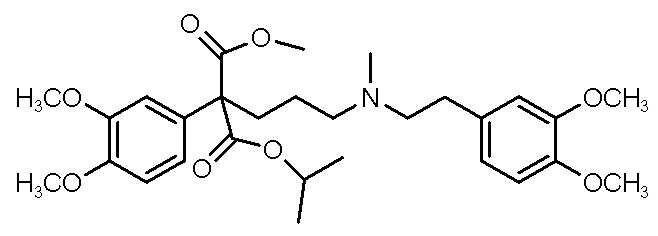 ,
,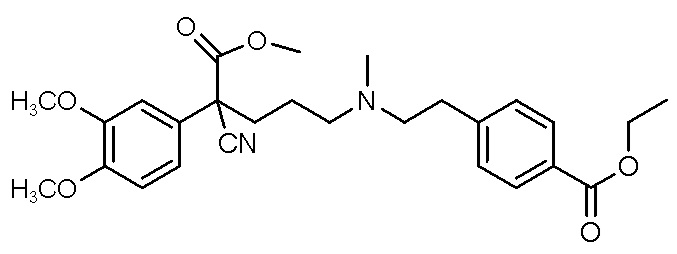 ,
,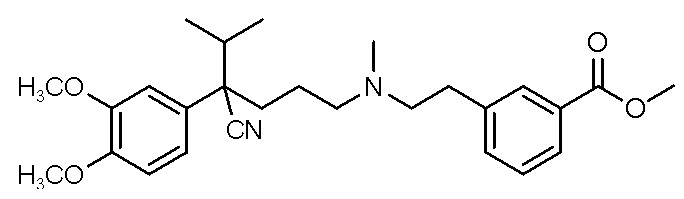 ,
,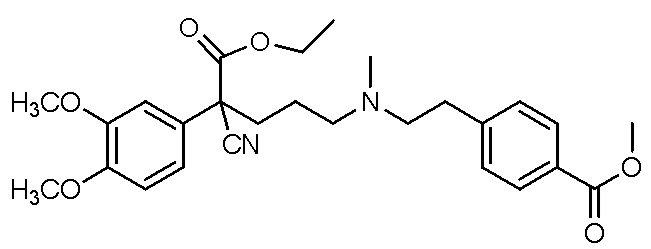 ,
,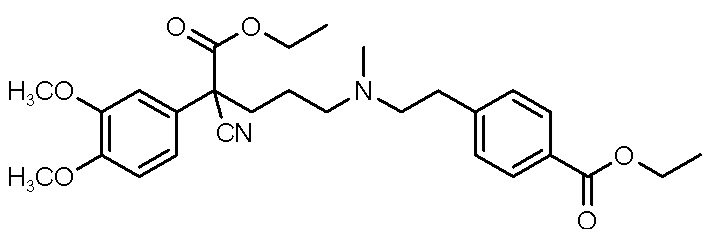 ,
,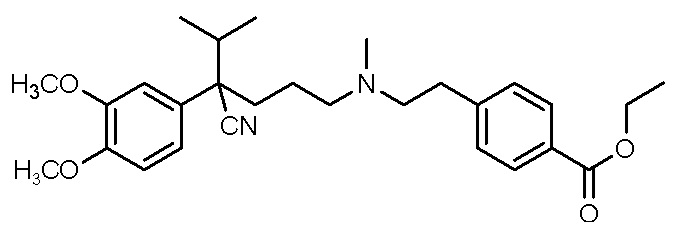 ,
,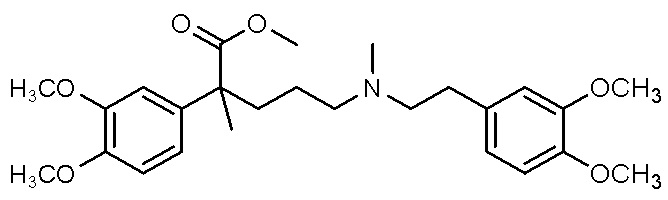 ,
,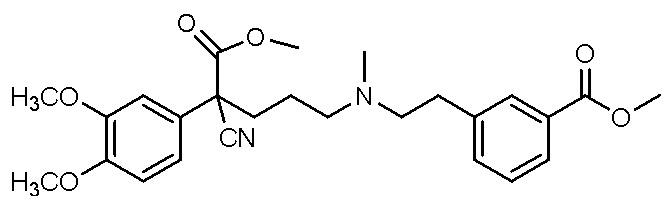 ,
,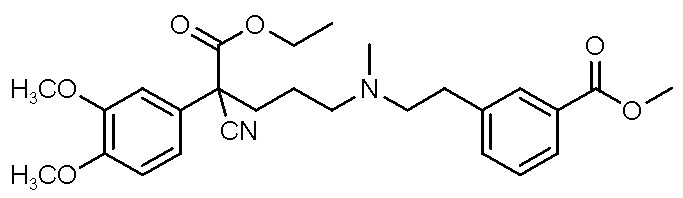 ,
,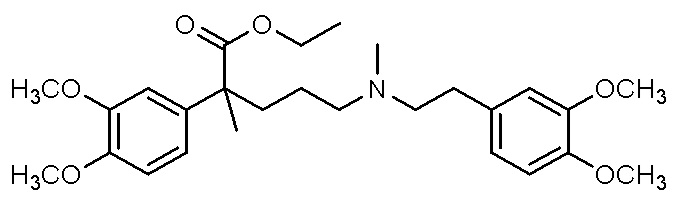 ,
,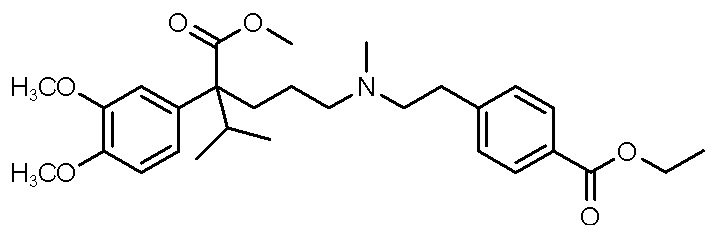 ,
,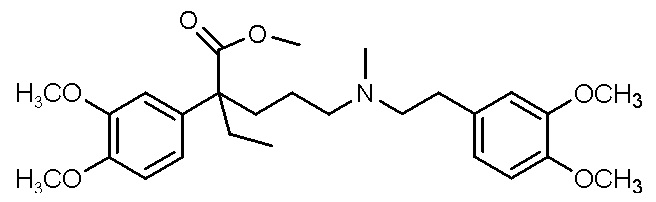 ,
,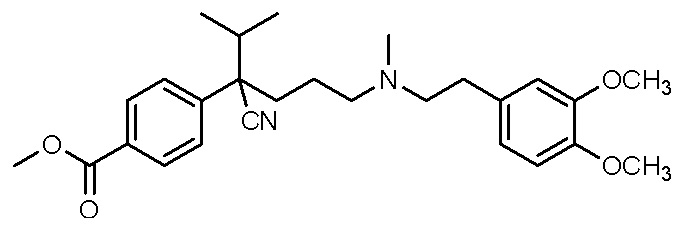 ,
,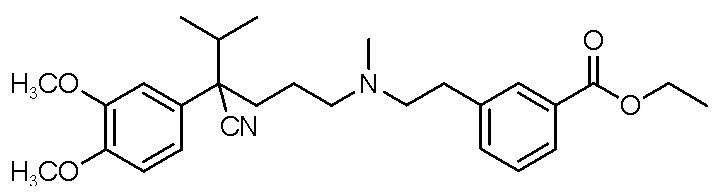 ,
,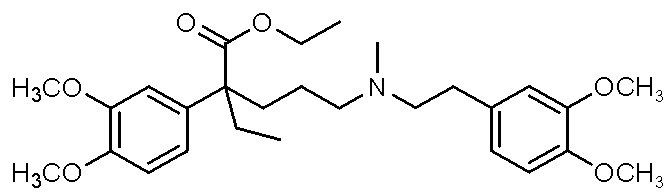 ,
,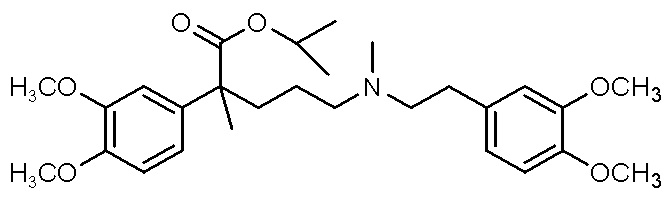 ,
,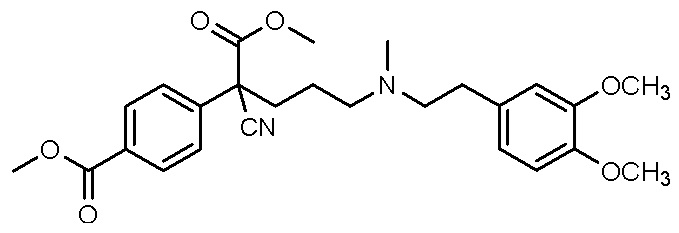 ,
,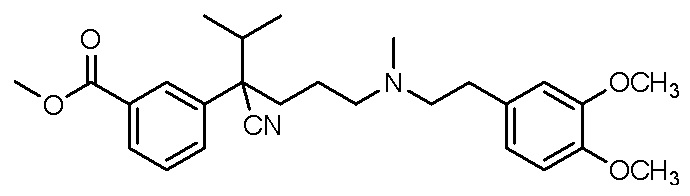 ,
,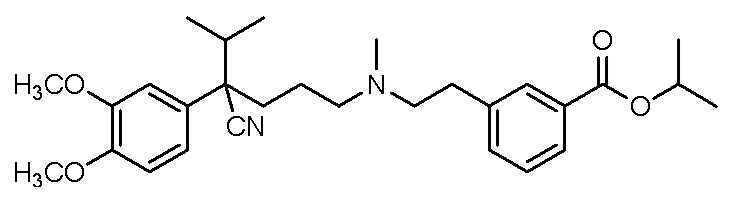 ,
,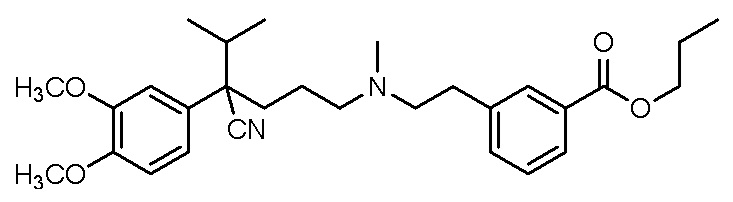 ,
,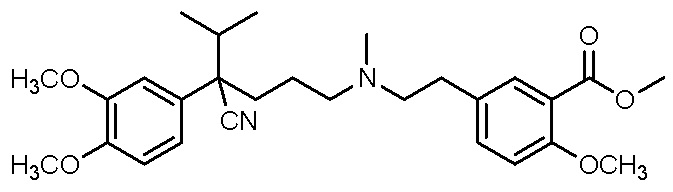 ,
,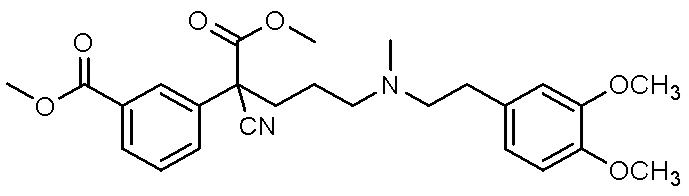 ,
,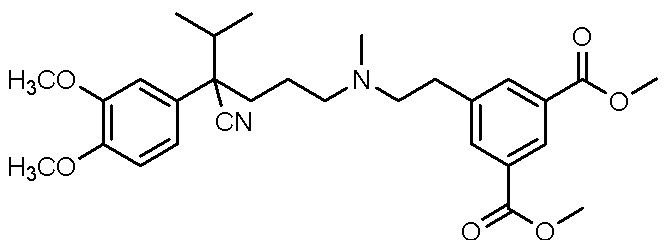 ,
,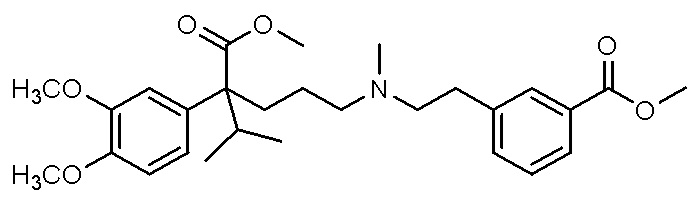 ,
,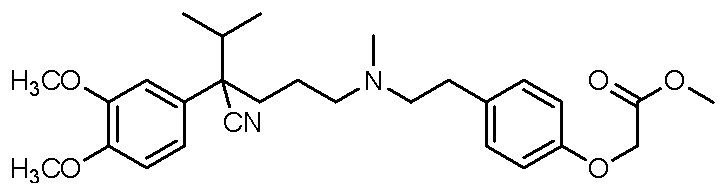 ,
,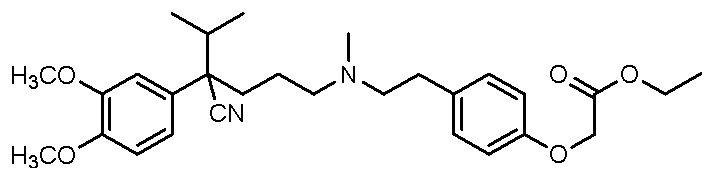 ,
,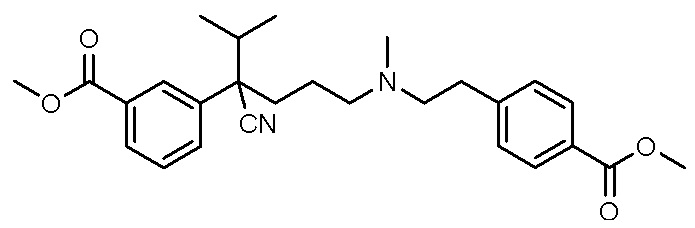 ,
,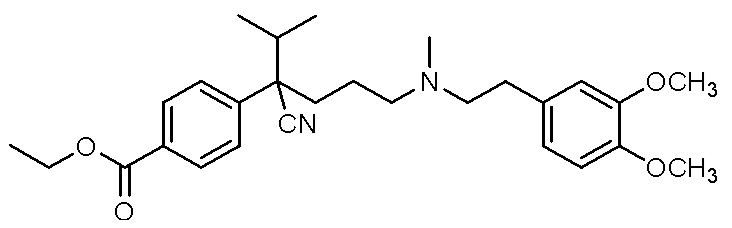 ,
,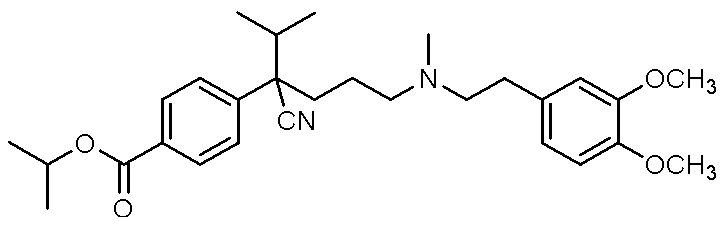 ,
,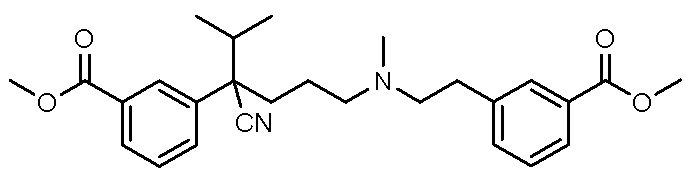 ,
,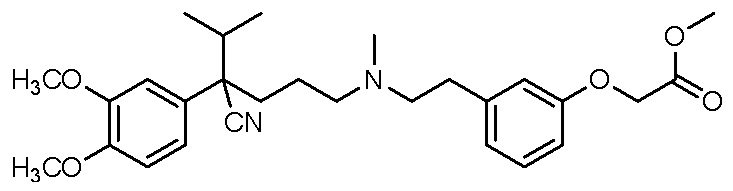 ,
,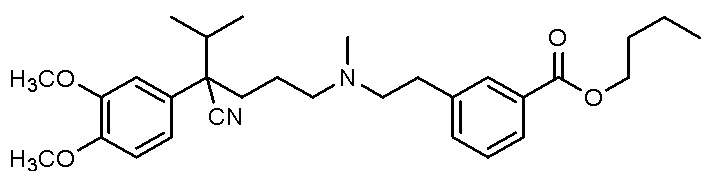 ,
,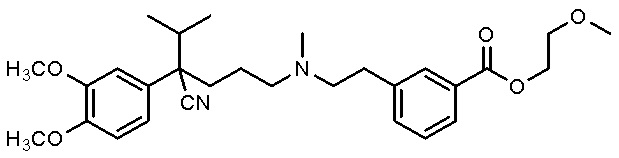 и
и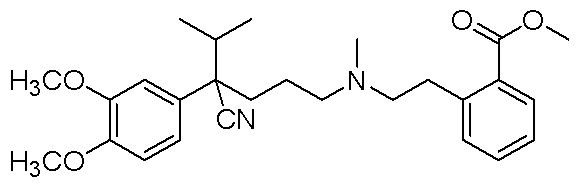 ,
,
либо его рацемат или энантиомер, при этом соединение растворено в водной композиции в концентрации от 150 мг/мл до 600 мг/мл.
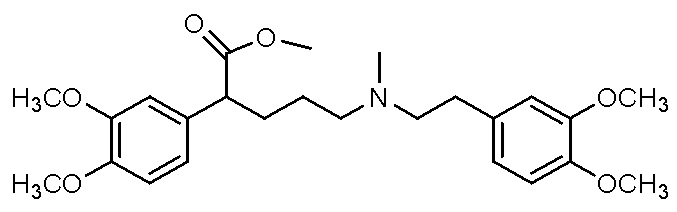
Варианты осуществления настоящего изобретения также относятся к водной композиции, сформулированной для назального введения, содержащей фармацевтически приемлемую соль или свободное основание соединения, выбранного из группы, состоящей из
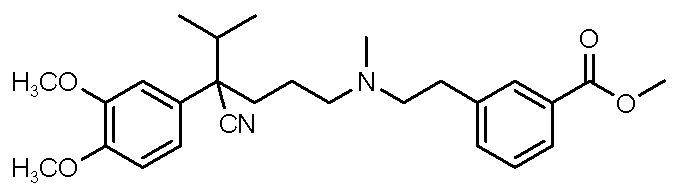 ,
,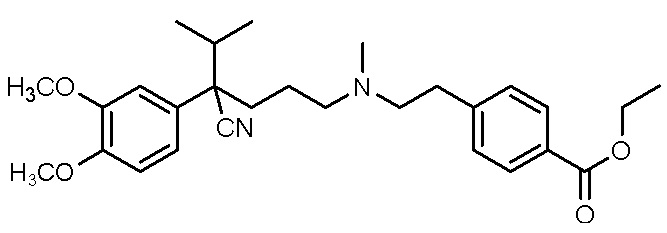 ,
,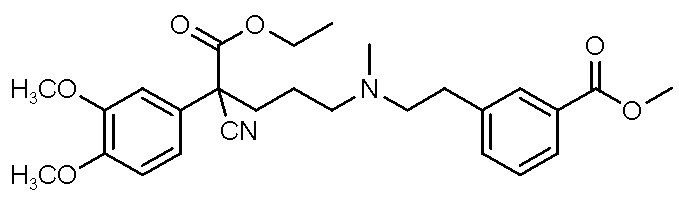 ,
,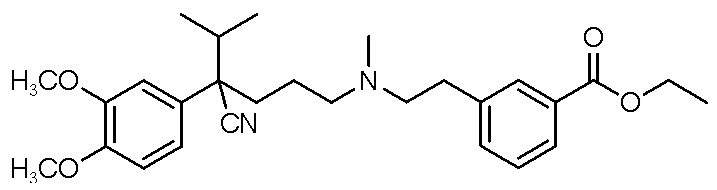 ,
,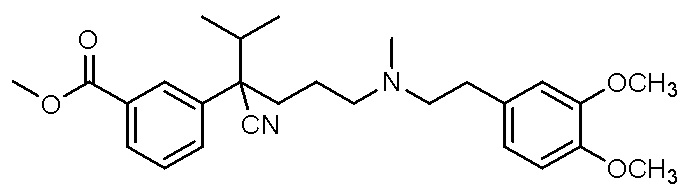 ,
,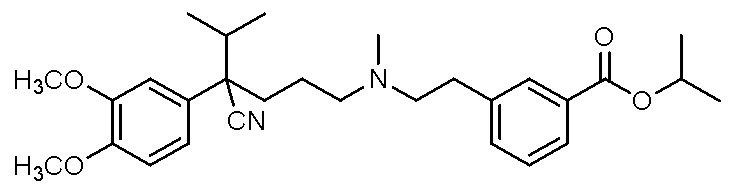 ,
,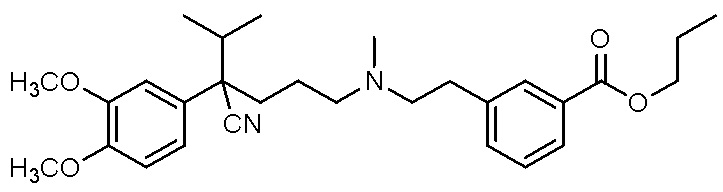 ,
,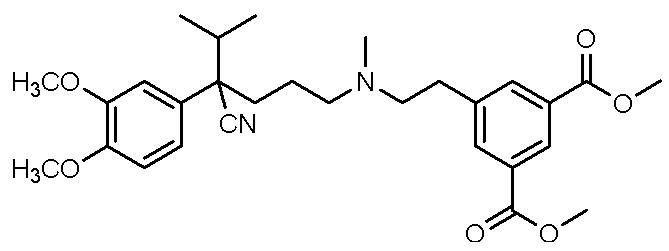 ,
, ,
,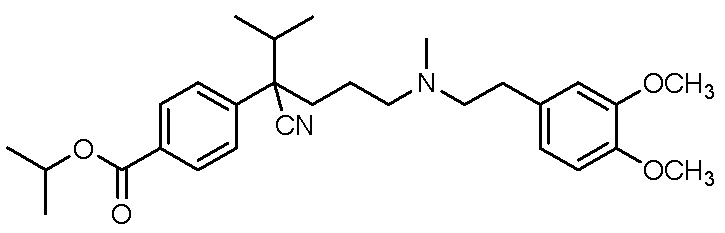 ,
,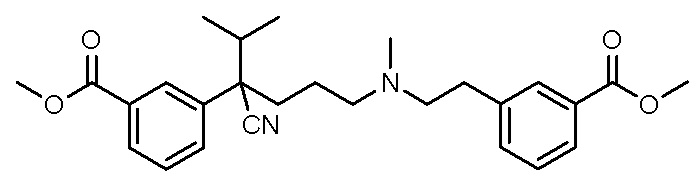 ,
,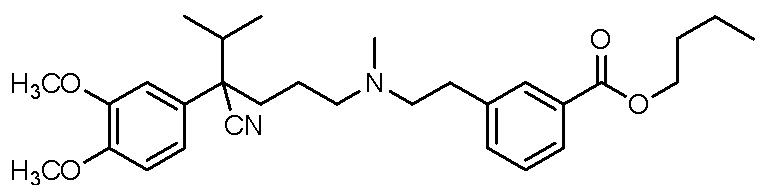 ,
,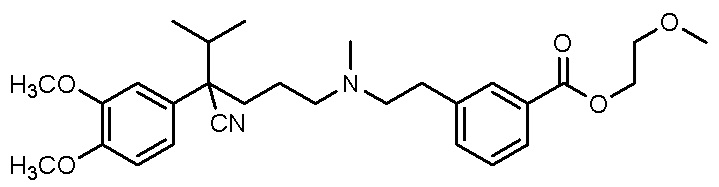 и
и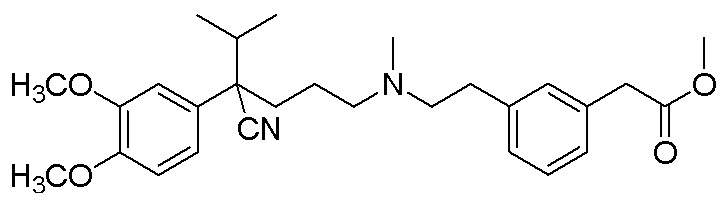 ,
,
либо его рацемат или энантиомер, при этом соединение растворено в водной композиции в концентрации от 150 мг/мл до 600 мг/мл.
В конкретных вариантах осуществления концентрация соединения, которое растворяется в водном растворе, составляет примерно 350 мг/мл. В альтернативных вариантах осуществления концентрация соединения, которое растворяется в водном растворе, составляет примерно 450 мг/мл. В некоторых случаях водная композиция по настоящему изобретению содержит от 40% до 85% (масс/об) воды. В дополнительных вариантах осуществления изобретения водная композиция имеет значение pH 4,5 ± 1,5.
Варианты осуществления настоящего изобретения относятся к водной композиции по любому из вышеуказанных вариантов осуществления, которая содержит соединение, описанное в настоящем документе, например, соединение I, верапамил, галлопамил или девапамил, и 0,5-1,5 молярных эквивалентов уксусной кислоты относительно соединения. Альтернативные варианты осуществления настоящего изобретения относятся к водной композиции по любому из вышеуказанных вариантов осуществления, которая содержит соединение, описанное в настоящем документе, например, соединение I, верапамил, галлопамил или девапамил, и 0,5-1,5 молярных эквивалентов метансульфоновой кислоты относительно соединения.
В некоторых случаях изобретение относится к композиции по любому из вышеуказанных вариантов осуществления, которая содержит хелатирующий агент. В конкретных вариантах осуществления хелатирующий агент представляет собой аминополикарбоновую кислоту.
Дополнительные варианты осуществления изобретения относятся к композиции по любому из вышеуказанных вариантов осуществления, которая содержит этилендиаминтетрауксусную кислоту (EDTA).
В других вариантах осуществления настоящего изобретения композиция по любому из вышеуказанных вариантов осуществления содержит регулятор pH, выбранный из группы, состоящей из серной кислоты и метансульфоновой кислоты. В предпочтительных вариантах осуществления регулятор pH представляет собой серную кислоту.
Дополнительные варианты осуществления изобретения относятся к композиции по любому из вышеуказанных вариантов осуществления, которая имеет вязкость от 10 мПа*с до 70 мПа*с.
Дополнительные варианты осуществления изобретения относятся к композиции по любому из вышеуказанных вариантов осуществления, которая содержит фармацевтически приемлемый эксципиент. В конкретных вариантах осуществления изобретения эксципиент выбирают из группы, состоящей из полисорбата и пропиленгликоля.
Варианты осуществления изобретения также относятся к композиции по любому из вышеуказанных вариантов осуществления, при этом водный раствор, содержащий соль соединения, описанного в настоящем документе, например, соединения I, верапамила, галлопамила или девапамила, остается гомогенным при комнатной температуре. В некоторых случаях водный раствор, содержащий соль соединения, описанного в настоящем документе, например, соединения I, верапамила, галлопамила или девапамила, остается гомогенным при температуре 10°C в течение 4 дней. В других случаях водный раствор, содержащий соль соединения I, остается гомогенным при температуре 2-5°C в течение 7 дней.
Настоящее изобретение также относится к назальной системе доставки, содержащей композицию по любому из вышеуказанных вариантов осуществления в стандартной лекарственной форме, которая содержит не более четырех однократных распыляемых доз. В альтернативных вариантах осуществления назальная система доставки содержит композицию по любому из вышеуказанных вариантов осуществления в стандартной лекарственной форме, которая содержит не более двух однократных распыляемых доз.
В других вариантах осуществления изобретения стандартная лекарственная форма назальной системы доставки спроектирована для введения не более 200 микролитров композиции в каждую ноздрю пациента. В альтернативных вариантах осуществления изобретения стандартная лекарственная форма назальной системы доставки спроектирована для введения не более 150 микролитров композиции в каждую ноздрю пациента.
Кроме того, варианты осуществления настоящего изобретения относятся к композиции, которая содержит ацетатную соль соединения, описанного в настоящем документе, например, соединения I, верапамила, галлопамила или девапамила. В альтернативных вариантах осуществления изобретение относится к композиции, которая содержит метансульфонатную соль соединения, описанного в настоящем документе, например, соединения I, верапамила, галлопамила или девапамила.
Альтернативные варианты осуществления изобретения относятся к способу усиления проникновения через назальный эпителий водного раствора, содержащего ацетатную соль или метансульфонатную соль соединения, описанного в настоящем документе, например, соединения I, верапамила, галлопамила или девапамила, сформулированного в виде раствора для назального спрея, в котором концентрация соли соединения, описанного в настоящем документе, например, соединения I, верапамила, галлопамила или девапамила, составляет от 150 до 600 мг/мл и значение pH раствора составляет 4,5 ± 1,5, включающему добавление примерно 5 мМ EDTA в раствор для назального спрея.
Дополнительные варианты осуществления изобретения относятся к способу лечения заболевания, выбранного из группы, состоящей из сердечной аритмии, стабильной стенокардии и мигрени, включающему назальное введение пациенту, который нуждается в этом, водной композиции, содержащей фармацевтически приемлемую соль соединения, описанного в настоящем документе, например, соединения I, верапамила, галлопамила или девапамила, при этом соединение растворено в водной композиции в концентрации от 150 мг/мл до 600 мг/мл. В конкретных вариантах осуществления заболевание представляет собой сердечную аритмию. В других вариантах осуществления заболевание представляет собой стабильную стенокардию. В альтернативных вариантах осуществления заболевание представляет собой мигрень. В конкретных вариантах осуществления сердечная аритмия представляет собой ПНЖТ, фибрилляцию предсердий или желудочковую тахикардию.
Варианты осуществления изобретения относятся к способу по любому из вышеуказанных вариантов осуществления, в котором соединение достигает терапевтически эффективной концентрации в плазме крови пациента в пределах 3-5 минут после введения пациенту.
Варианты осуществления изобретения также относятся к способу по любому из вышеуказанных вариантов осуществления, дополнительно включающему введение от 150 микролитров до 200 микролитров водной композиции пациенту.
Предпочтительные варианты осуществления изобретения относятся к способу по любому из вышеуказанных вариантов осуществления, в котором пациент является человеком.
Дополнительные варианты осуществления изобретения относятся к применению композиции по любому из вышеуказанных вариантов осуществления в производстве лекарственного средства для лечения заболевания, выбранного из группы, состоящей из сердечной аритмии, стабильной стенокардии и мигрени. В конкретных вариантах осуществления заболевание представляет собой сердечную аритмию. В других вариантах осуществления заболевание представляет собой стабильную стенокардию. В альтернативных вариантах осуществления заболевание представляет собой мигрень. В конкретных вариантах осуществления сердечная аритмия представляет собой ПНЖТ, фибрилляцию предсердий или желудочковую тахикардию.
Изобретение также относится к способу получения раствора, сформулированного для назального введения пациенту, включающему этапы:
a. добавления раствора, содержащего первую растворенную кислоту, к свободному основанию соединения по любому из вышеуказанных вариантов осуществления, с получением смеси;
b. добавления к смеси раствора, содержащего этилендиаминтетрауксусную кислоту;
c. нагревания и механического перемешивания полученной смеси до полного диспергирования соединения в смеси;
d. регулирования pH смеси путем добавления раствора, содержащего вторую растворенную кислоту, к смеси; и
e. разбавления смеси таким образом, чтобы конечная концентрация соединения в растворе составляла по меньшей мере 300 мг в 1 миллилитре.
В конкретных вариантах осуществления изобретения первую растворенную кислоту выбирают из группы, состоящей из уксусной кислоты и метансульфоновой кислоты.
В конкретных вариантах осуществления вторую растворенную кислоту выбирают из группы, состоящей из уксусной кислоты, серной кислоты и метансульфоновой кислоты.
В дополнительных вариантах осуществления конечное значение pH раствора составляет от примерно 4,0 до примерно 5,0. В предпочтительных вариантах осуществления конечное значение pH раствора составляет примерно 4,5.
Варианты осуществления изобретения также относятся к вышеописанному способу, в котором раствор, содержащий соль соединения, описанного в настоящем документе, например, соединения I, верапамила, галлопамила или девапамила, остается гомогенным при температуре 10°C в течение 4 дней. В альтернативных вариантах осуществления раствор, содержащий соль соединения, описанного в настоящем документе, например, соединения I, верапамила, галлопамила или девапамила, остается гомогенным при температуре 2-5°C в течение 7 дней.
ОПРЕДЕЛЕНИЯ
Используемый в настоящем документе термин «тахикардия» означает повышенную по сравнению с нормальным состоянием частоту сердечных сокращений в покое.
Используемый в настоящем документе термин «сердечная аритмия» означает состояние, характеризующееся аномальным сердечным ритмом, который бывает нерегулярным, слишком быстрым, слишком медленным, либо в случае проведения импульса через аномальный электрический путь в сердце. Сердечные аритмии включают фибрилляцию предсердий, характеризующуюся аномально быстрыми электрическими разрядами, которые заставляют предсердия сокращаться очень быстро, тем самым препятствуя эффективному перекачиванию крови в желудочки. Сердечные аритмии также включают ПНЖТ, которая характеризуется равномерным и быстрым сердечным ритмом с аритмогенным очагом, находящимся в сердечной ткани над желудочками. Сердечные аритмии также включают желудочковую тахикардию, которая характеризуется быстрым сердцебиением с аритмогенным очагом, находящимся в нижних отделах сердца.
Используемый в настоящем документе термин «стенокардия» означает состояние дискомфорта в грудной клетке, возникающее в результате ишемической болезни сердца. «Стабильная стенокардия» представляет собой стенокардию, которая в основном вызвана артериосклерозом.
Используемый в настоящем документе термин «мигрень» означает заболевание, которое характеризуется повторяющейся головной болью, как правило, на одной стороне головы, часто сопровождающейся тошнотой, рвотой или светочувствительностью.
Используемый в настоящем документе термин «эксципиент» означает любой ингредиент, отличный от активного соединения (например, соединения формулы I), описанного в настоящем документе. Эксципиенты могут включать, например: антиадгезивы, антиоксиданты, связывающие вещества, покрытия, добавки для прессования, дезинтегрирующие средства, красители (красящие вещества), смягчающие вещества, эмульгаторы, наполнители (разбавители), пленкообразующие вещества или покрытия, вкусо-ароматические добавки, ароматизаторы, вещества, способствующие скольжению (вещества, препятствующие слеживанию и комкованию), смазывающие средства, консерванты, печатные краски, сорбенты, суспендирующие или диспергирующие средства, подсластители или гидратную воду. Иллюстративные эксципиенты включают, но не ограничиваются ими: бутилированный гидрокситолуол (BHT), карбонат кальция, фосфат кальция (двухосновный), стеарат кальция, кроскармеллозу, сшитый поливинилпирролидон, лимонную кислоту, кросповидон, цистеин, этилцеллюлозу, желатин, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, лактозу, стеарат магния, мальтит, маннит, метионин, метилцеллюлозу, метилпарабен, микрокристаллическую целлюлозу, полиэтиленгликоль, поливинилпирролидон, повидон, прежелатинизированный крахмал, пропилпарабен, ретинил пальмитат, шеллак, диоксид кремния, натрий-карбоксиметилцеллюлозу, цитрат натрия, натриевую соль гликолята крахмала, сорбит, крахмал (кукурузный), стеариновую кислоту, стеариновую кислоту, сахарозу, тальк, диоксид титана, витамин A, витамин E, витамин C и ксилит. Дополнительные эксципиенты могут включать, без ограничения, полисорбат, пропиленгликоль, гидроксипропил-β-циклодекстрин, триэтилцитрат, бензалкония хлорид и N-додецил-β-D-мальтозид.
Используемый в настоящем документе термин «хелатирующий агент» означает молекулу, способную образовывать по меньшей мере две химические связи с катионом металла, в результате чего образуется комплекс.
Используемый в настоящем документе термин «аминополикарбоновая кислота» означает молекулу, содержащую по меньшей мере один амин и по меньшей мере две функциональные группы карбоновых кислот. Карбоновые кислоты в аминополикарбоновой кислоте могут быть депротонированы и существовать в анионной форме в виде карбоксилатных групп. Примеры аминополикарбоновых кислот включают, без ограничения, иминодиуксусную кислоту (IDA), нитрилотриуксусную кислоту (NTA), диэтилентриаминпентауксусную кислоту (DTPA), этилендиаминтетрауксусную кислоту (EDTA), этиленгликольтетрауксусную кислоту (EGTA), (1,2-бис(o-аминофенокси)этан-N,N,N',N'-тетрауксусную кислоту) (BAPTA), 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусную кислоту (DOTA) и N-(N-(3-амино-3-карбоксипропил)-3-амино-3-карбоксипропил)азетидин-2-карбоновую кислоту (никотианамин), среди прочих.
Используемый в настоящем документе термин «назальное введение» означает абсорбцию соединения или фармацевтически приемлемого препарата соединения при контакте соединения или препарата с назальным эпителием. Это может быть достигнуто путем распыления соединения или препарата в носовой полости. Предпочтительно, соединение представляет собой соединение I, верапамил, галлопамил или девапамил.
Используемую по настоящему изобретению «фармацевтически приемлемую соль» или «фармацевтически приемлемую кислотно-аддитивную соль» основного фармацевтически активного соединения получают путем обработки соединения органической кислотой или неорганической кислотой. Иллюстративные фармацевтически приемлемые кислотно-аддитивные соли включают соли, полученные при обработке соединения уксусной кислотой или метансульфоновой кислотой.
Используемый в настоящем документе термин «фармацевтически приемлемый носитель» означает носитель, в котором может быть суспендировано или растворено активное соединение, и который является нетоксичным и не вызывающем воспаление у пациента. Кроме того, фармацевтически приемлемый носитель может содержать фармацевтически приемлемую добавку, такую как консервант, антиоксидант, ароматизатор, эмульгатор, краситель или эксципиент, известную или используемую в области создания препаратов лекарственного средства, существенно не препятствующую терапевтическому действию активного средства и не токсичную для пациента.
Используемый в настоящем документе термин «фармацевтически приемлемый препарат» означает композицию, содержащую фармацевтически приемлемый носитель и активное соединение, например, соединение формулы I.
Используемый в настоящем документе термин «терапевтически эффективное количество» означает количество активного соединения, которое при введении пациенту приводит к уменьшению, устранению, либо предотвращению одного или более симптомов сердечной аритмии (такой как ПНЖТ), стабильной стенокардии или мигрени. Предпочтительно, терапевтически эффективное количество фармацевтического препарата представляет собой водный раствор, содержащий соединение по изобретению (например, соединение формулы I) в диапазоне концентраций от примерно 150 мг/мл до примерно 600 мг/мл.
Данные определения и другие определения, приведенные в сборниках «The Merck Manual», 16е издание, 1992 (Chapter 25. pp. 461-498; Chapter 25, pp. 498-507; и Chapter 24, pp. 413-429) и Goodman and Gilman, «The Pharmacological Basis of Therapeutics» 11е издание, 2006 (Chapter 34, pp. 899-908; Chapter 31, pp. 823-824 и pp. 830-832; и Chapter 32, pp. 845-846) включены в настоящий документ посредством ссылки.
Другие признаки и преимущества изобретения станут понятны из следующего далее подробного описания и формулы изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
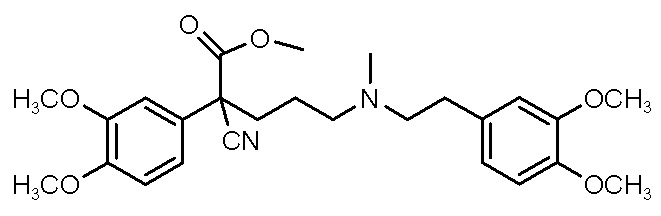
Настоящее изобретение основано на том неожиданном открытии, что ранее охарактеризованный блокатор кальциевых каналов может быть сформулирован в виде полученной с уксусной кислотой или метансульфоновой кислотой кислотно-аддитивной соли, которая имеет очень хорошую растворимость в водном растворе. Соединения по настоящему изобретению включают метил-3-(2-((4-циано-4-(3,4-диметоксифенил)-5-метилгексил)(метил)амино)этил)бензоат, имеющий приведенную ниже формулу I.
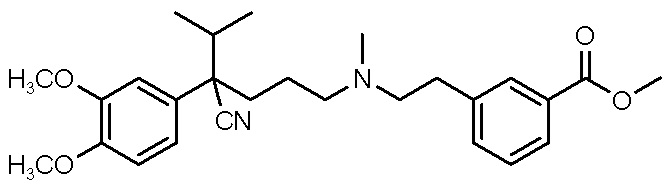 (I).
(I).
Дополнительные соединения по изобретению включают другие блокаторы кальциевых каналов, такие как верапамил, галлопамил, девапамил, а также конкретные соединения, описанные в настоящем документе.
Ранее известные препараты блокаторов кальциевых каналов, такие как верапамил и дилтиазем, не способны обеспечивать немедленное облегчение сердечной аритмии, стабильной стенокардии или мигрени. Причиной этого частично является фармакокинетический профиль этих препаратов лекарственных средств. Являясь пероральными терапевтическими средствами, эти соединения поступают в организм через желудочно-кишечный тракт, где они подвергаются деградации и инактивации под действием кислоты и ферментов. Эти соединения медленно поступают в кровоток за счет абсорбции кишечным эпителием. До настоящего времени такой путь введения препятствовал быстрому воздействию этих лекарственных средств на потенциал-чувствительные кальциевые каналы в зоне аномальной сигнализации в сердце, являющейся причиной сердечной аритмии, такой как ПНЖТ. Вследствие этого, данные лекарственные средства обычно принимают в режиме постоянного превентивного лечения и не используют для немедленного облегчения симптомов во время эпизодов этих заболеваний. Кроме того, поскольку кальциевая сигнализация также модулирует нормальные сокращения сердечной мышцы, в идеале, лекарственное средство для купирования эпизода сердечной аритмии, такой как ПНЖТ, должно быстро абсорбироваться и затем быстро метаболизироваться и дезактивироваться для уменьшения побочного ингибирования кальциевых каналов. Действительно, обычные побочные эффекты при приеме пероральных препаратов верапамила и дилтиазема включают уменьшение сократимости кардиомиоцитов и подавление проводимости АВ узла.
Растворимые в воде водные соли
Соединение I и другие блокаторы кальциевых каналов, такие как верапамил, галлопамил и девапамил, а также энантиомеры и рацематы данных соединений, могут быть растворены в водном растворе и сформулированы для назального введения. Назальное введение обладает преимуществом перед пероральным введением, заключающимся в том, что фармацевтически активное средство может быстро проходить через назальный эпителий и немедленно поступать в кровоток. В этом случае, когда терапевтически эффективное количество активного соединения находится в кровотоке, соединение может нарушать аберрантную сердечную сигнализацию в аномальных волокнах сердечной мышцы и обеспечивать пациенту облегчение при начавшемся эпизоде сердечной аритмии, стабильной стенокардии или мигрени. После нахождения в крови в течение периода времени, достаточного для восстановления надлежащей активности кардиомиоцитов, соединение быстро метаболизируется и дезактивируется, что предотвращает продолжительное воздействие на сердце и вредные побочные эффекты.
Несмотря на проверенные механизмы действия соединения I, верапамила, галлопамила и девапамила, для назального введения необходимы высокие концентрации активного соединения вследствие ограничения по объему, налагаемого размерами носовой полости. Объем, вводимый с помощью назальных спреев, как правило, ограничен примерно 150-200 мкл, жидкий препарат в объемах, превышающих эти значения, вводят через горло. Это обстоятельство, в свою очередь, налагает ограничения на количество фармацевтически активного средства, которое можно доставлять на эпителиальную выстилку носовой полости.
Из-за преобладания ароматических и насыщенных алифатических фрагментов в сочетании с недостатком образующих ионные или водородные связи функциональных групп не ожидалось, что соединение I, верапамил, галлопамил или девапамил будут легко растворяться в водном растворе. Кроме того, учитывая, что раствор одного из этих соединений должен быть высококонцентрированным, чтобы обеспечивать доставку терапевтически эффективного количества лекарственного средства в ограниченном объеме, диктуемом размерами носовой полости, до настоящего изобретения было неизвестно, является ли это осуществимым.
Удивительно, но концентрированные водные растворы соединения I могут быть получены путем обработки данного соединения конкретными органическими кислотами с целью образования кислотно-аддитивных солей. Метансульфоновая кислота и уксусная кислота были способны образовывать солевой раствор с соединением I в концентрациях, достаточных для назального введения. Для назального введения, предпочтительный водный раствор соединения I будет иметь растворимость примерно от 150 мг/мл до 600 мг/мл (например, 150 ± 25 мг/мл, 175 ± 25 мг/мл, 200 ± 25 мг/мл, 225 ± 25 мг/мл, 250 ± 25 мг/мл, 275 ± 25 мг/мл, 300 ± 25 мг/мл, 325 ± 25 мг/мл, 350 ± 25 мг/мл, 375 ± 25 мг/мл, 400 ± 25 мг/мл, 425 ± 25 мг/мл, 450 ± 25 мг/мл, 475 ± 25 мг/мл, 500 ± 25 мг/мл, 525 ± 25 мг/мл, 550 ± 25 мг/мл, 575 ± 25 мг/мл или 600 ± 25 мг/мл). Такие концентрации соответствуют процентному содержанию воды от 40% до 85% (масс/об). Неожиданно было обнаружено, что уксусная кислота и метансульфоновая кислота действительно способны индивидуально образовывать соли соединения I, имеющие высокую растворимость в водном растворе. Высокая растворимость ацетатных и мезилатных солей соединения I делает эти соли уникальным образом подходящими для назального введения, поскольку высокие концентрации соединения I, которые могут быть достигнуты в случае этих солевых форм, делают возможной доставку терапевтически эффективного количества соединения в объеме, ограниченном размерами носовой полости. С учетом сходства по химической структуре между соединением I и верапамилом, галлопамилом и девапамилом, а также их энантиомерами и рацематами, ожидается, что эти соединения будут аналогичным образом растворимы в условиях, описанных в настоящем документе.
Общепринятым способом определения эффективности лекарственного средства для купирования эпизода сердечной аритмии, такой как ПНЖТ, является анализ электрокардиограммы (ЭКГ), регистрируемой у пациента, испытывающего такой эпизод. ЭКГ регистрирует величину и время электрической сигнализации в сердечной ткани, и у пациентов во время эпизода ПНЖТ, как правило, наблюдается аномальный профиль ЭКГ, согласующийся с аберрантной сигнализацией в сердце. Одним из ключевых признаков сигнализации в здоровом сердце является временная задержка между инициацией предсердных и желудочковых потенциалов действия. Задержка между сигнализацией в предсердиях и желудочках необходима для эффективного перекачивания крови. В первую очередь должна начинаться сигнализация в предсердиях, чтобы вся находящаяся в камерах предсердий кровь переместилась в желудочки до того, как произойдет сокращение желудочков. Эта задержка фиксируется графически на ЭКГ как сегмент PR, который является интервалом между началом Р-волны (соответствующей началу деполяризации предсердий) и комплексом QRS (соответствующим началу деполяризации желудочков). У пациентов во время эпизода ПНЖТ, как правило, наблюдается сокращение задержки вследствие аберрантной сердечной сигнализации, заставляющей мышечную ткань, образованную кардиомиоцитами, сокращаться нерегулярно (Basta, et al., Cardiol. Clinics, 1997, 587-598). Вследствие этого, у таких пациентов наблюдается уменьшение сегмента PR при анализе ЭКГ.
Показано, что увеличение по меньшей мере на 10% сегмента PR на ЭКГ пациента, страдающего сердечной аритмией, хорошо коррелирует с завершением эпизода ПНЖТ. Например, показано, что терапевтическая доза верапамила, введенная внутривенно пациентам во время эпизода ПНЖТ, вызывала пролонгирование PR по меньшей мере на 10%, что коррелировало с 85-90% эффективностью купирования эпизода ПНЖТ (Reiter, et al., Clin. Pharmacol. Ther., 1982, 711-720). Также было показано, что внутривенное введение текаденозона способно приводить к купированию ПНЖТ с эффективностью примерно 86% (у 32 из 37 пациентов эпизод ПНЖТ был купирован). Такой результат коррелировал со средним пролонгированием PR на 8,5%. На основании совокупности этих данных можно ожидать, что терапевтическое средство, способное индуцировать пролонгирование PR по меньшей мере на примерно 10%, будет эффективным для купирования эпизода ПНЖТ у пациента. Были проведены эксперименты, в которых растворы по изобретению, содержащие растворенную ацетатную соль соединения I, вводили назально пациентам во время эпизода ПНЖТ. Вводимые пациентам растворы содержали ацетатную соль соединения I в разных концентрациях. Во время исследования раствор, содержащий ацетатную соль соединения I в конкретной концентрации, был введен пациенту, испытывающему эпизод ПНЖТ, и на протяжении всего эксперимента у пациента регистрировали электрокардиограмму. Введение растворов ацетатной соли соединения I, содержащих 60 мг или более соединения I, было способно приводить к среднему пролонгированию PR более, чем на 10% у пациентов, испытывающих эпизод ПНЖТ. Результаты этих экспериментов свидетельствуют о том, что доза, содержащая 60 мг соединения I, содержит количество соединения I, являющееся терапевтически эффективным для купирования эпизода ПНЖТ. Другие предпочтительные дозы соединения, описанного в настоящем документе, такого как соединение I, верапамил, галлопамил или девапамил, включают дозы в диапазоне от 15 мг до 140 мг активного соединения (например, 15 мг, 20 мг, 25 мг, 30 мг, 35 мг, 40 мг, 45 мг, 50 мг, 55 мг, 60 мг, 65 мг, 70 мг, 75 мг, 80 мг, 85 мг, 90 мг, 95 мг, 100 мг, 105 мг, 110 мг, 115 мг, 120 мг, 125 мг, 130 мг, 135 мг, 140 мг и так далее).
Водный раствор, содержащий ацетатную или метансульфонатную соль соединения, описанного в настоящем документе, такого как соединение I, верапамил, галлопамил или девапамил, имеют определенный диапазон вязкости. В конкретных вариантах осуществления вязкость такого раствора может находиться в диапазоне от 10 мПа*с до 70 мПа*с (например, 10 мПа*с, 15 мПа*с, 20 мПа*с, 25 мПа*с, 30 мПа*с, 35 мПа*с, 40 мПа*с, 45 мПа*с, 50 мПа*с, 55 мПа*с, 60 мПа*с, 65 мПа*с или 70 мПа*с). Например, раствор, содержащий соль соединения I в концентрации 315 мг/мл, имеет вязкость от примерно 16,515 мПа*с до примерно 37,505 мПа*с. В другом примере, раствор, содержащий соль соединения I в концентрации 360 мг/мл, имеет вязкость от примерно 25,645 мПа*с до примерно 63,105 мПа*с.
Усилитель проникновения
Чтобы иметь идеальный фармакокинетический профиль, фармацевтически активное соединение или его фармацевтически приемлемая соль могут быть сформулированы с материалом, способным усиливать проникновение активного средства. В препарате по настоящему изобретению соединение, описанное в настоящем документе, такое как соединение I, верапамил, галлопамил или девапамил, в идеале, будет поступать в кровоток быстро (например, в пределах 3-5 минут после введения пациенту).
В предпочтительном варианте осуществления настоящего изобретения усилитель проникновения настоящего препарата представляет собой хелатирующий агент. Более предпочтительно, хелатирующий агент способен координировать двухвалентные ионы кальция (Ca2+). Показано, что эпителиальные клетки слизистых оболочек находятся в тесном контакте за счет образования плотных соединений. Для параклеточного транспорта фармацевтически активного соединения через эпителий необходимо, чтобы соединение проникало через эти межклеточные соединения. Для трансклеточного транспорта, альтернативного параклеточному транспорту, необходимо, чтобы соединение проникало через эпителий путем прохождения через апикальную и базалатеральную мембраны, для этого процесса многие молекулы не подходят вследствие своего большого молекулярного объема. Однако хелатирующие агенты делают параклеточный транспорт возможным за счет связывания и секвестрирования внутриклеточного кальция (Cassidy, et al., J. Cell Biol., 1967, 32: 685-698). Кальций имеет важное значение для биогенеза плотных соединений между эпителиальными клетками, и уменьшение концентрации внутриклеточного кальция нарушает целостность этих соединений и позволяет некоторым молекулам проникать в межклеточное пространство между соседними клетками.
Иллюстративные хелатирующие агенты, способные координировать ионы кальция, включают аминополикарбоновые кислоты. Они включают, без ограничения, иминодиуксусную кислоту (IDA), нитрилотриуксусную кислоту (NTA), диэтилентриаминпентауксусную кислоту (DTPA), этилендиаминтетрауксусную кислоту (EDTA), этиленгликольтетрауксусную кислоту (EGTA), (1,2-бис(o-аминофенокси)этан-N,N,N',N'-тетрауксусную кислоту) (BAPTA), 1,4,7,10-тетраазациклододекан-1,4,7,10-тетрауксусную кислоту (DOTA) и N-(N-(3-амино-3-карбоксипропил)-3-амино-3-карбоксипропил)азетидин-2-карбоновую кислоту (никотианамин), среди прочих. В предпочтительном варианте осуществления хелатирующий агент представляет собой EDTA.
Несмотря на использование хелатирующих агентов, таких как EDTA, для увеличения способности лекарственных средств к проникновению через эпителиальную ткань, было удивительно, что использование EDTA в настоящем препарате приводило к усилению проникновения соединения I через назальный эпителий. В преддверии носа, на которое приходится примерно 3-4% площади поверхности носовой полости, полностью отсутствуют плотные межклеточные соединения и, вследствие этого, оно не подвержено влиянию хелатирующих кальций агентов. Показано, что EDTA модулирует образование плотных соединений, однако, даже когда соединения нарушены, межклеточные поры в назальном эпителии являются чрезвычайно мелкими. Вследствие этого, было постулировано, что назальный эпителий не восприимчив к модуляции проницаемости за счет EDTA (Aungst, et al., Pharma. Res., 1998, 5: 305-308). Кроме того, способность EDTA усиливать проникновение соединения через назальный эпителий снижается по мере возрастания молекулярной массы соединений (Nakanishi, et al., Chem. Pharm. Bull., 1984, 32: 1628-1632).
Регуляторы pH
В конкретных вариантах осуществления изобретения желательно регулировать pH водного раствора, содержащего фармацевтически приемлемую соль соединения, описанного в настоящем документе, такого как соединение I, верапамил, галлопамил или девапамил. Значение pH препарата можно регулировать, добавляя в водный раствор, содержащий соль одного из этих соединений, раствор, содержащий кислый или щелочной реагент. В предпочтительных вариантах осуществления pH препарата регулируют путем титрования водного раствора раствором, содержащим кислоту. Значение pH препарата предпочтительно составляет от 3,5 до 5,5, (например, 3,5, 3,6, 3,7, 3,8, 3,9, 4,0, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9, 5,0, 5,1, 5,2, 5,3, 5,4 или 5,5), и наиболее предпочтительно 4,5. Значение pH препарата можно регулировать путем добавления водного раствора, содержащего кислоту, к препарату, с тем, чтобы снизить значение pH до идеальной величины. Иллюстративные кислоты, которые можно использовать для титрования водного раствора, содержащего соль соединения, описанного в настоящем документе, такого как соединение I, верапамил, галлопамил или девапамил, включают, без ограничения, уксусную кислоту, серную кислоту и метансульфоновую кислоту. В предпочтительных вариантах осуществления кислота, используемая для регулирования pH препарата, представляет собой серную кислоту или метансульфоновую кислоту.
Дополнительные эксципиенты
Препараты по настоящему изобретению могут содержать другие средства, способные усиливать проникновение, повышать растворимость, стабильность или эффективность соединения, описанного в настоящем документе, такого как соединение I, верапамил, галлопамил или девапамил. Фармацевтически приемлемые эксципиенты могут включать антиадгезивы, антиоксиданты, связывающие вещества, покрытия, добавки для прессования, дезинтегрирующие средства, красители (красящие вещества), смягчающие вещества, эмульгаторы, наполнители (разбавители), пленкообразующие вещества или покрытия, вкусо-ароматические добавки, ароматизаторы, вещества, способствующие скольжению (вещества, препятствующие слеживанию и комкованию), смазывающие средства, консерванты, печатные краски, сорбенты, суспендирующие или диспергирующие средства, подсластители или гидратную воду. Иллюстративные эксципиенты включают, но не ограничиваются ими: бутилированный гидрокситолуол (BHT), карбонат кальция, фосфат кальция (двухосновный), стеарат кальция, кроскармеллозу, сшитый поливинилпирролидон, лимонную кислоту, кросповидон, цистеин, этилцеллюлозу, желатин, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, лактозу, стеарат магния, мальтит, маннит, метионин, метилцеллюлозу, метилпарабен, микрокристаллическую целлюлозу, полиэтиленгликоль, поливинилпирролидон, повидон, прежелатинизированный крахмал, пропилпарабен, ретинил пальмитат, шеллак, диоксид кремния, натрий-карбоксиметилцеллюлозу, цитрат натрия, натриевую соль гликолята крахмала, сорбит, крахмал (кукурузный), стеариновую кислоту, стеариновую кислоту, сахарозу, тальк, диоксид титана, витамин A, витамин E, витамин C и ксилит. Дополнительные эксципиенты могут включать, без ограничения, полисорбат, пропиленгликоль, гидроксипропил-β-циклодекстрин, триэтилцитрат, бензалкония хлорид и N-додецил-β-D-мальтозид.
Препарат по настоящему изобретению может, необязательно, содержать фармацевтически приемлемый носитель. Примеры фармацевтически приемлемых носителей включают, без ограничения, консервант, антиоксидант, ароматизатор, эмульгатор, краситель или эксципиент, известные или используемые в области создания препаратов лекарственного средства, существенно не препятствующие терапевтическому действию активного средства и не токсичные для пациента.
Назальная система доставки
Настоящее изобретение дополнительно относится к назальной системе доставки для введения водных растворов солей соединения, описанного в настоящем документе, такого как соединение I, верапамил, галлопамил или девапамил, в назальную полость пациента, страдающего сердечной аритмией, стабильной стенокардией или мигренью. Назальная система доставки по изобретению содержит водный раствор ацетатной или метансульфонатной соли соединения, описанного в настоящем документе, такого как соединение I, верапамил, галлопамил или девапамил, в стандартной лекарственной форме. Этот раствор может дополнительно содержать другие материалы, включая, без ограничения, усилитель проникновения, фармацевтически приемлемый эксципиент и/или регулятор pH. Назальная система доставки содержит стандартную лекарственную форму в виде распыляемой дозы. В этом случае назальную систему доставки можно использовать для введения водного раствора, содержащего ацетатную или метансульфонатную соль соединения, описанного в настоящем документе, такого как соединение I, верапамил, галлопамил или девапамил, в носовую полость пациента во время эпизода сердечной аритмии, стабильной стенокардии или мигрени. В момент начала эпизода пациент может с легкостью самостоятельно вводить себе данный препарат, содержащий одно из этих активных соединений, вводя аппликатор назальной системы доставки в носовую полость и нажатием приводя в действие распылительный насос. В результате произойдет впрыскивание аэрозоля, содержащего водный раствор соли активного соединения, в носовую полость и на назальный эпителий.
Назальная система доставки аналогична коммерчески доступным назальным системам доставки, таким как те, которые используют для доставки таких лекарственных средств, как имитрекс® (суматриптан) от компании GlaxoSmithKline (Brentford, UK) и зомиг® (золмитриптан) от компании Impax Pharmaceuticals (Hayward, CA, USA). Эти системы включают флакон, поршень, вихревую камеру и мундштук. При надавливании на мундштук жидкость проталкивается через вихревую камеру и выпускается в виде аэрозоля. Такие назальные системы доставки часто включают механизм стабилизации глубины нажатия для гарантии того, что к системе применяется одинаковое давление, для выпуска одного и того же объема аэрозоля (Rapoport, et al., Headache, 2006, 46: S192-S201). Назальная система доставки по изобретению содержит стандартную лекарственную форму, содержащую не более четырех (например, одну, две, три или четыре) однократных распыляемых доз. В альтернативных вариантах осуществления стандартная лекарственная форма содержит не более двух (например, одну или две) однократных распыляемых доз. Стандартная лекарственная форма может быть спроектирована для доставки не более 200 мкл (например, 200 мкл, 190 мкл, 180 мкл, 170 мкл, 160 мкл, 150 мкл, 140 мкл, 130 мкл, 120 мкл, 110 мкл или 100 мкл) водного раствора, содержащего соль соединения, описанного в настоящем документе, такого как соединение I, верапамил, галлопамил или девапамил. В альтернативных вариантах осуществления стандартная лекарственная форма спроектирована для доставки не более 150 мкл (например, 150 мкл, 140 мкл, 130 мкл, 120 мкл, 110 мкл или 100 мкл) водного раствора, содержащего ацетатную или метансульфонатную соль соединения, описанного в настоящем документе, такого как соединение I, верапамил, галлопамил или девапамил.
Способы формулирования
Настоящее изобретение дополнительно относится к способам получения водного раствора, содержащего соль соединения, описанного в настоящем документе, такого как соединение I, верапамил, галлопамил или девапамил. В конкретных вариантах осуществления изобретения свободное основание одного из этих соединений обрабатывают раствором, содержащим первую растворенную кислоту. Полученная смесь содержит кислотно-аддитивную соль, содержащую форму соединения с протонированным амином и основание, сопряженное с первой растворенной кислотой. Примеры первой растворенной кислоты, подходящей для образования соли активного соединения, включают уксусную кислоту и метансульфоновую кислоту. В данный раствор можно добавлять EDTA. Первую растворенную кислоту можно добавлять к соединению для образования соли, содержащей соединение и 0,5-1,5 молярных эквивалентов кислоты. Например, соединение можно обрабатывать уксусной кислотой для образования соли, содержащей соединение и 0,5-1,5 молярных эквивалентов уксусной кислоты относительно соединения. Альтернативно, соединение можно обрабатывать метансульфоновой кислотой для образования соли, содержащей соединение и 0,5-1,5 эквивалентов метансульфоновой кислоты относительно соединения. В конкретных вариантах осуществления смесь, содержащую соль, нагревают и механически перемешивают до полного диспергирования соединения в смеси. В дополнительных вариантах осуществления pH смеси затем регулируют путем добавления раствора, содержащего вторую растворенную кислоту, к этой смеси. Примеры второй растворенной кислоты, используемой для регулирования pH препарата, включают уксусную кислоту, серную кислоту и метансульфоновую кислоту. В предпочтительных вариантах осуществления вторая растворенная кислота представляет собой серную кислоту. В конкретных вариантах осуществления раствор впоследствии разбавляют так, чтобы конечная концентрация соединения в смеси составляла по меньшей мере 300 мг в 1 миллилитре (например, 300 мг/мл, 310 мг/мл, 320 мг/мл, 330 мг/мл, 340 мг/мл, 350 мг/мл, 360 мг/мл, 370 мг/мл, 380 мг/мл, 390 мг/мл, 400 мг/мл, 410 мг/мл, 420 мг/мл, 430 мг/мл, 440 мг/мл, 450 мг/мл, 460 мг/мл, 470 мг/мл, 480 мг/мл, 490 мг/мл, 500 мг/мл, 510 мг/мл, 520 мг/мл, 530 мг/мл, 540 мг/мл, 550 мг/мл, 560 мг/мл, 570 мг/мл, 580 мг/мл, 590 мг/мл, 600 мг/мл и так далее).
Ацетатные и метансульфонатные соли соединения, описанного в настоящем документе, такого как соединение I, верапамил, галлопамил или девапамил, могут иметь очень высокую растворимость в водном растворе. Водный раствор, содержащий одну из этих солей, может оставаться гомогенным в течение длительных периодов времени, даже при высоких концентрациях и пониженных температурах. Например, высококонцентрированные растворы, содержащие соединение I и 0,5-1,5 молярных эквивалентов уксусной кислоты или метансульфоновой кислоты относительно соединения, остаются гомогенными при комнатной температуре без образования видимого осадка. В конкретных вариантах осуществления эти растворы остаются гомогенными при 10°C в течение по меньшей мере 4 дней, и в альтернативных вариантах осуществления эти растворы остаются гомогенными при 2-5°C в течение по меньшей мере 7 дней. Например, водный раствор, содержащий 300 мг/мл соединения I, один молярный эквивалент метансульфоновой кислоты, 10 мМ ацетат натрия и 5 мМ динатрий EDTA, со значением pH 4,5, доведенным с помощью метансульфоновой кислоты, остается гомогенным при комнатной температуре и при 2-5°C без образования видимого осадка. Более того, этот раствор остается гомогенным даже при 0°C в течение по меньшей мере 7 дней. Кроме того, водный раствор, содержащий 400 мг/мл соединения I, один молярный эквивалент метансульфоновой кислоты относительно соединения I, 10 мМ ацетат натрия и 5 мМ динатрий EDTA, со значением pH 4,5, доведенным с помощью метансульфоновой кислоты, также остается гомогенным при комнатной температуре, 2-5°C и остается гомогенным при 0°C в течение по меньшей мере 7 дней. В другом примере раствор, содержащий 350 мг/мл соединения I и один молярный эквивалент уксусной кислоты относительно соединения I, со значением pH 4,5, доведенным с помощью 3,6 M серной кислоты, остается гомогенным при комнатной температуре и также остается гомогенным при 10°C в течение по меньшей мере 3 дней. Кроме того, раствор, содержащий свыше 500 мг/мл соединения I и один молярный эквивалент уксусной кислоты относительно соединения I, со значением pH 4,5, доведенным с помощью 3,6 M серной кислоты, остается гомогенным при комнатной температуре.
Для лучшего понимания данного изобретения приведены следующие примеры. Данные примеры приведены исключительно с иллюстративными целями и никоим образом не должны ограничивать объем изобретения.
ПРИМЕРЫ
Пример 1: Синтез метил-3-(2-((4-циано-4-(3,4-диметоксифенил)-5-метилгексил)(метил)амино)этил)бензоата
Часть I: Синтез 5-бром-2-(3,4-диметоксифенил)-2-изопропилпентаннитрила:
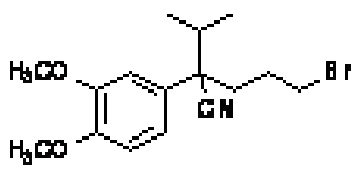 (II)
(II)
Метод A, стадия 1: К раствору 9,99 г (56,4 ммоль) (3,4-диметоксифенил)ацетонитрила в 141 мл тетрагидрофурана (THF) при -30°C медленно добавляли 56,4 мл (56,4 ммоль) натрий бис(триметилсилил)амида (NaHMDS, 1,0 M в THF). Смесь перемешивали при -30°C в течение 10 минут и добавляли 10,6 мл (113,0 ммоль) 2-бромпропана. Смесь кипятили с обратным холодильником в течение 2 часов (ч), затем оставляли при 22°C на примерно 16 ч. Добавляли насыщенный водный раствор NH4Cl, и смесь экстрагировали этилацетатом. Органический слой промывали рассолом, сушили (Na2SO4), фильтровали и выпаривали. Осадок очищали флэш-хроматографией на силикагеле, элюируя сначала гексаном, а затем постепенно повышая концентрацию до 15% этилацетата/гексане, с получением 2-(3,4-диметоксифенил)-3-метилбутаннитрила в виде масла.
Метод A, стадия 2: К раствору 11,21 г (51,1 ммоль) 2-(3,4-диметоксифенил)-3-метилбутаннитрила в 126 мл тетрагидрофурана (THF) при -30°C медленно добавляли 46,0 мл (46,0 ммоль) натрий бис(триметилсилил)амида (NaHMDS, 1,0 M в THF). Смесь перемешивали при -30°C в течение 10 минут и по каплям добавляли 9,40 мл (256 ммоль) 1,3-дибромпропана. Смесь нагревали до 22°C и перемешивали в течение примерно 16 ч. Затем добавляли насыщенный водный раствор NH4Cl, и смесь экстрагировали этилацетатом. Органический слой промывали рассолом, сушили (Na2SO4), фильтровали и выпаривали. Осадок очищали флэш-хроматографией на силикагеле, элюируя сначала гексаном, а затем постепенно повышая концентрацию до 15% этилацетата/гексане, с получением 5-бром-2-(3,4-диметоксифенил)-2-изопропилпентаннитрила в виде масла.
Часть II: Синтез метил-3-(2-(метиламино)этил)бензоата:
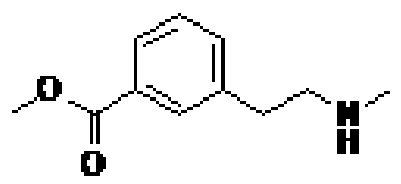 (III)
(III)
К раствору 5,71 г (24,9 ммоль) метил-3-бромметилбензоата в 36 мл метанола добавляли 2,11 г (32,4 ммоль) цианида калия. Смесь кипятили с обратным холодильником в течение примерно 16 ч, охлаждали до 22°C и фильтровали. Фильтрат выпаривали, и осадок очищали флэш-хроматографией на силикагеле, элюируя сначала гексаном, а затем постепенно повышая концентрацию до 15% этилацетата/гексане, с получением метил-3-(цианометил)бензоата.
К раствору 1,31 г (7,48 ммоль) метил-3-(цианометил)бензоата в 31 мл THF, перемешиваемому при -10°C, медленно добавляли 710 мг (18,7 ммоль) борогидрида натрия, а затем 1,44 мл (18,7 ммоль) трифторуксусной кислоты. Смесь нагревали до 22°C и перемешивали в течение примерно 16 ч. Примерно 100 мл воды осторожно добавляли к смеси (выделение газа). Смесь экстрагировали этилацетатом (5×50 мл). Органическую фазу промывали рассолом, сушили (Na2SO4), фильтровали и выпаривали, с получением метил-3-(2-аминоэтил)бензоата, который использовали в следующей стадии без очистки.
Метод B: К 5,12 г (28,6 ммоль) метил-3-(2-аминоэтил)бензоата в 71 мл тетрагидрофурана (THF) добавляли 7,48 г (34,3 ммоль) BOC2O. Смесь перемешивали в течение примерно 16 ч при 22°C и добавляли 100 мл воды. Смесь экстрагировали этилацетатом (2×100 мл), органическую фазу промывали рассолом, сушили (Na2SO4) и выпаривали. Осадок очищали флэш-хроматографией на силикагеле, элюируя сначала гексаном, а затем постепенно повышая концентрацию до 20% этилацетата/гексане, с получением метил-3-(2-(трет-бутоксикарбониламино)этил)бензоата, который затем переводили в соединение III методом C (описанным ниже).
Метод C, стадия 1: К раствору метил-3-(2-(трет-бутоксикарбониламино)этил)бензоата в сухом THF в атмосфере азота по каплям добавляли NaHMDS (1,0 M в THF) при 0°C. После перемешивания в течение 10 мин добавляли диметилсульфат, реакционную смесь нагревали до 22°C и перемешивали в течение примерно 16 ч. Реакционную смесь гасили добавлением 25 мл насыщенного раствора NaHCO3, и смесь экстрагировали DCM (2×25 мл). Объединенные органические экстракты сушили (Na2SO4), выпаривали, и осадок очищали флэш-хроматографией на силикагеле, элюируя сначала гексаном, а затем постепенно повышая концентрацию до 10% этилацетата/гексане, с получением метил-3-(2-(трет-бутоксикарбонил(метил)амино)этил)бензоата.
Метод C, стадия 2: К раствору метил-3-(2-(трет-бутоксикарбонил(метил)амино)этил)бензоата в DCM при 0°C добавляли трифторуксусную кислоту (TFA). Реакционную смесь нагревали до 22°C, перемешивали в течение 3 ч и затем растворители выпаривали. Осадок распределяли между 100 мл этилацетата и 100 мл 1 Н раствора NaOH, который был насыщен NaCl. Проводили обратную экстракцию водного слоя этилацетатом (6×50 мл), объединенные органические слои сушили (Na2SO4) и выпаривали, с получением 2c в виде бесцветного масла.
Часть III: Реакция соединения II с соединением III приводила к образованию соединения I. При анализе продукта методом масс-спектрометрии был обнаружен пик с отношением массы к заряду (m/z) 453, соответствующий M+H молекулярному иону соединения I.
Пример 2: Концентрированный раствор ацетатной соли соединения I
Концентрированный водный раствор ацетатной соли соединения I получали в соответствии со следующим протоколом:
Сначала получали водный 7,5 M раствор серной кислоты, разбавляя концентрированную серную кислоту в воде и вручную перемешивая в закрытой емкости, периодически давая выход давлению путем раскручивания крышки. Отдельно 175 ± 1,0 г соединения I переносили из предварительно нагретого контейнера в стеклянную емкость и поддерживали при температуре 50 ± 2°C на водяной бане. Затем к соединению I добавляли 96,7 ± 0,2 мл 4,0 M раствора уксусной кислоты, с последующим добавлением 83,3 мл ± 0,2 мл 31,8 мМ раствора EDTA. Смесь, содержащую (-) энантиомер (S-энантиомер) соединения I, поддерживали при температуре 50 ± 2°C и в обоих случаях при добавлении перемешивали с помощью якоря магнитной мешалки. Нагревание и перемешивание продолжали до полного визуального диспергирования соединения в смеси.
После полного диспергирования соединения I 7,5 M раствор серной кислоты по каплям добавляли к смеси соединения I до достижения значения pH 5,0 ± 0,1. В этот момент нагревание прекращали и смесь продолжали перемешивать. Затем смесь оставляли охлаждаться до температуры в пределах 2°C от температуры окружающей среды. Вслед за этим к смеси по каплям добавляли 0,9 M раствор серной кислоты до достижения значения pH 4,5 ± 0,1. Затем смесь, содержащую соединение I, разбавляли до 90% конечного целевого объема, добавляя в смесь воду, и после этого разбавления проверяли значение pH. При необходимости, pH вновь снижали до 4,5 ± 0,1, по каплям добавляя 0,9 M раствор серной кислоты. Затем смесь разбавляли до конечного целевого объема, добавляя воду.
Данный протокол может быть легко адаптирован для получения концентрированного раствора метансульфонатной соли соединения I.
Пример 3: Назальное введение соединения I
Пациент, испытывающий эпизод ПНЖТ, может использовать назальную систему доставки, содержащую ацетатную или метансульфонатную соль соединения I, для самостоятельного назального введения терапевтически эффективного количества соединения I и ослабления симптомов данного эпизода. В начале эпизода ПНЖТ пациент может поднести назальную систему доставки к носу, вводя аппликатор системы в носовую полость. Назальную систему доставки пациент, как правило, удерживает вторым и третьим пальцами, а большой палец кладет на мундштук. Этот процесс аналогичен использованию коммерчески доступных назальных систем доставки, таких как те, которые используют для доставки таких лекарственных средств, как имитрекс® (суматриптан) от компании GlaxoSmithKline (Brentford, UK) и зомиг® (золмитриптан) от компании Impax Pharmaceuticals (Hayward, CA, USA). Затем пациент может надавливать на мундштук, что заставляет жидкий раствор, содержащий растворенную ацетатную или метансульфонатную соль соединения I, проходить через вихревую камеру и выходить через отверстие аппликатора в виде аэрозоля. Раствор можно вводить одной, двумя, тремя или четырьмя однократными распыляемыми дозами для доставки 60 мг или более соединения I на назальный эпителий.
Аэрозоль, вводимый описанным методом, доставляет раствор, содержащий ацетатную или метансульфонатную соль соединения I, на назальный эпителий, что позволяет соединению I проникать через эпителий и быстро поступать в кровоток. Ацетатная или метансульфонатная соль соединения I, вводимая таким образом, достигает максимальной концентрации в плазме в пределах 3-5 минут после введения пациенту, и минимальные концентрации соединения в плазме крови наблюдаются через примерно 50-60 минут после введения. Таким образом, пациент испытывает облегчение от эпизода ПНЖТ очень быстро после введения и, за счет идеального фармакокинетического профиля соединения I, лекарственное средство не остается в кровотоке достаточно долго, чтобы вызывать неблагоприятные побочные эффекты.
Другие варианты осуществления
При том, что изобретение описано в связи с конкретными вариантами его осуществления, следует понимать, что оно может быть подвергнуто дальнейшим модификациям, и данная заявка должна охватывать любые вариации, варианты применения или адаптации изобретения, соответствующие, в целом, принципам изобретения и включающие любые отклонения от настоящего изобретения, которые находятся в рамках известной или обычной практики в области, к которой относится изобретение, и могут быть применены к основным признакам, изложенным выше в настоящем документе.
Все литературные источники, патенты, публикации патентных заявок и патентные заявки, цитированные в настоящем документе, включены в настоящий документ посредством ссылки в такой же степени, как если бы каждый документ из этих литературных источников, патентов, публикаций патентных заявок и патентных заявок был отдельно включен в настоящий документ посредством ссылки.
Группа изобретений относится к композициям, содержащим растворимые в воде соли соединения I
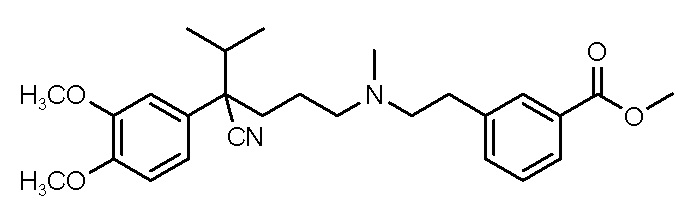 (I),
(I),
их получению, применению в производстве лекарственного средства, назальным системам доставки и способам лечения заболевания, выбранного из группы, состоящей из сердечной аритмии, стабильной стенокардии и мигрени, с их использованием. Водная композиция сформулирована для назального введения и содержит фармацевтически приемлемую ацетатную или метансульфонатную соль соединения I либо его рацемата или энантиомера, при этом соединение растворено в водной композиции в концентрации от 150 мг/мл до 600 мг/мл. Использование солей, имеющих высокую растворимость в воде, позволяет создать композицию для назального введения, что предоставляет новые терапевтические возможности для ослабления симптомов стабильной стенокардии, мигрени и сердечной аритмии, такой как ПНЖТ, непосредственно во время эпизода. 9 н. и 46 з.п. ф-лы, 3 пр.
1. Водная композиция, сформулированная для назального введения, содержащая фармацевтически приемлемую ацетатную или метансульфонатную соль соединения I
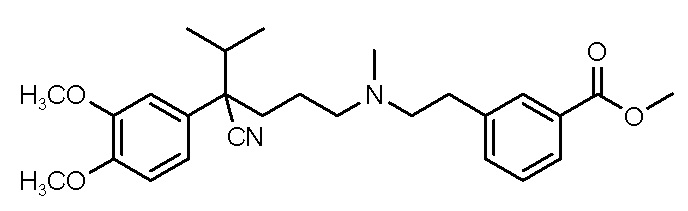 (I)
(I)
либо его рацемата или энантиомера, при этом соединение растворено в водной композиции в концентрации от 150 мг/мл до 600 мг/мл.
2. Водная композиция по п. 1, в которой соединение представляет собой S-энантиомер соединения I.
3. Водная композиция по любому из пп. 1, 2, в которой концентрация составляет 350 мг/мл ± 25 мг/мл.
4. Водная композиция по любому из пп. 1, 2, в которой концентрация составляет 450 мг/мл ± 25 мг/мл.
5. Водная композиция по любому из пп. 1, 2, содержащая от 40% до 85% (масс/об) воды.
6. Водная композиция по любому из пп. 1, 2, имеющая значение pH 4,5 ± 1,5.
7. Композиция по любому из пп. 1-6, содержащая соединение I или его рацемат или энантиомер и 0,5-1,5 молярных эквивалентов уксусной кислоты относительно соединения.
8. Композиция по любому из пп. 1-6, содержащая соединение I или его рацемат или энантиомер и 0,5-1,5 молярных эквивалентов метансульфоновой кислоты относительно соединения.
9. Водная композиция по любому из пп. 1-8, дополнительно содержащая хелатирующий агент.
10. Композиция по п. 9, в которой хелатирующий агент представляет собой аминополикарбоновую кислоту.
11. Композиция по любому из пп. 1-10, дополнительно содержащая EDTA.
12. Композиция по любому из пп. 1-11, дополнительно содержащая регулятор pH, выбранный из группы, состоящей из серной кислоты и метансульфоновой кислоты.
13. Композиция по п. 12, в которой регулятор pH представляет собой серную кислоту.
14. Композиция по любому из пп. 1-13, имеющая вязкость от 10 мПа*с до 70 мПа*с.
15. Композиция по любому из пп. 1-14, дополнительно содержащая фармацевтически приемлемый эксципиент.
16. Композиция по п. 15, в которой эксципиент представляет собой полисорбат или пропиленгликоль.
17. Водная композиция по любому из пп. 1-16, отличающаяся тем, что водная композиция является гомогенной при комнатной температуре.
18. Водная композиция по п.1, где фармацевтически приемлемая соль представляет собой ацетатную соль S-энантиомера соединения I.
19. Назальная система доставки, содержащая композицию по любому из пп. 1-18 в стандартной лекарственной форме в количестве не более четырех однократных распыляемых доз, где стандартная лекарственная форма спроектирована для введения не более 200 микролитров композиции в каждую ноздрю пациента.
20. Назальная система доставки, содержащая композицию по любому из пп. 1-18 в стандартной лекарственной форме в количестве не более двух однократных распыляемых доз, где стандартная лекарственная форма спроектирована для введения не более 200 микролитров композиции в каждую ноздрю пациента.
21. Назальная система доставки по п. 19 или 20, в которой стандартная лекарственная форма спроектирована для введения не более 150 микролитров композиции в каждую ноздрю пациента.
22. Назальная система доставки по п.19 или 20, в которой водная композиция содержит S-энантиомер соединения I.
23. Назальная система доставки по п.20, в которой каждая из двух однократных доз включает 35 мг S-энантиомера соединения I.
24. Назальная система доставки по п.20, в которой каждая из двух однократных доз включает 100 микролитров водной композиции.
25. Способ лечения заболевания, выбранного из группы, состоящей из сердечной аритмии, стабильной стенокардии и мигрени, включающий назальное введение пациенту, который нуждается в этом, водной композиции, содержащей фармацевтически приемлемую ацетатную или метансульфонатную соль соединения I, как определено в п.1, при этом ацетатная или метансульфонатная соль соединения I, как определено в п.1, растворена в водной композиции в концентрации от 150 мг/мл до 600 мг/мл.
26. Способ по п. 25 в случае, когда указанное заболевание представляет собой сердечную аритмию.
27. Способ по п. 25 в случае, когда указанное заболевание представляет собой стабильную стенокардию.
28. Способ по п. 25 в случае, когда указанное заболевание представляет собой мигрень.
29. Способ по п. 28 в случае, когда указанная сердечная аритмия представляет собой пароксизмальную наджелудочковую тахикардию (ПНЖТ), фибрилляцию предсердий или желудочковую тахикардию.
30. Способ по любому из пп. 25-29, включающий введение от 150 микролитров до 200 микролитров водной композиции пациенту.
31. Способ по любому из пп. 25-30, отличающийся тем, что пациент является человеком.
32. Применение композиции по любому из пп. 1-18 в производстве лекарственного средства для лечения заболевания, выбранного из группы, состоящей из сердечной аритмии, стабильной стенокардии и мигрени.
33. Применение по п. 32 в случае, когда указанное заболевание представляет собой сердечную аритмию.
34. Применение по п. 32 в случае, когда указанное заболевание представляет собой стабильную стенокардию.
35. Применение по п. 32 в случае, когда указанное заболевание представляет собой мигрень.
36. Применение по п. 33 в случае, когда указанная сердечная аритмия представляет собой ПНЖТ, фибрилляцию предсердий или желудочковую тахикардию.
37. Применение по п.36, в котором сердечная аритмия представляет собой пароксизмальную наджелудочковую тахикардию (ПНЖТ).
38. Способ получения раствора, содержащего ацетатную или метансульфонатную соль соединения I, сформулированного для назального введения пациенту, включающий этапы:
a) добавления раствора, содержащего первую растворенную кислоту, к свободному основанию соединения I
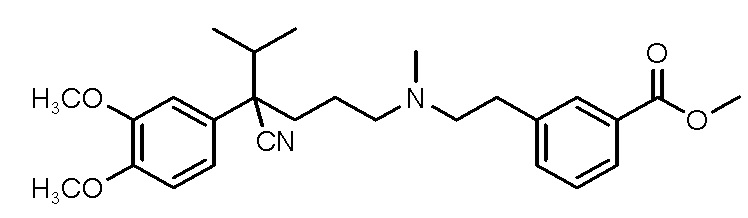 (I),
(I),
с получением смеси, где первая растворенная кислота представляет собой уксусную кислоту или метансульфоновую кислоту;
b) добавления к смеси раствора, содержащего этилендиаминтетрауксусную кислоту;
c) нагревания и механического перемешивания полученной смеси до полного диспергирования соединения в смеси;
d) регулирования pH смеси до значения от 3,5 до 5,5 путем добавления раствора, содержащего вторую растворенную кислоту, к смеси; где вторая растворенная кислота представляет собой уксусную кислоту, серную кислоту или метансульфоновую кислоту, и
e) разбавления смеси таким образом, чтобы конечная концентрация ацетатной или метансульфонатной соли соединения I в растворе составляла по меньшей мере 300 мг в 1 миллилитре.
39. Способ по п. 38, отличающийся тем, что конечное значение pH раствора составляет от 4,0 до 5,0.
40. Способ по п. 39, отличающийся тем, что конечное значение pH раствора составляет 4,5 ± 0,1.
41. Способ по п. 38, отличающийся тем, что раствор, содержащий соль соединения является гомогенным при комнатной температуре.
42. Способ по п.38, в котором конечная концентрация ацетатной или метансульфонатной соли соединения I в растворе составляет 350 мг/мл ± 25 мг/мл.
43. Способ по п.38, в котором первая растворенная кислота представляет собой уксусную кислоту, а вторая растворенная кислота представляет собой серную кислоту.
44. Способ по п.38, в котором на стадии d) рН доводят до 4,5 ± 0,1.
45. Водная композиция, сформулированная для назального введения, содержащая ацетатную соль S-энантиомера соединения I
 (I),
(I),
растворенную в водной композиции в концентрации 350 мг/мл ± 25 мг/мл.
46. Водная композиция по п.45, в которой S-энантиомер соединения I растворен в водной композиции в концентрации 350 мг/мл.
47. Водная композиция по п.45, в которой водная композиция имеет рН 4,5 ± 0,1.
48. Водная композиция по п.45, в которой водная композиция содержит от 0,5 до 1,5 молярных эквивалентов уксусной кислоты относительно соединения I.
49. Водная композиция по п.45, в которой водная композиция дополнительно содержит серную кислоту.
50. Водная композиция по п.45, в которой водная композиция дополнительно содержит этилендиаминтетрауксусную кислоту (ЭДТА).
51. Способ лечения пароксизмальной наджелудочковой тахикардии (ПНЖТ), где указанный способ включает назальное введение нуждающемуся в этом пациенту водной композиции, содержащей ацетатную соль S-энантиомера соединения I
 ,
,
в которой ацетатная соль S-энантиомера соединения I растворена в водной композиции в концентрации 350 мг/мл ± 25 мг/мл.
52. Способ по п.51, в котором 70 мг ацетатной соли S- энантиомера соединения I вводят пациенту.
53. Способ по п.51, в котором ацетатную соль S-энантиомера соединения I растворяют в водной композиции в концентрации 350 мг/мл.
54. Способ приготовления раствора, содержащего ацетатную соль S-энантиомера соединения I, для назального введения пациенту, причем способ включает стадии
a) добавление раствора, содержащего уксусную кислоту, к свободному основанию S-энантиомера соединения I

для образования смеси;
b) добавление к смеси раствора, содержащего этилендиаминтетрауксусную кислоту;
c) нагревание и механическое перемешивание полученной смеси до полного диспергирования S-энантиомера соединения I в смеси;
d) доведение рН смеси до 4,5 ± 0,1 путем добавления к смеси раствора, содержащего серную кислоту; и
e) разбавление смеси таким образом, чтобы конечная концентрация ацетатной соли S-энантиомера соединения I в растворе составляла 350 мг/мл ± 25 мг/мл.
55. Способ по п.54, в котором конечная концентрация ацетатной соли S-энантиомера соединения I в растворе составляет 350 мг/мл.
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
Авторы
Даты
2020-09-09—Публикация
2016-04-13—Подача