Настоящая заявка была подана в качестве Международной заявки на патент согласно РСТ 29 января 2016 года, от имени SurModics, Inc., национальной корпорации США, заявителя, указанного для всех стран, и Joram Slager, гражданина Нидерландов, Toni М. Неуеr, гражданина США, и David Е. Babcock, гражданина США, авторов настоящего изобретения, указанных для всех стран, и заявляет приоритет заявки на патент США №14/609270, поданной 29 января 2015 года, содержание которой включено в данный документ посредством ссылки во всей своей полноте.
Область изобретения
Настоящее изобретение относится к устройствам и покрытиям для устройств, таким как медицинское устройство. Более конкретно, настоящее изобретение относится к устройствам и покрытиям для устройств, содержащим частицы гидрофобного активного средства.
Предпосылки изобретения
Кровеносная система человека подвержена закупориванию вследствие образования бляшки внутри артерий. Частичное и даже полное закупоривание артерий посредством образования атеросклеротической бляшки является хорошо известной и часто встречающейся медицинской проблемой. Зачастую такое закупоривание возникает в коронарных артериях. Закупоривания также могут возникать вторично по отношению к прошедшим лечение конкретным участкам (рестеноз, например, вызванный быстрым делением клеток гладкой мускулатуры). Дополнительно, закупоривания также могут возникать применительно к периферическим артериям.
Закупоривания можно лечить с применением устройств для атерэктомии, которые механически удаляют бляшку; горячих или холодных лазеров, которые выпаривают бляшку; стентов, которые держат артерию открытой; и других устройств и процедур, разработанных для увеличения потока крови через артерию.
Одной общей процедурой для лечения закупоренных артерий является чрескожная транслюминальная коронарная ангиопластика (РТСА), также известная как баллонная ангиопластика. Согласно этой процедуре, катетер, имеющий надуваемый баллон на его дистальном конце, вводят в коронарную артерию, спущенный сложенный баллон располагают на стенозированном участке, и затем баллон надувают. Надувание баллона разрушает и сплющивает бляшку на стенке артерии и растягивает стенку артерии, что приводит к увеличению внутрипросветного прохода и увеличению потока крови. После такого расширения баллон спускают и баллонный катетер удаляют. Аналогичную процедуру, называемую чрескожной транслюминальной ангиопластикой (РТА), применяют для артерий, отличных от коронарных артерий, в сердечно-сосудистой системе. В других связанных процедурах небольшую сетчатую трубку, называемая стентом, имплантируют в стенозированный участок, чтобы помочь поддерживать проходимость коронарной артерии. В процедурах ротаблации, также называемых чрескожной транслюминальной коронарной ангиопластикой (PCRA), небольшое сверлильное устройство с наконечником, покрытым алмазной крошкой, вводят, в пораженную артерию с помощью процедуры катетеризации для удаления жировых отложений или бляшки. В процедуре разрезания с использованием баллона баллонный катетер с небольшими лезвиями надувают, чтобы разместить лезвия, надрезать бляшку и прижать жировое вещество к стенке артерии. Во время одной или нескольких из этих процедур, может быть желательным доставить терапевтическое средство или лекарственное средство в область, где осуществляется лечение для предотвращения рестеноза, восстановления повреждения сосудов или малых аневризм или обеспечения другой желаемой терапии.
Кроме того, может быть желательным перенос терапевтических средств в другие места у млекопитающего, такие как кожа, нейрососудистая система, носовая полость, полость рта, легкие, слизистая оболочка, пазухи, желудочно-кишечный тракт или периферическая сосудистая система почек.
Сущность изобретения
Варианты осуществления настоящего изобретения включают покрытия для доставки лекарственного средства и устройства, включающие таковые. В варианте осуществления настоящее изобретение включает покрытие для доставки лекарственного средства, включающее полимерный слой. Полимерный слой может включать гидрофильную наружную поверхность. Покрытие может также включать матрицу, находящуюся в контакте с гидрофильной наружной поверхностью. Матрица может содержать гидрофобное терапевтическое средство в виде частиц и катионное средство. Полимерный слой может дополнительно содержать гидрофильный полимер, имеющий боковые фотореактивные группы, и фотосшивающее средство, содержащее две арилкетонные функциональные группы. Другие варианты осуществления также включены в данный документ.
В варианте осуществления настоящее изобретение включает устройство для доставки лекарственного средства, содержащее подложку; слой гидрофильного полимера, расположенного на подложке; и покрытые частицы терапевтического средства, расположенные на слое гидрофильного полимера, при этом покрытые частицы терапевтического средства содержат гидрофобное терапевтическое средство в виде частиц; и катионное средство, расположенное над слоем гидрофобного терапевтического средства в виде частиц.
В варианте осуществления настоящее изобретение включает покрытие для доставки лекарственного средства, содержащее полимерный слой, при этом полимерный слой содержит гидрофильную поверхность; покрытые частицы терапевтического средства, расположенные на гидрофильной поверхности, при этом покрытые частицы терапевтического средства содержат ядро гидрофобного терапевтического средства в виде частиц; и катионное средство, окружающее ядро гидрофобного терапевтического средства в виде частиц, при этом катионное средство проявляет аффинность по отношению к поверхности клеточной мембраны.
В варианте осуществления настоящее изобретение включает способ образования покрытия для доставки лекарственного средства, предусматривающий нанесение гидрофильного грунтового покрытия на подложку; образование покрытых частиц терапевтического средства, причем покрытые частицы терапевтического средства содержат гидрофобное терапевтическое средство в виде частиц и катионное средство, расположенное над слоем гидрофобного терапевтического средства в виде частиц; и нанесение покрытых частиц терапевтического средства на подложку.
Данное краткое описание представляет собой обзор некоторых идей настоящей заявки и не является исключительной или исчерпывающей трактовкой настоящего объекта изобретения. Более подробная информация содержится в подробном описании и прилагаемой формуле изобретения. Другие аспекты будут очевидны для специалистов в данной области техники после прочтения и понимания следующего подробного описания и просмотра графических материалов, которые составляют его часть, каждый из которых не должен приниматься в ограничивающем смысле. Объем настоящего изобретения определяется прилагаемой формулой изобретения и ее юридическими эквивалентами.
Краткое описание чертежей
Настоящее изобретение может быть более полно понято в связи со следующими графическими материалами, в которых:
ФИГ. 1 представляет собой схематическую диаграмму поперечного сечения покрытия в соответствии с вариантом осуществления, представленным в данном документе.
ФИГ. 2 представляет собой схематическую диаграмму поперечного сечения покрытия в соответствии с вариантом осуществления, представленным в данном документе.
ФИГ. 3 представляет собой схематическую диаграмму поперечного сечения покрытия в соответствии с вариантом осуществления, представленным в данном документе.
ФИГ. 4 представляет собой схематическую диаграмму поперечного сечения покрытия в соответствии с вариантом осуществления, представленным в данном документе.
ФИГ. 5 представляет собой схематическую диаграмму поперечного сечения в соответствии с вариантом осуществления, представленным в данном документе.
ФИГ. 6 представляет собой схематическую диаграмму поперечного сечения покрытия в соответствии с различными вариантами осуществления, представленными в данном документе.
ФИГ. 7 представляет собой схематическую диаграмму поперечного сечения покрытия в соответствии с различными вариантами осуществления, представленными в данном документе.
ФИГ. 8 представляет собой схематическую диаграмму поперечного сечения покрытия в соответствии с различными вариантами осуществления, представленными в данном документе.
ФИГ. 9 представляет собой схематическую диаграмму поперечного сечения покрытия в соответствии с различными вариантами осуществления, представленными в данном документе.
ФИГ. 10 представляет собой график адгезии микрочастиц к пластинкам MATRIGEL® без добавления наполнителя и с использованием полиэтиленимина (PEI) в качестве наполнителя и полиакриловой кислоты (РАА).
Хотя настоящее изобретение подвержено различным модификациям и альтернативным формам, его особенности были показаны в качестве примера и графических материалов и будут подробно описаны. Однако следует понимать, что настоящее изобретение не ограничивается описанными конкретными вариантами осуществления. Напротив, целью является охват модификаций, эквивалентов и альтернатив, подпадающих под сущность и объем настоящего изобретения.
Подробное описание изобретения
Варианты осуществления настоящего изобретения, описанные в данном документе, не должны быть исчерпывающими или ограничивать настоящее изобретение точными формами, раскрытыми в следующем подробном описании. Напротив, варианты осуществления выбраны и описаны так, что другие специалисты в данной области техники могут оценить и понять принципы и методики настоящего изобретения.
Все публикации и патенты, упомянутые в данном документе, включены в данный документ посредством ссылки. Публикации и патенты, раскрытые в данном документе, предоставлены исключительно для их раскрытия. Ничто в данном документе не должно толковаться как признание того, что авторы настоящего изобретения не имеют права противопоставлять любую публикацию и/или патент с более ранним приоритетом, включая любую публикацию и/или патент, упомянутые в данном документе.
Как описано выше, в сочетании с такими процедурами, как чрескожная транслюминальная коронарная ангиопластика (РТСА), чрескожная транслюминальная ангиопластика (РТА) и т.д., может быть желательным доставить терапевтическое средство или лекарственное средство в область, где осуществляется лечение для предотвращения рестеноза, восстановления повреждения сосудов или малых аневризм или обеспечения другой желаемой терапии. Один из подходов для достижения этого заключается в том, чтобы доставить терапевтическое средство (или активное средство) в желаемый участок ткани с применением устройства для доставки лекарственного средства, такого как баллонный катетер, элюирующий лекарственное средство, или баллонный катетер, содержащий лекарственное средство.
Желательно, чтобы покрытия для доставки лекарственного средства для конкретных применений в медицине проявляли различные свойства. В качестве примера, в контексте баллонного катетера, элюирующего лекарственное средство, или баллонного катетера, содержащего лекарственное средство, покрытие должно поддерживать структурную целостность во время стадий, связанных с получением устройства баллонного катетера, включая складывание, свертывание и выдерживание (например, термическую обработку). Дополнительно, желательным для покрытия является поддержание структурной целостности в процессе прохождения катетера через кровеносную систему и/или через проволочный проводник, с ограниченными потерями активного средства. При этом также желательным при надувании баллона на желаемом участке является перенос значительного количества активного средства из баллона и на стенку сосуда. Дополнительно, желательным является максимально увеличить ввод активного средства в ткань стенки сосуда и уменьшить количество активного средства, которое вымывается с потоком крови через участок в кровеносной системе, поддающийся лечению.
Варианты осуществления, представленные в данном документе, могут быть пригодными для улучшения одного или нескольких желаемых свойств покрытий для доставки лекарственного средства, такого как данные свойства, желаемые в контексте баллонных катетеров, элюирующих лекарственное средство, баллонных катетеров, содержащих лекарственное средство, и подобных устройств. В различных вариантах осуществления предусмотрено устройство для доставки лекарственного средства, которое содержит подложку и покрытые частицы терапевтического средства, расположенные на подложке. Покрытые частицы терапевтического средства могут включать гидрофобное терапевтическое средство в виде частиц и катионное средство, расположенное над слоем гидрофобного терапевтического средства в виде частиц.
В данный момент ссылаясь на ФИГ. 1, предусмотрена схематическая диаграмма поперечного сечения (не масштабированная) покрытия в соответствии с вариантом осуществления, представленным в данном документе. В данном варианте осуществления покрытые частицы 104 терапевтического средства расположены на подложке 102. Иллюстративные подложки описаны более подробно ниже. Покрытые частицы 104 терапевтического средства могут включать множество катионных средств 108, расположенных над гидрофобным терапевтическим средством 106 в виде частиц. Покрытые частицы 104 терапевтического средства могут быть однородно покрыты катионными средствами 108. В других вариантах осуществления катионное средство 108, покрывающее частицы 104 терапевтического средства, может быть неоднородным. Кроме того, гидрофобные средства 106 в виде частиц могут совместно существовать в матрице с катионными средствами 108, где катионное средство 108 не покрывает гидрофобное средство 106 в виде частиц. Различные смеси в соответствии с вариантами осуществления, описанными выше, могут находиться на конкретной подложке 102. В качестве примера без ограничения покрытие на подложке может включать покрытые частицы 104 терапевтического средства, однородно покрытые катионными средствами 108, и гидрофобные средства 106 в виде частиц в матрице с катионными средствами 108, где катионное средство 108 не покрывает гидрофобное средство 106 в виде частиц. Следует принимать во внимание, что как фактически применяется, в данном покрытии будет много частиц гидрофобного терапевтического средства, и что одиночная частица показана на ФИГ. 1 только в целях упрощения иллюстрации. Иллюстративные катионные средства и гидрофобные терапевтические средства описаны более подробно ниже. Заряд, образованный катионными средствами 108, может электростатически притягиваться к отрицательно заряженным частицам и/или полярным группам, связанным с липидным бислоем 110 клеточной мембраны и компонентам клетки внутри липидного бислоя 110.
В некоторых вариантах осуществления нуклеиновые кислоты могут также быть включены в покрытия, описанные в данном документе. В качестве примера, нуклеиновые кислоты, включая без ограничения siRNA, могут быть связаны с катионным средством. Иллюстративные нуклеиновые кислоты описаны более подробно ниже. В данный момент ссылаясь на ФИГ. 2, предусмотрена схематическая диаграмма поперечного сечения (не масштабированная) для другого варианта осуществления, представленного в данном документе. В данном варианте осуществления покрытые частицы 204 терапевтического средства расположены на подложке 202. Покрытые частицы 204 терапевтического средства могут включать множество катионных средств 208, расположенных над гидрофобным терапевтическим средством 206 в виде частиц. Нуклеиновые кислоты 212 могут быть связаны с катионным средством. Заряд, образованный катионными средствами 208, может электростатически притягиваться к отрицательно заряженным частицам и/или полярным группам, связанным с липидным бислоем 210 клеточной мембраны и компонентам клетки внутри липидного бислоя 210.
В некоторых вариантах осуществления добавка может быть включена наряду с покрытыми частицами 304 терапевтического средства в покрытиях в данном документе. В данный момент ссылаясь на ФИГ. 3, предусмотрена схематическая диаграмма поперечного сечения (не масштабированная) для другого варианта осуществления. В данном варианте осуществления покрытые частицы 304 терапевтического средства расположены на подложке 302. Добавка 314 может быть расположена вместе с покрытыми частицами 304 терапевтического средства. Количество добавки 314 может быть более, менее или эквивалентным количеству покрытых частиц 304 терапевтического средства. В некоторых вариантах осуществления добавка 314 может образовывать матрицу или слой, в котором расположены покрытые частицы 304 терапевтического средства. В различных вариантах осуществления добавка может быть гидрофильной. Иллюстративные добавочные компоненты описаны более подробно ниже. Покрытые частицы 304 терапевтического средства могут включать множество катионных средств 308, расположенных над гидрофобным терапевтическим средством 306 в виде частиц. Заряд, образованный катионными средствами 308, может электростатически притягиваться к отрицательно заряженным частицам и/или полярным группам, связанным с липидным бислоем 310 клеточной мембраны и компонентам клетки внутри липидного бислоя 310.
В некоторых вариантах осуществления слой гидрофильного полимера может быть расположен на поверхности подложки, между покрытыми частицами терапевтического средства и поверхностью подложки. Иллюстративные полимеры для гидрофильного полимерного слоя описаны более подробно ниже. В данный момент ссылаясь на ФИГ. 4, предусмотрена схематическая диаграмма поперечного сечения (не масштабированная) для другого варианта осуществления, представленного в данном документе. В данном варианте осуществления покрытые частицы 404 терапевтического средства расположены на слое 416 гидрофильного полимера, который, в свою очередь, расположен на подложке 402. Покрытые частицы 404 терапевтического средства могут включать множество катионных средств 408, расположенных над гидрофобным терапевтическим средством 406 в виде частиц. Заряд, образованный катионными средствами 408, может электростатически притягиваться к отрицательно заряженным частицам и/или полярным группам, связанным с липидным бислоем 410 клеточной мембраны и компонентам клетки внутри липидного бислоя 410.
В данный момент ссылаясь на ФИГ. 5, показан схематический вид иллюстративного устройства в соответствии с вариантом осуществления. Устройство 500 может представлять собой, например, баллонный катетер для ангиопластики или баллонный катетер, элюирующий лекарственное средство, или баллонный катетер, содержащий лекарственное средство. Однако, следующие примеры иллюстративных устройств описаны более подробно ниже. Устройство 500 содержит стержень 502 катетера и разветвленный конец 505. Устройство 500 может также содержать надуваемый баллон 504, расположенный вокруг стержня 502 катетера. На фигуре ФИГ. 5 баллон 504 показан в надутой конфигурации. Стержень 502 катетера может содержать канал для транспортировки жидкости через канал 502 катетера и к баллону 504 или от него, таким образом баллон 504 может избирательно переходить от спущенной конфигурации в надутую конфигурацию и снова обратно.
Изготовление расширяемых баллонов хорошо известно из уровня техники, и любой подходящий способ можно осуществлять с получением расширяемой части подложки вставляемого медицинского устройства, описанного в данном документе. Схема устройства баллонного катетера описана в различных ссылочных материалах, например, в патентах США №№4490421, 5556383, 6210364, 6168748, 6328710 и 6482348. Для изготовления баллонов обычно осуществляют способы литья. В иллюстративных способах литья экструдированная полимерная трубка расширяется в радиальном и осевом направлении при повышенных значениях температуры в форме, имеющей желаемую форму баллона. Баллон может быть подвержен дополнительным видам обработки, следующим после способа литья. Например, образованный баллон может быть подвержен дополнительным стадиям нагревания для уменьшения сжатия баллона.
Ссылаясь снова на ФИГ. 5, вставляемое медицинское устройство 500 может также иметь одну или несколько нерасширяемых (или неэластичных) частей. Например, в баллонном катетере, часть стержня 502 катетера может являться нерасширяемой частью. Нерасширяемая часть может быть частично или полностью изготовлена из полимера. Полимеры включают таковые, образованные из синтетических полимеров, включающих олигомеры, гомополимеры и сополимеры, образующиеся в результате либо аддитивной, либо конденсационной полимеризации. Примеры подходящих аддитивных полимеров включают без ограничения полимеры на основе акрила, такие как полимеризуемые из метилакрилата, метилметакрилата, гидроксиэтилметакрилата, гидроксиэтилакрилата, акриловой кислоты, метакриловой кислоты, глицерилакрилата, глицерилметакрилата, метакриламида и акриламида; полимеры на основе винила, такие как этилен, пропилен, винилхлорид, винилацетат, винилпирролидон, винилидендифторид и стирол. Примеры конденсационных полимеров включают без ограничения полиамиды, такие как поликапролактам, полилауриллактам, полигексаметиленадипамид и полигексаметилендодекандиамид, а также полиуретаны, поликарбонаты, полиамиды, полисульфоны, поли(этилентерефталат), полидиметилсилоксаны и полиэфиркетон. Нерасширяемая часть также может быть частично или полностью изготовлена из металла.
В данный момент ссылаясь на ФИГ. 6, предусмотрена схематическая диаграмма поперечного сечения (не масштабированная) покрытия для доставки лекарственного средства в соответствии с различными вариантами осуществления, представленными в данном документе. В данном варианте осуществления гидрофобные терапевтические средства 606 в виде частиц расположены на подложке 602. Иллюстративные подложки описаны более подробно ниже. Множество катионных средств 608 также расположено на подложке. Гидрофобные терапевтические средства 606 в виде частиц и катионные средства 608 могут также образовывать матрицу. Следует принимать во внимание, что как фактически применяется, в данной матрице может быть намного больше частиц гидрофобного терапевтического средства. Иллюстративные катионные средства и гидрофобные терапевтические средства описаны более подробно ниже. Заряд, образованный катионными средствами 608, может электростатически притягиваться к отрицательно заряженным частицам и/или полярным группам, связанным с липидным бислоем 610 клеточной мембраны и компонентам клетки внутри липидного бислоя 610.
В данный момент ссылаясь на ФИГ. 7, предусмотрена схематическая диаграмма поперечного сечения (не масштабированная) покрытия для доставки лекарственного средства в соответствии с различными вариантами осуществления, представленными в данном документе. В данном варианте осуществления гидрофобные терапевтические средства 706 в виде частиц расположены на подложке 702. Множество катионных средств 708 также расположено на подложке. Гидрофобные терапевтические средства 706 в виде частиц и катионные средства 708 могут также образовывать матрицу. Гидрофобные терапевтические средства 706 в виде частиц и катионные средства 708 могут быть связаны друг с другом и в некоторых случаях могут образовывать покрытые частицы 704 терапевтического средства, расположенные на подложке 702. Покрытые частицы 704 терапевтического средства могут включать множество катионных средств 708, расположенных над гидрофобным терапевтическим средством 706 в виде частиц. Следует принимать во внимание, что как фактически применяется, в данном покрытии может быть много частиц гидрофобного терапевтического средства и что данные частицы показаны на ФИГ. 7 только в целях упрощения иллюстрации. Заряд, образованный катионными средствами 708, может электростатически притягиваться к отрицательно заряженным частицам и/или полярным группам, связанным с липидным бислоем 710 клеточной мембраны и компонентам клетки внутри липидного бислоя 710.
В некоторых вариантах осуществления слой гидрофильного полимера может быть расположен на поверхности подложки, между терапевтическим средством, катионным средством, и/или покрытыми частицами терапевтического средства и поверхностью подложки. Иллюстративные полимеры для гидрофильного полимерного слоя описаны более подробно ниже. В данный момент ссылаясь на ФИГ. 8, предусмотрена схематическая диаграмма поперечного сечения (не масштабированная) покрытия для доставки лекарственного средства в соответствии с различными вариантами осуществления, представленными в данном документе. Слой 816 гидрофильного полимера расположен на подложке 802. Гидрофобные терапевтические средства 806 в виде частиц расположены на слое 816 гидрофильного полимера. Множество катионных средств 808 может также быть расположено на слое 816 гидрофильного полимера. Гидрофобные терапевтические средства 806 в виде частиц и катионные средства 808 могут быть связаны друг с другом. Гидрофобные терапевтические средства 806 в виде частиц и катионные средства 808 могут также образовывать матрицу. Заряд, образованный катионными средствами 808, может электростатически притягиваться к отрицательно заряженным частицам и/или полярным группам, связанным с липидным бислоем 810 клеточной мембраны и компонентам клетки внутри липидного бислоя 810.
В данный момент ссылаясь на ФИГ. 9, предусмотрена схематическая диаграмма поперечного сечения (не масштабированная) покрытия для доставки лекарственного средства в соответствии с различными вариантами осуществления, представленными в данном документе. Слой 916 гидрофильного полимера расположен на подложке 902. Гидрофобные терапевтические средства 906 в виде частиц могут быть расположены на слое 916 гидрофильного полимера. Множество катионных средств 908 также может быть расположено на слое гидрофильного полимера 916. Гидрофобные терапевтические средства 906 в виде частиц и катионные средства 908 могут также образовывать матрицу. Гидрофобные терапевтические средства 906 в виде частиц и катионные средства 908 могут быть связаны друг с другом и в некоторых случаях могут образовывать покрытые частицы 904 терапевтического средства, расположенные на слое 916 гидрофильного полимера. Покрытые частицы 904 терапевтического средства могут включать множество катионных средств 908, расположенных над гидрофобным терапевтическим средством 906 в виде частиц. Заряд, образованный катионными средствами 908, может электростатически притягиваться к отрицательно заряженным частицам и/или полярным группам, связанным с липидным бислоем 910 клеточной мембраны и компонентам клетки внутри липидного бислоя 910.
Катионные средства
Катионные средства, применяемые в соответствии с вариантами осуществления, представленными в данном документе, могут включать соединения, содержащие часть, имеющую положительный заряд в водном растворе при нейтральном показателе рН наряду с частью, которая может проявлять аффинность по отношению к гидрофобным поверхностям (например, гидрофобные или амфифильные свойства) и, следовательно, могут связываться с гидрофобными активными средствами. В некоторых вариантах осуществления катионные средства, применяемые в соответствии с вариантами осуществления, представленными в данном документе, могут включать таковые, имеющие общую формулу X-Y, где X представляет собой радикал, содержащий положительно заряженную группу в водном растворе при нейтральном показателе рН и Y представляет собой радикал, проявляющий гидрофобные свойства. В некоторых вариантах осуществления катионное средство может включать гидрофильную головку и гидрофобный хвост, наряду с одним или несколькими положительно заряженными группами, как правило, в области гидрофильной головки.
Катионные средства по настоящему раскрытию могут включать соли катионных средств при различных диапазонах рН, например, без ограничения, соли галогенида, соли серной кислоты, соли угольной кислоты, соли азотной кислоты, соли фосфорной кислоты, соли уксусной кислоты и их смеси.
Катионные средства могут, как правило, включать катионные липиды и сеть нейтральных липидов, которые имеют катионную группу (нейтральные липиды с катионными группами). Иллюстративные липиды могут включать без ограничения 3β-[N-(N',N'-диметиламиноэтан)карбамоил]холестерина гидрохлорид (DC-холестерин); 1,2-диолеоил-3-триметиламмонийпропан (DOTAP); диметилдиоктадециламмоний (DDAB); 1,2-диолеол-зп-глицеро-3-этилфосфохолин (ЕРС); 1,2-ди-О-октадеценил-3-триметиламмонийпропан (DOTMA); 1,2-ди-(9Z-октадеценоил)-3-диметиламмонийпропан (DODAP); 1,2-дилинолеилокси-3-диметиламинопропан (DLinDMA) и их производные. Дополнительные липиды могут включать без ограничения 1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин (DOPE); холестерин; 1,2-диоктадеканоил-5«-глицеро-3-фосфохолин (DSPC); 1,2-дистеароил-5и-глицеро-3-фосфоетаноламин (DSPE). Другие катионные средства могут включать моно- или полиаминоалканы, такие как спермин и спермидин.
Катионные средства могут, как правило, включать катионные полимеры. Катионные средства могут также включать циклодекстрин, содержащий поликатион (например, без ограничения аминоциклодекстрин и его производные), аминодекстран, гистоны, протамины, катионизированнный альбумин сыворотки крови человека, аминопропилсахариды, например, хитозан, пептиды, например, поли-L-лизин, поли-L-орнитин, и сложный эфир поли(4-гидрокси-L-пролина и полиамины, например, полиэтиленимин (PEI; доступный от Sigma Aldrich), полиаллиламин, полипропиленимин, полиамидоаминовые дендримеры (РАМАМ; доступные от Sigma Aldrich), катионный полиоксазолин и сложные поли(бета-аминоэфиры). Катионные средства могут также, как правило, включать катионные липидоиды (описанные K.Т. Love в публикации PNAS 107, 1864-1869 (2010)). Другие иллюстративные катионные полимеры включают без ограничения блок-сополимеры, например сополимеры PEG-PEI и PLGA-PEI. Другие иллюстративные катионные средства включают положительно заряженный желатин (например, желатин, обработанный основанием) и семейство аминированных кукурбит[п]урилов (где n=5, 6, 7, 8, 10).
В других вариантах осуществления настоящего раскрытия катионные средства, содержащие часть, имеющую положительный заряд в водных растворах при нейтральном показателе рН, включают следующие соединения (A-I):

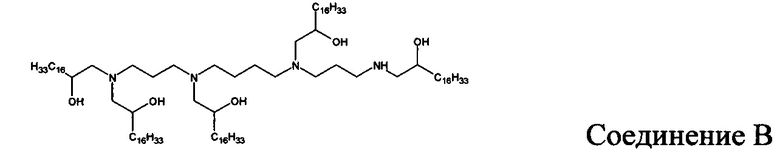
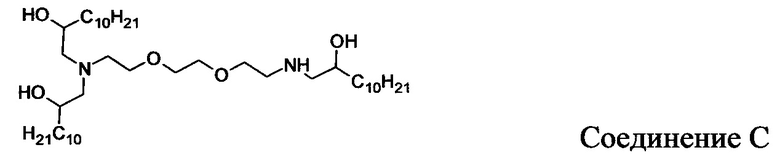

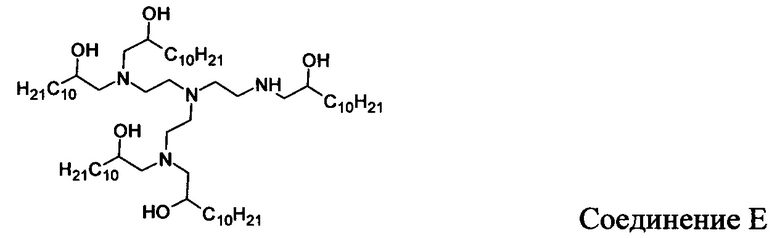
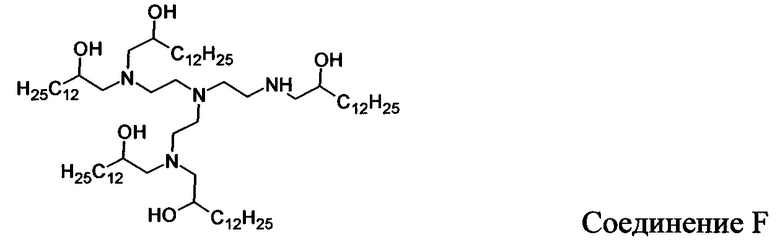

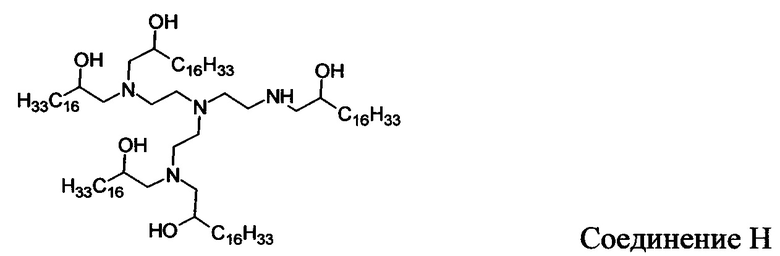
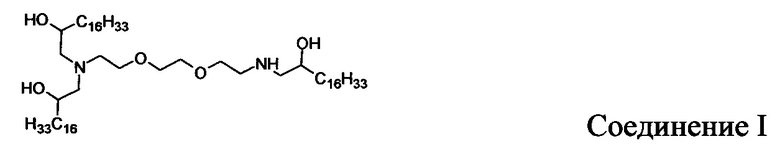
Кроме того, другие катионные средства включают структуры общей формулы I.
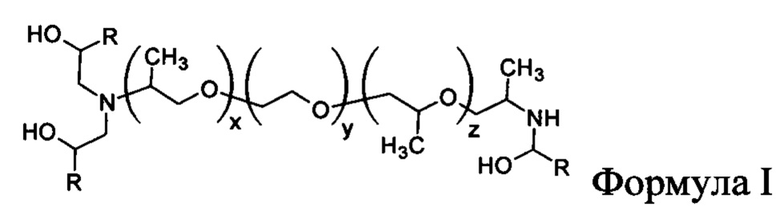

Катионные средства, например таковые, перечисленные выше, как правило, могут быть получены посредством реакции подходящего гидрофобного эпоксида (например, олеилэпоксида) с многофункциональным амином (например, пропилен диамином). Примеры синтеза дополнительных катионных средств описаны K.Т. Love в публикации PNAS 107,1864-1869 (2010) и Ghonaim et al, Pharma Res 27, 17-29 (2010).
Следует принимать во внимание, что производные полиамида PEI (РЕI-амиды) можно также применять в качестве катионных средств. PEI-амиды, как правило, можно получать посредством реакции PEI с кислотой или производным кислоты, таким как хлорангидрид или сложный эфир с образованием различных PEI-амидов. Например, можно осуществить реакцию PEI с метилолеатом с образованием PEI-амидов.
В еще одних вариантах осуществления катионные средства могут включать фрагменты, используемые для конденсации нуклеиновых кислот (например, липиды, пептиды или другие катионные полимеры). В некоторых случаях данные катионные средства могут быть использованы для образования липоплексов и полиплексов.
Иллюстративные варианты осуществления катионных средств могут также включать без ограничения производные катионного средства, которые являются фотореактивными. Фотореактивные группы описаны ниже. Такие производные катионных средств включают производные полимера на основе PEI бензофенона и производные полимера на основе РАМАМ бензофенона.
В некоторых вариантах осуществления молекулярная масса катионного средства может составлять приблизительно 1,2 кДа, 2,5 кДа, 10 кДа, 25 кДа, 250 кДа или даже, в некоторых случаях, 750 кДа. В еще одних вариантах осуществления молекулярная масса катионного средства может находиться в диапазоне 50-100 кДа, 70-100 кДа, 50-250 кДа, 25-100 кДа, 2,5-750 кДа или даже, в некоторых случаях, 2,5-2000 кДа. Другие варианты осуществления включают значения молекулярной массы выше 1,2 кДа, 2,5 кДа, 10 кДа, 25 кДа, 250 кДа или даже, в некоторых случаях, 750 кДа. Другие варианты осуществления могут включать катионные средства до 2000 кДа.
Низкомолекулярные мономеры катионного средства или низкомолекулярные катионные олигомеры могут быть объединены с гидрофобным активным средством для получения реакционноспособного покрытия. Эти реакционноспособные покрытия можно затем наносить в качестве покрытия на подложку и термически полимеризовать или полимеризовать с помощью УФ-излучения. Иллюстративные мономеры включают без ограничения азиридин, виниламин, аллиламин и олигомеры от 80 г/моль до 1200 г/моль. Сшивающие средства (например, 1,2-дихлорэтан, эпихлоргидрин, 1,6-диизоцианатогексан) могут быть использованы для сшитая олигомеров.
Добавочные компоненты
В некоторых вариантах осуществления настоящего раскрытия добавочные компоненты могут быть гидрофильными по природе. Иллюстративные гидрофильные полимеры включают без ограничения PEG, PVP и PVA.
Иллюстративные добавочные компоненты могут включать сахариды. Сахариды могут включать моносахариды, дисахариды, трисахариды, олигосахариды и полисахариды. Полисахариды могут быть линейными или разветвленными полисахаридами. Иллюстративные сахариды могут включать без ограничения декстрозу, сахарозу, мальтозу, маннозу, трегалозу и т.д. Иллюстративные сахариды могут дополнительно включать без ограничения полисахариды, включающие субъединицы пентозы и/или гексозы, в частности, включающие глюканы, такие как гликоген и амилопектин, и декстрины, включающие мальтодекстрины, фруктозу, маннозу, галактозу и т.д. Полисахариды могут также включать смолы, такие как пуллулан, арабинозу, галактан и т.д.
Сахариды могут также включать производные полисахаридов. Следует принимать во внимание, что полисахариды включают множество функциональных групп, которые могу выступать в качестве точек прикрепления или могут в ином случае быть химически модифицированными для изменения характеристик сахарида. В качестве одного примера следует принимать во внимание, что основные цепи сахарида, как правило, содержат значительные количества гидроксильных групп, которые можно применять для получения производных сахарида.
Сахариды могут также включать сополимеры и/или тройные сополимеры и т.д., которые включают сахарид и/или субъединицы сахарида и/или блоки.
Полисахариды, применяемые в соответствии с вариантами осуществления, представленными в данном документе, могут иметь различные значения молекулярной массы. В качестве примера, гликоген, применяемый в соответствии с вариантами осуществления, представленными в данном документе, может иметь молекулярную массу выше приблизительно 250000. В некоторых вариантах осуществления гликоген, применяемый в соответствии с вариантами осуществления, представленными в данном документе, имеет молекулярную массу от приблизительно 100000 до 10000000 Дальтон.
Уточнение молекулярной массы полисахаридов можно проводить с применением диафильтрации. Диафильтрация полисахаридов, таких как мальтодексрин, может проводиться с применением мембран для ультрафильтрации с различными размерами пор. В качестве примера, одну или несколько кассет с отсекающими молекулярную массу мембранами в диапазоне от приблизительно 1К до приблизительно 500 К можно применять в процессе диафильтрации с получением препаратов с полисахаридами со средними значениями молекулярной массы в диапазоне менее 500 кДа, в диапазоне от приблизительно 100 кДа до приблизительно 500 кДа, в диапазоне от приблизительно 5 кДа до приблизительно 30 кДа, в диапазоне от приблизительно 30 кДа до приблизительно 100 кДа, в диапазоне от приблизительно 10 кДа до приблизительно 30 кДа или в диапазоне от приблизительно 1 кДа до приблизительно 10 кДа.
Следует принимать во внимание, что полисахариды, например, мальтодекстрин и амилоза с различными значениями молекулярной массы являются коммерчески доступными из нескольких различных источников. Например, Glucidex™ 6 (ср. молекулярная масса ~95000 Да) и Glucidex™ 2 (ср. молекулярная масса ~300000 Да) доступны от Roquette (Франция); и мальтодекстрины MALTPJN™ с различными значениями молекулярной массы, включая значения молекулярной массы от приблизительно 12000 Да до 15000 Да доступны от GPC (Маскатин, Айова). Примеры других производных гидрофобных полисахаридов раскрыты в публикации заявки на патент США 2007/0260054 (Chudzik), которая включена в данный документ посредством ссылки.
Иллюстративные добавочные компоненты могут включать амфифильные соединения. Амфифильные соединения включают таковые, имеющие соответственно гидрофобную часть и соответственно гидрофильную часть. Иллюстративные амфифильные соединения могут включать без ограничения полимеры, включающие, по меньшей мере блоки поливинилпирролидона, поливинилового спирта, полиэтиленгликоля, полиоксазолинов (таких как поли(2-алкилоксазолин) и производные) и т.д. Иллюстративные амфифильные соединения могут, в частности, включать полоксамеры. Полоксамеры и неионные триблочные сополимеры состоят из центральной гидрофобной цепи полиоксипропилена, с расположенными по бокам от нее двумя гидрофильными цепями полиоксиэтилена. Полоксамеры зачастую обозначаются торговым названием PLURONIC®. Следует принимать во внимание, что многие аспекты сополимера могут изменяться, такие характеристики могут быть специально подобраны. Один иллюстративный полоксамер представляет собой PLURONIC® F68 (неионный сополимер этилена и пропиленоксида, коммерчески доступный от BASF Corporation; также называемый F68 и полоксамер F68), который относится к полоксамеру, характеризующемуся твердой формой при комнатной температуре, молекулярная масса полиоксипропилена составляет приблизительно 1800 г/моль и приблизительно 80% содержания полиоксиэтилена с общей молекулярной массой приблизительно 8400 г/моль, сополимер завершается первичными гидроксильными группами.
Иллюстративные добавочные компоненты могут дополнительно включать соединения, которые стабилизируют слабо растворимые в воде фармацевтические средства. Иллюстративные добавочные компоненты, обеспечивающие такую стабилизацию, включают биологически совместимые полимеры, например, альбумины. Дополнительные добавочные компоненты описаны в US 7034765 (De et al.), раскрытие которого включено в данный документ посредством ссылки. Стабилизация суспензий и эмульсий может также обеспечиваться посредством соединений, например, таких как поверхностно-активные вещества (например, F68).
Различные добавочные компоненты могут быть добавлены в качестве необязательного верхнего слоя покрытия над слоем, содержащим гидрофобное активное средство. В некоторых вариантах осуществления верхний слой покрытия можно наносить для модификации характеристики высвобождения гидрофобного активного средства. Другие верхние слои покрытия можно добавлять в качестве защитного слоя для уменьшения случайных потерь гидрофобного активного средства вследствие трения или общего истирания. Например, верхний слой покрытия может выступать в качестве защитного слоя для целей обращения при упаковке или для защиты гидрофобного активного средства, до тех пор, пока гидрофобное активное средство не будет доставлено в целевой участок тела, или и того и другого. Например, необязательный верхний слой покрытия может включать поливинилпирролидон (PVP), полиакриловую кислоту (РАА) и полиуретан.
Гидрофобные активные средства
Следует принимать во внимание, что гидрофобные активные средства в соответствии с вариантами осуществления, представленными в данном документе (например, гидрофобные терапевтические средства в виде частиц), могут включать средства, имеющие много различных типов действия. Термины "активное средство" и "терапевтическое средство", используемые в данном документе, должны быть смежными, если в контексте не указано иное. Гидрофобные активные средства могут, в частности, включать таковые, характеризующиеся растворимостью в воде менее приблизительно 100 мкг/мл при 25 градусах по Цельсию и при нейтральном показателе рН. В различных вариантах осуществления гидрофобные активные средства могут, в частности, включать таковые, характеризующиеся растворимостью в воде менее приблизительно 10 мкг/мл при 25 градусах по Цельсию и при нейтральном показателе рН. В некоторых вариантах осуществления гидрофобные активные средства могут, в частности, включать таковые, характеризующиеся растворимостью в воде менее приблизительно 5 мкг/мл при 25 градусах по Цельсию и при нейтральном показателе рН.
В некоторых иллюстративных вариантах осуществления активные средства могут включать без ограничения антипролиферативные средства, такие как паклитаксел, сиролимус (рапамицин), зотаролимус, эверолимус, темсиролимус, пимекролимус, такролимус и ридафоролимус; анальгезирующие средства и противовоспалительные средства, такие как алоксиприн, ауранофин, азапропазон, бенорилат, дифлунисал, этодолак, фенбуфен, фенопрофен кальция, флурбипрофен, ибупрофен, индометацин, кетопрофен, меклофенамовая кислота, мефенамовая кислота, набуметон, напроксен, оксифенбутазон, фенилбутазон, пироксикам, сулиндак; противоаритмические средства, такие как амиодарон НСl, дизопирамид, флекаинид ацетат, сернокислый хинидин; противобоктериальные средства, такие как бенетамин пенициллин, циноксацин, ципрофлоксацин НСl, кларитромицин, клофазимин, клоксациллин, демеклоциклин, доксициклин, эритромицин, этионамид, имипенем, налидиксовая кислота, нитрофурантоин, рифампицин, спирамицин, сульфабензамид, сульфадоксин, сульфамеразин, сульфацетамид, сульфадиазин, сульфафуразол, сульфаметоксазол, сульфапиридин, тетрациклин, триметоприм; антикоагулянты, такие как дикумарол, дипиридамол, аценакумарин, фениндион; антигипертензивные средства, такие как амлодипин, бенидипин, дародипин, дилитазем НСl, диазоксид, фелодипин, гуанабенз ацетат, исрадипин, миноксидил, никардипин НСl, нифедипин, нимодипин, феноксибензамин НСl, празозин HCl, резерпин, теразозин HCl; антимускариновые средства: атропин, бензгексол НСl, бипериден, этопропазин НСl, гиосциамин, мепензолат бромид, оксифенциклимин НСl, тропикамид; противоопухолевые средства и иммуносупрессанты, такие как аминоглутетимид, амсакрин, азатиоприн, бусульфан, хлорамбуцил, циклоспорин, дакарбазин, эстрамустин, этопозид, ломустин, мелфалан, меркаптопурин, метотрексат, митомицин, митотан, митозантрон, прокарбазин НСl, тамоксифен цитрат, тестолактон; бета-блокаторы, такие как ацебутолол, альфенолол, атенолол, лабеталол, метопролол, надолол, окспренолол, пиндолол, пропранолол; сердечные инотропные средства, такие как амринон, дигитоксин, дитоксин, эноксимон, ланатозид С, медигоксин; кортикостероиды, такие как беклометазон, бетаметазон, будесонид, кортизон ацетат, дезоксиметазон, дексазон, флудрокортизон ацетат, флунизолид, флукортолон, флутиказона пропионат, гидрокортизон, метилпреднизолон, преднизолон, преднизон, триамцинолон; средства, регулирующие содержание липидов, такие как безафибрат, клофибрат, фенофибрат, гемфиброзил, пробукол; нитраты и другие антиангинальные средства, такие как амилнитрит, глицерилтринитрат, изосорбида динитрат, изосорбид мононитрат, тетранитрат пентаэритритола.
Другие иллюстративные варианты осуществления активных средств, включают без ограничения активные средства для лечения гипертензии (HTN), такие как гуанетидин.
В конкретном варианте осуществления гидрофобные активные средства выбраны из группы, состоящей из паклитаксела, сиролимуса (рапамацина) и их смесей.
В некоторых вариантах осуществления гидрофобные активные средства могут быть конъюгированы с катионным средством. Конъюгация может включать гидрофобное активное средство, ковалентно связанное с катионным средством. В некоторых вариантах осуществления, где гидрофобное средство конъюгировано с катионным средством, сшивающее средство можно применять для присоединения гидрофобного средства к катионному средству. Подходящие сшивающие средства включают без ограничения полиэтиленгликоль, полиэтиленоксид и полипептиды встречающихся в природе и не встречающихся в природе аминокислот. В некоторых вариантах осуществления сшивающие средства могут быть биоразлагаемыми или расщепляемыми in vivo для помощи в высвобождении гидрофобных активных средств. Иллюстративные сшивающее средства могут дополнительно включать алкановые или ароматические соединения с замещениями по гетероатому, например N, S, Si, Se или О.
Размер частиц или распределение частиц препарата в виде частиц по размерам может быть определено с применением любой из различных методик, известных из уровня техники. В одном из способов практического применения лазерную дифракцию можно применять для измерения размера частиц и распределения. В процессе лазерной дифракции луч лазера проходит через диспергированный образец в виде частиц и происходит изменение интенсивности угла рассеивания света. Угол рассеивания света является большим для крупных частиц и меньшим для мелких частиц, и данные об интенсивности углового рассеивания можно собирать и анализировать для составления профиля размера частиц.
Анализ размера частиц и распределения можно осуществлять с применением лазерного оборудования для рассеивания света, например, Malvern System 4700, (для частиц от 1 нм до 3 мкм) или Horiba LA-930 (например, для частиц от 100 нм до 2 мм). Выходные данные таких анализаторов могут предоставлять информацию о размерах отдельных частиц и общем количестве частиц с такими размерами, отражающих распределение частиц по размеру. Анализ, предоставляющий данные о распределении по размеру, может быть предоставлен в виде гистограммы, графически представляющей размер и распределение по размеру всех частиц в препарате.
Иллюстративные гидрофобные терапевтические средства в виде частиц могут иметь различные морфологические характеристики. В некоторых вариантах осуществления гидрофобное терапевтическое средство в виде частиц может быть кристаллическим. В еще одних вариантах осуществления настоящего раскрытия гидрофобное терапевтическое средство в виде частиц может быть аморфным. Кроме того, комбинации кристаллических и аморфных гидрофобных терапевтических средств в виде частиц может быть желаемым для достижения, например, желаемой растворимости гидрофобных терапевтических средств в виде частиц.
В некоторых вариантах осуществления гидрофобное терапевтическое средство в виде частиц может характеризоваться средним диаметром ("dn", среднечисловой), который составляет меньше 30 мкм или меньше приблизительно 10 мкм. При этом, в некоторых вариантах осуществления гидрофобное терапевтическое средство в виде частиц может характеризоваться средним диаметром приблизительно 100 нм или больше. Например, микрочастицы, связанные с расширяющейся эластичной частью, могут характеризоваться средним диаметром в диапазоне от приблизительно 100 мкм до приблизительно 10 мкм, от приблизительно 150 мкм до приблизительно 2 мкм, от приблизительно 200 нм до приблизительно 5 мкм или даже от приблизительно 0,3 нм до приблизительно 1 мкм.
Нуклеиновые кислоты
Нуклеиновые кислоты, применяемые в вариантах осуществления настоящего изобретения, могут включать различные типы нуклеиновых кислот, которые могут действовать с обеспечением терапевтического эффекта. Иллюстративные виды нуклеиновых кислот могут включать без ограничения рибонуклеиновые кислоты (РНК), дезоксирибонуклеиновые кислоты (ДНК), малые интерферирующие РНК (siRNA), микроРНК (miRNA), взаимодействующую с piwi РНК (piRNA), короткую шпилечную РНК (shRNA), антисмысловые нуклеиновые кислоты, аптамеры, рибозимы, закрытые нуклеиновые кислоты и каталитическую ДНК. В конкретных вариантах осуществления применяемая нуклеиновая кислота представляет собой siRNA и/или ее производные.
В некоторых иллюстративных вариантах осуществления настоящего раскрытия, диапазон процентного соотношения гидрофобного активного средства и катионного средства (например, % РТХ/% PEI или % РТХ/% DOTAP; вес/вес) составляет от приблизительно 99,9/0,1 до приблизительно 70/30. В еще одних вариантах осуществления будет очевидно, что диапазон процентного соотношения гидрофобного активного средства составляет от приблизительно 99/1 до приблизительно 73/27; от приблизительно 98/2 до приблизительно 75/25; от приблизительно 98/2 до приблизительно 86/14; от приблизительно 97/3 до приблизительно 88/12; от приблизительно 95/5 до приблизительно 90/10 и даже в некоторых иллюстративных вариантах осуществления от приблизительно 93/7 до приблизительно 91/9.
Гидрофильные грунтовые покрытия
Один класс гидрофильных полимеров, пригодных в качестве полимерных материалов для образования гидрофильного грунтового покрытия, представляет собой синтетические гидрофильные полимеры. Синтетические гидрофильные полимеры, которые являются биологически стабильными (например, которые не показывают значительного разложения in vivo) можно получить из любого подходящего мономера, включая акриловые мономеры, виниловые мономеры, мономеры в виде простых эфиров или комбинации любого одного или нескольких из этих типов мономеров. Акриловые мономеры включают, например, метакрилат, метилметакрилат, гидроксиэтилметакрилат, гидроксиэтилакрилат, метакриловую кислоту, акриловую кислоту, глицерилакрилат, глицерилметакрилат, акриламид, метакриламид, диметилакриламид (DMA) и производные и/или смеси любого из них. Виниловые мономеры включают, например, винилацетат, винилпирролидон, виниловый спирт и производные любого из них. Мономеры в виде простых эфиров включают, например, этиленоксид, пропиленоксид, бутиленоксид и производные любого из них. Примеры полимеров, которые могут быть образованы из этих мономеров, включают
поли(акриламид), поли(метакриламид), поли(винилпирролидон), поли(акриловую кислоту),
поли(этиленгликоль), поли(виниловый спирт) и поли(НЕМА). Примеры гидрофильных сополимеров включают, например, сополимеры метилвинилового эфира/малеинового ангидрида и сополимеры винилпирролидона/(мет)акриламида. Можно применять смеси гомополимеров и/или сополимеров.
Примеры некоторых полимеров на основе акриламида, например, сополимер N,N-диметилакриламида и аминопропилметакриламида и сополимер акриламида и N,N-диметиламинопропилметакриламида описаны в примере 2 в патенте США №7807750 (Taton et al.), раскрытие которого включено в данный документ посредством ссылки.
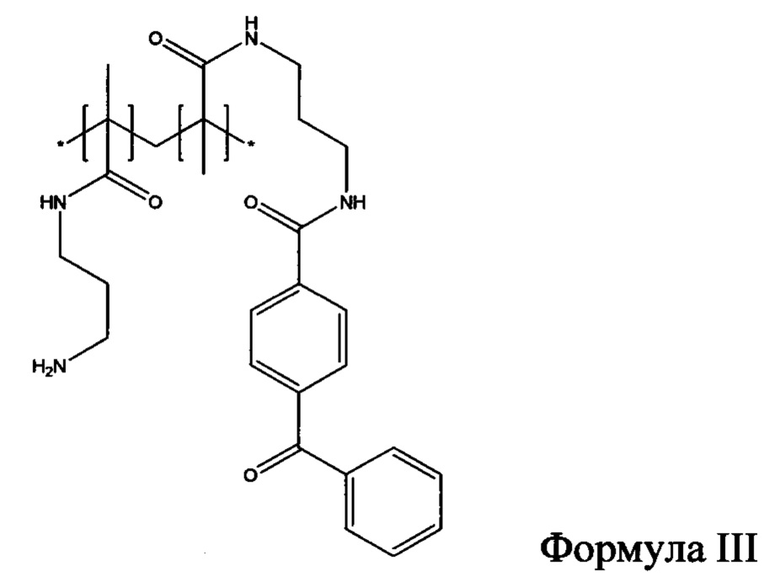
Другие гидрофильные полимеры, которые могут быть пригодными в настоящем раскрытии, представляют собой производные полимеров на основе акриламида с фотореактивными группами. Один такой иллюстративный гидрофильный полимер может быть образован в результате сополимеризации N-[3-(4-бензоилбензамидо)пропил]метакриламида (формула I) с N-(3-аминопропил)метакриламидом (формула II) с образованием сополимера (N-3-аминопропил)метакриламида и N-[3-(4-бензоилбензамидо)пропил]метакриламида (формула III). Получение полимера раскрыто в примере 1 в публикации заявки на патент США 2007/0032882 (выданного Lodhi, et al.), полное содержание которой включено в данный документ посредством ссылки.

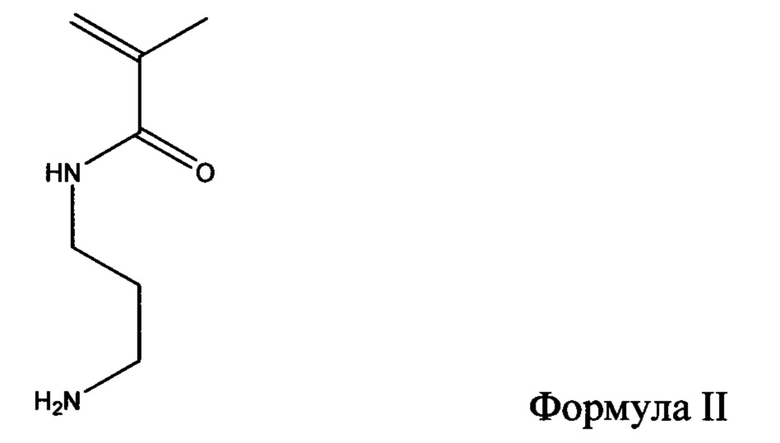
В некоторых вариантах осуществления гидрофильный полимер может представлять собой полимер на основе винилпирролидона или сополимер вини лпирро ли дона/(мет)акрил амида, такой как сополимер винилпирролидона и метакриламида. Если применяют сополимер на основе PVP, он может представлять собой сополимер винилпирролидона и мономера, выбранного из группы акриламидных мономеров. Иллюстративные акриламидные мономеры включают (мет)акриламид и производные (мет)акриламида, такие как алкил(мет)акриламид, примером чего является диметилакриламид и
аминоалкил(мет)акриламид, примером чего является аминопропилметакриламид и диметиламинопропилметакриламид. Например, сополимер винилпирролидона и N,N-диметиламинопропилметакриламида описан в примере 2 патента США №7807750 (Taton et al.).
В одном варианте осуществления полимеры и сополимеры, как описано, образуют производное с одной или несколькими фотоактивируемыми группами. Иллюстративные фотореактивные группы, которые могут быть боковыми по отношению к биологически стабильному гидрофильному полимеру, включают арилкетоны, такие как ацетофенон, бензофенон, антрахинон, антрон, хинон и антронподобные гетероциклы. Арилкетоны в данном документе могут, в частности, включать диарилкетоны. С помощью полимеров из данного документа можно получать гидрофильный полимер, имеющий боковую активируемую фотогруппу, который можно нанести на расширяемую и сжимаемую структуру и можно затем обработать актиничным излучением, достаточным, чтобы активировать фотогруппы и вызывать ковалентное связывание с целью, например, с материалом расширяемой и сжимаемой структуры. Фотогидрофильные полимеры можно применять для обеспечения прочного покрытия эластичной гидрогелевой матрицы, с гидрофильными полимерными материалами, ковалентно связанными с материалом расширяемой и сжимаемой структуры.
Гидрофильный полимер, имеющий боковые фотореактивные группы можно применять для получения эластичного гидрогелевого покрытия. Способы получения гидрофильных полимеров, имеющих
фотореактивные группы, известны из уровня техники. Например, способы получения фото-PVP описаны в патенте США №5414075, раскрытие которого
включено в данный документ посредством ссылки. Гидрофильные полимеры на основе фото-полиакриламида, например, сополимер акриламида и N-(3-(4-бензоилбензамидо)пропил)метакриламида, "Photo-PAA", и их производные можно применять для образования гидрофильных грунтовых покрытий в иллюстративных вариантах осуществления настоящего раскрытия. Способы получения фото-полиакриламида описаны в патенте США №6007833, раскрытие которого включено в данный документ посредством ссылки.
Другие варианты осуществления гидрофильных грунтовых покрытий включают производные полимеров на основе фото-полиакриламида, содержащие дополнительные реакционноспособные фрагменты. Некоторые иллюстративные реакционноспособные фрагменты включают N-оксисукцинимид и глицидилметакрилат.Иллюстративные производные фото-полиакриламида, содержащие дополнительные реакционноспособные фрагменты, включают сополимер акриламида, малеин-6-аминокапроновая-кислота-N-оксисукцинимида и N-(3-(4-бензоилбензамидо)пропил)метакриламида и сополимер акриламида, 3-(4-бензоилбензамидо)пропил)метакриламида и глицидилметакрилата. Дополнительные полимеры на основе фото-полиакриламида, содержащие реакционноспособные фрагменты, описаны в патентах США №№6465178 (выдан Chappa, et al.), 6762019 (выдан Swan, et al.) и 7309593 (выдан Ofstead, et al.), раскрытие которых включено в данный документ посредством ссылки.
Другие варианты осуществления иллюстративных гидрофильных грунтовых покрытий, которые включают производные полимеров на основе фото-полиакриламида, содержащие дополнительные реакционноспособные фрагменты, могут быть обнаружены в патенте США №6514734 (выдан Clapper, et al.), раскрытие которого включено в данный документ посредством ссылки во всей своей полноте.
В еще одних вариантах осуществления гидрофильное грунтовое покрытие может включать производные полимеров на основе фото-полиакриламида, содержащие заряженные фрагменты. Заряженные фрагменты включают как положительно, так и отрицательно заряженные частицы. Иллюстративные заряженные частицы включают без ограничения сульфонаты, фосфаты и производные четвертичных аминов. Некоторые примеры включают отрицательно заряженные частицы N-ацетилированного сополимера акриламида, натрий-2-акриламидо-2-метилпропансульфоната, N-(3-(4-бензоилбензамидо)пропил)метакриламида и метокси(этиленгликоль)монометакрилата. Другие отрицательно заряженные частицы, которые могут быть включены в гидрофильное грунтовое покрытие, описаны в патенте США №4973993, раскрытие которого включено в данный документ посредством ссылки во всей своей полноте. Положительно заряженные частицы могут включать сополимер акриламида, N-(3-(4-бензоилбензамидо)пропил)метакриламида и (3-(метакрилоиламино)пропил)триметиламмоний хлорида. Другие положительно заряженные частицы, которые могут быть включены в гидрофильное грунтовое покрытие, описаны в патенте США №5858653 (выдан Duran et al.), раскрытие которого включено в данный документ посредством ссылки во всей своей полноте.
В другом варианте осуществления полимеры и сополимеры, как описано, образуют производное с одной или несколькими полимеризуемыми группами. Полимеры с боковыми полимеризуемыми группами обычно называются макромерами. Полимеризуемая группа(-ы) может присутствовать на концевых участках (концах) полимерной цепи, или может присутствовать по длине полимера. В одном варианте осуществления полимеризуемые группы расположены случайным образом по длине полимера.
Иллюстративные покрытия на основе гидрофильных полимеров можно получить с применением методик прививания полимеров. Методики прививания полимеров могут включать нанесение неполимерного прививающего средства и мономеров на поверхность подложки, затем осуществление полимеризации мономеров на поверхности подложки при подходящей активации (например, без ограничения УФ-излучение) прививающего средства. Примеры способов прививания, образующие поверхности гидрофильных полимеров, представлены в патентах США №№7348055; 7736689 и 8039524 (все выданы Chappa et al.), полные раскрытия которых включены в данный документ посредством ссылки.
Необязательно покрытие может включать сшивающее средство. Сшивающее средство может ускорять ассоциацию полимеров на покрытии или привязывание полимеров к покрытой поверхности. Выбор конкретного сшивающего средства может зависеть от компонентов композиции для покрытия.
Подходящие сшивающие средства могут включать две или более активируемые группы, которые могут вступать в реакцию с полимерами в композиции. Подходящие активируемые группы могут включать фотореактивные группы, описанные в данном документе, такие как арилкетоны, такие как ацетофенон, бензофенон, антрахинон, антрон, хинон и антронподобные гетероциклы. Сшивающее средство, содержащее фотореактивную группу, может быть отнесено к фотосшивающему средству или фотоактивируемому сшивающему средству. Фотоактивируемое сшивающее средство может быть ионным и может характеризоваться хорошей растворимостью в водной композиции. Таким образом, в некоторых вариантах осуществления по меньшей мере одно ионное фотоактивируемое сшивающее средство можно использовать для образования покрытия. Ионное сшивающее средство может содержать кислую группу или ее соль, например, выбранную из сульфоновых кислот, карбоновых кислот, фосфоновых кислот, их солей и т.д. Иллюстративные противоионы включают щелочные, щелочноземельные металлы, аммоний, протонированные амины и т.д.
Иллюстративные фотоактивируемые сшивающие средства включают 4,5-бис(4-бензоилфенилметилеонокси)бензол-1,3-дисульфоновую кислоту или соль; 2,5-бис(4-бензоилфенилметиленокси)бензол-1,4-дисульфоновую кислоту; 2,5-бис(4-бензоилметиленокси)бензол-1-сульфоновую кислоту или соль; N,N-бис[2-(4-бензоилбензилокси)этил]-2-аминоэтансульфоновую кислоту или соль и т.д. См. патенты США №№6077698 (Swan et al.), 6278018 (Swan), 6603040 (Swan) и 7138541 (Swan), раскрытия которых включены в данный документ посредством ссылки.
Другие иллюстративные ионные фотоактивируемые сшивающие средства включают этилен-бис(4-бензоилбензилдиметиламмоний)дибромид и гексаметилен-бис(4-бензоилбензилдиметиламмоний)дибромид и т.д. См. патент США №5714360 (Swan et al.), раскрытие которого включено в данный документ посредством ссылки.
В еще одних вариантах осуществления можно применять связанные полифункциональные реагенты с фотоактивируемыми сшивающими группами. В некоторых примерах этих связанные полифункциональные реагенты включают тетракис(4-бензоилбензиловый эфир) пентаэритритола и тетракис(4-бензоилбензоатный эфир) пентаэритритола. См. патенты США №№5414075 (Swan et al.) и 5637460 (Swan et al.), раскрытия которых включены в данный документ посредством ссылки.
Дополнительные сшивающие средства могут включать таковые, характеризующиеся формулой Photo1-LG-Photo2, где Photo1 и Photo2 независимо представляют собой по меньшей мере одну фотореактивную группу и LG представляет собой сшивающую группу, содержащую по меньшей мере один атом кремния или по меньшей мере один атом фосфора, где сшивающее средство, способное к разложению, содержит ковалентную связь между по меньшей мере одной фотореактивной группой и сшивающей группой, где ковалентная связь между по меньшей мере одной фотореактивной группой и сшивающей группой прервана с помощью по меньшей мере одного гетероатома. См. патент США №8889760 (Kurdyumov, et al.), раскрытие которого включено в данный документ посредством ссылки. Дополнительные сшивающие средства могут включать таковые, имеющие молекулу ядра с одной или несколькими заряженными группами и одной или несколькими фотореактивными группами, ковалентно присоединенными к молекуле ядра посредством одного или нескольких линкеров, способных к разложению. См. публикацию заявки на патент США №2011/0144373 (Swan, et al.), раскрытие которой включено в данный документ посредством ссылки.
Сшивающие средства, применяемые в соответствии с вариантами осуществления, представленными в данном документе, могут включать таковые с по меньшей мере двумя фотореактивными группами. Иллюстративные сшивающие средства, представленные в качестве примера, описаны в патенте США №8889760, содержание которого включено в данный документ посредством ссылки во всей своей полноте.
В некоторых вариантах осуществления первое и/или второе сшивающее средство может иметь молекулярную массу менее приблизительно 1500 кДа. В некоторых вариантах осуществления сшивающее средство может иметь молекулярную массу менее приблизительно 1200, 1100, 1000, 900, 800, 700, 600, 500 или 400.
В некоторых вариантах осуществления по меньшей мере одно из первого и второго сшивающих средств, содержащее сшивающее средство, характеризующееся формулой Photo1-LG-Photo2, где Photo1 и Photo2 независимо представляют собой по меньшей мере одну фотореактивную группу и LG представляет собой сшивающую группу, содержащую по меньшей мере один атом кремния или по меньшей мере один атом фосфора, причем между по меньшей мере одной фотореактивной группой и сшивающей группой находится ковалентная связь, где ковалентная связь между по меньшей мере одной фотореактивной группой и сшивающей группой прервана с помощью по меньшей мере одного гетероатома.
В некоторых вариантах осуществления по меньшей мере одно из первого и второго сшивающих средств, содержащее сшивающее средство, характеризующееся формулой, выбранной из:
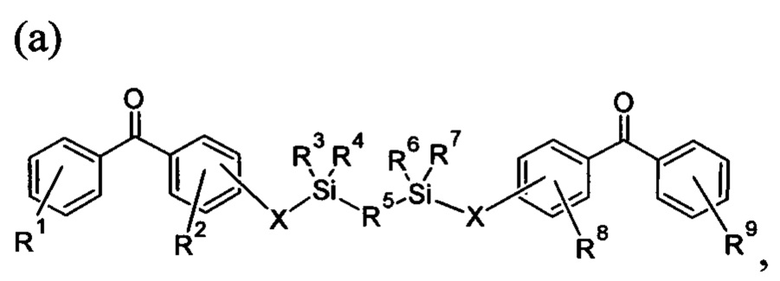
где R1, R2, R8 и R9 представляют собой любое замещение; R3, R4, R6 и R7 представляют собой алкил, арил или их комбинацию; R5 представляет собой любое замещение; и каждый X независимо представляет собой О, N, Se, S или алкил, или их комбинацию;
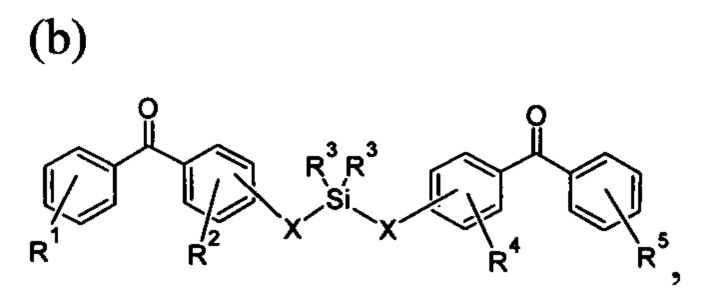
где R1 и R5 представляют собой любое замещение; R2 и R4 могут представлять собой любое замещение, за исключением ОН; R3 может представлять собой алкил, арил или их комбинацию; и X независимо представляет собой О, N, Se, S, алкилен или их комбинацию;
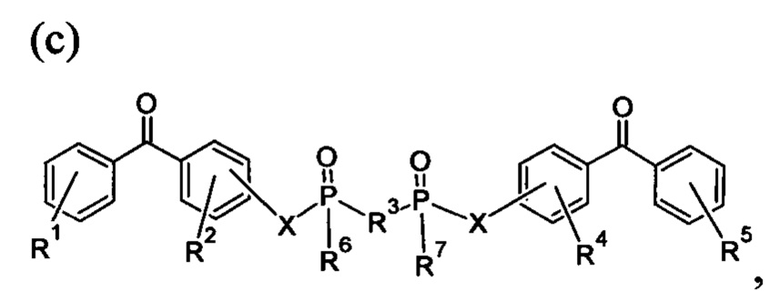
где R1, R2, R4 и R5 представляют собой любое замещение; R3 представляет собой любое замещение; R6 и R7 представляют собой алкил арил или их комбинацию; и каждый X может независимо представлять собой О, N, Se, S, алкилен или их комбинацию; и
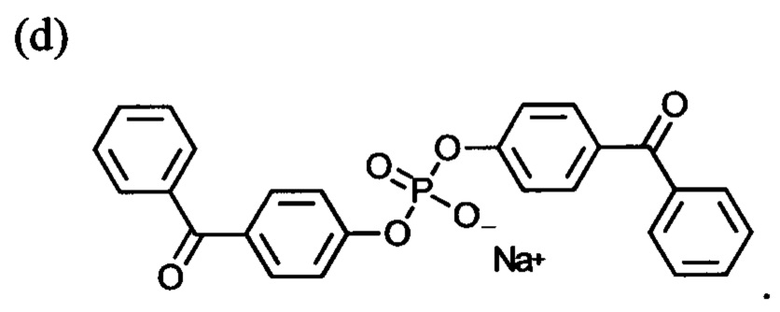
В конкретном варианте осуществления сшивающее средство может представлять собой бис(4-бензоилфенил)фосфат.
В некоторых вариантах осуществления фотоактивируемое сшивающее средство может быть ионным и может характеризоваться хорошей растворимостью в водной композиции, такой как первая и/или вторая композиция для покрытия. Таким образом, в некоторых вариантах осуществления по меньшей мере одно фотоактивируемое сшивающее средство применяют для образования покрытия. В некоторых случаях ионное фотоактивируемое сшивающее средство может сшивать полимеры внутри второго слоя покрытия, что также может улучшать долговечность покрытия.
Можно применять любое подходящее фотоактивируемое сшивающее средство. В некоторых вариантах осуществления ионное фотоактивируемое сшивающее средство представляет собой соединение формулы I: X1--Y--X2, где Y представляет собой радикал, содержащий по меньшей мере одну кислую группу, основную группу или соль кислой группы или основной группы. Каждый из X1 и Х2 независимо представляет собой радикал, содержащий скрытую фотореактивную группу. Фотореактивные группы могут быть такими же, как описано в данном документе. Спейсеры также могут быть частью X1 или Х2, наряду со скрытыми фотореактивными группами. В некоторых вариантах осуществления скрытые фотореактивные группы включают арилкетон или хинон.
Радикал Y в формуле I обеспечивает желаемую растворимость в воде для ионных фотоактивируемых сшивающих средств. Растворимость в воде (при комнатной температуре и оптимальном значении рН) составляет по меньшей мере приблизительно 0,05 мг/мл. В некоторых вариантах осуществления растворимость составляет от приблизительно 0,1 до приблизительно 10 мг/мл или от приблизительно 1 до приблизительно 5 мг/мл.
В некоторых вариантах осуществления формулы I Y представляет собой радикал, содержащий по меньшей мере одну кислую группу или ее соль. Такое фотоактивируемое сшивающее средство может быть анионным в зависимости от значения рН композиции для покрытия. Подходящие кислые группы включают, например, сульфоновые кислоты, карбоновые кислоты, фосфоновые кислоты и т.д. Подходящие соли таких групп включают, например, сульфонаты, карбоксилаты и фосфатные соли. В некоторых вариантах осуществления ионное сшивающее средство включает группу сульфоновой кислоты или сульфоната. Подходящие противоионы включают щелочные, щелочноземельные металлы, аммоний, протонированные амины и т.д.
Например, соединение формулы I может иметь радикал Y, который содержит группу сульфоновой кислоты или сульфоната; X1 и Х2 могут содержать фотореактивные группы, например, арилкетоны. Такие соединения включают 4,5-бис(4-бензоилфенилметилеонокси)бензол-1,3-дисульфоновую кислоту или соль; 2,5-бис(4-бензоилфенилметиленокси)бензол-1,4-дисульфоновую кислоту или соль; 2,5-бис(4-бензоилметиленокси)бензол-1-сульфоновую кислоту или соль; N,N-бис[2-(4-бензоилбензилокси)этил]-2-аминоэтансульфоновую кислоту или соль и т.д. См. патент США №6278018. Противоион соли может являться, например, аммонием или щелочным металлом, например, натрием, калием или литием.
В других вариантах осуществления формулы I Y может представлять собой радикал, который содержит основную группу или ее соль. Такие радикалы Y могут содержать, например, группу аммония, фосфония или сульфония. Группа может быть нейтральной или положительно заряженной, в зависимости от значения рН композиции для покрытия. В некоторых вариантах осуществления радикал Y содержит группу аммония. Подходящие противоионы включают, например, карбоксилаты, галогениды, сульфаты и фосфаты. Например, соединения формулы I могут иметь радикал Y, который содержит группу аммония; X1 и Х2 могут содержать фотореактивные группы, которые включают арилкетоны. Такие фотоактивируемые сшивающие средства включают этилен-бис(4-бензоилбензилдиметиламмониевую) соль; гексаметилен-бис(4-бензоилбензилдиметиламмониевую) соль; 1,4-бис(4-бензоилбензил)-1,4-диметилпиперазиндииевую) соль, бис(4-бензоилбензил)гексаметилентетрааминдииевую соль, бис[2-(4-безоилбензилдиметиламмноний)этил]-4-бензоилбензилметиламмониевую соль; 4,4-бис(4-бензоилбензил)морфолиновую соль; этиленбис[(2-(4-бензоилбензилдиметиламмоний)этил)-4-бензоилбензилметиламмониевую] соль; и 1,1,4,4-тетракис(4-бензоилбензил)пиперазиндииевую соль. См. патент США №5714360. Противоион, как правило, представляет собой карбоксилат-ион или галогенид. В одном варианте осуществления галогенид представляет собой бромид.
В других вариантах осуществления ионное фотоактивируемое сшивающее средство может представлять собой соединение, характеризующееся формулой:
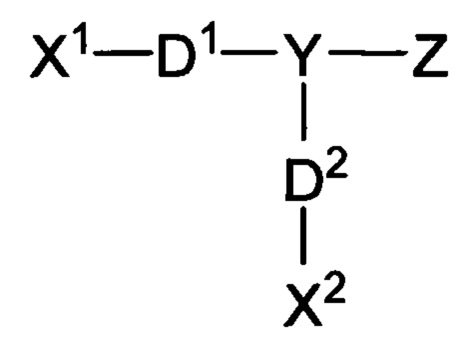
где X1 содержит первую фотореактивную группу; X2 содержит вторую фотореактивную группу; Y содержит молекулу ядра; Z содержит по меньшей мере одну заряженную группу; D1 содержит первый линкер, способный к разложению; и D2 содержит второй линкер, способный к разложению. Дополнительные иллюстративные ионные фотоактивируемые сшивающие средства, способные к разложению, представленные в качестве примера, описаны в публикации заявки на патент США 2011/0144373 (Swan et al., "Water Soluble Degradable Crosslinker"), раскрытие которой включено в данный документ посредством ссылки.
В некоторых аспектах можно применять неионное фотоактивируемое сшивающее средство. В одном варианте осуществления неионное фотоактивируемое сшивающее средство характеризуется формулой XR1R2R3R4, где X представляет собой химическую основную цепь и R1, R2, R3 и R4 представляют собой радикалы, которые содержат скрытую фотореактивную группу. Иллюстративные неионные сшивающие средства описаны, например, в патентах США №№5414075 и 5637460 (Swan et al., "Restrained Multifunctional Reagent for Surface Modification"). С химической точки зрения первая и вторая фотореактивные группы и соответствующие спейсеры могут быть одинаковыми или различными.
В других вариантах осуществления неионное фотоактивируемое сшивающее средство может быть представлено формулой: PG2-LE2-X-LE1-PG1,
где PG1 и PG2 независимо включают одну или несколько фотореактивных групп, например, арилкетонную фотореактивную группу, включающую без ограничения арилкетоны, например, ацетофенон, бензофенон, антрахинон, антрон, антронподобные гетероциклы, их замещенные производные или их комбинацию; LE1 и LE2 независимо представляют собой связующие элементы, включающие, например, сегменты, которые включают мочевину, карбамат, или их комбинацию; и X представляет собой молекулу ядра, которая может быть либо полимерной, либо неполимерной, включая без ограничения углеводород, включающий линейный, разветвленный, циклический углеводород или их комбинацию; моноциклический, полициклический, карбоциклический, гетероциклический или их комбинацию; бензол или его производное; или их комбинацию. Другие неионные сшивающие средства раскрыты, например, в заявке на патент США №13/316030, поданной 9 декабря 2011 года (публ. №US 2012/0149934) (Kurdyumov, "Photocrosslinker"), раскрытие которой включено в данный документ посредством ссылки.
Другие варианты осуществления неионных фотоактивируемых сшивающих средств могут включать, например, описанные в публикации заявки на патент США 2013/0143056 (Swan et al., "Photo-Vinyl Primers/Crosslinkers"), раскрытие которой включено в данный документ посредством ссылки. Иллюстративные сшивающие средства могут включать неионные фотоактивируемые сшивающие средства, характеризующиеся общей формулой R1 - X - R2, где R1 представляет собой радикал, содержащий виниловую группу, X представляет собой радикал, содержащий приблизительно от одного до двадцати атомов углерода, и R2 представляет собой радикал, содержащий фотореактивную группу.
Единичное фотоактивируемое сшивающее средство или любую комбинацию фотоактивируемых сшивающих средств можно применять для образования покрытия. В некоторых вариантах осуществления по меньшей мере одно неионное сшивающее средство, например, тетракис(4-бензоилбензиловый эфир) пентаэритритола можно применять с по меньшей мере одним ионным сшивающим средством. Например, по меньшей мере одно неионное фотоактивируемое сшивающее средство можно применять с по меньшей мере одним катионным фотоактивируемым сшивающим средством, например, этилен-бис(4-бензоилбензилдиметиламмониевой) солью или по меньшей мере одним фотоактивируемым сшивающим средством, например, 4,5-бис(4-биензоилфенилметиленокси)бензол-1,3-дисульфоновой кислотой или солью. В другом примере по меньшей мере одно неионное сшивающее средство можно применять с по меньшей мере одним катионным сшивающим средством и по меньшей мере одним анионным сшивающим средством. В еще одном примере по меньшей мере одно катионное сшивающее средство можно применять с по меньшей мере одним анионным сшивающим средством, но без неионного сшивающего средства.
Иллюстративное сшивающее средство представляет собой динатрий-4,5-бис[(4-бензоилбензил)окси]-1,3-бензолдисульфонат (DBDS). Этот реагент можно получить посредством объединения 4,5-дигидроксибензил-1,3-дисульфоната (CHBDS) с 4-бромметилбензофеоном (ВМВР) в THF и гидроксиде натрия, затем нагревания с обратным холодильником и охлаждения смеси с последующей очисткой и перекристаллизацией (также как описано в патенте США №5714360, включенном в данный документ посредством ссылки).
Дополнительные сшивающие средства могут включать сшивающие средства, описанные в публикации заявки на патент США №2010/0274012 (выдан Guire et al.) и патенте США №7772393 (выдан Guire et al.), содержание которых включено в данный документ посредством ссылки.
В некоторых вариантах осуществления сшивающие средства могут включать борсодержащие сшивающие средства, включая без ограничения борсодержащие сшивающие средства, раскрытые в публикации заявки на патент США 2013/0302529 под названием "Boron-Containing Linking Agents" от Kurdyumov et al., содержание которой включено в данный документ посредством ссылки. В качестве примера сшивающие средства могут включать группы бората, боразина или бороната и покрытия и устройства, которые включают такие сшивающие средства, наряду со связанными способами. В варианте осуществления сшивающее средство включает соединение, характеризующееся структурой (I):

где R1 представляет собой радикал, содержащий фотореактивную группу; R2 выбран из ОН и радикала, содержащего фотореактивную группу, алкильную группу и арильную группу; и R3 выбран из ОН и радикала, содержащего фотореактивную группу. В некоторых вариантах осуществления связи B-R1, B-R2 и B-R3 могут быть выбраны независимо для прерывания гетероатомом, таким как О, N, S или их смесями.
Дополнительные средства для применения в соответствии с вариантами осуществления, представленными в данном документе, могут включать реакционноспособные соединения на основе стильбена, включая без ограничения раскрытые в патенте США №8487137 под названием "Stilbene-Based Reactive Compounds, Polymeric Matrices Formed Therefrom, and Articles Visualizable by Fluorescence" от Kurdyumov et al., раскрытие которой включено в данный документ посредством ссылки.
Дополнительные фотореактивные средства, сшивающие средства, гидрофильные покрытия и связанные реагенты раскрыты в патентах США №№8513320 (выдан Rooijmans et al.); 8809411 (выдан Rooijmans) и 2010/0198168 (выдан Rooijmans), содержание которых включено в данный документ посредством ссылки.
Для образования гидрофильного грунтового покрытия можно также применять природные полимеры. Природные полимеры включают полисахариды, например, полидектсраны, карбоксиметилцеллюлозу и гидроксиметилцеллюлозу; гликозаминогликаны, например, гиалуроновую кислоту; полипептиды, например, растворимые белки, например, коллаген, альбумин и авидин и комбинации этих природных полимеров. Также можно применять комбинации природных и синтетических полимеров.
В некоторых случаях соединительный слой можно использовать для образования гидрофильное грунтовое слоя. В еще одних случаях соединительный слой можно добавлять к гидрофильному грунтовому слою. Соединительный слой может действовать для увеличения адгезии гидрофильного грунтового слоя к подложке. В других вариантах осуществления соединительный слой может действовать для увеличения адгезии гидрофобного активного средства к гидрофильному грунтовому слою. Иллюстративные соединительные слои включают без ограничения силан, бутадиен, полиуретан и парилен. Соединительные слои на основе силана описаны в публикации патента США 2012/0148852 (выдан Jelle, et al.), раскрытие которой включено в данный документ посредством ссылки.
В иллюстративных вариантах осуществления гидрофильный грунтовой слой может включать дубильную кислоту, полидофамин или другие материалы, содержащие катехин.
Подложки
Подложка может быть образована из любого желаемого материала или комбинации материалов, подходящих для применения внутри тела. В некоторых вариантах осуществления подложка образована из деформируемых и эластичных материалов, например, эластомеров (полимеры с эластичными свойствами). Иллюстративные эластомеры могут быть образованы из различных полимеров, включающих полиуретаны и сополимеры на основе полиуретана, полиэтилен, сополимеры стирола-бутадиена, полиизопрен, сополимеры изобутилена-изопрена (бутилкаучук), включающие галогенированный бутилкаучук, сополимеры бутадиена-стирена-акрилонитрила, силиконовые полимеры, фторсиликоновые полимеры, поликарбонаты, полиамиды, сложные полиэфиры, поливинилхлорид, сополимеры простого полиэфира-сложного полиэфира, сополимеры простого полиэфира-полиамида и т.д. Подложка может быть выполнена из единичного эластомерного материала или комбинации материалов.
Другие материалы для подложки могут включать образованные из полимеров, включающих олигомеры, гомополимеры и сополимеры, образующиеся в результате либо аддитивной, либо конденсационной полимеризации. Примеры подходящих аддитивных полимеров включают без ограничения полимеры на основе акрила, такие как полимеризуемые из метилакрилата, метилметакрилата, гидроксиэтилметакрилата, гидроксиэтилакрилата, акриловой кислоты, метакриловой кислоты, глицерилакрилата, глицерилметакрилата, метакриламида и акриламида; полимеры на основе винила, такие как этилен, пропилен, винилхлорид, винилацетат, винилпирролидон, винилидендифторид и стирол. Примеры конденсационных полимеров включают без ограничения полимеры на основе нейлона, такие как поликапролактам, полилауриллактам, полигексаметиленадипамид и полигексаметилендодекандиамид, а также полиуретаны, поликарбонаты, полиамиды, полисульфоны, поли(этилентерефталат), полидиметилсилоксаны и полиэфиркетон.
Кроме полимеров и в зависимости от типа устройства подложка может также быть образована из других неорганических материалов, например металлов (включая виды металлической фольги и сплавы металлов), стекла и керамики.
Способы модификации подложек, описанных выше, могут включать химические модификации для улучшения эксплуатационных характеристик подложки. Конкретные химические способы, которые можно применять, включают обработку озоном, химическое оксидирование, химическое травление кислотой, химическое травление щелочью, плазменную обработку и обработку коронированием, прививание к поверхности,
способы покрытия под действием теплового возбуждения (как ковалентные, так и нековалентные) и
модификации поверхности, включающие покрытия, содержащие допамин, дубильную кислоту, растительные полифенолы и другие катехины или содержащие катехины производные гидрофильных фрагментов. Кроме того, способы образования подложек, описанных выше, могут включать физические модификации, например, без ограничения пескоструйная обработка и текстурирование поверхности (например, либо во время, либо после способа литья полимеров).
В некоторых вариантах осуществления модификация подложек, описанных в данном документе, может обеспечивать пропускание слоя основного покрытия (например, гидофильного слоя) в качестве поверхностей подложки, которые были модифицированы, что будет обеспечивать улучшенную адгезию гидрофобного терапевтического средства и катионного средства, по сравнению с таковым для гидрофильного слоя.
Устройства
Следует принимать во внимание, что варианты осуществления, представленные в данном документе, включают, и могут применяться в сочетании с различными видами устройств, включающих без ограничения устройства для доставки лекарственного средства, например, баллонные катетеры, элюирующие лекарственное средство, баллонные катетеры, содержащие лекарственное средство, стенты, трансплантаты и т.д.
Некоторые варианты осуществления, описанные в данном документе, можно применять в сочетании с устройством отклонения потока, расширяемым баллоном, и саморасширяющимися устройствами отклонения потока. Другие варианты осуществления могут включать применения в контакте с баллонами для ангиопластики (например, без ограничения чрескожной транслюминальной коронарной ангиопластики и чрескожной транслюминальной ангиопластики). Еще одни варианты осуществления могут включать варианты применения в сочетании с баллонами для синопластики для лечения ENT, уретральными баллонами и уретральными стентами для лечения урологических заболеваний и лечения заболеваний желудочно-кишечного тракта (например, устройства, применяемые для колоноскопии). Гидрофобное активное средство можно переносить в ткань из надуваемого устройства в виде баллона или из устройства в виде пластыря. Другие варианты осуществления настоящего раскрытия можно дополнительно применять в сочетании с устройствами в виде катетера для микроинфузий. В некоторых вариантах осуществления устройства в виде катетера для микроинфузий можно применять для нацеливания активных средств на симпатические нервы почек для лечения, например, гипертензии.
Варианты осуществления, включенные в данный документ, также можно применять в сочетании с нанесением различных активных средств на кожу (например, без ограничения трансдермальная доставка лекарственного средства).
Другие иллюстративные применения в медицине, где можно применять варианты осуществления настоящего раскрытия, дополнительно охватывают способы лечения стеноза шейки мочевого пузыря (например, после трансуретральной резекции простаты), ларинготрахеального стеноза (например, в сочетании с последовательной эндоскопической дилатацией для лечения подсвязочного стеноза, лечения разновидностей рака ротовой полости и разновидностей герпеса губ и стеноза желчного протока (например, после лечения рака поджелудочной железы, гепатоклеточного или рака желчного протока). В качестве дополнительного примера, варианты осуществления, представленные в данном документе, можно применять в сочетании с инструментами для применения лекарственного средства. Инструменты для применения лекарственного средства могут включать таковые для применения в различных процедурах, включая хирургические процедуры, где необходимо наносить активные средства на конкретные места тканей. Примеры могут включать без ограничения инструменты для применения лекарственного средства, которые можно применять в хирургической ортопедии для того, чтобы наносить активные средства на конкретные поверхности кости, хряща, сухожилий или другой ткани посредством физического контакта инструмента для применения лекарственного средства с этими тканях. Инструменты для применения лекарственного средства могут включать без ограничения ручные инструменты для применения лекарственного средства, пластыри с лекарственным средством, марки с лекарственным средством, диски для нанесения лекарственного средства и т.д.
В некоторых вариантах осуществления инструменты для применения лекарственного средства могут иметь поверхность, содержащую слой гидрофильного полимера, расположенный на ней, и покрытые частицы терапевтического средства, расположенные на слое гидрофильного полимера, причем покрытые частицы терапевтического средства содержат гидрофобное терапевтическое средство в виде частиц; и катионное средство, расположенное на гидрофобном терапевтическое средстве в виде частиц.
При применении различные варианты осуществления, включенные в данном документе, могут обеспечивать быстрый перенос терапевтических средств в целевые ткани. Например, в некоторых вариантах осуществления медицинский работник может создавать физический контакт между частью устройства для доставки лекарственного средства, содержащего терапевтическое средство, и тканью, являющейся целевой, и при этом терапевтическое средство может быть быстро перенесено из устройства для доставки лекарственного средства в указанную ткань. Таким образом, можно достичь точного контроля того, какие ткани обеспечиваются терапевтическим средством.
Один благоприятный аспект различных вариантов осуществления, описанных в данном документе, заключается в том, что терапевтическое средство может быть очень быстро перенесено из устройства для доставки лекарственного средства или покрытия в целевую ткань. В некоторых вариантах осуществления полный перенос терапевтического средства из устройства для доставки лекарственного средства или покрытия в ткань происходит в течение 30 минут или менее. В некоторых вариантах осуществления полный перенос терапевтического средства из устройства для доставки лекарственного средства или покрытия в ткань происходит в течение 15 минут или менее. В некоторых вариантах осуществления полный перенос терапевтического средства из устройства для доставки лекарственного средства или покрытия в ткань происходит в течение 10 минут или менее. В некоторых вариантах осуществления полный перенос терапевтического средства из устройства для доставки лекарственного средства или покрытия в ткань происходит в течение 5 минут или менее. В некоторых вариантах осуществления полный перенос терапевтического средства из устройства для доставки лекарственного средства или покрытия в ткань происходит в течение 2 минут или менее. В некоторых вариантах осуществления полный перенос терапевтического средства из устройства для доставки лекарственного средства или покрытия в ткань происходит в течение 1 минуты или менее.
Дополнительные варианты осуществления
Как описано выше, некоторые варианты осуществления могут включать гидрофильное грунтовое покрытие или слой. В некоторых вариантах осуществления раствор гидрофильного полимера образован посредством объединения гидрофильного полимера с одним или несколькими растворителями. Иллюстративные гидрофильные полимеры описаны более подробно ниже. Раствор гидрофильного полимера можно затем наносить на подходящую подложку, такую как расширяемый баллон, расположенный на стержне катетера. Для нанесения раствора гидрофильного полимера на подложку можно применять много различных методик. В качестве примера, иллюстративные методики могут включать нанесение покрытия с помощью кисти, капельное нанесение покрытия, нанесение покрытия с помощью лезвия, нанесение покрытия погружением, нанесение покрытия распылением, методом микродисперсии и т.д.
В некоторых вариантах осуществления, например в таких, где применяют фотополимер для образования гидрофильного слоя, можно осуществлять стадию актиничного излучения для того, чтобы активировать скрытые фотореактивные группы на гидрофильном полимере или на сшивающем средстве для того, чтобы ковалентно связать гидрофильный полимер с поверхностью подложки. В качестве примера, после нанесения раствора гидрофильного полимера на подложку устройство может быть подвержено УФ-облучению при желаемой длине волны в течение определенного периода времени.
Затем гидрофобное активное средство может быть получено и обработано для подготовки его к осаждению. В некоторых вариантах осуществления обработка гидрофобного активного средства может включать стадии, такие как размалывание активного средства. В некоторых вариантах осуществления обработка гидрофобного активного средства может включать стадии, такие как перекристаллизация активного средства. В некоторых вариантах осуществления обработка гидрофобного активного средства может включать лиофилизацию активного средства.
В различных вариантах осуществления гидрофобное активное средство в виде частиц может быть суспендированно в воде. При применении гидрофобного активного средства и катионного средства могут быть образованы покрытые частицы терапевтического средства. В качестве примера, к суспензии гидрофобного активного средства можно добавлять катионное средство в воде или отличном растворителе. В различных вариантах осуществления можно осуществлять стадию смешивания или встряхивания для обеспечения связывания гидрофобного активного средства с катионным средством. В некоторых вариантах осуществления катионное средство будет окружать гидрофобное активное средство в виде частиц.
В некоторых вариантах осуществления, раствор нуклеиновой кислоты можно добавлять к смеси либо до, либо после добавления катионного средства и стадий смешивания/встряхивания. В некоторых вариантах осуществления добавочный компонент, такой как, описанные выше, может быть добавлен к смеси. Смесь можно наносить на подложку устройства либо непосредственно, либо поверх гидрофильного грунтового покрытия. В качестве примера, иллюстративные методики для нанесения могут включать нанесение покрытия с помощью кисти, капельное нанесение покрытия, нанесение покрытия с помощью лезвия, нанесение покрытия погружением, нанесение покрытия распылением, методом микродисперсии и т.д.
После нанесения обеспечивают высушивание композиции. В контексте баллонного катетера, элюирующего лекарственное средство, или баллонного катетера, содержащего лекарственное средство, например, баллоны можно складывать, гофрировать и заключать в оболочку. В некоторых вариантах осуществления баллоны можно помещать в печь на некоторый период времени.
В некоторых вариантах осуществления настоящего раскрытия активное средство, которое не является гидрофобным, может быть модифицировано для того, чтобы быть по существу гидрофобным для расположения слоя гидрофильного полимера. Иллюстративные модификации могут включать получение пролекарственных средств, за счет чего гидрофобность активного средства может быть модифицирована посредством ковалентной связи с полимером. Другие пролекарственные средства могут включать активное средство, которое образуется in-situ посредством расщепления связи пролекарственного средства. Другие иллюстративные модификации могут включать без ограничения частицы (например, наночастицы или микрочастицы), содержащие активное средство, инкапсулированное в гидрофобный полимер. В некоторых вариантах осуществления гидрофобный полимер может быть биологически разрушаемым, высвобождая активное средство в процессе доставки в целевую ткань. Другие иллюстративные модификации могут включать без ограничения мицеллы или другие подобные конструкции с измененной гидрофобностью, образованные в результате взаимодействия между активным средством и липидной добавкой.
Препараты в виде микрочастиц по настоящему раскрытию могут включать дополнительные наполнители для модификации поверхности микрочастицы для конкретного применения. Например, предпочтительными могут быть модификации поверхности микрочастицы, приводящие к образованию микрочастицы с положительным или отрицательным дзета-потенциалом. Иллюстративные материалы которые могут быть использованы для модификации дзета-потенциала поверхности микрочастицы, включают без ограничения полиакриловую кислоту (ПАА), полиглутаминовую кислоту, полиаспарагиновую кислоту, гепарин, альгинат, гиалуроновую кислоту и поливинилсульфоновую кислоту. Катионные полимеры, описанные выше, могут также быть иллюстративными материалами, применяемыми для модификации дзета-потенциала поверхности микрочастицы.
Настоящее изобретение можно лучше понять со ссылкой на следующие примеры. Эти примеры предназначены для иллюстрации конкретных вариантов осуществления настоящего изобретения и не предназначены для ограничения объема настоящего изобретения.
ПРИМЕРЫ
Пример 1. Получение паклитаксела и процесс нанесения покрытия на баллон
"Паклитаксел, измельченный в лабораторной мельнице". Паклитаксел (LC laboratories) суспендировали в воде при 65 мг/мл и измельчали с использованием 5 мм стабилизированных циркониевых 5×5 мм цилиндрических бусин (Stanford Materials Corp). После размалывания в течение 18 часов суспензию удаляли из бусин и лиофилизировали.
"Паклитаксел, подвергнутый действию ультразвука". Кристаллы паклитаксела получали путем суспендирования паклитаксела (LC Laboratories) в воде при 50 мг/мл. Паклитаксел тонко измельчали с использованием акустического зонда в течение 30 секунд и оставляли полученную суспензию на три дня при комнатной температуре на орбитальном встряхивателе с обработкой ультразвуком в течение 1 часа в день на ультразвуковой бане в течение трехдневного периода. Смесь лиофилизировали.
Если не указано иное, во всех исследованиях использовали следующие нейлоновые баллоны: 20×3,5 мм.
Гидрофильные грунтовые покрытия (R) наносили на поверхности нейлонового баллона. Раствор гидрофильного грунтового покрытия содержал 6,25 г/л поливинилпирролидона (PVP) с группами бензоилбензойной кислоты; 1,25 г/л полиакриламида; 2,5 г/л PVP (K90); и 0,05 г/л фотосшивающего средства; в растворе растворителя 85:15 вода/изопропанол. Для примеров 1-15 сшивающие средства получали, как описано в US 6278018, Swan. Для примеров 16-24 сшивающие средства получали, как описано в публикации заявки на патент США 2012/0046384, Kurdyumov et al. и US 6278018, Swan. После покрытия материал грунтового покрытия сушили при комнатной температуре в течение 15 минут и затем облучали с помощью УФ-излучения в течение 3 минут.
Как правило, для любого взятого состава достигалось количество 3 мкг/мм2 паклитаксела для покрытия на баллонах (которое составляло 660 мкг паклитаксела на баллон). Смесь для покрытия, содержащую паклитаксел, наносили поверх отвержденного гидрофильного грунтового покрытия (R) посредством пипетки прямого вытеснения и высушивали с использованием термопистолета.
Все баллоны высушивали в течение ночи при комнатной температуре. Баллоны складывали, гофрировали и заключали в нейлоновую оболочку. Затем баллоны помещали в печь при 55°С на 1 час.
Химические реактивы получали от Sigma Aldrich, если не указано иное. Количества (мкг) активного средства, которое переносили в ткань, и стандартные отклонения для примеров 2-15 перечислены в таблице 3. Количества (мкг) активного средства, которое переносили в ткань, и стандартные отклонения для примеров 16-24 перечислены в таблице 9.
Пример 2. Составы с РОТ АР и siRNA
Измельченный в лабораторной мельнице лиофилизированный паклитаксел суспендировали в воде при 67 мг/мл. К 100 мкл суспензии добавляли 31 мкл DOT АР при 20 мг/мл в этаноле (Avanti Polar Lipids) и подвергали действию ультразвука в течение 10 минут на ультразвуковой бане. Затем добавляли 4,4 мкл 1 мМ некодирующей siRNA, 0,065 мг. На три баллона наносили гидрофильное грунтовое покрытие (R) и верхний слой покрытия, содержащий паклитаксел, в соответствии с процедурой, описанной в примере 1.8 мкл смеси, содержащей паклитаксел, использовали для верхнего слоя покрытия.
К 130 мкл смеси, содержащей паклитаксел/DOTAP/siRNA, добавляли 3,7 мг гликогена (доступный от VWR) (74 мкл 50 мг/мл раствора в воде). На четыре баллона наносили гидрофильное грунтовое покрытие (R) и верхний слой покрытия, содержащий паклитаксел, с гликогеном в соответствии с процедурой, описанной в примере 1. Смесь, содержащую паклитаксел (8 мкл), использовали для верхнего слоя покрытия.
Все баллоны высушивали в течение ночи при комнатной температуре. Баллоны складывали, гофрировали и заключали в нейлоновую оболочку. Затем баллоны помещали в печь при 55°С на 1 час.
Высвобождение паклитаксела из покрытия затем оценивали в соответствии со следующей процедурой. Готовили вырезанные коронарные артерии свиньи (Pel-Freez Biologicals) и содержали при 37°С. После удаления оболочек из баллонов баллоны замачивали в PBS при 37°С в течение 30 секунд, а затем удаляли из PBS. Затем баллон расширяли в артериальной ткани при 60-80 фунт/кв. дюйм в течение 30 секунд при 37°С, и после выпускания воздуха и удаления баллона артериальную ткань промывали с помощью PBS при 37°С. После удаление баллона из ткани и промывания ткань помещали в раствор метанол/0,1% уксусная кислота. Полученный раствор метанола и уксусной кислоты тестировали в отношении содержания паклитаксела с использованием HPLC ("перенос лекарственного средства в ткань").
Пример 3. Составы с DOTAP и siRNA
Состав 1 - "PAX+DOTAP1x"
Измельченный в лабораторной мельнице паклитаксел суспендировали в воде при 65 мг/мл и обрабатывали с помощью акустического зонда в течение 30 секунд. Отвешивали 100 мг суспензии (6,35 мг паклитаксела) и добавляли 32 мкл раствора 20 мг/мл DOTAP в этаноле. Смесь подвергали действию ультразвука в течение 10 минут. На баллон наносили гидрофильное грунтовое покрытие (R) и верхний слой покрытия, содержащий паклитаксел, в соответствии с процедурой, описанной в примере 1. Смесь, содержащую паклитаксел (10 мкл), использовали для верхнего слоя покрытия.
Состав 2 - "PAX+DOTAP2x"
Измельченный в лабораторной мельнице паклитаксел суспендировали в воде при 65 мг/мл и обрабатывали с помощью акустического зонда в течение 30 секунд. Отвешивали 100 мг суспензии (6,35 мг паклитаксела) и добавляли 64 мкл раствора 20 мг/мл DOTAP в этаноле. Смесь подвергали действию ультразвука в течение 10 минут. На баллон наносили гидрофильное грунтовое покрытие (R) и верхний слой покрытия, содержащий паклитаксел, в соответствии с процедурой, описанной в примере 1. Смесь, содержащую паклитаксел (10 мкл), использовали для верхнего слоя покрытия.
Состав 3 - "PAX+DOTAP1x+si"
К составу 1 добавляли 60 мкг siRNA (4,2 мкл, 1 мМ раствор). На баллон наносили гидрофильное грунтовое покрытие (R) и верхний слой покрытия, содержащий паклитаксел, в соответствии с процедурой, описанной в примере 1. Смесь, содержащую паклитаксел (10 мкл), использовали для верхнего слоя покрытия.
Состав 4 - "PAX+DOTAP2x+si"
К составу 2 добавляли 120 мкг siRNA: 8,4 мкл 1 мМ раствор. На баллон наносили гидрофильное грунтовое покрытие (R) и верхний слой покрытия, содержащий паклитаксел, в соответствии с процедурой, описанной в примере 1. Смесь, содержащую паклитаксел (10 мкл), использовали для верхнего слоя покрытия.
Состав 5 - "PAX+DOTAP1x+si+F68"
К составу 3 добавляли 4 мкл F68 при 100 мг/мл в воде (400 мкг, ~ 6% вес/вес от общего содержания в составе). На баллон наносили гидрофильное грунтовое покрытие (R) и верхний слой покрытия, содержащий паклитаксел, в соответствии с процедурой, описанной в примере 1. Смесь, содержащую паклитаксел (10 мкл), использовали для верхнего слоя покрытия.
Состав 6 - "PAX+DOTAP2x+si+F68"
К составу 4 добавляли 4 мкл F68 при 100 мг/мл в воде (400 мкг, ~ 6% вес/вес от общего содержания в составе). На баллон наносили гидрофильное грунтовое покрытие (R) и верхний слой покрытия, содержащий паклитаксел, в соответствии с процедурой, описанной в примере 1. Смесь, содержащую паклитаксел (10 мкл), использовали для верхнего слоя покрытия.
Все баллоны высушивали в течение ночи при комнатной температуре. Баллоны складывали, гофрировали и заключали в нейлоновую оболочку. Затем баллоны помещали в печь при 55°С на 1 час.
Высвобождение паклитаксела из покрытия затем оценивали в соответствии с процедурой, описанной в примере 2.
Пример 4. Составы с DOTAP
Использовали паклитаксел, измельченный в лабораторной мельнице (как указано выше). В качестве альтернативы, паклитаксел тонко измельчали с использованием мельницы для тончайшего помола Netsch и высушивали сублимацией.
Измельченные в Netsch частицы паклитаксела суспендировали при 67 мг/мл в воде и подвергали действию ультразвука в течение 10 минут.
Измельченные в лабораторной мельнице частицы паклитаксела суспендировали при 67 мг/мл в воде и подвергали действию ультразвука в течение 10 минут.
Состав 1
Отвешивали 100 мг суспензии измельченного в Netsch паклитаксела при 67 мг/мл в DDW (6,28 мг паклитаксела) и подвергали действию ультразвука до хорошего измельчения. Добавляли раствор 20 мг/мл DOTAP в этаноле (31,4 мкл) и подвергали действию ультразвука на ультразвуковой бане в течение 10 минут. На каждый из двух баллонов наносили гидрофильное грунтовое покрытие (R) и верхний слой покрытия, содержащий паклитаксел, в соответствии с процедурой, описанной в примере 1. Смесь, содержащую паклитаксел (14 мкл), использовали для верхнего слоя покрытия.
Состав 2
Отвешивали 100 мг суспензии измельченного в Netsch паклитаксела при 67 мг/мл в DDW (6,28 мг паклитаксела) и подвергали действию ультразвука до хорошего измельчения. Добавляли 0,628 мг DOTAP (31,4 мкл 20 мг/мл DOTAP в этаноле) и подвергали действию ультразвука на ультразвуковой бане в течение 10 минут. Затем 0,063 мг siRNA: 4,4 мкл siRNA при 1 мМ, 14,2 мг/мл добавляли и хорошо перемешивали вихревым способом; подвергали действию ультразвука в течение 5 минут. Добавляли 4 мкл F68 при 10 мг/мл в воде. На каждый из двух баллонов наносили гидрофильное грунтовое покрытие (R) и верхний слой покрытия, содержащий паклитаксел, в соответствии с процедурой, описанной в примере 1. Смесь, содержащую паклитаксел (15 мкл), использовали для верхнего слоя покрытия.
Состав 3
Отвешивали 100 мг суспензии измельченного в лабораторной мельнице паклитаксела при 67 мг/мл в DDW (6,28 мг паклитаксела) и подвергали действию ультразвука до хорошего измельчения. Добавляли 31,4 мкл раствора 20 мг/мл DOTAP в этаноле и подвергали действию ультразвука на ультразвуковой бане в течение 10 минут. На каждый из двух баллонов наносили гидрофильное грунтовое покрытие (R) и верхний слой покрытия, содержащий паклитаксел, в соответствии с процедурой, описанной в примере 1. Смесь, содержащую паклитаксел (14 мкл), использовали для верхнего слоя покрытия. Тестировали только один баллон.
Состав 4
Отвешивали 200 мг суспензии измельченного в лабораторной мельнице паклитаксела при 67 мг/мл в DDW (12,56 мг паклитаксела) и подвергали действию ультразвука до хорошего измельчения. Добавляли 2,51 мг DOTAP (126 мкл 20 мг/мл DOTAP в этаноле) и подвергали действию ультразвука на ультразвуковой бане в течение 10 минут.На каждый из двух баллонов наносили гидрофильное грунтовое покрытие (R) и верхний слой покрытия, содержащий паклитаксел, в соответствии с процедурой, описанной в примере 1. Смесь, содержащую паклитаксел (17,5 мкл), использовали для верхнего слоя покрытия.
Состав 5
Отвешивали 100 мг суспензии измельченного в лабораторной мельнице паклитаксела при 67 мг/мл в DDW (6,28 мг паклитаксела) и подвергали действию ультразвука до хорошего измельчения. Добавляли 0,628 мг DOTAP (31,4 мкл 20 мг/мл DOTAP в этаноле) и подвергали действию ультразвука на ультразвуковой бане в течение 10 минут.
Добавляли 4 мкл F68 при 10 мг/мл в воде (0,6% против паклитаксела или общего количества). На каждый из двух баллонов наносили гидрофильное грунтовое покрытие (R) и верхний слой покрытия, содержащий паклитаксел, в соответствии с процедурой, описанной в примере 1. Смесь, содержащую паклитаксел (15 мкл), использовали для верхнего слоя покрытия.
Состав 6
В новую пробирку переносили 130 мкл состава 4 и добавляли 4 мкл F68 при 100 мг/мл в воде (0,5%). На два баллона наносили гидрофильное грунтовое покрытие (R) и верхний слой покрытия, содержащий паклитаксел, в соответствии с процедурой, описанной в примере 1. Смесь, содержащую паклитаксел (17,5 мкл), использовали для верхнего слоя покрытия.
Состав 7
Отвешивали 200 мг суспензии измельченного в лабораторной мельнице паклитаксела при 67 мг/мл в DDW (12,56 мг паклитаксела) и подвергали действию ультразвука до хорошего измельчения. Добавляли 1,26 мг DOTAP: 63 мкл 20 мг/мл DOTAP в этаноле и подвергали действию ультразвука на ультразвуковой бане в течение 10 минут. Затем 0,126 мг siRNA: 8,8 мкл siRNA при 1 мМ, 14,2 мг/мл добавляли и хорошо перемешивали вихревым способом; подвергали действию ультразвука в течение 5 минут. Добавляли 8 мкл F68 при 10 мг/мл в воде. На каждый из двух баллонов наносили гидрофильное грунтовое покрытие (R) и верхний слой покрытия, содержащий паклитаксел, в соответствии с процедурой, описанной в примере 1. Смесь, содержащую паклитаксел (15 мкл), использовали для верхнего слоя покрытия.
Все баллоны высушивали в течение ночи при комнатной температуре. Баллоны складывали, гофрировали и заключали в нейлоновую оболочку. Затем баллоны помещали в печь при 55°С на 1 час. Высвобождение паклитаксела из покрытия затем оценивали в соответствии с процедурой, описанной в примере 2.
Пример 5. Перенос покрытия из стержней
Верхнюю поверхность стержней длиной 5 см, имеющих диаметр 5 мм, покрывали гидрофильным грунтовым покрытием (R), описанным выше. Покрытие наносили посредством нанесения с помощью кисти раствора на поверхности стержней, высушивая в течении 15 минут при комнатной температуре, а затем облучения в течение 3 минут с помощью УФ. Получали три состава:
Состав 1
Паклитаксел, измельченный в лабораторной мельнице, суспендировали в воде при 67 мг/мл. Отвешивали 100 мг суспензии (6,28 мг паклитаксела) и подвергали действию ультразвука до хорошего измельчения. Добавляли 1,26 мг DOTAP (62,8 мкл 20 мг/мл DOTAP в этаноле) и подвергали действию ультразвука на ультразвуковой бане в течение 10 минут.
Состав 2
Паклитаксел, измельченный в лабораторной мельнице, суспендировали в воде при 67 мг/мл. Отвешивали 100 мг суспензии (6,28 мг паклитаксела) и подвергали действию ультразвука до хорошего измельчения. Добавляли 1,26 мг DOTAP (62,8 мкл 20 мг/мл DOTAP в этаноле) и подвергали действию ультразвука на ультразвуковой бане в течение 10 минут. Затем добавляли F68 5% вес/вес от общего состава в виде раствора 100 мг/мл в воде.
Состав 3
Паклитаксел, измельченный в лабораторной мельнице, суспендировали в воде при 67 мг/мл. Отвешивали 100 мг суспензии (6,28 мг паклитаксела) и подвергали действию ультразвука до хорошего измельчения. Добавляли 1,26 мг DOTAP (62,8 мкл 20 мг/мл DOTAP в этаноле) и подвергали действию ультразвука на ультразвуковой бане в течение 10 минут. Затем добавляли 62,8 мкл декстрана (100 мг/мл в воде).
В трех повторностях стержни покрывали верхним слоем покрытия, содержащим паклитаксел, посредством пипетирования 5 мкл одного из составов и обеспечения его высушивания при комнатной температуре в течение ночи.
Ex vivo ткань кожи свиньи обрезали от жира и вырезали 8 мм с помощью прибора для вырезания ткани (Sklar) и выдерживали при 37°С. Стержни замачивали в течение 30 секунд в PBS при 37°С. Затем стержни вдавливали в вырезанную ткань в течение 30 секунд. Образцы ткани помещали в раствор метанола/0,1% уксусной кислоты в сосуд со средой для разрушения ткани. Ткань разрушали для экстрагирования перенесенного паклитаксела.
Пример 6. Варьирующие соотношения компонентов
Гидрофильным грунтовым покрытием (R) покрывали стержни 10 нейлоновых баллонов в соответствии с процедурой, описанной в примере 1.
Паклитаксел, измельченный в лабораторной мельнице, суспендировали в воде при 65 мг/мл. DOTAP, растворенный в этаноле при 25 мг/мл, добавляли к составу при 20 или 40% вес/вес паклитаксела и подвергали действию ультразвука на ультразвуковой бане в течение 10 минут. К некоторым из полученных смесей добавляли желатин В, гликоген или декстран в виде раствора 100 мг/мл в воде при 33% или 50% вес/вес от общего веса матрицы. Составы наносили в качестве верхнего слоя покрытия на баллон (в соответствии с процедурой в примере 1), стремясь получить в общем 700 мкг паклитаксела в покрытии. Баллоны складывали, гофрировали и заключали в нейлоновую оболочку. Затем баллоны помещали в печь при 55°С на 1 час.
Высвобождение паклитаксела из покрытия затем оценивали в соответствии с процедурой, описанной в примере 2.
Пример 7. Составы с PLURONIC® F68
Составы получали путем суспендирования паклитаксела, измельченного в лабораторной мельнице, в воде при 65 мг/мл. DOTAP, растворенный в этаноле при 25 мг/мл, добавляли к составу при 20% вес/вес паклитаксела. К полученным смесям добавляли PLURONICR® F68 (BASF Corporation) в виде раствора 10 или 100 мг/мл в воде, достигая 0,6-5% вес/вес от общего количества матрицы. Составы наносили на верхний слой покрытия на баллоны с гидрофильными грунтовыми покрытиями R, как описано в эксперименте 1.
Все баллоны высушивали в течение ночи при комнатной температуре. Баллоны складывали, гофрировали и заключали в нейлоновую оболочку. Затем баллоны помещали в печь при 55°С на 1 час.
Высвобождение паклитаксела из покрытия затем оценивали в соответствии с процедурой, описанной в примере 2.
Пример 8. Аморфные наночастицы паклитаксела с DOTAP или полиэтиленимином
(i) Получение частиц аморфного паклитаксел: В трех повторностях в среднем 6,2 мг паклитаксела растворяли в 50 мкл хлороформа. Раствор диспергировали в 1 мл BSA при 50 мг/мл в воде с использованием акустического зонда в течение 20 секунд. Полученные эмульсии центрифугировали в течение 15 минут при 5000 об./мин. Прозрачную надосадочную жидкость удаляли; остаток замораживали и лиофилизировали. Остатки весили в среднем 9,8 мг. Для удаления оставшегося BSA, твердые частицы диспергировали в 1 мл свежей воды с использованием ультразвуковой бани и затем центрифугировали в течение 10 минут при 10000 об./мин. Надосадочную жидкость удаляли.
(ii) Получение дисперсии DOTAP в воде: В стеклянный контейнер с закругленным дном помещали 5 мл раствора DOTAP при 25 мг/мл в этаноле и выпаривали под вакуумом с получением пленки. DOTAP диспергировали в 12,5 мл воды путем добавления партий 4,2 мл воды в стеклянный контейнер и быстро подвергали обработке ультразвуком на ультразвуковой бане. Партии объединяли, подвергали действию ультразвука в течение 10 минут на ультразвуковой бане и фильтровали через 0,45 мкм фильтр.
На баллоны наносили грунтовой и верхний слой покрытия в соответствии с процедурой, описанной в примере 1. Для получения составов верхних слоев покрытия, содержащих паклитаксел, DOTAP диспергировали в воде или водный раствор PEI добавляли к полученным частицам аморфного паклитаксела следующим образом:
1. К 5,7 мкг паклитаксела добавляли 114 мкл дисперсии DOTAP в воде при 10 мг/мл. Для покрытия материала баллона использовали 15 мкл.
2. К 6,2 мкг паклитаксела добавляли 62 мкл полиэтиленимина с низким молекулярной массой (PEI-LMW) при 20 мг/мл с 31 мкл воды. Для покрытия материала баллона использовали 10 мкл.
3. К 6,7 мкг паклитаксела добавляли 67 мкл полиэтиленимина 750 кДа (PEI-HMW) при 20 мг/мл с 33 мкл воды. Для покрытия материала баллона использовали 10 мкл.
Все баллоны высушивали в течение ночи при комнатной температуре. Баллоны складывали, гофрировали и заключали в нейлоновую оболочку. Затем баллоны помещали в печь при 55°С на 1 час.
Высвобождение паклитаксела из покрытия затем оценивали в соответствии с процедурой, описанной в примере 2.
Пример 9. Измерения Z-потенциала
Паклитаксел (5 мг) растворяли в 10 мкл бензилового спирта. Раствор диспергировали в 1 мл BSA при 50 мг/мл в воде с использованием акустического зонда в течение 20 секунд. Полученную эмульсию разделяли 5 раз на порции по 200 мкл, которые затем центрифугировали в течение 10 минут при 10000 об./мин. (остаточные количества А-Е). Прозрачную надосадочную жидкость удаляли.
A. Остаток ресуспендировали в 1 мл DDW. Эту смесь разбавляли в 10 раз.
B. Добавляли 10 мкл раствора хитозана 10 мг/мл в 1% уксусной кислоте с 10 мкл DDW. Полученную суспензию разбавляли в DDW 10 раз.
C. Добавляли 1 мл раствора протамина 1 мг/мл в DDW. Полученную суспензию разбавляли в DDW 10 раз.
D. Твердые вещества диспергировали в 500 мкл DDW с использованием ультразвуковой бани и затем центрифугировали в течение 10 минут при 10000 об./мин. Надосадочную жидкость удаляли. В стеклянный контейнер с закругленным дном помещали 5 мл раствора DOTAP при 25 мг/мл в этаноле и выпаривали под вакуумом с получением пленки. DOTAP диспергировали в 12,5 мл воды путем добавления партий 4,2 мл воды в стеклянный контейнер и быстро подвергали обработке ультразвуком на ультразвуковой бане. Партии объединяли, подвергали действию ультразвука в течение 10 минут на ультразвуковой бане и фильтровали через 0,45 мкм фильтр. К аморфному остатку, содержащему паклитаксел, добавляли 25 мкл дисперсии DOTAP в воде при 10 мг/мл и подвергали действию ультразвука на ультразвуковой бане. Полученную дисперсию разбавляли в DDW 10 раз.
Измерения Z-размерности проводили с использованием прибора для измерения Z-размерности (доступный от Malvern), показывающего образование отрицательно заряженных капель во время дисперсии растворенных РТХ в растворе BSA. Положительно заряженные частицы получали при добавлении растворов хитозана, протамина или DOTAP.
Пример 10. Состав F68 на PTX/DOTAP
Составы получали путем суспендирования паклитаксела, измельченного в лабораторной мельнице, в воде при 65 мг/мл. DOTAP, растворенный в этаноле при 25 мг/мл, добавляли к составу при 20% вес/вес паклитаксела. К полученным смесям добавляли 2-16 мкл водного раствора F68 при 100 мг/мл, достигая 5-34% вес/вес от общего количества матрицы (50% вес/вес РТХ). На стержни баллонов наносили грунтовой и верхний слой покрытия в соответствии с процедурой, описанной в примере 1. Кроме того, тестировали состав PTX/DOTAP 80:20% вес/вес. Составы наносили на верхний слой покрытия на стержни баллона с гидрофильным грунтовым покрытием F (n=2 на состав).
Баллоны складывали, гофрировали и заключали в нейлоновую оболочку. Затем баллоны помещали в печь при 55°С на 1 час.
Высвобождение паклитаксела из покрытия затем оценивали в соответствии с процедурой, описанной в примере 2.
Пример 11. Применение аморфного РТХ и разных катионных фрагментов
На четыре баллона наносили грунтовой и верхний слой покрытия в соответствии с процедурой, описанной в эксперименте 1. Следующие составы наносили на верхний слой покрытия на стержни баллона с гидрофильным грунтовым покрытием R (n=1 на состав).
В каждой из 4 пробирок растворяли 5-7 мг паклитаксела в 50 мкл хлороформа. Раствор диспергировали в 1 мл BSA при 50 мг/мл в воде с использованием акустического зонда в течение 20 секунд. Полученные эмульсии центрифугировали в течение 10 минут при 5000 об./мин. Прозрачную надосадочную жидкость удаляли и остаток замораживали на сухом льду и затем лиофилизировали ("остаток, содержащий паклитаксел").
A. Начинали с 4,8 мкг паклитаксела. Остаток, содержащий паклитаксел, повторно растворяли в 96 мкл DDW. Для покрытия материала баллона использовали 14 мкл.
B. Начинали с 7,1 мкг паклитаксела. Остаточное количество BSA удаляли посредством диспергирования твердых частиц в 1 мл свежей воды с использованием ультразвуковой бани и затем центрифугировали в течение 10 минут при 10000 об./мин. Надосадочную жидкость удаляли. В стеклянный контейнер с закругленным дном помещали 5 мл раствора DOTAP при 25 мг/мл в этаноле и выпаривали под вакуумом с получением пленки. DOTAP диспергировали в 12,5 мл воды путем добавления партий 4,2 мл воды в стеклянный контейнер и быстро подвергали обработке ультразвуком на ультразвуковой бане. Партии объединяли, подвергали действию ультразвука в течение 10 минут на ультразвуковой бане и фильтровали через 0,45 мкм фильтр. К остатку, содержащему паклитаксел, добавляли 142 мкл дисперсии DOTAP в воде при 10 мг/мл. Для покрытия материала баллона использовали 14 мкл.
C. Начинали с 7,1 мкг паклитаксела. Хитозан растворяли в 1% уксусной кислоте при 100 мг/мл и 57 мкл добавляли к остатку, содержащему паклитаксел. Затем добавляли 57 мкл DDW. Частицы диспергировали с использованием ультразвуковой бани. Баллон покрывали с помощью 14 мкл этого материала.
D. Начинали с 5,1 мкг паклитаксела. Протамин растворяли в DDW при 10 мг/мл. К остатку, содержащему паклитаксел добавляли 51 мкл раствора протамина с дополнительными 51 мкл DDW. Частицы диспергировали с использованием ультразвуковой бани. Баллон покрывали с помощью 14 мкл этого материала.
Баллоны складывали, гофрировали и заключали в нейлоновую оболочку. Затем баллоны помещали в печь при 55°С на 1 час.
Высвобождение паклитаксела из покрытия затем оценивали в соответствии с процедурой, описанной в примере 2.
Пример 12. Исследование IV Эксперимент с текучестью
Полноразмерные баллонные катетеры покрывали гидрофильными грунтовыми покрытиями, как описано в эксперименте 1. Составы, содержащие паклитаксел, наносили на полноразмерные баллонные катетеры и тестировали ex-vivo в коронарных артериях свиньи в эксперименте с текучестью.
1.) Системы потока: Использовали два открытых кольцевых потока PBS в системе. Один, циркулирующий при 70 мл/мин., 2 л в общем и при 37°С, предназначался для артерии, в которой тестировали баллоны. Другой при 280 мл/мин., 1 л в общем и при 37°С, выступал в качестве разветвленной трубы, которая поддерживала четыре артерии одновременно (таким образом, поток на выходе составлял 70 мл/мин.).
2.) Соединения артерий: Коронарные артерии свиньи для тестирования получали путем обрезки и склеивания (с помощью цианакрилатного гелевого клея ("суперклея")) на 200 мкл наконечнике пипетки. Наконечник обрезали на коротком конце таким образом, чтобы отверстие в наконечнике составляло ~2-3 мм в диаметре. После склеивания артерии обрезали до 30 мм от конца наконечника пипетки до свободного конца артерии. Артерии выдерживали в PBS при комнатной температуре перед тестированием.
Каждый кусок трубки заканчивался 1 мл наконечником пипетки, который служил средством прикрепления артерий. На месте испытания наконечник был обрезан, чтобы вписаться в трубку на большом конце и быть больше диаметра направляющего катетера 7F на маленьком конце. На разветвленном конце наконечники были обрезаны, чтобы плотно входить в Y-образные соединительные разъемы на большом конце, но не были обрезаны на маленьком конце. Сопротивление, обеспечиваемое маленьким отверстием наконечника, обеспечивало равный поток через четыре отверстия.
Для тестирования артерии были помещены на конец проточной трубки посредством прижимания меньшего желтого наконечника пипетки к большому голубому наконечнику.
В шприц втягивали 10 мл PBS (на соединительном разъеме с кровоостанавливающий инструментом Y) и промывали через направляющий катетер, чтобы обеспечить заполнение катетера с помощью PBS. Подготовленную коронарную артерию свиньи помещали на тестовую петлю посредством прижимания ее к концу пипетки. Затем вводили покрытый баллонный катетер, когда кровоостанавливающий инструмент был широко открыт.Катетер проталкивали к точке, где проводник выходил из катетера, и удаляли проволочный проводник. Кровоостанавливающий инструмент закрывали в некоторой степени для того, чтобы уменьшить обратное течение. Затем баллонный катетер проталкивали к участку, поддающемуся лечению, внутри подготовленной коронарной артерии и кровоостанавливающий инструмент плотно закрывали. Баллон надували до 6 атм. и выдерживали в течение 30 секунд. Кровоостанавливающий инструмент открывали и баллонный катетер спускали и удаляли. Артерию затем удаляли из тестовой петли и помещали во второй коллектор потока (одно из четырех пространств) и оставляли на коллекторе потока в течение 13 минут, считая от времени спуска баллона. Артерию отрезали от наконечника пипетки, помещали в раствор метанола/0,1% уксусной кислоты. Полученный раствор метанола и уксусной кислоты тестировали в отношении содержания паклитаксела с использованием HPLC ("перенос лекарственного средства в ткань").
Пример 13. Высвобождение паклитаксела из полноразмерных баллонных катетеров
Один полноразмерный баллонный катетер и 2 стержня баллона покрывали гидрофильным грунтовым покрытием (R) в соответствии с примером 1 и покрывали следующими составами:
A) Паклитаксел, измельченный в лабораторной мельнице, суспендировали в воде при 67 мг/мл. Отвешивали 100 мг суспензии (6,28 мг паклитаксела) и подвергали действию ультразвука до хорошего измельчения. Добавляли 1,26 мг DOTAP (62,8 мкл 20 мг/мл DOTAP в этаноле) и подвергали действию ультразвука на ультразвуковой бане в течение 10 минут.Затем добавляли 62,8 мкл декстрана (100 мг/мл в воде). Баллон покрывали с помощью 22,5 мкл этого материала.
B) Паклитаксел, измельченный в лабораторной мельнице, суспендировали в воде при 67 мг/мл. Отвешивали 100 мг суспензии (6,28 мг паклитаксела) и подвергали действию ультразвука до хорошего измельчения. Добавляли 1,26 мг DOTAP (62,8 мкл 20 мг/мл DOTAP в этаноле) и подвергали действию ультразвука на ультразвуковой бане в течение 10 минут. Затем добавляли 62,8 мкл гликогена (100 мг/мл в воде). Баллон покрывали с помощью 22,5 мкл этого материала.
C) Паклитаксел, измельченный в лабораторной мельнице, суспендировали в воде при 67 мг/мл. Отвешивали 100 мг суспензии (6,28 мг паклитаксела) и подвергали действию ультразвука до хорошего измельчения. Добавляли 1,26 мг DOTAP (62,8 мкл 20 мг/мл DOTAP в этаноле) и подвергали действию ультразвука на ультразвуковой бане в течение 10 минут. Раствор желатина типа А (100 мг/мл в воде) нагревали до 37°С. Затем добавляли 62,8 мкл к смеси. Баллон покрывали с помощью 22,5 мкл этого материала.
D) Паклитаксел, измельченный в лабораторной мельнице, суспендировали в воде при 67 мг/мл. Отвешивали суспензию (100 мг; 6,28 мг паклитаксела) и подвергали действию ультразвука до хорошего измельчения. Добавляли смесь 953 мкг DOTAP и 318 мкг холестерина в 51 мкл этанола и подвергали действию ультразвука на ультразвуковой бане в течение 10 минут. Баллон покрывали с помощью 15,5 мкл этого материала.
Верхние слои покрытия высушивали в потоке горячего воздуха и оставляли дополнительно высушиваться в течение ночи при комнатной температуре. Затем баллоны складывали, гофрировали и заключали в нейлоновую оболочку. Затем баллоны помещали в печь при 55°С на 1 час.
Полноразмерный катетер тестировали в соответствии с процедурой в примере 12.
Высвобождение паклитаксела из покрытия на двух стержнях баллона оценивали в соответствии с процедурой, описанной в примере 2.
Пример 14. Высвобождение паклитаксела из баллонов
Три полноразмерных баллонных катетера на состав покрывали гидрофильным грунтовым покрытием (R) в соответствии с примером 1 и наносили верхний слой покрытия со следующими составами:
A) Паклитаксел, измельченный в лабораторной мельнице, суспендировали в воде при 67 мг/мл. Отвешивали 100 мг суспензии (6,28 мг паклитаксела) и подвергали действию ультразвука до хорошего измельчения. Добавляли 1,26 мг DOTAP (62,8 мкл 20 мг/мл DOTAP в этаноле) и подвергали действию ультразвука на ультразвуковой бане в течение 10 минут. Затем добавляли 62,8 мкл декстрана (100 мг/мл в воде). Баллон покрывали с помощью 22,5 мкл этого материала.
B) Паклитаксел, измельченный в лабораторной мельнице, суспендировали в воде при 67 мг/мл. Отвешивали 100 мг суспензии (6,28 мг паклитаксела) и подвергали действию ультразвука до хорошего измельчения. Добавляли 1,26 мг DOTAP (62,8 мкл 20 мг/мл DOTAP в этаноле) и подвергали действию ультразвука на ультразвуковой бане в течение 10 минут. Затем добавляли 62,8 мкл гликогена (100 мг/мл в воде). Баллон покрывали с помощью 22,5 мкл этого материала.
C) Паклитаксел, измельченный в лабораторной мельнице, суспендировали в воде при 67 мг/мл. Отвешивали 100 мг суспензии (6,28 мг паклитаксела) и подвергали действию ультразвука до хорошего измельчения. Добавляли 1,26 мг DOTAP (62,8 мкл 20 мг/мл DOTAP в этаноле) и подвергали действию ультразвука на ультразвуковой бане в течение 10 минут. К полученной смеси PLURONIC® добавляли F68 (доступный от BASF Corporation) в виде раствора 100 мг/мл в воде, достигая 5% вес/вес от общего количества состава.
Верхние слои покрытая высушивали в потоке горячего воздуха и оставляли дополнительно высушиваться в течение ночи при комнатной температуре. Затем баллоны складывали, гофрировали и заключали в нейлоновую оболочку. Затем баллоны помещали в печь при 55°С на 1 час.
Полноразмерные катетеры тестировали в соответствии с процедурой в примере 12.
Пример 15. Высвобождение паклитаксела из баллонов
Три полноразмерных баллонных катетера на состав покрывали гидрофильным грунтовым покрытием (R) в соответствии с примером 1 и наносили верхний слой покрытия со следующими составами:
На состав, 5-6 мг паклитаксела растворяли в 50 мкл хлороформа. Раствор диспергировали в 1 мл BSA при 50 мг/мл в воде с использованием акустического зонда в течение 20 секунд. Полученные эмульсии центрифугировали в течение 15 минут при 5000 об./мин. Прозрачную надосадочную жидкость удаляли; остаток замораживали и лиофилизировали. Остатки весили в среднем 9,8 мг. Для удаления оставшегося BSA, твердые частицы диспергировали в 1 мл свежей воды с использованием ультразвуковой бани и затем центрифугировали в течение 10 минут при 10000 об./мин. Надосадочную жидкость удаляли ("остаток, содержащий паклитаксел").
В стеклянный контейнер с закругленным дном помещали 5 мл раствора DOTAP при 25 мг/мл в этаноле и выпаривали под вакуумом с получением пленки. DOTAP диспергировали в 12,5 мл воды путем добавления партий 4,2 мл воды в стеклянный контейнер и быстро подвергали обработке ультразвуком на ультразвуковой бане. Партии объединяли, подвергали действию ультразвука в течение 10 минут на ультразвуковой бане и фильтровали через 0,45 мкм фильтр.
Полиэтиленимин с высокой молекулярной массой 50% вес/вес в воде (Sigma) растворяли в DDW до 2% вес/вес или 20 мг/мл раствора.
К аморфному остатку, содержащему паклитаксел, DOTAP или PEI в воде добавляли следующим образом.
1. (5 мкг паклитаксела) К остатку, содержащему паклитаксел, добавляли 100 мкл дисперсии DOTAP в воде при 10 мг/мл. Для покрытия материала баллона использовали 15,8 мкл.
2. (6 мкг паклитаксел) Добавляли 60 мкл полиэтиленимина с высокой молекулярной массой (PEI-HMW) при 20 мг/мл с 30 мкл воды. Для покрытия материала баллона использовали 11,8 мкл.
3. (5 мкг паклитаксела) К остатку, содержащему паклитаксел, добавляли 100 мкл дисперсии DOTAP в воде при 10 мг/мл. Затем добавляли 50 мкл декстрана (100 мг/мл в воде). Баллон покрывали с помощью 23,8 мкл этого материала.
4. В 75 мкл воды суспендировали 5 мг паклитаксела, измельченного в лабораторной мельнице, и подвергали действию ультразвука до хорошего измельчения. Добавляли 1 мг DOTAP (40 мкл 25 мг/мл DOTAP в этаноле) и подвергали действию ультразвука на ультразвуковой бане в течение 10 минут. Для покрытия материала баллона использовали 18,2 мкл.
Верхние слои покрытия высушивали в потоке горячего воздуха и оставляли дополнительно высушиваться в течение ночи при комнатной температуре. Затем баллоны складывали, гофрировали и заключали в нейлоновую оболочку. Затем баллоны помещали в печь при 55°С на 1 час.
Полноразмерные катетеры тестировали в соответствии с процедурой в примере 12.
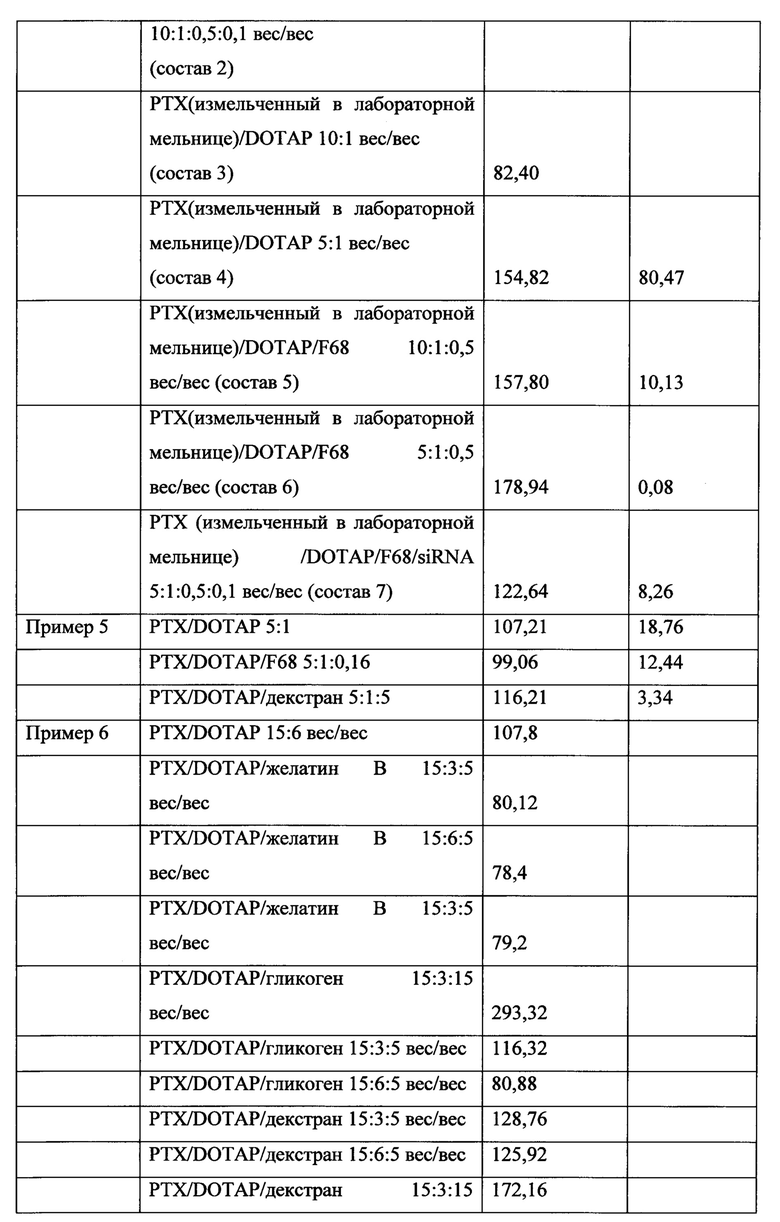
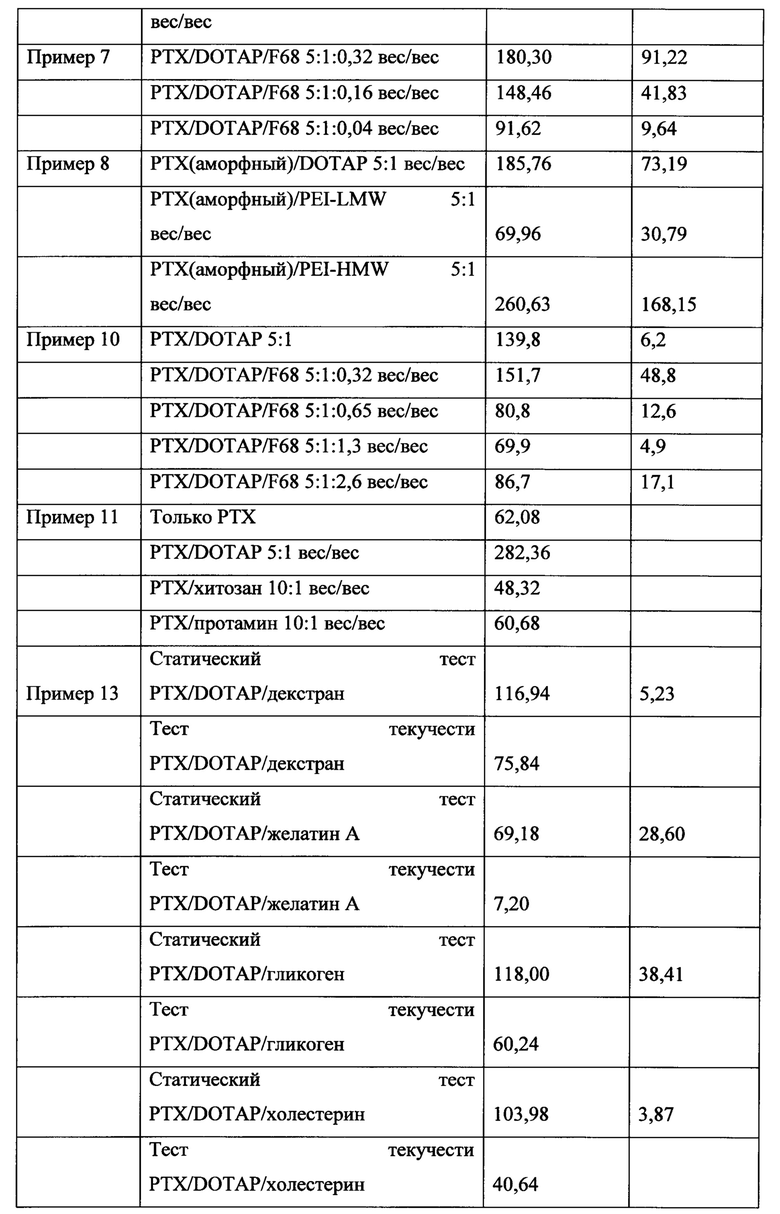
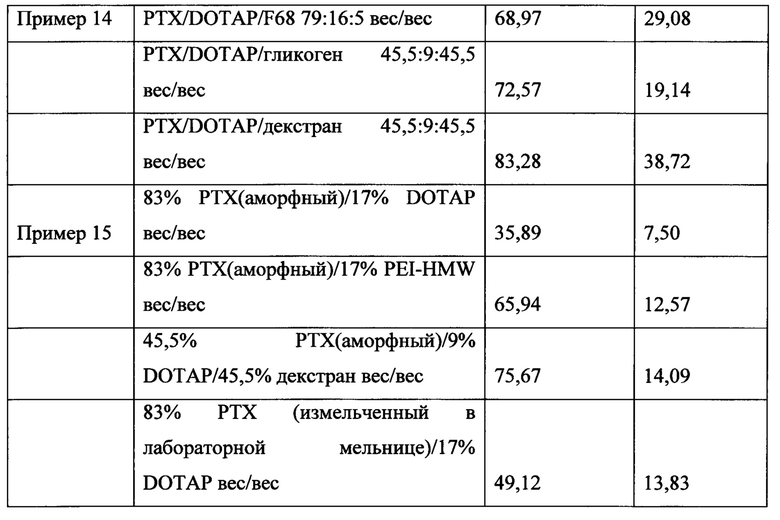
Пример 16. Дендримеры PEI и РАМАМ
Двенадцать стержней баллона покрывали гидрофильным грунтовым покрытием (R), как описано в примере 1. Следующие составы наносили поверх грунтового покрытия:
Стержень №1 и №2. Покрытие наносили в виде раствора 25% этанол/75% метанол, содержащего 75 мг/мл паклитаксела и 6,25 мг/мл полиэтиленимина (PEI-HMW) 750 кДа. Общее количество лекарственного средства достигало 660 мкг.
Стержень №3 и №4. Покрытие наносили в виде раствора 25% этанол/75% метанол, содержащего 75 мг/мл паклитаксела и 6,25 мг/мл полиамидоаминового дендримера (РАМАМ, пок. 4). Общее количество лекарственного средства достигало 660 мкг.
Стержень №5, №6 и №7. Паклитаксел растворяли в хлороформе при 100 мг/мл. Эмульгировали 400 мкл этого раствора в 10 мл водного раствора BSA при 50 мг/мл с использованием акустического зонда в течение 60 секунд. Полученную эмульсию лиофилизировали. BSA удаляли из аморфного паклитаксела с помощью промывания твердых частиц три раза бидистиллированной водой. К 6,5 мг аморфного паклитаксела добавляли 33 мкл воды и 65 мкл водного раствора 20 мг/мл PEI-HMW. Раствор для покрытия перемешивали вихревым способом и подвергали действию ультразвука на ультразвуковой бане. Общее количество лекарственного средства, покрывающего трубки, достигало 660 мкг.
Стержень №8, №9 и №10. К смеси 7 мг паклитаксела, измельченного в лабораторной мельнице, в 70 мкл воды добавляли 70 мкл водного раствора PEI-HMW при 20 мг/мл. Общее количество лекарственного средства достигало 660 мкг.
Стержень №11 и №12. Смесь паклитаксела, измельченного в лабораторной мельнице, при 50 мг/мл в DDW с 10 мг/мл РАМАМ в этаноле. Добавляли РАМАМ к суспензии паклитаксела до тех пор, пока не было достигнуто вес/вес соотношение 17:83 РАМАМ и паклитаксела. Общее количество лекарственного средства достигало 660 мкг.
Верхние слои покрытия высушивали в потоке горячего воздуха и оставляли дополнительно высушиваться в течение ночи при комнатной температуре. Затем баллоны складывали, гофрировали и заключали в нейлоновую оболочку. Затем баллоны помещали в печь при 55°С на 1 час.
Высвобождение паклитаксела из покрытия затем оценивали в соответствии с процедурой, описанной в примере 2.
Пример 17. Высвобождение паклитаксела из полноразмерных баллонных катетеров
Девять полноразмерных баллонных катетеров покрывали гидрофильным грунтовым покрытием (R) в соответствии с примером 1 и наносили верхний слой покрытия со следующими составами (n=3 на состав).
1. Объединяли 19 мг паклитаксела, измельченного в лабораторной мельнице, с 283,6 мкл дистиллированной воды и дважды подвергали действию ультразвука с использованием акустического зонда в течение 20 секунд при установке мощности "3". Отвешивали 99,5 мг смеси и добавляли 62,9 мкл раствора 20 мг/мл PEI 750 кДа в дистиллированной воде. На каждый из трех катетеров наносили верхний слой покрытия с 20,5 мкл состава.
2. Отвешивали 103,4 мг суспензии паклитаксела в воде. Добавляли 65,4 мкл раствора 20 мг/мл PEI 750 кДа в воде и 65,4 мкл раствора 100 мг/мл декстрана в воде. На каждый из трех катетеров наносили верхний слой покрытия с 28 мкл состава.
3. Аморфный паклитаксел получали в соответствии с процедурой, описанной в примере 8, начиная с 8 мг паклитаксела. К остатку, содержащему паклитаксел, добавляли 80 мкл раствора 20 мг/мл PEI 750 кДа в воде и 80 мкл раствора 100 мг/мл декстрана в воде. На три катетера наносили верхний слой покрытия с 15,8 мкл состава.
Верхние слои покрытия высушивали в потоке горячего воздуха и оставляли дополнительно высушиваться в течение ночи при комнатной температуре. Затем баллоны складывали, гофрировали и заключали в нейлоновую оболочку. Затем баллоны помещали в печь при 55°С на 1 час.
Полноразмерные катетеры тестировали в соответствии с процедурой в примере 12.
Высвобождение паклитаксела из покрытия на стержнях оценивали в соответствии с процедурой, описанной в примере 2.
Пример 18А. Верхний слой покрытия баллона с олеиламином
Восемь стержней баллона длиной 15 мм покрывали гидрофильным грунтовым покрытием (R), как описано в примере 1. Следующие составы наносили поверх грунтового покрытия.
1. Суспендировали 49,5 мг паклитаксела, измельченного в лабораторной мельнице, в 495 мкл дистиллированной воды, перемешивали вихревым способом и дважды подвергали действию ультразвука с использованием акустического зонда в течение 20 секунд. Затем добавляли 495 мкл PEI 750 кДа при 20 мг/мл, рН нейтрализовали до 7 с помощью 6 н. НСl. На два стержня наносили верхний слой покрытия с 10 мкл состава на стержень.
2. Паклитаксел растворяли в метаноле при 100 мг/мл. К 50 мкл раствора паклитаксела добавляли 50 мкл раствора 25 мг/мл PEI 750 кДа в этаноле. На два стержня наносили верхний слой покрытия с 10 мкл состава на стержень.
3. Олеиламин растворяли в этаноле при 20 мг/мл. Добавляли 25 мкл к 75 мкл раствора 100 мг/мл паклитаксела в метаноле. На два стержня наносили верхний слой покрытия с 7 мкл состава на стержень.
Верхние слои покрытия высушивали в потоке горячего воздуха и оставляли дополнительно высушиваться в течение ночи при комнатной температуре. Затем баллоны складывали, гофрировали и заключали в нейлоновую оболочку. Затем баллоны помещали в печь при 55°С на 1 час.
Высвобождение паклитаксела из покрытия затем оценивали в соответствии с процедурой, описанной в примере 2.
Пример 18В. Верхний слой покрытия баллона с полиуретандиолом, трикаприлилметиламмоний хлоридом, триметилпропан этоксилатом. пентаэритритол этоксилатом и джеффамином ED-900
Десять стержней баллона длиной 15 мм покрывали гидрофильным грунтовым покрытием (R) и наносили верхний слой покрытия, как описано в примере 1. Следующие составы наносили поверх грунтового покрытия. Суспендировали 100 мг паклитаксела, измельченного в лабораторной мельнице, в 1 мл дистиллированной воды и тщательно диспергировали с использованием вихревой мешалки и акустического зонда.
1. Полиуретандиол 88 вес. % растворяли в воде при 25 мг/мл. Отвешивали 55,7 мг суспензии паклитаксела и добавляли 40,7 мкл раствора полиуретандиола. На два стержня наносили верхний слой покрытия с 12,6 мкл состава на стержень.
2. Трикаприлметиламмоний хлорид растворяли в этаноле при 25 мг/мл. Отвешивали 77,4 мг суспензии паклитаксела и добавляли 56 мкл раствора трикаприламмония. На один стержень наносили верхний слой покрытия с 12,6 мкл состава.
3. Триметилпропан этоксилат 20/3 ЕО/ОН диспергировали в воде при 25 мг/мл. Отвешивали 57,4 мг суспензии паклитаксела и добавляли 41,7 мкл раствора триметилпропан этоксилата. На два стержня наносили верхний слой покрытия с 12,6 мкл состава на стержень.
4. Пентаэритритол этоксилат 15/4 ЕО/ОН растворяли в воде при 25 мг/мл. Отвешивали 67,9 мг суспензии паклитаксела и добавляли 49,4 мкл раствора пентаэритритола этоксилата. На два стержня наносили верхний слой покрытия с 12,6 мкл состава на стержень.
5. Джеффамин ED-900 растворяли в воде при 25 мг/мл. Отвешивали 59,8 мг суспензии паклитаксела и добавляли 43,5 мкл раствора джеффамина. На два стержня наносили верхний слой покрытия с 12,6 мкл состава на стержень.
Баллоны складывали, гофрировали и заключали в нейлоновую оболочку. Затем баллоны помещали в печь при 55°С на 1 час.
Высвобождение паклитаксела из покрытия затем оценивали в соответствии с процедурой, описанной в примере 2.
Пример 19. Синтезированный линейный и разветвленный PEI
Следующие соединения синтезировали на основе додекан-эпоксилирования спермина, триэтиламингликоля, 1-метилпропилдиамина или других производных амина.
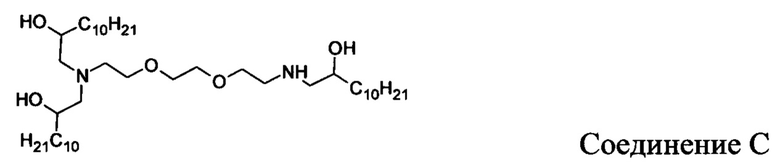




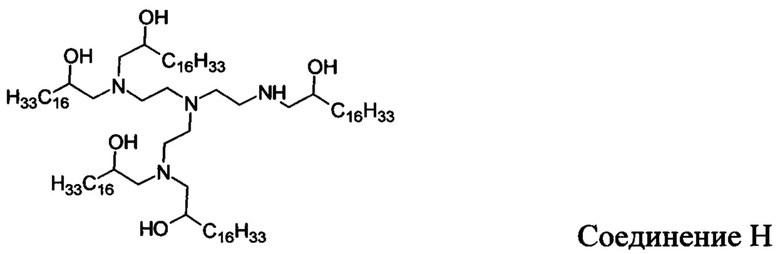
Стержни (22) баллона покрывали гидрофильным грунтовым покрытием (R) и покрывали верхним слоем покрытия, как описано в примере 1.
Получение составов для верхних слоев покрытия. Паклитаксел, измельченный в лабораторной мельнице, суспендировали в воде при 100 мг/мл и тщательно диспергировали с использованием вихревой мешалки и дважды с использованием акустического зонда в течение 20 секунд при установке "2,5". Все из следующих составов получали путем отвешивания суспензии паклитаксела и добавления раствора добавки таким образом, что соотношение вес/вес паклитаксела и добавки составляло 83:17% вес/вес. Полученные смеси тщательно перемешивали вихревым способом и помещали на ультразвуковую баню на 10 минут перед нанесением покрытия. Составы (12,6 мкл) наносили поверх грунтового покрытия каждого из 2 стержней и одного металлического образца для испытаний на состав. Следовали процедурам покрытия стержней, описанным в примере 1. Покрытия металлических образцов для испытаний взвешивали после того, как покрытие было полностью сухим.
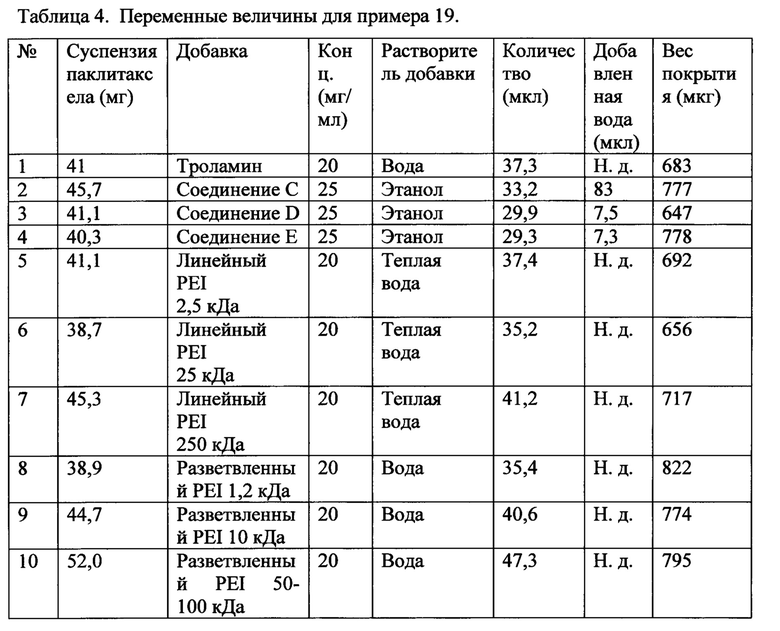
Числа 5-10 в таблице 4 (PEI полимеры) были приобретены у Polysciences, Inc.
Покрытые стержни баллона высушивали в потоке горячего воздуха и оставляли дополнительно высушиваться в течение ночи при комнатной температуре. Баллоны складывали, гофрировали и заключали в нейлоновую оболочку. Затем баллоны помещали в печь при 55°С на 1 час.
Высвобождение паклитаксела из покрытия затем оценивали в соответствии со следующей процедурой. Готовили вырезанные коронарные артерии свиньи (Pel-Freez Biologicals), помещали в пластиковую пробирку и содержали при 37°С. После удаления оболочек из стержней баллона стержни прикрепляли к мотору и вращали со скоростью 125 об./мин. и погружали в фетальную бычью сыворотку (FBS) при 37°С на 30 секунд. Баллоны удаляли из FBS (метанол затем добавляли к FBS при соотношении 1:3 FBS/метанол по объему для того, чтобы растворить паклитаксел). Затем баллоны расширяли в артериальной ткани при 60-80 фунт/кв. дюйм в течение 30 секунд при погружении в обычном PBS при 37°С и после спуска и удаления баллона артериальную ткань удаляли из пластмассовой пробирки и промывали PBS при 37°С. После удаления баллона из ткани и промывания ткань помещали в раствор метанол/0,1% уксусная кислота. Полученный раствор метанола и уксусной кислоты тестировали в отношении содержания паклитаксела с использованием HPLC ("перенос лекарственного средства в ткань"). Баллон также помещали в метанол и 0,1% раствор уксусной кислоты.
Пример 20. Кристаллический (измельченный в лабораторной мельнице против подвергнутого действию ультразвука) против аморфного паклитаксела
Стержни (22) баллона покрывали гидрофильным грунтовым покрытием (R) и наносили верхний слой покрытия, содержащий паклитаксел, как описано в примере 1. Следующие составы наносили на стержни баллона с гидрофильным грунтовым покрытием R (n=2 на состав).
a) Паклитаксел (75 мг) растворяли в 750 мкл метанола. Раствор паклитаксела (75 мкл) смешивали с 25 мкл раствора PEI 750 кДа при 25 мг/мл в этаноле. На два стержня в виде верхнего слоя покрытия наносили 8,8 мкл полученного раствора.
b) Паклитаксел, измельченный в лабораторной мельнице, суспендировали в воде при 100 мг/мл и тщательно диспергировали с использованием вихревой мешалки и дважды с использованием акустического зонда в течение 20 секунд при установке "2,5". Все из следующих составов получали путем отвешивания суспензии паклитаксела и добавления раствора добавки таким образом, что соотношение вес/вес паклитаксела и добавки составляло 83:17% вес/вес. Полученные смеси тщательно перемешивали вихревым способом и помещали на ультразвуковую баню на 10 минут перед нанесением покрытия. На два стержня в виде верхнего слоя покрытия наносили 13,9 мкл полученного раствора.
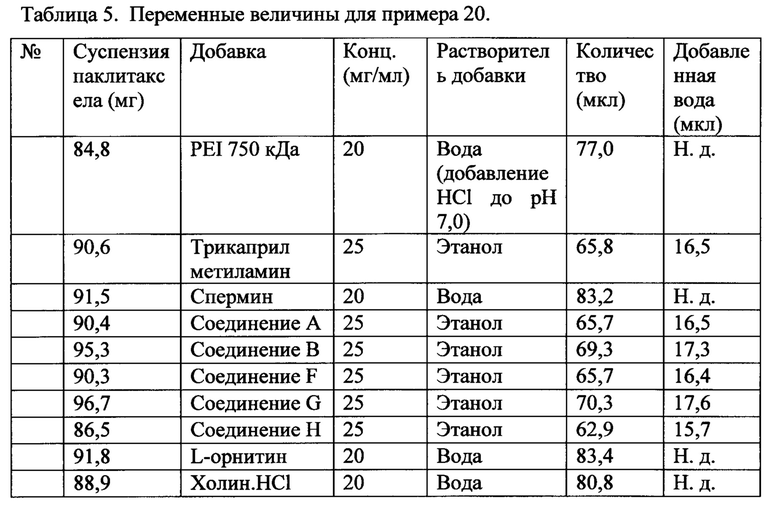
Покрытые стержни баллона высушивали в потоке горячего воздуха и оставляли дополнительно высушиваться в течение ночи при комнатной температуре. Баллоны складывали, гофрировали и заключали в нейлоновую оболочку. Затем баллоны помещали в печь при 55°С на 1 час.
Высвобождение паклитаксела из покрытия затем оценивали в соответствии со следующей процедурой. Готовили вырезанные коронарные артерии свиней (доступные от Pel-Freez Biologicals), помещали в пластиковую пробирку и содержали при 37°С. После удаления оболочек из стержней баллона стержни прикрепляли к мотору и вращали со скоростью 125 об./мин. и погружали в сыворотку лошади (HS) при 37°С в течение 30 секунд. Баллоны удаляли из HS. Затем баллоны расширяли в артериальной ткани при 60-80 фунт/кв. дюйм в течение 30 секунд при погружении в обычном PBS при 37°С и после спуска и удаления баллона артериальную ткань удаляли из пластмассовой пробирки и промывали PBS при 37°С.После удаления баллона из ткани и промывания ткань помещали в раствор метанол/0,1% уксусная кислота. Полученный раствор метанола и уксусной кислоты тестировали в отношении содержания паклитаксела с использованием HPLC ("перенос лекарственного средства в ткань"). Баллон также помещали в метанол и 0,1% раствор уксусной кислоты.
Пример 21. PEI, L-цитрулин, поли-L-орнитин и поли-L-глутаминовая кислота
Девять стержней баллона покрывали гидрофильным грунтовым покрытием (R) и получали верхний слой покрытия, как описано в примере 1.
Составы для верхних слоев покрытия. Паклитаксел, измельченный в лабораторной мельнице, суспендировали в воде при 100 мг/мл и тщательно диспергировали с использованием вихревой мешалки и дважды с использованием акустического зонда в течение 20 секунд при установке "2,5". Все из следующих составов получали путем отвешивания 50 мг суспензии паклитаксела и добавления 45,5 мкл водного раствора 20 мг/мл добавки таким образом, что соотношение вес/вес паклитаксела и добавки составляло 83:17%вес/вес. Полученные смеси тщательно перемешивали вихревым способом и помещали на ультразвуковую баню на 10 минут перед нанесением покрытия. Использовали следующие добавки:
(1) PEI 750 кДа; добавлена НСl до рН 7,0
(2) L-цитрулин
(3) Поли-L-орнитин
(4) Поли-L-глутаминовая кислота
Полученный состав (13,9 мкл) наносили в виде верхнего слоя покрытия на стержни (n=3 для PEI, n=2 на состав для других добавок).
Покрытые стержни высушивали в потоке горячего воздуха и оставляли дополнительно высушиваться в течение ночи при комнатной температуре. Баллоны складывали, гофрировали и заключали в нейлоновую оболочку. Затем баллоны помещали в печь при 55°С на 1 час.
Высвобождение паклитаксела из покрытия оценивали в соответствии с процедурой, описанной в примере 20.
Пример 22. Разветвленный PEI с привитыми участками олеиновой кислоты и сложными метиловыми эфирами аминокислоты
Восемь стержней баллона покрывали гидрофильным грунтовым покрытием (R) и получали верхний слой покрытия, как описано в примере 1. Паклитаксел, измельченный в лабораторной мельнице, суспендировали в воде при 100 мг/мл и тщательно диспергировали с использованием вихревой мешалки и дважды с использованием акустического зонда в течение 20 секунд при установке "2,5". Все из следующих составов получали путем отвешивания суспензии паклитаксела и добавления раствора добавки таким образом, что соотношение вес/вес паклитаксела и добавки составляло 83:17% вес/вес.

Полученные смеси тщательно перемешивали вихревым способом и помещали на ультразвуковую баню на 10 минут перед нанесением покрытия. Полученный раствор (13,8 мкл) наносили в качестве верхнего слоя покрытия на каждый из двух стержней. Покрытые стержни высушивали в потоке горячего воздуха и оставляли дополнительно высушиваться в течение ночи при комнатной температуре. Баллоны складывали, гофрировали и заключали в нейлоновую оболочку. Затем баллоны помещали в печь при 55°С на 1 час.
Высвобождение паклитаксела из покрытия оценивали в соответствии с процедурой, описанной в примере 20.
Пример 23. Производные РАМАМ
В этом исследовании изучали различные РАМАМ либо с кислотными (СООН) концевыми группами, либо со схожими концевыми аминогруппами схожего 4-го поколения с различными структурными элементами.
Химическая формула РАМАМ 4го покол. - полиамидоаминового дендримера, на основе ядра этилендиамина представляет собой следующее:

Пятнадцать стержней баллона покрывали гидрофильным грунтовым покрытием (R), как описано в примере 1.
Составы для верхних слоев покрытия:
Отвешивали приблизительно 10 мг подвергнутого действию ультразвука паклитаксела (см. эксперимент 1) и суспендировали в воде при 100 мг/мл. Раствор РАМАМ добавляли к суспензии паклитаксела таким образом, что соотношение вес/вес паклитаксела и добавки составляло 83:17% вес/вес. Полученные смеси тщательно перемешивали вихревым способом и дважды подвергали действию ультразвука в течение 20 секунд при установке "2,5" и помещали в ультразвуковую баню на 10 минут перед применением для нанесения верхнего слоя покрытия (нанесено в соответствии с процедурой, описанной в примере 1). Три стержня покрывали одним составом.

Верхние слои покрытия высушивали в потоке горячего воздуха и оставляли дополнительно высушиваться в течение ночи при комнатной температуре. Баллоны складывали, гофрировали и заключали в нейлоновую оболочку. Затем баллоны помещали в печь при 55°С на 1 час.
Высвобождение паклитаксела из покрытия оценивали в соответствии с процедурой, описанной в примере 20.
Пример 24. РАМАМ с различными значениями молекулярной массы
РАМАМ представляет собой полиамидоаминовый дендример (т.е. содержит как амидные, так и аминогруппы; см. иллюстративную химическую структуру ниже).

РАМАМ является глобулиновым полимером и синтезируется в поколениях: каждое последующее поколение по мере увеличения молекулярной массы сопровождается экспоненциальным увеличением количества ветвей. В этом примере группы поколений тестировали как при 90:10, так и при 75:25 РТХ/РАМАМ.
Двадцать восемь стержней баллона покрывали гидрофильным грунтовым покрытием (R) и получали верхний слой покрытия, как описано в примере 1.
Составы для верхних слоев покрытия:
Получали растворы РАМАМ поколения 0, 1, 2, 3, 4, 5 и 7 с ядром этилендиамина (доступный от Sigma) и разбавляли в метаноле до 50 мг/мл. Паклитаксел, подвергнутый действию ультразвука (см. эксперимент 1), суспендировали в воде при 50 мг/мл и тщательно диспергировали с использованием вихревой мешалки и дважды с использованием акустического зонда в течение 20 секунд при установке "2,5". 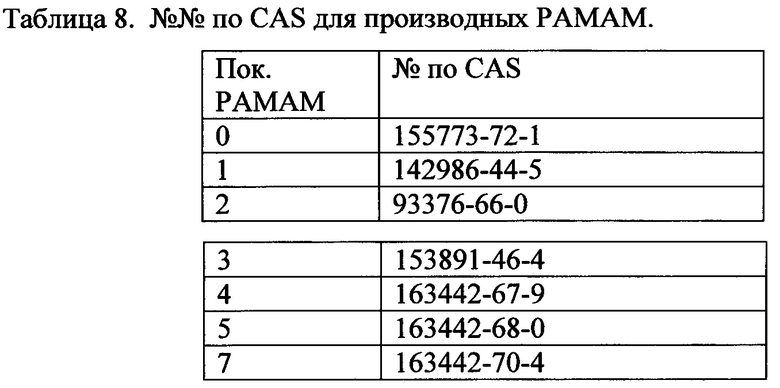
A. Составы паклитаксел/РАМАМ при соотношении 90:10 вес/вес.Отвешивали суспензию паклитаксела (50 мг) и добавляли 5,3 мкл раствора РАМАМ при 50 мг/мл в метаноле. Составы помещали в ультразвуковую баню на 10 минут перед их использованием для нанесения верхнего слоя покрытия. Два стержня покрывали одним составом.
B. Составы паклитаксел/РАМАМ при соотношении 75:25 вес/вес.Отвешивали суспензию паклитаксела (50 мг) и добавляли 15,9 мкл раствора РАМАМ при 50 мг/мл в метаноле. Составы помещали в ультразвуковую баню на 10 минут перед их использованием для нанесения верхнего слоя покрытия. Каждый из двух стержней покрывали одним составом.
Верхние слои покрытия высушивали в потоке горячего воздуха и оставляли дополнительно высушиваться в течение ночи при комнатной температуре. Баллоны складывали, гофрировали и заключали в нейлоновую оболочку. Затем баллоны помещали в печь при 55°С на 1 час. Высвобождение паклитаксела из покрытия оценивали в соответствии с процедурой, описанной в примере 20.
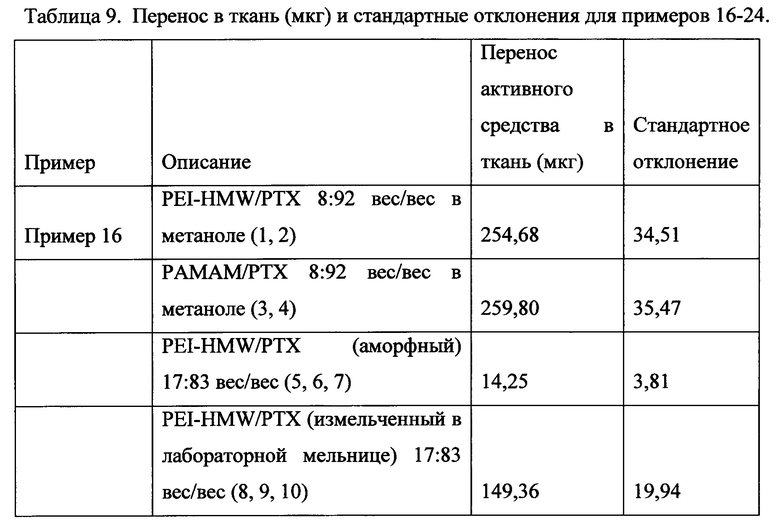

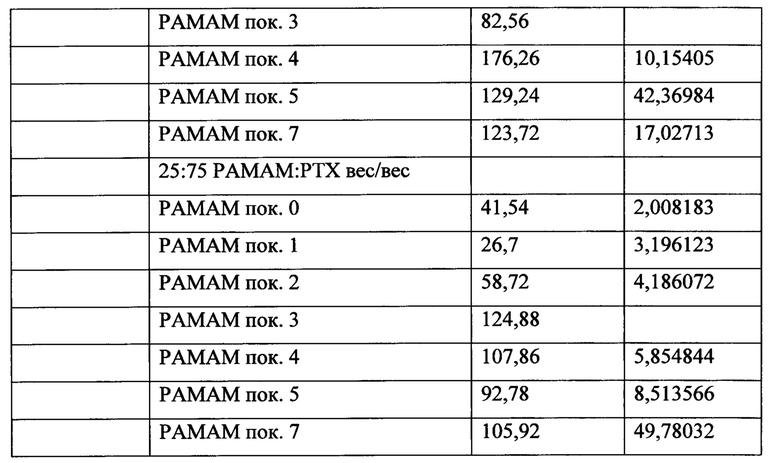
Пример 25. Микрочастицы с модифицированным дзета-потенциалом
Микрочастицы с рапамицином получали путем растворения рапамицина (100 мг; доступный от LC Laboratories, Вобурн, Массачусетс) и полимера SYNBIOSYS™ (200 мг; GAPEGCL-GALA; доступный от InnoCore Pharmaceuticals, Гронинген, Нидерланды) в этилацетате. Водную однородную фазу (1% или 0,1% полиакриловой кислоты; доступные от Sigma Chemicals; в воде при рН 7) насыщали этилацетатом. Гомогенизировали 3 мл раствора рапамицин-полимер SYNBIOSYS ™-этилацетат (при 5000 об./мин. в течение 1 минуты) в 100 мл одной из однородных фаз. Полученную смесь выливали в 500 мл деионизированной воды и микрочастицы выделяли посредством центифугирования и промывали 3 раза деионнизированной водой.
Покрытые MATRIGEL® 96-луночные планшеты (Corning) выдерживали в 100 мкл ЕСМ клеточной среды в течение 1 часа при 37°С. Суспензии получали из 11 мг/мл микрочастиц в водном растворе PEI 70 кДа (Polysciences) при 1 мг/мл или 2 мг/мл, рН растворов доводили до рН 7 с помощью НС1. 5 мкл составов пипетировали в 100 мкл среды в лунках луночного планшета, покрытого MATRIGEL®, и оставляли на 3 минуты. Все лунки затем промывали 3 раза с помощью 200 мкл PBS. Рапамицин, адсорбированный к 96-луночной поверхности, растворяли в ацетонитриле/0,1% АсОН и количественно определяли с помощью HPLC. На фиг. 10 показана адгезия микрочастиц к планшетам MATRIGEL® без наполнителя и с использованием PEI в качестве наполнителя при соотношениях 92:8 или 83:17 вес/вес частица/наполнитель и полиакриловой кислоты (РАА) при 1,0% вес/вес и 0,1% вес/вес в однородной фазе.
Следует отметить, что используемые в настоящем описании и прилагаемой формуле изобретения формы единственного числа включают формы множественного числа, если из контекста явно не следует иное. Таким образом, например, ссылка на композицию, содержащую "соединение" включает смесь двух или более соединений. Следует также отметить, что термин "или", как правило, используется в его смысле, включающем "и/или", если из контекста явно не следует иное.
Следует также отметить, что используемая в настоящем описании и прилагаемой формуле изобретения фраза "сконфигурированный" описывает систему, устройство или другую структуру, которая сконструирована или сконфигурирована для выполнения конкретной задачи или принимает конкретную конфигурацию. Фраза "сконфигурированный" может использоваться взаимозаменяемо с другими подобными фразами, такими как упорядоченный и сконфигурированный, сконструированный и упорядоченный, сконструированный, изготовленный и упорядоченный и т.д.
Все публикации и патентные заявки в настоящем описании указывают на уровень специалиста в данной области техники, к которому относится настоящее изобретение. Все публикации и патентные заявки включены в данный документ посредством ссылки в той же степени, как если бы каждая отдельная публикация или патентная заявка были конкретно и индивидуально указаны посредством ссылки. В той степени, в которой возникают несоответствия между публикациями и патентными заявками, включенными посредством ссылки и настоящим раскрытием, данные в настоящем раскрытии будут регулирующими.
Настоящее изобретение описано со ссылкой на различные конкретные и предпочтительные варианты осуществления и методики. Однако следует понимать, что многие варианты и модификации могут быть сделаны, оставаясь в пределах сущности и объема настоящего изобретения.

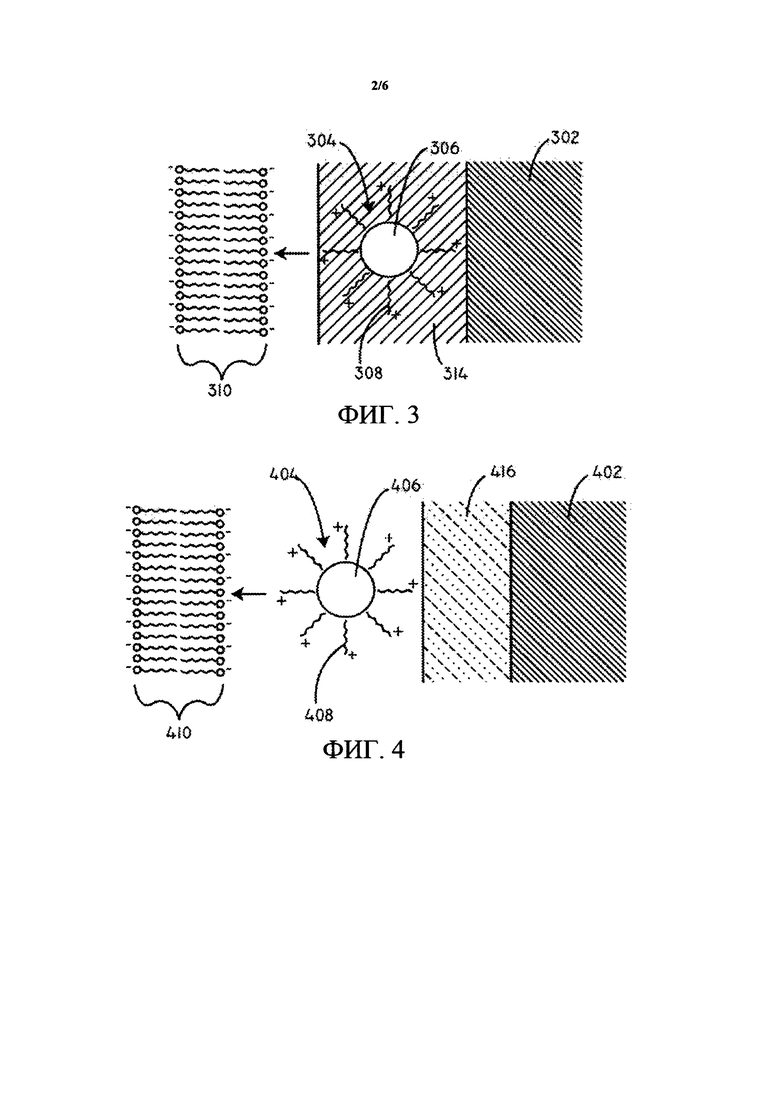

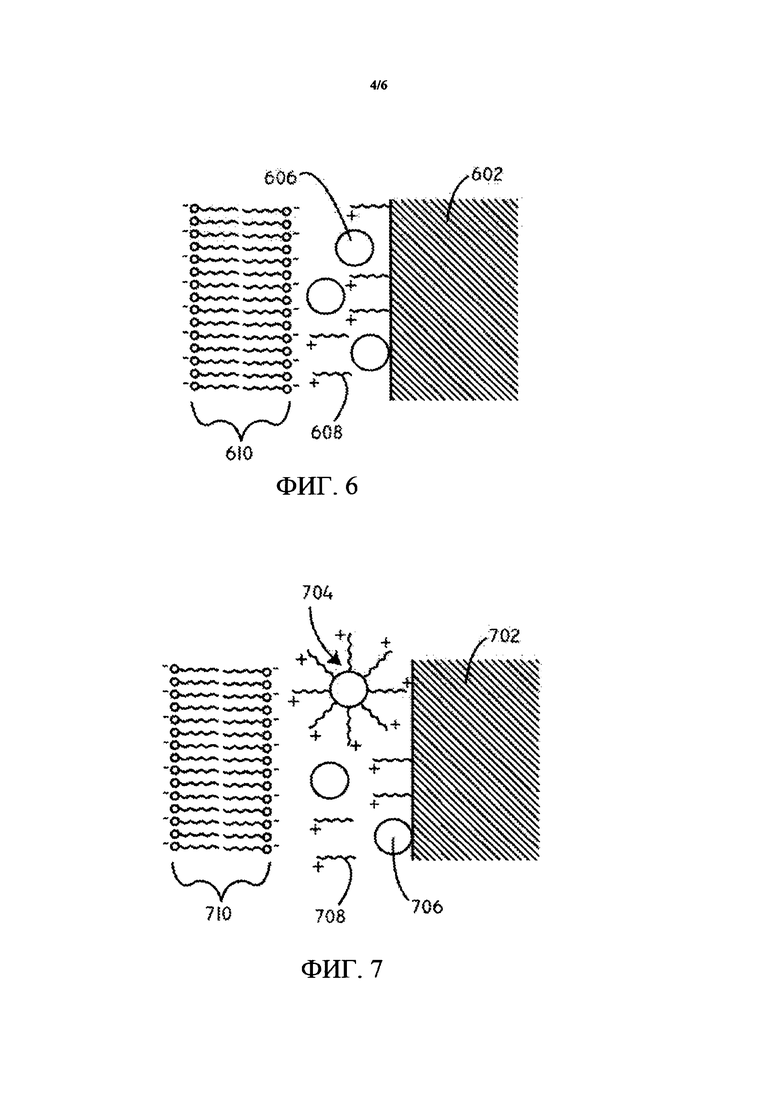
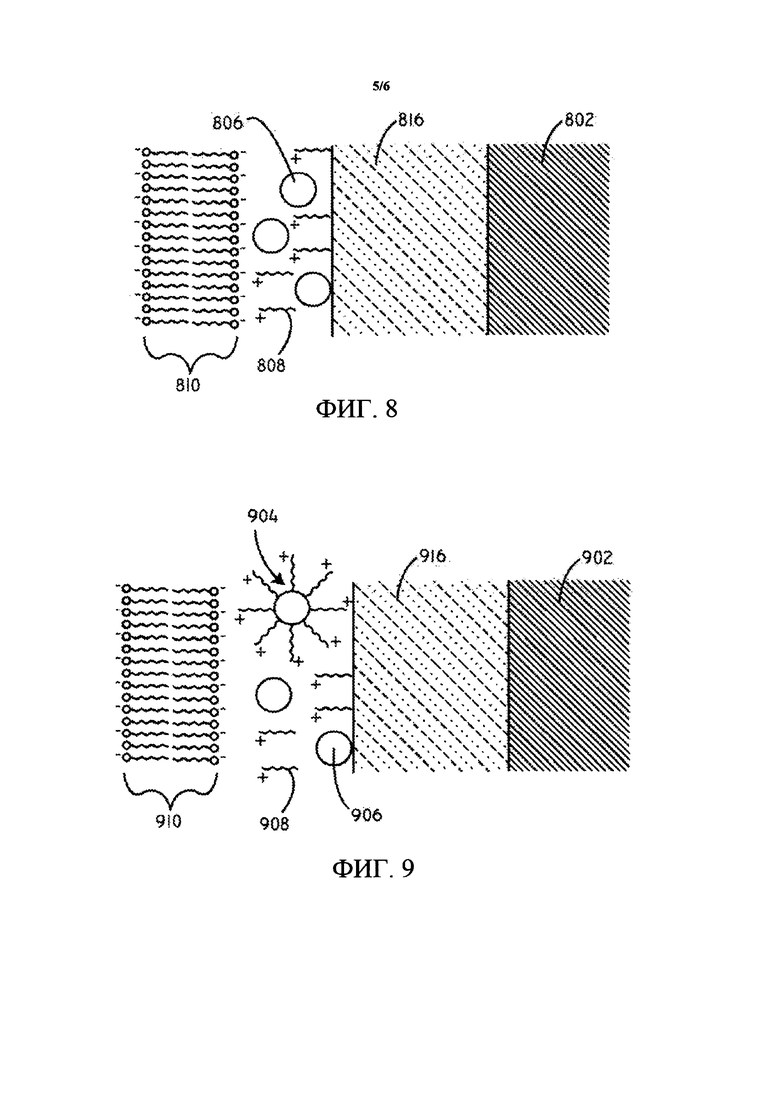

Изобретение относится к фармацевтической промышленности, а именно к покрытию для устройства для доставки гидрофобного терапевтического средства в виде частиц. Покрытие устройства для доставки гидрофобного терапевтического средства в виде частиц содержит полимерный слой, при этом полимерный слой содержит гидрофильное грунтовое покрытие; матрицу, находящуюся в контакте с гидрофильным грунтовым покрытием, при этом матрица содержит гидрофобное терапевтическое средство в виде частиц; катионное средство, выбранное из группы, состоящей из полиэтиленимина и 1,2-диолеоил-3-триметиламмонийпропана (DOTAP); и модификатор дзета-потенциала, содержащий полиакриловую кислоту (РАА), при этом процентное соотношение гидрофобного терапевтического средства в виде частиц и катионного средства составляет от 99,9/0,1 до 70/30, вес/вес; и при этом заряд, образованный катионным средством, электростатически притягивается к отрицательно заряженным частицам или полярным группам, связанным с липидным бислоем клеточной мембраны и компонентами клетки внутри липидного бислоя, облегчая перенос гидрофобного терапевтического средства в виде частиц в целевую ткань. Вышеописанное покрытие эффективно увеличивает адгезию частиц гидрофобного терапевтического средства. 7 з.п. ф-лы, 10 ил., 9 табл., 25 пр.
1. Покрытие устройства для доставки гидрофобного терапевтического средства в виде частиц, содержащее
полимерный слой, при этом полимерный слой содержит гидрофильное грунтовое покрытие;
матрицу, находящуюся в контакте с гидрофильным грунтовым покрытием, при этом матрица содержит
гидрофобное терапевтическое средство в виде частиц;
катионное средство, выбранное из группы, состоящей из полиэтиленимина и 1,2-диолеоил-3-триметиламмонийпропана (DOTAP); и
модификатор дзета-потенциала, содержащий полиакриловую кислоту (РАА),
при этом процентное соотношение, вес/вес, гидрофобного терапевтического средства в виде частиц и катионного средства составляет от 99,9/0,1 до 70/30; и
при этом заряд, образованный катионным средством, электростатически притягивается к отрицательно заряженным частицам или полярным группам, связанным с липидным бислоем клеточной мембраны и компонентами клетки внутри липидного бислоя.
2. Покрытие устройства по п. 1, в котором полимерный слой дополнительно содержит
гидрофильный полимер, имеющий боковые фотореактивные группы; и
фотосшивающее средство, содержащее по меньшей мере две арилкетонные функциональные группы.
3. Покрытие устройства по п. 2, в котором гидрофильный полимер имеет боковые фотореактивные группы, содержащие фото-полиакриламид.
4. Покрытие устройства по п. 3, в котором фото-полиакриламид выбран из сополимера (N-3-аминопропил)метакриламида и N-(3-(4-бензоилбензамидо)пропил)метакриламида; сополимера акриламида и N-(3-(4-бензоилбензамидо)пропил)метакриламида, сополимера акриламида, малеин-6-аминокапроновая-кислота-N-оксисукцинимида и N-(3-(4-бензоилбензамидо)пропил)метакриламида и сополимера акриламида, (3-(4-бензоилбензамидо)пропил)метакриламида и глицидилметакрилата.
5. Покрытие устройства по п. 3, в котором фото-полиакриламид представляет собой сополимер (N-3-аминопропил)метакриламида и N-(3-(4-бензоилбензамидо)пропил)метакриламида.
6. Покрытие устройства по п. 2, в котором фотосшивающее средство выбрано из этилен-бис(4-бензоилбензилдиметиламмоний)дибромида и натриевой соли бис(4-бензоил)фосфата.
7. Покрытие устройства по п. 3, в котором фото-полиакриламид представляет собой сополимер (N-3-аминопропил)метакриламида и N-(3-(4-бензоилбензамидо)пропил)метакриламида, и фотосшивающее средство представляет собой этилен-бис(4-бензоилбензилдиметиламмоний)дибромид.
8. Покрытие устройства по любому из пп. 1-7, в котором гидрофобное терапевтическое средство в виде частиц и катионное средство образуют покрытые частицы терапевтического средства.
| US 2013190689 A1, 25.07.2013 | |||
| US 2013190689 A1, 25.07.2013 | |||
| US 6506895 B2, 14.01.2003 | |||
| WO 2006026187 A2, 09.03.2006 | |||
| WO 2005079754 A2, 01.09.2005 | |||
| WO 2006019848 A1, 23.02.2006 | |||
| Ивонин А.Г | |||
| и др | |||
| НАПРАВЛЕННЫЙ ТРАНСПОРТ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ: СОВРЕМЕННОЕ СОСТОЯНИЕ ВОПРОСА И ПЕРСПЕКТИВЫ // Известия Коми научного центра УРО РАН | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| - С | |||
Авторы
Даты
2020-10-01—Публикация
2016-01-29—Подача