Декларация государственного интереса
Настоящее изобретение было создано полностью или частично при государственной поддержке в виде профессорской должности, поддерживаемой фондом ван Влиета (Van Vleet Professorship (D.D.M.)), и грантов NIH (национального института здравоохранения) R01CA148706, 1S10RR026337-01, 1S10OD010678-01 (W.L.). За правительством США закреплены определенные права на настоящее изобретение.
Область техники
Настоящее изобретение относится к соединениям, взаимодействующим с участком связывания колхицина, обладающим противораковой активностью, к композициям, содержащим указанные соединения, и к их применению для лечения различных форм рака.
Уровень техники
Рак является второй по распространенности причиной смертности в Соединенных Штатах, уступая только заболеваниям сердца. В Соединенных Штатах рак является причиной каждой 4-ой смерти. 5-летний уровень относительной выживаемости всех раковых пациентов, диагноз которым был поставлен в период с 1996 по 2003 год, составляет 66% - для сравнения: в период с 1975 по 1977 год указанный показатель составлял 50% (Cancer Facts & Figures American Cancer Society: Atlanta, GA (2008)). Такое улучшение выживаемости отражает прогресс в диагностике на ранних стадиях и развитие способов лечения. Главной задачей изучения рака является выявление высокоэффективных противораковых агентов с низкой токсичностью.
Рак простаты является одним из наиболее часто диагностируемых некожных видов рака у мужчин в США и представляет собой вторую по распространенности причину смертности от рака, при этом в текущем году ожидается выявление 180000 новых случаев и наступление почти 29000 смертей. Пациентам с распространенным раком простаты проводят антиандрогенную терапию (ADT), обычно с применением агонистов рилизинг-фактора лютеинизирующего гормона (РФЛГ) или путем двусторонней орхиэктомии. Антиандрогенная терапия снижает не только уровень тестостерона, но также уровень эстрогена, поскольку эстроген образуется в результате ароматизации тестостерона, уровень которого снижается в результате ADT. Дефицит эстрогена, вызванный антиандрогенной терапией, приводит к значительным побочным эффектам, включая приливы, гинекомастию и масталгию, потерю костной ткани, снижение качества и прочности костей, остеопороз и опасные для жизни переломы, необратимые изменения липидов, повышенный риск сердечно-сосудистых заболеваний и инфаркта миокарда, депрессию и другие изменения настроения.
Злокачественная меланома является наиболее опасной формой рака кожи и является причиной примерно 75% от всех смертей от рака кожи. Среди населения западного мира постепенно возрастает количество случаев меланомы. За последние 20 лет это количество удвоилось. По всему миру ежегодно диагностируется примерно 160000 новых случаев меланомы, наиболее часто у мужчин и представителей европеоидной расы. Согласно отчету ВОЗ ежегодно по всему миру наступает примерно 48000 смертей, связанных с меланомой.
В настоящее время эффективные способы лечения метастатической меланомы отсутствуют. Метастатическая меланома обладает высокой устойчивостью к существующим способам химиотерапии, радиотерапии и иммунотерапии. Метастатическая меланома характеризуется очень плохим прогнозом: среднее время выживаемости составляет 6 месяцев, а 5-летний уровень выживаемости составляет менее 5%. За последние 30 лет дакарбазин (DTIC) является единственным лекарственным средством, одобренным Управлением по контролю качества пищевых продуктов и лекарственных средств США (FDA) для лечения метастатической меланомы. Тем не менее, дакарбазин обеспечивает полную ремиссию только лишь менее чем у 5% пациентов. В последние годы предпринимались значительные усилия для борьбы с метастатической меланомой. Применение комбинаций DTIC с другими химиотерапевтическими лекарственными средствами (например, с цисплатином, винбластином и кармустином) или добавление интерферона-α2b к DTIC не обеспечивало улучшения выживаемости по сравнению с лечением с применением только DTIC. В проводившихся совсем недавно клинических испытаниях антител и вакцин для лечения метастатической меланомы также не удалось добиться удовлетворительной эффективности. Ипилимумаб (Yervoy) представляет собой лекарственное средство, которое задействует иммунную систему субъекта для борьбы с меланомой. Ипилимумаб применяют для лечения распространенной меланомы, которая распространяется за границы своего первоначального расположения. В направленной терапии применяют лекарственные средства, предназначенные для направленного воздействия на специфические уязвимые места в раковых клетках. Вемурафениб (Zelboraf) представляет собой средство для направленной терапии, одобренное для лечения распространенной меланомы, которая не поддается хирургическому лечению, или меланомы, распространившейся по организму. Вемурафениб может излечивать только меланому, имеющую определенную генетическую мутацию.
Лекарственные средства, взаимодействующие с тубулином/микротрубочками, успешно применяют для лечения широкого ряда раковых заболеваний человека. Их часто относят к двум основным категориям: лекарственные средства, стабилизирующие микротрубочки (например, таксаны, эпотилоны) и лекарственные средства, дестабилизирующие микротрубочки (например, алкалоиды винка, колхицин). В субъединицах α,β-тубулина были выявлены три основных связывающих участка: участки связывания таксанов, алкалоидов винка и колхицина. Несмотря на то, что антимитотические агенты, взаимодействующие с участками связывания таксанов или алкалоидов винка в тубулине, обладают очень высокой эффективностью в клинической онкологии, в настоящее время отсутствуют лекарственные средства, взаимодействующие с участком связывания колхицина, которые были бы одобрены Управлением по контролю качества продуктов питания и лекарственных средств США для лечения рака. Большинство агентов, связывающих колхицин, имеют высокую активность, химическую структуру, которую относительно просто оптимизировать, селективную токсичность в отношении сосудистой системы опухоли и обладают многообещающей способностью преодолевать множественную лекарственную устойчивость, опосредованную эффлюксным насосом Р-гликопротеина (P-gp).
Некоторые превосходные агенты для указанного подхода приведены на фигуре 1. Комбретастатин А-4 (СА-4) является наиболее активным членом семейства комбретастатинов, выделенным из африканского дерева Combretum caffrum. СА-4 обладает высокой антитубулиновой активностью за счет связывания с участком колхицина и является объектом клинических испытаний II и III фазы. Замена олефинового мостика в СА-4 на карбонильную группу приводит к получению фенстатина, который обладает активностью и механизмом действия, сходными с СА-4. BPR0L075 и Oxi-6196 представляют собой 2-ароилиндольные и дигидронафталиновые аналоги СА-4, которые обеспечивают сильное ингибирование полимеризации тубулина. Метилированный халкон SD400, который имеет значение IC50 в отношении клеток лейкоза человека K562, составляющее 0,21 нМ, является высокоактивным ингибитором тубулина. Подофиллотоксин представляет собой токсичный лигнин неалкалоидной природы и также обладает противораковыми свойствами, которые могут ингибировать полимеризацию тубулина за счет связывания с участком связывания колхицина. Соответственно, соединения, взаимодействующие с участком связывания колхицина, в последние годы представляют большой интерес для специалистов в области медицинской химии.
Краткое описание изобретения
В одном из вариантов реализации настоящее изобретение относится к соединению, представленному формулой II:
где
Q представляет собой S, NH или О;
Z представляет собой СН или N;
А представляет собой замещенный или незамещенный фенил; замещенный или незамещенный индолил; или замещенный или незамещенный индазолил;
причем необязательные заместители при А включают О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)iNHCH3, -(CH2)iNH2, -(CH2)iN(CH3)2, -OC(O)CF3, -SO2-арил, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н, -C(O)NH2 или их комбинацию;
R1 независимо представляет собой водород, О-алкил, О-галогеналкил, CF3, CN, NO2, -CH2CN, NH2, гидроксил, СООН, С(O)Н, NHCO-алкил, -O(CH2)jOCH3, -O(CH2)jOH, -O(CH2)jNHCH3, -O(CH2)jNH2, -O-(CH2)jN(CH3)2, -OC(O)CF3, -OC(O)CH2Cl, -OCH2Ph, -O(CH2)jNH2, -O(СН2)jN-фталимид или их комбинацию;
R2 представляет собой водород, О-алкил, О-галогеналкил, CF3, CN, NO2, -CH2CN, NH2, гидроксил, СООН, С(O)Н, NHCO-алкил, -O(CH2)kOCH3, -O(CH2)kOH, -O(CH2)kNHCH3, -O(CH2)kNH2, -O-(CH2)kN(CH3)2, -OC(O)CF3, -OC(O)CH2Cl, - OCH2Ph, -O(CH2)kNH2 или -O(СН2)kN-фталимид;
i, j и k независимо представляют собой целые числа от 0 до 5;
n представляет собой целое число от 1 до 4;
или его метаболиту, гидрату, изомеру, N-оксиду, пролекарству, фармацевтическому продукту, фармацевтически приемлемой соли, полиморфу, таутомеру или их комбинации.
В одном из вариантов реализации настоящее изобретение относится к соединению, представленному формулой XII:

где
Q представляет собой S, NH или О;
X представляет собой связь или NH;
А представляет собой замещенный или незамещенный фенил; замещенный или незамещенный индолил; или замещенный или незамещенный индазолил;
причем необязательные заместители при А включают О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)iNHCH3, -(CH2)jNH2, - (CH2)iN(CH3)2, -OC(O)CF3, -SO2-арил, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н, -C(O)NH2 или их комбинацию;
R3 представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)oNHCH3, -(CH2)oNH2, -(CH2)oN(CH3)2, - O(CH2)oOMe, -O(CH2)oOH, -OC(O)CF3, -SO2-арил, С1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н или -C(O)NH2;
i и о независимо представляют собой целые числа от 0 до 5;
или его метаболиту, гидрату, изомеру, N-оксиду, пролекарству, фармацевтическому продукту, фармацевтически приемлемой соли, полиморфу, таутомеру или их комбинации.
В одном из вариантов реализации настоящее изобретение относится к фармацевтической композиции согласно настоящему изобретению. В другом варианте реализации настоящее изобретение относится к фармацевтической композиции согласно настоящему изобретению и по меньшей мере к одному фармацевтически активному соединению, подходящему для лечения рака.
В одном из вариантов реализации настоящее изобретение относится к способу лечения, ослабления, снижения тяжести, снижения риска или подавления рака, включающему введение соединения согласно настоящему изобретению субъекту, больному раком, в условиях, которые являются эффективными для излечения рака. В другом варианте реализации рак выбран из группы, состоящей из рака простаты, рака простаты с лекарственной устойчивостью, рака груди, рака груди с лекарственной устойчивостью, рака яичников, рака яичников с лекарственной устойчивостью, рака кожи, меланомы, меланомы с лекарственной устойчивостью, рака легкого, рака толстой кишки, глиомы, лейкоза, лимфомы, рака почки, рака ЦНС, рака матки, рака матки с лекарственной устойчивостью и их комбинаций. В другом варианте реализации введение соединения согласно настоящему изобретению проводят в комбинации с другой терапией рака.
В одном из вариантов реализации настоящее изобретение относится к способу лечения опухоли или опухолей с лекарственной устойчивостью, включающему введение соединения согласно настоящему изобретению субъекту, страдающему от рака, в условиях, которые являются эффективными для излечения опухоли или опухолей с лекарственной устойчивостью. В другом варианте реализации рак выбран из группы, состоящей из рака простаты, рака простаты с лекарственной устойчивостью, рака груди, рака груди с лекарственной устойчивостью, рака яичников, рака яичников с лекарственной устойчивостью, рака кожи, меланомы, меланомы с лекарственной устойчивостью, рака легкого, рака толстой кишки, глиомы, лейкоза, лимфомы, рака почки, рака ЦНС, рака матки, рака матки с лекарственной устойчивостью и их комбинаций. В другом варианте реализации введение соединения согласно настоящему изобретению проводят в комбинации с другой терапией рака.
Другие отличительные признаки и преимущества настоящего изобретения станут понятны из последующего подробного описания, примеров и фигур. Следует понимать, тем не менее, что подробное описание и конкретные примеры, хоть в них и указаны предпочтительные варианты реализации согласно настоящему изобретению, приведены исключительно в качестве иллюстрации, так как различные изменения и модификации, не выходящие за рамки сущности и объема изобретения, будут очевидны специалистам в данной области техники после изучения настоящего подробного описания.
Краткое описание чертежей
На фигуре 1 изображены структуры типовых ингибиторов тубулина, которые связываются с участком связывания колхицина.
На фигуре 2 изображена схема синтеза для получения соединений согласно настоящему изобретению. Реагенты и условия: a) TsOH, EtOH, нагревание с обратным холодильником; b) (3,4,5-триметоксифенил)бороновая кислота, K2CO3, Pd(PPh3)4.
На фигуре 3 изображена схема синтеза для получения 4-замещенных аналогов метоксибензоил-арил-тиазола (SMART), направленная на модификацию по пара-положению бензоильного кольца. Реагенты и условия: (а) МеОН/фосфатный буфер, рН = 6,4, КТ; (b) EDCI, HOBt, NMM, CH3OCH3NH⋅HCl; (с) CBrCl3, DBU; (d) 5-бром-1,2,3-триметоксибензол/BuLi, ТГФ, -78°С; (е) AlCl3, CH2Cl2; (f) ClCH2COCl, CH2Cl2, NEt3 (12) или (CF3CO)2O, CH2Cl2, DMAP (13); (g) PhCH2Br, K2CO3, ДМФ (14); MOMCl, основание Хюнига, CH2Cl2 (15); BrCH2CH2NHBoc, ДМФ, Cs2CO3 (16) или 2-(2-бромэтил)изоиндолин-1,3-дион, K2CO3, ДМФ, 120°С (17); (h) 4М HCl в диоксане.
На фигуре 4 изображена схема синтеза для получения аналогов фенил-амино-тиазола/имидазола. Реагенты и условия: (a) BrCN, Et2O/гексан; (b) CH3SO3H, EtOH, нагревание с обратным холодильником, 24 часа; (с) (1) 6М HCl, (2) NaOH 25% конц.; (d) PhSO2Cl, Et3N; (е) -78°С, t-BuLi, 3,4,5-триметоксибензоилхлорид; (f) Boc2O, NaOH; (g) (хлорметантриил)трибензол, Et3N, CH2Cl2; (h) HCl; (i) H2, Pd-C, 5% EtOH, 40 psi (280 кПа); (j) PhCOSCN, Me2CO; (k) MeOH, 1н. NaOH; (l) EtOH, 65°C; (m) NaOH, MeOH; (n) HBTU, NMM, HNCH3OCH3⋅HCl, CH2Cl2; (о) 3,4,5-триметоксифенилбромид, n-BuLi, ТГФ.
На фигуре 5 изображены агенты, необратимо связывающие тубулин, и возможные взаимодействия Cys-241 по пара-положению бензоильного кольца в соединениях формулы XI-XV.
На фигуре 6 изображены возможные места для связывания с соединением 4 (модель трубок, индекс докинга Glidescore -8,58) и 7 (модель трубок, индекс докинга Glidescore -8,10) в α,β-димере тубулина (код PDB: 1SA0). Естественный лиганд, DAMA-колхицин (индекс докинга Glidescore -9,26) показан в проволочной модели.
На фигуре 7 изображены возможные места для связывания с соединением 33 (модель трубок, индекс докинга Glidescore -8,70) и естественным лигандом DAMA-колхицина (проволочная модель, индекс докинга Glidescore -9,26) в α,β-димере тубулина (код PDB: 1SA0).
На фигуре 8 приведены предполагаемые метаболиты и метаболический путь соединения 15.
На фигуре 9 приведены предполагаемые метаболиты и метаболический путь соединения 18.
На фигуре 10 приведены предполагаемые метаболиты и метаболический путь соединения 4.
На фигуре 11 приведены предполагаемые метаболиты и метаболический путь соединения 7.
На фигуре 12 показано ингибирование полимеризации тубулина под действием соединений 4 и 7 in vitro.
Подробное описание изобретения
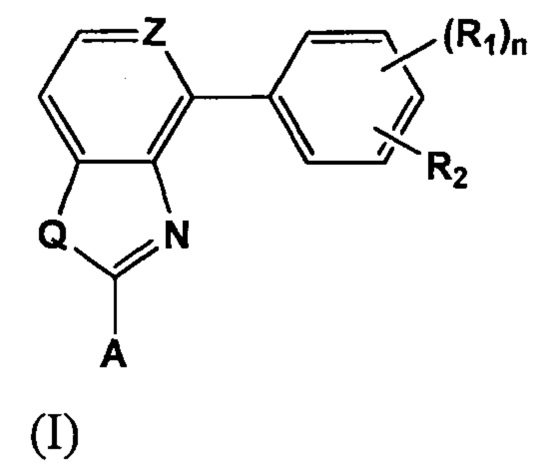
В одном из вариантов реализации настоящее изобретение относится к соединению формулы (I)
где
Q представляет собой S, NH или О;
Z представляет собой СН или N;
А представляет собой замещенные или незамещенные системы отдельных, конденсированных или нескольких арильных или (гетеро)циклических колец, включая насыщенные и ненасыщенные N-гетероциклы, насыщенные и ненасыщенные S-гетероциклы и насыщенные и ненасыщенные О-гетероциклы, насыщенные или ненасыщенные циклические углеводороды, насыщенные или ненасыщенные смешанные гетероциклы, алифатические линейные или разветвленные С1-С30 углеводороды;
причем необязательные заместители при А включают О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)iNHCH3, -(CH2)iNH2, -(CH2)iN(CH3)2, -OC(O)CF3, -SO2-арил, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н, -C(O)NH2 или их комбинацию;
R1 независимо представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, галогеналкил, CF3, CN, NO2, -CH2CN, NH2, гидроксил, СООН, С(O)Н, NHCO-алкил, -O(CH2)jOCH3, -O(CH2)jOH, -O(CH2)jNHCH3, -O(CH2)jNH2, -O-(CH2)jN(CH3)2, - OC(O)CF3, -OC(O)CH2Cl, -OCH2Ph, -O(CH2)jNH2, -O(СН2)jN-фталимид или их комбинацию;
R2 представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, галогеналкил, CF3, CN, NO2, -CH2CN, NH2, гидроксил, СООН, С(O)Н, NHCO-алкил, -O(CH2)kOCH3, -O(CH2)kOH, -O(CH2)kNHCH3, -O(CH2)kNH2, -O-(CH2)kN(CH3)2, -OC(O)CF3, -OC(O)CH2Cl, -OCH2Ph, -O(CH2)kNH2 или -O(СН2)kN-фталимид;
i, j и k независимо представляют собой целые числа от 0 до 5;
n представляет собой целое число от 1 до 4;
или его метаболиту, гидрату, изомеру, N-оксиду, пролекарству, фармацевтическому продукту, фармацевтически приемлемой соли, таутомеру, полиморфу или их комбинации.
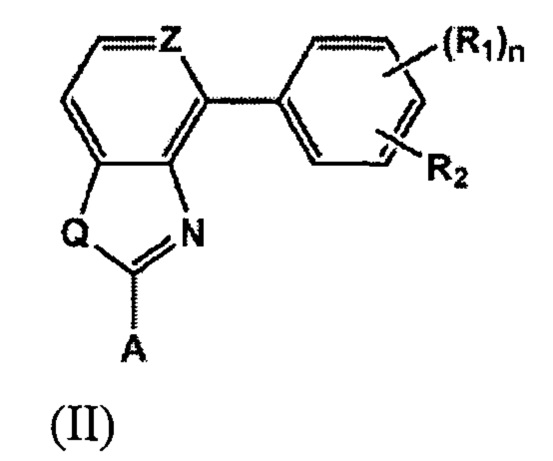
В одном из вариантов реализации настоящее изобретение относится к соединению формулы (II)

где
Q представляет собой S, NH или О;
Z представляет собой СН или N;
А представляет собой замещенный или незамещенный фенил; замещенный или незамещенный индолил; или замещенный или незамещенный индазолил;
причем необязательные заместители при А включают О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)iNHCH3, -(CH2)jNH2, -(CH2)jN(CH3)2, -OC(O)CF3, -SO2-арил, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н, -C(O)NH2 или их комбинацию;
R1 независимо представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, галогеналкил, CF3, CN, NO2, -CH2CN, NH2, гидроксил, СООН, С(O)Н, NHCO-алкил, -O(CH2)jOCH3, -O(CH2)jOH, -O(CH2)jNHCH3, -O(CH2)jNH2, -O-(CH2)jN(CH3)2, - OC(O)CF3, -OC(O)CH2Cl, -OCH2Ph, -O(CH2)jNH2, -O(СН2)jN-фталимид или их комбинацию;
R2 представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, галогеналкил, CF3, CN, NO2, -CH2CN, NH2, гидроксил, СООН, С(O)Н, NHCO-алкил, -O(CH2)kOCH3, -O(CH2)kOH, -O(CH2)kNHCH3, -O(CH2)kNH2, -O-(CH2)kN(CH3)2, -OC(O)CF3, -OC(O)CH2Cl, -OCH2Ph, -O(CH2)kNH2 или -O(СН2)jN-фталимид;
i, j и k независимо представляют собой целое число от 0 до 5;
n представляет собой целое число от 1 до 4;
или его метаболиту, гидрату, изомеру, N-оксиду, пролекарству, фармацевтическому продукту, фармацевтически приемлемой соли, полиморфу, таутомеру или их комбинации.
В одном из вариантов реализации настоящее изобретение относится к соединению формулы (III)

где:
Z представляет собой СН или N;
А представляет собой замещенный или незамещенный фенил; замещенный или незамещенный индолил; или замещенный или незамещенный индазолил;
причем необязательные заместители при А включают О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)iNHCH3, -(CH2)jNH2, -(CH2)iN(CH3)2, -OC(O)CF3, -SO2-арил, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н, -C(O)NH2 или их комбинацию;
R1 независимо представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, галогеналкил, CF3, CN, NO2, -CH2CN, NH2, гидроксил, СООН, С(O)Н, NHCO-алкил, -O(CH2)jOCH3, -O(CH2)jOH, -O(CH2)jNHCH3, -O(CH2)jNH2, -O(CH2)jN(CH3)2, -OC(O)CF3, -OC(O)CH2Cl, -OCH2Ph, -O(CH2)jNH2, -O(СН2)jN-фталимид или их комбинацию;
R2 представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, галогеналкил, CF3, CN, NO2, -CH2CN, NH2, гидроксил, СООН, С(O)Н, NHCO-алкил, -O(CH2)kOCH3, -O(CH2)kOH, -O(CH2)kNHCH3, -O(CH2)kNH2, -O(CH2)kN(CH3)2, -OC(O)CF3, -OC(O)CH2Cl, -OCH2Ph, -O(CH2)kNH2 или -O(СН2)kN-фталимид;
i, j и k независимо представляют собой целые числа от 0 до 5;
n представляет собой целое число от 1 до 4;
или его метаболиту, гидрату, изомеру, N-оксиду, пролекарству, фармацевтическому продукту, фармацевтически приемлемой соли, полиморфу, таутомеру или их комбинации.
В одном из вариантов реализации настоящее изобретение относится к соединению формулы (IV)

где
А представляет собой замещенный или незамещенный фенил; замещенный или незамещенный индолил; или замещенный или незамещенный индазолил;
причем необязательные заместители при А включают О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)iNHCH3, -(CH2)iNH2, -(CH2)iN(CH3)2, -OC(O)CF3, -SO2-арил, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н, -C(O)NH2 или их комбинацию;
R1 независимо представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, галогеналкил, CF3, CN, NO2, -CH2CN, NH2, гидроксил, СООН, С(O)Н, NHCO-алкил, -O(CH2)jOCH3, -O(CH2)jOH, -O(CH2)jNHCH3, -O(CH2)jNH2, -O(CH2)jN(CH3)2, -OC(O)CF3, -OC(O)CH2Cl, -OCH2Ph, -O(CH2)jNH2, -O(СН2)kN-фталимид или их комбинацию;
R2 представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, галогеналкил, CF3, CN, NO2, -CH2CN, NH2, гидроксил, СООН, С(O)Н, NHCO-алкил, -O(CH2)kOCH3, -O(CH2)kOH, -O(CH2)kNHCH3, -O(CH2)kNH2, -O(CH2)kN(CH3)2, -OC(O)CF3, -OC(O)CH2Cl, -OCH2Ph, -O(CH2)kNH2 или -O(СН2)kN-фталимид;
i, j и k независимо представляют собой целые числа от 0 до 5;
n представляет собой целое число от 1 до 4;
или его метаболиту, гидрату, изомеру, N-оксиду, пролекарству, фармацевтическому продукту, фармацевтически приемлемой соли, полиморфу, таутомеру или их комбинации.
В одном из вариантов реализации настоящее изобретение относится к соединению формулы (V)

где
А представляет собой замещенный или незамещенный фенил; замещенный или незамещенный индолил; или замещенный или незамещенный индазолил;
причем необязательные заместители при А включают О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)iNHCH3, -(CH2)iNH2, -(CH2)iN(CH3)2, -OC(O)CF3, -SO2-арил, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н, -C(O)NH2 или их комбинацию;
R1 независимо представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, галогеналкил, CF3, CN, NO2, -CH2CN, NH2, гидроксил, СООН, С(O)Н, NHCO-алкил, -O(CH2)jOCH3, -O(CH2)jOH, -O(CH2)jNHCH3, -O(CH2)jNH2, -O(CH2)jN(CH3)2, -OC(O)CF3, -OC(O)CH2Cl, -OCH2Ph, -O(CH2)jNH2, -O(СН2)jN-фталимид или их комбинацию;
R2 представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, галогеналкил, CF3, CN, NO2, -CH2CN, NH2, гидроксил, СООН, С(O)Н, NHCO-алкил, -O(CH2)kOCH3, -O(CH2)kOH, -O(CH2)kNHCH3, -O(CH2)kNH2, -O(CH2)kN(CH3)2, -OC(O)CF3, -OC(O)CH2Cl, -OCH2Ph, -O(CH2)kNH2 или -O(СН2)kN-фталимид;
i, j и k независимо представляют собой целые числа от 0-5;
n представляет собой целое число от 1 до 4;
или его метаболиту, гидрату, изомеру, N-оксиду, пролекарству, фармацевтическому продукту, фармацевтически приемлемой соли, полиморфу, таутомеру или их комбинации.
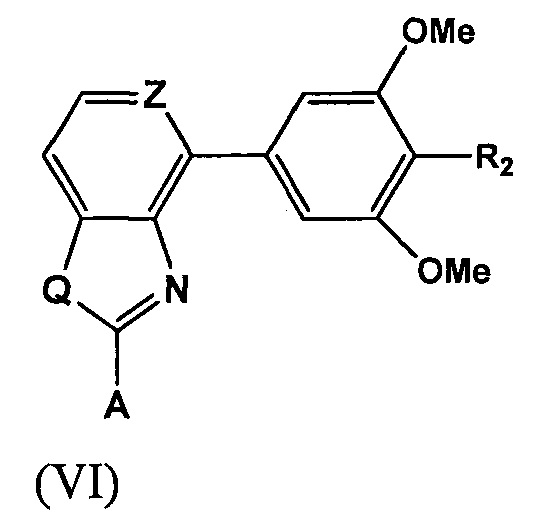
В одном из вариантов реализации настоящее изобретение относится к соединению формулы (VI)
где
Q представляет собой NH, S или О;
Z представляет собой СН или N;
А представляет собой замещенный или незамещенный фенил; замещенный или незамещенный индолил; или замещенный или незамещенный индазолил;
причем необязательные заместители при А включают О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)iNHCH3, -(CH2)iNH2, -(CH2)iN(CH3)2, -OC(O)CF3, -SO2-арил, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н, -C(O)NH2 или их комбинацию;
R2 представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, галогеналкил, CF3, CN, NO2, -CH2CN, NH2, гидроксил, СООН, С(O)Н, NHCO-алкил, -O(CH2)kOCH3, -O(CH2)kOH, -O(CH2)kNHCH3, -O(CH2)kNH2, -O(CH2)kN(CH3)2, -OC(O)CF3, -OC(O)CH2Cl, -OCH2Ph, -O(CH2)kNH2 или -O(СН2)kN-фталимид;
i и k независимо представляют собой целые числа от 0 до 5;
или его метаболиту, гидрату, изомеру, N-оксиду, пролекарству, фармацевтическому продукту, фармацевтически приемлемой соли, полиморфу, таутомеру или их комбинации.
В одном из вариантов реализации настоящее изобретение относится к соединению формулы (VII)

где
Z представляет собой СН или N;
А представляет собой замещенный или незамещенный фенил; замещенный или незамещенный индолил; или замещенный или незамещенный индазолил;
причем необязательные заместители при А включают О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)iNHCH3, -(CH2)iNH2, -(CH2)iN(CH3)2, -OC(O)CF3, -SO2-арил, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н, -C(O)NH2 или их комбинацию;
i представляет собой целое число от 0 до 5;
или его метаболиту, гидрату, изомеру, N-оксиду, пролекарству, фармацевтическому продукту, фармацевтически приемлемой соли, полиморфу, таутомеру или их комбинации.
В одном из вариантов реализации настоящее изобретение относится к соединению формулы (VIII)

где
Z представляет собой СН или N;
R4 независимо представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)qNHCH3, -(CH2)qNH2, -(CH2)qN(CH3)2, -OC(O)CF3, -SO2-арил, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н, -C(O)NH2 или их комбинацию;
R5 представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)tNHCH3, -(CH2)tNH2, -(CH2)tN(CH3)2, -OC(O)CF3, -SO2-арил, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н или -C(O)NH2;
m представляет собой целое число от 1 до 4;
t и q независимо представляют собой целые числа от 0 до 5;
или его метаболиту, гидрату, изомеру, N-оксиду, пролекарству, фармацевтическому продукту, фармацевтически приемлемой соли, полиморфу, таутомеру или их комбинации.
В одном из вариантов реализации соединение формулы VIII представляет собой:
 где его таутомер представляет собой:
где его таутомер представляет собой: 
В одном из вариантов реализации настоящее изобретение относится к соединению формулы (IX)

где
Z представляет собой СН или N;
R4 независимо представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)qNHCH3, -(CH2)qNH2, -(CH2)qN(CH3)2, -OC(O)CF3, -SO2-арил, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н, -C(O)NH2 или их комбинацию;
R5 представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)tNHCH3, -(CH2)tNH2, -(CH2)tN(CH3)2, -OC(O)CF3, -SO2-арил, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н или -C(O)NH2;
m представляет собой целое число от 1 до 4;
t и q независимо представляют собой целые числа от 0 до 5;
или его метаболиту, гидрату, изомеру, N-оксиду, пролекарству, фармацевтическому продукту, фармацевтически приемлемой соли, полиморфу, таутомеру или их комбинации.
В одном из вариантов реализации соединение формулы IX представляет собой:
 где его таутомер представляет собой:
где его таутомер представляет собой: 
или
 где его таутомер представляет собой:
где его таутомер представляет собой: 
В одном из вариантов реализации настоящее изобретение относится к соединению формулы (X)

где
Z представляет собой СН или N;
Р представляет собой СН или N;
R4 независимо представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)qNHCH3, -(CH2)qNH2, -(CH2)qN(CH3)2, -OC(O)CF3, -SO2-арил, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н, -C(O)NH2 или их комбинацию;
R5 представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)tNHCH3, -(CH2)tNH2, -(CH2)tN(CH3)2, -OC(O)CF3, -SO2-арил, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н или -C(O)NH2;
m представляет собой целое число от 1 до 4;
t и q независимо представляют собой целые числа от 0 до 5;
или его метаболиту, гидрату, изомеру, N-оксиду, пролекарству, фармацевтическому продукту, фармацевтически приемлемой соли, полиморфу, таутомеру или их комбинации.
В одном из вариантов реализации соединение формулы X представляет собой:
 где его таутомер представляет собой:
где его таутомер представляет собой: 
или
 где его таутомер включает:
где его таутомер включает: 
В одном из вариантов реализации настоящее изобретение относится к соединению формулы (XI)

где
Q представляет собой S, NH или О;
X представляет собой связь или NH;
А представляет собой замещенные или незамещенные системы отдельных, конденсированных или нескольких арильных или (гетеро)циклических колец, включая насыщенные и ненасыщенные N-гетероциклы, насыщенные и ненасыщенные S-гетероциклы и насыщенные и ненасыщенные О-гетероциклы, насыщенные или ненасыщенные циклические углеводороды, насыщенные или ненасыщенные смешанные гетероциклы, алифатические линейные или разветвленные C1-С30 углеводороды;
причем необязательные заместители при А включают О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)iNHCH3, -(CH2)iNH2, -(CH2)iN(CH3)2, -OC(O)CF3, -SO2-арил, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н, -C(O)NH2 или их комбинацию;
R представляет собой водород, С1-С5 линейный или разветвленный алкил; С1-С5 линейный или разветвленный алкенил, (CH2)lPh, арил, (CH2)lNHCH3, -(CH2)lNH2, -(CH2)lN(CH3)2, С(O)алкил, C(O)CF3, -(CH2)lOMe, -(CH2)lOH или галогеналкил;
R3 представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -O(CH2)oNHCH3, -O(CH2)oNH2, -O(CH2)oN(CH3)2, -O(CH2)oOMe, -O(CH2)oOH, -OC(O)CF3, -SO2-арил, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н или -C(O)NH2;
i, l и о независимо представляют собой целые числа от 0 до 5;
или его метаболиту, изомеру, N-оксиду, пролекарству, гидрату, фармацевтическому продукту, фармацевтически приемлемой соли, полиморфу, таутомеру или их комбинации.
В одном из вариантов реализации настоящее изобретение относится к соединению формулы (XII)

где
Q представляет собой S, NH или О;
X представляет собой связь или NH;
А представляет собой замещенный или незамещенный фенил; замещенный или незамещенный индолил; или замещенный или незамещенный индазолил;
причем необязательные заместители при А включают О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)iNHCH3, -(CH2)iNH2, -(CH2)iN(CH3)2, -OC(O)CF3, -SO2-арил, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н, -C(O)NH2 или их комбинацию;
R3 представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -O(CH2)oNHCH3, -O(CH2)oNH2, -O(CH2)oN(CH3)2, -O(CH2)oOMe, -O(CH2)oOH, -OC(O)CF3, -SO2-арил, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н или -C(O)NH2;
i и о независимо представляют собой целые числа от 0 до 5;
или его метаболиту, гидрату, изомеру, N-оксиду, пролекарству, фармацевтическому продукту, фармацевтически приемлемой соли, полиморфу, таутомеру. или их комбинации.
В одном из вариантов реализации формулы XII R3 отличается от ОМе.
В одном из вариантов реализации настоящее изобретение относится к соединению формулы (XIII)

где
Q представляет собой S, NH или О;
R представляет собой водород, С1-С5 линейный или разветвленный алкил; С1-С5 линейный или разветвленный алкенил, (CH2)lPh, арил, (CH2)lNHCH3, -(CH2)lNH2, -(CH2)lN(CH3)2, С(O)алкил, C(O)CF3, -(CH2)lOMe, -(CH2)lOH или галогеналкил;
R3 представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -O(CH2)oNHCH3, -O(CH2)oNH2, -O(CH2)oN(CH3)2, -O(CH2)oOMe, -O(CH2)oOH, -OC(O)CF3, -SO2-арил, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н или -C(O)NH2;
R4 независимо представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)qNHCH3, -(CH2)qNH2, -(CH2)qN(CH3)2, -OC(O)CF3, -SO2-арил, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н, -C(O)NH2 или их комбинацию;
R5 представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)tNHCH3, -(CH2)tNH2, -(CH2)tN(CH3)2, -OC(O)CF3, -SO2-арил, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н или -C(O)NH2;
m представляет собой целое число от 1 до 4;
l, о, t и q независимо представляют собой целые числа от 0 до 5;
или его метаболиту, гидрату, изомеру, N-оксиду, пролекарству, фармацевтическому продукту, фармацевтически приемлемой соли, полиморфу, таутомеру или их комбинации.
В одном из вариантов реализации соединение формулы XIII представляет собой:
 или
или 
В одном из вариантов реализации настоящее изобретение относится к соединению формулы (XIV):

где
Q представляет собой S, NH или О;
R представляет собой водород, С1-С5 линейный или разветвленный алкил, С1-С5 линейный или разветвленный алкенил, (CH2)lPh, арил, (CH2)lNHCH3, -(CH2)lNH2, -(CH2)lN(CH3)2, С(O)алкил, C(O)CF3, -(CH2)lOMe, -(CH2)lOH или галогеналкил;
R3 представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -O(CH2)oNHCH3, -O(CH2)oNH2, -O(CH2)oN(CH3)2, -O(CH2)oOMe, -O(CH2)oOH, -OC(O)CF3, -SO2-арил, С1-С5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н или -C(O)NH2;
R4 независимо представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)qNHCH3, -(CH2)qNH2, -(CH2)qN(CH3)2, -OC(O)CF3, -SO2-арил, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н, -C(O)NH2 или их комбинацию;
R5 представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)tNHCH3, -(CH2)tNH2, -(CH2)tN(CH3)2, -OC(O)CF3, -SO2-арил, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н или -C(O)NH2;
m представляет собой целое число от 1 до 4;
l, о, t и q независимо представляют собой целые числа от 0 до 5;
или его метаболиту, гидрату, фармацевтическому продукту, фармацевтически приемлемой соли, полиморфу, таутомеру или их комбинации.
В одном из вариантов реализации настоящее изобретение относится к соединению формулы (XV)

где
Q представляет собой S, NH или О;
X представляет собой связь или NH;
R представляет собой водород, С1-С5 линейный или разветвленный алкил, С1-С5 линейный или разветвленный алкенил, (CH2)lPh, арил, (CH2)lNHCH3, -(CH2)lNH2, -(CH2)1N(CH3)2, С(O)алкил, C(O)CF3, -(CH2)lOMe, -(CH2)lOH или галогеналкил;
R3 представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -O(CH2)oNHCH3, -O(CH2)oNH2, -O(CH2)oN(CH3)2, -O(CH2)oOMe, -O(CH2)oOH, -OC(O)CF3, -SO2-арил, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н или -C(O)NH2;
R4 независимо представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)qNHCH3, -(CH2)qNH2, -(CH2)qN(CH3)2, -OC(O)CF3, -SO2-арил, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н, -C(O)NH2 или их комбинацию;
Rs представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)tNHCH3, -(CH2)tNH2, -(CH2)tN(CH3)2, -OC(O)CF3, -SO2-арил, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н или -C(O)NH2;
m представляет собой целое число от 1 до 4;
l, о, t и q независимо представляют собой целые числа от 0 до 5;
или его метаболиту, гидрату, изомеру, N-оксиду, пролекарству, фармацевтическому продукту, фармацевтически приемлемой соли, полиморфу, таутомеру или их комбинации.
В одном из вариантов реализации формулы XI, XIII, XIV и XV О-R отличается от R3.
В одном из вариантов реализации соединения формулы XI-XV содержат группу R3 в пара-положении бензоильного кольца. Было обнаружено, что введение различных функциональных групп по пара-положению бензоильного кольца вероятно обеспечивает более сильные взаимодействия с Cys-241 в субъединице β-тубулина (фигура 5), что тем самым увеличивает активность ингибирования полимеризации тубулина. Кроме того, модификация бензоильного кольца помогла понять возможный механизм метаболического деметилирования. Вводили гидрофобные (OBn 14, ОМОМ 15) и гидрофильные (OCH2CH2NH2,18) группы, как показано на фигуре 3.
Другая стратегия была предложена на основании гипотезы о том, что при введении алкилирующей группы по пара-положению бензоильного кольца она может образовывать необратимую ковалентную связь с меркаптогруппой Cys-241 в домене связывания колхицина и обеспечивать необратимые митотические блоки. Хорошо описан механизм ингибирования сборки микротрубочек при связывании низкомолекулярных лекарственных средств с тубулином посредством ковалентного взаимодействия с амино-остатком тубулина. Баи с соавторами [Bai, R.; Covell, D.G.; Pei, X.F.; Ewell, J.В.; Nguyen, N.Y.; Brossi, A.; Hamel, E., Mapping the binding site of colchicinoids on beta-tubulin. 2-Cmoroacetyl-2-demethyltMocolchicine covalently reacts predominantly with cysteine 239 and secondarily with cysteine 354. J Biol Chem 2000, 275(51), 40443-52] сообщили, что 2- и 3-хлорацетильные аналоги диметилтиоколхицина необратимо связываются с участком связывания колхицина, главным образом, в Cys-241 и предотвращают связывание агентов, связывающихся с колхицином, с указанным участком. Ковалентное взаимодействие 2,4-дихлорбензилтиоцианата (фигура 5) с тубулином происходит по нескольким остаткам цистеина, в частности Cys-241 β-тубулина [Bai, R.L.; Lin, С.М.; Nguyen, N.Y.; Liu, Т.Y.; Hamel, Е., Identification of the cysteine residue of beta-tubulin alkylated by the antimitotic agent 2,4-dichlorobenzyl thiocyanate, facilitated by separation of the protein subunits of tubulin by hydrophobic column chromatography. Biochemistry 1989, 28(13), 5606-12]. Полагают, что образование ковалентной связи между тубулином и фрагментом 2,4-дихлорбензилмеркаптана является обратимым. 2-фтор-1-метокси-4-(пентафторфенилсульфонамидо)бензол (Т138067, фигура 5) необратимо связывает β-тубулин посредством замещения атома F в пара-положении тиольной группой Cys-241. Указанное соединение обеспечивало рекрутинг немодифицированных димеров тубулина в крупные аморфные агрегаты и, таким образом, быстро расходовало запас тубулина, доступного для образования микротрубочек [Shan, В.; Medina, J.С.; Santha, Е.; Frankmoelle, W.P.; Chou, Т.С.; Learned, R.M.; Narbut, M.R.; Stott, D.; Wu, P.; Jaen, J.C.; Rosen, Т.; Timmermans, P.В.; Beckmann, H., Selective, covalent modification of beta-tubulin residue Cys-239 by T138067, an antitumor agent with in vivo efficacy against multidrug-resistant tumors. Proceedings of the National Academy of Sciences of the United States of America 1999, 96(10), 5686-91].
В одном из вариантов реализации соединения согласно настоящему изобретению встраивают алкилирующую функциональную группу для образования ковалентной связи или усиления взаимодействия между Cys-241 и бензоильным кольцом соединений согласно настоящему изобретению. Таким образом, также синтезировали и исследовали хлоруксусный аналог (12) и трифторацетат (13), приведенные на фигуре 3.
В одном из вариантов реализации А в формуле I и XI представляет собой замещенную или незамещенную систему отдельных, конденсированных или нескольких арильных или (гетеро)циклических колец, включая насыщенные и ненасыщенные N-гетероциклы, насыщенные и ненасыщенные S-гетероциклы и насыщенные и ненасыщенные О-гетероциклы, насыщенные или ненасыщенные циклические углеводороды, насыщенные или ненасыщенные смешанные гетероциклы, алифатические линейные или разветвленные C1-С30 углеводороды.
В одном из вариантов реализации группа А представляет собой замещенный или незамещенный фуранил, бензофуранил, бензотиофенил, индолил, индазолил, пиридинил, фенил, бифенил, трифенил, дифенилметан, адамантанил, флуренил или другие гетероциклические аналоги, такие как, например, пирролил, пиразолил, имидазолил, пиридинил, пиримидинил, пиразинил, пиридазинил, триазинил, тетразинил, пирролизинил, индолил, изохинолинил, хинолинил, бензимидазолил, индазолил, хинолизинил, циннолинил, хиналолинил, фталазинил, нафтиридинил, хиноксалинил, оксиранил, оксетанил, тетрагидрофуранил, тетрагидропиранил, диоксанил, фуранил, пирилий, бензодиоксолил, тиранил, тиетанил, тетрагидротиофенил, дитиоланил, тетрагидротиопиранил, тиофенил, тиепинил, тианафтенил, оксатиоланил, морфолинил, тиоксанил, тиазолил, изотиазолил, тиадиазолил, оксазолил, изоксазолил и оксадиазолил.
Согласно настоящему описанию «насыщенные или ненасыщенные циклические углеводороды» могут представлять собой любой указанный циклический углеводород, включая, но не ограничиваясь ими, фенил, бифенил, трифенил, нафтил, циклоалкил, циклоалкенил, циклодиенил, флуорен, адамантан и т.д.; «насыщенные или ненасыщенные N-гетероциклы» могут представлять собой любой указанный N-содержащий гетероцикл, включая, но не ограничиваясь ими, аза- и диазациклоалкилы, такие как азиридинил, азетидинил, диазатидинил, пирролидинил, пиперидинил, пиперазинил и азоканил, пирролил, пиразолил, имидазолил, пиридинил, пиримидинил, пиразинил, пиридазинил, триазинил, тетразинил, пирролизинил, индолил, индазолил, хинолинил, изохинолинил, бензимидазолил, индазолил, хинолизинил, циннолинил, хиналолинил, фталазинил, нафтиридинил, хиноксалинил и т.д.; «насыщенные или ненасыщенные О-гетероциклы» могут представлять собой любой указанный О-содержащий гетероцикл, включая, но не ограничиваясь ими, оксиранил, оксетанил, тетрагидрофуранил, тетрагидропиранил, диоксанил, фуранил, пирилий, бензофуранил, бензодиоксолил и т.д.; «насыщенные или ненасыщенные S-гетероциклы» могут представлять собой любой указанный S-содержащий гетероцикл, включая, но не ограничиваясь ими, тиранил, тиетанил, тетрагидротиофенил, дитиоланил, тетрагидротиопиранил, тиофенил, тиепинил, тианафтенил и т.д.; «насыщенные или ненасыщенные смешанные гетероциклы» могут представлять собой любой гетероцикл, содержащий два или более гетероатомов S, N или О, включая, но не ограничиваясь ими, оксатиоланил, морфолинил, тиоксанил, тиазолил, изотиазолил, тиадиазолил, оксазолил, изоксазолил, оксадиазолил и т.д.
В одном из вариантов реализации А в формуле II-VII и XII представляет собой замещенный или незамещенный фенил; замещенный или незамещенный индолил; или замещенный или незамещенный индазолил. В другом варианте реализации А в формуле I, II-VII, XI и XII представляет собой замещенный или незамещенный фенил. В другом варианте реализации А в формуле I, II-VII, XI и XII представляет собой замещенный или незамещенный индолил. В другом варианте реализации индолил представляет собой замещенный или незамещенный 3-индолил, 4-индолил или 5-индолил. В другом варианте реализации группа А представляет собой замещенный или незамещенный 3-индолил. В определенных вариантах реализации группа А представляет собой незамещенный 3-индолил. В определенных вариантах реализации группа А представляет собой незамещенный 5-индолил. В определенных вариантах реализации группа А представляет собой замещенный 5-индолил. В другом варианте реализации индолил является замещенным или незамещенным и выбран из следующих структур:
 или
или 
В другом варианте реализации А в формуле I, II-VII, XI и XII представляет собой замещенный или незамещенный индазолил. В другом варианте реализации индазолил представляет собой замещенный или незамещенный 3-индазолил, 4-индазолил или 5-индазолил. В другом варианте реализации группа А представляет собой замещенный или незамещенный 3-индазолил. В определенных вариантах реализации группа А представляет собой незамещенный 3-индазолил. В определенных вариантах реализации группа А представляет собой незамещенный 5-индазолил. В определенных вариантах реализации группа А представляет собой замещенный 5-индазолил. В другом варианте реализации индазолил является замещенным или незамещенным и выбран из следующих структур:
 или
или 
В одном из вариантов реализации необязательные заместители при А в формуле I, II-VII, XI и XII отсутствуют или включают один, два, три, четыре или пять заместителей. В другом варианте реализации заместители являются одинаковыми. В другом варианте реализации заместители являются различными. Отдельные заместители могут присутствовать в орто-, мета- или пара-положениях. В некоторых вариантах реализации при наличии двух или более заместителей один из них находится в пара-положении.
В других вариантах реализации необязательные заместители при А включают О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)iNHCH3, -(CH2)iNH2, -(CH2)iN(CH3)2, -OC(O)CF3, -SO2-арил, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н, -C(O)NH2, NO2 или их комбинацию. В другом варианте реализации А является незамещенным. В другом варианте реализации А замещен О-алкилом. В другом варианте реализации А замещен О-галогеналкилом. В другом варианте реализации А замещен галогеном. В другом варианте реализации А замещен NO2. В другом варианте реализации А замещен галогеналкилом. В другом варианте реализации А замещен CF3. В другом варианте реализации А замещен CN. В другом варианте реализации А замещен -CH2CN. В другом варианте реализации А замещен NH2. В другом варианте реализации А замещен гидроксилом. В другом варианте реализации А замещен -(СН2)iNHCH3. В другом варианте реализации А замещен -(CH2)iNH2. В другом варианте реализации А замещен -(CH2)iN(CH3)2. В другом варианте реализации А замещен -ОС(O)CF3. В другом варианте реализации А замещен -SO2-арилом. В другом варианте реализации А замещен С1-С5 линейным или разветвленным алкилом. В другом варианте реализации А замещен галогеналкилом. В другом варианте реализации А замещен алкиламино. В другом варианте реализации А замещен аминоалкилом. В другом варианте реализации А замещен -OCH2Ph. В другом варианте реализации А замещен -NHCO-алкилом. В другом варианте реализации А замещен СООН. В другом варианте реализации А замещен -C(O)Ph. В другом варианте реализации А замещен С(O)O-алкилом. В другом варианте реализации А замещен С(O)Н. В другом варианте реализации А замещен -C(O)NH2.
В одном из вариантов реализации i представляет собой целое число от 0 до 5. В другом варианте реализации i равен 0. В другом варианте реализации i равен 1. В другом варианте реализации i равен 2. В другом варианте реализации i равен 3. В другом варианте реализации i равен 4. В другом варианте реализации i равен 5.
В одном из вариантов реализации Z в формуле I-III и VI-X представляет собой СН или N. В другом варианте реализации Z представляет собой СН. В другом варианте реализации Z представляет собой N.
В одном из вариантов реализации Р в формуле X представляет собой СН или N. В другом варианте реализации Р представляет собой СН. В другом варианте реализации Р представляет собой N.
В одном из вариантов реализации Q в формуле I, II, VI, XI, XII и XIII представляет собой S, О или NH. В другом варианте реализации Q представляет собой S. В другом варианте реализации Q представляет собой О. В другом варианте реализации Q представляет собой NH.
В одном из вариантов реализации X в формуле XI и XV представляет собой связь или NH. В другом варианте реализации X представляет собой связь. В другом варианте реализации X представляет собой NH.
В одном из вариантов реализации R1 в формуле I-V представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, галогеналкил, CF3, CN, NO2, -CH2CN, NH2, гидроксил, СООН, С(O)Н, NHCO-алкил, -O(CH2)jOCH3, -O(CH2)jOH, -O(CH2)jNHCH3, -O(CH2)jNH2, -O-(CH2)jN(CH3)2, -OC(O)CF3, -OC(O)CH2Cl, -OCH2Ph, -O(CH2)jNH2 или -O(СН2)jN-фталимид. В другом варианте реализации R1 представляет собой водород. В другом варианте реализации R1 представляет собой О-алкил. В другом варианте реализации R1 представляет собой О-галогеналкил. В другом варианте реализации R1 представляет собой галоген. В другом варианте реализации R1 представляет собой галогеналкил. В другом варианте реализации R1 представляет собой CF3. В другом варианте реализации R1 представляет собой CN. В другом варианте реализации R1 представляет собой NO2. В другом варианте реализации R1 представляет собой -CH2CN. В другом варианте реализации R1 представляет собой NH2. В другом варианте реализации R1 представляет собой гидроксил. В другом варианте реализации R1 представляет собой СООН. В другом варианте реализации R1 представляет собой С(O)Н. В другом варианте реализации R1 представляет собой NHCO-алкил. В другом варианте реализации R1 представляет собой -O(CH2)jOCH3. В другом варианте реализации R1 представляет собой -O(CH2)jOH. В другом варианте реализации R1 представляет собой -O(CH2)jNHCH3. В другом варианте реализации R1 представляет собой -O(CH2)jNH2. В другом варианте реализации R1 представляет собой -O-(CH2)jN(CH3)2. В другом варианте реализации R1 представляет собой -OC(O)CF3. В другом варианте реализации R1 представляет собой -ОС(O)CH2Cl. В другом варианте реализации R1 представляет собой -OCH2Ph. В другом варианте реализации R1 представляет собой -O(CH2)jNH2. В другом варианте реализации R1 представляет собой -O(СН2)jN-фталимид.
В одном из вариантов реализации j представляет собой целое число от 0 до 5. В другом варианте реализации j равен 0. В другом варианте реализации j равен 1. В другом варианте реализации j равен 2. В другом варианте реализации j равен 3. В другом варианте реализации j равен 4. В другом варианте реализации j равен 5.
В одном из вариантов реализации n представляет собой целое число от 1 до 4. В другом варианте реализации n равен 1. В другом варианте реализации n равен 2, в другом варианте реализации n равен 3. В другом варианте реализации n равен 4.
В одном из вариантов реализации R2 в формуле I-VI представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, галогеналкил, CF3, CN, NO2, -CH2CN, NH2, гидроксил, СООН, С(O)Н, NHCO-алкил, -O(CH2)jOCH3, -O(CH2)jOH, -O(CH2)jNHCH3, -O(CH2)jNH2, -O-(CH2)jN(CH3)2, -OC(O)CF3, -OC(O)CH2Cl, -OCH2Ph, -O(CH2)jNH2 или -O(СН2)jN-фталимид. В другом варианте реализации R2 представляет собой водород. В другом варианте реализации R2 представляет собой О-алкил. В другом варианте реализации R2 представляет собой О-галогеналкил. В другом варианте реализации R2 представляет собой галоген. В другом варианте реализации R2 представляет собой галогеналкил. В другом варианте реализации R2 представляет собой CF3. В другом варианте реализации R2 представляет собой CN. В другом варианте реализации R2 представляет собой NO2. В другом варианте реализации R2 представляет собой -CH2CN. В другом варианте реализации R2 представляет собой NH2. В другом варианте реализации R2 представляет собой гидроксил. В другом варианте реализации R1 представляет собой СООН. В другом варианте реализации R2 представляет собой С(O)Н. В другом варианте реализации R2 представляет собой NHCO-алкил. В другом варианте реализации R2 представляет собой -O(СН2)kOCH3. В другом варианте реализации R2 представляет собой -O(СН2)kOH. В другом варианте реализации R2 представляет собой -O(CH2)kNHCH3. В другом варианте реализации R2 представляет собой -O(CH2)kNH2. В другом варианте реализации R2 представляет собой -O-(CH2)kN(CH3)2. В другом варианте реализации R2 представляет собой -OC(O)CF3. В другом варианте реализации R2 представляет собой -ОС(O)CH2Cl. В другом варианте реализации R2 представляет собой -OCH2Ph. В другом варианте реализации R2 представляет собой -O(CH2)kNH2. В другом варианте реализации R2 представляет собой -O(CH2)kN-фталимид.
В одном из вариантов реализации по меньшей мере один из R1 и R2 в формуле I-V не является водородом.
В одном из вариантов реализации k представляет собой целое число от 0 до 5. В другом варианте реализации k равен 0. В другом варианте реализации к равен 1. В другом варианте реализации k равен 2. В другом варианте реализации k равен 3. В другом варианте реализации k равен 4. В другом варианте реализации k равен 5.
В одном из вариантов реализации R3 в формуле XI-XV представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -O(CH2)oNHCH3, -O(CH2)oNH2, -O(CH2)oN(CH3)2, -O(CH2)oOMe, -O(CH2)oOH, -OC(O)CF3, -SO2-арил, С1-С5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н или -C(O)NH2. В другом варианте реализации R3 представляет собой водород. В другом варианте реализации R3 представляет собой О-алкил. В другом варианте реализации R3 представляет собой О-галогеналкил. В другом варианте реализации R3 представляет собой галоген. В другом варианте реализации R3 представляет собой NO2. В другом варианте реализации R3 представляет собой галогеналкил. В другом варианте реализации R3 представляет собой CF3. В другом варианте реализации R3 представляет собой CN. В другом варианте реализации R3 представляет собой -CH2CN. В другом варианте реализации R3 представляет собой NH2. В другом варианте реализации R3 представляет собой гидроксил. В другом варианте реализации R3 представляет собой -O(CH2)oNHCH3. В другом варианте реализации R3 представляет собой -O(CH2)oNH2. В другом варианте реализации R3 представляет собой -O(CH2)oN(CH3)2. В другом варианте реализации R3 представляет собой -O(СН2)oOMe. В другом варианте реализации R3 представляет собой -O(СН2)oOH. В другом варианте реализации R3 представляет собой -OC(O)CF3. В другом варианте реализации R3 представляет собой -SO2-арил. В другом варианте реализации R3 представляет собой С1-С5 линейный или разветвленный алкил. В другом варианте реализации R3 представляет собой галогеналкил. В другом варианте реализации R3 представляет собой алкиламино. В другом варианте реализации R3 представляет собой аминоалкил. В другом варианте реализации R3 представляет собой -OCH2Ph. В другом варианте реализации R3 представляет собой -NHCO-алкил. В другом варианте реализации R3 представляет собой СООН. В другом варианте реализации R3 представляет собой -C(O)Ph. В другом варианте реализации R3 представляет собой С(O)O-алкил. В другом варианте реализации R3 представляет собой С(O)Н. В другом варианте реализации R3 представляет собой -C(O)NH2.
В одном из вариантов реализации о представляет собой целое число от 0 до 5. В другом варианте реализации о равен 0. В другом варианте реализации о равен 1. В другом варианте реализации о равен 2. В другом варианте реализации о равен 3. В другом варианте реализации о равен 4. В другом варианте реализации о равен 5. В одном из вариантов реализации R4 в формуле VIII-X и XIII-XV независимо представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)qNHCH3, -(CH2)qNH2, -(СН2)qN(СН3)2, -OC(O)CF3, -SO2-арил, C1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н, -C(O)NH2 или их комбинацию. В другом варианте реализации R4 представляет собой водород. В другом варианте реализации R4 представляет собой О-алкил. В другом варианте реализации R4 представляет собой О-галогеналкил. В другом варианте реализации R4 представляет собой галоген. В другом варианте реализации R4 представляет собой NO2. В другом варианте реализации R4 представляет собой галогеналкил. В другом варианте реализации R4 представляет собой CF3. В другом варианте реализации R4 представляет собой CN. В другом варианте реализации R4 представляет собой -CH2CN. В другом варианте реализации R4 представляет собой NH2. В другом варианте реализации R4 представляет собой гидроксил. В другом варианте реализации R4 представляет собой -(CH2)qNHCH3. В другом варианте реализации R4 представляет собой -(CH2)qNH2. В другом варианте реализации R4 представляет собой -(CH2)qN(CH3)2. В другом варианте реализации R4 представляет собой -OC(O)CF3. В другом варианте реализации R4 представляет собой -SO2-арил. В другом варианте реализации R4 представляет собой С1-С5 линейный или разветвленный алкил. В другом варианте реализации R4 представляет собой галогеналкил. В другом варианте реализации R4 представляет собой алкиламино. В другом варианте реализации R4 представляет собой аминоалкил. В другом варианте реализации R4 представляет собой -OCH2Ph. В другом варианте реализации R4 представляет собой -NHCO-алкил. В другом варианте реализации R4 представляет собой СООН. В другом варианте реализации R4 представляет собой -C(O)Ph. В другом варианте реализации R4 представляет собой С(O)O-алкил. В другом варианте реализации R4 представляет собой С(O)Н. В другом варианте реализации R4 представляет собой -C(O)NH2.
В одном из вариантов реализации q представляет собой целое число от 0 до 5. В другом варианте реализации q равен 0. В другом варианте реализации q равен 1. В другом варианте реализации q равен 2. В другом варианте реализации q равен 3. в другом варианте реализации q равен 4. В другом варианте реализации q равен 5. В одном из вариантов реализации m представляет собой целое число от 1 до 4. В другом варианте реализации m равен 1. В другом варианте реализации m равен 2. В другом варианте реализации m равен 3. В другом варианте реализации m равен 4.
В одном из вариантов реализации R5 в формуле VIII-X и XIII-XV представляет собой водород, О-алкил, О-галогеналкил, F, Cl, Br, I, NO2, галогеналкил, CF3, CN, -CH2CN, NH2, гидроксил, -(CH2)qNHCH3, -(CH2)qNH2, -(CH2)qN(CH3)2, -OC(O)CF3, -SO2-арил, С1-C5 линейный или разветвленный алкил, галогеналкил, алкиламино, аминоалкил, -OCH2Ph, -NHCO-алкил, СООН, -C(O)Ph, С(O)O-алкил, С(O)Н или -C(O)NH2. В другом варианте реализации R5 представляет собой водород. В другом варианте реализации R5 представляет собой О-алкил. В другом варианте реализации R5 представляет собой О-галогеналкил. В другом варианте реализации R5 представляет собой галоген. В другом варианте реализации R5 представляет собой NO2. В другом варианте реализации R5 представляет собой галогеналкил. В другом варианте реализации R5 представляет собой CF3. В другом варианте реализации R5 представляет собой CN. В другом варианте реализации R5 представляет собой -CH2CN. В другом варианте реализации R5 представляет собой NH2. В другом варианте реализации R5 представляет собой гидроксил. В другом варианте реализации R5 представляет собой -(CH2)tNHCH3. В другом варианте реализации R5 представляет собой -(CH2)tNH2. В другом варианте реализации R5 представляет собой -(CH2)tN(CH3)2. В другом варианте реализации R5 представляет собой -OC(O)CF3. В другом варианте реализации R5 представляет собой -SO2-арил. В другом варианте реализации R5 представляет собой С1-С5 линейный или разветвленный алкил. В другом варианте реализации R5 представляет собой галогеналкил. В другом варианте реализации R5 представляет собой алкиламино. В другом варианте реализации R5 представляет собой аминоалкил. В другом варианте реализации R5 представляет собой -OCH2Ph. В другом варианте реализации R5 представляет собой -NHCO-алкил. В другом варианте реализации R5 представляет собой СООН. В другом варианте реализации R5 представляет собой -C(O)Ph. В другом варианте реализации R5 представляет собой С(O)O-алкил. В другом варианте реализации R5 представляет собой С(O)Н. В другом варианте реализации R5 представляет собой -C(O)NH2.
В одном из вариантов реализации t представляет собой целое число от 0 до 5. В другом варианте реализации t равен 0. В другом варианте реализации t равен 1. В другом варианте реализации t равен 2. В другом варианте реализации t равен 3. В другом варианте реализации t равен 4. В другом варианте реализации t равен 5.
В одном из вариантов реализации R в формуле XI, XIII-XV представляет собой водород, С1-С5 линейный или разветвленный алкил; С1-С5 линейный или разветвленный алкенил, (CH2)lPh, арил, (CH2)lNHCH3, -(CH2)lNH2, -(CH2)lN(CH3)2, С(O)алкил, C(O)CF3, -(CH2)lOMe, -(CH2)lOH или галогеналкил. В другом варианте реализации R представляет собой водород. В другом варианте реализации R представляет собой С1-С5 линейный или разветвленный алкил. В другом варианте реализации R представляет собой С1-С5 линейный или разветвленный алкенил. В другом варианте реализации R представляет собой (CH2)lPhe. В другом варианте реализации R представляет собой арил. В другом варианте реализации R представляет собой (CH2)lNHCH3. В другом варианте реализации R представляет собой -(CH2)lNH2. В другом варианте реализации R представляет собой -(CH2)lN(CH3)2. В другом варианте реализации R представляет собой С(O)алкил. В другом варианте реализации R представляет собой C(O)CF3. В другом варианте реализации R представляет собой -(CH2)lOMe. В другом варианте реализации R представляет собой -(CH2)lOH. В другом варианте реализации R представляет собой галогеналкил.
В одном из вариантов реализации l представляет собой целое число от 0 до 5. в другом варианте реализации l равен 0. В другом варианте реализации l равен 1. В другом варианте реализации l равен 2. В другом варианте реализации l равен 3. В другом варианте реализации l равен 4. В другом варианте реализации l равен 5.
Согласно настоящему описанию термин «алкил» может представлять собой любую линейную или разветвленную алкильную группу, содержащую до 30 атомов углерода, если конкретно не указано иное. В другом варианте реализации алкил представляет собой С1-С5 алкил. В другом варианте реализации алкил представляет собой С2-С5 алкил. В другом варианте реализации алкил представляет собой С1-С7 алкил. Алкильная группа может представлять собой отдельный заместитель или может являться компонентом более крупного заместителя, такого как алкокси, галогеналкил, арилалкил, алкиламино, диалкиламино, алкил амид о, алкилмочевина и т.д. Предпочтительными алкильными группами являются метил, этил и пропил и, таким образом, галогенметил, дигалогенметил, тригалогенметил, галогенэтил, дигалогенэтил, тригалогенэтил, галогенпропил, дигалогенпропил, тригалогенпропил, метокси, этокси, пропокси, арилметил, арилэтил, арилпропил, метиламино, этиламино, пропиламино, диметиламино, диэтиламино, метиламидо, ацетамидо, пропиламидо, галогенметиламидо, галогенэтиламидо, галогенпропиламидо, метилмочевина, этилмочевина, пропилмочевина и т.д.
Согласно настоящему описанию термин «арил» относится к любому заместителю в виде ароматического кольца, который непосредственно связан с членом(-ами) кольца R1 или R2. Арильная группа может представлять собой отдельный заместитель, или арильная группа может являться компонентом более крупного заместителя, такого как арилалкил, ариламино, ариламидо и т.д. Типовые арильные группы включают без ограничений фенил, толуил, ксилил, фуранил, нафтил, пиридинил, пиримидинил, пиридазинил, пиразинил, триазинил, тиазолил, оксазолил, изоксазолил, пиразолил, имидазолил, тиофенил, пирролил, фенилметил, фенилэтил, фениламино, фениламидо и т.д.
Согласно настоящему описанию термин «аминоалкил» относится к аминогруппе, замещенной алкильной группой, такой как определено выше. Аминоалкил относится к моноалкиламину, диалкиламину или триалкиламину. Неограничивающими примерами аминоалкильных групп являются -N(Me)2, -NHMe, -NH3.
«Галогеналкильная» группа относится, в другом варианте реализации, к алкильной группе, такой как определено выше, замещенной одним или более атомами, галогенов, например, F, Cl, Br или I. Неограничивающими примерами галогеналкильных групп являются CF3, CF2CF3, CH2CF3.
В одном из вариантов реализации в изобретении предложено соединение согласно настоящему изобретению или его метаболит, фармацевтически приемлемая соль, фармацевтический продукт, гидрат, изомер, N-оксид, пролекарство, таутомер, полиморф или их комбинации. В одном из вариантов реализации в настоящем изобретении предложен метаболит соединения согласно настоящему изобретению. В другом варианте реализации в настоящем изобретении предложена фармацевтически приемлемая соль соединения согласно настоящему изобретению. В другом варианте реализации в настоящем изобретении предложен фармацевтический продукт соединения согласно настоящему изобретению. В другом варианте реализации в настоящем изобретении предложен гидрат соединения согласно настоящему изобретению. В другом варианте реализации в настоящем изобретении предложен изомер соединения согласно настоящему изобретению. В другом варианте реализации в настоящем изобретении предложен N-оксид соединения согласно настоящему изобретению. В другом варианте реализации в настоящем изобретении предложено пролекарство соединения согласно настоящему изобретению. В другом варианте реализации в настоящем изобретении предложен таутомер соединения согласно настоящему изобретению. В другом варианте реализации в настоящем изобретении предложен полиморф соединения согласно настоящему изобретению. В другом варианте реализации в настоящем изобретении предложена композиция, содержащая соединение согласно настоящему изобретению, такое как описано в настоящей заявке, или в другом варианте реализации комбинацию метаболита, фармацевтически приемлемой соли, фармацевтического продукта, гидрата, изомера, N-оксида, пролекарства или полиморфа соединения согласно настоящему изобретению.
Соединения согласно настоящему изобретению также могут существовать в форме гидрата, что означает, что соединение дополнительно включает стехиометрическое или нестехиометрическое количество воды, присоединенное посредством нековалентных межмолекулярных связей.
Соединения согласно настоящему изобретению могут существовать в виде одного или более возможных таутомеров, и в зависимости от конкретных условий можно разделять некоторые или все таутомеры на отдельные и различные молекулы. Следует понимать, что все возможные таутомеры, включая все дополнительные енольные и кето-таутомеры, и/или изомеры охвачены настоящим изобретением. Например, изобретение включает, но не ограничивается ими, следующие таутомеры.
Таутомеризация имидазольного кольца

Таутомеры индазольного кольца

Таутомеры бензимидазольного кольца

Таутомеры пиридиноимидазольного кольца
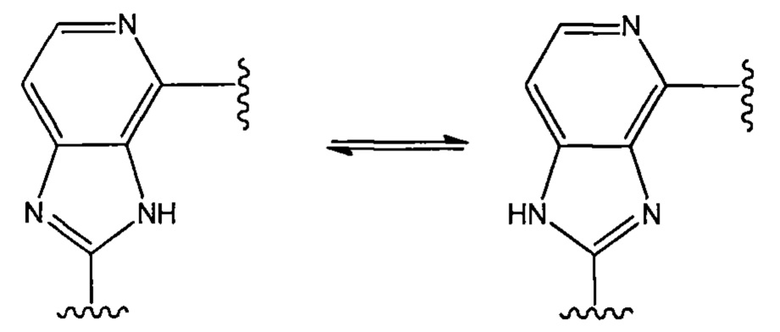
Таутомеры согласно настоящему изобретению представляют собой таутомеры, которые свободно превращаются друг в друга, но не являются неразделимыми смесями. Имидазолы, тиазол и другие системы колец согласно настоящему изобретению могут существовать в виде таутомеров. Все таутомеры рассматривают как часть изобретения.
Изобретение включает «фармацевтически приемлемые соли» соединений согласно настоящему изобретению, которые можно получать путем взаимодействия соединения согласно настоящему изобретению с кислотой или основанием. Определенные соединения, в частности содержащие кислые или основные группы, также могут иметь форму соли, предпочтительно фармацевтически приемлемой соли. Термин «фармацевтически приемлемая соль» относится к солям, которые сохраняют биологическую эффективность и свойства свободных оснований или свободных кислот, не являются нежелательными по биологическим или иным причинам. Соли получают с использованием неорганических кислот, таких как хлороводородная кислота, бромоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.д., органических кислот, таких как уксусная кислота, пропановая кислота, гликолевая кислота, виноградная кислота, щавелевая кислота, малеиновая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфокислота, этансульфокислота, n-толуолсульфокислота, салициловая кислота, N-ацетилцистеин и т.д. Специалистам в данной области техники известны другие соли, которые можно легко адаптировать для применения согласно настоящему изобретению.
Подходящие фармацевтически приемлемые соли аминов соединений согласно настоящему изобретению можно получать из неорганической кислоты или органической кислоты. В одном из вариантов реализации примерами неорганических солей аминов являются бисульфаты, бораты, бромиды, хлориды, гемисульфаты, гидроброматы, гидрохлораты, 2-гидроксиэтилсульфонаты (гидроксиэтансульфонаты), йодаты, йодиды, изотионаты, нитраты, персульфаты, фосфаты, сульфаты, сульфаматы, сульфанилаты, соли сульфокислот (алкилсульфонаты, арилсульфонаты, галогензамещенный алкилсульфонаты, галогензамещенный арилсульфонаты), сульфонаты и тиоцианаты.
В одном из вариантов реализации примеры органический солей аминов могут быть выбраны из классов алифатических, циклоалифатических, ароматических, аралифатических, гетероциклических, карбоновых и сульфо- органических кислот, примерами которых являются ацетаты, аргинины, аспартаты, аскорбаты, адипаты, антранилаты, альгенаты, алканкарбоксилаты, замещенные алканкарбоксилаты, альгинаты, бензолсульфонаты, бензоаты, бисульфаты, бутираты, бикарбонаты, битартраты, цитраты, камфораты, камфорсульфонаты, циклогексилсульфаматы, циклопентанпропионаты, эдетаты кальция, камсилаты, карбонаты, клавуланаты, циннаматы, дикарбоксилаты, диглюконаты, додецилсульфонаты, дигидрохлориды, деканоаты, энантуаты, этансульфонаты, эдетаты, эдисилаты, эстолаты, эсилаты, фумараты, формиаты, фториды, галактуронаты, глюконаты, глутаматы, гликоляты, глюкораты, глюкогептаноаты, глицерофосфаты, глюцептаты, гликолиларсанилаты, глутараты, глутаматы, гептаноаты, гексаноаты, гидроксималеаты, соли гидроксикарбоновых кислот, гексилрезорцинаты, гидроксибензоаты, гидроксинафтоаты, гидрофтораты, лактаты, лактобионаты, лаураты, малаты, малеаты, метиленбис(бета-оксинафтоаты), малонаты, манделаты, мезилаты, метансульфонаты, метилбромиды, метилнитраты, метилсульфонаты, малеаты монокалия, мукаты, монокарбоксилаты, нафталинсульфонаты, 2-нафталинсульфонаты, никотинаты, нитраты, напсилаты, N-метилглюкамины, оксалаты, октаноаты, олеаты, памоаты, фенилацетаты, пикраты, фенилбензоаты, пивалаты, пропионаты, фталаты, фенилацетат, пектинаты, фенилпропионаты, пальмитаты, пантотенаты, полигалактураты, пируваты, хинаты, салицилаты, сукцинаты, стеараты, сульфанилат, субацетаты, тартраты, теофиллинацетаты, n-толуолсульфонаты (тозилаты), трифторацетаты, терефталаты, таннаты, теоклаты, тригалогенацетаты, триэтиодид, трикарбоксилаты, ундеканоаты и валераты.
В одном из вариантов реализации примеры неорганических солей карбоновых кислот или гидроксилов могут быть выбраны из солей аммония, щелочных металлов, включая литий, натрий, калий, цезий; щелочноземельных металлов, включая кальций, магний, алюминий; цинка, бария, холинов, четвертичного аммония.
В другом варианте реализации примеры органических солей карбоновых кислоты или гидроксила могут быть выбраны из солей аргинина, органических аминов, включая алифатические органические амины, алициклические органические амины, ароматические органические амины, бензатины, трет-бутиламины, бенэтамины (N-бензилфенэтиламин), дициклогексиламины, диметиламины, диэтаноламины, этаноламины, этилендиамины, гидрабамины, имидазолы, лизины, метиламины, мегламины, N-метил-D-глюкамины, N,N'-дибензилэтилендиамины, никотинамиды, органические амины, орнитины, пиридины, пиколины, пиперазины, прокаин, трис(гидроксиметил)метиламины, триэтиламины, триэтаноламины, триметиламины, трометамины и мочевины.
В одном из вариантов реализации термин «изомер» включает, но не ограничивается ими, оптические изомеры и аналоги, структурные изомеры и аналоги, конформационные изомеры и аналоги и т.д.
В одном из вариантов реализации соединения согласно настоящему изобретению представляют собой чистые (E)-изомеры. В другом варианте реализации соединения согласно настоящему изобретению представляют собой чистые (Z)-изомеры. В другом варианте реализации соединения согласно настоящему изобретению представляют собой смесь (Е)- и (Z)-изомеров. В одном из вариантов реализации соединения согласно настоящему изобретению представляют собой чистые (R)-изомеры. В другом варианте реализации соединения согласно настоящему изобретению представляют собой чистые (S)-изомеры. В другом варианте реализации соединения согласно настоящему изобретению представляют собой смесь (R)- и (S)-изомеров.
Соединения согласно настоящему изобретению также могут присутствовать в виде рацемической смеси, содержащей по существу эквивалентные количества стереоизомеров. В другом варианте реализации соединения согласно настоящему изобретению можно получать или иным образом выделять при помощи известных способов, обеспечивающих образование одного стереоизомера, по существу не содержащего соответствующий другой стереоизомер (т.е. по существу чистого). Под по существу чистым понимают стереоизомер, который имеет чистоту по меньшей мере 95%, более предпочтительно по меньшей мере примерно 98%, наиболее предпочтительно по меньшей мере примерно 99%.
В одном из вариантов реализации соли можно получать при помощи традиционных способов, таких как взаимодействие продукта в виде свободного основания или свободной кислоты с одним или более эквивалентами соответствующей кислоты или основания в растворителе или среде, в которой соль нерастворима, или в растворителе, таком как вода, который удаляют в вакууме или путем лиофилизации, или путем обмена ионов существующей соли на другой ион или с применением подходящей ионообменной смолы.
В одном из вариантов реализации в изобретении предложено соединение согласно настоящему изобретению или его N-оксид.
Соединения согласно настоящему изобретению также можно вводить в виде метаболитов. В одном из вариантов реализации термин «метаболит» относится к любому веществу, получаемому из другого вещества путем метаболизма или метаболического процесса. В другом варианте реализации метаболиты согласно настоящему изобретению включают M1-M14, такие как описано в примере 6 и на фигурах 8-11.
Таким образом, определенные производные, которые как таковые имеют незначительную фармакологическую активность или не имеют ее вообще, при введении внутрь или на поверхность организма могут превращаться в соединения согласно настоящему изобретению, имеющие желательную активность, например, посредством гидролитического расщепления. Дополнительную информацию о применении пролекарств можно найти в Pro-drugs as Novel Delivery Systems, Vol. 14, ACS Symposium Series (Higuchi and Stella); и Bioreversible Carriers in Drug Design, Pergamon Press (ред. E В Roche, American Pharmaceutical Association) (1987), содержание каждой из которых включено в настоящую заявку во всей полноте посредством ссылок.
Пролекарства можно получать, например, путем замены соответствующих функциональных групп, содержащихся в соединениях согласно настоящему изобретению, на определенные фрагменты, известные специалистам в данной области техники как про-фрагменты. Примеры указанных пролекарств включают без ограничений пролекарства, где атом водорода в спиртовой функциональной группе (-ОН) заменен на C1-С6 алкил с образованием простого эфира; и (ii) атом водорода во вторичной аминогруппе заменен на C1-C10 алканоил с образованием амида.
Фармацевтическая композиция
Другой аспект настоящего изобретения относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и соединение согласно некоторым аспектам настоящего изобретения. Фармацевтическая композиция может содержать одно или более вышеуказанных соединений согласно настоящему изобретению. Как правило, фармацевтическая композиция согласно настоящему изобретению содержит соединение согласно настоящему изобретению или его фармацевтически приемлемую соль, а также фармацевтически приемлемый носитель. Термин «фармацевтически приемлемый носитель» относится к любым подходящим адъювантам, носителям, вспомогательным веществам или стабилизаторам и может иметь твердую или жидкую форму, такую как таблетки, капсулы, порошки, растворы, суспензии или эмульсии.
Обычно композиция содержит от примерно 0,01 до 99 процентов, предпочтительно от примерно 20 до 75 процентов активного(-ых) соединения(-ий) совместно с адъювантами, носителями и/или вспомогательными веществами. Несмотря на то, что потребности индивидуумов могут быть различными, определение оптимальных диапазонов эффективных количеств каждого компонента можно проводить в рамках знаний в данной области техники. Типовые дозировки содержат от примерно 0,01 до примерно 100 мг/кг массы тела. Предпочтительные дозировки содержат от примерно 0,1 до примерно 100 мг/кг массы тела. Наиболее предпочтительные дозировки содержат от примерно 1 до примерно 100 мг/кг массы тела. Специалисты в данной области техники также легко могут определить схему лечения с введением соединений согласно настоящему изобретению. То есть частоту введения и размер дозы можно устанавливать при помощи традиционного определения оптимальных характеристик, предпочтительно, добиваясь минимизации каких-либо побочных эффектов.
Твердые стандартные лекарственные формы могут быть традиционного типа. Твердая форма может представлять собой капсулу и т.д., такую как обычную капсулу желатинового типа, содержащую соединения согласно настоящему изобретению и носитель, например, смазывающие вещества и инертные наполнители, такие как лактоза, сахароза и кукурузный крахмал. В другом варианте реализации указанные соединения получают в виде таблеток с применением традиционной основы таблеток, такой как лактоза, сахароза или кукурузный крахмал, в комбинации со связывающими веществами, такими как аравийская камедь, кукурузный крахмал или желатин, разрыхлителями, такими как кукурузный крахмал, картофельный крахмал или альгиновая кислота, или смазывающим веществом, таким как стеариновая кислота или стеарат магния.
Таблетки, капсулы и т.д. также могут содержать связывающее вещество, такое как трагакантовая камедь, аравийская камедь, кукурузный крахмал или желатин; вспомогательные вещества, такие как фосфат дикальция; разрыхлитель, такой как кукурузный крахмал, картофельный крахмал, альгиновая кислота; смазывающее вещество, такое как стеарат магния; и подсластитель, такой как сахароза, лактоза или сахарин. Если стандартная лекарственная форма представляет собой капсулу, то она может содержать помимо материалов указанного выше типа жидкий носитель, такой как жирное масло.
Различные другие материалы можно вводить в качестве покрытий или для модификации физической формы лекарственной формы. Например, на таблетки можно наносить покрытия шеллака, сахара или обоих указанных материалов. Сироп может содержать помимо активного ингредиента сахарозу в качестве подсластителя, метил- и пропилпарабены в качестве консервантов, краситель и вкусоароматическую добавку, такую как вишневый или апельсиновый ароматизатор.
В случае перорального терапевтического введения указанные активные соединения можно вводить совместно со вспомогательными веществами и применять в форме таблеток, капсул, эликсиров, суспензий, сиропов и т.д. Указанные композиции и препараты могут содержать по меньшей мере 0,1% активного соединения. Процентное содержание соединения в указанных композициях, безусловно, может быть различным и традиционно составляет от примерно 2% до примерно 60% формы по массе. Количество активного соединения в указанных терапевтически подходящих композициях является таким, чтобы обеспечивать подходящую дозировку. Предпочтительные композиции согласно настоящему изобретению получают таким образом, чтобы пероральная лекарственная форма содержала от примерно 1 мг до 800 мг активного соединения.
Активные соединения согласно настоящему изобретению можно вводить перорально, например, совместно с инертным разбавителем или усваиваемым пищевым носителем, или они могут быть заключены в капсулы с твердой или мягкой оболочкой, или спрессованы в таблетки, или включены непосредственно в принимаемую пищу.
Фармацевтические формы, подходящие для применения в виде инъекции, включают стерильные водные растворы или дисперсии и стерильные порошки для немедленного получения стерильных инъецируемых растворов или дисперсий. Во всех случаях форма должна быть стерильной и обладать достаточной текучестью для простоты использования в шприце. Она должна быть стабильной в условиях получения и хранения и должна быть защищена от загрязняющего действия микроорганизмов, таких как бактерии и грибки. Носитель может представлять собой растворитель или диспергирующую среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль), их подходящие смеси и растительные масла.
Соединения или фармацевтические композиции согласно настоящему изобретению также можно вводить в виде инъецируемых дозировок раствора или суспензии указанных материалов в физиологически приемлемом разбавителе совместно с фармацевтическим адъювантом, носителем или вспомогательным веществом. Указанные адъюванты, носители и/или вспомогательные вещества включают, но не ограничиваются ими, стерильные жидкости, такие как вода и масла, с добавками поверхностно-активного вещества и других фармацевтически и физиологически приемлемых компонентов или без них. Иллюстративными маслами являются масла нефтяного, животного, растительного или синтетического происхождения, например, арахисовое масло, соевое масло или минеральное масло. В общем случае, предпочтительными жидкими носителями для инъецируемых растворов являются вода, солевой раствор, водная декстроза и раствор схожих Сахаров и гликоли, такие как пропиленгликоль или полиэтиленгликоль.
Указанные активные соединения также можно вводить парентерально. Растворы или суспензии указанных активных соединений можно получать в воде, смешанной с подходящим поверхностно-активным веществом, таким как гидроксипропилцеллюлоза. Также можно получать дисперсии в глицерине, жидких полиэтиленгликолях и их смесях в маслах. Иллюстративными маслами являются масла нефтяного, животного, растительного или синтетического происхождения, например, арахисовое масло, соевое масло или минеральное масло. В общем случае, предпочтительными жидкими носителями, особенно для инъецируемых растворов, являются вода, солевой раствор, водная декстроза и раствор схожих Сахаров и гликоли, такие как пропиленгликоль или полиэтиленгликоль. Указанные препараты в стандартных условиях хранения и применения содержат консервант для предотвращения роста микроорганизмов.
Для применения в аэрозолях соединения согласно настоящему изобретению в виде раствора или суспензии можно упаковывать в контейнеры, содержащие нагнетаемый аэрозоль совместно с подходящими вытеснителями, например, с углеводородными вытеснителями, такими как пропан, бутан или изобутан, и традиционными адъювантами. Материалы согласно настоящему изобретению также можно вводить в формах с атмосферным давлением, таких как небулайзер или распылитель.
В одном из вариантов реализации соединения согласно настоящему изобретению вводят в комбинации с противораковым агентом. В одном из вариантов реализации противораковый агент представляет собой моноклональное антитело. В некоторых вариантах реализации моноклональные антитела применяют для диагностики, мониторинга или лечения рака. В одном из вариантов реализации моноклональные антитела воздействуют на специфические антигены в раковых клетках. В одном из вариантов реализации моноклональное антитело действует как антагонист рецептора раковых клеток. В одном из вариантов реализации моноклональные антитела усиливают иммунный ответ пациента. В одном из вариантов реализации моноклональные антитела воздействуют на факторы клеточного роста и тем самым блокируют рост раковых клеток. В одном из вариантов реализации противораковые моноклональные антитела конъюгированы или связаны с противораковыми лекарственными средствами, радиоизотопами, другими модификаторами биологического ответа, другими токсинами или их комбинацией. В одном из вариантов реализации противораковые моноклональные антитела конъюгированы или связаны с соединением согласно настоящему изобретению, таким как описано выше в настоящей заявке.
Другой аспект настоящего изобретения относится к способу лечения рака, включающему выбор субъекта, нуждающегося в лечении рака, и введение субъекту фармацевтической композиции, содержащей соединение согласно первому аспекту настоящего изобретения и фармацевтически приемлемый носитель в условиях, которые являются эффективными для лечения рака.
Введение соединений согласно настоящему изобретению можно проводить системно или в качестве альтернативы непосредственно в специфический участок, где присутствуют раковые клетки или предраковые клетки. Таким образом, введение можно проводить при помощи любого способа, который является эффективным для доставки соединений или фармацевтических композиций к раковым клеткам или предраковым клеткам. Типовые способы введения включают без ограничений введение соединений или композиций при помощи перорального, местного, чрескожного, парентерального, подкожного, внутривенного, внутримышечного, интраперитонеального способов, путем интраназальной инсталляции, внутриполостной или внутрипузырной инсталляции, внутриглазного, внутриартериального, внутриочагового способов или нанесение на слизистые мембраны, такие как те, что находятся в носу, в горле и бронхиальных трубках.
Биологическая активность
Соединения согласно настоящему изобретению подходят для лечения или предотвращения различных форм рака, в частности рака простаты, рака груди, рака груди с лекарственной устойчивостью, рака яичников, рака кожи (например, меланомы), меланомы с лекарственной устойчивостью, рака легкого, рака толстой кишки, лейкоза, рака почки, рака ЦНС (например, глиомы, глиобластомы). Способы лечения указанных различных видов рака обоснованы в примерах, приведенных в настоящем описании. Кроме того, с учетом способа действия в качестве ингибиторов тубулина другие формы рака вероятно могут поддаваться лечению или предотвращению при введении соединений или композиций согласно настоящему изобретению пациенту. Предпочтительные соединения согласно настоящему изобретению селективно разрушают раковые клетки, вызывают истощение раковых клеток, но предпочтительно не нормальных клеток. Важно отметить, что вред для нормальных клеток минимизирован, так как раковые клетки восприимчивы к разрушению при применении значительно более низких концентраций соединений согласно настоящему изобретению.
Таким образом, дополнительный аспект настоящего изобретения относится к способу разрушения раковой клетки, включающему: обеспечение соединения согласно настоящему изобретению и последующее приведение в контакт раковой клетки с соединением в условиях, которые являются эффективными для разрушения вступившей в контакт раковой клетки. Согласно различным вариантам реализации разрушения раковых клеток разрушаемые клетки могут находиться in vivo или ex vivo (т.е. в культуре).
Дополнительный аспект настоящего изобретения относится к способу лечения или предотвращения ракового состояния, включающему: обеспечение соединения согласно настоящему изобретению и последующее введение эффективного количества соединения пациенту при помощи способа, который является эффективным для излечения или предотвращения ракового состояния.
Согласно одному из вариантов реализации пациент, подвергающийся лечению, характеризуется наличием предракового состояния, и введение соединения является эффективным для предотвращения развития предракового состояния до ракового состояния. Указанное предотвращение может происходить путем разрушения предраковой клетки перед ее дополнительным развитием до ракового состояния или одновременно с ним.
Согласно другому варианту реализации пациент, подвергающийся лечению, характеризуется наличием ракового состояния, и введение соединения является эффективным для регрессии ракового состояния или подавления развития ракового состояния, т.е. прекращения его развития или снижения скорости развития, что предпочтительно происходит при разрушении раковых клеток независимо от их расположения в организме пациента, то есть раковых клеток, которые расположены в первичном участке опухоли, или раковых клеток, которые образовали метастазы и создали вторичные опухоли в организме пациента.
Если соединения или фармацевтические композиции согласно настоящему изобретению вводят для лечения или предотвращения ракового состояния, то фармацевтическая композиция также может содержать другие терапевтические агенты, или ее можно применять совместно с другими схемами лечения, известными в настоящее время или теми, которые будут разработаны впоследствии, для лечения различных типов рака. Примеры других терапевтических агентов или схем лечения включают без ограничений лучевую терапию, иммунотерапию, химиотерапию, хирургическое вмешательство и их комбинации.
В одном из вариантов реализации в изобретении предложены соединения и композиции, включая любые варианты реализации, описанные в настоящей заявке, для применения в любом из способов согласно настоящему изобретению. В одном из вариантов реализации соединение согласно настоящему изобретению или содержащую его композицию можно применять для подавления, ослабления, усиления или стимуляции целевого ответа у субъекта, что должно быть понятно специалистам в данной области техники. В другом варианте реализации композиции могут содержать дополнительные активные ингредиенты, которые обладают подходящей активностью для конкретного применения, для которого вводят соединение согласно настоящему изобретению.
В одном из вариантов реализации настоящее изобретение относится к способу лечения, ослабления, снижения тяжести, снижения риска развития или подавления рака, включающему введение соединения согласно настоящему изобретению субъекту, страдающему от рака в условиях, которые являются эффективными для лечения рака.
Лекарственная устойчивость является основной причиной неудачного проведения химиотерапии против рака. Одним из основных факторов множественной лекарственной резистентности является повышенная экспрессия Р-гликопротеина (P-gp). Указанный белок представляет собой клинически важный транспортный белок, принадлежащий к семейству АТФ-связывающих кассетных транспортеров клеточной мембраны. Он может удалять субстраты, включая противораковые лекарственные средства, из клеток опухоли посредством АТФ-зависимого механизма.
В одном из вариантов реализации в настоящем изобретении предложены способы: а) лечения, ослабления, снижения тяжести, снижения риска или подавления рака; b) лечения, ослабления, снижения тяжести, снижения риска или подавления рака простаты; с) лечения, ослабления, снижения тяжести, снижения риска или подавления рака простаты с лекарственной устойчивостью; d) лечения, ослабления, снижения тяжести, снижения риска или подавления рака груди; е) лечения, ослабления, снижения тяжести, снижения риска или подавления рака груди с лекарственной устойчивостью; f) лечения, ослабления, снижения тяжести, снижения риска или подавления рака яичников; g) лечения, ослабления, снижения тяжести, снижения риска или подавления рака яичников с лекарственной устойчивостью; h) лечения, ослабления, снижения тяжести, снижения риска или подавления рака кожи; i) лечения, ослабления, снижения тяжести, снижения риска или подавления меланомы; j) лечения, ослабления, снижения тяжести, снижения риска или подавления метастатической меланомы; k) лечения, ослабления, снижения тяжести, снижения риска или подавления меланомы с лекарственной устойчивостью; l) лечения, ослабления, снижения тяжести, снижения риска или подавления рака легкого; m) лечения, ослабления, снижения тяжести, снижения риска или подавления рака толстой кишки; n) лечения, ослабления, снижения тяжести, снижения риска или подавления глиомы; о) лечения, ослабления, снижения тяжести, снижения риска или подавления лейкоза; р) лечения, ослабления, снижения тяжести, снижения риска или подавления лимфомы; q) лечения, ослабления, снижения тяжести, снижения риска или подавления рака почки; r) лечения, ослабления, снижения тяжести, снижения риска или подавления рака ЦНС; s) лечения, ослабления, снижения тяжести, снижения риска или подавления рака матки; t) лечения, ослабления, снижения тяжести, снижения риска или подавления рака матки с лекарственной устойчивостью; u) лечения опухоли или опухолей с лекарственной устойчивостью, где указанная опухоль выбрана из группы, состоящей из раковой опухоли простаты, раковой опухоли простаты с лекарственной устойчивостью, раковой опухоли груди, раковой опухоли груди с лекарственной устойчивостью, глиальной опухоли, раковой опухоли яичников, раковой опухоли яичников с лекарственной устойчивостью, раковой опухоли кожи, меланомной опухоли, меланомной опухоли с лекарственной устойчивостью, раковой опухоли легкого, раковой опухоли толстой кишки, лейкозной опухоли, лимфомной опухоли, раковой опухоли почки, раковой опухоли ЦНС, раковой опухоли матки, раковой опухоли матки с лекарственной устойчивостью и их комбинациями; включающие введение соединения согласно настоящему изобретению и/или метаболита, фармацевтически приемлемой соли, фармацевтического продукта, таутомера. гидрата, изомера, N-оксида, пролекарства, полиморфа указанного соединения или любой их комбинации. В другом варианте реализации субъекту ранее проводили лечение с применением химиотерапии, радиотерапии или биологической терапии.
Соединения согласно настоящему изобретению подходят для лечения, снижения тяжести, снижения риска или подавления рака, метастатического рака, опухолей с лекарственной устойчивостью, рака с лекарственной устойчивостью и различных форм рака. В предпочтительном варианте реализации рак представляет собой рак простаты, рак простаты с лекарственной устойчивостью, рак груди, рак груди с лекарственной устойчивостью, рак яичников, рак яичников с лекарственной устойчивостью, рак матки, рак матки с лекарственной устойчивостью, рак кожи (например, меланому), меланому с лекарственной устойчивостью, рак легкого, рак толстой кишки, лейкоз, лимфому, рак головы и шеи, поджелудочной железы, пищевода, рак почки или рак ЦНС (например, глиому, глиобластому). Способы лечения указанных различных видов рака обоснованы в примерах, приведенных в настоящем описании. Кроме того, с учетом способа действия в качестве ингибиторов тубулина другие формы рака вероятно могут поддаваться лечению или предотвращению при введении соединений или композиций согласно настоящему изобретению пациенту. Предпочтительные соединения согласно настоящему изобретению селективно разрушают раковые клетки, вызывают истощение раковых клеток, но предпочтительно не нормальных клеток. Важно отметить, что вред для нормальных клеток минимизирован, так как раковые клетки восприимчивы к разрушению при применении значительно более низких концентраций соединений согласно настоящему изобретению.
В некоторых вариантах реализации в настоящем изобретении предложено применение соединения, описанного в настоящей заявке, или его метаболита, фармацевтически приемлемой соли, фармацевтического продукта, таутомера, полиморфа, гидрата, изомера, N-оксида, пролекарства или любой их комбинации для лечения, ослабления, снижения тяжести, снижения риска или подавления рака у субъекта. В другом варианте реализации рак представляет собой карциному коры надпочечников, рак анального канала, рак мочевого пузыря, опухоль мозга, опухоль ствола головного мозга, рак груди, рак груди с лекарственной устойчивостью, глиому, астроцитому мозжечка, астроцитому мозга, эпендимому, медуллобластому, супратенториальные примитивные нейроэктодермальные опухоли шишковидной железы, глиому гипоталамуса, карциноидную опухоль, карциному, рак шейки матки, рак толстой кишки, рак центральной нервной системы (ЦНС), рак эндометрия, рак пищевода, рак внепеченочных желчных протоков, семейство опухолей Юинга (Pnet), внечерепную эмбрионально-клеточную опухоль, рак глаза, внутриглазную меланому, рак желчного пузыря, рак желудка, эмбрионально-клеточную опухоль, внегонадную гестационную трофобластическую опухоль, рак головы и шеи, гипофарингеальный рак, карциному островковых клеток, рак гортани, лейкоз, острый лимфобластный лейкоз, рак полости рта, рак печени, рак легкого, немелкоклеточный рак легкого, мелкоклеточную лимфому, лимфому, связанную со СПИД, (первичную) лимфому центральной нервной системы, кожную Т-клеточную лимфому, лимфому Ходжкина, неходжкинскую лимфому, злокачественную мезотелиому, меланому, меланому с лекарственной устойчивостью, карциному из клеток Меркеля, метастатическую плоскоклеточную карциному, множественную миелому, новообразования клеток плазмы, грибовидный микоз, миелодиспластический синдром, миелопролиферативные нарушения, рак носоглотки, нейробластому, рак ротоглотки, остеосаркому, рак яичников, рак эпителия яичников, эмбрионально-клеточную опухоль яичников, пограничную опухоль яичников, рак яичников с лекарственной устойчивостью, рак поджелудочной железы, экзокринный рак поджелудочной железы, карциному из островковых клеток, рак параназальных синусов и полости носа, рак паращитовидной железы, рак полового члена, феохромоцитому, рак гипофиза, новообразования клеток плазмы, рак простаты, рак простаты с лекарственной устойчивостью, рабдомиосаркому, рак прямой кишки, рак почки, почечно-клеточный рак, рак слюнных желез, синдром Сезари, рак кожи, кожную Т-клеточную лимфому, рак кожи, саркому Калоши, рак кожи, меланому, меланому с лекарственной устойчивостью, рак тонкого кишечника, саркому мягких тканей, рак яичек, злокачественную тимому, рак щитовидной железы, рак мочеиспускательного канала, рак матки, рак матки с лекарственной устойчивостью, саркому, редкие виды рака у детей, рак влагалища, рак наружных половых органов, опухоль Вильмса или любую их комбинацию. В другом варианте реализации субъекту ранее проводили лечение с применением химиотерапии, радиотерапии или биологической терапии.
В некоторых вариантах реализации в настоящем изобретении предложено применение соединения, описанного в настоящей заявке, или его метаболита, фармацевтически приемлемой соли, фармацевтического продукта, таутомера, полиморфа, гидрата, изомера, N-оксида, пролекарства или любой их комбинации для лечения, ослабления, снижения тяжести, снижения риска или подавления метастатического рака у субъекта. В другом варианте реализации рак представляет собой карциному коры надпочечников, рак анального канала, рак мочевого пузыря, опухоль мозга, опухоль ствола головного мозга, рак груди, рак груди с лекарственной устойчивостью, глиому, астроцитому мозжечка, астроцитому мозга, эпендимому, медуллобластому, супратенториальные примитивные нейроэктодермальные опухоли шишковидной железы, глиому гипоталамуса, карциноидную опухоль, карциному, рак шейки матки, рак толстой кишки, рак центральной нервной системы (ЦНС), рак эндометрия, рак пищевода, рак внепеченочных желчных протоков, семейство опухолей Юинга (Pnet), внечерепную эмбрионально-клеточную опухоль, рак глаза, внутриглазную меланому, рак желчного пузыря, рак желудка, эмбрионально-клеточную опухоль, внегонадную гестационную трофобластическую опухоль, рак головы и шеи, гипофарингеальный рак, карциному островковых клеток, рак гортани, лейкоз, острый лимфобластный лейкоз, рак полости рта, рак печени, рак легкого, немелкоклеточный рак легкого, мелкоклеточную лимфому, лимфому, связанную со СПИД, (первичную) лимфому центральной нервной системы, кожную Т-клеточную лимфому, лимфому Ходжкина, неходжкинскую лимфому, злокачественную мезотелиому, меланому, меланому с лекарственной устойчивостью, карциному из клеток Меркеля, метастатическую плоскоклеточную карциному, множественную миелому, новообразования клеток плазмы, грибовидный микоз, миелодиспластический синдром, миелопролиферативные нарушения, рак носоглотки, нейробластому, рак ротоглотки, остеосаркому, рак яичников, рак эпителия яичников, эмбрионально-клеточную опухоль яичников, пограничную опухоль яичников, рак яичников с лекарственной устойчивостью, рак поджелудочной железы, экзокринный рак поджелудочной железы, карциному из островковых клеток, рак параназальных синусов и полости носа, рак паращитовидной железы, рак полового члена, феохромоцитому, рак гипофиза, новообразования клеток плазмы, рак простаты, рак простаты с лекарственной устойчивостью, рабдомиосаркому, рак прямой кишки, рак почки, почечно-клеточный рак, рак слюнных желез, синдром Сезари, рак кожи, кожную Т-клеточную лимфому, рак кожи, саркому Калоши, рак кожи, меланому, меланому с лекарственной устойчивостью, рак тонкого кишечника, саркому мягких тканей, рак яичек, злокачественную тимому, рак щитовидной железы, рак мочеиспускательного канала, рак матки, рак матки с лекарственной устойчивостью, саркому, редкие виды рака у детей, рак влагалища, рак наружных половых органов, опухоль Вильмса или любую их комбинацию.
В некоторых вариантах реализации в настоящем изобретении предложено применение соединения, описанного в настоящей заявке, или его метаболита, фармацевтически приемлемой соли, фармацевтического продукта, таутомера, полиморфа, гидрата, изомера, N-оксида, пролекарства или любой их комбинации для лечения, ослабления, снижения тяжести, снижения риска или подавления рака с лекарственной устойчивостью или резистентного рака у субъекта. В другом варианте реализации рак представляет собой карциному коры надпочечников, рак анального канала, рак мочевого пузыря, опухоль мозга, опухоль ствола головного мозга, рак груди, рак груди с лекарственной устойчивостью, глиому, астроцитому мозжечка, астроцитому мозга, эпендимому, медуллобластому, супратенториальные примитивные нейроэктодермальные опухоли шишковидной железы, глиому гипоталамуса, карциноидную опухоль, карциному, рак шейки матки, рак толстой кишки, рак центральной нервной системы (ЦНС), рак эндометрия, рак пищевода, рак внепеченочных желчных протоков, семейство опухолей Юинга (Pnet), внечерепную эмбрионально-клеточную опухоль, рак глаза, внутриглазную меланому, рак желчного пузыря, рак желудка, эмбрионально-клеточную опухоль, внегонадную гестационную трофобластическую опухоль, рак головы и шеи, гипофарингеальный рак, карциному островковых клеток, рак гортани, лейкоз, острый лимфобластный лейкоз, рак полости рта, рак печени, рак легкого, немелкоклеточный рак легкого, мелкоклеточную лимфому, лимфому, связанную со СПИД, (первичную) лимфому центральной нервной системы, кожную Т-клеточную лимфому, лимфому Ходжкина, неходжкинскую лимфому, злокачественную мезотелиому, меланому, меланому с лекарственной устойчивостью, карциному из клеток Меркеля, метастатическую плоскоклеточную карциному, множественную миелому, новообразования клеток плазмы, грибовидный микоз, миелодиспластический синдром, миелопролиферативные нарушения, рак носоглотки, нейробластому, рак ротоглотки, остеосаркому, рак яичников, рак эпителия яичников, эмбрионально-клеточную опухоль яичников, пограничную опухоль яичников, рак поджелудочной железы, экзокринный рак поджелудочной железы, карциному из островковых клеток, рак параназальных синусов и полости носа, рак паращитовидной железы, рак полового члена, феохромоцитому, рак гипофиза, новообразования клеток плазмы, рак простаты, рабдомиосаркому, рак прямой кишки, рак почки, почечно-клеточный рак, рак слюнных желез, синдром Сезари, рак кожи, кожную Т-клеточную лимфому, рак кожи, саркому Калоши, рак кожи, меланому, меланому с лекарственной устойчивостью, рак тонкого кишечника, саркому мягких тканей, рак яичек, злокачественную тимому, рак щитовидной железы, рак мочеиспускательного канала, рак матки, саркому, редкие виды рака у детей, рак влагалища, рак наружных половых органов, опухоль Вильмса или любую их комбинацию.
В одном из вариантов реализации термин «метастатический рак» относится к раку, который распространился (метастазировал) из исходного участка в другую область организма. Теоретически все виды рака обладают потенциалом к распространению. Возможность развития метастазов зависит от сложного взаимодействия множества факторов, влияющих на раковые клетки, включая тип рака, степень зрелости (дифференцировку) опухолевых клеток, расположение и продолжительность существования рака, а также другие до конца не изученные факторы. Метастазы распространяются тремя способами - путем локального расширения опухоли в окружающие ткани, через кровоток к отдаленным участкам или через лимфатическую систему в соседние или удаленные лимфатические узлы. Каждый вид рака может иметь типичный способ распространения. Название опухоли определяют по первичному участку (например, рак груди, распространившийся в мозг, называют раком груди, метастазировавшим в мозг).
В одном из вариантов реализации термин «рак с лекарственной устойчивостью» относится к раковым клеткам, которые приобретают устойчивость к химиотерапии. Раковые клетки могут приобретать устойчивость к химиотерапии при помощи разнообразных механизмов, включая мутацию или повышенную экспрессию мишени лекарственного средства, инактивацию лекарственного средства или удаление лекарственного средства из клетки. Опухоли, повторно возникающие после первоначального ответа на химиотерапию, могут иметь устойчивость к нескольким лекарственным средствам (имеют множественную лекарственную устойчивость). В традиционном случае лекарственной устойчивости одна или нескольких клеток из опухолевой популяции приобретают генетические изменения, которые придают лекарственную устойчивость. Соответственно, причинами лекарственной резистентности являются помимо прочих: а) мутация (изменение) некоторых клеток, не уничтоженных в результате химиотерапии, приводящая к устойчивости к лекарственному средству. В результате количество резистентных клеток увеличивается и может начать превышать количество клеток, восприимчивых к химиотерапии; b) амплификация гена. Раковая клетка может вырабатывать сотни копий конкретного гена. Указанный ген запускает повышенную выработку белка, который делает неэффективным применение противоракового лекарственного средства; с) удаление лекарственного средства из раковых клеток сразу при поступлении в клетку под действием молекулы, называемой Р-гликопротеин; d) прекращение поступления лекарственного средства в раковые клетки из-за прекращения функционирования белка, обеспечивающего транспорт лекарственного средства через стенку клетки; е) распознавание раковыми клетками способа восстановления разрывов ДНК, вызываемых некоторыми противораковыми лекарственными средствами; f) развитие в раковых клетках механизма инактивации лекарственного средства. Одним из основных факторов множественной лекарственной устойчивости является повышенная экспрессия Р-гликопротеина (P-gp). Указанный белок представляет собой клинически важный транспортный белок, принадлежащий к семейству АТФ-связывающих кассетных транспортеров клеточной мембраны. Он может удалять субстраты, включая противораковые лекарственные средства, из клеток опухоли посредством АТФ-зависимого механизма. Таким образом, устойчивость к противораковым агентам, применяемым в химиотерапии, является основной причиной неэффективного лечения злокачественных нарушений, вызывающей увеличение устойчивости опухолей. Лекарственная устойчивость является основной причиной неэффективности химиотерапии рака.
В одном из вариантов реализации термин «резистентный рак» относится к раку с лекарственной устойчивостью, такому как описано выше в настоящей заявке. В другом варианте реализации «резистентный рак» относится к раковым клеткам, которые приобретают устойчивость к какому-либо способу лечения, такому как химиотерапия, радиотерапия или биологическая терапия.
В одном из вариантов реализации настоящее изобретение относится к способу лечения, ослабления, снижения тяжести, снижения риска или подавления рака у субъекта, где субъекту ранее проводили лечение при помощи химиотерапии, радиотерапии или биологической терапии.
В одном из вариантов реализации термин «химиотерапия» относится к химическому способу лечения рака, такому как применение лекарственных средств, которые непосредственно уничтожают раковые клетки. Указанные лекарственные средства называют «противораковыми» лекарственными средствами или «противоопухолевыми средствами». В настоящее время в терапии для лечения рака используют более 100 лекарственных средств. При лечении конкретного вида рака химиотерапию применяют для контролирования роста опухоли, если излечение невозможно; для уменьшения опухоли перед проведением хирургии или лучевой терапии; для ослабления симптомов (таких как боль); и для уничтожения микроскопических раковых клеток, которые могут сохраняться после удаления известной опухоли путем хирургии (так называемая адъювантная терапия). Адъювантную терапию проводят для предотвращения возможного повторного появления рака.
В одном из вариантов реализации термин «радиотерапия» относится к применению высокоэнергетических рентгеновских лучей и схожих лучей (таких как электроны) для лечения заболевания. Множеству людей, страдающих от рака, проводят радиотерапию как часть способа лечения. Радиотерапию можно проводить как внешнюю радиотерапию с применением рентгеновских лучей из источника, находящегося вне организма, или как внутреннюю радиотерапию, если источник лучей находится внутри организма. Действие радиотерапии основано на разрушении раковых клеток в области воздействия. Несмотря на то, что при радиотерапии также может происходить разрушение и нормальных клеток, они, как правило, могут восстанавливаться самостоятельно. Способ лечения путем радиотерапии может излечивать некоторые виды рака и также снижать шанс повторного возникновения рака после хирургии. Ее можно применять для снижения симптомов рака.
В одном из вариантов реализации термин «биологическая терапия» относится к применению веществ, которые обычно присутствуют в организме, для разрушения раковых клеток. Существует несколько типов лечения, включая: применение моноклональных антител, агентов, подавляющих рост раковых клеток, вакцин и генной терапии. Биологическую терапию также называют иммунотерапией.
В одном из вариантов реализации в настоящем изобретении предложен способ лечения субъекта, страдающего от рака простаты, метастатического рака простаты, резистентного рака простаты или рака простаты с лекарственной устойчивостью, включающий стадию введения указанному субъекту соединения согласно настоящему изобретению или его метаболита, фармацевтически приемлемой соли, фармацевтического продукта, таутомера, гидрата, изомера, N-оксида, пролекарства, полиморфа или любой их комбинации или содержащей его композиции в количестве, которое является эффективным для излечения рака простаты у субъекта. В одном из вариантов реализации соединение представляет собой соединение формулы I-XV. В другом варианте реализации соединение представляет собой соединение 4. В одном из вариантов реализации соединение представляет собой соединение 5. В другом варианте реализации соединение представляет собой соединение 6. В другом варианте реализации соединение представляет собой соединение 7. В другом варианте реализации соединение представляет собой соединение 14. В другом варианте реализации соединение представляет собой соединение 15. В другом варианте реализации соединение представляет собой соединение 18. В другом варианте реализации соединение представляет собой соединение 33.
В одном из вариантов реализации в настоящем изобретении предложен способ ослабления, снижения тяжести, снижения риска, отсрочки прогрессирования или подавления рака простаты, метастатического рака простаты, резистентного рака простаты или рака простаты с лекарственной устойчивостью у субъекта, включающий введение субъекту соединения согласно настоящему изобретению и/или его метаболита, фармацевтически приемлемой соли, фармацевтического продукта, таутомера, гидрата, изомера, N-оксида, пролекарства, полиморфа или любой их комбинации или содержащей его композиции. В одном из вариантов реализации соединение представляет собой соединение формулы I-XV. В другом варианте реализации соединение представляет собой соединение 4. В одном из вариантов реализации соединение представляет собой соединение 5. В другом варианте реализации соединение представляет собой соединение 6. В другом варианте реализации соединение представляет собой соединение 7. В другом варианте реализации соединение представляет собой соединение 14. В другом варианте реализации соединение представляет собой соединение 15. В другом варианте реализации соединение представляет собой соединение 18. В другом варианте реализации соединение представляет собой соединение 33.
В одном из вариантов реализации в настоящем изобретении предложен способ лечения субъекта, страдающего от рака груди, метастатического рака груди, резистентного рака груди или рака груди с лекарственной устойчивостью, включающий стадию введения указанному субъекту соединения согласно настоящему изобретению или его метаболита, фармацевтически приемлемой соли, фармацевтического продукта, таутомера, гидрата, изомера, N-оксида, пролекарства, полиморфа или любой их комбинации или содержащей его композиции. В другом варианте реализации субъект представляет собой мужчину или женщину. В одном из вариантов реализации соединение представляет собой соединение формулы I-XV. В другом варианте реализации соединение представляет собой соединение 4. В одном из вариантов реализации соединение представляет собой соединение 5. В другом варианте реализации соединение представляет собой соединение 6. В другом варианте реализации соединение представляет собой соединение 7. В другом варианте реализации соединение представляет собой соединение 14. В другом варианте реализации соединение представляет собой соединение 15. В другом варианте реализации соединение представляет собой соединение 18. В другом варианте реализации соединение представляет собой соединение 33.
В одном из вариантов реализации в настоящем изобретении предложен способ ослабления, снижения тяжести, снижения риска, отсрочки прогрессирования или подавления рака груди, метастатического рака груди, резистентного рака груди или рака груди с лекарственной устойчивостью у субъекта, включающий стадию введения указанному субъекту соединения согласно настоящему изобретению или его метаболита, фармацевтически приемлемой соли, фармацевтического продукта, таутомера, гидрата, изомера, N-оксида, пролекарства, полиморфа или любой их комбинации или содержащей его композиции. В одном из вариантов реализации соединение представляет собой соединение формулы I-XV. В другом варианте реализации соединение представляет собой соединение 4. В одном из вариантов реализации соединение представляет собой соединение 5. В другом варианте реализации соединение представляет собой соединение 6. В другом варианте реализации соединение представляет собой соединение 7. В другом варианте реализации соединение представляет собой соединение 14. В другом варианте реализации соединение представляет собой соединение 15. В другом варианте реализации соединение представляет собой соединение 18. В другом варианте реализации соединение представляет собой соединение 33.
В другом варианте реализации в настоящем изобретении предложено применение соединения, описанного в настоящей заявке, или его метаболита, фармацевтически приемлемой соли, фармацевтического продукта, таутомера, гидрата, изомера, N-оксида, пролекарства, полиморфа или любой их комбинации для лечения, ослабления, снижения тяжести, снижения риска, отсрочки прогрессирования или подавления рака яичников, метастатического рака яичников, резистентного рака яичников или рака яичников с лекарственной устойчивостью у субъекта. В одном из вариантов реализации соединение представляет собой соединение формулы I-XV. В другом варианте реализации соединение представляет собой соединение 4. В одном из вариантов реализации соединение представляет собой соединение 5. В другом варианте реализации соединение представляет собой соединение 6. В другом варианте реализации соединение представляет собой соединение 7. В другом варианте реализации соединение представляет собой соединение 14. В другом варианте реализации соединение представляет собой соединение 15. В другом варианте реализации соединение представляет собой соединение 18. В другом варианте реализации соединение представляет собой соединение 33.
В одном из вариантов реализации в настоящем изобретении предложен способ лечения, ослабления, снижения тяжести, снижения риска или подавления меланомы, метастатической меланомы, резистентной меланомы или меланомы с лекарственной устойчивостью у субъекта, включающий введение субъекту соединения согласно настоящему изобретению и/или его метаболита, фармацевтически приемлемой соли, фармацевтического продукта, таутомера, гидрата, изомера, N-оксида, пролекарства, полиморфа или любой их комбинации. В одном из вариантов реализации соединение представляет собой соединение формулы I-XV. В другом варианте реализации соединение представляет собой соединение 4. В одном из вариантов реализации соединение представляет собой соединение 5. В другом варианте реализации соединение представляет собой соединение 6. В другом варианте реализации соединение представляет собой соединение 7. В другом варианте реализации соединение представляет собой соединение 14. В другом варианте реализации соединение представляет собой соединение 15. В другом варианте реализации соединение представляет собой соединение 18. В другом варианте реализации соединение представляет собой соединение 33.
В другом варианте реализации в настоящем изобретении предложено применение соединения, описанного в настоящей заявке, или его метаболита, фармацевтически приемлемой соли, фармацевтического продукта, таутомера, гидрата, изомера, N-оксида, пролекарства, полиморфа или любой их комбинации для лечения, ослабления, снижения тяжести, снижения риска, отсрочки прогрессирования или подавления рака легкого, метастатического рака легкого, резистентного рака легкого или рака легкого с лекарственной устойчивостью. В одном из вариантов реализации соединение представляет собой соединение формулы I-XV. В другом варианте реализации соединение представляет собой соединение 4. В одном из вариантов реализации соединение представляет собой соединение 5. В другом варианте реализации соединение представляет собой соединение 6. В другом варианте реализации соединение представляет собой соединение 7. В другом варианте реализации соединение представляет собой соединение 14. В другом варианте реализации соединение представляет собой соединение 15. В другом варианте реализации соединение представляет собой соединение 18. В другом варианте реализации соединение представляет собой соединение 33.
В другом варианте реализации в настоящем изобретении предложено применение соединения, описанного в настоящей заявке, или его метаболита, фармацевтически приемлемой соли, фармацевтического продукта, таутомера, гидрата, изомера, N-оксида, пролекарства, полиморфа или любой их комбинации для лечения, ослабления, снижения тяжести, снижения риска, отсрочки прогрессирования или подавления немелкоклеточного рака легкого, метастатического мелкоклеточного рака легкого, резистентного мелкоклеточного рака легкого или мелкоклеточного рака легкого с лекарственной устойчивостью. В одном из вариантов реализации соединение представляет собой соединение формулы I-XV. В другом варианте реализации соединение представляет собой соединение 4. В одном из вариантов реализации соединение представляет собой соединение 5. В другом варианте реализации соединение представляет собой соединение 6. В другом варианте реализации соединение представляет собой соединение 7. В другом варианте реализации соединение представляет собой соединение 14. В другом варианте реализации соединение представляет собой соединение 15. В другом варианте реализации соединение представляет собой соединение 18. В другом варианте реализации соединение представляет собой соединение 33.
В другом варианте реализации в настоящем изобретении предложено применение соединения, описанного в настоящей заявке, или его метаболита, фармацевтически приемлемой соли, фармацевтического продукта, таутомера, гидрата, изомера, N-оксида, пролекарства, полиморфа или любой их комбинации для лечения, ослабления, снижения тяжести, снижения риска, отсрочки прогрессирования или подавления рака толстой кишки, метастатического рака толстой кишки, резистентного рака толстой кишки или рака толстой кишки с лекарственной устойчивостью. В одном из вариантов реализации соединение представляет собой соединение формулы I-XV. В другом варианте реализации соединение представляет собой соединение 4. В одном из вариантов реализации соединение представляет собой соединение 5. В другом варианте реализации соединение представляет собой соединение 6. В другом варианте реализации соединение представляет собой соединение 7. В другом варианте реализации соединение представляет собой соединение 14. В другом варианте реализации соединение представляет собой соединение 15. В другом варианте реализации соединение представляет собой соединение 18. В другом варианте реализации соединение представляет собой соединение 33.
В другом варианте реализации в настоящем изобретении предложено применение соединения, описанного в настоящей заявке, или его метаболита, фармацевтически приемлемой соли, фармацевтического продукта, таутомера, гидрата, изомера, N-оксида, пролекарства, полиморфа или любой их комбинации для лечения, ослабления, снижения тяжести, снижения риска, отсрочки прогрессирования или подавления лейкоза, метастатического лейкоза, резистентного лейкоза или лейкоза с лекарственной устойчивостью. В одном из вариантов реализации соединение представляет собой соединение формулы I-XV. В другом варианте реализации соединение представляет собой соединение 4. В одном из вариантов реализации соединение представляет собой соединение 5. В другом варианте реализации соединение представляет собой соединение 6. В другом варианте реализации соединение представляет собой соединение 7. В другом варианте реализации соединение представляет собой соединение 14. В другом варианте реализации соединение представляет собой соединение 15. В другом варианте реализации соединение представляет собой соединение 18. В другом варианте реализации соединение представляет собой соединение 33.
В другом варианте реализации в настоящем изобретении предложено применение соединения, описанного в настоящей заявке, или его метаболита, фармацевтически приемлемой соли, фармацевтического продукта, таутомера, гидрата, изомера, N-оксида, пролекарства, полиморфа или любой их комбинации для лечения, ослабления, снижения тяжести, снижения риска, отсрочки прогрессирования или подавления глиомы, метастатической глиомы, резистентной глиомы или глиомы с лекарственной устойчивостью. В одном из вариантов реализации соединение представляет собой соединение формулы I-XV. В другом варианте реализации соединение представляет собой соединение 4. В одном из вариантов реализации соединение представляет собой соединение 5. В другом варианте реализации соединение представляет собой соединение 6. В другом варианте реализации соединение представляет собой соединение 7. В другом варианте реализации соединение представляет собой соединение 14. В другом варианте реализации соединение представляет собой соединение 15. В другом варианте реализации соединение представляет собой соединение 18. В другом варианте реализации соединение представляет собой соединение 33.
В другом варианте реализации в настоящем изобретении предложено применение соединения, описанного в настоящей заявке, или его метаболита, фармацевтически приемлемой соли, фармацевтического продукта, таутомера, гидрата, изомера, N-оксида, пролекарства, полиморфа или любой их комбинации для лечения, ослабления, снижения тяжести, снижения риска, отсрочки прогрессирования или подавления лимфомы, метастатической лимфомы, резистентной лимфомы или лимфомы с лекарственной устойчивостью. В одном из вариантов реализации соединение представляет собой соединение формулы I-XV. В другом варианте реализации соединение представляет собой соединение 4. В одном из вариантов реализации соединение представляет собой соединение 5. В другом варианте реализации соединение представляет собой соединение 6. В другом варианте реализации соединение представляет собой соединение 7. В другом варианте реализации соединение представляет собой соединение 14. В другом варианте реализации соединение представляет собой соединение 15. В другом варианте реализации соединение представляет собой соединение 18. В другом варианте реализации соединение представляет собой соединение 33.
В другом варианте реализации в настоящем изобретении предложено применение соединения, описанного в настоящей заявке, или его метаболита, фармацевтически приемлемой соли, фармацевтического продукта, таутомера, гидрата, изомера, N-оксида, пролекарства, полиморфа или любой их комбинации для лечения, ослабления, снижения тяжести, снижения риска, отсрочки прогрессирования или подавления рака головы и шеи, метастатического рака головы и шеи, резистентного рака головы и шеи или рака головы и шеи с лекарственной устойчивостью. В одном из вариантов реализации соединение представляет собой соединение формулы I-XV. В другом варианте реализации соединение представляет собой соединение 4. В одном из вариантов реализации соединение представляет собой соединение 5. В другом варианте реализации соединение представляет собой соединение 6. В другом варианте реализации соединение представляет собой соединение 7. В другом варианте реализации соединение представляет собой соединение 14. В другом варианте реализации соединение представляет собой соединение 15. В другом варианте реализации соединение представляет собой соединение 18. В другом варианте реализации соединение представляет собой соединение 33.
В другом варианте реализации в настоящем изобретении предложено применение соединения, описанного в настоящей заявке, или его метаболита, фармацевтически приемлемой соли, фармацевтического продукта, таутомера, гидрата, изомера, N-оксида, пролекарства, полиморфа или любой их комбинации для лечения, ослабления, снижения тяжести, снижения риска, отсрочки прогрессирования или подавления рака поджелудочной железы, метастатического рака поджелудочной железы, резистентного рака поджелудочной железы или рака поджелудочной железы с лекарственной устойчивостью. В одном из вариантов реализации соединение представляет собой соединение формулы I-XV. В другом варианте реализации соединение представляет собой соединение 4. В одном из вариантов реализации соединение представляет собой соединение 5. В другом варианте реализации соединение представляет собой соединение 6. В другом варианте реализации соединение представляет собой соединение 7. В другом варианте реализации соединение представляет собой соединение 14. В другом варианте реализации соединение представляет собой соединение 15. В другом варианте реализации соединение представляет собой соединение 18. В другом варианте реализации соединение представляет собой соединение 33.
В другом варианте реализации в настоящем изобретении предложено применение соединения, описанного в настоящей заявке, или его метаболита, фармацевтически приемлемой соли, фармацевтического продукта, таутомера, гидрата, изомера, N-оксида, пролекарства, полиморфа или любой их комбинации для лечения, ослабления, снижения тяжести, снижения риска, отсрочки прогрессирования или подавления рака пищевода, метастатического рака пищевода, резистентного рака пищевода или рака пищевода с лекарственной устойчивостью. В одном из вариантов реализации соединение представляет собой соединение формулы I-XV. В другом варианте реализации соединение представляет собой соединение 4. В одном из вариантов реализации соединение представляет собой соединение 5. В другом варианте реализации соединение представляет собой соединение 6. В другом варианте реализации соединение представляет собой соединение 7. В другом варианте реализации соединение представляет собой соединение 14. В другом варианте реализации соединение представляет собой соединение 15. В другом варианте реализации соединение представляет собой соединение 18. В другом варианте реализации соединение представляет собой соединение 33.
В другом варианте реализации в настоящем изобретении предложено применение соединения, описанного в настоящей заявке, или его метаболита, фармацевтически приемлемой соли, фармацевтического продукта, таутомера, гидрата, изомера, N-оксида, пролекарства, полиморфа или любой их комбинации для лечения, ослабления, снижения тяжести, снижения риска, отсрочки прогрессирования или подавления рака почки, метастатического рака почки, резистентного рака почки или рака почки с лекарственной устойчивостью. В одном из вариантов реализации соединение представляет собой соединение формулы I-XV. В другом варианте реализации соединение представляет собой соединение 4. В одном из вариантов реализации соединение представляет собой соединение 5. В другом варианте реализации соединение представляет собой соединение 6. В другом варианте реализации соединение представляет собой соединение 7. В другом варианте реализации соединение представляет собой соединение 14. В другом варианте реализации соединение представляет собой соединение 15. В другом варианте реализации соединение представляет собой соединение 18. В другом варианте реализации соединение представляет собой соединение 33.
В другом варианте реализации в настоящем изобретении предложено применение соединения, описанного в настоящей заявке, или его метаболита, фармацевтически приемлемой соли, фармацевтического продукта, таутомера, гидрата, изомера, N-оксида, пролекарства, полиморфа или любой их комбинации для лечения, ослабления, снижения тяжести, снижения риска, отсрочки прогрессирования или подавления рака ЦНС, метастатического рака ЦНС, резистентного рака ЦНС или рака ЦНС с лекарственной устойчивостью. В одном из вариантов реализации соединение представляет собой соединение формулы I-XV. В другом варианте реализации соединение представляет собой соединение 4. В одном из вариантов реализации соединение представляет собой соединение 5. В другом варианте реализации соединение представляет собой соединение 6. В другом варианте реализации соединение представляет собой соединение 7. В другом варианте реализации соединение представляет собой соединение 14. В другом варианте реализации соединение представляет собой соединение 15. В другом варианте реализации соединение представляет собой соединение 18. В другом варианте реализации соединение представляет собой соединение 33.
В некоторых вариантах реализации в настоящем изобретении предложено применение соединения, описанного в настоящей заявке, или его метаболита, фармацевтически приемлемой соли, фармацевтического продукта, таутомера, полиморфа, гидрата, изомера, N-оксида, пролекарства или любой их комбинации для лечения, ослабления, снижения тяжести, снижения риска или подавления раковой(-ых) опухоли или опухолей с лекарственной устойчивостью у субъекта. В другом варианте реализации рак представляет собой карциному коры надпочечников, рак анального канала, рак мочевого пузыря, опухоль мозга, опухоль ствола головного мозга, рак груди, рак груди с лекарственной устойчивостью, глиому, астроцитому мозжечка, астроцитому мозга, эпендимому, медуллобластому, супратенториальные примитивные нейроэктодермальные опухоли шишковидной железы, глиому гипоталамуса, карциноидную опухоль, карциному, рак шейки матки, рак толстой кишки, рак центральной нервной системы (ЦНС), рак эндометрия, рак пищевода, рак внепеченочных желчных протоков, семейство опухолей Юинга (Pnet), внечерепную эмбрионально-клеточную опухоль, рак глаза, внутриглазную меланому, рак желчного пузыря, рак желудка, эмбрионально-клеточную опухоль, внегонадную гестационную трофобластическую опухоль, рак головы и шеи, гипофарингеальный рак, карциному островковых клеток, рак гортани, лейкоз, острый лимфобластный лейкоз, рак полости рта, рак печени, рак легкого, немелкоклеточный рак легкого, мелкоклеточную лимфому, лимфому, связанную со СПИД, (первичную) лимфому центральной нервной системы, кожную Т-клеточную лимфому, лимфому Ходжкина, неходжкинскую лимфому, злокачественную мезотелиому, меланому, меланому с лекарственной устойчивостью, карциному из клеток Меркеля, метастатическую плоскоклеточную карциному, множественную миелому, новообразования клеток плазмы, грибовидный микоз, миелодиспластический синдром, миелопролиферативные нарушения, рак носоглотки, нейробластому, рак ротоглотки, остеосаркому, рак яичников, рак эпителия яичников, эмбрионально-клеточную опухоль яичников, пограничную опухоль яичников, рак поджелудочной железы, экзокринный рак поджелудочной железы, карциному из островковых клеток, рак параназальных синусов и полости носа, рак паращитовидной железы, рак полового члена, феохромоцитому, рак гипофиза, новообразования клеток плазмы, рак простаты, рабдомиосаркому, рак прямой кишки, рак почки, почечно-клеточный рак, рак слюнных желез, синдром Сезари, рак кожи, кожную Т-клеточную лимфому, рак кожи, саркому Капоши, рак кожи, меланому, меланому с лекарственной устойчивостью, рак тонкого кишечника, саркому мягких тканей, рак яичек, злокачественную тимому, рак щитовидной железы, рак мочеиспускательного канала, рак матки, саркому, редкие раковые заболевания детей, рак влагалища, рак наружных половых органов, опухоль Вильмса или любую их комбинацию. В одном из вариантов реализации соединение представляет собой соединение формулы I-XV. В другом варианте реализации соединение представляет собой соединение 4. В одном из вариантов реализации соединение представляет собой соединение 5. В другом варианте реализации соединение представляет собой соединение 6. В другом варианте реализации соединение представляет собой соединение 7. В другом варианте реализации соединение представляет собой соединение 14. В другом варианте реализации соединение представляет собой соединение 15. В другом варианте реализации соединение представляет собой соединение 18. В другом варианте реализации соединение представляет собой соединение 33.
В другом варианте реализации опухоль представляет собой раковую опухоль простаты. В другом варианте реализации опухоль представляет собой раковую опухоль простаты с множественной лекарственной устойчивостью (МЛУ). В другом варианте реализации опухоль представляет собой раковую опухоль яичников. В другом варианте реализации опухоль представляет собой раковую опухоль яичников с множественной лекарственной устойчивостью (МЛУ). В другом варианте реализации опухоль представляет собой раковую опухоль матки. В другом варианте реализации опухоль представляет собой раковую опухоль матки с множественной лекарственной устойчивостью (МЛУ). В другом варианте реализации опухоль представляет собой меланомную опухоль. В другом варианте реализации опухоль представляет собой меланомную опухоль с лекарственной устойчивостью. В другом варианте реализации опухоль представляет собой меланомную опухоль с множественной лекарственной устойчивостью (МЛУ). В другом варианте реализации опухоль представляет собой раковую опухоль легкого. В другом варианте реализации опухоль представляет собой раковую опухоль толстой кишки. В другом варианте реализации опухоль представляет собой раковую опухоль груди. В другом варианте реализации опухоль представляет собой раковую опухоль груди с лекарственной устойчивостью. В другом варианте реализации опухоль представляет собой глиальную опухоль. В другом варианте реализации опухоль представляет собой лейкозную опухоль.
В одном из вариантов реализации настоящее изобретение относится к способу разрушения раковой клетки, включающему: обеспечение соединения согласно настоящему изобретению и приведение в контакт раковой клетки с соединением в условиях, которые являются эффективными для разрушения вступившей в контакт раковой клетки. Согласно различным вариантам реализации разрушения раковых клеток разрушаемые могут находиться in vivo или ex vivo (т.е. в культуре). В одном из вариантов реализации соединение представляет собой соединение формулы I-XV. В другом варианте реализации соединение представляет собой соединение 4. В одном из вариантов реализации соединение представляет собой соединение 5. В другом варианте реализации соединение представляет собой соединение 6. В другом варианте реализации соединение представляет собой соединение 7. В другом варианте реализации соединение представляет собой соединение 14. В другом варианте реализации соединение представляет собой соединение 15. В другом варианте реализации соединение представляет собой соединение 18. В другом варианте реализации соединение представляет собой соединение 33. В другом варианте реализации рак выбран из группы, состоящей из рака простаты, рака простаты с лекарственной устойчивостью, рака груди, рака груди с лекарственной устойчивостью, рака яичников, рака яичников с лекарственной устойчивостью, рака кожи, меланомы, меланомы с лекарственной устойчивостью, рака легкого, рака толстой кишки, лейкоза, глиомы, рака почки, рака ЦНС, рака матки, рака матки с лекарственной устойчивостью и их комбинаций.
В одном из вариантов реализации настоящее изобретение относится к способу подавления, предотвращения или замедления прогрессирования васкуляризации опухоли, включающему введение соединения согласно настоящему изобретению субъекту, больному раком, в условиях, которые являются эффективными для подавления, предотвращения или замедления прогрессирования васкуляризации указанной опухоли. В одном из вариантов реализации соединение представляет собой соединение формулы I-XV. В другом варианте реализации соединение представляет собой соединение 4. В одном из вариантов реализации соединение представляет собой соединение 5. В другом варианте реализации соединение представляет собой соединение 6. В другом варианте реализации соединение представляет собой соединение 7. В другом варианте реализации соединение представляет собой соединение 14. В другом варианте реализации соединение представляет собой соединение 15. В другом варианте реализации соединение представляет собой соединение 18. В другом варианте реализации соединение представляет собой соединение 33.
В одном из вариантов реализации настоящее изобретение относится к способу подавления, предотвращения или замедления прогрессирования васкуляризации метастатической опухоли, включающему введение соединения согласно настоящему изобретению субъекту, больному раком, в условиях, которые являются эффективными для подавления, предотвращения или замедления прогрессирования васкуляризации указанной опухоли. В одном из вариантов реализации соединение представляет собой соединение формулы I-XV. В другом варианте реализации соединение представляет собой соединение 4. В одном из вариантов реализации соединение представляет собой соединение 5. В другом варианте реализации соединение представляет собой соединение 6. В другом варианте реализации соединение представляет собой соединение 7. В другом варианте реализации соединение представляет собой соединение 14. В другом варианте реализации соединение представляет собой соединение 15. В другом варианте реализации соединение представляет собой соединение 18. В другом варианте реализации соединение представляет собой соединение 33.
В другом варианте реализации опухоль выбрана из группы, состоящей из раковой опухоли простаты, раковой опухоли простаты с лекарственной устойчивостью, раковой опухоли груди, раковой опухоли груди с лекарственной устойчивостью, глиальной опухоли, раковой опухоли яичников, раковой опухоли яичников с лекарственной устойчивостью, раковой опухоли кожи, меланомной опухоли, меланомной опухоли с лекарственной устойчивостью, раковой опухоли легкого, раковой опухоли толстой кишки, лимфомной опухоли, раковой опухоли почки, раковой опухоли ЦНС, раковой опухоли матки, раковой опухоли матки с лекарственной устойчивостью и их комбинаций.
Дополнительный аспект настоящего изобретения относится к способу лечения или предотвращения ракового состояния, включающему: обеспечение соединения согласно настоящему изобретению и последующее введение эффективного количества соединения пациенту при помощи способа, который является эффективным для лечения или предотвращения ракового состояния.
Согласно одному из вариантов реализации пациент, подвергающийся лечению, характеризуется наличием предракового состояния, и введение соединения является эффективным для предотвращения развития предракового состояния до ракового состояния. Указанное предотвращение может происходить путем разрушения предраковой клетки перед ее дополнительным развитием до ракового состояния или одновременно с ним.
Согласно другому варианту реализации пациент, подвергающийся лечению, характеризуется наличием ракового состояния, и введение соединения является эффективным для регрессии ракового состояния или подавления развития ракового состояния, т.е. прекращения его развития или снижения скорости развития, что предпочтительно происходит при разрушении раковых клеток независимо от их расположения в организме пациента, то есть раковых клеток, которые расположены в первичном участке опухоли, или раковых клеток, которые образовали метастазы и создали вторичные опухоли в организме пациента.
Согласно настоящему описанию субъект или пациент относится к любому пациенту-млекопитающему, включая без ограничений человека и других приматов, собак, кошек, лошадей, коров, овец, свиней, крыс, мышей и других грызунов. В одном из вариантов реализации субъект представляет собой человека. В одном из вариантов реализации субъект представляет собой мужчину. В другом варианте реализации субъект представляет собой женщину. В некоторых вариантах реализации способы, описанные в настоящей заявке, могут подходить для лечения мужчин или женщин.
Введение соединений согласно настоящему изобретению можно проводить системно или в качестве альтернативы непосредственно в специфический участок, где присутствуют раковые клетки или предраковые клетки. Таким образом, введение можно проводить при помощи любого способа, который является эффективным для доставки соединений или фармацевтических композиций к раковым клеткам или предраковым клеткам. Типовые способы введения включают без ограничений введение соединений или композиций при помощи перорального, местного, чрескожного, парентерального, подкожного, внутривенного, внутримышечного, интраперитонеального способов, путем интраназальной инсталляции, внутриполостной или внутрипузырной инсталляции, внутриглазного, внутриартериального, внутриочагового способов или нанесение на слизистые мембраны, такие как те, что находятся в носу, в горле и бронхиальных трубках.
Соединения согласно настоящему изобретению подходят для лечения или предотвращения различных форм рака, в частности рака простаты, рака простаты с лекарственной устойчивостью, рака груди, рака груди с лекарственной устойчивостью, рака яичников, рака яичников с лекарственной устойчивостью, рака кожи (например, меланомы), меланомы с лекарственной устойчивостью, рака легкого, рака толстой кишки, глиомы, лейкоза, лимфомы, рака почки, рака матки, рака матки с лекарственной устойчивостью и рака ЦНС (например, глиомы, глиобластомы). Кроме того, с учетом способа действия в качестве ингибиторов тубулина другие формы рака вероятно могут поддаваться лечению или предотвращению при введении соединений или композиций согласно настоящему изобретению пациенту. Предпочтительные соединения согласно настоящему изобретению селективно разрушают раковые клетки, вызывают истощение раковых клеток, но предпочтительно не нормальных клеток. Важно отметить, что вред для нормальных клеток минимизирован, так как раковые клетки восприимчивы к разрушению при применении значительно более низких концентраций соединений согласно настоящему изобретению.
Соединения согласно настоящему изобретению подходят для лечения, снижения тяжести, снижения риска или подавления рака, метастатического рака, резистентного рака или рака с лекарственной устойчивостью. В другом варианте реализации рак представляет собой рак простаты, рак груди, рак груди с лекарственной устойчивостью, рак яичников, рак кожи (например, меланому), меланому с лекарственной устойчивостью, рак легкого, рак толстой кишки, глиому, лейкоз, лимфомы, рак головы и шеи, поджелудочной железы, пищевода, рак почки, рак матки или рак ЦНС или их комбинации. Способы лечения указанных различных видов рака обоснованы в примерах, приведенных в настоящем описании. Кроме того, с учетом способа действия в качестве ингибиторов тубулина другие формы рака вероятно могут поддаваться лечению или предотвращению при введении соединений или композиций согласно настоящему изобретению пациенту. Предпочтительные соединения согласно настоящему изобретению селективно разрушают раковые клетки, вызывают истощение раковых клеток, но предпочтительно не нормальных клеток. Важно отметить, что вред для нормальных клеток минимизирован, так как раковые клетки восприимчивы к разрушению при применении значительно более низких концентраций соединений согласно настоящему изобретению. В одном из вариантов реализации соединение представляет собой соединение формулы I-XV. В другом варианте реализации соединение представляет собой соединение 4. В одном из вариантов реализации соединение представляет собой соединение 5. В другом варианте реализации соединение представляет собой соединение 6. В другом варианте реализации соединение представляет собой соединение 7. В другом варианте реализации соединение представляет собой соединение 14. В другом варианте реализации соединение представляет собой соединение 15. В другом варианте реализации соединение представляет собой соединение 18. В другом варианте реализации соединение представляет собой соединение 33.
В одном из вариантов реализации соединение вводят в комбинации с противораковым агентом посредством введения соединений, описанных в настоящей заявке, отдельно или в комбинации с другими агентами. В одном из вариантов реализации введение соединения проводят в комбинации с другой терапией рака (такой как радиотерапия, химиотерапия, биологическая терапия).
Если соединения или фармацевтические композиции согласно настоящему изобретению вводят для лечения, ослабления, снижения тяжести, снижения риска или подавления ракового состояния, то фармацевтическая композиция также может содержать другие терапевтические агенты, или ее можно применять совместно с другими схемами лечения, известными в настоящее время или теми, которые будут разработаны впоследствии, для лечения различных типов рака. Примеры других терапевтических агентов или схем лечения включают без ограничений лучевую терапию, иммунотерапию, химиотерапию, хирургическое вмешательство и их комбинации.
Последующие примеры приведены для более полной иллюстрации вариантов реализации изобретения. Тем не менее, их не следует рассматривать как ограничивающие каким-либо образом широкий объем изобретения.
Примеры
Пример 1
Синтез соединений формулы I (фигура 2)
Материалы. Все реагенты приобретали в Sigma-Aldrich Chemical Co., Fisher Scientific (Pittsburgh, PA, США), AK Scientific (Mountain View, CA, США), Oakwood Products (West Columbia, SC, США) и т.д. и использовали без дополнительной очистки. Взаимодействия, чувствительные к влаге, проводили в атмосфере аргона. Типовую тонкослойную хроматографию (ТСХ) проводили на пластинах Uniplates с алюминиевой подложкой (Analtech, Newark, DE, США). Температуру плавления измеряли при помощи устройства измерения температуры плавления Fisher-Johns (без коррекции). Спектры ЯМР получали на спектрометре Bruker АХ 300 (Billerica, MA, США) или спектрометре Varian Inova-500. Химические сдвиги выражены в частях на миллион (ppm) относительно TMS в CDCl3. Данные масс-спектрометрии получали на устройстве Bruker ESQUIRE с электронным распылением/ионной ловушкой в режиме детектирования положительных и отрицательных ионов. Элементный анализ проводили в Atlantic Microlab Inc., (Norcross, GA, США). Если конкретно не указано иное, все исследуемые соединения имели чистоту >95%, что было установлено при помощи анализа путем сжигания.
Общий способ получения соединений 3-7 (фигура 2): Различные альдегиды, 3-бромбензол-1,2-диамин (3 ммоль), n-толуолсульфокислоту (0,3 ммоль) и 15 мл EtOH кипятили с обратным холодильником в течение 24 часов в атмосфере аргона. Удаляли растворитель, добавляли 25 мл воды и экстрагировали смесь EtOAc (3×50 мл). Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии с получением целевого 4-бром-2-заместитель-1H-бензо[d]имидазола.
Соответствующие бромиды, полученные на предыдущей стадии, (1 экв.), 3,4,5-триметоксифенилбороновую кислоту (1 экв.), раствор карбоната натрия (2 экв.) в смеси ТГФ (3 мл)/вода (0,3 мл) и тетракис(трифенилфосфин)палладий (0,1 экв.) кипятили с обратным холодильником в течение ночи. После добавления воды реакционную смесь экстрагировали этилацетатом. Органический слой сушили над MgSO4, фильтровали и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии с получением целевых бензимидазольных соединений с конденсированным «D»-кольцом или имидазо[4,5-с]пиридинового соединения 7 (фигура 2).
2-фенил-4-(3,4,5-триметоксифенил)-1H-бензо[d]имидазол (3). 1Н ЯМР (CDCl3): 3,78, 3,93 (s, s, 6Н), 3,91, 3,98 (s, s, 3Н), 6,10, 6,82 (s, s, 2Н), 7,29-8,08 (m, 8Н), 9,70, 9,84 (s, шир., 1Н). МС (ИЭР) m/z 359,1 [М-H]-, 361,4 [М+Н]+. Анализ (C22H20N2O3) С, Н, N.
2-(1H-индол-3-ил)-4-(3,4,5-триметоксифенил)-1Н-бензо[d]имидазол (4). 1Н ЯМР (ДМСО-d6): 3,76, 3,97 (s, s, 3Н), 3,90, 3,97 (s, s, 6Н), 6,96-7,62 (m, Н), 7,62, 7,72 (s, s, 2H), 8,16, 8,42 (s, шир., 1H), 8,58, 8,66 (d, d, 1H), 11,57, 11,64 (s, s, 1H), 12,16, 12,60 (s, s, 1H). МС (ИЭР) m/z 398,1 [M-H]-, 400,3 [M+H]+. Анализ (C24H21N3O3) С, H, N.
2-(1H-индол-5-ил)-4-(3,4,5-триметоксифенил)-1H-бензо[d]имидазол (5). 1Н ЯМР (ДМСО-d6): 3,73, 3,87 (s, s, 6Н), 3,75, 3,92 (s, s, 3Н), 5,70, 5,75 (s, s, 2H), 6,32, 6,49 (s, s, 1H), 6,54, 6,85 (d, d, 1H), 7,22-7,65 (m, 4H), 8,01, 8,42 (шир., s, 2H), 11,09, 11,37 (s, s, 1H), 12,36, 12,84 (s, s, 1H). МС (ИЭР) m/z 398,1 [M-H]-, 400,1 [M+H]+. Анализ (C24H21N3O3) С, H, N.
3-(4-(3,4,5-триметоксифенил)-1H-бензо[d]имидазол-2-ил)-1H-индазол (6). 1Н ЯМР (ДМСО-d6): 3,76 (s, 3Н), 3,95 (s, 6Н), 6,65 (s, 1H), 6,93 (t, 1H), 7,34-7,34 (m, 2Н), 7,45-7,57 (m, 4Н), 7,63 (s, 2Н), 7,70 (d, 1Н), 8,75 (d, 1Н), 12,96 (s, 1H), 13,77 (s, 1H). МС (ИЭР) m/z 399,1 [М-Н]-, 401,3 [М+Н]+. Анализ (C23H20N4O3) С, Н, N.
2-(1H-индол-5-ил)-4-(3,4,5-триметоксифенил)-1H-имидазо[4,5-с]пиридин (7). 1Н ЯМР (ДМСО-d6): 3,77 (s, 3Н), 3,96 (s, 6Н), 6,61 (s, 1Н), 7,46-7,48 (m, 2Н), 7,59 (d, 1Н), 8,08 (dd, 1Н), 8,36 (d, 1Н), 8,41 (s, 2Н), 8,49 (s, 1H), 11,44 (s, 1H), 13,26 (s, 1Н). МС (ИЭР) m/z 399,0 [М-Н]-, 401,3 [М+Н]+. Анализ (C23H20N4O3) С, Н, N.
Пример 2
Синтез соединений формулы XI (фигура 3)
(4-гидрокси-3,5-диметоксифенил)(2-фенилтиазол-4-ил)метанон (11).
Промежуточные соединения 8-10 получали из бензонитрила и цистеина согласно способу, описанному в Lu, Y.; Li, С.М.; Wang, Z.; Ross, С.R., 2nd; Chen, J.; Dalton, J.Т.; Li, W.; Miller, D.D. Discovery of 4-substituted methoxybenzoyl-aryl-thiazole as novel anticancer agents: synthesis, biological evaluation, and structure-activity relationships. J Med Chem 2009, 52(6), 1701-11. Соединение 10 [матричное соединение «SMART» (4-замещенный метоксибензоил-арил-тиазол)] (500 мг, 1,4 ммоль) растворяли в CH2Cl2 (50 мл) при КТ в защитной атмосфере аргона. Добавляли безводный AlCl3 (374 мг, 2,8 ммоль) и перемешивали реакционную смесь в течение 12 часов. Реакцию гасили Н2О (30 мл), отделяли органическую фазу и экстрагировали водную фазу CH2Cl2 (2×20 мл). Объединенные органические фазы промывали солевым раствором, сушили над MgSO4, фильтровали и концентрировали досуха при пониженном давлении. После очистки путем колоночной флэш-хроматографии с использованием системы гексаны-EtOAc получали соединение 11 (410 мг, выход 85,9%). 1H ЯМР (CDCl3): 4,00 (s, 6Н), 6,02 (s, 1H), 7,47-7,48 (m, 3Н), 7,91 (s, 2Н), 8,01-8,03 (m, 2Н), 8,27 (s, 1Н). МС (ИЭР) m/z 339,9 [М-Н]-, 364,1 [M+Na]+. Анализ (C18H15NO4S) С, Н, N.
2,6-диметокси-4-(2-фенилтиазол-4-карбонил)фенил-2-хлорацетат (12). При 0°С в раствор 11 (100 мг, 0,29 ммоль) в CH2Cl2; (30 мл) добавляли 2-хлорацетилхлорид (100 мг, 0,9 ммоль). Затем в смесь добавляли триэтиламин (44 мг, 0,44 ммоль) и перемешивали до исчезновения исходного вещества в анализе ТСХ. Реакцию гасили Н2О (10 мл), отделяли органическую фазу и экстрагировали водную фазу CH2Cl2 (2×10 мл). Объединенные органические фазы промывали солевым раствором, сушили над MgSO4, фильтровали и концентрировали досуха при пониженном давлении. После очистки путем колоночной флэш-хроматографии с использованием системы гексаны-EtOAc получали соединение 12 (99 мг, выход 81,7%). Тпл 147-148°С. 1Н ЯМР (CDCl3): 3,92 (s, 6Н), 4,42 (s, 2Н), 7,47-7,49 (m, 3Н), 7,82 (s, 2Н), 8,00-8,02 (m, 2Н), 8,32 (s, 1Н). МС (ИЭР) m/z 418,1 [М-Н]-. Анализ (C20H16ClNO5S) С, Н, N.
2,6-диметокси-4-(2-фенилтиазол-4-карбонил)фенил-2,2,2-трифторацетат (13). При 0°С в раствор 11 (100 мг, 0,29 ммоль) в CH2Cl2 (10 мл) добавляли ангидрид трифторуксусной кислоты (189 мг, 0,9 ммоль). Затем в смесь добавляли DMAP (54 мг, 0,44 ммоль) и перемешивали при КТ до исчезновения исходного вещества в анализе ТСХ. Реакцию гасили H2O (10 мл), отделяли органическую фазу и экстрагировали водную фазу CH2Cl2 (2×10 мл). Объединенные органические фазы промывали солевым раствором, сушили над MgSO4, фильтровали и концентрировали досуха при пониженном давлении. После очистки путем колоночной флэш-хроматографии с использованием системы гексаны-EtOAc получали соединение 13 (89 мг, выход 70,2%). Тпл 151-153°С. 1Н ЯМР (CDCl3): 3,94 (s, 6Н), 7,48-7,49 (m, 3Н), 7,84 (s, 2Н), 8,00-8,02 (m, 2Н), 8,34 (s, 1Н). МС (ИЭР) m/z 438,1 [М+Н]+. Анализ (C20H164F3NO5S) С, Н, N.
(4-(бензилокси)-3,5-диметоксифенил)(2-фенилтиазол-4-ил)метанон (14). В атмосфере аргона в раствор 11 (60 мг, 0,176 ммоль) в 10 мл сухого ДМФ добавляли карбонат калия (49 мг, 0,352 ммоль) и бензилбромид (33 мг, 0,194 ммоль). Смесь перемешивали в течение 1 часа при 100°С, затем переносили в воду (10 мл). Соединение 14 экстрагировали EtOAc, промывали дистиллированной водой, сушили над сульфатом магния и концентрировали в вакууме на роторном испарителе. Неочищенный маслянистый продукт очищали путем колоночной флэш-хроматографии и получали белое твердое вещество 14 (51 мг). Выход = 62,7%. Тпл 119-120°С. 1Н ЯМР (CDCl3): 3,92 (s, 6Н), 5,15 (s, 2Н), 7,29-7,37 (m, 3Н), 7,48-7,51 (m, 5Н), 7,79 (s, 2Н), 8,01-8,02 (m, 2Н), 8,28 (s, 1H). МС (ИЭР) m/z 432,1 [М+Н]+. Анализ (C25H21NO4S) С, Н, N.
(3,5-диметокси-4-(метоксиметокси)фенил)(2-фенилтиазол-4-ил)метанон (15). При 0°С в раствор 11 (75 мг, 0,22 ммоль) в CH2Cl2 (10 мл) добавляли MOMCl (27 мг, 0,33 ммоль). Затем в смесь добавляли основание Хюнига (57 мг, 0,44 ммоль) и перемешивали при КТ до исчезновения исходного вещества в анализе ТСХ. Реакцию гасили Н2О (10 мл), отделяли органическую фазу и экстрагировали водную фазу CH2Cl2 (2×10 мл). Объединенные органические фазы промывали солевым раствором, сушили над MgSO4, фильтровали и концентрировали досуха при пониженном давлении. После очистки путем колоночной флэш-хроматографии с использованием системы гексаны-EtOAc получали соединение 15 (83 мг, выход 98,0%) в виде желтых кристаллов. Тпл 103-104°С. 1H ЯМР (CDCl3): 3,62 (s, 3Н), 3,95 (s, 6Н), 5,26 (s, 2Н), 7,47-7,49 (m, 3Н), 7,80 (s, 2Н), 8,01-8,03 (m, 2Н), 8,28 (s, 1Н). МС (ИЭР) m/z 408,1 [M+Na]+. Анализ (C20H19NO5S) С, Н, N.
2-(2-(2,6-диметокси-4-(2-фенилтиазол-4-карбонил)фенокси)этил)-изоиндолин-1,3-дион (17). В раствор 11 (200 мг, 0,59 ммоль) и 2-(2-бромэтил)изоиндолин-1,3-диона (223 мг, 0,88 ммоль) в ДМФ (2,5 мл) добавляли K2CO3 (97 мг, 0,7 ммоль) и перемешивали реакционную смесь при 120°С в течение ночи. Затем реакцию гасили водой и экстрагировали смесь этилацетатом. Концентрировали органический слой и дополнительно очищали путем колоночной хроматографии с получением 132 мг чистого целевого продукта 17. Выход = 43,5%. Тпл 148-150°С. 1Н ЯМР (CDCl3) δ 3,71 (s, 6Н), 4,14 (t, 2Н, J=5,5 Гц), 4,41 (t, 2Н, J=5,5 Гц), 7,49-7,51 (m, 3Н), 7,70 (s, 2Н), 7,75 (q, 2Н, J=3,0 Гц), 7,91 (q, 2Н, J=3,0 Гц), 8,01-8,03 (m, 2Н), 8,27 (s, 1H). МС (ИЭР) m/z 537,1 [M+Na]+. Анализ (C28H22N2O6S) С, Н, N.
(4-(2-аминоэтил)-3,5-диметоксифенил)(2-фенилтиазол-4-ил)метанон (18). В раствор 11 (23 мг, 0,07 ммоль) и «трет-бутил-(2-бромэтил)карбамата (23 мг, 0,1 ммоль) в ДМФ (2,5 мл) добавляли Cs2CO3 (46 мг, 0,2 ммоль) и перемешивали реакционную смесь в течение 3 дней при КТ до тех пор, пока анализ ТСХ не указывал на завершение взаимодействия. Затем реакцию гасили ледяной водой и экстрагировали смесь этилацетатом. Концентрировали органический слой и дополнительно очищали путем колоночной хроматографии с получением 22 мг чистого целевого продукта трет-бутил-(2-(2,6-диметокси-4-(2-фенилтиазол-4-карбонил)фенокси)этил)карбамата 16. Выход = 65,1%. МС (ИЭР) m/z 483,9 [М-Н]-, 485,1 [М+Н]+. Вос-защищенное соединение 16 добавляли в раствор HCl в диоксане (4М) и перемешивали в течение ночи. Собирали осадок и промывали диэтиловым эфиром с получением соли HCl соединения 18. 1Н ЯМР (ацетон-d6): 3,09-3,13 (q, 2Н, J=5,5 Гц), 3,79 (шир., 2Н), 3,90 (s, 6Н), 4,17 (t, 2Н, J=5,5 Гц), 7,55-7,58 (m, 3Н), 7,66 (s, 2Н), 8,02-8,04 (m, 2Н), 8,68 (s, 1H). МС (ИЭР) m/z 385,1 [М+Н]+. Анализ (C20H20N2O3S) С, Н, N.
Пример 3
Синтез фенил-амино-тиазольных/имидазольных соединений (фигура 4)
N-фенил-1H-имидазол-2-амин (21). При 0°С в раствор диэтилацеталя аминоацетальдегида (2,66 г, 20 ммоль) в смеси диэтиловый эфир/гексан (20 мл, 1:1) небольшими порциями добавляли BrCN (2,11 г, 20 ммоль). Реакционную смесь перемешивали при КТ в течение ночи. Удаляли твердое вещество путем фильтрования и промывали диэтиловым эфиром. Концентрировали объединенный фильтрат. Очистка путем колоночной флэш-хроматографии (силикагель, элюировали с градиентом дихлорметаном, затем 5% метанолом в дихлорметане) приводила к получению N-(2,2-диэтоксиэтил)карбодиимида 19. 1Н ЯМР, 500 МГц (CDCl3): 1,23 (t, 6Н, J=7,0 Гц), 3,16 (t, 2Н, J=6,0 Гц), 3,56 (dt, 2Н), 3,64 (шир., s, 1H), 3,73 (dt, 2Н), 4,58 (t, J=5,0 Гц, 1Н). МС (ИЭР) m/z 156,8 [М-Н]-, 180,9 [M+Na]+. Анилин (1,66 г, 17,8 ммоль) растворяли в этаноле (50 мл) и по каплям добавляли раствор 19 (2,82 г, 17,8 ммоль) в 5 мл диэтилового эфира. Затем добавляли метансульфокислоту (1,71 г, 17,8 ммоль) и смесь кипятили с обратным холодильником в течение 24 часов. Реакционную смесь выливали в NaOH (0,5М) и экстрагировали CH2Cl2. Сушка MgSO4 и концентрирование в вакууме приводили к получению продукта, который подвергали очистке путем флэш-хроматографии с получением промежуточного гуанидина 20 (3,3 г, 73,8%). Гуанидин (3 г, 12 ммоль) растворяли в HCl (5 мл, 6М) при 0°С, а затем перемешивали в течение 2 часов. После израсходования исходного вещества добавляли NaOH (25%) до образования осадка (рН 14). Полученную смесь перемешивали в течение 30 минут. Затем реакционную смесь выливали в NaOH (0,5М), экстрагировали CH2Cl2, сушили и концентрировали. Очистка путем флэш-хроматографии приводила к получению 21 (1,16 г, 61%). 1Н ЯМР (ДМСО-d6): 6,68 (s, 2Н), 6,75 (m, 1H), 7,17 (m, 2Н), 7,34 (m, 2Н), 8,58 (s, 1H). МС (ИЭР) m/z 157,6 [М-Н]-, 160,0 [М+Н]+.
3,4,5-триметокси-N-фенил-N-(1-(фенилсульфонил)-1H-имидазол-2-ил)бензамид (22). В раствор N-фенил-1H-имидазол-2-амина 21 (40 мг, 0,25 ммоль) в CH2Cl2 (10 мл) добавляли бензолсульфонилхлорид (441 мг, 2,5 ммоль) и триэтиламин (252 мг, 2,5 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакцию гасили нас. NH4Cl и экстрагировали смесь CH2Cl2. Сушка MgSO4 и концентрирование в вакууме приводили к получению продукта, который подвергали очистке путем флэш-хроматографии с получением бензолсульфонил-защищенного промежуточного соединения (79 мг, 72%). Полученное промежуточное соединение растворяли в ТГФ и охлаждали до -78°С, а затем добавляли t-BuLi (1,7М) в атмосфере Ar. После перемешивания в течение еще часа добавляли 3,4,5-триметоксибензоилхлорид (47 мг, 0,26 ммоль) и перемешивали в течение ночи. Реакционную смесь выливали в NH4Cl (нас.) и экстрагировали этилацетатом. Сушка MgSO4 и концентрирование в вакууме приводили к получению неочищенного продукта, который очищали путем флэш-хроматографии с получением 22 (35%). 1Н ЯМР (CDCl3): 3,78 (s, 6Н), 3,87 (s, 3Н), 6,91 (s, 2Н), 6,97 (s, 1H), 7,18 (m, 2Н), 7,20 (d, 1H), 7,25 (m, 2Н), 7,38 (m, 2Н), 7,40 (d, 1H), 7,54 (шир., 1H), 7,59 (t, 2Н). МС (ИЭР) m/z 491,9 [М-Н]-, 516,1 [М+Na]+.
N-(1H-имидазол-2-ил)-3,4,5-триметокси-N-фенилбензамид (23). В раствор N-фенил-1H-имидазол-2-амина 21 (900 мг, 5,66 ммоль) в диоксане и воде (30 мл, 3:1) добавляли Вос2О (2,68 г, 12,3 ммоль) и NaOH (0,6 г, 15 ммоль) и перемешивали в течение 4 часов. Концентрировали смесь в вакууме и очищали остаток путем флэш-хроматографии с получением Вос-защищенного промежуточного соединения. Полученное промежуточное соединение (130 мг, 0,502 ммоль) растворяли в ТГФ и охлаждали до -78°С, а затем добавляли t-BuLi (0,65 мл, 1,7М, 1,1 ммоль) в атмосфере Ar. После перемешивания в течение часа добавляли 3,4,5-триметоксибензоилхлорид (116 мг, 0,502 ммоль) и перемешивали в течение ночи. Реакционную смесь выливали в NH4Cl (нас.) и экстрагировали этилацетатом. Сушка MgSO4 и концентрирование в вакууме приводили к получению неочищенного продукта, который очищали путем флэш-хроматографии с получением 23 (35%). 1Н ЯМР (CDCl3): 3,65 (s, 6Н), 3,79 (s, 3Н), 6,56 (s, 2Н), 6,90 (m, 2Н), 7,27-7,39 (m, 5Н), 11,17 (шир., 1Н). МС (ИЭР) m/z 351,8 [М-Н]-, 376,3 [М+Na]+.
N-фенил-4-тритил-1H-имидазол-2-амин (24) и N-фенил-1-тритил-1H-имидазол-2-амин (25). В раствор N-фенил-1H-имидазол-2-амина 21 (159 мг, 10 ммоль) в триэтиламине и CH2Cl2, который перемешивали в инертной атмосфере при 0°С, добавляли (хлорметантриил)трибензол (5 экв.). Раствор оставляли нагреваться до КТ и перемешивали до завершения взаимодействия согласно ТСХ. Затем реакционную смесь концентрировали в вакууме, гасили насыщенным водным бикарбонатом натрия и экстрагировали этилацетатом, затем сушили сульфатом магния и концентрировали в вакууме. Полученный остаток очищали путем флэш-хроматографии с получением двух различных защищенных продуктов. 24: 1Н ЯМР (ДМСО-d6): 6,0 (s, 1H), 6,75 (m, 1Н), 7,29-7,62 (m, 19Н), 8,65 (s, 1Н), 10,62 (s, 1Н). МС (ИЭР) m/z 399,9 [М-Н]-, 403,1 [М+Н]+. 25: 1Н ЯМР (ДМСО-d6): 6,08 (s, 1Н), 6,41 (s, 1H), 6,85 (s, 1H), 7,13-7,52 (m, 20H), 8,65 (s, 1H), 10,62 (s, 1H). МС (ИЭР) m/z 399,8 [M-H]-, 402,8 [M+H]+.
(2-(фениламино)-1-тритил-1H-имидазол-4-ил)(3,4,5-триметоксифенил)-метанон (26). В раствор N-фенил-1-тритил-1H-имидазол-2-амина 25 (116 мг, 0,289 ммоль) в ТГФ (10 мл), который перемешивали в инертной атмосфере при -78°С, добавляли t-BuLi (0,34 мл, 1,7М, 0,58 ммоль) и триметоксибензоилхлорид (66,5 мг, 0,289 ммоль). Реакционную смесь оставляли для взаимодействия на ночь, затем реакцию гасили NH4Cl (нас.) и экстрагировали этилацетатом. Сушка MgSO4 и концентрирование в вакууме приводили к получению неочищенного продукта, который очищали путем флэш-хроматографии с получением 26 (75 мг, 43,7%). 1Н ЯМР (ДМСО-d6): 3,71 (s, 3Н), 3,78 (s, 6Н), 5,87 (s, 1H), 6,94 (s, 2Н), 7,18-7,58 (m, 21Н). МС (ИЭР) m/z 594,2 [М-Н]-, 596,3 [М+Н]+.
(2-(фениламино)-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метанон (27). (2-(фениламино)-1-тритил-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метанон растворяли в растворе НС1 в диэтиловом эфире (2М) и перемешивали в течение ночи. Затем добавляли насыщенный раствор NaHCO3 и трижды экстрагировали реакционную смесь диэтиловым эфиром. Сушили объединенные органические слои (сульфат натрия), фильтровали и концентрировали в вакууме. Остаток очищали путем флэш-хроматографии с получением чистого 27. 1Н ЯМР (ДМСО-d6): 3,73 (s, 3Н), 3,82 (s, 6Н), 6,62 (s, 2Н), 7,02 (s, 2Н), 7,33 (d, 2Н), 7,43-7,51 (m, 3Н), 7,54 (шир., 1Н). МС (ИЭР) m/z 352,1 [М-Н]-, 354,3 [М+Н]+. Анализ (C19H19N3O4) C, H, N.
N-((1H-индол-5-ил)карбамотиоил)бензамид (28). Смесь 5-нитро-1H-индола (11 г, 67,9 ммоль) и Pd/C (5%; 1 г), растворенную в этаноле (50 мл), гидрировали в течение 3 часов при 40 psi (280 кПа). Фильтровали реакционную смесь и выпаривали избыток этанола при пониженном давлении. Твердый продукт перекристаллизовывали из гексана с получением чистого 5-аминоиндольного соединения. Выход: 92,5%. 1Н ЯМР (500 МГц, CDCl3): δ 3,50 (s, 2Н), 6,37 (s, 1Н), 6,67 (dd, 1H), 6,95 (s, 1H), 7,13 (s, 1Н), 7,20 (d, 1Н), 7,96 (шир., 1H). МС (ИЭР) m/z 133,0 (М+Н)+. Проводили взаимодействие раствора 5-аминоиндола (8 г, 60,6 ммоль) в ацетоне (150 мл) с бензоилизотиоцианатом (9,88 г, 60 ммоль) при КТ в течение примерно 4 часов до тех пор, пока анализ ТСХ не указывал на завершение взаимодействия, получали соединение 28. 1Н ЯМР (300 МГц, CDCl3): δ 6,61 (шир., 1H), 7,26-7,28 (d, 1H), 7,38-7,45 (m, 2Н), 7,54-7,59 (m, 2Н), 7,65-7,70 (m, 1H), 7,91-7,94 (m, 2Н), 7,98 (s, 1H), 8,27 (s, шир., 1Н), 9,12 (s, 1Н), 12,51 (s, 1Н). МС (ИЭР) m/z 318,1 [M+Na]+.
2-(1H-индол-5-иламино)-N-метокси-N-метилтиазол-4-карбоксамид (32). Отфильтровывали полученное соединение 28 в виде твердого вещества и обрабатывали 2н. NaOH в ТГФ (120 мл). Смесь кипятили с обратным холодильником в течение примерно 6 часов и оставляли нагреваться до КТ. Выпаривали растворитель в вакууме. Остаток разбавляли водой (20 мл) и нейтрализовали до рН 7 при помощи 1н. HCl. Отфильтровывали полученное твердое вещество и сушили в вакууме с получением 5-индолилтиомочевины (29). Соединение 29 (0,01 моль) и этилбромпируват (0,011 моль) растворяли в 3 мл этанола и выдерживали при температуре обратной конденсации в течение 2 часов. Охлаждали реакционную смесь, собирали кристаллический этил-2-(1H-индол-5-иламино)тиазол-4-карбоксилат (30) путем фильтрования и промывали этанолом. Кипячение смеси сложных этиловых эфиров с раствором NaOH-этанол при температуре обратной конденсации приводило к получению 2-(1H-индол-5-иламино)тиазол-4-карбоновой кислоты (31), которую использовали непосредственно на следующих стадиях. В смесь неочищенной кислоты (2,5 ммоль), HBTU (2,6 ммоль) и NMM (5,3 ммоль) в CH2Cl2 (30 мл) добавляли соль HCl HNCH3OCH3 (2,6 ммоль) и продолжали перемешивать при КТ в течение ночи. Реакционную смесь разбавляли CH2Cl2 (20 мл) и последовательно промывали водой, нас. NaHCO3, солевым раствором и сушили над MgSO4. Удаляли растворитель при пониженном давлении с получением неочищенного продукта, который очищали путем колоночной хроматографии с получением чистого амида Вайнреба 2-(1Н-индол-5-иламино)-N-метокси-N-метилтиазол-4-карбоксамида (32) (общий выход 45,6% за 5 стадий). 1Н ЯМР (CDCl3): 3,42 (s, 3Н), 3,77 (s, 3Н), 6,54 (m, 1H), 7,26 (m, 1H), 7,29 (m, 2Н), 7,40 (d, 2Н), 7,61 (m, 1H), 8,30 (шир., 1H). МС (ИЭР) m/z 303,0 [М+Н]+.
(2-((1H-индол-5-ил)амино)тиазол-4-ил)(3,4,5-триметоксифенил)метанон (33). При -78°С в раствор 5-бром-1,2,3-триметоксибензола (1,235 г, 5,0 ммоль) в 30 мл ТГФ добавляли n-BuLi в гексане (2,5н., 2,4 мл, 6 ммоль) в защитной атмосфере Ar и перемешивали в течение 10 минут. К литийсодержащему реагенту добавляли амид Вайнреба 32 (1 ммоль) в 10 мл ТГФ и оставляли перемешиваться при КТ на 2 часа. Реакцию гасили нас. NH4Cl, экстрагировали смесь диэтиловым эфиром, сушили MgSO4. Удаляли растворитель при пониженном давлении с получением неочищенного продукта, который очищали путем колоночной хроматографии с получением чистого 33 (выход 51,7%). 1Н ЯМР (300 МГц, CDCl3) δ 3,89 (s, 6Н), 3,93 (s, 3Н), 6,55 (m, 1H), 7,15-7,12 (m, 1Н), 7,28-7,26 (m, 1H), 7,36 (s, 1Н), 7,39 (s, 1H), 7,46 (s, 2Н), 7,68 (d, 1H), 8,29 (шир., 1Н). МС (ИЭР) m/z 432,1 (М+Na)+, 408,0 (М-Н)-. Анализ (C23H19N3O4S) С, Н, N.
Пример 4
Молекулярное моделирование соединений согласно настоящему изобретению Молекулярное моделирование. Исследования молекулярного моделирования проводили с использованием опубликованных кристаллических структур комплекса димера α,β-тубулина с DAMA-колхицином (код банка данных белков 1SA0). В исследованиях моделирования использовали набор молекулярного моделирования Шредингер (Schrodinger Inc., Portland, OR) при помощи процедур, схожих с теми, что были описаны ранее в Chen, J. et al. Bioorg Med Chem 2011, 19(16), 4782-95; Slominski, A.T. et al. The Journal of Steroid Biochemistry and Molecular Biology 2013, 137, 107-23; Xiao, M et al. J Med Chem 2013, 56(8), 3318-29; Chen, J. et al. J Med Chem 2012, 55(16), 7285-9. Вкратце, структуры комплексов белок-лиганд получали при помощи модуля Protein Preparation (Получение белка) и активные участки связывания лиганда определяли по данным для естественного лиганда. Создавали структуры естественного лиганда DAMA-колхицина и предложенных ингибиторов тубулина, описанных в настоящем исследовании, и подготавливали для докинга при помощи модуля Ligprep (Получение лиганда), после чего проводили докинг в 1SA0. Индекс докинга Glidescore, полученный в указанном способе моделирования, представляет собой оценочное значение энергии связывания (ккал/моль) при связывании лиганда с димером тубулина. Более низкое (более отрицательное) значение свидетельствует о более благоприятном связывании между лигандом и рецептором. Анализ данных проводили при помощи интерфейса Maestro, включенного в программное обеспечение.
Проводили докинг соединений 4 и 7 в участке связывания колхицина в тубулине (фигура 6, код PDB: 1SA0), было показано, что они обладают очень схожим расположением при связывании, которое достаточно хорошо перекрывается с естественным лигандом. Как и предполагалось, триметокси-фрагмент в 4 или 7 занимал карман триметокси-фрагмента естественного лиганда (DAMA-колхицина), но наблюдали некоторое смещение его расположения. В результате указанного незначительного смещения атомы кислорода двух метоксигрупп в 4 и 7 располагались поблизости от Cys-241 в β-субъединице и обеспечивали образование двух водородных связей (пунктирные линии). NH в имидазольном фрагменте в 4 или 7 образовывал еще одну водородную связь с Thr-179 в α-субъединице, как показано на фигуре 6. Интересно отметить, что за счет образования плоской структуры в средней части 4 или 7 5-индолильный фрагмент изменял ориентацию таким образом, чтобы достигать ГТФ в α-субъединице. Индексы докинга Glidescore для 4 (-8,58) и 7 (-8,10) были сравнимыми с естественным лигандом, DAMA-колхицином (-9,26), согласно данным модельным вычислениям, это позволяет предположить, что они обладают сравнимым действием при связывании тубулина.
Пример 5
Активность соединений согласно настоящему изобретению в отношении рака простаты и меланомы
Клеточная культура и исследование цитотоксичности рака простаты и меланомы. Все клеточные линии получали от АТСС (Американская коллекция типовых культур, Manassas, VA, США), тогда как источники питания для клеточных культур приобретали в Cellgro Mediatech (Herndon, VA, США). Авторы настоящего изобретения исследовали антипролиферативную активность предложенных анти-тубулиновых соединений в отношении четырех клеточных линиях рака простаты человека (LNCaP, DU 145, РС-3 и РРС-1) и трех клеточных линиях меланомы (А375, B16-F1 и WM-164). Все клеточные линии рака простаты выращивали в RPMI 1640, дополненной 10% эмбриональной бычьей сывороткой (ЭБС). Клетки меланомы выращивали в DMEM, дополненной 5% ЭБС, 1% смесью антибиотик/противогрибковый агент (Sigma-Aldrich, Inc., St. Louis, MO, USA) и бычьим инсулином (5 мкг/мл; Sigma-Aldrich). Цитотоксический потенциал анти-тубулиновых соединений оценивали при помощи исследования сульфородамина В (SRB) после 96-часовой обработки.
Результаты:
По результатам сравнения данных активности в отношении пролиферации с соединением 10, которое является незамещенным соединением матрицы SMART, большая часть бензо-имидазолов 3-6 обладала только умеренной активностью; за исключением 4, которое содержит 5-индолил в качестве кольцевого заместителя А, которое обладало схожей активностью в отношении исследуемых клеточных линий меланомы и рака простаты (см. таблицу 1). Для дополнительной модификации 5-индолил сохраняли в качестве кольца А и имидазол, конденсированный с пиридином, использовали в качестве замены бензоимидазола, что давало соединение 7. Указанное соединение обладало повышенной активностью по сравнению с 10 и 4. Значения IC50 улучшались по меньшей мере в 5 раз в отношении клеток меланомы A375 и клеток восприимчивого к андрогену рака простаты LNCaP. Кроме того, указанные новые матрицы конденсированных колец блокировали возможные метаболические реакции I фазы, обеспечиваемые восстановлением кетона в 10 (пример 6).

Соединение 15 имело улучшенную активность по сравнению с триметоксибензоильным соединением 10 (т.е. 20 нМ (15) по сравнению с 28 нМ (10) в отношении клеток А375; таблица 2). Указанное открытие подтверждало предположение о том, что «ара-положение бензоильного кольца является подходящим местом для дополнительной модификации. Увеличение цепи на два атома (-ОСН2-) в 15 приводило к получению соединения, сохранявшего высокую активность. Тем не менее, идея алкилирования по пара-положению работала в отношении подавления роста раковых клеток не так, как ожидалось. Согласно результатам, показанным в таблице 2, видно, что активность алкилирующего агента 12 в отношении клеток меланомы и рака простаты значительно снижалась. Соединения 13 и 14 имели схожие тренды изменения активности, что и 12. 17, содержащее фталимидную защитную группу, проявляло активность в микромолярном диапазоне. Введение этиламина (18) по пара-положению сохраняло умеренную активность, где значение IC50 находилось в диапазоне сотен наномоль, но при этом было менее активным по сравнению с триметоксибензоильным соединением 10.

В таблице 3 приведены результаты для аналогов соединений, где 27 не демонстрировало какую-либо активность в отношении всех исследуемых клеточных линий. 33 обеспечивало превосходное подавление роста клеток рака простаты и меланомы in vitro. Значения IC50 в отношении клеток рака простаты улучшались в 2-3 раза по сравнению с PAT.

Исследования молекулярного моделирования соединения 33 (фигура 7) показывали взаимодействие между указанным лигандом и α,β-димером тубулина посредством трех водородных связей, схожее с взаимодействием 4 или 7 с тубулином. Тем не менее, видно, что 5-индолильный фрагмент в соединении 33 не достигал ГТФ фрагмента, как в случае 4 или 7, что возможно вызвано тем фактом, что фрагмент кетона не приближен к системе колец, как показано для 4 или 7. Таким образом, 33, главным образом, остается в β-субъединице димера тубулина и имеет значительно более лучший индекс докинга Glidescore (-8,70).
Пример 6
Исследования метаболической стабильности
Исследование микросомальной стабильности. Исследования метаболической стабильности проводили путем инкубации исследуемых соединений (0,5 мкМ) в реакционной смеси с общим объемом 1,2 мл, содержащей 1 мг/мл микросомальный белок в реакционном буфере [0,2М фосфатный буферный раствор (рН 7,4), 1,3 мМ НАДФ+, 3,3 мМ глюкоза-6-фосфат и 0,4 ед./мл глюкоза-6-фосфат дегидрогеназа], при 37°С во встряхивателе-инкубаторе. Для оценки метаболической стабильности применяли объединенные микросомы печени человека. Систему регенерации НАДФН (раствор А и В) получали от Xenotech, LLC (Lenexa, KS, США). Аликвоты (100 мкл) реакционных смесей для определения метаболической стабильности отбирали через 5, 10, 20, 30, 60 и 90 минут. Для гашения реакции и осаждения белков добавляли ацетонитрил (200 мкл), содержащий 200 нМ внутреннего стандарта. Затем образцы центрифугировали при 10000 об./мин в течение 15 минут при КТ и проводили прямой анализ надосадочной жидкости путем ЖХ-МС/МС (АВ Sciex API4500). Для идентификации метаболитов инкубировали реакционную смесь в течение 2 часов совместно с исследуемым соединением в 50 мкМ концентрации в описанных выше условиях. Проводили анализ надосадочной жидкости на масс-спектрометре высокого разрешения Water Xevo G2-S.
Исследования метаболической стабильности in vitro. Для определения возможности снижения метаболизма лабильного карбонильного линкера за счет встраивания его в циклическую структуру проводили измерение метаболической стабильности в микросомах печени при использовании двух высокоактивных соединений (4 и 7). Карбонильный линкер в 10, который был восприимчив к восстановлению кетона, заменяли на кольцо. Указанная модификация обеспечивала сохранение эффективности и при этом улучшала метаболическую стабильность примерно в 2-3 раза (17 минут по сравнению с 45 и 51 минутами для микросом печени человека, таблица 4) по сравнению с 10.

Кроме того, соединения 4 и 7 обладали повышенной активностью. Метаболическая стабильность другого активного аналога 15, содержащего увеличенную MOM концевую группу в пара-положении бензоильного кольца, не улучшалась для любой из исследуемых микросом печени. Другой заместитель, аминоэтил в 18, так же находящийся в пара-положении относительно О, блокировал тенденцию к метаболизму по бензоильному кольцу (T1/2 составлял от 110 до 225 минут для исследуемых видов микросом печени). Полученный результат подтверждал, что пара-положение бензоильного кольца может представлять собой место, модификация которого может приводить к улучшению стабильности соединения.
Метаболические пути соединений 4, 7, 15 и 18 in vitro. Для выяснения причины, по которой указанные новые аналоги имели различные профили метаболизма в микросомах печени, проводили дополнительные эксперименты с использованием более высокой концентрации (50 мкМ) исследуемых соединений. Авторы настоящего изобретения использовали масс-спектрометр высокого разрешения для идентификации метаболитов, где ошибка измеряемой массы в общем случае составляла менее 2 ppm. Подробная информация, касающаяся масс-спектров и хроматографии каждого из метаболитов, представлена во вспомогательных материалах. В случае 15 (фигура 8) удаление группы MOM с образованием M1 (который идентифицировали по масс-спектру 342,08 [М+1]) является основным метаболическим путем, затем происходит О-деметилирование 3'- или 5'-метоксигруппы с образованием М2 (который идентифицировали по масс-спектру 328,06 [М+1]). Указанный результат согласовывался с коротким периодом полувыведения (<10 минут) указанного соединения, как полагают, группа MOM является нестабильной после воздействия в микросомах печени. М3 (который идентифицировали по масс-спектру 372,09 [М+1]) также представлял собой продукт O-деметилирования, тем не менее, точный участок указанного деметилирования не был определен из-за ограниченной информации, доступной на указанной стадии. М4 (который идентифицировали по масс-спектру 388,12 [М+1]) представлял собой продукт восстановления кетона, затем происходило его гидроксилирование до М5 (который идентифицировали по масс-спектру 404,12 [М+1]) по положению, которое невозможно было определить из-за ограниченной информации. В случае 18 (фигура 9) основными метаболитами являются М6 (деалкилирование) (который идентифицировали по масс-спектру 342,08 [М+1]) и М8 (восстановление кетона) (который идентифицировали по масс-спектру 387,14 [М+1]). М7 (деаминирование) (который идентифицировали по масс-спектру 370,11 [М+1]) является неосновным продуктом. В случае 4 (фигура 10) основными являлись продукты (9-деметилирования (М9) и моногидроксилирования (М10). М9 (который идентифицировали по масс-спектру 386,15 [М+1]) и М10 (который идентифицировали по масс-спектру 416,16 [М+1]) имели более одной возможной структуры, что указано на хроматограммах. В случае 7 (фигура 11) обнаруживали различные метаболиты, включая продукты деметилирования (M12) (который идентифицировали по масс-спектру 387,15 [М+1]), моно-гидроксилирования (M14) (который идентифицировали по масс-спектру 417,16 [М+1]), О-деметилирования и последующего моно-гидроксилирования (М11) (который идентифицировали по масс-спектру 403,14 [М+1]) и дигидроксилирования (М13) (который идентифицировали по масс-спектру 433,15 [М+1]). Указанные продукты образовывались равномерно в схожих относительных количествах, и все указанные метаболиты имели несколько изомерных форм, что указано на хроматограммах.
Пример 7
Ингибирование полимеризации тубулина
Исследование полимеризации тубулина in vitro. Тубулин бычьего мозга (0,4 мг, чистота >97%) (Cytoskeleton, Denver, СО, США) смешивали с 10 мкМ исследуемым соединением и инкубировали в 100 мкл универсального буфера тубулина (80 мМ PIPES, 2,0 мМ MgCl2, 0,5 мМ ЭГТА и 1 мМ ГТФ) с рН 6,9. Поглощение при 340 нм отслеживали каждую минуту в течение 20 минут на анализаторе микропланшетов SYNERGY 4 Microplate Reader (Bio-Tek Instruments, Winooski, VT, США). Спектрофотометр устанавливали на 37°С для полимеризации тубулина.
Соединения ингибируют полимеризацию тубулина in vitro. Исследовали ингибирование полимеризации тубулина с применением выбранных высокоактивных соединений 4 и 7, обладающих улучшенными метаболическими свойствами, и сравнивали с положительным контролем колхицином и отрицательным контролем таксолом. В качестве пустого контроля использовали ДМСО. Тубулин бычьего мозга (чистота >97%) инкубировали с отдельными соединениями (5 или 10 мкМ) для исследования их действия на полимеризацию тубулина (фигура 12). После 20-минутной инкубации соединение 4 в концентрации 5 и 10 мкМ ингибировало полимеризацию тубулина на 30% и 60%, соответственно (фигура 12А) по сравнению с носителем. При этом для соединения 7 в концентрации 5 и 10 мкМ наблюдали 33% и 81% ингибирование, соответственно (фигура 12В). Оба соединения 4 и 7 обеспечивали более сильное ингибирование по сравнению с колхицином при двух исследуемых концентрациях. Полученные данные позволяли предположить, что указанные соединения обладают высокой активностью ингибирования полимеризации тубулина, что хорошо согласуется с их цитотоксичностью.
Все отличительные признаки, описанные в настоящей заявке (включая прилагаемую формулу изобретения, реферат и любые чертежи), и/или все стадии какого-либо раскрытого таким образом способа или процесса можно объединять с любыми из приведенных выше аспектов в любой комбинации за исключением комбинаций, где по меньшей мере некоторые из указанных отличительных признаков и/или стадий являются взаимоисключающими. Несмотря на то, что в настоящей заявке подробно отражены и описаны предпочтительные варианты реализации, специалистам в родственных областях техники должно быть понятно, что возможны различные модификации, добавления, замещения и т.п., не выходящие за рамки сущности изобретения, которые, соответственно, рассматриваются как входящие в объем изобретения, определяемый нижеследующей формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2015 |
|
RU2805949C2 |
| СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ТРИЖДЫ НЕГАТИВНОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ И РАКА ЯИЧНИКА | 2019 |
|
RU2776897C2 |
| СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2010 |
|
RU2581367C2 |
| СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2011 |
|
RU2762111C1 |
| СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2011 |
|
RU2609018C2 |
| СОЕДИНЕНИЕ ДЛЯ ЛЕЧЕНИЯ РАКА | 2014 |
|
RU2708247C2 |
| ЗАМЕЩЕННОЕ АРОМАТИЧЕСКОЕ ПРОИЗВОДНОЕ С КОНДЕНСИРОВАННЫМИ КОЛЬЦАМИ И КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ ЕГО, И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2811484C1 |
| МОДУЛЯТОРЫ АНДРОГЕНОВОГО РЕЦЕПТОРА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2797622C2 |
| СОЕДИНЕНИЯ И СПОСОБЫ МОДУЛИРОВАНИЯ КИНАЗЫ И ПОКАЗАНИЯ К ИХ ПРИМЕНЕНИЮ | 2013 |
|
RU2666146C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2680100C9 |





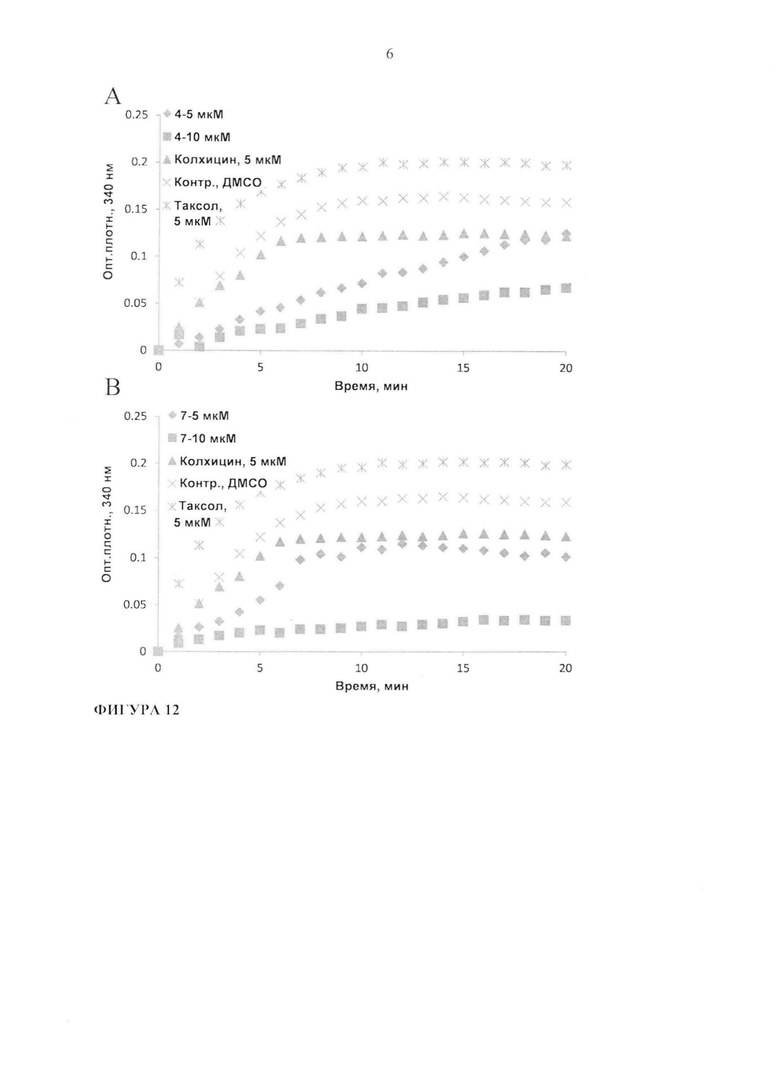
Настоящее изобретение относится к соединению, представленному формулой II, где Q представляет собой NH; Z представляет собой CH или N; A представляет собой фенил, индолил или индазолил, каждый из которых необязательно замещен по меньшей мере одним из следующего: C1-C5 линейный или разветвленный алкил или их комбинация; R1 независимо представляет собой водород, O-(C1-C5)алкил, O-галоген(C1-C5)алкил, галоген(C1-C5)алкил, -O(CH2)jOCH3, -O(CH2)jNHCH3, -O(CH2)jNH2, -O-(CH2)jN(CH3)2, - OC(O)CF3, -OC(O)CH2Cl, -OCH2Ph, -O(CH2)jN-фталимид или их комбинацию; R2 представляет собой водород, O-(C1-C5)алкил, O-галоген(C1-C5)алкил, F, Cl, Br, I, галоген(C1-C5)алкил, CN, NO2, -CH2CN, NH2, гидроксил, COOH, C(O)H, NHCO-(C1-C5)алкил, -O(CH2)kOCH3, -O(CH2)kOH, -O(CH2)kNHCH3, -O(CH2)kNH2, -O-(CH2)kN(CH3)2, -OC(O)CF3, - OC(O)CH2Cl, -OCH2Ph или -O(CH2)kN-фталимид; j и k независимо представляют собой целые числа от 1 до 5; n представляет собой целое число от 1 до 4; или его гидрату, фармацевтически приемлемой соли или их комбинации. Соединения формулы II обладают противораковой активностью и предназначены для лечения, ослабления, снижения тяжести, снижения риска развития или подавления рака. 4 н. и 19 з.п. ф-лы, 12 ил., 4 табл., 6 пр.

1. Соединение, представленное формулой II:

где
Q представляет собой NH;
Z представляет собой CH или N;
A представляет собой фенил, индолил или индазолил, каждый из которых необязательно замещен по меньшей мере одним из следующего: C1-C5 линейный или разветвленный алкил или их комбинация;
R1 независимо представляет собой водород, O-(C1-C5)алкил, O-галоген(C1-C5)алкил, галоген(C1-C5)алкил, -O(CH2)jOCH3, -O(CH2)jNHCH3, -O(CH2)jNH2, -O-(CH2)jN(CH3)2, - OC(O)CF3, -OC(O)CH2Cl, -OCH2Ph, -O(CH2)jN-фталимид или их комбинацию;
R2 представляет собой водород, O-(C1-C5)алкил, O-галоген(C1-C5)алкил, F, Cl, Br, I, галоген(C1-C5)алкил, CN, NO2, -CH2CN, NH2, гидроксил, COOH, C(O)H, NHCO-(C1-C5)алкил, -O(CH2)kOCH3, -O(CH2)kOH, -O(CH2)kNHCH3, -O(CH2)kNH2, -O-(CH2)kN(CH3)2, -OC(O)CF3, - OC(O)CH2Cl, -OCH2Ph или -O(CH2)kN-фталимид;
j и k независимо представляют собой целые числа от 1 до 5;
n представляет собой целое число от 1 до 4;
или его гидрат, фармацевтически приемлемая соль или их комбинация.
2. Соединение по п. 1, отличающееся тем, что указанная индолильная группа выбрана из:
 ,
, 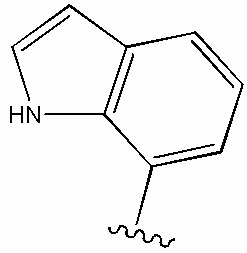 ,
,  или
или 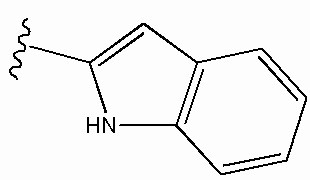 ,
,
где указанный индолил является замещенным или незамещенным.
3. Соединение по п. 1, отличающееся тем, что указанная индазолильная группа выбрана из:
 ,
,  или
или  ,
,
где указанная индазолильная группа является замещенной или незамещенной.
4. Соединение по п. 1, отличающееся тем, что Z представляет собой СН.
5. Соединение по п. 1, отличающееся тем, что Z представляет собой N.
6. Соединение по п. 1, отличающееся тем, что R1 представляет собой OCH3, n равен 3 и R2 представляет собой водород.
7. Соединение по п. 1 или его фармацевтически приемлемая соль, где указанное соединение представляет собой соединение 3, представленное структурой:
 .
.
8. Соединение по п. 1 или его фармацевтически приемлемая соль, отличающееся тем, что указанное соединение представляет собой соединение 4, 5, 6 или 7:
 ;
;  ;
;  или
или  .
.
9. Фармацевтическая композиция, обладающая противораковой активностью и содержащая соединение по п. 1 или его фармацевтически приемлемую соль в количестве, терапевтически эффективном для лечения рака, и по меньшей мере один фармацевтически приемлемый носитель.
10. Фармацевтическая композиция по п. 9, дополнительно содержащая по меньшей мере одно фармацевтически активное соединение, подходящее для лечения рака.
11. Способ лечения, ослабления, снижения тяжести, снижения риска развития или подавления рака, включающий введение соединения по п. 1 субъекту, больному раком, в условиях, эффективных для лечения указанного рака.
12. Способ по п. 11, отличающийся тем, что указанный рак выбран из группы, состоящей из рака простаты, рака простаты с лекарственной устойчивостью, рака груди, рака груди с лекарственной устойчивостью, рака яичников, рака яичников с лекарственной устойчивостью, рака кожи, меланомы, меланомы с лекарственной устойчивостью, рака легкого, рака толстой кишки, глиомы, лейкоза, лимфомы, рака почки, рака ЦНС, рака матки, рака матки с лекарственной устойчивостью и их комбинаций.
13. Способ по п. 11, отличающийся тем, что указанный рак представляет собой меланому.
14. Способ по п. 11, отличающийся тем, что указанный рак представляет собой метастатическую меланому.
15. Способ по п. 11, отличающийся тем, что указанный рак представляет собой рак простаты.
16. Способ по п. 15, отличающийся тем, что указанный рак простаты представляет собой рак простаты с лекарственной устойчивостью.
17. Способ по п. 11, отличающийся тем, что указанное введение проводят в комбинации с другой противораковой терапией.
18. Способ лечения опухоли или опухолей с лекарственной устойчивостью, включающий введение соединения по п. 1 субъекту, страдающему от рака, в условиях, эффективных для лечения указанной опухоли или опухолей с лекарственной устойчивостью.
19. Способ по п. 18, отличающийся тем, что указанная опухоль выбрана из группы, состоящей из раковой опухоли простаты, раковой опухоли простаты с лекарственной устойчивостью, раковой опухоли груди, раковой опухоли груди с лекарственной устойчивостью, глиальной опухоли, раковой опухоли яичника, раковой опухоли яичника с лекарственной устойчивостью, раковой опухоли кожи, меланомной опухоли, меланомной опухоли с лекарственной устойчивостью, раковой опухоли легкого, раковой опухоли толстой кишки, лейкозной опухоли, лимфомной опухоли, раковой опухоли почки, раковой опухоли ЦНС, раковой опухоли матки, раковой опухоли матки с лекарственной устойчивостью и их комбинации.
20. Способ по п. 18, отличающийся тем, что указанная опухоль представляет собой меланомную опухоль.
21. Способ по п. 18, отличающийся тем, что указанная опухоль представляет собой метастатическую меланомную опухоль.
22. Способ по п. 18, отличающийся тем, что указанная опухоль представляет собой раковую опухоль простаты.
23. Способ по п. 18, отличающийся тем, что указанное введение проводят в комбинации с другой противораковой терапией.
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2009 |
|
RU2514427C2 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
Авторы
Даты
2020-10-01—Публикация
2015-05-05—Подача