Настоящее изобретение относится к композициям и фармацевтическим продуктам для лечения бесплодия.
Методы технологии вспомогательной репродукции (ВРТ), такие как экстракорпоральное оплодотворение (ЭКО), хорошо известны. Для этих методов ВРТ обычно требуется стадия контролируемой стимуляции яичников (КСЯ), при которой когорту фолликулов стимулируют до полного созревания. Стандартные режимы КСЯ включают введение гонадотропинов, таких как фолликулостимулирующий гормон (ФСГ), отдельно или в комбинации с активностью лютеинизирующего гормона (ЛГ), для стимуляции развития фолликулов, обычно при введении аналога гонадотропин-высвобождающего гормона (ГнВГ) до и/или во время стимуляции, чтобы предотвратить преждевременный выброс ЛГ. Фармацевтические композиции, как правило, применяемые для КСЯ, включают рекомбинантный фолликулостимулирующий гормон (рФСГ), ФСГ, полученный из мочи, препараты рекомбинантного ФСГ и ЛГ, менотропин [менопаузальный гонадотропин человека (чМПГ)], полученный из мочи, и высокоочищенный менопаузальный гонадотропин человека (ВО-чМПГ). ЭКО может быть сопряжено с риском синдрома гиперстимуляции яичников (СГСЯ), который в некоторых случаях может угрожать жизни.
Способность к предсказанию потенциального ответа женщин на контролируемую стимуляцию яичников (КСЯ) может дать возможность разработки индивидуализированных протоколов КСЯ. Это может, например, уменьшить риск СГСЯ у женщин, у которых предсказан избыточный ответ на стимуляцию, и/или улучшить результаты беременности у женщин, классифицированных как низкоотвечающие. В настоящее время установлено, что сывороточная концентрация антимюллеровского гормона (АМГ) является надежным маркером яичникового резерва. Понижающиеся уровни АМГ соответствуют сниженному ответу яичников на гонадотропины во время КСЯ. Кроме того, высокие уровни АМГ являются хорошим предсказателем избыточного ответа яичников и показателем риска СГСЯ.
В предварительном исследовании женщин моложе 35 лет, проходящих ВРТ, для предсказания оптимальной начальной дозы ФСГ для КСЯ у женщин с риском развития СГСЯ, был использован алгоритм дозирования единых стандартов предоставления результатов испытания (CONSORT; от англ. "Consolidated Standards of Reporting Trials") (включающий базовый ФСГ, индекс массы тела (ИМТ), возраст и количество антральных фолликулов (КАФ (antral follicle count, AFC)) (Olivennes et. al., 2009). Индивидуализация дозы не привела к адекватному выходу ооцитов и достаточной частоте беременности. Тем не менее, в группе низкой дозы (75 ME (международная единица) ФСГ) частота исключений была высокой вследствие неадекватного ответа, и СГСЯ действительно встречался у значимой доли пациентов.
Следовательно, существует необходимость в композиции для применения в индивидуализированных протоколах КСЯ, обеспечивающей адекватный ответ на стимуляцию и/или пониженный риск СГСЯ.
Как указано выше, стандартные протоколы КСЯ могут включать введение ФСГ. ФСГ в природе секретируется передней долей гипофиза и функционирует как гормон, поддерживающий развитие фолликулов и овуляцию. ФСГ включает 92-аминокислотную альфа-субъединицу, также общую с другими гликопротеиновыми гормонами ЛГ и хорионическим гонадотропином (ХГ), и 111-аминокислотную бета-субъединицу, уникальную для ФСГ, которая придает этому гормону биологическую специфичность (Pierce and Parsons, 1981). Каждая субъединица претерпевает посттрансляционную модификацию посредством присоединения сложных углеводных остатков. Обе субъединицы несут два сайта присоединения N-связанного гликана, альфа-субъединица при аминокислотах 52 и 78, а бета-субъединица при аминокислотных остатках 7 и 24 (Rathnam and Saxena, 1975, Saxena and Rathnam, 1976). Таким образом, ФСГ гликозилируется примерно до 30% по массе (Dias and Van Roey. 2001; Fox et al. 2001).
ФСГ, очищенный из постклимактерической мочи человека, в течение многих лет применяли при лечении бесплодия; как для стимуляции овуляции при естественной репродукции, так и для получения ооцитов для технологий вспомогательной репродукции. Продукты рекомбинантного ФСГ (рФСГ), одобренные в настоящее время для стимуляции яичников, такие как фоллитропин альфа (ГОНАЛ-Ф, Merck Serono/EMD Serono) и фоллитропин бета (ПУРЕГОН/ФОЛЛИСТИМ, MSD/Schering-Plough), получают из линии клеток яичника китайского хомячка (СНО). В настоящее время в продаже отсутствуют продукты рФСГ из линии клеток человека.
Для препаратов ФСГ характерна значительная гетерогенность, связанная с различиями в количестве различных присутствующих изоформ. Индивидуальные изоформы ФСГ демонстрируют идентичные аминокислотные последовательности, но различаются по степени посттрансляционных модификаций; конкретные изоформы характеризуются гетерогенностью структур углеводных ветвей и различающимися количествами включения сиаловой кислоты (концевого сахара), где оба различия, по-видимому, влияют на специфичную биологическую активность изоформы.
Гликозилирование природного ФСГ в высшей степени сложно. Гликаны в гипофизарном ФСГ природного происхождения могут содержать широкий ряд структур, которые могут включать комбинации моно-, би-, три- и тетра-разветвленных гликанов (Pierce and Parsons, 1981; Ryan et al., 1987. Baenziger and Green, 1988). Гликаны могут нести дополнительные модификации: фукозилирование центральной части, разделяющий глюкозамин, цепи, удлиненные ацетиллактозамином, частичное или полное сиалирование, сиалирование с α2,3- и α2,6-связями и сульфатированный галактозамин, замещенный галактозой (Dalpathado et al., 2006). Кроме того, существуют различия между распределениями гликановых структур в индивидуальных сайтах гликозилирования. Сравнимый уровень сложности гликанов был обнаружен в ФСГ, выделенном из сыворотки индивидуумов и из мочи женщин в постклимактерическом периоде (Wide et al., 2007).
Гликозилирование продуктов рекомбинантного ФСГ отражает уровень гликозилтрансфераз, присутствующих в линии клеток-хозяев. Имеющиеся в продаже продукты рФСГ получены из клеток яичника китайского хомячка (клеток СНО), сконструированных методами генной инженерии. Диапазон гликановых модификаций в рФСГ, выделенном из клеток СНО, более ограничен, чем обнаруживаемый в природных продуктах. Примеры сниженной гликановой гетерогенности, обнаруживаемой в рФСГ, полученном из клеток СНО, включают отсутствие разделяющего глюкозамина и пониженное содержание фукозилирования центральной части и ацетиллактозаминных удлинений (Hard et al., 1990). Кроме того, клетки СНО способны присоединять сиаловую кислоту только с использованием α2,3-связи (Kagawa et al, 1988, Takeuchi et al, 1988, Svensson et al., 1990); рФСГ, полученный из клеток СНО, включает только α2,3-связанную сиаловую кислоту и не включает α2,6-связанную сиаловую кислоту.
Таким образом, рФСГ, полученный из клеток СНО, отличается от ФСГ природного происхождения (например, ФСГ гипофиза/сыворотки/мочи человека), который содержит гликаны, включающие смесь α2,3- и α2,6-связанной сиаловой кислоты с преобладанием первой.
Кроме того, также было показано, что имеющийся в продаже препарат рекомбинантного ФСГ отличается количествами ФСГ, имеющего изоэлектрическую точку (pI) ниже 4 (с учетом кислых изоформ) по сравнению с ФСГ гипофиза, сыворотки или постклимактерической мочи (Ulloa-Aguirre et al. 1995). Количество кислых изоформ в препаратах из мочи было значительно выше по сравнению с рекомбинантными продуктами, полученными из клеток СНО, Гоналом-ф (Merck Serono) и Пурегоном (Schering Plough) (Andersen et al. 2004). Это должно отражать более низкое молярное содержание сиаловой кислоты в рекомбинантном ФСГ, поскольку содержание отрицательно заряженного гликана, модифицированного сульфатом, в рекомбинантном ФСГ низко. Более низкое содержание сиаловой кислоты по сравнению с природным ФСГ является признаком обоих имеющихся в продаже продуктов рекомбинантного ФСГ и может отражать ограничение в процессе изготовления.
Время пребывания ФСГ в кровообращении было документировано для материалов из ряда источников. Некоторые из этих материалов были фракционированы на основе общего молекулярного заряда, который характеризуется их pI, в котором большее количество кислоты соответствует более высокому отрицательному заряду. Как установлено ранее, основным фактором, влияющим на общий молекулярный заряд, является суммарное содержание сиаловой кислоты каждой молекулы ФСГ. Например, рФСГ (Organon) имеет содержание сиаловой кислоты примерно 8 моль/моль, тогда как ФСГ полученный из мочи имеет более высокое содержание сиаловой кислоты (de Leeuw et al. 1996). Соответствующие скорости плазматического клиренса у крысы составляют 0,34 и 0,14 мл/мин (Ulloa-Aguirre et al. 2003). В другом примере, где образец рекомбинантного ФСГ был разделен на фракции, имеющие высокую и низкую pI, эффективность in vivo фракции с высокой pI (низкое содержание сиаловой кислоты) была снижена, и она имела более короткий период полувыведения из плазмы (D'Antonio et al. 1999). Также было описано, что более основной ФСГ, циркулирующий на последних стадиях цикла овуляции, является следствием понижающей регуляции α2,3-сиалилтрансферазы в передней доле гипофиза, вызванной возрастающими уровнями эстрадиола (Damian-Matsumara et al. 1999; Ulloa-Aguirre et al. 2001). Результаты для α2,6-сиалилтрансферазы не были описаны.
Следовательно, как изложено выше, рекомбинантные белки, экспрессируемые с использованием системы СНО, будут отличаться от их природных двойников своим типом концевых связей сиаловой кислоты. Это соображение важно при получении биопрепаратов для фармацевтического применения, поскольку углеводные группировки могут вносить вклад в фармакологические свойства молекулы.
Авторы настоящего изобретения разработали рекомбинантный ФСГ человеческого происхождения, который является объектом международной заявки на патент № PCT/GB2009/000978, опубликованной как WO 2009/127826 А. Рекомбинантный ФСГ, содержащий смесь как α2,3-, так и α2,6-связанной сиаловой кислоты, был получен путем генно-инженерного конструирования линии клеток человека для экспрессии как рФСГ, так и α2,3-сиалилтрансферазы. Экспрессируемый продукт является в высокой степени кислым и несет смесь как α2,3-, так и α2,6-связанных сиаловых кислот; последние образуются за счет активности эндогенной сиалилтрансферазы. Было обнаружено, что тип связи сиаловой кислоты, α2,3- или α2,6-, может оказывать существенное влияние на биологический клиренс ФСГ. Рекомбинантный ФСГ, содержащий смесь как α2,3-, так и α2,6-связанных сиаловых кислот, обладает двумя преимуществами по сравнению с рФСГ, экспрессируемым в традиционных клетках СНО: во-первых, этот материал в большей степени сиалирован за счет объединенных активностей двух сиалилтрансфераз; и, во-вторых, этот материал в большей степени напоминает природный ФСГ. Это, вероятно, более биологически целесообразно по сравнению с рекомбинантными продуктами, полученными из клеток СНО, которые могут продуцировать только α2,3-связанную сиаловую кислоту (Kagawa et al, 1988, Takeuchi et al, 1988, Svensson et al., 1990) и обладают пониженным содержанием сиаловой кислоты (Ulloa-Aguirre et al. 1995., Andersen et al. 2004).
Продукт рФСГ, раскрытый в международной заявке на патент PCT/GB2009/000978, содержит разветвленные гликановые группировки. ФСГ содержит гликаны (присоединенные к гликопротеинам ФСГ), и эти гликаны могут иметь широкое разнообразие структур. Как хорошо известно в данной области техники, разветвление (гликана) может происходить с таким результатом, что гликан имеет 1, 2, 3, 4 или большее количество концевых сахарных остатков или «ветвей»; гликаны, имеющие 1, 2, 3 или 4 концевых сахарных остатка или «ветви», называют, соответственно, моно-разветвленными, ди-разветвленными, три-разветвленными или тетра-разветвленными структурами. Гликаны могут иметь сиалирование, присутствующее на моно-разветвленных и/или ди-разветвленных и/или три-разветвленных и/или тетра-разветвленных структурах. Иллюстративный рФСГ, раскрытый в международной заявке на патент № PCT/GB2009/000978, включал моно-сиалированные, ди-сиалированные, три-сиалированные и тетра-сиалированные гликановые структуры, имеющие следующие относительные количества: 9-15% моно-сиалированных; 27-30% ди-сиалированных; 30-36% три-сиалированных и 25-29% тетра-сиалированных. Как хорошо известно, моно-сиалированная гликановая структура несет один остаток сиаловой кислоты; ди-сиалированная гликановая структура несет два остатка сиаловой кислоты; три-сиалированная гликановая структура несет три остатка сиаловой кислоты; и тетра-сиалированная гликановая структура несет четыре остатка сиаловой кислоты. В данной заявке терминология, такая как «Х% моно-сиалированных», «Х% ди-сиалированных», «Х% три-сиалированных» или «Х% тетра-сиалированных» относится к числу гликановых структур на ФСГ, который является моно-, ди-, три- или тетра-сиалированным (соответственно), выраженному в процентах (Х%) от общего числа гликановых структур на ФСГ, сиалированном в любом случае (несущем сиаловую кислоту). Таким образом, выражение «30-36% три-сиалированных гликановых структур» означает, что из общего числа гликановых структур на ФСГ, несущем остатки сиаловой кислоты (то есть сиалированном) от 30 до 36% этих гликановых структур являются три-сиалированными (несут три остатка сиаловой кислоты). Авторы изобретения неожиданно обнаружили, что ФСГ, имеющий определенное количество тетра-сиалированных гликановых структур (отличающийся от иллюстративного продукта рФСГ, раскрытого в упомянутом выше документе PCT/GB2009/000978), значительно более эффективен, чем рекомбинантные продукты ФСГ, имеющиеся в настоящее время в продаже. Аминокислотная последовательность продуктов, предложенных авторами изобретения, представляет собой нативную последовательность и идентична последовательности природного ФСГ человека и существующим продуктам рФСГ, полученным из СНО. Однако авторы настоящего изобретения обнаружили, что продукты рекомбинантного ФСГ человеческого происхождения (то есть рекомбинантный ФСГ, продуцируемый или экспрессируемый в линии клеток человека, например, в линии клеток человека, полученной методами генной инженерии), содержащие смесь как α2,3-, так и α2,6-связанной сиаловой кислоты, и/или определенное количество тетра-сиалированных гликановых структур, могут быть особенно эффективными при применении в протоколах КСЯ (например, индивидуализированных).
Согласно настоящему изобретению в первом аспекте предложен продукт (например, фармацевтическая композиция), содержащий фолликулостимулирующий гормон (ФСГ), для применения в лечении бесплодия у пациента (например, у пациента, имеющего сывороточный уровень АМГ 0,05 пмоль/л или выше, например 0,5 пмоль/л или выше), где этот продукт содержит дозу, равную или эквивалентную 1-24 мкг, например 2-24 мкг, например от 2 до 15 мкг, рекомбинантного ФСГ человеческого происхождения. Предпочтительно продукт содержит дозу, равную или эквивалентную от 4,5 до 12,5 мкг, например от 5 до 12,5 мкг, например от 6 до 12,5 мкг, например от 6,3 до 10,5 мкг, рекомбинантного ФСГ человеческого происхождения.
Согласно изобретению предложен продукт (например, фармацевтическая композиция), содержащий фолликулостимулирующий гормон (ФСГ), для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ менее 15 пмоль/л (например, от 0,05 пмоль/л до 14,9 пмоль/л), где продукт содержит (например, суточную) дозу, равную или эквивалентную от 9 до 14 мкг, например от 11 до 13 мкг, например 12 мкг, рекомбинантного ФСГ человеческого происхождения. Предпочтительно ФСГ представляет собой рекомбинантный ФСГ («рФСГ» или «рекФСГ»). Предпочтительно ФСГ представляет собой рекомбинантный ФСГ, полученный из линии клеток человека. Доза обеспечивает эффективный ответ, при этом сводя к минимуму риск СГСЯ. Предпочтительно лечение бесплодия включает стадию определения (например, измерения) сывороточного уровня АМГ пациента и введения дозы пациенту, имеющему сывороточный уровень АМГ составляющий менее 15 пмоль/л (например, от 0,05 пмоль/л до 14,9 пмоль/л).
Согласно изобретению в следующем аспекте предложен продукт (например, фармацевтическая композиция), содержащий фолликулостимулирующий гормон (ФСГ) для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ не менее 15 пмоль/л, где продукт содержит (например, суточную) дозу, равную или эквивалентную от 5 до 12,5 мкг, например от 6 до 10,5 мкг, рекомбинантного ФСГ человеческого происхождения. Предпочтительно ФСГ представляет собой рекомбинантный ФСГ («рФСГ» или «рекФСГ»). Предпочтительно ФСГ представляет собой рекомбинантный ФСГ, полученный из линии клеток человека. Доза обеспечивает эффективный ответ, при этом сводя к минимуму риск СГСЯ. Предпочтительно лечение бесплодия включает стадию определения (например, измерения) сывороточного уровня АМГ пациента и введения дозы пациенту, имеющему сывороточный уровень АМГ не менее 15 пмоль/л. В одном воплощении продукт предназначен для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ от 15 до 24,9 пмоль/л, и продукт предназначен для введения в (например, суточной) дозе, равной или эквивалентной от 5 до 12 мкг, например от 7 до 12 мкг, например от 8,7 до 10 мкг, рекомбинантного ФСГ человеческого происхождения (предпочтительно от 9 до 10 мкг рекомбинантного ФСГ человеческого происхождения). В данном воплощении лечение бесплодия может включать стадию определения (например, измерения) сывороточного уровня АМГ пациента и введение дозы пациенту, имеющему сывороточный уровень АМГ от 15 до 24,9 пмоль/л. В другом воплощении продукт предназначен для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ от 25 до 34,9 пмоль/л, и продукт предназначен для введения в (например, суточной) дозе, равной или эквивалентной от 5 до 12 мкг, например от 6 до 9 мкг, например от 7 до 8 мкг рекомбинантного ФСГ человеческого происхождения (предпочтительно от 7,3 до 8 мкг рекомбинантного ФСГ человеческого происхождения). В данном воплощении лечение бесплодия может включать стадию определения (например, измерения) сывороточного уровня АМГ пациента и введение дозы пациенту, имеющему сывороточный уровень АМГ от 25 до 34,9 пмоль/л. В другом воплощении продукт предназначен для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ не менее 35 пмоль/л, и продукт предназначен для введения в (например, суточной) дозе, равной от 5 до 11 мкг или эквивалентной ей, например от 6,3 до 7 мкг, рекомбинантного ФСГ человеческого происхождения (предпочтительно от 6 до 7 мкг рекомбинантного ФСГ человеческого происхождения). В данном воплощении лечение бесплодия может включать стадию определения (например, измерения) сывороточного уровня АМГ пациента и введение дозы пациенту, имеющему сывороточный уровень АМГ не менее 35 пмоль/л.
Вышеуказанные дозы могут быть предназначены для лечения бесплодия по первому протоколу стимуляции пациента (субъекта). Понятно, что для следующих циклов стимуляции дозы можно корректировать в соответствии с действительным ответом яичников в первом цикле.
Авторы изобретения обнаружили, что, как правило, необходимо извлекать около девяти ооцитов, чтобы дать возможность отбора двух высококачественных ооцитов для переноса.
Авторы изобретения обнаружили, что для субъектов, имеющих низкий АМГ (АМГ менее 15 пмоль/л на литр), для достижения этого результата требуется рационально высокая доза рекомбинантного ФСГ (например, 12 мкг). При данной дозе от 8 до 14 ооцитов будет извлечено у 60% субъектов с низким АМГ. Данный результат является неожиданным и значительным усовершенствованием по сравнению с лечением субъектов с низким АМГ 150 ME Гонала-ф, где извлекают от 8 до 14 ооцитов только у 33% субъектов. Авторы изобретения обнаружили, что нет необходимости корректировать эту дозу в соответствии с массой тела пациента.
Тем не менее, 60% населения (и 80% женщин моложе 30 лет, которых лечат от бесплодия) имеют высокий АМГ (то есть, АМГ не менее 15 пмоль/л). Для этих субъектов обычно достаточно просто извлекать в среднем от 9 до 11 ооцитов; проблема протоколов стимуляции заключается в риске СГСЯ. Авторы изобретения обнаружили, что у пациентов, получающих низкие дозы человеческого рекомбинантного ФСГ, существует взаимосвязь между извлекаемыми ооцитами и массой тела субъекта. Это означает, что может существовать риск, сопутствующий лечению фиксированными дозами ФСГ (что обычно в данной области техники). Авторы настоящего изобретения установили соотношение между дозой ФСГ и уровнем АМГ и массой субъекта, обеспечивающее улучшенный профиль безопасности (сниженный риск СГСЯ) с приемлемым или улучшенным извлечением ооцитов по сравнению с известными протоколами лечения (см. пример 10).
Согласно изобретению в следующем аспекте предложен продукт (например, фармацевтическая композиция), содержащий фолликулостимулирующий гормон (ФСГ). для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ не менее 15 пмоль/л, где продукт предназначен для введения в (например, суточной) дозе, равной или эквивалентной от 0,09 до 0,19 мкг (например от 0,09 до 0,17 мкг) рекомбинантного ФСГ человеческого происхождения на кг массы тела пациента. Предпочтительно лечение бесплодия включает стадию определения (например, измерения) сывороточного уровня АМГ пациента и введение дозы пациенту, имеющему сывороточный уровень АМГ не менее 15 пмоль/л. В одном воплощении продукт предназначен для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ от 15 до 24,9 пмоль/л, и продукт предназначен для введения в (например, суточной) дозе, равной или эквивалентной от 0,14 до 0,19 мкг рекомбинантного ФСГ человеческого происхождения (предпочтительно от 0,15 до 0,16 мкг рекомбинантного ФСГ человеческого происхождения) на кг массы тела пациента. В данном воплощении лечение бесплодия может включать стадию определения (например, измерения) сывороточного уровня АМГ пациента и введение дозы пациенту, имеющему сывороточный уровень АМГ от 15 до 24,9 пмоль/л. В другом воплощении продукт предназначен для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ от 25 до 34,9 пмоль/л, и продукт предназначен для введения в (например, суточной) дозе, равной или эквивалентной от 0,11 до 0,14 мкг рекомбинантного ФСГ человеческого происхождения (предпочтительно от 0,12 до 0,13 мкг рекомбинантного ФСГ человеческого происхождения) на кг массы тела пациента. В данном воплощении лечение бесплодия может включать стадию определения (например, измерения) сывороточного уровня АМГ пациента и введение дозы пациенту, имеющему сывороточный уровень АМГ от 25 до 34,9 пмоль/л. В другом воплощении продукт предназначен для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ не менее 35 пмоль/л, и продукт предназначен для введения в (например, суточной) дозе, равной или эквивалентной от 0,10 до 0,11 мкг рекомбинантного ФСГ человеческого происхождения на кг массы тела пациента. В данном воплощении лечение бесплодия может включать стадию определения (например, измерения) сывороточного уровня АМГ пациента и введение дозы пациенту, имеющему сывороточный уровень АМГ не менее 35 пмоль/л. Предпочтительно ФСГ представляет собой рекомбинантный ФСГ («рФСГ» или «рекФСГ»). Предпочтительно ФСГ представляет собой рекомбинантный ФСГ, полученный из линии клеток человека. Дозы обеспечивают эффективный ответ при сведении к минимуму риска СГСЯ.
Вышеуказанные дозы могут быть предназначены для лечения бесплодия по первому протоколу стимуляции пациента (субъекта). Понятно, что для следующих циклов стимуляции дозы можно корректировать в соответствии с действительным ответом яичников в первом цикле.
Согласно изобретению в следующем аспекте предложен продукт (например, фармацевтическая композиция), содержащий фолликулостимулирующий гормон (ФСГ) для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ менее 15 пмоль/л, где продукт предназначен для введения в (например, суточной) дозе, равной или эквивалентной от 0,15 до 0,21 мкг (например, от 0,19 до 0,21 мкг) рекомбинантного ФСГ человеческого происхождения на кг массы тела пациента. Предпочтительно лечение бесплодия включает стадию определения (например, измерения) сывороточного уровня АМГ пациента и введение дозы пациенту, имеющему сывороточный уровень АМГ менее 15 пмоль/л. Однако, нет необходимости, чтобы пациенты с уровнем АМГ менее 15 пмоль/л, получали дозу продукта в соответствии с массой тела. Понятно, что эти дозы можно легко преобразовать для лечения пациентов, получающих дозу продукта в соответствии с их ИМТ (индекс массы тела), используя преобразования, хорошо известные в данной области техники.
Продукт (например, фармацевтическая композиция) может быть предназначен для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ 5,0-14,9 пмоль/л, где продукт содержит дозу, равную или эквивалентную от 6 до 18 мкг, например от 8 до 11 мкг, например от 8,5 до 10,2 мкг, рекомбинантного ФСГ человеческого происхождения. Продукт может быть предназначен для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ 15,0-29,9 пмоль/л, где продукт содержит дозу, равную или эквивалентную от 4,8 до 15 мкг, например от 6 до 9 мкг, например от 6,8 до 8,5 мкг, рекомбинантного ФСГ человеческого происхождения. Продукт может быть предназначен для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ 30-44,9 пмоль/л, где продукт содержит дозу, равную или эквивалентную от 3,6 до 12 мкг, например от 4 до 7 мкг, например от 5,1 до 6,8 мкг, рекомбинантного ФСГ человеческого происхождения. Продукт может быть предназначен для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ 45 пмоль/л или более, где продукт содержит дозу, равную или эквивалентную от 2 до 9 мкг, например от 2,4 до 9 мкг (например, от 3,4 до 5,1 мкг) или от 2 до 5 мкг рекомбинантного ФСГ человеческого происхождения. Продукт может содержать фолликулостимулирующий гормон (ФСГ), для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ 5 пмоль/л или менее, где продукт содержит дозу, равную или эквивалентную от 7,2 до 24 мкг, например от 10 до 15 мкг, например от 10,2 до 13,6 мкг, рекомбинантного ФСГ человеческого происхождения. Продукт может быть предназначен для применения в лечении бесплодия у пациента, где продукт содержит дозу, равную или эквивалентную от 4,8 до 18 мкг, например от 6 до 11 мкг, например от 6,8 до 10,2 мкг, рекомбинантного ФСГ человеческого происхождения. Предпочтительно ФСГ представляет собой рекомбинантный ФСГ («рФСГ» или «рекФСГ»). Предпочтительно ФСГ представляет собой рекомбинантный ФСГ, полученный из линии клеток человека.
Предпочтительно рФСГ (например, рекомбинантный ФСГ, полученный из линии клеток человека) включает α2,3- и α2,6-сиалирование. ФСГ (рФСГ) для применения согласно изобретению, может иметь от 1% до 99% общего сиалирования, представляющего собой α2,3-сиалирование. ФСГ (рФСГ) согласно изобретению, может иметь от 1% до 99% общего сиалирования, представляющего собой α2,6-сиалирование. Предпочтительно от 50 до 70%, например от 60 до 69%, например примерно 65%, общего сиалирования представляют собой α2,3-сиалирование. Предпочтительно от 25 до 50%, например от 30 до 50%, например от 31 до 38%, например примерно 35%, общего сиалирования представляет собой α2,6-сиалирование.
Предпочтительно рФСГ (например, рекомбинантный ФСГ, полученный из линии клеток человека) включает моно-, ди-, три- и тетра-сиалированные гликановые структуры, где 15-24%, например 17-23%, сиалированных гликановых структур представляют собой тетра-сиалированные гликановые структуры (например, как показано с помощью анализа заряженных гликанов на слабой анионообменной колонке (WAX; от англ. Weak Anion Exchange), как изложено ниже в Примерах). ФСГ включает гликаны (присоединенные к гликопротеинам ФСГ). Хорошо известно, что гликаны в ФСГ могут иметь широкое разнообразие структур. Они могут включать комбинации моно-, ди-, три- и тетра-разветвленных гликанов. В данной заявке терминология, такая как «Х% сиалированных гликановых структур представляет собой тетра-сиалированные гликановые структуры» относится к числу гликановых структур на ФСГ, являющихся тетра-сиалированными, то есть несущими четыре остатка сиаловой кислоты, выраженному в процентах (Х%) от общего числа гликановых структур на ФСГ, в любом случае являющихся сиалированными (несущими сиаловую кислоту). Таким образом, выражение «15-24% сиалированных гликановых структур представляет собой тетра-сиалированные гликановые структуры» означает, что из общего числа гликановых структур на ФСГ, несущих остатки сиаловой кислоты (то есть являющихся сиалированными) от 15 до 24% этих гликановых структур являются тетра-сиалированными (несут четыре остатка сиаловой кислоты).
рФСГ может быть представлен в виде единственной изоформы или в виде смеси изоформ.
Авторы изобретения разработали «индивидуализированные» протоколы КСЯ, в которых определенные дозы рекомбинантного ФСГ, обладающего определенными характеристиками, применяют для лечения пациентов, опираясь на их определенные уровни АМГ, таким образом, повышая вероятность адекватного ответа на стимуляцию (например, у пациентов, имеющих низкий потенциал ответа) и/или снижение риска СГСЯ (например, у пациентов, классифицированных как пациенты с повышенной реакцией или с избыточной реакцией).
Сывороточный уровень АМГ можно определить (например, измерить) любым способом, известным в данной области техники. Предпочтительно сывороточный уровень АМГ измеряют, используя набор для твердофазного иммуноферментного анализа АМГ Gen-II (Beckman Coulter, Inc., Webster, Texas). В данном анализе можно обнаружить концентрации АМГ, составляющие более 0,57 пмоль/л, при минимальном пределе количественного определения 1,1 пмоль/л. Можно использовать другие анализы.
В данной заявке сывороточные значения АМГ, как правило, указаны в пмоль/л. Эти значения можно преобразовать в нг/мл, используя уравнение преобразования: 1 нг/мл АМГ=7,1 пмоль/л АМГ.
В данной заявке термины «пациент» и «субъект» используют взаимозаменяемо.
Как в данной заявке, так и в формуле изобретения продукт (например, фармацевтическая композиция) предпочтительно содержит суточную дозу, равную или эквивалентную определенным выше количествам рФСГ человеческого происхождения. (Суточная) доза может представлять собой начальную дозу (то есть она может быть снижена, повышена или сохранена в процессе лечения).
Продукт (например, фармацевтическая композиция) может быть предназначен для (ежедневного) введения ФСГ, начиная на первые сутки лечения и продолжая в течение от семи до тринадцати суток, например от девяти до тринадцати суток, например от 10 до 13 суток, например от 10 до 11 суток. Продукт (например, фармацевтическая композиция) может быть предназначен для введения в течение от 12 до 16, например от 13 до 15, например 14 суток после введения (например, после начала введения, например, после начала ежедневного введения) агониста ГнВГ (например, синарела, люпрона, декапептила). Продукт (например, фармацевтическая композиция) может быть предназначен для введения с агонистом ГнВГ. Продукт (например, фармацевтическая композиция) может быть предназначен для введения перед введением антагониста ГнВГ (например, ганиреликса, цетрореликса), например, для введения за пять или шесть суток до введения антагониста ГнВГ. Продукт (например, фармацевтическая композиция) может быть предназначен для введения с антагонистом ГнВГ. Предпочтительно продукт (например, фармацевтическая композиция) предназначен для введения перед введением высокой (овуляторной) дозы хорионического гонадотропина человека (ХГЧ) (например от 4000 до 11000 ME ХГЧ, например 5000 ME ХГЧ, 10000 ME ХГЧ и т.д.; или от 150 до 350 микрограммов рекомбинантного ХГЧ, например 250 микрограммов рекомбинантного ХГЧ), чтобы индуцировать окончательное созревание фолликулов.
Понятно, что продукт может быть предназначен для дозирования с частотами, большими (или меньшими), чем суточные, в этом случае релевантные дозы будут эквивалентны (суточным) дозам, указанным в данной заявке.
В данной заявке термин «лечение бесплодия» включает лечение бесплодия путем контролируемой стимуляции яичников (КСЯ) или способами, включающими стадию или этап контролируемой стимуляции яичников (КСЯ), например, внутриматочное оплодотворение (ВМО), экстракорпоральное оплодотворение (ЭКО) или интрацитоплазматическая инъекция сперматозоида (ИКСИ). Термин «лечение бесплодия» включает лечение бесплодия путем индукции овуляции (ИО) или способами, включающими этап или стадию индукции овуляции (ИО). Термин «лечение бесплодия» включает лечение бесплодия у субъекта, имеющего трубное или необъяснимое бесплодие, включая лечение бесплодия у субъекта, страдающего эндометриозом, например, эндометриозом стадии I или стадии II, и/или у субъекта, страдающего ановуляторным бесплодием, например, ановуляторным бесплодием типа II согласно классификации Всемирной организации здравоохранения (ВОЗ), и/или у субъекта, имеющего партнера с мужским фактором бесплодия. Продукт (или композиция) может быть предназначен для лечения (применения в лечении) бесплодия (и/или для контролируемой стимуляции яичников) у субъекта, страдающего эндометриозом, например, эндометриозом стадии I или стадии II, как определено системой классификации Американского Общества Репродуктивной Медицины (ASRM; The American Society for Reproductive Medicine) для различных стадий эндометриоза (стадия IV самая тяжелая; стадия I наименее тяжелая) [American Society for Reproductive Medicine. Revised American Society for Reproductive Medicine classification of endometriosis: 1996. Fertil Steril 1997; 67, 817 821].
Продукт (композиция) может быть предназначен для лечения (применения в лечении) бесплодия (и/или для контролируемой стимуляции яичников) у субъекта, имеющего нормальный сывороточный уровень ФСГ от 1 до 16 МЕ/л, например от 1 до 12 МЕ/л, в ранней фолликулярной фазе.
Продукт (композиция) может быть предназначен для лечения (применения в лечении) бесплодия (и/или для контролируемой стимуляции яичников) у субъекта в возрасте от 18 до 42 лет, например от 25 до 37 лет. Продукт может быть предназначен для лечения (применения в лечении) бесплодия (и/или для контролируемой стимуляции яичников) у субъекта, имеющего ИМТ более 1 и ИМТ менее 35 кг/м2, например у субъекта, имеющего ИМТ более 18 и ИМТ менее 25 кг/м2, например у субъекта, имеющего ИМТ более 20 и ИМТ менее 25 кг/м2.
рФСГ может предпочтительно включать 27-33%, например 30-32%, три-сиалированных гликановых структур. рФСГ может предпочтительно включать 24-33%, например 26-30%, ди-сиалированных гликановых структур. рФСГ может предпочтительно включать 12-21%, например 15-17%, моно-сиалированных гликановых структур. рФСГ предпочтительно включает моно-сиалированные, ди-сиалированные, три-сиалированные и тетра-сиалированные гликановые структуры в следующих относительных количествах: 15-17% моно-сиалированных; 26-30% ди-сиалированных; 27-33% (например 29-32%, например 30-32%, например 30-31%) три-сиалированных и 17-23% тетра-сиалированных (например, как показано с помощью анализа WAX заряженных гликанов, как изложено в Примерах). рФСГ может включать от 0 до 7%, например от 0,1 до 7%, например от 3 до 6%, например от 5 до 6%, нейтральных сиалированных структур. ФСГ содержит гликаны (присоединенные к гликопротеинам ФСГ). В данной заявке терминология, такая как «Х% моно-сиалированных», «Х% ди-сиалированных», «Х% три-сиалированных» или «Х% тетра-сиалированных» относится к числу гликановых структур на ФСГ, являющихся моно-, ди-, три- или тетра-сиалированными (соответственно), выраженному в процентах (Х%) от общего числа гликановых структур на ФСГ, в любом случае являющихся сиалированными (несущих сиаловую кислоту). Таким образом, выражение «27-33% три-сиалированных гликановых структур» означает, что из общего числа гликановых структур на ФСГ, несущих остатки сиаловой кислоты (то есть являющихся сиалированными) от 27 до 33% этих гликановых структур являются три-сиалированными (несут три остатка сиаловой кислоты).
рФСГ может иметь содержание сиаловой кислоты [выраженное в виде отношения числа моль сиаловой кислоты к числу моль белка] 6 моль/моль или более, например от 6 моль/моль до 15 моль/моль, например от 8 моль/моль до 14 моль/моль, например от 10 моль/моль до 14 моль/моль, например от 11 моль/моль до 14 моль/моль, например от 12 моль/моль до 14 моль/моль, например от 12 моль/моль до 13 моль/моль. рФСГ можно продуцировать или экспрессировать в линии клеток человека.
ФСГ (рФСГ), для применения согласно изобретению, может иметь от 1% до 99% общего сиалирования, представляющего собой α2,3-сиалирование. рФСГ может иметь 10% или более общего сиалирования, представляющего собой α2,3-сиалирование. Например, 20, 30, 40, 50, 60, 70, 80 или 90% или более общего сиалирования может представлять собой α2,3-сиалирование. рФСГ может предпочтительно включать α2,3-сиалирование в количестве, составляющем от 50 до 70% общего сиалирования, например от 60 до 69% общего сиалирования, например от 63 до 67%, например около 65% общего сиалирования. ФСГ (рФСГ), для применения согласно изобретению, может иметь от 1% до 99% общего сиалирования, представляющего собой α2,6-сиалирование. рФСГ (или препарат рФСГ) по изобретению может иметь 5% или более, например, от 5% до 99% общего сиалирования, представляющего собой α2,6-сиалирование. рФСГ может иметь 50% или менее общего сиалирования, представляющего собой α2,6-сиалирование. рФСГ может предпочтительно включать α2,6-сиалирование в количестве, составляющем от 25 до 50% общего сиалирования, например от 30 до 50% общего сиалирования, например от 31 до 38%, например около 35% общего сиалирования. Под сиалированием подразумевают количество остатков сиаловой кислоты, присутствующих на углеводных структурах ФСГ. α2,3-сиалирование означает сиалирование в 2,3-положении (как хорошо известно в данной области техники) и α2,6-сиалирование в 2,6-положении (что также хорошо известно в данной области техники). Таким образом, «% общего сиалирования может представлять собой α2,3-сиалирование» относится к % общего числа остатков сиаловой кислоты, присутствующих в ФСГ, являющихся сиалированными в 2,3-положении. Термин «% общего сиалирования, представляющего собой α2,6-сиалирование» относится к % общего числа остатков сиаловой кислоты, присутствующих в ФСГ, являющихся сиалированными в 2,6-положении.
рФСГ может иметь содержание сиаловой кислоты (количество сиалирования на молекулу ФСГ), составляющее (скорее на основе массы белка, чем массы белка вместе с углеводом) 6% или более (например от 6% до 15%, например от 7% до 13%, например от 8% до 12%, например от 11% до 15%, например от 12% до 14%) по массе.
рФСГ может представлять собой рФСГ или препарат рФСГ, в котором 16% или менее (например, от 0,1 до 16%) гликанов содержат (например, несут) разделяющий N-ацетилглюкозамин («разделяющий GlcNAc» или «бисGlcNAc»). Предпочтительно, рФСГ (или препарат рФСГ) представляет собой рФСГ или препарат рФСГ, в котором от 8 до 14,5% гликанов содержат (например, несут) разделяющий N-ацетилглюкозамин («разделяющий GlcNAc» или «бисGlcNAc»).
Понятно, что ФСГ содержит гликаны, присоединенные к гликопротеинам ФСГ. Также понятно, что 100% гликанов относится ко всем гликанам или означает все гликаны, присоединенные к гликопротеинам ФСГ. Таким образом, в данной заявке терминология «от 8 до 14,5% гликанов содержат (несут) разделяющий N-ацетилглюкозамин» означает, что от 8 до 14,5% от общего числа гликанов, присоединенных к гликопротеинам ФСГ, включают/несут разделяющий N-ацетилглюкозамин; «16% или менее гликанов включают (несут) разделяющий N-ацетилглюкозамин» означает, что 16% или менее от общего числа гликанов, присоединенных к гликопротеинам ФСГ, включают/несут разделяющий N-ацетилглюкозамин, и т.д.
Авторы изобретения обнаружили, что рекомбинантный ФСГ (препараты рФСГ; композиции рФСГ), в котором 16% или менее (например, от 8 до 14,5%) гликанов, содержащихся в гликопротеинах ФСГ, несут разделяющий GlcNac, может обладать преимущественными фармакокинетическими свойствами. Считают, что эти предпочтительные свойства, которые могут быть результатом количества гликанов, несущих разделяющий GlcNac, имеют сходство с продуктом Бравель, полученным из мочи человека, в меньшей степени, чем с другими препаратами рекомбинантного ФСГ, такими как раскрытые в документе WO 2012/017058.
рФСГ (или препарат рФСГ) может представлять собой рФСГ или препарат рФСГ, в котором 20% или более гликанов содержат (например, несут) N-ацетилгалактозамин (GalNAc), например, в котором 20% или более гликанов содержат (например, несут) концевой GalNAc. Предпочтительно рФСГ (или препарат рФСГ) представляет собой ФСГ или препарат ФСГ, в котором от 40 до 55%, например от 42% до 52%, гликанов содержат (например, несут) GalNAc. Предпочтительно рФСГ (или препарат рФСГ) представляет собой ФСГ или препарат ФСГ, в котором от 40 до 55%, например, от 42% до 52%, гликанов содержат (например, несут) концевой GalNAc.
Понятно, что ФСГ включает гликаны, присоединенные к гликопротеинам ФСГ. Также понятно, что 100% гликанов относится ко всем гликанам или означает все гликаны, присоединенные к гликопротеинам ФСГ. Таким образом, в данной заявке терминология «где 20% или более гликанов содержат (например, несут) GalNAc» означает, что 20% или более от общего числа гликанов, присоединенных к гликопротеинам ФСГ, включают/несут N-ацетилгалактозамин (GalNAc); «от 40 до 55%, например от 42% до 52%, гликанов содержат (например, несут) концевой GalNAc» означает, что от 40 до 55%, например от 42% до 52%, от общего числа гликанов, присоединенных к гликопротеинам ФСГ, включают/несут концевой GalNAc, и т.д.
Оказывается, что наличие α2,6-связи увеличивает число тетра-сиалированных структур по сравнению с продуктами, полученными из клеток СНО, которые имеют в наличии только α2,3-связь. Авторы изобретения также обнаружили, что их рФСГ отличается от других одобренных продуктов композицией сахара: он включает или может включать определенное количество GalNac. Это может быть связано с тетра-сиалированием и эффективностью, поскольку 2,6-сиалирование связано с GalNac. Другими словами, авторы настоящего изобретения разработали продукт рФСГ, который включает определенные характеристики (2,6-линкерные сайты, GalNac), обеспечивающие рФСГ высокую степень сиалирования, что, по-видимому, приводит к улучшенной эффективности in vivo.
рФСГ (или препарат рФСГ) может иметь от 16 до 24% гликанов, содержащих (например, концевой) одну фукозу Льюиса, например, от 16,5 до 18% гликанов, содержащих (например, концевой) одну фукозу Льюиса. рФСГ (или препарат рФСГ) может иметь от 1,5 до 4,5%, например от 2 до 4%, например 3,7%, гликанов, содержащих (например, концевой) две фукозы Льюиса. Содержание фукозы Льюиса может оказывать влияние на эффективность.
рФСГ можно продуцировать или экспрессировать в линии клеток человека, например, в линии клеток Per.С6, в линии клеток HEK293, в линии клеток НТ1080 и т.д. Это может упростить (и сделать более эффективным) способ продуцирования, поскольку манипуляции и контроль, например, среды для роста клеток для сохранения сиалирования, могут быть менее критичными, чем при известных методах. Способ может также быть более эффективным, поскольку продуцируется меньшее количество основного рФСГ по сравнению с продуцированием известных продуктов рФСГ; продуцируется более кислый рФСГ, и выделение/извлечение основного ФСГ менее проблематично. рФСГ можно продуцировать или экспрессировать в линии клеток PER.C6®, в линии клеток, имеющей происхождение от PER.C6®, или модифицированной линии клеток PER.C6®. рФСГ, продуцируемый или экспрессируемый в линии клеток человека (например, в линии клеток PER.C6®, в линии клеток HEK293, в линии клеток НТ1080 и т.д.), включает некоторое количество α2,6-связанных сиаловых кислот (α2,6-сиалирование), обеспечиваемых активностью эндогенной сиалилтрансферазы [линии клеток], и включает некоторое количество α2,3-связанных сиаловых кислот (α2,3-сиалирование), обеспечиваемых эндогенной активностью сиалилтрансферазы. Линия клеток может быть модифицирована с использованием α2,3-сиалилтрансферазы. Линия клеток может быть модифицирована с использованием α2,6-сиалилтрансферазы. Альтернативно или дополнительно рФСГ может включать α2,6-связанные сиаловые кислоты (α2,6-сиалирование), обеспечиваемые активностью эндогенной сиалилтрансферазы [линии клеток]. В данной заявке термин «рекомбинантный ФСГ человеческого происхождения» означает рекомбинантный ФСГ, продуцируемый или экспрессируемый в линии клеток человека (например, рекомбинантный ФСГ, полученный путем конструирования линии клеток человека методами генной инженерии).
рФСГ можно продуцировать, используя α2,3- и/или α2,6-сиалилтрансферазу. В примере рФСГ продуцируют, используя α2,3-сиалилтрансферазу. рФСГ может включать α2,6-связанные сиаловые кислоты (α2,6-сиалирование), обеспечиваемые активностью эндогенной сиалилтрансферазы.
Продукт может представлять собой фармацевтическую композицию. Фармацевтическая композиция предназначена для лечения бесплодия. Лечение бесплодия может включать технологии вспомогательной репродукции (ВРТ), индукцию овуляции или внутриматочное оплодотворение (ВМО). Фармацевтическую композицию можно применять, например, при медицинских показаниях, где применяют известные препараты ФСГ.
Продукт или композицию можно готовить в виде хорошо известных композиций для любого пути введения лекарственного средства, например, перорального, ректального, парентерального, чрескожного (например, технология пластырей), внутривенного, внутримышечного, подкожного, интрацистернального, интравагинального, интраперитонеального, местного (порошки, мази или капли) или в виде трансбуккального или назального спрея. Типичная композиция содержит фармацевтически приемлемый носитель, такой как водный раствор, нетоксичные эксципиенты, включая соли и консерванты, буферы и тому подобное, как описано среди прочего в Remington's Pharmaceutical Sciences, пятнадцатое издание (Matt Publishing Company, 1975), на стр. 1405-1412 и 1461-87, и в четырнадцатом издании национального фармакологического справочника XIV (American Pharmaceutical Association, 1975).
Примеры подходящих водных и неводных фармацевтических носителей, разбавителей, растворителей или наполнителей включают воду, этанол, полиолы (такие как глицерин, пропиленгликоль, полиэтиленгликоль и тому подобное), карбоксиметилцеллюлозу и ее подходящие смеси, растительные масла (такие как оливковое масло) и инъекционные органические сложные эфиры, такие как этилолеат. Композиции по настоящему изобретению также могут содержать добавки, такие как, но не ограниченные ими, консерванты, увлажняющие агенты, эмульгирующие агенты, поверхносто-активные вещества и диспергирующие агенты. Антибактериальные и противогрибковые агенты, которые можно включать для предотвращения роста микроорганизмов, включают, например, мета-крезол, бензиловый спирт, парабен, хлорбутанол, фенол, сорбиновую кислоту и тому подобное. При включении консерванта предпочтительны бензиловый спирт, фенол и/или мета-крезол; однако, консервант никоим образом не ограничен этими примерами. Кроме того, может быть желательным включать изотонические агенты, такие как сахара, хлорид натрия и тому подобное. Продукт или композиция могут дополнительно содержать соль, содержащую фармацевтически приемлемый катион щелочного металла, выбранную из группы, состоящей из солей Na+ или K+, или их комбинации. Предпочтительно соль представляет собой соль Na+, например, NaCl или Na2SO4.
Предпочтительно продукт или композиция содержат рекомбинантный ФСГ и одно или более чем одно из следующих веществ: полисорбата 20, L-метионина, фенола, динатрий-сульфатного и натрий-фосфатного буфера.
В некоторых случаях, чтобы осуществить пролонгированное действие, желательно замедлить всасывание ФСГ (и других активных ингредиентов, если они присутствуют) из подкожной или внутримышечной инъекции. Это может быть выполнено путем использования жидкой суспензии кристаллического или аморфного вещества, обладающего слабой растворимостью в воде. Скорость всасывания ФСГ в этом случае зависит от скорости его растворения, которая, в свою очередь, может зависеть от размера кристалла и кристаллической формы. Альтернативно, замедленное всасывание вводимой парентерально комбинированной формы ФСГ выполняют путем растворения или суспендирования комбинации ФСГ в масляном носителе. Инъекционные депо-формы могут быть получены путем образования микроинкапсулированных матриц ФСГ (и других агентов, если они присутствуют) в биоразлагаемых полимерах, таких как сополимер полилактида и полигликолида. В зависимости от отношения ФСГ к полимеру и от природы конкретного применяемого полимера можно контролировать скорость высвобождения ФСГ. Примеры других биоразлагаемых полимеров включают поливинилпирролидон, поли(ортоэфиры), поли(ангидриды) и т.д. Инъекционные депо-композиции также готовят путем включения ФСГ в липосомы или микроэмульсии, совместимые с тканями организма.
Инъекционные композиции можно стерилизовать, например, фильтрованием через фильтр, задерживающий бактерии, или включением стерилизующих агентов в форме стерильных твердых композиций, которые можно растворять или диспергировать в стерильной воде или в другой стерильной инъекционной среде непосредственно перед применением. Инъекционные композиции можно поставлять в любом подходящем контейнере, например флаконе, предварительно заполненном шприце, инъекционных картриджах и тому подобном.
Продукт или композицию можно готовить для однократного применения или для многократного применения (многократная доза). Если продукт или композицию готовят для многократного применения, предпочтительно включать консервант. При включении консерванта предпочтительны бензиловый спирт, фенол и/или мета-крезол, однако, консервант никоим образом не ограничен этими примерами. Продукт или композиция, приготовленные для однократного применения или для многократного применения, могут дополнительно содержать соль, содержащую фармацевтически приемлемый катион щелочного металла, выбранную из группы, состоящей из солей Na+ или K+ или их комбинации. Предпочтительно соль представляет собой соль Na+, например, NaCl или Na2SO4.
Продукт или композицию можно включать в контейнер, такой как флакон, предварительно заполненный картридж (например, для однократного введения или многократного применения) или инъекционное устройство, такое как «ручка», например, для введения многократных доз.
Продукт или композиция могут представлять собой композицию (например, инъекционную композицию), включающую ФСГ (возможно вместе с ХГЧ, ЛГ, активностью ЛГ и т.д.). Активность ЛГ, если она присутствует, может иметь происхождение от ЛГ или хорионического гонадотропина человека, ХГЧ. При наличии более чем одного активного ингредиента (то есть ФСГ и, например, ХГЧ или ЛГ) эти ингредиенты могут подходить для введения раздельно или совместно. При раздельном введении такое введение может быть последовательным. Продукт можно поставлять в любой подходящей упаковке. Например, продукт может включать ряд контейнеров (например, предварительно заполненных шприцов или флаконов), содержащих либо ФСГ, либо ХГЧ, либо комбинацию ФСГ и ХГЧ. ХГЧ может представлять собой рекомбинантный ХГЧ или ХГЧ из мочи. Если продукт включает ряд контейнеров (например, предварительно заполненных шприцов или флаконов), содержащих ФСГ, например, рекомбинантный ФСГ, каждый контейнер может включать одинаковое количество ФСГ. Один или более чем один контейнер может включать различное количество ФСГ. Шприцы или флаконы могут быть упакованы в блистерную упаковку или другие средства для поддержания стерильности. Любой продукт может возможно содержать инструкции по применению композиций ФСГ (и, например, ХГЧ при его наличии). рН и точную концентрацию различных компонентов фармацевтической композиции корректируют в соответствии с обычной практикой в данной области техники. См. документ GOODMAN and GILMAN's THE PHARMACOLOGICAL BASIS FOR THERAPEUTICES, 7th ed. В предпочтительном воплощении композиции по изобретению поставляют в виде композиций для парентерального введения. Общие способы изготовления парентеральных препаратов известны в данной области техники и описаны в REMINGTON; THE SCIENCE AND PRACTICE OF PHARMACY, см. выше, на стр. 780-820. Парентеральные композиции можно поставлять в виде жидкой композиции или в виде твердого вещества, которое может быть смешано со стерильной инъекционной средой непосредственно перед введением. В особенно предпочтительном воплощении парентеральные композиции поставляют в виде стандартной лекарственной формы для простоты введения и однородности дозировки.
Согласно настоящему изобретению в следующем аспекте предложен способ лечения бесплодия, включающий: (а) измерение сывороточного уровня АМГ субъекта; и (б) введение субъекту дозы, равной или эквивалентной 1-24 мкг, например 2-24 мкг, например 2-15 мкг, рекомбинантного ФСГ человеческого происхождения. Предпочтительно доза составляет или эквивалентна от 4,5 до 12,5 мкг, например от 5 до 12,5 мкг, например от 6 до 12,5 мкг, например от 6,3 до 12 мкг, рекомбинантного ФСГ человеческого происхождения.
Согласно настоящему изобретению в следующем аспекте предложен способ лечения бесплодия, включающий: (а) определение (например, измерение) сывороточного уровня АМГ субъекта; и (б) введение (например, суточной) дозы, равной или эквивалентной от 9 до 14 мкг, например от 11 до 13 мкг, например 12 мкг, рекомбинантного фолликулостимулирующего гормона (ФСГ) человеческого происхождения субъекту, имеющему сывороточный уровень АМГ менее 15 пмоль/л (например, от 0,05 пмоль/л до 14,9 пмоль/л). Предпочтительно ФСГ представляет собой рекомбинантный ФСГ («рФСГ» или «рекФСГ»). Предпочтительно ФСГ представляет собой рекомбинантный ФСГ, полученный из линии клеток человека. Доза обеспечивает эффективный ответ при сведении к минимуму риска СГСЯ.
Согласно настоящему изобретению в следующем аспекте предложен способ лечения бесплодия, включающий: (а) определение (например, измерение) сывороточного уровня АМГ субъекта; и (б) введение (например, суточной) дозы, равной или эквивалентной от 5 до 12,5 мкг рекомбинантного фолликулостимулирующего гормона (ФСГ) человеческого происхождения субъекту, имеющему сывороточный уровень АМГ не менее 15 пмоль/л. Доза (например, суточная доза) может составлять или быть эквивалентной от 6 до 10 мкг рекомбинантного фолликулостимулирующего гормона (ФСГ) человеческого происхождения. Предпочтительно ФСГ представляет собой рекомбинантный ФСГ («рФСГ» или «рекФСГ»). Предпочтительно ФСГ представляет собой рекомбинантный ФСГ, полученный из линии клеток человека. Доза обеспечивает эффективный ответ при сведении к минимуму риска СГСЯ.
В одном воплощении способ включает стадию введения (например, суточной) дозы, равной или эквивалентной от 5 до 12 мкг, например от 7 до 12 мкг, например от 8,7 до 10 мкг, рекомбинантного ФСГ человеческого происхождения (предпочтительно от 9 до 10 мкг рекомбинантного ФСГ человеческого происхождения) субъекту, имеющему сывороточный уровень АМГ от 15 до 24,9 пмоль/л. В другом воплощении способ включает стадию введения (например, суточной) дозы, равной или эквивалентной от 5 до 12 мкг рекомбинантного ФСГ человеческого происхождения (например от 7 до 12 мкг, например от 6 до 9 мкг, например от 7 до 8 мкг, например от 7,3 до 8 мкг, рекомбинантного ФСГ человеческого происхождения) субъекту, имеющему сывороточный уровень АМГ от 25 до 34,9 пмоль/л. В другом воплощении способ включает стадию введения (например, суточной) дозы, равной или эквивалентной от 5 до 11 мкг рекомбинантного ФСГ человеческого происхождения (например от 6 до 7 мкг, например от 6,3 до 7 мкг, рекомбинантного ФСГ человеческого происхождения) субъекту, имеющему сывороточный уровень АМГ не менее 35 пмоль/л.
Согласно настоящему изобретению в следующем аспекте предложен способ лечения бесплодия, включающий: (а) определение (например, измерение) сывороточного уровня АМГ субъекта; и (б) введение (например, суточной) дозы, равной или эквивалентной от 0,09 до 0,19 мкг (например от 0,09 до 0,17 мкг) рекомбинантного ФСГ человеческого происхождения на кг массы тела субъекта, где субъект имеет сывороточный уровень АМГ не менее 15 пмоль/л. Предпочтительно ФСГ представляет собой рекомбинантный ФСГ («рФСГ» или «рекФСГ»). Предпочтительно ФСГ представляет собой рекомбинантный ФСГ, полученный из линии клеток человека. Доза обеспечивает эффективный ответ при сведении к минимуму риска СГСЯ.
В одном воплощении способ включает стадию введения (например, суточной) дозы, равной или эквивалентной от 0,14 до 0,19 мкг рекомбинантного ФСГ человеческого происхождения (предпочтительно от 0,15 до 0,16 мкг рекомбинантного ФСГ человеческого происхождения) на кг массы тела субъекта, где субъект имеет сывороточный уровень АМГ от 15 до 24,9 пмоль/л. В другом воплощении способ включает стадию введения (например, суточной) дозы, равной или эквивалентной от 0,11 до 0,14 мкг рекомбинантного ФСГ человеческого происхождения (предпочтительно от 0,12 до 0,13 мкг рекомбинантного ФСГ человеческого происхождения) на кг массы тела субъекта, где субъект имеет сывороточный уровень АМГ от 25 до 34,9 пмоль/л. В другом воплощении способ включает стадию введения (например, суточной) дозы, равной или эквивалентной от 0,10 до 0,11 мкг рекомбинантного ФСГ человеческого происхождения на кг массы тела субъекта, где субъект имеет сывороточный уровень АМГ не менее 35 пмоль/л. Предпочтительно ФСГ представляет собой рекомбинантный ФСГ («рФСГ» или «рекФСГ»). Предпочтительно ФСГ представляет собой рекомбинантный ФСГ, полученный из линии клеток человека. Эти дозы обеспечивают эффективный ответ при сведении к минимуму риска СГСЯ.
Согласно настоящему изобретению в следующем аспекте предложен способ лечения бесплодия, включающий: (а) определение (например, измерение) сывороточного уровня АМГ субъекта; и (б) введение (например, суточной) дозы, равной или эквивалентной от 0,15 до 0,21 мкг (например, от 0,19 до 0,21 мкг) рекомбинантного ФСГ человеческого происхождения на кг массы тела субъекта, где субъект имеет сывороточный уровень АМГ менее 15 пмоль/л.
Введение предпочтительно включает суточную дозу, равную или эквивалентную количеству ФСГ, определенному выше и в формуле изобретения. (Суточная) доза может представлять собой начальную дозу (она может быть снижена, повышена или сохранена в процессе лечения).
Способ может представлять собой способ лечения бесплодия по первому протоколу стимуляции пациента (субъекта). Понятно, что для следующих циклов стимуляции дозы могут быть скорректированы в соответствии с действительным ответом яичников в первом цикле.
Согласно настоящему изобретению в следующем аспекте предложен способ лечения бесплодия, включающий: (а) определение (например, измерение) сывороточного уровня АМГ субъекта;
и (б) если субъект имеет сывороточный уровень АМГ менее 15 пмоль/л (например, от 0,05 пмоль/л до 14,9 пмоль/л), введение субъекту дозы, равной или эквивалентной от 10 до 14 мкг, например от 11 до 13 мкг, например 12 мкг, рекомбинантного фолликулостимулирующего гормона (ФСГ) человеческого происхождения; или,
если субъект имеет сывороточный уровень АМГ от 15 до 24,9 пмоль/л, введение субъекту дозы, равной или эквивалентной от 0,14 до 0,19 мкг рекомбинантного ФСГ человеческого происхождения (предпочтительно от 0,15 до 0,16 мкг рекомбинантного ФСГ человеческого происхождения) на кг массы тела субъекта; или,
если субъект имеет сывороточный уровень АМГ от 25 до 34,9 пмоль/л, введение субъекту дозы, равной или эквивалентной от 0,11 до 0,14 мкг рекомбинантного ФСГ человеческого происхождения (предпочтительно от 0,12 до 0,13 мкг рекомбинантного ФСГ человеческого происхождения) на кг массы тела субъекта; или
если субъект имеет сывороточный уровень АМГ не менее 35 пмоль/л, введение субъекту дозы, равной или эквивалентной от 0,10 до 0,11 мкг рекомбинантного ФСГ человеческого происхождения на кг массы тела субъекта.
Пациенту (субъекту), имеющему сывороточный уровень АМГ 5,0-14,9 пмоль/л, можно вводить дозу равную или эквивалентную от 6 до 18 мкг, например от 8 до 11 мкг, например от 8,5 до 10,2 мкг, рекомбинантного ФСГ человеческого происхождения. Пациенту (субъекту), имеющему сывороточный уровень АМГ 15,0-29,9 пмоль/л, можно вводить дозу, равную или эквивалентную от 4,8 до 15 мкг, например от 6 до 9 мкг, например от 6,8 до 8,5 мкг, рекомбинантного ФСГ человеческого происхождения. Пациенту (субъекту), имеющему сывороточный уровень АМГ 30-44,9 пмоль/л, можно вводить дозу, равную или эквивалентную от 3,6 до 12 мкг, например от 4 до 7 мкг, например от 5,1 до 6,8 мкг, рекомбинантного ФСГ человеческого происхождения. Пациенту (субъекту), имеющему сывороточный уровень АМГ 45 пмоль/л или более, можно вводить дозу, равную или эквивалентную от 2 до 9 мкг, например от 2,4 до 9 мкг (например от 3,4 до 5,1 мкг) или от 2 до 5 мкг, рекомбинантного ФСГ человеческого происхождения. Пациенту (субъекту), имеющему сывороточный уровень АМГ 5 пмоль/л или менее, можно вводить дозу, равную или эквивалентную от 7,2 до 24 мкг, например от 10 до 15 мкг, например от 10,2 до 13,6 мкг, рекомбинантного ФСГ человеческого происхождения. В некоторых примерах вводят дозу, равную или эквивалентную от 4,8 до 18 мкг, например от 6 до 11 мкг, например от 6,8 до 10,2, мкг рекомбинантного ФСГ человеческого происхождения. Предпочтительно ФСГ представляет собой рекомбинантный ФСГ («рФСГ» или «рекФСГ»). Предпочтительно ФСГ представляет собой рекомбинантный ФСГ, полученный из линии клеток человека. Введение предпочтительно включает суточную дозу, равную или эквивалентную количеству ФСГ, определенному выше и в формуле изобретения. (Суточная) доза может представлять собой начальную дозу (она может быть снижена, повышена или сохранена в процессе лечения).
Подробное описание изобретения
Теперь настоящее изобретение будет описано более подробно со ссылкой на прилагаемые графические материалы, в которых:
На фиг. 1 представлена плазмидная карта экспрессионного вектора pFSHalpha/beta (экспрессионный вектор ФСГ);
На фиг. 2 представлен экспрессионный вектор α2,3-сиалилтрансферазы (ST3GAL4);
На фиг. 3 представлен экспрессионный вектор α2,6-сиалилтрансферазы (ST6GAL1);
На фиг. 4 представлено распределение % относительного содержания сиаловой кислоты (ось Y) примеров рекомбинантного ФСГ, продуцируемого клетками PER.C6®, стабильно экспрессирующими ФСГ после конструирования с α2,3-сиалилтрансферазой;
На фиг. 5 представлено распределение % относительного содержания (ось Y) гликанового заряда примеров рекомбинантного ФСГ, продуцируемого клетками PER.C6®, стабильно экспрессирующими ФСГ после конструирования с α2,3-сиалилтрансферазой;
На фиг. 6 показана динамика изменения концентрации ингибина В по времени; представлено сравнение концентрации ингибина-В после введения 225 ME Гонала-ф (нижняя линия, пунктирная линия) и 225 ME Примера по изобретению (верхняя линия, сплошная линия);
На фиг. 7 показан эффект массы тела на ооциты, извлеченные в группе лечения низкой дозой АМГ (Пример 10, 10А); и
На фиг. 8 показан эффект массы тела на ооциты, извлеченные в группе лечения высокой дозой АМГ.
Отбор последовательности
ФСГ человека
Кодирующую область гена полипептида ФСГ альфа использовали в соответствии с документом Fiddes and Goodman (1981). Эта последовательность внесена в банк под номером АН007338, и на момент конструирования не было других вариантов этой белковой последовательности. Эта последовательность обозначена в данной заявке как SEQ ID NO: 1.
Кодирующую область гена полипептида ФСГ бета использовали в соответствии с документом Keene et al (1989). Эта последовательность внесена в банк под номером NM_000510, и на момент конструирования не было других вариантов этой белковой последовательности. Эта последовательность обозначена в данной заявке как SEQ ID NO: 2.
Сиалилтрансфераза
α2,3-Сиалилтрансфераза: кодирующую область гена бета-галактозид-альфа-2,3-сиалилтрансферазы 4 (α2,3-сиалилтрансферазы, ST3GAL4) использовали в соответствии с документом Kitagawa and Paulson (1994). Эта последовательность внесена в банк под номером L23767 и обозначена в данной заявке как SEQ ID NO: 3.
α2,6-Сиалилтрансфераза: кодирующую область гена бета-галактозамид-альфа-2,6-сиалилтрансферазы 1 (α2,6-сиалилтрансфераза, ST6GAL1) использовали в соответствии с документом Grundmann et al. (1990). Эта последовательность внесена в банк под номером NM_003032 и обозначена в данной заявке как SEQ ID NO: 4.
ПРИМЕРЫ
Пример 1. Конструирование экспрессионного вектора ФСГ
Кодирующую последовательность полипептида ФСГ альфа (АН007338, SEQ ID NO: 1) и полипептида ФСГ бета (NM_003032, SEQ ID NO: 2) амплифицировали с помощью полимеразной цепной реакции (ПЦР), используя комбинации праймеров FSHa-fw и FSHa-rev и FSHb-fw и FSHb-rev, соответственно.
FSHa-fw 5'-CCAGGATCCGCCACCATGGATTACTACAGAAAAATATGC-3' (SEQ ID NO: 9)
FSHa-rev 5'-GGATGGCTAGCTTAAGATTTGTGATAATAAC-3' (SEQ ID NO: 10)
FSHb-fw 5'-CCAGGCGCGCCACCATGAAGACACTCCAGTTTTTC-3' (SEQ ID NO: 11)
FSHb-rev 5'-CCGGGTTAACTTATTATTCTTTCATTTCACCAAAGG-3' (SEQ ID NO: 12)
Полученную в результате амплифицированную ДНК ФСГ бета расщепляли ферментами рестрикции AscI и HpaI и встраивали в сайты AscI и HpaI экспрессионного вектора млекопитающих, направляемого CMV (цитомегаловирус), несущего селективный маркер устойчивости к неомицину. Аналогично ДНК ФСГ альфа расщепляли BamHI и NheI и встраивали в сайты BamHI и NheI на экспрессионном векторе, уже содержащем ДНК полипептида ФСГ бета.
Векторную ДНК использовали для трансформации штамма DH5α E.coli. Колонии собирали для амплификации. Колонии, содержащие вектор, включающий ФСГ альфа и бета, отбирали для секвенирования, и все они содержали верные последовательности в соответствии с SEQ ID NO: 1 и SEQ ID NO: 2. Плазмида pFSH A+B#17 была отобрана для трансфекции (фиг. 1).
Пример 2. Конструирование экспрессионного вектора ST3
Кодирующую последовательность бета-галактозид-альфа-2,3-сиалилтрансферазы 4 (ST3, L23767, SEQ ID NO: 3) амплифицировали с помощью ПЦР, используя комбинацию праймеров 2,3STfw и 2,3STrev.
2,3STfw5-CCAGGATCCGCCACCATGTGTCCTGCAGGCTGGAAGC-3' (SEQ ID NO: 13)
2,3STrev 5'-TTTTTTTCTTAAGTCAGAAGGACGTGAGGTTCTTG-3' (SEQ ID NO: 14)
Полученную в результате амплифицированную ДНК ST3 расщепляли ферментами рестрикции BamHI и AflII и встраивали в сайты BamHI и AflII экспрессионного вектора млекопитающих, направляемого CMV, несущего маркер устойчивости к гигромицину. Вектор амплифицировали, как описано выше, и секвенировали. Клон pST3#1 (фиг. 2) содержал верную последовательность в соответствии с SEQ ID NO: 3 и был отобран для трансфекции.
Пример 3. Конструирование экспрессионного вектора ST6
Кодирующую последовательность бета-галактозамид-альфа-2,6-сиалилтрансферазы 1 (ST6, NM_003032, SEQ ID NO: 4) амплифицировали с помощью ПЦР, используя комбинацию праймеров 2,6STfw и 2,6STrev.
2,6STfw 5'-CCAGGATCCGCCACCATGATTCACACCAACCTGAAG-3' (SEQ ID NO: 15)
2,6STrev 5'-TTTTTTTCTTAAGTTAGCAGTGAATGGTCCGG-3' (SEQ ID NO: 16)
Полученную в результате амплифицированную ДНК ST6 расщепляли ферментами рестрикции BamHI и AflII и встраивали в сайты BamHI и AflII экспрессионного вектора млекопитающих, направляемого CMV, несущего маркер устойчивости к гигромицину. Вектор амплифицировали, как описано выше, и секвенировали. Клон pST6#11 (фиг. 3) содержал верную последовательность в соответствии с SEQ ID NO: 4 и был отобран для трансфекции.
Пример 4. Стабильная экспрессия pFSH α+β в клетках PER.C6®
Выделение трансфектантов и скрининг клонов
Клоны PER.C6®, продуцирующие ФСГ, были получены путем экспрессии обеих полипептидных цепей ФСГ с одной плазмиды (см. Пример 1).
Для получения стабильных клонов использовали агент трасфекции на основе липосом с конструкцией pFSH α+β. Стабильные клоны отбирали в среде VPRO дополненной 10% фетальной сыворотки теленка (ФСТ) и содержащей G418. Через три недели после трансфекции вырастали клоны, устойчивые к G418. Клоны отбирали для выделения. Выделенные клоны культивировали в селективной среде до 70-80% конфлюэнтности. Супернатанты анализировали на содержание белка ФСГ, используя ФСГ-селективный твердофазный иммуноферментный анализ (ELISA), и на фармакологическую активность при рецепторе ФСГ в клонированной линии клеток, используя анализ накопления цАМФ (циклический аденозинмонофосфат). Клоны, экспрессирующие функциональный белок, переносили в 24-луночные планшеты, 6-луночные планшеты и флаконы Т80 для размножения в культуре.
Исследования для определения продуктивности и качества материала из семи клонов начинали во флаконах Т80, чтобы получить достаточно материала. Клетки культивировали в обогащенной среде, как описано выше, в течение 7 суток, и супернатант собирали. Продуктивность определяли, используя ФСГ-селективный анализ ELISA. Изоэлектрический профиль материала определяли с помощью изоэлектрического фокусирования (ИЭФ) способами, известными в данной области техники. Клоны, обладающие достаточной продуктивностью и качеством, отбирали для конструирования сиалилтрансферазы.
Пример 5. Уровень сиалирования повышается в клетках с гиперэкспрессией α2,3-сиалилтрансферазы. Стабильная экспрессия pST3 в клетках PER.C6®, экспрессирующих ФСГ; выделение трансфектантов и скрининг клонов
Клоны PER.C6®, продуцирующие высоко сиалированный ФСГ, были получены путем экспрессии α2,3-сиалилтрансферазы с отдельных плазмид (Пример 2) в клетках PER.C6®, уже экспрессирующих обе полипептидные цепи ФСГ (из Примера 4). Клоны, полученные из клеток PER.C6®, как изложено в Примере 4, были отобраны на основании их характеристик, включающих продуктивность, хороший профиль роста, продуцирование функционального белка и продуцируемый ФСГ, включающий некоторое сиалирование. Стабильные клоны были получены, как описано выше в Примере 4. Клоны выделяли, размножали и анализировали. Клоны α2,3-сиалилтрансферазы были адаптированы к среде без сыворотки и условиям суспензии.
Как описано выше, клоны анализировали, используя ФСГ-селективный анализ ELISA, функциональный ответ в линии клеток рецептора ФСГ, ИЭФ, скорость метаболического клиренса и анализ Стильмана-Поули. Результаты сравнивали с имеющимся в продаже рекомбинантным ФСГ (Гоналом-ф, Serono) и ФСГ родительских линий клеток PER.C6®. ФСГ, продуцируемый большинством клонов, имел значительно улучшенное сиалирование (то есть в среднем большее число изоформ ФСГ с большим количеством сиаловых кислот) по сравнению с ФСГ, экспрессируемым без α2,3-сиалилтрансферазы. В заключение, экспрессия ФСГ вместе с сиалилтрансферазой в клетках PER.C6® привела в результате к повышенным уровням сиалированного ФСГ по сравнению с клетками, экспрессирующими только ФСГ.
Пример 6. Обзор продуцирования и очистки
Метод был разработан для продуцирования ФСГ в клетках PER.C6®, культивируемых в суспензии в среде без сыворотки. Метод описан ниже, и был применен к нескольким ФСГ-продуцирующим линиям клеток PER.C6®.
ФСГ из α2,3-клона (Пример 5) был получен, используя модификацию способа, описанного Lowry et al. (1976).
Для продуцирования PER.C6®-ФСГ эти линии клеток были адаптированы к среде без сыворотки, например, Excell 525 (JRH Biosciences). Сначала клетки культивировали до образования 70%-90% конфлюэнтного монослоя в культуральном флаконе Т80. При пересеве клетки ресуспендировали в среде без сыворотки Excell 525 с добавлением 4 мМ L-глутамина до плотности клеток 0,3×106 клеток/мл. 25 мл клеточной суспензии помещали во встряхиваемую колбу на 250 мл и встряхивали при 100 об/мин при 37°С при 5% СО2. После достижения плотности клеток более 1×106 клеток/мл клетки субкультивировали до плотности клеток 0,2 или 0,3×106 клеток/мл и далее культивировали во встряхиваемых колбах при 37°С, 5% СО2 и 100 об/мин.
Для продуцирования ФСГ клетки переносили в среду без сыворотки для продуцирования, то есть VPRO (JRH Biosciences), которая поддерживает рост клеток PER.C6® до очень высоких плотностей клеток (обычно более 107 клеток/мл в периодической культуре). Сначала клетки культивировали до более 1×106 клеток/мл в Excell 525, затем центрифугировали в течение 5 мин при 1000 об/мин, а затем суспендировали в среде VPRO с добавлением 6 мМ L-глутамина до плотности 1×106 клеток/мл. Затем клетки культивировали во встряхиваемой колбе в течение 7-10 суток при 37°С, 5% СО2 и 100 об/мин. В течение этого периода клетки вырастали до плотности более 107 клеток/мл. Культуральную среду собирали после того, как жизнеспособность клеток начинала снижаться. Клетки центрифугировали в течение 5 мин при 1000 об/мин, и супернатант использовали для количественного определения и очистки ФСГ. Концентрацию ФСГ определяли, используя ELISA (DRG EIA 1288).
Затем очистку ФСГ выполняли, используя модификацию способа, описанного Lowry et al. (1976). Очистку с использованием хроматографии с селективным зарядом проводили для обогащения высоко сиалированных форм способами, хорошо известными в данной области техники.
В процессе всех хроматографических методов обогащение сиалированных форм ФСГ, заявленных в данном изобретении, подтверждали радиоиммунологическим анализом (РИА) (DRG EIA 1288) и/или ИЭФ.
Пример 7. Количественное определение относительных количеств α2,3- и α2,6-сиаловой кислоты
Относительные процентные количества α2,3- и α2,6-сиаловой кислоты на очищенном рФСГ (Пример 6) измеряли, используя известные методы.
N-Гликаны высвобождали из образцов, используя пептид-N-гликозидазу (PNGазу) F в денатурирующих условиях, а затем метили 2-аминобензамидом. Затем высвобожденные гликановые формы разделяли и анализировали на слабой анионообменной колонке (WAX; Weak Anion Exchange) для определения распределения заряда. Меченые гликаны, обработанные 2,3,6,8-сиалидазой для определения суммарной сиаловой кислоты и 2,3-сиалидазой для определения 2,3-сиаловой кислоты, дополнительно анализировали с помощью колонки WAX.
Относительные процентные содержания заряженных гликанов были вычислены на основании структур, присутствующих в нерасщепленных и расщепленных пулах гликанов, и показаны на фиг. 4 (для 8 образцов). Было обнаружено, что они находятся в диапазоне 50%-70% (например, примерно 60% или 65%) для α2,3-сиалирования и от 28 до 50%, как правило, от 30 до 35% (например, примерно 31% или 35%) для α2,6-сиалирования.
Пример 8. Количественное определение относительных количеств моно-, ди-, три- и тетрасиалированных гликановых структур
Относительные процентные количества моно-, ди-, три- и тетра-сиалированных структур на гликанах, выделенных из очищенного рФСГ (Пример 6), измеряли, используя известные методы.
N-Гликаны высвобождали из образцов, используя PNGазу F в денатурирующих условиях, а затем метили 2-аминобензамидом. Гликаны высвобождали из образцов, используя PNGазу F в денатурирующих условиях, а затем метили 2-аминобензамидом. Затем высвобожденные гликановые формы разделяли и анализировали на слабой анионообменной колонке (WAX) для определения распределения сиалирования. Относительные количества нейтральных, моно-сиалированных, ди-сиалированных, три-сиалированных и тетра-сиалированных структур показаны на фиг. 5 (для 8 образцов, показанных на фиг. 4).
рФСГ включает нейтральные, моно-сиалированные, ди-сиалированные, три-сиалированные и тетра-сиалированные гликановые структуры при следующих относительных количествах: нейтральные 5-6%; 15-17% моно-сиалированных; 26-30% ди-сиалированных; 30-32% три-сиалированных и 17-23% тетра-сиалированных.
Пример 8а
Относительные процентные количества α2,6-сиаловой кислоты на очищенном рФСГ, выделенном из девяти образцов очищенного рФСГ (полученного способами Примера 6), измеряли, используя известные методы.
N-Гликаны высвобождали из образцов, используя PNGазу F в денатурирующих условиях, а затем метили 2-аминобензамидом. Затем высвобожденные гликановые формы разделяли и анализировали на слабой анионообменной колонке (WAX) для определения распределения заряда. Меченые гликаны, обработанные 2,3,6,8-сиалидазой для определения суммарной сиаловой кислоты и 2,3-сиалидазой для определения 2,3-сиаловой кислоты, анализировали далее с помощью колонки WAX (см. Пример 8). Этот анализ дает возможность вычислить количество α2,6-сиаловой кислоты.
Относительные процентные содержания заряженных гликанов были вычислены на основании структур, присутствующих в нерасщепленных и расщепленных пулах гликанов, и показаны в приведенной ниже таблице. Было обнаружено, что они находятся в диапазонах от 25 до 50%, как правило, от 30 до 35% для α2,6-сиалирования.
Относительные процентные количества разделяющего GlcNac, GalNac и 1-фукозы Льюиса на гликанах, выделенных из девяти образцов очищенного рФСГ (полученного способами Примера 6) измеряли, используя известные методы. N-Гликаны высвобождали из гликопротеина, используя PNGазу F, и метили 2-аминобензамидом (2АВ). Анализ проводили с помощью пространственного (2D) анализа ВЭЖХ (высокоэффективная жидкостная хроматография) в сочетании с ферментативным расщеплением гликанов. Для подтверждения гликаны анализировали с помощью масс-спектрометрии с ионизацией методом лазерной десорбции из матрицы (MALDI-MS). Относительные количества альфа-2,6-сиаловой кислоты и концевых остатков представлены в приведенной ниже таблице вместе с количествами для Гонала-ф (рекомбинантного ФСГ, полученного из клеток СНО) и Бравеля (ФСГ мочи человека).

Видно, что количество GalNac в ФСГ по изобретению варьирует от примерно 44,9 и 51%, в среднем примерно 47,1%.
Видно, что количество разделяющего GlcNac в ФСГ по изобретению варьирует от 8,7 до 13,9%, в среднем примерно 10,9%.
Видно, что количество 1-фукозы Льюиса в ФСГ по изобретению варьирует от 16,1 до 23,3%, в среднем примерно 19%.
Видно, что количество 2-фукозы Льюиса в ФСГ по изобретению варьирует от 1,9 до 4,4%, в среднем примерно 3,7%.
Пример 9. Исследование безопасности, переносимости, фармакокинетики, фармакодинамики и иммуногенности FE 999049 с использованием многократных доз по сравнению с Гоналом-ф
Исследуемая популяция
Всего 48 (24 на каждое лекарственное средство) здоровых женщин получали суточные дозы 14,6 мкг FE 999049 (композиции согласно изобретению, полученной в соответствии с Примером 6) или 16,5 мкг Гонала-ф в течение семи суток.
Результаты безопасности
Введение многократных доз FE 999049 и Гонала-ф было безопасным и в целом хорошо переносилось, что оценивали на основании вредных эффектов (ВЭ), основных показателей состояния организма, электрокардиограммы (ЭКГ), клинических лабораторных исследований и объективного обследования. Во время исследования серьезные неблагоприятные явления или смерть не встречались.
Фармакокинетические результаты
После введения FE 999049 и Гонала-ф в течение 7 суток значения концентрации ФСГ, оцениваемые непосредственно перед следующей инъекцией, повышались и, по-видимому, достигали равновесного уровня после 6-7 суток. Тем не менее, концентрация препарата (AUC и Cmax) FE 999049 была на 60% выше по сравнению с Гоналом-ф.
Фармакодинамические результаты
Концентрации всех гормонов: ингибина-В (см. фиг. 6), эстрадиола и прогестерона повышались после введения FE 999049 и Гонала-ф, тем не менее, в большей степени после введения FE 999049 по сравнению с Гоналом-ф. Как число, так и распределение размера фолликулов показало более высокий ответ на FE 999049 по сравнению с Гоналом-ф.
В Примере 9 продемонстрировано, что ФСГ, имеющий определенное количество (17-23%) тетра-сиалированных гликановых структур и, например, определенные количества α2,3-сиалирования и α2,6-сиалирования, значительно более эффективен, чем рекомбинантные препараты ФСГ, имеющиеся в настоящее время в продаже.
Пример 10. Исследование FE 999049 по сравнению с Гоналом-ф, с использованием многократных доз
Далее описано рандомизированное, контролируемое, слепое для эксперта, проводящего оценку данных, в параллельных группах, многонациональное, многоцентровое исследование, оценивающее отношение доза-ответ FE 999049 у пациентов, проходящих контролируемую стимуляцию яичников для экстракорпорального оплодотворения (ЭКО)/интрацитоплазматической инъекции сперматозоида (ИКСИ). Популяция пациентов представляла собой 265 пациенток ЭКО в возрасте от 18 до 37 лет, имеющих ИМТ от 18,5 до 32,0 кг/м2.
Испытание было разработано как испытание доза-ответ, в котором основным критерием оценки было число извлеченных ооцитов. Вторичные критерии оценки исследуют качественное и количественное воздействие различных доз FE 999049 в отношении эндокринного профиля, развития фолликулов, оплодотворения ооцитов, качества эмбрионов и эффективности лечения (то есть суммарное потребление гонадотропина и продолжительность стимуляции). Испытание предназначено для оценки эффективности FE 999049 для установления беременности при применении в контролируемой стимуляции яичников для циклов ЭКО/ИКСИ.
Субъектов оценивали в течение 3 месяцев перед рандомизацией на соответствие критериям включения и исключения, включающим оценку антимюллеровского гормона (АМГ) для увеличения однородности испытуемой популяции в отношении ответа яичников и минимизации числа потенциальных пациентов со слабым и чрезмерным ответом на дозы FE 999049 и дозу Гонала-ф, используемые в испытании. Оценку АМГ измеряли, используя набор для иммуноферментного твердофазного анализа АМГ Gen-II (Beckman Coulter, Inc., Webster, Texas). В данном анализе можно определить концентрации АМГ, превышающие 0,57 пмоль/л, при минимальном пределе количественного определения 1,1 пмоль/л.
На сутки 2-3 их менструального цикла субъектов рандомизировали способом 1:1:1:1:1:1 для лечения 90 ME, 120 ME, 150 ME, 180 ME или 210 ME FE 999049 или 150 ME Гонала-ф и начинали стимуляцию яичников. Рандомизацию стратифицировали в соответствии с уровнем АМГ при скрининге [5,0-14,9 пмоль/л (низкий АМГ) и от 15,0 до 44,9 пмоль/л (высокий АМГ)).
Гонал-ф дозируют по массе (FbM; от англ. filled by mass) по требованию FDA (Управление по контролю за продуктами и лекарствами); таким образом, целесообразна ссылка на дозу в мкг. На этикетке Гонала-ф указано 600 МЕ/44 мкг, что указывает на то, что 150 ME соответствует 11 мкг. Тем не менее, имеется некоторая вариация, и в сертификате партии для данного испытания указано, что 11,3 мкг Гонала-ф эквивалентны 150 ME. Дозы FE 999049 представлены вероятнее содержанием белка (мкг), чем биологической активностью. Таким образом, дозы FE 999049 составляли 5,2 мкг (90 ME), 6,9 мкг (120 ME), 8,6 мкг (150 ME), 10,3 мкг (180 ME) или 12,1 мкг (210 ME).
Распределение субъектов и дозы представлены ниже (данные представляют собой число субъектов):

Уровень суточной дозы FE 999049 или Гонала-ф является фиксированным на протяжении всего периода стимуляции. Во время стимуляции мониторинг пациентов проводят на сутки стимуляции 1, 4 и 6, а затем по меньшей мере каждые вторые сутки. Когда наблюдают 3 фолликула не менее 15 мм, визиты проводят ежесуточно. Субъектов лечат FE 999049 или Гоналом-ф в течение максимум 16 суток.
Чтобы предотвратить преждевременный выброс лютеинизирующего гормона (ЛГ) можно начать введение антагониста ГнВГ (ганиреликса ацетата, Оргалутрана, MSD/Schering-Plough) на сутки стимуляции 6 в суточной дозе 0,25 мг и продолжать на протяжении всего периода стимуляции. Запуск конечного созревания фолликулов проводят на сутки, когда наблюдают не менее 3 фолликулов диаметром не менее 17 мм. Если имеется менее 25 фолликулов диаметром не менее 12 мм, вводят 250 мкг рекомбинантного ХГЧ (хориогонадотропина альфа, Овитреля, Merck Serono/EMD Serono). Если имеется 25-35 фолликулов диаметром не менее 12 мм, вводят 0,2 мг агониста ГнВГ (трипторелина ацетата, Декапептила/Гонапептила, Ferring Pharmaceuticals). В случае избыточного ответа яичников, определенного как более 35 фолликулов диаметром не менее 12 мм, лечение прекращают. В случае слабого ответа яичников, определенного как менее 3 фолликулов диаметром не менее 10 мм, наблюдаемых на сутки стимуляции 10, цикл может быть прекращен.
Извлечение ооцитов происходит через 36 ч (±2 ч) после запуска конечного созревания фолликулов, и ооциты оплодотворяют посредством ЭКО и/или ИКСИ. Оплодотворение и развитие эмбриона оценивают со дня извлечения ооцита до дня подсадки. Для субъектов, подвергшихся запуску конечного созревания фолликулов посредством ХГЧ, одну доступную бластоцисту лучшего качества подсаживают на сутки 5 после извлечения ооцита, тогда как остальные бластоцисты замораживают. Для субъектов, подвергшихся запуску конечного созревания фолликулов посредством агониста ГнВГ, подсадку эмбриона в новом цикле не проводят, и вместо этого бластоцисты замораживают на сутки 5. Вагинальные таблетки прогестерона (Лютинуса, Ferring Pharmaceuticals) по 100 мг 3 раза ежедневно назначают для поддержания лютеиновой фазы с суток после извлечения ооцита до суток визита по клинической беременности. Тест β-ХГЧ проводят через 13-15 суток после подсадки эмбриона, и клиническую беременность подтверждают трансвагинальным ультразвуковым исследованием (ТВ-УЗИ) через 5-6 недель после подсадки эмбриона.
Результаты
Число извлеченных ооцитов (основной критерий оценки) представлено в приведенной ниже таблице.
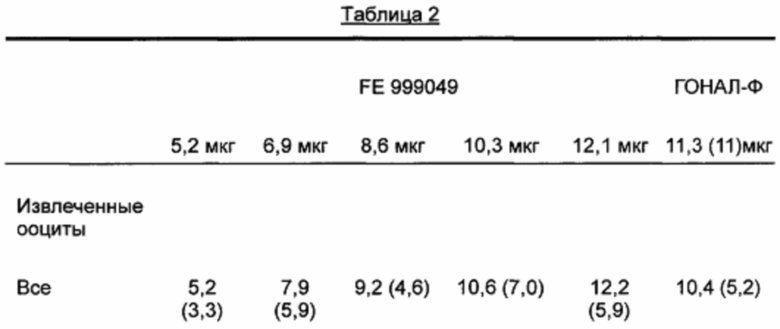

Соответствие основному критерию оценки было получено: значимое отношение доза-ответ было установлено для FE 999049 в отношении числа извлеченных ооцитов. Это явление наблюдали не только для всей испытуемой популяции, но также для каждой из двух страт АМГ, используемых при рандомизации.
Значимое отношение доза-ответ для FE 999049 было продемонстрировано для всех ключевых объективных фармакодинамических параметров, например, эстрадиола, ингибина В и ингибина А. При аналогичном уровне дозы в микрограммах фармакодинамические ответы на FE 999049 были выше, чем на Гонал-ф (эти результаты не представлены).
Сывороточные концентрации ФСГ после воздействия FE 999049 были значительно выше, чем для Гонала-ф. Эти результаты подтверждают, что фармакокинетический профиль FE 999049 отличается от профиля Гонала-ф.
Результаты оплодотворения, развития бластоцисты и частоты беременности у пациентов ЭКО/ИКСИ, пролеченных FE 999049, находились в пределах ожидаемых.
При применении FE 999049 проблемы безопасности отсутствовали. Была документирована хорошая локальная переносимость.
Дополнительный анализ
Авторы изобретения дополнительно проанализировали данные, чтобы идентифицировать дозу (дозы) FE 999049, удовлетворяющие описанным ниже критериям в отношении числа извлеченных ооцитов:
- Извлечение ооцитов в интервале 8-14
- Минимизация доли пациентов, имеющих менее 8 ооцитов
- Минимизация доли пациентов, имеющих не менее 20 ооцитов
Авторы изобретения также исследовали влияние массы тела. При необходимости дозу преобразовывали в мкг/кг для среднего субъекта. Данное значение в мкг/кг и ±0,01 мкг/кг оценивают в модели по отношению как к распределению извлеченных ооцитов, так и к профилю безопасности, и идентифицируют оптимальную дозу.
Страты низкого АМГ
Как видно из таблицы 2, доза FE 999049, удовлетворяющая первому критерию (ооциты, извлеченные в интервале 8-14), составляла 12,1 мкг (в среднем извлечено 9,4 ооцита). Распределение ооцитов представлено в таблице 3 ниже.

Как показано прямоугольником и стрелкой, доза 12,1 мкг FE 999049 обеспечивает извлечение наиболее желательного числа ооцитов у 60% субъектов в группе низкого АМГ. Этот результат является примечательным усовершенствованием по отношению к Гоналу-ф (наиболее желательное число ооцитов только у 33% субъектов).
В таблице 4 ниже показан анализ признаков избыточного ответа в стратах низкого АМГ (данные представляют собой число субъектов). Видно, что указания на ранний СГСЯ среднетяжелой или тяжелой природы отсутствовали, а также отсутствовали случаи необходимости предупредительного действия; проблемы, связанные с дозой 12,1 мкг FE 999049 у пациента, имеющего низкий АМГ, отсутствуют.

На фиг. 7 показан эффект массы тела на извлеченные ооциты (для страты низкого АМГ) для различных доз. Стрелками указано число ооцитов, извлеченных у субъектов, имеющих массу тела 45 кг и 90 кг, пролеченных дозой 12,1 мкг. Как можно видеть (текстовой блок), вариация между пациентами, имеющими массу тела 45 кг и 90 кг, составляет менее чем приблизительно 0,5 ооцита; иными словами, дозирование на основании массы тела не требуется для пациентов с низким АМГ, когда доза FE 999049 составляет по меньшей мере 12 мкг, поскольку при данной дозе отсутствует значительная вариация выделенных ооцитов в зависимости от массы тела.
Таким образом, авторы изобретения обнаружили, что доза, равная или эквивалентная от 6 до 18 мкг, например от 9 до 14 мкг, например 12 мкг, рекомбинантного ФСГ человеческого происхождения подходит для применения при лечении бесплодия у пациента, имеющего сывороточный АМГ менее 15 пмоль/л, например 0,05-14,9 пмоль/л, например 5,0-14,9 пмоль/л. Эта доза обеспечивает эффективный ответ при сведении к минимуму риска СГСЯ.
Страты высокого АМГ
Как видно из таблицы 2, три дозы FE 999049 удовлетворяли первому критерию (ооциты, извлеченные в интервале 8-14): 6,9 мкг (среднее число извлеченных ооцитов 9,1), 8,6 мкг (среднее число извлеченных ооцитов 10,6) и 10,3 мкг (среднее число извлеченных ооцитов 13,6).
На фиг. 8 показан эффект массы тела на извлеченные ооциты (для страт высокого АМГ) для различных доз. Стрелками указано число ооцитов, извлеченных у субъектов, имеющих массу тела от 45 кг до 90 кг, пролеченных дозами 6,9 мкг, 8,6 мкг и 10,3 мкг. Как можно видеть (текстовой блок), вариация является значительной: для дозы 6,9 мкг у пациента массой 45 кг извлекают 6 дополнительных ооцитов по сравнению с пациентом массой 90 кг; для дозы 8,6 мкг у пациента массой 45 кг извлекают 4 дополнительных ооцита по сравнению с пациентом массой 90 кг; и для дозы 10,1 мкг у пациента массой 45 кг извлекают 2,5 дополнительных ооцита по сравнению с пациентом массой 90 кг. Иными словами, дозирование на основании массы тела влияет на пациентов с высоким АМГ, когда доза FE 999049 составляет менее 12 мкг, поскольку при этих дозах существует значительная вариация в числе извлеченных ооцитов в зависимости от массы тела.
В таблице 5а ниже показано дополнительное количественное распределение извлеченных ооцитов (из таблицы 2) по АМГ. В таблице показаны дозы, удовлетворяющие первому критерию (число извлеченных ооцитов в интервале 8-14) для каждой субстраты АМГ (прямоугольники).
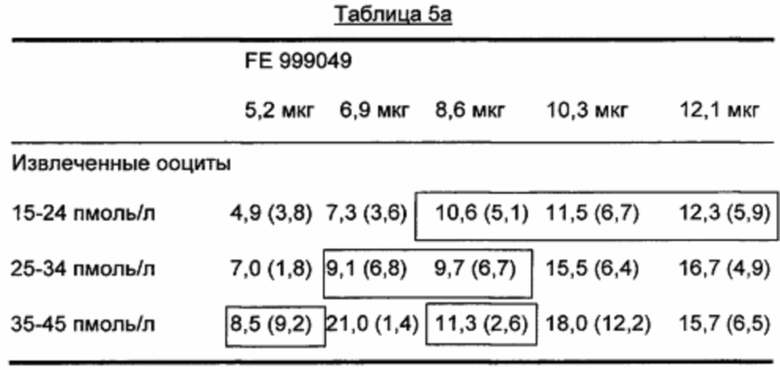
В таблице 5б ниже представлен анализ пациентов, у которых лечение было прекращено либо вследствие избыточного ответа, либо запуска агониста, для этих подгрупп. Например, одна пациентка в страте 25-34 пмоль/л АМГ была исключена вследствие избыточного ответа после дозы 10,3 мкг, одна пациентка в страте 25-34 пмоль/л АМГ была исключена вследствие избыточного ответа после дозы 12,1 мкг; одна пациентка в страте 35-45 пмоль/л АМГ была исключена вследствие запуска агониста после дозы 10,3 мкг; и одна пациентка в страте 35-45 пмоль/л АМГ была исключена вследствие запуска агониста после дозы 6,9 мкг.

Таким образом, можно видеть, что подбор дозы на основании массы тела (фиг. 8) и уровня АМГ был бы полезен в страте высокого АМГ для того, чтобы минимизировать исключения и максимально повысить извлечение ооцитов.
Авторы изобретения обнаружили, что приведенные ниже дозы обеспечивают эффективный ответ при сведении к минимуму риска СГСЯ (кг представляет собой кг массы тела пациента).


Нижеследующее целесообразно, если дозирование на основании массы тела нежелательно.

Нижеследующее целесообразно, если требуется меньше категорий АМГ.

Нижеследующее целесообразно, если дозирование на основании массы тела нежелательно.

Таким образом, авторы изобретения обнаружили, что доза, равная или эквивалентная от 9 до 14 мкг, например 12 мкг, рекомбинантного ФСГ человеческого происхождения подходит для применения в лечении бесплодия у пациента, имеющего сывороточный АМГ менее 15 пмоль/л, например 0,05-14,9 пмоль/л, например 5,0-14,9 пмоль/л. Эта доза обеспечивает эффективный ответ при сведении к минимуму риска СГСЯ.
Авторы изобретения обнаружили, что доза, равная или эквивалентная от 5 до 12,5 мкг, например от 6 до 10,5 мкг рекомбинантного ФСГ человеческого происхождения подходит для применения в лечении бесплодия у пациента, имеющего сывороточный АМГ не менее 15 пмоль/л. Эта доза обеспечивает эффективный ответ при сведении к минимуму риска СГСЯ.
Авторы изобретения обнаружили, что доза (например, суточная), равная или эквивалентная от 0,09 до 0,19 мкг рекомбинантного ФСГ человеческого происхождения на кг массы тела пациента подходит для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ не менее 15 пмоль/л. Авторы изобретения обнаружили, что доза (например, суточная), равная или эквивалентная от 0,14 до 0,19 мкг рекомбинантного ФСГ человеческого происхождения (предпочтительно от 0,15 до 0,16 мкг рекомбинантного ФСГ человеческого происхождения) на кг массы тела пациента подходит для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ от 15 до 24,9 пмоль/л. Авторы изобретения обнаружили, что доза (например, суточная), равная или эквивалентная от 0,11 до 0,14 мкг рекомбинантного ФСГ человеческого происхождения (предпочтительно от 0,12 до 0,13 мкг рекомбинантного ФСГ человеческого происхождения) на кг массы тела пациента подходит для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ от 25 до 34,9 пмоль/л. Авторы изобретения обнаружили, что доза (например, суточная), равная или эквивалентная от 0,10 до 0,11 мкг рекомбинантного ФСГ человеческого происхождения на кг массы тела пациента подходит для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ не менее 35 пмоль/л. Эти дозы обеспечивают эффективный ответ при сведении к минимуму риска СГСЯ.
Авторы изобретения обнаружили, что доза (например, суточная), равная или эквивалентная от 0,15 до 0,21 мкг (например, 0.16 мкг) рекомбинантного ФСГ человеческого происхождения на кг массы тела пациента подходит для применения в лечении бесплодия у пациента, имеющего сывороточный уровень АМГ менее 15 пмоль/л, например, для первого цикла стимуляции рекомбинантным ФСГ человеческого происхождения. Тем не менее, нет необходимости, чтобы пациенты получали дозу на основании массы тела при данном уровне АМГ.
Пример 10А. Индивидуализированный протокол КСЯ (низкий АМГ)
Отобранные пациенты собираются проходить КСЯ для экстракорпорального оплодотворения (ЭКО)/интрацитоплазматической инъекции сперматозоида (ИКСИ) способами, известными в данной области техники. Протокол подготовки к лечению включает оценку/скрининг сывороточного АМГ пациента с использованием набора для твердофазного иммуноферментного анализа АМГ Gen-II (Beckman Coulter, Inc., Webster, Texas). В данном анализе можно обнаружить концентрации АМГ выше 0,57 пмоль/л при минимальном пределе количественного определения 1,1 пмоль/л. АМГ можно измерить, используя другие аналитические наборы (например, имеющиеся в продаже от фирмы Roche).
Протокол КСЯ протекает обычным способом, за исключением введения начальной дозы FE 999049 в соответствии с уровнем АМГ при скрининге. Пациенту с уровнем АМГ менее 14,9 пмоль/л следует вводить начальную суточную дозу приблизительно 12 мкг FE 999049, препарата рекомбинантного ФСГ человеческого происхождения, полученного согласно способу Примера 6. Пациенту с уровнем АМГ от 15 до 24,9 пмоль/л следует вводить начальную суточную дозу от 0,15 до 0,19 мкг рекомбинантного ФСГ человеческого происхождения на кг массы тела пациента. Пациенту с уровнем АМГ от 25 до 34,9 пмоль/л следует вводить начальную суточную дозу от 0,11 до 0,13 мкг рекомбинантного ФСГ человеческого происхождения на кг массы тела пациента. Пациенту с уровнем АМГ не менее 35 пмоль/л следует вводить начальную суточную дозу от 0,10 до 0,11 мкг рекомбинантного ФСГ человеческого происхождения на кг массы тела пациента.
Пример 11. Индивидуализированные протоколы КСЯ
Дозы в данном протоколе менее предпочтительны, чем в Примере 10А.
Отобранные пациенты собираются проходить КСЯ для экстракорпорального оплодотворения (ЭКО)/интрацитоплазматической инъекции сперматозоида (ИКСИ) способами, известными в данной области техники. Протокол подготовки к лечению включает оценку/скрининг сывороточного АМГ пациента с использованием набора для твердофазного иммуноферментного анализа АМГ Gen-II (Beckman Coulter, Inc., Webster, Texas). В данном анализе можно обнаружить концентрации АМГ выше 0,57 пмоль/л при минимальном пределе количественного определения 1,1 пмоль/л.
Протокол КСЯ протекает обычным способом, за исключением введения начальной дозы FE 999049 в соответствии с уровнем АМГ при скрининге в соответствии с приведенной ниже таблицей. Таким образом, пациенту с уровнем АМГ 5-14,8 пмоль/л следует вводить 180 ME ФСГ в форме приблизительно 8-11 мкг FE 999049, продукта рекомбинантного ФСГ человеческого происхождения, полученного в соответствии со способом Примера 6. Пациенту с уровнем АМГ 30-44,9 пмоль/л следует вводить 120 ME ФСГ в форме приблизительно 4-7 мкг FE 999049, продукта рекомбинантного ФСГ человеческого происхождения, полученного в соответствии со способом Примера 6. Если уровень АМГ недоступен, пациенту следует вводить 120-180 ME рекомбинантного ФСГ в форме приблизительно 6-11 мкг FE 999049, продукта рекомбинантного ФСГ человеческого происхождения, полученного в соответствии со способом Примера 6.
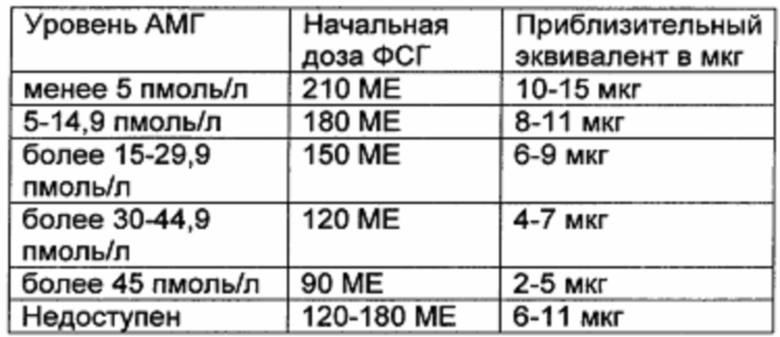
Ссылки
Andersen CY, Westergaard LG, and van Wely M. (2004). FSH isoform composition of commercial gonadotrophin preparations: a neglected aspect? Reprod Biomed Online. 9(2), 231-236.
Arey BJ, Stevis PE, Deecher DC, Shen ES, Frail DE, Negro-Vilar A, and Lopez FJ. (1997) Induction of promiscuous G protein coupling of the follicle-stimulating hormone (FSH) receptor: a novel mechanism for transducing pleiotropic actions of FSG isoforms. Mol Endocrinol. 11(5), 517-526.
Baenziger JU and Green ED. (1988). Pituitary glycoprotein hormone oligosaccharides: structure, synthesis and function of the asparagine-linked oligosaccharides on lutropin, follitropin and thyrotropin. Biochim Biophys Acta. 947(2), 287-306.
Bassett RM, and Driebergen R. (2005). Continued improvements in the quality and consistency of follitropin alfa, recombinant human FSH. Reprod Biomed Online. 10(2), 169-177.
 P, Zaga V, Maldonado A,
P, Zaga V, Maldonado A,  C, Timossi C, and Ulloa-Aguirre A. (1999). Oestrogens regulate pituitary alpha2,3-sialyltransferase messenger ribonucleic acid levels in the female rat. J Mol Endocrinol. 23(2), 153-165.
C, Timossi C, and Ulloa-Aguirre A. (1999). Oestrogens regulate pituitary alpha2,3-sialyltransferase messenger ribonucleic acid levels in the female rat. J Mol Endocrinol. 23(2), 153-165.
D'Antonio M., Borrelli F., Datola A., Bucci R., Mascia M., Polletta P., Piscitelli D., and Papoian R. (1999) Biological characterization of recombinant human follicle-stimulating hormone isoforms. Human Reproduction 14, 1160-1167.
Dalpathado DS, Irungu J, Go EP, Butnev VY, Norton K, Bousfield GR, and Desaire H. (2006). Comparative glycomics of the glycoprotein follicle-stimulating hormone: glycopeptide analysis of isolates from two mammalian species. Biochemistry. 45(28), 8665-8673. Копия отсутствует.
Dias JA, Van Roey P. (2001). Structural biology of human follitropin and its receptor. Arch Med Res. 32(6), 510-519.
Fiddes, J.C. and Goodman, H.M. (1979) Isolation, cloning and sequence analysis of the cDNA for the alpha-subunit of human chorionic gonadotropin. Nature, 281, 351-356.
Flack, M.R., Bennet, A.P., Froehlich, J. Anasti, JN and Nisula, B. (1994). Increased biological activity due to basic isoforms in recombinant human follicle-stimulating hormone produced in a human cell line. J. Clin. Endocrinol. Metab., 79, 756-760.
Fox KM, Dias JA, and Van Roey P. (2001). Three-dimensional structure of human follicle-stimulating hormone. Mol Endocrinol. 15(3), 378-89.
Grabenhorst E, Hoffmann A, Nimtz M, Zettlmeissl G, and Conradt HS. (1995). Construction of stable BHK-21 cells coexpressing human secretory glycoproteins and human Gal(beta 1-4)GlcNAc-R alpha 2,6-sialyltransferase alpha 2,6-linked NeuAc is preferentially attached to the Gal(beta 1-4)GlcNAc(beta 1-2)Man(alpha 1-3)-branch of diantennary oligosaccharides from secreted recombinant beta-trace protein. Eur J Biochem. 232(3), 718-25.
Green ED and Baenziger JU. (1988). Asparagine-linked oligosaccharides on lutropin, follitropin, and thyrotropin. II. Distributions of sulfated and sialylated oligosaccharides on bovine, ovine, and human pituitary glycoprotein hormones. J Biol Chem. 263(1), 36-44.
Grundmann, U., Nerlich, C., Rein, T. and Zettlmeissl, G. (1990). Complete cDNA sequence encoding human beta-galactoside alpha-2,6-sialyltransferase. G Nucleic Acids Res. 18(3), 667.
Howies, C.M. (1996). Genetic engineering of human FSH (Gonal-F). Hum Reprod. Update, 2, 172-191.
Kagawa Y, Takasaki S, Utsumi J, Hosoi K, Shimizu H, Kochibe N, and Kobata A. (1988). Comparative study of the asparagine-linked sugar chains of natural human interferon-beta 1 and recombinant human interferon-beta 1 produced by three different mammalian cells. J Biol Chem. 263(33), 17508-17515.
Keene, J.L, Matzuk, M.M., Otani, Т., Fauser, В., С., J., M., Galway, A.B., Hsueh, A.J.W. and Boime, I. (1989). Expression of Biologically active Human Follitropin in Chinese Hamster Ovary Cells. The Journal of Biological Chemistry, 264(9), 4769-4775.
Kitagawa, H. and Paulson, J.С (1994) Cloning of a novel alpha 2,3-sialyltransferase that sialylates glycoprotein and glycolipid carbohydrate groups. J. Biol. Chem. 269(2), 1394-1401.
Lee EU, Roth J, and Paulson JC (1989) Alteration of terminal glycosylation sequences on N-linked oligosaccharides of Chinese hamster ovary cells by expression of beta-galactoside alpha 2,6-sialyltransferase. J Biol Chem. 264(23), 13848-13855.
de Leeuw, R., Mulders, J., Voortman, G. Rombout, F. DaMM, J. and Kloosterboer, L. (1996) Structure-function relationship of recombinant follicle-stimulating hormone (Puregon). Mol. Hum. Reprod., 2, 361-369.
Lowry OH, Rosebrough NJ, Farr AL, Randall RJ. (1951) Protein measurement with the Folin phenol reagent. J Biol Chem. 193(1), 265-75.
Lowry, PJ, McLean, C, Jones RL and Satgunasingam N. (1976) Purification of anterior pituitary and hypothalamic hormones Clin Pathol Suppl (Assoc Clin Pathol). 7, 16-21.
Olivennes F, Howies CM, Borini A, Germond M, Trew G, Wikland M, Zegers-Hochschild F, Saunders H (2009) Individualizing FSH dose for assisted reproduction using a novel algorithm: the CONSORT study. Reprod Biomed Online. 2009 Feb; 18(2): 195-204.
Pierce JG, and Parsons TF (1981) Glycoprotein hormones: structure and function Annu Rev Biochem. 50, 465-495.
Pricer WE Jr, and Ashwell G. (1971). The binding of desialylated glycoproteins by plasma membranes of rat liver. J Biol Chem. 246(15), 4825-33.
Rathnam P, and Saxena BB. (1975). Primary amino acid sequence of follicle-stimulating hormone from human pituitary glands. I. alpha subunit. J Biol Chem.; 250(17): 6735-6746.
Regoeczi E, Debanne MT, Hatton MC, and Koj A. (1978) Elimination of asialofetuin and asialoorosomucoid by the intact rat. Quantitative aspects of the hepatic clearance mechanism. Biochim Biophys Acta. 541(3), 372-84.
Royle л, Radcliffe CM, Dwek RA and Rudd PM (2006) Methods in Molecular Biology, ed I Brockhausen-Schutzbach (Humana Press), 347: Glycobiology protocols, 125-144.
Ryan RJ, Keutmann HT, Charlesworth MC, McCormick DJ, Milius RP, Calvo FO and Vutyavanich T. (1987). Structure-function relationships of gonadotropins. Recent Prog Horm Res.; 43: 383-429.
Saxena BB and Rathnam P. (1976) Amino acid sequence of the beta subunit of follicle-stimulating hormone from human pituitary glands. J Biol Chem. 251(4), 993-1005.
Steelman SL, and Pohley FM. (1953) Assay of the follicle-stimulating hormone based on the augmentation with human chorionic gonadotropin. Endocrinology. 53(6), 604-616.
Steer CJ, and Ashwell G. (1980) Studies on a mammalian hepatic binding protein specific for asialoglycoproteins. Evidence for receptor recycling in isolated rat hepatocytes. J Biol Chem. 255(7), 3008-13.
Svensson EC, Soreghan B, and Paulson JC. (1990) Organization of the beta-galactoside alpha 2,6-sialyltransferase gene. Evidence for the transcriptional regulation of terminal glycosylation. J Biol Chem. 265(34): 20863-20868.
Takeuchi M, Takasaki S, Miyazaki H, Kato T, Hoshi S, Kochibe N, and Kobata A (1988). Comparative study of the asparagine-linked sugar chains of human erythropoietins purified from urine and the culture medium of recombinant Chinese hamster ovary cells. J Biol Chem. 263(8), 3657-3663.
Timossi CM, Barrios de Tomasi J, Zambrano E,  R, Ulloa-Aguirre A. (1998). A naturally occurring basically charged human follicle-stimulating hormone (FSH) variant inhibits FSH-induced androgen aromatization and tissue-type plasminogen activator enzyme activity in vitro. Neuroendocrinology. 67(3), 153-163.
R, Ulloa-Aguirre A. (1998). A naturally occurring basically charged human follicle-stimulating hormone (FSH) variant inhibits FSH-induced androgen aromatization and tissue-type plasminogen activator enzyme activity in vitro. Neuroendocrinology. 67(3), 153-163.
Timossi CM, Barrios-de-Tomasi J,  R, Arranz MC, Padmanabhan V, Conn PM, and Ulloa-Aguirre A. (2000). Differential effects of the charge variants of human follicle-stimulating hormone. J Endocrinol. 165(2), 193-205.
R, Arranz MC, Padmanabhan V, Conn PM, and Ulloa-Aguirre A. (2000). Differential effects of the charge variants of human follicle-stimulating hormone. J Endocrinol. 165(2), 193-205.
Ulloa-Aguirre, A., Espinoza, R., Damian-Matsumura, P. and Chappel, S.C. (1988) Immunological and biological potencies of the different molecular species of gonadotrophins. Hum. Reprod. 3, 491-501.
Ulloa-Aguirre, A., Cravioto, A.,  , P. Jimenez, M, Zambrano, E and Diaz-Sanchez, V. (1992) Biological characterization of the naturally occurring analogues of intrapituitary human follicle-stimulating hormone. Hum. Reprod. 7, 23-30.
, P. Jimenez, M, Zambrano, E and Diaz-Sanchez, V. (1992) Biological characterization of the naturally occurring analogues of intrapituitary human follicle-stimulating hormone. Hum. Reprod. 7, 23-30.
Ulloa-Aguirre A, Midgley AR Jr, Beitins IZ, and Padmanabhan V. (1995). Follicle-stimulating isohormones: characterization and physiological relevance. Endocr Rev. 16(6), 765-787.
Ulloa-Aguirre A, Maldonado A,  P, and Timossi С (2001). Endocrine regulation of gonadotropin glycosylation. Arch Med Res. 32(6), 520-532.
P, and Timossi С (2001). Endocrine regulation of gonadotropin glycosylation. Arch Med Res. 32(6), 520-532.
Ulloa-Aguirre A, Timossi C, Barrios-de-Tomasi J, Maldonado A, and Nayudu P. (2003). Impact of carbohydrate heterogeneity in function of follicle-stimulating hormone: studies derived from in vitro and in vivo models. Biol Reprod. 69(2), 379-389.
Van Lenten L., and Ashwell G. (1972) The binding of desialylated glycoproteins by plasma membranes of rat liver. Development of a quantitative inhibition assay. J Biol Chem. 247(14), 4633-40.
Wide, L. and Albertsson-Wikland, K. (1990) Change in electrophoretic mobility of human follicle-stimulating hormone in serum after administration of gonadotropin-releasing hormone. J. Clin. Endocrinol. Metab. 70, 271-276.
Wide, L. and Bakos, O. (1993). More basic forms of both human follicle-stimulating hormone and luteinizing hormone in serum at midcycle compared with the follicular or luteal phase. J. Clin. Endocrinol. Metab., 76, 885-889.
Wide L,  T,
T,  I, Eriksson K. (2007) Sulfonation and syalilation of gonadotropins in women during the menstrual cycle, after menopause, and with polycystic ovarian syndrome and in men. J Clin Endocrinol Metab.; 92(11), 4410-4417.
I, Eriksson K. (2007) Sulfonation and syalilation of gonadotropins in women during the menstrual cycle, after menopause, and with polycystic ovarian syndrome and in men. J Clin Endocrinol Metab.; 92(11), 4410-4417.
Zambrano E,  T, Olivares A, Barrios-de-Tomasi J, and Ulloa-Aguirre A. (1999). Receptor binding activity and in vitro biological activity of the human FSH charge isoforms as disclosed by heterologous and homologous assay systems: implications for the structure-function relationship of the FSH variants. Endocrine. 10(2), 113-121.
T, Olivares A, Barrios-de-Tomasi J, and Ulloa-Aguirre A. (1999). Receptor binding activity and in vitro biological activity of the human FSH charge isoforms as disclosed by heterologous and homologous assay systems: implications for the structure-function relationship of the FSH variants. Endocrine. 10(2), 113-121.
Zhang X, Lok SH, and Kon OL (1998) Stable expression of human alpha-2,6-sialyltransferase in Chinese hamster ovary cells: functional consequences for human erythropoietin expression and bioactivity. Biochim Biophys Acta. 1425(3), 441-452.
Фиг. 1, 2 и 3: Плазмидные карты экспрессионных векторов pFSHalpha/beta, pST3 и pST6. CMV - промотор цитомегаловируса, BGHp(A) - последовательность полиаденилирования гормона роста быка, fl ori - точка начала репликации fl, SV40 - промотор вируса обезьян 40, Neo - маркер устойчивости к неомицину, Hyg - маркер устойчивости к гигромицину, SV40 р(А) - последовательность полиаденилирования вируса обезьян 40, FSH А - полипептид фолликулостимулирующего гормона альфа, FSH В - полипептид фолликулостимулирующего гормона бета, ST3GAL4 - α2,3-сиалилтрансфераза, ST3GAL1 - α2,6-сиалилтрансфераза, ColEI - точка начала репликации ColEI, Amp - маркер устойчивости к ампициллину.
SEQ ID NO: 1
Полипептид фолликулостимулирующего гормона альфа
Номер доступа АН007338
Нуклеотидная последовательность ФСГ альфа

Белковая последовательность ФСГ альфа (SEQ ID NO: 5)

SEQ ID NO: 2
Полипептид фолликулостимулирующего гормона бета
Номер доступа NM_000510
Нуклеотидная последовательность ФСГ бета


Белковая последовательность ФСГ бета (SEQ ID NO: 6)

SEQ ID NO: 3
Бета-галактозид-альфа-2,3-сиалилтрансфераза 4
Номер доступа L23767
Нуклеотидная последовательность ST3GAL4

Белковая последовательность ST3GAL4 (SEQ ID NO: 7)


SEQ ID NO: 4
Бета-галактозамид-альфа-2,6-сиалилтрансфераза 1
Номер доступа NM_003032
Нуклеотидная последовательность ST6GAL1

Белковая последовательность ST6GAL1 (SEQ ID NO: 8)

--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Ферринг БВ
<120> Композиция для контролируемой стимуляции яичников
<130> P/66643.WO01
<150> EP 11176803.2
<151> 2011-08-08
<160> 16
<170> PatentIn версия 3.5
<210> 1
<211> 351
<212> ДНК
<213> Homo sapiens
<400> 1
atggattact acagaaaata tgcagctatc tttctggtca cattgtcggt gtttctgcat 60
gttctccatt ccgctcctga tgtgcaggat tgcccagaat gcacgctaca ggaaaaccca 120
ttcttctccc agccgggtgc cccaatactt cagtgcatgg gctgctgctt ctctagagca 180
tatcccactc cactaaggtc caagaagacg atgttggtcc aaaagaacgt cacctcagag 240
tccacttgct gtgtagctaa atcatataac agggtcacag taatgggggg tttcaaagtg 300
gagaaccaca cggcgtgcca ctgcagtact tgttattatc acaaatctta a 351
<210> 2
<211> 390
<212> ДНК
<213> Homo sapiens
<400> 2
atgaagacac tccagttttt cttccttttc tgttgctgga aagcaatctg ctgcaatagc 60
tgtgagctga ccaacatcac cattgcaata gagaaagaag aatgtcgttt ctgcataagc 120
atcaacacca cttggtgtgc tggctactgc tacaccaggg atctggtgta taaggaccca 180
gccaggccca aaatccagaa aacatgtacc ttcaaggaac tggtatatga aacagtgaga 240
gtgcccggct gtgctcacca tgcagattcc ttgtatacat acccagtggc cacccagtgt 300
cactgtggca agtgtgacag cgacagcact gattgtactg tgcgaggcct ggggcccagc 360
tactgctcct ttggtgaaat gaaagaataa 390
<210> 3
<211> 999
<212> ДНК
<213> Homo sapiens
<400> 3
atgtgtcctg caggctggaa gctcctggcc atgttggctc tggtcctggt cgtcatggtg 60
tggtattcca tctcccggga agacaggtac atcgagcttt tttattttcc catcccagag 120
aagaaggagc cgtgcctcca gggtgaggca gagagcaagg cctctaagct ctttggcaac 180
tactcccggg atcagcccat cttcctgcgg cttgaggatt atttctgggt caagacgcca 240
tctgcttacg agctgcccta tgggaccaag gggagtgagg atctgctcct ccgggtgcta 300
gccatcacca gctcctccat ccccaagaac atccagagcc tcaggtgccg ccgctgtgtg 360
gtcgtgggga acgggcaccg gctgcggaac agctcactgg gagatgccat caacaagtac 420
gatgtggtca tcagattgaa caatgcccca gtggctggct atgagggtga cgtgggctcc 480
aagaccacca tgcgtctctt ctaccctgaa tctgcccact tcgaccccaa agtagaaaac 540
aacccagaca cactcctcgt cctggtagct ttcaaggcaa tggacttcca ctggattgag 600
accatcctga gtgataagaa gcgggtgcga aagggtttct ggaaacagcc tcccctcatc 660
tgggatgtca atcctaaaca gattcggatt ctcaacccct tcttcatgga gattgcagct 720
gacaaactgc tgagcctgcc aatgcaacag ccacggaaga ttaagcagaa gcccaccacg 780
ggcctgttgg ccatcacgct ggccctccac ctctgtgact tggtgcacat tgccggcttt 840
ggctacccag acgcctacaa caagaagcag accattcact actatgagca gatcacgctc 900
aagtccatgg cggggtcagg ccataatgtc tcccaagagg ccctggccat taagcggatg 960
ctggagatgg gagctatcaa gaacctcacg tccttctga 999
<210> 4
<211> 1221
<212> ДНК
<213> Homo sapiens
<400> 4
atgattcaca ccaacctgaa gaaaaagttc agctgctgcg tcctggtctt tcttctgttt 60
gcagtcatct gtgtgtggaa ggaaaagaag aaagggagtt actatgattc ctttaaattg 120
caaaccaagg aattccaggt gttaaagagt ctggggaaat tggccatggg gtctgattcc 180
cagtctgtat cctcaagcag cacccaggac ccccacaggg gccgccagac cctcggcagt 240
ctcagaggcc tagccaaggc caaaccagag gcctccttcc aggtgtggaa caaggacagc 300
tcttccaaaa accttatccc taggctgcaa aagatctgga agaattacct aagcatgaac 360
aagtacaaag tgtcctacaa ggggccagga ccaggcatca agttcagtgc agaggccctg 420
cgctgccacc tccgggacca tgtgaatgta tccatggtag aggtcacaga ttttcccttc 480
aatacctctg aatgggaggg ttatctgccc aaggagagca ttaggaccaa ggctgggcct 540
tggggcaggt gtgctgttgt gtcgtcagcg ggatctctga agtcctccca actaggcaga 600
gaaatcgatg atcatgacgc agtcctgagg tttaatgggg cacccacagc caacttccaa 660
caagatgtgg gcacaaaaac taccattcgc ctgatgaact ctcagttggt taccacagag 720
aagcgcttcc tcaaagacag tttgtacaat gaaggaatcc taattgtatg ggacccatct 780
gtataccact cagatatccc aaagtggtac cagaatccgg attataattt ctttaacaac 840
tacaagactt atcgtaagct gcaccccaat cagccctttt acatcctcaa gccccagatg 900
ccttgggagc tatgggacat tcttcaagaa atctccccag aagagattca gccaaacccc 960
ccatcctctg ggatgcttgg tatcatcatc atgatgacgc tgtgtgacca ggtggatatt 1020
tatgagttcc tcccatccaa gcgcaagact gacgtgtgct actactacca gaagttcttc 1080
gatagtgcct gcacgatggg tgcctaccac ccgctgctct atgagaagaa tttggtgaag 1140
catctcaacc agggcacaga tgaggacatc tacctgcttg gaaaagccac actgcctggc 1200
ttccggacca ttcactgcta a 1221
<210> 5
<211> 116
<212> ПРТ
<213> Homo sapiens
<400> 5
Met Asp Tyr Tyr Arg Lys Tyr Ala Ala Ile Phe Leu Val Thr Leu Ser
1 5 10 15
Val Phe Leu His Val Leu His Ser Ala Pro Asp Val Gln Asp Cys Pro
20 25 30
Glu Cys Thr Leu Gln Glu Asn Pro Phe Phe Ser Gln Pro Gly Ala Pro
35 40 45
Ile Leu Gln Cys Met Gly Cys Cys Phe Ser Arg Ala Tyr Pro Thr Pro
50 55 60
Leu Arg Ser Lys Lys Thr Met Leu Val Gln Lys Asn Val Thr Ser Glu
65 70 75 80
Ser Thr Cys Cys Val Ala Lys Ser Tyr Asn Arg Val Thr Val Met Gly
85 90 95
Gly Phe Lys Val Glu Asn His Thr Ala Cys His Cys Ser Thr Cys Tyr
100 105 110
Tyr His Lys Ser
115
<210> 6
<211> 129
<212> ПРТ
<213> Homo sapiens
<400> 6
Met Lys Thr Leu Gln Phe Phe Phe Leu Phe Cys Cys Trp Lys Ala Ile
1 5 10 15
Cys Cys Asn Ser Cys Glu Leu Thr Asn Ile Thr Ile Ala Ile Glu Lys
20 25 30
Glu Glu Cys Arg Phe Cys Ile Ser Ile Asn Thr Thr Trp Cys Ala Gly
35 40 45
Tyr Cys Tyr Thr Arg Asp Leu Val Tyr Lys Asp Pro Ala Arg Pro Lys
50 55 60
Ile Gln Lys Thr Cys Thr Phe Lys Glu Leu Val Tyr Glu Thr Val Arg
65 70 75 80
Val Pro Gly Cys Ala His His Ala Asp Ser Leu Tyr Thr Tyr Pro Val
85 90 95
Ala Thr Gln Cys His Cys Gly Lys Cys Asp Ser Asp Ser Thr Asp Cys
100 105 110
Thr Val Arg Gly Leu Gly Pro Ser Tyr Cys Ser Phe Gly Glu Met Lys
115 120 125
Glu
<210> 7
<211> 332
<212> ПРТ
<213> Homo sapiens
<400> 7
Met Cys Pro Ala Gly Trp Lys Leu Leu Ala Met Leu Ala Leu Val Leu
1 5 10 15
Val Val Met Val Trp Tyr Ser Ile Ser Arg Glu Asp Arg Tyr Ile Glu
20 25 30
Leu Phe Tyr Phe Pro Ile Pro Glu Lys Lys Glu Pro Cys Leu Gln Gly
35 40 45
Glu Ala Glu Ser Lys Ala Ser Lys Leu Phe Gly Asn Tyr Ser Arg Asp
50 55 60
Gln Pro Ile Phe Leu Arg Leu Glu Asp Tyr Phe Trp Val Lys Thr Pro
65 70 75 80
Ser Ala Tyr Glu Leu Pro Tyr Gly Thr Lys Gly Ser Glu Asp Leu Leu
85 90 95
Leu Arg Val Leu Ala Ile Thr Ser Ser Ser Ile Pro Lys Asn Ile Gln
100 105 110
Ser Leu Arg Cys Arg Arg Cys Val Val Val Gly Asn Gly His Arg Leu
115 120 125
Arg Asn Ser Ser Leu Gly Asp Ala Ile Asn Lys Tyr Asp Val Val Ile
130 135 140
Arg Leu Asn Asn Ala Pro Val Ala Gly Tyr Glu Gly Asp Val Gly Ser
145 150 155 160
Lys Thr Thr Met Arg Leu Phe Tyr Pro Glu Ser Ala His Phe Asp Pro
165 170 175
Lys Val Glu Asn Asn Pro Asp Thr Leu Leu Val Leu Val Ala Phe Lys
180 185 190
Ala Met Asp Phe His Trp Ile Glu Thr Ile Leu Ser Asp Lys Lys Arg
195 200 205
Val Arg Lys Gly Phe Trp Lys Gln Pro Pro Leu Ile Trp Asp Val Asn
210 215 220
Pro Lys Gln Ile Arg Ile Leu Asn Pro Phe Phe Met Glu Ile Ala Ala
225 230 235 240
Asp Lys Leu Leu Ser Leu Pro Met Gln Gln Pro Arg Lys Ile Lys Gln
245 250 255
Lys Pro Thr Thr Gly Leu Leu Ala Ile Thr Leu Ala Leu His Leu Cys
260 265 270
Asp Leu Val His Ile Ala Gly Phe Gly Tyr Pro Asp Ala Tyr Asn Lys
275 280 285
Lys Gln Thr Ile His Tyr Tyr Glu Gln Ile Thr Leu Lys Ser Met Ala
290 295 300
Gly Ser Gly His Asn Val Ser Gln Glu Ala Leu Ala Ile Lys Arg Met
305 310 315 320
Leu Glu Met Gly Ala Ile Lys Asn Leu Thr Ser Phe
325 330
<210> 8
<211> 406
<212> ПРТ
<213> Homo sapiens
<400> 8
Met Ile His Thr Asn Leu Lys Lys Lys Phe Ser Cys Cys Val Leu Val
1 5 10 15
Phe Leu Leu Phe Ala Val Ile Cys Val Trp Lys Glu Lys Lys Lys Gly
20 25 30
Ser Tyr Tyr Asp Ser Phe Lys Leu Gln Thr Lys Glu Phe Gln Val Leu
35 40 45
Lys Ser Leu Gly Lys Leu Ala Met Gly Ser Asp Ser Gln Ser Val Ser
50 55 60
Ser Ser Ser Thr Gln Asp Pro His Arg Gly Arg Gln Thr Leu Gly Ser
65 70 75 80
Leu Arg Gly Leu Ala Lys Ala Lys Pro Glu Ala Ser Phe Gln Val Trp
85 90 95
Asn Lys Asp Ser Ser Ser Lys Asn Leu Ile Pro Arg Leu Gln Lys Ile
100 105 110
Trp Lys Asn Tyr Leu Ser Met Asn Lys Tyr Lys Val Ser Tyr Lys Gly
115 120 125
Pro Gly Pro Gly Ile Lys Phe Ser Ala Glu Ala Leu Arg Cys His Leu
130 135 140
Arg Asp His Val Asn Val Ser Met Val Glu Val Thr Asp Phe Pro Phe
145 150 155 160
Asn Thr Ser Glu Trp Glu Gly Tyr Leu Pro Lys Glu Ser Ile Arg Thr
165 170 175
Lys Ala Gly Pro Trp Gly Arg Cys Ala Val Val Ser Ser Ala Gly Ser
180 185 190
Leu Lys Ser Ser Gln Leu Gly Arg Glu Ile Asp Asp His Asp Ala Val
195 200 205
Leu Arg Phe Asn Gly Ala Pro Thr Ala Asn Phe Gln Gln Asp Val Gly
210 215 220
Thr Lys Thr Thr Ile Arg Leu Met Asn Ser Gln Leu Val Thr Thr Glu
225 230 235 240
Lys Arg Phe Leu Lys Asp Ser Leu Tyr Asn Glu Gly Ile Leu Ile Val
245 250 255
Trp Asp Pro Ser Val Tyr His Ser Asp Ile Pro Lys Trp Tyr Gln Asn
260 265 270
Pro Asp Tyr Asn Phe Phe Asn Asn Tyr Lys Thr Tyr Arg Lys Leu His
275 280 285
Pro Asn Gln Pro Phe Tyr Ile Leu Lys Pro Gln Met Pro Trp Glu Leu
290 295 300
Trp Asp Ile Leu Gln Glu Ile Ser Pro Glu Glu Ile Gln Pro Asn Pro
305 310 315 320
Pro Ser Ser Gly Met Leu Gly Ile Ile Ile Met Met Thr Leu Cys Asp
325 330 335
Gln Val Asp Ile Tyr Glu Phe Leu Pro Ser Lys Arg Lys Thr Asp Val
340 345 350
Cys Tyr Tyr Tyr Gln Lys Phe Phe Asp Ser Ala Cys Thr Met Gly Ala
355 360 365
Tyr His Pro Leu Leu Tyr Glu Lys Asn Leu Val Lys His Leu Asn Gln
370 375 380
Gly Thr Asp Glu Asp Ile Tyr Leu Leu Gly Lys Ala Thr Leu Pro Gly
385 390 395 400
Phe Arg Thr Ile His Cys
405
<210> 9
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер ПЦР FSHa-fw
<400> 9
ccaggatccg ccaccatgga ttactacaga aaaatatgc 39
<210> 10
<211> 31
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер ПЦР FSHa-rev
<400> 10
ggatggctag cttaagattt gtgataataa c 31
<210> 11
<211> 35
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер ПЦР FSHb-fw
<400> 11
ccaggcgcgc caccatgaag acactccagt ttttc 35
<210> 12
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер ПЦР FSHb-rev
<400> 12
ccgggttaac ttattattct ttcatttcac caaagg 36
<210> 13
<211> 37
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер ПЦР 2,3STfw
<400> 13
ccaggatccg ccaccatgtg tcctgcaggc tggaagc 37
<210> 14
<211> 35
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер ПЦР 2,3STrev
<400> 14
tttttttctt aagtcagaag gacgtgaggt tcttg 35
<210> 15
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер ПЦР 2,6STfw
<400> 15
ccaggatccg ccaccatgat tcacaccaac ctgaag 36
<210> 16
<211> 32
<212> ДНК
<213> Искусственная последовательность
<220>
<223> праймер ПЦР 2,6STrev
<400> 16
tttttttctt aagttagcag tgaatggtcc gg 32
<---

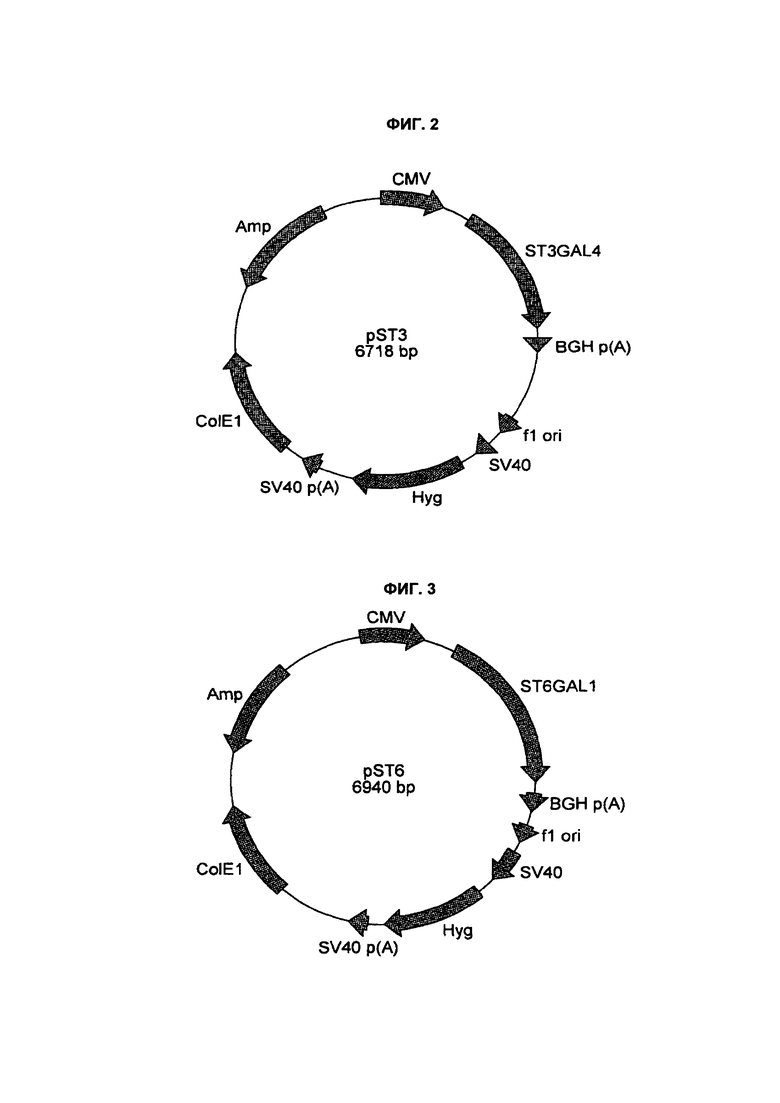
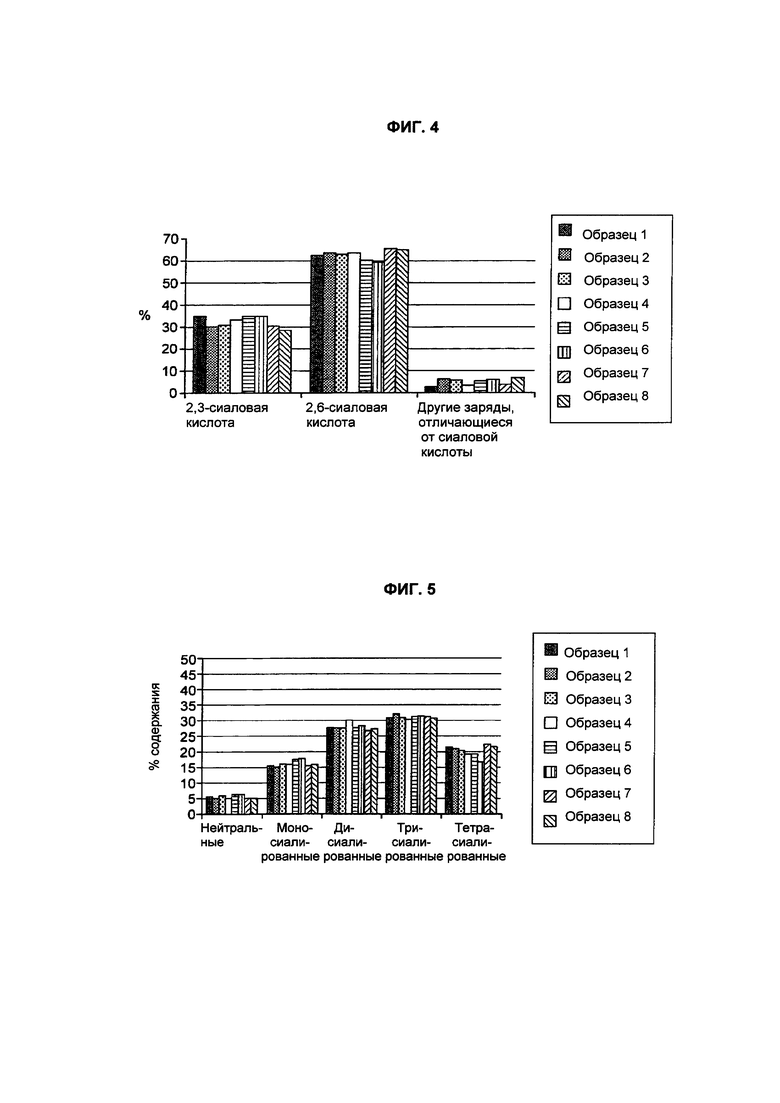


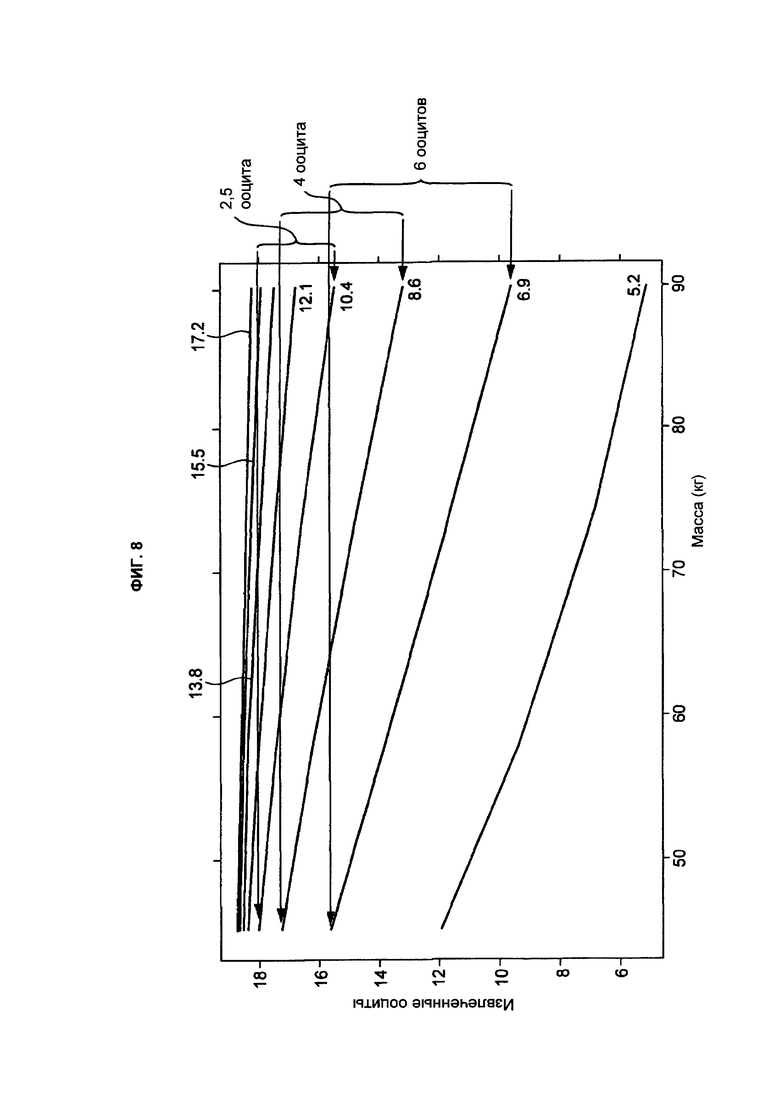
Группа изобретений относится к области медицины, а именно к репродуктивной медицине, и предназначена для лечения женского бесплодия. Обеспечиваются варианты применения фармацевтической композиции, содержащей фолликулостимулирующий гормон (ФСГ), для лечения бесплодия у пациентки, имеющей сывороточный уровень антимюллеровского гормона (АМГ) менее 15 пмоль/л, а также не менее 15 пмоль/л или не менее 35 пмоль/л. Фармацевтическая композиция предназначена для введения в дозе, равной или эквивалентной определенной дозе рекомбинантного ФСГ человеческого происхождения в сутки, причем указанный рекомбинантный ФСГ включает α2,3- и α2,6-сиалирование, где от 1 до 50% общего сиалирования представляет собой α2,6-сиалирование и от 50 до 99% общего сиалирования представляет собой α2,3-сиалирование. Использование группы изобретения позволяет повысить эффективность лечения бесплодия у пациентки. 12 н. и 28 з.п. ф-лы, 5 табл., 11 пр., 8 ил.
1. Применение фармацевтической композиции, содержащей фолликулостимулирующий гормон (ФСГ), для лечения бесплодия у пациентки, имеющей сывороточный уровень антимюллеровского гормона (АМГ) менее 15 пмоль/л, где фармацевтическая композиция предназначена для введения в дозе, равной или эквивалентной 11-13 мкг рекомбинантного ФСГ человеческого происхождения в сутки, причем указанный рекомбинантный ФСГ включает α2,3- и α2,6-сиалирование, где от 1 до 50% общего сиалирования представляет собой α2,6-сиалирование и от 50 до 99% общего сиалирования представляет собой α2,3-сиалирование, и где лечение бесплодия включает стадию определения сывороточного уровня АМГ пациента и стадию введения указанной дозы пациенту, имеющему сывороточный уровень АМГ менее 15 пмоль/л.
2. Применение по п. 1, где фармацевтическая композиция предназначена для введения в дозе, равной или эквивалентной 12 мкг рекомбинантного ФСГ в сутки.
3. Применение фармацевтической композиции, содержащей фолликулостимулирующий гормон (ФСГ), для лечения бесплодия у пациентки, имеющей сывороточный уровень антимюллеровского гормона (АМГ) не менее 15 пмоль/л, где фармацевтическая композиция предназначена для введения в дозе, равной или эквивалентной от 0,09 до 0,19 мкг рекомбинантного ФСГ человеческого происхождения на кг массы тела пациента в сутки, причем указанный рекомбинантный ФСГ включает α2,3- и α2,6-сиалирование, где от 1 до 50% общего сиалирования представляет собой α2,6-сиалирование и от 50 до 99% общего сиалирования представляет собой α2,3-сиалирование, и где лечение бесплодия включает стадию определения сывороточного уровня АМГ пациента и стадию введения указанной дозы пациенту, имеющему определенный сывороточный уровень АМГ.
4. Применение по п. 3 для лечения пациента, имеющего сывороточный уровень АМГ от 15 до 24,9 пмоль/л, где фармацевтическая композиция предназначена для введения в дозе, равной или эквивалентной от 0,14 до 0,19 мкг рекомбинантного ФСГ на кг массы тела пациента в сутки.
5. Применение по п. 3 для лечения пациента, имеющего сывороточный уровень АМГ от 25 до 34,9 пмоль/л, где фармацевтическая композиция предназначена для введения в дозе, равной или эквивалентной от 0,11 до 0,14 мкг рекомбинантного ФСГ на кг массы тела пациента в сутки.
6. Применение по п. 3 для лечения пациента, имеющего сывороточный уровень АМГ не менее 35 пмоль/л, где фармацевтическая композиция предназначена для введения в дозе, равной или эквивалентной от 0,10 до 0,11 мкг рекомбинантного ФСГ человеческого происхождения на кг массы тела пациента в сутки.
7. Применение по любому из пп. 1-6, где ФСГ включает моно-, ди-, три- и тетра-сиалированные гликановые структуры, где 15-24%, например 17-23%, сиалированных гликановых структур составляют тетра-сиалированные гликановые структуры.
8. Применение по любому из пп. 1-7, где фармацевтическая композиция дополнительно содержит соль, содержащую фармацевтически приемлемый катион щелочного металла, выбранную из группы, состоящей из солей Na+ или K+ или их комбинации.
9. Применение фармацевтической композиции, содержащей ФСГ, для лечения бесплодия у пациентки, имеющей сывороточный уровень АМГ не менее 35 пмоль/л, где фармацевтическая композиция предназначена для введения в дозе, равной или эквивалентной от 0,10 до 0,11 мкг рекомбинантного ФСГ на кг массы тела пациента в сутки, и где указанный ФСГ включает α2,3- и α2,6-сиалирование, где от 1 до 50% общего сиалирования представляет собой α2,6-сиалирование и от 50 до 99% общего сиалирования представляет собой α2,3-сиалирование.
10. Применение фармацевтической композиции, содержащей ФСГ, для лечения бесплодия у пациентки, имеющей риск синдрома гиперстимуляции яичников (СГСЯ), имеющей сывороточный уровень АМГ не менее 35 пмоль/л, где фармацевтическая композиция предназначена для введения в дозе, равной или эквивалентной от 0,10 до 0,11 мкг рекомбинантного ФСГ на кг массы тела пациента в сутки, и где указанный ФСГ включает α2,3- и α2,6-сиалирование, где от 1 до 50% общего сиалирования представляет собой α2,6-сиалирование и от 50 до 99% общего сиалирования представляет собой α2,3-сиалирование.
11. Применение по п. 9 или 10, где лечение бесплодия осуществляют путем контролируемой стимуляции яичников.
12. Применение по любому из пп. 9-11, где лечение бесплодия включает стадию определения сывороточного уровня АМГ пациента и стадию введения указанной дозы пациенту, имеющему сывороточный уровень АМГ не менее 35 пмоль/л.
13. Применение фармацевтической композиции, содержащей ФСГ, для лечения бесплодия у пациентки, имеющей риск синдрома гиперстимуляции яичников (СГСЯ) и имеющей сывороточный уровень АМГ не менее 15 пмоль/л, где фармацевтическая композиция предназначена для введения в дозе, равной или эквивалентной от 0,09 до 0,19 мкг рекомбинантного ФСГ на кг массы тела пациента в сутки, и где указанный ФСГ включает α2,3- и α2,6-сиалирование, где от 1 до 50% общего сиалирования представляет собой α2,6-сиалирование и от 50 до 99% общего сиалирования представляет собой α2,3-сиалирование.
14. Применение по п. 13, где лечение бесплодия осуществляют путем контролируемой стимуляции яичников.
15. Применение по п. 13 или 14, где лечение бесплодия включает стадию определения сывороточного уровня АМГ пациента.
16. Применение по любому из пп. 9-15, где указанный ФСГ включает α2,3- и α2,6-сиалирование, где 80% или более общего сиалирования представляет собой α2,3-сиалирование.
17. Применение по любому из пп. 9-16, где фолликулостимулирующий гормон (ФСГ) представляет собой рекомбинантный ФСГ человеческого происхождения.
18. Применение фармацевтической композиции, содержащей фолликулостимулирующий гормон (ФСГ), для лечения бесплодия у пациентки, имеющей сывороточный уровень АМГ менее 15 пмоль/л, где фармацевтическая композиция предназначена для введения в дозе, равной или эквивалентной 11-13 мкг рекомбинантного ФСГ человеческого происхождения в сутки, в течение 12-16 суток после введения агониста гонадотропин-высвобождающего гормона (ГнВГ), и где указанный ФСГ включает α2,3- и α2,6-сиалирование, где от 1 до 50% общего сиалирования представляет собой α2,6-сиалирование и от 50 до 99% общего сиалирования представляет собой α2,3-сиалирование.
19. Применение фармацевтической композиции, содержащей фолликулостимулирующий гормон (ФСГ), для лечения бесплодия у пациентки, имеющей сывороточный уровень АМГ не менее 15 пмоль/л, где фармацевтическая композиция предназначена для введения в дозе, равной или эквивалентной 0,09-0,19 мкг рекомбинантного ФСГ человеческого происхождения на кг массы тела пациента в сутки, в течение 12-16 суток после введения агониста ГнВГ, и где указанный ФСГ включает α2,3- и α2,6-сиалирование, где от 1 до 50% общего сиалирования представляет собой α2,6-сиалирование и от 50 до 99% общего сиалирования представляет собой α2,3-сиалирование.
20. Применение по п. 18 или 19, где лечение бесплодия включает стадию определения сывороточного уровня АМГ пациента и стадию введения указанной дозы пациенту, имеющему определенный сывороточный уровень АМГ.
21. Применение фармацевтической композиции, содержащей фолликулостимулирующий гормон (ФСГ), для лечения бесплодия у пациентки, имеющей сывороточный уровень АМГ менее 15 пмоль/л, где фармацевтическая композиция предназначена для введения в дозе, равной или эквивалентной 11-13 мкг рекомбинантного ФСГ человеческого происхождения в сутки, вместе с антагонистом ГнВГ, и где указанный ФСГ включает α2,3- и α2,6-сиалирование, где от 1 до 50% общего сиалирования представляет собой α2,6-сиалирование и от 50 до 99% общего сиалирования представляет собой α2,3-сиалирование.
22. Применение фармацевтической композиции, содержащей фолликулостимулирующий гормон (ФСГ), для лечения бесплодия у пациентки, имеющей сывороточный уровень АМГ не менее 15 пмоль/л, где фармацевтическая композиция предназначена для введения в дозе, равной или эквивалентной 0,09-0,19 мкг рекомбинантного ФСГ человеческого происхождения на кг массы тела пациента в сутки, вместе с антагонистом ГнВГ, и где указанный ФСГ включает α2,3- и α2,6-сиалирование, где от 1 до 50% общего сиалирования представляет собой α2,6-сиалирование и от 50 до 99% общего сиалирования представляет собой α2,3-сиалирование.
23. Применение по п. 21 или 22, где лечение бесплодия включает стадию определения сывороточного уровня АМГ пациента и стадию введения указанной дозы пациенту, имеющему определенный сывороточный уровень АМГ.
24. Применение фармацевтической композиции, содержащей рекомбинантный человеческий фолликулостимулирующий гормон (ФСГ), для лечения бесплодия у пациентки, имеющей сывороточный уровень АМГ менее 15 пмоль/л, где фармацевтическая композиция предназначена для введения в дозе, равной или эквивалентной 11-13 мкг рекомбинантного человеческого ФСГ в сутки, где фармацевтическая композиция дополнительно содержит хорионический гонадотропин человека (ХГЧ).
25. Применение по п. 24, где фармацевтическая композиция предназначена для введения в дозе, равной или эквивалентной 12 мкг рекомбинантного человеческого ФСГ в сутки.
26. Применение фармацевтической композиции, содержащей рекомбинантный человеческий фолликулостимулирующий гормон (ФСГ), для лечения бесплодия у пациентки, имеющей сывороточный уровень АМГ не менее 15 пмоль/л, где фармацевтическая композиция предназначена для введения в дозе, равной или эквивалентной 0,09-0,19 мкг рекомбинантного человеческого ФСГ на кг массы тела пациента в сутки, где фармацевтическая композиция дополнительно содержит ХГЧ.
27. Применение по п. 26 для лечения пациента, имеющего сывороточный уровень АМГ от 15 до 24,9 пмоль/л, где фармацевтическая композиция предназначена для введения в дозе, равной или эквивалентной от 0,14 до 0,19 мкг рекомбинантного ФСГ человеческого происхождения на кг массы тела пациента в сутки.
28. Применение по п. 26 для лечения пациента, имеющего сывороточный уровень АМГ от 25 до 34,9 пмоль/л, где фармацевтическая композиция предназначена для введения в дозе, равной или эквивалентной от 0,11 до 0,14 мкг рекомбинантного человеческого ФСГ на кг массы тела пациента в сутки.
29. Применение по п. 26 для лечения пациента, имеющего сывороточный уровень АМГ не менее 35 пмоль/л, где фармацевтическая композиция предназначена для введения в дозе, равной или эквивалентной от 0,10 до 0,11 мкг рекомбинантного ФСГ человеческого происхождения на кг массы тела пациента в сутки.
30. Применение по любому из пп. 23-29, где указанный рекомбинантный человеческий ФСГ представляет собой рекомбинантный человеческий ФСГ, который включает α2,3- и α2,6-сиалирование.
31. Применение по п. 30, где от 1 до 50% общего сиалирования представляет собой α2,6-сиалирование и от 50 до 99% общего сиалирования представляет собой α2,3-сиалирование.
32. Применение по любому из пп. 23-31, где фармацевтическая композиция дополнительно содержит соль, содержащую фармацевтически приемлемый катион щелочного металла, выбранную из группы, состоящей из солей Na+ или K+ или их комбинации.
33. Применение по любому из пп. 23-32, где указанный ХГЧ представляет собой рекомбинантный ХГЧ.
34. Применение по любому из пп. 23-33, где указанные ФСГ и ХГЧ предназначены для совместного введения.
35. Применение по любому из пп. 23-34, где указанные ФСГ и ХГЧ предназначены для раздельного введения.
36. Применение фармацевтической композиции, содержащей рекомбинантный фолликулостимулирующий гормон (ФСГ), для лечения бесплодия у пациентки, имеющей сывороточный уровень АМГ 0,05 пмоль/л или выше, где фармацевтическая композиция содержит дозу, равную или эквивалентную от 15 мкг до 24 мкг рекомбинантного ФСГ.
37. Применение по п. 36, где фармацевтическая композиция содержит дозу, равную или эквивалентную 15 мкг, 18 мкг или 24 мкг рекомбинантного ФСГ.
38. Применение по п. 36, где лечение бесплодия включает стадию определения сывороточного уровня АМГ пациента и стадию введения указанной дозы пациенту, имеющему сывороточный уровень АМГ 0,05 пмоль/л или выше.
39. Применение по п. 36, где указанный ФСГ включает α2,3- и α2,6-сиалирование.
40. Применение по любому из пп. 36-39, где фармацевтическая композиция дополнительно содержит ХГЧ.
| WO 2009127826 A1, 22.10.2009 | |||
| N | |||
| la COUR FREIESLEBEN et al "Prospective Investigation of Serum anti-Müllerian Hormone Concentration in Ovulatory Intrauterine Insemination Patients: A Preliminary Study" (Reprod Biomed Online, 2010, 20(5), р.582-7 | |||
| WO 2011044331 A1, 14.04.2011 | |||
| US 2008108571 A1, 08.05.2008 | |||
| FORESTA C | |||
| et al "Hormonal treatment |
Авторы
Даты
2020-12-21—Публикация
2012-08-08—Подача