Изобретение относится к медицине, а именно к нейроонкологии, и может быть использовано для прогнозирования течения низкодифференцированных глиальных опухолей (HGG) на основе цитокинового микроокружения.
Согласно данным CBTRUS 2012-2016 г., клиническим рекомендациям МЗ РФ по первичным опухолям центральной нервной системы от 2018 г. опухоли ЦНС составляют 1,5-2% в структуре всех онкозаболеваний. При пересчете на 100.000 населения в среднем частота выявления составляет 23,41 и имеет тенденцию к росту (Каприн А. Д., 2013).
К глиальным опухолям относится до 60% всех опухолей ЦНС, среди которых превалируют HGG, а именно: анапластическая астроцитома и глиобластома (ГБ), которые являются наиболее часто встречаемыми злокачественными опухолями головного мозга и составляют 63,4% от злокачественных опухолей ЦНС и до 85% всех глиальных опухолей. Пациенты с ГБ, несмотря на комплексный подход в лечении, имеют общую медиану выживаемости 14-16 месяцев, а пятилетний порог преодолевают не более 5% (Davis М. Е. et al., 2018).
Несмотря на идентичность прогностически благоприятных факторов: возраст до 60 лет, индекс по шкале Карновского до начала лечения более 70 баллов и стандартизированных подходов к лечению, гистологическая классификация первичных опухолей ЦНС не могла объяснить наличие пациентов «долгожителей» преодолевших 5-летний барьер. В последнее десятилетие, основной упор специалистов сконцентрирован на выявлении и изучении роли молекулярно-генетических аберраций. Определение ряда мутаций, наряду с гистологическими характеристиками, нашло отражение в классификации ВОЗ, 2016 (Louis D. N. et al., 2016).
В настоящее время прогностически значимым является определение статуса мутации генов IDH1/2, кодирующих фермент изоцитратдегидрогеназу (Thompson С.В., 2009; Кобяков Г.Л. и соавт., 2018). При глиальных опухолях данные мутации впервые были описаны при высокодифференцированных глиальных опухолях (LGG) и выявляются более чем в 90% случаев (Cancer Genome Atlas Research, 2015; Aibaidula A. et al., 2017; Sun H. et al., 2013).
По мнению ряда авторов, наличие мутации генов IDH1/2, вне зависимости от степени злокачественности, является предиктором лучшего ответа на комплексную терапию и, как следствие, более длительной послеоперационной выживаемости. Так пациенты с ГБ и наличием мутации в генах IDH1/2 имеют медиану выживаемости 27,1-45,6 месяцев, а пациенты с ГБ без мутации - 11,3-15 месяцев (Juratli Т.A. et al., 2012; Ahmadipour Y. et al., 2019). Suzuki et al. сообщили, что пациенты с ГБ и наличием IDH мутации имеют лучший прогноз в сравнении с высокодифференцированными глиальными опухолями без мутации в генах IDH (Suzuki Н. et al., 2015). В то же время Горяйнов и соавт. в своей работе, выполненной в Национальном научно-практическом центре нейрохирургии им. Акад. Н. Н. Бурденко, при ретроспективном анализе 84 пациентов с ГБ, проживших более 3 лет после первичной операции, не выявили достоверной разницы в их выживаемости в зависимости от наличия мутации в генах IDH1/2 (Горяйнов С.А. и соавт., 2017).
Определение мутации генов IDH1/2 осуществляется методом ПЦР в режиме реального времени, секвенирования. Данные методики впервые описаны Yan Н. et al. в 2009 г. Несмотря на высокую чувствительность данных методов, в нашей стране определение данной мутации доступно лишь в крупных Федеральных центрах.
Даже несмотря на «тотальное» удаление опухоли (более 95% объема) и комплексный подход к лечению, может отмечаться прогрессирование в раннем сроке наблюдения. Быстрый опухолевый рост невозможен без формирования благоприятного для него микроокружения, в которое вносят вклад локально продуцируемые цитокины, включая обладающие иммуносупрессивным и провоспалительным действием. Установленное значение неоангиогенеза в развитии глиом предполагает негативную роль гиперпродукции провоспалительных цитокинов, традиционно не считающихся иммуносупрессивными, однако, в данных условиях способствующих росту и трансформации опухоли. Следовательно, оценка локального содержания цитокинов может оказаться одним из прогностически значимых факторов.
Известны способы прогнозирования течения онкологических заболеваний в зависимости от характера их иммунологического микроокружения, использованные нами в качестве аналогов (см. патент RU 2643761, опубл. 05.02.2018, Бюл. №4; RU 2712921, опубл 03.02.2020, Бюл. №4). Авторами исследованы факторы микроокружения меланомы кожи, в том числе и цитокиновый состав опухоли и перитуморальной зоны. При этом установлена прогностическая роль высокого содержания IL-6 в ткани опухоли и IL-1β и IL-2 в перитуморальной зоне для раннего прогрессирования меланомы кожи. Однако авторами не проводилось исследование низкодифференцированных глиальных опухолей.
В работе Jiang Y. et al. изучали влияние снижения экспрессии IL-6 и блокирование рецепторов к IL-6 на рост глиобластомы. В этой же работе отмечено, что высокий уровень секреции IL-6, рецепторов IL-6 коррелирует с ранним рецидивированием. Возможность прогнозирования прогрессирования низкодифференцированных глиальных опухолей в зависимости от цитокинового микроокружения была показана лишь на основании изменения содержания IL-6 в ткани опухоли (Jiang Y. et al., 2017), тогда как остальные цитокины также могут быть информативными в этом плане. Данный способ прогнозирования течения HGG выбран нами в качестве прототипа.
При анализе базы данных ФИПС, Pubmed сообщений об иных прогностически значимых отличиях цитокинового микроокружения низкодифференцированных глиальных опухолей не выявлено.
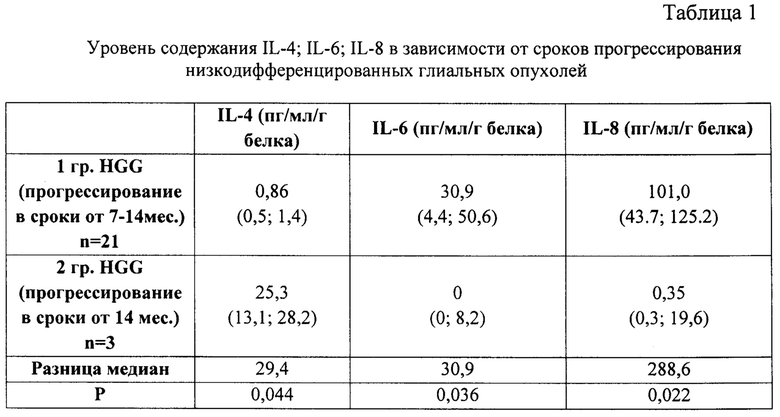
Нами были проанализированы уровни содержания в опухолевой ткани IL-1, IL-2, IL-4, IL-6, IL-8, IL-10, IFN-α, IFN-γ, фактора некроза опухоли. В результате была обнаружена прогностическая роль содержания в опухолевой ткани IL-4, IL-6, IL-8. В результате клинических наблюдений были сформированы 2 группы пациентов. 1-я группа (п=21) с прогрессированием опухолевого роста в срок от 7 до 14 месяцев. И 2-ая группа (п=3) с прогрессированием опухолевого роста в срок от 14 месяцев.
Предложенный нами метод позволяет прогнозировать течение HGG не только на основании измерения концентрации IL-6, но и IL-4 и IL-8 в ткани опухоли, что предполагает повышение чувствительности метода. Он основан на описанных в литературе биологических свойствах данных цитокинов.
IL4 обладает противовоспалительной активностью. IL-4 секретируют Т-лимфоциты, NK-клетки, базофилы, эозинофилы, тучные клетки. IL-4 влияет на рост и дифференцировку В- и Т-лимфоцитов, тучных клеток; регулирует деятельность макрофагов; стимулирует рост Т-хелперов, преимущественно, Th 2 типа, и Т-киллеров. Совместно с IL-2 повышает пролиферацию предшественников и индуцирует дифференцировку в Т-киллеры. В HGG отмечается повышенная экспрессия рецепторов к IL-4. (Okada Н. et al., 2003; Weber F. et al., 2003). Работ, посвященных прогнозированию течения низкодифференцированных глиальных опухолей по уровню IL-4 в ткани опухоли не обнаружено.
IL-8 в основном продуцируется активированными моноцитами и эпителиальными клетками. IL-8 влияет на синаптогенез, внутриклеточную концентрацию кальция и межсинаптическую передачу. Полиморфизмы гена, кодирующего IL-8, коррелируют с развитием злокачественных опухолей различной локализации, в том числе и головного мозга (Liu Н. et al., 2015). Повышение экспрессии IL-8 в крови свидетельствует о прогрессии ГБ, увеличении перитуморального отека и зон некроза (Henker С. et al., 2016). При ГБ IL-8 стимулирует неоангиогенез, повышает инвазивность опухоли (Kosmopoulos М. et al., 2018). В качестве прогностического критерия предложено повышение экспрессии IL-8 в крови, которое коррелировало с менее благоприятным прогнозом (Zhang В. et al., 2015; Muller L. et al., 2015). Однако, несмотря на то, что при проведении химиотерапии уровни IL-8 в крови снижались, прогноз пациентов с ГБ не менялся (Kosmopoulos М. et al., 2018). Работ, посвященных прогнозированию течения низкодифференцированных глиальных опухолей по уровню IL-8 в ткани опухоли не обнаружено.
Задачей изобретения является определение на этапе хирургического удаления опухоли характера дальнейшего течения злокачественного процесса у больных с низкодифференцированными глиальными опухолями.
Техническим результатом данного изобретения является разработка способа прогнозирования течения низкодифференцированных глиальных опухолей на основе их цитокинового микроокружения.
Технический результат достигается тем, что в опухолевой ткани методом иммуноферментного анализа определяют комплексное содержание интерлейкинов IL-4, IL-6, IL-8 и при их совокупном содержании IL-4 в пределах от 0,5 до 1,4 пг/мл/г белка, IL-6 от 4,4 до 50,6 пг/мл/г белка, IL-8 от 43,7 до 125,2 пг/мл/г белка прогнозируют раннее прогрессирование опухоли в сроки 7-14 месяцев после операции, а при совокупном содержании IL-4 в пределах от 13,1 до 28,2 пг/мл/г белка, IL-6 от 0 до 8,2 пг/мл/г белка, IL-8 от 0,3 до 19,6 пг/мл/г белка прогнозируют позднее прогрессирование в сроки более 14 месяцев после операции.
Изобретение «Способ прогнозирования течения низкодифференцированных глиальных опухолей на основе цитокинового микроокружения» является новым, так как оно неизвестно в нейроонкологии при прогнозировании течения низкодифференцированных глиальных опухолей.
Новизна изобретения заключается в том, что во время операции по поводу низкодифференцированных глиальных опухолей берут фрагмент опухолевой ткани. Образцы опухолевой ткани, размером 0,5×0,5×0,5 см, подвергают механическому дроблению. Приготовленный материал погружают в одноразовый механический дезагрегатор (Medicon, USA) с отделительными экранами на 35 мкм и на 50 мкм, добавляют 2 мл промывочного раствора для клеток (Cellwash). С последующим помещением в дезинтегратор ткани BD Medimachine (США) и гомогенизацией в течение 30-60 с. Полученные гомогенизированные ткани переносят в пластиковые одноразовые пробирки и центрифугируют в течение 4 мин. при 1500 об/мин. В результате получают разделенную на две фракции смесь: жидкую полупрозрачную часть сверху (супернатант) используют для определения цитокинов. Уровни цитокинов определяют методом ИФА: концентрацию провоспалительных и противовоспалительных цитокинов с использованием тест-систем «Вектор-Бест» (Новосибирск, Россия) в соответствии с инструкциями фирмы производителя. Оценку результатов количественного определения цитокинов осуществляют на анализаторе иммуноферментных реакций АИФР-01 (УНИПЛАН, Россия). Результаты выражают в виде удельного содержания в пересчете на 1 г белка гомогената, оцениваемого биуретовым методом (пг/мл/г белка). Концентрацию общего белка определяют биуретовым методом с использованием наборов «Общий белок Ольвекс» (Ольвекс-диагностикум, Россия) в соответствии с инструкцией фирмы производителя. Результаты реакции оценивают на полуавтоматическом биохимическом анализаторе BS-3000P (Sinnowa Medical Science & Technology Co., КНР).
При комплексном содержании IL-4 в пределах от 0,5 до 1,4 пг/мл/г белка, IL-6 от 4,4 до 50,6 пг/мл/г белка, IL-8 от 43,7 до 125,2 пг/мл/г белка прогнозируют раннее прогрессирование опухоли в сроки 7-14 месяцев, а при совокупном содержании IL-4 в пределах от 13,1 до 28,2 пг/мл/г белка, IL-6 от 0 до 8,2 пг/мл/г белка, IL-8 от 0,3 до 19,6 пг/мл/г белка прогнозируют позднее прогрессирование в сроки более 14 месяцев.
Изобретение «Способ прогнозирования течения низкодифференцированных глиальных опухолей на основе цитокинового микроокружения» является промышленно применимым и может быть многократно воспроизведен в здравоохранении в лечебных учреждениях специализированного профиля для лечения онкологических больных с данной локализацией злокачественного процесса.
Способ прогнозирования течения низкодифференцированных глиальных опухолей на основе цитокинового микроокружения выполняется следующим образом.
Интраоперационно производят забор опухолевой ткани. Далее методом ИФА в опухолевой ткани определяют уровень IL-4; IL-6; IL-8. При совокупном содержании IL-4 в пределах от 0,5 до 1,4 пг/мл/г белка, IL-6 от 4,4 до 50,6 пг/мл/г белка, IL-8 от 43,7 до 125,2 пг/мл/г белка прогнозируют раннее прогрессирование опухоли в сроки 7-14 месяцев, а при совокупном содержании IL-4 в пределах от 13,1 до 28,2 пг/мл/г белка, IL-6 от 0 до 8,2 пг/мл/г белка, IL-8 от 0,3 до 19,6 пг/мл/г белка прогнозируют позднее прогрессирование в сроки более 14 месяцев.
В ходе исследования нами установлено, что у больных с поздним прогрессированием низкодифференцированных глиальных опухолей тканевой уровень IL-4 был в 29,4 раз выше, чем у больных с ранним прогрессированием: 0,86 (0,5; 1,4) против 25,3 (13,1; 28,2). При этом уровни IL-6 и IL-8, напротив, были ниже (IL-6 в 30,9 раза: 30,9 (4,4; 50,6) против 0 (0; 8,2); IL-8 в 288,6 раз: 101 (43,7; 125,2) против 0,35 (0,3; 19,6). Все различия статистически достоверны, р<0,05. Статистическую обработку данных проводили с использованием пакета STATISTICA 13 (StatSoftlnc, США). Результаты представляли в виде центральной тенденции медианы (Me) и интерквартильного размаха - 25 и 75 процентили (Me [LQ; UQ]). Достоверность отличий между выборками оценивали с использованием непараметрического критерия Манна-Уитни. Результаты представлены в таблице 1.
Полученные результаты указывают на наличие статистически значимых отличий в содержании провоспалительных (IL-6: IL-8) и противовоспалительного (IL-4) интерлейкинов. С учетом их биологических функций микроокружение больных 1 группы может быть охарактеризовано как иммуносупрессивное и ростостимулирующее.
Клиническое применение способа позволит уже на этапе хирургического вмешательства выделять группы больных с высоким риском прогрессирования заболевания и прогнозировать хирургические, терапевтические и диагностические мероприятия в послеоперационном периоде.
Приводим примеры клинического наблюдения. Пример №1
Пациентка В., 28.06.1991 г. р., поступила в отделение нейроонкологии ФГБУ «НМИЦ онкологии» Минздрава России 17.10.2018 с жалобами на нарастающие по интенсивности головные боли, тошноту, периодическое нарушение речи.
Из анамнеза: считает себя больной в течение 2-х лет, когда при МРТ головного мозга выявлена опухоль левой лобной доли. От предложенного дообследования и лечения в 2017 г. пациентка отказалась. В связи с появившимися в сентябре 2018 г. речевыми нарушениями повторно обратилась в НМИЦ онкологии. По шкале Карновского 90 баллов.
Данные обследования. При выполнении МРТ головного мозга с и без контрастного усиления от 12.10.2018 определяется опухоль левой лобной доли, размерами 3,6×3,0×3,4 см. Дислокации срединных структур нет. При контрастном усилении отмечаются единичные участки накопления контраста.
С диагнозом: (С71.1) Глиальная опухоль левой лобной доли, клиническая группа 2 госпитализирована для проведения оперативного лечения.
19.10.2018 выполнена операция - костнопластическая краниотомия в левой лобной области, удаление опухоли левой лобной доли головного мозга в пределах видимых здоровых тканей с интраоперационным пробуждением пациента и применением нейрофизиологического мониторинга. Интраоперационно взят фрагмент опухолевой ткани для ИФА.
Послеоперационный период протекал без особенностей.
При гистологическом и иммуногистохимическом исследовании определяется анапластическая астроцитома, WHO Gr III. Индекс пролиферативной активности Ki 67 - 25%. При молекулярно-генетическом исследовании методом ПЦР определена мутация гена IDH1. Уровень метилирования промотора MGMT составил 35%.
При проведении ИФА опухолевой ткани с определением комплекса интерлейкинов были получены следующие данные: IL-4: 25,26 пг/мл/г белка; IL-6: 0 пг/мл/г белка; IL-8: 0,33 пг/мл/г белка.
При выполнении МРТ головного мозга от 08.11.2018 с и без контрастного усиления данных за остаточную опухоль не выявлено.
С 12.11.2018 по 18.12.2019 проведена лучевая терапия (СОД 60 Гр., РОД 2,19 Гр., №27) и химиотерапия темозоломидом в дозировке 120 мг.1 р/д в дни лучевой терапии. Далее рекомендовано продолжить химиотерапию темозоломидом в дозировке 150-200 мг/м в 1-5 дни с интервалом в 23 дня. Всего проведено 6 курсов химиотерапии.
При выполнении МРТ головного мозга от 14.03.2019, 05.06.2019, 03.10.2019 и 22.02.2020 с и без контрастного усиления признаков продолженного роста нет.
Приведенный клинический пример демонстрирует возможность прогнозирования течения низкодиффернцированной глиальной опухоли с развитием продолженного роста в сроки от 14 месяцев и определения объема симптоматической и химиотерапии, диагностических мероприятий.
Пример №2.
Пациент С, 04.01.1952 г.р., поступил в отделение нейроонкологии ФГБУ «НМИЦ онкологии» Минздрава России 17.12.2018 с жалобами на нарушение понимания обращенной речи, нарастающие по интенсивности головные боли, тошноту, рвоту.
Из анамнеза: считает себя больным в течение 1 месяца. При выполнении МРТ головного мозга выявлена опухоль левой височной и теменной долей. Далее за мед. помощью обратилась в НМИЦ онкологии. По шкале Карновского 80 баллов.
Данные обследования. При выполнении МРТ головного мозга с и без контрастного усиления от 10.12.2018 определяется опухоль левой височной и теменной долей, 4,2×4,6×5,5 см. Дислокации срединных структур нет. При контрастном усилении отмечаются единичные участки накопления контраста.
С диагнозом: (С71.0) Глиальная опухоль левой височной и теменной долей, клиническая группа 2 госпитализирован для проведения оперативного лечения.
19.12.2018 выполнена операция - костно-пластическая краниотомия в левой теменной области, удаление глиальной опухоли с применением интраоперационного нейрофизиологического мониторинга.
Интраоперационно взят фрагмент опухолевой ткани для ИФА.
Послеоперационный период протекал без особенностей.
При гистологическом и иммуногистохимическом исследовании определяется анапластическая астроцитома, WHO Gr III. Индекс пролиферативной активности Ki 67 - 20%. При молекулярно-генетическом исследовании методом ПНР мутация генов IDH установить гн удалось. Уровень метилирования промотора MGMT 15%.
При проведении ИФА опухолевой ткани с определением комплекса интерлейкинов были получены следующие данные: IL-4 0,72 пг/мл/г белка; IL-6 22,6 пг/мл/г белка; IL-8 94,2 пг/мл/г белка.
При выполнении МРТ головного мозга от 09.01.2019 с и без контрастного усиления данных за остаточную опухоль не выявлено.
С 28.01.2019 по 04.03.2019 проведена лучевая терапия (СОД 60 Гр., РОД 2 Гр., №30) и химиотерапия темозоломидом в дозировке 150 мг 1 р/д в дни лучевой терапии. Далее рекомендовано продолжить химиотерапию темозоломидом в дозировке 150 мг/м в 1-5 дни с интервалом в 23 дня.
25.07.2019 у пациента впервые развился первично генерализованный судорожный приступ. Начата противосудорожная терапия. При выполнении МРТ головного мозга от 27.07.2019 с и без контрастного усиления, отмечается зона накопления контраста размерами 1×1,5×0,7 см - продолженный рост. Продолжена химиотерапия темозоломидом в дозировке 300 мг в 1-5 дни с интервалом в 23 дня.
В связи с развитием тромбоцитопении пациент наблюдался у гематолога, проводилась ее коррекция.
При выполнении ПЭТ КТ с метионином от 29.07.2019 отмечается зона повышенного метаболизма, размерами 1,2×1,7×0,9 см. Данные свидетельствуют о продолженном росте. Продолжена химиотерапия темозоломидом. Всего проведено 9 курсов.
При выполнении МРТ головного мозга от 23.10.2019 и 02.02.2020 очаг накопления контраста без динамики.
Приведенный клинический пример демонстрирует возможность прогнозирования течения низкодифференцированной глиальной опухоли с развитием продолженного роста в сроки от 7 до 14 месяцев и, как следствие, необходимость более длительного курса симптоматической и химиотерапии, проведения большего объема диагностических мероприятий.
Технико-экономическая эффективность «Способ прогнозирования течения низкодифференцированных глиальных опухолей на основе цитокинового микроокружения» заключается в том, что совокупные уровни IL-4; IL-6; IL-8 в ткани опухоли могут являться прогностическим критерием прогрессирования опухоли и при персонифицированном подходе к ведению этих пациентов снизить экономические затраты на лечение прогрессирования опухоли.
Список литературы
1. Ahmadipour Y., Jabbarli R., Gembruch О., Pierscianek D., Darkwah Oppong M., Dammann P., Wrede K., Ozkan N., Mtiller O., Sure U., El Hindy N. Impact of multifocality and molecular markers on survival of glioblastoma. World Neurosurg 2019 Feb; 122. https://doi.org/10.1016/j.wneu.2018.10.075.
2. Aibaidula A., Chan A.K., Shi Z., Li Y., Zhang R., Yang R., Li K.K, Chung N.Y., Yao Y., Zhou L., Wu J., Chen H., Ng H.K. Adult IDH wild-type lower-grade gliomas should be further stratified. Neuro Oncol. 2017 Oct 1; 19(10): 1327-1337. doi: 10.1093/neuonc/nox078.
3. Cancer Genome Atlas Research.Comprehensive, Integrative Genomic Analysis of Diffuse Lower-Grade Gliomas. N Engl J Med. 2015 Jun 25; 372(26): 2481-2498. doi: 10.1056/NEJMoa1402121.
4. Davis M.E. Epidemiology and Overview of Gliomas. Semin Oncol Nurs. 2018 Dec; 34(5): 420-429. doi: 10.1016/j.soncn.2018.10.001.
5. Henker С, Kriesen Т., Furst K., Goody D., Glass A., Putzer B.M., Piek J. Effect of 10 different polymorphisms on preoperative volumetric characteristics of glioblastoma multiforme. J. Neurooncol., 2016; 126(3): 585-592. doi: 10.1007/s 11060-015-2005-9.
6. Jiang Y., Han S., Cheng W., Wang Z., Wu A. NFATI-regulated IL6 signalling contributes to aggressive phenotypes of glioma. Cell Commun Signal. 2017 Dec; 15(1): 54. doi: 10.1186/s 12964-017-0210-1.
7. Juratli T. A., Kirsch M, Geiger K., Klink В., Leipnitz E., Pinzer Т., Soucek S., Schrock E., Schackert G., Krex D. The prognostic value of IDH mutations and MGMT promoter status in secondary high-grade gliomas. J Neurooncol 2012; 110:325-33.doi: 10.1007/s11060-012-0977-2.
8. Kosmopoulos M., Christofides A., Drekolias D., Zavras P., Antonios N., Gargalionis, Piperi C. Critical Role of IL-8 Targeting in Gliomas. Current Medicinal Chemistry, 2018; 25: 1954-1967. doi: 10.2174/0929867325666171129125712.
9. Liu H., Mao P., Xie C, Xie W., Wang M., Jiang H. Association between interleukin 8-251 T/A and +781 C/T polymorphisms and glioma risk. Diagn. Pathol., 2015, 10: 138. doi: 10.1186/s13000-015-0378-x.
10. Louis D.N., Perry A., Reifenberger G., von Deimling A., Figarella-Branger D., Cavenee W.K., Ohgaki H., Wiestler O.D., Kleihues P., Ellison D.W. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathol 2016; 131: 803-20.doi: 10.1007/s00401-016-1545-1.
11. Muller L., Muller-Haegele S., Mitsuhashi M., Gooding W., Okada H., Whiteside T. L. Exosomes isolated from plasma of glioma patients enrolled in a vaccination trial reflect antitumor immune activity and might predict survival. Oncolmmunology, 2015; 4(6): el008347. doi: 10.1080/2162402X.2015.1008347.
12. Okada H., Lieberman F.S., Edington H.D., Witham T.F., Wargo M.J., Cai Q., Elder E.H., Whiteside T.L., Schold S.C. Jr., Pollack I.F. Autolologous glioma cell vaccine admixed with interleukin-4 gene transfected fibroblasts in the treatment of recurrent glioblastoma: preliminary observations in a patient with a favorable response to therapy. J Neurooncology 2003; 64:125-137. doi: 10.1186/1479-5876-5-67.
13. Sun H., Yin L., Li S., Han S., Song G., Liu N., Yan C. Prognosti csignificance of IDH mutation in adult low-grade gliomas: a meta-analysis. J Neurooncol 2013; 113:277-284. doi: 10.1007/s11060-013-1107-5.
14. Suzuki H., Aoki K., Chiba K., Sato Y., Shiozawa Y., Shiraishi Y., Shimamura Т., Niida A., Motomura K., Ohka F., Yamamoto Т., Tanahashi K., Ranjit M., Wakabayashi Т., Yoshizato Т., Kataoka K., Yoshida K., Nagata Y., Sato-Otsubo A., Tanaka H., Sanada M., Kondo Y., Nakamura H., Mizoguchi M., Abe Т., Muragaki Y., Watanabe R., Ito I., Miyano S., Natsume A., Ogawa S. Mutational landscape and clonal architecture in grade II and III gliomas. Nat Genet 2015; 47: 458-468. doi: 10.1038/ng.3273.
15. Thompson С.B. Metabolic enzymes as oncogenes or tumor suppressors. N Engl J Med. 2009; 360:813-815.
16. Weber F., Asher A., Bucholz R., Berger M., Prados M., Chang S., Bruce J., Hall W., Rainov N.G., Westphal M., Warnick R.E., Rand R. W., Floeth F., Rommel F., Pan H., Hingorani V. N., Puri R. K. Local convection enhanced delivery of IL4-Pseudomonas exotoxin (NBI-3001) for treatment of patients with recurrent malignant glioma. Acta Neurochir Suppl.2003; 88: 93-103. PMID: 14531567. doi: 10.1007/978-3-7091-6090-9J5.
17. Yan H., Parsons W., Jin G., McLendon R., Rasheed A., Yuan W., Kos I., Batinic-Haberle I., Jones S., Riggins G.J., Friedman H, Friedman A., Reardon D., Herndon J., Kinzler K.W., Velculescu V.E., Vogelstein В., Bigner D.D. IDH1 and IDH2 Mutations in Gliomas. N Eng J Med. 2009; 360: 765-73.
18. Zhang В., Shi L., Lu S., Sun X., Liu Y., Li H., Wang X., Zhao C, Zhang H., Wang Y. Autocrine IL-8 promotes F-actin polymerization and mediate mesenchymal transition via ELMO1-NF-KB-Snail signaling in glioma. Cancer Biol. Ther., 2015; 16(6): 898-911. doi: 10.1080/15384047.2015.1028702.
19. Горяйнов С.А., Гольдберг M.Ф., Голанов А.В., Золотова С.В., Шишкина Л.В., Рыжова М.В., Пицхелаури Д.И., Жуков В.Ю., Усачев Д.Ю., Беляев А.Ю., Кондратов А.В., Шурхай В.А., Потапов А.А. Феномен длительной выживаемости пациентов с глиобластомами. Часть I: роль клинико-демографических факторов и мутации IDH1 (R 132 Н) Вопросы нейрохирургии 2017; 3: 5-16. [Goryaynov S.A., Gol'dberg М. F., Golanov А.V., Zolotova S.V., Shishkina L.V., Ryzhova M.V., Pitskhelauri D.I., Zhukov V. Yu., Usachev D. Yu., Belyaev A. Yu., Kondrashov A.V., Shurkhay V.A., Potapov A.A. The phenomen on of long-term survival in glioblastoma patients. Part I: the role of clinical and demographic factors and an IDH1 mutation (R 132 H). Burdenko's J. of Neurosurgery 2017; 3: 5-16. (In Russian)].
20. Каприн А.Д. Злокачественные новообразования в России в 2013 году (заболеваемость и смертность) / А.Д. Каприн, В.В. Старинский, Г.В. // филиал ФГБУ «ФМИЦ им. П.А. Герцена» Минздрава России. - Москва. - 2015. - С.250.
21. Кобяков Г.Л., Абсалямова О.В., Поддубский А.А., Лодыгина К.С, Кобякова Е.А. Классификация ВОЗ первичных опухолей центральной нервной системы 2016 г.: взгляд клинициста. Вопросы нейрохирургии 2018; 3: 88-96. [Kobyakov G. L., Absalyamova О. V., Poddubskiy A.A., Lodygina K.S., Kobyakov Е.A. The 2016 WHO classification of primary tumors of the central nervous system: a clinician's opinion. Burdenko's J. of Neurosurgery 2018; 3: 88-96. (In Russian)].
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОГНОЗИРОВАНИЯ РЕЦИДИВОВ У ПАЦИЕНТОВ С ГЛИОМАМИ ГОЛОВНОГО МОЗГА | 2022 |
|
RU2776231C1 |
| Способ обнаружения свойств митохондрий глиобластомы человека индуцировать экстракраниальный диффузный опухолевый рост в органах экспериментальных животных | 2023 |
|
RU2794641C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЭФФЕКТИВНОСТИ АДЪЮВАНТНОЙ ИНТЕРФЕРОНОТЕРАПИИ МЕЛАНОМЫ КОЖИ | 2019 |
|
RU2722403C1 |
| Способ прогнозирования эффективности комбинированной адаптивной стереотаксической лучевой терапии с бевацизумабом у мужчин со злокачественными глиомами головного мозга | 2023 |
|
RU2801419C1 |
| СПОСОБ РАСЧЕТА ПРОГНОЗА РАННЕГО ПРОГРЕССИРОВАНИЯ МЕЛАНОМЫ КОЖИ | 2017 |
|
RU2643761C1 |
| Способ прогнозирования рецидива немышечно-инвазивного рака мочевого пузыря | 2022 |
|
RU2793510C1 |
| Способ оценки риска прогрессирования метастатического колоректального рака после анти-VEGF терапии | 2024 |
|
RU2823505C1 |
| Тест-система для определения статуса генов IDH ½ в тканях глиальных опухолей | 2023 |
|
RU2823028C1 |
| Способ диагностики глиальных опухолей головного мозга высокой степени злокачественности | 2020 |
|
RU2742413C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ПЕРИТОНЕАЛЬНЫХ МЕТАСТАЗОВ РАКА ЖЕЛУДКА | 2018 |
|
RU2686689C1 |
Изобретение относится к медицине и касается способа прогнозирования течения низкодифференцированных глиальных опухолей на основе цитокинового микроокружения, заключающегося в том, что в опухолевой ткани методом иммуноферментного анализа определяют комплексное содержание интерлейкинов IL-4, IL-6, IL-8 и при их совокупном содержании IL-4 в пределах от 0,5 до 1,4 пг/мл/г белка, IL-6 от 4,4 до 50,6 пг/мл/г белка, IL-8 от 43,7 до 125,2 пг/мл/г белка прогнозируют раннее прогрессирование опухоли в сроки 7-14 месяцев после операции, а при их совокупном содержании IL-4 в пределах от 13,1 до 28,2 пг/мл/г белка, IL-6 от 0 до 8,2 пг/мл/г белка, IL-8 от 0,3 до 19,6 пг/мл/г белка прогнозируют позднее прогрессирование в сроки более 14 месяцев после операции. Изобретение обеспечивает прогнозирование течения низкодифференцированных глиальных опухолей на основе их цитокинового микроокружения. 2 пр.
Способ прогнозирования течения низкодифференцированных глиальных опухолей на основе цитокинового микроокружения, заключающийся в том, что в опухолевой ткани методом иммуноферментного анализа определяют комплексное содержание интерлейкинов IL-4, IL-6, IL-8 и при их совокупном содержании IL-4 в пределах от 0,5 до 1,4 пг/мл/г белка, IL-6 от 4,4 до 50,6 пг/мл/г белка, IL-8 от 43,7 до 125,2 пг/мл/г белка прогнозируют раннее прогрессирование опухоли в сроки 7-14 месяцев после операции, а при их совокупном содержании IL-4 в пределах от 13,1 до 28,2 пг/мл/г белка, IL-6 от 0 до 8,2 пг/мл/г белка, IL-8 от 0,3 до 19,6 пг/мл/г белка прогнозируют позднее прогрессирование в сроки более 14 месяцев после операции.
| ШЕВЧЕНКО А.В | |||
| и др | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Медицинская Иммунология | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| Выбрасывающий ячеистый аппарат для рядовых сеялок | 1922 |
|
SU21A1 |
| WO 2015081067 A2, 04.06.2015 | |||
| CN 102625914 A, 01.08.2012 | |||
| RU 2009141727 A, 20.05.2011. | |||
Авторы
Даты
2021-01-28—Публикация
2020-06-08—Подача