ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет согласно предварительной заявке на патент США №15/065259, поданной 9 марта 2016 года, содержание которой полностью включено в настоящую заявку посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Эта заявка относится к способам получения стволовых клеток, стволовым клеткам и композициям, содержащим стволовые клетки, подходящим для лечения нескольких заболеваний, в частности неврологических заболеваний, и пригодным для системного введения.
УРОВЕНЬ ТЕХНИКИ
Несмотря на то, что гены, ответственные за нейродегенеративные заболевания и соответствующие белки установлены, механизм патогенеза, связанный с этими заболеваниями, до сих пор неизвестен, что препятствует разработке эффективных терапевтических методов. Известно, что, например, мутантная форма белка Хантингтона, несмотря на свою повсеместную распространенность, вызывает нейродегенерацию и избирательную утрату средних шипиковых нейронов, которая преимущественно возникает в стриатуме и в более глубоких слоях коры головного мозга в ранних фазах заболевания. Соответственно, исследуется клеточная терапия в качестве дополнительного или альтернативного лечения, способного положительно влиять на течение этого заболевания и других подобных нейродегенеративных заболеваний. Стволовые клетки являются важнейшими строительными блоками жизни и играют решающую роль в генезе и развитии всех высших организмов. Из-за гибели нейрональных клеток, вызванной, например, накоплением мутантного белка хантингтина (mHTT), маловероятно, чтобы такое повреждение головного мозга было лечить исключительно медикаментозными методами. Терапевтические средства на основе стволовых клеток важны для восстановления морфологической структуры и функциональной способности нервной ткани в поврежденных областях мозга пациентов. Эти препараты выполняли двоякую функцию: паракринная активность трансплантированных стволовых клеток (антиапоптотическое, противовоспалительное, противорубцовое, антибактериальное и ангиогенное действие) стимулирует выживание локальных клеток и ингибирует воспаление, а также стимулирует регенерацию мозговой ткани посредством образования биоактивных молекул, способствующих продуцированию новых нейронов из собственных и, вероятно, из донорских стволовых клеток.
Нейротрофический фактор мозга (BDNF) представляет собой ген, ответственный за экспрессию белка BDNF, которая присутствует в головном и спинном мозге. Этот белок способствует выживанию нервных клеток (нейронов), играя определенную роль в росте, созревании (дифференцировке) и поддержании этих клеток. В мозге белок BDNF активен на местах контакта между нервными клетками (синапсах), где происходит коммуникация между клетками. Белок BDNF помогает регулировать синаптическую пластичность, которая важна для обучения и памяти, и было обнаружено, что он экспрессируется в областях мозга, контролирующих питание, питье и массу тела. Таким образом, BDNF обладает дополнительной активностью при модуляции всех этих функций. Появляется все больше свидетельств того, что синаптическая дисфункция является ключевым патофизиологическим признаком нейродегенеративных расстройств (нарушений), включая болезнь Альцгеймера. Дефицит сигналов BDNF участвует в патогенезе нескольких важных заболеваний и расстройств, таких как болезнь Хантингтона и депрессия. Таким образом, управление путями BDNF представляет собой перспективный подход к лечению различных неврологических и психических расстройств. Введение одного только BDNF само по себе является жизнеспособным подходом к лечению нейродегенеративных заболеваний. Однако из-за генетического и индивидуального полиморфизма проявления нейродегенеративных заболеваний трудно найти идеальную дозу для каждого пациента. Передозировки BDNF способны вызывать образование опухолей в головном мозге; с другой стороны, низкие дозы BDNF не могут обеспечить эффективное лечение. После трансплантации стволовые клетки находятся под контролем биологии пациента, которая способна эффективно модулировать секрецию BDNF этими клетками для каждого пациента. Кроме того, исследования полезных эффектов трансплантации стволовых клеток для лечения болезни Альцгеймера показали, что трансплантированные нервные стволовые клетки (NSC) поддерживают формирование новых связей между клетками мозга хозяина. Эти исследования показывают, что усиление таких связей может привести к восстановлению памяти в мышиных моделях болезни Альцгеймера. По-видимому, BDNF, фактор, в естественных условиях секретируемый NSC, способен воспроизводить эффекты, обеспечиваемые трансплантацией стволовых клеток.
При этом NSC, как правило, труднодоступны, и не могут быть получены в достаточных терапевтических количествах для применения в терапии стволовыми клетками путем внутривенной (в/в) инъекции. Как правило, для увеличения секреции BDNF используются две стратегии. Во-первых, это добавление факторов роста в культуральную среду культивируемых in vitro стволовых клеток для индукции секреции BDNF. Однако эта стратегия имеет большие ограничения из-за того, что стволовые клетки продуцируют этот фактор только в условиях in vitro. Соответственно, когда такие клетки пересаживают пациенту, они быстро расходуют "запас" BDNF, что препятствует длительному лечению нейродегенеративно го заболевания. Другой подход заключается в создании генетически управляемых стволовых клеток, которые соответствующим образом модифицированы для сверхэкспрессии BDNF. Важно отметить, что даже NSC необходимо предварительно генетически модифицировать для получения терапевтически достаточных уровней BDNF. Однако генная модификация имеет свои корни в генной терапии, а это подход, который еще только предстоит испытать. Поэтому существует большая потребность в новых типах клеток и способах культивирования клеток, которые могут дать стволовые клетки с повышенной секрецией BDNF.
Субвентрикулярная зона (СВЗ) - это уникальная область мозга, где на протяжении всей жизни производятся новые нейроны (Altman J and Das GD 1965) и создаются клетки, которые способны участвовать в регенерации в течении взрослой жизни. Кровеносные сосуды, непосредственно смежные с СВЗ, проходят параллельно направлению тангенциальной миграции нейробластов и направляют мигрирующие нейробласты посредством сигнализации BDNF. Сейчас уже стало ясно, что организация СВЗ во взрослом человеческом мозге значительно отличается от организации у любых других изученных позвоночных. В частности, эта область во взрослом человеческом мозге содержит уникальную полосу из астроцитов, которые размножаются in vivo и могут функционировать как NSC in vitro. Астроциты в центральной нервной системе выполняют множество важных и разнообразных функций. Они участвуют в формировании нейрососудистой единицы, состоящей из нейрона, астроцита и кровеносного сосуда. Астроцитарные отростки распространяются на кровеносные сосуды и взаимодействуют с ними. Нервные окончания астроцита находятся в тесном контакте с базальной пластинкой, которая является компонентом стенки сосуда, и вместе с эндотелиальными клетками образуют гематоэнцефалический барьер (ГЭБ). Выделение стволовых клеток, способных мигрировать и поселяться в нейрогенной нише, а также вокруг кровеносных сосудов во взрослом человеческом мозге, в дальнейшем способных дифференцироваться в нейроны и глиальные клетки, является основой для разработки новых способов клеточной терапии нейродегенеративных заболеваний.
Основным фактором нейрогенеза во взрослой СВЗ является дофамин (DA) (Baker et al., 2004). Близость СВЗ к стриатуму делает его мишенью терапии нейродегенерации для заболеваний, связанных с нейродегенерацией стриатума, таких как болезнь Хантингтона (БХ) и болезнь Паркинсона (БП). Обе патологии характеризуются различными клиническими симптомами двигательной дисфункции, и обе, как полагают, включают СВЗ-стриарный сетевой путь дофамина с участием различных механизмов. Вызванная заболеванием DA-иннервация, которая возникает при БХ, является естественным защитным механизмом обратной связи, направленным на компенсацию патологической дегенерации внутренних нейронов стриатума, вызванную специфической генетической мутацией (Parent М et al., 2013). Дисрегуляция дофаминового рецептора D2 является чувствительным маркером патологии болезни Хантингтона у модельных мышей (Crook et al., 2012; Chen et al., 2013). Для сравнения, БП ассоциирована с массивной дегенерацией DA-нейронов из-за нарушения нейрогенеза в нигростриарной области, что является основной причиной патологии (Hoglinger et. al., 2004).
Первоначальная воспалительная реакция в организме возникает, чтобы ограничить инвазию чужеродных бактерий или вирусов или паразитов и защитить ткани от молекулярных врагов, которые затем удаляются из организма посредством противовоспалительных механизмов. В то же время, хроническое воспаление (ХВ) является обоюдоострым мечом. ХВ является продолжительным событием, и оно постоянно повреждает и убивает здоровые клетки, как, например, при ревматоидном артрите, когда воспаление становится самоподдерживающимся.
При нейродегенеративных заболеваниях несколько белковых молекул плотно слипаются внутри клетки в агрегат, который патологи называют "амилоидной" структурой, и эти липкие бляшки склонны закупоривать мозг. Такие белки были обнаружены при болезни Альцгеймера (БА) - амилоиды бета и тау, при болезни Паркинсона - альфа-синуклеин, а также при болезни Хантингтона - хантингтин. Эти агрегаты часто образуют большие нерастворимые отложения в мозге. Однако по-настоящему токсичными считаются небольшие растворимые агрегаты этих белков. Из-за накопления этих агрегатов в головном мозге хронические воспалительные реакции сохраняются при многих возрастных нейродегенеративных расстройствах, среди которых отмечены вышеупомянутые заболевания (Nuzzo et al., 2014).
Вырожденная ткань, наличие поврежденных нейронов и нейритов, значительно нерастворимые отложения амилоидных β-пептидов и нейрофибриллярные клубочки в мозге носителей болезни Альцгеймера (БА) создают очевидные стимулы для воспаления (Zotova et al., 2010; Schott and Revesz, 2013).
Многие исследования показали, что хроническое воспаление, наблюдаемое при АД, ускоряет болезненный процесс и может быть даже триггером болезни. История травм головы и системных инфекций являются факторами, которые обычно вызывают воспаление головного мозга и, как известно, являются факторами риска развития АД. Чрезмерная активность иммунных клеток головного мозга, которые являются глиальными клетками, является еще одним отличительным признаком болезни Альцгеймера. Хотя было высказано предположение, что воспаление ассоциировано с травмой и токсичностью для нейронов, связь между глиальными клетками, нейронами и липкими бляшками пока остается неясной. Воспалительные медиаторы, высвобождаемые глиальными клетками, могут быть чрезвычайно токсичными для нейронов. Поэтому они также рассматриваются в качестве медиаторов нейродегенерации.
Два близкородственных воспалительных белка, IL-12 и IL-23, относятся к числу белков, секретируемых микроглией, когда клетки становятся иммунологически активными. Исследования показали, что эти белки присутствуют в повышенных концентрациях в спинномозговой жидкости пациентов с АД. Блокирование этих воспалительных белков у старых мышей с болезнью Альцгеймера, мозг которых уже был покрыт бляшками, снижало уровни растворимых, более токсичных, форм бета-амилоида и ослабляло когнитивные дефициты у этих мышей (Vom Berg et al., 2012; Griffin, 2013).
Совсем недавно были описаны другие противовоспалительные подходы, такие как блокирование белка NLRP3 и микроглиального белка MRP14, которые также, по-видимому, хорошо работают в той же мышиной модели Альцгеймера. Эти подходы уменьшают воспаление головного мозга, отложение липких бляшек и когнитивные нарушения. У мышей с болезнью Альцгеймера, которые были генетически модифицированы для удаления NLRP3, микроглия вернулась обратно в невоспаленное состояние, в котором она потребляет гораздо больше белка амилоид бета и секретирует полезные для нейронов белки. В другом исследовании такой мишенью был белок микроглии MRP14, что также помогло вернуть микроглию в невоспаленное состояние (Heneka et al., 2013; Zhang et al., 2012).
Другим фактором, имеющим решающее значение для БА, является старение. Старение может способствовать запуску болезни Альцгеймера, усугубляя общие возрастные проблемы с нейронами, которые становятся функционально-дефицитными и теряют способность переносить и надлежащим образом размещать белки. Воспаление усугубляет эту проблему, увеличивая образование липких бляшек в воспаленных областях, подвергая нейроны стрессу и ускоряя возрастное угасание их систем транспорта и удаления белков. Воспаление реактивирует микроглию, возвращая ее в воспаленное состояние и, таким образом, уменьшает ее способность очищать мозг (Swindell et al., 2013).
В настоящее время предполагается, что воспаление способствует началу процесса АД, увеличивая образование липких бляшек. По-видимому, при БА воспаление является самоподдерживающимся, поскольку оно снижает способность микроглии удалять липкие бляшки. Поэтому постоянное осаждение липких бляшек не позволяет воспалению разрешиться, что усугубляется у пожилых носителей БА (Akiyama et al., 2000; Vom Berg et al., 2012; Zang et al., 2012; Griffin, 2013; Heneka et al., 2013; Swindell et al., 2013; Schott and Revesz, 2013).
Также есть веские основания предполагать вклад воспаления в нейродегенерацию при болезни Хантингтона (БХ); однако он менее изучен, чем при БА (Soulet and Cicchetti, 2011; Ellrichmann et al., 2013). Таким образом, активация иммунной системы при БХ была явно доказана повышенной экспрессией провоспалительных цитокинов, которые имеют решающее значение для иммунного ответа организма, таких как IL-6 и TNF-альфа. Эти провоспалительные цитокины были значительно повышены в стриатуме, плазме и ЦСЖ в мышиных моделях, и у пациентов с симптомами, а также с предсимптомами БХ. Кроме того, как у пациентов с БХ, так и в мышиных моделях БХ была выявлена врожденная гиперактивность иммунных клеток по повышенному продуцированию IL-6 в мутантных mHTT-экспрессирующих миелоидных клетках центральной (микроглия) и периферической врожденной иммунной системы (моноциты и макрофаги). Сообщалось также, что аномально высокие уровни цитокинов присутствуют в крови людей, несущих ген БХ, за многие годы до появления симптомов ( et al., 2008; Trager et al., 2014a, b). Состав цитокинов и уровни их экспрессии, которые можно измерить в крови пациентов, могут быть полезны для выявления необходимости начать вмешательство для терапии, а также сроков проведения терапии.
et al., 2008; Trager et al., 2014a, b). Состав цитокинов и уровни их экспрессии, которые можно измерить в крови пациентов, могут быть полезны для выявления необходимости начать вмешательство для терапии, а также сроков проведения терапии.
Клетки крови из-за присутствия аномального белка БХ (хантингтина) внутри клеток были гиперактивными у пациентов с ХД, как и микроглия в головном мозге, свидетельствуя о том, что аномальная иммунная активация может быть одной из самых ранних аномалий при БХ. Профиль крови пациента мог бы дать новое понимание эффектов БХ в мозге, а также предоставить маркеры тяжести БХ. Аномальная иммунная активация может стать мишенью для будущих способов лечения, направленных на замедление БХ (Soulet and Cicchetti, 2011, Ellrichmann et al., 2013).
Болезнь Паркинсона характеризуется медленной и прогрессирующей дегенерацией дофаминергических нейронов в черном веществе. Используя животные модели, исследователи получили непротиворечивые данные об участии иммунных компонентов как периферической, так и центральной нервной системы в ответе на воспаление, инициирующем иммунный ответ при БП. Наличие непрекращающихся и усиливающихся про воспалительных механизмов приводит к процессу, в котором защитные механизмы клеток преодолеваются, и более восприимчивые клетки, такие как дофаминергические нейроны, входят в путь клеточной гибели, что приводит к ряду событий, имеющих решающее значение для прогрессирования БП (Doursout et al., 2013). Воспалительные ответы, также проявляющиеся глиальными реакциями, инфильтрацией Т-клеток и повышенной экспрессией воспалительных цитокинов, а также других токсических медиаторов, секретируемых из активированных глиальных клеток, являются хорошо известными особенностями БП. Однако в недавних исследованиях in vitro было сделано предположение об участии также активации микроглии и впоследствии астроцитов посредством медиаторов, высвобождаемых поврежденными дофаминергическими нейронами, хотя они вряд ли могут быть основной причиной утраты нейронов (Hirsch et al., 2003). Эпидемиологические и генетические исследования на пациентах подтверждают роль нейровоспаления в патофизиологии БП. Патологоанатомические исследования подтверждают активность врожденного, а также адаптивного иммунитета в пораженных областях мозга у пациентов с БП. В черном веществе пациентов были обнаружены активированные микроглиальные клетки и Т-лимфоциты одновременно с повышенной экспрессией про воспалительных медиаторов (Tufekci et al., 2012; Hirsch et al., 2012). В другом исследовании, с участием 87 пациентов с болезнью Паркинсона в период с 2008 по 2012 год, наряду с 37 здоровыми контрольными участниками, измеряли маркеры воспаления, такие как С-реактивный белок (CRP), интерлейкин-6, фактор некроза опухоли-альфа, эотаксин, индуцированный гамма-интерфероном белок-10, моноцитарный хемотаксический белок-1 (МСР-1) и макрофагальный воспалительный белок 1-бета в обычных анализах крови. Все участники прошли также физикальное обследование. Это исследование показало, что степень нейровоспаления достоверно ассоциирована с более выраженной депрессией, усталостью и когнитивными нарушениями даже после поправки на такие факторы, как возраст, пол и продолжительность болезни (Lindqvist et al., 2013). Нейровоспалительные процессы могут представлять собой мишень для нейропротекции, а противовоспалительные стратегии могут быть одним из основных подходов к лечению БП.
Было опробовано множество подходов к восстановлению пациентов с заболеваниями ЦНС, ассоциированными с нейродегенерацией, включая клинические заболевания, связанные с двигательной дисфункцией (Wernig М, et al., 2011). Источники стволовых клеток, используемые для клеточной терапии нейродегенерации, включают мезенхимальные стволовые клетки (МСК), нейрональные клетки-предшественники (NP), нейрональные стволовые клетки плода человека (huNSC) и плюрипотентные стволовые клетки (как эмбриональные (ESC), так и индуцированные (iPSC)). В большинстве исследований по клеточной терапии неврологических состояний использовали нейроноподобные клетки с применением значительных модификаций клеток и/или высокоинвазивных способов доставки. Например, WO 2008/132722 и публикация заявки на патент США №2013/0344041 раскрывают стволовые клетки, генетически модифицированные с целью индуцировать характеристики стволовых клеток или высвобождение нейротрофических факторов; WO 2009/144718, а публикации патентных заявок США №№2014/0335059 и 2014/0154222 раскрывают индуцирование высвобождения нейротрофических факторов в более высоких количествах, чем на неиндуцированной этапы, путем воздействия биологических, природных или химических соединений в культуре; а в других исследованиях использовали иммортализованную клеточную линию эмбриональных стволовых клеток, экспрессирующих ранние маркеры дифференцировки нейронов. Несмотря на все эти исследования по терапии стволовыми клетками, полученные данные не показали, что терапия стволовыми клетками путем внутривенной (в/в) инъекции способна привести к прямому нейрогенезу за счет секреции BDNF или экспрессии D2 в отделах головного мозга, пораженных нейродегенеративным заболеванием.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В одном варианте осуществления настоящее изобретение относится к способу получения незрелых стволовых клеток пульпы зуба человека (hIDPSC), экспрессирующих CD44 и CD13, и не экспрессирующих CD146, включающему: а) получение пульпы зуба (DP) из человеческого молочного зуба; b) промывку DP раствором, содержащим антибиотики, и помещение DP в контейнер с культуральной средой; с) механический перенос DP в другой контейнер с культуральной средой после констатации отрастания и адгезии hIDPSC, с целью создания эксплантной культуры; d) повторение стадий b) и с) со сбором выращенных hIDPSC, экспрессирующих CD44 и CD13, и не экспрессирующих CD146.
В другом варианте реализации настоящее изобретение относится к способу получения незрелых стволовых клеток пульпы зуба человека (hIDPSC), экспрессирующих CD44 и CD13, и не экспрессирующих CD146, HLA-DR и HLA-ABC, включающему: а) получение пульпы зуба (DP) из человеческого молочного зуба; b) промывку DP раствором, содержащим антибиотики, и помещение DP в контейнер с культуральной средой; с) механический перенос DP в другой контейнер с культуральной средой после констатации отрастания и адгезии hIDPSC, с целью создания эксплантной культуры; d) повторение стадий b) и с) со сбором hIDPSC, экспрессирующих CD44 и CD13, и не экспрессирующих CD146, HLA-DR и HLA-ABC.
В некоторых аспектах этот способ дополнительно включает: е) подтверждение экспрессии CD44 и CD13 и отсутствие экспрессии CD146 в hIDPSC путем иммуноокрашивания образца hIDPSC для детектирования CD44, CD13, CD146, HLA-DR и/или HLA-ABC.
В других аспектах иммуноокрашивание включает в себя анализ образца проточной цитометрией.
В некоторых вариантах реализации этапы b) и с) повторяют более 5 раз и собирают hIDPSC из эксплантных культур, полученных после 5 переносов ПЗ. В других вариантах реализации этапы b) и с) повторяют более 10 раз, и hIDPSC собирают из эксплантных культур, полученных после 10 переносов ПЗ.
В одном аспекте эксплантная культура содержит полуконфлюентные колонии hIDPSC. В другом аспекте эксплантную культуру hIDPSC из этапы с) пассируют перед сбором. В еще одном аспекте пассирование эксплантной культуры hIDPSC включает ферментативную обработку hIDPSC и перенос hIDPSC для наращивания эксплантной культуры.
В некоторых вариантах реализации изобретение относится к способу, включающему: извлечение пульпы зуба (ПЗ) из зуба; культивирование ПЗ в базальной культуральной среде в первом контейнере для создания эксплантной культуры ПЗ, причем эксплантную культуру ПЗ культивируют без компонентов внеклеточного матрикса или по меньшей мере с одним компонентом внеклеточного матрикса, выбранным из группы, состоящей из: фибронектина, коллагена, ламинина, витронектина, полилизина, гепарансульфат-протеогликанов и энактинов; механический перенос ПЗ во второй контейнер для создания второй эксплантной культуры ПЗ; повторение этапы механического переноса ПЗ до тех пор, пока не будет создано, по меньшей мере, 15 ПЗ-эксплантатов; пассирование эксплантной культуры ПЗ с получением пассированной культуры ПЗ; и комбинирование пассированной культуры ПЗ популяции раннего сбора с популяцией позднего сбора с получением фармацевтической композиции, причем популяция раннего сбора содержит пассированную культуру ПЗ, созданную, по меньшей мере, из одной из первых 15 эксплантных культур ПЗ, а популяция позднего сбора содержит пассированную культуру ПЗ, созданную, по меньшей мере, из одной из эксплантных культур ПЗ после 15-й эксплантной культуры ПЗ. В некоторых вариантах реализации этап культивирования проводят в гипоксических условиях. В некоторых вариантах реализации этап объединения пассированной культуры ПЗ популяции раннего сбора и популяции позднего сбора с получением фармацевтической композиции включает: одновременное размораживание замороженного запаса пассированных культур ПЗ популяции раннего сбора и популяции позднего сбора; и объединение размороженной пассированной культуры ПЗ в пул с получением фармацевтической композиции.
В некоторых вариантах культивирование ПЗ в базальной культуральной среде при данном способе получения продолжается в течение по меньшей мере трех дней до механического переноса ПЗ. В некоторых вариантах реализации способ получения дополнительно включает создание замороженного запаса пассированной культуры ПЗ. В некоторых аспектах этот замороженный запас пассированной культуры ПЗ создают при третьем пассаже эксплантной культуры ПЗ.
В некоторых вариантах реализации изобретение относится к способу, включающему: извлечение пульпы зуба (ПЗ) из зуба; культивирование ПЗ в базальной культуральной среде в первом контейнере для создания эксплантной культуры ПЗ, причем стволовые клетки, содержащие поздний сбор, полученные обогащением из ткани, произошедшей из нервного гребня, являются дважды положительными по CD44 и CD13. В некоторых аспектах стволовые клетки, обогащенные из ткани нервного гребня, и дважды положительные по CD44 и CD13, представляют собой незрелые стволовые клетки пульпы зуба (IDPSC).
В некоторых вариантах реализации настоящее изобретение относится к способу, включающему: извлечение пульпы зуба (ПЗ) из зуба; культивирование ПЗ в базальной культуральной среде в первом контейнере для создания эксплантной культуры ПЗ, причем стволовые клетки, содержащие поздний сбор, обогащенные из ткани, произошедшей из нервного гребня, продемонстрировали повышенный уровень секреции эндогенного BDNF и/или других нейротрофических факторов (NF3, NF4 и NF5), по сравнению со стволовыми клетками, полученными из раннего сбора. В некоторых аспектах стволовые клетки, обогащенные из ткани нервного гребня и секретирующие высокий уровень эндогенного BDNF и/или других нейротрофических факторов (NF3, NF4 и NF5), представляют собой незрелые стволовые клетки пульпы зуба (IDPSC).
В других вариантах реализации способы по настоящему изобретению позволяют получить hIDPSC, экспрессируюшие CD44 и CD13 и не экспрессируюшие CD146, что позволяет hIDPSC пересекать ГЭБ, и/или не экспрессируюшие CD146, HLA-DR, и/или HLA-ABC, что предотвращает отторжение этих hIDPSC иммунными клетками.
В одном варианте реализации способы по настоящему изобретению п позволяют получить стволовые клетки, экспрессирующие по меньшей мере один маркер безопасности, выбранный из группы, состоящей из члена 2 подсемейства G АТР-связывающей кассеты (ABCG2), р53 и неактивного белка Nanog. Неактивный Nanog представялет собой экспрессированный Nanog, локализованный преимущественно в цитоплазме стволовых клеток. В некоторых аспектах по меньшей мере 75% стволовых клеток экспрессируют ABCG2, по меньшей мере 75% стволовых клеток экспрессируют р53, или не более 5% стволовых клеток экспрессируют неактивный Nanog. Некоторые стволовые клетки дополнительно экспрессируют маркер безопасности SOX2. В некоторых таких вариантах реализации не более 30% стволовых клеток экспрессируют SOX2.
Клетки hIDPSC по настоящему изобретению дополнительно получают способами, которые позволяют получить стволовые клетки, способные дополнительно секретировать по меньшей мере один маркер, выбранный из группы, состоящей из нейротрофического фактора мозга (BDNF), нейтротрофина-3 (NT3), нейтротрофина-4 (NT4), нейтротрофина-5 (NT5) и р75. В некоторых таких вариантах реализации стволовые клетки фармацевтической композиции экспрессируют BDNF, NT3, NT4, NT5 и р75 (CD271).
В другом варианте реализации hIDPSC по настоящему изобретению получают способами, которые позволяют получить стволовые клетки, экспрессирующие по меньшей мере один маркер нейроэпителиальных стволовых клеток, выбранный из группы, состоящей из BDNF, NT3, NT4, NT5 и р75. В некоторых аспектах стволовые клетки, продуцируемые способами по настоящему изобретению, экспрессируют BDNF, NT3, NT4, NT5 и р75. Эти клетки могут дополнительно экспрессировать по меньшей мере один маркер безопасности, выбранный из группы, состоящей из ABCG2, неактивного белка Nanog, р53 и SOX2. В некоторых аспектах по меньшей мере 75% стволовых клеток экспрессируют по меньшей мере один маркер, причем этот по меньшей мере один маркер представляет собой ABCG2. В некоторых аспектах по меньшей мере 75% стволовых клеток экспрессируют р53. В некоторых аспектах не более 5% стволовых клеток экспрессируют неактивный Nanog. В некоторых аспектах не более 30% стволовых клеток экспрессируют SOX2.
В некоторых аспектах настоящее изобретение относится к незрелым стволовым клеткам зубной пульпы (IDPSC).
В некоторых вариантах осуществления настоящее изобретение относится к hIDPSC, полученным в соответствии с раскрытыми в настоящей заявке способами.
В одном варианте реализации изобретение относится к стволовым клеткам, причем эти стволовые клетки содержат поздний сбор, полученный обогащением из ткани, произошедшей из нервного гребня. В некоторых вариантах реализации эта ткань нервного гребня представляет собой пульпу зуба. В некоторых аспектах стволовые клетки, полученные обогащением из ткани нервного гребня, представляют собой незрелые стволовые клетки пульпы зуба (IDPSC). Стволовые клетки раннего сбора, полученные обогащением из ткани нервного гребня, содержат IDPSC из первых пятнадцати или первых 25 циклов сбора, тогда как стволовые клетки позднего сбора включают IDPSC из шестидесяти или более циклов или 26-го или более позднего цикла сбора.
В других вариантах реализации изобретение включает hIDPSC, которые экспрессируют CD44 и CD13 и не экспрессируют CD146, что позволяет hIDPSC пересекать ГЭБ, и/или не экспрессируют CD146, HLA-DR и/или HLA-ABC, что предотвращает отторжение этих hIDPSC иммунными клетками.
В одном варианте реализации изобретение относится к стволовым клеткам, экспрессирующим по меньшей мере один маркер безопасности, выбранный из группы, состоящей из члена 2 подсемейства G АТФ-связывающей кассеты (ABCG2), р53 и неактивного Nanog. Неактивный Nanog представялет собой экспрессированный Nanog, локализованный преимущественно в цитоплазме стволовых клеток. В некоторых аспектах по меньшей мере 75% стволовых клеток экспрессируют ABCG2, по меньшей мере 75% стволовых клеток экспрессируют р53, или не более 5% стволовых клеток экспрессируют неактивный Nanog. Некоторые стволовые клетки дополнительно экспрессируют маркер безопасности SOX2. В некоторых таких вариантах реализации не более 30% стволовых клеток экспрессируют SOX2.
Стволовые клетки по настоящему изобретению могут дополнительно секретировать по меньшей мере один маркер, выбранный из группы, состоящей из нейротрофического фактора мозга (BDNF), нейтротрофина-3 (NT3), нейтротрофина-4 (NT4), нейтротрофина-5 (NT5), и р75. В некоторых таких вариантах реализации стволовые клетки фармацевтической композиции экспрессируют BDNF, NT3, NT4, NT5 и р75 (CD271).
В другом варианте реализации способы по настоящему изобретению позволяют получить клетки, экспрессирующие по меньшей мере один маркер нейроэпителиальных стволовых клеток, выбранный из группы, состоящей из BDNF, NT3, NT4, NT5 и р75. В некоторых аспектах стволовые клетки по настоящему изобретению экспрессируют BDNF, NT3, NT4, NT5 и р75. Эти клетки могут дополнительно экспрессировать по меньшей мере один маркер безопасности, выбранный из группы, состоящей из ABCG2, неактивного Nanog, р53 и SOX2. В некоторых аспектах по меньшей мере 75% стволовых клеток экспрессируют по меньшей мере один маркер, причем этот по меньшей мере один маркер представляет собой ABCG2. В некоторых аспектах по меньшей мере 75% стволовых клеток экспрессируют р53. В некоторых аспектах не более 5% стволовых клеток экспрессируют неактивный Nanog. В некоторых аспектах не более 30% стволовых клеток экспрессируют SOX2.
В некоторых вариантах реализации настоящее изобретение относится к композициям, содержащим hIDPSC, полученным в соответствии с раскрытыми в настоящей заявке способами.
В некоторых вариантах реализации настоящее изобретение относится к композиции, содержащей hIDPSC, раскрытые в настоящей заявке.
В других вариантах реализации настоящее изобретение относится к фармацевтическим композициям для применения в лечении неврологического заболевания или состояния, выбранного из группы, состоящей из болезни Паркинсона (БП), рассеянного склероза, бокового амиотрофического склероза (БАС), инсульта, аутоиммунного энцефаломиелита, диабетической невропатии, глаукоматозной невропатии, болезни Альцгеймера, болезни Хантингтона (БХ), аутизма, шизофрении, инсульта, ишемии, двигательного расстройства и судорожного расстройства.
Настоящее изобретение также относится к фармацевтическим композициям для системного введения субъекту для лечения неврологического состояния. Неврологическое заболевание или состояние могут представлять собой нейродегенеративное заболевание или состояние, аутизм, шизофрению, эпилепсию, инсульт, ишемию, двигательное расстройство или судорожное расстройство. Нейродегенеративное заболевание или состояние могут представлять собой болезнь Паркинсона (БП), рассеянный склероз, эпилепсию, боковой амиотрофический склероз (БАС), инсульт, аутоиммунный энцефаломиелит, диабетическую невропатию, глаукоматозную невропатию, болезнь Альцгеймера или болезнь Хантингтона (БХ).
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1. Иммунофенотипирование hIDPSC из раннего и позднего сбора. Сборы 0-10 были обозначены как ранние сборы. Все сборы начиная с 11-го были обозначены как поздние сборы.
Фиг. 2. IDPSC при позднем сборе (13 сборов) и при пассаже 3. Клетки были иммуноположительными по Р75 (CD271) (А, С, D), нестин (EG), CD13 (Н) и CD73 (I), и они не реагировали с CD146 (J) и HLA-ABC (K). Вставки изображают контрольные образцы для соответствующих вторичных антител. A-G световая микроскопия. H-L Эпифлуоресценция. Увеличение: A,J - 20х; C,E-G,H,I,L - 10х; D,K - 40х.
Фиг.3. а) Количественный анализ КОЕ-Ф (определение числа колониеобразующих единиц фибробластов), выполненный в трех повторностях при Т20, пассаже 3, демонстрирующий высокую клоногенную способность LP-популяции IDSC. На b) и с анализ FACS, выполненный для того, чтобы показать, что LP IDPSC (поздняя популяция) (партия №11) содержат приблизительно 80% клеток, экспрессирующих BDNF и DARPP 32, в то время как IDPSC ранней популяции ЕР являются отрицательными по этим маркерам (данные не показаны) и содержат очень низкое число клеток, экспрессирующих D2.
Фиг. 4А. Положительное иммуноокрашивание для BrdU (B-J) в контрольных клетках вторичным антителом. На Фиг. 4В и 4С показано количественное определение IDPSC поздней популяции LP, которые положительно реагируют с антителом BrdU. (А) - эпифлуоресценция, (В) и (С) - анализ FACS. Увеличение (А) - 200х. (В, Е и Н) - 400 х. (С, F, I, D, G и J) - 1000 х.
Фиг. 5. Количественная ПЦР для определении экспрессии эндогенных генов Oct4, Nanog и Sox2, наблюдаемых в hIDPSC до (черные столбики) и после перепрограммирования (белые столбики), а также в эмбриональных стволовых клетках человека (hESC) (заштрихованные столбики).
Фиг. 6. Количественная оценка экспрессии GFAP (глиальных фибриллярных кислых белков) и бета-III-тубулина в ЕР (ранняя популяция) и LP (поздняя популяция) IDPSC с помощью проточной цитометрии.
Фиг. 7. Анализ проточной цитометрии hIDPSC ЕР (ранняя популяция) и LP (поздняя популяция). После сбора ПЗ in vitro и пассирования hIDPSC наблюдались изменения в экспрессии CD146 и CD13. Для ЕР-hIDPSC наблюдалось -33% CD146-положительных клеток, тогда как для LP-hIDPSC менее 1% клеток были положительными по этому маркеру. Для ЕР-hIDPSC наблюдалось 52% CD13-положительных клеток, тогда как для LP-hIDPSC 95% клеток были положительными по этому маркеру.
Фиг. 8. Иммуноокрашивание IDPSC, выделенных из пульпы зуба мышей C57BL-6. IDPSC положительны по Oct4 (А-В) с экспрессией, главным образом локализованным в ядре. Клетки также положительны по Nanog, хотя экспрессия ограничена в (С). Симметричное деление наблюдалось в Nanog-положительных клетках (D). Две Sox2-положительных IDPSC и одна Sox2-отрицательная клетка получаются из симметричного и асимметричного деления (Е). Наблюдается симметричное деление Sox2-положительной клетки, с локализацией в ядерном белке (F). Асимметричное деление Sox2-положительных клеток, утрата экспрессии Sox2 более коммитированной дочерней клеткой (G). А-С: 200х. D-G: 400х.
Фиг. 9. Переход от симметричных к асимметричным делениям нервных стволовых клеток в зрительной доле.
Фиг. 10. Экспрессия белков недифференцированных LSC и дифференцированных роговичных клеток (как пример лимбальной нейроэктодермальной линии) в IDPSC, выращенных на пластиковом субстрате в течение семи дней в разных средах для культивирования. IDPSC, культивированные в средах Epilife, DMEM/KO, KSFM и SHEM, не экспрессируют ABCG2 (А1-А4). Однако экспрессия ABCG2 была обнаружена в IDPSC, культивированных в DMEM/F12, также известной как базальная культуральная среда (А5). У этих клеток развивалась фибробластоподобная морфология. IDPSC, культивированные в Epilife, KSFM и DMEM/F12, не экспрессируют CK3/12 (В1, В3, В5). Однако IDPSC, которые культивировали в DMEM/KO и SHEM, экспрессировали СК3/12 и имели эпителиально-подобную морфологию (В2, В4). Эпифлуоресценция (EF). Ядро окрашено DAPI (синий цвет). Масштабные отрезки: 10 мкм для А1-А4, B1, В2 и В4; 5 мкм для А5, В3 и В5.
Фиг. 11. Экспрессия маркеров недифференцированных LSC и дифференцированных клеток роговицы в IDPSC, которые выращивали в течение семи дней в разных средах для культивирования на амниотической мембране (AM). Виментин был обнаружен в IDPSC, выращенных в культурах DMEM/F12, SHEM, KSFM и DMEM/KO (А и А1-А3). ABCG2 был обнаружен в IDPSC, выращенных в базальных культуральных средах и SHEM (В и В1), но не в IDPSC, выращенных в KSFM и DMEM/KO (В2 и В3). Экспрессия СК3/12 не обнаруживалась в IDPSC, культивированных в DMEM/F12, SHEM и KSFM (С, С1 и С2). Несолько IDPSC, экспрессирующих СК3/12, было обнаружено в IDPSC, выращенных в DMEM/KO (С3). Эти IDPSC, экспрессирующие СК3/12, имеют фибробластоподобную морфологию. Ядро окрашено DAPI (синий цвет). EF. Масштабные отрезки: А1-А4, В1, В2, В4=10 мкм; А5, В3, В5=5 мкм.
Фиг. 12. Фармакологические исследования эффективности исследуемого продукта Cellavita™ (Стволовые Клетки).
Фиг. 13. Схема процесса получения композиций IDPSC, содержащих IDPSC как ранних, так и поздних популяций, пригодные для лечения неврологических заболеваний и состояний.
Фиг.14. График исследований стабильности hIDPSC при длительной криоконсервации, последующем размораживании и отправке перед применением на животных моделях заболеваний человека.
Фиг. 15. График пилотного исследования в модели болезни БХ. БХ индуцировали в течение первых четырех дней, с дня 0 (D0) до дня 4 (D4) путем введения 3-NP. На пятый день (D5) выполняли трансплантацию IDPSC внутривенным введением. Животных подвергали эвтаназии на 9-й день (D9) с последующей фиксацией тканей головного мозга и гистологическим анализом повреждений для выявления биораспределения и приживления IDPSC (Vybrant + иммуногистохимия с использованием специфических антител).
Фиг. 16. График изучения группы I в модели БХ. БХ индуцировали в течение первых четырех дней, с дня 0 (D0) до дня 4 (D4). На пятый день (D5) выполняли трансплантацию IDPSC внутривенным введением. Животных подвергали эвтаназии на 35-й день (D35) с последующей фиксацией тканей головного мозга и гистологическим анализом повреждений для выявления биораспределения и приживления IDPSC (Vybrant + иммуногистохимия с использованием специфических антител).
Фиг. 17. Список "глобальных биомаркеров" (т.е. принятых на международном уровне), используемых для оценки процесса нейродегенерации, вызванной 3-NP, а также влияния трансплантации IDPSC на этот процесс.
Фиг. 18. Локализация маркеров, используемых для оценки нейродегенерации. Красные круги указывают на обычные места повреждений БХ и образования рубцовой ткани, которые характеризуются положительной экспрессией коллагена I. В здоровых областях можно наблюдать экспрессию белков ГАМКергических рецепторов и рецепторов D2. Приживление hIDPSC после в/в введения показано обнаружением человеческого ядра с использованием иммуногистохимии и колокализации CD73 и hIDPSC с использованием иммунофлюоресценции.
Фиг. 19. Приживление hIDPSC после внутривенной инъекции животным. Микроскопические срезы демонстрируют при разной глубине фокуса (А1-А4) наличие IDPSC, окрашенных агентом Vybrant (зеленого цвета), а ядра окрашены PI (красного цвета). Клетки демонстрируют преобладающую капиллярную ассоциацию и различные морфологические типы: нейроноподобные клетки и перициты. На А2-А4 можно наблюдать два перицита в разных местах вдоль капилляра. Оба они имеют сходную морфологию. На А4 изображено ветвление аксона. На А5 представлена схема морфологии нейрона внутри тканей мозга, показанных на А2-А4. Нейрональные ядра светлые с ядрышком, имеют наблюдаемые отличия от ядер, которые сильно окрашены. Синий - искусственный цвет конфокального микроскопа. Эпифлуоресценция + дифференциальный интерференционный контраст (DIC). Масштабный отрезок = 10 мкм.
Фиг. 20. Приживление hIDPSC через четыре дня после в/в введения. Микроскопический срез демонстрирует hIDPSC, окрашенные агентом Vybrant (зеленый), и положительно реагирующие с антителом против hIDPSC (красный). Суперпозиция обоих дает желтый цвет. Клетки демонстрируют околокапиллярную локализацию. Использовали два маркера МСК: CD73 и CD105, демонстрирующие положительную реакцию с hIDPSC (A-D). Е. Положительный контроль - hIDPSC, культивированные in vitro. Конфокальный микроскоп. Эпифлуоресценция + дифференциальный интерференционный контраст (DIC). Масштабный отрезок: А=5 мкм; В=10 мкм; С=20 мкм; D=5 мкм.
Фиг. 21. Результаты иммуногистохимии с использованием антитела к ядрам человеческих клеток (hNu). В коре головного мозга крысы можно наблюдать лишь немногие клетки hIDPSC, тогда как в стриатуме наблюдаются множественные клетки. Световая микроскопия 90 х. Масштабные отрезки: 5 мкм (слева) и 25 мкм (справа).
Фиг. 22. Результаты иммуногистохимии головного мозга через 30 дней после инъекции IDPSC с использованием антитела к ядрам человеческих клеток (hNu). Синие круги указывают на клетки, демонстрирующих треугольное нейроноподобное тело. Размер этих треугольных клеток указывает на то, что они являются "нейронами". Белый круг указывает на фибробластоподобную клетку. Световая микроскопия 90х.
Фиг. 23. Результаты иммуногистохимии головного мозга с использованием антитела к ядрам человеческих клеток (hNu). В синих кругах показаны hIDPSC, локализованные в стриатуме и в СВЗ. Световая микроскопия 90х.
Фиг. 24. Положительное DARPP32-иммуноокрашивание нейронов в клетках животных, получавших CellavitaTM (Стволовые Клетки), через 30 дней после трансплантации hIDPSC. (А, В) У не получавших лечения животных (3-NP + физиологический раствор) отсутствует DARPP32-иммуноокрашивание в стриатуме или коре. (С, D) Образование нейронов у крысы в коре и стриатуме животных, получавших hIDPSC. В синем круге область с нейронами в (С), более высокое увеличение в (D). Световая микроскопия. Увеличение: 20х и 90х.
Фиг. 25. Экспрессия рецептора D2 в стриатуме модели БХ крысы до введения IDPSC и через 30 дней после введения IDPSC. Образцы животных с оценками 3 и 2 балла принадлежат животным, получившим 3-NP, но не получившим лечение IDPSC. В образце с оценкой 2 балла было обнаружено только несколько клеток, положительных по рецептору D2, в то время как образце с оценкой 3 балла такие клетки не наблюдались. Образец с оценкой 1 балл принадлежит животному, получившему 3-NP и IDPSC. В образце с оценкой 1 балл можно увидеть несколько клеток, положительных по рецептору D2. Вставка: при высоком увеличении показаны детали иммуноокрашивания и нейрональной морфологии.
Фиг. 26. План эксперимента для групп II и III для изучения влияния многократных трансплантаций IDPSC и повышенных доз водимых клеток в модели БХ.
Фиг. 27. Примерная схема определения степени нарушения двигательных функций у крыс с БХ, индуцированной 3-NP.
Фиг. 28. Вес тела животных из пилотного исследования до 3-NP-индукции, после 3-NP-индукции (день 4) и после лечения IDPSC (hIDPSC).
Фиг. 29. Вес тела животных группы II и группы III до 3-NP-индукции и после 3-NP-индукции.
Фиг. 30. Вес тела животных группы II после 3-NP-индукции и через 30 дней после лечения hIDPSC.
Фиг. 31. Вес тела животных III группы после 3-NP-индукции и через 30 дней после лечения hIDPSC.
Фиг. 32. График пилотного исследования в модели БХ (группы I, II, III и IV). БХ индуцировали в течение первых четырех дней, с дня 0 (D0) до дня 4 (D4) путем введения 3-NP. На пятый день (D5) выполняли трансплантацию IDPSC внутривенным введением. Животных подвергали эвтаназии на 9-й день (D9) с последующей фиксацией тканей головного мозга и гистологическим анализом повреждений для выявления биораспределения и приживления IDPSC (Vybrant + иммуногистохимия с использованием специфических антител). I и III группы подвергали эвтаназии на 35-й день (D35), а группы II и IV - на 95-й день с последующей фиксацией тканей головного мозга и гистологическим анализом повреждений для выявления биораспределения и приживления IDPSC (Vybrant + иммуногистохимия с использованием специфических антител).
Фиг. 33. Локализация hIDPSC в ткани мозга крысы через 4 дня после введения hIDPSC. Клетки hIDPSC окрашивали в зеленый цвет (Vybrant), а ядра окрашивали в красный цвет (PI) (А1-А4). Клетки локализовались главным образом в капиллярах и наблюдались два морфологических типа: нейроноподобные клетки и перициты. Обратите внимание на разную локализацию перицитов в капиллярах в А2, A3 и А4; в А4, клетки hIDPSC локализованы в бифуркации аксона. А5: морфология нейрона в тканях мозга (А2-А4); А6: схематическое изображение капилляра мозга, показывающее локализацию перицита. Конфокальная микроскопия. Эпифлуоресценция + дифференциальный интерференционный контраст (DIC). Масштабный отрезок = 10 мкм.
Фиг. 34. Приживление hIDPSC через четыре дня после в/в введения. Микроскопический срез демонстрирует hIDPSC, окрашенные агентом Vybrant (зеленый), и положительно реагирующие с антителом против hIDPSC (красный). Суперпозиция обоих дает желтый цвет. Клетки демонстрируют околокапиллярную локализацию. Использовали два маркера МСК: CD73 и CD105, демонстрирующие положительную реакцию с hIDPSC (A-D). Е. Положительный контроль - hIDPSC, культивированные in vitro. Конфокальная микроскопия. Эпифлуоресценция + дифференциальный интерференционный контраст (DIC). Масштабный отрезок: А=5 мкм; В=10 мкм; С=20 мкм; D=5 мкм.
Фиг. 35. Иммуногистохимические изображения, демонстрирующие положительное окрашивание hIDPSC на антитело к ядрам человеческих клеток (hNu) и локализацию hIDPSC в мозговой ткани крысы через 30 дней после введения hIDPSC. Примечание: Малое количество hIDPSC в коре (слева) и большое количество hIDPSC в стриатуме (справа). Световая микроскопия. 90-кратное увеличение. Масштабные отрезки: 5 мкм и 25 мкм соответственно.
Фиг. 36. Иммуногистохимическое изображение ткани головного мозга крысы после инъекции 3-NP и введения hIDPSC. Примечание: положительное окрашивание на антитело к ядрам человеческих клеток (hNu) в клетках. Нейроноподобные клетки обведены синим, а фибробластоподобные клетки обведены белым. Световая микроскопия, 90-кратное увеличение.
Фиг. 37. Окрашивание по Нисслю в стриатуме не получавших лечения животных (3-NP + физиологический раствор) (а-b1); контрольных животных (нет 3-NP или hIDPSC) (с, c1); и получавших лечение животных (3-NP + hIDPSC) (d-f1). В экспериментальных группах наблюдались разные оценки: 1 балл (a, a1, d и d1); оценка 2 балла (b, b1, е и e1); и 3 балла (с, c1, f и f1). Область обширной дегенерации (a, a1); тяжелой (d, d1), умеренной (b, b1, е и e1), легкой (f, f1) степени утраты нейронов и отсутствия (с, c1) утраты нейронов. Увеличение: 10х (a-f) и 20Х (a-f1). Вставки в (b, с, е и f) показывают типичную морфологию нейронов, окрашенных по Нисслю (40х). Световая микроскопия (a-f).
Фиг. 38. Иммуноокрашивание по DARPP32 в стриатуме не получавших лечения животных (3-NP + физиологический раствор) (а-b), контрольных животных (нет 3-NP или hIDPSC) (с) и получавших лечение животных (3-NP + hIDPSC) (d-e1), В (а) - отсутствие иммуноокрашивания (синяя стрелка, 1 балл), (b) - несколько DARPP32-положительных клеток (2 балла) и (с) контрольные животные (нет 3-NP и hIDPSC), показывающие положительный иммуноокрашивание по DARPP32 (3 балла). В (d, d1) - утрата нейронов у получавших лечение животных (3-NP + hIDPSC) с немногими окрашенными DARPP32 клетками (2 балла) (черная стрелка). В (е, e1) сильное анти-DARPP-32 иммуноокрашивание (3 балла). Вставки (а, b, с, d1) показывают DARPP32-положительные нейроны (черная стрелка) (40х). Окрашенные Н&Е (гематоксилин + эозин) ядра синего цвета. Увеличение: 10х (а, с, d, and е) and 20х (d, el).
Фиг. 39. Рост нейронов в стриатуме крыс после введения hIDPSC. Введение hIDPSC вызывало нейрорепаративный эффекту у животных, получавших hIDPSC, по данным (А) окрашивания по Нисслю Nissl и (В) экспрессии DARPP32. (С) Число животных, показывающих регенерацию нейронов после введения hIDPSC, по сравнению с контрольными. Большинство животных, получавших hIDPSC (3-NP + hIDPSC), имели оценку 3 и 2 балла (умеренная и легкая степень), тогда как большинство не получавших лечения животных (3 NP + физиологический раствор) имели оценку 2 и 1 балл (тяжелая и умеренная степень).
Фиг. 40. Экспрессия BDNF в мозговой ткани крысы после (a-f) инъекции 3-NP и (g-j) введения продукта Cellavita™ (Стволовые Клетки) (а, b). Отсутствие экспрессии BDNF через семь дней после инъекции 3-NP и (с, d) низкая экспрессия через 30 дней (е, f). Контрольные животные (без 3-NP и продукта Cellavita™ (Стволовые Клетки). Экспрессия BDNF через 7 (g, h) и 30 (i, j) дней после введения продукта CellavitaTM (Стволовые Клетки). Увеличение: 10х (а, с, е, f, g и h) и 20х (b, d, i и j).
Фиг. 41. Экспрессия DARPP32 в стриатуме крыс через 30 дней после введения продукта Cellavita™ (Стволовые Клетки) в 3-NP модели БХ. Конфокальная микроскопия, наложение изображений в А. Эпифлуоресценции + дифференциальный интерференционный контраст (DIC). B-D: эпифлуоресценция. Масштабный отрезок: 10 мкм.
Фиг. 42. Влияние введения hIDPSC на вес тела у получавших лечение (3-NP + hIDPSC) и не получавших лечения животных (3-NP + физиологический раствор). Вес тела регистрировали до и через 4 дня после введения 3-NP и после каждого введения hIDPSC (каждые 30 дней). Увеличения веса тела у получавших 3-NP животных через 30, 60 и 90 дней после введения 3-NP не наблюдалось. Вес тела у животных, получавших hIDPSC (доза 1x106), увеличивался после первого введения hIDPSC.
Фиг. 43. Типичные картины экспрессии BDNF в головном мозге животных, получавших 3-NP, через 4 дня после внутривенной трансплантации hIDPSC. Сильная секреция BDNF наблюдается в коре (1a, 1b). Более низкая секреция BDNF наблюдается в гиппокампе (1c, 1d). Сильная экспрессия BDNF наблюдается в стриатуме (1e, 1f). Контрольная 3-NP-группа не проявляет секреции BDNF в тех же областях мозга (2а-2f). Световая микроскопия. Увеличение 20х в 1а, 1с, 1е, 2а, 2с, 2е; Увеличение 40х в 1b, 1d, 1f, 2b, 2d, 2f. Стрелки в 1b и 1d и звездочки в 1e и 1f указывают на клетки, секретирующие BDNF. Ядра контрастируют с помощью Н&Е (гематоксилин + эозин).
Фиг. 44. Типичные картины экспрессии BDNF в головном мозге животных, получавших 3-NP, через 30 дней после внутривенной трансплантации hIDPSC. Сильная секреция BDNF наблюдается в коре (1a, 1b). Более низкая секреция BDNF наблюдается в гиппокампе (1c, 1d). Сильная экспрессия BDNF наблюдается в стриатуме (1e, 1f). Контрольная 3-NP группа не проявляет секреции BDNF в тех же областях мозга (2a-2f). Световая микроскопия. Увеличение 20х в 1a, 1c, 1е, 2а, 2 с, 2е; Увеличение 40х в 1b, 1d, 1f, 2b, 2d, 2f. Стрелки в 1b и 1d и звездочки в 1e и 1f указывают на клетки, секретирующие BDNF.
Фиг. 45. План эксперимента для всех исследований на модели БХ с целью оценить функциональные характеристики крыс с индуцированной БХ после трансплантации IDPSC.
Фиг. 46. Принципиальная разница между нормальными клетками МСК и ES (или iPS). Образование опухолей показывает корреляцию с ES- и iPS-клетками, но не с нормальными МСК.
Фиг. 47. Схема механизма эффективности hIDPSC для индуцирования нейрогенеза и обеспечения нейропротекции.
Фиг. 48. Ранняя фаза разработки производственного процесса для выделения продукта Cellavita™ (Стволовые Клетки) и смешивания партии.
Фиг. 49. Другая ранняя фаза разработки производственного процесса для продукта Cellavita™ (Стволовые Клетки).
Фиг. 50. Процесс получения продукта CellavitaTM (Стволовые Клетки), состоящий из нескольких основных этапов.
Фиг. 51. Исследования безопасности исследуемого продукта Cellavita™ (Стволовые Клетки).
ПОДРОБНОЕ ОПИСАНИЕ
В настоящем тексте глагол "содержать" (включать), как он используется в этом описании и в формуле изобретения, и его формы спряжения используются в его неограничивающем смысле, означающем, что элементы, следующие за соответствующим словом, включены, но элементы, не упомянутые конкретно, не исключены. Кроме того, указание на элемент в эдинственном числе (соотв. неопределенному артиклю в исходном текте на английском языке) не исключает возможности присутствия более одного такого элемента, если только контекст явно не требует наличия одного и только одного из таких элементов. Таким образом, неопределенный артикль обычно означает "по меньшей мере один".
В настоящем документе термин "высокая экспрессия" применительно к уровню экспрессии (в высокой степени иммуноположительный в отношении рассматриваемого антигена) какого-то гена в популяции клеток означает, что, по меньшей мере 75% данной популяции экспрессируют этот ген.
В настоящем документе термин "низкая экспрессия" применительно к уровню экспрессии какого-то гена в популяции клеток означает, что не более 30% популяции экспрессируют этот ген. В предпочтительных вариантах реализации низкая экспрессия означает, что не более 25% популяции экспрессируют этот ген.
В настоящем документе термин "отсутствие экспрессии" применительно к уровню экспрессии какого-то гена в популяции клеток означает отсутствие в популяции обнаружимых клеток, которые экспрессируют рассматриваемый ген. Отсутствие обнаружимой экспрессии включает в себя уровень экспрессии, который находится в пределах погрешности для данного способа измерения экспрессии.
В настоящем документе термин "субъект" или "пациент" относится к любому позвоночному животному, включая, помимо прочего, людей и других приматов (например, шимпанзе и других обезьян и видов обезьян), сельскохозяйственных животных (например, крупный рогатый скот, овец, свиней, коз и лошадей), домашних млекопитающих (например, собак и кошек), лабораторных животных (например, грызунов, таких как мыши, крысы и морские свинки) и птиц (например, домашних, диких и промысловых птиц, таких как курицы, индюки и другие куриные, утки, гуси и т.п.). В некоторых вариантах реализации субъект может представлять собой млекопитающее. В других вариантах реализации субъект может представлять собой человека.
В настоящем документе термин "стволовая клетка" относится к незрелым, неспециализированным клеткам, которые при определенных условиях могут дифференцироваться в зрелые функциональные клетки.
В настоящем документе термин "нервные стволовые клетки" или "NSC" относится к мультипотентным клеткам, которые являются самовоспроизводимыми и способными терминально дифференцироваться в нейроны, астроциты и олигодендроциты.
В настоящем документе термин "нервные (нейрональные) прогениторные клетки" относится к недифференцированным клеткам, продвинувшимся в процессе дифференцировки клеток дальше, чем нервные стволовые клетки. Таким образом, эти клетки происходят из нервных стволовых клеток и могут производить потомство, способное дифференцироваться в более чем один тип клеток центральной нервной системы (ЦНС) и периферической нервной системы (ПНС).
В настоящем документе термин "нервная (нейрональная) клетка-предшественник" или "NPC" относится к смешанной популяции клеток, состоящей из нервных стволовых клеток и всего их недифференцированного потомства. Поэтому NPC включают как NPC, так и NSC. NPC также могут быть подразделены на нейрональные NPC и глиальные NPC, которые производят нейроны и глиальные клетки, соответственно.
В настоящем документе термин "цикл сбора клеток" представляет собой перенос культуры органа (например, происходящей из нервного гребня, такого как пульпа зуба), или ткани в новый контейнер для культуры клеток после адгезии и разрастания стволовых клеток в ткани с последующей консервацией (например, криоконсервацией), и/или субкультивированием отростков IDPSC. Стволовые клетки, выделенные в первый раз из культуры органа (пульпа зуба) с использованием эксплантной технологии, принадлежат к ранним популяциям, таким образом стволовые клетки, выделенные из первого цикла сбора (первый перенос культуры органа), являются клетками ранней популяции. Например, стволовые клетки, выделенные из ткани пульпы зуба, стволовые клетки из выпавших человеческих молочных зубов (SHED) не могут быть разделены на раннюю и позднюю популяцию, так как эти клетки выделяют с использованием ферментативного метода только один раз из пульпы зуба, которую выбрасывают после выделения SHED. Таким образом, можно выделить только одну популяцию клеток SHED. Далее, после ферментативного расщепления, SHED можно пассировать из одной колбы для культивирования клеток в другую, таким образом, увеличивая число пассажей клеток, которые обычно выполняют, когда SHED достигают полу-конфлюэнтности.
В отличие от SHED, для незрелых стволовых клеток пульпы зуба (IPDSC) ферментативный метод не используется. IDPSC можно выделить как из эксплантной культуры пульпы зуба после первой адгезии ПЗ к пластику, и разрастания клеток - это будут клетки ранней популяции. На этой этапы пульпу зуба не выбрасывают и используют для последующих эксплантных культур пульпы зуба - поздних популяций. Таким образом, IDPSC, выделенные из второго или более позднего цикла сбора, представляют собой клетки поздних популяций. Например, IPDSC, которые выделены из второго цикла сбора или позже, представляют собой недифференцированные стволовые клетки поздних популяций. В настоящем документе термин "ранний пассаж" относится к клеткам из первых пяти пассажей эксплантной культуры. В настоящем документе термин "поздний пассаж" относится к клеткам из пассажей после пятого, например, в шестом пассаже или позже, эксплантной культуры. Таким образом, IDPSC могут быть из ранней или поздней популяции и дополнительно подразделяться на клетки раннего или позднего пассажа.
Настоящее изобретение относится к способу получения незрелых стволовых клеток зубной пульпы человека (hIDPSC). Изобретение также относится к уникальной популяции стволовых клеток, составленной из ранних и поздних популяций стволовых клеток из ткани, произошедшей из нервного гребня, которая может пересекать гематоэнцефалический барьер (ГЭБ) и индуцировать нейрогенез. Ткань, произошедшая из нервного гребня, включает, например, зубную, периодонтальную ткань и ткань волосяного фолликула. Ткань волосяного фолликула включает фолликулярную ткань вибриссы.
Клетки hIDPSC оценивали в крысиной модели БХ с использованием 3-NP (три-нитропропионовой кислоты). hIDPSC демонстрировали приживление в мозге крысы через 1 месяц после внутривенной инъекции 1×106 и 1×107 клеток/трансплантат (3×106 клеток/кг и 3×107 клеток/кг), помеченных флуоресцентным белком (Vibrant), а также после иммуногистохимического анализа с использованием специфического античеловеческого антитела. Приживление клеток наблюдалось в разных отделах головного мозга (коры, стриатума и субвентрикулярной зоны - СВЗ).
Способность пересекать ГЭБ делает возможным системное введение (например, в/в введение) терапии стволовыми клетками для лечения неврологических состояний, что обеспечивает значительное преимущество перед более локализованными способами введения. В дополнение к тому, что системное введение является менее инвазивным, способность стволовых клеток мигрировать в места, нуждающиеся в помощи, снижает риск скопления вредных масс клеток в месте введения. Например, хотя в доклинических и клинических исследованиях обычно планируется интратекальное (IT) введение терапии стволовыми клетками, этот способ может нести значительный риск, когда используемые стволовые клетки представляют собой МСК. Сообщалось, что в зависимости от плотности клеток, полученные из костного мозга МСК, которые были втянуты в паренхиму головного мозга (предположительно, в ответ на сигналы хемоаттрактанта из этого воспаления) после интрацеребровентрикулярного (ICV) введения, образовали клеточные скопления у 64% животных с тяжелым экспериментальным аллергическим энцефаломиелитом. Кариотипически нормальные МСК в ранних пассажах также индуцировали скопления клеток у не подвергавшихся воздействию животных (Grigoriadis et al., 2011). Таким образом, МСК, имплантированные непосредственно в ЦНС, сами по себе могут вызывать локальную патологию с неизвестными последствиями (Snyder et al., 2011). Объем этих скоплений, как оказалось, коррелирует с плотностью клеток. Поэтому допустимое число вводимых клеток, а также количество их введений могут быть ограничены и представлять собой факторы риска при IT и ICV способах применения в отличие от в/в.
Такая композиция из hIDPSC может быть в форме фармацевтической композиции, содержащей стволовые клетки, экспрессирующие иммунофенотипы мезенхимальных и нейроэпителиальных стволовых клеток. В некоторых вариантах реализации экспрессия молекулярного профиля мезенхимальных и нейроэпителиальных стволовых клеток представляет собой экспрессию маркеров МСК и нейроэпителиальных клеток/прогениторных клеток и генов, кодирующих нейропротекторные и иммунопротекторные факторы.
Клетки, экспрессирующие иммунофенотип МСК, также экспрессируют CD44. Предыдущие животные модели рассеянного склероза обнаружили, что адгезия NCS к воспаленным эндотелиальным клеткам, а затем трансэндотелиальная миграция через ГЭБ в воспаленные области ЦНС последовательно опосредуется конститутивной экспрессией функциональных молекул клеточной адгезии (САМ), особенно CD44 (Rampon С et al., 2008). Хотя точный механизм того, как hIDPSC способны пересекать ГЭБ, не ясен, считается, что эти клетки обладают такой способностью, поскольку они имеют перицитоподобные характеристики (Barros et al., 2014). Известно, что перициты играют важнейшую роль в интеграции функций эндотелия и астроцитов в нейрососудистой единице и в регуляции ГЭБ (Armulik et al., 2010; Liu et al., 2012). Согласно ранее проведенному исследованию (Yilmaz et al., 2011), мезенхимальные стволовые клетки (МСК) могут вливаться в мозг после системного введения благодаря экспрессии CD44, который является лигандом Е- и L- эндотелиальных селектинов кровеносных сосудов (Dimitroff, et al., 2001). МСК демонстрируют механизмы хоуминга, аналогичные лейкоцитам. Первая стадия миграции лейкоцитов включает захват лейкоцитов, свободно текущих в кровотоке, опосредованный гликопротеинами, известными как селектины. Р- и Е-селектины экспрессируются сосудистым эндотелием и являются главными медиаторами реакции в виде роллинга при миграции лейкоцитов через кровеносные сосуды (Luster et al., 2005). МСК могут использовать этот или подобные механизмы для приживления в нескольких органах (Sackstein et al., 2008), таких как мозг. Поэтому CD44 считается ключевым фактором для миграции МСК в мозг. Подобно МСК костного мозга, hIDPSC экспрессируют CD44, показывая, что CD44 также участвует в миграции hIDPSC в несколько органов (Barros et al., 2014, Castanheira et al., 2013), включая мозг, после внутривенного введения. Удивительно, что hIDPSC также экспрессируют CD13 (аминопептидаза N) (Kerkis et al., 2006; Kerkis and Caplan, 2012), который является многофункциональным белком и играет различные роли в миграции, пролиферации, дифференцировке клеток (Taylor et al., 1993; Mina-Osorio et al., 2008a/b). CD13 участвует в ангиогенезе, генерируя и модулируя ангиогенные сигналы, в процессе образования капилляров и в качестве маркера ангиогенных сосудов (Bhagwat et al., 2001). Это указывает на его возможную роль в способности hIDPSC мигрировать и нацеливаться на сосудистую сеть мозга. В упомянутом исследовании у крыс с использованием 3-NP, hIDPSC продемонстрировали тесную связь с капиллярами мозга.
В некоторых вариантах реализации IDPSC не экспрессируют CD146, HLA-DR и/или HLA-ABC. Отсутствие экспрессии этих маркеров облегчает применение hIDPSC в качестве безопасной гетерологичной терапии. Эндотелий играет важную роль в обмене молекулами, а также иммунными клетками между кровью и подстилающей тканью. Молекула эндотелиального антигена S-Endo 1 (CD146) предпочтительно расположена в эндотелиальных соединениях и, как утверждается, поддерживает целостность эндотелия. Таким образом, у людей МСАМ (CD146) экспрессируется в Т-клетках (3%) в периферическом кровообращении здоровых людей. МСАМ-положительные Т-клетки также демонстрируют повышенную способность связываться с эндотелиальными монослоями, и эти клетки могут реперезентировать ранние компоненты адаптивного иммунного ответа (Dagur et al., 2015). Поэтому стволовые клетки, экспрессирующие этот маркер, могут связываться с ГЭБ и не пересекать ГЭБ, а также быть иммуннореактивными.
Профиль генотипа мезенхимальных стволовых клеток также включает низкую экспрессию плюрипотентных маркеров ОСТ3/4 и Nanog. Интересно, что недифференцированные стволовые клетки фармацевтической композиции по изобретению не обязаны экспрессировать с-Мус, KLf-4 и REX-1. Фактически, эти стволовые клетки могут быть отрицательными по экспрессии с-Мус, KLf-4 и REX-1.
Стволовые клетки, экспрессирующие молекулярный профиль нейроэпителиальных стволовых клеток, экспрессируют по меньшей мере один, предпочтительно два, более предпочтительно - более двух NPC- и NSC-биомаркеров, выбранных из группы, состоящей из виментина, нестина, SOX2, р75 и других нейротрофических факторов, необходимых для развития и выживания нервных клеток. р75 является маркером нейротрофического рецептора. В недавних работах было высказано предположение, что нормализация экспрессии p75NTR и/или TrkB или их сигнализации может привести к усовершенствованию нейропротекторной терапии на основе BDNF (нейротрофический фактор мозга) при болезни Хантингтона (Brito et al., 2013).
Примерами нейротрофических факторов, необходимых для развития и выживаемости нейронов, являются BDNF (нейротрофический фактор мозга), GNDF (нейротрофический фактор линии глиальных клеток), NGF (фактор роста нервов) и NT (нейротрофины). BNDF играет важнейшую роль в болезни Хантингтона (Gauthier et al., Strand et al.) и болезни Паркинсона (Mogi et al.), обе из которых являются нейродегенеративными заболеваниями, ассоциированными с дофамином. В нескольких исследованиях показано, что сверхэкспрессированный при БХ белок htt дикого типа повышает экспрессию BDNF в клетках ЦНС, тогда как мутантный белок htt вызывает снижение экспрессии BDNF, что приводит к недостаточной нейротрофической поддержке и гибели нейронов (Zuccato et al., 2001). В мозге пациентов с АД снижены уровни NGF (Calissano et al.); вместе с тем, введение NGF может частично снизить холинергическую атрофию у пожилых грызунов (Fischer W et al.). В некоторых вариантах реализации предпочтительным NGF является NGF-β. NT, необходимые для развития и выживаемости нейронов, включают NT3, NT4 или NT5. Известно, что NT4 и NT5 способствуют росту сенсорного и двигательного аксонов.
В некоторых вариантах реализации стволовые клетки содержат клетки, аутологичные для субъекта, нуждающегося в этой фармацевтической композиции. В других вариантах реализации стволовые клетки содержат клетки, аллогенные для субъекта, нуждающегося в этой фармацевтической композиции. В некоторых вариантах реализации стволовые клетки содержат комбинацию клеток, аутологичных и аллогенных для субъекта, нуждающегося в этой фармацевтической композиции.
В одном варианте реализации стволовые клетки выделяют из ткани, произошедшей из нервного гребня, выбранной из группы, состоящей из зубной ткани, ткани периодонта и ткани волосяного фолликула. В предпочтительных вариантах реализации ткань, произошедшая из нервного гребня, представляет собой пульпу зуба. В наиболее предпочтительном варианте реализации стволовые клетки получены из незрелой пульпы зуба, например, представляют собой человеческие незрелые стволовые клетки пульпы зуба (IDPSC), как описано в международной заявке № PCT/IB14/59850 и в патентной заявке США №14/2140016. IDPSC несут множественные нейрональные маркеры и стабильно претерпевают дифференцировку в нейроны. Новизна иммунофенотипа IDPSC заключается в неожиданной экспрессии этих маркеров и в то же время маркеров, характерных для МСК, проявляющих иммунофенотип в соответствии с минимальными критериями Международного общества по клеточной терапии для определения мультипотентных мезенхимальных стромальных клеток (Dominici et al., 2006). Эта комбинация экспрессии клетками IDPSC маркеров МСК и множественных нейрональных маркеров не характерна для МСК (Dominici et al., 2006) и не была раскрыта для МСК ранее.
Фармацевтические композиции, предлагаемые в изобретении, предпочтительно являются изотоническими. Для внутривенной инъекции популяция незрелых стволовых клеток должна составлять от 104 до 1010 клеток на инъекцию, например, 104, 105, 106 и 107 клеток на кг массы тела. Фармацевтическая композиция, включающая популяцию стволовых клеток, может быть использована в дополнение к другим фармацевтически активным соединениям или способам лечения. Таким образом, в некоторых вариантах реализации фармацевтическая композиция может дополнительно содержать другое фармацевтически активное соединение или способ лечения.
Мезенхимальные стволовые клетки
В организме МСК обнаруживаются в костном мозге, ткани пуповины, пульпе зуба и жировых телах. Однако в костном мозге МСК относительно редки, составляя лишь одну из каждых 10000 клеток, тогда как другие источники значительно богаче этими клетками. В организме МСК ответственны за регенерацию тканей при заболеваниях, травмах или повреждениях в течение всей жизни человека. Эта функция МСК реалтзауется за счет их способностей к самообновлению и пластичности (способность к дифференцировке - продуцированию различных типов клеток). МСК можно легко выделить из вышеупомянутых тканей и легко культивировать в лаборатории. Получив ограниченное количество клеток от пациента, МСК можно быстро размножать in vitro и криоконсервировать для будущих клинических применений.
МСК способны секретировать разнообразные биологически активные молекулы, например цитокины, которые обеспечивают "трофическую активность" путем структурирования регенеративного микроокружения, и другие молекулы, которые способствуют иммуномодулирующим функциям клеток и даже переносу таких крупных продуктов, как митохондрии, в поврежденные клетки, которые нуждаются в помощи. При трансплантации in vivo МСК, в ответ на хемотаксические стимулы, могут мигрировать к очагу повреждения как из локальных, так и из окружающих участков. Кроме того, МСК могут способствовать уменьшению хронического воспаления, ингибированию апоптоза, обеспечению появления миофибробластов, ингибированию образования рубцов и стимуляции митоза свойственных данной ткани прогениторов, таким образом ремоделируя поврежденную ткань. Именно поэтому МСК также называют "лекарственными сигнальными клетками". Они стимулируют ангиогенез, процесс образования новых кровеносных сосудов, который тесно связан с нейрогенезом, процессом, за счет которого образуются новые нервные клетки. Кровеносные сосуды играют важную роль в качестве механизма миграции нейрональных прогениторных клеток в поврежденную область мозга. Факторы, секретируемые МСК, также уменьшают разрушающие эффекты окислительного повреждения. Используя все эти механизмы действия, МСК могут значительно улучшить поврежденное микро о кружение, что приводит к восстановлению поврежденных клеток. Поэтому МСК считаются "скорой помощью для клеток".
Когда МСК, полученные от людей, снабдили метками для отслеживания их передвижений и ввели мышам, имеющим какой-либо тип повреждения тканей, они мигрировали распределяясь по поврежденным тканям по-видимому равномерно. Эти клетки могут присутствовать или не присутствовать в ткани в течение значительного периода времени, что зависит от модели болезни. Длительное присутствие МСК важно, но не является существенным, для развития терапевтического процесса, поскольку оно указывает на то, что потенциальные долгосрочные положительные эффекты лечения могут быть устойчивыми.
Важно понимать, что временное присутствие МСК не является результатом действия иммунной системы хозяина, потому что этот эксперимент с мышами с повреждениями дал одни и те же результаты независимо от наличия у них функциональных иммунных систем. Дальнейшие исследования показали, что МСК подавляют иммунную систему и уменьшают воспаление. Другими словами, МСК можно переносить между организмами, так как они демонстрируют очень малое иммунное отторжение, которое возникает, когда иммунная система организма атакует чужую ткань при введении трансплантата. Это обнаруженное свойство делает МСК хорошим кандидатом на трансплантацию или инъекцию хозяину, поскольку они способны избегать отторжения иммунной системой хозяина (Le Blank,  , 2006; English, 2012; Miguel et al., 2012; Griffin et al., 2012; Ankrum et al., 2014).
, 2006; English, 2012; Miguel et al., 2012; Griffin et al., 2012; Ankrum et al., 2014).
Критическим вопросом клеточной терапии является путь доставки МСК в мозг, и для решения этой проблемы было испробовано несколько подходов. Для доставки МСК в мозг было предложено несколько подходов, таких как интратекальная, внутривенная инъекция, инъекция в пространство, окружающее спинной мозг, и даже путь введения через нос. На ранних этапах развитии, в результате сложных многоклеточных взаимодействий между незрелыми эндотелиальными клетками и нервными прогениторами, нейронами, радиальными глиями и перицитами, которые имеют сходные черты с МСК, формируется гематоэнцефалический барьер (ГЭБ), который контролирует селективную миграцию молекул или клеток между кровообращением и мозговым интерстициальным пространством. ГЭБ представляет значительные проблемы для доставки терапевтических агентов (лекарств или клеток) для лечения злокачественных новообразований и нейродегенеративных нарушений головного мозга. Системно-инфузионные МСК способны лечить острые травмы, воспалительные заболевания, инсульт центральной нервной системы (ЦНС) и даже опухоли головного мозга в силу своей регенеративной активности и способности выделять трофические, иммуномодулирующие или другие сконструированные генно-инженерным способом терапевтические факторы. Однако, вопрос, способны ли МСК мигрировать через ГЭБ в нормальных и патологических условиях, остается открытым (Liu et al., 2013).
Системная (например, в/в) инфузия МСК, размноженных in vitro, является минимально инвазивной и удобной процедурой, которая используется в большом количестве текущих клинических испытаний. Поэтому важно понять, способны ли трансплантированные МСК мигрировать к и приживаться на ишемических и поврежденных участках мозга, чтобы оказывать свой терапевтический эффект. Пока нет данных, которые бы свидетельствовали или раскрывали, что системная доставка минимально модифицированных МСК может привести к прямой трансплантации клеток в мозг через ГЭБ.
Простота получения, культивирования МСК, а также их уникальная "трофическая активность" и возможность их переноса в организм хозяина без иммунного отторжения, являются причинами, по которым терапия стволовыми клетками МСК является перспективным направление для лечения неврологических заболеваний и состояний, например нейродегенерации. Согласно недавним публикациям, МСК способны поддерживать восстановление после нейродегенерации путем секреции трофических факторов - белков, стимулирующих дифференцировку и выживание клеток. Эффекты этих факторов позволяют нервным клеткам реализовать несколько процессов, которые могут поддерживать выживание: удлинение, рост аксона и прикрепление клеток. Хотя есть свидетельства того, что МСК могут способствовать росту и восстановлению клеток в головном мозге, еще не подтверждено окончательно, что МСК могут стать зрелыми нервными клетками, способными к сигнализации или коммуникации с другими нервными клетками.
В предшествующих исследованиях тестировали потенциал МСК-терапии в животных моделях БХ (химические модели, где БХ индуцируют QA (хинолиновой кислотой) или 3-NP, и использование линий трансгенных мышей R6/2-J2, N171-82Q и R6/2). Однако, хотя авторы назвали тестируемые клетки "МСК", у этих клеток не было подтвержденного иммунофенотипа, типичного для МСК, согласно определению Международного общества клеточной терапии (Dominici et al., 2006). В этих доклинических исследованиях использовали аллогенную и ксеногенную первичную культуру и иммортализованные клеточные линии из костного мозга, жировой ткани и пуповинной крови, выращенные при нормальных уровнях кислорода (нормоксия) или при низких уровнях кислорода (гипоксия), а также, мононуклеарные клетки. Таким образом, эти исследования не установили, что клетки, рассматриваемые как МСК Международным обществом клеточной терапии, могут быть успешно использованы для лечения неврологических заболеваний без предшествующих специальных манипуляций в культуре.
Количество клеток, используемых в этих экспериментах, варьировалось от 105, 2×105, 4×105, 5×105, и до 106 на полушарие/стриатум. Время введения трансплантации МСК значительно варьировалось в разных исследованиях, составляя 1-3 дня, 2-4 недели и 8 недель. Эти клетки были обнаружены в головном мозге после прямой прививки, но прямая внутри мозговая доставка является чрезвычайно инвазивной и рискованной процедурой. Таким образом, эти исследования не продемонстрировали возможности использования для введения терапии стволовыми клетками минимально инвазивных способов, таких как системное введение путем внутривенной инъекции.
Во всех, кроме одного из этих исследований, использовали клетки после не более 10 пассажей. В одном лишь исследовании использовали МСК, полученные из пуповинной крови мыши (mUBC) после 40 и 50 пассажей. Интересно, что по данным исследования экспрессия маркера плюрипотентных стволовых клеток, такого как специфический для этапы эмбриональный антиген-4 (SSEA4), увеличивались по мере пассирования, и трансплантация МСК, полученных из mUCB, после большого числа пассажей приносит значительный полезный эффект для двигательной функции, в отличие от трансплантации полученных из mUCB МСК с низким числом пассажей. К сожалению, потенциальное плюрипотентное происхождение и высокий риск мутации кариотипа из-за более высокого числа пассажей делают клинические применения этой методики рискованными.
В отличие от этих исследований, настоящее изобретение относится к способу лечения неврологических заболеваний и состояний с применением уникальной популяции IDPSC, имеющих иммунофенотип, типичный для МСК, согласно определению Международного общества клеточной терапии, эффективных даже при минимально инвазивном введении, например посредством классического в/в пути доставки.
Как показали эти предыдущие исследования по лечению БХ предполагаемыми МСК, единственной надеждой в лечении нейродегенеративных заболеваний является использование стволовых клеток. К сожалению, только лечение введением донорской ткани плода в стриатум дошло до этапы клинического испытания, и это было всего лишь небольшое испытание.
Клеточные методы терапии при БХ предназначены для защиты популяций нейронов, восприимчивых к заболеванию, и/или замены дисфункциональных или умирающих нейронов. Поэтому клинический прогресс в клеточной терапии БХ был сосредоточен на разработке протоколов для трансплантации полученных из плода клеток в стриатум больного. Эта стратегия помогает внедрению терапии стволовыми клетками в клинику и обеспечивает больному период в несколько лет улучшения и стабильности, но не стойкое выздоровление (Bachoud-Levi et al., 2006). Долгосрочное наблюдение за 3-10-летним послеоперационным периодом пациентов приводит к выводу, что фетальная стриарная аллотрансплантация при БХ является безопасной. Однако устойчивых функциональных терапевтических эффектов обнаружено не было, возможно, из-за небольшого количества клеток, которые были привиты в этом исследовании безопасности, по сравнению с другими сообщениями о более успешных трансплантациях у пациентов с БХ (Barker et al., 2013).
Применение терапии стволовыми клетками при БХ неизбежно, поскольку в фенотип БХ вовлечены внутриклеточные и клеточные механизмы. Терапия стволовыми клетками также может ускорить процесс регенерации мозговой ткани. Стволовые клетки являются важным методом терапии, который поможет восстановить область мозга, наиболее поврежденную при БХ. Только медикаментозный подход не сможет восстановить поврежденные области мозга, особенно на поздних стадиях БХ.
МСК могут быть получены из удаленных человеческих зубов, как постоянных, так и молочных, с помощью ферментативного расщепления (Gronthos et al., 2000; Miura et al., 2003) или культуры органа, с последующей эксплантной технологией (незрелые стволовые клетки пульпы зуба, IDPSC), как раскрыто в международной заявке №. PCT/IB14/59850 и в патентной заявке США №14/2140016. IDPSC получают из ткани пульпы зуба, которая анатомически происходит из эктомехэнхимальной ткани, точнее из нервного гребня, представляющего собой ткань, присутствующую на ранних этапах формирования эмбриона. В конечном итоге из нервного гребня образуются твердые и мягкие ткани шеи и черепа.
Известно, что IDPSC, которые происходят из нервного гребня, мигрируют пренатально в различные, главным образом эктодермальные, ткани, и обладают способностью к самообновлению и демонстрируют почти такой же потенциал развития, как и эмбриональные стволовые клетки (ES), но без риска образования эмбриональных тел in vitro и тератом in vivo (Kerkis and Caplan, 2012). Постмиграционные стволовые клетки, произошедшие из нервного гребня, порождают все черепно-лицевые кости, большинство клеток и тканей центральной и периферической нервной системы, а также несколько типов не-нейральных клеток, таких как клетки гладкой мускулатуры сердечно-сосудистой системы, пигментные клетки в коже, клетки хряща, соединительной ткани, эпителия роговицы и пульпы зуба. Хотя постмиграционные постнатальные клетки, произошедшие из нервного гребня, имеют ограниченный потенциал развития, они сохраняют функциональные характеристики, сходные с их эмбриональными аналогами, и способность дифференцироваться в широкий спектр типов клеток (Le Douarin et al., 2004, 2007, 2008; Dupin et al., 2007; Le Douarin & Dupin, 2003, 2012).
In vitro IDPSC претерпевают единообразную дифференцировку в нейроны и глиальные клетки. Трансплантация in vivo человеческих IDPSC показала приживление с большой плотностью в различных тканях, включая нейроны. Дифференцировка в направлении нейронов основана на эпигенетической "памяти" орофациальных костей, включая пульпу зуба, по сравнению с клетками костей осевого и аппендикулярного скелета (костный мозг и подвздошный гребень) исходя из их различных эмбриологических источников. Верхняя челюсть, нижняя челюсть, в том числе альвеолярная кость (то есть дентин, пульпа зуба и периодонтальная связка), образованы исключительно клетками нервного гребня, а кости осевого и аппендикулярного скелета развиваются из мезодермы. Поэтому IDPSC обладают потенциалом для нейральной регенерации и нейропротекции.
В работе Logan A et al. показано, что для получения синергетического эффекта при нейропротекции клетки должны продуцировать множественные NTF (нейротрофические факторы). Поэтому важно, чтобы клетки hIDPSC экспрессировали и высвобождали множественные NTF. Недавние публикации сообщают о свидетельствах паракринного механизма действия стволовых клеток пульпы зуба (DPSC) в нейральной поддержке, с генной экспрессией многих NTF, таких как NGF (фактор роста нервов), BDNF и NT3, и полученные результаты продемонстрировали, что hIDPSC вызывает значительно большую нейропротекцию и нейрогенезаксотомизированных RGC (ганглиозные клетки сетчатки), чем hBMSC (МСК, полученные из костного мозга) или hAMSC (МСК, полученные из жировой ткани) Mead В et al., 2013; Mead В et al., 2014; Martens W et al., 2013). Для терапии сетчатки были предложены интравитреально трансплантированные DPSC в качестве более подходящего типа клеток, чем BMSC (Mead В et al., 2014). В этих исследованиях использовали DPSC (=SHED), ферментативно полученные от взрослых крыс с использованием трипсина.
Кроме того, полученные данные недавно были подтверждены результатами исследования с использованием модели повреждения спинного мозга на грызунах с трансплантацией SHED путем прямой трансплантации твердой мозговой оболочки вблизи и непосредственно в участок поражения, причем SHED превосходили три линии фибробластов кожи человека с точки зрения нейропротекции и нейрорегенерации благодаря как автономной клеточной, так и паракринной нейрорегенеративной активности (Sakai et al., 2012). В этих исследованиях использовали культивированные DPSC, ферментативно полученные из незрелых и взрослых зубов мудрости с использованием коллагеназы. При трансплантации DPSC животным также вводили циклоспорин для иммуносупрессии.
Безопасность системного введения стволовых клеток
Если трансплантат не является аутотрансплантатом, всегда существует риск того, что иммунная система хозяина будет атаковать трансплантат. Даже хорошо подобранный аллотрансплантат требует предварительной иммуносупрессии. Это справедливо и для трансплантации стволовых клеток.
Чтобы избежать атаки иммунной системы хозяина на трансплантированные клетки, популяция терапевтических стволовых клеток должна быть неиммуногенной. Иммуногенность - это способность аллогенных стволовых клеток провоцировать иммунный ответ при столкновении с иммунной системой хозяина после трансплантации (Schu S et al., 2012). Трансплантация NPC с несоответствующим главным комплексом гистосовместимости (МНС) мышам с демиелинизацией ЦНС, вызванной вирусом гепатита мыши, приводила к повышенной инфильтрации Т-клеток и отторжению NPC (Weinger JG et al., 2012). Однако недавние данные подтверждают возможность того, что недифференцированные взрослые стволовые клетки наделены иммунологически привилегированным статусом и способны избегать нормальных процессов аллогенного отторжения (Bifari F et al., 2010). Иммунологически привилегированный статус возможен для популяции клеток, если эти клетки не экспрессируют МНС. Например, у людей иммуногенность не может вызываться популяцией стволовых клеток, существенно отрицательных по лейкоцитарному антигену человека (HLA), который является человеческой версией МНС. Таким образом, отсутствие HLA-DR, которое является характеристикой контроля качества IDPSC, является важным маркером для возможности использования клетки для системной клеточной терапии без необходимости премедикации пациента с помощью токсичной иммуносупрессии.
Другой опасностью трансплантации стволовых клеток является повышенный риск развития опухоли, особенно для недифференцированных клеток, из-за потенциальной способности этих клеток дифференцироваться в другие типы клеток. Плюрипотентные стволовые клетки, особенно клетки hESC и iPSC, способны образовывать сферы, напоминающие эмбриоидные тела in vitro и тератомы in vivo. Все доступные в настоящее время технологии для применения плюрипотентных клеток несут риск возникновения опухоли. Экспрессия и отсутствие экспрессии определенных генов уменьшают эти риски, позволяя системное введение популяции стволовых клеток.
Nanog является транскрипционным фактором, ассоциированным с сохранением плюрипотентных клеток внутренней клеточной массы и образованием эмбриональных стволовых клеток. Nanog является ингибирующим лейкемию фактором (LIF) и активатором транскрипционно-независимого фактора-3 (STAT-3). Он регулируется ОСТ4 и SOX2 и в свою очередь положительно регулирует экспрессию ОСТ4, SOX2 и самого себя путем связывания с соответствующими промоторными участками гена (Boyer et al, 2005; Loh et al., 2006; Li, 2010). Вместе эти три фактора транскрипции играют важную роль в предотвращении дифференцировки плюрипотентных стволовых клеток (Boyer et al., 2005). Ранее было показано, что трансфекция клеточного ядра генами ОСТ3/4, SOX2, NANOG достаточна для индуцирования плюрипотентности во взрослых соматических клетках (создание iPSC), а затем приводит к полному профилю теоретических характеристик эмбриональных стволовых клеток: дифференцировке на 200 типов клеток в организме, неограниченному размножению, потенциалу обновления, образованию эмбрионального тела, образованию тератомы. Образование тератомы является основной угрозой безопасности в клеточной терапии. Однако отсутствие экспрессии Nanog в ядре является принципиальным маркером безопасности для определения того, подходит ли популяция стволовых клеток для системного введения. Отсутствие онкогенных свойств недифференцированных стволовых клеток in vivo требует отсутствия Nanog в ядре. Поэтому недифференцированные стволовые клетки, экспрессирующие неактивный Nanog, то есть Nanog, локализованный в цитоплазме, также не имеют онкогенных свойств in vivo.
Другим важным маркером безопасности для популяции стволовых клеток, подходящих для системного введения, является экспрессия р53. Этот белок имеет важнейшее значение для многоклеточных организмов, где он регулирует клеточный цикл и, таким образом, предотвращает рак, функционируя в роли супрессора опухолей.
Экспрессия белка ABCG2 также является маркером безопасности, который указывает, что популяция стволовых клеток подходит для системного введения. Экспрессия белка АТФ-связывающей кассеты (ABC), белка ABCG2 (BCRP) является важной детерминантой фенотипа популяции недифференцированных МСК. ABCG2 может служить маркером для недифференцированных стволовых клеток из разных источников, поскольку его экспрессия резко понижается с дифференцировкой. Примечательно, что транспортеры ABCG2 с болезнью Альцгеймера (БА) активно переносят Аβ, что подтверждено гистопатологически у пациентов с БА и в контрольной группе. В полногеномных исследованиях ассоциаций (Bertram L et al., 2007) были идентифицированы гены, модулирующие риск БА, включая генетические варианты в АВСА7, варианте гена ABC. Был сделан вывод, что увеличение экспрессии АВСА7 снижает риск БА, хотя увеличение экспрессии АВСА7 во время БА является недостаточным для блокирования прогрессирования заболевания (Jared В et al., 2014).
Поэтому некоторые варианты реализации фармацевтической композиции по изобретению содержат стволовые клетки из ткани, происходящей из нервного гребня, экспрессирующие по меньшей мере один маркер безопасности, выбранный из группы, состоящей из члена 2 подсемейства G АТР-связывающей кассеты (ABCG2), неактивного Nanog, р53 и SOX2. В некоторых аспектах этот по меньшей мере один маркер безопасности выбирают из группы, состоящей из члена 2 подсемейства G АТР-связывающей кассеты (ABCG2), неактивного Nanog и р53. IDPSC имеют высокую экспрессию ABCG2 и р53, но низкую экспрессию неактивного Nanog и SOX2. Например, когда по меньшей мере один маркер безопасности представляет собой ABCG2 или р53, по меньшей мере 75%, 80%, 85%, 90%, 95% или 98% стволовых клеток фармацевтической композиции экспрессируют данный по меньшей мере один маркер безопасности. С другой стороны, если этот по меньшей мере один маркер безопасности представляет собой неактивный Nanog или SOX2, не более 30%, 25%, 20%, 15%, 10%, 5% или 5% стволовых клеток экспрессируют данный по меньшей мере один маркер безопасности. В некоторых аспектах стволовые клетки фармацевтической композиции коэкспрессируют ABCG3, р53, неактивный Nanog и SOX2, причем по меньшей мере 75% стволовых клеток экспрессируют ABCG2, по меньшей мере 75% стволовых клеток экспрессируют р53, не более 5% стволовых клеток экспрессируют неактивный Nanog, и не более 30% стволовых клеток экспрессируют SOX2.
Другой вариант реализации фармацевтической композиции включает стволовые клетки из ткани, происходящей из нервного гребня, экспрессирующие по меньшей мере один маркер нейроэпителиальных стволовых клеток, выбранный из группы, состоящей из нейротрофического фактора мозга (BDNF), нейтротрофина-3 (NT3), нейтротрофина-4 (NT4), нейтротрофина-5 (NT5) и р75. В некоторых аспектах стволовые клетки имеют высокую экспрессию, по меньшей мере, одного маркера нейроэпителиальных стволовых клеток. Например, по меньшей мере 75%, 80%, 85% или 90% клеток экспрессируют по меньшей мере один маркер нейроэпителиальных стволовых клеток. В некоторых вариантах реализации стволовые клетки фармацевтической композиции коэкспрессируют BDNF, NT3, NT4, NT5 и р75.
В некоторых аспектах эти варианты реализации фармацевтической композиции включают стволовые клетки из ткани, происходящей из нервного гребня, которые являются отрицательными по HLA-DR. Стволовые клетки фармацевтической композиции также могут быть отрицательными по определенным маркерам МСК, выбранным из группы, состоящей из с-Мус, KLf-4 и REX-1. В предпочтительных вариантах реализации стволовые клетки фармацевтической композиции являются отрицательными по HLA-DR, с-Мус, KLf-4 и REX-1.
Различные варианты реализации фармацевтической композиции также могут быть объединены. Например, фармацевтическая композиция может содержать стволовые клетки из ткани, происходящей из нервного гребня, экспрессирующие по меньшей мере один маркер безопасности, выбранный из ABCG2, неактивного Nanog и р53, и дополнительно экспрессируют по меньшей мере один маркер нейроэпителиальных стволовых клеток, выбранный из группы, состоящей из BDNF, NT3, NT4, NT5 и р75. В качестве еще одного примера фармацевтическая композиция может содержать стволовые клетки из ткани, происходящей из нервного гребня, экспрессирующие по меньшей мере один маркер нейроэпителиальных стволовых клеток, выбранный из группы, состоящей из BDNF, NT3, NT4, NT5 и р75, при этом дополнительно экспрессирующие по меньшей мере один маркер безопасности, выбранный ABCG2, неактивного Nanog, р53 и SOX2.
Способы применения фармацевтических композиций
Настоящее изобретение относится к фармацевтическим композициям для лечения неврологических заболеваний и состояний, включающим системное введение субъекту фармацевтической композиции по изобретению. В некоторых вариантах реализации эти способы лечения неврологических заболеваний и состояний способствуют нейрогенезу и являются защитными в моделях нейродегенеративных заболеваний. В некоторых вариантах реализации системное введение популяции стволовых клеток, например в/в введение, приводит к непосредственной доставке клеток в мозг. В некоторых аспектах нейрогенез происходит благодаря тому, что популяция стволовых клеток самодифференцируется и/или стимулирует собственные стволовые клетки мигрировать и дифференцироваться. В некоторых аспектах нейрогенез предпочтительно является дофамин-ассоциированным.
В некоторых вариантах реализации этих способов неврологическое заболевание или состояние лечат стволовыми клетками, пересекающими гематоэнцефалический барьер (ГЭБ) и индуцирующими нейрогенез. В некоторых аспектах стволовые клетки после пересечения ГЭБ трансплантируют непосредственно в паренхиму головного мозга, включая стриатум. В некоторых вариантах реализации индуцированный нейрогенез является дофамин-ассоциированным. Например, дофамин-ассоциированный нейрогенез происходит благодаря самодифференцировке стволовых клеток или активации миграции и дифференцировки собственных стволовых клеток внешними стволовыми клетками. В некоторых аспектах массовый дофамин-ассоциированный нейрогенез происходит в субвентрикулярной зоне (СВЗ).
В некоторых вариантах реализации предлагаемые способы дополнительно включают измерение количества DA-рецептора у субъекта. В некоторых вариантах реализации измерение количества DA-рецептора у субъекта включает визуализацию субъекта для обнаружения DA-рецептора. В наиболее предпочтительных вариантах реализации способов нейрогенез опосредован дофаминовым рецептором D2, поэтому в некоторых вариантах реализации измеряемым DA-рецептором является рецептор D2.
В некоторых вариантах реализации способов фармацевтическая композиция обеспечивает нейропротекцию. Например, системная нейропротекция обеспечивается высоким базальным уровнем экспрессии нейротрофических и иммунопротекторных факторов и профилем высвобождения стволовых клеток из фармацевтической композиции. В некоторых аспектах эти стволовые клетки из фармацевтической композиции представляют собой IDPSC.
Неврологические заболевания и состояния включают, например, аутизм, шизофрению, эпилепсию, инсульт и ишемию, нейродегенеративное заболевание или состояние, двигательное расстройство или судорожное расстройство.
Нейродегенеративным заболеванием или состоянием может быть, например, болезнь Паркинсона, рассеянный склероз, боковой амиотрофический склероз (БАС), инсульт, аутоиммунный энцефаломиелит, диабетическая невропатия, глауком атозная нейропатия, болезнь Альцгеймера и болезнь Хантингтона. Двигательные расстройства включают, например, синдром Туретта, боковой амиотрофический склероз (БАС), прогрессирующий бульбарный паралич, спинальную мышечную атрофию (СМА), постполиомиелитный синдром (ППС). Судорожные расстройства включают, например, эпилепсию.
В некоторых вариантах реализации способы лечения неврологических заболеваний и состояний поддерживают естественный нейропротекторный механизм у пациентов с диагнозом ранней БХ. В других вариантах реализации способы лечения неврологических заболеваний и состояний восстанавливают утраченные DA-нейроны у пациентов с диагнозом БП.
Настоящее изобретение также относится к способам применения фармацевтической композиции в качестве профилактической терапии для субъектов, подверженных риску БХ.
В одном варианте реализации настоящее изобретение относится к фармацевтической композиции для системного введения субъекту для лечения неврологического состояния, которая содержит недифференцированные стволовые клетки из ткани, происходящей из нервного гребня, экспрессирующие по меньшей мере один маркер безопасности, выбранный из группы, состоящей из члена 2 подсемейства G АТР-связывающей кассеты (ABCG2), неактивного Nanog и р53. В некоторых аспектах неактивный Nanog представляет собой экспрессированный Nanog, локализующийся преимущественно в цитоплазме недифференцированной стволовой клетки. В другом аспекте по меньшей мере 75% недифференцированных стволовых клеток экспрессируют этот по меньшей мере один маркер, причем этот по меньшей мере один маркер представляет собой ABCG2 или р53. В еще одном аспекте не более 5% недифференцированных стволовых клеток экспрессируют этот по меньшей мере один маркер, причем этот по меньшей мере один биомаркер представляет собой Nanog.
В некоторых вариантах реализации недифференцированные стволовые клетки экспрессируют ABCG2, неактивный Nanog и р53. В одном аспекте по меньшей мере 75% недифференцированных стволовых клеток экспрессируют ABCG2, по меньшей мере, 75% недифференцированных стволовых клеток экспрессируют р53, и не более 5% недифференцированных стволовых клеток экспрессируют неактивный Nanog. В другом аспекте недифференцированные стволовые клетки дополнительно экспрессируют SOX2, и причем не более 30% недифференцированных стволовых клеток экспрессируют SOX2. В еще одном аспекте недифференцированные стволовые клетки дополнительно экспрессируют по меньшей мере один маркер нейроэпителиальных стволовых клеток, выбранный из группы, состоящей из нейротрофического фактора мозга (BDNF), нейтротрофина-3 (NT3), нейтротрофина-4 (NT4), нейтротрофина-5 (NT5) и р75.
В других вариантах реализации недифференцированные стволовые клетки экспрессируют BDNF, NT3, NT4, NT5 и р75. В одном варианте реализации настоящее изобретение относится к фармацевтической композиции для системного введения субъекту для лечения неврологического состояния, которая содержит недифференцированные стволовые клетки из ткани, происходящей из нервного гребня, экспрессирующие по меньшей мере один маркер нейроэпителиальных стволовых клеток, выбранный из группы, состоящей из BDNF, NT3, NT4, NT5 и р75.
В некоторых аспектах недифференцированные стволовые клетки экспрессируют BDNF, NT3, NT4, NT5 и р75. В других аспектах недифференцированные стволовые клетки дополнительно экспрессируют по меньшей мере один маркер безопасности, выбранный из группы, состоящей из ABCG2, неактивного Nanog, р53 и SOX2. В некоторых аспектах неактивный Nanog представляет собой экс премированный Nanog, локализующийся преимущественно в цитоплазме недифференцированной стволовой клетки.
В других вариантах реализации по меньшей мере 75% недифференцированных стволовых клеток экспрессируют по меньшей мере один маркер, причем этот по меньшей мере один маркер представляет собой ABCG2 или р53. В некоторых аспектах недифференцированные стволовые клетки являются отрицательными по HLA-DR. В одном варианте реализации ткань, происходящая из нервного гребня, представляет собой пульпу зуба. В других аспектах недифференцированные стволовые клетки из ткани, происходящей из нервного гребня являются незрелыми стволовыми клетками пульпы зуба (IDPSC).
В другом аспекте настоящее изобретение относится к способу лечения неврологического заболевания или состояния, включающему системное введение субъекту фармацевтической композиции, содержащей недифференцированные стволовые клетки из ткани, происходящей из нервного гребня, экспрессирующей по меньшей мере один маркер безопасности, выбранный из группы, состоящей из ABCG2, неактивного нестина и р53. В некоторых аспектах недифференцированные стволовые клетки фармацевтической композиции дополнительно экспрессируют по меньшей мере один маркер нейроэпителиальных стволовых клеток, выбранный из группы, состоящей из BDNF, NT3, NT4, NT5 и р75.
В еще одном варианте реализации настоящее изобретение относится к способу лечения неврологического заболевания или состояния, включающему системное введение субъекту фармацевтической композиции, содержащей недифференцированные стволовые клетки из ткани нервного гребня, экспрессирующей по меньшей мере один маркер нейроэпителиальных стволовых клеток, выбранный из группы, состоящей из BDNF, NT3, NT4, NT5 и р75.
В некоторых вариантах реализации недифференцированные стволовые клетки фармацевтической композиции дополнительно экспрессируют по меньшей мере один маркер безопасности, выбранный из группы, состоящей из ABCG2, неактивного нестина, р53 и SOX2.
В других аспектах эту фармацевтическую композицию вводят субъекту внутривенно. В некоторых вариантах реализации неврологическое заболевание или состояние лечат популяцией недифференцированных стволовых клеток, пересекающих гематоэнцефалический барьер и вызывающих нейрогенез. В одном аспекте неврологическое заболевание или состояние лечат недифференцированными стволовыми клетками, индуцирующими нейрогенез посредством дофамин-ассоциированного нейрогенеза. В другом аспекте дофамин-ассоциированный нейрогенез осуществляется посредством самодифференцировки недифференцированных стволовых клеток или активации миграции и дифференцировки собственных стволовых клеток недифференцированными стволовыми клетками.
В некоторых вариантах реализации недифференцированные стволовые клетки фармацевтической композиции обеспечивают нейротрофические факторы и иммунозащитные факторы. В других вариантах реализации недифференцированные стволовые клетки фармацевтической композиции обеспечивают системную нейропротекцию. В одном варианте реализации недифференцированные стволовые клетки являются аутологичными и/или аллогенными для субъекта.
В некоторых аспектах неврологическое заболевание или состояние представляет собой нейродегенеративное заболевание или состояние. Нейродегенеративное заболевание или состояние могут быть выбраны из группы, состоящей из болезни Паркинсона (БП), рассеянного склероза, бокового амиотрофического склероза (БАС), инсульта, аутоиммунного энцефаломиелита, диабетической невропатии, глаукоматозной невропатии, болезни Альцгеймера и болезни Хантингтона (БХ).
В некоторых аспектах способ включает в себя системное введение фармацевтической композиции субъекту, когда у этого субъекта диагностирована ранняя стадия БХ, для поддержки естественного нейропротекторного механизма у субъекта. В других аспектах способ включает системное введение фармацевтической композиции субъекту, когда у этого субъекта диагностирована БП, для восстановления утраченных дофаминергических нейронов у субъекта. В другом варианте реализации неврологическое заболевание или состояние выбрано из группы, состоящей из аутизма, шизофрении, инсульта и ишемии. В других вариантах реализации неврологическое заболевание или состояние выбрано из группы, состоящей из двигательного расстройства и судорожного расстройства.
В определенных аспектах субъекту назначают однократное введение фармацевтической композиции. В одном варианте реализации субъекту вводят одну внутривенную инъекцию фармацевтической композиции. В других вариантах реализации субъекту назначают первое и второе введение фармацевтической композиции.
В других вариантах реализации субъекту вводят первую и вторую внутривенную инъекцию фармацевтической композиции. В некоторых аспектах второе введение или внутривенная инъекция фармацевтической композиции выполняют по меньшей мере через 7 дней после первого введения или внутривенной инъекции.
В одном аспекте данный способ дополнительно включает измерение количества DA-рецептора у субъекта. В другом аспекте способ включает в себя измерение количества DA-рецептора у субъекта, включая визуализацию субъекта для обнаружения DA-рецептора. В одном аспекте DA-рецептор представляет собой рецептор D2.
Настоящее изобретение дополнительно иллюстрируется следующими примерами, которые не должны рассматриваться как ограничивающие. Содержание всех ссылок, патентов и опубликованных патентных заявок, приведенных во всей этой заявке, а также на фигурах, включено сюда посредством ссылки во всей их полноте для всех целей.
ПРИМЕРЫ
Пример 1. Исследование IDPSC ранних и поздних сборов и выделение нейрональных и глиальных клеток из IDPSC ранних и поздних сборов
Исследование IDPSC ранних и поздних сборов
Чтобы охарактеризовать свойства hIDPSC из ранних (n=8) и поздних (n=4) сборов (Таблица 1), выполняли проточный цитометрический анализ мезенхимальных маркеров CD13, CD105, CD73, CD90, CD44. Эксперименты FACS (метод анализа сортировки клеток с активированной флуоресценцией) проводили с использованием 2×105 клеток. Клетки дважды промывали ФБР (без кальция и магния), и добавляли маркерные антитела на 15 минут при комнатной температуре. Затем клетки дважды промывали холодным ФБР и анализировали проточным цитометром Becton-Dickinson. Для детектирования флуоресценции антител РЕ (FL2), FITC (FL1), АРС (FL4) использовали длины волн излучения 575 нм, 53 нм и 600 нм соответственно.
Клетки как раннего, так и позднего сбора экспрессировали высокие уровни мезенхимальных маркеров. Обе популяции были отрицательными по экспрессии антигена HLA-DR и HLA-ABC, что позволяет проводить аллогенную трансплантацию этих популяций клеток. Обе популяции были дважды иммуно положительными по маркерам мезенхимальных стволовых клеток, такие как CD13 и CD44 и другие, а также экспрессировали нестин, Р75 (CD271), маркеры нейроэпителиальных стволовых клеток и фактор роста нервов (NGF) (см. Фиг. 1 и 2A-2L и Таблицу 2), и были отрицательными по CD146 и HLA-ABC.
После многократного сбора ткани ПЗ и эксплантной культуры, IDPSC демонстрируют способность образовывать колонии (Фиг. 3). Анализ колониеобразующей активности (CFU-F) проводили в трех повторностях при Т20, Р3 с использованием 480 клеток, высеваемых в каждый планшет; на 8-й день появились многочисленные колонии, и на каждом планшете образовалось приблизительно 100 колоний (Фиг. 3). Способность к образованию колоний является одной из основных характеристик стволовых клеток. Поэтому мы заключаем, что эта способность была сохранена, когда клетки были получены с применением раскрытого способа многократного сбора ткани органа и способа эксплантации ткани. Кроме того, оценивали пролиферативную активность LP IDPSC, как показано на Фиг. 4, и эти клетки продемонстрировали очень высокую скорость пролиферации.
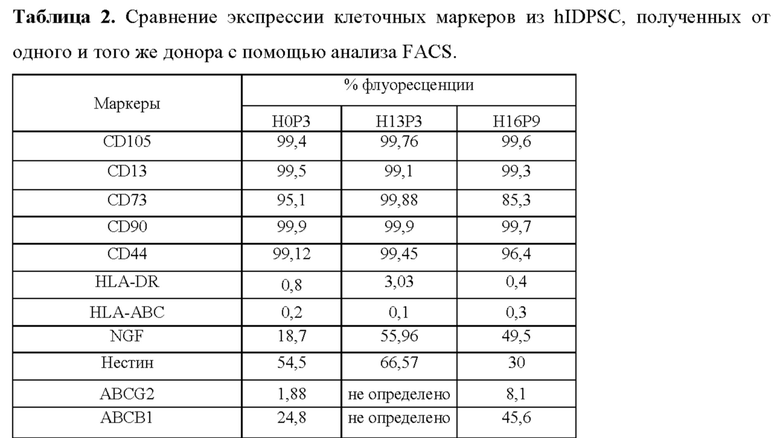
В Таблице 2 приведено сравнение экспрессии клеточных маркеров из разных сборов hIDPSC, полученных от одного и того же донора (т.е. Н0Р3 = первый сбор, Н13Р3 = более поздний сбор, Н16Р9 = последний сбор). В популяциях позднего сбора наблюдались более высокие уровни NGF, чем в популяциях раннего сбора. Также тестировали экспрессию в клетках транспортеров аденозинтрифосфат-связывающей кассеты (ABC). Транспортеры ABC участвуют в активном транспорте чрезвычайно разнообразного диапазона субстратов через биологические мембраны. Эти транспортеры обычно участвуют в развитии множественной лекарственной устойчивости, а также участвуют в многочисленных физиологических и гомеостатических процессах, включая транспорт липидов, миграцию и дифференцировку клеток. Кроме того, имеются свидетельства того, что транспортеры ABC служат фенотипическими маркерами и функциональными регуляторами стволовых клеток (Bunting 2002). Популяции как ранних, так и поздних сборов экспрессировали белок АВСВ1, продукт гена MDR1, но экспрессия была выше в позднем сборе. Согласно работе Islam et al. (2005), АВСВ1 экспрессируется в эмбриональных нервных стволовых /прогениторных клетках человека (hNSPCs).
Анализ FACS показывает, что LP IDPSC (партия №11) содержат приблизительно 80% клеток, которые экспрессируют BDNF и DARPP 32, тогда как ЕР IDPSC являются отрицательными по этим маркерам (данные не показаны), и очень малое количество клеток, которые экспрессируют D2 (Фиг. 3). Чтобы далее охарактеризовать ранний и поздний сбор hIDPSC, определяли общий уровень нейротрофического фактора мозга (BDNF), представленный количеством BNDF в среде, с использованием ИФА (Таблица 3). Уровни BDNF количественно определяли с использованием набора для определения человеческого BDNF, human BDNF Quantikine ELISA, в соответствии с протоколом производителя (R&D Systems, Миннеаполис, Миннесота). Клетки (1×106) из разных сборов инокулировали в 75 см см2 пластиковых колбах. Супернатанты собирали приблизительно через 4 дня после инокуляции. Результаты выражали в виде концентрации BDNF. BDNF секретировался во всех субпопуляциях клеток, но в поздних сборах уровни были в 4-10 раз выше.

Сравнение с другими МСК показывает, что hIDPSC секретируют гораздо больше BDNF.
Средний уровень BDNF, секретируемый 1×106 клетками hIDPSC, составляет 6589 пг, что во много раз выше, чем другие типы МСК, которые секретируют BNDF, такие как МСК из работы Gothelf et al. в 2014 году (Clin Transl Med., 2014, 3:21). Gothelf et al. стимулировали МСК, полученные из костного мозга (BM-MSC), дифференцироваться на клетки, секретирующие нейротрофический фактор (BM-MSC-NTF), путем инкубации BM-MSC в течение 72 часов в среде, содержащей 1 мМ дибутирил-циклического 15 АМФ (цАМФ), 20 нг/мл основного фактора роста фибробластов человека (hbFGF), 5 нг/мл тромбоцитарного фактора роста человека (PDGF-AA) и 50 нг/мл херегулина β1 человека. Хотя эта стимулирующая среда почти удвоила секрецию BDNF (827 пг BNDF/106 BM-MSC по сравнению с 1640 пг BNDF/106 BM-MSC-NTF клеток), hIDPSC все равно секретировали в четыре раза больше BDNF, чем BM-MSC-NTF. Соответственно, hIDSPC имеют гораздо больший нейропротекторный потенциал, чем полученные из костного мозга МСК, для секреции нейротрофических факторов.
Экспрессия Oct4, Nanog, Sox2 и р53
Известно, что МСК обычно экспрессируют плюрипотентные маркеры, такие как Oct4, Nanog и Sox2 на низких уровнях, как описано в литературе (Jiang et al., 2002; Guillot et al., 2007). Мы показали, что hIDPSC экспрессируют очень низкие уровни таких маркеров по сравнению с эмбриональными стволовыми клетками человека и даже индуцированными плюрипотентными стволовыми клетками, полученными из hIDPSC (см. Фиг. 5). Что еще более важно, мы продемонстрировали, что hIDPSC экспрессирует высокий уровень р53. Ген супрессора опухолей р53 хорошо известен как главный регулятор, помогающий сдерживать рак. Блокирование пути р53 значительно улучшает легкость и эффективность преобразования дифференцированных клеток в индуцированные плюрипотентные стволовые клетки (Dolgin, 2009).
Получение нейрональных и глиальных клеток из IDPSC ранних и поздних сборов
Нейрональная система состоит из двух классов нейральных клеток-предшественников: нейрональных NPC, которые дифференцируются в нейроны, и глиальных NPC, которые дифференцируются в глии. И нейрональные, и глиальные NPC происходят от одного и того же нейроэктодермального предшественника. Также был предложен третий класс клеток нервных предшественников, нейроглиобласты. Этот третий класс клеток включает в себя радиальные глиальные клетки, которые также могут выступать в роли предшественников нейронов, и только позже, после нейрогенеза, они смещаются в сторону исключительной генерации астроцитов.
Способность различить, является ли популяция клеток в клеточной терапии нейрональными NPS или глиальными NPC, имеет чрезвычайно важное значение для разработки эффективной стратегии клеточной терапии для лечения нейродегенеративных заболеваний, которые в основном связаны с повреждением или утратой как глии, так и нейронов. Протестировать известные популяции клеток на их потенциал дифференцироваться в нейроны или глии можно заставляя эти клетки дифференцироваться.
Способность ЕР (ранняя популяция) и LP (поздняя популяция) IDPSC продуцировать нейроны и глии тестировали путем стимуляции дифференцировки нейронов в ЕР и LP IDPSC в ранних (Р2) и поздних пассажах (Р7) в соответствии с ранее описанным протоколом (Kerkis et al., 2006) (Фиг. 6). Через 7 дней клетки собирали и анализировали с помощью проточной цитометрии с использованием GFAP (глиофибриллярного кислого белка) и бета-III-тубулиновых антител, соответственно. Наблюдается существенное различие в количестве клеток, экспрессирующих эти маркеры, между клетками ЕР (В-Е, слева) и LP (В-Е, справа), полученными согласно протоколу сбора пульпы зуба (ПЗ). С другой стороны, не было обнаружено существенной разницы в экспрессии обоих белков между различными пассажами (Р2 и Р7), полученными после ферментативного расщепления (Фиг. 6). Удивительно, но IDPSC могут представлять собой нейрональные и глиальные NPC. Ранний сбор ПЗ (ЕР IDPSC) позволяет выделить нервные прогениторные клетки, стремящиеся главным образом к глиальной дифференцировке, в то время как поздний сбор ПЗ (LP IDPSC) приводит к выделению нервных прогениторных клеток, стремящихся главным образом к нейрональной дифференцировке.
Таким образом, момент сбора ПЗ важен для создания популяции NPC, способной развиваться в нейроны или глии. SHED, которые являются стволовыми клетками из человеческих молочных зубов, не могут быть отнесены к категории ранних популяций или поздних популяций, поскольку они представляют собой стволовые клетки, выделенные из клеток пульпы зуба без сбора ПЗ. Единственная популяция SHED содержит нейрональные, а не глиальные предшественники. В работе Miura et al. (2003) нейрональная дифференцировка SHED приводила к увеличению экспрессии β-III-тубулина, GAD и NeuN, тогда как экспрессия нестина, GFAP, CNPase и NFM оставалась неизменной после индукции дифференцировки (см. Рис. 4I из работы Miura).
Пример 2. Экспрессия CD146 и CD13 в hIDPSC ранней фазы (ЕР) и поздней фазы (LP)
Экспрессию CD146 и CD13 анализировали с помощью проточной цитометрии в EP-hIDPSC и LP-hIDPSC. Результаты на Фиг. 7 показывают, что CD13 был экспрессирован в 52% EP-hIDPSC и в 95% LP-hIDPSC. Эти результаты свидетельствуют о том, что сбор ПЗ in vitro и пассирование hIDPSC производят увеличенные количества hIDPSC, экспрессирующих CD13, и лишенных экспрессии CD146.
Пример 3. Сравнение IDPSC и SHED
МСК из разных источников (например, костного мозга и жировой ткани) могут по-разному реагировать на разные стимулы (Fraser JK et al., 2006). Условия культивирования (например, среда с добавлением либо сыворотки крови человека, либо эмбриональной телячьей сыворотки (FCS), либо без сыворотки) также могут влиять на потенциал дифференцировки даже МСК одного и того же происхождения (Lindroos et al., 2011; Lizier et al., 2012). Весьма вероятно, что различия в эффективности дифференцировки в высокой степени отражают гетерогенность популяций МСК (т.е. наличие различающихся субпопуляций) (Но et al., 2008; Tormin et al., 2009; Mareddy et al., 2009; Rada et al., 2011). Различные протоколы выделения и культивирования, используемые различными группами исследователей, могут объяснять преобладание определенной субпопуляции МСК с отличающимся потенциалом дифференцировки [Но et al., 2008; Pevsner-Fischer et al., 2011; Rada et al., 2011).
Для SHED и IDPSC имеются различные методы выделения, и они происходят из разных ниш стволовых клеток. Поэтому неудивительно, что SHED и IPSC также показывают различную экспрессию маркеров стволовых клеток (см. Таблицу 4). SHED происходил из периваскулярной среды, и иммуногистохимическим окрашиванием было обнаружено, что клетки, положительные по STRO-1 и CD146 расположены вокруг кровеносных сосудов остаточной пульпы. Только незначительная доля (9%) размноженных ex vivo SHED дали положительный результат на антитело STRO-1 при анализе FACS.
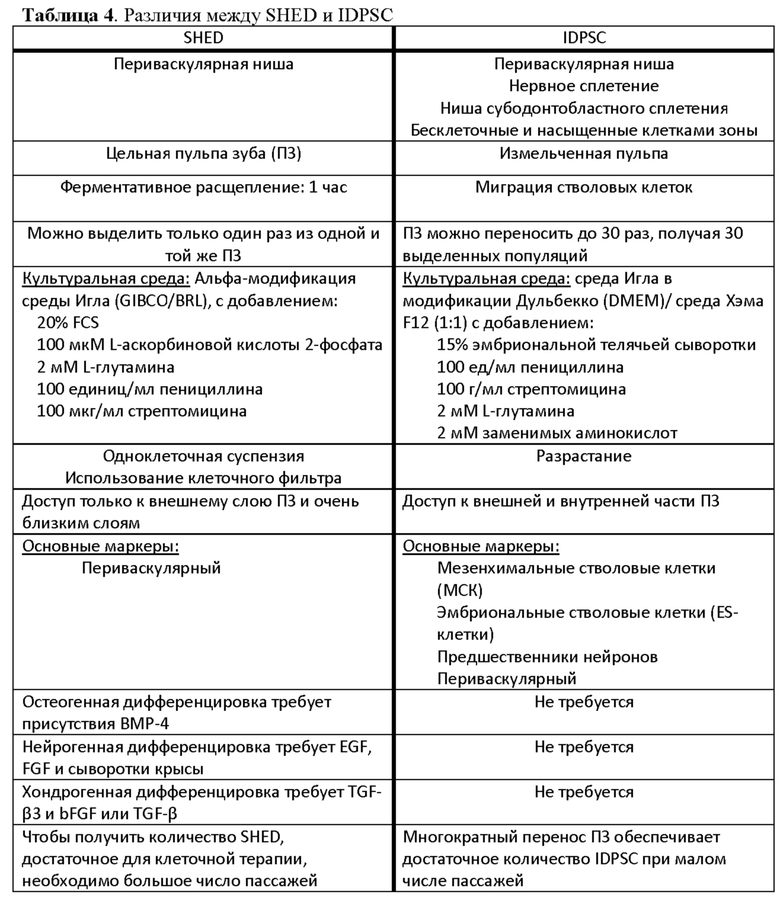
Требования для стимуляции дифференцировки SHED и IDPSC также являются различными. Например, чтобы индуцировать дифференцировку в нейроны, клеткам SHED необходима среда, содержащая EGF 20 нг/мл (BD Bioscience), FGF 40 нг/мл (BD Bioscience) и 3% сыворотку крыс. Им нужно четыре недели в нейронально-стимулирующей культуре, чтобы показать нейрональную морфологию и увеличить экспрессию нейрональных маркеров.
Отчасти из-за этих различий, IDPSC имеют преимущества перед SHED в отношении нейрогенеза. В одном исследовании SHED вводили в зубчатую извилину гиппокампа мышей со сниженной иммунной реакцией. Полученные данные показали, что SHED удалось выживать в мышином гиппокампа более 10 дней и экспрессировать NFM, который экспрессируют также недифференцированные SHED (Miura et al., 2003). В другом исследовании предварительно дифференцированные SHED (SHED-производные сферы, созданные с помощью комбинации EGF и bFGF в течение 7 дней in vitro) трансплантировали крысам с паркинсонизмом. Клеточную суспензию (200000/мкл) вводили в 2 участка стриатума, обедненного DA, у крыс (2,5 мкл на участок). Наблюдалась умеренная дифференцировка в DA-нейроны (Wang et al, 2010). В третьем исследовании SHED вводили в поврежденный мозг мышей на 5-й день постнатального периода, у которых повреждения были вызваны перинатальной гипоксией-ишемией (HI), дающей высокие показатели неврологического дефицита и смертности. Для защиты привитых клеток от иммунного ответа ксеногенного хозяина применяли циклоспорин А, тем не менее через восемь недель после трансплантации привитые SHED практически не содержали клеток, дифференцированных в нейроны, олигодендроциты или астроциты (Yamagata et al. 2013).
Все эти три эксперимента объединяет то, что SHED вводили вместе с циклоспорином А. Показано, что циклоспорин А уменьшает размер ишемического инфаркта головного мозга у крыс и защищает от синаптической дисфункции и гибели клеток в моделях травматического инфаркта головного мозга у грызунов, а такжен защищает стриарные нейроны от митохондриальной дисфункции при болезни Хантингтона (Matsomoto et al., 1999; Albensi et al., 2000; Leventhal et al., 2003). Таким образом, терапевтический эффект, наблюдаемый у крыс с паркинсонизмом и HI, не может быть отнесен исключительно к SHED, но также к воздействию циклоспорина А.
Пример 4. Сравнение с другими терапевтическими стволовыми клетками для лечения неврологических состояний
Как показано в Таблице 5, hIDPSC, произведенные Avita International LTD, имеют преимущество по сравнению с другими терапевтическими стволовыми клетками, представленными на рынке или использованными в клинических испытаниях. Клетки hIDPSC производства Avita International LTD имеют хороший профиль безопасности с низким риском иммуногенности и низкую стоимость получения, так как они допускают криоконсервацию.
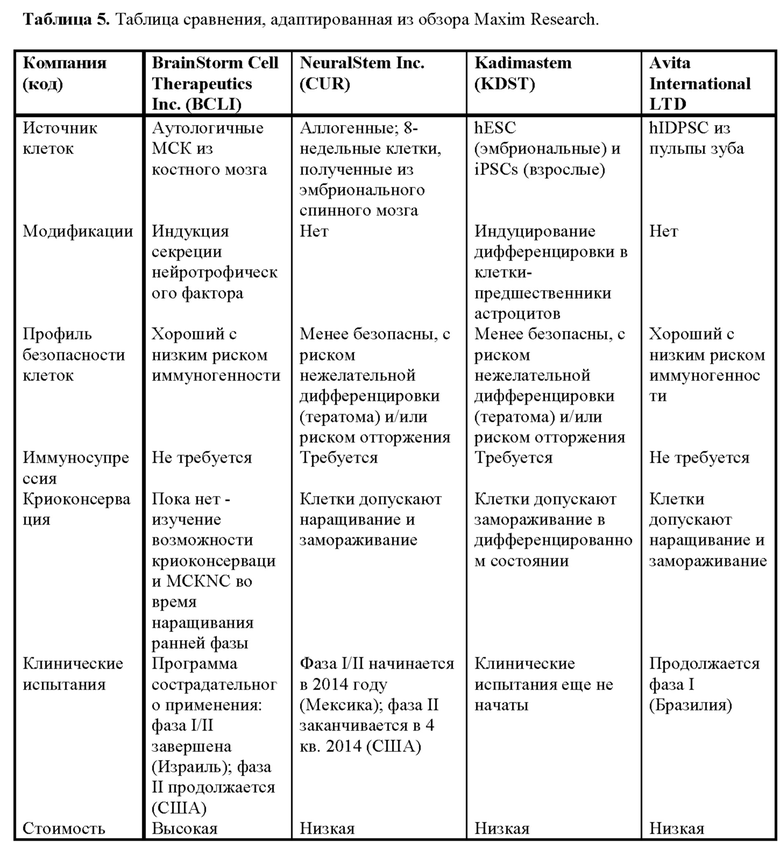
Пример 5. Сертификат анализа IDPSC (Cellavita), используемых для стерильной в/в инъекции
Сертификат анализа (Таблица 6) типичной партии IDPSC, использованных для в/в инъекций на животных моделях, подтверждает результаты исследования IDPSC.
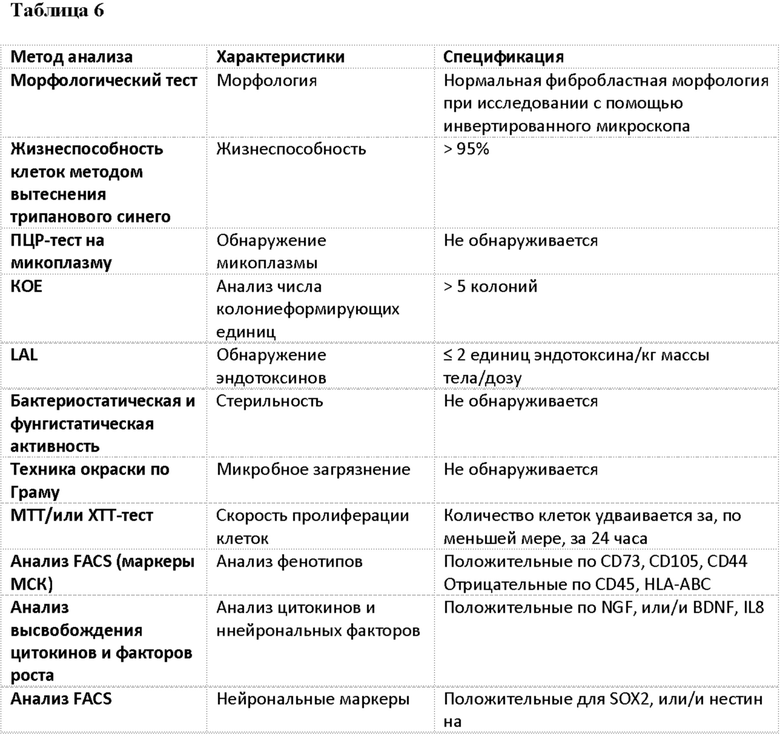
Пример 6. Выявление параметров для безопасного системного введения терапевтических стволовых клеток
IDPSC демонстрируют ядерную локализацию Oct4 (Фиг. 8А-В). Хотя большинство IDPSC содержат Nanog в цитоплазме клеток (Фиг. 8C-D), очень редкие клетки также демонстрируют ядерную локализацию. Внутриклеточная локализация Sox2 в IDPSC в основном является ядерной (Фиг. 8E-G), хотя в некоторых клетках также может проявляться цитоплазматическая локализация. Интересно отметить, что мы наблюдаем симметричное деление (Фиг. 8D-F), когда экспрессия Nanog и Sox2 фиксируется в обеих дочерних клетках, и наблюдаем асимметричное деление, когда после деления дочерние клетки не экспрессируют эти маркеры или утрачивают характеристики стволовых клеток и становятся менее потентной прогениторной или дифференцированной клеткой (Фиг. 8E-F).
Наши данные показывают, что в отличие от плюрипотентных стволовых клеток IDPSC классифицируются как МСК или как взрослые стволовые клетки. Внутриклеточная локализация Nanog указывает на то, что этот белок в основном неактивен. Это является резким отличием между плюрипотентными стволовыми клетками и взрослыми стволовыми клетками, которые экспрессируют маркеры плюрипотентных стволовых клеток. Эти клетки более незрелые, чем классические МСК, и могут дифференцироваться в более широкий спектр зрелых клеток, но они не способны образовывать тератому из-за неактивного состояния Nanog. Наши данные о симметричном и асимметричном делении наглядно демонстрируют, что эти клетки имитируют асимметричное деление нервных стволовых клеток (Фиг. 9).
Образование тератом является важным критерием при определении плюрипотентности любых плюрипотентных клеток, таких как эмбриональные или индуцированные плюрипотентные стволовые клетки (ES- и iPS-клетки). В наших исследованиях был установлен и использован единообразный протокол оценки способности клеток к образованию тератом, аналогичный протоколу, опубликованному недавно в работе Gropp et al., 2012. Наши и недавно опубликованные методы основаны на подкожной котрансплантации определенных количеств недифференцированных мышиных или человеческих ES- и iPS-клеток и Матригеля иммунодефицитным мышам. Было показано, что наш способ является в высокой степени воспроизводимым и эффективным при использовании 106 (в отличие от работы Gropp et al., 2012, где использовали 105 клеток) мышиных ES-клеток и человеческих iPS-клеток. В 100% случаев мы наблюдали образование тератомы у большого числа животных и при длительном наблюдении (до 6 месяцев). Мы также использовали эти способы для анализа биологической безопасности других взрослых МСК, таких как полученные из пульпы зуба молочных зубов, пуповины и жировой ткани.
Основной критерий для анализа на образование тератом
Мы оценили следующий критерий для анализа на образование тератом: чувствительность и количественность; окончательное число клеток и получение суспензии одиночных клеток; иммунофенотипирование исследуемой клетки в отношении экспрессии по маркерам плюрипотентных клеток и кариотипу; котрансплантация исследуемых клеток вместе с Матригелем. Клетки трансплантировали подкожно (п/к) мышам линии NOD/SCID, что позволяет осуществлять простой мониторинг развития тератом.
Развитие опухолей отслеживали начиная с 4 месяцев (~16 недель). Гистологические критерии для тератом включают дифференцировку плюрипотентных клеток в клетки-производные трех зародышевых слоев. Такое исследование обычно проводил патологоанатом.
Для взрослых/мезенхимальных стволовых клеток учитывали любые изменения любого типа в целостности нормальной ткани в месте инъекции клеток.
Применение критерия образования тератом
А. ЭКСПЕРИМЕНТАЛЬНАЯ СИСТЕМА(Ы):
a. Эмбриональные стволовые клетки мыши
b. Фибробласты мыши 3Т3, перманентная клеточная линия мышей Balbc 3Т3, клон А31
c. iPS-IDPSC человека
d. ES-клетки человека
e. IDPSC человека
Мы использовали вышеупомянутый способ в различных исследованиях для исследования плюрипотентности различных клеточных линий эмбриональных стволовый мыши, созданных нами, а также подтверждения плюрипотентности ES-клеток при большом числе пассажей, 25 или более, и для исследования субклонов, полученных из клеточных линий мыши ES (Sukoyan et al., 2002; Carta et al., 2006; Kerkis et al., 2007; Lavagnolli et al., 2007; Hayshi et al., 2010).
Кроме того, этот способ был использован для исследования плюрипотентности iPS-клеток, полученных из незрелых стволовых клеток пульпы зуба (IDPSC) в недавней публикации нашей группы ( et al., 2011). В этой публикации IDPSC человека использовали в качестве контроля для iPS-IDPSC. Мы показали, что iPS-IDPSC формировали типичные тератомы с тканями, возникшими из всех трех зародышевых слоев, тогда как hIDPSC не были способны продуцировать какие-либо типы тератом или любые другие типы новообразований. Кроме того, iPS-IDPSC экспрессировали Nanog в ядре, a hIDPSC не экспрессировали его.
et al., 2011). В этой публикации IDPSC человека использовали в качестве контроля для iPS-IDPSC. Мы показали, что iPS-IDPSC формировали типичные тератомы с тканями, возникшими из всех трех зародышевых слоев, тогда как hIDPSC не были способны продуцировать какие-либо типы тератом или любые другие типы новообразований. Кроме того, iPS-IDPSC экспрессировали Nanog в ядре, a hIDPSC не экспрессировали его.
РЕЗУЛЬТАТЫ
Раскрытая эксплантоподобная культура клеток из нескольких сборов, используемая для выделения популяции незрелых стволовых клеток пульпы зуба (IDPSC), вызывает экспрессию маркеров эмбриональных стволовых клеток Oct-4, Nanog, SSEA-3, SSEA-4, TRA-1-60 и TRA-1-81, а также нескольких маркеров мезенхимальных стволовых клеток в течение по меньшей мере 15 пассажей при сохранении нормального кариотипа и скорости размножения, характерных для стволовых клеток. Экспрессия этих маркеров сохранялась в субклонах, полученных из этих клеток. Более того, in vitro эти клетки можно заставить единообразно дифференцироваться в гладкие и скелетные мышцы, нейроны, хрящ и кость в условиях культуры с химически определенным составом. Важно отметить, что IDPSC, хотя и имеют небольшой размер и цитоплазму, бедную клеточными органеллами, отличаются от интактных плюрипотентных клеток, презентирующих типичную мезенхимально-фибробласто подобную морфологию. Поэтому IDPSC являются клетками мезенхимального типа, в отличие от ES и iPS-клеток, которые являются клетками эпителиального типа (Фиг. 8). Принципиальная разница между МСК и ES или iPS-клетками заключается в том, что МСК мигрируют и прикрепляются к пластику, они синтезируют внеклеточный матрикс и лишены межклеточных контактов.
В. ЭКСПЕРИМЕНТАЛЬНЫЕ СИСТЕМЫ:
a. три разных первичных культуры IDPSC на уровне ранних (n=10) и поздних пассажей (n=10)
b. первичный фибробласт человека
Кроме того, этот способ был валидирован с использованием фетальных стволовых клеток собак из костного мозга, печени, желточного мешка, аллантоиса и амниотической жидкости, которые также экспрессируют плюрипотентные маркеры.
IDPSC состоят из популяции МСК с вариативным числом стволовых клеток, экспрессирующих плюрипотентные маркеры (1-25% клеток) (Lizier et al., 2012). Эти клетки трансплантировали мышам NOD/SCID (n=20), и отслеживали развитие опухолей начиная с 4 месяцев (~ 16 недель). Учитывали любые типы изменения нормальной целостности тканей в месте инъекции клеток. Этот протокол адаптировали для популяции IDPSC, особенно в отношении используемого количества клеток, которое рассчитывали исходя из того, что 20% IDPSC экспрессируют плюрипотентные маркеры. В наших предыдущих тестах с ES- и iPS-клетками мы использовали 106 клеток, тогда как для тестирования тератогенности IDPSC и контрольных клеток использовали 5×106 клеток. Через 4 месяца, даже если макроскопически опухоли не наблюдались, мышей умерщвляли, получали замороженные срезы из различных органов, таких как мозг, легкие, почки, селезенка, печень, и анализировали их с помощью патологоанатома.
Хотя присутствие ДНК IDPSC было обнаружено во всех изученных органах, образования опухолей или каких-либо морфологических изменений выявлено не было.
Пример 7. Определение параметров для эффективного системного введения терапевтических стволовых клеток
Условия клеточной культуры для создания надлежащей популяции стволовых клеток.
Условия культивирования, такие как культуральная среда и адгезивная поверхность, могут влиять на экспрессию генов клеток. Такие гены включают ABCG2 и виментин, которые представляют собой два гена, способные указывать на пригодность клеток в культуре для терапевтического применения, в частности клеточных систем для системного введения, как в настоящем изобретении. Наиболее подходящей культуральной средой из протестированных является базальная среда DMEM/F12, с добавлением 5-10-15% FBS, антибиотиков и глутамата, и клетки следует культивировать без адгезионного слоя (например, без внеклеточного матрикса (ЕСМ) или каркаса), так чтобы клетки прикреплялись непосредственно к чашке для культивирования или гранулам пластика. Клетки, которые были выращены в условиях среды для роста эпителия, превращаются в эпителиально-подобные клетки. Использование различных сред без чужеродных компонентов (xeno-free) потребует добавления факторов роста, и при масштабирования для перехода от существующих клеток к условиям трехмерной культуры может быть полезно выбрать подходящее покрытие ВКМ, включая биореакторы, такие как биореактор с холофайбером Terumo, биореакторы Eppendorf-New Brunswick с гранулами и т.д. Связь экспрессии ABCG2 со статусом недифференцировки клеток показана на Фиг. 10 и 11, где продемонстрировано, что если ABCG2 не экспрессируется из-за измененной культуральной среды или слоя покрытия, то клетки имеют явно более похожую на фибробласты или эпителиальные клетки морфологию. Еще одно неожиданное открытие заключалось в том, что типичная среда, обычно используемая в предшествующем уровне техники для поддержания или индукции эмбриональных стволовых клеток, а именно среда Игла, модифицированная по Дульбекко (DMEM), с добавлением бессывороточной среды KnockOut Serum Replacement KOSR (KSFM), не благоприятна для создания или поддержания плюрипотентных клеток, полученных из hDPSC. Как показано на Фиг. 11, использование этой среды с фибронектинсодержащим каркасом/покрытием ЕСМ-матриксом или каркасом и без них приводило к дифференцировке hIDPSC в фибробластоподобные (Фиг. 11) или эпителиально-подобные клетки. Было обнаружено, что в отличие от использования одной среды Игла, модифицированной по Дульбекко (DMEM), среда Игла, модифицированная по Дульбекко (DMEM) или нейробазальная среда (NB), если в к ней добавлен В27 и, необязательно, добавлен FGF и/или EGF, приводит к образованию нейроно-подобных линий. Иллюстративные протоколы для дифференцировки в клетки нейральных линий также были ранее описаны в предшествующих патентных заявках, например, в международной заявке №. PCT/IB14/59850 и в заявке на патент США №14/2140016.
Дифференцировка на клетки роговицы
МАТЕРИАЛ И МЕТОДЫ
Деэпителизация амниотической мембраны в качестве потенциального фибронектинсодержащего каркаса для клеточной культуры hIDPSC
Амниотическую мембрану (AM) получали из донорской плаценты и хранили при -8°С (Covre JL at al 2011). Перед использованием AM, ее размораживали при комнатной температуре и три раза промывали в ФБР. Затем AM извлекали из нитроцеллюлозной мембраны и снова промывали. Чтобы удалить эпителий, AM инкубировали с ЭДТА в течение двух часов. Затем эпителий удаляли механически. После удаления эпителия AM становится прозрачной. Полностью прозрачную AM переносили на специальных пластинках (Covre JL at al 2011 and Melo GB at al 2007).
Культура IDPSC
IDPSC человека (2n=46, XX) были выделены из пульпы зуба молочных зубов и охарактеризованы ранее (Kerkis et al., 2006.). hIDPSC содержали в среде Игла, модифицированной по Дульбекко (DMEM)/ среда Хэма F12 (1:1, Invitrogen, Карлсбад, Калифорния), с добавлением 15% эмбриональной телячей сыворотки (FBS, Hyclone, Логан, Юта), 100 единиц/мл пенициллина (Gibco, Гранд-Айленд, Нью-Йорк), 100 мкг/мл стрептомицина (Gibco), 2 мМ L-глутамина (Gibco) и 2 мМ заменимых аминокислот (Gibco). Культуральную среду ежедневно меняли, а клетки заменяли каждые 3 дня. После того, как они достигали 80% конфлюентности, их дважды промывали в стерильном фосфатно-солевом буферном растворе (ФБР, Gibco, 0,01 М, рН 7,4), ферментативно обрабатывали 0,25% трипсином/ЭДТА (Invitrogen) и высевали на предварительно подготовленную амниотическую мембрану,.
Культуральные среды
Чтобы выбрать лучшие культуральные среды для культивирования IDPSC на AM, мы протестировали следующие культуральные среды: А) Первой была эпителиальная среда с добавлением гормона (SHEM), комбинация среды Игла, модифицированной по Дульбекко/питательной смеси Хэма F-12, (DMEM/F12, Invitrogen, Gibco Cell Culture, Портленд, Орегон, 1:1), содержащая 1,05 мМ кальция, с добавлением 5 мкг/мл кристаллического бычьего инсулина (Sigma Aldrich, Сент-Луис, Миссури), 30 нг/мл токсина холеры (Calbiochem, Сан-Диего, Калифорния), 2 нг/мл эпидермального фактора роста (EGF, R&D Systems, Inc., Миннеаполис, Миннесота), 0,5% диметилсульфоксида (ДМСО, Sigma Aldrich), 0,5 мкг/мл гидрокортизона, 5 нг/мл селенита натрия и 5 мкг/мл апотрансферрина и с добавлением 10% эмбриональной телячьей сыворотки (FBS). Все реагенты были получены от Invitrogen Corporation (Гранд-Айленд, Нью-Йорк), за исключением указанных в тексте. В) Второй была кератиноцитарная бессывороточная среда (KSFM), содержащая 0,09 мМ кальция, с добавлением 30 мг/мл экстракта гипофиза быка, 0,2 нг/мл EGF, 10% FBS и ампициллина/стрептомицина. С) Третьей была среда Epilife (Cascade Biologies, Портленд, Орегон), содержащая 0,06 мМ кальция, с добавлением 1% "ростовой добавки для роговицы человека" (Cascade Biologies), содержащей 0,2% экстракта гипофиза быка, 5 г/мл бычьего инсулина, 0,18 мг/мл гидрокортизона, 5 мкг/мл бычьего трансферрина, 0,2 нг/мл EGF, с добавлением 1% пенициллина G натрия (пенициллин G натрия 10000 г/мл, стрептомицина сульфат 25 мг/мл, амфотерицин В в 0,85% NaCl) и 5% FBS. D) Среда KnockOut Media.
Антитела
Мышиные античеловеческие моноклональные антитела: ABCG2 (Chemicon) и цитоплазматические/ядерные моноклональные антитела: мышиный антицитокератин 3/12 (K3/12) (RDI, Фландерс, Нью-Джерси, США), реагирует с клетками человека и кролика. Мышиные античеловеческие антитела IDPSC получали, как описано ранее (Kerkis et al., 2006), и успешно использовали в предыдущих исследованиях (Fonseca et al., 2009; Monteiro et al., 2009).
Иммунофлуоресцентное окрашивание
Клетки выращивали на стеклянных покровных стеклах до 70% конфлюентности, а также на AM, промывали в ФБР (Gibco) и фиксировали в течение ночи 4% параформальдегидом (Sigma). Покровные стекла трижды промывали трис-солевым буферным раствором (TBS), содержащим 20 мМ трис-HCl, рН 7,4 (Vetec, Дуки-ди-Кашиас, Рио-де-Жанейро, Бразилия), 0,15 М NaCl ( Reagent, Сан-Паулу, Сан-Паулу, Бразилия) и 0,05% Tween-20 (Sigma). Пермеабилизацию проводили с использованием 0,1% Triton Х-100 в течение 15 мин (Santa Cruz Biotechnology). Клетки промывали три раза и инкубировали в течение 30 мин в 5% бычьего сывороточного альбумина (Sigma) в ФБР с рН 7,4 (Gibco). Добавляли первичные антитела на 1 час на каждое покровное стекло при различных разведениях (ABCG2 и K3/12 (1:100) и анти-hIDPSC (1:1000)), и затем инкубировали при комнатной температуре. После промывки в TBS (три раза) клетки инкубировали в темноте в течение 1 часа со вторичным конъюгированным с антимышиным антителом флюоресцеином изотиоцианатом (FITC) при разведении 1:500. Покровные стекла для микроскопа монтировали в растворе среды для предотвращения выгорания флуоресценции (заливочная среда Vectashield, Vector Laboratories, Геркулес, Калифорния, США) с 4',6-диамидино-2-фенилиндолом (DAPI) и анализировали с помощью конфокального микроскопа. Контрольные препараты инкубировали с ФБР вместо первичного антитела с последующей промывкой и инкубацией с соответствующим вторичным антителом. Все эксперименты выполняли в трех повторностях.
Reagent, Сан-Паулу, Сан-Паулу, Бразилия) и 0,05% Tween-20 (Sigma). Пермеабилизацию проводили с использованием 0,1% Triton Х-100 в течение 15 мин (Santa Cruz Biotechnology). Клетки промывали три раза и инкубировали в течение 30 мин в 5% бычьего сывороточного альбумина (Sigma) в ФБР с рН 7,4 (Gibco). Добавляли первичные антитела на 1 час на каждое покровное стекло при различных разведениях (ABCG2 и K3/12 (1:100) и анти-hIDPSC (1:1000)), и затем инкубировали при комнатной температуре. После промывки в TBS (три раза) клетки инкубировали в темноте в течение 1 часа со вторичным конъюгированным с антимышиным антителом флюоресцеином изотиоцианатом (FITC) при разведении 1:500. Покровные стекла для микроскопа монтировали в растворе среды для предотвращения выгорания флуоресценции (заливочная среда Vectashield, Vector Laboratories, Геркулес, Калифорния, США) с 4',6-диамидино-2-фенилиндолом (DAPI) и анализировали с помощью конфокального микроскопа. Контрольные препараты инкубировали с ФБР вместо первичного антитела с последующей промывкой и инкубацией с соответствующим вторичным антителом. Все эксперименты выполняли в трех повторностях.
РЕЗУЛЬТАТЫ
Экспрессия недифференцированных LSC и дифференцированных белков клеток роговицы в IDPSC, которые выращивали в разных культуральных средах на субстрате из пластика
Был проанализирован профиль экспрессии белка ABCG2 (член 2 подсемейства G АТР-связывающей кассеты), который обычно используют для исследования LSC, и СКЗ (цитокератин 3) и цитокератина 12, который кодирует цепь промежуточных филаментов типа I, и оба экспрессируются в эпителии роговицы. На Фиг. 12 показано, что IDPSC проявляют дифференциальный ответ в отношении экспрессии изученных белков при культивировании в различных культуральных средах в течение 7 дней. IDPSC, выращенные на пластиковых поверхностях, не экспрессировали ABCG2 при культивировании в средах SHEM, KSFM, Epilife и DMEM/KO (Фиг. 10 А1-А4); IDPSC экспрессировали этот белок только при культивировании в базальной культуральной среде (Фиг. 10 А5). Интересно отметить, что IDPSC, культивируемые в SHEM и DMEM/KO, через семь дней изменили свою фибробласт-подобную морфологию (Фиг. 10 А5) на эпителиально-подобную (Фиг. 10 В2 и В4) и начали экспрессировать CK3/12, тогда как IDPSC, культивируемые в Epilife и KSFM и DMEM/F12, не начали экспрессировать K3/12 (Фиг. 10 В1, В3, В5).
Экспрессия маркеров недифференцированных LSC и маркера дифференцированных клеток, виментина, в IDPSC, выращенных в различных культуральных средах на AM
Затем экспрессию этих маркеров и дополнительно виментина проверяли в IDPSC, выращенных на AM в течение 7 дней (Фиг. 11). Среда Epilife была исключена из этого исследования из-за очень низкой выживаемости клеток (менее 50%), выращенных в этой среде и низкой адгезии клеток на AM в сочетании с Epilife. Экспрессия виментина наблюдалась во всех образцах (Фиг. 11А-A3), результат анализа на него был положительным в IDPSC, культивированных в DMEM/F12 и SHEM (Фиг. 11А и А2), и слабо положительным в IDPSC, культивированных в KSFM и DMEM/KO (Фиг. 11А2 и A3). Антитела к ABCG2 показали сильную иммуноположительность с IDPSC, культивированными в SHEM и DMEM/F12 (Фиг. 11В и В1), и отсутствие экспрессии ABCG2 в IDPSC, культивированных в KSFM (Фиг. 11 В2), а также слабую иммунореактивность с IDPSC, культивированными в DMEM/KO (Фиг. 11 В3). IDPSC не реагировали с IDPSC, культивированными в DMEM/F12 и KSFM (Фиг. 11С и С4), и проявляли очень слабую иммуноположительность с K3/12 при культивировании в SHEM и DMEM/KO (Фиг. 11 С1 и С3).
Пример 8. Доклинические исследования фармакологических свойств
На Фиг. 12 обобщены доклинические фармакологические исследования, направленные на изучение различных клинических применений исследуемого продукта Cellavita™ (Стволовые Клетки). Хотя многие из этих исследований были проведены для изучения фармакологической эффективности клеток по различным показаниям, все они демонстрируют профиль безопасности продукта, а также предлагаемого внутривенного введения.
Пример 9. Описание продукта и спецификации
В таблице 7 представлены спецификации Cellavita™ (Стволовые Клетки).
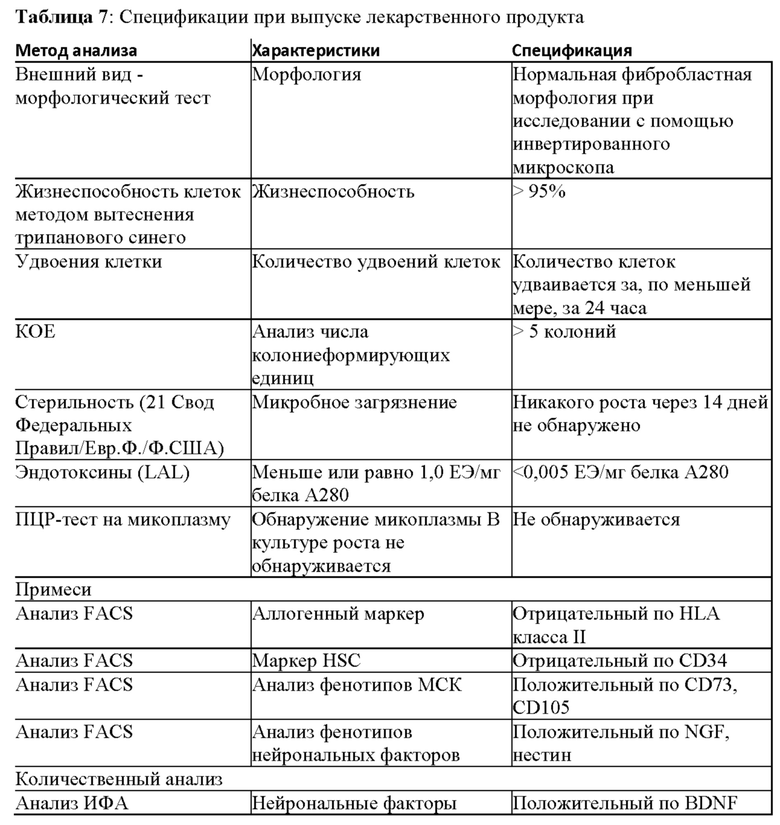
Аналитическая процедура
Контроль качества по безопасности - тест на микоплазму
Во время культивирования hIDPSC регулярно проводили тесты на микоплазму с помощью собственного фирменного теста ПЦР с обратной транскрипцией (EZ-PCR Biological Industries, Израиль) в соответствии с протоколом производителя.
Характеристики безопасности - анализ кариотипа
Для демонстрации стабильности кариотипа выполняли анализ кариотипа, и эти данные уже опубликованы (Kerkis et al., 2006;  , 2011; Lizier et al., 2012).
, 2011; Lizier et al., 2012).
Контроль качества по безопасности и идентичности - проточный цитометрический анализ клеточных поверхностных антигенов
Иммуноокрашивание маркеров клеточной поверхности проводили с помощью моноклональных антител против различных маркеров поверхностного антигена: HLA- DR-FITC, CD44-FITC, CD45-APC, CD105-PE, CD73-FITC, CD90-APC (eBioscience Калифорния, США), SOX2-РЕ, Nestin-PE, β-III Tubulin-APC, NGF-PE (R&D systems, Миннесота, США). Для экспериментов FACS использовали 2×105 клеток. Клетки дважды промывали ФБР (без Са и Mg) и суспендировали в 50 мкл ФБР. Затем клетки инкубировали с антителами в течение 15 мин при комнатной температуре. Клетки дважды промывали ФБР и анализировали проточным цитометром Becton-Dickinson. Флуоресценцию РЕ (FL2), FITC (FL1), АРС (FL4) детектировали на длинах волн 575 нм, 530 нм и 600 нм, соответственно.
Контроль качества с помощью биоанализа активности - анализ ИФА
Уровни BDNF количественно определяли с использованием набора для определения человеческого BDNF, human BDNF Quantikine ИФА в соответствии с протоколом производителя (R&D Systems, Миннесота, США).
Клетки (1×106) из разных сборов инокулировали в пластиковых колбах 75 см2.
Супернатанты собирали приблизительно через 4 дня после инокуляции. Результаты выражали в виде концентрации BDNF.
Анализ серии
В Таблице 8 приведен анализ партии номер 001H1-30/P1-5/F.
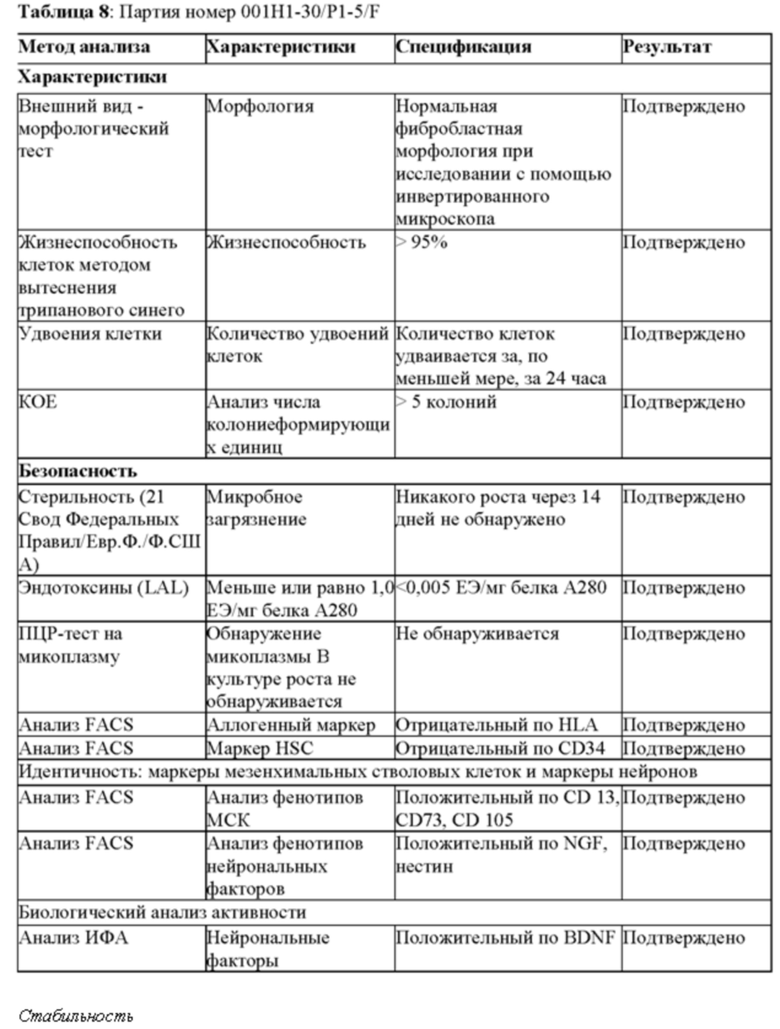
Стабильность
Компания Avita выполнила исследования, не соответствующие GMP и не соответствующие GLP, относительно стабильности hIDPSC. Для этой цели был создан единый главный банк клеток, который может минимизировать вариабельность конечной партии. Он состоял из 5 партий, каждая из которых происходила из пульпы зуба одного человека. Клетки получали, как описано на Фиг. 13. График исследований устойчивости hIDPSC представлены на Фиг. 14.
Была изучена экспрессия маркеров стволовых клеток, динамика пролиферации клеток и дифференцировочная способность hIDPSC, полученных из четырех партий до криоконсервации, а также миграция и биораспределение в разных органах после инъекции голым мышам. Тестирование продукта Cellavita™ (Стволовые Клетки) показало, что при стандартных условиях культивирования эти клетки в пассаже 6 из четырех независимых партий экспрессируют поверхностные маркеры мезенхимальных стволовых клеток (МСК), такие как CD105, CD73 и CD13. Тем не менее они не экспрессируют CD45, CD34, CD 14, CD43 и HLA-DR. Эти клетки смогли совершить спонтанную и индуцированную дифференцировку in vitro в остеобласты, адипоциты и хондробласты, мышечные клетки и в нейроны in vitro. После трансплантации в нормальных мышей эти клетки показали значительное приживление в печени, селезенке, головном мозге и почках, среди прочих органов.
Разработка программы стабильности
Прошлый опыт показал, что как исходный пул клеток (первичные клетки), так и его конечная смесь (после наращивания Р5 и смешивания всех переносов) являются стабильными при криоконсервировании при -192°С.
Пример 10. Эксперименты в моделях болезни Хантингтона на животных
Болезнь Хантингтона (БХ) как модель нейродегенерации.
Болезнь Хантингтона (БХ) представляет собой наследственную болезнь головного мозга, которая повреждает определенные клетки мозга. Заболевание повреждает некоторые нервные клетки в головном мозге, вызывая ухудшение и постепенную утрату функции этих областей мозга. Это может повлиять на движение, когнитивные функции (способность к восприятию, осознанию, мышлению, суждениям) и поведение. Наблюдаются типичные непроизвольные движения, называемые хореей, проявляющиеся в спонтанных и транзиторных сокращениях мышц. Этот симптом присутствует у более чем 90% пациентов с этим заболеванием. Со временем сознательные движения пациента становятся медленнее, и у него проявляются серьезные трудности в сохранении равновесия. Часто отмечаются затруднения в артикуляции (дизартрия) и проглатывании пищи (дисфагия). У пациента может также наблюдаться ригидность мышц, деменция и психические расстройства, такие как депрессия и бредовые идеи.
БХ и утрата нейронов.
БХ характеризуется прогрессирующей утратой срединных шипиковых нейронов, преимущественно ГАМКергических нейронов, в базальных ганглиях. Кроме того, БХ ассоциирована с тяжелой утратой стрпарных рецепторов D1 и D2, и следует учесть недавные сообщения, что дисрегуляция дофаминового рецептора D2 является чувствительным критерием количественной оценки патологии Хантингтона у модельных мышей (Crook et al., 2012; Chen et al., 2013). БХ становится наиболее выраженной в неостриатуме, обычно называемом просто стриатумом, также включающем хвостатое ядро и путамен. При посмертном анализе в 95% случаев в головном мозге, пораженном БХ, была выявлена атрофия стриатума, со средним уменьшением объема на 58% (Lange et al., 1976; Vonsattel and DiFiglia, 1998). У пациентов с БХ также наблюдалась утрата объема до 29% в коре головного мозга, 28% в таламусе и 29-34% в телэнцефалическом белом веществе конечного мозга, (De la Monte et al., 1988). Кроме того, у пациентов с БХ общий объем мозга был снижен на 19% по сравнению с мозгом в здоровой контрольной группе (Halliday et al., 1998).
Иммунная система и БХ.
Сегодня имеются согласованные свидетельства о ключевой роли нейровоспаления в развитии нескольких нейродегенеративных заболеваний. Есть веские основания предполагать вклад воспаления в нейродегенерацию при БХ. Так, активация иммунной системы при БХ была явно подтверждена повышенной экспрессией цитокинов, таких как IL-6, в мышиных моделях, а также у пациентов с симптомами и у пациентов с предсимптомией. Активация врожденных иммунных клеток ЦНС при БХ происходит через микроглию и астроциты, которые непосредственно вовлечены в патогенез нескольких нейродегенеративных заболеваний.
БХ и факторы роста нервов.
В нескольких исследованиях показано, что белок htt дикого типа повышает экспрессию нейротрофического фактора мозга (BDNF) в клетках ЦНС, тогда как мутантный белок htt приводит к снижению экспрессии нейротрофического фактора мозга (BDNF), что приводит к недостаточной нейротрофической поддержке и гибели нейронов (Zuccato et al., 2001).
Применение hIDPSC Cellavita в доклинической модели
В предыдущих публикациях использовались различные модели БХ - химические (хинолиновая кислота, QA, 3-нитропропионовая кислота, 3-NP) и генетические (R6/2-J2; N171-82Q, R6/2). Мы использовали в нашем неограничивающем примере классическую модель индукции БХ-подобных симптомов путем системного введения 3-NP. Основными целями доклинической оценки безопасности являются: 1) определение первоначальной безопасной дозы и схем последующей эскалации дозы у людей; 2) выявление потенциальных органов-мишеней для исследований токсичности и для изучения того, является ли такая токсичность обратимой; 3) определение параметров безопасности для клинического мониторинга; 4) детектирование IDPSC в мозге крысы.
БХ в нашем исследовании индуцировали воздействием 3-NP, которая является необратимым ингибитором сукцинатдегидрогеназы, ингибирующим как цикл Кребса, так и комплекс II, и системное введение 3-NP как крысам, так и приматам может приводить к селективным поражениям стриатума, которые являются следствием вторичных экситотоксических механизмов [95-96]. Эти поражения с высокой степенью точности воспроизводят ряд двигательных и невропатологических симптомов, наблюдаемых у пациентов с БХ. Системное введение 3-NP приводит к дифференциальному сохранению стриарной НАДФН-диафоразы и крупных холинергических нейронов со значительной утратой активности стриарных ГАМКергических нейронов в цепи транспорта электронов.
Мы использовали в нашем доклиническом исследовании трехмесячных самцов крыс Wistar с начальным весом от 300 до 350 г. БХ индуцировали ежедневной внутрибрюшинной инъекцией 20 мг/кг 3-NP (Sigma-Aldrich) в течение 4 дней. IDPSC человека выделяли в соответствии с протоколом, уже установленным для Kerkis с коллегами (2006). Клетки наращивали до пассажа 4. Клетки были иммуноположительными по маркерам МСК, таким как CD105, CD90 и CD73; маркерам перицитов, таким как CD146; и маркеру стволовых клеток нервного гребня, такому как CD271. Клетки были отрицательными по CD45 (маркер клеток крови) и HLA II (главный комплекс гистосовместимости: молекулы лейкоцитарных антигенов человека класса II). Все процедуры были разработаны в присутствии и под наблюдением ветеринара, специализирующегося на заболеваниях нервной системы.
А. Краткосрочное действие hIDPSC в экспериментальной модели БХ у крыс, индуцированной 3-NP.
Чтобы наблюдать маршрут миграции и биораспределение IDPSC в стриатуме и в других отделах мозга, они были предварительно окрашены агентом Vybrant (зеленый краситель Invitrogen, Карлсбад, Калифорния, США, V12883). После 24 часов индукции БХ с помощью 3-NP кислоты трансплантировали в общей сложности 1×106 IDPSC внутривенно (в каудальную вену), а через 4 дня (пилотное исследование) или через 35 дней (исследование группы I) животных подвергали эвтаназии. Образцы мозга отбирали для гистологического и иммуногистохимического анализа (Фиг. 15 и 16).
Чтобы оценить процесс нейродегенерации, индуцированной 3-NP, и влияние трансплантации IDPSC на этот процесс в экспериментальных группах, были использованы глобальные биомаркеры, приведенные на Фиг. 17.
Результаты: пилотное исследование
На Фиг. 18 продемонстрировано приживление hIDPSC по всей паренхиматозной ткани стриатума и коры. Ткани оценивали посредством иммуногистохимии с использованием специфических антител против клеточных ядер человека (коричневого цвета) и анти- hIDPSC антител (зеленого цвета). hIDPSC была колокализирована с CD73 (красного цвета), маркером человеческого МСК, что при наложении образует желтый цвет.(2) влияние на индукцию нейрогенеза, отмеченное стриарными ГАМКергическими нейронами, которые были иммунологически окрашены в коричневый цвет, а также (3) взрывные DA нейроны, показанные с высоким увеличением, проявили экспрессию рецептора D2 (коричневого цвета) в нейронах стриатума, тогда как (4) коллаген 1 показывает коричневым цветом область, которая была поражена воздействием 3-NP, имитируя БХ-подобные поражения стриатума.
После индукции БХ с помощью 3-NP кислоты мыши показали функциональные и анатомические характеристики, сходные с симптомами БХ человека:
1. У большинства животных наблюдались повреждения в стриатуме.
2. Все животные, получившие 3-NP, показали снижение массы тела, вялость и симптомы угнетенного состояния через 4 дня после индукции БХ.
3. Через четыре дня после трансплантации IDPSC существенной разницы в весе между животными, обработанными IDPSC, и контрольной группой (без лечения) не было
4. Обе группы показывали вялое и подавленное поведение.
5. Через четыре дня после трансплантации IDPSC были распределены по всей подкорковой части переднего мозга - стриатума (Фиг. 19).
В этот момент hIDPSC показывали дважды положительное иммуноокрашивание на антитела против IDPSC, CD73 и CD 105, демонстрируя, что через 4 дня после трансплантации большинство клеток все еще были недифференцированными. hIDPSC были в основном локализованы в паренхиме стриатума и вблизи от капилляров (Фиг. 20).
Таким образом, IDPSC, трансплантированные в/в путем у крыс с БХ, индуцированной 3-NP, могли пересекать ГЭБ и мигрировать в поврежденную область. Эти клетки продемонстрировали значительное приживление в паренхиме и вокруг капилляров. Через четыре дня после трансплантации клетки все еще были недифференцированы; однако также наблюдалось несколько человеческих клеток, которые проявляли нейроноподобную морфологию.
Результаты: исследование группы I
Целью исследования было выявить IDPSC в мозге крысы через 30 дней после инъекции. Через 30 дней после инъекции IDPSC они наблюдались в коре и главным образом в стриатуме, вблизи от капилляров, типичной локализации перицитов головного мозга (Фиг. 21). Дополнительные последовательные срезы, полученные из мозга крысы, демонстрируют нейроноподобную морфологию IDPSC, локализованных в паренхиме (Фиг. 22). Неожиданно IDPSC были обнаружены в субвентрикулярной зоне (СВЗ), которая считается нишей стволовых клеток для нейронов во взрослом мозге (Фиг. 23). Другим удивительным результатом, который был неожиданно получен, является стабильное продуцирование DARPP32-положительных нейронов у крыс, получивших трансплантацию hIDPSC. Для сравнения, этого не наблюдалось в контрольных группах (Фиг. 24). Важно отметить, что дофамин- и цАМФ-регулируемый фосфопротеин, Mr массой 32 килодальтон (DARPP-32), первоначально был идентифицирован как основная мишень для дофамина и протеинкиназы А (PKA) в стриатуме. Регулирование статуса фосфорилирования DARPP-32 дает механизм интеграции информации, поступающей в дофаминоцептивные нейроны, в нескольких областях мозга, через различные нейротрансмиттеры, нейромодуляторы, нейропептиды и стероидные гормоны (Svenningsson et al., 2004). БХ ассоциирована с тяжелой утратой стриарных рецепторов D1 и D2, и учитывая недавние сообщения, что дисрегуляция дофаминового рецептора D2 является чувствительным критерием количественной оценки патологии Хантингтона у модельных мышей (Crook et al., 2012; Chen et al., 2013), мы использовали этот маркер для оценки возможного воздействия IDPSC у крыс, индуцированных 3-NP.
Неожиданно мы наблюдали существенное различие в экспрессии рецептора D2 у крыс, получавших IDPSC, по сравнению с контрольными группами; в стриатуме контрольных животных можно наблюдать лишь немногие клетки с экспрессией D2. Поэтому мы предложили трехбалльную систему для оценки экспрессии этого белка (Фиг. 25), которая также может быть количественно определена.
В. Более долгосрочное действие hIDPSC в экспериментальной модели БХ у крыс, индуцированной 3-NP.
Мы провели два новых эксперимента (группа II и III), которые следовали представленной далее схеме эксперимента (Фиг. 26) и были нацелены на несколько трансплантаций IDPSC и увеличенное число клеток. Наблюдаемые клинические маркеры включали потерю веса и степень ухудшения двигательных функций. Степень ухудшения двигательных функций может быть определена по появлению дистонии, вялости, слабости задних конечностей, вентральному и латеральному лежачему положению или повышению экспрессии indh (то есть увеличению дефицита двигательной активности) при БХ. На Фиг. 27 представлена примерная система балльной оценки для оценки ухудшения двигательных функций. Клиническая оценка всех исследованных животных после индукции БХ представлена в таблице 9. На Фиг. 28-31 показаны статистические данные веса животных в пилотном исследовании, исследовании группы II и исследовании группы III. В более долгосрочных исследованиях животные, получавшие IDPSC, имели более высокую массу тела по сравнению с контрольными животными.

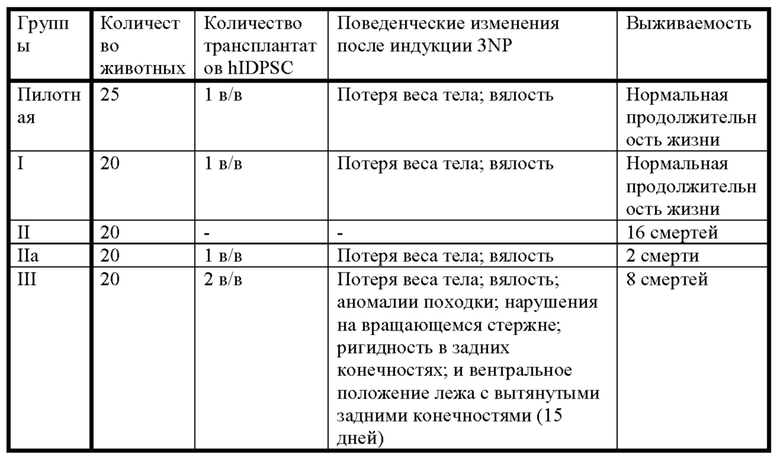
Пример 11. Модель болезни Хантингтона крыс с использованием 3- нитропронионовой кислоты (3-NP)
Этические вопросы
Все исследования были одобрены комитетом по этике Института энергетических и ядерных исследований (Instituto de Pesquisas Energeticas e Nucleares - IPEN)), Университета Сан-Паулу, Сан-Паулу, Бразилиа. Протоколы, касающиеся содержания, ухода и обращения с экспериментальными животными, соответствуют всем действующим в Бразилии законам и признанным на международном уровне нормам и протоколам. Весь персонал, работающий с экспериментальными животными, был полностью аккредитован в качестве штатных исследователей/специалистов и надлежащим образом обучен использованию животных в экспериментальных научных целях в соответствии с действующими в Бразилии нормами.
Основная цель
Исследовательская группа изучала эффекты hIDPSC в отношении нейропротекции и/или ремоделирования нервной ткани в химической модели болезни Хантингтона, вызванной 3-NP.
Животная модель
Системное введение митохондриального токсина, 3-нитропропионовой кислоты (3-NP), служит в качестве химической модели болезни Хантингтона у грызунов и приматов, не являющихся людьми, и используется для тестирования потенциальных лекарственных препаратов. 3-NP является необратимым ингибитором митохондриальной сукцинатдегидрогеназы (SDH), вызывающим гибель клеток главным образом в стриатуме, а также в ГАМКергических срединных шипиковых проекционных нейронах и шипиковых интернейронах. Благодаря способности 3-NP пересекать гематоэнцефалический барьер, ее можно вводить системно, вызывая селективную нейродегенерацию стриатума или всего тела стриатума. В зависимости от режима введения, 3-NP может имитировать различные этапы болезни Хантингтона. Интраперитонеальные инъекции двух доз 3-NP приводят к гиперкинетическим симптомам у мышей, ответствующим ранним стадиям заболевания, тогда как четыре или более дозы приводят к гипоактивности как на поздних стадиях заболевания (Beal et al., 1993; Brouillet et al., 1995; Yang et al., 2008; Borlogan et al., 1997).
Следует отметить, что модель животных, получавших 3-NP (химическая модель), имеет важное ограничение по сравнению с транс генными. В модели 3-NP поражение стриатума может самопроизвольно регенерировать через 10-12 дней благодаря наличию нормальных собственных предшественников нейронов и отсутствия генетического фона, обеспечивающего постоянную нейродегенерацию. Поэтому различие в двигательных и функциональных улучшениях между экспериментальной и контрольной группами может наблюдаться только до спонтанной нейрорегенерации.
Краткий протокол трансплантации hIDPSC
Крысам линии Lewis (n=124), весом 350-450 г, вводили 20 мг/кг 3-NP внутрибрюшинно (IP) один раз в день в течение четырех дней. Животных содержали в условиях 12-часового цикла чередования света и темноты, со свободным доступом к пище и воде. Крысам вводили IP 3-NP для индукции повреждений мозга. Затем их анестезировали и вводили в каудальную вену одну или три дозы по 1×106 в 250 мкл физиологического раствора или 1×107 в 300 мкл физиологического раствора hIDPSC на животное, что соответствует 0,35×106 и 3,5×106 на кг соответственно. Повторные дозы вводили с промежутком 30 дней (Фиг. 32).
Каждой группе лечения была сопоставлена контрольная группа, получавшая только физиологический раствор ("не получавшие лечения"). Таким образом, животные были сгруппированы в пять групп, как показано в Таблице 10.
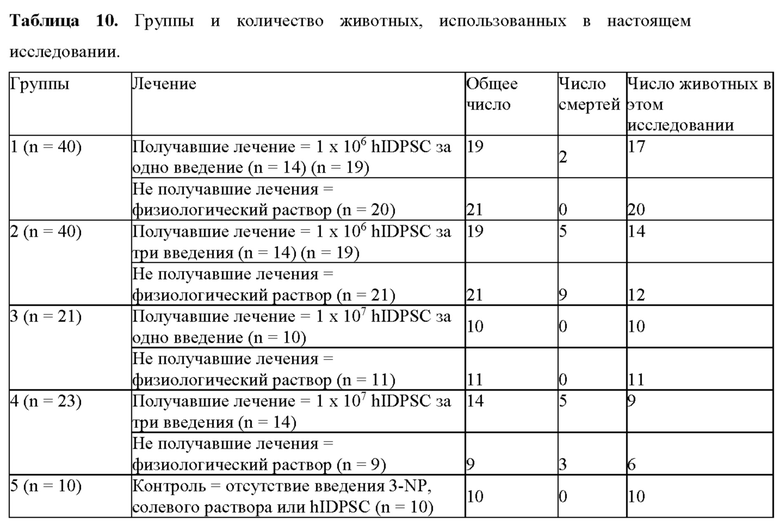
Функциональный анализ
Полуколичественная неврологическая шкала
Способность передвигаться два раза в неделю оценивал слепым методом один наблюдатель для каждой экспериментальной группы, с использованием количественной неврологической шкалы, адаптированный из работы Ludolph et al. (1991). Эта шкала измеряет поведение при передвижении (0-4 балла) крыс на плоской деревянной поверхности следующим образом: 0: нормальное поведение; 1: общая медлительность; 2: нарушения координации и походки; 3: паралич или ухудшение функций верхней конечности, неспособность двигаться; и 4: невозможность выйти из лежачего положения.
Исходно все крысы (30) в обеих группах проявляли нормальное поведение без какой-либо заметной аномалии походки до введения 3NP, получим, таким образом, оценку 0 баллов. К концу введения 3NP (через 4 дня), в конце 3NP-индукции, в общей сложности у 76 крыс наблюдалась общая медлительность (оценка 1); у 2 крыс - затруднения с передвижением (оценка 2); 20 крыс проявили неспособность двигаться в результате нарушения функций передних и задних конечностей (оценка 3); 24 крысы демонстрировали лежачее положение и, впоследствии, смерть (оценка 4). Через 24 часа после трансплантации HIDPSC крысы, получившие 3NP + hIDPSC (обе дозы), функционировали лучше по сравнению с крысами, получившими только 3NP. Однако через 5 дней после трансплантации hIDPSC крысы проявляли еще большее улучшение. В общей сложности у 27 крыс была нормальная оценка (0 баллов). Кроме того, после трансплантации HIDPSC у 20 крыс была оценка 1 балл, у 3 - 2 балла и у 2 - 3 балла, и ни одна крыса не имела оценку 4 балла (Таблица 12). При этом в контрольной группе (3NP + физиологический раствор) у 38 крыс была оценка 1 балл, у 1 - 2 балла, у 5 крыс - 3 балла и у 1 крысы - 4 балла (Таблица 11).
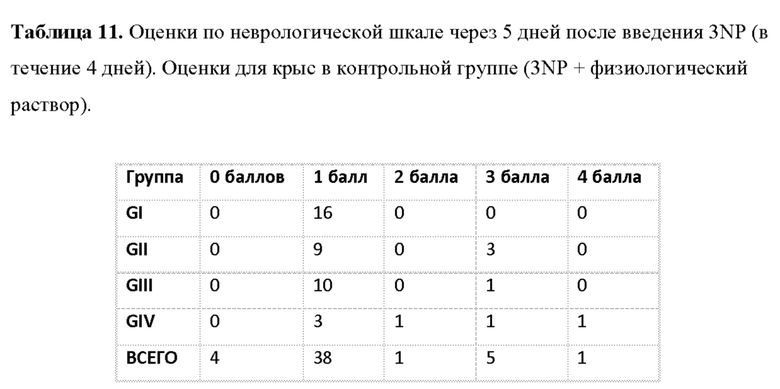
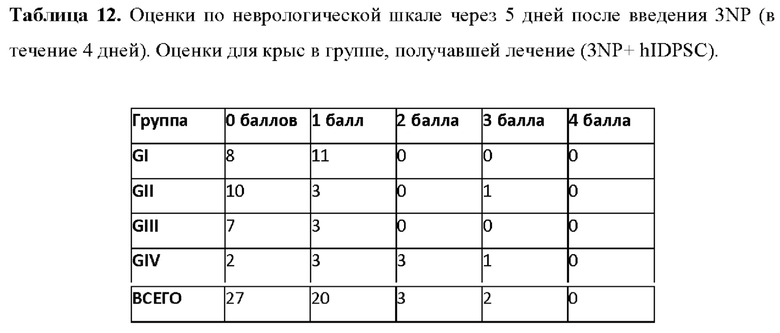
В таблице 13 показаны неврологические оценки контрольной группы (3NP + физиологический раствор) и группы, получавшей hIDPSC (3NP + трансплантация hIDPSC) после введения 3NP (в течение 4 дней), спустя 1 день и 5 дней после индукции 3NP и после трансплантации HIDPSC. Нормальное поведение без отклонений походки (оценка 0); общая медлительность (оценка 1 балл); изменения координации и походки (оценка 2); неспособность двигать задними, либо передними конечностями (оценка 3); и неспособность выйти из лежачего положения. Последняя группа в итоге умерла (оценка 4). Группа 1 = получавшие лечение = 1×106 hIDPSC в одном введении; Группа 2 = получавшие лечение = 1×106 hIDPSC в трех введениях; Группа 3 = получавшие лечение = 1×107 hIDPSC в одном введении: Группа 4 = получавшие лечение = 1×107 hIDPSC в трех введениях.
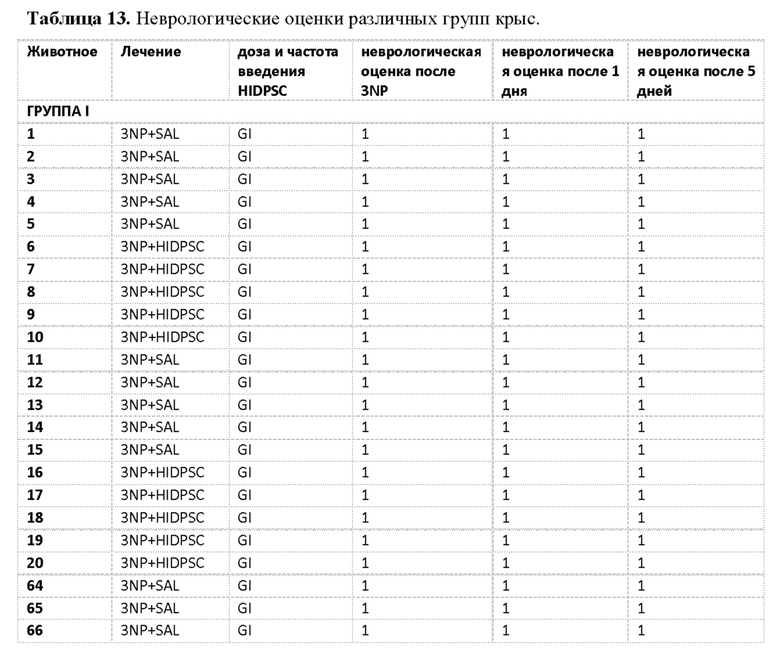
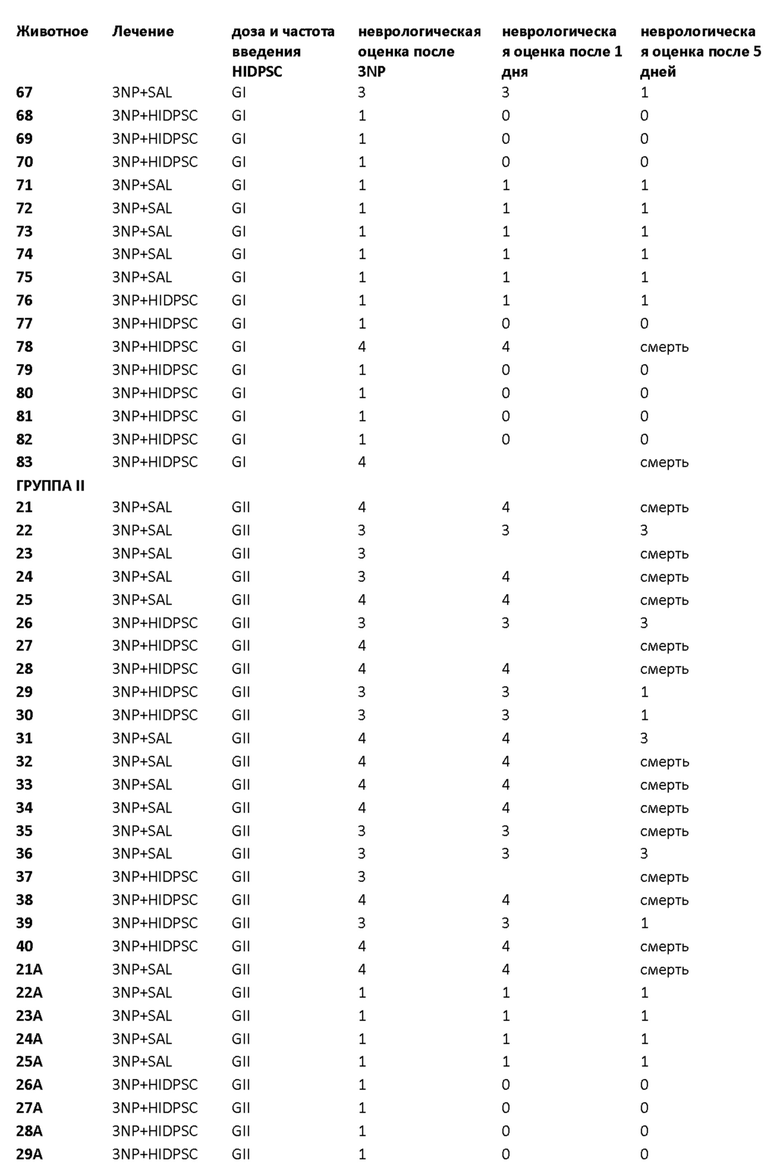
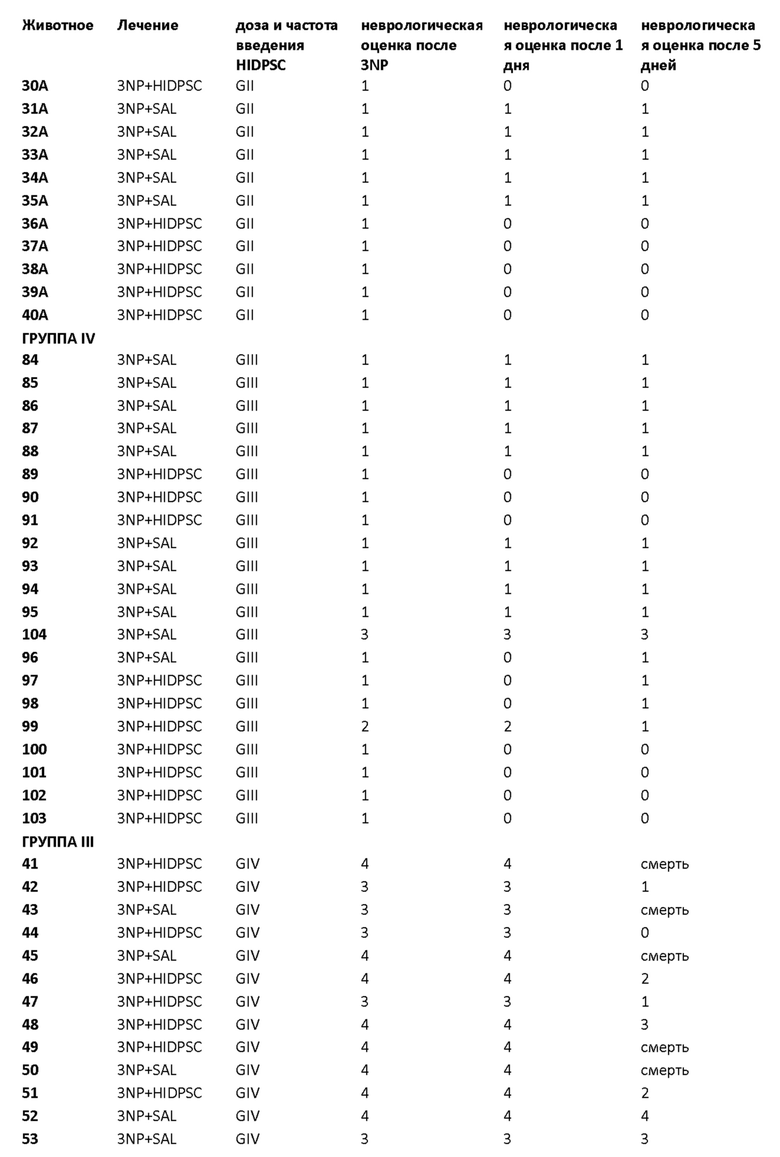
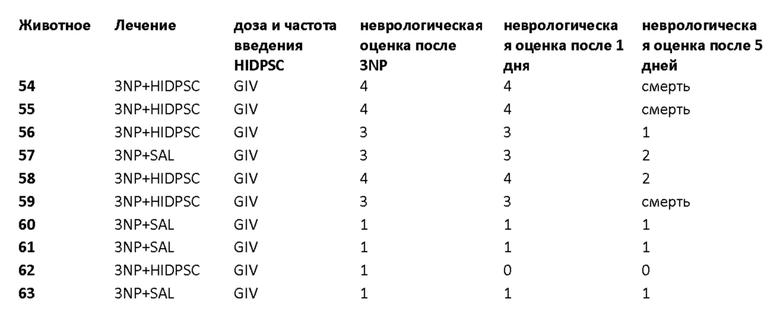
Гистопатологический и иммуногистологический анализ
Гистопатологические и иммуногистологические анализы проводили через 7, 30 и 90 дней после инъекции hIDPSC; животных перфузировали 4% параформальдегидом (приготовленным в ФБР, 0,1 моль/л). Фрагменты тканей дегидратировали в серии концентраций этанола (75, 95 и 100%) и окрашивали по Нисслю 0,1% крезиловым фиолетовым. Для определения присутствия hIDPSC в мозге крысы использовали два антитела, такие как антитело против клеточных ядер человека и анти-hIDPSC (1:1000, Abcam Plc). Для оценки нейропротекторного и нейрорепаративного эффектов hIDPSC использовали антитела против ГАМКергических срединных шипиковых нейронов DARPP32 (1:1000, Abcam Plc), дофамина D2 (1:800) и BDNF (1:500).
Приживление hIPDSC в головном мозге крысы
Одним из наиболее важных для нашей темы результатов исследования было детектирование hIDPSC в коре и стриатуме, что указывает на их способность пересекать гематоэнцефалический барьер и мигрировать в место повреждения (Фиг. 33). На Фиг. 33, микроскопические срезы демонстрируют при разной глубине фокуса (А1-А4) наличие IDPSC, окрашенных агентом Vybrant (зеленого цвета), а ядра окрашены PI (красного цвета). Клетки демонстрируют преобладающую капиллярную ассоциацию и различные морфологические типы: нейроно-подобные клетки и перициты. На А2, A3 и А4 можно наблюдать два перицита в разных местах вдоль капилляра, и оба они имеют сходную морфологию. На А4 изображено ветвление аксонов. Нейрональные ядра - светлые с ядрышком, и можно наблюдать различие с ядрами перицитов, которые сильно окрашены. Синий - искусственный цвет конфокального микроскопа. Микроскопию выполняли с эпифлуоресценцией и дифференциальным интерференционным контрастом (DIC), а масштабный отрезок на изображении = 10 мкм.
Кроме того, через четыре дня после введения hIDPSC несколько клеток оказались положительными по специфическим антителам МСК (анти-CD73 и анти-CD105), что указывает на то, что на этот момент некоторые клетки все еще были недифференцированными (Фиг. 34). Тем не менее, hIDPSC-производные нейроноподобные клетки и перициты (периваскулярные клетки из микрососудов) также наблюдались в тот же период (Фиг. 33).
На Фиг. 34 срез показывает IDPSC, окрашенные агентом Vybrant (зеленые) и положительно прореагировавшие с антителом против IDPSC (красного цвета). Суперпозиция обоих цветов дает желтый цвет. Клетка демонстрирует локализацию около капилляра. Использовались два маркера для МСК: CD73 и CD105, демонстрирующие положительную реакцию с IDPSC. Использовался конфокальный микроскоп с эпифлуоресценцией + и дифференциальным интерференционным контрастом (DIC). Масштабный отрезок = А = 5 мкм; В = 10 мкм; С = 20 мкм; D = 5 мкм.
Через тридцать дней после трансплантации hIDPSC, несколько HIDPSC наблюдалось в коре, и большое количество клеток наблюдалось в стриатуме вдоль капилляров (Фиг. 35). Последовательные срезы, полученные из мозга крысы, демонстрируют нейроноподобную морфологию IDPSC, локализованных в паренхиме (Фиг. 35). Кроме того, наблюдались нейроноподобные и фибробластоподобные клетки, подтверждающие, что hIDPSC подвергаются дифференцировке (Фиг. 36). Неожиданно IDPSC были обнаружены также в субвентрикулярной зоне (СВЗ), которая считается нишевой клеткой стволовых клеток нейронов во взрослом мозгу (Фиг. 35).
Нейропротекторные и нейрорепаративные эффекты
Индуцированные воздействием 3-NP стриарные поражения определяли по утрате нейронов с использованием окрашивания по Нисслю и экспрессии DARPP32 (Фиг. 37 и Фиг. 38 соответственно). Окрашивание по Нисслю используют для идентификации нейрональных структур в головном и спинном мозге (Фиг. 37), тогда как DARPP32 представляет собой цитоскелетный маркер, экспрессируемый в ГАМКергических нейронах и широкораспространенный в стриатуме здоровых млекопитающих (Фиг. 38). Используя эти два маркера, утрату нейронов в корпусе стриатум оценивали в баллах следующим образом:
• Оценка 1 балл (тяжелая степень): тяжелая утрата нейронов, с областями деградации, утрата иммуноокрашивания DARPP32 в латеральном стриатуме с небольшим числом или отсутствием клеток в центральном стриатуме;
• Оценка 2 балла (умеренная): умеренная утрата нейронов с "темными нейронами" (мертвые или апоптотические нейроны) и несколько клеток DARPP32 +; и
• Оценка 3 балла (легкая): отсутствие утраты нейронов и интенсивное иммуноокрашивание DARPP32 (Vis et al., 2001).
Получавшие 3-NP животные показали полную или частичную утрату нейронов в стриатуме по сравнению с контрольными (не получавшими ни 3-NP, ни hIDPSC). Две экспериментальные группы (получавшие и не получавшие лечения) продемонстрировали разные оценки утраты нейронов в стриатуме относительно контролей. Вместе с тем, морфометрический гистологический анализ показал, что большинство животных, получавших hIDPSC, имели оценки 3 и 2 балла, тогда как большинство не получавших лечения животных (3-NP + физиологический раствор) имели оценки утраты нейронов 2 и 1 балл (Фиг. 38). Ни у одного животного не отмечено видимой атрофии (Фиг. 37 и Фиг. 38).
На Фиг. 39 изображен рост нейронов в стриатум крыс после ведения hIDPSC. Введение hIDPSC вызывало нейрорепаративный эффект у животных, получавших hIDPSC, по данным (А) окрашивания по Нисслю и (В) экспрессии DARPP32. (С) Число животных, показывающих восстановление нейронов после введения hIDPSC по сравнению с контрольными. Большинство животных, получавших hIDPSC (3-NP + hIDPSC), имели оценки 3 и 2 балла (умеренная и легкая степень), тогда как большинство не получавших лечения животных (3 NP + физиологический раствор) имели оценки 2 и 1 балл (тяжелая и умеренная степень).
Мы также наблюдали, что экспрессия DARPP32 была выше у животных, получавших hIDPSC, чем не получавших лечения животных (Фиг. 40), что указывает на регенерацию нейронов. Микроскопические срезы на Фиг. 40 демонстрируют, что нейрон положительно реагирует с DARPP32.
Сообщается, что дисрегуляция дофаминового рецептора D2 является чувствительным критерием количественной оценки патологии Хантингтона у модельных мышей (Crook et al., 2012). Удивительный и неожиданный результат был получен в отношении стабильного продуцирования DARPP32-положительных нейронов у крыс, получивших трансплантацию hIDPSC. Для сравнения, в контрольных группах этого не наблюдалось (Фиг. 38). Важно отметить, что дофамин- и цАМФ-регулируемый фосфопротеин (DARPP-32) первоначально был идентифицирован как основная мишень для дофамина и протеинкиназы А (PKA) в стриатуме. Регулирование статуса фосфорилирования DARPP-32 дает механизм интеграции информации, поступающей в дофаминоцептивные нейроны, в нескольких областях мозга, через различные нейротрансмиттеры, нейромодуляторы, нейропептиды и стероидные гормоны (Svenningsson et al., 2004). БХ ассоциирована с тяжелой утратой стриарных рецепторов D1 и D2 и учитывая недавние сообщения, что дисрегуляция дофаминового рецептора D2 является чувствительным критерием количественной оценки патологии Хантингтона у модельных мышей (Crook et al., 2012; Chen et al., 2013), мы использовали этот маркер для оценки возможного воздействия IDPSC у крыс, индуцированных 3-NP.
Неожиданно мы наблюдали существенное различие в экспрессии рецептора D2 у крыс, получавших IDPSC, по сравнению с контрольными группами; в стриатуме контрольных животных можно наблюдать лишь немногие клетки с экспрессией D2 (Фиг. 41).
В мозжечке, caudate putamen, стриатуме и коре головного мозга пациентов с БХ наблюдались пониженные уровни мРНК и белка BDNF (Adachi et al., 2014). В настоящем исследовании в стриатуме, caudate, putamen и субвентрикулярной зоне животных, получавших hIDPSC, наблюдалась экспрессия BDNF через 7 и 30 дней после введения hIDPSC (Фиг. 40). Экспрессия BDNF в субвентрикулярной зоне указывает на то, что hIDPSC способствуют нейрогенезу. Экспрессия BDNF не наблюдалась у контрольных животных (3-NP + физиологический раствор)..
Также наблюдалась колокализация hIDPSC с маркером двигательных нейронов DARRP32, показывая, что hIDPSC дифференцируются в зрелые нейроны. Экспрессия DARPP32 была обнаружена в стриатуме животных, получавших hIDPSC, через 30 дней после введения hIDPSC в этой 3-NP модели БХ (Фиг. 41). Эти данные показывают, что hIDPSC дифференцируются in vivo в ГАМКергические шипиковые нейроны. Следует отметить, что интеграция сигналов нейротрансмиттеров и нейромодуляторов в стриатуме играет центральную роль в функциях базальных ганглиев. Более того, DARPP32 является ключевым фактором в интеграции ГАМКергических срединных шипиковых нейронов в ответ на дофамин и глутамат (Fernandez et al., 2006).
Гистологические и иммуногистохимические анализы продемонстрировали, что hIDPSC удалось преодолеть гематоэнцефалический барьер и достичь различных областей, пораженных БХ, включая стриатум и кору. Морфометрический гистологический анализ выявил, что большинство животных, получавших hIDPSC, показали умеренную утрату нейронов в стриатуме по сравнению с не получавшими лечения животными (3-NP + физиологический раствор). Более того, hIDPSC продемонстрировали нейропротекторный и нейрорепаративный эффект, что проявлялось усилением экспрессии BDNF, DARPP32 и рецептора D2, экспрессия которые снижена при болезни Хантингтона (Van Dellen et al., 2000; Crook and Housman, 2012). Таблица 14. Число выживших и мертвых животных.

Безопасность
В течение экспериментального периода у получавших и не получавших лечения животных регистрировали следующие физиологические параметры: вес тела и потребление корма и воды. Среди животных, получавших hIDPSC, наблюдалось меньшее количество смертей, чем у крысы с 3 NP-инъекциями, что указывает на безопасность введения hIDPSC. Кроме того, полученные результаты показывают, что введение hIDPSC улучшает общую выживаемость, защищая животных от нейротоксических эффектов 3-NP (Таблица 14).
Основным исследованием, оценивающим безопасность hIDPSC, была модель БХ, вызванной 3-нитропропионовой кислотой (3-NP), у крыс. В этом исследовании животным вводили две разные дозы клеток: 1×106 и 1×107 клеток/трансплантат или 3×106 клеток/кг и 3×107 клеток/кг соответственно. После введения 3-NP крысы получали одну в/в инъекцию или в общей сложности три в/в инъекции клеток с интервалом в один месяц.
Семь смертей произошли у 3-NP-индуцированных животных, получивших 3×106 клеток/кг, и 5 смертей произошли у животных, получивших 3×107 клеток/кг. В группах плацебо (3-NP-индуцированных животных без трансплантации клеток) погибло одно и то же число (12) животных. У всех погибших крысы наблюдались чрезвычайно тяжелые проявления болезни; смерть наступила в течение 5 дней после введения 3-NP. Никаких дополнительных смертей при повторных введениях hIDPSC не было. Исходя из этих данных, вероятной причиной всех ранних смертей была токсичность 3-NP. Отсутствие смертей после повторных трансплантаций hIDPSC подтверждает безопасность трансплантации hIDPSC (Таблица 14).
Пациенты с болезнью Хантингтона часто демонстрируют прогрессирующую потерю веса, несмотря на потребление адекватного или высокоэнергетического питания. Потеря веса может быть показателем нейротоксичности 3-NP, вызванной уменьшением энергетического метаболизма (Saydoff et al., 2003; Colle et al., 2013). Через 4 дня после введения 3-NP значительной потери веса у получавших 3-NP животных не наблюдалась. Однако через 30 дней после трансплантации hDPSC группа hDPSC (доза 1×106 клеток) демонстрировала значительный набор веса по сравнению с не получавшей hDPSC группой (3NP). Таким образом, введение hIDPSC ослабляет потерю веса (р=0,01) (Фиг. 42).
БХ является клинически инвалидизирующей болезнью, для остановки или регрессии которой терапии не существует. Одним из основных препятствий при лечения БХ, является то, что это нейродегенеративное расстройство, и некоторые таргетные системно доставляемые лекарства не смогут достичь своей цели; прохождение лекарств в мозг регулируется гематоэнцефалическим барьером (ГЭБ). ГЭБ представляет собой барьер высокоселективной проницаемости, который отделяет циркулирующую кровь от внеклеточной жидкости, окружающей нервную систему. Поэтому лечение клеточными препаратами, по-видимому, требует локализованной доставки в обход ГЭБ (то есть инъекции через этот барьер селективной проницаемости), поскольку обычно клетки не пересекают ГЭБ.
Обширные исследования показывают, что hIDPSC имеют атрибуты мезенхимальных стволовых клеток (МСК), способны выделять иммуномодулирующие и нейротропные факторы. Кроме того, гистологические и иммуногистохимические анализы в валидированной модели БХ у крыс показывают, что hIDPSC способны пересекать ГЭБ и достигать различных областей, пораженных БХ, включая стриатум и кору. Морфометрический гистологический анализ показывает, что большинство животных, получавших hIDPSC, демонстрируют умеренную утрату нейронов в стриатуме, по сравнению с контрольными животными. Более того, hIDPSC проявляют нейропротекторный и нейрорепаративный эффект, усиливая экспрессию BDNF, DARPP32 и D2 рецептора, уровни которых снижены при болезни Хантингтона (Van Dellen et al., 2000; Crook and Housman, 2012).
Наконец, исследования, оценивающие профиль безопасности hIDPSC, показывают, что hIDPSC не образуют тератомы, не проявляют хромосомной аберрации, и способны образовывать химеры человека/мыши. Поскольку эти исследования показывают, что hIDPSC безопасны и эффективны в лечении БХ, мы предлагаем использовать hIDPSC для лечения БХ.
Пример 12. Нейропротекторное воздействие hIDPSC на мозг. Кратко- и долгосрочное воздействие hIDPSC на экспрессию BDNF в модели БХ (индуцированной 3-NP) у крыс после системного введения hIDPSC (внутривенно).
Введение
Нейротрофические факторы, такие как нейротрофический фактор мозга (BDNF), являются важными условиями функции нейронов центральной нервной системы. BDNF играет важную роль в выживании и росте нейронов, служит в качестве модулятора нейротрансмиттеров и участвует в пластичности нейронов, необходимой для обучения и памяти. BDNF также поддерживает дифференцировку, созревание и выживаемость нейронов в нервной системе и проявляет нейропротекторный эффект. BDNF стимулирует и контролирует рост новых нейронов из нейральных стволовых клеток (NSC). При болезни Хантингтона снижение уровня BDNF ассоциировано с утратой нейронов. Исследования показывают снижение их наличия в мозге больных, свидетельствуя, что они играют важную роль в неврологических расстройствах и, в частности, в БХ. При не патологических состояниях BDNF синтезируется в коре, компактной части черного вещества, миндалевидном теле и таламусе. Все эти области снабжают стриатум фактором BDNF. При БХ дефицит BDNF в стриатуме может быть вызван снижением транскрипции гена BDNF в коре головного мозга или уменьшением везикулярного транспорта BDNF (или обоими механизмами). Снижение экспрессии BDNF, наблюдаемое при БХ, нарушает функцию дофаминергических нейронов, что может быть ассоциировано с двигательными нарушениями при БХ. В результате было проведено много исследований для изучения того, способно ли повышение уровня BDNF помочь в лечении БХ(1-7).
Материал и методы
Химическая модель БХ. Крысам линии Lewis весом 350-450 инъецировали 20 мг/кг 3 нитропропионовой кислоты (3-NP) (Sigma Aldrich) внутрибрюшинно один раз в день в течение четырех дней. Животных содержали в условиях 12-часового цикла чередования света и темноты, со свободным доступом к пище и воде. Крысам вводили 3-NP для индукции повреждений мозга. После введения 3NP в коре, гиппокампе и стриатуме происходит снижение экспрессии BDNF.
Трансплантация hIDPSC. Животных анестезировали и инъецировали внутривенно одну дозу 1×106 hIDPSC в 200 мкл ФБР (фосфатно-солевой буферный раствор) в хвостовую вену. Контрольное животное получало 200 мкл только ФБР тем же способом.
Иммуногистохимия Экспрессию BDNF анализировали с использованием античеловеческого анти-BDNF антитела (Santa Cruz) и иммуногистохимического анализа. Животных с БХ, индуцированных 3-NP и получивших hIDPSC или плацебо, умерщвляли через 4 и 30 дней после трансплантации клеток, выделяли головной мозг и препарировали соответствующие отделы мозга, фиксировали в 4% параформальдегиде в ФБР и заключали в парафин. Парафиновые срезы де парафинировали с помощью обычной методики. Затем препараты срезов инкубировали с гидроксидом аммиака (Sigma-Aldrich) в течение 10 минут и промывали четыре раза в дистиллированной воде в течение пяти минут каждый раз. Демаскирование антигена из срезов проводили с использованием буфера с рН=6, содержащего цитрат натрия (Sigma-Aldrich), в водяной бане при 95°С в течение 35 мин. Срезы блокировали перекисью водорода (Sigma-Aldrich) в течение 15 мин и инкубировали в течение ночи при 4°C с поликлональным кроличьим антителом против BDNF человека (N-20), разведенным 1:500 в BSA (Sigma-Aldrich). Затем срезы трижды промывали ФБР в течение пяти минут каждый раз и добавляли антикроличье антитело АР-2057, разведенное 1:100 в ФБР (оба антитела - Santa Cruz Biotechnologies, Даллас, штат Техас, США) в течение 40 мин при комнатной температуре. Затем срезы промывали три раза в ФБР в течение пяти минут каждый раз. Наконец, для коричневого окрашивания применяли систему прочного красного красителя (Abcam, Boston, MA, USA). Иммуноокрашенные срезы контрастировали гематоксилином (Sigma-Aldrich) и наблюдали под световым микроскопом (Axio Observer, Zeiss, Йена, Германия).
Результаты
Краткосрочный эффект трансплантации hIDPSC: Экспрессия BDNF сразу после индуцирования БХ воздействием 3-NP у крыс и через 4 дня после трансплантации hIDPSC.
На Фиг. 43 наблюдаются многочисленные BDNF-положительные клетки (здесь и далее коричневым цветом) в коре крыс (Фиг. 41, 1a и 1b) и в стриатуме (Фиг. 43 1е и 1f), известном в качестве ниши NSC. Небольшое число этих клеток наблюдается в гиппокампе (Фиг. 43 1с и 1d). Однако эти клетки показали морфологию, сходную с предшественником нейронов, а не зрелыми нейронами. Животные, которым после 3-NP вводили физиологический раствор (ФБР), не обнаруживали никаких клеток, секретирующих BDNF (Фиг. 43 2а-2f).
Долгосрочный эффект трансплантации hIDPSC: Экспрессия BDNF сразу после индуцирования БХ воздействием 3-NP у крыс и через 30 дней после трансплантации hIDPSC.
На Фиг. 44 наблюдаются многочисленные морфологически зрелые нейроны в коре, секретирующие BDNF (Фиг. 44 1a и 1b). В гиппокампе также присутствуют секретирующие BDNF клетки (Фиг. 44 1с и 1d), и многие экспрессирующие BDNF клетки наблюдались в стриатуме (Фиг. 44 1е и 1f). В контрольной группе секретирования BDNF не наблюдалось (Фиг. 44 2а-2f).
Заключение
В настоящем исследовании экспрессия BDNF рядом клеток была обнаружена в коре и стриатуме, но лишь в нескольких клетках гиппокампа в четырех группах, каждая из которых состояла по меньшей мере из 10 животных. Две группы состояли из животных, получивших 3-NP, а экспрессию BDNF анализировали спустя 4 дня (Фиг. 43) и 30 дней (Фиг. 44) после трансплантации hIDPSC. Две контрольные группы состояли из животных, которые после 3-NP получали только ФБР и которых анализировали спустя 4 (Фиг. 43) и 30 дней (Фиг. 44), соответственно. Полученные данные свидетельствуют о нейропротекторном эффекте hIDPSC, которые действуют через индукцию экспрессии BDNF собственными стволовыми клетками крыс в головном мозге получивших 3-NP крыс вскоре после трансплантации, и этот эффект повлиял на выживаемость и дифференцировку собственных NSC крыс в зрелые нейроны. Кроме того, трансплантация hIDPSC обеспечивает регенерацию нейронов спустя 30 дней после трансплантации (Фиг. 44)
Предыдущие исследования показывают тесную связь недостатка BDNF в стриатуме с патогенезом БХ. В настоящее время лекарства, разработанные для лечения БХ, способны облегчать симптомы, но не задерживают прогрессирование заболевания. Таким образом, восстановление стриарного уровня BDNF в стриатуме может иметь терапевтический потенциал при БХ. Примеры 10 и 11 также демонстрируют улучшенные поведенческие фенотипы у животных с БХ, получавших hIDPSC. Этот результат подтверждает, что экспрессия BDNF способна преодолеть функциональный дефицит, наблюдаемый у пациентов с БХ6,7.
Пример 13. Ветеринарное лечение подобного рассеянному склерозу заболевания, вызванного вирусом собачьей чумы (CDV), у собак
CDV у собак является хорошо охарактеризованной вирусной моделью демиелинизации с этиологией, подобной этиологии рассеянного склероза. Функциональное восстановление, показанное в раскрытом в настоящей заявке примере, показывает, что IDPSC индуцируют глиогенез в патофизиологических условиях CDV, что коррелирует с нашим предыдущим описанием экспрессии рецептора нейротропина р75, маркера для клеток Шванна, в hIDPSC, культивируемых методом, разработанным компанией Cellavita; или/и индуцируют иммунозащитный механизм для обеспечения функционального восстановления. Результаты тестирования более двадцати собак приведены в таблицах. (Подобные результаты восстановления, не показанные здесь, были обнаружены у нескольких лошадей, которых успешно лечили введением IDPSC от симптомов вирусного заболевания, сходного подобного кори).
В таблице 15 ниже кратко показано, что у большинства пациентов-собак наблюдается облегчение симптомов; только у одной собаки не было никакого эффекта. У большинства пациентов были симптомы выздоровления после второй трансплантации, а у некоторых пациентов была продемонстрирована тенденция к выздоровлению уже после первой трансплантации. Более 90% продемонстрировали частичное восстановление после третьей трансплантации. Около 50% продемонстрировали полное восстановление после третьей трансплантации.

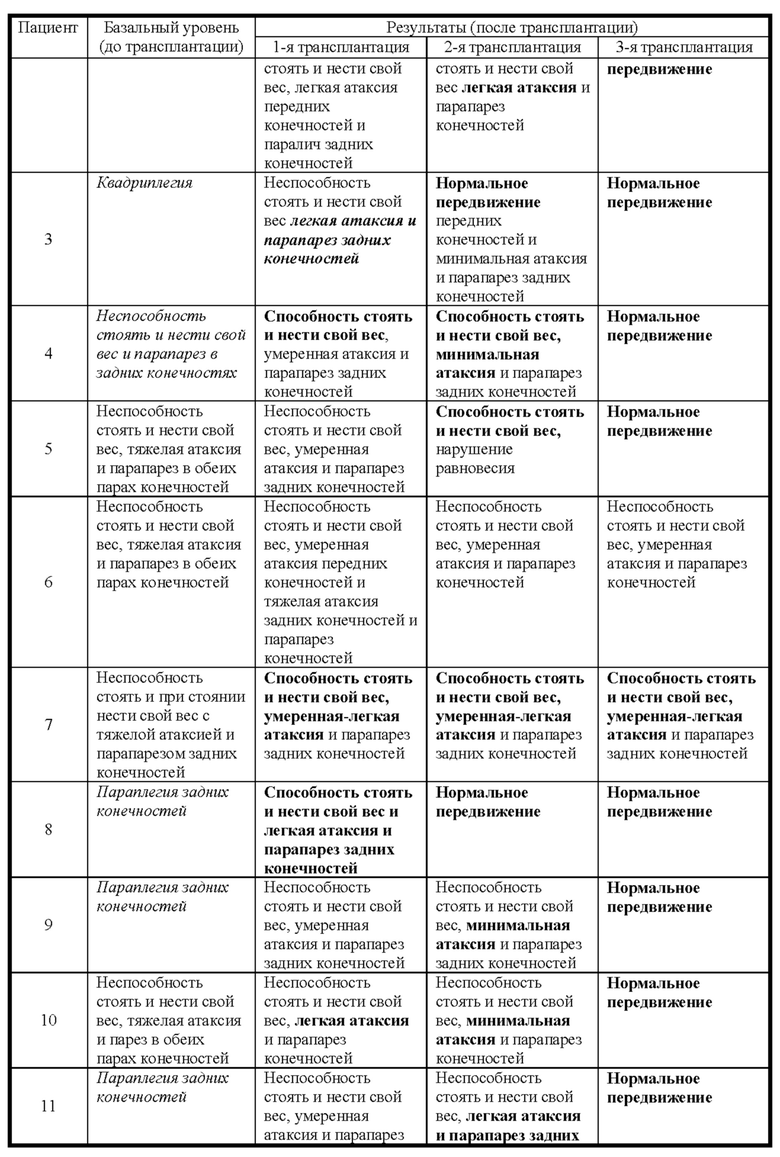
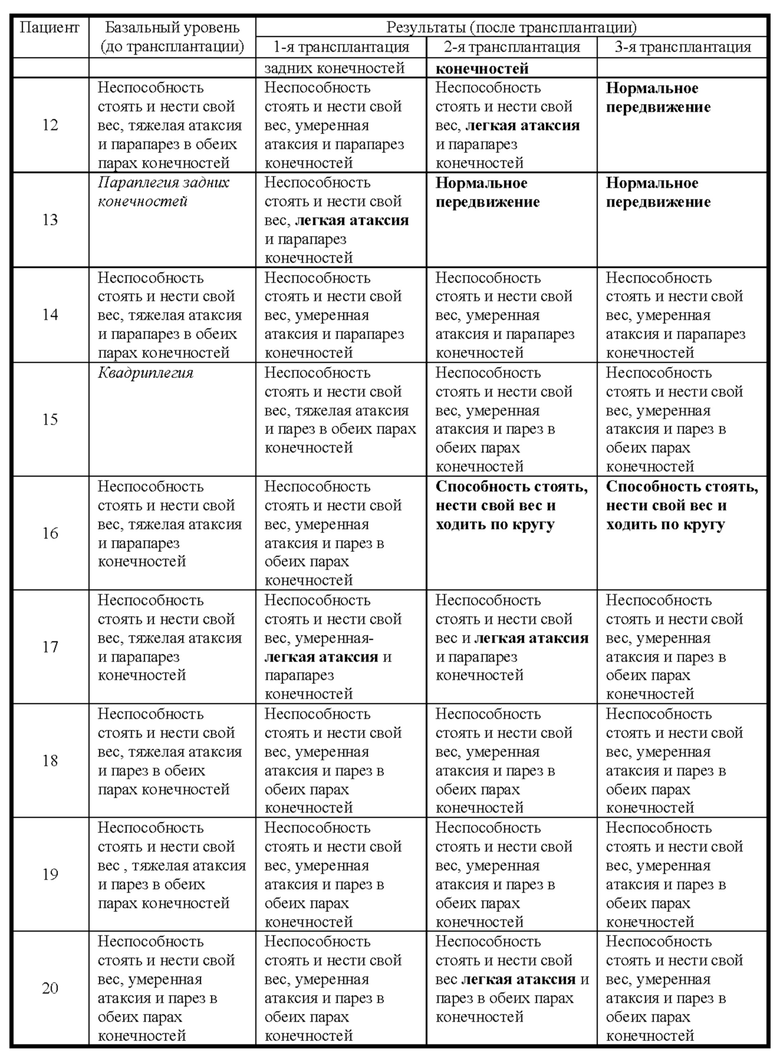
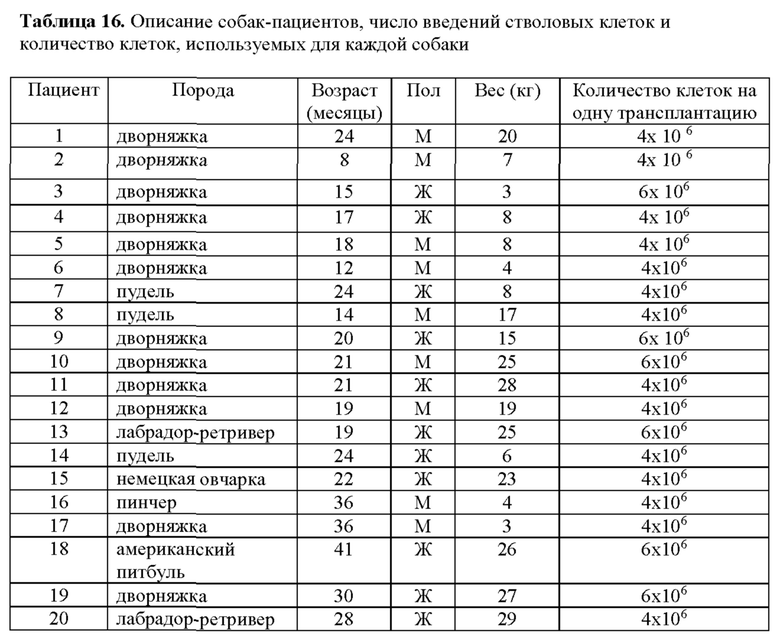
Пример 14. Процесс выпуска партий для промышленного масштабирования эксплантной культуры органов и тканей многократного сбора для продукта hIDPSC - Cellavita™ (Стволовые Клетки) методом поздней популяции
Номенклатура
Продукт Cellavita™ (Стволовые Клетки) представляет собой нефасованный материал перед окончательным составлением композиции. Продукт Cellavita™ (Стволовые Клетки) обозначается как лекарственная субстанция (DS). Cellavita™ (Стволовые Клетки) для в/в инфузии обозначается как лекарственный продукт (ПЗ). Процесс получения субстанции Cellavita™ (Стволовые Клетки) начинается с отбора и тестирования доноров, и заканчивается перед окончательным составлением композиции и криоконсервацией запаса клеток. Приготовление лекарственного продукта включает смешивание субстанции Cellavita™ (Стволовые Клетки) с дополнительными вспомогательными веществами.
Общие свойства
В одном варианте реализации продукт Cellavita™ (Стволовые Клетки) представляет собой стволовые клетки, экспрессирующие маркеры клеток нервного гребня/мезенхимальных стволовых клеток/прогениторных клеток, такие как CD13, CD105 (эндоглин), CD73, CD29 (интегрин b-1), CD44 и нестин (Kerkis et al., 2009; Kerkis et al., 2006), полученные с использованием эксплантной культуры многократного сбора органа и ткани.
В другом варианте реализации Cellavita™ (Стволовые Клетки) представляют собой МСК-подобные клетки, обладающие всеми основными свойствами этих клеток. Эти клетки определяют в соответствии с минимальными критериями для определения мультипотентных мезенхимальных стромальных клеток, установленных Комитетом по мезенхимальным и тканевым стволовым клетка Международного общества клеточной терапии. Это определение включает в себя адгезию на пластике при содержании в стандартных условиях культивирования, экспрессию CD105, CD73 и CD90 и отсутствие экспрессии CD45, CD34, CD14 или CD11b, CD79alpha или CD19 и поверхностных молекул HLA-DR, а также способность дифференцироваться в остеобласты, адипоциты и хондробласты in vitro (Dominici et al., 2006).
Способ получения исследуемого продукта Cellavita™ (Стволовые Клетки)
Для культивирования Cellavita™ могут использоваться только здоровые зубы детей в возрасте 6-12 лет. Законные представители детей отвечают на вопросник о соответствии требованиям здоровья ребенка, и образцы крови забирают для серологического тестирования для выявления инфекционных заболеваний, согласно рекомендации Руководства Еврокомиссии в отношении определенных технических требований к донорству (директива Комиссии 2006/17/ЕС). Обязательное тестирование включает тесты на ВИЧ-1 и -2 (анти-ВИЧ-1 и -2), HTLV-1 и -2 (Т-лимфотропный вирус человека), HBV (вирус гепатита В) (в частности, HBsAg, анти-НВс), HCV (вирус гепатита С) (в частности, анти-HCV-Ab) и Treponema pallidum (сифилис) (директива Комиссии 2006/17/ЕС).
Отбираются только здоровые зубы без зубных заболеваний, таких как зубной кариес, после естественной потери или хирургического удаления. Чтобы избежать ненужного тестирования, только тех доноров, чьи зубы имеют жизнеспособную пульпу для культивирования (определяется в лаборатории после двух недель культивирования клеток), просят вернуться в центр для тестирования соответствия требований к донорству (забор крови).
Забор зубов, контейнер, транспортировка
Немедленно после самопроизвольного выпадения зуб погружают в 3 мл стерильного раствора для транспортировки, состоящего из DMEM (среда Игла, модифицированная по Дульбекко) и 500 мМ гентамицина в 15 мл стерильной центрифужной пробирке. Зуб хранят при 4°С и подвергают обработке в течение 48-72 часов.
Процедура выделения и промывки пульпы
Недавно выпавший молочный зуб от здорового субъекта многократно промывают в стерильном растворе, содержащем 50% раствора пенициллина/стрептомицина (100 единиц/мл пенициллина, 100 единиц/мл стрептомицина) и 50% фосфатного буферного раствора (ФБР). Зубную пульпу извлекают из зуба с помощью стерильной иглы.
Выбор жизнеспособной пульпы в качестве сырья для наращивания стволовых клеток HIDPSC
Свежеприготовленную пульпу зуба (ПЗ) промывают в растворе, содержащем 3% раствора пенициллина/стрептомицина (100 единиц/мл пенициллина, 100 единиц/мл стрептомицина). Первоначальное культивирование и тестирование жизнеспособности пульпы зуба проводят в поддерживающей среде для пульпы зуба с добавлением 15% эмбриональной телячьей сыворотки (FBS, Hyclone), 100 единиц/мл пенициллина, 100 единиц/мл стрептомицина, 2 мМ L-глутамина и 2 мМ заменимых аминокислот. Эта процедура обычно занимает до одной недели. Как только ПЗ признают жизнеспособной, ее собирают и пассируют hIDPSC. Полученные hIDPSC крио консервируют в условиях GTP (надлежащая практика работы с культурами клеток и тканей) для будущих клинических исследований.
Описание предлагаемого производственного процесса
В одном аспекте производственный процесс включает этапы, приведенные на Фиг. 48, демонстрирующей первоначальный процесс выделения продукта Cellavita™ (Стволовые Клетки) и составления композиции партии. Вертикальный путь показывает процесс механического переноса (сбора) пульпы зуба для hIDPSC ранней популяции (выделенной из пульпы зуба до 5 сборов) и hIDPSC поздней популяции (выделенной из пульпы зуба после 5 сборов). Горизонтальный путь показывает традиционный ферментативный метод культивирования клеток, когда клетки заменяют с помощью повторяющихся пассажей. Окончательный продукт в партии представляет собой сумму hIDPSC, полученных из сбора пульпы зуба и пассажей (не более 5).
В другом аспекте технологический процесс включает этапы, показанные на Фиг. 48 и/или Фиг. 49. Процесс получения включает выделение Cellavita™ (Стволовые Клетки) и составления композиции партии. Вертикальный путь показывает механического переноса (сбора) пульпы зуба (ПЗ) для hIDPSC ранней популяции (выделенных из пульпы зуба до 5 сборов) и hIDPSC поздней популяции (выделенных из пульпы зуба после 5 сборов); горизонтальный путь показывает традиционный ферментативный метод культивирования клеток, когда клетки заменяют с помощью повторяющихся пассажей. Окончательный продукт в партии представляет собой сумму hIDPSC, полученных из сбора пульпы зуба и пассажей (не более 5).
Получение продукта Cellavita™ (Стволовые Клетки) выполняют в соответствующем существующему уровню техники чистом помещении с учетом правил GMP. В одном варианте реализации этот производственный процесс выполняют согласно этапам, описанным на Фиг. 50.
Сбор hIDPSC
Когда вокруг эксплантата пульпы зуба образуются полуконфлюэтные колонии hIDPSC, ПЗ переносят в новый сосуд для культивирования клеток для дальнейшего наращивания в поддерживающей среде для ПЗ.
Пассирование hIDPSC
hIDPSC промывают стерильным ФБР, диссоциируют раствором TrypLE и центрифугируют. Осадок ресуспендируют в поддерживающей среде для ПЗ и затем высевают в колбу для культивирования ткани (пассаж 1-Р1). Когда клетки достигают примерно 80% конфлюентности, их переносят в новую колбу (пассаж 2-Р2). Клетки инкубируют в увлажненном инкубаторе с 5% CO2.
Тесты безопасности перед замораживанием
hIDPSC из пассажа Р5 поддерживают в культуре в течение по меньшей мере 3-5 дней, затем собирают образцы среды, кондиционированной клетками, для тестирования на стерильность и микоплазму.
• Тест на стерильность выполняют согласно ISO-, GMP-сертифицированным методикам.
• Тестирование на микоплазму выполняют с использованием собственного теста ПЦР с обратной транскрипцией (EZ-PCR Biological Industries) и согласно ISO-, GMP-сертифицированным методикам.
Замораживание и хранение
Протокол замораживания hIDPSC адаптирован к стандартному протоколу замораживания для хранилища образцов - hIDPSC из Р5 переносят в 2 мл криоконсервационные флаконы, содержащие 1 мл среды для замораживания, состоящей из 90% FBS и 10% ДМСО (класс фармацевтической чистоты GMP/США). Крио консервируют 1×106 клеток на флакон.
Флаконы для крио консервации помещают в контейнер для замораживания Nalgene Cryo 1°C Freezing Container, заполненный изопропиловым спиртом, и выдерживают при -80°С в течение ночи. После этого флаконы переносят в парообразную фазу резервуара для хранения с жидким азотом и записывают места их хранения.
Контроль материалов
В Таблице 17 описан процесс, который используется для контроля материалов.
Пример 15. Онкогенность in vivo
Образование тератом является важным критерием при определении плюрипотентности любых плюрипотентных клеток, таких как эмбриональные или индуцированные плюрипотентные стволовые клетки (ES- и iPS-клетки). В наших исследованиях был установлен и использован единообразный протокол оценки способности клеток к образованию тератом, аналогичный протоколу, опубликованному недавно в работе Gropp et al., 2012. Наши и недавно опубликованные методы основаны на подкожной котрансплантации определенных количеств недифференцированных мышиных или человеческих ES- и iPS-клеток и Матригеля иммунодефицитным мышам. Было показано, что наш метод является в высокой степени воспроизводимым и эффективным при использовании 106 (в отличие от работы Gropp et al., 2012, где использовали 105 клеток) мышиных ES-клеток и человеческих iPS-клеток. В 100% случаев мы наблюдали образование тератомы у большого числа животных и при длительном наблюдении (до 6 месяцев). Мы также использовали эти методы для анализа биологической безопасности других взрослых МСК, таких как полученные из пульпы зуба молочных зубов, пуповины и жировой ткани.
Мы наблюдали развитие индуцированных плюрипотентных стволовых клеток из hIDPSC. Плюрипотентность клеток iPS, полученных из hIDPSC, тестировали по образованию тератом, при этом эмбриональные стволовые клетки (ES) человека и hIDPSC использовали в качестве контроля. Для получения тератом был использован рутинный протокол для ES-клеток (Hentze et al., 2009). В соответствии с этим протоколом 106 клеток каждой линии: клетки hIDPSC-iPS, клетки ES и hIDPSC инокулировали в мышцу задней ноги 4-недельного самца линии SCID. У животных, которым инокулировали клетки hIDPSC-iPS или клетки ES, через три месяца наблюдалось образование тератомы. Вместе с тем hIDPSC, которые использовались в этом исследовании в качестве отрицательного контроля и были инокулированы у 10 животных, не вызывали тератомы ни после трех, ни после шести месяцев наблюдения. Пять из этих животных сохраняли в живых в течение одного года, и даже после этого времени образования тератом не наблюдалось.
Гистологически образование тератомы из плюрипотентных стволовых клеток требует развития тканей, происходящих из трех зародышевых слоев. Для взрослых/мезенхимальных стволовых клеток учитывали любые изменения в целостности нормальной ткани в месте трансплантации. Через шесть месяцев животные, которым были инокулированы hIDPSC, и не развившие тератомы, были умерщвлены, и гистологические образцы головного мозга, легких, почек, селезенки и печени были проанализированы. Присутствие ДНК из hIDPSC было подтверждено во всех вышеупомянутых органах, но образования опухолей или каких-либо морфологических изменений обнаружено не было. Таким образом, мы установили безопасность регенерации клеток исследуемым продуктом Cellavita™ (Стволовые Клетки) в отношении образования опухолей и риска иммунного отторжения.
Кроме того, как показано в вышеупомянутых исследованиях с использованием hIDPSC на животных моделях повреждения спинного мозга, дефектов черепной кости, полного дефицита лимбальных стволовых клеток (TLSCD), мышечной дистрофии и остеонекроза головки бедренной кости (ONFH), случаев образования тератомы и/или риска иммунного отторжения не наблюдалось (Costa et. al., 2008; Kerkis et al., 2008; Monteiro et al., 2009; Gomes et al., 2010; Feitosa et al., 2010; Almeida et al., 2011).
На Фиг. 51 обобщены дополнительные уже опубликованные доклинические исследования, подтверждающие безопасность исследуемого продукта Cellavita™ (Стволовые Клетки).
Пример 16. Основной критерий для анализа на образование тератом
Мы оценили следующий критерий для анализа на образование тератом: чувствительность и количественность; окончательное число клеток и продуцирование суспензии одиночных клеток; иммунофенотипирование исследуемой клетки в отношении экспрессии по маркерам плюрипотентных клеток и кариотипу; котрансплантация исследуемых клеток вместе с Матригелем. Клетки трансплантировали подкожно (п/к) мышам линии NOD/SCID, что позволяет осуществлять простой мониторинг развития тератом.
Развитие опухолей отслеживали начиная с 4 месяцев (~16 недель). Гистологические критерии для тератом включали дифференцировку плюрипотентных клеток в клетки-производные трех зародышевых слоев. Такое исследование обычно проводил патологоанатом.
Для взрослых/мезенхимальных стволовых клеток учитывали любые изменения любого типа в целостности нормальной ткани в месте инъекции клеток.
Применение критерия образования тератом
А. Экспериментальная система(ы):
а. Эмбриональные стволовые клетки мыши
b. Фибробласты мыши 3Т3, перманентная клеточная линия мышей Balbc 3T3, клон А31
с. iPS-IDPSC человека
d. ES-клетки человека
е. IDPSC человека
Мы использовали вышеупомянутый метод в различных исследованиях для исследования плюрипотентности различных клеточных линий ES мыши, созданных нами, а также подтверждения плюрипотентности ES-клеток при большом числе пассажей, 25 или более, и для исследования субклонов, полученных из клеточных линий мыши ES (Sukoyan et al., 2002; Carta et al., 2006; Kerkis et al., 2007; Lavagnolli et al., 2007; Hayshi et al, 2010).
Кроме того, этот метод был использован для исследования плюрипотентности iPS-клеток, полученных из незрелых стволовых клеток пульпы зуба (IDPSC) в недавней публикации нашей группы (Beltrao-Braga et al., 2011). В этой публикации IDPSC человека использовали в качестве контроля для клеток iPS-IDPSC. Мы показали, что iPS-IDPSC формировали типичные тератомы с тканями, возникшими из всех трех зародышевых слоев, тогда как hIDPSC не были способны продуцировать какие-либо типы тератом или любые другие типы новообразований. Кроме того, iPS-IDPSC экспрессировали Nanog в ядре, а hIDPSC не экспрессировали его.
РЕЗУЛЬТАТЫ
Раскрытая эксплантоподобная культура клеток из нескольких сборов, используемая для выделения популяции незрелых стволовых клеток пульпы зуба (IDPSC), вызывает экспрессию маркеров эмбриональных стволовых клеток Oct-4, Nanog, SSEA-3, SSEA-4, TRA-1-60 и TRA-1-81, а также нескольких маркеров мезенхимальных стволовых клеток в течение по меньшей мере 15 пассажей при сохранении нормального кариотипа и скорости размножения, характерных для стволовых клеток. Экспрессия этих маркеров сохранялась в субклонах, полученных из этих клеток. Более того, in vitro эти клетки можно заставить единообразно дифференцироваться в гладкие и скелетные мышцы, нейроны, хрящ и кость в условиях культуры с химически определенным составом. Важно отметить, что IDPSC, хотя и имеют небольшой размер и цитоплазму, бедную клеточными органеллами, отличаются от интактных плюрипотентных клеток, презентирующих типичную мезенхимально-фибробласто подобную морфологию. Поэтому IDPSC являются клетками мезенхимального типа, в отличие от ES и iPS-клеток, которые являются клетками эпителиального типа. Принципиальная разница между МСК и ES- или iPS-клетками заключается в том, что МСК мигрируют и прикрепляются к пластику, они синтезируют внеклеточный матрикс и лишены межклеточных контактов.
В. Экспериментальная система(ы):
а. Три разных первичных культуры IDPSC на уровне ранних (n=10) и поздних пассажей (n=10)
b. Первичный фибробласт человека
Кроме того, этот способ был валидирован с использованием фетальных стволовых клеток собак из костного мозга, печени, желточного мешка, аллантоиса и амниотической жидкости, которые также экспрессируют плюрипотентные маркеры.
IDPSC состоят из популяции МСК с вариативным числом стволовых клеток, экспрессирующих плюрипотентные маркеры (1-25% клеток) (Lizier et al., 2012). Эти клетки трансплантировали мышам NOD/SCID (n=20), и отслеживали развитие опухолей начиная с 4 месяцев (~16 недель). Учитывали любые типы изменения нормальной целостности тканей в месте инъекции клеток. Этот протокол адаптировали для популяции IDPSC, особенно в отношении используемого количества клеток, которое рассчитывали исходя из того, что 20% IDPSC экспрессируют плюрипотентные маркеры. В наших предыдущих тестах с ES- и iPS-клетками мы использовали 106 клеток, тогда как для тестирования тератогенности IDPSC и контрольных клеток использовали 5×106 клеток. Через 4 месяца, даже если макроскопически опухоли не наблюдались, мышей умерщвляли, получали замороженные срезы из различных органов, таких как мозг, легкие, почки, селезенка, печень, и анализировали их с помощью патологоанатома.
Хотя во всех изученных органах было обнаружено присутствие ДНК IDPSC, образования опухолей или каких-либо морфологических изменений выявлено не было.
ССЫЛКИ
1. Altman J and Das GD. Post-natal origin of microneurones in the rat brain. Nature 1965; 207:953-956
2. Bachoud-Levi AC, Gaura V, Brugieres P, et al. Effect of fetal neural transplants in patients with Huntingdon's disease 6 years after surgery: a long-term follow-up study. Lancet Neurol 2006; 5: 303-09.
3. Baker SA, Baker KA and Hagg T. Dopaminergic nigrostriatal projections regulate neural precursor proliferation in the adult mouse subventricular zone. Eur J Neurosci 2004; 20:575-579
4. Brito et al., Imbalance of p75NTR/TrkB protein expression in Huntingdon's disease: implication for neuroprotective therapies. Cell Death and Disease (2013) 4, e595; doi:10.1038/cddis.2013.116
5. Lescaudron L, Unni D, Dunbar GL. Autologous adult bone marrow stem cell transplantation in an animal model of huntington's disease: behavioral and morphological outcomes. Int J Neurosci 2003; 113:945-956.
6. Vatzey ЕМ, Chen K, Hughes SM, Connor B: Transplanted adult neural progenitor cells survive, differentiate and reduce motor function impairment in a rodent model of Huntington's disease. Exp Neurol 2006; 199:384-396.
7. С. Uboldi, A.  , C. Alt, P. Estess, M. Siegelman, and B. Engelhardt, "L-Selectin-deficient SJL and C57BL/6 mice are not resistant to experimental autoimmune encephalomyelitis," European Journal of Immunology, vol. 38, no. 8, pp. 2156-2167, 2008.
, C. Alt, P. Estess, M. Siegelman, and B. Engelhardt, "L-Selectin-deficient SJL and C57BL/6 mice are not resistant to experimental autoimmune encephalomyelitis," European Journal of Immunology, vol. 38, no. 8, pp. 2156-2167, 2008.
8. B. Engelhardt, "Immune cell entry into the central nervous system: involvement of adhesion molecules and chemokines," Journal of the Neurological Sciences, vol. 274, no. 1-2, pp. 23-26, 2008.
9. S. Kim, K. A. Chang, J. Kim et al., "The preventive and therapeutic effects of intravenous human adipose-derived stem cells in Alzheimer's disease mice," PLoS ONE, vol. 7, no. 9, Article ID e45757, 2012.
10. D. Jeon, K. Chu, S. Lee et al., "A cell-free extract from human adipose stemcells protects mice against epilepsy," Epilepsia, vol. 52, no. 9, pp. 1617-1626, 2011.
11. Mullen RJ1, Buck CR, Smith AM. NeuN, a neuronal specific nuclear protein in vertebrates. Development. 1992 Sep; 116(1):201-11.
12. Shuo Liu, Dritan Agalliu, Chuanhui Yu and Mark Fisher. The Role of Pericytes in Blood-Brain Barrier Function and Stroke. Current Pharmaceutical Design, 2012, 18, 3653-3662.
13. De Miguel MP,  S,
S,  A, Pascual CY, Aller MA, Arias J, Amalich-Montiel F. Immunosuppressive properties of mesenchymal stem cells: advances and applications. Curr Mol Med. 2012 Jun; 12(5):574-91.
A, Pascual CY, Aller MA, Arias J, Amalich-Montiel F. Immunosuppressive properties of mesenchymal stem cells: advances and applications. Curr Mol Med. 2012 Jun; 12(5):574-91.
14. Le Blanc K,  O. Mesenchymal stem cells: properties and role in clinical bone marrow transplantation. Curr Opin Immunol. 2006 Oct; 18(5):586-91. Epub 2006 Aug 1.
O. Mesenchymal stem cells: properties and role in clinical bone marrow transplantation. Curr Opin Immunol. 2006 Oct; 18(5):586-91. Epub 2006 Aug 1.
15. Karen English Mechanisms of mesenchymal stromal cell immunomodulation. Immunol Cell Biol 91: 19-26; advance online publication, October 23, 2012; doi:10.1038/icb.2012.56
16. Matthew D Griffin, Aideen E Ryan, Senthilkumar Alagesan, Paul Lohan, Oliver Treacy and Thomas Ritter Anti-donor immune responses elicited by allogeneic mesenchymal stem cells: what have we learned so far? Immunol Cell Biol 91: 40-51; advance online publication, December 4, 2012; doi:10.1038/icb.2012.67
17. Svenningsson P, Nishi A, Fisone G, Girault JA, Nairn AC, Greengard P. DARPP-32: an integrator of neurotransmission. Annu Rev Pharmacol Toxicol. 2004; 44:269-96.
18. Crook ZR, Housman DE. Dysregulation of dopamine receptor D2 as a sensitive measure for Huntington disease pathology in model mice. Proc Natl Acad Sci USA. 2012 May 8; 109(19):7487-92. doi: 10.1073/pnas.1204542109. Epub 2012 Apr 23.
19. Chen JY, Wang EA, Cepeda C, Levine MS. Dopamine imbalance in Huntingdon's disease: a mechanism for the lack of behavioral flexibility. Front Neurosci. 2013 Jul 4; 7:114. doi: 10.3389/fnins.2013.00114. eCollection 2013.
20. Parent M,  C, Pourcher E. Am J Neurodegener Dis. 2013 Sep 18; 2(3):221-7.
C, Pourcher E. Am J Neurodegener Dis. 2013 Sep 18; 2(3):221-7.
21. Hoglinger GU, Rizk P, Muriel MP, Duyckaerts C, Oertel WH, Caille I and Hirsch EC.. Nat Neurosci 2004; 7: 726-735).
22. Wernig M, et al. Proc Natl Acad Sci USA. 2008; 105:5856-5861; Caiazzo M, et al. Nature. 2011; 476:224-227;
23. Lindvall, О. & Kokaia, Z., J Clin Invest, 2010 120, 29.
24. Calissano P, Matrone C, Amadoro G: Nerve growth factor as a paradigm of neurotrophins related to Alzheimer's disease. Dev Neurobiol 2010, 70:372-383.
25. M, Togari A, Kondo T, Mizuno Y, Komure O, Kuno S, Ichinose H, Nagatsu T: Brain-derived growth factor and nerve growth factor concentrations are decreased in the substantia nigra in Parkinson's disease. Neurosci Lett 1999, 270:45-48;
26. Gauthier LR, Charrin ВС, Borrell-Pages M, Dompierre JP, Rangone H, Cordelieres FP, De Mey J, MacDonald ME, Lessmann V, Humbert S, Saudou F: Huntingtin controls neurotrophic support and survival of neurons by enhancing BDNF vesicular transport along microtubules. Cell 2004, 118:127-138;
27. Strand AD, Baquet ZC, Aragaki AK, Holmans P, Yang L, Cleren C, Beal MF, Jones L, Kooperberg C, Olson JM, Jones KR: Expression profiling of Huntington's disease models suggests that brain-derived neurotrophic factor depletion plays a major role in striatal degeneration. J Neurosci 2007, 27:11758-11768;
28. Wictorin K, Bjorklund A, Williams LR, Varon S, Gage FH: Amelioration of cholinergic neuron atrophy and spatial memory impairment in aged rats by nerve growth factor Nature 1987, 329:65-68
29. Sukoyan MA, Kerkis AY, Mello MR, Kerkis IE, Visintin JA, Pereira LV. Establishment of new murine embryonic stem cell lines for the generation of mouse models of human genetic diseases. Braz J Med Biol Res. 2002 May; 35(5):535-42.
30. Carta L, Pereira L, Arteaga-Solis E, Lee-Arteaga SY, Lenart B, Starcher B, Merkel CA, Sukoyan M, Kerkis A, Hazeki N, Keene DR, Sakai LY, Ramirez F.Fibrillins 1 and 2 perform partially overlapping functions during aortic development. J Biol Chem. 2006 Mar 24; 281(12):8016-23
31. Kerkis A, Fonseca SA, Serafim RC, Lavagnolli TM, Abdelmassih S, Abdelmassih R, Kerkis I. In vitro differentiation of male mouse embryonic stem cells into both presumptive sperm cells and oocytes. Cloning Stem Cells. 2007 Winter; 9(4):535-48.
32. Lavagnolli TM, Fonseca SA, Serafim RC, Pereira VS, Santos EJ, Abdelmassih S, Kerkis A, Kerkis I. Presumptive germ cells derived from mouse pluripotent somatic cell hybrids. Differentiation. 2009 Sep-Oct; 78(2-3): 124-30
33. Hayashi MA, Guerreiro JR, Cassola AC, Lizier NF, Kerkis A, Camargo AC, Kerkis I. Long-term culture of mouse embryonic stem cell-derived adherent neurospheres and functional neurons. Tissue Eng Part C Methods. 2010 Dec; 16(6):1493-502.
34. Lima BL, Santos EJ, Fernandes GR, Merkel C, Mello MR, Gomes JP, Soukoyan M, Kerkis A, Massironi SM, Visintin JA, Pereira LV A new mouse model for marfan syndrome presents phenotypic variability associated with the genetic background and overall levels of Fbnl expression. PLoS One. 2010 Nov 30; 5(11):e14136.
35.  PC, Pignatari GC, Maiorka PC, Oliveira NA, Lizier NF, Wenceslau CV, Miglino MA, Muotri AR, Kerkis I. Feeder-free derivation of induced pluripotent stem cells from human immature dental pulp stem cells. Cell Transplant. 2011; 20(11-12):1707-19.
PC, Pignatari GC, Maiorka PC, Oliveira NA, Lizier NF, Wenceslau CV, Miglino MA, Muotri AR, Kerkis I. Feeder-free derivation of induced pluripotent stem cells from human immature dental pulp stem cells. Cell Transplant. 2011; 20(11-12):1707-19.
36. Bunting KD ABC transporters as phenotypic markers and functional regulators of stem cells. Stem Cells. 2002; 20(1):11-20.
37. Islam МО et al. Characterization of ABC transporter ABCB1 expressed in human neural stem/progenitor cells. FEBS letters. 2005 579(17): 3473-3480.
38. Mead В, Logan A, Berry M, Leadbeater W, Scheven BA. Intravitreally transplanted dental pulp stem cells promote neuroprotection and axon regeneration of retinal ganglion cells after optic nerve injury. Invest Ophthalmol Vis Sci. 2013; 54:7544-7556.
39. Mead B, Logan A, Berry M, Leadbeater W, Scheven BA. Paracrine-me dialed neuroprotection and neurito genes is of axotomised retinal ganglion cells by human dental pulp stem cells: comparison with human bone marrow and adipose-derived mesenchymal stem cells. PLoS One. 2014 Oct 7; 9(10).
40. Martens W, Sanen K, Georgiou M, Struys T, Bronckaers A, et al. Human dental pulp stem cells can differentiate into Schwann cells and promote and guide neurite outgrowth in an aligned tissue-engineered collagen construct in vitro. (2013) The FASEB Journal.
41. Sakai K, Yamamoto A, Matsubara K, Nakamura S, Naruse M, Yamagata M, Sakamoto K, Tauchi R, Wakao N, Imagama S, Hibi H, Kadomatsu K, Ishiguro N, Ueda M. Human dental pulp-derived stem cells promote locomotor recovery after complete transection of the rat spinal cord by multiple neuro-re generative mechanisms. J Clin Invest. 2012; 122: 80-90.
42. Rampon С, Weiss N, Deboux С, Chaverot N, Miller F, Buchet D, Tricoire-Leignel H, Cazaubon S, Baron-Van Evercooren A, Couraud PO. Molecular mechanism of systemic delivery of neural precursor cells to the brain: assembly of brain endothelial apical cups and control of transmigration by CD44. Stem Cells. 2008 Jul; 26(7): 1673-82.
43. Schu S, Nosov M,  , Shaw G, Treacy O, Barry F, Murphy M,
, Shaw G, Treacy O, Barry F, Murphy M,  , Ritter T. Immunogenicity of allogeneic mesenchymal stem cells. J Cell Mol Med. 2012; 16:2094-2103.
, Ritter T. Immunogenicity of allogeneic mesenchymal stem cells. J Cell Mol Med. 2012; 16:2094-2103.
44. Weinger JG, Weist BM, Plaisted WC, Klaus SM, Walsh CM, Lane ТЕ. МНС mismatch results in neural progenitor cell rejection following spinal cord transplantation in a model of viral-induced demyelination. Stem Cells. 2012 Nov; 30(11):2584-950
45. Bifari F, Pacelli L, Krampera M. Immunological properties of embryonic and adult stem cells. World J Stem Cells. 2010; 2:50-60.
46. Bertram L, McQueen MB, Mullin K, Blacker D, Tanzi RE. (2007) "Systematic meta-analyses of Alzheimer disease genetic association studies: the AIzGene database." Nat Genet 39(1): 17-23.
47. Jared В. Vasquez.a David W. Fardo,b and Steven Estusa,* ABCA7 expression is associated with Alzheimer's disease polymorphism and disease status. Neurosci Lett. Nov 27, 2014
48. Yamagata et al. Human Dental Pulp-Derived Stem Cells Protect Against Hypoxic-Ischemic Brain Injury in Neonatal Mice. Stroke. 2013; 44:551-554.
49. Albensi, В.С., Sullivan, P.G, Thompson, M.В., Scheff, S.W. & Mattson, M.P. Cyclosporine ameliorates traumatic brain injury-induced alterations of hippocampal synaptic plasticity. Exp. Neurol. 162, 385-389 (2000).
50. Matsumoto, S., Friberg, H., Ferrand-Drake, M. & Wieloch, T. Blockade of the mitochondrial permeability transition pore diminishes infarct size in the rat after transient middle cerebral artery occlusion. J. Cereb. Blood Flow Metab. 19, 736-741 (1999).
51. Leventhal L, Jeffrey H. Kordower Cyclosporine A Protects Striatal Neurons from Mitochondrial Dysfunction. Immuno suppress ant Analogs in Neuroprotection. 2003, pp 159-174.
52. Lee, R.H., Pulin, A.A., Seo, M.J., Kota, D.J., Ylostalo, J., Larson, B.L., Semprun-Prieto, L., Delafontaine, P., Prockop, D.J., 2009. Intravenous hMSCs improve myocardial infarction in mice because cells embolized in lung are activated to secrete the anti-inflammatory protein TSG-6. Cell Stem Cell 5 (1), 54-63.
53. Grigoriadis N, Lourbopoulos A, Lagoudaki R, Frischer Jm, Polyzoidou E, Touloumi O, Simeonidou C, Deretzi G, Kountouras J, Spandou E, Kotta K, Karkavelas G, Tascos N, Lassmann H (2011) Variable behavior and complications of autologous bone marrow mesenchymal stem cells transplanted in experimental autoimmune encephalomyelitis. Experimental neurology 230: 78-89.
54. E.Y. Snyder. The risk of putting something where it does not belong: Mesenchymal stem cells produce masses in the brain Experimental Neurology 230 (2011) 75-77.
55. Dagur PK, McCoy JP Jr. Endothelial-binding, pro inflammatory T cells identified by MCAM (CD146) expression: Characterization and role in human autoimmune diseases. Autoimmun Rev. 2015 May; 14(5):415-22.
56. Ryu JK, Kim J, Cho SJ, Hatori K, Nagai A, Choi HB, et al. Proactive transplantation of human neural stem cells prevents degeneration of striatal neurons in a rat model of Huntington disease. Neurobiol Dis. 2004; 16:68-77.
57. Zuccato C, Ciammola A, Rigamonti D, Leavitt BR, Goffredo D, Conti L, et al. Loss of huntingtin-mediated BDNF gene transcription in Huntington's disease. Science. 2001; 293(5529):493-8.
58. Zuccato C, Cattaneo E. Brain-derived neurotrophic factor in neurodegenerative diseases. Nat Rev Neurol. 2009; 5(6):311-22.
59. Altar CA, Cai N, Bliven T, Juhasz M, Conner JM, Acheson AL, et al. Anterograde transport of brain-derived neurotrophic factor and its role in the brain. Nature. 1997; 389(6653):856-60.
60. Baquet ZC, Gorski JA, Jones KR. Early striatal dendrite deficits followed by neuron loss with advanced age in the absence of anterograde с orticalbrain-derived neurotrophic factor. J Neurosci. 2004; 24(17):4250-8.
61. Zuccato C, Cattaneo E. Role of brain-derived neurotrophic factor in Huntingdon's disease. Prog Neurobiol. 2007; 81(5-6):294-330.
62.  M, Xu B. BDNF signaling and survival of striatal neurons. Front Cell Neurosci. 2014; 8:254.
M, Xu B. BDNF signaling and survival of striatal neurons. Front Cell Neurosci. 2014; 8:254.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ СТВОЛОВЫХ КЛЕТОК, ЭКСПРЕССИРУЮЩИХ МЕЗЕНХИМАЛЬНЫЕ И НЕЙРОНАЛЬНЫЕ МАРКЕРЫ, И ИХ КОМПОЗИЦИЙ ДЛЯ ЛЕЧЕНИЯ НЕВРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ (ВАРИАНТЫ) | 2017 |
|
RU2742828C2 |
| КОМПОЗИЦИИ СТВОЛОВЫХ КЛЕТОК И СПОСОБЫ ПОЛУЧЕНИЯ СТВОЛОВЫХ КЛЕТОК ДЛЯ ПРИМЕНЕНИЯ В ТЕРАПИИ | 2015 |
|
RU2714236C2 |
| ПОЛУЧЕНИЕ ТЕРМИНАЛЬНО ДИФФЕРЕНЦИРОВАННЫХ ДОФАМИНЕРГИЧЕСКИХ НЕЙРОНОВ ИЗ ЭМБРИОНАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ЧЕЛОВЕКА | 2004 |
|
RU2345133C2 |
| СПОСОБЫ ОЧИСТКИ КЛЕТОК, ПРОИЗВОДНЫХ ОТ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК | 2011 |
|
RU2607380C2 |
| СПОСОБЫ ОЧИСТКИ КЛЕТОК, ПРОИЗВОДНЫХ ОТ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК | 2011 |
|
RU2702198C2 |
| ПОЛУЧЕНИЕ ГАМКергических НЕЙРОНОВ in vitro ИЗ ЭМБРИОНАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ НЕВРОЛОГИЧЕСКИХ РАССТРОЙСТВ | 2004 |
|
RU2380410C2 |
| ТРАНСПЛАНТАЦИЯ НЕРВНЫХ КЛЕТОК ДЛЯ ЛЕЧЕНИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ СОСТОЯНИЙ | 2005 |
|
RU2434636C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОПУЛЯЦИИ СТРОМАЛЬНЫХ КЛЕТОК ЖИРОВОЙ ТКАНИ, ИНДУЦИРОВАННЫХ К НЕЙРАЛЬНОЙ ДИФФЕРЕНЦИРОВКЕ | 2008 |
|
RU2396345C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИНДУЦИРОВАННЫХ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК ИЗ ФИБРОБЛАСТОВ ПАЦИЕНТОВ С БОЛЕЗНЬЮ ХАНГИНГТОНА | 2011 |
|
RU2458983C1 |
| Ноотропная композиция на основе полипептидных комплексов, выделенных из нейронов и глиальных клеток, полученных методом направленной дифференцировки индуцированных плюрипотентных стволовых клеток человека | 2018 |
|
RU2690846C1 |
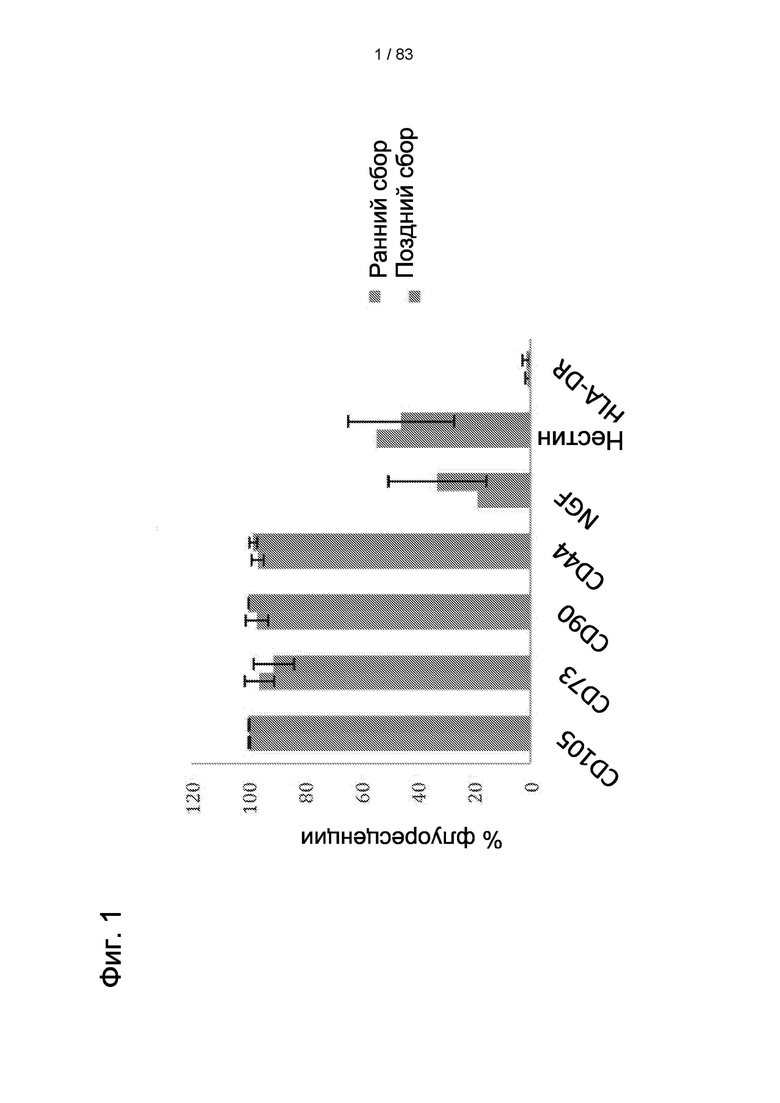

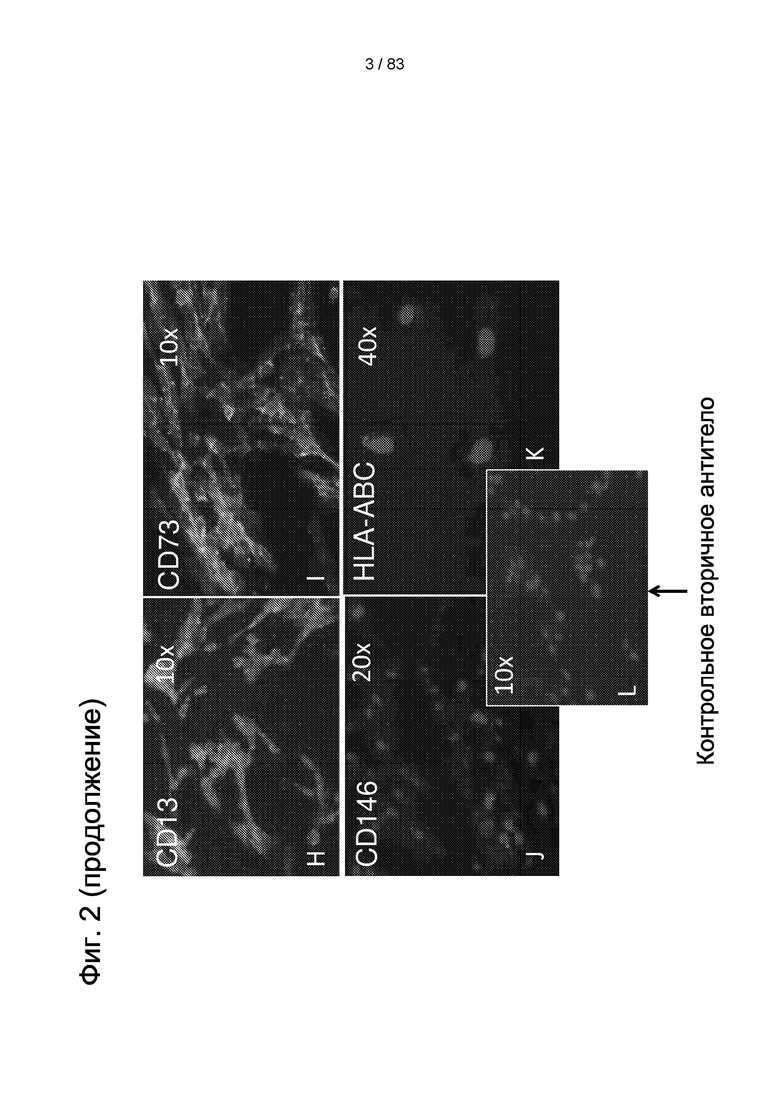
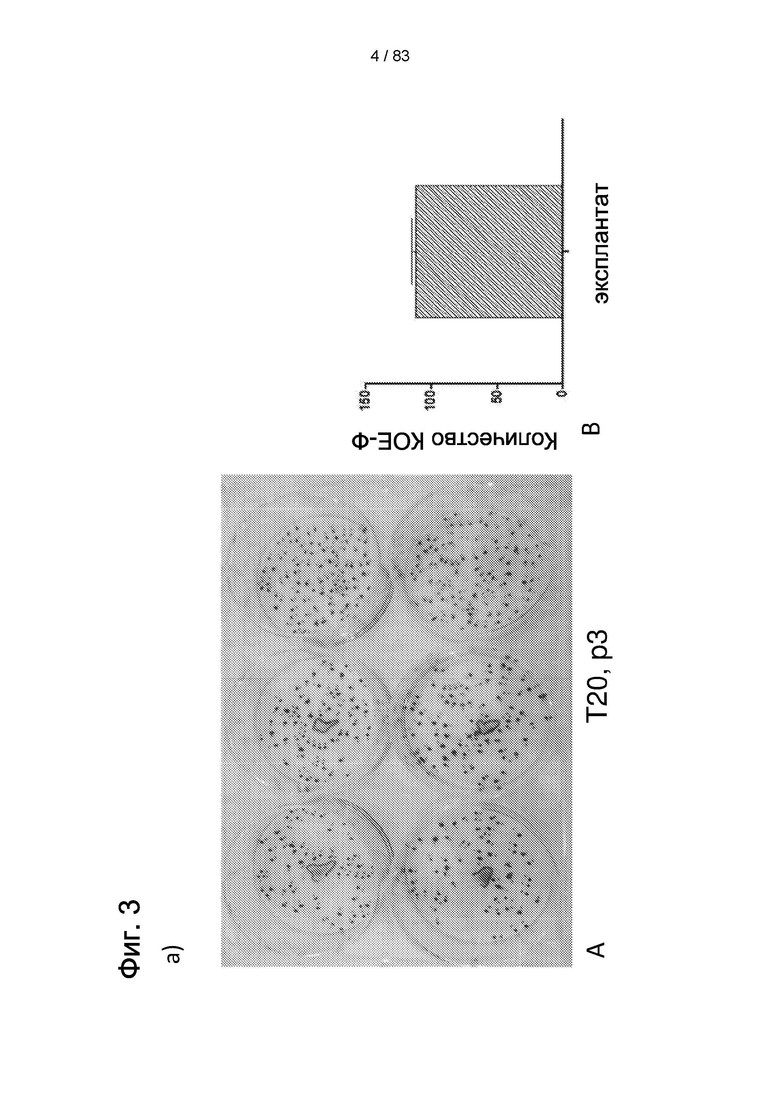
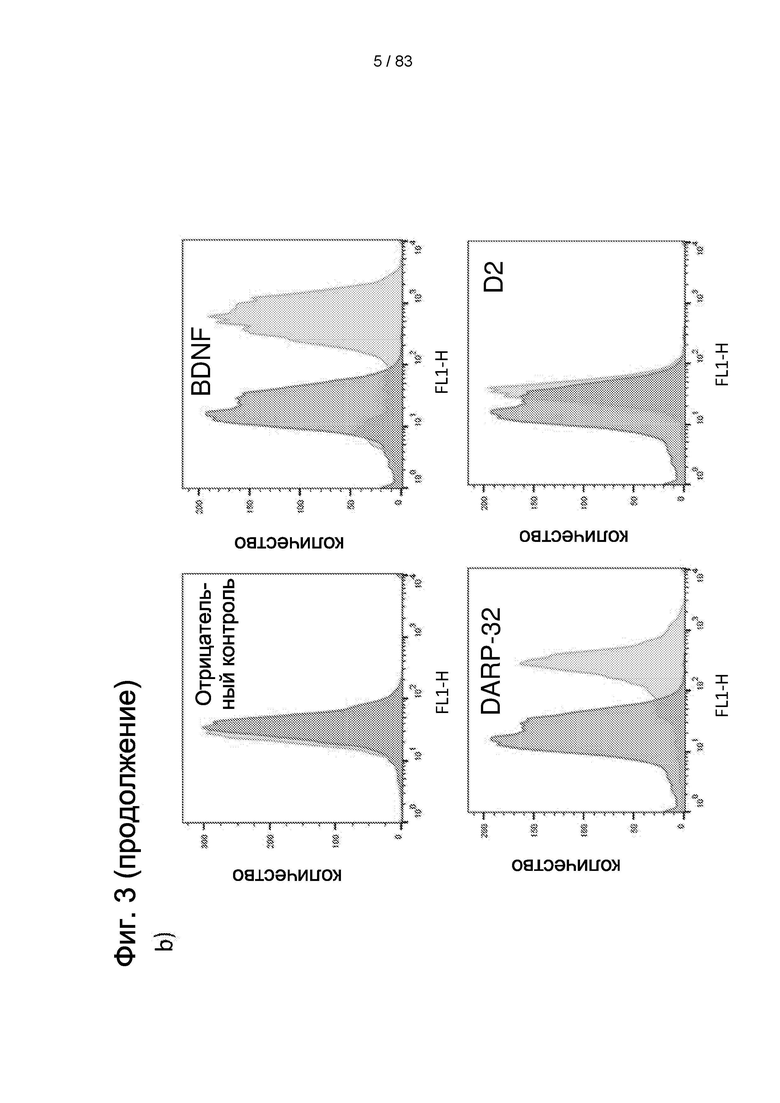
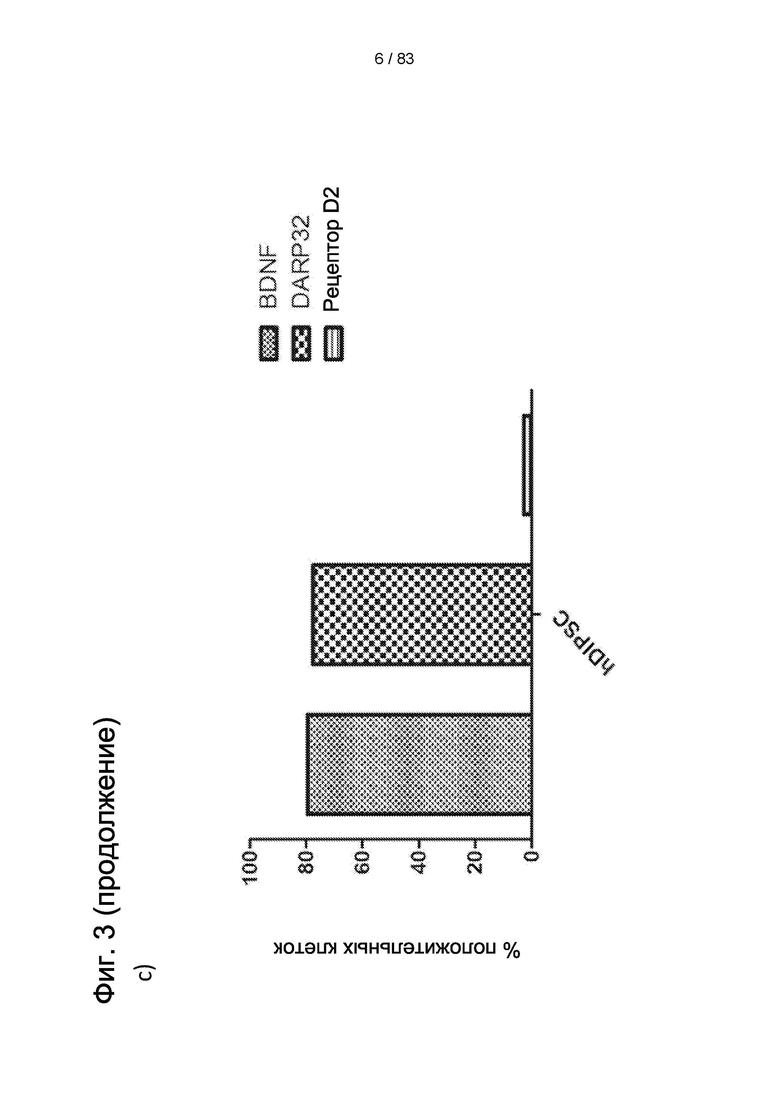
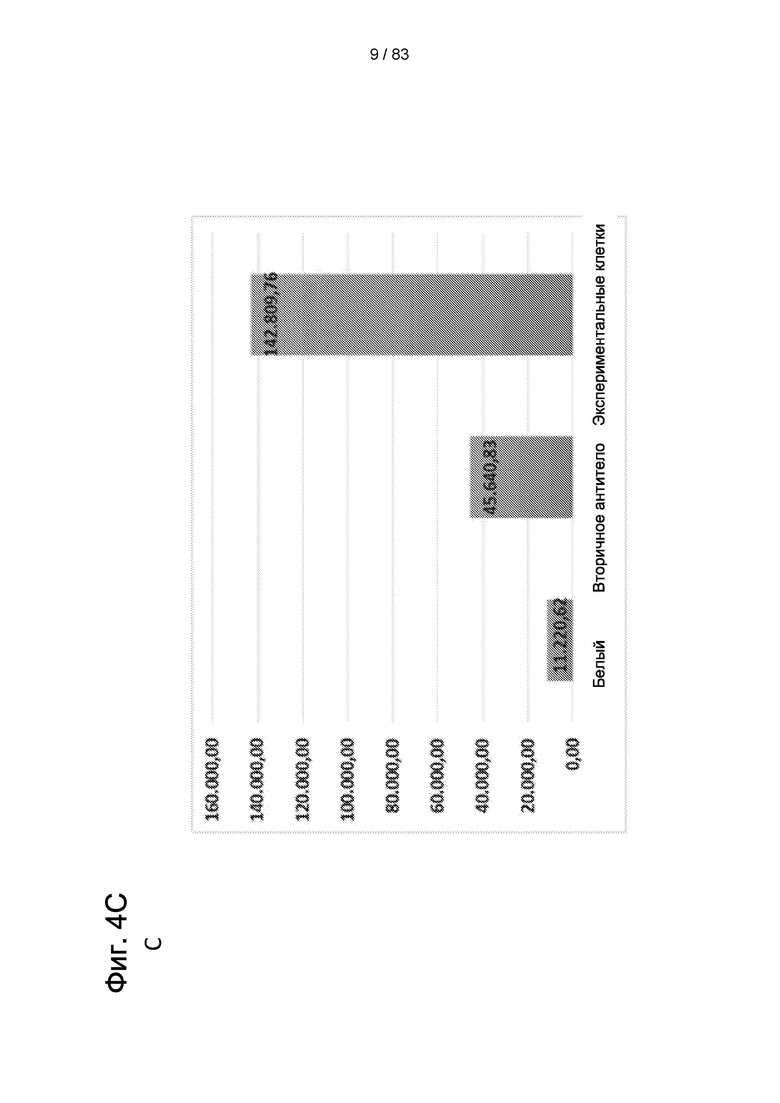
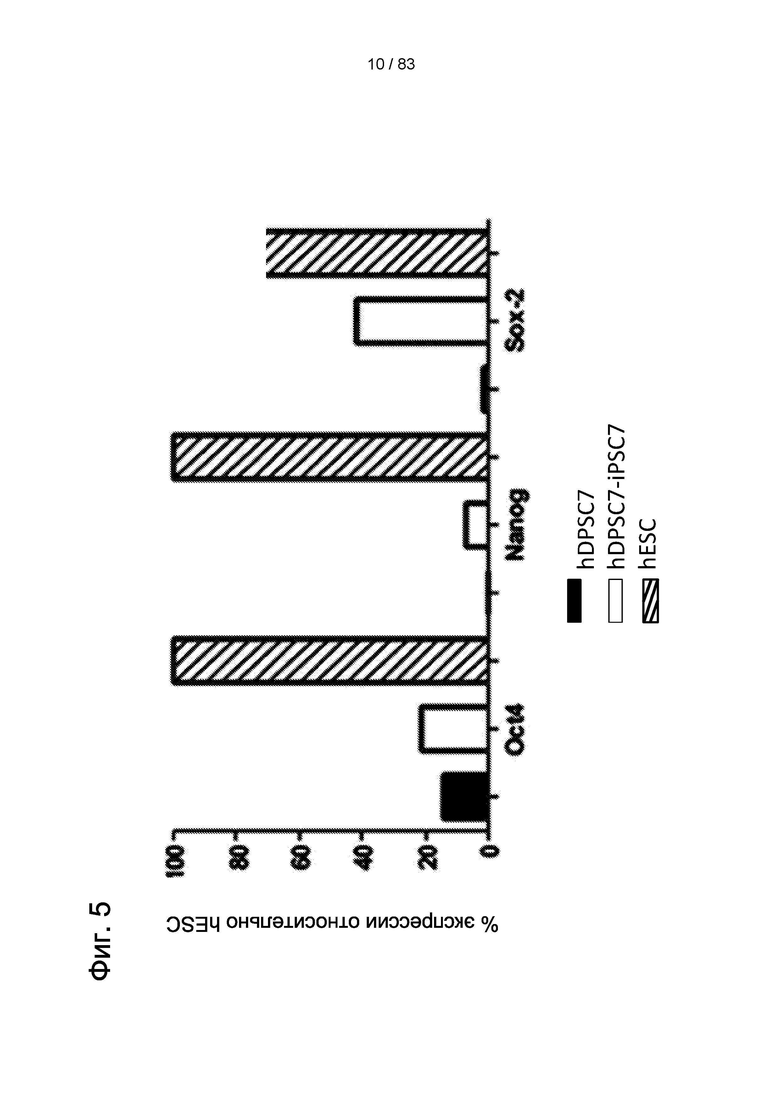
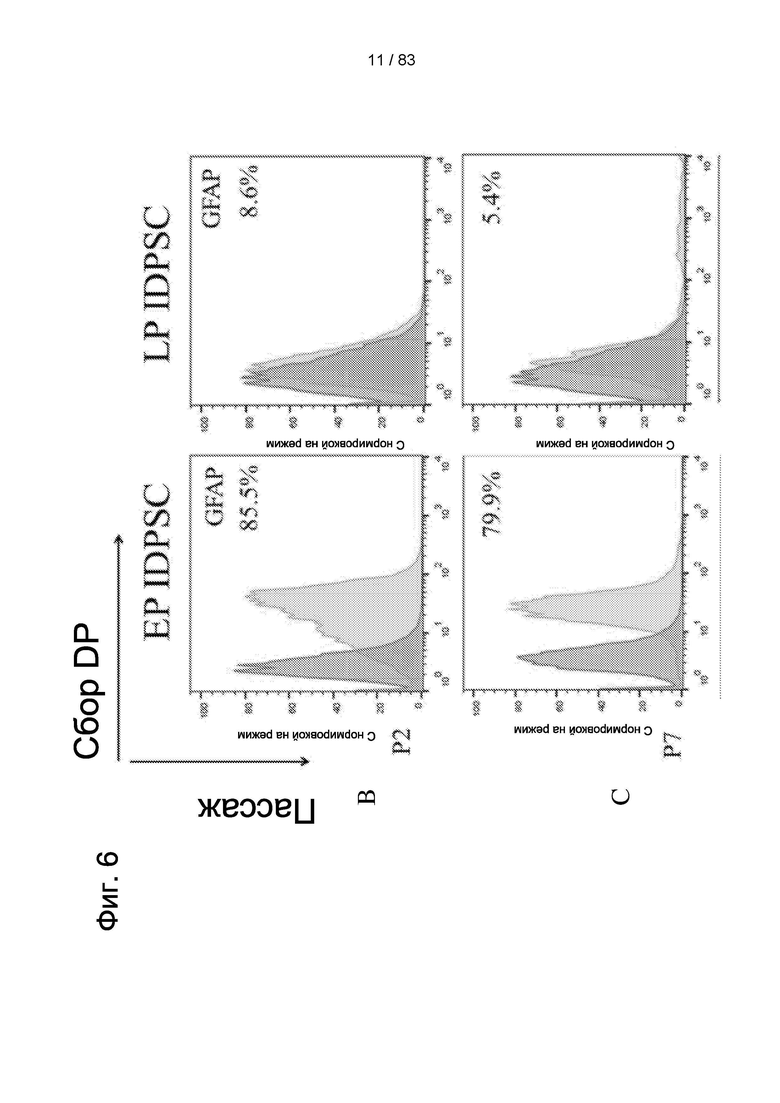
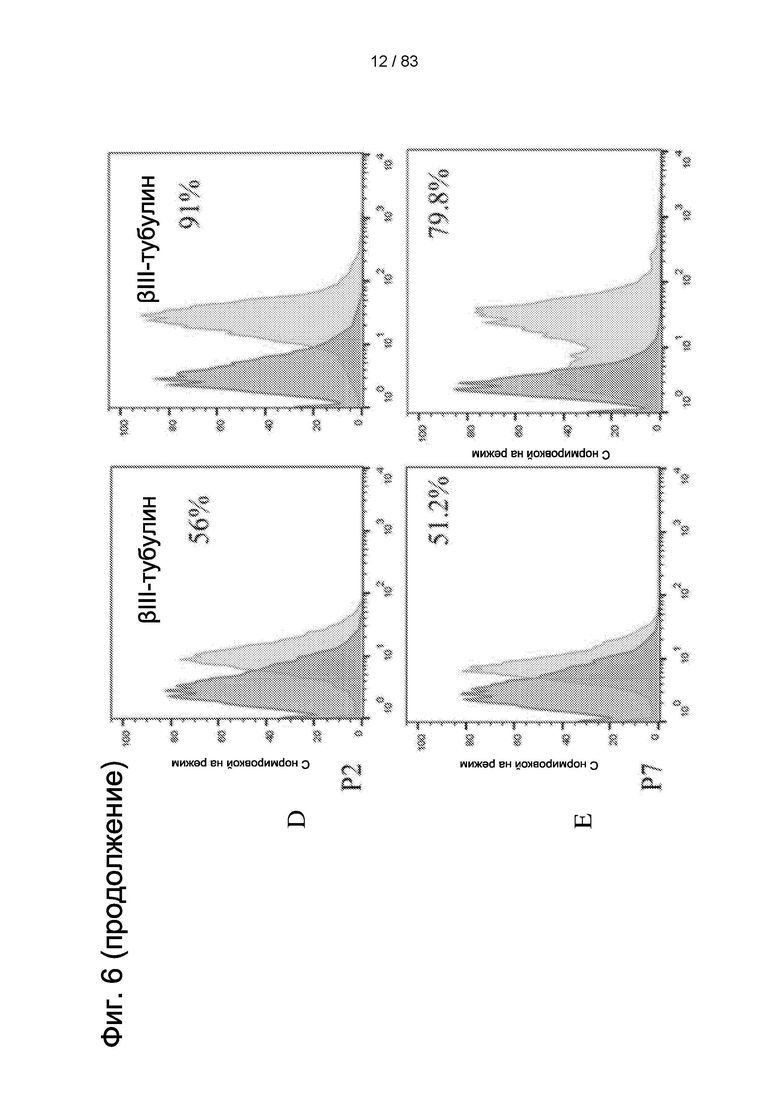
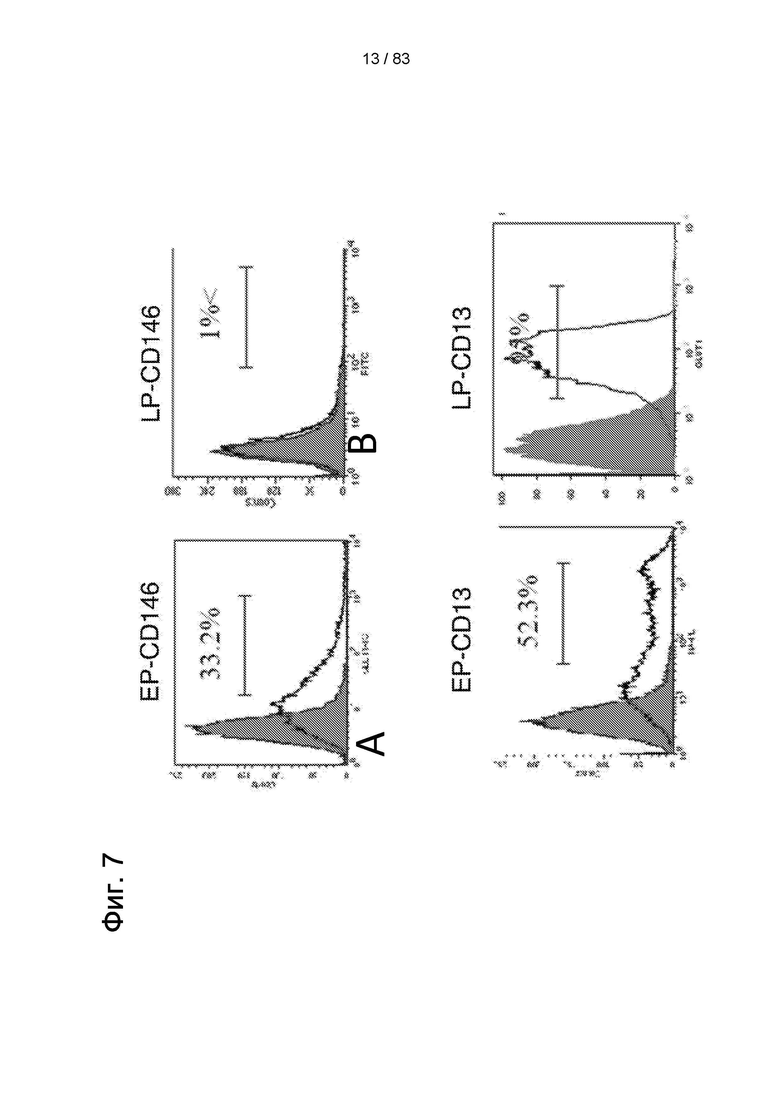
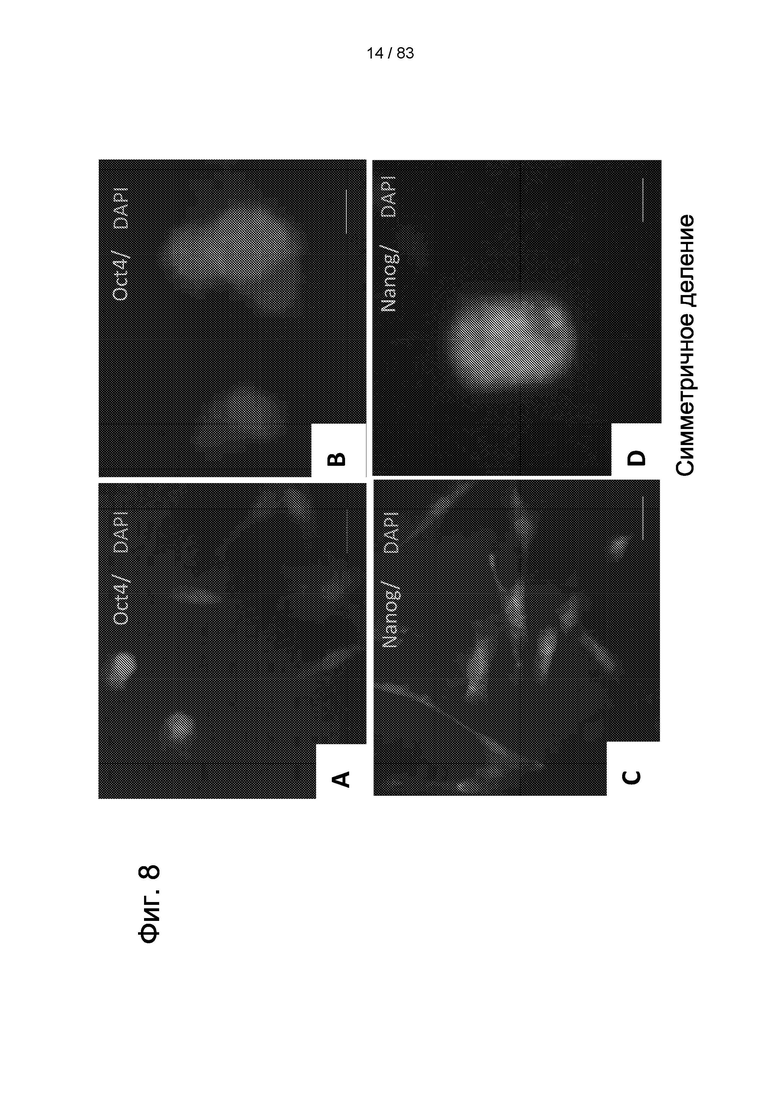
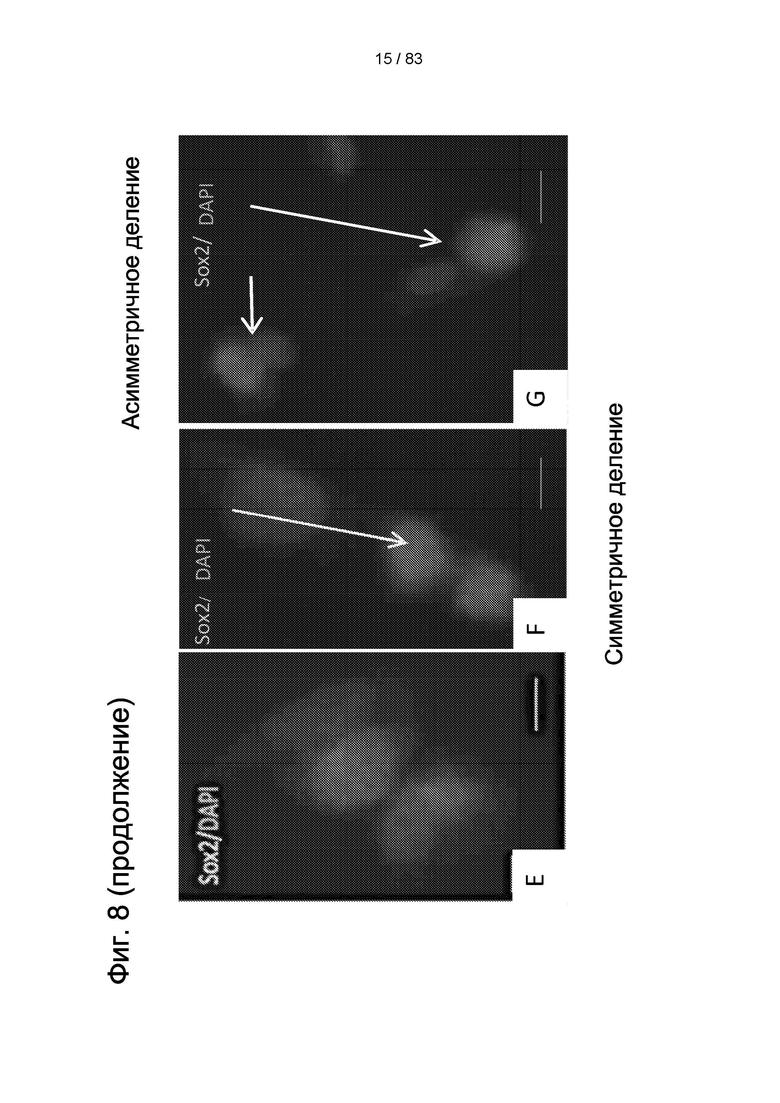
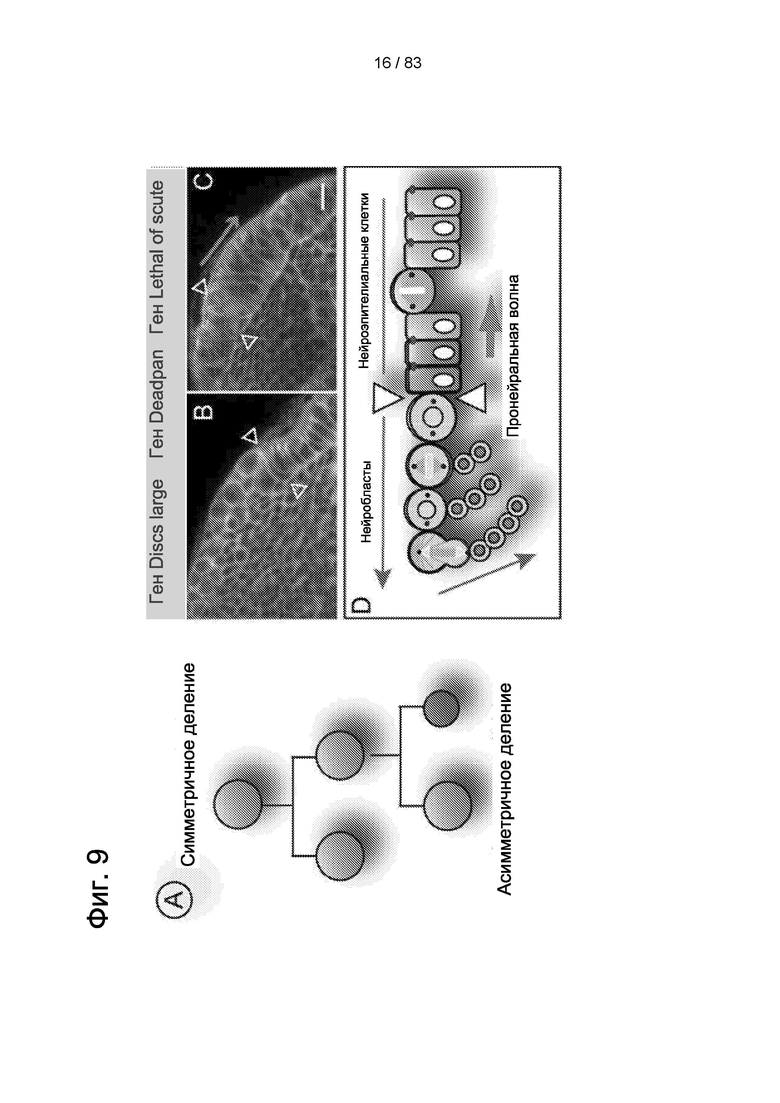
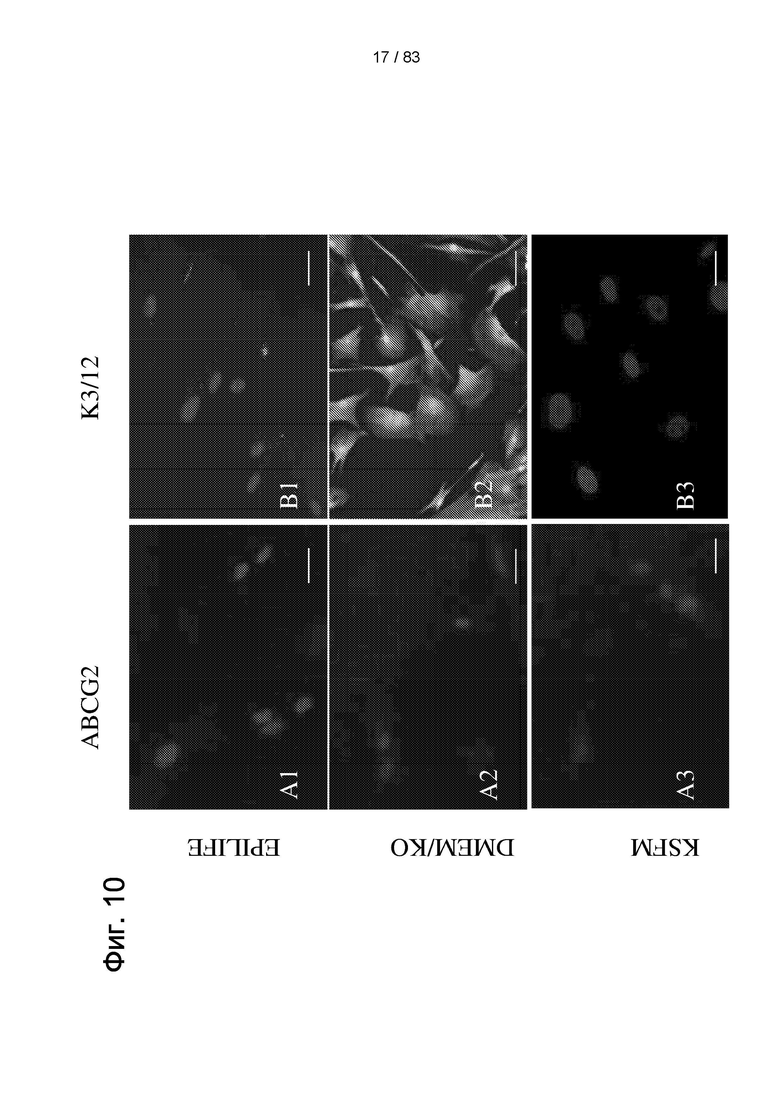
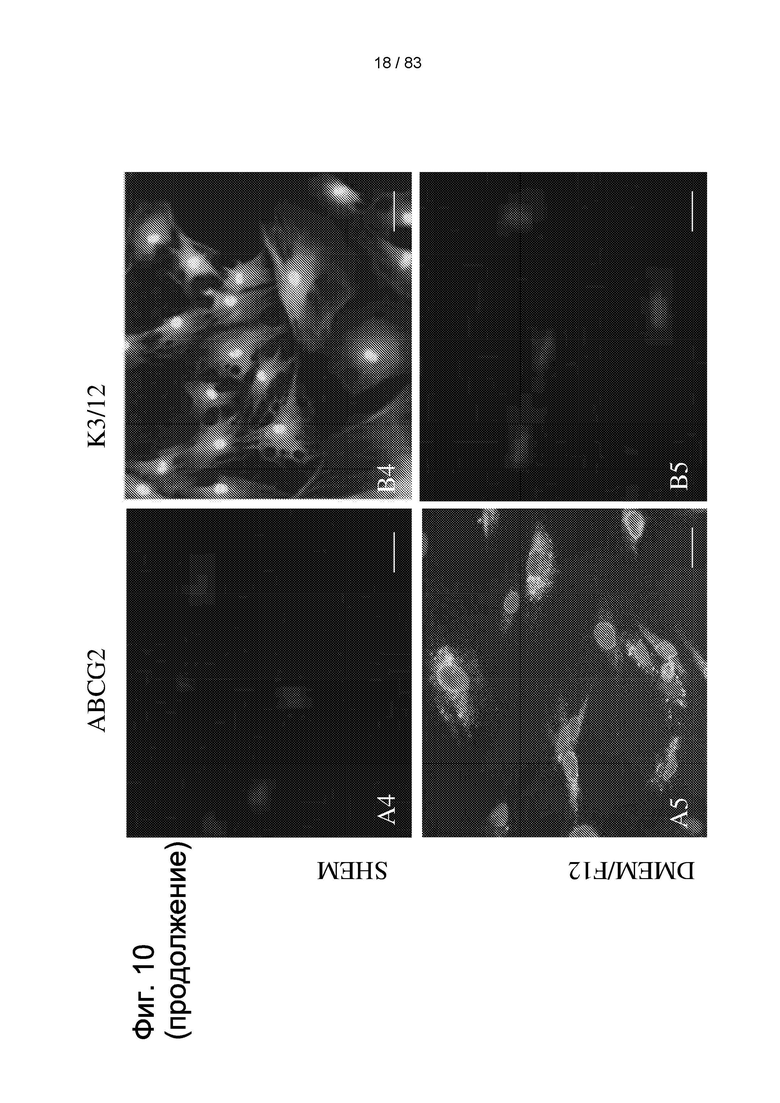
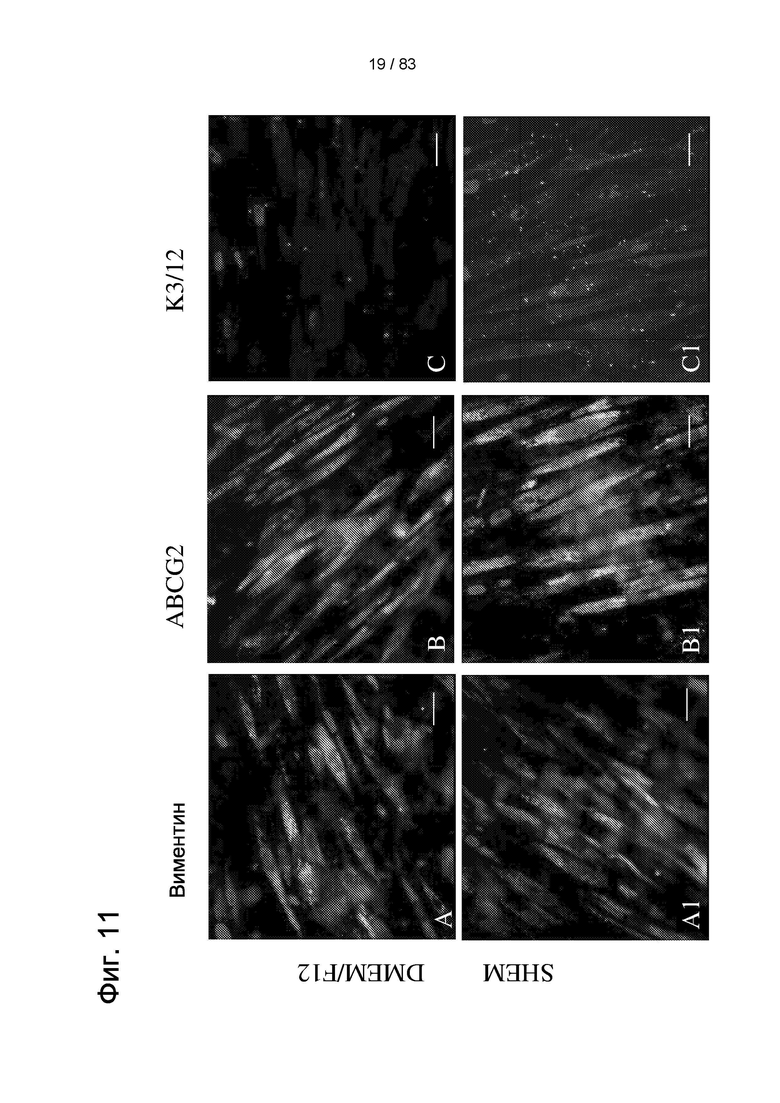
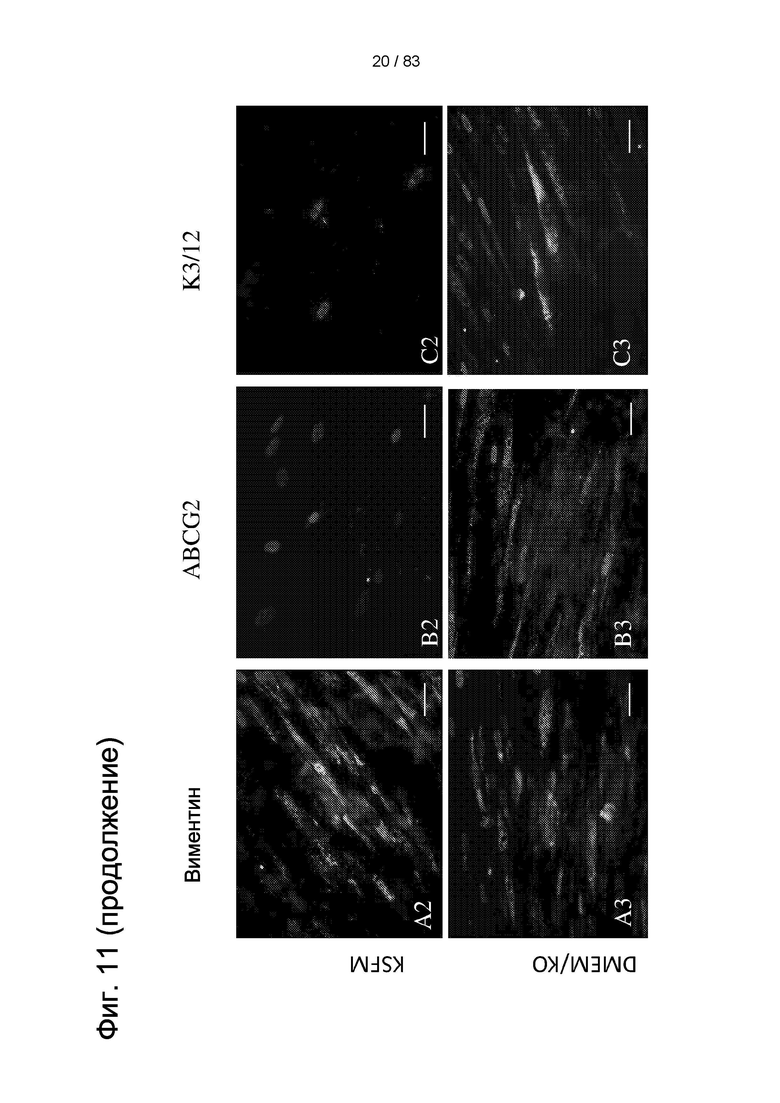
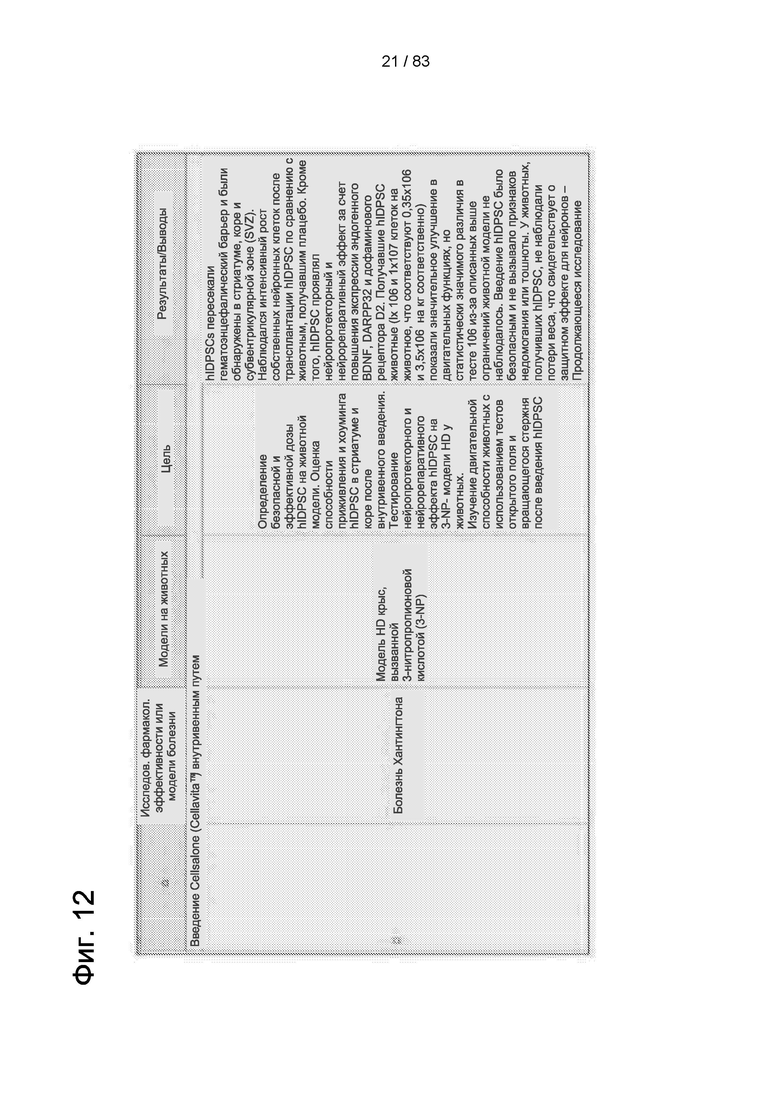
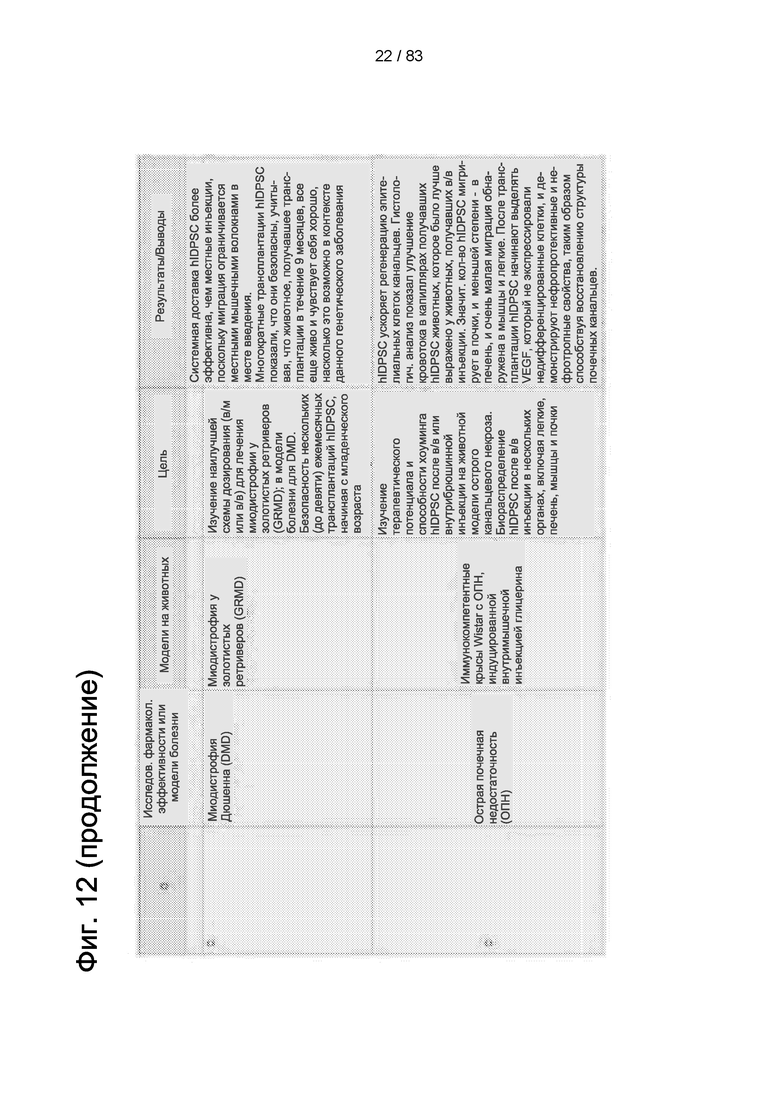
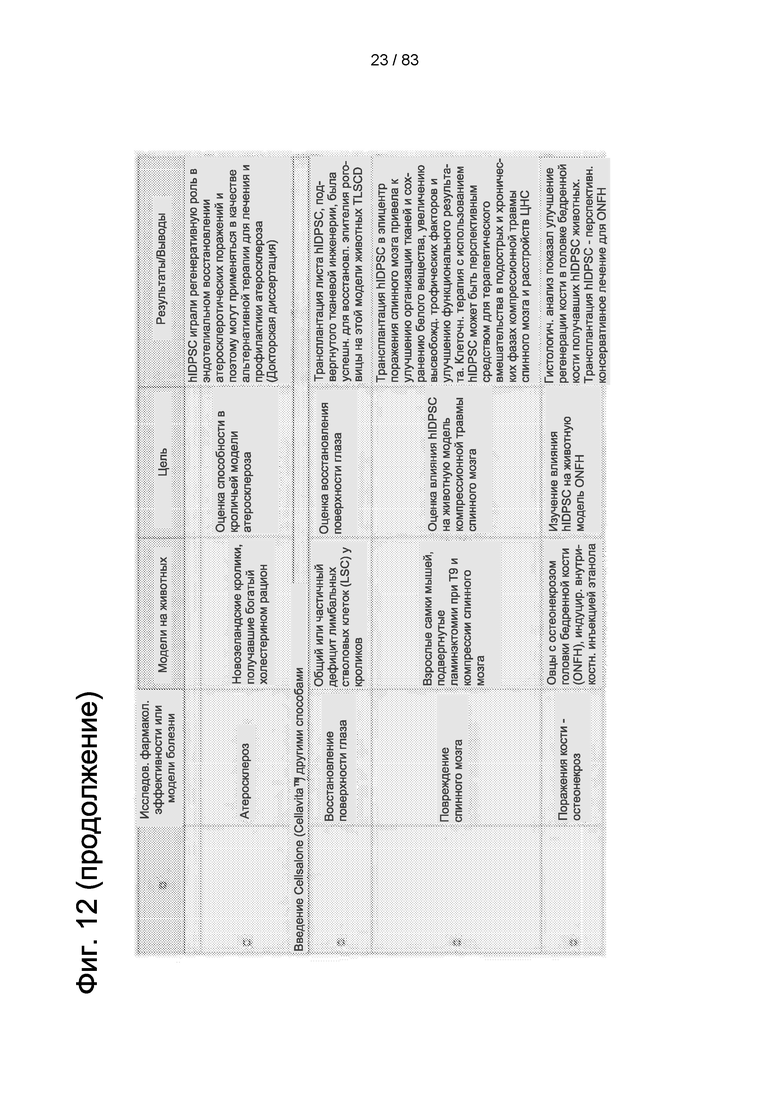

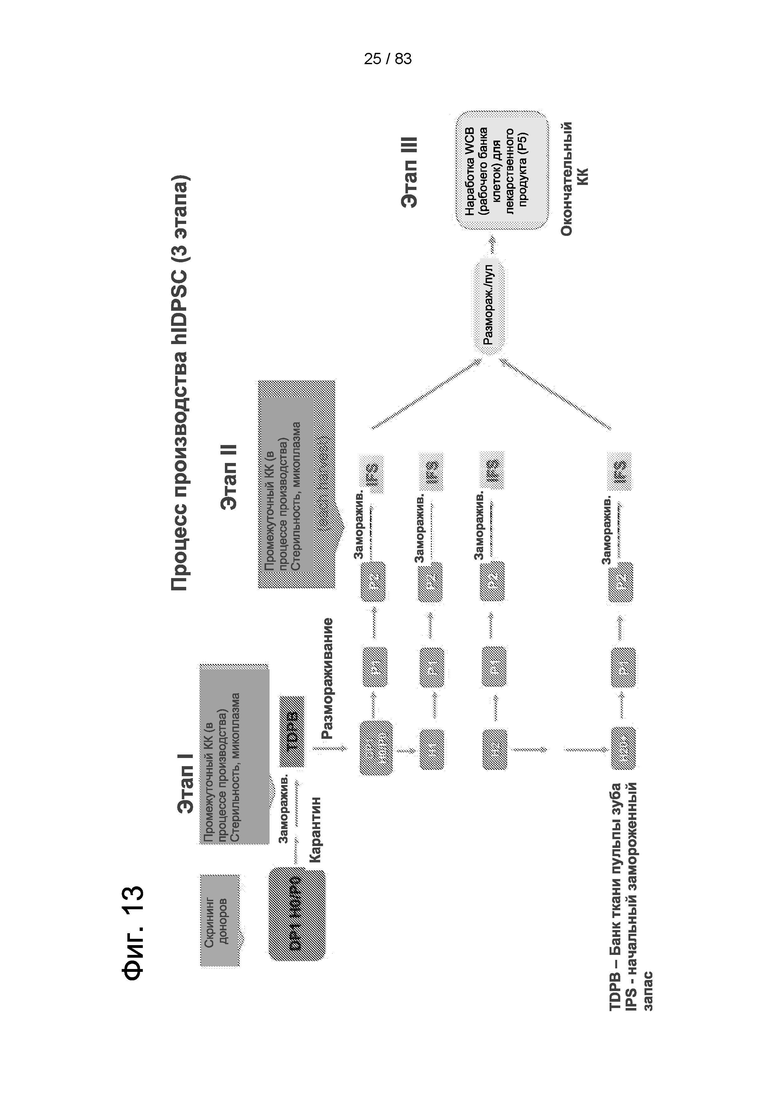
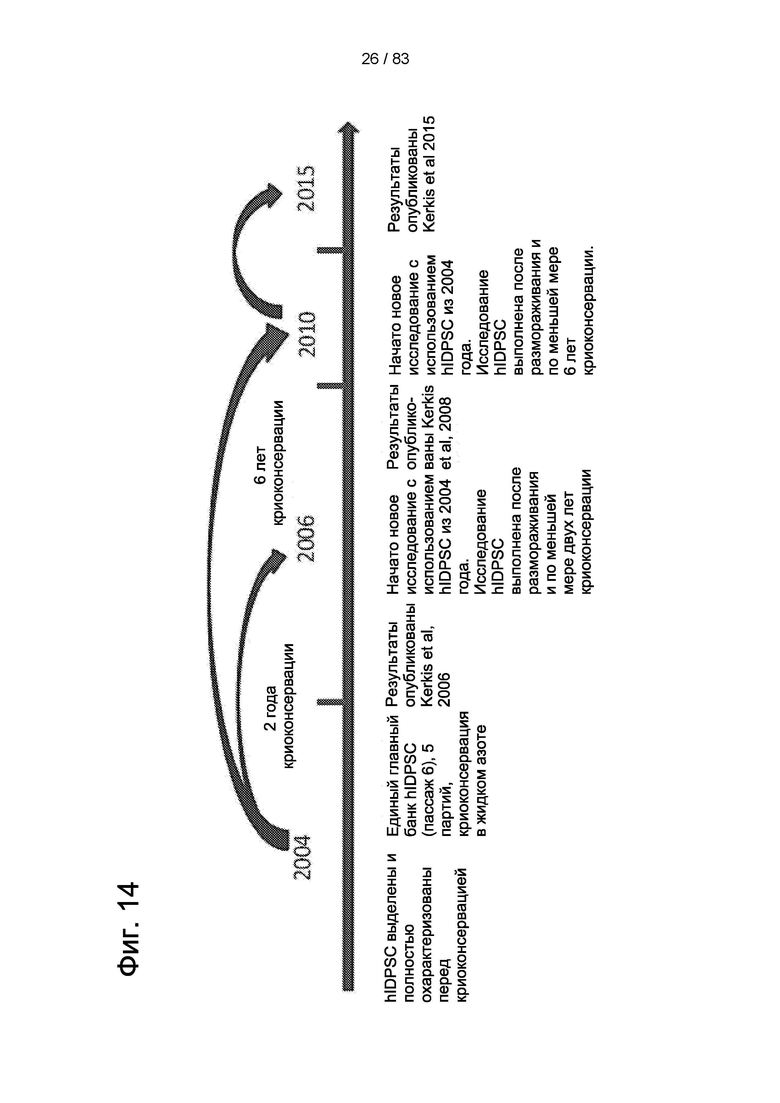
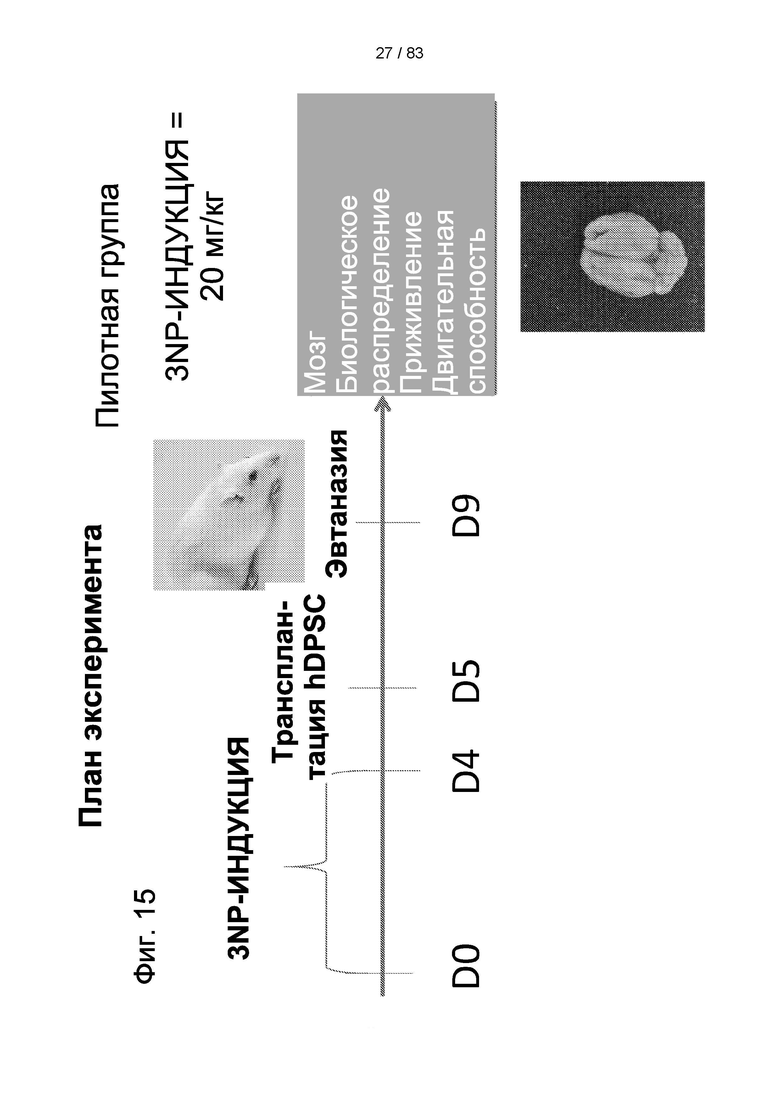
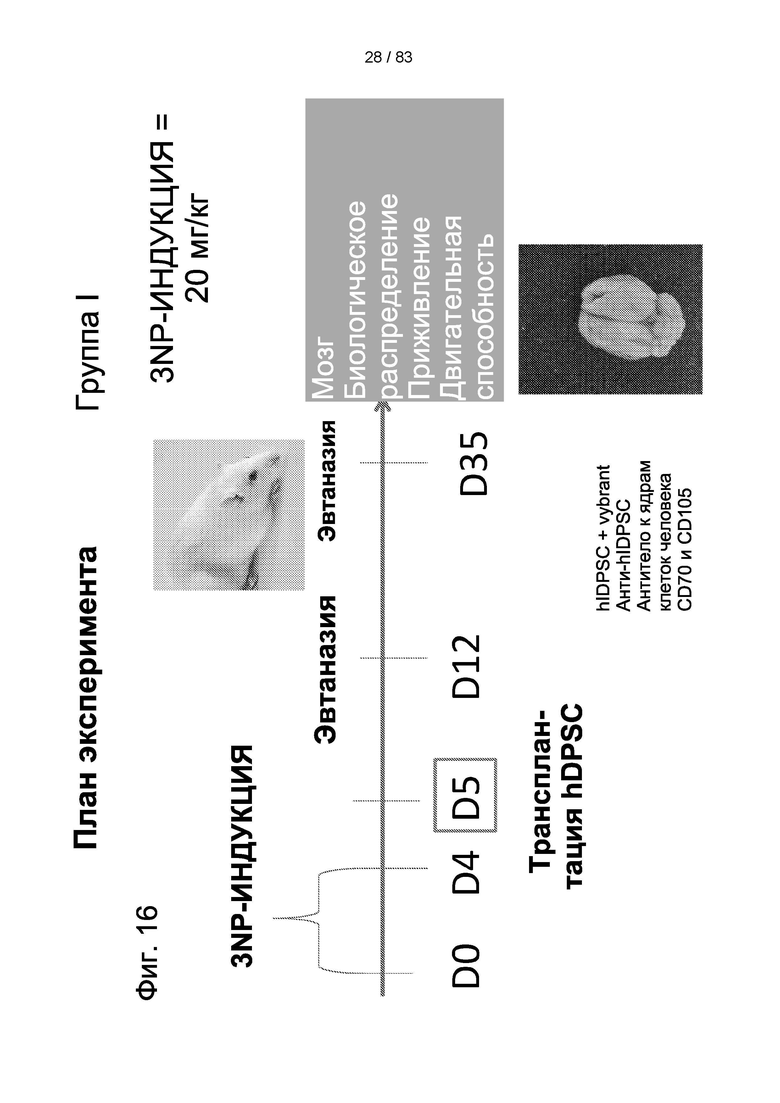
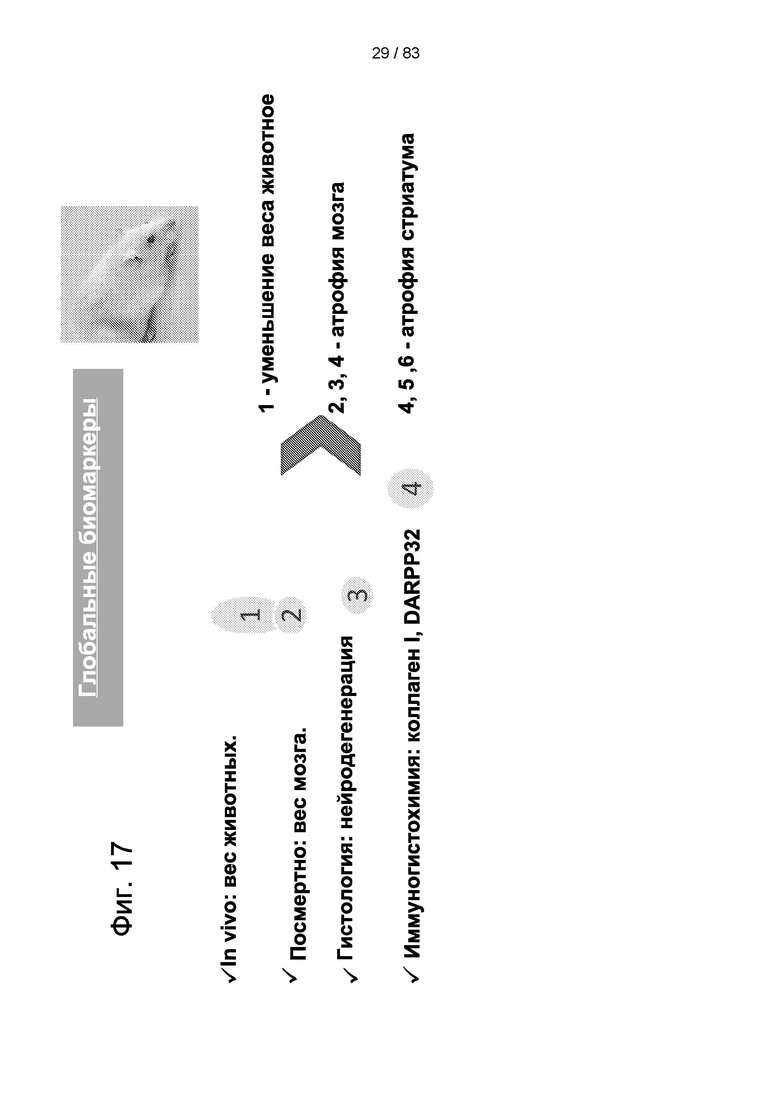
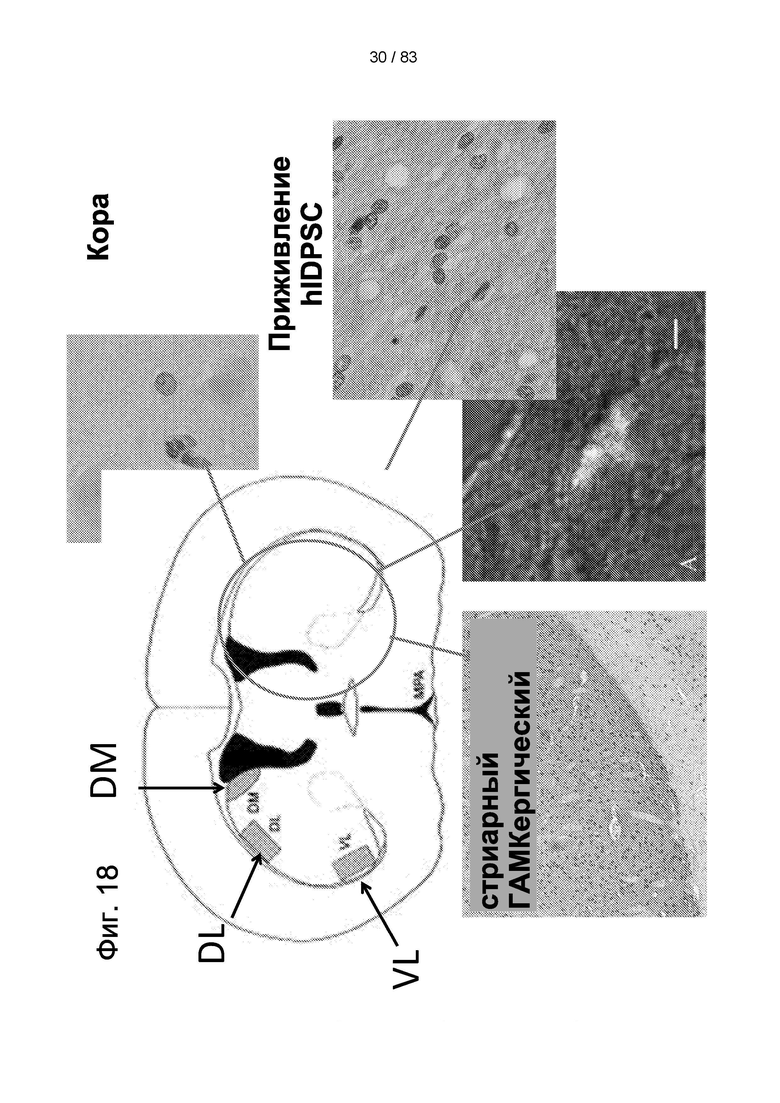
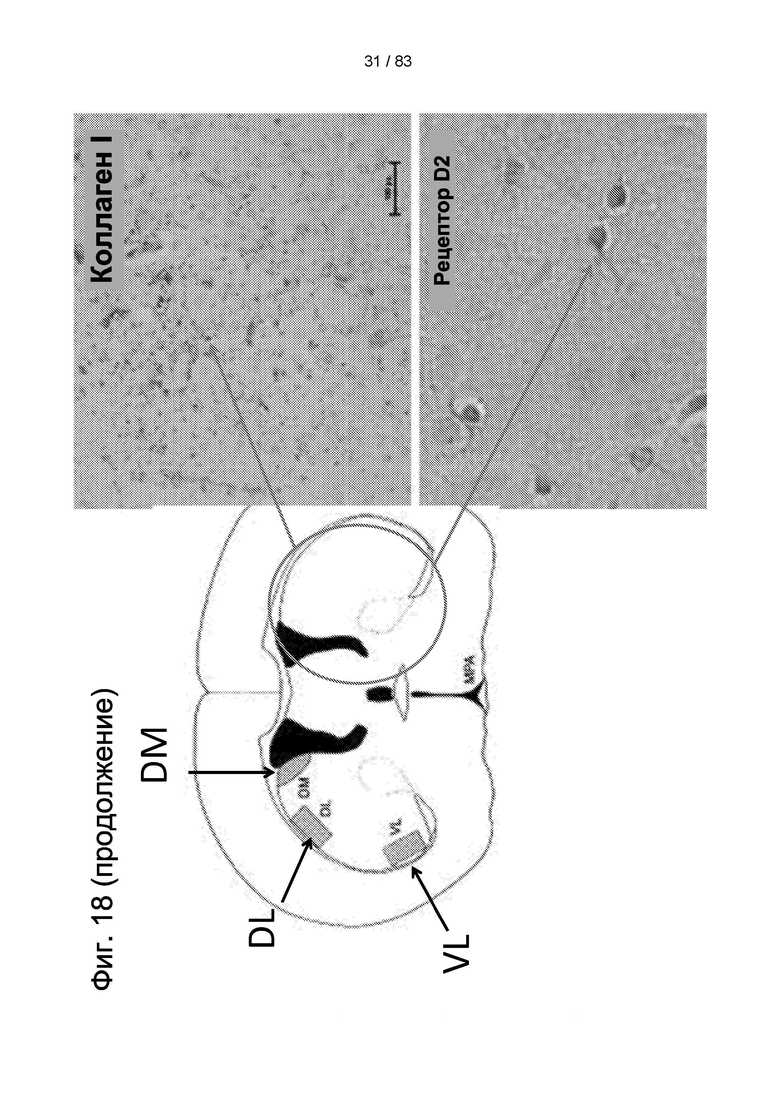
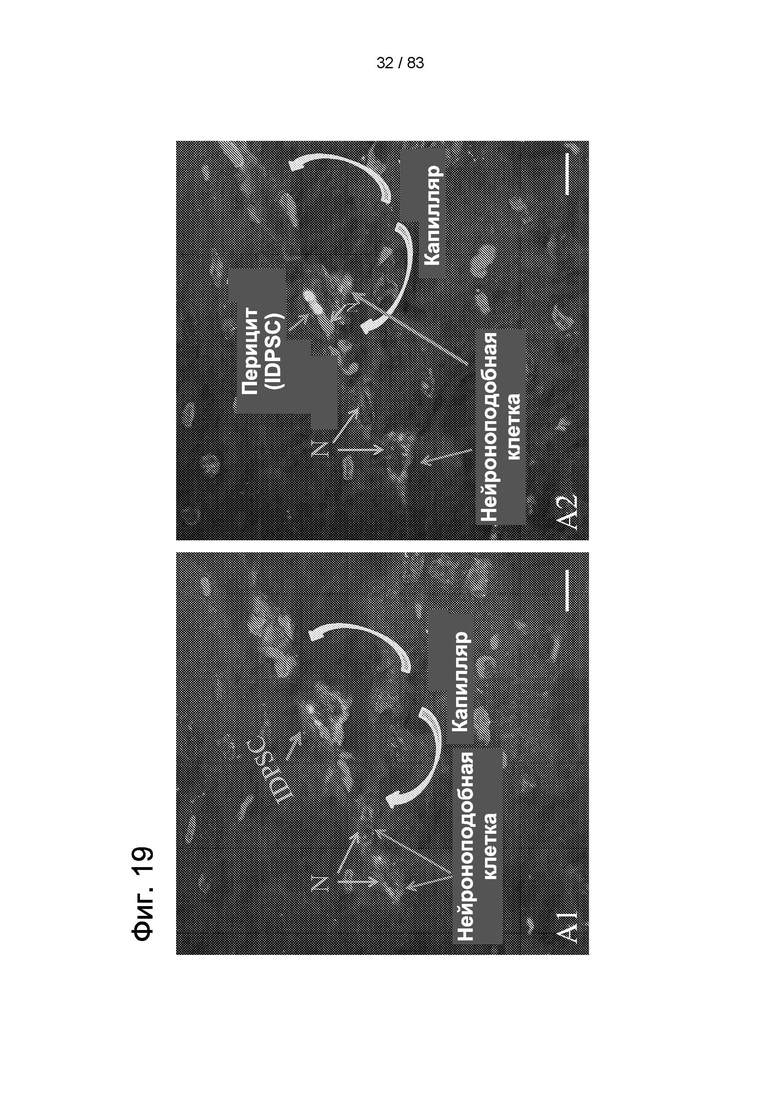
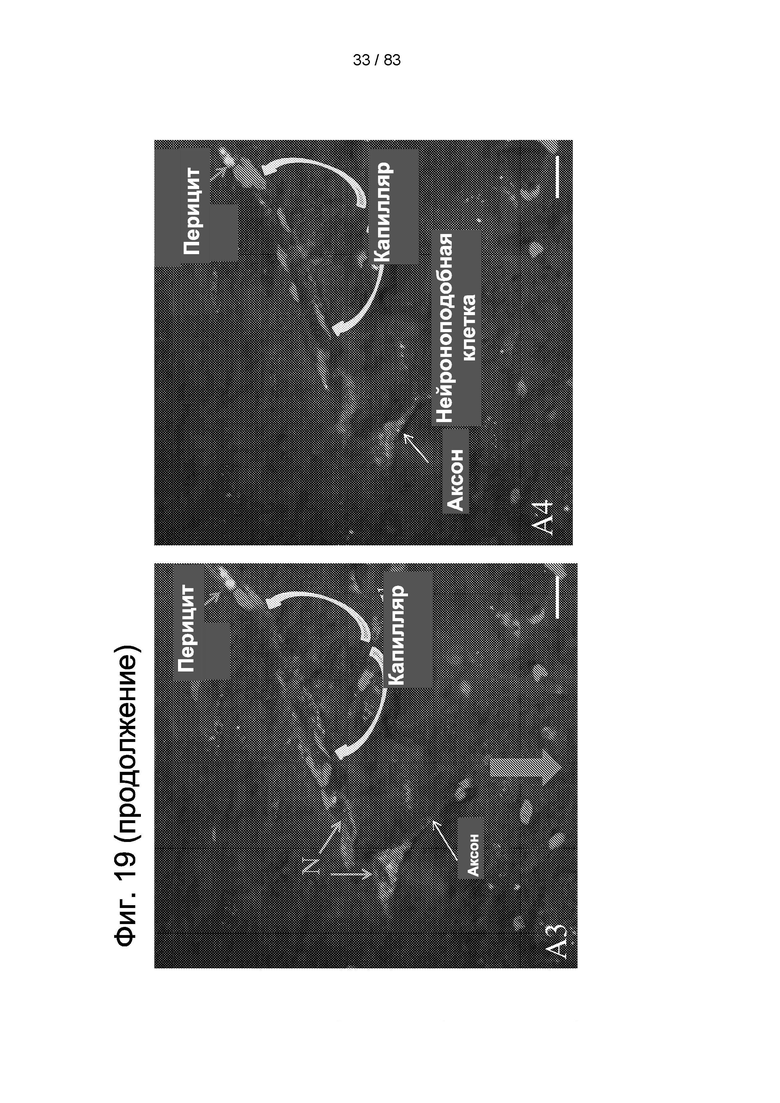
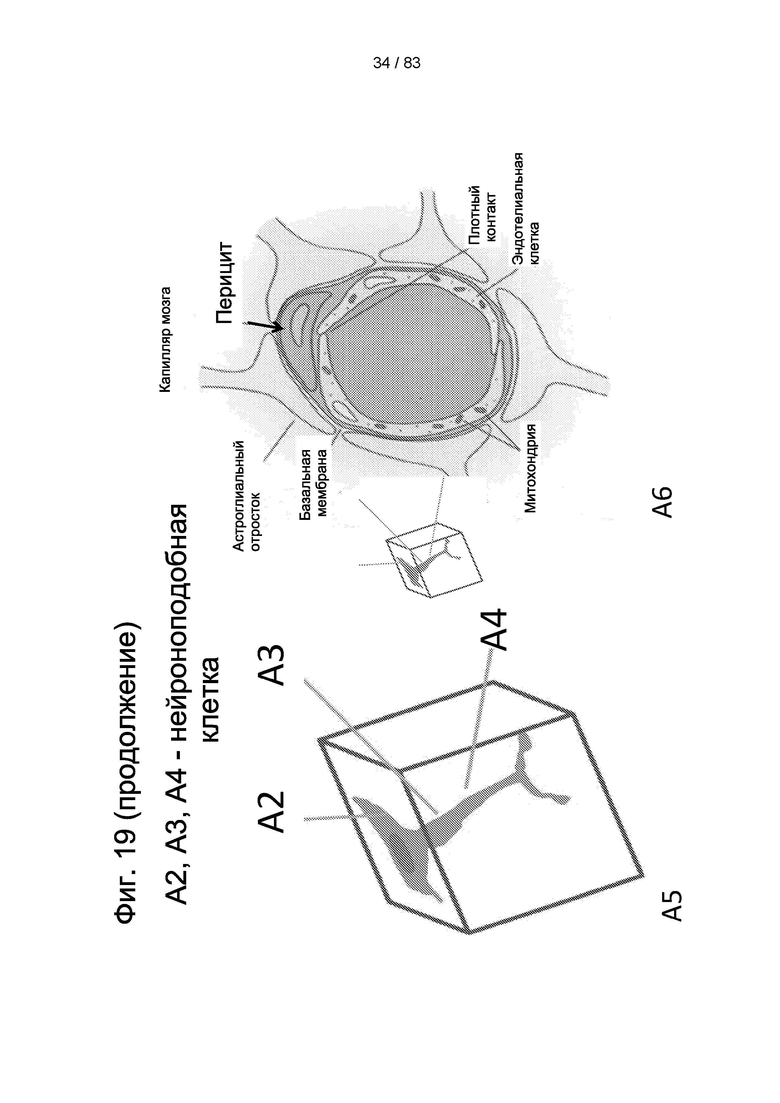
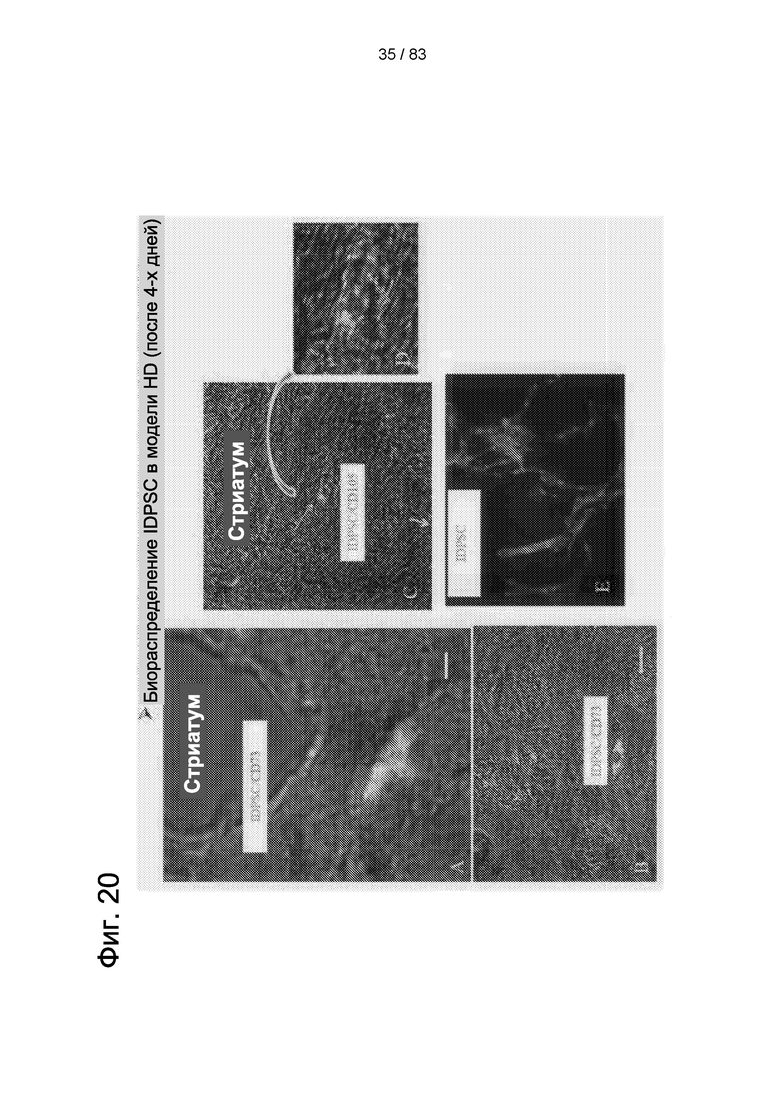
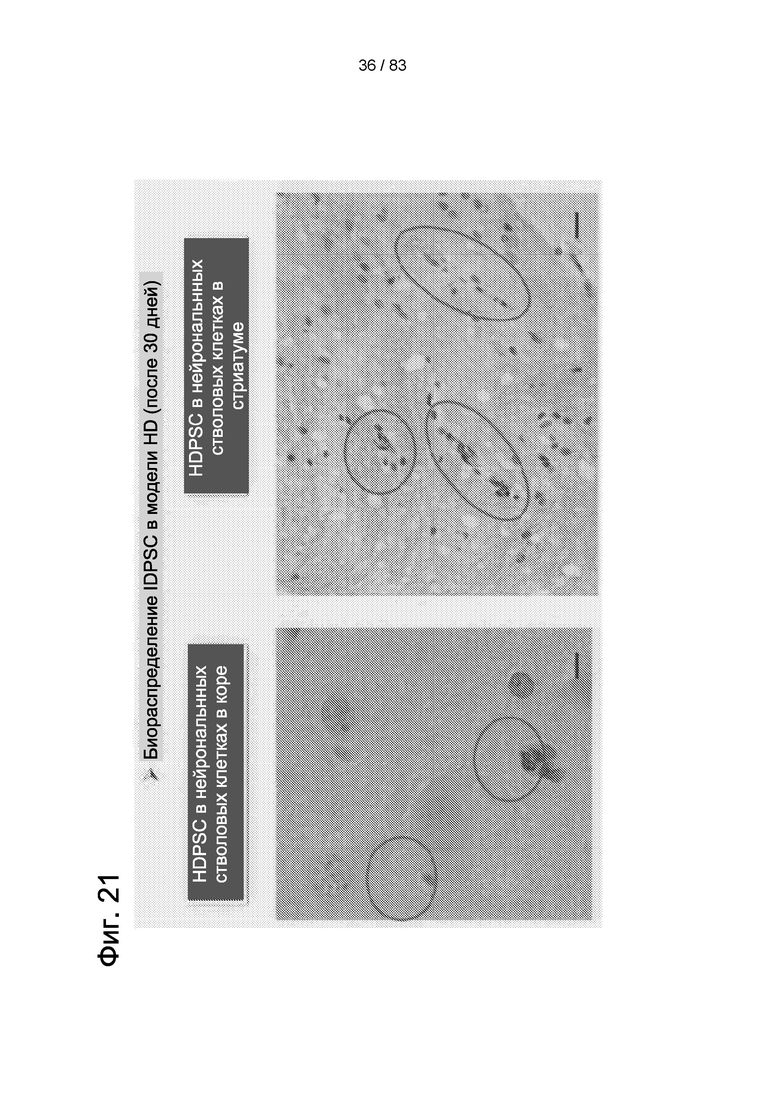
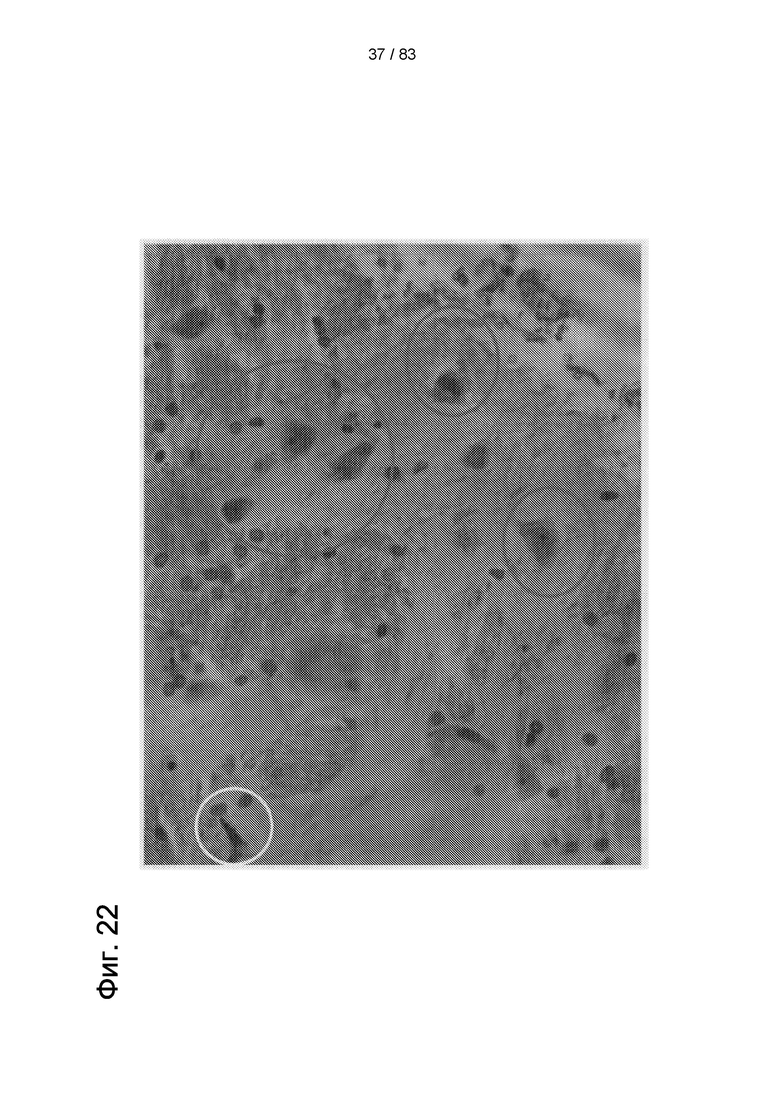
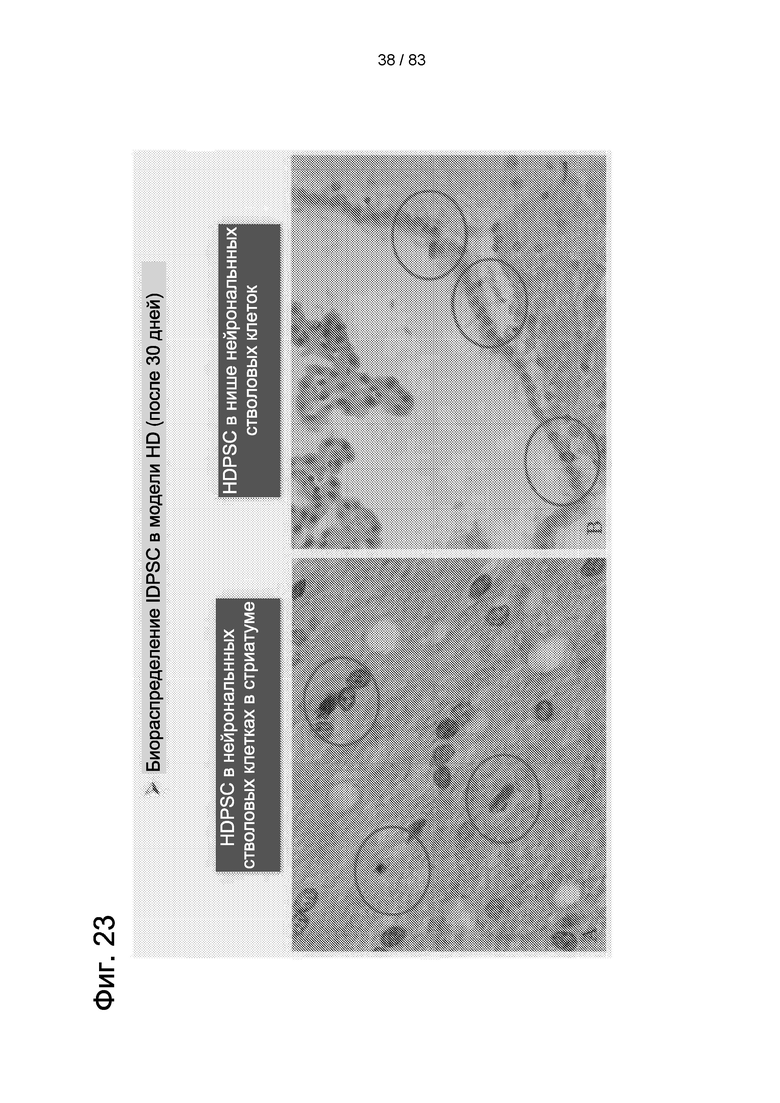


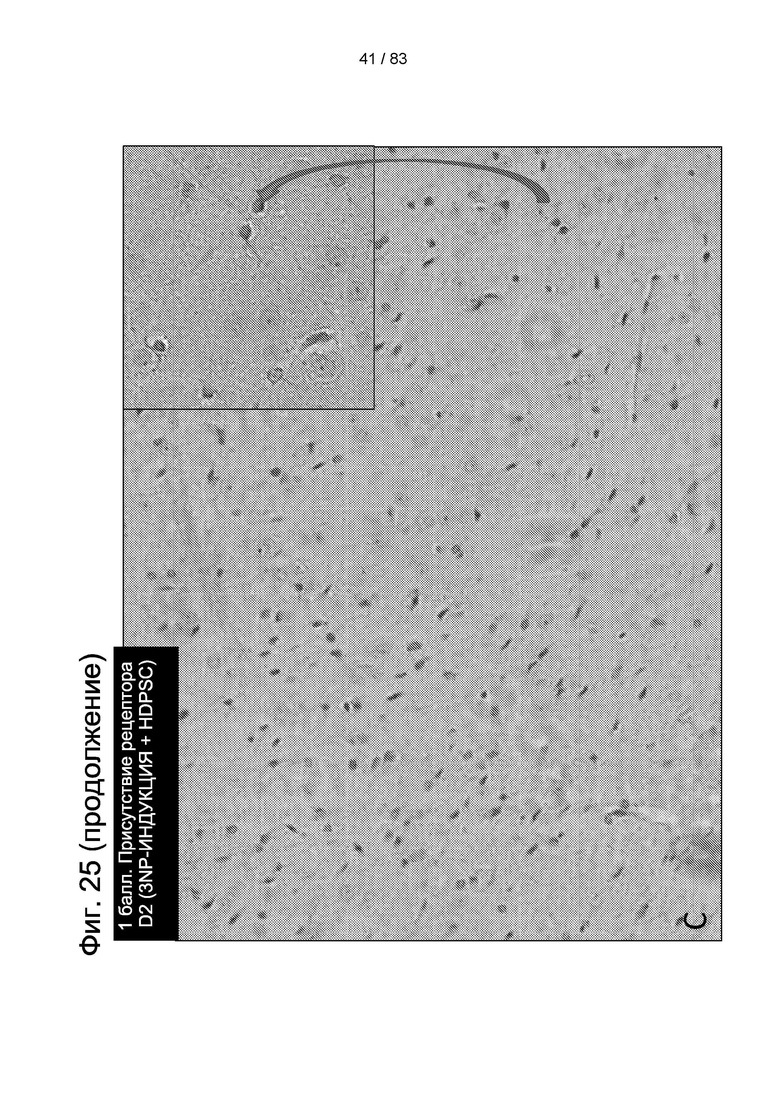
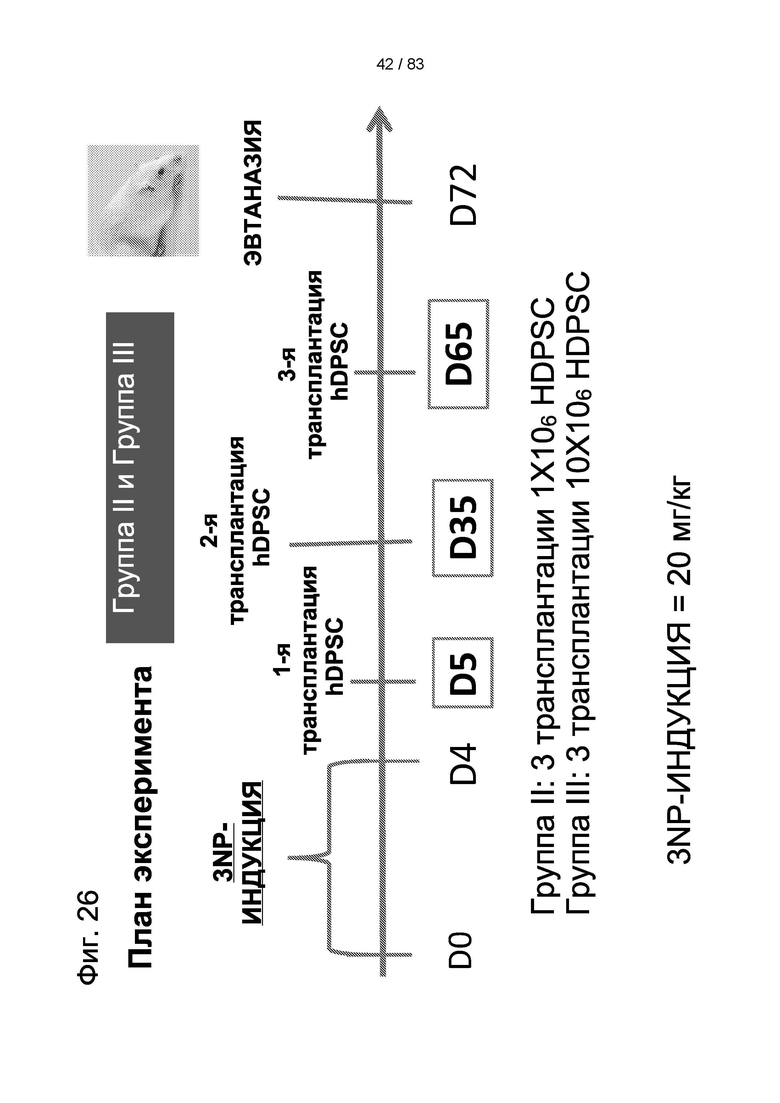

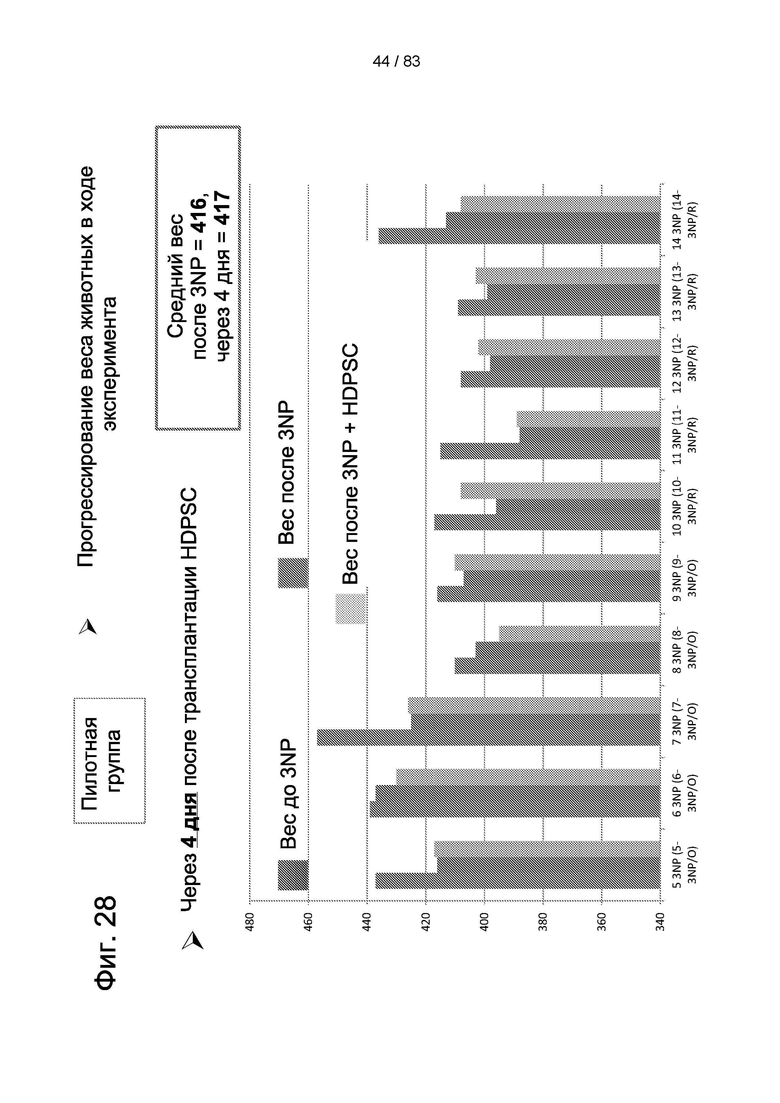
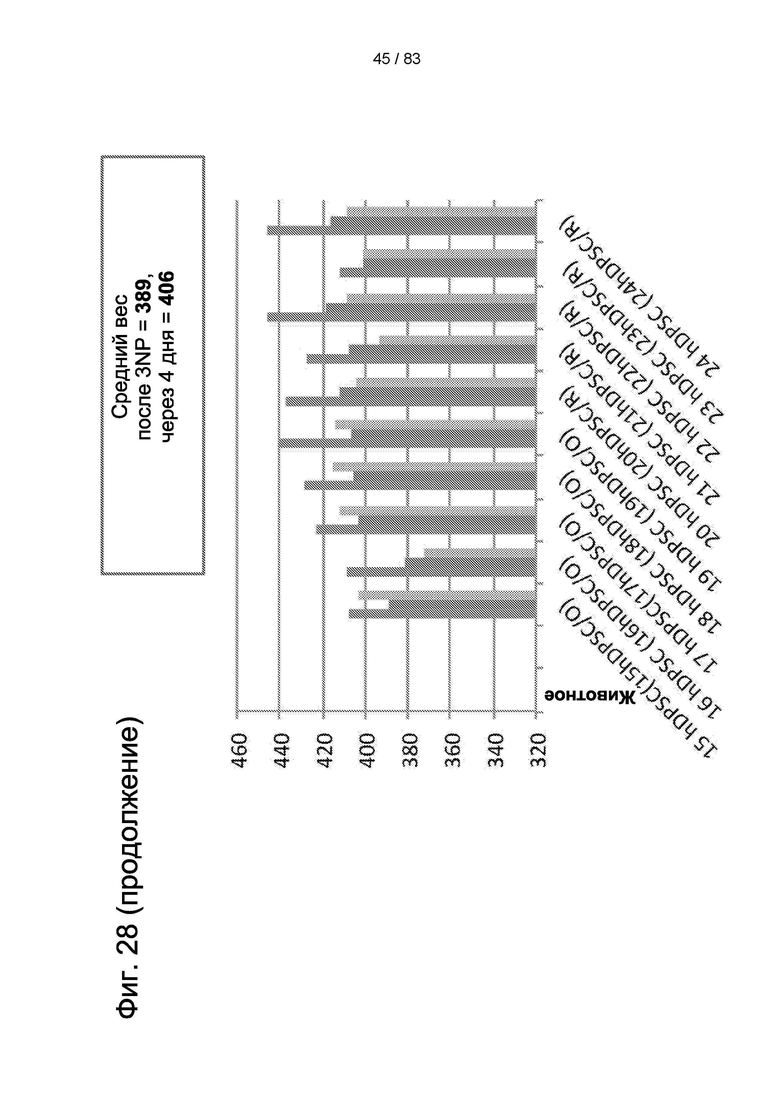
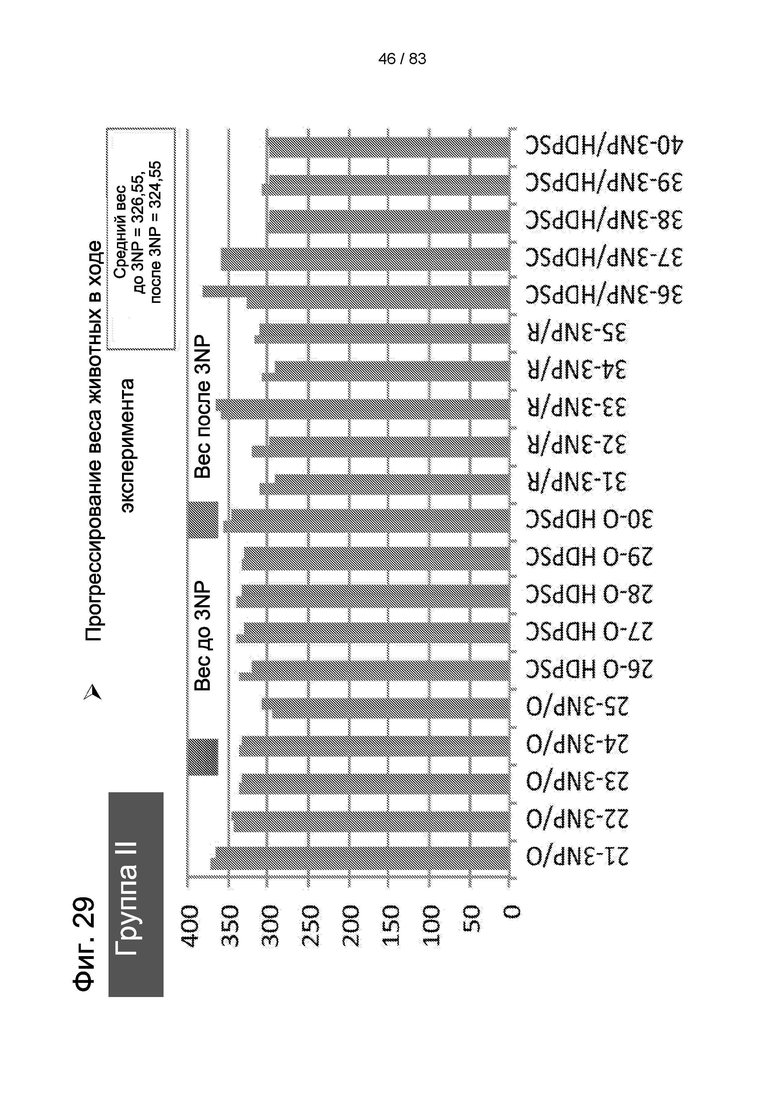
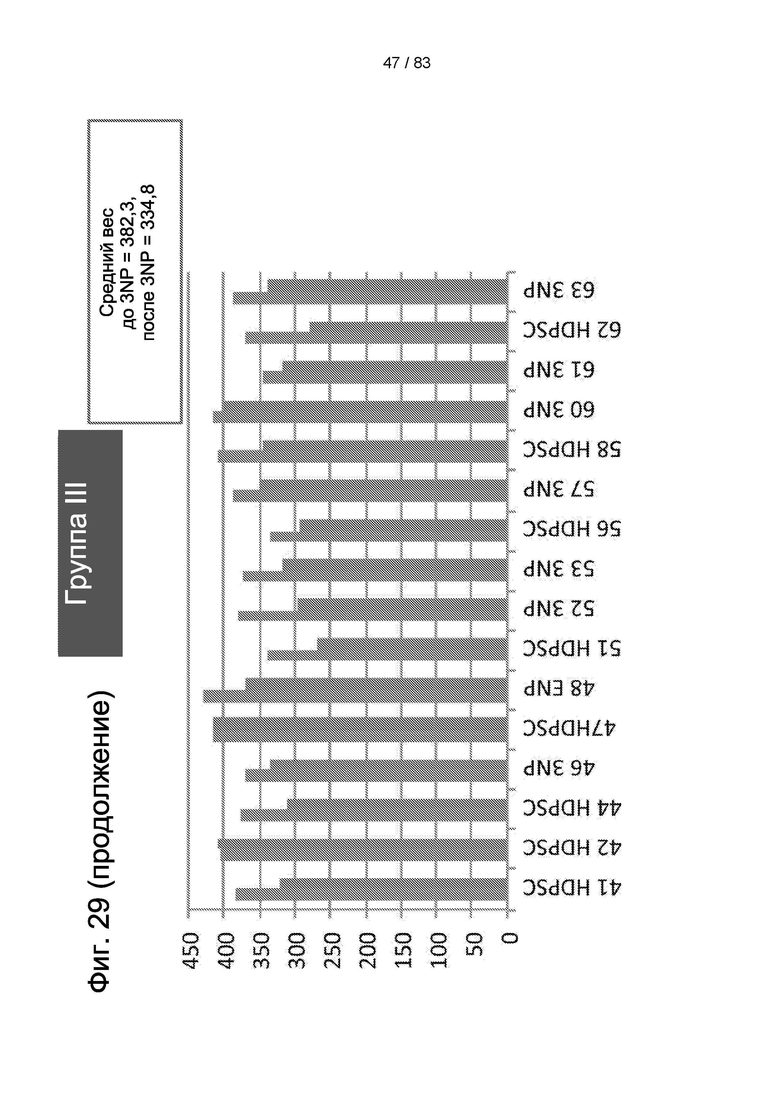
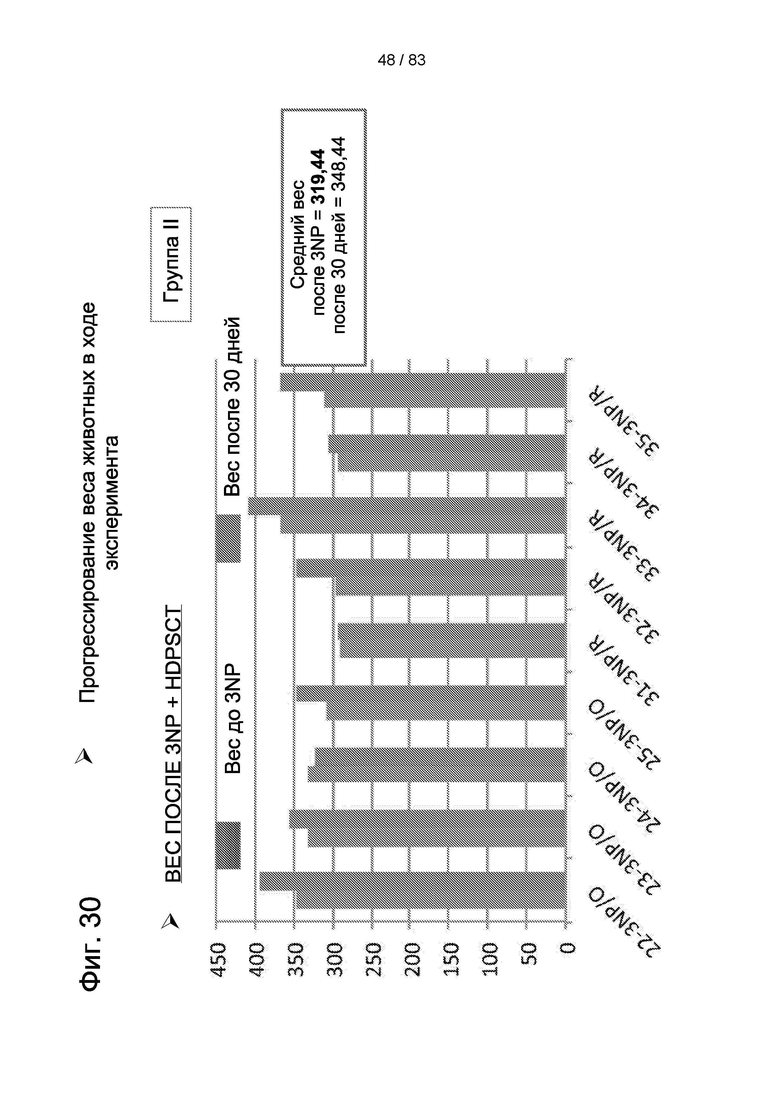
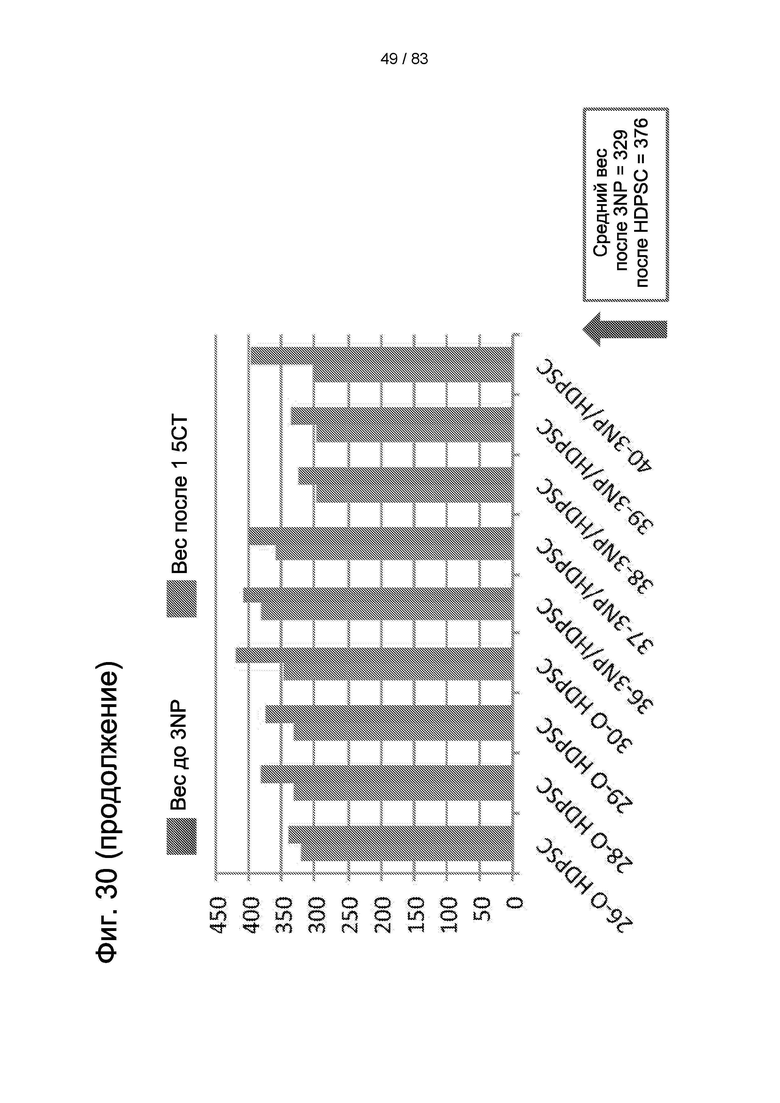
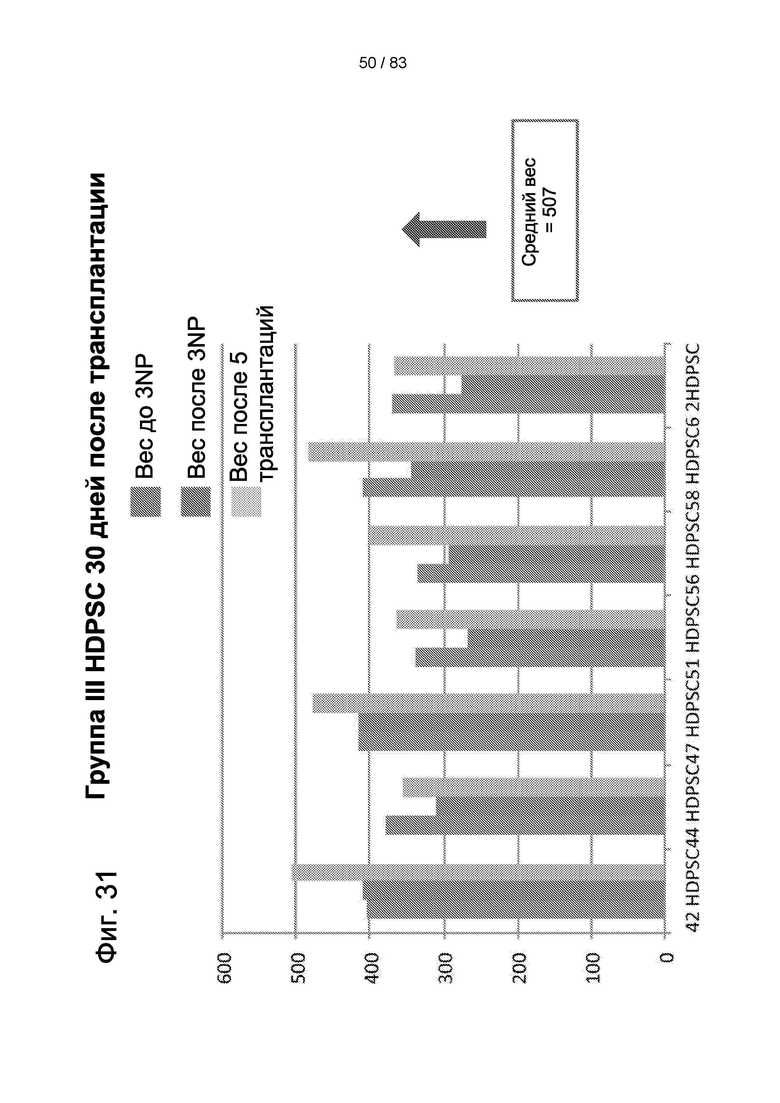
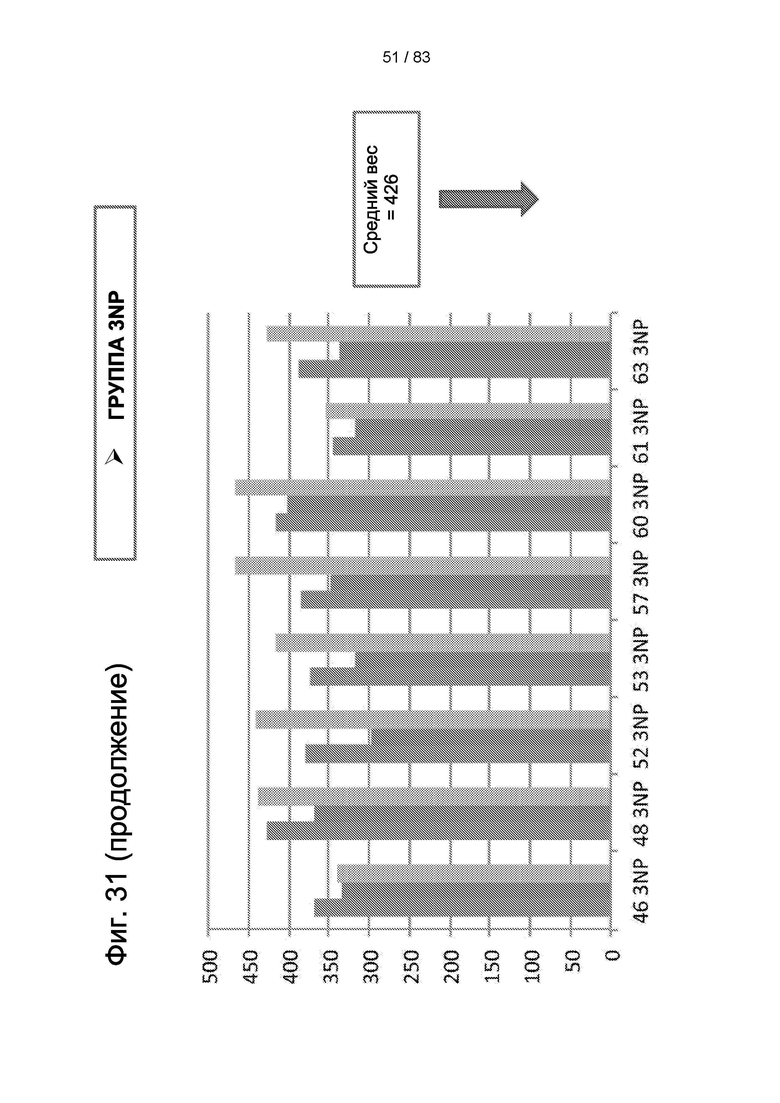
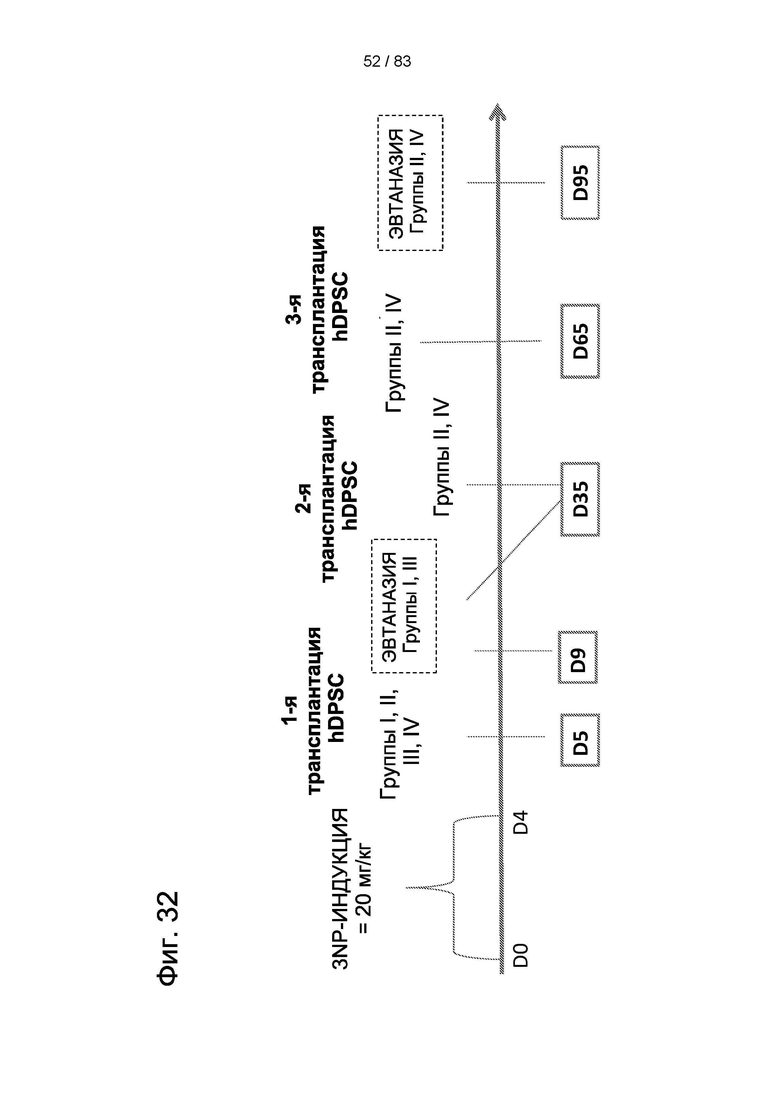

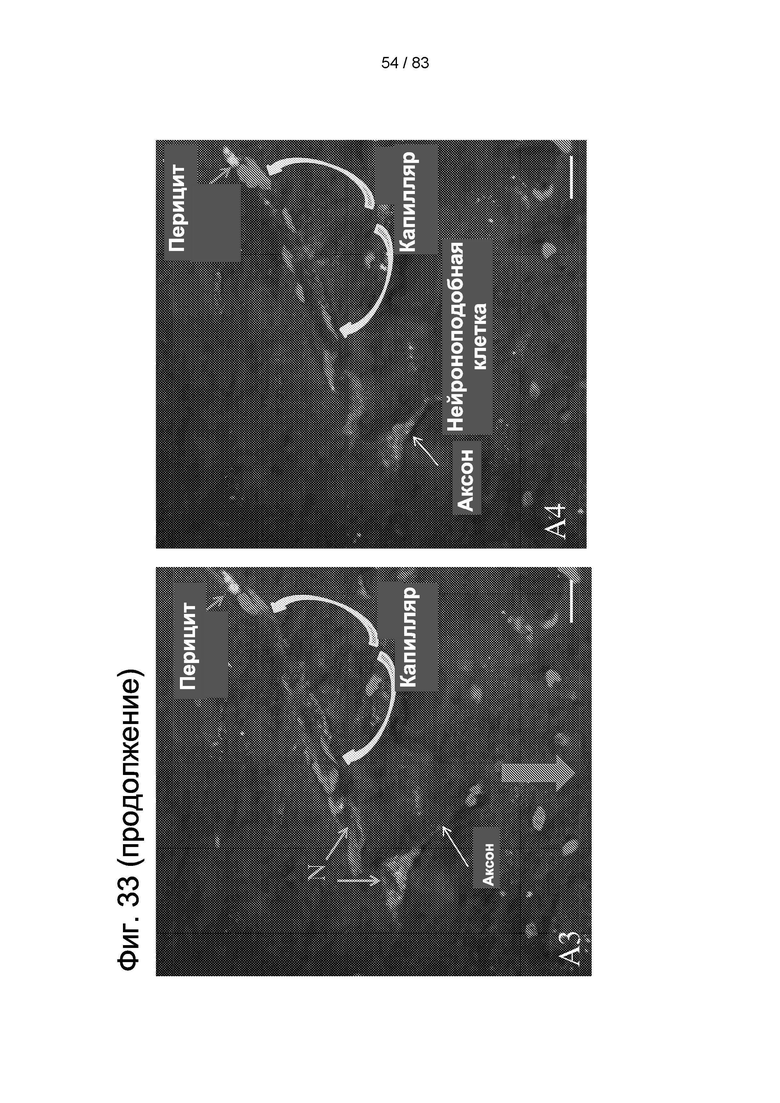
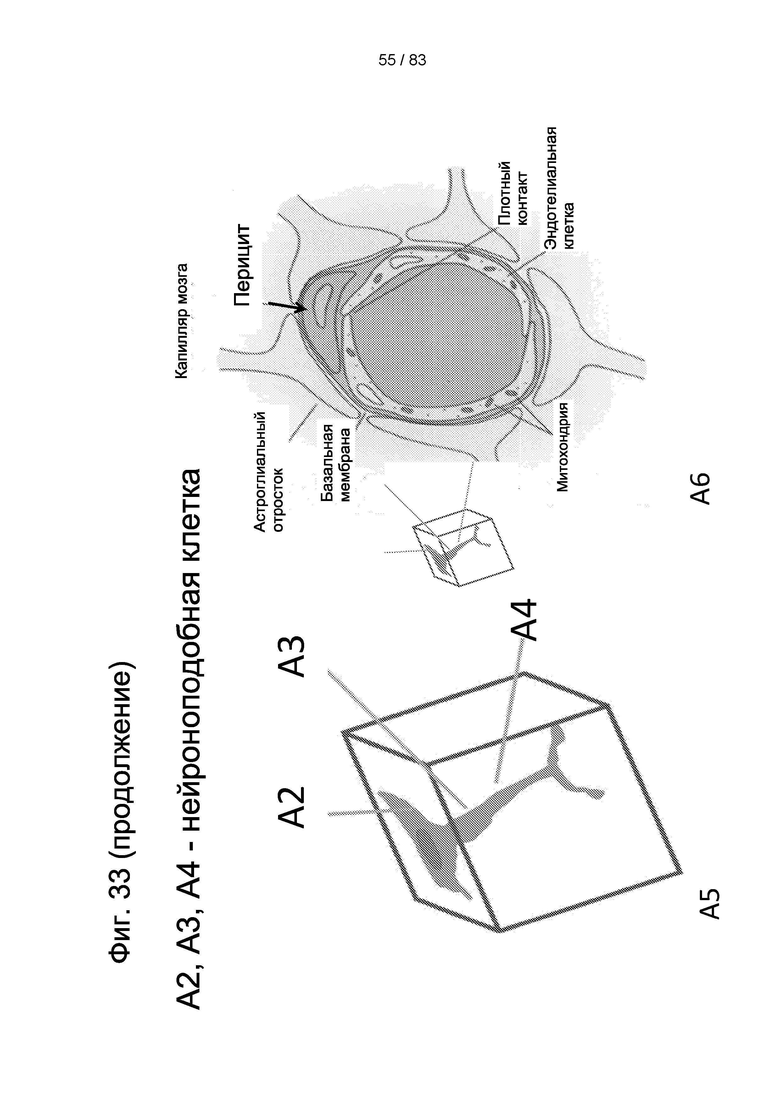
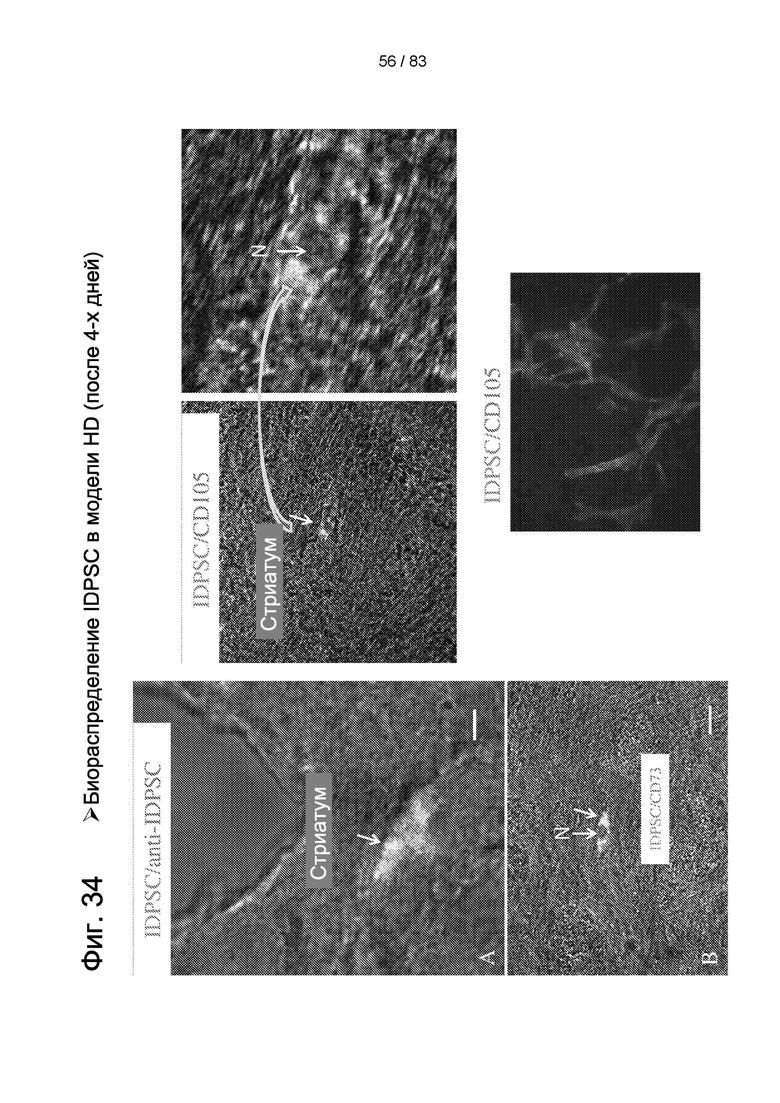
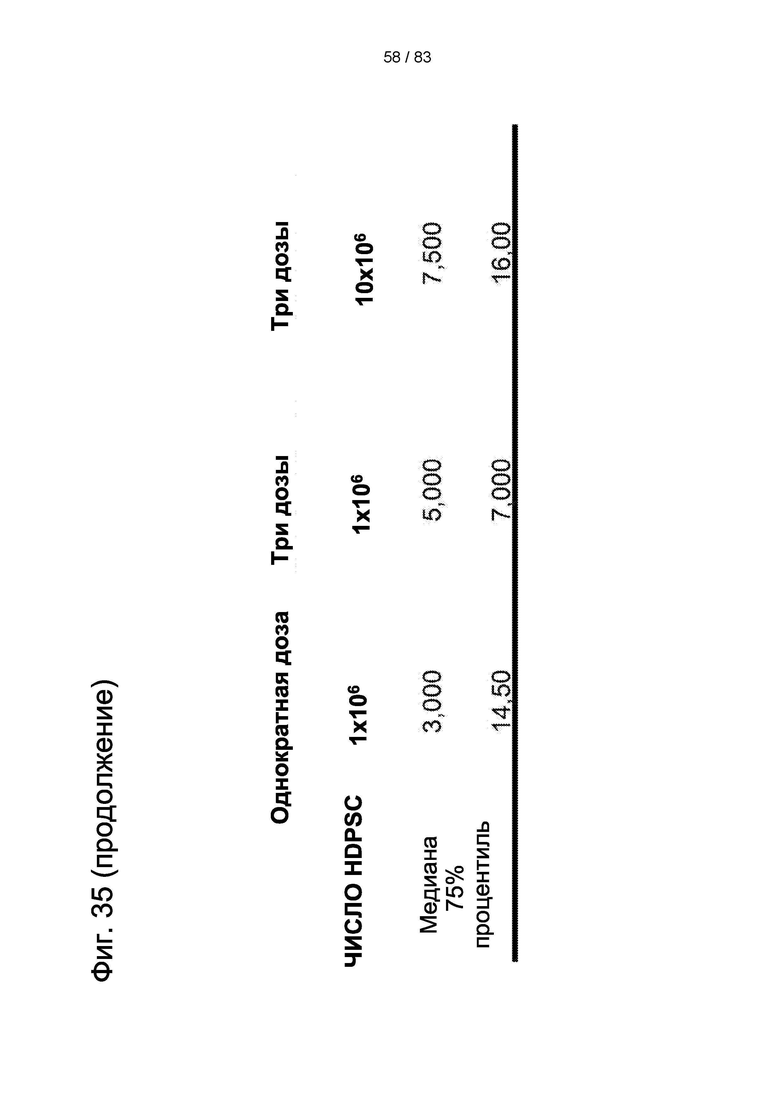
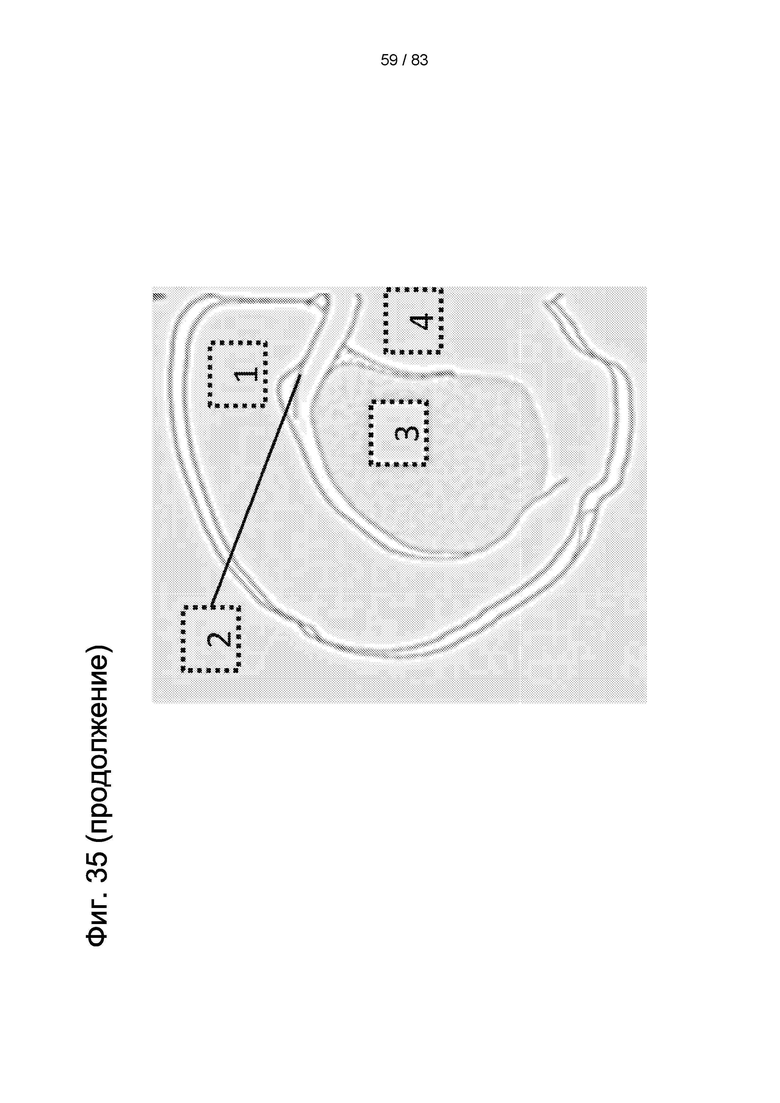
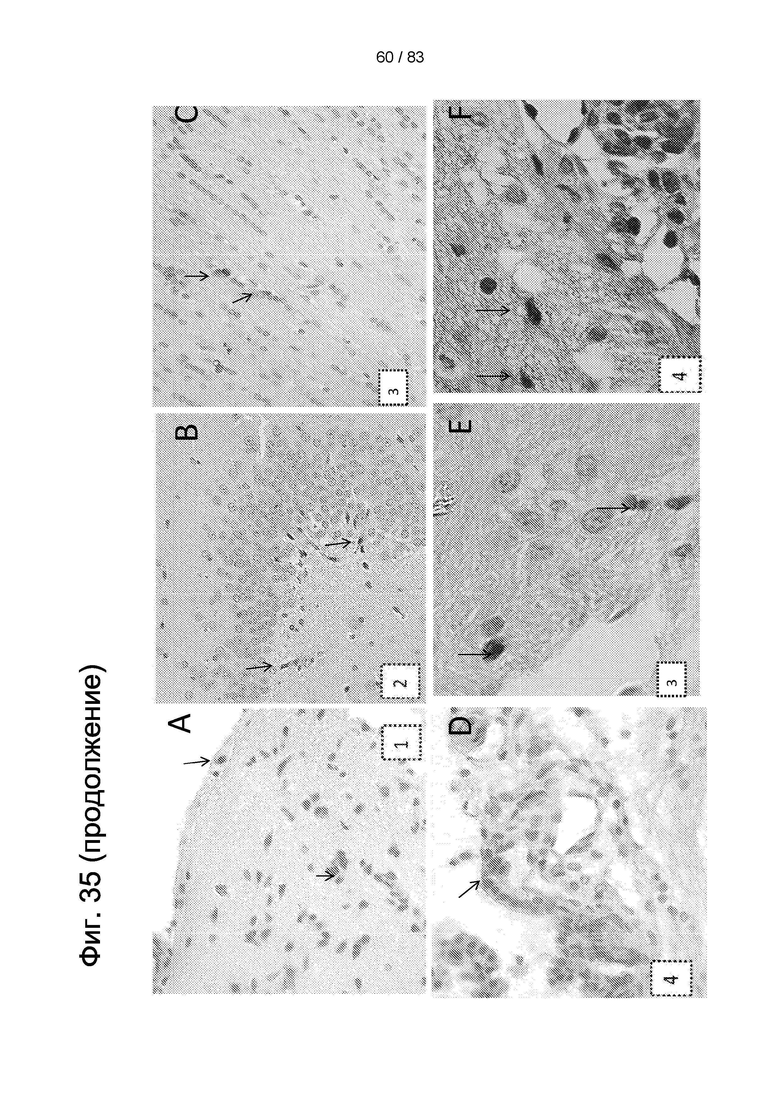
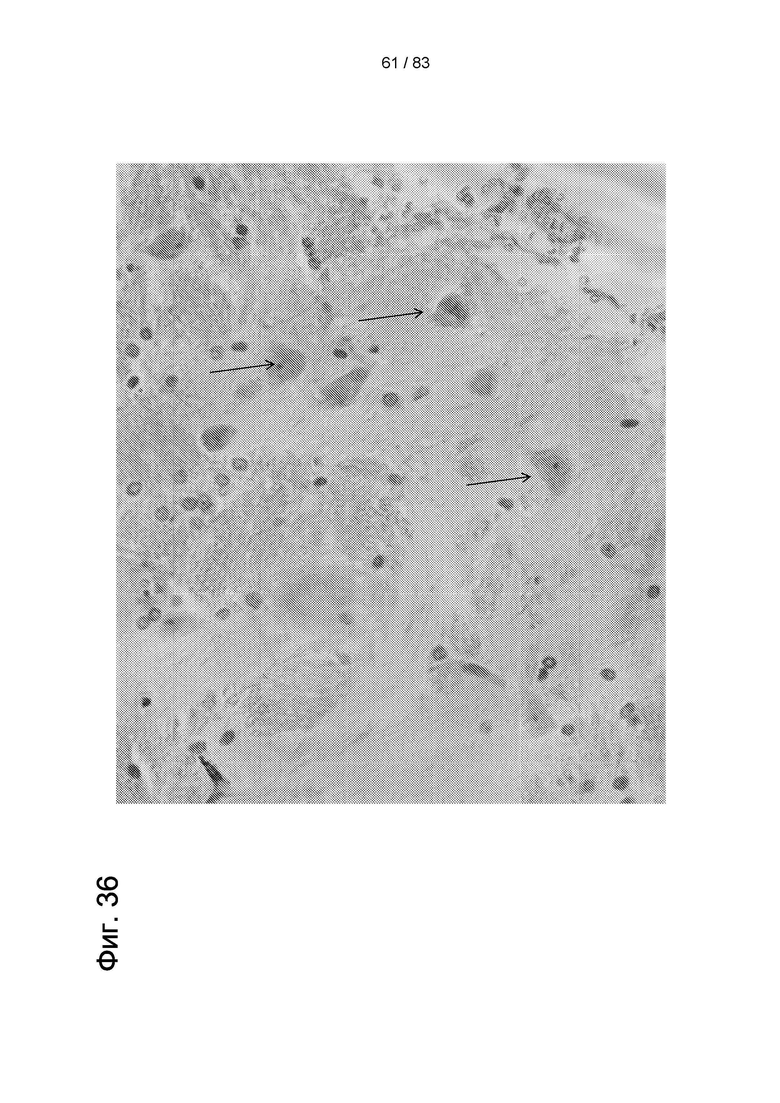
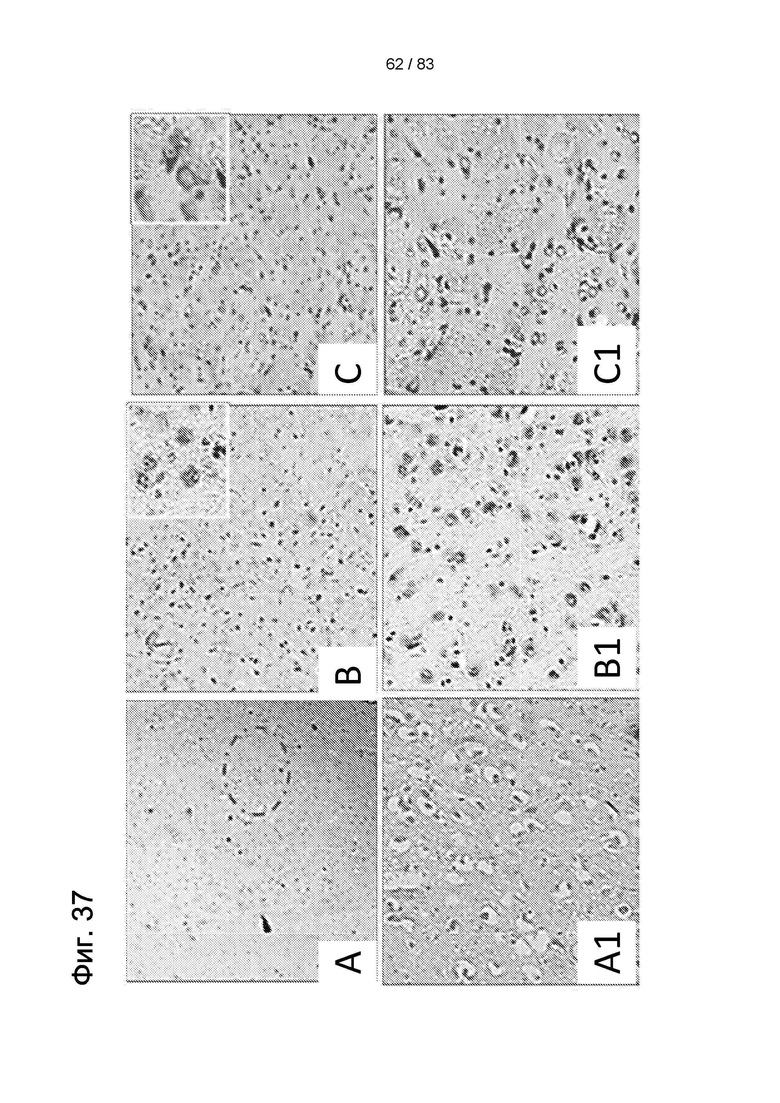
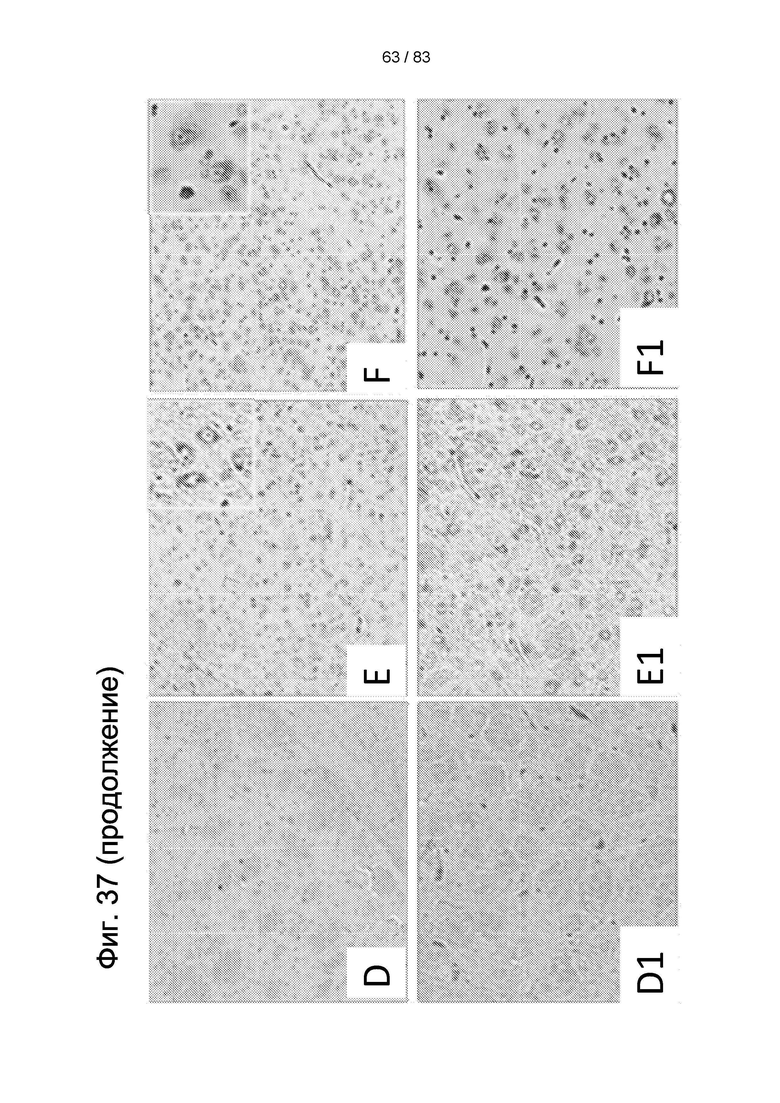
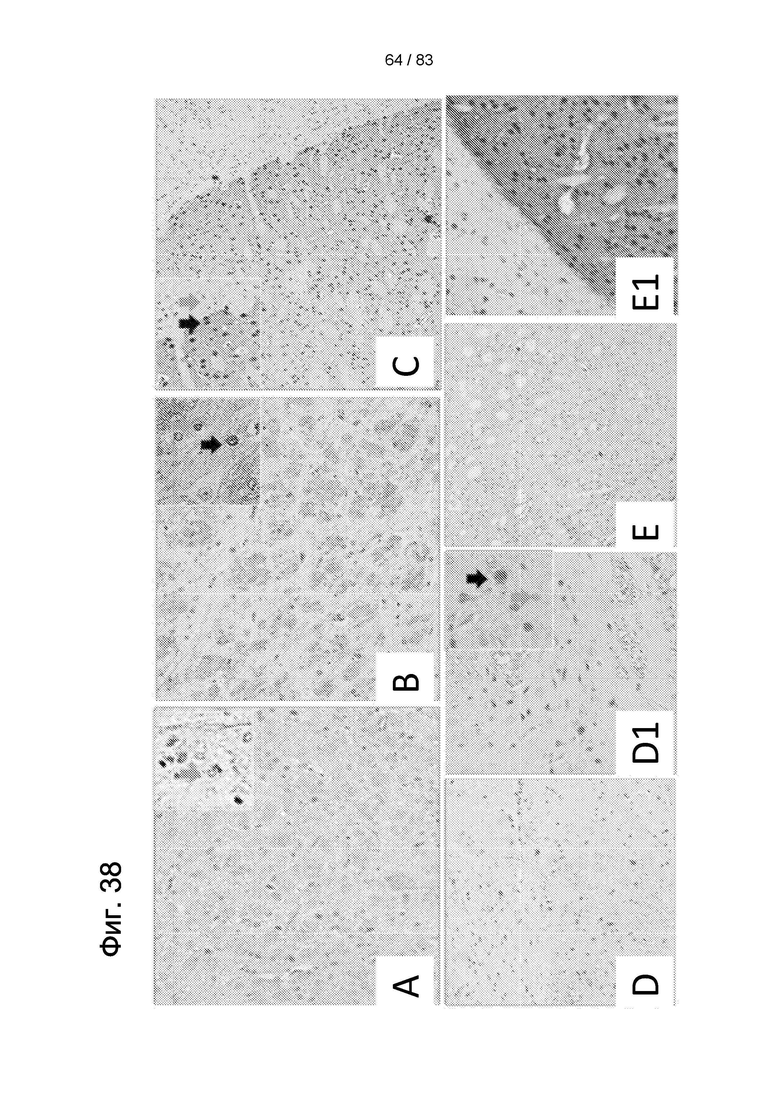
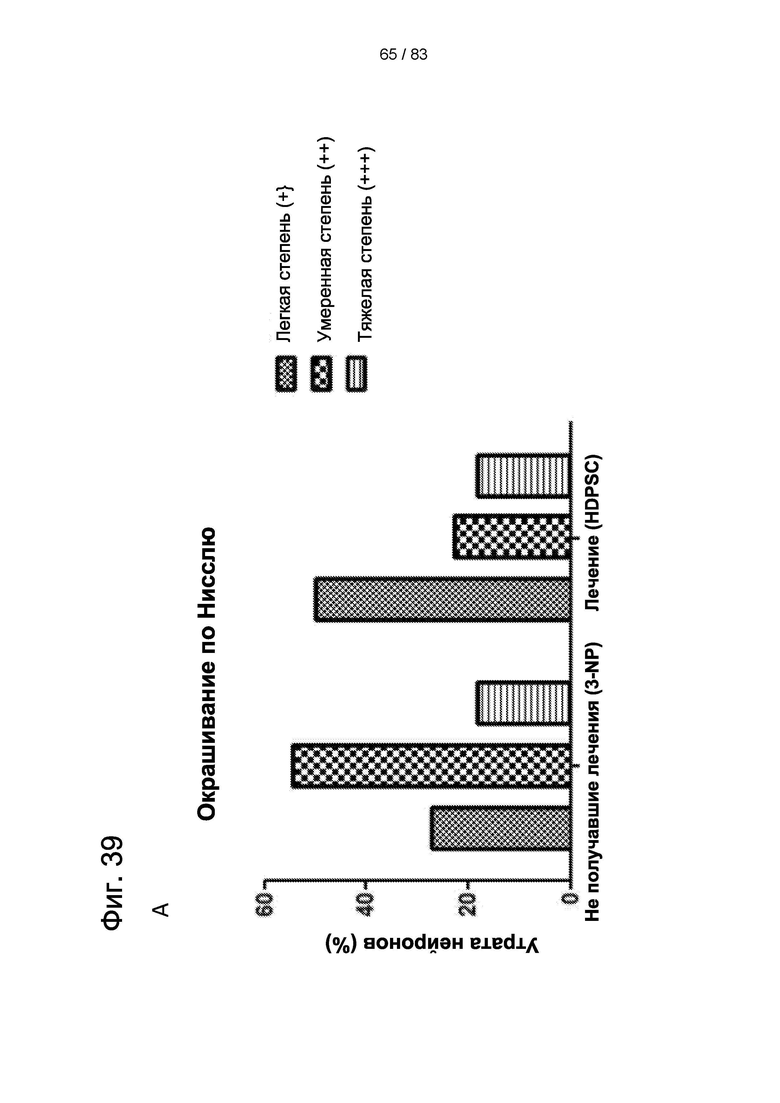
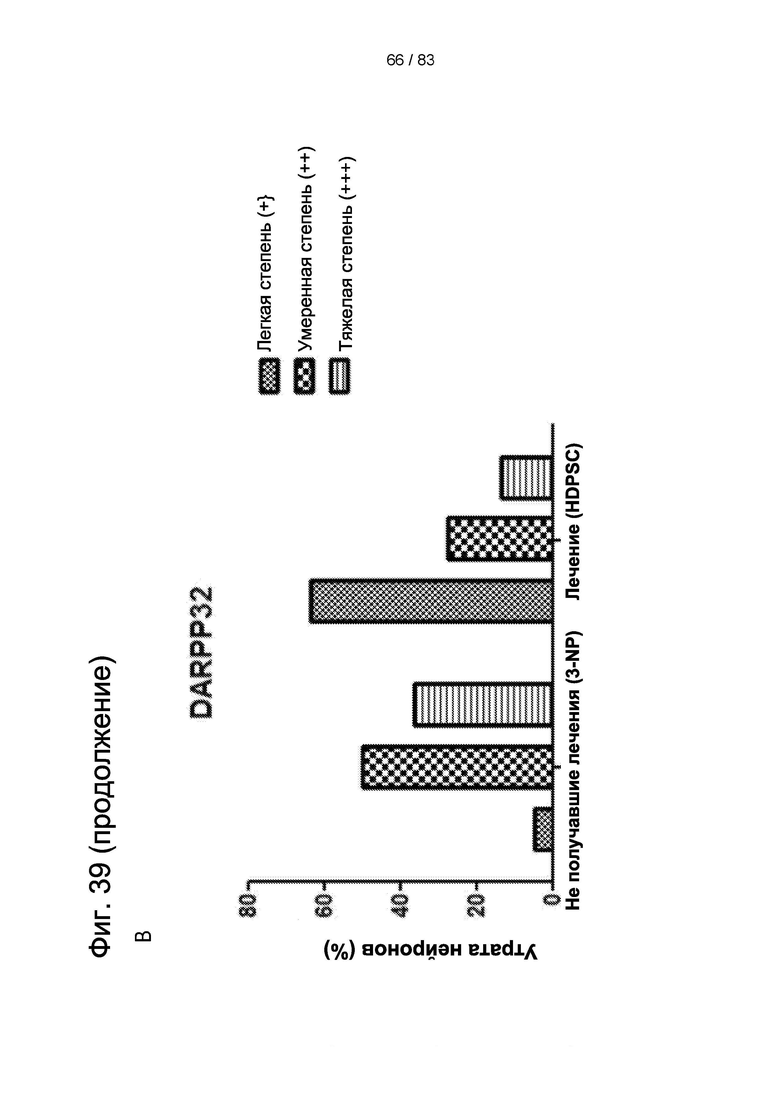

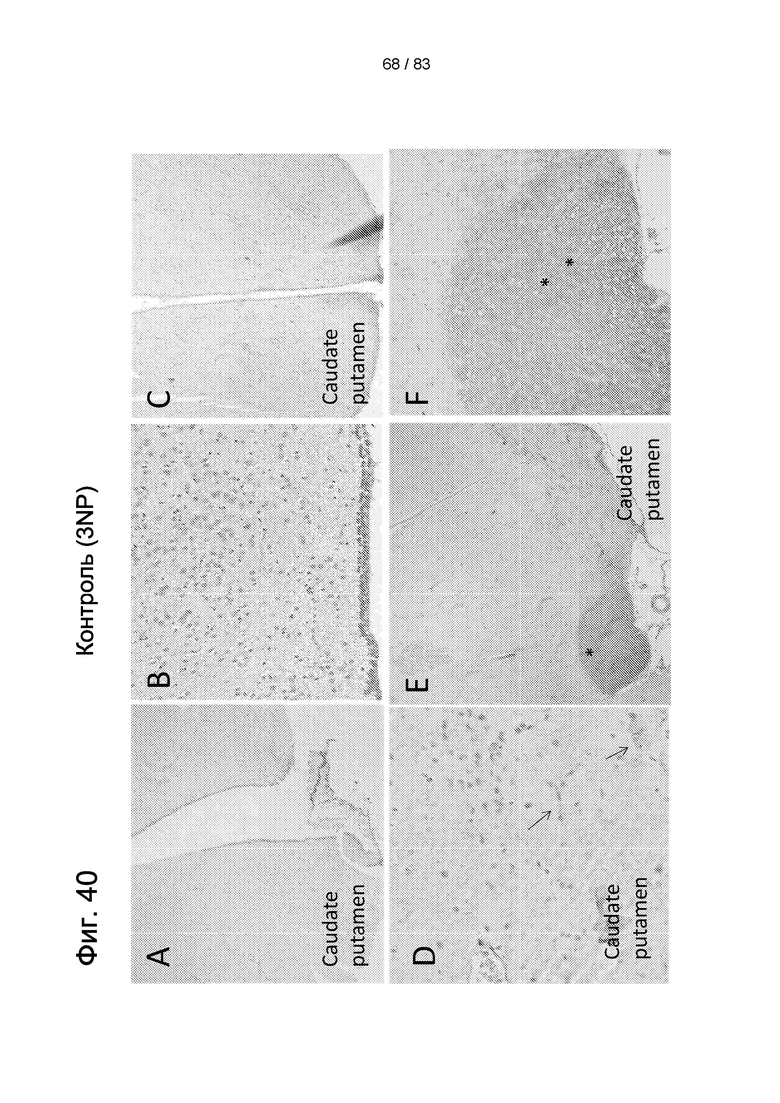
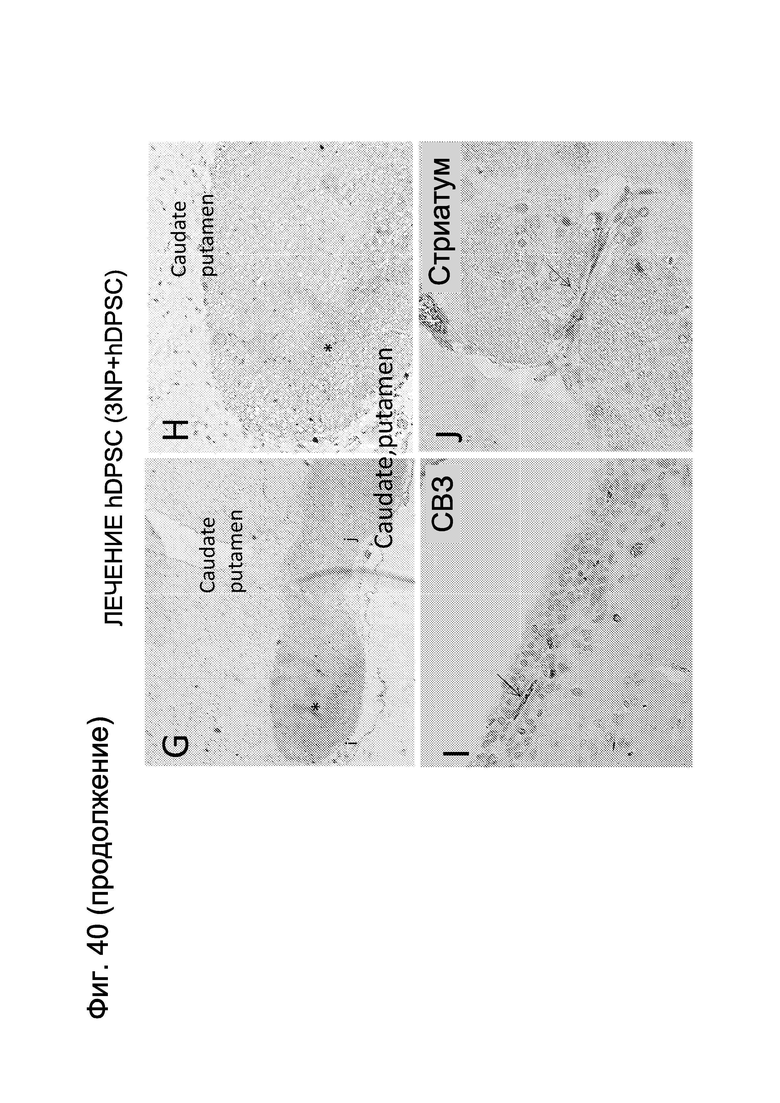
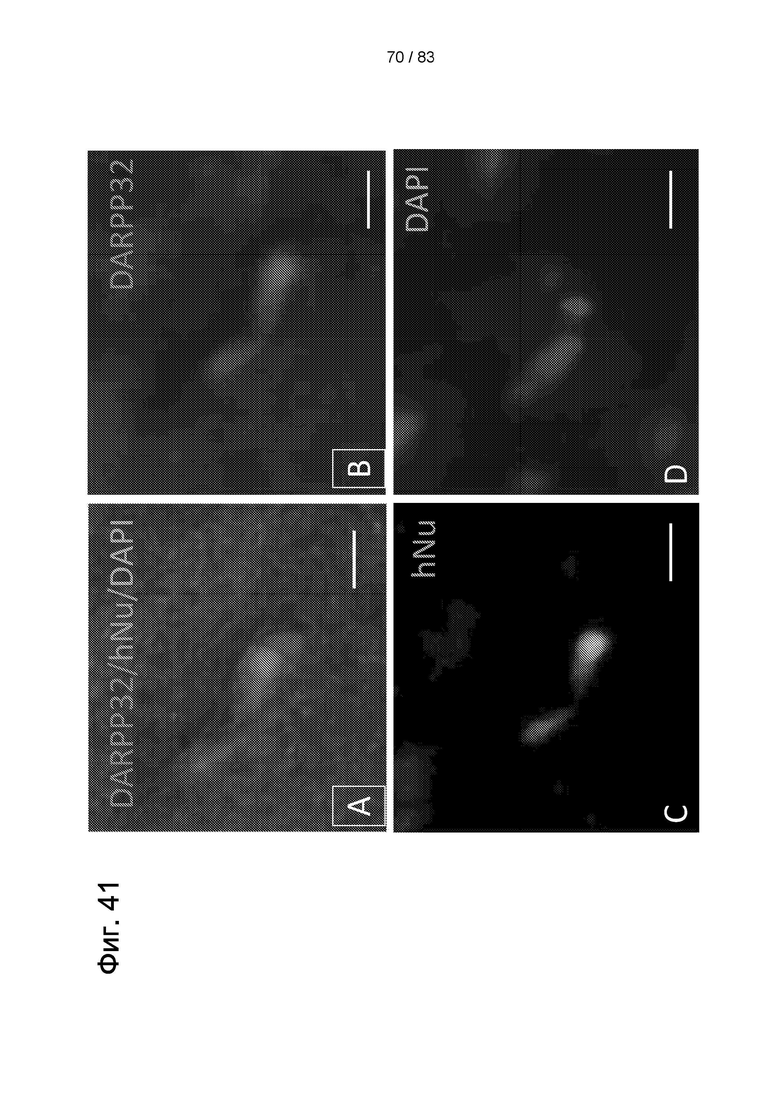
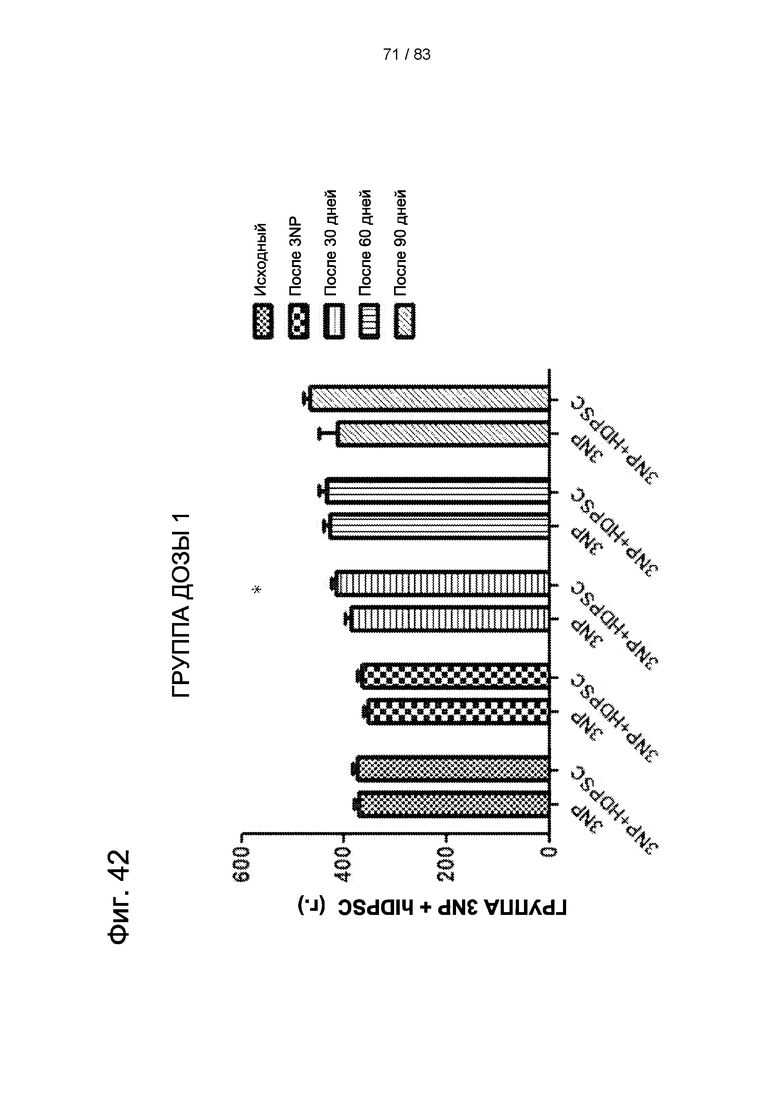
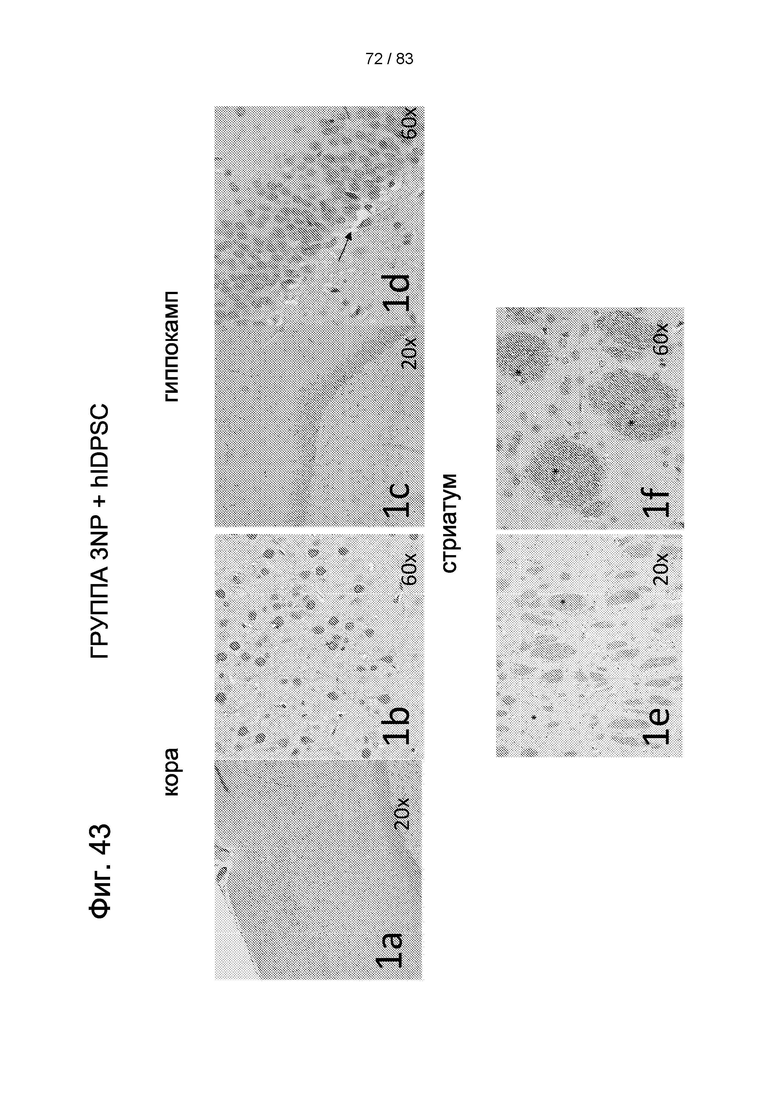
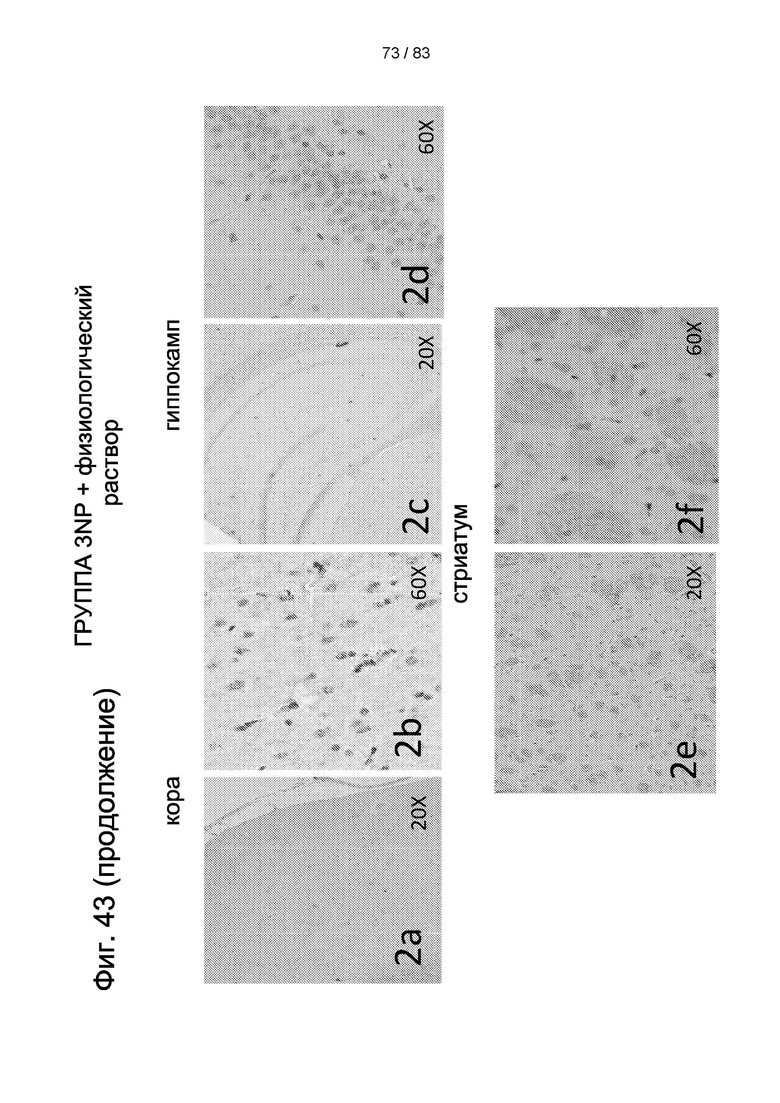
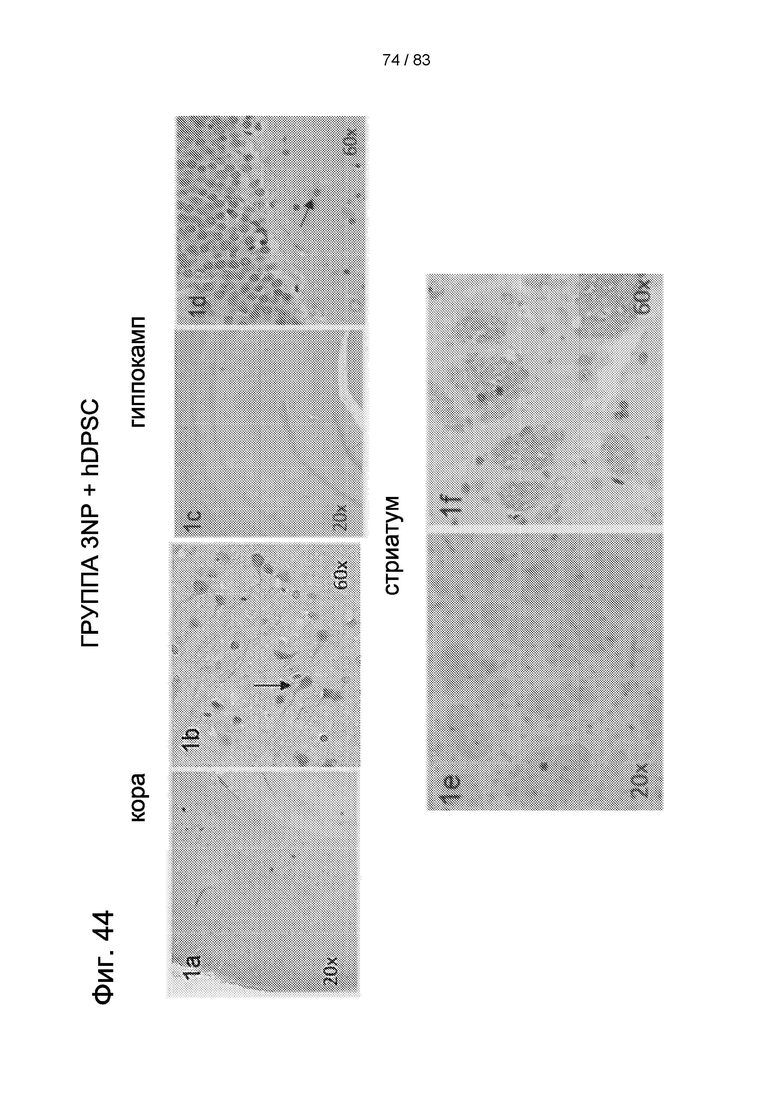
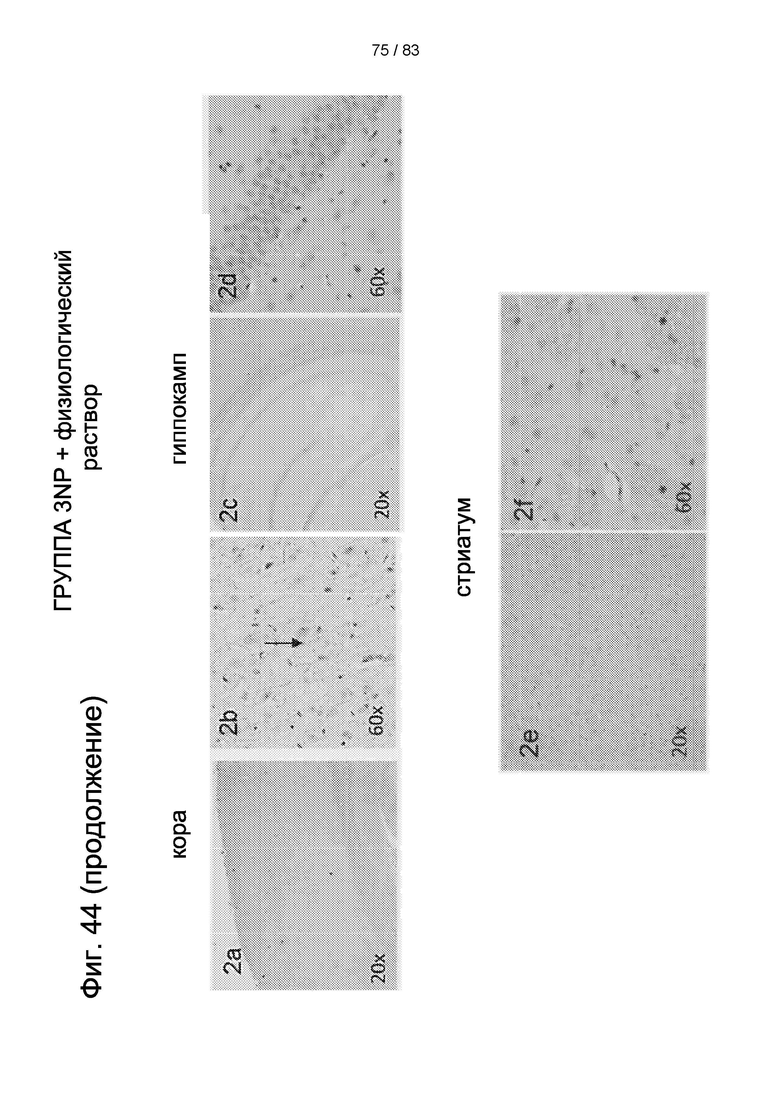
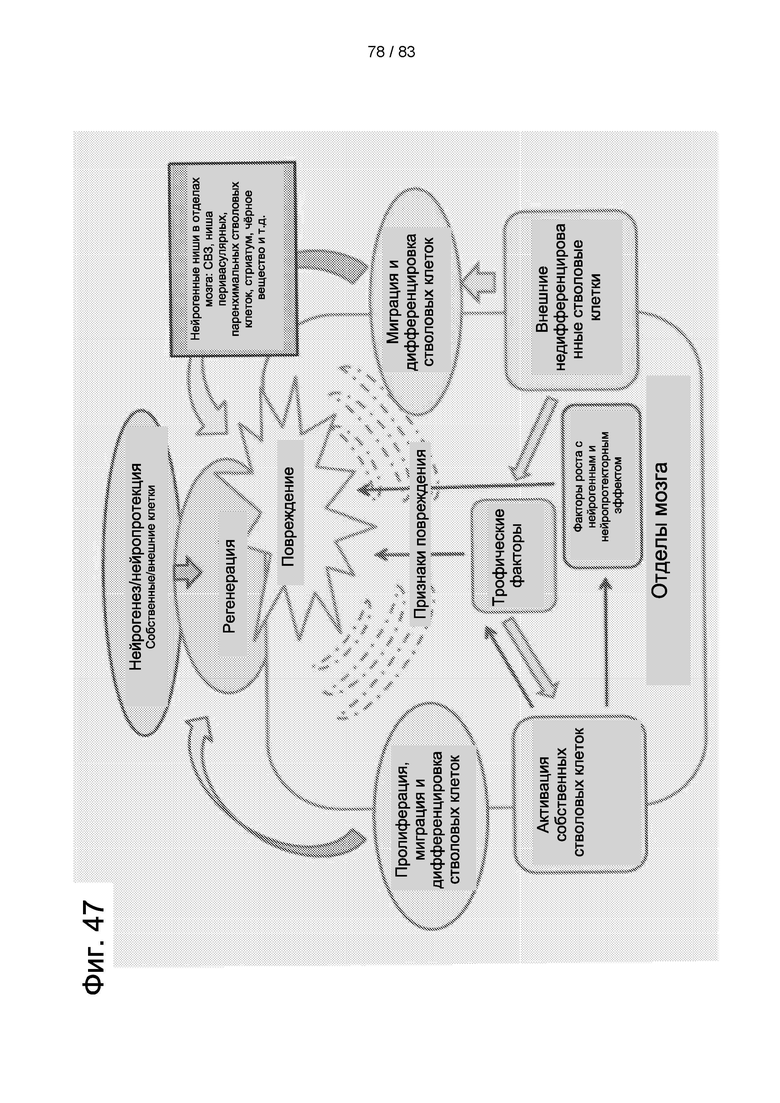
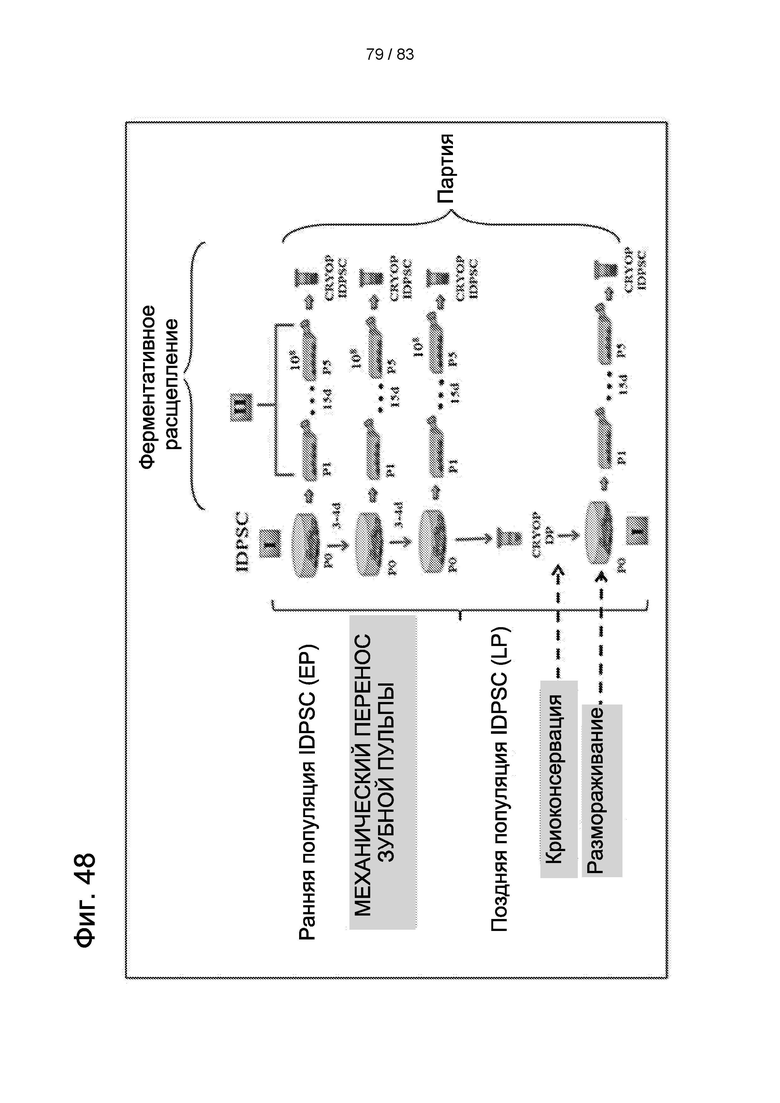
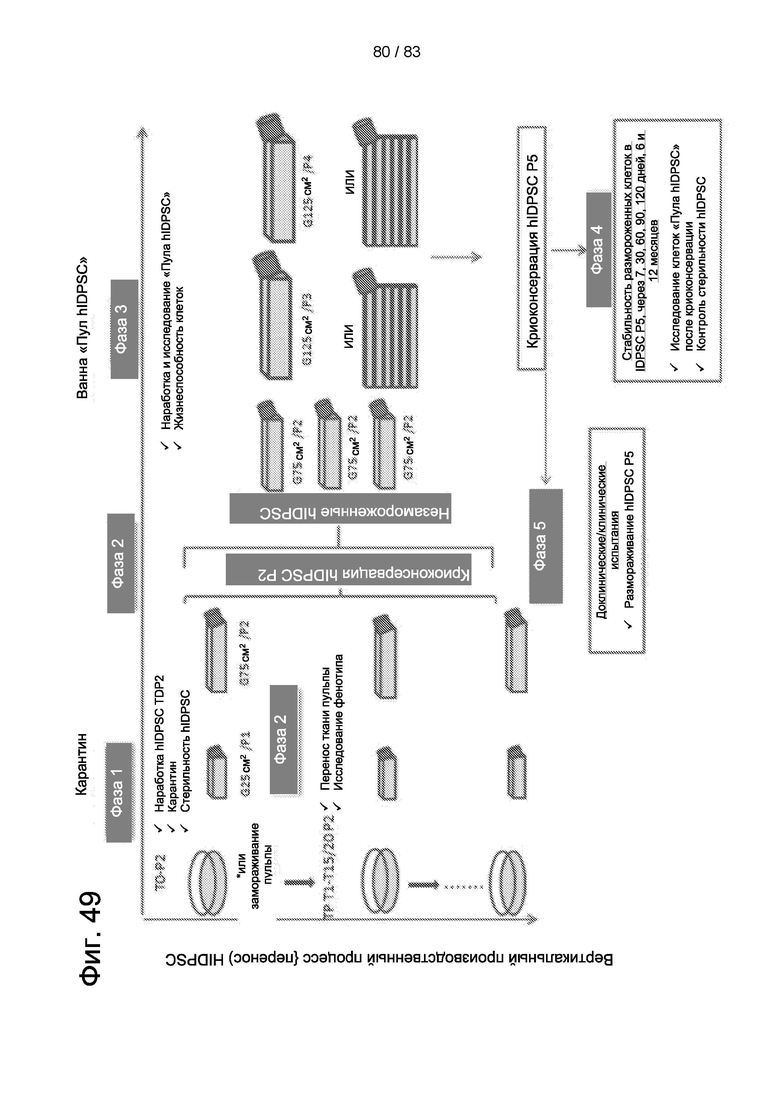
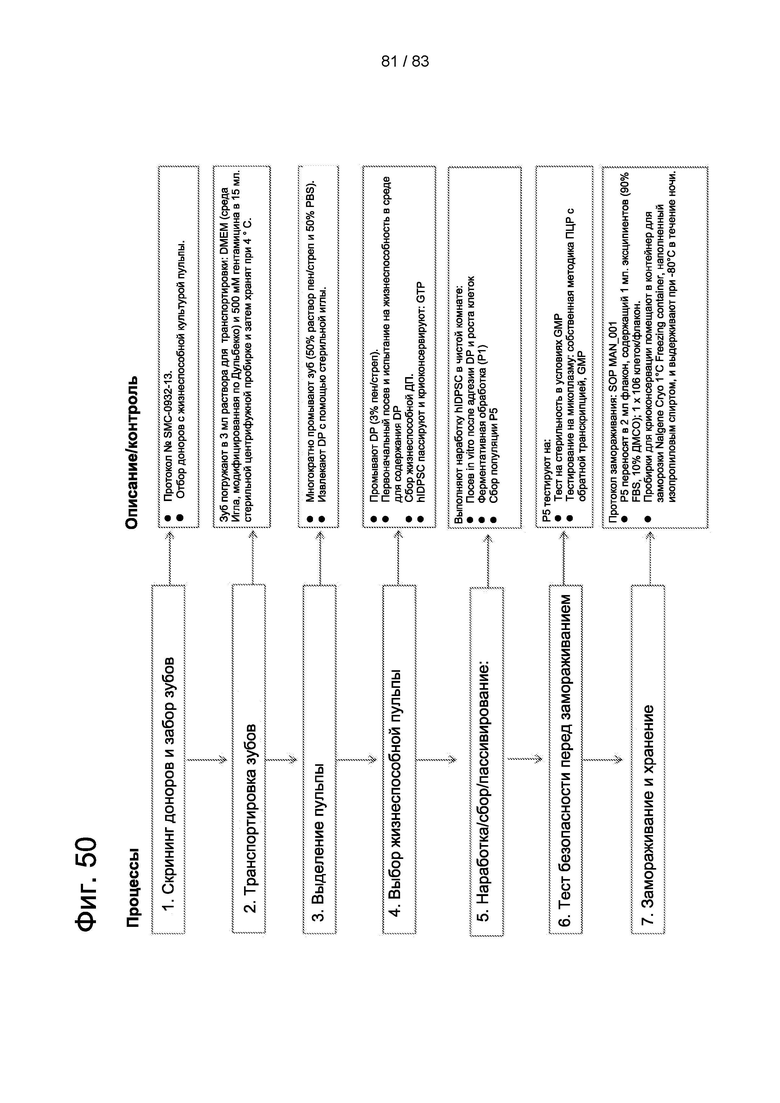


Изобретение относится к области биотехнологии, а именно к получению незрелых стволовых клеток пульпы зуба человека (hIDPSC), экспрессирующих CD44 и CD13, и клеток hIDPSC, экспрессирующих CD44 и CD13 и не экспрессирующих HLA-DR и HLA-ABC, а также фармацевтическим композициям для лечения неврологического заболевания или состояния у субъекта. Способ включает получение пульпы зуба (ПЗ) из человеческого молочного зуба, промывку ПЗ раствором, содержащим антибиотики, и помещение ПЗ в контейнер с культуральной средой. Затем осуществляют механический перенос ПЗ в другой контейнер с культуральной средой после констатации отрастания и адгезии hIDPSC для создания эксплантной культуры. Повторяют стадии со сбором выращенных hIDPSC, экспрессирующих CD44 и CD13, или hIDPSC, экспрессирующих CD44 и CD13 и не экспрессирующих HLA-DR и HLA-ABC, из второго или более позднего цикла сбора. Полученные клетки используют в составе фармацевтической композиции. Изобретение позволяет расширить арсенал технических средств. 4 н. и 18 з.п. ф-лы, 17 табл., 51 ил., 16 пр.
1. Способ получения незрелых стволовых клеток пульпы зуба человека (hIDPSC), экспрессирующих CD44 и CD13, включающий:
a) получение пульпы зуба (ПЗ) из человеческого молочного зуба;
b) промывку ПЗ раствором, содержащим антибиотики, и помещение ПЗ в контейнер с культуральной средой;
c) механический перенос ПЗ в другой контейнер с культуральной средой после констатации отрастания и адгезии hIDPSC для создания эксплантной культуры;
d) повторение стадий b) и c) со сбором выращенных hIDPSC, экспрессирующих CD44 и CD13, из второго или более позднего цикла сбора.
2. Способ по п.1, дополнительно включающий:
e) подтверждение экспрессии CD44 и CD13 в hIDPSC путем иммуноокрашивания образца hIDPSC для детектирования CD44 и CD13.
3. Способ по п.2, причем иммуноокрашивание включает в себя анализ образца проточной цитометрией.
4. Способ по любому из пп.1-3, причем стадии b) и c) повторяют более 5 раз и hIDPSC собирают из эксплантных культур, полученных после 5 переносов ПЗ.
5. Способ по п.4, причем стадии b) и c) повторяют более 10 раз и hIDPSC собирают из эксплантных культур, полученных после 10 переносов ПЗ.
6. Способ по любому из пп.1-5, причем экспрессия CD44 и CD13 позволяет hIDPSC пересекать гематоэнцефалический барьер (ГЭБ).
7. Способ по любому из пп.1-6, причем эксплантная культура содержит полуконфлюентные колонии hIDPSC.
8. Способ по любому из пп.1-7, причем эксплантную культуру hIDPSC из стадии с) перед сбором подвергают пассированию.
9. Способ по п.8, причем пассирование эксплантной культуры hIDPSC включает ферментативную обработку hIDPSC и перенос hIDPSC для наращивания эксплантной культуры.
10. Фармацевтическая композиция для применения в лечении неврологического заболевания или состояния у субъекта, содержащая hIDPSC, экспрессирующие CD44 и CD13, полученные в соответствии со способами по любому из пп.1-9.
11. Композиция по п.10 для применения в лечении неврологического заболевания или состояния, выбранного из группы, состоящей из болезни Паркинсона (БП), рассеянного склероза, бокового амиотрофического склероза (ALS), инсульта, аутоиммунного энцефаломиелита, диабетической невропатии, глаукоматозной невропатии, болезни Альцгеймера, болезни Хантингтона (БХ), аутизма, шизофрении, инсульта, ишемии, двигательного расстройства и судорожного расстройства.
12. Способ получения незрелых стволовых клеток зубной пульпы человека (hIDPSC), экспрессирующих CD44 и CD13 и не экспрессирующих HLA-DR и HLA-ABC, причем этот способ включает:
a) получение пульпы зуба (ПЗ) из человеческого молочного зуба;
b) промывку ПЗ раствором, содержащим антибиотики, и помещение ПЗ в контейнер с культуральной средой;
c) механический перенос ПЗ в другой контейнер с культуральной средой после констатации отрастания и адгезии hIDPSC для создания эксплантной культуры;
d) повторение стадий b) и c) со сбором hIDPSC, экспрессирующих CD44 и CD13 и не экспрессирующих CD146, HLA-DR и HLA-ABC, из второго или более позднего цикла сбора.
13. Способ по п.12, дополнительно включающий:
e) подтверждение экспрессии CD44 и CD13 и отсутствия экспрессии HLA-DR и HLA-ABC в hIDPSC путем иммуноокрашивания образца hIDPSC для детектирования CD44, CD13, HLA-DR и HLA-ABC.
14. Способ по п.13, причем иммуноокрашивание включает в себя анализ образца проточной цитометрией.
15. Способ по любому из пп.12-14, причем стадии b) и c) повторяют более 5 раз и hIDPSC собирают из эксплантных культур, полученных после 5 переносов ПЗ.
16. Способ по п.15, причем стадии b) и c) повторяют более 10 раз и hIDPSC собирают из эксплантных культур, полученных после 10 переносов ПЗ.
17. Способ по любому из пп.12-16, причем экспрессия CD44 и CD13 позволяет hIDPSC пересекать ГЭБ и отсутствие экспрессии HLA-DR и/или HLA-ABC предотвращает отторжение клеток hIDPSC иммунными клетками.
18. Способ по любому из пп.12-17, причем эксплантная культура содержит полуконфлюентные колонии hIDPSC.
19. Способ по любому из пп.12-18, причем эксплантную культуру hIDPSC из стадии с) перед сбором подвергают пассированию.
20. Способ по п.19, причем пассирование эксплантной культуры hIDPSC включает ферментативную обработку hIDPSC и перенос hIDPSC для наращивания эксплантной культуры.
21. Фармацевтическая композиция для применения в лечении неврологического заболевания или состояния у субъекта, содержащая hIDPSC, экспрессирующие CD44 и CD13 и не экспрессирующие HLA-DR и HLA-ABC, полученные в соответствии со способами по любому из пп.12-20.
22. Композиция по п.21 для применения в лечении неврологического заболевания или состояния, выбранного из группы, состоящей из болезни Паркинсона (PD), рассеянного склероза, бокового амиотрофического склероза (ALS), инсульта, аутоиммунного энцефаломиелита, диабетической невропатии, глаукоматозной невропатии, болезни Альцгеймера, болезни Хантингтона (БХ), аутизма, шизофрении, инсульта, ишемии, двигательного расстройства и судорожного расстройства.
| US 2015050248 A1, 19.02.2015 | |||
| СПОСОБ КУЛЬТИВИРОВАНИЯ КЛЕТОК ЗУБНОЙ ПУЛЬПЫ И СПОСОБ ПЕРЕНОСА ЭКСТРАГИРОВАННОГО ЗУБА НА ХРАНЕНИЕ | 2010 |
|
RU2499609C1 |
| СПОСОБ ТРАНСПОРТИРОВКИ ЖИДКОСТИ ПО ТРУБОПРОВОДУ И ПАРОВОДЯНОЙ КОМБАЙН ДЛЯ ЕГО РЕАЛИЗАЦИИ | 2016 |
|
RU2633870C1 |
| ВЕЧКАНОВ Е.М | |||
| и др | |||
| Основы клеточной инженерии: Учебное пособие | |||
| - Ростов-на-Дону, 2012. | |||
Авторы
Даты
2021-01-29—Публикация
2017-03-09—Подача