В современной медицине нейропептидные лекарственные препараты нашли широкое применение для лечения целого ряда нейродегенеративных заболеваний различного генеза. Препараты представляют собой композицию биологически-активных полипептидов, полученных из тканей головного мозга млекопитающих и обладающих ноотропной и нейрометаболической активностью. Различия в протоколах позволяют получить препараты, обогащенные различными белковыми факторами [Патент (RU 2477637)], которые отличаются по источнику сырья, срокам гестации при заборе, молекулярным массам входящих в него белково-полипептидных фракций, их качественному составу, по эволюционно закрепленным в онтогенезе концентрационным соотношениям белков роста, факторов дифференцировки и сигнальных молекул, по способу применения (парентерально, интратекально, интраназально, субконъюнктивально), по безопасности применения (отсутствие токсических, мутагенных, канцерогенных и аллергизирующих свойств), по биологической и фармакологической активности и ее специфичности (ткане- и органоспецифичная, репаративно-регенеративная). В экспериментальных и клинических исследованиях было показано, что такие препараты обладают мультимодальным действием и обеспечивают:
- метаболическую регуляцию - препараты повышают эффективность аэробного энергетического метаболизма мозга, улучшают внутриклеточный синтез белка в развивающемся и стареющем головном мозге;
- нейропротекторное действие - препараты защищают нейроны от повреждающего действия лактацидоза, предотвращают образование свободных радикалов и предотвращают гибель нейронов в условиях гипоксии и ишемии, снижают повреждающее нейротоксическое действие глутамата;
- нейротрофическую активность - препараты оказывают действие аналогичное действию естественных факторов нейронального роста (NGF);
- функциональную нейромодуляцию - препараты оказывают положительное влияние при нарушениях познавательных функций, улучшают концентрацию внимания, процессы запоминания.
К таким препаратам относятся: церебролизин - продукт обработки мозга интактных свиней - средство для лечения болезни Альцгеймера, геморрагического и ишемического инсультов, деменции различного генеза, хронической цереброваскулярной недостаточности, травматических повреждениий головного и спинного мозга фирмы «Ebewe» (Австрия) [РЛС, 2010]; цереброкурин - продукт обработки мозга эмбрионов животных -лекарственное средство при заболеваниях, сопровождающихся нарушением функций центральной нервной системы, фирмы ООО «НИР» (Украина) [РЛС, 2010]; кортексин - препарат полипептидной природы, получаемый путем экстракции из коры головного мозга крупного рогатого скота и свиней, фирмы ООО «Герофарм» (Россия) [РЛС, 2010], обладающий ноотропным, церебропротекторным, противосудорожным и антиоксидантным действием; церебролизат - препарат, повышающий устойчивость ткани головного мозга к интоксикации, гипоксии, гипогликемии, механической травме, фирмы «Микроген» НПО ФГУП (Иммунопрепарат) [РЛС, 2010], обладающий ноотропным действием, представляющий собой гидролизат коры головного мозга крупного рогатого скота.
В целом препараты пептидной природы обладают высокой эффективностью в малых и сверхмалых дозах (физиологическая активность пептидов во много раз превышает активность обычных химических соединений), не вызывают побочных эффектов, легко выводятся из организма без образования токсических продуктов, изменения в биохимических процессах организма, вызванные пептидами, физиологичны и безопасны для человека.
Нейропротекторное и трофическое действие данных препаратов осуществляется за счет специфических пептидов и аминокислот, молекулярной массы не выше 10 кДа, из которых доминирующими и определяющими свойства препарата являются аланин, лейцин и лизин. Наиболее известным и хорошо изученным препаратом группы является церебролизин. Препарат предназначен для внутримышечного, внутривенного введения и обладает невысокой концентрацией биологически активных компонентов, поэтому вводится в организм больного в значительных дозах длительное время [РЛС, 2014]. Разнородность входящих в препарат пептидов (по молекулярной массе, формуле и свойствам) не позволяет с определенностью связать положительные эффекты препарата с конкретной составляющей субстанцией. Действие церебролизина проявляется, прежде всего, преимущественным его влиянием на выраженность очагового неврологического дефекта. Вместе с тем изолированное назначение церебролизина, например, при исходно тяжелых инсультах, сопровождающихся не только очаговой, но и общемозговой симптоматикой, признаками отека мозга, часто оказывается недостаточно эффективным и требует совместного его применения с другими противоишемическими препаратами. Кроме того, выявлена сильная зависимость эффективности церебролизина от адекватности выбранной дозы. Бесконтрольное избыточное повышение дозы церебролизина часто оказывает негативное влияние на темпы и выраженность восстановительных процессов. Таким образом, основными недостатками препарата являются значительная продолжительность курса лечения, низкая активность и специфичность препарата в связи со слабым нейропротективным действием, обладая и низким регенеративным потенциалом для нервной ткани [Кайсарбекова, 2010, РЛС, 2014].
Основная причина, ограничивающая эффективность и безопасность всех существующих нейропептидных препаратов, полученных из головного мозга млекопитающих - это их ксеногенное происхождение. При выделении нейропептидов из тканей головного мозга животных для снижения их иммуногенности (антигенных свойств) прибегают к кислотному или ферментативному гидролизу белков и высокомолекулярных полипептидов, тем самым уменьшая количество нейротрофических факторов роста белковой и полипептидной природы [Хабриева. У., 2005]. Пептидный препарат, полученный таким способом, содержит денатурированные продукты кислотного гидролиза белков и полипептидов с нарушенной четвертичной и третичной структурой, что снижает его специфичность и биологическую активность, повышает его иммуногенность, вызывая аллергические реакции при применении.
Для решения данной проблемы нами предложено получить белково-пептидную композицию с выраженными ноотропными свойствами из нейрональных и глиальных клеток, полученных методом направленной дифференцировки индуцированных плюрипотентных стволовых клеток человека. Данная композиция характеризуется тем, что в ее состав входят белки и полипептиды с молекулярной массой от 0,5 кДа до 100 кДа, из которых 75% имеют молекулярную массу в диапазоне от 10 до 90 кДа, содержание мозгового нейротрофического фактора (BDNF) не менее 50 пг/мл и глиального нейротрофического фактора (GDNF) не менее 40 пг/мл, суммарная масса белка не менее 20 мг/мл препарата, при этом клеточная культура индуцированных плюрипотентных стволовых клеток, из которой получают композицию демонстрирует экспрессию генов, специфичных для ИПСК ОСТ4, SOX2, NANOG, FOXD3, HESX1, SALL4, а также для нейральных клеток DARPP-32, РАХ6, FOXP2, NCAM1, ENO2, Nestin, TUBB3, НТТ и синаптического транспортера ГАМК GAT1.
Видовая специфичность используемых клеточных культур позволит избежать иммунологических конфликтов, развитие которых возможно при использовании пептидных композиций ксеногенного происхождения, полученных из тканей мозга свиней, овец и других животных. Кроме того, использование клеточных культур человека позволит получить белково-пептидную композицию, содержащую белки и пептиды с молекулярной массой до 100 кДа, в которую будут включены не только небольшие пептиды, но и полноразмерные белковые нейрональные ростовые и дифференцировочные факторы. Эффективность действия таких факторов заведомо выше, чем у коротких пептидов, а иммуногенность отсутствует. Использование ИПСК в качестве источника получения белково-пептидной композиции позволяет решить проблему дефицита донорского материала и этические вопросы, возникающие при применении для аналогичных целей эмбрионального материала и культур эмбриональных стволовых клеток человека.
Исследования в области получения ИПСК проводятся только последние 10 лет. Характеристика и стандартизация культур ИПСК стала возможной благодаря открытию ряда транскрипционных факторов, которые являются уникальными для плюрипотентного состояния. К ним относятся, как минимум, 4 гена - Oct-4, Sox2, с-Мус и Klf4, которые способны трансформировать фибробласты в плюрипотентное состояние.
Помимо этого, известен следующий набор транскрипционных факторов: Oct4, Sox2, Nanog и Lin28 [Yu J. et al., 2007]. Исследования данных факторов дали возможность получения ИПСК, как от различных млекопитающих [Li W. et al., 2009, Liu H. et al, 2008, Kwon D.-J. et al., 2013]; так и из различных типов клеток [Aasen Т. et al., 2008, Aoi 2008, Lagarkova M.A. et al., 2010], и что самое важное для настоящей задачи - нейрональных клеток [Eminli S. et al. 2008], что говорит об универсальных механизмах репрограммирования соматических клеток до плюрипотентного состояния.
Для характеристики нейрональной дифференцировки известны такие маркеры, как nestin совместно с Sox2, ядерный белок нервных клеток NeuN, β-тубулин III, ассоциированный с микротрубочками белок МАР2, белки нейрофиламентов, нейрон- специфическая енолаза, синаптофизин и связанная с полисиаловой кислотой молекула адгезии нервных клеток (PSA-NCAM), кислый глиальный фибриллярный белок GFAP, белок S-100 и др.
Наиболее важным направлением современной медицины и биологической науки является выделение из клеточных культур биологически активных веществ, прежде всего молекул, запускающих каскад процессов регенерации и паракринной индукции репаративных процессов. Применение охарактеризованного и стандартизованного комплекса биологически активных веществ может обладать той же эффективностью, но гораздо большей безопасностью по сравнению с живыми клеточными культурами. Возможность эффективной экспансии ИПСК и их дифференцировки в разных направлениях, в том числе нейрональном, решают проблему дефицита донорского материала и снимают ряд этических вопросов.
Изобретение осуществляется следующим образом.
Пример 1. Получение белково-пептидного комплекса.
Забор биоптата кожи (размером от 0,5 до 1 см) производят из любого доступного участка (наиболее удобно из-за ушной раковиной или с внутренней стороны предплечья). После асептической обработки и анестезии 0,5% раствором новокаина участок кожи отсекают с помощью микрохирургического лезвия. Биоптат помещают в стерильный флакон, содержащий транспортную среду (F12 с амикацином, 0,5 г/л). Флакон с содержимым запечатывают и маркируют следующими данными: ФИО донора, дата и время забора. Транспортировку производят при температуре 2-6°С.
Полученный материал стерильно переносят в культуральную посуду и тщательно промывают раствором Хенкса с цефазолином (1 г/л). Материал трижды промывают раствором Версена и дезагрегируют путем инкубации в растворе Версена с добавлением 0,25% трипсина. В течение 1-1,5 часов при 37°С. После инкубации тканевую взвесь интенсивно перемешивают и центрифугируют в течение 10 минут при 1100 об/мин. Осадок разводят культуральной средой (DMEM/F12 1:1 с добавлением аутогенной сыворотки до 10%, амикацина до 500 мг/л), перемешивают и переносят в культуральную посуду. Культуральные флаконы помещают в СO2-инкубатор (37°С, 5% СO2).
Через 2-3 дня удаляют среду с не прикрепившимися клетками. Замену культуральной среды на свежую осуществляют каждые 3-4 дня. После образования субконфлуентного монослоя клетки дезагрегируют раствором Версена с добавлением 0,25% трипсина и переносят в новую культуральную посуду. Коэффициент рассева составляет от 3 до 10 выбирают в зависимости от индивидуальных пролиферативных характеристик фибробластов. Культивируют не более пяти пассажей. На пятом пассаже проводят контроль стабильности кариотипа и способность фибробластов синтезировать коллаген I типа (с помощью иммунофлуоресцентного окрашивания).
В результате были получены фибробласты в количестве 150 млн. клеток. Клеточная культура характеризовалась интенсивной пролиферацией, экспрессией тканеспецифических белков внеклеточного матрикса (гликозаминогликанов, хондроэтинсульфатов, фибронектина, коллагенов I, III типа). С помощью иммуноцитохимии охарактеризован фенотип полученных культур, относительное количество названных клеток в культуре составляет не менее 95%.
При необходимости длительного хранения полученные фибробласты подвергают криоконсервации. Перед замораживанием клетки рассевают из расчета получения субконфлуентного монослоя через 1-2 дня.
В боксе на ледяной бане (при 4°С) готовят криозащитный раствор, состоящий из 10% ДМСО (высокоочищенного диметилсульфоксида) и 90% аутогенной сыворотки.
Клеточную культуру дезагрегируют раствором Версена с добавлением 0,25% трипсина, подсчитывают количество клеток с помощью счетчика и осаждают клетки центрифугированием (1100 об/мин, 10 мин). К осадку добавляют свежеприготовленный криозащитный раствор из расчета 1 мл на 5 млн клеток, перемешивают и помещают полученную суспензию в криопробирки. Маркируют, указывая ФИО донора, номер пассажа, количество клеток, дату криозамораживания, данные ответственного исполнителя.
Образцы замораживают до -80°С с помощью программного замораживателя, а затем помещают в сосуды Дьюара с жидким азотом и хранят при - 196°С.
Криопробирки с клеточным материалом извлекают из сосуда Дьюара и быстро размораживают при температуре 37°С на водяной бане.
Клеточную суспензию из криопробирки по каплям переносят в центрифужную пробирку, доливают полной культуральной средой до десятикратного объема и центрифугируют при 1100 об/мин в течение 10 мин.
Отмытые от криоконсерванта клетки переносят в культуральную посуду с полной ростовой средой.
Перед процедурой репрограммирования культуру фибробластов переводят на среду, не содержащую компоненты животного происхождения. Для этого клетки 2-3 пассажа промывают PBS, затем открепляют раствором трипсина-версена в течение 3-5 минут. Открепленные клетки переносят в 15 мл пробирки, добавляют среду DMEM с содержанием 10% эмбриональной телячьей сыворотки для инактивации работы фермента и центрифугируют 5 минут при 1100 об/мин. Далее супернатант отбирают и сажают клетки на культуральный пластик в количестве 1500-2000 клеток/см в среду DMEM, содержащую эмбриональную телячью сыворотку 10%, L-глутамин 2 mМ, пенициллин-стрептомицин 100 мг/л. Через 24 часа клетки промывают PBS и заливают среду без добавления компонентов животного происхождения (на 1 литр готовой среды: DMEM/F12, HEPES 872 мл; натрия бикарбонат 7.5% 6,4 мл, заменитель эмбриональной телячьей сыворотки 100 мл, основной фактор роста фибробластов человека bFGF (10 μg/mL) 1,2 мл, эпидермальный фактор роста человека EGF (1 mg/mL) 1 мл, гидрокортизон (50 μМ) 20 мл). Клетки культивируют в данной среде один-два пассажа.
Для получения индуцированных плюрипотентных стволовых клеток (ИПСК) проводят репрограммирование фибробластов путем трансдукции с помощью вектора Sendai (CytoTune®-iPS Reprogramming Kits (Cat. № A13780-01, A13780-02)).
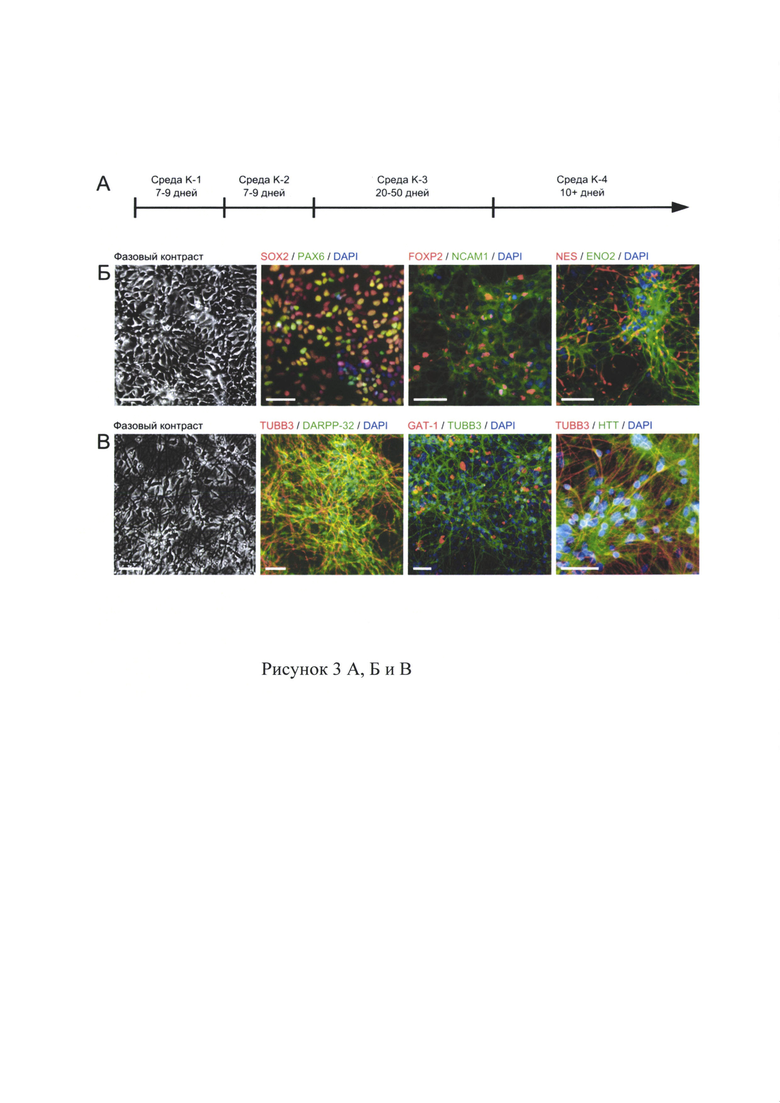
Фибробласты культивируют на 6 луночном планшете в течение 2 суток так, чтобы получить плотность клеток 200-300 тыс клеток на лунку. Перед проведением трансдукции снимают клетки с одной лунки и подсчитывают их число. Производят расчет объема вирусной суспензии по формуле:
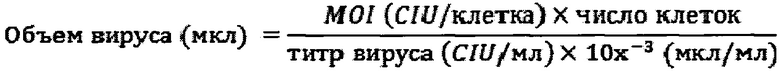
Трансдукцию производят со значениями MOI 5,5 и 3 (так как KOS М01=5, he-Мус MOI=5, hKlf4 MOI=3). Титр вектора зависит от номера партии реактива и должен быть определен на сайте производителя.
Для размораживания вирусной суспензии CytoTune®2.0 Sendai, которая хранится при -80°С, каждую пробирку погружают на 5-10 сек в воду при 37°С, а затем инкубируют при комнатной температуре до полного оттаивания. Суспензию центрифугируют, пробирку помещают в лед и добавляют необходимое количество CytoTune®2.0 Sendai в 1 мл среды для фибробластов, предварительно прогретой до 37°С. Аккуратно размешивают суспензию. Через 5 мин удаляют среду из лунок, в которых находятся фибробласты, и добавляют приготовленную вирусную суспензию. Инкубируют клетки ночь при стандартных культуральных условиях. Через 24 часа после трансдукции, производят замену среды на свежую. После трансдукции контролируют цитотоксичность вируса в течение 48 часов. Допускается гибель клеток не более 50%.
Клетки культивируют в течение 6 суток, меняя среду каждый день. На 7 сутки трансдуцированные клетки пересаживают на чашки Петри, предварительно покрытые витронектином.
Перед культивированием клеток на дне культуральной посуды формируют подложку из витронектина. Витронектин размораживают при комнатной температуре и разводят из расчета 40 мкл витронектина на 1 мл DPBS. Наносят 1 мл приготовленного раствора на чашку Петри диаметром 35 мм и инкубируют 1 час при комнатной температуре. Перед нанесением клеточной суспензии витронектин удаляют.
Для пересева на новые чашки Петри клетки промывают DPBS и дезагрегируют раствором Версена с добавлением 0,25% трипсина при комнатной температуре. Добавляют 2 мл культуральной среды в каждую лунку, перемешивают, переносят клеточную суспензию в пробирку и центрифугируют в режиме 200×g в течение 4 минут. Осадок ресуспензируют в культуральной среде, подсчитывают число клеток и рассаживают клетки на чашки Петри диаметром 10 см из расчета от 100 до 500 тыс.клеток на чашку. Культивируют при стандартных культуральных условиях. Через сутки заменяют среду на Essential 8™, которую далее меняют на свежую ежедневно. При визуальном осмотре под микроскопом выявляют репрограммированные клетки.
Через 3-4 недели после трансдукции клетки формируют крупные колонии. Выявление колоний репрограммированных клеток путем прижизненной окраски Tral-60 или Tral-81. Колонии iPS-клеток вручную отбирают и переносят на чашки Петри, покрытые витронектином для дальнейших исследований.
При культивировании ИПСК ведется визуальный контроль за морфологическими характеристиками культур. ИПСК растут плотными колониями с ровными краями. Клетки мелкие, с крупными ядрышками. Культивирование осуществляют в чашках Петри диаметром 35 мм, используя культуральную среду Essential 8™ (Е8).
Клетки рассаживают по достижении плотности 50-70% монослоя. Из чашек удаляют культуральную среду и промывают 2 мл DPBS. Для дезагрегации добавляют 1 мл 0,5 мМ раствора EDTA на DPBS и инкубируют 5-8 мин при комнатной температуре. Затем удаляют раствор EDTA, добавляют 2 мл предварительно подогретой среды, взбалтывают и переносят клеточную суспензию на чашки, предварительно покрытые витронектином, и добавляют среды до 2 мл. Замену среды на свежую проводят каждый день.
Стандартизацию ИПСК проводят по экспрессии генов, специфичных для эмбриональных стволовых клеток ОСТ4, SOX2, NANOG, FOXD3, HESX1, SALL4 методом ПЦР с обратной транскрипцией.
ИПСК подвергают криоконсервации. Готовят на льду криозащитный раствор из расчета на 1 чашку: 900 мкл среды Е8, 100 мкл DMSO и 1 мкл ингибитора Rho-киназы (сток 5 мМ). Из каждой чашки удаляют среду и промывают 2 мл DPBS. Добавляют 1 мл 0,5 мМ раствора EDTA и инкубируют 10 мин при комнатной температуре. Затем удаляют раствор EDTA и добавляют 1 мл криозащитного раствора. Клетки снимают с поверхности чашки, перемешивают и переносят в криопробирку объемом 1,8 мл (1 мл на 1 пробирку). Образцы замораживают до -80°С с помощью программного замораживателя, а затем помещают в сосуды Дьюара с жидким азотом и хранят при -196°С.
Криопробирки с клеточным материалом извлекают из сосуда Дьюара и размораживают при температуре 37°С на водяной бане.
Клеточную суспензию из криопробирки (1 мл) по каплям переносят в центрифужную пробирку, доливают 9 мл теплой культуральной среды DMEM/F12 до десятикратного объема и центрифугируют при 800 об/мин в течение 5 мин.
Отмытые от криоконсерванта клетки переносят на чашки Петри, предварительно покрытые витронектином, с культуральной средой Е8, содержащей ингибитор Rho-киназы. При переносе сохраняют целостность колоний. Адаптация клеток после криоконсервации продолжается от 1 до 3 недель.
Для проведения нейрональной дифференцировки ИПСК культивируют на чашках Петри диаметром 35 мм, покрытых человеческим рекомбинантным ламинином в среде Е8 до 80-90% монослоя. Среду меняют каждый день, наливая по 2 мл на чашку.
На первом этапе дифференцировки используют нейрональную среду №1 (Н-1) состоящую из DMEM/F12, пенициллин-стрептомицина 50 ед/мл, L-глутамина 1 мМ, 1% добавки N2, Noggin 20-80 нг/мл, SB431542 5-12 мкМ, дорсоморфин 2-6 мкМ (или LDN193189 0,1-3 мкМ). В первый день производят смену среды на смесь среды Е8 и Н-1 в соотношении 1:4, через день производят полную смену среда на Н-1. Клетки культивируют в течение 14-20 суток до формирования характерных скоплений звездчатой формы, что соответствует стадии формирования нервной трубки в эмбриогенезе. Скопления выявляют визуально при помощи микроскопа. Клетки дезагрегируют, добавляя 1 мл раствора Версена и инкубируют 3-5 мин при комнатной температуре. Затем удаляют раствор Версена, клетки снимают с подложки суспендированием и переносят в пробирку. Клетки центрифугируют 10 минут при 800-1100 об/мин., затем осадок переносят на новые чашки Петри в соотношении 1:3, предварительно покрытые человеческим рекомбинантным ламинином, и культивируют в среде для нейрональных предшественников (Н-2), состоящую из Neurobasal, 2% В27, пенициллин-стрептомицина 50 ед/мл, L-глутамина 1 мМ, FGF2 5-20 нг/мл, Purmorphamine 1-10 мкМ. Среду меняют через сутки до достижения плотного монослоя, после чего снова производят пересев в соотношении 1:3.
До полной зрелости нейрональные предшественники необходимо культивировать в среде для созревания №3 (Н-3), состоящую из Neurobasal, 2% В27, пенициллин-стрептомицина 50 ед/мл, L-глутамина 1 мМ, смеси незаменимых аминокислот 1%, аскорбиновой кислоты 200 мкМ, BDNF 10-20 нг/мл. На этом этапе происходит созревание нейрональных предшественников и глии. Морфологически большинство клеток имеют отростчатую форму.
Стандартизацию нейральных клеток проводили по экспрессии генов DARPP-32, РАХ6, FOXP2, NCAM1, EN02, Nestin, TUBB3, HIT, GFAP, S-100 и синаптического транспортера ГАМК GAT1.
Активную композицию белков и пептидов получают путем ионообменной хроматографии фильтрата надосадочной фракции отцентрифугированного гомогената культуры нейронов и глиальных клеток, в присутствии буферного раствора, детергентов и солюбилизантов. Условия ионообменной хроматографии подобраны таким образом, что катионные (внутриядерные белки) не сорбируются на сорбенте.
Культуру нейронов и глиальных клеток, полученных методом направленной дифференцировки индуцированных плюрипотентных стволовых клеток человека, поэтапно:
- гомогенизируют в буферном растворе с одновременной экстракцией в присутствии обратимых ингибиторов протеолиза и неионных детергентов при рН не менее 5,3 и не выше 8,3 с последующим центрифугированием при значении g в интервале 10000-28000 в течение 90-30 мин;
- полученный супернатант фильтруют;
- фильтрат подвергают ионообменной хроматографии с сепарацией связавшихся белков с использованием элюента с ионной силой в интервале от 0,14 до 0,21 ммоль/л при рН в интервале от 5,3 до 8,3. Сбор целевых фракций подвижной фазой начинают при значении ионной силы 0,175 ммоль/л, увеличивая ее постепенно или ступенчато с шагом 0,035 ммоль/л до значения ионной силы 0,22 ммоль/л, полученные фракции объединяют и подвергают стерилизующей фильтрации.
Полученная композиция включает в себя белки и пептиды молекулярной массой в пределах от 0,5 до 200 кДа, средняя молекулярная фракция находится в пределах от 20 до 180 кДа не менее 70%.
Пример 2. Характеристика ИПСК.
В процессе репрограммирования до плюрипотентного состояния происходят значительные изменения в паттерне экспрессии генов. Анализ экспрессии некоторых маркерных генов в клонах ИПСК проводят двумя различными методами: окрашивание антителами и ПЦР с обратной транскрипцией. Показано, что полученные клоны ИПСК специфично окрашиваются на маркеры ПСК ОСТ4 и SSEA-4. ОСТ4 и SSEA-4 является общепринятыми маркерами ПСК (Рисунок 1А, 1Б). Методом ПЦР с обратной транскрипцией была показана экспрессия генов, специфичных для ПСК ОСТ4, SOX2, NANOG, FOXD3, HESX1, SALL4, на таком же уровне, что и в ЭСК человека. Для нормировки количества кДНК использовали уровень экспрессии гена домашнего хозяйства GAPDH, в качестве положительного и отрицательного контролей использовали кДНК из ЭСК и фибробластов кожи человека.
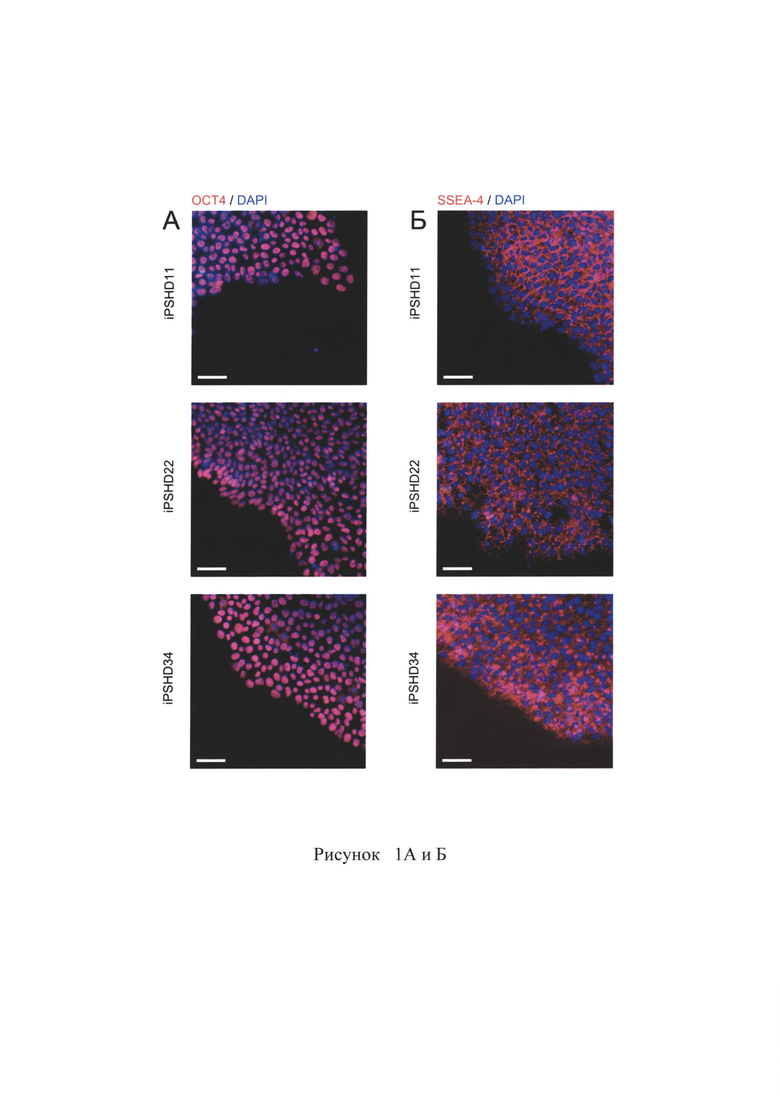
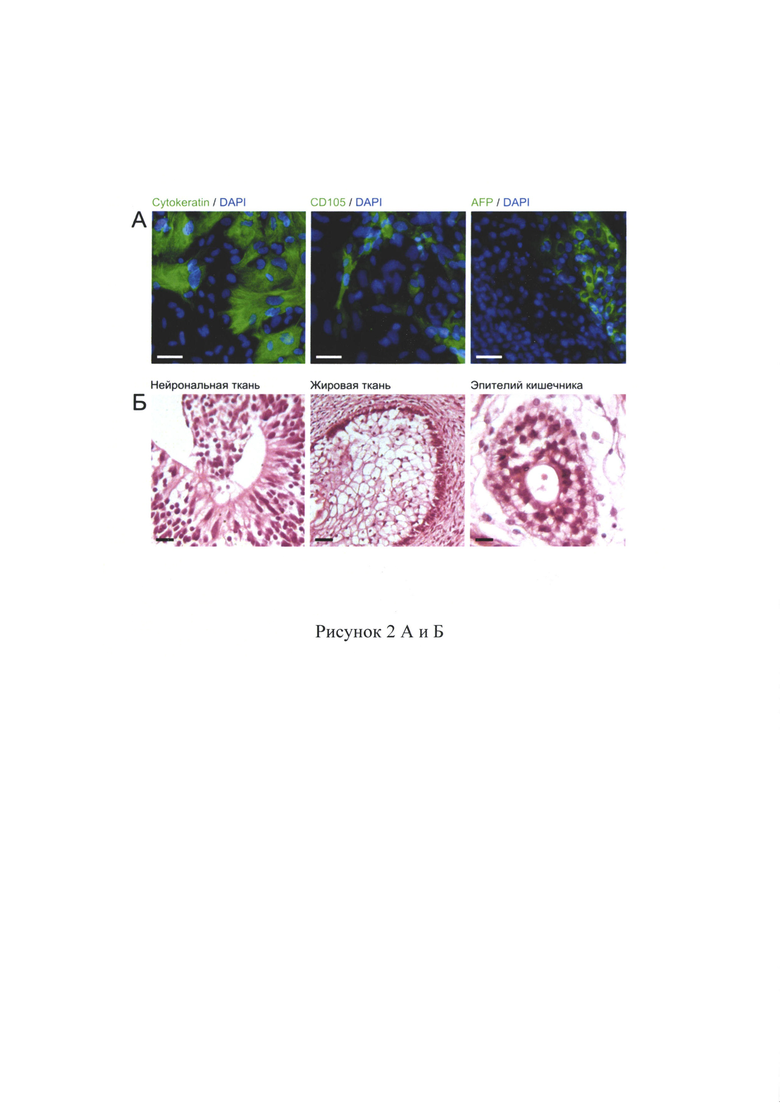
Тест на формирование жизнеспособных химер используют для выявления способности к дифференцировке во все типы клеток организма, доказательства плюрипотентности ИПСК мыши. В случае клеток человека доступны менее строгие тесты, такие как in vitro дифференцировка в клетки трех зародышевых листков, способность к образованию эмбриоидных телец, а в случае in vivo формирование тератома-подобных новообразований при введении ПСК иммунодефицитным мышам. Эмбриоидное тельце представляет начальный этап спонтанной дифференцировки и позволяет определить в своем составе клетки, принадлежащие разным зародышевым листкам. В результате такой спонтанной дифференцировки образовались клетки различной принадлежности. Через две недели после начала культивирования в адгезионной форме клетки фиксируют и проводят окрашивание клеточных культур с использованием антител к белкам-маркерам трех зародышевых листков. В культуре спонтанно дифференцировавшихся клеток находят клетки, положительно окрашивающиеся на маркер эктодермы пан-цитокератин (Cytokeratin), мезодермы CD 105 и энтодермы а-фетопротеин (AFP) (рис. 2А). Также для части клонов был выполнен тест на формирование тератом. ИПСК инъецировали подкожно в заднюю лапу иммунодефицитных мышей, после чего, через 10-12 недель формировались тератомы, в которых находили ткани, принадлежащие к трем зародышевым листкам (рис. 2Б). Таким образом, полученные ИПСК способны дифференцироваться в клетки всех трех зародышевых листков и являются плюрипотентными (рис. 3А).
Анализ экспрессии маркерных генов в нейронально преддифиренцированных плюрипотентных стволовых клеток Проведен анализ и выявлены нейроны, экспрессирующие белок DARPP-32, известный специфический маркер серединных шипиковых нейронов стриатума. На этапе наращивания, клетки латерального ганглионарного бугорка, демонстрировали экспрессию маркерных генов SOX2, РАХ6, FOXP2, NCAM1, EN02, Nestin (рис. 3Б). Анализ показал, что до 95% полученных клеток экспрессировали нейрональный маркер TUBB3, до 80% клеток, экспрессирующих TUBB3, также экспрессировали DARPP-32 (рис. 3В). Дифференцированные нейроны также продемонстрировали экспрессию НТТ и синаптического транспортера ГАМК GAT1 (рис. 3В).
Пример 3.
Композицию характеризовали по количеству в 1 мл общего белка и таких факторов, как мозговой нейротрофический фактор (Brain-Derived Neurotrophic Factor, BDNF) и глиальный нейротрофический фактор (GDNF). Для этого использовали твердофазный иммуноферментный анализ. 1 мл суспензии центрифугировали, полученные в результате центрифугирования супернатанты апплицировали в лунки планшета с предварительно адсорбированными первичными антителами к BDNF и GDNF, далее анализ проводили согласно инструкции производителя. Содержание факторов выражали в пг/мл композиции. Всего было исследовано 10 образцов композиции, получены результаты по содержанию BDNF не менее 50 пг/мл и GDNF не менее 40 пг/мл.
Общий белок в 1 мл суспензии определяли методом Бредфорда. Суммарная масса белка в составе композиции составляет не менее 20 мг/мл препарата.
Пример 4.
Оценка эффективности использования композиции на модели перманентной окклюзии правой средней мозговой артерии у крыс
На экспериментальной модели перманентной окклюзии правой средней мозговой артерии у крыс была продемонстрирована эффективность системного введения Препарата в отношении объема развивающегося инфаркта в бассейне средней мозговой артерии. В эксперименте были сформированы две группы: введение препарата (n=12) и введение физиологического раствора (n=12) в объеме 1 мл.
Введение препарата осуществляли внутрибрюшинно однократно через 60 минут после наступления окклюзии. Факт окклюзии кровеносных сосудов подтверждали с помощью лазерной допплеровской флоуметрии.
Проводили сравнение выживаемости (кривые Каплан-Мейера) через 14 суток между группой крыс с моделью инсульта и группой крыс с моделью инсульта и введением Препарата, при этом выживаемость составила 50 и 91, 6% соответственно.
Все крысы тестировались по шкале mNSS на 1, 8 и 15 сутки после инсульта. Нормирование баллов каждого животного производилась к 1 суткам (до введения Препарата и физиологического раствора). Отмечается достоверная разница нормированных баллов по шкале mNSS между группами на 8 (р=0,005) и 16 (р=0,005) сутки (U-критерий Манна-Уитни). Медиана нормированных баллов по шкале mNSS составила 95 и 49% на 8 день для группы с введением физиологического раствора и Препарата соответственно и 78 и 23% на 15 день.
Через 15 суток после наступления окклюзии животных выводили из эксперимента и исследовали серийные срезы всего головного мозга толщиной 2 мм, окрашенные 2,3,5-трифенилтетразолий хлоридом (ТТХ). Данный краситель окрашивает неишемизированые участки в розовый цвет, а ишемизированные, где наблюдается гибель клеток, остаются неокрашенными. Окрашенные срезы сканируют с двух сторон и высчитывают объем инфаркта ишемизированного полушария. Объемная доля инфаркта при введении физиологического раствора составила 25,4±5,6%, а после введения Препарата 19,8±3,9%.
Таким образом, введение композиции экспериментальным животным с острой перманентной окклюзией средней мозговой артерии приводит к достоверному увеличению выживаемости и уменьшению неврологических дефицитов у экспериментальных животных.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения ноотропной композиции на основе полипептидных комплексов, выделенных из нейронов и глиальных клеток, полученных методом направленной дифференцировки индуцированных плюрипотентных стволовых клеток человека | 2018 |
|
RU2690498C1 |
| Ноотропная композиция на основе полипептидных комплексов, выделенных из нейрональных прогениторных клеток в условиях теплового шока, и способ ее получения | 2019 |
|
RU2752906C2 |
| Ноотропная композиция на основе полипептидных комплексов, выделенных из нейрональных прогениторных клеток в условиях гипоксии, и способ ее получения | 2019 |
|
RU2732600C1 |
| Ноотропная композиция на основе полипептидных комплексов, выделенных из глиальных прогениторных клеток в условиях теплового шока, и способ её получения | 2019 |
|
RU2732599C1 |
| Способ получения глиальных производных индуцированных плюрипотентных стволовых клеток с повышенной экспрессией NGF для терапии нейродегенеративных заболеваний | 2023 |
|
RU2829363C1 |
| Способ получения глиальных производных индуцированных плюрипотентных стволовых клеток с повышенной экспрессией BDNF для терапии ишемического инсульта | 2023 |
|
RU2829361C1 |
| ПРИМЕНЕНИЕ СТВОЛОВЫХ КЛЕТОК, ЭКСПРЕССИРУЮЩИХ МЕЗЕНХИМАЛЬНЫЕ И НЕЙРОНАЛЬНЫЕ МАРКЕРЫ, И ИХ КОМПОЗИЦИЙ ДЛЯ ЛЕЧЕНИЯ НЕВРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ (ВАРИАНТЫ) | 2017 |
|
RU2742828C2 |
| УЛУЧШЕННЫЙ СПОСОБ ДИФФЕРЕНЦИРОВКИ ИНДУЦИРОВАННЫХ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК ЧЕЛОВЕКА В ДОФАМИНЭРГИЧЕСКИЕ НЕЙРОНЫ | 2023 |
|
RU2823290C1 |
| СПОСОБ ОЦЕНКИ МОРФОФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ ДИФЕРЕНЦИРОВАННЫХ В ДОФАМИНЕРГИЧЕСКИЕ НЕЙРОНЫ ИНДУЦИРОВАННЫХ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК БОЛЬНЫХ ПАРКИНСОНИЗМОМ | 2012 |
|
RU2501853C1 |
| СТВОЛОВЫЕ КЛЕТКИ, ЭКСПРЕССИРУЮЩИЕ МЕЗЕНХИМАЛЬНЫЕ И НЕЙРОНАЛЬНЫЕ МАРКЕРЫ, ИХ КОМПОЗИЦИИ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2017 |
|
RU2741839C2 |
Изобретение представляет собой ноотропную белково-пептидную композицию на основе полипептидных комплексов, выделенных из нейронов и глиальных клеток, полученных методом направленной дифференцировки индуцированных плюрипотентных стволовых клеток человека, характеризующуюся тем, что в ее состав входят белки и полипептиды с молекулярной массой от 0,5 до 100 кДа, из которых 75% имеют молекулярную массу в диапазоне от 10 до 90 кДа, содержание мозгового нейротрофического фактора (BDNF) не менее 50 пг/мл и глиального нейротрофического фактора (GDNF) не менее 40 пг/мл, суммарная масса белка не менее 20 мг/мл препарата, при этом клеточная культура индуцированных плюрипотентных стволовых клеток, из которой получают композицию, демонстрирует экспрессию генов, специфичных для ИПСК ОСТ4, SOX2, NANOG, FOXD3, HESX1, SALL4, а также для нейральных клеток DARPP-32, РАХ6, FOXP2, NCAM1, ENO2, Nestin, TUBB3, НТТ и синаптического транспортера ГАМК GAT1. Использование клеточных культур человека позволяет получить белково-пептидную композицию, в которую будут включены не только небольшие пептиды, но и полноразмерные белковые нейрональные ростовые и дифференцировочные факторы. Эффективность действия таких факторов заведомо выше, чем у коротких пептидов, а иммуногенность отсутствует. Использование ИПСК в качестве источника получения белково-пептидной композиции позволяет решить проблему дефицита донорского материала и этические вопросы, возникающие при применении для аналогичных целей эмбрионального материала и культур эмбриональных стволовых клеток человека. 4 пр., 3 ил.
Ноотропная белково-пептидная композиция на основе полипептидных комплексов, выделенных из нейронов и глиальных клеток, полученных методом направленной дифференцировки индуцированных плюрипотентных стволовых клеток человека, характеризующаяся тем, что в ее состав входят белки и полипептиды с молекулярной массой от 0,5 до 100 кДа, из которых 75% имеют молекулярную массу в диапазоне от 10 до 90 кДа, содержание мозгового нейротрофического фактора (BDNF) не менее 50 пг/мл и глиального нейротрофического фактора (GDNF) не менее 40 пг/мл, суммарная масса белка не менее 20 мг/мл препарата, при этом клеточная культура индуцированных плюрипотентных стволовых клеток, из которой получают композицию, демонстрирует экспрессию генов, специфичных для ИПСК ОСТ4, SOX2, NANOG, FOXD3, HESX1, SALL4, а также для нейральных клеток DARPP-32, РАХ6, FOXP2, NCAM1, ENO2, Nestin, TUBB3, НТТ и синаптического транспортера ГАМК GAT1.
| ПОЛУЧЕНИЕ ТЕРМИНАЛЬНО ДИФФЕРЕНЦИРОВАННЫХ ДОФАМИНЕРГИЧЕСКИХ НЕЙРОНОВ ИЗ ЭМБРИОНАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК ЧЕЛОВЕКА | 2004 |
|
RU2345133C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ПРЕДНАЗНАЧЕННАЯ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ ЦЕНТРАЛЬНОЙ И ПЕРИФЕРИЧЕСКОЙ НЕРВНОЙ СИСТЕМЫ СОСУДИСТОГО, ТРАВМАТИЧЕСКОГО, ТОКСИЧЕСКОГО, ГИПОКСИЧЕСКОГО И АУТОИММУННОГО ГЕНЕЗА | 2010 |
|
RU2445106C1 |
| WO 2001088104 A2, 22.11.2001 | |||
| СПОСОБ ЛЕЧЕНИЯ ОСТРОГО НАРУШЕНИЯ МОЗГОВОГО КРОВООБРАЩЕНИЯ ИШЕМИЧЕСКОГО И ГЕМОРРАГИЧЕСКОГО ХАРАКТЕРА | 2010 |
|
RU2477637C2 |
| Гудашева Т.А | |||
| и др | |||
| Мозговой нейротрофический фактор и его низкомолекулярные миметики, Фармакокинетика и Фармакодинамика, 2017 (3), найдено онлайн 04.04.2019, найдено в Интернет http://www.pharmacokinetica.ru/articles/item/mozgovoj-nejrotroficheskij-faktor-i-ego-nizkomolekulyarnye-mimetiki. | |||
Авторы
Даты
2019-06-06—Публикация
2018-05-17—Подача