Изобретение относится к способу получения щелочных металлов, в частности лития, путем электролиза водных растворов солей, содержащих ионы лития.
Данный способ также может быть использован для избирательного извлечения лития из растворов, содержащих как ионы лития, так и ионы других элементов.
Известен способ получения металлического кальция [1]. Способ включает в себя электролиз растворов его солей, который проводят в апротонном растворителе в виде диметилсульфоксида, или диметилацетамида, или их смеси. В качестве солей кальция может быть использован хлорид или ацетат кальция. Обеспечивается получение металлического кальция при комнатной температуре.
Описанный способ относится к металлургии и касается способа получения кальция. Изобретение может быть использовано для получения щелочных и щелочноземельных металлов, но преимущественно оно предназначено для получения кальция в режиме электролиза неводного раствора кальциевой соли.
Данный способ относится в основном к способам получения металлического кальция, так как активность щелочных металлов более зысокая, чем у кальция. Кроме того металл, который получается предложенным способом, является сильно загрязненным, что требует дополнительных затрат на очистку.
Известен способ получения щелочных и щелочноземельных металлов [2]. В данном описании приводится пример получения металлического лития с использованием гетерополикислоты 2-18 ряда, имеющей химическую формулу H6[P2W18O62]. Далее процесс получения металлического лития осуществлялся следующим образом. Раствор гетерополикислоты налили в гальваническую ванну и опустили два графитовых электрода. Затем через раствор начали пропускать постоянный электрический ток. Напряжение между электродами составило 2,3 В. Начальная сила тока - 70 мкА. На катоде происходило восстановление анионного комплекса гетерополикислоты, а на аноде выделялся кислород:
H6[P2W18O62] + 9 H2O = H24[P2W18O62] + 4,5 O2
После того, как сила тока стала меньше 30 мкА, процесс остановили. Полученную кислоту нейтрализовали гидроксидом лития прямо в гальванической ванне с раствором. С помощью лакмусовой бумажки контролировали рН раствора. После того как рН стал равным примерно семи, LiOH добавлять перестали. рН равный семи означал, что кислота полностью нейтрализована. В виде химического уравнения реакции процесс можно представить следующим образом:
Н24[P2W18O62]+24 LiOH = Li24[P2W18O62] + 24 H2O
Полученную гетерополисоль выделили из раствора методом выпаривания и высушили. Сухие кристаллы Li24[P2W18O62] растворили при температуре 22°С в пиридине, доведя концентрацию до насыщения, после чего в раствор опустили два графитовых электрода (анод и катод) и электролизовали раствор постоянным электрическим током. Электролиз проводили при напряжении между анодом и катодом 3,1 В в течение 8 часов. Сила тока при этом составила 140 мкА. На катоде происходило окисление анодного комплекса:
[P2W18O62]24-→[P2W18O62]6- + 18e-
с образованием исходной кислоты. Остаточная вода, которая осталась в Li24[P2Me18O62], разлагалась в ходе процесса, и часть водорода связывалась анионным комплексом.
Затраты электрической энергии составили 12,5 Дж, что в 5300 раз меньше, чем при обычном электролизе солей в растворах. Процесс получения лития можно представить следующим уравнением:
Li24[P2W18O62] + 2 H2O = 24 Li↓ + H6[P2W18O62] + 3 O2 + 3 H2
Недостатками данного способа является сложность технологического процесса, использование нераспространенного в промышленности основного реагента - вольфрамовой гетерополикислоты 2-18 ряда, а также использование достаточно токсичного растворителя пиридина.
Наиболее близким к патентуемому изобретению является электрохимический способ получения лития [3]. Способ получения металлического лития из водного раствора, по крайней мере, одной соли лития включает две стадии: получение амальгамы лития из водного раствора, по крайней мере, одной соли лития; и электролиз с применением анода, содержащего амальгаму лития, твердого электролита, проводящего ионы лития, и жидкого лития в качестве катода, причем амальгама лития действует в качестве анода, при этом твердый электролит является герметичным в отношении гелия и используемую в качестве анода амальгаму лития поддерживают в состоянии движения, обеспечивается снижение энергетических затрат и повышение выхода лития по току.
Недостатками данного способа является большая трудоемкость метода, сложность технологического оборудования, использование в технологии амальгамы и то, что данное изобретение относится к улучшенному электрохимическому способу получения лития из водных растворов его солей, который используют при ускоренном повторном цикле лития.
Техническая задача настоящего изобретения заключается в разработке способа получения лития путем электролиза, где в водной части содержатся растворенные соли лития с возможными растворенными солями других элементов.
Сущность патентуемого способа заключается в приготовлении водных растворов неорганических солей или щелочей в диапазоне температур от +5°С до +20°С, где концентрация ионов лития не должна быть меньше 0,1 мг/л.
Для осуществления процесса из соединений лития могут быть использованы такие вещества, как гидроксид лития, хлорид лития, нитрат лития, сульфат лития. В качестве сопутствующих веществ в водном растворе допускается присутствие хлоридов, нитратов, сульфатов, сульфитов других элементов, которые также растворимы в воде в температурном диапазоне от +5°С до +20°С, где суммарная концентрация сопутствующих веществ не должна превышать 35 г/л.
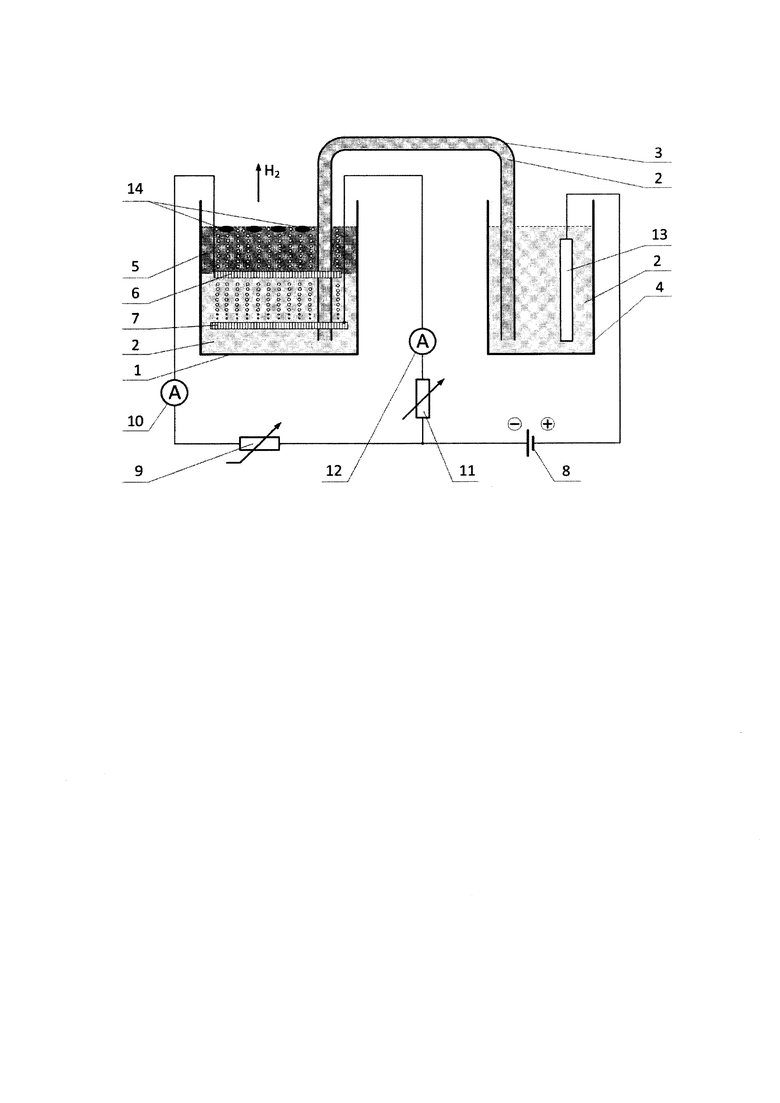
Процесс получения лития осуществляют следующим образом. В сосуд 1 (см. Рис.) из стекла, керамики или полиэтилена заливают водный раствор 2, содержащий гидроксид лития, хлорид лития, нитрат лития, сульфат лития или их смесь при концентрации ионов лития в растворе не меньше 0,1 мг/л. Затем сосуд 1 соединяют с помощью гибкой или изогнутой трубки 3 из стекла или полимера с сосудом 4 из стекла, керамики или полиэтилена. После чего сосуд 4 заполняют таким же водным раствором, как и сосуд 1, и далее с помощью гибкой или изогнутой соединительной трубки 3 выравнивают уровень жидкости в обоих сосудах с заполнением упомянутой трубки 3 указанным водным раствором 2 полностью. Затем в сосуд 1 наливают жидкий углеводород 5, объем которого в четыре раза меньше объема упомянутого водного раствора 2, после чего в сосуде 1 горизонтально размещают два перфорированных электрода из нержавеющей стали, у которых диаметр перфорированного отверстия составляет 3-15 мм, причем поверхность электродов закрывает внутреннюю поверхность сосуда 1 с зазором между внутренней стенкой сосуда 1 и краями электродов, составляющим 2-7 мм, причем каждый из электродов имеет отверстие, через которое пропускают гибкую или изогнутую соединительную трубку 3. При этом один электрод 6 размещают горизонтально на границе раздела между жидким углеводородом 5 и упомянутым водным раствором 2, а другой электрод 7, такой же по площади как и электрод 6, размещают в упомянутом водном растворе под электродом 6 на расстоянии 10-40 мм, причем оба электрода, являющиеся катодами, соединяют с минусовой клеммой источника напряжения постоянного тока 8 последовательно. Далее к электроду 6 подключают нелинейный переменный резистор 9 и амперметр 10, а к электроду 7 последовательно подключают линейный переменный резистор 11 и другой амперметр 12, а к плюсовой клемме источника напряжения постоянного тока 8 подключают графитовый анод 13, который опускают в сосуд 4 и с помощью источника постоянного тока задают напряжение между катодами и анодом в диапазоне 3,5-50,0 В для обеспечения электрического тока в электрической цепи, регулируемого на электродах 6 и 7 переменными резисторами 9 и 11, и проводят электролиз упомянутого водного раствора, при котором в сосуде 4 на графитовом аноде 13 осуществляется окисление анионов с выделением кислорода и хлора. Если в водном растворе содержатся ионы хлора, а в сосуде 1 на катодах 6 и 7 осуществляется восстановление катионов, при этом на электроде 6 образуется литий за счет восстановления ионов лития постоянным электрическим током, который одновременно обеспечивает катодную защиту, и на катоде 6 осуществляется выделение газообразного водорода, который обеспечивает защитную рубашку от быстрого взаимодействия с водой образующегося лития. На электроде 7 образуется газообразный водород, пузырьки которого поднимаются вверх к электроду 6 и создают дополнительную водородную рубашку для защиты лития от взаимодействия с водой, при этом образующийся на электроде 6 литий 14 за счет своей меньшей плотности по сравнению с жидким углеводородом 5 всплывает наверх в жидкий углеводород и полностью изолируется от взаимодействия с упомянутым водным раствором 2.
Также необходимо отметить, что в водном растворе в качестве сопутствующих веществ наряду с солями лития содержатся растворимые соли в виде хлоридов, нитратов, сульфатов и сульфитов других элементов, концентрация которых не превышает 35 г/л и которые растворимы в воде в диапазоне температур от 5 до 20°С, кроме того в качестве жидких углеводородов используют керосин, гексан, пентан или гептан.
Поскольку электрод 6 расположен на границе, разделяющей водную 2 и углеводородную фазу 5, то образующийся на электроде литий 14 за счет своей меньшей плотности (0,534 кг/м3) по сравнению с керосином (800 кг/м3), пентаном (0,63 кг/м3), гексаном (0,66 кг/м3), и гептаном (0,68 кг/м3), сразу всплывает наверх в углеводородную фазу 5 и полностью изолируется от взаимодействия с водным раствором 2. Для регулировки тока на электродах 6 и 7 используют переменные резисторы 9 и 11.
При проведении процесса сосуд 1 должен быть термостатирован в интервале температур от +5°С до +20°С. Выделяющийся водород из сосуда 1, а также газы, выделяющиеся из сосуда 4, должны быть отведены и могут быть в дальнейшем использованы для других технологических нужд.
Другие щелочные или щелочноземельные металлы, которые выделяются на катодах, поскольку их плотность выше плотности углеводородов 14, не поднимаются и при выделении сразу реагируют с водой 2 и остаются в ионном виде в растворе.
Пример. Способ получения лития путем электролиза из водных растворов, содержащих ионы лития.
Приготовили раствор, содержащий хлорид лития и хлорид натрия. Концентрация хлорида лития составила 150 мг/л, а хлорида натрия - 200 мг/л. Раствор был приготовлен путем растворения соответствующих навесок вышеуказанных солей в 300 л дистиллированной воды при температуре 18°С. После полного растворения солей раствор 2 (см. Рис.) был перелит в сосуд 1, выполненный из полиэтилена емкостью 400 л. После того, как раствор 2 был залит в сосуд 1, сосуд 1 соединили с помощью стеклянной изогнутой трубки 3 с сосудом 4 емкостью 5 л, выполненным также из полиэтилена. С помощью насоса часть раствора 2 перекачали в сосуд 4 до выравнивания уровней жидкостей. При этом стеклянная трубка 3, соединяющая сосуды 2 и 4, была полностью заполнена раствором 2.
В сосуд 1 залили 74,25 л керосина 5, что в четыре раза меньше объема водного раствора 2. Поскольку плотность керосина 5 меньше плотности приготовленного раствора 2, то слой керосина 5 соответственно занял верхнюю часть сосуда 1. Таким образом, в сосуде 1 образовалась двухфазовая водно-углеводородная смесь с четким разделением слоев.
Затем в сосуд 1 поместили два перфорированных электрода, выполненных из нержавеющей стали. Размер одного перфорированного отверстия для обоих электродов составил 7 мм. Электроды разместили горизонтально так, чтобы их поверхность практически полностью закрыла площадь сосуда 1. Зазор между краем электродов и внутренней поверхностью сосуда 1 составил 5 мм. Отверстия в электродах позволяли раствору 2 и керосиновой фазы 5 свободно проходить через электроды 6 и 7. Также в обоих электродах 6 и 7 были сделаны отверстия для соединительной стеклянной трубки 3. Один электрод 6 разместили горизонтально на границе раздела фаз между водным раствором 2 и слоем керосина 5. Другой электрод 7, идентичный электроду 6, разметили в водной части раствора под электродом 6 на расстоянии 25 мм. Оба электрода 6 и 7 являются катодами и были подключены к минусовой клемме источника напряжения постоянного тока 8. При этом к электроду 6 последовательно подключили нелинейный переменный резистор 9 и амперметр 10, а к электроду 7 также последовательно был подключен линейный переменный резистор 11 и другой амперметр 12.
Далее к плюсовой клемме источника напряжения постоянного тока 8 подключили графитовый анод 13, который опустили в сосуд 4. С помощью источника постоянного тока задали напряжение между катодами и анодом номиналом 41 В, вследствие чего в электрической цепи устройства появляется ток и начался процесс электролиза водных растворов солей. В сосуде 4 на графитовом аноде 13 происходило окисление анионов, вследствие чего выделялся кислород и выделялся хлор. Хлор в ходе процесса утилизировался.
В сосуде 1 на катодах 6 и 7 происходило восстановление катионов. Непосредственно металлический литий выделялся на электроде 6 за счет восстановления ионов лития постоянным электрическим током, который одновременно обеспечивал электроду катодную защиту. Также на катоде 6 происходило выделение газообразного водорода, создавая некую защитную рубашку, которая частично предохраняла выделяющийся литий от быстрого взаимодействия с водой. На электроде 7 также выделялся газообразный водород, пузырьки которого поднимались вверх к электроду 6 и создавали дополнительную водородную рубашку для защиты лития.
Поскольку электрод 6 был расположен на границе водной 2 и углеводородной фаз 5, то образующийся на электроде литий 14 за счет своей плотности меньшей (0,534 кг/м3) по сравнению с керосином (800 кг/м3), сразу всплывал наверх в керосиновую фазу 5 и полностью изолировался от взаимодействия с водным раствором 2. Для регулировки тока на электродах 6 и 7 использовали переменные резисторы 9 и 11. Силу тока на электроде 6 поддерживали 3,5 А в течение 5 часов.
За данное время было получено 4,1 г лития. При проведении процесса температура сосуда 1 поддерживалась около +17°С ± 2 градуса.
Вывод. Патентуемый способ может быть использован для разработки новой технологии по получению лития из водных растворов солей.
Источники информации:
1. Патент РФ №2633673 С1.
2. Патент РФ №2283371 C1.
3. Патент РФ №2250274 С2.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ МАГНИЯ ИЗ ВОДНЫХ РАСТВОРОВ ЕГО СОЛЕЙ | 2022 |
|
RU2792523C1 |
| ЭЛЕКТРОХИМИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ ЛИТИЯ | 2000 |
|
RU2250274C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЩЕЛОЧНЫХ И ЩЕЛОЧНО-ЗЕМЕЛЬНЫХ МЕТАЛЛОВ | 2005 |
|
RU2283371C1 |
| СПОСОБ ПОЛУЧЕНИЯ ХЛОРИДА ЛИТИЯ | 2005 |
|
RU2300497C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕТЕРОМЕТАЛЛИЧЕСКОГО МАЛАТА Fe (III) И Nd (III) | 2007 |
|
RU2351602C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЖИДКОГО УГЛЕВОДОРОДНОГО ТОПЛИВА ИЗ БИОМАССЫ РАСТИТЕЛЬНОГО ПРОИСХОЖДЕНИЯ | 2020 |
|
RU2733394C1 |
| Электролизер для получения лития | 1990 |
|
SU1747540A1 |
| ГАЛЬВАНИЧЕСКИЙ ИСТОЧНИК ПОСТОЯННОГО ТОКА | 2005 |
|
RU2282917C1 |
| ЭЛЕКТРОХИМИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ ЩЕЛОЧНОГО МЕТАЛЛА ИЗ ВОДНОГО РАСТВОРА | 2000 |
|
RU2253703C2 |
| ЭЛЕКТРОЛИТИЧЕСКАЯ ЯЧЕЙКА И СПОСОБ ПОЛУЧЕНИЯ ЩЕЛОЧНОГО МЕТАЛЛА ИЗ АМАЛЬГАМЫ ЩЕЛОЧНОГО МЕТАЛЛА И ОБЪЕДИНЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ ХЛОРА И ЩЕЛОЧНОГО МЕТАЛЛА ИЗ ХЛОРИДА ЩЕЛОЧНОГО МЕТАЛЛА | 1999 |
|
RU2250933C2 |
Изобретение относится к способу получения лития путем электролиза водных растворов солей, содержащих ионы лития. В два сосуда заливают водный раствор, содержащий гидроксид лития, хлорид лития, нитрат лития, сульфат лития или их смесь при концентрации ионов лития в растворе не меньше 0,1 мг/л. Оба сосуда соединяют между собой с помощью гибкой или изогнутой соединительной трубки и выравнивают в них уровень жидкости. В первый сосуд наливают жидкий углеводород, объем которого в четыре раза меньше объема упомянутого водного раствора. В первом сосуде горизонтально размещают два перфорированных электрода из нержавеющей стали. Один электрод размещают горизонтально на границе раздела между жидким углеводородом и упомянутым водным раствором. Другой электрод, такой же по площади, как и упомянутый первый электрод, размещают в упомянутом водном растворе под первым электродом на расстоянии 10-40 мм. Оба электрода, являющиеся катодами, соединяют с минусовой клеммой источника напряжения постоянного тока, а к плюсовой клемме источника напряжения постоянного тока подключают графитовый анод, который опускают во второй сосуд, и с помощью источника постоянного тока задают напряжение между катодами и анодом в диапазоне 3,5-50,0 В для проведения электролиза упомянутого водного раствора. В первом сосуде на катодах осуществляется восстановление катионов лития. Литий за счет своей меньшей плотности по сравнению с жидким углеводородом всплывает наверх в жидкий углеводород и полностью изолируется от взаимодействия с упомянутым водным раствором. Обеспечивается получение лития путем электролиза, при котором в водной части содержатся растворенные соли лития с возможными растворенными солями других элементов. 2 з.п. ф-лы, 1 ил., 1 пр.
1. Способ получения лития путем электролиза из водных растворов, содержащих ионы лития, включающий использование растворимых солей лития, отличающийся тем, что в сосуд 1 из стекла, керамики или полиэтилена заливают водный раствор 2, содержащий гидроксид лития, хлорид лития, нитрат лития, сульфат лития или их смесь при концентрации ионов лития в растворе не меньше 0,1 мг/л, затем сосуд 1 соединяют с помощью гибкой или изогнутой трубки 3 из стекла или полимера с сосудом 4 из стекла, керамики или полиэтилена, затем сосуд 4 заполняют таким же водным раствором, как и сосуд 1, после чего с помощью гибкой или изогнутой соединительной трубки 3 выравнивают уровень жидкости в обоих сосудах с заполнением упомянутой трубки 3 указанным водным раствором 2 полностью, затем в сосуд 1 наливают жидкий углеводород 5, объем которого в четыре раза меньше объема упомянутого водного раствора 2, после чего в сосуде 1 горизонтально размещают два перфорированных электрода из нержавеющей стали, у которых диаметр перфорированного отверстия составляет 3-15 мм, причем поверхность электродов закрывает внутреннюю поверхность сосуда 1 с зазором между внутренней стенкой сосуда 1 и краями электродов, составляющим 2-7 мм, причем каждый из электродов имеет отверстие, через которое пропускают гибкую или изогнутую соединительную трубку 3, при этом один электрод 6 размещают горизонтально на границе раздела между жидким углеводородом 5 и упомянутым водным раствором 2, а другой электрод 7, такой же по площади, как и электрод 6, размещают в упомянутом водном растворе под электродом 6 на расстоянии 10-40 мм, причем оба электрода, являющиеся катодами, соединяют с минусовой клеммой источника напряжения постоянного тока 8 последовательно, затем к электроду 6 подключают нелинейный переменный резистор 9 и амперметр 10, а к электроду 7 последовательно подключают линейный переменный резистор 11 и другой амперметр 12, а к плюсовой клемме источника напряжения постоянного тока 8 подключают графитовый анод 13, который опускают в сосуд 4, и с помощью источника постоянного тока задают напряжение между катодами и анодом в диапазоне 3,5-50,0 В для обеспечения электрического тока в электрической цепи, регулируемого на электродах 6 и 7 переменными резисторами 9 и 11, и проводят электролиз упомянутого водного раствора, при котором в сосуде 4 на графитовом аноде 13 осуществляется окисление анионов с выделением кислорода и хлора, если в водном растворе содержатся ионы хлора, а в сосуде 1 на катодах 6 и 7 осуществляется восстановление катионов, при этом на электроде 6 образуется литий за счет восстановления ионов лития постоянным электрическим током, который одновременно обеспечивает катодную защиту, и на катоде 6 осуществляется выделение газообразного водорода, который обеспечивает защитную рубашку от быстрого взаимодействия с водой образующегося лития, на электроде 7 образуется газообразный водород, пузырьки которого поднимаются вверх к электроду 6 и создают дополнительную водородную рубашку для защиты лития от взаимодействия с водой, при этом образующийся на электроде 6 литий 14 за счет своей меньшей плотности по сравнению с жидким углеводородом 5 всплывает наверх в жидкий углеводород и полностью изолируется от взаимодействия с упомянутым водным раствором 2.
2. Способ по п. 1, отличающийся тем, что в водном растворе в качестве сопутствующих веществ наряду с солями лития содержатся растворимые соли в виде хлоридов, нитратов, сульфатов и сульфитов других элементов, концентрация которых не превышает 35 г/л и которые растворимы в воде в диапазоне температур от 5 до 20°С.
3. Способ по п. 1, отличающийся тем, что в качестве жидких углеводородов используют керосин, гексан, пентан или гептан.
| ЭЛЕКТРОХИМИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ ЛИТИЯ | 2000 |
|
RU2250274C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЩЕЛОЧНЫХ И ЩЕЛОЧНО-ЗЕМЕЛЬНЫХ МЕТАЛЛОВ | 2005 |
|
RU2283371C1 |
| СПОСОБ ПОЛУЧЕНИЯ МЕТАЛЛИЧЕСКОГО ЛИТИЯ С ИСПОЛЬЗОВАНИЕМ ПРОДУКТОВ ПЕРЕРАБОТКИ ПРИРОДНЫХ РАССОЛОВ | 2015 |
|
RU2616749C1 |
| US 6787019 B2, 07.09.2004 | |||
| ПОЧВООБРАБАТЫВАЮЩИЙ КАТОК | 2023 |
|
RU2807072C1 |
Авторы
Даты
2021-02-02—Публикация
2020-07-09—Подача