Изобретение относится к медицине, а именно к нейрохирургии, и может быть использовано при прямом и комбинированном методах хирургической реваскуляризации головного мозга, а также может быть использовано в других областях медицины при необходимости выбора акцепторной артерии. Интраоперационный выбор акцепторной корковой артерии для хирургической реваскуляризации головного мозга выполняется с использованием контактной доплерографии во время оперативного вмешательства.
Известны способы интраоперционного исследования кровотока в корковых артериях головного мозга, которые широко используются с целью анализа гемодинамических особенностей кортикального кровотока при разной патологии до операции и его изменения после операции. Как правило, сравнивают разные по этиологии стено-окклюзирующующие заболевания магистральных артерий головного мозга, например, болезнь моя-моя с атеросклеротическими поражениями церебральных артерий, заведомо предполагая, что гемодинамика и механизм перестройки мозгового кровообращения различены [1].
Также известен способ хирургического лечения с использованием интраоперационного микроскопа со встроенной функцией флуоресцентной инфракрасной ангиографии в режиме 800 нм (IR800) уже после наложения сосудистого анастомоза. Во время операции после создания экстра-интракраниального анастомоза и достижения тщательного гемостаза проводится исследование наполнения артерий, в том числе уже созданного анастомоза путем медленного (в течение 2 минут) введения в вену флуоресцентного контрастного вещества индоцианина-зеленого (IGC Pulsion) из расчета 15 мг порошка (ампула) на 20 мл физиологического раствора и переключение операционного микроскопа в режим IR800. Наличие кровотока в созданном анастомозе и его контрастирование в данной зоне свидетельствовало о его функционировании. При отсутствии визуализации анастомоза при интраоперационной ангиографии (при явном контрастировании сосудистого русла головного мозга или его медленное антеградное или ретроградное заполнение) указывало на его дисфункцию [2].
Недостатками данного способа являются: ее инвазивность (необходимо вводить внутривенно контрастное вещество); возможна непереносимостью препарата пациентом; наличие дорогостоящего оборудования со специальной системой оснащения (микроскоп с функцией IR800); не информативность при интраоперационном выборе артерии, так как возможно оценить только функционирование созданного анастомоза [3, 4].
Прототипом предлагаемого способа является исследование кровотока до и после наложения экстра-интраоперационого анастомоза в корковых артериях бассейна средней мозговой артерии (акцепторных артериях), в лобной или теменной ветвях поверхностной височной артерии (донорских артериях), а также в области наложенного анастомоза. Основной задачей исследования оставалось регистрация изменения скорости потока крови в корковых артериях принимающего русла до и после создания анастомоза и проходимость анастомоза после его создания. Обращалось особое внимание на референсные значения кровотока во всех артериях, анастомозе с учетом направления кровотока до и после операции в корковых артериях [5]. Однако, вышеописанные методы использования интраоперационной доплерограции не предполагают выбора заведомо «выгодной» акцепторной артерии, не оценивают естественные анастомозы и количественные скоростные показатели потока крови воспринимающего русла (кровоток в акцепторных артериях) до создания анастомоза.
Технической задачей заявляемого изобретения является разработка способа выбора акцепторной артерии при хирургической реваскуляризации головного мозга у больных с хронической церебральной ишемией, позволяющей добиться максимальной компенсации недостающего кровоснабжения головного мозга и его нормализации.
Технический результат разработанного нами способа выбора акцепторной артерии заключается в интраоперационном выборе наиболее дефицитного принимающего русла в виде акцепторной артерии с наименьшим кровотоком для создания анастомоза с целью компенсации недостаточного мозгового кровоснабжения головного мозга.
Предполагаемый способ позволяет достигнуть значительного, качественного улучшения результатов хирургической реваскуляризации головного мозга, способствует более адекватному перераспределению крови в артериях головного мозга и улучшает его питание с сохранением жизненно важных функций.
Решение поставленной технической задачи достигается тем, что у больных во время прямого/комбинированного способа хирургической реваскуляризации головного мозга выполняется исследование кровотока артерий принимающего русла и выбирается артерия с наименьшим кровотоком перед наложением экстра-интракраниального анастомоза между теменной ветвью поверхностной височной артерии и корковыми ветвями бассейна средней мозговой артерии с расширенной костно-пластической трепанацией. В целом расширенная трепанация выполняется по классической методике, однако с акцентом, сохранения артерий твердой мозговой оболочки.
Во время операции, после выполнения расширенной костнопластической трепанации и вскрытия твердой мозговой оболочки (с сохранением ее артерий) выполняется исследование локального кровообращения в акцепторных корковых артериях бассейна планируемой реваскуляризации у больных с церебральной ишемией для получения цифровых характеристик гемодинамического дефицита в реальном времени. По результату интраоперационного исследования выбирается корковая артерия с наименьшей скоростью линейного кровотока, доступная в области выполненной расширенной костнопластической трепанации для создания микрососудистого анастомоза. Акцепторная артерия с наименьшим кровотоком редко выбирается хирургом с целью наложения прямого микрососудистого анастомоза, так как технически работать с сосудами наименьшего диаметра крайне сложно. Как правило, выбор падает на корковые артерии среднего и большего диаметра и, соответственного, с большим кровотоком, что, по нашему мнению, технически не верно. Однако, подобная тактика зачастую приводит либо к раннему тромбированию созданного анастомоза, либо неадекватному потоку крови к мозговой ткани без учета ее потребности. Артерии с более высоким кровотоком вероятнее всего дополнительно участвуют в создании естественных анастомозов, то есть воспринимающее русло перенасыщено, что приводит к неэффективности хирургической реваскуляризации.
Вышеописанное исследование занимает несколько минут, однако, способно достоверно интраоперационно определить акцепторную артерию с наименьшим кровотоком при помощи интраоперационной контактной допплерографии, что помогает компенсировать гемодинамический дефицит и улучшает результаты хирургического лечения.
Разработанный способ и достигнутые результаты проиллюстрированы на чертежах:
- на Фиг. 1 представлены данные церебральной ангиографии, иллюстрирующие окклюзию левой средней мозговой артерии (СМА), стеноз левой внутренней сонной артерии (ВСА), стеноз левой передней мозговой артерии (ПМА) с формированием ангиопатии «моя-моя» (указано стрелкой), спонтанный анастомоз из менингеальной ветви в межполушарную щель слева;
- на Фиг. 2 представлены данные церебральной ангиографии, иллюстрирующие стеноз правой внутренней сонной артерии (ВСА), стеноз правой средней мозговой артерии (СМА), стеноз правой мозговой артерии (ПМА), выраженную сеть коллатеральных сосудов моя-моя с двух сторон (указано стрелкой). Лептоменингеальные анастомозы из системы задней мозговой артерии (ЗМА);
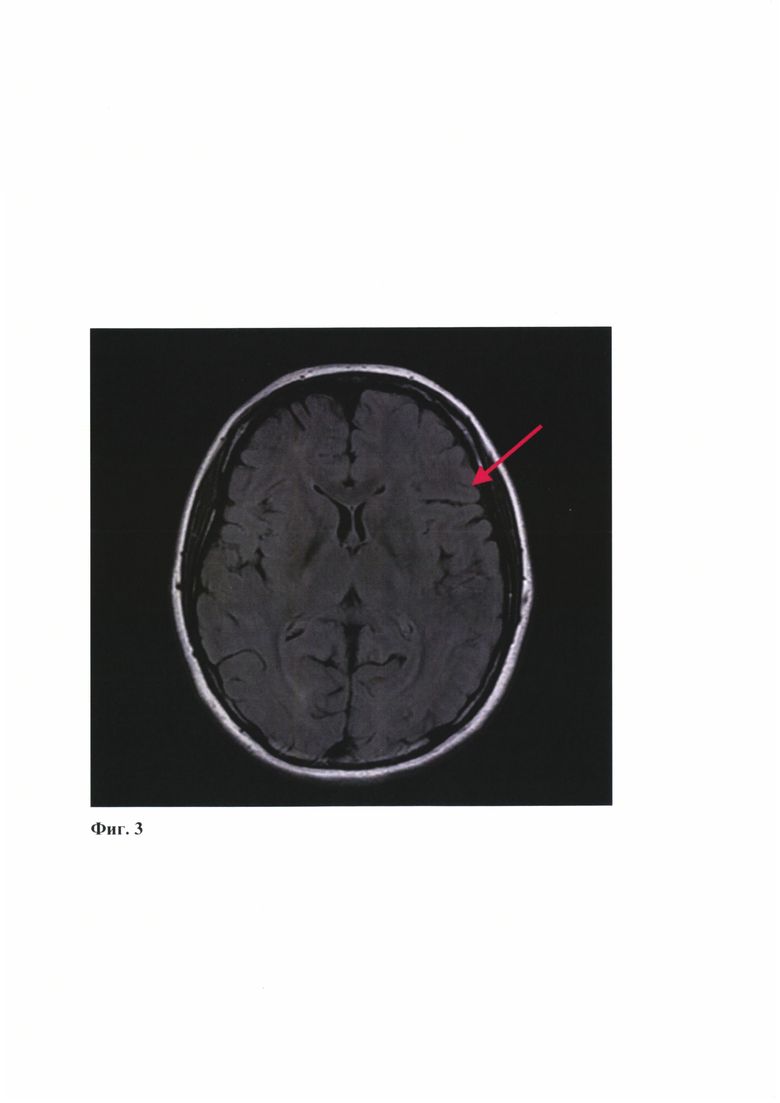
- на Фиг. 3 представлены данные магнитно-резонансной томографии в режиме FLAIR (Fluid attenuated inversion recovery), кистозно-глиозные очаги отсутствуют в левом полушарии (указано стрелкой);
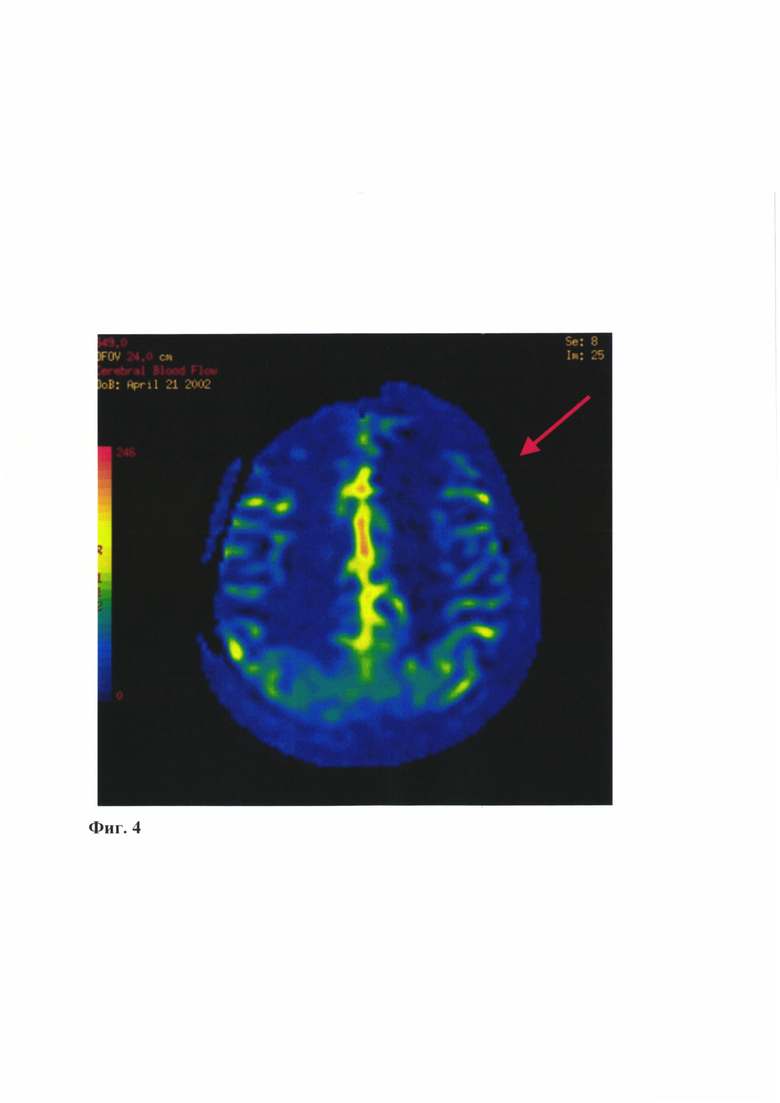
- на Фиг. 4 представлены данные магнитно-резонансной томографии в режиме перфузии (Arterial Spin Labeling (ASL)), подтверждающая наличие гемодинамического дефицита в обоих полушариях, в том числе и в левом полушарии (указано стрелкой);
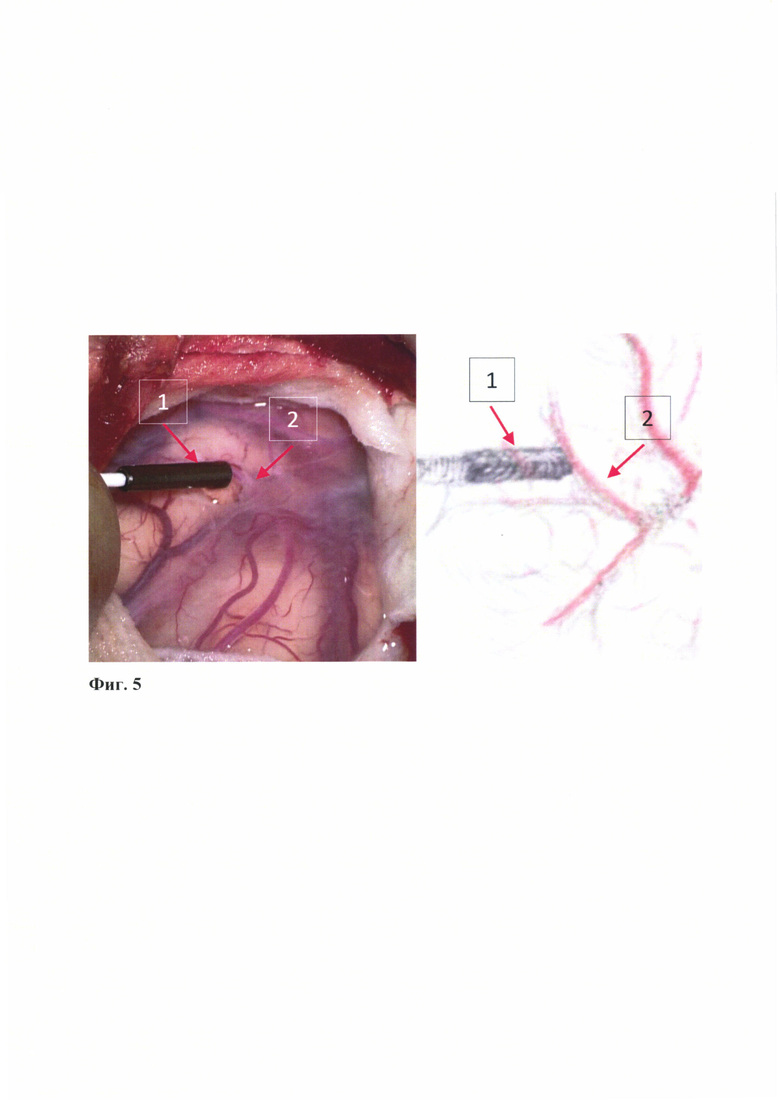
- на Фиг. 5 представлена техника выполнения выбора акцепторной артерии при хирургической реваскуляризации (со схематическим изображением) с помощью интраоперационной контактной доплерографии после выполнения расширенной трепанации и вскрытия твердой и арахноидальной оболочек: 1 - микро-датчик плотно прижатый к корковой артерии (акцепторной) принимающего русла; 2 - акцепторная (корковая) артерия;
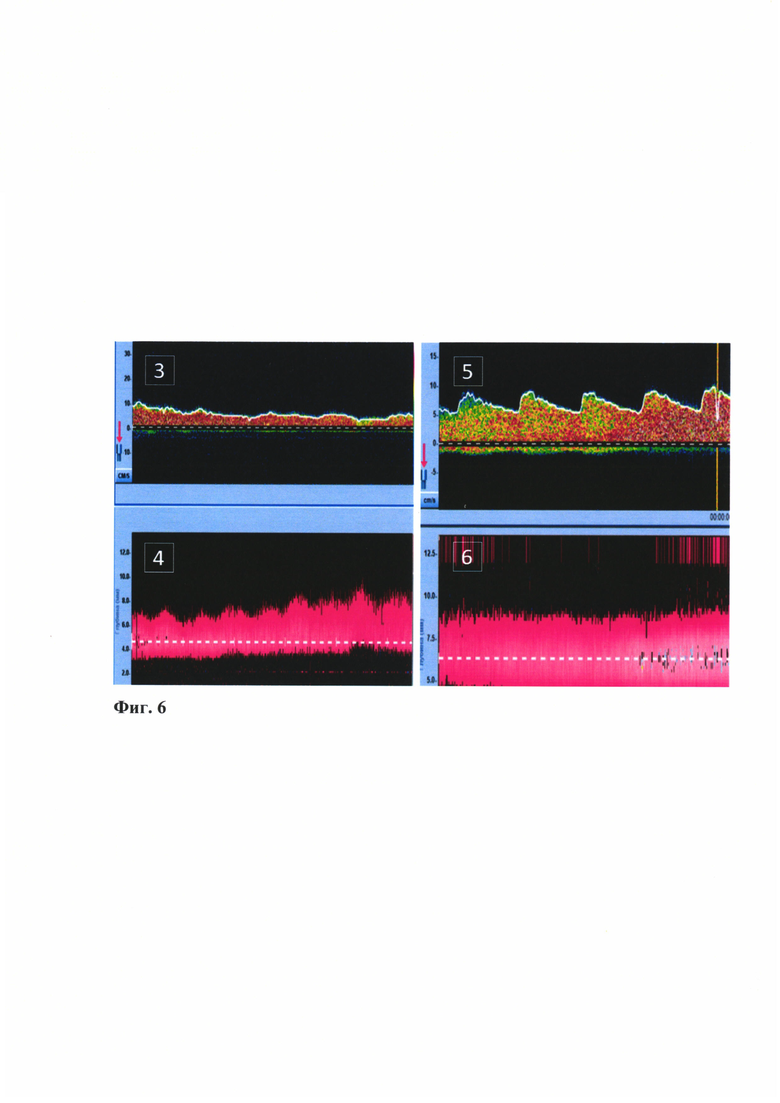
- на Фиг. 6 представлены кровотоки в акцепторных артериях с наименьшим кровотоком: 3 - скорость кровотока в первой лобной корковой артерии (5-7 см/с), 4 - глубина, выставленная на датчике для измерения кровотока для первой лобной артерии (3-5 мм); 5 - скорость кровотока во второй лобной корковой артерии (7-8 см/с), 6 - глубина, выставленная на датчике для измерения кровотока для второй лобной артерии (5-7 мм);
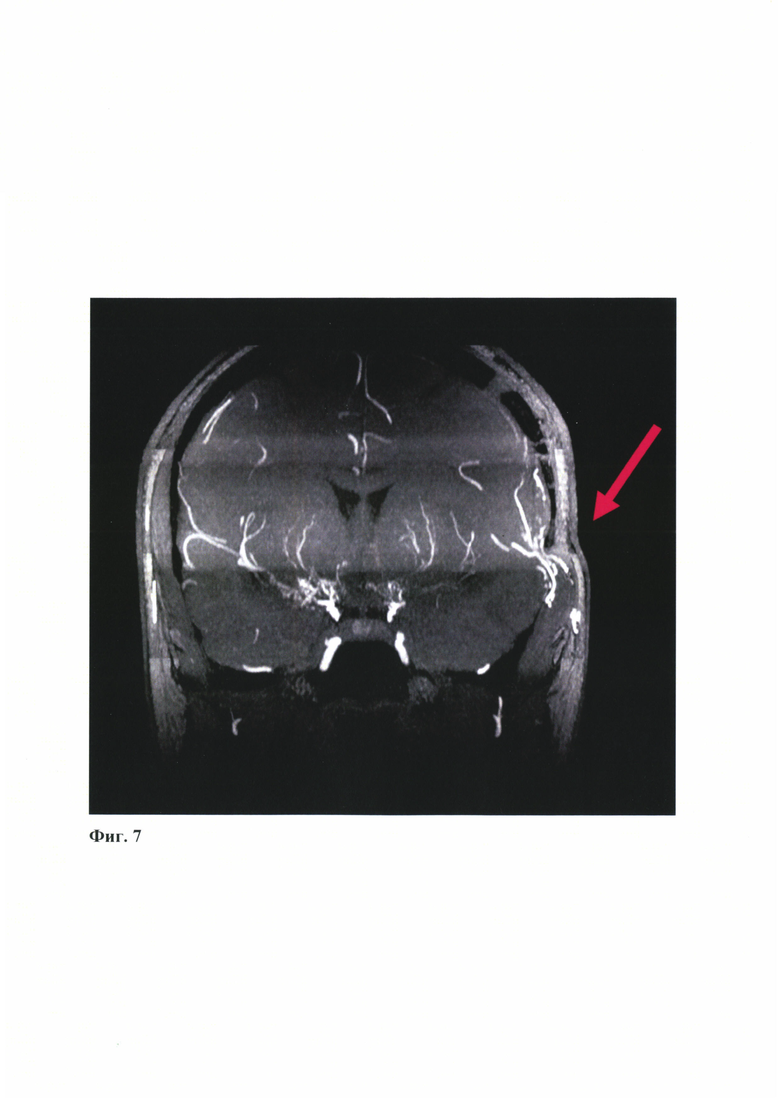
- на Фиг. 7 представлены данные магнитно-резонансной томографии в сосудистом режиме (артериальная фаза) стрелкой указан функционирующий анастомоз;
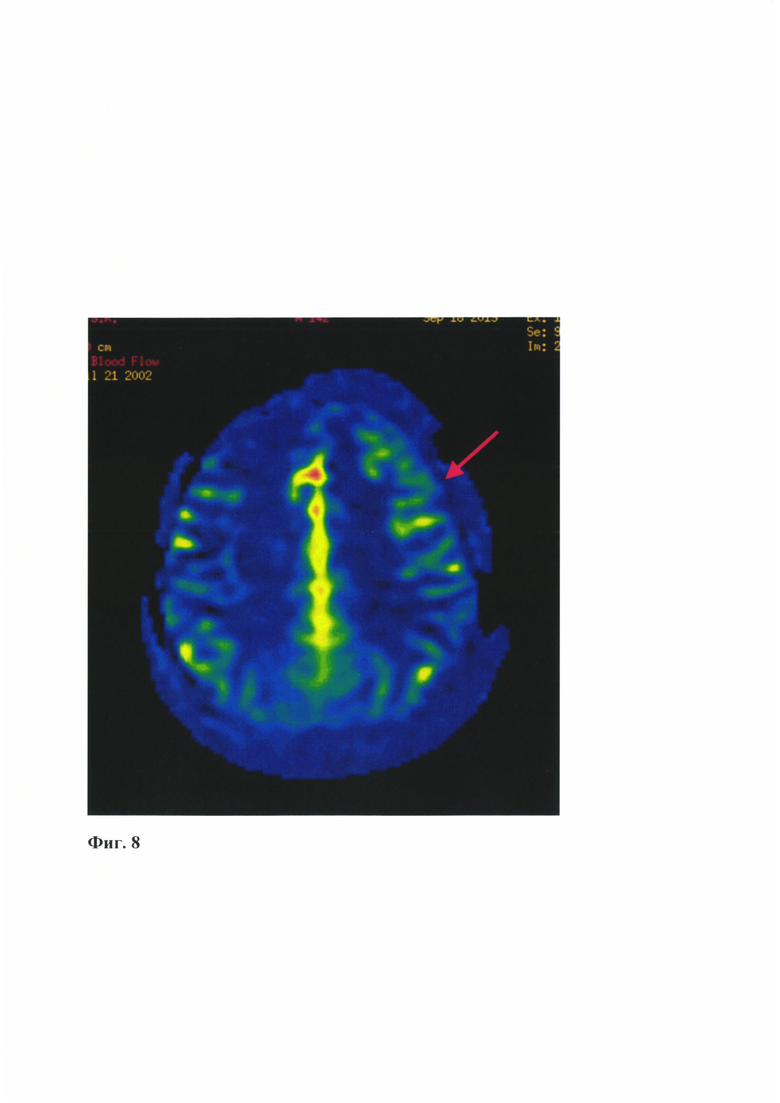
- На Фиг. 8 представлены данные магнитно-резонансной томографии в режиме перфузии (Arterial Spin Labeling (ASL)), с положительной динамикой в левом полушарии головного мозга (указано стрелкой)
В заявляемом способе хирургической реваскуляризации головного мозга интраоперационно выполняется выбор акцепторной артерии у пациента с цереброваскулярной патологией и наличием хронической церебральной ишемии, подтвержденной перфузионными методами нейровизуализации (Фиг. 1 - Фиг. 4). Особое внимание уделяется отсутствию обширных постишемических кистозно-глиозных изменений (Фиг. 3). После выбора артерии с наименьшим кровотоком принимающего русла накладывается экстра-интракраниальный анастомоз с выбранной акцепторной (корковой) артерией под углом 45 градусов. Обязательно учитывается направление кровотока в корковой артерии во избежание появления гемодинамических факторов, препятствующих току крови по анастомозу, что связано с физическим столкновением потоков крови в области анастомоза и прилежащих областях (образование зон турбулентности и формирование гемодинамического стеноза). После создания анастомоза кровоток в артериях вновь измеряли, что связано со значительным интересом локальных изменений гемодинамики после наложения экстра-интракраниального анастомоза с последующим измерением величин и анализом направлений кровотока в акцепторной артерии проксимальнее и дистальнее области анастомоза. У пациентов с гемодинамическим дефицитом церебрального кровоснабжения поток крови может меняться по отношению к исходному току крови в корковых артериях, что связано с градиентом давления между донорской артерией и проксимальными отделами акцепторной артерии. Следует отметить, что при планировании и моделировании экстра-интракраниального анастомоза по отношению тока крови в корковой артерии наблюдалось расширение профиля скоростей в области анастомоза и увеличивалась скорость кровотока как в дистальных отделах корковой артерии, так и в самом анастомозе более 11%. Данный феномен объясняется наличием «порога насыщения» головного мозга кровью. Однако, не было понятно, как интраоперационно определить область церебрального гемодинамического дефицита. Наиболее благоприятным прогнозом для создания анастомоза у пациентов со стено-окклюзирующей патологией с хронической церебральной ишемией в исследуемой группе, как показала практика, обладали с интраоперационными значениями в акцепторной корковой артерии в диапазоне до 18 см/сек. Проанализировав полученные результаты, пришли к выводу, что при выборе акцепторной артерии с наименьшим кровотоком позволяет улучшить результаты хирургической реваскуляризации более чем в 2 раза.
Клинический пример.
Больная Ш., 17 лет, и/б 3705/19
Клинический диагноз: Цереброваскулярная болезнь. Стеноз внутренней сонной артерии, окклюзия средней мозговой артерии, передней мозговой артерии с двух сторон. Болезнь моя-моя.
Поступила в ФГАУ НМИЦ нейрохирургии им. ак. Н.Н. Бурденко Минздрава России 22.05.2019 с жалобами на быструю утомляемость, головные боли.
Из анамнеза заболевания известно, что болеет с 2014 года, когда появились "подергивания" в конечностях и мускулатуре лица, эпизоды нарушения речи. В 2015 году количество насильственных движений увеличилось, проходила консервативную терапию, после которой отмечала улучшение своего состояния. С конца 2015 года вновь появились эпизоды "подергиваний" в правых конечностях, нарушение речи. Была продолжена консервативная терапия. В последующем приступы слабости в правых конечностях и нарушения речи повторялись 1 раз в 6 месяцев.
Обследована ревматологом (2015 г): ANCA 0,1, волчаночный антикоагулянт - отриц, АНФ - отриц, ANA профиль отриц.
Обследована гематологом (25.01.2019): гематогенная тромбофилия?
При обследовании на МРТ головного мозга от 16.01.2019 г - явных признаков перенесенных нарушений мозгового кровообращения нет (Фиг. 3).
По данным СКТ-ангиографии от 12.02.2019 и прямой ангиографии от 14.02.2019 г. - признаки болезни моя-моя с двух сторон: окклюзия левой средней мозговой артерии, стеноз внутренней сонной и передней мозговой артерий слева, спонтанный анастомоз из менингеальной ветви в межполушарную щель слева, стеноз внутренней сонной, средней мозговой и передней мозговой артерий справа, выраженная сеть коллатеральных сосудов моя-моя с двух сторон. Лептоменингеальные анастомозы из системы задней мозговой артерии (Фиг. 1, Фиг. 2).
По данным МРТ головного мозга в режиме ASL-перфузии от 16.05.2019 г. - значительное снижение перфузионных параметров в бассейнах кровоснабжения обеих ВСА (Фиг. 4).
Учитывая наличие клинической картины хронической церебральной ишемии, а также наличие гемодинамического дефицита на фоне прогрессирующего стено-окклюзирующего процесса магистральных артерий головного мозга с 2х сторон решено выполнить хирургическую реваскуляризацию головного мозга.
23.05.2019 выполнен комбинированный метод хирургической реваскуляризации головного мозга: создание двух экстра-интракраниальных микроанастомозов лобной ветвью поверхностной височной артерии (ПВА) с лобной прецентральной и теменной ветви поверхностно-височной артерии (ПВА) с корковой центральной ветвью М4 бассейна СМА слева с использоваием контактной доплерографией и интраоперационным выбором акцепторной артерии.
Описание операции
Под эндотрахеальным наркозом установлена скоба Мейфилда в положении лежа с разворотом головы вправо и валиком под плечом. Пальпаторно идентифицированы теменная и лобная ветвь правой поверхностной височной артерии. Подковообразный разрез кожи в левой лобно-височной области с обнажением апоневроза и височной мышцы на протяжении. На сформированном кожном лоскуте выделены донорские артерии: теменная (1 мм) и лобная ветви (1,1 мм) поверхностно0височной артерии на протяжении 8 см и 5 см соответственно. Отсепарована височная мышца крупным фрагментом вместе с апоневрозом спереди до области гребня основной кости и частично рассечена на основании - в этой области под мышцу пропущена выделенная донорская артерия. Выполнена расширенная костно-пластическая трепанация в левой височно-теменной области размером 7×10 см. В ходе трепанации поврежден основной ствол поверхностной менингеальной артерии. ТМО фиксирована по краю костного дефекта, рассечена на 5 лоскутов с сохранением крупных ветвей оболочечной артерии. Далее выполняется измерение скоростных показателей потока крови в корковых артериях головного мозга. Данное исследование проводится с помощью интраоперационной контактной доплерографии с использованием 16 Mhz мегагерцевого датчика (RIMED DigiLite, Израиль). Датчик плотно прижимается к стенке акцепторной артерии под минимальным к ней углом (Фиг. 5). Глубина локации устанавливается на 3-7 мм. Измерение абсолютных величин линейной скорости кровотока в корковой артерии проводится до начала работы с акцепторной артерией. На основании полученных данных вычисляется пульсационный индекс по стандартной методике. Таким образом, проводится анализ цифровых параметров кровотока. По данным интраоперационной контактной доплерографии: кровоток в корковых артериях (лобных) антероградного направления, до 5-8 см/сек (Фиг. 6); в височных и ангулярной - ретроградный кровоток до 25-30 см/сек. Выделена первая акцепторная артерий (лобная прецентральная артерия диаметром до 1 мм на протяжении 1,5 мм) с наименьшим кровотоком. Произведено наложение микроанастомоза между лобной ветвью поверхностной височной артерии (диаметр до 1 мм) и корковой ветвью по типу «конец в бок» отдельными узловыми швами нитью Prolene 10.0 в дистальном направлении. Отмечается выраженное истончение стенок артерии ("красного типа"). Сняты клипсы с артерий - хорошая пульсация артерий в ране. Область сосудистого анастомоза укутана гемостатической губкой. Кровотечения из области сосудистого анастомоза не отмечается. Время пережатия артерии 22 мин. По данным интраоперационной контактной доплерографии: кровоток в донорской артерии до 70 см/сек, в акцепторной артерии до 35 см/сек в дистальном направлении, до 65 см/сек в проксимальном. После наложения анастомоза отмечено увеличение кровотока в корковых артериях до 10-12 см/сек. Дополнительно выделена вторая акцепторная артерия с низким кровотоком (лобная центральная ветвь диаметром до 1,1 мм) из арахноидальных сращений на протяжении до 1 см. Произведено наложение микроанастомоза между теменной ветвью поверхностной височной артерии (диаметр до 1 мм) и корковой ветвью по типу «конец в бок» отдельными узловыми швами нитью Prolene 10.0 в дистальном направлении. Сняты клипсы с артерий - хорошая пульсация артерий в ране. Область сосудистого анастомоза укутана гемостатической губкой. Кровотечения из области сосудистого анастомоза не отмечается. Время пережатия артерии 33 мин. По данным интраоперационной контактной доплерографии: - кровоток в донорской артерии до 55 см/сек, в акцепторной артерии до 25 см/сек в дистальном направлении, до 35 см/сек в проксимальном. Ретроградный кровоток в височных и ангулярной артериях существенно не изменился. Донорская артерия уложена на пиальную оболочку левой лобной доли над Сильвиевой щелью (пиальный ангиоз), прижата к нему височной мышцей. Тщательный гемостаз лоскутов твердой мозговой оболочки, они уложены на мозг и инвертированы (твердая мозговая оболочка не ушивалась). На кору головного мозга и сохраненные ветви оболочечной артерии уложен выкроенный лоскут височной мышцы, который фиксирован к краю трепанационного дефекта, подшит к костному краю. Сверху уложен костный лоскут после дополнительной базальной резекции фрагмента кости толщиной 5 мм (область прохождения мышцы и донорской ветви), фиксированный 5 шелковыми лигатурами и 3 титановыми пластинками и 8 винтами. Мягкие ткани ушиты в 3 слоя наглухо без установки активного дренажа.
В послеоперационном периоде данных за ухудшение состояния или нарастания неврологического дефицита не получено. Пациентка выписана на 7-е сутки после операции после снятия швов.
При контрольном исследовании через 3 месяца после операции при контрольной нейровизуализации прослеживается положительный результат хирургической иреваскуляризации: созданный анастомоз функционирует, отмечается улучшение гемодинамических показателей в области анастомоза (Фиг. 7, Фиг. 8).
Источники информации, принятые во внимание:
1. Morisawa Н, Kawamata Т, Kawashima A, Hayashi М, Yamaguchi K, Yoneyama Т, Okada.Y. Hemodynamics and changes after STA-MCA anastomosis in moyamoya disease and atherosclerotic cerebrovascular disease measured by micro-Doppler ultrasonography. Neurosurg Rev. 2013 Jul; 36(3):411-9. doi:10.1007/sl0143-012-0441-y. Epub 2012 Nov 29. PubMed PMID: 23192651;
2. Barrow D.L., Boyer K.L., Joseph G.J. Intraoperative angiography in the management of neurovascular disorders. Neurosurgery. 1992. T. 30. №2. - C. 153-9;
3. Lee M, Guzman R, Bell-Stephens T, Steinberg GK. Intraoperative blood flow analysis of direct revascularization procedures in patients with moyamoya disease. J Cereb Blood Flow Metab. 2011 Jan; 31(l):262-74. doi: 10.1038/jcbfm.2010.85. Epub 2010 Jun 30. PubMed PMID: 20588321; PubMed Central PMCID: PMC3049490
4. Ashley W.W., Amin-Hanjani S., Alaraj A., Shin J.H., Charbel F.T. Flow-assisted surgical cerebral revascularization. Neurosurgical focus. 2008. T. 24. №2. - С.E20;
5. Лукшин B.A., Усачев Д.Ю., Шульгина A.A., Шевченко Е.В. Локальная гемодинамика после создания ЭИКМА у пациентов с симптоматическими окклюзиями сонных артерий. Журнал Вопросы нейрохирургии имени Н.Н. Бурденко. Москва, том 83, №3, с. 29-41
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ДИНАМИЧЕСКОГО ОПРЕДЕЛЕНИЯ ОБЪЁМА РЕВАСКУЛЯРИЗАЦИИ ГОЛОВНОГО МОЗГА С ИСПОЛЬЗОВАНИЕМ ИНТРАОПЕРАЦИОННОЙ МАГНИТНО-РЕЗОНАНСНОЙ ТОМОГРАФИИ | 2023 |
|
RU2811955C1 |
| СПОСОБ ЛЕЧЕНИЯ ЦЕРЕБРАЛЬНОЙ ИШЕМИИ | 2008 |
|
RU2408300C2 |
| СПОСОБ РЕВАСКУЛЯРИЗАЦИИ ГОЛОВНОГО МОЗГА ПРИ ОСТРОМ ИШЕМИЧЕСКОМ ИНСУЛЬТЕ | 2019 |
|
RU2707258C1 |
| СПОСОБ КОМБИНИРОВАННОЙ РЕВАСКУЛЯРИЗАЦИИ ГОЛОВНОГО МОЗГА ПРИ БОЛЕЗНИ МОЙАМОЙА | 2013 |
|
RU2522917C1 |
| Способ планирования мини-доступа для создания экстра-интракраниального микроанастомоза с использованием МСКТ-ангиографии головного мозга в 3D реконструкции. | 2016 |
|
RU2637826C1 |
| СПОСОБ ВЫПОЛНЕНИЯ СЕЛЕКТИВНОГО ЭИКМА В РЕГИОНЕ ГИПОПЕРФУЗИИ С ИСПОЛЬЗОВАНИЕМ НЕЙРОНАВИГАЦИИ | 2017 |
|
RU2648001C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ХРОНИЧЕСКОЙ ИШЕМИИ ГОЛОВНОГО МОЗГА | 2002 |
|
RU2212191C1 |
| Способ разметки средней оболочечной артерии для хирургической реваскуляризации головного мозга с использованием МСКТ-ангиографии головного мозга в 3D реконструкции | 2019 |
|
RU2724023C1 |
| СПОСОБ ЛЕЧЕНИЯ ОПУХОЛЕЙ ОСНОВАНИЯ ЧЕРЕПА С ВОВЛЕЧЕНИЕМ В НОВООБРАЗОВАНИЕ МАГИСТРАЛЬНЫХ АРТЕРИЙ ГОЛОВНОГО МОЗГА | 2021 |
|
RU2779729C1 |
| СПОСОБ ВЫПОЛНЕНИЯ ОБХОДНОГО ШУНТИРОВАНИЯ ГОЛОВНОГО МОЗГА С ИСПОЛЬЗОВАНИЕМ УСТЬЯ ВЕРХНЕЧЕЛЮСТНОЙ АРТЕРИИ (анастомоз по типу конец-в-конец) | 2021 |
|
RU2781443C1 |


Изобретение относится к медицине, а именно к сосудистой нейрохирургии, и может быть использовано для выбора акцепторной артерии при хирургической реваскуляризации головного мозга у пациентов с хронической церебральной ишемией. Для этого регистрируют изменения скорости потока крови в корковых артериях принимающего русла до и после создания анастомоза и проходимость анастомоза после его создания. При расширенной костно-пластической трепанации интраоперационно осуществляют выбор акцепторной (принимающей) артерии с наименьшим кровотоком до 18 см/с и определяют направление потока крови в ней для создания микрососудистого анастомоза в зоне дефицита кровоснабжения головного мозга. Изобретение позволяет сохранить устойчивое функционирование созданного анастомоза и минимизировать возможные осложнения хирургической реваскуляризации головного мозга. 8 ил., 1 пр.
Способ выбора акцепторной артерии при хирургической реваскуляризации головного мозга у пациентов с хронической церебральной ишемией, включающий регистрацию изменения скорости потока крови в корковых артериях, принимающего русла до и после создания анастомоза и проходимость анастомоза после его создания, отличающийся тем, что при расширенной костно-пластической трепанации интраоперационно осуществляют выбор акцепторной (принимающей) артерии с наименьшим кровотоком до 18 см/с и определяют направление потока крови в ней для создания микрососудистого анастомоза в зоне дефицита кровоснабжения головного мозга.
| Способ и устройство для определения ишемического состояния головного мозга | 2018 |
|
RU2693819C1 |
| СПОСОБ РЕВАСКУЛЯРИЗАЦИИ ГОЛОВНОГО МОЗГА ПРИ ОСТРОМ ИШЕМИЧЕСКОМ ИНСУЛЬТЕ | 2019 |
|
RU2707258C1 |
| NAKAGAWA A | |||
| et al., Intraoperative infrared brain surface blood flow monitoring during superficial temporal artery-middle cerebral artery anastomosis in patients with childhood moyamoya disease | |||
| Childs Nerv Syst | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| PMID: 18622619 | |||
| ЛУКШИН | |||
Авторы
Даты
2021-02-03—Публикация
2019-12-23—Подача