Изобретение относится к области медицины, в частности к нейрохирургии, может быть использовано при цереброваскулярных заболеваниях.
Хирургическим методом увеличения церебральной перфузии при окклюзии брахиоцефальных артерий (БЦА) с гемодинамической недостаточностью является создание экстра-интракраниального микроанастомоза (далее по тексту ЭИКМА). В настоящее время, с развитием нейровизуализации и новых компьютерных технологий стало возможным осуществлять нейрохирургические вмешательства через мини-доступы. Известны способы создания ЭИКМА из мини-доступа с использованием нейронавигационных установок и без них.
Известен способ создания экстра-интракраниального микроанастомоза из мини-доступа с использованием нейронавигационных установок (см. статью Minimally invasive superficial temporal artery to middle cerebral artery bypass through an enlarged bur hole: the use of computed tomography angiography neuronavigation in surgical planning, Jeroen R. Coppens, M.D., John D. Cantando, D.O., Neurosurg 109:000-000, 2008), при котором используют компьютерно-томографическое (КТ)-планирование в формате 3D и безрамную нейронавигацию. Моделируется проекция и размеры трепанации черепа, что позволяет с минимальной травматичностью создать ЭИКМА.
Недостатком этого способа является удлинение времени операции в связи с применением навигационной рабочей станции и как следствие проведения с ее использованием этапов КТ-разметки, 3D-моделирования, регистрации, разметки на поверхности головы. Способ не исключает возникновения погрешности на этапе регистрации и, следовательно, отклонения от заданной траектории.
Известен способ создания ЭИКМА с использованием 3D магнитно-резонансной ангиографии (см. статью Minimally invasive superficial temporal artery bypass throught a minicranitomy: benefit of three-dimensional virtual reality planning using magnetic resonance angiography, Fischer G, Stadie A, Schwandt E. et al., Neursurg Focus. - 2009. - Vol. 26(5). - P. 20. DOI 10.3171). Данная методика сокращает время хирургии, уменьшает травму тканей, исключает возможную погрешность навигации. Доступ снижает риск образования оболочечных гематом, существенно снижает рубцово-спаечный процесс, предоставляет предоперационный выбор оптимального донора и реципиента, позволяет выделить донор на меньшем протяжении и получить результат оптимального функционирования анастомоза. В связи с использованием МРТ исследования, метод исключает радиологическое облучение пациента, а также основан на визуализации мягкотканых компонентов, исключая костные ориентиры.
Недостатками способа являются необходимость дополнительного времени для предоперационного планирования, вероятность повреждения донора либо реципиента во время доступа, ограниченную возможность переключиться на другой донор или реципиент, наличие большого опыта хирурга для выполнения данной методики, а также неоправданно высокая стоимость магнитно-резонансного ангиографического исследования и малая доступность высокопольного сверхпроводящего MP-томографа с напряженностью поля 3.0 тесла в региональных сосудистых центрах РФ.
Известен способ создания ЭИКМА с использованием субтракционной ангиографии (СА) с 3D-моделированием и предоперационным планированием (см. статью Virtual surgical planning for superficial temporal artery to middle cerebral artery bypass using three-dimensional digital subtraction angiography, Nakagawa I, Kurokawa S, Tanisaka M, Kimura R, Nakase H., Acta Neurochir (Wien). - 2010. - Vol. Sep; 152(9). - P. 1535-40; DOI 10.1007). По мнению авторов, метод имеет более высокую точность изображения подходящего донора и реципиента по сравнению с методами КТ- и МР-визуализации. В известном способе измеряют расстояние до точки доступа от корня скуловой дуги. Мини-доступ позволяет минимизировать разрез кожи, длину выделения донора, разрез височной мышцы и размер краниотомии, сопровождается меньшим послеоперационным болевым синдромом, уменьшает риски периоперационных осложнений.
Недостатками известного способа являются риски периоперационных осложнений СА, связанных с симптоматической ишемией головного мозга, локальными осложнениями в зоне пункции магистральной артерии и повышенное радиологическое облучение пациента.
Наиболее близким заявляемому способу (прототипом) является способ создания ЭИКМА с помощью 3D мультиспиральной компьютерной томографии (МСКТ) ангиографии. (см. статью Less invasive technique for EC-IC bypass, Kaku Y., Watarai H., Kokuzawa J., Tanaka Т., Andoh Т., Acta Neurochirurgica Supplements. - 2008. - стр. 83-86 DOI 10.1007). Авторы использовали 3D МСКТ-ангиографию с предоперационным планированием на рабочей станции, что позволило им выбрать наиболее подходящего донора и реципиента, смоделировать проекцию и размеры трепанации черепа.
По известному способу разметка осуществляется от завитка наружной ушной раковины, что, по нашему мнению, является недостатком этого способа. В связи со сложностью и малой информативностью, т.к. МСКТ исследование позволяет визуализировать мягкотканые структуры в меньшей степени, что может привести к отклонению от заданной проекции. Планирование осуществляется на рабочей станции томографа на рабочем месте врача-рентгенолога, что мешает его работе, основой которой является интерпретация томограмм. Приобрести рабочую станцию в нейрохирургическое отделение только для разметки мини-доступа не рентабельно в связи с ее высокой стоимостью.
Задачей заявляемого изобретения является сокращение времени проведения операции, упрощение способа, увеличение точности планирования мини-доступа для создания ЭИКМА по данным МСКТ-ангиографии головного мозга с помощью доступного программного обеспечения.
Технический результат заключается в повышении точности выхода на артерию реципиент.
Технический результат достигается тем, что способ планирования мини-доступа для создания экстра-интракраниального микроанастомоза с использованием МСКТ-ангиографии головного мозга в 3D реконструкции, при котором мини-доступ выполняется через кожный разрез в проекции ветви поверхностной височной артерии, которая определяется в трехмерном изображении в визуализационной программе, и имеет минимальное расстояние до оптимальной по размеру и локализации реципиентной артерии, при этом разметка линии разреза осуществляется в 3D-реконструкции измерением расстояния от точки пересечения основного ствола либо теменной ветви поверхностной височной артерии со скуловой дугой до выбранной точки-доступа, расположенной посередине доступа.
Предлагаемый способ позволяет моделировать проекцию и минимальные размеры трепанации черепа для создания ЭИКМА. Также метод позволяет выбрать наиболее подходящего донора и реципиента, уменьшает травматизацию слоев тканей, косметически превосходен, уменьшает время операции, снижает кровопотерю. Метод может быть полезен для пациентов с системными заболеваниями, кардиальной дисфункцией.
Согласно изобретению, разметка осуществляется в 3D-реконструкции измерением расстояния от точки пересечения поверхностной височной артерии со скуловой дугой до выбранной точки доступа в доступном программном обеспечении, например, программном обеспечении «ЛИНС Махаон Рабочая станция врача».
С помощью данного программного обеспечения возможно выполнять моделирование мини-доступа с измерением расстояния от пересечения поверхностной височной артерии со скуловой дугой до выбранной точки доступа (кратчайшем расстоянии между наиболее конгруэнтными донором и реципиентом) в 3D-реконструкции, тем самым уменьшая вероятность отклонения от заданной хирургической цели.
Программное обеспечение устанавливается в персональный компьютер врача нейрохирурга и совместимо с диагностическим оборудованием и PACS-системами ((англ. Picture Archiving and Communication System) — системы передачи и архивации DICOM изображений) в рамках стандарта DICOM ((англ. Digital Imaging and Communications in Medicine) — отраслевой стандарт создания, хранения, передачи и визуализации медицинских изображений и документов обследованных пациентов). Ее стоимость позволяет оснастить рабочие места врачей нейрохирургических отделений.
Способ иллюстрируется следующими чертежами.
Фиг.1 - Вид экрана программы с серией ангиографических изображений с максимальным количеством срезов.
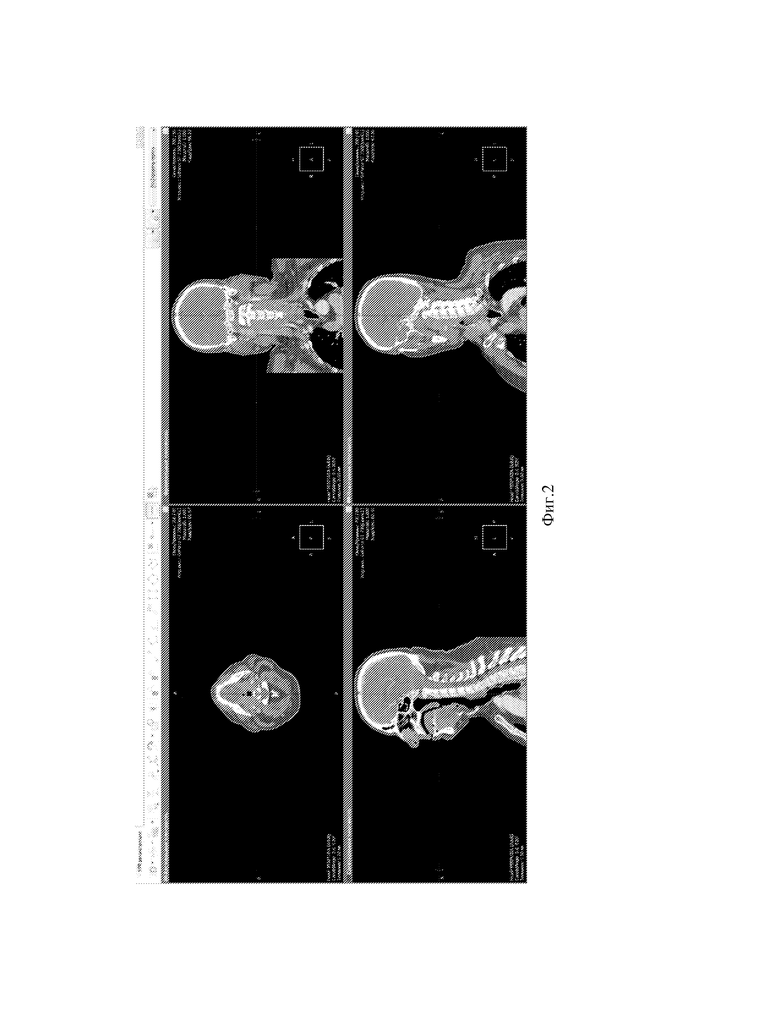
Фиг.2 - Вид экрана программы построение MPR путем выбора окна 3D.
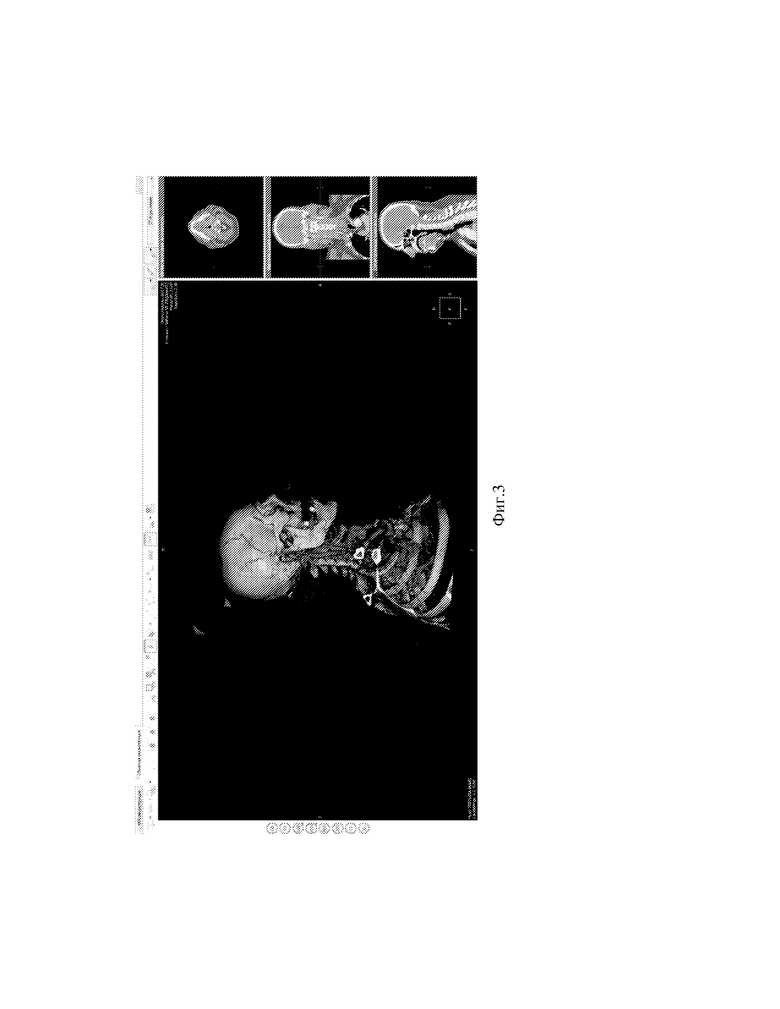
Фиг.3 - Вид экрана программы построение объемной реконструкции с выводом ПВА.
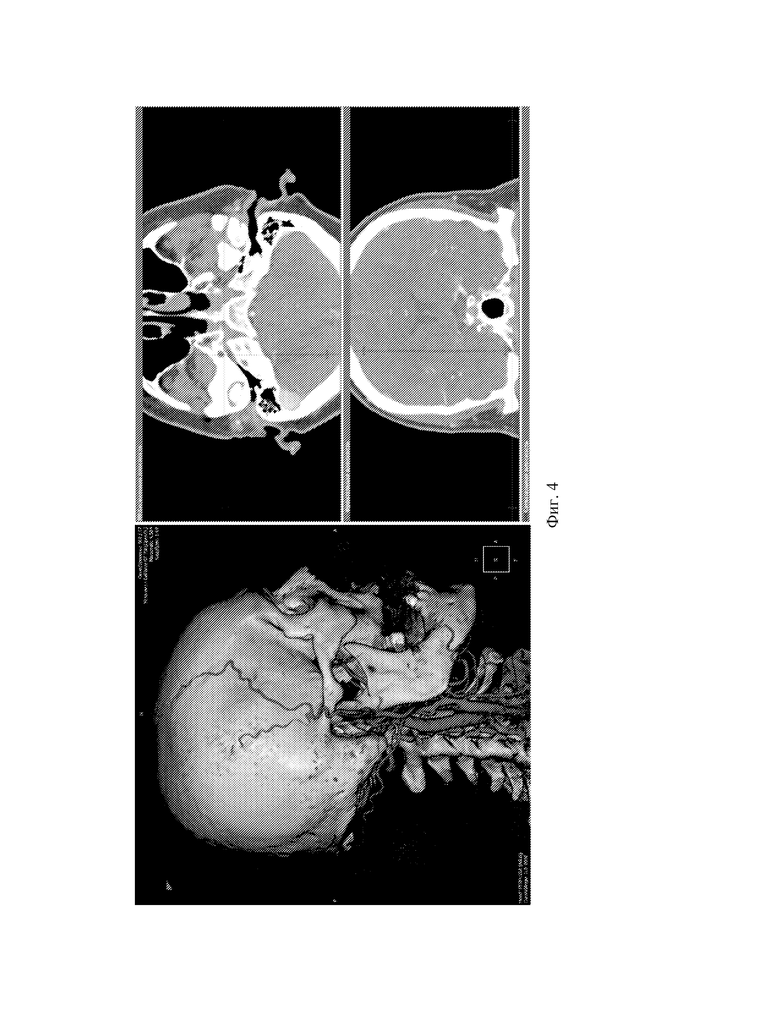
Фиг.4 - Вид экрана программы в объемной реконструкции с увеличенными окнами аксиальной и фронтальной плоскостей и изображениями.
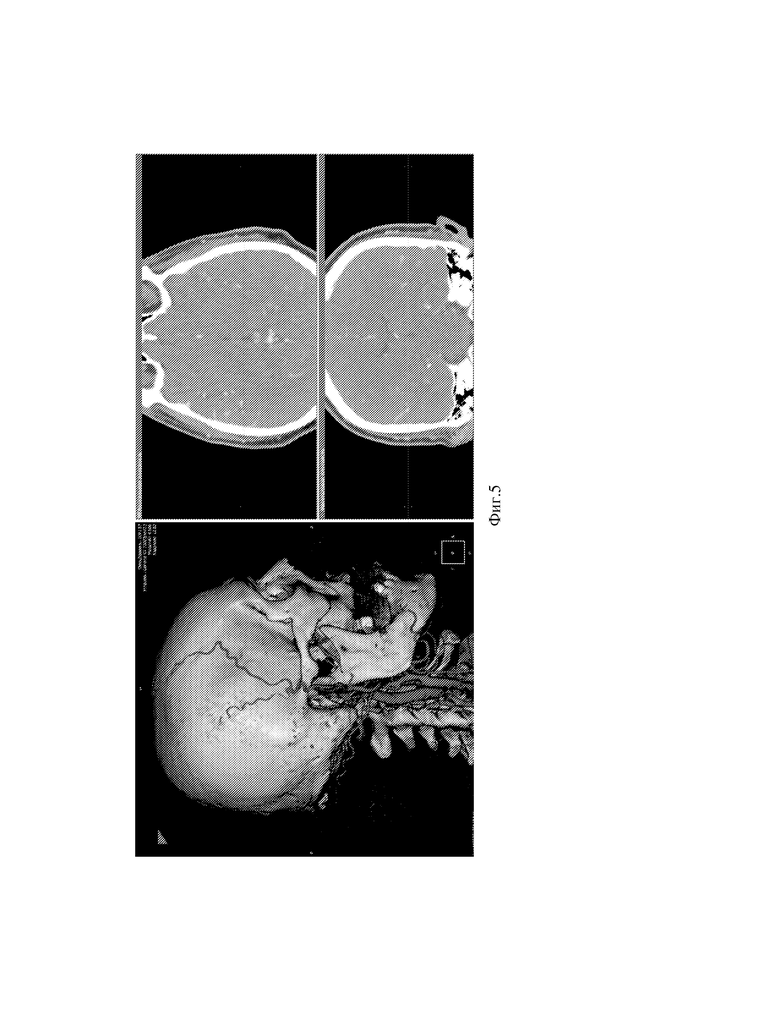
Фиг.5 - Вид экрана программы в объемной реконструкции с отметкой точки доступа.
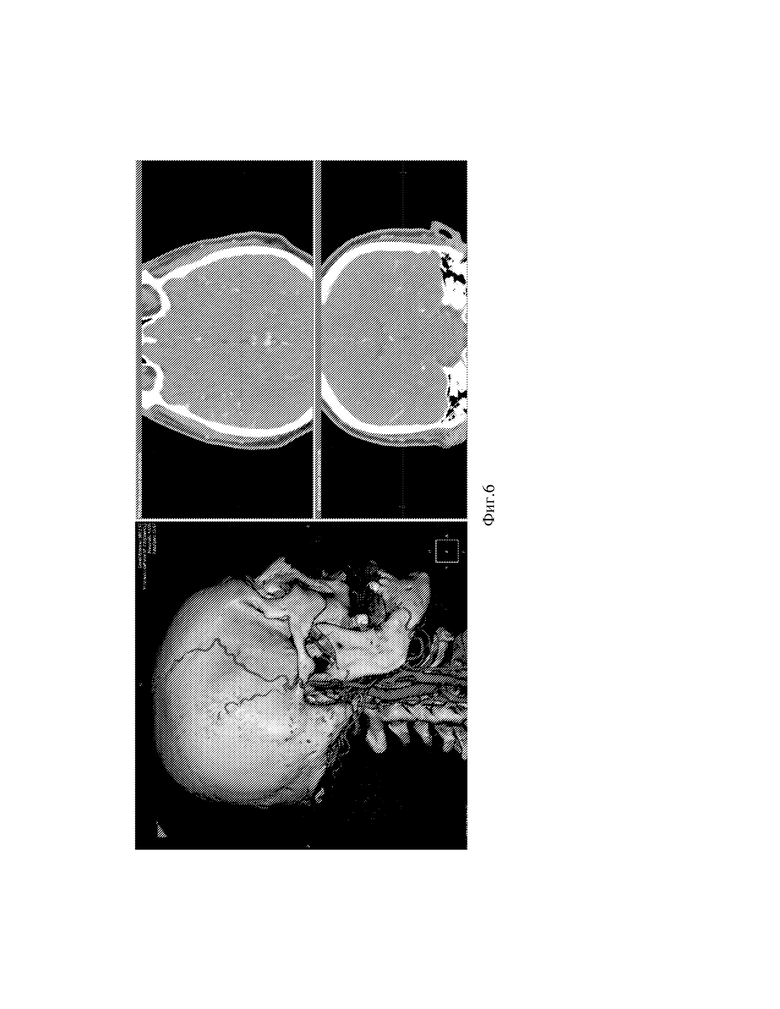
Фиг.6 - Вид экрана программы с отметкой точки доступа и точки пересечения ПВА со скуловой дугой.
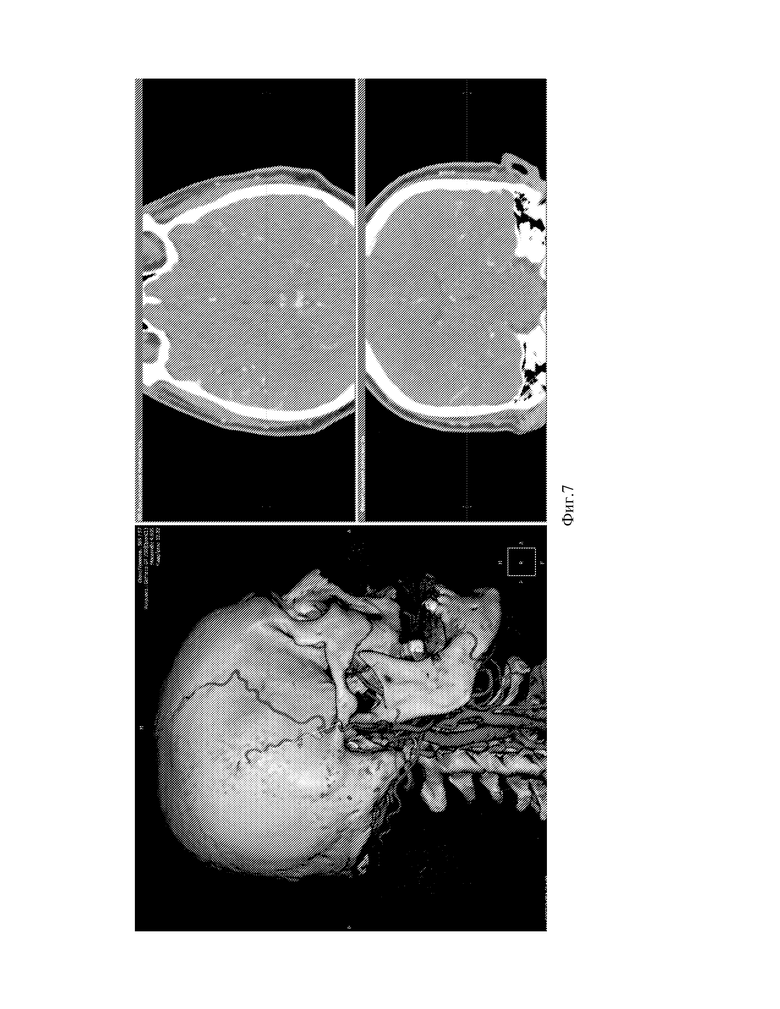
Фиг.7 - Вид экрана программы с определением расстояния от точки доступа до точки пересечения ПВА со скуловой дугой.
Фиг.8 - Вид головы пациента с разметкой доступа на ее поверхности.
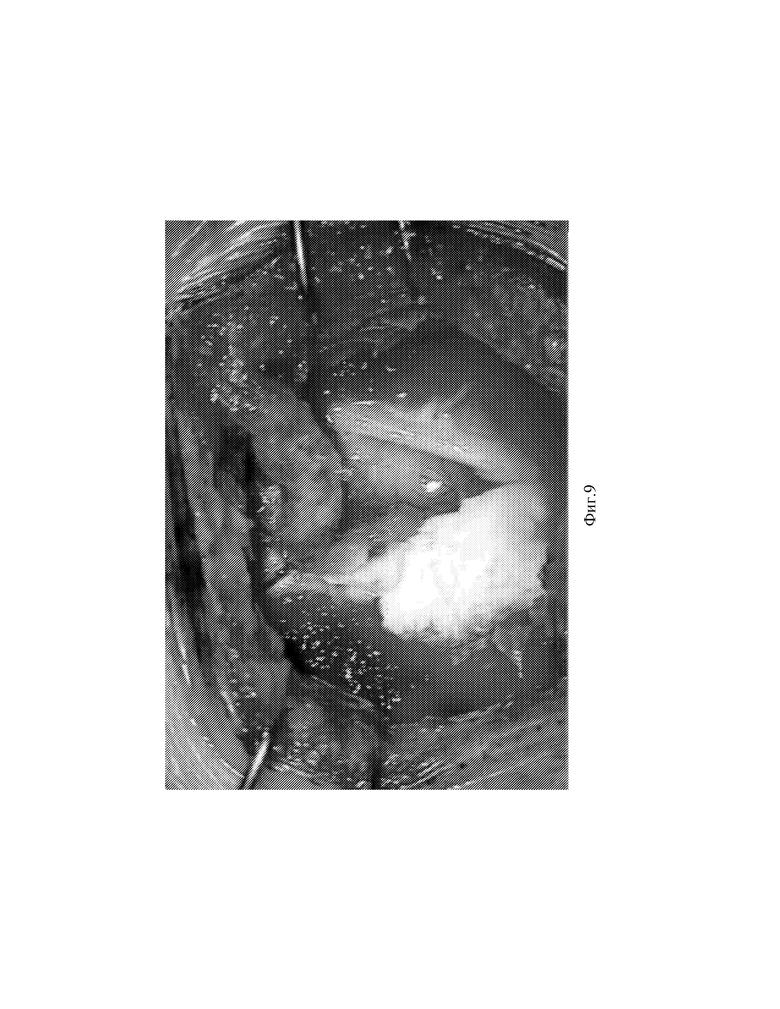
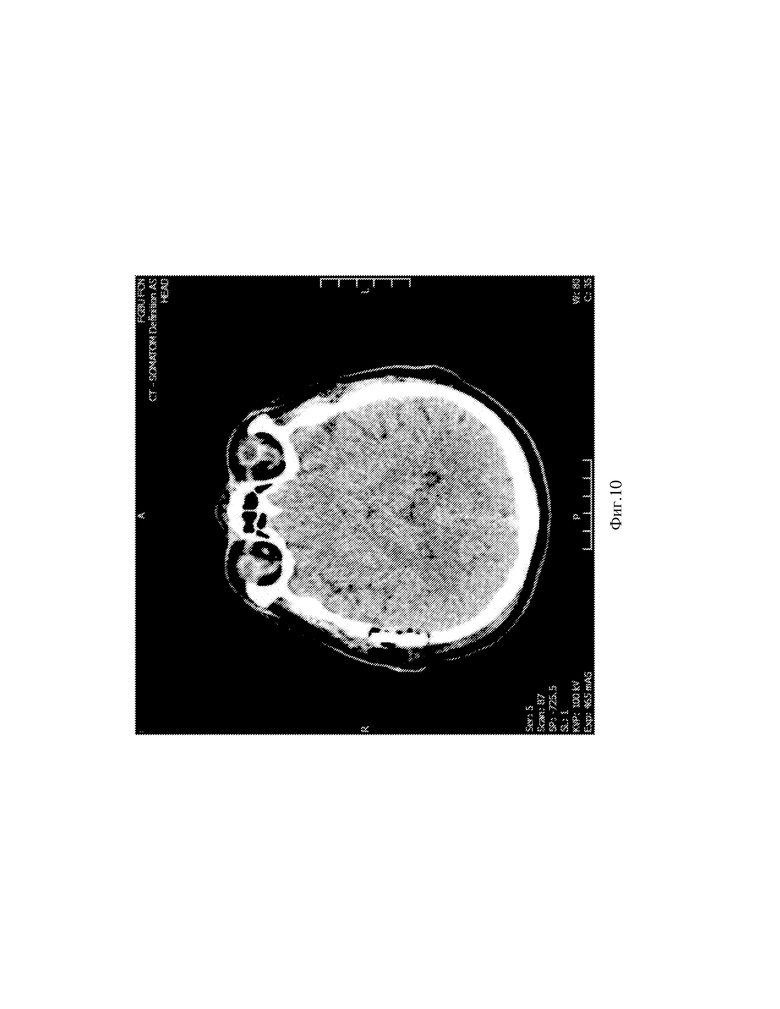
Фиг.9 - Вид операционной раны и функционирующего анастомоза через операционный микроскоп. Фиг.10 Вид экрана программы МСКТ- головного мозга.
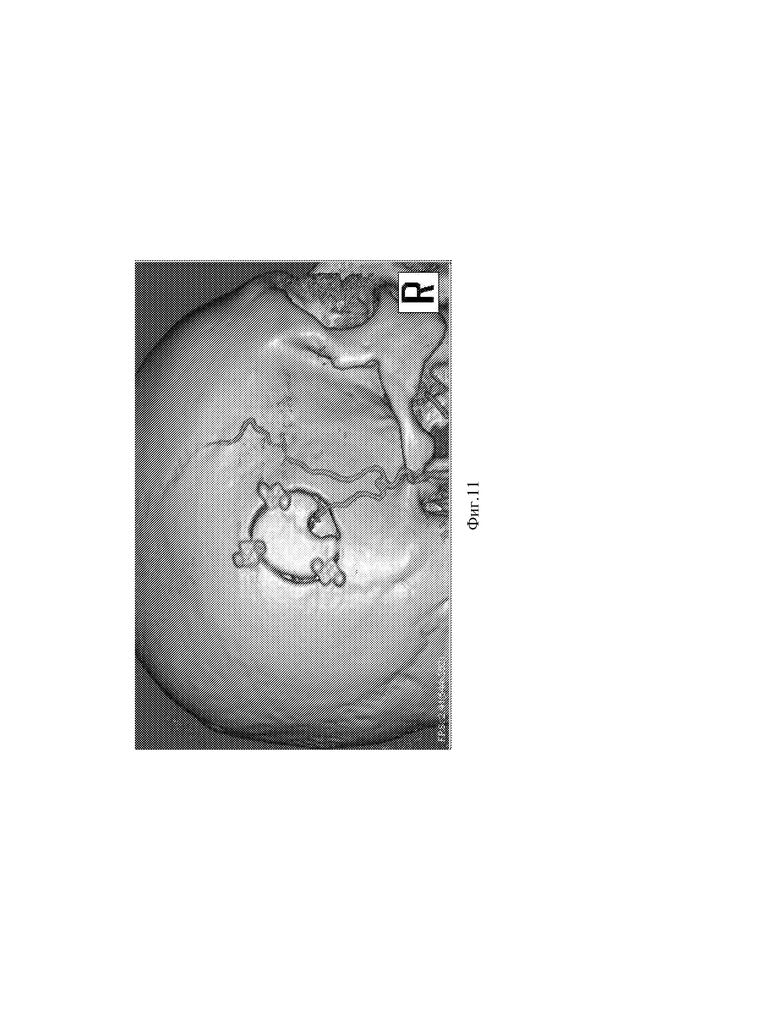
Фиг.11. - Вид экрана программы (экстракраниальный вид) МСКТ-ангиографии головного мозга.
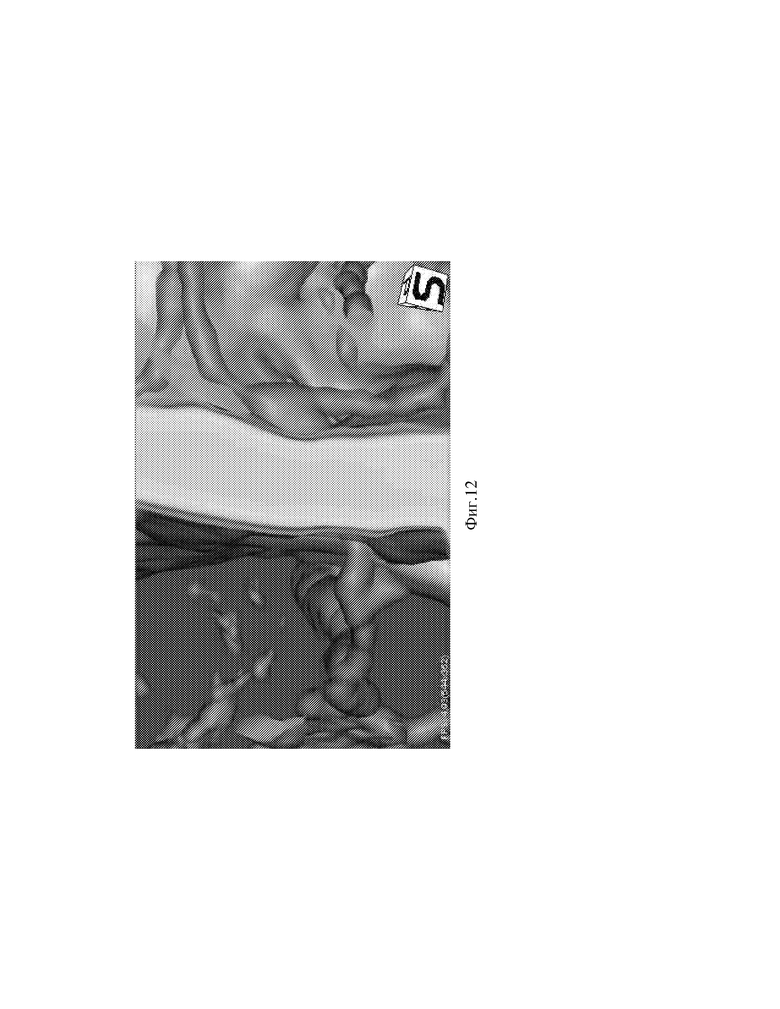
Фиг.12 - Вид экрана программы (экстра-интракраниальный вид) МСКТ-ангиографии головного мозга.
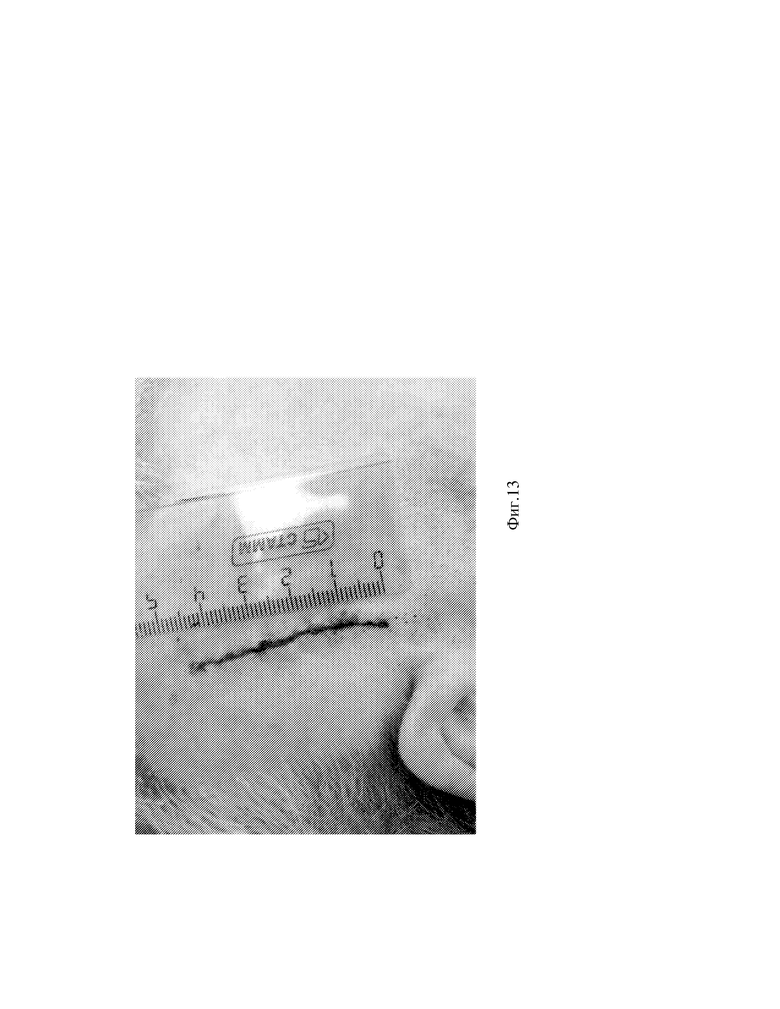
Фиг.13 - Вид поверхности головы пациента с послеоперационным швом.
Способ осуществляется следующим образом.
Данные МСКТ-ангиографии пациента интегрируются в локальную базу программы, например, программы «ЛИНС Махаон Рабочая станция врача». Выбирается серия ангиографических изображений с максимальным количеством срезов (см. фиг.1). Выполняется построение MPR (мультипланарной реконструкции) путем выбора окна 3D (см. фиг.2). Выполняется построение объемной реконструкции, выводится поверхностная височная артерия (далее ПВА) (см. фиг.3). Увеличиваем окна аксиальной и фронтальной плоскостей, а также изображений в них, для лучшей визуализации артерий. Выбирается окно MPR-курсор, в котором с интервалом в несколько миллиметров проводится курсором по ветви поверхностной височной артерии на 3D модели до ближайшего и более конгруэнтного реципиента по окнам аксиальной и фронтальной плоскостей (см. фиг.4,5). Отмечаются точка доступа и точка пересечения ПВА со скуловой дугой (см. фиг.6) Определяется расстояние от точки доступа до точки пересечения ПВА со скуловой дугой. (см. фиг.7)
С июля 2015 года по июнь 2016 года в отделении сосудистой нейрохирургии федерального центра нейрохирургии (ФЦН) г.Новосибирск прооперировано 14 пациентов с использованием данной методики. Мини-доступ выполнялся через кожный разрез в проекции донорской артерии, длиной от 3,5 см до 5,5 см. Размер трепанации составил до 3,5 см. В качестве реципиента использовали М4 и М3 сегменты средней мозговой артерии (СМА). Во всех наблюдениях реципиентная артерия располагалась в пределах выполненного доступа. После создания микроанастомоза твердая мозговая оболочка ушивалась с оставлением дефекта для донорской артерии. Костный дефект закрывали аутокостью со сформированным отверстием для артериального шунта, с фиксацией на титановые пластинки. По данным контрольной МСКТ-ангиографии все анастомозы функционировали, хирургических осложнений не было. Средняя продолжительность операции составила 3 часа 27 минут.
Планирование доступа осуществлялось на основе сопоставления данных МСКТ-ангиографии, с использованием визуализационной компьютерной программы. После моделирования трехмерного изображения, в режиме MPR-курсор определялась точка на донорской артерии, имеющая минимальное расстояние до оптимальной по размеру и локализации реципиентной артерии (точка доступа), с измерением расстояния до точки пересечения ПВА со скуловой дугой. Точка доступа определялась на поверхности головы, измерением от вышеуказанной точки пересечения ПВА и скуловой дуги; далее расчерчивалась линия кожного разреза.
Клинический пример. Пациент К. заболел в 2012 г, когда появились приступы головной боли, головокружения. По месту жительства обследован, выявлены стенозы ветвей дуги аорты. В мае 2014 г. в г. Благовещенск, с целью профилактики ишемического инсульта, проведено оперативное лечение по поводу гемодинамически значимого стеноза левой внутренней сонной артерии (ВСА), выполнена эверсионная эндартерэктомия слева, 10.12.2014 проведено оперативное лечение – эверсионная эндартерэктомия справа. В феврале 2016 года при контрольном ультразвуковом исследовании брахиоцефальных артерий (БЦА) выявлена окклюзия правой ВСА. Консультирован сосудистым нейрохирургом ФЦН, госпитализирован в сосудистое нейрохирургическое отделение, для оперативного лечения.
При поступлении объективно выявлена вертебробазилярная недостаточность, в виде атаксичной походки, как следствие синдрома обкрадывания ввиду окклюзии правой ВСА. Пациенту выполнялась МСКТ-ангиография экстра и интракраниальных артерий, МСКТ-перфузия головного мозга с нагрузочными пробами, на 64-срезовом КТ (Siemens Somatom Definition AS). По данным МСКТ-перфузионного исследования головного мозга отмечается снижение цереброваскулярного резерва в бассейне правой средней мозговой артерии (СМА).
С целью профилактики ишемического инсульта в бассейне правой ВСА, пациенту после предоперационной разметки с использованием программы «ЛИНС: Махаон: Рабочая станция врача», проведено оперативное лечение миникраниотомия в правой теменно-височной области, создание экстра-интракраниального микроанастомоза между теменной ветвью правой ПВА и М4 сегментом правой СМА.
Предоперационная разметка осуществлялась следующим образом. Данные МСКТ-ангиографии пациента интегрировали в локальную базу программы «ЛИНС; Махаон; Рабочая станция врача». Выбирали серии ангиографических изображений с максимальным количеством срезов. Выполняли построение MPR-реконструкции путем выбора окна 3D. Выполняли построение объемной реконструкции, выводили поверхностную височную артерию (ПВА), увеличивали окна аксиальной и фронтальной плоскостей и изображения. Выбирали окно MPR-курсор, в котором с интервалом в несколько миллиметров проводили курсором по ветви поверхностной височной артерии на 3D модели до ближайшего и более конгруэнтного реципиента по окнам аксиальной и фронтальной плоскостей. Отмечали точку доступа и точку пересечения ПВА со скуловой дугой, определяли расстояние от точки доступа до точки пересечения ПВА со скуловой дугой.
В условиях операционной, под эндотрахеальным наркозом (ЭТН), в положении больного лёжа на спине, с поворотом головы влево, пальпаторно в правой лобной, теменной, височной областях проведена разметка ветвей ПВА. С помощью линейки определена точка доступа в проекции теменного ствола ПВА, по расстоянию от точки пересечения ПВА со скуловой дугой. Расчерчена линия разреза кожи с точкой доступа посередине.
Операция. Под ЭТН, в положении больного лёжа на спине, с поворотом головы влево, после обработки, разметки и отграничения
операционного поля, в проекции теменного ствола правой поверхностной височной артерии произведён линейный разрез кожи длинной 5 см. Гемостаз. Тупо и остро выделен теменной ствол правой поверхностной височной артерии, 1,3 мм в диаметре, в мягкотканном футляре на всём протяжении длинника раны, мобилизован. Височная мышца рассечена линейным разрезом, разведена в стороны крючками. В височной кости наложено фрезевое отверстие, из которого выполнена автоматическая краниотомия диаметром 3х3 см. Гемостаз. ТМО рассечена крестообразно, отвернута в стороны, взята на держалки. Выделена корковая артерия до 1,3 мм в диаметре (М4 сегмент правой средней мозговой артерии). Кровоток по артерии на 1 см участке перекрыт с помощью двух временных микро-клипс. Донорская артерия пересечена в дистальном участке, коагулирован "пенек". Кровоток по теменному стволу правой поверхностной височной артерии перекрыт временным мини-клипсом в проксимальном участке. Конец артерии-донора сформирован по типу "рыбьей пасти". Произведено создание анастомоза между артерией-донором и артерией-реципиентом по типу конец-в-бок с помощью полиэфирной нити 10-0 узловыми швами. Кровоток по артериям запущен (см.фиг.9). Время пережатия М4 сегмента составило 37 минут. Отмечена хорошая пульсация зоны анастомоза. Кровоток по анастомозу проконтролирован допплеровским микродатчиком, до 150 см/сек. Швы на ТМО, пластика дефекта ТМО Тахокомбом. Костный лоскут уложен на место с оставлением дефекта для артерии-донора, фиксирован на три титановых мини-пластины 6 винтами-саморезами. Мягкие ткани ушиты послойно наглухо с использованием внутрикожного шва. Туалет раны спиртом. Ас повязка.
Послеоперационный период без осложнений, вечером в день операции после перевода из реанимации и проведения МСКТ-контроля головного мозга, ангиографии головного мозга, пациент передвигался в пределах палаты без дополнительного неврологического дефицита (см.фиг.10,11,12). Пациент выписан на 3 сутки после операции, для дальнейшего наблюдения у невролога по месту жительства.
Предлагаемый мини-доступ при создании ЭИКМА является малоинвазивным, уменьшает операционную травму, уменьшает интраоперационную кровопотерю, имеет лучший косметический эффект (см.фиг.13), полностью исключает вероятность возникновения краевого некроза раны. При использовании предоперационного планирования по данным 3D МСКТ-ангиографии значимо сокращает время операции т.к. не требует использования нейронавигационных установок и имеет высокую точность определения подходящего реципиента. Данный доступ обладает высоким потенциалом широкого применения в клинической практике.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ разметки средней оболочечной артерии для хирургической реваскуляризации головного мозга с использованием МСКТ-ангиографии головного мозга в 3D реконструкции | 2019 |
|
RU2724023C1 |
| СПОСОБ ВЫПОЛНЕНИЯ СЕЛЕКТИВНОГО ЭИКМА В РЕГИОНЕ ГИПОПЕРФУЗИИ С ИСПОЛЬЗОВАНИЕМ НЕЙРОНАВИГАЦИИ | 2017 |
|
RU2648001C1 |
| СПОСОБ ЛЕЧЕНИЯ ЦЕРЕБРАЛЬНОЙ ИШЕМИИ | 2008 |
|
RU2408300C2 |
| СПОСОБ АУТОВЕНОЗНОГО ШУНТИРОВАНИЯ ПРИ ОККЛЮЗИРУЮЩИХ ПОРАЖЕНИЯХ АРТЕРИЙ ГОЛОВНОГО МОЗГА | 2014 |
|
RU2554210C1 |
| СПОСОБ КОМБИНИРОВАННОЙ РЕВАСКУЛЯРИЗАЦИИ ГОЛОВНОГО МОЗГА ПРИ БОЛЕЗНИ МОЙАМОЙА | 2013 |
|
RU2522917C1 |
| СПОСОБ ОТБОРА ПАЦИЕНТОВ ДЛЯ ОПЕРАЦИИ ЭКСТРА-ИНТРАКРАНИАЛЬНОГО МИКРОАНАСТОМОЗА ПРИ АТЕРОСКЛЕРОТИЧЕСКОЙ ОККЛЮЗИИ ВНУТРЕННЕЙ СОННОЙ АРТЕРИИ | 2018 |
|
RU2695275C1 |
| СПОСОБ РЕВАСКУЛЯРИЗАЦИИ ГОЛОВНОГО МОЗГА ПРИ ОСТРОМ ИШЕМИЧЕСКОМ ИНСУЛЬТЕ | 2019 |
|
RU2707258C1 |
| Способ выбора акцепторной артерии при хирургической реваскуляризации головного мозга у пациентов с хронической церебральной ишемией | 2019 |
|
RU2742191C1 |
| СПОСОБ ДИНАМИЧЕСКОГО ОПРЕДЕЛЕНИЯ ОБЪЁМА РЕВАСКУЛЯРИЗАЦИИ ГОЛОВНОГО МОЗГА С ИСПОЛЬЗОВАНИЕМ ИНТРАОПЕРАЦИОННОЙ МАГНИТНО-РЕЗОНАНСНОЙ ТОМОГРАФИИ | 2023 |
|
RU2811955C1 |
| Способ визуализации результата хирургического лечения ювенильных ангиофибром носоглотки и основания черепа | 2017 |
|
RU2649474C1 |


Изобретение относится к медицине, нейрохирургии, может быть использовано при цереброваскулярных заболеваниях. При планировании мини-доступа для создания экстра-интракраниального микроанастомоза используют МСКТ-ангиографию головного мозга в 3D-реконструкции. При этом мини-доступ выполняют через кожный разрез в проекции ветви поверхностной височной артерии (ПВА), которая определяется в трехмерном изображении в визуализационной программе и имеет минимальное расстояние до оптимальной по размеру и локализации реципиентной артерии. Разметка линии разреза осуществляется в 3D-реконструкции измерением расстояния от точки пересечения основного ствола либо теменной ветви ПВА со скуловой дугой до выбранной точки-доступа, которая расположена посередине доступа. Способ обеспечивает повышение точности планирования мини-доступа с выходом на артерию-реципиент, в качестве которой может быть средняя мозговая артерия, а также сокращение времени операции, уменьшение травматизации тканей, снижение кровопотери, лучший косметический эффект, с полным исключением формирования краевого некроза раны, упрощение способа с использованием доступного программного обеспечения. 13 ил., 1 пр.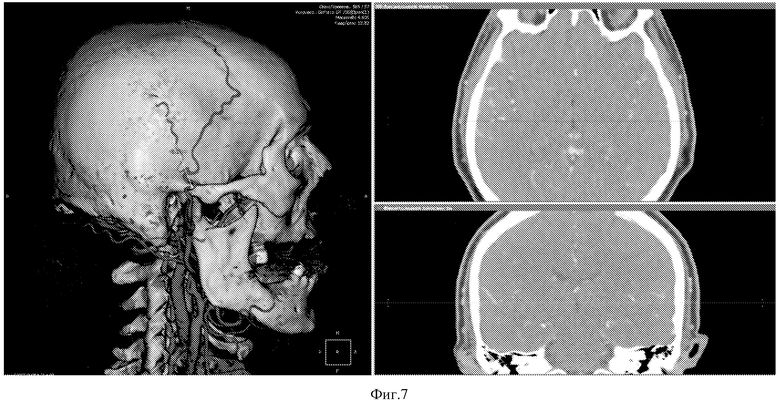
Способ планирования мини-доступа для создания экстра-интракраниального микроанастомоза с использованием МСКТ-ангиографии головного мозга в 3D реконструкции, при котором мини-доступ выполняется через кожный разрез в проекции ветви поверхностной височной артерии, которая определяется в трехмерном изображении в визуализационной программе и имеет минимальное расстояние до оптимальной по размеру и локализации реципиентной артерии, отличающийся тем, что разметка линии разреза осуществляется в 3D-реконструкции измерением расстояния от точки пересечения основного ствола либо теменной ветви поверхностной височной артерии со скуловой дугой до выбранной точки-доступа, расположенной посередине доступа.
| KAKU Y | |||
| et al | |||
| Less invasive technique for EC-IC bypass// Acta Neurochir Suppl | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| СПОСОБ ЛЕЧЕНИЯ ЦЕРЕБРАЛЬНОГО ВАЗОСПАЗМА | 2000 |
|
RU2209041C2 |
| СПОСОБ ЛЕЧЕНИЯ ЦЕРЕБРАЛЬНОЙ ИШЕМИИ | 2008 |
|
RU2408300C2 |
| Способ лечения нарушений мозгового кровообращения | 1986 |
|
SU1507336A1 |
| ЛУКЬЯНЧИКОВ В.А | |||
| и др | |||
| Возможность выполнения экстра-интракраниального микроанастомоза с использованием системы безрамной нейронавигации// Нейрохир | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| ЧУРИЛОВ М.В | |||
| Экстра-интракраниальный микрососудистый анастомоз в хирургии гигантских аневризм головного мозга, автореф | |||
| дисс.к.м.н., М., 1992, 11 с | |||
| NAKAGAWA I | |||
| et al | |||
| Virtual surgical planning for superficial temporal artery to middle cerebral artery bypass using three-dimentional digital subtraction angiography// Acta Neurochir | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
Авторы
Даты
2017-12-07—Публикация
2016-06-17—Подача