Область техники, к которой относится изобретение
[0001]
Настоящее изобретение относится к способу получения фторсодержащего соединения, в частности, к способу получения соединения, имеющего фторметиленовую группу.
Уровень техники
[0002]
Поскольку некоторые физиологически активные вещества in vivo представляют собой фторированные метиленсодержащие соединения, применения фторметиленсодержащих соединений к лекарственным средствам и т.п. были активно изучены.
Например, способы получения фторсодержащих метиленовых соединений, таких как α-фторметиленовые соединения и α-дифторалдольные соединения, которые представляют собой карбонильные соединения, имеющие в α-положении по меньшей мере один заместитель, выбранный из группы, состоящей из атомов фтора и перфторорганических групп, являются весьма полезными (непатентные документы 1 и 2).
[0003]
Что касается способа получения карбонильного соединения, имеющего в α-положении по меньшей мере один заместитель, выбранный из группы, состоящей из атомов фтора и перфторорганических групп, до сих пор мало что сообщалось о получении фторсодержащего карбонильного соединения, в котором легкодоступные трифторметилкетон и карбонильное соединение используются в качестве исходных материалов. Желателен эффективный и простой способ получения с использованием таких исходных материалов.
[0004]
В непатентном документе 3 α-дифторальдольное соединение получают из трифторметилацетона; однако для этого необходимо пять стадий. Кроме того, применение тиофенола в качестве реагента требует высокотоксичного реагента, такого как хлорид ртути, для удаления серы из реакционной системы, что делает процесс реакции сложным.
[0005]
В непатентном документе 4 α-дифторальдольное соединение получают с помощью реакции 2,2-дифторенольного простого силилового эфира, который был получен путем связанного с магнием селективного расщепления связей C-F в трифторметилкетоне, с помощью бензальдегида в присутствии хлортриметилсилана; однако для такой реакции необходимо три стадии, а также требуется большое количество реагента для субстрата реакции. Соответственно, существует возможность для усовершенствования с точки зрения выхода и т.п.
[0006]
Кроме того, поскольку все вышеуказанные способы образуют неорганические соли в качестве побочных продуктов, необходима стадия удаления солей. Таким образом, с учетом стоимости производства, эффективности реакции, легкости и т.д., желателен усовершенствованный или полностью новый способ получения.
[0007]
В непатентном документе 5 описано опосредованное видимым светом внутримолекулярное присоединение гликозилгалогенидов к олефинам, которые замещены электроноакцепторными группами, в котором в качестве субстрата используется соединение, не содержащее фтора, и амин, и используется сложный эфир Ганча в качестве вспомогательного вещества для амина.
[0008]
В непатентном документе 6 описан способ получения соединения, имеющего фторметиленовую группу, причем способ использует соединение, не содержащее фтора в качестве субстрата.
Перечень ссылок
Непатентные документы
[0009]
NPL 1: John T. Welch et al., Tetrahedron, 1987, 43, 14, p.3123.
NPL 2: Svante et al., J. Am. Chem. Soc., 1981, 103, p.4452.
NPL 3: Howa et al., Synthetic Communications, 1999, 29 (2), p.235.
NPL 4: Amii et al., Chem. Commun., 1999, p.1323.
NPL 5: Andrews et al., Angew. Chem. Int. Ed., 2010, 49, p.7274.
NPL 6: Yu et al., Chem. Commun., 2014, 50, p.12884.
Сущность изобретения
Техническая задача
[0010]
Задачей настоящего изобретения является предложить новый способ для эффективного получения соединения, имеющего фторметиленовую группу.
Решение задачи
[0011]
В результате обширных исследований авторы изобретения обнаружили, что данная задача может быть решена следующим способом.
Способ получения соединения, представленного следующей формулой (1), или производного соединения с замкнутым или разомкнутым кольцом (иногда называемого «соединение (1)» в данном описании):
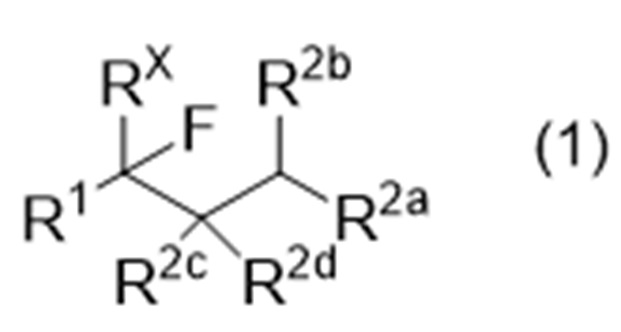
где R1 представляет собой органическую группу,
RX представляет собой водород или фтор,
R2a, R2b, R2c и R2d являются одинаковыми или различными, и каждый представляет собой -Y-R21 или -N(-R22)2, или R2b и R2c могут соединяться друг с другом с образованием связи,
где Y обозначает связь, кислород или серу,
R21 представляет собой водород или органическую группу, и
R22, в каждом случае, является одинаковым или различным и представляет собой водород или органическую группу;
включающий стадию А взаимодействия соединения (иногда называемого «соединение (2)» в описании), представленного формулой (2):
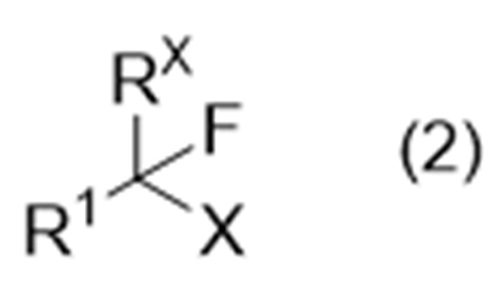
где Х представляет собой удаляемую группу, а другие символы являются такими, как определено выше,
с соединением (иногда называемым «соединение (3)» в описании), представленным формулой (3):
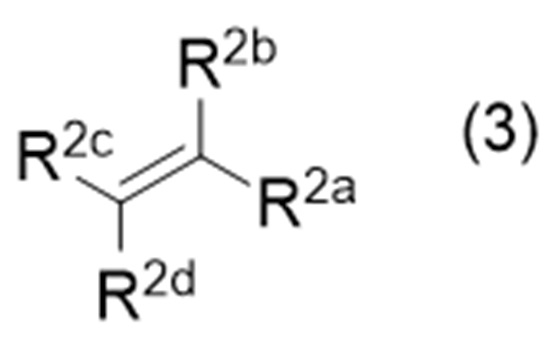
где символы являются такими, как определено выше,
в присутствии восстановителя при облучении светом.
Авторы изобретения, таким образом, осуществили изобретение.
[0012]
Настоящее изобретение включает следующее.
[0013]
Пункт 1.
Способ получения соединения, представленного следующей формулой (1), или производного соединения с замкнутым или разомкнутым кольцом:

где R1 представляет собой органическую группу,
RX представляет собой водород или фтор,
R2a, R2b, R2c и R2d являются одинаковыми или различными, и каждый представляет собой -Y-R21 или -N(-R22)2, или R2b и R2c могут соединяться друг с другом с образованием связи,
где Y обозначает связь, кислород или серу,
R21 представляет собой водород или органическую группу, и
R22, в каждом случае, является одинаковым или различным и представляет собой водород или органическую группу;
причем способ включает стадию А взаимодействия соединения, представленного формулой (2):

где Х представляет собой удаляемую группу, а другие символы являются такими, как определено выше,
с соединением, представленным формулой (3):

в которой символы являются такими, как определено выше, в присутствии восстановителя при облучении светом.
Пункт 2.
Способ по п.1, в котором R1 представляет собой алкил, фторалкил, алкоксикарбонил или ароматическую группу.
Пункт 3.
Способ по п.1 или п.2, в котором R2a представляет собой алкил или арил, и каждый из R2b, R2c и R2d представляет собой водород.
Пункт 4.
Способ по любому из п.п.1-3, в котором X представляет собой бром.
Пункт 5.
Способ по любому из п.п.1-4, в котором стадию А реакции проводят в присутствии азотсодержащего ненасыщенного гетероциклического соединения, имеющего N-H фрагмент.
Пункт 6.
Способ по любому из п.п.1-5, в котором восстановитель представляет собой соединение, представленное формулой (4):
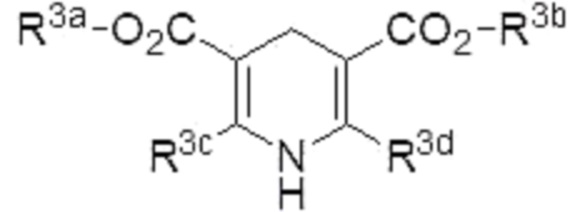
где R3a, R3b, R3c и R3d являются одинаковыми или различными, и каждый из них представляет собой алкил.
Пункт 7.
Способ по любому из п.п.1-6, в котором стадию А взаимодействия проводят в присутствии катализатора.
Пункт 8.
Способ по п.7, в котором катализатор представляет собой по меньшей мере один элемент, выбранный из группы, состоящей из комплексов переходных металлов и соединений органического красителя.
Полезные эффекты изобретения
[0014]
Настоящее изобретение предлагает эффективный новый способ получения соединения, имеющего фторметиленовую группу.
Описание вариантов осуществления
[0015]
Термины
Символы и сокращения в данном описании должны интерпретироваться как имеющие общепринятое значение в соответствующей технической области, к которой относится настоящее изобретение, в соответствии с контекстом данного описания, если не указано иное.
[0016]
В данном описании термины «содержит» и «включает» охватывают значения «состоит по существу из» и «состоит из».
[0017]
Стадии, обработки или операции в данном описании могут быть осуществлены при комнатной температуре, если не указано иное.
В данном описании комнатная температура относится к температуре в диапазоне от 10°C до 40°C.
[0018]
В данном описании «Cn-m» (здесь n и m являются натуральными числами) указывает на то, что число атомов углерода равно n или более и m или менее, как это принято в области органической химии.
[0019]
В данном описании термин фторметилен включает монофторметилен и дифторметилен, если не указано иное.
[0020]
В данном описании, если не указано иное, примеры атома галогена включают фтор, хлор, бром и йод.
[0021]
В данном описании, если не указано иное, термин «органическая группа» относится к группе, содержащей по меньшей мере один атом углерода в качестве своего составляющего атома.
В данном описании, если не указано иное, примеры органической группы включают углеводород, циано, карбокси, алкокси, сложный эфир, простой эфир и ацил.
[0022]
В данном описании, если не указано иное, термин «углеводород» относится к группе, содержащей по меньшей мере один атом углерода и по меньшей мере один атом водорода в качестве составляющих ее атомов.
В данном описании, если не указано иное, примеры углеводорода включают алифатический углеводород, ароматический углеводород (арил), и их сочетания.
[0023]
В данном описании, если не указано иное, термин «алифатический углеводород» может означать линейный, разветвленный или циклический алифатический углеводород, или их сочетание.
[0024]
В данном описании, если не указано иное, термин «алифатический углеводород» может представлять насыщенный или ненасыщенный алифатический углеводород.
[0025]
В данном описании, если не указано иное, примеры алифатического углеводорода включают алкил, алкенил, алкинил и циклоалкил.
[0026]
В данном описании, если не указано иное, термин «алкил» относится к линейному или разветвленному C1-10 алкилу, такому как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил и гексил.
[0027]
В данном описании термин «фторалкил» относится к алкилу, имеющему по меньшей мере один атом водорода, замещенный атомом фтора.
В данном описании число атомов фтора во «фторалкиле» может быть один или более (например, от 1 до 3, от 1 до 6, от 1 до 12 или от 1 до максимального числа заместителей).
Термин «фторалкил» включает перфторалкил. Термин «перфторалкил» относится к алкилу, в котором все атомы водорода замещены атомами фтора.
[0028]
В данном описании, если не указано иное, термин «алкенил» относится к линейному или разветвленному C1-10 алкенилу, такому как винил, 1-пропенил, изопропенил, 2-метил-1-пропенил, 1-бутен, 2-бутенил, 3-бутенил, 2-этил-1-бутенил, 1-пентенил, 2-пентенил, 3-пентенил, 4-пентенил, 4-метил-3-пентенил, 1-гексенил, 2-гексенил, 3-гексенил, 4-гексенил и 5-гексенил.
[0029]
В данном описании, если не указано иное, термин «алкинил» относится к линейному или разветвленному C2-6 алкинилу, такому как этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 3-бутинил, 1-пентинил, 2-пентинил, 3-пентинил, 4-пентинил, 1-гексинил, 2-гексинил, 3-гексинил, 4-гексинил и 5-гексинил.
[0030]
В данном описании, если не указано иное, термин «циклоалкил» относится к C3-10 циклоалкилу (предпочтительно C4-10 циклоалкилу), такому как циклопентил, циклогексил и циклогептил.
[0031]
В данном описании, если не указано иное, термин «алкокси» относится, например, к группе, представленной формулой RO- (где R означает алкил).
[0032]
В данном описании, если не указано иное, термин «сложный эфир» относится, например, к группе, представленной формулой RCO2- (где R означает алкил).
[0033]
В данном описании, если не указано иное, термин «простой эфир» относится к группе, имеющей простую эфирную связь (-O-), и примеры простого эфира включают простой полиэфир. Примеры простого полиэфира включают группы, представленные формулой Ra-(O-Rb)n- (где Ra означает алкил, Rb в каждом случае является одинаковым или различным и означает алкилен, и n является целым числом, равным 1 или более). Алкилен представляет собой двухвалентную группу, образованную удалением одного атома водорода из алкильной группы.
[0034]
В данном описании, если не указано иное, термин «ацил» включает алканоил. В данном описании, если не указано иное, термин «алканоил» относится, например, к группе, представленной формулой RCO- (где R означает алкил).
[0035]
В данном описании, если не указано иное, термин «ароматическая группа» включает арил и гетероарил.
В данном описании примеры «арила» включают С6-10 арил, такой как фенил и нафтил.
В данном описании примеры «гетероарила» включают 5-14-членные (моноциклические, дициклические или трициклические) гетероциклические группы, содержащие, в дополнение к углероду, от 1 до 4 гетероатомов, выбранных из группы, состоящей из азота, серы и кислорода в качестве кольцевого атома.
В данном описании примеры «гетероарила» включают (1) моноциклические ароматические гетероциклические группы, такие как фурил, тиенил, пиридил, пиримидинил, пиридазинил, пиразинил, пирролил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, изоксазолил, оксадиазолил, тиадиазолил, и триазолил, тетразолил и триазинил; и
(2) полициклические (например, дициклические) ароматические гетероциклические группы, такие как хинолил, изохинолил, хиназолил, хиноксалил, бензофурил, бензотиенил, бензоксазолил, бензизоксазолил, бензотиазолил, бензимидазолил, benzotriazolyl, индолил, индазолил, пирролопиразинил, имидазопиридинил, имидазопиразинил, имидазотиазолил пиразолопиридинил, пиразолотиенил и пиразолоториадинил.
[0036]
Способ получения
Способ получения соединения, представленного следующей формулой (1), или производного соединения с замкнутым или разомкнутым кольцом:

где R1 представляет собой органическую группу,
RX представляет собой водород или фтор,
R2a, R2b, R2c и R2d являются одинаковыми или различными, и каждый представляет собой -Y-R21 или -N(-R22)2, или R2b и R2c могут соединяться друг с другом с образованием связи,
где Y обозначает связь, кислород или серу,
R21 представляет собой водород или органическую группу, и R22, в каждом случае, является одинаковым или различным и представляет собой водород или органическую группу,
включает стадию А реакции соединения, представленного формулой (2):

где Х представляет собой удаляемую группу, а другие символы являются такими, как определено выше, с соединением, представленным формулой (3):

в которой символы являются такими, как определено выше, в присутствии восстановителя при облучении светом.
[0037]
Символы в приведенных выше химических формулах объяснены ниже.
[0038]
Предпочтительные примеры «органической группы», представленной R1, включают алкильные, фторалкильные, алкоксикарбонильные и ароматические группы.
Более предпочтительные примеры «органической группы», представленной R1, включают фторалкил.
[0039]
Примеры «алкоксикарбонила» включают C1-6 алкоксикарбонил, такой как метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, изобутоксикарбонил, втор-бутоксикарбонил, трет-бутоксикарбонил, пентабутоксикарбонил, изопентоксикарбонил и гексилоксикарбонил.
[0040]
Предпочтительные примеры «ароматических групп» включают арил и, более предпочтительно, С6-10 арил, такой как фенил и нафтил.
[0041]
RX предпочтительно является фтором.
[0042]
Когда R2b и R2c соединяются друг с другом с образованием связи, как легко понятно специалисту в данной области, структура формулы (1) является структурой, представленной следующей химической формулой:
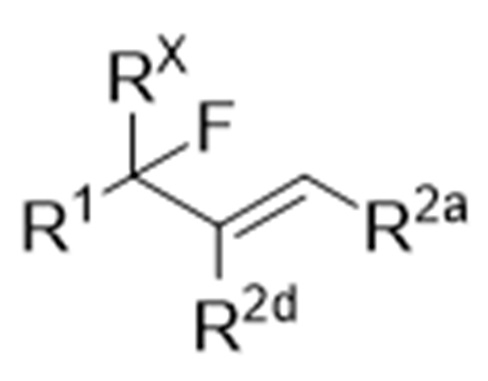
и структура формулы (3) является структурой, представленной следующей химической формулой:
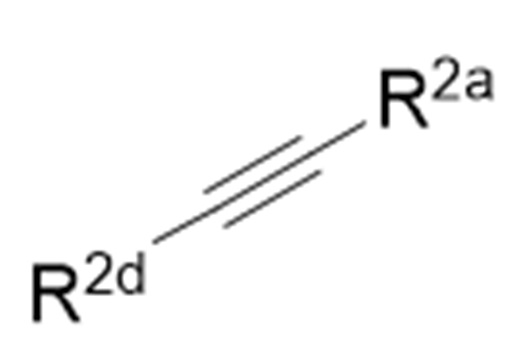 .
.
[0043]
По меньшей мере один из R2a, R2c, R2c или R2d предпочтительно представляет собой электронодонорную группу.
[0044]
В предпочтительном варианте осуществления настоящего изобретения по меньшей мере один из R2a, R2b, R2c или R2d может быть углеводородом, необязательно имеющим по меньшей мере один заместитель.
Примеры заместителя включают гетероарил, необязательно имеющий по меньшей мере один заместитель, (более предпочтительно 5-18-членный гетероарил, необязательно имеющий по меньшей мере один заместитель), простой тиоэфир, необязательно имеющий по меньшей мере один заместитель, и силазан, необязательно имеющий по меньшей мере один заместитель.
[0045]
Предпочтительные примеры «заместителя» в «гетероариле, необязательно имеющем по меньшей мере один заместитель», «простом тиоэфире, необязательно имеющем по меньшей мере один заместитель», или «силазане, необязательно имеющем по меньшей мере один заместитель», включают галоген (предпочтительно фтор), циано, амино, алкокси, перфторорганические группы (предпочтительно C1-8 перфторорганические группы, более предпочтительно трифторметил) и пентафторсульфанил (F5S-).
В предпочтительном варианте осуществления настоящего изобретения по меньшей мере один из R2a, R2b, R2c или R2d может быть незамещенным углеводородом (предпочтительно C1-10 углеводородом).
[0046]
Предпочтительные примеры «углеводорода» включают алкил (предпочтительно С1-10 алкил), циклоалкил (предпочтительно С3-10 циклоалкил и более предпочтительно С4-8 циклоалкил) и арил (предпочтительно С6-10 арил).
[0047]
В более предпочтительном варианте осуществления настоящего изобретения R2a представляет собой алкил или арил, и каждый из R2b, R2c и R2d представляет собой водород.
[0048]
Примеры удаляемой группы, представленной X, включают атомы галогена (такие как фтор, хлор, бром и йод), алкилсульфонилокси (C1-6 алкилсульфонилокси, такие как метансульфонилокси и трифторметансульфонилокси), арилсульфонилокси (C6-10 арилсульфонилокси, такие как бензолсульфонилокси и п-толуолсульфонилокси).
Предпочтительные примеры Х включают атомы галогена.
Более предпочтительные примеры Х включают хлор, бром и йод.
Еще более предпочтительные примеры Х включают бром.
[0049]
В предпочтительном варианте осуществления настоящего изобретения, R1 представляет собой фторалкил, алкоксикарбонил или арил;
RX представляет собой фтор;
R2a, R2b, R2c и R2d являются одинаковыми или различными, и каждый из них представляет собой алкил (предпочтительно C1-10 алкил), циклоалкил (предпочтительно C3-10 циклоалкил, и более предпочтительно C4-8 циклоалкил), или арил (предпочтительно C6-10 арил); и
X представляет собой бром.
[0050]
Количество соединения (3) на стадии А предпочтительно составляет 0,5-10 моль, более предпочтительно 1-8 моль и еще более предпочтительно 1,2-6 моль на моль соединения (2).
[0051]
Когда соединение (3) имеет по меньшей мере одну двойную углерод-углеродную связь в дополнение к двойной углерод-углеродной связи, показанной в структурной формуле формулы (3), соединение (1) может быть производным с замкнутым кольцом соединения, представленного формулой (1), полученным с помощью реакции замыкания кольца. Кольцо, образованное реакцией замыкания кольца, предпочтительно представляет собой 5-7-членное кольцо. Кольцо, образованное реакцией замыкания кольца, может быть карбоциклическим кольцом или гетероциклическим кольцом, содержащим, в дополнение к углероду, по меньшей мере один (предпочтительно один или два) гетероатом, выбранный из группы, состоящей из азота, серы и кислорода в качестве кольцевого атома.
[0052]
Когда R2a является эпокси (т.е. когда соединение (3) представляет собой эпоксисоединение), соединение (1) может быть производным с разомкнутым кольцом (т.е. эпокси-производным с разомкнутым кольцом) соединения, представленного формулой (1), полученным с помощью реакции раскрытия кольца.
[0053]
Стадию А реакции проводят в присутствии восстановителя.
[0054]
Восстановитель, используемый в настоящем изобретении, может быть неорганическим или органическим восстановителем. Примеры восстановителя включают водород, муравьиную кислоту, формиат аммония, формиат натрия, муравьиную кислоту-триэтиламин, триэтилсилан, тетраметилдисилоксан, полиметилгидросилоксан, NaBH3CN, NHCBH3 (N-гетероциклические карбеновые бораны) и азотсодержащее ненасыщенное гетероциклическое соединение, имеющее N-H фрагмент (иминогруппу).
[0055]
Предпочтительные примеры восстановителя, используемого в настоящем изобретении, включают азотсодержащее ненасыщенное гетероциклическое соединение, имеющее N-H фрагмент.
[0056]
Примеры «азотсодержащего ненасыщенного гетероциклического соединения, имеющего N-H фрагмент», которое может использоваться в качестве восстановителя в настоящем изобретении, включают соединение, представленное формулой (4) (в описании иногда называемое «соединение (4)»),
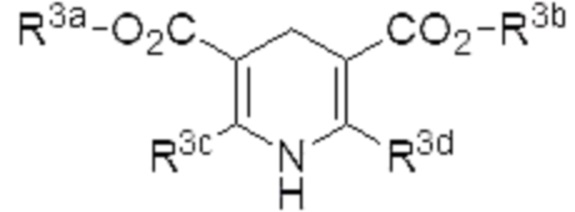
где R3a, R3b, R3c и R3d являются одинаковыми или различными, и каждый из них представляет собой алкил.
[0057]
R3a предпочтительно представляет собой C1-6 алкил, более предпочтительно метил или этил.
[0058]
R3b предпочтительно представляет собой C1-6 алкил, более предпочтительно метил или этил.
[0059]
R3c предпочтительно представляет собой C1-6 алкил, более предпочтительно метил или этил.
[0060]
R3d предпочтительно представляет собой C1-6 алкил, более предпочтительно метил или этил.
[0061]
Более предпочтительные примеры восстановителя, которые могут использоваться в настоящем изобретении, включают соединения, представленные приведенными ниже формулами. Эти соединения являются «эфирами Ганча».
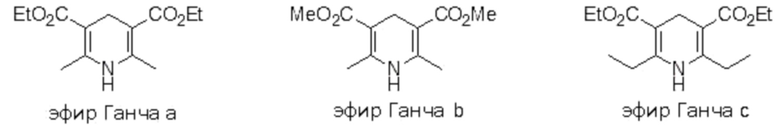
[0062]
В соответствии с общими техническими знаниями в области органической химии нужно учитывать следующее. Поскольку соединение (2), содержащее галогенированное производное алкана, является легко окисляемым, восстановитель, такой как эфир Ганча, непосредственно вызывает окислительно-восстановительную реакцию с производным, что предотвращает стадию А реакции, не приводя к получению соединения (1). Однако, неожиданно было обнаружено, что стадия А реакции надлежащим образом протекает в присутствии соединения (4), содержащего эфир Ганча. Результаты представлены в примерах.
[0063]
Такие восстановители могут использоваться по отдельности или в сочетании двух или более.
[0064]
На стадии А реакции необязательно может использоваться агент, удаляющий кислоту, такой как амин.
Когда используется соединение (4), предпочтительно не использовать другие амины.
[0065]
Когда восстановитель используется на стадии А, количество восстановителя предпочтительно составляет 0,5-10 моль, более предпочтительно 1,0-5,0 моль и еще более предпочтительно 1,2-3,0 моль на моль соединения, представленного формулой (2), которое используется в качестве субстрата.
[0066]
Стадию А реакции можно проводить в присутствии катализатора или по существу или полностью в отсутствие катализатора.
Стадию А реакции предпочтительно проводят в присутствии катализатора.
[0067]
Примеры катализатора, используемого в настоящем изобретении, включают комплексы переходных металлов и соединения органического красителя.
[0068]
Примеры видов центрального металла, содержащегося в комплексах переходных металлов, которые могут быть использованы в настоящем изобретении, включают кобальт, рутений, родий, рений, иридий, никель, палладий, осмий и платину.
Предпочтительные примеры видов центрального металла включают рутений, иридий и палладий.
[0069]
Примеры лигандов комплексов переходных металлов, которые могут использоваться в настоящем изобретении, включают азотсодержащие соединения, кислородсодержащие соединения и серосодержащие соединения.
[0070]
Примеры «азотсодержащих соединений», используемых в качестве лигандов, включают диаминовые соединения (например, этилендиамин) и азотсодержащие гетероциклические соединения (например, пиридин, бипиридин, фенантролин, пиррол, индол, карбазол, имидазол, пиразол, хинолин, изохинолин, акридин, пиридазин, пиримидин, пиразин, фталазин, хиназолин и хиноксалин).
[0071]
Примеры «кислородсодержащих соединений», используемых в качестве лигандов, включают дикетоны (например, дипивалоилметан) и кислородсодержащие гетероциклические соединения (например, фуран, бензофуран, оксазол, пиран, пирон, кумарин и бензопирон).
[0072]
Примеры «серосодержащих соединений», используемых в качестве лигандов, включают серосодержащие гетероциклические соединения (например, тиофен, тионафтен и тиазол).
[0073]
В комплексе переходных металлов число лигандов этих соединений может составлять один или более. Однако, вполне понятно, что количество лигандов не обязательно должно быть точно определенным.
[0074]
Когда катализатор используется на стадии А реакции, количество катализатора на стадии А предпочтительно составляет 0,0001-0,1 моль, более предпочтительно 0,001-0,05 моль и еще более предпочтительно 0,005-0,02 моль на моль соединения (2).
[0075]
Соединение органического красителя, которое может использоваться в настоящем изобретении, может представлять собой соединение, не содержащее атома металла в молекуле.
Примеры таких соединений органических красителей включают бенгальский розовый, эритрозин, эозин (например, эозин В и эозин Y), акрифлавин, рибофлавин и тионин.
[0076]
Предпочтительные примеры катализаторов включают [Ir{dF(CF3) ppy}2(dtbpy)]PF6, [Ir(dtbbpy)(ppy)2][PF6], Ir(ppy)3, Ru(bpy)3Cl2⋅6H2O, [Ru(bpz)3][PF6]2, [Ru(bpm)3][Cl]2, [Ru(bpy)2(phen-5-NH2)][PF6]2, [Ru(bpy)3][PF6]2, Ru(phen)3Cl2, Cu(dap)2 хлорид, 9-мезитил-10-метилакридиния перхлорат, Ir(ppy)3 и Pd(PPh3)4.
[0077]
Катализаторы могут использоваться по отдельности или в сочетании двух или более.
[0078]
Фоторедокс-катализатор может предпочтительно использоваться в качестве катализатора, применяемого на стадии А.
[0079]
Катализатор, используемый на стадии А, может быть нанесен на носитель (например, цеолит).
[0080]
Стадию А реакции можно проводить в присутствии растворителя или по существу или полностью в отсутствие растворителя.
Стадию А реакции предпочтительно осуществляют в присутствии растворителя.
[0081]
Примеры растворителей, используемых в настоящем изобретении, включают диметилформамид (DMF), толуол, CH3CN, простой эфир, тетрагидрофуран (THF), бензол, диметилсульфоксид (DMSO), гексан и бензотрифторид (BTF).
[0082]
Эти растворители могут использоваться по отдельности или в сочетании двух или более.
[0083]
Когда стадия А реакции начинается, концентрация соединения (2) в смеси реакционной системы предпочтительно находится в пределах 1-10000 мМ, более предпочтительно 10-1000 мМ и еще более предпочтительно 50-200 мМ.
[0084]
Когда стадия А реакции начинается, концентрация соединения (3) в смеси реакционной системы предпочтительно находится в пределах 5-50000 мМ, более предпочтительно 50-5000 мМ и еще более предпочтительно 250-1000 мМ.
[0085]
Когда катализатор используется в реакции на стадии А, концентрация катализатора в смеси реакционной системы предпочтительно составляет 0,01-100 мМ, более предпочтительно 0,1-10 мМ, и еще более предпочтительно 0,5-2 мМ.
[0086]
Стадия А может осуществляться путем смешивания соединения (2), соединения (3), желаемого восстановителя, желаемого катализатора и желаемого растворителя.
Для смешивания этих веществ можно использовать общепринятые способы.
При смешивании все вещества могут смешиваться одновременно или же смешиваться последовательно или постепенно.
[0087]
Стадию А реакции проводят при облучении светом.
Любой излучаемый свет может использоваться для облучения светом, при условии, что свет может инициировать и/или стимулировать стадию А реакции. Примеры источника света включают ртутную лампу низкого давления, среднего давления или высокого давления, вольфрамовую лампу и светоизлучающий диод (LED).
Излучаемый свет может быть предпочтительно видимым светом.
Излучаемый свет предпочтительно представляет собой свет, имеющий длину волны 300-600 нм, и более предпочтительно свет, имеющий длину волны 400-500 нм.
Время облучения предпочтительно составляет 1-24 ч, и более предпочтительно 10-18 ч.
Облучение светом может начинаться перед, во время, одновременно или после смешивания.
Интенсивность облучения светом может быть такой, что обеспечивается энергия для инициирования и/или стимулирования стадии А реакции. Например, интенсивность облучения светом может быть соответствующим образом скорректирована путем регулирования, исходя из общих технических знаний, выходной мощности источника света, расстояния между источником света и реакционной системой стадии А и т.д., чтобы стадия А реакции протекала надлежащим образом.
[0088]
Стадию А реакции можно проводить в присутствии инертного газа. Примеры инертного газа включают азот и аргон.
[0089]
Температура реакции на стадии А предпочтительно находится в диапазоне от 0°С до 120°С, более предпочтительно в диапазоне от 10°С до 80°С, и еще более предпочтительно в диапазоне от 20°С до 60°С.
Слишком низкая температура реакции может вызвать недостаточную реакцию на стадии А.
Слишком высокая температура реакции является неблагоприятной с точки зрения затрат и может вызвать нежелательную реакцию.
[0090]
Продолжительность реакции на стадии А предпочтительно находится в диапазоне 1-24 ч, более предпочтительно в диапазоне 5-18 ч, и еще более предпочтительно в диапазоне 10-15 ч.
Слишком короткая продолжительность реакции может вызвать недостаточную реакцию на стадии А.
Слишком большая продолжительность реакции является неблагоприятной с точки зрения затрат и может вызвать нежелательную реакцию.
[0091]
Реакцию на стадии А можно предпочтительно осуществлять в периодическом режиме или в проточной системе.
[0092]
Соединение (1), полученное с помощью способа получения настоящего изобретения, может быть очищено, если необходимо, известным способом очистки, таким как сольвентная экстракция, высушивание, фильтрация, дистилляция, концентрирование, и их сочетание.
[0093]
В соответствии со способом получения по настоящему изобретению степень конверсии соединения (2), которое является исходным материалом, составляет предпочтительно 40% или более, более предпочтительно 60% или более, и еще более предпочтительно 80% или более.
В соответствии со способом получения по настоящему изобретению селективность соединения (1) составляет предпочтительно 70% или более, и более предпочтительно 80% или более.
В соответствии со способом получения по настоящему изобретению выход соединения (1) составляет предпочтительно 40% или более, и более предпочтительно 60% или более.
[0094]
Соединение (1), полученное способом получения по настоящему изобретению, может быть использовано, например, в качестве фармацевтического промежуточного соединения.
Примеры
[0095]
Настоящее изобретение подробно описано ниже со ссылкой на примеры; однако настоящее изобретение не ограничивается ими.
[0096]
В приведенных ниже примерах выходы представляют собой фактические выходы, если не указано иное.
[0097]
Пример 1

(1) Ru(bpy)3Cl2⋅6H2O (7,5 мг, 1 мол.%), использовавшийся в качестве фоторедокс-катализатора, и эфир Ганча а (380,7 мг, 1,5 ммоль) добавляли в контейнер, и смесь растворяли в DMF (5 мл). (Бромдифторметил)бензол (206,6 мг, 1,0 ммоль), 1-октен (0,78 мл, 5,0 ммоль), Et3N (201,0 мг, 1,99 ммоль), и DMF (5 мл) далее добавляли в смесь для осуществления Ar-замещения, и полученную смесь перемешивали при облучении белым светом в течение 12 ч.
После реакции, 40 мл раствора, содержащего EtOAc/гексан=9/1, добавляли в раствор, и органический слой промывали 20 мл чистой воды 3 раза и 30 мл насыщенного солевого раствора один раз. После этого органический слой обезвоживали, фильтровали и сушили, и затем проводили колоночную хроматографию на силикагеле (проявляющий растворитель: гексан) с получением 1,1-дифтор-1-фенилнонана (151,6 мг, выход: 63%).
(2) Осуществляли ту же реакцию, что и в пункте (1) выше, за исключением того, что не использовали фоторедокс-катализатор.
(3) Осуществляли ту же реакцию, что и в пункте (1) выше, за исключением того, что не использовали Et3N.
Результаты представлены в таблице ниже. Как видно из результатов, степень конверсии повышалась при использовании фоторедокс-катализатора. Реакция протекала надлежащим образом независимо от присутствия или отсутствия Et3N.
[0098]
Таблица 1
a: В качестве внутреннего стандарта использовали ундекан, степень конверсии определяли с помощью ГХ.
b: ЯМР-выход
[0099]
(4) Используя соединения (2) и (3) в таблице ниже, соединения (1), показанные в таблице ниже, получали таким же образом, как и в пункте (1) выше. Результаты показаны в таблице ниже вместе с результатами пункта (1) выше.
[0100]
Таблица 2
(целевое соединение)
(соединение (1)/другое соединение) a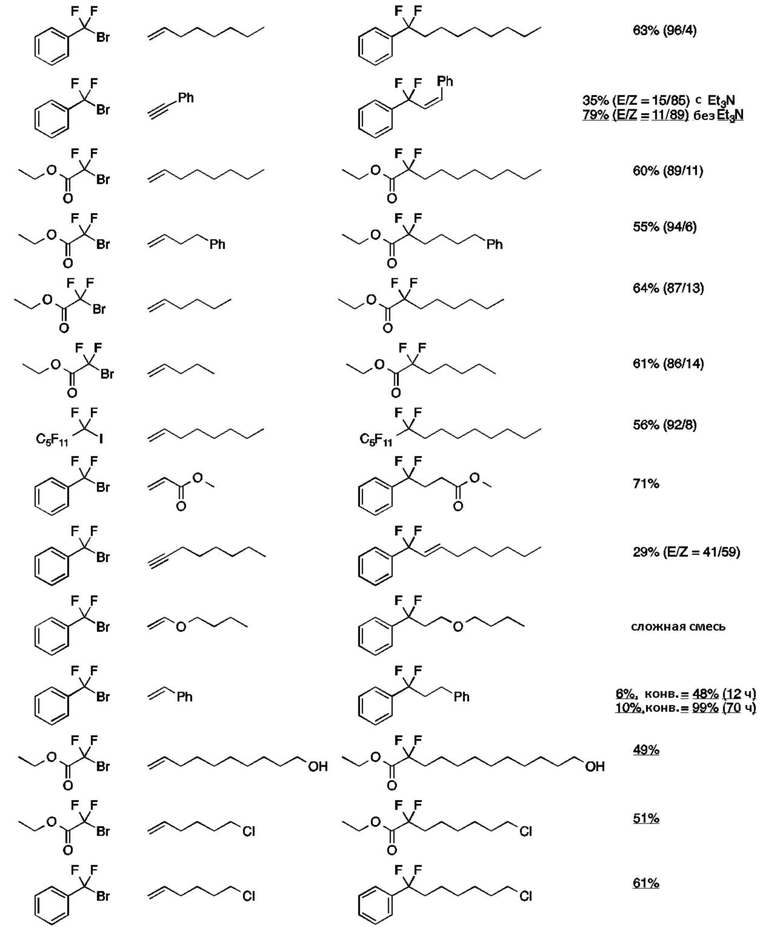
[0101]
(5) В некоторых соединениях исходных материалов (таблица ниже), в дополнение к целевому соединению а (соединение (1)), атом брома - замещенное соединение b, восстановительный аддукт с, с которым связаны две молекулы олефина, и подвижный атом брома, с которым связаны две молекулы олефина, одновременно получали путем реакций (1)-(4). Для каждого исходного материала в таблице ниже показан выход и соотношение площадей по ГХ соединений a, b, c и d.
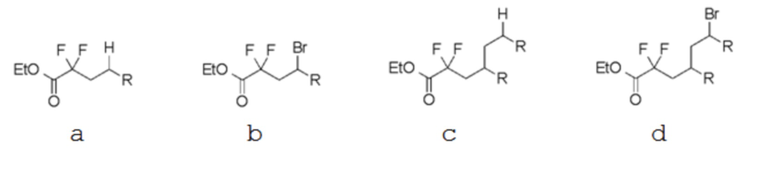
(R в каждой формуле соответствует R2a).
Таблица 3
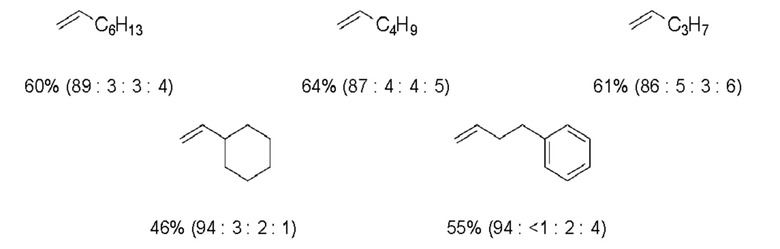
[0102]
Пример 2
Таким же образом, как и в примере 1 (1), реакцию примера 1 (1) проводили в условиях, указанных в таблице ниже. Результаты представлены в таблице ниже.
Таблица 4
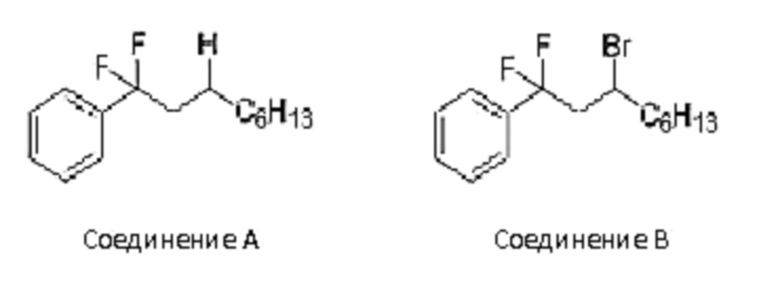
10 мл
1,5 экв.
1 мол.%
[0103]
Пример 3
Таким же образом, как и в примере 1 (1), (бромдифторметил)бензол (1,0 ммоль), 1-октен (5,0 ммоль), фоторедокс-катализатор, показанный в таблице ниже (1 мол.% или 0 мол.% по отношению к (бромдифторметил)бензолу), эфир Ганча а (1,5 ммоль), Et3N (2,0 ммоль), и DMF (10 мл) добавляли в контейнер для осуществления Ar-замещения. После этого полученную смесь перемешивали в течение 12 ч при облучении светом с использованием источника света, показанного в таблице ниже. Белый LED (5 Вт) использовали в качестве источника белого света. SOLARBOX 1500e (ксеноновая лампа, УФ-фильтр из известково-натриевого стекла, производимый CO.FO.ME.GRA. Srl) использовалась в качестве источника дневного света.
После реакции, 40 мл раствора, содержащего EtOAc/гексан=9/1, добавляли в раствор, и органический слой промывали 20 мл чистой воды 3 раза и 30 мл насыщенного солевого раствора один раз. После этого органический слой обезвоживали, фильтровали и сушили, и затем проводили колоночную хроматографию на силикагеле (проявляющий растворитель: гексан) с получением 1,1-дифтор-1-фенилнонана.
Степень конверсии и ГХ-выход приведены в таблице ниже.
Таблица 5

1 мол.%
[0104]
Пример 4
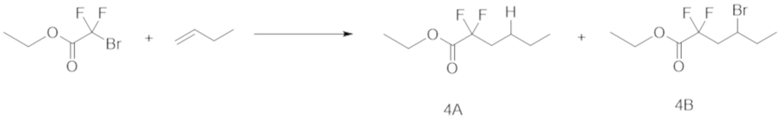
Таким же образом, как и в примере 1 (1), этил-2-бром-2,2-дифторацетат (1,0 ммоль), 1-бутен (количество в таблице ниже) и Ru(bpy)3Cl2⋅6H2O (1,0 мол.% относительно этил-2-бром-2,2-дифторацетата), эфир Ганча а (1,5 ммоль), Et3N (1,0 ммоль) и DMF (5 мл) добавляли в контейнер для осуществления Ar-замещения. Полученную смесь затем перемешивали при облучении белым светом в течение 12 ч.
После реакции раствор очищали таким же образом, как и в примере 1 (1), с получением соединения 4А.
Выход и ГХ-выход приведены в таблице ниже.
[0105]
Таблица 6
[0106]
Пример 5
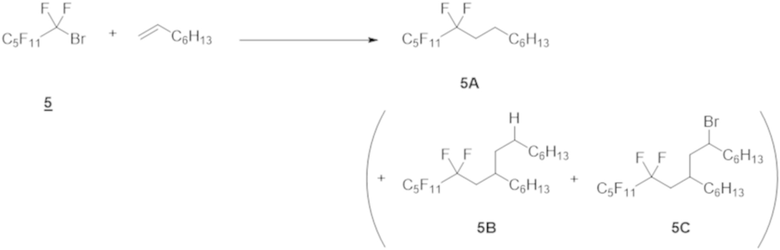
Таким же образом, как и в примере 1 (1), перфторгексилбромид 5 (1,0 ммоль), 1-октен (количество в таблице ниже) и Ru(bpy)3Cl2⋅6H2O (1 мол.% относительно перфторгексилбромида 5), эфир Ганча а (1,5 ммоль), Et3N (1,0 ммоль) и DMF (5 мл) добавляли в контейнер для осуществления Ar-замещения. Полученную смесь перемешивали при облучении белым светом в течение 12 ч.
Реакционный раствор очищали таким же образом, как и в примере 1 (1), с получением соединения 5А.
Выход и ГХ-выход приведены в таблице ниже.
Как показано в таблице ниже, при увеличении количества 1-октена с 5 молярных эквивалентов до 20 молярных эквивалентов, выход соединения 5А повышался; однако побочные продукты (соединение 5B, соединение 5C), к которым были добавлены две молекулы 1-октена, образовывались одновременно, снижая селективность соединения 5A.
Таблица 7
(5A/5B/5C)
[0107]
Пример 6

Таким же образом, как и в примере 1 (1), этилбромфторацетат (1,0 ммоль), 1-октен (5 молярных эквивалентов, 10 молярных эквивалентов или 20 молярных эквивалентов относительно этилбромфторацетата), Ru(bpy)3Cl2·6H2O (1 мол.% относительно этилбромфторацетата), эфир Ганча а (1,5 ммоль), Et3N (1,0 ммоль) и DMF (5 мл) добавляли в контейнер для осуществления Ar-замещения. Полученную смесь перемешивали при облучении белым светом в течение 12 ч.
Реакционный раствор очищали таким же образом, как и в примере 1 (1), с получением соединения 6А.
Выход и ГХ-выход приведены в таблице ниже.
Как показано в таблице, при увеличении количества 1-октена с 5 молярных эквивалентов до 20 молярных эквивалентов, выход соединения 6А повышался.
[0108]
Таблица 8
[0109]
Пример 7

Таким же образом, как и в примере 1 (1), перфторгексилйодид 7 (1,0 ммоль), 1-октен (5,0 ммоль), Ru(bpy)3Cl2·6H2O (1,0 мол.% относительно перфторгексилйодида 7), эфир Ганча а (1,5 ммоль), Et3N (0 или 2,0 ммоль) и DMF (5-10 мл) добавляли в контейнер для осуществления Ar-замещения. Полученную смесь затем перемешивали при облучении белым светом в течение 12 ч.
После реакции раствор очищали таким же образом, как и в примере 1 (1), с получением соединения 7А.
Степень конверсии в каждом случае составляла 100%.
Выход и ГХ-выход приведены в таблице ниже.
Как показано в таблице, соединение 7A получали с отличным выходом независимо от присутствия или отсутствия триэтиламина.
[0110]
Таблица 9
[0111]
Пример 8

Таким же образом, как и в примере 1 (1), перфтороктилбромид 8 (1,0 ммоль), Ru(bpy)3Cl2·6H2O (1,0 мол.% относительно перфтороктилбромида 8), 1-октен (20 ммоль), эфир Ганча а (1,5 ммоль), Et3N (0 или 2,0 ммоль) и DMF (5-10 мл) добавляли в контейнер для осуществления Ar-замещения. Полученную смесь затем перемешивали при облучении белым светом в течение 12 ч.
После реакции раствор очищали таким же образом, как и в примере 1 (1), с получением фторированного соединения 8А.
Выход показан в таблице ниже.
[0112]
Таблица 10
[0113]
Пример 9

Таким же образом, как и в примере 1 (1), (бромдифторметил)бензол (1,0 ммоль), акрилонитрил (5,0 ммоль), Ru(bpy)3Cl2⋅6H2O (1,0 мол.% относительно (бромдифторметил)бензола), эфир Ганча а (1,5 ммоль), Et3N (1,0 ммоль) и DMF (5 мл) добавляли в контейнер для осуществления Ar-замещения. Полученную смесь затем перемешивали при облучении белым светом в течение 12 ч.
После реакции раствор очищали таким же образом, как и в примере 1 (1), с получением соединения 8А.
Выход составлял 77%.
[0114]
Пример 10 (реакция 1 в проточной системе)

Этил-2-бром-2,2-дифторацетат (1,0 ммоль) подвергали реакции с 1-октеном (5,0 ммоль) в проточной системе в присутствии Ru(bpy)3Cl2⋅6H2O (1,0 мол.% относительно этил-2-бром-2,2-дифторацетата), эфира Ганча а (1,5 ммоль), Et3N (2,0 ммоль) и DMF (10 мл), с помощью оптического микрореактора (облучение белым светом (белый LED), с каналом потока (ширина: 1 мм, глубина: 300 мкм и длина: 2,35 м).
В результате получали соединение 10A с выходом 56% при времени пребывания 30 мин.
[0115]
Пример 11 (реакция 2 в проточной системе)
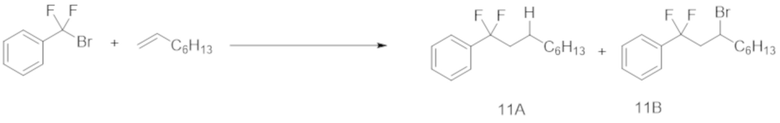
(Бромдифторметил)бензол (1,5 ммоль) подвергали реакции с 1-октеном (7,5 ммоль) в проточной системе в присутствии Ru(bpy)3Cl2⋅6H2O (1,0 мол.% относительно (бромдифторметил)бензола), эфира Ганча а (1,5 молярных эквивалента (2,25 ммоль) относительно (бромдифторметил)бензола)) и DMF (15 мл), с помощью оптического микрореактора (облучение белым светом), с каналом потока (ширина: 2 мм, глубина: 1 мм и длина: 3 м).
В результате получали соединение 10A с выходом 56% при времени пребывания 30 мин.
Степень конверсии и ГХ-выход для каждого времени пребывания показаны в таблице ниже.
[0116]
Таблица 11
(мин)
(11A/11B)
Как показано в таблице, выход повышался по мере увеличения времени пребывания. В результате той же самой реакции, осуществляемой в течение 12 ч, ГХ-выход соединения 11А составил 86% (выход: 64%). Принимая во внимание время реакции, было подтверждено, что реакция в проточной системе дает целевое вещество более эффективно, чем периодическая реакция.
[0117]
Пример 12 (реакция 3 в проточной системе)

Реакцию в проточной системе осуществляли таким же образом, как и в примере 11, за исключением того, что использовали метилакрилат вместо 1-октена в качестве субстрата.
Результаты представлены в таблице ниже.
В результате той же самой реакции, осуществляемой в течение 12 ч, ГХ-выход соединения 12А составил 90% (выход: 72%). Принимая во внимание время реакции, было подтверждено, что реакция в проточной системе дает целевое вещество более эффективно, чем периодическая реакция.
[0118]
Таблица 12
| название | год | авторы | номер документа |
|---|---|---|---|
| СУЛЬФОНАМИДНЫЕ СОЕДИНЕНИЯ, ОБЛАДАЮЩИЕ АНТАГОНИСТИЧЕСКОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ TRPM8 | 2012 |
|
RU2563030C2 |
| НОВЫЕ СОЕДИНЕНИЯ | 2016 |
|
RU2747645C2 |
| ФОТОДИНАМИЧЕСКИЕ ТИОФЕНЫ НА ОСНОВЕ МЕТАЛЛА И ИХ ПРИМЕНЕНИЕ | 2013 |
|
RU2677855C2 |
| ЭФФЕКТИВНЫЙ ПРОЦЕСС ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 6-КАРБОКСИБЕНЗОКСАЗОЛА | 2020 |
|
RU2810493C1 |
| КООРДИНАЦИОННЫЕ КОМПЛЕКСЫ НА ОСНОВЕ МЕТАЛЛОВ В КАЧЕСТВЕ ФОТОДИНАМИЧЕСКИХ СОЕДИНЕНИЙ И ИХ ПРИМЕНЕНИЕ | 2014 |
|
RU2682674C2 |
| ПРОИЗВОДНЫЕ ХИНАЗОЛИНА ИЛИ ХИНОЛИНА И ЛЕКАРСТВЕННЫЕ СРЕДСТВА НА ИХ ОСНОВЕ | 2001 |
|
RU2268260C2 |
| АЗОЛИНОВЫЕ СОЕДИНЕНИЯ, ЗАМЕЩЕННЫЕ КОНДЕНСИРОВАННОЙ КОЛЬЦЕВОЙ СИСТЕМОЙ | 2015 |
|
RU2742767C2 |
| ВЫСОКОСЕЛЕКТИВНЫЕ ПОЛИИМИДНЫЕ МЕМБРАНЫ С ПОВЫШЕННОЙ ПРОПУСКАЮЩЕЙ СПОСОБНОСТЬЮ, ПРИЧЕМ УКАЗАННЫЕ МЕМБРАНЫ ВКЛЮЧАЮТ БЛОК-СОПОЛИИМИДЫ | 2014 |
|
RU2663831C1 |
| НУКЛЕОЗИДЫ И НУКЛЕОТИДЫ С 3’-ГИДРОКСИ БЛОКИРУЮЩИМИ ГРУППАМИ И ИХ ПРИМЕНЕНИЕ В СПОСОБАХ СЕКВЕНИРОВАНИЯ ПОЛИНУКЛЕОТИДОВ | 2019 |
|
RU2818762C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ИНГИБИРОВАНИЯ ПУТИ JAK | 2011 |
|
RU2672100C2 |
Изобретение относится к усовершенствованному способу получения фторированного соединения, представленного следующей формулой (1), или производного соединения с замкнутым кольцом, где R1, RX, R2a, R2b, R2c и R2d определены в формуле изобретения,включающему взаимодействие соединения, представленного формулой (2), где Х представляет собой удаляемую группу, с соединением, представленным формулой (3), в присутствии восстановителя при облучении светом, где взаимодействие проводят в присутствии азотсодержащего ненасыщенного гетероциклического соединения, имеющего N-H фрагмент. Данное изобретение решает задачу обеспечения эффективного способа получения фторметиленсодержащего соединения.
5 з.п. ф-лы, 12 пр., 12 табл.
1. Способ получения фторированного соединения, представленного следующей формулой (1), или производного соединения с замкнутым кольцом:
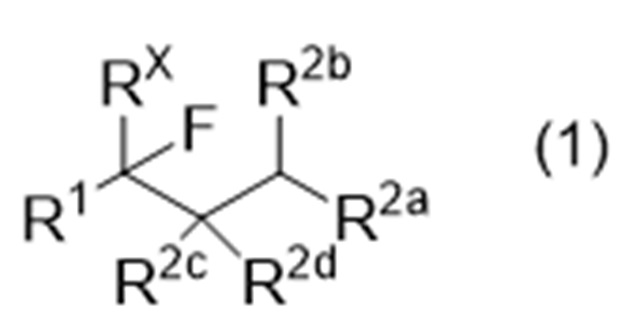
где R1 представляет собой алкил, фторалкил, алкоксикарбонил или ароматическую группу,
RX представляет собой водород или фтор,
R2a, R2b, R2c и R2d являются одинаковыми или различными, и каждый представляет собой водород, углеводород, имеющий по меньшей мере один заместитель, -O-R21 или -S-R21, или альтернативно R2b и R2c могут соединяться друг с другом с образованием связи,
где заместитель представляет собой по меньшей мере один член, выбранный из группы, состоящей из арила, гидроксила и галогена,
R21 представляет собой углеводород;
включающий взаимодействие соединения, представленного формулой (2):
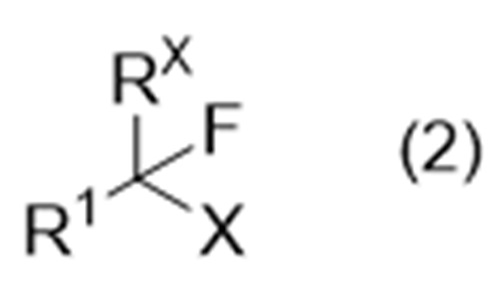
где Х представляет собой удаляемую группу, и другие символы являются такими, как определено выше,
с соединением, представленным формулой (3):
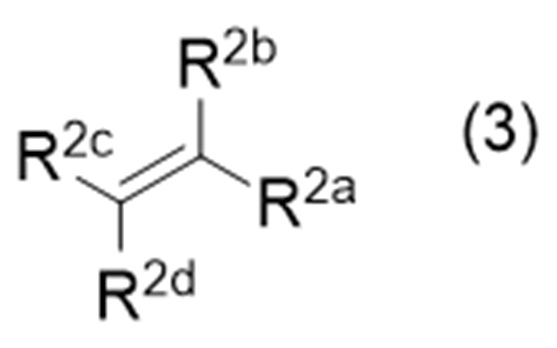 ,
,
где символы являются такими, как определено выше,
в присутствии восстановителя при облучении светом,
где взаимодействие проводят в присутствии азотсодержащего ненасыщенного гетероциклического соединения, имеющего N-H фрагмент.
2. Способ по п.1, где R2a представляет собой алкил или арил, и каждый из R2b, R2c и R2d представляет собой водород.
3. Способ по любому из пп.1, 2, где X представляет собой бром.
4. Способ по любому из пп.1-3, где восстановитель представляет собой соединение, представленное формулой (4):
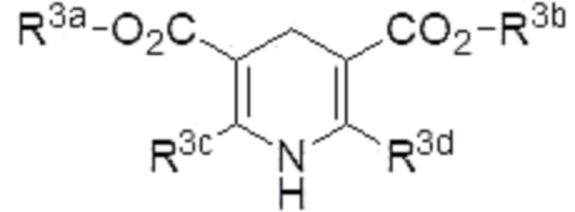 ,
,
где R3a, R3b, R3c и R3d являются одинаковыми или различными, и каждый из них представляет собой алкил.
5. Способ по любому из пп.1-4, где взаимодействие проводят в присутствии катализатора.
6. Способ по п.5, где катализатор представляет собой по меньшей мере один элемент, выбранный из группы, состоящей из комплексов переходных металлов и соединений органического красителя.
| Chunghyeon Yu et al., Selective difluoroalkylation of alkenes by using visible light photoredox catalysis, Chemical Communications, 2014, vol.50, 12884-12887 | |||
| Shuhei Sumino et al., Reductiv bromine arom-transfer reaction, Organic letters, 2013, vol.15,11, 2826-2829 | |||
| Shuhei Sumino et al., Hydroalkylation of alkenes using alkyl iodides and hantzsch |
Авторы
Даты
2021-02-12—Публикация
2017-03-08—Подача