Область техники, к которой относится изобретение
Настоящее изобретение относится к новым сульфонамидным соединениям, обладающим антагонистической активностью в отношении TRPM8, которые являются полезными в качестве лекарственного средства.
Уровень техники
Каналы транзиторного рецепторного потенциала (TRP) являются неселективными катионными каналами, которые активируются в результате воздействия различных физических (например, температура, осмолярность, механические стимулы) и химических стимулов. Подмножества суперсемейства каналов TRP термически восприимчивы, причем каждый канал активируется в своем температурном диапазоне, причем такие температурные диапазоны в совокупности простираются от вредоносного холода до вредоносного тепла. TRP меластатин 8 (TRPM8) принадлежит к меластатиновой подгруппе суперсемейства TRP каналов. TRPM8 чувствителен к низкой температуре и ментолу, и поэтому его также называют холодным ментоловым рецептором-1 (CMR-1) (см., например, непатентный документ 1). Известно, что TRPM8 стимулируется под воздействием прохладной-холодной температуры (от 8 до 28°C), а также химическими веществами, подобными ментолу и ицилину.
Рецептор TRPM8 расположен на первичных ноцицептивных нейронах (А-δ и С-волокна), и его активность модулируется вторичными сигналами, опосредованными воспалением (см., например, непатентные документы 2 и 3). Расположение TRPM8 на А-δ, а также на C-волокнах может обуславливать аномальную холодовую чувствительность в патологических состояниях, в которых эти нейроны изменяются, что приводит к боли, часто жгучего характера. Окрашивание TRPM8 с помощью иммунной метки в афферентных нейронах увеличено у крыс с хроническим сдавливающим повреждением (CCI), и в модели нейропатической боли проявляется холодовая аллодиния в задних конечностях (см., например, непатентный документ 4). Экспрессия TRPM8 в первичных фферентных нейронах увеличена в модели холодовой аллодинии, индуцированной оксалиплатиной у мышей (см., например, непатентный документ 5).
Непереносимость холода и ощущение парадоксального жжения, индуцированные химическими веществами или термическим охлаждением, являются родственными симптомами, наблюдаемыми в широком спектре клинических расстройств, и это дает разумные основания для разработки TRPM8 модуляторов с целью получения новых средств против гипералгезии или против аллодинии. TRPM8, как известно, также экспрессируется в мозге, легких, мочевом пузыре, желудочно-кишечном тракте, кровеносных сосудах, предстательной железе и иммунных клетках, что предоставляет возможность для терапевтического воздействия в широком спектре заболеваний.
В качестве TRPM8-модуляторов известны N-бензотиофенилсульфонамидные соединения (см., например, патентный документ 1), N-бензимидазолилсульфонамидные соединения (см., например, патентный документ 2), N-фенилсульфонамидные соединения, N-пиридилсульфонамидные соединения (см., например, патентный документ 3) и др. Однако нет никаких сведений о том, что TRPM8-антагонистической активностью обладает соединения, в которых имеется бициклический ароматический гетероцикл, включающий в себя пиридин, конденсированный с бензолом, или пиридин, конденсированный с моноциклическим ароматическим гетероциклом, и в которых бициклический ароматический гетероцикл связан с сульфониламиногруппой.
Патентный документ 1: публикация WO 2009/012430
Патентный документ 2: публикация WO 2010/144680
Патентный документ 3: публикация WO 2010/125831
Непатентный документ 1: D.D. McKemy и два других автора, "Identification of a cold receptor reveals a general role for TRP channels in thermosensation". Nature, 2002, т.416, №6876, с.52-58.
Непатентный документ 2: J. Abe и четыре других автора, "Ca2+-dependent PKC activation mediates menthol-induced desensitization of transient receptor potential M8", Neuroscience Letters, 2006, т.397, №1-2, с.140-144.
Непатентный документ 3: L.S. Premkumar и четыре других автора, "Downregulation of Transient Receptor Potential Melastatin 8 by Protein Kinase C-Mediated Dephosphorylation", The Journal of Neuroscience, 2005, т.25, №49, с.11322-11329.
Непатентный документ 4: H. Xing и четыре других автора, "TRPM8 Mechanism of Cold Allodynia after Chronic Nerve Injury", The Journal of Neuroscience, 2007, т.27, №50, с.13680-13690.
Непатентный документ 5: Р. Gauchan и три других автора, "Involvement of increased expression of transient receptor potential melastatin 8 in oxaliplatin-induced cold allodynia in mice", Neuroscience Letters, 2009, т.458, №2, с.93-95
Раскрытие изобретения
Задачи, решаемые в настоящем изобретении
Целью настоящего изобретения является получение новых сульфонамидных соединений, обладающих антагонистической активностью в отношении TRPM8, которые являются полезными в качестве лекарственных средств.
Решение поставленных задач
Настоящее изобретение относится к соединению формулы (I):
 ,
,
в котором кольцо A представляет собой бициклический ароматический гетероцикл, состоящий из (a) пиридина, конденсированного с бензолом; или (b) пиридина, конденсированного с моноциклическим ароматическим гетероциклом, и кольцо A связано с сульфониламиногруппой по атому углерода, расположенному рядом с атомом азота пиридинового кольца, входящего в состав кольца A,
кольцо B является (a) моноциклическим или бициклическим ароматическим углеводородом; (b) моноциклическим или бициклическим алициклическим углеводородом; (c) моноциклическим или бициклическим ароматическим гетероциклом; или (d) моноциклическим или бициклическим неароматическим гетероциклом,
кольцо C представляет собой (a) бензол; или (b) моноциклический ароматический гетероцикл,
заместитель R1 означает (a) водород; (b) необязательно замещенный алкил; (c) необязательно замещенный циклоалкил; (d) необязательно замещенную алкокси-группу; (e) необязательно замещенный фенил; (f) галоген; или (g) нитрил,
каждый R2a, R2b, R2c и R2d независимо представляет собой (a) водород; (b) необязательно замещенный алкил; (c) необязательно замещенный циклоалкил; (d) необязательно замещенную алкокси-группу; (e) необязательно замещенный фенил; (f) необязательно замещенную моноциклическую ароматическую гетероциклическую группу; (g) необязательно замещенную моноциклическую неароматическую гетероциклическую групп; (h) галоген; или (i) нитрил,
каждый R3a, R3b, R3c и R3d независимо означает (a) водород; (b) необязательно замещенный алкил; (c) необязательно замещенный циклоалкил; (d) необязательно замещенную алкокси-группу; (е) необязательно замещенную циклоалкокси-группу; (f) необязательно замещенный фенил; (g) необязательно замещенную моноциклическую ароматическую гетероциклическую группу; (h) необязательно замещенную моноциклическую неароматическую гетероциклическую группу; (i) необязательно замещенную фенокси-группу; (j) галоген; или (k) гидрокси, или
два заместителя, выбранных из группы, состоящей из R3a, R3b, R3c и R3d, объединяются вместе с образованием оксо-группы,
каждый из R5 и R6 независимо представляет собой (a) водород; (b) алкил; (c) галогеналкил; (d) циклоалкил; или (e) галогенциклоалкил, или R5 и R6 объединяются между собой при концевых группах и вместе с соседним атомом углерода образуют моноциклическую алициклическую углеводородную группу,
n означает 0, 1 или 2,
X является карбокси-группой, алкоксикарбонилом, гидроксиалкилом, необязательно замещенным аминокарбонилом или необязательно замещенным алканоилом; или его фармацевтически приемлемая соль или его пролекарство.
Эффект, достигаемый с использованием настоящего изобретения
Соединение формулы (I) демонстрирует отличную ингибирующую активность в отношении явлений, индуцированных агонистами TRPM8, а также антагонистическую активность в отношении рецептора TRPM8. Таким образом, соединение формулы (I) полезно в качестве лекарственного средства для предупреждения и лечения различных заболеваний, связанных с TRPM8 (например, хроническая боль, такая как нейропатическая боль (предпочтительно, нейропатическая боль, вызванная холодовой аллодинией или диабетической нейропатией)).
Осуществление изобретения
Ниже следуют определения каждого из терминов, использованных в настоящем изобретении.
Термин "алкил" относится к насыщенной углеводородной линейной или разветвленной цепочке, имеющей от 1 до 6 атомов углерода, и включает метил, этил, пропил, изопропил, бутил, трет-бутил, изобутил и их различные изомеры с разветвленной цепочкой. Предпочтительно алкил является углеводородной линейной или разветвленной цепочкой, имеющей от 1 до 4 атомов углерода.
Термин "алкенил" относится к ненасыщенной углеводородной линейной или разветвленной цепочке, имеющей от 2 до 6 атомов углерода и содержащей одну углерод-углеродную двойную связь, и включает винил, пропенил, бутенил и их различные изомеры с разветвленной цепочкой. Предпочтительно алкенил является ненасыщенной углеводородной линейной или разветвленной цепочкой, имеющей от 2 до 4 атомов углерода.
Термин "циклоалкил" относится к алициклическому насыщенному углеводороду, имеющему от 3 до 7 атомов углерода, и включает циклопропил, циклобутил, циклопентил или циклогексил. Предпочтительно циклоалкил является алициклическим насыщенным углеводородом, имеющим от 3 до 6 атомов углерода.
Термин "циклоалкенил" относится к алициклическому ненасыщенному углеводороду, имеющему от 3 до 7 атомов углерода и содержащему одну углерод-углеродную двойную связь, и включает циклопропенил, циклобутенил, циклопентенил или циклогексенил. Предпочтительно циклоалкенил является алициклическим ненасыщенным углеводородом, имеющим от 3 до 6 атомов углерода.
Термин "галоген" или "галогено" относится к фтору, хлору, брому и йоду, предпочтительно к хлору и фтору.
Термин "алкокси" относится к группе, в которой атом кислорода связан с алкилом, имеющим линейную или разветвленную цепочку с 1-6 атомами углерода, и включает метокси, этокси, пропокси, изопропокси, бутокси, трет-бутокси, изобутокси и их различные изомеры с разветвленной цепочкой. Предпочтительной алкоксигруппой является группа, в которой атом кислорода связан с линейной или разветвленной цепочкой насыщенного углеводорода, имеющего от 1 до 4 атомов углерода.
Термин "циклоалкокси" относится к группе, в которой атом кислорода связан с циклоалкилом, имеющим от 3 до 7 атомов углерода, и включает циклопропокси, циклобутокси, циклопентокси или циклогексокси. Предпочтительной циклоалкоксигруппой является группа, в которой атом кислорода связан с алициклическим насыщенным углеводородом, имеющим от 3 до 6 атомов углерода.
Термин "алканоил" относится к группе, в которой алкил связан с карбонилом, и включает ацетил, пропаноил, бутирил, пентаноил и их различные изомеры с разветвленной цепочкой. Предпочтительной алканоилгруппой является группа, в которой с карбонилом связана линейная или разветвленная цепочка насыщенного углеводорода из 1-4 атомов углерода.
Термины "галогеноалкил", "галогеноалкокси" и "галогеноциклоалкил" относятся к алкилу, алкокси и циклоалкилу, которые, соответственно, замещены 1-7 атомами галогена.
Термин "моноциклический или бициклический ароматический углеводород" относится к моноциклическому или бициклическому ароматическому углеводороду, имеющему от 6 до 11 атомов углерода в кольце, и включает моноциклические ароматические углеводороды, такие как бензол; и бициклические ароматические углеводороды с 9-11 атомами углерода в кольце, такие как нафталин, тетрагидронафталин, инден, индан или азулен.
Термин "моноциклический алициклический углеводород" относится к моноциклическому алициклическому углеводороду, имеющему от 3 до 7 атомов углерода в кольце, и включает циклопропан, циклобутан, циклопентан, циклопентен, циклогексан или циклогексен. Предпочтительным является моноциклический алициклический углеводород, имеющий от 3 до 6 атомов углерода в кольце.
Термин "моноциклический или бициклический алициклический углеводород" относится к моноциклическому или бициклическому алициклическому углеводороду, имеющему от 3 до 12 атомов углерода в кольце, и включает моноциклические алициклические углеводороды, имеющие от 3 до 7 атомов углерода в кольце, такие как циклопропан, циклобутан, циклопентан, циклопентен, циклогексан или циклогексен; бициклические алициклические углеводороды с 8-12 атомами углерода в кольце, такие как бициклооктан, бициклононан, бициклононен, бициклодекан, бициклодецен, спиро-октан, спиро-нонан, спиро-декан или спиро-ундекан.
Термин "моноциклический ароматический гетероцикл" относится к 5-6-членному моноциклическому ароматическому гетероциклу, содержащему атомы углерода и от 1 до 4 гетероатомов, выбранных из атома кислорода, атома серы и атома азота, и включает пиррол, фуран, тиофен, пиразол, имидазол, оксазол, изооксазол, тиазол, изотиазол, тиадиазол, пиридин, пиримидин или пиридазин.
Термин "моноциклический или бициклический ароматический гетероцикл" относится к 5-11-членному моноциклическому или бициклическому ароматическому гетероциклу, содержащему атомы углерода и от 1 до 4 гетероатомов, выбранных из атома кислорода, атома серы и атома азота, и включает 5-6-членные моноциклические ароматические гетероциклы, такие как пиррол, фуран, тиофен, пиразол, имидазол, оксазол, изооксазол, тиазол, изотиазол, тиадиазол, пиридин, пиримидин или пиридазин; 8-11-членные бициклические ароматические гетероциклы, такие как индол, индолин, изоиндолин, индазол, бензофуран, дигидробензофуран, дигидроизобензофуран, бензотиофен, дигидробензотиофен, дигидроизобензотиофен, бензооксазол, дигидробензооксазол, бензотиазол, дигидробензотиазол, хинолин, тетрагидрохинолин, изохинолин, тетрагидроизохинолин, нафтиридин, тетрагидронафтиридин, хиноксалин, тетрагидрохиноксалин или хиназолин.
Термин "моноциклический или бициклический неароматический гетероцикл" относится к 4-12-членному моноциклическому или бициклическому неароматическому гетероциклу, содержащему атомы углерода и от 1 до 4 гетероатомов, выбранных из атома кислорода, атома серы и атома азота, и включает 4-7-членные моноциклические неароматические гетероциклы, такие как пирролидин, пиперидин, тетрагидрофуран, тетрагидротиофен, дигидроизооксазол и морфолин; 8-12-членные бициклические неароматические гетероциклы, такие как октагидроиндолин, октагидробензофуран, октагидробензотиофен, декагидрохинолин, декагидроизохинолин, оксааза-спиро-нонен, оксааза-спиро-децен, оксааза-спиро-ундецен.
Термин "моноциклическая ароматическая гетероциклическая группа" относится к 5-6-членной моноциклической ароматической гетероциклической группе, содержащей атомы углерода и от 1 до 4 гетероатомов, выбранных из атома кислорода, атома серы и атома азота, и включает пирролил, фурил, тиенил, пиразолил, имидазолил, оксазолил, изооксазолил, тиазолил, изотиазолил, тиадиазолил, пиридил, пиримидил или пиридазил.
Термин "моноциклическая неароматическая гетероциклическая группа" относится к 4-7-членной моноциклической неароматической гетероциклической группе, содержащей атомы углерода и от 1 до 4 гетероатомов, выбранных из атома кислорода, атома серы и атома азота, и включает пирролидинил, пиперидинил, тетрагидрофуранил, тетрагидротиенил, дигидроизооксазолил и морфолил.
Подробные определения каждого из символов в соединениях формулы (I) приведены ниже.
Моноциклический ароматический гетероцикл в "бициклическом ароматическом гетероцикле, содержащем пиридин, конденсированный с моноциклическим ароматическим гетероциклом" из кольца A, предпочтительно представляет собой пиррол, тиофен или пиридин.
Кольцо А предпочтительно означает бициклический ароматический гетероцикл, состоящий из (a) пиридина, конденсированного с бензолом; (b) пиридина, конденсированного с пирролом; (c) пиридина, конденсированного с тиофеном; или (d) пиридина, конденсированного с пиридином, более конкретно бициклический ароматический гетероцикл, содержащий пиридин, конденсированный с бензолом, а особенно хинолин (в частности, хинолин-2-ил) или изохинолин (в частности, изохинолин-3-ил).
"Моноциклический или бициклический ароматический углеводород" из кольца В предпочтительно представляет собой бензол, нафталин, тетрагидронафталин или индан.
"Моноциклическим или бициклическим алициклическим углеводородом" из кольца B предпочтительно является циклопентан или циклогексан.
"Моноциклический или бициклический ароматический гетероцикл" из кольца B предпочтительно представляет собой тиофен, пиридин, пиримидин, индол, индазол, дигидробензофуран, дигидроизобензофуран, бензотиофен, бензооксазол, бензотиазол, хинолин или изохинолин.
"Моноциклическим или бициклическим неароматическим гетероциклом" из кольца B предпочтительно является пиперидин или оксааза-спиро-децен.
Кольцо B предпочтительно является (a) моноциклическим или бициклическим ароматическим углеводородом; или (b) моноциклическим или бициклическим ароматическим гетероциклом, более конкретно бензолом, нафталином, тетрагидронафталином, инданом, тиофеном, пиридином, пиримидином, индолом, индазолом, дигидробензофураном, дигидроизобензофураном, бензотиофеном, бензооксазолом, бензотиазолом, хинолином или изохинолином, более предпочтительно бензолом, нафталином, тетрагидронафталином, инданом, тиофеном, пиридином, индолом или бензотиофеном, в частности бензолом, нафталином (в частности, нафталин-2-илом), тетрагидронафталином (в частности, 1,2,3,4-тетрагидронафталин-6-илом), инданом (в частности, индан-1-илом или индан-5-илом), пиридином (в частности, пиридин-2-илом) или бензотиофеном (в частности, бензотиофен-2-илом).
"Моноциклический ароматический гетероцикл" из кольца C предпочтительно представляет собой тиофен или пиридин.
Кольцо C предпочтительно является бензолом, тиофеном или пиридином, в частности бензолом.
Количество заместителей в "необязательно замещенном алкиле" из R1 может составлять один или несколько (например, от 1 до 7), причем такие заместители могут быть одинаковыми или различными. В качестве указанных заместителей могут быть упомянуты, например, циклоалкил, алкокси, галоген, оксо и гидрокси.
Количество заместителей в "необязательно замещенном циклоалкиле" из R1 может составлять один или несколько (например, от 1 до 7), причем такие заместители могут быть одинаковыми или различными. В качестве указанных заместителей могут быть упомянуты, например, алкил, алкокси и галоген.
Количество заместителей в "необязательно замещенной алкокси-группе" из R1 может составлять один или несколько (например, от 1 до 7), причем такие заместители могут быть одинаковыми или различными. В качестве указанных заместителей могут быть упомянуты, например, циклоалкил, алкокси, галоген и гидрокси.
Количество заместителей в "необязательно замещенном фениле" из R1 может составлять один или несколько (например, от 1 до 3), причем такие заместители могут быть одинаковыми или различными. В качестве указанных заместителей могут быть упомянуты, например, алкил, галогеноалкил, циклоалкил, галогеноциклоалкил, алкокси, галогеноалкокси и галоген.
Заместитель R1 предпочтительно является (a) водородом; (b) необязательно замещенным алкилом; (c) необязательно замещенным циклоалкилом; (d) необязательно замещенной алкокси-группой; или (e) галогеном. Более предпочтительно R1 представляет собой (a) водород; (b) C1-С6-алкил, необязательно замещенный 1-7 группами, выбранными из галогена, оксо- и гидрокси-; (c) C3-C7-циклоалкил; (d) C1-C6-алкокси-; или (e) галоген, и особенно предпочтительными являются водород, метил, трифторметил, этил, оксоэтил, гидроксиэтил, изопропил, циклопропил, метокси, хлор или бром. В частности, предпочтительными являются (a) C1-C6 алкил, необязательно замещенный 1-7 атомами галогена; (b) C3-C7 циклоалкил; (c) C1-C6 алкокси; или (d) галоген, и особенно предпочтительными являются метил, трифторметил, изопропил, циклопропилил и метокси. Более предпочтительными заместителями являются метил, трифторметил или циклопропил.
Количество заместителей в каждом "необязательно замещенном алкиле" из R2a, R2b, R2c или R2d может составлять один или несколько (например, от 1 до 7), причем такие заместители могут быть одинаковыми или различными. В качестве указанных заместителей могут быть упомянуты, например, алкокси, циклоалкил, галоген, оксо и гидрокси.
Количество заместителей в каждом "необязательно замещенном циклоалкиле" из R2a, R2b, R2c или R2d может составлять один или несколько (например, от 1 до 7), причем такие заместители могут быть одинаковыми или различными. В качестве указанных заместителей могут быть упомянуты, например, алкил, алкокси и галоген.
Количество заместителей в каждой "необязательно замещенной алкокси-группе" из R2a, R2b, R2c или R2d может составлять один или несколько (например, от 1 до 7), причем такие заместители могут быть одинаковыми или различными. В качестве указанных заместителей могут быть упомянуты, например, алкокси, циклоалкил и галоген.
Количество заместителей в каждом "необязательно замещенном фениле" из R2a, R2b, R2c или R2d может составлять один или несколько (например, от 1 до 3), причем такие заместители могут быть одинаковыми или различными. В качестве указанных заместителей могут быть упомянуты, например, алкил, галогеноалкил, циклоалкил, галогеноциклоалкил, алкокси, галогеноалкокси и галоген.
Количество заместителей в каждой "необязательно замещенной моноциклической ароматической гетероциклической группе" из R2a, R2b, R2c или R2d может составлять один или несколько (например, от 1 до 3), причем такие заместители могут быть одинаковыми или различными. В качестве указанных заместителей могут быть упомянуты, например, алкил, галогеноалкил, циклоалкил, галогеноциклоалкил, алкокси, галогеноалкокси и галоген.
Количество заместителей в каждой "необязательно замещенной моноциклической неароматической гетероциклической группе" из R2a, R2b, R2c или R2d может составлять один или несколько (например, от 1 до 3), причем такие заместители могут быть одинаковыми или различными. В качестве указанных заместителей могут быть упомянуты, например, алкил, галогеноалкил, циклоалкил, галогеноциклоалкил, алкокси, галогеноалкокси и галоген.
Каждый из R2a, R2b и R2c независимо и предпочтительно представляет собой: (a) водород; (b) необязательно замещенный алкил; (c) необязательно замещенный циклоалкил; или (d) галоген. Более предпочтительно они представляют собой (a) водород; (b) C1-С6-алкил; (c) С3-С7-циклоалкил; или (d) галоген, и более предпочтительно - водород, метил, циклопропил или хлор. В частности, предпочтительным является водород.
Предпочтительно R2d представляет собой (a) водород; (c) необязательно замещенный алкил; (c) необязательно замещенный циклоалкил; (d) необязательно замещенную алкокси-группу; (е) необязательно замещенный фенил; (f) необязательно замещенную моноциклическую ароматическую гетероциклическую группу; (g) необязательно замещенную моноциклическую неароматическую гетероциклическую группу; или (h) галоген. Более предпочтительным заместителем является (а) водород; (b) C1-С6-алкил, необязательно замещенный 1-7 группами, выбранными из C1-С6 алкокси, галогена и гидрокси; (с) С3-С7 циклоалкил; (d) C1-С6 алкокси; (e) фенил; (f) 5-6-членная моноциклическая ароматическая гетероциклическая группа; (g) моноциклическая неароматическая гетероциклическая группа; или (h) галоген, и более предпочтительными являются водород, метил, трифторметил, метоксиметил, этил, гидроксиэтил, пропил, изопропил, циклопропил, циклопентил, метокси, этокси, изопропокси, фенил, пиридил, пирролидил, фтор, хлор или бром. В частности, предпочтительными являются (а) водород; (b) C1-С6 алкил; (с) С3-С7 циклоалкил; или (d) C1-С6 алкокси-группа, и более предпочтительными являются водород, метил, этил, изопропил, циклопропил, циклопентил, метокси или этокси. Более предпочтительным заместителем является водород, изопропил или циклопропил.
Количество заместителей в "необязательно замещенном алкиле" из R3a, R3b, R3c или R3d может составлять один или несколько (например, от 1 до 7), причем такие заместители могут быть одинаковыми или различными. В качестве указанных заместителей могут быть упомянуты, например, циклоалкил, галогеноциклоалкил (где каждый циклоалкил и галогеноциклоалкил может быть независимо и необязательно замещен 1-3 группами, выбранными из алкила и галогеноалкила), алкокси, галогеноалкокси, фенил, моноциклическая ароматическая гетероциклическая группа, моноциклическая неароматическая гетероциклическая группа (где каждый фенил, ароматическая гетероциклическая группа и неароматическая гетероциклическая группа могут быть независимо и необязательно замещены 1-3 группами, выбранными из алкила, галогеноалкила, циклоалкила, галогеноциклоалкила, алкокси, галогеноалкокси и галогена), галоген, оксо и гидрокси.
Количество заместителей в каждом "необязательно замещенном циклоалкиле" из R3a, R3b, R3c или R3d может составлять один или несколько (например, от 1 до 7), причем такие заместители могут быть одинаковыми или различными. В качестве указанных заместителей могут быть упомянуты, например, алкил, галогеноалкил, алкокси, галогеноалкокси, галоген и гидрокси.
Количество заместителей в каждой "необязательно замещенной алкокси-группе" из R3a, R3b, R3c или R3d может составлять один или несколько (например, от 1 до 7), причем такие заместители могут быть одинаковыми или различными. В качестве указанных заместителей могут быть упомянуты, например, циклоалкил, галогеноциклоалкил (где каждый циклоалкил и галогеноциклоалкил может быть независимо и необязательно замещен 1-3 группами, выбранными из алкила и галогеноалкила), алкокси, галогеноалкокси, фенил, моноциклическая ароматическая гетероциклическая группа, моноциклическая неароматическая гетероциклическая группа (где каждый фенил, ароматическая гетероциклическая группа и неароматическая гетероциклическая группа независимо может быть необязательно замещена 1-3 группами, выбранными из алкила, галогеноалкила, циклоалкила, галогеноциклоалкила, алкокси, галогеноалкокси и галогена), галоген и гидрокси.
Количество заместителей в каждой "необязательно замещенной циклоалкокси-группе" из R3a, R3b, R3c или R3d может составлять один или несколько (например, от 1 до 7), причем такие заместители могут быть одинаковыми или различными. В качестве указанных заместителей могут быть упомянуты, например, алкил, галогеноалкил, алкокси, галогеноалкокси, галоген и гидрокси.
Количество заместителей в каждом "необязательно замещенном фениле" из R3a, R3b, R3c или R3d может составлять один или несколько (например, от 1 до 3), причем такие заместители могут быть одинаковыми или различными. В качестве указанных заместителей могут быть упомянуты, например, алкил, галогеноалкил, циклоалкил, галогеноциклоалкил, алкокси, галогеноалкокси и галоген.
Количество заместителей в каждой "необязательно замещенной моноциклической ароматической гетероциклической группе" из R3a, R3b, R3c или R3d может составлять один или несколько (например, от 1 до 3), причем такие заместители могут быть одинаковыми или различными. В качестве указанных заместителей могут быть упомянуты, например, алкил, галогеноалкил, циклоалкил, галогеноциклоалкил, алкокси, галогеноалкокси и галоген.
Количество заместителей в каждой "необязательно замещенной моноциклической неароматической гетероциклической группе" из R3a, R3b, R3c или R3d может составлять один или несколько (например, от 1 до 3), причем такие заместители могут быть одинаковыми или различными. В качестве указанных заместителей могут быть упомянуты, например, алкил, галогеноалкил, циклоалкил, галогеноциклоалкил, алкокси, галогеноалкокси и галоген.
Количество заместителей в каждой "необязательно замещенной фенокси-группе" из R3a, R3b, R3c или R3d может составлять один или несколько (например, от 1 до 3), причем такие заместители могут быть одинаковыми или различными. В качестве указанных заместителей могут быть упомянуты, например, алкил, галогеноалкил, циклоалкил, галогеноциклоалкил, алкокси, галогеноалкокси и галоген.
Каждый заместитель R3a, R3b, R3c и R3d независимо и предпочтительно представляет собой (а) водород; (b) необязательно замещенный алкил; (с) необязательно замещенный циклоалкил; (d) необязательно замещенную алкокси-группу; (е) необязательно замещенную циклоалкокси; (f) необязательно замещенный фенил; (g) необязательно замещенную моноциклическую ароматическую гетероциклическую группу; (h) необязательно замещенную фенокси-группу; (i) галоген; или (j) гидрокси. Более предпочтительными вариантами являются (а) водород; (b) C1-С6 алкил, необязательно замещенный 1-7 группами, выбранными из С3-С7 циклоалкила (где циклоалкил может быть необязательно замещен 1-3 группами, выбранными из C1-С6 алкила и C1-С6 галогеноалкила), C1-С6 алкокси, C1-С6 галогеноалкокси, галогена и гидрокси; (с) С3-С7 циклоалкил, необязательно замещенный 1-7 группами, выбранными из С1-С6 алкила, C1-С6 галогеноалкила и галогена; (d) C1-С6 алкокси-группа, необязательно замещенная 1-7 группами, выбранными из С3-С7 циклоалкила, C1-С6 алкокси, C1-С6 галогеноалкокси и галогена; (е) С3-С7 циклоалкокси; (f) фенил, необязательно замещенный 1-3 галогенами; (g) 5-6-членная моноциклическая ароматическая гетероциклическая группа; (h) фенокси-группа; (i) галоген; или (j) гидрокси, и в частности предпочтительными являются (а) водород; (b) C1-С6 алкил, необязательно замещенный 1-7 группами, выбранными из С3-С7 циклоалкила (где циклоалкил необязательно может быть замещен 1-3 группами, выбранными из C1-С6 алкила и C1-С6 галогеноалкила), C1-С6 алкокси, C1-C6 галогеноалкокси и галогена; (с) С3-С7 циклоалкил, необязательно замещенный 1-7 группами, выбранными из C1-С6 алкила, C1-С6 галогеноалкила и галогена; (d) C1-С6 алкокси-группа, необязательно замещенная 1-7 группами, выбранными из С3-С7 циклоалкила, С1-С6 алкокси, С1-С6 галогеноалкокси и галогена; или (е) галоген.
Каждый R5 и R6 независимо и предпочтительно представляет собой водород или алкил, в частности водород.
n предпочтительно означает 0 или 1.
Количество заместителей в "необязательно замещенном аминокарбониле" из Х может быть равно 1. В качестве указанного заместителя могут быть упомянуты, например, алкил, алкокси и нитрил.
Количество заместителей в "необязательно замещенном алканоиле" из Х может составлять один или несколько (например, от 1 до 3), причем такие заместители могут быть одинаковыми или различными. В качестве указанных заместителей может быть упомянут, например, галоген.
Х предпочтительно представляет собой (а) карбокси-группу; (b) C1-С6-алкоксикарбонил; (с) гидроксиалкил-С1-С6; (d) аминокарбонил, в котором атом азота необязательно может быть замещен одной группой, выбранной из C1-С6 алкила, C1-С6-алкокси и нитрила; (е) С3-С7 алканоил, необязательно замещенный 1-3 атомами галогена. В частности предпочтительными являются (а) карбокси- или (b) аминокарбонил, в котором атом азота необязательно может быть замещен одной группой, выбранной из C1-С6 алкила, C1-С6 алкокси и нитрила, и особенно предпочтительной является карбокси-группа.
Фармацевтически приемлемые соли соединений формулы (I) включают соли щелочных металлов: лития, натрия, калия и др.; соли металлов Ни группы: кальция, магния, и др.; соли цинка или алюминия; соли аминов, таких как аммиак, холин, диэтаноламин, лизин, этилендиамин, трет-бутиламин, трет-октиламин, трис(гидроксиметил)аминометан, N-метилглюкозамин, триэтаноламин, дегидроабиетиламин; соли неорганических кислот, таких как хлористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота; соль органической кислоты, такой как муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, винная кислота, лимонная кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота; или соли аминокислот, таких как аспарагиновая кислота, глутаминовая кислота.
Фармацевтически приемлемые соли соединений формулы (I) включают внутримолекулярные соли, их гидраты и сольваты.
Термин "пролекарство" относится к соединению, которое в организме превращается в оказывающую фармакологическое воздействие активную форму, например путем гидролиза в крови. Примеры фармацевтически приемлемых пролекарств описаны в литературе [Т. Higuchi и V. Stella, Prodrugs as Novel Drug Delivery Systems, "Bioreversible Carriers in Drug Design", под ред. Edward В. Roche, American Pharmaceutical Association and Pergamon Press, A.C.S. Symposium Series, т.14, (1987); и D. Fleisher, R. Bong и В.Н. Stewart, "Improved oral drug delivery: Solubility limitations overcome by the use of prodrugs". Advanced Drug Delivery Reviews (1996) 19(2): 115-130]. Пролекарства в тех случаях, когда соединение формулы (I) представляет собой карбоновую кислоту, включают сложные эфиры, такие как метиловый эфир, этиловый эфир, двойной эфир.
Соединение по настоящему изобретению необязательно может иметь один или несколько асимметричных атомов углерода в составе одной из замещающих групп. Соединение формулы (I) может существовать в виде энантиомера, диастереомера, или их смеси. Соединение по настоящему изобретению включает как смеси стереоизомеров, так и чистые или практически чистые изомеров. Соединение формулы (I), полученное в виде диастереомера или энантиомера, можно выделить с использованием традиционных методов, известных из уровня техники, например хроматографии или фракционной кристаллизации.
В предпочтительном варианте осуществления настоящего изобретения R1 означает (а) водород; (b) C1-С6алкил, необязательно замещенный 1-7 группами, выбранными из С3-С7 циклоалкила, C1-С6 алкокси, галогена, оксо и гидрокси; (с) С3-C7 циклоалкил, необязательно замещенный 1-7 группами, выбранными из C1-С6 алкила, C1-С6 алкокси и галогена; (d) C1-С6 алкокси-группу, необязательно замещенную 1-7 группами, выбранными из С3-С7 циклоалкила, C1-С6 алкокси, галогена и гидрокси; (е) фенил, необязательно замещенный 1-3 группами, выбранными из C1-С6 алкила, C1-С6 галогеноалкила, С3-С7 циклоалкила, С3-С7 галогеноциклоалкила, C1-С6 алкокси, C1-С6 галогеноалкокси и галогена; (f) галоген; или (g) нитрил.
Каждый R2a, R2b, R2c и R2d независимо представляет собой (а) водород; (b) C1-С6 алкил, необязательно замещенный 1-7 группами, выбранными из C1-С6 алкокси, С3-С7 циклоалкила, галогена, оксо и гидрокси; (с) С3-С7 циклоалкил, необязательно замещенный 1-7 группами, выбранными из C1-С6 алкила, C1-С6 алкокси и галогена; (d) C1-С6 алкокси-группу, необязательно замещенную 1-7 группами, выбранными из C1-С6 алкокси, С3-С7 циклоалкила и галогена; (е) фенил, необязательно замещенный 1-3 группами, выбранными из C1-С6 алкила, C1-С6 галогеноалкила, С3-С7 циклоалкила, С3-С7 галогеноциклоалкила, C1-С6 алкокси, C1-С6 галогеноалкокси и галогена; (f) 5-6-членную моноциклическую ароматическую гетероциклическую группу, необязательно замещенную 1-3 группами, выбранными из C1-С6 алкила, C1-С6 галогеноалкила, С3-С7 циклоалкила, С3-С7 галогеноциклоалкила, C1-С6 алкокси, C1-С6 галогеноалкокси и галогена; (g) 4-7-членную моноциклическую неароматическую гетероциклическую группу, необязательно замещенную 1-3 группами, выбранными из C1-С6 алкила, C1-С6 галогеноалкила, С3-С7 циклоалкила, С3-С7 галогеноциклоалкила, C1-С6 алкокси, C1-С6 галогеноалкокси и галогена; (h) галоген; или (i) нитрил,
Каждый R3a, R3b, R3c и R3d независимо означает (а) водород; (b) C1-С6 алкил, необязательно замещенный 1-7 группами, выбранными из С3-С7 циклоалкила, С3-С7 галогеноциклоалкила (где каждый циклоалкил и галогеноциклоалкил может быть независимо и необязательно замещен 1-3 группами, выбранными из C1-С6 алкила и C1-С6 галогеноалкила), C1-С6 алкокси, C1-С6 галогеноалкокси, фенила, 5-6-членной моноциклической ароматической гетероциклической группу, 4-7-членной моноциклической неароматической гетероциклической группы (где каждый фенил, ароматическая гетероциклическая группа и неароматическая гетероциклическая группа могут быть независимо и необязательно замещены 1-3 группами, выбранными из C1-С6 алкила, C1-С6 галогеноалкила, С3-С7 циклоалкила, С3-С7 галогеноциклоалкила, C1-С6 алкокси, C1-С6 галогеноалкокси и галогена), галогена, оксо и гидрокси; (с) С3-С7 циклоалкил, необязательно замещенный 1-7 группами, выбранными из С1-С6 алкила, C1-С6 галогеноалкила, C1-С6 алкокси, C1-С6 галогеноалкокси, галогена и гидрокси; (d) C1-С6 алкокси-группу, необязательно замещенную 1-7 группами, выбранными из С3-С7 циклоалкила, С3-С7 галогеноциклоалкила (где каждый циклоалкил и галогеноциклоалкил может быть независимо и необязательно замещен 1-3 группами, выбранными из C1-С6 алкила и C1-С6 галогеноалкила), C1-С6 алкокси, C1-С6 галогеноалкокси, фенила, 5-6-членной моноциклической ароматической гетероциклической группы, 4-7-членной моноциклической неароматической гетероциклической группы (где каждый фенил, ароматическая гетероциклическая групп и неароматическая гетероциклическая группа могут быть независимо и необязательно замещены 1-3 группами, выбранными из C1-С6 алкила, C1-С6 галогеноалкила, С3-С7 циклоалкила, С3-С7 галогеноциклоалкила, C1-С6 алкокси, C1-С6 галогеноалкокси и галогена), галоген и гидрокси; (е) С3-С7 циклоалкокси-группу, необязательно замещенную 1-7 группами, выбранными из C1-С6 алкила, C1-С6 галогеноалкила, C1-С6 алкокси, C1-С6 галогеноалкокси, галогена и гидрокси; (f) фенил, необязательно замещенный 1-3 группами, выбранными из C1-С6 алкила, C1-С6 галогеноалкила, С3-C7 циклоалкила, С3-С7 галогеноциклоалкила, C1-С6 алкокси, C1-С6 галогеноалкокси и галогена; (g) 5-6-членную моноциклическую ароматическую гетероциклическую группу, необязательно замещенную 1-3 группами, выбранными из C1-С6 алкила, C1-С6 галогеноалкила, С3-С7 циклоалкила, С3-С7 галогеноциклоалкила, C1-С6 алкокси, C1-С6 галогеноалкокси и галогена; (h) 4-7-членную моноциклическую неароматическую гетероциклическую группу, необязательно замещенную 1-3 группами, выбранными из C1-С6 алкила, C1-С6 галогеноалкила, С3-С7 циклоалкила, С3-С7 галогеноциклоалкила, C1-С6 алкокси, C1-С6 галогеноалкокси и галогена; (i) фенокси-группу, необязательно замещенную 1-3 группами, выбранными из C1-С6 алкила, C1-С6 галогеноалкила, С3-C7 циклоалкила, С3-С7 галогеноциклоалкила, C1-С6 алкокси, C1-С6 галогеноалкокси и галогена; (j) галоген; или (k) гидрокси, или две группы из R3a, R3b, R3c и R3d объединяются вместе с образованием оксо-группы,
Каждый R5 и R6 независимо представляет собой (а) водород; (b) C1-С6 алкил; (с) C1-С6 галогеноалкил; (d) С3-С7 циклоалкил; или (е) С3-С7 галогеноциклоалкил, или R5 и R6 объединяются друг с другом у концевых групп и вместе с соседним атомом углерода образуют 3-7-членный алициклический моноциклический углеводород,
Х означает (а) карбокси; (b) C1-С6 алкоксикарбонил; (с) гидроксиалкил C1-С6; (d) аминокарбонил, в котором атом азота необязательно замещен одной группой, выбранной из C1-С6 алкила, C1-С6 алкокси и нитрила; или (е) С2-С7 алканоил, необязательно замещенный 1-3 атомами галогена.
В другом предпочтительном варианте осуществления настоящего изобретения кольцо А является хинолином, изохинолином или пирролопиридином.
В другом дополнительном предпочтительном варианте осуществления настоящего изобретения соединение по настоящему изобретению представлено следующей формулой (I-A):
 ,
,
где группа формулы:

является бициклическим ароматическим гетероциклом, состоящим из пиридина, конденсированного с: (а) бензолом или (b) моноциклическим ароматическим гетероциклом (где один из Y и Z означает CR2d, а другой является химической связью), и остальные символы имеют указанные выше значения. В этом варианте осуществления группа формулы:

предпочтительно является группой формулы:

где символы имеют указанные выше значения.
В другом предпочтительном варианте осуществления настоящего изобретения кольцо С является бензолом, а Х означает карбокси-группу и связан с кольцом С в положении 4 по аминосульфонильной группе.
В другом предпочтительном варианте осуществления настоящего изобретения соединение по настоящему изобретению представлено следующей формулой (I-B):

где символы имеют указанные выше значения.
В другом предпочтительном варианте осуществления настоящего изобретения кольцо A, R1, R2a, R2b, R2c и R2d представлены следующей формулой:

где символы имеют указанные выше значения.
В другом предпочтительном варианте осуществления настоящего изобретения кольцо В представляет собой (а) моноциклический или бициклический ароматический углеводород; или (b) моноциклический или бициклический ароматический гетероцикл, и n равно 0 или 1. Более предпочтительно кольцо В означает бензол, нафталин, тетрагидронафталин, индан, пиридин, индол, дигидробензофуран, дигидроизобензофуран или бензотиофен, особенно бензол, нафталин (в частности, нафталин-2-ил), тетрагидронафталин (в частности, 1,2,3,4-тетрагидронафталин-6-ил), индан (в частности, индан-1-ил или индан-5-ил), пиридин (в частности, пиридин-2-ил) или бензотиофен (в частности, бензотиофен-2-ил).
В этом варианте осуществления предпочтительная частичная структура формулы:

является группой формулы (А):

где символы имеют указанные выше значения.
В другом предпочтительном варианте осуществления частичная структура формулы:

является группой формулы (В):

где символы имеют указанные выше значения.
В другом предпочтительном варианте осуществления настоящего изобретения R1 представляет собой (а) C1-С6 алкил, необязательно замещенный 1-7 атомами галогена; (b) С3-С7 циклоалкил; (с) C1-С6 алкокси или (d) галоген,
R2a, R2b и R2c означают водород,
R2d означает (а) водород; (b) C1-С6 алкил, необязательно замещенный 1-7 атомами галогена; (с) С3-С7 циклоалкил; или (d) C1-С6 алкокси,
каждый R3a и R3b независимо представляет собой (а) водород; (b) C1-С6 алкил, необязательно замещенный 1-7 группами, выбранными из С3-С7 циклоалкила (где циклоалкил необязательно может быть замещен 1-3 группами, выбранными из C1-С6 алкила и C1-С6 галогеноалкила), C1-С6 алкокси, C1-C6 галогеноалкокси, и галогена; (с) С3-С7 циклоалкил, необязательно замещенный 1-7 группами, выбранными из C1-С6 алкила, С1-С6 галогеноалкила и галогена; (d) C1-С6 алкокси-группу, необязательно замещенную 1-7 группами, выбранными из С3-С7 циклоалкила, C1-С6 алкокси, C1-С6 галогеноалкокси и галогена; или (е) галоген,
R3c и R3d означают водород,
R5 и R6 означают водород,
n равно 1.
В другом предпочтительном варианте осуществления настоящего изобретения частичная структура формулы:

является группой формулы (С):

где p означает 1 или 2, и другие символы имеют указанные выше значения,
R1 представляет собой (а) C1-С6 алкил, необязательно замещенный 1-7 атомами галогена; (b) С3-С7 циклоалкил; (с) C1-С6 алкокси; или (d) галоген,
R2a, R2b и R2c означают водород,
R2d означает (а) водород; (b) C1-С6 алкил, необязательно замещенный 1-7 атомами галогена; (с) С3-С7 циклоалкил; или (d) С1-С6 алкокси,
каждый R3a и R3b независимо представляет собой (а) водород; (b) C1-С6 алкил, необязательно замещенный 1-7 группами, выбранными из С3-С7 циклоалкила (где циклоалкил необязательно может быть замещен 1-3 группами, выбранными из C1-С6 алкила и C1-С6 галогеноалкила), C1-С6 алкокси, C1-С6 галогеноалкокси, и галогена; (с) С3-С7 циклоалкил, необязательно замещенный 1-7 группами, выбранными из C1-С6 алкила, С1-С6 галогеноалкила, и галогена; (d) C1-С6 алкокси-группу, необязательно замещенную 1-7 группами, выбранных из С3-С7 циклоалкил, C1-С6 алкокси, C1-С6 галогеноалкокси, и галогена; или (е) галоген.
В другом предпочтительном варианте осуществления настоящего изобретения частичная структура формулы (А):

является следующей частичной структурой формулы (A-I):
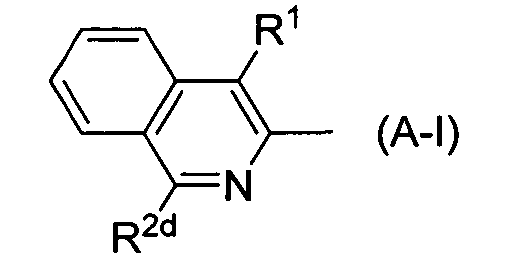
где символы имеют указанные выше значения,
кольцо В является бензолом или пиридином (в частности, пиридин-2-илом),
R1 означает метил, трифторметил, изопропил, циклопропил или метокси,
R2d представляет собой (а) водород; (b) C1-С6 алкил, необязательно замещенный 1-7 атомами галогена; (с) С3-С7 циклоалкил; или (d) C1-С6алкокси,
каждый R3a и R3b независимо означает (а) водород; (b) C1-С6 алкил, необязательно замещенный 1-7 группами, выбранными из С3-С7 циклоалкила (где циклоалкил необязательно может быть замещен 1-3 группами, выбранными из C1-С6 алкила и C1-С6 галогеноалкила), C1-С6 алкокси, C1-С6 галогеноалкокси, и галогена; (с) С3-C7 циклоалкил; (d) C1-С6 алкокси-группу, необязательно замещенную 1-7 атомами галогена; или (е) галоген,
R3c и R3d означают водород,
R5 и R6 означают водород,
n равно 1.
В этом варианте осуществления предпочтительная частичная структура формулы (А):

является следующей частичной структурой формулы (A-II):

кольцо В является бензолом или пиридином (в частности, пиридин-2-илом),
каждый R3a и R3b независимо представляет собой (а) водород; (b) С1-С6 алкил, необязательно замещенный 1-7 группами, выбранными из С3-С7 циклоалкила (где циклоалкил необязательно может быть замещен 1-3 группами, выбранными из C1-С6 алкила и C1-С6 галогеноалкила), C1-С6 алкокси, C1-С6 галогеноалкокси, и галогена; (с) С3-С7 циклоалкил; (d) C1-С6 алкокси-группу, необязательно замещенную 1-7 атомами галогена; или (е) галоген,
R3c и R3d означает водород,
R5 и R6 означает водород,
n равно 1.
Более предпочтительно в этом варианте осуществления каждый R3a и R3b независимо представляет собой (а) водород; (b) C1-С6 алкил, необязательно замещенный 1-7 группами, выбранными из С3-С7 циклоалкила и галогена; (с) C1-С6 алкокси-группу, необязательно замещенную 1-7 атомами галогена; или (е) галоген.
В другом предпочтительном варианте осуществления настоящего изобретения предпочтительная частичная структура формулы (А):

является следующей частичной структурой формулы (A-III):

кольцо В означает бензол,
каждый R3a и R3b независимо представляет собой (а) водород; (b) C1-С6 алкил, необязательно замещенный 1-7 группами, выбранными из С3-С7 циклоалкила (где циклоалкил необязательно может быть замещен 1-3 группами, выбранными из C1-С6 алкила и C1-С6 галогеноалкила), C1-С6 алкокси, C1-С6 галогеноалкокси, и галогена; (с) С3-С7 циклоалкил; (d) C1-С6 алкокси-группу, необязательно замещенную 1-7 атомами галогена; или (е) галоген,
R3c и R3d означают водород,
R5 и R6 означают водород,
n равно 1.
Более предпочтительно в этом варианте осуществления каждый R3a и R3b независимо означает (а) водород; (b) C1-С6 алкил, необязательно замещенный 1-7 группами, выбранными из С3-С7 циклоалкила и галогена; (с) C1-С6 алкокси-группу, необязательно замещенную 1-7 атомами галогена; или (е) галоген.
В другом предпочтительном варианте осуществления настоящего изобретения предпочтительная частичная структура формулы (А):

является следующей частичной структурой формулы (A-IV):

где Me является метилом, а остальные символы имеют указанные выше значения,
кольцо В означает бензол,
R2d означает (а) водород; (b) C1-С6 алкил, необязательно замещенный 1-7 атомами галогена; или (с) С3-С7 циклоалкил,
каждый R3a и R3b независимо представляет собой (а) водород; (b) C1-С6 алкил, необязательно замещенный 1-7 группами, выбранными из С3-С7 циклоалкила (где циклоалкил необязательно может быть замещен 1-3 группами, выбранными из C1-С6 алкила и C1-С6 галогеноалкила), C1-С6 алкокси, C1-С6 галогеноалкокси и галогена; (с) С3-С7 циклоалкил; (d) C1-С6 алкокси-группу, необязательно замещенную 1-7 атомами галогена; или (е) галоген,
R3c и R3d означает водород,
R5 и R6 означает водород,
n равно 1.
Более предпочтительно в этом варианте осуществления R2d является водородом, изопропилом или циклопропилом,
каждый R3a и R3b независимо представляет собой (а) водород; (b) C1-С6 алкил, необязательно замещенный 1-7 группами, выбранными из С3-С7 циклоалкила и галогена; (с) C1-С6 алкокси-группу, необязательно замещенную 1-7 атомами галогена; или (е) галоген.
В другом предпочтительном варианте осуществления настоящего изобретения предпочтительная частичная структура формулы (А):

является следующей частичной структурой формулы (A-V):

где символы имеют указанные выше значения,
кольцо В означает бензол,
R1 означает изопропил или метокси,
каждый R3a и R3b независимо представляет собой (а) водород; (b) C1-С6 алкил, необязательно замещенный 1-7 группами, выбранными из С3-С7 циклоалкила (где циклоалкил необязательно может быть замещен 1-3 группами, выбранными из C1-С6 алкила и C1-С6 галогеноалкила), C1-С6 алкокси, C1-С6 галогеноалкокси, и галогена; (с) С3-С7 циклоалкил; (d) C1-С6 алкокси-группу, необязательно замещенную 1-7 атомами галогена; или (е) галоген,
R3c и R3d означает водород,
R5 и R6 означает водород,
n равно 1.
Более предпочтительно в этом варианте осуществления каждый R3a и R3b независимо представляет собой (а) водород; (b) C1-С6 алкил, необязательно замещенный 1-7 группами, выбранными из С3-С7 циклоалкила и галогена; (с) C1-С6 алкокси-группу, необязательно замещенную 1-7 атомами галогена; или (е) галоген.
В другом предпочтительном варианте осуществления настоящего изобретения предпочтительная частичная структура формулы:

является группой формулы (D):

где символы имеют указанные выше значения,
каждый R3a и R3b независимо означает (а) водород; (b) C1-С6 алкил, необязательно замещенный 1-7 группами, выбранными из С3-С7 циклоалкила и галогена; (с) C1-С6 алкокси-группу, необязательно замещенную 1-7 атомами галогена; или (е) галоген.
Предпочтительные соединения по настоящему изобретению выбирают из группы, состоящей из:
4-({(4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты;
4-{[[3-фтор-4-(трифторметокси)бензил](4-метилизохинолин-3-ил)амино]сульфонил}-бензойной кислоты;
4-({(1-циклопропил-4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты;
4-{[[4-(1-этокси-2,2,2-трифтор-1-метилэтил)бензил](4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты;
4-({(3-метилхинолин-2-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты;
4-{[[4-фтор-3-(трифторметил)бензил](3-метилхинолин-2-ил)амино]сульфонил} бензойной кислоты;
4-{[(4-трет-бутилбензил)(4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты;
4-{[[4-(циклопропилметил)бензил](4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты;
4-{[[4-фтор-3-(трифторметил)бензил](4-метилизохинолин-3-ил)амино]сульфонил}-бензойной кислоты;
4-{[(4-метилизохинолин-3-ил)(2-нафтилметил)амино]сульфонил}бензойной кислоты;
4-({(1-метокси-4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты;
4-({(4-хлоризохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты;
4-{[(4-метилизохинолин-3-ил)(5,6,7,8-тетрагидронафталин-2-илметил)амино]сульфонил}бензойной кислоты;
4-{[(2,3-дигидро-1Н-инден-5-илметил)(4-метилизохинолин-3-ил)амино]сульфонил}-бензойной кислоты;
4-{[[(1,1-диметил-2,3-дигидро-1Н-инден-5-ил)метил](4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты;
4-{[[(2,2-диметил-2,3-дигидро-1Н-инден-5-ил)метил](4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты;
4-{[[(3,3-диметил-2,3-дигидро-1-бензофуран-6-ил)метил](4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты;
4-{[[(1-бензотиофен-2-ил)метил](4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты;
4-({(1,4-диметилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты; и
4-({(4-метилизохинолин-3-ил)[4-(2,2,2-трифтор-1-метокси-1-метилэтил)бензил]амино}сульфонил)бензойной кислоты; или
их фармацевтически приемлемых солей или их пролекарств.
Другие предпочтительные соединения по настоящему изобретению выбирают из группы, состоящей из:
4-({(1-циклопропил-4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты;
4-({(1-метокси-4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты;
4-({(1-изопропил-4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты;
4-{[{3-хлор-4-[циклопропил(дифтор)метил]бензил}(4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты;
4-({(4-циклопропилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты;
4-{[{3-хлор-4-[циклопропил(дифтор)метил]бензил}(1-циклопропил-4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты;
4-{[{4-[циклопропил(дифтор)метил]-3-фторбензил}(4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты;
4-({[4-(трифторметокси)бензил][4-(трифторметил)изохинолин-3-ил]амино}сульфонил)бензойной кислоты;
4-[((4-циклопропилизохинолин-3-ил){[5-(трифторметил)пиридин-2-ил]метил}амино)сульфонил]бензойной кислоты;
4-{[{3-хлор-4-[циклопропил(дифтор)метил]бензил}(4-циклопропилизохинолин-3-ил)амино]сульфонил}бензойной кислоты;
4-{[{4-[циклопропил(дифтор)метил]-3-фторбензил}(4-циклопропилизохинолин-3-ил)амино]сульфонил}бензойной кислоты;
4-({(4-циклопропилизохинолин-3-ил)[5-(трифторметокси)-2,3-дигидро-1Н-инден-1-ил]амино}сульфонил)бензойной кислоты;
4-({{3-хлор-4-[циклопропил(дифтор)метил]бензил}[4-(трифторметил)изохинолин-3-ил]амино}сульфонил)бензойной кислоты; и
4-({{4-[циклопропил(дифтор)метил]-3-фторбензил}[4-(трифторметил)изохинолин-3-ил]амино}сульфонил)бензойной кислоты; или
их фармацевтически приемлемых солей или их пролекарств.
Соединения по настоящему изобретению обладают новой структурой, в которой бициклический ароматический гетероцикл, в котором пиридин конденсирован с бензолом или пиридин конденсирован с моноциклическим ароматическим гетероциклом, связан с сульфониламино-группой, и демонстрируют отличную антагонистическую активность отношении TRPM8 в тесте ингибирования индуцированного ментолом притока кальция. Кроме того, соединение по настоящему изобретению демонстрирует отличное ингибирующее действие на реакцию типа «Отряхивание мокрой собаки», индуцированную агонистом TRPM8 (например, ментолом или ицилином), например, у крыс.
Таким образом, соединение по настоящему изобретению является эффективным для предупреждения и лечения:
(a) хронической боли: такой как нейропатическая боль (например, холодовая аллодиния, диабетическая нейропатия, невралгия после герпеса, совокупный региональный болевой синдром, периферическая нейропатия, индуцированная химиотерапией, тройничная невралгия, боль после инсульта, боль от повреждения спинного мозга, невралгия, или нейропатическая боль, индуцированная повреждением нерва), ноцицептивная боль (например, ревматоидный артрит, остеоартрит, послеоперационная боль или миофасциальная боль) или комбинированная боль (например, боль при раке, синдром фибромиалгии или хроническая поясничная боль);
(b) цефалгии: такой как мигрень или приступы головной боли или головная боль напряженного состояния;
(c) урологических заболеваний: таких как повышенная активность мышцы-сжимателя, повышенная активность мочевого пузыря, недержание мочи, нейрогенный мочевой пузырь, гиперрефлексия мышцы-сжимателя, беспричинная повышенная активность мышцы-сжимателя, нестабильность мышцы-сжимателя, интерстициальный цистит, доброкачественная гиперплазия простаты, хронический простатит или симптом нижнего мочевого пути;
(d) карциномы: такой как рак предстательной железы или рак молочной железы;
(e) респираторных заболеваний: таких как астма, ХОЗЛ (хроническое обструктивное заболевание легких) или легочная гипертензия;
(f) желудочно-кишечных заболеваний: таких как синдром раздраженной толстой кишки;
(g) психиатрических заболеваний: таких как нарушения настроения (например, депрессия или биполярный синдром) или тревожное настроение (например, беспокойство);
(h) неврологических заболеваний, таких как нейродегенеративное заболевание или инсульт; или
(i) дерматоза: такого как зуд.
Предпочтительно соединение по настоящему изобретению является полезным для предупреждения и лечения хронической боли или урологического заболевания, в частности хронической боли.
Соединение по настоящему изобретению или его фармацевтически приемлемая соль, или его пролекарство можно вводить перорально или парентерально, и его можно использовать в форме подходящей фармацевтической рецептуры. Фармацевтическая рецептура, подходящая для перорального введения, включает твердую рецептуру, например таблетку, гранулу, капсулу, порошок, или жидкую рецептуру, суспензию, эмульсию. Фармацевтическая рецептура, подходящая для парентерального введения, включает суппозиторий; инъекционная или внутривенная инфузия, при которой используется вода для инъекции, физиологический раствор или водный раствор глюкозы; и лекарственную форму для ингаляции.
Фармацевтическая композиция по изобретению может содержать от около 0,01 мг/кг до около 100 мг/кг (предпочтительно от около 0,01 мг/кг до около 50 мг/кг, более предпочтительно от около 0,01 мг/кг до около 30 мг/кг) активного компонента в стандартной дозе, например в таблетке, капсуле, порошке, инъекции, суппозитории, чайной ложке, и может назначаться в дозе от около 0,01 мг/кг/сутки до около 100 мг/кг/сутки (предпочтительно от около 0,01 мг/кг/сутки до около 50 мг/кг/сутки, более предпочтительно от около 0,01 мг/кг/сутки до около 30 мг/кг/сутки). Фармацевтическая композиция, содержащая любое из указанных в изобретении соединений и фармацевтически приемлемые носители, может быть использована в способе лечения описанных в изобретении заболеваний. Лекарственная форма может содержать от около 0,01 мг/кг до около 100 мг/кг (предпочтительно от около 0,01 мг/кг до около 50 мг/кг, более предпочтительно от около 0,01 мг/кг до около 30 мг/кг) активного компонента, и может формоваться в любые формы, подходящие для выбранного способа введения. Доза может изменяться в соответствии со способами применения, потребностями пациентов, серьезности излечиваемой болезни и соединений, которые будут использоваться. Фармацевтическая композиция может вводиться ежедневно или периодически.
Соединение (I) по настоящему изобретению может быть получено способами, соответствующими следующим схемам 1, 2 или 3, однако только ими способы получения соединения (I) не ограничиваются.
Требуется и/или является желательным, чтобы чувствительные или реакционноспособные группы в представляющей интерес молекуле можно было защитить в ходе любого процесса получения соединений по настоящему изобретению. Защита может быть осуществлена с помощью традиционных защитных групп. Защитные группы и их обычное использование описаны в книге Т.W. Greene, и др., "Protecting Groups in Organic Synthesis", John Wiley & Sons, New York, 2006. Защитные группы можно удалять традиционным способом при последующей обработке.
Схема 1:

(В приведенной выше схеме LG представляет собой уходящую группу и включает галоген, такой как хлор, бром, замещенную сульфонилокси-группу, такую как пара-толуолсульфонилокси, метансульфонилокси и трифторметилсульфонилокси, а другие символы имеют указанные выше значения).
Соединение (IV) может взаимодействовать с соединением (V) с образованием соединения (II). Образовавшееся соединение может взаимодействовать с соединением (III), с образованием соединения (I).
Стадия 1:
Соединение (II) можно получать путем конденсации соединения (IV) с соединением (V) в растворителе в присутствии основания.
Предпочтительно в ходе конденсации в качестве растворителей можно использовать любые растворители, при условии что они не влияют на протекающую реакцию, и примеры растворителя включают простые эфиры, такие как тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан; углеводороды, такие как толуол, гексан, ксилол; галогеноуглеводороды, такие как дихлорметан, хлороформ, 1,2-дихлорэтан; сложные эфиры, такие как этилацетат, бутилацетат; кетоны, такие как ацетон, бутанон; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид, 1,3-диметил-2-имидазолидинон и N-метилпирролидон; сульфоксиды, такие как диметилсульфоксид, и следующие амины также могут быть использованы в качестве растворителя. Указанные растворители могут быть использоваться по отдельности или в комбинации. Предпочтительным растворителем в указанной реакции является амин, такой как пиридин; или галогеноуглеводород, такой как хлороформ.
В качестве основания могут использоваться любые традиционные основания, и примеры оснований включают амиды щелочных металлов, такие как диизопропиламид лития, амид натрия, бис(триметилсилил)амид лития; карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия, гидрокарбонат натрия, гидрокарбонат калия; фосфаты щелочных металлов, такие как фосфат натрия, фосфат калия; амины, такие как триэтиламин, диизопропилэтиламин, пиридин, N-метилморфолин, предпочтительно такой амин, как пиридин.
Реакция может быть осуществлена при низкой температуре, комнатной температуре или повышенной температуре, например от 0°C до 120°C.
Когда два эквивалента соединения формулы (V) конденсируются с одним эквивалентом соединения формулы (IV) с образованием сульфонимидного соединения, это сульфонимидное соединение можно обработать тетрабутиламмонийфторидом с получением соответствующего соединение (II).
Стадия 2:
Соединение (I) можно получить путем конденсации соединения (II) с соединением (III) в растворителе в присутствии основания.
Предпочтительно в качестве растворителей можно использовать любые растворители, не оказывающие влияния на протекающую при конденсации реакцию, и примеры растворителей включают простые эфиры, такие как тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан; углеводороды, такие как толуол, гексан, ксилол; галогеноуглеводороды, такие как дихлорметан, хлороформ, 1,2-дихлорэтан; сложные эфиры, такие как этилацетат, бутилацетат; кетоны, такие как ацетон, бутанон; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид, 1,3-диметил-2-имидазолидинон и N-метилпирролидон; сульфоксиды, такие как диметилсульфоксид, и следующие амины также могут быть использованы в качестве растворителя. Указанные растворители могут быть использованы по отдельности или в комбинации. Предпочтительным растворителем в указанной реакции является амид, такой как N,N-диметилформамид.
В качестве основания могут быть использованы любые традиционные основания, и примеры оснований включают амиды щелочных металлов, такие как диизопропиламид лития, амид натрия, бис(триметилсилил)амид лития; карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия, карбонат цезия, гидрокарбонат натрия, гидрокарбонат калия; фосфаты щелочных металлов, такие как фосфат натрия, фосфат калия; амины, такие как триэтиламин, диизопропилэтиламин, пиридин, N-метилморфолин, предпочтительно карбонаты щелочных металлов, такие как карбонат калия.
Реакция может быть осуществлена при низкой температуре, комнатной температуре или повышенной температуре, например от -20°С до 80°С.
Схема 2:

(В приведенной выше схеме символы имеют указанные выше значения).
Соединение (IV) может взаимодействовать с соединением (V) с образованием соединения (II). Образовавшееся соединение может взаимодействовать с соединением (VI) с образованием соединения (I).
Стадия 1:
Соединение (II) можно получить в соответствии со способом со схемы 1, стадия 1.
Стадия 2:
Соединение (I) можно получить по реакции Мицунобу между соединением (II) и соединением (VI) в растворителе.
Реакция Мицунобу может быть осуществлена в подходящем растворителе в присутствии фосфина и азодикарбоксилатного соединения.
Примеры фосфинов включают трифенилфосфин, дифенил(2-пиридил)фосфин, (4-диметиламинофенил)дифенилфосфин, изопропилдифенилфосфин, диэтилфенилфосфин, дициклогексилфенилфосфин, трибутилфосфин, три-трет-бутилфосфин, трициклогексилфосфин. Примеры азодикарбоксилатных соединений включают диэтил-азодикарбоксилат, диизопропилазодикарбоксилат, дибутилазодикарбоксилат, азодикарбонилдипиперазин, тетраметилазодикарбоксамид. Указанная реакция может быть осуществлена в присутствии цианометилентрибутилфосфорана, используемого вместо фосфина, и азодикарбоксилатного соединения.
Предпочтительно в качестве растворителей можно использовать любые растворители из тех, которые не влияют на протекающую реакцию, и примеры растворителей включают простые эфиры, такие как тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан; углеводороды, такие как толуол, гексан, ксилол; сложные эфиры, такие как этилацетат, бутилацетат; кетоны, такие как ацетон, бутанон; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид, 1,3-диметил-2-имидазолидинон и N-метилпирролидон; сульфоксиды, такие как диметилсульфоксид. Указанные растворители могут быть использованы по отдельности или в комбинации. Предпочтительным растворителем в указанной реакции является простой эфир, такой как тетрагидрофуран.
Реакция может быть осуществлена при низкой температуре, комнатной температуре или повышенной температуре, например от -20°С до 80°С.
Схема 3:

(В приведенной выше схеме символы имеют указанные выше значения).
Соединение (VIII) может взаимодействовать с соединением (IX) с образованием соединения (VII). Образовавшееся соединение может взаимодействовать с соединением (V) с образованием соединения (I).
Стадия 1:
Соединение (VII) может быть приготовлено путем конденсации соединения (VIII) с соединением (IX) в растворителе или без растворителя в присутствии основания.
Предпочтительно в качестве растворителей можно использовать любые растворители из тех, которые не влияют на реакцию, и примеры растворителей включают простые эфиры, такие как тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан; углеводороды, такие как толуол, гексан, ксилол; сложные эфиры, такие как этилацетат, бутилацетат; кетоны, такие как ацетон, бутанон; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид, 1,3-диметил-2-имидазолидинон и N-метилпирролидон; сульфоксиды, такие как диметилсульфоксид. Указанные растворители могут быть использованы по отдельности или в комбинации. Предпочтительно эту реакцию проводят в отсутствии растворителя.
В качестве основания могут быть использованы любые традиционные основания, и примеры оснований включают амиды щелочных металлов, такие как диизопропиламид лития, амид натрия, бис(триметилсилил)амид лития; карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия, гидрокарбонат натрия, гидрокарбонат калия; фосфаты щелочных металлов, такие как фосфат натрия, фосфат калия; амины, такие как триэтиламин, диизопропилэтиламин, пиридин, N-метилморфолин. Кроме того, в качестве основания можно использовать избыточное количество соединения (IX). Предпочтительным основанием в указанной реакции является избыточное количество соединения (IX).
Реакция может быть осуществлена при высокой температуре, например при 100°С-250°С, и предпочтительно может быть осуществлена с использованием микроволнового облучения.
Стадия 2:
Соединение (I) можно приготовить по способу со схемы 1, стадия 1.
Далее, традиционным способом может быть осуществлено превращение соединения (I), полученного вышеуказанным образом, или промежуточного соединения, полученного в ходе получения соединения (I).
Соединение (I), в котором кольцо В представляет собой индол, и его промежуточное соединение может быть получено путем окисления соединения (I), в котором кольцо В представляет собой индолин, и его промежуточного соединения, соответственно. Процесс окисления может быть осуществлен в подходящем растворителе в присутствии окислителя.
Окислители включают 2,3-дихлор-5,6-дициано-пара-бензохинон. Растворитель может быть выбран из любых растворителей, которые не влияют на реакцию, и примеры растворителей включают ароматические углеводороды, такие как толуол и ксилол; простые эфиры, такие как тетрагидрофуран, 1,2-диметоксиэтан и 1,4-диоксан; галогеноуглеводороды, такие как дихлорметан, хлороформ и 1,2-дихлорэтан. Указанные растворители могут быть использованы по отдельности или в комбинации.
Соединение (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d является необязательно замещенным фенилом, и его промежуточное соединение (в последующем также может называться как соединение, содержащее необязательно замещенный фенил) могут быть приготовлены путем сочетания соединения (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d является галогеном (в частности, бромом, йодом), и его промежуточного соединения (в последующем также может называться как соединение, содержащее галоген), соответственно, с Ar1B(OH)2 или циклическим борным эфиром этой кислоты, Ar1BF3K или Ar1Sn(н-Bu)3 (где Ar1 является необязательно замещенным фенилом, и н-Bu означает бутил), и т.п.
Реакция сочетания может быть осуществлена как традиционная реакция сочетания арилов, например сочетание Сузуки (см., Suzuki и др., Synth. Commun. 11:513 (1981); Suzuki, Pure и Appl. Chem. 57:1749-1758 (1985); Suzuki и др., Chem. Rev. 95:2457-2483 (1995); Shieh и др., J. Org. Chem. 57:379-381 (1992); Martin и др., Acta Chemica Scandinavica 47:221-230 (1993); Wallace и др., TeTpahedron Lett. 43:6987-6990 (2002) и Molander и др., J. Org. Chem. 68:4302-4314 (2003)) и сочетание Стилле (см., Stille, Angew. Chem. Int. Ed. Engl. 25:508-524 (1986) и Liebeskind и др., J. Org. Chem. 59:5905-5911 (1994)).
Реакция сочетания может быть осуществлена в подходящем растворителе в присутствии или в отсутствие лиганда, основания и добавки, в присутствии палладиевого катализатора.
Примеры Pd катализаторов включают тетракис(трифенилфосфин)палладий(0), палладий(II) ацетат, бис(ацетонитрил)дихлорпалладий(II), дихлорбис(трифенилфосфин)-палладий(II), комплекс [1,1′-бис(дифенилфосфино)ферроцен]дихлорпалладия(II) с дихлорметаном, аддукт трис(дибензилиденацетон)дипалладия(0) с хлороформом и хлорид палладия(II). Примеры оснований включают карбонаты щелочных металлов, такие как карбонат цезия, карбонат калия, карбонат натрия и гидрокарбонат натрия; фосфаты щелочных металлов, такие как трехосновный фосфат калия, фосфат натрия и гидрофосфат натрия; амины, такие как N,N-диизопропилэтиламин; фториды щелочных металлов, такие как фторид цезия и фторид калия; алкоксиды щелочных металлов, такие как трет-бутоксид, натрия, трет-бутоксид, калия. Примеры лигандов включают трифенилфосфин, трибутилфосфин, тетрафторборат три-трет-бутилфосфония, 1,3-бис(дифенилфосфино)пропан, 2,2′-бис(дифенилфосфино)-1,1′-бинафтил, 1,1′-бис(дифенилфосфино)ферроцен, 2-(ди-трет-бутилфосфино)бифенил, 2-дициклогексилфосфино-2′-(N,N-диметиламино)бифенил, 2-(дициклогексилфосфино)бифенил, ди(1-адамантил)-бутилфосфин. Примером добавки является иодид меди(I).
Растворитель может быть выбран из любых растворителей, которые не влияют на реакцию сочетания, и примеры растворителей включают ароматические углеводороды, такие как толуол и ксилол; простые эфиры, такие как тетрагидрофуран, 1,2-диметоксиэтан и 1,4-диоксан; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид, 1,3-диметил-2-имидазолидинон и N-метилпирролидон; спирты, такие как метанол, этанол и 2-пропанол; воду. Указанные растворители могут быть использованы по отдельности или в комбинации.
Реакция сочетания может быть осуществлена при комнатной температуре или повышенной температуре, например при 20-150°С.
Соединение (I), в котором замещающая группа R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d является необязательно замещенной моноциклической ароматической гетероциклической группой или необязательно замещенной моноциклической неароматической гетероциклической группой, и его промежуточное соединение могут быть получены путем сочетания соединения (I), в котором замещающая группа R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d представляет собой галоген (в частности, бром, йод), и его промежуточного соединения, соответственно, с Ar2B(OH)2, Ar2BF3K или Ar2Sn(н-Bu)3 (где Ar2 является необязательно замещенной моноциклической ароматической гетероциклической группой или необязательно замещенной моноциклической неароматической гетероциклической группой, и н-Bu означает н-бутил).
Указанная реакция может быть осуществлена в соответствии с методикой реакции сочетания, как в описанном выше способе получения соединения, содержащего необязательно замещенный фенил, из соединения, содержащего галоген.
Соединение (I), в котором замещающая группа R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d представляет собой необязательно замещенную моноциклическую неароматическую гетероциклическую группу, содержащую атом азота в кольце, и связана с кольцом А или кольцом В через атом азота, и его промежуточное соединение, могут быть получены путем сочетания соединения (I), в котором замещающая группа R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d является галогеном (в частности, бромом, йодом), и его промежуточного соединения, соответственно, с подходящей моноциклической неароматической гетероциклической группой, в которой атом азота замещен водородом.
Указанная реакция может быть осуществлена с использованием традиционной методики аминирования, например методики аминирования Бухвальда-Хартвига (см., Yang, В.Н.; Buchwald, S.L.J. Organomet. Chem. 576 (1999) 125-146).
Более конкретно, такая реакция может быть осуществлена с использованием реакции сочетания, как описано выше для получения соединения, содержащего необязательно замещенный фенил, из соединения, содержащего галоген.
Соединение (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d представляет собой необязательно замещенный алкил, и его промежуточное соединение могут быть приготовлены путем алкилирования соединения (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d является галогеном (в частности, бромом, йодом) и его промежуточного соединения, соответственно.
Реакция алкилирования может быть осуществлена путем обработки соединения (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d представляет собой галоген, или его промежуточного соединения алкиллитием (например, бутиллитием), и затем соответствующим галогеналкилом (например, йодалкилом) в подходящем растворителе (например, простой эфир, такой как тетрагидрофуран).
Соединение (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d является метилом, и его промежуточное соединение могут быть получены путем сочетания соединения (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d представляет собой галоген (в частности, бром, йод) и его промежуточного соединения, соответственно, с метилборатом или его циклическим боратным эфиром, триметилбороксином или метилтрифторборатом калия.
Такая реакция может быть осуществлена с использованием реакции сочетания, как описано выше для получения соединения, содержащего необязательно замещенный фенил, из соединения, содержащего галоген.
Соединение (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d является необязательно замещенным С2-С6 алкилом, и его промежуточное соединение могут быть приготовлены путем сочетания соединения (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d представляет собой галоген (в частности, бром, йод), и его промежуточного соединения, соответственно, с реагентом R7B(OH)2 или R7BF3K (где R7 означает необязательно замещенный С2-С6 алкенил) с образованием необязательно замещенного алкенильного соединения, с последующим гидрированием.
Реакция образования необязательно замещенного алкенильного соединения может быть осуществлена с использованием реакции сочетания, как описано выше для получения соединения, содержащего необязательно замещенный фенил, из соединения, содержащего галоген.
Процесс гидрирования необязательно замещенного алкенильного соединения может быть осуществлен в атмосфере водорода, в подходящем растворителе, в присутствии катализатора. Примеры катализаторов включают палладий на угле, гидроксид палладия и оксид платины.
Растворитель может быть выбран из любых растворителей, которые не влияют на реакцию сочетания, и примеры растворителей включают простые эфиры, такие как тетрагидрофуран, 1,2-диметоксиэтан и 1,4-диоксан; спирты, такие как метанол, этанол и 2-пропанол; сложные эфиры, такие как этилацетат; карбоновые кислоты, такие как уксусная кислота. Указанные растворители могут быть использованы по отдельности или в комбинации.
Реакция может быть осуществлена при комнатной температуре или повышенной температуре, например от 20°С до 80°С.
Соединение (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d означает циклопропилметил, и его промежуточное соединение могут быть приготовлены путем сочетания соединения (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d представляет собой галоген (в частности, бром, йод), и его промежуточного соединения, соответственно, с аллилтрибутилоловом, с последующим циклопропилированием двойных связей образовавшегося аллила.
Реакция получения аллильного соединения может быть осуществлена с использованием реакции сочетания, как описано выше для получения соединения, содержащего необязательно замещенный фенил, из соединения, содержащего галоген.
Реакция циклопропилирования может быть осуществлена в подходящем растворителе в присутствии дигалогенметана и диэтилцинка.
Примеры дигалогенметана включают хлориодметан и дииодметан.
Растворитель может быть выбран из любых растворителей, не влияющих на реакцию циклопропилирования, и примеры растворителей включают галогенуглеводороды, такие как дихлорметан, хлороформ и 1,2-дихлорэтан. Указанные растворители могут быть использованы по отдельности или в комбинации.
Реакция может быть осуществлена при комнатной температуре или повышенной температуре, например, от 20°С до 80°С.
Соединение (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3a или R3d является оксо-замещенным алкилом, и его промежуточное соединение могут быть приготовлены путем N-метокси-N-метиламидирования соединения (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d представляет собой алкил, замещенный гидрокси- и оксо-группой при одном том же атоме углерода, и его промежуточного соединения, соответственно, с последующим алкилированием или циклоалкилированием образовавшегося амида с использованием R8Li или R8MgLG1 (где R8 является соответствующим необязательно замещенным алкилом или соответствующим необязательно замещенным циклоалкилом, и LG1 означает галоген).
Реакция N-метокси-N-метиламидирования может быть осуществлена в подходящем растворителе (например, галогенуглеводороде, таком как дихлорметан, хлороформ или дихлорэтан) в присутствии (или в отсутствие) N-гидроксибензотриазола, в присутствии амина (например, N,O-диметилгидроксиламина или гидрохлорида N,O-диметилгидроксиламина), конденсирующего реагента (например, карбодиимида, такого как гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида) и основания (например, амина, такого как триэтиламин).
Реакция алкилирования или циклоалкилирования может быть осуществлена в подходящем растворителе (например, простом эфире, таком как тетрагидрофуран или углеводороде, таком как гексан, или в их смеси).
Соединение (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d является необязательно замещенным алканоилом, и его промежуточное соединение могут быть приготовлены путем сочетания соединения (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d представляет собой галоген (в частности, бром, йод) и его промежуточного соединения, соответственно, с реагентом R9Sn(н-Bu)3 (где R9 означает 1-алкокси-1-алкен-1-ил, и н-Bu означает бутил) с образованием алкенилэфирного соединения с последующим гидролизом. Реакция получения алкенилэфирного соединения может быть осуществлена с использованием реакции сочетания, как описано выше для получения соединения, содержащего необязательно замещенный фенил, из соединения, содержащего галоген.
Гидролиз может быть осуществлен в подходящем растворителе (например, простой эфир, такой как тетрагидрофуран; сложный эфир, такой как этилацетат; или вода, или их смеси) в присутствии кислоты (например, неорганической кислоты, такой как хлористый водород).
В альтернативном варианте соединение (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d является необязательно замещенным алканоилом, и его промежуточное соединение могут быть приготовлены путем алканоилирования соединения (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d представляет собой галоген (в частности, бром, йод) и его промежуточного соединения, соответственно.
Реакция алканоилирования может быть осуществлена путем обработки соединения (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d является галогеном, или его промежуточного соединения алкиллитием (например, бутиллитием), и затем соединением следующей формулы:

где R10 необязательно представляет собой замещенный алкил и Me означает метил,
в подходящем растворителе (например, в простом эфире, таком как тетрагидрофуран, или углеводороде, таком как гексан, или в их смеси).
Соединение (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d является необязательно замещенным циклоалкилом, и его промежуточное соединение могут быть приготовлены путем сочетания соединения (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d представляет собой галоген (в частности, бром, йод) и его промежуточного соединения, соответственно, с реагентом R11B(OH)2 или R11BF3K (где R11 необязательно является замещенным циклоалкилом).
Эта реакция может быть осуществлена с использованием реакции сочетания, как описано выше для получения соединения, содержащего необязательно замещенный фенил, из соединения, содержащего галоген.
В альтернативном варианте соединение (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d является необязательно замещенным циклоалкилом, и его промежуточное соединение могут быть приготовлены путем сочетания соединения (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d представляет собой галоген (в частности, бром, йод), и его промежуточного соединения, соответственно, с реагентом R12B(OH)2 или R12BF3K (где R12 является необязательно замещенным циклоалкенилом) с образованием необязательно замещенного циклоалкенильного соединения, с последующим гидрированием.
Процесс получения необязательно замещенного циклоалкенильного соединения может быть осуществлен с использованием реакции сочетания, как описано выше для получения соединения, содержащего необязательно замещенный фенил, из соединения, содержащего галоген.
Гидрирование циклоалкенильного соединения может быть осуществлено с использованием вышеуказанного метода гидрирования необязательно замещенного С2-С6 алкенильного соединения.
Соединение (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d является водородом, и его промежуточное соединение могут быть приготовлены путем восстановления соединения (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d представляет собой галоген (в частности, бром, йод), и его промежуточного соединения, соответственно.
Процесс восстановления может быть осуществлен в атмосфере водорода, в подходящем растворителе в присутствии основания (или без него), в присутствии катализатора. Примеры катализаторов включают палладий на угле, гидроксид палладия и оксид платины. Примеры оснований включают амин, такой как триэтиламин.
Растворитель может быть выбран из любых растворителей, не влияющих на реакцию, и примеры растворителей включают простые эфиры, такие как тетрагидрофуран, 1,2-диметоксиэтан и 1,4-диоксан; спирты, такие как метанол, этанол и 2-пропанол; сложные эфиры, такие как этилацетат; карбоновые кислоты, такие как уксусная кислота. Указанные растворители могут быть использованы по отдельности или в комбинации.
Реакция может быть осуществлена при комнатной температуре или повышенной температуре, например от 20°С до 80°С.
В альтернативном варианте процесс восстановления может быть осуществлен в подходящем растворителе (например, вторичном спирте, таком как 2-пропанол) в присутствии или в отсутствие лиганда (например трифенилфосфина) в присутствии Pd катализатора (например, ацетата палладия(II)) и основания (например, карбоната щелочного металла, такого как карбонат калия).
Соединение (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d является фторалкилом, и его промежуточное соединение могут быть приготовлены путем сочетания соединения (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d представляет собой галоген (в частности, йод) и его промежуточного соединения, соответственно, с метилфторсульфонилдифторацетатом, фторалкилкарбоксилатом калия или фторалкилтриметилсиланом.
Реакция сочетания может быть осуществлена в подходящем растворителе в присутствии или в отсутствие добавки, в присутствии комплекса Cu.
Примеры комплексов Cu включают бромид меди(I), иодид меди(I) или тиофен-2-карбоксилат меди(I), предпочтительно бромид меди(I) и иодид меди(I). Кроме того, реакция может быть осуществлена путем введения добавки. Примеры добавок включают фторид калия.
Предпочтительно в качестве растворителей можно использовать любые растворители из тех, которые не влияют на реакцию, и примеры растворителей включают простые эфиры, такие как тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид, 1,3-диметил-2-имидазолидинон и N-метилпирролидон; апротонные полярные растворители, такие как диметилсульфоксид, триамид гексаметилфосфорной кислоты. Эти растворители могут быть использованы по отдельности или в комбинации. Предпочтительным растворителем в этой реакции является смесь амида, такого как N,N-диметилформамид, и апротонного полярного растворителя, такого как триамид гексаметилфосфорной кислоты.
Реакция может быть осуществлена при комнатной температуре или повышенной температуре, например от 20°С до 120°С.
Соединение (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d представляет собой алкил, имеющий два атома фтора при одном и том же атоме углерода, и его промежуточное соединение могут быть приготовлены путем дифторирования соединения (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d является оксо-замещенным алкилом, и его промежуточного соединения соответственно.
Реакция дифторирования может быть осуществлена в подходящем растворителе (например, галогенуглеводороде, таком как дихлорметан, хлороформ или дихлорэтан) или без растворителя, с катализатором или без катализатора (например, спирта, такого как метанол или этанол) в присутствии фторирующего агента (например, трифторида диэтиламиносеры или трифторида бис(2-метоксиэтил)аминосеры).
Предпочтительно эта реакция может быть осуществлена при температуре от 0°С до 100°C, в частности от 20°С до 80°С.
Соединение (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d представляет собой алкокси-замещенный алкил, и его промежуточное соединение могут быть приготовлены путем алкилирования соединения (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d является гидрокси-замещенным алкилом, и его промежуточного соединения, соответственно, реагентом R13LG2 (где R13 означает алкил, и LG2 является уходящей группой и включает галоген, такой как бром, йод; замещенную сульфонилокси-группу, такую как пара-толуолсульфонилокси-, метансульфонилокси-, трифторметансульфонилокси- и алкоксисульфонилокси-группу).
Реакция алкилирования может быть осуществлена в подходящем растворителе в присутствии основания.
Предпочтительно в качестве растворителей можно использовать любые растворители из тех, которые не влияют на реакцию алкилирования, и примеры растворителей включают простые эфиры, такие как тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан; углеводороды, такие как толуол, гексан, ксилол; сложные эфиры, такие как этилацетат, бутилацетат; амиды, такие как N,N-диметилформамид, N,N-диметилацетамид, 1,3-диметил-2-имидазолидинон и N-метилпирролидон. Указанные растворители могут быть использованы по отдельности или в комбинации, предпочтительным является амид, такой как N,N-диметилформамид.
Примеры оснований включают гидриды щелочных металлов, такие как гидрид натрия, гидрид калия; гидроксиды щелочных металлов, такие как гидроксид натрия, гидроксид калия; гидроксиды щелочноземельных металлов, такие как гидроксид кальция, гидроксид бария; алкоксиды щелочных металлов, такие как метоксид натрия, этоксид натрия, этоксид калия, трет-бутоксид калия; амиды щелочных металлов, такие как диизопропиламид лития, амид натрия, бис(триметилсилил)амид лития; карбонаты щелочных металлов, такие как карбонат натрия, карбонат калия, гидрокарбонат натрия, гидрокарбонат калия, предпочтительно гидрид щелочного металла, такой как гидрид натрия.
Соединение (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d представляет собой алкил, замещенный при одном и том же атоме углерода (а) C1-С3 перфторалкилом (например, трифторметилом, пентафторэтилом или гептафторпропилом) и (b) гидрокси-группой, и его промежуточное соединение могут быть приготовлены путем перфторалкилирования соединения (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d является оксо-замещенным алкилом, и его промежуточного соединения, соответственно, реагентом R14SiMe3 (где R14 означает перфторалкил, и Me означает метил).
Реакция перфторалкилирования может быть осуществлена в подходящем растворителе (например, простом эфире, таком как тетрагидрофуран) в присутствии источника фторид-ионов (например, тетрабутиламмонийфторид).
Соединение (I), в котором две замещающие группы, выбранные из замещающих групп R3a, R3b, R3c и R3d, представляют собой: (а) C1-С3 перфторалкил (например, трифторметил, пентафторэтил или гептафторпропил) и (b) гидрокси-группу, размещенные при одном и том же атоме углерода кольца В, и его промежуточное соединение могут быть приготовлены путем перфторалкилирования соединения (I), в котором две замещающие группы, выбранные из соответствующих замещающих групп R3a, R3b, R3c и R3d, объединены друг с другом с образованием оксо-группы, и его промежуточного соединения, соответственно, реагентом R15SiMe3 (где R15 означает перфторалкил, и Me означает метил).
Эта реакция может быть осуществлена с использованием вышеуказанного метода перфторалкилирования оксо-замещенного алкила.
Соединение (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d представляет собой алкил, замещенный при одном и том же атоме углерода циклоалкилом и гидрокси-группой, и его промежуточное соединение могут быть приготовлены путем циклоалкилирования соединения (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d является оксо-замещенным алкилом, и его промежуточного соединения, соответственно, реагентом R16Li или R16MgLG1 (где R16 означает циклоалкил, и LG1 означает галоген).
Реакция циклоалкилирования может быть осуществлена в подходящем растворителе (например, простом эфире, таком как тетрагидрофуран).
Соединение (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d представляет собой гидрокси-замещенный алкил, и его промежуточное соединение могут быть приготовлены путем восстановления соединения (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d является оксо-замещенным алкилом, и его промежуточного соединения, соответственно.
Процесс восстановления может быть осуществлен в подходящем растворителе (например, спирте, таком как метанол, этанол) в присутствии восстановителя (например, боргидрида лития, боргидрида натрия).
Соединение (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d представляет собой алкил, и его промежуточное соединение могут быть приготовлены путем восстановления силаном соединения (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d является гидрокси-замещенным алкилом, и его промежуточного соединения, соответственно.
Процесс восстановления может быть осуществлен в подходящем растворителе (например, в галогенуглеводороде, таком как хлороформ) или без растворителя, в присутствии кислоты (например, карбоновой кислоты, такой как трифторуксусная кислота) и восстановителя (например, триалкилсилана, такого как триэтилсилан).
Соединение (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d является необязательно замещенным алкилом и присоединена к атому азота, входящему в состав кольца А или кольца В, и его промежуточное соединение могут быть приготовлены путем алкилирования соединения (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d является водородом, и его промежуточного соединения, соответственно, реагентом R17LG2 (где R17 является необязательно замещенным алкилом и LG2 означает уходящую группу и включает галоген, такой как бром, йод; замещенную сульфонилокси-группу, такую как пара-толуолсульфонилокси, метансульфонилокси, трифторметансульфонилокси и алкоксисульфонилокси-группу).
Реакция получения указанного соединения может быть осуществлена с использованием вышеуказанного метода алкилирования гидрокси-замещенного алкила, и предпочтительное основание представляет собой карбонат щелочного металла, такой как карбонат калия, или гидрид щелочного металла, такой как гидрид натрия.
Соединение (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d является необязательно замещенным циклоалкилом и присоединена к атому азота, входящему в состав кольца А или кольца В, и его промежуточное соединение (далее может также называться соединением, содержащим необязательно замещенный циклоалкил) могут быть приготовлены путем сочетания соединения (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d представляет собой водород, и его промежуточного соединения (далее может также называться соединением, содержащим водород при атоме азота), соответственно, с реагентом R18B(OH)2 или R18BF3K (где R18 является необязательно замещенным циклоалкилом).
Реакция сочетания может быть осуществлена в подходящем растворителе (например, галогенуглеводороде, таком как 1,2-дихлорэтан) с лигандом (например, диамин, такой как 2,2′-бипиридил) или без него в присутствии медного катализатора (например, ацетата меди(II)) и основания (например, карбоната щелочного металла, такого как карбонат натрия).
Соединение (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d является необязательно замещенной алкокси-группой, и его промежуточное соединение могут быть приготовлены путем алкоксилирования соединения (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d представляет собой галоген (в частности, бром или йод) и его промежуточного соединения, соответственно.
Реакция алкоксилирования может быть осуществлена в подходящем растворителе (например, простом эфире, таком как тетрагидрофуран) в присутствии соответствующего спирта и основания (например, гидрид щелочного металла, такой как гидрид натрия).
Соединение (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d представляет собой йод, и его промежуточное соединение могут быть приготовлены путем иодирования соединения (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d является бромом, и его промежуточного соединения, соответственно.
Реакция иодирования может быть осуществлена в подходящем растворителе с лигандом или без него, в присутствии иодирующего агента и катализатора.
Примеры иодирующих агентов включают иодид натрия. Примеры катализаторов включает иодид меди(I). Примером лиганда является диамин, такой как N,N′-диметилэтилендиамин и N,N′-1,2-циклогександиамин.
Растворитель может быть выбран из любых растворителей, не влияющих на протекающую реакцию, и примеры растворителей включают простые эфиры, такие как тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан; алкилнитрилы, такие как ацетонитрил, пропионитрил. Эти растворители могут быть использованы по отдельности или в комбинации.
Реакция может быть осуществлена при комнатной температуре или повышенной температуре, например от 20°С до 120°С.
Соединение (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d представляет собой фтор, и его промежуточное соединение могут быть приготовлены путем фторирования соединения (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d является бромом или йодом, и его промежуточного соединения, соответственно.
Реакция фторирования может быть осуществлена путем обработки соединения (I), содержащего бром или йод, или его промежуточного соединения в подходящем растворителе (например, простом эфире, таком как тетрагидрофуран, или алифатическом углеводороде, таком как гексан, или в их смеси) алкиллитием (например, бутиллитием), а затем фторирующим агентом (например, N-фторбензолсульфонимидом).
Соединение (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d представляет собой галоген, и его промежуточное соединение могут быть приготовлены путем галогенирования соединения (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d является водородом, и его промежуточного соединения, соответственно.
Реакция галогенирования может быть осуществлена в подходящем растворителе (например, простом эфире, таком как тетрагидрофуран; амиде, таком как N,N-диметилформамид; галогенуглеводороде, таком как дихлорметан, или в карбоновой кислоте, такой как уксусная кислота, или смеси этих растворителей) в присутствии агента галогенирования (например, N-галоидсукцинимида).
Соединение (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d представляет собой алкил, и его промежуточное соединение могут быть приготовлены путем обработки гидразином соединения (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d является оксо-замещенным алкилом, и его промежуточного соединения, соответственно, с последующим восстановлением образовавшегося гидразона.
Обработка гидразином может быть осуществлена в подходящем растворителе (например, в спирте, таком как этанол) в присутствии моногидрата гидразина.
Реакция восстановления гидразона может быть осуществлена в подходящем растворителе (например, в спирте, таком как этиленгликоль) в присутствии основания (например, гидроксида щелочного металла, такого как гидроксид калия).
В альтернативном варианте соединение (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d представляет собой алкил, и его промежуточное соединение могут быть приготовлены путем восстановления силаном соединения (I), в котором замещающая группа R1, R2a, R2b, R2c, R2d, R3a, R3b, R3c или R3d является оксо-замещенным алкилом, и его промежуточного соединения, соответственно.
Восстановление силаном оксо-замещенного алкила может быть осуществлено с использованием вышеуказанного метода восстановления силаном гидрокси-замещенного алкила.
Соединение (I), в котором две замещающие группы, выбранные из групп R3a, R3b, R3c и R3d, представляют собой два атома водорода при одном и том же атоме углерода, входящем в состав кольца В, и его промежуточное соединение могут быть приготовлены путем восстановления гидразоном или восстановления силаном соединения (I), в котором замещающие группы, выбранные из группы R3a, R3b, R3c и R3d, объединяются друг с другом с образованием оксо-группы, и его промежуточного соединения, соответственно.
Восстановление гидразоном или восстановление силаном может быть осуществлено с использованием вышеуказанного метода восстановления оксо-замещенного алкила.
Соединение (I), в котором замещающая группа Х является карбокси-группой, и его промежуточное соединение могут быть приготовлены путем гидролиза соединения (I), в котором замещающая группа Х представляет собой алкоксикарбонил, и его промежуточного соединения, соответственно, в соответствии с общепринятыми методами.
Гидролиз может быть осуществлен путем обработки соединения (I), в котором замещающая группа Х представляет собой алкоксикарбонил, или его промежуточного соединения основанием (например, гидроксидом натрия, гидроксидом калия, гидроксидом лития, метоксидом натрия и этоксидом натрия) в подходящем инертном растворителе (например, в тетрагидрофуране, 1,4-диоксане, метаноле, этаноле и воде, или в их смеси).
Соединение (I), в котором замещающая группа Х представляет собой гидроксиалкил, и его промежуточное соединение могут быть приготовлены путем взаимодействия соединения (I), в котором замещающая группа Х является алкоксикарбонилом или алканоилом, и его промежуточного соединения, соответственно, с литийалюминий гидридом или алкилмагний бромидом.
Соединение (I), в котором замещающая группа Х является необязательно замещенным аминокарбонилом, и его промежуточное соединение могут быть приготовлены путем амидирования соответствующим амином соединения (I), в котором замещающая группа Х представляет собой карбокси- или алкоксикарбонил, и его промежуточного соединения, соответственно, в соответствии с общепринятыми методами.
Получение промежуточных соединений
Соединение (IV) может быть получено согласно следующей схеме А1.
Схема А1:

(В приведенной выше схеме LGA представляет собой уходящую группу и содержит галоген, такой как хлор, бром; замещенную сульфонилокси-группу, такую как трифторметилсульфонилокси, причем остальные символы имеют указанные выше значения.)
Соединение (А-1) можно аминировать с образованием соединения (А-2). Образовавшееся соединение можно гидролизовать с образованием соединения (IV).
Аминирование соединения (А-1) может быть осуществлено в подходящем растворителе (например, в ароматическом углеводороде, таком как толуол) с лигандом (например, фосфином, таким как 2,2′-бис(дифенилфосфино)-1,1′-бинафтил) или без него в присутствии бензофенонимина, палладиевого катализатора (например, трис(дибензилиденацетон)дипалладия) и основания (например, алкоксида щелочного металла, такого как трет-бутоксид натрия). Реакция может быть осуществлена при повышенной температуре, например от 80°С до 140°С.
Гидролиз соединения (А-2) может быть осуществлен путем обработки кислотой (например, неорганической кислотой, такой как хлористый водород) в подходящем растворителе (например, простом эфире, таком как тетрагидрофуран; воде или в их смеси). Реакция может быть осуществлена при пониженной температуре, комнатной температуре или повышенной температуре, например от 0°С до 60°С.
Соединение (IV-1), среди соединений (IV), может быть получено согласно следующей схеме А2.
Схема А2:

(В приведенной выше схеме символы имеют указанные выше значения).
Соединение (А-3) можно нитровать с образованием соединения (А-4). Образовавшееся соединение можно восстанавливать с образованием соединения (IV-1).
Нитрование соединения (А-3) может быть осуществлено без растворителя в присутствии нитрующего агента (например, нитрата калия) и кислоты (например, неорганической кислоты, такой как серная кислота). Реакция может быть осуществлена при комнатной температуре или повышенной температуре, например от 20°С до 100°С.
Восстановление соединения (А-4) может быть осуществлено в подходящем растворителе (например, спирте, таком как этанол; карбоновой кислоте, такой как уксусная кислота, или в их смеси) в присутствии восстановителя (например, железа(0)). Реакция может быть осуществлена при повышенной температуре, например от 60°С до 120°С.
Соединение (IV-2), среди соединений (IV), может быть получено согласно следующей схеме A3.
Схема A3:

(В приведенной выше схеме символы имеют указанные выше значения).
Соединение (А-5) можно алкенилировать с образованием соединения (А-6). Образовавшееся нитросоединение можно восстанавливать с образованием аминосоединения, и при последующей циклизации можно получить соединение (IV-2).
Алкенилирование соединения (А-5) может быть осуществлено в подходящем растворителе (например, в простом эфире, таком как тетрагидрофуран) в присутствии соответствующего эфира фосфоновой кислоты (например, замещенного диэтилфосфоната) и основания (например, алкоксида щелочного металла, такого как трет-бутоксид калия). Реакция может быть осуществлена при комнатной температуре или повышенной температуре, например от 20°С до 100°С.
Восстановление соединения (А-6) может быть осуществлено в подходящем растворителе (например, спирте, таком как этанол), в присутствии восстановителя (например, хлорида олова(II)). Реакция может быть осуществлена при повышенной температуре, например от 60°С до 100°С.
Циклизация образовавшегося аминосоединения может быть осуществлена в подходящем растворителе (например, спирте, таком как этанол), в присутствии основания (например, алкоксида щелочного металла, такого как этоксид натрия). Реакция может быть осуществлена при повышенной температуре, например от 60°С до 100°С.
Соединение (IV-3), среди соединений (IV), может быть получено согласно следующей схеме А4.
Схема А4:

(В приведенной выше схеме группа:

представляет собой бензол или моноциклический ароматический гетероцикл; группа:

является бициклическим ароматическим гетероциклом, содержащим (а) пиридин, конденсированный с бензолом; или (b) пиридин, конденсированный с моноциклическим ароматическим гетероциклом; R1A является водородом или необязательно замещенным алкилом; причем остальные символы имеют указанные выше значения.)
Соединение (А-7) можно алкилировать с образованием соединения (А-8). Образовавшееся соединение можно подвергнуть циклизации с образованием соединения (IV-3), в котором R1A является необязательно замещенным алкилом.
Соединение (А-7) можно подвергнуть циклизации с образованием соединения (IV-3), в котором R1A представляет собой водород.
Алкилирование соединения (А-7) может быть осуществлено в подходящем растворителе (например, простом эфире, таком как тетрагидрофуран; спирте, таком как этанол) в присутствии соответствующего галогеноалкила (например, алкилиодида или алкилбромида) и основания (например, литийорганического соединения, такого как бутиллитий; или алкоксида щелочного металла, такого как этоксид натрия). Реакция может быть осуществлена при низкой температуре или комнатной температур, например от -80°С до 20°С.
Циклизация соединения (А-7) или (А-8) может быть осуществлена в подходящем растворителе (например, карбоновой кислоте, такой как уксусная кислота) в присутствии бромистого водорода. Реакция может быть осуществлена при пониженной температуре или комнатной температуре, например от -20°С до 20°С.
Соединение (VIII-1), среди соединений (VIII), может быть получено согласно следующей схеме А5.
Схема А5:

(В приведенной выше схеме Е1, Е2, G1 и G2 означают СН, СН, N+O- и N, соответственно, или представляют собой N+O-, N, СН и СН, соответственно.)
Соединение (А-9) можно восстановить с образованием соединения (А-10). Образовавшееся соединение может быть превращено в пирролопиридин с образованием соединения (VIII-1).
Восстановление соединения (А-9) может быть осуществлено в подходящем растворителе (например, галогенуглеводороде, таком как хлороформ) в присутствии восстановителя (например, оксихлорид фосфора). Реакция может быть осуществлена при повышенной температуре, например от 40°С до 100°С.
Превращение соединения (А-10) в пирролопиридин может быть осуществлено в подходящем растворителе (например, простом эфире, таком как тетрагидрофуран) в присутствии винилирующего агента (например, винилмагнийбромида). Реакция может быть осуществлена при низкой температуре или комнатной температуре, например, от -40°С до 20°С.
Соединение (VI-1), среди соединений (VI), может быть получено согласно следующей схеме В1.
Схема В1:

(В приведенной выше схеме LGB1 представляет собой галоген (в частности, бром или йод), RB1 означает алкил, а остальные символы имеют указанные выше значения.)
Соединение (В-1) можно подвергнуть алкоксикарбонилированию с образованием соединения (В-2). Образовавшееся соединение можно восстановить с образованием соединения (VI-1).
Соединение (В-1) может подвергнуть формилированию с образованием соединения (В-3). Образовавшееся соединение можно восстановить с образованием соединения (VI-1).
Соединение (В-4) может быть этерифицировано с образованием соединения (В-2). Образовавшееся соединение можно восстановить с образованием соединения (VI-1).
Кроме того, соединение (В-4) может быть восстановлено с образованием соединения (VI-1).
Алкоксикарбонилирование соединения (В-1) может быть осуществлено в атмосфере монооксида углерода в подходящем растворителе (например, амиде, таком как N,N-диметилформамид или N,N-диметилацетамид) с лигандом (например, 1,1′-бис(дифенилфосфино)ферроценом) или без него в присутствии соответствующего спирта (RB1OH), основания (например, амина, такого как триэтиламин) и палладиевого катализатора (например, ацетата палладия). Реакция может быть осуществлена при повышенной температуре, например от 60°С до 120°С.
Восстановление соединения (В-2) может быть осуществлено в подходящем растворителе (например, ароматическом углеводороде, таком как толуол, ксилол; простом эфире, таком как тетрагидрофуран, диэтиловый эфир; спирте, таком как метанол, этанол, или в их смеси) в присутствии восстановителя (например, боргидрида лития, боргидрида натрия, литийалюминийгидрида, диизобутилалюминийгидрида). Реакция может быть осуществлена при низкой температуре или комнатной температур, например от -80°С до 20°С.
Формилирование соединения (В-1) может быть осуществлено путем обработки соединения (В-1) бутиллитием и затем N,N-диметилформамидом в подходящем растворителе (например, простом эфире, таком как тетрагидрофуран). Реакция может быть осуществлена при низкой температуре или комнатной температуре, например от -80°С до 20°С.
Восстановление соединения (В-3) может быть осуществлено с использованием вышеуказанного метода восстановления соединения (В-2).
Этерификация соединения (В-4) может быть осуществлена в присутствии тионилхлорида в растворе соответствующего спирта (RB1OH). Реакция может быть осуществлена при пониженной температуре или комнатной температуре, например от -20°С до 20°С.
В альтернативном варианте этерификация соединения (В-4) может быть осуществлена в подходящем растворителе (например, амиде, таком как N,N-диметилформамид) в присутствии соответствующего йодалкила (RB1I) и основания (например, карбоната щелочного металла, такого как карбонат калия). Реакция может быть осуществлена при комнатной температуре или повышенной температуре, например от 20°С до 60°С.
Восстановление соединения (В-4) может быть осуществлено в подходящем растворителе (например, простом эфире, таком как тетрагидрофуран) в присутствии восстановителя (например, боранового комплекса, такого как боран-тетрагидрофурановый комплекс или боран-диметилсульфидный комплекс). Реакция может быть осуществлена при пониженной температуре или комнатной температуре, например от -20°С до 20°С.
В альтернативном варианте восстановление соединения (В-4) может быть осуществлено путем обработки соединения (В-4) активатором (например, N,N′-карбодиимидазолом) с последующей обработкой восстановителем (например, боргидридом натрия) в подходящем растворителе (например, простом эфире, таком как тетрагидрофуран). Реакция может быть осуществлена при пониженной температуре, комнатной температуре или повышенной температуре, например от -20°С до 80°С.
Соединение (VI-2), среди соединений (VI), может быть получено согласно следующей схеме В2.
Схема В2:
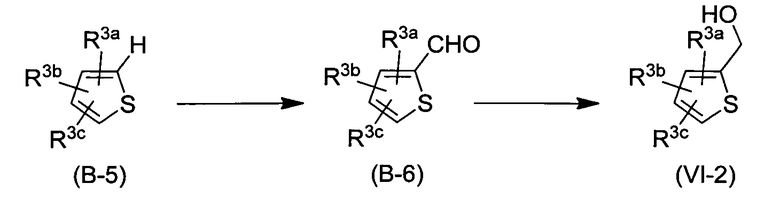
(В приведенной выше схеме символы имеют указанные выше значения.)
Соединение (В-5) можно подвергнуть формилированию с образованием соединения (В-6). Образовавшееся соединение можно восстановить с образованием соединения (VI-2).
Формилирование соединения (В-5) может быть осуществлено путем обработки соединения (В-5) основанием (например, амидом щелочного металла, таким как диизопропиламид лития), и затем формилирующим агентом (например, N,N-диметилформамидом) в подходящем растворителе (например, простом эфире, таком как тетрагидрофуран). Реакция может быть осуществлена при низкой температуре или комнатной температуре, например от -80°С до 20°С.
Восстановление соединения (В-6) может быть осуществлено с использованием вышеуказанного метода восстановления соединения (В-2).
Соединение (VI-3), среди соединений (VI), может быть получено согласно следующей схеме В3.
Схема В3:

(В приведенной выше схеме RB2 означает алкил, а остальные символы имеют указанные выше значения.)
Соединение (В-7) можно подвергнуть окислению с образованием соединения (В-8). Образовавшееся соединение можно цианировать с образованием соединения (В-9). Образовавшееся соединение можно восстановить с образованием соединения (В-10). Кроме того, образовавшееся соединение можно восстановить с образованием соединения (VI-3).
Окисление соединения (В-7) может быть осуществлено в подходящем растворителе (например, галогенуглеводороде, таком как дихлорметан) в присутствии окислителя (например, пероксикарбоновой кислоты, такой как метахлорпероксибензойная кислота). Реакция может быть осуществлена при пониженной температуре, комнатной температуре или повышенной температуре, например от 0°С до 50°С.
Цианирование соединения (В-8) может быть осуществлено в подходящем растворителе (например, галогенуглеводороде, таком как дихлорметан) в присутствии цианирующего агента (например, цианида тетрабутиламмония). Реакция может быть осуществлена при комнатной температуре или повышенной температуре, например от 20°С до 50°С.
Восстановление соединения (В-9) может быть осуществлено в подходящем растворителе (например, простом эфире, таком как тетрагидрофуран) в присутствии восстановителя (например, диизобутилалюминийгидрида). Реакция может быть осуществлена при низкой температуре, например от -80°С до 0°С.
Восстановление соединения (В-10) может быть осуществлено с использованием вышеуказанного метода восстановления соединения (В-2).
Соединение (VI-4), среди соединений (VI), может быть получено согласно следующей схеме В4.
Схема В4:

(В приведенной выше схеме RB3 представляет собой алкил, а остальные символы имеют указанные выше значения).
Соединение (В-11) может быть превращено в бензотиофен с образованием соединения (В-12). Образовавшееся соединение можно восстановить с образованием соединения (VI-4).
Соединение (В-12) можно гидролизовать с образованием соединения (В-13). Карбоксильная группа образовавшегося соединения может быть превращена в N-метокси-N-метиламид, с образованием в результате последующего восстановления соединения (В-14). Образовавшееся соединение можно восстановить с образованием соединения (VI-4).
Соединение (В-13) можно восстановить с образованием соединения (VI-4).
Превращение соединения (В-11) в бензотиофен может быть осуществлено в подходящем растворителе (например, амиде, таком как N,N-диметилформамид) в присутствии соответствующего эфира тиогликолевой кислоты и основания (например, карбоната щелочного металла, такого как карбонат калия). Реакция может быть осуществлена при повышенной температуре, например от 40°С до 80°С.
Восстановление соединения (В-12) может быть осуществлено с использованием вышеуказанного метода восстановления соединения (В-2).
Гидролиз соединения (В-12) может быть осуществлен с использованием вышеуказанного метода превращения соединения (I), в котором замещающая группа Х представляет собой алкоксикарбонил, и его промежуточного соединения в соединение (I), в котором замещающая группа Х является карбокси-группой, и его промежуточное соединение, соответственно.
Превращение соединения (В-13) в N-метокси-N-метиламид может быть осуществлено в подходящем растворителе (например, галогенуглеводороде, таком как дихлорметан, хлороформ или дихлорэтан) в присутствии амина (например, N,O-диметилгидроксиамина или гидрохлорида N,О-диметилгидроксиамина) и основания (например, органического основания, такого как триэтиламин). Последующее восстановление может быть осуществлено с использованием вышеуказанного метода восстановления соединения (В-9).
Восстановление соединения (В-14) может быть осуществлено с использованием вышеуказанного метода восстановления соединения (В-2).
Восстановление соединения (В-13) в соединение (VI-4) может быть осуществлено с использованием вышеуказанного метода восстановления соединения (В-4).
Соединение (VI-5), среди соединений (VI), может быть получено согласно следующей схеме В5.
Схема В5:

(В приведенной выше схеме p означает 1 или 2; группа

представляет собой: (а) бициклический ароматический углеводород, состоящий из бензола, конденсированного с моноциклическим алициклическим углеводородом; или (b) бициклический ароматический гетероцикл, состоящий из моноциклического ароматического гетероцикла, конденсированного с моноциклическим алициклическим углеводородом; а остальные символы имеют указанные выше значения.)
Соединение (В-15) можно восстановить с образованием соединения (VI-5).
Восстановление соединения (В-15) может быть осуществлено с использованием вышеуказанного метода восстановления соединения (В-2).
В альтернативном варианте восстановление соединения (В-15) может быть осуществлено в подходящем растворителе (например, простом эфире, таком как тетрагидрофуран) с катализатором (например, борсодержащим пятичленным циклическим соединением, таким как (2S)-1-(1,3,2-диоксаборолан-2-илокси)-3-метил-1,1-дифенилбутан-2-амин) или без него в присутствии восстановителя (например, боранового комплекса, такого как боран-тетрагидрофурановый комплекс или боран-диметилсульфидный комплекс). Реакция может быть осуществлена при низкой температуре или комнатной температуре, например от -40°С до 20°С.
Защита аминогруппы может быть осуществлена путем превращения аминогруппы, например, в трет-бутоксикарбонил.
Превращение аминогруппы в трет-бутоксикарбонил может быть осуществлено в подходящем растворителе (например, галогенуглеводороде, таком как дихлорметан) в присутствии ди-трет-бутилдикарбоната и катализатора (например, N,N-диметил-4-аминопиридина).
Удаление трет-бутилкарбонильной защитной группы может быть осуществлено путем обработки кислотой (например, хлористым водородом или трифторуксусной кислотой) в подходящем растворителе (например, простом эфире, таком как тетрагидрофуран) или без растворителя.
В альтернативном варианте удаление трет-бутилкарбонильной защитной группы может быть осуществлено в подходящем растворителе (например, смешанном растворителе диметилсульфоксид-вода) при повышенной температуре, например от 100°С до 150°С.
Защита гидроксильной группы может быть осуществлена путем превращения гидрокси-группы, например, в метоксиметил.
Превращение гидрокси-группы в метоксиметил может быть осуществлено в подходящем растворителе (например, галогенуглеводороде, таком как дихлорметан) в присутствии простого хлорметил-метилового эфира и основания (например, амина, такого как N,N-диизопропилэтиламин).
Удаление метоксиметильной защитной группы может быть осуществлено путем обработки кислотой (например, хлористым водородом) в подходящем растворителе (например, смешанном спиртовом растворителе, таком как этанол и вода).
Другие исходные материалы могут быть или доступными от производителей, или же их можно легко получить с использованием традиционных методов, известных из уровня техники.
Настоящее изобретение более подробно иллюстрируется следующими далее примерами, которые, однако, не ограничивают объем настоящего изобретения.
Примеры
В следующем разделе в примерах и таблицах Me означает метил, Et является этил и н-Pr означает пропил. Рацемические смеси можно разделить с использованием хиральной ВЭЖХ с получением оптически активных соединений.
Пример 1: Получение этил 4-({(4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил) бензоата

(1) К раствору 4-метилизохинолин-3-амина (2,00 г, 12,6 ммоль) в пиридине (50,6 мл) добавляют этиловый эфир 4-хлорсульфонилбензойной кислоты (3,30 г, 13,3 ммоль) при комнатной температуре. Смесь перемешивают при 80°С в течение 3 часов, и затем реакционный раствор концентрируют при пониженном давлении. Образовавшийся остаток разбавляют 2-молярным раствором хлористоводородной кислоты и водой, и дважды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 4:1→1:1 (градиент)), и затем промывают диизопропиловым эфиром с получением этил 4-{[(4-метилизохинолин-3-ил)амино]сульфонил}бензоата (4,29 г, 92%) в виде бледно-желтого порошка.
APCI-MS (масс-спектрометрия с химической ионизацией при атмосферном давлении) m/z: 371 [М+Н]+.
(2) К раствору указанного выше соединения (800 мг, 2,16 ммоль) в N,N-диметилформамиде (21,6 мл) добавляют карбонат калия (358 мг, 2,59 ммоль) и 1-(бромметил)-4-(трифторметокси)бензол (427 мкл, 2,59 ммоль) при комнатной температуре. Смесь перемешивают в течение ночи при комнатной температуре, и затем в реакционный раствор добавляют воду. Смесь дважды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 9:1→3:1) с получением этил 4-({(4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензоата (1,12 г, 95%) в виде бесцветного порошка.
APCI-MS m/z: 545 [M+H]+.
1Н-ЯМР (ДМСО-d6) δ 1,37 (3Н, т, J=7,3 Гц), 2,44 (3Н, с), 4,39 (2Н, кв, J=7,3 Гц), 4,45-5,30 (2Н, м), 7,20 (2Н, д, J=8,2 Гц), 7,30 (2Н, д, J=8,8 Гц), 7,74 (1Н, т, J=7,3 Гц), 7,81-7,88 (3Н, м), 8,05 (1Н, д, J=8,5 Гц), 8,10-8,18 (3Н, м), 9,00 (1Н, с).
Пример 2: Получение натриевой соли 4-({(4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты
Суспензию этил 4-({(4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензоата (1,11 г, 2,04 ммоль), приготовленного в примере 1, и 2-молярного водного раствора гидроксида натрия (1,02 мл, 2,04 ммоль) в этаноле (20,4 мл) нагревают при кипении (с обратным холодильником) в течение 1 часа. Реакционный раствор концентрируют при пониженном давлении, и образовавшийся остаток промывают диэтиловым эфиром и пентаном с получением натриевой соли 4-({(4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты (1,07 г, 94%) в виде бесцветного порошка.
ESI-MS m/z: 515 [M-Na]-.
1H-ЯМР (ДМСО-d6) δ 2,46 (3Н, с), 4,40-5,20 (2Н, м), 7,19 (2Н, д, J=8,0 Гц), 7,30 (2Н, д, J=8,7 Гц), 7,58 (2Н, д, J=8,3 Гц), 7,72 (1Н, т, J=7,1 Гц), 7,80-7,85 (1Н, м), 7,98 (2Н, д, J=8,7 Гц), 8,04 (1Н, д, J=8,7 Гц), 8,11 (1Н, д, J=8,0 Гц), 9,01 (1Н, с).
Пример 3: Получение этил 4-{[[3-фтор-4-(трифторметокси)-бензил](4-метилизохинолин-3-ил)амино]сульфонил}бензоата

К раствору этил 4-{[(4-метилизохинолин-3-ил)амино]сульфонил}-бензоата (80 мг, 0,22 ммоль), полученного в примере 1-(1), и [3-фтор-4-(трифторметокси)фенил]метанола (57 мг, 0,27 ммоль), полученного в ссылочном примере 1, в тетрагидрофуране (3 мл) добавляют трифенилфосфин (85 мг, 0,32 ммоль) при комнатной температуре. Указанный выше раствор охлаждают до 0°С, и затем туда добавляют диизопропилазодикарбоксилат (64 мкл, 0,32 ммоль). Смесь медленно нагревают до комнатной температуры и перемешивают при той же температуре в течение ночи. Реакционный раствор концентрируют при пониженном давлении, и образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 5:1→2:1) с получением этил 4-{[[3-фтор-4-(трифторметокси)бензил](4-метилизохинолин-3-ил)амино]сульфонил}бензоата (51 мг, 42%) в виде белого твердого вещества.
APCI-MS m/z: 563 [М+Н]+.
1Н-ЯМР (ДМСО-d6) δ 1,36 (3Н, т, J=7,0 Гц), 2,50 (3Н, с), 4,39 (2Н, кв, J=7,2 Гц), 4,68-5,01 (2Н, м), 7,18 (1Н, д, J=8,5 Гц), 7,33 (1Н, дд, J=10,9, 1,8 Гц), 7,43 (1Н, дд, J=8,5, 8,5 Гц), 7,75 (1Н, м), 7,83-7,88 (3Н, м), 8,09 (1Н, д, J=8,5 Гц), 8,13-8,15 (3Н, м), 9,01 (1Н, с).
Пример 4: Получение натриевой соли 4-{[[3-фтор-4-(трифторметокси)бензил](4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты

К суспензии этил 4-{[[3-фтор-4-(трифторметокси)бензил](4-метилизохинолин-3-ил)амино]сульфонил}бензоата (47 мг, 0,084 ммоль), приготовленного в примере 3, в этаноле (1 мл) добавляют 1-молярный водный раствор гидроксида натрия (167 мкл, 0,167 ммоль), и смесь перемешивают при комнатной температуре в течение ночи. В реакционный раствор добавляют воду (2 мл), и затем раствор подкисляют 6 молярным раствором хлористоводородной кислоты. Выпавшее в осадок твердое вещество фильтруют, промывают водой, и затем сушат при 60°С при пониженном давлении с получением белого твердого вещества (39,7 мг). Это твердое вещество повторно суспендируют в этаноле (1 мл), и затем туда добавляют 1-молярный водный раствор гидроксида натрия (73 мкл, 0,073 ммоль). Смесь перемешивают до растворения, и затем реакционный раствор концентрируют при пониженном давлении, а выпавшее в осадок твердое вещество сушат с получением натриевой соли 4-{[[3-фтор-4-(трифторметокси)бензил](4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты (42 мг, 89%) в виде белого твердого вещества.
ESI-MS m/z: 533 [M-Na]-.
1Н-ЯМР (ДМСО-d6) δ 2,52 (3Н, с), 4,68 (1Н, шир. с), 4,96 (1Н, шир. с), 7,18 (1Н, д, J=8,7 Гц), 7,33 (1Н, дд, J=11,2, 1,9 Гц), 7,42 (1Н, дд, J=8,0, 8,0 Гц), 7,73 (1Н, м), 7,56 (2Н, м), 7,84 (1Н, м), 7,97 (2Н, м), 8,07 (1Н, д, J=8,7 Гц), 8,12 (1Н, д, J=8,0 Гц), 9,11 (1Н, с).
Пример 5: Получение этил 4-({(4-хлор-1-метил-1Н-пирроло[2,3-с]пиридин-7-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензоата

(1) Смесь 4,7-дихлор-1-метил-1Н-пирроло[2,3-с]пиридина (153 мг, 760 мкмоль), полученного в ссылочном примере 2, и 4-(трифторметокси)бензиламина (1,45 г, 7,60 ммоль) перемешивают при 200°С в течение 6 ч при микроволновом облучении. После охлаждения в реакционный раствор добавляют 1-молярный водный раствор лимонной кислоты, и смесь дважды экстрагируют этилацетатом. Органические слои объединяют, промывают водой, фильтруют через диатомитовую колонку, и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 19:1→1:1) с получением 4-хлор-1-метил-N-[4-(трифторметокси)бензил]-1Н-пирроло[2,3-с]пиридин-7-амина (138 мг, 51%) в виде желтого вязкого вещества.
APCI-MS m/z: 356/358 [М+Н]+.
(2) К раствору указанного выше соединения (136 мг, 381 мкмоль) в пиридине (1,91 мл) добавляют этил 4-хлорсульфонилбензоат (190 мг, 763 мкмоль) при комнатной температуре, и смесь перемешивают при 80°С в течение 6 ч. Затем, туда же дополнительно вводят этил 4-хлорсульфонилбензоат (379 мг, 1,53 ммоль), и смесь перемешивают при 80°С в течение ночи. После охлаждения реакционный раствор разбавляют этилацетатом, промывают 1-молярным водным раствором лимонной кислоты, водой, насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом натрия, и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 19:1→4:1) с получением этил 4-({(4-хлор-1-метил-1Н-пирроло[2,3-с]пиридин-7-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензоата (51,1 мг, 24%) в виде бледно-желтого вязкого вещества.
APCI-MS m/z: 568/570 [M+H]+.
1Н-ЯМР (ДМСО-d6) δ 1,37 (3Н, т, J=7,3 Гц), 3,87 (3Н, с), 4,39 (2Н, кв, J=7,3 Гц), 4,59 (1Н, д, J=13,0 Гц), 5,07 (1Н, д, J=13,0 Гц), 6,56 (1Н, д, J=3,0 Гц), 7,20 (2Н, д, J=8,0 Гц), 7,25 (2Н, д, J=8,8 Гц), 7,66 (2Н, д, J=3,0 Гц), 7,85 (1Н, д, J=8,5 Гц), 7,97 (1Н, с), 8,16 (2Н, д, J=8,5 Гц).
Пример 6: Получение натриевой соли 4-({(4-хлор-1-метил-1Н-пирроло[2,3-с]пиридин-7-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты

Этил 4-({(4-хлор-1-метил-1Н-пирроло[2,3-с]пиридин-7-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензоат (50,7 мг, 89,3 мкмоль), приготовленный в примере 5, обрабатывают таким же образом, как в примере 2, с получением натриевой соли 4-({(4-хлор-1-метил-1Н-пирроло[2,3-с]пиридин-7-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты (49,4 мг, 98%) в виде бесцветного порошка.
ESI-MS (масс-спектрометрия с ионизацией электрораспылением) m/z: 538/540 [М-Na]-.
1Н-ЯМР (ДМСО-d6) δ 3,90 (3Н, с), 4,58 (1Н, д, J=13,2 Гц), 4,99 (1Н, д, J=13,2 Гц), 6,54 (1Н, д, J=3,2 Гц), 7,20 (2Н, д, J=8,0 Гц), 7,25 (2Н, д, J=8,7 Гц), 7,53 (2Н, д, J=8,3 Гц), 7,64 (1Н, д, J=2,9 Гц), 7,96-8,00 (3Н, м).
Пример 7: Получение этил 4-{[[(4′-фторбифенил-4-ил)метил](4-метилизохинолин-3-ил)амино]сульфонил}бензоата

(1) Этил 4-{[(4-метилизохинолин-3-ил)амино]сульфонил}бензоат, полученный в примере 1-(1) и 1-бром-4-(бромметил)бензол обрабатывают таким же образом, как в примере 1-(2), с получением этил 4-{[(4-бромбензил)(4-метилизохинолин-3-ил)амино]сульфонил}бензоата (469 мг, 79%) в виде бесцветного порошка.
APCI-MS m/z: 539 [M+H]+.
(2) К перемешиваемому раствору указанного выше соединения (110 мг, 0,2 ммоль), 4-фторфенилборной кислоты (33 мг, 0,22 ммоль) и тетракис(трифенилфосфин)-палладия(0) (5 мг, 0,004 ммоль) в 1,2-диметоксиэтане (2,0 мл) и воде (1,0 мл) добавляют карбонат натрия (33 мг, 0,3 ммоль), и смесь нагревают при кипении в течение 6 часов. В реакционный раствор добавляют воду, и смесь дважды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия, и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 9:1→3:1) с получением этил 4-{[[(4′-фторбифенил-4-ил)метил](4-метилизохинолин-3-ил)амино]сульфонил}бензоата (88,0 мг, 78%) в виде бесцветного порошка.
Пример 8: Получение 4-{[[(4′-фторбифенил-4-ил)метил](4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты

Суспензию этил 4-{[[(4′-фторбифенил-4-ил)метил](4-метилизохинолин-3-ил)амино]сульфонил}бензоата (88,0 мг, 0,16 ммоль), приготовленную в примере 7, и 1-молярный водный раствор гидроксида натрия (320 мкл, 0,32 ммоль) в метаноле (1,6 мл) перемешивают при комнатной температуре в течение ночи, и затем в реакционный раствор добавляют 2-молярный раствор хлористоводородной кислоты (400 мкл). Смесь дважды экстрагируют хлороформом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия, и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (хлороформ : метанол = 10:0→9:1) с получением 4-{[[(4′-фторбифенил-4-ил)метил](4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты (62,1 мг, 74%) в виде бесцветного порошка.
APCI-MS m/z: 527 [M+H]+.
1Н-ЯМР (ДМСО-d6) δ 2,49 (3Н, с), 4,50-5,15 (2Н, м), 7,19-7,28 (4Н, м), 7,50 (2Н, д, J=8,4 Гц), 7,58-7,63 (2Н, м), 7,70-7,74 (1Н, м), 7,80-7,86 (3Н, м), 8,03-8,06 (1Н, м), 8,11-8,15 (3Н, м), 9,01 (1Н, с).
Пример 9: Получение этил 4-({(1-циклопропил-4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензоата

(1) 1-Бром-4-метилизохинолин-3-амин, этиловый эфир 4-хлорсульфонилбензойной кислоты и 1-(бромметил)-4-(трифторметокси)бензол обрабатывают таким же образом, как в примерах 1-(1) и (2), с получением этил 4-({(1-бром-4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензоата в виде бесцветного твердого вещества.
APCI-MS m/z: 623/625 [M+H]+.
(2) Смесь указанного выше соединения (100 мг, 160 мкмоль), циклопропилтрифторбората калия (45,9 мг, 321 мкмоль), ацетата палладия (3,7 мг, 16,0 мкмоль), ди(1-адамантил)бутилфосфина (9,1 мг, 24,1 мкмоль), карбоната цезия (105 мг, 321 мкмоль), воды (80 мкл) и толуола (802 мкл) нагревают при кипении в атмосфере аргона в течение 3 часов. После охлаждения реакционный раствор разбавляют этилацетатом, фильтруют через диатомитовую колонку и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 19:1→17:3) с получением этил 4-({(1-циклопропил-4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензоата (93,0 мг, 99%) в виде бледно-желтого твердого вещества.
APCI-MS m/z: 585 [M+H]+.
1Н-ЯМР (ДМСО-d6) δ 0,25-0,95 (4Н, м), 1,37 (3Н, т, J=7,3 Гц), 2,38 (3Н, с), 2,73-2,82 (1Н, м), 4,40 (2Н, кв, J=7,3 Гц), 4,46-5,12 (2Н, м), 7,20 (2Н, д, J=8,2 Гц), 7,26 (2Н, д, J=8,8 Гц), 7,69-7,75 (1Н, м), 7,77-7,84 (3Н, м), 8,01 (1Н, д, J=8,2 Гц), 8,14 (2Н, д, J=8,5 Гц), 8,49 (1Н, д, J=8,2 Гц).
Пример 10: Получение натриевой соли 4-({(1-циклопропил-4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты

Смесь этил 4-({(1-циклопропил-4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензоата (92,0 мг, 157 мкмоль), приготовленного в примере 9, 2-молярного водного раствора гидроксида натрия (79 мкл, 157 мкмоль) и этанола (1,57 мл) нагревают при кипении в течение 1 ч. Реакционный раствор концентрируют при пониженном давлении, и образовавшийся остаток промывают диэтиловым эфиром и пентаном с получением натриевой соли 4-({(1-циклопропил-4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты (86,6 мг, 95%) в виде бесцветного порошка.
ESI-MS m/z: 555 [M-Na]-.
1Н-ЯМР (ДМСО-d6) δ 0,45-0,95 (4Н, м), 2,41 (3Н, с), 2,76-2,83 (1Н, м), 4,40-5,10 (2Н, м), 7,19 (2Н, д, J=8,0 Гц), 7,27 (2Н, д, J=8,7 Гц), 7,53 (2Н, д, J=8,7 Гц), 7,68-7,73 (1Н, м), 7,77-7,82 (1Н, м), 7,97-8,02 (3Н, м), 8,49 (1Н, д, J=8,3 Гц).
Пример 11: Получение этил 4-{[{[5-фтор-6-(трифторметил)пиридин-2-ил]метил}(4-метилизохинолин-3-ил)амино]сульфонил}бензоата

(1) Этил 4-{[(4-метилизохинолин-3-ил)амино]сульфонил}бензоат, полученный в примере 1-(1), и 6-(бромметил)-3-фтор-2-иодпиридин, полученный в ссылочном примере 3, обрабатывают таким же образом, как в примере 1-(2), с получением этил 4-{[[(5-фтор-6-иодпиридин-2-ил)метил](4-метилизохинолин-3-ил)амино]сульфонил}бензоата в виде бесцветного вязкого вещества.
APCI-MS m/z: 606 [М+Н]+.
(2) В перемешиваемый раствор указанного выше соединения (68 мг, 0,112 ммоль) в N,N-диметилформамиде (0,5 мл) и триамида гексаметилфосфорной кислоты (0,5 мл) добавляют метил 2,2-дифтор-2-(фторсульфонил)ацетат (104 мкл, 0,82 ммоль) и иодид меди(I) (156 мг, 0,82 ммоль) при комнатной температуре в атмосфере аргона. Реакционный раствор перемешивают при 70°С в течение ночи, охлаждают до комнатной температуры, и затем в реакционный раствор добавляют воду. Смесь дважды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 17:3→3:2) с получением этил 4-{[{[5-фтор-6-(трифторметил)пиридин-2-ил]метил}(4-метилизохинолин-3-ил)амино]сульфонил}бензоата (41 мг, 68%) в виде бесцветного порошка.
APCI-MS m/z: 548 [M+H]+.
1Н-ЯМР (CDCl3) δ 1,43 (3Н, т, J=7,3 Гц), 2,73 (3Н, с), 4,44 (2Н, кв, J=7,3 Гц), 5,02 (2Н, с), 7,44-7,49 (1Н, м), 7,63-7,66 (1Н, м), 7,73-7,76 (2Н, м), 7,78 (2Н, д, J=8,5 Гц), 7,93 (1Н, д, J=8,3 Гц), 8,03 (1Н, д, J=8,3 Гц), 8,16 (2Н, д, J=8,5 Гц), 8,82 (1Н, с).
Пример 12: Получение натриевой соли 4-{[{[5-фтор-6-(трифторметил)пиридин-2-ил]метил}(4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты

Этил 4-{[{[5-фтор-6-(трифторметил)пиридин-2-ил]метил}(4-метилизохинолин-3-ил)амино]сульфонил}бензоат (38 мг, 0,64 ммоль), приготовленный в примере 11, обрабатывают таким же образом, как в примере 2, с получением натриевой соли 4-{[{[5-фтор-6-(трифторметил)пиридин-2-ил]метил}(4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты (35 мг, 93%) в виде бесцветного порошка.
ESI-MS m/z: 518 [M-Na]-.
1Н-ЯМР (ДМСО-d6) δ 2,61 (3Н, с), 4,85 (1Н, шир. с), 5,10 (1Н, шир. с), 7,55 (2Н, д, J=8,7 Гц), 7,70-7,74 (1Н, м), 7,77-7,79 (1Н, м), 7,83-7,86 (1Н, м), 7,92-7,95 (1Н, м), 7,96 (2Н, д, J=8,3 Гц), 8,10 (2Н, д, J=8,7 Гц), 8,97 (1Н, с).
Пример 13: Получение этил 4-{[[4-(1-этокси-2,2,2-трифтор-1-метилэтил)бензил](4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты

(1) Этил 4-{[(4-метилизохинолин-3-ил)амино]сульфонил}бензоат, полученный в примере 1-(1), и 4-(2,2,2-трифтор-1-гидрокси-1-метилэтил)-бензиловый спирт обрабатывают таким же образом, как в примере 3, с получением этил 4-({(4-метилизохинолин-3-ил)[4-(2,2,2-трифтор-1-гидрокси-1-метилэтил)-бензил]амино}сульфонил)бензоата в виде бесцветного вязкого вещества.
APCI-MS m/z: 573 [М+Н]+.
(2) К раствору указанного выше соединения (100 мг, 0,18 ммоль) в N,N-диметилформамиде (2 мл) добавляют гидрид натрия (10,5 мг, 0,26 ммоль) при 0°С. Смесь перемешивают при 0°С в течение 30 минут, и затем туда же добавляют йодэтан (42 мкл, 0,52 ммоль) при той же температуре. Смесь перемешивают при комнатной температуре в течение ночи, и затем в реакционный раствор добавляют воду. Смесь дважды экстрагируют этилацетатом. Органические слои объединяют, дважды промывают водой, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 10:0→7:3) с получением этил 4-{[[4-(1-этокси-2,2,2-трифтор-1-метилэтил)бензил](4-метилизохинолин-3-ил)амино]сульфонил}бензоата (103 мг, 98%) в виде бесцветной жидкости.
APCI-MS m/z: 601 [М+Н]+.
1Н-ЯМР (400М Гц, ДМСО-d6) δ 1,00-1,13 (3Н, м), 1,37 (3Н, т, J=7,0 Гц), 1,66 (3Н, с), 2,39 (3Н, с), 2,89-3,05 (1Н, м), 3,29-3,41 (1Н, м), 4,39 (2Н, кв, J=7,0 Гц), 4,48-5,16 (2Н, м), 7,22 (2Н, д, J=8,5 Гц), 7,34 (2Н, д, J=8,2 Гц), 7,73 (1Н, т, J=7,3 Гц), 7,82 (1Н, д, J=8,5 Гц), 7,86 (2Н, д, J=8,5 Гц), 8,03 (1Н, д, J=8,5 Гц), 8,12-8,15 (3Н, м), 9,11 (1Н, с).
Пример 14: Получение 4-{[[4-(1-этокси-2,2,2-трифтор-1-метилэтил)бензил](4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты
В перемешиваемый раствор этил 4-{[[4-(1-этокси-2,2,2-трифтор-1-метилэтил)бензил](4-метилизохинолин-3-ил)амино]сульфонил}бензоата (102 мг, 0,17 ммоль), приготовленного в примере 13, в этаноле (1 мл) и тетрагидрофуране (1 мл) добавляют 2-молярный водный раствор гидроксида натрия (340 мкл, 0,68 ммоль) при комнатной температуре. Реакционный раствор перемешивают при комнатной температуре в течение ночи, и затем в реакционный раствор добавляют 2-молярный раствор хлористоводородной кислоты (1 мл). Смесь трижды экстрагируют хлороформом. Органические слои объединяют, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (хлороформ : метанол = 10:0→10:1) с получением 4-{[[4-(1-этокси-2,2,2-трифтор-1-метилэтил)бензил](4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты (82 мг, 85%) в виде бесцветного порошка.
APCI-MS m/z: 573 [М+Н]+.
1H-ЯМР (ДМСО-d6) δ 1,00-1,14 (3Н, м), 1,66 (3Н, с), 2,39 (3Н, с), 2,89-3,05 (1Н, м), 3,17-3,51 (1Н, м), 4,49-5,28 (2Н, м), 7,22 (2Н, д, J=8,5 Гц), 7,34 (2Н, д, J=8,2 Гц), 7,73 (1Н, т, J=7,3 Гц), 7,81-7,85 (3Н, м), 8,03 (1Н, д, J=8,8 Гц), 8,11-8,14 (3Н, м), 9,02 (1Н, с), 12,71-14,59 (1Н, м).
Примеры 15-37
Соответствующие исходные соединения обрабатывают таким же образом, как в примерах 1, 2 и/или 8, с получением следующих соединений из таблицы 1. Взаимные превращения соединений-карбоновых кислот и их солей друг в друга могут быть проведены по традиционным методикам получения солей и деминерализации, соответственно.






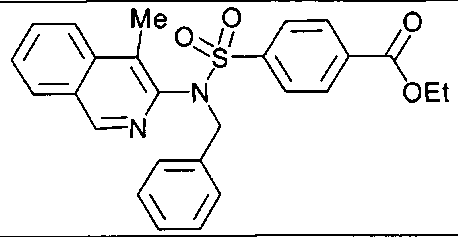
















Примеры 38-87
Соответствующие исходные соединения обрабатывают таким же образом, как в примерах 3, 4 и/или 8, с получением следующих соединений из таблицы 2. Взаимные превращения соединений-карбоновых кислот и их солей друг в друга могут быть проведены по традиционным методикам получения солей и деминерализации, соответственно.

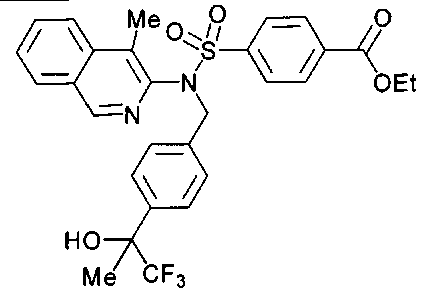














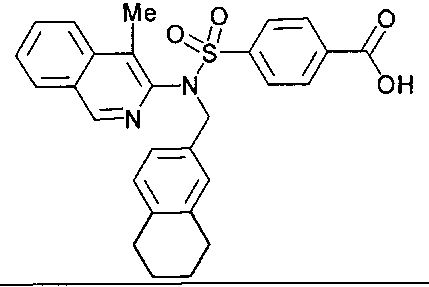


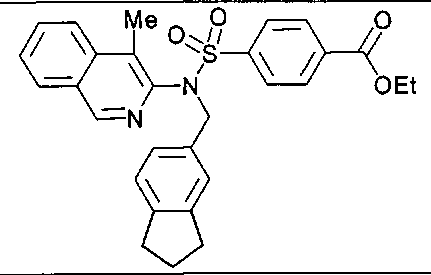





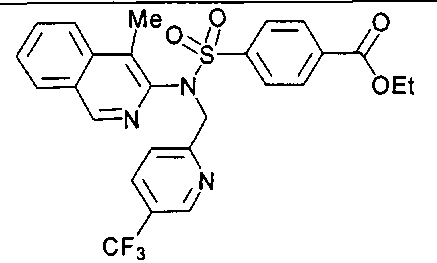
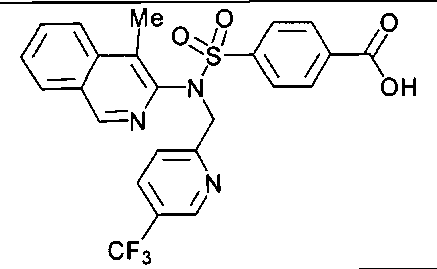



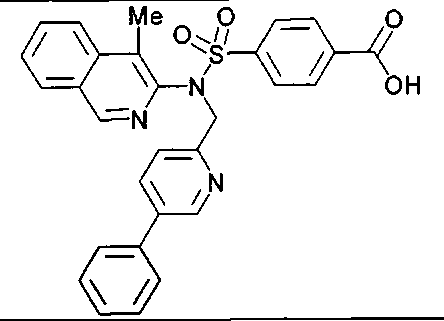



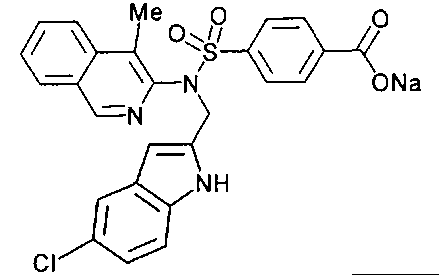



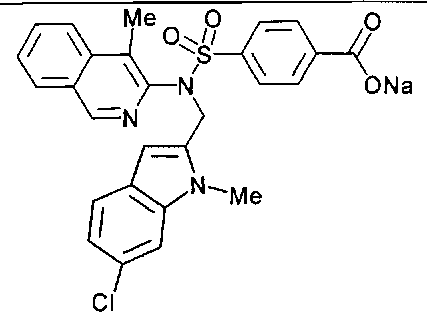









Примеры 88-91
Соответствующие исходные соединения обрабатывают таким же образом, как в примерах 7, 8 и/или 2, с получением следующих соединений из таблицы 3. Взаимные превращения соединений-карбоновых кислот и их солей друг в друга могут быть проведены по традиционным методикам получения солей и деминерализации, соответственно.




Примеры 92-95
Соответствующие исходные соединения обрабатывают таким же образом, как в примерах 9 и/или 10, с получением следующих соединений из таблицы 4. Взаимные превращения соединений-карбоновых кислот и их солей друг в друга могут быть проведены по традиционным методикам получения солей и деминерализации, соответственно.




Пример 96
Соответствующие исходные соединения обрабатывают таким же образом, как в примерах 13 и 14, с получением следующих соединений из таблицы 5. Взаимные превращения соединений-карбоновых кислот и их солей друг в друга могут быть проведены по традиционным методикам получения солей и деминерализации, соответственно.

Пример 97: Получение 4-({(4-метил-1-пропилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты

(1) Этил 4-({(1-бром-4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]-амино}сульфонил)бензоат (93,5 мг, 0,15 ммоль), полученный в примере 9-(1), и 1-пропенилборную кислоту обрабатывают таким же образом, как в примере 7-(2), с получением этил 4-({{4-метил-1-[(1E)-проп-1-ен-1-ил]изохинолин-3-ил}[4-(трифторметокси)бензил]амино}сульфонил) бензоат (86,9 мг, 99%) в виде бледно-желтого вязкого вещества.
APCI-MS m/z: 585 [M+H]+
(2) К раствору указанного выше соединения (86,9 мг, 0,149 ммоль) в тетрагидрофуране (5 мл) добавляют оксид платины (3,4 мг, 0,0149 ммоль), и смесь перемешивают в атмосфере водорода при комнатной температуре в течение 3 ч и фильтруют через диатомовую землю с использованием этилацетата. Фильтрат концентрируют при пониженном давлении с получением сырого этил 4-({(4-метил-1-пропилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензоата.
(3) Сырой продукт обрабатывают таким же образом, как в примере 14, с получением 4-({(4-метил-1-пропилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты (70,3 мг, 84%, выход для двух стадий) в виде белого порошка.
APCI-MS m/z: 559 [M+H]+
Пример 98: Получение этил 4-({(4-метил-1-пирролидин-1-илизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензоата

Смесь этил 4-({(1-бром-4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензоата (93,5 мг, 0,15 ммоль), приготовленного в примере 9-(1), пирролидина (0,015 мл, 0,18 ммоль), 2,2′-бис(дифенилфосфино)-1,1′-бинафтила (9,3 мг, 0,015 ммоль), трис(дибензилиденацетон)дипалладия (6,9 мг, 0,0075 ммоль) и трет-бутоксида натрия (20,2 мг, 0,21 ммоль) в толуоле (2 мл) перемешивают при 100°C в течение 4 ч в атмосфере аргона. Смесь охлаждают до комнатной температуры и затем фильтруют, и фильтрат концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (этилацетат/гексан=10%→25%) с получением этил 4-({(4-метил-1-пирролидин-1-илизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензоата (22,4 мг, 24%) в виде желтого вязкого вещества.
APCI-MS: m/z 614 [М+Н]+
Пример 99: Получение 4-({(4-метил-1-пирролидин-1-илизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты

Этил 4-({(4-метил-1-пирролидин-1-илизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензоат (22,4 мг, 0,0365 ммоль), приготовленный в примере 98, обрабатывают таким же образом, как в примере 14, с получением 4-({(4-метил-1-пирролидин-1-илизохинолин-3-ил)[4-(трифторметокси)бензил]амино}-сульфонил)бензойной кислоты (20,8 мг, 97%) в виде желтого порошка.
APCI-MS: m/z 586 [M+H]+
Пример 100: Получение 4-({(1-изопропокси-4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты

К суспензии этил 4-({(1-бром-4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензоата (93,5 мг, 0,15 ммоль), приготовленного в примере 9-(1), и гидрида натрия (60,0 мг, 1,5 ммоль) в тетрагидрофуране (2 мл) добавляют 2-пропанол (0,115 мл, 1,5 ммоль) в атмосфере аргона, и смесь нагревают при кипении в течение 4 ч. Смесь нейтрализуют 2-молярной хлористоводородной кислотой, и затем в нее добавляют хлороформ. Смесь перемешивают и затем разделяют. Органический слой концентрируют при пониженном давлении, и остаток очищают с помощью хроматографической колонки с силикагелем (метанол/хлороформ=2%→10%) с получением 4-({(1-изопропокси-4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты (53,1 мг, 58%) в виде коричневого порошка.
APCI-MS: m/z 575 [М+Н]+
Пример 101: Получение изопропил 4-({(5-хлоризохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты

(1) 1-Бром-5-хлоризохинолин-3-амин (258 мг, 1 ммоль), полученный в ссылочном примере 21, этил 4-хлорсульфонилбензоат и 1-(бромметил)-4-(трифторметокси)бензол обрабатывают таким же образом, как в примерах 1-(1) и (2), с получением этил 4-({(1-бром-5-хлоризохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензоата в виде коричневого твердого вещества.
APCI-MS: m/z 643/645/647 [М+Н]+
(2) Смесь указанного выше соединения (193 мг, 0,3 ммоль), ацетата палладия (3,4 мг, 0,015 ммоль), трифенилфосфина (15,7 мг, 0,06 ммоль) и карбоната калия (82,9 мг, 0,6 ммоль) в 2-пропаноле (2 мл) нагревают при кипении в течение 6 часов в атмосфере аргона. Реакционный раствор охлаждают до комнатной температуры, и туда же добавляют этилацетат. Смесь фильтруют, и удаляют нерастворимое вещество. Фильтрат концентрируют при пониженном давлении и затем очищают с помощью хроматографической колонки с силикагелем (этилацетат/гексан=10%→30%) с получением изопропил 4-({(5-хлоризохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензоата (81,2 мг, 47%) в виде бледно-желтого вязкого вещества.
APCI-MS: m/z 579/581 [М+Н]+
Пример 102: Получение 4-({(5-хлоризохинолин-3-ил)[4-(трифторметокси)-бензил]амино}сульфонил)бензойной кислоты

Изопропил 4-({(5-хлоризохинолин-3-ил)[4-(трифторметокси)бензил]-амино}сульфонил)бензоат (42,2 мг, 0,0729 ммоль), приготовленный в примере 101, обрабатывают таким же образом, как в примере 14, с получением 4-({(5-хлоризохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты (35,8 мг, 91%) в виде белого порошка.
APCI-MS: m/z 537/539 [M+H]+
Пример 103: Получение этил 4-({(4-циклопропилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензоата

Смесь этил 4-({(4-бромизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензоата (65,0 мг, 0,107 ммоль), приготовленного в примере 153, циклопропилбороновой кислоты (27,0 мг, 0,321 ммоль), ацетата палладия (2,5 мг, 0,011 ммоль), трициклогексилфосфина (5,9 мг, 0,021 ммоль) и трифосфата калия (79,0 мг, 0,375 ммоль) в воде (0,027 мл) и толуоле (0,54 мл) перемешивают в атмосфере аргона при 100°C в течение 5 ч. После охлаждения реакционный раствор разбавляют этилацетатом, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 95:5→65:35) с получением этил 4-({(4-циклопропилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензоата (46,7 мг, 78%) в виде белого порошка.
APCI-MS m/z: 571 [M+H]+.
Пример 104: Получение 4-({(4-циклопропилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты

Этил 4-({(4-циклопропилизохинолин-3-ил)[4-(трифторметокси)бензил]-амино}сульфонил)бензоат (46,0 мг, 0,081 ммоль), приготовленный в примере 103, обрабатывают таким же образом, как в примере 14, с получением 4-({(4-циклопропилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты (41,1 мг, 91%) в виде белого порошка.
APCI-MS m/z: 543 [М+Н]+.
Пример 105: Получение этил 4-({[4-(трифторметокси)бензил][4-(трифторметил)изохинолин-3-ил]амино}сульфонил)бензоата

(1) Изохинолин-3-амин и этил 4-хлорсульфонилбензоат обрабатывают таким же образом, как в примере 1-(1), с получением этил 4-[(изохинолин-3-иламино)сульфонил]бензоата в виде белого порошка.
APCI-MS m/z: 357 [M+H]+.
(2) Смесь указанного выше соединения (356,0 мг, 1,00 ммоль) и N-йодсукцинимида (337,0 мг, 1,50 ммоль) в уксусной кислоте (5 мл) перемешивают в атмосфере аргона при 80°C в течение 8 ч. Реакционный раствор охлаждают и затем концентрируют при пониженном давлении. Остаток разбавляют этилацетатом, промывают водным раствором гидрокарбоната натрия и насыщенным раствором соли и затем сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 19:1→3:2) с получением этил 4-{[(4-йодизохинолин-3-ил)амино]сульфонил}бензоата (250,0 мг, 52%) в виде бледно-красного порошка.
APCI-MS m/z: 483 [M+Н]+.
(3) Указанное выше соединение (96,0 мг, 0,20 ммоль) обрабатывают таким же образом, как в примере 1-(2), с получением этил 4-({(4-йодизохинолин-3-ил)[4-(трифторметокси) бензил]амино}сульфонил)бензоата (122,0 мг, 93%) в виде белого порошка.
APCI-MS m/z: 657 [M+H]+.
(4) Указанное выше соединение (116,0 мг, 0,18 ммоль) обрабатывают таким же образом, как в примере 11-(2), с получением этил 4-({[4-(трифторметокси)бензил][4-(трифторметил)изохинолин-3-ил]амино}сульфонил)бензоата (95,0 мг, 90%) в виде белого порошка.
APCI-MS m/z: 599 [M+H]+.
Пример 106: Получение 4-({[4-(трифторметокси)бензил][4-(трифторметил)изохинолин-3-ил]амино}сульфонил)бензойной кислоты

Этил 4-({[4-(трифторметокси)бензил][4-(трифторметил)изохинолин-3-ил]амино}сульфонил)бензоат (93,0 мг, 0,16 ммоль), приготовленный в примере 105, обрабатывают таким же образом, как в примере 14, с получением 4-({[4-(трифторметокси)бензил][4-(трифторметил)изохинолин-3-ил]амино}сульфонил)бензойной кислоты (77,7 мг, 88%) в виде белого порошка.
APCI-MS m/z: 571 [M+H]+.
Пример 107: Получение этил 4-({[4-метил-1-(трифторметил)изохинолин-3-ил][4-(трифторметокси)бензил]амино}сульфонил)бензоата

(1) Этил 4-({(1-бром-4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]-амино}сульфонил)бензоат (93,5 мг, 0,15 ммоль), приготовленный в примере 9-(1), обрабатывают таким же образом, как в ссылочном примере 3, с получением этил 4-({(1-йод-4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензоата 73,7 мг, 73%) в виде белого твердого вещества.
APCI-MS: m/z 671 [М+Н]+
(2) Указанное выше соединение (73,7 мг, 0,11 ммоль) обрабатывают таким же образом, как в примере 11-(2), с получением этил 4-({[4-метил-1-(трифторметил)изохинолин-3-ил][4-(трифторметокси)бензил]амино}сульфонил)-бензоата (52,7 мг, 78%) в виде белого твердого вещества.
APCI-MS: m/z 613 [М+Н]+
Пример 108: Получение 4-({[4-метил-1-(трифторметил)изохинолин-3-ил][4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты

Этил 4-({[4-метил-1-(трифторметил)изохинолин-3-ил][4-(трифторметокси)-бензил]амино}сульфонил)бензоат (52,7 мг, 0,086 ммоль), приготовленный в примере 107, обрабатывают таким же образом, как в примере 14, с получением 4-({[4-метил-1-(трифторметил)изохинолин-3-ил][4-(трифторметокси)бензил]амино}сульфонил)-бензойной кислоты (47,8 мг, 95%) в виде белого порошка.
APCI-MS: m/z 585 [М+Н]+
Пример 109: Получение этил 4-({[1-изопропил-4-(трифторметил)-изохинолин-3-ил][4-(трифторметокси)бензил]амино}сульфонил)бензоата

(1) 4-Йод-1-изопропилизохинолин-3-амин, полученный в ссылочном примере 25, этил 4-хлорсульфонилбензоат и 1-(бромметил)-4-(трифторметокси)бензол обрабатывают таким же образом, как в примерах 1-(1) и (2), с получением этил 4-({(4-йод-1-изопропилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензоата в виде белого порошка.
APCI-MS m/z: 699 [M+H]+.
(2) Указанное выше соединение обрабатывают таким же образом, как в примере 11-(2), с получением этил 4-({[1-изопропил-4-(трифторметил)изохинолин-3-ил][4-(трифторметокси)бензил]амино}сульфонил)бензоата в виде белого порошка.
APCI-MS m/z: 641 [М+Н]+.
Пример 110: Получение 4-({[1-изопропил-4-(трифторметил)изохинолин-3-ил][4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты

Этил 4-({[1-изопропил-4-(трифторметил)изохинолин-3-ил][4-(трифторметокси)бензил]амино}сульфонил)бензоат, полученный в примере 109, обрабатывают таким же образом, как в примере 14, с получением 4-({[1-изопропил-4-(трифторметил)изохинолин-3-ил][4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты в виде белого порошка.
APCI-MS m/z: 613 [M+H]+.
Пример 111: Получение этил 4-({(4-ацетилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензоата

Смесь этил 4-({(4-бромизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензоата (122,0 мг, 0,20 ммоль), приготовленного в примере 153, трибутил(1-этоксивинил)олова (94,0 мг, 0,26 ммоль) и дихлорбис(трифенилфосфин)палладия(II) (14,0 мг, 0,02 ммоль) в 1,4-диоксане (1 мл) нагревали при кипении в атмосфере аргона в течение 16 ч. После охлаждения реакционный раствор разбавляли этилацетатом и выливали в водный раствор фторида калия. Смесь перемешивали в течение 6 ч. Нерастворимое вещество отфильтровывали, и затем фильтрат экстрагировали этилацетатом. Органический слой промывали водой. Затем туда же добавляли 2-молярную хлористоводородную кислоту, и смесь перемешивали 3 дня. Затем органический слой отделяли, промывали водой и насыщенным раствором соли, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Образовавшийся остаток очищали с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 19:1→3:2) с получением этил 4-({(4-ацетилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензоата (53,4 мг, 47%) в виде белого порошка.
APCI-MS m/z: 573 [M+H]+.
Пример 112: Получение 4-({(4-ацетилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты
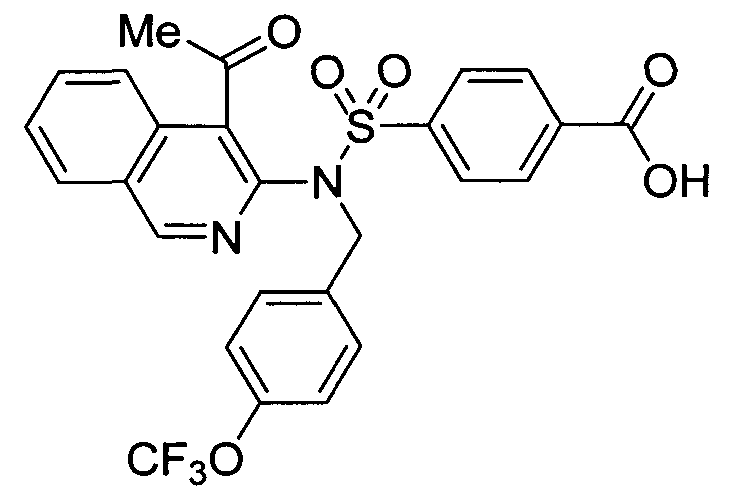
Этил 4-({(4-ацетилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензоат (51,0 мг, 0,089 ммоль), приготовленный в примере 111, обрабатывают таким же образом, как в примере 14, с получением 4-({(4-ацетилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты (36,9 мг, 76%) в виде белого порошка.
APCI-MS m/z: 545 [M+H]+.
Пример 113: Получение 4-({[4-(1-гидроксиэтил)изохинолин-3-ил][4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты

К раствору 4-({(4-ацетилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты (20,0 мг, 0,036 ммоль), приготовленной в примере 112, в этаноле (1 мл) добавляют боргидрид натрия (10,0 мг, 0,264 ммоль), и смесь перемешивают при комнатной температуре в течение 3 ч. В реакционный раствор добавляют 1-молярную хлористоводородную кислоту. Реакционный раствор концентрируют при пониженном давлении, и затем разбавляют этилацетатом, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (хлороформ : метанол = 10:0→9:1) с получением 4-({[4-(1-гидроксиэтил)изохинолин-3-ил][4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты (17,1 мг, 87%) в виде белого порошка.
APCI-MS m/z: 547 [M+H]+.
Пример 114: Получение этил 4-({[1-(1-гидроксиэтил)-4-метилизохинолин-3-ил][4-(трифторметокси)бензил]амино}сульфонил)бензоата

(1) Смесь этил 4-({(1-бром-4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензоата (93,5 мг, 0,15 ммоль), приготовленного в примере 9-(1), трибутил(1-этоксивинил)олова (0,061 мл, 0,18 ммоль) и дихлорбис(трифенилфосфин)палладия(II) (5,3 мг, 0,0075 ммоль) в 1,4-диоксане (2 мл) перемешивают при 80°C в течение 4 ч в атмосфере аргона. Реакционный раствор концентрируют при пониженном давлении, и остаток очищают хроматографически на силикагеле (этилацетат : гексан = 1:9→3:7) с получением сырого этил 4-({[1-(1-этоксивинил)-4-метилизохинолин-3-ил][4-(трифторметокси)бензил]амино}сульфонил)бензоата (152 мг) в виде бледно-желтого вязкого вещества.
(2) К раствору указанного выше сырого продукта в тетрагидрофуране (5 мл) добавляют 6-молярную хлористоводородную кислоту (0,5 мл), и смесь перемешивают при комнатной температуре в течение 24 ч. Реакционный раствор разбавляют водой и затем трижды экстрагируют этилацетатом. Органические слои объединяют, промывают насыщенным водным раствором гидрокарбоната натрия, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении с получением сырого этил 4-({(1-ацетил-4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензоата.
(3) К раствору указанного выше сырого продукта в этаноле (5 мл) добавляют боргидрид натрия (11,3 мг, 0,3 ммоль) при 0°C, и смесь перемешивают при той же температуре в течение 30 мин. Затем туда же добавляют насыщенный водный раствор хлористого аммония, и смесь концентрируют при пониженном давлении, чтобы удалить этанол, и затем трижды экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (этилацетат : гексан = 1:3→1:1) с получением этил 4-({[1-(1-гидроксиэтил)-4-метилизохинолин-3-ил][4-(трифторметокси)бензил]амино}сульфонил)бензоата (83,0 мг, 94%, выход для трех стадий) в виде бесцветного вязкого вещества.
APCI-MS: m/z 589 [M+H]+
Пример 115: Получение 4-({[1-(1-гидроксиэтил)-4-метилизохинолин-3-ил][4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты
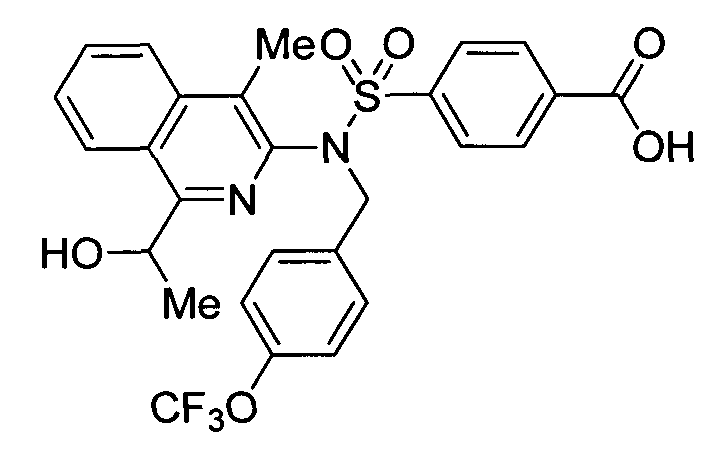
Этил 4-({[1-(1-гидроксиэтил)-4-метилизохинолин-3-ил][4-(трифторметокси)-бензил]амино}сульфонил)бензоат (83,0 мг, 0,141 ммоль), приготовленный в примере 114, обрабатывают таким же образом, как в примере 14, с получением 4-({[1-(1-гидроксиэтил)-4-метилизохинолин-3-ил][4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты (76,0 мг, 96%) в виде белого порошка.
APCI-MS: m/z 561 [М+Н]+
Пример 116: Получение этил 4-{[(1Н-индол-6-илметил)(4-метилизохинолин-3-ил)амино]сульфонил}бензоата

(1) Трет-бутил 6-(гидроксиметил)-1Н-индол-1-карбоксилат (770 мг, 3,1 ммоль) и этил 4-{[(4-метилизохинолин-3-ил)амино]сульфонил}бензоат (887 мг, 2,4 ммоль), полученный в примере 1-(1), обрабатывают таким же образом, как в примере 3, с получением трет-бутил 6-{[{[4-(этоксикарбонил)фенил]сульфонил}(4-метилизохинолин-3-ил)амино]метил}-1Н-индол-1-карбоксилата (789 мг, 55%) в виде бесцветного масла.
APCI-MS: m/z 600 [М+Н]+
(2) К раствору указанного выше соединения (789 мг, 1,32 ммоль) в диметилсульфоксиде (5,2 мл) добавляют воду (2,6 мл) при комнатной температуре, и смесь перемешивают при 120°C в течение 5 ч. Реакционный раствор охлаждают до комнатной температуры и затем в него добавляют воду. Смесь дважды экстрагируют этилацетатом. Органические слои объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 19:1→2:1) с получением этил 4-{[(1Н-индол-6-илметил)(4-метилизохинолин-3-ил)амино]сульфонил}бензоата (535 мг, 81%) в виде белого твердого вещества.
APCI-MS: m/z 500 [М+Н]+
Пример 117: Получение 4-{[(1Н-индол-6-илметил)(4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты

Этил 4-{[(1Н-индол-6-илметил)(4-метилизохинолин-3-ил)амино]сульфонил}бензоат (62 мг, 0,13 ммоль), приготовленный в примере 116, обрабатывают таким же образом, как в примере 8, с получением 4-{[(1Н-индол-6-илметил)(4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты (28 мг, 48%) в виде белого твердого вещества.
APCI-MS: m/z 472 [М+Н]+
Пример 118: Получение этил 4-{[[(1-метил-1Н-индол-6-ил)метил](4-метилизохинолин-3-ил)амино]сульфонил}бензоата
(1) (1-Метил-2,3-дигидро-1Н-индол-6-ил)метанол (245 мг, 1,50 ммоль), полученный в ссылочном примере 52, и этил 4-{[(4-метилизохинолин-3-ил)амино]сульфонил}бензоат (427 мг, 1,15 ммоль), полученный в примере 1-(1), обрабатывают таким же образом, как в примере 3, с получением этил 4-{[[(1-метил-2,3-дигидро-1Н-индол-6-ил)метил](4-метилизохинолин-3-ил)амино]сульфонил}бензоата (127 мг, 21%) в виде белого твердого вещества.
APCI-MS: m/z 516 [М+Н]+
(2) К раствору указанного выше соединения (125 мг, 0,24 ммоль) в 1,4-диоксане (12 мл) добавляют 2,3-дихлор-5,6-дициано-пара-бензохинон (61 мг, 0,26 ммоль) при комнатной температуре, и смесь перемешивают при комнатной температуре в течение 3 дней. В реакционный раствор добавляют насыщенный водный раствор бикарбоната натрия, и смесь перемешивают в течение 3 ч, и затем фильтруют через диатомитовую землю. Нерастворимое вещество отфильтровывают. Фильтрат дважды экстрагируют этилацетатом. Органические слои объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 9:1→3:1) с получением этил 4-{[[(1-метил-1Н-индол-6-ил)метил](4-метилизохинолин-3-ил)амино]сульфонил}бензоата (87 мг, 70%) в виде белого твердого вещества.
APCI-MS: m/z 514 [М+Н]+
Пример 119: Получение 4-{[[(1-метил-1Н-индол-6-ил)метил](4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты

Этил 4- {[[(1-метил-1Н-индол-6-ил)метил](4-метилизохинолин-3-ил)амино]сульфонил}бензоат (83 мг, 0,16 ммоль), приготовленный в примере 118, обрабатывают таким же образом, как в примере 8, с получением 4-{[[(1-метил-1Н-индол-6-ил)метил](4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты (65 мг, 83%) в виде белого твердого вещества.
MS: 486 [M+H]+, APCI
Пример 120: Получение этил 4-{[[(3-хлор-1Н-индол-6-ил)метил](4-метилизохинолин-3-ил)амино]сульфонил}бензоата

К раствору этил 4-{[(1Н-индол-6-илметил)(4-метилизохинолин-3-ил)амино]сульфонил}бензоата (177 мг, 0,36 ммоль), приготовленного в примере 116, в тетрагидрофуране (1,8 мл) добавляют N-хлорсукцинимид (57 мг, 0,43 ммоль) при комнатной температуре, и смесь перемешивают в течение 17 ч. Реакционный раствор концентрируют при пониженном давлении, и образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 5:1→1:1) с получением этил 4-{[[(3-хлор-1Н-индол-6-ил)метил](4-метилизохинолин-3-ил)амино]сульфонил}бензоата (124 мг, 65%) в виде белого твердого вещества.
APCI-MS: m/z 534/536 [М+Н]+
Пример 121: Получение 4-{[[(3-хлор-1Н-индол-6-ил)метил](4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты

Этил 4-{[[(3-хлор-1Н-индол-6-ил)метил](4-метилизохинолин-3-ил)амино]сульфонил}бензоат (32 мг, 0,06 ммоль), приготовленный в примере 120, обрабатывают таким же образом, как в примере 8, с получением 4-{[[(3-хлор-1Н-индол-6-ил)метил](4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты (8 мг, 28%) в виде белого твердого вещества.
APCI-MS: m/z 506/508 [М+Н]+
Пример 122: Получение 4-{[[(3-хлор-1-метил-1Н-индол-6-ил)метил](4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты

(1) К раствору этил 4-{[[(3-хлор-1Н-индол-6-ил)метил](4-метилизохинолин-3-ил)амино]сульфонил}бензоата (81 мг, 0,15 ммоль), приготовленного в примере 120, в N,N-диметилформамиде (1 мл) добавляют гидрид натрия (9 мг, 0,22 ммоль) при 0°C, и смесь перемешивают при той же температуре в течение 30 мин. В реакционный раствор добавляют метилиодид (29 мкл, 0,46 ммоль), и смесь перемешивают при комнатной температуре в течение 18 ч. В реакционный раствор добавляют воду, и смесь дважды экстрагируют этилацетатом. Органические слои объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 9:1→2:1) с получением сырого этил 4-{[[(3-хлор-1-метил-1Н-индол-6-ил)метил](4-метилизохинолин-3-ил)амино]сульфонил}бензоата (53,0 мг) в виде бесцветного порошка.
(2) Сырой продукт обрабатывают таким же образом, как в примере 8, с получением 4-{[[(3-хлор-1-метил-1Н-индол-6-ил)метил](4-метилизохинолин-3-ил)амино]сульфонил}-бензойной кислоты (38 мг, 48%, выход для двух стадий) в виде белого твердого вещества.
APCI-MS: m/z 520/522 [М+Н]+
Пример 123: Получение 4-({(4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензамида
К раствору натриевой соли 4-({(4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты (100 мг, 0,186 ммоль), приготовленной в примере 2, хлористого аммония (50 мг, 0,929 ммоль) и N,N-диизопропилэтиламина (162 мкл, 0,929 ммоль) в N,N-диметилацетамиде (1,8 мл) добавляют 2-(1Н-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилуроний-гексафторфосфат метанаминия (85 мг, 0,223 ммоль) при 0°C, и смесь перемешивают при комнатной температуре в течение ночи. В реакционный раствор добавляют насыщенный водный раствор гидрокарбоната натрия, и смесь трижды экстрагируют этилацетатом. Органические слои объединяют, дважды промывают водой и концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (хлороформ : метанол = 100:0→91:9) с получением 4-({(4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензамида (26 мг, 27%) в виде бесцветного порошка.
APCI-MS: m/z 516 [М+Н]+
Пример 124: Получение N-метокси-4-({(4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензамида
К суспензии натриевой соли 4-({(4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты (107,7 мг, 0,200 ммоль), приготовленной в примере 2, в хлороформе (1 мл) добавляют оксалилдихлорид (21 мкл, 0,240 ммоль), и смесь перемешивают при комнатной температуре в течение 2 ч. Затем туда же дополнительно вводят оксалилдихлорид (21 мкл, 0,24 ммоль), и смесь перемешивают при комнатной температуре в течение 1 ч. Реакционный раствор концентрируют при пониженном давлении. Затем образовавшийся остаток суспендируют в хлороформе (1 мл) и добавляют по каплям в суспензию гидрохлорида O-метилгидроксиламина (50,1 мг, 0,600 ммоль) и триэтиламина (139 мкл, 1,00 ммоль) в хлороформе (1 мл), и смесь перемешивают при комнатной температуре в течение 1 ч. Образовавшийся остаток очищают с использованием хроматографической колонки с силикагелем (гексан : этилацетат = 3:1→0:10) с получением N-метокси-4-({(4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензамида (88,1 мг, 81%) в виде белого порошка.
APCI-MS m/z: 546 [М+Н]+.
Пример 125: Получение 4-(1-гидрокси-1-метилэтил)-N-(4-метилизохинолин-3-ил)-]N-[4-(трифторметокси)бензил]бензолсульфонамида
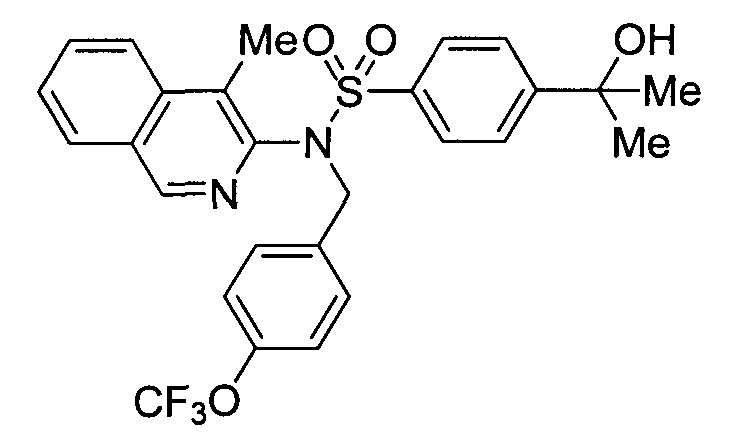
К раствору 4-ацетил-N-(4-метилизохинолин-3-ил)-N-[4-(трифторметокси)бензил]-бензолсульфонамида (98 мг, 0,190 ммоль), приготовленного в примере 152, в диэтиловом эфире (2 мл) добавляют метилмагнийбромид (раствор в тетрагидрофуране, 3 моль/л, 0,229 ммоль) при 0°C, и смесь перемешивают при комнатной температуре в течение ночи. В реакционный раствор добавляют 1-молярную хлористоводородную кислоту, и смесь трижды экстрагируют этилацетатом. Органические слои объединяют и концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 80:20→40:60) с получением (1-гидрокси-1-метилэтил)-N-(4-метилизохинолин-3-ил)-N-[4-(трифторметокси)бензил]бензолсульфонамида (83 мг, 82%) в виде бесцветного порошка.
APCI-MS m/z: 531 [М+Н]+.
Примеры 126-158
Соответствующие исходные соединения обрабатывают таким же образом, как в примерах 1, 2 и/или 8, с получением следующих соединений из таблицы 6. Взаимные превращения соединений-карбоновых кислот и их солей друг в друга могут быть проведены по традиционным методикам получения солей и деминерализации, соответственно.








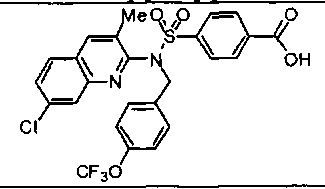
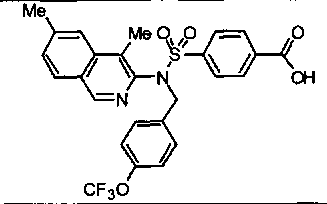


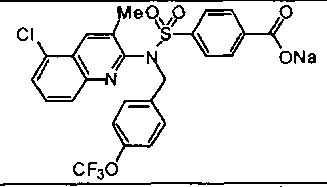


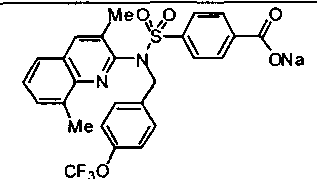




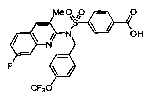
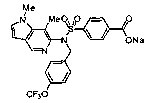








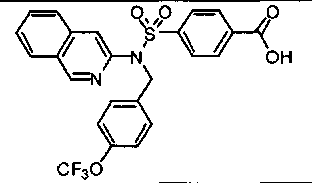


Примеры 159-210
Соответствующие исходные соединения обрабатывают таким же образом, как в примерах 3, 4 и/или 8, с получением следующих соединений из таблицы 7. Взаимные превращения соединений-карбоновых кислот и их солей друг в друга могут быть проведены по традиционным методикам получения солей и деминерализации, соответственно.






















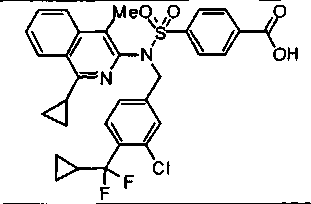












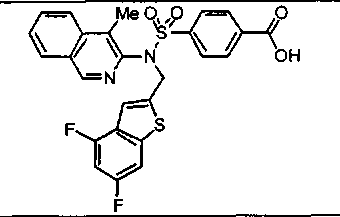




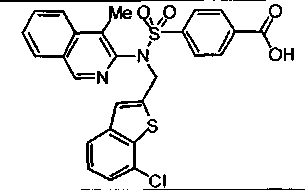











Примеры 211 и 212
Соответствующие исходные соединения обрабатывают таким же образом, как в примерах 5, 6 и/или 8, с получением следующих соединений из таблицы 8. Взаимные превращения соединений-карбоновых кислот и их солей друг в друга могут быть проведены по традиционным методикам получения солей и деминерализации, соответственно.


Примеры 213-218
Соответствующие исходные соединения обрабатывают таким же образом, как в примерах 8, 9 и/или 10, чтобы получить следующие соединения в таблице 9. Взаимные превращения соединений-карбоновых кислот и их солей друг в друга могут быть проведены по традиционным методикам получения солей и деминерализации, соответственно.


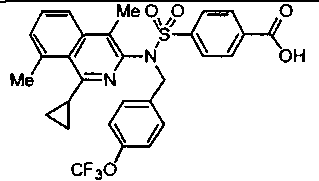



Примеры 219-224
Соответствующие исходные соединения обрабатывают таким же образом, как в примерах 8, 13 и/или 14, с получением следующих соединений из таблицы 10. Взаимные превращения соединений-карбоновых кислот и их солей друг в друга могут быть проведены по традиционным методикам получения солей и деминерализации, соответственно.






Примеры 225-227
Соответствующие исходные соединения обрабатывают таким же образом, как в примере 97, с получением следующих соединений из таблицы 11. Взаимные превращения соединений-карбоновых кислот и их солей друг в друга могут быть проведены по традиционным методикам получения солей и деминерализации, соответственно.
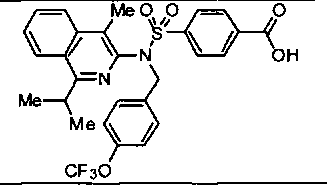

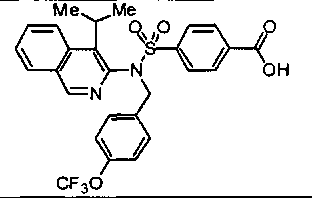
Примеры 228-229
Соответствующие исходные соединения обрабатывают таким же образом, как в примере 100, с получением следующих соединений из таблицы 12. Взаимные превращения соединений-карбоновых кислот и их солей друг в друга могут быть проведены по традиционным методикам получения солей и деминерализации, соответственно.


Пример 230
Соответствующие исходные соединения обрабатывают таким же образом, как в примерах 101 и 102, с получением следующих соединений из таблицы 13. Взаимные превращения соединений-карбоновых кислот и их солей друг в друга могут быть проведены по традиционным методикам получения солей и деминерализации, соответственно.
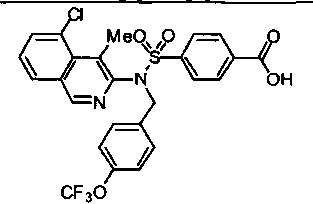
Примеры 231 и 232
Соответствующие исходные соединения обрабатывают таким же образом, как в примерах 103 и 104, с получением следующих соединений из таблицы 14. Взаимные превращения соединений-карбоновых кислот и их солей друг в друга могут быть проведены по традиционным методикам получения солей и деминерализации, соответственно.


Примеры 233-235
Соответствующие исходные соединения обрабатывают таким же образом, как в примерах 105 и 106, с получением следующих соединений из таблицы 15. Взаимные превращения соединений-карбоновых кислот и их солей друг в друга могут быть проведены по традиционным методикам получения солей и деминерализации, соответственно.



Примеры 236 и 237
Соответствующие исходные соединения обрабатывают таким же образом, как в примерах 120, 121 и/или 122, с получением следующих соединений из таблицы 16. Взаимные превращения соединений-карбоновых кислот и их солей друг в друга могут быть проведены по традиционным методикам получения солей и деминерализации, соответственно.
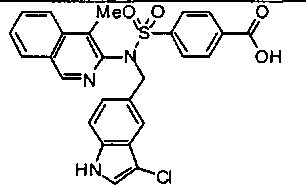
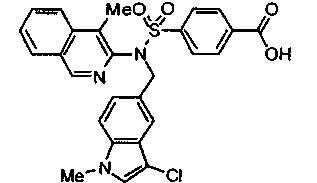
Примеры 238-240
Соответствующие исходные соединения обрабатывают таким же образом, как в примере 123, с получением следующих соединений из таблицы 17.



Примеры 241-242
Соответствующие исходные соединения обрабатывают таким же образом, как в примере 124, с получением следующих соединений из таблицы 18.
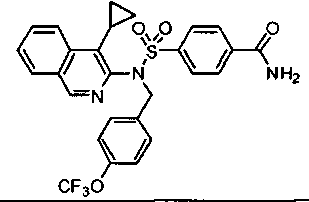

Ссылочный пример 1:
Получение [3-фтор-4-(трифторметокси)фенил]метанола

(1) К раствору 3-фтор-4-(трифторметокси)бензойной кислоты (1,00 г, 4,46 ммоль) в этаноле (10 мл) добавляют тионилхлорид (1,33 г, 11,2 ммоль) при 0°C. Реакционный раствор медленно нагревают до комнатной температуры и перемешивают при той же температуре в течение ночи. Реакционный раствор выливают в насыщенный водный раствор бикарбоната натрия и дважды экстрагируют этилацетатом. Органические слои объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 10:0→9:1) с получением этил 3-фтор-4-(трифторметокси)бензоата (0,72 г, 64%) в виде бесцветного и прозрачного масла.
1Н-ЯМР (ДМСО-d6) δ 1,33 (3Н, т, J=7,1 Гц), 4,35 (2Н, кв, J=7,1 Гц), 7,77-7,73 (1Н, м), 7,92-7,90 (1Н, м), 8,00 (1Н, дд, J=10,6, 1,9 Гц).
(2) К раствору указанного выше соединения (698 мг, 2,77 ммоль) в тетрагидрофуране (7 мл) добавляют литийалюминийгидрид (79 мг, 2,08 ммоль) при 0°C. Смесь перемешивают при той же температуре в течение 30 мин и перемешивают при комнатной температуре 5 ч. Реакционный раствор охлаждают до 0°C, и затем туда же добавляют диэтиловый эфир и 1-молярный водный раствор гидроксида натрия (10 мл). Смесь перемешивают при той же температуре в течение 15 мин. Реакционный раствор дважды экстрагируют диэтиловым эфиром. Органические слои объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 6:1→2:1) с получением указанного в заголовке соединения - [3-фтор-4-(трифторметокси)-фенил]метанола (0,52 г, 90%) в виде бесцветного и прозрачного масла.
1Н-ЯМР (ДМСО-d6) δ 4,53 (2Н, д, J=5,4 Гц), 5,44 (1Н, т, J=5,7 Гц), 7,26 (1Н, м), 7,40 (1Н, дд, J=11,5, 1,5 Гц), 7,53-7,49 (1Н, м).
Ссылочный пример 2:
Получение 4,7-дихлор-1-метил-1Н-пирроло[2,3-с]пиридина

(1) К раствору 2,5-дихлор-3-нитропиридина (5,00 г, 25,9 ммоль) в тетрагидрофуране (164 мл) добавляют 1-молярный раствор винилмагнийбромида в тетрагидрофуране (82,9 мл, 82,9 ммоль) при -78°C. Смесь перемешивают при -20°C в течение ночи и затем в реакционный раствор добавляют насыщенный водный раствор хлористого аммония. Смесь дважды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 19:1→7:3) и затем промывают диизопропиловым эфиром с получением 4,7-дихлор-1Н-пирроло[2,3-с]пиридина (1,12 г, 23%) в виде бледно-желтого порошка.
APCI-MS m/z: 187/189 [M+Н]+.
(2) К раствору указанного выше соединения (150 мг, 802 мкмоль) в диметилсульфоксиде (4,01 мл) добавляют карбонат калия (228 мг, 1,60 ммоль) и йодметан (100 мкл, 1,60 ммоль) при комнатной температуре. Смесь перемешивают при той же температуре в течение ночи, и затем в реакционный раствор добавляют воду. Смесь дважды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, фильтруют через диатомитовую колонку и затем концентрируют при пониженном давлении с получением указанного в заголовке соединения - 4,7-дихлор-1-метил-1Н-пирроло[2,3-с]пиридина (156 мг, 97%) в виде желтого твердого вещества.
APCI-MS m/z: 201/203 [M+H]+.
Ссылочный пример 3:
Получение 6-(бромметил)-3-фтор-2-йодпиридина

(1) К раствору 2-бром-3-фтор-6-метилпиридина (1000 мг, 5,26 ммоль) в 1,4-диоксана (16 мл) добавляют иодид натрия (1580 мг, 10,52 ммоль), иодид меди(I) (150 мг, 0,26 ммоль), N,N′-диметилэтилендиамин (62 мкл, 0,58 ммоль) в атмосфере аргона. Реакционный раствор нагревают при кипении в течение 4 ч, охлаждают до комнатной температуры и затем в реакционный раствор добавляют воду. Смесь дважды экстрагируют этилацетатом. Органические слои объединяют, промывают водным раствором лимонной кислоты и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении с получением 3-фтор-2-йод-6-метилпиридина (1169 мг, 94%) в виде белого порошка.
APCI-MS m/z: 238 [M+H]+.
(2) К раствору указанного выше соединения (100 мг, 0,42 ммоль) в 1,2-дихлорэтане (2 мл) добавляют N-бромсукцинимид (86 мг, 0,49 ммоль) и 2,2′-азобисизобутиронитрил (3 мг, 0,015 ммоль), и смесь перемешивают при 75°C в течение ночи. Смесь охлаждают до комнатной температуры, и затем в реакционный раствор добавляют насыщенный водный раствор бикарбоната натрия. Смесь дважды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 97:3→9:1) с получением указанного в заголовке соединения - 6-(бромметил)-3-фтор-2-йодпиридин. Образовавшееся соединение используют на следующей стадии без дополнительной очистки.
Ссылочный пример 4:
Получение 4-(2-метоксиэтокси)бензил 4-метилбензолсульфоната

(1) К раствору 4-(2-метоксиэтокси)бензойной кислоты (100 мг, 0,51 ммоль) в N,N-диметилформамиде (2 мл) добавляют карбонат калия (282 мг, 2,04 ммоль) и йодметан (79 мкл, 1,27 ммоль) при комнатной температуре. Смесь перемешивают при той же температуре в течение ночи, и затем в реакционный раствор добавляют воду. Смесь дважды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток растворяют в тетрагидрофуране (3 мл) и затем туда же добавляют боргидрид лития (53 мг, 2,45 ммоль) при 0°C. Реакционный раствор медленно нагревают до комнатной температуры и перемешивают в течение 3 дней. В реакционный раствор добавляют воду, и смесь дважды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении с получением [4-(2-метоксиэтокси)фенил]метанола (61 мг, 68%) в виде бесцветного и прозрачного масла.
APCI-MS m/z: 200[M+NH4]+.
(2) К раствору указанного выше соединения (58 мг, 0,32 ммоль) в дихлорметане (1,5 мл) добавляют пара-толуолсульфонилхлорид (79 мг, 0,41 ммоль), N,N-диизопропилэтиламин (162 мкл, 0,95 ммоль) и N,N-диметил-4-аминопиридин (8 мг, 0,064 ммоль) при 0°C. Реакционный раствор медленно нагревают до комнатной температуры и перемешивают в течение 7 ч. В реакционный раствор добавляют воду, и смесь дважды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении с получением указанного в заголовке соединения - 4-(2-метоксиэтокси)бензил 4-метилбензолсульфонат. Образовавшееся соединение используют на следующей стадии без дополнительной очистки.
Ссылочный пример 5:
Получение [4-фтор-5-(трифторметил)-2-тиенил]метанола

(1) К раствору N,N-диизопропиламина (680 мкл, 5,19 ммоль) в тетрагидрофуране (5 мл) добавляют по каплям 1,67-молярный раствор н-бутиллития в гексане (3,11 мл, 5,19 ммоль) при -78°C в атмосфере аргона, и смесь перемешивают при той же температуре в течение 15 мин. Реакционный раствор медленно нагревают до 0°C и перемешивают в течение 20 мин и затем охлаждают до -40°C. Затем туда же добавляют по каплям раствор 3-бром-2-(трифторметил)тиофена (1000 мг, 4,33 ммоль) в тетрагидрофуране (15 мл). Смесь перемешивают при той же температуре 20 мин, и реакционный раствор медленно нагревают до -10°C и затем перемешивают в течение 5 мин. Реакционный раствор охлаждают -40°C и затем туда же добавляют по каплям N,N-диметилформамид (1 мл). Затем смесь медленно нагревают до 0°C и перемешивают в течение ночи. В реакционный раствор добавляют воду, и смесь дважды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 10:0→9:1) с получением 4-бром-5-(трифторметил)тиофен-2-карбальдегида (527 мг, 47%) в виде желтого масла.
1Н-ЯМР (CDCl3) δ 7,71 (1Н, м), 9,93 (1Н, с).
(2) К раствору указанного выше соединения (520 мг, 2,01 ммоль) в этаноле (10 мл) добавляют боргидрид натрия (152 мг, 4,02 ммоль) при 0°C. Смесь перемешивают при этой же температуре 1 ч, и затем в реакционный раствор добавляют воду. Смесь дважды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия, и затем концентрируют при пониженном давлении с получением [4-бром-5-(трифторметил)-2-тиенил]метанола (432 мг, 82%) в виде бледно-желтого масла.
1Н-ЯМР (CDCl3) δ 2,01 (1Н, т, J=6,0 Гц), 4,84 (2Н, д, J=6,0 Гц), 6,96 (1Н, с).
(3) К раствору указанного выше соединения (427 мг, 1,64 ммоль) в дихлорметане (6 мл) добавляют хлорметил-метиловый эфир (311 мкл, 4,09 ммоль) и N,N-диизопропилэтиламин (1289 мкл, 7,38 ммоль) при комнатной температуре. Смесь перемешивают при этой температуре в течение 3 дней и затем в реакционный раствор добавляют воду. Смесь дважды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 10:0→9:1) с получением 3-бром-5-[(метоксиметокси)метил]-2-(трифторметил)тиофена (363 мг, 73%) в виде бесцветного и прозрачного масла.
1Н-ЯМР (CDCl3) δ 3,41 (3Н, с), 4,70 (2Н, с), 4,72 (2Н, с), 6,97 (1Н, с).
(4) К раствору указанного выше соединения (358 мг, 1,17 ммоль) в тетрагидрофуране (4 мл) добавляют по каплям 1,67-молярный раствор н-бутиллития в гексане (0,84 мл, 1,41 ммоль) при -78°C в атмосфере аргона. Смесь перемешивают при этой температуре в течение 90 мин, и затем туда же добавляют раствор N-фторбензол-сульфонимида (553 мг, 1,76 ммоль) в тетрагидрофуране (6 мл). Реакционный раствор медленно нагревают до комнатной температуры и перемешивают в течение ночи. В реакционный раствор добавляют воду, и смесь дважды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 10:0→19:1) с получением смеси приблизительно 1:1 3-фтор-5-[(метоксиметокси)метил]-2-(трифторметил)тиофена и 2-[(метоксиметокси)метил]-5-(трифторметил)тиофена. Образовавшуюся смесь растворяют в этаноле (2 мл), и затем туда добавляют 6-молярный раствор хлористоводородной кислоты (1 мл) при комнатной температуре. Смесь перемешивают при комнатной температуре в течение ночи, и затем реакционный раствор подщелачивают путем добавления насыщенного водного раствора гидрокарбоната натрия, и затем дважды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 4:1→3:2) с получением указанного в заголовке соединения - [4-фтор-5-(трифторметил)-2-тиенил]метанола (34 мг, 15%) в виде бесцветного и прозрачного масла.
1Н-ЯМР (CDCl3) δ 2,01 (1Н, т, J=6,0 Гц), 4,81 (2Н, д, J=6,0 Гц), 6,76 (1Н, с).
Ссылочный пример 6:
Получение [4-(циклопропокси)фенил]метанола

(1) К раствору 1-бром-4-(циклопропокси)бензола (492 мг, 2,31 ммоль) в тетрагидрофуране (10 мл) добавляют по каплям 2,66-молярный раствор н-бутиллития в гексане (0,955 мл, 2,54 ммоль) при -78°C в атмосфере аргона, и смесь перемешивают 2,5 часа. Затем туда добавляют по каплям N,N-диметилформамид (0,358 мл, 4,62 ммоль) при той же температуре, и смесь перемешивают в течение 3,5 ч при медленном нагревании до комнатной температуры. В реакционный раствор добавляют насыщенный водный раствор хлористого аммония, и смесь перемешивают и затем трижды экстрагируют этилацетатом. Органические слои объединяют, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении с получением сырого 4-(циклопропокси)бензальдегида в виде бледно-желтой жидкости. Образовавшееся соединение используют на следующей стадии без дополнительной очистки.
(2) Раствор указанного выше сырого продукта в метаноле (5 мл) охлаждают до 0°C, и затем туда добавляют боргидрид натрия (175 мг, 4,62 ммоль), и смесь перемешивают 1 час. Затем туда же добавляют насыщенный раствор соли, и затем реакционный раствор концентрируют при пониженном давлении. Образовавшийся остаток растворяют в этилацетате, промывают насыщенным раствором соли, и органический слой сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся сырой продукт очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 9:1→3:2) с получением указанного в заголовке соединения - [4-(циклопропокси)фенил]метанола (216 мг, 57%, выход на двух 2 стадиях) в виде белого твердого вещества.
APCI-MS m/z: 182 [M+NH4]+.
Ссылочный пример 7:
Получение [4-(циклопропилметил)фенил]метанола

1-Бром-4-(циклопропилметил)бензол обрабатывают таким же образом, как в Ссылочных примерах 6-(1) и (2) с получением указанного в заголовке соединения.
APCI-MS m/z: 180 [M+NH4]+.
Ссылочный пример 8:
Получение (1,1-диметил-2,3-дигидро-1Н-инден-5-ил)метанола

1,1-Диметилиндан-5-карбальдегид, приготовленный в соответствии со способом из документа WO 2006/013048 A1, обрабатывают таким же образом, как в Ссылочном примере 6-(2) с получением указанного в заголовке соединения.
APCI-MS m/z: 194 [M+NH4]+.
Ссылочный пример 9:
Получение (3,3-диметил-2,3-дигидро-1-бензофуран-6-ил)метанола

К раствору метил 3,3-диметил-2,3-дигидро-1-бензофуран-6-карбоксилата (44 мг, 0,21 ммоль), приготовленного в соответствии со способом из документа US 2009/105209, в тетрагидрофуране (1,5 мл) добавляют боргидрид лития (23 мг, 1,07 ммоль) и метанол (43 мкл, 1,07 ммоль) при 0°C, и смесь перемешивают при комнатной температуре 1 час. В реакционный раствор добавляют воду, и смесь дважды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении с получением указанного в заголовке соединения (38 мг, 100%) в виде бесцветного и прозрачного масла.
APCI-MS m/z: 196 [M+NH4]+.
Ссылочный пример 10:
Получение (1,1-диметил-1,3-дигидро-2-бензофуран-5-ил)метанола

5-Бром-1,1-диметил-1,3-дигидро-2-бензофуран, приготовленный в соответствии со способом из документа US 2010/197591 A1, обрабатывают таким же образом, как в Ссылочных примерах 6-(1) и (2) с получением указанного в заголовке соединения.
APCI-MS m/z 196 [M+NH4]+.
Ссылочный пример 11:
Получение (2,2-диметил-2,3-дигидро-1Н-инден-5-ил)метанола

2,2-Диметилиндан-5-карбальдегид, приготовленный в соответствии со способом из документа US 4952722, обрабатывают таким же образом, как в Ссылочном примере 6-(2) с получением указанного в заголовке соединения.
APCI-MS m/z: 194 [M+NH4]+.
Ссылочный пример 12:
Получение 4-хлор-3-метилхинолин-2-амина

(1) Раствор 2,4-дихлор-3-метилхинолина (1,08 г, 5,1 ммоль), трис(дибензилиденацетон)дипалладия (12 мг, 0,0025 ммоль), 2,2′-бис(дифенилфосфино)-1,1′-бинафтила (32 мг, 0,01 ммоль) и трет-бутоксида натрия (735 мг, 7,6 ммоль) в толуоле (51 мл) перемешивают при комнатной температуре 5 мин. В раствор добавляют бензофенонимин (852 мкл, 5,1 ммоль), и смесь перемешивают при 100°C в течение 4 ч. Реакционный раствор охлаждают до комнатной температуры и затем туда же добавляют диэтиловый эфир (10 мл). Смесь перемешивают 10 мин. Раствор фильтруют через диатомитовую землю и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан→тексан : этилацетат = 10:1) с получением сырого 4-хлор-N-(дифенилметилен)-3-метилхинолин-2-амина (910 мг, 50%) в виде желтого твердого вещества.
(2) Указанное выше сырое соединение (910 мг, 2,6 ммоль) растворяют в тетрагидрофуране (10 мл), и затем туда же добавляют 1-молярный раствор хлористоводородной кислоты (2 мл), и смесь перемешивают при комнатной температуре 1 час. Затем туда же вводят дополнительно 1-молярный раствор хлористоводородной кислоты (1 мл), и смесь перемешивают в течение 30 мин. К раствору добавляют насыщенный водный раствор бикарбоната натрия, и смесь дважды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 3:1→1:1) с получением 4-хлор-3-метилхинолин-2-амина (261 мг, 53%) в виде белого твердого вещества.
APCI-MS m/z: 193/195 [М+Н]+.
Ссылочный пример 13:
Получение 1,7-диметил-1Н-пирроло[3,2-с]пиридин-6-амина

(1) К раствору 6-хлор-7-йод-1Н-пирроло[3,2-с]пиридина (600 мг, 2,15 ммоль) в N,N-диметилформамиде (8 мл) добавляют 60%-ный гидрид натрия (130 мг, 3,25 ммоль) в атмосфере аргона, и смесь перемешивают при комнатной температуре 1 ч. Реакционный раствор охлаждают до 0°C, и затем туда же добавляют по каплям диметилсульфат (250 мкл, 2,64 ммоль). После этого смесь перемешивают при комнатной температуре 3 ч. В реакционный раствор добавляют воду и затем смесь трижды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 97:3→75:25) с получением 6-хлор-7-йод-1-метил-1Н-пирроло[3,2-с]пиридина (540 мг, 86%) в виде бесцветного порошка.
APCI-MS m/z: 293/295 [M+H]+.
(2) К раствору указанного выше соединения (650 мг, 2,22 ммоль) в тетрагидрофуране (13 мл) добавляют по каплям 1,65-молярный раствор н-бутиллития в гексане (1,75 мл, 2,89 ммоль) при -78°C в атмосфере аргона. Смесь перемешивают при указанной температуре в течение 2 ч, и затем туда же добавляют по каплям раствор йодметана (180 мкл, 2,89 ммоль) в тетрагидрофуране (4 мл), и смесь перемешивают при той же температуре 1 ч. Реакционный раствор медленно нагревают до 10°C, и затем в реакционный раствор добавляют воду, и смесь трижды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 95:5→65:35) с получением 6-хлор-1,7-диметил-1Н-пирроло[3,2-с]пиридина (204 мг, 51%) в виде бесцветного порошка.
APCI-MS m/z 181/183 [М+Н]+.
(3) Суспензию указанного выше соединения (200 мг, 1,11 ммоль), бензофенонимин (560 мкл, 3,35 ммоль), трис(дибензилиденацетон)дипалладий (100 мг, 0,11 ммоль), 2,2′-бис(дифенилфосфино)-1,1′-бинафтил (140 мг, 0,22 ммоль) и трет-бутоксид натрия (320 мг, 3,33 ммоль) в толуоле (10 мл) перемешивают при 110°C в течение 15 ч при микроволновом облучении. После охлаждения в реакционный раствор добавляют воду, и смесь трижды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия, и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 98:2→40:60) с получением N-(дифенилметилен)-1,7-диметил-1Н-пирроло[3,2-с]пиридин-6-амина (244 мг, 68%) в виде желтого порошка.
APCI-MS m/z: 316 [M+H]+.
(4) К раствору указанного выше соединения (240 мг, 0,74 ммоль) в тетрагидрофуране (10 мл) добавляют 1-молярный раствор хлористоводородной кислоты (3,70 мл, 3,70 ммоль), и смесь перемешивают при комнатной температуре 2 ч. Реакционный раствор подщелачивают путем добавления насыщенного водного раствора гидрокарбоната натрия, и затем туда же добавляют хлорид натрия, и смесь экстрагируют этилацетатом шесть раз. Органические слои объединяют, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (NH-силикагель, хлороформ : метанол = 100:0→95:5) с получением 1,7-диметил-1Н-пирроло[3,2-с]пиридин-6-амин (106 мг, 90%) в виде бледно-желтого порошка.
APCI-MS m/z: 162 [M+H]+.
Ссылочный пример 14:
Получение 4-метоксиизохинолин-3-амина

(1) К раствору 4-метоксиизохинолина (130 мг, 0,82 ммоль) в 98%-ный серной кислоте (0,61 мл) добавляют нитрат калия (91 мг, 0,90 ммоль), и смесь нагревают до 60°C и перемешивают в течение 2 ч. Реакционный раствор охлаждают, и затем в раствор добавляют лед. Порошок отфильтровывают и растворяют в этилацетате. Полученный раствор промывают водным раствором гидрокарбоната натрия и насыщенным раствором соли, затем сушат над безводным сульфатом натрия и после этого концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 9:1→2:8) с получением 4-метокси-3-нитроизохинолина (58,3 мг, 35%) в виде бледно-желтого порошка.
APCI-MS m/z: 205 [M+H]+.
(2) В перемешиваемый раствор указанного выше соединения (67,0 мг, 0,33 ммоль) в уксусной кислоте (3,3 мл) и этаноле (3,3 мл) добавляют восстановленное железо (183,0 мг, 3,28 ммоль), и смесь нагревают при кипении в атмосфере аргона в течение 2 ч. Реакционный раствор охлаждают и затем разбавляют этилацетатом, промывают насыщенным водным раствором гидрокарбоната натрия. Затем нерастворимое вещество отфильтровывают. Фильтрат промывают насыщенным раствором соли и затем сушат над безводным сульфатом натрия и после этого концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 3:1→1:3) с получением 4-метоксиизохинолин-3-амина (48,1 мг, 84%) в виде белого порошка.
APCI-MS m/z: 175 [M+H]+.
Ссылочный пример 15:
Получение 5-хлор-3-метилхинолин-2-амина

(1) Раствор диэтил(1-цианоэтилового)эфира фосфоновой кислоты (1,26 г, 8,5 ммоль) в тетрагидрофуране (20 мл) охлаждают до 0°C, и затем туда добавляют трет-бутоксид калия (744 мг, 8,5 ммоль). Смесь перемешивают при указанной температуре 10 мин. Затем туда же добавляют 2-хлор-6-нитробензальдегид (948 мг, 6,6 ммоль), и затем смесь перемешивают при 60°C в течение 5 ч. Реакционный раствор охлаждают до комнатной температуры, и затем в реакционный раствор добавляют насыщенный водный раствор бикарбоната натрия, и смесь дважды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан→гексан : этилацетат = 3:1) с получением 3-(2-хлор-6-нитрофенил)-2-метилакрилонитрила (0,98 г, 86%) в виде желтого масла.
APCI-MS m/z: 240/242 [M+NH4]+.
(2) К раствору указанного выше соединения (2,0 г, 9 ммоль) в этаноле (180 мл) добавляют дигидрат хлористого олова(II) (12,2 г, 54 ммоль) при комнатной температуре, и смесь нагревают при кипении в течение 45 мин. Раствор охлаждают до комнатной температуры и затем туда добавляют насыщенный водный раствор хлористоводородной кислоты (15 мл), и смесь нагревают при кипении в течение 6 ч. Раствор охлаждают до комнатной температуры, и медленно добавляют по каплям в насыщенный водный раствор бикарбоната натрия. Суспензию фильтруют через диатомитовую землю, и образовавшийся раствор дважды экстрагируют хлороформом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. К раствору образовавшегося остатка в этаноле (50 мл) добавляют этоксид натрия (535 мг, 13,5 ммоль) при комнатной температуре, и затем смесь нагревают при кипении в течение 4 ч. Затем туда же добавляют этоксид натрия (357 мг, 9 ммоль), и затем смесь нагревают при кипении в течение 17 ч. Реакционный раствор охлаждают до комнатной температуры, и затем в реакционный раствор добавляют воду, и смесь дважды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 3:1→1:1) с получением 5-хлор-3-метилхинолин-2-амина (457 мг, 26%) в виде бледно-коричневого твердого вещества.
APCI-MS m/z: 193/195 [M+H]+.
Ссылочный пример 16:
Получение 4,5-диметилизохинолин-3-амина

(1) Раствор этоксида натрия (8,76 мл, 23,5 ммоль, 21 мас.% раствор) в этаноле (10 мл) охлаждают до 0°C в атмосфере аргона, и туда же добавляют по каплям раствор 3-бром-2-(цианометил)бензонитрила (4,33 г, 19,6 ммоль) и йодметана (1,46 мл, 23,5 ммоль) в тетрагидрофуране (10 мл) в течение 30 мин, и затем смесь перемешивают при комнатной температуре 6,5 ч. Смесь концентрируют при пониженном давлении, и затем остаток нейтрализуют 2-молярной хлористоводородной кислотой, и трижды экстрагируют этилацетатом. Органические слои объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (этилацетат/гексан=10%→40%) с получением 3-бром-2-(1-цианоэтил)бензонитрила (3,11 г, 67%) в виде желтого вязкого вещества.
APCI-MS: m/z 252/254 [M+NH4]+.
(2) Указанное выше соединение (3,11 г, 13,2 ммоль), триметилбороксин (1,85 мл, 13,2 ммоль), тетракис(трифенилфосфин)палладий(0) (306 мг, 0,265 ммоль) и карбонат калия (5,49 г, 39,7 ммоль) перемешивают в N,N-диметилформамиде (10 мл) при 120°C в течение 6 ч в атмосфере аргона. Смесь охлаждают до комнатной температуры, и затем в нее добавляют воду, смесь перемешивают и трижды экстрагируют этилацетатом. Органические слои объединяют, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (этилацетат/гексан=10%→40%) с получением 2-(1-цианоэтил)-3-метилбензонитрила (1,99 г, 89%) в виде коричневого твердого вещества.
APCI-MS: m/z 188 [M+H]+.
(3) Суспензию указанного выше соединения (1,99 г, 11,7 ммоль) в уксусной кислоте (1 мл) охлаждают до 0°C, и затем туда же добавляют 25%-ный раствор бромистого водорода (5 мл, в уксусной кислоте), и смесь перемешивают 2 часа при нагревании до комнатной температуры. Смесь разбавляют диизопропиловым эфиром, и образовавшееся твердое вещество отфильтровывают. К образовавшемуся твердому веществу добавляют насыщенный водный раствор гидрокарбоната натрия, смесь перемешивают, и твердое вещество отфильтровывают и сушат с получением неочищенного продукта. Указанный продукт суспендируют и промывают диизопропиловым эфиром, и твердое вещество отфильтровывают, и затем сушат с получением 1-бром-4,5-диметилизохинолин-3-амина (843 мг, 29%) в виде желтого порошка.
APCI-MS: m/z 251/253 [М+Н]+.
(4) К раствору указанного выше соединения (843 мг, 3,36 ммоль) в смеси метанол-тетрагидрофуран (1:1, 10 мл) добавляют катализатор - 10% палладий - на угле (42,2 мг) и триэтиламин (0,561 мл, 4,03 ммоль), и смесь перемешивают при комнатной температуре 2 часа в атмосфере водорода. Смесь фильтруют через диатомовую землю, промывают этилацетатом, и фильтрат концентрируют при пониженном давлении. Остаток растворяют в этилацетате, и промывают насыщенным водным раствором гидрокарбоната натрия. Органический слой сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (этилацетат/гексан=25%→50%) с получением 4,5-диметилизохинолин-3-амина (456 мг, 79%) в виде желтого порошка.
APCI-MS: m/z 173 [М+Н]+.
Ссылочный пример 17:
Получение 4,6-диметилизохинолин-3-амина
4-Бром-2-(цианометил)бензонитрил обрабатывают таким же образом, как в Ссылочном примере 16-(1)-(4), с получением 4,6-диметилизохинолин-3-амина в виде бледно-желтого твердого вещества.
APCI-MS: m/z 173 [М+Н]+.
Ссылочный пример 18:
Получение 4,6-диметилизохинолин-3-амина

2-(Цианометил)-5-метилбензонитрил обрабатывают таким же образом, как в Ссылочном примере 16-(1), (3) и (4), с получением 4,7-диметилизохинолин-3-амина в виде желтого порошка.
APCI-MS: m/z 173 [М+Н]+.
Ссылочный пример 19:
Получение 4,8-диметилизохинолин-3-амина

2-(Цианометил)-6-метилбензонитрил обрабатывают таким же образом, как в Ссылочном примере 16-(1), (3) и (4), с получением 4,8-диметилизохинолин-3-амина в виде желтого порошка.
APCI-MS: m/z 173 [М+Н]+.
Ссылочный пример 20:
Получение 1-бром-5-хлор-4-метилизохинолин-3-амина

3-Хлор-2-(цианометил)бензонитрил обрабатывают таким же образом, как в Ссылочном примере 16-(1) и (3), с получением 1-бром-5-хлор-4-метилизохинолин-3-амина.
APCI-MS: m/z 271/273 [М+Н]+.
Ссылочный пример 21:
Получение 1-бром-5-хлоризохинолин-3-амина

3-Хлор-2-(цианометил)бензонитрил (883 г, 5 ммоль) обрабатывают таким же образом, как в Ссылочном примере 16-(3), с получением 1-бром-5-хлоризохинолин-3-амина (717 мг, 56%) в виде желтого порошка.
APCI-MS: m/z 257/259 [М+Н]+.
Ссылочный пример 22:
Получение 5-метил-1,7-нафтиридин-6-амина

(1) К раствору 3-(цианометил)пиридин-2-карбонитрила (синтезирован по методике, описанной в журнале: Synthesis 1973, 47; 530 мг, 3,70 ммоль) в тетрагидрофуране (14 мл) добавляют по каплям 1,65-молярный раствор н-бутиллития в гексане (2,60 мл, 4,29 ммоль) при -78°C в атмосфере аргона. Смесь перемешивают при указанной температуре 30 мин, и затем туда же добавляют по каплям йодметан (300 мкл, 4,81 ммоль) в тетрагидрофуране (7 мл). Смесь перемешивают при той же температуре 1 час. Реакционный раствор медленно нагревают до комнатной температуры, и затем в реакционный раствор добавляют воду, и смесь экстрагируют этилацетатом 4 раза. Органические слои объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 95:5→50:50) с получением 3-(1-цианоэтил)пиридин-2-карбонитрила (514 мг, 88%) в виде желтого масла.
APCI-MS m/z: 175 [M+NH4]+.
(2) Указанное выше соединение обрабатывают таким же образом, как в Ссылочном примере 16-(3) и (4), с получением 5-метил-1,7-нафтиридин-6-амина.
APCI-MS m/z: 160 [M+H]+.
Ссылочный пример 23:
Получение 4,7-дихлор-1-метил-1Н-пирроло[3,2-с]пиридина

(1) К раствору оксихлорида фосфора (6,40 мкл, 73,21 ммоль) в хлороформе (61,2 мл) добавляют 2,5-дихлор-4-нитропиридин-1-оксид (3,06 г, 14,64 ммоль), и смесь перемешивают при кипячении в течение ночи. Реакционный раствор выливают на лед, доводят значение pH 7 до 8, добавляя насыщенный водный раствор гидрокарбоната натрия, и трижды экстрагируют хлороформом. Органические слои объединяют, фильтруют через фазовый сепаратор (фирмы Varian Inc.) и затем концентрируют при пониженном давлении с получением сырого 2,5-дихлор-4-нитропиридина (2,98 г, колич. выход) в виде желтого масла.
(2) К раствору винилмагнийбромида (54,04 ммоль) в тетрагидрофуране (104 мл) добавляют раствор указанного выше сырого соединения (2,98 г, 15,44 ммоль) в тетрагидрофуране (100 мл) при 0°C в течение 40 мин, и смесь перемешивают при комнатной температуре в течение 1 ч. В реакционный раствор добавляют насыщенный водный раствор гидрокарбоната натрия, и смесь трижды экстрагируют этилацетатом. Органические слои объединяют, фильтруют через фазовый сепаратор (Varian Inc.) и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 80:20→50:50) с получением 4,7-дихлор-1Н-пирроло[3,2-с]пиридина (0,74 г, 27%) в виде бледно-желтого порошка.
APCI-MS m/z: 187/189 [M+H]+.
(3) К раствору указанного выше соединения (300 мг, 1,60 ммоль) в N,N-диметилформамиде (3 мл) добавляют карбонат калия (443 мг, 3,21 ммоль) и йодметан (150 мкл, 2,41 ммоль), и смесь перемешивают при комнатной температуре в течение ночи. В реакционный раствор добавляют воду, и смесь трижды экстрагируют этилацетатом. Затем органические слои объединяют и дважды промывают водой. Органический слой фильтруют через фазовый сепаратор (Varian Inc.) и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 100:0→70:30) с получением 4,7-дихлор-1-метил-1Н-пирроло[3,2-с]пиридина (240 мг, 75%) в виде бесцветного порошка.
APCI-MS m/z: 201/203 [М+Н]+.
Ссылочный пример 24:
Получение 4-бром-1-изопропилизохинолин-3-амина

(1) 1-Бромизохинолин-3-амин и пинаколиновый эфир изопропенилбороновой кислоты обрабатывают таким же образом, как в примерах 97-(1) и (2), с получением 1-изопропилизохинолин-3-амина в виде белого порошка.
APCI-MS m/z: 187 [M+H]+.
(2) Раствор указанного выше соединения (186,0 мг, 1,00 ммоль) и N-бромсукцинимида (214,0 мг, 1,20 ммоль) в метаноле перемешивают при комнатной температуре 1 ч. Реакционный раствор концентрируют при пониженном давлении, и образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 10:0→3:1) с получением 4-бром-1-изопропилизохинолин-3-амина (155,1 мг, 58%) в виде белого порошка.
APCI-MS m/z: 265/267 [M+H]+.
Ссылочный пример 25:
Получение 4-йод-1-изопропилизохинолин-3-амина

(1) 1-Бромизохинолин-3-амин и пинаколиновый эфир изопропенилбороновой кислоты обрабатывают таким же образом, как в примерах 97-(1) и (2), с получением 1-изопропилизохинолин-3-амина в виде белого порошка.
APCI-MS m/z: 187 [M+H]+.
(2) К раствору указанного выше соединения (146,0 мг, 0,784 ммоль) в этаноле добавляют йод (219,0 мг, 0,862 ммоль) и сульфат серебра (269,0 мг, 0,862 ммоль), и смесь перемешивают при комнатной температуре 4 ч. Реакционный раствор разбавляют этилацетатом, нерастворимое вещество отфильтровывают, и фильтрат концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 10:0→17:3) с получением 4-йод-1-изопропилизохинолин-3-амина (78,7 мг, 32%) в виде бледно-желтого порошка.
APCI-MS m/z: 313 [М+Н]+.
Ссылочный пример 26:
Получение 1,4-диизопропилизохинолин-3-амина

4-Бром-1-изопропилизохинолин-3-амин, полученный в ссылочном примере 24, и пинаколиновый эфир изопропенилбороновой кислоты обрабатывают таким же образом, как в примерах 97-(1) и (2), с получением 1,4-диизопропилизохинолин-3-амина в виде белого порошка.
APCI-MS m/z: 229 [M+H]+.
Ссылочный пример 27:
Получение 4-бром-1-циклопропилизохинолин-3-амина
(1) 1-Бромизохинолин-3-амин обрабатывают таким же образом, как в примере 9-(2), с получением 1-циклопропилизохинолин-3-амина в виде белого порошка.
APCI-MS m/z: 185 [M+H]+.
(2) Указанное выше соединение обрабатывают таким же образом, как в ссылочном примере 24-(2), с получением 4-бром-1-циклопропилизохинолин-3-амина в виде белого порошка.
APCI-MS m/z: 263/265 [M+H]+.
Ссылочный пример 28:
Получение 4-циклопропилизохинолин-3-амина
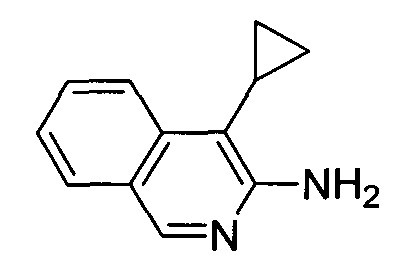
4-Бромизохинолин-3-амин обрабатывают таким же образом, как в примере 103, с получением 4-циклопропилизохинолин-3-амина в виде бледно-желтого порошка.
APCI-MS m/z: 185 [М+Н]+.
Ссылочный пример 29:
Получение [4-(циклопропилметил)-2-фторфенил]метанола

(1) Метиловый эфир 4-бром-2-фторбензойной кислоты (424 мг, 1,82 ммоль), аллилтрибутилолово (0,846 мл, 2,73 ммоль), тетракис(трифенилфосфин)палладий(0) (105 мг, 0,091 ммоль) и фторид цезия (415 мг, 2,73 ммоль) нагревают при кипении в 1,4-диоксане (10 мл) в течение 7 ч в атмосфере аргона. Смесь охлаждают до комнатной температуры и затем фильтруют через диатомовую землю с использованием этилацетата, и фильтрат концентрируют при пониженном давлении. Остаток очищают с помощью хроматографической колонки с силикагелем (этилацетат/гексан=2%→10%) с получением метил 4-аллил-2-фторбензойной кислоты (333 мг, 94%) в виде бледно-желтого вязкого вещества.
APCI-MS: m/z 195 [M+H]+.
(2) К раствору указанного выше соединения (333 мг, 1,71 ммоль) в 1,2-дихлорэтане (10 мл) добавляют хлориодметан (1,25 мл, 17,1 ммоль) в атмосфере аргона, и затем туда же медленно добавляют по каплям раствор диэтилцинка (8,57 мл, 8,57 ммоль, в гексане), и смесь перемешивают в течение 16 ч при комнатной температуре и 7 ч при 50°C. Смесь охлаждают до комнатной температуры, и затем туда же добавляют насыщенный раствор хлористого аммония, и смесь трижды экстрагируют хлороформом. Органический слой сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток перемешивают в смеси с тетраоксидом осмия (219 мг, 0,0865 ммоль) в микрокапсуле, N-метилморфолин-N-оксидом (260 мг, 2,22 ммоль) в системе ацетон-ацетонитрил-вода (1:1:1,6 мл) при комнатной температуре в течение 21 ч. Смесь фильтруют и концентрируют с получением сырого продукта, и затем этот продукт очищают с помощью хроматографической колонки с силикагелем (этилацетат/гексан=2%→15%) с получением метил 4-(циклопропилметил)-2-фторбензоата (155 мг, 44%) в виде бесцветной жидкости.
APCI-MS: m/z 209 [М+Н]+.
(3) К раствору указанного выше соединения (155 мг, 0,744 ммоль) в тетрагидрофуране (5 мл) добавляют боргидрид лития (81,1 мг, 3,72 ммоль) и метанол (0,151 мл, 3,72 ммоль) при 0°C в атмосфере аргона, и смесь перемешивают при комнатной температуре 3 дня. Затем туда же добавляют насыщенный раствор соли, и смесь трижды экстрагируют этилацетатом, с последующей сушкой над безводным сульфатом натрия и концентрацией при пониженном давлении. Остаток очищают с помощью хроматографической колонки с силикагелем (этилацетат/гексан=15%→40%) с получением [4-(циклопропилметил)-2-фторфенил]метанола (126 мг, 94%) в виде бесцветной жидкости.
APCI-MS: m/z 198 [M+NH4]+.
Ссылочный пример 30:
Получение [4-(циклопропилметил)-3-фторфенил]метанола

Метил 4-бром-3-фторбензоат обрабатывают таким же образом, как в Ссылочном примере 29-(1)-(3), с получением [4-(циклопропилметил)-3-фторфенил]метанола в виде бесцветной жидкости.
APCI-MS: m/z 198 [M+NH4]+.
Ссылочный пример 31:
Получение (4-{[1-(трифторметил)циклопропил]метил}фенил)метанола

(1) К раствору 4-бромиодбензола (2150 мг, 7,60 ммоль) в тетрагидрофуране (20 мл) добавляют по каплям 1,67-молярный раствор н-бутиллития в гексане (4,50 мл, 7,52 ммоль) при -78°C в атмосфере аргона. Смесь перемешивают при той же температуре 1 ч, и затем туда добавляют по каплям раствор N-метокси-N-метил-1-(трифторметил)циклопропан-карбоксамида (синтезирован по методике: Organic Process Research and Development 2009, 13, 576; 1000 мг, 5,07 ммоль) в тетрагидрофуране (10 мл), и смесь перемешивают при той же температуре 1 ч. В реакционный раствор добавляют насыщенный водный раствор хлорида аммония при -78°C, и затем смесь нагревают до комнатной температуры и экстрагируют этилацетатом три раза. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия, и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 100:0→95:5), чтобы получить (4-бромфенил)[1-(трифторметил)циклопропил]метанон (783 мг, 76%) в виде бледно-коричневого масла.
1Н-ЯМР (CDCl3) δ 1,36-1,50 (4Н, м), 7,61 (2Н, д, J=8,7 Гц), 7,79 (2Н, д, J=8,7 Гц).
(2) К раствору указанного выше соединения (780 мг, 3,26 ммоль) в этаноле (10 мл) добавляют 78% моногидрата гидразина (1000 мкл, 16,1 ммоль). Реакционный раствор нагревают при кипении в течение ночи и охлаждают до комнатной температуры, и затем в реакционный раствор добавляют воду, и смесь трижды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении с получением сырого гидразона (4-бромфенил)[1-(трифторметил)циклопропил]метанона (784 мг) в виде бледно-коричневого масла. Этот продукт используют на следующей стадии без дополнительной очистки.
APCI-MS m/z: 307/309 [M+NH4]+.
(3) К раствору указанного выше сырого продукта (775 мг) в этиленгликоле (8 мл) добавляют гидроксид калия (580 мг, 10,3 ммоль), и смесь нагревают до 180°C при перемешивании в течение 2 ч. Смесь охлаждают до комнатной температуры, и затем в реакционный раствор добавляют воду, и смесь трижды экстрагируют диэтиловым эфиром. Органические слои объединяют, промывают 2-молярным раствором хлористоводородной кислоты, водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан) с получением 1-бром-4-{[1-(трифторметил)циклопропил]-метил} бензола (148 мг, 21%, выход для двух стадий) в виде бесцветного масла.
1Н-ЯМР (CDCl3) δ 0,48-0,53 (2Н, м), 0,92-0,97 (2Н, м), 2,95 (2Н, с), 7,04 (2Н, д, J=8,2 Гц), 7,42 (2Н, д, J=8,2 Гц).
(4) В перемешиваемый раствор указанного выше соединения (145 мг, 0,52 ммоль), ацетата палладия (15 мг, 0,07 ммоль), 1,1′-бис(дифенилфосфино)ферроцена (75 мг, 0,14 ммоль) в N,N-диметилформамиде (5 мл) и метаноле (1,1 мл) добавляют триэтиламин (200 мкл, 1,43 ммоль). Реакционный раствор перемешивают в атмосфере монооксида углерода при 90°C в течение ночи. Раствор охлаждают до комнатной температуры, и затем в реакционный раствор добавляют воду, и смесь трижды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 98:2→90:10) с получением метил 4-{[1-(трифторметил)-циклопропил]метил}бензоата (129 мг, 96%) в виде бесцветного масла.
APCI-MS m/z: 259 [M+H]+.
(5) К раствору указанного выше соединения (110 мг, 0,43 ммоль) в тетрагидрофуране (4 мл) и метаноле (110 мкл, 2,71 ммоль) добавляют боргидрид лития (60 мг, 2,75 ммоль) при 0°C. Смесь перемешивают при комнатной температуре в течение ночи, и затем в реакционный раствор добавляют воду при 0°C, и смесь трижды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении с получением сырого (4-{[1-(трифторметил)циклопропил]метил}фенил)метанола (103 мг) в виде бесцветного масла. Этот продукт используют на следующей стадии без дополнительной очистки.
APCI-MS m/z: 248 [M+NH4]+.
Ссылочный пример 32:
Получение {4-[циклопропил(дифтор)метил]фенил}метанола

(1) В перемешиваемый раствор (4-бромфенил)(циклопропил)метанона (синтезирован по методике: Pesticide Science 1980, 11, 513; 5,00 г, 22,0 ммоль), ацетата палладия (0,52 г, 2,3 ммоль) и 1,1′-бис(дифенилфосфино)ферроцена (2,50 г, 4,5 ммоль) в N,N-диметилформамиде (150 мл) и метаноле (40 мл) добавляют триэтиламин (6,7 мл, 48,1 ммоль). Реакционный раствор перемешивают в атмосфере монооксида углерода при 90°C в течение ночи. Раствор охлаждают до комнатной температуры, и затем в реакционный раствор добавляют воду, и смесь трижды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 98:2→80:20) с получением метил 4-(циклопропилкарбонил)бензоата (4,28 г, 94%) в виде бесцветного порошка.
APCI-MS m/z: 205 [M+H]+.
(2) Указанное выше соединение (1000 мг, 4,90 ммоль) растворяют в трифториде бис(2-метоксиэтил)аминосерной кислоты (8,0 мл, 43,4 ммоль) в пробирке, изготовленной из фторопласта. Затем туда добавляют по каплям метанол (60 мкл, 1,48 ммоль) при 0°C, и затем смесь нагревают при 80°C в течение 8 дней при перемешивании. Реакционный раствор охлаждают, и затем в раствор добавляют по каплям насыщенный водный раствор гидрокарбоната натрия при 0°С, и смесь трижды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 98:2→90:10) с получением метил 4-[циклопропил(дифтор)метил]бензоата (924 мг, 84%) в виде бледно-желтого масла.
1Н-ЯМР (ДМСО-d6) δ 0,64-0,74 (4Н, м), 1,66-1,79 (1Н, м), 3,88 (3Н, с), 7,72 (2Н, д, J=8,8 Гц), 8,07 (2Н, д, J=8,8 Гц).
(3) К раствору указанного выше соединения (920 мг, 4,07 ммоль) в тетрагидрофуране (25 мл) добавляют боргидрид лития (340 мг, 15,6 ммоль) и метанол (630 мкл, 15,5 ммоль) при 0°C. Смесь перемешивают при комнатной температуре в течение ночи, и затем в реакционный раствор добавляют воду при 0°C, и смесь трижды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 95:5→65:35) с получением {4-[циклопропил-(дифтор)метил]фенил}метанола (905 мг, 98%) в виде бесцветного масла.
1Н-ЯМР (ДМСО-d6) δ 0,58-0,71 (4Н, м), 1,61-1,75 (1Н, м), 4,54 (2Н, д, J=5,7 Гц), 5,29 (1Н, т, J=5,7 Гц), 7,42 (2Н, д, J=8,8 Гц), 7,50 (2Н, д, J=8,5 Гц).
Ссылочный пример 33:
Получение {3-[циклопропил(дифтор)метил]фенил}метанола

Этил 3-(циклопропилкарбонил)бензоат (синтезирован по методике: WO 2006/067445) обрабатывают таким же образом, как в Ссылочном примере 32-(2) и (3), с получением {3-[циклопропил(дифтор)метил]фенил}метанола.
1Н-ЯМР (ДМСО-d6) δ 0,60-0,72 (4Н, м), 1,61-1,75 (1Н, м), 4,55 (2Н, д, J=5,1 Гц), 5,32 (1Н, т, J=5,4 Гц), 7,39-7,45 (3Н, м), 7,50 (1Н, с).
Ссылочный пример 34:
Получение {4-[дифтор(1-метилциклопропил)метил]фенил}метанола

(1) К раствору метил 4-(циклопропилкарбонил)бензоата (500 мг, 2,45 ммоль) в тетрагидрофуране (12 мл) добавляют по каплям 1-молярный раствор гексаметилдисилазана лития в тетрагидрофуране (3,0 мл, 3,00 ммоль) при -78°C в атмосфере аргона, и смесь перемешивают 15 минут. В смесь добавляют по каплям йодметан (200 мкл, 3,21 ммоль) при той же температуре, и реакционный раствор медленно нагревают до комнатной температуры и перемешивают в течение ночи. В реакционный раствор добавляют насыщенный водный раствор хлористого аммония, и смесь трижды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 100:0→97:3) с получением метил 4-[(1-метилциклопропил)карбонил]бензоата (45 мг, 8%) в виде бесцветного масла.
APCI-MS m/z: 219 [M+H]+.
(2) Метил 4-[(1-метилциклопропил)карбонил]бензоат обрабатывают таким же образом, как в Ссылочном примере 32-(2) и (3), с получением {4-[дифтор(1-метилциклопропил)метил]фенил}метанола.
APCI-MS m/z: 230[M+NH4]+.
Ссылочный пример 35:
Получение {4-[циклопропил(дифтор)метил]-3-фторфенил}метанола

(4-Бром-2-фторфенил)циклопропилкетон обрабатывают таким же образом, как в Ссылочном примере 32-(1), (2) и (3), с получением {4-[циклопропил(дифтор)метил]-3-фторфенил}метанола.
1Н-ЯМР (ДМСО-d6) δ 0,60-0,74 (4Н, м), 1,69-1,84 (1Н, м), 4,55 (2Н, д, J=4,2 Гц), 5,43 (1Н, т, J=5,3 Гц), 7,23 (1Н, с), 7,26 (1Н, д, J=6,7 Гц), 7,51 (1Н, т, J=8,0 Гц).
Ссылочный пример 36:
Получение {3-[циклопропил(дифтор)метил]-4-фторфенил}метанола
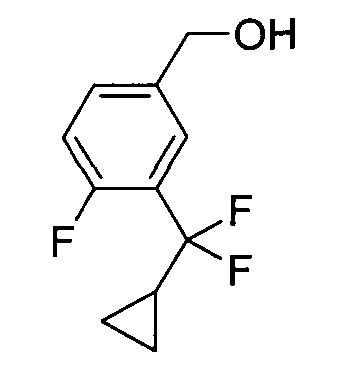
(5-Бром-2-фторфенил)(циклопропил)метанон (синтезирован по методике: Bioorganic & Medicinal Chemistry Letters 2010, 20, 1652) обрабатывают таким же образом, как в Ссылочном примере 32-(1), (2) и (3), с получением {3-[циклопропил(дифтор)метил]-4-фторфенил}метанола.
1H-ЯМР (ДМСО-d6) δ 0,61-0,74 (4Н, м), 1,69-1,84 (1Н, м), 4,51 (2Н, д, J=4,8 Гц), 5,35 (1Н, т, J=5,6 Гц), 7,29 (1Н, дд, J=11,2, 8,5 Гц), 7,45-7,52 (2Н, м).
Ссылочный пример 37:
Получение {3-хлор-4-[циклопропил(дифтор)метил]фенил}метанола

(1) К раствору 4-бром-2-хлор-N-метокси-N-метилбензамида (синтезирован по методике: Bioorganic & Medicinal Chemistry Letters 2003, 13, 3983; 5,90 г, 21,0 ммоль) в тетрагидрофуране (180 мл) добавляют по каплям 0,7-молярный раствор циклопропилмагнийбромида в тетрагидрофуране (65,0 мл, 45,5 ммоль) при 0°C. Смесь перемешивают при той же температуре в течение 4 ч, и затем в реакционный раствор добавляют насыщенный водный раствор хлористого аммония, и смесь трижды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 100:0→93:7) с получением (4-бром-2-хлорфенил)(циклопропил)метанона (3,75 г, 68%) в виде бледно-желтого масла.
APCI-MS m/z: 259/261/263 [М+Н]+.
(2) (4-Бром-2-хлорфенил)(циклопропил)метанон обрабатывают таким же образом, как в Ссылочном примере 32-(1), (2) и (3), с получением {3-хлор-4-[циклопропил(дифтор)метил]фенил}метанола.
1Н-ЯМР (ДМСО-d6) δ 0,62-0,74 (4Н, м), 1,84-1,98 (1Н, м), 4,54 (2Н, д, J=4,5 Гц), 5,42 (1Н, т, J=5,4 Гц), 7,37 (1Н, д, J=8,1 Гц), 7,50 (1Н, с), 7,58 (1Н, д, J=7,9 Гц).
Ссылочный пример 38:
Получение {4-[циклобутил(дифтор)метил]фенил}метанола

К раствору этил 4-[циклобутил(дифтор)метил]бензоата (синтезирован по методике: WO 2005/032465, 140 мг, 0,55 ммоль) в тетрагидрофуране (5 мл) и метаноле (112 мкл, 2,76 ммоль) добавляют боргидрид лития (60 мг, 2,75 ммоль) при 0°C. Смесь перемешивают при комнатной температуре 3 ч, и затем в реакционный раствор добавляют воду при 0°C, и смесь трижды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении с получением сырого {4-[циклобутил(дифтор)метил]фенил}метанола (111 мг) в виде бесцветного масла. Этот продукт используют на следующей стадии без дополнительной очистки.
APCI-MS m/z: 230 [M+H]+.
Ссылочный пример 39:
Получение 1-циклопропил-2,2,2-трифтор-1-[4-(гидроксиметил)фенил]этанола

(1) К раствору (4-бромфенил)(циклопропил)метанона (587 мг, 2,60 ммоль) в тетрагидрофуране (5,2 мл) добавляют молекулярное сито 4 Å (500 мг), триметилсилилтрифторметан (772 мкл, 5,20 ммоль) и раствор тетрабутиламмонийфторида в тетрагидрофуране (1 моль/л, 3,9 мл, 3,90 ммоль) при 0°C, и смесь перемешивают при комнатной температуре в течение 18 ч. Раствор фильтруют через диатомитовую землю, и затем туда же добавляют 1-молярный раствор хлористоводородной кислоты (10 мл), и смесь дважды экстрагируют этилацетатом. Органические слои объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 20:1→5:1) с получением 1-(4-бромфенил)-1-циклопропил-2,2,2-трифторэтанола (747 мг, 97%) в виде бесцветного масла.
APCI-MS m/z: 353/355 [М+СН3СОО]-.
(2) Указанное выше соединение (747 мг, 2,53 ммоль) обрабатывают таким же образом, как в Ссылочном примере 6-(1) и (2), с получением 1-циклопропил-2,2,2-трифтор-1-[4-(гидроксиметил)фенил]этанола (112 мг, 18%) в виде бесцветного масла.
ESI-MS m/z: 353/355 [M-H]-.
Ссылочный пример 40:
Получение {4-[(трифторметокси)метил]фенил}метанола

(1) К раствору 4-[(трифторметокси)метил]бензойной кислоты (500 мг, 2,27 ммоль) в N,N-диметилформамиде (25 мл) добавляют йодметан (300 мкл, 4,82 ммоль) и карбонат калия (1000 мг, 7,24 ммоль). Смесь перемешивают при комнатной температуре в течение ночи, затем в реакционный раствор добавляют воду, и смесь трижды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 99:1→80:20) с получением метил 4-[(трифторметокси)метил]бензоата (453 мг, 85%) в виде светло-коричневого масла.
APCI-MS m/z: 235 [M+H]+.
(2) К раствору указанного выше соединения (450 мг, 1,92 ммоль) в тетрагидрофуране (5 мл) и метаноле (130 мкл, 3,20 ммоль) добавляют боргидрид лития (70 мг, 3,20 ммоль) при 0°C. Смесь перемешивают при комнатной температуре в течение ночи, и затем в реакционный раствор добавляют воду при 0°C, и смесь трижды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 85:15), с получением {4-[(трифторметокси)-метил]фенил}метанола (239 мг, 60%) в виде бесцветного твердого вещества.
APCI-MS m/z: 224 [M+NH4]+.
Ссылочный пример 41:
Получение 1,1,1-трифтор-2-[2-фтор-4-(гидроксиметил)фенил]пропан-2-ола
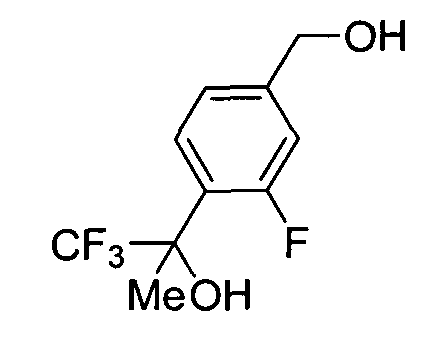
(1) В перемешиваемый раствор 1-(4-бром-2-фторфенил)этанона (1,00 г, 4,5 ммоль), ацетата палладия (0,12 г, 0,54 ммоль) и 1,1′-бис(дифенилфосфино)ферроцена (0,50 г, 0,90 ммоль) в N,N-диметилацетамиде (22 мл) и метаноле (7 мл) добавляют триэтиламин (1,3 мл, 9,2 ммоль). Реакционный раствор перемешивают в атмосфере монооксида углерода при 90°C в течение ночи. Раствор охлаждают до комнатной температуры, и затем реакционный раствор фильтруют через диатомовую землю и силикагель, и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 100:0→60:40) с получением метил 4-ацетил-3-фторбензоата (0,83 г, 93%) в виде бледно-желтого порошка.
APCI-MS m/z: [M+H]+.
(2) К раствору указанного выше соединения (825 мг, 4,21 ммоль) в тетрагидрофуране (8,4 мл) добавляют триметилсилилтрифторметан (1240 мкл, 8,41 ммоль) и раствор тетрабутиламмонийфторида в тетрагидрофуране (1 моль/л, 6,3 мл, 6,31 ммоль) при 0°C, и смесь перемешивают при комнатной температуре 3 ч. В раствор добавляют 1-молярный раствор хлористоводородной кислоты, и смесь трижды экстрагируют этилацетатом. Органические слои объединяют, фильтруют через фазовый сепаратор (Varian Inc.) и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 100:0→60:40) с получением метил 3-фтор-4-(2,2,2-трифтор-1-гидрокси-1-метилэтил)бензоата (650 мг, 58%) в виде бледно-желтого масла.
ESI-MS m/z: 324 [M-H]-.
(3) К раствору указанного выше соединения (648 мг, 2,43 ммоль) в тетрагидрофуране (4 мл) добавляют литийалюминийгидрид (110 мг, 2,92 ммоль) при 0°C. Смесь перемешивают при комнатной температуре 5 ч, и затем в реакционный раствор добавляют воду и 2н водный раствор гидроксида натрия при 0°C, и смесь фильтруют через диатомитовую землю. Фильтрат трижды экстрагируют этилацетатом. Органические слои объединяют, фильтруют через фазовый сепаратор (фирма Varian Inc.) и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 80:20→40:60) с получением 1,1,1-трифтор-2-[2-фтор-4-(гидроксиметил)фенил]пропан-2-ола (494 мг, 85%) в виде бесцветного порошка.
APCI-MS m/z: [M+NH4]+.
Ссылочный пример 42:
Получение 2-[2-хлор-4-(гидроксиметил)фенил]-1,1,1-трифторпропан-2-ола

(1) К раствору 4-ацетил-3-хлорбензойной кислоты (синтезирована по методике: Teтpahedron 1988, 44, 1631; 700 мг, 3,52 ммоль) в N,N-диметилформамиде (4 мл) добавляют карбонат калия (974 мг, 7,05 ммоль) и йодметан (658 мкл, 10,57 ммоль) при комнатной температуре, и смесь перемешивают при комнатной температуре 1 час. В реакционный раствор добавляют воду, и смесь трижды экстрагируют этилацетатом. Органические слои объединяют, фильтруют через фазовый сепаратор (Varian Inc.) и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 100:0→75:25) с получением метил 4-ацетил-3-хлорбензоата (707 мг, 94%) в виде бледно-желтого порошка.
APCI-MS m/z: 213/215 [М+Н]+.
(2) Метил 4-ацетил-3-хлорбензоат обрабатывают таким же образом, как в Ссылочном примере 41-(2) и (3), с получением 2-[2-хлор-4-(гидроксиметил)фенил]-1,1,1-трифторпропан-2-ола.
APCI-MS m/z: 272/274 [M+NH4]+.
Ссылочный пример 43:
Получение 3,3,4,4,4-пентафтор-2-[4-(гидроксиметил)фенил]бутан-2-ола
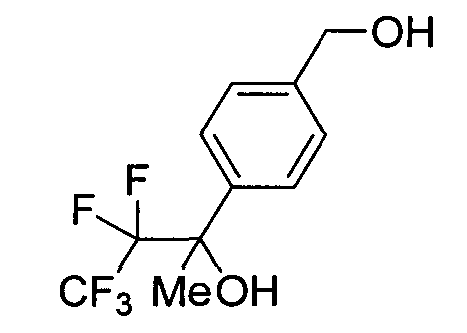
(1) К раствору метил 4-ацетилбензоата (700 мг, 3,85 ммоль) в тетрагидрофуране (7,7 мл) добавляют (пентафторэтил)триметилсилан (1370 мг, 6,93 ммоль) и раствор тетрабутиламмонийфторида в тетрагидрофуране (1 моль/л, 5,7 мкл, 5,78 ммоль) при 0°C, и смесь перемешивают при комнатной температуре в течение ночи. В раствор добавляют 1-молярный раствор хлористоводородной кислоты, и смесь трижды экстрагируют этилацетатом. Органические слои объединяют, фильтруют через фазовый сепаратор (Varian Inc.) и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 100:0→70:30) с получением метил 4-(2,2,3,3,3-пентафтор-1-гидрокси-1-метилпропил)бензоата (765 мг, 67%) в виде бледно-желтого вязкого вещества.
APCI-MS m/z: 316 {M+NH4]+.
(2) К раствору указанного выше соединения (760 мг, 2,55 ммоль) в тетрагидрофуране (13 мл) добавляют боргидрид лития (278 мг, 12,7 ммоль) и метанол (6516 мкл, 12,7 ммоль) при 0°C. Смесь перемешивают при комнатной температуре в течение ночи, и затем в реакционный раствор добавляют воду при 0°C, и смесь трижды экстрагируют этилацетатом. Органические слои объединяют, фильтруют через фазовый сепаратор (Varian Inc.) и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 100:0→60:40) с получением 3,3,4,4,4-пентафтор-2-[4-(гидроксиметил)фенил]бутан-2-ола (580 мг, 84%) в виде бесцветного порошка.
APCI-MS m/z: 288 [M+NH4]+.
Ссылочный пример 44:
Получение (7-фтор-2,3-дигидро-1Н-инден-5-ил)метанола
(1) К раствору 6-бром-4-фториндан-1-она (57 мг, 0,26 ммоль) в трифторуксусной кислоте (1,1 мл) добавляют триэтилсилан (103 мкл, 0,65 ммоль), и смесь перемешивают при комнатной температуре в течение ночи. Реакционный раствор выливают в ледяную воду, и смесь трижды экстрагируют этилацетатом. Органические слои объединяют, промывают насыщенным водным раствором гидрокарбонат натрия, и органический слой фильтруют через фазовый сепаратор (Varian Inc.) и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 100:0) с получением сырого 6-бром-4-фториндана (61 мг) в виде желтого масла. Этот продукт используют на следующей стадии без дополнительной очистки.
(2) Указанный сырой продукт обрабатывают таким же образом, как в ссылочном примере 41-(1), с получением сырого метил 7-фториндан-5-карбоксилата. Этот продукт используют на следующей стадии без дополнительной очистки.
(3) Указанный выше сырой продукт обрабатывают таким же образом, как в ссылочном примере 43-(2), с получением сырого (7-фтор-2,3-дигидро-1Н-инден-5-ил)метанола. Этот продукт используют на следующей стадии без дополнительной очистки.
Ссылочный пример 45:
Получение 5-(гидроксиметил)-1-(трифторметил)индан-1-ола

5-Броминдан-1-он обрабатывают таким же образом, как в Ссылочном примере 41-(1), (2) и (3), с получением 5-(гидроксиметил)-1-(трифторметил)индан-1-ола.
APCI-MS m/z: 250 [M+NH4]+.
Ссылочный пример 46:
Получение [5-(циклопропилметил)пиримидин-2-ил]метанола

(1) К раствору 2-(метилтио)пиридин-5-карбальдегида (2000 мг, 12,97 ммоль) в тетрагидрофуране (20 мл) добавляют 0,5-молярный раствор циклопропилмагнийбромида в тетрагидрофуране (28,6 мл) при -40°C в атмосфере аргона. Реакционный раствор перемешивают при той же температуре в течение 10 мин и затем медленно нагревают до 0°C и перемешивают в течение 1 ч. В реакционный раствор добавляют водный раствор хлористого аммония, и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 70:30→30:70) с получением циклопропил[2-(метилтио)пиримидин-5-ил]метанола (822 мг, 32%) в виде бесцветного масла.
APCI-MS m/z: 197 [M+H]+.
(2) К раствору указанного выше соединения (815 мг, 4,15 ммоль) в хлороформе (12 мл) добавляют триэтилсилан (1,99 мл, 12,46 ммоль) при комнатной температуре. В реакционный раствор добавляют по каплям трифторуксусную кислоту (1,54 мл, 20,15 ммоль) при охлаждении льдом, и затем смесь медленно нагревают до комнатной температуры и перемешивают в течение 4 дней. В реакционный раствор добавляют насыщенный водный раствор бикарбоната натрия, и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 95:5→75:25) с получением 5-(циклопропилметил)-2-(метилтио)-пиримидина (229 мг, 31%) в виде бесцветного масла.
APCI-MS m/z: 181 [M+H]+.
(3) К раствору указанного выше соединения (225 мг, 1,25 ммоль) в дихлорметане (5 мл) добавляют по каплям раствор метахлорпероксибензойной кислоты (624 мг, 2,50 ммоль) в дихлорметане (5 мл) при 0°C. Реакционный раствор медленно нагревают до комнатной температуры и перемешивают в течение 1 ч и 30 минут, и затем туда же добавляют водный раствор тиосульфата натрия, и смесь дополнительно перемешивают в течение 30 мин. В реакционный раствор добавляют насыщенный водный раствор бикарбоната натрия, и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 70:30→35:65) с получением 5-(циклопропилметил)-2-(метилсульфонил)пиримидина (173 мг, 65%) в виде бесцветного масла.
APCI-MS m/z: 213 [M+H]+.
(4) К раствору указанного выше соединения (169 мг, 0,796 ммоль) в дихлорметане (4 мл) добавляют цианид тетрабутиламмония (235 мг, 0,876 ммоль) при комнатной температуре, и смесь перемешивают при той же температурой в течение ночи. В реакционный раствор добавляют цианид тетрабутиламмония (85 мг), смесь дополнительно перемешивают 3 часа, и затем туда же добавляют насыщенный водный раствор бикарбоната натрия, и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 95:5→80:20) с получением сырого 5-(циклопропилметил)пиримидин-2-карбонитрила (130 мг) в виде бесцветного масла. Этот продукт используют на следующей стадии без дополнительной очистки.
APCI-MS m/z: 160 [M+H]+.
(5) К раствору сырого продукта (125 мг) в тетрагидрофуране (3 мл) добавляют 1,0-молярный раствор диизобутилалюминийгидрида в толуоле (0,82 мл) при -78°C в атмосфере аргона. Смесь перемешивают при той же температуре в течение 2 ч, и затем в реакционный раствор добавляют метанол, и смесь медленно нагревают до комнатной температуры. В реакционный раствор добавляют 6,0-молярный раствор хлористоводородной кислоты, и смесь перемешивают при комнатной температуре 2 часа, и затем туда же добавляют насыщенный водный раствор бикарбоната натрия, и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом натрия, и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 65:35→35:65) с получением сырого 5-(циклопропилметил)-пиримидин-2-карбальдегида (94 мг) в виде бесцветного масла. Этот продукт используют на следующей стадии без дополнительной очистки.
APCI-MS m/z: 163 [М+Н]+.
(6) В перемешиваемый раствор указанного выше сырого продукта (88 мг) в этаноле (1 мл) и тетрагидрофурана (1 мл) добавляют боргидрид натрия (24 мг, 0,643 ммоль) при 0°C. Смесь перемешивают при той же температуре 30 мин, и затем в реакционный раствор добавляют водный раствор хлористого аммония, и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 50:50→0:100) с получением [5-(циклопропилметил)пиримидин-2-ил]метанола (24 мг) в виде бесцветного масла.
APCI-MS m/z: 165 [M+H]+
Ссылочный пример 47:
Получение (5-хлор-1-этил-1Н-индол-2-ил)метанола

(1) Смесь этил 5-хлор-1Н-индол-2-карбоксилата (500 мг, 2,17 ммоль), карбоната калия (450 мг, 3,25 ммоль), йодэтана (260 мкл, 3,25 ммоль) и N,N-диметилформамида (10,8 мл) перемешивают при комнатной температуре 3 дня. В реакционный раствор добавляют воду, и смесь дважды экстрагируют этилацетатом. Органические слои объединяют, трижды промывают водой, и органический слой фильтруют через диатомитовую землю, затем через силикагель, и затем фильтрат концентрируют при пониженном давлении с получением этил 5-хлор-1-этил-1Н-индол-2-карбоксилата (566 мг, 100%) в виде масла.
APCI-MS m/z: 252/254 [M+H]+.
(2) К раствору указанного выше соединения (561 мг, 2,23 ммоль) в диэтиловом эфире (11,1 мл) добавляют литийалюминийгидрид (127 мг, 3,34 ммоль) отдельными порциями при 0°C, и смесь перемешивают при комнатной температуре 1,5 часа. В реакционную смесь последовательно добавляют воду (127 мкл), 15%-ный водный раствор гидроксида натрия (127 мкл) и воду (381 мкл), и затем смесь фильтруют через диатомитовую землю. Фильтрат концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 9:1→3:2) с получением указанного в заголовке соединения - (5-хлор-1-этил-1Н-индол-2-ил)метанола (429 мг, 92%) в виде порошка.
APCI-MS m/z: 210/212 [M+H]+.
Ссылочный пример 48:
Получение (6-хлор-1-этил-1Н-индол-2-ил)метанола

Этил 6-хлор-1Н-индол-2-карбоксилат обрабатывают таким же образом, как в Ссылочном примере 47-(1) и (2), с получением указанного в заголовке соединения - (6-хлор-1-этил-1Н-индол-2-ил)метанола.
APCI-MS m/z: 210/212 [M+H]+.
Ссылочный пример 49:
Получение (4-хлор-1-метил-1Н-индол-2-ил)метанола

4-Хлор-1Н-индол-2-карбоновую кислоту и йодметан обрабатывают таким же образом, как в Ссылочном примере 47-(1) и (2), с получением указанного в заголовке соединения - (4-хлор-1-метил-1Н-индол-2-ил)метанола.
APCI-MS m/z: 196/198 [M+H]+.
Ссылочный пример 50:
Получение (1-циклопропил-1Н-индол-2-ил)метанола
(1) Смесь метил 1Н-индол-2-карбоксилата (1,00 г, 5,71 ммоль), циклопропилбороновой кислоты (981 мг, 11,4 ммоль), ацетата меди (II) (1,04 г, 5,71 ммоль), 2,2-бипиридила (892 мг, 5,71 ммоль), карбоната натрия (1,21 г, 11,4 ммоль) и 1,2-дихлорэтана (15,0 мл) перемешивают при 70°C в течение 19 ч. Затем в смесь добавляют циклопропилбороновую кислоту (981 мг, 11,4 ммоль) и карбонат натрия (1,21 г, 11,4 ммоль), смесь перемешивают при 70°C в течение 8 ч, и затем туда же добавляют циклопропилбороновую кислоту (981 мг, 11,4 ммоль), карбонат натрия (1,21 г, 11,4 ммоль), ацетат меди(II) (1,04 г, 5,71 ммоль) и 2,2-бипиридил (892 мг, 5,71 ммоль), и смесь перемешивают при 70°C в течение 16 ч. Смесь выдерживают на холоду, и затем в реакционную смесь добавляют насыщенный водный раствор хлористого аммония. Смесь фильтруют через диатомитовую землю, и фильтрат экстрагируют этилацетатом. Органический слой промывают водой и насыщенным раствором соли, сушат над сульфатом натрия и затем фильтрат концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 19:1→17:3) с получением этил 1-циклопропил-1Н-индол-2-карбоксилата (882 мг, 72%) в виде порошка.
APCI-MS m/z: 216 [M+H]+.
(2) К раствору указанного выше соединения (865 мг, 4,02 ммоль) в толуоле (20,1 мл) добавляют 1,01-молярный раствор диизобутилалюминийгидрида в толуоле (9,94 мл, 10,0 ммоль) при -78°C, и смесь перемешивают при -78°C в течение 1,5 ч. В реакционную смесь добавляют метанол, и смесь подкисляют путем добавления 1-молярной хлористоводородной кислоты, и экстрагируют этилацетатом. Органический слой промывают водой и насыщенным раствором соли, сушат над сульфатом натрия, и затем фильтрат концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 9:1→7:3) с получением (1-циклопропил-1Н-индол-2-ил)метанола (708 мг, 94%) в виде порошка.
APCI-MS m/z: 188 [М+H]+.
Ссылочный пример 51:
Получение (5-хлор-1-циклопропил-1Н-индол-2-ил)метанола

Этил 5-хлор-1Н-индол-2-карбоксилат обрабатывают таким же образом, как в Ссылочном примере 50-(1) и (2), с получением указанного в заголовке соединения - (5-хлор-1-циклопропил-1Н-индол-2-ил)метанола.
APCI-MS m/z: 222/224 [M+H]+.
Ссылочный пример 52:
Получение (1-метил-2,3-дигидро-1Н-индол-6-ил)метанола

К раствору 1-метилиндолин-6-карбоновой кислоты (321 мг, 1,80 ммоль) в тетрагидрофуране (6 мл) добавляют N,N′-карбодиимидазол (309 мг, 1,89 ммоль) при комнатной температуре. Смесь перемешивают при 50°C в течение 15 мин, и затем охлаждают до 0°C. Затем в нее добавляют воду (1 мл) и гидроборат натрия (204 мг, 5,40 ммоль), и смесь перемешивают при указанной температуре в течение 1 ч. Реакционный раствор охлаждают до комнатной температуры, и затем туда добавляют воду, и смесь дважды экстрагируют этилацетатом. Органические слои объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 5:1→1:1) с получением (1-метил-2,3-дигидро-1Н-индол-6-ил)метанола (245 мг, 83%) в виде бледно-желтого масла.
APCI-MS m/z: 164 [M+H]+.
Ссылочный пример 53:
Получение трет-бутил 3-хлор-6-(гидроксиметил)-1Н-индазол-1-карбоксилата

(1) Раствор метил 3-хлор-1Н-индазол-6-карбоксилата (891 мг, 4,2 ммоль) в тетрагидрофуране (10 мл) охлаждают до -78°C, и затем туда же добавляют по каплям раствор диизобутилалюминийгидрида в тетрагидрофуране (1 моль/л, 12,7 мл, 12,6 ммоль) при указанной температуре, и смесь перемешивают при той же температуре 2 ч. В реакционный раствор добавляют воду, и смесь дважды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан→гексан : этилацетат = 2:1) с получением (3-хлор-1H-индазол-6-ил)метанола (344 мг, 45%) в виде желтого твердого вещества.
APCI-MS m/z: 183/185 [M+H]+.
(2) К раствору указанного выше соединения (270 мг, 1,50 ммоль) в дихлорметане (15 мл) добавляют ди-трет-бутилдикарбонат (323 мг, 1,50 ммоль) при комнатной температуре, и смесь перемешивают при указанной температуре 18 ч. В реакционный раствор добавляют N,N-диметил-4-аминопиридин (5 мг, в качестве катализатора), и смесь перемешивают 1 ч. Реакционный раствор концентрируют при пониженном давлении и очищают с помощью хроматографической колонки с силикагелем (гексан→гексан : этилацетат = 2:1) с получением трет-бутил 3-хлор-6-(гидроксиметил)-1Н-индазол-1-карбоксилата (356 мг, 85%) в виде бледно-желтого масла.
APCI-MS m/z: 283/285 [M+H]+.
Ссылочный пример 54:
Получение (4,6-дифтор-1-бензотиен-2-ил)метанола

(1) В суспензию 2,4,6-трифторбензальдегида (5,00 г, 31,2 ммоль) и карбоната калия (5,61 г, 40,6 ммоль) в N,N-диметилформамиде (63 мл) добавляют этилтиогликолят (3,40 г, 28,3 ммоль) при 0°C. Смесь перемешивают при комнатной температуре в течение ночи, и затем нагревают при 60°C в течение 6 ч при перемешивании. Смесь охлаждают до комнатной температуры, и затем в реакционный раствор добавляют воду, и смесь экстрагируют этилацетатом. Органический слой промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 97:3→93:7) с получением этил 4,6-дифтор-1-бензотиофен-2-карбоксилата (1,95 г, 29%) в виде бледно-желтого твердого вещества.
APCI-MS m/z: 243 [М+Н]+.
(2) К раствору указанного выше соединения (1000 мг, 4,13 ммоль) в диэтиловом эфире (21 мл) отдельными порциями добавляют литийалюминийгидрид (235 мг, 6,19 ммоль) при 0°C в атмосфере аргона, и смесь перемешивают при комнатной температуре 40 мин. В реакционный раствор добавляют воду (0,24 мл) и 15%й водный раствор гидроксида натрия (0,24 мл) при охлаждении льдом, и затем туда же дополнительно вводят воду (0,72 мл), и затем смесь перемешивают при комнатной температуре. Нерастворимое вещество отфильтровывают, промывают диэтиловым эфиром, и затем фильтрат объединяют с промывочным раствором, и концентрируют при пониженном давлении. Образовавшийся остаток промывают смесью гексан-диизопропиловый эфир с получением (4,6-дифтор-1-бензотиен-2-ил)метанола (731 мг, 88%) в виде бесцветного порошка.
1Н-ЯМР (ДМСО-d6) δ 4,74 (2Н, д, J=5,7 Гц), 5,75 (1Н, т, J=5,9 Гц), 7,26 (1Н, dt, J=10,1, 2,1 Гц), 7,30 (1Н, с), 7,77 (1Н, дд, J=8,8, 2,1 Гц).
Ссылочный пример 55:
Получение (5,7-дифтор-1-бензотиен-2-ил)метанола

(1) К раствору 5,7-дифтор-1-бензотиофен-2-карбоновой кислоты (синтезирована по методике: WO 2003/055878; 1,95 г, 9,10 ммоль), гидрохлорида N,O-диметилгидроксиамина (977 мг, 10,0 ммоль), гидрохлорида 1-этил-3-(3′-диметиламинопропил)карбодиимида (1,92 г, 10,0 ммоль) и N-гидроксибензотриазола (1,35 г, 10,0 ммоль) в дихлорметане (20 мл) добавляют триэтиламин (1,90 мл, 13,7 ммоль) при комнатной температуре. Смесь перемешивают при комнатной температуре в течение ночи, и затем в реакционный раствор добавляют 10%-ный раствор хлористоводородной кислоты, и смесь экстрагируют хлороформом. Органический слой промывают насыщенным водным раствором гидрокарбоната натрия, сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении с получением сырого 5,7-дифтор-N-метокси-N-метил-1-бензотиофен-2-карбоксамида (2,48 г) в виде бесцветного твердого вещества. Этот продукт используют на следующей стадии без дополнительной очистки.
APCI-MS m/z: 258 [M+H]+.
(2) К раствору сырого продукта (2,45 г) в тетрагидрофуране (40 мл) добавляют по каплям 1-молярный раствор диизобутилалюминийгидрида в толуоле (14,3 мл, 14,3 ммоль) при -70°C в атмосфере аргона. Реакционный раствор медленно нагревают до -40°C, и затем в реакционный раствор добавляют 10%-ный раствор хлористоводородной кислоты (50 мл), и смесь экстрагируют диэтиловым эфиром. Органический слой промывают насыщенным раствором соли, сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении с получением 5,7-дифтор-1-бензотиофен-2-карбальдегида (1,67 г, 92%, выход для двух стадий) в виде бесцветного твердого вещества.
APCI-MS m/z: 213 [М+Н+МеОН-H2O]+.
(3) К раствору указанного выше соединения (1000 мг, 5,05 ммоль) в метаноле (25 мл) добавляют боргидрид натрия (383 мг, 10,1 ммоль) при 0°C. Смесь перемешивают при комнатной температуре 40 мин, и затем в реакционный раствор добавляют воду, и смесь дважды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток очищают с помощью хроматографической колонки с силикагелем (гексан : этилацетат = 90:10→70:30) с получением (5,7-дифтор-1-бензотиен-2-ил)метанола (933 мг, 92%) в виде бесцветного твердого вещества.
1Н-ЯМР (ДМСО-d6) δ 4,77 (2Н, дд, J=5,7, 0,9 Гц), 5,84 (1Н, т, J=5,7 Гц), 7,28 (1Н, дт, J=9,9, 2,3 Гц), 7,35 (1Н, д, J=3,6 Гц), 7,54 (1Н, дд, J=9,4, 2,1 Гц).
Ссылочный пример 56:
Получение (7-хлор-1-бензотиен-2-ил)метанола
К раствору 7-хлор-1-бензотиофен-2-карбоновой кислоты (синтезирована по методике: Journal of Chemical Society Perkin Trans. 1, 1984, 385; 1,00 г, 4,70 ммоль) в тетрагидрофуране (17 мл) добавляют 0,95-молярный раствор боран-тетрагидрофуранового комплекса в тетрагидрофуране (9,90 мл, 9,41 ммоль) при 0°C. Смесь перемешивают при комнатной температуре в течение ночи, и затем в реакционный раствор добавляют воду, и смесь концентрируют при пониженном давлении с целью удаления растворителя. К образовавшемуся остатку добавляют насыщенный водный раствор гидрокарбоната натрия, и смесь дважды экстрагируют этилацетатом. Органические слои объединяют, промывают водой и насыщенным раствором соли, сушат над безводным сульфатом натрия и затем концентрируют при пониженном давлении. Образовавшийся остаток промывают смесью гексана с диизопропиловым эфиром с получением (7-хлор-1-бензотиен-2-ил)метанола (842 мг, 90%) в виде бесцветного порошка.
APCI-MS m/z: 216/218 [M+NH4]+.
Ссылочный пример 57:
Получение 5-(трифторметокси)индан-1-ола

(2S)-1-(1,3,2-Диоксаборолан-2-илокси)-3-метил-1,1-дифенилбутан-2-амин (33 мг, 0,1 ммоль), полученный способом, аналогичным описанному в European Journal of Organic Chemistry, 1999, p.1775, суспендируют в тетрагидрофуране (5 мл), и затем туда же добавляют боран-диметилсульфидный комплекс (10 моль/л, 0,1 мл, 1 ммоль) при комнатной температуре. Смесь перемешивают при указанной температуре 20 мин, и затем в нее добавляют отдельными порциями 5-трифторметоксииндан-1-он (0,217 г, 1 ммоль), полученный способом, аналогичным описанному в патенте US 6,159,996, в течение 1 ч, и смесь перемешивают при комнатной температуре в течение ночи. Смесь охлаждают до 5°C, и затем в нее добавляют метанол (2 мл). Смесь перемешивают при указанной температуре 1 ч, затем реакционный раствор концентрируют, и затем в смесь добавляют хлороформ. Раствор в хлороформе выливают в насыщенный водный раствор хлористого аммония, трижды экстрагируют хлороформом, и органический слой промывают насыщенным раствором соли. Этот продукт сушат над сульфатом магния и затем концентрируют. К образовавшемуся остатку добавляют диэтиловый эфир и гексан, и полученное белое твердое вещество отфильтровывают. Фильтрат концентрируют с получением сырого 5-(трифторметокси)индан-1-ола (62,5 мг). Этот продукт используют на следующей стадии без дополнительной очистки.
Фармакологические эксперименты
1. Испытание ингибирования TRPM8
Испытуемые соединения:
В испытании ингибирования TRPM8 использовались соединения из Примеров.
Методика:
Функциональную активность соединений определяют путем измерения изменений концентрации внутриклеточного кальция с использованием флуоресцентного красителя, чувствительного к Ca2+. Изменения сигнала флуоресценции регистрируются путем визуализации клетки с использованием Функциональной системы скрининга лекарственных средств (FDSS) фирмы Hamamatsu Photonics's. Увеличение концентрации внутриклеточного Ca2+ легко детектируется при активации ментолом.
Клетки HEK293, стабильно экспрессирующие человеческий TRPM8, выращивают в колбах. В день анализа культуральную среду удаляют, и клетки промывают фосфатно-солевым буферным раствором (PBS) и собирают с PBS, содержащим 2 ммоль/л динатриевой соли этилендиаминтетрауксусной кислоты (2Na·ЭДТУК). Затем клетки культивируют в течение 60 минут с аналитическим буферным раствором, содержащим 3 мкмоль/л Fura-2AM и 0,01% Pluronic F-127 (поверхностно-активное вещество). Затем от 20000 до 50000 суспендированных клеток в каждой лунке культивируют с испытуемым соединением (при различных концентрациях) в течение 20 мин при 37°C. Изменения концентрации внутриклеточного Ca2+, вызванные дозой ментола (100 мкмоль/л), измеряют в течение 2 мин, используя FDSS. Величины ингибирующей на 50% концентрации - IC50 определяют по четырем точкам при исследовании отклика на концентрацию. Кривые были построены с использованием средних значений в четырех лунках для каждой точки на графике.
Результаты:
В следующей таблице 19 приведены величины IC50 для каждого испытанного соединения.
2. Испытание TRPM8 антагонистической активности на крысах in vivo
Испытуемые соединения:
В испытании TRPM8 антагонистической активности на крысах использовались соединения из Примеров.
Методика:
Антагонистическую активность соединений оценивают на крысах в модели «отряхивание мокрой собаки» (WDS). У крыс наблюдается реакция отряхивания в ответ на введение ментола - агониста TRPM8. Предварительная обработка крыс антагонистом TRPM8 до введения ментола ингибирует наблюдаемую реакцию отряхивания.
Для оценки способности антагониста TRPM8 предотвращать у самцов крыс Sprague Dawley (SD) индуцированную ментолом реакцию отряхивания испытуемые соединения вводили перорально (3 мг/кг, в 0,5% метилцеллюлозы; число животных в группе = 3-4) за 1 час до ментолового провокационного стимула (50 мг/кг, внутрибрюшинно, в 10% Macrogol 15 гидроксистеарат/физиологический раствор). Самопроизвольная реакция WDS регистрируется в течение 5 мин после ввода дозы ментола. Ингибирование самопроизвольной реакции WDS относительно предварительной обработки носителем выражается как процент ингибирования, рассчитанный следующим образом: % ингибирования = [1-(число отряхиваний WDS после ввода антагониста/число WDS после носителя)]×100.
Результаты:
В следующей таблице 20 показан процент ингибирования для дозы 3 мг/кг каждого из исследованных соединений.
Промышленная применимость
Соединения (I) по настоящему изобретению являются полезными для предупреждения и лечения различных заболеваний, ассоциируемых с TRPM8 (нап0ример, хроническая боль, такая как нейропатическая боль (предпочтительно, нейропатическая боль, вызванная холодовой аллодинией или диабетической нейропатией)).
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ-3 ГЛИКОГЕНСИНТАЗЫ | 2011 |
|
RU2623427C2 |
| ПРОИЗВОДНЫЕ СПИРООКСИНДОЛА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ТЕРАПЕВТИЧЕСКИХ АГЕНТОВ | 2006 |
|
RU2415143C2 |
| КЛАСС КОНДЕНСИРОВАННЫХ КОЛЬЦЕВЫХ СОЕДИНЕНИЙ И ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 2021 |
|
RU2831125C1 |
| ЗАМЕЩЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СУЛЬФОНАМИДНЫЕ СОЕДИНЕНИЯ, ПОЛЕЗНЫЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ TRPA 1 | 2014 |
|
RU2675792C2 |
| АНАЛОГИ БУПРЕНОРФИНА | 2009 |
|
RU2520222C2 |
| СОЕДИНЕНИЯ ТИЕНИЛ[3, 2-d]ПИРИМИДИН-4-ОН, СПОСОБ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2624021C2 |
| ЗАМЕЩЕННЫЕ ГЕТЕРОАРИЛОМ ПИРИДИНЫ И СПОСОБЫ ПРИМЕНЕНИЯ | 2017 |
|
RU2756743C2 |
| ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛОВ В КАЧЕСТВЕ МОДУЛЯТОРОВ СВЯЗАННОГО С РЕТИНОИДАМИ ОРФАННОГО РЕЦЕПТОРА ГАММА (RORγ) И ИХ ФАРМАЦЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ | 2019 |
|
RU2789059C2 |
| 2, 5-ДИОКСОИМИДАЗОЛИДИН-4-ИЛ-МЕТИЛКАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ИХ ПРИМЕНЕНИЕ В ИЗГОТОВЛЕНИИ ЛЕКАРСТВЕННОГО СРЕДСТВА | 2003 |
|
RU2326117C2 |
| СОЕДИНЕНИЕ, НАЦЕЛЕННОЕ НА БЕЛОК И ЕГО ДЕГРАДАЦИЮ, И СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2021 |
|
RU2829459C1 |
Изобретение относится к новым сульфонамидным соединениям указанной ниже струтуры или к его фармацевтически приемлемой соли, где 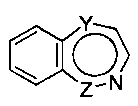 : бициклический ароматический гетероцикл, состоящий из пиридина, конденсированного с бензолом; один из Y и Z является CR2d, а другой - химической связью; кольцо В является (а) моно- или бициклическим ароматическим углеводородом, имеющим 6-11 атомов углерода в качестве кольцевых атомов; (b) 5-11-членным моно- или бициклическим ароматическим гетероциклом, содержащим атомы углерода и 1-4 гетероатома, выбранных из атомов кислорода, серы и азота; или (с) 4-12-членным моно- или бициклическим неароматическим гетероциклом, содержащим атомы углерода и 1-4 гетероатома, выбранных из атомов кислорода, серы и азота; кольцо С: бензол, R1: (а) Н; (b) C1-С6алкил, который необязательно может быть замещен 1-3 группами, выбранными из галогена, оксо и гидрокси; (с) С3-С7циклоалкил; (d) C1-С6алкокси-группу; или (е) галоген, каждый из R2a, R2b, R2c и R2d независимо представляет собой (а) Н; (b) C1-С6 алкил, который необязательно может быть замещен 1-3 группами, выбранными из C1-С6алкокси-группы, галогена и гидрокси; (с) С3-С7циклоалкил; (d) C1-С6алкокси-группу; (е) фенил; (f) 6-членную моноциклическую ароматическую гетероциклическую группу, содержащую атомы углерода и 1-4 гетероатома, выбранных из атомов кислорода, серы и азота; (g) 5-членную моноциклическую неароматическую гетероциклическую группу, содержащую атомы углерода и 1-4 гетероатома, выбранных из атомов кислорода, серы и азота; или (h) галоген, каждый из R3a, R3b, R3c и R3d независимо означает (а) Н; (b) C1-С6алкил, который необязательно может быть замещен 1-7 группами, выбранными из С3-С7циклоалкила (в котором циклоалкил необязательно может быть замещен 1 группой, выбранной из C1-С6алкила и C1-С6галогеноалкила), C1-С6алкокси-группы, C1-С6галогеноалкокси, галогена и гидрокси; (с) С3-С7циклоалкил; (d) C1-С6алкокси-группу, которая необязательно может быть замещена 1-3 группами, выбранными из С3-С7циклоалкила, C1-С6алкокси-группы и галогена; (е) С3-С7циклоалкокси-группу; (f) фенил, который необязательно может быть замещен 1 группой, выбранной из галогена; (g) 6-членную моноциклическую ароматическую гетероциклическую группу, содержащую атомы углерода и 1-4 гетероатома, выбранных из атомов кислорода, серы и азота; (h) фенокси-группу; (j) галоген; или (k) гидрокси, каждый из R5 и R6: Н, n означает 0 или 1, X является (а) карбокси-группой; (b) C1-С6алкоксикарбонилом; (с) гидрокси-C1-С6-алкилом, (d) аминокарбонилом, где атом азота необязательно может быть замещен одной группой, выбранной из C1-С6алкила, C1-С6алкокси-группы и нитрила; или (е) С2-С7алканоила. Также изобретение относится к фармацевтической композиции на основании заявленного соединения и к применению заявленного соединения. Технический результат: получены новые сульфонамидные соединения, обладающие антагонистической активностью в отношении TRPM8. 3 н. и 13 з.п. ф-лы, 20 табл., 242 пр.
: бициклический ароматический гетероцикл, состоящий из пиридина, конденсированного с бензолом; один из Y и Z является CR2d, а другой - химической связью; кольцо В является (а) моно- или бициклическим ароматическим углеводородом, имеющим 6-11 атомов углерода в качестве кольцевых атомов; (b) 5-11-членным моно- или бициклическим ароматическим гетероциклом, содержащим атомы углерода и 1-4 гетероатома, выбранных из атомов кислорода, серы и азота; или (с) 4-12-членным моно- или бициклическим неароматическим гетероциклом, содержащим атомы углерода и 1-4 гетероатома, выбранных из атомов кислорода, серы и азота; кольцо С: бензол, R1: (а) Н; (b) C1-С6алкил, который необязательно может быть замещен 1-3 группами, выбранными из галогена, оксо и гидрокси; (с) С3-С7циклоалкил; (d) C1-С6алкокси-группу; или (е) галоген, каждый из R2a, R2b, R2c и R2d независимо представляет собой (а) Н; (b) C1-С6 алкил, который необязательно может быть замещен 1-3 группами, выбранными из C1-С6алкокси-группы, галогена и гидрокси; (с) С3-С7циклоалкил; (d) C1-С6алкокси-группу; (е) фенил; (f) 6-членную моноциклическую ароматическую гетероциклическую группу, содержащую атомы углерода и 1-4 гетероатома, выбранных из атомов кислорода, серы и азота; (g) 5-членную моноциклическую неароматическую гетероциклическую группу, содержащую атомы углерода и 1-4 гетероатома, выбранных из атомов кислорода, серы и азота; или (h) галоген, каждый из R3a, R3b, R3c и R3d независимо означает (а) Н; (b) C1-С6алкил, который необязательно может быть замещен 1-7 группами, выбранными из С3-С7циклоалкила (в котором циклоалкил необязательно может быть замещен 1 группой, выбранной из C1-С6алкила и C1-С6галогеноалкила), C1-С6алкокси-группы, C1-С6галогеноалкокси, галогена и гидрокси; (с) С3-С7циклоалкил; (d) C1-С6алкокси-группу, которая необязательно может быть замещена 1-3 группами, выбранными из С3-С7циклоалкила, C1-С6алкокси-группы и галогена; (е) С3-С7циклоалкокси-группу; (f) фенил, который необязательно может быть замещен 1 группой, выбранной из галогена; (g) 6-членную моноциклическую ароматическую гетероциклическую группу, содержащую атомы углерода и 1-4 гетероатома, выбранных из атомов кислорода, серы и азота; (h) фенокси-группу; (j) галоген; или (k) гидрокси, каждый из R5 и R6: Н, n означает 0 или 1, X является (а) карбокси-группой; (b) C1-С6алкоксикарбонилом; (с) гидрокси-C1-С6-алкилом, (d) аминокарбонилом, где атом азота необязательно может быть замещен одной группой, выбранной из C1-С6алкила, C1-С6алкокси-группы и нитрила; или (е) С2-С7алканоила. Также изобретение относится к фармацевтической композиции на основании заявленного соединения и к применению заявленного соединения. Технический результат: получены новые сульфонамидные соединения, обладающие антагонистической активностью в отношении TRPM8. 3 н. и 13 з.п. ф-лы, 20 табл., 242 пр.

1. Соединение следующей общей формулы:

где
 представляет собой бициклический ароматический гетероцикл, состоящий из пиридина, конденсированного с бензолом;
представляет собой бициклический ароматический гетероцикл, состоящий из пиридина, конденсированного с бензолом;
один из Y и Z представляет собой CR2d, а другой означает химическую связь;
кольцо В является (а) моноциклическим или бициклическим ароматическим углеводородом, имеющим 6-11 атомов углерода в качестве кольцевых атомов; (b) 5-11-членным моноциклическим или бициклическим ароматическим гетероциклом, содержащим атомы углерода и от 1 до 4 гетероатомов, выбранных из атомов кислорода, атомов серы и атомов азота; или (с) 4-12-членным моноциклическим или бициклическим неароматическим гетероциклом, содержащим атомы углерода и от 1 до 4 гетероатомов, выбранных из атомов кислорода, атомов серы и атомов азота
кольцо С представляет собой бензол,
R1 означает (а) водород; (b) C1-С6 алкил, который необязательно может быть замещен 1-3 группами, выбранными из галогена, оксо и гидрокси; (с) С3-С7 циклоалкил; (d) C1-С6 алкокси-группу; или (е) галоген,
каждый из R2a, R2b, R2c и R2d независимо представляет собой (а) водород; (b) C1-С6 алкил, который необязательно может быть замещен 1-3 группами, выбранными из C1-С6 алкокси-группы, галогена и гидрокси; (с) С3-С7 циклоалкил; (d) C1-С6 алкокси-группу; (е) фенил; (f) 6-членную моноциклическую ароматическую гетероциклическую группу, содержащую атомы углерода и от 1 до 4 гетероатомов, выбранных из атомов кислорода, атомов серы и атомов азота; (g) 5-членную моноциклическую неароматическую гетероциклическую группу, содержащую атомы углерода и от 1 до 4 гетероатомов, выбранных из атомов кислорода, атомов серы и атомов азота; или (h) галоген,
каждый из R3a, R3b, R3c и R3d независимо означает (а) водород; (b) C1-С6 алкил, который необязательно может быть замещен 1-7 группами, выбранными из С3-С7 циклоалкила (в котором циклоалкил необязательно может быть замещен 1 группой, выбранной из C1-С6 алкила и C1-С6 галогеноалкила), C1-С6 алкокси-группы, C1-С6 галогеноалкокси, галогена и гидрокси; (с) С3-С7 циклоалкил; (d) C1-С6 алкокси-группу, которая необязательно может быть замещена 1-3 группами, выбранными из С3-С7 циклоалкила, C1-С6 алкокси-группы и галогена; (е) С3-С7 циклоалкокси-группу; (f) фенил, который необязательно может быть замещен 1 группой, выбранной из галогена; (g) 6-членную моноциклическую ароматическую гетероциклическую группу, содержащую атомы углерода и от 1 до 4 гетероатомов, выбранных из атомов кислорода, атомов серы и атомов азота; (h) фенокси-группу; (j) галоген; или (k) гидрокси,
каждый из R5 и R6 представляют собой водород,
n означает 0 или 1,
X является (а) карбокси-группой; (b) C1-С6 алкоксикарбонилом; (с) гидрокси-C1-С6-алкилом, (d) аминокарбонилом, где атом азота необязательно может быть замещен одной группой, выбранной из C1-С6 алкила, C1-С6 алкокси-группы и нитрила; или (е) С2-С7 алканоила; или его фармацевтически приемлемая соль.
2. Соединение по п.1, в котором X является карбокси-группой и связан с кольцом С в 4-положении относительно аминосульфонильной группы, или его фармацевтически приемлемая соль.
3. Соединение по п.2, в котором кольцо В является (а) моноциклическим или бициклическим ароматическим углеводородом, имеющим от 6 до 11 атомов углерода в качестве кольцевых атомов; или (b) 5-11-членным моноциклическим или бициклическим ароматическим гетероциклом, содержащим атомы углерода и от 1 до 4 гетероатомов, выбранных из атомов килорода, атомов серы и атомов азота, или его фармацевтически приемлемая соль.
4. Соединение по п.3, в котором n равно 1, или его фармацевтически приемлемая соль.
5. Соединение по п.3 или 4, в котором частичная структура:
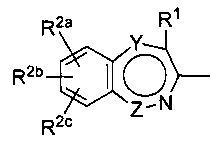
означает группу следующей формулы (А):

или его фармацевтически приемлемая соль.
6. Соединение по п.3 или 4, в котором частичная структура:

означает группу следующей формулы (В):
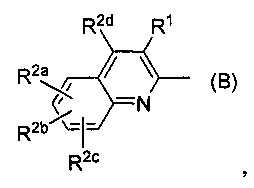
или его фармацевтически приемлемая соль.
7. Соединение по п.5, в котором R1 означает (а) C1-С6 алкил, необязательно замещенный 1-3 атомами галогена; (b) С3-С7 циклоалкил; (с) C1-С6 алкокси; или (d) галоген,
R2a, R2b и R2c означают водород,
R2d представляет собой (а) водород; (b) C1-С6 алкил, необязательно замещенный 1-3 атомами галогена; (с) С3-С7 циклоалкил; или (d) C1-С6 алкокси,
каждый из R3a и R3b независимо представляет собой (а) водород; (b) C1-С6 алкил, необязательно замещенный 1-7 группами, выбранными из С3-С7 циклоалкила (где циклоалкил необязательно может быть замещен 1 группой, выбранными из C1-С6 алкила и C1-С6 галогеноалкила), C1-С6 алкокси, C1-С6 галогеноалкокси, и галогена; (с) С3-С7 циклоалкил; (d) C1-С6 алкокси-группу, необязательно замещенную 1-3 группами, выбранными из С3-С7 циклоалкила, C1-С6 алкокси и галогена; или (е) галоген,
R3c и R3d означают водород,
R5 и R6 означают водород,
n означает 1,
или его фармацевтически приемлемая соль.
8. Соединение по п.7, в котором кольцо В означает бензол или пиридин,
R1 является метилом, трифторметилом, изопропилом, циклопропилом или метокси-группой,
R3a и R3b каждый независимо представляет собой (а) водород; (b) C1-С6 алкил, который необязательно может быть замещен 1-3 группами, выбранными из С3-С7 циклоалкила (в котором циклоалкил необязательно может быть замещен 1 группой, выбранной из C1-С6 алкила и C1-С6 галогеноалкила), C1-С6 алкокси-группы, C1-С6 галогеноалкокси и галогена; (с) С3-С7 циклоалкил; (d) C1-С6 алкокси-группу, которая необязательно может быть замещена 1-3 атомами галогена; или (е) галоген,
или его фармацевтически приемлемая соль.
9. Соединение по п.1, выбранное из группы, состоящей из:
4-({(4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты;
4-{[[3-фтор-4-(трифторметокси)бензил](4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты;
4-({(1-циклопропил-4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил) бензойной кислоты;
4-{[[4-(1-этокси-2,2,2-трифтор-1-метилэтил)бензил](4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты;
4-({(3-метилхинолин-2-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты;
4-{[[4-фтор-3-(трифторметил)бензил](3-метилхинолин-2-ил)амино]сульфонил}бензойной кислоты;
4-{[(4-трет-бутилбензил)(4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты;
4-{[[4-(циклопропилметил)бензил](4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты;
4-{[[4-фтор-3-(трифторметил)бензил](4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты;
4-{[(4-метилизохинолин-3-ил)(2-нафтилметил)амино]сульфонил}бензойной кислоты;
4-({(1-метокси-4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты;
4-({(4-хлоризохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты;
4-{[(4-метилизохинолин-3-ил)(5,6,7,8-тетрагидронафталин-2-илметил)амино]сульфонил}бензойной кислоты;
4-{[(2,3-дигидро-1Н-инден-5-илметил)(4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты;
4-{[[(1,1-диметил-2,3-дигидро-1Н-инден-5-ил)метил](4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты;
4-{[[(2,2-диметил-2,3-дигидро-1Н-инден-5-ил)метил](4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты;
4-{[[(3,3-диметил-2,3-дигидро-1-бензофуран-6-ил)метил](4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты;
4-{[[(1-бензотиофен-2-ил)метил](4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты;
4-({(1,4-диметилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты; и
4-({(4-метилизохинолин-3-ил)[4-(2,2,2-трифтор-1-метокси-1-метилэтил)бензил]амино}сульфонил)бензойной кислоты; или его фармацевтически приемлемая соль.
10. Соединение по п.1, выбранное из группы, состоящей из:
4-({(1-циклопропил-4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты;
4-({(1-метокси-4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты;
4-({(1-изопропил-4-метилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты;
4-{[{3-хлор-4-[циклопропил(дифтор)метил]бензил}(4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты;
4-({(4-циклопропилизохинолин-3-ил)[4-(трифторметокси)бензил]амино}сульфонил)бензойной кислоты;
4-{[{3-хлор-4-[циклопропил(дифтор)метил]бензил}(1-циклопропил-4-метилизохинолин-3-ил)амино] сульфонил}бензойной кислоты;
4-{[{4-[циклопропил(дифтор)метил]-3-фторбензил}(4-метилизохинолин-3-ил)амино]сульфонил}бензойной кислоты;
4-({[4-(трифторметокси)бензил][4-(трифторметил)изохинолин-3-ил]амино}сульфонил)бензойной кислоты;
4-[((4-циклопропилизохинолин-3-ил){[5-(трифторметил)пиридин-2-ил]метил}амино)сульфонил]бензойной кислоты;
4-{[{3-хлор-4-[циклопропил(дифтор)метил]бензил}(4-циклопропилизохинолин-3-ил)амино]сульфонил}бензойной кислоты;
4-{[{4-[циклопропил(дифтор)метил]-3-фторбензил}(4-циклопропилизохинолин-3-ил)амино]сульфонил}бензойной кислоты;
4-({(4-циклопропилизохинолин-3-ил)[5-(трифторметокси)-2,3-дигидро-1Н-инден-1-ил]амино}сульфонил)бензойной кислоты;
4-({{3-хлор-4-[циклопропил(дифтор)метил]бензил}[4-(трифторметил)изохинолин-3-ил]амино}сульфонил)бензойной кислоты; и
4-({{4-[циклопропил(дифтор)метил]-3-фторбензил}[4-(трифторметил)изохинолин-3-ил]амино}сульфонил)бензойной кислоты; или
его фармацевтически приемлемая соль.
11. Фармацевтическая композиция, обладающая антагонистичной активностью по отношению к TRPM8 и содержащая в качестве активного компонента соединение по любому из пп.1-10 или его фармацевтически приемлемую соль.
12. Применение соединения по любому из пп.1-10 или его фармацевтически приемлемой соли в производстве лекарственного агента, обладающего антагонистичной активностью по отношению к TRPM8.
13. Фармацевтическая композиция по п.11, предназначенная для предупреждения или лечения заболевания или состояния, выбранного из хронической боли, цефалгии, урологических заболеваний, карциномы, респираторных заболеваний, желудочно-кишечных заболеваний, психиатрических заболеваний, неврологических заболеваний и дерматоза.
14. Фармацевтическая композиция по п.11, предназначенная для предупреждения или лечения заболевания или состояния, выбранного из хронической боли и урологических заболеваний.
15. Фармацевтическая композиция по п.11, предназначенная для предупреждения или лечения заболевания или состояния, выбранного из нейропатической боли, ноцицептивной боли и комбинированной боли.
16. Применение по п.12, в котором лекарственное средство предназначено для предупреждения или лечения заболевания или состояния, выбранного из хронической боли, цефалгии, урологических заболеваний, карциномы, респираторных заболеваний, желудочно-кишечных заболеваний, психиатрических заболеваний, неврологических заболеваний и дерматоза.
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| EA 200901583 A1, 29.10.2010 | |||
| ПРОИЗВОДНЫЕ АРИЛПИРИДИНА | 2005 |
|
RU2374239C2 |
Авторы
Даты
2015-09-20—Публикация
2012-03-15—Подача