Изобретение относится к фармацевтике, медицине и ветеринарии и описывает способ получения лекарственного препарата на основе натриевой соли 5-амино-2,3-дигидрофталазин-1,4-диона (аминодигидрофталазиндион натрия) в форме лиофилизата.
Известен способ получения 2-амино-1,2,3,4-тетрагидрофталазин-1,4-дион натриевая соль дигидрата (см., например, Абидов М.Т. «Токсический синдром при инфекционном воспалении, патогенезе и коррекции», докторская диссертация, С.-П., 1994), названного лекарственным препаратом Галавит (см., например, «Новые отечественные лекарственные средства», Издание официальное, выпуск 4, М., 1998, с. 18).
Лекарственный препарат Галавит получают при производстве известного хемилюминесцентного вещества люминол-гидразид 3-аминофталевой кислоты (см., например, Хольцбекер З. и др. «Органические реагенты в неорганическом анализе», - М.: Мир, 1979, с. 107) путем переработки люминола воздействием на него основания (NaOH) с последующим выделением путем физико-химической селекции из полученного вещества, побочного продукта - 2-аминофталгидразида, являющегося изомером люминола и составляющего примерно 2-3% от общего количества производимого продукта. При получении лекарственного препарата Галавит, включающем получение исходного продукта и взаимодействие с основанием, например гидроксидом натрия (NaOH), проводят реакцию молекулярной перегруппировки исходного продукта и получают его изомер, на который затем воздействуют гидроксидом натрия, причем в качестве исходного продукта получают 3-аминофталгидразид, после перегруппировки - 2-аминофталгидразид. Выходной продукт получают в виде 2-амино-1,2,3,4-тетрагидрофталазин-1,4-дион натриевой соли дигидрата, при этом перегруппировку проводят в присутствии галогена, например, брома (Br2), при температуре 10-80°С. (Способ получения лекарственного препарата Галавит патент RU №2138264 с приоритетом от 1999.05.06)
Производство лекарственных препаратов ведут повторяющимися циклами, в каждом из которых на исходный состав, содержащий 5-амино-2,3-дигидрофталазин-1,4-дион, воздействуют водным раствором гидроксида щелочного металла, а промежуточный состав выделяют в виде соответствующей соли 5-амино-2,3-дигидрофталазин-1,4-диона, после чего этот промежуточный состав растворяют в воде или в соответствующем гидрокарбонатном буферном растворе и обрабатывают, очищая от примесей, до получения целевого продукта в виде соли 5-амино-2,3-дигидрофталазин-1,4-диона, который после получения высушивают, причем оставшиеся после выделения промежуточного состава или целевого продукта маточные растворы обрабатывают, осадок и оставшиеся части маточных растворов или выводят из цикла, или смешивают с исходным составом, или с реакционной смесью, получаемой в последующем цикле производства. Проводят кристаллизацию соответствующей полученной щелочной соли и получают химически чистый или особой чистоты продукт, воду предварительно подвергают кипячению в течение (0,1-2) часов, а при обработке промежуточного состава или целевого продукта после их выделения в виде щелочных солей 5-амино-2,3-дигидрофталазин-1,4-диона производят их высушивание (Патент РФ №2302863, МПК A61K 31/502, дата публикации 20.07.2007).
Данный способ производства лекарственного препарата представляет собой высокотехнологичный процесс малоотходного производства. Способ обеспечивает получение вариантов лекарственного препарата разной степени химической чистоты, в том числе и фармацевтической, что существенно расширяет возможности их использования и в случаях длительного хранения в водных растворах. Однако в этом способе используется нагревание реакционной смеси, что приводит к раскрытию цикла и потемнению реакционной смеси и, соответственно, к снижению качества и выхода конечного целевого продукта.
В качестве ближайшего аналога может быть указан Патент РФ №2625267 (МПК А61К 31/502, C07D 237/32, дата публикации 22.09.2016), описывающий способ получения стерильного лиофилизированного лекарственного препарата на основе натриевой соли 5-амино-2,3-дигидрофталазин-1,4-диона путем переработки безводной и/или двухводной нестерильной субстанции натриевой соли 5-амино-2,3-дигидрофталазин-1,4-диона.
Данный способ реализуется путем переработки промежуточного продукта 5-амино-2,3-дигидрофталазин-1,4-диона в его натриевую соль путем растворения в водно-органическом щелочном растворе, так что безводную и/или двухводную субстанцию натриевой соли 5-амино-2,3-дигидрофталазин-1,4-диона получают кристаллизацией при температуре минус 5-7°С из водно-органического раствора натриевой соли 5-амино-2,3-дигидрофталазин-1,4-диона, после чего субстанцию растворяют в стерильной дистилированной или инъекционной воде с температурой 50-55°С с гидразингидратом, вливают ацетон с температурой 45°С и производят стерильную фильтрацию со стадией лиофилизации для получения стерильного лекарственный препарата.
Недостатком данного способа получения лекарственного препарата является применение в технологии гидразингидрата и ацетона, которые являются ядовитыми, химически опасными веществами, воздействующими на систему кроветворения, печень, центральную нервную систему. Гидразингидрат является канцерогеном. В указанном патенте полученный стерильный лиофилизированный препарат обладает высокой влажностью, что существенно влияет на стабильность препарата при хранении и способствует деградации действующего вещества. Также в указанном способе не описывается процесс осуществления лиофильной сушки, который существенно влияет на конечную форму лекарственного препарата, а именно на соотношение кристаллических форм.
Настоящим изобретением является новый технологический способ производства лекарственного препарата «Тамерон», а именно лиофильно высушенной натриевой соли 5-амино-2,3-дигидрофталазин-1,4-диона, обладающей противовоспалительным, иммуномодулирующим, антиоксидантным, регенерирующим, противовирусным, антибактериальным, противогрибковым, нейропротекторным, обезболивающим, противоопухолевым действиями.
Задачей является обеспечение повышенной стабильности, репрезентативности полученного препарата, воспроизводимости заявленного технологического процесса, условий его осуществления и контроля, минимизации вредных примесей (изомерных микропримесей типа N-аминоизомера и линейных олигомеров натрия), экологической безвредности процесса.
Полученный заявленным способом аминодигидрофталазиндион натрия (лиофилизат аминодигидроталазиндион натрия, лекарственный препарат «Тамерон») характеризуется низким содержанием примесей, в частности, остаточных органических растворителей, деградантов аминодигидрофталазиндион натрия, и быстрым восстановлением влагосодержания в водном растворе, например, в инъекционной воде и/или в водном растворе хлорида натрия, а именно, 0,9-1,0-%-ном растворе хлорида натрия (физиологический раствор).
Лиофилизат аминодигидрофталазиндион натрия, полученный по данному изобретению, не оказывает местного раздражающего действия при многократном применении, обладает лучшей всасываемостью и биодоступностью в сравнении с другими монопрепаратами на основе аминодигидрофталазиндион натрия.
Технические результаты достигаются за счет того, что разработан способ получения лиофилизированного лекарственного препарата «Тамерон», представляющий собой аминодигидрофталазиндион натрия в форме стабильных кристаллов с переменным мольным соотношением субстанция/вода, с точной фиксацией количества воды, с низким содержанием механических, химических и биологических примесей, позволяющий получить стабильную готовую форму, обладающую повышенной растворимостью, с заданным соотношением кристаллических форм и низким содержанием влаги.
Поставленная техническая задача и полученный технический результат достигаются заявленным способом получения лиофилизата аминодигидрофталазиндион натрия (5-амино-2,3-дигидрофталазин-1,4-дион), включающим следующие стадии:
1) приготовление водного раствора аминодигидрофтализиндион натрия до полного его растворения с концентрацией в растворе 0,3-250 мг/мл в течение 0,1-1,5 ч;
2) стерилизующая фильтрация полученного раствора препарата в асептических условиях и дозирование его в первичную упаковку для лиофилизированных форм;
3) проведение лиофильной сушки препарата в камере лиофильной сушки в несколько этапов, при этом проводят охлаждение до температуры минус 75°С - минус 15°С со скоростью 0,5-10°С в минуту и дальнейшее высушивание под вакуумом. Сушку проводят до содержания влаги в продукте не более 10%;
4) заполнение сушки инертным газом или стерильным воздухом, укупоривание первичной упаковки и закатка или запайка.
Стадия стерилизующей фильтрации может быть проведена несколько раз в зависимости от качества исходной фармацевтической субстанции.
Известно, что кристаллы аминодигидрофталазиндион натрия могут находиться в нескольких модификациях. Так в Кембриджской Базе Структурных Данных (КБСД) содержаться коды трех модификаций солей аминодигидрофталазиндион натрия LOHKOK1 (1 Rybakov, V.B., Chernyshev, V.V., Paseshnichenko, K.А. et al. Crystallogr. Rep. (2014) 59: 383. https://doi.org/10.1134/S1063774514020187.), LOHKOK012 (2 Martin, Т., Greim, D., Milius, W., Niedermaier, M., Ludescher, В., von Wegerer, J., Brysch, W.,  K., Senker, J. and Breu, J. (2015), The Same at a First Glance: The Diffractogram of a New Polymorph of Anhydrous Sodium Luminolate Almost Perfectly Resembles the Diffraction Trace of an Already Known Polymorph. Z. anorg. allg. Chem., 641: 332-338. https://doi.org/10.1002/zaac.201400604.), LOHKOK022 (2 Martin, Т., Greim, D., Milius, W., Niedermaier, M., Ludescher, В., von Wegerer, J., Brysch, W.,
K., Senker, J. and Breu, J. (2015), The Same at a First Glance: The Diffractogram of a New Polymorph of Anhydrous Sodium Luminolate Almost Perfectly Resembles the Diffraction Trace of an Already Known Polymorph. Z. anorg. allg. Chem., 641: 332-338. https://doi.org/10.1002/zaac.201400604.), LOHKOK022 (2 Martin, Т., Greim, D., Milius, W., Niedermaier, M., Ludescher, В., von Wegerer, J., Brysch, W.,  K., Senker, J. and Breu, J. (2015), The Same at a First Glance: The Diffractogram of a New Polymorph of Anhydrous Sodium Luminolate Almost Perfectly Resembles the Diffraction Trace of an Already Known Polymorph. Z. anorg. allg. Chem., 641: 332-338. https://doi.org/10.1002/zaac.201400604.) и код аморфной части степени кристаллизации данного соединения LOHKIE1 (1 Rybakov, V.B., Chernyshev, V.V., Paseshnichenko, K.А. et al. Crystallogr. Rep. (2014) 59: 383. https://doi.org/10.1134/S1063774514020187).
K., Senker, J. and Breu, J. (2015), The Same at a First Glance: The Diffractogram of a New Polymorph of Anhydrous Sodium Luminolate Almost Perfectly Resembles the Diffraction Trace of an Already Known Polymorph. Z. anorg. allg. Chem., 641: 332-338. https://doi.org/10.1002/zaac.201400604.) и код аморфной части степени кристаллизации данного соединения LOHKIE1 (1 Rybakov, V.B., Chernyshev, V.V., Paseshnichenko, K.А. et al. Crystallogr. Rep. (2014) 59: 383. https://doi.org/10.1134/S1063774514020187).
Исходя из экспериментальных данных было установлено, что скорость охлаждения раствора до температур минус 30-40°С влияет на образования полиморфных модификаций аминодигидрофталазиндион натрия в конечном продукте.
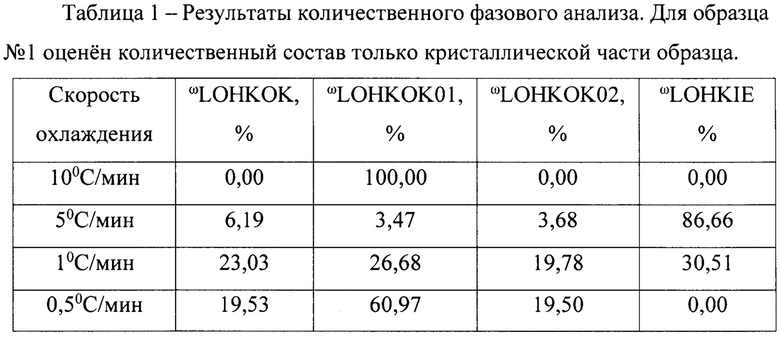
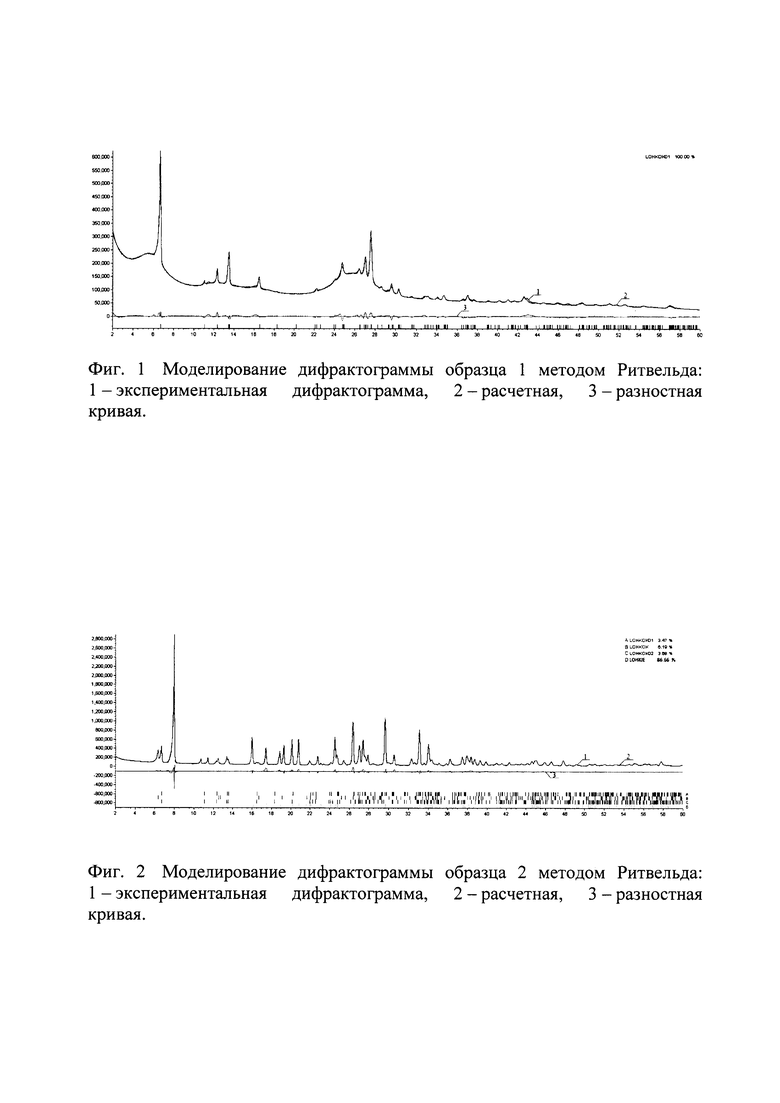
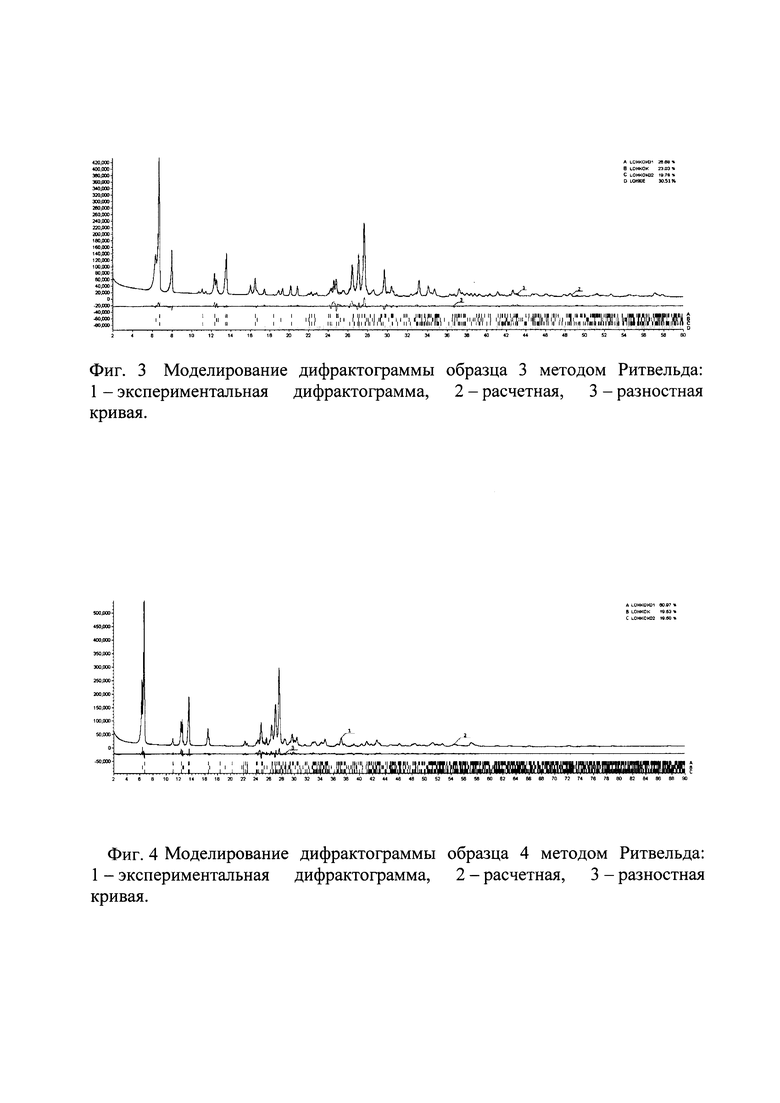
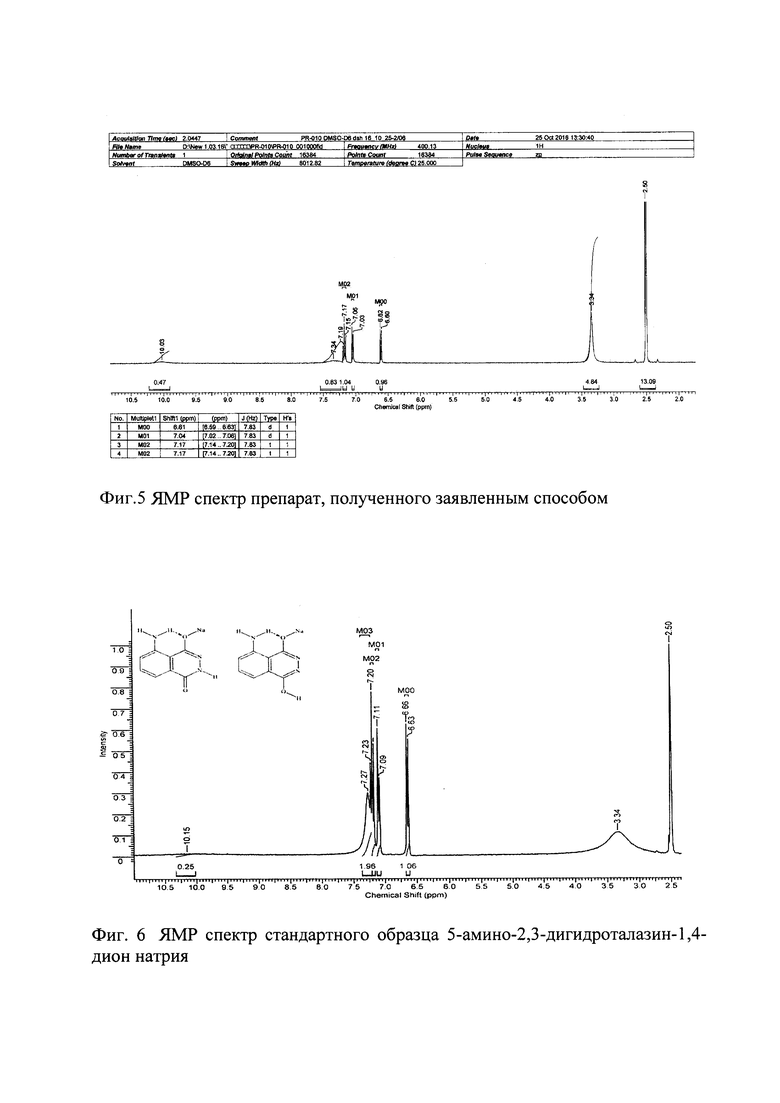
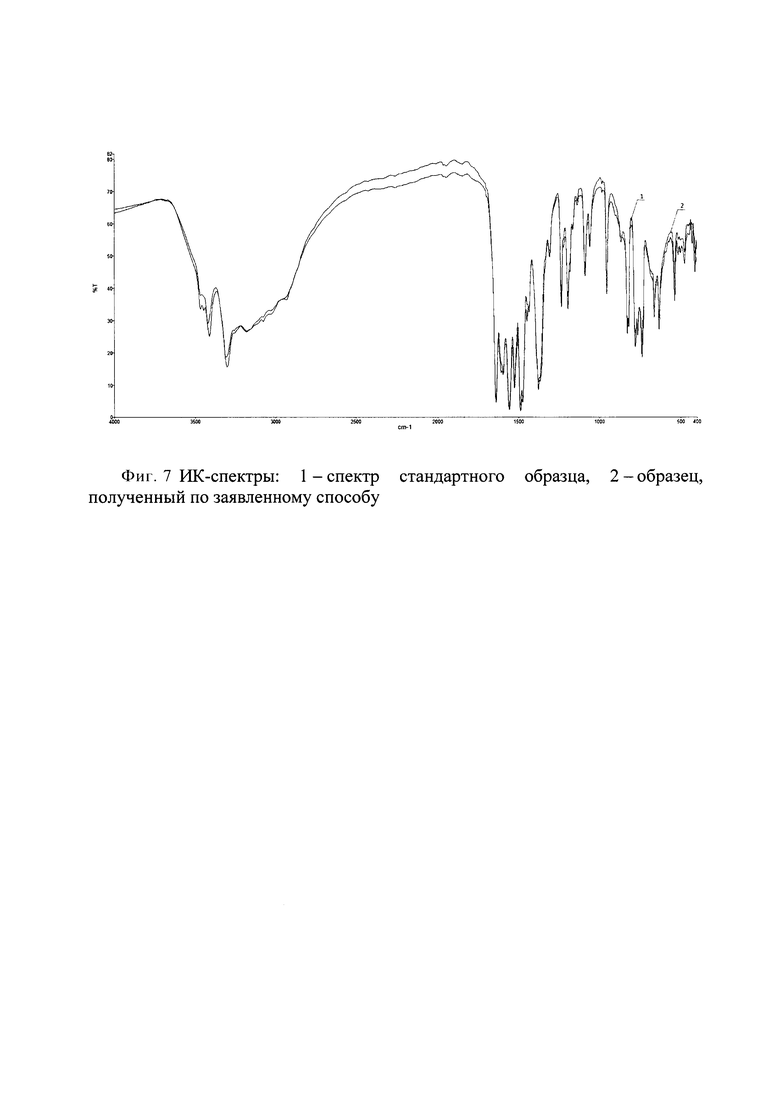
Для этого нами был проведен количественный фазовый анализ образцов, полученных при разной скорости охлаждения по описанному способу, методом Ритвельда с использованием программы Bruker Topas53 (3 Bruker TOPAS 5 User Manual. - Karlsruhe, Germany: Bruker AXS GmbH, 2015.).
Все дифрактограммы зарегистрированы на дифрактометре Bruker D8 Advance Vario, оснащенном рентгеновской трубкой с медным анодом и Ge(111)-монохроматором (CuKα1) и позиционно-чувствительным детектором LynxEye, в установках на просвет. Для образцов 1, 2, 3 интервал съемки составил 2-60° 2θ, шаг 0.02° 2θ. Для образца 4 был выбран интервал съемки 2-60° 2θ, шаг 0.02° 2θ.
Образец 4 содержит смесь трех полиморфных модификаций безводной натриевой соли люминола; коды КБСД - LOHKOK, LOHKOK01, LOHKOK02. Образцы 2 и 3 кроме фаз безводной соли аминодигидрофталазиндиона натрия содержат фазу моногидрата соли аминодигидрофталазиндиона натрия; код в КБСД LOHKIE2. Образец №1 в отличие от остальных образцов содержит значительную аморфную составляющую. Единственная кристаллическая фаза в составе образца №1 - безводная соль аминодигидрофталазиндиона натрия LOHKOK01. По соотношению интенсивностей пиков кристаллической фазы и уширенных пиков аморфной части степень кристалличности можно оценить в 20%. Количественные фазовые составы образцов, оцененные методом Ритвельда, представлены в таблице 1 и на фигурах 1-4.
Ниже приведены для иллюстрации примеры, не ограничивающие заявленное изобретение.
Пример 1.
В воду для инъекций вносят субстанцию аминодигидрофталазиндион натрия, полученную по способу, описанному в патенте RU №2673452 С1, и проводят перемешивание в течение 30 минут. Затем проводят стерилизующую фильтрацию через фильтр с диаметром пор 0,22 мкм. Стерильный раствор дозируют во флаконы и осуществляют охлаждение до температуры -45°С±5°С со скоростью 5°С в минуту. Затем проводят высушивание до содержания влаги в препарате не более 10%. Камеру сушки заполняют стерильным воздухом, флаконы укупоривают и закатывают алюминиевыми колпачками.
Пример 2.
В воду для инъекций вносят микробиологически чистую субстанцию аминодигидрофталазиндион натрия и проводят перемешивание в течение 60 минут. Затем проводят предварительную фильтрацию через фильтр с размером пор не более 0,45 мкм и стерилизующую фильтрацию через фильтр с номинальным размером пор не более 0,22 мкм. Стерильный раствор дозируют в ампулы и осуществляют охлаждение до температуры -20°С±5°С со скоростью 1°С в минуту. Затем проводят высушивание до содержания влаги в препарате не более 10%. Камеру сушки заполняют инертным газом, ампулы запаивают.
Пример 3.
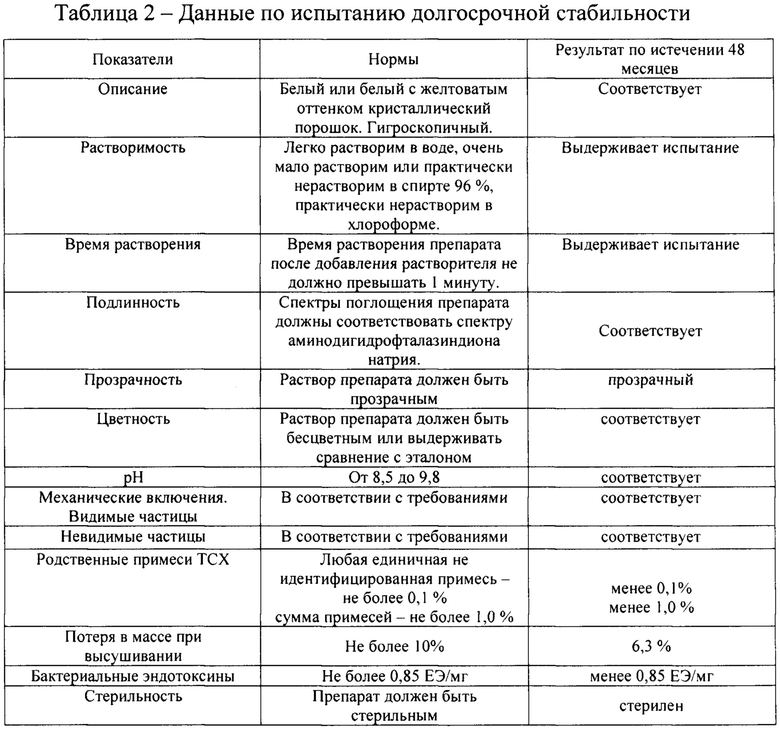
Полученные результаты по стабильности препарата методами «ускоренного старения» и естественного хранения показали, что препарат стабилен и не теряет свои свойства при хранении до 4 лет (таблица 2). Изучение стабильности продолжается.
Пример 4.
При сравнении образца, полученного заявленным способом, со стандартным образцом 5-амино-2,3-дигидрофталазин-1,4-диона натрия фирмы Sigma методом ЯМР спектроскопии было установлено, что в полученном образце отсутствуют посторонние примеси (Фиг. 5, 6). Данные ЯМР H1 спектра аминодигидрофталазиндион натрия, полученного указанным методом, показывают наличие сигналов ароматических протонов (д, 1Н, 6.61 м.д.; м, 1Н, 7.04 м.д.; т, 1Н, 7.17 м.д.) и протонов NH2 группы в области 7.34 м.д. Спектр снимали при нагревании образца в ДМСО d6 до 70°С до полного его растворения.
Пример 5.
При сравнении методом ИК-спектроскопии образец, полученный заявленным способом, имеет сопоставимый ИК-спектр со спектром стандартного образца 5-амино-2,3-дигидрофталазин-1,4-диона натрия фирмы Sigma (Фиг. 7).
Пример 6.
Проведенные доклинические исследования лекарственного препарата аминодигидрофталазиндион натрия, полученного по заявленному способу, показали:
1) Оценку острой токсичности проводили на белых беспородных крысах, которым однократно внутримышечно вводили препараты в дозах 40, 200 и 1000 мг/кг по субстанции, что соответствует 14-, 70- и 350-кратным терапевтическим для человека дозам. Каждая доза препаратов испытана на 5 самцах и 5 самках. Животным контрольных групп вводили носитель - 0,9% физиологический раствор хлорида натрия - в таком же объеме, как и тестируемый объект во всех дозах. ЛД50 препарата для белых беспородных крыс обоего пола превышают максимальную испытанную дозу - 1000 мг/кг. Препарат не обладает местным раздражающим действием при однократном внутримышечном введении.
2) Изучение хронической токсичности проводили на белых беспородных крысах, которым в течение 14 дней ежедневно внутримышечно вводили препарат в дозах 18 и 125 мг/кг по субстанции, что соответствует 6- и 44-кратным терапевтическим для человека дозам. Каждая доза препарата испытана на 10 самцах и 10 самках. Животным контрольных групп вводили носитель - 0,9% физиологический раствор хлорида натрия - в таком же объеме, как и препарат во всех дозах. По результатам клинических наблюдений за общим состоянием животных, гематологических анализов периферической крови, биохимических анализов сыворотки крови, клинических анализов мочи и патоморфологических исследований после 14-дневного курса введения в испытанных дозах неблагоприятных изменений, вызванных действием тестируемого препарата, не выявлено. Препарат не обладает местным раздражающим действием при многократном применении.
3) Оценка основных фармакокинетических параметров препарата проводилась при однократном внутримышечном введении крысам.
50-ти крысам (I группа) рецептуру вводили внутримышечно в виде водного раствора с аналитической добавкой меченого тритием препарата. При определении основных фармакокинетических параметров в процессе моделирования использовали 10 временных точек. На каждую временную точку приходилось по 5 животных (повторов). Были изучены изменения концентрации меченого препарата в крови.
В результате исследования было установлено, что препарат обладает высокой степенью высвобождения и достигает максимальной концентрации в крови за короткий период времени.
Таким образом, можно выделить следующие преимущества предлагаемого способа:
- использование разных способов заморозки минус 45°С - минус 15°С со скоростью 0,5-10°С в минуту с последующим лиофильным высушиванием, способствующее получению в форме стабильных кристаллов различной конфигурацией, которая придает различные положительные биологические свойства препарата;
- получение стабильного лекарственного препарата на основе аминодигидрофталазиндион натрия высокого качества с низким содержанием влаги (не более 10%), механических, химических и биологических примесей;
- исключение использования токсичного гидразингидрата и других вредных сырьевых компонентов;
- повышение конверсии, эргономики и экологичности;
- полностью подавлено образование смолистых веществ, линейных олиго- и полиимидов, изомерных фталимидов.
Изобретение относится к фармацевтике и описывает способ получения лекарственного препарата на основе натриевой соли 5-амино-2,3-дигидрофталазин-1,4-диона (аминодигидрофталазиндион натрия) в форме лиофилизата. Способ включает приготовление водного раствора аминодигидрофталазиндион натрия с концентрацией 03-250 мг/мл; проведение стерилизующей фильтрации полученного раствора и дозирование стерильного раствора в первичную упаковку; проведение лиофилизации. Лиофильную сушку осуществляют в несколько этапов, при этом проводят охлаждение до минус 75оС – минус 15оС со скоростью 0,5-10оС в минуту и дальнейшее высушивание проводят до содержания влаги в продукте не более 10%. На последней стадии заполняют камеру лиофильной сушки стерильным воздухом, закупоривают и закатывают/запаивают упаковку. Способ по изобретению позволяет получить стабильный и высокоочищенный лекарственный препарат в форме лиофилизата аминодигидрофталазиндиона натрия с повышением эргономики и конверсии процесса. 1 з.п. ф-лы, 2 табл., 7 ил., 6 пр.
1. Способ получения лиофилизата аминодигидрофталазиндион натрия, включающий следующие стадии:
1) приготовление водного раствора аминодигидрофтализиндион натрия до его полного растворения с концентрацией в растворе 0,3-250 мг/мл в течение 0,1-1,5 ч;
2) стерилизующая фильтрация полученного раствора препарата в асептических условиях и дозирование его в первичную упаковку для лиофилизированных форм;
3) проведение лиофильной сушки препарата в камере лиофильной сушки в несколько этапов, при этом проводят охлаждение до температуры минус 75°С - минус 15°С со скоростью 0,5-10°С в минуту и дальнейшее высушивание под вакуумом до содержания влаги в продукте не более 10%;
4) заполнение сушки инертным газом или стерильным воздухом, укупоривание первичной упаковки и закатка или запайка.
2. Способ получения лиофилизата аминодигидрофталазиндион натрия по п. 1, отличающийся тем, что стадия стерилизующей фильтрации может быть проведена несколько раз в зависимости от качества исходной фармацевтической субстанции.
| СПОСОБ ПОЛУЧЕНИЯ АКТИВНОЙ ФАРМАЦЕВТИЧЕСКОЙ СУБСТАНЦИИ, ПРЕДСТАВЛЯЮЩЕЙ СОБОЙ АМИНОДИГИДРОФТАЛАЗИНДИОН НАТРИЯ | 2017 |
|
RU2673452C1 |
| СПОСОБ ПРОИЗВОДСТВА НЕСТЕРИЛЬНЫХ СУБСТАНЦИЙ БЕЗВОДНОГО "ТАМЕРИТА" И/ИЛИ ДВУХВОДНОГО "ГАЛАВИТА" - НАТРИЕВЫХ СОЛЕЙ 5-АМИНО-2,3-ДИГИДРОФТАЛАЗИН-1,4-ДИОНА (ВАРИАНТЫ) И СПОСОБЫ ДАЛЬНЕЙШЕЙ ИХ ПЕРЕРАБОТКИ В СТЕРИЛЬНЫЕ ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ | 2016 |
|
RU2625267C1 |
| Царьков А | |||
| Н., Царькова Е | |||
| А.: "Инновационный препарат "Тамерон" | |||
| Известия института инженерной физики, 2019, том 54, с.111-115 | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
Авторы
Даты
2021-03-16—Публикация
2020-04-28—Подача