Изобретение относится к области медицины и радиобиологии, а именно радиопротекторному, радиомитигаторному и радиосенсибилизирующему фармакологическому средству, содержащему препарат ТАМЕРОН на основе активной фармацевтической субстанции 5-амино-2,3-дигидро-1,4-фталазиндион натрия (5-амино-2,3-дигидрофталазин-1,4-дион натрия, аминодигидрофталазиндиона натрия, люминол натрия), а также препаратов на основе других солей щелочных и щелочноземельных металлов аминодигидрофталазиндиона. Средство может применяться для лечения и профилактики лучевого поражения, а также при лечении онкологических заболеваний при лучевой терапии в качестве радиопротекторного и радиомитигаторного препарата, защищающего нормальные клетки организма от лучевого поражения при различных видах лучевой терапии и работающего как радиосенсибилизатор для раковых клеток.
В настоящее время известно несколько типов радиопротекторных средств, которые обладают прямым радиопротекторным действием - различные восстановленные тиосоединения (например, этиол (амифостин), N-ацетилцистеин) или вещества, блокирующие важные ферментные системы, играющие роль в развитии последствий лучевого поражения (например, ингибиторы NO-синтаз - N-ацил-S-алкилзамещенные изотиомочевины, индралин (альфа-адреномиметик)) [1]. В России к применению разрешен только индралин, а за рубежом - амифостин [2]. Ведутся разработки соединений на основе N-ацил-S-алкилзамещенных изотиомочевин, которые показали достаточно высокую эффективность в качестве радиопротекторов [3]. Также известны перспективные радиопротекторы на основе меланина [4] и пирувата лития [5]. В качестве радиомитигаторных средств для применения в ранние сроки после воздействия ионизирующего излучения в РФ зарегистрирован только интерлейкин-1β человека (Беталейкин). В США (US FDA) одобрено в качестве перспективных радиомитигаторов генистеин (BIO 300), 5-андростендиол (Neumune), рекомбинантный человеческий интерлейкин-12 (HemaMax), CBLB502 (Entolimod), гранулоцитарный колониестимулирующий фактор (G-CSF, Neupogen), ингибитор киназы ON01210 (ExRAD) и беклометазон (OrbeShield) [2].
Несмотря на достаточное количество известных потенциальных радиопротекторов и радиомитигаторов их эффективность проявляется в достаточно высоких концентрациях, при которых наблюдаются токсические эффекты. Поэтому применение таких веществ в качестве профилактических или тактических средств связано со значительными побочными эффектами. Аналогично и применение этих препаратов в онкологической практике ограничено в связи с плохой переносимостью и потенциальной токсичностью. В США единственным допущенным препаратом в качестве средства профилактики осложнений радиотерапии опухолей является амифостин, который в связи с токсичностью лишь ограниченно используется при лечении некоторых видов новообразований [2]. При этом в настоящее время нет препаратов, которые бы проявляли свойства радиопротектора, радиомитигатора и радиосенсибилизатора и обладали бы низкой токсичностью. В настоящем изобретении в качестве такого препарата предлагается использовать соединения аминодигидрофталазиндиона, а именно его соединения в виде соли натрия (лекарственный препарат ТАМЕРОН), а также других солей щелочных и щелочноземельных металлов аминодигидрофталазиндиона.
Препарат ТАМЕРОН на основе активной фармацевтической субстанции аминодигидрофталазиндиона натрия обладает иммунотропным действием, регулирует биологическую активность иммунных клеток, нормализуя избыточный синтез провоспалительных цитокинов - TNF-α, ИЛ-1, ИЛ-6 иммунными клетками [6-10]. Показано, что биологические свойства аминодигидрофталазиндиона натрия преимущественно связаны с его прямой и косвенной антиоксидантной активностью. Косвенная - за счет механизма опосредованной активации антиоксидантных систем препаратом ТАМЕРОН путем стабилизации транскрипционного фактора Nrf2. Этот белок влияет на экспрессию генов, связанных с регуляцией окислительно-восстановительного баланса клетки [11]. Прямая антиоксидантная защита реализуется путем химического взаимодействия аминодигидрофталазиндиона натрия с радикалами [12, 13].
Натриевая соль люминола способна диссоциировать с образованием аниона при более низких значениях рН, близких к физиологическим, в отличие от люминола, где реакция может происходить только в достаточно сильно-щелочных условиях (при рН 8-10), которые не свойственны организму. Аминодигидрофталазиндион натрия в биологических жидкостях не проявляет реакционной способности, но при добавлении индуктора окислительного стресса - пероксида водорода, люминол натрия окисляется, нейтрализуя свободные радикалы [14]. Известно, что соли других щелочных металлов и соли щелочноземельных металлов аминодигидрофталазиндиона обладают аналогичными иммуномодулирующим свойствами и полностью сохраняют свою реакционную способность в отношении активных форм кислорода [15]. Таким образом, вещества на основе солей щелочных и щелочноземельных металлов аминодигидрофталазиндиона могут длительное время, циркулируя в организме, нейтрализовать свободные АФК в местах лучевого поражения или окислительных процессов и воспаления после лучевой терапии [16]. Эти вещества взаимодействуют с наиболее токсичными для клетки радикалами - супероксид и гидропероксид анионами, которые отвечают за дальнейшее развитие свободнорадикальной цепи и процессы перекисного окисления липидов мембран клеток, белков, других биологических структур при воздействии ионизирующего излучения [17].
Отличительной чертой препарата ТАМЕРОН и других солей щелочных и щелочноземельных металлов аминодигидрофталазиндиона является и чрезвычайно малая токсичность для организма человека и животных. Так, LD50 для крыс составляет более 1000 мг/кг для острой токсичности, для хронической более 500 мг/кг. Для человека возможные разовые дозы применения препарата ТАМЕРОН и других солей щелочных и щелочноземельных металлов аминодигидрофталазиндиона от 10 до 2000 мг [6, 15].
Целью изобретения является обеспечение радиопротекторных свойств посредством использования радиопротекторного средства на основе аминодигидрофталазиндиона натрия (лекарственного препарата ТАМЕРОН) в дозах от 10 до 2000 мг как разово (внутримышечно и внутривенно в виде порошка или лиофилизата, сублингвально в виде таблеток, в виде кишечнорастворимых капсул, в виде свечей и других возможных лекарственных форм и способов введения) в качестве радиопротекторного и радиомитигаторного препарата, так и длительно в тех же суточных дозах (внутримышечно и внутривенно в виде порошка или лиофилизата, сублингвально в виде таблеток, в виде кишечнорастворимых капсул, в виде свечей и других возможных лекарственных форм и способов введения) при хроническом воздействии ионизирующего излучения или при курсе лучевой терапии. Применение этого препарата способно значительно снизить побочные эффекты лучевого поражения. Препарат ТАМЕРОН и другие соли щелочных и щелочноземельных металлов аминодигидрофталазиндиона возможно применять как в виде порошка чистого вещества, так и в составе композиций в виде мазей, крема и др. в качестве наружных средств для уменьшения лучевого повреждения кожи (в случае лечения кожных онкологических заболеваний или опасности лучевого поражения кожи). Применение препарата ТАМЕРОН и других солей щелочных и щелочноземельных металлов аминодигидрофталазиндиона в указанных выше дозах и способах при лучевой терапии является радиосенсибилизатором - усиливает гибель раковых клеток, но способствует выживанию нормальных клеток организма.
Для подтверждения достижения цели изобретения были проведены биологические испытания радиопротекторных, радиомитигаторных и радиосенсибилизирующих свойств препарата на основе натриевой соли аминодигидрофталазиндиона (препарат ТАМЕРОН) на примере культуры нормальных и раковых клеток человека, а также животных - лабораторных мышах.
Перечень фигур
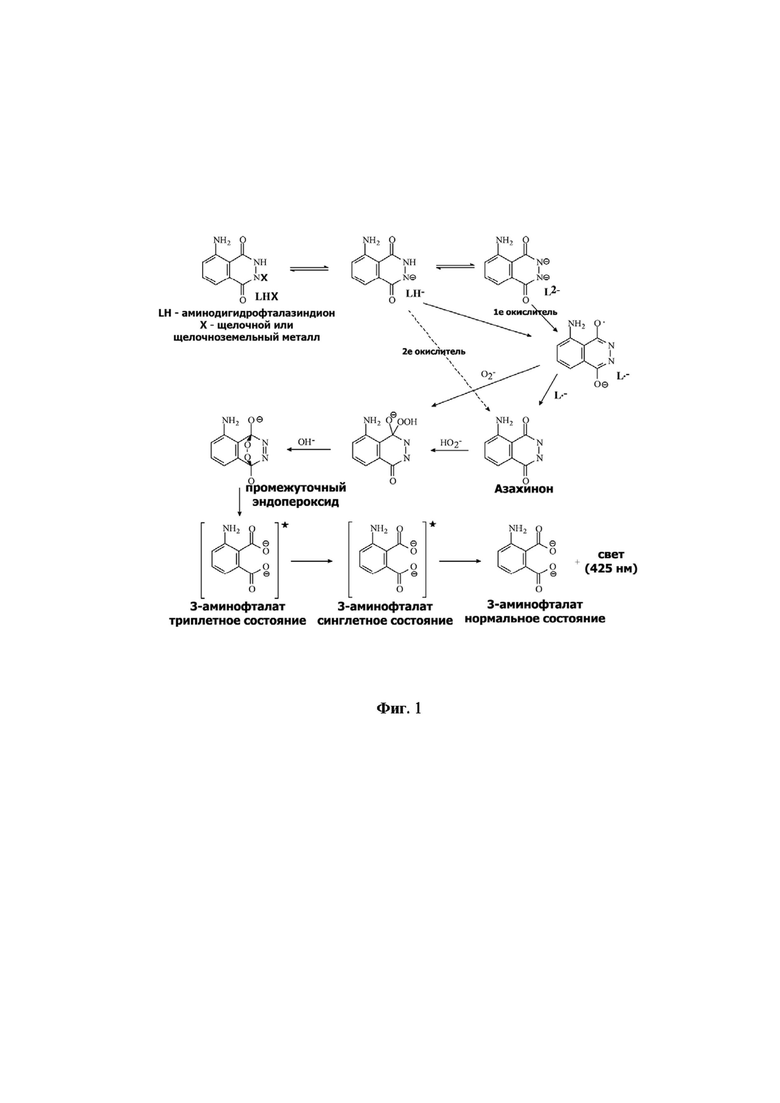
Фиг. 1. Схема прямой антиоксидантной активности солей щелочных и щелочноземельных металлов аминдогидрофталазиндиона за счет химического взаимодействия со свободными радикалами.
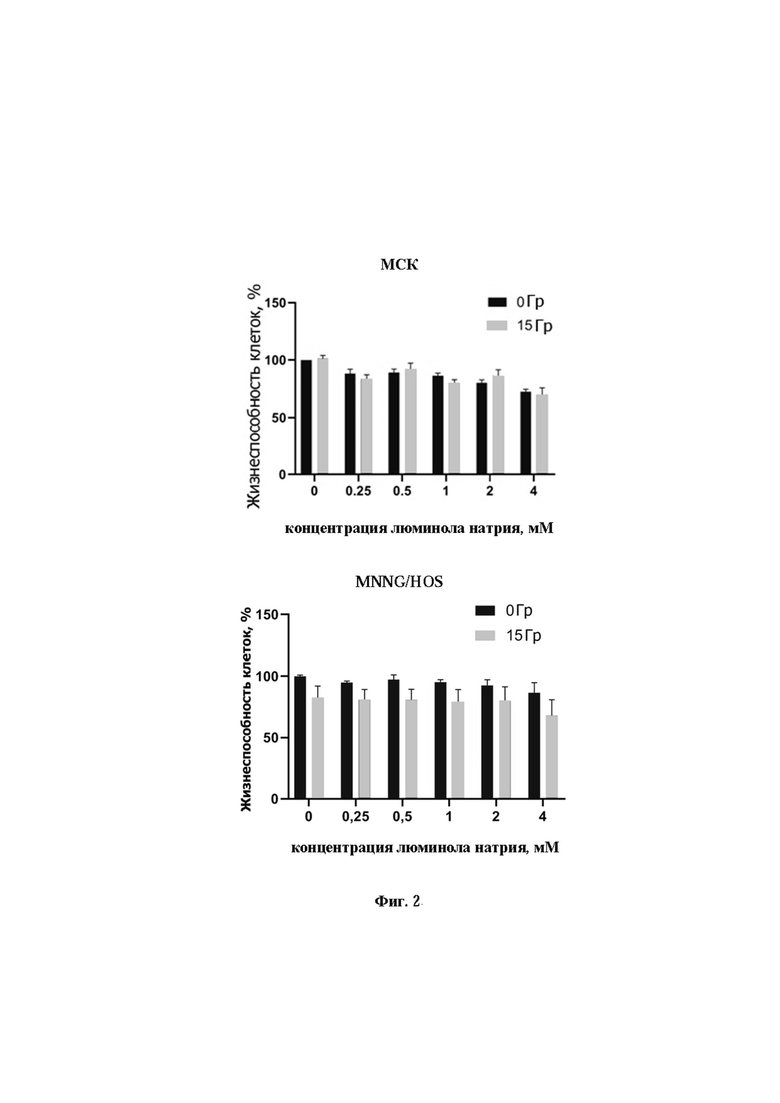
Фиг. 2. Анализ жизнеспособности МСК человека и клеток остеосаркомы линии MNNG/Hos после инкубации с различными концентрациями аминодигидрофталазиндиона натрия (0.25-4 мМ) после облучения рентгеновскими лучами в дозе 15 Гр.
Фиг. 3. Радиопротекторные и радиомитигаторные свойства аминодигидрофталазиндиона натрия Тест жив-мертв МСК человека и клеток остеосаркомы линии MNNG/Hos после инкубации с различными концентрациями аминодигидрофталазиндиона натрия (0.25-4 мМ) после облучения рентгеновскими лучами в дозе 15 Гр. На микрофотографиях над диаграммами показаны типичное распределение клеток - зеленые живые, красные - мертвые. Линейка - 100 μm.
Фиг. 4. Радиопротекторные свойства аминодигидрофталазиндиона натрия. Анализ уровня внутриклеточных АФК (пероксидов и гидроксильного радикала) в МСК человека и клеток остеосаркомы линии MNNG/Hos после инкубации с различными концентрациями аминодигидрофталазиндиона натрия (0.25-4 мМ) после облучения рентгеновскими лучами в дозе 15 Гр. Клетки окрашивали селективными красителя CellROX и DHE.
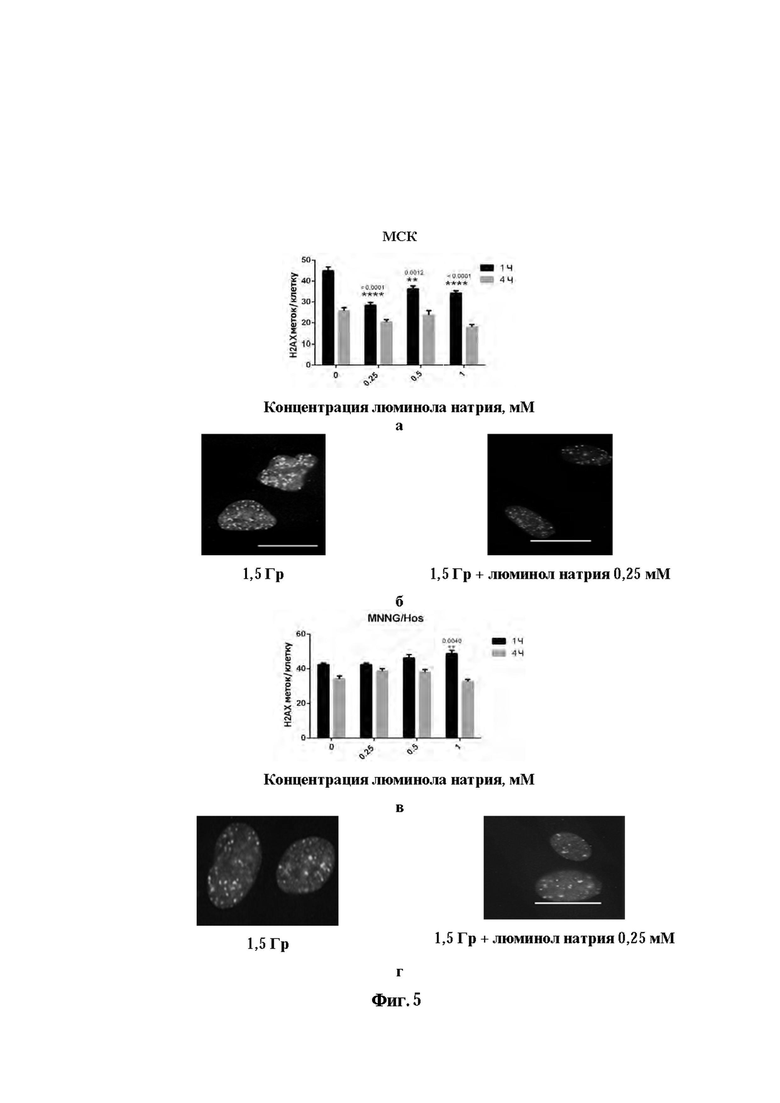
Фиг. 5. Радиомитигаторные и радиосенсибилизирующие свойства аминодигидрофталазиндиона натрия, тест на двунитиевые разрывы ДНК после рентгеновского облучения в дозе 1,5 Гр мезенхимальных стволовых клеток (МСК) и раковых клеток линии MNNG/Hos. а - подсчет количества фокусов разрывов ДНК в культивируемых мезенхимальных стволовых клетках (МСК) человека через 1 и 4 часа после облучения рентгеном в дозе 1,5 Гр в контроле и в присутствии люминола натрия, б - визуализация разрывов ДНК в ядрах МСК на микрофтографиях, в - подсчет количества фокусов разрывов ДНК в культивируемых раковых клетках (MNNG/Hos) человека через 1 и 4 часа после облучения рентгеном в дозе 1,5 Гр в контроле и в присутствии люминола натрия, г - визуализация разрывов ДНК в ядрах клеток MNNG/Hos на микрофтографиях. Линейка - 10 мкм.
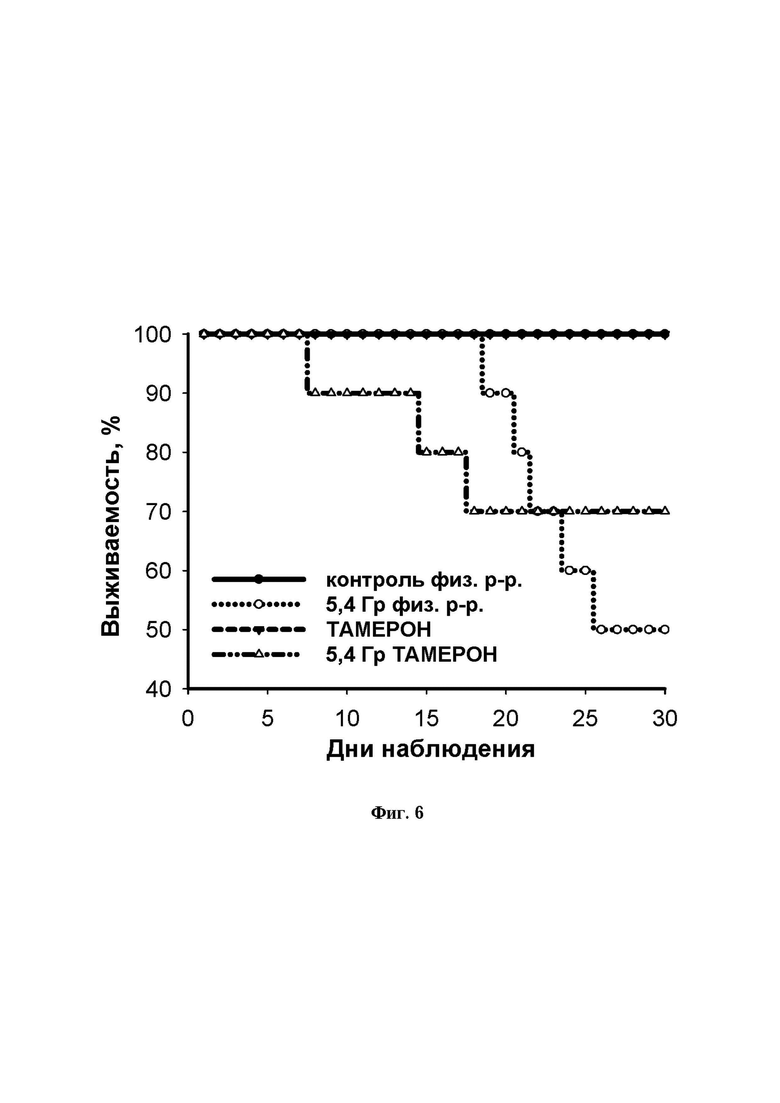
Фиг. 6. Радиомитигаторные свойства аминодигидрофталазиндиона натрия. Кривая выживаемости мышей линии SHK после облучения в дозе 5,4 Гр после 3-кратного внутрибрюшинного введения препарата ТАМЕРОН.
Пример. Исследование радиопротекторных, радиомитигаторных и радиосенсибилизирующих и свойств препарата ТАМЕРОН
На фиг. 1 представлена схема прямой антиоксидантной активности солей щелочных и щелочноземельных металлов аминодигидрофталазиндиона путем захвата анионом люминола свободных радикалов кислорода и его дальнейшего окисления до конечного продукта - 3-аминофталевой кислоты. Так анион люминола в растворе при взаимодействии с одно или двух электронным окислителем образует люминол - радикал. Далее он претерпевает превращение в азахинон с переходом в окисленное промежуточное перекисное соединение, как при взаимодействии с гидропероксильным радикалом, так и при непосредственном взаимодействии с супероксид радикалом. Промежуточный продукт этих реакций нестабилен и он превращается в 3-аминофталевый дианион, при этом электроны последнего соединения, находившиеся в триплетном состоянии, переходит в синглетное состояние. Возвращение электронов 3-аминофталевого дианиона из триплетного состояния в нормальное сопровождается испусканием квантов света с длиной волны 425 нм.
Анализ изменений уровня метаболической активности методом МТТ теста после облучения рентгеном показан на фиг 2. Он выявил, что у стволовых и раковых клеток значения этого показателя мало изменялись как в контроле, так и после облучения. Стоит отметить, что даже очень высокие концентрации аминодигидрофталазиндиона натрия (до 4 мМ) не обладали цитотоксическим эффектом. В целом стоит отметить, что МТТ тест является достаточно грубым и показывает изменения метаболической активности клеток только при значительных повреждениях систем метаболизма клеток.
На фиг 3 показаны более точные данные, полученные при оценке доли живых и мертвых клеток. Так, в культуре мезенхимальных стволовых клеток облучение рентгеном и аминодигидрофталазиндиона натрия значимо не вызывали увеличения доли мертвых клеток. Напротив, у раковых клеток аминодигидрофталазиндиона натрия приводил к развитию процесса гибели клеток и эффект увеличивался при повышении концентрации. При концентрации 4 мМ в популяции наблюдалось более 25% клеток. Стоит отметить, что на фоне облучения рентгеном он не проявлял радиозащитного эффекта, а напротив, даже усиливал гибель раковых клеток на 25%.
Анализ изменений уровня АФК в клетках после облучения рентгеном представлен на фиг. 4. Так облучение клеток МСК и MNNG/Hos сопровождалось значительным ростом генерации активных форм кислорода. Внесение люминола натрия в культуральную среду, где находились исследуемые клетки приводило к тому, что концентрация радикалов в клетках после облучения была значительно ниже, чем в контроле. В данном случае наблюдалась относительная обратная зависимость генерации АФК от концентрации люминола натрия - максимальный эффект ингибирования генерации свободных радикалов наблюдался при концентрациях 1 и 2 мМ. Анализ количества двунитевых разрывов ДНК методом иммуноокрашивания фосфорилированных локусов Н2АХ после облучения рентгеновскими лучами в дозе 1.5 Гр показан на фиг. 5. Он выявил различный ответ клеточных культур на предварительную их обработку аминодигидрофталазиндиона натрия в различных концентрациях (0.25-1 мМ). Предобработка МСК человека аминодигидрофталазиндионом натрия во всех исследованных концентрациях (0.25-1 мМ) через 1 час после облучения выявил достоверное снижение количества двунитевых разрывов ДНК по сравнению с необработанным контролем (*р ≤ 0.0001 для 0.25 мМ, p ≤ 0.0012 для 0.5 мМ, p ≤ 0.0001 для 1 мМ). При этом через 4 часа после облучения только максимальная концентрация препарата показала различие с контрольной группой. Более низкие концентрации препарата (0.25-0.5 мМ) через 4 часа после облучения не обеспечивали достоверного ускорения репарации двунитевых разрывов ДНК. В случае клеток остеосаркомы человека линии MNNG/Hos препарат не только не снижал количество двунитевых разрывов ДНК в концентрациях 0.25 и 0.5 мМ, но и достоверно увеличивал (*р ≤ 0.004) в максимальной концентрации (1 мМ). Через 4 часа после облучения количество двунитевых разрывов ДНК во всех исследованных концентрациях не имело достоверных различий с контрольной группой (без воздействия препарата).
На фигуре 6 показана кривая выживаемости мышей после облучения рентгеном в дозе 5,4 Гр. Животные, которые получали внутрибрюшинно физ. раствор или ТАМЕРОН в дозе 300 мг/кг (суммарно 900 мг/кг) показывали в течение 30 суток после введения выживаемость на уровне 100%. Мыши, получавшие внутрибрюшинно физ. раствор и подвергшиеся облучению рентгеном в дозе 5,4 Гр гибли с 20 суток после облучения, и количество погибших животных достигало 50% к 25 суткам наблюдения. Животные, которые после облучения троекратно получали инъекцию препарата ТАМЕРОН показывали более лучшую динамику выживаемости. Хотя и животные на фоне применения препарата начинали гибнуть несколько раньше (с 8 суток), но при этом выживаемость их достигла 70% к 18 суткам наблюдения и сохранялась на этом уровне до конца эксперимента, т.е. применение препарата ТАМЕРОН улучшало выживаемость животных на 20%, по сравнению с животными, которые препарат не получали.
Материалы и методы
Культуры клеток
Эксперименты проводились на культуре нормальных (мезенхимальные стволовые клетки, выделенные из пульпы зуба) и раковых клеток (остеосаркома человека линии MNNG/Hos). Мезенхимальные стволовые клетки человека (hMSc) были выделены из зачатка третьего моляра, извлеченного по ортодонтическим показаниям у здорового 16-летнего пациента. Клетки экстрагировали в среде DMEM/F12 (ПанЭко, Россия), содержащей 200 ЕД/мл пенициллина и 200 мг/мл стрептомицина (Life Technologies, США), шприцем, вставленным в верхушку зуба, с последующей обработкой 0,25% трипсином + 0,02% ЭДТА (Life Technologies). Technologies, США) в течение 30 мин при 37°С. Выделенные клетки центрифугировали в течение 2 мин при 1500 об/мин и ресуспендировали до состояния единичных клеток в культуральной среде, состоящей из DMEM/F12 (1:1; Life Technologies) с добавлением 10% эмбриональной бычьей сыворотки (FBS). Полученный раствор переносили во флаконы по 25 мл и культивировали в атмосфере 5% СО2 при 37°С с добавлением 10% FBS (HyClone), 100 ЕД/мл пенициллина/стрептомицина, 2 мМ L-глутамина в DMEM (ПанЭко, Россия). При достижении состояния субконфлюэнтных клеток культивируемые клетки обрабатывали 0,25% раствором ЭДТА/трипсин и добавляли во флаконы объемом 75 см2 в соотношении 1:3. Клетки культивировали в среде DMEM/F12 («ПанЭко», Россия) с добавлением 10% FBS, 100 ЕД/мл пенициллина/стрептомицина и 2 мМ L-глутамина. В нашем исследовании использовали культуры клеток 3-4 пассажей. Культура клеток остеосаркомы человека линии MNNG/Hos была получена из криобанка лаборатории роста клеток и тканей ИТЭБ РАН.
Облучение клеточных культур
Облучение клеточных клеток проводили с использованием терапевтического рентгеновского аппарата РУТ-15 (Мосрентген, Россия) в дозе 15 Гр при мощности дозы 1 Гр/мин, напряжении 200 кВ, фокусном расстоянии 37,5 см и ток 20 мА. Клетки облучали в 96 луночных культуральных планшетах или культуральных флаконах. Мышей облучали индивидуально в клетках в дозе 5,4 Гр, при мощности дозы 1 Гр/мин.
Анализ уровня внутриклеточных АФК
Уровень внутриклеточных АФК после облучения определялся с использованием 2 селективных флуоресцентных красителей: CellROX (Invitrogen) и дигидроэтидиум (Sigma Aldrich). Краситель CellROX (2 μM), способен эффективно проникать в клетку, и при окислении активными формами кислорода (в основном пероксидами) проявлять ярко-зеленую фотостабильную флуоресценцию и при последующем связывании с ДНК имеет максимумы поглощения/испускания при ~ 485/520 нм. Для анализа уровня гидроксильного радикала после облучения в присутствии особочистого люминола натрия был использован дигидроэтидиум (4 μM). Клетки были высеяны в 96-луночные культуральные планшеты в плотности 20 тыс.кл./см2. Плотность посева клеток MNNG составляла 15 тыс. кл/см2. После культивирования в течении 14 часов среде ДМЕМ/F12 (1:1) с 10% добавлением фетальной бычьей сыворотки (FBS) при температуре 37°С, 95%-ой влажности в атмосфере с содержанием 5% СО2 вносили различные концентрации люминола Na. Через 3 часа инкубации клетки окрашивали зондами CellRox и dihydroethdium. После окрашивания в течение 30 мин, добавляли культуральную среду без фенолового красного и облучали клетки рентгеновским излучением с дозой 15 Гр. Регистрировали флуоресценцию на планшетном ридере H1 Synergy Biotek (USA) в течение 20 часов.
Анализ уровня антиоксидантов
Были высеяны стволовые клетки, полученные из пульпы зуба человека (DPSc) в 96-луночные культуральные планшеты в плотности 2*104 кл/см2. Плотность посева клеток MNNG составляла 15 тыс. кл/см2. После культивирования в течении 14 часов среде ДМЕМ/F12 (1:1) с 10% добавлением фетальной бычьей сыворотки (FBS) при температуре 37°С, 95%-ой влажности в атмосфере с содержанием СО2 5% вносили разные концентрации люминола Na. Через 3 часа инкубации клетки окрашивали ThiolTracker (оценка уровня восстановленного глутатиона). После окрашивания в течение 30 мин, добавляли культуральную среду без фенолового красного и облучали клетки рентгеновским излучением с дозой 15 Gy. Регистрировали флуоресценцию на планшетном ридере H1 Synergy Biotek (USA) в течение 20 часов.
МТТ тест
Определение активности метаболической активности клеточных культур проводили методом МТТ теста, принцип которого основан на восстановлении клеточными дегидрогеназами бесцветной водорастворимой соли тетразолия (бромид 3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолия) до нерастворимых кристаллов формазана. Клетки высевали в 96-луночные планшеты и культивировали в атмосфере, содержащей 5% СО2, при 37°С. Через шесть часов после посева среду заменяли средой, содержащей различные концентрации люминола натрия (от 0.1 до 2 мМ). Через 24, 48 и 72 часа после добавления микрокапсул определяли жизнеспособность.
Тест жив-мертв
Оценку жизнеспособности клеток, культивируемых в присутствии особо чистого люминола натрия, проводили на микроскопе Carl Zeiss Axiovert 200. Для анализа использовали набор L-7007 LIVE/DEAD BaeLight Bacterial Viability Kit (Invitrogen), который включает флуоресцентный краситель SYTO 9 для окрашивания всех клеток (поглощение - 420 нм, испускание - 580 нм) и краситель йодида пропидия (PI), который окрашивает ядра только мертвых клеток (поглощение 488 нм и эмиссия 640 нм). В среду вносили смесь красителей (1 мкг/мл) и затем помещали культуральный планшет в СО2-инкубатор на 15 мин. Микрофотографии были сделаны после промывания клеток фосфатно-солевым буфером.
Анализ двунитевых разрывов ДНК
Клетки высевали с плотностью 2*104 см2, культивировали 16 часов (overnight) и вносили люминол натрия в различных концентрациях (0,25, 0,5 и 1 мМ). Далее клетки культивировались в присутствии синтезированного особо чистого люминола натрия в течение 24 часов и подвергались облучению рентгеновскими лучами в дозе 1,5 Гр. Анализ количества двунитевых разрывов ДНК проводили через 1 и 4 часа после облучения. После облучения клетки дважды промывали фосфатно-солевым буфером (PBS, рН 7,4). Затем клетки фиксировали 4% раствором параформальдегида в PBS в течение 10 минут, пермеабилизировали с использованием 0,3% раствора Triton Х-100 в PBS в течение 5 минут, тщательно промывали PBS, блокировали в 1% BSA в PBS в течение 30 минут при комнатной температуре. Для иммуноокрашивания использовали первичные антитела, моноклональные мышиные γH2AX (ab195188 Recombinant, Anti-gamma H2A.X (фосфо S139), (Alexa Fluor® 488), Abcam). Получение изображений очагов репарации DSB проводилось с использованием инвертированной микроскопии Zeiss Axiovert Observer 200М (Carl Zeiss Microscopy, Йена, Германия) с использованием объектива 63х. Анализ клеток, окрашенных γH2AX, проводили с помощью подключаемого модуля FindFoci ImageJ для автоматического распознавания очагов. Для каждой экспериментальной группы анализировалось не менее 20 полей зрения.
Анализ выживаемости мышей после облучения рентгеном
Эксперимент по выживаемости животных проводили на аутбредных мышах SHK, полученных из аккредитованного питомника «Столбовая» (Филиал "Столбовая" Федерального государственного бюджетного учреждения науки "Научный центр биомедицинских технологий Федерального медико-биологического агентства"). В эксперименте были следующие группы животных: контрольная группа, которой внутрибрюшинно кололи физ. раствор и не облучали рентгеном; группа, которой внутрибрюшинно кололи физ. раствор и облучали рентгеном в дозе 5,4 Гр; группа, которой внутрибрюшинно кололи ТАМЕРОН (лиофилизат, производства АНО Института инженерной физики) в дозе 300 мг/кг троекратно каждые сутки (3 введения в сумме) и не облучали рентгеном; группа, которой внутрибрюшинно кололи ТАМЕРОН (лиофилизат, производства АНО Института инженерной физики) в дозе 300 мг/кг троекратно каждые сутки (3 введения в сумме) после облучения рентгеном в дозе 5,4 Гр. Далее в течение 30 суток оценивали число выживших животных. В каждой группе было по 25 мышей.
Статистическая обработка экспериментальных данных
Статистический анализ проводился с использованием программы GraphPad Prism 8.0. Все экспериментальные данные были представлены как среднее значение ± стандартное отклонение (SD) и были проверены на наличие статистически значимых различий с использованием однофакторного дисперсионного анализа (ANOVA). Различия между экспериментальными группами считали статистически значимыми при значении p<0,05.
Источники литературы
1. Васин М.В. Классификация противолучевых средств как отражение современного состояния и перспективы развития радиационной фармакологии // Радиац. биол. Радиоэкол. 2013, 53(5). С. 459-467.
2. Гребенюк А.Н., Гладких В.Д. Современное состояние и перспективны разработки лекарственных средств для профилактики и ранней терапии радиационных поражений // Радиац. биология. Радиоэкология. 2019. 59(2). С. 132-49.
3. Филимонова М.В. и др. Радиозащитное фармакологическое средство. Патент РФ № RU 2733883 C2 (15.04.2020).
4. Котенко К.В. и др. Способ профилактики и лечения острой лучевой болезни в эксперименте. Патент РФ №RU 2551619 C1 (19.05.2014).
5. Плотников Е.В., Третьякова М.С. Радиопротекторное средство. Патент РФ № RU 2737898 C1
6. Абидов М.Т., Хохлов А.П. Иммуномодулирующее средство. Патент РФ № RU 2113222 C1 (30.09.1997).
7. Царьков А.Н., Царькова Е.А. Инновационный препарат «ТАМЕРОН» // Известия Института инженерной физики, 2019. №4(54). С. 111-115.
8. Царьков А.Н., Краснова Ю.В., Царькова Е.А. Технология производства иммунотропного инновационного препарата «ТАМЕРОН» // Известия Института инженерной физики, 2020. №2(56). С. 82-86.
9. Мрикаев Б.М. Разработка физико-химических, клеточных и молекулярных моделей изучения эффектов нового отечественного иммуномодулятора «Галавит» (Экспериментальное исследование): дисс. канд. мед. наук. М., 2005. 138 с.
10. Вольский B.C. и др. Способ получения лиофилизата аминодигидрофталазиндион натрия - лекарственного препарата "Тамерон". Патент РФ №2744858 (28.04.2020).
11. Scofield V.L., Yan M., Kuang X., Kim S.J., Wong P.K. The drug monosodium luminol (GVT) preserves crypt-villus epithelial organization and allows survival of intestinal T cells in mice infected with the ts1 retrovirus // Immunol Lett, 2009. 122(2). P. 150-158.
12. Barni F., Lewis S.W., Berti A., Miskelly G.M., Lago G. Forensic application of the luminol reaction as a presumptive test for latent blood detection // Talanta, 2007. 72(3). P. 896-913.
13. Khan P., Idrees D., Moxley M.A., Corbett J.A., Ahmad F., von Figura G., Sly W.S., Waheed A., Hassan M.I. Luminol-based chemiluminescent signals: clinical and non-clinical application and future uses // Appl Biochem Biotechnol., 2014. 173(2). P. 333-55.
14. Ермаков A.M., Царькова Е.А. К вопросу об антиоксидантной активности препарата «ТАМЕРОН» // Известия Института инженерной физики. 2020. №3 (57). С. 103-106.
15. Предводителев Д.А., Абидов М.Т. Лекарственный препарат (варианты). Патент РФ №RU 2302863 C2 (20.11.2001).
16. Ермаков A.M., Царькова Е.А., Антонова О.Ю., Каменских К.А., Кочеткова О.Ю., Колманович Д.Д. К вопросу о радиопротекторных свойствах препарата Тамерон // Известия Института инженерной физики. 2022. №2 (64). С. 97-100.
17. Dong, S., Lyu, X., Yuan, S., Wang, S., Li, W., Chen, Z., Yu, H., Li, f, Jiang, Q., 2020. Oxidative stress: A critical hint in ionizing radiation induced pyroptosis. Radiation Medicine and Protection 1. P. 179-185.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения лиофилизата аминодигидрофталазиндион натрия - лекарственного препарата "Тамерон" | 2020 |
|
RU2744858C1 |
| СПОСОБ ПОВЫШЕНИЯ ЧАСТОТЫ ОБРАЗОВАНИЯ ДВУНИТЕВЫХ РАЗРЫВОВ ДНК В КЛЕТКАХ ЧЕЛОВЕКА ПРИ ДЕЙСТВИИ ИОНИЗИРУЮЩИХ ИЗЛУЧЕНИЙ В УСЛОВИЯХ ВЛИЯНИЯ РАДИОМОДИФИКАТОРОВ | 2018 |
|
RU2699670C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТВЕРДОЙ ФОРМЫ ЛЕКАРСТВЕННОГО СРЕДСТВА ТАМЕРОН В ВИДЕ КИШЕЧНОРАСТВОРИМЫХ КАПСУЛ | 2023 |
|
RU2827329C1 |
| ЛЕЧЕНИЕ РАКА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ И НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО ИНГИБИТОРАМИ ATR | 2012 |
|
RU2648507C2 |
| ПРИМЕНЕНИЕ ФРАГМЕНТА ДНК ТРАНСКРИБИРУЕМОЙ ОБЛАСТИ РИБОСОМНОГО ПОВТОРА ДЛЯ ПОВЫШЕНИЯ УСТОЙЧИВОСТИ МЕЗЕНХИМНЫХ СТВОЛОВЫХ КЛЕТОК К ДЕЙСТВИЮ АГРЕССИВНЫХ ФАКТОРОВ ОКРУЖАЮЩЕЙ СРЕДЫ | 2013 |
|
RU2560270C2 |
| СПОСОБ ЗАЩИТЫ ЖИВОТНЫХ ОТ ВЫСОКОДОЗОВОГО ИОНИЗИРУЮЩЕГО ИЗЛУЧЕНИЯ | 2019 |
|
RU2701155C1 |
| Способ повышения эффективности действия ионизирующих излучений на меланому | 2021 |
|
RU2774032C1 |
| РАСТВОР АМИНОДИГИДРОФТАЛАЗИНДИОНА НАТРИЯ ДЛЯ ВНУТРИВЕННОГО ВВЕДЕНИЯ | 2023 |
|
RU2821033C1 |
| СПОСОБ ПОВЫШЕНИЯ ЭФФЕКТИВНОСТИ ДЕЙСТВИЯ ПРОТОННОЙ ТЕРАПИИ НА СТВОЛОВЫЕ КЛЕТКИ МЕЛАНОМЫ | 2022 |
|
RU2798733C2 |
| БИОЛОГИЧЕСКИ АКТИВНАЯ ДОБАВКА К ПИЩЕ | 2002 |
|
RU2247514C2 |


Изобретение относится к области медицины и радиобиологии, а именно к применению лекарственного препарата Тамерон в качестве радиопротекторного, радиомитигаторного и радиосенсибилизирующего средства. Вышеописанное изобретение позволяет обеспечить радиопротекторные свойства препарата Тамерон посредством использования радиопротекторного средства на основе аминодигидрофталазиндиона натрия в дозах от 10 до 2000 мг как разово в качестве радиопротекторного и радиомитигаторного препарата, так и длительно в тех же суточных дозах при хроническом воздействии ионизирующего излучения или при курсе лучевой терапии. 6 ил., 1 пр.
Применение лекарственного препарата Тамерон в качестве радиопротекторного, радиомитигаторного и радиосенсибилизирующего средства.
| СТОПОРНОЕ УСТРОЙСТВО ДЛЯ УДЕРЖАНИЯ ВАГОНЕТКИВ КЛЕТИ | 0 |
|
SU209681A1 |
| Интернет-справочник Видаль, "Тамерон", найдено 17.06.2021, ссылка на источник: https://web.archive.org/web/20210617022909/https://www.vidal.ru/drugs/tameron | |||
| Интернет-справочник Видаль, "Галавит", сохраненная копия от 16.01.2021, ссылка на источник: | |||
Авторы
Даты
2023-10-09—Публикация
2022-06-07—Подача